JP2012525336A - α−4インテグリンのピリジノンアンタゴニスト - Google Patents
α−4インテグリンのピリジノンアンタゴニスト Download PDFInfo
- Publication number
- JP2012525336A JP2012525336A JP2012507475A JP2012507475A JP2012525336A JP 2012525336 A JP2012525336 A JP 2012525336A JP 2012507475 A JP2012507475 A JP 2012507475A JP 2012507475 A JP2012507475 A JP 2012507475A JP 2012525336 A JP2012525336 A JP 2012525336A
- Authority
- JP
- Japan
- Prior art keywords
- dihydro
- inden
- oxo
- dihydropyridine
- carboxamide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
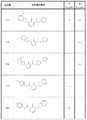
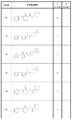
- 0 C**(*)C(C1=C(*)C(*C)=C(*)*(C(*)(*)C2(CCC(*)CCCC2)N)C1=O)=* Chemical compound C**(*)C(C1=C(*)C(*C)=C(*)*(C(*)(*)C2(CCC(*)CCCC2)N)C1=O)=* 0.000 description 13
- KAHCJJUCWNRCRR-UQMNCTFVSA-N C/C=C\C(\NC(C1=CC=CN(C2c3cccc(-c4ccccc4)c3CC2)C1=O)=O)=C/C Chemical compound C/C=C\C(\NC(C1=CC=CN(C2c3cccc(-c4ccccc4)c3CC2)C1=O)=O)=C/C KAHCJJUCWNRCRR-UQMNCTFVSA-N 0.000 description 1
- VWYSBCZFGVSRPL-UHFFFAOYSA-N C=[O]=C(C1=CC=CN(C2c3cccc(C(O)=O)c3CC2)C1=O)Nc1ccncc1 Chemical compound C=[O]=C(C1=CC=CN(C2c3cccc(C(O)=O)c3CC2)C1=O)Nc1ccncc1 VWYSBCZFGVSRPL-UHFFFAOYSA-N 0.000 description 1
- HZPDEVHTMDHHIN-UHFFFAOYSA-N CCOC(C1=CC=CN(C2c3cccc(Br)c3CC2)C1=O)=O Chemical compound CCOC(C1=CC=CN(C2c3cccc(Br)c3CC2)C1=O)=O HZPDEVHTMDHHIN-UHFFFAOYSA-N 0.000 description 1
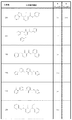
- XKEWNMYIOXKSII-UHFFFAOYSA-N CCOC(C1=CC=CN(C2c3cccc(NC4CC4)c3CC2)C1=O)=O Chemical compound CCOC(C1=CC=CN(C2c3cccc(NC4CC4)c3CC2)C1=O)=O XKEWNMYIOXKSII-UHFFFAOYSA-N 0.000 description 1
- JMXMRMSUOHVHOF-UHFFFAOYSA-N COc1cccc2c1CCC2N Chemical compound COc1cccc2c1CCC2N JMXMRMSUOHVHOF-UHFFFAOYSA-N 0.000 description 1
- DSIQPOAWFQGISS-QBFSEMIESA-N C[O](C1)C1c1c(CC/C2=N/O)c2ccc1 Chemical compound C[O](C1)C1c1c(CC/C2=N/O)c2ccc1 DSIQPOAWFQGISS-QBFSEMIESA-N 0.000 description 1
- ITQTTZVARXURQS-UHFFFAOYSA-N Cc1cccnc1 Chemical compound Cc1cccnc1 ITQTTZVARXURQS-UHFFFAOYSA-N 0.000 description 1
- YIUOAAUFVBZQPM-UHFFFAOYSA-N Cc1ncncn1 Chemical compound Cc1ncncn1 YIUOAAUFVBZQPM-UHFFFAOYSA-N 0.000 description 1
- XJEVHMGJSYVQBQ-UHFFFAOYSA-N NC(CC1)c2c1cccc2 Chemical compound NC(CC1)c2c1cccc2 XJEVHMGJSYVQBQ-UHFFFAOYSA-N 0.000 description 1
- RAWJRBXOODIXOY-UHFFFAOYSA-N O=C(C1=CC=CN(C2c3ccc4OCOc4c3CC2)C1=O)Nc1ccncc1 Chemical compound O=C(C1=CC=CN(C2c3ccc4OCOc4c3CC2)C1=O)Nc1ccncc1 RAWJRBXOODIXOY-UHFFFAOYSA-N 0.000 description 1
- IGECQYWWTCKFMT-UHFFFAOYSA-N O=C1c2ccc3OCOc3c2CC1 Chemical compound O=C1c2ccc3OCOc3c2CC1 IGECQYWWTCKFMT-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/81—Amides; Imides
- C07D213/82—Amides; Imides in position 3
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
Abstract
Description
本願は、米国仮特許出願第61/172,876号(2009年4月27日出願)の米国特許法§119(e)に基づく利益を主張する。この仮特許出願は、参照によりその全体が、本明細書に援用される。
発明の分野
本発明は、白血球接着、特に、α4β7によって媒介される白血球接着を阻害する化合物に関する。したがって、本発明の化合物は、α4β7結合ならびに細胞の接着および活性化によって媒介される疾患(多発性硬化症、喘息、アレルギー性鼻炎、関節リウマチ、化膿性関節炎、再狭窄、炎症性腸疾患(潰瘍性大腸炎およびクローン病が含まれる)、皮膚炎、および乾癬など)の処置および防止で有用である。
以下の刊行物、特許、および特許出願は、以下の上付番号として本出願で引用する。
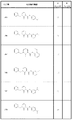
種々の態様では、本発明は、式(Ia):
mは0〜4から選択される整数であり、
nは0〜3から選択される整数であり、
pは0〜4から選択される整数であり、
環Aは、置換または非置換のアリールおよび置換または非置換のヘテロアリールから選択されるメンバーであり、
Cyは、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、および置換または非置換のヘテロアリールから選択されるメンバーであり、
各R1および各R2は、H、置換または非置換の(C1〜C10)アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、ニトロ、CN、ハロゲン、OR12、SR12、NR12R13、C(O)R14、C(O)NR12R13、OC(O)NR12R13、C(O)OR12、NR15C(O)R14、NR15C(O)OR12、NR15C(O)NR12R13、NR15C(S)NR12R13、NR15S(O)2R14、S(O)2NR12R13、およびS(O)zR14から独立して選択されるメンバーであり、
zは1または2であり、
R12、R13、およびR15は、H、アシル、置換または非置換の(C1〜C10)アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキルから独立して選択されるメンバーであり、
R14は、置換または非置換の(C1〜C10)アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキルから独立して選択されるメンバーであり、
R12およびR13は、これらと結合する窒素原子と共に任意選択的に連結して4〜7員環を形成し、
2つの隣接するR1はこれらと結合する原子と共に任意選択的に連結して5〜7員環を形成し、
2つの隣接するR2は、これらと結合する原子と共に任意選択的に連結して5〜7員環を形成し、
R3、R4、およびR5は、H、置換または非置換の(C1〜C4)アルキル、ハロゲン、およびCNから独立して選択されるメンバーであり、
R6は、Hおよび置換または非置換の(C1〜C4)アルキルから選択されるメンバーである)の化合物またはその塩、溶媒和物、単一の立体異性体、もしくは立体異性体の混合物を提供する。
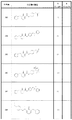
m1は0〜3から選択される整数であり、
R1aおよびR1bは、上記で定義のR1およびR2と同一の群から独立して選択される)の化合物を対象にする。
(i)リガンドの表面への結合、
(ii)化合物の存在下でのリガンドのインテグリンを発現する細胞との接触、および
(iii)表面への細胞の結合量の測定。
定義
この書類全体(明細書および特許請求の範囲の両方が含まれる)を通して使用される用語について以下のように定義および説明する。明細書および添付の特許請求の範囲を通して、所与の式および名称は、その全ての異性体(立体異性体、幾何異性体、光学異性体、互変異性体、およびその混合物など)を含むものとし、かかる異性体ならびにその薬学的に許容可能な塩および溶媒和物(水和物など)が存在する。
立体異性体を含む組成物
本発明の化合物は、特定の幾何異性体または立体異性体の形態で存在し得る。本発明は、全てのかかる化合物(シスおよびトランス異性体、(−)−および(+)−鏡像異性体、ジアステレオマー、(D)−異性体、(L)−異性体、そのラセミ混合物、ならびにその他の混合物(本発明の範囲内に含まれる鏡像異性体またはジアステレオマーが豊富な混合物など)が含まれる)を意図する。さらなる不斉炭素原子は、アルキル基などの置換基中に存在し得る。全てのかかる異性体およびその混合物は、本発明に含まれることが意図される。本明細書中に記載の化合物がオレフィン二重結合または幾何学的非対称の他の中心を含む場合で且つ他で特定しない限り、化合物にはEおよびZ幾何異性体の両方が含まれることが意図される。同様に、全ての互変異性体形態および互変異性体の混合物が含まれる。
種々の態様では、本発明は、式(Ia)、式(Ia’)、式(Ib)、または式(Ic):
1つの例では、式(Ia)、式(Ia’)、式(Ib)、式(IIa)、式(IIa’)、または式(IIb)では、環Aは5または6員の芳香環またはヘテロ芳香環である。Aの例示的環には、フェニル、ピリジン、チオフェン、チアゾール、およびオキサゾールが含まれる。別の例では、Aはフェニルまたはチオフェンであり、本発明の化合物は、式(IIIa)、式(IIIa’)、または式(IIIb):
上記式のいずれか中のCyは、環系または融合環系であり得る。1つの実施形態では、上記式のいずれか中のCyは、置換または非置換のシクロアルキル(例えば、C3〜C8シクロアルキル)、置換または非置換のヘテロシクロアルキル(例えば、3〜8員ヘテロシクロアルキル)、置換または非置換のアリール、および置換または非置換のヘテロアリールから選択されるメンバーである。特定の例では、Cyは、置換または非置換のアリール(例えば、フェニル、ビフェニル、ナフチル)および置換または非置換のヘテロアリール(例えば、ピリジル、キノリニル、キナゾリニル)から選択されるメンバーである。別の例では、Cyは、式:
一定の本発明の化合物は、種々のin vitro生物活性を示す。具体的には、一定の本発明の化合物は、α4インテグリンのその各リガンドへの結合を阻害する。これらの化合物をα4アンタゴニストと呼ぶ。例えば、本発明の化合物は、α4インテグリン(例えば、α4β7またはVLA−4)のその天然のリガンド(フィブロネクチン、VCAM−1、またはMadCAMなど)への結合を阻害する。かかる活性の決定のためのin vitroアッセイは当該分野で公知である(例えば、WO2000/51974号(本明細書中で参考として援用される)を参照のこと)。例示的なアッセイ形式を本明細書中に記載する(例えば、実施例32〜38を参照のこと)。
一定の本発明の化合物は、in vivo生物活性(本明細書中の実施例39〜41に記載のものなど)を示す。
本発明の化合物を、有機合成分野で公知の方法および本明細書中に記載の方法を使用して調製することができる(例えば、実施例1〜13を参照のこと)。出発物質および種々の中間体を、商業的供給者から得ることができ、市販の化合物から調製し、そして/または公知の合成方法を使用して調製することができる。例えば、本発明の化合物および全ての中間体を、溶液または固相技術のいずれかを使用した公知の過程によって合成することができる。本発明の化合物の調製のための例示的な手順を、以下のスキームで概説する。
本発明は、さらに、本発明の化合物(例えば、式(I)〜(XV)の化合物)および薬学的に許容可能なキャリアを含む薬学的組成物を提供する。薬学的に許容可能なキャリアは、本明細書中に記載されている。本発明の薬学的組成物は、1つまたは複数の薬学的に許容可能なキャリアおよび任意選択的な他の有効成分と組み合わせた1つまたは複数の本発明の化合物を含むことができる。
方法
本発明の抱合体は、インテグリンへの競合的結合によるインテグリン(α4β7およびVLA−4)によって媒介される白血球の内皮細胞への接着のin vivo阻害を示すと予想される。好ましくは、本発明の化合物を、かかるインテグリンによって媒介される疾患または白血球接着に関与する疾患の処置のための静脈内処方物で使用することができる。かかる疾患には、哺乳動物患者における炎症性疾患(喘息、アルツハイマー病、アテローム性動脈硬化症、エイズ痴呆、糖尿病(急性若年発症糖尿病が含まれる)、炎症性腸疾患(潰瘍性大腸炎およびクローン病が含まれる)、多発性硬化症(MS)、特発性肺線維症(IPF;特発性線維化肺胞炎ともいう)、関節リウマチ(RA)、組織移植、腫瘍転移、液性腫瘍、髄膜炎、脳炎、卒中、および他の脳外傷、腎炎、網膜炎、アトピー性皮膚炎、乾癬、心筋虚血、および急性白血球媒介性肺損傷(成人呼吸急迫症候群で生じるものなど)など)が含まれる。本発明の化合物および薬学的処方物は、胃/腸/腸管の炎症性疾患(炎症性腸疾患(IBD)(クローン病および潰瘍性大腸炎が含まれる)など)の処置で特に有用である。
本発明は、さらに、α4β1またはα4β7インテグリンのインテグリンリガンド(フィブロネクチン(FN)、VCAM−1、オステオポンチン、およびMadCAMなど)への結合を測定するin vitroアッセイでの本発明の化合物の使用方法を提供する。例えば、本発明の化合物を、他の試験化合物(すなわち、候補化合物)がインテグリンに結合する能力またはリガンドのインテグリンへの結合を破壊する能力を比較および評価するためのかかるアッセイ(すなわち、競合結合アッセイ)における基準化合物として使用することができる。用語「in vitroアッセイ」には、細胞ベースの(例えば、ex vivo)アッセイが含まれる。試験化合物がMadCAMの細胞表面α4β7インテグリンへの結合を阻害する能力を測定する例示的な細胞ベースのin vitroアッセイを本明細書中に記載する。例示的なアッセイは、(i)リガンド(例えば、組換えMadCAM−抗体抱合体)を表面(例えば、ウェルプレート)に結合する工程;(ii)本発明の化合物の存在下でインテグリン(例えば、α4β7)を発現する細胞とその細胞表面上でリガンドを接触させる工程、および(iii)細胞の表面への結合量を測定する工程を含む。例えば、細胞表面上のインテグリンは、固定化リガンドに結合する。化合物がインテグリンに結合し、それにより、インテグリンのリガンドへの結合が減少するにつれて、かかる結合は本発明の化合物によって阻害される。
他で示さない限り、商業的供給者から入手した試薬および溶媒を、さらに精製せずに使用した。薄層クロマトグラフィを、プレコーティングした0.25mmシリカゲルプレート(E.Merck、シリカゲル60、F254)にて行った。UV照明またはリンモリブデン酸、ニンヒドリン、または他の一般的な染色試薬での染色を使用して視覚化した。フラッシュクロマトグラフィを、Biotage Flash 40システムおよび充填済シリカゲルカラムまたは手作業で充填したカラム(E.Merckシリカゲル60、230〜400メッシュ)のいずれかを使用して行った。分取HPLCを、Varian Prepstar高速液体クロマトグラフにて行った。1Hおよび13C NMRスペクトルを、Varian GeminiまたはBruker Avance 分光計にてそれぞれ300MHzおよび75MHzで記録した。テトラメチルシラン(TMS)またはNMR 溶媒の不完全な重水素化に起因するプロトン共鳴と比較した化学シフトを、百万分率(ppm)低磁場で記録する(δスケール)。質量スペクトルを、Agilentシリーズ1100HPLCに接続したAgilentシリーズ1100質量分析計にて記録した。
μ=マイクロ
Ac=アセタート
bd=ブロードダブレット
BINAP=2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル
BOC=tert−ブチルオキシカルボニル
BSA=ウシ血清アルブミン
d=ダブレット
DCM=ジクロロメタン
dd=ダブルダブレット
DEAD=ジエチルアゾジカルボキシラート
DIAD=ジイソプロピルアゾジカルボキシラート
DIEA=ジイソプロピルエチルアミン
DME=ジメチルエーテル
DMF=ジメチルホルムアミド
DMSO=ジメチルスルホキシド
dppf=1,1’−ビス(ジフェニルホスフィノ)フェロセン
dppp=1,1−ビス(ジフェニルホスフィノ)メタン
EDC=1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミドヒドロクロリド
eq=当量
Et=エチル
FBS=ウシ胎児血清
g=グラム
HBTU=2−(1H−ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスファート
HEPES=4−2−ヒドロキシエチル−1−ピペラジンエタンスルホン酸
HOBt=1−ヒドロキシベンゾトリアゾール
HPLC=高速液体クロマトグラフィ
hr=時間
LAH=水素化アルミニウムリチウム
m=マルチプレット
M=モル
m−CPBA=メタ−クロロ過安息香酸
MeOH=メタノール
mg=ミリグラム
MHz=メガヘルツ
min=分
ml=ミリリットル
mM=ミリモル
mmol=ミリモル
MS(ESI)=エレクトロスプレーイオン化質量分析
N=正常
NMR=核磁気共鳴
Pd/C=炭素担持パラジウム
Pd2(dba)3=トリス(ジベンジリデンアセトン)ジパラジウム(0)
Ph=フェニル
psi=ポンド/平方インチ
q=カルテット
Ra−Ni=ラネーニッケル
rpm=回転/分
RT=室温
s=シングレット
t=トリプレット
TFA=トリフルオロ酢酸
THF=テトラヒドロフラン
uLまたはμl=マイクロリットル
w/v=重量/体積
δ=化学シフト。
方法[1]=20% [B]:80% [A]から70% [B]:30% [A]の1.75分での勾配、その後2mL/分で保持([A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Phenomenex Luna C18(2)4.6mm×30cmカラム、3ミクロン充填にて35℃210nmの検出)。
方法[2]=50% [B]:50% [A]から95% [B]:5% [A]の2.5分での勾配、その後2mL/分で保持([A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Phenomenex Luna C18(2)4.6mm×30cmカラム、3ミクロン充填にて35℃210nmの検出)。
方法[3]=5% [B]:95% [A]から20% [B]:80% [A]の2.5分での勾配、その後2mL/分で保持([A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Phenomenex Luna C18(2)4.6mm×30cmカラム、3ミクロン充填にて35℃210nmの検出)。
方法[4]=20% [B]:80% [A]から70% [B]:30% [A]の2.33分での勾配、その後1.5mL/分で保持([A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Phenomenex Luna C18(2)4.6mm×30cmカラム、3ミクロン充填にて35℃210nmの検出)。
方法[5]=50% [B]:50% [A]から95% [B]:5% [A]の3.33分での勾配、その後1.5mL/分で保持([A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Phenomenex Luna C18(2)4.6mm×30cmカラム、3ミクロン充填にて35℃210nmの検出)。
方法[6]=5% [B]:95% [A]から20% [B]:80% [A]の3.33分での勾配、その後1.5mL/分で保持([A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Phenomenex Luna C18(2)4.6mm×30cmカラム、3ミクロン充填にて35℃210nmの検出)。
方法[7]=20% [B]:80% [A]から70% [B]:30% [A]の10.0分での勾配、その後1.5mL/分で保持([A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Phenomenex Luna C18(2)4.6mm×3cmカラム、3ミクロン充填にて35℃210nmの検出)。
方法[8]=10% [B]:90% [A]から40% [B]:60% [A]の10.0分での勾配、その後1.5mL/分で保持([A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Phenomenex Luna C18(2)4.6mm×3cmカラム、3ミクロン充填にて35℃210nmの検出)。
方法[9]=23% [B]:77% [A]から30% [B]:70% [A]の15.0分での勾配、その後1.0mL/分で保持( [A]=0.1%トリフルオロ酢酸水溶液;[B]=0.1%トリフルオロ酢酸のアセトニトリル溶液、Zorbex SB−フェニルC18、2.1mm×5cmカラム、5ミクロン充填にて30℃で210nmの検出)。
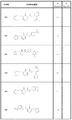
1.1.(R)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(1)の合成
プロトコールA
上記のプロトコールA、B、およびCまたはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(2)
保持時間(分)=2.757,方法[7],MS(ESI)332.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.98(s,1H),8.71(d,2H),8.48(d,1H),8.18(d,2H),7.68(d,1H),7.36(m,2H),7.33(m,1H),7.24(t,1H),7.15(d,1H),6.61(t,1H),6.49−6.52(m,1H),3.01−3.19(m,1H),2.71−2.98(m,1H),2.65−2.69(m,1H),2.11−2.14(m,1H)。
N−(4−クロロフェニル)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(3)
保持時間(分)=8.869,方法[7],MS(ESI)365.0(M+H);1H NMR(300 MHz,CDCl3)δ 12.17(s,1H),8.59(dd,1H),7.74(d,2H),7.28−7.39(m,5H),7.21(dd,1H),7.19(d,1H),6.61(q,1H),6.39(t,1H),2.99−3.16(m,1H),2.79−2.91(m,1H),1.97−2.09(m,1H)。
保持時間(分)=2.691,方法[7],MS(ESI)332.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.38(s,1H),843−8.47(m,3H),7.69(d,2H),7.59(d,1H),7.40(m,2H),7.35(m,1H),7.24(t,1H),7.15(d,1H),6.50−6.59(m,2H),3.02−3.18(m,12H),2.70−2.99(m,1H),2.62−2.68(m,1H),2.02−2.14(m,1H)。
保持時間(分)=9.461,方法[7],MS(ESI)365.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.60(d,1H),7.74(d,2H),7.28−7.39(m,5H),7.21(d,1H),7.19(d,1H),6.61(q,1H),6.39(t,1H),2.91−3.16(m,1H),2.79−2.89(m,1H),2.05−2.09(m,1H)。
保持時間(分)=7.443,方法[7],MS(ESI)381.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.06(s,1H),8.51(dd,1H),7.68(d,2H),7.28−7.40(m,5H),7.22(m,1H),7.13(d,1H),6.44(d,1H),6.37(t,1H),4.97(m,1H),3.36(dd,1H),3.05(dd,1H),2.81(d,1H)。
保持時間(分)=1.869,方法[7],MS(ESI)348.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.42(s,1H),8.45−8.50(m,3H),7.69(d,2H),7.49(d,1H),7.23−7.39(m,3H),7.08(d,1H),6.57(t,1H),6.48(d,1H),5.31(d,1H),4.66(m,1H),3.24(m,1H),2.90−2.96(d,1H)。
保持時間(分)=7.441,方法[7],MS(ESI)381.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.09(s,1H),8.51(d,1H),7.66(d,2H),7.23−7.39(m,5H),7.22(m,1H),7.13(d,1H),6.44(d,1H),6.37(t,1H),4.99(m,1H),3.37(dd,1H),3.05(dd,1H),2.81(d,1H)。
保持時間(分)=1.882,方法[7],MS(ESI)348.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.44(s,1H),8.45−8.50(m,3H),7.68(d,2H),7.49(d,1H),7.23−7.39(m,3H),7.08(d,1H),6.57(t,1H),6.48(d,1H),5.31(d,1H),4.64(m,1H),3.24(m,1H),2.96(d,1H)。
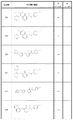
2.1.N−(4−クロロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(11)の合成
プロトコールD
上記のプロトコールD、E、A、B、およびCまたはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
1−(6−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(12)
保持時間(分)=3.113,方法[7],MS(ESI)362.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.41(s,1H),8.42−8.47(m,3H),7.69(d,2H),7.53(d,1H),7.28(d,1H),6.89(d,1H),6.71(s,1H),6.56(t,1H),6.47(m,1H),3.65(s,3H),3.01−3.08(m,1H),2.71−2.98(m,1H),2.62−2.69(m,1H),2.06−2.11(m,1H)。
保持時間(分)=9.412,方法[7],MS(ESI)395.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.18(s,1H),8.59(dd,1H),7.75(d,2H),7.19−7.32(m,4H),6.90(d,1H),6.55−6.61(m,2H),6.40(t,1H),3.75(s,3H),2.90−3.08(m,2H),2.78−2.88(m,1H),1.97−2.09(m,1H)。
保持時間(分)=9.404,方法[7],MS(ESI)417.1(M+Na);1H NMR(300 MHz,CDCl3)δ 12.19(s,1H),8.58(dd,1H),7.74(d,2H),7.32(d,2H),7.18(d,1H),7.06(d,1H),6.89(s,1H),6.83(d,1H),6.49(m,1H),6.37(t,1H),3.83(s,3H),2.90−3.13(m,2H),2.78−2.87(m,1H),1.99−2.09(m,1H)。
保持時間(分)=3.067,方法[7],MS(ESI)362.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.39(s,1H),8.50−8.59(m,3H),7.68(d,2H),7.23(d,1H),7.04(d,1H),6.84(s,1H),6.50(d,1H),6.47(m,1H),6.38(t,1H),3.82(s,3H),2.91−3.11(m,2H),2.79−2.88(m,1H),1.99−2.10(m,1H)。
保持時間(分)=10.360,方法[7],MS(ESI)445.0(M+H);1H NMR(300 MHz,CDCl3)δ 12.11(s,1H),8.59(dd,1H),7.73(d,2H),7.46(d,1H),7.20−7.33(m,5H),6.61(t,1H),6.45(t,1H),2.91−3.08(m,2H),2.79−2.89(m,1H),2.07−2.11(m,1H)。
保持時間(分)=3.842,方法[7],MS(ESI)411.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.27(s,1H),8.61(d,1H),8.58(d,2H),7.58(d,2H),7.46(d,1H),7.18−7.38(m,2H),6.61(t,1H),6.44(t,1H),2.90−3.14(m,2H),2.80−2.89(m,1H),1.84−2.09(m,1H)。
保持時間(分)=3.095,方法[7],MS(ESI)362.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.37(s,1H),8.41−8.47(m,3H),7.69(d,2H),7.58(d,1H),7.25(t,1H),6.93(d,1H),6.70(d,1H),6.49−6.58(m,2H),3.81(s,3H),3.00−3.08(m,1H),2.71−2.98(m,1H),2.65−2.69(m,1H),2.03−2.12(m,1H)。
保持時間(分)=2.848,方法[7],MS(ESI)362.0(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.43(s,1H),8.42−8.47(m,3H),7.69(d,2H),7.00−7.39(m,2H),6.97(d,1H),6.88(d,1H),6.51(t,1H),6.38(m,1H),3.61(s,3H),2.90−3.08(m,1H),2.71−2.88(m,1H),2.61−2.69(m,1H),1.97−2.04(m,1H)。
保持時間(分)=8.530,方法[7],MS(ESI)395.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.22(s,1H),8.57(d,1H),7.75(d,2H),7.27−7.39(m,3H),7.10(d,1H),6.97(d,1H),6.74(d,1H),6.49(m,1H),6.38(t,1H),3.68(s,3H),2.94−3.15(m,2H),2.75−2.88(m,1H),2.04−2.11(m,1H)。
保持時間(分)=9.284,方法[7],MS(ESI)379.0(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.62(dd,1H),7.74(d,2H),7.24−7.45(m,6H),6.98(d,1H),6.63(m,1H),6.46(t,1H),3.19−3.39(m,1H),2.97−3.12(m,1H),1.52(m,1H),1.46(d,3H)
1−(3−メチル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(22)
保持時間(分)=3.413,方法[7],MS(ESI)346.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.99(s,1H),8.76(d,2H),8.63(d,1H),8.21(d,2H),7.85(d,1H),7.31−7.49(m,3H),7.26(t,1H),6.97(d,1H),6.68(t,1H),6.49−6.57(m,1H),3.22−3.33(m,1H),2.84−2.95(m,1H),2.65−2.69(m,1H),1.65−1.78(m,1H),1.36(d,3H)。
保持時間(分)=3.715,方法[7],MS(ESI)411.0(M+H);1H NMR(300MHz,DMSO−d6)δ 12.34(s,1H),8.52−8.61(m,3H),7.67(d,2H),7.52(d,1H),7.27(m,1H),7.15(t,1H),7.05(d,1H),6.71(t,1H),6.45(t,1H),2.91−3.22(m,2H),2.84−2.90(m,1H),2.00−2.11(m,1H)。
保持時間(分)=9.577,方法[7],MS(ESI)395.1(M+H);1H NMR(300MHz,CDCl3)δ 12.08(s,1H),8.57(dd,1H),7.69(d,2H),7.49(d,1H),7.28(d,2H),7.19(m,1H),7.13(t,1H),7.02(d,1H),6.68(t,1H),6.40(t,1H),2.85−3.19(m,2H),2.79−2.84(m,1H),1.97−2.08(m,1H)。
表題化合物(鏡像異性体A)を、ラセミ混合物のキラル分離によって得た。保持時間(分)=6.118,方法[7],MS(ESI)362.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.37(s,1H),8.58(dd,1H),8.52(d,2H),7.69(d,2H),7.23−7.29(m,2H),6.85(d,1H),6.71(d,1H),6.60(m,1H),6.40(t,1H),3.88(s,3H),2.91−3.09(m,2H),2.79−2.89(m,1H),1.96−2.07(m,1H)。
表題化合物(鏡像異性体B)を、ラセミ混合物のキラル分離によって得た。保持時間(分)=6.123,方法[7],MS(ESI)362.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.34(s,1H),8.55(dd,1H),8.49(d,2H),7.65(d,2H),7.20−7.26(m,2H),6.82(d,1H),6.69(d,1H),6.58(m,1H),6.37(t,1H),3.85(s,3H),2.91−3.08(m,2H),2.76−2.88(m,1H),1.93−2.04(m,1H)。
保持時間(分)=10.542,方法[7],MS(ESI)437.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.19(s,1H),8.59(dd,1H),7.82(d,2H),7.56−7.59(m,4H),7.30−7.42(m,2H),7.17−7.28(m,3H),6.82(d,1H),6.70(d,1H),6.61(m,1H),6.36(t,1H),3.86(s,3H),2.91−3.09(m,2H),2.77−2.89(m,1H),1.94−2.05(m,1H)。
保持時間(分)=10.455,方法[7],MS(ESI)453.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.09(s,1H),8.59(dd,1H),7.76(d,2H),7.18−7.32(m,4H),6.95−7.12(m,5H),6.84(d,1H),6.74(d,1H),6.63(m,1H),6.37(t,1H),3.91(s,3H),2.95−3.12(m,2H),2.78−2.93(m,1H),1.96−2.08(m,1H)。
保持時間(分)=9.797,方法[7],MS(ESI)441.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.19(s,1H),8.58(dd,1H),7.68(d,2H),7.45(d,2H),7.19−7.28(m,2H),6.84(d,1H),6.71(d,1H),6.60(m,1H),6.38(t,1H),3.88(s,3H),2.86−3.09(m,2H),2.78−2.84(m,1H),1.95−2.06(m,1H)。
保持時間(分)=4.451,方法[7],MS(ESI)390.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.39(s,1H),8.58(dd,1H),8.52(d,2H),7.68(d,2H),7.19−7.28(m,2H),6.83(d,1H),6.68(d,1H),6.57(m,1H),6.40(t,1H),4.56−4.64(m,2H),2.90−3.10(m,2H),2.77−2.86(m,1H),1.94−2.05(m,1H),1.35−1.40(m,3H)。
保持時間(分)=10.240,方法[7],MS(ESI)423.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.55(dd,1H),7.70(d,2H),7.16−7.30(m,4H),6.81(d,1H),6.64(d,1H),6.54(m,1H),6.36(t,1H),4.53−4.61(m,2H),2.83−3.05(m,2H),2.74−2.81(m,1H),1.90−2.02(m,1H),1.32−1.37(m,3H)。
表題化合物(鏡像異性体A)を、ラセミ混合物のキラル分離によって得た。保持時間(分)=10.451,方法[7],MS(ESI)453.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.09(s,1H),8.59(dd,1H),7.74(d,2H),7.18−7.34(m,4H),6.98−7.09(m,5H),6.84(d,1H),6.73(d,1H),6.63(m,1H),6.38(t,1H),3.88(s,3H),2.93−3.11(m,2H),2.79−2.91(m,1H),1.96−2.07(m,1H)。
表題化合物(鏡像異性体B)を、ラセミ混合物のキラル分離によって得た。保持時間(分)=10.452,方法[7],MS(ESI)453.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.07(s,1H),8.56(dd,1H),7.74(d,2H),7.16−7.31(m,4H),6.95−7.07(m,5H),6.81(d,1H),6.70(d,1H),6.59(m,1H),6.35(t,1H),3.85(s,3H),2.94−3.09(m,2H),2.76−2.90(m,1H),1.93−2.074(m,1H)。
表題化合物(鏡像異性体A)を、ラセミ混合物のキラル分離によって得た。保持時間(分)=10.564,方法[7],MS(ESI)437.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.21(s,1H),8.61(dd,1H),7.86(d,2H),7.59−7.62(m,4H),7.30−7.44(m,2H),7.19−7.29(m,3H),6.84(d,1H),6.73(d,1H),6.62(m,1H),6.39(t,1H),3.89(s,3H),2.90−3.12(m,2H),2.80−2.89(m,1H),1.97−2.08(m,1H)。
表題化合物(鏡像異性体B)を、ラセミ混合物のキラル分離によって得た。保持時間(分)=10.564,方法[7],MS(ESI)437.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.21(s,1H),8.58(dd,1H),7.83(d,2H),7.55−7.59(m,4H),7.39−7.42(m,2H),7.17−7.31(m,3H),6.82(d,1H),6.71(d,1H),6.61(m,1H),6.36(t,1H),3.86(s,3H),2.91−3.08(m,2H),2.79−2.89(m,1H),1.947−2.05(m,1H)。
表題化合物(鏡像異性体A)を、ラセミ混合物のキラル分離によって得た。保持時間(分)=3.960,方法[7],MS(ESI)411.0(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.32(s,1H),8.60(dd,1H),8.52(d,2H),7.67(d,2H),7.52(d,1H),7.27(m,1H),7.15(t,1H),7.05(d,1H),6.71(m,1H),6.45(t,1H),3.01−3.22(m,2H),2.83−2.94(m,1H),2.00−2.11(m,1H)。
表題化合物(鏡像異性体B)を、ラセミ混合物のキラル分離によって得た。保持時間(分)=3.933,方法[7],MS(ESI)411.0(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.32(s,1H),8.60(dd,1H),8.52(d,2H),7.67(d,2H),7.52(d,1H),7.27(m,1H),7.15(t,1H),7.05(d,1H),6.71(m,1H),6.45(t,1H),2.98−3.18(m,2H),2.80−2.92(m,1H),2.97−2.09(m,1H)。
保持時間(分)=10.216,方法[7],MS(ESI)445.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.22(s,1H),8.58(d,1H),7.79(d,2H),7.18−7.29(m,4H),6.84(d,1H),6.72(d,1H),6.60(m,1H),6.39(t,1H),3.88(s,3H),2.93−3.11(m,2H),2.79−2.91(m,1H),1.96−2.07(m,1H)。
保持時間(分)=7.962,方法[7],MS(ESI)367.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 9.83(m,1H),8.49(d,1H),7.20−7.25(m,1H),7.10−7.13(m,1H),6.82(d,1H),6.68(d,1H),6.58(m,1H),6.29(t,1H),3.99−4.01(m,1H),3.86(s,3H),2.92−3.08(m,2H),2.76−2.89(m,1H),1.92−2.00(m,3H),1.72−1.90(m,3H),1.26−1.48(m,5H)。
保持時間(分)=7.946,方法[7],MS(ESI)379.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.09(s,1H),8.57(dd,J=2.1Hz,7.2Hz,1H),7.68−7.78(m,2H),7.18−7.30(overlap with CDCl3,2H),7.02(m,2H), 6.82(d,J=8.1Hz,1H),6.70(d,J=7.5Hz,1H),6.58(dd,J=5.7 Hz,8.1Hz,1H),6.40(t,J=7.2Hz,1H),3.87(s,3H),2.75−3.10(m,3H),1.95−2.05(m,1H)。
保持時間(分)=9.596,方法[7],MS(ESI)487.0(M+H);1H NMR(300 MHz,CDCl3)δ 12.10(s,1H),8.60(dd,J=2.1Hz,7.2Hz,1H),7.67(d,J=8.7 Hz,2H),7.59(d,J=8.7 Hz,2H),7.20−7.35(overlap with CDCl3,2H),6.87(d,J=7.8 Hz,1H),6.74(d,J=7.8 Hz,1H),6.60(dd,J=5.7 Hz,7.8 Hz,1H),6.41(t,J=7.2Hz,1H),3.92(s,3H),2.80−3.14(m,3H),1.95−2.05(m,1H)。
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−フェニル−1,2−ジヒドロピリジン−3−カルボキサミド(42)
保持時間(分)=8.181,方法[7],MS(ESI)361.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.05(s,1H),8.60(dq,J=7.0Hz,1.2Hz,1H),7.67(d,J=8.4 Hz,2H),7.36(t,J=8.4 Hz,2H),7.27(overlap with CDCl3,1H),7.20((dq,J=7.0Hz,1.2 Hz,1H),7.13(t,J=7.5Hz,1H), 6.85(d,J=8.1Hz,1H),6.73(d,J=7.5Hz,1H),6.63(dd,J=6.0Hz,7.8 Hz,1H),6.40(t,J=7.0Hz,1H),3.90(s,3H),2.78−3.16(m,3H),1.95−2.05(m,1H)。
保持時間(分)=7.374,方法[7],MS(ESI)403.2(M+H);1H NMR(300 MHz,CDCl3)δ 10.00(d,J=7.2Hz,1H),8.49(dd,J=7.0Hz,2.4 Hz,1H),7.26(overlap with CDCl3,1H),7.16((dd,J=7.0,2.4 Hz,1H),6.83(d,J=8.1Hz,1H),6.69(d,J=7.5Hz,1H),6.56(dd,J=5.7 Hz,8.1Hz,1H),6.33(t,J=7.0Hz,1H),4.05−4.20(m,1H),3.88(s,3H),2.78−3.16(m,3H),1.85−2.12(m,9H)。
保持時間(分)=10.129,方法[7],MS(ESI)483.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.06(s,1H),8.59(m,1H),7.71(d,J=8.7 Hz,2H),7.20−7.35(overlap with CDCl3,3H),6.87(t,J=9.3 Hz,4H),6.80−6.92(m,3H),6.73(m,1H),6.41(t,J=7.0Hz,1H),3.89(s,3H),3.80(s,3H),2.78−3.13(m,3H),1.95−2.05(m,1H)。
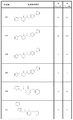
3.1.1−(4−シクロプロピル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(46)の合成
プロトコールF
3.2.N−(4−クロロフェニル)−1−(4−シクロプロピル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(47)の合成
上記のプロトコールF、H、A、B、およびCまたはそのわずかに修正したバージョンを使用して、適切な出発物質から表題化合物を合成した。
4.1.1−(7,8−ジヒドロ−6H−インデノ[5,4−d][1,3]ジオキソール−6−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(48)の合成
4.2.さらなる化合物
上記の実施例4.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
保持時間(分)=9.105,方法[7],MS(ESI)431.1(M+Na);1H NMR(300 MHz,CDCl3)δ 12.15(s,1H),8.58(dd,1H),7.73(d,2H),7.31(d,2H),7.20−7.28(m,1H),6.77(d,1H),6.47(m,1H),6.39(t,1H),6.02(s,2H),2.97−3.03(m,2H),2.78−2.90(m,1H),2.01−2.14(m,1H)。
保持時間(分)=10.805,方法[7],MS(ESI)449.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.15(s,1H),8.60(d,1H),7.72(d,2H),7.21−7.35(m,5H),7.05(d,1H),6.68(t,1H),6.44(t,1H),3.03−3.26(m,2H),2.84−2.96(m,1H),2.02−2.14(m,1H)。
保持時間(分)=4.679,方法[7],MS(ESI)416.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.89(s,1H),8.70(d,2H),8.49(dd,1H),8.17(d,2H),7.82(d,1H),7.31−7.41(m,2H),7.17(d,1H),6.55−6.66(m,2H),3.16−3.26(m,1H),2.96−3.07(m,1H),2.68−2.80(m,1H),2.14−2.26(m,1H)。
1−(4−(メチルチオ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(52)の合成
6.1.tert−ブチル4−(1−(2−オキソ−3−(ピリジン−4−イルカルバモイル)ピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート(53)の合成
上記の実施例6.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
tert−ブチル4−(1−(3−(4−クロロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート(54)
保持時間(分)=10.340,方法[7],MS(ESI)549.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.15(s,1H),8.59(dd,1H),7.73(d,2H),7.32(d,2H),7.20−7.28(m,2H),6.89(d,1H),6.76(d,1H),6.60(m,1H),6.40(t,1H),3.57−3.60(m,4H),2.90−3.09(m,6H),2.78−2.89(m,1H),1.97−2.09(m,1H),1.48(s,9H)。
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(55)
保持時間(分)=2.219,方法[7],MS(ESI)417.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.37(s,1H),8.59(dd,1H),8.52(d,2H),7.68(d,2H),7.23−7.29(m,2H),6.92(d,1H),6.76(d,1H),6.58(t,1H),6.42(t,1H),3.83−3.88(m,4H),2.87−3.13(m,6H),2.78−2.86(m,1H),2.00−2.09(m,1H).
N−(4−クロロフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(56)
保持時間(分)=8.265,方法[7],MS(ESI)450.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.13(s,1H),8.56(dd,1H),7.70(d,2H),7.20−7.30(m,4H),6.88(d,1H),6.73(d,1H),6.56(t,1H),6.37(t,1H),3.80−3.85(m,4H),2.83−3.10(m,6H),2.74−2.81(m,1H),1.93−2.06(m,1H)。
保持時間(分)=9.261,方法[7],MS(ESI)508.3(M+H);1H NMR(300 MHz,CDCl3)δ 12.08(s,1H),8.57(dd,1H),7.72(d,2H),7.19−7.31(m,4H),6.95−7.06(m,5H),6.88(d,1H),6.74(d,1H),6.56(t,1H),6.37(t,1H),3.80−3.85(m,4H),2.92−3.10(m,6H),2.75−2.89(m,1H),1.95−2.13(m,1H)。
保持時間(分)=7.109,方法[7],MS(ESI)434.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.11(s,1H),8.43(dd,1H),7.71−7.75(m,2H),7.57(m,1H),7.15−7.21(m,3H),6.88(d,1H),6.71(d,1H),6.49−6.57(m,2H),3.68−3.77(m,4H),2.85−3.07(m,6H),2.60−2.71(m,1H),2.02−2.13(m,1H)。
保持時間(分)=8.050,方法[7],MS(ESI)495.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.56(dd,1H),7.66(d,2H),7.43(d,2H),7.20−7.25(m,2H),6.88(d,1H),6.73(d,1H),6.56(t,1H),6.37(t,1H),3.82−3.85(m,4H),2.90−3.10(m,6H),2.77−2.87(m,1H),2.00−2.06(m,1H)。
保持時間(分)=6.326,方法[7],MS(ESI)422.2(M+H);1H NMR(300 MHz,CDCl3)δ 9.79(d,1H),8.48(dd,1H),7.10−7.20(m,2H),6.86(d,1H),6.70(d,1H),6.54(t,1H),6.28(t,1H),3.95−4.04(m,1H),3.81−3.85(m,4H),2.73−3.09(m,6H),1.90−2.02(m,3H),1.71−1.78(m,2H),1.60−1.69(m,1H),1.21−1.46(m,5H)。
保持時間(分)=8.637,方法[7],MS(ESI)542.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.17(s,1H),8.59(dd,1H),7.64(d,2H),7.56(d,2H),7.23−7.28(m,2H),6.91(d,1H),6.75(d,1H),6.59(t,1H),6.39(t,1H),3.85−3.88(m,4H),2.88−3.13(m,6H),2.77−2.86(m,1H),1.97−2.09(m,1H)。
保持時間(分)=7.330,方法[7],MS(ESI)430.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.00(s,1H),8.57(dd,1H),7.63(d,2H),7.18−7.25(m,2H),7.13(d,2H),6.88(d,1H),6.73(d,1H),6.58(t,1H),6.35(t,1H),3.82−3.85(m,4H),2.92−3.10(m,6H),2.76−2.89(m,1H),2.30(s,3H),1.95−2.06(m,1H)。
保持時間(分)=6.803,方法[7],MS(ESI)416.3(M+H);1H NMR(300 MHz,CDCl3)δ 12.09(s,1H),8.64(dd,1H),7.79−7.82(m,2H),7.31−7.40(m,2H),7.24−7.28(m,2H),7.16(m,1H),6.93(d,1H),6.80(d,1H),6.64(t,1H),6.42(t,1H),3.86−3.91(m,4H),2.98−3.16(m,6H),2.81−2.95(m,1H),2.01−2.12(m,1H)。
保持時間(分)=9.430,方法[7],MS(ESI)492.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.62(dd,1H),7.85(d,2H),7.58−7.61(m,4H),7.40−7.45(m,2H),7.23−7.33(m,3H),6.91(d,1H),6.77(d,1H),6.62(t,1H),6.40(t,1H),3.83−3.89(m,4H),2.90−3.13(m,6H),2.79−2.89(m,1H),1.99−2.11(m,1H)。
保持時間(分)=6.038,方法[7],MS(ESI)458.2(M+H);1H NMR(300 MHz,CDCl3)δ 9.98(d,1H),8.47(dd,1H),7.14−7.21(m,2H),6.86(d,1H),6.70(d,1H),6.52(t,1H),6.30(t,1H),4.07−4.11(m,1H),3.82−3.85(m,4H),2.90−3.09(m,6H),2.74−2.87(m,1H),1.66−2.11(m,9H)。
保持時間(分)=6.165,方法[7],MS(ESI)446.1(M+H);1H NMR(300 MHz,CDCl3)δ 11.99(s,1H),8.63(dd,1H),7.73(d,2H),7.23−7.31(m,2H),6.90−6.95(m,3H),6.79(d,1H),6.63(t,1H),6.341(t,1H),3.88−3.93(m,4H),3.83(s,3H),2.93−3.16(m,6H),2.80−2.91(m,1H),2.01−2.12(m,1H)。
保持時間(分)=7.400,方法[7],MS(ESI)482.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.13(s,1H),8.63(dd,1H),7.79(d,2H),7.23−7.31(m,2H),7.13(d,2H),6.94(d,1H),6.79(d,1H),6.62(t,1H),6.50(t,1H),6.43(t,1H),3.88−3.91(m,4H),2.93−3.16(m,6H),2.80−2.91(m,1H),2.01−2.12(m,1H)。
保持時間(分)=8.696,方法[7],MS(ESI)500.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.21(s,1H),8.60(dd,1H),7.80(d,2H),7.18−7.28(m,4H),6.92(d,1H),6.76(d,1H),6.59(t,1H),6.40(t,1H),3.83−3.88(m,4H),2.90−3.13(m,6H),2.78−2.89(m,1H),1.98−2.10(m,1H)。
保持時間(分)=8.662,方法[7],MS(ESI)484.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.35(s,1H),8.58(dd,1H),7.86(d,2H),7.58(d,2H),7.21−7.26(m,2H),6.89(d,1H),6.73(d,1H),6.57(t,1H),6.38(t,1H),3.80−3.86(m,4H),2.90−3.10(m,6H),2.75−2.88(m,1H),1.96−2.07(m,1H)。
保持時間(分)=6.687,方法[7],MS(ESI)441.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.49(s,1H),8.44(dd,1H),7.89(d,2H),7.80(d,2H),7.61− 7.63(m,1H),7.19(t,1H),6.88(d,1H),6.72(d,1H),6.49−6.59(m,2H),3.68−3.77(m,4H),2.85−3.07(m,6H),2.58−2.70(m,1H),2.04−2.14(m,1H)。
保持時間(分)=4.433,方法[7],MS(ESI)464.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.23(s,1H),8.42(dd,1H),7.75(d,2H),7.58−7.61(m,1H),7.38(d,2H),7.14(t,1H),6.86(d,1H),6.65(d,1H),6.48−6.57(m,2H),4.68(d,1H),3.57−3.64(m,1H),3.15−3.23(m,2H),2.93−3.06(m,2H),2.46−2.91(m,3H),2.03−2.12(m,1H),1.81−1.86(m,2H),1.46−1.56(m,2H)。
保持時間(分)=7.749,方法[7],MS(ESI)537.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 11.96(s,1H),8.40(dd,1H),7.81(s,1H),7.50−7.56(m,3H),7.18(t,1H),7.00(d,2H),6.82−6.92(m,5H),6.70(d,1H),6.49−6.55(m,2H),3.71−3.74(m,4H),3.68(s,3H),2.85−3.08(m,6H),2.58−2.69(m,1H),2.01−2.13(m,1H)。
保持時間(分)=7.787,方法[7],MS(ESI)452.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.20(s,1H),8.59(dd,1H),7.85−7.93(m,1H),7.24−7.33(m,3H),7.06−7.16(m,1H),6.92(d,1H),6.75(d,1H),6.58(t,1H),6.41(t,1H),3.85−3.88(m,4H),2.86−3.13(m,6H),2.77−2.84(m,1H),1.98−2.09(m,1H)。
保持時間(分)=9.762,方法[7],MS(ESI)533.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.06(s,1H),8.57(dd,1H),7.68−7.72(m,2H),7.19−7.24(m,2H),6.98−7.04(m,2H),6.86(d,1H),6.73(d,1H),6.57(t,1H),6.37(t,1H),3.53−3.59(m,4H),2.91−3.08(m,6H),2.78−2.89(m,1H),1.99−2.06(m,1H),1.45(s,9H)。
保持時間(分)=11.439,方法[7],MS(ESI)594.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.14(s,1H),8.56(dd,1H),7.65(d,2H),7.42(d,2H),7.19−7.24(m,2H),6.86(d,1H),6.73(d,1H),6.54(t,1H),6.37(t,1H),3.54−3.57(m,4H),2.87−3.08(m,6H),2.75−2.86(m,1H),1.94−2.06(m,1H),1.45(s,9H)。
保持時間(分)=3.575,方法[7],MS(ESI)459.2(M+H);1H NMR(300 MHz,CDCl3)δ 11.87(s,1H),8.59(dd,1H),7.65(d,2H),7.18−7.27(m,2H),7.13(d,2H),6.90(d,1H),6.72−6.78(m,3H),6.60(t,1H),6.37(t,1H),3.82−3.85(m,4H),2.95−3.13(m,6H),2.94(s,6H),2.79−2.84(m,1H),1.98−2.07(m,1H)。
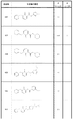
1−(4−(シクロプロピルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(78)の合成
8.1.N−(4−クロロフェニル)−1−(4−(メチルスルホニル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(79)の合成
実施例8.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から表題化合物を合成した。
9.1.N−(4−クロロフェニル)−2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(81)の合成
実施例9.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(82)
保持時間(分)=8.285,方法[6],MS(ESI)416.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.37(s,1H),8.42−8.47(m,3H),7.66(d,2H),7.62(m,1H),7.16(t,1H),6.85(d,1H),6.68(d,1H),6.48−6.57(m,2H),2.83−3.06(m,10H),2.60−2.69(m,1H),2.03−2.12(m,1H)。
保持時間(分)=4.282,方法[7],MS(ESI)433.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.11(s,1H),8.59(dd,1H),7.73(d,2H),7.71−7.75(m,2H),7.21−7.27(m,2H),7..00−7.26(m,2H),6.91(d,1H),6.73(d,1H),6.58(t,1H),6.39(t,1H),2.90−3.07(m,10H),2.76−2.87(m,1H),1.97−2.08(m,1H)。
保持時間(分)=5.915,方法[7],MS(ESI)493.1(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.56(dd,1H),7.65(d,2H),7.42(d,2H),7.19−7.23(m,2H),6.88(d,1H),6.70(d,1H),6.55(t,1H),6.36(t,1H),2.87−3.01(m,10H),2.73−2.84(m,1H),1.94−2.05(m,1H)。
10.1.N−(4−クロロフェニル)−1−(4−(4−(2−ヒドロキシエチル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(85)の合成
実施例10.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から表題化合物を合成した。保持時間(分)=5.652,方法[7],MS(ESI)581.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.22(s,1H),9.71(m,1H),8.44(dd,1H),7.75(d,2H),7.57−7.60(m,1H),7.41(d,2H),7.21(t,1H),6.93(d,1H),6.78(d,1H),6.49−58(m,2H),3.76−3.82(m,2H),3.54−3.67(m,6H),3.38−3.51(m,8H),2.85−3.32(m,6H),2.62−2.69(m,1H),2.06−2.13(m,1H)。
11.1.N−(4−クロロフェニル)−1−(4−(4−メチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(87)の合成
実施例11.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から表題化合物を合成した。MS(ESI)430.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.34(s,1H),8.56(dd,1H),8.50(d,2H),7.65(d,2H),7.19−7.26(m,2H),6.90(d,1H),6.71(d,1H),6.54(t,1H),6.38(t,1H),2.74−3.09(m,7H),2.53−2.67(m,4H),1.95−2.06(m,1H)。
12.1.1−(4−(4−アセチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(89)の合成
実施例12.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
1−(4−(4−アセチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(90)
保持時間(分)=1.528,方法[7],MS(ESI)485.2(M+H);1H NMR(300 MHz,CDCl3)δ 13.24(s,1H),8.58(dd,1H),8.50(d,2H),8.06(d,2H),7.24−7.36(m,2H),6.89(d,1H),6.75(d,1H),6.54(m,1H),6.46(t,1H),3.58−3.84(m,4H),2.93−3.09(m,6H),2.80−2.91(m,1H),2.15(s,3H),1.97−2.08(m,1H)。
保持時間(分)=8.145,方法[7],MS(ESI)528.1(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.19(s,1H),8.43(dd,1H),7.75(d,2H),7.60(m,1H),7.38(d,2H),7.20(t,1H),6.92(d,1H),6.75(d,1H),6.49−6.58(m,2H),3.24−3.27(m,4H),3.03−3.12(m,5H),2.86−2.96(m,4H),2.60−2.71(m,1H),2.08−2.12(m,1H)。
tert−ブチル2−(2−(2−(2−(4−(1−(3−(4−クロロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−イル)−2−オキソエトキシ)エトキシ)エトキシ)エチルカルバマート(92)の合成
1−(4−(4−(2−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)アセチル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(93)の合成
15.1.N−(4’−ヒドロキシビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(94)の合成
実施例15.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4’−メトキシビフェニル−4−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(95)
保持時間(分)=10.232,方法[7],MS(ESI)467.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.12(s,1H),8.58(dd,1H),7.80(d,2H),7.49−7.53(m,4H),7.16−7.26(m,2H),6.92(m,2H),6.82(d,1H),6.70(d,1H),6.60(m,1H),6.36(t,1H),3.86(s,3H),3.81(s,3H),2.91−3.09(m,2H),2.77−2.89(m,1H),1.94−2.05(m,1H)。
保持時間(分)=11.100,方法[7],MS(ESI)481.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.58(dd,1H),7.82(d,2H),7.55(d,2H),7.06−7.29(m,5H),6.82(m,2H),6.70(d,1H),6.60(m,1H),6.36(t,1H),4.06(q,2H),3.85(s,3H),2.91−3.07(m,2H),2.79−2.89(m,1H),1.96−2.05(m,1H),1.41(t,3H)。
保持時間(分)=10.286,方法[7],MS(ESI)467.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.64(dd,1H),7.85(d,2H),7.56(d,2H),7.22−7.38(m,4H),6.99−7.07(m,2H),6.78(d,1H),6.76(d,1H),6.66(m,1H),6.41(t,1H),3.91(s,3H),3.84(s,3H),2.92−3.15(m,2H),2.83−2.90(m,1H),2.00−2.11(m,1H)。
保持時間(分)=5.056,方法[7],MS(ESI)452.2(M+H);1H NMR(300 MHz,CDCl3)δ 12.16(s,1H),8.63(dd,1H),7.83(d,2H),7.55(d,2H),7.44(d,2H),7.21−7.32(m,2H),6.87(d,1H),6.75−6.79(m,3H),6.66(m,1H),6.41(t,1H),4.89(s,3H),3.91(s,3H),3.73(s,2H),2.94−3.13(m,2H),2.82−2.92(m,1H),1.99−2.10(m,1H)。
16.1.N−(4’−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(99)の合成
プロトコールK
プロトコールL
実施例16.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
N−(3’−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(100)
保持時間(分)=6.291,方法[7],MS(ESI)584.3(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.24(s,1H),8.44(dd,1H),7.78−7.82(m,4H),7.67(d,2H),7.55−7.58(m,1H),7.34(t,1H),6.88−6.95(m,2H),6.71(d,1H),6.52−6.58(m,2H),4.15−4.18(m,2H),3.81(s,3H),3.74−3.77(m,2H),3.57−3.63(m,6H),2.99−3.09(m,1H),2.92−2.95(m,2H),2.81−2.98(m,1H),2.65−2.75(m,1H),2.00−2.12(m,1H)。
保持時間(分)=8.271,方法[7],MS(ESI)453.2(M+H);1H NMR(300 MHz,DMSO−d6)δ 12.22(s,1H),9.48(s,1H),8.43(dd,1H),7.78(d,2H),7.55−7.60(m,3H),7.19−7.25(m,2H),6.92−7.06(m,3H),6.72(d,1H),6.55(m,1H),3.81(s,3H),2.91−3.09(m,1H),2.71−2.86(m,1H),2.63−2.69(m,1H),2.01−2.12(m,1H)。
tert−ブチル2−(2−(2−(4−(4−(1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド)フェノキシ)フェノキシ)エトキシ)エトキシ)−エチルカルバマート(102)の合成
N−(4−(4−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)フェノキシ)フェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(103)の合成
2−オキソ−1−(4−(ピリジン−3−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(104)の合成
1−(4−ニトロ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(105)の合成
プロトコールI
1−(4−アミノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(106)の合成
1−(4−シアノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(107)の合成
1−(4−クロロ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(108)の合成
1−(4−(メチルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(109)および1−(4−(ジメチルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(110)の合成
():MS(ESI)361.0(M+H);1H NMR(300 MHz,CDCl3)δ 12.43(s,1H),8.58(d,J=5.4 Hz,1H),8.53(d,J=3.6Hz,2H),7.71(d,J=3.6Hz,2H),7.28(overlap with CDCl3,1H),7.23(t,J=6.0Hz,1H),6.61(d,J=6.0Hz,1H),6.56(t,J=4.8 Hz,1H),6.50(d,J=6.0Hz,1H),6.40(t,J=5.4 Hz,1H),2.95(s,3H),2.75−2.90(m,3H),2.00−2.05(m,1H)。
1−(4−アセトアミド−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(111)の合成
1−(4−アミノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(140mg、1.0当量)を含むDCM(8mL)の混合物に、塩化アセチル(1.5当量)およびEt3N(2.0当量)を添加し、混合物を室温で一晩撹拌した。反応終了後、混合物を濃縮し、水を添加し、次いで、酢酸エチルで抽出した。合わせた有機層をブラインで洗浄し、MgSO4で乾燥させ、濾過し、目的の生成物が沈殿するまで蒸発させ、濾過し、いくらかのDCMで洗浄して、1−(4−アセトアミド−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(90mg、59%)を得た。MS(ESI)389.1(M+H);1H NMR(300 MHz,DMSO−d6)δ ・3.06(s,1H),9.56(s,1H),8.77(d,J=3.9 Hz,2H),8.51(d,J=4.2Hz,1H),8.27(d,J=3.9 Hz,2H),7.72(m,2H),7.23(t,J=4.5Hz,1H),6.90(d,J=4.5Hz,1H),6.55(t,J=4.2Hz,1H),6.57(t,J=4.2Hz,1H),3.05−3.15(m,1H),2.90−3.05(m,1H),2.60−2.75(m,1H),2.05−2.15(m,1H),2.11(s,3H)。
1−(4−メチル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(112)の合成
2−オキソ−1−(4−フェニル−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(113)の合成
1−(4−(メチルカルバモイル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド(114)の合成
28.1.N−(4−ブロモフェニル)−1−(4−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(115)の合成
29.1.N−(4−ブロモフェニル)−1−(4−(2−ヒドロキシエトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(117)の合成
実施例29.1に概説の手順またはそのわずかに修正したバージョンを使用して、適切な出発物質から以下の化合物を合成した。
N−(4−ブロモフェニル)−1−(4−(2−(2−(2−ヒドロキシエトキシ)エトキシ)エトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド(118)
tert−ブチル2−(2−(2−(1−(3−(ビフェニル−4−イルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イルオキシ)エトキシ)エトキシ)エチルカルバマート(120)の合成
1−(4−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ビフェニル−4−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミドトリフルオロアセタートの合成
(121)
in Vitro α4β7インテグリン接着アッセイ(MadCAM−Fcへの8866細胞接着)
本発明の化合物を、以下の細胞ベースのアッセイを使用して、天然リガンド(MadCAM)とα4β7インテグリンへの結合を競合する(すなわち、MadCAM−α4/β7インテグリン相互作用を遮断する)能力について試験した。
H/S++緩衝液:140mM NaCl、20mM HEPES、1mM CaCl2、1mM MgCl2)
アッセイ緩衝液:H/S++緩衝液(0.3%BSA含有)
8866培地のレシピ(1リットル):RPMI1640培地(Gibco)(880ml)、10%FBS(100ml)、Penn/Strep(培地アリコート)(10ml)、L−グルタミン(培地アリコート)(10ml)
A.細胞の調製、細胞の採取、および標識
8866細胞をアッセイ前日に運搬用フラスコから分注し、8866培地中にて37℃および5%CO2でインキュベートした。
300倍のマウス腹水抗HuFc(Sigma I−6260)を調製した。180μlのストックを54mlのH/S++緩衝液に添加した。100μl/ウェルを96ウェルELISAプレート(Costar 3590)に添加し、室温で1時間インキュベートした。
(a)基準化合物(ELAN 91852−8)
42.3μLの10mM(DMSO)ストックの0.7mL培地の添加によって604.08μMを調製した。この化合物をA1−A3の100%プレートに添加し、Hamiltonプログラム「α4β7 1:3」を使用して、化合物1〜3を希釈した。
(b)試験化合物
10μMの出発濃度のために、15μLの化合物を285μLのDMSOで希釈した。100%プレートのA列に三連で移し、Hamiltonを使用して1〜3を希釈した。100μMの出発濃度のために、105μL化合物を105μLのDMSOで希釈し、3倍希釈すべき100%プレートに三連で添加した。
最終濃度10μg/mlのために、作業濃度20μg/mlで21/6を調製した。20μg/mlの21/6溶液を全ての2%プレートのH4〜H12ウェルに添加した。
細胞をディープウェルに入れ、化合物を2%プレートに入れ、1%プレートをmultimekに移した。70μl/ウェルのディープウェルプレート由来の細胞を1%プレートに移し、その後に70μl/ウェルの2%プレート由来の各化合物を1%プレートに添加した(H1〜H3中に細胞や化合物は含まれない)。細胞+化合物を室温で30分間インキュベートした。
in vitro生物学評価(SRU MadCAMアッセイ)
本発明の化合物を、以下のアッセイを使用して、天然リガンド(MadCAM)とα4β7インテグリンへの結合を競合する能力について試験した。SRU Bindプラットフォームは、以下の3つのパーツからなる無標識アッセイプラットフォームである:(1)プレートベースの光バイオセンサー、(2)Bindリーダー、および(3)ソフトウェア分析パケット。このシステムは、処理量の増加、より高い感度、およびより低いアッセイ間のばらつきという面から手作業の方法を超える利点が得られる。具体的には、このアッセイは、a4b7を内因的に発現する8866細胞の固定化された組換えおよび可溶性MadCAMへの接着(ヒトIgGFcテールを有する融合タンパク質として発現した)を測定する。
細胞接着アッセイ
本発明の化合物を、細胞接着を阻害する能力について試験することができる。RPMI−8866細胞を使用して、組換え固定化可溶性MadCAM−1への接着を測定することができる。このアッセイは、Tidswell et al.,J.Immunol.(1997)159(3):1497−1505によって記載されている。
可溶性MadCAM−1 FACSアッセイ
このアッセイは、懸濁液中の組換え可溶性MadCAM−1のRPMI−8866細胞との相互作用を測定する。組換え可溶性MadCAM−1(「rsMadCAM−1」)を、ヒトIgG Fcテールを有する融合タンパク質として発現した(Tidswell et al.,J.Immunol.(1997)159(3):1497−1505)。可溶性MadCAM−lを、試験化合物の存在下および非存在下でRPMI−8866細胞と混合した。1mM MnCl2をアッセイ緩衝液中に含めて、α4β7インテグリンの活性を増加させ、且つMadCAM−1構築物とのその相互作用を促進した。室温で30分後、細胞を1mM MnCl2を含む緩衝液で洗浄し、1mM MnCl2の存在下でMadCAM−1融合タンパク質のFcテールに対する蛍光標識した抗体に4℃で30分間曝露した。細胞を洗浄し、MnCl2含有緩衝液に再懸濁し、FACS分析によって試験した。同一のアッセイを行って、組換え可溶性VCAM−1のα4β1を発現する細胞(JurkatT細胞株など)との相互作用を測定することができる。
無細胞ELISAアッセイ
このアッセイは、可溶化インテグリンのプラスチック表面に固定したMadCAM−1との相互作用を測定する。RPMI−8866細胞を界面活性剤で溶解して、α4β7インテグリンを可溶化した。β7インテグリン(2G3)に対する抗体を、溶解物に添加した。Tidswell et al.J.Immunol.(1997)159(3):1497−l505を参照のこと。この抗体は、以下の2つの目的を果たす。第1に、アッセイにおいてα4β7インテグリンを検出することができるタグであり、第2に、2G3は、β7インテグリンのリガンド占有高次構造を安定化し、β7インテグリン依存性相互作用を促進する抗体である。細胞溶解物2G3および試験化合物を、MadCAM−1でコーティングしたマイクロタイターウェルに添加した。混合物を室温で30分間インキュベートした。プレートを洗浄し、1%BSAでブロッキングし、MadCAM結合α4β7インテグリンに関連する2G3を認識するHRP抱合ヤギ抗マウスIgに曝露した。室温で30分後、ウェルを洗浄し、HRPの基質に曝露してα4β7インテグリンのMadCAM−1への結合量を定量した。
受容体占有についてのFACSアッセイ
このアッセイは、抗体2G3のRPMI−8866細胞またはリンパ球との相互作用を測定する。抗体は、ラットまたはヒトβ7インテグリンのいずれかのリガンド占有エピトープを認識する。漸増濃度の小分子リガンドは、β7インテグリン上の2G3エピトープを誘導し、より高いレベルで抗体を細胞表面に結合させるであろう。受容体占有に必要なリガンド濃度は、リガンドのα4β7インテグリンに対する親和性に直接関連する。リガンドのα4β1インテグリンとの相互作用を試験するための類似のアッセイが記載されており、このアッセイはβ1インテグリンのリガンド占有エピトープに対する類似の抗体(抗体15/7;Yednock et al.(1995)JBC 270:28740−50)を使用する。β1インテグリンアッセイは、α4β7インテグリンよりもむしろα4β1インテグリンを発現する細胞(Jurkat細胞など)に依存する。両方のアッセイでは、適切な細胞を、小分子リガンドの存在下で2G3または15/7のいずれかと混合する。細胞を室温で30分間インキュベートし、洗浄して非結合抗体を除去する。細胞を、マウスIgGに対する蛍光標識抗体(細胞関連2G3または15/7を検出する)に曝露し、細胞をFACS分析によって試験する。
ex vivo細胞接着アッセイ
このアッセイは、パイエル板(腸に関連するリンパ組織)の組織切片中に曝露した高内皮細静脈へのリンパ球またはRPMI−8866細胞の接着を測定する。これらの血管は、高レベルのMadCAM−lを発現する。このアッセイは、Yednock et al.,JCB(1987)104:725−731によって記載されている。
in vivo遊走アッセイ
in vivoでのIn111標識または蛍光標識したリンパ球のパイエル板への遊走。このアッセイでは、リンパ球を、第1の動物群から単離し、放射性トレーサーまたは蛍光トレーサーで標識する。細胞を、第2の動物群に静脈内注射する。1〜24時間後、標識した細胞の異なる組織への局在化を、ガンマカウンターにおける異なる細胞に関連する放射能数の決定または組織からのリンパ球の単離および蛍光タグを保有する細胞数の決定(FACS分析によって決定)のいずれかによってモニタリングすることができる。このアッセイ型は、Rosen et al.,J.Immunol.1989,142:1895−1902によって記載されている。
in vivo生物学評価(喘息モデル)
α4β1インテグリンによって媒介される炎症状態には、例えば、好酸球流入、気道過敏症、および慢性喘息を伴って生じる閉塞が含まれる。以下に、喘息処置で用いる本発明の化合物のin vivo効果を研究するために使用される喘息動物モデルを記載する。
Chapman,et al.,Am J.Resp.Crit.Care Med.,153−4,A219(1996)およびChapman,et al.,Am.J.Resp.Crit.Care Med.155:4,A881(1997)(その両方全体が本明細書中で参考として援用される)に記載の手順に従う。
Kung,et al.,Am J.Respir.Cell Mol.Biol.,13:360−365,(1995)およびSchneider,et al.,(1999).Am J.Respir.Cell Mol.Biol.20:448−457,(1999)(その全体が本明細書中で参考としてそれぞれ援用される)に記載された手順にしたがった急性肺炎症のマウスモデルでも化合物を評価する。雌Black/6マウス(8〜12週齢)を、20μgのオバ(グレード4、Sigma)および2mg イムジェクトアルム(inject Alum)(Pierce)を含む0.2mLオバ/アルム混合物の腹腔内注射によって1日目に感作する。14日目に追加抗原注射を行う。28日目および29日目にマウスにエアロゾル化した1%オバ(0.9%生理食塩水中)を20分間使用する攻撃誘発を行う。30日目(最初の攻撃誘発の48時間後)に、マウスを安楽死させ、気管支肺胞洗浄(bronchaveolar lavage)サンプル(3mL)を回収する。好酸球を、FACS/FITC染色法によって定量する。本発明の化合物を0.5%カルボキシメチルセルロースおよび2%ツウィーン80懸濁液に処方し、アレルゲン(オボアルブミン)に対して感作したマウスに経口投与する。能動感作したC57BL/6マウスの気道中のアレルゲン誘導された白血球蓄積を阻害した化合物を、このモデルにおいて活性と見なす。
このモデルは、Abraham,et al.,J.Clin,Invest,93:776−787(1994)およびAbraham,et al.,Am J.Respir.Crit.Care Med.,156:696−703(1997)(その両方全体が本明細書中で参考として援用される)によって記載の手順を使用する。本発明の化合物を、ブタ回虫抗原に過敏性を示すヒツジへの静脈内投与(生理食塩水溶液)、経口投与(2%ツウィーン80、0.5%カルボキシメチルセルロース)、およびエアロゾル投与によって評価する。初期抗原誘導性気管支応答を減少させ、そして/または晩期気道応答(例えば、抗原誘導性晩期応答に対する防御効果を有する)および気道過敏症(「AHR」)を遮断する化合物を、このモデルにおいて活性と見なす。
濃度30.0mg/mLの化合物を含む0.5%重炭酸ナトリウム/生理食塩水(w/v)の溶液を、以下の手順にしたがって調製する。
1.0.5g重炭酸ナトリウムを100mLメスフラスコに添加する。
2.およそ90.0mL生理食塩水を添加し、溶解するまで超音波処理する。
3.生理食塩水を用いて100.0mLまで適量を添加し、完全に混合する。
1.0.300gの化合物を10.0mLメスフラスコに添加する。
2.およそ9.7mLの0.5%重炭酸ナトリウム/生理食塩水ストック溶液を添加する。
3.化合物が完全に溶解するまで超音波処理する。
4.0.5%重炭酸ナトリウム/生理食塩水ストック溶液を使用して10.0mLまで適量を添加し、完全に混合する。
in vivo生物学評価(関節炎)
40.1.ラットにおけるアジュバント誘発関節炎
アジュバント誘発関節炎(「AIA」)は、ルイスラットの尾基部への結核菌の注射によって誘導された関節リウマチ(「RA」)の研究で有用な動物モデルである。注射から10日後と15日後との間に、動物は重症で進行性の関節炎を発症する。
ラットのII型コラーゲン関節炎の発症時に起こる炎症、軟骨破壊、および骨吸収の阻害の測定によって、この動物モデルにおいて本発明の化合物を試験することができる。
−1日目に投与を開始した。馴化動物をイソフルランで麻酔し、コラーゲン注射を行った(D0)。6日目に、第2のコラーゲン注射のために、動物を再度麻酔した。コラーゲンを、4mg/mLの0.01N酢酸溶液の作製によって調製した。等体積のコラーゲンおよびフロント不完全アジュバントを、この材料のビーズが水にいれた場合にその形態を保持するまでの手作業での混合によって乳化した。各動物に、300μLの混合物を各時間に背部の3部位に広げた。9日目に、正常な(疾患前)右および左の足関節をカリパスで測定した。10〜12日目に、関節炎を発症した。
関節の処理
1〜2日間の固定および4〜5日間の脱灰後、足関節を長手方向に半分に切断し、膝関節を前平面に半分に切断し、処理し、包埋し、切片にし、トルイジンブルーで染色した。
in vivo生物学評価(結腸炎)
HLA−B27ラットにおける結腸炎の誘導
結腸炎の逆転における本発明の化合物の有効性を、HLA−B27トランスジェニックラットにおいて決定した。HLA−B27トランスジェニックラットは、ヒトのクローン病を模倣する炎症性腸疾患の動物モデルとして使用されている。このラットは、ヒトMHCクラスI HLA−B27重鎖およびβ−2ミクログロブリンタンパク質(種々の自己免疫疾患(結腸の炎症が含まれる)を誘導する)を過剰発現する。
20匹のHLA−B27(6〜9週齢)トランスジェニックラットを、Taconicから注文した。ラットを、動物施設に10週間馴化させた。「汚れた」環境微生物叢を調節するために、異なるケージ由来の動物用床敷きを週1回混合した。一定の本発明の化合物は、マウスにおけるカイニン酸誘導性ホスホ−cJun上方制御を阻害する。
本発明は、例えば以下の項目を提供する。
(項目1) 式(Ia):
mは0〜4から選択される整数であり、
nは0〜3から選択される整数であり、
pは0〜4から選択される整数であり、
環Aは、置換または非置換のアリールおよび置換または非置換のヘテロアリールから選択されるメンバーであり、
Cyは、置換または非置換の(C 3 〜C 10 )シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、および置換または非置換のヘテロアリールから選択されるメンバーであり、
各R 1 および各R 2 は、H、置換または非置換の(C 1 〜C 10 )アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換の(C 3 〜C 10 )シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、ニトロ、CN、ハロゲン、OR 12 、SR 12 、NR 12 R 13 、C(O)R 14 、C(O)NR 12 R 13 、OC(O)NR 12 R 13 、C(O)OR 12 、NR 15 C(O)R 14 、NR 15 C(O)OR 12 、NR 15 C(O)NR 12 R 13 、NR 15 C(S)NR 12 R 13 、NR 15 S(O) 2 R 14 、S(O) 2 NR 12 R 13 、およびS(O) z R 14 から独立して選択されるメンバーであり、
zは1または2であり、
R 12 、R 13 、およびR 15 は、H、アシル、置換または非置換の(C 1 〜C 10 )アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、置換または非置換の(C 3 〜C 10 )シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキルから独立して選択されるメンバーであり、
R 14 は、置換または非置換の(C 1 〜C 10 )アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、置換または非置換の(C 3 〜C 10 )シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキルから独立して選択されるメンバーであり、
R 12 およびR 13 は、これらと結合する窒素原子と共に任意選択的に連結して4〜7員環を形成し、
2つの隣接するR 1 は、これらと結合する原子と共に任意選択的に連結して5〜7員環を形成し、
2つの隣接するR 2 は、これらと結合する原子と共に任意選択的に連結して5〜7員環を形成し、
R 3 、R 4 、およびR 5 は、H、置換または非置換の(C 1 〜C 4 )アルキル、ハロゲン、およびCNから独立して選択されるメンバーであり、
R 6 は、Hおよび置換または非置換の(C 1 〜C 4 )アルキルから選択されるメンバーである)の構造を有する化合物またはその塩、溶媒和物、単一の立体異性体、もしくは立体異性体の混合物。
(項目2) 環Aは、フェニルおよびチオフェンから選択されるメンバーである、項目1に記載の化合物。
(項目3) R 3 、R 4 、およびR 5 は、HおよびFからそれぞれ独立して選択される、項目1または2に記載の化合物。
(項目4) nは1である、項目1、2、または3に記載の化合物。
(項目5) R 6 はHである、項目1、2、3、または4に記載の化合物。
(項目6) 前記化合物は、式(IVa):
qは0〜4から選択される整数であり、
Cy、R 1 、R 2 、およびmは項目1に定義の通りである)の構造を有する、項目1に記載の化合物またはその塩もしくは溶媒和物。
(項目7) 前記化合物は、式(IVb)または式(IVc):
(項目8) Cyは、置換または非置換のフェニルおよび置換または非置換のピリジルから選択されるメンバーである、前記項目のいずれか1項に記載の化合物。
(項目9) 前記化合物は、式(XII):
環A、R 1 、R 2 、R 3 、R 4 、R 5 、R 6 、m、n、およびpは項目1に定義の通りであり、
sは0〜4から選択される整数であり、
X 7 はCR 16 およびNから選択されるメンバーであり、
各R 16 は、H、置換または非置換の(C 1 〜C 10 )アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換の(C 3 〜C 10 )シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、CN、ハロゲン、OR 17 、SR 17 、NR 17 R 18 、C(O)R 19 、C(O)NR 17 R 18 、OC(O)NR 17 R 18 、C(O)OR 17 、NR 20 C(O)R 19 、NR 20 C(O)OR 17 、NR 20 C(O)NR 17 R 18 、NR 20 C(S)NR 17 R 18 、NR 20 S(O) 2 R 19 、S(O) 2 NR 17 R 18 、およびS(O) p R 19 から独立して選択されるメンバーであり、
pは1または2であり、
R 17 、R 18 、およびR 20 は、H、置換または非置換のC 1 〜C 10 アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のC 3 〜C 10 シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、および置換または非置換のヘテロアリールから独立して選択されるメンバーであり、R 17 およびR 18 は、これらと結合する窒素原子と共に任意選択的に連結して5〜7員環を形成し、
R 19 は、置換または非置換のC 1 〜C 10 アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のC 3 〜C 10 シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、および置換または非置換のヘテロアリールから独立して選択されるメンバーであり、
2つの隣接するR 16 は、これらと結合する原子と共に任意選択的に連結して5〜7員環を形成する)の構造を有する、項目1に記載の化合物またはその塩もしくは溶媒和物。
(項目10) R 6 はHである、項目9に記載の化合物。
(項目11) R 3 、R 4 、およびR 5 は、HおよびFからそれぞれ独立して選択される、項目9または10に記載の化合物。
(項目12) nは1である、項目9、10、または11に記載の化合物。
(項目13) 環Aは、フェニルおよびチオフェンから選択されるメンバーである、項目9、10、11、または12に記載の化合物。
(項目14) 前記化合物は、式(XIIb):
(項目15) R 16 は、置換または非置換のフェニル、ハロゲン、およびOR 17 から選択されるメンバーであり、R 17 は項目9に定義の通りである、項目9から14のいずれか1項に記載の化合物。
(項目16) 前記化合物は、式(XIIc)または式(XIId):
R 16a は、ハロゲン、置換または非置換のフェニル、および置換または非置換のフェニルオキシから選択されるメンバーである)の構造を有する、項目9に記載の化合物またはその塩もしくは溶媒和物。
(項目17) 各R 1 は、H、(C 1 〜C 4 )アルキル、CN、およびハロゲンから独立して選択されるメンバーである、前記項目のいずれか1項に記載の化合物。
(項目18) 各R 2 は、H、置換または非置換のフェニル、NR 12 R 13 、置換または非置換のピリジル、置換または非置換のシクロプロピル、OR 12 、SR 12 、ハロゲン、およびCNから選択されるメンバーである、前記項目のいずれか1項に記載の化合物。
(項目19)(R)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
(S)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
(S)−N−(4−クロロフェニル)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
(R)−N−(4−クロロフェニル)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−((1S,2R)−2−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−((1S,2R)−2−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−((1R,2S)−2−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−((1R,2S)−2−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(6−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(6−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(5−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(6−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(6−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(6−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(7−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(7−クロロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(3−メチル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(3−メチル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−フェノキシフェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−イソプロポキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−イソプロポキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−フェノキシフェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−フェノキシフェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−(トリフルオロメトキシ)フェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−シクロヘキシル−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−フルオロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ヨードフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−フェニル−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4,4−ジフルオロシクロヘキシル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3,4−ジフルオロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−(4−メトキシフェノキシ)フェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−シクロプロピル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−シクロプロピル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(7,8−ジヒドロ−6H−インデノ[5,4−d][1,3]ジオキソール−6−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(7,8−ジヒドロ−6H−インデノ[5,4−d][1,3]ジオキソール−6−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−2−オキソ−1−(4−(トリフルオロメトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
2−オキソ−N−(ピリジン−4−イル)−1−(4−(トリフルオロメトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(メチルチオ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル4−(1−(2−オキソ−3−(ピリジン−4−イルカルバモイル)ピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート;
tert−ブチル4−(1−(3−(4−クロロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−フェノキシフェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−フルオロフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−シクロヘキシル−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ヨードフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−p−トリル−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−フェニル−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−フェニル−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4,4−ジフルオロシクロヘキシル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−メトキシフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−(ジフルオロメトキシ)フェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−(トリフルオロメトキシ)フェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−(トリフルオロメチル)フェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−シアノフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(4−ヒドロキシピペリジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−ヒドロキシピペリジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−(4−メトキシフェニルアミノ)フェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3,4−ジフルオロフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル4−(1−(3−(4−フルオロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート;
tert−ブチル4−(1−(3−(4−クロロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート;
N−(4−(ジメチルアミノ)フェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(シクロプロピルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(メチルスルホニル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(メチルスルホニル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−フルオロフェニル)−2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−(2−ヒドロキシエチル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−(2−(2−(2−ヒドロキシエトキシ)エトキシ)エチル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−メチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(4−メチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(4−アセチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(4−アセチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−(メチルスルホニル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル2−(2−(2−(2−(4−(1−(3−(4−クロロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−イル)−2−オキソエトキシ)エトキシ)エトキシ)エチルカルバマート;
1−(4−(4−(2−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)アセチル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4’−ヒドロキシビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4’−メトキシビフェニル−4−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3’−エトキシビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(2’−メトキシビフェニル−4−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4’−アミノビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4’−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3’−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3’−ヒドロキシビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル2−(2−(2−(4−(4−(1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド)フェノキシ)フェノキシ)エトキシ)エトキシ)−エチルカルバマート;
N−(4−(4−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)フェノキシ)フェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
2−オキソ−1−(4−(ピリジン−3−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ニトロ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−アミノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−シアノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−クロロ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(メチルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(ジメチルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−アセトアミド−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メチル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
2−オキソ−1−(4−フェニル−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(メチルカルバモイル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−(2−ヒドロキシエトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−(2−(2−(2−ヒドロキシエトキシ)エトキシ)エトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−(2−(2−(2−ヒドロキシエトキシ)エトキシ)エトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル2−(2−(2−(1−(3−(ビフェニル−4−イルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イルオキシ)エトキシ)エトキシ)エチルカルバマート;および
1−(4−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ビフェニル−4−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミドトリフルオロアセタート
からなる群から選択される化合物またはその塩もしくは溶媒和物。
(項目20) 前記項目のいずれか1項に記載の化合物および薬学的に許容可能なキャリアを含む薬学的組成物。
(項目21) 炎症性疾患の処置方法であって、薬学的有効量の項目1から19のいずれか1項に記載の化合物または項目20に記載の組成物を炎症性疾患の処置を必要とする哺乳動物被験体に投与する工程を含む、方法。
(項目22) 前記炎症性疾患が、クローン病および潰瘍性大腸炎から選択されるメンバーである、項目21に記載の方法。
(項目23) α4β1またはα4β7インテグリンのインテグリンリガンドへの結合を測定するin vitroアッセイにおける、項目1から19のいずれか1項に記載の化合物の使用。
(項目24) 前記インテグリンリガンドが、フィブロネクチン(FN)、VCAM−1、オステオポンチン、およびMadCAMから選択されるメンバーである、項目23に記載の使用。
(項目25) 前記アッセイが、
(iv)前記リガンドの表面への結合、
(v)前記化合物の存在下での該リガンドの前記インテグリンを発現する細胞との接触、および
(vi)該表面への細胞の結合量の測定
を含む、項目23または24に記載の使用。
(項目26) 候補分子の存在下での前記化合物のα4β1またはα4β7インテグリンへの結合を測定するin vitroアッセイにおける、項目1から19のいずれか1項に記載の化合物の使用。
(項目27) α4β1またはα4β7インテグリンに結合することができる候補分子の同定のためのin vitroアッセイにおける、項目1から19のいずれか1項に記載の化合物の使用。
(項目28) 前記アッセイが競合結合アッセイである、項目23から27のいずれか1項に記載の使用。
Claims (28)
- 式(Ia):
mは0〜4から選択される整数であり、
nは0〜3から選択される整数であり、
pは0〜4から選択される整数であり、
環Aは、置換または非置換のアリールおよび置換または非置換のヘテロアリールから選択されるメンバーであり、
Cyは、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、および置換または非置換のヘテロアリールから選択されるメンバーであり、
各R1および各R2は、H、置換または非置換の(C1〜C10)アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、ニトロ、CN、ハロゲン、OR12、SR12、NR12R13、C(O)R14、C(O)NR12R13、OC(O)NR12R13、C(O)OR12、NR15C(O)R14、NR15C(O)OR12、NR15C(O)NR12R13、NR15C(S)NR12R13、NR15S(O)2R14、S(O)2NR12R13、およびS(O)zR14から独立して選択されるメンバーであり、
zは1または2であり、
R12、R13、およびR15は、H、アシル、置換または非置換の(C1〜C10)アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキルから独立して選択されるメンバーであり、
R14は、置換または非置換の(C1〜C10)アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキルから独立して選択されるメンバーであり、
R12およびR13は、これらと結合する窒素原子と共に任意選択的に連結して4〜7員環を形成し、
2つの隣接するR1は、これらと結合する原子と共に任意選択的に連結して5〜7員環を形成し、
2つの隣接するR2は、これらと結合する原子と共に任意選択的に連結して5〜7員環を形成し、
R3、R4、およびR5は、H、置換または非置換の(C1〜C4)アルキル、ハロゲン、およびCNから独立して選択されるメンバーであり、
R6は、Hおよび置換または非置換の(C1〜C4)アルキルから選択されるメンバーである)の構造を有する化合物またはその塩、溶媒和物、単一の立体異性体、もしくは立体異性体の混合物。 - 環Aは、フェニルおよびチオフェンから選択されるメンバーである、請求項1に記載の化合物。
- R3、R4、およびR5は、HおよびFからそれぞれ独立して選択される、請求項1または2に記載の化合物。
- nは1である、請求項1、2、または3に記載の化合物。
- R6はHである、請求項1、2、3、または4に記載の化合物。
- Cyは、置換または非置換のフェニルおよび置換または非置換のピリジルから選択されるメンバーである、前記請求項のいずれか1項に記載の化合物。
- 前記化合物は、式(XII):
環A、R1、R2、R3、R4、R5、R6、m、n、およびpは請求項1に定義の通りであり、
sは0〜4から選択される整数であり、
X7はCR16およびNから選択されるメンバーであり、
各R16は、H、置換または非置換の(C1〜C10)アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換の(C3〜C10)シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、置換または非置換のヘテロアリール、CN、ハロゲン、OR17、SR17、NR17R18、C(O)R19、C(O)NR17R18、OC(O)NR17R18、C(O)OR17、NR20C(O)R19、NR20C(O)OR17、NR20C(O)NR17R18、NR20C(S)NR17R18、NR20S(O)2R19、S(O)2NR17R18、およびS(O)pR19から独立して選択されるメンバーであり、
pは1または2であり、
R17、R18、およびR20は、H、置換または非置換のC1〜C10アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のC3〜C10シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、および置換または非置換のヘテロアリールから独立して選択されるメンバーであり、R17およびR18は、これらと結合する窒素原子と共に任意選択的に連結して5〜7員環を形成し、
R19は、置換または非置換のC1〜C10アルキル、置換または非置換の2〜10員のヘテロアルキル、置換または非置換のC3〜C10シクロアルキル、置換または非置換の3〜10員のヘテロシクロアルキル、置換または非置換のアリール、および置換または非置換のヘテロアリールから独立して選択されるメンバーであり、
2つの隣接するR16は、これらと結合する原子と共に任意選択的に連結して5〜7員環を形成する)の構造を有する、請求項1に記載の化合物またはその塩もしくは溶媒和物。 - R6はHである、請求項9に記載の化合物。
- R3、R4、およびR5は、HおよびFからそれぞれ独立して選択される、請求項9または10に記載の化合物。
- nは1である、請求項9、10、または11に記載の化合物。
- 環Aは、フェニルおよびチオフェンから選択されるメンバーである、請求項9、10、11、または12に記載の化合物。
- R16は、置換または非置換のフェニル、ハロゲン、およびOR17から選択されるメンバーであり、R17は請求項9に定義の通りである、請求項9から14のいずれか1項に記載の化合物。
- 各R1は、H、(C1〜C4)アルキル、CN、およびハロゲンから独立して選択されるメンバーである、前記請求項のいずれか1項に記載の化合物。
- 各R2は、H、置換または非置換のフェニル、NR12R13、置換または非置換のピリジル、置換または非置換のシクロプロピル、OR12、SR12、ハロゲン、およびCNから選択されるメンバーである、前記請求項のいずれか1項に記載の化合物。
- (R)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
(S)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
(S)−N−(4−クロロフェニル)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
(R)−N−(4−クロロフェニル)−1−(2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−((1S,2R)−2−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−((1S,2R)−2−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−((1R,2S)−2−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−((1R,2S)−2−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(6−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(6−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(5−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(6−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(6−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(6−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(7−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(7−クロロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(3−メチル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(3−メチル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−フェノキシフェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−イソプロポキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−イソプロポキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−フェノキシフェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−フェノキシフェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ブロモ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−(トリフルオロメトキシ)フェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−シクロヘキシル−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−フルオロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ヨードフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−フェニル−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4,4−ジフルオロシクロヘキシル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3,4−ジフルオロフェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−(4−メトキシフェノキシ)フェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−シクロプロピル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−シクロプロピル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(7,8−ジヒドロ−6H−インデノ[5,4−d][1,3]ジオキソール−6−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(7,8−ジヒドロ−6H−インデノ[5,4−d][1,3]ジオキソール−6−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−2−オキソ−1−(4−(トリフルオロメトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
2−オキソ−N−(ピリジン−4−イル)−1−(4−(トリフルオロメトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(メチルチオ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル4−(1−(2−オキソ−3−(ピリジン−4−イルカルバモイル)ピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート;
tert−ブチル4−(1−(3−(4−クロロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−フェノキシフェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−フルオロフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−シクロヘキシル−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ヨードフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−p−トリル−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−フェニル−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−フェニル−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4,4−ジフルオロシクロヘキシル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−メトキシフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−(ジフルオロメトキシ)フェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−(トリフルオロメトキシ)フェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(4−(トリフルオロメチル)フェニル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−シアノフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(4−ヒドロキシピペリジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−ヒドロキシピペリジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−(4−メトキシフェニルアミノ)フェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3,4−ジフルオロフェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル4−(1−(3−(4−フルオロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート;
tert−ブチル4−(1−(3−(4−クロロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−カルボキシラート;
N−(4−(ジメチルアミノ)フェニル)−1−(4−モルホリノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(シクロプロピルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(メチルスルホニル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(メチルスルホニル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−フルオロフェニル)−2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−2−オキソ−1−(4−(ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−(2−ヒドロキシエチル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−(2−(2−(2−ヒドロキシエトキシ)エトキシ)エチル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−メチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(4−メチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(4−アセチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(4−アセチルピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−クロロフェニル)−1−(4−(4−(メチルスルホニル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル2−(2−(2−(2−(4−(1−(3−(4−クロロフェニルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イル)ピペラジン−1−イル)−2−オキソエトキシ)エトキシ)エトキシ)エチルカルバマート;
1−(4−(4−(2−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)アセチル)ピペラジン−1−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4−クロロフェニル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4’−ヒドロキシビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(4’−メトキシビフェニル−4−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3’−エトキシビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−N−(2’−メトキシビフェニル−4−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4’−アミノビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4’−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3’−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)ビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(3’−ヒドロキシビフェニル−4−イル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル2−(2−(2−(4−(4−(1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド)フェノキシ)フェノキシ)エトキシ)エトキシ)−エチルカルバマート;
N−(4−(4−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)フェノキシ)フェニル)−1−(4−メトキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
2−オキソ−1−(4−(ピリジン−3−イル)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−ニトロ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−アミノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−シアノ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−クロロ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(メチルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(ジメチルアミノ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−アセトアミド−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−メチル−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
2−オキソ−1−(4−フェニル−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
1−(4−(メチルカルバモイル)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−N−(ピリジン−4−イル)−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−ヒドロキシ−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−(2−ヒドロキシエトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(4−ブロモフェニル)−1−(4−(2−(2−(2−ヒドロキシエトキシ)エトキシ)エトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
N−(ビフェニル−4−イル)−1−(4−(2−(2−(2−ヒドロキシエトキシ)エトキシ)エトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミド;
tert−ブチル2−(2−(2−(1−(3−(ビフェニル−4−イルカルバモイル)−2−オキソピリジン−1(2H)−イル)−2,3−ジヒドロ−1H−インデン−4−イルオキシ)エトキシ)エトキシ)エチルカルバマート;および
1−(4−(2−(2−(2−アミノエトキシ)エトキシ)エトキシ)−2,3−ジヒドロ−1H−インデン−1−イル)−N−(ビフェニル−4−イル)−2−オキソ−1,2−ジヒドロピリジン−3−カルボキサミドトリフルオロアセタート
からなる群から選択される化合物またはその塩もしくは溶媒和物。 - 前記請求項のいずれか1項に記載の化合物および薬学的に許容可能なキャリアを含む薬学的組成物。
- 炎症性疾患の処置方法であって、薬学的有効量の請求項1から19のいずれか1項に記載の化合物または請求項20に記載の組成物を炎症性疾患の処置を必要とする哺乳動物被験体に投与する工程を含む、方法。
- 前記炎症性疾患が、クローン病および潰瘍性大腸炎から選択されるメンバーである、請求項21に記載の方法。
- α4β1またはα4β7インテグリンのインテグリンリガンドへの結合を測定するin vitroアッセイにおける、請求項1から19のいずれか1項に記載の化合物の使用。
- 前記インテグリンリガンドが、フィブロネクチン(FN)、VCAM−1、オステオポンチン、およびMadCAMから選択されるメンバーである、請求項23に記載の使用。
- 前記アッセイが、
(iv)前記リガンドの表面への結合、
(v)前記化合物の存在下での該リガンドのインテグリンを発現する細胞との接触、および
(vi)該表面への細胞の結合量の測定
を含む、請求項23または24に記載の使用。 - 候補分子の存在下での前記化合物のα4β1またはα4β7インテグリンへの結合を測定するin vitroアッセイにおける、請求項1から19のいずれか1項に記載の化合物の使用。
- α4β1またはα4β7インテグリンに結合することができる候補分子の同定のためのin vitroアッセイにおける、請求項1から19のいずれか1項に記載の化合物の使用。
- 前記アッセイが競合結合アッセイである、請求項23から27のいずれか1項に記載の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US17287609P | 2009-04-27 | 2009-04-27 | |
| US61/172,876 | 2009-04-27 | ||
| PCT/US2010/032632 WO2010126914A1 (en) | 2009-04-27 | 2010-04-27 | Pyridinone antagonists of alpha-4 integrins |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012525336A true JP2012525336A (ja) | 2012-10-22 |
| JP2012525336A5 JP2012525336A5 (ja) | 2013-06-13 |
Family
ID=42235905
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012507475A Pending JP2012525336A (ja) | 2009-04-27 | 2010-04-27 | α−4インテグリンのピリジノンアンタゴニスト |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US8367836B2 (ja) |
| EP (1) | EP2424841A1 (ja) |
| JP (1) | JP2012525336A (ja) |
| CN (1) | CN102459179A (ja) |
| AU (1) | AU2010241742A1 (ja) |
| BR (1) | BRPI1015259A2 (ja) |
| CA (1) | CA2760151A1 (ja) |
| IL (1) | IL215956A0 (ja) |
| MX (1) | MX2011011326A (ja) |
| SG (2) | SG10201401836RA (ja) |
| WO (1) | WO2010126914A1 (ja) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8304413B2 (en) | 2008-06-03 | 2012-11-06 | Intermune, Inc. | Compounds and methods for treating inflammatory and fibrotic disorders |
| NZ605692A (en) | 2010-07-29 | 2015-04-24 | Rigel Pharmaceuticals Inc | Ampk-activating heterocyclic compounds and methods for using the same |
| KR101317656B1 (ko) * | 2011-06-30 | 2013-10-15 | 연세대학교 산학협력단 | 복제효소 인산화를 조절하는 신규 c형 간염 예방 또는 치료용 조성물 |
| EP2562174A1 (de) * | 2011-08-24 | 2013-02-27 | Bayer Cropscience AG | Herbizid wirksame 6-Oxo-1,6-dihydropyrimidin-5-carboxamide und 2-Oxo-1,2-dihydropyridin-3-carboxamide |
| DK2810937T3 (en) * | 2012-01-31 | 2017-03-13 | Daiichi Sankyo Co Ltd | PYRIDONE DERIVATIVES |
| US9375005B2 (en) * | 2012-05-09 | 2016-06-28 | Bayer Cropscience Ag | 5-halogenopyrazole indanyl carboxamides |
| AR092742A1 (es) | 2012-10-02 | 2015-04-29 | Intermune Inc | Piridinonas antifibroticas |
| EP3126362B1 (en) | 2014-04-02 | 2022-01-12 | Intermune, Inc. | Anti-fibrotic pyridinones |
| TWI723572B (zh) | 2014-07-07 | 2021-04-01 | 日商第一三共股份有限公司 | 具有四氫吡喃基甲基之吡啶酮衍生物及其用途 |
| WO2019200114A1 (en) * | 2018-04-12 | 2019-10-17 | Arbutus Biopharma Corporation | Methods for preparing substituted dihydroindene-4-carboxamide compounds |
| US11174256B2 (en) | 2018-10-30 | 2021-11-16 | Gilead Sciences, Inc. | Imidazopyridine derivatives |
| CR20210213A (es) | 2018-10-30 | 2021-06-24 | Gilead Sciences Inc | Derivados de quinolina como inhibidores de la integrina alfa4beta7 |
| AU2019373245C1 (en) | 2018-10-30 | 2022-10-27 | Gilead Sciences, Inc. | Compounds for inhibition of alpha 4β7 integrin |
| JP7189368B2 (ja) | 2018-10-30 | 2022-12-13 | ギリアード サイエンシーズ, インコーポレイテッド | アルファ4ベータ7インテグリンの阻害のための化合物 |
| SG11202109392YA (en) * | 2019-02-28 | 2021-09-29 | Kezar Life Sciences | Thiazole derivatives as protein secretion inhibitors |
| EP4005637A4 (en) * | 2019-07-29 | 2023-07-19 | Takeda Pharmaceutical Company Limited | HETEROCYCLIC COMPOUND |
| AU2020329207B2 (en) | 2019-08-14 | 2024-02-29 | Gilead Sciences, Inc. | Compounds for inhibition of alpha 4 beta 7 integrin |
| JP2024505258A (ja) * | 2021-02-02 | 2024-02-05 | エルジー・ケム・リミテッド | タンパク質キナーゼ阻害剤としての新規な化合物 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002544161A (ja) * | 1999-05-07 | 2002-12-24 | テキサス・バイオテクノロジー・コーポレイシヨン | インテグリンのその受容体への結合を阻害するカルボン酸誘導体 |
| WO2004046122A2 (en) * | 2002-11-16 | 2004-06-03 | Oxford Glycosciences (Uk) Ltd | Benzoxazole, benzthiazole and benzimidazole acid derivatives and their use as heparanase inhibitors |
| WO2007008541A2 (en) * | 2005-07-08 | 2007-01-18 | Kalypsys, Inc. | Cellular cholesterol absorption modifiers |
| JP2007505901A (ja) * | 2003-09-18 | 2007-03-15 | アストラゼネカ・アクチエボラーグ | 好中球エラスターゼ阻害剤としての2−ピリドン誘導体およびそれらの使用 |
| WO2009032277A1 (en) * | 2007-09-06 | 2009-03-12 | Schering Corporation | Gamma secretase modulators |
| JP2009526761A (ja) * | 2006-01-30 | 2009-07-23 | アレイ バイオファーマ、インコーポレイテッド | ヘテロ二環式チオフェン化合物および使用の方法 |
Family Cites Families (84)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2525656A1 (de) | 1974-06-19 | 1976-01-15 | Sandoz Ag | Verfahren zur herstellung neuer heterocyclischer verbindungen |
| US4046876A (en) * | 1974-11-08 | 1977-09-06 | Mitsubishi Chemical Industries Limited | N2 -alkoxynaphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| US4096255A (en) * | 1974-11-08 | 1978-06-20 | Mitsubishi Chemical Industries Limited | N2 -naphthalenesulfonyl-L-argininamides, and pharmaceutical salts, compositions and methods |
| US4041156A (en) * | 1974-11-08 | 1977-08-09 | Mitsubishi Chemical Industries Limited | N2 -alkoxynaphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| US4018915A (en) * | 1976-01-05 | 1977-04-19 | Mitsubishi Chemical Industries Ltd. | N2 -alkoxynaphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| US4070457A (en) * | 1974-11-08 | 1978-01-24 | Mitsubishi Chemical Industries Ltd. | N2 -naphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| US4073914A (en) * | 1974-11-08 | 1978-02-14 | Mitsubishi Chemical Industries Limited | N2 -naphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| US4055651A (en) * | 1974-11-08 | 1977-10-25 | Mitsubishi Chemical Industries Ltd. | N2 -alkoxynaphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| US4055636A (en) * | 1974-11-08 | 1977-10-25 | Mitsubishi Chemical Industries Ltd. | N2 -alkoxynaphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| US4104392A (en) * | 1974-11-08 | 1978-08-01 | Mitsubishi Chemical Industries Ltd. | N2 -naphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof, and antithrombotic compositions and methods employing them |
| JPS5727454B2 (ja) * | 1975-02-21 | 1982-06-10 | ||
| US4036955A (en) * | 1976-07-22 | 1977-07-19 | Mitsubishi Chemical Industries Ltd. | N2 -naphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| CA1102316A (en) | 1975-12-09 | 1981-06-02 | Shosuke Okamoto | N su2 xx-arylsulfonyl-l-argininamides and the pharmaceutically acceptable salts thereof |
| US4018913A (en) * | 1976-01-14 | 1977-04-19 | Mitsubishi Chemical Industries Ltd. | N2 -alkoxynaphthalenesulfonyl-L-argininamides and the pharmaceutically acceptable salts thereof |
| DE2742173A1 (de) * | 1977-09-20 | 1979-03-29 | Bayer Ag | Phenoxy-pyridinyl(pyrimidinyl)-alkanole, verfahren zu ihrer herstellung sowie ihre verwendung als fungizide |
| US4235871A (en) * | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| IT1211096B (it) * | 1981-08-20 | 1989-09-29 | Lpb Ist Farm | Pirimidine e s.triazinici adattivita' ipolipidemizzante. |
| US4672065A (en) * | 1982-11-19 | 1987-06-09 | Chevron Research Company | N-substituted phenoxyacetamide fungicides |
| US4501728A (en) * | 1983-01-06 | 1985-02-26 | Technology Unlimited, Inc. | Masking of liposomes from RES recognition |
| US4565814A (en) | 1983-01-28 | 1986-01-21 | Sanofi | Pyridazine derivatives having a psychotropic action and compositions |
| JPS59212480A (ja) | 1983-05-17 | 1984-12-01 | Nippon Soda Co Ltd | ピリダジン誘導体及び除草剤 |
| DE3322720A1 (de) * | 1983-06-24 | 1985-01-03 | Chemische Werke Hüls AG, 4370 Marl | Verwendung von in 2-stellung mit (substituierten) aminogruppen substituierten 4-dl-alkylester-(alpha)-alaninyl-6-chlor-s-triazinen als herbizide, insbesondere gegen flughafer |
| US4505910A (en) * | 1983-06-30 | 1985-03-19 | American Home Products Corporation | Amino-pyrimidine derivatives, compositions and use |
| NZ210669A (en) | 1983-12-27 | 1988-05-30 | Syntex Inc | Benzoxazin-4-one derivatives and pharmaceutical compositions |
| PH22520A (en) * | 1984-11-12 | 1988-10-17 | Yamanouchi Pharma Co Ltd | Heterocyclic compounds having 4-lover alkyl-3-hydroxy-2-lower alkyl phenoxy-lower alkylene-y-group, and process of producing them |
| US4959364A (en) * | 1985-02-04 | 1990-09-25 | G. D. Searle & Co. | Method of treating inflammation, allergy, asthma and proliferative skin disease using heterocyclic amides |
| US5023252A (en) * | 1985-12-04 | 1991-06-11 | Conrex Pharmaceutical Corporation | Transdermal and trans-membrane delivery of drugs |
| US4837028A (en) * | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| JPH0784424B2 (ja) | 1987-04-15 | 1995-09-13 | 味の素株式会社 | チロシン誘導体及びその用途 |
| EP0330506A3 (en) | 1988-02-26 | 1990-06-20 | Dana Farber Cancer Institute | Vla proteins |
| US5011472A (en) * | 1988-09-06 | 1991-04-30 | Brown University Research Foundation | Implantable delivery system for biological factors |
| DE3904931A1 (de) * | 1989-02-17 | 1990-08-23 | Bayer Ag | Pyridyl-substituierte acrylsaeureester |
| US5030644A (en) * | 1989-07-31 | 1991-07-09 | Merck & Co., Inc. | Imidazole compounds and their use as transglutaminase inhibitors |
| US5260210A (en) | 1989-09-27 | 1993-11-09 | Rubin Lee L | Blood-brain barrier model |
| US4992439A (en) * | 1990-02-13 | 1991-02-12 | Bristol-Myers Squibb Company | Pyridazine carboxylic acids and esters |
| FR2679903B1 (fr) | 1991-08-02 | 1993-12-03 | Elf Sanofi | Derives de la n-sulfonyl indoline portant une fonction amidique, leur preparation, les compositions pharmaceutiques en contenant. |
| NZ239846A (en) * | 1990-09-27 | 1994-11-25 | Merck & Co Inc | Sulphonamide derivatives and pharmaceutical compositions thereof |
| DE4108029A1 (de) * | 1991-03-13 | 1992-09-17 | Bayer Ag | Triazinyl-substituierte acrylsaeureester |
| WO1992016549A1 (de) | 1991-03-18 | 1992-10-01 | Pentapharm Ag | Para-substituierte phenylalanin-derivate |
| IT1247509B (it) * | 1991-04-19 | 1994-12-17 | Univ Cagliari | Composti di sintesi atti all'impiego nella terapia delle infezioni da rhinovirus |
| US5296486A (en) | 1991-09-24 | 1994-03-22 | Boehringer Ingelheim Pharmaceuticals, Inc. | Leukotriene biosynthesis inhibitors |
| AU3420693A (en) | 1991-12-24 | 1993-07-28 | Fred Hutchinson Cancer Research Center | Competitive inhibition of high-avidity alpha4-beta1 receptor using tripeptide ldv |
| NZ249789A (en) * | 1992-03-11 | 1997-07-27 | Narhex Ltd | Hydrazine, carbazate and 1,2-diazacyclic derivatives and pharmaceutical compositions |
| GB9307555D0 (en) * | 1992-04-16 | 1993-06-02 | Zeneca Ltd | Heterocyclic compounds |
| US5518730A (en) | 1992-06-03 | 1996-05-21 | Fuisz Technologies Ltd. | Biodegradable controlled release flash flow melt-spun delivery system |
| DE4227748A1 (de) * | 1992-08-21 | 1994-02-24 | Bayer Ag | Pyridyloxy-acrylsäureester |
| JP2848232B2 (ja) * | 1993-02-19 | 1999-01-20 | 武田薬品工業株式会社 | アルデヒド誘導体 |
| US5770573A (en) * | 1993-12-06 | 1998-06-23 | Cytel Corporation | CS-1 peptidomimetics, compositions and methods of using the same |
| TW530047B (en) * | 1994-06-08 | 2003-05-01 | Pfizer | Corticotropin releasing factor antagonists |
| US5510332A (en) * | 1994-07-07 | 1996-04-23 | Texas Biotechnology Corporation | Process to inhibit binding of the integrin α4 62 1 to VCAM-1 or fibronectin and linear peptides therefor |
| CA2193508A1 (en) | 1994-07-11 | 1996-01-25 | Eugene D. Thorsett | Inhibitors of leukocyte adhesion |
| US6306840B1 (en) | 1995-01-23 | 2001-10-23 | Biogen, Inc. | Cell adhesion inhibitors |
| IL117659A (en) * | 1995-04-13 | 2000-12-06 | Dainippon Pharmaceutical Co | Substituted 2-phenyl pyrimidino amino acetamide derivative process for preparing the same and a pharmaceutical composition containing same |
| ZA968183B (en) * | 1995-09-29 | 1997-04-25 | Sankyo Co | 13-Substituted milbemycin 5-oxime derivatives their preparation and their use against insects and other pests |
| DE19536891A1 (de) | 1995-10-04 | 1997-04-10 | Basf Ag | Neue Aminosäurederivate, ihre Herstellung und Verwendung |
| DE19548709A1 (de) | 1995-12-23 | 1997-07-03 | Merck Patent Gmbh | Tyrosinderivate |
| KR100459978B1 (ko) | 1996-06-21 | 2005-01-15 | 다께다 케미칼 인더스트리즈,리미티드 | 펩티드제조방법 |
| KR20000022190A (ko) | 1996-06-28 | 2000-04-25 | 플레믹 크리스티안 | 인테그린 저해제로서의 페닐알라닌 유도체 |
| DE19654483A1 (de) | 1996-06-28 | 1998-01-02 | Merck Patent Gmbh | Phenylalanin-Derivate |
| DE19629817A1 (de) * | 1996-07-24 | 1998-01-29 | Hoechst Ag | Neue Imino-Derivate als Inhibitoren der Knochenresorption und Vitronectinrezeptor-Antagonisten |
| DE19647317A1 (de) * | 1996-11-15 | 1998-05-20 | Hoechst Schering Agrevo Gmbh | Substituierte Stickstoff-Heterocyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Schädlingsbekämpfungsmittel |
| DE19713000A1 (de) | 1997-03-27 | 1998-10-01 | Merck Patent Gmbh | Adhäsionsrezeptor-Antagonisten |
| IL143929A0 (en) * | 1999-01-22 | 2002-04-21 | Elan Pharm Inc | Acyl derivatives which treat vla-4 related disorders |
| TW593284B (en) * | 1999-01-22 | 2004-06-21 | Elan Pharm Inc | Fused ring heteroaryl and heterocyclic compounds which inhibit leukocyte adhesion mediated by VLA-4 |
| US6436904B1 (en) * | 1999-01-25 | 2002-08-20 | Elan Pharmaceuticals, Inc. | Compounds which inhibit leukocyte adhesion mediated by VLA-4 |
| AU782616B2 (en) * | 1999-05-07 | 2005-08-11 | Encysive Pharmaceuticals Inc. | Carboxylic acid derivatives that inhibit the binding of integrins to their receptors |
| US6544994B2 (en) * | 2000-06-07 | 2003-04-08 | Eprov Ag | Pharmaceutical preparation for treating or preventing cardiovascular or neurological disorders by modulating of the activity of nitric oxide synthase |
| US6794506B2 (en) * | 2000-07-21 | 2004-09-21 | Elan Pharmaceuticals, Inc. | 3-(heteroaryl) alanine derivatives-inhibitors of leukocyte adhesion mediated by VLA-4 |
| US6689781B2 (en) * | 2000-07-21 | 2004-02-10 | Elan Pharmaceuticals, Inc. | Phenylalanine derivatives as alpha 4 integrin inhibitors |
| JP4137636B2 (ja) * | 2000-12-28 | 2008-08-20 | 塩野義製薬株式会社 | カンナビノイド2型受容体親和作用を有するピリドン誘導体 |
| SI21096B (sl) * | 2001-10-09 | 2012-05-31 | Encysive Pharmaceuticals Inc | Derivati karboksilne kisline ki inhibirajo vezavo integrinov na njihove receptorje |
| TWI281470B (en) * | 2002-05-24 | 2007-05-21 | Elan Pharm Inc | Heterocyclic compounds which inhibit leukocyte adhesion mediated by alpha4 integrins |
| TW200307671A (en) * | 2002-05-24 | 2003-12-16 | Elan Pharm Inc | Heteroaryl compounds which inhibit leukocyte adhesion mediated by α 4 integrins |
| US20050176755A1 (en) * | 2003-10-31 | 2005-08-11 | Dyatkin Alexey B. | Aza-bridged-bicyclic amino acid derivatives as alpha4 integrin antagonists |
| ATE371649T1 (de) * | 2004-02-10 | 2007-09-15 | Janssen Pharmaceutica Nv | Pyridazinonharnstoffe als antagonisten von a4- integrinen |
| CN101035563B (zh) * | 2004-07-08 | 2012-03-28 | 艾伦药物公司 | 包括聚合物部分的多价vla-4拮抗剂 |
| TWI360539B (en) * | 2004-10-28 | 2012-03-21 | Shionogi & Co | 3-carbamoyl-2-pyridone derivatives |
| US20060116713A1 (en) * | 2004-11-26 | 2006-06-01 | Ivan Sepetka | Aneurysm treatment devices and methods |
| JO2787B1 (en) * | 2005-04-27 | 2014-03-15 | امجين إنك, | Alternative amide derivatives and methods of use |
| CA2851103A1 (en) * | 2005-09-29 | 2007-04-12 | Elan Pharmaceuticals, Inc. | Carbamate compounds which inhibit leukocyte adhesion mediated by vla-4 |
| WO2007041270A1 (en) * | 2005-09-29 | 2007-04-12 | Elan Pharmaceuticals, Inc. | Pyrimidinyl amide compounds which inhibit leukocyte adhesion mediated by vla-4 |
| CA2643838A1 (en) * | 2006-02-27 | 2007-09-07 | Elan Pharmaceuticals, Inc. | Pyrimidinyl sulfonamide compounds which inhibit leukocyte adhesion mediated by vla-4 |
| EP2038272B8 (en) * | 2006-06-30 | 2013-10-23 | Sunesis Pharmaceuticals, Inc. | Pyridinonyl pdk1 inhibitors |
| MX2009006814A (es) * | 2006-12-27 | 2009-07-02 | Shionogi & Co | Proceso para la produccion de un derivado de acido 2-piridon-3-carboxilico 1-sustituido. |
-
2010
- 2010-04-27 CN CN2010800273757A patent/CN102459179A/zh active Pending
- 2010-04-27 SG SG10201401836RA patent/SG10201401836RA/en unknown
- 2010-04-27 SG SG2011078409A patent/SG175355A1/en unknown
- 2010-04-27 AU AU2010241742A patent/AU2010241742A1/en not_active Abandoned
- 2010-04-27 EP EP10719684A patent/EP2424841A1/en not_active Withdrawn
- 2010-04-27 CA CA2760151A patent/CA2760151A1/en not_active Abandoned
- 2010-04-27 US US12/768,680 patent/US8367836B2/en not_active Expired - Fee Related
- 2010-04-27 WO PCT/US2010/032632 patent/WO2010126914A1/en active Application Filing
- 2010-04-27 MX MX2011011326A patent/MX2011011326A/es active IP Right Grant
- 2010-04-27 JP JP2012507475A patent/JP2012525336A/ja active Pending
- 2010-04-27 BR BRPI1015259A patent/BRPI1015259A2/pt not_active IP Right Cessation
-
2011
- 2011-10-26 IL IL215956A patent/IL215956A0/en unknown
-
2012
- 2012-12-28 US US13/730,522 patent/US20130252957A1/en not_active Abandoned
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002544161A (ja) * | 1999-05-07 | 2002-12-24 | テキサス・バイオテクノロジー・コーポレイシヨン | インテグリンのその受容体への結合を阻害するカルボン酸誘導体 |
| WO2004046122A2 (en) * | 2002-11-16 | 2004-06-03 | Oxford Glycosciences (Uk) Ltd | Benzoxazole, benzthiazole and benzimidazole acid derivatives and their use as heparanase inhibitors |
| JP2007505901A (ja) * | 2003-09-18 | 2007-03-15 | アストラゼネカ・アクチエボラーグ | 好中球エラスターゼ阻害剤としての2−ピリドン誘導体およびそれらの使用 |
| WO2007008541A2 (en) * | 2005-07-08 | 2007-01-18 | Kalypsys, Inc. | Cellular cholesterol absorption modifiers |
| JP2009526761A (ja) * | 2006-01-30 | 2009-07-23 | アレイ バイオファーマ、インコーポレイテッド | ヘテロ二環式チオフェン化合物および使用の方法 |
| WO2009032277A1 (en) * | 2007-09-06 | 2009-03-12 | Schering Corporation | Gamma secretase modulators |
Also Published As
| Publication number | Publication date |
|---|---|
| US20130252957A1 (en) | 2013-09-26 |
| CN102459179A (zh) | 2012-05-16 |
| SG175355A1 (en) | 2011-12-29 |
| US20110009407A1 (en) | 2011-01-13 |
| AU2010241742A1 (en) | 2011-11-17 |
| IL215956A0 (en) | 2012-01-31 |
| US8367836B2 (en) | 2013-02-05 |
| MX2011011326A (es) | 2012-02-13 |
| BRPI1015259A2 (pt) | 2016-05-03 |
| CA2760151A1 (en) | 2010-11-04 |
| WO2010126914A1 (en) | 2010-11-04 |
| EP2424841A1 (en) | 2012-03-07 |
| SG10201401836RA (en) | 2014-10-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2012525336A (ja) | α−4インテグリンのピリジノンアンタゴニスト | |
| CA2718310C (en) | Pyridyl derivatives as cftr modulators | |
| RU2629118C2 (ru) | Замещенные бензольные соединения | |
| CA2931134C (en) | Heteroaryl derivatives as cftr modulators | |
| JP5135235B2 (ja) | Val−4によって媒介される白血球の接着を阻害するピリミジニルスルホンアミド化合物 | |
| AU732096B2 (en) | Ether muscarinic antagonists | |
| CN105102432A (zh) | 经取代的苯化合物 | |
| JP4732354B2 (ja) | グリシン輸送阻害薬としての二環式[3.1.0]誘導体 | |
| ES2569053T3 (es) | Nuevos compuestos disubstituidos de la 3,4-diamino-3-ciclobuteno-1,2-diona útiles en el tratamiento de patologías mediadas por quimioquinas | |
| US20040192701A1 (en) | Phenlypyridine carbonyl piperazine derivative | |
| JP4776136B2 (ja) | アミド化合物およびその用途 | |
| CA2629461A1 (en) | Substituted quinolones and methods of use | |
| IL223856A (en) | Heterocyclic compounds activate ampk and their methods | |
| KR20160144506A (ko) | 리신 특이적 데메틸라제-1의 억제제 | |
| JP6899323B2 (ja) | 低分子量タンパク質チロシンホスファターゼの阻害剤、及びその使用 | |
| JP2018504437A (ja) | [9,10−ジメトキシ−3−(2−メチルプロピル)−1H,2H,3H,4H,6H,7H,11bH−ピリド[2,1−a]イソキノリン−2−イル]メタノール、ならびにそれに関する化合物、組成物、および方法 | |
| AU2007257841A1 (en) | Substituted phenyl acetic acids as DP-2 antagonists | |
| CZ62293A3 (en) | Pyridine and pyridine-n-oxide derivatives of diaryl-methyl-piperidines or piperazines and preparations therefrom as well as method of their application | |
| CA2700559A1 (fr) | Derives de nicotinamide, leur preparation et leur application en therapeutique | |
| KR20120049940A (ko) | 키나제 억제제로서의 헤테로아릴 화합물 | |
| KR20130121818A (ko) | Stat 단백질의 저해제로서의 치환된 2-히드록시-4-(2-(페닐설폰아미도)아세트아미도)벤조산 유사체 | |
| CN101490024A (zh) | 用作dp-2拮抗剂的取代的苯乙酸 | |
| TW201629012A (zh) | 雜環衍生物及其用途(一) | |
| WO2010109122A1 (fr) | Derives de nicotinamide, leur preparation et leur application en therapeutique comme anticancereux | |
| CA2913913A1 (en) | Dihydropyridinone mgat2 inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130423 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130423 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20140529 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140604 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140901 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140908 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141003 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141010 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150109 |