(発明の詳細な説明)
本発明は、PRLRが癌の発生に関与することを確認する。したがってPRLR遺伝子は、「癌関連遺伝子」と呼ばれる。それゆえこの遺伝子によってコードされたPRLRポリペプチドは、「癌関連ポリペプチド」または「癌関連タンパク質」と呼ばれる。これらの癌関連ポリペプチドをコードする核酸配列は、「癌関連ポリヌクレオチド」と呼ばれる。癌関連遺伝子をコードおよび/または発現する細胞は、「癌関連細胞」と呼ばれる。癌関連遺伝子をコードする細胞は、「癌関連遺伝子型」を有すると言われる。癌関連タンパク質を発現する細胞は、「癌関連表現型」を有すると言われる。「癌関連遺伝子配列」は、PRLRポリペプチドおよびポリヌクレオチド配列の両方を指す。「癌関連核酸」は、癌関連遺伝子(PRLR)を含むDNAはもちろんのこと、その遺伝子に由来するmRNAおよびcDNAも含む。
本文脈での「関連」とは、ヌクレオチドまたはタンパク質配列が正常組織と比較して、癌において差次的に発現、活性化、不活性化または改変されることを意味する。以下で概説するように、癌関連PRLR配列は、癌においてアップレギュレート(すなわちより高いレベルで発現)される配列はもちろんのこと、ダウンレギュレート(すなわちより低いレベルで発現)される配列も含む。癌関連PRLR配列は、改変された配列(すなわち切断配列または点変異を含む、置換、欠失または挿入を持つ配列)も含み、同じ発現プロフィールまたは改変されたプロフィールのどちらかを示す。一般に、癌関連PRLR配列は、ヒト由来である;しかしながら当業者によって認識されるように、他の生物からの癌関連配列は疾患および薬物評価の動物モデルにおいて有用であり得る;それゆえ他の癌関連PRLR配列は、哺乳類を含む、げっ歯類(ラット、マウス、ハムスター、モルモットなど)、霊長類、および家畜(ヒツジ、ヤギ、ブタ、ウシ、ウマなどを含む)を含む脊椎動物から同定できる。ある例において、原核癌関連配列は有用であり得る。他の生物からの癌関連配列は、以下に概説する技法を使用して得ることができる。
癌関連PRLR配列は組換え核酸を含む。用語「組換え核酸」は本明細書において、自然界で通常は見出されない形の、一般にポリメラーゼおよびエンドヌクレアーゼによる核酸の操作による、インビトロで当初は形成された核酸を意味する。それゆえ組換え核酸は、直鎖形の、または通常は連結されないDNA分子を連結させることによりインビトロで形成されたベクター内クローニングされる単離核酸でもあり、どちらも本発明の目的で組換え体と見なされる。いったん組換え核酸が作製され、宿主細胞または生物に再導入されると、インビトロでの操作ではなく宿主細胞のインビボでの細胞機構を使用して複製することが理解されるであろう;しかしながらそのような核酸はいったん組換えにより作製されると、続いてインビボで複製されても、本発明の目的ではなお組換え体と見なされるか、または単離される。本明細書で使用するとき、「ポリヌクレオチド」または「核酸」は、リボヌクレオチドまたはデオキシリボヌクレオチドのどちらかの、いずれかの長さのヌクレオチドの重合形である。この用語は分子の一次構造のみを指す。それゆえこの用語は二本鎖および一本鎖DNAおよびRNAを含む。それはまたは公知の種類の修飾、たとえば当分野で公知である標識、メチル化、「キャップ」、天然発生型ヌクレオチドの1個以上の類似物質による置換、インターヌクレオチド修飾、たとえば非荷電性結合によるもの(たとえばホスホロチオエート、ホスホロジチオエートなど)、ペンダント部分、たとえばタンパク質を含有するもの(たとえばヌクレアーゼ、毒素、抗体、シグナルペプチド、ポリ−L−リジンなど)、インタカレータによるもの(たとえばアクリジン、ソラレンなど)、キレート剤を含有するもの(たとえば金属、放射性金属など)、アルキル化剤を含有するもの、修飾結合によるもの(たとえばアルファアノマー核酸など)はもちろんのこと、ポリヌクレオチドの非修飾形も含む。
本明細書で使用するとき、指定された配列「に由来する」ポリヌクレオチドは、指定されたヌクレオチド配列の領域に対応する、ほぼ少なくとも約6ヌクレオチド、好ましくは少なくとも約8ヌクレオチド、さらに好ましくは少なくとも約10〜12ヌクレオチド、そしてなおさらに好ましくは少なくとも約15〜20ヌクレオチドより成るポリヌクレオチド配列を指す。「対応する」とは、指定された配列に対して相同性または相補性であることを意味する。好ましくはポリヌクレオチドが由来する領域の配列は、癌関連遺伝子に特有である配列に対して相同性または相補性である。
「組換えタンパク質」は、組換え技法を使用して、すなわち上述したように組換え核酸の発現を通じて作製したタンパク質である。組換えタンパク質は、少なくとも1つ以上の特徴によって天然発生型タンパク質から区別される。たとえばタンパク質は、通常、その野生種宿主内で結合しているタンパク質または化合物の一部またはすべてから単離または精製することができ、それゆえ実質的に純粋であり得る。たとえば単離タンパク質は、所与のサンプル中の全タンパク質の重量の好ましくは少なくとも約0.5%、さらに好ましくは少なくとも約5%を構成する、通常はその天然状態で結合する物質の少なくとも一部を伴わない。実質的に純粋なタンパク質は、全タンパク質の重量の約50〜75%を構成し、約80%が好ましく、約90%が特に好ましい。定義は、各種の生物または宿主細胞内での1つの生物からのPRLRなどの癌関連タンパク質の生成を含む。あるいはタンパク質は、タンパク質が上昇した濃度レベルで作製されるように、誘導プロモータまたは高発現プロモータの使用によって通常見られるよりも著しく高い濃度で作製できる。あるいはタンパク質は、以下で議論するようにエピトープタグの付加またはアミノ酸置換、挿入および欠失においてなど、天然には通常見いだされない形で存在し得る。
本明細書で使用するとき、用語「タグ」、「配列タグ」または「プライマータグ配列」は、そのようなタグを中に保持するポリヌクレオチドのバッチを同定する役割を果たす特異性核酸配列を持つオリゴヌクレオチドを指す。同じ生物源によるポリヌクレオチドは、特異性配列タグによって共有結合的にタグ付けされるので、続いての分析でポリヌクレオチドはその供給源に従って同定できる。配列タグも核酸増幅反応のプライマーとして役割を果たす。
「マイクロアレイ」は、好ましくは不連続の領域の直鎖または二次元アレイであり、それぞれ固体支持体表面上に形成された定義範囲を有する。マイクロアレイ上の不連続領域の密度は、単一の固相支持体の表面上で検出される標的ポリヌクレオチドの総数によって決定され、好ましくは少なくとも50/cm2、さらに好ましくは少なくとも100/cm2、なおさらに好ましくは少なくとも約500/cm2、およびなおさらに好ましくは少なくとも約1,000/cm2である。本明細書で使用するとき、DNAマイクロアレイは、標的ポリヌクレオチドを増幅またはクローニングするために使用されるチップまたは他の表面上に配置されたオリゴヌクレオチドプライマーのアレイである。アレイ内のプライマーの各特定の基の位置が既知であるため、標的ポリヌクレオチドの同一性は、マイクロアレイ内の特定の位置へのその結合に基づいて決定できる。
「リンカー」は、制限部位を含有する合成オリゴデオキシリボヌクレオチドである。リンカーは、ベクター分子内への断片の続いてのクローニングに使用できる制限部位を作製するために、DNA配列の末端へ平滑末端ライゲーションできる。
用語「標識」は、アッセイサンプル中での標的ポリヌクレオチドの存在を示す検出可能なシグナルを生成することができる組成物を指す。適切な標識としては、放射性同位体、ヌクレオチド発色団、酵素、基質、蛍光分子、化学発光部分、磁性粒子、生物発光部分などが挙げられる。そのようなものとして、標識は、分光学的、光化学的、生物化学的、免疫化学的、電気的、光学的、化学的、またはいずれかの他の適切な手段によって検出可能ないずれかの組成物である。用語「標識」は、検出可能な物理的特性を有するいずれかの化学基または部分、あるいは基質の検出可能な生成物への変換を触媒する酵素などの、化学基または部分に検出可能な物理的特性を示させることができるいずれかの化合物を指すために使用される。用語「標識」は、特定の物理的特性の発現を抑制する化合物も含む。標識は、結合対の一方のメンバーである化合物であってもよく、その他方のメンバーは検出可能な物理的特性を保持する。
用語「支持体」は、ビーズ、粒子、ディップスティック、ファイバ、フィルタ、膜などの従来の支持体、およびガラススライドなどのシランまたはシリケート支持体を指す。
用語「増幅する」は、広範な意味で、たとえば追加の標的分子、あるいは標的様分子または標的分子に対して相補性である分子を含み得る増幅生成物を作製することを意味するために使用され、それらの分子はサンプル中の標的分子の存在によって作製される。標的が核酸である状況において、増幅生成物はDNAまたはRNAポリメラーゼまたは逆転写酵素を用いて酵素的に作製できる。
本明細書で使用するとき、「生物学的サンプル」は、限定されないが、たとえば血液、血漿、血清、髄液、リンパ液、皮膚、気道、腸管および尿生殖路、涙液、唾液、乳汁、細胞(限定されないが血液細胞を含む)、腫瘍、臓器、ならびにインビトロでの細胞培養構成要素のサンプルも含む、個体から単離された組織または液体のサンプルを指す。
用語「生物源」は、本明細書で使用するとき、標的ポリヌクレオチドが由来する源を指す。源は、限定されないが細胞、組織または液体を含む、上述のような「サンプル」のいずれの形でもよい。「異なる生物源」は、同じ個体の異なる細胞/組織/臓器、または同じ種の異なる個体からの細胞/組織/臓器、あるいは異なる種からの細胞/組織/臓器を指すことができる。
PRLR遺伝子
「PRLR」によって、我々は、NCBIパブリックデータベースで遺伝子座位ID5618によって呼ばれ、アセッション番号NM_000949で呼ばれるmRNAを有し、アセッション番号NP_000940で呼ばれるポリペプチドをコードする、遺伝子「プロラクチンレセプタ」を意味する。PRLRはレセプタタンパク質である。この遺伝子は、16症例においてMLVまたはMMTVプロウィルスのどちらかのタイプIおよびII組込みを受けた。この遺伝子は、試験した癌組織タイプの4つで過剰発現され、サンプリングした皮膚腫瘍の45%で、サンプリングした肺腫瘍の34%で、そしてサンプリングした乳房腫瘍の40%で過剰発現されることが見出された。この遺伝子は、サンプリングした前立腺腫瘍でも過剰発現されることが見出された(t検定)。このことは、この遺伝子が皮膚癌、肺癌、乳癌および前立腺癌に相関しており、したがってこれらの疾患の診断および治療の標的であることを意味している。
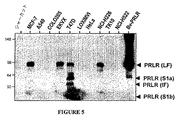
PRLRのヌクレオチド配列は配列番号:1に列挙され、アミノ酸配列は配列番号2に列挙される。細胞外ドメインは配列番号:2のアミノ酸25〜234から成り、これを2つの主要なドメインS1(アミノ酸25〜122)およびS2(アミノ酸123〜234)に分割できる。PRLRの多数の異なるアイソフォーム:長(L)、中間(I)、ΔS1、不活性溶解形(PRLBP)、および不活性短形SIaおよびSIbが同定されている。各アイソフォーム内に含有されるエキソンおよびヌクレオチド領域を図8に示す。例示的な実施形態において、本発明はS1ドメインに、またはS2ドメインに結合する抗体を考慮する。S2ドメインに結合するそのような抗体は、すべての活性アイソフォームを標的とし得る。本発明は、1つのアイソフォームに特異的に結合して、別のアイソフォーム(たとえば中間で、SIaまたはSIbではない)に結合しない、あるいは活性アイソフォーム(長、中間およびΔS1)に特異的に結合するが、不活性アイソフォーム(SIaおよびSIb)には結合しない抗体も考慮する。例示的な実施形態において、本発明の抗体は、ある癌で支配的に発現される長アイソフォームに特異的に結合され得るが、他のアイソフォーム(たとえばヌクレオチド1293〜1866によってコードされたアミノ酸)に結合しない、あるいは領域:EWEIHFAGQQTEFKILSLHPに結合できる。
したがってPRLRの1つの発現の存在または不存在は、癌を引き起こすのに十分であり得る。あるいはPRLR遺伝子の1つの発現の増加または減少は、癌を引き起こすのに十分であり得る。さらなる代案において、癌は、PRLR遺伝子が閾値レベルに到達するか、それを超えたときに誘発され得る。閾値レベルは、発現の「正常な」制御レベルにおける発現と比較したときに、PRLR遺伝子の発現の増加または減少パーセンテージとして表すことができる。
本発明は、PRLR遺伝子の相同体、断片、および機能同等物の使用も可能にする。相同性は、上で参照した全PRLR遺伝子配列に基づいていてよく、一般に相同性プログラムまたはハイブリダイゼーション条件を使用して、下で概説するように決定される。PRLR遺伝子のホモログは好ましくは、約75%を超える(すなわち80、85、90、92、94、95、96、97、98、99%以上)、PRLR遺伝子との相同性を有する。そのようなホモログは、スプライス変異体、欠失、付加および/または置換突然変異体を含み、一般に機能類似性を有し得る。
この文脈での相同性は、配列類似性または同一性を意味して、同一性が好ましい。相同性目的での好ましい比較は、配列決定エラーを含有する配列を正しい配列と比較することである。この相同性は、限定されないが、Smith & Waterman,Adv.Appl.Math.2:482(1981)の局所相同性アルゴリズム、Needleman & Wunsch,J.MoL Biol.48:443(1970)の相同性アラインメントアルゴリズムにより、Pearson & Lipman,PNAS USA 85:2444(1988)の類似性方法の検索により、これらのアルゴリズムのコンピュータによる実行により(GAP,BESTFIT,FASTA,and TFASTA in the Wisconsin Genetics Software Package,Genetics Computer Group,575 Science Drive,Madison,WI)、好ましくはデフォルト設定を使用するDevereuxら、Nucl.Acid Res.12:387−395(1984)によって記載されたBest Fit配列プログラムを含む当分野で公知の技法を使用して、または検査によって決定されるであろう。
有用なアルゴリズムの一例はPILEUPである。PILEUPは、累進的ペアワイズアラインメントを使用して関連する配列の群からマルチプル配列アラインメントを生成する。アラインメントを生成するのに使用されるクラスタリング関係を示すツリーをプロットすることもできる。PILEUPは、Feng & Doolittle,J.Mol.Evol.35:351−360(1987)の累進的アラインメント方法の簡略化を使用する;その方法はHiggins & Sharp CABIOS 5:151−153(1989)によって記載された方法に似ている。有用なPILEUPパラメータは、3.00のデフォルトギャップ重み付け、0.10のデフォルトギャップ長重み付け、および重み付けエンドキャップを含む。
有用なアルゴリズムの別の例は、Altschulら、J.Mol.Biol.215,403−410,(1990)およびKarlinら、PNAS USA 90:5873−5787(1993)に記載されているBLAST(Basic Local Alignment Search Tool)アルゴリズムである。特に有用なBLASTプログラムは、Altschulら、Methods in Enzymology,266:460−480(1996);http://blast.wustl.edu/]から入手したWU−BLAST−2プログラムである。WU−BLAST−2は、大半がデフォルト値に設定されている複数の検索パラメータを使用する。調節可能なパラメータは、次の値:オーバーラップスパン=1、オーバーラップフラクション=0.125、ワード閾値(T)=11に設定される。HSP SパラメータおよびHSP S2パラメータは動的な値であり、特定の配列の組成および目的の配列が検索される特定のデータベースの組成に依存して、プログラム自体によって確立される;しかしながらこの値は、感度を向上させるために調節できる。アミノ酸配列同一性の値は、整列された領域の「より長い」配列の残基の総数によって除算された、一致する同一残基の数によって決定される。「より長い」配列は、整列された領域において最も多くの実際の残基を有する配列である(アラインメントスコアを最大にするためにWU−Blast−2によって導入されるギャップは無視される)。
アラインメントは、整列される配列へのギャップの導入を含み得る。加えてPRLR遺伝子のヌクレオチドよりも多いまたは少ないヌクレオチドを含有する配列では、相同性のパーセンテージが、ヌクレオシドの総数に関連して相同性ヌクレオシドの数に基づいて決定されることが理解される。それゆえ本明細書で同定された配列よりも短い配列の相同性は、より短い配列内のヌクレオシドの数を使用して決定されるであろう。
本発明の別の実施形態において、中程度から高度のストリンジェントな条件下において本明細書で与えるポリヌクレオチド配列、またはその断片、またはその相補性配列にハイブリダイズできるという条件で、ポリヌクレオチド組成物が提供される。ハイブリダイゼーション技法は、分子生物学の分野で公知である。例示のために、本発明のポリヌクレオチドの他のポリヌクレオチドとのハイブリダイゼーションを試験するための適切な中程度の厳密条件は、5×SSC(「生理食塩水クエン酸ナトリウム」;9mM NaCl、0.9mMクエン酸ナトリウム)、0.5% SDS、1.0mM EDTA(pH8.0)溶液中での予備洗浄;50〜60℃、5×SSCにて一晩のハイブリダイゼーション;続いて、0.1% SDSを含む2×SSC、0.5×SSCおよび0.2×SSCをそれぞれ用いた、65℃で20分間の2回の洗浄を含む。当業者は、ハイブリダイゼーションの厳密性が、たとえばハイブリダイゼーション溶液の塩含有量および/またはハイブリダイゼーションが実施される温度を変化させることによってただちに操作できることを理解するであろう。たとえば別の実施形態において、適切な高厳密ハイブリダイゼーション条件は、ハイブリダイゼーション温度がたとえば60〜65℃または65〜70℃まで上昇されることを除いて、上記の条件を含む。厳密条件は、ホルムアミドなどの不安定化剤の添加によって達成することもできる。
それゆえ高厳密性下で、本出願および配列リストを通して同定される核酸、またはその相補体にハイブリダイズする核酸は、PRLRまたは癌関連配列とみなされる。高厳密条件が当分野で公知である;たとえばManiatisら、Molecular Cloning:A Laboratory Manual,2nd Edition,1989,およびShort Protocols in Molecular Biology,ed.Ausubel,らを参照、そのどちらも参照により本明細書に組み入れられている。厳密条件は配列依存性であり、異なる状況において異なるであろう。より長い配列はより高温にて特異的にハイブリダイズする。核酸のハイブリダイゼーションへの広範な指針は、Tijssen,Techniques in Biochemistry and Molecular Biology−Hybridization with Nucleic Acid Probes,“Overview of principles of hybridization and the strategy of nucleic acid assays”(1993)に見出される。一般に、厳密条件は、定義されたイオン強度pHにおいて、特定の配列の熱融解点(Tm)より約5〜10℃低くなるように選択される。Tmは、(定義されたイオン強度、pHおよび核酸濃度下で)その標的に相補性であるプローブの50%が、平衡状態の標的配列にハイブリダイズする温度である(標的配列は過剰に存在するので、Tmにて、平衡状態では50%のプローブが占有される)。厳密条件は、塩濃度が、pH7.0〜8.3にて約1.0Mナトリウムイオン未満、典型的には約0.01〜1.0Mナトリウムイオン濃度(または他の塩)であり、温度が、短プローブ(たとえば10〜50ヌクレオチド)では少なくとも約30℃、長プローブ(たとえば50ヌクレオチド超)では少なくとも約60℃である条件である。別の実施形態において、より低い厳密ハイブリダイゼーション条件が使用される;たとえば中程度〜低い厳密条件が当分野で公知であるように使用できる;たとえばManiatis and Ausubel,同上、およびTijssen,同上を参照。
PRLR遺伝子発現の検出
PRLR遺伝子は同定されており、コード配列およびアミノ酸配列本は明細書で参照される。直鎖核酸セグメントとしてたとえばプラスミドまたは他のベクターに含有されたその天然源から単離されれば、あるいはそこから切除されれば、組換えPRLR核酸は、他のPRLR核酸、たとえば追加のコード領域を同定および単離するためのプローブとしてさらに使用できる。それは「修飾」または変異体PRLR核酸およびタンパク質を作製するために「前駆体」核酸として使用することもできる。PRLRヌクレオチド配列は、PRLR遺伝子に特異性のプローブを設計するために使用できる。
PRLR核酸は複数の方法で使用してよい。PRLR核酸にハイブリダイズできる核酸プローブを作製して、スクリーニングおよび診断方法で使用される、あるいは遺伝子治療および/またはアンチセンス用途のためにバイオチップに結合させることができる。あるいはPRLRタンパク質のコード領域を含むPRLR核酸を、再度、スクリーニング目的、または患者への投与のどちらかのためのPRLRタンパク質の発現のために発現ベクター内に配置することができる。
遺伝子発現を定量するための1つのそのようなシステムは、動力学的ポリメラーゼ連鎖反応(PCR)である。動力学的PCRは、特異的核酸配列の同時増幅および定量を可能にする。特異性は、標的部位をまとめた一本鎖核酸配列に優先的に接着するように設計された、合成オリゴヌクレオチドプライマーに由来する。このオリゴヌクレオチドプライマー対は、標的配列の各鎖に特異的な非共有結合複合体を形成する。これらの複合体が、対向する向きでの二本鎖DNAのインビトロ転写を促進する。反応混合物の温度サイクリングは、プライマー結合、転写、および核酸から個別の鎖への再融解という連続的なサイクルを生成する。結果は、標的dsDNA産物の指数関数的な増加である。この生成物は、挿入染料または配列特異性プローブのどちらかの使用によってリアルタイムで定量できる。SYBR(登録商標)GreenIは、dsDNAに優先的に結合して、蛍光シグナルの同時増加を発生させる挿入染料の例である。TaqMan(登録商標)技術で使用されるような配列特異性プローブは、オリゴヌクレオチドの対向する末端に共有結合する蛍光色素および消光分子から成る。プローブは、2つのプライマー間の標的DNA配列に選択的に結合するように設計されている。DNA鎖がPCR反応中に合成されるとき、蛍光色素はポリメラーゼのエキソヌクレアーゼ活性によってプローブから開裂されて、シグナルの脱消光を引き起こす。プローブシグナル伝達方法は、挿入染料方法よりも特異的であり得るが、それぞれの場合でシグナル強度は生成されたdsDNA産物に比例する。各種類の定量方法はマルチウェル液相アレイにおいて使用でき、各ウェルは、興味のある核酸配列に特異的なプライマーおよび/またはプローブを示す。組織または細胞系のメッセンジャーRNA調製物と共に使用した場合、プローブ/プライマー反応のアレイは、興味のある多数の遺伝子産物の発現を同時に定量できる。Germer,S.,ら、Genome Res.10:258−266(2000);Heid,C.A.,ら、Genome Res.6,986−994(1996)を参照。
DNAマイクロアレイ技術における最近の開発は、単一の固相支持体上での複数のPRLR核酸分子の大規模アッセイを実施することを可能にする。米国特許第5,837,832号(Cheeら)および関連出願には、サンプル中の特異的な核酸配列のハイブリダイゼーションおよび検出のための、オリゴヌクレオチドプローブアレイの固定化について記載されている。興味のある組織から単離された興味のある標的ポリヌクレオチドは、DNAチップにハイブリダイズされ、そして別個のプローブ位置でのその標的ポリヌクレオチドの優先度およびハイブリダイゼーションの程度に基づいて、特異的配列が検出される。アレイの1つの重要な用途は、差次的遺伝子発現の分析にあり、ここで異なる細胞、しばしば興味のある細胞および対照細胞における遺伝子発現プロフィールが比較されて、各細胞間での遺伝子発現のいずれかの相違が同定される。このような情報は、特定の細胞または組織タイプで発現される遺伝子タイプの同定、およびその発現プロフィールに基づく癌状態の診断のために有用である。
典型的には、興味のあるサンプル由来のRNAに逆転写を受けさせて、標識cDNAを得る。米国特許第6,410,229等(Lockhartら)を参照。次いで該cDNAは、チップまたは他の表面上に公知の順序で整列された公知配列のオリゴヌクレオチドまたはcDNAにハイブリダイズされる。該標識cDNAがハイブリダイズするオリゴヌクレオチドの位置は、該cDNAに関する配列情報を提供するのに対して、標識ハイブリダイズRNAまたは標識ハイブリダイズcDNAの量は、興味のあるRNAまたはcDNAの相対的提示の推定を提供する。Schena,ら、Science 270:467−470(1995)を参照。たとえばヒト癌の遺伝子発現パターンを分析するためのDNAマイクロアレイの使用については、DeRisi,ら(Nature Genetics 14:457−460(1996)が記載している。
PRLR核酸に対応する核酸プローブを作製できる。典型的には、これらのプローブは開示されたPRLR遺伝子に基づいて合成される。バイオチップに付着する核酸プローブは、PRLR核酸、すなわち標的配列(たとえばサンドイッチアッセイにおける、サンプルの標的配列または他のプローブ配列のどちらか)に対して実質的に相補的であるように設計されるので、標的配列と本発明のプローブとの特異的ハイブリダイゼーションが起こる。下で概説するように、この相補性は、標的配列と本発明の一本鎖核酸との間のハイブリダイゼーションを妨害するいずれかの数の塩基対ミスマッチが存在し得るという点で、完全である必要はない。ヌクレオチドレベルでの遺伝子の全体の相同性は、おそらく約40%以上、おそらく約60%以上、そして、なおさらにおそらく約80%以上であることと;加えて、約8〜12ヌクレオチド以上の対応する連続配列が存在することが予想される。しかしながら変異の数があまりにも多いので、最低の厳密ハイブリダイゼーション条件下でさえ、ハイブリダイゼーションが起こらず、該配列は相補性標的配列ではない。それゆえ「実質的に相補性の」は本明細書では、プローブが、本明細書で概説するように通常の反応条件、特に高ストリンジェントな条件下でハイブリダイズするために標的配列に対して十分に相補性であることを意味する。配列が本発明によるPRLR遺伝子にとって独自かどうかは、当業者に公知の技法によって判定できる。たとえば配列は、データバンク、たとえばGeneBankの配列と比較され得、非感染宿主または他の生物に存在するかどうかが判定され得る。配列は、癌を誘発することが公知であるウィルス因子を含む、他のウィルス因子の公知の配列と比較することもできる。
核酸プローブは一般に一本鎖であるが、部分的に一本鎖であり、部分的に二本鎖であり得る。プローブの鎖状態は、標的配列の構造、組成、および特性によって決定される。一般にオリゴヌクレオチドプローブは、約6、8、10、12、15、20、30〜約100塩基長の範囲であり、約10〜約80塩基が好ましく、約30〜約50塩基対が特に好ましい。すなわち一般に遺伝子全体は、プローブとしてめったに使用されない。ある実施形態において、数百塩基までのより長い核酸を使用できる。プローブは、当業者によって公知の条件下で相補性テンプレート配列にハイブリダイズするのに十分特異性である。プローブ配列とそれらがハイブリダイゼーションの間にハイブリダイズするその相補性テンプレート(標的)配列との間のミスマッチの数は、FASTA(デフォルト設定)によって決定されるように、一般に15%を超えず、典型的には10%を超えず、好ましくは5%を超えない。
オリゴヌクレオチドプローブとしては、核酸で通常見出される天然発生型へテロシクリル塩基(ウラシル、シトシン、チミン、アデニンおよびグアニン)はもちろんのこと、修飾塩基および塩基類似物質が挙げられ得る。プローブの標的配列へのハイブリダイゼーションと適合するいずれの修飾塩基または塩基類似物質も、本発明の常法で有用である。プローブの糖またはグリコシド部分は、デオキシリボース、リボースおよび/またはこれらの糖の修飾形、たとえば2’−O−アルキルリボースを含み得る。実施形態において、糖部分は2’−デオキシリボースである;しかしながらプローブが標的配列にハイブリダイズする能力と適合性であるいずれの糖部分も使用できる。
プローブのヌクレオシド単位は、当分野で公知であるように、ホスホジエステル主鎖によって連結され得る。さらなる実施形態において、ヌクレオチド間結合は、限定されないが、ホスホロチオエート、メチルホスホネート、サルファメート(たとえば米国特許第5,470,967号)およびポリアミド(すなわちペプチド核酸)を含む、プローブの特異的ハイブリダイゼーションと適合性である、当業者に既知であるいずれの結合も含み得る。ペプチド核酸は、Nielsenら(1991)Science 254:1497−1500,米国特許第5,714,331号、およびNielsen(1999)Curr.Opin.Biotechnol.10:71−75に記載されている。
プローブは、キメラ分子、すなわち1種類を超える塩基または糖サブユニットを含み得る、および/または、結合が同じプライマー内で1を超える種類であり得る。プローブは、当分野で公知であるように、その標的配列へのハイブリダイゼーションを促進する部分、たとえばインタカレータおよび/または副溝バインダを含み得る。塩基、糖およびヌクレオシド間主鎖の変化は、プローブ上のいずれかのペンダント基の存在と同様に、配列特異的な方式で、プローブがその標的配列に結合する能力と適合するであろう。多数の構造上の修飾は、既知のものおよび開発中のものの両方とも、これらの結合内で可能である。好都合には、本発明によるプローブは、シグナル増幅を可能にするような構造上の特徴を有することができ、このような構造上の特徴はたとえばUrdeaら(Nucleic Acids Symp.Ser.,24:197−200(1991))または欧州特許EP−0225,807に記載されたような分岐DNAプローブである。その上、プローブを形成する様々な複素環塩基、糖、ヌクレオシドおよびヌクレオチドを調製するための合成方法、および特異的な既定の配列のオリゴヌクレオチドの調製は十分に開発されており、当分野で公知である。オリゴヌクレオチド合成の方法は、米国特許第5,419,966号の教示を含む。
多数のプローブが特定の標的核酸に対して設計され、標的核酸における多型および/または二次構造、データの重複性などを説明し得る。ある実施形態において、配列当たり1つを超えるプローブが使用される場合、オーバーラッププローブまたは単一の標的PRLR遺伝子の異なる区間に対するプローブのどちらかが使用される。すなわち特定の標的の重複性を構築するために、2、3、4つ以上のプローブが使用され、3つが好ましい。プローブは、オーバーラップ(すなわち、共通したいくつかの配列を有する)し得るか、またはPRLR遺伝子の別個の配列に対して特異性であり得る。本発明に従って複数の標的ポリヌクレオチドが検出されるとき、特定の標的ポリヌクレオチドに対応する各プローブまたはプローブ群は、マイクロアレイの別個の範囲に位置する。
プローブは、溶液中、たとえばウェル中またはマイクロアレイの表面上にあり得るか、または固体支持体に付着され得る。使用され得る固体支持体材料の例としては、プラスチック、セラミック、金属、樹脂、ゲルおよび膜が挙げられる。有用な種類の固体支持体としては、プレート、ビーズ、磁気材料、マイクロビーズ、ハイブリダイゼーションチップ、膜、結晶、セラミックおよび自己集合単層が挙げられる。実施形態は、二次元または三次元マトリクス、たとえば複数のプローブ結合部位を備えたゲルまたはハイブリダイゼーションチップを含む(Pevznerら、J.Biomol.Struc.& Dyn.9:399−410,1991;Maskos and Southern,Nuc.Acids Res.20:1679−84,1992)。ハイブリダイゼーションチップは、次に標的核酸によってハイブリダイズされる非常に大型のプローブアレイを構築するために使用され得る。チップのハイブリダイゼーションパターンの解析は、標的ヌクレオチド配列の同定を補助し得る。パターンは手動またはコンピュータで解析され得るが、ハイブリダイゼーションによる位置配列決定が、コンピュータ解析および自動化に役立つことは明らかである。配列再構築のために開発されているアルゴリズムおよびソフトウェアは、本明細書に記載される方法に利用できる(R.Drmanacら、J.Biomol.Struc.& Dyn.5:1085−1102,1991;P.A.Pevzner,J.Biomol.Struc.& Dyn.7:63−73,1989)。
当業者によって認識されるように、核酸は多岐に亘る方法で固体支持体に付着または固定化され得る。「固定化される」とは本明細書では、核酸プローブと固体支持体との間の結合または接合が、下で概説するような結合、洗浄、解析、および除去の条件下で十分に安定であることを意味する。結合は、共有結合性または非共有結合性であり得る。「非共有結合」および文法的等価語は本明細書では、静電的、親水性、および疎水性の相互作用のいずれか1つ以上を意味する。非共有結合としては、ストレプトアビジンなどの分子の支持体への共有結合的付着およびビオチン化プローブのストレプトアビジンへの非共有的結合が挙げられる。「非共有結合」および文法的等価語は本明細書では、2つの部分、すなわち固体支持体およびプローブが、シグマ結合、パイ結合および配位結合を含む少なくとも1つの結合に付着される。共有結合は、プローブと固体支持体との間に直接形成され得るか、あるいは架橋剤によって、あるいは固体支持体またはプローブのいずれかまたは両方の分子への特異的反応性基の包含によって形成され得る。固定化は、共有結合性および非共有結合性相互作用の組合せを含むこともできる。
核酸プローブは、共有結合、たとえばカップリング剤を用いたコンジュゲーションによって、あるいは共有結合または非共有結合、たとえば静電気的相互作用、水素結合または抗体−抗原カップリング、あるいはこれらの組合せによって固体支持体に付着され得る。典型的なカップリング剤としては、ビオチン/アビジン、ビオチン/ストレプトアビジン、黄色ブドウ球菌タンパク質A/IgG抗体Fc断片、およびストレプトアビジン/タンパク質Aキメラ(T.Sano and C.R.Cantor,Bio/Technology 9:1378−81(1991))、あるいはこれらの薬剤の誘導体または組合せが挙げられる。核酸は、光開裂性結合、静電気的結合、ジスルフィド結合、ペプチド結合、ジエステル結合、またはこれらの種類の結合の組合せによって固体支持体に付着され得る。該アレイは、選択的に解放可能な結合、たとえば4,4’−ジメトキリトリチルまたはその誘導体によっても固体支持体に付着され得る。有用であることが見出された誘導体としては、3または4[ビス−(4−メトキシフェニル)]−メチル−安息香酸、N−スクシンイミジル−3または4[ビス−(4−メトキシフェニル)]−メチル−安息香酸、N−スクシンイミジル−3または4[ビス−(4−メトキシフェニル)]−ヒドロキシメチル−安息香酸、N−スクシンイミジル−3または4[ビス−(4−メトキシフェニル)]−クロロメトキシ−安息香酸、およびこれらの酸の塩が挙げられる。
プローブは当業者によって認識されるように、バイオチップに多岐に亘る方法で付着され得る。本明細書中に記載されるように、核酸は、最初に合成され、その後にバイオチップに付着され得る、あるいは直接バイオチップ上で合成され得るかのどちらかである。
バイオチップは、適切な固体基材を含む。「基材」または「固体支持体」または他の文法的等価語は本明細書では、核酸プローブの付着または結合のために適切な別個のそれぞれの部位を含有するように修飾することが可能であり、少なくとも1つの検出方法に従ういずれかの材料を意味する。本発明の固相支持体は、ヌクレオチドハイブリダイゼーションおよび合成を支持するのに適したいずれの固体材料および構造でもよい。好ましくは、固相支持体は、プライマーを固定化でき、逆転写酵素反応が実施され得る、少なくとも1つの実質的に剛性の表面を含む。ポリヌクレオチドマイクロアレイ要素が安定して結合される基材は、プラスチック、セラミック、金属、アクリルアミド、セルロース、ニトロセルロース、ガラス、ポリスチレン、ポリエチレンビニルアセテート、ポリプロピレン、ポリメタクリレート、ポリエチレン、ポリエチレンオキシド、ポリケイ酸塩、ポリカーボネート、Teflon(登録商標)、フルオロカーボン、ナイロン、シリコンゴム、ポリ無水物、ポリグリコール酸、ポリ乳酸、ポリオルトエステル、ポリプロピルフマレート、コラーゲン、グリコサミノグリカンおよびポリアミノ酸を含む各種の材料から製造され得る。基材は、形が二次元または三次元、たとえばゲル、膜、薄膜、ガラス、プレート、円筒、ビーズ、磁気ビーズ、光ファイバ、製織繊維などであり得る。アレイの1つの形は三次元アレイである。三次元アレイの1つの種類は、タグ付きビーズの集合である。各タグ付きビーズは、それに付着した異なるプライマーを有する。タグは、シグナル伝達手段、たとえば呈色(Luminex,Illumina)および電磁場(Pharmaseq)によって検出可能であり、タグ付きビーズ上のシグナルは(たとえば光ファイバを用いて)さらに遠隔でも検出され得る。固体支持体のサイズは、DNAマイクロアレイ技術に有用な標準マイクロアレイのいずれでもよく、サイズは本発明の反応を実施するために使用される特定の機械に適合するように調整され得る。一般に基材は、光学的検出を可能にして、感知されるほどには蛍光を発さない。
バイオチップおよびプローブの表面は、続いての2つの結合のために化学官能基によって誘導体化され得る。それゆえ、たとえばバイオチップは、限定されないがアミノ基、カルボキシ基、オキソ基およびチオール基を含む化学官能基によって誘導体化され、アミノ基が特に好ましい。これらの官能基を使用して、プローブはプローブ上の官能基を使用して付着され得る。たとえばアミノ基を含有する核酸は、アミノ基を含む表面にたとえば当分野で公知であるようなリンカーを使用して付着され得る;たとえばホモまたはヘテロ二官能性リンカーが公知である(参照により本明細書に組み入れられる、(1994)Pierce Chemical Company catalog,technical section on cross−linkers,155−200ページを参照)。加えて、ある場合では、追加のリンカー、たとえばアルキル基(置換およびヘテロアルキル基を含む)が使用され得る。
オリゴヌクレオチドは当分野で公知であるように合成され得、次に固体支持体の表面に付着され得る。当業者によって認識されるように、5’末端または3’末端のどちらかが固体支持体に結合され得るか、あるいはこの結合は内在性ヌクレオチドを介してよい。追加の実施形態において、固体支持体への固定化は非常に強力であり得るが、なお非共有結合性であり得る。たとえば、ストレプトアビジンで共有結合的にコートされた表面に結合し、付着を生じるビオチン化オリゴヌクレオチドを作製し得る。
アレイは、いずれかの好都合な方法、たとえばポリヌクレオチドマイクロアレイ要素を実施し、次にそれらを表面に安定に会合させることによって作製され得る。あるいはオリゴヌクレオチドは、当分野で公知であるように表面上で合成され得る。多数の異なるアレイ構成およびその製造方法が当業者に公知であり、WO95/25116およびWO95/35505(フォトリングラフィー技法)、米国特許第5,445,934号(フォトリングラフィーによるインサイチュー合成)、米国特許第5,384,261号(機械指示流路によるインサイチュー合成);および米国特許第5,700,637号(スポッティング、印刷または結合による合成)に開示されており、その開示は参照によりその全体が本明細書に組み入れられている。DNAをビーズにカップリングする別の方法は、ビーズに付着されたリガンド結合分子を連結させるために、DNAの末端に付着された特異性リガンドを使用する。考えられるリガンド結合パートナーとしては、ビオチン−アビジン/ストレプトアビジン、または各種の抗体/抗原対、たとえばジゴキシゲニン−抗ジゴキシゲニン抗体が挙げられる(Smithら“Direct Mechanical Measurements of the Elasticity of Single DNA Molecules by Using Magnetic Beads,”Science 258:1122−1126(1992))。DNAの支持体への共有結合性化学付着は、ホスホアミデート結合を介してDNAの5’−ホスフェートをコーティングされた微粒子に連結するために標準カップリング剤を使用することによって実施できる。オリゴヌクレオチドの固体基材への固定化の方法は十分に確立されている。Peaseら、Proc.Natl.Acad.Sci.USA 91(11):5022−5026(1994)を参照。オリゴヌクレオチドを固体基材に付着させる1つの方法は、Guoら、Nucleic Acids Res.22:5456−5465(1994)によって記述されている。固定化は、インサイチューDNA合成(Maskos and Southern,Nucleic Acids Research,20:1679−1684(1992)、またはロボットアレイ作製技術と組合された化学合成オリゴヌクレオチドの共有結合性付着(Guoら、同上)のどちらかによって実施され得る。
発現産物
用語「発現産物」は、本明細書で使用するとき、たとえばmRNAを含む核酸ならびにPRLR遺伝子の転写および/または翻訳によって産生されたポリペプチド産物の両方を指す。
ポリペプチドは、成熟タンパク質の形であり得るか、あるいは活性成熟ポリペプチドを産生するためにプレ−、プロ−またはプレプロ−部分の開裂によって活性化され得るプレ−、プロ−またはプレプロ−タンパク質であり得る。このようなポリペプチドにおいて、プレ−、プロ−またはプレプロ−配列は、リーダーまたは分泌配列であり得るか、あるいは成熟ポリペプチド配列の精製のために利用される配列であり得る。このようなポリペプチドは、「癌関連ポリペプチド」または「PRLRポリペプチド」と呼ばれる。
用語「癌関連ポリペプチド」または「PRLRポリペプチド」は、断片、ホモログ、融合物および突然変異体も含む。相同性ポリペプチドは、ギャップオープンペナルティ=12、ギャップ拡大ペナルティ=2、BLOSUMマトリクス=62のアフィンギャップ検索を用いるSmith−Waterman相同性検索アルゴリズムで決定されるように、上で言及されたPRLRポリペプチドとの少なくとも80%以上(すなわち85、90、91、92、93、94、95、96、97、98、99%以上)の配列同一性を有する。Smith−Waterman相同性検索アルゴリズムは、Smith and Waterman,Adv.Appl.Math.(1981)2:482−489に教示されている。変異体ポリペプチドは天然的または非天然的にグリコシル化されることができ、すなわち該ポリペプチドは、対応する天然発生型タンパク質で見出されるグリコシル化パターンとは異なるグリコシル化パターンを有する。
突然変異体としては、アミノ酸置換、付加または欠失が挙げられる。アミノ酸置換は、保存的アミノ酸置換、あるいはたとえばグリコシル化部位、ホスホリル化部位、またはアセチル化部位を改変して非必須アミノ酸を除去するための、または機能には不要である1つ以上のシステイン残基の置換または欠失による誤った折畳みを最小限にするための置換であり得る。保存的アミノ酸置換は、置換されたアミノ酸の全体の電荷、疎水性/親水性および/または立体容積を保存する置換である。これらの産物の変異体は、タンパク質の特定の領域(たとえば機能ドメイン、および/またはポリペプチドがタンパク質ファミリーのメンバーである場合、コンセンサス配列に関連する領域)の強化された生物学的活性を維持または所持するように設計され得る。このような変異体は次に検出または処置の方法で使用され得る。変異体の産生のためアミノ酸改変の選択は、アミノ酸の到達性(内側対外側)(たとえばGoら、Int.J.Peptide Protein Res.(1980)75:211を参照)、変異体ポリペプチドの熱安定性(たとえばQuerolら、Prot.Eng.(1996)9:265を参照)、所望のグリコシル化部位(たとえばOlsen and Thomsen,J Gen.Microbiol.(1991)137:579を参照)、所望のジスルフィドブリッジ(たとえばClarkeら、Biochemistry(1993)32:4322;およびWakarchukら、Protein Eng.(1994)7:1379を参照)、所望の金属結合部位(たとえばTomaら、Biochemistry(1991)30:91,およびHaezerbrouckら、Protein Eng.(1993)6:643を参照)、プロリンループ内の所望の置換(たとえばMasulら、Appl.Env.Microbiol.(1994)60:3579を参照)に基づき得る。システイン欠失ムテインは、米国特許第4,959,314号に開示されているように産生され得る。
変異体は、本明細書で開示したポリペプチドの断片、特に生物活性断片および/または機能ドメインに対応する断片も含む。興味のある断片は、典型的には、長さが少なくとも約8アミノ酸(aa)、10aa、15aa、20aa、25aa、30aa、35aa、40aa、少なくとも約45aaまで、通常、長さが少なくとも約50aa、少なくとも約75aa、少なくとも約100aa、少なくとも約125aa、少なくとも約150aa、少なくとも約200aa、少なくとも約300aa、少なくとも約400aaであり、そして長さが500aa以上であり得るが、通常、長さが約1000aaを超えず、該断片は、本明細書中で提供されるポリヌクレオチド配列のいずれか1つの配列を有するポリヌクレオチドによってコードされるポリペプチドまたはそのホモログと同一のアミノ酸のストレッチを有するであろう。本明細書に記載するタンパク質変異体は、本発明の範囲内のポリヌクレオチドによってコードされる。遺伝子コードを使用して、対応する変異体を構築するための適切なコドンを選択できる。
PRLR遺伝子によってコードされたポリペプチドの発現の改変レベルは、遺伝子およびその産物が癌において役割を果たすことを示し得る。好ましくは、形成される複合体の量の2倍の増加または減少は、疾患を示す。なおさらに好ましくは、形成される複合体の量の3倍、4倍、5倍、10倍、20倍、50倍、またなお100倍の増加または減少が、疾患を示す。
PRLRポリペプチドは、野生種アミノ酸配列より短くてよく、または長くてよく、同等のコードmRNAは野生種mRNAと比較して同様に修飾され得る。それゆえPRLRポリペプチドの定義には、本明細書の野生種配列の部分または断片が含まれる。加えて、上で概説したように、当分野で公知の技法を使用すると、PRLR遺伝子を使用して追加のコード領域、それゆえ追加のタンパク質配列を入手できる。
実施形態において、PRLRポリペプチドは野生種配列と比較して、誘導体または変異体PRLRポリペプチドである。すなわち、下でさらに十分に概説するように、誘導体PRLRポリペプチドは、少なくとも1つのアミノ酸置換、欠失または挿入を含有し、アミノ酸置換が特に好ましい。アミノ酸置換、挿入または欠失は、PRLRポリペプチド内のいずれかの残基にて起こり得る。
PRLRポリペプチドのアミノ酸配列変異体も含まれる。これらの変異体は、3つのクラス:置換、挿入または欠失変異体の1つ以上に分類される。これらの変異体は普通、変異体をコードするDNAを産生するために、カセット式またはPCR変異誘発あるいは当分野で公知の他の技法を使用して、PRLRタンパク質をコードするDNAのヌクレオチドの部位特異性変異誘発によって調製され、そしてその後、上で概説したような組換え細胞培養でDNAを発現させる。しかしながら、約100〜150残基までを有する変異体PRLRポリペプチド断片は、確立された技法を使用してインビトロでの合成によって調製できる。アミノ酸配列変異体は、変異体の予め定められた性質、PRLRポリペプチドアミノ酸配列の天然発生型対立または種間変異からそれらを区別する特徴によって特徴付けられる。変異体は、典型的には、天然発生型類似物質と同じ定性的生物活性を示すが、下で十分に概説されるように、改良された特徴を有する変異体も選択され得る。
アミノ酸配列変異を導入するための部位または領域が予め定められているのに対して、突然変異自体は予め定められる必要がない。たとえば所与の部位での突然変異の性能を最適化するために、標的コドンまたは領域においてランダム突然変異誘発を実施して、発現されたPRLRポリペプチド変異体を所望の活性の最適な組合せに関してスクリーニングできる。公知の配列を有するDNAの予め定めた部位に置換突然変異を作製する技法、たとえばM13プライマー突然変異誘発およびLAR突然変異誘発は公知である。突然変異のスクリーニングは、PRLRタンパク質活性のアッセイを使用して実施する。
アミノ酸置換は、典型的には1個の残基であるが、もちろん複数の残基であってよい;挿入は通常、約1〜20アミノ酸に対してであるが、かなりより大きい挿入が許容され得る。欠失は約1〜約20残基の範囲であるが、ある場合では欠失ははるかに大きくなり得る。
置換、欠失、挿入またはそのいずれかの組合せは、最終誘導体に達するために使用され得る。一般にこれらの変化は、分子の改変を最小限にするために数個のアミノ酸に対して実施される。しかしながら、より大規模な変更がある状況では許容され得る。PRLRポリペプチドの特徴の小規模な改変が所望されるとき、置換は一般に次の表に従って実施される:
置換が、表1に示す置換ほど保存的でないときに、機能または免疫同一性の実質的な変化が起こる。たとえば、置換は、次の:改変領域におけるポリペプチド主鎖の構造(たとえばα−らせん構造またはβ−シート構造);標的部位における分子の電荷または疎水性;および側鎖のかさ高さ;の1つ以上にさらに著しい影響を及ぼすために、全長で行なわれ得る。一般にポリペプチドの特性で最大の変化を生じることが予想される置換は、(a)親水性残基、たとえばセリルまたはトレオニルが、疎水性残基、たとえばロイシル、イソロイシル、フェニルアラニル、バリルまたはアラニルと(またはこれらによって)置換される;(b)システインまたはプロリンが、いずれかの他の残基と(またはこれらによって)置換される;(c)電気陽性側鎖を有する残基、たとえばリジル、アルギニル、またはヒスチジルが、電気陰性残基、たとえばグルタミルまたはアスパルチルと(またはこれらによって)置換される;あるいは(d)かさ高い側鎖を有する残基、たとえばフェニルアラニンが、側鎖を有さない残基、たとえばグリシンと(またはこれらによって)置換される;置換である。
変異体は、典型的には、天然発生型類似物質と同じ定性的生物活性を示し、同じ免疫応答を誘発するが、変異体は改良された特徴も有し得る。
PRLRポリペプチドは、検出および処置の方法においてそれ自体発現されて、使用され得る。それらはこのような方法でのそれらの使用を補助するためにさらに修飾され得る。
PRLRポリペプチドの共有結合性修飾はたとえばスクリーニングに利用され得る。共有結合性修飾の1つの種類は、PRLRポリペプチドの標的化アミノ酸残基を、PRLRポリペプチドの選択された側鎖あるいはNまたはC末端残基と反応することができる有機誘導体化剤と反応させる工程を含む。二官能性薬剤を用いる誘導体化は、たとえば、下でさらに十分に記載するように、抗PRLR抗体を精製するための、またはスクリーニングアッセイのための方法のための、PRLRポリペプチドを水−不溶性支持体マトリクスまたは表面へ架橋するために有用である。一般に使用される架橋剤としては、たとえば1,1−ビス(ジアゾアセチル)−2−フェニルエタン、グルタルアルデヒド、N−ヒドロキシスクシンイミドエステル、たとえば4−アジドサリチル酸とのエステル、3,3’−ジチオビス(スクシンイミジルプロピオネート)などのジスクシンイミジルエステルを含むホモ二官能性イミドエステル、ビス−N−マレイミド−1,8−オクタンなどの二官能性マレイミドおよびメチル−3−[(p−アジドフェニル)ジチオ]プロピオイミデートなどの薬剤が挙げられる。
他の修飾としては、グルタミニル残基およびアスパラギニル残基の、それぞれ対応するグルタミル残基およびアスパルチル残基への脱アミド化、プロリンおよびリジンのヒドロキシル化、セリル、トレオニルまたはチロシル残基のヒドロキシル基のホスホリル化、リジン、アルギニン、およびヒスチジン側鎖のa−アミノ基のメチル化(T.E.Creighton、Proteins:Structure and Molecular Properties,W.H.Freeman & Co.,San Francisco,pp.79−86(1983))、N末端アミンのアセチル化、およびいずれかのC末端カルボキシル基のアミド化が挙げられる。
本発明の範囲に含まれるPRLRポリペプチドの共有結合性修飾の別のタイプは、ポリペプチドの未変性グリコシル化を変更することを含む。「未変性グリコシル化パターンを変更すること」は、本明細書の目的では、未変性配列PRLRポリペプチドに見出される1つ以上の炭水化物部分を欠失させること、および/または未変性配列PRLRポリペプチド中に存在しない1つ以上のグリコシル化部位を付加することを意図している。
グリコシル化部位のPRLRポリペプチドへの付加は、そのアミノ酸配列を変更することによって実施され得る。変更はたとえば、(O結合グリコシル化部位について)未変性配列PRLRポリペプチドへの1つ以上のセリンまたはトレオニン残基の付加、あるいは置換によって実施され得る。PRLRアミノ酸配列は、場合により、特に、所望のアミノ酸へ翻訳するコドンが産生されるようにPRLRポリペプチドをコードするDNA予備選択した塩基にて変異させることによって、DNAレベルでの変化を通じて変更させることができる。
PRLRポリペプチドの炭化水素部分の数を増加させる別の手段は、グリコシドのポリペプチドへの化学的または酵素的カップリングによる。このような方法は、当分野で、たとえば1987年9月11に公開されたWO87/05330に、そしてAplin and Wriston,LA Crit.Rev.Biochem.,pp.259−306(1981)に記載されている。
PRLRポリペプチドに存在する炭水化物部分の除去は、化学的または酵素的に、あるいはグリコシル化の標的として作用するアミノ酸残基をコードするコドンの突然変異的置換によって達成され得る。化学的脱グリコシル化技法は当分野で公知であり、たとえば、Hakimuddin,ら、Arch.Biochem.Biophys.,259:52(1987)によって、そしてEdgeら、Anal.Biochem.,118:131(1981)によって記載されている。ポリペプチドの炭水化物部分の酵素的開裂は、Thotakuraら、Meth.Enzymol.,138:350(1987)によって記載されているように、各種のエンドグリコシダーゼおよびエキソグリコシダーゼの使用によって達成され得る。
PRLRの共有結合性修飾の別のタイプは、米国特許第4,640,835号;第4,496,689号;第4,301,144号;第4,670,417号;第4,791,192号または第4,179,337号に記載されている方法で、PRLRポリペプチドを各種の非タンパク質性ポリマー、たとえばポリエチレングリコール、ポリプロピレングリコール、またはポリオキシアルキレンの1つに連結することを含む。
PRLRポリペプチドは、別の異種ポリペプチドまたはアミノ酸配列に融合されたPRLRポリペプチドを含むキメラ分子を形成する方法で修飾することもできる。一実施形態において、このようなキメラ分子は、PRLRポリペプチドと、抗タグ抗体が選択的に結合し得るエピトープを提供するタグポリペプチドとの融合を含む。エピトープタグは一般に、PRLRポリペプチドのアミノ−またはカルボキシル−末端に配置されるが、ある例では内部融合も許容され得る。PRLRポリペプチドのこのようなエピトープタグ付き形の存在は、タグポリペプチドに対する抗体を使用して検出できる。また、エピトープタグの供給は、PRLRポリペプチドが抗タグ抗体またはエピトープタグに結合する他の種類の親和性マトリクスを使用する親和性精製によって容易に精製されるようにする。代わりの実施形態において、キメラ分子は、PRLRポリペプチドと免疫グロブリンまたは免疫グロブリンの特定の領域との融合を含み得る。キメラ分子の2価形では、このような融合はIgG分子のFc領域に対してであり得る。
各種のタグポリペプチドおよびそれらの各抗体は当分野で公知である。例としては、ポリ−ヒスチジン(poly−his)またはポリ−ヒスチジン−グリシン(poly−his−gly)タグ;flu HAタグポリペプチドおよびその抗体12CA5(Fieldら、Mol.Cell.Biol.,8:2159−2165(1988));c−mycタグおよびこれに対する8F9、3C7、6E10、G4、B7および9E10抗体(Evanら、Molecular and Cellular Biology,5:3610−3616(1985));ならびに単純ヘルペスウイルス糖タンパク質D(gD)タグおよびその抗体(Paborskyら、Protein Engineering,3(6):547−553(1990))が挙げられる。他のタグポリペプチドとしては、Flagペプチド(Hoppら、Bio Technology,6:1204−1210(1988));KT3エピトープペプチド(Martinら,Science,255:192−194(1992));チューブリンエピトープペプチド(Skinnerら、J.Biol.Chem.,266:15163−15166(1991));およびT7遺伝子10タンパク質ペプチドタグ(Lutz−Freyermuthら、Proc.Natl.Acad.Sci.USA,87:6393−6397(1990))が挙げられる。
あるいは、PRLRタンパク質ファミリーの他のPRLRタンパク質、および他の生物からのPRLRタンパク質も下で概説するようにクローニングおよび発現され得る。それゆえプローブまたは縮重ポリメラーゼ連鎖反応(PCR)プライマー配列を使用して、ヒトまたは他の生物から他の関連するPRLRタンパク質を見出すことができる。当業者によって認識されるように、特に有用なプローブおよび/またはPCRプライマー配列は、PRLR核酸配列の独自の範囲を含む。当分野で一般に既知であるように、好ましいPCRプライマーは約15〜約35ヌクレオチド長であり、約20〜約30が好ましく、必要に応じてイノシンを含有し得る。PCR反応の条件は、当分野で公知である。
加えて本明細書で概説するように、PRLR遺伝子によってコードされるものより長いPRLRタンパク質を、たとえば追加配列の解明、エピトープまたは精製タグの添加、他の融合配列の添加などによって作製できる。
PRLR核酸によってコードされるようなPRLRタンパク質も同定され得る。それゆえ、上で挙げたPRLR遺伝子、またはそれらの補体にハイブリダイズするPRLRタンパク質は、本明細書で概説するようにコードされる。
PRLRポリペプチドの発現
PRLRタンパク質をコードするPRLR遺伝子に由来する核酸は、上述のように次にスクリーニングアッセイで使用され得るPRLRタンパク質を発現する各種の発現ベクターを作製するために使用され得る。発現ベクターは、自己複製染色体外ベクターまたは宿主ゲノムに組み込まれるベクターのどちらかであり得る。一般に、これらの発現ベクターは、PRLRタンパク質をコードする核酸に作動可能に連結された転写および翻訳制御核酸を含む。用語「制御配列」は、特定の宿主生物において、作動可能に連結されたコード配列の発現に不可欠なDNA配列を指す。原核生物に適切な制御配列としては、たとえばプロモータ、場合によりオペレータ配列、およびリボソーム結合部位が挙げられる。真核生物細胞は、プロモータ、ポリアデニル化シグナル、およびエンハンサを利用することが公知である。
核酸は、別の核酸配列と機能的関係で配置されるときに、「作動可能に連結される」。たとえば、プレ配列または分泌リーダーのDNAは、ポリペプチドの分泌に関与するプレタンパク質として発現される場合、ポリペプチドのDNAに作動可能に連結される;プロモータまたはエンハンサは、コード配列の転写に影響する場合、この配列に作動可能に連結される;あるいはリボソーム結合部位は、翻訳を容易にするように配置された場合、コード配列に作動可能に連結される。一般に、「作動可能に連結される」は、連結されるDNA配列が隣接すること、および分泌リーダーの場合は、隣接してリーディングフレームにあることを意味する。しかしながら、エンハンサは、隣接する必要はない。連結は、好都合な制限部位での結合によって達成される。このような部位が存在しない場合、合成オリゴヌクレオチドアダプタまたはリンカーが、従来の常法に従って使用される。転写調節核酸および翻訳調節核酸は一般に、PRLRタンパク質を発現させるために使用される宿主細胞にとって適切である;たとえば、Bacillus由来の転写調節核酸配列および翻訳調節核酸配列は好ましくは、Bacillus中でPRLRタンパク質を発現させるために使用される。多くの種類の適切な発現ベクター、および適切な調節配列が、種々の宿主細胞について、当分野で公知である。
一般に、転写調節配列および翻訳調節配列としては、限定されないが、プロモータ配列、リボソーム結合部位、転写開始配列および転写停止配列、翻訳開始配列および翻訳停止配列、ならびにエンハンサ配列またはアクチベータ配列が挙げられる。実施形態において、制御配列はプロモータならびに転写開始および停止配列を含む。
プロモータ配列は、構成的プロモータまたは誘導プロモータのどちらかをコードする。プロモータは天然発生型プロモータまたはハイブリッドプロモータのどちらかであり得る。1つを超えるプロモータの要素を組合せるハイブリッドプロモータも当分野で公知であり、本発明で有用である。
加えて、発現ベクターは追加の要素を含み得る。たとえば、発現ベクターは2つの複製系を有することができ、このためそれを2種類の生物、たとえば発現のための哺乳類細胞または昆虫細胞およびクローニングおよび増幅のための原核生物宿主において維持されるようにする。さらに、発現ベクターを組み込むために、発現ベクターは、宿主細胞ゲノムに相同性である少なくとも1つの配列と、好ましくは発現構築物に隣接する2つの相同配列とを含有する。組み込みベクターは、ベクター内への封入のために適切な相同配列を選択することによって、宿主細胞内の特定の座位に向けることができる。組み込みベクターの構築物は当分野で公知である。
加えて、実施形態において、発現ベクターは、形質転換された宿主細胞の選択を可能にするために、選択可能なマーカー遺伝子を含有する。抗生物質抵抗性遺伝子を含む選択遺伝子は当分野で公知であり、使用する宿主細胞の種類によって変わるであろう。
PRLRタンパク質は、PRLRタンパク質の発現を誘起または発生させるのに適切な条件下で、PRLRタンパク質をコードする核酸を含有する発現ベクターによって形質転換された宿主細胞を培養することによって産生され得る。PRLRタンパク質発現に適切な条件は、発現ベクターおよび宿主細胞の選択によって変化し、日常的な実験を通じて当業者によって容易に確認されるであろう。たとえば、発現ベクター内での構成的プロモータの使用は、宿主細胞の成長および増殖の最適化を必要とするのに対して、誘導プロモータの使用は誘導に適切な成長条件を必要とする。加えて、ある実施形態において、収集のタイミングが重要である。たとえば、昆虫細胞発現で使用されるバキュロウィルス系は溶解性のウィルスであり、それゆえ収集時間選択は産物収率にとって重要であり得る。
適切な宿主細胞としては、酵母、細菌、古細菌、真菌、ならびに昆虫細胞、植物細胞および哺乳類を含む動物細胞が挙げられる。特に興味があるのは、キイロショウジョウバエ(Drosophila melanogaster)細胞、サッカロマイセス・セレヴィシエ(Saccharomyces cerevisiae)および他の酵母、大腸菌(E.coli)、枯草菌(Bacillus subtillis)、Sf9細胞、C129細胞、293細胞、アカパンカビ(Neurospora)、BHK、CHO、COS、HeLa細胞、THP1細胞株(マクロファージ細胞株)ならびに細胞およびヒト細胞株である。
好ましくは、PRLRタンパク質は哺乳類細胞において発現される。哺乳類発現系も当分野で公知であり、レトロウィルス系を含む。好ましい発現ベクター系は、どちらも参照により明示的に本明細書に組み入れられているWO97/27212(PCT/US97/01019)およびWO97/27213(PCT/US97/01048)に一般に記載されているようなレトロウィルスベクター系である。哺乳類プロモータとして特に有用なのは、ウィルス遺伝子が高度に発現されることが多く、広範な宿主の範囲を有するため、哺乳類ウィルス遺伝子からのプロモータである。例としては、SV40初期プロモータ、マウス乳腺腫瘍ウィルスLTRプロモータ、アデノウィルス主要後期プロモータ、単純ヘルペスウィルスプロモータ、およびCMVプロモータが挙げられる。典型的には、哺乳類細胞によって認識される転写終結配列およびポリアデニル化配列は、翻訳停止コドンの3’側に位置する制御領域であり、それゆえプロモータ要素と共にコード配列に隣接する。転写ターミネータおよびポリアデニル化シグナルの例としては、SV40に由来するものが挙げられる。
哺乳類宿主はもちろんのこと、他の宿主に外来核酸を導入する方法は、当分野で公知であり、そして使用される宿主細胞によって変化するであろう。技法としては、デキストラン媒介トランスフェクション、カルシウムホスフェート沈殿、ポリブレン媒介トランスフェクション、プロトプラスト融合、電気穿孔、ウィルス感染、リポソーム中へのポリヌクレオチドのカプセル化、および核内へのDNAの直接微量注入が挙げられる。
代わりの実施形態において、PRLRタンパク質は細菌系で発現される。細菌発現系は当分野で公知である。バクテリオファージからのプロモータも当分野で使用され得、公知である。加えて、合成プロモータおよびハイブリッドプロモータも有用である;たとえば、tacプロモータはtrpおよびlacプロモータ配列のハイブリッドである。さらに、細菌プロモータは、細菌RNAポリメラーゼに結合して転写を開始する能力を有する非細菌起源の天然発生型プロモータを含み得る。機能プロモータ配列に加えて、効率的なリボソーム結合部位が望ましい。発現ベクターは、細菌におけるPRLRタンパク質の分泌を与えるシグナルペプチド配列も含み得る。タンパク質は、成長培地(グラム陽性細菌)内、または細胞の内膜と外膜との間に位置する細胞膜周辺腔(グラム陰性細菌)内へのどちらかへ分泌される。細菌発現ベクターは、形質転換された細菌株の選択を可能にする選択型マーカー遺伝子も含み得る。適切な選択遺伝子は、アンピシリン、クロラムフェニコール、エリスロマイシン、カナマイシン、ネオマイシンおよびテトラサイクリンなどの薬物に対して細菌を耐性にする遺伝子を含む。選択可能なマーカーは、ヒスチジン、トリプトファンおよびロイシン生合成経路におけるものなどの生合成遺伝子も含む。これらの構成要素は発現ベクター中へ構築される。細菌の発現ベクターは当分野で公知であり、特に枯草菌、大腸菌、クレモリス菌(Streptococcus cremoris)、およびStreptococcus lividansのベクターを含む。細菌発現ベクターは、当分野で公知の技法、たとえばカルシウムクロライド処理、電気穿孔およびその他などを使用して、細菌宿主細胞内へ形質転換される。
PRLRタンパク質は、昆虫細胞内で産生され得る。昆虫内の形質転換のための発現ベクター、そして特にバキュロウィルスベース発現ベクターは当分野で公知である。
さらなる実施形態において、PRLRタンパク質は酵母細胞内で産生され得る。酵母発現系は当分野で公知であり、サッカロマイセス・セレヴィシエ、カンジダ菌(Candida albicans)およびC.maltosa、Hansenula polymorpha、Kluyveromyces fragilisおよびK.lactis、Pichia guillerimondiiおよびP.pastoris、シゾサッカロミセス・ポンベ(Schizosaccharomyces pombe)ならびにYarrowia lipolyticaのための発現ベクターを含む。
PRLRタンパク質は、当分野で公知の技法を使用して、融合タンパク質としても産生され得る。それゆえ、たとえば、モノクローナル抗体の産生のためである。所望のエピトープが小さい場合、PRLRタンパク質は、免疫原を形成するために担体タンパク質に融合され得る。あるいは、PRLRタンパク質は、発現を増強するために、または他の理由のために融合タンパク質として作製され得る。たとえば、PRLRタンパク質がPRLRペプチドであるとき、ペプチドをコードする核酸は発現目的で他の核酸に連結され得る。
癌
本発明の方法によって検出される癌は、限定されないが、口腔および咽頭(唇、舌、唾液腺、口腔底、歯肉および他の口、鼻咽頭、扁桃、口腔咽頭部、下咽頭、他の口腔/他の咽頭)の癌;消化系(食道;胃;小腸;結腸および直腸;肛門、肛門管、および肛門直腸;肝臓;肝臓内胆汁管;胆嚢;他の胆管;膵臓;腹膜後腔;腹膜、網、および腸間膜、他の消化器)の癌;呼吸系(鼻腔、中耳、および洞;喉頭;肺および気管支;胸膜;気管;縦隔;ならびに他の呼吸系)の癌;中皮腫;骨および関節;および軟組織(心臓を含む)の癌;皮膚癌(黒色腫および他の非上皮性皮膚癌を含む);カポジ肉腫および乳癌;女性生殖系(子宮頸;子宮体;子宮、nos;卵巣;膣;外陰;および他の女性生殖器)の癌;男性生殖系(前立腺;精巣;陰茎;および他の男性生殖器)の癌;泌尿系(膀胱;腎臓および腎盤;尿管;および他の泌尿器)の癌;眼および眼窩の癌;脳および神経系(脳;および他の神経系)の癌;内分泌系(甲状腺、および胸腺を含む他の内分泌腺)の癌;リンパ腫(ホジキン病リンパ腫および非ホジキン性リンパ腫)、多発性骨髄腫、ならびに白血病(リンパ性白血病;骨髄性白血病;単球性白血病;および他の白血病)を含む。
組織学的タイプによって分類される他の癌としては、限定されないが、新生物(悪性);癌腫(NOS);癌腫(未分化、NOS);巨細胞癌腫および紡錘体細胞癌;小細胞癌(NOS);乳頭状癌(NOS);扁平上皮癌(NOS);リンパ上皮癌腫;基底細胞癌(NOS);毛質癌腫;移行上皮癌(NOS);乳頭状移行上皮癌;腺癌(NOS);ガストリノーマ(悪性);胆管癌;肝細胞癌(NOS);肝細胞癌と胆管癌との複合癌;索状腺癌;腺様嚢胞癌;腺腫様ポリープにおける腺癌;腺癌(大腸家族性ポリポシス);固形癌腫(NOS);カルチノイド腫瘍(悪性);気管支槽腺癌;乳頭状腺癌(NOS);色素嫌性癌腫;好酸性癌腫;好酸性腺癌;好塩基性癌腫;明細胞腺癌(NOS);顆粒細胞癌腫;濾胞状腺癌(NOS);乳頭状腺癌および濾胞状腺癌;非被包硬化癌腫;副腎皮質癌腫;類内膜癌;皮膚付属器癌腫;アポクリン腺癌;脂腺腺癌;耳垢腺癌;粘膜表皮癌腫;嚢胞腺癌(NOS);乳頭状嚢胞腺癌(NOS);乳頭状漿液嚢胞腺癌;粘液性嚢胞腺癌(NOS);粘液性腺癌;印環細胞癌;浸潤腺管癌;髄様癌(NOS);小葉癌;炎症性癌;パジェット疾患(乳房);腺房細胞癌腫;腺扁平上皮癌;上皮扁平化生を伴う腺癌;胸腺腫(悪性);卵巣間質腫瘍(悪性);莢膜腫(悪性);顆粒膜細胞腫(悪性);男性ホルモン産生細胞腫(悪性);セルトーリ細胞癌腫;ライディッヒ細胞腫(悪性);脂質細胞腫瘍(悪性);パラガングリオーマ(悪性);乳房外パラガングリオーマ(悪性);褐色細胞腫;グロムス血管肉腫;悪性黒色腫(NOS);メラニン欠乏症黒色腫;表在拡大型黒色腫;巨大色素性母斑における悪性黒色腫;類上皮細胞黒色腫;青色母斑(悪性);肉腫(NOS);線維肉腫(NOS);線維性組織球腫(悪性);粘液肉腫;脂肪肉腫(NOS);平滑筋肉腫(NOS);横紋筋肉腫(NOS);胎児性横紋筋肉腫;槽横紋筋肉腫;間質肉腫(NOS);複合腫瘍(悪性、NOS);ミュラー複合腫瘍;腎臓芽細胞腫;肝臓芽細胞腫;癌肉腫(NOS);間葉腫(悪性);ブレンナー腫(悪性);葉状腫瘍(悪性);滑膜肉腫(NOS);中皮腫(悪性);未分化胚細胞腫;胎生期癌(NOS);奇形腫(悪性、NOS);卵巣甲状腺腫(悪性);絨毛癌;中腎腫(悪性);血管肉腫;血管内皮腫(悪性);カポジ肉腫;血管周囲細胞腫(悪性);リンパ管肉腫;骨肉腫(NOS);皮質近接部骨肉腫;軟骨肉腫(NOS);軟骨芽細胞腫(悪性);間葉軟骨肉腫;骨巨細胞腫;ユーイング肉腫;歯原性腫瘍(悪性);エナメル上皮歯原性肉腫;エナメル上皮腫(悪性);エナメル上皮線維肉腫;松果体腫(悪性);脊索腫;神経膠腫(悪性);上衣腫(NOS);星状細胞腫(NOS);原型質性星状細胞腫;線維性星状細胞腫;星状芽細胞腫;膠芽細胞腫(NOS);希突起膠腫(NOS);希突起膠細胞腫;未分化神経外胚葉性腫瘍;小脳肉腫(NOS);神経節芽細胞腫;神経芽細胞腫(NOS);網膜芽腫(NOS);嗅神経原性腫瘍;髄膜腫(悪性);神経線維肉腫;神経鞘腫(悪性);顆粒細胞腫瘍(悪性);悪性リンパ腫(NOS);ホジキン病(NOS);ホジキン性病側肉芽種(NOS);悪性リンパ腫(小リンパ球性);悪性リンパ腫(大細胞、散在性);悪性リンパ腫(濾胞状、NOS);菌状息肉腫;他の特定の非ホジキン性リンパ腫;悪性組織球増殖;多発性骨髄腫;肥満細胞肉腫;免疫増殖性小腸疾患;白血病(NOS);リンパ性白血病(NOS);形質細胞性白血病;赤白血病;リンパ肉腫細胞白血病;骨髄性白血病(NOS);好塩基球性白血病;好酸球性白血病;単球性白血病(NOS);肥満細胞性白血病;巨核芽球性白血病;骨髄性肉腫;ならびにヘアリーセル白血病が挙げられる。
好ましくは、本発明の方法によって検出および処置される癌は、リンパ腫、白血病、乳癌、結腸癌、腎臓癌、肝臓癌、肺癌、卵巣癌、膵臓癌、前立腺癌、子宮癌、子宮頸部癌または皮膚癌から選択される。
抗体
本発明は、PRLR遺伝子によって発現されたPRLRポリペプチドに結合する、好ましくはこのようなポリペプチドに特異的に結合する抗体を使用する。用語「特異的に結合する」は、抗体が他の関連ポリペプチドに対するその親和性よりも、その標的PRLRポリペプチドに対して実質的に高い親和性を有することを意味する。本明細書で使用するとき、用語「抗体」は、問題の抗原決定基に結合できる無傷分子はもちろんのこと、その断片、たとえばFab、F(ab’)2およびFvも指す。抗体のさらなる例としては、完全集合(fully assembled)抗体、モノクローナル抗体、ポリクローナル抗体、多重特異性抗体(たとえば二重特異性抗体)、一本鎖抗体、キメラ抗体、ヒト化抗体、human engineered antibody、ヒト抗体、ダイアボディ、トリアボディ、テトラボディ、ミニボディ、直鎖抗体、キレート組換え抗体、イントラボディ、ナノボディ、小型モジュール免疫薬(small modular immunopharmaceutical(SMIP))、抗原結合ドメイン免疫グロブリン融合タンパク質、ラクダ化抗体、VHH含有抗体、または抗体の1つ以上のCDR配列を含むこれらの抗体のいずれか1つのムテイン、およびそれらが所望の生物活性(たとえばPRLRの細胞外ドメインへの結合)を示す限り、上記を含む組換えペプチドを含む。「実質的に高い親和性」によって、我々は、他の関連ポリペプチドに対する親和性と比較して、本発明の標的PRLRポリペプチドに対する親和性の測定可能な上昇があることを意味する。好ましくは、親和性は、他の公知のホモログまたはオルソグの親和性と比較して、標的PRLRポリペプチドに対して少なくとも1.5倍、2倍、5倍、10倍、100倍、103倍、104倍、105倍、106倍またはそれ以上である。あるいは抗体が公知のホモログおよびオルソグと交差反応することが有用であり得る。
好ましくは、抗体は高い親和性で、好ましくは10−4M、10−5M、10−6Mまたはそれ未満、好ましくは10−7M、10−8Mまたはそれ未満、最も好ましくは10−9Mまたは10−10Mあるいはそれ未満の解離定数でPRLRに結合し;サブナノモルの親和性(0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1nMまたはなおそれ未満)が好ましい。PRLRポリペプチドがたとえば免疫療法のための抗体を産生するのに使用されるとき、PRLRポリペプチドは少なくとも1つのエピトープまたは決定基を全長タンパク質と共有する。「エピトープ」または「決定基」とは本明細書では、MHCの文脈で抗体またはT細胞レセプタを産生および/または結合するであろうタンパク質の部分を意味する。それゆえ、大半の例において、より小さいPRLRポリペプチドに対して作製された抗体は、全長タンパク質に結合できるであろう。実施形態において、エピトープは独自である;すなわち、独自のエピトープに対して産生された抗体は、交差反応性をほとんどまたは全く示さない。
PRLR遺伝子によってコードされるいずれかのポリペプチド配列を分析して、ポリペプチドのある好ましい領域を決定し得る。高い抗原性の領域は、DNASTAR分析のデータから、免疫応答の開始のプロセスで抗原認識が生じ得る環境で、ポリペプチドの表面上に露出されやすいポリペプチドの領域を表す値を選択することによって決定される。たとえば、PRLR遺伝子配列によってコードされるポリペプチドのアミノ酸配列は、DNASTARコンピュータアルゴリズムのデフォルトのパラメータを用いて分析され得る(DNASTAR,Inc.,Madison,Wis.;dnastar.comでワールドワイドウェブサイトを参照)。
DNASTARコンピュータアルゴリズムを使用して日常的に得ることができるポリヌクレオチドレオチドの特徴としては、限定されないが:Garnier−Robsonのアルファ領域、ベータ領域、ターン領域およびコイル領域(Garnierら、J.Mol.Biol.,120:97(1978));Chou−Fasmanのアルファ領域、ベータ領域およびターン領域(Adv.Enzymol.,47:45−148(1978));Kyte−Doolittleの親水性領域および疎水性領域(J.Mol.Biol.,157:105−132(1982));Eisenbergのアルファ領域およびベータ領域;Karplus−Schulz柔軟性領域;Eminiの表面形成領域(J.Virol.,55(3):836−839(1985));ならびに高い抗原指数のJameson−Wolf領域(CABIOS,4(1):181−186(1988))が挙げられる。Kyte−Doolittleの親水性領域および疎水性領域、Eminiの表面形成領域ならびにJameson−Wolfの高い抗原指数の領域(すなわちJameson−Wolfプログラムのデフォルトパラメータを用いて同定されるように、1.5以上の抗原指数を有する4つ以上の連続するアミノ酸を含有する)は、抗原性に対する高度の可能性を示すポリペプチド領域を決定するために日常的に用いられ得る。タンパク質に対する抗体を調製する1つの手法は、タンパク質のすべてまたは一部のアミノ酸配列の選択および調製、その配列の化学的合成、ならびに適切な動物、典型的には、ウサギ、ハムスターまたはマウスへのその注射である。オリゴペプチドは、親水性領域に存在するオリゴペプチドに基づくPRLRタンパク質に対する抗体産生の候補として選択でき、それゆえ成熟なタンパク質中で露出されやすい。追加のオリゴペプチドは、たとえば参照により本明細書に組み入れられている、Antigenicity Index,Welling,G.W.ら、FEBS Lett.188:215−218(1985)を使用して決定され得る。
用語「モノクローナル抗体」は、本明細書で使用するとき、実質的に同種の抗体の集合から得た抗体を指し、すなわち集合を含む個々の抗体が、微量で存在し得ると考えられる天然発生型突然変異体を除いて同一である。モノクローナル抗体は高度に特異性であり、単一の抗原部位に対して作られる。さらに、異なる決定基(エピトープ)に対して作られた、異なる抗体を典型的に含む、従来の(ポリクローナル)抗体調製とは対照的に、各モノクローナル抗体は抗原上の単一の決定基に対して作られる。その特異性に加えて、モノクローナル抗体は、それらが異なる特異性および特徴を備えた他の免疫グロブリンによって汚染されていない均質培養物によって合成されるという点で好都合である。
修飾語句「モノクローナル」は、抗体の特徴が抗体の実質的に同種の集合から得られた通りであり、特定の方法による抗体の産生を必要とするとして解釈されるべきでない。たとえば、本発明に従って使用されるモノクローナル抗体は、Kohlerら、Nature,256:495[19751によって最初に記載されたように作製され得るか、または組換えDNA法によって作製され得る(たとえば米国特許第4,816,567号)。「モノクローナル抗体」は、たとえばClacksonら、Nature,352:624628[1991]およびMarksら、J.Mol.Biol.,222:581−597(1991)に記載されている技法を使用してファージ抗体ライブラリーから単離することもできる。
その重鎖の定常ドメインのアミノ酸配列に応じて、免疫グロブリンを異なるクラスに割り当てることができる。5つの主要なクラスIgA、IgD、IgE、IgGおよびIgMがあり、これらのいくつかはサブクラスまたはアイソタイプ、たとえばIgG1、IgG2、IgG3、IgG4、IgA1およびIgA2にさらに分割できる。免疫グロブリンの異なるクラスに対応する重鎖定常ドメインは、それぞれアルファ、デルタ、イプシロン、ガンマおよびミューと呼ばれる。免疫グロブリンの異なるクラスのサブユニット構造および三次元配置は周知である。異なるアイソタイプは異なるエフェクタ機能を有する;たとえば、IgG1およびIgG3アイソタイプはADCC活性を有する。
「抗体フラグメント」は、無傷の全長抗体の一部、好ましくは無傷の抗体の抗原結合または可変領域を含む。抗体フラグメントの例としては、Fab、Fab’、F(ab’)2、およびFv断片;ダイアボディ、直鎖抗体(Zapataら、Protein Eng.,8(10):1057−1062(1995));一本鎖抗体分子;および抗体断片から形成された多重特異性抗体が挙げられる。抗体のパパイン消化は、それぞれ単一の抗原結合部位を備えた「Fab」断片と、その名前がただちに結晶化するその能力を反映している残りの「Fc」断片と呼ばれる、2つの同一の抗原結合断片を産生する。ペプシン処理は、抗体のVHおよびVLドメインを含む2つの「一本鎖Fv」または「sFv」抗体断片を有するF(ab’)2断片を産生し、これらのドメインは単一のポリペプチド鎖内に存在する。好ましくは、Fvポリペプチドは、Fvに抗原結合のための所望の構造を形成させることができるVHドメインとVLドメインとの間のポリペプチドリンカーをさらに含む。sFvの総説については、Pluckthun in The Pharmacology of Monoclonal Antibodies,vol.113,Rosenburg and Moore eds.,Springer−Verlag,New York,pp.269−315(1994)を参照。
用語「超可変」領域は、抗原結合の原因となる抗体のアミノ酸残基を指す。超可変領域は、相補性決定領域すなわちCDRからのアミノ酸残基[すなわちKabatら、Sequences of Proteins of Immunological Interest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,Md.(1991)によって記載されている、軽鎖可変ドメインの24−34(L1)、50−56(L2)および89−97(L3)ならびに重鎖可変ドメインの31−35(H1)、50−65(H2)および95−102(H3)]および/または超可変ループからのこのような残基(すなわち[Chothiaら、J.Mol.Biol.196:901−917(1987)]によって記載されている、軽鎖可変ドメインの残基26−32(Ll)、50−52(L2)および91−96(L3)ならびに重鎖可変ドメインの26−32(H1)、53−55(H2)および96−101(H3))を含む。
「フレームワーク」すなわちFR残基は、超可変領域残基以外のこのような可変ドメイン残基である。
ポリクローナル抗体
ポリクローナル抗体を調製する方法は当業者に公知である。ポリクローナル抗体は、たとえば免疫剤、および所望ならばアジュバントの1回以上の注射によって哺乳類において産生できる。典型的には、免疫剤および/またはアジュバントは、複数回の皮下または腹腔内注射によって哺乳類に注射されるであろう。免疫剤は、図の核酸またはその断片またはその融合タンパク質によってコードされるタンパク質を含み得る。免疫化される哺乳類において免疫原であることは、公知のタンパク質に免疫剤をコンジュゲートすることに有用であり得る。そのような免疫原性タンパク質の例としては、限定されないが、キーホールリンペットヘモシアニン、血清アルブミン、ウシサイログロブリン、およびダイズトリプシンインヒビタが挙げられる。利用され得るアジュバントの例としては、フロイント完全アジュバントおよびMPL−TDMアジュバント(モノホスホリルリピッドA、合成トレハロースジコリノミコレート)が挙げられる。免疫プロトコルは、過度の実験をすることなく、当業者によって選択され得る。
モノクローナル抗体
好ましくは、抗体はモノクローナル抗体である。モノクローナル抗体は、Kohler and Milstein、Nature,256:495(1975)によって記載されるようなハイブリドーマ法を使用して調製され得る。ハイブリドーマ法では、マウス、ハムスター、または他の適切な宿主動物は、典型的には、免疫剤に特異的に結合する抗体を産生するか、または産生し得るリンパ球を誘発するために免疫剤によって免疫化される。あるいは、リンパ球はインビトロで免疫化され得る。免疫剤は、典型的には、PRLRポリペプチド、あるいはその断片またはその融合タンパク質を含むであろう。一般に、ヒト起源の細胞が所望の場合には末梢血リンパ球(PBL)が使用され、あるいは非ヒト哺乳類源が所望の場合には脾臓細胞またはリンパ節細胞が使用される。リンパ球は次にハイブリドーマ細胞を形成するために、適切な融合剤、たとえポリエチレングリコールを使用して不死化細胞株と融合される(Goding,Monoclonal Antibodies:Principles and Practice,Academic Press,(1986)pp.59−103)。不死化細胞株は通常、形質転換された哺乳類細胞、特にげっ歯類、ウシおよびヒト起源の骨髄腫細胞である。通常、ラットまたはマウス骨髄腫細胞株が利用される。ハイブリドーマ細胞は、未融合の不死化細胞の成長または生存を抑制する1つ以上の物質を好ましくは含有する適切な培養培地中で培養され得る。たとえば、親細胞で酵素ヒポキサンチングアニンホスホリルトランスフェラーゼ(HGPRTまたはHPRT)が欠乏している場合、ハイブリドーマの培養培地は、典型的には、ヒポキサンチン、アミノプテリン、およびチミジン(「HAT培地」)を含み、この物質は、HGPRT欠失細胞の成長を予防する。モノクローナル抗体技術は、研究、診断および治療の実行に使用される。モノクローナル抗体は、インビトロでの診断のためのラジオイムノアッセイ、酵素結合免疫吸着測定法、免疫細胞病理学およびフローサイトメトリーで、およびヒト疾患の診断および免疫治療のためにインビボで使用される。Waldmann,T.A.(1991)Science 252:1657−1662。特に、モノクローナル抗体は、正常組織を避けながら悪性病巣を標的とすることが所望である癌の診断および治療に幅広く利用されている。たとえばFrankel,らへの米国特許第4,753,894号;Ringらへの米国特許第4,938,948号;およびBjornらへの米国特許第4,956,453号を参照。
抗体断片
抗体は二重特異性断片であり得る。この場合の用語「抗体」としては、本明細書で使用するとき、当分野で公知であるような、Fab、Fab’、F(ab’)2、およびFv断片;ダイアボディ;直鎖抗体;一本鎖抗体分子;多重特異性抗体、たとえば二重特異性などの抗体;ミニボディ;キレート組換え抗体;トリボディ;バイボディ;イントラボディ;ナノボディ;小型モジュール免疫薬(SMIP)、結合ドメイン免疫グロブリン融合タンパク質;ラクダ化抗体、VHH含有抗体、キメラ抗体など、および抗体全体の修飾によって産生された抗体断片または組換えDNA技術を使用してデノボ合成された抗体断片のどちらかから形成された他のポリペプチドが挙げられる。
用語「ダイアボディ」は、2個の抗原結合部位を備えた小型抗体断片を指し、その断片は同じポリペプチド鎖(VHVL)内に軽鎖可変ドメイン(VL)に結合された重鎖可変ドメイン(VH)を含む。同じ鎖上の2個のドメイン間の対形成を可能にするには短すぎるリンカーを使用することによって、ドメインは強制的に別の鎖の相補性ドメインと対形成させられて、2個の抗原結合部位を生成する。ダイアボディは、たとえば欧州特許第404,097号;WO93/11161;および30、Hollingerら、Proc.Natl.Acad.Sci.USA,90:6444−6448(1993)により十分に記載されている。
抗体のパパイン消化は、それぞれ単一の抗原結合部位を備えたVL、VH、CLおよびCHドメインより成る1価断片である「Fab」断片と、その名前がただちに結晶化するその能力を反映している残りの「Fc」断片と呼ばれる、2つの同一の抗原結合断片を産生する。ペプシン処理は、抗体のVHおよびVLドメインを含む2個の「一本鎖Fv」または「sFv」抗体断片を有する、ヒンジ領域にてジスルフィドブリッジによって連結された2個のFab断片を含む2価断片であるF(ab’)2断片を産生し、これらのドメインは単一のポリペプチド鎖内に存在する。好ましくは、Fvポリペプチドは、Fvに抗体結合のための所望の構造を形成させて、一本鎖抗体(scFv)を生じさせる、VHドメインとVLドメインとの間のポリペプチドリンカーをさらに含み、VLおよびVH領域は対形成して、それらを単一のタンパク質鎖として生成させる合成リンカーによって1価分子を形成する(Birdら、Science 242:423−426,1988,およびHustonら、Proc.Natl.Acad.Sci.USA 85:5879−5883,1988)。sFvの総説については、Pluckthun in The Pharmacology of Monoclonal Antibodies,vol.113,Rosenburg and Moore eds.,Springer−Verlag,New York,pp.269−315(1994)を参照。Fd断片はVHドメインおよびCH1ドメインより成る。
追加の抗体断片は、VHドメインを構成するドメイン抗体(dAb)断片(Wardら、Nature 341:544−546,1989)を含む。
「直鎖抗体」は、抗原結合領域の対を形成するタンデムFdセグメント(VH−CH1−VH−CH1)の対を含む。直鎖抗体は、二重特異性または単一特異性であり得る(Zapataら、Protein Eng.8:1057−62(1995))。
ペプチドリンカー(ヒンジなし)を介して、またはIgGヒンジを介してCH3に融合されたscFvより成る「ミニボディ」は、Olafsen,ら、Protein Eng Des Sel 2004 Apr;17(4):315−23に記載されている。
軽鎖を欠失した機能重鎖抗体は、テンジクザメ(Greenbergら、Nature 374:168−73,1995)、ウォビゴンサメ(Nuttallら、Mol Immunol.38:313−26,2001)およびラクダ、ヒトコブラクダ、アルパカおよびラマなどのラクダ科(Hamers−Castermanら、Nature 363:446−8,1993;Nguyenら、J.Mol.Biol.275:413,1998)で自然に発生する。抗原結合部位は、これらの動物で単一のドメインのVHHドメインに還元される。これらの抗体は、重鎖可変領域のみを使用して抗原結合領域を形成し、すなわちこれらの機能抗体は、構造H2L2のみを有する重鎖のホモダイマーである(「重鎖抗体」または「HCAb」と呼ばれる)。ラクダ化VHHは、ヒンジ、CH2およびCH3ドメインを含有し、CH1ドメインを欠失したIgG2およびIgG3定常領域と組換えることが報じられている(Hamers−Castermanら、同上)。たとえば、リマIgG1は、VHがヒンジ、CH1、CH2およびCH3ドメインを含有する定常領域と組換える従来の(H2L2)抗体アイソタイプであるのに対して、リマIgG2およびIgGは、CH1ドメインを欠失して、軽鎖を含有しない重鎖のみのアイソタイプである。古典的なVHのみの断片は、溶解形で産生することが困難であるが、フレームワーク残基をさらにVHH様に改変したときに溶解度および特異性結合の改良を得ることができる。(たとえばReichman,ら、J Immunol Methods 1999,231:25−38)。ラクダ科VHHドメインは、高い親和性を備えた抗原に結合することと(Desmyterら、J.Biol.Chem.276:26285−90,2001)、溶液中で高い安定性を持つこと(Ewertら、Biochemistry 41:3628−36,2002)が見出されている。ラクダ化重鎖を有する抗体を産生する方法は、たとえば、米国特許公開第20050136049号および第20050037421号に記載されている。
重鎖抗体の可変領域はわずか15kDaの分子量を持つ最小の完全機能抗原結合断片であるため、この実体はナノボディと呼ばれる(Cortez−Retamozoら、Cancer Research 64:2853−57,2004)。ナノボディライブラリーは、Conrathら(Antimicrob Agents Chemother 45:2807−12,2001)に記載されている免疫化ヒトコブラクダから、またはSchoonjansら(J Immunol.165:7050−57,2000)およびWillemsら(J Chromatogr B Analyt Technol Biomed Life Sci.786:161−76,2003)に記載されている、二重特異性Fab−scFv(「バイボディ」)および三重特異性Fab−(scFv)(2)(「トリボディ」)の産生に記載されているような組換え方法を使用して、産生され得る。バイボディまたはトリボディでは、scFv分子はVL−CL(L)鎖およびVH−CH1(Fd)鎖の一方または両方に融合されて、たとえば2個のscFvがFabのC−termに融合されたトリボディを産生するのに対して、バイボディでは1個のscFvがFabのC−termに融合される。
イントラボディは、細胞内発現を証明する一本鎖抗体であり、細胞内タンパク質機能を操作し得る(Biocca,ら、EMBO J.9:101−108,1990;Colbyら、Proc.Natl Acad Sci USA.101:17616−21,2004)。細胞内領域で抗体構築物を保持する細胞シグナル配列を含むイントラボディは、Mhashilkarら(EMBO J 14:1542−51,1995)およびWheelerら(FASEB J.17:1733−5.2003)に記載されているように産生され得る。トランスボディは、タンパク質伝達ドメイン(PTD)が一本鎖可変断片(scFv)抗体と融合される細胞透過性抗体である、Hengら(Med Hypotheses.64:1105−8,2005)。
標的タンパク質に対して特異性であるSMIPまたは結合ドメイン免疫グロブリン融合タンパク質が、さらに考慮される。これらの構築物は、抗体エフェクタ機能を実施するのに必要な免疫グロブリンドメインに融合した抗体結合ドメインを含む一本鎖ポリペプチドである。たとえばWO03/041600、米国特許公開第20030133939号および米国特許公開第20030118592号を参照。
多重特異性抗体
ある実施形態において、少なくとも2つの異なるエピトープに対する結合特異性を有する多重特異性(たとえば二重特異性、三重特異性など)モノクローナル抗体を産生することが望ましい。例示的な二重特異性抗体は、PRLRの2つの異なるエピトープに結合し得る。あるいは抗PRLRアームを、T細胞レセプタ分子などの白血球上のトリガー分子(たとえばCD2またはCD3)、またはIgGのFcレセプタ(FcγR)、たとえばFcγRI(CD64)、FcγRII(CD32)およびFcγRIII(CD16)に結合するアームと結合させて、細胞防御機構をPRLR発現細胞に集中させることができる。
別の例において、結合特異性の1つはPRLRポリペプチド、PRLRまたはその断片に対してであり、もう一方は他の抗原、たとえば細胞表面タンパク質またはレセプタまたはレセプタサブユニットに対してであり、好ましくは腫瘍特異性または組織特異性であるものである。例としては、皮膚癌特異性抗原、肺癌特異性抗原、乳癌特異性抗原、または前立腺癌特異性抗原が挙げられる。
二重特異性抗原は、PRLRを発現する細胞に細胞傷害剤を局在化させるためにも使用され得る。このような抗体は、PRLR結合アームと、細胞傷害剤(たとえばサポニン、抗インターフェロン60、ビンカアルカロイド、リシンA鎖、メトトレキサートまたは放射性同位体ハプテン)を結合するアームとを所有する。二重特異性抗原は、全長抗体または抗体断片として調製され得る。
二重特異性抗体を作製する別の手法により、抗体分子の対の間の界面は、組換え細胞培養物から回収されるヘテロダイマーのパーセンテージを最大にするように設計され得る。好ましい界面は、抗体定常ドメインのCH3ドメインの少なくとも一部を含む。この方法では、第1の抗体分子からの1個以上の小型アミノ酸側鎖がより大型の側鎖(たとえばチロシンまたはトリプトファン)によって交換される。大型側鎖に対する同じまたは同様のサイズの代償性「空洞」が、大型アミノ酸側鎖をより小型の側鎖(たとえばアラニンまたはトレオニン)と交換することによって、第2の抗体分子の界面上に作製される。これはホモダイマーなどの他の望ましくない最終産物よりもヘテロダイマーの収率を向上させるための機構を提供する。1996年9月6日に公開されたWO96/27011を参照。
二重特異性抗体としては、架橋または「ヘテロコンジュゲート」抗体を含む。たとえば、ヘテロコンジュゲートにおける抗体の一方をアビジンに、他方をビオチンにコンジュゲートさせることができる。ヘテロコンジュゲート抗体は、いずれかの好都合な架橋法を使用して作製され得る。適切な架橋剤は当分野で公知であり、多くの架橋技法と共に米国特許第4,676,980号に開示されている。
抗体断片から二重特異性抗体を産生するための技法も文献に記載されている。たとえば、二重特異性抗体は、化学結合を使用して調製され得る。Brennanら、Science 229:81(1985)は、無傷の抗体をタンパク質分解により開裂させてF(ab’)断片を産生する。これらの断片は、近接するジチオールを安定化させて、分子間ジスルフィド形成を予防するために、ジチオール錯化剤の亜ヒ酸ナトリウムの存在下で還元される。産生されたFab’断片は次に、チオニトロベンゾエート(TNB)誘導体に変換される。Fab−TNB誘導体の1つは次に、メルカプトエチルアミンによる還元によってFab’−チオールに再変換され、等モル量の他のFab’−TNB誘導体と混合して二重特異性抗体が形成される。産生された二重特異性抗体は、酵素の選択的固定化のための薬剤として使用され得る。なおさらなる実施形態において、大腸菌から直接回収されたFab’−SH断片は、二重特異性抗体を形成するためにインビトロで化学カップリングされ得る(Shalabyら、J.Exp.Med.175:217−225(1992))。
Shalabyら、J.Exp.Med.175:217−225(1992)は、完全ヒト化二重特異性抗体F(ab’)2分子の産生について記載している。各Fab’断片は、大腸菌から独立して分泌され、二重特異性抗体を形成するためにインビトロでの定方向化学カップリングに供される。このように形成された二重特異性抗体は、HER2レセプタを過剰発現する細胞および正常ヒトT細胞に結合するのはもちろんのこと、ヒト乳房腫瘍標的に対してヒト細胞傷害性リンパ球の溶解活性を誘発させることも可能であった。
組換え細胞培養物から直接、二重特異性抗体断片を作製および単離する各種の技法も記載されている。たとえば、二重特異性抗体は、ロイシンジッパーを使用して産生されている。(Kostelnyら、J.Immunol.148(5):1547−1553(1992))。FosおよびJunタンパク質によるロイシンジッパーペプチドは、2つの異なる抗体のFab’部分に遺伝子融合によって連結された。抗体ホモダイマーはヒンジ領域にて還元されてモノマーを形成し、次に再酸化されて抗体へテロダイマーを形成する。この方法も抗体ホモダイマーの産生に利用され得る。Hollingerら、Proc.Natl.Acad.Sci.USA 90:6444−6448(1993)によって記載された「ダイアボディ」技術は、二重特異性抗体断片を作製するための代わりの機構を提供している。
断片は、同じ鎖上の2個のドメイン間の対形成を可能にするには短すぎるリンカーによって軽鎖可変領域(VL)に結合された重鎖可変領域(VH)を含む。したがって、1つの断片のVHドメインおよびVLドメインは、別の断片の相補性VHドメインおよびVLドメインと強制的に対形成させられて、それにより2個の抗原結合部位を形成する。短鎖Fv(sFv)ダイマーの使用により二重特異性抗体断片を作製する別の方法も報告されている。Gruberら、J.Immunol.152:5368(1994)を参照。
あるいは、二重特異性抗体は、Zapataら、Protein Eng.8(10):1057−1062(1995)に記載されているように産生された「直鎖抗体」であり得る。簡潔には、これらの抗体は、抗原結合領域の対を形成するタンデムFdセグメント(VH−CH1−VH−CH1)の対を含む。直鎖抗体は二重特異性または単一特異性であり得る。
2を超える価数を持つ抗体も考慮される。たとえば、三重特異性抗体が調製され得る(Tuttら、J.Immunol.147:60(1991))。「キレート組換え抗体」は、標的抗原の隣接および非重複エピトープを認識する二重特異性抗体であり、両方のエピトープを同時に結合するのに十分な柔軟性である(Neriら、J Mol Biol.246:367−73,1995)。
別の実施形態において、PRLRポリペプチドに対する抗体は、下に記載するように、PRLRポリペプチドの生物機能を低下または消滅させることができる。すなわち、抗PRLRポリペプチド抗体(ポリクローナル、または好ましくはモノクローナルのどちらか)の、PRLRポリペプチド(またはPRLRポリペプチドを含有する細胞)への添加は、PRLRポリペプチド活性を低下または消滅させ得る。一般に、活性の少なくとも25%の低下が好ましく、少なくとも約50%が特に好ましく、約95〜100%の低下がとりわけ好ましい。
抗体の組換え産生
抗体の組換え産生では、それをコードする抗体が単離されて、さらなるクローニング(DNAの増幅)のために、または発現のために複製可能なベクター内に挿入される。モノクローナル抗体をコードするDNAはただちに単離され、従来の手順を使用して(たとえば、抗体の重鎖および軽鎖をコードする遺伝子に特異的に結合できるオリゴヌクレオチドプローブを使用して)配列決定される。多くのベクターが利用可能である。ベクター構成要素は、一般に、限定されないが、次の1つ以上:シグナル配列、複製源、1つ以上の選択的マーカー遺伝子、エンハンサ要素、プロモータ、転写終結配列、当分野で公知であるものの例を含む。
当業者に公知である組換えポリペプチドの機能発現のために各種の異種系が利用可能である。そのような系としては、細菌(Strosberg,ら、Trends in Pharmacological Sciences(1992)13:95−98)、酵母(Pausch,Trends in Biotechnology(1997)15:487−494)、複数の種類の昆虫細胞(Vanden Broeck,Int.Rev.Cytology(1996)164:189−268)、両生類細胞(Jayawickremeら、Current Opinion in Biotechnology(1997)8:629−634)および複数の哺乳類細胞株(CHO,HEK293,COSなど;Gerhardt,ら、Eur.J.Pharmacology(1997)334:1−23を参照)が挙げられる。これらの例は、線虫類から得た細胞株(PCT出願WO98/37177)を含む、他の考えられる細胞発現系の使用を除外しない。
キメラ、ヒト化、Human Engineered(商標)およびヒト抗体
ヒトでの反復インビボ投与に対するげっ歯類抗体は単独で、またはコンジュゲートとしてのどちらかで、げっ歯類抗体に対するレシピエントにおける免疫応答;いわゆるHAMA反応(ヒト抗マウス抗体、Human Anti Mouse Antibody)を引き起こすであろう。HAMA応答は、反復投薬が要求される場合に、薬剤の有効性を制限し得る。抗体の免疫原性は、ポリエチレングリコールなどの親水性ポリマーによる抗体の化学修飾によって、または抗体結合構造をよりヒト様にするための遺伝子操作の方法を使用することによって低下させることができる。
実施形態において、PRLRポリペプチドに対する抗体はヒト化またはキメラ抗体である。「ヒト化」抗体は、非ヒト種からの免疫グロブリンに実質的に由来する抗原結合部位を有する分子を指し、分子の残りの免疫グロブリン構造はヒト免疫グロブリンの構造および/または配列に基づいている。抗原結合部位は、定常ドメイン上に融合された完全可変ドメイン、または可変ドメイン内の適切なフレームワーク領域上にグラフトされた相補性決定領域(CDR)のみのどちらかを含み得る。抗原結合部位は、野生種であり得るか、または1つ以上のアミノ酸置換によって修飾され得る、たとえばヒト免疫グロブリンにより精密に似るように修飾され得る。あるいは、ヒト化抗体は、親非ヒト抗体の抗原結合特性を保持または実質的に保持するが、ヒトへの投与時に親抗体と比較して減弱した免疫原性を示すキメラ抗体より由来し得る。句「キメラ抗体」は、本明細書で使用するとき、典型的に異なる種を起源とする2つの異なる抗体に由来する配列を含有する抗体を指す(たとえば米国特許第4,816,567号を参照)。典型的には、これらのキメラ抗体では、軽鎖および重鎖の両方の可変領域は、哺乳類の1つの種に由来する抗体の可変領域を模倣するのに対して、定常部分は別の哺乳類に由来する抗体の配列と相同である。より典型的には、キメラ抗体はヒトおよびマウス抗体断片、一般にヒト定常およびマウス可変領域を含む。げっ歯類モノクローナル抗体の可変Igドメインがヒト定常Igドメインに融合されるキメラモノクローナル抗体は、当分野で公知の標準手順を使用して産生できる(Morrison,S.L.,ら(1984)Chimeric Human Antibody Molecules;Mouse Antigen Binding Domains with Human Constant Region Domains,Proc.Natl.Acad.Sci.USA 81,6841−6855;およびBoulianne,G.L.,ら、Nature 312,643−646(1984)を参照)。あるキメラモノクローナル抗体はヒトにおいてあまり免疫原性でないことが判明しているが、マウス可変Igドメインは著しいヒト抗マウス反応をなお引き起こし得る。
ヒト化抗体は、ヒト抗体(アクセプタ抗体)の相補性決定領域(CDR)を、所望の特異性、親和性および能力を有するマウス、ラットまたはウサギなどの非ヒト抗体(ドナー抗体)のそれらで置換することによって作製される。ある例では、ヒト「アクセプタ」抗体のFvフレームワーク残基は、「ドナー」抗体からの対応する非ヒト残基によって交換される。ヒト化抗体は、レシピエント抗体にも、インポートされたCDRにも、あるいはフレームワーク配列にも見出されない残基も含み得る。一般に、ヒト化抗体は、実質的に少なくとも1つの、そして典型的には2つの可変ドメインを含み、そこではCDR領域のすべてまたは実質的にすべてが非ヒト免疫グロブリンのそれらに相当し、あるいはフレームワーク残基(FR)領域のすべてまたは実質的にすべてがヒト免疫グロブリンコンセンサス配列のそれらである。ヒト化抗体は最適には、免疫グロブリン定常領域(Fc)の少なくとも一部、典型的にはヒト免疫グロブリンのそれも含むであろう(Jonesら、Nature,321:522−525(1986);Riechmannら、Nature,332:323−329(1988);およびPresta,Curr.Op.Struct.Biol,2:593−596(1992))。このようなキメラにとっての1つの明らかな利点は、たとえば可変領域が、たとえば、ヒト細胞調製物に由来する定常領域と組合せて非ヒト宿主生物からただちに入手できるハイブリドーマまたはB細胞を使用して、現在既知の源から好都合に得られるということである。可変領域は調製が容易であるという利点を有し、特異性はその源から影響を受けないが、定常領域はヒトであり、抗体を注射するときに、非ヒト源からの定常領域よりもヒト対象から免疫反応をより誘発しにくい。しかしながら、定義はこの特定の例に限定されない。
ヒト化抗体は親マウスモノクローナル抗体よりもはるかに免疫原性が低いため、それらはアナフィラキシーのはるかに低いリスクでヒトの処置に使用され得る。それゆえ、これらの抗体は、ヒトへのインビボ投与を含む治療用途、たとえば腫瘍性疾患の処置のための放射線増感剤としての使用またはたとえば癌療法の副作用を減少させる方法での使用において好ましい。非ヒト抗体をヒト化する方法は当分野で公知である。一般に、ヒト化抗体は、非ヒトである源からのそれに導入される1つ以上のアミノ酸残基を有する。これらの非ヒトアミノ酸残基は、インポート残基と呼ばれることが多く、典型的には、インポート可変ドメインから得られる。ヒト化は、Winter and co−workers(Jonesら、Nature 321:522−525(1986);Riechmannら、Nature 332:323−327(1988);Verhoeyenら、Science 239:1534−1536(1988))の方法に従って、げっ歯類CDRまたはヒト抗体の対応する配列のCDR配列を置換することによって本質的に実施され得る。したがって、このような非ヒト化抗体はキメラ抗体であり(米国特許第4,816,567号)、ここで実質的により少ない無傷のヒト可変ドメインが、非ヒト種からの対応する配列によって置換されている。実際に、ヒト化抗体は典型的には、あるCDR残基およびおそらくあるFR残基がげっ歯類抗体の類似部位からの残基によって置換されるヒト抗体である。
しかしながら、CDRグラフトの欠点は、フレームワーク領域のアミノ酸が抗原結合に寄与できないため、そしてCDRループのアミノ酸が2つの可変Igドメインの結合に影響を及ぼし得るため、元のマウス抗体よりも実質的に低い親和性を有するヒト化抗体を生じ得ることである。ヒト化モノクローナル抗体の親和性を維持するために、CDRグラフト技法は、元のマウス抗体のフレームワーク領域に最も厳密に似ているヒトフレームワーク領域を選択することによって、そして抗原結合部位のコンピュータモデル化によって補助されたフレームワークまたはCDR内の単一アミノ酸の部位依存性突然変異誘によって改善され得る(たとえばCo,M.S.,ら(1994),J.Immunol.152,2968−2976)。
抗体をヒト化する1つの方法は、非ヒト重鎖および軽鎖配列をヒト重鎖および軽鎖配列に整列させることと、そのようなアラインメントに基づいて非ヒトフレームワークをヒトフレームワークによって選択および交換する工程と、ヒト化配列の配座を予測するために分子モデル化する工程と、親抗体の配座と比較する工程とを含む。このプロセスには、ヒト化配列モデルの予測配座が親非ヒト抗体の非ヒトCDRの配座と厳密に近づくまで、CDRの構造を妨害するCDR領域内の残基の反復復帰突然変異が続く。
非ヒト免疫グロブリンに由来する抗原結合部位を含む多数の「ヒト化」抗体分子が、ヒト定常ドメインに融合されたげっ歯類V領域およびその関連CDRを有するキメラ抗体(Winterら(1991)Nature 349:293−299;Lobuglioら(1989)Proc.Nat.Acad.ScL USA 86:4220−4224;Shawら(1987)J Immunol.138:4534−4538;and Brownら(1987)Cancer Res.47:3577−3583)、適切なヒト抗体定常ドメインとの融合前にヒト支持FR内にグラフトされたげっ歯類CDR(Riechmannら(1988)Nature 332:323−327;Verhoeyenら(1988)Science 239:1534−1536;およびJonesら(1986)Nature 321:522−525)、および組換えベニヤ化げっ歯類FRによって支持されたげっ歯類CDR(欧州特許公開第519,596号、1992年12月23日公開)を含めて記載されている。
ヒト化抗体は、たとえば:(1)非ヒト相補性決定領域(CDR)をヒトフレームワークおよび定常領域上にグラフトすること(当分野で「ヒト化」と呼ばれるプロセス)、または代わりに(2)非ヒト可変ドメイン全体を移植するが、表面残基の交換によりそれらをヒト様表面で「被覆」すること(当分野で「ベニヤ化」と呼ばれるプロセス)を含む各種の方法によって実現され得る。本発明において、ヒト化抗体は「ヒト化」および「ベニヤ化」抗体の両方を含むであろう。同様に、ヒト抗体は、ヒト免疫グロブリン座位を、内在性免疫グロブリン遺伝子が部分的または完全に不活性化されているトランスジェニック動物、たとえばマウスに導入することによって作製できる。攻撃時に、遺伝子再構成、構築、および抗体レパートリーを含めて、あらゆる点でヒトに見られるものと厳密に類似したヒト抗体産生が観察される。この手法はたとえば米国特許第5,545,807号;第5,545,806号;第5,569,825号;第5,625,126号;第5,633,425号;第5,661,016号に、そして次の科学文献に記載されている:Marksら、Bio/Technology 10,779−783(1992);Lonbergら、Nature 368 856−859(1994);Morrison,Nature 368,812−13(1994);Fishwildら、Nature Biotechnology 14,845−51(1996);Neuberger,Nature Biotechnology 14,826(1996);Lonberg and Huszar,Intern.Rev.Immunol.13 65−93(1995);Jonesら、Nature 321:522−525(1986);Morrisonら、Proc.Natl.Acad.Sci,USA.,5i:6851−6855(1984);Morrison and Oi,Adv.Immunol,44:65−92(1988);Verhoeyerら、Science 239:1534−1536(1988);Padlan,Molec.Immun.25:489−498(1991);Padlan,Molec.Immunol.31(3):169−217(1994);およびKettleborough,CA.ら、Protein Eng.4(7):773−83(1991);そのそれぞれが参照により本明細書に組み入れられている。
句「相補性決定領域」は、未変性免疫グロブリン結合部位の天然Fv領域の結合親和性および特異性を共に定義するアミノ酸配列を指す。たとえばChothiaら、J.Mol.Biol.196:901−917(1987);Kabatら、U.S.Dept.of Health and Human Services NIH Publication No.91−3242(1991)を参照。句「定常領域」は、エフェクタ機能を与える抗体分子の部分を指す。本発明において、マウス定常領域はヒト定常領域によって置換される。対象ヒト化抗体の定常領域は、ヒト化抗体に由来する。重鎖定常領域は、5つのアイソタイプ:アルファ、デルタ、イプシロン、ガンマまたはミューのいずれかから選択され得る。抗体をヒト化する1つの方法は、非ヒト重鎖および軽鎖配列をヒト重鎖および軽鎖配列に整列させることと、そのようなアラインメントに基づいて非ヒトフレームワークをヒトフレームワークによって選択および交換する工程と、ヒト化配列の配座を予測するために分子モデル化する工程と、親抗体の配座と比較する工程とを含む。このプロセスには、ヒト化配列モデルの予測配座が親非ヒト抗体の非ヒトCDRの配座と厳密に近づくまで、CDRの構造を妨害するCDR領域内の残基の反復復帰突然変異が続く。そのようなヒト化抗体は、たとえばAshwellレセプタを介した摂取およびクリアランスを促進するためにさらに誘導体化され得る。たとえば、参照により本明細書に組み入れられる米国特許第5,530,101号および第5,585,089号を参照。
Human Engineering(商標)
抗体可変ドメインのHuman Engineering(商標)は、Studnicka[たとえばStudnickaら、米国特許第5,766,886号;Studnickaら、Protein Engineering 7:805−814(1994)を参照]によって、抗体分子の結合特異性を維持しながら免疫原性を低下させる方法として記載されている。該方法によって、各可変領域アミノ酸は、置換のリスクを割り当てられている。アミノ酸置換は、3つのリスクカテゴリの1つによって区別される:(1)低リスク変化は、抗原結合を妨害する最も低い可能性で免疫原性を低下させる最大の可能性を有する変化である;(2)中程度のリスク変化は、免疫原性をさらに低下させるが、抗原結合またはタンパク質折り畳みに影響を及ぼすより高い可能性を有する変化である;(3)高リスク残基は、結合にとって、または抗体構造を維持するために重要であり、抗体結合またはタンパク質折り畳みが影響される最高のリスクを持つものである。プロリンの三次元構造の役割のために、プロリンにおける修飾は一般に、位置が典型的には低リスク位置であっても、少なくとも中程度のリスク変化であると見なされる。
げっ歯類抗体の軽鎖および重鎖の可変領域は、抗原結合またはタンパク質折り畳みのどちらかに悪影響を及ぼしにくいが、ヒト環境での免疫原性を低下させやすいことが判定された位置にてヒトアミノ酸を置換するための、次のようなHuman Engineered(商標)である。「低リスク」位置にあり、本方法による修飾の候補であるアミノ酸残基は、げっ歯類可変領域のアミノ酸配列をヒト可変領域配列と共に整列させることによって同定される。個々のVHまたはVL配列あるいはヒトコンセンサスVHまたはVL配列あるいは個々のまたはコンセンサスのヒト生殖系列配列を含む、いずれのヒト可変領域も使用され得る。低リスク位置のいずれの数の、または低リスク位置すべてのアミノ酸残基が変更され得る。たとえば、整列されたマウスおよびヒトアミノ酸残基が異なる各低リスク位置では、げっ歯類残基をヒト残基と交換するアミノ酸修飾が導入される。あるいは、低リスク位置すべての、および中程度のリスク位置のいずれかの数のアミノ酸残基が変更され得る。理想的には、最も少ない免疫原性を達成するために、低および中程度のリスク位置のすべてでげっ歯類からヒト配列へ変更される。
修飾重鎖および/または軽鎖可変領域を含有する合成遺伝子が構築されて、ヒトγ重鎖および/またはカッパ軽鎖定常領域に連結される。いずれのヒト重鎖および軽鎖定常領域も、IgA(いずれのサブクラスの、たとえばIgA1またはIgA2)、IgD、IgE、IgG(いずれのサブクラスの、たとえばIgG1、IgG2、IgG3、またはIgG4)、またはIgMを含むHuman Engineered(商標)抗体可変領域と組合せて使用され得る。ヒト重鎖および軽鎖遺伝子は宿主細胞、たとえば哺乳類細胞に導入され、生じた組換え免疫グロブリン産物が取得およびキャラクタリゼーションされる。ヒト抗体は、ファージ提示ライブラリーを含む当分野で公知の各種技法を使用しても産生され得る[Hoogenboom and Winter,J.Mol.Biol.,227:381(1991);Marksら、J.Mol.Biol,222:581(1991)]。Coleら、およびBoernerらの技法もヒトモノクローナル抗体の調製に利用できる[Coleら、Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,p.77(1985)およびBoernerら、J.Immunol.,147(1):86 95(1991)]。
PRLRポリペプチドに対するヒト抗体はまた、ヒト免疫グロブリン座位を含有するように操作されたトランスジェニック動物を使用して産生され得る。たとえばWO98/24893は、ヒトIg座位を有するトランスジェニック動物を開示し、そこでは動物は内在性重鎖および軽鎖座位の不活性化のために機能性内在性免疫グロブリンを産生しない。WO91/10741はまた、免疫原に対する免疫応答を開始できるトランスジェニック非霊長類哺乳類宿主を開示し、ここで抗体は霊長類定常および/または可変領域を有し、ここで内在性免疫グロブリンコード座位が置換または不活性化される。WO96/30498は、定常または可変領域の全部または一部を交換して修飾抗体分子を形成するなどのために、哺乳類の免疫グロブリン座位を修飾するCre/Lox系の使用を開示する。WO94/02602は、不活性化された内在性Ig座位および機能性ヒトIg座位を有する非ヒト哺乳類宿主を開示する。米国特許第5,939,598号は、マウスが内在性重鎖を欠失し、1つ以上の異種定常領域を含む外来免疫グロブリン座位を発現する、トランスジェニックマウスを作製する方法を開示する。
上述のようなトランスジェニック動物を使用すると、選択した抗原分子に対する免疫反応を生成することができ、抗体産生細胞を動物から除去でき、ヒトモノクローナル抗体を分泌するハイブリドーマを産生するために使用できる。免疫化プロトコル、アジュバントなどは当分野で公知であり、たとえばWO96/33735に記載されているようにトランスジェニックマウスの免疫化に使用される。モノクローナル抗体は、対応するタンパク質の生物活性または生理学的効果を抑制または中和する能力を試験するために使用され得る。Jakobovitsら、Proc.Natl.Acad.Sci.USA,90:2551[0192](1993);Jakobovitsら、Nature,362:255−258(1993);Bruggermannら、Year in Immuno.,7:33(1993);ならびに米国特許第5,591,669号、米国特許第5,589,369号、米国特許第5,545,807号;ならびに米国特許公開第20020199213号、WO96/34096および米国特許公開第20030194404号;ならびに米国特許公開第20030031667号も参照。米国特許公開第20030092125号は、動物の免疫応答を所望のエピトープにバイアスさせるための方法を記載している。ヒト抗体は、インビトロでの活性化B細胞によっても産生され得る(米国特許第5,567,610号および米国特許第5,229,275号を参照)。
モノクローナル抗体を作製するのに有用なトランスジェニック動物としては、ヒト抗体の重鎖および軽鎖をコードする再編成されていないヒト抗体遺伝子からの遺伝子配列を含有する、米国特許第5,770,429号およびFishwild,ら(Nat.Biotechnol.14:845−851,1996)に記載されているMedarex HuMAb−MOUSE(登録商標)が挙げられる。HuMAb−MOUSE(登録商標)の免疫化は、標的タンパク質に対するモノクローナル抗体の産生を可能にする。
またIshidaら(Cloning Stem Cells.4:91−102,2002)は、ヒトDNAのメガベース単位のセグメントを含み、ヒト免疫グロブリン(hIg)座位全体を包含する、TransChromo Mouse(TCMOUSE(商標))について記載している。TCMOUSEは、IgGの全サブクラス(IgG1〜G4)を含む、hIgの完全に多様なレパートリーを有する。各種ヒト抗原によるTCマウスの免疫化は、ヒト抗体を含む抗体反応を産生する。
組換えヒト抗体遺伝子のレパートリーを作製する技術の開発、およびコードされた抗体断片の繊維状バクテリオファージ表面への提示は、ヒト抗体を直接作製する手段を提供してきた。ファージ技術によって産生された抗体は、抗原結合断片−通例、FvまたはFab断片として細菌内で産生され、それゆえエフェクタ機能が欠如している。エフェクタ機能は、2つの方法のうちの1つによって導入され得る。断片は、哺乳類細胞内での発現のために完全抗体中、またはエフェクタ機能を誘発できる第2結合部位を持つ二重特異性抗体断片中のどちらかへ操作することができる。
典型的には、抗体のFd断片(VH−CH1)および軽鎖(VL−CL)は、PCRによって個別にクローニングされ、組合せファージ提示ライブラリー内でランダムに組換えられ、これが次に特定の抗原への結合のために選択され得る。Fab断片はファージ表面に発現される、すなわちそれらをコードする遺伝子に物理的に連結される。それゆえ、抗原結合によるFabの選択は、次に増幅され得るFabコード配列のための同時選択する。パニングと呼ばれる手順である、複数回の抗原結合および再増幅によって、抗原に対して特異性のFabが濃縮され、最終的に単離される。
1994年に、「誘導選択」と呼ばれる抗体のヒト化のための手法が記載された。誘導選択は、マウスモノクローナル抗体のヒト化のためのファージ提示技法の能力を利用する(Jespers,L.S.,ら、Bio/Technology 12,899−903(1994)を参照)。このために、マウスモノクローナル抗体のFd断片をヒト軽鎖ライブラリーと組合せて提示させて、得られたハイブリッドFabライブラリーを次に抗原を用いて選択することができる。それによりマウスFd断片は、選択を誘導するためのテンプレートを与える。続いて、選択されたヒト軽鎖がヒトFd断片ライブラリーと組み合わされる。得られたライブラリーの選択は、ヒトFab全体を生じる。
ファージ提示ライブラリーからヒト抗体を得るための各種の手順が記載されている(たとえばHoogenboomら、J.Mol.Biol.,227:381(1991);Marksら、J.Mol.Biol,222:581−597(1991);米国特許第5,565,332号および第5,573,905号;Clackson,T., and Wells,J.A.,TIBTECH 12,173−184(1994)を参照)。特に、ファージ提示ライブラリーから得られた抗体のインビトロでの選択および進化は、強力なツールとなっている(Burton,D.R.,and Barbas III,C.F.,Adv.Immunol.57,191−280(1994);およびWinter,G.,ら、Annu.Rev.Immunol.12,433−455(1994);米国特許公開第20020004215号およびWO92/01047;2003年10月9日に公開された米国特許公開第20030190317号および米国特許第6,054,287号;米国特許第5,877,293号を参照。
Watkins,“Screening of Phage−Expressed Antibody Libraries by Capture Lift,”Methods in Molecular Biology,Antibody Phage Display:Methods and Protocols 178:187−193、および2003年3月6日に公開された米国特許公開第200120030044772号は、キャプチャーリフトによってファージ発現抗体ライブラリーまたは他の結合分子をスクリーニングする方法、固体支持体への候補結合分子の固定化を含む方法を記載している。
抗体産物は、活性について、そして本発明の処置方法での適合性について、本明細書の「スクリーニング方法」という題の節に記載したアッセイを使用して、または当分野で公知のいずれかの適切なアッセイを使用してスクリーニングされ得る。
本発明では、上に挙げたPRLRポリペプチドおよびその変異体を使用して上述のようなトランスジェニック動物を免疫化し得る。モノクローナル抗体は当分野で公知の方法を使用して作製され、抗体の特異性は単離PRLRポリペプチドを使用して試験される。ヒトまたは霊長類PRLRまたはそのエピトープの調製方法としては、限定されないが、化学合成、組換えDNA技法または生物学的サンプルからの単離が挙げられる。ペプチドの化学合成はたとえば、古典的なMerrifeldの固相ペプチド合成方法(参照により組み入れられる、Merrifeld,J.Am.Chem.Soc.85:2149,1963)、または高速自動多重ペプチド合成システムでのFMOCストラテジー(E.I.du Pont de Nemours Company,Wilmington,DE)(参照により組み入れられる、Caprino and Han,J.Org.Chem.37:3404,1972)によって実施され得る。
ポリクローナル抗体は、抗原を注射すること、それに続く適切な間隔での追加免疫によってウサギまたは他の動物を免疫化することによって調製され得る。代わりの動物としては、マウス、ラット、ニワトリ、モルモット、ヒツジ、ウマ、サル、ラクダおよびサメが挙げられる。動物は放血させて、通常はELISAによって、またはPRLRタンパク質の作用を遮断する能力に基づくバイオアッセイによって精製PRLRタンパク質に対して血清アッセイする。トリ種、たとえばニワトリ、シチメンチョウなどを使用するとき、抗体は卵黄から単離され得る。モノクローナル抗体は、Milstein and Kohlerの方法の後に、免疫化したマウスからの脾細胞を骨髄腫またはリンパ腫細胞などの連続複製腫瘍細胞と融合させることによって調製され得る。(参照により組み入れられる、Milstein and Kohler,Nature 256:495−497,1975;Gulfre and Milstein,Methods in Enzymology:Immunochemical Techniques 73:1−46,Langone and Banatis eds.,Academic Press,1981)。そのように形成されたハイブリドーマは次に、限界希釈法によってクローニングされ、上清を抗体産生のためのELISA、RIAまたはバイオアッセイによってアッセイする。
標的タンパク質を認識して特異的に結合する抗体の独自の能力は、タンパク質の過剰発現を処置するための手法を提供する。それゆえ、本発明の別の態様は、PRLRタンパク質に対する特異性抗体による患者の処置によって、PRLRポリペプチドの過剰発現を伴う疾患を予防または処置する方法を提供する。
PRLRタンパク質に対する、ポリクローナルまたはモノクローナルのどちらかの特異性抗体は、上述のような当分野で公知のいずれかの適切な方法によって産生され得る。たとえば、マウスまたはヒトモノクローナル抗体は、ハイブリドーマ技術によって産生され得るか、あるいはPRLRタンパク質、またはその免疫活性断片、または抗イディオタイプ抗体、またはその断片を動物に投与して、PRLRタンパク質を認識および結合できる抗体の産生を誘発し得る。そのような抗体は、限定されないが、IgG、IgA、IgM、IgD、およびIgEを含むいずれのクラスの抗体からでも、またはトリ種の場合にはIgYおよび抗体のいずれのサブクラスからでもよい。
アミノ酸配列変異体
突然変異誘発のために好ましい位置である抗体のある残基または領域の同定のための有用な方法は、Cunningham and Wells Science,244:1081−1085(1989)によって記載されているように「アラニンスキャニング突然変異誘発」と呼ばれる。ここで、残基または標的残基の群が同定され(たとえばarg、asp、his、lys、およびgluなどの帯電残基)、中性または負に帯電したアミノ酸(最も好ましくはアラニンまたはポリアラニン)によって交換されて、アミノ酸と抗体との相互作用に影響を及ぼす。置換に対して機能感受性を示すアミノ酸位置は次に、置換の部位に、または置換の部位のためにさらなるまたは他の変異体を導入することによって改良される。それゆえ、アミノ酸配列変異体を導入するための部位が予め定められているのに対して、突然変異体自体の性質は予め定められる必要がない。たとえば、所与の部位における突然変異体の性能を解析するために、アラニンスキャニングまたはランダム突然変異誘発が標的コドンまたは領域にて実施され、発現された抗体変異体を所望の活性についてスクリーニングする。
アミノ酸配列挿入は、1個の残基から100個以上の残基を含有するポリペプチドまでの範囲で長さが変化するアミノ−および/またはカルボキシル−末端融合はもちろんのこと、1個または複数のアミノ酸残基の配列内挿入も含む。末端挿入の例としては、N末端メチオニル残基を持つ抗体、あるいはエピトープタグまたはサルベージレセプタエピトープに融合された抗体(抗体断片を含む)が挙げられる。抗体分子の他の挿入変異体としては、たとえばN末端またはC末端にて抗体の血清半減期を延長するポリペプチドへの融合が挙げられる。
用語「エピトープタグ付き」は、エピトープタグに融合された抗体を指す。エピトープタグポリペプチドは、それに対する抗体が作製され得るが、それが抗体の活性を妨害しないようになお十分短いエピトープを供給するために十分な残基を有する。エピトープタグは好ましくは十分に独自であるため、それに対する抗体は他のエピトープと実質的に交差反応しない。適切なタグポリペプチドは一般に、少なくとも6アミノ酸残基を有し、通常は約8〜50アミノ酸残基を有する(好ましくは約9〜30残基)。例としては、flu HAタグポリペプチドおよびその抗体12CA5[Fieldら、Mol.Cell.Biol.8:2159−2165(1988)];c−mycタグならびにそれに対する8F9、3C7、6E10、G4、B7および9E10抗体[Evanら、Mol.Cell.Biol.5(12):3610−3616(1985)];ならびにHerpes Simplex virus glycoprotein D(gD)タグおよびその抗体[Paborskyら、Protein Engineering 3(6):547−553(1990)]が挙げられる。他の例示的なタグは、ニッケルキレート化を使用してそのように標識された化合物の単離を可能にするポリ−ヒスチジン配列、一般に約6ヒスチジン残基である。当分野で公知であり日常的に使用される他の標識およびタグ、たとえばFLAG(登録商標)タグ(Eastman Kodak,Rochester,NY)は、本発明に含まれる。
別の種類の変異体は、アミノ酸置換変異体である。これらの変異体は、除去された抗体分子内の少なくとも1個のアミノ酸残基と、その場所に挿入された別の残基とを有する。超可変またはCDR領域あるいはフレームワーク領域のいずれかの中での置換突然変異誘発が考慮される。保存的置換を表2に示す。最も保存的な置換は、「好ましい置換」の見出しの下に見出される。このような置換が生物活性に何の変化も生じない場合は、次に、表2で「例示的置換」と呼ぶ、またはアミノ酸クラスに関して以下でさらに記載するような、さらに実質的な変化を導入することができ、産物がスクリーニングされる。
抗体の生物学的特性の実質的修飾は、(a)置換のエリアにおけるポリペプチド主鎖の構造、たとえばシートまたはらせん状配座、(b)標的部位における分子の電荷または疎水性、あるいは(c)側鎖のかさ高さを維持することに対する、それらの効果が著しく異なる置換を選択することによって達成される。天然発生型残基は、共通の側鎖特性に基づいた群に分けられる:
(1)疎水性:ノルロイシン、met、ala、val、leu、ile;
(2)中性親水性:cys、ser、thr;
(3)酸性:asp、glu;
(4)塩基性:asn、gin、his、lys、arg;
(5)鎖配向に影響する残基:gly、pro;および
(6)芳香族:trp、tyr、phe。
保存的置換は、アミノ酸をそのクラスの別のメンバーと交換することを含む。非保存的置換は、これらのクラスの1つのメンバーを別のクラスのメンバーで交換することを含む。
モノクローナル、ヒト、ヒト化、または変異体抗体の適正な配座を維持することに関与していないいずれのシステイン残基も、分子の酸化安定性を改善し、異常な架橋を予防するために、一般にセリンによって置換され得る。反対に、(複数の)システイン結合は、その安定性を改善するために抗体に添加され得る(特に、抗体が、Fv断片などの抗体断片である場合)。
親和性成熟は、親抗体のCDR内に置換を有する抗体変異体を調製およびスクリーニングすることと、親抗体に対する結合親和性などの改善された生物学的特性を有する変異体を選択することとを含む。このような置換変異体を産生するための好都合な方法は、ファージ提示を使用する親和性成熟である。簡潔には、いくつかの超可変領域部位(たとえば6〜7部位)が変異されて、各部位にすべての考えられるアミノ置換を産生する。このように産生された抗体変異体は、繊維状ファージ粒子から1価方式で、各粒子内にパッケージされたM13の遺伝子III産物への融合として提示される。ファージ提示変異体は次に、その生物活性(たとえば結合親和性)についてスクリーニングされる。
アラニンスキャニング突然変異誘発は、抗原結合に著しく寄与する超可変領域残基を同定するために実施され得る。あるいは、または加えて、抗体と抗原との間の接触点を同定するために抗原−抗体複合体の結晶構造を分析することが有益であり得る。このような接触残基および隣接残基は、本明細書で詳説する技法による置換の候補である。このような変異体は、いったん産生されたら、変異体のパネルに本明細書に記載するようなスクリーニングに供されて、1つ以上の関連アッセイにおいて優れた特性を備えた抗体がさらなる開発のために選択され得る。
親抗体に対する修飾グリコシル化パターンを有する抗体変異体も、たとえば抗体に見出される1個以上の炭化水素部分を除去して、および/または抗体に存在しない1個以上のグリコシル化部位を付加して産生され得る。
抗体のグリコシル化は、典型的には、N結合またはO結合のどちらかである。N結合は、アスパラギン残基の側鎖への炭水化物部分の付加を指す。トリペプチド配列のアスパラギン−X−セリンおよびアスパラギン−X−トレオニン(Xはプロリンを除くいずれかのアミノ酸である)は、炭化水素部分のアスパラギン側鎖への酵素付着のための認識配列である。ポリペプチド内でのこれらのトリペプチド配列のどちらかの存在は、潜在的なグリコシル化部位を形成する。それゆえ、N結合グリコシル化部位は、アミノ酸配列がこれらのトリペプチド配列の1つ以上を含有するようにアミノ酸配列を改変することによって抗体に付加され得る。O結合グリコシル化は、糖であるN−アセチルガラクトサミン、ガラクトース、またはキシロースの1つの、ヒドロキシアミノ酸、最も一般的にはセリンまたはトレオニンへの付着を指すが、5−ヒドロキシプロリンまたは5−ヒドロキシリシンも使用され得る。O結合グリコシル化部位は、1個以上のセリンまたはトレオニン残基を元の抗体の配列に挿入または置換することによって、抗体に付加され得る。
改変されたエフェクタ機能
抗体の他の修飾が考慮される。たとえば、癌を処置する抗体の有効性を強化するために、たとえばエフェクタ機能、たとえば半減期、CDCまたはADCC活性に関する本発明の抗体を修飾することが所望であり得る。たとえばシステイン残基はFc領域に導入され得、それによりこの領域での鎖間ジスルフィド結合形成を可能にする。このように産生されたホモダイマー抗体が、内部移行能力を改善させた、および/または補体媒介殺細胞および抗体依存性細胞傷害(ADCC)を向上させた可能性がある。Caronら、J.Exp Med.176:1191−1195(1992)およびShopes,B.J.Immunol.148:2918−2922(1992)を参照。強化された抗腫瘍活性を備えたホモダイマー抗体も、Wolffら、Cancer Research 53:2560−2565(1993)に記載されているようにヘテロ二官能性架橋剤を使用して調製され得る。あるいは、デュアルFc領域を有する抗体は操作されて、それにより強化された補体溶解およびADCC機能を有し得る。Stevensonら、Anti−Cancer Drug Design 3:219−230(1989)を参照。加えて、CDR内の配列が抗体をMHCクラスIIに結合させることができ、望ましくないヘルパーT細胞応答を誘発させることが示されている。保存的置換は、抗体に結合活性を維持させるが、望ましくないT細胞応答を誘発するその能力をなお失わせることができる。マウス可変領域がヒトガンマ1、ガンマ2、ガンマ3、およびガンマ4定常領域と接合されるキメラ抗体について記載した、参照によりその全体が本明細書に組み入れられているSteplewskiら、Proc Natl Acad Sci USA.1988;85(13):4852−6も参照。特異性Fcガンマレセプタ(R)のみへの結合を改善し、同時にFcガンマRの1つの種類への結合を改善して、そして別の種類への結合を低減させた、IgG1のFc領域内の複数の位置が見出されたことについて記載した、参照によりその全体が本明細書に組み入れられているPrestaら、Biochem Soc Trans.2002;30(4):487−90も参照。FcガンマRIIIaへの結合が改善された選択されたIgG1変異体を次にインビトロでの抗体依存性細胞傷害(ADCC)アッセイで試験すると、末梢血単核細胞またはナチュラルキラー細胞のどちらかが使用されたときにADCCの向上を示した。
本発明のある実施形態において、たとえば腫瘍浸透を向上させるために、無傷の抗体よりもむしろ抗体断片を使用することが所望であり得る。この場合、その血清半減期を延長するために抗体断片を修飾することが所望であり得、PEGまたはポリサッカライドポリマーを含む他の水溶性ポリマーなどの分子を抗体断片に添加してその半減期を延長する。これはたとえば抗体断片内へのサルベージレセプタ結合エピトープの包含によっても達成され得る(たとえば、抗体断片内の適切な領域の突然変異によって、または次にたとえばDNAまたはペプチド合成によって抗体断片に端部または中間のどちらかで融合されるペプチドタグ内にエピトープを包含させることによって)(たとえばWO96/32478を参照)。
加えて抗体は、たとえばその循環半減期を延長するために、ポリマーへの共有結合性コンジュゲーションによって化学修飾され得る。各抗体分子は、1個以上(すなわち1、2、3、4、5個以上)のポリマー分子に付着され得る。ポリマー分子は、好ましくは、リンカー分子によって抗体に付着される。ポリマーは、一般に、合成または天然発生型ポリマー、たとえば場合により置換された直鎖または分岐鎖ポリアルケン、ポリアルキレンまたはポリオキシアルキレンポリマーあるいは分岐または非分岐ポリサッカライド、たとえばホモまたはヘテロサッカライドであり得る。好ましいポリマーは、ポリオキシエチレンポリオールおよびポリエチレングリコール(PEG)である。PEGは室温にて水溶性であり、一般式:R(O−−CH2−−CH2)nO−−Rを有し、式中、Rは水素または保護基、たとえばアルキルまたはアルカノール基であり得る。好ましくは、保護基は1〜8個の炭素を有し、さらに好ましくはメチルである。記号nは正の整数、好ましくは1〜1,000、さらに好ましくは2〜500である。PEGは、好ましい1000〜40,000の、さらに好ましくは2000〜20,000の、最も好ましくは3,000〜12,000の平均分子量を有する。好ましくは、PEGは少なくとも1個のヒドロキシ基を有し、さらに好ましくは、それは末端ヒドロキシ基である。それは、好ましくは活性化されてインヒビタの遊離アミノ基と反応するこのヒドロキシ基である。しかしながら、反応性基の種類および量は、共有結合的にコンジュゲートされたPEG/本発明の抗体を得るために変更され得る。好ましいポリマー、およびそれらをペプチドに付着させる方法は、参照によりその全体が本明細書にすべて組み入れられている米国特許第4,766,106号;第4,179,337号;第4,495,285号;および第4,609,546号に示されている。
本明細書で使用するとき、用語「サルベージレセプタ結合エピトープ」は、IgG分子のインビボでの血清半減期を延長する原因であるIgG分子(たとえばIgG1、IgG2、IgG3、またはIgG4)のFc領域のエピトープを指す。
サルベージレセプタ結合エピトープは、好ましくは、Fcドメインの1または2個のループからのいずれかの1個以上のアミノ酸残基が抗体断片の類似位置に移動される領域を構成する。なおさらに好ましくは、Fcドメインの1または2個のループからの3個以上の残基が移動される。まださらに好ましくは、エピトープが(たとえばIgGの)Fc領域のCH2ドメインから採取され、抗体のCH1、CH3、またはVH領域、あるいは1より多いそのような領域に移動される。あるいは、エピトープがFc領域のCH2ドメインから採取され、抗体断片のCL領域またはVH領域、あるいは両方に移動される。Fc変異体およびサルベージレセプタとのその相互作用について記載している国際出願WO97/34631およびWO96/32478も参照。
それゆえ、本発明の抗体は、ジスルフィド結合に含まれるシステインが修飾または除去される、および/またはmetがN末端に付加される、および/またはN末端20アミノ酸の1つ以上が除去される、および/またはC1q結合部位などの補体と相互作用する領域が改変または除去される、および/またはADCC部位が改変または除去される変異体を含む、Fcサルベージレセプタと相互作用する能力を保持する、ヒトFc部分、ヒトコンセンサスFc部分、またはその変異体を含み得る[たとえばMolec.Immunol.29(5):633−9(1992)を参照]。
以前の研究は、FcRのためのヒトおよびマウスIgGの結合部位を、主に、IgG残基233−239より成る下部ヒンジ領域にマッピングした。他の研究は、追加の広範なセグメント、たとえばヒトFcレセプタIのGly316−Lys338、ヒトFcレセプタIIIのLys274−Arg301およびTyr407−Arg416を提案し、下部ヒンジ外側のいくつかの特異性領域、たとえばマウスFcレセプタIIと相互作用するマウスIgG2bのAsn297およびGlu318を見出した。ヒトFcレセプタIIIAを持つヒトIgG1 Fc断片の3.2Å結晶構造の報告は、FcレセプタIIIAへの結合に関与するようなIgG1残基Leu234−Ser239、Asp265−Glu269、Asn297−Thr299、およびAla327−Ile332を記載している。結晶構造に基づいて、下部ヒンジ(Leu234−Gly237)に加えて、IgG CH2ドメインループFG(残基326−330)およびBC(残基265−271)の残基がFcレセプタHAへの結合に役割を果たし得ることが示唆された。参照によりその全体が本明細書に組み入れられている、Shieldsら、L Biol.Chem.,276(9):6591−6604(2001)を参照。Fcレセプタ結合部位内の残基の突然変異は、改変されたエフェクタ機能、たとえば改変されたADCCまたはCDC活性、または改変された半減期をもたらし得る。上述したように、潜在的な突然変異は、アラニンによる置換、保存的置換、非保存的置換または異なるIgGサブクラスからの同じ位置の対応するアミノ酸残基による交換(たとえばIgG1残基をその位置の対応するIgG2残基と交換すること)を含む、1個以上の残基の挿入、欠失または置換を含む。
Shieldsらは、すべてのヒトFcレセプタへの結合に関与するIgG1残基が、ヒンジに近接したCH2ドメイン内に位置し、次のような2つの種類に分類されることを報告した:1)すべてのFcRと直接相互作用し得る位置としては、Leu234−Pro238、Ala327、およびPro329(およびおそらくAsp265)が挙げられる;2)炭水化物の性質または位置に影響する位置としては、Asp265およびAsn297が挙げられる。FcレセプタIIへの結合に影響した追加のIgG1残基は次の通りである:(最大効果)Arg255、Thr256、Glu258、Ser267、Asp270、Glu272、Asp280、Arg292、Ser298、および(より低い効果)His268、Asn276、His285、Asn286、Lys290、Gln295、Arg301、Thr307、Leu309、Asn315、Lys322、Lys326、Pro331、Ser337、Ala339、Ala378、およびLys414。A327Q、A327S、P329A、D265AおよびD270Aは結合を低下させた。すべてのFcRについて上で同定した残基に加えて、FcレセプタIIIAへの結合を40%以上低下させた追加のIgG1残基は次の通りである:Ser239、Ser267(GIyのみ)、His268、Glu293、Gln295、Tyr296、Arg301、Val303、Lys338、およびAsp376。FcRIIIAへの結合を改善した変異体としては、T256A、K290A、S298A、E333A、K334A、およびA339Tが挙げられる。Lys414はFcRIIAおよびFcRIIBへの結合で40%の低下を示し、Arg416はFcRIIAおよびFcRIIIAへの結合で30%の低下を示し、Gln419はFcRIIAへの結合で30%の、そしてFcRIIBへの結合で40%の低下を示し、そしてLys360はFcIIIAへの結合で23%の改善を示した。Prestaら、Biochem.Soc.Trans.(2001)30,487−490も参照。
たとえば参照によりその全体が本明細書に組み入れられている米国特許第6,194,551号は、ヒトIgG Fc領域内のアミノ酸位置329、331または322(カバットナンバリングを使用)に突然変異を含有する改変されたエフェクタ機能を備えた変異体と、その一部は低下したC1q結合またはCDC活性を示すこととを記載している。別の例として、参照によりその全体が本明細書に組み入れられている米国特許第6,737,056号は、ヒトIgG Fc領域内のアミノ酸位置238、239、248、249、252、254、255、256、258、265、267、268、269、270、272、276、278、280、283、285、286、289、290、292、294、295、296、298、301、303、305、307、309、312、315、320、322、324、326、327、329、330、331、333、334、335、337、338、340、360、373、376、378、382、388、389、398、414、416、419、430、434、435、437、438または439(カバットナンバリングを使用)に突然変異を含有する改変されたエフェクタまたはFcガンマレセプタ結合を備えた変異体と、その一部は低下したADCCまたはCDC活性と関連するレセプタ結合プロフィールを示すこととを記載している。これらのうち、アミノ酸位置238、265、269、270、327または329における突然変異がFcRIへの結合を低下させることが記載され、アミノ酸位置238、265、269、270、292、294、295、298、303、324、327、329、333、335、338、373、376、414、416、419、435、438または439における突然変異がFcRIIへの結合を低下させることが記載され、アミノ酸位置238、239、248、249、252、254、265、268、269、270、272、278、289、293、294、295、296、301、303、322、327、329、338、340、373、376、382、388、389、416、434、435または437における突然変異がFcRIIIへの結合を低下させることが記載されている。
参照によりその全体が本明細書に組み入れられている米国特許第5,624,821号は、マウス抗体のC1q結合活性は、重鎖のアミノ酸残基318、320または322を突然変異させることによって改変可能であることと、残基297(Asn)を交換することが溶解活性の除去を引き起こすこととを報告している。
参照によりその全体が本明細書に組み入れられている米国特許公開第20040132101号は、アミノ酸位置240、244、245、247、262、263、266、299、313、325、328、または332(カバットナンバリングを使用)または位置234、235、239、240、241、243、244、245、247、262、263、264、265、266、267、269、296、297、298、299、313、325、327、328、329、330、または332(カバットナンバリングを使用)における突然変異を備えた変異体と、そのうち位置234、235、239、240、241、243、244、245、247、262、263、264、265、266、267、269、296、297、298、299、313、325、327、328、329、330、または332における突然変異がADCC活性を低下させる、またはFcガンマレセプタへの結合を低下させ得ることとを記載している。
参照によりその全体が本明細書に組み入れられているChappelら、Proc Natl Acad Sci USA.1991;88(20):9036−40は、IgG1の細胞親和活性がその重鎖CH2ドメインの固有の特性であることを報告している。IgG1のアミノ酸残基234−237のいずれかにおける単一点突然変異は、その活性を著しく低下させるか、または無効にする。IgG1残基234−237のすべて(LLGG)のIgG2およびIgG4への置換は、完全な結合活性を回復するために必要であった。ELLGGP配列全体(残基233−238)を含有するIgG2抗体は、野生種IgG1よりも活性であることが観察された。
参照によりその全体が本明細書に組み入れられているIsaacsら、J Immunol.1998;161(8):3862−9は、FcガンマR結合にとって重要なモチーフ内の突然変異(グルタメート233からプロリン、ロイシン/フェニルアラニン234からバリン、およびロイシン235からアラニン)が標的細胞の欠乏を完全に予防したことを報告している。グルタメート318からアラニンへの突然変異は、マウスIgG2bのエフェクタ機能を除去して、ヒトIgG4の効力も低下させた。
参照によりその全体が本明細書に組み入れられているArmourら、MoI Immunol.2003;40(9):585−93は、活性化レセプタFcガンマRIIaと野生種IgG1よりも少なくとも10分の1の効率で反応するが、抑制性レセプタFcガンマRIIbへのその結合は4分の1に低下するのみである、IgG1変異体を同定した。突然変異はアミノ酸233−236の領域および/またはアミノ酸位置327、330および331にて行われた。参照によりその全体が本明細書に組み入れられているWO99/58572も参照。
参照によりその全体が本明細書に組み入れられているXuら、J Biol Chem.1994;269(5):3469−74は、IgGl Pro331からSerへの突然変異はC1q結合を顕著に減少させ、溶解活性を本質的に排除したことを報告している。対照的に、IgG4内のSer331のProによる置換は、IgG4 Pro331変異体に部分溶解活性(40%)を与えた。
参照によりその全体が本明細書に組み入れられているSchuurmanら、Mol Immunol.2001;38(1):1−8は、重鎖内結合形成Cys226に関与するヒンジシステインの1つのセリンへの突然変異、さらに安定な重鎖内連鎖を生じたことを報告している。IgGヒンジ配列Cys−Pro−Ser−CysのIgG1ヒンジ配列Cys−Pro−Pro−Cysへの突然変異も、重鎖間の共有結合性相互作用を顕著に安定化させる。
参照によりその全体が本明細書に組み入れられているAngalら、Mol Immunol.1993;30(1):105−8は、IgG4におけるアミノ酸位置241のセリンのプロリン(IgG1およびIgG2においてその位置に見出される)への突然変異は、相同性抗体の産生はもちろんのこと、元のキメラIgG4と比較して血清半減期の延長および組織分布の改善ももたらす。
本発明は、改善されたADCC活性を示すフコシル化の不存在または低下を伴う抗体分子を含めて、改変されたエフェクタ活性を生じる、改変された炭水化物構造を持つ抗体分子の産生も考慮する。このことを達成するために各種の方法が当分野で公知である。たとえば、ADCCエフェクタ活性は、抗体分子を、CH2ドメインのAsn−297におけるN結合グリコシル化の炭水化物構造に依存することが示されているFcγRIIIレセプタに結合することによって媒介される。非フコシル化抗体は、向上した親和性でこのレセプタを結合して、未変性のフコシル化抗体よりも効率的にFcγRIII媒介エフェクタ機能を誘発する。たとえば、アルファ−1,6−フコシルトランスフェラーゼ酵素がノックアウトされたCHO細胞における非フコシル化抗体の組換え産生は、ADCC活性が100倍上昇した抗体を生じる[Yamane−Ohnukiら、Biotechnol Bioeng.2004 Sep 5;87(5):614−22]。同様の効果が、たとえばsiRNAまたはアンチセンスRNA処理によってフコシル化経路におけるこのまたは他の酵素の活性を低下させること、酵素をノックアウトするために細胞系を操作すること、または選択的グリコシル化インヒビタと共に培養することによって達成され得る[Rothmanら、Mol Immunol.1989 Dec;26(12):1113−23]。ある宿主細胞株、たとえばLec13またはラットハイブリドーマYB2/0細胞系は、より低いフコシル化レベルの抗体を自然に産生する。Shieldsら、J Biol Chem.2002 JuI 26;277(30):26733−40;Shinkawaら、J Biol Chem.2003 Jan 31;278(5):3466−73。たとえばGnTIII酵素を過剰発現する細胞内の組換え産生抗体による二等分された炭水化物レベルの上昇も、ADCC活性を上昇させると判定されている。Umanaら、Nat Biotechnol.1999 Feb;17(2):176−80。2つのフコース残基の一方のみの不存在がADCC活性を上昇させるのに十分であり得ることが予測されている。Ferraraら、J Biol Chem.2005 Dec 5;[Epub ahead of print]。
他の共有結合性修飾
抗体の共有結合性修飾も本発明の範囲内に含まれる。それらは化学合成によって、あるいは妥当な場合は抗体の酵素または化学開裂によって行うことができる。抗体の他の種類の共有結合性修飾は、抗体の標的アミノ酸残基に、選択された側鎖あるいはNまたはC末端残基と反応することができる有機誘導体化剤を反応させることによって分子中に挿入される。
システイニル残基は最も一般的には、α−ハロアセテート(および対応するアミン)、たとえばクロロ酢酸またはクロロアセトアミドと反応して、カルボキシメチルまたはカルボキシアミドメチル誘導体を与える。システイニル残基は、ブロモトリフルオロアセトン、アルファ−ブロモ−□−(5−イミドゾイル)プロピオン酸、クロロアセチルホスフェート、N−アルキルマレイミド、3−ニトロ−2−ピリジルジスルフィド、メチル2−ピリジルジスルフィド、p−クロロメルクリベンゾエート、2−クロロメルクリ−4−ニトロフェノール、またはクロロ−7−ニトロベンゾ−2−オキサ−1,3−ジアゾールとの反応によっても誘導体化される。
ヒスチジル残基はpH5.5〜7.0におけるジエチルピロカーボネートとの反応によって誘導体化されるのは、この薬剤がヒスチジル側鎖に対して比較的特異性であるためである。パラ−ブロモフェニルブロミドも有用である;反応は好ましくはpH6.0にて0.1Mナトリウムカコジレート中で実施される。
リシニルおよびアミノ末端残基を、コハク酸または他のカルボン酸無水物と反応させる。これらの薬剤による誘導体化は、リシニル残基の電荷を反転させる効果を有する。アルファ−アミノ含有残基を誘導体化するための他の適切な試薬としては、メチルピコリンイミデートなどのイミドエステル、ピリドキサールホスフェート、ピリドキサールクロロボロヒドリド、トリニトロベンゼンスルホン酸、O−メチルイソ尿素、2,4−ペンタンジオンおよびグリオキシレートとのトランスアミナーゼ触媒反応が挙げられる。
アルギニル残基は、1つまたは複数の従来の試薬、その中でもフェニルグリオキサール、2,3−ブタンジオン、1,2−シクロヘキサンジオン、およびニンヒドリンによって修飾される。アルギニン残基の誘導体化は、グアニジン官能基の高いpKaのために反応がアルカリ性条件で実施されることを必要とする。さらにこれらの試薬は、リシンの基はもちろんのこと、アルギニンイプシロンアミノ基とも反応し得る。
チロシル残基の特異的修飾は、芳香族ジアゾニウム化合物またはテトラニトロメタンとの反応によるチロシル残基へのスペクトル標識の導入に特に興味を持って行われ得る。最も一般には、O−アセチルチロシル種および3ニトロ誘導体をそれぞれ生成するために、N−アセチルイミジゾールおよびテトラニトロメタンが使用される。チロシル残基は、ラジオイムノアッセイで使用するための標識タンパク質を調製するために125Iおよび131Iを使用してヨウ素化される。
カルボキシル側基(アスパルチルまたはグルタミル)は、1−シクロヘキシル−3−(2−モルホリニル−4−エチル)カルボジイミドまたは1−エチル−3−(4−アゾニア−4,4−ジメチルペンチル)カルボジイミドなどのカルボジイミド(R−N.dbd.C.dbd.N−R’)(式中、RおよびR’は異なるアルキル基である)との反応によって選択的に修飾される。さらに、アスパルチルおよびグルタミル残基は、アンモニウムイオンとの反応によってアスパラギニルおよびグルタミニル残基に変換される。
グルタミニルおよびアスパラギニル残基は、それぞれ対応するグルタミルおよびアスパルチル残基に頻繁に脱アミド化される。これらの残基は、中性または塩基性条件下で脱アミド化される。これらの残基の脱アミド化形は、本発明の範囲に含まれる。
他の修飾としては、プロリンおよびリジンのヒドロキシル化、セリルまたはトレオニル残基のヒドロキシル基のホスホリル化、リジン、アルギニン、およびヒスチジン側鎖のアルファ−アミノ基のメチル化(T.E.Creighton、Proteins:Structure and Molecular Properties,W.H.Freeman & Co.,San Francisco,pp.79−86(1983))、N末端アミンのアセチル化、およびいずれかのC末端カルボキシル基のアミド化が挙げられる。
別の種類の共有結合性修飾は、グリコシドを抗体に化学的または酵素的にカップリングさせることを含む。これらの手順は、それらが、NまたはO結合グリコシル化のためにグリコシル化機能を有する宿主細胞内での抗体の産生を必要としないという点で好都合である。使用するカップリング方式に応じて、糖は(a)アルギニンおよびヒスチジン、(b)遊離カルボキシル基、(c)遊離スルフヒドリル基、たとえばシステインの遊離スルフヒドリル基、(d)遊離ヒドロキシル基、たとえばセリン、トレオニン、またはヒドロキシプロリンの遊離ヒドロキシル基、(e)芳香族残基、たとえばフェニルアラニン、チロシン、またはトリプトファンの芳香族残基、あるいは(f)グルタミンのアミド基に付着され得る。これらの方法は、当分野で、たとえば1987年9月11に公開されたWO87/05330に、そしてAplin and Wriston,CRC Crit.Rev.Biochem.,pp.259−306(1981)に記載されている。
抗体上に存在するいずれかの炭水化物部分の除去は、化学的または酵素的に達成され得る。化学的脱グリコシル化は、化合物トリフルオロメタンスルホン酸、または同等の化合物への抗体の暴露を必要とする。この処理は、結合する糖(N−アセチルグルコサミンまたはN−アセチルガラクトサミン)を除いて大半またはすべての糖の開裂を生じるが、抗体を無傷のままにする。化学的脱グリコシル化は、Hakimuddin,ら、Arch.Biochem.Biophys.259:52(1987)によって、そしてEdgeら、Anal.Biochem.,118:131(1981)によって記載されている。抗体の炭水化物部分の酵素的開裂は、Thotakuraら、Meth.Enzymol.,138:350(1987)によって記載されているように、各種のエンドグリコシダーゼおよびエキソグリコシダーゼの使用によって達成され得る。
抗体の別の種類の共有結合性修飾は、抗体を各種の非タンパク質性ポリマーの1つ、たとえばポリエチレングリコール、ポリプロピレングリコール、ポリオキシエチル化ポリオール、ポリオキシエチル化ソルビトール、ポリオキシエチル化グルコース、ポリオキシエチル化グリセロール、ポリオキシアルキレン、またはデキストランなどのポリサッカライドポリマーに連結することを含む。このような方法は当分野で公知であり、たとえば米国特許第4,640,835号;第4,496,689号;第4,301,144号;第4,670,417号;第4,791,192号、第4,179,337号、第4,766,106号、第4,179,337号、第4,495,285号、第4,609,546号または欧州特許第315456号を参照。
遺伝子治療
適切な細胞への治療用抗体の送達は、物理的DNA伝達法(たとえばリポソームまたは化学処置)の使用、またはウィルスベクター(たとえばアデノウィルス、アデノ関連ウィルス、またはレトロウィルス)の使用を含む、当分野で公知のいずれかの適切な手法の使用によるエキソビボ、インサイチュー、またはインビボでの遺伝子治療によって実施され得る。たとえば、インビボでの治療では、所望の抗体をコードする核酸は単独で、またはベクター、リポソーム、または沈殿物と併せてのどちらかで対象に直接注射され得るか、ある実施形態において、抗体化合物の発現が所望である部位に注射され得る。エキソビボ処置では、対象の細胞が取り出され、核酸がこれらの細胞内に導入されて、修飾された細胞が直接、またはたとえば患者に移植される多孔性膜内にカプセル化されてのどちらかで対象に戻される。たとえば米国特許第4,892,538号および第5,283,187号を参照。核酸を生細胞内に導入するために利用できる各種の技法がある。技法は、核酸が目的とする宿主の細胞のインビトロ、またはインビボのどちらで培養された細胞に伝達されるかによって変わる。核酸の試験管内の哺乳類細胞への伝達に適した技法としては、リポソーム、電気穿孔、微量注入、細胞融合、DEAE−デキストラン、およびカルシウムホスフェート沈殿の使用が挙げられる。核酸のエキソビボ送達のために一般に使用されるベクターはレトロウィルスである。
他のインビボ核酸伝達技法としては、ウィルスベクター(たとえばアデノウィルス、Herps simplex Iウィルス、またはアデノ関連ウィルス)および脂質ベースシステムを使用したトランスフェクションが挙げられる。核酸およびトランスフェクション剤は微粒子と場合により結合される。例示的なトランスフェクション剤としては、カルシウムホスフェートおよびカルシウムクロライドの共沈殿物、DEAE−デキストラン媒介トランスフェクション、GIBCO−BRLによってリポフェクチンとして商品化された4級アンモニウム両親媒性物質DOTMA((ジオレオイルオキシプロピル)トリメチルアンモニウムブロミド(Felgnerら(1987)Proc.Natl.Acad.Sci.USA 84,7413−7417;Maloneら(1989)Proc.Natl Acad.Sci.USA 86 6077−6081);ペンダントトリメチルアンモニウムヘッドを備えた親油性グルタメートジエステル(Itoら(1990)Biochem.Biophys.Acta 1023,124−132);代謝性親脂質、たとえばカチオン脂質ジオクタデシルアミドグリシルスペルミン(DOGS,Transfectam,Promega)およびジパルミトイルホスファチジルエタノールアミルスペルミン(DPPES)(J.P.Behr(1986)Tetrahedron Lett.27,5861−5864;J.P.Behrら(1989)Proc.Natl.Acad.Sci.USA 86,6982−6986);代謝性4級アンモニウム塩(DOTB、N−(1−[2,3−ジオレイルオキシ]プロピル)−N,N,N−トリメチルアンモニウムメチルサルフェート(DOTAP)(Boehringer Mannheim)、ポリエチレンイミン(PEI)、ジオレイルエステル、ChoTB,ChoSC,DOSC)(Leventisら(1990)Biochim.Inter.22,235−241);3ベータ[N−(N’,N’−ジメチルアミノエタン)−カルバモイル]コレステロール(DC−Choi)、1:1混合物のジオレイルホスファチジルエタノールアミン(DOPE)/3ベータ[N−(N’,N’−ジメチルアミノエタン)−カルバモイル]コレステロールDC−Chol(Gaoら(1991)Biochim.Biophys.Acta 1065,8−14)、スペルミン、スペルミジン、リポポリアミン(Behrら、Bioconjugate Chem,1994,5:382−389)、親油性ポリリシン(LPLL)(Zhouら(1991)Biochim.Biophys.Acta 939,8−18)、過剰なホスファチジルコリン/コレステロールを含む[[(1,1,3,3−テトラメチルブチル)クレソキシ]エトキシ]エチル)ジメチルベンジルアンモニウムヒドロキシド(DEBDAヒドロキシド)(Ballasら(1988)Biochim.Biophys.Acta 939,8−18)、セチルトリメチルアンモニウムブロミド(CTAB)/DOPE混合物(Pinnaduwageら(1989)Biochim.Biophys.Acta 985,33−37)、ホスファチジルエタノールアミンとの混合物中のDOPE、CTAB、DEBDA、ジドデシルアンモニウムブロミド(DDAB)、およびステアリルアミンとのグルタミン酸の親油性ジエステル(TMAG)(Roseら(1991)Biotechnique 10,520−525)、DDAB/DOPE(TransfectACE、GIBCO BRL)、およびオリゴガラクトース含有脂質が挙げられる。伝達の効率を上昇させる例示的なトランスフェクション強化剤としては、たとえばDEAE−デキストラン、ポリブレン、リソソーム破壊ペプチド(Ohmori N Iら、Biochem Biophys Res Commun Jun.27,1997;235(3):726−9)、コンドロイタンベースプロテオグリカン、硫酸化プロテオグリカン、ポリエチレンイミン、ポリリシン(Pollard Hら、J Biol Chem,1998 273(13):7507−11)、インテグリン結合ペプチドCYGGRGDTP、直鎖デキストランノナサッカライド、グリセロール、オリゴヌクレオチドの3’−末端インターヌクレオチド連鎖に結合されたコレステリル基(Letsinger,R.L.1989 Proc Natl Acad Sci USA 86:(17):6553−6)、リソホスファチド、リソホスファチジルコリン、リソホスファチジルエタノールアミン、および1−オレイル−リソホスファチジルコリンが挙げられる。
ある状況において、核酸含有ベクターを標的細胞に向ける薬剤と共に核酸を送達することが所望であり得る。このような「ターゲッティング」分子としては、標的細胞の細胞表面膜タンパク質に対して特異性の抗体、または標的細胞のレセプタに対するリガンドを含む。リポソームを利用する場合、エンドサイトーシスに関連する細胞表面膜タンパク質に結合するタンパク質がターゲッティングに、および/または摂取を促進するために使用され得る。このようなタンパク質の例としては、特定の細胞タイプに対してトロピックであるカプシドタンパク質およびその断片、循環中に内部移行を受けるタンパク質に対する抗体、および細胞内局在化を標的として、細胞内半減期を延長するタンパク質が挙げられる。他の実施形態において、レセプタ媒介エンドサイトーシスが使用され得る。このような方法は、たとえば、Wuら、1987またはWagnerら、1990に記載されている。現在公知である遺伝子マーキングおよび遺伝子治療プロトコルの総説については、Anderson 1992を参照。WO93/25673およびそこで引用されている参考文献も参照。遺伝子治療技術のさらなる総説については、Friedmann,Science,244:1275−1281(1989);Anderson,Nature,supplement to vol.392,no 6679,pp.25−30(1998);Verma,Scientific American:68−84(1990);およびMiller,Nature,357:455460(1992)を参照。
スクリーニング方法
有効な治療学は、著しい毒性のない有効な薬剤を確認することに依存する。抗体は、当分野で公知の方法によって結合親和性についてスクリーニングされ得る。たとえば、ゲルシフトアッセイ、ウェスタンブロット、放射性標識競合アッセイ、クロマトグラフィーによる同時分画、同時沈殿、架橋、ELISAなどを使用でき、それらはたとえば参照によりその全体が本明細書に組み入れられているCurrent Protocols in Molecular Biology(1999)John Wiley & Sons,NYに記載されている。
PRLRの所望のエピトープ(たとえばPRLRの細胞外ドメイン)に結合する抗体を最初にスクリーニングするために、Antibodies,A Laboratory Manual,Cold Spring Harbor Laboratory, Ed Harlow and David Lane(1988)に記載されているアッセイのような、日常的なクロスブロッキングアッセイが実施され得る。未知の抗体が、本発明のPRLR特異性抗体へのPRLRの結合を抑制するその能力によって特徴付けられる、日常的な競合結合アッセイも使用され得る。エピトープマッピングは、Champeら、J.Biol.Chem.270:1388−1394(1995)に記載されている。
インビトロでの結合アッセイの1つの変形において、本発明は(a)固定化PRLRに候補抗体を接触させる工程と、(b)候補抗体のPRLRへの結合を検出する工程とを含む方法を提供する。代わりの実施形態において、候補抗体は固定化され、PRLRの結合が検出される。固定化は、支持体、ビーズ、またはクロマトグラフィー樹脂への共有結合はもちろんのこと、非共有結合性の高親和性相互作用、たとえば抗体結合、または固定化化合物がビオチン部分を含むストレプトアビジン/ビオチン結合の使用を含む、当分野で公知の方法のいずれを使用しても達成される。結合の検出は、当分野で公知であり、日常的に実施される他の技法と同様に、(i)固定化されていない化合物の放射性標識を使用して、(ii)非固定化化合物の蛍光標識を使用して、(iii)非固定化化合物に対して免疫特異性である抗体を使用して、(iv)非固定化化合物が付着される蛍光支持体を励起する非固定化化合物の標識を使用して達成され得る。
PRLRの活性または発現を調節(すなわち上昇、下降、または遮断)する抗体は、推定上のモジュレータを、PRLRを発現する細胞によってインキュベートすることと、PRLRの活性または発現に対する推定上のモジュレータの効果を決定することによって同定され得る。PRLRポリペプチドまたはポリヌクレオチドの活性を調節する抗体の選択性は、PRLRポリペプチドまたはポリヌクレオチドに対するその効果を、他の関連化合物に対するその効果と比較することによって評価され得る。選択的モジュレータとしてはたとえば、PRLRポリペプチドに、またはPRLRポリペプチドをコードする核酸に特異的に結合する抗体および他のタンパク質、ペプチド、または有機分子が挙げられ得る。PRLR活性のモジュレータは、PRLRポリペプチドの正常または異常な活性が関与する疾患または生理的状態の処置に治療上有用であろう。
癌の予防または処置に潜在的に有用な化合物は、各種のアッセイを使用してスクリーニングされ得る。たとえば、候補アンタゴニストは、はじめに、STAT5および/MAPKホスホリル化の誘発におおいてPRLRダイマー化を予防する、および/またはPRLRを中和するその能力を判定するために、培養細胞系にて特徴付けられ得る。
特定のPRLR抗体、またはPRLR抗体の組合せの抗腫瘍活性は、適切な動物モデルを使用してインビボで評価され得る(Loukopoulosら、Pancreas,29(3):193−203(2004))。加えて、特定のPRLR抗体の抗腫瘍活性は、たとえばSTAT5および/MAPKホスホリル化あるいはPRLRシグナル伝達の他のインジケータをアッセイすることによって評価され得る。加えて、本明細書に記載するような増殖アッセイ、軟寒天アッセイ、および/または細胞傷害性アッセイを含む細胞アッセイは、特定のPRLR抗体を評価するために使用され得る。
本発明は、PRLRポリペプチドと相互作用する、またはPRLRポリペプチドの生物活性を抑制する(すなわち酵素活性、結合活性などを抑制する)ハイスループットスクリーニング(HTS)アッセイも含む。HTSアッセイは、効率的な方式での多数の化合物のスクリーニングを可能にする。PRLRポリペプチドとその結合パターンとの間の相互作用を調査するために、細胞ベースHTSシステムが考慮される。HTSアッセイは、所望の特性を改善するための修飾が設計され得る所望の特性を有する「ヒット」または「リード化合物」を同定するように設計される。「ヒット」または「リード化合物」の化学修飾は、「ヒット」とPRLRポリペプチドとの間の同定可能な構造/活性関係に基づくことが多い。
本発明の別の態様は、PRLRに抗体を接触させる工程と、抗体がPRLRの活性を修飾するかどうかを判定する工程とを含む、PRLRの活性を調節する(すなわち低下させる)抗体を同定する方法に関する。試験抗体の存在下での活性を、試験抗体の不存在下での活性と比較する。試験抗体を含有するサンプルの活性が、試験抗体のないサンプルの活性より低い場合、抗体は抑制された活性を有するであろう。
抗体コンジュゲート
抗PRLR抗体は、その「裸の」または「非コンジュケート」形で投与され得るか、あるいは他の治療または診断剤にコンジュゲートされ得るか、あるいは間接的にそのような他の治療または診断剤を含む担体ポリマーにコンジュゲートされ得る。
抗体は、放射性同位体、親和性標識(たとえばビオチン、アビジンなど)、酵素標識(たとえばホースラディッシュペルオキシダーゼ、アルカリホスファターゼなど)、蛍光または発光または生物発光標識(たとえばFITCまたはローダミンなど)、常磁性原子などの使用によって検出できるように標識され得る。このような標識を達成する手順は当分野で公知である;たとえば(Sternberger,L.A.ら、J.Histochem.Cytochem.18:315(1970);Bayer,E.A.ら、Meth.Enzym.62:308(1979);Engval,E.ら、Immunol.109:129(1972);Goding,J.W.J.Immunol.Meth.13:215(1976))を参照。
抗体部分のコンジュゲーションは米国特許第6,306,393号に記載されている;一般技法はShihら、Int.J.Cancer 41:832−839(1988);Shihら、Int.J.Cancer 46:1101−1106(1990);およびShihら、米国特許第5,057,313号にも記載されている。この一般的な方法は、酸化炭水化物部分を有する抗体成分に、少なくとも1つの遊離アミン官能基を有し、複数の薬物、毒素、キレート剤、ホウ素アデンド(addend)、または他の治療剤が装入される担体ポリマーと反応させることを含む。この反応は初期のシッフ塩基(イミン)結合を生じさせ、これを2級アミンへの還元によって安定化させて最終コンジュゲートを生成させることができる。
担体ポリマーはたとえば、少なくとも50アミノ酸残基のアミノデキストランまたはポリペプチドであり得る。薬物または他の薬剤の担体ポリマーにコンジュゲートするための各種の技法は当分野で公知である。ポリペプチド担体はアミノデキストランの代わりに使用され得るが、ポリペプチド担体は鎖内に少なくとも50アミノ酸残基、好ましくは100〜5000アミノ残基を有するべきである。アミノ酸の少なくとも一部は、リシン残基あるいはグルタメートまたはアスパルテート残基であるべきである。リシン残基のペンダントアミンならびにグルタミンおよびアスパルテートのペンダントカルボキシレートは、薬物、毒素、免疫調節剤、キレート剤、ホウ素アデンドまたは他の治療剤を付着するのに好都合である。適切なポリペプチド担体の例としては、ポリリシン、ポリグルタミン酸、ポリアスパラギン酸、そのコポリマー、ならびに得られた装入担体およびコンジュゲートに所望の溶解度特性を付与するための、これらのアミノ酸およびその他、たとえばセリンの混合ポリマーが挙げられる。
あるいは、コンジュゲート抗体は、抗体成分に治療剤を直接結合させることによって作製され得る。一般的な手順は、治療剤が酸化された抗体成分に直接付着していることを除いて、コンジュゲーションの間接方法と似ている。たとえば、抗体の炭水化物部分は、半減期を延長するためにポリエチレングリコールに付着され得る。
あるいは、治療剤は、ジスルフィド結合形成を介して、またはヘテロ二官能性架橋剤、たとえばN−スクシニル3−(2−ピリジルジチオ)プロピオネート(SPDP)を使用して、還元された抗体成分のヒンジ領域に付着され得る。Yuら、Int.J.Cancer56:244(1994)。このようなコンジュゲートの一般技法は、当分野で公知である。たとえばWong,Chemistry Of Protein Conjugation and Cross−Linking(CRC Press 1991);Upeslacisら“Modification of Antibodies by Chemical Methods,”in Monoclonal Antibodies:Principles and Applications,Birchら(eds.),pages 187−230(Wiley−Liss,Inc.1995);Price,“Production and Characterization of Synthetic Peptide−Derived Antibodies,” in Monoclonal Antibodies:Production,Enineering and Clinical Application,Ritterら(eds.),pages 60−84(Cambridge University Press 1995)を参照。各種の二官能性タンパク質カップリング剤、たとえばN−スクシンイミジル−3−(2−ピリジルジチオール)プロピオネート(SPDP)、イミノチオラン(IT)、イミドエステルの二官能性誘導体(たとえばジメチルアジピミデートHCL)、活性エステル(たとえばジスクシンイミジルスベレート)、アルデヒド(たとえばグルタルアルデヒド)、ビスアジド化合物(たとえばビス(p−アジドベンゾイル)ヘキサンジアミン)、ビスジアゾニウム誘導体(たとえばビス−(p−ジアゾニウムベンゾイル)−エチレンジアミン)、ジイソシアネート(たとえばトリエン2,6−ジイソシアネート)、およびビス活性フッ素化合物(たとえば1,5−ジフルオロ−2,4−ジニトロベンゼン)が当分野で公知である。
最後に、1つ以上の抗PRLR抗体および別のポリペプチドより成る融合タンパク質が構築され得る。抗体融合タンパク質を作製する方法は、当分野で公知である。たとえば米国特許第6,306,393号を参照。インターロイキン−2部分を含む抗体融合タンパク質は、Boletiら、Ann.Oncol.6:945(1995)、Nicoletら、Cancer Gene Ther.2:161(1995)、Beckerら、Proc.Nat’l Acad.Sci.USA 93:7826(1996)、Hankら、Clin.Cancer Res.2:1951(1996)、およびHuら、Cancer Res.56:4998(1996)によって記載されている。
併用療法
動物モデルで有効である1を超えるPRLR抗体が同定されたら、癌に対してなお改善された有効性を提供するために2つ以上のこのようなPRLR抗体を共に混合することがさらに好都合であり得る。1つ以上のPRLR抗体を含む組成物は、癌に罹患している、または癌に罹患する素因のあるヒトまたは哺乳類に投与され得る。PRLR抗体はまた、別の治療剤、たとえば細胞傷害剤、または癌化学治療剤と共に投与され得る。2つの治療剤の同時投与は、薬剤がその治療効果を及ぼす期間に重複がある限り、薬剤が同時に、または同じ経路で投与されることを必要としない。投与が別の日または週であるような、同時または連続投与が考慮される。
本発明の方法は、単一の抗PRLR抗体の投与はもちろんのこと、異なる抗体の組合せ、すなわち「カクテル」も考慮する。そのような抗体カクテルは、異なるエフェクタ機構を利用する、または細胞傷害性抗体を免疫エフェクタ機能性に依存する抗体と直接結合させる抗体をそれらが含有する限り、ある利点を有し得る。組合されたこのような抗体は、相乗治療効果を示すことができる。
細胞傷害剤は、細胞の機能を抑制または予防および/あるいは細胞の破壊を引き起こす物質を指す。該用語は、放射性同位体(たとえばI131、I125、Y90およびRe186)、化学療法剤、および毒素、たとえば細菌、真菌、植物または動物起源の酵素活性毒素あるいは合成毒素、またはその断片を含むものである。非細胞傷害剤は、細胞の機能を抑制または予防しない、および/あるいは細胞の破壊を引き起こさない物質を指す。非細胞傷害剤は、活性化されて細胞傷害性となり得る薬剤を含み得る。非細胞傷害剤は、ビーズ、リポソーム、マトリクスまたは粒子を含み得る(たとえば、参照により本明細書に組み入れられている、米国特許公開第2003/0028071号および第2003/0032995号を参照)。このような薬剤は、本発明による抗体にコンジュゲート、カップリング、連結または結合され得る。
癌化学療法剤としては、非限定的に、アルキル化剤、たとえばカルボプラチンおよびシスプラチン;ナイトロジェンマスタードアルキル化剤;ニトロソ尿素アルキル化剤、たとえばカルムスチン(BCNU);抗代謝産物、たとえばメトトレキサート;ホリニン酸;プリン類似物質抗代謝産物、メルカプトプリン;ピリミジン類似物質抗代謝産物、たとえばフルオロウラシル(5−FU)およびゲムシタビン(Gemzar(登録商標));ホルモン抗新生物薬、たとえばゴセレリン、ロイプロリド、およびタモキシフェン;天然抗新生物薬、たとえばアルデスロイキン、インターロイキン−2、ドセタキセル、エトポシド(VP−16)、インターフェロンアルファ、パクリタキセル(タキソール(登録商標))、およびトレチオニン(ATRA);抗生天然抗新生物薬、たとえばブレオマイシン、ダクチノマイシン、ダウノルビシン、ドキソルビシン、ダウノマイシンおよびマイトマイシンCを含むマイトマイシン;およびビンカアルカロイド天然抗新生物薬、たとえばビンブラスチン、ビンクリスチン、ビンデシン;ヒドロキシ尿素;アセグラトン、アドリアマイシン、イフォスファミド、エノシタビン、エピチオスタノール、アクラルビシン、アンシタビン、ニムスチン、プロカルバジンヒドロクロライド、カルボコン、カルボプラチン、カルモフール、クロモマイシンA3、抗腫瘍ポリサッカライド、抗腫瘍血小板因子、シクロホスファミド(サイトキシン(登録商標))、スキゾフィラン、シタラビン(シトシンアラビノシド)、ダカルバジン、チオイノシン、チオテパ、テガフール、ドラスタチン、ドラスタチン類似物質、たとえばオーリスタチン、CPT−11(イリノテカン)、ミトザントロン、ビノレルビン、テニポシド、アミノプテリン、カルミノマイシン、エスペラマイシン(たとえば米国特許第4,675,187号を参照)、ネオカルジノスタチン、OK−432、ブレオマイシン、フルツロン、ブロクスウリジン、ブスルファン、ホンバン、ペプロマイシン、ベスタチン(ウベニメクス(登録商標))、インターフェロン−β、メピチオスタン、ミトブロニトール、メルファラン、ラミニンペプチド、レンチナン、カワラタケ抽出物、テガフール/ウラシル、エストラムスチン(エストロゲン/メクロレタミン)が挙げられる。さらに、癌患者への療法として使用される追加の薬剤としては、EPO、G−CSF、ガンシクロビル;抗生剤、ロイプロリド;メペリジン;ジドブジン(AZT);突然変異体および類似物質を含む、インターロイキン1〜18;インターフェロンおよびサイトカイン、たとえばインターフェロンα、β、およびγホルモン、たとえば黄体形成ホルモン放出ホルモン(LHRH)および類似物質ならびにゴナドトロピン放出ホルモン(GnRH);成長因子、たとえば形質転換増殖因子−β(TGF−β)、線維芽細胞成長因子(FGF)、神経増殖因子(NGF)、成長ホルモン放出因子(GHRF)、上皮増殖因子(EGF)、線維芽細胞増殖因子相同因子(FGFHF)、肝細胞増殖因子(HGF)、およびインスリン増殖因子(IGF);腫瘍壊死因子−αおよびβ(TNF−αおよびβ);浸潤抑制因子−2(IIF−2);骨形成タンパク質1〜7(BMP1〜7);ソマトスタチン;サイモシン−α−1;γ−グロブリン;スーパーオキシドジスムターゼ(SOD);補体因子;抗血管新生因子;抗原性物質;ならびにプロドラッグが挙げられる。
プロドラッグは、親薬物と比較して腫瘍細胞に対してより細胞傷害性が低いか、または細胞傷害性でなく、酵素活性化され得るか、あるいは活性形またはさらに活性な親形に変換され得る、製薬的活性物質の前駆物質または誘導体を指す。たとえば、Wilman,“Prodrugs in Cancer Chemotherapy”Biochemical Society Transactions,14,pp.375−382,615th Meeting Belfast(1986)およびStellaら“Prodrugs:A Chemical Approach to Targeted Drug Delivery,”Directed Drug Delivery,Borchardtら(ed.),pp.247−267,Humana Press(1985)を参照。プロドラッグとしては、限定されないが、さらに活性の細胞傷害性遊離薬に変換され得る、ホスフェート含有プロドラッグ、チオホスフェート含有プロドラッグ、サルフェート含有プロドラッグ、ペプチド含有プロドラッグ、D−アミノ酸含有プロドラッグ、D−アミノ酸修飾プロドラッグ、□−ラクタム含有プロドラッグ、場合により置換されたフェノキシアセトアミド含有プロドラッグまたは場合により置換されたフェニルアセトアミド含有プロドラッグ、5−フルオロシトシンおよび他のフルオロウリジンプロドラッグが挙げられる。本明細書で使用するためのプロドラッグ形に誘導体化され得る細胞傷害薬の例としては、限定されないが、上述した化学療法剤が挙げられる。
投与および調製
本発明の方法の常法で使用される抗PRLR抗体は、所望の送達方法に適した担体を含む製薬組成物に調合され得る。適切な担体としては、抗PRLR抗体と結合させたときに、抗体の抗腫瘍機能を保持し、対象の免疫系と非反応性であるいずれの物質でも挙げられる。例としては、限定されないが、滅菌リン酸緩衝生理食塩溶液、静菌水などの、多数の標準製薬担体のいずれもが挙げられる。各種の水性担体、たとえば水、緩衝水、0.4%生理食塩水、0.3%グリシンなどが使用でき、安定性を向上させるための、軽度の化学修飾などに付された他のタンパク質、たとえばアルブミン、リポフェクチン、グロブリンなどを含み得る。
抗体の治療用調合物は、所望の純度を有する抗体を任意の生理学的に許容される担体、賦形剤または安定剤(Remington’s Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980))と混合することにより、凍結乾燥調合物または水溶液の形で貯蔵のために調製される。許容される担体、賦形剤または安定剤は利用される投薬量および濃度においてレシピエントに対して非毒性であり、リン酸塩、クエン酸塩、および他の有機酸などの緩衝液;アスコルビン酸およびメチオニンを含む抗酸化剤;保存料(たとえばオクタデシルジメチルベンジルアンモニウムクロライド;ヘキサメトニウムクロライド;ベンズアルコニウムクロライド、ベンズエトニウムクロライド;フェノール、ブチルまたはベンジルアルコール;アルキルパラベン、たとえばメチルまたはプロピルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3−ペンタノール;およびm−クレゾール);低分子量(約10残基未満)ポリペプチド;タンパク質、たとえば血清アルブミン、ゼラチン、または免疫グロブリン;親水性ポリマー、たとえばポリビニルピロリドン;アミノ酸、たとえばグリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン、またはリシン;モノサッカライド、ジサッカライド、およびグルコース、マンノース、またはデキストリンを含む他の炭水化物;キレート剤、たとえばEDTA;糖、たとえばスクロース、マンニトール、トレハロースまたはソルビトール;塩形成対イオン、たとえばナトリウム;金属錯体(たとえばZn−タンパク質錯体);および/または非イオン性界面活性剤、たとえばTWEEN(商標)、PLURONICS(商標)またはポリエチレングリコール(PEG)が挙げられる。
本明細書の調合物は、処置される特定の適応症のために必要に応じて1を超える活性化合物、好ましくは相互に悪影響を及ぼさない補足的活性を備えた化合物も含有し得る。たとえば、免疫抑制剤をさらに提供することが所望であり得る。そのような分子は、意図した目的に有効である量と組合されて適切に存在する。
活性成分は、コロイド薬物送達システム(たとえばリポソーム、アルブミン、ミクロスフェア、マイクロエマルジョン、ナノ粒子およびナノカプセル)における、たとえばコアセルベーション技法によって、または界面重合によって調製されたマイクロカプセル、たとえばそれぞれヒドロキシメチルセルロースまたはゼラチンマイクロカプセルおよびポリ(メチルメタクリレート)マイクロカプセル中に、あるいはマクロエマルジョン中に捕捉され得る。そのような技法は、Remington’s Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980)に開示されている。
インビボ投与に使用される調合物は滅菌されている必要がある。これは滅菌濾過膜によってただちに達成される。
非経口、皮下、腹腔内、肺内、および鼻腔内を含むいずれかの適切な手段によって、所望ならば局所処置には病巣内投与によって投与される。非経口注入としては、静脈内、動脈内、腹腔内、筋肉内、皮内または皮下投与が挙げられる。加えて、抗体は、特に抗体の漸減用量でのパルス注入によって適切に投与される。好ましくは、投薬は注入によって、最も好ましくは、一部は投与が短期または慢性的であるかによって、静脈内または皮下注入によって与えられる。たとえば所望の部位に近接して配置されたカテーテルを通じた局所、特に経皮、経粘膜、直腸、経口または局所投与を含む、他の投与方法が考慮される。
本発明の組成物は、たとえば顆粒剤、粉剤、錠剤、カプセル剤、シロップ剤、坐剤、注射剤、乳剤、エリキシル剤、懸濁剤または液剤の形であり得る。本組成物は、たとえば経口投与による、経鼻投与による、直腸投与、皮下注射、静脈内注射、筋肉内注射、または腹腔内注射による、各種の投与経路のために調合され得る。下の投薬形は一例として与えられ、本発明を制限するとして解釈されるべきではない。
注射用投薬形としては、一般に、適切な分散剤または湿潤剤および懸濁化剤を使用して調製され得る水性懸濁剤または油性懸濁剤が挙げられる。注射形は溶液相であっても、懸濁剤の形でもよく、溶媒または希釈剤を用いて調製される。許容される溶媒またはビヒクルとしては、滅菌水、リンゲル液、または等張生理的食塩水溶液が挙げられる。あるいは、溶媒または懸濁化剤として滅菌油が利用され得る。好ましくは、天然または合成油、脂肪酸、モノ、ジまたはトリグリセリドを含む油または脂肪酸は非揮発性である。
注射の場合、製薬調合物および/または薬剤は、上述のような適切な溶液を用いた再構成に適した粉剤であり得る。これらの例としては、限定されないが、凍結乾燥、回転乾燥またはスプレー乾燥粉剤、アモルファス粉剤、顆粒剤、沈殿物、または微粒子が挙げられる。注射の場合、調合物は場合により、安定剤、pH調節剤、界面活性剤、生物学的利用能調節剤およびこれらの組合せを含有し得る。
持続放出調製物が調製され得る。持続放出調製物の適切な例としては、抗体を含有する固体疎水性ポリマーの半透性マトリクスが挙げられ、該マトリクスは成形品、たとえばフィルムまたはマイクロカプセルの形である。持続放出マトリクスの例としては、ポリエステル、ハイドロゲル(たとえばポリ(2−ヒドロキシエチル−メタクリレート)、またはポリ(ビニルアルコール))、ポリラクチド(米国特許第3,773,919号)、L−グルタミン酸とy エチル−L−グルタメートとのコポリマー、非分解性エチレン−ビニルアセテート、分解性乳酸−グリコール酸コポリマー、たとえばLupron Depot(商標)(乳酸−グリコール酸コポリマーおよびロイプロリドアセテートから成る注射用ミクロスフェア)、およびポリ−D−(+)−3−ヒドロキシ酪酸が挙げられる。エチレン−ビニルアセテートおよび乳酸−グリコール酸などのポリマーは100日に亘る分子の放出を可能にするが、あるハイドロゲルはタンパク質をより短い期間に亘って放出する。カプセル化抗体が体内に長期に亘って残存するとき、それらは37℃の水分への曝露の結果として変性または凝集して、生物活性の損失および免疫原性の考えられる変化を生じ得る。関与する機構に応じた安定化のための合理的なストラテジーが考案され得る。たとえば、凝集機構がチオ−ジスルフィド交換による分子内S−S結合形成であることが見出される場合、安定化は、スルフヒドリル残基を修飾することと、酸性溶液から凍結乾燥させることと、水分含量を制御することと、適切な添加剤を使用することと、特有のポリマーマトリクス組成物を開発することとによって達成され得る。
本発明の調合物は、本明細書に記載するように短時間作用性、高速放出性、長時間作用性、または持続放出性となるように設計され得る。それゆえ、製薬調合物は、制御放出のために、または短時間放出のためにも調合され得る。
本組成物は、たとえばミセルまたはリポソームあるいは他のカプセル化形を含むこともあり、あるいは長期の貯蔵および/または送達効果を提供するために長時間放出形として投与され得る。したがって、製薬調合物および薬剤は、ペレットまたはシリンダー内に圧入して、デポー注射として、またはステントなどのインプラントとして筋肉内または皮下に移植され得る。このようなインプラントは、シリコーンおよび生分解性ポリマーなどの公知の不活性材料を利用し得る。
上述したこれらの代表的な投薬形以外に、製薬的に許容される賦形剤および担体は一般に当業者に公知であり、それゆえ本発明に含まれる。このような賦形剤および担体はたとえば、参照により本明細書に組み入れられている“Remingtons Pharmaceutical Sciences”Mack Pub.Co.,New Jersey(1991)に記載されている。
疾患、対象の年齢、体重、全身健康状態、性別、および食餌、投薬間隔、投与経路、排泄率、および薬物の組合せに応じて、特定の投薬量が調整され得る。有効量を含有する上の投薬形のいずれも日常的な実験の十分な限度内にあり、したがって本発明の十分な範囲内にある。
治療薬として有用なPRLR抗体は、他の天然発生型免疫グロブリンまたは他の生体分子を実質的に含まずに調製されることが多いであろう。好ましいPRLR抗体は、その必要がある対象に投与されたときに最小毒性も示すであろう。
本発明の組成物は、従来の公知の滅菌技法によって滅菌され得る。得られた液剤は使用のために包装されるか、または無菌条件下で濾過されていてよく、凍結乾燥され、凍結乾燥調製物は投与前に滅菌溶液と混合される。組成物は、生理学的条件に近づけるために必要に応じて製薬的に許容される補助物質、たとえばpH調節剤および緩衝剤、張性調節剤など、たとえば酢酸ナトリウム、乳酸ナトリウム、塩化ナトリウム、塩化カリウム、塩化カルシウムおよび安定剤(たとえば120%マルトースなど)を含有し得る。
本発明のPRLR抗体はリポソームによっても投与でき、リポソームは、薬物(たとえば本明細書で開示した抗体、そして場合により化学治療剤)の送達に有用である脂質および/またはリン脂質および/または界面活性剤の各種のタイプから成る小型ベシクルである。リポソームはエマルジョン、泡、ミセル、不溶性単層、リン脂質分散物、ラメラ層などを含み、ビヒクルとしてPRLR抗体を特定の組織に標的化するのはもちろんのこと、組成物の半減期を延長するためにも作用し得る。参照により本明細書に組み入れられている米国特許第4,837,028号および第5,019,369号に記載されているような、リポソームを調製するための各種の方法が利用され得る。
抗体を含有するリポソームは、Epsteinら、Proc.Natl.Acad.Sci.USA 82:3688(1985);Hwangら、Proc.Natl Acad.Sci.USA 77:4030(1980);ならびに米国特許第4,485,045号および第4,544,545号に記載されているような当分野で公知の方法によって調製される。長い循環期間を持つリポソームは米国特許第5,013,556号に開示されている。
特に有用なリポソームは、ホスファチジルコリン、コレステロールおよびPEG誘導体化ホスホチジルエタノールアミン(PEG−PE)を含む脂質組成物を用いて逆相蒸発法によって生成され得る。リポソームは、所望の直径を持つリポソームを生じるために定義された孔径のフィルタを通じて押し出される。本発明の抗体の断片は、Martinら、J.Biol.Chem.257:286−288(1982)に記載されているように、ジスルフィド交換反応によってリポソームにコンジュゲートされ得る。化学療法剤(たとえばドキソルビシン)は場合によりリポソーム中に含有される[たとえばGabizonら、J.National Cancer Inst.81(19):1484(1989)を参照]。
これらの組成物中のPRLR抗体の濃度は非常に幅広く、すなわち約10%未満、通常は少なくとも約25%から75重量%または90重量%までも変化可能であり、選択された特定の投与方式に従って流体体積、粘度などによって主に選択されるであろう。経口、局所および非経口投薬組成物を調製するための実際の方法は、当業者に公知または明白となり、たとえば参照により本明細書に組み入れられているRemington’s Pharmaceutical Science,19th ed.,Mack Publishing Co.,Easton,PA(1995)に詳細に記載されている。
本発明の組成物は、癌にすでに罹患している、または癌の素因がある哺乳類に、癌の発達を予防または少なくとも部分的に停止するのに十分な量で投与される。これを達成するのに十分な量は、「治療的有効用量」として定義される。PRLR抗体の有効量は変化し、疾患の重症度ならびに処置される患者の体重および全身状態によって変化するが、一般に約1.0μg/kg〜約100mg/kg体重、または約10μg/kg〜約30mg/kgの範囲であり、適用ごとに約0.1mg/kg〜約10mg/kgまたは約1mg/kg〜約10mg/kgが最も普通に使用される。たとえば、1回以上の別個の投薬によるか、または連続注入によるかにかかわらず、たとえば、抗体約10μg/kg〜約5mg/kgまたは約30μg/kg〜約1mg/kgが患者への投与のための初期候補投薬量である。投与は、疾患への応答および患者の治療耐性によって必要に応じて、毎日、1日おき、毎週またはそれ以下の頻度である。より長期間、たとえば4、5、6、7、8、10または12週以上に亘る維持投薬量は、疾患症状の所望の抑制が起こるまで必要であり、投薬量は必要に応じて調節され得る。この治療の進捗は従来の技法およびアッセイによって容易に監視される。
組成物の1回または複数回の投与は、治療する医師によって選択される用量レベルおよびパターンによって実施され得る。疾患の予防および処置では、抗体の適切な投薬量は、上で定義したように処置される疾患の種類、疾患の重症度および経過、抗体が予防または治療目的のどちらで投与されるか、以前の治療、患者の臨床暦および抗体への反応、および担当医の裁量によって変わるであろう。抗体は、1回に、または一連の処置に亘って患者に適切に投与される。
抗体組成物は、良質の医療に一致する様式で調合、投薬、および投与されるであろう。この文脈で考慮する因子としては、処置される特定の障害、処置される特定の哺乳類、個々の患者の臨床状態、障害の原因、薬剤の送達部位、投与方法、投与計画、および開業医に公知の他の因子が挙げられる。投与される抗体の治療的有効量は、このような考慮事項によって影響され、PRLR媒介疾患、状態または障害を予防、寛解、または処置するために、詳細には癌細胞を処置するために、最も詳細には腫瘍細胞転移を処置するために必要な最小量である。このような量は好ましくは、宿主に対して毒性である、または宿主を感染に著しくさらに感受性にする量より少ない。
抗体は必ずではないが、場合により、問題の障害を予防または処置するために現在使用される1つ以上の薬剤を用いて調合される。たとえば癌では、抗体は化学療法剤と併せて、または上述のようにADEPTで投与され得る。このような他の薬剤の有効量は、調合物に存在する抗体の量、疾患の種類、状態または障害または処置、および上で議論した他の因子によって変わる。これらは一般に、同じ投薬量および投薬経路で、またはこれまでに利用した投薬量の約1〜99%で使用される。
本発明の別の実施形態において、癌の処置のためを含めた、上述の疾患、障害または状態の処置に有用な材料を含有する製造品が提供される。製造品は容器およびラベルを含む。適切な容器としてはたとえば、ボトル、バイアル、注射器、および試験管が挙げられる。容器は、ガラスまたはプラスチックなどの各種の材料から形成され得る。容器は、状態を処置するために有効である組成物を保持し、滅菌アクセスポートを有し得る(たとえば容器は、皮下注射針によって穿刺できるストッパを有する静脈内液剤バッグまたはバイアルであり得る)。組成物中の活性剤は、本発明の抗体である。容器に添付または結び付けられたラベルは、組成物が選択の状態を処置するために使用されることを示す。製造品はさらに、製薬的に許容される緩衝液、たとえばリン酸緩衝生理食塩水、リンゲル液およびデキストロース液から成る第2の容器を含み得る。それは、他の緩衝液、希釈剤、フィルタ、針、注射器、および使用説明を含むパッケージ挿入物を含む、商業上またはユーザーの視点から望ましい他の材料をさらに含み得る。
標識化
一実施形態において、本発明のPRLR核酸、タンパク質および抗体が標識される。「標識される」とは本明細書では、化合物が、化合物の検出を可能にするために結合された少なくとも1つの元素、同位体または化学化合物を有することを意味する。一般に、標識は3つのクラスに分類される:a)放射性同位体または重同位体であり得る、同位体標識;b)抗体または抗原であり得る、免疫標識;およびc)有色染料または蛍光染料。標識は、PRLR核酸、タンパク質および抗体のいずれかの位置に包含され得る。たとえば、標識は、検出可能なシグナルを直接または間接的にどちらかで産生させ得るべきである。検出可能な部分は、3H、14C、32P、35S、または125Iなどの放射性同位体、フルオレセインイソチオシネート、ローダミンまたはルシフェリンなどの蛍光または化学発光化合物、あるいはたとえばアルカリホスファターゼ、ベータガラクトシダーゼまたはホースラディッシュペルオキシダーゼなどの酵素であり得る。Hunterら、Nature,144:945(1962);Davidら、Biochemistry,13:1014(1974);Painら、J.Immunol.Meth.,40:219(1981);およびNygren,J.Histochem.and Cytochem.,30:407(1982)によって記載された方法を含む、抗体を標識にコンジュゲートするための当分野で公知のいずれの方法も利用され得る。
癌表現型の検出
いったん発現され、必要ならば精製されると、PRLRタンパク質および核酸は多数の用途で使用される。1つの態様において、遺伝子の発現レベルは癌表現型における各種の細胞状態について決定される;すなわち正常組織および癌組織における(および一部の場合では、下で概説するように、予後に関連するリンパ腫の各種の重症度の変化に関して)遺伝子の発現レベルは、発現プロフィールを提供するために評価される。発生の特定の細胞状態または時点の発現プロフィールは本質的に、状態の「フィンガープリント」である;2つの状態がいずれかの特定の遺伝子を同様に発現させたとき、多数の遺伝子の評価は、細胞の状態に独自である遺伝子発現プロフィールの生成を可能にする。異なる状態での細胞の発現プロフィールを比較することによって、これらの状態のそれぞれにおいて(遺伝子のアップレギュレーションおよびダウンレギュレーションの両方を含む)どちらの遺伝子が重要であるかに関する情報が得られる。次に、診断が実施または確認され得る:特定の患者からの組織は、正常または癌組織の遺伝子発現プロフィールを有する。
「差次的発現」または等価語は、本明細書で使用するとき、細胞内および細胞間の遺伝子の時間的および/または細胞的な発現パターンの定性的相違はもちろんのこと、定量的相違の両方を指す。それゆえ、差次的に発現された遺伝子は、たとえば正常組織対癌組織における活性化および不活性化を含めて、その発現を定性的に変化させ得る。すなわち遺伝子は、別の状態に対する特定の状態において作動または遮断され得る。当業者に明白であるように、2つ以上の状態のいずれの比較を行うこともできる。このような定性的に制御された遺伝子は、状態または細胞タイプ内での発現パターンであって、1つのこのような状態または細胞タイプにおいて標準技法によって検出可能であるが、両方においては検出できない、状態または細胞タイプ内での発現パターンを示すであろう。あるいは、判定は、発現が上昇または下降されるという点で定量的である;すなわち、遺伝子の発現は、アップレギュレートされて転写量の増加を生じさせ、あるいはダウンレギュレートされて転写量の減少を生じさせるかのどちらかである。発現の相違の程度は、下に概説するように、たとえば参照により本明細書に明示的に組み入れられているAffymetrix GeneChip(登録商標)発現アレイ、Lockhart,Nature Biotechnology,14:1675−1680(1996)の使用によってなどの標準キャラクタリゼーション技法で定量するのに十分な大きさでさえあればよい。他の技法としては、限定されないが、定量的逆転写酵素PCR、ノザン解析およびRNase保護が挙げられる。上で概説したように、好ましくは、発現(すなわちアップレギュレーションまたはダウンレギュレーション)の変化は、少なくとも2倍、3倍、5倍、10倍、20倍、50倍、またはなお100倍あるいはそれ以上である。
当業者によって認識されるように、これは遺伝子転写、またはタンパク質レベルのどちらかでの評価によって行われ得る;すなわち、遺伝子発現の量は、遺伝子転写のDNAまたはRNA等価物に対して核酸プローブを使用して監視でき、遺伝子発現レベルの定量、ありは最終遺伝産物自体(タンパク質)は、たとえばPRLRタンパク質に対する抗体または標準イムノアッセイ(ELISAなど)あるいは質量分析アッセイ、2Dゲル電気泳動アッセイなどの他の技法の使用によって監視され得る。それゆえ、PRLR遺伝子に対応するタンパク質、すなわち特定の癌表現型において重要であると同定されたタンパク質は、その癌に特異的である診断試験において評価され得る。
実施形態において、遺伝子発現の監視が実施され、多数の遺伝子が同時に監視される。しかしながら、遺伝子プロフィールを作製するために、複数の遺伝子発現の監視が同様に実施され得る。あるいはこれらのアッセイは個別ベースで実施され得る。
一実施形態において、PRLR核酸プローブは、特定の細胞内のPRLR配列の検出および定量のために本明細書で概説するようにバイオチップに付着され得る。アッセイは当分野で公知であるように実施される。当業者によって認識されるように、いずれの数の異なるPRLR配列もプローブとして使用でき、単一の配列アッセイは複数の場合に使用され、本明細書に記載した複数の配列は他の実施形態で使用される。加えて、固相アッセイも記載されているが、いずれの数の溶液ベースのアッセイも同様に実施され得る。
実施形態において、固体および液体ベースアッセイの両方を使用して、正常組織と比較してアップレギュレートまたはダウンレギュレートされるPRLR配列を検出できる。PRLR配列が改変されているが、同じ発現プロフィールまたは改変プロフィールを示す例では、タンパク質は本明細書で概説するように検出されるであろう。
実施形態において、PRLRタンパク質をコードする核酸が検出される。PRLRタンパク質をコードするDNAまたはRNAが検出され得るが、PRLRタンパク質をコードするmRNAが検出される方法が特に興味深い。サンプル中のmRNAの存在は、PRLR遺伝子が転写されてmRNAを形成したことの表示であり、タンパク質が発現されることを示唆している。mRNAを検出するプローブは、mRNAを持つ塩基対に対して and 相補性であり、限定されないが、オリゴヌクレオチド、cDNAまたはRNAを含む、いずれのヌクレオチド/デオキシヌクレオチドであってもよい。プローブは、本明細書で定義するように、検出可能な標識も含有すべきである。1つの方法において、mRNAは、検査される核酸をナイロン膜などの固体支持体に固定化して、プローブをサンプルによってハイブリダイズした後に検出される。非特異性結合プローブを除去するための洗浄後に、標識が検出される。別の方法において、mRNAの検出はインサイチューで実施される。この方法では、透過処理された細胞または組織サンプルに検出可能な標識核酸プローブを、プローブが標的mRNAとハイブリダイズするのに十分な時間に亘って接触させる。非特異性結合プローブを除去するための洗浄後に、標識が検出される。たとえば、PRLRタンパク質をコードするmRNAに相補性であるジゴキシゲニン標識リボプローブ(RNAプローブ)は、ジゴキシゲニンに抗ジゴキシゲニン二次抗体を結合させることによって検出され、ニトロブルーテトラゾリウムおよび5−ブロモ−4−クロロ−3−インドリルホスフェートによって展開される。
本明細書に記載したタンパク質の3つのクラス(分泌、膜貫通または細胞内タンパク質)のいずれも、診断アッセイに使用され得る。PRLR配列を含有する、PRLRタンパク質、抗体、核酸、修飾タンパク質および細胞が診断アッセイに使用される。これは個々の遺伝子または対応するポリペプチドレベルで、あるいはアッセイのセットとして実施され得る。
本明細書で記載および定義するように、PRLRタンパク質は癌のマーカーとしての用途を見出している。推定癌組織または患者におけるこれらのタンパク質の検出は、癌の種類の判定または診断を可能にする。当業者に公知の多くの方法が癌の検出に用途を見出している。
抗体はPRLRタンパク質を検出するのに使用され得る。1つの方法は、タンパク質をサンプルまたは患者からゲル電気泳動によって分離する(典型的には、変性および還元タンパク質ゲル、しかし等電点電気泳動ゲルなどを含む、他のいずれの種類のゲルであってもよい)。タンパク質の分離後、PRLRタンパク質は、PRLRタンパク質に対して産生された抗体を用いた免疫ブロッティングによって検出される。免疫ブロッティングの方法は当業者に公知である。このような方法で使用する抗体は、上述のように標識され得る。
別の方法において、PRLRタンパク質に対する抗体は、インサイチュー撮像技法に用途を見出している。この方法では、細胞に(複数の)PRLRタンパク質に対する1つから多くの抗体を接触させる。非特異的抗体結合を除去するための洗浄後、1つまたは複数の抗体の存在が検出される。一実施形態において、抗体は検出可能な標識を含有する二次抗体を用いてインキュベートすることによって検出される。別の方法では、PRLRタンパク質に対する一次抗体は、検出可能な標識を含有する。別の方法では、複数の一次抗体のそれぞれ1つが別個の検出可能な標識を含有する。この方法は、複数のPRLRタンパク質の同時スクリーニングに特に用途を見出している。当業者によって認識されるように、多数の他の組織学的撮像技法が本発明で有用である。
標識は、異なる波長の放出を検出および識別する能力を有する蛍光光度計で検出され得る。加えて、方法では蛍光活性化細胞選別器(FACS)が使用され得る。
抗体は血液サンプルから癌を診断するのに使用され得る。上述したように、あるPRLRタンパク質は分泌/循環分子である。したがって血液サンプルは、分泌PRLRタンパク質の存在について調査または試験されるサンプルとして有用である。抗体は、当業者によって認識されるように、ELISA、免疫ブロッティング(ウェスタンブロッティング)、免疫沈降、BIACORE技術などを含む、上述のイムノアッセイ技法のいずれかによってPRLRタンパク質を検出するために使用され得る。
組織アレイへの標識PRLR核酸プローブのインサイチューハイブリダイゼーションが実施され得る。たとえば、癌組織および/または正常組織を含む組織サンプルのアレイが作製される。インサイチューハイブリダイゼーションは次に、当分野で公知であるように実施される。
個体と標準との間で発現フィンガープリントを比較するときに、当業者が予後と同様に診断を実施できることが理解される。診断を示す遺伝子が予後を示す遺伝子と異なり得ることがさらに理解される。
上記のように、PRLR配列を含有する、PRLRタンパク質、抗体、核酸、修飾タンパク質および細胞が予後アッセイに使用される。上のように、長期予後の点から、癌、特にリンパ腫、重症度に関連する遺伝子発現プロフィールが生成され得る。再度、これは好ましい遺伝子の使用によって、タンパク質または遺伝子レベルのどちらかで実施され得る。上述のように、PRLRプローブは、組織または患者におけるPRLR配列の検出および定量のためにバイオチップに付着される。アッセイは診断のために上述したように進行する。
PRLR遺伝子および発現産物に標的化された薬物のスクリーニング
本明細書に記載するcPRLR遺伝子配列のいずれも、薬物スクリーニングアッセイに使用され得る。PRLR遺伝子配列を含有するPRLRタンパク質、抗体、核酸、修飾タンパク質および細胞は、薬物スクリーニングアッセイで、または「遺伝子発現プロフィール」またはポリペプチドの発現プロフィールに対する薬物候補の効果を評価することによって使用される。1つの方法では、発現プロフィールは好ましくは、ハイスループットスクリーニング技法と併せて使用されて、候補因子による処置後の発現プロフィール遺伝子の監視を可能にする、Zlokarnik,ら、Science 279,84−8(1998),Heid,ら、Genome Res.,6:986−994(1996)。
別の方法では、未変性または修飾PRLRタンパク質を含有するPRLRタンパク質、抗体、核酸、修飾タンパク質および細胞がスクリーニングアッセイで使用される。すなわち、本発明は、癌表現型を調節する組成物をスクリーニングするための新規の方法を提供する。上述のように、これは遺伝子発現のモジュレータを、またはタンパク質活性のモジュレータをスクリーニングすることによって実施され得る。同様に、これは個々の遺伝子またはタンパク質レベルで、または「遺伝子発現プロフィール」に対する薬物候補の効果を評価することによって実施され得る。実施形態において、発現プロフィールは好ましくは、ハイスループットスクリーニング技法と併せて使用されて、候補因子による処置後の発現プロフィール遺伝子の監視を可能にする、Zlokarnik、同上を参照。
PRLR遺伝子発現に対する薬剤の効果を評価する各種のアッセイが実行され得る。実施形態において、アッセイは個々の遺伝子またはタンパク質レベルで実施され得る。すなわち、癌において異常に制御されたような特定の遺伝子を同定すると、候補生物活性剤は遺伝子の制御を調節するためにスクリーニングされ得る。「調節」はそれゆえ、遺伝子発現または活性の上昇および下降の両方を含む。調節の好ましい量は、正常組織対腫瘍組織における遺伝子発現の元の変化であって、少なくとも10%、好ましくは50%、さらに好ましくは100〜300%、およびある実施形態では300〜1000%以上の変化に依存する。それゆえ、遺伝子が腫瘍において正常組織と比較して4倍の上昇を示す場合、約4倍の下降が望ましい;腫瘍において正常組織と比較して10倍の下降が発現の10倍の上昇を与えるのは、候補因子が望ましいからなどである。あるいはPRLR配列が改変されているが、同じ発現プロフィールまたは改変プロフィールを示す場合、タンパク質は本明細書で概説するように検出されるであろう。
当業者によって認識されるように、これは遺伝子またはタンパク質レベルのどちらかでの評価によって実施され得る;すなわち、遺伝子発現の量は核酸プローブおよび遺伝子発現レベルの定量を使用して監視され得るか、あるいは遺伝産物自体のレベルがたとえばPRLRタンパク質に対する抗体の使用および標準イムノアッセイによって監視され得る。あるいは、タンパク質を用いた結合および生物活性アッセイが下で概説するように実施され得る。
実施形態において、多数の遺伝子が同時に監視される、すなわち発現プロフィールが作製されるが、複数のタンパク質発現監視も同様に実施され得る。
本実施形態において、PRLR核酸プローブは、特定の細胞内のPRLR配列の検出および定量のために本明細書で概説するようにバイオチップに付着される。アッセイは下でさらに記載する。
一般に、好ましい方法では、分析の前に候補生物活性剤が細胞に添加される。さらに、特定の種類の癌を調節し、PRLRタンパク質を調節し、PRLRタンパク質に結合し、またはPRLRタンパク質と抗体との間の結合を妨害する、候補生物活性剤を同定するためのスクリーンが供給される。
用語「候補生物活性剤」または「薬物候補」または文法的等価語は本明細書で使用されるように、癌表現型を直接または間接的のどちらかで改変できる、PRLRタンパク質に結合および/またはPRLRタンパク質の生物活性、または核酸配列およびタンパク質配列の両方を含むPRLR配列の発現を調節できる生物活性剤に対して試験される、いずれかの分子、たとえばタンパク質、オリゴペプチド、小型有機または無機分子、ポリサッカライド、ポリヌクレオチドなどを説明する。一実施形態において、候補因子はたとえば正常組織フィンガープリントに対するPRLR表現型を抑制する。同様に、候補因子は好ましくは、重篤なPRLR癌関連表現型を抑制する。一般に、各種の濃度に対する差次的応答を得るために、複数のアッセイ混合物は、異なる薬剤濃度で並行に処理される。典型的には、これらの濃度の1つは負の対照として、すなわちゼロ濃度または検出レベル未満として作用する。
好ましくは、候補因子はPRLRタンパク質の効果を中和するであろう。「中和する」とは、細胞に対して実質的に効果を有さず、それゆえ癌の重症度を低下させるか、または癌の発生を防止するために、タンパク質の活性が抑制されること、または対抗されることのどちらかを意味する。
候補因子は多くの化学クラスを含むが、典型的にはそれらは有機または無機分子、好ましくは100ダルトンを超え、約2500ダルトン未満の分子量を有する小型有機化合物である。好ましい小型分子は、2000Da未満、または1500Da未満、または1000Da未満、または500Da未満である。候補因子は、タンパク質との構造的相互作用、特に水素結合に必要な官能基を含み、典型的には、少なくともアミン、カルボニル、ヒドロキシルまたはカルボキシル基、好ましくは官能化学基の少なくとも2個を含む。候補因子は、上の官能基の1個以上によって置換された環式炭素または複素環式構造および/あるいは芳香族またはポリ芳香族構造を含むことが多い。候補因子は、ペプチド、サッカライド、脂肪酸、ステロイド、プリン、ピロリジン、その誘導体、構造類似物質または組合せを含む生体分子にも見出される。特に好ましいのはペプチドである。
候補因子は、合成または天然化合物のライブラリーを含む多岐に亘る源より得られる。たとえば、ランダム化オリゴヌクレオチドの発現を含む、多岐に亘る有機化合物および生体分子のランダムおよび定方向合成には多くの手段が利用できる。あるいは、細菌、真菌、植物および動物抽出物の形の天然化合物のライブラリーは、入手可能であるか、または直ちに産生される。加えて、天然または合成産生ライブラリーおよび化合物は、従来の化学的、物理的、および生化学的手段によってただちに修飾される。公知の薬理活性物質は構造類似物質を産生するために、定方向またはランダム化学修飾、たとえばアシル化、アルキル化、エステル化、またはアミド化に付すことができる。
一実施形態において、候補生物活性剤はタンパク質である。「タンパク質」とは本明細書では、少なくとも2個の共有結合的に付着されたアミノ酸を意味し、タンパク質、ポリペプチド、オリゴペプチドおよびペプチドを含む。タンパク質は、天然発生型アミノ酸およびペプチド結合、または合成ペプチド模倣構造より構成され得る。それゆえ、「アミノ酸」、または「ペプチド残基」は本明細書で使用するとき、天然発生型および合成アミノ酸の両方を意味する。たとえば、ホモフェニルアラニン、シトルリンおよびノルロイシンは本明細書の目的ではアミノ酸と見なされる。「アミノ酸」は、プロリンおよびヒドロキシプロリンなどのイミノ酸残基も含む。側鎖は、(R)または(S)配置のどちらかであり得る。1つの実施形態では、アミノ酸は(S)またはL−配置である。非天然発生型側鎖が使用される場合、非アミノ酸置換基がたとえばインビボでの分解を防止または遅延するために使用され得る。
実施形態において、候補生物活性剤は、天然発生型タンパク質または天然発生型タンパク質の断片である。それゆえ、たとえば、タンパク質を含有する細胞抽出物、あるいはタンパク質細胞抽出物のランダムまたは定方向消化物が使用され得る。このようにして、本発明の方法でスクリーングするための原核および真核タンパク質のライブラリーが作製され得る。本実施形態で特に好ましいのは、細菌、真菌、ウィルス、および哺乳類のライブラリーであり、後者が好ましく、ヒトタンパク質が特に好ましい。
別の実施形態において、候補生物活性剤は、約5〜約30アミノ酸のペプチドであり、約5〜約20アミノ酸が好ましく、約7〜約15が特に好ましい。ペプチドは、上で概説したような天然発生型タンパク質の消化物、または「バイアスされた」ランダムペプチドであり得る。「ランダム化」または文法的等価語は本明細書で、各核酸およびペプチドがそれぞれ本質的にランダムなヌクレオチドおよびアミノ酸より成ることを意味する。一般にこれらのランダムペプチド(または後述するように核酸)は化学的に合成されるので、それらはヌクレオチドまたはアミノ酸をいずれかの位置に組み入れることができる。合成プロセスは、ランダム化タンパク質または核酸を産生させて、配列の長さに亘って考えられる組合せのすべてまたは大半の形成を可能にして、それゆえランダム化候補生物活性タンパク質薬剤のライブラリーを形成させるために設計され得る。
一実施形態において、ライブラリーは完全にランダム化され、いずれの位置にも配列優先性または定常部はない。実施形態において、ライブラリーはバイアスされる。すなわち、配列内のある位置は一定のままであるか、制限数の可能性から選択される。たとえば、一実施形態において、核酸結合ドメインの作製、システインの作製に向けて、SH−3ドメインではプロリンを、ホスホリル化部位などではセリン、トレオニン、チロシンまたはヒスチジンを、あるいはプリンなどに架橋するために、ヌクレオチドまたはアミノ酸残基は、たとえば疎水性アミノ酸、親水性残基、立体的にバイアスされた(小型または大型のどちらか)残基の定義されたクラス内でランダム化される。
一実施形態において、候補生物活性剤は核酸である。タンパク質について一般に上述したように、核酸候補生物活性剤は天然発生型核酸、ランダム核酸、または「バイアスされた」ランダム核酸であり得る。別の実施形態において、候補生物活性剤は有機化学部分であり、多岐に亘るそれは文献で入手できる。
PRLR遺伝子の発現プロフィールの改変を試験するアッセイでは、候補因子が添加され、細胞がある期間に亘ってインキュベートされた後に、分析される標的配列を含有する核酸サンプルが調製される。標的配列は既知の技法(たとえば上述のようにRNAから標識cDNAに変換される)を使用して調製され、適切なマイクロアレイに添加される。たとえば、ヌクレオシドに共有結合的に付着された標識を用いたインビトロでの逆転写が実施される。一般に核酸は、本明細書で定義するような標識によって、特にビオチン−FITCまたはPE、Cy3およびCy5によって標識される。
当業者によって認識されるように、これらのアッセイは直接ハイブリダイゼーションアッセイであり得るか、またはそのすべてが参照により本明細書に明示的に組み入れられている米国特許第5,681,702号、第5,597,909号、第5,545,730号、第5,594,117号、第5,591,584号、第5,571,670号、第5,580,731号、第5,571,670号、第5,591,584号、第5,624,802号、第5,635,352号、第5,594,118号、第5,359,100号、第5,124,246号および第5,681,697号に一般に概説されているように、複数のプローブの使用を含む「サンドイッチアッセイ」を含み得る。本実施形態において、一般に、標的核酸は上で概説されたように調製され、次に複数の核酸プローブを含むバイオチップに、ハイブリダイゼーション複合体の形成を可能にする条件下で添加される。
本発明では、上で概説したように高い、中程度の、および低いストリンジェントな条件下を含む、各種のハイブリダイゼーション条件が使用され得る。アッセイは一般に、標的の存在下のみで標識プローブハイブリダイゼーション複合体の形成を可能にするストリンジェントな条件下で処理される。厳密性は、限定されないが、温度、ホルムアミド濃度、塩濃度、カオトロピック塩濃度、pH、有機溶媒濃度などを含む熱力学変数である工程パラメータを改変することによって制御され得る。これらのパラメータも、一般に米国特許第5,681,697号に記載されているように、非特異性結合を制御するために使用され得る。それゆえ非特異性結合を減少させるために、より高い厳密条件である工程を実施することが所望であり得る。
本明細書で概説する反応は、当業者によって認識されるように、各種の方法で達成され得る。反応の成分は、同時に、またはいずれかの順序で連続して添加され、下で概説する形態で示される。加えて反応は、アッセイにおける各種の他の試薬を含み得る。これらとしては、最適なハイブリダイゼーションおよび検出を促進して、および/または非特異性またはバックグラウンドの相互作用を低下させるために使用され得る、塩、緩衝剤、中性タンパク質、たとえばアルブミン、洗浄剤などの試薬が挙げられる。またそうでなければアッセイの効率を改善する試薬、たとえばプロテアーゼインヒビタ、ヌクレアーゼインヒビタ、抗菌剤が、サンプル調製方法および標的の純度に応じて使用され得る。加えて、固相または溶液ベースの(すなわち動力学的PCR)どちらかのアッセイが使用され得る。
いったんアッセイが行われると、データが分析されて、発現レベルと個々の遺伝子の状態間の発現レベルの変化が決定されて、遺伝子発現プロフィールが形成される。
実施形態において、診断および予後用途に関して、いずれかの1つの状態において重要な差次的に発現された遺伝子または変異された遺伝子が同定されると、PRLR遺伝子の発現の改変について個別に試験するためにスクリーンが実施され得る。すなわち、単一の遺伝子の発現の制御の調節のためのスクリーニングが実施され得る。それゆえ、たとえば、2つの状態の間でその存在または不存在が独自である標的遺伝子の場合、スクリーニングは標的遺伝子発現のモジュレータについて実施される。
加えて、候補因子に応答して誘発される新規な遺伝子についてスクリーンが実施され得る。正常組織からの遺伝子の発現を模倣するために、正常な発現パターンにつながるPRLR発現パターンを抑制する、またはPRLR遺伝子発現プロフィールを調節するその能力に基づいて候補因子を同定した後に、該薬剤に応答して特異的に調節される遺伝子を同定するために上述のスクリーンが実施され得る。正常組織と薬剤処置組織との間の発現プロフィールの比較は、正常組織または癌組織では発現されないが、薬剤処置組織で発現される遺伝子を明らかにする。これらの薬剤特異性配列は、PRLR遺伝子またはタンパク質について本明細書に記載する方法のいずれかによって同定および使用され得る。特にこれらの配列およびそれらがコードするタンパク質は、薬剤処置細胞をマーキングおよび同定するのに用途を見出している。加えて、抗体は薬剤誘発タンパク質に対して産生され、処置された組織サンプルに新規な治療剤を標的化するために使用され得る。
それゆえ、一実施形態において、候補因子は、関連するPRLR発現プロフィールを有する癌関連細胞の集合に投与される。「投与」または「接触」とは本明細書では、摂取および細胞内作用によって、または細胞表面での作用によってのいずれにしても、薬剤を細胞に作用させるような方法で候補因子が細胞に添加されることを意味する。ある実施形態において、タンパク質候補因子(すなわちペプチド)をコードする核酸は、レトロウィルス構築物などのウィルス性構築物内に挿入されて、ペプチド薬剤の発現が実現されるように細胞内に添加される;参照により本明細書に明示的に組み入れられている、PCT US97/01019を参照。
いったん候補因子が細胞に投与されると、細胞は所望ならば洗浄されて、好ましい生理学的条件下である期間に亘ってインキュベートされる。細胞は次に収集されて、本明細書で概説するように新たな遺伝子発現プロフィールが産生される。
それゆえ、たとえば、癌組織は、PRLR関連表現型を低下または抑制させる薬剤についてスクリーニングされ得る。発現プロフィールの少なくとも1つの遺伝子の変化は、薬剤がPRLR活性に効果を有することを示す。PRLR関連表現型に関するそのようなサインを定義することによって、表現型を改変する新たな薬物に対するスクリーンが考案され得る。この手法において、薬物標的は公知である必要はなく、元の発現スクリーニングプラットフォームに示される必要はなく、標的タンパク質の転写のレベルを変更する必要もない。
実施形態において、上で概説したように、スクリーンは個々の遺伝子および遺伝産物(タンパク質)に対して実施され得る。すなわち、特定の状態において重要であるような特定の差次的に発現された遺伝子が同定されると、遺伝子または遺伝産物自体のどちらかの発現のモジュレータのスクリーニングが実施され得る。PRLRタンパク質は断片であるか、あるいは上に挙げたPRLR遺伝子によってコードされる断片に対する全長タンパク質であり得る。別の実施形態において、配列は、上でさらに記載したような配列変異体である。
好ましくは、PRLRタンパク質は長さが約14〜24アミノ酸の断片である。さらに好ましくは、断片は溶解性断片である。好ましくは、断片は非膜貫通領域を含む。実施形態において、断片は溶解性を補助するためにN末端Cysを有する。一実施形態において、断片のC末端は遊離酸として保持され、N末端はたとえばシステインへのカップリングを補助するための遊離アミンである。
一実施形態において、PRLRタンパク質は本明細書で議論するような免疫原にコンジュゲートされる。一実施形態において、PRLRタンパク質はBSAにコンジュゲートされる。
実施形態において、PRLR遺伝子の発現産物の生物機能を改変するためにスクリーニングが実施される。再度、特定の状態における遺伝子の重要性を確認したら、遺伝産物を結合する、および/または遺伝産物の生物活性を調節する薬剤のスクリーニングが、下でさらに十分に概説するように実施され得る。
実施形態において、スクリーンは、PRLRタンパク質に結合し得る候補因子を最初に発見するように設計され、次にこれらの薬剤は、PRLRタンパク質活性および癌表現型を調節する候補因子の能力を評価するアッセイで使用され得る。それゆえ当業者によって認識されるように、実施され得る多数の異なるアッセイ;結合アッセイおよび活性アッセイがある。
実施形態において、結合アッセイが実施される。一般に、精製または単離遺伝産物が使用される;すなわち1つ以上のPRLR核酸の遺伝産物が作製される。一般にこれは当業界で公知であるように実施される。たとえば、タンパク質遺伝産物に対する抗体が産生され、存在するタンパク質の量を決定するために標準イムノアッセイが実施される。あるいは、PRLRタンパク質を含む細胞がアッセイで使用され得る。
それゆえ、実施形態において、方法は、PRLRタンパク質および候補生物活性剤を結合させる工程と、PRLRタンパク質への候補因子の結合を判定する工程とを含む。ある実施形態は、ヒトまたはマウスPRLRタンパク質を利用するが、他の哺乳類タンパク質も、たとえばヒト疾患の動物モデルの開発のために使用され得る。ある実施形態において、本明細書で概説されるように、変異体または誘導体PRLRタンパク質が使用され得る。
一般に、本明細書の方法の一実施形態において、PRLRタンパク質または候補因子は、単離されたサンプルの収容エリア(たとえばマイクロタイタープレート、アレイなど)を有する不溶性支持体に非拡散的に結合される。不溶性支持体は、組成物が結合され得るいずれの組成から成ってもよく、溶解性物質からただちに分離され、そうでなければスクリーニング方法全体と適合性であり得る。このような支持体の表面は固体または多孔性であり、いずれの好都合な形状であってもよい。適切な不溶性支持体の例としては、マイクロタイタープレート、アレイ、膜およびビーズを含む。これらは、典型的には、ガラス、プラスチック(たとえばポリスチレン)、ポリサッカライド、ナイロンまたはニトロセルロース、テフロン(登録商標)などから成る。マイクロタイタープレートおよびアレイは、少量の試薬およびサンプルを使用して、多数のアッセイが同時に実施可能であるため、特に好都合である。
組成物の結合の特定の方式は、それが試薬および本発明の方法全体と適合性であり、組成物の活性を維持して、非拡散性である限り、重要ではない。結合の好ましい方法としては、(タンパク質が支持体に結合されるときに、リガンド結合部位または活性化配列のどちらかを立体的に遮断しない)抗体の使用、「粘着性」またはイオン性支持体への直接結合、化学架橋、タンパク質または薬剤の表面上での合成が挙げられる。タンパク質または薬剤の結合の後に、過剰な未結合物質が洗浄により除去される。サンプル収容エリアは次に、ウシ血清アルブミン(BSA)、カゼインあるいは他の無害なタンパク質または他の部分を用いたインキュベーションによって遮断され得る。
実施形態において、PRLRタンパク質は支持体に結合され、候補生物活性剤がアッセイに添加される。あるいは候補因子が支持体に結合され、PRLRタンパク質が添加される。新規な結合剤としては、特異性抗体、化学ライブラリーのスクリーンで同定された非天然結合剤またはペプチド類似物質が挙げられる。特に興味深いのは、ヒト細胞に対して低い毒性を有する薬剤に対するスクリーニングアッセイである。この目的で、標識インビトロタンパク質−タンパク質結合アッセイ、電気泳動移動度シフトアッセイ、タンパク質結合に関するイムノアッセイ、機能アッセイ(ホスホリル化アッセイなど)などを含む、多岐に亘るアッセイが使用され得る。
PRLRタンパク質への候補生物活性剤の結合の判定は、多数の方法で実施され得る。一実施形態において、候補生物活性剤が標識され、結合は直接判定される。たとえば、これは、PRLRタンパク質の全部または一部を固体担体に付着させる工程と、標識候補因子(たとえば蛍光標識)を添加する工程と、過剰な試薬を洗い流す工程と、標識が固体担体に存在するかどうかを判定する工程とによって実施され得る。当分野で公知であるような各種の遮断および洗浄工程が利用され得る。
ある実施形態において、成分の1つのみが標識される。たとえば、タンパク質(またはタンパク質候補因子)は、125Iを使用してチロシン位置で、またはフルオロフォアを用いて標識され得る。あるいは1を超える成分に、たとえばタンパク質には125Iを、候補因子にフルオロフォアを使用して、異なる標識によって標識され得る。
実施形態において、候補生物活性剤の結合は、競合結合アッセイの使用によって判定される。本実施形態において、競合物は標的分子(すなわちPRLRタンパク質)に結合することが公知である結合部分、たとえば抗体、ペプチド、結合パートナー、リガンドなどである。ある状況下では、生物活性剤と結合部分との間のような競合結合があり、結合部分が生物活性剤に置き換わる。
一実施形態において、候補生物活性剤は標識されている。候補生物活性剤、または競合物、あるいは両方のいずれかは、最初にタンパク質に、存在する場合には結合を可能にするのに十分な時間に亘って添加される。インキュベーションは、最適な活性を促進するいずれかの温度、典型的には、4〜40℃で実施され得る。インキュベーション期間は最適活性のために選択されるが、迅速なハイスループットスクリーニングを促進するためにも最適化され得る。典型的には、0.1〜1時間が十分であろう。過剰な試薬は一般に除去されるか、洗い流される。次に第2の成分が添加され、結合を示すために標識成分の存在または不存在が追跡される。
実施形態において、競合物が最初に添加され、候補生物活性剤が続く。競合物の交換は、候補生物活性剤がPRLRタンパク質へ結合しており、それゆえPRLRタンパク質の活性への結合すること、そして潜在的にPRLRタンパク質の活性を調節することが可能であることの表示である。本実施形態では、どちらかの成分が標識され得る。それゆえ、たとえば、競合物が標識される場合、洗浄溶液中の標識の存在は薬剤による交換を示す。あるいは、候補生物活性剤が標識される場合、支持体での標識の存在が交換を示す。
代わりの実施形態において、候補生物活性剤が最初に添加され、インキュベーションおよび洗浄を伴い、競合物が続く。競合物による結合の不存在は、生物活性剤がPRLRタンパク質により高い親和性で結合していることを示すことができる。それゆえ、候補生物活性剤が標識される場合、支持体上の標識の存在は、競合物結合の欠如と相まって、候補因子がPRLRタンパク質に結合できることを示すことができる。
実施形態において、該方法は、PRLRタンパク質の活性を調節できる生物活性剤を同定するための差次的スクリーニングを含む。本実施形態において、該方法はPRLRタンパク質および第1サンプル中の競合物を結合させる工程を含む。第2サンプルは、候補生物活性剤、PRLRタンパク質および競合物を含み得る。競合物の結合は両方のサンプルについて判定され、2つのサンプル間の結合の変化、または相違は、PRLRタンパク質に結合可能であり、その活性を潜在的に調節できる薬剤の存在を示す。すなわち、競合物の結合が第1サンプルと比較して第2サンプルで異なる場合、薬剤はPRLRタンパク質に結合可能である。
あるいは、実施形態は、未変性PRLRタンパク質に結合するが、修飾PRLRタンパク質には結合できない薬物候補を同定するために差次的スクリーニングを利用する。PRLRタンパク質の構造はモデル化され、その部位と相互作用する薬剤を合成するための合理的な薬物設計で使用され得る。PRLR生物活性に影響する薬物候補は、タンパク質の活性を上昇または下降させる能力について薬物をスクリーニングすることによっても同定される。
アッセイでは正の対照および負の対照が使用され得る。統計的に有意な結果を得るために、好ましくはすべての対照および試験サンプルは少なくとも3通り実施される。すべてのサンプルのインキュベーションは、タンパク質への薬剤の結合に十分な時間に亘る。インキュベーションの後、すべてのサンプルは非特異性結合物質を含まないように洗浄され、結合された、一般に標識された薬剤の量が決定される。たとえば、放射性標識が利用される場合、結合された化合物の量を決定するためにサンプルはシンチレーションカウンタでカウントすることができる。
各種の他の試薬がスクリーニングアッセイに含まれ得る。これらとしては、最適なタンパク質−タンパク質結合および検出を促進して、および/または非特異性またはバックグラウンドの相互作用を低下させるために使用され得る、塩、中性タンパク質、たとえばアルブミン、洗浄剤などの試薬が挙げられる。またそうでなければアッセイの効率を改善する試薬、たとえばプロテアーゼインヒビタ、ヌクレアーゼインヒビタ、抗菌剤などが使用され得る。成分の混合物は、必要な結合を与えるいずれの順序でも添加され得る。
PRLRタンパク質の活性を調節する薬剤のスクリーニングも実施され得る。実施形態において、PRLRタンパク質の活性を調節できる生物活性剤をスクリーニングする方法は、上述のように候補生物活性剤をPRLRタンパク質に添加する工程と、PRLRタンパク質の生物活性の改変を判定する工程とを含む。「PRLRタンパク質の活性を調節すること」は、活性の上昇、活性の下降、または存在する活性のタイプまたは種類の変化を含む。それゆえ、本実施形態において、候補因子はPRLRタンパク質に結合する(このことは必要ではないが)と共に、本明細書で定義するようなその生物または生化学活性を改変するべきである。該方法は、一般に上で概説したようなインビトロでのスクリーニング方法と、PRLRタンパク質の存在、分布、活性または量の改変のための細胞のインビボでのスクリーニングとの両方を含む。
それゆえ、本実施形態において、該方法は、PRLRサンプルと候補生物活性剤とを結合させる工程と、PRLR活性に対する効果を評価する工程とを含む。「PRLR活性」または文法的等価語とは本明細書では、限定されないが、好ましくはリンパ組織における細胞分裂、細胞増殖、腫瘍成長および細胞の形質転換を含む腫瘍形成におけるその役割を含む、PRLRタンパク質の生物活性の1つを意味する。一実施形態において、PRLR活性は、上で確認したようなPRLR遺伝子から由来する核酸によってコードされたタンパク質の、またはタンパク質による活性を含む。PRLR活性のインヒビタは、いずれか1つ以上のPRLR活性の抑制である。
一実施形態において、PRLRタンパク質の活性は上昇する;別の実施形態において、PRLRタンパク質の活性は下降する。それゆえ、ある実施形態ではアンタゴニストである生物活性剤が好ましく、他の実施形態ではアゴニストである生物活性剤が好ましい。
一実施形態において、本発明は、PRLRタンパク質の活性を調節できる生物活性剤をスクリーニングする方法を提供する。該方法は、上で定義したような候補生物活性剤を、PRLRタンパク質を含む細胞に添加する工程を含む。好ましい細胞タイプは、ほぼいずれの細胞も含む。細胞は、PRLRタンパク質をコードする組換え核酸を含有する。一実施形態において、候補因子のライブラリーは複数の細胞に対して試験される。
一態様において、アッセイは、生理学的シグナル、たとえばホルモン、抗体、ペプチド、抗原、サイトカイン、増殖因子、活動電位、化学療法剤、放射線、発癌、または他の細胞(すなわち細胞−細胞接触)を含む薬理作用物質の存在または不存在あるいは曝露の前または後で評価される。他の例において、判定は細胞周期プロセスの異なるステージにて判定される。
このようにして、生物活性剤は同定される。薬理活性を備えた化合物は、PRLRタンパク質の活性を上昇または妨害できる。
癌の診断および処置
癌細胞分裂を抑制する方法が発明により提供される。別の実施形態において、腫瘍成長を抑制する方法が提供される。さらなる実施形態において、癌を持つ細胞または個体を処置する方法が提供される。
方法は、癌インヒビタの投与を含み得る。特定の実施形態において、癌インヒビタは、アンチセンス分子、製薬組成物、治療剤または小型分子、あるいはモノクローナル、ポリクローナル、キメラまたはヒト化抗体である。特定の実施形態において、治療剤は抗体、好ましくはモノクローナル抗体と結合される。
個体での癌細胞の検出または診断の方法も提供される。特定の実施形態において、診断/検出剤は、本発明によるPRLRタンパク質に優先的に結合する小型分子である。一実施形態において、診断/検出剤は、抗体、好ましくはモノクローナル抗体で、好ましくは検出可能な薬剤に連結されている。
本発明の他の実施形態において、動物モデルおよびトランスジェニック動物が提供され、それらは癌、特にリンパ腫および癌種の動物モデルを発生させるのに用途を見出している。
(a)アンチセンス分子
使用される癌インヒビタは、アンチセンス分子であり得る。アンチセンス分子は本明細書で使用するように、癌分子の標的mRNA(センス)またはDNA(アンチセンス)配列に結合できる一本鎖核酸配列(RNAまたはDNAのどちらか)を含むアンチセンスまたはセンスオリゴヌクレオチドを含む。本発明によるアンチセンスまたはセンスオリゴヌクレオチドは、一般に少なくとも14ヌクレオチドの、好ましくは約14〜30ヌクレオチドの断片を含む。所与のタンパク質をコードするcDNA配列に基づいてアンチセンスまたはセンスオリゴヌクレオチドを誘導する能力は、たとえばStein and Cohen,Cancer Res.48:2659,(1988)およびvan der Krolら、BioTechniques 6:958,(1988)に記載されている。
アンチセンス分子は、修飾または非修飾RNA、DNA、あるいは混合ポリマーオリゴヌクレオチドであり得る。これらの分子機能はマッチング配列に特異的に結合することによって、立体遮断またはRNase H酵素の活性化のどちらかにより、ペプチド合成の抑制を引き起こす(Wu−Pong,Nov 1994,BioPharm,20−33)。アンチセンス分子は、RNA処理または核の細胞質内への輸送を妨害することによっても、タンパク質合成を改変し得る(Mukhopadhyay & Roth,1996,Crit.Rev.in Oncogenesis 7,151−190)。加えて、一本鎖DNAのRNAへの結合は、ヘテロ二本鎖のヌクレアーゼ媒介分解を引き起こし得る(Wu−Pong,同上)。RNase Hの基質として作用することがこのようにずっと示されてきた主鎖修飾DNA化学的性質は、ホスホロチオエート、ホスホロジチオエート、ボロントリフルオリダート、および2’−アラビノおよび2’−フルオロアラビノ含有オリゴヌクレオチドである。
アンチセンス分子は、WO91/04753に記載されているようにリガンド結合分子とのコンジュゲートの形成により、標的ヌクレオチド配列を含有する細胞内に導入され得る。適切なリガンド結合分子としては、限定されないが、細胞表面レセプタ、増殖因子、他のサイトカイン、または細胞表面レセプタに結合する他のリガンドを含む。好ましくは、リガンド結合分子のコンジュゲーションは、リガンド結合分子がその対応する分子またはレセプタに結合する能力、あるいはセンスまたはアンチセンスオリゴヌクレオチドまたはそのコンジュゲート版の細胞内への進入を遮断する能力を実質的に妨害しない。あるいは、センスまたはアンチセンスオリゴヌクレオチドは、WO90/10448に記載されているようなオリゴヌクレオチド−脂質複合体の形成により、標的核酸配列を含有する細胞内に導入され得る。処置の方法に加えて、アンチセンス分子またはノックアウトおよびノックインモデルの使用も上述のようなスクリーニングアッセイで使用され得ることが理解される。
(b)RNA干渉
RNA干渉は、短干渉RNA(siRNA)によって媒介される動物における、配列特異性転写後遺伝子サイレンシングのプロセスを指す(Fireら、Nature,391,806(1998))。植物での対応するプロセスは、転写後遺伝子サイレンシングまたはRNAサイレンシングと呼ばれ、真菌類ではクエリング(quelling)とも呼ばれる。細胞でのdsRNAの存在は、まだ十分に特徴付けられていない機構を通じてRNAi応答を誘発する。この機構は、リボヌクレアーゼLによるmRNAの非特異性開裂を生じるタンパク質キナーゼPKRおよび2’,5’−オリゴアデニレートシンターゼのdsRNA介在活性化から生じるインターフェロン応答とは異なるように思われる(Sharp,P.A.,RNA interference−2001,Genes & Development 15:485−490(2001)に概説)
小型干渉RNA(siRNA)は、RNA干渉(RNAi)として公知のプロセスを通じて培養された哺乳類細胞における遺伝子の発現を抑制するように設計された、強力な配列特異性試薬である。Elbashir,S.M.ら、Nature 411:494−498(2001);Caplen,NJ.ら、Proc.Natl.Acad.Sci.USA 98:9742−9747(2001);Harborth,J.ら、J. Cell Sci.114:4557−4565(2001)。用語「短干渉RNA」または「siRNA」は、RNA干渉「RNAi」が可能である二本鎖核酸分子を指す(Kreutzerら、WO00/44895;Zernicka−Goetzら、WO01/36646;Fire,WO99/32619;Mello and Fire,WO01/29058を参照)。本明細書で使用するとき、siRNA分子はRNA分子に限定されるが、化学修飾ヌクレオチドおよび非ヌクレオチドもさらに含む。siRNA遺伝子ターゲッティング実験は、細胞内への過渡的なsiRNA転移によって実施されている(リポソーム介在トランスフェクション、電気穿孔、または微量注入などの方法によって達成)。
siRNAの分子は21〜23ヌクレオチドRNAであり、特徴的な2〜3ヌクレオチド3’突出端は、RNAiを通常開始する長二本鎖RNA(dsRNA)のRNase III処理産物に似ている。細胞内に導入されるとき、それらはエンドヌクレアーゼ複合体(RNA誘発サイレンシング複合体)のまだ同定されていないタンパク質と結集して、これは次に標的mRNAの開裂を誘導する。標的mRNAの分解の結果として、対応するタンパク質産物の抑制を特徴とする特異性表現型を持つ細胞が得られる。これまでのアンチセンス分子と比較したsiRNAの小さいサイズは、哺乳類細胞に存在するdsRNA誘発型インターフェロン系の活性化を防止する。これは、体細胞内の30塩基対を超えるdsRNAによって通常産生される非特異性表現型を回避する。
小型RNA分子の細胞内転写は、siRNAテンプレートを、通常は小型核RNA(snRNA)U6またはヒトRNase P RNA H1をコードするRNAポリメラーゼIII(Pol III)転写単位内にクローニングすることによって達成される。siRNAを発現させるために2つの手法が開発されている:第1に、siRNA二本鎖を構成するセンスおよびアンチセンス鎖は個々のプロモータによって転写される(Lee,N.S.ら、Nat.Biotechnol.20,500−505(2002);Miyagishi,M.& Taira,K.Nat.Biotechnol.20,497−500(2002).)、第2に、siRNAは、細胞内処理の後にsiRNAを生じさせる折り畳みステムループ構造として発現される(Paul,C.P.ら、Nat.Biotechnol.20:505−508(2002))。導入されたDNAテンプレートからのsiRNAの内在性発現は、外来siRNA送達のある制限、特に表現型の過渡的消失を克服すると考えられる。U6およびH1 RNAプロモータは、Pol IIIプロモータのタイプIIIクラスのメンバーである。(Paule,M.R.& White,RJ.Nucleic Acids Res.28,1283−1298(2000))。
センスおよびアンチセンスsiRNAの同時発現は、標的遺伝子のサイレンシングを媒介するのに対して、センスまたはアンチセンスsiRNAの発現は単独では標的遺伝子発現に大幅な影響を及ぼさない。合成siRNAではなくプラスミドDNAのトランスフェクションは、RNase汚染の危険および化学合成siRNAまたはsiRNA転写キットのコストを考慮すると、有利であると思われ得る。siRNAの安定な発現は、新たな遺伝子治療用途、たとえば持続性ウィルス感染の処置を可能にする。siRNAと高い特異性を考慮して、該手法は、残存する野生種対立遺伝子を改変せずに、点突然変異との疾患由来転写、たとえばRASまたはTP53発癌遺伝子転写のターゲッティングも可能にする。最後に、各種のゲノムのハイスループット配列解析によって、DNAベース方法は、とりわけ小型アレイベース表現型スクリーンと組合せたときに、自動化ゲノム規模の機能消失表現型解析の費用効率的な代替手段でもあり得る。(Ziauddin,J.&Sabatini,D.M.Nature 411:107−110(2001))。
細胞での長dsRNAの存在は、ダイサーと呼ばれるリボヌクレアーゼIII酵素の活性を刺激する。ダイサーは、dsRNAの、短干渉RNA(siRNA)として公知であるdsRNAの短片への処理に関与する(Bersteinら、2001,Nature,409:363(2001))。ダイサー活性に由来する短干渉RNAは、典型的には、長さが約21〜23ヌクレオチドであり、約19塩基対二本鎖を含む。ダイサーは、翻訳制御に関与している保存構造の前駆体RNAからの21および22ヌクレオチド小型一過性RNA(RNA)の切除にも関与している(Hutvagnerら、Science,293,834(2001))。RNAi応答は、siRNAと相同である配列を有する一本鎖RNAの開裂を媒介する、RNA誘発サイレンシング複合体(RISC)と一般に呼ばれる、siRNAを含有するエンドヌクレアーゼ複合体も特徴とする。標的RNAの開裂は、siRNA二本鎖のガイド配列に相補性である領域の中間で起こる(Elbashirら、Genes Dev.,15,188(2001))。
本発明は、PRLR配列に特異的にハイブリダイズできる配列を含む単離核酸分子を含む発現系を提供する。実施形態において、核酸分子はPRLRタンパク質の発現を抑制することができる。短RNAのベクターに向けた発現による、細胞内でのPRLR遺伝子発現の発現を抑制する方法であり、短RNAはそれ自体折り畳まれていてよく、PRLR mRNA配列同一性を有し、細胞内のPRLR遺伝子の、転写後遺伝子サイレンシング、またはRNA干渉(RNAi)を誘発できる二本鎖RNAを作製できる。別の方法において、PRLR遺伝子の転写後遺伝子サイレンシング、またはRNAiを誘発するために、PRLR mRNA配列同一性を有する短二本鎖RNAは細胞内に送達される。各種の実施形態において、核酸分子は少なくとも7mer、少なくとも10mer、または少なくとも20merである。さらなる実施形態において、配列は独自である。
(c)製薬組成物
本発明に含まれる製薬組成物は、活性剤として、本明細書で開示する本発明のポリペプチド、ポリヌクレオチド、アンチセンスオリゴヌクレオチド、または抗体を治療的有効量で含む。「有効量」とは、臨床結果を含む有利なまたは所望の結果に十分な量である。有効量は、1回以上の投与で投与され得る。この発明の目的では、アデノウィルスベクターの有効量は、疾患状態の進行を軽減、寛解、安定化、逆行、低速化または遅延するのに十分な量である。
組成物は、癌はもちろんのこと、原発性癌の転移も処置するために使用され得る。加えて、製薬組成物は、腫瘍を放射線または従来の化学療法に感作させるために、従来の癌処置方法と併せて使用され得る。「処置」、「処置すること」、「処置する」などの用語は本明細書で使用するとき、所望の薬理学的および/または生理学的効果を一般に指すために使用される。効果は、疾患またはその症状を完全または部分的に予防するという点で予防的であり得るか、および/または、疾患および/または疾患に起因する悪影響に対する部分的または完全な安定化または治癒の点で治療的であり得る。「処置」は本明細書で使用するとき、哺乳類、特にヒトにおける疾患のいずれの処置も対象とし、(a)疾患または症状が、疾患または症状の素因があり得るが、まだそれを有するとして診断されていない対象で発生するのを防止すること;(b)疾患症状を抑制すること、すなわちその発生を停止させること;または(c)疾患症状を軽減すること、すなわち疾患または症状の退行を引き起こすこと;を含む。
製薬組成物が差次的に発現されたポリヌクレオチドによってコードされた遺伝子産物に特異的に結合する抗体を含む場合、抗体は、処置部位への送達のための薬物に連結され得るか、または癌細胞、たとえば前立腺癌細胞を含む部位の撮像を容易にするために検出可能な標識に連結され得る。抗体を薬物および検出可能な標識に連結する方法は、検出可能な標識を使用して撮像する方法と同様に当分野で公知である。
本発明の目的で用語「患者」は、ヒトおよび他の動物、特に哺乳類、ならびに生物を指す。それゆえ該方法は、ヒト療法および獣医用途に利用できる。一実施形態において、患者は哺乳類であり、好ましくは、患者はヒトである。1つの標的患者集合は、癌、特に本明細書で挙げる特定の癌タイプの処置を現在受けているすべての患者を含む。これらの患者集合のサブセットは、過去6ヶ月に以前に処置されたこのタイプの癌の再発を経験した患者および過去6ヶ月に疾患の進行がある患者を含む。
用語「治療的有効量」用語は、本明細書で使用するとき、所望の疾患または症状を処置、寛解、または予防するための、あるいは検出可能な治療または予防効果を示すための治療剤の量を指す。効果は、たとえば化学マーカーまたは抗原レベルによって検出され得る。治療効果は、身体症状の減退、たとえば体温の低下を含み得る。対象の正確な有効量は、対象のサイズおよび健康状態、状態の性質および程度、投与のために選択された治療薬または治療薬の組合せによって変わるであろう。所与の状況のための有効量は、日常的な実験によって決定され、臨床医の判断の範囲内である。本発明の目的では、有効用量は一般に、それが投与される個体におおて本発明の組成物の約0.01mg/kg〜約5mg/kg、または約0.01mg/kg〜約50mg/kg、または約0.05mg/kg〜約10mg/kgであろう。
製薬組成物は、製薬的に許容される担体も含有し得る。用語「製薬的に許容される担体」は、治療剤、たとえば抗体またはポリペプチド、遺伝子、および他の治療剤の投与のための担体を指す。該用語は、組成物を摂取する個体に有害である抗体の産生をそれ自体は誘発せず、過度の毒性なしに投与され得るいずれの製薬担体も指す。適切な担体は、大型で低速代謝される巨大分子、たとえばタンパク質、ポリサッカライド、ポリ乳酸、ポリグリコール酸、ポリマーアミノ酸、アミノ酸コポリマー、および不活性ウィルス粒子であり得る。そのような担体は当業者に公知である。治療用組成物中の製薬的に許容される担体は、水、生理食塩水、グリセロールおよびエタノールなどの液体を含み得る。補助物質、たとえば湿潤剤または乳化剤、pH緩衝物質などもそのようなビヒクル中に存在し得る。典型的には、治療用組成物は、注射剤として、液体溶液または懸濁剤のどちらかとして調製される;注射前に液体ビヒクルへの溶解、または懸濁に適した固体形も調製され得る。リポソームは、製薬的に許容される担体の定義の範囲内に含まれる。製薬的に許容される塩、たとえばヒドロクロライド、ヒドロブロミド、ホスフェート、サルフェートなどの無機塩;アセテート、プロピオネート、マロネート、ベンゾエートなどの有機酸の塩も、製薬組成物中に存在し得る。製薬的に許容される賦形剤の完全な議論は、Remington:The Science and Practice of Pharmacy(1995)Alfonso Gennaro,Lippincott,Williams,& Wilkinsで入手できる。
製薬組成物は、各種の形で、たとえば顆粒剤、錠剤、丸剤、坐剤、カプセル剤、懸濁剤、軟膏、ローション剤などで調製され得る。経口または局所使用に適した製薬グレードの有機または無機担体および/または希釈剤は、治療活性化合物を含有する組成物を作製するために使用され得る。当分野で公知の希釈剤としては、水性媒体、植物および動物油脂が挙げられる。安定剤、湿潤剤および乳化剤、浸透圧を変化させるための塩および十分なpH値を確保するための緩衝剤、ならびに皮膚浸透促進剤は、助剤として使用され得る。
本発明の製薬組成物は、患者への投与に適した形のPRLRタンパク質を含む。一実施形態において、製薬組成物は、酸および塩基添加塩の両方を含むことを意図する、製薬的に許容される塩として存在するような水溶形である。「製薬的に許容される酸添加塩」は、塩酸、臭化水素酸、硫酸、硝酸、リン酸などの無機酸、および酢酸、プロピオン酸、グリコール酸、ピルビン酸、シュウ酸、マレイン酸、マロン酸、コハク酸、フマル酸、酒石酸、クエン酸、安息香酸、桂皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、p−トルエンスルホン酸、サリチル酸などの有機酸によって形成される、遊離塩基の生物的有効性を保持して、生物的にも、そうでなくても望ましくなくはない塩を指す。「製薬的に許容される塩基添加塩」としては、ナトリウム、カリウム、リチウム、アンモニウム、カルシウム、マグネシウム、鉄、亜鉛、銅、マンガン、アルミニウム塩などの無機塩基に由来するものが挙げられる。特に好ましいのは、アンモニウム、カリウム、ナトリウム、カルシウム、およびマグネシウム塩である。製薬的に許容される有機非毒性塩基に由来する塩としては、1級、2級、および3級アミン、天然発生型置換アミンを含む置換アミン、環式アミンおよび塩基性イオン交換樹脂、たとえばイソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、およびエタノールアミンが挙げられる。
製薬組成物は、次の:担体タンパク質、たとえば血清アルブミン;緩衝剤;充填剤、たとえばマクロ結晶性セルロース、ラクトース、トウモロコシおよび他のデンプン;結合剤;甘味料および他の調味料;着色剤;およびポリエチレングリコールの1つ以上も含み得る。添加剤は当分野で公知であり、各種の調合物で使用される。
所望の薬理活性を有する化合物は、上述したように宿主に生理学的に許容される担体中で投与され得る。製薬組成物は、限定されないが、静脈内、筋肉内、動脈内、髄内、髄腔内、脳室内、経皮(transdermal)または経皮(transcutaneous)用途(たとえばWO98/20734を参照)、皮下、腹腔内、鼻腔内、腸内、局所、舌下、腟内または直腸手段を含む各種の経路で投与され得る。導入の方式に応じて、化合物は各種の方法で調合され得る。治療用活性化合物の濃度は、約0.1〜100%wgt/volで変化し得る。いったん調合されると、発明により考慮される組成物は(1)対象に直接投与され得る(たとえばポリヌクレオチド、ポリペプチド、小型分子アゴニストまたはアンタゴニストなどとして);または(2)エキソビボで対象に由来する細胞へ送達される(エキソビボでの遺伝子治療と同様に)。組成物の直接送達は一般に、たとえば皮下、腹腔内、静脈内または筋肉内、腫瘍内などによる、あるいは組織の組織内空間への非経口注射によって達成されるであろう。投与の他の方式としては、経口および肺投与、坐剤、および経皮用途、針、ならびに遺伝子銃(powderject.comのワールドワイドウェブサイトを参照)またはハイポスプレーが挙げられる。投薬処置は、1回用量計画および複数回用量計画であり得る。
対象内への形質転換細胞のエキソビボ送達および再移植の方法は、当分野で公知であり、たとえばWO93/14778に記載されている。エキソビボ用途で有用な細胞の例としては、たとえば幹細胞、特に造血、リンパ細胞、マクロファージ、樹状細胞、または腫瘍細胞が挙げられる。一般に、エキソビボおよびインビトロ用途の両方への核酸の送達は、すべて当分野で公知の、たとえばデキストラン媒介トランスフェクション、カルシウムホスフェート沈殿、ポリブレン媒介トランスフェクション、プロトブラスト融合、電気穿孔、リポソームへのポリヌクレオチドのカプセル化、および核へのDNAの微量注入によって達成され得る。
本明細書に記載したPRLRポリヌクレオチドに対応する遺伝子の差次的発現が増殖性障害、たとえば新形成、異形成、および過形成に関連することがいったん見出されると、該障害は、提供されたポリヌクレオチド、対応するペプチドまたは他の対応する分子(たとえばアンチセンス、リボザイムなど)をベースとする治療剤の投与による処置に影響を受けやすくなり得る。他の実施形態において、該障害は、たとえば正常細胞と比較して癌性細胞において発現増加を有する遺伝子のコードされた遺伝子産物の機能のインヒビタ(アンタゴニスト)として、または癌性細胞において発現が減少する遺伝子産物のアゴニストとして(たとえば腫瘍抑制剤として作用する遺伝子産物の活性を促進するために)作用する小型分子薬物の投与による処置に影響を受けやすくなり得る。
本発明の製薬組成物の投与の用量および手段は、治療用組成物の特定の品質、患者の状態、年齢、および体重、疾患の進行、および他の関連因子に基づいて決定される。たとえば、ポリヌクレオチド治療用組成物剤の投与としては、注射を含む局所(local)または全身投与、経口投与、パーティクルガンまたはカテーテル処置投与、および局所(topical)投与が挙げられる。好ましくは、治療用ポリヌクレオチド組成物は、本明細書で開示するポリヌクレオチドの少なくとも12、22、25、30、または35隣接ntのポリヌクレオチドに操作可能に連結されたプロモータを含む発現構築物を含有する。治療用組成物を体内の特定の部位に直接投与するために、各種の方法が使用され得る。たとえば、小規模な転移病巣が発見され、治療的組成物は腫瘍体内の複数の異なる位置に数回注入される。あるいは腫瘍に供給する動脈が特定されて、組成物を腫瘍に直接送達するために、治療用組成物がそのような動脈に注入される。壊死中心を有する腫瘍は吸引されて、組成物は腫瘍の今や空の中心へ直接注入される。アンチセンス組成物は、たとえば組成物の局所施用によって、腫瘍の表面に直接投与される。X線撮像は、上の送達方法のいくつかで補助するために使用される。
アンチセンスポリヌクレオチド、サブゲノムポリヌクレオチド、または特定の組織に対する抗体を含有する治療用組成物の標的送達も使用され得る。レセプタ媒介DNA送達技法はたとえば、Findeisら、Trends Biotechnol.(1993)11:202;Chiouら、Gene Therapeutics:Methods And Applications Of Direct Gene Transfer (J.A.Wolff,ed.)(1994);Wuら、J.Biol.Chem.(1988)263:621;Wuら、J.Biol.Chem.(1994)269:542;Zenkeら、Proc.Natl.Acad.Sci.(USA)(1990)87:3655;Wuら、J.Biol.Chem.(1991)266:338に記載されている。ポリヌクレオチドを含有する治療用組成物は、遺伝子治療プロトコルの局所投与ではDNA約100ng〜約200mgの範囲で投与される。DNA約500ng〜約50mg、約1μg〜約2mg、約5μg〜約500μg、および約20μg〜約100μgの濃度範囲が遺伝子治療プロトコルの間に使用され得る。作用の方法(たとえばコードされた遺伝子産物のレベルを上昇させる、または抑制するための)ならびに形質転換および発現の有効性などの因子は、アンチセンスサブゲノムポリヌクレオチドの最終有効性に必要な投薬量に影響を及ぼし得る考慮事項である。より広い範囲の組織に対してより高い発現が所望である場合、より大量のアンチセンスサブゲノムポリヌクレオチドまたは投与の連続プロトコルで再投与された同じ量、またはたとえば腫瘍部位の別の隣接または近接組織部への複数回の投与が、明確な治療結果をもたらすために必要であり得る。あらゆる場合において、臨床試験での日常的な実験が最適な治療効果のための特定の範囲を決定するであろう。
本発明の治療用ポリヌクレオチドおよびポリペプチドは、遺伝子送達ビヒクルを使用して送達され得る。遺伝子送達ビヒクルは、ウィルスまたは非ウィルス起源でありうる(一般にJolly,Cancer Gene Therapy(1994)1:51;Kimura,Human Gene Therapy(1994)5:845;Connelly,Human Gene Therapy(1995)1:185;and Kaplitt,Nature Genetics(1994)6:148を参照)このようなコード配列の発現は、内在性哺乳類または異種プロモータを使用して誘発され得る。コード配列の発現は構成的であるか、または制御され得る。
所望のポリヌクレオチドの送達および所望の細胞における発現のためのウィルスベースベクターは、当分野で公知である。例示的なウィルスベースビヒクルとしては、限定されないが、組換えレトロウィルス(たとえばWO90/07936;WO94/03622;WO93/25698;WO93/25234;米国特許第5,219,740号;WO93/11230;WO93/10218;米国特許第4,777,127号;英国特許第2,200,651号;欧州特許第0345242号;およびWO91/02805を参照)、アルファウィルスベースベクター(たとえばSindbisウィルスベクター、Semliki forestウィルス(ATCC VR−67;ATCC VR−1247)、Ross Riverウィルス(ATCC VR−373;ATCC VR−1246)およびベネズエラ馬脳炎ウィルス(ATCC VR−923;ATCC VR−1250;ATCC VR1249;ATCC VR−532))、ならびにアデノ関連ウィルス(AAV)ベクター(たとえばWO94/12649、WO93/03769;WO93/19191;WO94/28938;WO95/11984およびWO95/00655を参照)が挙げられる。Curiel,Hum.Gene Ther.(1992)3:147に記載されているような、死んだアデノウィルスに連結されたDNAの投与も利用され得る。
限定されないが、死んだアデノウィルスのみに結合された、または結合されていないポリカチオン性縮合DNA(たとえばCuriel,Hum.Gene Ther.(1992)3:147を参照);リガンド結合DNA(たとえばWu,J.Biol.Chem.(1989)264:16985を参照);真核細胞送達ビヒクル細胞(たとえば米国特許第5,814,482号;WO95/07994;WO96/17072;WO95/30763;およびWO97/42338を参照)ならびに核電荷中和または細胞膜との融合を含む、非ウィルス性送達ビヒクルおよび方法も利用され得る。裸のDNAも利用されうる。例示的な裸のDNA導入方法は、WO90/11092および米国特許第5,580,859号に記載されている。遺伝子送達ビヒクルとして作用し得るリポソームは、米国特許第5,422,120号;WO95/13796;WO94/23697;WO91/14445;および欧州特許第0524968号に記載されている。追加の手法は、Philip,Mol.Cell Biol.(1994)14:2411に、そしてWoffendin,Proc.Natl.Acad.Sd.(1994)97:1581に記載されている。
使用に適切なさらなる非ウィルス性送達は、Woffendinら、Proc.Natl.Acad.Sci USA(1994)91(24):11581に記載されている手法などの機械的送達システムを含む。その上、コード配列およびその発現の産物は、光重合ハイドロゲル材料の沈着または電離放射線の使用によって送達され得る(たとえば米国特許第5,206,152号およびWO92/11033を参照)。コード配列の送達に使用され得る遺伝子送達のための他の従来の方法としては、たとえば手持ち式遺伝子転移パーティクルガンの使用(たとえば米国特許第5,149,655号を参照);転移遺伝子を活性化するための電離放射線の使用(たとえば米国特許第5,206,152号およびWO92/11033)の使用が挙げられる。
一実施形態において、PRLRタンパク質およびモジュレータは治療剤として投与され、上で概説したように調合され得る。同様に、PRLR遺伝子(PRLRコード配列の全長配列、部分配列、または制御配列の両方を含む)は、当分野で公知であるように遺伝子治療で投与され得る。PRLR遺伝子は、当業者に認識されるように、遺伝子治療(すなわちゲノムへの組み入れのための)、またはアンチセンス組成物のどちらかとしてのアンチセンス用途を含み得る。
それゆえ一実施形態において、細胞または生物におけるPRLR遺伝子活性を調節する方法が提供される。一実施形態において、該方法は、細胞に内在性PRLRタンパク質の生物活性を低下または消滅させる抗PRLR抗体を投与する工程を含む。あるいは該方法は、細胞または生物にPRLRタンパク質をコードする組換え核酸を投与する工程を含む。当業者によって認識されるように、これは多くの方法で達成され得る。一実施形態において、たとえばPRLR配列が癌においてダウンレギュレートされるとき、PRLR発現産物の活性は、細胞内のPRLR発現の量を増加させることによって、たとえば公知の遺伝子治療技法を使用して内在性PRLR遺伝子を過剰発現させることによって、またはPRLR配列をコードする遺伝子を投与することによって上昇される。一実施形態において、遺伝子治療技法は、たとえば参照によりその全体が本明細書に組み入れられているPCT/US93/03868に記載されているように、向上した相同組換え(EHR)を使用する外来性遺伝子の組み入れを含む。あるいは、たとえば、PRLR配列が癌においてアップレギュレートされるとき、PRLR遺伝子の活性はたとえばPRLRアンチセンス核酸の投与によって低下される。
(d)ワクチン
一実施形態において、PRLR遺伝子は単独でまたは他の遺伝子と組合されてDNAワクチンとして投与される。裸のDNAワクチンが当分野で一般に公知である。Brower,Nature Biotechnology,16:1304−1305(1998)。
一実施形態において、本発明のPRLR遺伝子はDNAワクチンで使用される。DNAワクチンとしての遺伝子の使用方法は当業者に公知であり、癌患者における発現のためのプロモータの制御の下にPRLR遺伝子またはPRLR遺伝子の一部を配置する工程を含む。DNAワクチンに使用されるPRLR遺伝子は、全長PRLRタンパク質をコードし得る、より好ましくはPRLRに由来するペプチドを含むPRLRタンパク質の一部をコードする。一実施形態において、患者はPRLR遺伝子に由来する複数のヌクレオチド配列を含むDNAワクチンによって免疫化される。同様に、PRLR遺伝子に由来する複数のヌクレオチド配列によって患者を免疫化することが可能である。理論に縛られることなく、PRLRタンパク質を発現する細胞を認識および破壊または消滅する、DNAワクチン、細胞傷害性T細胞、ヘルパーT細胞および抗体によってコードされるポリペプチドの発現が誘発される。
一実施形態において、DNAワクチンは、DNAワクチンと共にアジュバント分子をコードする遺伝子を含む。このようなアジュバント分子としては、DNAワクチンによってコードされたPRLRポリペプチドに対する免疫原性応答を増強するサイトカインを含む。さらなるまたは代わりのアジュバントは当業者に公知であり、本発明で用途を見出している。
(e)抗体
上述のPRLR抗体は、多数の利用法に用途を見出している。たとえば、PRLR抗体は、標準親和性クロマトグラフィーカラムに結合されて、PRLRタンパク質を精製するために使用され得る。抗体はまた、それらがPRLRタンパク質に特異的に結合されるので、上で概説したようにブロッキングポリペプチドとして治療的に使用され得る。
本発明はさらに、生物学的サンプル中のポリペプチドの存在を検出するための、および/またはそのレベルを測定するための方法を提供し、PRLRポリペプチドは、コードされたポリペプチドに対して特異性の抗体を使用して、癌細胞内で差次的に発現されるPRLRポリヌクレオチドによってコードされる。該方法は一般に:a)サンプルに、癌細胞内で差次的に発現されるPRLRポリヌクレオチドによってコードされるポリペプチドに対して特異性の抗体を接触させる工程と;b)抗体とサンプルの分子との間の結合を検出する工程と;を含む。
コードされたPRLRポリペプチドに対して特異性の抗体の特異的結合の検出は、適切な対照と比較したときに、コードされたポリペプチドがサンプル中に存在することの表示である。適切な対照は、コードされたPRLRポリペプチドを含有しないことが公知である、またはポリペプチドのレベル上昇を含有しないことが公知であるサンプル、たとえば正常組織、そしてコードされたポリペプチドに対して特異性でない抗体、たとえば抗イディオタイプ抗体と接触させたサンプルを含む。特異的な抗体−抗原相互作用を検出する各種の方法が当分野で公知であり、限定されないが、標準免疫組織学的方法、免疫沈降、酵素イムノアッセイ、およびラジオイムノアッセイを含む方法で使用され得る。一般に、特異性抗体は直接または間接的のどちらかで、検出されるように標識されるであろう。直接標識としては、放射性同位体;その産物が検出可能である酵素(たとえばルシフェラーゼ、β−ガラクトシダーゼなど);蛍光標識(たとえばフルオレセインイソチオシアネート、ローダミン、フィコエリトリンなど);EDTAなどの金属キレート基を通じて抗体に付着された、蛍光放出金属、たとえば152Eu、または他のランタニド系列;化学発光化合物、たとえばルミノール、イソルミノール、アクリジニウム塩など;生物発光化合物、たとえばルシフェリン、エクオリン(緑色蛍光タンパク質)などが挙げられる。抗体は、不溶性支持体、たとえばポリスチレンプレートまたはビーズに付着(結合)され得る。間接標識としては、コードされたポリペプチド(「一次特異性抗体」)に対して特異性の抗体に対して特異性の二次抗体であって、上述のように標識される二次抗体;特異性結合対、たとえばビオチン−アビジンのメンバーなどが挙げられる。生物学的サンプルは、細胞、細胞粒子、または溶解性タンパク質を固定化できる固体支持体または担体、たとえばニトロセルロースに接触させられて、固定化され得る。支持体は次に適切な緩衝剤で洗浄され、検出可能に標識された一次特異性抗体との接触が続く。検出方法は当分野で公知であり、検出可能な標識によって発生するシグナルに適するように選択されるであろう。検出は一般に、適切な対照との、そして適切な標準との比較で達成される。
ある実施形態において、該方法は、たとえば癌細胞が存在する部位を発見または同定するためのインビボでの使用に適している。これらの実施形態において、PRLRポリペプチドに対して特異性の検出されるように標識された部分、たとえば抗体が個体に(たとえば注射によって)投与され、標識細胞は、限定されないが、磁気共鳴撮影、コンピュータ断層撮影などを含む標準撮影技法を使用して発見される。この方式では、癌細胞は差次的に標識される。
(f)癌の検出および診断の他の方法
理論に縛られることなく、PRLR遺伝子は癌において重要であると思われる。したがって突然変異体または変異体PRLR遺伝子に基づく障害が判定され得る。一実施形態において、本発明は、細胞内の少なくとも1つの細胞内のPRLR遺伝子の配列の全部または一部を判定する工程を含む、PRLR遺伝子の変異体を含有する細胞を同定する方法を提供する。当業者によって認識されるように、これはいずれの数の配列決定技法を使用して実施され得る。実施形態において、本発明は、個体の少なくとも1つのPRLR遺伝子の配列の全部または一部を決定する工程を含む、個体のPRLR遺伝子型を同定する方法を含む。これは一般に個体の少なくとも1つの組織で実施され、多数の組織または同じ組織の異なるサンプルの評価を含み得る。該方法は、配列決定されたPRLR遺伝子の配列を既知のPRLR遺伝子、すなわち野生種遺伝子に対して比較する工程を含み得る。当業者によって認識されるように、PRLR遺伝子の配列における改変は、疾患の存在、または疾患を発生させる性向、または予後評価のどちらかの表示であり得る。
PRLR遺伝子の全部または一部の配列は次に、何らかの相違が存在するかどうか判定するために既知のPRLR遺伝子の配列と比較され得る。これは、いずれの数の既知の相同性プログラム、たとえばBestfitなどを使用して実施され得る。一実施形態において、患者のPRLR遺伝子と既知のPRLR遺伝子との間の配列の相違の存在は、本明細書で概説されるように、疾患状態または疾患状態への性向を示す。
一実施形態において、PRLR遺伝子は、ゲノム内のPRLR遺伝子の複製の数を決定するためにプローブとして使用される。たとえば、ある癌は、染色体欠失または挿入を示し、遺伝子の複製数の改変を生じる。
別の実施形態において、PRLR遺伝子はPRLR遺伝子の染色体位置を決定するプローブとして使用される。染色体位置などの情報は、特に転座などの染色体異常がPRLR遺伝子座位で同定されたときに、診断または予後を提供するために用途を見出している。
本発明は、癌細胞を検出するために、対象における癌の診断および癌の重症度(たとえば腫瘍異型度、全身腫瘍組織量など)を促進するために、対象の予後の判定を促進するために、(たとえば化学療法計画の間または後に全身腫瘍組織量を評価することによって、たとえば治療効果の尺度を提供することによって)治療に対する対象の応答性を評価するために、本明細書に記載したポリヌクレオチドを使用する方法を提供する。検出は、癌細胞において差次的に発現されたポリヌクレオチドの検出、および/または癌細胞において差次的に発現されたポリヌクレオチドによってコードされたポリヌクレオチドの検出に基づき得る。本発明の検出方法は、インビトロまたはインビボで、単離細胞に対して、または組織全体または体液中で、たとえば血液、血漿、血清、尿中などで実施され得る。
ある実施形態において、癌細胞において差次的に発現される転写物の細胞において発現を検出することによって、癌細胞を検出する方法が提供される。各種の公知の方法のいずれも、限定されないが、前立腺癌細胞において差次的に発現されるポリヌクレオチドにハイブリダイズするポリヌクレオチドとのハイブリダイゼーションによる転写物の検出;特異性オリゴヌクレオチドプライマーを使用するポリメラーゼ連鎖反応による転写物の検出;を含む検出、前立腺癌細胞において差次的に発現される遺伝子にハイブリダイズするポリヌクレオチドをプローブとして使用する細胞のインサイチューハイブリダイゼーションに使用され得る。該方法は、癌細胞において差次的に発現される遺伝子のmRNAレベルを検出および/または測定するために使用され得る。ある実施形態において、該方法は:a)サンプルに、ハイブリダイゼーションを可能にする条件下で本明細書に記載した差次的に発現された遺伝子に対応するポリヌクレオチドを接触させる工程と;b)存在する場合には、ハイブリダイゼーションを検出する工程と;を含む。
差次的ハイブリダイゼーションの検出は、適切な対照と比較したときに、癌細胞において差次的に発現されるポリヌクレオチドのサンプルでの存在の表示である。適切な対照としては、たとえば、癌細胞において差次的に発現されるポリヌクレオチドを含有しないことが公知であるサンプルと、癌細胞において差次的に発現されるポリヌクレオチドとしての、同じ「意味」の標識ポリヌクレオチドの使用が挙げられる。ハイブリダイゼーションを可能にする条件は当分野で公知であり、上でさらに詳細に記載されている。検出はまた、限定されないが、インサイチューハイブリダイゼーション、PCR(ポリメラーゼ連鎖反応)、RT−PCR(逆転写−PCR)、TMA、bDNA、ならびにNasbauおよび「ノザン」またはRNAブロッティング、あるいはこのような技法の組合せを含む、いずれかの公知の方法によって、適切に標識されたポリヌクレオチドを使用して達成され得る。ポリヌクレオチドの各種の標識および標識方法は当分野で公知であり、本発明のアッセイ方法で使用され得る。ハイブリダイゼーションの特異性は、適切な対照との比較によって決定され得る。
本明細書で提供するポリヌクレオチドの少なくとも10nt、少なくとも12ntまたは少なくとも15隣接ヌクレオチドを一般に含むポリヌクレオチドは、各種の目的に、たとえば前立腺癌で差次的に発現されるポリヌクレオチドの転写レベルの検出および/または測定のためのプローブに使用される。当業者によってただちに認識されるように、プローブは検出可能に標識されて、試験サンプル(たとえばmRNA)から得た固定化ポリヌクレオチドを含むアレイと接触させることができる。あるいは、プローブはアレイに固定化されて、試験サンプルを検出可能に標識することができる。本発明の方法のこれらまたは他の変形形態は当業者の十分に範囲内であり、本発明の範囲内である。
ヌクレオチドプローブは、提供されたポリヌクレオチドに対応する遺伝子の発現を検出するために使用される。ノザンブロットでは、mRNAは電気泳動によって分離され、プローブに接触させられる。プローブは、特定のサイズのmRNA種にハイブリダイズされるときに検出される。ハイブリダイゼーションの量は、たとえば特定の条件下での発現の相対量を決定するために定量化され得る。プローブは、発現を検出するために細胞へのインサイチューハイブリダイゼーションに使用される。プローブは、ハイブリダイズ配列の診断検出のためにインビボで使用され得る。プローブは、典型的には、放射性同位体によって標識される。検出可能な標識の他のタイプ、たとえば発色団、フルオロフォア、および酵素が使用され得る。ヌクレオチドハイブリダイゼーションアッセイの他の例は、WO92/02526および米国特許第5,124,246号に記載されている。
PCRは、少量の標的核酸を検出する別の手段である(たとえばMullisら、Meth.Enzymol.(1987)155:335;米国特許第4,683,195号;および米国特許第4,683,202号を参照)。標的核酸とハイブリダイズする2つのプライマーオリゴヌクレオチドは、反応を刺激するために使用される。プライマーは、本明細書で開示されたPRLRポリヌクレオチド内の配列、またはPRLRポリヌクレオチドに対して3’または5’の配列より構成され得る。あるいはプライマーがこれらのポリヌクレオチドに対して3’または5’である場合、それらはそれらまたは他の補体にハイブリダイズする必要はない。標的の熱安定性ポリメラーゼによる増幅の後、増幅された標的核酸は、当分野で公知の方法、たとえばサザンブロットによって検出され得る。mRNAまたはcDNAは、Sambrookら“Molecular Cloning:A Laboratory Manual”(New York,Cold Spring Harbor Laboratory,1989)に記載された伝統的なブロッティング技法(たとえばサザンブロット、ノザンブロットなど)によっても検出され得る(たとえばPCR増幅なしで)。一般に、mRNAまたはポリメラーゼ酵素を使用してmRNAから産生されたcDNAは、ゲル電気泳動を使用して精製および分離され、固体支持体、たとえばニトロセルロースに転移され得る。固体支持体は、標識プローブに曝露され、いずれの非ハイブリダイズプローブも除去するために洗浄されて、標識プローブを含有する二本鎖が検出される。
PCR増幅を使用する方法は、単一の細胞によるDNAに対して実施され得るが、少なくとも約105個の細胞を使用することが好都合である。ポリメラーゼ連鎖反応の使用はSaikiら(1985)Science 239:487に記載され、現在の技法の概説はSambrook,ら、Molecular Cloning:A Laboratory Manual,CSH Press 1989,pp.14.2−14.33に見出され得る。検出可能な標識は、増幅反応に含まれ得る。適切な検出可能な標識としては、蛍光色素(たとえばフルオロセインイソチオシアネート(FITC)、ローダミン、テキサスレッド、フィコエリトリン、アロフィコシアニン、6−カルボキシフルオロセイン(6−FAM)、2’,7’−ジメトキシ−4’,5’−ジクロロ−6−カルボキシフルオレセイン、6−カルボキシ−X−ローダミン(ROX)、6−カルボキシ−2’,4’,7’,4,7−ヘキサクロロフルオレセイン(HEX)、5−カルボキシフルオレセイン(5−FAM)またはN,N,N’,N’−テトラメチル−6−カルボキシローダミン(TAMRA))、放射性標識(たとえば32P、35S、3Hなど)などが挙げられる。標識は2段階の系であり、ポリヌクレオチドは、高親和性結合パートナー、たとえばアビジン、特異性抗体などを有するビオチン、ハプテンなどにコンジュゲートされ、結合パートナーは、検出可能な標識にコンジュゲートされる。標識は、プライマーの一方または両方にコンジュゲートされ得る。あるいは増幅で使用されるヌクレオチドのプールは、標識を増幅産物に組込むために標識される。
検出方法で使用される試薬は、キットの一部として提供され得る。それゆえ本発明は、生物学的サンプル中の癌細胞において差次的に発現されるポリヌクレオチドの、および/またはそれによってコードされるポリペプチドの存在および/またはレベルを(たとえば興味のある差次的に発現された遺伝子によってコードされるmRNAの検出によって)検出するためのキットをさらに提供する。これらのキットを使用する手順は、臨床研究室、実験研究室、開業医、または私人によって実施され得る。癌細胞において差次的に発現されるポリヌクレオチドにコードされたポリペプチドを検出するための本発明のキットは、ポリペプチドまたはその断片を結合する抗体であり得るポリペプチドに特異的に結合する部分を含み得る。前立腺癌細胞において差次的に発現され得るポリヌクレオチドを検出するために使用される本発明のキットは、このようなポリヌクレオチドに特異的にハイブリダイズする部分を含み得る。該キットは、限定されないが、緩衝剤、展開試薬、標識、反応表面、検出手段、対照サンプル、標準、説明書、および説明情報を含む、手順で有用である追加の構成要素を場合により提供し得る。
本発明はさらに、哺乳類(たとえばヒト)における腫瘍性または前癌状態を検出/診断する方法に関する。「診断」としては本明細書で使用するとき、一般に、疾患または障害に対する対象の感受性の判定、対象が疾患または障害に現在影響されているかどうかに関する判定、疾患または障害に影響された対象の予後(たとえば前転移性または転移性癌状態の同定、癌の段階、または治療に対する癌の応答性)、およびセラメトリクス(therametrics)(たとえば対象の状態を監視して、治療の効果または有効性に関する情報を提供する)が挙げられる。
「有効量」とは、臨床結果を含む有利なまたは所望の結果に十分な量である。有効量は、1回以上の投与で投与され得る。
「細胞サンプル」は、個体から得られた各種のサンプルタイプを含み、診断または監視アッセイに使用され得る。定義は、生物起源の血液および他の液体サンプル、固体組織サンプル、たとえば生検標本または組織培養物あるいはそれに由来する細胞およびその子孫を含む。定義は、その調達後に何らかの方法で、たとえば試薬による処置、可溶化、またはある成分、たとえばタンパク質またはポリヌクレオチドなどの濃縮などによって操作されたサンプルも含む。用語「細胞サンプル」は、臨床サンプルを含み、培養中のサンプル、細胞上清、細胞溶解液、血清、血漿、生体液、および組織サンプルも含む。
本明細書で使用するとき、「新生細胞」、「新形成」、「腫瘍」、「腫瘍細胞」、「癌」および「癌細胞」(互換的に使用される)は、比較的自立的な成長を示す細胞を指すので、それらは細胞増殖の著しい制御の喪失を特徴とする異常増殖表現型を示す(すなわち、無秩序な細胞分裂)。新生細胞は悪性または良性であり得る。
用語「個体」、「対象」、「宿主」、および「患者」は、本明細書では互換的に使用され、診断、処置、または治療が所望であるいずれかの哺乳類対象、特にヒトを指す。他の対象は、ウシ、イヌ、ネコ、モルモット、ウサギ、ラット、マウス、ウマなどを含み得る。これらの方法に従って検出/診断され得る状態の例としては、癌が挙げられる。適切な発現パターンを示す遺伝子に対応するポリヌクレオチドは、対象の癌を検出するのに使用され得る。癌のマーカーの概説については、Hanahanら、Cell 100:57−70(2000)を参照。
ある検出/診断方法は:(a)哺乳類(たとえばヒト)から生物学的サンプルを採取する工程と、(b)PRLRタンパク質のサンプルの存在を検出する工程と、(c)存在する産物の量を対照サンプル中のそれと比較する工程とを含む。これらの方法に従って、PRLR遺伝子産物の上昇したレベルのサンプル中での存在は、対照が腫瘍性または前癌状態を有することを示す。
本方法で使用するのに適した生物学的サンプルとしては、生体液、たとえば血清、血漿、胸水、尿および脳脊髄液(CSF)が挙げられ、組織サンプル(たとえば乳腺腫瘍または前立腺組織スライス)も、生検より得られたサンプルを含めて本発明の方法で使用され得る。たとえば組織生検から得られた細胞培養物または細胞抽出物も使用され得る。
化合物は好ましくは、結合タンパク質、たとえば抗体、ポリクローナルまたはモノクローナル、あるいはその抗原結合断片であり、検出可能なマーカー(たとえばフルオロフォア、発色団または同位体など)によって標識され得る。適切な場合、化合物を固体支持体、たとえばビーズ、プレート、フィルタ、樹脂などに付着させることができる。複合体の形成の判定は、複合体に第1の化合物(または複合体)に特異的に結合するさらなる化合物(たとえば抗体)を接触させることによって実施され得る。第1の化合物と同様に、さらなる化合物は固体支持体に付着させ得るか、および/または検出可能なマーカーによって標識され得る。
本発明によるPRLRタンパク質の上昇レベルの同定は、アジュバント治療に恩恵を受けやすい対象(患者)の同定を可能にする。たとえば、一次治療後対象(たとえば手術を受けた患者)からの生物学的サンプルは、正常な集合の試験によって決定され、残存する腫瘍組織を示す、PRLRタンパク質の存在、タンパク質の上昇レベルの存在についてスクリーニングされ得る。同様に、外科的に除去された腫瘍部位からの組織は(たとえば免疫蛍光法によって)検査することができ、(周囲組織と比較した)産物の上昇レベルの存在は、腫瘍の不完全な除去を示す。このような対象を同定する能力は、特定の対象の必要性に治療を適合させることを可能にする。非手術治療、たとえば化学療法または放射線療法を受ける対象を監視することもでき、このような対象からのサンプル中のPRLRタンパク質の上昇レベルの存在は、継続処置の必要性を示す。疾患のステージング(たとえば処置計画を最適化する目的での)も、たとえばPRLRタンパク質に対して特異性の抗体を用いた、たとえば生検によって実施され得る。
(g)動物モデルおよびトランスジェニック
遺伝子は、癌の動物モデルの産生にも用途を見出している。当業者によって認識されるように、同定されたPRLR遺伝子が癌組織において抑制または減少されるときに、アンチセンスRNAがPRLR遺伝子に向けられた遺伝子治療技術も、遺伝子の発現を減少または抑制するであろう。そのように産生された動物は、生物活性薬候補のスクリーニングにおいて用途が見出される、PRLR関連癌の動物モデルとして機能する。同様に、たとえば適切な遺伝子ターゲッティングベクターとの相同組換えの結果としての、遺伝子ノックアウト技術は、PRLRタンパク質の不存在を引き起こすであろう。所望のときに、PRLRタンパク質の組織特異性発現またはノックアウトは必要であり得る。
PRLRタンパク質を癌、特に乳癌、前立腺癌、肺癌および皮膚癌で過剰発現させることも可能である。そのようなものとして、PRLRタンパク質を過剰発現するトランスジェニック動物が産生され得る。所望の発現レベルに応じて、各種の強度のプロモータを利用してトランス遺伝子を発現させることができる。組込みトランス遺伝子の複製の数を決定でき、トランス遺伝子の発現レベルの決定のために比較することができる。このような方法によって産生された動物は、PRLR関連癌の動物モデルとして用途を見出し、加えて癌を処置するための生物活性分子のスクリーニングにも有用である。