JP2005232103A - 光学活性なビシナルジアミンおよびその製造方法 - Google Patents
光学活性なビシナルジアミンおよびその製造方法 Download PDFInfo
- Publication number
- JP2005232103A JP2005232103A JP2004044771A JP2004044771A JP2005232103A JP 2005232103 A JP2005232103 A JP 2005232103A JP 2004044771 A JP2004044771 A JP 2004044771A JP 2004044771 A JP2004044771 A JP 2004044771A JP 2005232103 A JP2005232103 A JP 2005232103A
- Authority
- JP
- Japan
- Prior art keywords
- group
- substituted
- halogen atom
- optionally
- alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000004519 manufacturing process Methods 0.000 title claims abstract description 20
- 150000004753 Schiff bases Chemical class 0.000 claims abstract description 142
- 239000002262 Schiff base Substances 0.000 claims abstract description 132
- 150000001413 amino acids Chemical class 0.000 claims abstract description 79
- 150000001875 compounds Chemical class 0.000 claims abstract description 46
- 150000004820 halides Chemical class 0.000 claims abstract description 18
- 150000003242 quaternary ammonium salts Chemical class 0.000 claims abstract description 17
- 230000003301 hydrolyzing effect Effects 0.000 claims abstract description 5
- 125000005843 halogen group Chemical group 0.000 claims description 487
- 125000003118 aryl group Chemical group 0.000 claims description 120
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 99
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 61
- 125000000217 alkyl group Chemical group 0.000 claims description 50
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 40
- 150000004985 diamines Chemical group 0.000 claims description 35
- 125000001072 heteroaryl group Chemical group 0.000 claims description 35
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 34
- 125000003545 alkoxy group Chemical group 0.000 claims description 33
- 238000000034 method Methods 0.000 claims description 31
- 125000003342 alkenyl group Chemical group 0.000 claims description 30
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 30
- 125000004475 heteroaralkyl group Chemical group 0.000 claims description 23
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 claims description 20
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 20
- 229910052740 iodine Inorganic materials 0.000 claims description 20
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims description 18
- 125000004209 (C1-C8) alkyl group Chemical group 0.000 claims description 17
- 229910052801 chlorine Inorganic materials 0.000 claims description 16
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 15
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 15
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 14
- 125000000304 alkynyl group Chemical group 0.000 claims description 14
- 239000003444 phase transfer catalyst Substances 0.000 claims description 13
- 125000004122 cyclic group Chemical group 0.000 claims description 11
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 10
- 229910052757 nitrogen Inorganic materials 0.000 claims description 10
- 229910052717 sulfur Inorganic materials 0.000 claims description 10
- 125000004429 atom Chemical group 0.000 claims description 9
- 125000004649 C2-C8 alkynyl group Chemical group 0.000 claims description 8
- 229910052736 halogen Inorganic materials 0.000 claims description 8
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 claims description 6
- 125000004648 C2-C8 alkenyl group Chemical group 0.000 claims description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 6
- HTZCNXWZYVXIMZ-UHFFFAOYSA-M benzyl(triethyl)azanium;chloride Chemical compound [Cl-].CC[N+](CC)(CC)CC1=CC=CC=C1 HTZCNXWZYVXIMZ-UHFFFAOYSA-M 0.000 claims description 6
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 claims description 6
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 6
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 6
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 6
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 6
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 6
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 6
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 claims description 6
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 claims description 6
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 claims description 6
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 claims description 6
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 6
- 239000003054 catalyst Substances 0.000 claims description 5
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 5
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 5
- 125000004851 cyclopentylmethyl group Chemical group C1(CCCC1)C* 0.000 claims description 5
- 150000002367 halogens Chemical class 0.000 claims description 4
- 125000005842 heteroatom Chemical group 0.000 claims description 4
- JRMUNVKIHCOMHV-UHFFFAOYSA-M tetrabutylammonium bromide Chemical group [Br-].CCCC[N+](CCCC)(CCCC)CCCC JRMUNVKIHCOMHV-UHFFFAOYSA-M 0.000 claims description 4
- VJGNLOIQCWLBJR-UHFFFAOYSA-M benzyl(tributyl)azanium;chloride Chemical compound [Cl-].CCCC[N+](CCCC)(CCCC)CC1=CC=CC=C1 VJGNLOIQCWLBJR-UHFFFAOYSA-M 0.000 claims description 3
- KXHPPCXNWTUNSB-UHFFFAOYSA-M benzyl(trimethyl)azanium;chloride Chemical compound [Cl-].C[N+](C)(C)CC1=CC=CC=C1 KXHPPCXNWTUNSB-UHFFFAOYSA-M 0.000 claims description 3
- 230000001548 androgenic effect Effects 0.000 claims description 2
- 125000005415 substituted alkoxy group Chemical group 0.000 claims 1
- 150000007529 inorganic bases Chemical class 0.000 abstract description 5
- 229910052987 metal hydride Inorganic materials 0.000 abstract description 4
- 150000004681 metal hydrides Chemical class 0.000 abstract description 4
- 235000001014 amino acid Nutrition 0.000 description 74
- -1 may Chemical group 0.000 description 51
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 24
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 24
- 238000004458 analytical method Methods 0.000 description 19
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 18
- 230000015572 biosynthetic process Effects 0.000 description 15
- 238000003786 synthesis reaction Methods 0.000 description 15
- 239000000203 mixture Substances 0.000 description 14
- 239000000243 solution Substances 0.000 description 14
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 12
- 230000003287 optical effect Effects 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- 238000006243 chemical reaction Methods 0.000 description 11
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 0 Bc1cc(-c2cc(cccc3)c3c(-c3c(cccc4)c4c4)c2C[N+](C2)(Cc(ccc5c6cccc5)c6-c5c2ccc2c5cccc2)Cc3c4-c2cc(*)cc(*)c2)cc(*)c1 Chemical compound Bc1cc(-c2cc(cccc3)c3c(-c3c(cccc4)c4c4)c2C[N+](C2)(Cc(ccc5c6cccc5)c6-c5c2ccc2c5cccc2)Cc3c4-c2cc(*)cc(*)c2)cc(*)c1 0.000 description 8
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 7
- 239000012300 argon atmosphere Substances 0.000 description 7
- 238000001914 filtration Methods 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 230000000052 comparative effect Effects 0.000 description 6
- 239000000543 intermediate Substances 0.000 description 6
- 229910052938 sodium sulfate Inorganic materials 0.000 description 6
- 235000011152 sodium sulphate Nutrition 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 5
- 235000004279 alanine Nutrition 0.000 description 5
- 238000004440 column chromatography Methods 0.000 description 5
- 239000003480 eluent Substances 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 239000000741 silica gel Substances 0.000 description 5
- 229910002027 silica gel Inorganic materials 0.000 description 5
- 239000003905 agrochemical Substances 0.000 description 4
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 230000007062 hydrolysis Effects 0.000 description 4
- 238000006460 hydrolysis reaction Methods 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 239000003960 organic solvent Substances 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- MFGOFGRYDNHJTA-UHFFFAOYSA-N 2-amino-1-(2-fluorophenyl)ethanol Chemical compound NCC(O)C1=CC=CC=C1F MFGOFGRYDNHJTA-UHFFFAOYSA-N 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 235000008206 alpha-amino acids Nutrition 0.000 description 3
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 3
- HUCVOHYBFXVBRW-UHFFFAOYSA-M caesium hydroxide Inorganic materials [OH-].[Cs+] HUCVOHYBFXVBRW-UHFFFAOYSA-M 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 238000000605 extraction Methods 0.000 description 3
- 239000012074 organic phase Substances 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- BHELZAPQIKSEDF-UHFFFAOYSA-N allyl bromide Chemical compound BrCC=C BHELZAPQIKSEDF-UHFFFAOYSA-N 0.000 description 2
- 150000001371 alpha-amino acids Chemical class 0.000 description 2
- 150000003862 amino acid derivatives Chemical class 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 230000000975 bioactive effect Effects 0.000 description 2
- 239000012267 brine Substances 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- PCEBAZIVZVIQEO-UHFFFAOYSA-N iodocyclopentane Chemical compound IC1CCCC1 PCEBAZIVZVIQEO-UHFFFAOYSA-N 0.000 description 2
- FMKOJHQHASLBPH-UHFFFAOYSA-N isopropyl iodide Chemical compound CC(C)I FMKOJHQHASLBPH-UHFFFAOYSA-N 0.000 description 2
- 239000012280 lithium aluminium hydride Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 description 2
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- DYFFAVRFJWYYQO-UHFFFAOYSA-N n-methyl-n-phenylaniline Chemical compound C=1C=CC=CC=1N(C)C1=CC=CC=C1 DYFFAVRFJWYYQO-UHFFFAOYSA-N 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 239000012044 organic layer Substances 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- PUZPDOWCWNUUKD-UHFFFAOYSA-M sodium fluoride Chemical compound [F-].[Na+] PUZPDOWCWNUUKD-UHFFFAOYSA-M 0.000 description 2
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 2
- 230000000707 stereoselective effect Effects 0.000 description 2
- 125000003107 substituted aryl group Chemical group 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- MPPPKRYCTPRNTB-UHFFFAOYSA-N 1-bromobutane Chemical compound CCCCBr MPPPKRYCTPRNTB-UHFFFAOYSA-N 0.000 description 1
- LSXKDWGTSHCFPP-UHFFFAOYSA-N 1-bromoheptane Chemical compound CCCCCCCBr LSXKDWGTSHCFPP-UHFFFAOYSA-N 0.000 description 1
- MNDIARAMWBIKFW-UHFFFAOYSA-N 1-bromohexane Chemical compound CCCCCCBr MNDIARAMWBIKFW-UHFFFAOYSA-N 0.000 description 1
- VMKOFRJSULQZRM-UHFFFAOYSA-N 1-bromooctane Chemical compound CCCCCCCCBr VMKOFRJSULQZRM-UHFFFAOYSA-N 0.000 description 1
- YZWKKMVJZFACSU-UHFFFAOYSA-N 1-bromopentane Chemical compound CCCCCBr YZWKKMVJZFACSU-UHFFFAOYSA-N 0.000 description 1
- CYNYIHKIEHGYOZ-UHFFFAOYSA-N 1-bromopropane Chemical compound CCCBr CYNYIHKIEHGYOZ-UHFFFAOYSA-N 0.000 description 1
- LMHCYRULPLGEEZ-UHFFFAOYSA-N 1-iodoheptane Chemical compound CCCCCCCI LMHCYRULPLGEEZ-UHFFFAOYSA-N 0.000 description 1
- ANOOTOPTCJRUPK-UHFFFAOYSA-N 1-iodohexane Chemical compound CCCCCCI ANOOTOPTCJRUPK-UHFFFAOYSA-N 0.000 description 1
- UWLHSHAHTBJTBA-UHFFFAOYSA-N 1-iodooctane Chemical compound CCCCCCCCI UWLHSHAHTBJTBA-UHFFFAOYSA-N 0.000 description 1
- BLXSFCHWMBESKV-UHFFFAOYSA-N 1-iodopentane Chemical compound CCCCCI BLXSFCHWMBESKV-UHFFFAOYSA-N 0.000 description 1
- 125000006019 1-methyl-1-propenyl group Chemical group 0.000 description 1
- 125000006021 1-methyl-2-propenyl group Chemical group 0.000 description 1
- NAMYKGVDVNBCFQ-UHFFFAOYSA-N 2-bromopropane Chemical compound CC(C)Br NAMYKGVDVNBCFQ-UHFFFAOYSA-N 0.000 description 1
- 125000006020 2-methyl-1-propenyl group Chemical group 0.000 description 1
- 125000006022 2-methyl-2-propenyl group Chemical group 0.000 description 1
- DMAYBPBPEUFIHJ-UHFFFAOYSA-N 4-bromobut-1-ene Chemical compound BrCCC=C DMAYBPBPEUFIHJ-UHFFFAOYSA-N 0.000 description 1
- AVPYQKSLYISFPO-UHFFFAOYSA-N 4-chlorobenzaldehyde Chemical compound ClC1=CC=C(C=O)C=C1 AVPYQKSLYISFPO-UHFFFAOYSA-N 0.000 description 1
- LPNANKDXVBMDKE-UHFFFAOYSA-N 5-bromopent-1-ene Chemical compound BrCCCC=C LPNANKDXVBMDKE-UHFFFAOYSA-N 0.000 description 1
- RIMXEJYJXDBLIE-UHFFFAOYSA-N 6-bromohex-1-ene Chemical compound BrCCCCC=C RIMXEJYJXDBLIE-UHFFFAOYSA-N 0.000 description 1
- GNYDYUQVALBGGZ-UHFFFAOYSA-N 7-bromohept-1-ene Chemical compound BrCCCCCC=C GNYDYUQVALBGGZ-UHFFFAOYSA-N 0.000 description 1
- SNMOMUYLFLGQQS-UHFFFAOYSA-N 8-bromooct-1-ene Chemical compound BrCCCCCCC=C SNMOMUYLFLGQQS-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- KFCIRXLXKTUEFO-UHFFFAOYSA-N Fc(cc(cc1F)-c2cc(cccc3)c3c(-c3c(cccc4)c4c4)c2C[N+]2(CC(C=CC5=CCCC=C55)=C5c5c(cccc6)c6ccc5C2)Cc3c4-c(cc2F)cc(F)c2F)c1F Chemical compound Fc(cc(cc1F)-c2cc(cccc3)c3c(-c3c(cccc4)c4c4)c2C[N+]2(CC(C=CC5=CCCC=C55)=C5c5c(cccc6)c6ccc5C2)Cc3c4-c(cc2F)cc(F)c2F)c1F KFCIRXLXKTUEFO-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 239000012448 Lithium borohydride Substances 0.000 description 1
- CJUMAFVKTCBCJK-UHFFFAOYSA-N N-benzyloxycarbonylglycine Chemical compound OC(=O)CNC(=O)OCC1=CC=CC=C1 CJUMAFVKTCBCJK-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- CYHJHZRTJFAJAR-UHFFFAOYSA-K O.[OH-].[OH-].[OH-].[Ce+3] Chemical compound O.[OH-].[OH-].[OH-].[Ce+3] CYHJHZRTJFAJAR-UHFFFAOYSA-K 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 150000001370 alpha-amino acid derivatives Chemical class 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- TZIHFWKZFHZASV-UHFFFAOYSA-N anhydrous methyl formate Natural products COC=O TZIHFWKZFHZASV-UHFFFAOYSA-N 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 1
- 239000012965 benzophenone Substances 0.000 description 1
- QLFNUXTWJGXNLH-UHFFFAOYSA-N bis(2-methoxyethoxy)alumane Chemical compound COCCO[AlH]OCCOC QLFNUXTWJGXNLH-UHFFFAOYSA-N 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- LOXORFRCPXUORP-UHFFFAOYSA-N bromo-Cycloheptane Chemical compound BrC1CCCCCC1 LOXORFRCPXUORP-UHFFFAOYSA-N 0.000 description 1
- AQNQQHJNRPDOQV-UHFFFAOYSA-N bromocyclohexane Chemical compound BrC1CCCCC1 AQNQQHJNRPDOQV-UHFFFAOYSA-N 0.000 description 1
- KFKLBMQLKLKHLU-UHFFFAOYSA-N bromocyclooctane Chemical compound BrC1CCCCCCC1 KFKLBMQLKLKHLU-UHFFFAOYSA-N 0.000 description 1
- BRTFVKHPEHKBQF-UHFFFAOYSA-N bromocyclopentane Chemical compound BrC1CCCC1 BRTFVKHPEHKBQF-UHFFFAOYSA-N 0.000 description 1
- KMGBZBJJOKUPIA-UHFFFAOYSA-N butyl iodide Chemical compound CCCCI KMGBZBJJOKUPIA-UHFFFAOYSA-N 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000006165 cyclic alkyl group Chemical group 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- SXZIXHOMFPUIRK-UHFFFAOYSA-N diphenylmethanimine Chemical compound C=1C=CC=CC=1C(=N)C1=CC=CC=C1 SXZIXHOMFPUIRK-UHFFFAOYSA-N 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 125000006301 indolyl methyl group Chemical group 0.000 description 1
- ZQCXCNPOYCQOEW-UHFFFAOYSA-N iodocycloheptane Chemical compound IC1CCCCCC1 ZQCXCNPOYCQOEW-UHFFFAOYSA-N 0.000 description 1
- FUCOMWZKWIEKRK-UHFFFAOYSA-N iodocyclohexane Chemical compound IC1CCCCC1 FUCOMWZKWIEKRK-UHFFFAOYSA-N 0.000 description 1
- LDKYPRVLJQWKBI-UHFFFAOYSA-N iodocyclooctane Chemical compound IC1CCCCCCC1 LDKYPRVLJQWKBI-UHFFFAOYSA-N 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- SKTCDJAMAYNROS-UHFFFAOYSA-N methoxycyclopentane Chemical compound COC1CCCC1 SKTCDJAMAYNROS-UHFFFAOYSA-N 0.000 description 1
- PVWOIHVRPOBWPI-UHFFFAOYSA-N n-propyl iodide Chemical compound CCCI PVWOIHVRPOBWPI-UHFFFAOYSA-N 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000005344 pyridylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 239000011775 sodium fluoride Substances 0.000 description 1
- 235000013024 sodium fluoride Nutrition 0.000 description 1
- 125000005017 substituted alkenyl group Chemical group 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000005301 thienylmethyl group Chemical group [H]C1=C([H])C([H])=C(S1)C([H])([H])* 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
【解決手段】 光学活性なビシナルアミンおよびその製造方法が開示されている。本発明は、アミノ酸アミドのシッフ塩基と有機ハロゲン化物とを無期塩基の存在下、以下の構造:
【化1】
を有する四級アンモニウム塩の存在下にて反応させて、光学活性な置換アミノ酸アミドのシッフ塩基を得、当該置換アミノ酸アミドのシッフ塩基を加水分解を行って得られた生成物に、水素化金属を作用する事により、光学活性なビシナルジアミンを得ることができる。
【選択図】 なし
Description
Z−グリシン(10mmol)およびN−メチルモルホリン(11mmol)のジクロロメタン溶液(30mL)に、エチルクロロホルメート(11mmol)を0℃にてアルゴン雰囲気下で添加し、そして混合物を30分間撹拌した。ベンジルアミン(11mmol)のジクロロメタン溶液(5mL)を、0℃で滴下し、混合物全体を室温まで加温した。5時間撹拌した後、得られた混合物を水に注いだ。ジクロロメタンを用いて抽出操作を行い、そして合わせた有機層を硫酸ナトリウムで乾燥した。濾過およびエバポレーションにより得られた残渣を、エーテルで希釈し、次いで沈殿した物質を濾過により集めた。得られた固形物およびPd/C触媒(50mg)を、メタノール(10mL)および酢酸エチル(10mL)中、水素ガス雰囲気下、室温にて懸濁させ、そして混合物を10時間撹拌した。濾過した後、溶液を減圧下にて濃縮し、そしてメタノール(20mL)中の1Nの塩酸を用いて室温にて処理した。溶液を再度濃縮し、そしてエーテルで希釈した。次いで、得られた白色の沈殿物を濾過により集めた。ジクロロメタン(20mL)中の固形物のスラリーに、アルゴン雰囲気下にてベンゾフェノンイミンを室温にて滴下し、そして混合物を10時間激しく撹拌した。得られた混合物を濾過して塩を除去し、そして濾液を濃縮した。ジクロロメタン/ヘキサンから残渣を再結晶し、グリシンベンジルアミド−ベンゾフェノンシッフ塩基(1)を、無色結晶として得た。得られたグリシンベンジルアミド−ベンゾフェノンシッフ塩基については、更なる精製を施すことなく、後述する実施例に使用した。
参考例1におけるベンジルアミンの代わりにジフェニルメチルアミンを用いたこと以外は、参考例1と同様にして、グリシンジフェニルメチルアミド−ベンゾフェノンシッフ塩基(2)を得た。
Z−アラニン(10mmol)およびN−メチルモルホリン(11mmol)のジクロロメタン溶液(30mL)に、エチルクロロホルメート(11mmol)を0℃にてアルゴン雰囲気下で添加し、そして混合物を30分間撹拌した。ジフェニルメチルアミン(11mmol)のジクロロメタン溶液(5mL)を、0℃で滴下し、混合物全体を室温まで加温した。3時間撹拌した後、得られた混合物を水に注いだ。ジクロロメタンを用いて抽出操作を行い、そして合わせた有機層を硫酸ナトリウムで乾燥した。濾過およびエバポレーションにより得られた残渣を、ヘキサンで希釈し、次いで沈殿した物質を濾過により集めた。得られた固形物およびPd/C触媒(213mg、0.2mmol)を、メタノール(20mL)中、水素ガス雰囲気下、室温にて懸濁させ、そして混合物を1日間撹拌した。濾過した後、溶液を減圧下にて濃縮し、そして残渣をベンゼン(12mL)中に溶解した。溶液に、オルトメチルホルメート(1.4mL、13mmol)およびp−クロロベンズアルデヒド(591mg,4.2mmol)を、室温にてアルゴン雰囲気下にて添加し、そして混合物を10時間撹拌した。反応溶液を水に注ぎ、そして酢酸エチルで抽出した。合わせた抽出物を硫酸ナトリウムで乾燥し、そして濃縮した。シリカゲルを用いたカラムクロマトグラフィー(ヘキサン/酢酸エチル=3:1)(溶離液))による残渣の精製を行い、アラニンジフェニルメチルアミド−p−クロロフェニルアルジミンシッフ塩基(3)を白色固体として得た。
参考例1で得られたシッフ塩基(33mg,0.1mmol)およびテトラブチルアンモニウムブロミド(3.2mg,0.01mmol)のトルエン溶液(1mL)に、78%水酸化セシウム水溶液(30μL)および2−ヨードプロパン(50μL,0.5mmol)を0℃にてアルゴン雰囲気下で順次添加し、そして反応混合物を2時間撹拌した。得られた混合物を水で希釈し、そしてエーテルで抽出した。有機相をブラインで洗浄し、そして硫酸ナトリウムで乾燥した。溶媒のエバポレーションと、シリカゲルを用いたカラムクロマトグラフィー(ヘキサン/酢酸エチル=5:1(溶離液))による残渣の精製とを行い、置換アミノ酸アミドのシッフ塩基(4)を収率82%で得た。
参考例1で得られたシッフ塩基の代わりに、参考例2で得られたシッフ塩基(40mg,0.1mmol)を使用した以外は、実施例1と同様にして、置換アミノ酸アミドのシッフ塩基(5)を収率87%で得た。
参考例1で得られたシッフ塩基の代わりに、tert−ブチルグリシネート−ベンゾフェノンシッフ塩基(6)を使用し、78%水酸化セシウム水溶液の代わりに、50%水酸化カリウム水溶液を使用したこと以外は、実施例1と同様にして、アルキル化されたアミノ酸エステルのシッフ塩基(7)を収率1%以下で得た。
参考例1で得られたシッフ塩基の代わりに、tert−ブチルグリシネート−ベンゾフェノン シッフ塩基(6)を使用したこと以外は、実施例1と同様にして、アルキル化されたアミノ酸エステルのシッフ塩基(7)を収率28%で得た。
参考例2で得られたシッフ塩基(2)(40mg、0.1mmol)および特開2003−081976号公報に記載の方法に基づいて製造された以下の化合物(8):
参考例2で得られたシッフ塩基(2)の代わりに、参考例1で得られたシッフ塩基(1)を使用したこと以外は、実施例3と同様にして、置換アミノ酸アミドのシッフ塩基(10)を光学純度69%で得た。
参考例2で得られたシッフ塩基(2)の代わりに、参考例1で得られたシッフ塩基(1)を使用し、特開2003−081976号公報に記載の方法に基づいて製造された化合物(8)の代わりに、特開2003−081976号公報に記載の方法に基づいて製造された以下の化合物(11):
参考例2で得られたシッフ塩基(2)の代わりに、参考例1で得られたシッフ塩基(1)を使用し、反応混合物の撹拌を3時間行った代わりに10時間行い、特開2003−081976号公報に記載の方法に基づいて製造された化合物(8)の代わりに、特開2001−48866号公報に記載の方法に基づいて製造された以下の化合物(12):
表7に示す製造原料を使用し、表8に示す製造条件で製造を行ったこと以外は、実施例3と同様にして、実施例5〜13を行い、置換アミノ酸アミドのシッフ塩基(13)〜(19)を得た。
参考例3で得られたシッフ塩基(3)(75mg,0.2mmmol)、ヨードシクロペンタン(116μL、1.0mmol)および特開2003−081976号公報に記載の方法に基づいて製造された以下の化合物(8):
実施例3で得られた光学活性な置換アミノ酸アミドのシッフ塩基(9)(99mg、0.2mmol)のテトラヒドロフラン溶液(2mL)に、室温で、1規定の塩酸を加え、その混合物を1時間撹拌した。水層をエーテルで洗浄し、1モル濃度の水酸化ナトリウムで、塩基性にした。酢酸エチルを用いて抽出し、次いで、エバポレーションにより、白色固体として脱保護されたα−アミノ酸アミドを得た。そして、得られた固形物を、水素化アルミニウムリチウム(30.4mg、0.8mmol)のシクロペンチル メチル エーテル溶液(3mL)で、100℃にて2時間還元を行った。フッ化ナトリウム(134mg、3.2mmol)と水(43.2μL、2.4mmol)を順次加えて、0℃で急冷し、1時間撹拌した。得られた灰色の沈殿物をセライトのパッドで濾過し、濾液を濃縮した。シリカゲルを用いたカラムクロマトグラフィー(酢酸エチル/メタノール=4:1(溶離液))による残渣の精製を行い、光学活性なビシナルジアミン(21)を収率96%で得た。
実施例3で得られた光学活性な置換アミノ酸アミドのシッフ塩基(9)の代わりに、実施例5〜13で得られた光学活性な置換アミノ酸アミドのシッフ塩基(13)〜(19)をそれぞれ使用した事以外は、実施例15と同様して、実施例16〜22を行い、光学活性なビシナルジアミン(22)〜(28)を得た。
Claims (17)
- 以下の式(I):
- 上記式(I)で表される化合物のR3およびR6が互いに異なる基である光学活性な化合物である、請求項1に記載の置換アミノ酸アミドのシッフ塩基。
- 置換アミノ酸アミドのシッフ塩基の製造方法であって、以下の式(II):
- R6が、n−プロピル基、イソプロピル基、プロペニル基、n−ブチル基、sec−ブチル基、ブテニル基、ペンチル基、シクロペンチル基、ペンテニル基、シクロヘキシル基、シクロヘプチル基、シクロペンチルメチル基、シクロヘキシルメチル基、シクロオクチル基、ベンジル基、フェネチル基およびナフチルメチル基からなる群より選択される基であり、そしてYが臭素原子、またはヨウ素原子であるハロゲン原子である、請求項4に記載の方法。
- 前記相間移動触媒が四級アンモニウム塩である、請求項3から5のいずれかに記載の方法。
- 前記四級アンモニウム塩が、テトラブチルアンモニウムブロミド、ベンジルトリメチルアンモニウムクロリド、ベンジルトリエチルアンモニウムクロリドまたはベンジルトリブチルアンモニウムクロリドである、請求項6に記載の方法。
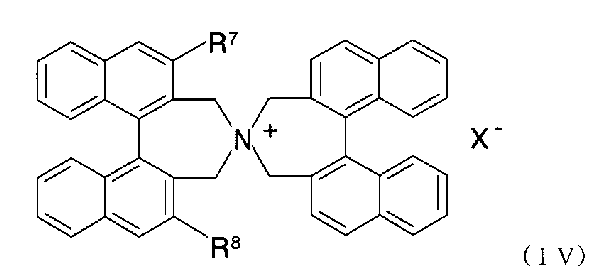
- 前記四級アンモニウム塩が、以下の式(IV):
- 前記式(IV)で表される化合物または前記式(IV’)で表される化合物のR7およびR8がそれぞれ独立して、ハロゲン原子で置換されていてもよいC1〜C4のアルキル基で置換されていてもよいアリール基で置換されたアリール基である、請求項8に記載の方法。
- 前記式(IV)で表される化合物の立体配置が(S,S)または(R,R)である、請求項8に記載の方法。
- 前記置換アミノ酸アミドのシッフ塩基が、光学活性な化合物である請求項3に記載の方法。
- 以下の式(V):
- 光学活性なビシナルジアミンの製造方法であって、以下の式(II):
- R6が、n−プロピル基、イソプロピル基、プロペニル基、n−ブチル基、sec−ブチル基、ブテニル基、ペンチル基、シクロペンチル基、ペンテニル基、シクロヘキシル基、シクロヘプチル基、シクロペンチルメチル基、シクロヘキシルメチル基、シクロオクチル基、ベンジル基、フェネチル基およびナフチルメチル基からなる群より選択される基であり、そしてYが臭素原子、またはヨウ素原子であるハロゲン原子である、請求項14に記載の方法。
- 前記式(IV)で表される化合物または前記式(IV’)で表される化合物のR7およびR8がそれぞれ独立して、ハロゲン原子で置換されていてもよいC1〜C4のアルキル基で置換されていてもよいアリール基で置換されたアリール基である、請求項13に記載の方法。
- 前記式(IV)で表される化合物の立体配置が(S,S)または(R,R)である、請求項13に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004044771A JP2005232103A (ja) | 2004-02-20 | 2004-02-20 | 光学活性なビシナルジアミンおよびその製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004044771A JP2005232103A (ja) | 2004-02-20 | 2004-02-20 | 光学活性なビシナルジアミンおよびその製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005232103A true JP2005232103A (ja) | 2005-09-02 |
Family
ID=35015417
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004044771A Pending JP2005232103A (ja) | 2004-02-20 | 2004-02-20 | 光学活性なビシナルジアミンおよびその製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005232103A (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008088115A (ja) * | 2006-10-03 | 2008-04-17 | Nippon Soda Co Ltd | 置換アミノ酸シッフ塩基化合物の製造方法 |
| CN113929923A (zh) * | 2021-11-29 | 2022-01-14 | 湖北大学 | 纳米球形共价有机框架及其粒径可控的制备方法与应用 |
Citations (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2413248A (en) * | 1945-02-21 | 1946-12-24 | Commercial Solvents Corp | Polyamines and process for preparing them |
| JPS54125644A (en) * | 1978-02-27 | 1979-09-29 | Synthelabo | Benzylidene derivative and its manufacture |
| JPS6330498A (ja) * | 1985-07-24 | 1988-02-09 | メルク エンド カムパニ− インコ−ポレ−テツド | ペプチド酵素阻害剤 |
| JPH02241A (ja) * | 1987-12-01 | 1990-01-05 | Simes Spa | β−遮断活性を有する化合物およびその製造方法 |
| JPH06510792A (ja) * | 1991-11-12 | 1994-12-01 | ファイザー・インコーポレーテッド | サブスタンスp受容体アンタゴニストとしての非環式エチレンジアミン誘導体 |
| JPH072765A (ja) * | 1993-04-30 | 1995-01-06 | Shell Internatl Res Maatschappij Bv | 殺生物性化合物 |
| JPH08119921A (ja) * | 1994-10-24 | 1996-05-14 | Ajinomoto Co Inc | DL−α−アミノ酸−N−(S)−α−アルキルベンジルアミドのジアステレオマ−分割法 |
| JPH08157437A (ja) * | 1994-12-08 | 1996-06-18 | Ajinomoto Co Inc | D−アミノ酸−N−(S)−α−アルキルベンジルアミドの製造法 |
| JP2000501111A (ja) * | 1996-01-26 | 2000-02-02 | バーテックス ファーマシューティカルズ インコーポレイテッド | アスパルチルプロテアーゼインヒビター |
| JP2000128869A (ja) * | 1998-10-16 | 2000-05-09 | Ciba Specialty Chem Holding Inc | 制御されたラジカル重合方法における調節剤としての複素環式アルコキシアミン |
| JP2001048866A (ja) * | 1999-06-04 | 2001-02-20 | Nagase & Co Ltd | 軸不斉を有する光学活性な4級アンモニウム塩、その製法およびα−アミノ酸誘導体の不斉合成への応用 |
| JP2002265526A (ja) * | 2001-03-14 | 2002-09-18 | National Institute Of Advanced Industrial & Technology | ポリエチレングリコールリンカーを有するポリスチレン担持光学活性アンモニウム塩、その製造方法、それから成るポリマー担持型光学活性相間移動触媒及びその触媒を用いる化学反応方法 |
| JP2003081976A (ja) * | 2001-07-02 | 2003-03-19 | Nagase & Co Ltd | キラル相間移動触媒およびそれを用いた不斉ペプチドの製造方法 |
| JP2003261524A (ja) * | 2002-03-08 | 2003-09-19 | Nippon Soda Co Ltd | アミノ化合物類ならびにその立体選択的製造方法 |
| JP2006506352A (ja) * | 2002-09-11 | 2006-02-23 | メルク エンド カムパニー インコーポレーテッド | Hivインテグラーゼ阻害剤として有用なジヒドロキシピリドピラジン−1,6−ジオン化合物 |
-
2004
- 2004-02-20 JP JP2004044771A patent/JP2005232103A/ja active Pending
Patent Citations (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2413248A (en) * | 1945-02-21 | 1946-12-24 | Commercial Solvents Corp | Polyamines and process for preparing them |
| JPS54125644A (en) * | 1978-02-27 | 1979-09-29 | Synthelabo | Benzylidene derivative and its manufacture |
| JPS6330498A (ja) * | 1985-07-24 | 1988-02-09 | メルク エンド カムパニ− インコ−ポレ−テツド | ペプチド酵素阻害剤 |
| JPH02241A (ja) * | 1987-12-01 | 1990-01-05 | Simes Spa | β−遮断活性を有する化合物およびその製造方法 |
| JPH06510792A (ja) * | 1991-11-12 | 1994-12-01 | ファイザー・インコーポレーテッド | サブスタンスp受容体アンタゴニストとしての非環式エチレンジアミン誘導体 |
| JPH072765A (ja) * | 1993-04-30 | 1995-01-06 | Shell Internatl Res Maatschappij Bv | 殺生物性化合物 |
| JPH08119921A (ja) * | 1994-10-24 | 1996-05-14 | Ajinomoto Co Inc | DL−α−アミノ酸−N−(S)−α−アルキルベンジルアミドのジアステレオマ−分割法 |
| JPH08157437A (ja) * | 1994-12-08 | 1996-06-18 | Ajinomoto Co Inc | D−アミノ酸−N−(S)−α−アルキルベンジルアミドの製造法 |
| JP2000501111A (ja) * | 1996-01-26 | 2000-02-02 | バーテックス ファーマシューティカルズ インコーポレイテッド | アスパルチルプロテアーゼインヒビター |
| JP2000128869A (ja) * | 1998-10-16 | 2000-05-09 | Ciba Specialty Chem Holding Inc | 制御されたラジカル重合方法における調節剤としての複素環式アルコキシアミン |
| JP2001048866A (ja) * | 1999-06-04 | 2001-02-20 | Nagase & Co Ltd | 軸不斉を有する光学活性な4級アンモニウム塩、その製法およびα−アミノ酸誘導体の不斉合成への応用 |
| JP2002265526A (ja) * | 2001-03-14 | 2002-09-18 | National Institute Of Advanced Industrial & Technology | ポリエチレングリコールリンカーを有するポリスチレン担持光学活性アンモニウム塩、その製造方法、それから成るポリマー担持型光学活性相間移動触媒及びその触媒を用いる化学反応方法 |
| JP2003081976A (ja) * | 2001-07-02 | 2003-03-19 | Nagase & Co Ltd | キラル相間移動触媒およびそれを用いた不斉ペプチドの製造方法 |
| JP2003261524A (ja) * | 2002-03-08 | 2003-09-19 | Nippon Soda Co Ltd | アミノ化合物類ならびにその立体選択的製造方法 |
| JP2006506352A (ja) * | 2002-09-11 | 2006-02-23 | メルク エンド カムパニー インコーポレーテッド | Hivインテグラーゼ阻害剤として有用なジヒドロキシピリドピラジン−1,6−ジオン化合物 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008088115A (ja) * | 2006-10-03 | 2008-04-17 | Nippon Soda Co Ltd | 置換アミノ酸シッフ塩基化合物の製造方法 |
| CN113929923A (zh) * | 2021-11-29 | 2022-01-14 | 湖北大学 | 纳米球形共价有机框架及其粒径可控的制备方法与应用 |
| CN113929923B (zh) * | 2021-11-29 | 2023-02-24 | 湖北大学 | 纳米球形共价有机框架及其粒径可控的制备方法与应用 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2008041571A1 (en) | Process for producing optically active beta-hydroxy-alpha-aminocarboxylic acid ester | |
| CN113896662A (zh) | 一种氨基环丙烷羧酸类化合物及其制备方法和应用 | |
| CN114106089A (zh) | 一种经由碳氢活化芳基化合成β2AR别构调节剂化合物的方法 | |
| JP2005232103A (ja) | 光学活性なビシナルジアミンおよびその製造方法 | |
| US20120071673A1 (en) | Synthesis of (s)-n-[2-(1,6,7,8-tetrahydro-2h-indeno-[5,4-b]furan-8-yl)ethyl]propionamide | |
| JP2003261522A (ja) | 光学活性フェニルアラニン誘導体の製造方法 | |
| CA2536901A1 (en) | Cycloalkylaminoacid compounds, processes for making and uses thereof | |
| US11453648B2 (en) | Method for producing orotic acid derivative | |
| JP5344523B2 (ja) | 立体選択的にストレッカー反応を進行させ得る触媒、およびそれを用いたα−アミノニトリル誘導体を立体選択的に製造するための方法 | |
| JP3547590B2 (ja) | 不斉ジルコニウム触媒 | |
| JP2002187873A (ja) | 光学活性1−(トリフルオロメチルモノ置換フェニル)エチルアミンの精製方法 | |
| JP4802191B2 (ja) | 軸不斉を有する光学活性な4級アンモニウム塩およびそれを用いたα−アミノ酸およびその誘導体の製造方法 | |
| JP4643566B2 (ja) | N−アシルヒドラゾンのアリル化方法 | |
| KR101890979B1 (ko) | 알카인을 이용한 아마이드 화합물의 제조방법 및 이를 이용한 펩타이드 제조 방법 | |
| JP4529419B2 (ja) | 光学活性含フッ素化合物類、及びこれらの製造方法 | |
| JP4310284B2 (ja) | エナミドのアゾ化合物への求核付加反応方法 | |
| CN109081785B (zh) | 一种含氟甘氨酸酯衍生物的合成方法 | |
| JP2000344694A (ja) | 光学活性3−ペンチン−2−オールの製造方法 | |
| JP2006151839A (ja) | α,β−不飽和カルボン酸誘導体からのエナンチオ選択的β−シアノカルボン酸誘導体の調製方法、及び該方法に用いる触媒 | |
| JP2025134168A (ja) | 銅触媒による立体特異的シアノ化反応 | |
| JP2002255933A (ja) | 光学活性7−アミノ−5−アザスピロ[2.4]ヘプタンの製造法 | |
| WO1998035934A1 (fr) | DERIVES DE η-OXO-HOMOPHENYLALANINE ET PROCEDE DE PRODUCTION DE DERIVES D'HOMOPHENYLALANINE PAR REDUCTION DE CES DERNIERS | |
| JP2831776B2 (ja) | 異性体分離法 | |
| JPH10182574A (ja) | α−アミノ酸アミド、α−アミノ酸及びそれらの誘導体を調製する方法 | |
| JP2000256284A (ja) | イミンおよびエナミンの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20061023 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100310 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100317 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20100419 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100713 |