ES2748136T3 - Método para aumentar el rendimiento de las crías - Google Patents
Método para aumentar el rendimiento de las crías Download PDFInfo
- Publication number
- ES2748136T3 ES2748136T3 ES08840208T ES08840208T ES2748136T3 ES 2748136 T3 ES2748136 T3 ES 2748136T3 ES 08840208 T ES08840208 T ES 08840208T ES 08840208 T ES08840208 T ES 08840208T ES 2748136 T3 ES2748136 T3 ES 2748136T3
- Authority
- ES
- Spain
- Prior art keywords
- animal
- composition
- algae
- fatty acids
- omega
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000000034 method Methods 0.000 title claims abstract description 66
- 239000000203 mixture Substances 0.000 claims abstract description 246
- MBMBGCFOFBJSGT-KUBAVDMBSA-N all-cis-docosa-4,7,10,13,16,19-hexaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCC(O)=O MBMBGCFOFBJSGT-KUBAVDMBSA-N 0.000 claims abstract description 164
- 241001465754 Metazoa Species 0.000 claims abstract description 137
- 241000195493 Cryptophyta Species 0.000 claims abstract description 122
- 235000020660 omega-3 fatty acid Nutrition 0.000 claims abstract description 103
- 229940012843 omega-3 fatty acid Drugs 0.000 claims abstract description 88
- 235000020669 docosahexaenoic acid Nutrition 0.000 claims abstract description 85
- 229940090949 docosahexaenoic acid Drugs 0.000 claims abstract description 82
- 239000006014 omega-3 oil Substances 0.000 claims abstract description 72
- JAZBEHYOTPTENJ-JLNKQSITSA-N all-cis-5,8,11,14,17-icosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O JAZBEHYOTPTENJ-JLNKQSITSA-N 0.000 claims abstract description 58
- 235000020673 eicosapentaenoic acid Nutrition 0.000 claims abstract description 58
- 229960005135 eicosapentaenoic acid Drugs 0.000 claims abstract description 58
- JAZBEHYOTPTENJ-UHFFFAOYSA-N eicosapentaenoic acid Natural products CCC=CCC=CCC=CCC=CCC=CCCCC(O)=O JAZBEHYOTPTENJ-UHFFFAOYSA-N 0.000 claims abstract description 58
- 230000000968 intestinal effect Effects 0.000 claims abstract description 35
- 150000002148 esters Chemical class 0.000 claims abstract description 34
- 235000015097 nutrients Nutrition 0.000 claims abstract description 23
- 238000004519 manufacturing process Methods 0.000 claims abstract description 22
- 241000894007 species Species 0.000 claims abstract description 17
- 238000002560 therapeutic procedure Methods 0.000 claims abstract 2
- 230000006651 lactation Effects 0.000 claims description 32
- 230000032258 transport Effects 0.000 claims description 32
- 239000003921 oil Substances 0.000 claims description 29
- 230000035935 pregnancy Effects 0.000 claims description 29
- 210000003205 muscle Anatomy 0.000 claims description 21
- 241000287828 Gallus gallus Species 0.000 claims description 20
- 235000020665 omega-6 fatty acid Nutrition 0.000 claims description 17
- 229940033080 omega-6 fatty acid Drugs 0.000 claims description 16
- 241000286209 Phasianidae Species 0.000 claims description 14
- 239000003963 antioxidant agent Substances 0.000 claims description 10
- 241000283707 Capra Species 0.000 claims description 7
- 229920002527 Glycogen Polymers 0.000 claims description 7
- 229940096919 glycogen Drugs 0.000 claims description 7
- 125000003147 glycosyl group Chemical group 0.000 claims description 7
- 230000004584 weight gain Effects 0.000 claims description 7
- 235000019786 weight gain Nutrition 0.000 claims description 7
- 241001494479 Pecora Species 0.000 claims description 6
- 241000282465 Canis Species 0.000 claims description 5
- 241000282324 Felis Species 0.000 claims description 5
- 230000003078 antioxidant effect Effects 0.000 claims description 5
- 241000283073 Equus caballus Species 0.000 claims description 2
- 241000272525 Anas platyrhynchos Species 0.000 claims 1
- 241000272534 Struthio camelus Species 0.000 claims 1
- 235000005911 diet Nutrition 0.000 description 115
- 230000037213 diet Effects 0.000 description 112
- 235000014113 dietary fatty acids Nutrition 0.000 description 68
- 229930195729 fatty acid Natural products 0.000 description 66
- 239000000194 fatty acid Substances 0.000 description 66
- 150000004665 fatty acids Chemical class 0.000 description 66
- 238000011282 treatment Methods 0.000 description 58
- 239000000047 product Substances 0.000 description 37
- 210000001630 jejunum Anatomy 0.000 description 33
- 235000019198 oils Nutrition 0.000 description 28
- 239000003925 fat Substances 0.000 description 27
- 235000019197 fats Nutrition 0.000 description 27
- 235000021323 fish oil Nutrition 0.000 description 26
- 210000001519 tissue Anatomy 0.000 description 26
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 19
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 19
- 235000013330 chicken meat Nutrition 0.000 description 18
- 235000020777 polyunsaturated fatty acids Nutrition 0.000 description 18
- 108090000623 proteins and genes Proteins 0.000 description 18
- 108091006277 SLC5A1 Proteins 0.000 description 17
- 102000058090 Sodium-Glucose Transporter 1 Human genes 0.000 description 17
- 241000282898 Sus scrofa Species 0.000 description 17
- 239000004615 ingredient Substances 0.000 description 16
- 102000004169 proteins and genes Human genes 0.000 description 16
- 241000282887 Suidae Species 0.000 description 15
- 240000008042 Zea mays Species 0.000 description 14
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 14
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 14
- 235000005822 corn Nutrition 0.000 description 14
- 235000013336 milk Nutrition 0.000 description 14
- 210000004080 milk Anatomy 0.000 description 14
- 239000008267 milk Substances 0.000 description 14
- 235000018102 proteins Nutrition 0.000 description 14
- YUFFSWGQGVEMMI-JLNKQSITSA-N (7Z,10Z,13Z,16Z,19Z)-docosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCCCC(O)=O YUFFSWGQGVEMMI-JLNKQSITSA-N 0.000 description 13
- 235000021294 Docosapentaenoic acid Nutrition 0.000 description 13
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 description 12
- 239000008103 glucose Substances 0.000 description 12
- 238000002360 preparation method Methods 0.000 description 12
- 241000233671 Schizochytrium Species 0.000 description 11
- 235000013312 flour Nutrition 0.000 description 11
- 239000012528 membrane Substances 0.000 description 11
- 102000058058 Glucose Transporter Type 2 Human genes 0.000 description 10
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 10
- 108091006299 SLC2A2 Proteins 0.000 description 10
- 235000020940 control diet Nutrition 0.000 description 10
- 230000000694 effects Effects 0.000 description 10
- 235000010469 Glycine max Nutrition 0.000 description 9
- 235000006708 antioxidants Nutrition 0.000 description 9
- 239000000872 buffer Substances 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 230000004190 glucose uptake Effects 0.000 description 9
- 210000004379 membrane Anatomy 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 241000196324 Embryophyta Species 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 8
- 238000005538 encapsulation Methods 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- 235000013305 food Nutrition 0.000 description 7
- 150000002632 lipids Chemical class 0.000 description 7
- 210000004185 liver Anatomy 0.000 description 7
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 6
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 244000060011 Cocos nucifera Species 0.000 description 6
- 235000013162 Cocos nucifera Nutrition 0.000 description 6
- 235000019733 Fish meal Nutrition 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 description 6
- 238000009395 breeding Methods 0.000 description 6
- 230000001488 breeding effect Effects 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 235000013601 eggs Nutrition 0.000 description 6
- 239000004467 fishmeal Substances 0.000 description 6
- 230000006377 glucose transport Effects 0.000 description 6
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 235000003441 saturated fatty acids Nutrition 0.000 description 6
- 239000013589 supplement Substances 0.000 description 6
- 241000272517 Anseriformes Species 0.000 description 5
- 241000283690 Bos taurus Species 0.000 description 5
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 5
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 5
- 229930195725 Mannitol Natural products 0.000 description 5
- 235000020661 alpha-linolenic acid Nutrition 0.000 description 5
- 235000011089 carbon dioxide Nutrition 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 229940013317 fish oils Drugs 0.000 description 5
- VZCCETWTMQHEPK-UHFFFAOYSA-N gamma-Linolensaeure Natural products CCCCCC=CCC=CCC=CCCCCC(O)=O VZCCETWTMQHEPK-UHFFFAOYSA-N 0.000 description 5
- VZCCETWTMQHEPK-QNEBEIHSSA-N gamma-linolenic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/CCCCC(O)=O VZCCETWTMQHEPK-QNEBEIHSSA-N 0.000 description 5
- 239000000499 gel Substances 0.000 description 5
- 239000000594 mannitol Substances 0.000 description 5
- 235000010355 mannitol Nutrition 0.000 description 5
- 235000012054 meals Nutrition 0.000 description 5
- 229920006395 saturated elastomer Polymers 0.000 description 5
- 150000004671 saturated fatty acids Chemical class 0.000 description 5
- 125000003821 2-(trimethylsilyl)ethoxymethyl group Chemical group [H]C([H])([H])[Si](C([H])([H])[H])(C([H])([H])[H])C([H])([H])C(OC([H])([H])[*])([H])[H] 0.000 description 4
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 4
- 241000251468 Actinopterygii Species 0.000 description 4
- 108010039627 Aprotinin Proteins 0.000 description 4
- 241001474374 Blennius Species 0.000 description 4
- 235000004977 Brassica sinapistrum Nutrition 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 241000283086 Equidae Species 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- 229930182816 L-glutamine Natural products 0.000 description 4
- GDBQQVLCIARPGH-UHFFFAOYSA-N Leupeptin Natural products CC(C)CC(NC(C)=O)C(=O)NC(CC(C)C)C(=O)NC(C=O)CCCN=C(N)N GDBQQVLCIARPGH-UHFFFAOYSA-N 0.000 description 4
- 235000019764 Soybean Meal Nutrition 0.000 description 4
- 241000271567 Struthioniformes Species 0.000 description 4
- 229960004405 aprotinin Drugs 0.000 description 4
- 235000021342 arachidonic acid Nutrition 0.000 description 4
- 229940114079 arachidonic acid Drugs 0.000 description 4
- 235000012343 cottonseed oil Nutrition 0.000 description 4
- 235000019784 crude fat Nutrition 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 235000019688 fish Nutrition 0.000 description 4
- 235000020664 gamma-linolenic acid Nutrition 0.000 description 4
- 229960002733 gamolenic acid Drugs 0.000 description 4
- KEMQGTRYUADPNZ-UHFFFAOYSA-N heptadecanoic acid Chemical compound CCCCCCCCCCCCCCCCC(O)=O KEMQGTRYUADPNZ-UHFFFAOYSA-N 0.000 description 4
- 238000003119 immunoblot Methods 0.000 description 4
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 4
- 229910052500 inorganic mineral Inorganic materials 0.000 description 4
- 108010052968 leupeptin Proteins 0.000 description 4
- GDBQQVLCIARPGH-ULQDDVLXSA-N leupeptin Chemical compound CC(C)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C=O)CCCN=C(N)N GDBQQVLCIARPGH-ULQDDVLXSA-N 0.000 description 4
- 235000020778 linoleic acid Nutrition 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000011707 mineral Substances 0.000 description 4
- 235000010755 mineral Nutrition 0.000 description 4
- 230000003647 oxidation Effects 0.000 description 4
- 238000007254 oxidation reaction Methods 0.000 description 4
- 108010091212 pepstatin Proteins 0.000 description 4
- 229950000964 pepstatin Drugs 0.000 description 4
- FAXGPCHRFPCXOO-LXTPJMTPSA-N pepstatin A Chemical compound OC(=O)C[C@H](O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)C[C@H](O)[C@H](CC(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)CC(C)C FAXGPCHRFPCXOO-LXTPJMTPSA-N 0.000 description 4
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 4
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 4
- 238000004626 scanning electron microscopy Methods 0.000 description 4
- 210000000813 small intestine Anatomy 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000004455 soybean meal Substances 0.000 description 4
- 235000012424 soybean oil Nutrition 0.000 description 4
- 239000003549 soybean oil Substances 0.000 description 4
- 230000009469 supplementation Effects 0.000 description 4
- 210000004291 uterus Anatomy 0.000 description 4
- 229940088594 vitamin Drugs 0.000 description 4
- 229930003231 vitamin Natural products 0.000 description 4
- 235000013343 vitamin Nutrition 0.000 description 4
- 239000011782 vitamin Substances 0.000 description 4
- DVSZKTAMJJTWFG-SKCDLICFSA-N (2e,4e,6e,8e,10e,12e)-docosa-2,4,6,8,10,12-hexaenoic acid Chemical compound CCCCCCCCC\C=C\C=C\C=C\C=C\C=C\C=C\C(O)=O DVSZKTAMJJTWFG-SKCDLICFSA-N 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 3
- GZJLLYHBALOKEX-UHFFFAOYSA-N 6-Ketone, O18-Me-Ussuriedine Natural products CC=CCC=CCC=CCC=CCC=CCC=CCCCC(O)=O GZJLLYHBALOKEX-UHFFFAOYSA-N 0.000 description 3
- 235000014698 Brassica juncea var multisecta Nutrition 0.000 description 3
- 235000006008 Brassica napus var napus Nutrition 0.000 description 3
- 235000006618 Brassica rapa subsp oleifera Nutrition 0.000 description 3
- 244000188595 Brassica sinapistrum Species 0.000 description 3
- 239000012839 Krebs-Henseleit buffer Substances 0.000 description 3
- 235000019755 Starter Diet Nutrition 0.000 description 3
- 230000009056 active transport Effects 0.000 description 3
- 150000001720 carbohydrates Chemical class 0.000 description 3
- 235000014633 carbohydrates Nutrition 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000012937 correction Methods 0.000 description 3
- 230000002354 daily effect Effects 0.000 description 3
- 230000000378 dietary effect Effects 0.000 description 3
- KAUVQQXNCKESLC-UHFFFAOYSA-N docosahexaenoic acid (DHA) Natural products COC(=O)C(C)NOCC1=CC=CC=C1 KAUVQQXNCKESLC-UHFFFAOYSA-N 0.000 description 3
- 238000013401 experimental design Methods 0.000 description 3
- -1 fatty acid ester Chemical class 0.000 description 3
- 235000021050 feed intake Nutrition 0.000 description 3
- 230000012447 hatching Effects 0.000 description 3
- 230000037427 ion transport Effects 0.000 description 3
- OYHQOLUKZRVURQ-IXWMQOLASA-N linoleic acid Natural products CCCCC\C=C/C\C=C\CCCCCCCC(O)=O OYHQOLUKZRVURQ-IXWMQOLASA-N 0.000 description 3
- 229960004488 linolenic acid Drugs 0.000 description 3
- 239000000944 linseed oil Substances 0.000 description 3
- 235000021388 linseed oil Nutrition 0.000 description 3
- 150000004668 long chain fatty acids Chemical class 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 210000000110 microvilli Anatomy 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 235000019799 monosodium phosphate Nutrition 0.000 description 3
- 210000004877 mucosa Anatomy 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 235000016709 nutrition Nutrition 0.000 description 3
- 235000014571 nuts Nutrition 0.000 description 3
- 239000006072 paste Substances 0.000 description 3
- WTWWXOGTJWMJHI-UHFFFAOYSA-N perflubron Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)Br WTWWXOGTJWMJHI-UHFFFAOYSA-N 0.000 description 3
- 244000144977 poultry Species 0.000 description 3
- 235000013594 poultry meat Nutrition 0.000 description 3
- 230000000384 rearing effect Effects 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 3
- 229910000162 sodium phosphate Inorganic materials 0.000 description 3
- 239000006054 starter diet Substances 0.000 description 3
- 238000007619 statistical method Methods 0.000 description 3
- 235000015112 vegetable and seed oil Nutrition 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- MJYQFWSXKFLTAY-OVEQLNGDSA-N (2r,3r)-2,3-bis[(4-hydroxy-3-methoxyphenyl)methyl]butane-1,4-diol;(2r,3r,4s,5s,6r)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O.C1=C(O)C(OC)=CC(C[C@@H](CO)[C@H](CO)CC=2C=C(OC)C(O)=CC=2)=C1 MJYQFWSXKFLTAY-OVEQLNGDSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 102100036009 5'-AMP-activated protein kinase catalytic subunit alpha-2 Human genes 0.000 description 2
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 2
- 102100040768 60S ribosomal protein L32 Human genes 0.000 description 2
- 241001482107 Alosa sapidissima Species 0.000 description 2
- NBSCHQHZLSJFNQ-GASJEMHNSA-N D-Glucose 6-phosphate Chemical compound OC1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H](O)[C@H]1O NBSCHQHZLSJFNQ-GASJEMHNSA-N 0.000 description 2
- 102000016911 Deoxyribonucleases Human genes 0.000 description 2
- 108010053770 Deoxyribonucleases Proteins 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101000783681 Homo sapiens 5'-AMP-activated protein kinase catalytic subunit alpha-2 Proteins 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- OYHQOLUKZRVURQ-HZJYTTRNSA-N Linoleic acid Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(O)=O OYHQOLUKZRVURQ-HZJYTTRNSA-N 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 239000000020 Nitrocellulose Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- 235000019485 Safflower oil Nutrition 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 235000019486 Sunflower oil Nutrition 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- 239000013504 Triton X-100 Substances 0.000 description 2
- 238000005273 aeration Methods 0.000 description 2
- 229940072056 alginate Drugs 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 229940094199 black currant oil Drugs 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 235000021324 borage oil Nutrition 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 230000005754 cellular signaling Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 239000002285 corn oil Substances 0.000 description 2
- 235000005687 corn oil Nutrition 0.000 description 2
- 230000001186 cumulative effect Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 2
- 150000002066 eicosanoids Chemical class 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 235000008524 evening primrose extract Nutrition 0.000 description 2
- 239000010475 evening primrose oil Substances 0.000 description 2
- 229940089020 evening primrose oil Drugs 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 235000019387 fatty acid methyl ester Nutrition 0.000 description 2
- 235000004426 flaxseed Nutrition 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- 235000012041 food component Nutrition 0.000 description 2
- 239000005417 food ingredient Substances 0.000 description 2
- 238000004817 gas chromatography Methods 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 235000003869 genetically modified organism Nutrition 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 238000001114 immunoprecipitation Methods 0.000 description 2
- 239000002198 insoluble material Substances 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 235000020667 long-chain omega-3 fatty acid Nutrition 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 235000021416 maternal diet Nutrition 0.000 description 2
- 230000008774 maternal effect Effects 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 235000006109 methionine Nutrition 0.000 description 2
- 235000021281 monounsaturated fatty acids Nutrition 0.000 description 2
- 229920001220 nitrocellulos Polymers 0.000 description 2
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 230000008092 positive effect Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 235000005713 safflower oil Nutrition 0.000 description 2
- 239000003813 safflower oil Substances 0.000 description 2
- FQENQNTWSFEDLI-UHFFFAOYSA-J sodium diphosphate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]P([O-])(=O)OP([O-])([O-])=O FQENQNTWSFEDLI-UHFFFAOYSA-J 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 229940048086 sodium pyrophosphate Drugs 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- 239000002600 sunflower oil Substances 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 235000019818 tetrasodium diphosphate Nutrition 0.000 description 2
- 239000001577 tetrasodium phosphonato phosphate Substances 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 235000019165 vitamin E Nutrition 0.000 description 2
- 239000011709 vitamin E Substances 0.000 description 2
- YKHVVNDSWHSBPA-BLHCBFLLSA-N (2E,4E)-deca-2,4-dienoic acid Chemical compound CCCCC\C=C\C=C\C(O)=O YKHVVNDSWHSBPA-BLHCBFLLSA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- OYHQOLUKZRVURQ-NTGFUMLPSA-N (9Z,12Z)-9,10,12,13-tetratritiooctadeca-9,12-dienoic acid Chemical compound C(CCCCCCC\C(=C(/C\C(=C(/CCCCC)\[3H])\[3H])\[3H])\[3H])(=O)O OYHQOLUKZRVURQ-NTGFUMLPSA-N 0.000 description 1
- YKHVVNDSWHSBPA-UHFFFAOYSA-N 2,4-Decadienoic acid Natural products CCCCCC=CC=CC(O)=O YKHVVNDSWHSBPA-UHFFFAOYSA-N 0.000 description 1
- 239000001763 2-hydroxyethyl(trimethyl)azanium Substances 0.000 description 1
- 108010011619 6-Phytase Proteins 0.000 description 1
- JBYXPOFIGCOSSB-GOJKSUSPSA-N 9-cis,11-trans-octadecadienoic acid Chemical compound CCCCCC\C=C\C=C/CCCCCCCC(O)=O JBYXPOFIGCOSSB-GOJKSUSPSA-N 0.000 description 1
- RTRQQBHATOEIAF-UHFFFAOYSA-N AICA riboside Natural products NC1=C(C(=O)N)N=CN1C1C(O)C(O)C(CO)O1 RTRQQBHATOEIAF-UHFFFAOYSA-N 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 241000200158 Amphidinium Species 0.000 description 1
- 235000019737 Animal fat Nutrition 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 240000002900 Arthrospira platensis Species 0.000 description 1
- 235000016425 Arthrospira platensis Nutrition 0.000 description 1
- 206010003497 Asphyxia Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 241000157302 Bison bison athabascae Species 0.000 description 1
- 240000002791 Brassica napus Species 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 244000020518 Carthamus tinctorius Species 0.000 description 1
- 241000200138 Ceratium Species 0.000 description 1
- 241000227752 Chaetoceros Species 0.000 description 1
- 241000195649 Chlorella <Chlorellales> Species 0.000 description 1
- 235000019743 Choline chloride Nutrition 0.000 description 1
- 241001300810 Cochlodinium Species 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 235000019750 Crude protein Nutrition 0.000 description 1
- 241000199912 Crypthecodinium cohnii Species 0.000 description 1
- 241001147476 Cyclotella Species 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- 239000004470 DL Methionine Substances 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 241000199914 Dinophyceae Species 0.000 description 1
- 208000035240 Disease Resistance Diseases 0.000 description 1
- 241000271559 Dromaiidae Species 0.000 description 1
- 241000283074 Equus asinus Species 0.000 description 1
- 239000004258 Ethoxyquin Substances 0.000 description 1
- 206010015719 Exsanguination Diseases 0.000 description 1
- 102000018711 Facilitative Glucose Transport Proteins Human genes 0.000 description 1
- 108010027279 Facilitative Glucose Transport Proteins Proteins 0.000 description 1
- 108010073178 Glucan 1,4-alpha-Glucosidase Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 241000200139 Gonyaulax Species 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000672453 Homo sapiens 60S ribosomal protein L32 Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- 241001501885 Isochrysis Species 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 235000019738 Limestone Nutrition 0.000 description 1
- 235000004431 Linum usitatissimum Nutrition 0.000 description 1
- 240000006240 Linum usitatissimum Species 0.000 description 1
- 208000035752 Live birth Diseases 0.000 description 1
- 240000004658 Medicago sativa Species 0.000 description 1
- 235000017587 Medicago sativa ssp. sativa Nutrition 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- DFPAKSUCGFBDDF-UHFFFAOYSA-N Nicotinamide Chemical compound NC(=O)C1=CC=CN=C1 DFPAKSUCGFBDDF-UHFFFAOYSA-N 0.000 description 1
- 241000180701 Nitzschia <flatworm> Species 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 241000199911 Peridinium Species 0.000 description 1
- 235000004347 Perilla Nutrition 0.000 description 1
- 244000124853 Perilla frutescens Species 0.000 description 1
- 102000015439 Phospholipases Human genes 0.000 description 1
- 108010064785 Phospholipases Proteins 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 229920001030 Polyethylene Glycol 4000 Polymers 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 102000002278 Ribosomal Proteins Human genes 0.000 description 1
- 108010000605 Ribosomal Proteins Proteins 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 229930182558 Sterol Natural products 0.000 description 1
- WBWWGRHZICKQGZ-UHFFFAOYSA-N Taurocholic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(=O)NCCS(O)(=O)=O)C)C1(C)C(O)C2 WBWWGRHZICKQGZ-UHFFFAOYSA-N 0.000 description 1
- 101000959274 Tenebrio molitor Antidiuretic factor A Proteins 0.000 description 1
- BGNXCDMCOKJUMV-UHFFFAOYSA-N Tert-Butylhydroquinone Chemical compound CC(C)(C)C1=CC(O)=CC=C1O BGNXCDMCOKJUMV-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 244000098338 Triticum aestivum Species 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 235000019742 Vitamins premix Nutrition 0.000 description 1
- 101100118936 Xenopus laevis epabp-a gene Proteins 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- RTRQQBHATOEIAF-UUOKFMHZSA-N acadesine Chemical compound NC1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RTRQQBHATOEIAF-UUOKFMHZSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- OENHQHLEOONYIE-UKMVMLAPSA-N all-trans beta-carotene Natural products CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C OENHQHLEOONYIE-UKMVMLAPSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- OGBUMNBNEWYMNJ-UHFFFAOYSA-N batilol Chemical class CCCCCCCCCCCCCCCCCCOCC(O)CO OGBUMNBNEWYMNJ-UHFFFAOYSA-N 0.000 description 1
- DQGMPXYVZZCNDQ-OBWVEWQSSA-N beta-calendic acid Chemical compound CCCCC\C=C\C=C\C=C\CCCCCCC(O)=O DQGMPXYVZZCNDQ-OBWVEWQSSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 235000013734 beta-carotene Nutrition 0.000 description 1
- 239000011648 beta-carotene Substances 0.000 description 1
- TUPZEYHYWIEDIH-WAIFQNFQSA-N beta-carotene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2=CCCCC2(C)C TUPZEYHYWIEDIH-WAIFQNFQSA-N 0.000 description 1
- 229960002747 betacarotene Drugs 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- 229940043253 butylated hydroxyanisole Drugs 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 1
- 238000010805 cDNA synthesis kit Methods 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- FAPWYRCQGJNNSJ-UBKPKTQASA-L calcium D-pantothenic acid Chemical compound [Ca+2].OCC(C)(C)[C@@H](O)C(=O)NCCC([O-])=O.OCC(C)(C)[C@@H](O)C(=O)NCCC([O-])=O FAPWYRCQGJNNSJ-UBKPKTQASA-L 0.000 description 1
- 229960002079 calcium pantothenate Drugs 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 239000000828 canola oil Substances 0.000 description 1
- 235000019519 canola oil Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- SGMZJAMFUVOLNK-UHFFFAOYSA-M choline chloride Chemical compound [Cl-].C[N+](C)(C)CCO SGMZJAMFUVOLNK-UHFFFAOYSA-M 0.000 description 1
- 229960003178 choline chloride Drugs 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229940108924 conjugated linoleic acid Drugs 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 238000000326 densiometry Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 235000013367 dietary fats Nutrition 0.000 description 1
- 235000019621 digestibility Nutrition 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- PXEDJBXQKAGXNJ-QTNFYWBSSA-L disodium L-glutamate Chemical compound [Na+].[Na+].[O-]C(=O)[C@@H](N)CCC([O-])=O PXEDJBXQKAGXNJ-QTNFYWBSSA-L 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 239000008393 encapsulating agent Substances 0.000 description 1
- 235000019285 ethoxyquin Nutrition 0.000 description 1
- DECIPOUIJURFOJ-UHFFFAOYSA-N ethoxyquin Chemical compound N1C(C)(C)C=C(C)C2=CC(OCC)=CC=C21 DECIPOUIJURFOJ-UHFFFAOYSA-N 0.000 description 1
- 229940093500 ethoxyquin Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 239000002778 food additive Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 229940098330 gamma linoleic acid Drugs 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 230000002394 glycogenic effect Effects 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 239000008173 hydrogenated soybean oil Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 230000013016 learning Effects 0.000 description 1
- 239000006028 limestone Substances 0.000 description 1
- KQQKGWQCNNTQJW-UHFFFAOYSA-N linolenic acid Natural products CC=CCCC=CCC=CCCCCCCCC(O)=O KQQKGWQCNNTQJW-UHFFFAOYSA-N 0.000 description 1
- 210000005228 liver tissue Anatomy 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- FFEARJCKVFRZRR-UHFFFAOYSA-N methionine Chemical compound CSCCC(N)C(O)=O FFEARJCKVFRZRR-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 235000013379 molasses Nutrition 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 235000013923 monosodium glutamate Nutrition 0.000 description 1
- 230000007658 neurological function Effects 0.000 description 1
- 229960003966 nicotinamide Drugs 0.000 description 1
- 235000005152 nicotinamide Nutrition 0.000 description 1
- 239000011570 nicotinamide Substances 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 230000000474 nursing effect Effects 0.000 description 1
- 235000019488 nut oil Nutrition 0.000 description 1
- 235000015816 nutrient absorption Nutrition 0.000 description 1
- 235000021049 nutrient content Nutrition 0.000 description 1
- 235000021048 nutrient requirements Nutrition 0.000 description 1
- 235000021231 nutrient uptake Nutrition 0.000 description 1
- 235000006180 nutrition needs Nutrition 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-N palmitic acid group Chemical group C(CCCCCCCCCCCCCCC)(=O)O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 238000003359 percent control normalization Methods 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 229940085127 phytase Drugs 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- LXNHXLLTXMVWPM-UHFFFAOYSA-N pyridoxine Chemical compound CC1=NC=C(CO)C(CO)=C1O LXNHXLLTXMVWPM-UHFFFAOYSA-N 0.000 description 1
- 235000019171 pyridoxine hydrochloride Nutrition 0.000 description 1
- 239000011764 pyridoxine hydrochloride Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 229940119224 salmon oil Drugs 0.000 description 1
- 235000021003 saturated fats Nutrition 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 229940073490 sodium glutamate Drugs 0.000 description 1
- 235000013599 spices Nutrition 0.000 description 1
- 229940082787 spirulina Drugs 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 150000003432 sterols Chemical class 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000012134 supernatant fraction Substances 0.000 description 1
- 230000001502 supplementing effect Effects 0.000 description 1
- WBWWGRHZICKQGZ-GIHLXUJPSA-N taurocholic acid Chemical compound C([C@@H]1C[C@H]2O)[C@@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@@H]([C@@H](CCC(=O)NCCS(O)(=O)=O)C)[C@@]2(C)[C@H](O)C1 WBWWGRHZICKQGZ-GIHLXUJPSA-N 0.000 description 1
- 239000004250 tert-Butylhydroquinone Substances 0.000 description 1
- 235000019281 tert-butylhydroquinone Nutrition 0.000 description 1
- 229960003495 thiamine Drugs 0.000 description 1
- DPJRMOMPQZCRJU-UHFFFAOYSA-M thiamine hydrochloride Chemical compound Cl.[Cl-].CC1=C(CCO)SC=[N+]1CC1=CN=C(C)N=C1N DPJRMOMPQZCRJU-UHFFFAOYSA-M 0.000 description 1
- 235000010384 tocopherol Nutrition 0.000 description 1
- 229960001295 tocopherol Drugs 0.000 description 1
- 229930003799 tocopherol Natural products 0.000 description 1
- 239000011732 tocopherol Substances 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- MEYZYGMYMLNUHJ-UHFFFAOYSA-N tunicamycin Natural products CC(C)CCCCCCCCCC=CC(=O)NC1C(O)C(O)C(CC(O)C2OC(C(O)C2O)N3C=CC(=O)NC3=O)OC1OC4OC(CO)C(O)C(O)C4NC(=O)C MEYZYGMYMLNUHJ-UHFFFAOYSA-N 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 235000021122 unsaturated fatty acids Nutrition 0.000 description 1
- 150000004670 unsaturated fatty acids Chemical class 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 230000004304 visual acuity Effects 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019166 vitamin D Nutrition 0.000 description 1
- 239000011710 vitamin D Substances 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 229940011671 vitamin b6 Drugs 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 210000001325 yolk sac Anatomy 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
- OENHQHLEOONYIE-JLTXGRSLSA-N β-Carotene Chemical compound CC=1CCCC(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C OENHQHLEOONYIE-JLTXGRSLSA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/02—Algae
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K20/00—Accessory food factors for animal feeding-stuffs
- A23K20/10—Organic substances
- A23K20/158—Fatty acids; Fats; Products containing oils or fats
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K40/00—Shaping or working-up of animal feeding-stuffs
- A23K40/30—Shaping or working-up of animal feeding-stuffs by encapsulating; by coating
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K50/00—Feeding-stuffs specially adapted for particular animals
- A23K50/30—Feeding-stuffs specially adapted for particular animals for swines
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K50/00—Feeding-stuffs specially adapted for particular animals
- A23K50/70—Feeding-stuffs specially adapted for particular animals for birds
- A23K50/75—Feeding-stuffs specially adapted for particular animals for birds for poultry
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/115—Fatty acids or derivatives thereof; Fats or oils
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/115—Fatty acids or derivatives thereof; Fats or oils
- A23L33/12—Fatty acids or derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/20—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids
- A61K31/202—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids having three or more double bonds, e.g. linolenic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Polymers & Plastics (AREA)
- Engineering & Computer Science (AREA)
- Food Science & Technology (AREA)
- Zoology (AREA)
- Animal Husbandry (AREA)
- Birds (AREA)
- Mycology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Nutrition Science (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Epidemiology (AREA)
- Biotechnology (AREA)
- Natural Medicines & Medicinal Plants (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Alternative & Traditional Medicine (AREA)
- Botany (AREA)
- Medical Informatics (AREA)
- Microbiology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Fodder In General (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Un método no terapéutico de aumento del transporte intestinal de nutrientes en las crías de un animal, comprendiendo el método las etapas de administración al animal de una composición de pienso que comprende una composición de algas o una composición no de algas que comprende ácidos grasos omega-3 o ésteres de los mismos; y el aumento del transporte intestinal en las crías del animal, donde i) la relación de ácido docosahexaenoico respecto al ácido eicosapentaenoico en la composición de algas es aproximadamente de 60:1 a aproximadamente 1:1 y el animal es una cerda gestante, una cerda post-parto, otra especie de animal de producción, un ser humano, o un animal de compañía, o ii) la relación de ácido docosahexaenoico respecto al ácido eicosapentaenoico en la composición no de algas es aproximadamente de 30:1 a aproximadamente 1:1 y el animal es una especie de animal de producción distinto de un cerdo, un ser humano, o un animal de compañía; donde la composición de pienso como mezcla final comprende aproximadamente un 0,01 % a aproximadamente un 4,0 % por peso de la composición de algas o la composición no de algas.
Description
DESCRIPCIÓN
Método para aumentar el rendimiento de las crías
Campo de la invención
La invención se refiere a métodos para aumentar el transporte intestinal de nutrientes en las crías de un animal, y composiciones de los mismos. La invención se refiere a métodos para aumentar el rendimiento de crecimiento de las crías de un animal, y composiciones de los mismos.
Antecedentes y sumario
Los ácidos grasos omega-3 y omega-6 y sus metabolitos regulan numerosas actividades in vivo, incluyendo la inflamación, resistencia a la enfermedad, función de plaquetas y contracciones de la pared vascular. Además, se ha informado que el suplemento de ácidos grasos omega-3 y/o el ácido gamma linolénico presentes en la dieta de animales y seres humanos tiene efectos favorables sobre la enfermedad cardíaca, trastornos inflamatorios y autoinmunitarios, diabetes, enfermedad renal, cáncer, e inmunidad, así como el aprendizaje, agudeza visual y función neurológica.
A nivel celular, los ácidos grasos omega-3 de cadena larga se incorporan fácilmente en la fracción fosfolipídica de las membranas celulares donde tienen influencia sobre la permeabilidad/fluidez de la membrana y el transporte. Esto representa una forma de almacenamiento de estos ácidos grasos, donde se mantienen hasta que actúan mediante las enzimas fosfolipasas que los liberan para la conversión adicional en eicosanoides.
Los ácidos linoleico y alfa linolénico son ácidos grasos que contienen C18 que son compuestos parentales de las familias de ácido grasos omega-6 y omega-3, respectivamente. Los ácidos grasos omega-3 y omega-6 se someten a insaturación (es decir, adición de dobles enlaces) y alargamiento secuencial desde el extremo carboxilo (es decir, añadiendo 2 unidades de carbono) con la enzima D6-desaturasa siendo la tasa de enzima limitante en el metabolismo de estos ácidos grasos de cadena larga. Las mismas enzimas se utilizan para estas familias, haciendo que las familias sean antagónicas unas de otras. Dicho antagonismo, que resultan de las necesidades de las mismas enzimas, se extiende en el metabolismo adicional de los miembros que contienen C20 de estas familias en los llamados eicosanoides.
Los ácidos grasos poliinsaturados, incluyendo los ácidos grasos omega-3 y omega-6, se diferencian de otros ácidos grasos en que no se pueden sintetizar en el cuerpo a partir de ácidos grasos saturados o monoinsaturados, sino que se deben obtener de la dieta. El ácido graso omega-6, ácido linoleico, se encuentra en grandes cantidades en los aceites vegetales tales como de maíz, semilla de algodón, soja, cártamo y aceite de girasol. El ácido graso omega-3, ácido alfa-linolénico, se encuentra en grandes cantidades en el aceite de linaza, aceite de semilla de lino, aceite de perilla y aceite de canola. Otro compuesto importante incluye el ácido araquidónico, que se encuentra en la grasa animal; el ácido gamma linolénico, que se encuentra en el aceite de onagra, aceite de borraja, y aceite de grosella negra; y ácido eicosapentaenoico, ácido docosahexaenoico, y ácido docosapentaenoico derivado de aceites de pescado y algas. Estos ácidos grasos de cadena larga se pueden formar en el cuerpo mediante el alargamiento y desaturación de los ácidos linoleico y alfa-linolénico parentales si los compuestos parentales se suministran en la dieta.
Los documentos WO 2004/095940 A1, WO 03/017945 A2, WO 2004/080196 A2 y US 2006/0217385 A1 desvelan loas fuentes de PUFA (PolyUnsaturated Fatty Acids) de algas y composiciones nutricionales que comprenden dichas fuentes.
Los solicitantes han descubierto que la suplementación de la dieta de los animales con ácidos grasos poliinsaturados, incluyendo ácidos grasos omega-3, derivados de fuentes de algas y fuentes no algas que tienen alto contenido en ácido docosahexaenoico, da como resultado efectos positivos para las crías del animal cuando la madre se alimenta con estas composiciones que contienen ácidos grasos. De manera interesante, estas composiciones producen efectos positivos para las crías incluyendo el aumento de transporte intestinal y un aumento del rendimiento de crecimiento, incluyendo un aumento de la tasa de crecimiento, una disminución de pienso para la ganancia de peso y un aumento en la eficacia de utilización del pienso.
Los métodos y composiciones para aumentar el transporte intestinal de nutrientes en una cría de un animal se describen en el presente documento.
Específicamente, la presente invención proporciona las siguientes realizaciones definidas en las reivindicaciones adjuntas.
Se desvela en el presente documento un método de aumento del transporte intestinal de nutrientes en las crías de un animal al que se le proporciona. El método comprende las etapas de administración al animal de un composición de un pienso que comprende una composición de algas que comprende ácidos grasos omega-3 o ésteres de los
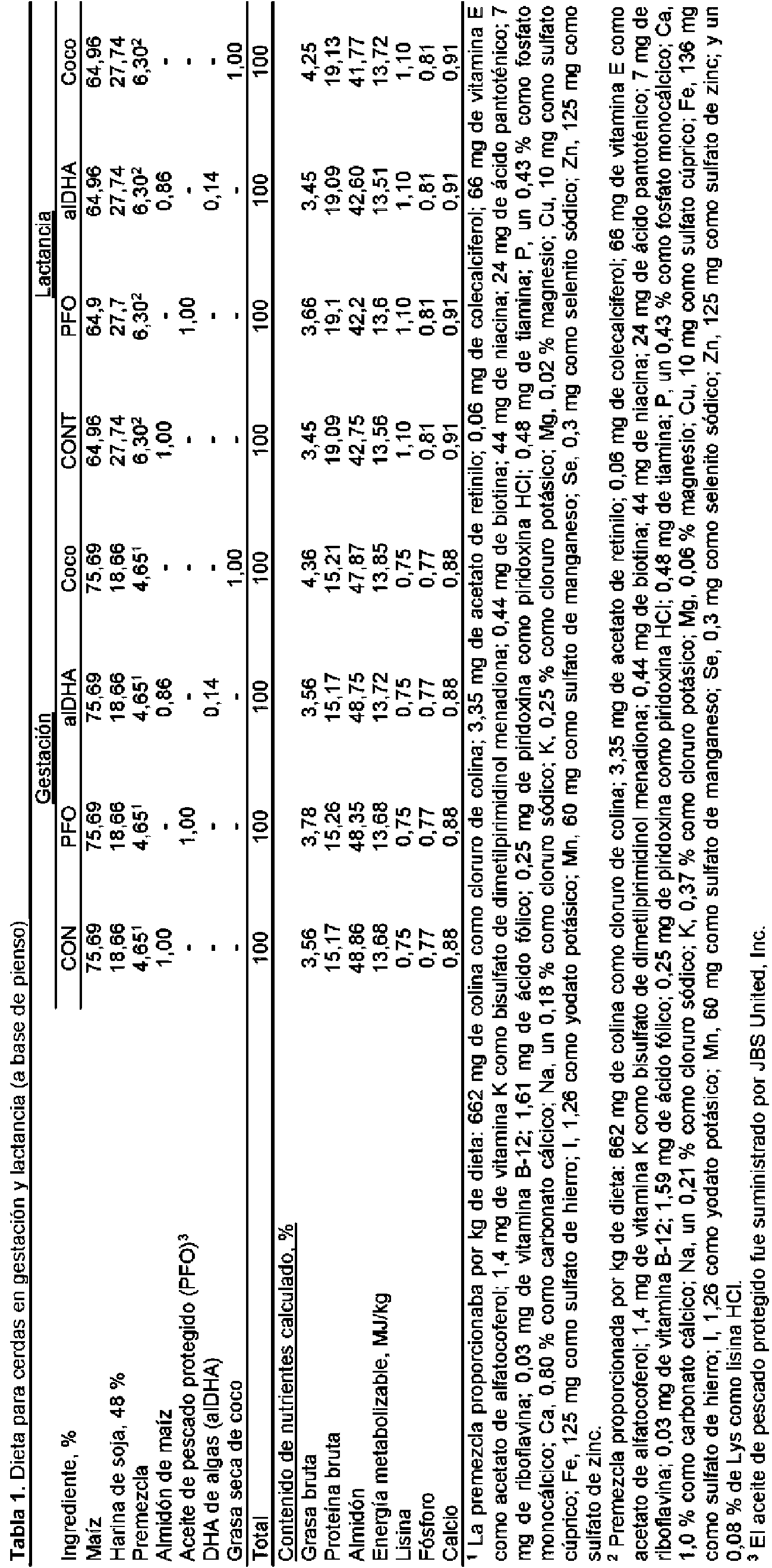
mismos, donde la composición de pienso como mezcla final comprende aproximadamente de un 0,01 % a aproximadamente un 60 % por peso de la composición de algas y donde el animal es una cerda gestante, una cerda postparto, otra especie de animal de producción, un animal de compañía, o un ser humano, y el aumento del transporte intestinal en las crías del animal.
La composición de algas puede estar en forma de algas secas o un aceite derivado de las algas y los ácidos grasos omega-3 pueden comprender ácidos grasos omega-3 C22 o C20. La composición de pienso como mezcla final puede comprender de aproximadamente 0,01 % a aproximadamente 3,0 % por peso, de aproximadamente 0,01 % a aproximadamente 4,0% por peso, de aproximadamente 0,01% a aproximadamente 1,5% por peso, de aproximadamente 0,01 % a aproximadamente 1,0 % por peso, de aproximadamente 0,01 % a aproximadamente 0,8 % por peso, de aproximadamente 0,01 % a aproximadamente 0,5 % por peso, de aproximadamente 0,01 % a aproximadamente 0,3% por peso, de aproximadamente 0,1% a aproximadamente 0,5% por peso, de aproximadamente 0,01 % a aproximadamente 18% por peso, de aproximadamente 0,01 % a aproximadamente 20 % por peso, de aproximadamente 0,01 % a aproximadamente 30 % por peso, de aproximadamente 0,01 % a aproximadamente 40 % por peso, de aproximadamente 0,01 % a aproximadamente 50 % por peso, o de aproximadamente 0.01 % a aproximadamente 60 % por peso de la composición de algas.
La composición de pienso como mezcla final puede comprender adicionalmente ácidos grasos omega-6 o ésteres de los mismos, la composición de pienso se puede administrar durante la lactancia, gestación, o diariamente al animal, la composición de pienso como mezcla final puede comprender adicionalmente un antioxidante, los ácidos grasos omega-3 en la composición de pienso pueden estar estabilizados por encapsulación, los ácidos grasos omega-3 pueden comprender ácido docosahexaenoico y ácido eicosapentaenoico, y los ácidos grasos omega-3 pueden comprender ácido docosahexaenoico, ácido eicosapentaenoico y ácido docosapentaenoico. Adicionalmente de acuerdo con esta realización, la relación de ácido docosahexaenoico con respecto al ácido eicosapentaenoico puede ser de aproximadamente 60:1, aproximadamente 30:1, aproximadamente 28:1, aproximadamente 25:1, aproximadamente 20:1, aproximadamente 15:1, aproximadamente 10:1, aproximadamente 5:1, o aproximadamente 2:1. Las especies de animales de producción se pueden seleccionar de entre el grupo que consiste en pollos, caballos, ponys, vacas, pavos, faisanes, codornices, animales ovinos, cabras, avestruces y patos, y el animal de compañía se puede seleccionar de entre el grupo que consiste en una especie canina y una especie felina.
Se desvela en el presente documento un método de aumento del transporte intestinal de nutrientes en un lechón. El método comprende las etapas de administración al lechón una composición de pienso que comprende una composición de algas que comprende ácidos grasos omega-3 o ésteres de los mismos, donde la composición de algas comprende ácido docosahexaenoico y ácido eicosapentaenoico y la relación del ácido docosahexaenoico respecto al ácido eicosapentaenoico en la composición de algas es de aproximadamente 30:1 a aproximadamente 1:1, y aumenta el transporte intestinal en el lechón.
La composición de algas puede estar en forma de algas secas o un aceite derivado de las algas y los ácidos grasos omega-3 pueden comprender ácidos grasos omega-3 C22 o C20. También de acuerdo con esta realización, la composición de pienso como mezcla final puede comprender de aproximadamente 0,01 % a aproximadamente 3,0 % por peso, de aproximadamente 0,01 % a aproximadamente 4,0 % por peso, de aproximadamente 0,01 % a aproximadamente 1,5% por peso, de aproximadamente 0,01% a aproximadamente 1,0 % por peso, de aproximadamente 0,01 % a aproximadamente 0,8 % por peso, de aproximadamente 0,01 % a aproximadamente 0,5% por peso, de aproximadamente 0,01 % a aproximadamente 0,3% por peso, de aproximadamente 0,1 % a aproximadamente 0,5% por peso, de aproximadamente 0,01% a aproximadamente 18% por peso, de aproximadamente 0,01 % a aproximadamente 20 % por peso, de aproximadamente 0,01 % a aproximadamente 30 % por peso, de aproximadamente 0,01 % a aproximadamente 40 % por peso, de aproximadamente 0,01 % a aproximadamente 50 % por peso, o de aproximadamente 0,01 % a aproximadamente 60 % por peso de la composición de algas.
La composición de pienso como mezcla final puede comprender adicionalmente ácidos grasos omega-6 o ésteres de los mismos, la composición de pienso se puede administrar durante la lactancia, gestación, o diariamente al animal, la composición de pienso como mezcla final puede comprender adicionalmente un antioxidante, los ácidos grasos omega-3 en la composición de pienso pueden estar estabilizados por encapsulación, los ácidos grasos omega-3 pueden comprender adicionalmente el ácido docosapentaenoico. Adicionalmente, la relación de ácido docosahexaenoico respecto a ácido eicosapentaenoico puede ser de aproximadamente 30:1, aproximadamente 28:1, aproximadamente 25:1, aproximadamente 20:1, aproximadamente 15:1, aproximadamente 10:1, aproximadamente 5:1, o aproximadamente 1:1.
Se desvela adicionalmente en el presente documento un método de aumento del transporte intestinal de nutrientes en las crías de un animal. El método comprende las etapas de administración al animal de un composición de un pienso que comprende una composición no de algas que comprende ácidos grasos omega-3 o ésteres de los mismos, donde la relación de ácido docosahexaenoico respecto al ácido eicosapentaenoico es aproximadamente de 30:1 a aproximadamente 1:1 y donde el animal es una cerda gestante, una cerda postparto, otra especie de animal de producción, un animal de compañía, o un ser humano, y el aumento del transporte intestinal en las crías del animal.
Los ácidos grasos omega-3 pueden comprender ácidos grasos omega-3 C22 o C20. La composición de pienso como mezcla final puede comprender de aproximadamente 0,01 % a aproximadamente 3,0 % por peso, de aproximadamente 0,01 % a aproximadamente 4,0 % por peso, de aproximadamente 0,01 % a aproximadamente 1,5 % por peso, de aproximadamente 0,01 % a aproximadamente 1,0 % por peso, de aproximadamente 0,01 % a aproximadamente 0,8 % por peso, de aproximadamente 0,01 % a aproximadamente 0,5 % por peso, de aproximadamente 0,01 % a aproximadamente 0,3% por peso, de aproximadamente 0,1 % a aproximadamente 0,5% por peso, de aproximadamente 0,01 % a aproximadamente 18% por peso, de aproximadamente 0,01 % a aproximadamente 20 % por peso, de aproximadamente 0,01 % a aproximadamente 30 % por peso, de aproximadamente 0,01 % a aproximadamente 40 % por peso, de aproximadamente 0,01 % a aproximadamente 50 % por peso, o de aproximadamente 0,01 % a aproximadamente 70 % por peso de la composición de algas.
La composición de pienso como mezcla final puede comprender adicionalmente ácidos grasos omega-6 o ésteres de los mismos, la composición de pienso se puede administrar durante la lactancia, gestación, o diariamente al animal, la composición de pienso como mezcla final puede comprender adicionalmente un antioxidante, los ácidos grasos omega-3 en la composición de pienso pueden estar estabilizados por encapsulación, los ácidos grasos omega-3 pueden comprender adicionalmente el ácido docosapentaenoico. Adicionalmente, la relación de ácido docosahexaenoico con respecto al ácido eicosapentaenoico puede ser de aproximadamente 25:1, aproximadamente 20:1, aproximadamente 15:1, aproximadamente 10:1, aproximadamente 5:1, o aproximadamente 2:1. Las especies de animales de producción se pueden seleccionar de entre el grupo que consiste en pollos, caballos, ponys, vacas, pavos, faisanes, codornices, animales ovinos, cabras, avestruces y patos, y el animal de compañía se puede seleccionar de entre el grupo que consiste en una especie canina y una especie felina.
Se desvela adicionalmente en el presente documento un método de aumento del rendimiento de crecimiento de las crías de un animal. El método comprende las etapas de administración al animal de una composición de un pienso que comprende una composición de algas que comprende ácidos grasos omega-3 o ésteres de los mismos, donde la composición de algas comprende ácido docosahexaenoico y ácido eicosapentaenoico y la relación de ácido docosahexaenoico con respecto al ácido eicosapentaenoico es de aproximadamente 60:1 a aproximadamente 1:1 y donde el animal es una cerda gestante, una cerda postparto, otra especie de animal de producción, un animal de compañía, o un ser humano, y el aumento del rendimiento de crecimiento de las crías del animal. El rendimiento de crecimiento se selecciona de entre el grupo que consiste en un aumento de la tasa de crecimiento de las crías, una disminución de la relación de pienso respecto a ganancia de peso de las crías, y un aumento de la eficacia de utilización del pienso.
Se desvela adicionalmente en el presente documento un método de aumento del rendimiento de crecimiento de las crías de un animal. El método comprende las etapas de administración al animal de un composición de un pienso que comprende una composición de algas que comprende ácidos grasos omega-3 o ésteres de los mismos, donde la composición de pienso como mezcla final comprende aproximadamente de un 0,01 % a aproximadamente un 60 % por peso de la composición de algas y donde el animal es una cerda gestante, una cerda postparto, otra especie de animal de producción, un animal de compañía, o un ser humano, y el aumento del rendimiento de crecimiento de las crías del animal. En un aspecto, el rendimiento de crecimiento se selecciona de entre el grupo que consiste en un aumento de la tasa de crecimiento de las crías y una disminución de la relación de pienso respecto a ganancia de peso de las crías.
Se desvela adicionalmente en el presente documento un aumento del rendimiento de crecimiento de las crías de un animal. El método comprende las etapas de administración al animal de un composición de un pienso que comprende una composición no de algas que comprende ácidos grasos omega-3 o esteres de los mismos, donde la relación del ácido docosahexaenoico respecto al ácido eicosapentaenoico en la composición no de algas es de aproximadamente 30:1 a aproximadamente 1:1 y donde el animal es una especie de animal de producción distinta de un cerdo, un animal de compañía, o un ser humano, y el aumento del rendimiento de crecimiento de las crías del animal; donde el rendimiento de crecimiento se puede seleccionar de entre el grupo que consiste en un aumento de la tasa de crecimiento de las crías y una disminución de la relación de pienso con respecto a la ganancia de peso de las crías.
Se desvela adicionalmente en el presente documento un método de aumento del rendimiento de crecimiento de las crías de un animal. El método comprende las etapas de administración al animal de un composición de un pienso que comprende una composición no de algas que comprende ácidos grasos omega-3 o ésteres de los mismos, donde la composición del pienso como mezcla final puede comprender desde aproximadamente un 0,01 % a aproximadamente un 90 % por peso de la composición no de algas, donde el animal es una especie de animal de producción, un animal de compañía, o un ser humano, y el aumento del rendimiento de crecimiento de las crías del animal, donde el rendimiento de crecimiento se puede seleccionar de entre el grupo que consiste en un aumento de la tasa de crecimiento de las crías y una disminución de la relación del pienso con respecto a la ganancia de peso de las crías.
Se desvela adicionalmente en el presente documento un método de aumento del transporte intestinal en las crías de un cerdo. El método comprende las etapas de administración al cerdo de una composición de pienso que
comprende una composición no de algas que comprende ácidos grasos omega-3 o esteres de los mismos, donde la relación del ácido docosahexaenoico respecto al ácido eicosapentaenoico en la composición no de algas es de aproximadamente 30:1 a aproximadamente 2:1.
Se desvela adicionalmente en el presente documento un método de aumento del rendimiento de crecimiento de las crías de cerdo. El método comprende las etapas de administración al cerdo de una composición de pienso que comprende una composición no de algas que comprende ácidos grasos omega-3 o esteres de los mismos, donde la relación del ácido docosahexaenoico respecto al ácido eicosapentaenoico en la composición no de algas es de aproximadamente 30:1 a aproximadamente 2:1.
Breve descripción de los dibujos
La Fig. 1 muestra el transporte activo de glucosa (panel A) y glutamina (panel B) en muestras de yeyuno obtenidas de lechones destetados a los 14-17 días de edad de cerdas alimentadas con una de cuatro dietas: (1) una dieta básica de control con harina de maíz/soja (sin grasa añadida, CONT); (2) la dieta básica suplementada con aceite de pescado protegido (PFO); (3) la dieta básica suplementada con grasas DHA de algas Schizochytrium (alDHA); o (4) la dieta básica suplementada con grasa seca de coco (COCO). Los lechones (n = 4 por tratamiento) se privaron de pienso durante 24 horas tras el destete. Las medias sin una letra común difieren, P <0,05. Se muestran los SEM agrupados.
La Fig. 2 muestra la expresión de proteína GLUT2 en muestras de yeyuno obtenidas de lechones destetados a los 14-17 días de edad. Los lechones eran de cerdas alimentadas con: (1) una dieta básica de control con harina de maíz/soja (sin grasa añadida, CONT); (2) la dieta básica suplementada con aceite de pescado protegido (PFO); (3) la dieta básica suplementada con grasas DHA de algas Schizochytrium (alDHA); o (4) la dieta básica suplementada con grasa seca de coco (COCO). Los lechones (n = 4 por tratamiento) se privaron de pienso durante 24 horas tras el destete y se muestran los SEM agrupados.
La Fig. 3 muestra la expresión de proteína SGLT1 en muestras de yeyuno obtenidas de lechones destetados a los 14-17 días de edad. Las cerdas se alimentaron con: (1) una dieta básica de control con harina de maíz/soja (sin grasa añadida, CONT); (2) la dieta básica suplementada con aceite de pescado protegido (PFO); (3) la dieta básica suplementada con grasas DHA de algas Schizochytrium (alDHA); o (4) la dieta básica suplementada con grasa seca de coco (COCO). Los lechones (n = 4 por tratamiento) se privaron de pienso durante 24 horas tras el destete. Las medias sin una letra común difieren, P <0,05. Se muestran los SEM agrupados.
La Fig. 4 muestra las concentraciones de glucosa, glicógeno, y glicosilo total en muestras del músculo longissimus (panel A) y el hígado (panel B) obtenidas de lechones destetados a los 14-17 días de edad. Los lechones eran de cerdas alimentadas con: (1) una dieta básica de control con harina de maíz/soja (sin grasa añadida, CONT); (2) la dieta básica suplementada con aceite de pescado protegido (PFO); (3) la dieta básica suplementada con grasas DHA de algas Schizochytrium (alDHA); o (4) la dieta básica suplementada con grasa seca de coco (COCO). Los lechones (n = 4 por tratamiento) se privaron de pienso durante 24 horas tras el destete. Las diferentes letras representan diferencias significativas (P <0,05). Se muestran los SEM agrupados.
La Fig. 5 muestra la captación activa de glucosa ex vivo por el yeyuno proximal de lechones a los 21 días de edad después de la privación de pienso durante 24 horas para simular el estrés del destete. Las madres se alimentaron con regímenes de dieta de control (Cont) y aceite de pescado protegido (PFO) durante la gestación y la lactancia (G/L). Los datos representan las medias de 6 lechones por tratamiento. Las medias sin una letra común son significativamente diferentes (P <0,05).
La Fig. 6 muestra la cantidad de proteína GLUT2 en las membranas de borde en cepillo (Brush Border Membranes, BBM) en bruto (panel A) y las preparaciones tisulares totales (panel B) del yeyuno proximal de lechones de 21 días de edad después de la privación de pienso durante 24 horas para simular el estrés del destete. Las madres se alimentaron con regímenes de dieta de control (Cont) y aceite de pescado protegido (PFO) durante la gestación y la lactancia (G/L). Los datos representan las medias ± SD de 6 lechones por tratamiento. Las medias sin una letra común son significativamente diferentes (P <0,05).
La Fig. 7 muestra la cantidad de proteína SGLT1 en las membranas de borde en cepillo en bruto (BBM) (panel A) y las preparaciones tisulares totales (panel B) del yeyuno proximal de lechones de 21 días de edad después de la privación de pienso durante 24 horas para simular el estrés del destete. Las madres se alimentaron con regímenes de dieta de control (Cont) y aceite de pescado protegido (PFO) durante la gestación y(o) la lactancia (G/L). Los datos representan las medias ± SD de 6 lechones por tratamiento. Las medias sin una letra común son significativamente diferentes (P <0,05), y las Cont/Cont y Cont/PFO se diferenciaban con una P < 0,10.
La Fig. 8 muestra la captación de glucosa en el yeyuno de pollos. Los valores son las medias ± SEM de los cuadrados mínimos (n = 10/tratamiento). Las diferentes letras representan diferencias significativas con una P <0,05. La Fig. 9 muestra la captación de glutamina en el yeyuno de pollos. Los valores son las medias ± SEM de los
cuadrados mínimos (n = 10/tratamiento).
Descripción detallada de la invención
Se describirán en detalle las realizaciones específicas en el presente documento.
Se describen métodos y composiciones para aumentar el transporte intestinal de nutrientes en las crías de un animal. Más particularmente, se describen métodos y composiciones para la administración a un animal de una composición de pienso suplementada con una composición que comprende ácidos grasos omega-3 o ésteres de los mismos, para aumentar el transporte intestinal de nutrientes en las crías del animal. Por ejemplo, los métodos y composiciones descritos en el presente documento pueden aumentar el transporte intestinal de nutrientes incluyendo, pero sin limitarse a, vitaminas, lípidos, minerales, aminoácidos (por ejemplo, glutamina, etc.), carbohidratos (por ejemplo, glucosa, etc.), proteínas y similares. Adicionalmente, los métodos y composiciones descritos son útiles para aumentar los depósitos de energía tisulares (por ejemplo, las unidades de glucógeno muscular o las unidades de glicosilo muscular).
Las composiciones descritas en el presente documento contienen, en particular, una fuente de ácidos grasos omega-3 o ésteres de los mismos, tales como productos de fuentes de algas (por ejemplo, aceites de alga, productos de algas secas, y restos y derivados de las mismas), fuentes no de algas (por ejemplo, aceites, productos secados y derivado de fuentes marinas no algas, así como frutos secos, semillas y productos vegetales), o combinaciones de los mismos. Los productos de algas y no de algas sirven como una fuente de ácidos grasos omega-3/ésteres y sus metabolitos, tales como el ácido eicosapentaenoico (EPA), ácido docosahexaenoico (DHA), y ácido docosapentaenoico (DPA), o mezclas de los mismos.
Se puede utilizar cualquier fuente de ácidos grasos omega-3 en los métodos y composiciones descritos en el presente documento. En una realización, las fuentes de ácido graso omega-3 útiles en los métodos y composiciones descritos en el presente documento comprenden ácidos grasos omega-3 C22 y/o ácidos grasos omega-3 C20. En otra realización las composiciones para su uso como una fuente de ácidos grasos omega-3 en la composición de pienso como una mezcla final tendrá una relación de DHA:EPA > 1:1. En otra realización ilustrativa más, la composición de pienso como mezcla final como se describe en el presente documento comprende DHA y EPA en una relación DHA:EPA de aproximadamente 1: 1 a aproximadamente 60:1. En otra realización ilustrativa, las composiciones de pienso finales como se describen en el presente documento comprenden DHA y EPA en una relación de desde aproximadamente 8:1 a aproximadamente 30:1, o aproximadamente 30:1, aproximadamente 28:1, aproximadamente 25:1, aproximadamente 20:1, aproximadamente 15:1, aproximadamente 10:1, aproximadamente 5:1, o aproximadamente 2:1.
Los ácidos grasos sin dobles enlaces se denominan ácidos grasos saturados, los que tienen un doble enlace se denominan ácidos grasos monoinsaturados, y los que tienen múltiples enlaces dobles se denominan ácidos grasos poliinsaturados. La digestibilidad total parece que aumenta con el grado de insaturación. Se utiliza un sistema de atajo conveniente en la presente memora descriptiva para mencionar la estructura de los ácidos grasos. El sistema utiliza un número que denota el número de carbonos de la cadena de hidrocarbonos, seguido por un guion y un número que indica el número de dobles enlaces en la molécula, y entonces "w6" o "w3" para denotar "omega-6" u "omega-3", respectivamente (por ejemplo, 22:5w6). La "w6" o "w3" denota la localización del primer doble enlace desde el extremo metilo de la molécula del ácido graso. Los nombres habituales en la serie de ácidos grasos w6 incluyen el ácido linoleico (18:2w6), ácido gamma-linoleico (18:3w6) y el ácido araquidónico (20:4w6). El único ácido graso en la serie w3 con un nombre común es el ácido alfa-linolénico (18:3w3). Para los fines de la presente solicitud un ácido graso con la nomenclatura 20:5w3 es el ácido eicosapentaenoico, con la nomenclatura 22.6w3 es el ácido docosahexaenoico, y con la nomenclatura 22.5w3 es el ácido docosapentaenoico.
Los métodos desvelados en el presente documento utilizan una composición que contiene un ácido graso omega-3 como fuente de ácidos grasos omega-3 de cadena larga, tales como el ácido eicosapentaenoico, ácido docosahexaenoico, ácido docosapentaenoico, y ésteres de los mismos, para aumentar el transporte intestinal de nutrientes en las crías de un animal. La composición que contiene un ácido graso omega-3 que se utiliza en el presente documento se puede obtener a partir de una fuente de algas o una fuente no de algas. La composición de pienso se puede suplementar con una composición que contiene ácidos grasos omega-3 que comprende DHA y EPA, donde la relación DHA:EPA en la composición de pienso como mezcla final es aproximadamente de 1:1 a aproximadamente 30:1. En un aspecto, esta composición de pienso puede darse como alimento a los lechones. La relación DHA:EPA en la composición de pienso final es aproximadamente de 30:1 a aproximadamente 2:1. La composición de pienso puede contener una fuente de no algas de ácidos grasos omega-3. La relación DHA:EPA en la composición de pienso final es aproximadamente de 28:1 a aproximadamente 25:1, aproximadamente 20:1, aproximadamente 15:1, aproximadamente 10:1, aproximadamente 5:1 o aproximadamente 2:1.
Se puede administrar una cantidad biológicamente activa de la composición que contiene ácidos grasos omega-3 para aumentar el transporte intestinal de nutrientes en las crías de animales. Por "cantidad biológicamente eficaz" quiere decirse una cantidad de la composición que contiene un ácido graso omega-3 capaz de aumentar el transporte intestinal de nutrientes en las crías de un animal por cualquier mecanismo, incluyendo los descritos en el
presente documento. Adicionalmente, una cantidad biológicamente eficaz de la composición que contiene ácidos grasos omega-3 puede ser una cantidad capaz de aumentar los depósitos de energía tisular, y/o una cantidad eficaz para aumentar el rendimiento de crecimiento (por ejemplo, aumentando la tasa de crecimiento, reduciendo la relación de pienso respecto a ganancia de peso, aumentando el peso al destete, o aumentando la eficiencia de la utilización del pienso).
Por ejemplo, las composiciones de pienso que contienen ácidos grasos omega-3 se administran a los animales por vía oral, pero se pueden utilizar otros métodos de administración eficaces conocidos por los expertos en la técnica. Por ejemplo, la composición de pienso como una mezcla final puede comprender una composición derivada de algas o una composición derivada no de algas, tales como un producto marino no de algas (por ejemplo, aceite de pescado o harina de pescado), o un producto derivado de frutos secos, semillas o de plantas (por ejemplo, frutos secos, linaza, canola, aceite de soja, o aceite de maíz, o un derivado de los mismos), o combinaciones de los mismos. Por ejemplo, la composición de pienso como una mezcla final puede suplementarse con cualquier composición que contiene ácidos grasos omega-3, y puede incluir, por ejemplo, un aceite de alga, un producto de alga desecado (incluyendo células secas completas y productos de lecho de algas), un aceite de pescado (por ejemplo, aceite de salmón u otro aceite de pescado de un pez de agua fría del Atlántico Norte), harina de pescado, o un aceite derivado de harina de pescado, o una mezcla de los mismos, o restos de cualquiera de estas fuentes de ácidos grasos omega-3 para proporcionar una fuente de ácidos grasos omega-3/ésteres en una mezcla con una mezcla de pienso para animales reconocida en la técnica.
Por ejemplo, la composición de pienso como una mezcla final puede administrarse al animal durante cualquier periodo de tiempo que sea eficaz para aumentar el transporte intestinal de nutrientes en las crías del animal. Por ejemplo, la composición de pienso se puede dar como alimento a un animal hembra diariamente durante toda la vida del animal. De manera alternativa, la composición de pienso se puede administrar al animal durante un periodo de tiempo más corto. La composición de pienso se puede administrar a una cerda gestante, una cerda postparto, un lechón, otras especies de animales de producción, un animal de compañía, o un ser humano (por ejemplo, para aumentar la longevidad del ser humano o el animal). De manera ilustrativa, el animal de compañía, el ser humano, o la especia de animal de producción puede ser un animal gestante, lactante o en postparto.
La composición de pienso se puede administrar a un animal postnatal, incluyendo un animal lactante o un animal que se va a destetar o un animal después del destete. La composición de pienso puede administrarse a un animal prenatal in utero alimentando con la composición a una madre gestante. La composición de pienso se puede administrar a un animal lactante alimentando con la composición a la madre lactante, o de manera alternativa, alimentando con la composición directamente al animal lactante a través de una dieta preparada (por ejemplo, una fórmula). Los periodos de tiempo para la administración de la composición en pienso que se ha descrito anteriormente no son limitantes y debería apreciarse que se puede utilizar cualquier periodo de tiempo que se determine que sea eficaz para aumentar el transporte intestinal de nutrientes en las crías del animal.
Una especie de animal de producción distinto del cerdo puede alimentarse con la composición de pienso y las especies pueden incluir especies bovinas (por ejemplo, ganado bovino y bisonte), especies equinas (por ejemplo, caballos, ponys, y burros), especies ovinas (por ejemplo, ovejas), especies caprinas (por ejemplo, cabras), conejos y aves de corral (por ejemplo, pollos, pavos, faisanes, patos, avestruces, emúes, codornices y gansos). Como se utiliza en el presente documento, una especie de un animal de producción distinta de un cerdo puede incluir cualquier animal que es cría para un uso personal (por ejemplo, para proporcionar comida, combustible, etc.) o un beneficio. Un animal de compañía se puede alimentar también con las composiciones descritas en el presente documento y un animal de compañía incluye cualquier animal que se mantiene o se cría con fines de acompañamiento, por ejemplo, especies caninas y felinas.
Cualquier mezcla de pienso para animales conocida en la técnica se puede utilizar para fabricar la composición de pienso tale como harina de canola, harina de linaza, harina de semillas de algodón, harina de soja, y harina de maíz. La mezcla de pienso para animales se puede suplementar con una composición que contenga ácidos grasos omega-3, pero se pueden añadir opcionalmente otros ingredientes a la mezcla de pienso para animales. Los ingredientes de la mezcla de pienso para animales incluyen azúcares y carbohidratos complejos tal como monosacáridos, disacáridos y polisacáridos hidrosolubles e insolubles en agua. Los ingredientes de aminoácidos opcionales que se pueden añadir a la mezcla de pienso son arginina, histidina, isoleucina, lisina, metionina, fenilalanina, treonina, triptófano, valina, etil HCl de tirosina, alanina, ácido aspártico, glutamato sódico, glicina, prolina, serina, etil HCl de cisteína, y análogos y sales de los mismos. Las vitaminas que se pueden añadir opcionalmente son HCl de tiamina, riboflavina, HCl de piridoxina, niacina, niacinamida, inositol, cloruro de colina, pantotenato de calcio, biotina, ácido fólico, ácido ascórbico, y vitaminas A, B, K, D, E, y similares. También se podrían añadir mezclas opcionales de lípidos de origen animal o vegetal o ingredientes de fibra. También se pueden añadir ingredientes proteicos e incluyen proteínas obtenidas de harina de carne o harina de pescado, huevos líquidos o en polvo, solubles de pescado y similares. También se pueden añadir ingredientes medicamentosos conocidos en la técnica a la mezcla de pienso para animales tales como antibióticos.
Se pueden añadir antioxidantes a la composición de pienso para evitar la oxidación de ácidos grasos presentes en la composición que contiene ácidos grasos omega-3 utilizada para suplementar la composición de pienso, tal como los
ácidos grasos de cadena larga omega-3, ácido eicosapentaenoico, ácido docosahexaenoico, y ácido docosapentaenoico. La oxidación de los ácidos grasos se produce a lo largo del tiempo y pueden estar afectada por condiciones tales como la humedad y la presencia de catalizadores minerales y por características de los ácidos grasos como el número de enlaces dobles y el posicionamiento y la configuración de los enlaces. La oxidación de estos ácidos grasos omega-3 puede evitarse por la introducción de antioxidantes de origen natural, tal como betacaroteno, vitamina E, vitamina C, y tocoferol o de antioxidantes sintéticos tales como hidroxitolueno butilado, hidroxianisol butilado, butilhidroquinona terciaria, propil galato o etoxiquina a la composición de pienso. También se pueden añadir compuestos que actúan sinérgicamente con antioxidantes, tales como el ácido ascórbico, ácido cítrico, y ácido fosfórico. La cantidad de antioxidantes incorporados de esta manera depende de necesidades tales como la formulación del producto, condiciones de expedición (por ejemplo, expedición bajo una manta de nitrógeno), métodos de envasado y vida de almacenamiento deseada.
La composición que contiene ácidos grasos omega-3 que se utilizan para el suplemento de la composición de pienso se deriva de una preparación de algas de alta pureza que comprende un alto contenido de DHA. La preparación de algas puede comprender una relación alta de DHA:EPA, es decir, la cantidad de DHA en la composición puede ser mayor o igual que la cantidad de EPA en la composición (por ejemplo, hasta una relación de 60:1 de DHA:EPA). De manera alternativa, no existe EPA en la composición de algas. Se describen distintas relaciones en el presente documento. Por ejemplo, la composición de pienso como mezcla final puede suplementarse con una composición que contiene ácidos nucleicos omega-3 derivados de algas, tales como aceites, geles, pastas, productos secos y restos o derivados de los mismos. La composición que contiene ácidos grasos omega-3 puede incluir productos de algas completos, productos de lecho de algas, o productos residuales que permanecen de la producción de aceites, geles, pastas y productos secos, o derivados de los mismos. En aspectos ilustrativos, el producto de algas se puede obtener a partir de cualquier fuente de algas, incluyendo fuentes de algas marinas o de agua dulce.
Las fuentes de algas pueden incluir, pero no se limitan a, especies de Schizochytrium, Spirulina, Chlorella, Chaetoceros, Cyclotella, Isochrysis, Nonnocholoropsis, Nitzschia, Phyaeodactylum, así como dinoflagelados, incluyendo especies de Amphidinium, Ceratium, Cochlodinium, Crypthecodinium (por ejemplo, Crypthecodinium cohnii), Gonyaulax, y Peridinium. La composición que contiene ácidos grasos omega-3 derivada de algas puede incluir una composición derivada de organismos modificados genéticamente, modificados por la expresión de un gen de alga. Se puede utilizar cualquier fuente de alga no tóxicas capaz de aumentar el transporte intestinal de nutrientes en un animal. Los productos de algas como se describen en el presente documento proporcionan una fuente de ácidos grasos omega-3 poliinsaturados de cadena larga incluyendo el ácido eicosapentaenoico (20:5w3), ácido docosahexaenoico (22:6w3), y ácido docosapentaenoico (22:5w3). Por ejemplo, la composición que contiene ácidos grasos omega-3 derivada de algas tiene una relación DHA:EPA > 1:1, > 5:1, >10:1, >15:1, >20:1, o >25:1.
La mezcla de pienso para animales se puede suplementar con una composición que contenga ácidos grasos omega-3 derivada de una fuente no de algas que contiene omega-3, tal como aceites de pescado o harina de pescado, así como aceites de frutos secos o semillas, o un derivado de los mismos, o una combinación de los mismos. La composición que contiene ácidos grasos omega-3 derivada de una fuente no de algas puede incluir composiciones derivadas de un organismo modificado genéticamente. Por ejemplo, se pueden utilizar plantas modificadas genéticamente, incluyendo plantas transgénicas, como una fuente no de algas de ácidos grasos omega-3. Además, se pueden utilizar plantas o semillas fortificadas nutricionalmente como una fuente no de algas de ácidos grasos omega-3. Ejemplos de plantas que pueden estar modificadas genéticamente o mejoradas nutricionalmente para su uso como una fuente no de algas incluyen, pero no se limitan a maíz, canola, soja, linaza, colza, y afrecho. Los aceites no de algas descritos en el presente documento pueden obtenerse de cualquier fuente. La fuente de aceite no de algas puede ser de peces de agua fría del Atlántico Norte. Los aceites de pescado proporcionan una fuente de ácidos grasos tanto omega-3 como omega-6, pero son particularmente una buena fuente de ácidos grasos omega -3 poliinsaturados. Los ácidos grasos omega-3 poliinsaturados de cadena larga ácido eicosapentaenoico (20:5w3), ácido docosahexaenoico (22:6w3), y ácido docosapentaenoico (22:5w3) son típicos de aceites de pescado y juntos comprenden aproximadamente un 25-38 % por peso del aceite de pescado. Los ácidos grasos omega-6 poliinsaturados presentes en los aceites de pescado incluyen el ácido linoleico y ácido araquidónico y están presentes en concentraciones menores de aproximadamente un 10 % por peso.
Se entiende que los aceites son lípidos o grasas incluyendo los ésteres glicéridos de ácidos grasos junto con fosfátidos asociados, esteroles, alcoholes, hidrocarbonos, cetonas, alquil ésteres, sales, y compuestos relacionados. Adicionalmente, como se ha descrito en el presente documento, los productos secos incluyen algas y productos no algas preparados por cualquier método conocido en la técnica, y puede incluir productos secados por pulverización o secados por congelación. Las composiciones de algas y no algas descritas en el presente documento pueden incluir productos celulares completos, productos molidos, o residuos o derivados de los mismos.
En distintos aspectos ilustrativos, los aceites de o componentes de ésteres de ácidos grasos pueden añadirse en una forma sin procesar o en forma pura, o pueden estar conjugados o no conjugados, incluyendo los suplementos (por ejemplo, ácido linoleico conjugado). De manera ilustrativa, los ésteres de ácidos grasos añadidos a la composición de pienso pueden ser triglicéridos, diglicéridos, monoglicéridos, fosfolípidos, lisofosfolípidos, o pueden estar beneficiados químicamente o beneficiados enzimáticamente para aumentar el contenido de los ésteres de
ácido graso deseados.
Las composiciones de pienso descritas en el presente documento pueden comprender también ácidos grasos omega-6 o ésteres de los mismos, como se describe en la Patente de EE. UU. N.° 7.084.175 y la Solicitud de patente de EE. UU. N.° 10/142.685. De manera ilustrativa, los ácidos grasos omega-6 que se pueden utilizar en la presente invención pueden ser ácidos grasos insaturados que tienen al menos dos dobles enlaces carbono-carbono tal como el ácido 2,4-decadienoico, ácido linolénico, ácido gamma linolénico, ácido 8,10,12-octadecatrienoico y ácido araquidónico. De manera alternativa, el ácido graso omega-6 puede ser el ácido gamma-linolénico. Los ésteres/ácidos grasos omega-6 para su uso en la composición de pienso pueden incluir ésteres/ácidos grasos omega-6 derivados de una harina reconocida en la técnica tal como la harina de maíz, o harina de soja o de aceites tales como el aceite de maíz, aceite de semillas de algodón, aceite de soja, aceite de cártamo, aceite de girasol, aceite de linaza, aceite de borraja, aceite de grosella negra, aceite de onagra, y similares.
La composición de pienso descrita en el presente documento se puede suplementar con concentraciones de una composición que contiene ácidos grasos omega-3 tal como productos de aceite, gel, pasta, productos secos de algas, o una combinación de los mismos, o restos de los mismos, suficientes para proporcionar cantidades de ésteres/ácidos grasos omega-3 en la composición de pienso como una mezcla final que son eficaces para aumentar el transporte intestinal de nutrientes en las crías de un animal. De manera alternativa, la composición de pienso se puede suplementar con una composición que contiene ácidos grasos omega-3, tal como aceite de pescado, harina de pescado, productos derivados de plantas, o combinaciones de los mismos, suficientes para proporcionar cantidades de ésteres/ácidos grasos omega-3 en la composición de pienso como una mezcla final que son eficaces para aumentar el transporte intestinal de nutrientes en las crías de un animal. La composición de pienso puede suplementarse con una combinación de fuentes que contienen ácidos grasos omega-3 de algas y no de algas.
De manera ilustrativa, la composición de pienso se puede suplementar con una composición que contienen ácidos grasos omega-3 en una cantidad desde aproximadamente un 0,01 % a aproximadamente un 60 % por peso de la composición de pienso como una mezcla final. De manera alternativa, la composición de pienso se puede suplementar con una composición que contiene ácidos grasos omega-3 en una cantidad desde aproximadamente un 0,1 % a aproximadamente un 0,5% por peso de la composición de pienso como una mezcla final. De manera alternativa, la composición de pienso se puede suplementar con una composición que contiene ácidos grasos omega-3 en una cantidad de aproximadamente 0,01 % a aproximadamente 0,3 % por peso, de aproximadamente 0,01 % a aproximadamente 0,5 % por peso, de aproximadamente 0,01 % a aproximadamente 0,8 % por peso, de aproximadamente 0,01 % a aproximadamente 1,0 % por peso, de aproximadamente 0,01 % a aproximadamente 1,5 % por peso, de aproximadamente 0,01 % a aproximadamente 3,0 % por peso, de aproximadamente 0,01 % a aproximadamente 4,0% por peso, de aproximadamente 0,01% a aproximadamente 18% por peso, de aproximadamente 0,01 % a aproximadamente 20 % por peso, de aproximadamente 0,01 % a aproximadamente 30 % por peso, de aproximadamente 0,01 % a aproximadamente 40 % por peso, de aproximadamente 0,01 % a aproximadamente 50 % por peso, de aproximadamente 0,01 % a aproximadamente 60 % por peso, o de aproximadamente 0,01 % a aproximadamente 90 % por peso de la composición de pienso como una mezcla final.
En cada uno de los casos se tiene que entender que el porcentaje de la composición que contiene ácidos grasos omega-3 por peso de la composición de pienso se refiere a la composición de pienso final (es decir, la composición de pienso como una mezcla final) que contiene la mezcla de pienso animal, la composición que contiene ácidos grasos omega-3 (por ejemplo, aceite de algas, lecho de algas u otro producto de algas seco, o restos de los mismos o aceite de pescado, etc.) y opcionalmente ingredientes añadidos. En dichas realizaciones de la invención, la composición que contiene ácidos grasos omega-3 puede derivarse de cualquier tipo de fuente de algas o no de algas.
En distintos aspectos, la composición que contiene ácidos grasos omega-3 como se describe en el presente documento se puede administrar en una forma encapsulada o no encapsulada en una mezcla con una mezcla de pienso para animales. La encapsulación protege los ésteres/ácidos grasos omega-3 y ésteres/ácidos grasos omega-6 de la rotura y/u oxidación antes de la digestión y absorción de los ésteres/ácidos grasos por el animal (es decir, la encapsulación aumenta la estabilidad de ácidos grasos) y proporciona un producto seco para mezclar más fácilmente con la mezcla de pienso para animales. Los ésteres/ácidos grasos omega-3 y ésteres/ácidos grasos omega-6 se pueden proteger de esta manera, por ejemplo, revistiendo el aceite con una proteína o cualquier otra de las sustancias conocidas en la técnica que sean agentes de encapsulación eficaces tales como polímeros, ceras, grasas, y aceites vegetales hidrogenados. Por ejemplo, un aceite u otro producto de algas o no de algas, pueden encapsularse utilizando una técnica reconocida en la técnica tal como una técnica de encapsulación en alginato Na2+ donde el aceite se recubre seguido por una conversión con alginato de Ca2+ en presencia de iones de Ca2+ para la encapsulación. De manera alternativa, el aceite u otro producto de algas o no de algas pue den encapsularse mediante una técnica reconocida en la técnica tal como envolver los ácidos grasos para estabilizar los ácidos grasos o granulación (es decir, atomizando un líquido fundido y enfriamiento de gotas para formar una perla). Por ejemplo, el aceite u otro producto de algas o no de algas se puede granular en copos de semilla de algodón hidrogenados o aceite de judía de soja hidrogenado para producir un aceite seco. El aceite u otro producto de algas o no de algas se puede utilizar en una forma no encapsulada completamente, una forma completamente encapsulado, o se pueden añadir mezclas de aceite encapsulado y no encapsulado a la composición de pienso.
Las composiciones de pienso descritas en el presente documento, cuando se dan como alimento in utero a través de la madre (por ejemplo, una cerda gestante) y/o a animales postnatales (por ejemplo, por lactancia a través de una cerda postparto o directamente al animal postnatal), puede dar como resultado no solo aumentos en el transporte intestinal, sino también en beneficios con respecto a la sensibilidad a la insulina, y aumentos en el rendimiento del crecimiento de animales postnatales (por ejemplo, un lechón). Se puede utilizar cualquiera de los métodos descritos anteriormente para aumentar el rendimiento de crecimiento (por ejemplo, un aumento de la tasa de crecimiento, una disminución de la relación pienso ganancia de peso, o un aumento de la eficacia de utilización del pienso) de las crías de un animal.
En consecuencia, se desvela en el presente documento un método para aumentar el rendimiento del crecimiento del animal postnatal. El método comprende la etapa de administración al animal postnatal o la madre de una composición de pienso que comprende una composición de algas que comprende ácidos grasos omega-3 o ésteres de los mismos, donde la composición de pienso como mezcla final comprende aproximadamente de un 0,01 % a aproximadamente un 60 % por peso de la composición de algas y donde el animal es una cerda, un lechón, otra especie de animal de producción, un animal de compañía, o un ser humano.
De acuerdo con la presente divulgación, la composición de algas puede estar en forma de algas secas o un aceite derivado de las algas o un residuo de otra composición, y los ácidos grasos omega-3 pueden comprender ácidos grasos omega-3 C22 o C20.
También de acuerdo con la presente divulgación, la composición de pienso como mezcla final puede comprender de aproximadamente 0,01 % a aproximadamente 3,0 % por peso, de aproximadamente 0,01 % a aproximadamente 4,0 % por peso, de aproximadamente 0,01 % a aproximadamente 1,5 % por peso, de aproximadamente 0,01 % a aproximadamente 1,0 % por peso, de aproximadamente 0,01% a aproximadamente 0,8 % por peso, de aproximadamente 0,01 % a aproximadamente 0,5 % por peso, de aproximadamente 0,01 % a aproximadamente 0,3% por peso, de aproximadamente 0,1 % a aproximadamente 0,5% por peso, de aproximadamente 0,01 % a aproximadamente 18% por peso, de aproximadamente 0,01% a aproximadamente 20% por peso, de aproximadamente 0,01 % a aproximadamente 30 % por peso, de aproximadamente 0,01 % a aproximadamente 40 % por peso, de aproximadamente 0,01 % a aproximadamente 50 % por peso, o de aproximadamente 0,01 % a aproximadamente 60 % por peso de la composición de algas.
También de acuerdo con la presente divulgación, la composición de pienso como mezcla final puede comprender adicionalmente ácidos grasos omega-6 o ésteres de los mismos, la composición de pienso se puede administrar durante la lactancia, o diariamente al animal, la composición de pienso como mezcla final puede comprender adicionalmente un antioxidante, los ácidos grasos omega-3 en la composición de pienso pueden estar estabilizados por encapsulación, los ácidos grasos omega-3 pueden comprender ácido docosahexaenoico y ácido eicosapentaenoico, y los ácidos grasos omega-3 pueden comprender ácido docosahexaenoico, ácido eicosapentaenoico, y ácido docosapentaenoico. Adicionalmente de acuerdo con esta realización, la relación de ácido docosahexaenoico con respecto al ácido eicosapentaenoico puede ser de aproximadamente 60:1, aproximadamente 30:1, aproximadamente 25:1, aproximadamente 20:1, aproximadamente 15:1, aproximadamente 10:1, aproximadamente 5:1, aproximadamente 2:1, o aproximadamente 1:1. Las especies de animales de producción se pueden seleccionar de entre el grupo que consiste en pollos, caballos, ponys, vacas, pavos, faisanes, codornices, animales ovinos, cabras, avestruces y patos, y el animal de compañía se puede seleccionar de entre el grupo que consiste en una especie canina y una especie felina.
La presente divulgación puede comprender también realizaciones del método donde el animal postnatal se alimenta con una composición de pienso suplementada con una fuente no de algas de ácidos grasos omega-3 con cualquiera de las condiciones descritas anteriormente donde la relación de DHA:EPA es aproximadamente de 30:1 a aproximadamente 1:1.
Aunque ciertas realizaciones de la presente invención se describen y/o ejemplifican posteriormente, se contempla que son posibles variaciones y modificaciones considerables.
Ejemplo 1. Animales y diseño experimental
Se alimentaron veinte cerdas de cría (20 cerdas Línea Ausgene x verracos SPI) con una de cuatro dietas experimentales durante aproximadamente 150 días antes del parto de los cochinillos (Tabla 1). Los cuatro tratamientos de dieta experimental consistían en (1) una dieta básica de control con harina de maíz/soja (sin grasa añadida, "CONT"); (2) la dieta básica suplementada con aceite de pescado protegido (FERTILIUM™ o GROMEGA365™; JBS United Inc., Sheridan, IN [es decir, PFO]); (3) la dieta básica suplementada con grasas DHA de algas Schizochytrium (alDHA); (4) la dieta básica suplementada con grasa seca de coco (COCO).
Los perfiles de ácidos grasos de las dietas se presentan en la Tabla 2. Ambos ingredientes del aceite de pescado protegido y alDHA tenían una alta concentración de (n-3) de PUFA y contenían un 29 y un 43 % de grasa total, respectivamente. El resto de estos ingredientes comprendían proteínas y carbohidratos. La dieta alDHA contenía un 40 % de DHA y un 2 % de EPA por porcentaje de grasa, mientras que la de PFO tenía aproximadamente un 13 % de
EPA y un 13 % de DHA. La grasa total de las cuatro dietas era diferente. Sin embargo, el porcentaje de DHA en la dieta alDHA era igual al porcentaje de DHA en la dieta PFO. El ingrediente en grasa del COCO consistía en un 88 % de grasa saturada (alto en ácidos grasos saturados C10:0-C16:0) como porcentaje de grasa. Todas las dietas (Tabla 1) cumplían y excedían las necesidades nutricionales para las cerdas gestantes y lactantes [véase, NCR, Nutritional Requirements of Swine, 10a ed., Washington, DC: Natl. Acad. Press (1998)] y todos los lechones tenían acceso al agua en cualquier momento.
Aunque parieron en dos grupos repetidos durante dos semanas, las camadas se normalizaron a diez cochinillos por camada a las 24 horas del nacimiento, se produjo la adopción cruzada solamente dentro del tratamiento. Posteriormente, a los 14-17 días de edad, se separó aleatoriamente un lechón de tamaño medio (4,1 kg ± 0,49) por camada de la madre, y se agrupó en una pocilga con lechones de otras camadas y se dejaron en ayuno durante una noche para simular el proceso de destete (total n = 4 por tratamiento). Después del destete simulado, los lechones se sacrificaron con una pistola de bala cautiva seguido por la exanguinación inmediata y escisión de los tejidos. Se recolectaron muestras de yeyuno del intestino delgado, hígado y músculos y se congelaron instantáneamente en nitrógeno líquido, y las muestras de yeyuno se colocaron en formalina al 10 % para los análisis posteriores.
Ejemplo 2. Análisis de ácidos grasos
Una semana después del parto, se obtuvieron aproximadamente 40 ml de leche de media lactancia de cuatro cerdas de cada dieta de tratamiento a continuación de una inyección i.v de 10 UI de oxitocin-S (Intervet, Millsboro, DE USA) para inducir la secreción de leche. Se ordeñaron aleatoriamente varias ubres de cada cerda, se agruparon y se congelaron instantáneamente en hielo seco pendientes del análisis de ácidos grasos. Los lípidos de las muestras de leche, músculo e hígado se extrajeron por el método de Lepage y Roy [J. Lipid Res, 27: 114-120 (1986)], con mínimas modificaciones. En resumen, se homogeneizaron 0,5 g de tejido o 300 pl de leche en 2,5 ml de metanol:hexano 4:1 y se añadieron 200 pl de ácido heptadecanoico 3,7 mmol/l de metanol a cada muestra como referencia interna.
Se analizaron los metilésteres de ácidos grasos mediante cromatografía de gases en un Hewlett-Packard modelo 6890 (Hewlett-Packard, Palo Alto, CA) ajustado con una columna de capilaridad Omegawax 320 (30 m x 0,32 mm ID, 0,25 pm) (Sigma-Aldrich, St Louis, MO USA). El hidrógeno era el vehículo gaseoso. La temperatura programada variaba desde 80 °C a 250 °C con un aumento de temperatura de 5 °C/min. Las temperaturas del inyector y el detector eran de 250 °C y se inyectó 1 pl de muestra y se ejecutó sin dividir. Los ácidos grasos se identificaron por sus tiempos de retención en la columna con respecto a las referencias apropiadas.
Las madres gestantes y lactantes alimentadas con las dietas CONT, PFO, alDHA o COCO, que variaban considerablemente en sus perfiles de ácidos grasos, tenían en consecuencia cambios de la composición de ácidos grasos en la leche (Tabla 3). Las dietas PFO y alDHA tenían las proporciones más altas (n-3) de ácidos grasos, reflejando de esta manera la concentración de ingredientes DHA y EPA particulares. Como resultado, la leche de las madres alimentadas con las dietas CONT y COCO tenían relaciones de ácidos grasos (n-6):(n-3) más altas que las de las madres alimentadas con las otras dos dietas. Adicionalmente, la leche de las cerdas alimentadas con la dieta de COCO era más alta en ácidos grasos saturados totales en comparación con la de PFO y alDHA, pero no en comparación con la leche de CONT (P<0,05, Tabla 3). De los ácidos grasos saturados encontrados en la leche de las cerdas, el C12:0 era seis veces mayor en las muestras de leche de COCO en comparación con CONT o (n-3) PUFA (P<0,05, Tabla 3).
Los perfiles de ácidos grasos en el intestino delgado y músculo de los lechones se presentan en la Tabla 4. La suplementación de ácidos grasos (n-3) PUFA mediante la dieta maternal PFO aumentaba la concentración total de (n-3) PUFA en el intestino delgado y músculo de los lechones, un 200 y 400 %, respectivamente, vs. El grupo de CONT (Tabla 4). Este aumento reflejaba el porcentaje de DHA y(o) EPA de las dietas de las cerdas (Tabla 2) y la leche (Tabla 3), y se correspondía significativamente con la disminución de las relaciones (n-6):(n-3) en todos los tejidos ensayados (Tabla 4).
Ejemplo 3. Cámara Ussing
Las muestras de yeyuno proximal comenzando a 40 cm del estómago que consistían en un segmento de 20-30 cm de yeyuno proximal, se retiraron y colocaron en un tampón de Krebs-Henseleit enfriado (que consistía en mmol/l: 25 de NaHCO3,120 de NaCl, 1 de MgSO4, 6,3 de KCl, 2 de CaCl, 0,32 de NaH2PO4; pH 7,4) para el transporte de vuelta al laboratorio (< 40 min) con aireación constante hasta cerrarlas en la cámaras Ussing. Se separaron las capas musculares externas de dos segmentos de yeyuno por cerdo y se montaron inmediatamente en Cámaras Ussing (DVC 1000 World Precision Instruments, New haven, CT USA).
Cada segmento se bañó por su superficie mucosa y serosa (área de apertura de 1,0 cm2) con 8 ml de solución de Krebs y se gaseó con una mezcla de un 95 % de O2-5 % CO2. Los segmentos intestinales se pinzaron con una tensión de cero mV mediante una corriente externa tras la corrección de la resistencia de la solución. Después de un periodo de 30 minutos para permitir que el tejido se estabilizara, se desafiaron independientemente con 10 mmol/l de D-glucosa y 10 mmol/l de L-glutamina que se añadieron al tampón seroso con adición de manitol equimolar (10
mmol/l) en el lado mucoso.
Se midió la diferencia de potencial a través del tejido durante 30 min después de cada desafío mediante condiciones de circuito abierto cada 10 segundos debido a que se suministró una corriente de cortocircuito mediante un aparato de pinza de tensión. Se registró el cambio de la corriente máxima y se calculó la conductancia del tejido desde la corriente de corto circuito y la diferencia de potencial utilizando la ley de Ohm. Esto se repitió en cuatro días diferentes con un total de cuatro cerdos por tratamiento.
Se evaluó la absorción de nutrientes ex vivo en el yeyuno a continuación de la adición de 10 mmol/l de D-glucosa o L-glutamina de tres maneras: (1) la corriente de cortocircuito, que mide el cambio en el transporte activo de iones; (2) la conductancia, que mide los cambios en el transporte total de iones; y (3) el transporte pasivo de iones, que se mide por cambios en la resistencia.
El transporte activo era significativamente mayor a continuación de la adición de D- glucosa en los tejidos obtenidos de los lechones de madres alimentadas con las dietas alDHA y PFO vs. Los lechones de CONT (P < 0,05, Fig. 1, panel A). Sin embargo, solo el transporte de glucosa con el tratamiento con alDHA era significativamente mayor que en los lechones de COCO (P < 0,05, Fig. 1, panel A). En comparación con los tejidos de CONT, la captación activa de D-glucosa del tejido de lechones alDHA era un 470 % mayor, pero las dietas PFO y COCO también daban como resultado una captación mayor vs. la de CONT (un 320 % y 40 %, respectivamente). Véase también la Fig. 5. Sin embargo, la captación activa de L-glutamina solo era mayor en el tejido de lechones de madres alimentadas con la dieta alDHA en comparación con los lechones de CONT y PFO (Fig. 1, panel B). Ni el transporte de iones total ni el pasivo estaban afectados por la suplementación de (n-3) PUFA o COCO en la dieta (datos no mostrados).
Ejemplo 4. Determinación del glucógeno en el músculo e hígado
Las muestras de músculo (longissimus dorsi) o tejido hepático (0,5 g) se extrajeron en ácido perclórico (0,5 mol/l) enfriado en hielo utilizando un homogeneizador Tissue Tearor. Las muestras por duplicado (300 pl) de cada homogenado se prepararon entonces por hidrólisis glicogénica con 0,3 g/l de amiloglucosidasa (Sigma-Aldrich, St Louis, MO USA) durante 120 minutos a 38 °C. La incubación se paró por adición de 0,6 mol/l de ácido perclórico y se clarificaron las muestras por centrifugación (1.500 x g, 15 minutos a 4 °C). Se utilizaron kits de ensayo (HK) de glucosa (Sigma-Aldrich, St Louis, MO USA) para determinar las unidades de glicosilo micromolar totales (glucosa, glucosa-6-P, y glucosa a partir de glucógeno) a partir de las muestras clarificadas y a partir del homogenado original (solo glucosa, glucosa-6-P). Los resultados se expresaron como mg de unidades glicosilo por g de tejido húmedo. Aunque las concentraciones de glucosa muscular no se alteraban con el tratamiento alimentario (Fig. 4, panel A), el glucógeno y las unidades totales de glicosilo aumentaron (P = 0,05) en los lechones de madres alimentadas con la dieta alDHA vs. la dieta de CONT. Por el contrario, las concentraciones no cambiaron en los lechones de madres alimentadas con las dietas de PFO y COCO. Al igual que el músculo, el glucógeno hepático y las unidades totales de glicosilo en los lechones de madres alimentadas con la diana alDHA tendían a ser mayores (P = 0,089, Fig. 4, panel B). Ni las dietas con (n-3) PUFA, ni la dieta de COCO, alteraban las concentraciones de glucosa hepática en comparación con el CONT.
Ejemplo 5. Extracción de ARN y PCR cuantitativa
Se recuperó el ARN total de las células utilizando el reactivo Trizol (Invitrogen, Carlsbad, CA USA), se trató con DNasa utilizado la Turbo DNase® (Ambion; Houston, TX USA) y el ARN total (2 pg) se transcribieron de manera inversa utiolizando el kit de síntesis iScript cDNA (BioRad; Hercules, CA USA).
Las secuencias eran: AMPKa2 porcino, 5'-cgacgtggagctgtactgctt-3' y 5'-cataggtcaggcagaacttgc-3', SGLT1 porcino, 5'-cgtgctgtttccagatgatg-3' y 5'-atcagctccatgaccagctt-3', y proteína ribosómica porcina L32 (constitutiva), 5'-tggaagagacgttgtgagcaa-3' y 5'-cggaagtttctggtacacaatgtaa-3', todas las secuencias eran en sentido y antisentido respectivamente.
Las condiciones del ciclador térmico para las reacciones de PCR eran de 95 °C durante 3 min seguido por 40 ciclos de 95 °C durante 15 s, 65 °C durante 30 s, y 72 °C durante 30 s. Los productos amplificados de la reacción en cadena de polimerasa se clonaron en el vector pGEMT (Promega, Madison, WI USA) y se secuenciaron para su verificación. Las reacciones en tiempo real se llevaron a cabo en una máquina iCycler real-time utilizando el kit IQ™ SYBR Green Supermix (BioRad, Hercules, CA USA). Se calculó la cantidad de producto genético regresando contra la curva de referencia generada en la misma reacción por sus plásmidos respectivos y valores genéticos normalizados al gen constitutivo de la proteína L32 ribosómica (RPL32) que no estaba afectado por el tratamiento alimentario (P > 0,10).
Para confirmar el aumento de captación de glucosa en los tratamientos con (n-3) PUFA y para validar un mecanismo potencial, se examinó la expresión proteica de GLUT2 y SGLT1 y la cantidad de ARNm de SGLT1. En comparación con el yeyuno de lechones de CONT, los análisis de inmunotransferencia semicuantitativos demostraron que los lechones con el tratamiento de PFO, alDHA y COCO tendían a tener una expresión total de proteína GLUT2 mayor
aproximadamente un 20 % (P = 0,095, Fig. 2). Además, las dietas PFO y alDHA daban como resultado una expresión total de proteína SGLT1 significativamente mayor en comparación con los lechones de madres alimentadas con la dieta CONT (P<0,05, Fig. 3), mientras que no había ningún efecto con la dieta COCO. Véase también las Fig. 6 y 7. También se llevó a cabo la PCR cuantitativa para determinar si la cantidad de ARNm (es decir, la cantidad log de inicio) de SGLT1 también estaba influenciada por la dieta materna. La suplementación de ácidos grasos en la dieta no altera la expresión de ARNm de SGLT1 en el yeyuno (datos presentados como la cantidad de inicio log para COT (1,87), PFO (1,71), alDHA (1,84) y COCO (1,70), SEM agrupado = 0,14).
Ejemplo 6. Expresión proteica
Las secciones completas de yeyuno (1 g) congeladas se descongelaron y homogeneizaron en hielo en 700 pl de tampón A (50 mmol/l de Tris-HCl pH 7,5, 50 mmol/l NaF, 5 mmol/L de pirofosfato sódico, 1 mmol/l de EDTa , 1 mmol/l de DTT, 9,1 mmol/l de fenilmetilsulfonil fluoruro, un 10 % de glicerol) que contiene un 1 % de Triton X-100, 5 pmol/l de aprotinina, leupeptina, y pepstatina. Los lisados se centrifugaron a 6.000 x g durante 20 minutos a 4 °C para retirar el material insoluble. Se recolectaron los sobrenadantes y se cuantificaron las proteínas utilizando los reactivos BCA (Pierce, Rockford, IL USA) y se congelaron hasta su ensayo. Los lisados de yeyuno se utilizaron tanto para el ensayo de AMPK y al análisis de transferencia de western.
Se determinó la cantidad de las proteínas GLUT2 (~60 kDa) y SGLT1 (~70 kDa) se determinó por análisis de transferencia de western. En resumen, el sobrenadante que contenía 200 pg de proteína se inmunoprecipitó a temperatura ambiente durante 2 horas utilizando el Sistema de inmunoprecipitación reversible Catch and Release v2.0 (Upstate Cell Signaling Solutions, Charlottesville, VA USA). Tanto GLUT2 como SGLT1 se inmunoprecipitaron con anticuerpos primarios (Chemicom International, Temecula, CA USA) diluidos 1:100. Las proteínas inmunoprecipitadas se separaron mediante SDS-PAGE utilizando un 12% de gel de resolución y se transfirieron a una membrana de nitrocelulosa y se hibridaron durante una noche con los anticuerpos primarios para GLUT2 O SGLT1 (1:1000). Las membranas se hibridaron con un anticuerpo de cabra-HRP anti-IgG de conejo (Pierce, Rockford, IL USA) a 1:20.000 durante 1 h a temperatura ambiente. Las transferencias se desarrollaron utilizando el sistema de sustrato quimioluminiscente the SuperSignal West Pico (Pierce, Rockford, IL USA), capturado en una micro-película para el análisis y densitometría de la proteína determinada utilizando el software de análisis Quantity One 1-D (Bio-Rad, Hercules, CA USA).
Ejemplo 7. Análisis estadístico
Todos los datos se presentan como las medias ± SEM agrupado. Los efectos de los ácidos grasos se ensayaron mediante el procedimiento PROC MIXED en SAS (Versión 9,1, SAS Institute, Cary, NC) y se evaluaron las diferencias de tratamiento utilizando diferencias significativas mínimas, que proporcionan todas comparaciones de modo pareja. La camada/lechón se consideró la unidad experimental y el replicado experimental o el día de la recolección se consideró un efecto aleatorio. Las diferencias se consideraron significativas cuando P < 0,05, y se anotaron las tendencias a P < 0,10.
Ejemplo 8. Animales y diseño experimental
Se alimentaron treinta dos hembras (madres Línea Ausgene 20 x verraco SPI) con una de dos dietas experimentales durante aproximadamente 150 días para englobar el periodo de gestación completo o 17-19 días durante el periodo de lactancia antes del destete. Los tratamientos alimentarios (Tabla 5) consistían en las siguientes: 1) dieta básica de control con harina de maíz/soja (sin grasa añadida, CONT); o 2) la dieta básica suplementada con un producto de aceite de pescado protegido ([PFO], Gromega 365™; JBS United Inc., Sheridan, IN). El producto PFO contiene un 29 % de grasa total como n-3 PUFa , con aproximadamente un 13 % de EPA y un 13 % de DHA. Las dietas de gestación y lactancia se formularon para satisfacer o exceder todas las necesidades para las cerdas gestantes y lactantes [NRC, Nutritional Requirements of Swine, 10a ed., Natl. Acad. Press, Washington, DC (1998)]. Las madres y los lechones tenían acceso al agua en cualquier momento.
En el parto de los cochinillos después de aproximadamente 150 días de las dietas de gestación las camadas se normalizaron a diez lechones por madre. Para conseguir la exposición de los lechones a los ácidos grasos n-3 solo durante el periodo de gestación o al mamar (lactancia), las camadas se intercambiaron recíprocamente de manera que las madres alimentadas con dieta CONT recibían lechones de una madre alimentada con dieta PFO, y viceversa, durante 15-19 días. Los cuatro tratamientos ahora consistían en una alimentación de gestación/lactancia para dar lechones CONT/CONT, CONT/PFO, PFO/PFO o PFO/CONT. A los 15-19 días de edad, se transfirió aleatoriamente un lechón de tamaño medio (5,4 ± 0,50 kg) por camada a una sala separada de las madres, se agruparon en una pocilga y se dejaron en ayuno durante una noche para simular el proceso de destete (total n = 6 por tratamiento). A la mañana siguiente, los lechones se sometieron a eutanasia y se recolectaron las muestras tisulares. Se recolectaron muestras de yeyuno del intestino delgado y músculos y se congelaron en nitrógeno líquido, y se colocaron muestras de yeyuno adicionales en formalina al 10 % para los análisis posteriores.
Ejemplo 9. Análisis de ácidos grasos
Los lípidos se extrajeron del músculo e hígado de los lechones por el método de Lepage y Roy [J. Lipid Res, 27: 114-120 (1986)], con mínimas modificaciones. En resumen, se homogeneizaron 0,5 gramos de tejido en 2,5 ml de metanol:hexano 4:1 y entonces se añadieron 200 j l de una solución de 3,7 mmol de ácido heptadecanoico/l de metanol a cada muestra como referencia interna. Se analizaron los metilésteres de ácidos grasos mediante cromatografía de gases en un Hewlett-Packard modelo 6890 (Hewlett-Packard, Palo Alto, CA) ajustado con una columna de capilaridad Omegawax 320 (30 m x 0,32 mm ID, 0,25 jm ) (Sigma-Aldrich, St Louis, MO USA). El hidrógeno era el vehículo gaseoso. La temperatura programada variaba desde 80 °C a 250 °C con un aumento de temperatura de 5 °C/min. Las temperaturas del inyector y el detector eran de 250 °C y se inyectó 1 j l de muestra y se ejecutó sin dividir. Los ácidos grasos se identificaron por sus tiempos de retención en la columna como se juzgó por las referencias apropiadas.
Los tejidos de los lechones reflejaban los perfiles de ácidos grasos alimentarios de la dieta materna
Los perfiles de ácidos grasos para el yeyuno y el músculo longissimus se presentan en las Tablas 14 y 15. La alimentación con PFO durante la gestación y lactancia daba como resultado contenidos significativamente (P<0,05) más altos de n-3 PUFA tanto en yeyuno y músculo vs el régimen CONT/CONT. Este aumento se conseguía tanto para el DHA como EPA en el yeyuno, pero el músculo presentaba un enriquecimiento sobre todo como DHA. La eliminación de la dieta PFO al inicio de la lactancia producía una disminución significativa de los contenidos de DHA, EP, y n-3 total en ambos tejidos. Sin embargo, la alimentación con dieta PFO durante solo el periodo de lactancia se conseguía un enriquecimiento similar al de la alimentación con esta fuente de n-3 durante los 150 días completos.
Ejemplo 10. Cámara Ussing
Las muestras de yeyuno proximal comenzando a 40 cm del estómago que consistían en un segmento de 20-30 cm de yeyuno, se retiraron y colocaron en un tampón de Krebs-Henseleit enfriado (pH 7,4), que consistía en lo siguiente: 25 mM NaHCO3, 120 mM NaCl, 1 mM MgSO4, 6,3 mM KCl, 2 mM CaCI, 0,32 mM NaH2PO4. Los tejidos se aireaban continuamente hasta fijarlos en las cámaras Ussing en el laboratorio. Se retiró la túnica muscular a partir de dos segmentos del yeyuno por cerdo, y se montaron inmediatamente en las cámaras Ussing (DVC 1000 World Precision Instruments, New haven, CT USA). Cada segmento se bañó por su superficie mucosa y serosa (área de apertura de 1,0 cm2) con 8 ml de solución de Krebs y se gaseó con una mezcla de un 95 % de O2-5 % CO2. Se pinzó con una tensión de 0 mV mediante una corriente externa tras la corrección de la resistencia de la solución. Después de un periodo de 30 minutos para permitir que los tejidos se estabilizaran, se desafiaron con 10 mM de D-glucosa que se añadieron al tampón seroso, y se añadió una concentración de manitol equimolar al tampón mucoso. Adicionalmente, las muestras de yeyuno de algunos lechones CONT/CONT se montaron, estabilizaron y trataron (mucosa) con 0,1 mM de DHA o 2,5 mM de AICAR solubilizado en 20 mM de ácido taurocólico. La captación de glucosa se evaluó entonces después de 20 minutos, con los tejidos desafiados con 10 mM de D-glucosa como se ha descrito anteriormente. Se midió la diferencia de potencial a través del tejido durante 30 minutos después de cada desafío mediante condiciones de circuito abierto cada 10 segundos debido a que se suministró una corriente de cortocircuito mediante un aparato de pinza de tensión. Se registró el cambio de la corriente máxima y se calculó la conductancia del tejido desde la corriente de corto circuito y la diferencia de potencial utilizando la ley de Ohm. Este procedimiento se repitió en cuatro días diferentes con un cerdo de cada régimen alimentario para alcanzar un total de cuatro cerdos por tratamiento.
Transporte de glucosa
Se compararon los cambios en el transporte activo de glucosa en el yeyuno de lechones destetados de madres alimentadas con dietas CONT o PFO. Como se muestra en la Fig. 5, la alimentación con PFO a lo largo de la gestación y lactancia aumentaba la captación de glucosa en un 500 % (5 vs 25 jA/cm2, P<0,05), y proporcionado la fuente n-3 solo en la gestación mejoraba la captación de glucosa aproximadamente un 400 %. Por el contrario, la alimentación con PFO solo en la lactancia impedía cualquier aumento significativo de la captación de glucosa (15 vs 5 jA/cm2, respectivamente, P = 0,16).
Ejemplo 11. Análisis de inmunotransferencia de proteínas de transporte de glucosa en preparaciones totales y de la membrana en borde de cepillo
Se retiró el yeyuno proximal intacto reciente, se lavó con solución salina y se colocó en hielo mientras se retiraban aproximadamente 4 g de mucosa y se transfirieron a 2 mM de tampón Tris-HCl frío (pH 7,1) que contenía 50 mM de manitol e inhibidores de proteasa (5 jM de aprotinina, leupeptina, y pepstatina). La mucosa se homogeneizó entonces y se añadió PEG 4000 hasta una concentración final de un 10 % y se agitó en hielo durante 15 minutos. El homogenado se centrifugó entonces durante 15 minutos a 7.500 x g y la fracción de sobrenadante resultante se centrifugó a 27.000 x g durante 60 minutos a 4 °C. El aglomerado se lavó en tampón de suspensión (10 mM de Tris-HCl, pH 7,1, que contenían 300 mM de manitol e inhibidores de proteasa 5 jM de aprotinina, leupeptina y pepstatina) y se recolectaron de nuevo por centrifugación durante 5 minutos, 27.000 x g a 4 °C. El aglomerado de membrana de borde en cepillo en bruto (BBM) se suspendió en 1 ml de tampón de suspensión. Para la preparación de membranas totales, las secciones de yeyuno (1 g) congeladas se homogeneizaron en hielo en 700 j l de tampón A (50 mM de Tris-HCl pH 7,5, 50 mM de NaF, 5 mM de pirofosfato sódico, 1 mM de EDTA, 1 mM de DTT, 0,1 mM de
fenilmetilsulfonil fluoruro, un 10 % de glicerol) que contiene un 1 % de Tritón X-100 y 5 pM de aprotinina, leupeptina, y pepstatina. Los homogenados se centrifugaron a 6.000 x g durante 20 minutos a 4 °C para retirar el material insoluble. Las concentraciones proteicas de las preparaciones de BBM totales se determinaron utilizando los reactivos BCA (Pierce, Rockford, IL USA). Las preparaciones totales finales y de membrana con borde de cepillo se congelaron a -80 °C hasta que se ensayaran. La pureza de las preparaciones de membrana con borde en cepillo según se medían con fosfatasa alcalina no estaban afectadas por el tratamiento (datos no mostrados).
Se determinó la cantidad de proteína GLUT2 y SGLT1 en la BBM total y bruta mediante análisis de transferencia de western. En resumen, las preparaciones que contenían 250 pg de proteína se inmunoprecipitaron a temperatura ambiente durante 2 h utilizando el Sistema de inmunoprecipitación reversible Catch and Release v2.0 (Upstate Cell Signaling Solutions, Charlottesville, VA USA). Tanto GluT2 como SGLT1 se inmunoprecipitaron con anticuerpos primarios (Chemicom International, Temecula, CA USA) diluidos 1:100. Las proteínas inmunoprecipitadas se separaron mediante SDS-PAGE utilizando un 12% de gel de resolución y se transfirieron a una membrana de nitrocelulosa y se incubaron durante una noche con los anticuerpos primarios para GLUT2 o SGLT1 (diluidos a 1:1000).
Expresión de proteínas de transporte de glucosa en el yeyuno
Las inmunotransferencias de la cantidad de GLUT2 en las preparaciones de BBM en bruto presentaban un enriquecimiento pequeño pero significativo (P<0,05) en la última fracción obtenida de los lechones de madres que consumieron las dietas PFO (Fig. 6, panel A), pero no había un cambio aparente en la cantidad de los homogenados totales (Fig. 6, panel B). Este resultado no estaba influenciado por la duración del régimen de PFO ni era específico para los periodos de gestación o lactancia.
Se llevaron a cabo inmunotransferencias similares para SGLT1. Como se ve en la Fig. 7, panel A, el régimen alimentario CONT/PFO tendía a aumentar la cantidad de la proteína SGLT1 en las preparaciones BBM, pero solo el régimen PFO/CONT era significativo (P<0,05). Por el contrario, la alimentación con PFO en cualquier régimen alimentario aumentaba (P<0,06) la cantidad de proteína SGLT1 en el homogenado total (Fig. 7, panel B).
Ejemplo 12. Análisis estadísticos
Todos los datos se expresan como las medias ± SEM. Los efectos del régimen de tratamiento alimentario se determinaron mediante el procedimiento PROC MIXED en SAS (Versión 9,1, SAS Institute, Cary, NC) y se establecieron las diferencias utilizando un procedimiento de diferencias significativas mínimas cuando se protegen por un valor F significativo. El efecto de la gestación, lactancia o gestación y lactancia de la alimentación con n-3 PUFA se evaluó en el modelo. La camada/lechón se consideró la unidad experimental y el replicado experimental o el día de la recolección se consideró un efecto aleatorio. Las diferencias se consideraron significativas cuando P < 0,05, y se anotaron las tendencias a P < 0,10.
Ejemplo 13. Diseño experimental
Se emplearon un total de cuatro tratamientos alimentarios experimentales. Los tratamientos alimentarios consistían en 1) una dieta básica de harina de maíz/soja (sin grasa añadida, de control), o la dieta básica suplementada con cualquiera de 2) aceite de pescado protegido (Fertilium™ o PFO), 3) alDHA, y 4) grasa de coco extruida (Coco) (Tabla 1). Los perfiles de ácidos grasos de los ingredientes alimentarios utilizados para proporcionar los ácidos grasos a distintas dietas se muestran en la Tabla 7. La composición de ácidos grasos de todas las dietas utilizadas en este experimento se equilibró al porcentaje del total de grasa cruda de las dietas, con el porcentaje de DHA de las dietas de DHA coincidentes con el porcentaje de ADHA calculado en la dieta Fertilium™. Las cerdas se alimentaron con una dieta de gestación y lactancia (Tablas 1, 2 y 8) continuamente comenzando aproximadamente 35 d antes de la monta. Los lechones en cría se introdujeron a las dietas de inicio y se llevaron a una cuarta fase de régimen alimentario (Tabla 9). Al salir de los criaderos, los cerdos estaban en la fase de dietas de pienso (Tabla 10) que contenían uno de los cuatro tratamientos experimentales.
Ejemplo 14. Animales
Cerdas y lechones
Las cerdas se alojaron en una pocilga de gestación y zonas de parto que tenían clima controlado. Doscientas cuarenta cerdas genéticamente AusGene se colocaron en uno de cuatro tratamientos experimentales aproximadamente 35 d antes de la monta. Las cerdas secas y lactantes tenían libre acceso al agua en cualquier momento y se alimentaron dos veces al día. Se formaron camadas experimentales normalizando las camadas dentro de cada tratamiento. Dentro del tratamiento, todos los lechones de ese día de parto se agruparon y entonces se pesaron individualmente según se adoptaban de manera cruzada de vuelta con cerdas del mismo tratamiento. Las cerdas experimentales tenían aproximadamente 10-11 lechones. Los pesos de los lechones individuales, el número total y los datos de sexo se registraron para cada camada experimental y los lechones se tatuaron y se les hicieron muescas en las orejas según tratamiento, camada y número del lechón.
Aproximadamente 2200 lechones se colocaron en los tratamientos de destete (Tabla 9) y se destetaron en tres porquerizas en la granja de producción al día siguiente. Los lechones de cerdas alimentadas con los trat. 2-4 se dividieron completamente y se mantuvieron con el tratamiento de la cerda o se cambiaron a Coco (si habían estado en dietas con PUFA) o PFO si habían tenido la dieta de Coco. Por lo tanto, los tres tratamientos se convirtieron en siete que consistían en los siguientes: el de control que se mantuvo como control; el PFO, PFO/Coco o PFO/PFO, DHA, DHA/Coco o DHA/DHA y Coco, Coco/PFO o Coco/Coco. Se intentaba que las pocilgas de destete tuvieran 24 cerdos por pocilga, mismo sexo, peso y distribuciones covariantes. Las pocilgas de cría se clasificaron en bloques aleatoriamente en las porquerizas y se alcanzaron un total de nueve repeticiones de tratamientos.
Cría
Los criaderos en la granja de producción también se controlaron con termostatos a una temperatura inicial de 30 °C y la temperatura se disminuyó semanalmente hasta una temperatura diana de 25 °C. Los lechones tenían acceso libre al agua y se alimentaron ad libitum con una dieta granulada de inicio durante dos semanas antes de cambiarles a una dieta básica. Al final de la semana 13, los cerdos, manteniendo la disposición de las pocilgas, se transfirieron a una final dentro de la misma porqueriza.
Recría-finalización
Dentro de las porquerizas, los cerdos tenían acceso al agua y se alimentaron de nuevo ad libitum con un pienso básico que contenía el tratamiento de control, PFO, DHA o Coco (Tabla 10).
Rendimiento total de crecimiento
La eficacia de conversión del pienso tendía a mejorar hasta un 2,5 % (P<0,10, Tabla 11) en todos los tratamientos PFO o DHA, excepto para los cerdos que habían tenido una exposición a Coco in utero, en comparación con el tratamiento de control. La exposición de los lechones a EPA y d Ha in utero y en la leche de la cerda mejoraron la conversión de pienso en las crías (P<0,10).
Aumento en la tasa de crecimiento pre-destete de los lechones y reducción de la mortalidad pre-destete cuando las cerdas se alimentaron con n-3 PUFA durante la gestación y lactancia
Las cerdas se alimentaron con dietas de maíz/sbm suplementadas con n-3 PUFA protegidos de Fertilium™ para proporcionar un 0,022% de DHA y EPA en la alimentación final de la cerda (Tablas 12 y 13). Las dietas se administraron a las cerdas desde aproximadamente 35 días antes de la monta y durante todo el periodo de gestación y lactancia posterior. Las camadas se normalizaron al mismo número de lechones. El número de lechones y el peso de la camada se recopiló a los 14 días del parto para determinar el impacto pre-destete sobre la tasa de crecimiento y la tasa de mortalidad en los lechones. La dieta Fertilium™ aumentaba el número de cerdos destetados y el peso de los cerdos al destete (Tabla 12 y 13).
Ejemplo 15. Análisis estadísticos
Todos los datos se analizaron por el procedimiento PROC MIXED en SAS (Versión 9.1, SAS Institute, Cary, NC). En los experimentos de lactancia, la cerda se consideró la unidad experimental y se incluyeron en bloques por semana y zona de parto. Para los datos experimentales de cría y recría-finalización, la unidad experimental era la pocilga y se incluyeron en bloques por tratamiento y por las nueve repeticiones generadas al destete.
Ejemplo 16. Transporte de nutrientes en pollos
Se alojaron nuevo gallinas capa Leghorn S1 en gallineros individuales en una sección de unas instalaciones de ambiente controlado. Las gallinas se alimentaron con dietas que se diferenciaban en el contenido en ácidos grasos n-3 poliinsaturados (PUFA) y ácido docosahexaenoico (DHA), y se formularon para cumplir los requisitos de aves de corral del NRC (National Research Council, 1994. Nutrient requirements of poultry. 9a Ed. NRC, Washington D.C.). Los tres tratamientos alimentarios se suministraron para evaluar el impacto de la ingesta materna de n-3 PUFA y DHA sobre la captación intestinal de nutrientes de las crías. Los tratamientos incluían: 1) (CON) Dieta suplementada con aceite de soja con una inclusión en la dieta del 2,7 %; 2) Dieta (PFO) suplementada con aceite de pescado protegido de GROMEGA 365™ (JBS United, Sheridan, IN) con un 13,56 % de la dieta para proporcionar una fuente no de algas de DHA; o 3) (alDHA) Dieta suplementada con DHA de algas Schizochytrium con un 1,13 % de la dieta (Tabla 1). Adicionalmente el suministro de aceite de pescado protegido y algas se formuló para que fuera igual para los tratamientos de PFO y DHA (Tabla 2). Las dietas se formularon basándose en la ingesta de pienso diaria de 115 g/gallina/d.
Tabla 1. Dietas experimentales a
Ingredientes, % Control alDHA3 PFOb
Maíz 62,00 65,48 53,63
Harina de soja 24,96 23,03 22,43
Caliza 7,75 7,75 7,75
Aceite de soja 2,70 0,00 0,00
aIDHAa 0,00 1,13 0,00
PFOb 0,00 0,00 13,56
Fosfato dicálcico 1,42 1,43 1,46
Premezlca de vitaminas 0,50 0,50 0,50
Sal 0,40 0,40 0,40
DL-Metionina 0,11 0,13 0,12
Premezcla de minerales 0,10 0,10 0,10
Premezcla de selenio 0,05 0,05 0,05
aalDHA = algas Schizochytrium
b PFO = aceite de pescado protegido
Tabla 2. Contenido formulado de ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA) de las dietas experimentales e ingesta diaria calculada (g/d)__________________________________________
Control alDHAa PFOb
Tasa de inclusión del suplemento, % 0,00 1,13 13,56
Contenido en EPA del suplemento, % 0,00 0,99 2,61
Contenido en DHA del suplemento, % 0,00 20,94 1,73
EPA suplementado a la dieta de las gallinas, % 0,00 0,01 0,35
DHA suplementado a la dieta de las gallinas, % 0,00 0,24 0,24
Ingesta diaria estimada, g/d 115 115 115
Ingesta de EPA estimada, g/d 0,00 0,01 0,41
Ingesta de DHA estimada, g/d 0,00 0,27 0,27
a alDHA = algas Schizochytrium
b PFO = aceite de pescado protegido
Ejemplo 17. Protocolo con los animales: transporte de nutrientes en pollos
Las gallinas se alimentaron con las dietas durante 21 días antes de la recolección de aproximadamente 10 huevos fértiles de cada una de las 3 gallinas/trat., por nidada (un conjunto de 30 huevos por nidada por tratamiento). Tras la eclosión, se sacrificaron aproximadamente cinco pollitos de 3 días de edad de cada gallina para el análisis de la captación de glucosa y glutamina intestinal (15 pollitos/trat ). Se incubaron los huevos a 37,5 °C y un 60,4% de humedad relativa en una incubadora comercial con volteo automático de los huevos (Jamesway, Modelo n° 252), y el día 19 los huevos se transfirieron a una cesta de eclosión y eclosionaron en la incubadora. Al eclosionar, los pollitos se colocaron en una batería de jaulas precalentadas y se les proveyó con agua y una dieta de inicio de pollos común. Aproximadamente a las 72 horas post-eclosión, los pollitos se sometieron a eutanasia mediante asfixia en CO2 y se recogieron los segmentos de yeyuno intestinal para la evaluación de la absorción de nutrientes intestinal.
Ejemplo 18. Protocolo con las cámaras Ussing: transporte de nutrientes en pollos
Las muestras de yeyuno proximal entre el conducto biliar y el saco vitelino se retiraron y se colocaron en tampón de Krebs-Henseleit (que consiste en mmol/l: 25 de NaHCO3,120 de NaCl, 1 de MgSO4, 6,3 de KCl, 2 de CaCl, 0,32 de NaH2PO4; pH 7,4) para el transporte de vuelta al laboratorio (< 40 min) con aireación constante hasta fijarlas en las cámaras Ussing. Se montaron inmediatamente dos segmentos de yeyuno por pollito en Cámaras Ussing (DVC 4000 World Precision Instruments, New haven, CT USA). Cada segmento se bañó por su superficie mucosa y serosa (área de apertura de 1,0 cm2) con 3 ml de solución de Krebs y se gaseó con una mezcla de un 95 % de O2-5 % CO2. Los segmentos intestinales se pinzaron con una tensión de cero mV mediante una corriente externa tras la corrección de la resistencia de la solución. Después de que se estableciera y estabilizara una corriente de cortocircuito (5 a 10 min), se tomaron las mediciones de corriente de cortocircuito básicas utilizando el software MP100A (BioPac Systems Inc., Santa Barbara, CA). El software permitía mediciones en tiempo real de la corriente y de esta manera se monitorizaban constantemente los cambios de corriente. Después de que el tejido se estabilizara, se desafiaron independientemente con 10 mmol/l de D-glucosa y 10 mmol/l de L-glutamina que se añadieron al tampón seroso, con adición equimolar (10 mmol/l) de manitol en el lado mucoso. Se registró el cambio máximo de corriente y esto se repitió en cuatro días diferentes con un total de diez pollitos por tratamiento.
Ejemplo 19. Modulación de ácidos grasos del transporte de nutrientes en pollos
La Figura 8 muestra la captación de glucosa en pollitos de tres días de gallinas alimentadas con una dieta enriquecida en DHA de algas Schizochytrium (alDHA) o aceite de pescado protegido (PFO). El transporte de glucosa intestinal (10 mM) se evaluó mediante una técnica modificada de cámara Ussing como se ha descrito anteriormente.
La Figura 9 muestra la captación de glutamina en pollitos de tres días de gallinas alimentadas con una dieta enriquecida en DHA de algas Schizochytrium (alDHA) o aceite de pescado protegido (PFO). El transporte de glucosa intestinal (10 mM) se evaluó mediante una técnica modificada de cámara Ussing.
Los pollitos eclosionados de gallinas suplementadas con n-3 PUFA y DHA de una fuente de algas (alDHA) o no de algas (PFO) presentaban una captación de glucosa en el yeyuno significativamente aumentada en comparación con los pollitos eclosionados de gallinas no suplementadas con n-3 PUFA o DHA (P < 0,05) (Fig. 8). La captación activa de glucosa en los tratamientos con alDHA y PFO eran un 41 % y 37 % mayores que en los pollos alimentados con la dieta de control, respectivamente. No había diferencia en la captación de glucosa entre alDHA o PFO (P > 0,50) (Fig. 8). No había diferencia entre los tratamientos para la captación de glutamina (P > 0,10) (Fig. 9).
Ejemplo 20. Fórmula ejemplar de PFO
A continuación, se dan las fórmulas ejemplares de una composición no de algas que comprende ácidos grasos omega-3 o ésteres de los mismos que se pueden añadir a las composiciones de pienso como se ha descrito en el presente documento.
GroMega extrusionado Formula n° 1:
Ingrediente % de producto
Harina de trigo 65,45
Aceite de sábalo atlántico 20,00
Harina de alfalfa 8,80
Melazas secas 5,60
Vitaminas 0,15
Para cerdos 4,53-9,07 kg/tonelada de pienso completo
Relación DHA:EPA 0,75-1:1
GroMega extrusionado Formula n° 2:
Ingrediente % de producto
Aceite de sábalo atlántico 60
Vehículo de almidón 40
Total 100
Para cerdos 2,27-4,53 kg/tonelada de pienso completo
Relación DHA:EPA 0,75-1:1
Tabla 2. Composición de ácidos grasos de la dieta de lactancia de cerdas
Dieta
CONT PFO alDHA COCO (g/100 g de ácidos grasos totales)
6:0 0,00 0,00 0,00 0,06
8:0 0,00 0,00 0,00 1,44
10:0 0,00 0,00 0,00 1,11
12:0 0,00 1,37 1,38 8,97
14:0 0,00 0,47 0,28 3,82
16:0 15,53 15,56 15,22 14,53
16:1 0,00 0,67 0,00 0,00
18:0 3,18 3,20 2,95 3,09
18:1 23,63 21,55 23,19 19,19
18:2(n-6) 54,07 52,36 52,74 44,53 18:3(n-3) 3,02 3,05 2,88 2,69
20:0 0,44 0,41 0,44 0,36
20:1 0,00 0,27 0,00 0,00
20:3(n-6) 0,00 0,00 0,00 0,00 20:5(n-3) 0,00 0,58 0,00 0,00 22:5(n-3) 0,00 0,00 0,00 0,00 22:6(n-3) 0,00 0,51 0,80 0,00 Otros 0,12 0,00 0,12 0,20 Saturados 19,27 21,51 21,20 33,58 Total (n-3) 3,02 4,14 3,68 2,69 Total (n-6) 54,07 52,36 52,74 44,53 (n-6) / (n-3) 17,90 12,6 14,3 16,5
Tabla 3. Perfil de ácidos grasos de la leche de cerda después de la alimentación en gestación y lactancia con las dietas modificadas con ácidos grasos 12
Dieta SEM CONT PFO alDHA COCO Agrupados (g/100 g de ácidos grasos totales)
10:0 0,24 0,17 0,18 0,28 0,059
12:0 0,27a 0,20a 0,23a 1,30b 0,154
14:0 3,61 2,68 3,14 4,28 0,586
16:0 33,91 27,59 28,59 34,47 3,091
16:1 10,51 7,84 8,83 10,87 2,55
18:0 5,08 5,55 5,49 4,73 0,305
18:1 29,89 39,22 36,69 28,78 4,733
18:2(n-6) 13,39 13,08 13,18 12,26 1,640 18:3(n-3) 0,61 0,57 0,56 0,55 0,053
20:0 0,09 0,06 0,12 0,04 0,061
20:1 0,22 0,42 0,36 0,25 0,144
20:2 0,25 0,42 0,43 0,30 0,101
20:3(n-6) 0,34 0,07 0,10 0,00 0,203 20:4(n-6) 0,50 0,67 0,71 0,82 0,208 20:5(n-3) 0,00 0,07 0,00 0,00 0,040 22:5(n-3) 0,00a 0,27b 0,12ab 0,00a 0,069 22:6(n-3) 0,00a 0,24b 0,29b 0,00a 0,035 Otros 1,07 0,88 0,99 1,06 0,149 Saturados 43,31bc 36,25a 37,75ab 45,11c 3,512 Total (n-3) 0,61a 1,16b 0,97b 0,55a 0,122 Total (n-6) 14,72 14,41 14,60 13,68 1,926 (n-6) / (n-3) 24,1b 12,5a 15,4a 24,9b 1,611 Medias de las muestras de leche recolectadas de 4 cerdas por tratamiento.
Dentro de una fila, se diferencian las medias con superíndices sin una letra común, P < 0,05.
Tabla 5. Dietas de gestación y lactancia (a base de pienso)
Gestación Lactancia Ingrediente. % Control PFO Control PFO Maíz 75,69 75,69 64,96 64,96 Harina de soja, 48 % 18,66 18,66 27,74 27,74 Premezcla de Vitaminas/minerales/fitasa 4,65 4,65 6,30 6,30 Almidón de maíz 1,00 - 1,00 -Aceite de pescado protegido (PFO)a - 1,00 - 1,00 Total 100 100 100 100
Contenido de nutrientes calculado, %
Grasa bruta 3,56 3,78 3,45 3,66 Proteína bruta 15,17 15,26 19,09 19,18 Lisina 0,75 0,75 1,10 1,10 Fósforo 0,77 0,77 0,81 0,81
Calcio 0,88 0,88 0,91 0,91
EPAb - 0,007 - 0,007
DHAb - 0,007 - 0,007 12:0, 14:0 y 16:0b - 0,013 - 0,013 Total de ácidos grasos n-6 1,58 1,58 1,43 1,43 Total de ácido grasos n-3 0,06 0,13 0,07 0,14 Relación de ácidos grasos n-6:n-3 26,70 12,04 20,51 10,11 a El aceite de pescado protegido fue suministrado por JBS United, Inc.
b Porcentaje calculado de la grasa total de la dieta
Tabla 7. Perfil de ácidos grasos del ingrediente como aditivo de la dieta: los ácidos grasos se ______________ presentan como el porcentaje de ácidos grasos totales. *______________
Ingrediente alimentario*
Ácido graso
FERTILIUM™ alDHA Coco
C10:0 0,258 0,098 6,702
C12:0 (láurico) 0,117 0,327 51,754 CI4:0 (mirístico) 8,662 9,117 19,393
C 16:0 (palmítico) 18,009 23,127 9,625 C16:1n7 11,190 0,048 0,029 C18:0 (esteárico) 3,031 0,545 3,010 C18:1n9 3,067 0,077 0,084 C18:1n7 0,118 0,132 6,816 C18:2n6 4,382 0,031 2,266 C18:3n6 0,270 0,240
C18:3n3 (a-linolénico) 1,476 0,097 0,090
C20:0 0,182 0,167 0,091
C20:1n9 1,419 0,046 C20:3n6 0,184 0,409
C20:4n6 (araquidónico) 0,622 2,410
C20:3 0,242 0,237
C20:5n3 (EPA) 12,806 1,656
C22:0 0,134 0,075 0,024
C22:4n6 0,111 0,085
C22:5n6 0,343 15,736
C22:5n3 (DPA) 2,185 0,405 0,034 C24:0 0,268
C22:6n3 (DHA) 12,213 40,940
Total de ácidos grasos n3 28,680 43,100 0,124 Total de ácidos grasos n6 5,913 18,911 2,266 Total de ácidos grasos saturados 30,527 33,381 87,565 Relación n6:n3 0,21 0,44 21,25
Tabla 8. Dietas experimentales que denotan el balance calculado de ácidos grasos añadidos durante la gestación y la lactancia de la cerda. Cálculos basados en la grasa bruta total y DHA en ambas dietas con PUFA coincidiendo con el contenido en la dieta Fertilium.
Tabla 9. Balance aproximado calculado de ácidos grasos de las dietas en la fase de cría. Los ácidos grasos añadidos presentes se basaron en el porcentaje de grasa bruta y el contenido de DHA coincidía en ambos tratamientos con PUFA con los de Fertilium.
Tabla 10. Balance de ácidos grasos calculado aproximadamente de las dietas en la fase recría-finalización. Los ácidos grasos presentes se basaban en el porcentaje de grasa bruta total y el contenido de DHA coincide para ambos tratamientos con PUFA con el de Fertilium.
continuación
Tabla 11. Rendimiento acumulado de los cerdos de ganancia (ADG), ingesta de pienso (ADFI) y conversión del pienso (FG) para cerdos criados por cerdas alimentadas con fuentes diferenciales de ácidos grasos en gestación ____________ lactancia o los lechones post-destete. Las dietas se entrecruzaron en la fase de cría.____________
Tratamiento alimentario Significación Dieta de la cerda Control Fertilium Fertilium DHA DHA Coco Coco
X X X X X X X X SEM
Dieta Trt Rep cría/finalización Control Coco Fertilium Coco DHA Fertilium Coco
Total acumulado
f
ADG 0,50 0,51 0,51 0,52 0,51 0,52 0,52 0,007 0,28 <0,0001 (kg/d)
DFI
(kg/d) 1,21 1,23 1,22 1,23 1,22 1,27 1,26 0,019 0,27 <0, 0001 F:G 2,43 2,39 2,39 2,37 2,40 2,43 2,44 0,015 0,017 <0, 0001 f Señala el periodo entre el destete y el mercado
ADG = ganancia media diaria (kg/d), ADFI = ingesta diaria de pienso (kg/d), F:G = relación de conversión del pienso (pienso respecto a ganancia)
Tabla 12. Efecto de alimentación continua con Fertilium™ en gestación y lactancia sobre el tamaño ______________ posterior de la camada y los pesos corporales de los lechones._______________
Criterios de respuesta Control FERTILIUM™ SEM valor P de la agrupado dieta1 Camada posterior
Cerdas, n2 336 336 — — Nacimientos totales, n 11,7 12,1 0,2 0,146 Nacidos vivos, n 11,1 11,4 0,2 0,197 Peso al nacer, kg/cerdo 1,732 1,728 0,04 0,906
Destete 3
Lechones destetados, n 9,5 10,0 0,2 0,066 Peso al destete, kg/cerdo 5,511 5,683 0,12 0,026 1 El efecto principal de la dieta se evaluó frente al error terminal de la dieta x grupo de interacción. El grupo se refiere a una sala de parto de 28 cerdas, la mitad por tratamiento.
2 Había un total de 24 grupos de cerdas que tenían información de camada individual.
3 Debido a la adopción cruzada y destete de golpe, los lechones destetados (el total de los 24 grupos con toda la información disponible) se refiere al número total de lechones trasladados a la gradería dividido por el número total de camadas paridas del tratamiento, y el peso de destete (total de los 31 grupos destetados) se refiere al total de kilogramos de cerdo trasladados a la cría divididos por el número total de cerdos trasladados dentro de cada grupo de tratamiento.
Tabla 13. Efecto de alimentación continua con Fertilium™ sobre los pesos corporales de los lechones. Criterios de
respuesta Control FERTILIUM™ valor P de la dieta Cerdas, n 77 88
Camada
normalizada
Tamaño de la
camada, n 11,6 ± 0,2 11,5 ± 0,1 0,843 Peso de los
lechones, kg 1,705 1,705 Covariable Camada el día 14
Tamaño de
camada, n 10,4 ±0,1 10,7 ± 0,1 0,130 Peso de
lechones, kg 4,381 ± 0,09 4,644 ± 0,086 0,05 1 Incluyendo el peso de lechones al normalizarse como covariable (medias ajustadas a 1,705 kg para ambos grupos de tratamiento)
Tabla 14. Composición de ácidos grasos de muestras de yeyuno obtenidas de los lechones destetados de madres alimentadas con los regímenes alimentarios de control (Cont) y aceite de _____________ pescado protegido durante la gestación y(o) lactancia (G/L).12_____________ Cont/Cont Cont/PFO PFO/PFO PFO/Cont Ácido graso (g/100 g)
14:0 0,06 0,09 0,05 0,10
16:0 19,82 19,31 20,13 21,52
16:1 1,45 1,27 1,24 1,17
18:0 22,14 25,86 23,28 20,03
18:1 13,43 12,31 11,64 14,60
18:2n6 21,65 20,28 20,25 20,05 18:3n6 0,25 0,16 0,24 0,24 18:3n-3 0,32 0,33 0,34 0,37
20:2 0,42 0,24 0,22 0,40
20:3n6 0,63 0,46 0,69 0,51 20:4n6 14,66 12,29 13,61 14,75 20:5n-3 0,18a 0,73b 0,74b 0,25a
22:4 1,82 1,27 1,17 1,94
22:5n-3 1,11a 1,33b 1,38b 1,40b 22:6n-3 0,27a 3,68b 4,51b 2,15c Otros 1,77 0,39 0,51 0,54 Total 100,00 100,00 100,00 100,00 Saturados 42,69 45,64 43,88 42,19 n-3 2,88a 6,06c 6,97c 4,17b n6 37,20 33,20 34,79 35,54 n6/n-3 12,91a 5,47b 5,16b 8,81b
1 Medias de cuatro lechones por tratamiento
2 Dentro de las filas, las medias con una letra común se diferencian, P< 0.05.
Tabla 15. Composición de ácidos grasos de muestras del músculo longissimus dorsi obtenidas de lechones destetados de madres alimentadas con los regímenes alimentarios de control (Cont) y aceite de pescado protegido (PFO) durante la gestación y(o) lactancia (G/L).12____________________________________________________________________
Cont/Cont Cont/PFO PFO/PFO PFO/Cont Ácidos grasos (g/100 g de ácidos grasos)
14:0 0,25 0,22 0,16 0,51 16:0 21,41 21,23 20,64 20,48 16:1 2,68 2,55 2,44 3,43 18:0 15,77 15,22 14,59 15,82 18:1 13,51 12,92 14,94 17,79 18:2n6 26,92 25,45 23,76 23,46 18:3n6 0,00 0,00 0,08 0,00 18:3n-3 0,39 0,36 0,32 0,39 20:2 0,61 0,59 0,63 0,68 20:3n6 1,05 1,09 0,93 1,02 20:4n6 13,32 12,20 12,43 12,18 20:5n-3 0,34 0,98 3,29 0,30 22:4 2,14 1,55 1,48 1,71 22:5n-3 1,52 1,87 1,83 1,44 22:6n-3 0,00a 1,97b 2,48b 0,70c Otros 0,09 0,00 0,00 0,10 Total 100,00 100,00 100,00 100,07 Saturados 37,43 38,47 35,39 36,81 n-3 2,25a 5,18bc 7,92b 2,84ac n6 41,29 38,74 37,20 36,65
1 Medias de cuatro lechones por tratamiento.
2 dentro de las líneas, las medias sin una letra común son diferentes, P< 0,05
Claims (13)
1. Un método no terapéutico de aumento del transporte intestinal de nutrientes en las crías de un animal, comprendiendo el método las etapas de
administración al animal de una composición de pienso que comprende una composición de algas o una composición no de algas que comprende ácidos grasos omega-3 o ésteres de los mismos; y
el aumento del transporte intestinal en las crías del animal, donde
i) la relación de ácido docosahexaenoico respecto al ácido eicosapentaenoico en la composición de algas es aproximadamente de 60:1 a aproximadamente 1:1 y el animal es una cerda gestante, una cerda post-parto, otra especie de animal de producción, un ser humano, o un animal de compañía, o
ii) la relación de ácido docosahexaenoico respecto al ácido eicosapentaenoico en la composición no de algas es aproximadamente de 30:1 a aproximadamente 1:1 y el animal es una especie de animal de producción distinto de un cerdo, un ser humano, o un animal de compañía;
donde la composición de pienso como mezcla final comprende aproximadamente un 0,01 % a aproximadamente un 4,0 % por peso de la composición de algas o la composición no de algas.
2. El método de la reivindicación 1, donde la composición de algas está en forma de algas secas o un aceite derivado de las algas.
3. El método de la reivindicación 1 o 2 donde los ácidos grasos omega-3 comprenden ácidos grasos omega-3 C22 o ácidos grasos omega-3 C20.
4. El método de las reivindicaciones 1 a 3 donde la composición de pienso como mezcla final comprende adicionalmente ácidos grasos omega-6 o ésteres de los mismos.
5. El método de las reivindicaciones 1 a 4 donde la composición de pienso que comprende la composición de algas se administra durante la lactancia o la gestación.
6. El método de las reivindicaciones 1 a 5 donde la composición de pienso se administra diariamente al animal.
7. El método de las reivindicaciones 1 a 6 donde la composición de pienso como mezcla final comprende adicionalmente un antioxidante.
8. El método de las reivindicaciones 1 a 7, donde el animal es de otra especie de animal de producción seleccionado de entre el grupo que consiste en un pollo, un caballo, un pony, una vaca, un pavo, una cabra, una oveja, una codorniz, un faisán, un avestruz, y un pato.
9. El método de las reivindicaciones 1 a 7, donde el animal es un animal de compañía seleccionado de entre el grupo que consiste en una especie canina y una especie felina.
10. El método de las reivindicaciones 1 a 9, donde el aumento de transporte intestinal da como resultado un aumento de unidades de glucógeno muscular o unidades de glicosilo muscular.
11. El método de las reivindicaciones 1 y 3 a 7, donde el animal es un pollo y las crías son pollitos y la composición de pienso que comprende la composición no de algas también se administra al pollito.
12. El método de las reivindicaciones 1 a 11, que comprende adicionalmente la etapa de aumentar el rendimiento de crecimiento de las crías del animal.
13. El método de la reivindicación 12, donde el rendimiento de crecimiento se selecciona de entre el grupo que consiste en un aumento de la tasa de crecimiento de las crías y una disminución de la relación de pienso respecto a ganancia de peso de las crías.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US98014307P | 2007-10-15 | 2007-10-15 | |
| PCT/US2008/079995 WO2009052182A1 (en) | 2007-10-15 | 2008-10-15 | Method for increasing performance of offspring |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2748136T3 true ES2748136T3 (es) | 2020-03-13 |
Family
ID=40567767
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES08840208T Active ES2748136T3 (es) | 2007-10-15 | 2008-10-15 | Método para aumentar el rendimiento de las crías |
Country Status (5)
| Country | Link |
|---|---|
| US (4) | US8409585B2 (es) |
| EP (1) | EP2214481B1 (es) |
| CA (1) | CA2702577A1 (es) |
| ES (1) | ES2748136T3 (es) |
| WO (1) | WO2009052182A1 (es) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1294236B1 (en) * | 2000-06-01 | 2008-08-13 | United Feeds, Inc. | Animal food and method |
| CA2702577A1 (en) | 2007-10-15 | 2009-04-23 | Jbs United, Inc. | Method for increasing performance of offspring |
| WO2014015000A1 (en) * | 2012-07-17 | 2014-01-23 | Cornell University | Algal-based animal feed composition, animal feed supplement, and uses thereof |
| US8747916B1 (en) | 2012-10-30 | 2014-06-10 | Donald M. Smith | Selecting, producing, and feeding whole algae as a feed supplement for cattle and bison to produce meat high in omega 3's for human health |
| MX372929B (es) * | 2013-06-13 | 2020-04-13 | Revival Animal Health Llc | Composiciones para usarse para mejorar la salud reproductiva y respiratoria. |
| CN105555146A (zh) * | 2013-07-11 | 2016-05-04 | 康奈尔大学 | 包含外源性蛋白酶的基于藻类的动物饲料组合物、动物饲料添加剂、及其用途 |
| ES2946751T3 (es) | 2013-10-24 | 2023-07-25 | Univ Boston | Sistema de infusión para prevenir la canalización incorrecta de múltiples medicamentos |
| CN107072182B (zh) | 2014-07-17 | 2021-11-09 | 康奈尔大学 | 用脱脂微藻动物饲料对家禽产品的ω-3脂肪酸富集 |
| EP3319662B1 (en) | 2015-07-08 | 2023-09-13 | Trustees of Boston University | Infusion system and components thereof |
| RU2757312C2 (ru) | 2017-01-06 | 2021-10-13 | Трастис Оф Бостон Юниверсити | Инфузионная система и ее компоненты |
| CN108576458A (zh) * | 2018-01-31 | 2018-09-28 | 上海概杰科技发展有限公司 | 一种富含Omega-3的鸡蛋的获得方法 |
| CN108567919A (zh) * | 2018-05-24 | 2018-09-25 | 眉山市中医医院(眉山市东坡区人民医院) | 一种治疗产后缺乳的药膳及其制备方法 |
| JP7645517B2 (ja) | 2019-07-16 | 2025-03-14 | ベータ バイオニクス,インコーポレイテッド | 歩行型デバイス及びその構成要素 |
| USD1099024S1 (en) | 2020-03-10 | 2025-10-21 | Beta Bionics, Inc. | Charging device for medicament infusion pump device |
| US11278661B2 (en) | 2020-03-10 | 2022-03-22 | Beta Bionics, Inc. | Infusion system and components thereof |
| USD1031975S1 (en) | 2020-03-10 | 2024-06-18 | Beta Bionics, Inc. | Medicament infusion pump device |
| PT4037666T (pt) | 2020-12-08 | 2024-06-25 | Ruminant Biotech Corp Ltd | Aperfeiçoamentos de dispositivos e métodos para administração de substâncias a animais |
Family Cites Families (116)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2800457A (en) | 1953-06-30 | 1957-07-23 | Ncr Co | Oil-containing microscopic capsules and method of making them |
| US4211795A (en) | 1965-02-03 | 1980-07-08 | Institut National de la Recherche Agronomique and Aussedat-Rey | Animal feeds |
| US4196291A (en) | 1973-12-17 | 1980-04-01 | Merck Patent Gesellschaft Mit Beschraenkter Haftung | 2-Acyl-4-oxo-pyrazino-isoquinoline derivatives and process for the preparation thereof |
| US4113867A (en) | 1973-12-17 | 1978-09-12 | Merck Patent Gesellschaft Mit Beschrankter Haftung | 2-acyl-4-oxo-pyrazino-isoquinoline derivatives and process for the preparation thereof |
| DE2362539C2 (de) | 1973-12-17 | 1986-05-07 | Merck Patent Gmbh, 6100 Darmstadt | 2-Acyl-4-oxo-1,2,3,6,7,11b-hexahydro-4H-pyrazino[2,1-a]isochinoline, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende Arzneimittel |
| US3966998A (en) | 1974-06-19 | 1976-06-29 | Blue Wing Corporation | Feed supplements for ruminants |
| NL8203710A (nl) | 1982-09-24 | 1984-04-16 | Artemia Nv | Werkwijze en inrichting voor het produceren van artemia nakomelingen; verpakking artemia nakomelingen; werkwijze voor het voeden van artemia's; werkwijze voor het bereiden van voer voor larven van vissen of kreeftachtigen; voeding omvattende met een voedingsadditief beklede deeltjes; en werkwijze voor het vervaardigen van dierlijk voedsel. |
| US5113755A (en) | 1984-04-30 | 1992-05-19 | Advanced Hydrolyzing Systems, Inc. | Apparatuses for producing a proteinaceous product by digestion of raw animal parts |
| US5053234A (en) | 1984-04-30 | 1991-10-01 | Advanced Hydrolyzing Systems, Inc. | Method for producing a proteinaceous product by digestion of raw animal parts |
| US5162129A (en) | 1984-04-30 | 1992-11-10 | Advanced Hydrolyzing Systems, Inc. | Particulate proteinaceous product containing non-heat-denatured animal protein |
| US4752618A (en) | 1984-07-12 | 1988-06-21 | New England Deaconess Hospital | Method of minimizing efects of infection through diet |
| JPS61130279A (ja) | 1984-11-30 | 1986-06-18 | Nissan Chem Ind Ltd | 4,6−ジアリ−ル−テトラヒドロ−2h−1,3,5−チアジアジン−2−チオン誘導体 |
| HU196128B (en) | 1985-01-10 | 1988-10-28 | Chinoin Gyogyszer Es Vegyeszet | Process for production of compound substituating bile and forwarding digestion of fat |
| GB8517436D0 (en) | 1985-07-10 | 1985-08-14 | Efamol Ltd | Treatment of horses |
| US5110731A (en) | 1985-08-26 | 1992-05-05 | Amgen, Inc. | System for biotin synthesis |
| FR2603804B1 (fr) | 1986-09-17 | 1989-10-27 | Jouveinal Sa | Lipases et extraits lipasiques, leur procede de preparation et leur application en therapeutique |
| JPS6398355A (ja) | 1986-10-16 | 1988-04-28 | Kazumitsu Maruta | 動物用飼料 |
| US4792546A (en) | 1986-12-05 | 1988-12-20 | American Cyanamid Company | Method for increasing weight gains and reducing deposition of fat in animals |
| US5110592A (en) | 1987-12-16 | 1992-05-05 | Stitt Paul A | Method of increasing live births to female animals and animal feed blend suitable for same |
| GB8729751D0 (en) | 1987-12-21 | 1988-02-03 | Norsk Hydro As | Feed additive & feed containing such additive |
| US5023100A (en) | 1988-05-02 | 1991-06-11 | Kabi Vitrum Ab | Fish oil |
| GB8819110D0 (en) | 1988-08-11 | 1988-09-14 | Norsk Hydro As | Antihypertensive drug & method for production |
| US5985348A (en) | 1995-06-07 | 1999-11-16 | Omegatech, Inc. | Milk products having high concentrations of omega-3 highly unsaturated fatty acids |
| US5332577A (en) | 1988-12-27 | 1994-07-26 | Dermamed | Transdermal administration to humans and animals |
| CA2063791C (en) | 1989-08-17 | 2000-12-19 | Michael John Story | Hard gelatine capsule containing fat-soluble nutrients. |
| US5532002A (en) | 1989-08-17 | 1996-07-02 | Cortecs Limited | Gelatin pharmaceutical formulations |
| US4981105A (en) | 1989-10-16 | 1991-01-01 | Research And Development Institute, Inc. At Montana State University | Method for increasing performance of ruminant animals |
| US5324521A (en) | 1989-12-18 | 1994-06-28 | Dermamed | Systems for transdermal administration of medicaments |
| US5407957A (en) | 1990-02-13 | 1995-04-18 | Martek Corporation | Production of docosahexaenoic acid by dinoflagellates |
| US5132118A (en) | 1990-05-11 | 1992-07-21 | Mills John A | Treatment of exercise-induced pulmonary hemorrhage in animals |
| US5098573A (en) | 1990-09-12 | 1992-03-24 | The United States Of America As Represented By The Secretary Of The Interior | Binary concentration and recovery process |
| US5141755A (en) | 1991-05-29 | 1992-08-25 | Weisman Eric H | Reduced animal product pet food composition |
| US5571522A (en) | 1994-01-31 | 1996-11-05 | Micro Flo Company | Bait with corn germ |
| US5439924A (en) | 1991-12-23 | 1995-08-08 | Virbac, Inc. | Systemic control of parasites |
| SE9200541D0 (sv) | 1992-02-24 | 1992-02-24 | Kabi Pharmacia Ab | New usee of omega-3-fatty acids |
| US5478557A (en) | 1992-07-29 | 1995-12-26 | The United States Of America, As Represented By The Secretary Of Agriculture | Probiotic for control of salmonella |
| US5340577A (en) | 1992-07-29 | 1994-08-23 | The United States Of America, As Represented By The Secretary Of Agriculture | Probiotic for control of salmonella |
| US5834473A (en) | 1993-04-29 | 1998-11-10 | Cultor, Ltd. | Method for treating coccidiosis |
| US5876780A (en) | 1993-04-29 | 1999-03-02 | Cultor, Ltd. | Compositions for treating coccidiosis |
| JPH0898658A (ja) * | 1994-01-28 | 1996-04-16 | Kanagawa Kagaku Kenkyusho:Kk | 動物用飼料およびそれを用いた動物性食品の生産方法 |
| FR2721481B1 (fr) | 1994-06-27 | 1996-09-06 | Inst Rech Biolog Sa | Nouvelles compositions diététiques à base de phospholipides et leur utilisation comme complément nutritionnel. |
| NL9401743A (nl) | 1994-10-20 | 1996-06-03 | Prospa Bv | Zouten van aminoalcoholen en farmaceutische formuleringen die deze bevatten. |
| US5798112A (en) | 1994-12-09 | 1998-08-25 | The United States Of America As Represented By The Secretary Of Agriculture | Phototoxic insecticidal composition and method for controlling insect populations |
| WO1996029405A2 (en) | 1995-03-20 | 1996-09-26 | Ligand Pharmaceuticals Incorporated | MODULATORS OF ob GENE AND SCREENING METHODS THEREFOR |
| CA2196205C (en) * | 1995-05-30 | 2005-02-01 | Kengo Akimoto | Domestic fowl eggs having a high content of highly unsaturated fatty acid, their production process and their use |
| US5670191A (en) | 1995-09-26 | 1997-09-23 | Church & Dwight Co., Inc. | Aliphatic amide feed supplement for ruminants |
| US6015798A (en) | 1995-10-10 | 2000-01-18 | Colgate Palmolive Company | Method for reducing the damaging effects of radiation therapy on animal skin and mucosa |
| US5698246A (en) | 1996-01-29 | 1997-12-16 | Cargill, Incorporated | Foodstuff for and method of feeding crustaceans and fish |
| US5876995A (en) | 1996-02-06 | 1999-03-02 | Bryan; Bruce | Bioluminescent novelty items |
| US6235783B1 (en) | 1996-06-29 | 2001-05-22 | Jsr Clover Ltd. | Male fertility with antioxidants and/or polyunsaturated fatty acids |
| US6316038B1 (en) | 1997-03-17 | 2001-11-13 | Btg International Limited | Therapeutic compositions |
| US6323237B1 (en) | 1997-03-17 | 2001-11-27 | Btg International Limited | Therapeutic compositions |
| US6060087A (en) | 1997-04-25 | 2000-05-09 | Wisconsin Alumni Research Foundation | Method of increasing fat firmness and improving meat quality in animals |
| US6566583B1 (en) | 1997-06-04 | 2003-05-20 | Daniel Facciotti | Schizochytrium PKS genes |
| WO1999006585A1 (en) | 1997-08-01 | 1999-02-11 | Martek Biosciences Corporation | Dha-containing nutritional compositions and methods for their production |
| AU728842B2 (en) | 1997-08-18 | 2001-01-18 | South Dakota State University | Dairy products with enhanced CLA content |
| US6086878A (en) | 1997-08-21 | 2000-07-11 | Dcv, Inc. | Method of increasing muscle protein and reducing fat in animals |
| US5951977A (en) | 1997-10-14 | 1999-09-14 | The United States Of America, As Represented By The Secretary Of Agriculture | Competitive exclusion culture for swine |
| EP0919230A1 (en) | 1997-12-01 | 1999-06-02 | Societe Des Produits Nestle S.A. | NMIFA's as anti-inflammatory agents in superficial mammal tissues |
| US7015249B1 (en) | 1997-12-12 | 2006-03-21 | Purdue Research Foundation | Methods and compositions for treating diabetes |
| EP1037624B1 (en) | 1997-12-12 | 2005-11-23 | Purdue Research Foundation | Use of conjugated linoleic acid for treating type ii diabetes |
| JP2002500868A (ja) * | 1998-01-21 | 2002-01-15 | ユニバーシティ・オブ・メリーランド・バイオテクノロジー・インスティテュート | 稚魚に不可欠な栄養素で生飼料を栄養強化する方法 |
| US6020377A (en) | 1998-03-13 | 2000-02-01 | Kansas State University Research Foundation | Modified tall oil supplemented diet for growing-finishing pigs |
| KR100619651B1 (ko) | 1998-03-17 | 2006-09-05 | 콘린코 인크. | 공액 리놀레산 조성물 |
| WO1999058120A1 (en) | 1998-05-08 | 1999-11-18 | Rolf Berge | USE OF NON-β-OXIDIZABLE FATTY ACID ANALOGUES FOR TREATMENT OF SYNDROME-X CONDITIONS |
| US6723897B2 (en) | 1998-08-10 | 2004-04-20 | Monsanto Technology, Llc | Methods for controlling gibberellin levels |
| CA2339941A1 (en) | 1998-09-15 | 2000-03-23 | Btg International Limited | Use of cyclic esters of r-3-hydroxybutyrate for treatment of metabolic and neural degenerative disorders |
| NO308764B2 (no) | 1998-10-28 | 2000-10-30 | Ewos Innovation As | Sammensatt, partikkelformig fôr for larver eller yngel av fisk og andre marine organismer, samt fremgangsmåte for fremstilling derav |
| US6576819B1 (en) | 1999-02-18 | 2003-06-10 | Pioneer Hi-Bred International, Inc. | Methods for modulating the levels of organic sulfur compounds in plants by transforming with (P)APS reductase DNA |
| US6429198B1 (en) | 1999-04-12 | 2002-08-06 | Bioenergy Inc. | Compositions for increasing athletic performance in mammals |
| US6624194B1 (en) | 1999-06-04 | 2003-09-23 | Metabolex, Inc. | Use of (−) (3-trihalomethylphenoxy) (4-halophenyl) acetic acid derivatives for treatment of insulin resistance, type 2 diabetes, hyperlipidemia and hyperuricemia |
| US7576131B2 (en) | 1999-06-04 | 2009-08-18 | Metabolex, Inc. | Use of (-) (3-trihalomethylphenoxy) (4-halophenyl) acetic acid derivatives for treatment of insulin resistance, type 2 diabetes, hyperlipidemia and hyperuricemia |
| US6262118B1 (en) | 1999-06-04 | 2001-07-17 | Metabolex, Inc. | Use of (-) (3-trihalomethylphenoxy) (4-halophenyl) acetic acid derivatives for treatment of insulin resistance, type 2 diabetes and hyperlipidemia |
| US6190720B1 (en) | 1999-06-15 | 2001-02-20 | Opta Food Ingredients, Inc. | Dispersible sterol compositions |
| JP3492349B2 (ja) | 1999-10-19 | 2004-02-03 | ニチユソリューション株式会社 | 繁殖用雌ブタの飼育方法及び繁殖用雌ブタ用飼料 |
| US6391620B1 (en) | 1999-11-02 | 2002-05-21 | Paul A. Olivier | Method for bio-conversion of putrescent wastes |
| US7115297B2 (en) | 2000-02-22 | 2006-10-03 | Suzanne Jaffe Stillman | Nutritionally fortified liquid composition with added value delivery systems/elements/additives |
| US20010046493A1 (en) | 2000-02-24 | 2001-11-29 | Alex Margolin | Lipase-containing composition and methods of use thereof |
| US8642051B2 (en) | 2000-03-21 | 2014-02-04 | Suzanne Jaffe Stillman | Method of hydration; infusion packet system(s), support member(s), delivery system(s), and method(s); with business model(s) and Method(s) |
| US7226916B1 (en) | 2000-05-08 | 2007-06-05 | N.V. Nutricia | Preparation for the prevention and/or treatment of vascular disorders |
| EP1294236B1 (en) * | 2000-06-01 | 2008-08-13 | United Feeds, Inc. | Animal food and method |
| US6608222B2 (en) | 2000-11-21 | 2003-08-19 | Alpha Food Ingredients, Inc. | Bioactive conjugated linoleic acid glycerides and method of use |
| US6822142B2 (en) | 2001-01-05 | 2004-11-23 | Monsanto Company | Transgenic plants containing altered levels of steroid compounds |
| US6632291B2 (en) | 2001-03-23 | 2003-10-14 | Ecolab Inc. | Methods and compositions for cleaning, rinsing, and antimicrobial treatment of medical equipment |
| US20050154064A1 (en) | 2001-03-27 | 2005-07-14 | The Regents Of The University Of California | Dietary and other compositions, compounds, and methods for reducing body fat, controlling appetite, and modulating fatty acid metabolism |
| JP2004523248A (ja) | 2001-04-23 | 2004-08-05 | オメガヌトレル インク | 必須脂肪酸含有食餌サプリメント及びその製品 |
| US7001610B2 (en) | 2001-04-23 | 2006-02-21 | Omeganutrel Inc. | Food supplement and use thereof for elevating levels of essential fatty acids in livestock and products therefrom |
| JP2002360184A (ja) * | 2001-06-06 | 2002-12-17 | Harumi Okuyama | アレルギー体質改善用動物性食品 |
| US20040176320A1 (en) | 2001-06-29 | 2004-09-09 | Jari Natunen | Use of at least one glycoinhibitor substance |
| AU2002323409A1 (en) * | 2001-08-24 | 2003-03-10 | Martek Biosciences Boulder Corporation | Products containing highly unsaturated fatty acids for use by women and their children during stages of preconception, pregnancy and lactation/post-partum |
| US20030070674A1 (en) | 2001-10-12 | 2003-04-17 | Bryan Perry | Use of aerosolized compounds in the treatment of exercise induced pulmonary hemorrhage in an equine |
| EP1325681A1 (en) | 2001-12-11 | 2003-07-09 | Société des Produits Nestlé S.A. | Composition for promotion of bone growth and maintenance of bone health |
| EP1531832B1 (en) | 2002-06-28 | 2009-04-15 | Glykos Finland Oy | Therapeutic compositions for use in prophylaxis or treatment of diarrheas |
| CA2395622A1 (fr) | 2002-07-22 | 2004-01-22 | Edwin Bourget | Procede d'enrichissement en lipides et en acides gras omega-3 dans les cultures d'algues |
| JP2004065002A (ja) * | 2002-08-01 | 2004-03-04 | Ise Shokuhin Kk | 養鶏用飼料及び鶏卵 |
| US20040044079A1 (en) | 2002-09-04 | 2004-03-04 | The Iams Company | Methods and compositions for weight control |
| US7244874B2 (en) | 2002-09-17 | 2007-07-17 | The Regents Of The University Of California | Stearoyl CoA desaturase transgenic non-human animals |
| AU2002951913A0 (en) | 2002-10-08 | 2002-10-24 | Chevis Agriservices & Consulting Pty. Limited | Method of treatment |
| FI20021989A0 (fi) | 2002-11-06 | 2002-11-06 | Halina Miller-Podraza | Korkean affiniteetin Helicobacter pylori-reseptorit ja niiden käyttö |
| CA2518197A1 (en) * | 2003-03-07 | 2004-09-23 | Advanced Bionutrition Corporation | Feed formulation for terrestrial and aquatic animals |
| US6753350B1 (en) | 2003-03-24 | 2004-06-22 | Bristol-Myers Squibb Company | Method to reduce the incidence of intraventricular hemorrhage in preterm infants |
| WO2004095940A1 (en) * | 2003-04-25 | 2004-11-11 | The University Of Newcastle | Biomass containing animal feed |
| CA2537744A1 (en) | 2003-09-05 | 2005-03-17 | Timothy P. Carr | Compound and method for enhancing the cholesterol lowering property of plant sterol and stanol esters |
| US20050119222A1 (en) | 2003-12-01 | 2005-06-02 | The Iams Company | Compositions comprising fermentable fiber which are adapted for use by a companion animal and kits and methods of their use |
| US20050118299A1 (en) | 2003-12-01 | 2005-06-02 | The Iams Company | Companion animal compositions comprising short chain oligofructose |
| WO2005072722A2 (en) | 2004-01-20 | 2005-08-11 | Nutrition Therapeutics, Inc. | Method of using punicic acid to enhance immune response and prevent metabolic disorders |
| WO2005080373A1 (en) | 2004-02-04 | 2005-09-01 | Pfizer Products Inc. | Substituted quinoline compounds |
| US7297356B2 (en) | 2004-05-10 | 2007-11-20 | Grain States Soya, Inc. | Method for manufacturing animal feed, method for increasing the rumen bypass capability of an animal feedstuff and animal feed |
| JP4069159B2 (ja) | 2004-05-25 | 2008-04-02 | ファイザー・プロダクツ・インク | テトラアザベンゾ[e]アズレン誘導体及びそれらのアナログ |
| US7803842B2 (en) | 2004-06-08 | 2010-09-28 | Hass Patel | Choline esters useful for the treatment of cognitive dysfunctions and enhancement of memory, learning and cognition |
| US20060217385A1 (en) * | 2005-03-10 | 2006-09-28 | Edwards John B | Nutritional preparations |
| US20070082063A1 (en) | 2005-10-11 | 2007-04-12 | Douglas Bibus | Risk assessment and correction of membrane damage of the upper GI tract |
| US20070098822A1 (en) | 2005-10-31 | 2007-05-03 | Mankovitz Roy J | Food compositions and methods |
| AU2007235419A1 (en) | 2006-04-03 | 2007-10-18 | Advanced Bionutrition Corporation | Feed formulations containing docosahexaenoic acid |
| CA2702577A1 (en) | 2007-10-15 | 2009-04-23 | Jbs United, Inc. | Method for increasing performance of offspring |
| US20100323028A1 (en) | 2007-11-30 | 2010-12-23 | Jbs United, Inc. | Method and composition for treating pulmonary hemorrhage |
-
2008
- 2008-10-15 CA CA2702577A patent/CA2702577A1/en not_active Abandoned
- 2008-10-15 ES ES08840208T patent/ES2748136T3/es active Active
- 2008-10-15 WO PCT/US2008/079995 patent/WO2009052182A1/en not_active Ceased
- 2008-10-15 EP EP08840208.6A patent/EP2214481B1/en not_active Not-in-force
-
2010
- 2010-11-19 US US12/950,620 patent/US8409585B2/en active Active
-
2013
- 2013-03-04 US US13/784,111 patent/US9675651B2/en active Active
-
2015
- 2015-07-21 US US14/804,992 patent/US9272009B2/en active Active
-
2017
- 2017-06-12 US US15/619,846 patent/US10583159B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US10583159B2 (en) | 2020-03-10 |
| US9675651B2 (en) | 2017-06-13 |
| EP2214481A1 (en) | 2010-08-11 |
| US20160000119A1 (en) | 2016-01-07 |
| US20180008654A1 (en) | 2018-01-11 |
| CA2702577A1 (en) | 2009-04-23 |
| EP2214481A4 (en) | 2010-11-03 |
| US8409585B2 (en) | 2013-04-02 |
| US9272009B2 (en) | 2016-03-01 |
| EP2214481B1 (en) | 2019-05-01 |
| WO2009052182A1 (en) | 2009-04-23 |
| US20110256170A1 (en) | 2011-10-20 |
| US20130184349A1 (en) | 2013-07-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2748136T3 (es) | Método para aumentar el rendimiento de las crías | |
| CN100490666C (zh) | 动物性饲料和方法 | |
| ES2632951T3 (es) | Método para mejorar la absorción de vitamina E en un animal de compañía | |
| JP5554758B2 (ja) | 動物による消費のための組成物及びmapキナーゼ活性を低減する方法 | |
| ES2625490T3 (es) | Adyuvante de sales biliares para animales para mejorar la eficacia de la utilización de grasas en los cuerpos de los animales | |
| Lin et al. | Lipids and lipid utilization in swine | |
| CN1050732C (zh) | 饲喂幼畜的方法 | |
| Xu et al. | Medium-chain TAG improve intestinal integrity by suppressing toll-like receptor 4, nucleotide-binding oligomerisation domain proteins and necroptosis signalling in weanling piglets challenged with lipopolysaccharide | |
| Lauridsen et al. | Lipid composition of lactational diets influences the fatty acid profile of the progeny before and after suckling | |
| CN101594849A (zh) | 具有有机酸和脂肪酸的基质嵌入型组合物 | |
| ES2791323T3 (es) | Composiciones para aumentar la producción de grasa lechera en ruminantes lactantes y métodos utilizando los mismos | |
| FR3017778A1 (fr) | Adjuvant comprenant de la baicaline notamment issue d'un extrait de scutellaria baicalensis et aliment pour animaux comprenant un tel adjuvant | |
| KR20100080781A (ko) | 사료 요구율 감소 또는 성장률 증가를 위한 돼지의 처리 | |
| CN117652601A (zh) | 脂肪酸组合物及其在制备用于猪的饲料添加剂或饲料中的应用 | |
| Sretenović et al. | Nutritional factors influencing improvement of milk and meat quality as well as productive and reproductive parameters of cattle | |
| ES2435538T3 (es) | Medios y métodos para potenciar la ganancia de peso en aves de corral | |
| Mishra et al. | Effect of betaine supplementation on serum metabolite profile in gestating sows | |
| US20250177439A1 (en) | Low dose pre-mix feed for trace mineral supplementation | |
| MOTLAGH | Effect of Omega-3 resource on glucose and total protein in ostriches | |
| MXPA06004342A (es) | Mjetodo veterinario para administrar un derivado y formulacion de la vitamina e. | |
| ES3020833A1 (es) | Procedimiento para la mejora de la ratio de acidos grasos omega-6 a omega-3 y su cantidad en aves para el consumo humano | |
| PL243592B1 (pl) | Zastosowanie paszy z nanocząsteczkami ZnO w żywieniu kurcząt rzeźnych jako czynnika poprawiającego wyniki odchowu | |
| Sokół et al. | Effect of naked oats and enzyme supplementation on egg yolk fatty acid composition and performance of hens |