EP0483053A1 - Dekontaminationsmittel und Verfahren zur Lösung von radioaktiv kontaminierten Oberflächen von Komponenten aus Metall - Google Patents
Dekontaminationsmittel und Verfahren zur Lösung von radioaktiv kontaminierten Oberflächen von Komponenten aus Metall Download PDFInfo
- Publication number
- EP0483053A1 EP0483053A1 EP91810731A EP91810731A EP0483053A1 EP 0483053 A1 EP0483053 A1 EP 0483053A1 EP 91810731 A EP91810731 A EP 91810731A EP 91810731 A EP91810731 A EP 91810731A EP 0483053 A1 EP0483053 A1 EP 0483053A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- contaminated
- lead
- oxidizing agent
- decontamination
- hydrogen peroxide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 238000000034 method Methods 0.000 title claims abstract description 44
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 claims abstract description 56
- 229910004039 HBF4 Inorganic materials 0.000 claims abstract description 36
- 239000002253 acid Substances 0.000 claims abstract description 30
- 229910052751 metal Inorganic materials 0.000 claims abstract description 28
- 239000002184 metal Substances 0.000 claims abstract description 28
- 239000007800 oxidant agent Substances 0.000 claims abstract description 21
- 239000003153 chemical reaction reagent Substances 0.000 claims abstract description 18
- 239000000203 mixture Substances 0.000 claims abstract description 13
- 238000005202 decontamination Methods 0.000 claims description 22
- 239000000243 solution Substances 0.000 claims description 21
- 230000003588 decontaminative effect Effects 0.000 claims description 20
- 230000002285 radioactive effect Effects 0.000 claims description 19
- 238000005868 electrolysis reaction Methods 0.000 claims description 18
- RILZRCJGXSFXNE-UHFFFAOYSA-N 2-[4-(trifluoromethoxy)phenyl]ethanol Chemical compound OCCC1=CC=C(OC(F)(F)F)C=C1 RILZRCJGXSFXNE-UHFFFAOYSA-N 0.000 claims description 17
- 239000003795 chemical substances by application Substances 0.000 claims description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 6
- 238000011161 development Methods 0.000 claims description 4
- 239000012286 potassium permanganate Substances 0.000 claims description 4
- 239000002244 precipitate Substances 0.000 claims description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 3
- 150000002500 ions Chemical class 0.000 claims description 3
- 239000000463 material Substances 0.000 claims description 3
- 239000001301 oxygen Substances 0.000 claims description 3
- 229910052760 oxygen Inorganic materials 0.000 claims description 3
- 230000001172 regenerating effect Effects 0.000 claims description 3
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 claims description 2
- 229910001861 calcium hydroxide Inorganic materials 0.000 claims description 2
- 239000000920 calcium hydroxide Substances 0.000 claims description 2
- 239000012065 filter cake Substances 0.000 claims description 2
- 239000000706 filtrate Substances 0.000 claims description 2
- 239000002351 wastewater Substances 0.000 claims description 2
- 239000007864 aqueous solution Substances 0.000 claims 2
- 239000011575 calcium Substances 0.000 claims 1
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 abstract description 9
- 229910045601 alloy Inorganic materials 0.000 abstract description 6
- 239000000956 alloy Substances 0.000 abstract description 6
- 229910052759 nickel Inorganic materials 0.000 abstract description 6
- 239000002699 waste material Substances 0.000 abstract description 5
- 229910000831 Steel Inorganic materials 0.000 abstract description 4
- 229910052802 copper Inorganic materials 0.000 abstract description 4
- 239000003792 electrolyte Substances 0.000 abstract description 4
- 239000010959 steel Substances 0.000 abstract description 4
- YEXPOXQUZXUXJW-UHFFFAOYSA-N oxolead Chemical compound [Pb]=O YEXPOXQUZXUXJW-UHFFFAOYSA-N 0.000 abstract description 3
- 229910000464 lead oxide Inorganic materials 0.000 abstract description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 abstract 1
- 238000007792 addition Methods 0.000 abstract 1
- 239000010949 copper Substances 0.000 abstract 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 abstract 1
- 229910052753 mercury Inorganic materials 0.000 abstract 1
- 229910052709 silver Inorganic materials 0.000 abstract 1
- 239000004332 silver Substances 0.000 abstract 1
- 238000002474 experimental method Methods 0.000 description 11
- 238000004090 dissolution Methods 0.000 description 10
- YADSGOSSYOOKMP-UHFFFAOYSA-N dioxolead Chemical compound O=[Pb]=O YADSGOSSYOOKMP-UHFFFAOYSA-N 0.000 description 7
- 150000002739 metals Chemical class 0.000 description 7
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 6
- 230000004580 weight loss Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 5
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 229910000978 Pb alloy Inorganic materials 0.000 description 2
- 229910002804 graphite Inorganic materials 0.000 description 2
- 239000010439 graphite Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 229910044991 metal oxide Inorganic materials 0.000 description 2
- 150000004706 metal oxides Chemical class 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- SIWNEELMSUHJGO-UHFFFAOYSA-N 2-(4-bromophenyl)-4,5,6,7-tetrahydro-[1,3]oxazolo[4,5-c]pyridine Chemical compound C1=CC(Br)=CC=C1C(O1)=NC2=C1CCNC2 SIWNEELMSUHJGO-UHFFFAOYSA-N 0.000 description 1
- 229910000881 Cu alloy Inorganic materials 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- -1 cationic ion Chemical class 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000004519 grease Substances 0.000 description 1
- XLYOFNOQVPJJNP-ZSJDYOACSA-N heavy water Substances [2H]O[2H] XLYOFNOQVPJJNP-ZSJDYOACSA-N 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- WABPQHHGFIMREM-UHFFFAOYSA-N lead(0) Chemical compound [Pb] WABPQHHGFIMREM-UHFFFAOYSA-N 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000007769 metal material Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 150000002815 nickel Chemical class 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23G—CLEANING OR DE-GREASING OF METALLIC MATERIAL BY CHEMICAL METHODS OTHER THAN ELECTROLYSIS
- C23G1/00—Cleaning or pickling metallic material with solutions or molten salts
- C23G1/02—Cleaning or pickling metallic material with solutions or molten salts with acid solutions
- C23G1/10—Other heavy metals
-
- G—PHYSICS
- G21—NUCLEAR PHYSICS; NUCLEAR ENGINEERING
- G21F—PROTECTION AGAINST X-RADIATION, GAMMA RADIATION, CORPUSCULAR RADIATION OR PARTICLE BOMBARDMENT; TREATING RADIOACTIVELY CONTAMINATED MATERIAL; DECONTAMINATION ARRANGEMENTS THEREFOR
- G21F9/00—Treating radioactively contaminated material; Decontamination arrangements therefor
- G21F9/001—Decontamination of contaminated objects, apparatus, clothes, food; Preventing contamination thereof
- G21F9/002—Decontamination of the surface of objects with chemical or electrochemical processes
- G21F9/004—Decontamination of the surface of objects with chemical or electrochemical processes of metallic surfaces
Definitions
- the present invention relates to a method and a decontamination agent for dissolving oxidized or non-oxidized, radioactive contaminated surfaces of objects made of metal.
- shielding stones are formed from lead or lead alloys, which are used to create entire walls around highly radioactive components. Heavily radioactive tubes are also covered with lead mats. Of course, these shielding stones, lead mats or lead plates can also be radioactively contaminated. They must therefore be decontaminated from time to time. So far, this has been unsatisfactory.
- the lead or lead-containing elements were scraped off on the surface or brushed manually, the contaminated scraped material was radioactively disposed of and the remaining, still slightly contaminated components were melted down.
- a second variant was to provide the lead shielding stones or plates with a plastic covering that is renewed from time to time. The contaminated plastic cover was always disposed of by nuclear waste. Both variants led to a relatively large amount of nuclear waste to be disposed of.
- Lead components are used in various nuclear applications. For example in nuclear weapons, where lead components are used, among other things, as reflector shields. From time to time, these lead components must be renewed to maintain the functionality of the nuclear weapons and the lead waste must be decontaminated.
- the radioactive contaminated metallic components are placed in a fluoroboric acid bath and this is electrochemically regenerated and the metals are recovered while the regenerated fluoroboric acid is fed back into the process.
- this method has proven to be too time-consuming that it can also only be used at elevated temperature and concentration.
- the solubility of lead and other metals such as Ni, Cu, Hg, Ag or steel is also an extremely slow process in HBF4 acid at room temperature, which also takes place with the development of hydrogen H2.
- This object is achieved by a method having the features of claim 1, or a decontamination agent having the features of claim 22.
- a lead plate with a thickness of 0.25 mm and a surface area of 2 ⁇ 88 cm 2 was used in the experiments described below. To prevent the lead plate from being coated with a protective grease film, it was degreased with acetone before being introduced into the solution.
- This information relates to a reagent of 5% HBF4 with 0.5% H2O2 at a temperature of 25 ° C.
- the solubility rate of lead in 5% HBF4 acid has now been determined as a function of the concentration of the hydrogen peroxide present therein. The result is shown in FIGS. 2A and B. With increasing H2O2 concentration, a constant increase in the dissolution rate of the lead was found, namely within the range from 0 to 2 vol%.
- the now decontaminated lead plates are removed from the solution bath (2).
- the solution, which is now contaminated, is led (4) to an electrolysis bath by performing the electrolysis (5).
- the contaminated lead or lead dioxide is now deposited on the anode or cathode.
- the concentrated radioactive contaminated material (6) is now in a highly concentrated form and can now be disposed of in a nuclear manner in a known manner.
- the remaining HBF4 acid is removed from the electrolysis cell (7). Now the return (9) of the HBF4 acid can take place in the solution bath (2). This is done with addition (8) of H2O2 until the desired concentration is reached again.
- the process can be terminated by neutralizing the acid after the electrolysis has been carried out by adding calcium hydroxide or regenerating it on a cationic ion exchanger to the pure, uncontaminated acid. As is known, this produces a precipitate that can be filtered out or sedimented. The remaining, contaminated filter cake can solidify and be disposed of by nuclear waste. The remaining filtrate is free of activity and also no longer contains lead. It can therefore be disposed of without additional precautionary measures, for example by disposing it to the wastewater disposal system.
- the experiments were carried out at room temperature and using stainless steel on the cathode and a graphite anode.
- the electrolyte consisted of a 5% HBF4 acid with a content of about 30 grams per liter of Pb2 +.
- the electrolyte was produced by the solution of lead in a 5% HBF4 acid with a content of 0.5% H2O2.
- the initial pH was around 0.
- Lead electrolysis was started at a potential of approximately 2.0 volts. Initially, bubbles formed on the anode surface. These disappeared as soon as lead dioxide had formed.
- FIG. 5A shows two examples of lead electrolysis. In both cases the current was kept at a fixed value.
- this reagent can also be pumped directly into a closed pipe system, for example a heat exchanger in a nuclear power plant, and can be circulated therein for a few hours, and then the radioactive reagent can be pumped out and electrolytically regenerated. Because the solution is completely water-soluble, the pipe system can then be rinsed with water.
- An alternative is to leave the reagent in the pipe system, but after a while pass it through an ion exchanger, which can be used to remove all radioactive components and the dissolved metals from the system.
- the cleaning by means of ion exchangers is in itself a known technology that does not need to be discussed further here.
- a possible alternative is that the parts to be decontaminated are first exposed to an oxidizing agent and only then placed in a pure HBF4 acid bath or sprayed with HBF4 acid. This procedure can be repeated several times until the metal surface to be decontaminated has radioactivity below the free measurement limit.
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- General Engineering & Computer Science (AREA)
- Mechanical Engineering (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Electrochemistry (AREA)
- High Energy & Nuclear Physics (AREA)
- Materials Engineering (AREA)
- Life Sciences & Earth Sciences (AREA)
- Metallurgy (AREA)
- Organic Chemistry (AREA)
- Electrolytic Production Of Metals (AREA)
- Cleaning And De-Greasing Of Metallic Materials By Chemical Methods (AREA)
- Detergent Compositions (AREA)
- Apparatus For Disinfection Or Sterilisation (AREA)
Abstract
Description
- Die vorliegende Erfindung betrifft ein Verfahren sowie ein Dekontaminationsmittel zur Lösung von oxidierten oder nicht oxidierten, radioaktiv kontaminierten Oberflächen von Gegenständen aus Metall.
- An nuklearen Arbeitsplätzen werden Komponenten aus Blei oder bleienthaltenden Legierungen zur Abschirmung der radioaktiven Strahlung verwendet. Es ist bekannt, dass eine etwa 5 cm dicke Bleiplatte die radioaktive Strahlung um einen Faktor 10 reduziert. Deshalb bildet man aus Blei oder Bleilegierungen sogenannte Abschirmungssteine, mit denen ganze Mauern um hochradioaktive Bauteile erstellt werden. Stark radioaktiv strahlende Rohre werden auch mit Bleimatten ummantelt. Selbstverständlich können diese Abschirmungssteine, Bleimatten oder Bleiplatten ebenfalls radioaktiv kontaminiert sein. Sie müssen daher auch von Zeit zu Zeit dekontaminiert werden. Bisher geschah dies auf nicht zufriedenstellende Weise. Die Blei oder bleienthaltenden Elemente wurden oberflächlich abgekratzt oder manuell gebürstet, das kontaminierte abgekratzte Material radioaktiv entsorgt und die verbleibenden, immer noch leicht kontaminierten Komponenten eingeschmolzen.
- Das Resultat war unbefriedigend und führte zusätzlich zu einer Verschleppung der Radioaktivität. Die wiedergewonnenen Komponenten aus Blei oder bleihaltigen Legierungen konnten zwar wiederverwendet werden, wiesen aber von Anfang an eine erhöhte Radioaktivität auf. Eine zweite Variante bestand darin, die Bleiabschirmungssteine oder Platten mit einer Plastikumhüllung zu versehen, die von Zeit zu Zeit erneuert wird. Die kontaminierte Plastikumhüllung wurde jedesmal wieder nuklear entsorgt. Beide Varianten führten zu einer relativ grossen Menge an nuklear zu entsorgendem Abfall.
- Bleikomponenten werden in diversen nuklearen Anwendungen eingesetzt. So beispielsweise in nuklearen Waffen, wo Bleikomponenten unter anderem als Reflektorschilder eingesetzt werden. Von Zeit zu Zeit müssen diese Bleikomponenten zur Aufrechterhaltung der Funktionstüchtigkeit der nuklearen Waffen erneuert und die Bleiabfälle dekontaminiert werden.
- Die gleiche Problematik, die bei Blei und Bleilegierungen auftritt, ist auch bei anderen Metallen relevant. So sind in Anlagen zur Herstellung von UF₆ in zivilen und militärischen Bereichen grosse Mengen von radioaktiv kontaminiertem Nickel vorhanden. Obwohl der Wert dieser Metalle gross ist, liess sich nur der geringste Teil zur Wiederverwertung gewinnen. Eine Anlage zur Herstellung von UF₆ enthält ca. 1'000 - 10'000 t reines Nickel. Ferner enthalten Wärmetauscher und Dampferzeugungsanlagen in DruckwasserReaktoren grosse Mengen von Nickel-Basislegierungen wie z.B. Inocel 600 mit einem Anteil von ca. 70% Ni. Aber auch Cu und Cu-Legierungen werden bei Wärmetauscher und Kondensatoren in nuklearen Anlagen verwendet.
- Aus der US-A-4828759 ist ein Verfahren zur Dekontamination radioaktiv kontaminierter metallischer Materialien bekannt.
- Die radioaktiv kontaminierten metallischen Komponenten werden in ein fluorobor-säurehaltiges Bad gegeben und dieses elektrochemisch regeneriert und die Metalle rückgewonnen, während die regenerierte Fluoroborsäure dem Prozess wieder zugeführt wird. Für die Dekontamination von Komponenten aus Blei und bleihaltigen Legierungen hat sich dieses Verfahren als zu zeitaufwendig erwiesen, dass zudem nur bei erhöhter Temperatur und Konzentration anwendbar ist. Die Löslichkeit von Blei und anderen Metallen wie Ni, Cu, Hg, Ag oder Stahl ist auch in HBF4-Säure bei Raumtemperatur ein äusserst langsamer Prozess, der zudem unter Entwicklung von Wasserstoff H₂ abläuft.
- Es ist daher die Aufgabe der vorliegenden Erfindung, ein Verfahren sowie ein Dekontaminierungsmittel zu schaffen, das insbesondere zur Ablösung von oxidierten oder nicht oxidierten, radioaktiv kontaminierten Oberflächen von metallenen Gegenständen geeignet ist, und den Prozess der Ablösung gegenüber der Durchführung mit bekannten Verfahren erheblich beschleunigt und bei Raumtemperatur durchführbar ist. Diese Aufgabe löst ein Verfahren mit den Merkmalen des Patentanspruches 1, beziehungsweise ein Dekontaminierungsmittel mit den Merkmalen des Patentanspruches 22.
- Die Erläuterung des erfindungsgemässen Verfahrens und des Dekontaminierungsmittels erfolgt in der nachfolgenden Beschreibung anhand der beigefügten Figuren. Es zeigt:
- Fig. 1A + B den Gewichtsverlust einer Bleiplatte in verschiedenen HBF₄ Konzentrationen in Funktion der Zeit A) unter Beifügung von 0,5 Vol % H₂O₂ und B) ohne Beifügung von H₂O₂;
- Fig. 2A + B zeigen wiederum den Gewichtsverlust einer Bleiplatte in 5%iger HBF₄ mit verschiedenen Konzentrationen von H₂O₂;
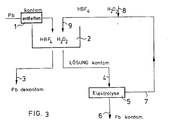
- Fig. 3 eine schematische Darstellung des Ablaufs des erfindungsgemässen Verfahrens
- Fig. 4 die Versuchsanordnung der Elektrolysezelle und die Reagenzgleichungen
- Fig. 5 den Verlauf der hier durchgeführten Elektrolyse in Abhängigkeit der Stromdichte, namentlich A bei 30 mA/cm² und B bei 45 mA/cm²;
- Wenn im nachfolgenden Text von Reagenz gesprochen wird, so wird hierunter das erfindungsgemässe Dekontaminierungsmittel verstanden.
- Bei der Durchführung der nachfolgend beschriebenen Experimente wurde eine Bleiplatte mit der Dicke von 0,25 mm und einer Oberfläche von 2 x 88 cm² verwendet. Um zu vermeiden, dass die Bleiplatte mit einem schützenden Fettfilm überzogen ist, wurde diese jeweils vor dem Einbringen in die Lösung mit Aceton entfettet.
- Bei der Verwendung der Fluoroborsäure HBF₄ wurde jeweils von einer 50%igen reinen Säure ausgegangen und die verschiedenen Verdünnungsgrade durch Zufügung von deionisiertem Wasser erreicht. Die Bleiplatte wurde vor und nach jedem Experiment gewogen. In einer ersten Versuchsreihe wurde der Gewichtsverlust einer genormten Bleiplatte der eingangs genannten Art in verschiedenen HBF₄-Konzentrationen in Abhängigkeit der Zeit ermittelt.
- Hierbei ergab sich das Bild gemäss der Figur 1B. Bei einer reinen HBF₄-Säure zeigten sich nach 200 Minuten bei den unterschiedlichen Konzentrationen zwischen 5 und 50% kaum relevante Unterschiede. Erst nach rund 400 Minuten zeigten sich unterschiedliche Gewichtsverluste an den Bleiplatten, wobei Bleiplatten, die höherkonzentrierter HBF₄-Säure ausgesetzt waren, einen grösseren Bleiverlust zeigten. Nach rund 200 Minuten betrug der Bleigewichtsverlust pro Platte bei allen Konzentrationen der HBF₄-Säure ungefähr 0,05 Gramm. Die gleichen Versuche wurden wiederholt unter Beigabe von 0,5 Vol % H₂O₂ wiederum in Abhängigkeit verschiedener Konzentrationen der HBF₄-Säure. Das nun sich zeigende Bild gemäss der Figur 1A zeigte eine stark verbesserte Bleiablösung an den Platten.
- Nach rund 100 Minuten wurde an allen Platten unabhängig der Konzentration der HBF₄-Säure ein Gewichtsverlust von rund 15 Gramm gemessen. Folglich zeigte sich, dass innert der halben Zeit die Bleiablösung sich um einen Faktor 300 erhöht hatte. Im Gegensatz zu den Versuchen ohne Zusatz von Hydrogenperoxyd zeigte sich, dass die Steigerung der Konzentration der HBF₄-Säure über 5% keine Resultatverbesserung brachte.
- Es zeigte sich folglich, dass durch die Hinzufügung von 0,5 Vol % H₂O₂ die Reduktion der Oxydschicht sofort erfolgte und die Bleiauflösung schnell einsetzte. Die Auflösung war anfänglich schnell und wurde danach langsamer. Die Auflösung stoppte, wenn eine Konzentration von 55 Gramm Blei pro Liter erreicht war.
- Analoge Beobachtungen haben sich nach Versuchen mit Ni, Cu, Ag, Hg und Stahl gezeigt. Hiernach wurden die bisher bei Raumtemperatur durchgeführten Versuche bei einer Temperatur von 60° C wiederholt. Auch hier zeigte sich wiederum, dass die Auflösungsrate sich durch die Zufügung von 0,5 % H₂O₂ scharf anstieg, doch eine erhöhte Bleilöslichkeit gegenüber der Durchführung der Versuche bei Raumtemperatur wurde nicht festgestellt.
- Diese Angaben beziehen sich auf eine Reagenz von 5% HBF₄ mit 0,5% H₂O₂ bei einer Temperatur von 25° C.
- Aus den bisherigen Experimenten ergibt sich somit, dass eine 5%ige HBF₄-Säure ein optimales Resultat ergibt.
- Es wurde nun die Löslichkeitsrate von Blei in 5%iger HBF₄-Säure in Abhängigkeit der Konzentration des darin vorhandenen Hydrogenperoxydes ermittelt. Das Resultat zeigen die Figuren 2A und B. Bei steigender H₂O₂-Konzentration wurde ein ständiger Anstieg der Auflösungsgeschwindigkeit des Bleies festgestellt, und zwar innerhalb dem Bereich von 0 bis 2 Vol %.
- In jedem Fall war die Bleiauflösung anfänglich schnell und nach 60 Minuten langsamer. Bei Hydrogenperoxyd-Konzentrationen zwischen 0,5 und 1,0% erreichte die Lösung gegen Ende des Prozesses eine maximale Bleikonzentration von 80 Gramm pro Liter. Bei dieser Konzentration bildete sich ein weisser Niederschlag in der Lösung und auf der Bleioberfläche. Bei höheren Konzentrationen von H₂O₂ verlief die Auflösungsreaktion stark exotherm. Bei der Versuchsanordnung mit 50 Milliliter Lösung begann diese sofort zu kochen, und fast gleichzeitig bildete sich ein weisser Niederschlag in der Lösung. Die maximale Bleikonzentration in einer 10%igen HBF₄-Lösung stellte sich bei etwa 120 Gramm pro Liter ein. Diese Konzentration ist zwar etwa 50% höher als die in den zuvor gemessenen Fällen, doch sind solche Auflösungsbedingungen bei einem Verfahren in industriellem Massstab nicht akzeptabel.
- Aus der Gesamtheit der beschriebenen Versuche ergab sich, dass die bevorzugte Reagenz zur Auflösung der Oberflächen von oxidierten oder nicht oxidierten Bleiplatten am vorteilhaftesten mit einer Lösung bestehend aus einer 5%igen HBF₄-Säure mit einem Anteil von 0,5 Vol % Hydrogenperoxyd erfolgt. Mit dieser Lösung wurden die Versuche bezüglich dem Verfahren zur Dekontamination von radioaktiv kontaminierten Komponenten aus Blei oder bleienthaltenden Legierungen durchgeführt.
- Einige wenige Versuche, Hydrogenperoxid durch andere Oxidationsmittel zu ersetzen, haben sich als ebenfalls gangbare Lösungen erwiesen. So zeigten Versuche unter Verwendung von Permanganate-HBF₄-Lösungen auch annehmbare Resultate.
- Erstaunlicherweise die allerbesten Resultate ergaben sich bei der Kombination von verschiedenen Oxidationsmitteln zusammen mit einer 5%igen Fluoroborsäure. Insbesondere eine Mischung, bei der man der 5%igen Fluoroborsäure 0,5 bis 2% Hydrogen-Peroxid und 0,1 bis 2% Kalumpermanganat beigab, führte dazu, dass die in der Tabelle bezüglich der Abtragungskinetik angegebenen Werte nochmals erheblich gesteigert werden konnten. Das Oxidationsmittel Kalziumpermanganat KMnO₄ oxidiert die Metalle resp. die Metalloxide und führt sie in eine in der Säure besonders gut lösliche Form über. Eine solche Lösung von Metalle und Metalloxide, welche die Radioaktivität beinhalten, ist beispielsweise:
- Im Gegensatz zum bekannten AP-Citrox Dekontaminationsverfahren wird hier kein Mangatdioxid MnO₂ an der Metalloberfläche ausgeschieden.
- In einem ersten Schritt (l), wie in Figur 3 dargestellt, müssen die kontanimierten Komponenten entfettet werden. Hiernach werden sie in ein Lösungsbad (2) gegeben. Dieses enthält die bereits beschriebene Reagenz, bestehend aus einer 5%igen HBF₄-Säure und 0,5 % Hydrogenperoxyd.
- Nachdem man die Reagenz abhängig von der notwendigen Abtragstiefe während ca. 60 Minuten auf die Bleiplatten hat einwirken lassen, entnimmt man (3) die nun dekontaminierten Bleiplatten dem Lösungsbad (2). Die Lösung, die nun kontaminiert ist, führt man (4) zu einem Elektrolysebad, indem man die Elektrolyse (5) durchführt. An der Anode bzw. Kathode lagern sich nun das kontaminierte Blei bzw. Bleidioxyd. Das konzentrierte radioaktiv kontaminierte Material (6) liegt nun in hochkonzentrierter Form vor und kann nun auf bekannte Weise nuklear entsorgt werden. Die verbleibende HBF₄-Säure wird der Elektrolyse-Zelle entnommen (7). Nun kann die Rückführung (9) der HBF₄-Säure in das Lösungsbad (2) erfolgen. Dies geschieht unter Zufügung (8) von H₂O₂, bis die gewünschte Konzentration wieder erreicht ist. Sind sämtliche Komponenten dekontaminiert, so kann das Verfahren abgebrochen werden, indem man die Säure nach der Durchführung der Elektrolyse durch Zufügung von Kalzium-Hydroxyd neutralisiert oder an einem kationischen Ionentauscher bis zur reinen, nicht kontaminierten Säure regeneriert. Hierbei entsteht bekannterweise ein Niederschlag, den man ausfiltrieren oder sedimentieren kann. Der verbleibende, kontaminierte Filterkuchen lässt sich verfestigen und nuklear entsorgen. Das verbleibende Filtrat ist aktivitätsfrei und enthält auch kein Blei mehr. Es kann somit ohne zusätzliche Vorsichtsmassnahmen entsorgt werden, beispielsweise indem man es der Abwasserentsorgung zuführt.
- In weiteren Versuchsreihen wurde ermittelt, bei welchen Bedingungen die Elektrolyse der 5%igen HBF₄-Säure durchgeführt werden soll, um eine möglichst effiziente Ausscheidung des Bleis bzw. des Bleioxydes zu erhalten.
- Die Versuche wurden bei Raumtemperatur und bei Verwendung von rostfreiem Stahl an der Kathode und einer Grafitanode durchgeführt. Der Elektrolyt bestand aus einer 5%igen HBF₄-Säure mit einem Gehalt von ca. 30 Gramm pro Liter Pb2+. Der Elektrolyt wurde hergestellt durch die Lösung von Blei in einer 5%igen HBF₄-Säure mit einem Gehalt von 0,5% H₂O₂. Der anfängliche pH-Wert war etwa 0. Die Bleielektrolyse wurde gestartet bei einem Potential von ungefähr 2.0 Volt. Anfänglich bildeten sich Blasen an der Anodenoberfläche. Diese verschwanden, sobald sich Bleidioxyd gebildet hatte.
- Die Spannung blieb stabil während der Elektrolyse sowohl bei 30 wie auch bei 45 Milliampère pro cm² Stromdichte bis die Bleikonzentration etwa 5 Gramm pro Liter betrug. Von diesem Punkt weg begann die Spannung zu steigen, während gleichzeitig Blasenbildung inbesondere an der Anode beobachtet werden konnte. Hiermit einher ging eine rapide Verschlechterung der coulomb'schen Effizienz. Bei einer Dichte des Elektrolysestroms von 30 mA pro cm² betrug die coulomb'sche Effizienz etwas mehr als 80%, während bei einer Erhöhung der Stromdichte auf 45 mA pro cm² die coulomb'sche Effizienz bei annähernd 100% lag. Die coulomb'sche Effizienz ist davon abhängig, ob sie vor oder nach dem Zeitpunkt der Spannungserhöhung berechnet wird. Die Figur 5A zeigt zwei Beispiele der Bleielektrolyse. In beiden Fällen wurde der Strom auf einem festen Wert gehalten. Es wurde festgestellt, dass die Spannung stabil blieb solange wie die Bleikonzentration über 5 bis 6 Gramm pro Liter war. Sobald diese Konzentration erreicht war, begann die Spannung zu steigen, und die coulomb'sche Effizienz sank. Eine Steigerung der Spannung führte auch zur Bildung von Sauerstoffblasen an der Oberfläche der Anode. Es scheint somit vorteilhaft die Elektrolyse unter Spannungskontrolle durchzuführen, um die Sauerstoffentwicklung zu verhindern.
- Aus den Versuchen ging hervor, dass die Auflösung von metallischem Blei in HBF₄-Säure von weniger als 50% bei einem Gehalt von weniger als 2 Vol % H₂O₂ eine erheblich verbesserte Auflösung bewirkte. Besonders gute Resultate wurden mit einer 5%igen HBF₄-Säure mit einem Gehalt von 0,5% H₂O₂ erzielt. In dieser Lösung liessen sich 35 Gramm Blei pro Liter in etwa 90 - 120 Minuten auflösen. Nach der Bleiauflösung wurde die Lösung ohne zusätzliche Modifikation direkt als Elektrolyt für die Bleirückgewinnung verwendet. Die Elektrolyse ergab an der Stahlkathode homogenes Blei und an der Graphitanode entsprechend Bleidioxyd Pb0₂. Die coulomb'sche Effizienz war höher als 90% solange die Elektrolysespannung auf einem Potential gehalten wurde, bei der sich kaum eine O₂-Entwicklung zeigte.
- Bei der Verwendung einer Reagenz, die aus einer Mischung von 5%igem HBF₄ sowie 0,5 - 2% H₂O₂ und 0,1 - 2% KMnO₂ besteht, lassen sich verschiedene zusätzliche Anwendungsverfahren realisieren. Da bei der Verwendung dieser Reagenz lauter wasserlösliche Teile anfallen, können die dekontaminierten Metallteile schliesslich ganz einfach mit Wasser sauber gespült werden.
- Ferner hat sich bei der hohen Geschwindigkeit der Auflösung gezeigt, dass diese Reagenz auch direkt in ein geschlossenes Rohrsystem, beispielsweise einen Wärmetauscher in einem Kernkraftwerk, eingepumpt und in diesem während einigen Stunden umgewälzt werden kann und anschliessend die radioaktive Reagenz ausgepumpt und elektrolytisch regeneriert werden kann. Weil die Lösung vollständig wasserlöslich ist, kann danach das Rohrsystem mit Wasser durchgespült werden.
- Eine Alternative besteht darin, dass man die Reagenz im Rohrsystem belässt, jedoch nach einiger Zeit über einen Ionentauscher führt, mit dem sich alle radioaktiven Anteile und die gelösten Metalle aus dem System entnehmen lassen. Die Reinigung mittels Ionentauscher ist an und für sich eine bekannte Technologie, die hier nicht weiter erörtert werden muss.
- Eine mögliche Alterantive besteht darin, dass man die zu dekontamierenden Teile erst einem Oxidationsmittel aussetzt und danach erst in ein reines HBF₄-Säurebad gibt, beziehungsweise mit HBF₄-Säure besprüht. Diese Vorgehensweise kann mehrmals wiederholt werden, bis die zu dekontaminierende Metalloberfläche eine Radioaktivität unterhalt der Freimessgrenze aufweist.
- Schlussendlich ist es aber auch möglich, erst eine Oxidation mittels einem Oxidationsmittel durchzuführen und anschliessend erst das bereits vorher beschriebene Verfahren durchzuführen und die radioaktiv zu dekontaminierenden Metallteile in eine Reagenz aus HBF₄ und einem Oxidationsmittel zu geben.
Claims (27)
- Verfahren zur Lösung von radioaktiv kontaminierenden Oberflächen von Gegenständen aus Metall, wobei die zu dekontaminierenden Gegenstände mit einem Dekontaminationsmittel, enthaltend Fluoroborsäure in wässriger Lösung mit einer Konzentration von 0,05 bis etwa 50 Mol/Liter in Kontakt gebracht und die kontaminierten Komponenten oder zumindest deren Oberflächen vom Dekontaminationsmittel aufgelöst werden, worauf die kontamierten Materialien nuklear entsorgt werden, dadurch gekennzeichnet, dass man zusätzlich die Oberflächen der radioaktiv kontaminierten Komponenten mit einem Oxidationsmittel in einen oxidierten Zustand überführt, welcher in der Fluoroborsäure eine erhöhte, schnellere Löslichkeit aufweist, worauf anschliessend die bekannten Dekontaminationsverfahrensschritte durchgeführt werden.
- Verfahren nach Anspruch 1, dadurch gekennzeichnet, dass man als Oxidationsmittel Hydrogen-Peroxid verwendet.
- Verfahren nach Anspruch 2, dadurch gekennzeichnet, dass man als Oxidationsmittel Hydrogen Peroxid in einer Konzentration von weniger als 20 Volumenprozent verwendet.
- Verfahren nach Anspruch 1, dadurch gekennzeichnet, dass man als Oxidationsmittel eine Mischung von Hydrogen-Peroxid und einem weiteren Oxidationsmittel verwendet.
- Verfahren nach den Ansprüchen 1 bis 4, dadurch gekennzeichnet, dass man das Oxidationsmittel erst mit der Oberfläche der radioaktiv kontaminierten Metallkomponente in Kontakt bringt und anschliessend mit der Fluoroborsäure, bevor die weiteren Dokontaminationsverfahrensschritte durchgeführt werden.
- Verfahren nach Anspruch 5, dadurch gekennzeichnet, dass die beiden ersten Schritte mehrmals wiederholt werden, bevor die weiteren Dekontaminationsschritte durchgeführt werden.
- Verfahren nach Anspruch 5 oder 6, dadurch gekennzeichnet, dass die Oberflächen der ratioaktiv kontaminierten Metallkomponenten abwechslungsweise mit dem Oxidationsmittel und der Fluoroborsäure besprüht werden.
- Verfahren nach Anspruch 5 oder 6, dadurch gekennzeichnet, dass die Oberflächen der radionaktiv kontaminierten Metallkomponenten abwechslungsweise in ein Oxidationsmittel und in Fluoroborsäure getaucht werden.
- Verfahren nach Anspruch 1, dadurch gekennzeichnet, dass man die Oberflächen der radioaktiv kontaminierten Metallkomponenten mit einer Mischung von vorzugsweise 5%iger Fluoroborsäure und 0,5 Volumenprozent Hydrogen-Peroxid in Kontakt bringt.
- Verfahren nach Anspruch 4, dadurch gekennzeichnet, dass man die Oberfläche der radioaktiv kontaminierten Metallkomponenten mit einer Mischung von vorzugsweise 5%iger Fluoroborsäure, 0,5% bis 2% Hydrogen-Peroxid und 0,1 bis 2% Kalium-Permanganat in Kontakt bringt.
- Verfahren nach Anspruch 1, dadurch gekennzeichnet, dass man die Oberflächen der radioaktiven Metallkomponenten zuerst entfettet.
- Verfahren nach Anspruch 1, dadurch gekennzeichnet, dass man die radioaktiven Metallkomponenten bei Raumtemperatur in einem Bad aus Fluoroborsäure und Oxidationsmittel löst.
- Verfahren nach Anspruch 12, dadurch gekennzeichnet, dass man eine regenerative Elektrolyse des kontaminierten Geschmisches aus Fluoroborsäure und Oxidationsmittel bei einer Temperatur von vorzugsweise 25° C mit einer Stromdichte von 5 - 500 mA/cm² durchführt.
- Verfahren nach Anspruch 13, dadurch gekennzeichnet, dass die regenerative Elektrolyse des kontaminierenden Gemisches unterhalb einer Spannung, die zur Sauerstoffentwicklung führt, durchgeführt wird.
- Verfahren nach Anspruch 12, dadurch gekennzeichnet, dass eine Elektrolyse des Gemisches aus HBF₄-Säure und Oxidationsmittel solange durchgeführt wird, bis der Metallgehalt weniger als 0,1 g pro Liter beträgt, worauf die verbleibende HBF₄-Säure zur Wiederholung des Prozesses wiederverwendet wird.
- Verfahren nach Anspruch 12, dadurch gekennzeichnet, dass nach Durchführung der Elektrolyse die Säure durch Zufügung von Calziumhydroxid Ca(OH)₂ neutralisiert wird und der entstehende Niederschlag ausfiltriert und/oder sedimentiert wird und der verbleibende, kontaminierte Filterkuchen verfestigt und nuklear entsorgt wird, während das verbleibende, aktivitäts- und bleifreie Filtrat der Abwasserentsorgung zugeführt wird.
- Verfahren nach Anspruch 12, dadurch gekennzeichnet, dass die Elektrolyse der Mischung solange durchgeführt wird, bis der Bleigehalt weniger als 0,1 g pro Liter beträgt, worauf diese noch eine Restradioaktivität aufweisende Lösung durch einen Kathionentauscher geführt wird, wodurch eine aktivitätsfreie und bleifreie 5% HBF₄-Säure erhalten wird.
- Verfahren nach Anspruch 10, dadurch gekennzeichnet, dass die dekontaminierten Metallteile mittels einer Wasserspülung gereinigt werden.
- Verfahren nach Anspruch 10 zur Dekontamination von radioaktiv kontaminierten, geschlossenen Rohrsystemen aus Metall, dadurch gekennzeichnet, dass in das Rohrsystem die Mischung eingepumpt und während einer Zeit umgewälzt wird und schliesslich während einer weiteren Zeit die Reagenz über einen Ionentauscher führt.
- Verfahren nach Anspruch 10 zur Dekontamination von radioaktiv kontaminierten, geschlossenen Rohrsystemen aus Metall, dadurch gekennzeichnet, dass in das Rohrsystem das Gemisch eingepumpt und während einer Zeit umgewälzt wird, worauf die verunreinigte Reagenz abgepumpt und das Rohrsystem mit Wasser durchgespült wird.
- Verfahren nach Anspruch 20, dadurch gekennzeichnet, dass die abgepumpte Reagenz elektrolytisch regeneriert wird.
- Dekontiminationsmittel enthaltend Fluoroborsäure in wässriger Lösung mit einer Konzentration von 0,05 bis etwa 50 Mol/Liter, zur Lösung von radioaktiv kontaminierten, oxidierten oder nicht oxidierten Oberflächen von Gegenständen aus Metall, dadurch gekennzeichnet, dass das Dekontaminationsmittel zudem mindestens ein Oxidationsmittel enthält.
- Dekontaminationsmittel nach Anspruch 1, dadurch gekennzeichnet, dass das Oxidationsmittel Hydrogen-Peroxid ist.
- Dekontaminationsmittel nach Anspruch 2, dadurch gekennzeichnet, dass dieses weniger als 20 Volumenprozent Hydrogen-Peroxid enthält.
- Dekontaminationsmittel nach Anspruch 1, dadurch gekennzeichnet, dass es eine Mischung von zwei verschiedenen Oxidationsmitteln enthält, von denen mindestens eines Hydrogen-Peroxid ist.
- Dekontaminationsmittel nach Anspruch 2, dadurch gekennzeichnet, dass dasselbe vorzugsweise 5%ige Fluoroborsäure und 0,5 Volumenprozent Hydrgen-Peroxid enthält.
- Dekontaminationsmittel nach Anspruch 3, dadurch gekennzeichnet, dass dasselbe vorzugsweise 5%ige Fluoroborsäure, 0,5 bis 2% Hydrogen-Peroxid H₂O₂ und 0,1 bis 2% Kalium-Permanganat KMnO₄ enthält.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH3429/90A CH682023A5 (de) | 1990-10-26 | 1990-10-26 | |
| CH3429/90 | 1990-10-26 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0483053A1 true EP0483053A1 (de) | 1992-04-29 |
| EP0483053B1 EP0483053B1 (de) | 1995-03-01 |
Family
ID=4255784
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP91810731A Expired - Lifetime EP0483053B1 (de) | 1990-10-26 | 1991-09-16 | Dekontaminationsmittel und Verfahren zur Lösung von radioaktiv kontaminierten Oberflächen von Komponenten aus Metall |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US5340505A (de) |
| EP (1) | EP0483053B1 (de) |
| JP (1) | JPH04285898A (de) |
| BG (1) | BG95366A (de) |
| CA (2) | CA2054234A1 (de) |
| CH (1) | CH682023A5 (de) |
| CS (1) | CS325391A3 (de) |
| DE (1) | DE59104768D1 (de) |
| ES (1) | ES2071278T3 (de) |
| FI (1) | FI914870A7 (de) |
| HU (1) | HU212234B (de) |
| RU (1) | RU2029400C1 (de) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1996014640A1 (en) * | 1994-11-04 | 1996-05-17 | British Nuclear Fuels Plc | Decontamination processes |
| US5805654A (en) * | 1997-04-08 | 1998-09-08 | Wood; Christopher J. | Regenerative LOMI decontamination process |
| US5901368A (en) * | 1997-06-04 | 1999-05-04 | Electric Power Research Institute | Radiolysis-assisted decontamination process |
| US6320675B1 (en) | 1997-07-15 | 2001-11-20 | Canon Kabushiki Kaisha | Image processing apparatus and method and storage medium |
| RU2397558C1 (ru) * | 2009-07-27 | 2010-08-20 | Федеральное государственное унитарное предприятие "Научно-исследовательский технологический институт имени А.П. Александрова" | Способ очистки и дезактивации оборудования атомных электрических станций (варианты) |
| CN112176393A (zh) * | 2020-09-28 | 2021-01-05 | 中核四川环保工程有限责任公司 | 一种电化学去污电解液及其制备方法和应用 |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5458745A (en) * | 1995-01-23 | 1995-10-17 | Covofinish Co., Inc. | Method for removal of technetium from radio-contaminated metal |
| US5724668A (en) * | 1995-11-07 | 1998-03-03 | Electronic Power Research Institute | Method for decontamination of nuclear plant components |
| US6147274A (en) * | 1996-11-05 | 2000-11-14 | Electric Power Research Insitute | Method for decontamination of nuclear plant components |
| US7384529B1 (en) | 2000-09-29 | 2008-06-10 | The United States Of America As Represented By The United States Department Of Energy | Method for electrochemical decontamination of radioactive metal |
| RU2195728C2 (ru) * | 2000-11-22 | 2002-12-27 | Государственное предприятие "Курская атомная станция" | Способ малореагентной дезактивации |
| FR2873848B1 (fr) * | 2004-08-02 | 2006-11-17 | Tech En Milieu Ionisant Stmi S | Procede de decontamination d'objets en plomb |
| US20100010285A1 (en) * | 2008-06-26 | 2010-01-14 | Lumimove, Inc., D/B/A Crosslink | Decontamination system |
| JP6220114B2 (ja) * | 2011-11-30 | 2017-10-25 | 荏原工業洗浄株式会社 | 放射性セシウム固体状被汚染物の除染方法及び装置 |
| RU2502567C1 (ru) * | 2012-07-27 | 2013-12-27 | Федеральное государственное унитарное предприятие "Российский Федеральный ядерный центр - Всероссийский научно-исследовательский институт экспериментальной физики" - ФГУП "РФЯЦ-ВНИИЭФ" | Способ удаления металлических покрытий с поверхности деталей из радиоактивного химически активного металла |
| JP6403517B2 (ja) * | 2014-09-25 | 2018-10-10 | 三菱重工業株式会社 | 放射性廃棄物除染方法 |
| RU2646535C1 (ru) * | 2017-04-12 | 2018-03-06 | Федеральное государственное унитарное предприятие "Научно-исследовательский институт Научно-производственное объединение "ЛУЧ" (ФГУП "НИИ НПО "ЛУЧ") | Способ переработки отходов ядерного производства |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB891670A (en) * | 1957-09-04 | 1962-03-14 | English Electric Co Ltd | Improvements in and relating to the removing of scale from silicon iron and other metals |
| US3565707A (en) * | 1969-03-03 | 1971-02-23 | Fmc Corp | Metal dissolution |
| US3873362A (en) * | 1973-05-29 | 1975-03-25 | Halliburton Co | Process for cleaning radioactively contaminated metal surfaces |
| WO1986007184A1 (fr) * | 1985-05-28 | 1986-12-04 | Jozef Hanulik | Moyen pour la decontamination de materiaux contamines metalliques ou renfermant du ciment, son procede de fabrication et son utilisation |
Family Cites Families (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1899734A (en) * | 1930-01-18 | 1933-02-28 | American Sheet & Tin Plate | Removal of oxids from ferrous metal |
| US2154451A (en) * | 1934-12-17 | 1939-04-18 | Du Pont | Bright dip |
| GB891760A (en) * | 1957-07-08 | 1962-03-21 | Derek Richard Stuckey | Improvements in or relating to sleeved garments |
| US3080323A (en) * | 1959-04-07 | 1963-03-05 | Purex Corp Ltd | Composition for radioactive decontamination and descaling of cobalt alloys |
| BE670521A (de) * | 1964-10-05 | 1900-01-01 | ||
| US3341304A (en) * | 1966-04-08 | 1967-09-12 | Billie J Newby | Separation of uranium from uranium dioxide-zirconium dioxide mixtures |
| US3409413A (en) * | 1967-08-11 | 1968-11-05 | Atomic Energy Commission Usa | Method of dissolving aluminum-clad thoria target elements |
| US3668131A (en) * | 1968-08-09 | 1972-06-06 | Allied Chem | Dissolution of metal with acidified hydrogen peroxide solutions |
| SU398702A1 (ru) * | 1970-04-29 | 1973-09-27 | Раствор для стравливания гальванических покрытий сплавами олово—свинец | |
| DE2058766A1 (de) * | 1970-11-30 | 1972-05-31 | Siemens Ag | Verfahren zur Reinigung von metallischen Oberflaechen,insbesondere radioaktiv verseuchten Oberflaechen |
| US3891741A (en) * | 1972-11-24 | 1975-06-24 | Ppg Industries Inc | Recovery of fission products from acidic waste solutions thereof |
| GB1446816A (en) * | 1973-05-02 | 1976-08-18 | Furukawa Electric Co Ltd | Chemical dissolution treatment of tin or alloys thereof |
| US3965237A (en) * | 1975-04-11 | 1976-06-22 | The United States Of America As Repesented By The United States Energy Research And Development Administration | Dissolution process for ZrO2 -UO2 -CaO fuels |
| DE2553569C2 (de) * | 1975-11-28 | 1985-09-12 | Kernforschungszentrum Karlsruhe Gmbh, 7500 Karlsruhe | Verfahren zur Verfestigung von radioaktiven wäßrigen Abfallstoffen durch Sprühkalzinierung und anschließende Einbettung in eine Matrix aus Glas oder Glaskeramik |
| BE838533A (fr) * | 1976-02-13 | 1976-05-28 | Procede de sechage des solutions contenant de l'acide borique | |
| CH619807A5 (de) * | 1976-04-07 | 1980-10-15 | Foerderung Forschung Gmbh | |
| DE2910677C2 (de) * | 1979-03-19 | 1983-12-22 | Kraftwerk Union AG, 4330 Mülheim | Verfahren zur Behandlung von borhaltigen radioaktiven Konzentraten aus Abwässern von Druckwasserreaktoren |
| US4217192A (en) * | 1979-06-11 | 1980-08-12 | The United States Of America As Represented By The United States Department Of Energy | Decontamination of metals using chemical etching |
| US4443269A (en) * | 1979-10-01 | 1984-04-17 | Health Physics Systems, Inc. | Tool decontamination method |
| JPS57164984A (en) * | 1981-04-06 | 1982-10-09 | Metsuku Kk | Exfoliating solution for tin or tin alloy |
| CH653466A5 (de) * | 1981-09-01 | 1985-12-31 | Industrieorientierte Forsch | Verfahren zur dekontamination von stahloberflaechen und entsorgung der radioaktiven stoffe. |
| US4686019A (en) * | 1982-03-11 | 1987-08-11 | Exxon Research And Engineering Company | Dissolution of PuO2 or NpO2 using electrolytically regenerated reagents |
| US4530723A (en) * | 1983-03-07 | 1985-07-23 | Westinghouse Electric Corp. | Encapsulation of ion exchange resins |
| US4620947A (en) * | 1983-10-17 | 1986-11-04 | Chem-Nuclear Systems, Inc. | Solidification of aqueous radioactive waste using insoluble compounds of magnesium oxide |
| US4537666A (en) * | 1984-03-01 | 1985-08-27 | Westinghouse Electric Corp. | Decontamination using electrolysis |
| US4701246A (en) * | 1985-03-07 | 1987-10-20 | Kabushiki Kaisha Toshiba | Method for production of decontaminating liquid |
| JPS6267500A (ja) * | 1985-09-20 | 1987-03-27 | 日立プラント建設株式会社 | 放射能汚染物の化学的除染方法及び装置 |
| CH679158A5 (de) * | 1989-07-20 | 1991-12-31 | Recytec S A C O Orfigest S A | |
| JPH0375386A (ja) * | 1989-08-18 | 1991-03-29 | Metsuku Kk | 錫又は錫‐鉛合金の剥離方法 |
| US5084253A (en) * | 1989-11-13 | 1992-01-28 | Nuclear Metals, Inc. | Method of removing niobium from uranium-niobium alloy |
-
1990
- 1990-10-26 CH CH3429/90A patent/CH682023A5/de not_active IP Right Cessation
-
1991
- 1991-08-16 US US07/746,027 patent/US5340505A/en not_active Expired - Fee Related
- 1991-09-16 DE DE59104768T patent/DE59104768D1/de not_active Expired - Fee Related
- 1991-09-16 ES ES91810731T patent/ES2071278T3/es not_active Expired - Lifetime
- 1991-09-16 EP EP91810731A patent/EP0483053B1/de not_active Expired - Lifetime
- 1991-10-16 FI FI914870A patent/FI914870A7/fi not_active Application Discontinuation
- 1991-10-17 JP JP3298544A patent/JPH04285898A/ja active Pending
- 1991-10-25 CS CS913253A patent/CS325391A3/cs unknown
- 1991-10-25 CA CA002054234A patent/CA2054234A1/en not_active Abandoned
- 1991-10-25 CA CA002054236A patent/CA2054236A1/en not_active Abandoned
- 1991-10-25 RU SU915001980A patent/RU2029400C1/ru active
- 1991-10-25 BG BG095366A patent/BG95366A/bg unknown
- 1991-10-25 HU HU913363A patent/HU212234B/hu not_active IP Right Cessation
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB891670A (en) * | 1957-09-04 | 1962-03-14 | English Electric Co Ltd | Improvements in and relating to the removing of scale from silicon iron and other metals |
| US3565707A (en) * | 1969-03-03 | 1971-02-23 | Fmc Corp | Metal dissolution |
| US3873362A (en) * | 1973-05-29 | 1975-03-25 | Halliburton Co | Process for cleaning radioactively contaminated metal surfaces |
| WO1986007184A1 (fr) * | 1985-05-28 | 1986-12-04 | Jozef Hanulik | Moyen pour la decontamination de materiaux contamines metalliques ou renfermant du ciment, son procede de fabrication et son utilisation |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1996014640A1 (en) * | 1994-11-04 | 1996-05-17 | British Nuclear Fuels Plc | Decontamination processes |
| US5805654A (en) * | 1997-04-08 | 1998-09-08 | Wood; Christopher J. | Regenerative LOMI decontamination process |
| US5901368A (en) * | 1997-06-04 | 1999-05-04 | Electric Power Research Institute | Radiolysis-assisted decontamination process |
| US6320675B1 (en) | 1997-07-15 | 2001-11-20 | Canon Kabushiki Kaisha | Image processing apparatus and method and storage medium |
| US6721067B2 (en) | 1997-07-15 | 2004-04-13 | Canon Kabushiki Kaisha | Processing apparatus and method and storage medium |
| RU2397558C1 (ru) * | 2009-07-27 | 2010-08-20 | Федеральное государственное унитарное предприятие "Научно-исследовательский технологический институт имени А.П. Александрова" | Способ очистки и дезактивации оборудования атомных электрических станций (варианты) |
| CN112176393A (zh) * | 2020-09-28 | 2021-01-05 | 中核四川环保工程有限责任公司 | 一种电化学去污电解液及其制备方法和应用 |
| CN112176393B (zh) * | 2020-09-28 | 2021-09-21 | 中核四川环保工程有限责任公司 | 一种电化学去污电解液及其制备方法和应用 |
| US11342092B2 (en) | 2020-09-28 | 2022-05-24 | China Nuclear Sichuan Environmental Protection Engineering Co., Ltd. | Electrolyte for electrochemical decontamination and preparation method and application thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| CS325391A3 (en) | 1992-06-17 |
| HUT69460A (en) | 1995-09-28 |
| CH682023A5 (de) | 1993-06-30 |
| ES2071278T3 (es) | 1995-06-16 |
| CA2054234A1 (en) | 1992-04-27 |
| EP0483053B1 (de) | 1995-03-01 |
| BG95366A (bg) | 1993-12-24 |
| CA2054236A1 (en) | 1992-04-27 |
| JPH04285898A (ja) | 1992-10-09 |
| DE59104768D1 (de) | 1995-04-06 |
| US5340505A (en) | 1994-08-23 |
| HU212234B (en) | 1996-04-29 |
| HU913363D0 (en) | 1992-01-28 |
| FI914870A0 (fi) | 1991-10-16 |
| RU2029400C1 (ru) | 1995-02-20 |
| FI914870A7 (fi) | 1992-04-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0483053B1 (de) | Dekontaminationsmittel und Verfahren zur Lösung von radioaktiv kontaminierten Oberflächen von Komponenten aus Metall | |
| EP0073366B1 (de) | Verfahren zur Dekontamination von Stahloberflächen und Entsorgung der radioaktiven Abfälle | |
| EP0224510B1 (de) | Verfahren zur dekontamination von radioaktiv kontaminierten gegenständen aus metall oder aus zementhaltigem material | |
| DE2714245B2 (de) | Verfahren zur Dekontamination von Metalloberflächen | |
| DE19943353A1 (de) | Verfahren zur Behandlung von Abfall von Kernbrennstoffhandhabungseinrichtungen und Einrichtung zur Ausführung des Verfahrens | |
| DE69417018T2 (de) | Verfahren zur behandlung von teilchenmaterial | |
| DE69507709T2 (de) | Dekontaminierungsverfahren | |
| EP0313843B1 (de) | Verfahren zur Dekontamination von Oberflächen | |
| DE102010028457A1 (de) | Verfahren zur Oberflächen-Dekontamination | |
| DE3507334A1 (de) | Vorrichtung zum entseuchen strahlungsverseuchter metallischer gegenstaende | |
| DE1496907B2 (de) | Verfahren zum kontinuierlichen elektrolytischen entzundern von nickel und chrom enthaltenden staehlen | |
| DE1196048B (de) | Verfahren und Vorrichtung zum chemischen Ent-oxydieren von Metallen | |
| DE3607608A1 (de) | Verfahren zur herstellung einer dekontaminierungsfluessigkeit | |
| EP0610153B1 (de) | Verfahren zur Dekontamination von radioaktiven Metalloberflächen | |
| DE2635033A1 (de) | Behandlung von fluorborat enthaltenden loesungen | |
| DE69012677T2 (de) | Verfahren zur Auflösung von auf einem Substrat deponierten Oxiden und Verwendung zur Dekontaminierung. | |
| EP1141445B1 (de) | Verfahren zur dekontamination einer oberfläche eines bauteiles | |
| CH647001A5 (de) | Verfahren zur selektiven entfernung von kupferverunreinigungen aus palladium und zinn enthaltenden waessrigen aktivatorloesungen. | |
| DE2728650C2 (de) | Verfahren zur Vorbehandlung von Stahloberflächen für das nachfolgende Überziehen | |
| DE1496906A1 (de) | Verfahren zum elektrolytischen Entzundern von Eisen und Stahl | |
| DE3871710T2 (de) | Verfahren zur reduktiven aufloesung von pu02, verwendbar in der behandlung von mit pu02 verunreinigten organischen abfaellen. | |
| DE4420139C1 (de) | Verfahren zur elektrochemischen Dekontamination von radioaktiv belasteten Oberflächen von Metallkomponenten aus kerntechnischen Anlagen | |
| DE86459C (de) | ||
| DE10134812A1 (de) | Enteisende Fluxsalz-Zusammensetzung für Fluxbäder | |
| EP1149927B1 (de) | Verfahren zur Aufarbeitung eines Goldbades |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): BE CH DE ES FR GB LI SE |
|
| 17P | Request for examination filed |
Effective date: 19920611 |
|
| 17Q | First examination report despatched |
Effective date: 19940314 |
|
| RAP1 | Party data changed (applicant data changed or rights of an application transferred) |
Owner name: RECYTEC S.A. |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): BE CH DE ES FR GB LI SE |
|
| REF | Corresponds to: |
Ref document number: 59104768 Country of ref document: DE Date of ref document: 19950406 |
|
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) |
Effective date: 19950310 |
|
| ET | Fr: translation filed | ||
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FG2A Ref document number: 2071278 Country of ref document: ES Kind code of ref document: T3 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 19960830 Year of fee payment: 6 Ref country code: FR Payment date: 19960830 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BE Payment date: 19960913 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: SE Payment date: 19960917 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: ES Payment date: 19960919 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19960930 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19961223 Year of fee payment: 6 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970916 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970917 Ref country code: ES Free format text: LAPSE BECAUSE OF THE APPLICANT RENOUNCES Effective date: 19970917 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970930 Ref country code: FR Free format text: THE PATENT HAS BEEN ANNULLED BY A DECISION OF A NATIONAL AUTHORITY Effective date: 19970930 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970930 Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970930 |
|
| BERE | Be: lapsed |
Owner name: S.A. RECYTEC Effective date: 19970930 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 19970916 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980603 |
|
| EUG | Se: european patent has lapsed |
Ref document number: 91810731.9 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FD2A Effective date: 20001102 |