DE69925019T2 - Kombinationen für diabetes welche glyburide, troglitazon (und ein biguanid) enthalten - Google Patents
Kombinationen für diabetes welche glyburide, troglitazon (und ein biguanid) enthalten Download PDFInfo
- Publication number
- DE69925019T2 DE69925019T2 DE69925019T DE69925019T DE69925019T2 DE 69925019 T2 DE69925019 T2 DE 69925019T2 DE 69925019 T DE69925019 T DE 69925019T DE 69925019 T DE69925019 T DE 69925019T DE 69925019 T2 DE69925019 T2 DE 69925019T2
- Authority
- DE
- Germany
- Prior art keywords
- troglitazone
- patients
- study
- sulfonylurea
- metformin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- GXPHKUHSUJUWKP-UHFFFAOYSA-N troglitazone Chemical compound C1CC=2C(C)=C(O)C(C)=C(C)C=2OC1(C)COC(C=C1)=CC=C1CC1SC(=O)NC1=O GXPHKUHSUJUWKP-UHFFFAOYSA-N 0.000 title claims description 98
- 229960001641 troglitazone Drugs 0.000 title claims description 97
- GXPHKUHSUJUWKP-NTKDMRAZSA-N troglitazone Natural products C([C@@]1(OC=2C(C)=C(C(=C(C)C=2CC1)O)C)C)OC(C=C1)=CC=C1C[C@H]1SC(=O)NC1=O GXPHKUHSUJUWKP-NTKDMRAZSA-N 0.000 title claims description 96
- ZNNLBTZKUZBEKO-UHFFFAOYSA-N glyburide Chemical compound COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZNNLBTZKUZBEKO-UHFFFAOYSA-N 0.000 title claims description 31
- 229960004580 glibenclamide Drugs 0.000 title claims description 29
- 229940123208 Biguanide Drugs 0.000 title claims description 21
- XNCOSPRUTUOJCJ-UHFFFAOYSA-N Biguanide Chemical compound NC(N)=NC(N)=N XNCOSPRUTUOJCJ-UHFFFAOYSA-N 0.000 title claims description 20
- 206010012601 diabetes mellitus Diseases 0.000 title claims description 15
- 229940100389 Sulfonylurea Drugs 0.000 claims description 51
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 claims description 51
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 claims description 43
- 238000011282 treatment Methods 0.000 claims description 40
- 229960003105 metformin Drugs 0.000 claims description 39
- NKOHRVBBQISBSB-UHFFFAOYSA-N 5-[(4-hydroxyphenyl)methyl]-1,3-thiazolidine-2,4-dione Chemical compound C1=CC(O)=CC=C1CC1C(=O)NC(=O)S1 NKOHRVBBQISBSB-UHFFFAOYSA-N 0.000 claims description 32
- 239000003472 antidiabetic agent Substances 0.000 claims description 22
- 230000003178 anti-diabetic effect Effects 0.000 claims description 19
- 239000000825 pharmaceutical preparation Substances 0.000 claims description 13
- 238000002360 preparation method Methods 0.000 claims description 11
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 6
- 229940124531 pharmaceutical excipient Drugs 0.000 claims description 5
- 239000004480 active ingredient Substances 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 4
- 229940125708 antidiabetic agent Drugs 0.000 claims description 3
- 239000000203 mixture Substances 0.000 claims description 3
- 239000000126 substance Substances 0.000 claims description 3
- 239000013543 active substance Substances 0.000 claims description 2
- 238000004519 manufacturing process Methods 0.000 claims description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 46
- 238000009097 single-agent therapy Methods 0.000 description 37
- 230000002641 glycemic effect Effects 0.000 description 30
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 28
- 239000008103 glucose Substances 0.000 description 28
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 25
- 102000004877 Insulin Human genes 0.000 description 23
- 108090001061 Insulin Proteins 0.000 description 23
- 238000002648 combination therapy Methods 0.000 description 23
- 229940125396 insulin Drugs 0.000 description 23
- 230000008859 change Effects 0.000 description 21
- 230000000694 effects Effects 0.000 description 21
- YASAKCUCGLMORW-UHFFFAOYSA-N Rosiglitazone Chemical compound C=1C=CC=NC=1N(C)CCOC(C=C1)=CC=C1CC1SC(=O)NC1=O YASAKCUCGLMORW-UHFFFAOYSA-N 0.000 description 20
- HYAFETHFCAUJAY-UHFFFAOYSA-N pioglitazone Chemical compound N1=CC(CC)=CC=C1CCOC(C=C1)=CC=C1CC1C(=O)NC(=O)S1 HYAFETHFCAUJAY-UHFFFAOYSA-N 0.000 description 18
- 229940079593 drug Drugs 0.000 description 16
- 239000003814 drug Substances 0.000 description 16
- 230000009467 reduction Effects 0.000 description 16
- 206010022489 Insulin Resistance Diseases 0.000 description 14
- 230000006872 improvement Effects 0.000 description 14
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 12
- 229960005095 pioglitazone Drugs 0.000 description 9
- 229960004586 rosiglitazone Drugs 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 238000002560 therapeutic procedure Methods 0.000 description 9
- 230000003247 decreasing effect Effects 0.000 description 8
- 231100000673 dose–response relationship Toxicity 0.000 description 8
- 230000003914 insulin secretion Effects 0.000 description 8
- 108010075254 C-Peptide Proteins 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- 150000003626 triacylglycerols Chemical class 0.000 description 7
- 108010010234 HDL Lipoproteins Proteins 0.000 description 6
- 102000015779 HDL Lipoproteins Human genes 0.000 description 6
- 102000001554 Hemoglobins Human genes 0.000 description 6
- 108010054147 Hemoglobins Proteins 0.000 description 6
- 108010007622 LDL Lipoproteins Proteins 0.000 description 6
- 102000007330 LDL Lipoproteins Human genes 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- 235000012000 cholesterol Nutrition 0.000 description 6
- 239000002699 waste material Substances 0.000 description 6
- 230000004584 weight gain Effects 0.000 description 6
- 235000019786 weight gain Nutrition 0.000 description 6
- VOUAQYXWVJDEQY-QENPJCQMSA-N 33017-11-7 Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)NCC(=O)NCC(=O)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N1[C@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O)CCC1 VOUAQYXWVJDEQY-QENPJCQMSA-N 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 238000005534 hematocrit Methods 0.000 description 5
- 210000000496 pancreas Anatomy 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- 230000035487 diastolic blood pressure Effects 0.000 description 4
- 235000005911 diet Nutrition 0.000 description 4
- 230000037213 diet Effects 0.000 description 4
- 230000009230 endogenous glucose production Effects 0.000 description 4
- 235000012054 meals Nutrition 0.000 description 4
- 230000000291 postprandial effect Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 3
- 238000011284 combination treatment Methods 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 230000002489 hematologic effect Effects 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 229960004329 metformin hydrochloride Drugs 0.000 description 3
- OETHQSJEHLVLGH-UHFFFAOYSA-N metformin hydrochloride Chemical compound Cl.CN(C)C(=N)N=C(N)N OETHQSJEHLVLGH-UHFFFAOYSA-N 0.000 description 3
- 230000003248 secreting effect Effects 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- 208000032843 Hemorrhage Diseases 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- 208000013016 Hypoglycemia Diseases 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 208000034158 bleeding Diseases 0.000 description 2
- 230000000740 bleeding effect Effects 0.000 description 2
- 230000036772 blood pressure Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 108010022197 lipoprotein cholesterol Proteins 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000002483 medication Methods 0.000 description 2
- 229940084921 micronized glyburide Drugs 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 238000011269 treatment regimen Methods 0.000 description 2
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 2
- 238000013293 zucker diabetic fatty rat Methods 0.000 description 2
- XUFXOAAUWZOOIT-SXARVLRPSA-N (2R,3R,4R,5S,6R)-5-[[(2R,3R,4R,5S,6R)-5-[[(2R,3R,4S,5S,6R)-3,4-dihydroxy-6-methyl-5-[[(1S,4R,5S,6S)-4,5,6-trihydroxy-3-(hydroxymethyl)-1-cyclohex-2-enyl]amino]-2-oxanyl]oxy]-3,4-dihydroxy-6-(hydroxymethyl)-2-oxanyl]oxy]-6-(hydroxymethyl)oxane-2,3,4-triol Chemical compound O([C@H]1O[C@H](CO)[C@H]([C@@H]([C@H]1O)O)O[C@H]1O[C@@H]([C@H]([C@H](O)[C@H]1O)N[C@@H]1[C@@H]([C@@H](O)[C@H](O)C(CO)=C1)O)C)[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O XUFXOAAUWZOOIT-SXARVLRPSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- 206010005746 Blood pressure fluctuation Diseases 0.000 description 1
- 208000032928 Dyslipidaemia Diseases 0.000 description 1
- 206010014486 Elevated triglycerides Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- FAEKWTJYAYMJKF-QHCPKHFHSA-N GlucoNorm Chemical compound C1=C(C(O)=O)C(OCC)=CC(CC(=O)N[C@@H](CC(C)C)C=2C(=CC=CC=2)N2CCCCC2)=C1 FAEKWTJYAYMJKF-QHCPKHFHSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- 206010060378 Hyperinsulinaemia Diseases 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- 241000371980 Influenza B virus (B/Shanghai/361/2002) Species 0.000 description 1
- 102000003746 Insulin Receptor Human genes 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 108010028554 LDL Cholesterol Proteins 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 208000017170 Lipid metabolism disease Diseases 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 206010038063 Rectal haemorrhage Diseases 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 229960002632 acarbose Drugs 0.000 description 1
- XUFXOAAUWZOOIT-UHFFFAOYSA-N acarviostatin I01 Natural products OC1C(O)C(NC2C(C(O)C(O)C(CO)=C2)O)C(C)OC1OC(C(C1O)O)C(CO)OC1OC1C(CO)OC(O)C(O)C1O XUFXOAAUWZOOIT-UHFFFAOYSA-N 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 210000003486 adipose tissue brown Anatomy 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 1
- 150000004283 biguanides Chemical class 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000001364 causal effect Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 229940116283 combination glucose Drugs 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 230000003205 diastolic effect Effects 0.000 description 1
- 235000021004 dietary regimen Nutrition 0.000 description 1
- 230000003292 diminished effect Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 208000014617 hemorrhoid Diseases 0.000 description 1
- 230000003451 hyperinsulinaemic effect Effects 0.000 description 1
- 230000000910 hyperinsulinemic effect Effects 0.000 description 1
- 201000008980 hyperinsulinism Diseases 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 230000031891 intestinal absorption Effects 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 238000011545 laboratory measurement Methods 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 230000004322 lipid homeostasis Effects 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 230000009245 menopause Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 238000000034 method Methods 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 230000036581 peripheral resistance Effects 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 230000029537 positive regulation of insulin secretion Effects 0.000 description 1
- 229960002354 repaglinide Drugs 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- -1 strength Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000035488 systolic blood pressure Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/427—Thiazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/155—Amidines (), e.g. guanidine (H2N—C(=NH)—NH2), isourea (N=C(OH)—NH2), isothiourea (—N=C(SH)—NH2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/426—1,3-Thiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/64—Sulfonylureas, e.g. glibenclamide, tolbutamide, chlorpropamide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
Landscapes
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Obesity (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
- UMFELD DER ERFINDUNG
- Diese Erfindung bezieht sich auf Kombinationen antidiabetisch wirksamer Verbindungen und die Anwendung solcher Verbindungen zur Herstellung von Arzneistoffzubereitungen zur Behandlung von Diabetes.
- HINTERGRUND DER ERFINDUNG
- Diabetes mellitus ist eine Funktionsstörung des Metabolismus, die durch Überzuckerung, Insulinresistenz charakterisiert ist und oft mit anderen Funktionsstörungen wie Fettleibigkeit, Hypertonie, Hyperlipidämie einhergeht, ebenso wie mit Komplikationen von der Art wie Herz-Kreislauf-Erkrankungen, Retinopathie, Neuropathie und Nephropathie. Die Erkrankung ist von Natur aus fortschreitend und kann anfänglich oft alleine durch Diät kontrolliert werden, benötigt jedoch im Allgemeinen eine medikamentöse Behandlung wie eine solche mit Sulfonylharnstoffen und exogenen Insulininjektionen. Kürzlich erreichte eine neue, als Glitazone bekannte Stoffklasse, bezüglich ihrer Eignung bei der Diabetesbehandlung große Aufmerksamkeit. Diese Verbindungen bewirken die Erhöhung der Empfindlichkeit der Insulinrezeptoren überall im Körper, wobei sie den Bedarf nach exogenem Insulin vermindern oder eliminieren. Ein anderer, als Biguanid bekannter Wirkstoff wird ebenfalls zur Reduktion der in der Leber erzeugten Glukose wie auch zur intestinalen Absorption der Glukose eingesetzt.
- Es wurde jetzt entdeckt, dass die Kombinationstherapie aus einem Biguanid und einem Glitazon zu einer erheblichen Verbesserung der glykämischen Kontrolle führt und dass durch Anwendung einer Kombination umfassend ein Biguanid, ein Glitazon und ein Sulfonylharnstoff eine noch bessere Kontrolle erreicht werden kann. Infolgedessen sind solche Kombinationen bei der Diabetesbehandlung und deren Begleitkomplikationen besonders nützlich.
- In der Comprehensive Therapy, Vol. 24, 1998, Seiten 319–326, haben Kappel et al. die derzeit verfügbare Mono- und Kombinationstherapie zur Behandlung des Typ-2-Diabetes mellitus aufgeführt. Pharmakologisch wirksame Stoffe, die zu Behandlungszwecken zugelassen wurden, sind Sulfonylharnstoffe, Insulin, Metformin, Acarbose, Troglitazon und Repaglinid.
- Diese Erfindung legt eine pharmazeutische Zubereitung vor, umfassend ein antidiabetisch wirksames Glitazon und ein antidiabetisch wirksamer Sulfonylharnstoff sowie einen gebräuchlichen pharmazeutischen Hilfs- oder Trägerstoff, eine pharmazeutische Zubereitung umfassend ein antidiabetisch wirksames Glitazon und ein antidiabetisch wirksames Biguanid sowie einen gebräuchlichen pharmazeutischen Hilfs- oder Trägerstoff, den Gebrauch einer Kombination eines Glitazons und eines Sulfonylharnstoffes zur Herstellung einer pharmazeutischen Zubereitung für die Behandlung von Diabetes und den Gebrauch einer Kombination umfassend ein Glitazon und ein Biguanid zur Herstellung einer pharmazeutischen Zubereitung für die Behandlung von Diabetes, worin das Glitazon Troglitazon ist und der Sulfonylharnstoff Glyburid ist. Die hier vorgelegten klinischen Daten bestätigen die biologischen Vorteile, die mit diesen Kombinationen unerwarteterweise erzielbar sind.
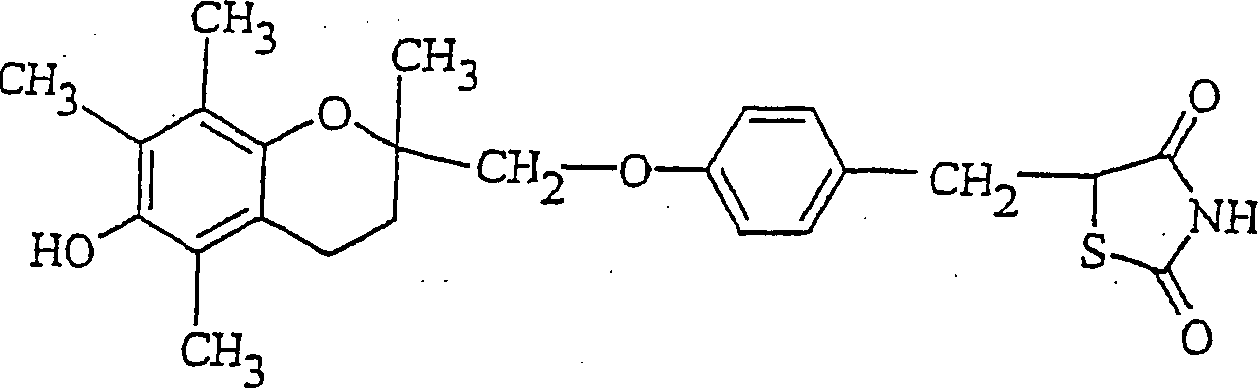
- Entsprechend dieser Erfindung wird der vorhergehende Sulfonylharnstoff in Kombination mit einem Glitazon zur Behandlung der Diabetes und der Verbesserung der glykämischen Kontrolle verwendet. Das eingesetzte Glitazon ist Troglitazon mit der Formel:
- Ein typisches Biguanid stellt Metformin dar. Es wird üblicherweise klinisch als pharmazeutisch akzeptables Salz benutzt, vorzugsweise als Hydrochloridsalz. Es ist eine handelsübliche Form des Metforminhydrochlorids verfügbar und sein chemischer Name lautet N,N-dimethylimidodicarbonimiddiamidhydrochlorid. Metforminhydrochlorid hat die Strukturformel:
- So wie hierin benutzt, bedeutet „Metformin" die Verbindung als Base ebenso wie deren pharmazeutisch akzeptablen Salze. Metformin wird klinisch eingesetzt, um mit dem NIDDM umzugehen, und zwar insbesondere bei Patienten, die mit einem Sulfonylharnstoff nicht wirksam behandelt werden können. Obwohl es mit Sulfonylharnstoffen nicht chemisch verwandt ist, wird es routinemäßig in Kombination mit einem Sulfonylharnstoff verwendet und es hat sich in einigen Fällen als synergistisch erwiesen. Auch andere Biguanide können verwendet werden.
- KURZE BESCHREIBUNG DER ABBILDUNGEN
-
1 – Dosis-Wirkungs-Beziehung von CS-045 (Troglitazon), Pioglitazon und BRL-49653 (Rosiglitazon) als Ursache für die Reduktion der Anzahl roter Blutkörperchen bei weiblichen Ratten. -
2 – Dosis-Wirkungs-Beziehung von Troglitazon, Pioglitazon und Rosiglitazon bezüglich des Anstiegs an braunem Fettgewebe bei Ratten. -
3 – Dosis-Wirkungs-Beziehung von Troglitazon, Pioglitazon und Rosiglitazon bezüglich des Anstiegs des Gewichtes des Herzens (Masse) bei Ratten. -
4 – Dosis-Wirkungs-Beziehung (ED25) von Troglitazon, Pioglitazon und Rosiglitazon als Ursache für die Abnahme der Glukose im Serum von KK-Mäusen. -
5 – Dosis-Wirkungs-Beziehung (ED25) von Troglitazon, Pioglitazon und Rosiglitazon als Ursache für die Abnahme der Glukose (%) im Serum von ZDF Ratten. -
5 – Dosis-Wirkungs-Beziehung (ED25) von Troglitazon, Pioglitazon und Rosiglitazon als Ursache für die Abnahme der Glukose (%) im Serum von ZDF Ratten. -
6 – Dosis-Wirkungs-Beziehung von Troglitazon, Pioglitazon und Rosiglitazon als Ursache für die Abnahme der Glukose (%) im Serum von GK Ratten. -
7 – Dosis-Wirkungs-Beziehung von Troglitazon, Pioglitazon und Rosiglitazon als Ursache für die Abnahme der Glukose (%) im Serum von db/db Mäusen. -
8 – Änderung der Glukose im Nüchternserum (FPG = fasting plasma glukose) (±SEM) während der Metformin und Troglitazon Monotherapie und während der Metformin und Troglitazon Kombinationstherapie. -
9 – Änderung bezüglich FPG und der post-prandialen Glukose (PPG) (±SEM) nach 3 Monaten Metformin und Troglitazon Monotherapie. -
10 – (A) Mittlere prozentuale Änderung bezüglich der endogenen Glukoseproduktion (EGP) nach 3 Monaten Metformin und Troglitazon Monotherapie. (B) Mittlere prozentuale Änderung bezüglich der Glukoseabsenkungsraten (GDR = glucose disposal rate) unter hyperinsulinämischen Clamp-Konditionen (hyperinsulinemic clamp condition) nach 3 Monaten Monotherapie mit Metformin und Troglitazon. -
11 – Änderungen der FPG und der PPG nach 3 Monaten Metformin und Troglitazon Monotherapie und nach 3 weiteren Monaten Kombinationstherapie (Metformin und Troglitazon). -
12 – Änderung bezüglich des Hämoglobin A1c (HbA1c) (±SEM) während 3 Monaten Metformin und Troglitazon Monotherapie und nach 3 weiteren Monaten Kombinationstherapie (Metformin und Troglitazon). - AUSFÜHRLICHE BESCHREIBUNG DER ERFINDUNG
- Die Erfindung legt eine pharmazeutische Zubereitung vor, umfassend ein antidiabetisch wirksames Glitazon und einen antidiabetisch wirksamen Sulfonylharnstoff und einen allgemein gebräuchlichen pharmazeutischen Hilfs- oder Trägerstoff, dadurch charakterisiert, dass das antidiabetisch wirksame Glitazon Troglitazon bedeutet und der antidiabetisch wirksame Sulfonylharnstoff Glyburid bedeutet, eine pharmazeutische Zubereitung, umfassend ein antidiabetisch wirksames Glitazon und ein antidiabetisch wirksames Biguanid und einen allgemein gebräuchlichen pharmazeutischen Hilfs- oder Trägerstoff, dadurch charakterisiert, dass das antidiabetisch wirksame Glitazon Troglitazon bedeutet, den Gebrauch einer Kombination aus einem Glitazon und einem Sulfonylharnstoff zur Herstellung einer pharmazeutischen Zubereitung für die Diabetesbehandlung und zur Verbesserung der glykämischen Kontrolle bei solchen Patienten, die eine solche Behandlung benötigen, dadurch charakterisiert, dass das Glitazon Troglitazon bedeutet und der Sulfonylharnstoff Glyburid bedeutet und den Gebrauch einer Kombination umfassend ein Glitazon und ein Biguanid zur Herstellung einer pharmazeutischen Zubereitung für die Diabetesbehandlung und zur Verbesserung der glykämischen Kontrolle bei solchen Patienten, die eine solche Behandlung benötigen, dadurch charakterisiert, dass das Glitazon Troglitazon ist.
- Die Verbindungen können individuell verwendet werden oder sie können in einer einzigen Formulierung in Kombination vorhanden sein, beispielsweise als Tablette, Kapsel, Sirup, Lösung ebenso wie in Formulierungen mit verzögerter Freisetzung. Bei einem bevorzugten Ausführungsbeispiel werden der Sulfonylharnstoff das Biguanid und das Glitazon individuell formuliert und in der gleichen Weise verabreicht wie dies klinisch üblicherweise praktiziert wird.
- Die Dosis eines jeden Wirkstoffes wird unterschiedlich sein und zwar abhängig von der Schwere der Krankheit, der Häufigkeit der Verordnung, den speziellen Wirkstoffen und den verwendeten Kombinationen sowie von anderen Faktoren, die routinemäßig vom betreuenden praktischen Arzt in Betracht gezogen werden. Der Sulfonylharnstoff wird normalerweise in Tagesdosen von ungefähr 0,25 mg bis zu ungefähr 500 mg verabreicht, typisch sind etwa 3 mg bis etwa 250 mg. Eine zum Beispiel für Glyburid typische Dosis ist ungefähr 10 mg bis ungefähr 20 mg täglich. Die Glitazone werden normalerweise in Tagesdosen von ungefähr 5 mg bis ungefähr 2500 mg verabreicht, noch typischer ist von etwa 50 mg bis etwa 1500 mg pro Tag. Ein bevorzugtes Glitazon ist Troglitazon und es wird in Tagesdosen von ungefähr 100 mg bis ungefähr 1000 mg angewandt. Ein weiteres bevorzugtes Glitazon ist Rosiglitazon (BRL 49653) und es wird in Tagesdosen von ungefähr 5 mg bis ungefähr 10 mg angewandt. Ein anderes, bevorzugtes Glitazon ist Pioglitazon und es wird in Tagesdosen von ungefähr 50 mg bis ungefähr 200 mg angewandt. Metforminhydrochlorid wird in Tagesdosen von ungefähr 300 mg bis ungefähr 2000 mg verabreicht. Es ist n im Handel in Form von Tabletten erhältlich, die 500 mg und 850 mg des Wirkstoffes enthalten. Diese können bis zu zweimal oder mehrfach täglich gegeben werden.
- Typische Kombinationen, die gemäß dieser Erfindung verwendet werden, umfassen folglich Troglitazon plus Metformin und Troglitazon plus Metformin plus Glyburid.
- Diese Kombinationen erzeugen eine bessere NIDDM-Kontrolle als erwartet. Falls Glyburid und Troglitazon zusammen formuliert werden, enthalten die Zubereitungen ungefähr ein bis etwa 1000 Gewichtsanteile Sulfonylharnstoff und etwa 1000 bis etwa einem Gewichtsanteil Glitazon. Zum Beispiel enthält eine typische Zubereitung von Glyburid und Troglitazon etwa 12 mg Glyburid und etwa 500 mg Troglitazon. Eine solche Kombination wird dem erwachsenen Patienten etwa einmal täglich verabreicht, um die gewünschte glykämische Kontrolle zu erreichen. Metformin kann mit Troglitazon direkt kombiniert werden. Typische Dosen sind ungefähr 500 mg für Metformin und ungefähr 300 bis 600 mg Troglitazon. Eine typische Dreierkombination umfasst 12 mg Glyburid, 400 mg Troglitazon und 500 mg Metformin.
- Die Zubereitungen können Hilfs- und Trägerstoffe wie Stärke, Saccharose, Talkum, Gelatine, Methylcellulose und Magnesiumstearat enthalten. Die Zubereitungen werden üblicherweise für die orale Einnahme hergestellt, beispielsweise als Tabletten oder Kapseln, sie können aber auch in Form wässriger Suspensionen oder als Lösungen, als Suppositorien, als langsam freisetzende Formen, zum Beispiel unter Verwendung einer osmotischen Pumpe, eines Hautpflasters oder Ähnlichem vorliegen.
- Der Nutzen einer der durch diese Erfindung einer pharmazeutischen Zubereitung zur Diabetesbehandlung vorgelegten Kombination wurde in einer klinischen Langzeitkontrolle-Studie ermittelt. Eine typische Studie bestimmte die Wirksamkeit und die Arzneimittelsicherheit von Troglitazon alleine und in Kombination mit dem Sulfonylharnstoff Glyburid zur Behandlung des nicht insulinabhängigen Diabetes Mellitus (NIDDM = non insulin-dependent diabetes mellitus). Diese Studie zielte auf das Segment der NIDDM-Population, bei der die Krankheit zu einem Punkt fortgeschritten war, wo maximale Dosisgaben an Sulfonylharnstoff keine entsprechende glykämische Kontrolle mehr herstellen konnten. Diese Patienten sind in einem Stadium, wo die maximale Stimulation der Insulinsekretion in der Pankreas mit der steigenden Nachfrage nicht Schritt hält. Da bei dieser Population die nichtstimulierte (Abwesenheit von Sulfonylharnstoff) sekretorische Kapazität der Betazellen sehr niedrig ist, wäre die Umkehr der Insulinresistenz alleine nur von teilweisem Nutzen. Daher kann die Aufrechterhaltung eines Grades stimulierter Insulinsekretion mittels Sulfonylharnstoff bei gleichzeitigem Zusatz von Troglitazon zur Verbesserung der Insulinsensibilität einen Grad glykämischer Kontrolle liefern, der bei jedweder Einzelmedikation unerreichbar ist.
- Ein Hauptziel der Studie war es, die Wirksamkeit von Troglitazon alleine oder in Kombination mit mikronisiertem Glyburid bei Patienten mit NIDDM zu überprüfen, wobei die Veränderungen in den Markern der glykämischen und lipiden Homeostasis über ein Jahr Behandlungszeit vergleichend untersucht wurden. Die Langzeitarzneimittelsicherheit war ebenfalls ein Ziel dieser Studie, was anhand von Nebenwirkungen und klinischer Labordaten ermittelt wurde.
- In einer Untergruppe der Patienten wurde die Auswirkung der Behandlung auf das Verhaltensmuster der post-prandialen Glukosetoleranz bestimmt (2-Stunden-Standardtest zur Verträglichkeit von Mahlzeiten). Zusätzlich wurden bei einer Patientenuntergruppe die Masse und die Funktion des Herzens (echokardiographisches Verfahren) überprüft.
- Basierend auf dieser Studie hat die U.S. Food and Drug Administration nun die Verwendung von Troglitazon in Kombination mit Sulfonylharnstoffen für die Behandlung von Typ-II-Diabetes zugelassen. Troglitazon wird nun klinisch routinemäßig in Kombination mit Sulfonylharnstoffen, insbesondere mit Glyburid verwendet. Untenstehend wird eine kurze Zusammenfassung der 12-Monatsergebnisse einer 30 Zentren umfassenden klinischen Prüfstudie an 552 Patienten erläutert.
- Überblick
- Die Troglitazon Monotherapie und die Troglitazon/Glyburid Kombinationstherapie wurden während der gesamten Studie gut vertragen. Insgesamt zeigten sich bei 70% der Troglitazon-Monotherapie-Patienten Nebenwirkungen, verglichen mit 90% bei Patienten, die mit der Glyburid-(Kontrolle)-Therapie behandelt wurden. Patienten, die mit der Kombinationstherapie behandelt wurden, zeigten bezüglich der Nebenwirkungen eine ähnliche Anfallsrate wie bei der Glyburid-Therapie: 91%. In welchem Umfang die hohe Ausfallrate bei der Troglitazon-Therapie das Auftreten von Nebenwirkungen beeinflusst hat, ist nicht bekannt.
- Im Allgemeinen war das Auftreten von Nebenwirkungen nicht vom Alter oder vom Status der Menopause beeinflusst. Insgesamt hatten die Patienten, die mit der Kombinationstherapie behandelt wurden, eine höhere Anfallsrate an zugehörigen Nebenwirkungen (26%) im Vergleich mit jenen, die mit Glyburid behandelt wurden (10%).
- Das Auftreten schwerer Nebenwirkungen war bei allen Behandlungsarten ähnlich; die infolge von Nebenwirkungen aus der Studie herausgenommen Patienten war mit 8% über alle Behandlungsarten verteilt.
- Klinische Labormessungen
- Änderungen von der Basislinie bis außerhalb des Normalbereiches
- Zur Erkennung ungewöhnlicher Trends wurden die Basislinienparameter der klinischen Labordaten mit den Werten am Ende der Studie (letzte Visite) verglichen. Der Prozentanteil der Patienten mit ansteigenden oder abfallenden Laborwerten wurde basierend auf der Anzahl der Patienten berechnet, die Gefahr liefen, dass die Veränderungen außerhalb des Referenzbereiches lagen; das heißt Patienten mit niedrigen oder hohen Basislinienwerten wurden im Hinblick auf einen Abfall oder beziehungsweise einen Anstieg nicht als gefährdet eingestuft.
- Einen Trend bezüglich der klinischen Nebenwirkungen wurden bei keinem der Laborparameter beobachtet. Dennoch ergab sich offensichtlich eine für alle Kombinations-Therapiegruppen eine drastische Verbesserung (das heißt Absenkung) bezüglich der im Urin gemessenen Glukosewerte.
- Klinisch relevante Veränderungen
- Die Richtlinien zur Auswertung klinischer Labordaten wurden herangezogen, um solche Patienten zu identifizieren, die bezüglich des einen oder anderen Laborwertes eine klinisch relevante Veränderung erkennen ließen und zwar zu jedem Zeitpunkt der Studie. Für diese speziellen Patienten wurden die Laborwerte dann überprüft, um herauszufinden, welche Patienten klinisch relevante Veränderungen bezüglich eines vorgegebenen Laborparameters aufwiesen. Kleinere Änderungen bezüglich eines jeden Laborparameters traten über alle Behandlungsarten hinweg auf.
- Unten werden solche Patienten diskutiert, die die Kriterien relevanter Veränderungen erfüllten. Eine größere Anzahl von Patienten, die mit der Troglitazon-Kombinationstherapie behandelt worden waren, anders als jene der Troglizaon-Monotherapie, wiesen Veränderungen auf, die aussagekräftige klinische Kriterien bezüglich einer Veränderung erfüllten. Ein Patient hatte signifikant erhöhte ALT- und AST-Werte, was vom Studienleiter dem Wirkstoff der Studie zugesprochen wurde und was kausal nicht mit Sicherheit ausgeschlossen werden kann: Patient 4, bei Zentrum 16 zeigte signifikant erhöhte ALT- (1155 U/L) und AST-Werte (458 U/L) nach 57 Tagen einer 600 mg Troglitazon-Kombinationstherapie und erhaltenem Grippeimpfstoff. 49 Tage nach Absetzen der Therapie kehrte der ALT- und der AST-Wert in den Bereich der Basislinienwerte zurück.
- Spezifische Laborparameter
- Hämatologie: Bei jedem der hämatologischen Parameter traten nur minimale Veränderungen auf. Veränderungen, die die Kriterien für eine mögliche klinische Relevanz erfüllten, waren Anstiege und Abfälle innerhalb des normalen Rahmens oder vorübergehende Veränderungen, die sich in der Folge zurückbildeten. Patienten mit klinisch relevanten Veränderungen bezüglich der hämatologischen Parameter wurden hier nicht beobachtet. 34 Patienten zeigten Veränderungen der Hämoglobin- oder Hämatokritwerte oder beides, was die Kriterien einer klinisch aussagekräftigen Veränderung erfüllten. Sieben Patienten hatten milde, vorübergehende Abfälle, die auf Basislinienniveau zurückkehrten wobei die Troglitazon- (3 Patienten, zwei auf 400 mg, einer auf 600 mg) oder die Troglitazon-Kombinationsbehandlung (4 Patienten, drei auf 400 mg/12 mg, einen auf 600 mg/12 mg) beibehalten wurde. Acht Patienten hatten leichte Abfälle innerhalb des Normalbereiches oder lagen am unteren Limit der Basislinie und fielen während der Studie unterhalb der normalen Limits, wobei die der Hämoglobin- oder Hämatokritbereiche innerhalb der Studie stabil blieben. Acht Patienten hatten bezüglich des Basislinienwertes Werte unterhalb des normalen Referenzlimits für Hämoglobin- oder Hämatokrit und blieben während der gesamten Studie unterhalb der normalen Limits und wurden aus diesem Grunde auch nicht aus der Studie herausgenommen. Vierzehn Patienten hatten verminderte Hämoglobin- und Hämatokritwerte als Folge eines Blutverlustes aus verschiedenen Gründen, zum Beispiel eine akute Blutung infolge eines Autounfalls, rektale Blutung in Folge von Hämorriden, Blutspende, blutendes Geschwür (2 Patienten), eine CABG Operation (2 Patienten). Zwei dieser Patienten nahmen bis zu 50 Medikamente ein und zwei weitere Patienten hatten schwere Infektionen begleitet von zeitweise verringerten Hämoglobin- und Hämatokritwerten. Nach gründlicher Durchsicht der Labordaten der Patienten zeigte sich, dass keinem Patienten bei irgendeinem der hämatologischen Parameter eine klinisch relevante Absenkung widerfuhr, die eindeutig auf Troglitazon zurückgeführt werden konnte.
- Leberenzyme: Dreizehn Patienten hatten klinisch relevante erhöhte ALT-, AST-Werte oder beides. Drei Patienten wurden aufgrund der erhöhten Leberenzymwerte aus der Studie herausgenommen; bei allen erfolgte die Rückkehr der Enzymwerte zu entweder den Basislinienwerten oder sie lagen innerhalb der normalen Grenzbereiche. Vier weitere Patienten hatten vorübergehende Erhöhungen, die während der fortgesetzten Troglitazon- oder der Troglitazon-Kombinationstherapie zurückgingen. Zwei Patienten der 600 mg Troglitazonkombinationsgruppe, drei der 300 mg Troglitazonkombinationsgruppe und ein Patient der 200 mg – Troglitazon-Monotheraphie hatten am Ende der Studie leicht erhöhte Werte (< 3 × oberer normaler Grenzbereich). Drei dieser Patienten nahmen gleichzeitig zahlreiche andere Medikamente für bestehende Erkrankungen ein, was somit nicht als kausaler oder zusätzlicher Beitrag bezüglich der erhöhten Enzymwerte ausgeschlossen werden kann.
- DISKUSSION
- Obwohl Troglitazon die Insulinwirkung im zellularen Bereich verbessert, stimuliert es weder die Insulinfreisetzung noch imitiert es dessen Wirkung. Die therapeutischen Vorteile der Troglitazonbehandlung hängen von der Verfügbarkeit adäquater Mengen Insulin ab. Die zusätzliche Gabe von Troglitazon zu der bestehenden Sulfonylharnstoffbehandlung liefert eine Ausgewogenheit von stimulierter Insulinfreisetzung bei gleichzeitiger Verbesserung der Insulinresistenz. Die in dieser Studie erzielten Ergebnisse unterstützen diese Hypothese und liefern den Nachweis einer signifikanten Verbesserung der glykämischen Kontrolle bei solchen Patienten, bei denen nur sehr wenige therapeutische Möglichkeiten übrigbleiben.
- Glykämische Parameter
- Die hauptsächliche Veränderung der Basislinie des FSG für den 600T/12G-Studienzweig betrug –56 mg/dl, was eine Differenz von –79 mg/dl bezüglich des Kontroll- Studienzweigs darstellt. Die Verbesserung des FSG wird durch eine mittlere Veränderung der Basislinie des HbA1c-Wertes von –1,75% im selben Behandlungsstudienzweig bestätigt, was eine Differenz von –2,65% des aktiven Kontroll-Studienzweigs darstellt. Ungefähr 60% der Patienten im 600T/12G-Studienzweig erreichten einen HbA1c-Bereich von ≤ 8%. Die Größe dieser Veränderungen stellen eine eindrucksvolle Verbesserung der glykämischen Kontrolle dar und dies ohne die Zuführung von Insulin von außen. Obwohl die glykämischen Verbesserungen in den 400T/12G und den 200T/12G Studienzweigen weniger deutlich ausgefallen sind, liefern diese Daten die Begründung für die Titration, die auf dem Grad der glykämischen Kontrolle basiert. Andererseits sollten die Ergebnisse des Troglitazon-Monotherapie-Studienzweigs sorgfältig interpretiert werden. Im Hinblick auf die langsam wirkenden Eigenschaften des Troglitazons würde ein rascher Wechsel von Sulfonylharnstoff zu Troglitazon, noch bevor eine Verbesserung beobachtet wird, eine Verminderung der glykämischen Kontrolle verursachen. Mehr noch, der unmittelbare Wechsel würde bei Patienten, die ohnehin schon schlecht kontrollierbar sind, den Grad der Glukosetoxizität verschlimmern und eine adäquate glykämische Kontrolle sogar noch deutlich erschweren. Jene Patienten wurden von der maximalen Glyburiddosis zum Zeitpunkt der Randomisierung auf die Troglitazon-Monotherapie umgestellt. Infolgedessen verschlechterte sich die glykämische Kontrolle in der Mehrzahl der Patienten und Patienten mit exzessiver Überzuckerung mussten aus Sicherheitsgründen aus der Studie genommen werden. Entsprechend der Natur der ITT-Analyse mittels LOCF, der mittleren Änderung bei FSG und bei HbA1c, spiegeln sich die hohen glykämischen Werte der Patienten wider, die frühzeitig die Studie abbrachen. Mit anderen Worten, je höher die anfängliche Studienabbruchrate war, desto schlechter erscheinen die Studienergebnisse am Ende. Dies ist besonders bei dem T200-Studienzweig der Fall, da infolge mangelnder Wirksamkeit die Studienausfallrate nahezu 60% erreichte. Daher geben die Ergebnisse der ITT-Analyse in diesem Fall kein gutes Abbild der wahren Responses aller Patienten. Andererseits sind die Ergebnisse der Patienten, die die Studie beendeten, für Troglitazon tendenziell günstig. Die Analyse der Patienten, die die Studie abgeschlossen haben, würde wohl die Sub-Population wirksam herausfiltern, die auf die Studienmedikation besser angesprochen hat. Die wahren Responses dieser Behandlungsstudienzweige wird wohl eher zwischen den Ergebnissen der ITT-Population und derjenigen der Studienabschlussgruppen liegen. Wie auch immer, die klinische Interpretation dieser Daten zeigt, dass der Wechsel der Patienten vom Gebrauch des Sulfonylharnstoffes zur Troglitazon-Monotherapie, insbesondere bei jenen, die hohe Dosen benötigen, kein therapeutisch sinnvoller Ansatz ist.
- Troglitazon sollte anfangs mit 200 mg und bis auf 600 mg ansteigend zu der derzeitigen Sulfonylharnstoff-Behandlung je nach Bedarf zur Optimierung der glykämischen Kontrolle, zudosiert werden. So wie die Patienten die Ziele der glykämischen Kontrolle erreicht haben, sollte die Dosisgabe des Sulfonylharnstoffes je nach Grad der glykämischen Kontrolle reduziert oder sogar eliminiert werden. Deshalb wird bei diesen Patienten (negative Ergebnisse bei Sulfonylharnstoffgabe) die Troglitazon-Monotherapie nur angewandt, falls dies aufgrund der glykämischen Kontrollparameter als sicher vorgegeben erscheint. Gegenüber der Alternative, die Dosis eines der Wirkstoffe zu reduzieren, sollte die Pathophysiologie der Erkrankung in Betracht gezogen werden. Die Behandlung der fundamentalen Ursache des Typ-2 Diabetes, das heißt, der Insulinresistenz, sollte Vorrang haben vor der die infolge Stimulation durch Sulfonylharnstoff Pankreas erschöpfende Insulinausschüttung. Daher sollte mit verbesserter glykämischer Kontrolle die Sulfonylharnstoffdosis verringert oder, falls angezeigt, ganz beendet werden. Troglitazon alleine kann in naiven Patienten wirksam eingesetzt werden, die bezüglich Diät und Bewegung nicht gut eingestellt sind und noch nicht mit oralen Wirkstoffen behandelt wurden. Das Defizit der sekretorischen Insulinkapazität bei naiven Patienten ist im Allgemeinen relativ und die Verbesserung der Insulinempfindlichkeit kann ausreichen, den Glukosenormalbereich wiedereinzustellen.
- Insulin-, C-Peptid- und Mahlzeitverträglichkeitstest
- Die beobachtete Reduktion an Insulin im Kombinationsbehandlungsstudienzweig wiederspiegelt eine Verbesserung der Insulinempfindlichkeit, da der Insulinpegel eher mit signifikanten Absenkungen bei den FSG- und HbA1c-Werten einhergeht als mit Anstiegen. Die Richtung der Änderung des Nüchterninsulinspiegels und des Nüchternglukosewertes widerspiegelt sich in ähnlichen Veränderungen während des Mahlzeittoleranztests für die Kombinationsstudienzweige im AUC des Insulins und der Serumglukose. Die verbesserte Insulinempfindlichkeit führt zu einer verminderten Anforderung bezüglich der Insulinausschüttung in der Pankreas, was ein wünschenswertes Ergebnis darstellt, wenn man das natürliche Fortschreiten der Erkrankung betrachtet.
- Das Ausmaß der Insulinreduktion in den Monotherapiestudienzweigen ist größer als jenes, das bei den zahlreichen Kombinationsstudienzweigen beobachtet wurde. Während, basierend auf der erhöhten Insulinaktivität, eine ähnliche Reduktion zwischen den Monotherapie- und den Kombinationsbehandlungsstudienzweigen zu erwarten gewesen ist, kann der zusätzliche Abfall der Insulinspiegel dem Ausbleiben der sulfonylharnstoff stimulierten Insulinsekretion zugeordnet werden. Schließlich kann die im Kontrollstudienzweig (mikronisiertes Glyburid) beobachtete Reduktion dem graduellen Abbau der sekretorischen Funktion der Pankreas zugeordnet werden oder einem Sekundärdefekt, wie er üblicherweise bei einer Sulfonylharnstoffbehandlung über die Zeit beobachtet wird. Diese Veränderung kann nicht den Verbesserungen der Insulinaktivität zugeordnet werden, da die FSG-Spiegel ansteigen und nicht abfallen. Die beobachteten Veränderungen der Insulinspiegel sind in Übereinstimmung mit ähnlichen Veränderungen bei C-Peptid-Spiegeln bei allen Behandlungsstudienzweigen sowohl in der Richtung als auch im Ausmaß.
- Blutfettwerte
- Die klassischen Manifestationen der Insulinresistenz einer diabetischen Population zeigen sich in erhöhten Triglyzeridwerten und niedrigen HDL-Spiegeln. Daher sollte man bei Umkehr der Insulinresistenz erwarten, dass günstige Veränderungen bei diesen Blutfettwerten anfallen, wie dies auch in dieser Studie beobachtet wurde. Obgleich die statistische Signifikanz in einigen Behandlungsstudienzweigen (aber nicht in allen) erreicht wurde, ist der generelle Trend der Veränderungen im Einklang mit der Umkehr der Insulinresistenz, das heißt, dass eine Reduktion der Triglyzeride und ein Anstieg des HDL-Wertes erreicht wurden. Die Reduktion der Insulinspiegel und in der Folge der Anstieg der Aktivität der Liprotein Lipase (LPL) kann für die Veränderungen bei den Triglyzeriden und dem HDL-Wert verantwortlich sein. Geringe Anstiege mit minimaler klinischer Signifikanz bezüglich Gesamtcholesterol und LDL wurden bei den Monotherapiestudienzweigen beobachtet. Ähnliche, wenn auch weniger ausgeprägte Veränderungen wurden bei den Kombinationsstudienzweigen beobachtet. Es ist wichtig darauf hinzuweisen, dass die LDL-Werte direkt bestimmt worden sind und nicht indirekt aus den Triglyzeriden und den Cholesterolwerten mit Hilfe der Freidwaldformel berechnet wurden. LDL und Cholesterol sind beide relativ konstante Parameter und werden nicht vom Nüchternzustand des Patienten beeinflusst. Triglyzeride hingegen sind extrem variabel und werden vom Nüchternzustand des Patienten beeinflusst. Diese Variabilität kann die Tatsache erklären, dass eine klinisch wünschenswerte Reduktion über 50 mg/dl hinaus, wie sie bei der T600/12G-Gruppe beobachtet wurde, keine statistische Signifikanz erreichte. Im Gegenteil, das Ausmaß der Veränderung bei Cholesterol und LDL war bei beiden von geringer klinischer Signifikanz (nur 4%–7% in den Kombinationsbehandlungsstudienzweigen), es war jedoch statistisch signifikant.
- Die Veränderungen bei den Lipiden in dieser Studie sind konsistent mit den Ergebnissen vorhergehender Studien. Die günstige Änderung bei den Triglyzeriden, dem HDL und dem FFA steht im Gegensatz zu den minimalen Anstiegen des Gesamtcholesterols, des LDL, des Lp (a) und dem unveränderten Apo (A1) und Apo (B). Alles zusammengenommen können diese Veränderungen dahingehend interpretiert werden, als dass sie einen potentiell günstigen Einfluss auf ein arterielles Risiko ausüben. Es muss festgehalten werden, dass Patienten mit erhöhten Triglyzeridspiegeln aus einer Troglitazonbehandlung einen wesentlichen Nutzen ziehen können und synergetisch zum Umgang mit ihrer Dyslipidämie beitragen, da erhöhte Triglyzeridspiegel als unabhängiger Risikofaktor für cardiovaskuläre Erkrankungen gelten.
- Blutdruck
- Am Ende der Studie wurden keine statistisch oder klinisch signifikanten Veränderungen des systolischen Blutdruckes beobachtet. Dennoch fiel bei Patienten, die mit der 600 mg/12 mg Kombinationstherapie behandelt wurden, der mittlere diastolische Blutdruck signifikant ab (p < 0,05). Eine Verringerung des diastolischen Blutdruckes (DBD) ist konsistent mit einer ähnlichen Beobachtung in anderen Troglitazonstudien. Die Richtung und das Ausmaß der Veränderung des DBD ermöglichen bei dieser Population einen klinisch wünschenswerten Endpunkt. Aufgrund des Umstandes, dass Bluthochdruckpatienten von dieser Studie ausgeschlossen wurden, würde man nur geringe Veränderungen erwarten. Da diese Studie nicht darauf abzielte, kleine Veränderungen des Blutdruckes zu erfassen, weist die Richtung der Veränderung dennoch auf eine wünschenswerte Veränderung bei dieser Population hin. Bei der Patientenuntergruppe, die im Rahmen dieser Studie Herzleistungsprüfungen unterzogen wurden, wird die Reduktion des diastolischen BD durch den Abfall im berechneten peripheren Widerstand untermauert. Diese Veränderung des Blutdruckes könnte indirekt aus der umgekehrten Insulinresistenz und der Verbesserung bei der Hyperinsulinämie herrühren, oder alternativ, auf eine direkte Wirkung des Troglitazon auf die periphere Vaskulatur zurückzuführen sein.
- Gewicht
- Bei den Kombinationsstudienzweigen wurde ein statistisch signifikanter Anstieg des Körpergewichts beobachtet, im Gegensatz zu den Monotherapiestudienzweigen, bei denen bescheidene Gewichtsverluste von 1 bis 7 Pfund gesehen werden konnten. Während das Ausmaß der Veränderung relativ klein (ungefähr 6%) ausfiel, sollten Anstiege im Gewicht bei dieser Population sorgfältig registriert werden. Die Tatsache, dass Gewichtsanstiege ausschließlich in der Kombinationstherapie und nicht in der Monotherapie beobachtet wurden, deutet auf andere Faktoren als auf Troglitazon hin, die für den Gewichtsanstieg verantwortlich sind. In dieser Studie dürften verschiedene Faktoren zur Gewichtszunahme beigetragen haben. Die Tatsache, dass die Gewichtszunahme hauptsächlich bei den Behandlungsstudienzweigen im Zusammenhang mit verbesserter glykämischer Kontrolle beobachtet wurde, lässt vermuten, dass die verminderte Glukose im Blut wohl zur Gewichtszunahme beigetragen hat. Der Gewichtsanstieg kann möglicherweise das Ergebnis einer Vervielfachung des bei der Sulfonylharnstofftherapie bekannten Gewichtszunahmeeffektes sein. Zusätzlich wurden die Patienten dieser Studie angewiesen, für die Dauer der Studie eine Diät zur Aufrechterhaltung ihres Gewichtes durchzuführen. Zeckdienliche diabetische Diätvorschriften mit dem Ziel eines idealen Körpergewichtes wurden für diese Studie nicht verlangt. Schließlich sind der strikte Kalorienhaushalt und die Zuckeraufnahme mit dem Ziel der Verbesserung der Überzuckerung und das Erreichen der glykämischen Kontrolle für diese Population eine Entmutigung. In der klinischen Praxis sollte allerdings auf die Diät und deren Anwendung großen Wert gelegt werden, um erhebliche Gewichtszunahme zu vermeiden.
- Arzneimittelsicherheit
- Troglitazon wurde in beiden Therapiearten, der Mono- und der Kombinationstherapie während der gesamten Studiendauer gut vertragen. Insgesamt war das Nebenwirkungsprofil der Troglitazon/Glyburid-Kombinationstherapie ähnlich dem Nebenwirkungsprofil der Troglitazon-Monotherapie. Die meisten Nebenwirkungen mit den geringeren Vorfällen traten im Vergleich zu den mit der Glyburid-Monotherapie behandelten Patienten bei den Patienten auf, die mit der Troglitazon-Monotherapie behandelt wurden. Dies kann dem besseren Nebenwirkungsprofil des Troglitazons zugeschrieben werden und kann teilweise auch durch die hohe Ausfallrate der Patienten, die mit der Troglitazon-Monotherapie behandelt wurden, verursacht sein. Verträglichkeit war auch dadurch offensichtlich, dass in nur wenigen Fällen inakzeptable Werte für die klinischen Laborparameter auftraten; die meisten dieser Fälle klärten sich während der fortgesetzten Behandlung im Rahmen der Studie.
- Zusammenfassung
- Zusammenfassend kann gesagt werden, dass Patienten mit Typ 2-Diabetes, die maximale Sulfonylharnstoffdosierungen verabreicht bekommen, nur sehr wenige orale therapeutische Alternativen zur Verfügung haben. Neben der Insulinresistenz ist das Kennzeichen der Erkrankung in diesem Stadium hauptsächlich eine verminderte Reaktion der Pankreas auf die Stimulanz der Glukose. Die Verbesserung der Insulinrestistenz ist von großem Vorteil, wenn sie zusätzlich zu einer laufenden Medikation hinzukommt, die in der Lage ist, die Insulinfreisetzung zu stimulieren (zum Beispiel Sulfonylharnstoff). Die Kombinationstherapie von Troglitazon und Glyburid scheint sicher und gut verträglich zu sein und kann folglich die glykämische Kontrolle signifikant verbessern. Es muss festgestellt werden, dass Patienten, die maximale Dosen an Sulfonylharnstoff erhalten, nicht auf die Troglitazon-Monotherapie umgestellt werden sollten. Monotherapie sollte nur dann angewandt werden, falls dies bei der Abwärtsdosiseinstellung bei Sulfonylharnstoffgaben angezeigt ist. Schließlich sollte die Anwendung der Ergebnisse dieser Studie nicht auf Patienten beschränkt werden, die auf Maximaldosen bei der Sulfonylharnstofftherapie nicht ansprechen, sondern sollte auch auf Patienten mit geringeren Sulfonylharnstoffdosen ausgedehnt werden.
- SCHLUSSFOLGERUNGEN
- Die Troglitazon/Glyburid-Kombinationstherapie ist gut verträglich und verbessert, verglichen mit der Glyburid-Monotherapie bei Patienten mit NIDDM, die mittels der Sulfonylharnstofftherapie nicht adäquat kontrolliert werden können, die glykämische Kontrolle bei Dosisgaben von 200 mg/12 mg bis 600 mg/12 mg über einen Zeitraum von 52 Wochen, signifikant (p < 0,0001).
- In einem klinischen Versuch wurden Patienten 3 Monate lang mit einer Metformin- oder Troglitazon-Monotherapie, gefolgt von einer dreimonatigen Kombinationstherapie, behandelt. 29 Patienten, die als NIDDM aufweisend diagnostiziert wurden, wurden randomisiert. 15 Testpersonen erhielten die Metformin-Monotherapie und zwar 1000 mg orale Gabe, zweimal täglich über einen Zeitraum von 3 Monaten. Eine Gruppe von 14 Testpersonen erhielt 3 Monate lang eine Tagesdosis von 400 mg Troglitazon. Ein Patient, der zur Troglitazongruppe randomisiert worden war, beendete seine Teilnahme nach 2 Wochen. Ein Patient jeder Gruppe beendete die 3-Monats-Monotherapiephase, schied jedoch vor dem Beginn der Kombinationstherapie aus. Zwei weitere Testpersonen, die ursprünglich in der Monotherapiegruppe waren, schieden später im Verlauf der Kombinationstherapie vor deren Ende aus. Die Basisliniendaten aller Testpersonen, die die 3-Monats-Monotherapiephase absolviert haben, sind in der untenstehenden Tabelle 5 aufgeführt:
- Die Patienten wurden bezüglich des Alters, des Körpermaßindex (body mass index = BMI), dem Nüchternglucoseplasma (fasting plasma glucose = FPG), dem HbA1C, dem Nüchterninsulin und den C-Peptiden gleichmäßig angepasst. Die Behandlungsgruppe war in der Regel korpulent, leicht diabetisch und hatte einen mittleren BMI von 33,5 Kg/m2, einen mittleren HbA1C (vor Studienbeginn) von 9,6% und einen mittleren FPG von 280 mg/dl.
- Nach der initialen 3-Monats-Monotherapie-Periode wurden die verbliebenen Testpersonen für eine weitere Periode von drei Monaten auf eine Kombinationsdosis von Metformin und Troglitazon eingestellt (1000 mg Metformin BID, 400 mg Troglitazon QD).
- Metformin und Troglitazon verursachten beide während der 3 Monate der Monotherapie einen 20% betragenden Abfall der Basisliniendaten von FPG von 58 mg/dl beziehungsweise 54 mg/dl (
8 ). Die HbA1C-Spiegel veränderten sich bei keinem der Wirkstoffe in signifikanter Weise. Mittlere post-prandiale Glukosewerte fielen bei beiden Gruppen um etwa 25% ab (Metformin 87 mg/dl, Troglitazon 83 mg/dl), wie in9 dargestellt ist. Die post-prandial zirkulierenden Insulin- und C-Peptid Abfälle waren von den Basisliniendaten beider Behandlungsgruppen signifikant verschieden. Im Anschluss an eine zwölfstündige Nüchternheitszeit wurden alle Testpersonen einem hyperinsulämischenglykämischen Clamp Assay unterzogen. Nach einer Behandlungsdauer von 3 Monaten fiel die EGP in der Metformingruppe (10A ) von 108 auf 87 mg/m2/min ab (18%), wohingegen Troglitazon keinen Einfluss auf das EGP hatte (10B ). Demgegenüber verursachte Metformin einen weniger als 27%-igen Anstieg der Glukoseabbaurate (glucose disposal rate = GDP) (240 bis 272 mg/m2/min) (10B ), wohingegen Troglitazon einen 97%igen Anstieg bewirkte (172 bis 265 mg/m2/min) (10B ). - Als den Patienten der Studie eine dreimonatige Kombination aus Metformin und Troglitazon verabreicht wurde, wurden drastische und unerwartete Wirkungen beobachtet. Nüchternglukoseplasmasiegel verringerten sich zusätzlich um 18% (41 mg/dl), wie in
8 dargestellt ist. Verglichen mit Basislinienwerten war der mittlere Abfall des FPG-Wertes bei allen Testpersonen über die gesamte sechsmonatige Prüfdauer 98 mg/dl oder 35%. Die Kombinationstherapie verursachte im Verlauf des Mahlzeittoleranztests bezüglich des Plasmaglukose-Wertes (PG) einen zusätzlichen Abfall von 21% oder 54 mg/dl (11 ). Während der gesamten 6-monatigen Behandlungszeit fiel der Gesamt-PG um 41% oder 140 mg/dl. Die HbA1C-Spiegel verringerten sich im Verlauf der Kombinationstherapie um 1,2% (12 ). - Die vorangegangene Studie verdeutlicht, dass die Kombination von Metformin und Troglitazon klinisch signifikant und unerwartet beides, den Nüchternzucker und den postpranialen Zucker im Vergleich zu jedem einzeln eingesetzten Wirkstoff weiterhin absenkt. Folglich liefert die im Zuge dieser Erfindung vorgelegte Kombination eine weitere Verbesserung der Glukosekontrolle ohne die Insulinsekretion zu stimulieren.
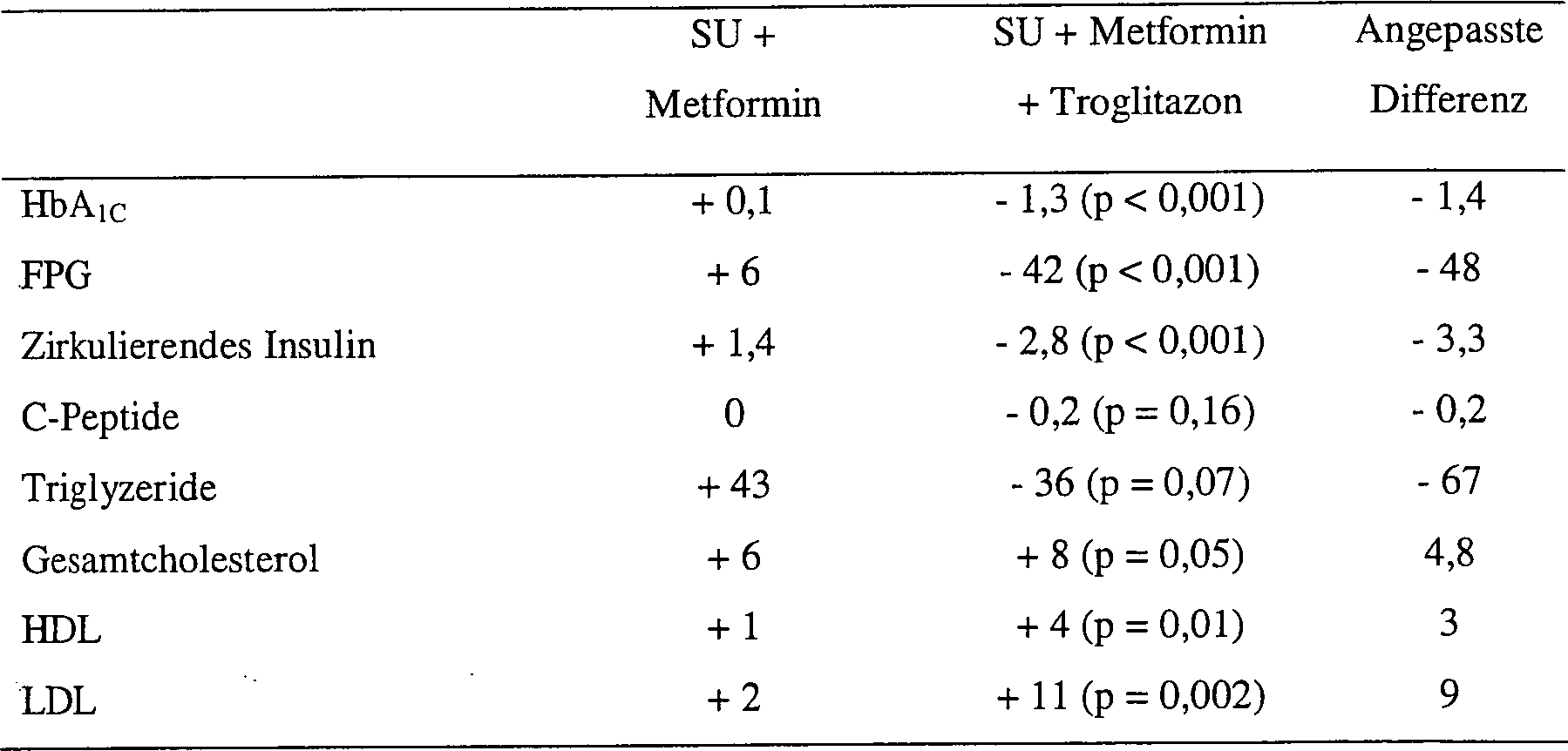
- Sofern die Dreierkombination aus Biguanid, Sulfonylharnstoff und Glitazon benutzt wird, sind die beobachteten klinischen Ergebnisse sogar noch überraschender. Es wurde eine klinische Prüfung durchgeführt, um die Wirkungen von Metformin, Glyburid und Troglitazon im Vergleich zu einer üblichen Glyburid- und Metforminbehandlung zu untersuchen. Es wurden 200 NIDDM Patienten in eine randomisierte, placebokontrollierte, doppelt verblindete Multizenterstudie eingebracht. Alle eingeschriebenen Patienten hatten eine beeinträchtigte glykämische Kontrolle und wurden zurzeit mit Sulfonylharnstoff behandelt (vergleichbare Dosisstärken von mindestens 20 mg Glyburid) und erhielten mindestens 1500 mg Metformin täglich. Von den eingeschriebenen 200 Patienten beendeten 178 den 24-Wochenversuch vollständig. Die Population der Studie bestand aus 57% Männer und 43% Frauen mit einem mittleren Alter von 59. Die Patienten hatten eine mittlere NIDDM-Dauer von 11,3 Jahren. Die Population hatte ein Durchschnittsgewicht von 85 Kg (187 Pfund) und ein BMI von 30,1 Kg/m2. Zu Beginn der Prüfung erhielten 101 Patienten eine orale Dosis von Troglitazon (400 mg einmal täglich), einen Sulfonylharnstoff (SU) und Metformin. Die Kontrollgruppe, bestehend aus 99 Testpersonen erhielt einen Sulfonylharnstoff und Metformin. Der primär gemessene Wirkungsparameter war HbA1C. Sekundäre Wirkungsparameter waren FSG, C-Peptide, Gesamtseruminsulin, BMI, Gewicht, Triglyzeride, Gesamtcholesterol (total cholesterol = TC), High-density Lipoprotein (HDL) und Low-density Lipoprotein (LDL). Zu Beginn der Studie waren Die glykämischen Basislinienstände: HbA1C: 9,7%, FDG: 234 mg/dl, zirkulierender Insulinspiegel: 14,4 μIN/ml, C-Peptid: 3,4 ng/ml. Die Ergebnisse der klinischen Studie nach 24-wöchiger Behandlung sind in Tabelle 6 dargestellt.
- In der vorangegangenen Studie waren bei der Gruppe, die die Dreifachkombination erhielt, die Glukoseplasmaspiegel nach Woche 8 um 42 mg/dl reduziert. Dies ist eine drastische und rasche Absenkung des FPG-Wertes, welches den unerwartet schnellen Beginn der Wirkung, die bei der Dreifachkombination erreicht wird und die Synergie im Zusammenhang mit Metformin, Sulfonylharnstoff und Glitazon aufzeigt. Dies bedeutet gute glykämische Kontrolle in der halben Zeit wie sie üblicherweise bei der medikamentösen Einstellung mit antidiabetisch wirksamen Stoffen bei der Monotherapie beobachtet wird oder sogar bei der Verwendung einer Kombination von Sulfonylharnstoff und Biguanid beobachtet werden. Die durch die Dreifachkombination verursachte drastische Reduktion an endogenem Insulin (19%) war ebenso überraschend. Mehr noch, während die Sulfonylharnstoff/Metformin-Kombination keinen Einfluss auf die C-Peptidspiegel hatte, bewirkte die Dreifachkombination aus Sulfonylharnstoff/Biguanid/Troglitazon eine 7-prozentige Reduktion. Gleichermaßen, während die mit Sulfonylharnstoff/Metformin behandelte Gruppe einen Anstieg bezüglich der Triglyzeride von 43 mg/dl verzeichnet, bewirkte die Sulfonylharnstoff/Biguanid/Troglitazon-Kombination eine Reduktion von 36 mg/dl.
- Die vorangegangene klinische Prüfung offenbart, dass die Dreifachkombination aus Glyburid/Biguanid/Troglitazon überraschenderweise bei der Reduktion des HbA1C-Wertes wirksam ist und eine sehr rasche und signifikante Verringerung des Plasmaglukosespiegels bewirkt. Solcherlei Kombinationen sind besonders gut geeignet, einen an NIDDM leidenden Patienten, der gefährliche hohe Plasmaglukosespiegel aufweist, rasch unter Kontrolle zu bringen. Ein anderer, wichtiger und wesentlicher Gesichtspunkt der vorangegangenen klinischen Prüfung ist die Tatsache, dass die Patienten nur sehr wenige Nebenwirkungen erfahren mussten und dass die Ausfallrate extrem gering war.
Claims (9)
- Eine pharmazeutische Zubereitung umfassend ein Glitazon-Antidiabetikum und ein Sulfonylharnstoff-Antidiabetikum und einen üblichen pharmazeutischen Hilfsstoff oder Trägerstoff, dadurch charakterisiert, dass das Glitazon-Antidiabetikum Troglitazon ist und das Sulfonylharnstoff-Antidiabetikum Glyburid ist.
- Eine Zubereitung gemäß Anspruch 1 umfassend Troglitazon und Glyburid in einer Dosierung von 200 mg/12 mg bis 600 mg/12 mg pro Tag.
- Eine Zubereitung gemäß Anspruch 1 oder 2 umfassend zusätzlich Metformin als Biguanid-Antidiabetikum.
- Eine pharmazeutische Zubereitung umfassend als einzige Wirksubstanz ein Glitazon-Antidiabetikum und ein Biguanid Antidiabetikum und einen üblichen pharmazeutischen Hilfsstoff oder Trägerstoff, dadurch charakterisiert, dass das Glitazon Antidiabetikum Troglitazon ist.
- Eine Zubereitung gemäß Anspruch 4 worin das Biguanid-Antidiabetikum Metformin ist.
- Die Verwendung der Kombination eines Glitazons und eines Sulfonylharnstoffes für eine pharmazeutische Zubereitung zur Behandlung von Diabetes, dadurch charakterisiert, dass das Glitazon Troglitazon ist und der Sulfonylharnstoff Glyburid ist.
- Die Anwendung von Anspruch zusätzlich umfassend Metformin als Biguanid.
- Die Verwendung einer Kombination umfassend als einzigen Wirkstoff ein Glitazon und ein Biguanid für die Herstellung einer pharmazeutischen Zubereitung zur Behandlung von Diabetes dadurch charakterisiert, dass das Glitazon Troglitazon ist.
- Die Anwendung von Anspruch 8 worin das Biguanid Metformin ist.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US189132 | 1998-11-09 | ||
| US09/189,132 US6011049A (en) | 1997-02-19 | 1998-11-09 | Combinations for diabetes |
| PCT/US1999/018140 WO2000027401A1 (en) | 1998-11-09 | 1999-08-11 | Combinations for diabetes which contain a sulfonylurea, a glitazone and a biguanide |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69925019D1 DE69925019D1 (de) | 2005-06-02 |
| DE69925019T2 true DE69925019T2 (de) | 2006-03-02 |
Family
ID=22696072
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69925019T Expired - Fee Related DE69925019T2 (de) | 1998-11-09 | 1999-08-11 | Kombinationen für diabetes welche glyburide, troglitazon (und ein biguanid) enthalten |
Country Status (20)
| Country | Link |
|---|---|
| US (1) | US6011049A (de) |
| EP (2) | EP1128834B1 (de) |
| JP (1) | JP2002529417A (de) |
| AR (1) | AR020973A1 (de) |
| AT (1) | ATE293980T1 (de) |
| AU (1) | AU5347399A (de) |
| CA (1) | CA2345524C (de) |
| CO (1) | CO5150152A1 (de) |
| CR (1) | CR6128A (de) |
| DE (1) | DE69925019T2 (de) |
| DK (1) | DK1128834T3 (de) |
| ES (1) | ES2241305T3 (de) |
| GT (1) | GT199900158A (de) |
| HN (1) | HN1999000184A (de) |
| PA (1) | PA8484901A1 (de) |
| PE (1) | PE20001235A1 (de) |
| PT (1) | PT1128834E (de) |
| SI (1) | SI1128834T1 (de) |
| UY (1) | UY25791A1 (de) |
| WO (1) | WO2000027401A1 (de) |
Families Citing this family (139)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI238064B (en) * | 1995-06-20 | 2005-08-21 | Takeda Chemical Industries Ltd | A pharmaceutical composition for prophylaxis and treatment of diabetes |
| US6291495B1 (en) * | 1997-02-24 | 2001-09-18 | Robert B. Rieveley | Method and composition for the treatment of diabetes |
| AU6452098A (en) | 1997-03-07 | 1998-09-22 | Metabasis Therapeutics, Inc. | Novel purine inhibitors of fructose-1,6-bisphosphatase |
| US6099859A (en) | 1998-03-20 | 2000-08-08 | Andrx Pharmaceuticals, Inc. | Controlled release oral tablet having a unitary core |
| US6099862A (en) * | 1998-08-31 | 2000-08-08 | Andrx Corporation | Oral dosage form for the controlled release of a biguanide and sulfonylurea |
| PL205184B1 (pl) | 1998-09-09 | 2010-03-31 | Metabasis Therapeutics Inc | Nowe heteroaromatyczne inhibitory 1,6-bisfosfatazy fruktozy, kompozycje farmaceutyczne zawierające te związki i ich zastosowanie |
| US20040081697A1 (en) * | 1998-11-12 | 2004-04-29 | Smithkline Beecham P.L.C. | Pharmaceutical composition for modified release of an insulin sensitiser and another antidiabetic agent |
| US20030153607A1 (en) * | 1998-11-12 | 2003-08-14 | Smithkline Beecham P.L.C. | Novel composition and use |
| US20040102486A1 (en) * | 1998-11-12 | 2004-05-27 | Smithkline Beecham Corporation | Novel method of treatment |
| GB9824893D0 (en) * | 1998-11-12 | 1999-01-06 | Smithkline Beckman Corp | Novel method of treatment |
| US6559188B1 (en) | 1999-09-17 | 2003-05-06 | Novartis Ag | Method of treating metabolic disorders especially diabetes, or a disease or condition associated with diabetes |
| US6878749B2 (en) | 1999-09-17 | 2005-04-12 | Novartis Ag | Method of treating metabolic disorders, especially diabetes, or a disease or condition associated with diabetes |
| US6586438B2 (en) * | 1999-11-03 | 2003-07-01 | Bristol-Myers Squibb Co. | Antidiabetic formulation and method |
| IL151248A0 (en) | 2000-03-08 | 2003-04-10 | Metabasis Therapeutics Inc | Novel aryl fructose-1,6-bisphosphatase inhibitors |
| US6610272B1 (en) | 2000-05-01 | 2003-08-26 | Aeropharm Technology Incorporated | Medicinal aerosol formulation |
| US6780432B1 (en) * | 2000-05-01 | 2004-08-24 | Aeropharm Technology, Inc. | Core formulation |
| ES2290130T3 (es) * | 2000-05-01 | 2008-02-16 | Aeropharm Technology, Llc | Formulacion de nucleo. |
| US6296874B1 (en) * | 2000-05-01 | 2001-10-02 | Aeropharm Technology Incorporated | Core formulation comprising troglitazone and abiguanide |
| US7563774B2 (en) | 2000-06-29 | 2009-07-21 | Metabasis Therapeutics, Inc. | Combination of FBPase inhibitors and antidiabetic agents useful for the treatment of diabetes |
| DK1322158T3 (da) * | 2000-10-02 | 2012-11-19 | Usv Ltd | Farmaceutiske præparater med langvarig frigivelse, som indeholder metformin, og fremgangsmåde til fremstilling deraf |
| US6866866B1 (en) * | 2000-11-03 | 2005-03-15 | Andrx Labs, Llc | Controlled release metformin compositions |
| BRPI0206432A2 (pt) | 2001-01-12 | 2016-10-25 | Sun Pharmaceutical Ind Ltd | métodos para administrar dois ou mais agentes terapêuticos ativos e para tratar diabetes melito ou sintomas associados com diabetes melito em um humano e sistema de liberação espaçada de medicamento |
| KR200249057Y1 (ko) * | 2001-03-22 | 2001-10-19 | 김진환 | 뚜껑, 받침대에 합체된 하수역류. 악취방지 장치 |
| FR2823225B1 (fr) * | 2001-04-04 | 2004-09-17 | Pierre Desreumaux | Utilisation de composes modulant l'activite de l'heterodimere rxr-ppar a titre de medicament pour le traitement de l'hepatite c, et procede de criblage correspondant |
| WO2002080887A2 (en) * | 2001-04-10 | 2002-10-17 | Sun Pharmaceutical Industries Limited | Timed pulse release composition |
| US20040156903A1 (en) * | 2002-05-22 | 2004-08-12 | Abrams Andrew L.. | Metering and packaging of controlled release medication |
| SE0101980D0 (sv) * | 2001-06-01 | 2001-06-01 | Astrazeneca Ab | Pharmaceutical combination |
| SE0101982D0 (sv) * | 2001-06-01 | 2001-06-01 | Astrazeneca Ab | Pharmaceutical combination |
| JP2004536842A (ja) * | 2001-07-10 | 2004-12-09 | エアロファーム テクノロジー インコーポレイテッド | トログリタゾンおよびビグアナイドを含むコア製剤 |
| MXPA04000180A (es) * | 2001-07-10 | 2004-11-22 | Kos Life Sciences Inc | Formulacion de nucleo que comprende hidrocloruro de pioglitazona y una biguanida. |
| AU2001273310B2 (en) * | 2001-07-10 | 2004-10-07 | Kos Life Sciences, Inc. | A core formulation |
| CA2452558C (en) * | 2001-07-17 | 2009-12-22 | N-Gene Research Laboratories Inc. | A synergistic pharmaceutical combination for the prevention or treatment of diabetes |
| EP1414476A1 (de) * | 2001-07-27 | 2004-05-06 | MERCK PATENT GmbH | Bauhinia extrakte |
| KR100924478B1 (ko) | 2001-07-30 | 2009-11-03 | 미쓰비시 타나베 파마 코퍼레이션 | 식후 과혈당 개선제 |
| FR2832633B1 (fr) * | 2001-11-28 | 2004-09-24 | Lipha | Composition pharmaceutique comprenant une association metformine et un acide 4-oxo-butanoique et son utilisation pour traiter le diabete |
| US7183321B2 (en) * | 2001-12-17 | 2007-02-27 | Bristol-Myers Squibb Company | Antidiabetic formulation and method |
| FR2834640B1 (fr) * | 2002-01-11 | 2004-09-24 | Lipha | Composition pharmaceutique comprenant une glitazone et un acide 4-oxobutanoique et son utilisation pour traiter le diabete |
| ATE361065T1 (de) * | 2002-01-25 | 2007-05-15 | Silanes Sa De Cv Lab | Pharmazeutische zusammensetzung zur kontrolle des blutzuckers bei patienten mit typ 2 diabetes |
| US6682759B2 (en) | 2002-02-01 | 2004-01-27 | Depomed, Inc. | Manufacture of oral dosage forms delivering both immediate-release and sustained-release drugs |
| US20030187074A1 (en) * | 2002-03-04 | 2003-10-02 | Javed Hussain | Oral compositions for treatment of diabetes |
| KR100897890B1 (ko) | 2002-06-17 | 2009-05-18 | 인벤티아 헬스케어 피브이티. 엘티디. | 티아졸리딘디온 및 바이구아나이드를 함유하는 다층 정제및 그의 제조 방법 |
| US20040081678A1 (en) * | 2002-08-09 | 2004-04-29 | Anthony Cincotta | Therapeutic process for the treatment of obesity and associated metabolic disorders |
| US8821915B2 (en) * | 2002-08-09 | 2014-09-02 | Veroscience, Llc | Therapeutic process for the treatment of the metabolic syndrome and associated metabolic disorders |
| US7407955B2 (en) | 2002-08-21 | 2008-08-05 | Boehringer Ingelheim Pharma Gmbh & Co., Kg | 8-[3-amino-piperidin-1-yl]-xanthines, the preparation thereof and their use as pharmaceutical compositions |
| US8084058B2 (en) | 2002-09-20 | 2011-12-27 | Watson Pharmaceuticals, Inc. | Pharmaceutical formulation containing a biguanide and a thiazolidinedione derivative |
| US9060941B2 (en) * | 2002-09-20 | 2015-06-23 | Actavis, Inc. | Pharmaceutical formulation containing a biguanide and a thiazolidinedione derivative |
| US7785627B2 (en) * | 2002-09-20 | 2010-08-31 | Watson Pharmaceuticals, Inc. | Pharmaceutical formulation containing a biguanide and a thiazolidinedione derivative |
| US7959946B2 (en) * | 2002-09-20 | 2011-06-14 | Watson Pharmaceuticals, Inc. | Pharmaceutical formulation containing a biguanide and a thiazolidinedione derivative |
| JP4694841B2 (ja) | 2002-09-20 | 2011-06-08 | アンドルックス ラボズ リミテッド ライアビリティ カンパニー | ビグアニドおよびチアゾリジンジオン誘導体を含有する多段階製剤 |
| AU2003266559B2 (en) * | 2002-09-26 | 2008-01-24 | Eisai R&D Management Co., Ltd. | Combination drug |
| IN192749B (de) * | 2002-11-15 | 2004-05-15 | Ranbaxy Lab Ltd | |
| WO2004108067A2 (en) * | 2003-04-03 | 2004-12-16 | Sun Pharmaceutical Industries Limited | Programmed drug delivery system |
| US20050013863A1 (en) | 2003-07-18 | 2005-01-20 | Depomed, Inc., A Corporation Of The State Of California | Dual drug dosage forms with improved separation of drugs |
| WO2005009412A1 (en) * | 2003-07-24 | 2005-02-03 | Wockhardt Limited | Oral compositions for treatment of diseases |
| US20050054731A1 (en) * | 2003-09-08 | 2005-03-10 | Franco Folli | Multi-system therapy for diabetes, the metabolic syndrome and obesity |
| CN1874774B (zh) | 2003-10-31 | 2011-04-13 | 武田药品工业株式会社 | 包含胰岛素致敏剂、胰岛素促分泌素和聚氧乙烯脱水山梨醇脂肪酸酯的固体制剂 |
| US7501426B2 (en) | 2004-02-18 | 2009-03-10 | Boehringer Ingelheim International Gmbh | 8-[3-amino-piperidin-1-yl]-xanthines, their preparation and their use as pharmaceutical compositions |
| EP1807066A1 (de) * | 2004-10-25 | 2007-07-18 | Novartis AG | Kombination aus dpp-iv-hemmer, ppar-antidiabetikum und metformin |
| DE102004054054A1 (de) | 2004-11-05 | 2006-05-11 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verfahren zur Herstellung chiraler 8-(3-Amino-piperidin-1-yl)-xanthine |
| WO2006074278A2 (en) * | 2005-01-05 | 2006-07-13 | Mitsunori Ono | Compositions for treating diabetes or obesity |
| EP1906934A4 (de) * | 2005-07-14 | 2012-03-07 | Franco Folli | Tägliches dosierschema zur behandlung von diabetes, fettsucht, metabolischem syndrom und polyzystischem ovarialsyndrom |
| MXPA05009633A (es) * | 2005-09-08 | 2007-03-07 | Silanes Sa De Cv Lab | Composicion farmaceutica estable de glimepirida de liberacion inmediata y metformina de liberacion prolongada. |
| MXPA05010977A (es) * | 2005-10-12 | 2007-04-11 | Abdala Leopoldo Espinosa | Composiciones farmaceuticas que comprenden sustancias antidiabeticas combinadas para su uso en diabetes mellitus. |
| MXPA05014092A (es) * | 2005-12-20 | 2007-06-20 | Leopoldo De Jesus Espinosa Abdala | Composiciones farmaceuticas que comprenden sustancias derivadas de la tiazolidinedionas combinadas con una biguanida para su uso en diabetes mellitus tipo 2. |
| FR2896159B1 (fr) * | 2006-01-13 | 2008-09-12 | Merck Sante Soc Par Actions Si | Combinaison de derives de triazine et d'agents sensibilisateurs a l'insuline. |
| WO2007127791A2 (en) * | 2006-04-25 | 2007-11-08 | The Administrators Of The Tulane Educational Fund | New pharmacological method for treatment of neuropathic pain |
| EP1852108A1 (de) | 2006-05-04 | 2007-11-07 | Boehringer Ingelheim Pharma GmbH & Co.KG | Zusammensetzungen von DPP-IV-Inhibitoren |
| SG174054A1 (en) | 2006-05-04 | 2011-09-29 | Boehringer Ingelheim Int | Polymorphs |
| PE20110235A1 (es) | 2006-05-04 | 2011-04-14 | Boehringer Ingelheim Int | Combinaciones farmaceuticas que comprenden linagliptina y metmorfina |
| US20090221703A1 (en) | 2006-07-09 | 2009-09-03 | Chongxi Yu | High penetration composition and uses thereof |
| US20090238763A1 (en) * | 2006-07-09 | 2009-09-24 | Chongxi Yu | High penetration compositions and uses thereof |
| WO2008026668A1 (en) * | 2006-08-31 | 2008-03-06 | Daiichi Sankyo Company, Limited | Medicinal composition containing insulin resistance improving agent |
| EP2084124B9 (de) | 2006-10-02 | 2015-07-01 | Techfields Biochem Co. Ltd | Positiv geladene wasserlösliche prodrugs von prostaglandinen und verwandten verbindungen mit sehr hohen hautpenetrationsraten |
| AU2006350707A1 (en) | 2006-11-08 | 2008-05-15 | Chongxi Yu | Transdermal delivery systems of peptides and related compounds |
| WO2008072032A1 (en) | 2006-12-10 | 2008-06-19 | Chongxi Yu | Transdermal delivery systems of beta-lactam antibiotics |
| CA2972344C (en) | 2007-01-15 | 2021-10-26 | Chongxi Yu | Positively charged water-soluble prodrugs of retinoids and retinoid-like compounds with very high skin penetration rates |
| CA2675845C (en) | 2007-01-31 | 2019-03-05 | Chongxi Yu | Positively charged water-soluble prodrugs of 1h-imidazo[4,5-c]quinolin-4-amines and related compounds with very high skin penetration rates |
| US20070172525A1 (en) * | 2007-03-15 | 2007-07-26 | Ramesh Sesha | Anti-diabetic combinations |
| US20080064701A1 (en) * | 2007-04-24 | 2008-03-13 | Ramesh Sesha | Anti-diabetic combinations |
| ES2586433T3 (es) * | 2007-04-11 | 2016-10-14 | Omeros Corporation | Composiciones y métodos para la profilaxis y el tratamiento de adicciones |
| US20160331729A9 (en) * | 2007-04-11 | 2016-11-17 | Omeros Corporation | Compositions and methods for prophylaxis and treatment of addictions |
| US11241420B2 (en) | 2007-04-11 | 2022-02-08 | Omeros Corporation | Compositions and methods for prophylaxis and treatment of addictions |
| AU2010224037B2 (en) | 2009-03-11 | 2015-02-05 | Omeros Corporation | Compositions and methods for prophylaxis and treatment of addictions |
| KR20210103586A (ko) * | 2007-06-04 | 2021-08-23 | 테크필즈 인크 | 매우 높은 피부 및 막 침투율을 가지는 비스테로이드성 소염제(nsaia) 약물전구체 및 이들의 새로운 의약적 용도 |
| RU2569749C2 (ru) * | 2007-08-17 | 2015-11-27 | Бёрингер Ингельхайм Интернациональ Гмбх | Производные пурина, предназначенные для применения для лечения заболеваний, связанных с баф (белок-активатор фибробластов) |
| US8551524B2 (en) * | 2008-03-14 | 2013-10-08 | Iycus, Llc | Anti-diabetic combinations |
| PE20140960A1 (es) | 2008-04-03 | 2014-08-15 | Boehringer Ingelheim Int | Formulaciones que comprenden un inhibidor de dpp4 |
| PE20100156A1 (es) * | 2008-06-03 | 2010-02-23 | Boehringer Ingelheim Int | Tratamiento de nafld |
| US8476008B2 (en) * | 2008-07-23 | 2013-07-02 | Diabetomics, Llc | Methods for detecting pre-diabetes and diabetes |
| BRPI0916997A2 (pt) | 2008-08-06 | 2020-12-15 | Boehringer Ingelheim International Gmbh | Inibidor de dpp-4 e seu uso |
| UY32030A (es) * | 2008-08-06 | 2010-03-26 | Boehringer Ingelheim Int | "tratamiento para diabetes en pacientes inapropiados para terapia con metformina" |
| PE20110297A1 (es) * | 2008-08-15 | 2011-05-26 | Boehringer Ingelheim Int | Inhibidores de dpp-4 para la cicatrizacion de heridas |
| EP2361092A4 (de) * | 2008-09-04 | 2012-07-11 | Anthony I Rozmanith | Gesundheitsfürsorge |
| WO2010036822A1 (en) * | 2008-09-24 | 2010-04-01 | Hollis-Eden Pharmaceuticals, Inc. | Patient populations and treatment methods |
| US20200155558A1 (en) | 2018-11-20 | 2020-05-21 | Boehringer Ingelheim International Gmbh | Treatment for diabetes in patients with insufficient glycemic control despite therapy with an oral antidiabetic drug |
| MX380878B (es) * | 2008-12-04 | 2025-03-12 | Chongxi Yu | Composiciones de alta penetracion y sus aplicaciones. |
| EP2382216A1 (de) | 2008-12-23 | 2011-11-02 | Boehringer Ingelheim International GmbH | Salzformen einer organischen verbindung |
| AR074990A1 (es) | 2009-01-07 | 2011-03-02 | Boehringer Ingelheim Int | Tratamiento de diabetes en pacientes con un control glucemico inadecuado a pesar de la terapia con metformina |
| SG175390A1 (en) | 2009-04-29 | 2011-12-29 | Amarin Corp Plc | Pharmaceutical compositions comprising epa and a cardiovascular agent and methods of using the same |
| WO2010127103A1 (en) | 2009-04-29 | 2010-11-04 | Amarin Pharma, Inc. | Stable pharmaceutical composition and methods of using same |
| KR20180110187A (ko) | 2009-05-08 | 2018-10-08 | 테크필즈 바이오켐 코., 엘티디. | 펩티드 및 펩티드관련 화합물의 고침투성 전구약물 조성물 |
| US9352025B2 (en) | 2009-06-05 | 2016-05-31 | Veroscience Llc | Combination of dopamine agonists plus first phase insulin secretagogues for the treatment of metabolic disorders |
| US9969751B2 (en) | 2009-06-10 | 2018-05-15 | Techfields Pharma Co., Ltd. | High penetration prodrug compositions of antimicrobials and antimicrobial-related compounds |
| SI2443246T1 (en) | 2009-06-15 | 2018-05-31 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for lowering triglycerides without raising ldl-c levels in a subject on concomitant statin therapy |
| US20110065756A1 (en) * | 2009-09-17 | 2011-03-17 | De Taeye Bart M | Methods and compositions for treatment of obesity-related diseases |
| EP3646859A1 (de) | 2009-11-27 | 2020-05-06 | Boehringer Ingelheim International GmbH | Behandlung von genotypisierten diabetes-patienten mit dpp-iv-hemmern wie etwa linagliptin |
| BR112012026005A2 (pt) * | 2010-04-13 | 2015-09-08 | Nucitec Sa De Cv | composições e métodos para tratar diabetes do tipo ii e distúrbios relacionados |
| NZ602921A (en) | 2010-05-05 | 2016-01-29 | Boehringer Ingelheim Int | Combination therapy comprising the administration of a glp-1 receptor agonist and a ddp-4 inhibitor |
| AU2011257964B2 (en) | 2010-05-24 | 2014-10-30 | Ozstar Therapeutics Pty Ltd | Anti-diabetic compositions and methods |
| KR20230051307A (ko) | 2010-06-24 | 2023-04-17 | 베링거 인겔하임 인터내셔날 게엠베하 | 당뇨병 요법 |
| AR083878A1 (es) | 2010-11-15 | 2013-03-27 | Boehringer Ingelheim Int | Terapia antidiabetica vasoprotectora y cardioprotectora, linagliptina, metodo de tratamiento |
| EP2646013A4 (de) | 2010-11-29 | 2014-03-26 | Amarin Pharma Inc | Zusammensetzung mit geringem aufstosseffekt und verfahren zur behandlung und/oder vorbeugung kardiovaskulärer erkrankungen bei einem patienten mit fischallergie/-überempfindlichkeit |
| AU2012285904C1 (en) | 2011-07-15 | 2017-08-31 | Boehringer Ingelheim International Gmbh | Substituted quinazolines, the preparation thereof and the use thereof in pharmaceutical compositions |
| US11291643B2 (en) | 2011-11-07 | 2022-04-05 | Amarin Pharmaceuticals Ireland Limited | Methods of treating hypertriglyceridemia |
| CN103159651B (zh) * | 2011-12-14 | 2015-06-17 | 安徽贝克联合制药有限公司 | 磺酰脲胍及其制备方法和用途 |
| CA3189252A1 (en) | 2012-01-18 | 2013-11-21 | Techfields Pharma Co., Ltd. | High penetration prodrug compositions and pharmaceutical composition thereof for treatment of pulmonary conditions |
| US9555001B2 (en) | 2012-03-07 | 2017-01-31 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition and uses thereof |
| EP4151218A1 (de) | 2012-05-14 | 2023-03-22 | Boehringer Ingelheim International GmbH | Linagliptin, ein xanthinderivat als dpp-4-inhibitor zur verwendung bei der behandlung von sirs und/oder sepsis |
| US20130303462A1 (en) | 2012-05-14 | 2013-11-14 | Boehringer Ingelheim International Gmbh | Use of a dpp-4 inhibitor in podocytes related disorders and/or nephrotic syndrome |
| WO2013174767A1 (en) | 2012-05-24 | 2013-11-28 | Boehringer Ingelheim International Gmbh | A xanthine derivative as dpp -4 inhibitor for use in modifying food intake and regulating food preference |
| US20140187633A1 (en) | 2012-12-31 | 2014-07-03 | Amarin Pharmaceuticals Ireland Limited | Methods of treating or preventing nonalcoholic steatohepatitis and/or primary biliary cirrhosis |
| US20140271841A1 (en) | 2013-03-15 | 2014-09-18 | Amarin Pharmaceuticals Ireland Limited | Pharmaceutical composition comprising eicosapentaenoic acid and derivatives thereof and a statin |
| US9585859B2 (en) | 2013-10-10 | 2017-03-07 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for lowering triglycerides without raising LDL-C levels in a subject on concomitant statin therapy |
| EP3110449B1 (de) | 2014-02-28 | 2023-06-28 | Boehringer Ingelheim International GmbH | Medizinische verwendung eines dpp-4-inhibitors |
| US10172818B2 (en) | 2014-06-16 | 2019-01-08 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing or preventing oxidation of small dense LDL or membrane polyunsaturated fatty acids |
| NL2015957B1 (en) | 2015-12-14 | 2017-06-29 | Scala Pharma B V | Compositions and methods for inducing beige or brown fat tissue. |
| EP3184106A1 (de) * | 2015-12-23 | 2017-06-28 | Sanofi-Aventis Deutschland GmbH | Wachstumsdifferenzierungsfaktor 15 als biomarker für metformin |
| EP3468562A1 (de) | 2016-06-10 | 2019-04-17 | Boehringer Ingelheim International GmbH | Kombinationen aus linagliptin und metformin |
| US12274703B2 (en) | 2017-12-21 | 2025-04-15 | Gliapharm Sa | Compositions and methods of treatment for neurological disorders comprising a dementia |
| US12310967B2 (en) | 2017-12-21 | 2025-05-27 | Gliapharm Sa | Compositions and methods of treatment for neurological disorders comprising motor neuron diseases |
| HUE067138T2 (hu) | 2018-09-24 | 2024-10-28 | Amarin Pharmaceuticals Ie Ltd | Módszerek kardiovaszkuláris események veszélyének csökkentésére egy alanyban |
| WO2020132378A2 (en) | 2018-12-22 | 2020-06-25 | Gliapharm Sa | Compositions and methods of treatment for neurological disorders comprising depression |
| CN116350616A (zh) | 2019-11-12 | 2023-06-30 | 阿马里纳药物爱尔兰有限公司 | 降低心房纤颤和/或心房扑动受试者心血管事件风险的方法 |
| NL2024493B1 (en) | 2019-12-16 | 2021-09-02 | Logick Energetics B V | Pharmaceutical composition for preventing or stopping metastases |
| US20230023285A1 (en) | 2019-12-18 | 2023-01-26 | Logick Energetics B.V. | Pharmaceutical composition for use in preventing or stopping metastases |
| NL2025335B1 (en) | 2020-04-10 | 2021-10-26 | Logick Energetics B V | Pharmaceutical composition for treatment of corona virus infection |
| US11986452B2 (en) | 2021-04-21 | 2024-05-21 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing the risk of heart failure |
| NL2028476B1 (en) | 2021-06-17 | 2022-12-27 | Logick Energetics B V | Pharmaceutical composition for increasing mitochondrial activity and/or improving adiponectin production |
| NL2029634B1 (en) | 2021-11-04 | 2023-06-02 | Logick Energetics B V | Pharmaceutical composition for increasing mitochondrial activity and/or improving adiponectin production |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5917052A (en) * | 1994-09-28 | 1999-06-29 | Shaman Pharmaceuticals, Inc. | Hypoglycemic agent from cryptolepis |
| TWI238064B (en) * | 1995-06-20 | 2005-08-21 | Takeda Chemical Industries Ltd | A pharmaceutical composition for prophylaxis and treatment of diabetes |
| US5798375A (en) * | 1995-07-03 | 1998-08-25 | Sankyo Company, Limited | Treatment of arteriosclerosis and xanthoma |
| GB9715295D0 (en) * | 1997-07-18 | 1997-09-24 | Smithkline Beecham Plc | Novel method of treatment |
-
1998
- 1998-11-09 US US09/189,132 patent/US6011049A/en not_active Expired - Fee Related
-
1999
- 1999-06-01 HN HN1999000184A patent/HN1999000184A/es unknown
- 1999-08-11 PT PT99939130T patent/PT1128834E/pt unknown
- 1999-08-11 DK DK99939130T patent/DK1128834T3/da active
- 1999-08-11 DE DE69925019T patent/DE69925019T2/de not_active Expired - Fee Related
- 1999-08-11 EP EP99939130A patent/EP1128834B1/de not_active Expired - Lifetime
- 1999-08-11 SI SI9930780T patent/SI1128834T1/xx unknown
- 1999-08-11 AT AT99939130T patent/ATE293980T1/de not_active IP Right Cessation
- 1999-08-11 WO PCT/US1999/018140 patent/WO2000027401A1/en not_active Ceased
- 1999-08-11 JP JP2000580630A patent/JP2002529417A/ja active Pending
- 1999-08-11 AU AU53473/99A patent/AU5347399A/en not_active Abandoned
- 1999-08-11 CA CA002345524A patent/CA2345524C/en not_active Expired - Fee Related
- 1999-08-11 EP EP04029821A patent/EP1514550A3/de not_active Withdrawn
- 1999-08-11 ES ES99939130T patent/ES2241305T3/es not_active Expired - Lifetime
- 1999-09-17 GT GT199900158A patent/GT199900158A/es unknown
- 1999-10-26 AR ARP990105394A patent/AR020973A1/es unknown
- 1999-10-29 PA PA19998484901A patent/PA8484901A1/es unknown
- 1999-11-05 CR CR6128A patent/CR6128A/es unknown
- 1999-11-05 PE PE1999001121A patent/PE20001235A1/es not_active Application Discontinuation
- 1999-11-05 CO CO99070009A patent/CO5150152A1/es unknown
- 1999-11-05 UY UY25791A patent/UY25791A1/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CR6128A (es) | 2000-11-30 |
| US6011049A (en) | 2000-01-04 |
| GT199900158A (es) | 2001-03-10 |
| EP1128834A1 (de) | 2001-09-05 |
| HN1999000184A (es) | 2000-02-10 |
| EP1514550A3 (de) | 2009-04-29 |
| PT1128834E (pt) | 2005-07-29 |
| CA2345524C (en) | 2005-09-20 |
| CO5150152A1 (es) | 2002-04-29 |
| AU5347399A (en) | 2000-05-29 |
| WO2000027401A1 (en) | 2000-05-18 |
| CA2345524A1 (en) | 2000-05-18 |
| UY25791A1 (es) | 2001-03-16 |
| DE69925019D1 (de) | 2005-06-02 |
| ES2241305T3 (es) | 2005-10-16 |
| DK1128834T3 (da) | 2005-07-04 |
| ATE293980T1 (de) | 2005-05-15 |
| SI1128834T1 (de) | 2005-08-31 |
| EP1514550A2 (de) | 2005-03-16 |
| PA8484901A1 (es) | 2000-09-29 |
| AR020973A1 (es) | 2002-06-05 |
| JP2002529417A (ja) | 2002-09-10 |
| PE20001235A1 (es) | 2000-11-08 |
| EP1128834B1 (de) | 2005-04-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69925019T2 (de) | Kombinationen für diabetes welche glyburide, troglitazon (und ein biguanid) enthalten | |
| DE60038455T2 (de) | Arzneimittel, umfassend eine kombination aus metformin und glibenclamide | |
| DE60036367T2 (de) | Synergitische verwendung von thiazolidinedionen und glucagon-ähnlichem peptid-1 und dessen agonisten für die behandlung von nicht-insulin-abhängigen diabetes | |
| DE69627883T2 (de) | Zusammensetzung von glibenclamid und metformine zur behandlung von diabetes mellitis typ ii | |
| EP0128482B1 (de) | Neue galenische Zubereitungsformen von oralen Antidiabetika und Verfahren zu ihrer Herstellung | |
| DE60320652T2 (de) | Zusammensetzung frei von ascorbicsäure enthaltend einen hemmer der cholesterinabsorption, einen hemmer der hmg-coa reduktase und ein stabilisierungsmittel | |
| DE60117295T2 (de) | Synergistische kombinationen mit einem renin-inhibitor für kardiovaskuläre erkrankungen | |
| DE69837261T2 (de) | Behandlung der diabetes mit thiazolidindione und metformin | |
| DE69731840T2 (de) | Pharmazeutische Zusammensetzungen enthaltend CS-866 und Insulinresistenz verbessernde Mittel und deren Verwendung zur Behandlung von Arteriosklerose und Xanthom | |
| EP1037648B1 (de) | Verwendung von erythropoietin und eisenpräparaten zur herstellung von pharmazeutischen kombinationspräparaten zur behandlung von rheumatischen erkrankungen | |
| DE69219136T2 (de) | Flüssiges nahrungsmittel, das 3-guanidinopropionsäure enthält | |
| EP0521388B1 (de) | Verfahren zur Herstellung einer pharmazeutischen Zubereitung mit wenigstens zwei verschiedenen Wirkstoffen und Verwendung einer solchen Zubereitung | |
| EP1140082A1 (de) | Kombination von cerivastatin und fibraten | |
| EP1509207B1 (de) | Pharmazeutische zusammensetzung, enthaltend oxcarbazepin mit kontrollierter wirkstofffreisetzung | |
| DE3856555T2 (de) | Diltiazem-Zusammensetzungen mit kontrollierter Wirkstoffabsorption | |
| DE2823174A1 (de) | Arzneimittel fuer die prophylaktische behandlung postoperativer tiefer venenthrombose | |
| DE60219963T2 (de) | Pharmazeutische zusammensetzung, die zur glukosekontrolle im blut von patienten mit diabetes typ 2 eingesetzt wird | |
| EP0305890A2 (de) | Verwendung von Bezafibrat zur Behandlung von Diabetes | |
| WO2003099265A2 (de) | Pharmazeutische wirkstoffkombination sowie deren verwendung | |
| EP1001756B1 (de) | Synergistisch wirkende zusammensetzungen zur selektiven bekämpfung von tumorgewebe | |
| DE60209824T2 (de) | Dosierschema für ppar-gamma-aktivatoren | |
| DE3117756C2 (de) | ||
| DE602004012593T2 (de) | Kombinationen aus valsartan, amilorid oder triamterin und einem diuretikum | |
| DE3635522A1 (de) | Pharmazeutische zusammensetzung | |
| EP1383523A2 (de) | Kombinationspräparat zur behandlung des diabetes mellitus |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |