DE69918277T2 - Verfahren zur herstellung von 13-cis retinsaüre - Google Patents
Verfahren zur herstellung von 13-cis retinsaüre Download PDFInfo
- Publication number
- DE69918277T2 DE69918277T2 DE69918277T DE69918277T DE69918277T2 DE 69918277 T2 DE69918277 T2 DE 69918277T2 DE 69918277 T DE69918277 T DE 69918277T DE 69918277 T DE69918277 T DE 69918277T DE 69918277 T2 DE69918277 T2 DE 69918277T2
- Authority
- DE
- Germany
- Prior art keywords
- solvent
- formula
- butenolide
- weak base
- magnesium
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000004519 manufacturing process Methods 0.000 title description 9
- 238000000034 method Methods 0.000 claims abstract description 49
- 150000003839 salts Chemical class 0.000 claims abstract description 23
- SQEBMLCQNJOCBG-HVHJFMEUSA-N (5s)-3-(hydroxymethyl)-5-methoxy-4-methyl-5-[(e)-2-phenylethenyl]furan-2-one Chemical compound C=1C=CC=CC=1/C=C/[C@]1(OC)OC(=O)C(CO)=C1C SQEBMLCQNJOCBG-HVHJFMEUSA-N 0.000 claims abstract description 18
- FBMORZZOJSDNRQ-UHFFFAOYSA-N Demethoxy,B,HCl-Adriamycin Natural products C1C2C(=C)CCCC2(C)CC2(O)C1=C(C)C(=O)O2 FBMORZZOJSDNRQ-UHFFFAOYSA-N 0.000 claims abstract description 18
- JUTMAMXOAOYKHT-UHFFFAOYSA-N karrikinolide Natural products C1=COC=C2OC(=O)C(C)=C21 JUTMAMXOAOYKHT-UHFFFAOYSA-N 0.000 claims abstract description 18
- 239000002841 Lewis acid Substances 0.000 claims abstract description 17
- 150000007517 lewis acids Chemical class 0.000 claims abstract description 17
- 239000002904 solvent Substances 0.000 claims abstract description 13
- 229960005280 isotretinoin Drugs 0.000 claims description 26
- 239000011541 reaction mixture Substances 0.000 claims description 16
- 150000001875 compounds Chemical class 0.000 claims description 14
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 12
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 claims description 12
- 125000000217 alkyl group Chemical group 0.000 claims description 11
- 125000003118 aryl group Chemical group 0.000 claims description 11
- 125000000623 heterocyclic group Chemical group 0.000 claims description 11
- 239000003880 polar aprotic solvent Substances 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 9
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 claims description 8
- 125000003545 alkoxy group Chemical group 0.000 claims description 8
- 229910052757 nitrogen Inorganic materials 0.000 claims description 8
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 7
- 125000004663 dialkyl amino group Chemical group 0.000 claims description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 6
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 6
- 150000003512 tertiary amines Chemical class 0.000 claims description 5
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 4
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 claims description 4
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 claims description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 4
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 claims description 4
- 229910052736 halogen Inorganic materials 0.000 claims description 4
- 150000002367 halogens Chemical group 0.000 claims description 4
- 229910052739 hydrogen Inorganic materials 0.000 claims description 4
- 239000001257 hydrogen Substances 0.000 claims description 4
- 229910001629 magnesium chloride Inorganic materials 0.000 claims description 4
- 239000012454 non-polar solvent Substances 0.000 claims description 3
- 238000002360 preparation method Methods 0.000 claims description 3
- CYSGHNMQYZDMIA-UHFFFAOYSA-N 1,3-Dimethyl-2-imidazolidinon Chemical compound CN1CCN(C)C1=O CYSGHNMQYZDMIA-UHFFFAOYSA-N 0.000 claims description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 claims description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 claims description 2
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 claims description 2
- HTLZVHNRZJPSMI-UHFFFAOYSA-N N-ethylpiperidine Chemical compound CCN1CCCCC1 HTLZVHNRZJPSMI-UHFFFAOYSA-N 0.000 claims description 2
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical group OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 claims description 2
- OTCKOJUMXQWKQG-UHFFFAOYSA-L magnesium bromide Chemical compound [Mg+2].[Br-].[Br-] OTCKOJUMXQWKQG-UHFFFAOYSA-L 0.000 claims description 2
- 229910001623 magnesium bromide Inorganic materials 0.000 claims description 2
- ORUIBWPALBXDOA-UHFFFAOYSA-L magnesium fluoride Chemical compound [F-].[F-].[Mg+2] ORUIBWPALBXDOA-UHFFFAOYSA-L 0.000 claims description 2
- 229910001635 magnesium fluoride Inorganic materials 0.000 claims description 2
- BLQJIBCZHWBKSL-UHFFFAOYSA-L magnesium iodide Chemical compound [Mg+2].[I-].[I-] BLQJIBCZHWBKSL-UHFFFAOYSA-L 0.000 claims description 2
- 229910001641 magnesium iodide Inorganic materials 0.000 claims description 2
- OJOZHRCRUJKPIJ-UHFFFAOYSA-N magnesium;2,2,2-trifluoroacetic acid Chemical compound [Mg].OC(=O)C(F)(F)F OJOZHRCRUJKPIJ-UHFFFAOYSA-N 0.000 claims description 2
- BZQRBEVTLZHKEA-UHFFFAOYSA-L magnesium;trifluoromethanesulfonate Chemical compound [Mg+2].[O-]S(=O)(=O)C(F)(F)F.[O-]S(=O)(=O)C(F)(F)F BZQRBEVTLZHKEA-UHFFFAOYSA-L 0.000 claims description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 2
- SHGAZHPCJJPHSC-NUEINMDLSA-N Isotretinoin Chemical compound OC(=O)C=C(C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-NUEINMDLSA-N 0.000 claims 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 claims 2
- 150000002431 hydrogen Chemical class 0.000 claims 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 claims 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 claims 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 claims 1
- 150000001335 aliphatic alkanes Chemical class 0.000 claims 1
- ZOAIGCHJWKDIPJ-UHFFFAOYSA-M caesium acetate Chemical compound [Cs+].CC([O-])=O ZOAIGCHJWKDIPJ-UHFFFAOYSA-M 0.000 claims 1
- 235000011056 potassium acetate Nutrition 0.000 claims 1
- 239000001632 sodium acetate Substances 0.000 claims 1
- 235000017281 sodium acetate Nutrition 0.000 claims 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 claims 1
- 235000017557 sodium bicarbonate Nutrition 0.000 claims 1
- SHGAZHPCJJPHSC-XFYACQKRSA-N isotretinoin Chemical compound OC(=O)/C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-XFYACQKRSA-N 0.000 description 25
- 238000006243 chemical reaction Methods 0.000 description 12
- -1 but not limited to Chemical group 0.000 description 11
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 8
- 238000007239 Wittig reaction Methods 0.000 description 6
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- 229910001385 heavy metal Inorganic materials 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 125000003282 alkyl amino group Chemical group 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 239000012467 final product Substances 0.000 description 3
- 125000001188 haloalkyl group Chemical group 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- 239000003504 photosensitizing agent Substances 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- 125000005083 alkoxyalkoxy group Chemical group 0.000 description 2
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 238000006317 isomerization reaction Methods 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 229910052703 rhodium Inorganic materials 0.000 description 2
- 239000010948 rhodium Substances 0.000 description 2
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 2
- 239000002002 slurry Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- CMSYDJVRTHCWFP-UHFFFAOYSA-N triphenylphosphane;hydrobromide Chemical compound Br.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 CMSYDJVRTHCWFP-UHFFFAOYSA-N 0.000 description 2
- PZGYHDPZANRCSM-PKNBQFBNSA-N (1e)-3-methyl-1-(2,6,6-trimethylcyclohexen-1-yl)penta-1,4-dien-3-ol Chemical compound CC1=C(\C=C\C(C)(O)C=C)C(C)(C)CCC1 PZGYHDPZANRCSM-PKNBQFBNSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- XRNPHZPFAWLRNJ-UHFFFAOYSA-N 2-hydroxy-3-methyl-2h-furan-5-one Chemical compound CC1=CC(=O)OC1O XRNPHZPFAWLRNJ-UHFFFAOYSA-N 0.000 description 1
- 125000005916 2-methylpentyl group Chemical group 0.000 description 1
- 125000004189 3,4-dichlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(Cl)C([H])=C1* 0.000 description 1
- 125000004179 3-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(Cl)=C1[H] 0.000 description 1
- 125000004180 3-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(F)=C1[H] 0.000 description 1
- MBVFRSJFKMJRHA-UHFFFAOYSA-N 4-fluoro-1-benzofuran-7-carbaldehyde Chemical compound FC1=CC=C(C=O)C2=C1C=CO2 MBVFRSJFKMJRHA-UHFFFAOYSA-N 0.000 description 1
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 208000002874 Acne Vulgaris Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- UJUZVVSRNMBGRO-UHFFFAOYSA-N [3-methyl-5-(2,6,6-trimethylcyclohexen-1-yl)penta-2,4-dienyl]-triphenylphosphanium Chemical class CC=1CCCC(C)(C)C=1C=CC(C)=CC[P+](C=1C=CC=CC=1)(C=1C=CC=CC=1)C1=CC=CC=C1 UJUZVVSRNMBGRO-UHFFFAOYSA-N 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 206010000496 acne Diseases 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000003302 alkenyloxy group Chemical group 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 125000005277 alkyl imino group Chemical group 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- 125000004656 alkyl sulfonylamino group Chemical group 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 125000005121 aminocarbonylalkoxy group Chemical group 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 229910052789 astatine Inorganic materials 0.000 description 1
- RYXHOMYVWAEKHL-UHFFFAOYSA-N astatine atom Chemical compound [At] RYXHOMYVWAEKHL-UHFFFAOYSA-N 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 150000003842 bromide salts Chemical class 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229910052792 caesium Inorganic materials 0.000 description 1
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 150000003857 carboxamides Chemical class 0.000 description 1
- 125000005111 carboxyalkoxy group Chemical group 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 239000012039 electrophile Substances 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- JEGUKCSWCFPDGT-UHFFFAOYSA-N h2o hydrate Chemical compound O.O JEGUKCSWCFPDGT-UHFFFAOYSA-N 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000004628 isothiazolidinyl group Chemical group S1N(CCC1)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- GBMDVOWEEQVZKZ-UHFFFAOYSA-N methanol;hydrate Chemical compound O.OC GBMDVOWEEQVZKZ-UHFFFAOYSA-N 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 238000007699 photoisomerization reaction Methods 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 229930002330 retinoic acid Natural products 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000003548 sec-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 238000000935 solvent evaporation Methods 0.000 description 1
- 125000003107 substituted aryl group Chemical group 0.000 description 1
- PXQLVRUNWNTZOS-UHFFFAOYSA-N sulfanyl Chemical class [SH] PXQLVRUNWNTZOS-UHFFFAOYSA-N 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000005309 thioalkoxy group Chemical group 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- AVCVDUDESCZFHJ-UHFFFAOYSA-N triphenylphosphane;hydrochloride Chemical compound [Cl-].C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1 AVCVDUDESCZFHJ-UHFFFAOYSA-N 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C403/00—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone
- C07C403/20—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone having side-chains substituted by carboxyl groups or halides, anhydrides, or (thio)esters thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/09—Geometrical isomers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/16—Systems containing only non-condensed rings with a six-membered ring the ring being unsaturated
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Description
- Technisches Gebiet der Erfindung
- Die vorliegende Erfindung bezieht sich auf ein Verfahren zur Herstellung von 13-cis-Retinsäure.
- Hintergrund der Erfindung
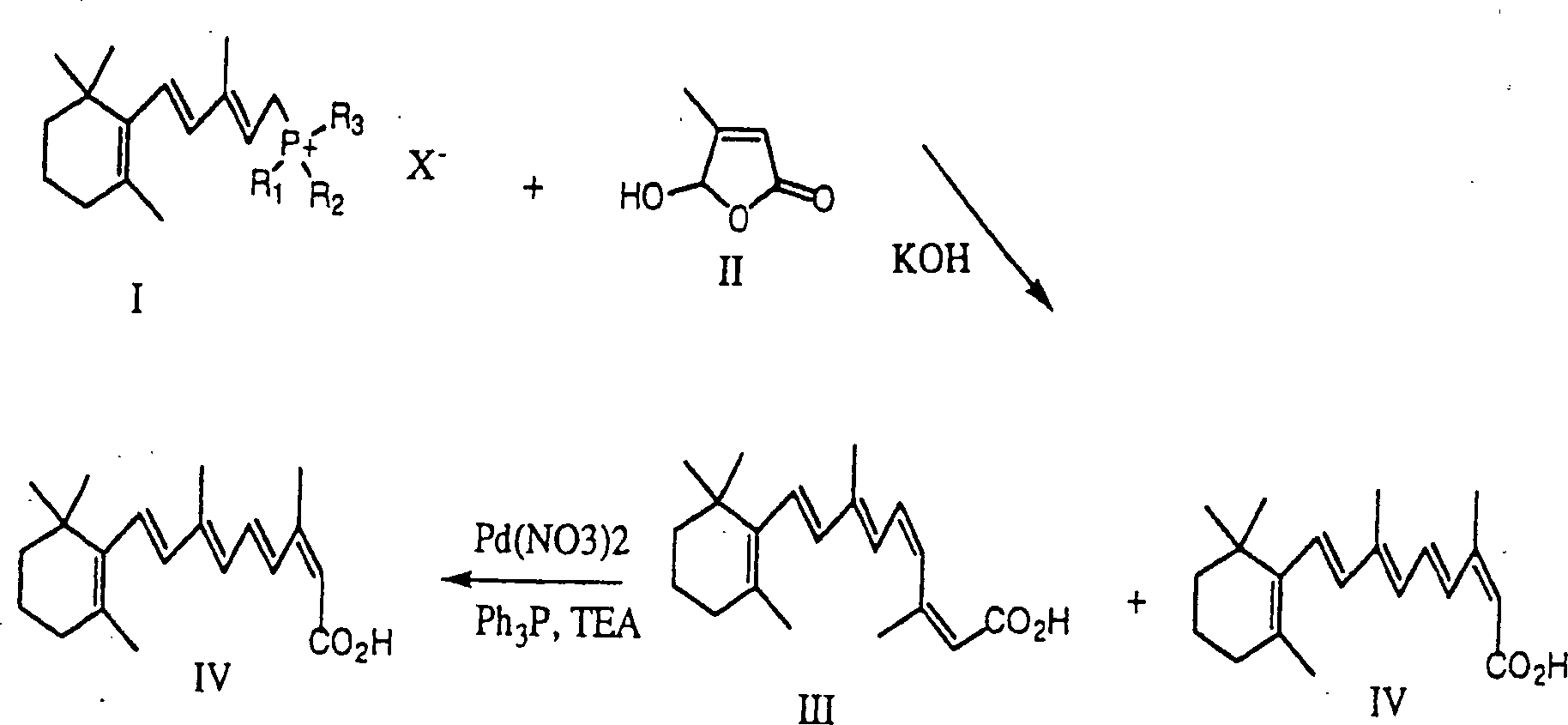
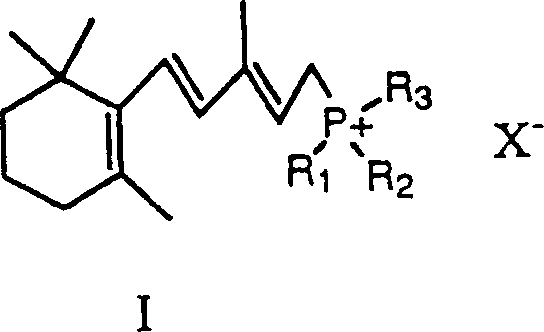
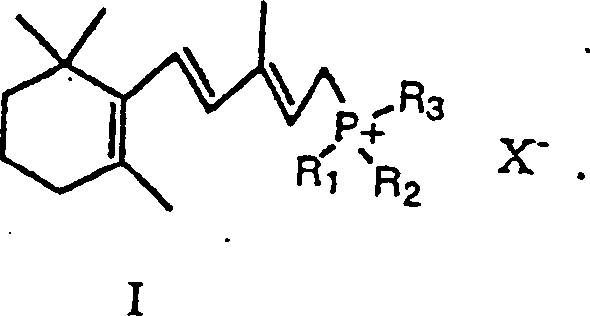
- Das 13-cis Isomer von Retinsäure (2Z, 4E, 6E, 8E)-3,7-Dimethyl-9-(2,6,6-trimethylcyclohex-1-enyl)nona-2,4,6,8-tetraenonsäure, anderweitig bekannt als Isotretinoin, ist ein wertvolles pharmazeutisches Mittel, das verwendet wird zur Behandlung von Akne. Viele Verfahren zur Synthetisierung von Isotretinoin sind im Fachgebiet bekannt. U.S. Patent 4,556,518 ('das 518 Patent) beschreibt ein Verfahren zur Herstellung von Isotretinoin gemäß dem folgenden Reaktionsschema:
- Der erste Schritt der Reaktion schließt die Reaktion eines Wittig Salzes ein, das die Formel I hat, mit einem Butenolid, das die Formel II hat, bei einer Temperatur von etwa –10° bis –50°C in der Anwesenheit einer starken Base, wie zum Beispiel einem Hydroxid oder Alkoxid, und einem organischen Lösungsmittel. Wie oben gezeigt, erzeugt die Reaktion des Wittig Salzes, das die Formel I hat, und des Butenolids der Formel II Verbindungen, die die Formeln III und IV haben. Das Hauptprodukt ist das 11-cis Isomer (Formel III). Um 13-cis Retinsäure als das Hauptprodukt herzustellen, wird die Verbindung, die die Formel III hat, isomerisiert, um eine Verbindung, die die Formel IV hat, herzustellen. Die Isomerisationsreaktion wird durchgeführt durch Behandeln der Verbindung, die die Formel III hat, mit einem Katalysator in einem inerten Lösungsmittelmedium. Der Katalysator. ist typischerweise eine Verbindung oder ein Komplex von Palladium oder Rhodium. Der Katalysator isomerisiert selektiv die 11-cis Doppelbindung in der Verbindung, die die Formel III hat, zu der entsprechenden trans Doppelbindung, ohne Beeinflussung der 13-cis Doppelbindung, um eine Verbindung, die die Formel IV hat, herzustellen.
- Deshalb besteht im Fachgebiet ein Bedarf nach einem Verfahren zur Herstellung von Isotretinoin unter milden Bedingungen, das keine toxischen Schwermetalle verwendet.
- Es gibt einige Schwierigkeiten, die mit der Reaktion, die in dem '518 Patent beschrieben ist, in Zusammenhang stehen. Zunächst sind Palladium und Rhodium Schwermetalle, die toxisch sind. Es ist auch schwierig die Mengen dieser Schwermetalle in dem Endprodukt auf ein akzeptables Niveau zu reduzieren. Außerdem ist die bevorzugte Temperatur für die Wittig Reaktion –25°C oder darunter, was die Verwendung einer speziellen Ausstattung für die kommerzielle Herstellung notwendig macht.
- US Patent 5,424,465 beschreibt die Verwendung von Bestrahlung in einem organischen Lösungsmittel in der Anwesenheit eines geeigneten Photosensibilisators, um die Isomerisation des 11-cis Isomers zu dem 11-trans Isomer zu beeinflussen. Die Nachteile dieses Verfahrens schließen ein, dass die Mutterlaugen recycelt werden müssen, um die vollständige Photoisomerisierung zu beeinflussen, die Verwendung von spezieller Ausstattung und das Entfernen von restlichem Photosensibilisator aus dem Endprodukt.
- Zusammenfassung der Erfindung
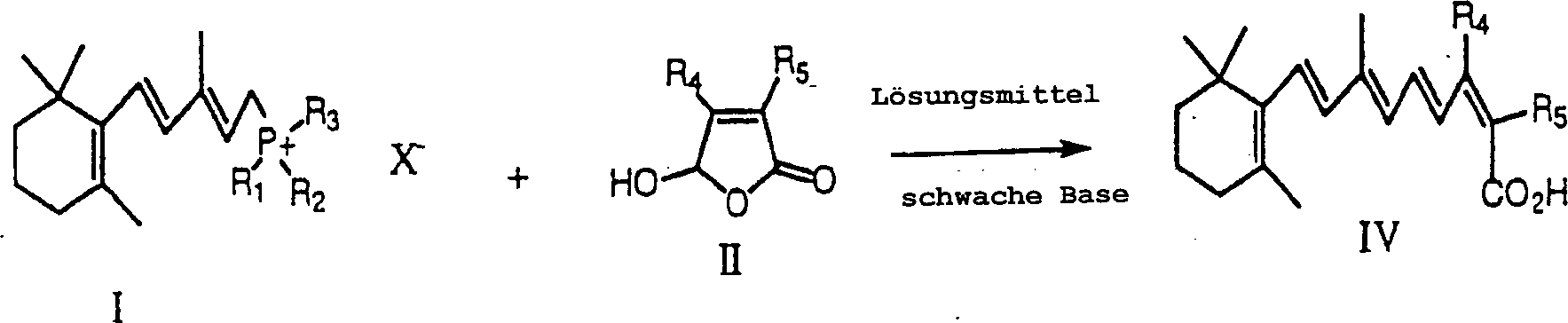
- Die vorliegende Erfindung bezieht sich auf ein Verfahren zur Herstellung von 13-cis Retinsäure, auch bekannt als Isotretinoin. Das Verfahren der vorliegenden Erfindung schließt das Reagieren eines Wittig Salzes in einem Lösungsmittel in der Anwesenheit einer schwachen Base, und wahlweise einer Lewis Säure, mit einem Butenolid durch eine Wittig Reaktion ein, um 13-cis Retinsäure herzustellen.
- Ausführliche Beschreibung der Erfindung
- Die vorliegende Erfindung schließt ein Verfahren zur Herstellung von Isotretinoin ein. Allgemein schließt das Verfahren der vorliegenden Erfindung das Reagieren eines Wittig Salzes in einem Lösungsmittel in der Anwesenheit einer schwachen Base, und wahlweise einer Lewis Säure, mit einem Butenolid durch eine Wittig Reaktion ein, um Isotretinoin herzustellen. Das Isotretinoin, hergestellt gemäß dem Verfahren der vorliegenden Erfindung, wird direkt aus der Wittig Reaktion hergestellt. Das Verfahren der vorliegenden Erfindung ist in Schema I gezeigt.
-
- Für den Zweck dieser Offenbarung haben die oben genannten Ausdrücke die folgenden Bedeutungen:
Die Ausdrücke "Niederalkyl" oder "Alkyl", wie hierin verwendet, bezieht sich auf gerade- oder verzweigtkettige Alkylradikale, die von 1 bis 6 Kohlenstoffatomen enthalten, einschließlich, aber nicht begrenzt auf Methyl, Ethyl, n-Propyl, iso-Propyl, n-Butyl, iso-Butyl, sec-Butyl, t-Butyl, n-Pentyl, 1-Methylbutyl, 2,2-Dimethylbutyl, 2-Methylpentyl, 2,2-Dimethylpropyl, n-Hexyl und dergleichen. - Der Ausdruck "Dialkylamino", wie hierin verwendet, bezieht sich auf R11R12N-, worin R11 und R12 unabhängig gewählt sind aus Niederalkyl, zum Beispiel Diethylamino, Methylpropylamino und dergleichen.
- Wie hierin verwendet, bezieht sich der Ausdruck "Aryl" auf ein mono- oder bicyclisches carbocyclisches Ringsystem, das ein oder zwei aromatische Ringe hat, einschließlich, aber nicht begrenzt auf Phenyl, Naphthyl, Anthryl, Phenanthryl, Tetrahydronaphthyl, Indanyl, Indenyl und dergleichen. Arylgruppen können unsubstituiert oder substituiert sein mit ein, zwei oder drei Substituenten unabhängig gewählt aus Niederalkyl, Halogen, Haloalkyl, Hydroxy, Hydroxyalkyl, Alkenyl, Alkenyloxy, Alkoxy, Alkoxyalkoxy, Alkoxycarbonyl, Amino, Alkylamino, Alkylsulfonyl, Dialkylamino, Aminocarbonyl, Aminocarbonylalkoxy, Aryl, Arylalkyl, Arylalkoxy, Aryloxy, Cyano, Nitro, Carboxy, Cycloalkyl, Cycloalkylalkyl, Carboxyalkoxy, Alkylsulfonylamino und Phenyl. Beispiele von substituiertem Aryl schließen 3-Chlorphenyl, 3-Fluorphenyl, 4-Chlorphenyl, 4-Fluorphenyl, 3,4-Dichlorphenyl, 3-Chlor-4-fluorphenyl, 4-Methylsulfonylphenyl, 3-Isopropoxyphenyl und dergleichen ein.
- Der Ausdruck "Alkoxy", wie hierin verwendet, bezieht sich auf R13O-, worin R13 eine Niederalkylgruppe ist, wie oben definiert. Beispiele von Alkoxy schließen ein, sind aber nicht begrenzt auf Ethoxy, tert-Butoxy und dergleichen.
- Der Ausdruck "Cycloalkyl", wie hierin verwendet, bezeichnet ein aliphatisches Ringsystem, das 3 bis 10 Kohlenstoffatome und 1 bis 3 Ringe hat, einschließlich, aber nicht begrenzt auf, Cyclopropyl, Cyclopentyl, Cyclohexyl, Norbornyl, Adamantyl und dergleichen. Cycloalkylgruppen können unsubstituiert oder substituiert mit ein, zwei oder drei Substituenten unabhängig gewählt aus Niederalkyl, Haloalkyl, Alkoxy, Thioalkoxy, Amino, Alkylamino, Dialkylamino, Hydroxy, Halo, Mercapto, Nitro, Carboxaldehyd, Carboxy, Alkoxycarbonyl und Carboxamid.
- Die Ausdrücke "Halogen" oder "Halo", beziehen sich auf eins der elektronegativen Elemente der Gruppe VIIA des Periodensystems der Elemente, wie beispielsweise Fluor, Chlor, Brom, Jod und Astat.
- Die Ausdrücke "heterocyclischer Ring" oder "heterocyclisch" oder "Heterocyclus", wie hierin verwendet, beziehen sich auf irgend einen 3- oder 4-gliedrigen Ring, enthaltend ein Heteroatom, gewählt aus Sauerstoff, Stickstoff und Schwefel; oder einen 5-, 6- oder 7-gliedrigen Ring, enthaltend ein, zwei oder drei Stickstoffatome; ein Stickstoff- und ein Schwefelatom; oder ein Stickstoff- der und ein Sauerstoffatom. Der 5-gliedrige Ring hat 0-2 Doppelbindungen und der 6- und der 7-gliedrige Ring haben 0-3 Doppelbindungen. Die Stickstoffheteroatome können wahlweise quaternisiert sein. Der Ausdruck "heterocyclisch", schließt auch bicyclische Gruppen ein, in denen irgend einer der obigen heterocyclischen Ringe an einen Benzenring oder einen Cyclohexanring oder an einen anderen heterocyclischen Ring (zum Beispiel Indolyl, Chinolyl, Isochinolyl, Tetrahydrochinolyl, Benzofuryl oder Benzothienyl und dergleichen) ankondensiert ist. Heterocyclen schließen ein: Azetidinyl, Pyrrolyl, Pyrrolinyl, Pyrrolidinyl, Pyrazolyl, Pyrazolinyl, Pyrazolidinyl, Imidazolyl, Imidazolinyl, Imidazolidinyl, Pyridyl, Piperidinyl, Homopiperidinyl, Pyrazinyl, Piperazinyl, Pyrimidinyl, Pyridazinyl, Oxazolyl, Oxazolidinyl, Isoxazolyl, Isoxazolidinyl, Morpholinyl, Thiazolyl, Thiazolidinyl, Isothiazolyl, Isothiazolidinyl, Indolyl, Chinolinyl, Isochinolinyl, Benzimidazolyl, Benzothiazolyl, Benzoxazolyl, Furyl, Thienyl und Benzothienyl.
- Heterocyclen können unsubstituiert oder monosubstituiert oder disubstituiert sein mit Substituenten unabhängig gewählt aus Hydroxy, Halo, Oxo (=O), Alkylimino(R*N= worin R* eine Niederalkylgruppe ist), Amino, Alkylamino, Dialkylamino, Alkoxy, Alkoxyalkoxy, Haloalkyl, Cycloalkyl, Aryl, Arylalkyl, -COOH, -SO3H und Niederalkyl. Zusätzlich können Stickstoff enthaltende Heterocyclen N-geschützt sein.
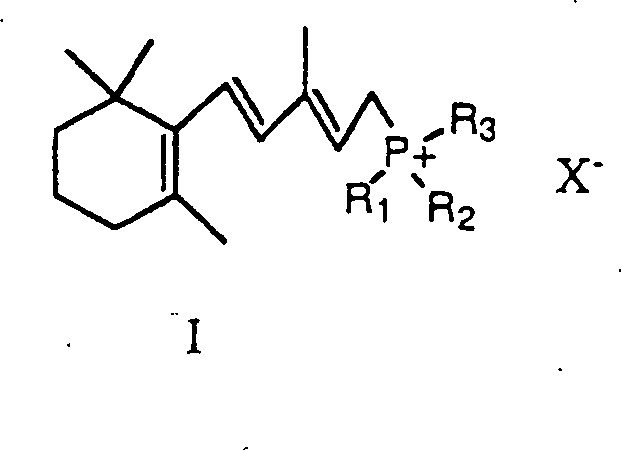
- Die Verbindung von Formel I kann irgendein herkömmliches Wittig Salz sein. Vorzugsweise ist die Verbindung von Formel I ein Triphenylphosphoniumchlorid- oder Bromidsalz.
- Das Wittig Salz, das die Formel I hat, kann durch irgendein Verfahren hergestellt werden, das im Fachgebiet bekannt ist. Zum Beispiel kann das Wittig Salz hergestellt werden durch Reaktion von Vinyl-β-ionol mit Triphenylphosphinhydrobromid, um ein Triphenylphosphoniumbromidsalz, das die Formel I hat, zu ergeben. Dieses Triphenylphosphoniumbromidsalz kann direkt nach der Lösungsmittelverdampfung verwendet werden, um Isotretinoin herzustellen. Ein Vorteil des Verfahrens ist, daß das Wittig Salz nicht für die Verwendung isoliert werden muss. Die restlichen Inhaltsstoffe, die für die Synthese von Isotretinoin erforderlich sind, können direkt zu dem Reaktionsgefäß hinzugefügt werden, das für die Synthese des Wittig Salzes verwendet wurde.
- Nachdem ein Wittig Salz mit der Formel I hergestellt wurde, wird das Wittig Salz in einem Lösungsmittel aufgelöst, um eine Reaktionsmischung zu bilden. Vorzugsweise ist das Lösungsmittel ein polares aprotisches Lösungsmittel. Irgendein polares aprotisches Lösungsmittel oder eine Mischung von polaren aprotischen Lösungsmitteln kann in dem Verfahren der vorliegenden Erfindung verwendet werden. Beispiele von polaren aprotischen Lösungsmitteln, die in dem Verfahren der vorliegenden Erfindung verwendet werden können, schließen ein, sollen aber nicht eingeschränkt sein auf Methylenchlorid, Chloroform, Acetonitril, Tetrahydrofuran, 1,4-Dioxan, N,N'-Dimethylformamid, 1-Methyl-2-pyrrolidinon, 1,3-Dimethyl-2-imidazolidinon, N,N'-Dimethylacetamid und Mischungen davon. Zusätzlich kann das Lösungsmittel eine Mischung aus einem polaren aprotischen Lösungsmittel und einem nicht polaren Lösungsmittel sein. Beispiele von nicht polaren Lösungsmitteln, die in dem Verfahren der vorliegenden Erfindung verwendet werden können, schließen ein, sollen aber nicht eingeschränkt sein auf Toluen und Chlorbenzen.
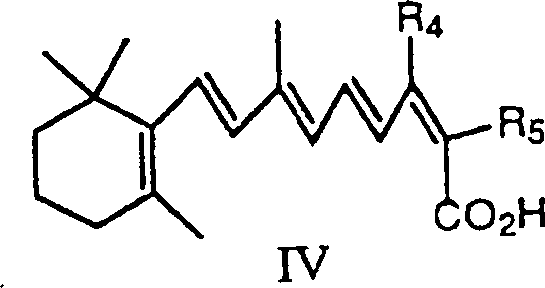
- In Übereinstimmung mit dem Verfahren der vorliegenden Erfindung wird das Wittig Salz der Formel I in einem Lösungsmittel in der Anwesenheit einer schwachen Base, und wahlweise einer Lewis Säure, mit einem Butenolid, das die Formel II hat reagiert: worin R4 und R5 unabhängig Wasserstoff, Niederalkyl, Alkoxy, Cycloalkyl, Aryl, oder Heterocyclus sind. In dem Verfahren zur Herstellung von Isotretinoin (Formel IV), ist R4 Methyl und R5 ist Wasserstoff:
- Die Reihenfolge der Zugabe der schwachen Base, der Lewis Säure und des Butenolids zu der Reaktionsmischung ist nicht entscheidend. Beim Ausführen der Reaktion der vorliegenden Erfindung kann man eine inerte Atmosphäre verwenden, wie beispielsweise Stickstoff, um die Oxidation des Endprodukts zu verhindern.
- Das molare Verhältnis von Butenolid zu dem Wittig Salz in der Reaktionsmischung ist von ungefähr 1:1 bis ungefähr 10:1, vorzugsweise von ungefähr 1:1 bis ungefähr 2:1.
- Irgendeine schwache Base kann in dem Verfahren der vorliegenden Erfindung verwendet werden. Wie hierin verwendet, bedeutet der Ausdruck "schwache Base" eine Base, die in Lösung einen niedrigen prozentualen Anteil an Ionisierung hat. Beispiele von schwachen Basen, die in der vorliegenden Erfindung verwendet werden können, schließen ein, sollen aber nicht eingeschränkt sein auf tertiäre Amine wie beispielsweise Triethylamin, Diisopropylethylamin und N-Ethylpiperidin, Carbonate, Bicarbonate und Acetate von Natrium, Kalium oder Caesium. Das molare Verhältnis von schwacher Base zu Butenolid in der Reaktionsmischung ist von ungefähr 2:1 bis ungefähr 10:1, vorzugsweise von ungefähr 3:1 bis ungefähr 7:1.
- Eine Lewis Säure kann wahlweise in dem Verfahren der vorliegenden Erfindung verwendet werden. Wie hierin verwendet, bezieht sich der Ausdruck "Lewis Säure" auf irgendein Molekül oder Ion (ein Elektrophil genannt), das mit einem anderen Molekül oder Ion durch Bilden einer Bindung mit zwei Elektronen kombiniert werden kann, um ein zweites Molekül oder Ion zu bilden. Beispiele von geeigneten Lewis Säuren, die in der vorliegenden Erfindung verwendet werden können, schließen ein, sollen aber nicht eingeschränkt sein auf Magnesiumchlorid, Magnesiumtriflat, Magnesiumbromid, Magnesiumtrifluoracetat, Magnesiumjodid und Magnesiumfluorid. Wenn eine Lewis Säure in dem Verfahren der vorliegenden Erfindung verwendet wird, wird es vorgezogen, daß vor dem Zusatz der Lewis Säure die Reaktionsmischung auf eine Temperatur von ungefähr –5°C bis ungefähr 15°C abgekühlt wird. Das molare Verhältnis von Lewis Säure zu Wittig Salz, das die Formel I hat, ist in der Reaktionsmischung von ungefähr 1:1 bis ungefähr 3:1, vorzugsweise von ungefähr 1,5:1 bis ungefähr 2,5:1.
- Nachdem das Butenolid, die schwache Base und wahlweise die Lewis Säure zu der Reaktionsmischung hinzugefügt wurden, wurde die Reaktionsmischung bei Umgebungstemperatur unter einer inerten Atmosphäre für einen Zeitraum von ungefähr 10 Stunden bis ungefähr 72 Stunden, vorzugsweise von ungefähr 15 Stunden bis ungefähr 48 Stunden gerührt. Nach dem Rühren wird das Isotretinoin unter Verwendung von Techniken, die im Fachgebiet bekannt sind, aus der Reaktionsmischung gewonnen.
- Unter Verwendung von herkömmlichen Bedingungen einer Wittig Reaktion, ist das erzeugte Hauptprodukt das 11-cis Isomer von Isotretinoin. In dem Verfahren der vorliegenden Erfindung wird die Stereoselektivität einer herkömmlichen Wittig Reaktion umgekehrt durch Reaktion des Wittig Salzes mit dem Butenolid in Anwesenheit einer schwachen Base, um vorzugsweise Isotretinoin herzustellen. Die Menge an aus der Reaktion gewonnenem Isotretinoin kann erhöht werden, wenn eine Lewis Säure in der Reaktionsmischung mit der schwachen Base verwendet wird.
- In einer bevorzugten Ausführungsform der vorliegenden Erfindung wird Butenolid und eine schwache Base zu der Reaktionsmischung hinzugefügt, die das Wittig Salz, aufgelöst in einem polaren aprotischen Lösungsmittel, enthält. Die resultierende Suspension wird auf 0°C abgekühlt, gefolgt von der Zugabe einer Lewis Säure. Die Reaktionsmischung wird für ungefähr 15 Stunden bei Umgebungstemperatur gerührt. Isotretinoin wird dann aus der Reaktionsmischung wiedergewonnen. Weil das Verfahren der vorliegenden Erfindung keinerlei Schwermetalle oder Photosensibilisatoren verwendet, ist die Qualität des Isotretinoins, das als ein Ergebnis des Verfahrens hergestellt wird, verbessert.
- Das folgende Beispiel veranschaulicht die bevorzugte Ausführungsform des Verfahrens der vorliegenden Erfindung und ist für die Beschreibung und die Ansprüche in keiner Weise einschränkend.
- BEISPIEL 1: Herstellung von Isotretinoin
- Synthese von Isotretinoin unter Verwendung von Triethylamin und Magnesiumchlorid
- N,N-Dimethylacetamid (300 Milliliter (ml)), 5-Hydroxy-4-methyl-2[5H]-furanon (26, 81 Gramm (g)), 235 Millimol (mmol), 1,2 Äquivalente) und Triethylamin (164 ml, 1,2 mole, 6 Äquivalente) wurden zu 107,26g (197 mmol) von [3-Methyl-5-(2, 6,6-trimethyl-1-cyclohexen-l-yl)-2,4-pentadienyl]triphenylphosphoniumsalz hinzugefügt. Die resultierende Mischung wurde auf 15°C abgekühlt vor der Zugabe von Magnesiumchlorid (30,03 g, 315 mmol, 1,6 Äquivalente). Man ließ die Reaktionsmischung bei Raumtemperatur für 17 Stunden rühren. Die Reaktionslösung wurde mit 200 ml Heptan gewaschen. Toluen (100 ml) wurde hinzugefügt und die Lösung wurde mit 280 ml 20 Vol% HCl angesäuert. Die wässerige Schicht wurde drei mal, jedes mal mit 200 ml einer 9:1 Heptan:Toluenmischung, zurückextrahiert. Die kombinierten organischen Schichten wurden mit wässerigem Methanol, Wasser gewaschen, und dann konzentriert, um einen orangen Feststoff zu ergeben. Heptan (250 ml) wurde zu dem rohen Feststoff hinzugefügt und die Aufschlämmung wurde auf 0°C gekühlt und dann gefiltert. Aceton (200 ml) und Heptan (800 ml) wurden zu dem Feststoff hinzugefügt und die resultierende Mischung wurde bei 25°C gerührt. Die Filtration dieser Aufschlämmung lieferte Isotretinoin mit >98% Reinheit als einen Feststoff.
Claims (19)
- Ein Verfahren zur Herstellung einer Verbindung von Formel IV: das die folgenden Schritte umfasst: a) Reagieren in einem Lösungsmittel in der Anwesenheit einer schwachen Base eines Butenolids der Formel II: mit einem Salz der Formel worin R1, R2 und R3 unabhängig gewählt sind aus Aryl oder Dialkylamino, R4 und R5 sind unabhängig gewählt aus Wasserstoff, Niederalkyl, Alkoxy, Cycloalkyl, Aryl oder Heterozyklus, und X ist gewählt aus Halogen oder Hydrogensulfat, um eine Reaktionsmischung zu bilden; und b) Gewinnen der Verbindung aus der Reaktionsmischung.
- Das Verfahren von Anspruch 1, worin das Lösungsmittel ein polares aprotisches Lösungsmittel ist.
- Das Verfahren von Anspruch 2, worin das polare aprotische Lösungsmittel gewählt ist aus der Gruppe bestehend aus: Methylenchlorid, Chloroform, Acetonitril, Tetrahydrofuran, 1,4-Dioxan, N,N'-Dimethylformamid, 1-Methyl-2-pyrrolidinon, 1,3-Dimethyl-2-imidazolidinon, N,N'-Dimethylacetamid und Mischungen davon.
- Das Verfahren von Anspruch 2, worin das Lösungsmittel eine Mischung aus einem polaren aprotischen Lösungsmittel und einem nicht-polaren Lösungsmittel ist.
- Das Verfahren von Anspruch 4, worin das nicht polare Lösungsmittel Toluen, Chlorbenzen oder Alkane ist.
- Das Verfahren von Anspruch 1, worin die schwache Base ein tertiäres Amin, Carbonat, Bicarbonat oder ein Acetat ist.
- Das Verfahren von Anspruch 6, worin die schwache Base gewählt ist aus tertiären Aminen, Natriumacetat, Kaliumacetat, Caesiumacetat und Natriumbicarbonat.
- Das Verfahren von Anspruch 1, worin die Verbindung 13-cis Retinsäure ist.
- Das Verfahren von Anspruch 1, worin das Verhältnis von schwacher Base zu Butenolid von 2:1 bis 10:1 ist.
- Das Verfahren von Anspruch 1, worin das Verhältnis von Butenolid zu dem Wittig Salz von 1:1 bis 10:1 ist.
- Ein Verfahren zur Herstellung einer Verbindung von Formel IV: wobei das Verfahren die Schritte Reagieren in einem Lösungsmittel in der Anwesenheit einer schwachen Base und einer Lewis Säure eines Butenolids der Formel II umfaßt: worin R1, R2 und R3 unabhängig gewählt sind aus Aryl oder Dialkylamino, und R4 und R5 sind unabhängig gewählt aus Wasserstoff, Niederalkyl, Alkoxy, Cycloalkyl, Aryl oder Heterozyklus, mit einem Salz der Formel I:
- Das Verfahren von Anspruch 11, worin das Lösungsmittel ein polares aprotisches Lösungsmittel oder eine Mischung aus einem polaren aprotischen Lösungsmittel und einem nicht-polaren Lösungsmittel ist.
- Das Verfahren von Anspruch 11, worin die Lewis Säure Magnesiumtriflat, Magnesiumbromid, Magnesiumtrifluoracetat, Magnesiumchlorid, Magnesiumjodid oder Magnesiumfluorid ist.
- Das Verfahren von Anspruch 11, worin das molare Verhältnis von Lewis Säure zu dem Wittig Salz von 1:1 bis 3:1 ist:
- Das Verfahren von Anspruch 11, worin das Verhältnis von schwacher Base zu Butenolid von 2:1 bis 10:1 ist.
- Das Verfahren von Anspruch 11, worin das Verhältnis von Butenolid zu dem Wittig Salz von 1:1 bis 10:1 ist.
- Das Verfahren von Anspruch 11, worin die Verbindung 13-cis Retinsäure ist.
- Das Verfahren von Anspruch 11, worin die schwache Base ein tertiäres Amin ist.
- Das Verfahren von Anspruch 18, worin das tertiäre Amin gewählt ist aus Triethylamin, Diisopropylethylamin und N-Ethylpiperidin.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US47700 | 1998-03-25 | ||
| US09/047,700 US6124485A (en) | 1998-03-25 | 1998-03-25 | Process for producing 13-cis retinoic acid |
| PCT/US1999/006385 WO1999048866A1 (en) | 1998-03-25 | 1999-03-23 | Process for producing 13-cis retinoic acid |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69918277D1 DE69918277D1 (de) | 2004-07-29 |
| DE69918277T2 true DE69918277T2 (de) | 2005-07-14 |
Family
ID=21950449
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69918277T Expired - Fee Related DE69918277T2 (de) | 1998-03-25 | 1999-03-23 | Verfahren zur herstellung von 13-cis retinsaüre |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US6124485A (de) |
| EP (1) | EP1066253B1 (de) |
| JP (1) | JP4532734B2 (de) |
| AT (1) | ATE269847T1 (de) |
| CA (1) | CA2325517A1 (de) |
| DE (1) | DE69918277T2 (de) |
| ES (1) | ES2229691T3 (de) |
| PT (1) | PT1066253E (de) |
| WO (1) | WO1999048866A1 (de) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102558007B (zh) * | 2011-12-31 | 2014-02-26 | 湖南师范大学 | 一种全反式维a酸类药物的合成方法 |
| CN104447459A (zh) * | 2014-11-28 | 2015-03-25 | 重庆华邦制药有限公司 | 异维a酸的新晶型及其制备方法与应用 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE32217T1 (de) * | 1982-12-10 | 1988-02-15 | Hoffmann La Roche | Verfahren zur herstellung von 13-cis-retinsaeure. |
| US4556518A (en) * | 1982-12-10 | 1985-12-03 | Hoffmann-La Roche Inc. | Preparation of 13-cis retinoic acid |
| US4556578A (en) * | 1983-06-30 | 1985-12-03 | Mallinckrodt, Inc. | NaCl-Free salt substitute containing potassium chloride, maltodextrin and potassium bitartrate and method of preparation |
| US5191110A (en) * | 1987-05-21 | 1993-03-02 | L'oreal | Process for the synthesis of vitamin A and certain ones of derivatives |
| US5061819A (en) * | 1988-10-31 | 1991-10-29 | Loyola University Of Chicago | Methods for synthesizing phosphonate reagents and retinoids |
| US4916250A (en) * | 1988-10-31 | 1990-04-10 | Loyola University Of Chicago | Phosphonate reagent compositions |
| JP3159413B2 (ja) * | 1993-01-20 | 2001-04-23 | 株式会社クラレ | 3−置換−4−ヒドロキシ−2−ブテノライドの製造方法 |
| DE4313089A1 (de) * | 1993-04-22 | 1994-10-27 | Basf Ag | Verfahren zur Herstellung von 13-(Z)-Retinsäure |
| JP3599403B2 (ja) * | 1995-02-24 | 2004-12-08 | 山之内製薬株式会社 | ベンズアゼピン誘導体の新規製造法 |
| IT1274494B (it) * | 1995-05-12 | 1997-07-17 | Lab Mag Spa | Procedimento fotochimico per la preparazione dell'acido 13-cis-retinoico |
| JPH10298173A (ja) * | 1997-04-30 | 1998-11-10 | Kuraray Co Ltd | 4−ヒドロキシ−2−ブテノリド類の製造方法 |
-
1998
- 1998-03-25 US US09/047,700 patent/US6124485A/en not_active Expired - Lifetime
-
1999
- 1999-03-23 AT AT99914082T patent/ATE269847T1/de not_active IP Right Cessation
- 1999-03-23 CA CA002325517A patent/CA2325517A1/en not_active Abandoned
- 1999-03-23 ES ES99914082T patent/ES2229691T3/es not_active Expired - Lifetime
- 1999-03-23 EP EP99914082A patent/EP1066253B1/de not_active Expired - Lifetime
- 1999-03-23 JP JP2000537849A patent/JP4532734B2/ja not_active Expired - Fee Related
- 1999-03-23 DE DE69918277T patent/DE69918277T2/de not_active Expired - Fee Related
- 1999-03-23 PT PT99914082T patent/PT1066253E/pt unknown
- 1999-03-23 WO PCT/US1999/006385 patent/WO1999048866A1/en not_active Ceased
-
2000
- 2000-01-18 US US09/484,675 patent/US20010018533A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| DE69918277D1 (de) | 2004-07-29 |
| US20010018533A1 (en) | 2001-08-30 |
| EP1066253B1 (de) | 2004-06-23 |
| ES2229691T3 (es) | 2005-04-16 |
| WO1999048866A1 (en) | 1999-09-30 |
| ATE269847T1 (de) | 2004-07-15 |
| US6124485A (en) | 2000-09-26 |
| JP4532734B2 (ja) | 2010-08-25 |
| JP2002507596A (ja) | 2002-03-12 |
| CA2325517A1 (en) | 1999-09-30 |
| EP1066253A1 (de) | 2001-01-10 |
| PT1066253E (pt) | 2004-10-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69908390T2 (de) | Transferhydrierungsverfahren | |
| CH670644A5 (de) | ||
| DE2159509A1 (de) | Herstellung von Prostaglandinestern | |
| EP0644186B1 (de) | Verfahren zur Herstellung von 13-(Z)-Retinsäure | |
| DE69918277T2 (de) | Verfahren zur herstellung von 13-cis retinsaüre | |
| DE2003486C3 (de) | Verfahren zur Spaltung von racemisehen organischen Aminen durch die ( )-Di-O-isopropyliden-2-keto-L-gulonsäure | |
| EP1067129B1 (de) | Racemisierung von R,S-Dioxo-benzylpyrrolopiperidin | |
| DE2109339A1 (de) | Mono und dl substituierte Sulfamoyl benzoesauren | |
| EP0397042B1 (de) | Herstellung von Isochinolinderivaten | |
| DE2258257A1 (de) | Citronensaeurederivate | |
| EP0111325B1 (de) | Verfahren zur Herstellung von 13-cis-Retinsäure | |
| DE1620522A1 (de) | Verfahren zur Herstellung von 5-substituierten Isoxazolidonverbindungen | |
| DE19926972A1 (de) | Ketosulfonderivate und Verfahren zu deren Herstellung | |
| EP1076646B1 (de) | Verfahren zur stereochemisch kontrollierten herstellung isomerenreiner hochsubstituierter azacyclischer verbindungen | |
| DE19926090A1 (de) | Verfahren und Zwischenprodukt zur Herstellung von Retinal | |
| DE2931295C2 (de) | ||
| DE2527654A1 (de) | Olefinische sulfone, verfahren zu ihrer herstellung und ihre verwendung fuer die herstellung von biologisch aktiven produkten | |
| MXPA00009377A (en) | Process for producing 13-cis retinoic acid | |
| CH535236A (de) | Verfahren zur Herstellung neuer reaktionsträger Lysergsäurederivate | |
| DE2013527C3 (de) | Verfahren zur Herstellung von 1 -Alkylamino-S-aryloxy^-propanolen | |
| DE2453229A1 (de) | Rhodiumhaltige komplexverbindungen | |
| DE1445680C (de) | Verfahren zur Herstellung von 3 Aminopyrazol aus 3 Amino Delta hoch 3 pyrazolin | |
| CH581625A5 (en) | 2-dimethylallylbenzomorphans - analgesics | |
| AT388912B (de) | Verfahren zur herstellung von alkylendiaminen und ihren salzen | |
| DE943947C (de) | Verfahren zur Herstellung der erythro-1-p-Nitrophenyl-2-amino-1, 3-propandiole |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |