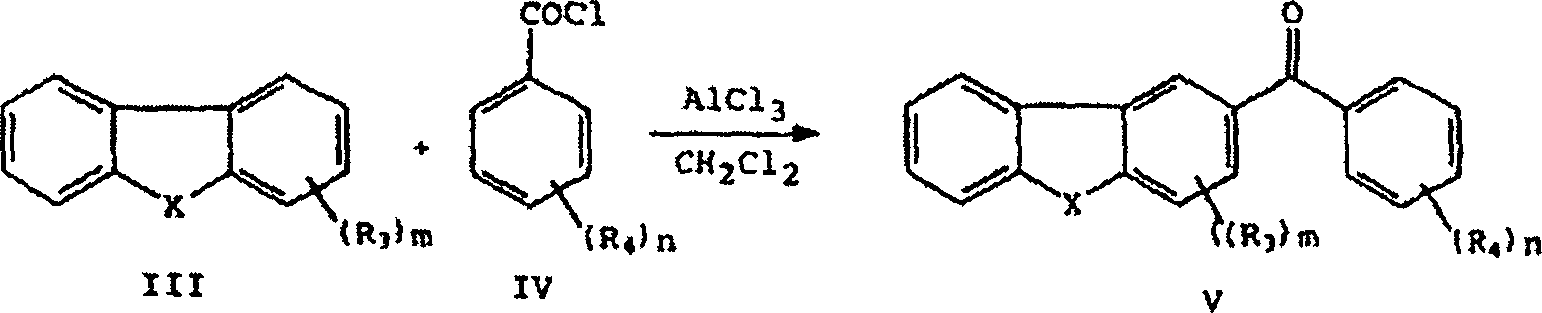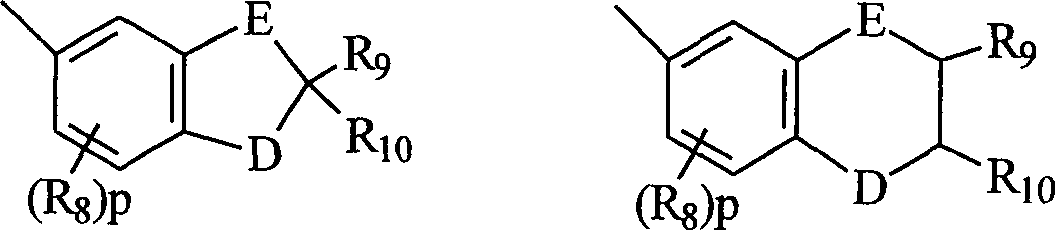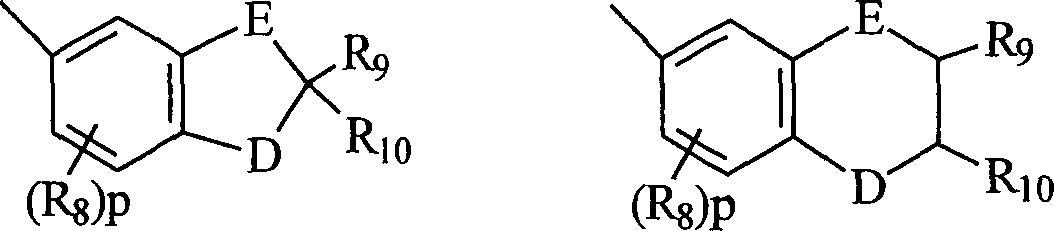DE69730833T2 - Photochrome heterocyclische annelierte indenonaphthopyrane - Google Patents
Photochrome heterocyclische annelierte indenonaphthopyrane Download PDFInfo
- Publication number
- DE69730833T2 DE69730833T2 DE69730833T DE69730833T DE69730833T2 DE 69730833 T2 DE69730833 T2 DE 69730833T2 DE 69730833 T DE69730833 T DE 69730833T DE 69730833 T DE69730833 T DE 69730833T DE 69730833 T2 DE69730833 T2 DE 69730833T2
- Authority
- DE
- Germany
- Prior art keywords
- alkyl
- mono
- alkoxy
- group
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- -1 Indenonaphthopyran compound Chemical class 0.000 claims description 78
- 150000001875 compounds Chemical class 0.000 claims description 40
- 239000001257 hydrogen Substances 0.000 claims description 40
- 229910052739 hydrogen Inorganic materials 0.000 claims description 40
- 239000000178 monomer Substances 0.000 claims description 37
- 239000000463 material Substances 0.000 claims description 34
- 125000001997 phenyl group Chemical class [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 31
- 239000000126 substance Substances 0.000 claims description 27
- 125000001424 substituent group Chemical group 0.000 claims description 23
- 125000000623 heterocyclic group Chemical group 0.000 claims description 21
- 125000003118 aryl group Chemical group 0.000 claims description 20
- 150000002431 hydrogen Chemical class 0.000 claims description 20
- 125000001624 naphthyl group Chemical group 0.000 claims description 20
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 19
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 17
- 229920001577 copolymer Chemical compound 0.000 claims description 17
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 16
- 239000000460 chlorine Substances 0.000 claims description 16
- 229910052801 chlorine Inorganic materials 0.000 claims description 16
- 229910052731 fluorine Inorganic materials 0.000 claims description 16
- 229910052799 carbon Inorganic materials 0.000 claims description 15
- 239000011737 fluorine Substances 0.000 claims description 15
- 229920000642 polymer Polymers 0.000 claims description 15
- 150000002430 hydrocarbons Chemical group 0.000 claims description 12
- UEOGLANRPZAEAC-UHFFFAOYSA-N indeno-naphthopyran Chemical class O1C=CC=C2C3=C4C=C(C=CC=C5)C5=C4C=CC3=CC=C21 UEOGLANRPZAEAC-UHFFFAOYSA-N 0.000 claims description 12
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 10
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 10
- 229910052760 oxygen Chemical group 0.000 claims description 10
- 239000001301 oxygen Chemical group 0.000 claims description 10
- 125000001153 fluoro group Chemical group F* 0.000 claims description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 9
- XFCMNSHQOZQILR-UHFFFAOYSA-N 2-[2-(2-methylprop-2-enoyloxy)ethoxy]ethyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCOCCOC(=O)C(C)=C XFCMNSHQOZQILR-UHFFFAOYSA-N 0.000 claims description 8
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 8
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 8
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 8
- 229910052794 bromium Inorganic materials 0.000 claims description 8
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 claims description 8
- 239000000203 mixture Substances 0.000 claims description 8
- 230000003287 optical effect Effects 0.000 claims description 8
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 8
- 229920006395 saturated elastomer Polymers 0.000 claims description 8
- 125000003003 spiro group Chemical group 0.000 claims description 8
- 125000001544 thienyl group Chemical group 0.000 claims description 8
- JHQVCQDWGSXTFE-UHFFFAOYSA-N 2-(2-prop-2-enoxycarbonyloxyethoxy)ethyl prop-2-enyl carbonate Chemical compound C=CCOC(=O)OCCOCCOC(=O)OCC=C JHQVCQDWGSXTFE-UHFFFAOYSA-N 0.000 claims description 7
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 7
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 claims description 7
- 229910052757 nitrogen Inorganic materials 0.000 claims description 7
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 claims description 6
- 238000010521 absorption reaction Methods 0.000 claims description 6
- 125000004244 benzofuran-2-yl group Chemical group [H]C1=C(*)OC2=C([H])C([H])=C([H])C([H])=C12 0.000 claims description 6
- 125000004534 benzothien-2-yl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 claims description 6
- JKJWYKGYGWOAHT-UHFFFAOYSA-N bis(prop-2-enyl) carbonate Chemical compound C=CCOC(=O)OCC=C JKJWYKGYGWOAHT-UHFFFAOYSA-N 0.000 claims description 6
- QIWKUEJZZCOPFV-UHFFFAOYSA-N phenyl 2-methylprop-2-enoate Chemical class CC(=C)C(=O)OC1=CC=CC=C1 QIWKUEJZZCOPFV-UHFFFAOYSA-N 0.000 claims description 6
- 125000000587 piperidin-1-yl group Chemical class [H]C1([H])N(*)C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 6
- 125000004309 pyranyl group Chemical class O1C(C=CC=C1)* 0.000 claims description 6
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical class FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 claims description 6
- 125000004890 (C1-C6) alkylamino group Chemical group 0.000 claims description 5
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 claims description 5
- 150000001562 benzopyrans Chemical class 0.000 claims description 5
- 229920005862 polyol Polymers 0.000 claims description 5
- 150000003077 polyols Chemical class 0.000 claims description 5
- 239000004814 polyurethane Substances 0.000 claims description 5
- 229920002635 polyurethane Polymers 0.000 claims description 5
- 125000002733 (C1-C6) fluoroalkyl group Chemical group 0.000 claims description 4
- HIACAHMKXQESOV-UHFFFAOYSA-N 1,2-bis(prop-1-en-2-yl)benzene Chemical compound CC(=C)C1=CC=CC=C1C(C)=C HIACAHMKXQESOV-UHFFFAOYSA-N 0.000 claims description 4
- 125000004171 alkoxy aryl group Chemical group 0.000 claims description 4
- 125000004104 aryloxy group Chemical group 0.000 claims description 4
- QUZSUMLPWDHKCJ-UHFFFAOYSA-N bisphenol A dimethacrylate Chemical class C1=CC(OC(=O)C(=C)C)=CC=C1C(C)(C)C1=CC=C(OC(=O)C(C)=C)C=C1 QUZSUMLPWDHKCJ-UHFFFAOYSA-N 0.000 claims description 4
- 125000001246 bromo group Chemical group Br* 0.000 claims description 4
- STVZJERGLQHEKB-UHFFFAOYSA-N ethylene glycol dimethacrylate Chemical compound CC(=C)C(=O)OCCOC(=O)C(C)=C STVZJERGLQHEKB-UHFFFAOYSA-N 0.000 claims description 4
- 125000002541 furyl group Chemical group 0.000 claims description 4
- 150000002829 nitrogen Chemical class 0.000 claims description 4
- 229920002037 poly(vinyl butyral) polymer Polymers 0.000 claims description 4
- 229920001223 polyethylene glycol Polymers 0.000 claims description 4
- 239000004926 polymethyl methacrylate Substances 0.000 claims description 4
- 229920002689 polyvinyl acetate Polymers 0.000 claims description 4
- 239000011118 polyvinyl acetate Substances 0.000 claims description 4
- 239000011347 resin Substances 0.000 claims description 4
- 229920005989 resin Polymers 0.000 claims description 4
- 229920001169 thermoplastic Polymers 0.000 claims description 4
- 239000004416 thermosoftening plastic Substances 0.000 claims description 4
- GTELLNMUWNJXMQ-UHFFFAOYSA-N 2-ethyl-2-(hydroxymethyl)propane-1,3-diol;prop-2-enoic acid Chemical class OC(=O)C=C.OC(=O)C=C.OC(=O)C=C.CCC(CO)(CO)CO GTELLNMUWNJXMQ-UHFFFAOYSA-N 0.000 claims description 3
- XVIMXPFMJNJACY-UHFFFAOYSA-N 6-oxapentacyclo[12.7.0.02,7.08,13.015,20]henicosa-1(21),2,4,7,9,11,13,15,17,19-decaene Chemical compound C1=CC=CC2=C3C4=CC=CC=C4C=C3C3=CC=COC3=C21 XVIMXPFMJNJACY-UHFFFAOYSA-N 0.000 claims description 3
- JYUCUBBIDFTEQV-UHFFFAOYSA-N C1=CC=C2C(=C1)C3=C(O2)C=CC4=C3C=C5C4=C6C=CC=CC6=C7C5=CC=CO7 Chemical compound C1=CC=C2C(=C1)C3=C(O2)C=CC4=C3C=C5C4=C6C=CC=CC6=C7C5=CC=CO7 JYUCUBBIDFTEQV-UHFFFAOYSA-N 0.000 claims description 3
- CERQOIWHTDAKMF-UHFFFAOYSA-M Methacrylate Chemical compound CC(=C)C([O-])=O CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 claims description 3
- 239000004793 Polystyrene Substances 0.000 claims description 3
- 229920002301 cellulose acetate Polymers 0.000 claims description 3
- 229920006217 cellulose acetate butyrate Polymers 0.000 claims description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 3
- 229920003229 poly(methyl methacrylate) Polymers 0.000 claims description 3
- 229920000515 polycarbonate Polymers 0.000 claims description 3
- 239000004417 polycarbonate Substances 0.000 claims description 3
- 229920000728 polyester Polymers 0.000 claims description 3
- 229920002223 polystyrene Polymers 0.000 claims description 3
- 239000007787 solid Substances 0.000 claims description 3
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 2
- FAQVDANXTSFXGA-UHFFFAOYSA-N 2,3-dihydro-1h-benzo[g]indole Chemical compound C1=CC=CC2=C(NCC3)C3=CC=C21 FAQVDANXTSFXGA-UHFFFAOYSA-N 0.000 claims description 2
- OOXMQACSWCZQLX-UHFFFAOYSA-N 3,9-bis(ethenyl)-2,4,8,10-tetraoxaspiro[5.5]undecane Chemical compound C1OC(C=C)OCC21COC(C=C)OC2 OOXMQACSWCZQLX-UHFFFAOYSA-N 0.000 claims description 2
- UIYCIISWTDMWTR-UHFFFAOYSA-N C(C=C)(=O)OBrOC(C(=C)C)=O Chemical compound C(C=C)(=O)OBrOC(C(=C)C)=O UIYCIISWTDMWTR-UHFFFAOYSA-N 0.000 claims description 2
- 229920008347 Cellulose acetate propionate Polymers 0.000 claims description 2
- 229920002284 Cellulose triacetate Polymers 0.000 claims description 2
- 229920001328 Polyvinylidene chloride Polymers 0.000 claims description 2
- NNLVGZFZQQXQNW-ADJNRHBOSA-N [(2r,3r,4s,5r,6s)-4,5-diacetyloxy-3-[(2s,3r,4s,5r,6r)-3,4,5-triacetyloxy-6-(acetyloxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6s)-4,5,6-triacetyloxy-2-(acetyloxymethyl)oxan-3-yl]oxyoxan-2-yl]methyl acetate Chemical compound O([C@@H]1O[C@@H]([C@H]([C@H](OC(C)=O)[C@H]1OC(C)=O)O[C@H]1[C@@H]([C@@H](OC(C)=O)[C@H](OC(C)=O)[C@@H](COC(C)=O)O1)OC(C)=O)COC(=O)C)[C@@H]1[C@@H](COC(C)=O)O[C@@H](OC(C)=O)[C@H](OC(C)=O)[C@H]1OC(C)=O NNLVGZFZQQXQNW-ADJNRHBOSA-N 0.000 claims description 2
- 125000004532 benzofuran-3-yl group Chemical group O1C=C(C2=C1C=CC=C2)* 0.000 claims description 2
- 125000004197 benzothien-3-yl group Chemical group [H]C1=C(*)C2=C([H])C([H])=C([H])C([H])=C2S1 0.000 claims description 2
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 claims description 2
- 150000008371 chromenes Chemical class 0.000 claims description 2
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 2
- 125000004986 diarylamino group Chemical group 0.000 claims description 2
- 125000004988 dibenzothienyl group Chemical group C1(=CC=CC=2SC3=C(C21)C=CC=C3)* 0.000 claims description 2
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 claims description 2
- 125000004407 fluoroaryl group Chemical group 0.000 claims description 2
- AQYSYJUIMQTRMV-UHFFFAOYSA-N hypofluorous acid Chemical compound FO AQYSYJUIMQTRMV-UHFFFAOYSA-N 0.000 claims description 2
- 229910052751 metal Inorganic materials 0.000 claims description 2
- 239000002184 metal Substances 0.000 claims description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 2
- 150000004893 oxazines Chemical class 0.000 claims description 2
- 125000005702 oxyalkylene group Chemical group 0.000 claims description 2
- 229920003251 poly(α-methylstyrene) Polymers 0.000 claims description 2
- 229920000139 polyethylene terephthalate Polymers 0.000 claims description 2
- 239000005020 polyethylene terephthalate Substances 0.000 claims description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 claims description 2
- 239000004800 polyvinyl chloride Substances 0.000 claims description 2
- 229920000915 polyvinyl chloride Polymers 0.000 claims description 2
- 150000005846 sugar alcohols Polymers 0.000 claims description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims 5
- 125000006615 aromatic heterocyclic group Chemical group 0.000 claims 3
- 125000006559 (C1-C3) alkylamino group Chemical group 0.000 claims 2
- 125000002877 alkyl aryl group Chemical group 0.000 claims 2
- 125000003282 alkyl amino group Chemical group 0.000 claims 1
- 125000000217 alkyl group Chemical group 0.000 claims 1
- 125000000000 cycloalkoxy group Chemical group 0.000 claims 1
- CUILPNURFADTPE-UHFFFAOYSA-N hypobromous acid Chemical compound BrO CUILPNURFADTPE-UHFFFAOYSA-N 0.000 claims 1
- 238000006243 chemical reaction Methods 0.000 description 19
- 238000000034 method Methods 0.000 description 8
- 230000007935 neutral effect Effects 0.000 description 8
- 239000012780 transparent material Substances 0.000 description 7
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 6
- 150000004880 oxines Chemical class 0.000 description 6
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 5
- 239000003086 colorant Substances 0.000 description 5
- 150000002148 esters Chemical class 0.000 description 5
- GFSXWQUSLTVUBW-UHFFFAOYSA-N 10bh-benzo[h]chromene Chemical compound C1=CC=C2C3OC=CC=C3C=CC2=C1 GFSXWQUSLTVUBW-UHFFFAOYSA-N 0.000 description 4
- VCMLCMCXCRBSQO-UHFFFAOYSA-N 3h-benzo[f]chromene Chemical class C1=CC=CC2=C(C=CCO3)C3=CC=C21 VCMLCMCXCRBSQO-UHFFFAOYSA-N 0.000 description 4
- 241000569510 Spino Species 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 150000002576 ketones Chemical class 0.000 description 4
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- 0 C(C1)CC1C1C*CC1 Chemical compound C(C1)CC1C1C*CC1 0.000 description 3
- QGJOPFRUJISHPQ-UHFFFAOYSA-N Carbon disulfide Chemical compound S=C=S QGJOPFRUJISHPQ-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 239000000975 dye Substances 0.000 description 3
- 229920001519 homopolymer Polymers 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- SJJCQDRGABAVBB-UHFFFAOYSA-N 1-hydroxy-2-naphthoic acid Chemical class C1=CC=CC2=C(O)C(C(=O)O)=CC=C21 SJJCQDRGABAVBB-UHFFFAOYSA-N 0.000 description 2
- MGADZUXDNSDTHW-UHFFFAOYSA-N 2H-pyran Chemical compound C1OC=CC=C1 MGADZUXDNSDTHW-UHFFFAOYSA-N 0.000 description 2
- 238000005727 Friedel-Crafts reaction Methods 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical compound C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 238000004020 luminiscence type Methods 0.000 description 2
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 2
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 2
- 238000006053 organic reaction Methods 0.000 description 2
- 239000006223 plastic coating Substances 0.000 description 2
- 229920006254 polymer film Polymers 0.000 description 2
- TVDSBUOJIPERQY-UHFFFAOYSA-N prop-2-yn-1-ol Chemical compound OCC#C TVDSBUOJIPERQY-UHFFFAOYSA-N 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- 238000012795 verification Methods 0.000 description 2
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 1
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 description 1
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical class C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 1
- ITHGKFNFXCDUDC-UHFFFAOYSA-N 2,3-dihydro-1h-benzo[g]indole;2h-pyrido[2,3-h][1,2]benzoxazine Chemical class C1=CC=CC2=C(NCC3)C3=CC=C21.C1=CC2=NC=CC=C2C2=C1C=CNO2 ITHGKFNFXCDUDC-UHFFFAOYSA-N 0.000 description 1
- WBIQQQGBSDOWNP-UHFFFAOYSA-N 2-dodecylbenzenesulfonic acid Chemical compound CCCCCCCCCCCCC1=CC=CC=C1S(O)(=O)=O WBIQQQGBSDOWNP-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- VCDAWCBLCCVSKE-UHFFFAOYSA-N 2h-benzo[h]chromene Chemical class C1=CC2=CC=CC=C2C2=C1C=CCO2 VCDAWCBLCCVSKE-UHFFFAOYSA-N 0.000 description 1
- WGKGXTCSZHEWRU-UHFFFAOYSA-N 2h-naphtho[2,1-h]chromene Chemical class C1=CC2=CC=C3C=CC=CC3=C2C2=C1C=CCO2 WGKGXTCSZHEWRU-UHFFFAOYSA-N 0.000 description 1
- 125000003682 3-furyl group Chemical group O1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- QXXOQHRPPIEPBG-UHFFFAOYSA-N 3h-naphtho[1,2-h]chromene Chemical class C1=CC2=CC=CC=C2C(C=C2)=C1C1=C2C=CCO1 QXXOQHRPPIEPBG-UHFFFAOYSA-N 0.000 description 1
- 150000000565 5-membered heterocyclic compounds Chemical class 0.000 description 1
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 1
- 241000272517 Anseriformes Species 0.000 description 1
- KYNSBQPICQTCGU-UHFFFAOYSA-N Benzopyrane Chemical compound C1=CC=C2C=CCOC2=C1 KYNSBQPICQTCGU-UHFFFAOYSA-N 0.000 description 1
- 229920002799 BoPET Polymers 0.000 description 1
- GEUYPZMYEBVITI-UHFFFAOYSA-N C1=CC2=CC=COC2=C2C1=CC=C1C3=CC=CC=C3C=C21 Chemical class C1=CC2=CC=COC2=C2C1=CC=C1C3=CC=CC=C3C=C21 GEUYPZMYEBVITI-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- DQEFEBPAPFSJLV-UHFFFAOYSA-N Cellulose propionate Chemical compound CCC(=O)OCC1OC(OC(=O)CC)C(OC(=O)CC)C(OC(=O)CC)C1OC1C(OC(=O)CC)C(OC(=O)CC)C(OC(=O)CC)C(COC(=O)CC)O1 DQEFEBPAPFSJLV-UHFFFAOYSA-N 0.000 description 1
- MUXOBHXGJLMRAB-UHFFFAOYSA-N Dimethyl succinate Chemical compound COC(=O)CCC(=O)OC MUXOBHXGJLMRAB-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 238000006000 Knoevenagel condensation reaction Methods 0.000 description 1
- 229920004142 LEXAN™ Polymers 0.000 description 1
- 239000004418 Lexan Substances 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 239000005041 Mylar™ Substances 0.000 description 1
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 1
- 229920005372 Plexiglas® Polymers 0.000 description 1
- 238000006680 Reformatsky reaction Methods 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 238000006600 Stobbe condensation reaction Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical class [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- 229910021627 Tin(IV) chloride Inorganic materials 0.000 description 1
- 150000001266 acyl halides Chemical class 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- DCBMHXCACVDWJZ-UHFFFAOYSA-N adamantylidene Chemical group C1C(C2)CC3[C]C1CC2C3 DCBMHXCACVDWJZ-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- HOPRXXXSABQWAV-UHFFFAOYSA-N anhydrous collidine Natural products CC1=CC=NC(C)=C1C HOPRXXXSABQWAV-UHFFFAOYSA-N 0.000 description 1
- 239000012965 benzophenone Substances 0.000 description 1
- 150000008366 benzophenones Chemical class 0.000 description 1
- PASDCCFISLVPSO-UHFFFAOYSA-N benzoyl chloride Chemical class ClC(=O)C1=CC=CC=C1 PASDCCFISLVPSO-UHFFFAOYSA-N 0.000 description 1
- OOSCHYDNHHSIKU-UHFFFAOYSA-N bicyclo[4.3.2]undecane Chemical compound C1CC2CCCC1CCCC2 OOSCHYDNHHSIKU-UHFFFAOYSA-N 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 229920001727 cellulose butyrate Polymers 0.000 description 1
- 229920006218 cellulose propionate Polymers 0.000 description 1
- 239000012320 chlorinating reagent Substances 0.000 description 1
- QZHPTGXQGDFGEN-UHFFFAOYSA-N chromene Chemical compound C1=CC=C2C=C[CH]OC2=C1 QZHPTGXQGDFGEN-UHFFFAOYSA-N 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 239000008199 coating composition Substances 0.000 description 1
- UTBIMNXEDGNJFE-UHFFFAOYSA-N collidine Natural products CC1=CC=C(C)C(C)=N1 UTBIMNXEDGNJFE-UHFFFAOYSA-N 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 238000006210 cyclodehydration reaction Methods 0.000 description 1
- 125000004386 diacrylate group Chemical group 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 229940060296 dodecylbenzenesulfonic acid Drugs 0.000 description 1
- 239000000428 dust Substances 0.000 description 1
- 230000005670 electromagnetic radiation Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 230000004438 eyesight Effects 0.000 description 1
- 238000005562 fading Methods 0.000 description 1
- YLQWCDOCJODRMT-UHFFFAOYSA-N fluoren-9-one Chemical compound C1=CC=C2C(=O)C3=CC=CC=C3C2=C1 YLQWCDOCJODRMT-UHFFFAOYSA-N 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 150000002390 heteroarenes Chemical class 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000000976 ink Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- VGKONPUVOVVNSU-UHFFFAOYSA-N naphthalen-1-yl acetate Chemical class C1=CC=C2C(OC(=O)C)=CC=CC2=C1 VGKONPUVOVVNSU-UHFFFAOYSA-N 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 238000010422 painting Methods 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 239000002985 plastic film Substances 0.000 description 1
- 229920006255 plastic film Polymers 0.000 description 1
- 229920005668 polycarbonate resin Polymers 0.000 description 1
- 239000004431 polycarbonate resin Substances 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 229910052717 sulfur Chemical group 0.000 description 1
- 239000011593 sulfur Chemical group 0.000 description 1
- GFYHSKONPJXCDE-UHFFFAOYSA-N sym-collidine Natural products CC1=CN=C(C)C(C)=C1 GFYHSKONPJXCDE-UHFFFAOYSA-N 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 239000004753 textile Substances 0.000 description 1
- HPGGPRDJHPYFRM-UHFFFAOYSA-J tin(iv) chloride Chemical compound Cl[Sn](Cl)(Cl)Cl HPGGPRDJHPYFRM-UHFFFAOYSA-J 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 238000001429 visible spectrum Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D493/00—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system
- C07D493/02—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system in which the condensed system contains two hetero rings
- C07D493/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
- C09B57/02—Coumarine dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K9/00—Tenebrescent materials, i.e. materials for which the range of wavelengths for energy absorption is changed as a result of excitation by some form of energy
- C09K9/02—Organic tenebrescent materials
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B5/00—Optical elements other than lenses
- G02B5/20—Filters
- G02B5/22—Absorbing filters
- G02B5/23—Photochromic filters
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Materials Engineering (AREA)
- General Physics & Mathematics (AREA)
- Engineering & Computer Science (AREA)
- Pyrane Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Description
- Die vorliegende Erfindung betrifft bestimmte neue Naphthopyranverbindungen. Genauer gesagt betrifft die Erfindung neue fotochrome heterocyclisch fusionierte Indenonapthopyran-Verbindungen und Zusammensetzungen und Gegenstände, die solche neuen Indenonaphthopyran-Verbindungen enthalten. Wenn sie elektromagnetischer Strahlung, die ultraviolette Strahlen enthält, wie beispielweise ultravioletter Strahlung im Sonnenlicht oder dem Licht einer Quecksilberdampflampe, ausgesetzt werden, zeigen viele fotochrome Verbindungen eine reversible Änderung in ihrer Farbe. Wenn die ultraviolette Strahlung unterbrochen wird, wird eine solche fotochrome Verbindung zum Zustand ihrer ursprünglichen Farbe oder Farblosigkeit zurückkehren.
- Verschiedene Klassen von fotochromen Verbindungen wurden synthetisiert und zur Verwendung in Anwendungen vorgeschlagen, in welchen eine von Sonnenlicht induzierte reversible Farbänderung oder Verdunkelung gewünscht wird. US-Patent 3,567,605 (Becker) beschreibt eine Serie von Pyranderivaten, die bestimmte Benzopyrane und Napthopyrane einschließen. Diese Verbindungen werden als Derivate von Chromen beschrieben und es wird beschrieben, dass sie einer Farbänderung, z. B. von Farblos nach Gelb-Orange infolge von Bestrahlung durch ultraviolettes Licht bei Temperaturen unterhalb von –30°C unterzogen werden. Bestrahlung der Verbindungen mit sichtbarem Licht oder Anstieg der Temperatur auf etwa 0°C bringt die Färbung – wie berichtet – in einen farblosen Zustand zurück.
- US-Patent 5,066,818 beschreibt verschiedene 3,3-Diaryl-3H-naphtho[2,1-b]pyrane als die gewünschten fotochromen Eigenschaften aufweisend, d. h. hohe Färbbarkeit und akzeptables Verblassen, für die Behandlung von Augenkrankheiten und andere Anwendungen. Im Rahmen eines Vergleichsbeispiels in dem '818-Patent werden auch die Isomeren 2,2-Diaryl-2H-naphtho[1,2-b]pyrane, von denen berichtet wird, dass sie unakzeptabel lange Zeiträume benötigen, um nach der Aktivierung zu verblassen, offenbart.
- US-Patent 3,627,690 beschreibt fotochrome 2,2-disubstituierte 2H-Naphtho[1,2-b]pyranverbindungen, die kleinere Mengen entweder einer Base oder einer schwachen bis mittelstarken Säure enthalten. Die Zugabe entweder einer Säure oder einer Base zu der Naphthopyranverbindung – so wird beschrieben – vergrößert die Verblassungsrate der gefärbten Naphthopyrane, was sie sinnvoll in Anwendungen zum Augenschutz, beispielsweise für Sonnenbrillen, macht. Es wird dort des Weiteren berichtet, dass die Verblassungsrate von 2H-Naphtho[1,2-b]pyranen ohne die zuvor genannten Additiva von mehreren Stunden bis mehrere Tage dauert, um vollständige Zurückbildung zu erlangen.
- US-Patent 4,818,096 offenbart purpur-/blaufarbene fotochrome Benzo- oder Naphthopyrane, die an der α-Position zum Sauerstoff des Pyranrings eine Vinylgruppe aufweisen mit einem Stickstoff- enthaltenden Substituenten in der ortho- bzw. para-Position. WO 96/14596 beschreibt neue fotochrome indenofusionierte Naphthopyranverbindungen, wobei die 2,1-Positionen der Indenogruppe an die f-Seite des Naphthopyrans fusioniert ist.
- Die vorliegende Erfindung betrifft neu Indenonaphtho[1,2-b]pyranverbindungen, die einen substituierten oder unsubstituierten heterocyclischen Ring aufweisen, dessen 2,3- oder 3,2-Positionen mit der d-, h-, i-, n-, o- oder p-Seite des Indenonaphthopyrans fusioniert sind, und bestimmte Substituenten an der 3-Position des Pyranrings. Es hat sich unerwarteterweise herausgestellt, dass diese Verbindungen einen bathochromen Shift der Wellenlänge in das sichtbare Spektrum zeigen, in welchem die maximale Absorption der aktivierten (farbigen) Form der fotochromen Verbindung, d. h. der λmax-Wert (Vis), auftritt, was dann in aktivierten Farben, die von Orange zu Blau/Grau reichen, resultiert.
- Detaillierte Beschreibung der Erfindung
- In jüngster Zeit waren fotochrome Materialien aus Plastik, insbesondere Materialien aus Plastik für optische Anwendungen Gegenstand von merklicher Aufmerksamkeit. Speziell fotochrome Brillengläser aus Plastik wurden untersucht, da sie Gewichtsvorteile bieten im Vergleich zu Brillengläser aus Glas. Darüber hinaus waren fotochrome transparente Materialien für Fahrzeuge, wie z. B. Autos und Flugzeuge, wegen ihren potenziellen Sicherheitseigenschaften, die solche transparente Materialien bieten von Interesse.
- In Übereinstimmung mit der vorliegenden Erfindung wurde nun festgestellt, dass bestimmte neue Indeno[2,1-f]naphtho[1,2-b]pyrane aktivierte Farben aufweisen, die von Orange nach Blau/Grau reichen, hergestellt werden können. Diese Verbindungen können als Indenonaphthopyrane beschrieben werden, die einen unsubstituierten, monosubstituierten oder disubstituierten heterocyclischen Ring, dessen 2,3- oder 3,2-Positionen mit den g-, h-, i-, n-, o- oder p-Seiten des Indenonaphthopyrans fusioniert sind und bestimmte Substituenten an der 3-Position des Pyranrings aufweisen. Bestimmte Substituenten können auch an den Nr. 5, 6, 7 oder 8 Kohlenstoffatomen der Naphthopyran-Verbindung vorhanden sein, wenn der heterocyclische Ring an die n-, o- oder p-Seite des Indenonaphthopyrans fusioniert wird; oder an den 9, 10, 11 oder 12 Kohlenstoffatomen der Naphthopyranverbindung, wenn der heterocyclische Ring an die g-, h- oder i-Seite des Indenonaphthopyrans fusioniert wird.
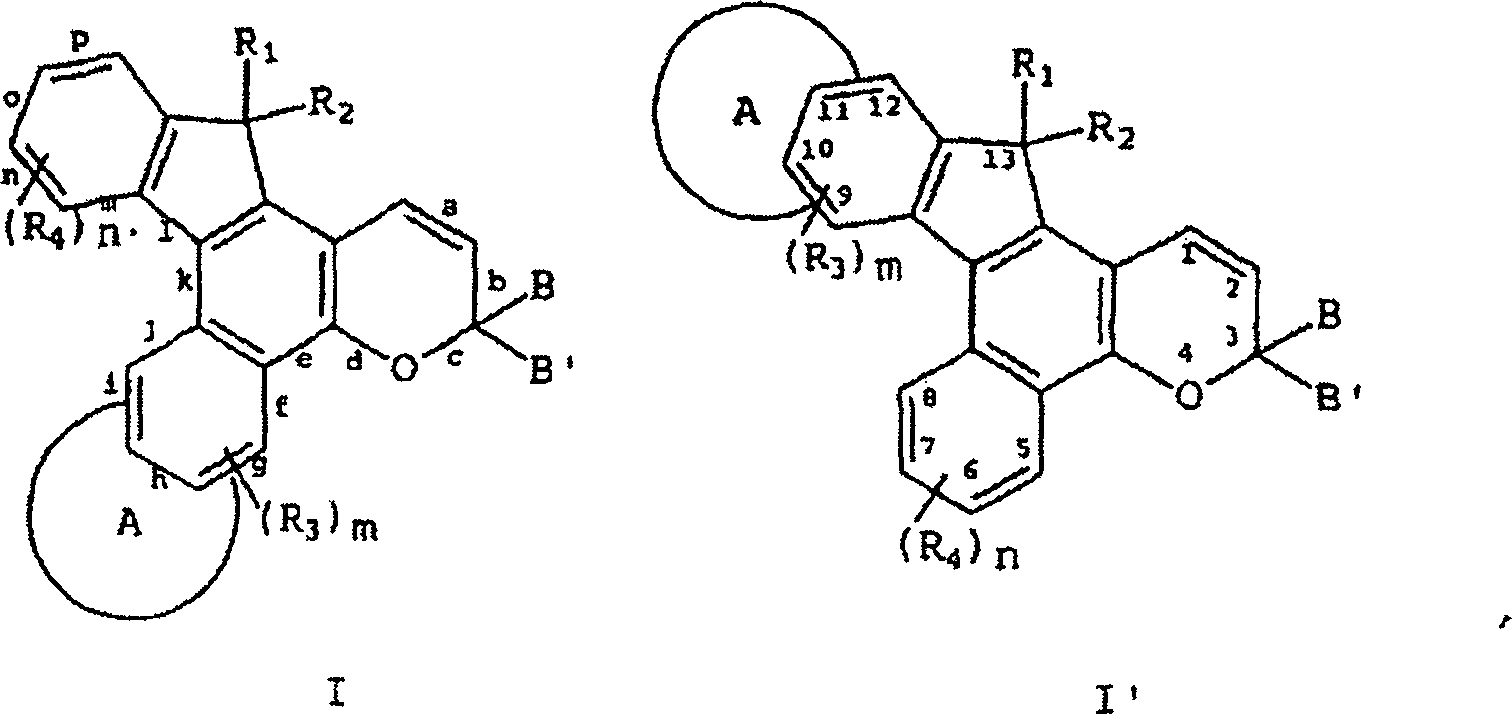
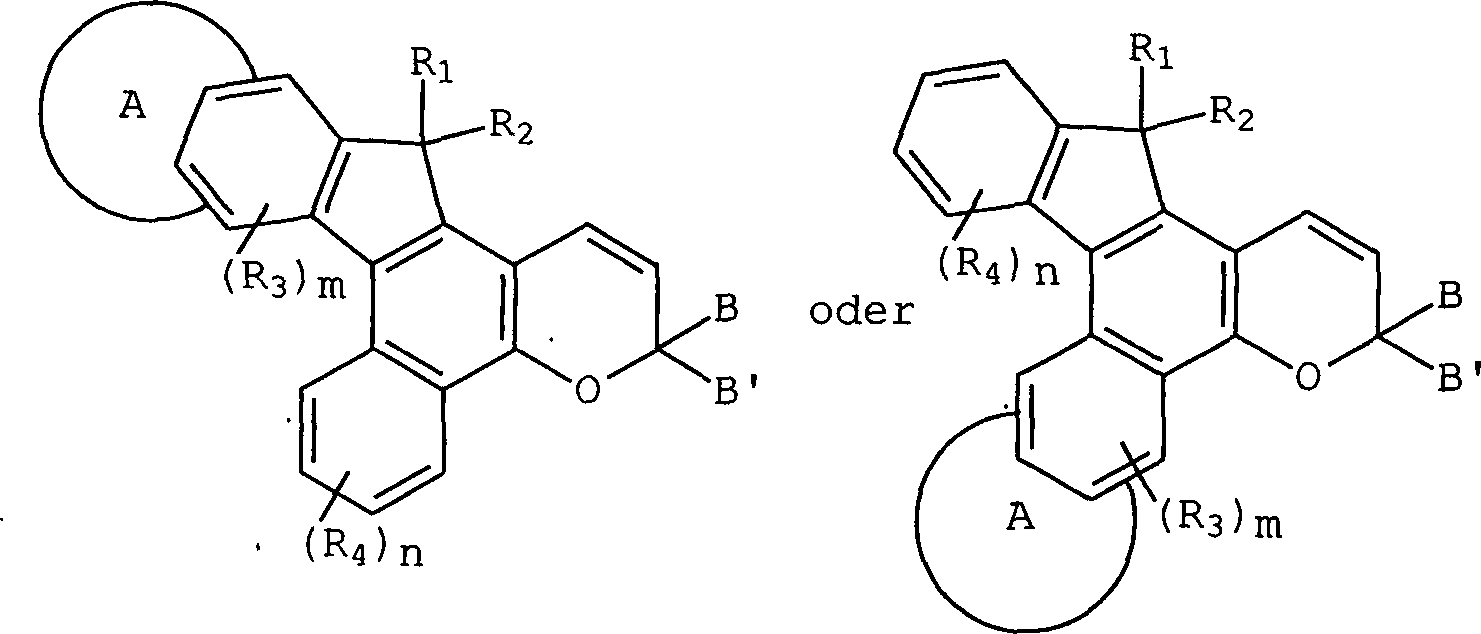
- Die oben beschriebenen Indenonaphthopyran-Verbindungen können durch die folgenden grafischen Formeln I und I', in welchen die Buchstaben a bis p die Seiten oder Flächen der verschiedenen molekularen Ringe, welche die Verbindung umfassen, repräsentieren, repräsentiert werden und die Zahlen 1 bis 13 identifizieren die Ringatome des heterocyclisch fusionierten Indenonaphthopyrans. In der Definition der Substituenten, die in Formeln I und I' gezeigt sind, haben gleiche Symbole die gleiche Bedeutung, solange nichts anderes angegeben wird.
- In den grafischen Formeln I und I' kann A ein unsubstituierter, monosubstituierter oder disubstituierter oder heterocyclischer Ring sein, ausgewählt aus der Gruppe bestehend aus Benzothieno, Benzofurano und Indolo, wobei die 2,3- oder 3,2-Positionen des heterocyclischen Rings an die g-, h-, i-, n-, o- oder p-Seite des Indenonaphthopyrans fusioniert sind. Jeder der oben beschriebenen heterocyclischen Ringsubstituenten kann C1-C6-Alkyl, C5-C7-Cycloalkyl, C1-C6-Alkoxy, Brom, Chlor oder Fluor sein. Vorzugsweise ist der heterocyclische Ring A unsubstituiert oder monosubstituiert und die heterocyclischen Ringsubstituenten sind C1-C4-Alkyl oder C1-C4-Alkoxy. Am meisten bevorzugt ist der heterocyclische Ring A unsubstituiert oder monosubstituiert, die 2,3- oder 3,2-Position des heterocyclischen Rings ist an die g- oder p-Seite des Indenonaphthopyrans fusioniert und die heterocyclischen Ringsubstituenten sind C1-C3-Alkyl oder C1-C3-Alkoxy.
- In der grafischen Formel I kann R1 Wasserstoff, Hydroxy, Brom, Fluor oder Chlor sein, und R2 kann die Gruppe CH(V)2 sein, worin V gleich -CN oder -COOR5 ist, und jedes R5 stellt Wasserstoff, C1-C6-Alkyl, Phenyl-(C1-C3)-alkyl, mono-(C1-C6)-alkylsubsituiertes Phenyl-(C1-C3)-alkyl, mono-(C1-C6)-alkoxysubstituiertes Phenyl-(C1-C3)-alkyl oder die unsubstituierten, mono- oder disubstituierten Arylgruppen Phenyl oder Naphthyl dar, oder R2 kann die Gruppe -CH(R6)Y sein, worin R6 Wasserstoff, C1-C6-Alkyl oder die unsubstituierte, mono- oder disubstituierte Arylgruppen Phenyl oder Naphthyl darstellt, und Y -COOR5, -COR7 oder -CH2OR11 ist, worin R7 Wasserstoff, C1-C6-Alkyl, die unsubstituierten, mono- oder disubstituierten Arylgruppen Phenyl oder Naphthyl, Amino, Mono-C1-C6-alkylamino, Di-(C1-C6)-alkylamino, beispielsweise Dimethylamino, Methylpropylamino, etc., Phenylamino, Mono- oder Di-(C1-C6)-alkyl-substituiertes Phenylamino, mono- oder di-(C1-C6)-alkoxy es Phenylamino, Diphenylamino, mono- oder di-(C1-C6)-alkyl-substituiertes Diphenylamino darstellt, d. h. jedes Phenyl weist einen oder zwei C1-C6-Alkylsubsituenten auf, mono- oder di-(C1-C6)-alkoxy-substituiertes Diphenylamino, Morpholino oder Piperidino darstellt; R11 Wasserstoff, -COR5, C1-C6-Alkyl, C1-C3-Alkoxy-(C1-C6)-alkyl, Phenyl-(C1-C3)-alkyl, mono-(C1-C6)-alkylsubsituiertes Phenyl-(C1-C3)-alkyl, mono-(C1-C6)-alkoxy-substituiertes Phenyl-(C1-C3)-alkyl oder die unsubstituierten, mono- oder disubstituierten Arylgruppen Phenyl oder Naphthyl darstellt, wobei alle der oben genannten Arylgruppen Substituenten C1-C6-Alkyl oder C1-C6-Alkoxy sind. Alternativ können R1 und R2 zusammen die Gruppen =C(V)2 oder =C(R6)W ausbilden, wobei W gleich -COOR5 oder -COR7 ist.
- Vorzugsweise ist R1 Wasserstoff, Hydroxy, Fluor oder Chlor und R2 ist die Gruppe -CH(V)2, worin V gleich -CN oder gleich -COOR5 ist und jedes R5 stellt Wasserstoff, C1-C4-Alkyl, Phenyl-(C1-C2)-alkyl, mono-(C1-C4)-alkylsubsituiertes Phenyl-(C1-C2)-alkyl, mono-(C1-C4)-alkoxysubsituiertes Phenyl-(C1-C2)-alkyl oder die unsubsituierten oder mono-substituierten Alkylgruppen Phenyl oder Naphthyl dar oder R2 ist die Gruppe -CH(R6)Y, worin R6 Wasserstoff, C1-C4-Alkyl oder die unsubstituierten oder mono-substituierten Arylgruppen Phenyl oder Naphthyl und Y gleich -COOR5, -COR7 oder -CH2OR11 darstellt, wobei R7 Wasserstoff, C1-C4-Alkyl, die unsubstituierten oder mono-substituierten Arylgruppen Phenyl oder Naphthyl, Amino, Mono-(C1-C4)-alkylamino, Di-(C1-C4)-alkylamino, Phenylamino, mono- oder di-(C1-C4)-alkyl-substituiertes Phenylamino, mono- oder di-(C1-C4)-alkoxy-substituiertes Phenylamino, Diphenylamino, mono- oder di-(C1-C4)-alkylsubsituiertes Diphenylamino, mono- oder di-(C1-C4)-alkoxy-substituiertes Diphenylamino, Morpholino oder Piperidino ist; R11 stellt Wasserstoff, -COR5, C1-C4-Alkyl, C1-C2-Alkoxy-(C1-C4)-alkyl, Phenyl-(C1-C2)-alkyl, mono-(C1-C4)-alkyl-substituiertes Phenyl-(C1-C2)-alkyl, mono-(C1-C4)-alkoxy-substituiertes Phenyl-(C1-C2)-alkyl oder die unsubstituierten oder mono-substituierten Alkylgruppen Phenyl oder Naphthyl dar, wobei alle der oben genannten Arylgruppensubstituenten C1-C4-Alkyl oder C1-C4-Alkoxy sind.
- Mehr bevorzugt ist R1 Wasserstoff, Hydroxy oder Chlor und R2 ist die Gruppe -CH(V)2, worin V gleich CN ist, oder R2 ist die Gruppe -CH(R6)Y, worin R6 Wasserstoff oder C1-C4-Alkyl darstellt und Y -COOR5 oder -CH2OR11 ist, worin R5 Wasserstoff oder C1-C4-Alkyl darstellt, und R11 Wasserstoff, -COR5 oder C1-C4-Alkyl ist. Alternativ bilden R1 und R2 die Gruppe =C(V)2 oder =C(R6)W aus, worin W gleich -COOR5 ist.
- In den grafischen Formeln I und I' können R3 und R4 jeweils C1-C6-Alkyl, C1-C6-Alkoxy, Brom, Chlor oder Fluor sein, und m und n sind ganze Zahlen 0, 1 oder 2. Vorzugsweise sind R1 und R2 jeweils C1-C4-Alkyl, C1-C4-Alkoxy, Chlor oder Fluor, und m und n sind jeweils ganze Zahlen 0 oder 1. Am meisten bevorzugt sind R3 und R4 jeweils C1-C3-Alkyl und C1-C3-Alkoxy, und m und n sind die ganzen Zahlen 0 oder 1.
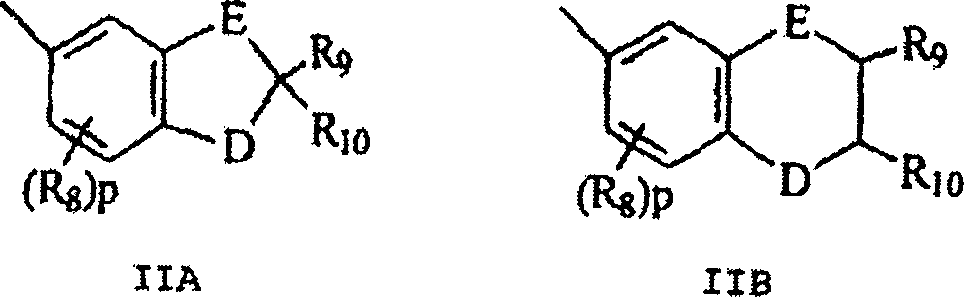
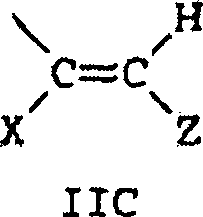
- B und B' in den grafischen Formeln I und I' können jeweils ausgewählt sein aus der Gruppe bestehend aus: (I) den unsubstituierten mono-, di- und trisubsubstituierten Arylgruppen Phenyl und Naphthyl; (II) den unsubstituierten, mono- und disubstituierten aromatischen heterocyclischen Gruppen Pyridyl, Furanyl, Benzofuran-2-yl, Benzofuran-3-yl, Thienyl, Benzothien-2-yl, Benzothien-3-yl, Dibenzofuranyl, Dibenzothienyl, Carbazolyl und Fluorenyl, wobei ein jeder von den besagten Aryl- und aromatischen heterocyclischen Substituenten in den Teilen (I) und (II) ausgewählt ist aus der Gruppe bestehend aus Hydroxy, Aryl, Mono-(C1-C6)-alkoxyaryl, Di-(C1-C6)-alkoxyaryl, Mono-(C1-C6)-alkylaryl, Di-(C1-C6)-alkylaryl, Bromoaryl, Chloroaryl, Fluoroaryl, C3-C7-Cycloalkylaryl, C3-C7-Cycloalkyl, C3-C7-Cycloalkyloxy, C3-C7-Cycloalkyloxy-(C1-C6)-alkyl, C3-C7-Cycloalkyloxy-(C1-C6)-alkyl, C3-C7-Cycloalkyloxy-(C1-C6)-alkoxy, Aryl-(C1-C6)-alkyl, Aryl-(C1-C6)-alkoxy, Aryloxy, Aryloxy-(C1-C6)-alkyl, Aryloxy-(C1-C6)-alkoxy, Mono- und Di-(C1-C6)-alkylaryl-(C1-C6)-alkyl, Mono- und Di-(C1-C6)-alkoxyaryl-(C1-C6)-alkyl, Mono- und Di-(C1-C6)-alkylaryl-(C1-C6)-alkoxy, Mono- und Di-(C1-C6)-alkoxyaryl-(C1-C6)-alkoxy, Amino, Mono-(C1-C6)-alkylamino, Di-(C1-C6)-alkylamino, Diarylamino, N-(C1-C6)-Alkylpiperazino, N-Arylpiperazino, Aziridino, Indolino, Piperidino, Arylpiperidino, Morpholino, Thiomorpholino, Tetrahydrochinolino, Tetrahydroisochinolino, Pyrryl, C1-C6-Alkyl, C1-C6-Bromoalkyl, C1-C6-Chloroalkyl, C1-C6-Fluoroalkyl, C1-C6-Alkoxy, Mono-(C1-C6)-alkoxy-(C1-C4)-alkyl, Acryloxy, Methacryloxy, Brom, Chlor und Fluor; (III) den Gruppen, repräsentiert durch folgende grafischen Formeln: worin E Kohlenstoff oder Sauerstoff sein kann und D Sauerstoff oder substituierter Stickstoff sein kann, unter der Voraussetzung, dass wenn D substituierter Stickstoff ist, E Kohlenstoff ist, besagte Stickstoffsubstituenten ausgewählt sind aus der Gruppe bestehend aus Wasserstoff, C1-C6-Alkyl und C2-C6-Acyl; jedes R8 C1-C6-Alkyl, C1-C6-Alkoxy, Hydroxy, Brom, Chlor oder Fluor ist; R9 und R10 Wasserstoff oder C1-C6-Alkyl sind; und p die ganze Zahl von 0, 1 oder 2 ist; (IV) C1-C6-Alkyl, C1-C6-Bromoalkyl, C1- C6-Chloroalkyl, C1-C6-Fluoroalkyl, C1-C6-Alkoxy-(C1-C6)-alkyl, C3-C6-Cycloalkyl, Mono-(C1-C6)-alkoxy-(C3-C6)-cycloalkyl, Mono-(C1-C6)-alkyl-(C3-C6)-cycloalkyl, Bromo-(C3-C6)-cycloalkyl, Chloro-(C3-C6)-cycloalkyl und Fluoro-(C3-C6)-cycloalkyl; und (V) der Gruppe repräsentiert durch die folgende grafische Formel: worin X in der grafischen Formel IIC Wasserstoff oder C1-C4-Alkyl sein kann, und Z in der grafischen Formel IIC ausgewählt sein kann aus der Gruppe der unsubstituierten, mono- und disubstituierten Mitglieder der Gruppe bestehend aus Naphthyl, Phenyl, Furanyl und Thienyl, wobei eine jede von besagten Gruppen Substituenten in diesem Teil (V) C1-C4-Alkyl, C1-C4-Alkoxy, Brom, Fluor oder Chlor ist; oder (VI) B und B', gemeinsam genommen, Fluoren-9-yliden, mono- oder disubstituiertes Fluoren-9-yliden ausbilden oder ein Mitglied, ausgewählt aus der Gruppe bestehend aus gesättigten C3-C12-spiromonocyclischen Kohlenwasserstoffringen, beispielsweise Cyclopropyliden, Cyclobutyliden, Cyclopentyliden, Cyclohexyliden, Cycloheptyliden, Cyclooctyliden, Cyclononyliden, Cyclodecyliden, Cycloundecyliden und Cyclododecyliden; gesättigten C1-C12-spirobicyclischen Kohlenwasserstoffringen, beispielsweise bicyclo[2.2.1]heptyliden, d. h. Norbornyliden, 1,7,7-Trimethylbicyclo[2.2.1]heptyliden, d. h. Bornyliden, Bicyclo[3.2.1]octyliden, Bicyclo[3.3.1]nonan-9-yliden und Bicyclo[4.3.2]undecan, und gesättigten C1-C12-spiro-tricyclischen Kohlenwasserstoffringen, beispielsweise Tricyclo[2.2.1.02,6]heptyliden und Tricyclo[3.3.1.13,7]decyliden, d. h. Adamantyliden und Tricyclo[5.3.1.12,6]dodecyliden, wobei ein jeder von besagten Fluoren-9-yliden-Substituenten ausgewählt ist aus der Gruppe bestehend aus C1-C4-Alkyl, C1-C4-Alkoxy, Brom, Fluor und Chlor.
- Mehr bevorzugt sind B und B' jeweils ausgewählt aus der Gruppe bestehend aus: (I) Phenyl, mono-substituierter Phenyl und disubstituiertes Phenyl, vorzugsweise substituiert in der meta- und/oder para-Position; (II) den unsubstituierten mono- und disubstituierten aromatischen heterocyclischen Gruppen Furanyl, Benzofuran-2-yl, Thienyl, Benzothien-2-yl, Dibenzofuran-2-yl und Dibenzothien-2-yl, wobei jeder der besagten Phenyl- und aromatischen heterocyclischen Substituenten in (I) und (II) ausgewählt ist aus der Gruppe bestehend aus Hydroxy, Aryl, Aryloxy, Aryl-(C1-C3)-alkyl, Amino, Mono-(C1-C3)-alkylamino, Di-(C1-C3)-alkylamino, N-(C1-C3)-Alkylpiperazino, Indolino, Piperidino, Morpholino, Pyrryl, C1-C3-Alkyl, C1-C3-Chloralkyl, C1-C3-Fluoralkyl, C1-C3-Alkoxy, Mono-(C1-C3)-akoxy-(C1-C3)-alkyl, Fluor und Chlor; (III) der Gruppe repräsentiert durch die grafischen Formeln IIA und IIB, worin E Kohlenstoff und D Sauerstoff ist, R8 C1-C3-Alkyl oder C1-C3-Alkoxy ist, R9 und R10 jeweils Wasserstoff oder C1-C4-Alkyl sind; und p die ganze Zahl 0 oder 1 ist; (IV) C1-C4-Alkyl; und (V) der Gruppe repräsentiert durch die grafische Formel IIC, worin X Wasserstoff oder Methyl ist und Z Phenyl oder monosubstituiertes Phenyl ist, wobei besagter Phenylsubstituent ausgewählt ist aus der Gruppe bestehend aus C1-C3-Alkyl, C1-C3-Alkoxy und Fluor ist; oder (VI) B und B' gemeinsam genommen Fluoren-9-yliden ausbilden, monosubstituiertes Fluoren-9-yliden oder ein Mitglied, ausgewählt aus der Gruppe bestehend aus gesättigten C3-C8-spiro-monocyclischen Kohlenwasserstoffringen, gesättigten C7-C10-spiro-bicyclischen Kohlenwasserstoffringen und gesättigten C7-C10-spiro-bicyclischen Kohlenwasserstoffringen, wobei besagter Fluoren-9-yliden-Substituent ausgewählt ist aus der Gruppe bestehend aus C1-C3-Alkyl, C1-C3-Alkoxy, Fluor und Chlor.
- Am meisten bevorzugt sind B und B' ausgewählt aus der Gruppe bestehend aus (I) Phenyl, mono- und disubstituiertem Phenyl; (II) den unsubstituierten, mono- und disubstituierten aromatischen heterocyclischen Gruppen Furanyl, Benzofuran-2-yl, Thienyl und Benzothien-2-yl, wobei jeder von besagten Phenyl- und aromatischen heterocyclischen Substituenten in (II) und (II) ausgewählt ist aus der Gruppe bestehend aus Hydroxy, C1-C3-Alkyl, C1-C3-Alkoxy, Aryl, Indolino, Fluoro und Chloro ist; und (III) der Gruppe repräsentiert durch die grafische Formel IIA, worin E Kohlenstoff und D Sauerstoff ist, R8 C1-C3-Alkyl oder C1-C3-Alkoxy ist; R9 und R10 jeweils Wasserstoff oder C1-C3-Alkyl sind; und p die ganze Zahl 0 oder 1 ist; oder (IV) B und B', gemeinsam genommen, Fluoren-9-yliden, Adamantyliden, Bomyliden, Norbornyliden oder Bicyclo[3.3.1]nonan-9-yliden ausbilden.
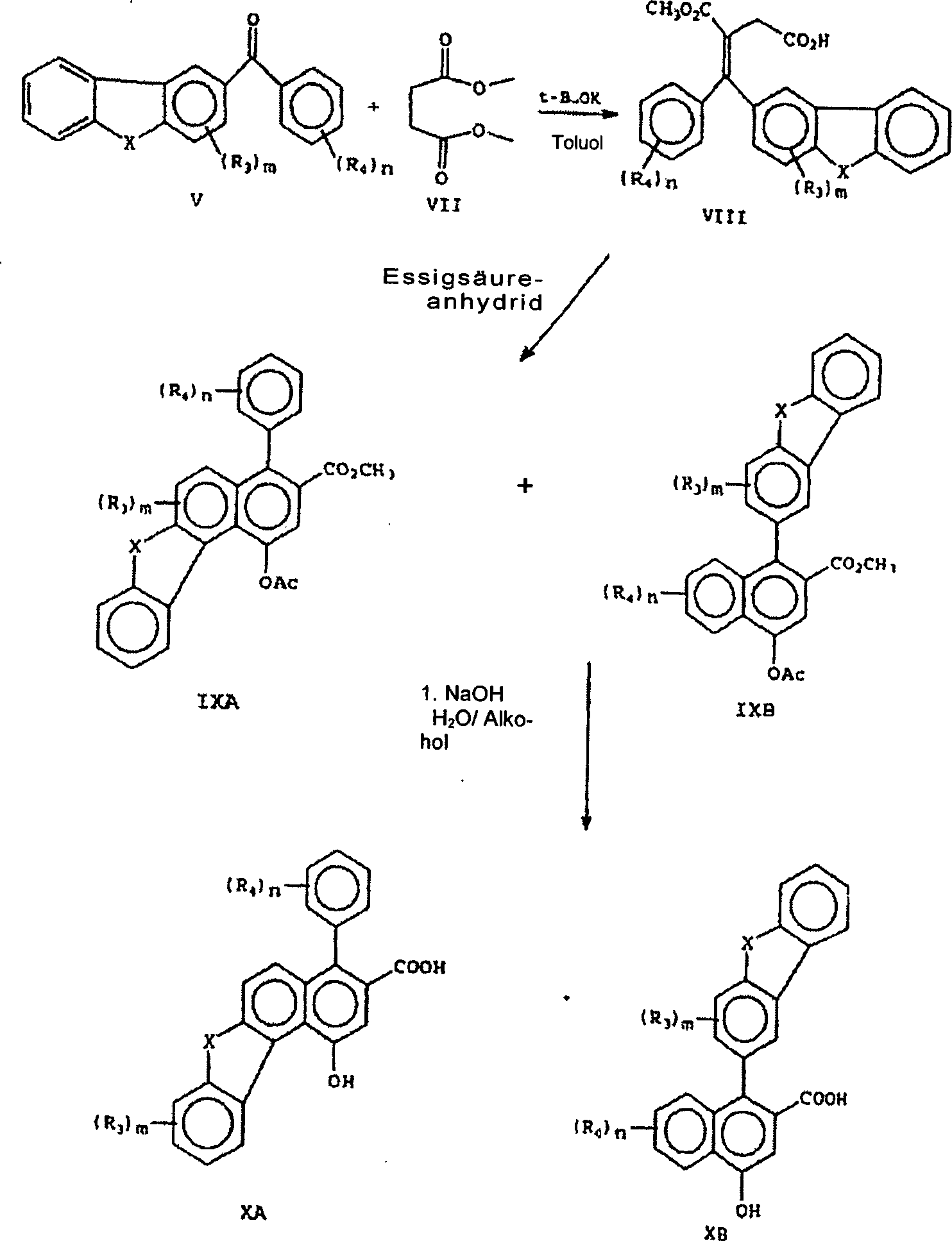
- Verbindungen repräsentiert durch die grafischen Formeln I und I', die die Substituenten R3 und R4, wie hier zuvor beschrieben, aufweisen, können durch die im Folgenden beschriebenen Reaktionen A bis E hergestellt werden. Verbindungen repräsentiert durch die grafischen Formeln V oder VA (wie in den Reaktionen A bzw. B gezeigt) werden durch Friedel-Crafts-Verfahren, wie in Reaktion A gezeigt, unter Verwendung eines geeignet substituierten oder unsubstituierten Benzoylchlorides der grafischen Formel IV mit einer kommerziell verfügbaren substituierten oder unsubstituierten heterocyclischen Verbindung der grafischen Formel III hergestellt. Siehe die Veröffentlichung Friedel-Crafts and Related Reactions, George A. Olah, Interscience Publishers, 1964, Vol. 3, Chapter XXXI (Aromatic Crafts Acylation of 1,2,3,4-Tetrahydroquinoline and Related Nitrogen Heterocycles: Effect on NH Protective Groups and Ring Size" bei Ishihara, Yugi et al., J. Chem. Soc., Perkin Trans. 1, Seiten 3401 bis 3406, 1992.
- In Reaktion A werden die Verbindungen repräsentiert durch die grafischen Formeln III (wobei X Sauerstoff, Stickstoff oder Schwefel ist) und IV in einem Solvens aufgelöst, beispielsweise in Schwefelkohlenstoff oder Methylenchlorid, und in der Gegenwart einer Lewissäule, wie z. B. Aluminiumchlorid oder Zinntetrachlorid, umgesetzt, um das korrespondierende substituierte Benzophenon repräsentiert durch die grafische Formel V auszubilden.
- In Reaktion B wird das substituierte oder unsubstituierte Keton, repräsentiert durch die grafische Formel VA mit Natriumazetylid in einem geeigneten Solvens, wie z. B. anhydridischem Tetrahydrofuran (THF), umgesetzt, um den korrespondierenden Propargylalkohol, repräsentiert durch die grafische Formel VI auszubilden. Propargylalkohole, welche B- oder B'-Gruppen aufweisen, die sich von substituiertem und unsubstituiertem Phenyl unterscheiden, können aus kommerziell verfügbaren Ketonen oder Ketonen hergestellt durch die Reaktion eines Acylhalogenides mit einem substituierten oder unsubstituierten Benzol, Naphthalin oder einer heteroaromatischen Verbindung hergestellt werden. Propargylalkohole, welche eine B- oder B'-Gruppe aufweisen und repräsentiert durch die grafische Formel IIC wären, können durch die Verfahren wie in US-Patent 5,274,132, Spalte 2, Zeilen 40 bis 68 beschrieben, hergestellt werden.
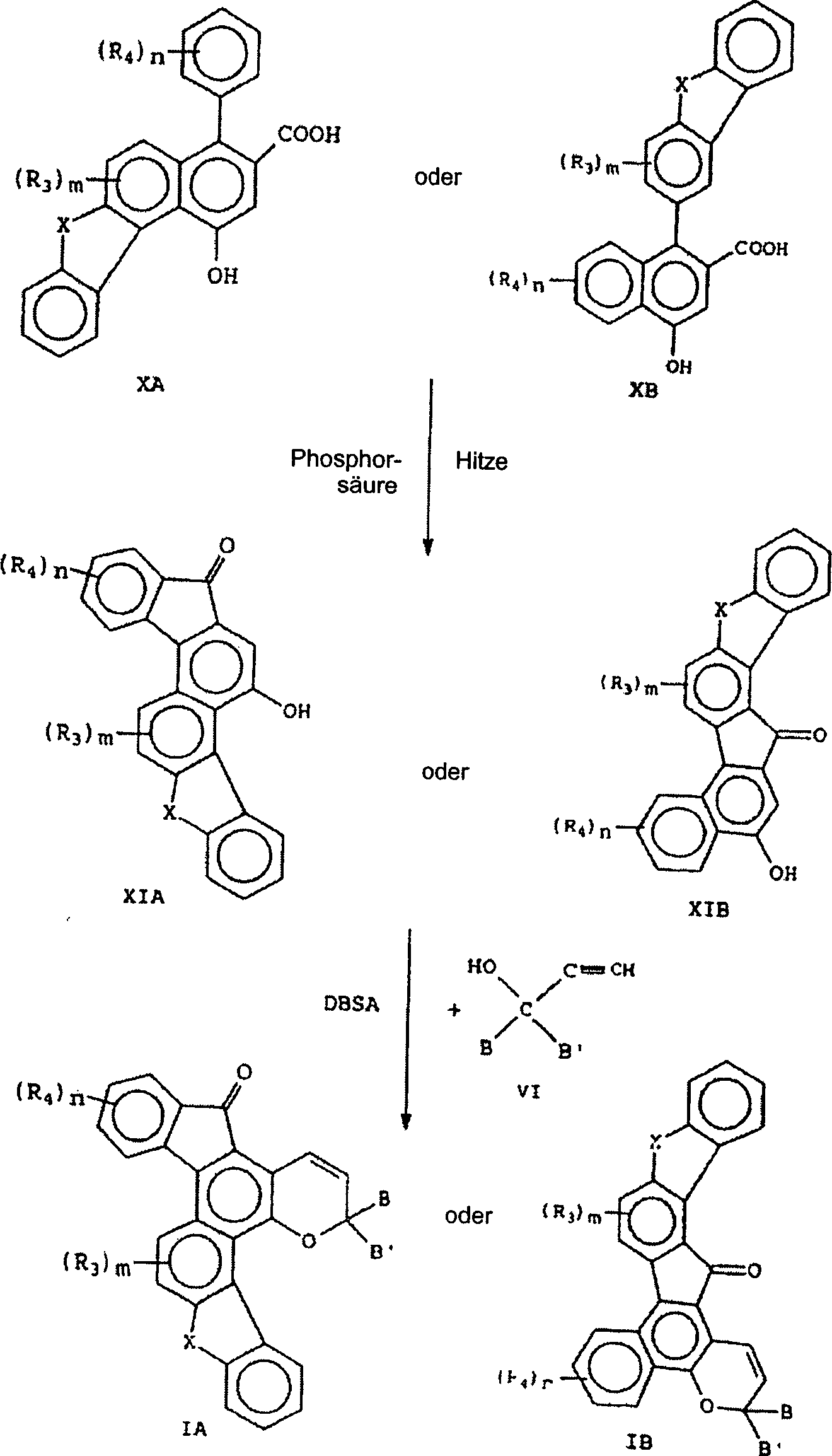
- In Reaktion C wird das substituierte oder unsubstituierte Keton repräsentiert durch die grafische Formel V mit einem Ester von Succinsäure, wie z. B. Dimethylsuccinat, repräsentiert durch die grafische Formel VII umgesetzt. Die Addition der Reaktanten, an ein Solvens, beispielsweise Toluol, welches tert-Butoxykalium oder Natriumhydrid als die Base enthält, führt zu dem halben Ester der Stobbe-Kondensation, repräsentiert durch die grafische Formel VIII. Der halbe Ester (VIII) vollzieht eine Cyclodehydratation in der Gegenwart von Acetanhydrid, um die heterofusionierten Acetoxynaphthaline, repräsentiert durch die grafischen Formeln IXA und IXB auszubilden. Die Verbindung IXA und IXB können durch Kristallisation getrennt werden, in einer wässrig alkoholischen Lösung einer Base hydrolysiert werden, beispielsweise in Natriumhydroxid, gefolgt von einer Behandlung in einer wässrigen Salzsäure (H+), um die Carboxynaphthole, repräsentiert durch die grafischen Formeln XA bzw. XB auszubilden.
- In Reaktion D werden Carboxynaphthole repräsentiert durch die grafischen Formeln XA und XB durch Erhitzen cyclisiert, z. B. von etwa 160°C auf etwa 220°C in der Gegenwart einer Säure, wie z. B. Phosphorsäure, um ein hydroxy-substituiertes benzfusioniertes Fluorenon repräsentiert durch die grafischen Formeln XIA und XIB auszubilden. Siehe den Artikel von F. G. Baddar et al. in J. Chem. Soc., Seite 986, 1958. Ein alternatives Verfahren zur Synthese der Verbindung repräsentiert durch die grafische Formel XIB wird von C. F. Koelsch in der Journal of Organic Chemistry, Volume 26, Seite 2590, 1961, beschrieben.
- Das Koppeln der Verbindungen repräsentiert durch die grafischen Formeln XIA und XIB mit Propargylalkohol repräsentiert durch die grafischen Formel VI in der Gegenwart einer katalytischen Menge einer Säure, beispielsweise Dodecylbenzolsulfonsäure (DBSA, dodecylbenzene sulfonic acid), resultiert in dem indeno-fusionierten Naphthopyran repräsentiert durch die grafischen Formeln IA und IB.
- In Reaktion E werden weitere Verfahren zum Herstellen von Verbindungen repräsentiert durch die grafische Formel I', die eine Vielzahl von R1- und R2-Substituenten aufweist, beschrieben. Beginnend mit der Verbindung repräsentiert mit der grafischen Formel I'C führt die Behandlung mit einem α-Bromoester der grafischen Formel XII in der Gegenwart von aktiviertem Zinnstaub zu der Verbindung repräsentiert durch die grafische Formel I'D. Diese Reaktion, die man als Reformatsky-Reaktion bezeichnet, wird von R. L. Shriner in Organic Reactions, Vol. 1, Seiten 1–37, 1942, gereviewt. Die Verbindung repräsentiert durch die grafische Formel I'D kann des Weiteren mit chlorierenden Reagenzien umgesetzt werden, beispielsweise mit Thionylchlorid, um Derivate, repräsentiert durch die grafische Formel I'E herzustellen. Die Verbindung repräsentiert die grafische Formel I'E kann dehydrohalogeniert werden durch Erhitzen in der Gegenwart eines tertiären Amins, beispielsweise Collidin, um α,β-ungesättigte Ester der grafischen Formel I'F zu erhalten.
- Alternativ kann die Verbindung repräsentiert durch die grafische Formel I'C mit einer Verbindung kondensiert werden, die ein aktives Methylen repräsentiert durch die grafische Formel XIII enthält, und zwar in der Gegenwart eines Amins, um die Verbindung repräsentiert durch die grafische Formel I'G herzustellen. Diese Reaktion, die man als die Knoevenagel-Kondensation bezeichnet, wird von G. Jones in Organic Reactions, Vol. 15, Seiten 204–599, 1967, gereviewt.
- Alle die Schritte der Reaktion E können auch mit einer Verbindung durchgeführt werden, welche analog zu der Verbindung repräsentiert durch die grafische Formel I'C ist, jedoch die A-Gruppe in der Position aufweist, wie in der grafischen Formel I repräsentiert.
- Verbindungen repräsentiert durch die grafische Formel I, I', IA, IB, I'C, I'D, I'E, I'F und I'G können in denjenigen Anwendungen verwendet werden, in welchen organische fotochrome Substanzen eingesetzt werden können, wie z. B. für optische Linsen, z. B. die Sehkraft korrigierenden Brillengläser und Planlinsen, Gesichtsschilde, Schutzbrillen, Visiere, Kameralinsen, Fenster, Auto-Windschutzscheiben, transparente Materialien in Flugzeugen und Autos, z. B. T-Roofs, Seiten- und Rücklichter, Filme aus Plastik und Beschichtungen, Textilien und Coatings, beispielsweise Coating-Zusammensetzungen, wie z. B. Lackierungen und Verifikationsmarkierungen auf Sicherheitsdokumenten, beispielsweise Dokumenten, wie Banknoten, Pässen und Führerscheinen, für welche Authentifikation oder Verifikation der Authentizität gewünscht sein können. Heterocyclisch fusionierte Indenonaphthopyrane repräsentiert durch die oben beschriebenen grafischen Formeln zeigen Farbveränderungen von Farblos zu Farben, die von Orange bis Blau/Grau reichen.
- Beispiele von in Erwägung gezogenen Indenonaphthopyranverbindungen innerhalb des Umfangs der Erfindung schließen die Folgenden ein:
- (a) 3,3-Di(4-methoxyphenyl)-16-(ethoxycarbonyl)methyl-16-hydroxy-3,16-di[H]-benzofuro[2',3':3,4]naptho[1,2-b]pyran;
- (b) 3-(4-Methoxyphenyl)-3-(4-morpholinophenyl)-16-(ethoxycarbonyl)methyl-16-hydroxy-3,16-di[H]-benzofuro[2',3':7,8]indeno[2',3':3,4]naphtho[1,2-b]pyran;
- (c) 3-Phenyl-3-(4-methoxyphenyl)-16-(ethoxycarbonyl)methyl-16-hydroxy-3,16-di[H]-benzofuro[2'',3'':6',7']indeno[3',2':4,3]naphtho[1,2-b]pyran; und
- (d) 3-Phenyl-3-(4-morpholinophenyl)-16-(ethoxycarbonyl)methyl-16-hydroxy-3,16-di[H]-benzofuro[2'',3'':6',7']ideno[3',2':4,3]naphtho[1,2-b]pyran.
- Es ist in Erwägung gezogen worden, dass die organisch fotochromen Idenonaphthopyrane der vorliegenden Erfindung allein, in Kombination mit anderen Idenonaphthopyranen der vorliegenden Erfindung oder in Kombination mit einem oder mehreren anderen geeigneten komplementären organischen fotochromen Materialien, d. h. organisch fotochromen Verbindungen, die zumindest ein aktiviertes Absorptionsmaximum innerhalb des Bereiches zwischen ungefähr 400 und 700 Nanometer aufweisen, oder mit Substanzen, die solche enthalten, verwendet werden können und eingebracht, d. h. in einem polymerischen organischen Wirtsmaterial aufgelöst oder dispergiert werden können, das verwendet wird, um fotochrome Artikel herzustellen und dessen Farbe bei Aktivierung einen geeigneten Farbton einnimmt.
- Außer dort, wo es anders angezeigt wird, verstehen sich alle Zahlen, die Wellenlängen ausdrücken, Mengen von Bestandteilen oder Reaktionsbedingungen, die hier verwendet werden, als modifiziert in allen Fällen um die Bezeichnung "ungefähr".
- Beispiele von komplementären organischen fotochromen Verbindungen schließen andere Indenonaphthopyrane, Chromene und Oxazine, beispielsweise Naphthopyrane, welche die 2,1-Position einer Indenogruppe fusioniert an die f-Seite des Naphtho-Teils aufweisen, und bestimmte Substituenten an der 3-Position des Pyranrings, substituierte 2H-Phenanthro[4,3-b]pyran- und 3H-Phenanthro[1,2-b]pyranverbindungen, Benzopyranverbindungen, die Substituenten an der 2-Position des Pyranrings aufweisen, einschließend eine dibenzofusionierte 5-gliedrige heterocyclische Verbindung und einen substituierten oder unsubstituierten heterocyclischen Ring, wie z. B. einen Benzothieno- oder Benzufuranoring fusioniert an den Benzolteil des Benzopyrans, Spino(benzindolin)napththopyrane, Spiro(indolin)benzopyrane, Spino(indolin)naphthopyrane, Spiro(indolin)chinopyrane, Spiro(indolin)pyrane, Spino(indolin)napthoxazine, Spiro(indolin)pyridobenzoxazine, Spino(benzindolin)pyridobenzoxazine, Spiro(benzindolin)naphthoxazine, Spiro(indolin)benzoxazine und Mischung solcher fotochromer Verbindungen ein. Viele solcher fotochromer Verbindungen werden in der breiten Literatur beschrieben, beispielsweise in den US-Patenten Nr. 3,562,172; 3,567,605; 3,578,602; 4,215,010; 4,342,668; 4,816,584; 4,818,096; 4,826,977; 4,880,667; 4,931,219; 5,066,818; 5,238,931; 5,274,132; 5,384,077; 5,405,958; 5,429,774; 5,466,398; 5,514,817; 5,552,090; 5,552,091; 5,565,146; 5,573,712; 5,578,252; WO 96 14596 und in der japanische Patentveröffentlichung 62/195383. Spiro(indolin)pyrane werden auch in dem Text Techniques in Chemistry, Volume III, "Photochromism", Chapter 3, Glenn H. Brown, Editor, John Wiley and Sons, Inc., New York, 1971, beschrieben.
- Andere fotochrome Substanzen, die in Erwägung gezogen sind, sind fotochrome Metalldithizonate, beispielsweise Quecksilberdithizonate, die beispielsweise in US-Patent 3,361,706 beschrieben sind, Fulgide und Fulgimide, wie z. B. die 3-Furyl- und 3-Thienylfulgide und Fulgimide, welche in US-Patent Nr. 4,931,220 in Spalte 20, Zeile 5 bis Spalte 21, Zeile 38 beschrieben werden.
- Die Offenbarungen, die sich auf solche fotochrome Verbindungen in den oben genannten Patenten beziehen, sind in ihrer Gesamtheit per Verweis eingeschlossen. Die fotochromen Artikel der vorliegenden Erfindungen können eine fotochrome Verbindung oder eine Mischung von fotochromen Verbindungen je nach Bedarf enthalten.
- Jede der fotochromen Verbindungen, die hier beschrieben wird, kann in Mengen (oder in einem Anteil) verwendet werden, so dass ein organisches Wirtsmaterial, auf welches die fotochromen Verbindungen oder die Mischung der Verbindungen angewandt wird oder in welchen sie enthalten sind, eine gewünschte resultierende Farbe zeigt, beispielsweise eine substanziell neutrale Farbe, wenn sie mit ungefiltertem Sonnenlicht aktiviert wird, d. h. so nahe einer neutralen wie möglich, geht man von den Farben der aktivierten fotochromen Verbindungen aus. Neutrale graue und neutrale braune Farben sind bevorzugt.
- Eine neutrale graue Farbe zeigt ein Spektrum, das eine relativ gleichmäßige Absorption im sichtbaren Bereich zwischen 400 und 700 Nanometern aufweist. Eine neutrale braune Farbe zeigt ein Spektrum, in welchem die Absorption in den Bereich zwischen 400 und 550 Nanometer moderat größer als in dem 550 bis 700 Nanometerbereich ist. Ein alternativer Weg, Farbe zu beschreiben, ist mit Hilfe ihrer chromatografischer Koordinaten, welche die Qualität einer Farbe zusätzlich zu ihrem Lumineszenzfaktor, d. h. ihre Chromatizität, beschreiben. In dem CIE-System werden die Chromatizitätskoordinaten dadurch erhalten, dass man die Verhältnisse der Tristimuluswerte zu ihrer Summe nimmt, beispielsweise x = X/(X + Y + Z) und y = Y/(X + Y + Z). Farbe, wie in dem CIE-System beschrieben, kann auf einem Chromatizitätsdiagramm geplottet werden, üblicherweise ein Plott der Chromatizitätskoordinaten x und y. Siehe Seiten 47 bis 52 von Principles of Color Technology, bei F. W. Billmeyer, Jr., und Max Saltzman, Second Edition, John Wiley and Sons, N.Y. (1981). Wie hier verwendet, ist eine annähernd neutrale Farbe eine, in welchem die Chromatizitätskoordinatenwerte von "x" und "y" für die Farbe innerhalb der folgenden Bereiche (D65 Selbstleuchtner) liegen: x = 0,260 bis 0,400, y = 0,280 bis 0,400 infolge der Aktivierung auf 40% Lumineszenztransmission infolge von Exposition an Sonneneinstrahlung (Luftmasse 1 oder 2).
- Die Menge der fotochromen Substanz oder Zusammensetzung, die selbige enthält, angewandt auf oder eingebracht in ein Wirtsmaterial, ist nicht kritisch unter der Vorausset zung, dass eine hinreichende Menge verwendet wird, um einen fotochromen Effekt, der erkennbar mit dem bloßen Auge nach Aktivierung ist, zu erzeugen. Generell kann solch eine Menge als fotochrome Menge bezeichnet werden. Die besondere Menge, welche verwendet wird, hängt oft von der gewünschten Intensität der Farbe nach ihrer Bestrahlung ab sowie von dem Verfahren, welches verwendet wird, um die fotochromen Substanzen einzubringen oder anzuwenden. Üblicherweise ist die Farbintensität bis zu einer bestimmten Grenze größer, je mehr fotochrome Substanz appliziert oder eingebracht wird.
- Die relativen Mengen der oben genannten verwendeten fotochromen Verbindungen werden variieren und hängen zum Teil von den relativen Intensitäten der Farbe der aktivierten Spezies solcher Verbindungen ab und von der letztendlich gewünschten Farbe. Im Allgemeinen kann die Menge der insgesamt auf ein fotochromes optisches Wirtsmaterial eingebrachten oder darauf applizierten fotochromen Substanz von 0,05 bis 1,0, beispielsweise von 0,1 bis 0,45, Milligramm pro Quadratzentimeter Oberfläche reichen, auf welche die fotochrome Substanz (die fotochrome Substanzen) eingebracht oder appliziert wird (werden).
- Die fotochromen Substanzen der vorliegenden Erfindung können auf ein Wirtsmaterial, wie z. B. ein polymerisches organisches Wirtsmaterial, appliziert werden oder in selbiges mit Hilfe verschiedener Verfahren eingebracht werden, die im Stand der Technik beschrieben werden. Solche Verfahren schließen Auflösen oder Dispergieren der fotochromen Substanz innerhalb des Wirtsmaterials ein, z. B. dessen Eingießen an Ort und Stelle, durch Zugabe der fotochromen Substanz zu dem monomerischen Wirtsmaterial vor der Polymerisation; das Aufsaugen von fotochromen Substanzen in das Wirtsmaterial durch Eintauchen des Wirtsmaterials in eine heiße Lösung der fotochromen Substanz oder durch thermalen Transfer; das Bereitstellen der fotochromen Substanz als separate Schicht zwischen benachbarten Schichten des Wirtsmaterials, beispielsweise als ein Teil eines Polymerfilms; und das Applizieren der fotochromen Substanz als Teil eines Coatings oder Films platziert an der Oberfläche des Wirtsmaterials. Die Bezeichnung "Aufsaugen" oder "aufsaugen" soll das Eindringen der fotochromen Substanz allein in das Wirtsmaterial, den von einem Lösungsmittel unterstützten Transfer der fotochromen Substanz in ein poröses Polymer, Gasphasentransfer sowie andere derartige Transfermechanismen bedeuten bzw. einschließen.
- Kompatible (chemische und farbartige) Tinten, d. h. Farbstoffe, können auf das Wirtsmaterial appliziert werden, um ein ästhetischeres Resultat zu erzielen, aus medizinischen Gründen oder aus modischen Gründen. Der spezielle ausgewählte Farbstoff wird variieren und von dem oben genannten Bedarf bzw. dem erreichenden Ergebnis abhängen. In einer anderen Ausführungsform kann der Farbstoff so ausgewählt werden, dass er das Komplement der Farbe darstellt, die sich aus den aktivierten fotochromen Substanzen ergibt, z. B. um eine eher neutrale Farbe zu erreichen oder eine spezielle Wellenlänge des einfallenden Lichts. In einer anderen Ausführungsform kann der Farbstoff so ausgewählt werden, dass er der Wirtsmatrix eine gewünschte Färbung verleiht, wenn die fotochromen Substanzen in einem nicht-aktivierten Zustand sind.
- Das Wirtsmaterial wird üblicherweise transparent sein, kann aber durchscheinend oder gar opak sein. Das Wirtsmaterial muss nur insofern transparent sein, als der Teil des elektromagnetischen Spektrums, welcher die fotochromen Substanzen aktiviert, d. h. die Wellenlänge des ultravioletten (UV-)Lichts, welche die freie Form der Substanz erzeugt bzw. der Teil des sichtbaren Lichts, der das Maximum der Absorptionswellenlänge der Substanz in seiner UV-aktivierten Form einschließt, d. h. in der freien Form, betroffen ist. Vorzugsweise sollte die Wirtsfarbe nicht so sein, dass sie die Farbe der aktivierten Form der fotochromen Substanz maskiert, d. h., so dass die Veränderung der Farbe sofort dem Betrachter offensichtlich ist. Mehr bevorzugt stellt der Wirtsmaterialartikel ein festes transparentes Material oder ein optisch klares Material dar, beispielsweise ein Material, geeignet für optische Anwendungen, wie z. B. plane Linsen und Brillengläser, Fenster, Auto-Transparent-Materialien, z. B. Windschutzscheiben, Flugzeug-Transparent-Materialien, Plastikbeschichtungen, Polymerfilme, etc.
- Beispiele von polymerischen organischen Wirtsmaterialien, die mit den fotochromen Substanzen oder Zusammensetzungen, wie sie hier beschrieben werden, verwendet werden können, schließen ein: Polymere, d. h. Homopolymere und Copolymere, von Polyol(allylcarbonat)monomeren, Diethylenglycoldimethacrylatmonomeren, Diisopropenylbenzenmonomeren, ethoxylierten Bisphenol A-dimethacrylatmonomeren, Ethylenglycolbismethacrylatmonomeren, Poly(ethlyenglycol)bismethacrylatmonomeren, ethoxylierten Phenolmethacrylatmonomeren und alkoxylierten polyhydrierten Alkoholacrylatmonomeren, wie z. B. ethoxylierten Trimethylolpropantriacrylatmonomeren; Polyme re, d. h. Homopolymere und Copolymere, von polyfunktionalen, beispielsweise mono-, di- oder multifunktionalen Acrylat- und/oder Methacrylatmonomeren, poly(C1-C12-alkylmethacrylaten), wie z. B. Poly(methylmethacrylat), Poly(oxyalkylendimethacrylat), poly(alkoxylierten Phenolmethacrylat), Celluloseacetat, Cellulosetriacetat, Celluloseacetatpropionat, Celluloseacetatbutyrat, Poly(vinylacetat), Poly(vinylalkohol), Poly(vinylchlorid), Poly(vinylidenchlorid), Polyurethane, thermoplastische Polycarbonate, Polyester, Poly(ethlyenterephthalat), Polystyrol, Poly(alphamethylstyrol), Copoly(styrolmethylmethacrylat), Copoly(styrolacrylonitril), Polyvinylbutyral; und Polymere, d. h. Homopolymere und Copolymere, von Diallylidenpentaerythritol, insbesondere Copolymere mit Polyol(allylcarbonat)monomeren, beispielsweise Diethylenglycolbis(allylcarbonat) und Acrylatmonomeren.
- Transparente Copolymere und Mischungen von transparenten Polymeren sind auch als Wirtsmaterial geeignet. Vorzugsweise wird das Wirtsmaterial ein optisch klares polymerisiertes organisches Material hergestellt aus einem thermoplastischen Polycarbonatharz enthalten, wie z. B. das Carbonat-verknüpfte Harz, erhalten aus Bisphenol A und Phosgen, das unter dem Warenzeichen LEXAN verkauft wird; ein Polyester, wie z. B. das Material, das unter dem Warenzeichen MYLAR verkauft wird; ein Poly(methylmethacrylat), wie z. B. das Material, das unter dem Warenzeichen PLEXIGLAS verkauft wird; Polymerisate eines Polyol(allylcarbonat)monomers, speziell Diethylenglycolbis(allylcarbonat), das unter dem Warenzeichen CR-39 verkauft wird und Polymerisate von Copolymeren eines Polyol(allylcarbonats), beispielsweise Diethylenglycolbis(allylcarbonat), mit anderen copolymerisierbaren monomerischen Materialien, wie z. B. Copolymere mit Vinylacetat, z. B. Copolymere von 80 bis 90% Diethylenglycolbis(allylcarbonat) und 10 bis 20% Vinylacetat, insbesondere 80 bis 85% des Bis(allylcarbonats) und 15 bis 20% Vinylacetat, und Copolymere mit einem Polyurethan, das endständige Diacrylatfunktionalität aufweist, wie in den US-Patenten 4,360,653 und 4,994,208 beschrieben; und Copolymere mit aliphatischen Urethanen, deren endständige Einheiten allyl- oder acrylylfunktionelle Gruppen enthalten, wie in US-Patent 5,200,483 beschrieben; Poly(vinylacetat), Polyvinylbutyral, Polyurethan, Polymere von Mitgliedern der Gruppe bestehend aus Diethylenglycoldimethacrylatmonomeren, Diisopropenylbenzolmonomere, ethoxylierten Bisphenol A-dimethacrylatmonomeren, Ethylenglycolbismethacrylatmonomeren, Poly(ethlyenglycol)bismethacrylatmonomeren, ethoxylierten Phenolmethacrylatmonomeren und ethoxy lierten Trimethylolpropantriacrylatmonomeren; Celluloseacetat, Cellulosepropionat, Cellulosebutyrat, Celluloseacetatbutyrat, Polystyrol und Copolymere von Styrol mit Methylmethacrylat, Vinylacetat und Acrylonitril.
- Besonders in Erwägung gezogen ist die Verwendung der fotochromen Indenonaphthopyranen der vorliegenden Erfindung zusammen mit optischen organischen Harzmonomeren, die verwendet werden, um optisch klare Polymerisate herzustellen, d. h., Materialien, geeignet für optische Anwendungen, wie z. B. plane Linsen und Brillengläser, Fenster und transparente Materialien in Automobilen. Solche optisch klaren Polymerisate können einen refraktiven Index aufweisen, der von ungefähr 1,48 bis 1,75 reicht, beispielsweise von 1,495 bis 1,66. Speziell in Erwägung gezogen sind optische Harze verkauft von PPG Industries, Inc., unter der Bezeichnung CR-307 und CR-407.
- Obwohl die vorliegende Erfindung unter Verweis auf spezielle Details von ihren besonderen Ausführungsformen beschrieben wurde, ist es nicht beabsichtigt, dass solche Details als Limitierungen für den Umfang der Erfindung betrachtet werden, ausgenommen, dass und in dem Umfang dass sie in den beigefügten Ansprüchen enthalten sind.
Claims (15)
- Indenonaphthopyranverbindung, die durch die folgenden graphischen Formeln wiedergegeben ist: worin: (a) A ein unsubstituierter, monosubstituierter oder disubstituierter heterocyclischer Ring ist, ausgewählt aus der Gruppe bestehend aus Benzothieno, Benzofurano und Indolo, wobei die 2,3- oder 3,2-Positionen dieses heterocyclischen Rings an die g-, h-, i-, n-, o- oder p-Seite dieses Indenonaphthopyrans kondensiert sind, wobei die Substituenten dieses heterocyclischen Rings C1-C6-Alkyl, C5-C7-Cycloalkyl, C1-C6-Alkoxy, Brom, Chlor oder Fluor sind, (b) R1 gleich Wasserstoff, Hydroxy, Brom, Fluor oder Chlor ist und R2 die Gruppe -CH(V)2 ist, worin V gleich -CN oder -COOR5 ist und jedes R5 gleich Wasserstoff, C1-C6-Alkyl, Phenyl(C1-C3)alkyl, mono(C1-C6)alkylsubstituiertes Phenyl(C1-C3)alkyl, mono(C1-C6)alkoxysubstituiertes Phenyl(C1-C3)alkyl oder die unsubstituierte, mono- oder disubstituierte Arylgruppe Phenyl oder Naphthyl ist oder R2 die Gruppe -CH(R6)Y ist, worin R6 gleich Wasserstoff, C1-C6-Alkyl oder die unsubstituierte, mono- oder disubstituierte Arylgruppe Phenyl oder Naphthyl ist und Y gleich -COOR5, -COR7 oder -CH2OR11 ist, worin R7 gleich Wasserstoff, C1-C6-Alkyl, die unsubstituierte, mono- oder disubstituierte Arylgruppe Phenyl oder Naphthyl, Amino, Mono(C1-C6)alkylamino, Di(C1-C6)alkylamino, Phenylamino, mono- oder di(C1-C6)alkylsubstituiertes Phenylamino, mono- oder di(C1-C6)alkoxysubstituiertes Phenylamino, Diphenylamino, mono- oder di(C1-C6)alkylsubstituiertes Diphenylamino, mono- oder di(C1-C6)alkoxysubstituiertes Diphenylamino, Morpholino oder Piperidino ist, R11 gleich Wasserstoff, -COR5, C1-C6-Alkyl, C1-C3-Alkoxy(C1-C6)alkyl, Phenyl(C1-C3)alkyl, mono(C1-C6)alkylsubstituiertes Phenyl(C1-C3)alkyl, mono(C1-C6)alkoxysubstituiertes Phenyl(C1-C3)alkyl oder die unsubstituierte, mono- oder disubstituierte Arylgruppe Phenyl oder Naphthyl ist, wobei jeder von all diesen Substituenten der Arylgruppen gleich C1-C6-Alkyl oder C1-C6-Alkoxy ist, oder (c) R1 und R2 zusammengenommen die Gruppe =C(V)2 oder =C(R6)W bilden, worin W gleich -COOR5 oder -COR7 ist, (d) R3 und R4 jeweils C1-C6-Alkyl, C1-C6-Alkoxy, Brom, Chlor oder Fluor sind und m und n jeweils die ganzen Zahlen 0, 1 oder 2 sind und (e) B und B' jeweils ausgewählt sind aus der Gruppe bestehend aus: (i) den unsubstituierten, mono-, di- und trisubstituierten Arylgruppen Phenyl und Naphthyl, (ii) den unsubstituierten, mono- und disubstituierten aromatischen heterocyclischen Gruppen Pyridyl, Furanyl, Benzofuran-2-yl, Benzofuran-3-yl, Thienyl, Benzothien-2-yl, Benzothien-3-yl, Dibenzofuranyl, Dibenzothienyl, Carbazolyl und Fluorenyl, wobei jeder Substituent dieser Aryl- und aromatischen heterocyclischen Gruppen in (e)(i) und (ii) ausgewählt ist aus der Gruppe bestehend aus Hydroxy, Aryl, Mono(C1-C6)alkoxyaryl, Di(C1-C6)alkoxyaryl, Mono(C1-C6)alkylaryl, Di(C1-C6)alkylaryl, Bromaryl, Chloraryl, Fluoraryl, C3-C7-Cycloalkylaryl, C3-C7-Cycloalkyl, C3-C7-Cycloalkyloxy, C3-C7-Cycloalkyloxy(C1-C6)alkyl, C3-C7-Cycloalkyloxy(C1-C6)alkyl, C3-C7-Cycloalkyloxy(C1-C6)alkoxy, Aryl(C1-C6)alkyl, Aryl(C1-C6)alkoxy, Aryloxy, Aryloxy(C1-C6)alkyl, Aryloxy(C1-C6)alkoxy, Mono- und Di(C1-C6)alkylaryl(C1-C6)alkyl, Mono- und Di(C1-C6)alkoxyaryl(C1-C6)alkyl, Mono- und Di(C1-C6)alkylaryl(C1-C6)alkoxy, Mono- und Di(C1-C6)alkoxyaryl(C1-C6)alkoxy, Amino, Mono(C1-C6)alkylamino, Di(C1-C6)alkylamino, Diarylamino, N-(C1-C6)Alkylpiperazino, N-Arylpiperazino, Aziridino, Indolino, Piperidino, Arylpiperidino, Morpholino, Thiomorpholino, Tetrahydrochinolino, Tetrahydroisochinolino, Pyrryl, C1-C6-Alkyl, C1-C6-Bromalkyl, C1-C6-Chloralkyl, C1-C6-Fluoralkyl, C1-C6-Alkoxy, Mono(C1-C6)alkoxy(C1-C4)alkyl, Acryloxy, Methacryloxy, Brom, Chlor und Fluor, (iii) den Gruppen, die durch die folgenden graphischen Formeln wiedergegeben sind: worin E gleich Kohlenstoff oder Sauerstoff ist und D gleich Sauerstoff oder substituierter Stickstoff ist, unter der Voraussetzung, dass, wenn D substituierter Stickstoff ist, E gleich Kohlenstoff ist, wobei diese Substituenten des Stickstoffs ausgewählt sind aus der Gruppe bestehend aus Wasserstoff, C1-C6-Alkyl und C2-C6-Acyl, jedes R8 gleich C1-C6-Alkyl, C1-C6-Alkoxy, Hydroxy, Brom, Chlor oder Fluor ist, R9 und R10 jeweils Wasserstoff oder C1-C6-Alkyl sind und p die ganze Zahl 0, 1 oder 2 ist, (iv) C1-C6-Alkyl, C1-C6-Bromalkyl, C1-C6-Chloralkyl, C1-C6-Fuoralkyl, C1-C6-Alkoxy(C1-C4)alkyl, C3-C6-Cycloalkyl, Mono(C1-C6)alkoxy(C3-C6)cycloalkyl, Mono(C1-C6)alkyl(C3-C6)-cycloalkyl, Brom(C3-C6)cycloalkyl, Chlor(C3-C6)cycloalkyl und Fluor(C3-C6)cycloalkyl und (v) der Gruppe, die durch die folgende graphische Formel wiedergegeben ist: worin X gleich Wasserstoff oder C1-C4-Alkyl ist und Z ausgewählt ist aus den unsubstituierten, mono- und disubstituierten Mitgliedern der Gruppe bestehend aus Naphthyl, Phenyl, Furanyl und Thienyl, wobei jeder Substituent dieser Gruppe C1-C4-Alkyl, C1-C4-Alkoxy, Brom, Fluor oder Chlor ist, oder (vi) B und B' zusammengenommen Fluoren-9-yliden, mono- oder disubstituiertes Fluoren-9-yliden oder ein Mitglied, ausgewählt aus der Gruppe bestehend aus gesättigten C3-C12-spiromonocyclischen Kohlenwasserstoffringen, gesättigten C7-C12-spirobicyclischen Kohlenwasserstoffringen und gesättigten C7-C12-spirotricyclischen Kohlenwasserstoffringen, bilden, wobei die Substituenten des Fluoren-9-ylidens ausgewählt sind aus der Gruppe bestehend aus C1-C4-Alkyl, C1-C4-Alkoxy, Brom, Fluor und Chlor.
- Indenonaphthopyran nach Anspruch 1, worin: (a) der heterocyclische Ring A unsubstituiert oder monosubstituiert ist und die Substituenten dieses heterocyclischen Rings gleich C1-C4-Alkyl oder C1-C4-Alkoxy sind, (b) R1 gleich Wasserstoff, Hydroxy, Fluor oder Chlor ist und R2 die Gruppe -CH(V)2 ist, worin V gleich -CN oder -COOR5 ist und jedes R5 gleich Wasserstoff, C1-C4-Alkyl, Phenyl(C1-C2)alkyl, mono(C1-C4)alkylsubstituiertes Phenyl(C1-C2)alkyl, mono(C1-C4)alkoxysubstituiertes Phenyl(C1-C2)alkyl oder die unsubstituierte oder monosubstituierte Arylgruppe Phenyl oder Naphthyl ist oder R2 die Gruppe -CH(R6)Y ist, worin R6 gleich Wasserstoff, C1-C4-Alkyl oder die unsubstituierten oder monosubstituierten Arylgruppen Phenyl oder Naphthyl ist und Y gleich -COOR5, -COR7 oder -CH2OR11 ist, worin R7 gleich Wasserstoff, C1-C4-Alkyl, die unsubstituierte oder monosubstituierte Arylgruppe Phenyl oder Naphthyl, Amino, Mono(C1-C4)alkylamino, Di(C1-C4)alkylamino, Phenylamino, mono- oder di(C1-C4)alkylsubstituiertes Phenylamino, mono- oder di(C1-C4)alkoxysubstituiertes Phenylamino, Diphenylamino, mono- oder di(C1-C4)alkylsubstituiertes Diphenylamino, mono- oder di(C1-C4)alkoxysubstituiertes Diphenylamino, Morpholino oder Piperidino ist, R11 gleich Wasserstoff, -COR5, C1-C4-Alkyl, C1-C2-Alkoxy(C1-C4)alkyl, Phenyl(C1-C2)alkyl, mono(C1-C4)alkylsubstituiertes Phenyl(C1-C2)alkyl, mono(C1-C4)alkoxysubstituiertes Phenyl(C1-C2)alkyl oder die unsubstituierte oder monosubstituierte Arylgruppe Phenyl oder Naphthyl ist, wobei jeder von all diesen Substituenten der Arylgruppen gleich C1-C4-Alkyl oder C1-C4-Alkoxy ist, oder (c) R1 und R2 zusammengenommen die Gruppe =C(V)2 oder =C(R6)W bilden, worin W gleich -COOR5 oder -COR7 ist, (d) R3 und R4 jeweils C1-C4-Alkyl, C1-C4-Alkoxy, Chlor oder Fluor sind und m und n jeweils die ganzen Zahlen 0 oder 1 sind und (e) B und B' jeweils ausgewählt sind aus der Gruppe bestehend aus: (i) Phenyl, mono substituiertem und disubstituiertem Phenyl, (ii) den unsubstituierten, mono- und disubstituierten aromatischen heterocyclischen Gruppen Furanyl, Benzofuran-2-yl, Thienyl, Benzothien-2-yl, Dibenzofuran-2-yl und Dibenzothien-2-yl, wobei jeder Substituent dieser Phenyl- und aromatischen heterocyclischen Gruppen in (e)(i) und (ii) ausgewählt ist aus der Gruppe bestehend aus Hydroxy, Aryl, Aryloxy, Aryl(C1-C3)alkyl, Amino, Mono(C1-C3)alkylamino, Di(C1-C3)alkylamino, N-(C1-C3)Alkylpiperazino, Indolino, Piperidino, Morpholino, Pyrryl, C1-C3-Alkyl, C1-C3-Chloralkyl, C1-C3-Fluoralkyl, C1-C3-Alkoxy, Mono(C1-C3)alkoxy(C1-C3)alkyl, Fluor und Chlor, (iii) den Gruppen, die durch die folgenden graphischen Formeln wiedergegeben sind: worin E gleich Kohlenstoff und D gleich Sauerstoff ist, R8 gleich C1-C3-Alkyl oder C1-C3-Alkoxy ist, R9 und R10 jeweils Wasserstoff oder C1-C4-Alkyl sind und p die ganze Zahl 0 oder 1 ist, (iv) C1-C4-Alkyl und (v) der Gruppe, die durch die folgende graphische Formel wiedergegeben ist: worin X gleich Wasserstoff oder Methyl ist und Z gleich Phenyl oder monosubstituiertes Phenyl ist, wobei dieser Substituent des Phenyls ausgewählt ist aus der Gruppe bestehend aus C1-C3-Alkyl, C1-C3-Alkoxy und Fluor, oder (vi) B und B' zusammengenommen Fluoren-9-yliden, monosubstituiertes Fluoren-9-yliden oder ein Mitglied, ausgewählt aus der Gruppe bestehend aus gesättigten C3-C8-spiromonocyclischen Kohlenwasserstoffringen, gesättigten C7-C10-spirobicyclischen Kohlenwasserstoffringen und gesättigten C7-C10-spirotricyclischen Kohlenwasserstoffringen, bilden, wobei dieser Substituent des Fluoren-9- ylidens ausgewählt ist aus der Gruppe bestehend aus C1-C3-Alkyl, C1-C3-Alkoxy, Fluor und Chlor.
- Indenonaphthopyran nach Anspruch 2, worin: (a) der heterocyclische Ring A unsubstituiert oder monosubstituiert ist, die 2,3- oder 3,2-Positionen dieses heterocyclischen Rings an die g- oder p-Seite dieses Indenonaphthopyrans kondensiert sind und die Substituenten dieses heterocyclischen Rings C1-C3-Alkyl oder C1-C3-Alkoxy sind, (b) R1 gleich Wasserstoff, Hydroxy oder Chlor ist und R2 die Gruppe -CH(V)2 ist, worin V gleich -CN ist, oder R2 die Gruppe -CH(R6)Y ist, worin R6 gleich Wasserstoff oder C1-C4-Alkyl ist und Y gleich -COOR5 oder -CH2OR11 ist, worin R5 gleich Wasserstoff oder C1-C4-Alkyl ist, R11 gleich Wasserstoff, -COR5 oder C1-C4-Alkyl ist, oder (c) R1 und R2 zusammengenommen die Gruppe =C(V)2 oder =C(R6)W bilden, worin W gleich -COOR5 ist, (d) R3 und R4 jeweils C1-C3-Alkyl oder C1-C3-Alkoxy sind und m und n jeweils die ganzen Zahlen 0 oder 1 sind und (e) B und B' jeweils ausgewählt sind aus der Gruppe bestehend aus: (i) Phenyl, monosubstituiertem und disubstituiertem Phenyl, (ii) den unsubstituierten, mono- und disubstituierten aromatischen heterocyclischen Gruppen Furanyl, Benzofuran-2-yl, Thienyl und Benzothien-2-yl, wobei jeder Substituent dieser Phenyl- und aromatischen heterocyclischen Gruppen in (e)(i) und (ii) ausgewählt ist aus der Gruppe bestehend aus Hydroxy, C1-C3-Alkyl, C1-C3-Alkoxy, Aryl, Indolino, Fluor und Chlor, und (iii) der Gruppe, die durch die folgende graphische Formel wiedergegeben ist: worin E gleich Kohlenstoff und D gleich Sauerstoff ist, R8 gleich C1-C3-Alkyl oder C1-C3-Alkoxy ist, R9 und R10 jeweils Wasserstoff oder C1-C3-Alkyl sind und p die ganze Zahl 0 oder 1 ist, oder (iv) B und B' zusammengenommen Fluoren-9-yliden, Adamantyliden, Bornyliden, Norbornyliden oder Bicyclo(3.3.1)nonan-9-yliden bilden.
- Indenonaphthopyranverbindung, ausgewählt aus der Gruppe bestehend aus: (a) 3,3-Di(4-methoxyphenyl)-16-(ethoxycarbonyl)methyl-16-hydroxy-3,16-di[H]-benzofuro[2',3':7,8]indeno[2',3':3,4]naphtho[1,2-b]pyran; (b) 3-(4-Methoxyphenyl)-3-(4-morpholinophenyl)-16-(ethoxycarbonyl)methyl-16-hydroxy-3,16-di[H]-benzofuro[2',3':7,8]indeno[2',3':3,4]naphtho[1,2-b]pyran; (c) 3-Phenyl-3-(4-methoxyphenyl)-16-(ethoxycarbonyl)methyl-16-hydroxy-3,16-di[H]-benzofuro[2'',3'':6',7']indeno[3',2':4,3]naphtho[1,2-b]pyran und (d) 3-Phenyl-3-(4-morpholinophenyl)-16-(ethoxycarbonyl)methyl-16-hydroxy-3,16-di[H]-benzofuro[2'',3'':6',7']indeno-[3',2':4,3]naphtho[1,2-b]pyran.
- Photochromer Gegenstand, enthaltend ein polymeres organisches Wirtsmaterial und eine photochrome Menge der Indenonaphthopyranverbindung nach einem der Ansprüche 1–4.
- Photochromer Gegenstand, enthaltend in Kombination ein festes transparentes polymeres organisches Wirtsmaterial und eine photochrome Menge von jedem von (a) wenigstens einer Indenonaphthopyranverbindung nach einem der Ansprüche 1–4 und (b) wenigstens einer anderen organischen photochromen Verbindung, die wenigstens ein aktiviertes Absorptionsmaximum innerhalb des Bereichs zwischen etwa 400 und 700 nm aufweist.
- Photochromer Gegenstand nach Anspruch 6, wobei die organische photochrome Verbindung (b) ausgewählt ist aus der Gruppe bestehend aus anderen Indenonaphthopyranen, Chromenen, Oxazinen, Metalldithizonaten, Fulgiden und Fulgimiden.
- Photochromer Gegenstand nach Anspruch 7, wobei die organische photochrome Verbindung ausgewählt ist aus der Gruppe bestehend aus Naphthopyranen, Benzopyranen, Phenanthropyranen, Indenonaphthopyranen, Spiro(benzindolin)naphthopyranen, Spiro(indolin)benzopyranen, Spiro(indolin)naphthopyranen, Spiro(indolin)chinopyranen, Spiro(indolin)pyranen, Spiro(indolin)naphthoxazinen, Spiro(indolin)pyridobenzoxazinen, Spiro(benzindolin)pyridobenzoxazinen, Spiro(benzindolin)naphthoxazinen, Spiro(indolin)benzoxazinen und Mischungen solcher photochromen Verbindungen.
- Photochromer Gegenstand nach einem der Ansprüche 5–8, wobei die photochrome Verbindung in einer Menge von 0,05 bis 1,0 mg/cm2 organische Wirtsmaterialoberfläche, auf die die photochrome(n) Substanz(en) eingebracht oder aufgebracht ist (sind), vorhanden ist.
- Photochromer Gegenstand nach einem der Ansprüche 5–9, wobei das polymere organische Wirtsmaterial ausgewählt ist aus der Gruppe bestehend aus Poly(C1-C12-alkylmethacrylaten), Poly(oxyalkylendimethacrylaten), poly(alkoxylierten Phenolmethacrylaten), Celluloseacetat, Cellulosetriacetat, Celluloseacetatpropionat, Celluloseacetatbutyrat, Poly(vinylacetat), Poly(vinylalkohol), Poly(vinylchlorid), Poly(vinylidenchlorid), thermoplastischen Polycarbonaten, Polyestern, Polyurethanen, Poly(ethylenterephthalat), Polystyrol, Poly(alpha-methylstyrol), Copoly(styrol-methylmethacrylat), Copoly(styrol-acrylnitril), Polyvinylbutyral und Polymeren von Mitgliedern der Gruppe bestehend aus Polyol(allylcarbonat)monomeren, polyfunktionellen Acrylatmonomeren, polyfunktionellen Methacrylatmonomeren, Diethylenglykoldimethacrylatmonomeren, Diisopropenylbenzolmonomeren, ethoxylierten Bisphenol-A-dimethacrylatmonomeren, Ethylenglykolbismethacrylatmonomeren, Poly(ethylenglykol)bismethacrylatmonomeren, ethoxylierten Phenolmethacrylatmonomeren, alkoxylierten mehrwertigen Alkoholacrylatmonomeren und Diallylidenpentaerythritolmonomeren.
- Photochromer Gegenstand nach Anspruch 10, worin das polymere organische Wirtsmaterial ein festes transparentes Polymer ist, ausgewählt aus der Gruppe bestehend aus Poly(methylmethacrylat), Poly(ethylenglykolbismethacrylat), poly(ethoxyliertem Bisphenol-A-dimethacrylat), thermoplastischem Polycarbonat, Poly(vinylacetat), Polyvinylbutyral, Polyurethan und Polymeren von Mitgliedern der Gruppe bestehend aus Diethylenglykolbis(allylcarbonat)monomeren, Diethylenglykoldimethacrylatmonomeren, ethoxylierten Phenolmethacrylatmonomeren, Diisopropenylbenzolmonomeren und ethoxylierten Trimethylolpropantriacrylatmonomeren.
- Photochromer Gegenstand, enthaltend ein Polymerisat eines optischen organischen Harzmonomers und eine photochrome Menge der Indenonaphthopyranverbindung nach einem der Ansprüche 1–4.
- Photochromer Gegenstand nach Anspruch 12, wobei der Brechungsindex des Polymerisats ungefähr 1,48 bis ungefähr 1,75 beträgt.
- Photochromer Gegenstand nach Anspruch 13, wobei der Brechungsindex des Polymerisats ungefähr 1,495 bis ungefähr 1,66 beträgt.
- Photochromer Gegenstand nach einem der Ansprüche 5–14, wobei der Gegenstand eine Linse ist.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US666942 | 1984-10-31 | ||
| US819969 | 1992-01-13 | ||
| US66694296A | 1996-06-17 | 1996-06-17 | |
| US08/783,343 US5698141A (en) | 1996-06-17 | 1997-01-16 | Photochromic heterocyclic fused indenonaphthopyrans |
| US783343 | 1997-01-16 | ||
| US08/819,969 US5723072A (en) | 1996-06-17 | 1997-03-18 | Photochromic heterocyclic fused indenonaphthopyrans |
| PCT/US1997/009686 WO1997048993A1 (en) | 1996-06-17 | 1997-06-04 | Novel photochromic heterocyclic fused indenonaphthopyrans |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69730833D1 DE69730833D1 (de) | 2004-10-28 |
| DE69730833T2 true DE69730833T2 (de) | 2005-09-29 |
Family
ID=27418157
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69730833T Expired - Lifetime DE69730833T2 (de) | 1996-06-17 | 1997-06-04 | Photochrome heterocyclische annelierte indenonaphthopyrane |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US5723072A (de) |
| EP (1) | EP0912908B1 (de) |
| JP (1) | JP2000504031A (de) |
| CN (1) | CN1226319A (de) |
| AU (1) | AU709675B2 (de) |
| BR (1) | BR9709811A (de) |
| CA (1) | CA2256479C (de) |
| DE (1) | DE69730833T2 (de) |
| ES (1) | ES2229367T3 (de) |
| IL (1) | IL127169A0 (de) |
| WO (1) | WO1997048993A1 (de) |
Families Citing this family (97)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6018059A (en) * | 1996-12-23 | 2000-01-25 | Corning Incorporated | (Benzofuran) naphthopyrans, the compositions and (co)polymer matrices containing them |
| EP0987260B1 (de) * | 1998-05-29 | 2004-03-03 | Rodenstock GmbH | Photochrome Spirofluorenopyrane |
| JP2002518494A (ja) | 1998-06-19 | 2002-06-25 | オプティッシェ、ベルケ、ゲー.ローデンシュトック | 光互変性ナフトピラン |
| EP1097155B1 (de) * | 1998-07-10 | 2002-09-18 | Transitions Optical, Inc. | Photochrome sechsgliedrige heterocyclisch kondensierte naphthopyrane |
| US6022495A (en) * | 1998-07-10 | 2000-02-08 | Transitions Optical, Inc. | Photochromic benzopyrano-fused naphthopyrans |
| FR2783249B1 (fr) * | 1998-09-11 | 2001-06-22 | Flamel Tech Sa | Naphtopyranes anneles en c5-c6, leur preparation et les compositions et matrices (co)polymeres les renfermant |
| EP1144416B1 (de) | 1999-11-10 | 2005-03-02 | Rodenstock GmbH | Heterocyclisch annellierte indenochromenderivate |
| US6736998B2 (en) * | 2000-12-29 | 2004-05-18 | Transitions Optical, Inc. | Indeno-fused photochromic naphthopyrans |
| US7008568B2 (en) * | 2001-11-20 | 2006-03-07 | Vision-Ease Lens, Inc. | Photochromic naphthopyran compounds: compositions and articles containing those naphthopyran compounds |
| US7452611B2 (en) * | 2001-12-27 | 2008-11-18 | Transitions Optical, Inc. | Photochromic optical article |
| JP2005289812A (ja) * | 2002-04-01 | 2005-10-20 | Tokuyama Corp | クロメン化合物 |
| US7320826B2 (en) * | 2003-03-20 | 2008-01-22 | Ppg Industries Ohio, Inc. | Photochromic articles with reduced temperature dependency and methods for preparation |
| US7262295B2 (en) | 2003-03-20 | 2007-08-28 | Transitions Optical, Inc. | Indeno-fused photochromic naphthopyrans, naphthols and photochromic articles |
| US20040186241A1 (en) * | 2003-03-20 | 2004-09-23 | Gemert Barry Van | Photochromic ocular devices |
| US7632540B2 (en) | 2003-07-01 | 2009-12-15 | Transitions Optical, Inc. | Alignment facilities for optical dyes |
| US7978391B2 (en) * | 2004-05-17 | 2011-07-12 | Transitions Optical, Inc. | Polarizing, photochromic devices and methods of making the same |
| US7342112B2 (en) * | 2003-07-01 | 2008-03-11 | Ppg Industries Ohio, Inc. | Photochromic compounds |
| US8545984B2 (en) * | 2003-07-01 | 2013-10-01 | Transitions Optical, Inc. | Photochromic compounds and compositions |
| US8698117B2 (en) | 2003-07-01 | 2014-04-15 | Transitions Optical, Inc. | Indeno-fused ring compounds |
| US8089678B2 (en) * | 2003-07-01 | 2012-01-03 | Transitions Optical, Inc | Clear to circular polarizing photochromic devices and methods of making the same |
| US8545015B2 (en) | 2003-07-01 | 2013-10-01 | Transitions Optical, Inc. | Polarizing photochromic articles |
| US8518546B2 (en) | 2003-07-01 | 2013-08-27 | Transitions Optical, Inc. | Photochromic compounds and compositions |
| US8582192B2 (en) | 2003-07-01 | 2013-11-12 | Transitions Optical, Inc. | Polarizing photochromic articles |
| US8211338B2 (en) | 2003-07-01 | 2012-07-03 | Transitions Optical, Inc | Photochromic compounds |
| US9096014B2 (en) | 2003-07-01 | 2015-08-04 | Transitions Optical, Inc. | Oriented polymeric sheets exhibiting dichroism and articles containing the same |
| US20110140056A1 (en) | 2003-07-01 | 2011-06-16 | Transitions Optical, Inc. | Indeno-fused ring compounds |
| US7256921B2 (en) * | 2003-07-01 | 2007-08-14 | Transitions Optical, Inc. | Polarizing, photochromic devices and methods of making the same |
| US7097303B2 (en) | 2004-01-14 | 2006-08-29 | Ppg Industries Ohio, Inc. | Polarizing devices and methods of making the same |
| US20050168689A1 (en) * | 2004-01-30 | 2005-08-04 | Knox Carol L. | Photochromic optical element |
| US20070159594A9 (en) * | 2004-05-13 | 2007-07-12 | Jani Dharmendra M | Photochromic blue light filtering materials and ophthalmic devices |
| US8563213B2 (en) * | 2004-07-16 | 2013-10-22 | Transitions Optical, Inc. | Methods for producing photosensitive microparticles |
| US8563212B2 (en) | 2004-07-16 | 2013-10-22 | Transitions Optical, Inc. | Methods for producing photosensitive microparticles, non-aqueous dispersions thereof and articles prepared therewith |
| US8153344B2 (en) * | 2004-07-16 | 2012-04-10 | Ppg Industries Ohio, Inc. | Methods for producing photosensitive microparticles, aqueous compositions thereof and articles prepared therewith |
| DE112005002092A5 (de) * | 2004-10-21 | 2007-10-11 | Rodenstock Gmbh | Photochrome h-annellierte Benzo-[f]chromen-Derivate |
| US20060093844A1 (en) * | 2004-10-29 | 2006-05-04 | Conklin Jeanine A | Photochromic coating compositions, methods of making coated articles and articles thereof |
| US9139552B2 (en) | 2005-04-08 | 2015-09-22 | Transitions Optical, Inc. | Indeno-fused naphthopyrans having ethylenically unsaturated groups |
| US20060228557A1 (en) * | 2005-04-08 | 2006-10-12 | Beon-Kyu Kim | Photochromic materials having extended pi-conjugated systems and compositions and articles including the same |
| US9052438B2 (en) | 2005-04-08 | 2015-06-09 | Johnson & Johnson Vision Care, Inc. | Ophthalmic devices comprising photochromic materials with reactive substituents |
| US9028728B2 (en) | 2005-04-08 | 2015-05-12 | Transitions Optical, Inc. | Photochromic materials that include indeno-fused naphthopyrans |
| US8647538B2 (en) | 2005-04-08 | 2014-02-11 | Transitions Optical, Inc. | Photochromic compounds having at least two photochromic moieties |
| US7556750B2 (en) | 2005-04-08 | 2009-07-07 | Transitions Optical, Inc. | Photochromic materials with reactive substituents |
| US8158037B2 (en) | 2005-04-08 | 2012-04-17 | Johnson & Johnson Vision Care, Inc. | Photochromic materials having extended pi-conjugated systems and compositions and articles including the same |
| US20060226402A1 (en) * | 2005-04-08 | 2006-10-12 | Beon-Kyu Kim | Ophthalmic devices comprising photochromic materials having extended PI-conjugated systems |
| US8147725B2 (en) | 2005-04-08 | 2012-04-03 | Transitions Optical, Inc | Photochromic materials having extended pi-conjugated systems and compositions and articles including the same |
| JP5442258B2 (ja) * | 2005-11-10 | 2014-03-12 | ローデンストック.ゲゼルシャフト.ミット.ベシュレンクテル.ハフツング | 光互変性スピロジヒドロフェナントロピラン |
| CN102030880A (zh) | 2006-05-05 | 2011-04-27 | Ppg工业俄亥俄公司 | 由硫醚官能的低聚多硫醇制备的组合物和制品 |
| US7907346B2 (en) | 2007-03-16 | 2011-03-15 | Transitions Optical, Inc. | Photochromic materials and photochromic compositions and articles including the same |
| ES2372734T3 (es) * | 2007-11-26 | 2012-01-25 | Rodenstock Gmbh | Benzopiranos fotocrómicos. |
| DE102008060096A1 (de) | 2007-12-20 | 2009-06-25 | Rodenstock Gmbh | Photochrome Spirobenzopyranobenzopyrane |
| AU2009245089B2 (en) * | 2008-05-09 | 2012-07-05 | Tokuyama Corporation | Chromene compound |
| US8110127B2 (en) | 2008-06-19 | 2012-02-07 | Essilor International (Compagnie Generale D'optique) | Photochromic coating exhibiting improved performance |
| US20100014010A1 (en) * | 2008-06-27 | 2010-01-21 | Transitions Optical, Inc. | Formulations comprising mesogen containing compounds |
| US20090326186A1 (en) * | 2008-06-27 | 2009-12-31 | Transitions Optical, Inc. | Mesogen containing compounds |
| US8628685B2 (en) * | 2008-06-27 | 2014-01-14 | Transitions Optical, Inc | Mesogen-containing compounds |
| US7910019B2 (en) | 2008-06-27 | 2011-03-22 | Transitions Optical, Inc. | Mesogen containing compounds |
| US8431039B2 (en) | 2008-06-27 | 2013-04-30 | Transitions Optical, Inc. | Mesogenic stabilizers |
| US8349210B2 (en) | 2008-06-27 | 2013-01-08 | Transitions Optical, Inc. | Mesogenic stabilizers |
| US8613868B2 (en) | 2008-06-27 | 2013-12-24 | Transitions Optical, Inc | Mesogenic stabilizers |
| US7910020B2 (en) * | 2008-06-27 | 2011-03-22 | Transitions Optical, Inc. | Liquid crystal compositions comprising mesogen containing compounds |
| US8623238B2 (en) | 2008-06-27 | 2014-01-07 | Transitions Optical, Inc. | Mesogenic stabilizers |
| EP2145936A3 (de) * | 2008-07-14 | 2010-03-17 | Gracel Display Inc. | Fluoren und Pyren Derivate und organische Elektrolumineszenzvorrichtung damit |
| DE102009058906A1 (de) | 2008-12-18 | 2010-06-24 | Rodenstock Gmbh | Photochrome Naphthopyrane mit Verbrückung zweier aromatischer Teilsysteme |
| US8518305B2 (en) | 2009-10-28 | 2013-08-27 | Transitions Optical, Inc. | Photochromic materials |
| US8920928B2 (en) | 2010-12-16 | 2014-12-30 | Transitions Optical, Inc. | Photochromic compounds and compositions |
| US9034219B2 (en) | 2010-12-16 | 2015-05-19 | Transitions Optical, Inc. | Photochromic compounds and compositions |
| EP2655354B1 (de) | 2010-12-23 | 2014-08-06 | Rodenstock GmbH | Photochrome annellierte naphthopyrane mit einem zum pyransauerstoff benachbarten benzolring, der über beide meta-stellungen mit dem para-substituenten verknüpft ist |
| US8848288B2 (en) | 2011-03-04 | 2014-09-30 | Ppg Industries Ohio, Inc. | Composite optical articles |
| US8641933B2 (en) | 2011-09-23 | 2014-02-04 | Ppg Industries Ohio, Inc | Composite crystal colloidal array with photochromic member |
| WO2013045086A1 (de) | 2011-09-26 | 2013-04-04 | Rodenstock Gmbh | Photochrome zweifach-annellierte naphthopyrane |
| ES2563502T3 (es) | 2011-12-09 | 2016-03-15 | Rodenstock Gmbh | Naftopiranos fotocromáticos doblemente indenoanillados |
| JP6085367B2 (ja) * | 2012-07-12 | 2017-02-22 | ローデンシュトック ゲーエムベーハー | 規定のジベンゾ[b,d]ピラノ縮合結合を有するフォトクロミックフルオレノピラン |
| US9133362B2 (en) | 2012-07-16 | 2015-09-15 | Ppg Industries Ohio, Inc. | Coating composition having mechanochromic crystals |
| US9145383B2 (en) | 2012-08-10 | 2015-09-29 | Hallstar Innovations Corp. | Compositions, apparatus, systems, and methods for resolving electronic excited states |
| US9125829B2 (en) | 2012-08-17 | 2015-09-08 | Hallstar Innovations Corp. | Method of photostabilizing UV absorbers, particularly dibenzyolmethane derivatives, e.g., Avobenzone, with cyano-containing fused tricyclic compounds |
| WO2014025370A1 (en) | 2012-08-10 | 2014-02-13 | Hallstar Innovations Corp. | Tricyclic energy quencher compounds for reducing singlet oxygen generation |
| JP6071398B2 (ja) * | 2012-10-05 | 2017-02-01 | キヤノン株式会社 | インデノ[1,2−b]フェナンスレン化合物及びこれを有する有機発光素子 |
| US20140264979A1 (en) | 2013-03-13 | 2014-09-18 | Transitions Opticals, Inc. | Method of preparing photochromic-dichroic films having reduced optical distortion |
| EP3010924B1 (de) | 2013-06-17 | 2016-09-14 | Rodenstock GmbH | Uv-härtungskompatible photochrome annellierte naphthopyrane |
| JP6502333B2 (ja) | 2013-10-11 | 2019-04-17 | トランジションズ オプティカル, インコーポレイテッド | 有機溶媒前処理およびフォトクロミックコーティングを使用するフォトクロミック光学物品を調製する方法 |
| JP6631514B2 (ja) * | 2014-05-07 | 2020-01-15 | 三菱瓦斯化学株式会社 | 重縮合で製造された樹脂および樹脂組成物 |
| BR112017006502B1 (pt) | 2014-09-30 | 2022-10-11 | Transitions Optical, Inc | Composto e elemento óptico |
| EP3268375B1 (de) | 2015-03-10 | 2022-06-15 | Transitions Optical, Inc. | Photochrome thienochromenverbindungen |
| JP6949946B2 (ja) * | 2016-09-26 | 2021-10-13 | ローデンシュトック ゲーエムベーハー | 可視波長帯に向けて遠くから伸びる超長波長吸収を有する、フォトクロミック多環縮合ナフトピラン |
| US10884288B2 (en) | 2016-12-30 | 2021-01-05 | Transitions Optical, Ltd. | Polarizing article and method of forming a polarizing article |
| CN110730778B (zh) | 2017-05-10 | 2023-09-12 | 光学转变有限公司 | 光致变色茚并稠合的菲并吡喃化合物 |
| US10866455B2 (en) | 2017-10-19 | 2020-12-15 | Ppg Industries Ohio, Inc. | Display devices including photochromic-dichroic compounds and dichroic compounds |
| DE102018004790A1 (de) | 2018-06-14 | 2019-12-19 | Rodenstock Gmbh | Photochrome annellierte Naphthopyran-Systeme mit speziellen Substituenten zur Realisierung sehr schneller Aufhellgeschwindigkeiten |
| US20210284778A1 (en) | 2020-03-11 | 2021-09-16 | Alcon Inc. | Photochromic polydiorganosiloxane vinylic crosslinkers |
| CN111519469B (zh) * | 2020-05-18 | 2021-12-24 | 湖南翰坤实业有限公司 | 一种防拍纸张材料及其制备方法 |
| EP4158392A1 (de) | 2020-06-02 | 2023-04-05 | Alcon Inc. | Verfahren zur herstellung von photochromen kontaktlinsen |
| HUE069854T2 (hu) | 2020-10-28 | 2025-04-28 | Alcon Inc | Eljárás fotokróm kontaktlencsék elõállítására |
| EP4240579B1 (de) | 2020-11-04 | 2024-12-04 | Alcon Inc. | Verfahren zur herstellung photochromer kontaktlinsen |
| EP4240578B1 (de) | 2020-11-04 | 2024-12-18 | Alcon Inc. | Verfahren zur herstellung photochromer kontaktlinsen |
| KR20230131494A (ko) | 2021-03-08 | 2023-09-13 | 알콘 인코포레이티드 | 광기능성 콘택트 렌즈의 제조 방법 |
| KR20230144634A (ko) | 2021-04-01 | 2023-10-16 | 알콘 인코포레이티드 | 광변색성 콘택트 렌즈의 제조 방법 |
| KR20240153593A (ko) | 2022-04-28 | 2024-10-23 | 알콘 인코포레이티드 | Uv- 및 hevl-흡수 안과용 렌즈의 제조 방법 |
| DE102023109737A1 (de) | 2023-04-18 | 2024-10-24 | Rodenstock Gmbh | Höhermolekulare photochrome Farbstoffe mit mindestens einer und höchstens vier Naphthopyran-Untereinheiten sowie mehreren Polyether-Ketten |
Family Cites Families (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3361706A (en) * | 1964-03-06 | 1968-01-02 | American Cyanamid Co | Control of the photochromic return rate of (arylazo) thioformic arylhydrazidates |
| US3567605A (en) * | 1966-03-30 | 1971-03-02 | Ralph S Becker | Photochemical process |
| GB1186987A (en) * | 1967-08-30 | 1970-04-08 | Fuji Photo Film Co Ltd | Photochromic Compounds |
| JPS4948631B1 (de) * | 1968-10-28 | 1974-12-23 | ||
| US3627690A (en) * | 1969-10-01 | 1971-12-14 | Itek Corp | Photochromic naphthopyran compositions |
| US4342668A (en) * | 1978-09-08 | 1982-08-03 | American Optical Corporation | Photochromic compounds |
| US4215010A (en) * | 1978-09-08 | 1980-07-29 | American Optical Corporation | Photochromic compounds |
| US4360653A (en) * | 1981-10-23 | 1982-11-23 | Ppg Industries, Inc. | Polymerizate of (allyl carbonate) and aliphatic polyurethane having acrylic unsaturation |
| US4720356A (en) * | 1982-03-22 | 1988-01-19 | American Optical Corporation | Photochromic composition resistant to fatigue |
| DE3300004A1 (de) * | 1983-01-03 | 1984-07-12 | Bayer Ag, 5090 Leverkusen | Substituierte 4-aminomethylenchromane bzw. -chromene, verfahren zu ihrer herstellung sowie ihre verwendung in arzneimitteln |
| US4637698A (en) * | 1983-11-04 | 1987-01-20 | Ppg Industries, Inc. | Photochromic compound and articles containing the same |
| US4880667A (en) * | 1985-09-24 | 1989-11-14 | Ppg Industries, Inc. | Photochromic plastic article and method for preparing same |
| JPS62195383A (ja) * | 1986-02-21 | 1987-08-28 | Toray Ind Inc | 新規スピロナフトピラン化合物 |
| GB8611837D0 (en) * | 1986-05-15 | 1986-06-25 | Plessey Co Plc | Photochromic spiropyran compounds |
| GB8614680D0 (en) * | 1986-06-17 | 1986-07-23 | Plessey Co Plc | Photoreactive lenses |
| US4816584A (en) * | 1986-11-12 | 1989-03-28 | Ppg Industries, Inc. | Photochromic spiro(indoline)benzoxazines |
| GB8712210D0 (en) * | 1987-05-22 | 1987-06-24 | Pilkington Brothers Plc | Photochromic articles |
| US4931219A (en) * | 1987-07-27 | 1990-06-05 | Ppg Industries, Inc. | Photochromic compound and articles containing the same |
| US4931220A (en) * | 1987-11-24 | 1990-06-05 | Ppg Industries, Inc. | Organic photochromic pigment particulates |
| JPH0745490B2 (ja) * | 1988-09-05 | 1995-05-17 | 株式会社トクヤマ | スピロピラン化合物及びその製造方法 |
| US4931221A (en) * | 1988-12-30 | 1990-06-05 | Ppg Industries, Inc. | Photochromic spiropyran compounds |
| US4994208A (en) * | 1989-04-18 | 1991-02-19 | Ppg Industries, Inc. | Photochromic polymeric article |
| US5066818A (en) * | 1990-03-07 | 1991-11-19 | Ppg Industries, Inc. | Photochromic naphthopyran compounds |
| US5244602A (en) * | 1990-12-03 | 1993-09-14 | Ppg Industries, Inc. | Photochromic naphthopyrans |
| US5200483A (en) * | 1991-11-07 | 1993-04-06 | Ppg Industries, Inc. | Polyol(allyl carbonate) composiitons and articles prepared there from |
| US5585042A (en) * | 1992-02-24 | 1996-12-17 | Transitions Optical, Inc. | Photochromic naphthopyrans |
| US5238981A (en) * | 1992-02-24 | 1993-08-24 | Transitions Optical, Inc. | Photochromic naphthopyrans |
| US5274132A (en) * | 1992-09-30 | 1993-12-28 | Transitions Optical, Inc. | Photochromic naphthopyran compounds |
| US5405958A (en) * | 1992-12-21 | 1995-04-11 | Transitions Optical, Inc. | Photochromic spiro(indoline)naphthoxazine compounds |
| WO1994020869A1 (en) * | 1993-03-12 | 1994-09-15 | Ppg Industries, Inc. | Novel benzopyrans |
| US5552090A (en) * | 1993-06-21 | 1996-09-03 | Ppg Industries, Inc. | Photochromic naphthopyran compounds |
| US5578252A (en) * | 1993-06-21 | 1996-11-26 | Transitions Optical, Inc. | Photochromic substituted naphthopyran compounds |
| US5384077A (en) * | 1993-06-21 | 1995-01-24 | Transitions Optical, Inc. | Photochromic naphthopyran compounds |
| US5466398A (en) * | 1993-06-21 | 1995-11-14 | Transitions Optical, Inc. | Photochromic substituted naphthopyran compounds |
| US5458814A (en) * | 1993-12-09 | 1995-10-17 | Transitions Optical, Inc. | Substituted naphthopyrans |
| US5451344A (en) * | 1994-04-08 | 1995-09-19 | Transitions Optical, Inc. | Photochromic naphthopyran compounds |
| US5395567A (en) * | 1994-04-18 | 1995-03-07 | Ppg Industries, Inc. | Photochromic spironaphthopyran compounds |
| US5514817A (en) * | 1994-08-04 | 1996-05-07 | Ppg Industries, Inc. | Substituted phenanthropyrans |
| IL115803A (en) * | 1994-11-03 | 2000-02-17 | Ppg Industries Inc | Indeno-naphthopyran derivatives useful for photochromic articles |
| US5645767A (en) * | 1994-11-03 | 1997-07-08 | Transitions Optical, Inc. | Photochromic indeno-fused naphthopyrans |
-
1997
- 1997-03-18 US US08/819,969 patent/US5723072A/en not_active Expired - Lifetime
- 1997-06-04 CN CN97195587.5A patent/CN1226319A/zh active Pending
- 1997-06-04 EP EP97929796A patent/EP0912908B1/de not_active Expired - Lifetime
- 1997-06-04 AU AU33772/97A patent/AU709675B2/en not_active Ceased
- 1997-06-04 DE DE69730833T patent/DE69730833T2/de not_active Expired - Lifetime
- 1997-06-04 BR BR9709811A patent/BR9709811A/pt not_active IP Right Cessation
- 1997-06-04 IL IL12716997A patent/IL127169A0/xx unknown
- 1997-06-04 JP JP10503038A patent/JP2000504031A/ja active Pending
- 1997-06-04 WO PCT/US1997/009686 patent/WO1997048993A1/en not_active Ceased
- 1997-06-04 ES ES97929796T patent/ES2229367T3/es not_active Expired - Lifetime
- 1997-06-04 CA CA002256479A patent/CA2256479C/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| EP0912908B1 (de) | 2004-09-22 |
| WO1997048993A1 (en) | 1997-12-24 |
| US5723072A (en) | 1998-03-03 |
| CN1226319A (zh) | 1999-08-18 |
| AU709675B2 (en) | 1999-09-02 |
| EP0912908A1 (de) | 1999-05-06 |
| CA2256479C (en) | 2004-04-20 |
| JP2000504031A (ja) | 2000-04-04 |
| ES2229367T3 (es) | 2005-04-16 |
| AU3377297A (en) | 1998-01-07 |
| CA2256479A1 (en) | 1997-12-24 |
| EP0912908A4 (de) | 2000-03-22 |
| BR9709811A (pt) | 1999-08-10 |
| DE69730833D1 (de) | 2004-10-28 |
| IL127169A0 (en) | 1999-09-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69730833T2 (de) | Photochrome heterocyclische annelierte indenonaphthopyrane | |
| DE69523779T2 (de) | Neue substituierte phenanthropyrane | |
| DE69804498T2 (de) | Neue wasserlösliche photochromische verbindungen | |
| DE60112811T2 (de) | Neue photochrome indenonaphthopyranverbindungen | |
| DE69732372T2 (de) | Neuartige photochrome heterozyklische geschmolzene indenonaphthopyrane | |
| DE69726574T2 (de) | Neue photochrome indenokondensierte naphthopyrane | |
| DE60019770T2 (de) | Photochrome naphtopyranen | |
| DE69802439T2 (de) | Photochrome indeno-kondensierte naphtho[2,1-b]pyrane | |
| DE69903309T2 (de) | Photochrome benzopyrankondensierte naphthopyrane | |
| DE69809584T2 (de) | Photochrome, carbocyclisch kondensierte naphthopyranderivate | |
| DE69903042T2 (de) | Photochrome sechsgliedrige heterocyclisch kondensierte naphthopyrane | |
| DE69526246T2 (de) | Neuartiges photochromes, indeno-kondensiertes naphthopyran | |
| DE69631765T2 (de) | Photochrome substitutierte Naphthopyran-Derivate | |
| DE69821525T2 (de) | Photochrome pyrano-kondensierte naphthopyrane | |
| DE69322403T2 (de) | Photochrome naphthopyran-derivate | |
| US5578252A (en) | Photochromic substituted naphthopyran compounds | |
| DE69635284T2 (de) | Neue substituierte napthopyrane | |
| DE69425749T2 (de) | Photochrome substituierte naphtopyranverbindungen | |
| DE69324350T3 (de) | Photochrome naphthopyrane | |
| DE69427859T2 (de) | Photochrome naphthopyranverbindungen | |
| DE69711640T2 (de) | Naphthopyrane, zusammensetzungen und artikel die diese enthalten | |
| US5552090A (en) | Photochromic naphthopyran compounds | |
| DE69810954T2 (de) | 7-methyliden-5-oxo-kondensierte naphtopyrane | |
| EP1194424B1 (de) | Photochrome pyranderivate | |
| EP2788340B1 (de) | Photochrome zweifach-indenoannellierte naphthopyrane |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |