-
Die
vorliegende Erfindung betrifft ein Verfahren zur Behandlung von
Fasermaterialien mit einem Einschlusskomplex faserreaktiver Cyclodextrinderivate
mit speziellen antimikrobiellen Wirkstoffen, wässrige Zusammensetzungen umfassend
diese Einschlusskomplexe und neue Einschlusskomplexe.
-
Die
Verwendung von antimikrobiellen Wirkstoffen in verschiedenen textilbezogenen
Anwendungen ist von zunehmender Bedeutung. Einige antimikrobielle
Substanzen haben keine gute Substantivität auf Textilsubstraten, wie
beispielsweise Baumwolle. Es wird oft gefunden, dass der antimikrobielle
Wirkstoff nach Auftragung auf Textilmaterialien nach einigen Waschzyklen
abgewaschen wird und die antimikrobielle Aktivität verringert wird. Aus diesem
Grund ist das Auffinden eines Verfahrens oder einer Formulierung,
welches) die Waschbeständigkeit
verlängern
kann, wissenschaftlich interessant und kommerziell verheißungsvoll.
Es wurde überraschenderweise
gefunden, dass spezielle antimikrobielle Wirkstoffe mit faserreaktiven
Cyclodextrinderivaten komplexiert werden können. Die Letztgenannten sind
durch die Anwesenheit einer Aushöhlung
gekennzeichnet, die durch ihre spezielle molekulare Konfiguration
gebildet wird. Überdies
können
solche faserreaktiven Cyclodextrinderivate kovalent an Baumwollsubstrate
fixiert werden. Daher kann ein kontrolliertes Abgabesystem hergestellt
werden, worin das reaktive Cyclodextrin sowohl als Anker an die
Fasermaterialien als auch als Träger
für eine
interessante antimikrobielle Substanz wirkt.
-
Es
wurde gefunden, dass die antimikrobiellen Wirkstoff/Cyclodextrin-Komplexe
nach Aufnahme in Fasermaterialien verlängerte Waschbeständigkeit
liefern können.
Die verlängerte
Anwesenheit von in Fasermaterialien aufgenommenen, antimikrobiellen
Wirkstoffen macht die Substrate hygienischer, weniger anfällig für Kreuzkontamination
und frischer. Der letztgenannte Aspekt wird erreicht, weil die ausgewählten antimikrobiellen
Wirkstoffe in der Lage sind, das Wachstum von bestimmten Mikroorganismen
zu inhibieren, speziell von gram-positiven Bakterien, welche als
fähig erachtet
werden, Geruch durch Metabolisieren bestimmter Bestandteile in Schweiß und anderer
Substanzen, welche auf Textilsubstraten gefunden werden können, zu
entwickeln.
-
Ein
weiterer wichtiger Aspekt ist, dass die Leistung hinsichtlich Inhibierung
der Geruchsbildung durch die Anwesenheit von antimikrobiellen Wirkstoffen
mit einem solchen Komplex verbessert werden kann, da Cyclodextrin
selbst gewisse Kapazitäten
besitzt, kleine geruchsverursachende Moleküle zu absorbieren. Aus diesem
Grund ist der Komplex in der Lage, die Geruchsbildung aufgrund von
Bakterienme tabolismus zu inhibieren und gleichfalls andere Gerüche zu absorbieren,
welche in dem Umfeld, in dem Textilprodukte verwendet werden, vorkommen,
wie beispielsweise Rauchgeruch, wenn er in Fasermaterialien aufgenommen
ist.
-
Aufgrund
der Veränderung
der physikalischen Eigenschaften des Komplexes, verglichen mit denen der
antimikrobiellen Wirkstoffe alleine, kann die Substantivität von antimikrobiellen
Wirkstoffen auf verschiedenen Textilsubstraten überdies erhöht werden. Solch ein Aspekt
ist von Interesse, wenn antimikrobielle Wirkstoffe in Waschverfahren
verwendet werden. Herkömmlich
werden antimikrobielle Wirkstoffe einem Waschmittel beigemischt
und im Waschverfahren verwendet. Jedoch kann aufgrund der geringen
Substantivität
von ausgewählten
antimikrobiellen Wirkstoffen gegenüber dem Substrat ein großer Anteil
der antimikrobiellen Wirkstoffe nicht durch das Substrat absorbiert
werden und wird zusammen mit der Waschlauge abgespült. Die
Verbesserung des antimikrobiellen Wirkstoffs in einem Trägersystem
kann deshalb aus den folgenden Gesichtspunkten günstig sein: effizientere Verwendung
des antimikrobiellen Wirkstoffes, weniger antimikrobieller Wirkstoff
in dem Abwasser und aus diesem Grund geringere ökotoxologische Einwirkung,
bessere Stabilität
und weniger Wechselwirkungen der antimikrobiellen Wirkstoffe mit
anderen Hilfsstoffen, welche in üblichen
(Wäsche)
Waschmitteln gefunden werden.
-
Die
vorliegende Erfindung betrifft deshalb ein Verfahren zur antimikrobiellen
Behandlung von Fasermaterialien, umfassend das Auftragen eines Einschlusskomplexes
eines faserreaktiven Cyclodextrinderivates mit einem antimikrobiellen
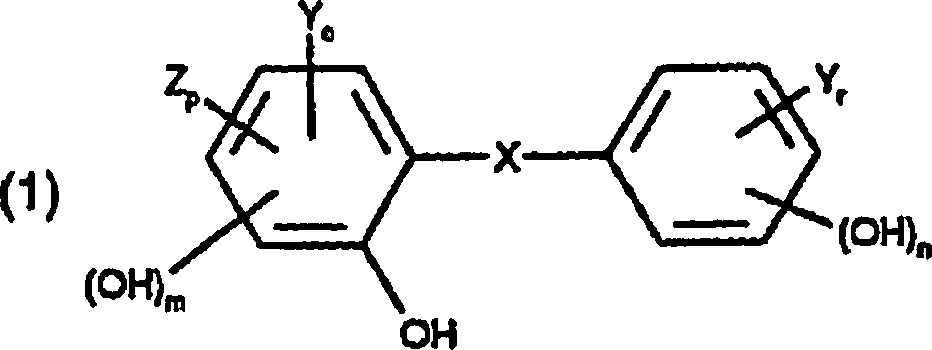
Wirkstoff, welcher eine Halogen-o-hydroxydiphenyl-Verbindung oder eine
nichthalogenierte Hydroxydiphenylether-Verbindung ist, auf das Fasermaterial.
-
Vorzugsweise
ist der antimikrobielle Wirkstoff als eine Halogen-o-hydroxydiphenyl-Verbindung
ausgewählt
aus Verbindungen der Formel
worin
X Sauerstoff,
Schwefel oder -CH
2- darstellt,
Y Chlor
oder Brom darstellt,
Z SO
2H, NO
2 oder C
1-C
4-Alkyl darstellt,
r 0 bis 3 ist,
o
0 bis 3 ist,
p 0 oder 1 ist,
m 0 oder 1 ist und
n
0 oder 1 ist;
und mindestens eines von r oder o ≠ 0 ist.
-
Vorzugsweise
werden in dem vorliegenden Verfahren antimikrobielle Wirkstoffe
der Formel (1) verwendet, worin
X Sauerstoff, Schwefel oder
-CH2- darstellt, und
Y Chlor oder Brom
darstellt,
m 0 ist,
n 0 oder 1 ist,
o 1 oder 2 ist,
r
1 oder 2 ist und
p 0 ist.
-
Von
besonderem Interesse als antimikrobieller Wirkstoff der Formel (1)
ist eine Verbindung der Formel
worin
X -O- oder -CH
2- darstellt;
m 1 bis 3 ist; und
n
1 oder 2 ist, und am bevorzugtesten eine Verbindung der Formel
-
-
Vorzugsweise
ist der antimikrobielle Wirkstoff als eine nichthalogenierte Hydroxydiphenylether-Verbindung
ausgewählt
aus Verbindungen der Formel
worin
U
1 und
U
2 unabhängig
voneinander Wasserstoff, Hydroxy, unsubstituiertes oder hydroxysubstituiertes C
1-C
20-Alkyl, C
5-C
7-Cycloalkyl,
C
1-C
6-Alkylcarbonyl,
C
1-C
20-Alkoxy, Phenyl oder
Phenyl-C
1-C
3-alkyl
darstellen;
U
3 Wasserstoff, C
1-C
20-Alkyl, C
1-C
20-Alkoxy oder
C
1-C
6-Alkylcarbonyl
darstellt; und
U
4 Wasserstoff, unsubstituiertes
oder hydroxysubstituiertes C
1-C
20-Alkyl,
C
5-C
7-Cycloalkyl,
Hydroxy, Formyl, Acetonyl, C
1-C
6-Alkylcarbonyl,
C
2-C
20-Alkenyl,
Carboxy, Carboxy-C
1-C
3-alkyl,
C
1-C
3-Alkylcarbonyl-C
1-C
3-alkyl oder Carboxyallyl
darstellt.
-
U1, U2, U3 und
U4 als C1-C20-Alkyl sind geradkettige oder verzweigte
Alkylreste, wie beispielsweise Methyl, Ethyl, n-Propyl, Isopropyl,
n-Butyl, sec-Butyl, tert-Butyl, Pentyl, Isopentyl, tert-Pentyl,
Hexyl, Cyclohexyl, Heptyl, Octyl, Isooctyl, Nonyl oder Decyl und
dergleichen.
-
U1, U2 und U3 als C1-C20-Alkoxy sind geradkettige oder verzweigte
Alkoxyreste, wie beispielsweise Methoxy, Ethoxy, n-Propoxy, Isopropoxy,
n-Butoxy, sec-Butoxy, tert-Butoxy, Pentyloxy, Isopentyloxy, tert-Pentyloxy,
Heptyloxy, Octyloxy, Isooctyloxy, Nonyloxy oder Decyloxy und dergleichen.
-
U1, U2, U3 und
U4 als C1-C6-Alkylcarbonyl sind geradkettige oder verzweigte
Carbonylreste, wie beispielsweise Acetyl, Propionyl, Butyryl, Isobutyryl,
Valeryl, Isovaleryl oder Pivaloyl und dergleichen.
-
U1, U2 und U4 als hydroxysubstituiertes C1-C20-Alkyl sind zum Beispiel Hydroxymethyl,
Hydroxyethyl, Hydroxypropyl, Hydroxybutyl, Hydroxypentyl, Hydroxyhexyl,
Hydroxyheptyl, Hydroxyoctyl, Hydroxynonyl oder Hydroxydecyl und
dergleichen.
-
Vorzugsweise
werden Verbindungen der Formel (1') verwendet, worin OH in der para-Position
in Bezug auf die Etherbrücke
ist.
-
U1 und U2 sind unabhängig voneinander
vorzugsweise Wasserstoff, C1-C20-Alkyl,
C1-C6-Alkylcarbonyl oder
C1-C20-Alkoxy.
-
U3 ist vorzugsweise Wasserstoff, C1-C20-Alkyl oder
C1-C20-Alkoxy.
-
U4 stellt vorzugsweise Wasserstoff, C1-C20-Alkyl, Hydroxy,
Formyl, Acetonyl, Allyl, Carboxymethyl, Carboxyallyl, hydroxysubstituiertes
C1-C20-Alkyl oder
C1-C6-Alkylcarbonyl
dar.
-
Bevorzugt
sind Verbindungen der Formel (1'),
worin U1 und U3 beide
C1-C4-Alkyl darstellen
und U2 und U4 beide
Wasserstoff darstellen.
-
Verbindungen
der Formel (1'),
welche von besonderem Interesse sind, schließen die folgenden ein:
-
-
Andere
Verbindungen der Formel (1'),
welche von besonderem Interesse sind, schließen die folgende ein:
worin
U
1 C
1-C
5-Alkyl darstellt;
zum Beispiel die Verbindung der Formel
-
-
Von
Interesse sind auch Verbindungen der Formel
worin
U
4 C
1-C
5-Alkyl darstellt,
zum Beispiel die Verbindung der Formel
-
-
Verbindungen
von besonderem Interesse schließen
die folgenden ein:
-
-
Die
Verbindungen der Formel (1')
sind bekannt oder können
in Analogie zu bekannten Verbindungen hergestellt werden.
-
Faserreaktive
Gruppen der Cyclodextrinderivate sind Gruppen, welche fähig sind,
mit dem Fasermaterial zu reagieren, zum Beispiel mit den Hydroxylgruppen
von Zellulose, den Amino-, Carboxyl-, Hydroxyl- oder Thiolgruppen
im Falle von Wolle oder Seide oder mit den Amino- und möglicherweise
den Carboxylgruppen von synthetischen Polyamiden unter Bildung von
kovalenten chemischen Bindungen. Faserreaktive Gruppen sind im Allgemeinen
direkt oder über
ein Brückenstück an ein
Kohlenstoffatom des Cyclodextrinderivates gebunden. Beispiele für geeignete
faserreaktive Gruppen schließen
solche ein, welche mindestens einen ablösbaren Substituenten an einem
aliphatischen, aromatischen oder vorzugsweise an einem heterocyclischen Rest
enthalten oder in welchem die erwähnten Reste einen Rest enthalten,
welcher für
die Reaktion mit dem Fasermaterial geeignet ist. Beispiele für geeignete
Brückenstücke, gemäß welchen
die faserreaktiven Gruppen an ein Kohlenstoff des Cyclodextrinderivates
gebunden werden können,
sind -O-CO- und vorzugsweise -O-.
-
Beispiele
für faserreaktive
Gruppen schließen
faserreaktive Reste ein, welche carbo- oder heterocyclische mit
einem ablösbaren
Atom oder einer Gruppe substituierte 4-, 5- oder 6-Ringe enthalten.
Beispiele für heterocyclische
Reste schließen
heterocyclische Reste ein, welche mindestens einen ablösbaren Substituenten,
ge bunden an einen heterocyclischen Ring, enthalten; und solche,
welche mindestens einen reaktiven Substituenten, gebunden an einen
5- oder 6-gliedrigen heterocyclischen Ring, enthalten, wie beispielsweise an
ein Triazin, Pyridin oder Pyrimidin. Die erwähnten heterocyclischen faserreaktiven
Reste können überdies weitere
faserreaktive Reste über
eine direkte Bindung oder über
ein Brückenstück enthalten.
-
Die
faserreaktive Gruppe des Cyclodextrinderivates ist vorzugsweise
ein Stickstoff enthaltender Heterozyklus mit mindestens einem Substituenten,
ausgewählt
aus der Gruppe, bestehend aus Halogen, insbesondere Fluor oder Chlor,
und unsubstituiertem oder substituiertem Pyridinium.
-
Beispiele
für solche
faserreaktiven Gruppen sind
- a) eine Triazingruppe
der Formel worin
R10 Fluor,
Chlor oder unsubstituiertes oder carboxysubstituiertes Pyridinium
darstellt, und
R11 wie oben definiert
für R10 ist oder einen Rest der Formel -OR12 oder -N(R13)R14 darstellt, worin
R12 Wasserstoff,
Alkali, C1-C8-Alkyl,
welches unsubstituiert ist oder substituiert ist mit Hydroxy oder C1-C4-Alkoxy, darstellt,
und
R13 und R14 unabhängig voneinander
Wasserstoff; C1-C8-Alkyl,
welches unsubstituiert ist oder substituiert ist mit C1-C4-Alkoxy, Hydroxy, Sulfo, Sulfato oder Carboxy;
oder Phenyl, welches unsubstituiert ist oder substituiert ist mit
C1-C4-Alkyl, C1-C4-Alkoxy, Halogen, Nitro, Carboxy oder Sulfo,
darstellen;
- b) oder eine Pyrimidinylgruppe der Formel worin
einer der Reste
R15 und R16 Fluor
oder Chlor darstellt und der andere der Reste R15 und
R16 Fluor, Chlor oder einen Rest der Formel
-OR12 oder -N(R13)R14 wie oben de finiert darstellt, und
R16 C1-C4-Alkylsulfonyl,
C1-C4-Alkoxysulfonyl,
C1-C4-Alkoxycarbonyl,
C2-C4-Alkanoyl,
Chlor, Nitro, Cyano, Carboxyl oder Hydroxyl darstellt;
- c) oder eine Dichlorchinoxalin-Gruppe der Formel
-
Höchstbevorzugt
sind Gruppen der Formel (10), speziell solche, in welchen R10 Chlor darstellt. R11 ist bevorzugt
ein Rest der Formel -OR12, worin R12 Wasserstoff, Alkali oder C1-C8-Alkyl darstellt. Bevorzugte Reste R11 sind solche der Formel -OR12,
worin R12 Wasserstoff, Alkali oder C1-C4-Alkyl darstellt,
insbesondere Wasserstoff oder Alkali. Alkali ist höchst bevorzugt.
Alkali ist vorzugsweise Natrium.
-
Die
Cyclodextrinderivate enthalten bevorzugt 2 bis 3 faserreaktive Gruppen.
-
Faserreaktive
Cyclodextrinderivate sind bekannt, und die Herstellung solcher faserreaktiven
Cyclodextrinderivate kann gemäß bekannter
Verfahren ausgeführt
werden (siehe zum Beispiel U5-A-5,728,823).
-
Zum
Beispiel wird Trichlortriazin oder Trifluortriazin einer Kondensationsreaktion
mit einer Verbindung der Formel H-R10 und/oder
H-R11 unterworfen, und die erhaltene faserreaktive
Gruppe, welche mindestens einen Chlor- oder Fluor-Substituenten
enthält,
wird einer weiteren Kondensationsreaktion mit dem Cyclodextrinderivat
unterworfen. Die Kondensationsreaktionen können bei einer Temperatur von
0 bis 25°C
in wässrigem Medium
durchgeführt
werden. Es ist bevorzugt, die Kondensationsreaktionen unter pH-Kontrolle
in leicht alkalischem Medium durchzuführen.
-
Bevorzugt als Cyclodextrin
ist β-Cyclodextrin.
-
Die
Herstellung des Einschlusskomplexes kann gemäß bekannter Verfahren durchgeführt werden. Zum
Beispiel können
die Einschlusskomplexe durch Kombinieren einer Mischung A) enthaltend
das faserreaktive Cyclodextrin und Wasser mit einer Mischung B)
enthaltend den antimikrobiellen Wirkstoff und ein organisches Lösungsmittel
hergestellt werden. Es ist bevorzugt, entweder die Mischung A) oder
die Mischung B) in Portionen hinzuzufügen. Die Zugabe kann bei Raumtemperatur
durchgeführt
werden. Das Gewichtsverhältnis
von Cyclodextrin/Wasser in Mischung A) ist gewöhnlich 0,1/1 bis 1/0,1, im
Besonderen 0,5/1 bis 1/0,5. Ein Gewichtsverhältnis von ungefähr 1/1 ist
bevorzugt für
Mischung A). Das Gewichtsverhältnis
von antimikrobiellem Wirkstoff/organischem Lösungsmittel in Mischung B)
ist gewöhnlich
0,1/1 bis 1/0,1, im Besonderen 0,5/1 bis 1/0,5. Ein Gewichtsverhältnis von
ungefähr
1/1 ist bevorzugt für
Mischung B). Die zu kombinierenden Mengen von Mischungen A) und
B) können
so gewählt
werden, dass das molare Verhältnis
von antimikrobiellem Wirkstoff/Cyclodextrin gewöhnlich 0,1/1 bis 1/0,1 ist,
im Besonderen 0,5/1 bis 1/0,5. Ein molares Verhältnis von ungefähr 1/1 ist
bevorzugt. Bevorzugte organische Lösungsmittel sind Methanol und
speziell Ethanol. Die Herstellung des Einschlusskomplexes wird zum
Beispiel bei einem pH von ≥ 7,
bevorzugt von ≥ 9
und im Besonderen von ≥ 10
ausgeführt.
Als eine Obergrenze ist ein pH von beispielsweise 12 geeignet.
-
Während und
nach der Kombination von Mischungen A) und B) wird die erhaltene
Mischung gerührt oder
wenn nötig
geknetet, zum Beispiel für
1 bis 24 Stunden. Dann werden die Lösungsmittel entfernt, zum Beispiel
durch Trocknen, bei einer Temperatur von 40 bis 100°C.
-
Gewöhnlich werden
die faserreaktiven Einschlusskomplexe durch zuerst Herstellen des
faserreaktiven Cyclodextrins und dann Einführen des zu komplexierenden
Wirkstoffs hergestellt. Indes besitzt ein solches Verfahren den
Nachteil, dass die faserreaktive Gruppe in allen Reaktionsschritten
anwesend ist, und deshalb kann ein Hydrolysieren der faserreaktiven
Gruppe in einem größeren Umfang
stattfinden. Weiterhin ist es gemeinhin Praxis, dass das unkomplexierte
faserreaktive Cyclodextrin nach der Herstellung getrocknet wird
und zur Herstellung des Einschlusskomplexes wieder in Wasser aufgelöst wird.
Solch ein Verfahren hat wiederum den Nachteil, dass ein Hydrolysieren
der faserreaktiven Gruppe während
des zusätzlichen
Trocknungsschrittes stattfinden kann.
-
Es
wurde nun gefunden, dass ein Hydrolysieren minimiert werden kann,
wenn ein Verfahren verwendet wird, welches umfasst:
- a) Bildung eines Einschlusskomplexes von Cyclodextrin mit mindestens
einem der oben angeführten
antimikrobiellen Wirkstoffe; und dann
- b) Einführen
mindestens einer faserreaktiven Gruppe in den Einschlusskomplex,
welcher gemäß Schritt
a) erhalten wurde.
-
Vorzugsweise
wird der Einschlusskomplex, welcher gemäß Schritt a) erhalten wurde,
direkt ohne zwischenzeitliches Trocknen verarbeitet.
-
Schritt
a) wird gewöhnlich
bei Temperaturen von 20 bis 80°C,
im Besonderen 40 bis 70°C,
in einem wässrigen
Medium, welches das nichtreaktive Cyclodextrin und den antimikrobiellen
Wirkstoff enthält,
ausgeführt.
Das Gewichtsverhältnis
von Cyclodextrin/antimikrobiellem Wirkstoff ist gewöhnlich 0,1/1
bis 1/0,05, speziell 0,5/1 bis 1/0,1. Ein Gewichtsverhältnis von
ungefähr
1/1 bis 1/0,1 ist bevorzugt. Es ist bevorzugt, dass nach der Herstellung
der nichtreaktive Einschlusskomplex, zum Beispiel durch Filtration,
abgetrennt wird oder die Reaktionsmischung, welche gemäß Schritt
a) erhalten wurde, als solche verwendet wird. Vorzugsweise wird
das erhaltene Produkt nicht getrocknet bevor Schritt b) ausgeführt wird.
Dies bedeutet, dass der nasse Kuchen, welcher nach der Filtration
erhalten wurde, als solches für
Schritt b) verwendet wird oder alternativ die Reaktionsmischung,
welche gemäß Schritt
a) erhalten wurde, direkt für
Schritt b) verwendet wird.
-
Schritt
b) wird gewöhnlich
bei Temperaturen von 0 bis 40°C,
im Besonderen von 0 bis 25°C,
in einem wässrigen
Medium, welches den nichtreaktiven Einschlusskomplex, welcher gemäß Schritt
a) erhalten wurde, und die faserreaktive Gruppe enthält, durchgeführt. Das
Gewichtsverhältnis
von nichtreaktivem Einschlusskomplex/faserreaktiver Gruppe beträgt gewöhnlich 0,1/1
bis 1/0,05, im Besonderen 0,5/1 bis 1/0,1, bevorzugter 1/1 bis 1/0,1.
-
Nach
der Herstellung des faserreaktiven Einschlusskomplexes kann das
Produkt getrocknet werden, bevorzugt unter milden Bedingungen, um
die Hydrolyse der faserreaktiven Gruppe zu minimieren. Solch ein Trocknen
kann zum Beispiel durch Verdampfen bei niedrigem Druck (wie 0,01
bis 0,9 Bar, speziell 0,01 bis 0,2 Bar) oder in einem Schaufeltrockner
oder in einem Sprühturm
ausgeführt
werden. Die für
den Trocknungsschritt zu verwendenden Temperaturen können abhängig von
dem verwendeten Trocknungsverfahren variieren. Zum Verdampfen oder
Trocknen in einem Schaufeltrockner sind Temperaturen von beispielsweise
20 bis 80°C
bevorzugt. Trocknen in einem Sprühturm
kann zum Beispiel bei Temperaturen von 100 bis 200°C ausgeführt werden.
-
Die
Auftragung des Einschlusskomplexes wird in der Regel in wässrigem
Medium durchgeführt.
Die Konzentration des Einschlusskomplexes in dem wässrigen
Bad ist bevorzugt 0,1 bis 100 g/Liter, speziell 2 bis 100 g/Liter.
Höchst
bevorzugt ist eine Konzentration von 2 bis 50 g/Liter, speziell
2 bis 25 g/Liter. Es ist bevorzugt, die Auftragung des Einschlusskomplexes
bei einem pH von 4 bis 7 durchzuführen.
-
Die
Auftragung kann gemäß gut bekannter
textilbezogener Verfahren ausgeführt
werden; zum Beispiel gemäß konventioneller
Füllverfahren
(Padding-Verfahren). Zum Beispiel wird das Fasermaterial durch eine wässrige Flüssigkeit
geführt,
welche den Einschlusskomplex enthält, das Textilmaterial wird
dann auf einen definierten Flüssigkeits-Aufnahmegrad
ausgequetscht, und dann kann, wenn gewünscht, eine Wärmebehandlung
ausgeführt
werden. Der Flüssigkeits-Aufnahmegrad
ist gewöhnlich
40 bis 200 Gew.-%, im Speziellen 50 bis 150 Gew.-%, bezogen auf
das Gewicht des Fasermaterials.
-
Die
Wärmebehandlung
kann bei einer Temperatur von 60 bis 200°C ausgeführt werden, speziell von 90
bis 200°C.
Bevorzugt ist eine Temperatur von 150 bis 200°C. Es ist bevorzugt, dass vor
der Wärmebehandlung
die Fasermaterialien getrocknet werden.
-
Das
Füllverfahren
(Padding-Verfahren) wird gewöhnlich
als ein kontinuierliches Verfahren ausgeführt, in welchem das Fasermaterial
kontinuierlich durch die wässrige
Flüssigkeit,
welche den Einschlusskomplex enthält, geführt wird.
-
Weiterhin
kann die Auftragung auch gemäß bekannter
Ausschöpfverfahren
(Exhaustion-Verfahren) durchgeführt
werden. Gemäß diesem
Verfahren werden die Fasermaterialien in ein Bad eingetaucht. Die
zu verwendende Temperatur kann zwischen 20 und 100°C variieren.
-
Fasermaterialien,
welche mit dem Einschlusskomplex behandelt werden können, sind
Fasermaterialien, welche zum Beispiel natürliche oder synthetische Polyamide
(wie Wolle, Seide, Nylon) und zellulose-enthaltende Textilmaterialien
jeglicher Art, zum Beispiel regenerierte oder im Speziellen natürliche Zellulosefasern,
wie beispielsweise Baumwolle, Leinen, Jute, Hanf und Ramie; oder
die obigen Fasermaterialien enthaltende Mischungen, wie Polyamid/Polyester,
Polyester/Baumwolle und Polyester/Wolle umfassen.
-
Bevorzugte
Fasermaterialien sind solche, welche Wolle, synthetisches Polyamid
und speziell Zellulose enthaltende Fasermaterialien, bevorzugt Baumwolle
umfassen.
-
Das
Fasermaterial kann in verschiedenen Gestaltungsformen vorliegen,
wie beispielsweise als gewebte oder gestrickte Gewebe oder als Stückgüter, wie
beispielsweise als Strickwaren, nichtgewebte Textilien, Teppiche,
Garn oder Spinnfaser.
-
Weiterhin
ist die vorliegende Erfindung auf wässrige Zusammensetzungen gerichtet,
welche die obigen Einschlusskomplexe umfassen. Bezüglich dieser
Zusammensetzungen kommen die obigen Bedeutungen und bevorzugten
Ausführungsformen
zur Anwendung.
-
Ein
weiteres Ziel der vorliegenden Erfindung sind die oben angeführten Einschlusskomplexe.
Bezüglich
dieser Einschlusskomplexe kommen die obigen Bedeutungen und bevorzugten
Ausführungsformen
zur Anwendung.
-
In
den folgenden Beispielen sind Prozentangaben gewichtsbezogen.
-
Beispiel 1 (Herstellung
des Einschlusskomplexes)
-
38,5
g Cavasol W7 MCT® (β-Cyclodextrin, welches 2 bis
3 faserreaktive Monochlortriazinyl-Gruppen enthält, welche durch -ONa substituiert
und an das Cyclodextrin über
ein Brückenstück der Formel
-O- gebunden sind; kommerziell erhältlich von Wacker Chemie AG,
Deutschland) und 33,5 g entionisiertes Wasser werden zur Bildung
der Mischung A) vermischt.
-
7,5
g antimikrobieller Wirkmittel der Formel
und 7,5
g Ethanol werden zur Bildung der Mischung B) vermischt.
-
Mischung
A) wird in einen Kenwood-Kneter überführt, und
Mischung B) wird in Portionen während
des Knetens hinzugegeben. Nach der vollständigen Zugabe der Mischung
B) wird für
4 Stunden weitergeknetet. Das erhaltene Produkt wird in einen Trockner
gegeben und das Lösungsmittel
bei einer Temperatur von 60°C verdampft.
Schließlich
wird das Produkt in einem Mörser
gemahlen.
-
Beispiel 2 (Auftragung
des gemäß Beispiel
1 hergestellten Einschlusskomplexes)
-
a) Herstellung der Formulierung
des Einschlusskomplexes
-
10,03
g des gemäß Beispiel
1 hergestellten Einschlusskomplexes werden in 500 ml Wasser gelöst und durch
Zugabe von ungefähr
8 ml Essigsäure
zur Erreichung eines pH-Wertes von 5 angesäuert.
-
b) Auftragung der gemäß a) hergestellten
Formulierung
-
Die
Formulierung wird jeweils auf ungefärbte Baumwollgewebe durch Füllen (Padding)
mit einem Aufnahmegrad von 100% aufgetragen. Der Druck wird auf
einen Aufnahmegrad von 100% eingestellt (1,8 Bar).
-
Dann
wurden die Proben, welche in Reihe 1 der folgenden Tabelle 1 angezeigt
sind, wie folgt behandelt:
| Probe
1: | getrocknet
bei Raumtemperatur/ungewaschen (Referenz) |
| Probe
2: | erst
bei Raumtemperatur und dann 5 Minuten bei 150°C getrocknet/ungewaschen |
| Probe
3: | erst
bei Raumtemperatur und dann 5 Minuten bei 170°C getrocknet/ungewaschen |
| Probe
4: | getrocknet
bei Raumtemperatur/20× gewaschen
(Referenz) |
| Probe
5: | erst
bei Raumtemperatur und dann 5 Minuten bei 150°C getrocknet/20× gewaschen |
| Probe
6: | erst
bei Raumtemperatur und dann 5 Minuten bei 170°C getrocknet/20× gewaschen |
| Probe
7: | getrocknet
bei Raumtemperatur/30× gewaschen
(Referenz) |
| Probe
8: | erst
bei Raumtemperatur und dann 5 Minuten bei 150°C getrocknet/30× gewaschen |
| Probe
9: | erst
bei Raumtemperatur und dann 5 Minuten bei 170°C getrocknet/30× gewaschen |
-
c) Waschtest
-
Das
Gewebe wird 20× unter
den folgenden Waschbedingungen gewaschen (bzw. 30×):
| Waschmittel: | 30
g IEC 456-A (Standardwaschmittel) |
| Waschmaschine: | Wascator
FOM 71MP LAB |
| Temperatur: | 40°C |
-
d) Antimikrobielle Tests
(Bestimmung der antimikrobiellen Wirkungskraft der behandelten Faser)
-
Die
antimikrobielle Aktivität
einer Probe wurde in einem Agar-Diffusionstest getestet.
| Mikrobiologische
Evaluation: | Bestimmung
der bakteriostatischen Aktivität
gemäß dem Bakterienwachstums-Inhibierungstest. |
| Prinzip: | Scheiben
von behandelten Baumwollproben mit 20 mm Durchmesser wurden unter
sterilen Bedingungen geschnitten und dann auf die obere Schicht
des erhärteten
Agars aufgetragen, welcher die Bakterien enthielt (aus Übernacht-Kulturen
wurde eine 1:500-(S.
aureus) und eine 1:1.000-(E. coli)Verdünnung zenem Agar hinzugegeben).
Nach der Inkubation hergestellt, und 3,5 ml wurden zu 500 ml geschmolwurden
die Inhibierungszonen gemessen, und die erhaltenen Ergebnisse sind
in Tabelle 1 dargestellt. |
| Testbakterien: | Staphylococcus
aureus ATCC 9144
Escherichia coli NCTC 8196 |
| Nährmedium: | Caseinsojamehlpeptonagar
(zwei Schichten von Agar: 15 ml Unterschicht ohne Keime und 6 ml
Oberschicht mit Bakterien) |
| Inkubation: | 18
bis 24 Stunden bei 37°C |
-
Tabelle
1 (Alle Tests wurden zweimal durchgeführt und beide Ergebnisse in
der Tabelle aufgeführt)
-
Legende:
-
-
- RT
- = Raumtemperatur
- ZI
- = Inhibierungszone
in mm um die Scheibe
-
Beispiel 3 (Herstellung
des Einschlusskomplexes)
-
38,4
g Cavasol W7 MCT® (kommerziell erhältlich von
Wacker Chemie AG, Deutschland) und 33,5 g Wasser werden gemeinsam
zur Bildung der Mischung A vermischt.
-
7,5
g antimikrobieller Wirkstoff der Formel
und 7,5
g Ethanol werden gemeinsam zur Bildung der Mischung B vermischt.
-
Mischung
A wird in einen Kenwood-Kneter überführt und
Mischung B in Portionen während
des Knetens hinzugefügt.
Nach vollständiger
Zugabe der Mischung B wird der Knetprozess für ungefähr 4 Stunden fortgeführt. Dann
wird die Paste in einen (Vakuum-)Trockner bei ungefähr 60°C gegeben,
um das Lösungsmittel und
das Wasser zu verdampfen. Schließlich wird das getrocknete
Produkt mit einem Mörser
gemahlen, um ein rieselfähiges
Pulver zu erhalten.
-
Beispiel 4 (Herstellung
des Einschlusskomplexes)
-
24
g Cavasol W7 MCT® (kommerziell erhältlich von
Wacker Chemie AG, Deutschland) werden zu 70 g Wasser unter Rühren hinzugegeben.
Das Rühren
wird für
eine Stunde fortgeführt,
um eine Lösung
zu erhalten. Dann wird der pH-Wert auf einen Wert von 7,5 durch
Zugabe von 2,5 g Dinatriumhydrogenphosphat gebracht. Es werden 4
g antimikrobieller Wirkstoff der Formel (101) unter Rühren hinzugegeben,
und das Rühren wird
für 16
Stunden bei einer Temperatur von 40°C fortgeführt. Dann wird die Lösung, welche
ein trübes
Aussehen hat, unter vermindertem Druck filtriert und die erhaltene
klare Lösung
bei einem Druck von 50 mBar und einer Temperatur von ungefähr 40°C in einem
Schaufeltrockner (Venulett) getrocknet. Es werden 28 g eines weißen Produktes
erhalten, welches auf Baumwollfasern gemäß dem in Beispiel 2 angegebenen
Verfahren aufgetragen werden kann.
-
Beispiel 5 (Herstellung
des Einschlusskomplexes)
-
24
g Cavasol W7 MCT
® (kommerziell erhältlich von
Wacker Chemie AG, Deutschland) werden zu 70 g Wasser unter Rühren hinzugegeben.
Eine geringe Menge Entschäumer
wird hinzugegeben, und das Rühren wird
für eine
Stunde fortgeführt,
um eine Lösung
zu erhalten. Der pH-Wert wird dann durch Zugabe von 2,5 g Dinatriumhydrogenphosphat
auf einen Wert von 7,5 gebracht. Es werden 4,5 g des antimikrobiellen
Wirkstoffs der Formel
unter
Rühren
hinzugegeben, und das Rühren
wird für
10 Stunden bei einer Temperatur von 40°C fortgeführt. Dann wird die Lösung, welche
ein trübes
Aussehen hat, über
eine Filterpresse geführt
und die erhaltene klare Lösung
in einem Sprühtrockner
bei einer Eintrittstemperatur von 180°C getrocknet. Es werden 29 g
eines weißen
Produkts erhalten, welches auf Baumwollfasern gemäß dem in
Beispiel 2 angegebenen Verfahren aufgetragen werden kann.
-
Beispiel 6 (Herstellung
des Einschlusskomplexes)
-
24
g Cavasol W7 MCT® (kommerziell erhältlich von
Wacker Chemie AG, Deutschland) werden zu 70 g Wasser unter Rühren hinzugegeben.
Das Rühren
wird für
eine Stunde fortgeführt,
um eine Lösung
zu erhalten. Dann wird der pH-Wert durch Zugabe der geeigneten Menge
Natriumhydroxid auf einen Wert von 10 gebracht. Es werden 4 g antimikrobieller
Wirkstoff der Formel (101) unter Rühren hinzugegeben, und das
Rühren wird
für 16
Stunden bei einer Temperatur von 40°C fortgeführt. Der pH-Wert wird durch
Zugabe von Natriumhydroxid auf einem Wert von 10 gehalten. Dann
wird die Lösung,
welche ein trübes
Aussehen hat, unter vermindertem Druck filtriert und die erhaltene
klare Lösung
bei einem Druck von 50 mBar und einer Temperatur von ungefähr 40°C in einem
Schaufeltrockner (Venulett) getrocknet. Es werden 28 g eines weißen Produktes erhalten,
welches auf Baumwollfasern gemäß dem in
Beispiel 2 angegebenen Verfahren aufgetragen werden kann.
-
Beispiel 7 (Herstellung
des Einschlusskomplexes)
-
- a) 31 g β-Cyclodextrin
werden zu 1.000 g entionisiertem Wasser bei einer Temperatur von
60°C unter
Rühren
hinzugegeben, und das Rühren
wird für
15 Minuten fortgeführt,
um eine Lösung
zu erhalten. Dann werden 7 g des antimikrobiellen Wirkstoffs der
Formel (101) hinzugegeben, und die Lösung wird bei einer Temperatur
von 60°C
für zwei
Stunden gerührt.
Anschließend
wird die Lösung
auf 20°C
gekühlt.
Die erhaltene weiße
Suspension wird unter vermindertem Druck filtriert. Der erhaltene
nasse Kuchen wird in 40 g Wasser und 9,5 g Natriumhydroxidlösung (36%)
gelöst.
- b) Eine separate Lösung
wird durch Zugabe von 12,4 g Cyanurchlorid und einer geringen Menge
Entschäumer
zu einer Mischung von 60 g Wasser und 60 g Eis hergestellt. Die
Mischung wird für
5 Stunden bei einer Temperatur von 0 bis 5°C und einem pH-Wert von 9 bis
11 (durch Zugabe von Natriumhydroxidlösung, 36%) gehalten.
- c) Die gemäß a) hergestellte
Lösung
wird zu der gemäß b) hergestellten
Lösung
innerhalb eines Zeitraumes von 2 Stunden hinzugegeben, wobei der
pH-Wert bei einem Wert von ungefähr
10 bis 12 gehalten wird. Das Rühren
wird für
3 Stunden fortgeführt,
die Mischung filtriert und die klare Lösung einem Rotationsverdampfer
bei einer Temperatur von ungefähr
40°C und
einem Druck von 50 mBar unterworfen. Es werden 50 g eines weißen Produktes
erhalten, welches auf Baumwollfasern gemäß dem in Beispiel 2 angegebenen Verfahren
aufgetragen werden kann.
-
Beispiel 8 (Herstellung
des Einschlusskomplexes)
-
- a) Eine separate Lösung wird durch Zugabe von
20 g Cyanurchlorid zu einer Mischung von 100 g Wasser, 90 g Eis
und einer geringen Menge eines Entschäumers bei einer Temperatur
von 0 bis 5°C
hergestellt. Die Mischung wird für
ungefähr
5 Stunden bei einer Temperatur von 0 bis 5°C und einem pH-Wert von 9 bis
12 (durch Zugabe von Natriumhydroxidlösung, 36%) gehalten.
- b) Eine weitere Lösung
wird durch Zugabe von 30,8 g β-Cyclodextrin
zu einer Mischung von 40 g Wasser und 15,6 g Natriumhydroxidlösung hergestellt.
- c) Die gemäß b) hergestellte
Lösung
wird zu der gemäß a) hergestellten
Lösung über einen
Zeitraum von 3 Stunden hinzugegeben, wobei der pH bei einem Wert
von 10 bis 12 gehalten wird. Das Rühren wird für 3 Stunden bei einem pH-Wert
von 8 bis 10 fortgeführt.
Die Mischung wird filtriert, und 14 g des antimikrobiellen Wirkstoffs
der Formel (103) und 4,5 g Dinatriumhydrogenphosphat werden zu der
klaren Lösung
hinzugegeben. Das Rühren
wird für
16 Stunden bei einer Temperatur von 40°C fortgeführt. Die erhaltene Lösung, welche
ein trübes
Aussehen hat, wird unter vermindertem Druck filtriert und die erhaltene
klare Lösung
bei einem Druck von 50 mBar und einer Temperatur von ungefähr 40°C in einem
Schaufeltrockner (Venulett) getrocknet. Es werden 60 g eines weißen Produktes
erhalten, welches auf Baumwollfasern gemäß dem in Beispiel 2 angegebenen
Verfahren aufgetragen werden kann.