DE60031505T2 - Verfahren zur Verbesserung der Schmiereigenschaften eines Triacylglycerol enthaltenden pflanzlichen Öls - Google Patents
Verfahren zur Verbesserung der Schmiereigenschaften eines Triacylglycerol enthaltenden pflanzlichen Öls Download PDFInfo
- Publication number
- DE60031505T2 DE60031505T2 DE60031505T DE60031505T DE60031505T2 DE 60031505 T2 DE60031505 T2 DE 60031505T2 DE 60031505 T DE60031505 T DE 60031505T DE 60031505 T DE60031505 T DE 60031505T DE 60031505 T2 DE60031505 T2 DE 60031505T2
- Authority
- DE
- Germany
- Prior art keywords
- oil
- fatty acid
- carbon atoms
- ester
- chain fatty
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 235000015112 vegetable and seed oil Nutrition 0.000 title claims abstract description 51
- 239000008158 vegetable oil Substances 0.000 title claims abstract description 51
- 238000000034 method Methods 0.000 title claims abstract description 47
- 230000001050 lubricating effect Effects 0.000 title claims description 16
- DCXXMTOCNZCJGO-UHFFFAOYSA-N tristearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCCCCCC DCXXMTOCNZCJGO-UHFFFAOYSA-N 0.000 title claims description 5
- 230000008569 process Effects 0.000 title description 5
- 239000003921 oil Substances 0.000 claims abstract description 89
- 235000019198 oils Nutrition 0.000 claims abstract description 89
- -1 triacylglycerol polyol ester Chemical class 0.000 claims abstract description 79
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerol Natural products OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims abstract description 38
- 229920005862 polyol Polymers 0.000 claims abstract description 37
- 230000001590 oxidative effect Effects 0.000 claims description 41
- 239000003963 antioxidant agent Substances 0.000 claims description 38
- 125000004432 carbon atom Chemical group C* 0.000 claims description 37
- 230000003078 antioxidant effect Effects 0.000 claims description 23
- 150000003365 short chain fatty acid esters Chemical class 0.000 claims description 22
- 150000004666 short chain fatty acids Chemical class 0.000 claims description 18
- 235000019486 Sunflower oil Nutrition 0.000 claims description 8
- 239000002600 sunflower oil Substances 0.000 claims description 8
- 235000019484 Rapeseed oil Nutrition 0.000 claims description 6
- 239000000828 canola oil Substances 0.000 claims description 6
- 235000019519 canola oil Nutrition 0.000 claims description 6
- 238000002425 crystallisation Methods 0.000 claims description 6
- 230000008025 crystallization Effects 0.000 claims description 6
- 235000021281 monounsaturated fatty acids Nutrition 0.000 claims description 6
- 239000003549 soybean oil Substances 0.000 claims description 5
- 235000012424 soybean oil Nutrition 0.000 claims description 5
- 239000001257 hydrogen Substances 0.000 claims description 4
- 229910052739 hydrogen Inorganic materials 0.000 claims description 4
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 4
- 150000002989 phenols Chemical class 0.000 claims description 4
- UQJDVLPHTXQTRP-UHFFFAOYSA-N 2,2-bis(heptanoyloxymethyl)butyl heptanoate Chemical compound CCCCCCC(=O)OCC(CC)(COC(=O)CCCCCC)COC(=O)CCCCCC UQJDVLPHTXQTRP-UHFFFAOYSA-N 0.000 claims description 3
- 229920000098 polyolefin Polymers 0.000 claims description 3
- 150000004671 saturated fatty acids Chemical class 0.000 claims description 3
- PQGAHNJECSVDEI-UHFFFAOYSA-N [CH2]CCCCC Chemical compound [CH2]CCCCC PQGAHNJECSVDEI-UHFFFAOYSA-N 0.000 claims description 2
- 239000002285 corn oil Substances 0.000 claims description 2
- 235000005687 corn oil Nutrition 0.000 claims description 2
- DUUPDCPVCHSTFF-UHFFFAOYSA-N nonane Chemical compound [CH2]CCCCCCCC DUUPDCPVCHSTFF-UHFFFAOYSA-N 0.000 claims description 2
- 238000005461 lubrication Methods 0.000 abstract description 6
- 239000000047 product Substances 0.000 description 65
- 238000005809 transesterification reaction Methods 0.000 description 44
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 36
- 235000006708 antioxidants Nutrition 0.000 description 34
- 150000004702 methyl esters Chemical class 0.000 description 28
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 28
- 238000006243 chemical reaction Methods 0.000 description 27
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 27
- 238000012360 testing method Methods 0.000 description 27
- 150000004665 fatty acids Chemical group 0.000 description 26
- 239000000203 mixture Substances 0.000 description 25
- 239000003054 catalyst Substances 0.000 description 23
- ZJCCRDAZUWHFQH-UHFFFAOYSA-N Trimethylolpropane Chemical compound CCC(CO)(CO)CO ZJCCRDAZUWHFQH-UHFFFAOYSA-N 0.000 description 21
- 235000014113 dietary fatty acids Nutrition 0.000 description 19
- 239000000194 fatty acid Substances 0.000 description 19
- 229930195729 fatty acid Natural products 0.000 description 19
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 19
- 239000000314 lubricant Substances 0.000 description 18
- 238000007254 oxidation reaction Methods 0.000 description 18
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 17
- 230000003647 oxidation Effects 0.000 description 16
- 239000012071 phase Substances 0.000 description 16
- 239000000126 substance Substances 0.000 description 16
- 150000003626 triacylglycerols Chemical class 0.000 description 16
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 15
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 15
- 239000005642 Oleic acid Substances 0.000 description 15
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 15
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 15
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 14
- 150000002148 esters Chemical class 0.000 description 13
- 235000011187 glycerol Nutrition 0.000 description 13
- 230000006698 induction Effects 0.000 description 13
- 229910052751 metal Inorganic materials 0.000 description 13
- 239000002184 metal Substances 0.000 description 13
- 239000000523 sample Substances 0.000 description 13
- 150000003077 polyols Chemical class 0.000 description 12
- 235000021391 short chain fatty acids Nutrition 0.000 description 12
- 239000000654 additive Substances 0.000 description 11
- DPUOLQHDNGRHBS-UHFFFAOYSA-N Brassidinsaeure Natural products CCCCCCCCC=CCCCCCCCCCCCC(O)=O DPUOLQHDNGRHBS-UHFFFAOYSA-N 0.000 description 10
- URXZXNYJPAJJOQ-UHFFFAOYSA-N Erucic acid Natural products CCCCCCC=CCCCCCCCCCCCC(O)=O URXZXNYJPAJJOQ-UHFFFAOYSA-N 0.000 description 10
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 10
- 239000002253 acid Substances 0.000 description 10
- DPUOLQHDNGRHBS-KTKRTIGZSA-N erucic acid Chemical compound CCCCCCCC\C=C/CCCCCCCCCCCC(O)=O DPUOLQHDNGRHBS-KTKRTIGZSA-N 0.000 description 10
- 238000009472 formulation Methods 0.000 description 9
- 229930003799 tocopherol Natural products 0.000 description 9
- 239000011732 tocopherol Substances 0.000 description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 7
- 239000007866 anti-wear additive Substances 0.000 description 7
- 238000004128 high performance liquid chromatography Methods 0.000 description 7
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 7
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- BGNXCDMCOKJUMV-UHFFFAOYSA-N Tert-Butylhydroquinone Chemical compound CC(C)(C)C1=CC(O)=CC=C1O BGNXCDMCOKJUMV-UHFFFAOYSA-N 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 238000012512 characterization method Methods 0.000 description 6
- 235000019387 fatty acid methyl ester Nutrition 0.000 description 6
- 125000001183 hydrocarbyl group Chemical group 0.000 description 6
- 239000011541 reaction mixture Substances 0.000 description 6
- 231100000241 scar Toxicity 0.000 description 6
- 238000010561 standard procedure Methods 0.000 description 6
- 239000004250 tert-Butylhydroquinone Substances 0.000 description 6
- 235000019281 tert-butylhydroquinone Nutrition 0.000 description 6
- 239000004034 viscosity adjusting agent Substances 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 5
- 125000001931 aliphatic group Chemical group 0.000 description 5
- OBETXYAYXDNJHR-UHFFFAOYSA-N alpha-ethylcaproic acid Natural products CCCCC(CC)C(O)=O OBETXYAYXDNJHR-UHFFFAOYSA-N 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 5
- 238000000113 differential scanning calorimetry Methods 0.000 description 5
- 230000032050 esterification Effects 0.000 description 5
- 238000005886 esterification reaction Methods 0.000 description 5
- 230000006872 improvement Effects 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 230000008018 melting Effects 0.000 description 5
- 238000002844 melting Methods 0.000 description 5
- 229910052760 oxygen Inorganic materials 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- 235000010384 tocopherol Nutrition 0.000 description 5
- 229960001295 tocopherol Drugs 0.000 description 5
- OBETXYAYXDNJHR-SSDOTTSWSA-M (2r)-2-ethylhexanoate Chemical compound CCCC[C@@H](CC)C([O-])=O OBETXYAYXDNJHR-SSDOTTSWSA-M 0.000 description 4
- XZOYHFBNQHPJRQ-UHFFFAOYSA-N 7-methyloctanoic acid Chemical compound CC(C)CCCCCC(O)=O XZOYHFBNQHPJRQ-UHFFFAOYSA-N 0.000 description 4
- 235000004977 Brassica sinapistrum Nutrition 0.000 description 4
- 235000003901 Crambe Nutrition 0.000 description 4
- 241000220246 Crambe <angiosperm> Species 0.000 description 4
- 241000208818 Helianthus Species 0.000 description 4
- 239000002518 antifoaming agent Substances 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 229930195733 hydrocarbon Natural products 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 4
- 150000004668 long chain fatty acids Chemical class 0.000 description 4
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 4
- 235000019341 magnesium sulphate Nutrition 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- 238000004809 thin layer chromatography Methods 0.000 description 4
- 235000019149 tocopherols Nutrition 0.000 description 4
- QUEDXNHFTDJVIY-UHFFFAOYSA-N γ-tocopherol Chemical class OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1 QUEDXNHFTDJVIY-UHFFFAOYSA-N 0.000 description 4
- 235000014698 Brassica juncea var multisecta Nutrition 0.000 description 3
- 235000006008 Brassica napus var napus Nutrition 0.000 description 3
- 235000006618 Brassica rapa subsp oleifera Nutrition 0.000 description 3
- 244000188595 Brassica sinapistrum Species 0.000 description 3
- 241000196324 Embryophyta Species 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 235000010469 Glycine max Nutrition 0.000 description 3
- 235000003222 Helianthus annuus Nutrition 0.000 description 3
- 241001072282 Limnanthes Species 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 239000007795 chemical reaction product Substances 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 230000000875 corresponding effect Effects 0.000 description 3
- 239000003599 detergent Substances 0.000 description 3
- 239000002270 dispersing agent Substances 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 235000021588 free fatty acids Nutrition 0.000 description 3
- 150000002430 hydrocarbons Chemical class 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 238000002329 infrared spectrum Methods 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 229920000768 polyamine Polymers 0.000 description 3
- 229920000728 polyester Polymers 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 229920000193 polymethacrylate Polymers 0.000 description 3
- 230000035484 reaction time Effects 0.000 description 3
- 239000000344 soap Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- BITHHVVYSMSWAG-KTKRTIGZSA-N (11Z)-icos-11-enoic acid Chemical compound CCCCCCCC\C=C/CCCCCCCCCC(O)=O BITHHVVYSMSWAG-KTKRTIGZSA-N 0.000 description 2
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 2
- LJKQIQSBHFNMDV-UHFFFAOYSA-N 7-thiabicyclo[4.1.0]hepta-2,4-dien-6-ol Chemical class C1=CC=CC2(O)C1S2 LJKQIQSBHFNMDV-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 2
- 239000004215 Carbon black (E152) Substances 0.000 description 2
- 244000068988 Glycine max Species 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- 240000008042 Zea mays Species 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- 239000003377 acid catalyst Substances 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 150000001336 alkenes Chemical class 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 239000002199 base oil Substances 0.000 description 2
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 238000007707 calorimetry Methods 0.000 description 2
- 238000006555 catalytic reaction Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000007797 corrosion Effects 0.000 description 2
- 238000005260 corrosion Methods 0.000 description 2
- 230000009849 deactivation Effects 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 239000008367 deionised water Substances 0.000 description 2
- 229910021641 deionized water Inorganic materials 0.000 description 2
- 230000000994 depressogenic effect Effects 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 229940108623 eicosenoic acid Drugs 0.000 description 2
- BITHHVVYSMSWAG-UHFFFAOYSA-N eicosenoic acid Natural products CCCCCCCCC=CCCCCCCCCCC(O)=O BITHHVVYSMSWAG-UHFFFAOYSA-N 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- QUPDWYMUPZLYJZ-UHFFFAOYSA-N ethyl Chemical compound C[CH2] QUPDWYMUPZLYJZ-UHFFFAOYSA-N 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000003925 fat Substances 0.000 description 2
- 229940093915 gynecological organic acid Drugs 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid Chemical compound CCCCCCC(O)=O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000010487 meadowfoam seed oil Substances 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 239000010705 motor oil Substances 0.000 description 2
- SLCVBVWXLSEKPL-UHFFFAOYSA-N neopentyl glycol Chemical compound OCC(C)(C)CO SLCVBVWXLSEKPL-UHFFFAOYSA-N 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- WXZMFSXDPGVJKK-UHFFFAOYSA-N pentaerythritol Chemical compound OCC(CO)(CO)CO WXZMFSXDPGVJKK-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 229950000688 phenothiazine Drugs 0.000 description 2
- 150000003254 radicals Chemical class 0.000 description 2
- 239000010499 rapseed oil Substances 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 150000003902 salicylic acid esters Chemical class 0.000 description 2
- 235000003441 saturated fatty acids Nutrition 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 239000011593 sulfur Substances 0.000 description 2
- 239000010409 thin film Substances 0.000 description 2
- WMYJOZQKDZZHAC-UHFFFAOYSA-H trizinc;dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical class [Zn+2].[Zn+2].[Zn+2].[O-]P([O-])([S-])=S.[O-]P([O-])([S-])=S WMYJOZQKDZZHAC-UHFFFAOYSA-H 0.000 description 2
- 238000005292 vacuum distillation Methods 0.000 description 2
- 238000003828 vacuum filtration Methods 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- 229910052725 zinc Inorganic materials 0.000 description 2
- GZIFEOYASATJEH-VHFRWLAGSA-N δ-tocopherol Chemical compound OC1=CC(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1 GZIFEOYASATJEH-VHFRWLAGSA-N 0.000 description 2
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical compound C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- YBQZXXMEJHZYMB-UHFFFAOYSA-N 1,2-diphenylhydrazine Chemical compound C=1C=CC=CC=1NNC1=CC=CC=C1 YBQZXXMEJHZYMB-UHFFFAOYSA-N 0.000 description 1
- 150000000183 1,3-benzoxazoles Chemical class 0.000 description 1
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Substances OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 1
- YZUPZGFPHUVJKC-UHFFFAOYSA-N 1-bromo-2-methoxyethane Chemical compound COCCBr YZUPZGFPHUVJKC-UHFFFAOYSA-N 0.000 description 1
- KUUNNVBBPBDFJZ-UHFFFAOYSA-N 1-dodecylselanyldodecane Chemical compound CCCCCCCCCCCC[Se]CCCCCCCCCCCC KUUNNVBBPBDFJZ-UHFFFAOYSA-N 0.000 description 1
- JCTXKRPTIMZBJT-UHFFFAOYSA-N 2,2,4-trimethylpentane-1,3-diol Chemical compound CC(C)C(O)C(C)(C)CO JCTXKRPTIMZBJT-UHFFFAOYSA-N 0.000 description 1
- YMHOBZXQZVXHBM-UHFFFAOYSA-N 2,5-dimethoxy-4-bromophenethylamine Chemical compound COC1=CC(CCN)=C(OC)C=C1Br YMHOBZXQZVXHBM-UHFFFAOYSA-N 0.000 description 1
- DSKYSDCYIODJPC-UHFFFAOYSA-N 2-butyl-2-ethylpropane-1,3-diol Chemical compound CCCCC(CC)(CO)CO DSKYSDCYIODJPC-UHFFFAOYSA-N 0.000 description 1
- MVRPPTGLVPEMPI-UHFFFAOYSA-N 2-cyclohexylphenol Chemical compound OC1=CC=CC=C1C1CCCCC1 MVRPPTGLVPEMPI-UHFFFAOYSA-N 0.000 description 1
- YKIBDQMASGIXFB-UHFFFAOYSA-N 2-ethylhexanoic acid;2-ethyl-2-(hydroxymethyl)propane-1,3-diol Chemical compound CCC(CO)(CO)CO.CCCCC(CC)C(O)=O.CCCCC(CC)C(O)=O.CCCCC(CC)C(O)=O YKIBDQMASGIXFB-UHFFFAOYSA-N 0.000 description 1
- HYFFNAVAMIJUIP-UHFFFAOYSA-N 2-ethylpropane-1,3-diol Chemical compound CCC(CO)CO HYFFNAVAMIJUIP-UHFFFAOYSA-N 0.000 description 1
- 241001136792 Alle Species 0.000 description 1
- 244000068687 Amelanchier alnifolia Species 0.000 description 1
- 235000009027 Amelanchier alnifolia Nutrition 0.000 description 1
- 235000011331 Brassica Nutrition 0.000 description 1
- 241000219198 Brassica Species 0.000 description 1
- 240000002791 Brassica napus Species 0.000 description 1
- 208000032544 Cicatrix Diseases 0.000 description 1
- GZIFEOYASATJEH-UHFFFAOYSA-N D-delta tocopherol Natural products OC1=CC(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1 GZIFEOYASATJEH-UHFFFAOYSA-N 0.000 description 1
- 208000010201 Exanthema Diseases 0.000 description 1
- 238000001159 Fisher's combined probability test Methods 0.000 description 1
- 101000823778 Homo sapiens Y-box-binding protein 2 Proteins 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- XQVWYOYUZDUNRW-UHFFFAOYSA-N N-Phenyl-1-naphthylamine Chemical compound C=1C=CC2=CC=CC=C2C=1NC1=CC=CC=C1 XQVWYOYUZDUNRW-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 235000019482 Palm oil Nutrition 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 229920002367 Polyisobutene Polymers 0.000 description 1
- 238000001069 Raman spectroscopy Methods 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- XKXYLRHFXANGHG-IUPFWZBJSA-N TG(20:1(11Z)/20:1(11Z)/20:1(11Z)) Chemical compound CCCCCCCC\C=C/CCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCC\C=C/CCCCCCCC)COC(=O)CCCCCCCCC\C=C/CCCCCCCC XKXYLRHFXANGHG-IUPFWZBJSA-N 0.000 description 1
- YSMRWXYRXBRSND-UHFFFAOYSA-N TOTP Chemical compound CC1=CC=CC=C1OP(=O)(OC=1C(=CC=CC=1)C)OC1=CC=CC=C1C YSMRWXYRXBRSND-UHFFFAOYSA-N 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- BAECOWNUKCLBPZ-HIUWNOOHSA-N Triolein Natural products O([C@H](OCC(=O)CCCCCCC/C=C\CCCCCCCC)COC(=O)CCCCCCC/C=C\CCCCCCCC)C(=O)CCCCCCC/C=C\CCCCCCCC BAECOWNUKCLBPZ-HIUWNOOHSA-N 0.000 description 1
- PHYFQTYBJUILEZ-UHFFFAOYSA-N Trioleoylglycerol Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC(OC(=O)CCCCCCCC=CCCCCCCCC)COC(=O)CCCCCCCC=CCCCCCCCC PHYFQTYBJUILEZ-UHFFFAOYSA-N 0.000 description 1
- 241000545067 Venus Species 0.000 description 1
- 235000007244 Zea mays Nutrition 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- AQMHNCQZLQUNJI-UHFFFAOYSA-N [CH2]CCCCCC Chemical compound [CH2]CCCCCC AQMHNCQZLQUNJI-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 229960000583 acetic acid Drugs 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000003254 anti-foaming effect Effects 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical class C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- YXVFYQXJAXKLAK-UHFFFAOYSA-N biphenyl-4-ol Chemical compound C1=CC(O)=CC=C1C1=CC=CC=C1 YXVFYQXJAXKLAK-UHFFFAOYSA-N 0.000 description 1
- PVEOYINWKBTPIZ-UHFFFAOYSA-N but-3-enoic acid Chemical class OC(=O)CC=C PVEOYINWKBTPIZ-UHFFFAOYSA-N 0.000 description 1
- BMRWNKZVCUKKSR-UHFFFAOYSA-N butane-1,2-diol Chemical compound CCC(O)CO BMRWNKZVCUKKSR-UHFFFAOYSA-N 0.000 description 1
- OWBTYPJTUOEWEK-UHFFFAOYSA-N butane-2,3-diol Chemical compound CC(O)C(C)O OWBTYPJTUOEWEK-UHFFFAOYSA-N 0.000 description 1
- SNCZNSNPXMPCGN-UHFFFAOYSA-N butanediamide Chemical class NC(=O)CCC(N)=O SNCZNSNPXMPCGN-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- SHZIWNPUGXLXDT-UHFFFAOYSA-N caproic acid ethyl ester Natural products CCCCCC(=O)OCC SHZIWNPUGXLXDT-UHFFFAOYSA-N 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 235000010389 delta-tocopherol Nutrition 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- QBCOASQOMILNBN-UHFFFAOYSA-N didodecoxy(oxo)phosphanium Chemical compound CCCCCCCCCCCCO[P+](=O)OCCCCCCCCCCCC QBCOASQOMILNBN-UHFFFAOYSA-N 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 239000012990 dithiocarbamate Substances 0.000 description 1
- 150000004659 dithiocarbamates Chemical class 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- HQQADJVZYDDRJT-UHFFFAOYSA-N ethene;prop-1-ene Chemical group C=C.CC=C HQQADJVZYDDRJT-UHFFFAOYSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 201000005884 exanthem Diseases 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000010408 film Substances 0.000 description 1
- 230000009969 flowable effect Effects 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000010382 gamma-tocopherol Nutrition 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000012362 glacial acetic acid Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-M hexanoate Chemical compound CCCCCC([O-])=O FUZZWVXGSFPDMH-UHFFFAOYSA-M 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000010720 hydraulic oil Substances 0.000 description 1
- 125000006289 hydroxybenzyl group Chemical group 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910012375 magnesium hydride Inorganic materials 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 150000004667 medium chain fatty acids Chemical class 0.000 description 1
- 229910052987 metal hydride Inorganic materials 0.000 description 1
- 150000004681 metal hydrides Chemical class 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- KICUISADAVMYCJ-UHFFFAOYSA-N methyl 2-ethylhexanoate Chemical compound CCCCC(CC)C(=O)OC KICUISADAVMYCJ-UHFFFAOYSA-N 0.000 description 1
- IEHIOXQFWRLVGR-UHFFFAOYSA-N methyl 7-methyloctanoate Chemical compound COC(=O)CCCCCC(C)C IEHIOXQFWRLVGR-UHFFFAOYSA-N 0.000 description 1
- 125000004492 methyl ester group Chemical group 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- DNIAPMSPPWPWGF-UHFFFAOYSA-N monopropylene glycol Natural products CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 239000002540 palm oil Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000013520 petroleum-based product Substances 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 150000003014 phosphoric acid esters Chemical class 0.000 description 1
- 239000006069 physical mixture Substances 0.000 description 1
- 239000010773 plant oil Substances 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920000166 polytrimethylene carbonate Polymers 0.000 description 1
- 235000020777 polyunsaturated fatty acids Nutrition 0.000 description 1
- 239000011736 potassium bicarbonate Substances 0.000 description 1
- 235000015497 potassium bicarbonate Nutrition 0.000 description 1
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 206010037844 rash Diseases 0.000 description 1
- QEVHRUUCFGRFIF-MDEJGZGSSA-N reserpine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C(C5=CC=C(OC)C=C5N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 QEVHRUUCFGRFIF-MDEJGZGSSA-N 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 230000037387 scars Effects 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000000526 short-path distillation Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- CMXPERZAMAQXSF-UHFFFAOYSA-M sodium;1,4-bis(2-ethylhexoxy)-1,4-dioxobutane-2-sulfonate;1,8-dihydroxyanthracene-9,10-dione Chemical compound [Na+].O=C1C2=CC=CC(O)=C2C(=O)C2=C1C=CC=C2O.CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC CMXPERZAMAQXSF-UHFFFAOYSA-M 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000013179 statistical model Methods 0.000 description 1
- 229920003048 styrene butadiene rubber Polymers 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- KZNICNPSHKQLFF-UHFFFAOYSA-N succinimide Chemical class O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 210000003411 telomere Anatomy 0.000 description 1
- 102000055501 telomere Human genes 0.000 description 1
- 108091035539 telomere Proteins 0.000 description 1
- 150000003505 terpenes Chemical class 0.000 description 1
- 235000007586 terpenes Nutrition 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 150000003557 thiazoles Chemical class 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- PHYFQTYBJUILEZ-IUPFWZBJSA-N triolein Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(OC(=O)CCCCCCC\C=C/CCCCCCCC)COC(=O)CCCCCCC\C=C/CCCCCCCC PHYFQTYBJUILEZ-IUPFWZBJSA-N 0.000 description 1
- 229940117972 triolein Drugs 0.000 description 1
- 235000021122 unsaturated fatty acids Nutrition 0.000 description 1
- 150000004670 unsaturated fatty acids Chemical class 0.000 description 1
- 239000003039 volatile agent Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 239000002478 γ-tocopherol Substances 0.000 description 1
- QUEDXNHFTDJVIY-DQCZWYHMSA-N γ-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1 QUEDXNHFTDJVIY-DQCZWYHMSA-N 0.000 description 1
- 239000002446 δ-tocopherol Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M101/00—Lubricating compositions characterised by the base-material being a mineral or fatty oil
- C10M101/04—Fatty oil fractions
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M105/00—Lubricating compositions characterised by the base-material being a non-macromolecular organic compound
- C10M105/08—Lubricating compositions characterised by the base-material being a non-macromolecular organic compound containing oxygen
- C10M105/32—Esters
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M105/00—Lubricating compositions characterised by the base-material being a non-macromolecular organic compound
- C10M105/08—Lubricating compositions characterised by the base-material being a non-macromolecular organic compound containing oxygen
- C10M105/32—Esters
- C10M105/34—Esters of monocarboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M105/00—Lubricating compositions characterised by the base-material being a non-macromolecular organic compound
- C10M105/08—Lubricating compositions characterised by the base-material being a non-macromolecular organic compound containing oxygen
- C10M105/32—Esters
- C10M105/38—Esters of polyhydroxy compounds
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11C—FATTY ACIDS FROM FATS, OILS OR WAXES; CANDLES; FATS, OILS OR FATTY ACIDS BY CHEMICAL MODIFICATION OF FATS, OILS, OR FATTY ACIDS OBTAINED THEREFROM
- C11C3/00—Fats, oils, or fatty acids by chemical modification of fats, oils, or fatty acids obtained therefrom
- C11C3/04—Fats, oils, or fatty acids by chemical modification of fats, oils, or fatty acids obtained therefrom by esterification of fats or fatty oils
- C11C3/10—Ester interchange
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/2805—Esters used as base material
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/281—Esters of (cyclo)aliphatic monocarboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/281—Esters of (cyclo)aliphatic monocarboxylic acids
- C10M2207/2815—Esters of (cyclo)aliphatic monocarboxylic acids used as base material
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/282—Esters of (cyclo)aliphatic oolycarboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/283—Esters of polyhydroxy compounds
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/283—Esters of polyhydroxy compounds
- C10M2207/2835—Esters of polyhydroxy compounds used as base material
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/284—Esters of aromatic monocarboxylic acids
- C10M2207/2845—Esters of aromatic monocarboxylic acids used as base material
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/286—Esters of polymerised unsaturated acids
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/34—Esters having a hydrocarbon substituent of thirty or more carbon atoms, e.g. substituted succinic acid derivatives
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/28—Esters
- C10M2207/34—Esters having a hydrocarbon substituent of thirty or more carbon atoms, e.g. substituted succinic acid derivatives
- C10M2207/345—Esters having a hydrocarbon substituent of thirty or more carbon atoms, e.g. substituted succinic acid derivatives used as base material
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/40—Fatty vegetable or animal oils
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2207/00—Organic non-macromolecular hydrocarbon compounds containing hydrogen, carbon and oxygen as ingredients in lubricant compositions
- C10M2207/40—Fatty vegetable or animal oils
- C10M2207/404—Fatty vegetable or animal oils obtained from genetically modified species
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Emergency Medicine (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Lubricants (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Fats And Perfumes (AREA)
- Separation Using Semi-Permeable Membranes (AREA)
Description
- TECHNISCHES GEBIET
- Die Erfindung betrifft ein Verfahren, das mit kurzkettigen Fettsäureestern umgeesterte Öle mit verbesserten Schmiereigenschaften bereitstellt.
- HINTERGRUND
- Bei technischen Anwendungen werden als Öle in der Regel auf Erdöl basierende Kohlenwasserstoffe eingesetzt, die die Umwelt schädigen können und bei ihrer Verwendung Gesundheitsrisiken bergen. Pflanzenöle sind eine umweltfreundliche Alternative zu Produkten auf Erdölbasis und basieren auf erneuerbaren natürlichen Ressourcen. Die Hauptkomponenten von Pflanzenölen sind Triacylglycerine (TAGs), die drei mit einer Glycerineinheit veresterte Fettsäureketten enthalten. Es wird angenommen, daß sich die polaren Glycerinbereiche und unpolaren Kohlenwasserstoffbereiche von TAGs an Metallgrenzflächen ausrichten und somit bessere Schmiereigenschaften aufweisen als Erdöl-Kohlenwasserstoffe.
- Der Verwendung von Pflanzenölen für technische Anwendungen sind jedoch durch ihre Tieftemperatureigenschaften und oxidative Stabilität Grenzen gesetzt. Technische Öle müssen bei niedrigen Temperaturen flüssig sein und eine angemessene Viskosität aufweisen. Die meisten Pflanzenöle besitzen keine derartigen Tieftemperatureigenschaften. So hat beispielsweise Rapsöl mit hohem Anteil an Erucasäure Stockpunkt (d. h. die Temperatur, bei der das Öl zu fließen aufhört) von –16°C, erfährt jedoch bei abnehmenden Temperaturen eine erhebliche Viskositätszunahme.
- Technische Öle müssen auch eine hohe oxidative Stabilität aufweisen, die im allgemeinen mit dem in den Fettsäureacylketten vorliegenden Ungesättigtheitsgrad zusammenhängt. Die Reaktion eines Pflanzenöls mit Sauerstoff kann zu Polymerisation und Vernetzung der Fettsäureacylketten und verringerter oxidativer Stabi lität führen. Auf gesättigten Kohlenwasserstoffen basierende Öle weisen keine Ungesättigtheit auf und haben daher eine hohe oxidative Stabilität.
- In der WO 96/07632 A1 wird ein Verfahren zur Herstellung eines synthetischen Esters aus einem pflanzlichen Öl mit einer zweistufigen Transesterfizierung bzw. Umesterung beschrieben. Im ersten Schritt wird das Pflanzenöl mit einem niederen Alkanol zu einem Gemisch von Fettsäureniederalkylestern umgesetzt. Im zweiten Schritt wird das erhaltene Gemisch mit einem Polyol umgesetzt.
- In Jaocs, Band 75, Nr. 11 (1998), S. 1557–1563, wird die Umesterung von Trimethylolpropan und Rapsölmethylester beschrieben.
- In der
EP 0 843 000 A1 wird eine Esteraustauschreaktion mit einem Pflanzenöl und einem Niederalkoholester einer mittelkettigen Fettsäure bei einem Verfahren zur Herstellung eines Schmierstoff-Grundöls beschrieben. - Die WO 93/07240 A1 betrifft ein Verfahren zur Verbesserung der thermischen Stabilität eines synthetischen Esterschmierstoffs, der Syntheseverunreinigungen enthält, bei dem man den Schmierstoff bei einer Temperatur von mehr als 200°C und über einen Zeitraum, der zur weitgehenden Oxidation der in dem Schmierstoff vorhandenen Verunreinigungen ausreicht, aber nicht zur weitgehenden Oxidation des Esters oder zur weitgehenden Zersetzung des Esters ausreicht, mit Luft oder Sauerstoff in Berührung bringt.
- Aus der WO 97/40698 A1 ist ein Sojaöl mit hohem Gehalt an Ölsäure und hoher oxidativer Stabilität bekannt, das einen C18:1-Gehalt von mehr als 65% der Fettsäureeinheiten in dem Öl, einen kombinierten C18:2- und C18:3-Gehalt von weniger als 20% der Fettsäureeinheiten in dem Öl enthält und eine Induktionszeit gemäß der Active Oxygen Method von mehr als 50 Stunden aufweist, wobei die oxidative Stabilität ohne Zusatz eines Antioxidationsmittels erreicht wird.
- KURZE DARSTELLUNG DER ERFINDUNG
- Die Erfindung basiert auf der Umesterung von kurzen gesättigten Fettsäureestern mit Triacylglycerin enthaltenden Ölen, wie Pflanzenölen, zu Ölen mit verbesserten Schmiereigenschaften. Pflanzenöle liefern zwar bekanntlich eine gute Grenzflächenschmierung, können jedoch wegen ihrer geringen oxidativen Stabilität und schlechten Tieftemperatureigenschaften häufig nicht bei Schmieranwendungen verwendet werden. Durch Umesterung verschiedener kurzer gesättigter Fettsäureester mit einem Pflanzenöl werden die oxidative Stabilität und die Tieftemperatureigenschaften aufgrund der erhöhten Sättigung und der Heterogenität der mit den Polyolen veresterten Fettsäuren verbessert.
- Gegenstand der Erfindung ist ein Verfahren zur Verbesserung von Schmiereigenschaften eines Pflanzenöls gemäß Anspruch 1. Zu den Schmiereigenschaften können Verschleißeigenschaften, Viskosität oder Kristallisationstemperatur gehören. Bei dem Verfahren wird das Pflanzenöl mit einem kurzkettigen Fettsäureester umgeestert. Das Pflanzenöl kann einen Gehalt an einfach ungesättigten Fettsäuren von mindestens 50%, z. B. mindestens 70%, aufweisen und beispielsweise aus der Gruppe ausgewählt sein, welche aus Maisöl, Rapsöl, Sojaöl und Sonnenblumenöl besteht. Ein besonders gut geeignetes Rapsöl ist Canolaöl. Der kurzkettige Fettsäureester kann gesättigt sein und ist vier bis 10 Kohlenstoffatome lang. Insbesondere kann der kurzkettige Fettsäureester sechs bis zehn Kohlenstoffatome lang sein. Der kurzkettige Fettsäureester ist verzweigt und kann ein Methylester oder ein Polyolester, wie ein Neopentylglykolester, ein Pentaerythritolester oder ein Trimethylolpropanester, sein. Ein brauchbarer Trimethylolpropanester ist Trimethylolpropantriheptanoat.
- Das Verfahren kann ferner das Hinzufügen eines Antioxidationsmittels umfassen, welches zur Erhöhung der oxidativen Stabilität des umgeesterten Pflanzenöls wirksam ist. Das Antioxidationsmittel kann aus der Gruppe ausgewählt sein, welche aus gehinderten Phenolen, Dithiophosphaten und geschwefelten Polyalkenen besteht. Die Antioxidationsmittelmenge kann etwa 0,001 bis etwa 10 Gew.-% betragen.
- Nach dem beanspruchten Verfahren erhaltene Öle können ferner ein Antioxidationsmittel, ein Antiverschleißadditiv, einen Stockpunkterniedriger, ein Rostschutzadditiv oder ein Antischaumadditiv umfassen. Der Glycerinpolyolester derartiger Öle ist gekennzeichnet durch die Formel: wobei R1, R2 und R3 unabhängig voneinander aliphatische Hydrocarbylreste mit drei bis 23 Kohlenstoffatomen sind, wobei mindestens einer der Reste R1, R2 und R3 einen gesättigten aliphatischen Hydrocarbylrest mit drei bis neun Kohlenstoffatomen aufweist und mindestens einer der Reste R1, R2 und R3 einen aliphatischen Hydrocarbylrest mit 11 bis 23 Kohlenstoffatomen aufweist. Bei dem gesättigten aliphatischen Hydrocarbylrest kann es sich beispielsweise um einen Hexylrest, einen Heptylrest oder einen Nonylrest handeln. Der aliphatische Kohlenstoffrest mit 11 bis 23 Atomen kann sich von Ölsäure, Eicosensäure oder Erucasäure ableiten.
- Erfindungsgemäße Öle können ferner einen Nichtglycerinpolyolester aufweisen. Der Nichtglycerinpolyolester kann gekennzeichnet sein durch die Formel: wobei R4 und R5 unabhängig voneinander aliphatische Hydrocarbylreste mit drei bis 23 Kohlenstoffatomen sind, wobei mindestens einer der Reste R4 und R5 einen gesättigten aliphatischen Hydrocarbylrest mit drei bis neun Kohlenstoffatomen aufweist und mindestens einer der Reste R4 und R5 einen aliphatischen Hydrocarbylrest mit 11 bis 23 Kohlenstoffatomen aufweist, wobei R6 und R7 unabhängig voneinander für Wasserstoff, einen aliphatischen Hydrocarbylrest mit 1 bis 4 Kohlenstoffatomen oderstehen, wobei X eine ganze Zahl von 0 bis 6 ist und R8 ein aliphatischer Hydrocarbylrest mit drei bis 23 Kohlenstoffatomen ist. So kann es sich beispielsweise bei R6 um einen Ethylrest und bei R7 umhandeln, wobei X 1 ist und R8 ein aliphatischer Hydrocarbylrest mit drei bis 23 Kohlenstoffatomen ist.
- Gegenstand der Erfindung ist gemäß einer alternativen Ausführungsform ein Öl, das einen Nichtglycerinpolyolester enthält. Der Nichtglycerinpolyolester ist gekennzeichnet durch die Formel: worin R1 und R2 unabhängig voneinander aliphatische Hydrocarbylreste mit drei bis 23 Kohlenstoffatomen sind, wobei mindestens einer der Reste R1 und R2 einen gesättigten aliphatischen Hydrocarbylrest mit drei bis neun Kohlenstoffatomen aufweist und mindestens einer der Reste R1 und R2 einen aliphatischen Hydrocarbylrest mit 11 bis 23 Kohlenstoffatomen aufweist, wobei R3 und R4 unabhängig voneinander für Wasserstoff, einen aliphatischen Hydrocarbylrest mit 1 bis 4 Kohlenstoffatomen oderstehen, wobei X eine ganze Zahl von 0 bis 6 ist und R5 ein aliphatischer Hydrocarbylrest mit drei bis 23 Kohlenstoffatomen ist.
- Sofern nicht anders definiert, haben alle hier verwendeten technischen und wissenschaftlichen Termini die dem Fachmann auf dem Gebiet der vorliegenden Erfindung geläufige Bedeutung. Zur Ausübung der Erfindung können zwar ähnliche oder äquivalente Verfahren und Materialien wie hier beschrieben verwendet werden, jedoch sind geeignete Verfahren und Materialien nachstehend beschrieben. Im Konfliktfall gibt die vorliegende Beschreibung einschließlich Definitionen den Ausschlag. Außerdem dienen die Materialien, Verfahren und Beispiele lediglich zur Erläuterung und sollen die Erfindung nicht einschränken.
- Weitere Merkmale und Vorteile der Erfindung ergeben sich aus der folgenden näheren Beschreibung und aus den Ansprüchen.
- BESCHREIBUNG DER ZEICHNUNGEN
-
1 ist ein Diagramm, das die Synthese des Methylesters von 2-Ethylhexansäure (A) und die Synthese von TMP-Estern (B) zeigt. -
2 ist ein Diagramm, das die Umesterung von Methylestern (A) und TMP-Estern (B) mit IMC-130 zeigt. -
3 ist ein Graph der erwarteten Fettsäureverteilung der TAGs von mit TMPTH und IMC-130 umgeesterten Produkten. - Die
4A und4B sind HPLC-Chromatogramme der TMPTH- bzw. IMC-130-Triacylglycerin-Elution. - Die
5A ,5B und5C sind HPLC-Chromatogramme einer Umesterungsreaktion vor der Zugabe von Katalysator (5A ), fünf Minuten nach Initiierung (5B ) und 95 Minuten nach Initiierung (5C ). -
6 ist ein DSC-Profile von IMC-TMPTH vor und nach der Umesterung. - NÄHERE BESCHREIBUNG
- Die Umesterung von zwei Polyolestern randomisiert die Verteilung von Fettsäuren unter den Polyolhauptketten, was dazu führt, daß die umgeesterten Produkte Eigenschaften aufweisen, die von jedem der ursprünglichen Polyolester verschiedenen sind. Wie hier beschrieben, werden durch die Umesterung eines TAG enthaltenden Öls, wie eines Pflanzenöls, mit einem kurzkettigen Fettsäureester die Schmiereigenschaften des TAG enthaltenden Öls verbessert. Im Rahmen der vorliegenden Erfindung bezieht sich "Schmiereigenschaften" auf Tieftemperatureigenschaften wie Viskosität und Kristallisationstemperatur und Verschleißeigenschaften, wie geringer Verschleiß und verringerte Reibung des Öls. Umgeesterte Reaktionsprodukte haben das Potential für erhöhte oxidative Stabilität aufgrund eines erhöhten Gehalts an gesättigten Fettsäuren und verbesserte Tieftemperatureigenschaften aufgrund der Heterogenität der Fettsäureketten. Es wird eine statistisch signifikante Verbesserung der Schmiereigenschaften im Vergleich zu einem entsprechenden nichtmodifizierten Öl beobachtet. Um zu bestimmen, ob eine Schmiereigenschaft signifikant verbessert wird, kann man sich standardmäßiger statistischer Tests bedienen.
- Ausgangsöle
- Geeignete Ausgangsöle enthalten TRGs und können synthetisch sein oder sich von einer Pflanze oder einem Tier ableiten. Als Ausgangsstoffe können beispielsweise TAGs, wie Triolein, Trieicosenoin oder Trierucin verwendet werden. TAGs sind im Handel erhältlich, beispielsweise von Sigma Chemical Company (St. Louis, MO), oder können nach Standardtechniken synthetisiert werden. Von Pflanzen abgeleitete Öle, d. h. Pflanzenöle, eignen sich besonders gut als Ausgangsstoffe, da sie die Herstellung von erfindungsgemäßen Ölen auf kosteneffektive Art und Weise erlauben. Geeignete Pflanzenöle haben einen Gehalt an monoungesättigten bzw. einfach ungesättigten Fettsäuren von mindestens etwa 50%, bezogen auf den gesamten Fettsäuregehalt, und schließen beispielsweise Öl aus Rapssaat (Brassica), Sonnenblumen (Helianthus), Sojabohnen (Glycine max), Mais (Zea mays), Crambe (Crambe) und Wiesenschaumkraut (Limnanthes) ein. Ein brauchbares Rapsöl ist Canolaöl, das weniger als 2% Erucasäure enthält. In Betracht kommen auch weitere Öle wie Palmöl oder Erdnußöl, die so modifiziert werden können, daß sie einen hohen Gehalt an einfach ungesättigten Verbindungen aufweisen. Öle mit einem Gehalt an einfach ungesättigten Fettsäuren von mindestens 70% sind besonders gut geeignet. Der Gehalt an einfach ungesättigten Fettsäuren kann sich beispielsweise aus Ölsäure (C18:1), Eicosensäure (C20:1), Erucasäure (C22:1) oder Kombinationen davon zusammensetzen.
- Öle mit einem Ölsäuregehalt von etwa 70% bis etwa 90% sind besonders gut geeignet. So hat beispielsweise Canolaöl IMC-130, das von Cargill, Inc., erhältlich ist, einen Ölsäuregehalt von etwa 75% und einen Gehalt an mehrfach ungesättigten Fettsäuren (C18:2 und C18:3) von etwa 14%. In der US-PS 5,767,338 werden Pflanzen und Samen von IMC 130 beschrieben. Siehe auch US-PS 5,861,187. Ölsäurereiche Sonnenblumenöle mit Ölsäurege halten von beispielsweise etwa 77% bis etwa 81% oder etwa 86% bis etwa 92% sind von A. C. Humko, Memphis, TN, erhältlich. In der US-PS 4,627,192 werden ölsäurereiche Sonnenblumenöle beschrieben.
- Zu den Ölen mit hohem Eicosensäuregehalt gehört Wiesenschaumkrautöl. Wiesenschaumkrautöl hat in der Regel einen Eicosensäuregehalt von etwa 60% bis etwa 65%. Ein derartiges Öl wird von der Fanning Corporation unter dem Handelsnamen "Fancor Meadowfoam" vertrieben.
- Zu den Ölen mit hohem Erucasäuregehalt gehören Erucasäurereiches Rapsöl (HEAR-Öl) und Crambeöl. HEAR-Öl hat einen Erucasäuregehalt von etwa 45% bis etwa 55% und ist im Handel beispielsweise von CanAmera Foods (Saskatoon, Kanada) erhältlich. Beispielsweise ist eine Rapslinie mit hohem Erucasäuregehalt verwendbar, die unter dem Handelsnamen Hero vertrieben wird. Andere Erucasäurereiche Varianten wie Venus, Mercury, Neptune oder 589–3673 haben Erucasäuregehalte von etwa 50% oder mehr und können ebenfalls verwendet werden. McVetty, P. B. E. et al., Can. J. Plant Sci., 76 (2): 341–342 (1996); Scarth, R. et al., Can. J. PlantSci., 75 (1): 205–206 (1995); und McVetty, P. B. E. et al., Can. J. Plant Sci., 76 (2): 343–344 (1996). Crambeöl hat einen Erucasäuregehalt von etwa 50% bis etwa 55% und ist von AgGrow Oils LLC, Carrington, ND erhältlich.
- Umesterung
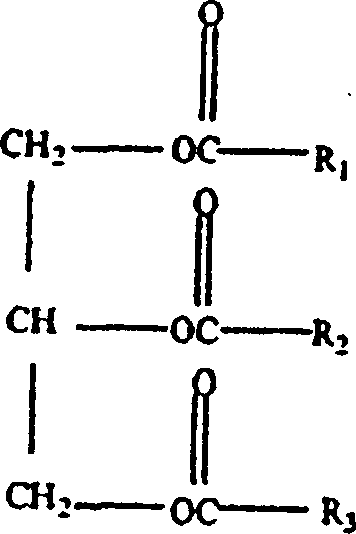
- Erfindungsgemäß führt die Umesterung (d. h. der Austausch einer Acylgruppe eines Esters mit der eines anderen Esters) eines Pflanzenöls mit einem Ester einer kurzkettigen Fettsäure zu einer statistischen Veresterung der kurzkettigen Fettsäuren mit der Glycerinhauptkette des Pflanzenöls unter Bildung von TAGs mit der folgenden Struktur:
- In dieser Struktur sind R1, R2 und R3 unabhängig voneinander aliphatische Hydrocarbylreste mit etwa drei bis etwa 23 Kohlenstoffatomen einschließlich, wobei mindestens einer der Reste R1, R2 und R3 einen gesättigten aliphatischen Hydrocarbylrest mit drei bis neun Kohlenstoffatomen einschließlich aufweist und mindestens einer der Reste R1, R2 und R3 einen aliphatischen Hydrocarbylrest mit elf bis 23 Kohlenstoffatomen einschließlich aufweist. Im Rahmen der vorliegenden Erfindung bezieht sich "Hydrocarbylrest" auf aliphatische Alkyl- und Alkenylgruppen einschließlich aller normaler und verzweigter Isomere. Geeignete gesättigte aliphatische Hydrocarbylreste sind u. a. Butyl-, Pentyl-, Hexyl-, Heptyl-, Octyl-, Nonyl- und Decylgruppen. Alkenylreste können eine einzige Doppelbindung aufweisen, wie Heptadecenyl, oder zwei oder drei Doppelbindungen aufweisen, wie Heptadecadienyl und Heptadecatrienyl.
- Zu den Estern kurzkettiger Fettsäuren gehören Methylester und Polyolester. Methylester sind beispielsweise durch Veresterung von Fettsäuren erhältlich. Die Fettsäuren werden in der Regel mit Methanol in einer säure- oder basenkatalysierten Reaktion in Methylester umgewandelt. Alternativ dazu sind Methylester im Handel erhältlich und können beispielsweise von Sigma Chemical Company, St. Louis, MO, oder von Proctor and Gamble, New Milford, CT, käuflich erworben werden. Die Umesterung eines Pflanzenöls mit kurzkettigen Methylestern ergibt TAG-Ester mit langen und kurzen Ketten. Die Nebenprodukte der Reaktion, Methylester von lang- und kurzkettigen Fettsäuren, können beispielsweise durch Vakuumdestillation entfernt werden.
- Bei der Umesterung von Pflanzenölen können auch Polyolester verwendet werden. Im Rahmen der vorliegenden Erfindung bezieht sich "Polyolester" auf Ester, die aus Polyolen mit etwa zwei bis etwa zehn Kohlenstoffatomen und zwei bis sechs Hydroxylgruppen hergestellt werden. Vorzugsweise enthalten die Polyole zwei bis vier Hydroxylreste. Nichteinschränkende Beispiele für Polyole sind 1,2-Propandiol, 1,3-Propandiol, 1,2-Butandiol, 1,3-Butandiol, 2,3-Butandiol, 2-Ethyl-1,3-propandiol, 2-Ethyl-2-butyl-1,3-propandiol, Neopentylglykol, 2,2,4-Trimethyl-1,3pentandiol, Trimethylolpropan (TMP) und Pentaerythritol. Besonders gut geeignete Polyole sind Neopentylglykol, TMP und Pentaerythritol. Polyolester werden durch Umesterung eines Polyols mit Methylestern kurzkettiger Fettsäuren hergestellt. Im Rahmen der vorliegenden Erfindung bezieht sich "kurzkettige Fettsäure" auf alle Isomere von gesättigten Fettsäuren mit Ketten mit vier bis zehn Kohlenstoffen einschließlich Fettsäuren mit ungerader oder gerader Zahl von Kohlenstoffatomen. Kurzkettige Fettsäuren können Alkylgruppen enthalten. So ist beispielsweise 2-Ethylhexansäure eine brauchbare kurzkettige Fettsäure. Geeignete TMP-Ester sind beispielsweise TMP-Tri(2-ethylhexanoat), TMP-Triheptanoat (TMPTH), TMP-Tricaprylat, TMP-Tricaproat und TMP-Tri(isononanoat).
- Durch die Umesterung eines Polyolesters mit einem Pflanzenöl werden die kurzen Fettsäureketten des Polyols und die langen Fettsäureketten des TAG statistisch unter den Polyol- und Glycerinhauptketten verteilt. Bei einer Ausführungsform enthalten erfindungsgemäße Öle TAGs mit einer wie oben definierten Struktur und einem Nichtglycerinpolyolester mit der folgenden Struktur: worin R4 und R5 unabhängig voneinander aliphatische Hydrocarbylreste mit drei bis 23 Kohlenstoffatomen einschließlich sind, wobei mindestens einer der Reste R4 und R5 einen gesättigten aliphatischen Hydrocarbylrest aufweist und mindestens einer der Reste R4 und R5 einen aliphatischen Hydrocarbylrest mit 11 bis 23 Kohlenstoffatomen aufweist. R6 und R7 sind unabhängig voneinander Wasserstoff, ein aliphatischer Hydrocarbylrest mit ein bis vier Kohlenstoffatomen oder X ist eine ganze Zahl von 0 bis 6. R8 ist ein aliphatischer Hydrocarbylrest mit drei bis 23 Kohlenstoffatomen. Bei besonderen Ausführungsformen ist R6 ein Ethylrest und R7worin X 1 ist und R8 ein aliphatischer Hydrocarbylrest mit drei bis 23 Kohlenstoffatomen ist. Bei einer alternativen Ausführungsform enthält das Öl einen Nichtglycerinpolyolester und keinen auf Glycerin basierenden Polyolester. Derartige Öle sind durch Umesterung des Nichtglycerinpolyols mit einem langkettigen Methylester oder Veresterung des Nichtglycerinpolyols mit einer langkettigen Fettsäure erhältlich.
- Die Umesterung kann im allgemeinen durchgeführt werden, indem man ein Pflanzenöl in Gegenwart eines geeigneten Katalysators mit mindestens einem kurzkettigen Fettsäureester versetzt und die Mischung erhitzt. In der Regel macht das Pflanzenöl etwa 5 bis etwa 90 Gew.-% der Reaktionsmischung aus. So kann das Pflanzenöl beispielsweise etwa 10 bis etwa 90%, etwa 40 bis etwa 90% oder etwa 60 bis etwa 90% der Mischung ausmachen. Im Rahmen der vorliegenden Beschreibung können kurzkettige Fettsäuren etwa 10 bis etwa 95 Gew.-% der Reaktionsmischung und insbesondere etwa 15 bis etwa 30 Gew.-% der Reaktionsmischung ausmachen. So können die kurzkettigen Fettsäureester beispielsweise etwa 20 bis etwa 25 Gew.-% der Reaktionsmischung ausmachen. Verhältnisse von Pflanzenöl zu kurzkettigem Fettsäureester von etwa 80:20, etwa 75:25 oder etwa 70:30 ergeben eine große Zahl von TAGs mit einer einzigen kurzen Kette und modifizieren auch einen großen Teil der TAGs in dem Pflanzenöl.
- Nichteinschränkende Beispiele für Katalysatoren sind Basenkatalysatoren, Natriummethoxid, Säurekatalysatoren einschließlich von anorganischen Säuren wie Schwefelsäure und acidifizierten Tonen, organischen Säuren wie Methansulfonsäure, Benzolsulfonsäure und Toluolsulfonsäure und sauren Harzen wie Amberlyst 15. Als Katalysatoren kommen auch Metalle wie Natrium und Magnesium und Metallhydride in Betracht. Der Fortschritt der Reaktion kann mit Hilfe von Standardtechniken, wie Hochleistungs-Flüssigkeitschromatographie (HPLC), Infrarot-Spektrometrie, Dünnschichtchromatographie (TLC), Raman-Spektrometrie oder UV-Absorption, verfolgt werden. Nach Beendigung der Reaktion kann der Natriummethoxid-Katalysator neutralisiert werden, beispielsweise durch Zugabe von Wasser oder wäßrigem Ammoniumchlorid. Säurekatalysatoren können mit einer Base, wie Natriumhydrogencarbonatlösunq, neutralisiert werden. Desaktivierter Katalysator und Seifen können durch Waschen mit Wasser und nachfolgende Zentrifugation entfernt werden. Das Öl kann durch Zugabe von wasserfreiem Magnesiumsulfat oder Natriumsulfat getrocknet werden. Wasserreste können durch Erhitzen auf etwa 40°C bis etwa 90°C, z. B. etwa 60°C unter Vakuum entfernt werden. Methylester können abdestilliert werden.
- Charakterisierung von umgeesterten Ölen
- Wie hier beschrieben, werden durch die Umesterung von kurzkettigen Fettsäureestern mit Pflanzenölen die Tieftemperaturschmiereigenschaften der Pflanzenöle verbessert. Tieftemperatureigenschaften von Interesse sind u. a. Kristallisationstemperatur, Schmelzenthalpie und Viskosität. Die Kristallisationstemperatur und das allgemeine Schmelzverhalten des Umesterungsprodukts kann mit Hilfe von Differentialkalometrie (DSC) beurteilt werden.
- Die Viskosität eines erfindungsgemäßen Öls kann durch Bestimmen des Viskositätsindex, einer willkürlichen Zahl, die die Beständigkeit eines Schmierstoffs gegenüber Viskositätsänderung mit der Temperatur angibt, beurteilt werden. Der Viskositätsindex kann nach dem Normverfahren D2270-91 der American Society for Testing and Materials (ASTM) leicht gemessen werden. Der Viskositätsindex kann auch aus den beobachteten kinematischen Viskositäten eines Schmierstoffs bei 40°C und 100°C berechnet werden. Werte für die kinematische Viskosität können gemäß den Prüfmethoden D445, IP71 oder ISO 3104 bestimmt werden.
- Viskositätsindexwerte liegen in der Regel im Bereich von 0 bis mehr als 200. Ein höherer Viskositätsindex gibt an, daß das Öl sich bei einer Temperaturänderung weniger verändert. Mit anderen Worten, je höher der Viskositätsindex, desto größer die Beständigkeit des Schmierstoffs gegenüber Verdickung bei niedrigen Temperaturen und Verdünnung bei hohen Temperaturen. Wie hier beschrieben, waren die Viskositäten von umgeesterten Produkten bei tiefen Temperaturen (–5°C) niedriger als ein herkömmlicher Schmierstoff und Canolaöl IMC 130 und bei 40°C und 100°C ähnlich wie herkömmliche Schmierstoffe. Eine niedrige Viskosität bei niedrigen Temperaturen ist eine besonders wertvolle Eigenschaft. Die Viskositätsindizes lagen für erfindungsgemäße Öle im Bereich von etwa 190 bis etwa 255, was einen für Schmieranwendungen wünschenswerten Bereich darstellt.
- So ergab beispielsweise die Umesterung von IMC 130 mit TMPTH ein Öl mit einem Viskositätsindex von mehr als 200.
- Eine andere Eigenschaft von Interesse ist die oxidative Stabilität eines Öls. Die oxidative Stabilität steht mit dem Ungesättigheitsgrad im Öl in Zusammenhang und kann z. B. mit einem Oxidative-Stability-Index-Instrument, Omnion, Inc., Rockland, MA, gemäß AOCS Official Method Cd 12b-92 (überarbeitet 1993) gemessen werden. Die oxidative Stabilität wird oft in "AOM-Stunden" ausgedrückt. Je höher die AOM-Stunden, desto größer die oxidative Stabilität des Öls. Die oxidative Stabilität kann auch durch Bestimmung der Oxidationsinduktionszeit, eines Zeitraums, in dem die Oxidationsgeschwindigkeit auf ein Maximum beschleunigt wird, beurteilt werden. Die Oxidationsinduktionszeit kann gemäß ASTM D6196-98 mittels Druck-Differentialkalometrie gemessen werden.
- Bei der Herstellung eines erfindungsgemäßen Öls durch Umesterung eines Pflanzenöls ist die oxidative Stabilität des umgeesterten Öls größer als die des Ausgangspflanzenöls, wenn beide mit dem gleichen Antioxidationsmittelgehalt formuliert werden. Eine weitere Verbesserung der oxidativen Stabilität eines derartigen umgeesterten Öls ist zu erwarten, wenn die Verluste an Tocopherolen, die im Ausgangspflanzenöl vorliegen, während der Umsetzung minimiert werden, und außerdem mit Antioxidationsmittelformulierung.
- Andere wertvolle Eigenschaften eines erfindungsgemäßen Öls sind u. a. Schmiereigenschaften und Verschleißverhalten. Reibungkoeffizienten und Antiverschleißeigenschaften können beispielsweise durch eine Vierkugel-Verschleißprüfung oder eine Mikro-Vierkugel-Verschleißprüfung beurteilt werden. Siehe Asadauskas, S. et al., J. Soc. Tribologists Lubrication Engineers, 52 (12): 877–882 (1995). Zur Evaluierung von durch einen Schmierstoff gebildeten Ablagerungen oder flüchtigen Stoffen kann auch eine Mikrooxidationsprüfung verwendet werden. Beispielsweise kann eine Dünnschichtoxidationsprüfung wie der Klaus Penn State Microoxidation Test verwendet werden, bei dem Verdampfung und Ablagerungen nach etwa 2–3 Stunden bei etwa 190°C gemessen werden. Siehe Cvitkovic, E. et al., ASLE Transactions, 22 (4): 395–401.
- Mit TMP-Estern von 2-Ethylhexansäure, Isononansäure und Heptansäure umgeesterte Pflanzenöle haben kleinere Reibungskoeffizienten und bessere Antiverschleißeigenschaften als das Ausgangspflanzenöl oder ein formulierter handelsüblicher Schmierstoff, was darauf schließen läßt, daß die Umesterung mit kurzen Fettsäure ketten die Schmierfähigkeit des Ausgangsöls verbessert.
- Ölformulierungen
- Erfindungsgemäße Öle können mit einem oder mehreren Additiven formuliert und als kosteneffektive, hochleistungsfähige und leicht biologisch abbaubare technische Öle, wie Hochleistungs-Hydraulikfluide oder Motorschmierstoffe, verwendet werden. Additive liegen in Schmierstoffzusammensetzungen in der Regel in Gesamtmengen von etwa 0,001 bis etwa 20 Gew.-% vor. So kann beispielsweise ein Getriebeöl für Dieselmotoren hergestellt werden, das Antioxidationsmittel, Antischaumadditive, Antiverschleißadditive, Korrosionsinhibitoren, Dispergiermittel, Detergentien und Säureneutralisatoren oder Kombinationen davon enthält. Hydraulikölformulierungen können Antioxidationsmittel, Rostschutzadditive, Antiverschleißadditive, Stockpunkterniedriger, Viskositätsindexverbesserer und Antischaumadditive oder Kombinationen davon enthalten. Spezifische Ölformulierungen variieren je nach Endverwendung des Öls; die Eignung einer spezifischen Formulierung für eine spezielle Verwendung kann mit Hilfe von Standardtechniken beurteilt werden. Außerdem können Grundöle, wie Kohlenwasserstoffmineralöle, zugegeben werden.
- Typische Antioxidationsmittel sind aromatische Amine, Phenole, Schwefel oder Selen enthaltende Verbindungen, Dithiophosphate, geschwefelte Polyalkene und Tocopherole. Geeignete Antioxidationsmittel sind außerdem u. a. heterocyclische Verbindungen, die Schwefel, Stickstoff und Sauerstoff enthalten. Beispiele für geeignete heterocyclische Antioxidationsmittel sind Thiazole, Benzothiazole, Triazole und Benzoxazole. Gehinderte Phenole sind besonders gut geeignet und schließen beispielsweise 2,6-Di-tert.-butyl-p-cresol (DBPC), tert.-Butylhydrochinon (TBHQ), Cyclohexylphenol und p-Phenylphenol ein. Ein brauchbarer Phenoltyp von Antioxidationsmittel ist Dovernox (Dover Chemical, Dover, OH). Beispiele für Antioxidationsmittel vom Amin-Typ sind Phenyl-α-napthylamin, alkylierte Dephenylamine und unsymmetrisches Diphenylhydrazin. Ein brauchbarer Amin-Typ von Antioxidationsmittel ist Irganox (Ciba Specialty Chemical, Tarrytown, NY). Beispiele für brauchbare Antioxidationsmittel sind Zinkdithiophosphate, Metalldithiocarbamate, Phenolsulfide, Metallphenolsulfide, Metallsalicylate, phosphosulfurisierte Fette und Olefine, geschwefelte Olefine, geschwefelte Fette und Fettderivate, geschwefelte Paraffine, geschwefelte Carbonsäuren, Disalieylal-1,2,-propandiamin, 2,4-Bis(alkyldithio)-1,3,4-thiadiazole) und Dilaurylselenid. Ein besonders gut geeignetes Antioxidationsmittelgemisch ist Lubrizol Produkt-Nr. 121056F (Wickliffe, OH). Antioxidationsmittel liegen in der Regel in Mengen von etwa 0,001 bis etwa 10 Gew.-% vor. Bei besonderen Ausführungsformen wird ein erfindungsgemäßes Öl mit etwa 0,01 bis etwa 3,0% eines Antioxidationsmittels versetzt. Beispielsweise können etwa 0,1 bis etwa 0,4% eines Antioxidationsmittels vom Amin-Typ und etwa 0,5 bis etwa 0,9% eines Antioxidationsmittels vom Phenol-Typ zugegeben werden. Bezüglich einer Beschreibung weiterer Antioxidationsmittel siehe die US-Patentschriften 5,451,334 und 5,773,391.
- Rostinhibitoren schützen Oberflächen gegen Rost und schließen organische Säuren vom Alkylbernsteinsäuretyp und Derivate davon, Alkylthioessigsäuren und Derivate davon, organische Amine, organische Phosphate, mehrwertige Alkohole und Natrium- und Calciumsulfonate ein. Antiverschleißadditive werden an Metall adsorbiert und liefern einen Film, der den Metall-Metall-Kontakt verringert. Zu den Antiverschleißadditiven gehören im allgemeinen Zinkdialkyldithiophosphat, Tricresylphosphat, Didodecylphosphit, geschwefeltes Spermöl, geschwefelte Terpene und Zinkdialkyldithiocarbamat, und sie werden in Mengen von etwa 0,05 bis etwa 4,5 Gew.-% verwendet.
- Korrosionsinhibitoren sind u. a. Dithiophosphate und insbesondere Zinkdithiophosphate, Metallsulfonate, Metallphenatsulfide, Fettsäuren, saure Phosphatester und Alkylbernsteinsäure.
- Stockpunkterniedriger ermöglichen das Fließen der Ölformulierung unterhalb des Stockpunkts des unmodifizierten Schmierstoffs. Übliche Stockpunkterniedriger sind u. a. Polymethacrylate, wachsalkylierte Naphthalinpolymere, wachsalkylierte Phenolpolymere und chlorierte Polymere und liegen im allgemeinen in Mengen von etwa 1% oder weniger vor. Bei einigen Ausführungsformen liegen Stockpunkterniedriger in Mengen > 1% vor. So können Stockpunkterniedriger beispielsweise in Mengen von etwa 6% oder weniger vorliegen (z. B. 0,01 bis etwa 6%, 0,2 bis etwa 5%, 0,2 bis etwa 4%, 0,5 bis etwa 5%, 0,5 bis etwa 3% oder 1 bis etwa 2%. Geeignete Mengen an Stockpunkterniedrigern können nach Standardmethoden ermittelt werden, wie durch Bestimmung der Fließfähigkeit des Schmierstoffs bei niedrigen Temperaturen. Siehe beispielsweise die US-Patentschriften 5,451,334 und 5,413,725.
- Der Viskositätsindex kann durch Zugabe von Viskositätsmodifikatoren, wie Polyisobutylenen, Polymethacrylaten, Polyacrylaten, Vinylacetaten, Ethylen-Propylen-Copoly meren, Styrol-Isopren-Copolymeren, Styrol-Butadien-Copolymeren oder Styrol-Maleinsäureester-Copolymeren, erhöht werden.
- Antischaumadditive verringern oder verhindern die Bildung eines stabilen Oberflächenschaums und liegen in der Regel in Mengen von etwa 0,00003 bis etwa 0,05 Gew.-% vor. Nichteinschränkende Beispiele für Antischaumadditive sind Polymethylsiloxane, Polymethacrylate, Salze von Alkylendithiophosphaten, Amylacrylat-Telomer und Poly-(2-ethylhexylacrylat-co-ethylacrylat).
- Detergentien und Dispergiermittel sind polare Substanzen, die eine Reinigungsfunktion erfüllen. Detergentien sind u. a. Metallsulfonate, Metallsalicylate und Metallthiophosponate, Dispergiermittel sind u. a. Polyaminsuccinimide, Hydroxybenzylpolyamine, Polyaminsuccinamide, Polyhydroxysuccinicester und Polyaminamidimidazoline.
- Die Erfindung wird nun in den folgenden Beispielen näher beschrieben, die den Schutzbereich der in den Ansprüchen beschriebenen Erfindung nicht einschränken.
- BEISPIELE
- Beispiel 1 – Synthese von Methylestern:
- Freie Fettsäuren wurden durch eine säurekatalysierte Reaktion der freien Fettsäure mit Methanol in Methylester umgewandelt. Bezüglich einer Beschreibung der Syntheseroute mit 2-Ethylhexansäure (Kyowa Hakko, New York, NY) als Beispiel siehe
1A . In einem 1000-ml-Rundkolben mit Rückflußkühler wurden etwa 100 g Fettsäure und 400 g Methanol vorgelegt. Nach langsamer Zugabe von 25 g konzentrierter Schwefelsäure wurde die Mischung dann unter Rückfluß erhitzt. Kleine Proben (2–4 Tropfen) wurden entnommen und auf die Oberfläche der ATR-Zelle des Infrarotspektrometers (Nicollet, Madison, WI) aufgebracht. Das Methanol wurde mit einem Stick stoffstrom verdampft und das IR-Spektrum aufgezeichnet. Die Reaktionen wurden als beendet erachtet, wenn die Proben keine weiteren spektralen Änderungen, insbesondere in den Bereichen von 3500–4000 cm–1 und 1400–1500 cm–1 ergaben. Die typische Reaktionszeit betrug etwa 1,5 bis etwa 2 Stunden. - Nach Beendigung der Reaktion wurde die Mischung auf Raumtemperatur abkühlen gelassen und mit etwa 200 ml Wasser versetzt. Alternativ dazu kann man nach Beendigung der Reaktion das Methanol abdestillieren und dann mit Hexan extrahieren. Nach Überführung in einen 1000-ml-Scheidetrichter wurde die Reaktionsmischung mit etwa 400 ml Hexan gewaschen. Nach Trennung der beiden Phasen wurde die die Methylester enthaltende Hexanphase beiseite gestellt. Die Methanolphase wurde wiederholt mit 200 ml Hexan extrahiert, bis nur noch unbedeutende Mengen von Methylestern gewonnen wurden (wie durch Messung des IR-Spektrums der Hexanphase bestimmt). Im allgemeinen wurden insgesamt 5–6 Extraktionen durchgeführt.
- Die Hexanphasen wurden in einem Scheidetrichter vereinigt und mit etwa 100 ml 1%igem KHCO3 (in Wasser) gewaschen. Nach Entfernung der wäßrigen Phase wurde die Hexanphase erneut mit etwa 100 ml entionisiertem Wasser gewaschen. Das entionisierte Wasser wurde aus dem Scheidetrichter entfernt und mit pH-Papier geprüft. Die Wasserphase war neutral.
- Zur Entfernung von Wasserspuren wurde die Hexanphase in einen 1000-ml-Erlenmeyerkolben gegossen und mit 10 g Magnesiumsulfat versetzt. Nach fünf Minuten schnellem Rühren wurde das Magnesiumsulfat durch Vakuumfiltration entfernt. Das Hexan wurde am Rotationsverdampfer angedampft, wonach die Methylester gewogen wurden und ihre Ausbeute berechnet wurde. Die Ausbeuten beliefen sich in der Regel auf 90% oder mehr.
- Beispiel 2 – Synthese von TMP-Estern:
- Eine Portion der in Beispiel 1 beschriebenen Fettsäuremethylester wurde folgendermaßen mit TMP umgeestert. Die Reaktion ist schematisch in
1B dargestellt. - In einem 250-ml-Rundkolben wurden 100 g eines Methylesters aus Beispiel 1 vorgelegt. Dann wurde Trimethylolpropan (97%, Aldrich, Milwaukee, WI) in einer solchen Menge zugegeben, daß das Molverhältnis von Methylestergruppen zu Hydroxylgruppen etwa 1:0,75 betrug. Die Lösung wurde unter konstantem Stickstoffstrom auf 80°C erhitzt und mit 1 g Natriummethoxid (30%, Acros, Pittsburgh, PA) in Methanol versetzt (das Methanol wurde vor der Zugabe nicht abgedampft). Die Reaktion wurde durch Messung der IR-Spektren kleiner Proben verfolgt und als beendet erachtet, als keine weiteren Änderungen im Spektrum beobachtet wurden (insbesondere im Hydroxylbereich 3500 cm–1).
- Nach Beendigung der Reaktion wurde die Mischung auf Raumtemperatur abkühlen gelassen. Der Katalysator wurde durch Zugabe von 5 g Wasser und 30 Sekunden schnelles Rühren deaktiviert. Dann wurden Wasser und Seifen durch Zentrifugation bei 7000 U/min über einen Zeitraum von zehn Minuten entfernt. Es wurde eine zweite Wasserwäsche durchgeführt, und die Mischung wurde fünf Minuten gerührt. Dann wurde erneut zentrifugiert, um die Wasserphase zu entfernen. Die Reaktionsmischung wurde in einen sauberen 250-ml-Rundkolben gegossen und zur Entfernung von nicht umgesetzten Methylestern unter Hochvakuum auf 100°C erhitzt. Dann wurde die Substanz mittels Säulenchromatographie an Kieselgel (50 bis 100 Mesh, Aldrich, Milwaukee, WI) gereinigt.
- Beispiel 3 – Allgemeine Umesterungsvorschrift:
- Kurzkettige Fettsäuren in Form von TMP- oder Methylestern wurden nach der folgenden Vorschrift mit IMC-130 (Intermountain Canola, Idaho Falls, ID) umgeestert. Die Umesterung von Methylestern (A) und TMP-Estern (B) mit IMC-130 ist in
2 dargestellt. Es sei darauf hingewiesen, daß bei Vorliegen der kurzkettigen Fettsäuren in Form von Methylestern die lang- und kurzkettigen Fettsäuremethylester-Nebenprodukte nach der Umesterung durch Vakuumdestillation entfernt wurden. - In einen 250-ml-Rundkolben wurden ungefähr 80 g IMC-130 gegossen. Zur Verhinderung der Deaktivierung des Katalysators wurde das Öl zur Entfernung von Feuchtigkeitsspuren unter Hochvakuum auf 100°C erhitzt. Separat wurde 1 g 30%ige Natriummethoxidlösung (in Methanol) in ein 20-ml-Scintillationsröhrchen gegeben und das Methanol mit einem Strom von Stickstoffgas abgedampft. Es wurde darauf geachtet, den Katalysator nicht zu überhitzen, da dies zu Zersetzung und Deaktivierung führen kann. Das getrocknete Natriummethoxid wurde mit einem Metallspatel vorsichtig zu einem feinen Pulver aufgebrochen. Alternativ dazu ist pulverförmiges Natriummethoxid im Handel erhältlich.
- Der Katalysator wurde zusammen mit 20 g des kurzkettigen Fettsäureesters (Methyl- oder TNP-Ester) in den Reaktionskolben gegeben. Bei Verwendung eines TMP-Esters wurde die Temperatur unter Hochvakuum auf 100°C erhöht. Im Fall von Methylestern, die unter diesen Bedingungen flüchtig waren, wurde eine Temperatur von 80°C mit einer Stickstoffatmosphäre verwendet.
- Nach Erreichen von 70-80°C wurde die Mischung dunkel, was darauf schließen ließ, daß die Umesterung begonnen hatte. Die Reaktion wurde noch 30 Minuten weiterlaufen gelassen und dann auf Raumtemperatur zurückgebracht. Der Katalysator wurde durch Zugabe von 5 g Wasser und schnelles Rühren über einen Zeitraum von 30 Sekunden neutralisiert. Deaktivierter Katalysator und gebildete Seifen wurden durch Zentrifugation bei 7000 U/min über einen Zeitraum von zehn Minuten entfernt. Die Ölphase wurde abdekantiert und fünf Minuten mit 5 g Wasser gewaschen und dann nach der gleichen Zentrifugationsmethode abgetrennt.
- Die Ölphase wurde mit 5 g wasserfreiem Magnesiumsulfat versetzt und fünf Minuten schnell gerührt, wonach das Magnesiumsulfat durch Vakuumfiltration entfernt wurde. Die verbleibende Spurenmenge Wasser wurde durch Einbringen des Öls in einen Kolben und Erhitzen auf 60°C unter Hochvakuum entfernt. Bei Verwendung von Methylestern bei der Umesterung wurden Methylesterreste unter Verwendung einer Kugelrohr-Kurzwegdestillationseinheit (Aldrich, Milwaukee, WI) entfernt. Bei der Destillation wurde das Öl in einem Heißluftbad langsam auf 200°C erhitzt, wonach diese Temperatur 20 Minuten gehalten wurde und die Fettsäuremethylester in einer Destillatfalle aufgefangen wurden.
- Beispiel 4 – Umesterung von Pflanzenölen mit kurzkettigen Fettsäureestern:
- Es wurde ein statistisches Modell auf der Basis einer statistischen Verteilung entwickelt, um zu bestimmen, wie die langkettigen Fettsäuren von IMC-130-Öl-TAGs und die kurzkettigen Fettsäuren des Nichtglycerinesters bei Umesterung von kurzkettigen Fettsäureestern mit IMC-130-Öl bei verschiedenen Konzentrationen verteilt sein würden. Das für die Umesterung von IMC-130-Öl und TMPTH konstruierte Modell ist in
3 gezeigt. Die Umesterung von etwa 20–25 Gew.-% TMPTH mit IMC-130-Öl ergibt eine große Zahl von TAGs mit einer kurzen Kette und modifiziert über 70% der ursprünglichen TAGs in IMC-130. Wenngleich Modelle für andere kurzkettige Fettsäuren als TMPTH aufgrund von Molekulargewichtsunterschieden leicht abwichen, ergaben ungefähr 20–25 Gew.-% eine hohe Zahl von TAGs mit einer einzigen kurzen Kette sowie die Modifizierung eines großen Teils der TAGs in IMC-130. Daher wurden Umesterungen in der Regel mit etwa 20–25 Gew.-% der kurzkettigen Fettsäuren durchgeführt. - Es wurden mehrere Arten von auf der Basis ihrer Verfügbarkeit und ihres erwarteten Beitrags zu den Tieftemperatureigenschaften ausgewählte Fettsäuren und Fettsäureester erhalten. Trimethylolpropantriheptanoat (TMPTH, Inolex, Pittsburgh, PA, Katalog-Nr. 3I-310) hat drei Fettsäureketten mit jeweils sieben Kohlenstoffatomen die mit TMP verestert sind. Trimethyolpropantricaprylat und -caproat (TMPTC/c, Inolex, Pittsburgh, PA, Katalog-Nr. 3N-310) besteht aus einer TMP-Hauptkette, die mit Fettsäuren mit acht oder zehn Kohlenstoffatomen verestert ist. Bei C810 Methyl Esters (Proctor and Gamble, New Milford, CT) handelt es sich um ein Gemisch von Methylestern von C8:0- und C10:0-Fettsäuren. C1098 Methyl Esters (Proctor and Gamble, New Milford, CT) besteht aus C10:0-Fettsäuremethylestern. 2-Ethylhexansäuremethylester wurde durch Veresterung von 2-Ethylhexansäure mit Methanol hergestellt. Isononansäuremethylester wurde durch Veresterung von Isononansäure (Kyowa Hakko, New York, NY) mit Methanol hergestellt. Trimethylolpropantri(2-ethylhexanoat) wurde durch Umesterung des entsprechenden Fettsäuremethylesters mit TMP hergestellt. Trimethyolpropantri(isononanoat) wurde durch Umesterung des entsprechenden Fettsäuremethylester mit TMP hergestellt. IMC-130-Öl wurde mit etwa 20 Gew.-% kurzkettigen Fettsäureestern umgeestert. Bei einer Umsetzung wurden 25% TMPTH und 75% IMC-130 verwendet.
- Die Umesterungsreaktionen wurden mittels HPLC verfolgt. Reaktionsproben wurden mit einer kleinen Menge Wasser gewaschen, um die Reaktion zu stoppen. Nach Abzentrifugieren der Wasserphase wurde die Ölphase mit einer kleinen Menge Magnesiumsulfat getrocknet. Die Proben wurden über ein kleines Filter (Gelman Acrodisc, 0,45 μm) filtriert und dann in Lösungsmittel gelöst und auf die Säule aufgegeben. Die mobile Phase bestand aus 40% Acetonitril (Fisher, Pittsburgh, PA) und 60% Aceton und wurde mit einer Rate von 1 ml/min durch eine Spherisorb-RP-C18-Säule (Phase Separations, Norwalk, CT) gepumpt (110B Solven Module, Beckman, Palo Altos, CA). Die Säule wurde durch eine Säulenheizvorrichtung (Biorad, Hercules, CA) bei 40°C gehalten und mit einem an einen Plotter/Integrator (HP-3395 Hewlett-Packard, Santa Clarita, CA) angeschlossenen Brechungsindexdetektor (Waters, Milford, MA) überwacht.
- Es wurde ein Versuch zur Bestimmung der zur vollständigen Randomisierung von Fettsäuren bei der Umesterung erforderlichen Zeitspanne durchgeführt. Dabei wurde die Umesterung von TMPTH mit IMC-130 mittels HPLC verfolgt. Vor Beginn der Reaktion wurde eine Probe der physikalischen Mischung (IMC-130 und TMPTH ohne Katalysator) entnommen. Die zweite Probe wurde fünf Minuten nach Beginn der Reaktion entnommen, während die restlichen Proben in 30-Minuten-Intervallen entnommen wurden.
- TMPTH eluierte 4,1 Minuten nach der Aufgabe und ergab nur einen Peak nach der Lösungsmittelfront (siehe
4A ). IMC-130 ergab aufgrund des Vorliegens einer breiten Palette von TAGs mehrere Peaks, die alle längere Elutionszeiten als TMPTH aufweisen (siehe4B ). Wie in5 gezeigt, waren die Chromatogramme der fünf Minuten und 95 Minuten nach Initiierung der Umesterunsreaktion entnommenen Proben (5B und5C ) identisch, was darauf schließen ließ, daß die Reaktion beendet war und die Randomisierung in etwa fünf Minuten erreicht worden war. Aus den HPLC-Versuchen wurde geschätzt, daß zur Erzielung einer vollständigen Randomisierung eine Reaktionszeit von etwa fünf Minuten erforderlich war, wenngleich zur Gewährleistung einer vollständigen Randomisierung 30 Minuten verwendet wurden. - Außerdem wurde zur Verifizierung, daß die Umesterung erfolgt war, Umkehrphasen-Dünnschichtchromatographie (Umkehrphasen-DC) verwendet. Dabei wurde Eisessig als Elutionsmittel verwendet und die Platte durch Verkohlen mit Schwefelsäure entwickelt. Alle umgeesterten Produk te ergaben das gleiche allgemeine Muster von drei Punkten. Punkt 3 war dem Ursprung am nächsten und wurde von Triacylpolyolen mit 3 langen Fettsäureketten gebildet. Der zweite Punkt stammt von Triacylpolyolen mit zwei langen und einer kurzen Fettsäurekette. Der erste Punkt war am weitesten vom Ursprung entfernt und enthielt Triacylpolyole mit einer langen und zwei kurzen Fettsäureketten. Es sei darauf hingewiesen, daß Punkte mit drei kurzen Ketten nicht beobachtet wurden, da kürzere Fettsäuren gegenüber Verkohlung weniger empfindlich sind.
- Beispiel 5 – Charakterisierung von umgeesterten Ölprodukten:
- Die oxidative Stabilität wurde als AOM-Stunden (AOM = Active Oxygen Method) gemäß der offiziellen Methode OSI (Oxidative Stability Index) Cd 12b-92 gemessen. Tocopherole wurden nach der offiziellen Methode AOCS Ce 7-87 vermessen.
- Die Tieftemperatureigenschaften wurden mittels Differentialkalorimetrie (DSC) unter Verwendung eines Differentialkalorimeters Modell 7 von Perkin-Elmer (Norwalk, CT) evaluiert. Die Proben wurden eine Minute bei 20°C gehalten und dann mit einer Rate von 40°C/Minute auf 75°C erhitzt. Die Proben wurden zehn Minuten bei 75°C gehalten und dann mit 1°C/Minute auf –40°C abgekühlt. Nach 20 Minuten Halten bei –40°C wurden die Proben mit 1°C/Minute auf 75°C erhitzt.
- Die oxidative Stabilität und die Tieftemperatureigenschaften von umgeesterten (UE) Ölen sind in Tabelle 1 gezeigt. Das Verhältnis von Öl zu kurzkettigem Fettsäureester betrug bei jedem dieser Beispiele 80:20, sofern nicht anders vermerkt.
- Die oxidativen Stabilitäten der umgeesterten Produkte ohne Antioxidationsmittelzusatz waren geringer als das Ausgangsöl, was vermutlich auf den Verlust von Tocopherolen aus dem Canolaöl bei der Herstellung der umgeesterten Produkte zurückzuführen ist. Die AOM-Stabilitäten der umgeesterten Produkte korrelierten mit ihrer Tocopherol-Konzentration. Durch Zugabe von Antioxidationsmitteln zu den umgeesterten Ölen konnten die oxidativen Stabilitäten über diejenigen von IMC-130 mit einer ähnlichen Menge Antioxidationsmittel angehoben werden (Tabelle 1). Dies läßt darauf schließen, daß die umgeesterten Produkte auf Antioxidationsmittel besser ansprechen als Pflanzenöle. Eine weitere Verbesserung der oxidativen Stabilität der umgeesterten Öle ist zu erwarten, wenn der Tocopherolverlust auf ein Minimum verringert wird. Es ist vorgesehen, daß der Tocopherolverlust durch eine routinemäßige Abwandlung der Reaktionsbedingungen auf ein Minimum reduziert wird.
- Die Tieftemperatureigenschaften lassen darauf schließen, daß die Umesterung in den meisten Fällen Verbesserungen des Pflanzenöls ergab. Die Umesterung mit TMPTH war bemerkenswert, da sie die Kristallisationsschmelztemperaturen der umgeesterten Ölprodukte im Vergleich mit dem Ausgangspflanzenöl signifikant herabsetzte. Das DSC-Profil der IMC/TMPTH-Mischung vor und nach der Umesterung ist in
6 gezeigt. - Unter Verwendung eines Brookfield-Viskosimeters mit einem Kleinprobenadapter wurden Viskositätsprofile als Funktion der Temperatur erhalten. An den Adaptermantel war ein Ethylenglykol und Wasser (1:1) enthaltendes Umlaufwasserbad angeschlossen, um die Temperatur der Probe zu regulieren. Die Probe wurde auf –5°C abgekühlt und bei dieser Temperatur 2–3 Minuten äquilibrieren gelassen. Danach wurde die Viskosität aufgezeichnet. Die Temperatur wurde um 5°C erhöht, und das Verfahren der Temperaturäquilibrierung und Viskositätsmessung wurde alle 5°C wiederholt, bis eine Temperatur von 100°C erreicht war. Der Viskositätsindex wurde nach der offiziellen ASTM-Methode D2270 berechnet.
- Viskositätsunterschiede waren am leichtesten bei niedrigen Temperaturen festzustellen. Mit zunehmender Temperatur ähneln die Viskositäten aller umgeesterten Produkte IMC-130. Die Viskositäten (cP) und Viskositätsindizes der umgeesterten (UE) Öle sind in Tabelle 2 aufgeführt.
- Außerdem wurden Mikro-Vierkugel-Prüfungen durchgeführt, bei denen Reibung und Verschleiß gemessen wurde. Bei den Mikro-Vierkugel-Prüfungen wurde unter Verwendung einer 10-ml-Weißölprobe bei 10 bzw. 40 kg Belastung ein 30-Minuten-Vorkonditionierungssegment durchgeführt. Danach wurde der Kugeltopf gereinigt, ohne die Kugeln zu bewegen, und es wurden die Narbendurchmesser gemessen. Bei diesen Lasten sollten Verschleißnarben von 0,40 ± 0,02 mm bei 10 kg und 0,50 ± 0,02 mm bei 40 kg erhalten werden. Wenn die Narben nicht innerhalb dieser Grenzen lagen, wurde die Prüfung für ungültig erklärt. Dieses Verfahren führt zu einer gemeinsamen Ausgangsoberfläche und Last.
- Für das 30-Minuten-Prüfungssegment wurde eine 6-μl-Probe jedes Prüföls mit einer Spritze zur subkutanen Injektion vorsichtig auf den Narbenbereich der obersten Kugel gegeben. Die Kugeln wurden lastfrei vorsichtig miteinander in Berührung gebracht und per Hand etwas gedreht, um die Flüssigkeitsprobe zu verteilen. Dann wurde die Last angelegt und die Prüfung noch 30 Minuten fortgesetzt. Alle Prüfungen wurden zweimal durchgeführt, und es wurde der Mittelwert angegeben. Die Prüftemperatur betrug bei allen Prüfungen 75°C.
- Die Schmierprüfungen ließen darauf schließen, daß die Umesterung von IMC-130 mit kurzkettigen Fettsäuren sowohl den Reibungskoeffizienten (f) als auch die Antiverschleißeigenschaften (ΔNarbe) verbessert. Der Δ-Narbenwert von Mineralöl beträgt in der Regel etwa 0,2 mm und der Reibungskoeffizient beträgt in der Regel etwa 0,07. Ein Reibungskoeffizient von weniger als 0,05 wird als sehr gut erachtet. Die Ergebnisse für die umgeesterten Produkte sind in Tabelle 3 aufgeführt. TABELLE 3 Ergebnisse der Mini-Vierkugel-Prüfung
- 1 mit der Mikro-Vierkugel-Prüfung bei 40 kg, 75°C und 30 min erhaltene Ergebnisse
- 2 der handelsübliche Esterschmierstoff ist formuliert, alle andere Proben nicht
- Die Oxidationsstabilität der Fluide wurde mit dem Klaus Penn State Micro-Oxidation Test (PSMO) evaluiert, bei dem die Bildung von oxidierten Ablagerungen und flüchtigen Stoffen gemessen wird. Die Prüfung ist eine Dünnschichtoxidationsprüfung mit nur 20 μl Prüffluid. Die ersten Prüfungen wurden über einen Zeitraum von drei Stunden bei 190°C durchgeführt. Die Prüfungsbedingungen waren im wesentlichen äquivalent zu 0,5 Stunden bei 225°C, was zur Durchmusterung von Motorölen für IIID-Motorenprüfungen verwendet wird. Unter diesen Bedingungen würde ein nichtadditiviertes Weißöl etwa 25% Verdampfung und 10% Ablagerung aufweisen.
- Zur Demonstration des Effekts von Zeit und Temperatur bei diesen Prüfungen wurden Proben in dem PSMO bei drei verschiedenen Bedingungen (2 Stunden bei 190°C, 1 Stunde bei 200°C, 0,5 Stunden bei 225°C) gefahren. Die 200°C- und 225°C-Bedingungen sind nicht so streng wie die 190°C-Bedingungen. Auf der Grundlage der Ergebnisse dieser drei Bedingungen liefert die Prüfung von formulierten Ölen bei 190°C über einen Zeitraum von zwei Stunden eine rigorosere Beurteilung ihrer Stabilität und der Schmierbedingungen.
- Die Ergebnisse einer PSMO-Prüfung sind in Tabelle 4 aufgeführt. Proben mit kleinerem prozentualem Gehalt an flüchtigen Stoffen und Ablagerungen haben eine höhere Oxidationsbeständigkeit. Wie aus Tabelle 3 ersichtlich ist, arbeiteten umgeesterte Produkte genauso gut wie die Ausgangspflanzenöle.
- Beispiel 6 – Herstellung und Charakterisierung von umgeesterten Soja- und Sonnenblumenprodukten:
- In Analogie zu Beispiel 3 wurden umgeesterte Produkte mit Pflanzenölen mit einem höheren Ölsäuregehalt als IMC-130 hergestellt. IMC 93-GS, das einen Ölsäuregehalt von 84,5% aufweist wurde von Intermountain Canola, Cargill, Inc., erhalten. Ölsäurereiches Sonnenblumenöl (HO SFO, Intermountain Canola, Cargill, Inc.) und ölsäurereiches Sojaöl (HO-SBO, Optimum Quality Grains, L. L. C., West Des Moines, IA) haben Ölsäuregehalte von 81% bzw. 83%. Das zur Herstellung der umgeesterten Reaktionsprodukte verwendete Verhältnis von Pflanzenöl zu TMPTH sowie die oxidative Stabilität der Produkte ohne Antioxidantien (an sich) und mit 0,75% TBHQ oder 3% Lubrizol sind in Tabelle 5 angegeben. Dort sind auch die Ergebnisse aus der Druck-Differentialkalorimetrie (PDSC) aufgeführt, die nach Normmethode ASTM D 6186-98 erhalten wurden. Die PDSC wurde an Proben ohne Additive bei 130°C oder mit einer Antioxidationsmittelmischung mit 0,75% Dovernox (Dover Chemical, Dover, OH) und 0,256 Irganox (Ciba Specialty Chemical, Tarry Town, NY) bei 160°C durchgeführt. Dovernox ist ein Antioxidationsmittel vom Phenol-Typ, und Irganox ist ein Antioxidationsmittel vom Amin-Typ. Die Ergebnisse sind als oxidative Induktionszeit in Tabelle 5 aufgeführt.
- Wie in Tabelle 5 angegeben, ergaben Pflanzenöle mit hohem Ölsäuregehalt umgeesterte Produkte mit hoher oxidativer Stabilität. Im Vergleich dazu haben unmodifizierte Pflanzenöle eine geringere oxidative Stabilität als die umgeesterten Produkte (Tabelle 5). So hat beispielsweise IMC-130 eine oxidative Stabilität von 34 AOM-Stunden, IMC 93-GS eine oxidative Stabilität von 66 AOM-Stunden und ölsäurereiches Sojaöl eine oxidative Stabilität von 100 AOM-Stunden. Die Induktionszeit für TMPTH konnte aufgrund von Basisliniendrift nicht gemessen werden.
- Beispiel 7 – Charakterisierung von mit verschiedenen IMC-130- und TMPTH-Verhältnissen hergestelltem umgeesterten Produkt:
- Gemäß Beispiel 3 wurde mit Verhältnissen von IMC-130 zu TMPTH von 70:30, 73:27, 75:25 und 80:20 umgeestertes Produkt hergestellt. Von den umgeesterten Produkten wurde DSC durchgeführt, um den Schmelzpunkt (°C), die Schmelzenthalpie (ΔHschmelz, j/g) zu bestimmen. Dazu wurde ein Differentialkalorimeter von Perkin Elmer verwendet. Die Proben wurden mit 1°C/Minute von Raumtemperatur auf –40°C abgekühlt, 20 Minuten bei –40°C gehalten und dann mit 1°C/Minute von –40°C auf 75°C erhitzt. Wie in Tabelle 6 angegeben ist, ergab die Erhöhung des TMPTH-Gehalts bei der Umesterungsreaktion eine Substanz mit niedrigerem Schmelzpunkt und kleinerer Schmelzenthalpie.
- Beispiel 8 – Formulierung von umgeesterten Produkten mit Viskositätsmodifikatoren:
- Ein gemäß Beispiel 3 unter Verwendung eines Verhältnisses von IMC-130 zu TMPTH von 73:27 hergestelltes umgeestertes Produkt wurde mit Viskositätsmodifikatoren versetzt. Viskositätsmodifikatoren einschließlich V-508 (Functional Products, Mecadonia, OH), Erucichem T6000 (Erucichem Division of ILI, Seattle, WA) und Lubrizolprodukt Nr. 105648F (Wickliffe, OH) wurden in Konzentrationen im Bereich von etwa 0,2% bis etwa 5% zuge geben. Die Viskosität (cP) bei 40°C bzw. 37,8°C (100°F) ist in Tabelle 7 aufgeführt. Die Zugabe von Lubrizolprodukt Nr. 105648F lieferte die größte Viskositätszunahme.
- Beispiel 9 – Formulierung von umgeesterten Produkten mit Stockpunkterniedrigern:
- Im allgemeinen wurde eine spezifizierte Schmierstoffmenge (hergestellt wie in Beispiel 3 beschrieben, Verhältnis von IMC-130 zu TMPTH 73:27) und Stockpunkterniedriger in 20-ml-Scintillationsröhrchen eingewogen, wonach der Inhalt magnetisch gerührt wurde, bis die Substanzen gründlich durchmischt waren. Die Proben wurden in einen aufrecht stehenden Laborgefrierschrank gestellt, in dem die Temperatur bei ungefähr –25°C gehalten wurde. Ungefähr alle zwei Tage wurden Beobachtungen durchgeführt. Die Leistungsfähigkeit von drei verschiedenen Stockpunkterniedrigern wurde verglichen. Verwendet wurden Lubrizolprodukt Nr. 143850, 134894A und 146533 (Wickliffe, OH). Eine Zusammenfassung der Beobachtungen ist in Tabelle 8 aufgeführt. Zum Vergleich geliert IMC 130 bei dieser Temperatur innerhalb von zwei Stunden.
- Lubrizolprodukt Nr. 143850 wurde auch zur Formulierung von aus einem Verhältnis von IMC-130 zu TMPTH von 80:20 und 75:25 hergestellten umgeesterten Produkten verwendet. Wie in Tabelle 9 angegeben, hat ein aus einem Verhältnis von IMC-130 zu TMPTH von 75:25 hergestelltes umgeestertes und mit Lubrizolprodukt Nr. 143850 hergestelltes Produkt eine bessere Leistungsfähigkeit als mit einem Verhältnis von IMC-130 zu TMPTH von 80:20 hergestellter und mit dem gleichen Stockpunkterniedriger formulierter Schmierstoff.
- Die Leistungsfähigkeit von mit Lubrizolprodukt Nr. 143850 formuliertem umgeesterten Produkt wurde mit Kielflow-Stockpunkterniedrigern (Ferro Corporation, Hammond, IN) 195 und 150 verglichen. Das verwendete umgeesterte Produkt wurde mit einem Verhältnis von IMC-130 zu TMPTH von 70:30 hergestellt. Die Substanz wurde einen Monat in einer neuen Gefriertruhe, die weniger Temperaturschwankungen ergab als der oben verwendete Gefrierschrank, aufbewahrt. Wie in Tabelle 10 aufgeführt, blieb mit 0,5–1,0% Kielflow 195 oder 150 oder 1–2% Lubrizolprodukt Nr. 143850 formuliertes umgeestertes Produkt nach einem Monat fließfähig.
- Beispiel 10 – Formulierung von umgeestertem Produkt mit Antioxidationsmitteln:
- Mit einem Verhältnis von IMC-130 zu TMPTH von 70:30 hergestellter Schmierstoff wurde mit Antioxidationsmitteln formuliert. Die Leistungsfähigkeit von mit Dovernox formuliertem Produkt wurde mit dem mit TBHQ formulierten Produkt verglichen. Die oxidative Stabilität wurde wie in Beispiel 5 beschrieben gemessen und ist in Tabelle 11 in AOM-Stunden angegeben. Die Zugabe von Dovernox ergab bei diesem Produkt eine größere oxidative Stabilität als TBHQ (Tabelle 11).
- Außerdem wurde die Leistungsfähigkeit einer zweikomponentigen Antioxidationsmittelmischung beurteilt. Die zur Formulierung des umgeesterten Produkts verwendeten prozentualen Anteile an Dovernox und Irganox sind in Tabelle 12 aufgeführt. Zur Beurteilung der Leistungsfähigkeit wurde PDSC verwendet und ist als Oxidationsinduktionszeit (min) angegeben.
- Die Zugabe von Irganox und Dovernox verbesserte die Leistungsfähigkeit, wie durch PDSC gemessen. Die Zugabe von mehr als 0,25% Irganox ergab kleiner werdende Verbesserungen, wohingegen die Erhöhung der Menge an Dovernox eine stetige Zunahme der Leistungsfähigkeit ergab. Auf der Grundlage dieser Ergebnisse wurde bestimmt, daß die Zugabe von etwa 0,25% Irganox von etwa 0,75% Dovernox maximale Vorteile ergab.
- Die Leistungsfähigkeit von Phenothiazin (Aldrich Chemical Co., St. Louis, MO) wurde mit der Dovernox-Irganox-Kombination in umgeestertem Produkt aus ölsäurereichem Sonnenblumenöl und TMPTH (70:30) verglichen. Außerdem wurde Irganox mit Phenothiazin kombiniert, um zu bestimmen, ob sich dadurch ein Vorteil für die oxidative Stabilität ergab. Zur Beurteilung der formulierten Produkte wurde PDSC verwendet. Die Ergebnisse sind in Tabelle 13 als Oxidationsinduktionszeit angegeben.
- Beispiel 11 – Optimierung der Reaktionsbedingungen:
- Bei diesem Versuch wurden die Reaktionszeit, die Reaktionstemperatur und die Katalysatorkonzentration variiert. Es wurde angenommen, daß das bei der Reaktion mit 0,3% Natriummethoxid-Katalysator über einen Zeitraum von drei Stunden erhaltene Reaktionsprodukt "vollständig randomisierte" Fettsäureacylketten an den Polyolen aufwies. Alle anderen Proben wurden mit dieser vollständig randomisierten Probe verglichen. Es wurden Reaktionen bei 80°C mit 0,05%, 0,1% bzw. 0,3% Katalysator und bei 100°C mit 0,05%, 0,1% und 0,3% Katalysator durchgeführt. Die Proben wurden mittels HPLC mit einer ODS-Hypersil-Säule von Hewlett Packard (Teilchengröße 5 μm, 200 × 2,1 mm) und 40% Acetonitril und 60% Aceton als Lösungsmittel bei einer Durchflußrate von 1 ml/min beurteilt. Als Detektor dient ein Differentialrefraktometer von Waters (Modell R401).
- Aus diesen Daten wurde geschlossen, daß bei 100°C durchgeführte Reaktionen besser waren als die bei 80°C durchgeführten. Außerdem waren bei dieser Temperatur Katalysatorkonzentrationen von 0,3 und 0,1% äquivalent und beide arbeiteten besser als 0,05% Katalysator.
- Es wurden zwei Methoden zur Entfernung von Katalysator beurteilt, u. a. um zu bestimmen, ob Eigenschaften wie die oxidative Stabilität beeinflußt wurden. Bei der ersten Methode wurde mit Wasser gewaschen und nachfolgend zentrifugiert. Bei der zweiten Methode wurde angesäuert und nachfolgend filtriert. Es wurden fünf Reaktionen durchgeführt, und jede Reaktion wurde in zwei Teile aufgeteilt. Der erste Teil wurde mit genug 6 M HCl zur Neutralisierung des Basenkatalysators behandelt. Dann wurde die Mischung über eine Filterhilfe filtriert. Die andere Hälfte wurde mit 5% Wasser behandelt, mit einem Magnetrührer zehn Minuten schnell gerührt und dann bei 5000 U/min 15 Minuten zentrifugiert. Nach Entnahme einer Probe für die PDSC wurde noch einmal mit Wasser gewaschen und zentrifugiert. Die PDSC-Scans (130°C) wurden in zufälliger Reihenfolge durchgeführt. Die oxidative Induktionszeit ist in Tabelle 14 angegeben. Die Varianzanalyse ergab, daß zwei Wasserwäschen zu einer höheren oxidativen Stabilität führten und eine Wasserwäsche statistisch mit den mit Säure behandelten Proben äquivalent war. Bei Verwendung der Wasserwaschprozedur war neben der Erhöhung der oxidativen Stabilität auch die Säurezahl (d. h. zur Neutralisierung der freien Fettsäuren in einem Gramm Probe benötigte Milligramm Kaliumhydroxid) signifikant kleiner. Typische Säurewerte für mit Wasser gewaschene und mit Säure behandelte Proben betragen 0,02 bzw. 0,7, wie gemäß der offiziellen Methode AOCS Cd 3d-63 bestimmt.
- Beispiel 12 – Bestimmung der Antiverschleißeigenschaften eines formulierten umgeesterten Produkts:
- Umgeestertes Produkt (IMC-130 zu TMPTH 73:27) wurde mit 1,5% Stockpunkterniedriger (Lubrizolprodukt Nr. 143850), 0,75 Viskositätsmodifikator (Lubrizolprodukt Nr. 105648F) und 0,75% TBHQ formuliert, und es wurde eine Vierkugel-Prüfung gemäß ASTM D4172 durchgeführt. Antiverschleißadditive wurde nicht zugegeben. Die mittleren Narbendurchmesser über drei Prüfungsdurchgänge betrugen 0,651, 0,614 und 0,656 mm mit einem Gesamtmittelwert von 0,641 mm. Diese Narbendurchmesser lassen darauf schließen, daß die Substanz gute Schmiereigenschaften aufweist. Durch Zugabe von Antiverschleißadditiven kann die Leistungsfähigkeit der Substanz weiter verbessert werden.
- Beispiel 13 – Charakterisierung von umgeestertem Produkt aus ölsäurereichem Sonnenblumenöl und TMPTH:
- Produkt wurde in Analogie zu Beispiel 6 unter Verwendung eines Verhältnisses von ölsäurereichem Sonnenblumenöl zu TMPTH von 70:30 hergestellt. Der Katalysator wurde durch Waschen mit Wasser neutralisiert. Die Leitfähigkeit wurde mit einem Leitfähigkeitsmeßgerät (Emcess Electronics, Venice, FL) beurteilt. Die Leitfähigkeit (Pikosiemens/Meter, ps/m) der Substanz ist in Tabelle 15 ausgeführt. Die Steigung betrug 0,23 ps/m/g.
- Die Viskosität des Produkts wurde bei Temperaturen im Bereich von –5°C bis 100°C beurteilt und ist in Tabelle 16 (cP) angegeben. Die Berechnung des Viskositätsindex ergab für dieses Produkt einen Wert von 196.
- Das umgeesterte ölsäurereiche Sonnenblumenprodukt wurde auch in 1% Antioxidationsmittel (Dovernox:Irganox 75:25) formuliert und bezüglich der in Tabelle 17 aufgelisteten Parameter beurteilt.
- Für die Probe an sich und nach Zugabe von 0,75% Dovernox und 0,25% Irganox wurde die Oxidationsinduktionszeit gemessen. Die Proben wurden zweimal gemessen. Ohne Additive wurden Oxidationsinduktionszeiten von 13,56 und 14,36 Minuten beobachtet, wohingegen die Oxidationsinduktionszeit mit Antioxidationsmitteln 62 und 62,7 Minuten betrugen.
- Außerdem wurde der Tocopherolgehalt wie in Beispiel 5 beschrieben gemessen. Der Tocopherol-Gesamtgehalt betrug 191 ppm und setzt sich aus 160 ppm alpha-Tocopherol, 11 ppm beta-ocopherol, 17 ppm gamma-Tocopherol und 4 ppm delta-Tocopherol zusammen.
- Die Berechnung der Säurezahl gemäß obiger Beschreibung ergab einen Wert von 0,02. Des weiteren wurde der Feuchtigkeitsgehalt nach der Karl-Fisher-Methode beurteilt. Die Wasserkonzentration betrug für zwei Proben 189,5 ppm und 145,02 ppm.
- ANDERE AUSFÜHRUNGSFORMEN
- Die Erfindung wurde in Verbindung mit der näheren Beschreibung beschrieben, jedoch versteht es sich, daß die vorhergehende Beschreibung zur Erläuterung dient und den Schutzbereich der Erfindung nicht einschränken soll, der durch den Schutzbereich der beigefügten Ansprüche definiert ist. Andere Aspekte, Vorteile und Abwandlungen liegen im Schutzbereich der folgenden Ansprüche.
Claims (21)
- Verfahren zur Verbesserung einer Schmiereigenschaft eines Triacylglycerin enthaltenden Pflanzenöls, umfassend die Transesterfizierung des Pflanzenöls mit einem verzweigten kurzkettigen Fettsäure-Ester, wobei die kurzkettige Fettsäure ein Isomer einer eine Kette von vier bis 10 Kohlenstoffen aufweisenden gesättigten Fettsäure ist.
- Verfahren nach Anspruch 1, wobei das Pflanzenöl aus der Gruppe ausgewählt ist, welche aus Maisöl, Rapsöl, Sojaöl und Sonnenblumenöl besteht.
- Verfahren nach Anspruch 2, wobei das Rapsöl Canolaöl ist.
- Verfahren nach Anspruch 1, wobei das Pflanzenöl einen Gehalt an einfach ungesättigten Fettsäuren von zumindest 50% aufweist.
- Verfahren nach Anspruch 1, wobei das Pflanzenöl einen Gehalt an einfach ungesättigten Fettsäuren von zumindest 70% aufweist.
- Verfahren nach Anspruch 1, wobei der kurzkettige Fettsäure-Ester vier bis 10 Kohlenstoffe lang ist.
- Verfahren nach Anspruch 1, wobei der kurzkettige Fettsäure-Ester sechs bis 10 Kohlenstoffe lang ist.
- Verfahren nach Anspruch 1, wobei der kurzkettige Fettsäure-Ester ein Polyol-Ester ist.
- Verfahren nach Anspruch 1, wobei der kurzkettige Fettsäure-Ester ein Trimethylolpropan-Ester ist.
- Verfahren nach Anspruch 1, wobei der kurzkettige Fettsäure-Ester ein Trimethylolpropantriheptanoat ist.
- Verfahren nach Anspruch 1, wobei die kurzkettige Fettsäure ein Neopentylglycol-Ester ist.
- Verfahren nach Anspruch 1, wobei der kurzkettige Fettsäure-Ester ein Pentaerythritol-Ester ist.
- Verfahren nach Anspruch 1, wobei das Verfahren des Weiteren das Hinzufügen einer Menge eines Antioxidationsmittels umfasst, welches zum Erhöhen der oxidativen Stabilität des umgeesterten Pflanzenöls wirksam ist.
- Verfahren nach Anspruch 13, wobei das Antioxidationsmittel aus der Gruppe ausgewählt ist, welche aus behinderten Phenolen, Dithiophosphaten und geschwefelten Polyalkenen besteht.
- Verfahren nach Anspruch 14, wobei die Menge des Antioxidationsmittels etwa 0,001 bis etwa 10 Gew.-% umfasst.
- Verfahren nach Anspruch 1, wobei die Schmiereigenschaft aus der Gruppe ausgewählt ist, welche aus Verschleißeigenschaften, Viskosität und Kristallisierungstemperatur besteht.
- Verfahren nach Anspruch 1, welches die Transesterfizierung des Öl enthaltenden Triacylglycerins mit einem Nichtglycerin-Polyol-Ester umfasst, um ein transesterfiziertes Öl herzustellen, wobei das transesterfizierte Öl einen ersten Glycerin-Polyol-Ester und einen zweiten Nichtglycerin-Polyol- Ester umfasst, wobei der erste Polyol-Ester gekennzeichnet ist durch die Formel: wobei R1, R2 und R3 drei bis 23 Kohlenstoffatome aufweisende unabhängig aliphatische Hydrocarbyl-Reste sind, wobei zumindest einer der R1, R2 und R3 einen drei bis neun Kohlenstoffatome aufweisenden gesättigten aliphatischen Hydrocarbyl-Rest aufweist, und wobei zumindest einer der R1, R2 und R3 einen 11 bis 23 Kohlenstoffatome aufweisenden aliphatischen Hydrocarbyl-Rest aufweist.
- Verfahren nach Anspruch 17, wobei der zweite Polyol-Ester gekennzeichnet ist durch die Formel: wobei R4 und R5 drei bis 23 Kohlenstoffatome aufweisende unabhängig aliphatische Hydrocarbyl-Reste sind, wobei zumindest einer der R4 und R5 einen drei bis neun Kohlenstoffatome aufweisenden gesättigten aliphatische Hydrocarbyl-Rest aufweist, und wobei zumindest einer der R4 und R5 einen 11 bis 23 Kohlenstoffatome aufweisenden aliphatischen Hydrocarbyl-Rest aufweist, wobei R6 und R7 unabhängig ein Wasserstoff, ein ein bis vier Kohlenstoffatome aufweisendes aliphatisches Hydrocarbyl oder sind, wobei X eine ganze Zahl zwischen 0 und 6 ist und R8 ein drei bis 23 Kohlenstoffatome aufweisender aliphatischer Hydrocarbyl-Rest ist.
- Verfahren nach Anspruch 18, wobei das Pflanzenöl einen Gehalt an einfach ungesättigten Fettsäuren von zumindest 70% aufweist.
- Verfahren nach Anspruch 17, wobei der drei bis neun Kohlenstoffatome aufweisende gesättigte aliphatische Hydrocarbyl-Rest ein Hexyl-Rest ist.
- Verfahren nach Anspruch 17, wobei der drei bis neun Kohlenstoffatome aufweisende gesättigte aliphatische Hydrocarbyl-Rest ein Nonyl-Rest ist.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US233617 | 1988-08-18 | ||
| US09/233,617 US6278006B1 (en) | 1999-01-19 | 1999-01-19 | Transesterified oils |
| PCT/US2000/001300 WO2000041515A2 (en) | 1999-01-19 | 2000-01-19 | Oils with heterogenous chain lengths |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE60031505D1 DE60031505D1 (de) | 2006-12-07 |
| DE60031505T2 true DE60031505T2 (de) | 2007-08-23 |
Family
ID=22878007
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE60031505T Expired - Lifetime DE60031505T2 (de) | 1999-01-19 | 2000-01-19 | Verfahren zur Verbesserung der Schmiereigenschaften eines Triacylglycerol enthaltenden pflanzlichen Öls |
Country Status (13)
| Country | Link |
|---|---|
| US (4) | US6278006B1 (de) |
| EP (1) | EP1144563B1 (de) |
| JP (1) | JP2002534561A (de) |
| KR (1) | KR20010108111A (de) |
| AT (1) | ATE343621T1 (de) |
| AU (1) | AU3210600A (de) |
| BR (1) | BR0008177A (de) |
| CA (1) | CA2359571C (de) |
| DE (1) | DE60031505T2 (de) |
| IL (1) | IL144372A0 (de) |
| MY (1) | MY121138A (de) |
| NO (1) | NO20013561L (de) |
| WO (1) | WO2000041515A2 (de) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10640722B2 (en) | 2015-08-31 | 2020-05-05 | Fraunhofer-Gesellschaft Zur Foerderung Der Angewandten Forschung E.V. | Lubricating mixture having glycerides |
Families Citing this family (67)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020058774A1 (en) * | 2000-09-06 | 2002-05-16 | Kurth Thomas M. | Transesterified polyol having selectable and increased functionality and urethane material products formed using the polyol |
| US20050020458A1 (en) * | 1998-10-15 | 2005-01-27 | Wolfgang Becker | Lubricants for spinning combed wool slivers and methods of using the same |
| US6278006B1 (en) * | 1999-01-19 | 2001-08-21 | Cargill, Incorporated | Transesterified oils |
| US6645261B2 (en) | 2000-03-06 | 2003-11-11 | Cargill, Inc. | Triacylglycerol-based alternative to paraffin wax |
| US6503285B1 (en) * | 2001-05-11 | 2003-01-07 | Cargill, Inc. | Triacylglycerol based candle wax |
| US7128766B2 (en) | 2001-09-25 | 2006-10-31 | Cargill, Incorporated | Triacylglycerol based wax compositions |
| MY128504A (en) * | 2001-09-25 | 2007-02-28 | Pennzoil Quaker State Co | Environmentally friendly lubricants |
| US6793959B2 (en) * | 2002-03-18 | 2004-09-21 | Bunge Foods Corporation | Low viscosity structured lipid pan release compositions and methods |
| US7192457B2 (en) | 2003-05-08 | 2007-03-20 | Cargill, Incorporated | Wax and wax-based products |
| US20050070449A1 (en) * | 2003-09-30 | 2005-03-31 | Roby Stephen H. | Engine oil compositions |
| US20050070450A1 (en) * | 2003-09-30 | 2005-03-31 | Roby Stephen H. | Engine oil compositions |
| US20060105920A1 (en) * | 2004-11-16 | 2006-05-18 | Dalman David A | Performance-enhancing additives for lubricating oils |
| BRPI0606718A2 (pt) | 2005-01-10 | 2009-07-14 | Cargill Inc | vela e cera para vela contendo produtos de metátese e semelhantes a metátese |
| US7465696B2 (en) * | 2005-01-31 | 2008-12-16 | Chevron Oronite Company, Llc | Lubricating base oil compositions and methods for improving fuel economy in an internal combustion engine using same |
| US20070124992A1 (en) * | 2005-12-01 | 2007-06-07 | Her Majesty In Right Of Canada | Methods for concentration and extraction of lubricity compounds and biologically active fractions from naturally derived fats, oils and greases |
| US7850745B2 (en) * | 2005-12-01 | 2010-12-14 | Her Majesty In Right Of Canada As Represented By The Minister Of Agriculture And Agri-Food Canada | Method for concentration and extraction of lubricity compounds from vegetable and animal oils |
| US7538236B2 (en) | 2006-01-04 | 2009-05-26 | Suresh Narine | Bioplastics, monomers thereof, and processes for the preparation thereof from agricultural feedstocks |
| US7964002B2 (en) * | 2006-06-14 | 2011-06-21 | Chemtura Corporation | Antioxidant additive for biodiesel fuels |
| EP2046908B1 (de) | 2006-07-12 | 2017-01-11 | Elevance Renewable Sciences, Inc. | Schmelzklebemittel mit metathesiertem ungesättigtem polyolesterwachs |
| US20080125338A1 (en) * | 2006-11-29 | 2008-05-29 | Corbett Patricia M | Food grade lubricant compositions |
| CA2681802C (en) | 2007-02-16 | 2015-12-08 | Elevance Renewable Sciences, Inc. | Wax compositions and methods of preparing wax compositions |
| EP2142624B1 (de) * | 2007-04-25 | 2017-09-06 | Dow Global Technologies LLC | Gemischte schmiermittelzusammensetzung |
| US7989555B2 (en) * | 2007-05-21 | 2011-08-02 | Global Agritech, Inc. | Glycerol derivatives and methods of making same |
| CN101772564B (zh) | 2007-05-30 | 2015-07-15 | 埃莱文斯可更新科学公司 | 含有小粒子的颗粒状蜡以及由其制造的侧面光滑的压制蜡烛 |
| CA2690811C (en) | 2007-06-15 | 2017-02-28 | Elevance Renewable Sciences, Inc. | Hybrid wax compositions for use in compression molded wax articles such as candles |
| US7842102B2 (en) * | 2007-11-05 | 2010-11-30 | Sunbelt Corporation | Liquid dye formulations in non-petroleum based solvent systems |
| US7994107B2 (en) * | 2008-05-06 | 2011-08-09 | Archer-Daniels-Midland Company | Lubricant additives |
| CH699659B1 (de) * | 2008-10-14 | 2012-10-15 | Natoil Ag | Hydraulikflüssigkeit und Getriebeöl auf Pflanzenölbasis. |
| ES2583639T3 (es) | 2008-11-28 | 2016-09-21 | Terravia Holdings, Inc. | Producción de aceites específicos en microorganismos heterótrofos |
| US8790553B2 (en) * | 2009-07-07 | 2014-07-29 | 3M Innovative Properties Company | Electrical equipment containing erucic acid dielectric oil |
| WO2011112486A1 (en) | 2010-03-10 | 2011-09-15 | Elevance Renewable Sciences, Inc. | Lipid-based wax compositions substantially free of fat bloom and methods of making |
| US8641814B2 (en) | 2010-05-12 | 2014-02-04 | Elevance Renewable Sciences, Inc. | Natural oil based marking compositions and their methods of making |
| JP5996527B2 (ja) | 2010-05-28 | 2016-09-21 | テラヴィア ホールディングス, インコーポレイテッド | 用途に応じた油を含む食品成分 |
| EP2590911B1 (de) | 2010-07-09 | 2014-05-14 | Elevance Renewable Sciences, Inc. | Wachse aus metathesierten rohölen und aminen und ihre herstellung |
| EP2643445B1 (de) | 2010-11-23 | 2019-01-30 | Cargill, Incorporated | Weitgehend fettreifreie wachszusammensetzungen auf lipidbasis und herstellungsverfahren |
| JP6071904B2 (ja) | 2011-02-02 | 2017-02-01 | テラヴィア ホールディングス, インコーポレイテッド | 組み換え油産生微生物から生成される用途に応じた油 |
| CA2841137A1 (en) | 2011-07-10 | 2013-01-17 | Elevance Renewable Sciences, Inc. | Metallic soap compositions for various applications |
| US8586518B2 (en) | 2011-08-26 | 2013-11-19 | State Industrial Products Corporation | Biobased penetrating oil |
| EP2758969B1 (de) | 2011-09-23 | 2015-11-04 | E. I. du Pont de Nemours and Company | Dielektrische flüssigkeiten mit polyolestern, verfahren zur herstellung von mischungen von polyolestern und elektrische vorrichtungen mit dielektrischen polyolesterflüssigkeiten |
| US9028727B2 (en) | 2011-09-23 | 2015-05-12 | E I Du Pont De Nemours And Company | Dielectric fluids comprising polyol esters |
| SG11201406711TA (en) | 2012-04-18 | 2014-11-27 | Solazyme Inc | Tailored oils |
| US8400030B1 (en) * | 2012-06-11 | 2013-03-19 | Afton Chemical Corporation | Hybrid electric transmission fluid |
| US20140194331A1 (en) * | 2013-01-10 | 2014-07-10 | Washington State University | High performance biohydraulic fluid |
| US9816079B2 (en) | 2013-01-29 | 2017-11-14 | Terravia Holdings, Inc. | Variant thioesterases and methods of use |
| US9567615B2 (en) | 2013-01-29 | 2017-02-14 | Terravia Holdings, Inc. | Variant thioesterases and methods of use |
| US9290749B2 (en) | 2013-03-15 | 2016-03-22 | Solazyme, Inc. | Thioesterases and cells for production of tailored oils |
| US9783836B2 (en) | 2013-03-15 | 2017-10-10 | Terravia Holdings, Inc. | Thioesterases and cells for production of tailored oils |
| US9249252B2 (en) | 2013-04-26 | 2016-02-02 | Solazyme, Inc. | Low polyunsaturated fatty acid oils and uses thereof |
| CN103497814B (zh) * | 2013-09-02 | 2015-07-01 | 安庆市中天石油化工有限公司 | 一种专用于高温窑车的润滑脂及其制备方法 |
| WO2015051319A2 (en) | 2013-10-04 | 2015-04-09 | Solazyme, Inc. | Tailored oils |
| US9850444B2 (en) | 2014-07-21 | 2017-12-26 | Elevance Renewable Sciences, Inc. | Unsaturated polyol esters used in hydraulic fluid applications |
| EP3172320B1 (de) | 2014-07-24 | 2019-11-20 | Corbion Biotech, Inc. | Variante thioesterasen und verfahren zur verwendung |
| US10414859B2 (en) | 2014-08-20 | 2019-09-17 | Resinate Materials Group, Inc. | High recycle content polyester polyols |
| BR112017005370A2 (pt) | 2014-09-18 | 2017-12-12 | Terravia Holdings Inc | acil-acp tioesterases e mutantes das mesmas |
| US11248245B2 (en) | 2014-12-19 | 2022-02-15 | International Flora Technologies, Ltd. | Processes and systems for catalytic manufacture of wax ester derivatives |
| US10435726B2 (en) | 2014-12-19 | 2019-10-08 | International Flora Technologies, Ltd. | Processes and systems for catalytic manufacture of wax ester derivatives |
| CN107960101A (zh) | 2015-04-06 | 2018-04-24 | 柯碧恩生物技术公司 | 具有lpaat消融的产油微藻 |
| CN106479682B (zh) * | 2015-08-25 | 2021-04-02 | 丰益(上海)生物技术研发中心有限公司 | 油脂组合物、其制备方法及其用途 |
| CA2996591C (en) * | 2015-08-31 | 2021-07-20 | International Flora Technologies, Ltd. | Processes and systems for catalytic manufacture of wax ester derivatives |
| CN108822931B (zh) * | 2018-04-13 | 2021-05-11 | 东风商用车有限公司 | 一种车用低温举升油及其制备方法 |
| CN108865351A (zh) * | 2018-07-05 | 2018-11-23 | 胡果青 | 一种环保润滑油 |
| US10577305B1 (en) | 2018-11-13 | 2020-03-03 | Eastman Chemical Company | Process for the production of esters |
| CN113166028B (zh) | 2018-11-13 | 2024-03-12 | 伊士曼化工公司 | 使用多相au/tio2催化剂合成酯 |
| US10829429B2 (en) * | 2018-11-13 | 2020-11-10 | Eastman Chemical Company | Synthesis of triethylene glycol bis(2-ethylhexanoate) |
| US10590062B1 (en) | 2018-11-13 | 2020-03-17 | Eastman Chemical Company | Iron-catalyzed selective production of methyl esters from aldehydes |
| JP7430072B2 (ja) * | 2020-02-14 | 2024-02-09 | ミヨシ油脂株式会社 | 潤滑油基剤と、これを含む摩擦低減剤および金属加工油 |
| KR102636241B1 (ko) * | 2021-04-08 | 2024-02-16 | 주식회사 한국발보린 | 전기전도도가 제어된 글리세린-에스테르계 윤활기유 및 이를 포함하는 환경친화형 윤활유 조성물 |
Family Cites Families (55)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1444852A1 (de) | 1959-03-12 | 1968-11-07 | Tenneco Chem | Schmiermittelzusammensetzung |
| US4144183A (en) | 1973-01-22 | 1979-03-13 | Henkel Kommanditgesellschaft Auf Aktien | Mixed branched and straight chain ester oils |
| IT991051B (it) | 1973-07-09 | 1975-07-30 | Snam Progetti | Esteri organici per composizioni lubrificanti |
| NL7811913A (nl) | 1978-12-06 | 1980-06-10 | Skf Ind Trading & Dev | Smeermiddelpreparaat. |
| FI66899C (fi) | 1983-02-11 | 1984-12-10 | Kasvisoeljy Vaextolje Ab Oy | Smoerjmedel med triglycerider som huvudkomponent |
| US4627192B1 (en) | 1984-11-16 | 1995-10-17 | Sigco Res Inc | Sunflower products and methods for their production |
| US4832975A (en) | 1987-09-29 | 1989-05-23 | The Procter & Gamble Company | Tailored triglycerides having improved autoignition characteristics |
| DE3881184T2 (de) | 1987-12-15 | 1993-09-02 | Procter & Gamble | Fette mit verringertem gehalt an kalorien, hergestellt aus fettsaeure mit mittlerer und langer kette enthaltenden triglyceriden. |
| JPH0819431B2 (ja) | 1988-06-09 | 1996-02-28 | 日本パーカライジング株式会社 | 冷間圧延用潤滑油 |
| US5282989A (en) | 1988-07-19 | 1994-02-01 | International Lubricants, Inc. | Vegetable oil derivatives as lubricant additives |
| KR950005694B1 (ko) | 1989-07-05 | 1995-05-29 | 가부시끼가이샤 교오세끼 세이힝기주쓰 겡뀨쇼 | 냉각윤활제 |
| DE3927155A1 (de) | 1989-08-17 | 1991-02-21 | Henkel Kgaa | Umweltfreundliches grundoel fuer die formulierung von hydraulikoelen |
| US5258197A (en) | 1989-09-20 | 1993-11-02 | Nabisco, Inc. | Reduced calorie triglyceride mixtures |
| DK0435253T3 (da) | 1989-12-28 | 1994-06-20 | Nippon Oil Co Ltd | Køleolier til brug sammen med hydrogenholdige halogencarbonkølemidler |
| US5155244A (en) * | 1990-02-28 | 1992-10-13 | Karlshamns Ab | Preparation of antioxidant glyceride derivatives utilizing esterification |
| US5021179A (en) * | 1990-07-12 | 1991-06-04 | Henkel Corporation | Lubrication for refrigerant heat transfer fluids |
| US5861187A (en) | 1990-08-30 | 1999-01-19 | Cargill, Incorporated | Oil from canola seed with altered fatty acid profiles and a method of producing oil |
| ATE181210T1 (de) * | 1990-12-07 | 1999-07-15 | Nabisco Inc | Kalorienarme triglyzerid mischungen |
| CA2060685A1 (en) * | 1991-03-04 | 1992-09-05 | Mahmood Sabahi | Ether-ester lubricant |
| JPH04314790A (ja) * | 1991-04-12 | 1992-11-05 | Nippon Oil Co Ltd | 食品機械用油脂組成物 |
| US5346724A (en) | 1991-04-12 | 1994-09-13 | Nippon Oil Company, Ltd. | Oil and fat composition for lubricating food processing machines and use thereof |
| JP2968368B2 (ja) * | 1991-04-12 | 1999-10-25 | 日石三菱株式会社 | 食品機械用油脂組成物 |
| DE59209625D1 (de) * | 1991-07-17 | 1999-03-11 | Ciba Geigy Ag | Multifunktionelle Schmierstoff-Additive |
| US5240630A (en) * | 1991-09-16 | 1993-08-31 | Ethyl Corporation | Refrigeration compositions containing diester-amides of dialkanolamines |
| WO1993007240A1 (en) | 1991-10-03 | 1993-04-15 | Exxon Chemical Patents Inc. | Process for producing fluids of enhanced thermal stability |
| US5399279A (en) * | 1991-12-23 | 1995-03-21 | Albemarle Corporation | Refrigeration compositions |
| US5683618A (en) * | 1991-12-23 | 1997-11-04 | Albemarle Corporation | Refrigeration compositions in which the lubricant comprises at least one ester, ketoester, or ester-nitrile oil |
| US6074995A (en) * | 1992-06-02 | 2000-06-13 | The Lubrizol Corporation | Triglycerides as friction modifiers in engine oil for improved fuel economy |
| JP2601104B2 (ja) * | 1992-06-29 | 1997-04-16 | 不二製油株式会社 | 耐凍性油脂とその製造方法及び油脂含有冷凍食品 |
| US5322633A (en) * | 1992-11-16 | 1994-06-21 | Albemarle Corporation | Preparation of branched chain carboxylic esters |
| ZA938322B (en) * | 1992-12-17 | 1994-06-07 | Exxon Chemical Patents Inc | Refrigeration working fluid compositions containing trifluoroethane |
| US5413725A (en) | 1992-12-18 | 1995-05-09 | The Lubrizol Corporation | Pour point depressants for high monounsaturated vegetable oils and for high monounsaturated vegetable oils/biodegradable base and fluid mixtures |
| US5538661A (en) * | 1993-03-22 | 1996-07-23 | Albemarle Corporation | Ester lubricants |
| JP3527242B2 (ja) | 1993-04-27 | 2004-05-17 | カージル,インコーポレーテッド | 食用の非水素化カノラ油 |
| WO1994026855A1 (en) | 1993-05-13 | 1994-11-24 | Loders-Croklaan | Human milk fat replacers from interesterified blends of triglycerides |
| WO1994028087A1 (en) * | 1993-06-01 | 1994-12-08 | Albemarle Corporation | Invert drilling fluids |
| US5391312A (en) * | 1993-08-02 | 1995-02-21 | Albemarle Corportion | Lubricant additives |
| JPH07179882A (ja) * | 1993-12-22 | 1995-07-18 | Nisshin Oil Mills Ltd:The | 耐冷凍性油脂およびその製造法 |
| JP3375726B2 (ja) * | 1994-05-18 | 2003-02-10 | 雪印乳業株式会社 | 食用油脂および油脂混合物 |
| FI95367C (fi) | 1994-09-07 | 1996-01-25 | Raision Tehtaat Oy Ab | Menetelmä synteettisen esterin valmistamiseksi kasviöljystä |
| FI95395C (fi) * | 1994-09-07 | 1996-01-25 | Raision Tehtaat Oy Ab | Entsymaattinen menetelmä synteettisen esterin valmistamiseksi kasviöljystä |
| US5599574A (en) * | 1994-09-26 | 1997-02-04 | The Procter & Gamble Company | Process for reducing in-mould times for chocolate confections containing reduced calorie fats |
| BR9504838A (pt) | 1994-11-15 | 1997-10-07 | Lubrizol Corp | Ester de poliol composição de óleo lubrificante |
| US5648018A (en) * | 1995-01-12 | 1997-07-15 | Albemarle Corporation | Ester/polyolefin refrigeration lubricant |
| US5589217A (en) | 1995-05-11 | 1996-12-31 | Arco Chemical Technology, L.P. | Reduced calorie fat component |
| US5549836A (en) | 1995-06-27 | 1996-08-27 | Moses; David L. | Versatile mineral oil-free aqueous lubricant compositions |
| TW349119B (en) | 1996-04-09 | 1999-01-01 | Mitsubishi Gas Chemical Co | Polyol ester based-lubricant |
| AR006830A1 (es) | 1996-04-26 | 1999-09-29 | Du Pont | Aceite de soja con alta estabilidad oxidativa |
| JPH1053780A (ja) * | 1996-06-04 | 1998-02-24 | Fuji Oil Co Ltd | 潤滑油基油の製造法 |
| EP0843000B1 (de) | 1996-06-04 | 2002-10-16 | Fuji Oil Company, Limited | Basisschmieröl und verfahren zu seiner herstellung |
| EP0925271B1 (de) | 1996-08-16 | 2002-02-06 | Unichema Chemie B.V. | Verfahren zur herstellung von fettsäuren |
| WO1998007680A1 (en) | 1996-08-16 | 1998-02-26 | Unichema Chemie B.V. | Process for preparation of branched fatty acids |
| JP3361705B2 (ja) | 1996-11-15 | 2003-01-07 | 株式会社日立製作所 | 液晶コントローラおよび液晶表示装置 |
| US6278006B1 (en) * | 1999-01-19 | 2001-08-21 | Cargill, Incorporated | Transesterified oils |
| US6127324A (en) * | 1999-02-19 | 2000-10-03 | The Lubrizol Corporation | Lubricating composition containing a blend of a polyalkylene glycol and an alkyl aromatic and process of lubricating |
-
1999
- 1999-01-19 US US09/233,617 patent/US6278006B1/en not_active Expired - Lifetime
-
2000
- 2000-01-19 WO PCT/US2000/001300 patent/WO2000041515A2/en active IP Right Grant
- 2000-01-19 AT AT00909928T patent/ATE343621T1/de not_active IP Right Cessation
- 2000-01-19 BR BR0008177-9A patent/BR0008177A/pt not_active Application Discontinuation
- 2000-01-19 US US09/487,700 patent/US6465401B1/en not_active Expired - Lifetime
- 2000-01-19 EP EP00909928A patent/EP1144563B1/de not_active Expired - Lifetime
- 2000-01-19 AU AU32106/00A patent/AU3210600A/en not_active Abandoned
- 2000-01-19 DE DE60031505T patent/DE60031505T2/de not_active Expired - Lifetime
- 2000-01-19 IL IL14437200A patent/IL144372A0/xx unknown
- 2000-01-19 KR KR1020017009082A patent/KR20010108111A/ko active IP Right Grant
- 2000-01-19 JP JP2000593137A patent/JP2002534561A/ja active Pending
- 2000-01-19 MY MYPI20000167A patent/MY121138A/en unknown
- 2000-01-19 CA CA2359571A patent/CA2359571C/en not_active Expired - Fee Related
-
2001
- 2001-07-18 NO NO20013561A patent/NO20013561L/no not_active Application Discontinuation
-
2002
- 2002-09-24 US US10/253,742 patent/US6943262B2/en not_active Expired - Lifetime
-
2005
- 2005-03-04 US US11/072,071 patent/US7514394B2/en not_active Expired - Fee Related
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10640722B2 (en) | 2015-08-31 | 2020-05-05 | Fraunhofer-Gesellschaft Zur Foerderung Der Angewandten Forschung E.V. | Lubricating mixture having glycerides |
Also Published As
| Publication number | Publication date |
|---|---|
| US20050176597A1 (en) | 2005-08-11 |
| WO2000041515A2 (en) | 2000-07-20 |
| JP2002534561A (ja) | 2002-10-15 |
| NO20013561D0 (no) | 2001-07-18 |
| NO20013561L (no) | 2001-09-18 |
| US6278006B1 (en) | 2001-08-21 |
| ATE343621T1 (de) | 2006-11-15 |
| WO2000041515A3 (en) | 2000-11-30 |
| CA2359571A1 (en) | 2000-07-20 |
| KR20010108111A (ko) | 2001-12-07 |
| IL144372A0 (en) | 2002-05-23 |
| BR0008177A (pt) | 2001-11-06 |
| AU3210600A (en) | 2000-08-01 |
| US20030176300A1 (en) | 2003-09-18 |
| EP1144563B1 (de) | 2006-10-25 |
| WO2000041515A9 (en) | 2002-10-03 |
| CA2359571C (en) | 2011-04-05 |
| EP1144563A2 (de) | 2001-10-17 |
| MY121138A (en) | 2005-12-30 |
| US6465401B1 (en) | 2002-10-15 |
| DE60031505D1 (de) | 2006-12-07 |
| US6943262B2 (en) | 2005-09-13 |
| US7514394B2 (en) | 2009-04-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE60031505T2 (de) | Verfahren zur Verbesserung der Schmiereigenschaften eines Triacylglycerol enthaltenden pflanzlichen Öls | |
| DE69516154T2 (de) | Verfahren zur herstellung eines synthetischen esters aus pflanzlichem öl | |
| US9534184B2 (en) | Electrical discharge machining comprising the use of estolide compositions | |
| EP0797563B1 (de) | Synthetische ester aus alkoholen und fettsäuregemischen aus ölsäurereichen, stearinsäurearmen pflanzenölen | |
| CA2948777C (en) | Branched diesters and methods of making and using the same | |
| EP2758969B1 (de) | Dielektrische flüssigkeiten mit polyolestern, verfahren zur herstellung von mischungen von polyolestern und elektrische vorrichtungen mit dielektrischen polyolesterflüssigkeiten | |
| EP0088895B1 (de) | Synthetische flüssige Wachsester | |
| DE69716380T2 (de) | Basisschmieröl und verfahren zu seiner herstellung | |
| DE2755346A1 (de) | Austauschmaterial fuer geschwefeltes spermoel, verfahren zu seiner herstellung und verwendung als zusatzstoff in schmiermitteln | |
| Basu et al. | Preparation of glycol derivatives of partially hydrogenated soybean oil fatty acids and their potential as lubricants | |
| EP0009701A1 (de) | Schwefelhaltige Umsetzungsprodukte, Verfahren zu ihrer Herstellung und Verwendung als Zusatz zu Schmiermitteln | |
| EP2444473B1 (de) | Mehrdimensionaler Polyester, seine Herstellung und seine Verwendung als Basisöl für Schmierstoffe | |
| WO1995002658A1 (de) | Hydrauliköle enthaltend biologisch abbaubare guerbetalkohole | |
| EP2228425A1 (de) | Schmiermittel | |
| EP1075460A1 (de) | Verfahren zur herstellung von polyolestern | |
| JP3536332B2 (ja) | 冷間圧延油 | |
| MXPA01007307A (en) | Oils with heterogenous chain lengths | |
| Benecke et al. | Effect of Structure on Viscosity and Pour Points of Epoxidized Soybean Oil Lubricants | |
| DE10115829A1 (de) | Oxidationsstabiles Hydrauliköl | |
| Honary | Industrial oil types and uses. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8381 | Inventor (new situation) |
Inventor name: KODALI, DHARMA, R., PLYMOUTH, MN 55447, US Inventor name: NIVENS, SCOTT, C., NEW HOPE, MN 55428, US |
|
| 8364 | No opposition during term of opposition |