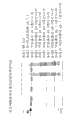CN102257005A - 在抗体纯化过程中的病毒灭活 - Google Patents
在抗体纯化过程中的病毒灭活 Download PDFInfo
- Publication number
- CN102257005A CN102257005A CN2009801513952A CN200980151395A CN102257005A CN 102257005 A CN102257005 A CN 102257005A CN 2009801513952 A CN2009801513952 A CN 2009801513952A CN 200980151395 A CN200980151395 A CN 200980151395A CN 102257005 A CN102257005 A CN 102257005A
- Authority
- CN
- China
- Prior art keywords
- antibody
- sample
- exchange
- post
- minimizing
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D15/00—Separating processes involving the treatment of liquids with solid sorbents; Apparatus therefor
- B01D15/08—Selective adsorption, e.g. chromatography
- B01D15/26—Selective adsorption, e.g. chromatography characterised by the separation mechanism
- B01D15/36—Selective adsorption, e.g. chromatography characterised by the separation mechanism involving ionic interaction
- B01D15/361—Ion-exchange
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D15/00—Separating processes involving the treatment of liquids with solid sorbents; Apparatus therefor
- B01D15/08—Selective adsorption, e.g. chromatography
- B01D15/26—Selective adsorption, e.g. chromatography characterised by the separation mechanism
- B01D15/36—Selective adsorption, e.g. chromatography characterised by the separation mechanism involving ionic interaction
- B01D15/361—Ion-exchange
- B01D15/362—Cation-exchange
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D15/00—Separating processes involving the treatment of liquids with solid sorbents; Apparatus therefor
- B01D15/08—Selective adsorption, e.g. chromatography
- B01D15/26—Selective adsorption, e.g. chromatography characterised by the separation mechanism
- B01D15/36—Selective adsorption, e.g. chromatography characterised by the separation mechanism involving ionic interaction
- B01D15/361—Ion-exchange
- B01D15/363—Anion-exchange
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D15/00—Separating processes involving the treatment of liquids with solid sorbents; Apparatus therefor
- B01D15/08—Selective adsorption, e.g. chromatography
- B01D15/26—Selective adsorption, e.g. chromatography characterised by the separation mechanism
- B01D15/38—Selective adsorption, e.g. chromatography characterised by the separation mechanism involving specific interaction not covered by one or more of groups B01D15/265 - B01D15/36
- B01D15/3804—Affinity chromatography
- B01D15/3809—Affinity chromatography of the antigen-antibody type, e.g. protein A, G, L chromatography
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
- C07K1/36—Extraction; Separation; Purification by a combination of two or more processes of different types
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
- C07K1/16—Extraction; Separation; Purification by chromatography
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
- C07K1/16—Extraction; Separation; Purification by chromatography
- C07K1/18—Ion-exchange chromatography
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Analytical Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Diabetes (AREA)
- Rheumatology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Neurosurgery (AREA)
- Emergency Medicine (AREA)
- Endocrinology (AREA)
- Pain & Pain Management (AREA)
- Obesity (AREA)
- Neurology (AREA)
- Transplantation (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Dermatology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Treatment Of Liquids With Adsorbents In General (AREA)
Abstract
本文描述的是用于从样品基质分离且纯化抗体的方法。本公开内容的一个方面涉及在抗体纯化的各个步骤中生成的样品的病毒减少/灭活。在特定方面,本文方法采用酸化步骤,随后为一个或多个层析步骤。层析步骤可以包括一个或多个下述层析程序:离子交换层析、亲和层析和疏水作用层析。
Description
与相关申请的交叉参考
本申请要求于2008年10月20日提交的美国临时申请系列号61/196,754的利益,其在此整体引入作为参考。
发明背景
用于通过发酵培养生产的药物级别单克隆抗体的纯化方法一般涉及4个基本步骤。这些步骤包括(1)收获/澄清 – 宿主细胞与发酵培养物分离;(2)捕获 – 抗体与澄清的收获物中的大多数组分分离;(3)精细纯化 – 去除残留的宿主细胞污染物和聚集体;和(4)配制 – 将抗体置于合适载体内用于最大限度的稳定性和保存期限。
然而,通常这些步骤不一定解决可能的病毒污染。目前需要生产且纯化适合于临床用途的目的抗体的方法,其包括污染性有害病毒的减少和/或灭活。本发明解决了这个需要。
发明概述
本发明涉及用于从样品基质分离且纯化抗体的方法。本发明的一个方面涉及在抗体纯化的各个步骤中生成的样品的病毒灭活。在特定方面,本文方法采用酸灭活步骤,随后为一个或多个层析步骤。层析步骤可以包括一个或多个下述层析程序:离子交换层析、亲和层析和疏水作用层析。进一步地,本发明涉及包括通过本文描述的方法纯化的一种或多种抗体的药物组合物。
本发明的一个实施方案涉及从样品基质纯化抗体或其抗原结合部分,从而使得所得到的抗体组合物基本上不含宿主细胞蛋白质(“HCPs”)的方法。在一个方面,样品基质(或简单地“样品”)包括细胞系收获物,其中所述细胞系用于产生本发明的特定抗体。在具体方面,样品基质由用于产生抗IL-12抗体的细胞系制备;在另一个方面,样品基质由用于产生抗TNFα抗体的细胞系制备;并且在另一个方面,样品基质由用于产生抗IL-18抗体的细胞系制备。
本发明的一种方法涉及对包括推定的目的抗体或其抗原结合部分的样品基质实施pH调整。在一个方面,将pH调整至酸性pH。合适pH的例子是约3 – 约5,优选约3.5。这个初步回收部分为减少或灭活pH敏感性病毒而执行。除减少和/或灭活病毒外,酸性条件还促进细胞和细胞碎片的去除,从而形成初步回收样品。在合适的时间段后,pH可以朝向更中性或碱性的pH调整,并且在特定实施方案中,将对样品实施一个或多个层析步骤,包括但不限于亲和层析、离子交换层析和疏水作用层析。
在一个实施方案中,亲和层析步骤包括使初步回收样品经历包括合适亲和层析支持体的柱的处理。此种层析支持体的非限制性例子包括但不限于A蛋白树脂、G蛋白树脂、包括针对其产生目的抗体的抗原的亲和支持体、和包含Fc结合蛋白的亲和支持体。A蛋白树脂用于抗体(IgG)的亲和纯化和分离。在一个方面,在样品装载前,A蛋白柱用合适缓冲液进行平衡。合适缓冲液的例子是Tris/NaCl缓冲液,pH约7.2。在这个平衡后,可以将样品装载到柱上。在柱装载后,柱可以使用例如平衡缓冲液洗涤一次或多次。可以在洗脱柱前使用其他洗涤,包括采用不同缓冲液的洗涤。A蛋白柱随后可以使用合适的洗脱缓冲液进行洗脱。合适洗脱缓冲液的例子是乙酸/NaCl缓冲液,pH约3.5。洗脱物可以使用本领域技术人员众所周知的技术进行监控。例如,可以注意在OD280的吸光度。随后可以制备一种或多种目的洗脱的级分用于进一步加工。
在特定实施方案中,对样品实施一个或多个另外的层析程序。在一个方面,对初步回收样品实施离子交换层析。在这个实施方案中,离子交换步骤可以是阳离子或阴离子交换层析或两者的组合。这个步骤可以包括多个离子交换步骤,例如阳离子交换步骤随后为阴离子交换步骤,或反之亦然。在一个方面,离子交换步骤涉及两步骤离子交换过程。在特定方面,第一个阳离子交换步骤随后为第二个阴离子交换步骤。合适的阳离子交换柱是其固定相包括阴离子基团的柱。此种柱的例子是Fractogel
SO3 -柱。这个离子交换捕获层析步骤促进从初步回收样品分离目的抗体。合适的阴离子交换柱是其固定相包括阳离子基团的柱。此种柱的例子是Q
Sepharose™柱。一个或多个离子交换步骤通过减少杂质进一步分离抗体,所述杂质例如宿主细胞蛋白质和DNA以及在可应用时的亲和基质蛋白质。这个阴离子交换程序是层析的流通(flow-through)模式(与阳离子交换程序形成对比),其中抗体不与阴离子交换树脂(或固相)相互作用或结合。然而,许多杂质的确与阴离子交换树脂相互作用且结合。
在另一个实施方案中,对离子交换样品实施进一步层析。在一个方面,这个步骤涉及疏水作用层析(“HIC”)的使用。合适的柱是其固定相包括疏水基团的那种。此种柱的例子是苯基Sepharose™柱。可能的是抗体在分离/纯化过程期间已形成聚集体。这个疏水层析步骤促进这些聚集的消除。它还帮助去除杂质。该程序使用高盐缓冲液,其促进抗体(或其聚集)与疏水柱的相互作用。柱使用较低浓度的盐进行洗脱。
在一个实施方案中,在初步回收后执行第一个和第二个离子交换步骤。在这个实施方案中,对离子交换样品实施中间过滤步骤。在一个方面,这个过滤步骤包括捕获超滤/渗滤(“UF/DF”)。这个过滤步骤促进例如抗体及其抗原结合部分的浓缩。
在另一个实施方案中,HIC洗脱物使用病毒去除滤器例如Ultipor DV50™滤器进行过滤。这个程序使病毒颗粒与苯基洗脱物分离,以使病毒(如果存在的话)量减少至安全水平。本领域技术人员众所周知的滤器可以在这个实施方案中使用。
在所得到的样品产物中单克隆抗体的纯度可以使用本领域技术人员众所周知的方法进行分析,例如蛋白质印迹分析。
在另外一个实施方案中,本发明涉及包括分离的单克隆抗体或其抗原结合部分和可接受载体的一种或多种药物组合物。在另一个方面,组合物进一步包括一种或多种药物试剂。
附图简述
图1公开了抗IL-12抗体(ABT-847)的非限制性例子的重和轻链可变区序列。
图2公开了抗IL-18抗体(ABT-325)的非限制性例子的重和轻链序列。
图3公开了抗TNFα抗体(阿达木单抗(Adalimumab))的非限制性例子的重和轻链序列。
图4描述了本发明的纯化方案的非限制性流程图。
图5是指出待纯化的抗体分子在澄清的培养基的pH降低后保留在溶液中的聚丙烯酰胺电泳凝胶照片。
发明详述
本发明涉及用于从样品基质分离且纯化抗体的方法。本发明的一个方面涉及在抗体纯化的各个步骤中生成的样品的病毒灭活。在具体方面,本文的方法采用酸灭活步骤,随后为一个或多个层析步骤。层析步骤可以包括一个或多个下述层析程序:离子交换层析、亲和层析和疏水作用层析。进一步地,本发明涉及包括通过本文描述的方法纯化的一种或多种抗体的药物组合物。
为了清楚起见且非限制性地,这个详述分成下述亚部分:
1. 定义;
2. 抗体生成;
3. 抗体生产;
4. 抗体纯化;
5. 测定样品纯度的方法;
6. 进一步修饰;
7. 药物组合物;和
8. 抗体用途。
1. 定义
为了本发明可以更容易理解,首先定义了特定术语。
术语 “抗体”包括免疫球蛋白分子,其包含通过二硫键互连的4条多肽链――2条重(H)链和2条轻(L)链。每条重链包括重链可变区(本文缩写为HCVR或VH)和重链恒定区(CH)。重链恒定区包括3个结构域――CH1、CH2和CH3。每条轻链包括轻链可变区(本文缩写为LCVR或VL)和轻链恒定区。轻链恒定区包括一个结构域――CL。VH和VL区可以进一步再分成称为互补性决定区(CDRs)的高变区,由称为构架区(FR)的更保守区域点缀。每个VH和VL由3个CDRs和4个FRs组成,从氨基末端到羧基末端以下述次序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。
术语抗体的“抗原结合部分”(或 “抗体部分”)包括抗体的片段,其保留与抗原(例如,hIL-12、hTNFα或hIL-18)特异性结合的能力。已显示抗体的抗原结合功能可以通过全长抗体的片段执行。在术语抗体的“抗原结合部分”内包含的结合片段例子包括(i)Fab片段,包括VL、VH、CL和CH1结构域的单价片段;(ii)F(ab')2片段,包括在铰链区通过二硫键连接的2个Fab片段的二价片段;(iii)包括VH和CH1结构域的Fd片段;(iv)包括抗体单臂的VL和VH结构域的Fv片段,(v)包括VH结构域的dAb片段(Ward等人,(1989)Nature 341:544
546,其完整教导引入本文作为参考);和(vi)分离的互补性决定区(CDR)。此外,尽管Fv片段的2个结构域VL和VH由分开的基因编码,但它们可以使用重组法通过合成接头进行连接,所述合成接头使得它们能够制备为单条蛋白质链,其中VL和VH区配对以形成单价分子(称为单链Fv(scFv);参见例如,Bird等人(1988)Science
242:423-426;和Huston等人(1988)Proc. Natl. Acad. Sci. USA 85:5879-5883,其完整教导引入本文作为参考)。此种单链抗体也意欲包含在术语抗体的“抗原结合部分”内。还包含其他形式的单链抗体,例如双抗体。双抗体是二价、双特异性抗体,其中VH和VL结构域在单条多肽链上表达,但使用太短而不允许相同链上的2个结构域之间配对的接头,从而迫使结构域与另一条链的互补结构域配对,并且产生2个抗原结合部位(参见例如,Holliger,P.,等人(1993)Proc. Natl.
Acad. Sci. USA 90:6444-6448;Poljak,R. J.,等人(1994)Structure 2:1121-1123,其完整教导引入本文作为参考)。再进一步地,抗体或其抗原结合部分可以是通过抗体或抗体部分与一种或多种其他蛋白质或肽的共价或非共价结合形成的较大免疫粘附分子的部分。此种免疫粘附分子的例子包括使用链霉抗生物素蛋白核心区,以制备四聚scFv分子(Kipriyanov,S. M.,等人(1995)Human Antibodies
and Hybridomas 6:93-101,其完整教导引入本文作为参考),以及使用半胱氨酸残基、标记肽和C末端多组氨酸标签,以制备二价和生物素化的scFv分子(Kipriyanov,S. M.,等人(1994)Mol. Immunol. 31:1047-1058,其完整教导引入本文作为参考)。抗体部分例如Fab和F(ab')2片段可以使用常规技术由完整抗体制备,例如完整抗体分别地木瓜蛋白酶或胃蛋白酶消化。此外,抗体、抗体部分和免疫粘附分子可以使用标准重组DNA技术获得,如本文描述的。在一个方面,抗原结合部分是完整结构域或完整结构域对。
如本文使用的,短语“人白细胞介素12”(本文缩写为hIL-12或IL-12)包括主要由巨噬细胞和树突细胞分泌的人细胞因子。该术语包括包含35 kD亚基(p35)和40 kD亚基(p40)的异二聚体蛋白质,其通过二硫键连接在一起。异二聚体蛋白质被称为“p70亚基”。人IL-12的结构在例如下述中进一步描述:Kobayashi,等人(1989)J. Exp Med.
170:827-845;Seder,等人(1993)Proc. Natl. Acad. Sci. 90:10188-10192;Ling,等人(1995)J. Exp Med. 154:116-127;Podlaski,等人(1992)Arch. Biochem.
Biophys. 294:230-237,其完整教导引入本文作为参考。编码IL-12的核酸可作为GenBank登记号NM_000882获得,并且多肽序列可作为GenBank登记号NP_000873.2获得。术语人IL-12意欲包括重组人IL-12(rh IL-12),其可以通过标准重组表达方法进行制备。
如本文使用的,短语“人白细胞介素18”(本文缩写为hIL-18或IL-18)包括最初作为无生物学活性的193氨基酸前体蛋白质合成的人细胞因子,以及例如但不限于通过例如胱天蛋白酶-1或胱天蛋白酶-4切割前体蛋白质产生的156氨基酸成熟蛋白质,其显示包括T细胞增殖的共刺激、NK细胞细胞毒性的增强、通过T细胞和NK细胞的IFN-γ生产的诱导、和T辅助1型(Th1)分化的加强的生物学活性。编码IL-18的核酸可作为GenBank登记号NM_001562获得,并且多肽序列可作为GenBank登记号NP_001553获得。术语人IL-18意欲包括重组人IL-18(rh IL-18),其可以通过标准重组表达方法进行制备。
短语“人肿瘤坏死因子-α”(本文缩写为hTNFα或TNFα)是占优势地由单核细胞/巨噬细胞分泌的多功能促炎细胞因子,其对脂质代谢、凝固、胰岛素耐受性和内皮功能有作用。TNFα是17 kD蛋白质亚基的可溶性同三聚体。还存在膜结合的26 kD前体形式的TNFα。它在组织中的滑膜细胞和巨噬细胞中发现。除单核细胞或巨噬细胞外的细胞也产生TNFα。例如,人非单核细胞肿瘤细胞系产生TNFα以及CD4+和CD8+外周血T淋巴细胞,并且一些培养的T和B细胞系产生TNFα。编码TNFα的核酸可作为GenBank登记号X02910获得,并且多肽序列可作为GenBank登记号CAA26669获得。术语人TNFα意欲包括重组人TNFα(rh TNFα),其可以通过标准重组表达方法进行制备。
术语“Kabat编号”、“ Kabat定义”和“Kabat标记”在本文中可互换使用。本领域公认的这些术语指编号氨基酸残基的系统,所述氨基酸残基比抗体或其抗原结合部分的重和轻链可变区中的其他氨基酸残基更可变(即高变)(Kabat等人(1971)Ann. NY Acad,Sci. 190:382-391和Kabat,E. A.,等人(1991)Sequences of Proteins of Immunological Interest,第5版,U.S. Department
of Health and Human Services,NIH公开号91-3242,其完整教导引入本文作为参考)。对于重链可变区,高变区范围为关于CDR1的氨基酸位置31 - 35、关于CDR2的氨基酸位置50 – 65、和关于CDR3的氨基酸位置95 – 102。对于轻链可变区,高变区范围为关于CDR1的氨基酸位置24 - 34、关于CDR2的氨基酸位置50 – 56、和关于CDR3的氨基酸位置89 – 97。
术语“人抗体”包括具有与人种系免疫球蛋白序列对应的可变和恒定区的抗体,如由Kabat等人描述的(参见Kabat,等人(1991)Sequences of proteins of Immunological Interest,第5版,U.S. Department
of Health and Human Services,NIH公开号91-3242)。本发明的人抗体可以包括例如在CDRs且特别是CDR3中不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点专一诱变或通过体内体细胞突变引入的突变)。突变可以使用“选择性诱变方法”引入。人抗体可以具有由氨基酸残基替换的至少一个位置,所述氨基酸残基例如不由人种系免疫球蛋白序列编码的活性增强氨基酸残基。人抗体可以具有由并非人种系免疫球蛋白序列的部分的氨基酸残基替换的最高达20个位置。在其他实施方案中,替换最高达10个、最高达5个、最高达3个或最高达2个位置。在一个实施方案中,这些替换在CDR区内。然而,如本文使用的,术语“人抗体”不意欲包括这样的抗体,其中衍生自另一个哺乳动物物种例如小鼠种系的CDR序列已嫁接到人构架序列上。
短语“选择性诱变方法”包括改善抗体活性的方法,其通过选择且个别突变在至少一个适当的选择性诱变位置、高变和/或接触位置的CDR氨基酸来实现。“选择性突变的”人抗体是包括在使用选择性诱变方法选择的位置上的突变的抗体。在另一个方面,选择性诱变方法意欲提供优先突变所选择的个别氨基酸残基的方法,所述氨基酸残基在抗体重链可变区的CDR1、CDR2或CDR3(下文分别为H1、H2和H3),或轻链可变区的CDR1、CDR2或CDR3(下文分别为L1、L2和L3)中。氨基酸残基可以选自选择性诱变位置、接触位置或高变位置。个别氨基酸基于其在轻或重链可变区中的位置进行选择。应当理解高变位置还可以是接触位置。在一个方面,选择性诱变方法是“靶向的方法”。语言“靶向的方法”意欲包括以靶向的方式例如“逐组(Group-wise)靶向的方法”或“逐CDR(CDR-wise)靶向的方法”,突变抗体重链可变区的CDR1、CDR2或CDR3或轻链可变区的CDR1、CDR2或CDR3中所选的个别氨基酸残基的方法。在“逐组靶向的方法”中,特定组中的个别氨基酸残基被靶向用于选择性突变,包括组I(包括L3和H3)、II(包括H2和L1)和III(包括L2和H1),所述组以用于靶向的优先次序列出。在“逐CDR靶向的方法”中,特定CDRs中的个别氨基酸残基被靶向用于选择性突变,其中用于靶向的优先次序如下:H3、L3、H2、L1、H1和L2。所选择的氨基酸残基例如突变为至少2个其他氨基酸残基,并且测定突变对抗体活性的作用。活性测量为抗体结合特异性/亲和力,和/或抗体中和能力中的改变。应当理解选择性诱变方法可以用于最优化衍生自任何来源的任何抗体,所述任何来源包括噬菌体展示、具有人IgG种系基因的转基因动物、从人B细胞中分离的人抗体。选择性诱变方法可以在不可使用噬菌体展示技术进一步最优化的抗体上使用。应当理解可以在选择性诱变方法前或后对来自任何来源的抗体实施回复突变,所述任何来源包括噬菌体展示、具有人IgG种系基因的转基因动物、从人B细胞中分离的人抗体。
短语“重组人抗体”包括通过重组方法制备、表达、产生或分离的人抗体,例如使用转染到宿主细胞内的重组表达载体表达的抗体,从重组、组合人抗体文库中分离的抗体,从对于人免疫球蛋白基因是转基因的动物(例如小鼠)中分离的抗体(参见例如,Taylor,L. D.,等人(1992)Nucl. Acids Res. 20:6287-6295,其完整教导引入本文作为参考),或通过任何其他方法制备、表达、产生或分离的抗体,所述任何其他方法涉及人免疫球蛋白基因序列与其他DNA序列的剪接。此种重组人抗体具有衍生自人种系免疫球蛋白序列的可变和恒定区(参见,Kabat,E. A. ,等人(1991)Sequences of
Proteins of Immunological Interest,第5版,U.S. Department of Health and Human Services,NIH公开号91-3242)。然而,在特定实施方案中,对此种重组人抗体实施体外诱变(或当使用对于人Ig序列是转基因的动物时,体内体细胞诱变),并且因此重组抗体的VH和VL区的氨基酸序列是这样的序列,其虽然衍生自且涉及人种系VH和VL序列,但可能不天然存在于体内人抗体种系谱(repertoire)内。然而,在特定实施方案中,此种重组抗体是选择性诱变方法或回复突变或两者的结果。
“分离的抗体”包括基本上不含具有不同抗原特异性的其他抗体的抗体(例如,与hIL-12特异性结合的分离的抗体基本上不含特异性结合除hIL-12外的抗原的抗体)。特异性结合hIL-12的分离的抗体可以结合来自其他物种的IL-12分子。此外,分离的抗体可以基本上不含其他细胞材料和/或化学试剂。可以在本发明的背景中纯化的合适抗IL-12抗体公开于美国专利号6,914,128(其在此整体引入作为参考)中,包括但不限于在那个专利中鉴定为J695的抗IL-12抗体,并且其随后已被鉴定为ABT-874。可以在本发明的背景中纯化且分离的合适抗IL-18抗体公开于USSNs
09/780,035和10/988,360中,包括随后已鉴定为ABT-325的抗体。合适的抗TNFα抗体是阿达木单抗(Abbott
Laboratories)。
“中和抗体”(或“中和hIL-12活性的抗体”)包括其与hIL-12的结合导致hIL-12生物学活性抑制的抗体。hIL-12生物学活性的这种抑制可以通过测量hIL-12生物学活性的一种或多种指示剂进行评估,例如植物凝集素胚细胞增殖测定(blast
proliferation assay)(PHA)中的人植物凝集素胚细胞增殖的抑制,或人IL-12受体结合测定中的受体结合的抑制。hIL-12生物学活性的这些指示剂可以通过本领域已知的几种标准体外或体内测定中的一种或多种进行评估。
“中和抗体”(或“中和hIL-18活性的抗体”)包括其与hIL-18的结合导致hIL-18生物学活性抑制的抗体。hIL-18生物学活性的这种抑制可以通过测量hIL-18生物学活性的一种或多种指示剂进行评估,例如通过T细胞或NK细胞的IFN-γ生产的诱导,或人IL-18受体结合测定中的IL-18受体结合的抑制。hIL-18生物学活性的这些指示剂可以通过本领域已知的几种标准体外或体内测定中的一种或多种进行评估。
术语“活性”包括这样的活性,例如抗体对于抗原的结合特异性/亲和力,例如与IL-12抗原结合的抗hIL-12抗体,和/或抗体的中和能力,例如其与hIL-12的结合抑制hIL-12的生物学活性的抗hIL-12抗体,例如PHA胚细胞增殖的抑制或人IL-12受体结合测定中的受体结合的抑制。术语“活性”还包括这样的活性,例如抗IL-18抗体对于其抗原的结合特异性/亲和力,例如与IL-18抗原结合的抗hIL-18抗体,和/或抗体的中和能力,例如其与hIL-18的结合抑制hIL-18的生物学活性的抗hIL-18抗体。术语“活性”还包括这样的活性,例如抗TNFα抗体对于其抗原的结合特异性/亲和力,例如与TNFα抗原结合的抗TNFα抗体,和/或抗体的中和能力,例如其与hTNFα的结合抑制hTNFα的生物学活性的抗TNFα抗体。
短语“表面等离振子共振”包括允许通过检测在生物传感器基质内的蛋白质浓度中的改变分析实时生物特异性相互作用的光学现象,例如使用BIAcore系统(Pharmacia Biosensor AB,Uppsala,瑞典和Piscataway,N.J.)。关于进一步描述,参见Jonsson,U.,等人(1993)Ann. Biol. Clin.
51:19-26;Jonsson,U.,等人(1991)Biotechniques
11:620-627;Johnsson,B.,等人(1995)J. Mol.
Recognit. 8:125-131;和Johnnson,B.,等人(1991)Anal. Biochem. 198:268-277,其完整教导引入本文。
如本文使用的,术语“Koff”意指抗体从抗体/抗原复合物中解离的解离速率常数。
如本文使用的,术语“Kd”意指特定抗体-抗原相互作用的解离常数。
短语“核酸分子”包括DNA分子和RNA分子。核酸分子可以是单链或双链的,但在一个方面,是双链DNA。
如本文提及编码诸如结合hIL-12、hTNFα或hIL-18的那些的抗体或抗体部分(例如,VH、VL、CDR3)的核酸使用的,短语“分离的核酸分子”包括这样的核酸分子,其中编码抗体或抗体部分的核苷酸序列不含编码结合除hIL-12、hTNFα或hIL-18外的抗原的抗体或抗体部分的其他核苷酸序列,所述其他序列可以在人基因组DNA中天然位于核酸侧面。因此,例如编码抗IL-12h、抗TNFα或抗hIL-18抗体的VH区的本发明的分离的核酸不包含编码结合除例如IL-12、hTNFα或hIL-18外的抗原的其他VH区的其他序列。短语“分离的核酸分子”还意欲包括编码二价、双特异性抗体的序列,例如其中VH和VL区不包含除双抗体序列外的其他序列的双抗体。
短语“重组宿主细胞”(或简单地“宿主细胞”)包括重组表达载体已引入其内的细胞。应当理解此种术语不仅意指具体主题细胞还指此种细胞的后代。因为特定修饰可以由于突变或环境影响而在随后世代中发生,所以此种后代事实上可以不等同于亲本细胞,但仍包括在如本文使用的术语“宿主细胞”的范围内。
如本文使用的,术语“修饰”意指改变抗体或其抗原结合部分中的一个或多个氨基酸。改变可以通过在一个或多个位置上添加、取代或缺失氨基酸而产生。改变可以使用已知技术例如PCR诱变而产生。
如本文使用的,术语“约”意指大于或小于参考值约10-20%的范围。在特定情况下,本领域技术人员将认识到由于参考值的性质,术语“约”可以意指距离所述值多于或小于10-20%的偏差。
如本文使用的,短语“病毒减少/灭活”意指特定样品中病毒颗粒数目中的降低(“减少”),以及活性例如但不限于特定样品中病毒颗粒感染性或复制能力中的降低(“灭活”)。病毒颗粒数目和/或活性中的此种降低可以相当于约1%- 约99%、优选约20%- 约99%、更优选约30%- 约99%、更优选约40%- 约99%、甚至更加优选约50%- 约99%、甚至更加优选约60%- 约99%、更加优选约70%- 约99%、更加优选约80%- 99%、且更加优选约90%- 约99%。在特定非限制性实施方案中,如果存在,那么纯化的抗体产物中的病毒量小于关于那种病毒的ID50(将感染50%靶群体的病毒量)、优选关于那种病毒的ID50的至少1/10、更优选关于那种病毒的ID50的至少1/100、并且更加优选关于那种病毒的ID50的至少1/1000。
短语“接触位置”包括在抗体重链可变区或轻链可变区的CDR1、CDR2或CDR3中的氨基酸位置,其由在26种已知抗体-抗原结构之一中接触抗原的氨基酸占据。如果26种已知抗体-抗原复合物解决的结构的任何一种中的CDR氨基酸接触抗原,那么那个氨基酸可以被视为占据接触位置。接触位置具有比非接触位置中由接触抗原的氨基酸占据的更高可能性。在一个方面,接触位置是包含在26种结构的超过3种(>1.5%)中接触抗原的氨基酸的CDR位置。在另一个方面,接触位置是包含在25种结构的超过8种(>32%)中接触抗原的氨基酸的CDR位置。
2. 抗体生成
如这个章节中使用的,术语“抗体”指完整抗体或其抗原结合片段。
本公开内容的抗体可以通过多种技术生成,包括用目的抗原免疫接种动物随后为常规单克隆抗体方法,例如Kohler和Milstein(1975)Nature 256:495的标准体细胞杂交技术。尽管体细胞杂交程序是优选的,但原则上可以采用用于生产单克隆抗体的其他技术,例如B淋巴细胞的病毒或致癌性转化。
用于制备杂交瘤的一种优选动物系统是鼠系统。杂交瘤生产是非常良好确立的程序。用于分离免疫接种的脾细胞用于融合的免疫接种规程和技术是本领域已知的。融合配偶体(例如,鼠骨髓瘤细胞)和融合程序也是已知的。
抗体优选可以是人、嵌合或人源化抗体。本公开内容的嵌合或人源化抗体可以基于如上所述制备的非人单克隆抗体序列进行制备。编码重和轻链免疫球蛋白的DNA可以得自目的非人杂交瘤,并且使用标准分子生物学技术工程改造为包含非鼠(例如,人)免疫球蛋白序列。例如,为了产生嵌合抗体,鼠可变区可以使用本领域已知的方法与人恒定区连接(参见例如授予Cabilly等人的美国专利号4,816,567)。为了产生人源化抗体,可以使用本领域已知的方法将鼠CDR区插入人构架内(参见例如授予Winter的美国专利号5,225,539,和授予Queen等人的美国专利号5,530,101;5,585,089;5,693,762和6,180,370)。
在一个非限制性实施方案中,本公开内容的抗体是人单克隆抗体。针对IL-12、hTNFα或IL-18的此种人单克隆抗体可以使用转基因或转染色体(transchromosomic)小鼠生成,所述转基因或转染色体小鼠携带人免疫系统而不是小鼠系统的部分。这些转基因和转染色体小鼠包括在本文中被称为HuMAb
Mouse®(Medarex,Inc.)、KM Mouse®(Medarex,Inc.)和XenoMouse®(Amgen)的小鼠。
此外,表达人免疫球蛋白基因的可替代转染色体动物系统是本领域可获得的,并且可以用于产生本公开内容的抗体,例如抗IL-12、抗TNFα或抗IL-18抗体。例如,可以使用被称为“TC小鼠”的携带人重链转染色体和人轻链转染色体的小鼠;此种小鼠在Tomizuka等人(2000)Proc. Natl.
Acad. Sci. USA 97:722-727中描述。此外,携带人重和轻链转染色体的牛已在本领域中得到描述(例如,Kuroiwa等人(2002)Nature
Biotechnology 20:889-894和PCT申请号WO 2002/092812),并且可以用于产生本公开内容的抗IL-12、抗TNFα或抗IL-18抗体。
本发明的重组人抗体,包括但不限于抗IL-12、抗TNFα或抗IL-18抗体或其抗原结合部分,或本文公开的抗IL-12相关的、抗TNFα相关的或抗IL-18相关的抗体,可以通过筛选重组组合抗体文库进行分离,例如使用由衍生自人淋巴细胞的mRNA制备的人VL和VH cDNAs制备的scFv噬菌体展示文库。用于制备且筛选此种文库的方法是本领域已知的。除用于生成噬菌体展示文库的商购可得的试剂盒外(例如,Pharmacia
Recombinant Phage Antibody System,目录号27-9400-01;和Stratagene SurfZAPTM噬菌体展示试剂盒,目录号240612,其完整教导引入本文),特别适合于在生成和筛选抗体展示文库中使用的方法和试剂的例子可以在例如下述中找到:Ladner等人美国专利号5,223,409;Kang等人PCT公开号WO 92/18619;Dower等人PCT公开号WO 91/17271;Winter等人PCT公开号WO 92/20791;Markland等人PCT公开号WO 92/15679;Breitling等人PCT公开号WO 93/01288;McCafferty等人PCT公开号WO 92/01047;Garrard等人PCT公开号WO 92/09690;Fuchs等人(1991)Bio/Technology 9:1370-1372;Hay等人(1992)Hum Antibod
Hybridomas 3:81-85;Huse等人(1989)Science
246:1275-1281;McCafferty等人,Nature(1990)348:552-554;Griffiths等人(1993)EMBO J 12:725-734;Hawkins等人(1992)J Mol Biol
226:889-896;Clackson等人(1991)Nature 352:624-628;Gram等人(1992)PNAS
89:3576-3580;Garrard等人(1991)Bio/Technology 9:1373-1377;Hoogenboom等人(1991)Nuc Acid Res
19:4133-4137;和Barbas等人(1991)PNAS 88:7978-7982;其完整教导引入本文。
本公开内容的人单克隆抗体还可以使用人免疫细胞已重构到其内,从而使得人抗体应答可以在免疫接种后生成的SCID小鼠进行制备。此种小鼠在例如授予Wilson等人的美国专利号5,476,996和5,698,767中描述。
在特定实施方案中,本发明的方法包括抗IL-12、抗TNFα或抗IL-18抗体和抗体部分、抗IL-12相关的、抗TNFα相关的或抗IL-18相关的抗体和抗体部分、以及具有与抗IL-12、抗TNFα或抗IL-18抗体等价性质的人抗体和抗体部分,例如具有低解离动力学和高中和能力的与hIL-12、hTNFα或hIL-18的高亲和力结合。在一个方面,本发明提供了用分离的人抗体或其抗原结合部分的治疗,其以约1 x 10-8 M或更少的Kd和1 x 10-3 s-1或更少的Koff速率常数与hIL-12、hTNFα或hIL-18解离,两者都通过表面等离振子共振进行测定。在特异性非限制性实施方案中,根据本发明纯化的抗IL-12抗体在生理条件下竞争性抑制ABT-874与IL12的结合。在特异性非限制性实施方案中,根据本发明纯化的抗IL-18抗体在生理条件下竞争性抑制ABT-325与IL-18的结合。在特异性非限制性实施方案中,根据本发明纯化的抗TNFα抗体在生理条件下竞争性抑制阿达木单抗与TNFα的结合。
在本发明的另外一个实施方案中,可以改变抗体或其片段,例如但不限于抗IL-12、抗TNFα或抗IL-18抗体或其片段,其中修饰抗体的恒定区,以相对于未修饰抗体减少至少一种恒定区介导的生物学效应子功能。为了修饰本发明的抗体,从而使得它显示出与Fc受体减少的结合,抗体的免疫球蛋白恒定区区段可以在Fc受体(FcR)相互作用所必需的特定区域上进行突变(参见例如,Canfield和Morrison(1991)J. Exp. Med.
173:1483-1491;和Lund等人(1991)J. of Immunol. 147:2657-2662,其完整教导引入本文)。抗体的FcR结合能力中的减少还可以减少依赖于FcR相互作用的其他效应子功能,例如调理作用和吞噬作用和抗原依赖性细胞毒性。
3. 抗体生产
为了表达本发明的抗体,将编码部分或全长轻和重链的DNAs插入一种或多种表达载体内,从而使得基因与转录和翻译控制序列可操作地连接。(参见例如,美国专利号6,914,128,其完整教导引入本文作为参考)。在这个背景中,术语“可操作地连接”意指抗体基因这样连接到载体内,从而使得载体内的转录和翻译控制序列发挥其调节抗体基因转录和翻译的预期功能。表达载体和表达控制序列选择为与所使用的表达宿主细胞相容。抗体轻链基因和抗体重链基因可以插入分开的载体内,或更一般地,2种基因都插入到相同表达载体内。抗体基因通过标准方法插入表达载体内(例如,在抗体基因片段和载体上的互补限制位点的连接,或如果不存在限制位点,那么平端连接)。在插入抗体或抗体相关的轻或重链序列前,表达载体可以已携带抗体恒定区序列。例如,将抗IL-12、抗TNFα或抗IL-18抗体或抗IL-12、抗TNFα或抗IL-18抗体相关的VH和VL序列转变为全长抗体基因的一种方法是将其分别插入已编码重链恒定区和轻链恒定区的表达载体内,从而使得VH区段与载体内的一个或多个CH区段可操作地连接,并且VL区段与载体内的CL区段可操作地连接。另外或可替代地,重组表达载体可以编码促进抗体链从宿主细胞中分泌的信号肽。抗体链基因可以克隆到载体内,从而使得信号肽与抗体链基因的氨基末端符合读框地连接。信号肽可以是免疫球蛋白信号肽或异源信号肽(即,来自非免疫球蛋白蛋白质的信号肽)。
除抗体链基因外,本发明的重组表达载体可以携带一种或多种调节序列,其控制抗体链基因在宿主细胞中的表达。术语“调节序列”意欲包括控制抗体链基因转录或翻译的启动子、增强子和其他表达控制元件(例如,多腺苷酸化信号)。此种调节序列例如在Goeddel;Gene Expression Technology:Methods
in Enzymology 185,Academic Press,San Diego,CA(1990)中描述,其完整教导引入本文作为参考。本领域技术人员将认识到,表达载体的设计包括调节序列的选择可以依赖于此种因素,如待转化的宿主细胞的选择、所需蛋白质表达水平等。用于哺乳动物宿主细胞表达的合适调节序列包括指导在哺乳动物细胞中的高水平蛋白质表达的病毒元件,例如衍生自巨细胞病毒(CMV)(例如CMV启动子/增强子)、猿猴病毒40(SV40)(例如SV40启动子/增强子)、腺病毒(例如腺病毒主要晚期启动子(AdMLP))和多瘤的启动子和/或增强子。关于病毒调节元件及其序列的进一步描述,参见例如,Stinski的美国专利号5,168,062、Bell等人的美国专利号4,510,245、和Schaffner等人的美国专利号4,968,615,其完整教导引入本文作为参考。
除抗体链基因和调节序列外,本发明的重组表达载体还可以携带一种或多种另外序列,例如调节载体在宿主细胞中的复制的序列(例如复制起点)和/或选择标记基因。选择标记基因促进载体已引入其内的宿主细胞的选择(参见例如,全部为Axel等人的美国专利号4,399,216、4,634,665和5,179,017,其完整教导引入本文作为参考)。例如,一般地,选择标记基因对载体已引入其内的宿主细胞赋予针对药物的抗性,所述药物例如G418、潮霉素或氨甲蝶呤。合适的选择标记基因包括二氢叶酸还原酶(DHFR)基因(用于与氨甲蝶呤选择/扩增一起在dhfr-宿主细胞中使用)和neo基因(用于G418选择)。
本发明的抗体或抗体部分可以通过免疫球蛋白轻和重链基因在宿主细胞中的重组表达进行制备。为了重组表达抗体,用携带编码抗体的免疫球蛋白轻和重链的DNA片段的一种或多种重组表达载体转染宿主细胞,从而使得轻和重链在宿主细胞中表达且分泌到宿主细胞在其中培养的培养基内,从所述培养基中可以回收抗体。标准重组DNA方法用于获得抗体重和轻链基因,将这些基因掺入重组表达载体内,并且将载体引入宿主细胞内,例如Sambrook,Fritsch和Maniatis(编辑),Molecular Cloning;A
Laboratory Manual,第2版,Cold Spring Harbor,N.Y.,(1989),Ausubel等人(编辑)Current Protocols in Molecular Biology,Greene Publishing Associates,(1989)以及美国专利号4,816,397和6,914,128中描述的那些,其完整教导引入本文。
为了表达轻和重链,通过标准技术将编码重和轻链的一种或多种表达载体转染到宿主细胞内。各种形式的术语“转染”意欲包含通常用于将外源DNA引入原核或真核宿主细胞内的广泛多样的技术,例如电穿孔、磷酸钙沉淀、DEAE-葡聚糖转染等。尽管理论上可能在原核或真核宿主细胞中表达本发明的抗体,但在真核细胞例如哺乳动物宿主细胞中表达抗体是合适的,因为此种真核细胞且特别是哺乳动物细胞比原核细胞更可能装配且分泌正确折叠且免疫学活性的抗体。已报道抗体基因的原核表达对于生产高得率的活性抗体是无效的(Boss和Wood(1985)Immunology Today 6:12-13,其完整教导引入本文作为参考)。
用于在本文载体中克隆或表达DNA的合适宿主细胞是上文描述的原核生物、酵母或高等真核生物细胞。用于这个目的的合适原核生物包括真细菌,例如革兰氏阴性或革兰氏阳性生物,例如肠杆菌科(Enterobacteriaceae),例如埃希氏菌属(Escherichia)例如大肠杆菌(E.
coli)、肠杆菌属(Enterobacter)、欧文氏菌属(Erwinia)、克雷伯氏菌属(Klebsiella)、变形菌属(Proteus)、沙门氏菌属(Salmonella)例如鼠伤寒沙门氏菌(Salmonella typhimurium)、沙雷氏菌属(Serratia)例如粘质沙雷氏菌(Serratia marcescans)、和志贺氏菌属(Shigella)、以及杆菌(Bacilli)例如枯草芽孢杆菌(B. subtilis)和地衣芽孢杆菌(B. licheniformis)(例如于1989年4月12日公开的DD 266,710中公开的地衣芽孢杆菌41P)、假单胞菌属(Pseudomonas)例如铜绿假单胞菌(P.
aeruginosa)、和链霉菌属(Streptomyces)。一种合适的大肠杆菌克隆宿主是大肠杆菌294(ATCC
31,446),尽管其他菌株例如大肠杆菌B、大肠杆菌X1776(ATCC 31,537)、和大肠杆菌W3110(ATCC 27,325)也是合适的。这些例子是举例说明性而不是限制性的。
除原核生物外,真核微生物例如丝状真菌或酵母是用于多肽编码载体的合适克隆或表达宿主。啤酒糖酵母(Saccharomyces
cerevisiae)或通常的面包酵母是低等真核宿主微生物中最常用的。然而,许多其他属、物种和菌株是通常可得且在本文中有用的,例如粟酒裂殖糖酵母(Schizosaccharomyces
pombe);克鲁维氏酵母属(Kluyveromyces)宿主例如乳克鲁维氏酵母(K. lactis)、脆壁克鲁维氏酵母(K.
fragilis)(ATCC 12,424)、保加利亚克鲁维氏酵母(K. bulgaricus)(ATCC
16,045)、威克曼氏克鲁维氏酵母(K. wickeramii)(ATCC 24,178)、瓦尔特克鲁维氏酵母(K.
waltii)(ATCC 56,500)、果蝇克鲁维氏酵母(K. drosophilarum)(ATCC
36,906)、耐热克鲁维氏酵母(K. thermotolerans)、和马克斯克鲁维氏酵母(K. marxianus);耶氏酵母属(yarrowia)(EP 402,226);巴斯德毕赤氏酵母(Pichia
pastoris)(EP 183,070);假丝酵母属(Candida);里氏木霉(Trichoderma reesia)(EP
244,234);粗糙链孢霉(Neurospora crassa);许旺氏酵母属(Schwanniomyces)例如西方许旺氏酵母(Schwanniomyces
occidentalis);和丝状真菌例如链孢霉属(Neurospora)、青霉属(Penicillium)、弯颈霉属(Tolypocladium)、和曲霉属(Aspergillus)宿主例如构巢曲霉(A.
nidulans)和黑色曲霉(A. niger)。
用于表达糖基化抗体的合适宿主细胞衍生自多细胞生物。无脊椎动物细胞的例子包括植物和昆虫细胞。已鉴定了众多杆状病毒毒株和变体以及来自宿主的相应允许昆虫宿主细胞,例如草地夜蛾(Spodoptera
frugiperda)(毛虫)、埃及伊蚊(Aedes aegypti)(蚊子)、白纹伊蚊(Aedes albopictus)(蚊子)、黑腹果蝇(Drosophila
melanogaster)(果蝇)、和家蚕(Bombyx mori)。用于转染的多种病毒毒株是可公开获得的,例如苜蓿丫纹夜蛾(Autographa californica)NPV的L-1变体和家蚕NPV的Bm-5毒株,并且此种病毒可以根据本发明在本文中用作病毒,特别是用于转染草地夜蛾细胞。棉花、玉米、马铃薯、大豆、矮牵牛、番茄和烟草的植物细胞培养物也可以用作宿主。
用于表达本发明的重组抗体的合适哺乳动物宿主细胞包括中国仓鼠卵巢(CHO细胞)(包括在Urlaub和Chasin,(1980)PNAS USA 77:4216-4220中描述的dhfr-
CHO细胞,与DHFR选择标记一起使用,例如如Kaufman和Sharp(1982)Mol. Biol. 159:601-621中描述的,其完整教导引入本文作为参考)、NS0骨髓瘤细胞、COS细胞和SP2细胞。当编码抗体基因的重组表达载体引入哺乳动物宿主细胞内时,通过使宿主细胞培养足以允许抗体在宿主细胞中表达或抗体分泌到宿主细胞在其中生长的培养基内的一段时间,产生抗体。有用的哺乳动物宿主细胞系的其他例子是通过SV40转化的猴肾CV1系(COS-7,ATCC CRL 1651);人胚肾系(亚克隆用于在悬浮培养中生长的293或293细胞,Graham等人,J. Gen Virol. 36:59(1977));幼仓鼠肾细胞(BHK,ATCC CCL 10);中国仓鼠卵巢细胞/-DHFR(CHO,Urlaub等人,Proc. Natl.
Acad. Sci. USA 77:4216(1980));小鼠支持细胞(sertoli cell)(TM4,Mather,Biol. Reprod.
23:243-251(1980));猴肾细胞(CV1
ATCC CCL 70);非洲绿猴肾细胞(VERO-76,ATCC
CRL-1587);人子宫颈癌细胞(HELA,ATCC
CCL 2);犬肾细胞(MDCK,ATCC
CCL 34);水牛大鼠肝细胞(BRL 3A,ATCC
CRL 1442);人肺细胞(W138,ATCC
CCL 75);人肝细胞(Hep G2,HB
8065);小鼠乳房肿瘤(MMT 060562,ATCC
CCL51);TRI细胞(Mather等人,Annals N.Y. Acad. Sci. 383:44-68(1982));MRC 5细胞;FS4细胞;和人肝癌系(Hep G2),其完整教导引入本文作为参考。
宿主细胞用上述表达或克隆载体转化用于抗体生产,并且在适当修饰的常规营养培养基中培养,用于诱导启动子、选择转化体、或扩增编码所需序列的基因。
用于生产抗体的宿主细胞可以在多种培养基中进行培养。商购可得的培养基例如Ham's F10™(Sigma)、Minimal
Essential Medium™((MEM)、(Sigma)、RPMI-1640(Sigma)、和Dulbecco's
Modified Eagle's Medium™((DMEM),Sigma)适合于培养宿主细胞。此外,Ham等人,Meth. Enz. 58:44(1979),Barnes等人,Anal. Biochem.
102:255(1980),美国专利号4,767,704;4,657,866;4,927,762;4,560,655;或5,122,469;WO 90/03430;WO
87/00195;或美国专利号Re. 30,985中描述的任何一种培养基都可以用作用于宿主细胞的培养基,其完整教导引入本文作为参考。这些培养基中的任何一种都可以根据需要补加有激素和/或其他生长因子(例如胰岛素、运铁蛋白或表皮生长因子)、盐(例如氯化钠、钙、镁和磷酸盐)、缓冲液(例如HEPES)、核苷酸(例如腺苷和胸苷)、抗生素(例如庆大霉素药物)、痕量元素(定义为通常以微摩尔范围的最终浓度存在的无机化合物)、和葡萄糖或等价能源。任何其他必需的补充物也可以以本领域技术人员已知的合适浓度包括。培养条件例如温度、pH等是先前由选择用于表达的宿主细胞使用的那些,并且对于普通技术人员将是显而易见的。
宿主细胞还可以用于产生完整抗体的部分,例如Fab片段或scFv分子。应当理解关于上述程序的变化在本发明的范围内。例如,在特定实施方案中,可以希望用编码本发明抗体的轻链或重链(但并非两者)的DNA转染宿主细胞。重组DNA技术也可以用于去除编码轻和重链中任一或两者的一些或全部DNA,在抗IL-12抗体的背景中,其并非是对于与IL-12特别是hIL-12结合所必需的,或在抗IL-18抗体的背景中,其并非是对于与IL-18特别是hIL-18结合所必需的,或在抗TNFα抗体的背景中,其并非是对于与TNFα特别是hTNFα结合所必需的。由此种截短的DNA分子表达的分子也由本发明的抗体包含。此外,通过经由标准化学交联方法使本发明的抗体与第二种抗体交联,可以生产双功能抗体,其中一条重链和一条轻链是本发明的抗体,并且另一条重和轻链对于除IL-12、TNFα或IL-18外的抗原特异,这依赖于本发明抗体的特异性。
在用于重组表达本发明的抗体或其抗原结合部分的合适系统中,通过磷酸钙介导的转染,将编码抗体重链和抗体轻链的重组表达载体引入dhfr-CHO细胞内。在重组表达载体内,抗体重和轻链基因各自与CMV增强子/AdMLP启动子调节元件可操作地连接,以驱动基因的高水平转录。重组表达载体还携带DHFR基因,其允许使用氨甲蝶呤选择/扩增选择已用载体转染的CHO细胞。培养所选择的转化体宿主细胞,以允许抗体重和轻链表达,并且从培养基中回收完整抗体。标准分子生物学技术用于制备重组表达载体,转染宿主细胞,选择转化体,培养宿主细胞且从培养基中回收抗体。
当使用重组技术时,抗体可以在细胞内、在周质间隙中产生、或直接分泌到培养基内。在一个方面,如果抗体在细胞内产生,那么作为第一个步骤,可以例如通过离心或超滤去除颗粒碎片,或者宿主细胞或者裂解的细胞(例如,起因于匀浆)。当抗体分泌到培养基内时,来自此种表达系统的上清液可以首先使用商购可得的蛋白质浓缩滤器进行浓缩,例如Amicon™或Millipore Pellicon™超滤单元。
在本发明的方法前,用于从细胞碎片中纯化抗体的程序最初依赖于抗体的表达部位。一些抗体可以从细胞直接分泌到周围生长培养基内;其他在细胞内制备。对于后面一种抗体,纯化方法的第一个步骤一般涉及:使细胞裂解,这可以通过多种方法完成,包括机械剪切、渗压震扰或酶促处理。此种破坏将细胞的完整内容物释放到匀浆内,并且另外产生由于其小尺寸难以去除的亚细胞片段。这些一般通过差速离心或通过过滤去除。当抗体被分泌时,来自此种表达系统的上清液一般首先使用商购可得的蛋白质浓缩滤器进行浓缩,例如Amicon™或Millipore Pellicon™超滤单元。当抗体被分泌到培养基内时,重组宿主细胞还可以例如通过切向流过滤与细胞培养基分离。抗体可以使用本发明的抗体纯化方法从培养基中进一步回收。
4. 抗体纯化
4.1 一般地抗体纯化
本发明提供了用于从包括抗体和至少一种HCP的混合物中产生纯化的(或“HCP减少的”)抗体制剂的方法。当抗体已使用上文描述的方法和本领域的常规方法产生时,本发明的纯化方法以分离步骤开始。表1概括了纯化方案的一个实施方案。设想了这个方案的变化,包括但不限于其中略去A蛋白亲和层析步骤或颠倒离子交换步骤次序的变化,并且在本发明的范围内。
表1 纯化步骤与其相关目的
| 纯化步骤 | 目的 |
| 初步回收 | 样品基质的澄清 |
| 亲和层析 | 抗体捕获、宿主细胞蛋白质和相关杂质减少 |
| 阳离子交换层析 | 抗体捕获、宿主细胞蛋白质和相关杂质减少 |
| 超滤/渗滤 | 浓缩和缓冲液更换 |
| 阴离子交换层析 | 宿主细胞蛋白质和DNA的减少 |
| 苯基SepharoseTM HP层析 | 抗体聚集体和宿主细胞蛋白质的减少 |
| 病毒过滤 | 如果存在的话,大病毒的去除 |
| 最后超滤/渗滤 | 浓缩和配制抗体 |
一旦已获得包括抗体的澄清的溶液或混合物,就使用不同纯化技术的组合执行抗体与由细胞产生的其他蛋白质例如HCPs的分离,包括一个或多个离子交换分离步骤和一个或多个疏水作用分离步骤。分离步骤基于其电荷、疏水性程度或大小分离蛋白质的混合物。在本发明的一个方面,分离使用层析执行,包括阳离子、阴离子和疏水作用。几种不同的层析树脂可用于这些技术中的每种,从而允许纯化方案准确适合于所涉及的具体蛋白质。每种分离方法的本质是可以引起蛋白质以不同速率向下穿过柱,从而达到当它们进一步向下经过柱时增加的物理分离,或与分离介质选择性粘附,随后通过不同溶剂差异性洗脱。在一些情况下,当杂质与柱特异性粘附,并且抗体则不是时,即抗体存在于流通物中,抗体与杂质分离。
如上所述,纯化方案的准确适合依赖于待纯化蛋白质的考虑。在特定实施方案中,本发明的分离步骤用于使抗体与一种或多种HCPs分离。可以使用本文描述的方法成功地纯化的抗体包括但不限于,人IgA1、IgA2、IgD、IgE、IgG1、IgG2、IgG3、IgG4和IgM抗体。在特定实施方案中,本发明的纯化策略排除A蛋白亲和层析的使用,例如IgG3抗体的纯化,这是因为IgG3抗体与A蛋白无效率地结合。允许纯化方案特异性适合的其他因素包括但不限于:Fc区的存在或不存在(例如,在全长抗体的背景中,与其Fab片段相比较),因为A蛋白与Fc区结合;在生成目的抗体中采用的具体种系序列;和抗体的氨基酸组成(例如,抗体的一级序列以及分子的总电荷/疏水性)。共享一种或多种特征的抗体可以使用适合于利用那种特征的纯化策略进行纯化。
4.2
初步回收
本发明的纯化方法的起始步骤涉及从样品基质中澄清和初步回收抗体的第一个阶段。此外,初步回收过程还可以是在其下灭活可以存在于样品基质中的病毒的点。例如,在纯化的初步回收阶段过程中可以使用多种病毒灭活方法中的任何一种或多种,包括热灭活(巴斯德消毒法)、pH灭活、溶剂/去污剂处理、UV和γ-射线照射和特定化学灭活试剂例如β-丙酸内酯或例如铜菲咯啉的添加,如美国专利号4,534,972中,其完整教导引入本文作为参考。在本发明的特定实施方案中,在初步回收阶段过程中使样品基质暴露于pH病毒灭活。
pH病毒灭活的方法包括但不限于使混合物在低pH温育一段时间,并且随后中和pH并且通过过滤取出颗粒。在特定实施方案中,混合物将在pH约2 - 5温育,优选在pH约3 - 4,且更优选在pH约3.5。样品混合物的pH可以通过任何合适的酸降低,包括但不限于柠檬酸、乙酸、辛酸或其他合适的酸。pH水平的选择在很大程度上依赖于抗体产物的稳定性概况和缓冲液组分。已知靶抗体在低pH病毒灭活过程中的质量受pH和低pH温育持续时间影响。在特定实施方案中,低pH温育持续时间将是0.5小时 – 2小时,优选0.5小时 – 1.5小时,且更优选持续时间将是1小时。病毒灭活依赖于这些相同参数加上蛋白质浓度,这可以在高浓度减少灭活。因此,可以选择蛋白质浓度、pH和灭活持续时间的正确参数,以达到所需病毒灭活水平。
在特定实施方案中,病毒灭活可以经由使用合适滤器来达到。合适滤器的非限制性例子是来自Pall Corporation的Ultipor DV50™滤器。尽管本发明的特定实施方案在初步回收阶段过程中采用此种过滤,但在其他实施方案中,它在纯化过程的其他阶段时采用,包括作为纯化的倒数第二个或最后一个步骤。在特定实施方案中,采用可替代滤器用于病毒灭活,例如但不限于,Viresolve™滤器(Millipore,Billerica,Mass.);Zeta Plus VR™滤器(CUNO;Meriden,Conn.);和Planova™滤器(Asahi Kasei Pharma,Planova
Division,Buffalo Grove,Ill.)。
在其中采用病毒灭活的这些实施方案中,样品混合物可以根据需要进行调整,用于进一步的纯化步骤。例如,在低pH病毒灭活后,在继续纯化过程前,样品混合物的pH一般调整至更中性的pH,例如从约4.5到约8.5,优选约4.9。此外,混合物可以用注射用水(WFI)冲洗,以获得所需导电性。
在特定实施方案中,初步回收将包括一个或多个离心步骤,以进一步澄清样品基质且从而帮助纯化抗IL-12、抗TNFα或抗IL-18抗体。样品的离心可以在例如但不限于7,000 x g – 约12,750 x g运行。在大规模纯化的背景中,此种离心可以在线(on-line)发生,其流速设为达到例如但不限于在所得到的上清液中150 NTU的浊度水平。此种上清液随后可以收集用于进一步纯化。
在特定实施方案中,初步回收将包括一个或多个深层过滤步骤的使用,以进一步澄清样品基质且从而帮助纯化抗-IL-12、抗TNFα或抗-IL-18抗体。深层滤器包含具有分级密度的过滤介质。此种分级密度允许较大颗粒接近滤器表面被截留,而较小颗粒穿透滤器表面上的较大开放区域,仅在更接近于滤器中心的较小开口中被截留。在特定实施方案中,深层过滤步骤可以是去脂深层过滤步骤。尽管特定实施方案仅在初步回收阶段过程中采用深层过滤步骤,但其他实施方案在一个或多个另外纯化阶段过程中采用深层滤器,包括去脂深层滤器。可以在本发明的背景中使用的深层滤器的非限制性例子包括Cuno™型号30/60ZA深层滤器(3M Corp.)和0.45/0.2μm Sartopore™双层过滤药液筒。
4.3
亲和层析
在特定实施方案中,对初步回收样品实施亲和层析,以进一步纯化目的抗体远离HCPs。在特定实施方案中,层析材料能够与目的抗体选择性或特异性结合。此种层析材料的非限制性例子包括:A蛋白、G蛋白、包括由目的抗体结合的抗原的层析材料、和包括Fc结合蛋白的层析材料。在特定实施方案中,亲和层析步骤涉及使初步回收样品经历包括合适A蛋白树脂的柱的处理。A蛋白树脂对于多种抗体同种型特别是IgG1、IgG2和IgG4的亲和纯化和分离有用。A蛋白是主要通过其Fc区与哺乳动物IgGs结合的细菌细胞壁蛋白质。在其自然状态下,A蛋白具有5个IgG结合结构域以及功能未知的其他结构域。
存在关于A蛋白树脂的几个商业来源。一种合适的树脂是来自GE
Healthcare的MabSelect™。用MabSelect™装填的合适柱的非限制性例子是约1.0 cm直径 x 约21.6 cm长的柱(~17 mL柱床体积)。这种大小的柱可以用于小规模纯化,并且可以与用于按比例扩大的其他柱比较。例如,其柱床体积为约6.6 L的20 cm x 21 cm柱可以用于更大的纯化。与柱无关,柱可以使用合适树脂例如MabSelect™进行装填。
在特定实施方案中,鉴定A蛋白树脂的动态结合容量(DBC)以使纯化适合具体目的抗体将是有利的。例如但不限于,MabSelect™柱的DBC可以通过单流速装载或双重流动装载策略进行测定。单流速装载可以在整个装载时间段自始至终以约300 cm/小时的速度进行评价。双重流速装载策略可以通过下述进行测定:以约300 cm/小时的线速度将柱装载到最高约35 mg蛋白质/mL树脂,然后使线速度减少一半以允许装载的最后部分的更长停留时间(residence time)。
在特定实施方案中,在样品装载前,A蛋白柱可以用合适缓冲液进行平衡。合适缓冲液的非限制性例子是Tris/NaCl缓冲液,pH约7.2。合适平衡条件的非限制性例子是25 mM Tris、100
mM NaCl,pH约7.2。在这个平衡后,可以将样品装载到柱上。在柱装载后,柱可以使用例如平衡缓冲液洗涤一次或多次。可以在洗脱柱前采用其他洗涤,包括采用不同缓冲液的洗涤。例如,柱可以使用在pH约6.0的一个或多个柱体积的20 mM柠檬酸/柠檬酸钠、0.5 M NaCl进行洗涤。这个洗涤可以任选随后为使用平衡缓冲液的一次或多次洗涤。A蛋白柱随后可以使用合适的洗脱缓冲液进行洗脱。合适洗脱缓冲液的非限制性例子是乙酸/NaCl缓冲液,pH约3.5。合适条件是例如0.1 M乙酸,pH约3.5。洗脱物可以使用本领域技术人员众所周知的技术进行监控。例如,可以注意在OD280的吸光度。可以收集从约0.5 AU的初始偏转开始到在洗脱峰尾随边缘(trailing
edge)约0.5 AU的读数的柱洗脱物。随后可以制备一种或多种目的洗脱级分用于进一步加工。例如,收集的样品可以使用在pH约10的Tris(例如,1.0 M)滴定至pH约5.0。任选地,这种滴定的样品可以进行过滤且进一步加工。
4.4
离子交换层析
在特定实施方案中,本发明提供了用于从包括抗体和至少一种HCP的混合物中生产HCP减少的抗体制剂的方法,其通过对混合物实施至少一个离子交换分离步骤,从而使得获得包括抗体的洗脱物来实现。离子交换分离包括基于其各自离子电荷中的差异通过其分离2种物质的任何方法,并且可以采用阳离子交换材料或阴离子交换材料。
阳离子交换材料与阴离子交换材料比较的使用基于蛋白质的总电荷。因此,在使用阳离子交换步骤前采用阴离子交换步骤,或在使用阴离子交换步骤前采用阳离子交换步骤,这在本发明的范围内。此外,采用仅阳离子交换步骤、仅阴离子交换步骤或两者的任何系列组合,这在本发明的范围内。
在执行分离中,通过使用多种技术中的任何一种,例如使用分批纯化技术或层析技术,可以使起始抗体混合物与离子交换材料接触。
例如,在分批纯化的背景中,离子交换材料在所需起始缓冲液中进行制备,或平衡至所需起始缓冲液。在制备或平衡后,获得离子交换材料的浆。使抗体溶液与浆接触,以吸附要被分离到离子交换材料的抗体。例如通过允许浆沉降且去除上清液,使包括不与离子交换材料结合的一种或多种HCP的溶液与浆分离。可以对浆实施一个或多个洗涤步骤。如果需要,则可以使浆与更高导电性的溶液接触,以使已与离子交换材料结合的HCPs解吸。为了洗脱结合的多肽,可以增加缓冲液的盐浓度。
离子交换层析也可以用作离子交换分离技术。离子交换层析基于分子总电荷之间的差异分离分子。对于抗体的纯化,抗体必须具有与和离子交换材料例如树脂附着的官能团的那种相反的电荷,以便结合。例如,一般在pH低于其pI的缓冲液中具有总正电荷的抗体将与阳离子交换材料良好结合,所述阳离子交换材料包含带负电荷的官能团。
在离子交换层析中,在溶质表面上的荷电小块通过与层析基质附着的相反电荷吸引,条件是周围缓冲液的离子强度低。洗脱一般通过增加缓冲液的离子强度(即导电性)来达到,以与溶质竞争离子交换基质的荷电位点。改变pH且从而改变溶质的电荷是达到溶质洗脱的另一种方法。导电性或pH中的改变可以是逐渐的(梯度洗脱)或分级的(分级洗脱)。
阴离子或阳离子取代基可以与基质附着,以形成阴离子或阳离子支持体用于层析。阴离子交换取代基的非限制性例子包括二乙氨乙基(DEAE)、季氨乙基(QAE)和季胺(Q)基团。阳离子取代基包括羧甲基(CM)、磺乙基(SE)、磺丙基(SP)、磷酸盐(P)和磺酸盐(S)。纤维素离子交换树脂例如DE23™、DE32™、DE52™、CM-23™、CM-32™和CM-52™可从Whatman Ltd.
Maidstone,Kent,U.K获得。基于SEPHADEX®和-locross-linked的离子交换剂也是已知的。例如,DEAE-、QAE-、CM-和SP- SEPHADEX®以及DEAE-、Q-、CM-和S-SEPHAROSE®和SEPHAROSE® Fast Flow都可从Pharmacia
AB获得。进一步地,DEAE和CM衍生的乙二醇-甲基丙烯酸酯共聚物,例如TOYOPEARL™ DEAE-650S或M和TOYOPEARL™ CM-650S或M可从Toso Haas Co.,Philadelphia,Pa获得。
将包括抗体和杂质例如一种或多种HCP的混合物装载到离子交换柱例如阳离子交换柱上。例如但不限于,依赖于所使用的柱,混合物可以以约80 g蛋白质/L树脂的负载装载。合适阳离子交换柱的例子是80 cm直径x 23 cm长的柱,其柱床体积是约116 L。装载到这个阳离子柱上的混合物可以随后用洗涤缓冲液(平衡缓冲液)洗涤。随后从柱中洗脱抗体,且获得第一种洗脱物。
这个离子交换步骤促进目的抗体的捕获,同时减少杂质例如HCPs。在特定方面,离子交换柱是阳离子交换柱。例如但不限于,用于此种阳离子交换柱的合适树脂是CM
HyperDF树脂。这些树脂可从商业来源例如Pall Corporation获得。这种阳离子交换程序可以在室温或在室温左右进行。
4.5
超滤/渗滤
本发明的特定实施方案采用超滤和/或渗滤步骤,以进一步纯化且浓缩抗体样品。超滤在Microfiltration
and Ultrafiltration:Principles and
Applications,L. Zeman和A.
Zydney(Marcel Dekker,Inc.,New York,N.Y.,1996);以及Ultrafiltration Handbook,Munir
Cheryan(Technomic Publishing,1986;ISBN No.
87762-456-9)中详细描述。优选过滤方法是如名称为"Pharmaceutical
Process Filtration Catalogue"第177-202页的Millipore目录(Bedford,Mass.,1995/96)中描述的切向流过滤。超滤一般被视为意指使用具有小于0.1 μm孔径的滤器的过滤。通过采用具有此种小孔径的滤器,样品体积可以通过样品缓冲液渗透经过滤器而减少,同时抗体被保留在滤器后。
渗滤是使用超滤器以去除且更换盐、糖和非水溶剂,分离游离与结合的种类,去除低分子量材料,和/或引起离子和/或pH环境的快速改变的方法。通过以约等于超滤速率的速率将溶剂添加到被超滤的溶液中,最有效地去除微溶质(microsolutes)。这以恒定体积洗涤来自溶液的微种类(microspecies),从而有效纯化所保留的抗体。在本发明的特定实施方案中,渗滤步骤用于更换与本发明结合使用的各种缓冲液,任选在进一步层析或其他纯化步骤前,以及去除来自抗体制剂的杂质。
4.6
疏水作用层析
本发明的特征还在于用于从包括抗体和至少一种HCP的混合物中生产HCP减少的抗体制剂的方法,其进一步包括疏水作用分离步骤。例如,可以使得自离子交换柱的第一种洗脱物经历疏水作用材料的处理,从而使得获得具有减少水平的HCP的第二种洗脱物。一般执行疏水作用层析步骤,例如本文公开的那些,以去除蛋白质聚集体,例如抗体聚集体,和过程相关的杂质。
在执行分离中,使样品混合物与HIC材料接触,例如使用分批纯化技术或使用柱。在HIC纯化前,可能希望去除任何离液剂或非常疏水的物质,例如通过使混合物经过前置柱。
例如,在分批纯化的背景中,HIC材料在所需平衡缓冲液中进行制备,或平衡至所需平衡缓冲液。获得HIC材料的浆。使抗体溶液与浆接触,以吸附要被分离到HIC材料的抗体。例如通过允许浆沉降且去除上清液,使包括不与HIC材料结合的HCPs的溶液与浆分离。可以对浆实施一个或多个洗涤步骤。若需要,则可以使浆与更低导电性的溶液接触,以使已与HIC材料结合的抗体解吸。为了洗脱结合的抗体,可以降低盐浓度。
虽然离子交换层析依赖于抗体的电荷以分离它们,但疏水作用层析使用抗体的疏水性质。在抗体上的疏水基团与在柱上的疏水基团相互作用。蛋白质越疏水,它将与柱的相互作用越强。因此,HIC步骤去除宿主细胞衍生的杂质(例如,DNA以及其他高和低分子量产物相关的种类)。
疏水作用在高离子强度下是最强的,因此,这种形式的分离方便地在盐沉淀或离子交换程序后执行。抗体与HIC柱的吸附受高盐浓度支持,但实际浓度可以在广泛范围上改变,这依赖于抗体的性质和所选择的具体HIC配体。各种离子可以以所谓的憎溶(soluphobic)系列排列,这依赖于其是促进疏水作用(盐析效应)还是破坏水的结构(离液效应),并且导致疏水作用的减弱。阳离子就渐增的盐析效应而言排序为Ba++;Ca++;Mg++;Li+ ;Cs+ ;Na+ ;K+ ;Rb+ ;NH4+,而阴离子可以就渐增的离液效应而言排序为PO--- ;SO4--
;CH3CO3 - ;Cl- ;Br- ;NO3- ;ClO4- ;I- ;SCN-。
一般而言,Na、K或NH4硫酸盐有效促进HIC中的配体-蛋白质相互作用。可以配制影响相互作用强度的盐,如由下述关系给出的:(NH4)2SO4 > Na2SO4 > NaCl > NH4Cl > NaBr >
NaSCN。一般而言,约0.75 – 约2 M硫酸铵或约1 – 4 M NaCl的盐浓度是有用的。
HIC柱正常包括疏水配体(例如,烷基或芳基)与之偶联的基本基质(例如,交联琼脂糖或合成共聚物材料)。合适的HIC柱包括由苯基基团取代的琼脂糖树脂(例如,Phenyl Sepharose™柱)。许多HIC柱是商购可得的。例子包括但不限于,具有低或高取代的Phenyl
Sepharose™ 6 Fast Flow柱(Pharmacia LKB Biotechnology,AB,瑞典);Phenyl Sepharose™ High
Performance柱(Pharmacia LKB Biotechnology,AB,瑞典);Octyl Sepharose™ High Performance柱(Pharmacia
LKB Biotechnology,AB,瑞典);Fractogel™ EMD Propyl或Fractogel™ EMD Phenyl柱(E. Merck,德国);Macro-Prep™ Mehyl或Macro-Prep™ t-Butyl Supports(Bio-Rad,California);WP
HI-Propyl(C3)™柱(J. T.
Baker,New Jersey);和Toyopearl™醚、苯基或丁基柱(TosoHaas,PA)。
4.7
示例性纯化策略
在特定实施方案中,初步回收可以通过顺次采用pH减少、离心和过滤步骤进行,以去除来自生产生物反应器收获物的细胞和细胞碎片(包括HCPs)。例如但不限于,可以使用约3.5的酸性pH进行约1小时,对包括抗体、培养基和细胞的培养物实施pH介导的病毒灭活。pH减少可以使用已知酸制剂得到促进,例如柠檬酸、例如3 M柠檬酸。暴露于酸性pH减少,如果并非完全消除的话,pH敏感性病毒污染物且使一些培养基/细胞污染物沉淀。在这个病毒减少/灭活步骤后,使用碱例如氢氧化钠,例如3 M氢氧化钠,进行约20 – 约40分钟,将pH调整至约4.9或5.0。这种调整可以在约20℃发生。在特定实施方案中,pH调整的培养物随后以约7000 x g – 约11,000 x g离心。在特定实施方案中,所得到的样品上清液随后经过包括多个深层滤器的滤器列(train)。在特定实施方案中,滤器列包括约12个16英寸Cuno™型号30/60ZA深层滤器(3M Corp.)和约3个圆形滤器外壳,配备有3个30英寸0.45/0.2 μm Sartopore™ 2过滤药液筒(Sartorius)。在容器例如预灭菌的收获容器中收集澄清的上清液,并且保持在约8℃。随后在下文概述的一个或多个捕获层析步骤前,将这个温度调整至约20℃。应当指出本领域技术人员可以改变上文描述的条件,并且仍在本发明的范围内。
在特定实施方案中,初步回收随后将为使用A蛋白树脂的亲和层析。存在关于A蛋白树脂的几个商业来源。一种合适的树脂是来自GE Healthcare的MabSelect™。用MabSelect™装填的合适柱的例子是约1.0 cm直径 x 约21.6 cm长的柱(~17 mL柱床体积)。这种大小的柱可以用于桌面规模。这可以与用于按比例提高的其他柱相比较。例如,其柱床体积为约6.6 L的20 cm x 21 cm柱可以用于按比例提高。与柱无关,柱可以使用合适树脂例如MabSelect™进行装填。
在其他实施方案中,使用阳离子交换柱进一步纯化澄清的上清液。在特定实施方案中,在阳离子交换柱中使用的平衡缓冲液是具有约5.0的pH的缓冲液。合适缓冲液的例子是约210 mM乙酸钠,pH 5.0。在平衡后,使柱装载有由上文初步回收步骤制备的样品。使柱装填阳离子交换树脂,例如来自GE
Healthcare的CM Sepharose™ Fast Flow。随后使用平衡缓冲液洗涤柱。接下来使用缓冲液对柱实施洗脱步骤,所述缓冲液与平衡或洗涤缓冲液相比较具有更大离子强度。例如,合适的洗脱缓冲液可以是约790
mM乙酸钠,pH 5.0。抗体将得到洗脱,且可以使用设为OD280nm的UV分光光度计进行监控。在一个具体例子中,洗脱收集可以来自上侧3
OD280nm到下侧8 OD280nm。应当理解本领域技术人员可以改变条件且仍在本发明的范围内。
在特定实施方案中,相反使用阴离子交换柱进一步纯化由初步回收获得的澄清的上清液。用于这个步骤的合适柱的非限制性例子是60 cm直径 x 30 cm长的柱,其柱床体积是约85 L。使柱装填阴离子交换树脂,例如来自GE Healthcare的Q Sepharose™ Fast
Flow。柱可以使用约7柱体积的合适缓冲液例如Tris/氯化钠进行平衡。合适条件的例子是在pH 8.0的25 mM
Tris,50 mM氯化钠。技术人员可以改变条件但仍在本发明的范围内。使柱装载有从上文概述的初步回收步骤收集的样品。在另一个方面,使柱装载在阳离子交换过程中收集的洗脱物。在柱装载后,用平衡缓冲液(例如Tris/氯化钠缓冲液)洗涤柱。可以使用UV分光光度计在OD280nm监控包括抗体的流通物。这个阴离子交换步骤减少过程相关的杂质,例如核酸如DNA和宿主细胞蛋白质。分离由于下述事实而发生:目的抗体基本上不与柱的固相例如Q Sepharose™相互作用也不与之结合,但许多杂质的确与柱的固相相互作用且结合。阴离子交换可以在约12℃执行。
在特定实施方案中,依赖于首先采用哪个离子交换步骤,接下来使用例如16英寸Cuno™去脂滤器过滤阳离子交换或阴离子交换洗脱物。使用去脂滤器的这种过滤可以随后为例如30英寸0.45/0.2 μm Sartopore™双层过滤药液筒。离子交换洗脱缓冲液可以用于冲洗在滤器中保留的剩余体积,并且准备用于超滤/渗滤。
为了完成超滤/渗滤步骤,在合适缓冲液例如20 mM磷酸钠,pH 7.0中制备过滤介质。可以添加盐例如氯化钠以增加离子强度,例如100
mM氯化钠。这个超滤/渗滤步骤用来浓缩抗IL-12、抗TNFα或抗IL-18抗体,去除乙酸钠且调整pH。商业滤器可用于实行这个步骤。例如,Millipore制造了30 kD分子量截止(MWCO)纤维素超滤器膜盒。这个过滤程序可以在室温或室温左右执行。
在特定实施方案中,对来自上文捕获过滤步骤的样品实施第二次离子交换分离步骤。优选地,这个第二次离子交换分离将涉及基于第一次离子交换分离相反电荷的分离。例如,如果在初步回收后采用阴离子交换步骤,那么第二个离子交换层析步骤可以是阳离子交换步骤。相反,如果初步回收步骤随后为阳离子交换步骤,那么这个步骤将随后为阴离子交换步骤。在特定实施方案中,可以直接对第一次离子交换洗脱物实施第二个离子交换层析步骤,其中将第一次离子交换洗脱物调整至合适缓冲条件。合适的阴离子和阳离子分离材料和条件在上文描述。
在本发明的特定实施方案中,包含抗体的样品将使用疏水作用分离步骤进一步加工。用于此种步骤的合适柱的非限制性例子是80 cm直径 x 15 cm长的柱,其柱床体积是约75 L,其装填用于HIC的合适树脂,例如但不限于来自Amersham
Biosciences,Upsala,瑞典的Phenyl
HP Sepharose™。得自先前阴离子交换层析步骤的包括目的抗体的流通物制剂可以用等体积的约1.7 M硫酸铵、50 mM磷酸钠,pH 7.0进行稀释。随后可以使用0.45/0.2 μm
Sartopore™ 2双层滤器或其等价物对这实施过滤。在特定实施方案中,疏水层析程序涉及2个或更多个循环。
在特定实施方案中,HIC柱首先用合适缓冲液进行平衡。合适缓冲液的非限制性例子是0.85
M硫酸铵、50 mM磷酸钠,pH
7.0。通过改变缓冲试剂的浓度和/或置换等价缓冲液,本领域技术人员可以改变平衡缓冲液且仍在本发明的范围内。在特定实施方案中,随后使柱装载有阴离子交换流通物样品,并且用合适缓冲系统例如硫酸铵/磷酸钠洗涤多次,例如3次。合适缓冲系统的例子包括具有约7.0的pH的1.1 M硫酸铵、50 mM磷酸钠缓冲液。任选地,柱可以经历进一步的洗涤循环。例如,第二个洗涤循环可以包括使用合适缓冲系统的多次柱洗涤,例如1 - 7次。合适缓冲系统的非限制性例子包括0.85 M硫酸铵、50 mM磷酸钠,pH 7.0。在一个方面,装载的柱经历使用合适缓冲系统的第三次洗涤。柱可以使用缓冲系统例如在pH约7.0的1.1 M硫酸铵、50 mM磷酸钠洗涤多次,例如1 - 3次。再次,本领域技术人员可以改变缓冲条件但仍在本发明的范围内。
柱使用合适的洗脱缓冲液进行洗脱。此种洗脱缓冲液的合适例子是在pH约7.0的0.5 M硫酸铵、15 mM磷酸钠。目的抗体可以使用常规分光光度计进行检测且收集,从在3 OD280 nm的上侧到在3 OD280 nm的峰的下侧。
在本发明的特定方面,对来自疏水层析步骤的洗脱物实施过滤用于去除病毒颗粒,包括完整病毒,如果存在的话。合适滤器的非限制性例子是来自Pall
Corporation的Ultipor DV50™滤器。其他病毒滤器可以用于这个过滤步骤,并且是本领域技术人员众所周知的。使HIC洗脱物经过约0.1 μm的预湿润滤器和在约34 磅/英寸2(psig)的2 x 30英寸Ultipor DV50™滤器列。在特定实施方案中,在过滤过程后,使用例如HIC洗脱缓冲液洗涤滤器,以去除滤器外壳中保留的任何抗体。滤液可以贮存于在约12℃的预灭菌的容器中。
在特定实施方案中,对来自上文的滤液再次实施超滤/渗滤。这个步骤是重要的,如果专业人员的终点是在例如药物制剂中使用抗体的话。如果采用,那么这个过程可以促进抗体的浓缩、先前使用的缓冲盐的去除,并且用特定配制缓冲液替换其。在特定实施方案中,执行用多个体积例如2体积的配制缓冲液的连续渗滤。合适配制缓冲液的非限制性例子是5 mM甲硫氨酸、2%甘露糖醇、0.5%蔗糖、pH 5.9缓冲液(无Tween)。在这个渗滤体积倍数(diavolume)交换完成后,使抗体浓缩。一旦已达到抗体的预定浓缩,专业人员随后就可以计算应添加的10%Tween量,以达到约0.005%(v/v)的最终Tween浓度。
本发明的特定实施方案将包括进一步的纯化步骤。可以在离子交换层析方法之前、期间或之后执行的另外纯化程序的例子包括乙醇沉淀、等电聚焦、反相HPLC、在二氧化硅上的层析、在肝素Sepharose™上的层析、进一步的阴离子交换层析和/或进一步的阳离子交换层析、层析聚焦、SDS-PAGE、硫酸铵沉淀、羟磷灰石层析、凝胶电泳、透析和亲和层析(例如使用A蛋白、G蛋白、抗体、特异性底物、配体或抗原作为捕获试剂)。
在本发明的特定实施方案中,抗IL-12抗体是包括图1中概述的重和轻链可变区序列的IgA1、IgA2、IgD、IgE、IgG1、IgG2、IgG3、IgG4或IgM同种型抗体。在优选实施方案中,抗IL-12抗体是包括图1中概述的重和轻链可变区序列的IgG1、IgG2、IgG3或IgG4同种型抗体,更优选地,抗IL-12抗体是包括图1中概述的重和轻链可变区序列的IgG1抗体。在本发明的特定实施方案中,抗TNFα抗体是包括图3中概述的重和轻链可变区序列的IgA1、IgA2、IgD、IgE、IgG1、IgG2、IgG3、IgG4或IgM同种型抗体。在优选实施方案中,抗TNFα抗体是包括图3中概述的重和轻链可变区序列的IgG1、IgG2、IgG3或IgG4同种型抗体,更优选地,抗TNFα抗体是包括图3中概述的重和轻链可变区序列的IgG1抗体。
5. 测定样品纯度的方法
5.1 测定宿主细胞蛋白质
本发明还提供了用于测定分离/纯化的抗体组合物中的宿主细胞蛋白质(HCP)浓度的残留水平的方法。如上所述,希望从最终靶物质产物例如抗IL-12、抗TNFα或抗IL-18抗体中排除HCPs。示例性HCPs包括源于抗体生产来源的蛋白质。无法鉴定且从靶抗体中充分去除HCPs可以导致减少的功效和/或不利的受试者反应。
如本文使用的,术语“HCP ELISA”指其中在测定中使用的第二种抗体对于由细胞例如CHO细胞产生的HCPs特异的ELISA,所述细胞用于生成抗体(例如抗IL-12、抗TNFα或抗IL-18抗体)。第二种抗体可以根据本领域技术人员已知的常规方法进行生产。例如,第二种抗体可以使用通过假生产和纯化运行获得的HCPs进行生产,即使用用于生产目的抗体的相同细胞系,但不用抗体DNA转染该细胞系。在示例性实施方案中,使用类似于在选择的细胞表达系统中表达的那些的HCPs生产第二种抗体,即用于生产靶抗体的细胞表达系统。
一般地,HCP ELISA包括使包括HCPs的液体样品夹心在2层抗体之间,即第一种抗体和第二种抗体。使样品温育,在这时间期间通过第一种抗体捕获在样品中的HCPs,所述第一种抗体例如但不限于亲和纯化的山羊抗CHO(Cygnus)。添加对由用于生成抗体的细胞生产的HCPs特异的、标记的第二种抗体,或抗体的掺合物,例如抗CHO
HCP Biotinylated,并且与样品内的HCPs结合。在特定实施方案中,第一种和第二种抗体是多克隆抗体。在特定方面,第一种和第二种抗体是针对HCPs产生的多克隆抗体的掺合物,例如但不限于生物素化的山羊抗宿主细胞蛋白质混合物599/626/748。使用基于第二种抗体的标记的合适测试,测定在样品中包含的HCP量。
HCP
ELISA可以用于测定抗体组合物中的HCPs水平,所述抗体组合物例如使用上文描述的方法获得的洗脱物或流通物。本发明还提供了包括抗体的组合物,其中所述组合物不具有如通过HCP酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay)(“ELISA”)测定的可检测水平的HCPs。
5.2
测定亲和层析材料
在特定实施方案中,本发明还提供了用于测定分离/纯化的抗体组合物中残留水平的亲和层析材料的方法。在特定背景中,此种材料在纯化过程期间浸出到抗体组合物内。在特定实施方案中,采用用于鉴定分离/纯化的抗体组合物中的A蛋白浓度的测定。如本文使用的,术语“A蛋白ELISA”指其中在测定中使用的第二种抗体对用于纯化目的抗体的A蛋白特异的ELISA,所述目的抗体例如抗IL-12、抗TNFα或抗IL-18抗体。第二种抗体可以根据本领域技术人员已知的常规方法进行生产。例如,在用于抗体生成和生产的常规方法的背景中,第二种抗体可以使用天然存在或重组的A蛋白进行生产。
一般地,A蛋白ELISA包括使包括A蛋白(或可能包含A蛋白)的液体样品夹心在2层抗A蛋白抗体之间,即第一种抗A蛋白抗体和第二种抗A蛋白抗体。使样品暴露于第一层抗A蛋白抗体,例如但不限于多克隆抗体或多克隆抗体掺合物,并且温育足够样品中的A蛋白被第一种抗体捕获的时间。随后添加对A蛋白特异的标记的第二种抗体,例如但不限于多克隆抗体或多克隆抗体掺合物,并且与样品内捕获的A蛋白结合。在本发明的背景中有用的抗A蛋白抗体的另外非限制性例子包括鸡抗A蛋白和生物素化的抗A蛋白抗体。在样品中包含的A蛋白量使用基于第二种抗体的标记的合适测试进行测定。相似测定可以用于鉴定可替代的亲和层析材料的浓度。
A蛋白ELISA可以用于测定抗体组合物中的A蛋白水平,例如使用上文中描述的过程获得的洗脱物或流通物。本发明还提供了包括抗体的组合物,其中所述组合物不具有如通过A蛋白酶联免疫吸附测定(“ELISA”)测定的可检测水平的A蛋白。
6.
进一步修饰
本发明的抗体可以进行修饰。在一些实施方案中,抗体或其抗原结合片段进行化学修饰,以提供所需效应。例如,本发明的抗体或抗体片段的加入聚乙二醇可以通过本领域已知的任何加入聚乙二醇反应执行,如例如下述参考文献中描述的:Focus
on Growth Factors 3:4-10(1992);EP 0 154 316;和EP 0
401 384,其各自整体引入本文作为参考。在一个方面,经由与反应性聚乙二醇分子(或类似的反应性水溶性聚合物)的酰化反应或烷基化反应执行加入聚乙二醇。用于本发明的抗体和抗体片段的加入聚乙二醇的合适水溶性聚合物是聚乙二醇(PEG)。如本文使用的,“聚乙二醇”意欲包含已用于衍生其他蛋白质的任何形式的PEG,例如单(Cl-ClO)烷氧基或芳氧基-聚乙二醇。
用于制备本发明的加入聚乙二醇的抗体和抗体片段的方法一般将包括步骤(a)在由此抗体或抗体片段变得与一个或多个PEG基团附着的合适条件下,使抗体或抗体片段与聚乙二醇反应,例如PEG的反应性酯或醛衍生物,和(b)获得反应产物。基于已知参数和所需结果选择最佳反应条件或酰化反应,对于本领域普通技术人员将是显而易见的。
对于IL-12、TNFα或IL-18特异的加入聚乙二醇的抗体和抗体片段一般可以用于治疗本发明的IL-12相关的、TNFα相关的或IL-18相关的病症,其通过施用本文描述的抗IL-12、抗TNFα或抗IL-18抗体和抗体片段来实现。一般地,与非加入聚乙二醇的抗体和抗体片段相比较,加入聚乙二醇的抗体和抗体片段具有增加的半衰期。加入聚乙二醇的抗体和抗体片段可以单独、一起或与其他药物组合物组合使用。
本发明的抗体或抗体部分可以由另一种功能分子(例如,另一种肽或蛋白质)衍生或连接。因此,本发明的抗体和抗体部分意欲包括衍生化且以其他方式修饰形式的本文描述的人抗hIL-12、抗TNFα或抗hIL-18抗体,包括免疫粘附分子。例如,本发明的抗体或抗体部分可以与一种或多种其他分子实体在功能上连接(通过化学偶联、遗传融合、非共价结合或其他方式),所述其他分子实体例如另一种抗体(例如,双特异性抗体或双抗体)、可检测试剂、细胞毒剂、药物试剂和/或蛋白质或肽,其可以介导抗体或抗体部分与另一种分子(例如链霉抗生物素蛋白核心区或多组氨酸标签)的结合。
一类衍生化抗体通过使2种或更多种抗体(具有相同类型或不同类型,例如以产生双特异性抗体)交联而产生。合适交联剂包括其为异双功能或同双功能(例如,二琥珀酰亚胺基辛二酸酯)的那些,所述异双功能的那些具有由合适间隔基分开的2种不同的反应基团(例如,m-马来酰亚胺基苯甲酰-N-羟基琥珀酰亚胺酯)。此种接头可从Pierce Chemical Company,Rockford,IL获得。
本发明的抗体或抗体部分可以由其衍生的有用可检测试剂包括荧光化合物。示例性荧光可检测试剂包括荧光素、异硫氰酸荧光素、罗丹明、5-二甲胺-1-萘磺酰氯、藻红蛋白等。抗体还可以由可检测酶衍生,例如碱性磷酸酶、辣根过氧化物酶、葡糖氧化酶等。当抗体由可检测酶衍生化时,它通过添加酶用于产生可检测反应产物的另外试剂进行检测。例如,当存在可检测试剂辣根过氧化物酶时,过氧化氢和二氨基联苯胺的添加导致可检测的有色反应产物。抗体还可以由生物素衍生化,并且通过抗生物素蛋白或链霉抗生物素蛋白结合的间接测量进行检测。
7. 药物组合物
本发明的抗体和抗体部分可以掺入适合于给受试者施用的药物组合物内。一般地,药物组合物包含本发明的抗体或抗体部分和药学可接受的载体。如本文使用的,“药学可接受的载体”包括生理学相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗和吸收延迟剂等。药学可接受的载体的例子包括下述一种或多种:水、盐水、磷酸缓冲盐水、葡萄糖、甘油、乙醇等,及其组合。在许多情况中,需要在组合物中包括等渗剂,例如糖、多元醇例如甘露糖醇、山梨糖醇、或氯化钠。药学可接受的载体可以进一步包含少量辅助物质,例如湿润剂或乳化剂、防腐剂或缓冲液,所述辅助物质增强抗体或抗体部分的保存期限或效力。
本发明的抗体和抗体部分可以掺入适用于肠胃外施用的药物组合物内。抗体或抗体部分可制备为包含例如0.1-250 mg/mL抗体的可注射溶液。可注射溶液可以由在燧石或琥珀色小瓶、安瓿或预装注射器中的液体或冷冻干燥剂型组成。缓冲液可以是约1-50
mM的L-组氨酸(最佳5-10
mM),pH 5.0-7.0(最佳pH
6.0)。其他合适的缓冲液包括但不限于,琥珀酸钠、柠檬酸钠、磷酸钠或磷酸钾。氯化钠可以用于修饰浓度0-300
mM(对于液体剂型最佳150 mM)的溶液的毒性。对于冷冻干燥剂型可以包括冷冻保护剂,主要为0-10%蔗糖(最佳0.5-1.0%)。其他合适的冷冻保护剂包括海藻糖和乳糖。对于冷冻干燥剂型可以包括膨胀剂,主要为1-10%甘露糖醇(最佳24%)。稳定剂可以在液体和冷冻干燥剂型中使用,主要为1-50
mM L-甲硫氨酸(最佳5-10 mM)。其他合适的膨胀剂包括甘氨酸、精氨酸,可以作为0-0.05%聚山梨醇酯80(最佳0.005-0.01%)包括。另外的表面活性剂包括但不限于,聚山梨醇酯20和BRIJ表面活性剂。
在一个方面,药物组合物包括约0.01 mg/kg-10 mg/kg剂量的抗体。在另一个方面,抗体的剂量包括每隔一周施用的约1
mg/kg,或每周一次施用的约0.3 mg/kg。熟练专业人员可以确定用于施用于受试者的正确剂量和方案。
本发明的组合物可以为多种形式。这些包括例如,液体、半固体和固体剂型,例如液体溶液(例如,可注射和可输注溶液)、分散体或悬浮液、片剂、丸剂、粉末、脂质体和栓剂。形式取决于例如预期施用方式和治疗应用。一般的组合物为可注射或可输注溶液形式,例如类似于由其他抗体被动免疫接种人使用的那些的组合物。一种施用方式是肠胃外的(例如,静脉内、皮下、腹膜内、肌内)。在一个方面,抗体通过静脉内输注或注射来施用。在另一个方面,抗体通过肌内或皮下注射来施用。
治疗组合物一般必须是无菌的且在制备和贮存条件下是稳定的。组合物可以配制为溶液、微乳剂、分散体、脂质体、或适合于高药物浓度的其他有序结构。无菌可注射溶液可以通过下述制备:将需要量的活性化合物(即,抗体或抗体部分)与上文列举的一种成分或成分组合一起掺入合适的溶剂中,必要时随后进行过滤灭菌。一般地,分散体通过将活性化合物掺入无菌载体内来制备,所述无菌载体包含基本分散介质和来自上文列举那些的必需的其他成分。在用于制备无菌可注射溶液的无菌、冷冻干燥粉末的情况下,制备方法是由其先前无菌过滤的溶液产生活性成分加任何另外所需成分的粉末的真空干燥和喷雾干燥。溶液的正确流动性可以通过下述来维持,例如利用包衣例如卵磷脂,在分散体的情况下维持所需颗粒大小和利用表面活性剂。可注射组合物的延长吸收可以通过在组合物中包括延迟吸收的试剂来引起,所述试剂例如单硬脂酸盐和明胶。
本发明的抗体和抗体部分可以通过本领域已知的多种方法来施用,一种施用途径/模式是皮下注射、静脉内注射或输注。如技术人员将认识到的,施用途径和/或模式将依所需结果而变。在某些实施方案中,活性化合物可以与载体一起制备,所述载体将保护化合物免于快速释放,例如控释制剂,包括植入物、经皮贴剂、和微囊化递送系统。可以使用生物可降解的、生物相容的聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备此种制剂的许多方法是获得专利保护的或是本领域技术人员一般已知的。参见,例如,Sustained
and Controlled Release Drug Delivery Systems,J.R.
Robinson,编辑,Marcel Dekker,Inc.,New York,1978,其完整教导引入本文作为参考。
在特定方面,本发明的抗体或抗体部分可以例如,与惰性稀释剂或可同化食用载体一起经口施用。化合物(和若需要,其他成分)也可以装入硬或软壳明胶胶囊中,压缩成片剂,或直接掺入受试者的饮食内。对于经口治疗施用,化合物可以与赋形剂掺合,且以可摄食片剂、口腔含化片剂、锭剂、胶囊、酏剂、悬浮液、糖浆、薄片(wafer)等的形式使用。为了通过除肠胃外施用外施用本发明的化合物,可能必须用材料包被化合物、或将化合物与材料共施用,以防止其失活。
补充性活性化合物也可以掺入组合物内。在特定方面,本发明的抗体或抗体部分与一种或多种另外的治疗剂共配制和/或共施用,所述治疗剂可用于治疗其中IL-12、TNFα或IL-18活性有害的病症。例如,本发明的抗hIL-12、抗TNFα或抗IL-18抗体或抗体部分可以与结合其他靶的一种或多种另外的抗体(例如,结合其他细胞因子或结合细胞表面分子的抗体)共配制和/或共施用。此外,本发明的一种或多种抗体可以与2种或更多前述治疗剂组合使用。此种组合疗法可以有利地利用较低剂量的施用的治疗剂,从而避免与各种单一疗法相关的可能毒性或并发症。熟练专业人员将认识到,当本发明的抗体用作联合治疗的部分时,可能需要比抗体单独施用于受试者时更低剂量的抗体(例如,协同疗效可以通过使用联合治疗来达到,其反过来又允许使用较低剂量的抗体以达到所需疗效)。
应当理解本发明的抗体或其抗原结合部分可以单独或与另外的试剂例如治疗剂组合使用,所述另外的试剂由技术人员根据其预期目的进行选择。例如,另外的试剂可以是领域公认为治疗由本发明的抗体治疗的疾病或状况有用的治疗剂。另外的试剂也可以是赋予治疗组合物有利属性的试剂,例如影响组合物粘度的试剂。
应进一步理解将包括在本发明内的组合是对其预期目的有用的那些组合。下文所述试剂是举例说明性的且不希望是限制性的。作为本发明部分的组合可以是本发明的抗体和选自下列的至少一种另外的试剂。组合还可以包括超过一种另外的试剂,例如,2种或3种另外的试剂,如果组合是这样的,从而使得形成的组合物可以执行其预期功能的话。
一些组合是非类固醇消炎药,也称为NSAIDS,它包括药物如布洛芬。其他组合是皮质类固醇,包括强的松龙;当与本发明的抗-IL-12抗体组合治疗患者时,通过逐渐减少所需的类固醇剂量,可以减少或甚至消除类固醇使用的众所周知的副作用。本发明的抗体或抗体部分可以与之组合用于类风湿性关节炎的治疗剂的非限制性例子包括下述:细胞因子抑制性消炎药(CSAIDs);针对其他人细胞因子或生长因子的抗体或拮抗剂,例如,TNF、LT、IL-1、IL-2、IL-6、IL-7、IL-8、IL-15、IL-16、IL-18、EMAP-II、GM-CSF、FGF、和PDGF。本发明的抗体或其抗原结合部分可以与针对细胞表面分子或其配体包括CD154(gp39或CD40L)的抗体组合,所述细胞表面分子例如CD2、CD3、CD4、CD8、CD25、CD28、CD30、CD40、CD45、CD69、CD80(B7.1)、CD86(B7.2)、CD90。
治疗剂的一些组合可以在自身免疫和后续炎症级联中的不同点上进行干扰;例子包括TNF拮抗剂,如嵌合、人源化或人TNF抗体,D2E7(于1996年2月9日提交的美国申请系列号08/599,226,其完整教导引入本文作为参考),cA2(Remicade™),CDP 571,抗TNF抗体片段(例如CDP870),和可溶性p55或p75 TNF受体,其衍生物(p75TNFRIgG(EnbrelTM)或p55TNFR1gG(Lenercept),可溶性IL-13受体(sIL-13),以及TNFα转换酶(TACE)抑制剂;类似地由于相同原因IL-1抑制剂(例如,白细胞介素-1转换酶抑制剂,例如Vx740或IL-1RA等)可以是有效的。其他组合包括白细胞介素11、抗-P7s和p-选择蛋白糖蛋白配体(PSGL)。另外的组合包括自身免疫应答的关键参与物(player),所述关键参与物与IL-12功能平行作用,依赖于IL-12功能或与IL-12功能一致;尤其包括的是IL-18拮抗剂,包括IL-18抗体或可溶性IL-18受体,或IL-18结合蛋白。已显示IL-12和IL-18具有重叠但不同的功能,且针对二者的拮抗剂组合可能是最有效的。另外一种组合包括非耗尽性抗CD4抑制剂。另外一种组合包括共刺激途径CD80(B7.1)或CD86(B7.2)的拮抗剂,包括抗体、可溶性受体或拮抗性配体。
本发明的抗体或其抗原结合部分还可以与试剂组合,所述试剂例如氨甲蝶呤、6-MP、硫唑嘌呤 柳氮磺吡啶、美沙拉秦、奥沙拉嗪氯喹(chloroquinine)/羟氯喹、青霉胺、硫化苹果酸金(肌内和经口)、硫唑嘌呤、秋水仙碱、皮质类固醇(经口、吸入和局部注射)、β2肾上腺素受体激动剂(沙丁胺醇、特布他林、沙美特罗)、黄嘌呤(茶碱、氨茶碱)、色甘酸盐、萘多罗米、酮替芬、异丙托铵和乙东碱、环孢菌素、FK506、雷帕霉素、霉酚酸酯、来氟洛米、NSAIDs例如布洛芬、皮质类固醇例如强的松龙、磷酸二酯酶抑制剂、腺苷激动剂、抗凝剂、补体抑制剂、肾上腺素能药、干扰经由促炎细胞因子例如TNFα或IL-1的发信号的试剂(例如IRAK、NIK、IKK、p38或MAP激酶抑制剂)、IL-1β转换酶抑制剂(例如Vx740)、抗-P7s、p-选择蛋白糖蛋白配体(PGSL)、TNFα转换酶(TACE)抑制剂、T细胞发信号抑制剂例如激酶抑制剂、金属蛋白酶抑制剂、柳氮磺吡啶、硫唑嘌呤、6-巯基嘌呤、血管紧张素转换酶抑制剂、可溶性细胞因子受体及其衍生物(例如,可溶性p55或p75 TNF受体和衍生物p75TNFRIgG(Enbrel.TM.)和p55TNFRIgG(Lenercept)、sIL-1RI、sIL-1RII、sIL-6R、可溶性IL-13受体(sIL-13))和抗炎细胞因子(例如,IL-4、IL-10、IL-11、IL-13和TGFβ)。一些组合包括氨甲蝶呤或来氟洛米,并且在中等或重度类风湿性关节炎的情况下,环孢菌素。
本发明的抗体或抗体部分可以与之组合用于炎性肠病的治疗剂的非限制性例子包括下述:布地奈德,表皮生长因子,皮质类固醇,环孢菌素,柳氮磺吡啶,氨基水杨酸盐,6-巯基嘌呤,硫唑嘌呤,甲硝唑,脂肪加氧酶抑制剂,美沙拉秦,奥沙拉嗪,巴柳氮,抗氧化剂,血栓烷抑制剂,IL-1受体拮抗剂,抗-IL-1α单克隆抗体,抗-IL-6单克隆抗体,生长因子,弹性蛋白酶抑制剂,吡啶基-咪唑化合物,针对其他人细胞因子或生长因子的抗体或拮抗剂,所述细胞因子或生长因子例如TNF、LT、IL-1、IL-2、IL-6、IL-7、IL-8、IL-15、IL-16、IL-18、EMAP-II、GM-CSF、FGF、和PDGF。本发明的抗体或其抗原结合部分可以与针对细胞表面分子或其配体的抗体组合,所述细胞表面分子例如CD2、CD3、CD4、CD8、CD25、CD28、CD30、CD40、CD45、CD69、CD90。本发明的抗体或其抗原结合部分还可以与试剂组合,所述试剂例如氨甲蝶呤、环孢菌素、FK506、雷帕霉素、霉酚酸酯、来氟洛米、NSAIDs例如布洛芬、皮质类固醇例如强的松龙、磷酸二酯酶抑制剂、腺苷激动剂、抗凝剂、补体抑制剂、肾上腺素能药、干扰经由促炎细胞因子例如TNFα或IL-1的发信号的试剂(例如IRAK、NIK、IKK、p38或MAP激酶抑制剂)、IL-1β转换酶抑制剂(例如Vx740)、抗-P7s、p-选择蛋白糖蛋白配体(PGSL)、TNFα转换酶抑制剂、T细胞发信号抑制剂例如激酶抑制剂、金属蛋白酶抑制剂、柳氮磺吡啶、硫唑嘌呤、6-巯基嘌呤、血管紧张素转换酶抑制剂、可溶性细胞因子受体及其衍生物(例如可溶性p55或p75 TNF受体,sIL-1RI、sIL-1RII、sIL-6R、可溶性IL-13受体(sIL-13))和抗炎细胞因子(例如,IL-4、IL-10、IL-11、IL-13和TGFβ)。
其中抗体或抗原结合部分可以组合用于Crohn氏病的治疗剂的例子包括下述:TNF拮抗剂,例如抗TNF抗体,D2E7(于1996年2月9日提交的美国申请系列号08/599,226,其完整教导引入本文作为参考)、cA2(RemicadeTM)、CDP 571、抗TNF抗体片段(例如,CDP870),TNFR-Ig构建体(p75TNFRIgG(EnbrelTM)和p55TNFRIgG(Lenercept))、抗-P7s、p-选择蛋白糖蛋白配体(PGSL)、可溶性IL-13受体(sIL-13)和PDE4抑制剂。本发明的抗体或其抗原结合部分可以与皮质类固醇组合,例如布地奈德和地塞米松。本发明的抗体或其抗原结合部分还可以与试剂组合,所述试剂例如柳氮磺吡啶、5-氨基水杨酸和奥沙拉嗪,以及干扰促炎细胞因子例如IL-1合成或作用的试剂,例如IL-1转换酶抑制剂(例如Vx740)和IL-1ra。本发明的抗体或其抗原结合部分还可以与T细胞发信号抑制剂一起使用,例如,酪氨酸激酶抑制剂 6-巯基嘌呤。本发明的抗体或其抗原结合部分可以与IL-11组合。
本发明的抗体或抗体部分可以与之组合用于多发性硬化的治疗剂的非限制性例子包括下述:皮质类固醇,强的松龙,甲基强的松龙,硫唑嘌呤,环磷酰胺,环孢菌素,氨甲蝶呤,4-氨基吡啶,替扎尼定,IFNβ1a(Avonex;Biogen),IFNβ1b(Betaseron;Chiron/Berlex),共聚物1(Cop-1,Copaxone,Teva
Pharmaceutical Industries,Inc.),高压氧,静脉内免疫球蛋白,克拉屈滨(clabribine),针对其他人细胞因子或生长因子的抗体或拮抗剂,例如,TNF、LT、IL-1、IL-2、IL-6、IL-7、IL-8、IL-15、IL-16、IL-18、EMAP-II、GM-CSF、FGF、和PDGF。本发明的抗体或其抗原结合部分可以与针对细胞表面分子或其配体的抗体组合,所述细胞表面分子例如CD2、CD3、CD4、CD8、CD25、CD28、CD30、CD40、CD45、CD69、CD80、CD86、CD90。本发明的抗体或其抗原结合部分还可以与试剂组合,所述试剂例如氨甲蝶呤、环孢菌素、FK506、雷帕霉素、霉酚酸酯、来氟洛米、NSAIDs例如布洛芬、皮质类固醇例如强的松龙、磷酸二酯酶抑制剂、腺苷激动剂、抗凝剂、补体抑制剂、肾上腺素能药、干扰经由促炎细胞因子例如TNFα或IL-1的发信号的试剂(例如IRAK、NIK、IKK、p38或MAP激酶抑制剂)、IL-1β转换酶抑制剂(例如Vx740)、抗-P7s、p-选择蛋白糖蛋白配体(PGSL)、TACE抑制剂、T细胞发信号抑制剂例如激酶抑制剂、金属蛋白酶抑制剂、柳氮磺吡啶、硫唑嘌呤、6-巯基嘌呤、血管紧张素转换酶抑制剂、可溶性细胞因子受体及其衍生物(例如可溶性p55或p75 TNF受体,sIL-1RI、sIL-1RII、sIL-6R、可溶性IL-13受体(sIL-13))和抗炎细胞因子(例如IL-4、IL-10、IL-13和TGFβ)。
其中本发明的抗体或其抗原结合部分可以组合用于多发性硬化的治疗剂的例子包括IFNβ,例如IFNβ1a和IFNβ1b,考帕松,皮质类固醇,IL-1 抑制剂,TNF抑制剂,以及针对CD40配体和CD80的抗体。
本发明的药物组合物可以包括“治疗有效量”或“预防有效量”的本发明的抗体或抗体部分。“治疗有效量”指在所需剂量和时间段有效达到所需治疗结果的量。抗体或抗体部分的治疗有效量可以根据下述因素而变,例如个体疾病状态、年龄、性别、和重量,以及抗体或抗体部分在个体中引起所需应答的能力。治疗有效量也是其中治疗有利作用大于抗体或抗体部分的任何毒性或有害作用的量。“预防有效量”指在所需剂量和时间段有效达到所需预防结果的量。一般地,因为预防剂量在疾病前或疾病早期时在受试者中使用,所以预防有效量将小于治疗有效量。
剂量方案可以进行调整以提供最佳所需应答(例如,治疗或预防应答)。例如,可以施用快速灌注方式,几个分份剂量可以随着时间过去而施用,或剂量可以如治疗情形的紧急状态所指示的按比例减少或增加。在特定实施方案中,为了易于施用和剂量一致,以单位剂型配制肠胃外组合物是尤其有利的。如本文使用的,单位剂型指适合作为单一剂量用于待治疗的哺乳动物受试者的物理上不连续单位;每个单位包含与所需药学载体结合的计算为产生所需疗效的预定量的活性化合物。关于本发明的单位剂型的详细说明由下述指示且直接取决于下述:(a)活性化合物的独特特征和待达到的具体治疗或预防作用,和(b)配合这种用于治疗个体中敏感性的活性化合物的领域固有的局限性。
关于本发明的抗体或抗体部分的治疗或预防有效量的示例性、非限制性范围是0.01-20 mg/kg,或1-10 mg/kg,或0.3-1
mg/kg。应当指出剂量值可以依待减轻的状况类型和严重性而变。应进一步理解对于任何特定受试者,根据个体需要和施用或监督组合物施用的人的专业判断,具体剂量方案应当随着时间过去进行调整,并且本文所述的剂量范围仅是示例性的,且不意欲限制要求保护的组合物的范围或实践。
8. 本发明抗体的用途
8.1. 抗IL-12抗体的一般用途
已知其与IL-12结合的能力,本发明的抗IL-12抗体或其部分可以用于检测IL-12,在一个方面,hIL-12(例如在样品基质中,在一个方面,生物学样品,例如血清或血浆),其中使用常规免疫测定,例如酶联免疫吸附测定(ELISA)、放射免疫测定(RIA)或组织免疫组织化学。本发明提供了用于检测生物学样品中的IL-12的方法,其包括使样品与本发明的抗体或抗体部分接触,并且检测与IL-12结合的抗体(或抗体部分)或未结合的抗体(或抗体部分),以从而检测样品中的IL-12。抗体用可检测物质直接或间接进行标记,以促进结合或未结合的抗体的检测。合适的可检测物质包括各种酶、辅基、荧光材料、发光材料和放射性材料。合适酶的例子包括辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶;合适辅基复合物的例子包括链霉抗生物素蛋白/生物素和抗生物素蛋白/生物素;合适荧光材料的例子包括伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺(dichlorotriazinylamine)荧光素、丹磺酰氯或藻红蛋白;发光材料的例子包括鲁米诺;并且合适放射性材料的例子包括125 I、131 I、35 S或3 H。样品中IL-12的检测可以用于诊断背景中,例如在与增加的IL-12相关的状况诊断中,和/或可以用于鉴定可能获益于用抗IL-12抗体治疗的受试者中。
对于标记抗体可替代的,可以通过竞争免疫测定来测定样品中的IL-12,其中利用例如用可检测物质标记的rhIL-12标准和未标记的抗IL-12抗体,例如抗hIL-12抗体。在这个测定中,使样品、标记的rhIL-12标准和抗hIL-12抗体组合,并且测定与未标记的抗体结合的标记的rhIL-12标准的量。样品中的hIL-12的量与和抗hIL-12抗体结合的标记的rhIL-12标准的量成反比。
本发明的抗体和抗体部分能够在体外和体内中和IL-12活性,在一个方面,hIL-12活性。因此,本发明的抗体和抗体部分可以用于抑制IL-12活性,例如在包含IL-12的细胞培养中、在人受试者中或在具有本发明的抗体与之交叉反应的IL-12的其他哺乳动物受试者中(例如灵长类动物,例如狒狒、食蟹猴和猕猴)。在一个方面,本发明提供了分离的人抗体或其抗原结合部分,其中和人IL-12和选自下述的至少一种另外灵长类动物IL-12的活性:狒狒IL-12、狨猴IL-12、黑猩猩IL-12、食蟹猴IL-12和猕猴IL-12,但不中和小鼠IL-12的活性。在一个方面,IL-12是人IL-12。例如,在包含或怀疑包含hIL-12的细胞培养中,本发明的抗体或抗体部分可以添加到培养基中,以抑制培养物中的hIL-12活性。
在另一个方面,本发明提供了用于抑制受试者中的IL-12活性的方法,所述受试者患有其中IL-12活性有害的病症。IL-12已牵涉于广泛多样病症的病理生理学(Windhagen等人,(1995)J. Exp. Med. 182:1985-1996;Morita等人(1998)Arthritis and
Rheumatism. 41:306-314;Bucht等人,(1996)Clin. Exp.
Immunol. 103:347-367;Fais等人(1994)J. Interferon
Res. 14:235-238;Pyrronchi等人,(1997)Am. J. Path.
150:823-832;Monteleone等人,(1997)Gastroenterology. 112:1169-1178,和Berrebi等人,(1998)Am. J. Path 152:667-672;Pyrronchi等人(1997)Am. J. Path.
150:823-832,其完整教导引入本文作为参考)。本发明提供了用于抑制患有此种病症的受试者中的IL-12活性的方法,所述方法包括给受试者施用本发明的抗体或抗体部分,从而使得抑制受试者中的IL-12活性。在一个方面,IL-12是人IL-12,并且受试者是人受试者。可替代地,受试者可以是表达本发明的抗体与之交叉反应的IL-12的哺乳动物。再进一步地,受试者可以是hIL-12已引入其内(例如,通过施用hIL-12或通过表达hIL-12转基因)的哺乳动物。本发明的抗体可以施用于人受试者用于治疗目的。此外,本发明的抗体可以施用于表达抗体与之交叉反应的IL-12的非人哺乳动物用于兽医学目的或作为人疾病的动物模型。关于后者,此种动物模型可以用于评价本发明的抗体的治疗功效(例如,测试施用剂量和时间过程)。
如本文使用的,短语“其中IL-12活性有害的病症”意欲包括这样的疾病和其他病症,其中在患有病症的受试者中IL-12的存在已显示负责或怀疑负责病症的病理生理学,或者是或怀疑是促成病症恶化的因素。因此,其中IL-12活性有害的病症是其中IL-12活性的抑制预期减轻病症的症状和/或进展的病症。此种病症可以例如通过患有病症的受试者的生物学流体中IL-12浓度中的增加(例如,在受试者的血清、血浆、滑液等中IL-12浓度中的增加)得以证明,这可以例如使用如上所述的抗IL-12抗体进行检测。存在其中IL-12活性有害的病症的众多例子。在一个方面,抗体或其抗原结合部分可以在疗法中用于治疗本文描述的疾病或病症。在另一个方面,抗体或其抗原结合部分可以用于制造用于治疗本文描述的疾病或病症的药物。本发明的抗体和抗体部分在少数非限制性特定病症的治疗中的使用在下文进一步讨论。
白细胞介素12在与涉及免疫和炎症要素的多种疾病相关的病理学中起关键作用。这些疾病包括但不限于,类风湿性关节炎、骨关节炎、青少年慢性关节炎、莱姆关节炎、牛皮癣性关节炎、反应性关节炎、脊椎关节病、全身性红斑狼疮、Crohn氏病、溃疡性结肠炎、炎性肠病、胰岛素依赖性糖尿病、甲状腺炎、哮喘、变应性疾病、牛皮癣、皮炎硬皮病、特应性皮炎、移植物抗宿主病、器官移植排斥、与器官移植相关的急性或慢性免疫性疾病、肉状瘤病、动脉粥样硬化、弥散性血管内凝血、Kawasaki氏病、Grave氏病、肾病综合征、慢性疲乏综合征、韦格纳氏肉芽肿病、过敏性紫癜(Henoch-Schoenlein
purpurea)、肾显微血管炎、慢性活动性肝炎、葡萄膜炎、脓毒性休克、中毒性休克综合征、脓毒病综合征、恶病质、传染病、寄生虫病、获得性免疫缺陷综合征、急性横贯性脊髓炎、亨廷顿氏舞蹈病、帕金森氏病、阿尔茨海默氏病、中风、原发性胆汁性肝硬变、溶血性贫血、恶性肿瘤、心力衰竭、心肌梗死、Addison氏病、散发性多腺性I型缺乏和多腺性II型缺乏、Schmidt氏综合征、成人(急性)呼吸窘迫综合征、秃头、斑秃(alopecia
areata)、血清反应阴性关节病(arthopathy)、关节病、Reiter氏病、牛皮癣性关节病、溃疡性结肠炎性关节病、肠病性滑膜炎、衣原体、耶尔森氏菌和沙门氏菌相关性关节病、脊椎关节病(spondyloarthopathy)、动脉粥样化疾病/动脉硬化、特应性变态反应、自身免疫性大疱性疾病、寻常天疱疮、落叶状天疱疮、类天疱疮、线性IgA疾病、自身免疫性溶血性贫血、Coombs阳性溶血性贫血、获得性恶性贫血、青少年性恶性贫血、肌痛脑炎/Royal
Free疾病、慢性粘膜皮肤念珠菌病、巨细胞性动脉炎、原发性硬化性肝炎、隐原性自身免疫性肝炎、获得性免疫缺陷病综合征、获得性免疫缺陷相关病、丙型肝炎、常见的各种免疫缺陷(常见的可变低丙种球蛋白血症)、扩张型心肌病、女性不育、卵巢衰竭、过早卵巢衰竭、纤维化肺疾病、隐原性纤维化肺泡炎、炎症后间质性肺病、间质性肺炎、结缔组织病相关性间质性肺病、混合型结缔组织病相关性肺病、全身性硬皮病相关性间质性肺病、类风湿性关节炎相关性间质性肺病、全身性红斑狼疮相关性肺病、皮肌炎/多肌炎相关性肺病、Sjodgren氏病相关性肺病、强直性脊柱炎相关性肺病、脉管炎性弥散性肺病、含铁血黄素沉着病相关性肺病、药物诱导的间质性肺病、放射性纤维化、闭塞性细支气管炎、慢性嗜酸性肺炎、淋巴细胞性浸润性肺病、传染后间质性肺病、痛风性关节炎、自身免疫性肝炎、1型自身免疫性肝炎(传统自身免疫性或狼疮样肝炎)、2型自身免疫性肝炎(抗LKM抗体肝炎)、自身免疫介导的低血糖、具有黑棘皮症的B型胰岛素耐受性、甲状旁腺机能减退、与器官移植相关的急性免疫性疾病、与器官移植相关的慢性免疫性疾病、骨关节病、原发性硬化性胆管炎、特发性白细胞减少(leucopenia)、自身免疫性嗜中性白细胞减少症、肾脏病NOS、肾小球肾炎(glomerulonephritides)、肾显微血管炎(vasulitis)、莱姆病、盘状红斑狼疮、特发性男性不育症或NOS、精子自身免疫性、多发性硬化(所有亚型)、胰岛素依赖性糖尿病、交感性眼炎、结缔组织病继发的肺动脉高压、Goodpasture氏综合征、结节性多动脉炎的肺表现、急性风湿热、类风湿性脊椎炎、Still氏病、全身性硬皮病、Takayasu氏病/动脉炎、自身免疫性血小板减少症、特发性血小板减少症、自身免疫性甲状腺病、甲状腺机能亢进、甲状腺肿性(goitrous)自身免疫性甲状腺功能减退(Hashimoto氏病)、萎缩性自身免疫性甲状腺功能减退、原发性粘液性水肿、晶状体性(phacogenic)葡萄膜炎、原发性血管炎和白癜风。本发明的人抗体和抗体部分可以用于治疗自身免疫疾病,特别是与炎症相关的那些,包括类风湿性脊椎炎、变态反应、自身免疫性糖尿病和自身免疫性葡萄膜炎。
在特定方面,本发明的抗体或其抗原结合部分用于治疗类风湿性关节炎、Crohn氏病、多发性硬化、胰岛素依赖性糖尿病和牛皮癣。
8.2
抗IL-12抗体在类风湿性关节炎中的用途
白细胞介素-12已暗示在炎性疾病例如类风湿性关节炎中起作用。已在来自类风湿性关节炎患者的滑液中检测出诱导型IL-12p40信息,并且已显示IL-12存在于来自具有类风湿性关节炎的患者的滑液中(参见例如,Morita等人,(1998)Arthritis and
Rheumatism 41:306-314,其完整教导引入本文作为参考)。已发现IL-12阳性细胞存在于类风湿性关节炎滑膜的衬里下层(sublining layer)中。本发明的人抗体和抗体部分可以用于治疗例如类风湿性关节炎、青少年类风湿性关节炎、莱姆关节炎、类风湿性脊椎炎、骨关节炎和痛风性关节炎。一般地,全身性施用抗体或抗体部分,尽管对于特定病症,抗体或抗体部分的局部施用可以是有利的。本发明的抗体或抗体部分也可以与在自身免疫疾病治疗中有用的一种或多种另外治疗剂一起施用。
在关于类风湿性关节炎的胶原诱导的关节炎(CIA)鼠模型中,在关节炎前用抗IL-12
mAb(大鼠抗小鼠IL-12单克隆抗体,C17.15)治疗小鼠深刻抑制疾病的发作,并且减少疾病的发病率和严重性。在关节炎发作后早期用抗IL-12 mAb治疗减少严重性,但在疾病发作后小鼠用抗IL-12 mAb的后期治疗对疾病严重性具有最低限度作用。
8.3
抗IL-12抗体在Crohn氏病中的用途
白细胞介素-12还在炎性肠病――Crohn氏病中起作用。IFN-γ和IL-12增加的表达在具有Crohn氏病的患者的肠粘膜中发生(参见例如,Fais等人,(1994)J. Interferon
Res. 14:235-238;
Pyrronchi等人,(1997)Amer.
J. Pathol. 150:823-832;Monteleone等人,(1997)Gastroenterology
112:1169-1178;Berrebi等人,(1998)Amer. J. Pathol.
152:667-672,其完整教导引入本文作为参考)。已显示抗IL-12抗体抑制在小鼠结肠炎模型例如TNBS诱导的结肠炎IL-12敲除小鼠中,和近期在IL-10敲除小鼠中的疾病。因此,本发明的抗体和抗体部分可以用于治疗炎性肠病。
8.4
抗IL-12抗体在多发性硬化中的用途
白细胞介素-12已暗示为多发性硬化的关键介质。诱导型IL-12
p40信息或IL-12自身的表达可以在具有多发性硬化的患者的损伤中得到证实(Windhagen等人,(1995)J. Exp. Med. 182:1985-1996,Drulovic等人,(1997)J. Neurol. Sci.
147:145-150,其完整教导引入本文作为参考)。具有多发性硬化的慢性进行性患者具有升高的IL-12循环水平。用来自具有多发性硬化的患者的T细胞和抗原呈递细胞(APCs)的研究揭示自持系列的免疫相互作用作为进行性多发性硬化的基础,从而导致Th1型免疫应答。来自T细胞的IFN-γ增加的分泌导致通过APCs增加的IL-12产生,这维持导致Th1型免疫激活和疾病的慢性状态的循环(Balashov
等人,(1997)Proc.
Natl. Acad. Sci. 94:599-603,其完整教导引入本文作为参考)。IL-12在多发性硬化中的作用已使用多发性硬化的小鼠和大鼠实验性变应性脑脊髓炎(EAE)模型进行研究。在小鼠中多发性硬化的复发-缓和EAE模型中,用抗IL-12 mAb的预处理延迟瘫痪且减少临床得分。在瘫痪最高峰或在后续缓和时间段过程中用抗IL-12
mAb治疗减少临床得分。因此,本发明的抗体或其抗原结合部分可以用来减轻在人中与多发性硬化相关的症状。
8.5
抗IL-12抗体在胰岛素依赖性糖尿病中的用途
白细胞介素-12已暗示为胰岛素依赖性糖尿病(IDDM)的重要介质。通过施用IL-12在NOD小鼠中诱导IDDM,并且抗IL-12抗体在IDDM的过继转移模型中是保护性的。早期发作的IDDM患者经常经历所谓的“蜜月时间段(honeymoon period)”,在这个过程中一些残留胰岛细胞功能得以维持。这些残留胰岛细胞产生胰岛素,并且比施用的胰岛素更好地调节血糖水平。这些早期发作患者用抗IL-12抗体的治疗可以预防胰岛细胞的进一步破坏,从而维持胰岛素的内源来源。
8.6
抗IL-12抗体在牛皮癣中的用途
白细胞介素-12已暗示为牛皮癣中的关键介质。牛皮癣涉及与TH 1-型细胞因子表达概况相关的急性和慢性皮肤损伤。(Hamid等人(1996)J. Allergy Clin. Immunol. 1:225-231;Turka等人(1995)Mol. Med. 1:690-699,其完整教导引入本文作为参考)。在患病人皮肤样品中检测到IL-12
p35和p40 mRNAs。因此,本发明的抗体或其抗原结合部分可以用来减轻慢性皮肤病症例如牛皮癣。
8.7
抗IL-18抗体的一般用途
已知其与IL-18结合的能力,本发明的抗IL-18抗体或其部分可以用于检测IL-18,在一个方面,hIL-18(例如在样品基质中,在一个方面,生物学样品,例如血清或血浆),其中使用常规免疫测定,例如酶联免疫吸附测定(ELISA)、放射免疫测定(RIA)或组织免疫组织化学。本发明提供了用于检测生物学样品中的IL-18的方法,其包括使样品与本发明的抗体或抗体部分接触,并且检测与IL-18结合的抗体(或抗体部分)或未结合的抗体(或抗体部分),以从而检测样品中的IL-18。抗体用可检测物质直接或间接进行标记,以促进结合或未结合的抗体的检测。合适的可检测物质包括各种酶、辅基、荧光材料、发光材料和放射性材料。合适酶的例子包括辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶;合适辅基复合物的例子包括链霉抗生物素蛋白/生物素和抗生物素蛋白/生物素;合适荧光材料的例子包括伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺(dichlorotriazinylamine)荧光素、丹磺酰氯或藻红蛋白;发光材料的例子包括鲁米诺;并且合适放射性材料的例子包括125 I、131 I、35 S或3 H。样品中IL-18的检测可以用于诊断背景中,例如在与增加的IL-18相关的状况诊断中,和/或可以用于鉴定可能获益于用抗IL-18抗体治疗的受试者中。
对于标记抗体可替代的,可以通过竞争免疫测定来测定样品中的IL-18,其中利用例如用可检测物质标记的rhIL-18标准和未标记的抗IL-18抗体,例如抗hIL-18抗体。在这个测定中,使样品、标记的rhIL-18标准和抗hIL-18抗体组合,并且测定与未标记的抗体结合的标记的rhIL-18标准的量。样品中的hIL-18的量与和抗hIL-18抗体结合的标记的rhIL-18标准的量成反比。
本发明的抗体和抗体部分能够在体外和体内中和IL-18活性,在一个方面,hIL-18活性。因此,本发明的抗体和抗体部分可以用于抑制IL-18活性,例如在包含IL-18的细胞培养中、在人受试者中或在具有本发明的抗体与之交叉反应的IL-18的其他哺乳动物受试者中(例如灵长类动物,例如狒狒、食蟹猴和猕猴)。在一个方面,本发明提供了分离的人抗体或其抗原结合部分,其中和人IL-18和选自下述的至少一种另外灵长类动物IL-18的活性:狒狒IL-18、狨猴IL-18、黑猩猩IL-18、食蟹猴IL-18和猕猴IL-18,但不中和小鼠IL-18的活性。在一个方面,IL-18是人IL-18。例如,在包含或怀疑包含hIL-18的细胞培养中,本发明的抗体或抗体部分可以添加到培养基中,以抑制培养物中的hIL-18活性。
在另一个方面,本发明提供了用于抑制患有其中IL-18活性有害的病症的受试者中的IL-18活性的方法。白细胞介素18在与涉及免疫和炎症要素的多种疾病相关的病理学中起关键作用。
如本文使用的,短语“其中IL-18活性有害的病症”意欲包括这样的疾病和其他病症,其中在患有病症的受试者中IL-18的存在已显示负责或怀疑负责病症的病理生理学,或者是或怀疑是促成病症恶化的因素。因此,其中IL-18活性有害的病症是其中IL-18活性的抑制预期减轻病症的症状和/或进展的病症。此种病症可以例如通过患有病症的受试者的生物学流体中IL-18浓度中的增加(例如,在受试者的血清、血浆、滑液等中IL-18浓度中的增加)得以证明,这可以例如使用如上所述的抗IL-18抗体进行检测。存在其中IL-18活性有害的病症的众多例子。在一个方面,抗体或其抗原结合部分可以在疗法中用于治疗本文描述的疾病或病症。在另一个方面,抗体或其抗原结合部分可以用于制造用于治疗本文描述的疾病或病症的药物。本发明的抗体和抗体部分在少数非限制性特定病症的治疗中的使用在下文进一步讨论。
本发明提供了用于治疗需要调节IL-18活性的疾病或状况的药物组合物。这些疾病或状况包括自身免疫疾病、I型糖尿病、类风湿性关节炎、移植物排斥、炎性肠病、脓毒病、多发性硬化、缺血性心脏病(包括心脏病发作)、缺血性脑损伤、慢性肝炎、牛皮癣、慢性胰腺炎、急性胰腺炎等。
因此,抗IL-18抗体或其抗原结合部分、或在体内表达其的载体指示用于治疗自身免疫疾病、I型糖尿病、类风湿性关节炎、移植物排斥、炎性肠病、脓毒病、多发性硬化、缺血性心脏病包括急性心脏病发作、缺血性脑损伤、慢性肝炎、牛皮癣、慢性胰腺炎和急性胰腺炎和相似疾病,其中存在IL-18的异常表达,从而导致IL-18过量或在并发症的情况下由于外源施用的IL-18。
8.8
抗IL-18抗体在肝损伤中的用途
本发明的一个方面是提供用于治疗和/或预防肝损伤的新方法。已发现IL-18抑制剂在预防和治疗肝损害中是有效的。本发明因此还涉及IL-18抑制剂用于制备用于治疗和/或预防肝损伤的药物的用途。更具体而言,本发明涉及治疗和/或预防由酒精性肝炎、病毒性肝炎、免疫性肝炎(immune
hepatitis)、暴发性肝炎、肝硬变和原发性胆汁性肝硬变引起的肝损伤。
8.9
抗IL-18抗体在关节炎中的用途
依照本发明已发现IL-18的抑制剂在关节炎治疗中是有效的。疗效包括减少疾病的严重性,以及预防疾病的传播。本发明因此涉及IL-18的抑制剂用于治疗和/或预防关节炎的用途。这个发现是出乎意料的,因为根据上文概述的技术发展水平,不能得出结论认为与关节炎有关的一种特异性因子即白细胞介素IL-18的阻断,将导致关节炎的减轻或甚至患病关节炎关节的治愈。
术语“关节炎”包括所有不同类型的关节炎和关节炎状况,急性和慢性关节炎,如例如在Homepage of the
Department of Orthopaedics of the University of Washington on Arthritis中定义的。关于关节炎状况的例子是强直性脊柱炎、背痛、腕沉积综合征(carpal deposition syndrome)、Ehlers-Danlos-综合征、痛风、少年关节炎、红斑狼疮、肌炎、成骨不全(osteogenesis
imperfecta)、骨质疏松症、多关节炎(polyartheritis)、多肌炎、牛皮癣性关节炎、Reiter氏综合征、硬皮病、伴肠病关节炎、Behcets氏病、儿童关节炎、关节变性病、纤维肌痛(fibromyalgia)、感染性关节炎、莱姆病、Marfan综合征、骨关节炎、骨坏死、Pagets病、风湿性多肌痛、假痛风、交感反射性营养不良、类风湿性关节炎、风湿病、Sjogren氏综合征、家族性腺瘤性息肉病等。
类风湿性关节炎(RA)引起关节衬里(滑膜,单细胞层上皮)和/或内脏中的炎症。该疾病趋于持续多年,一般影响遍及身体的许多不同关节,且最终可以引起对软骨、骨、腱和韧带的损害。可以受RA影响的关节是位于例如颈、肩、肘、髋、腕、手、膝、踝和足中的关节。在许多情况下,关节在RA中以对称模式发炎。
RA在约1%的美国人口中流行,分布在所有种族组和年龄中。它遍及全世界发生,并且在具有RA的那些人中女性以3比1在数目上超过男性。
已发现IL-18抑制剂的施用显著减少关节炎鼠模型中的软骨侵蚀。本发明因此还涉及IL-18的抑制剂在制备用于治疗和/或预防软骨破坏的药物中的用途。
8.10
抗TNFα抗体的一般用途
肿瘤坏死因子α是占优势地由单核细胞/巨噬细胞分泌的多功能促炎细胞因子,其对脂质代谢、凝固、胰岛素耐受性和内皮功能有作用。TNFα是17 kD蛋白质亚基的可溶性同三聚体。还存在膜结合的26 kD前体形式的TNFα。它在组织中的滑膜细胞和巨噬细胞中发现。除单核细胞或巨噬细胞外的细胞也产生TNFα。例如,人非单核细胞肿瘤细胞系产生TNFα以及CD4+和CD8+外周血T淋巴细胞,并且一些培养的T和B细胞系产生TNFα。它与类风湿性关节炎有关但不是只有类风湿性关节炎才有的,并且在许多炎性疾病中出现。关于TNFα的受体在几种单核细胞上,在滑膜、以及外周血和滑液中。TNFα是类风湿性关节炎中的关键炎症介质,并且因此是可以用于特异性免疫治疗的有用靶。
TNFα引起促炎作用,这导致组织损伤,例如软骨和骨降解,粘附分子诱导,诱导对血管内皮细胞的前凝血剂活性,增加嗜中性粒细胞和淋巴细胞的贴壁,以及刺激血小板活化因子从巨噬细胞、嗜中性粒细胞和血管内皮细胞中的释放。近期证据使TNFα与感染、免疫病症、致瘤性病理学、自身免疫病理学和移植物抗宿主病理学关联。
TNFα被认为在革兰氏阴性脓毒病和内毒素休克中起重要作用,包括发热、不适、食欲缺乏和恶病质。内毒素强烈激活单核细胞/巨噬细胞产生和分泌TNFα和其他细胞因子。TNFα和其他单核细胞衍生的细胞因子介导对于内毒素的代谢和神经激素应答。对于人志愿者的内毒素施用产生具有流感样症状的急性病,包括发热、心动过速、代谢速率增加和应激激素释放。循环TNFα在患有革兰氏阴性脓毒病的患者中增加。
因此,TNFα已牵涉于炎性疾病,自身免疫疾病,病毒、细菌和寄生物感染,恶性肿瘤,和/或神经变性疾病,并且是用于在疾病例如类风湿性关节炎和Crohn氏病中的特异性生物学疗法的有用靶。已报道了在用针对TNFα的嵌合单克隆抗体的开放性(open-lable)试验中的有利作用,伴随炎症的抑制和在类风湿性关节炎和Crohn氏病中的复发后成功的再治疗。
针对TNFα的中和抗血清或mAbs已在哺乳动物中显示在实验性内毒素血症和菌血症中的致命攻击后,取消不利生理变化且预防死亡。阿达木单抗(也通过其可从Abbott
Laboratories获得的商标HUMIRA®已知)是对于TNFα特异的重组人单克隆抗体。这种单克隆抗体与TNFα结合,且阻断其与p55和p75细胞表面TNFα受体的相互作用。这种单克隆抗体对于TNFα相当特异,因为它看起来不抑制TNFβ的活性。在补体的存在下,阿达木单抗裂解表达TNFα的细胞的表面。
实施例
1.
在抗IL-18抗体纯化和分离过程中的病毒清除
这个研究的目的是评价关于抗IL-18抗体纯化过程的病毒清除有效性。评价的步骤包括低pH灭活、阳离子交换捕获层析(Fractogel™ EMD S03-树脂)、阴离子交换层析(Q-Sepharose™ FF树脂)和疏水作用层析(Phenyl Sepharose™ HP树脂)精细纯化层析。这个研究满足关于在药物制造过程中通过正交方法的病毒清除的ICH指导。
研究覆盖2种病毒――异嗜性鼠白血病病毒(X-MuLV或X-MLV)和小鼠极小病毒(MVM或MMV)的清除。遵循ICH指导,选择2种病毒“以类似可能污染产物的病毒且代表广泛范围的物理化学性质,以测试系统消除一般而言的病毒的能力”。(参见,“Q5A
Viral Safety Evaluation of Biotechnology Products Derived From Cell Lines of
Human or Animal Original,” Federal
Register / 第63卷,No.
185中公开 / 1998年9月24日,星期四 / Notices(http://www.fds.gove/cber/gdlns/virsafe.pdf,其完整教导引入本文作为参考。)2种病毒的性质在表2中呈现。选择X-MLV逆转录病毒作为特异性模型病毒,这是因为非传染性逆转录病毒样颗粒通常在啮齿类动物起源的细胞系中发现,例如中国仓鼠卵巢(CHO)细胞,包括用于生产抗体例如抗IL-18抗体的CHO细胞系。对物理化学灭活高度抗性的MVM可以视为相关病毒,这是因为几个报道指出它在几个CHO细胞培养上清液批次中的存在(R.L. Garnick,Dev.
Biol. Stand.,88,第49-56页(1996))。MVM与鼠极小病毒MMV同义。
表2 病毒特征
1.1 方法
根据图4中概述的规程执行这个研究。每个过程步骤用在进料流中的浓缩病毒掺料(病毒掺料体积1-7.1%v/v)攻击。就病毒计数测定装载、产物和保持对照流,并且测定关于每个步骤的对数减少系数(log
reduction factor)。
每个过程步骤(参见图4)一式两份地运行。层析树脂在正常制造操作条件的按比例减少模型中攻击,如表4中所示。所有1 cm I.D.柱满足关于柱不对称因子(0.5-2.0)的可接受范围。每个按比例减少柱的容许柱床高度(bed height)范围与制造柱相同。操作条件的总结在表3中。
表3. 关于纯化程序的操作条件
表4 用于过程步骤的靶操作条件
1.2 缓冲液毒性/干扰结果
作为病毒清除研究的部分,测试样品和缓冲液,以测定任何是否对测定中使用的病毒细胞系有毒。样品和缓冲液还就其对选择的病毒感染指示细胞系的能力进行评价。当结果针对相关阳性对照比较时,对于测试的任何缓冲液未检测出病毒传染力的显著减少。作为这个测试的结果,在纯化过程中使用的缓冲液被批准用于在超滤后病毒制剂的重悬浮,用于在关于层析和纳米过滤步骤的攻击测试中使用。
1.3
病毒清除研究结果
通过根据下述等式计算对数减少系数(LRF)测定每个过程步骤在减少病毒滴度中的有效性:
病毒对数减少数据在表5中总结且呈现。作为下限呈现的结果(例如LRF ≥ 4.54)指出病毒以低于定量限度的水平存在。
表5. 病毒对数减少系数
* 未完成
仅对X-MLV执行低pH灭活步骤,这是因为已知MMV对低pH灭活高度抗性。在零时间点时达到高水平的减少。在15分钟时间点时,未观察到病毒传染力。大量接种(bulk
inoculation)用于60分钟时间点样品,以增加测定灵敏度,并且导致对于一式两份运行≥ 4.54
log10和≥ 5.07 log10的减少系数。关于X-MLV的病毒灭活速率是快速的;与澄清的收获物包含来自离心澄清过程的约0.5%残留细胞和来自培养基组分的高浓度蛋白质的事实无关。
在Fractogel™ SO3 -平衡缓冲液中的X-MLV或MMV掺料的Fractogel™ SO3 -装载材料上执行Fractogel™ SO3 -层析步骤。对于测试的2种病毒,在来自Fractogel™柱的洗脱物级分中观察到传染性病毒。对于一式两份运行,对于X-MLV观察到的减少系数是5.78 log10和5.22
log10。对于MMV,减少系数是≥ 1.39 log10和≥ 1.33
log10。
在Q-Sepharose™平衡缓冲液中的X-MLV或MMV掺料的Q装载材料上执行Q-Sepharose™层析步骤。对于测试的任一病毒,在来自Q-Sepharose™柱的流通洗脱物样品中未观察到传染性病毒,其中2种情况下都达到测定的最低限度限制。对于一式两份运行,对于X-MLV观察到的减少系数是≥ 5.51 log10和 ≥ 5.59 log10;在2个运行中对于MMV的减少系数是7.04 log10。
在Phenyl Sepharose™ HP平衡缓冲液中的X-MLV或MMV掺料的苯基装载材料上执行Phenyl Sepharose™ HP层析步骤。对于测试的2种病毒,在来自Phenyl Sepharose™ HP柱的洗脱物级分中观察到传染性病毒。对于一式两份运行,对于X-MLV观察到的减少系数是2.45 log10和2.03
log10。这个过程步骤对于MMV较不坚定,具有0.49 log10和0.96
log10的减少系数。
Pall
DV50™纳米滤器用于使用X-MLV的病毒攻击实验。Pall
DV20™滤器用于使用MMV的过滤实验。在添加到Phenyl
Sepharose™ HP洗脱物材料前,使2种病毒重悬浮于Phenyl Sepharose™ HP洗脱缓冲液中。选择DV20™滤器用于MMV的清除性能。使用DV50滤器,在关于X-MLV的滤液样品中未观察到传染性病毒。对于一式两份运行,对于X-MLV观察到的减少系数是≥ 4.95
log10和≥ 4.61 log10。使用DV20滤器,在关于MMV的滤液样品中观察到传染性病毒。对于一式两份运行,对于MMV观察到的减少系数是≥ 2.98
log10和≥ 4.88 log10。2次DV20运行之间的结果中的不一致不能通过关于每种滤器或病毒掺料滴度的操作条件中的差异加以解释,这是因为这些参数满足预定的规格。然而,不一致可能可归因于在操作前滤器设备的装配。使膜滤器预湿润且高压灭菌;同时使滤器外壳分开蒸汽灭菌。紧接在操作前,拆开滤器外壳,并且将膜置于外壳中且重新装配。在重新装配前O型环配合的尾端件(O-ring fitted end piece)的变紧可能已导致小于置于滤器外壳内的膜的最佳性能。
病毒灭活/清除数据(表6)证实使用DV50纳米过滤膜,抗体纯化过程能够去除最低限度21.91
log10单位的X-MLV。不计算DV50膜,关于MMV的总减少系数是最低限度8.37 log10。如果DV20膜待在抗体纯化过程中实施,那么关于MMV的总减少系数增至最低限度11.29
log10。这些数据证实纯化过程确保抗体药物物质(例如抗IL-18抗体)的病毒安全。
表6. 总体病毒清除LRFs
*ND = 未完成;**在总体LRFs中不包括;***在DV20™前通过Phenyl Sepharose™ HP层析的清除
通过离心(3000 x g)和0.2 μm过滤来澄清包括抗IL-18抗体的细胞培养收获物。使用1 M柠檬酸调整澄清的收获物,并且保持在室温。通过离心(16,000
x g)使沉淀的蛋白质与可溶蛋白质分离。在SDS的存在下,使可溶和不溶蛋白质的样品在60℃热处理30分钟,并且通过聚丙烯酰胺凝胶电泳进行分析。
根据电泳凝胶(图5),明显的是在澄清的培养基的pH降低后,抗体分子保留在溶液中,所述澄清的培养基还包含宿主细胞相关蛋白质和培养基组分。在较低pH,宿主细胞蛋白质差异沉淀并且可以通过离心去除。在pH 4 – pH
3.5范围中可见最大限度沉淀。
通过阳离子交换(CEX)层析测定装载pH对关于抗IL-18抗体的结合容量的作用(参见表7)。通过添加柠檬酸调整细胞培养收获物的pH。在室温保持1小时后,使收获物离心且实施0.2 μm过滤。随后用水将导电性调整至10 mS。将测试物品装载到0.5 x
5 cm CEX柱上。在以200 cm/小时的线速度装载过程中测定动态结合容量。定量分析A蛋白HPLC测定用于测量在柱流通样品中的抗体效价,以测定在装载过程中的5%突破。
表7. pH对结合容量的作用
抗IL-18抗体的等电点(pI)是8.43。在低于pI 1个pH单位的溶液中,抗体分子应带正电,并且与低导电性的带负电的阳离子交换树脂结合。然而,如上表1中可见,抗体在大大低于pI 8.43 1个pH单位的中性pH 7.0根本不结合,但随着pH降低,捕获树脂的结合容量增强。滴定收获物的pH具有其他后果,因为沉淀事件发生。然而,这是有利的,因为存在宿主细胞相关蛋白质和核酸的选择性沉淀。
细胞生存力。在生产阶段结束时在高生存力下;从2升生物反应器中取出细胞培养物的等分试样。用3 M柠檬酸首先使收获培养物酸化至pH 5.0,随后至pH
3.5,并且在环境温度保持1小时。在1小时保持时间段后,用3 M NaOH将培养物调整至pH
4.8。取出样品且测量处理的培养物的细胞计数和生存力。关于结果参见表8。
表8. 酸化对细胞生存力的作用
在细胞培养物1小时暴露于pH
3.5后,存在生存力中的适度19.6%下降(92.8%与74.6%比较)。总细胞密度下降12.4%(5.46 x 106与4.77
x 106比较)。
使酸化的培养物在pH 5和4℃的温度保持过夜,导致生存力(3%- 74.6%与72.4%比较)和细胞密度(10.5%-4.77 x 106与4.27
x 106比较)中的小增量减少。细胞密度和生存力的精确测量是困难的,这是由于来自宿主细胞蛋白质和核酸沉淀的浊度增加。然而,基于肉眼观察没有关于任何大规模细胞裂解的证据。
抗体回收。细胞培养物得自在发酵过程结束时的生产生物反应器。通过以7000 x g离心从等分试样之一中取出细胞。使用3 M柠檬酸使样品酸化,并且在环境温度保持1小时时间段。在1小时保持时间段后,用3 M NaOH将培养物调整至pH 4.9。通过以11,000 x g离心和0.2 μm过滤使酸化的样品澄清。定量分析型A蛋白HPLC测定用于测量抗体效价。使酸化/澄清后的效价与对照的起始效价比较,以测定百分比回收。在中和至pH 5后和在4℃的另外过夜保持后测定样品。
表9. 低pH酸化/澄清对抗体回收的作用
*NA – 不可适用
如由表9中的数据可见的,关于在抗体收获物的酸化/澄清后的抗体效价回收的最佳pH在pH范围3.7 - 3.9中。在pH 3.5,观察到抗体效价中的小减少(5.1至-6.4%)。在连同和不连同细胞酸化的培养物中观察到效价中的这种小丧失。最佳pH基于具体抗体分子的生物化学和物理性质将是不同的。
抗体功能。使用3 M柠檬酸使生物反应器培养物酸化至pH 3.5,并且在环境温度保持1小时。随后用3M NaOH将酸化的收获物滴定至pH 5,并且通过离心和0.2 μm过滤澄清。通过阳离子交换层析进一步纯化来自酸化/澄清的收获物的抗体。通过离心和0.2 μm过滤澄清非酸化的生物反应器培养物,并且通过A蛋白亲和层析纯化抗体。对于靶抗原测定由酸化的和非酸化的收获物纯化的抗体的结合动力学。参见表10。
表10. 低pH酸化/澄清对抗体功能的作用
| 样品ID | 结合速率(M-1s-1) | 解离速率(s-1) | Kd(M) |
| 通过阳离子交换层析由酸化的收获物纯化的抗体 | 4.10 x 10-5 | 8.04 x 10-5 | 1.96 x 10-10 |
| 通过A蛋白层析由非酸化的收获物纯化的抗体 | 3.31 x 10-5 | 6.94 x 10-5 | 2.10 x 10-10 |
数据证实对于抗体,生物反应器的酸化对纯化后的抗体功能性具有很少作用。
酸类型对抗体回收的作用。细胞培养物得自在发酵过程结束时的生产生物反应器。使用3M柠檬酸、3M磷酸或3M盐酸使样品缓慢酸化,并且在环境温度保持1小时时间段。在1小时保持时间段后,用3 M NaOH将培养物调整至pH
5.0。通过以11,000 x g离心和0.2 μm过滤使酸化的样品澄清。定量分析型A蛋白HPLC测定用于测量抗体效价。使酸化/澄清后的效价与对照的起始效价比较,以测定百分比回收。参见表11。
表11. 酸类型对低pH酸化/澄清后的抗体回收的作用
NA" – 不可适用
如由表11中的数据可见的,当使用柠檬酸或磷酸用于抗体收获物的低pH酸化/澄清时,抗体效价回收是最佳的。如先前使用3M柠檬酸观察到的,将培养物调整至略微更高的pH,导致更佳的抗体回收。在pH
3.5,观察到抗体效价中的小减少(对于3M柠檬酸2.1%,对于3M磷酸1%,并且对于3M盐酸7.7%)。
2.
抗IL-12抗体组合物中宿主细胞蛋白质浓度的测定
这个程序描述了用于测定抗IL-12抗体样品中的残留宿主细胞蛋白质浓度的测试方法。酶联免疫吸附测定(ELISA)用于使宿主细胞蛋白质(抗原)夹心在2层特异性抗体之间。这随后为用酪蛋白封闭非特异性位点。宿主细胞蛋白质随后进行温育,在这期间通过第一种抗体(包被抗体)捕获抗原分子。随后添加与抗原(宿主细胞蛋白质)固定的第二种抗体(生物素化的抗宿主细胞蛋白质)。添加HRP缀合的中性抗生物素蛋白(Neutravidin),其与生物素化的抗宿主细胞蛋白质结合。这随后为K蓝色(K blue)底物的添加。通过结合的酶缀合的抗体水解生色底物,从而产生蓝色。反应用2M H3PO4终止,从而使颜色变成黄色。颜色强度与孔中结合的抗原量成正比。
50 mM碳酸氢钠(包被缓冲液),pH 9.4的制备。向1 L烧杯中添加:900 mL Milli-Q水;4.20
g ± 0.01 g碳酸氢钠。搅拌直至完全溶解。用1 N
NaOH将pH调整至9.4。转移至1 L容量瓶且用Milli-Q水达到体积。通过倒置混合直至均质。通过0.22 µm无菌过滤单元过滤。从制备日期起贮存于标称4℃最多7天。
0.104
M Na2HPO4 * 7H2O、1.37
M NaCl、0.027 M KCl、0.0176 M KH2PO4,pH = 6.8 - 6.9(10X
PBS)的制备。将约400 mL的Milli-Q水添加到玻璃烧杯中。添加13.94 g ± 0.01
g Na2HPO4 x 7H2O。添加40.0
g ± 0.1 g NaCl。添加1.00 g ± 0.01 g KCl。添加1.20 g ± 0.01 g KH2PO4。搅拌直至均质。转移至500 mL容量瓶。用Milli-Q水QS至500 mL体积。通过倒置混合。通过0.2 µm无菌过滤单元过滤。贮存于室温最多7天。
1X
PBS + 0.1%Triton X-100,pH 7.40:(板洗涤缓冲液)的制备。在4 L量筒中,使400 mL 10 X PBS(步骤5.2)与3500 mL Milli-Q水混合。检查pH,并且若需要则用1 N HCl或1 N NaOH调整至7.40 ± 0.05。用Milli-Q水达到体积。紧紧用石蜡膜封口量筒,并且通过倒置混合直至均质。转移至4 L瓶。取出4 mL 1 X PBS且弃去。将4 mL
triton X-100添加到3996 mL 1 X PBS中。置于搅拌板上且搅拌至完全溶解。通过0.22 µm无菌过滤单元过滤用于稀释缓冲液制剂所需的板洗涤缓冲液量。贮存于室温最多7天。
包被抗体混合物的制备:山羊抗CHO 599/626/748(批次#G11201
@ 1.534 mg/mL),亲和纯化的:注:原液贮存于标称-80℃在小瓶中。制备等分试样。在使用时拿出一个等分试样/板。紧接在使用前:如下在冷50 mM碳酸氢钠中稀释抗体混合物,以具有4 µg/mL的最终浓度。例如:将31
µLs包被抗体混合物添加到11969 µLs冷包被缓冲液中。通过倒置轻轻混合。
生物素化的山羊抗宿主细胞蛋白质混合物,599/626/748(批次# G11202 @ 0.822 mg/mL)的制备:注:原液贮存于标称-80℃在小瓶中。制备等分试样。在使用时拿出一个等分试样/板。紧接在使用前:如下在37℃±2℃酪蛋白中稀释生物素化的抗体混合物,以具有1
µg/mL的最终浓度。例如:将14.6 µLs生物素化的抗体混合物添加到11985
µLs 37℃±2℃酪蛋白。通过倒置轻轻混合。
中性抗生物素蛋白-HRP的制备。如下重构新批次(2 mg/小瓶)至1 mg/mL:将400 µL Milli-Q水添加到小瓶中,随后添加1600 µL 1X PBS,总共2 mL。轻轻涡旋以混合。贮存于标称-20℃。制备具有所需体积的等分试样,从而使得使用1个等分试样/板。在聚丙烯管中制备。定量新批次以测定工作浓度。指定从制备日期起6个月到期。例如,如果工作浓度测定为0.2 µg/mL,那么如下制备。紧接在使用前,使中性抗生物素蛋白-HRP的等分试样在室温解冻。用37℃±2℃酪蛋白将1 mg/mL中性抗生物素蛋白溶液稀释至0.1 mg/mL(100 µg/mL)。例如:稀释X10,将50 µL中性抗生物素蛋白添加到450 µL酪蛋白中。轻轻涡旋以混合。用37℃±2℃酪蛋白将100 µg/mL溶液进一步稀释至0.2 µg/mL。例如,稀释X500,将24 µL中性抗生物素蛋白(100 µg/mL)添加到11976 µL酪蛋白中。轻轻涡旋以混合。
5.7
2M的磷酸(终止液)的制备。如下由浓磷酸制备2 M磷酸溶液。根据标签上所述的磷酸%、密度(1.685g/mL)和式量(98 g/摩尔),计算制备500 mL 2M磷酸所需的浓磷酸体积。将上述计算的浓磷酸体积添加到瓶中。用Milli-Q水达到体积,并且通过倒置混合直至均质。从制备日期起在环境温度贮存最多6个月。
稀释缓冲液(在1X PBS + 0.1 %Triton
X100,pH 7.4中稀释X100的酪蛋白)的制备。在0.22 µm无菌过滤的1X
PBS + 0.1 %Triton X100,pH 7.4(来自上文)中,将37℃ ± 2℃酪蛋白稀释X100。例如:将1 mL 37℃ ± 2℃酪蛋白添加到99 mL 0.22 µm无菌过滤的1X
PBS + 0.1 %Triton X100,pH 7.4。充分混合。对于每次使用新鲜制备。
标准的制备。宿主细胞蛋白质标准(抗原标准)(批次#G11203 @ 1.218 mg/mL):注:原液在标称-80℃,以70 µL等分试样贮存。在室温解冻等分试样。使用稀释缓冲液在聚丙烯管中执行连续稀释。
样品的制备。在聚丙烯管中,在稀释缓冲液中将最终总试样稀释至24 mg/mL。记录浓度。注:使用下文溶液以制备掺料样品且制备下文提及的12 mg/mL溶液。在聚丙烯微型管(microtube)中,在稀释缓冲液中将24
mg/mL溶液进一步稀释至12 mg/mL。在板上对于12
mg/mL溶液各自装载一式三份的孔,总共6个孔。
掺料的制备。在聚丙烯微型管中,通过用稀释缓冲液将其稀释2 X,由上文制备的20
ng/mL标准制备10 ng/mL宿主细胞蛋白质掺料。在板上装载对于10
ng/mL掺料溶液的3个孔。使用来自步骤6.1的20 ng/mL标准溶液用于掺料样品。
掺料样品的制备。在聚丙烯微型管中,用300 µL 20 ng/mL掺料溶液(6.1)掺料300 µL各24 mg/mL的最终本体溶液。对于每种掺料样品溶液装载一式三份的孔,总共6个孔。
对照的制备。在常规测试中使用前,对于每一种新对照母液必须设定对照范围。对照原液:制备ABT-874药物物质浓缩物分批的150 µL等分试样,且冷冻贮存于标称-80℃最多3年。
工作对照的制备。使对照的等分试样在室温解冻。在聚丙烯管中,用稀释缓冲液将对照稀释至24 mg/mL。在聚丙烯微型管中,用稀释缓冲液将24 mg/mL对照溶液进一步稀释至12
mg/mL。制备单一稀度且将对照装载到板的3个孔内。
ELISA程序。用板洗涤缓冲液(参考步骤5.3,1X PBS + 0.1%Triton X-100)装满板洗涤瓶。起动板洗涤器。检查下述参数:参数应设为:板类型:对于每个循环1(总共5个循环):体积:400 µls;浸泡时间:10秒;抽吸时间(Asp. Time):4秒。
测定程序。用100 µL/孔在冷50 mM碳酸氢钠中的4 µg/mL山羊包被抗体混合物包被板。轻敲板的侧面,直至包被溶液均匀地覆盖孔底部,用封条覆盖并且在标称4℃温育,同时在板振荡器(或等价物)上以速度3振荡18小时 ± 1小时。在过夜温育后,从冰箱中取出板,并且允许平衡至室温。抖开包衣。在纸巾上吸干板。用300
µL/孔37℃ ± 2℃酪蛋白封闭,用封条覆盖且在37℃ ± 2℃温育,同时在Lab-line
Environ板振荡器(或等价物)上以80 rpm ± 5 rpm振荡1小时。在封闭温育过程中制备标准、样品、对照、掺料和掺料样品。用洗涤缓冲液将板洗涤5次。在纸巾上将板吸干。使用8道移液管,将100 µL/孔的标准、样品、掺料、掺料样品和对照移液到板的一式三份孔内。将100 µL/孔的稀释缓冲液移液到板的所有空孔内,以充当空白。用封条覆盖且在37℃ ± 2℃温育,同时在Lab-line Environ板振荡器(或等价物)上以80 rpm ± 5
rpm振荡1小时。填满模板以用作在装载板时的指导。
板阅读器设置。设置模板,输入关于标准的浓度。不输入关于样品、对照、掺料或掺料样品的稀释因子。将包含稀释剂的孔指定为空白,以从所有孔中扣除。用洗涤缓冲液将板洗涤5次。在纸巾上将板吸干。添加100 µL/孔生物素化的山羊抗体。用封条覆盖且在37℃ ± 2℃温育,同时在Lab-line
Environ板振荡器(或等价物)上以80 rpm ± 5 rpm振荡1小时。用洗涤缓冲液将板洗涤5次。在纸巾上将板吸干。添加100 µL/孔中性抗生物素蛋白-HRP缀合物溶液。用封条覆盖且在37℃ ± 2℃温育,同时在Lab-line
Environ板振荡器(或等价物)上以80 rpm ± 5 rpm振荡1小时。用洗涤缓冲液将板洗涤5次。在纸巾上将板吸干。添加100 µL/孔冷K蓝色底物,用封条覆盖且在室温温育10分钟(一将底物添加到第一行中就起动定时器),同时在Lab-line滴定板振荡器(或等价物)上振荡速度3。通过添加100 µL/孔2M磷酸(步骤5.7)停止反应。将板置于以速度3的板振荡器上进行3-5分钟。在450 nm阅读板。
数据分析和计算。注:仅接受这样的样品、掺料、掺料样品和对照,其光密度属于标准曲线的实际定量限度(2.5 ng/mL标准)且满足下文陈述的%CV或%差异标准。如果样品OD降到2.5 ng/mL标准之下,那么结果应报道为小于2.5 ng/mL。这个值随后应除以稀释的样品浓度(12 mg/mL),以报道ng/mg的值。如果样品在宿主细胞浓度中是高的,从而引起非掺料和/或掺料样品超过标准曲线,那么将值报道为>
100 ng/mL。这个值随后应除以稀释的样品浓度(12 mg/mL),以报道ng/mg的值。当样品低于2.5 ng/mL标准时,对于掺料回收计算将样品值视为零。
标准曲线。标准浓度应输入规程模板内。使用二次曲线拟合。决定系数必须是 = 0.99,并且在一式三份孔之间的%CV必须是 = 20%。如果这个标准不满足:那么可以放弃一个标准(1个水平,3个孔)。如果放弃1.25 ng/mL,那么仅具有光密度属于2.5
ng/mL和100 ng/mL(剩余的标准曲线点)光密度的样品和掺料样品是可接受的。另外,对于一式三份的每个标准水平,如果单个孔被明确污染或显示低结合,那么它可以被放弃。如果孔从标准水平中放弃,那么剩余的重复必须具有%差异= 20%。关于显示接近于板本底(空白)的OD值的最低标准的%CV应是 = 30%。如果放弃一个孔,那么关于剩余的重复的%差异必须是 = 35%。如果放弃最低标准,那么仅具有光密度属于剩余的标准曲线水平光密度的样品和掺料样品是可接受的。
样品。%CV在一式三份孔之间应是 = 20%。报道在一式三份孔之间的%CV。可以放弃来自每个样品稀度的一个孔。剩余的重复必须具有 = 20%的%差异。注:如果非掺料样品OD低于2.5 ng/mL标准OD,那么%差异标准不应用于非掺料结果。参考上文计算。
如下根据平均(ng/mL)值计算以ng/mg表示的实际宿主细胞浓度:CHO宿主细胞蛋白质(ng/mg)= 平均“非掺料样品结果(ng/mL)” _稀释的样品浓度(12 mg/mL)。
掺料。%CV在一式三份孔之间应是 = 20%。记录%CV。可以放弃来自掺料的一个孔。剩余的点必须具有 = 20%的%差异。参考上文中的计算。以ng/mL报道宿主细胞浓度。这个结果将在掺料回收计算中使用。关于掺料所得到的浓度(ng/mL)必须是理论掺料浓度的 ± 20%。记录结果且指出通过(Pass)或失败(Fail)。如果掺料结果未在理论的20%内,那么必须重复测定。平均掺料浓度(ng/mL)x 100 =必须是100%± 20%10 ng/mL。
掺料样品。%CV在一式三份孔之间应是 = 20%。记录在一式三份孔之间的%CV。可以放弃来自每个掺料样品稀度的一个孔。剩余的重复必须具有 = 20%的%差异。参考上文计算。对于每个稀度以ng/mL报道“掺料样品结果”。记录一式两份稀度之间的%差异。稀度之间的%差异应是 = 25%。这些结果将在掺料回收计算中使用。
使用下式对于每个稀度设置计算%掺料回收:%掺料回收= 掺料样品值 – 非掺料样品值 X 100掺料值。注:(1)如果非掺料样品值OD降到2.5 ng/mL标准之下,那么在%掺料回收计算中将值视为零。对于每个样品的每个稀度,%掺料回收必须是100%± 50%(50%- 150%)。记录结果和通过/失败。
对照。%CV在一式三份孔之间应是 = 20%。记录%CV结果。可以放弃来自对照的一个孔。剩余的重复必须具有 = 20%的%差异。参考上文计算。以ng/mL报道对照中的宿主细胞浓度。如下以ng/mg计算宿主细胞浓度:宿主细胞蛋白质(ng/mg)= 以ng/mL表示的对照宿主细胞蛋白质结果。
3.
抗IL-12抗体组合物中A蛋白浓度的测定
在这个ELISA中,板用鸡抗A蛋白包被且温育。用在PBS中的酪蛋白封闭非特异性位点。板在1X
PBS + 0.1%Triton X-100中洗涤,以去除未结合的材料。样品和Cys-rprotein A标准在1X PBS + 4.1%Triton
X + 10%酪蛋白中稀释。通过在95℃±2℃加热使溶液变性,使A蛋白与ABT-874分离。随后将溶液添加到板中且温育。用1X PBS + 0.1%Triton X-100洗掉未结合的材料。将生物素化的鸡抗A蛋白添加到微量滴定板中且温育。洗涤板以去除未结合的材料,且添加中性抗生物素蛋白 – 过氧化物酶缀合物。
中性抗生物素蛋白将与生物素化的鸡抗A蛋白结合,所述生物素化的鸡抗A蛋白已与孔结合。再次洗涤板以去除未结合的中性抗生物素蛋白,并且将K蓝色(K-Blue)(四甲基联苯胺(TMB))底物添加到板中。底物通过结合的中性抗生物素蛋白水解,从而产生蓝色。反应用磷酸终止,从而使颜色变成黄色。孔中黄色的强度与孔中存在的A蛋白浓度成正比。
试剂和溶液的制备。酪蛋白瓶必须加温至37℃±2℃;超声处理2分钟,并且等分试样。将等分试样贮存于标称4℃。当测定要运行时,需要的酪蛋白等分试样数目应置于37℃±2℃。使用冷的包被缓冲液和底物(直接在使用前从标称4℃获得)。
50 mM碳酸氢钠(包被缓冲液),pH 9.4。向1 L烧杯中添加:900 mL Milli-Q水、4.20
g ± 0.01 g碳酸氢钠。搅拌直至完全溶解。用1 N
NaOH将pH调整至9.4。转移至1 L容量瓶且用Milli-Q水达到体积。通过倒置混合直至均质。通过0.22 CA µm无菌过滤单元过滤。从制备日期起贮存于标称4℃最多7天。
104 M
Na2HPO4 * 7H2O、1.37
M NaCl、0.027 M KCl、0.0176 M KH2PO4,pH = 6.8 - 6.9(10X
PBS):将约400 mL的Milli-Q水添加到玻璃烧杯中。添加13.94 g ± 0.01
g Na2HPO4 x 7H2O。添加40.0
g ± 0.1 g NaCl。添加1.00 g ± 0.01 g KCl。添加1.20 g ± 0.01 g KH2PO4。搅拌直至均质。转移至500 mL容量瓶。用Milli-Q水QS至500 mL体积。通过倒置混合。通过0.2 CA µm无菌过滤单元过滤。贮存于室温最多7天。
1X
PBS + 0.1%Triton X-100,pH 7.40:(板洗涤缓冲液)。在4 L量筒中,使400 mL 10 X PBS(参见上文)与3500
mL Milli-Q水混合。检查pH,并且若需要则用1 N
HCl或1 N NaOH调整至7.40 ± 0.05。用Milli-Q水达到体积。紧紧用石蜡膜封口量筒,并且通过倒置混合直至均质。转移至4 L瓶。取出4 mL
1 X PBS且弃去。将4 mL triton X-100添加到3996 mL 1 X PBS中。置于搅拌板上且搅拌至完全溶解。贮存于室温最多7天。
鸡抗A蛋白包被抗体。在使用时拿出抗体的一个等分试样/板。为了定量鸡抗A蛋白的新批次,可能必须一起使用且定量生物素缀合的鸡抗A蛋白(Chicken Anti-Protein A-Biotin Conjugated)(由相同包被批次制备)。紧接在使用前:在冷50 mM碳酸氢钠中稀释抗体混合物,至在包被定量过程中测定的浓度。例如:如果在定量过程中装载到板上的包被浓度测定为6
µg/mL,并且如果原液浓度是3000 µg/mL,那么将24µLs包被抗体添加到11976 µLs冷包被缓冲液中。通过倒置轻轻混合。
生物素化的鸡抗A蛋白。在使用时拿出抗体的一个等分试样/板。为了定量生物素缀合的鸡抗A蛋白的新批次,可能必须用它由之制备的鸡抗A蛋白的相同批次使用且定量其。紧接在使用前:在37℃±2℃酪蛋白中稀释生物素化的抗体,至在生物素化的抗体定量过程中测定的浓度。例如:如果在定量过程中装载到板上的生物素化的抗体浓度测定为4
µg/mL,并且如果原液浓度是1000 µg/mL,那么将48
µLs生物素化的抗体添加到11952 µLs 37℃±2℃酪蛋白中。通过倒置轻轻混合。
中性抗生物素蛋白-HRP。如下重构新批次(2 mg/小瓶)至1 mg/mL:将400 µL Milli-Q水添加到小瓶中,随后添加1600 µL 1X PBS,总共2 mL。轻轻涡旋以混合。贮存于标称-80℃。制备具有所需体积的等分试样,从而使得使用1个等分试样/板。在聚丙烯管中制备。指定从制备日期起6个月的到期日。例如,如果工作浓度测定为0.1 µg/mL,那么如下制备。紧接在使用前,使中性抗生物素蛋白-HRP的等分试样在室温解冻。用37℃±2℃酪蛋白将1 mg/mL中性抗生物素蛋白溶液稀释至0.01 mg/mL(10 µg/mL)。例如:稀释X10,将50 µL中性抗生物素蛋白添加到450 µL酪蛋白中。轻轻涡旋以混合,X10再次,将100 µL X10中性抗生物素蛋白添加到900 µL酪蛋白中。轻轻涡旋以混合。用37℃±2℃酪蛋白将10 µg/mL溶液进一步稀释至0.1 µg/mL。例如,稀释X100,将120 µL中性抗生物素蛋白(10 µg/mL)添加到11880 µL酪蛋白中。轻轻倒置几次以混合。
终止液(使用购买的1 N磷酸)。从收到日期起在环境温度贮存最多1年。稀释缓冲液(1X PBS + 4.1%Triton
X100 + 10%酪蛋白,pH 7.4)。将86 mL
1X PBS + 0.1%Triton X100,pH 7.4(来自步骤5.3)添加到烧杯或瓶中,添加4 mL Triton X-100和10 mL在PBS中的阻断剂酪蛋白,并且搅拌以溶解/混合。可能需要20 – 30分钟以溶解triton。这等于1X PBS + 4.1%Triton X100 + 10%酪蛋白,pH
7.4溶液。通过0.22 CA µm无菌过滤单元过滤。对于每次使用新鲜制备。这对于1块板足够。
A蛋白标准(抗原标准)。注:原液在标称-20℃以70 µL等分试样贮存。在冰上解冻等分试样。根据下表中的例子使用稀释缓冲液(参见上文)在聚丙烯管中执行连续稀释,其中使用制造商COA上陈述的浓度:例如,如果COA陈述原液浓度是2.1 mg/mL(2100000 ng/mL),那么:在冰上解冻样品。在聚丙烯微量离心管中,在稀释缓冲液(上文)中将最终总试样稀释至20
mg/mL。执行2次分开稀释。记录浓度。使用下文溶液以制备掺料样品且制备10
mg/mL溶液。例如:来自120原液样品的浓度(mg/mL)X mg/mL溶液体积µL稀释剂体积(µL)连续稀释。在聚丙烯微量离心管中,在稀释缓冲液中将20
mg/mL溶液进一步稀释至10 mg/mL。
掺料的制备。在聚丙烯微量离心管中,通过用稀释缓冲液将其稀释2 X,由上文步骤6.1中制备的0.593 ng/mL标准制备0.296
ng/mL A蛋白掺料。执行单一稀度。将在板上装载对于0.296 ng/mL掺料溶液一式三份的孔。使用来自步骤6.1的0.593
ng/mL标准溶液用于掺料样品。
掺料样品的制备。在聚丙烯微量离心管中,用500 µL 0.593 ng/mL掺料溶液掺料500 µL各20 mg/mL的最终本体溶液。保持用于变性。将在板上装载对于每种掺料样品溶液一式三份的孔,总共6个孔。
对照的制备。获得ABT-874药物物质的批次。制备150 µL等分试样,且从等分试样的日期起冷冻贮存于标称-80℃进行3年。
工作对照。使对照的等分试样在冰上解冻。在聚丙烯微量离心管中,用稀释缓冲液将对照稀释至10 mg/mL,以具有1000 µLs的最终体积。制备单一稀度。保持用于变性。一式三份的对照孔将装载到板上。
变性。对于板空白,将1000 µLs稀释缓冲液添加到等于将在板上运行的空白数目的微量离心管中。管的盖可以用石蜡膜封口,以防止其在加热过程中爆开,或第二个支架可以置于其顶部以保持盖闭合。使标准、非掺料样品、掺料样品、掺料、空白和对照在95℃±2℃加热15分钟。在冷却过程中从管中去除石蜡膜,如果使用的话。允许冷却15分钟,并且以约10000
rpm离心5分钟。将700
µLs上清液转移到微型管内以装载到板上。小心不干扰triton/蛋白质沉淀。
板洗涤器说明书和水浴设置。用板洗涤缓冲液(参考步骤5.3,1X
PBS + 0.1%Triton X-100)装满板洗涤瓶。起动板洗涤器。检查下述参数:参数应设为:板类型:对于每个循环1(总共4个循环):抽吸速度(Asp speed):10 mm/s;体积:400 µls;浸泡时间:5秒;抽吸时间(Asp. Time):6秒。打开水浴且设为95℃。允许水浴温度平衡至95℃±2℃进行至少30分钟。
测定程序。检查表可以用作在填写所述表格时通过检验步骤的指导。另外,记录在测定过程中使用的所有设备。对于测定将运行的每天要使用的酪蛋白等分试样的量必须置于37℃±2℃。使用冷的包被缓冲液和底物。在封闭温育前和过程中制备标准、样品、对照、掺料和掺料样品。可能花费长于1小时的封闭温育以制备稀释物,转移至eppendorf管,变性15分钟,冷却15分钟,离心5分钟,并且转移至微型管。在封闭板前允许至少40分钟。使用12道移液管,将样品、掺料样品、标准、对照、测定掺料和空白从行B到G水平地装载到板上。标准从高到低浓度装载。板包被、生物素添加、中性抗生物素蛋白添加、底物添加和终止液添加从列2到11垂直地进行。
用100 µL/孔在冷50 mM碳酸氢钠中的包被抗体包被板。轻敲板的侧面,直至包被溶液均匀地覆盖孔底部,用封条覆盖并且在标称4℃温育,同时在板振荡器(或等价物)上以速度3振荡。
在过夜温育后,从冰箱中取出板,并且允许平衡至室温。抖开包衣。在纸巾上吸干板。用300 µL/孔37℃ ± 2℃酪蛋白封闭,用封条覆盖且在37℃ ± 2℃温育,同时在Lab-line Environ板振荡器(或等价物)上以80
rpm ± 5 rpm振荡1小时±10分钟。
在封闭温育前和过程中制备标准、样品、对照、掺料和掺料样品。用洗涤缓冲液将板洗涤4次。在纸巾上将板吸干。使用8道移液管,将100 µL/孔的变性标准、样品、掺料、掺料样品、空白和对照移液到板的一式三份孔内。不使用板的外部孔,将未处理的稀释缓冲液添加到这些孔中。用封条覆盖且在37℃ ± 2℃温育,同时在Lab-line
Environ板振荡器(或等价物)上以80 rpm ± 5 rpm振荡2小时。填满模板以用作在装载板时的指导。
板阅读器设置。用洗涤缓冲液将板洗涤4次。在纸巾上将板吸干。添加100
µL/孔生物素化的抗体。用封条覆盖且在37℃ ± 2℃温育,同时在Lab-line Environ板振荡器(或等价物)上以80 rpm ± 5
rpm振荡1小时。
用洗涤缓冲液将板洗涤4次。在纸巾上将板吸干。添加100 µL/孔中性抗生物素蛋白-HRP缀合物溶液。一将中性抗生物素蛋白添加到最后一行中就起动定时器。用封条覆盖且在37℃ ± 2℃温育,同时在Lab-line
Environ板振荡器(或等价物)上以80 rpm ± 5 rpm振荡30分钟。用洗涤缓冲液将板洗涤4次。在纸巾上将板吸干。添加100 µL/孔冷K蓝色底物,用封条覆盖且在室温温育10分钟(一将底物添加到第一行中就起动定时器),同时在Lab-line滴定板振荡器(或等价物)上振荡速度3。通过添加100 µL/孔1 N磷酸停止反应。将板置于以速度3的板振荡器上进行3分钟。在450 nm阅读板。
数据分析和计算。注:仅接受这样的样品、掺料、掺料样品和对照,其光密度属于标准曲线的实际定量限度,且满足下文陈述的%CV或%差异标准。如果样品OD降到标准曲线之下,那么结果应报道为小于0.18
ng/mL(测定LOQ)。这个值随后应除以稀释的样品浓度(10
mg/mL),以报道ng/mg的值。如果样品在A蛋白浓度中是高的,从而引起非掺料和/或掺料样品超过标准曲线(2
ng/mL),那么将进一步稀释至在标准曲线内。这个值随后应除以稀释的样品浓度,以报道ng/mg的值。对于掺料回收计算,即使当非掺料样品值(ng/mL)低于曲线时,也从掺料样品值(ng/mL)中扣除非掺料样品值(ng/mL)。如果值是负的或获得‘范围’,那么对于掺料回收计算将非掺料样品视为零。
标准曲线。标准浓度应输入规程模板内。使用二次曲线拟合。决定系数必须是 = 0.99,并且在一式三份孔之间的%CV必须是 = 20%。如果这个标准不满足:那么可以放弃一个标准(1个水平,3个孔)。如果放弃0.18 ng/mL,那么仅具有光密度属于0.26
ng/mL和2 ng/mL(剩余的标准曲线点)光密度的样品和掺料样品是可接受的。另外,对于一式三份的每个标准水平,如果单个孔被明确污染或显示低结合,那么它可以被放弃。如果孔从标准水平中放弃,那么剩余的重复必须具有%差异 = 20%。关于显示接近于板本底(空白)的OD值的最低标准的%CV应是 = 30%。如果放弃一个孔,那么关于剩余的重复的%差异必须是 = 35%。如果放弃最低标准,那么仅具有光密度属于剩余的标准曲线水平光密度的样品和掺料样品是可接受的。
如下计算%差异:%差异 =(Abs.(结果稀度1 – 结果稀度2)/平均值)X 100%。如果标准不满足上述标准,那么必须重复测定。报道测定结果的%CV和/或%差异值和标准曲线系数。
样品。%CV在一式三份孔之间应是 = 20%。报道在一式三份孔之间的%CV。可以放弃来自每个样品稀度的一个孔。剩余的重复必须具有 = 20%的%差异。注:如果非掺料样品OD低于最低标准OD,那么%差异标准不应用于非掺料结果。参考上文计算。
对于每个稀度以ng/mL报道“非掺料样品结果”。这些值将在掺料回收计算中使用。计算稀度之间的平均“非掺料样品结果(ng/mL)”和%差异。报道结果。稀度之间的%差异必须是 = 25%。如下根据平均(ng/mL)值计算以ng/mg表示的实际A蛋白浓度: A蛋白(ng/mg)= 平均“非掺料样品结果(ng/mL)”稀释的样品浓度(10 mg/mL)。记录结果。
掺料。%CV在一式三份孔之间应是 = 20%。记录%CV。可以放弃来自掺料的一个孔。剩余的点必须具有 = 20%的%差异。参考上文计算。以ng/mL报道A蛋白浓度。这个结果将在掺料回收计算中使用。关于掺料所得到的浓度(ng/mL)必须是理论掺料浓度的 ± 20%。记录结果且指出通过(Pass)或失败(Fail)。如果掺料结果未在理论的20%内,那么必须重复测定。平均掺料浓度(ng/mL)x 100 =必须是100%± 20%0.296 ng/mL。
掺料样品。%CV在一式三份孔之间应是 = 20%。记录在一式三份孔之间的%CV。可以放弃来自每个掺料样品稀度的一个孔。剩余的重复必须具有 = 20%的%差异。参考上文计算。对于每个稀度以ng/mL报道“掺料样品结果”。记录一式两份稀度之间的%差异。稀度之间的%差异应是 = 25%。这些结果将在掺料回收计算中使用。使用下式对于每个稀度设置计算%掺料回收:%掺料回收= 掺料样品值 – 非掺料样品值 X 100. 掺料值。注:对于掺料回收计算,即使当非掺料样品值(ng/mL)低于曲线时,也从掺料样品值(ng/mL)中扣除非掺料样品值(ng/mL)。如果值是负的或获得‘范围’,那么对于掺料回收计算将非掺料样品视为零。对于每个样品的每个稀度,%掺料回收必须是100%± 50%(50%- 150%)。记录结果和通过/失败。
对照。%CV在一式三份孔之间应是 = 20%。记录%CV结果。可以放弃来自对照的一个孔。剩余的重复必须具有 = 20%的%差异。
本文引用了各种出版物,其内容在此整体引入作为参考。
Claims (31)
1.一种用于从包括抗体、宿主细胞蛋白质(HCP)和病毒颗粒的样品混合物中产生宿主细胞蛋白质减少的抗体制剂的方法,其中与所述样品混合物相比较,所述制剂包括减少数目的病毒颗粒或减少的病毒活性,所述方法包括:
(a)对所述样品基质实施pH的减少,从而形成初步回收样品,其中所述pH的减少是至pH约3 –
约5;
(b)将所述初步回收样品调整至约4.5 – 约6.5的pH,随后将所述初步回收样品应用于离子交换树脂,且收集离子交换样品;
(c)将所述离子交换样品应用于疏水作用层析(HIC)树脂,且收集HIC样品,其中所述HIC样品包括所述HCP减少的抗体制剂。
2.权利要求1的方法,其中所述pH的减少通过使合适的酸与所述样品混合物混合来完成,并且其中所述合适的酸选自柠檬酸、磷酸、乙酸、辛酸等。
3.权利要求1的方法,其中所述离子交换树脂是阴离子交换树脂或阳离子交换树脂。
4.权利要求3的方法,其中所述离子交换树脂是阳离子交换树脂。
5.权利要求4的方法,其中所述阳离子交换树脂选自羧甲基(CM)、磺乙基(SE)、磺丙基(SP)、Fractogel SO3 -、磷酸盐(P)和磺酸盐(S)。
6.权利要求5的方法,其中所述阳离子交换树脂是Fractogel SO3 -。
7.权利要求3的方法,其中所述离子交换树脂是阴离子交换树脂。
8.权利要求7的方法,其中所述阴离子交换树脂选自Q Sepharose、二乙氨乙基(DEAE)、季氨乙基(QAE)和季胺(Q)基团。
9.权利要求8的方法,其中所述阴离子交换树脂是Q-Sepharose。
10.权利要求1的方法,其中所述离子交换步骤包括第一个离子交换步骤和第二个离子交换步骤。
11.权利要求10的方法,其中所述第一个离子交换步骤是阳离子交换步骤,随后为第二个阴离子交换步骤。
12.权利要求10的方法,其进一步包括中间步骤,其中所述中间步骤是在所述第一个和所述第二个离子交换步骤之间发生的过滤步骤。
13.权利要求12的方法,其中所述过滤步骤通过捕获超滤/渗滤完成。
14.权利要求1的方法,其中所述HIC使用包括一种或多种疏水基团的柱完成。
15.权利要求14的方法,其中所述一种或多种疏水基团选自烷基、芳基基团及其组合。
16.权利要求14的方法,其中所述柱选自苯基Sepharose™(例如Phenyl Sepharose™ 6 Fast Flow柱、Phenyl Sepharose™ High Performance柱),Octyl Sepharose™ High Performance柱,Fractogel™ EMD Propyl,Fractogel™ EMD Phenyl柱,Macro-Prep™ Methyl,Macro-Prep™ t-Butyl Supports,WP HI-Propyl(C3)™柱,和Toyopearl™醚、苯基或丁基柱。
17.权利要求16的方法,其中所述柱包括苯基琼脂糖。
18.权利要求1的方法,其进一步包括过滤步骤,其中对所述HIC样品实施过滤,以去除病毒颗粒且促进缓冲液更换。
19.权利要求1的方法,其中所述HCP减少的抗体制剂包括抗IL-12抗体或抗IL-18抗体或其抗原结合部分。
20.权利要求19的方法,其中所述抗IL-18抗体或其抗原结合部分是人源化抗体、嵌合抗体或多价抗体。
21.权利要求20的方法,其中所述抗IL-18抗体或其抗原结合部分是人源化抗体。
22.权利要求20的方法,其中所述抗IL-18抗体或其抗原结合部分是分离的人抗体,其以范围约10-6 – 约10-12 M或更少的Kd与人IL-18解离。
23.权利要求19的方法,其中所述抗IL-18抗体或其抗原结合部分在体内和体外中和IL-18。
24.权利要求1的方法,其中所述制剂基本上不含HCPs。
25.一种用于从包括抗体和至少一种宿主细胞蛋白质(HCP)的样品混合物中产生宿主细胞蛋白质减少的抗体制剂的方法,所述方法包括:
(a)对所述样品基质实施pH的减少,从而形成初步回收样品,其中所述pH的减少是至约3.5;
(b)将所述初步回收样品调整至约5.0的pH,随后将所述初步回收样品应用于阳离子交换树脂,且收集阳离子交换样品;
(c)将所述阳离子交换样品应用于阴离子交换树脂且收集阴离子交换样品;和
(d)将所述阴离子交换样品应用于疏水作用层析(HIC)树脂且收集HIC样品,其中所述HIC样品包括所述HCP减少的抗体制剂。
26.一种用于从包括抗体和至少一种宿主细胞蛋白质(HCP)的样品混合物中产生宿主细胞蛋白质减少的抗体制剂的方法,所述方法包括:
(a)对所述样品基质实施pH的减少,从而形成初步回收样品,其中所述pH的减少是至约3.5;
(b)将所述初步回收样品调整至约5.0的pH,随后将所述初步回收样品应用于阳离子交换树脂,且收集阳离子交换样品;
(c)对所述阳离子交换样品实施过滤且收集滤液;
(d)将来自(c)的所述滤液应用于阴离子交换树脂且收集阴离子交换样品;和
(e)将所述阴离子交换样品应用于疏水作用层析(HIC)树脂且收集HIC样品,其中所述HIC样品包括所述HCP减少的抗体制剂。
27.权利要求26的方法,其进一步包括在将所述初步回收样品应用于阳离子交换树脂前的A蛋白亲和层析步骤。
28.一种药物组合物,其包括通过权利要求1的方法产生的HCP减少的抗体制剂和药学上可接受的载体。
29.权利要求28的药物组合物,其中所述抗体是抗IL-12抗体或抗IL-18抗体或其抗原结合部分。
30.权利要求28的药物组合物,其中所述组合物基本上不含HCPs。
31.权利要求28的药物组合物,其用于中和IL-12或IL-18促进的病症。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201510353605.3A CN104974251A (zh) | 2008-10-20 | 2009-10-20 | 在抗体纯化过程中的病毒灭活 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US19675408P | 2008-10-20 | 2008-10-20 | |
| US61/196754 | 2008-10-20 | ||
| PCT/US2009/061338 WO2010048192A2 (en) | 2008-10-20 | 2009-10-20 | Viral inactivation during purification of antibodies |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201510353605.3A Division CN104974251A (zh) | 2008-10-20 | 2009-10-20 | 在抗体纯化过程中的病毒灭活 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102257005A true CN102257005A (zh) | 2011-11-23 |
Family
ID=41832791
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2009801513952A Pending CN102257005A (zh) | 2008-10-20 | 2009-10-20 | 在抗体纯化过程中的病毒灭活 |
| CN201510353605.3A Pending CN104974251A (zh) | 2008-10-20 | 2009-10-20 | 在抗体纯化过程中的病毒灭活 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201510353605.3A Pending CN104974251A (zh) | 2008-10-20 | 2009-10-20 | 在抗体纯化过程中的病毒灭活 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US9109010B2 (zh) |
| EP (1) | EP2346897A2 (zh) |
| JP (3) | JP5856845B2 (zh) |
| KR (1) | KR101722423B1 (zh) |
| CN (2) | CN102257005A (zh) |
| AU (1) | AU2009307737B2 (zh) |
| BR (1) | BRPI0920572A8 (zh) |
| CA (1) | CA2738499A1 (zh) |
| IL (1) | IL211917A0 (zh) |
| MX (1) | MX2011004201A (zh) |
| NZ (1) | NZ592097A (zh) |
| RU (1) | RU2551237C2 (zh) |
| SG (2) | SG195577A1 (zh) |
| TW (1) | TW201028433A (zh) |
| WO (1) | WO2010048192A2 (zh) |
| ZA (1) | ZA201102552B (zh) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104411820A (zh) * | 2012-06-29 | 2015-03-11 | Emd密理博公司 | 在蛋白纯化过程中灭活病毒的方法 |
| CN106029682A (zh) * | 2013-12-27 | 2016-10-12 | 中外制药株式会社 | 等电点低的抗体的纯化方法 |
| CN106459142A (zh) * | 2014-04-30 | 2017-02-22 | 诺和诺德股份有限公司 | 使用辛酸纯化蛋白质的方法 |
| CN107586760A (zh) * | 2016-07-07 | 2018-01-16 | 扬州优邦生物药品有限公司 | 一种猪圆环病毒2型病毒样颗粒的纯化方法及其应用 |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2346897A2 (en) | 2008-10-20 | 2011-07-27 | Abbott Laboratories | Viral inactivation during purification of antibodies |
| CA2932207A1 (en) | 2008-10-20 | 2010-12-09 | Abbvie Inc. | Isolation and purification of antibodies using protein a affinity chromatography |
| CN107188960A (zh) * | 2009-08-07 | 2017-09-22 | Emd密理博公司 | 从样品的一或多种杂质中纯化靶蛋白的方法 |
| ES2813398T3 (es) | 2009-10-20 | 2021-03-23 | Abbvie Inc | Aislamiento y purificación de anticuerpos anti-IL-13 usando cromatografía de afinidad a Proteína A |
| GB201012603D0 (en) | 2010-07-27 | 2010-09-08 | Ucb Pharma Sa | Protein purification |
| SG186915A1 (en) | 2010-07-30 | 2013-02-28 | Emd Millipore Corp | Chromatography media and method |
| JP6023715B2 (ja) * | 2010-10-11 | 2016-11-09 | アッヴィ・バハマズ・リミテッド | タンパク質の精製方法 |
| CA2814781A1 (en) * | 2010-11-01 | 2012-05-10 | Diderik Reinder Kremer | Single unit ion exchange chromatography antibody purification |
| EP2702077A2 (en) | 2011-04-27 | 2014-03-05 | AbbVie Inc. | Methods for controlling the galactosylation profile of recombinantly-expressed proteins |
| KR102038336B1 (ko) | 2011-07-08 | 2019-10-31 | 이엠디 밀리포어 코포레이션 | 일회용 생명공학적 공정용의 개선된 심층 필터 |
| US9067990B2 (en) | 2013-03-14 | 2015-06-30 | Abbvie, Inc. | Protein purification using displacement chromatography |
| WO2013158273A1 (en) | 2012-04-20 | 2013-10-24 | Abbvie Inc. | Methods to modulate c-terminal lysine variant distribution |
| US9334319B2 (en) | 2012-04-20 | 2016-05-10 | Abbvie Inc. | Low acidic species compositions |
| US9249182B2 (en) | 2012-05-24 | 2016-02-02 | Abbvie, Inc. | Purification of antibodies using hydrophobic interaction chromatography |
| EP2682168A1 (en) | 2012-07-02 | 2014-01-08 | Millipore Corporation | Purification of biological molecules |
| US9512214B2 (en) | 2012-09-02 | 2016-12-06 | Abbvie, Inc. | Methods to control protein heterogeneity |
| CA2883272A1 (en) | 2012-09-02 | 2014-03-06 | Abbvie Inc. | Methods to control protein heterogeneity |
| JOP20200308A1 (ar) | 2012-09-07 | 2017-06-16 | Novartis Ag | جزيئات إرتباط il-18 |
| WO2014071344A2 (en) * | 2012-11-05 | 2014-05-08 | Medimmune, Llc | Method of isolating synagis® in the absence of benzonase |
| SG11201507230PA (en) | 2013-03-12 | 2015-10-29 | Abbvie Inc | Human antibodies that bind human tnf-alpha and methods of preparing the same |
| US10023608B1 (en) | 2013-03-13 | 2018-07-17 | Amgen Inc. | Protein purification methods to remove impurities |
| WO2014151878A2 (en) | 2013-03-14 | 2014-09-25 | Abbvie Inc. | Methods for modulating protein glycosylation profiles of recombinant protein therapeutics using monosaccharides and oligosacharides |
| US9017687B1 (en) | 2013-10-18 | 2015-04-28 | Abbvie, Inc. | Low acidic species compositions and methods for producing and using the same using displacement chromatography |
| WO2014159579A1 (en) | 2013-03-14 | 2014-10-02 | Abbvie Inc. | MUTATED ANTI-TNFα ANTIBODIES AND METHODS OF THEIR USE |
| EP2997036B1 (en) * | 2013-05-15 | 2021-03-03 | Medimmune Limited | Purification of recombinantly produced polypeptides |
| KR101569783B1 (ko) * | 2013-06-05 | 2015-11-19 | 한화케미칼 주식회사 | 항체의 정제 방법 |
| US9632087B2 (en) | 2013-09-10 | 2017-04-25 | MockV Solutions | Methods for evaluating viral clearance from a biopharmaceutical solution employing mock viral particles |
| MX2016002799A (es) | 2013-09-13 | 2016-05-26 | Genentech Inc | Composiciones y metodos para detectar y cuantificar la proteina en la celula hospedera en las lineas de celulas y productos de polipeptidos recombinantes. |
| NZ756750A (en) | 2013-09-13 | 2022-05-27 | Genentech Inc | Methods and compositions comprising purified recombinant polypeptides |
| EP3052640A2 (en) | 2013-10-04 | 2016-08-10 | AbbVie Inc. | Use of metal ions for modulation of protein glycosylation profiles of recombinant proteins |
| CA2926588C (en) | 2013-10-16 | 2020-07-21 | Oncobiologics, Inc. | Buffer formulations for enhanced antibody stability |
| US9085618B2 (en) | 2013-10-18 | 2015-07-21 | Abbvie, Inc. | Low acidic species compositions and methods for producing and using the same |
| US8946395B1 (en) | 2013-10-18 | 2015-02-03 | Abbvie Inc. | Purification of proteins using hydrophobic interaction chromatography |
| US9181337B2 (en) | 2013-10-18 | 2015-11-10 | Abbvie, Inc. | Modulated lysine variant species compositions and methods for producing and using the same |
| WO2015073884A2 (en) | 2013-11-15 | 2015-05-21 | Abbvie, Inc. | Glycoengineered binding protein compositions |
| US10280195B2 (en) * | 2014-05-28 | 2019-05-07 | Agency For Science, Technology And Research | Virus reduction method |
| SG11201700030UA (en) | 2014-09-02 | 2017-02-27 | Emd Millipore Corp | High surface area fiber media with nano-fibrillated surface features |
| AR102198A1 (es) | 2014-10-09 | 2017-02-08 | Regeneron Pharma | Proceso para reducir partículas subvisibles en una formulación farmacéutica |
| CA2966515C (en) | 2014-12-08 | 2021-04-27 | Emd Millipore Corporation | Mixed bed ion exchange adsorber |
| EP3247718B1 (en) | 2015-01-21 | 2021-09-01 | Outlook Therapeutics, Inc. | Modulation of charge variants in a monoclonal antibody composition |
| EP3088006A1 (de) * | 2015-04-28 | 2016-11-02 | Bayer Technology Services GmbH | Verfahren zur kontinuierlichen virusinaktivierung in einem mikroreaktor |
| EP3398965A4 (en) * | 2015-12-28 | 2019-09-18 | Chugai Seiyaku Kabushiki Kaisha | METHOD FOR PROMOTING THE EFFICACY OF PURIFYING A POLYPEPTIDE CONTAINING AN FC REGION |
| CA3013336A1 (en) | 2016-02-03 | 2017-08-10 | Oncobiologics, Inc. | Buffer formulations for enhanced antibody stability |
| AU2017312785B2 (en) | 2016-08-16 | 2024-10-10 | Regeneron Pharmaceuticals, Inc. | Methods for quantitating individual antibodies from a mixture |
| IL312194A (en) | 2016-10-25 | 2024-06-01 | Regeneron Pharma | Methods and systems for analysis of chromatography data |
| EP3446710A1 (en) * | 2017-08-25 | 2019-02-27 | Glenmark Pharmaceuticals S.A. | Methods of inactivating viral contaminants |
| WO2019060062A1 (en) | 2017-09-19 | 2019-03-28 | Regeneron Pharmaceuticals Inc. | METHODS OF REDUCING PARTICLE FORMATION AND COMPOSITIONS FORMED THEREFROM |
| CN108059650A (zh) * | 2018-01-05 | 2018-05-22 | 上海药明生物技术有限公司 | 低pH病毒灭活工艺中的纯化方法 |
| CA3103817A1 (en) | 2018-07-02 | 2020-01-09 | Regeneron Pharmaceuticals, Inc. | Systems and methods for preparing a polypeptide from a mixture |
| US20210221840A1 (en) * | 2020-01-17 | 2021-07-22 | Regeneron Pharmaceuticals, Inc. | Hydrophobic interaction chromatography for viral clearance |
| CN111991571B (zh) * | 2020-08-12 | 2022-04-05 | 湖州师范学院 | 一种柱上低pH病毒灭活的方法 |
| TW202233644A (zh) * | 2020-10-30 | 2022-09-01 | 美商建南德克公司 | 用於獲得水解酵素活性率降低的醫藥組成物之純化平台 |
| CN113880908B (zh) * | 2021-08-25 | 2024-05-14 | 北京伟德杰生物科技有限公司 | 纯化重组人血清白蛋白的融合蛋白的方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1146730A (zh) * | 1994-02-22 | 1997-04-02 | 史密丝克莱恩比彻姆公司 | 抗体纯化 |
Family Cites Families (165)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5045468A (en) | 1986-12-12 | 1991-09-03 | Cell Enterprises, Inc. | Protein-free culture medium which promotes hybridoma growth |
| SU1484094A1 (ru) * | 1987-04-03 | 1994-01-15 | Институт биоорганической химии АН БССР | Способ очистки антител к тиреоидным гормонам |
| US6048728A (en) | 1988-09-23 | 2000-04-11 | Chiron Corporation | Cell culture medium for enhanced cell growth, culture longevity, and product expression |
| US5110913A (en) | 1990-05-25 | 1992-05-05 | Miles Inc. | Antibody purification method |
| US5096816A (en) | 1990-06-05 | 1992-03-17 | Cetus Corporation | In vitro management of ammonia's effect on glycosylation of cell products through pH control |
| EP0666312A1 (en) | 1994-02-08 | 1995-08-09 | Wolfgang A. Renner | Process for the improvement of mammalian cell growth |
| US5853714A (en) | 1995-03-27 | 1998-12-29 | Genetics Institute, Inc. | Method for purification of IL-12 |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US6656466B1 (en) | 1995-06-06 | 2003-12-02 | Genetech, Inc. | Human tumor necrosis factor—immunoglobulin(TNFR1-IgG1) chimera composition |
| US5721121A (en) | 1995-06-06 | 1998-02-24 | Genentech, Inc. | Mammalian cell culture process for producing a tumor necrosis factor receptor immunoglobulin chimeric protein |
| US5705364A (en) | 1995-06-06 | 1998-01-06 | Genentech, Inc. | Mammalian cell culture process |
| JP4306813B2 (ja) | 1995-09-19 | 2009-08-05 | アスビオファーマ株式会社 | 動物細胞の新規培養方法 |
| ATE222598T1 (de) | 1996-04-19 | 2002-09-15 | Nestle Sa | Menschliche immortalisierte colon- epithelialzellen |
| AU5082698A (en) | 1996-10-23 | 1998-05-15 | Oravax, Inc | Heat inactivation of viruses in antibody preparations |
| WO1998022137A1 (en) | 1996-11-15 | 1998-05-28 | The Kennedy Institute Of Rheumatology | SUPPRESSION OF TNF α AND IL-12 IN THERAPY |
| PT950067E (pt) | 1996-11-27 | 2007-12-06 | Genentech Inc | Purificação por afinidade de um polipéptido numa matriz de proteína a. |
| US6955917B2 (en) | 1997-06-20 | 2005-10-18 | Bayer Healthcare Llc | Chromatographic method for high yield purification and viral inactivation of antibodies |
| IL121900A (en) | 1997-10-07 | 2001-12-23 | Omrix Biopharmaceuticals Ltd | A method for the purification of immunoglobulins |
| US20020045207A1 (en) | 1997-10-31 | 2002-04-18 | Lynne A. Krummen | Glycoprotein production process |
| WO1999032605A1 (en) | 1997-12-19 | 1999-07-01 | Novo Nordisk A/S | Method for producing heterologous proteins in eukaryotic cells on an industrial scale using nucleotide-manipulating agents |
| ATE370961T1 (de) | 1998-05-06 | 2007-09-15 | Genentech Inc | Reinigung von antikörpern durch ionenaustauschchromatographie |
| US6528286B1 (en) | 1998-05-29 | 2003-03-04 | Genentech, Inc. | Mammalian cell culture process for producing glycoproteins |
| CA2276216A1 (en) * | 1998-06-24 | 1999-12-24 | Kabushiki Kaisha Hayashibara Seibutsu Kagaku Kenkyujo | An artificial peptide capable of neutralizing the biological activity of interleukin-18 |
| US6914128B1 (en) | 1999-03-25 | 2005-07-05 | Abbott Gmbh & Co. Kg | Human antibodies that bind human IL-12 and methods for producing |
| WO2001023592A2 (en) | 1999-09-27 | 2001-04-05 | Genentech, Inc. | Methods for making recombinant proteins using apoptosis inhibitors |
| WO2001059089A2 (en) | 2000-02-08 | 2001-08-16 | Genentech, Inc. | Improved galactosylation of recombinant glycoproteins |
| TWI373343B (en) | 2000-02-10 | 2012-10-01 | Abbott Gmbh & Co Kg | Antibodies that bind human interleukin-18 and methods of making and using |
| US7598055B2 (en) | 2000-06-28 | 2009-10-06 | Glycofi, Inc. | N-acetylglucosaminyltransferase III expression in lower eukaryotes |
| EP1175931A1 (en) | 2000-07-25 | 2002-01-30 | Computer Cell Culture Center S.A. | Integration of high cell density bioreactor operation with ultra fast on-line downstream processing |
| US6902734B2 (en) * | 2000-08-07 | 2005-06-07 | Centocor, Inc. | Anti-IL-12 antibodies and compositions thereof |
| US6635448B2 (en) | 2000-08-21 | 2003-10-21 | Clonexdevelopment, Inc. | Methods and compositions for increasing protein yield from a cell culture |
| US6693173B2 (en) | 2000-12-26 | 2004-02-17 | Alpha Therapeutic Corporation | Method to remove citrate and aluminum from proteins |
| US20030096414A1 (en) | 2001-03-27 | 2003-05-22 | Invitrogen Corporation | Culture medium for cell growth and transfection |
| CA2448788C (en) | 2001-06-05 | 2010-08-24 | Genetics Institute, Llc. | Methods for purifying highly anionic proteins |
| RU2321630C2 (ru) | 2001-08-03 | 2008-04-10 | Гликарт Биотекнолоджи АГ | Гликозилированные антитела (варианты), обладающие повышенной антителозависимой клеточной цитотоксичностью |
| HUP0402158A2 (hu) | 2001-10-02 | 2005-01-28 | Novo Nordisk Health Care Ag | Rekombináns fehérjék előállítási eljárása eukarióta sejtekben |
| ATE430580T1 (de) | 2001-10-25 | 2009-05-15 | Genentech Inc | Glycoprotein-zusammensetzungen |
| MXPA04004671A (es) | 2001-11-14 | 2005-08-25 | Johnson & Johnson | Anticuerpos anti-interleucina-6, composiciones, metodos y usos. |
| HUP0402226A2 (hu) | 2001-11-28 | 2005-02-28 | Sandoz Ag. | Eljárás sejttenyésztésre |
| AU2002359816B2 (en) | 2001-12-21 | 2006-07-13 | Immunex Corporation | Methods for purifying protein |
| US20030201229A1 (en) | 2002-02-04 | 2003-10-30 | Martin Siwak | Process for prefiltration of a protein solution |
| DK1472275T3 (da) | 2002-02-05 | 2009-04-14 | Genentech Inc | Proteinoprensning |
| CA2417689C (en) | 2002-03-05 | 2006-05-09 | F. Hoffmann-La Roche Ag | Improved methods for growing mammalian cells in vitro |
| US20030190710A1 (en) | 2002-03-28 | 2003-10-09 | Devries Ruth L. | Control of glycoforms in IgG |
| JPWO2003085118A1 (ja) | 2002-04-09 | 2005-08-11 | 協和醗酵工業株式会社 | 抗体組成物の製造方法 |
| ATE359358T1 (de) | 2002-07-15 | 2007-05-15 | Immunex Corp | Verfahren und medien zur kontrolle der sialysierung von proteinen, die von säugetierzellen produziert werden |
| US7067279B1 (en) | 2002-08-23 | 2006-06-27 | Immunex Corporation | Cell culture performance with betaine |
| US6974681B1 (en) | 2002-08-23 | 2005-12-13 | Immunex Corporation | Cell culture performance with vanadate |
| WO2004026427A2 (en) | 2002-09-17 | 2004-04-01 | Gtc Biotherapeutics, Inc. | Isolation of immunoglobulin molecules that lack inter-heavy chain disulfide bonds |
| US7208585B2 (en) | 2002-09-18 | 2007-04-24 | Genencor International, Inc. | Protein purification |
| US20040162414A1 (en) | 2002-11-22 | 2004-08-19 | Santora Ling C. | Method for reducing or preventing modification of a polypeptide in solution |
| WO2004058800A2 (en) | 2002-12-23 | 2004-07-15 | Bristol-Myers Squibb Company | Mammalian cell culture processes for protein production |
| PL377603A1 (pl) | 2002-12-23 | 2006-02-06 | Bristol-Myers Squibb Company | Poprawa jakości produktu w hodowlach komórek ssaczych do wytwarzania białka |
| WO2004087761A1 (ja) * | 2003-03-31 | 2004-10-14 | Kirin Beer Kabushiki Kaisha | ヒトモノクローナル抗体およびヒトポリクローナル抗体の精製 |
| WO2004104186A1 (en) | 2003-05-15 | 2004-12-02 | Wyeth | Restricted glucose feed for animal cell culture |
| SI1648940T1 (sl) | 2003-07-28 | 2016-08-31 | Genentech, Inc. | Zmanjševanje izluževanja proteina A med afinitetno kromatografijo proteina A |
| GB2404665B (en) | 2003-08-08 | 2005-07-06 | Cambridge Antibody Tech | Cell culture |
| JP4740138B2 (ja) | 2003-10-10 | 2011-08-03 | ノボ ノルディスク ヘルス ケア アクチェンゲゼルシャフト | 真核生物細胞におけるポリペプチドの大規模生産方法及びそれに適した培養容器 |
| CA2543193C (en) | 2003-10-27 | 2015-08-11 | Wyeth | Removal of high molecular weight aggregates using hydroxyapatite chromatography |
| US8084032B2 (en) | 2004-01-21 | 2011-12-27 | Ajinomoto Co., Inc. | Purification method which prevents denaturation of an antibody |
| SE0400886D0 (sv) | 2004-04-02 | 2004-04-02 | Amersham Biosciences Ab | Process of purification |
| US20060127950A1 (en) | 2004-04-15 | 2006-06-15 | Massachusetts Institute Of Technology | Methods and products related to the improved analysis of carbohydrates |
| US20080305518A1 (en) | 2004-05-04 | 2008-12-11 | Novo Nordisk Healthcare A/G | O-Linked Glycoforms Of Polypeptides And Method To Manufacture Them |
| US7294484B2 (en) | 2004-08-27 | 2007-11-13 | Wyeth Research Ireland Limited | Production of polypeptides |
| KR101238798B1 (ko) | 2004-09-30 | 2013-03-04 | 바이엘 헬스케어, 엘엘씨 | 생물학적 분자의 통합된 연속 제조를 위한 장치 및 방법 |
| US20060094104A1 (en) | 2004-10-29 | 2006-05-04 | Leopold Grillberger | Animal protein-free media for cultivation of cells |
| JP2006143601A (ja) | 2004-11-16 | 2006-06-08 | Yamato Yakuhin Kk | 血液粘度低下剤 |
| US8728828B2 (en) | 2004-12-22 | 2014-05-20 | Ge Healthcare Bio-Sciences Ab | Purification of immunoglobulins |
| ES2380485T3 (es) | 2005-02-11 | 2012-05-14 | Novo Nordisk Health Care Ag | Producción de un polipéptido en un lÃquido de cultivo sin suero con hidrolizado de proteÃnas vegetales |
| JP5199063B2 (ja) | 2005-03-11 | 2013-05-15 | ワイス・エルエルシー | 弱分配クロマトグラフィー方法 |
| CA2604877A1 (en) | 2005-04-11 | 2006-10-19 | J.P. Sercel Associates Inc. | Protein purification |
| US20090203055A1 (en) | 2005-04-18 | 2009-08-13 | Massachusetts Institute Of Technology | Compositions and methods for RNA interference with sialidase expression and uses thereof |
| US7247457B2 (en) | 2005-04-26 | 2007-07-24 | United States Of America As Represented By The Secretary Of The Department Of Health And Human Services, Centers For Disease Control And Prevention | Detection and identification of enteroviruses by semi-nested amplification of the enterovirus VP1 protein |
| AU2006255085A1 (en) | 2005-06-03 | 2006-12-14 | Genentech, Inc. | Method of producing antibodies with modified fucosylation level |
| MX2007015476A (es) | 2005-06-14 | 2008-02-25 | Amgen Inc | Formulaciones de proteina autoamortiguadoras. |
| KR101247836B1 (ko) | 2005-06-17 | 2013-03-28 | 와이어쓰 엘엘씨 | 항 a 베타 항체의 정제 방법 |
| RS57549B1 (sr) | 2005-08-26 | 2018-10-31 | Ares Trading Sa | Proces za pripremu glikoziliranog interferona beta |
| AR058140A1 (es) | 2005-10-24 | 2008-01-23 | Wyeth Corp | Metodo de produccion proteica utilizando compuestos anti-senescencia |
| US7972810B2 (en) | 2005-12-08 | 2011-07-05 | Amgen Inc. | Production of glycoproteins using manganese |
| US20070190057A1 (en) | 2006-01-23 | 2007-08-16 | Jian Wu | Methods for modulating mannose content of recombinant proteins |
| NZ571479A (en) | 2006-04-05 | 2012-10-26 | Abbott Biotech Ltd | Antibody purification |
| WO2007136752A2 (en) | 2006-05-19 | 2007-11-29 | Glycofi, Inc. | Erythropoietin compositions |
| WO2009017491A1 (en) | 2006-06-14 | 2009-02-05 | Smithkline Beecham Corporation | Methods for purifying antibodies using ceramic hydroxyapatite |
| DK2495307T5 (en) | 2006-07-13 | 2018-07-16 | Wyeth Llc | Preparation of coagulation factor IX with improved glycosylation pattern |
| PL2061803T5 (pl) * | 2006-08-28 | 2023-03-27 | Ares Trading S.A. | Proces oczyszczania białek zawierających fc |
| KR20090064377A (ko) | 2006-09-08 | 2009-06-18 | 와이어쓰 | 친화성 크로마토그래피를 사용하는 단백질 정제에 있어서 아르기닌 세척 |
| US10982250B2 (en) | 2006-09-18 | 2021-04-20 | Genentech, Inc. | Methods of protein production |
| MX2009004519A (es) | 2006-11-03 | 2009-05-12 | Wyeth Corp | Sustancias que inhiben la glucolisis en un cultivo de celulas. |
| WO2008068879A1 (en) | 2006-12-06 | 2008-06-12 | Jcr Pharmaceuticals Co., Ltd. | Method for production of human erythropoietin |
| US8163886B2 (en) * | 2006-12-21 | 2012-04-24 | Emd Millipore Corporation | Purification of proteins |
| DK2115126T3 (en) | 2007-03-02 | 2015-05-04 | Wyeth Llc | Use of copper and glutamate in cell culture for the preparation of polypeptides |
| EP2703007A1 (en) | 2007-03-30 | 2014-03-05 | MedImmune, LLC | Antibodies with decreased deamidation profiles |
| JP5967861B2 (ja) | 2007-04-03 | 2016-08-10 | オキシレイン ユーケー リミテッド | 分子のグリコシル化 |
| CN101681396A (zh) | 2007-04-16 | 2010-03-24 | 动量制药公司 | 限定的糖蛋白产品以及相关方法 |
| TW200902708A (en) | 2007-04-23 | 2009-01-16 | Wyeth Corp | Methods of protein production using anti-senescence compounds |
| EP1988101A1 (en) | 2007-05-04 | 2008-11-05 | Novo Nordisk A/S | Improvement of factor VIII polypeptide titers in cell cultures |
| WO2008135498A2 (en) | 2007-05-04 | 2008-11-13 | Novo Nordisk A/S | Prevention of protein degradation in mammalian cell cultures |
| AU2008251446B2 (en) * | 2007-05-11 | 2013-11-07 | The Board Of Regents Of The University Of Nebraska | Compositions for protein delivery and methods of use thereof |
| AU2008251405B2 (en) | 2007-05-11 | 2012-05-17 | Amgen Inc. | Improved feed media |
| US20100221823A1 (en) | 2007-06-11 | 2010-09-02 | Amgen Inc. | Method for culturing mammalian cells to improve recombinant protein production |
| KR20190140090A (ko) | 2007-07-09 | 2019-12-18 | 제넨테크, 인크. | 폴리펩티드의 재조합 생산 동안의 디술피드 결합 환원의 방지 |
| US20090042253A1 (en) | 2007-08-09 | 2009-02-12 | Wyeth | Use of perfusion to enhance production of fed-batch cell culture in bioreactors |
| WO2009058769A1 (en) | 2007-10-30 | 2009-05-07 | Schering Corporation | Purification of antibodies containing hydrophobic variants |
| EP3441402A1 (en) | 2007-10-30 | 2019-02-13 | Genentech, Inc. | Antibody purification by cation exchange chromatography |
| TWI661833B (zh) | 2007-11-30 | 2019-06-11 | 百慕達商艾伯維生物技術有限責任公司 | 蛋白質調配物及製造其之方法 |
| KR101818411B1 (ko) | 2007-12-27 | 2018-01-12 | 박스알타 인코퍼레이티드 | 세포 배양 방법 |
| WO2009092014A1 (en) | 2008-01-18 | 2009-07-23 | Gagnon Peter S | Enhanced purification of antibodies and antibody fragments by apatite chromatography |
| CA2717614A1 (en) | 2008-03-11 | 2009-09-17 | Genentech, Inc. | Antibodies with enhanced adcc function |
| WO2009129226A1 (en) | 2008-04-15 | 2009-10-22 | Talecris Biotherapeutics, Inc. | Two-stage ultrafiltration/diafiltration |
| CA2723197C (en) | 2008-05-02 | 2017-09-19 | Seattle Genetics, Inc. | Methods and compositions for making antibodies and antibody derivatives with reduced core fucosylation |
| WO2010016943A2 (en) | 2008-08-08 | 2010-02-11 | Biogen Idec Ma Inc. | Nutrient monitoring and feedback control for increased bioproduct production |
| FI3604324T3 (fi) | 2008-08-14 | 2024-05-16 | Genentech Inc | Menetelmiä epäpuhtauden poistamiseksi käyttäen luontaisen proteiinin syrjäytyksen ioninvaihtomembraanikromatografiaa |
| US8084222B2 (en) | 2008-09-26 | 2011-12-27 | Eureka Therapeutics, Inc. | Methods for generating host cells |
| CA2932207A1 (en) | 2008-10-20 | 2010-12-09 | Abbvie Inc. | Isolation and purification of antibodies using protein a affinity chromatography |
| NZ592094A (en) | 2008-10-20 | 2013-01-25 | Abbott Lab | Antibodies that bind to il-18 and methods of purifying the same |
| EP2346897A2 (en) | 2008-10-20 | 2011-07-27 | Abbott Laboratories | Viral inactivation during purification of antibodies |
| NZ592096A (en) | 2008-10-20 | 2013-01-25 | Abbott Lab | Antibodies that bind to il-12 and methods of purifying the same |
| WO2010051360A1 (en) | 2008-10-31 | 2010-05-06 | Wyeth Llc | Purification of acidic proteins using ceramic hydroxyapatite chromatography |
| WO2010066634A1 (en) | 2008-12-09 | 2010-06-17 | F. Hoffmann-La Roche Ag | Method for obtaining an excipient-free antibody solution |
| US9631008B2 (en) | 2008-12-22 | 2017-04-25 | Hoffmann-La Roche Inc. | Immunoglobulin purification |
| CA2748807C (en) | 2009-01-08 | 2019-01-29 | Ge Healthcare Bio-Sciences Ab | Separation method using single polymer phase systems |
| US9127043B2 (en) | 2009-03-05 | 2015-09-08 | Biogen Ma Inc. | Purification of immunoglobulins |
| EP2412817B2 (en) | 2009-03-27 | 2019-06-05 | Asahi Kasei Medical Co., Ltd. | Method for removing viruses in high-concentration monoclonal antibody solution |
| TW201041899A (en) | 2009-04-13 | 2010-12-01 | Bristol Myers Squibb Co | Protein purification by citrate precipitation |
| CN102803292A (zh) | 2009-04-20 | 2012-11-28 | 辉瑞公司 | 蛋白质糖基化的控制及其相关组合物和方法 |
| WO2010136515A1 (en) | 2009-05-28 | 2010-12-02 | Boehringer Ingelheim International Gmbh | Method for a rational cell culturing process |
| CA2763164A1 (en) | 2009-06-05 | 2010-12-09 | Momenta Pharmaceuticals, Inc. | Methods of modulating fucosylation of glycoproteins |
| MX2012000354A (es) | 2009-07-06 | 2012-02-01 | Genentech Inc | Metodo para cultivar celulas eucarionticas. |
| BRPI1010119A2 (pt) | 2009-07-24 | 2016-03-15 | Hoffmann La Roche | "método de produção de composição de anticorpo e uso de cromatografia de troca de íons analítica" |
| WO2011015926A1 (en) | 2009-08-03 | 2011-02-10 | Avesthagen Limited | A process of fermentation, purification and production of recombinant soluble tumour necrosis factor alfa receptor (tnfr) - human igg fc fusion protein |
| WO2011031397A1 (en) | 2009-08-06 | 2011-03-17 | Genentech, Inc. | Method to improve virus removal in protein purification |
| WO2011019622A1 (en) | 2009-08-14 | 2011-02-17 | Genentech, Inc. | Cell culture methods to make antibodies with enhanced adcc function |
| WO2011024025A1 (en) | 2009-08-28 | 2011-03-03 | Avesthagen Limited | An erythropoietin analogue and a method thereof |
| PL2473617T3 (pl) | 2009-09-01 | 2020-06-29 | F. Hoffmann-La Roche Ag | Ulepszone oczyszczanie białka poprzez zmodyfikowaną elucję z białka A |
| US9540426B2 (en) | 2009-10-06 | 2017-01-10 | Bristol-Myers Squibb Company | Mammalian cell culture processes for protein production |
| ES2813398T3 (es) | 2009-10-20 | 2021-03-23 | Abbvie Inc | Aislamiento y purificación de anticuerpos anti-IL-13 usando cromatografía de afinidad a Proteína A |
| WO2011049798A1 (en) | 2009-10-20 | 2011-04-28 | Merck Sharp & Dohme Corp. | Use of mixed mode chromatography for the capture and purification of basic antibody products |
| WO2011065940A1 (en) | 2009-11-24 | 2011-06-03 | Biogen Idec Ma Inc. | Method of supplementing culture media to prevent undesirable amino acid substitutions |
| WO2011069056A2 (en) | 2009-12-04 | 2011-06-09 | Momenta Pharmaceuticals, Inc. | Antennary fucosylation in glycoproteins from cho cells |
| US8277649B2 (en) | 2009-12-14 | 2012-10-02 | General Electric Company | Membranes and associated methods for purification of antibodies |
| SG181771A1 (en) | 2009-12-18 | 2012-07-30 | Novartis Ag | Wash solution and method for affinity chromatography |
| KR101405463B1 (ko) | 2010-01-15 | 2014-06-27 | 그래핀스퀘어 주식회사 | 기체 및 수분 차단용 그래핀 보호막, 이의 형성 방법 및 그의 용도 |
| US8152870B2 (en) | 2010-04-06 | 2012-04-10 | Heliae Development, Llc | Methods of and systems for producing biofuels |
| WO2011127322A1 (en) | 2010-04-07 | 2011-10-13 | Momenta Pharmaceuticals, Inc. | High mannose glycans |
| SG185038A1 (en) | 2010-04-26 | 2012-11-29 | Novartis Ag | Improved cell culture medium |
| SG185014A1 (en) | 2010-04-26 | 2012-11-29 | Novartis Ag | Improved cell cultivation process |
| HUE030820T2 (en) | 2010-05-28 | 2017-06-28 | Hoffmann La Roche | Decreasing Lactate Levels and Enhancing Polypeptide Production by Control of Lactate Dehydrogenase and Pyruvate Dehydrogenase Kinase Expression |
| EP2601287B1 (en) | 2010-08-05 | 2015-01-07 | Amgen Inc. | Dipeptides to enhance yield and viability from cell cultures |
| WO2012030512A1 (en) | 2010-09-03 | 2012-03-08 | Percivia Llc. | Flow-through protein purification process |
| US20130224797A1 (en) | 2010-10-15 | 2013-08-29 | Jcr Pharmaceuticals Co., Ltd. | Method for producing glycoprotein having mannose residue as non-reducing end of sugar chain |
| EP2450375A1 (en) | 2010-11-09 | 2012-05-09 | Sandoz Gmbh | Cell culture medium and process for protein expression, said medium and process comprising a PAM inhibitor |
| WO2012078376A1 (en) | 2010-12-08 | 2012-06-14 | Amgen Inc. | Ion exchange chromatography in the presence of an amino acid |
| CN103380144B (zh) | 2010-12-21 | 2016-03-02 | 霍夫曼-拉罗奇有限公司 | 同等型富集的抗体制备物及其获得方法 |
| CA2829110C (en) | 2011-03-06 | 2019-01-15 | Merck Serono S.A. | Low fucose cell lines and uses thereof |
| AU2012237026A1 (en) | 2011-03-25 | 2013-10-24 | Genentech, Inc. | Novel protein purification methods |
| EP2511293A1 (en) | 2011-04-13 | 2012-10-17 | LEK Pharmaceuticals d.d. | A method for controlling the main complex N-glycan structures and the acidic variants and variability in bioprocesses producing recombinant proteins |
| WO2012145682A1 (en) | 2011-04-21 | 2012-10-26 | Amgen Inc. | A method for culturing mammalian cells to improve recombinant protein production |
| KR101644954B1 (ko) | 2011-04-29 | 2016-08-02 | 바이오콘 리서치 리미티드 | 배양 동안 락테이트의 축적을 감소시키는 방법 및 폴리펩타이드를 생산하는 방법 |
| US20120283419A1 (en) | 2011-05-03 | 2012-11-08 | Avantor Performance Materials, Inc. | Separation of protein monomers from aggregates by solid weak anion exchange support functionalized with amine moieties |
| WO2012158551A1 (en) | 2011-05-13 | 2012-11-22 | Biogen Idec Ma Inc. | Methods of preventing and removing trisulfide bonds |
| KR20240005106A (ko) | 2011-07-01 | 2024-01-11 | 암젠 인크 | 포유동물 세포 배양 |
| WO2013006461A1 (en) | 2011-07-01 | 2013-01-10 | Biogen Idec Ma Inc. | Cholesterol-based media supplementals for cell culture |
| CN103717729B (zh) | 2011-07-08 | 2017-11-21 | 动量制药公司 | 细胞培养方法 |
| WO2013013013A2 (en) | 2011-07-21 | 2013-01-24 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for producing modified glycoproteins |
| CN108314729A (zh) | 2011-10-19 | 2018-07-24 | 罗切格利卡特公司 | 岩藻糖基化抗体的分离方法 |
-
2009
- 2009-10-20 EP EP09752562A patent/EP2346897A2/en not_active Ceased
- 2009-10-20 NZ NZ592097A patent/NZ592097A/xx unknown
- 2009-10-20 MX MX2011004201A patent/MX2011004201A/es active IP Right Grant
- 2009-10-20 RU RU2011120174/10A patent/RU2551237C2/ru active
- 2009-10-20 KR KR1020117011273A patent/KR101722423B1/ko active IP Right Grant
- 2009-10-20 CN CN2009801513952A patent/CN102257005A/zh active Pending
- 2009-10-20 AU AU2009307737A patent/AU2009307737B2/en active Active
- 2009-10-20 JP JP2011532335A patent/JP5856845B2/ja active Active
- 2009-10-20 TW TW098135686A patent/TW201028433A/zh unknown
- 2009-10-20 CA CA2738499A patent/CA2738499A1/en not_active Abandoned
- 2009-10-20 CN CN201510353605.3A patent/CN104974251A/zh active Pending
- 2009-10-20 BR BRPI0920572A patent/BRPI0920572A8/pt active Search and Examination
- 2009-10-20 SG SG2013077995A patent/SG195577A1/en unknown
- 2009-10-20 US US12/582,556 patent/US9109010B2/en active Active
- 2009-10-20 WO PCT/US2009/061338 patent/WO2010048192A2/en active Application Filing
- 2009-10-20 SG SG10201702951RA patent/SG10201702951RA/en unknown
-
2011
- 2011-03-24 IL IL211917A patent/IL211917A0/en unknown
- 2011-04-06 ZA ZA2011/02552A patent/ZA201102552B/en unknown
-
2014
- 2014-10-01 JP JP2014203181A patent/JP6023140B2/ja active Active
-
2015
- 2015-08-17 US US14/828,072 patent/US20150344564A1/en not_active Abandoned
-
2016
- 2016-04-13 JP JP2016080187A patent/JP2016193900A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1146730A (zh) * | 1994-02-22 | 1997-04-02 | 史密丝克莱恩比彻姆公司 | 抗体纯化 |
Non-Patent Citations (1)
| Title |
|---|
| TAKASHI ISHIHARA ET AL.: "Accelerated purification process development of monoclonal antibodies for shortening time to clinic Design and case study of chromatography processes", 《JOURNAL OF CHROMATOGRAPHY A》 * |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104411820A (zh) * | 2012-06-29 | 2015-03-11 | Emd密理博公司 | 在蛋白纯化过程中灭活病毒的方法 |
| CN104411820B (zh) * | 2012-06-29 | 2017-05-03 | Emd密理博公司 | 在蛋白纯化过程中灭活病毒的方法 |
| CN106029682A (zh) * | 2013-12-27 | 2016-10-12 | 中外制药株式会社 | 等电点低的抗体的纯化方法 |
| US10654933B2 (en) | 2013-12-27 | 2020-05-19 | Chugai Seiyaku Kabushiki Kaisha | Method for purifying antibody having low isoelectric point |
| CN106459142A (zh) * | 2014-04-30 | 2017-02-22 | 诺和诺德股份有限公司 | 使用辛酸纯化蛋白质的方法 |
| CN106459142B (zh) * | 2014-04-30 | 2021-07-13 | 诺和诺德股份有限公司 | 使用辛酸纯化蛋白质的方法 |
| CN107586760A (zh) * | 2016-07-07 | 2018-01-16 | 扬州优邦生物药品有限公司 | 一种猪圆环病毒2型病毒样颗粒的纯化方法及其应用 |
| CN107586760B (zh) * | 2016-07-07 | 2019-10-11 | 扬州优邦生物药品有限公司 | 一种猪圆环病毒2型病毒样颗粒的纯化方法及其应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2010048192A3 (en) | 2010-06-24 |
| RU2551237C2 (ru) | 2015-05-20 |
| US20100136025A1 (en) | 2010-06-03 |
| RU2011120174A (ru) | 2012-11-27 |
| JP6023140B2 (ja) | 2016-11-09 |
| KR101722423B1 (ko) | 2017-04-18 |
| EP2346897A2 (en) | 2011-07-27 |
| WO2010048192A2 (en) | 2010-04-29 |
| SG195577A1 (en) | 2013-12-30 |
| JP5856845B2 (ja) | 2016-02-10 |
| NZ592097A (en) | 2013-01-25 |
| US20150344564A1 (en) | 2015-12-03 |
| JP2012506385A (ja) | 2012-03-15 |
| BRPI0920572A8 (pt) | 2015-10-27 |
| ZA201102552B (en) | 2012-01-25 |
| JP2016193900A (ja) | 2016-11-17 |
| BRPI0920572A2 (pt) | 2015-09-29 |
| AU2009307737A1 (en) | 2010-04-29 |
| AU2009307737B2 (en) | 2015-07-23 |
| KR20110086069A (ko) | 2011-07-27 |
| MX2011004201A (es) | 2011-05-24 |
| US9109010B2 (en) | 2015-08-18 |
| TW201028433A (en) | 2010-08-01 |
| CN104974251A (zh) | 2015-10-14 |
| JP2015051975A (ja) | 2015-03-19 |
| CA2738499A1 (en) | 2010-04-29 |
| IL211917A0 (en) | 2011-06-30 |
| SG10201702951RA (en) | 2017-06-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102257005A (zh) | 在抗体纯化过程中的病毒灭活 | |
| CN102257006A (zh) | 使用a蛋白亲和层析分离和纯化抗体 | |
| CN102257004A (zh) | 与il-12结合的抗体及其纯化方法 | |
| CN102257007A (zh) | 与il-18结合的抗体及其纯化方法 | |
| AU2015203650B2 (en) | Viral inactivation during purification of antibodies | |
| AU2015201093A1 (en) | Antibodies that bind to IL-12 and methods of purifying the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| ASS | Succession or assignment of patent right |
Owner name: ABBVIE COMPANY Free format text: FORMER OWNER: ABBOTT GMBH. + CO. KG Effective date: 20130619 |
|
| C41 | Transfer of patent application or patent right or utility model | ||
| TA01 | Transfer of patent application right |
Effective date of registration: 20130619 Address after: Illinois State Applicant after: ABBVIE company Address before: Illinois State Applicant before: Abbott GmbH. & Co. Kg |
|
| RJ01 | Rejection of invention patent application after publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20111123 |