WO2016116652A1 - Moduladores de los receptores a3 de adenosina - Google Patents
Moduladores de los receptores a3 de adenosina Download PDFInfo
- Publication number
- WO2016116652A1 WO2016116652A1 PCT/ES2016/070032 ES2016070032W WO2016116652A1 WO 2016116652 A1 WO2016116652 A1 WO 2016116652A1 ES 2016070032 W ES2016070032 W ES 2016070032W WO 2016116652 A1 WO2016116652 A1 WO 2016116652A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- cyano
- thiazol
- ylcarbamoyl
- carboxylic acid
- group
- Prior art date
Links
- CAPQNJPHPLILDH-AWEZNQCLSA-N C[C@@H](CC[O](C)C(c1ccc(C(Nc2nc(-c3ccccc3)c(N)[s]2)=O)[s]1)=O)C1CC1 Chemical compound C[C@@H](CC[O](C)C(c1ccc(C(Nc2nc(-c3ccccc3)c(N)[s]2)=O)[s]1)=O)C1CC1 CAPQNJPHPLILDH-AWEZNQCLSA-N 0.000 description 1
- QUYRKLOQNGWLBO-UHFFFAOYSA-P F[B](F)(F)[F]C(C[NH+]1F)[NH+](CCl)CC1[F][B](F)(F)F Chemical compound F[B](F)(F)[F]C(C[NH+]1F)[NH+](CCl)CC1[F][B](F)(F)F QUYRKLOQNGWLBO-UHFFFAOYSA-P 0.000 description 1
- XRYGWHNTKGAFAY-UHFFFAOYSA-N N#Cc1c(-c2ccccc2)nc(NC(C2SC(C(O)=O)=CC2)=O)[s]1 Chemical compound N#Cc1c(-c2ccccc2)nc(NC(C2SC(C(O)=O)=CC2)=O)[s]1 XRYGWHNTKGAFAY-UHFFFAOYSA-N 0.000 description 1
- FTAOMRJSRMZZGW-UHFFFAOYSA-N Nc1nc(-c2ccccc2)c(F)[s]1 Chemical compound Nc1nc(-c2ccccc2)c(F)[s]1 FTAOMRJSRMZZGW-UHFFFAOYSA-N 0.000 description 1
- PYSJLPAOBIGQPK-UHFFFAOYSA-N Nc1nc(-c2ccccc2)c[s]1 Chemical compound Nc1nc(-c2ccccc2)c[s]1 PYSJLPAOBIGQPK-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D277/38—Nitrogen atoms
- C07D277/42—Amino or imino radicals substituted by hydrocarbon or substituted hydrocarbon radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/426—1,3-Thiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/427—Thiazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4436—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a heterocyclic ring having sulfur as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
- A61K31/167—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide having the nitrogen of a carboxamide group directly attached to the aromatic ring, e.g. lidocaine, paracetamol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/275—Nitriles; Isonitriles
- A61K31/277—Nitriles; Isonitriles having a ring, e.g. verapamil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/549—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame having two or more nitrogen atoms in the same ring, e.g. hydrochlorothiazide
Definitions
- the present invention relates to 2-amido-1,3-thiazole derivatives conveniently substituted as modulators of adenosine A 3 receptors.
- Other objects of the present invention are to provide a process for preparing said compounds; pharmaceutical compositions comprising an effective amount of said compounds; the use of the compounds in the manufacture of a medicament to treat pathological conditions or diseases that can be improved by antagonism of the A 3 adenosine receptors.
- adenosine are mediated through at least four specific membrane receptors that are classified as A ⁇ A 2 A, A 2B and A 3 receptors and belong to the family of G-protein coupled receptors.
- the Ai and A 3 decrease intracellular levels of cyclic adenosine monophosphate (cAMP) by coupling to inhibitory G proteins (G ⁇ ) that inhibit the enzyme adenylate cyclase.
- the A3 ⁇ 4 and A 2B receptors are coupled to stimulant G proteins (G s ) that activate the enzyme adenylate cyclase and increase intracellular cAMP levels. Through these receptors, adenosine regulates a wide range of physiological functions.
- Ulcerative colitis and Crohn's disease are serious and debilitating disorders with an increasing incidence.
- Adenosine A 3 receptor modulators are being studied as emerging treatments for bowel inflammation.
- a 3 AR adenosine A 3 receptors
- the well-known agonist of A 3 AR, IB-MECA was used in mice to improve intestinal inflammation and spontaneous colitis. Stimulation of the A 3 ARs was able to markedly reduce the colonic levels of proinflammatory cytosines such as IL-1, IL-6 and IL-12 (Mabley, J .; Soriano, F .; Pacher, P .; Hasko, G. ; Marton, A .; Wallace, R .; Salzman, A .; Szabo, C.
- the adenosine A 3 agonist receptor, N6- (3-iodobenzyl) -adenosine-5'-N-methyluronamide is protective in two murine models of colitis, Eur. J. Pharmacol. 2003, 466, 323-329).
- a 3 adenosine receptors are widely distributed in the central nervous system but at low levels and with reduced affinity.
- the role of A 3 ARs in various pathophysiological conditions of the brain is controversial, although there are sufficient indications that point to an important role of these receptors in neurotransmission (Boison, D. Adenosine as a modulator of brain activity. Drug News Perspect. 2007 , 20, 607-611; Burnstock, G .; Fredholm, BB; Verkhratsky, A. Adenosine and ATP receptors in the brain. Curr. Top. Med. Chem. 201 1, 1 1, 973-101 1).
- a 3 ARs play a protective role in the first phase of ischemia by reducing synaptic transmission (Pugliese, AM; Latini, S .; Corradetti, R .; Pedata, F. Brief, repeated, oxygen-glucose deprivation episodes protect neurotransmission from a longer ischemic episode in the in vitro hippocampus: role of adenosine receptors. Br. J. Pharmacol. 2003, 140, 305-314).
- adenosine through the A 3 receptor can mediate vascular protection and help decrease the size of myocardial infarction by a mechanism that involves PKC, activation of KATP channels, phosphorylation of p38MAPKs and glycogen synthase kinase (Maddock, H. L; Mocanu, MM; Yellon, DM Adenosine A 3 receptor activation protects the myocardium from reperiusion / reoxygenation injury. Am. J. Physiol .: Heart Circ. Physiol. 2002, 283, H1307-H1313).
- Arteriosclerosis a multifactorial disease of the large arteries, is the leading cause of heart disease and stroke worldwide.
- Epidemiological studies have discovered several environmental and genetic risk factors associated with this disease. More recently, it has been shown that adenosine through the activation of A 3 ARs stimulates the secretion of endothelial growth factor vascular (VEGF) and cell foam formation, and this effect is greatly reduced by treatment with adenosine A 3 receptor antagonists.
- VEGF endothelial growth factor vascular
- a 3 AR antagonists may be of interest to block important steps in the development of atherosclerotic plaque (Gessi, S .; Fogli, E .; Sacchetto, V .; Merighi, S .; Varani, K .; Preti, D .; Leung, E .; Maclennan, S .; Borea, PA Adenosine modulates HIF-1 ⁇ alpha ⁇ , VEGF, IL-8, and foam cell formation in a human model of hypoxic foam cells Arterioscler., Thromb., Vasc. Biol. 2010, 30, 90-97).
- a 3 ARs are present in immune cells and participate in the immune response of inflammatory processes. Numerous results from in vitro and in vivo studies suggest that the activation of A 3 ARs can be both pro-inflammatory and anti-inflammatory depending on the type of cell examined or the animal species considered.
- adenosine in the regulation of the respiratory system is based on the high levels of adenosine found in bronchoalveolar lavage (BAL), blood and condensed exhaled air of patients with asthma and chronic obstructive pulmonary disease (COPD).
- BAL bronchoalveolar lavage
- COPD chronic obstructive pulmonary disease
- a 3 ARs have been involved in inflammatory processes, playing an important role in both pro and anti-inflammatory responses, depending on their function in different cell types (Salvatore, O A .; Tilley, S. L; Latour, AM; Fletcher, DS; Koller, BH; Jacobson, MA Disruption of the A 3 adenosine receptor gene in mice and its effect on stimulated inflammatory cells. J. Biol. Chem. 2000, 275, 4429-4434).
- mice treated with selective adenosine A 3 receptor antagonists showed marked attenuation of pulmonary inflammation, reducing eosinophil infiltration and production of mucus in the airways (Young, HW; Molina, JG; Dimina, D .; Zhong, H .; Jacobson, M .; Chan, LN; Chan, TS; Lee, JJ; Blackburn, MR
- a 3 adenosine receptor signaling contributes to airway inflammation and mucus production in adenosine deaminase-deficient mice. J. Immunol. 2004,173, 1380-1389).
- adenosine A 3 receptors Modulation of adenosine A 3 receptors has been reported as a possible therapeutic target for the treatment of various eye diseases, such as dry eye syndrome, glaucoma or uveitis (Y. Zhong, et al., Adenosine, adenosine receptors and glaucoma: An updated overview, Biochim. Biophys. Acta, 2013).
- mRNA and adenosine A 3 receptor protein have been found to be increased in the colorless ciliary epithelium of the eye in glaucoma lens pseudoexfoliation syndrome, compared to the normal eye (Schlotzer-Schrehardt, U. ; Zenkel, M .; Decking, U .; Haubs, D .; Kruse, FE; Junemann, A .; Coca-Prados, M .; Naumann, GO Selective upregulation of the A 3 adenosine receptor in eyes with pseudoexfoliation syndrome and glaucoma Invest. Ophthalmol. Visual Sci. 2005, 46, 2023-2034).
- IB-MECA inhibits the clinical and pathological manifestations of uveitis (Bar-Yehuda, S .; Luger, D .; Ochaion, A .; Cohen, S .; Patokaa, R .; Zozulya, G .; Silver, PB; De Morales, JMGR; Casp ⁇ , RR; Fishman, P.
- a 3 ARs are present in different types of tumor cells, such as the HL60 and K562 human tumor lines of leukemia and lymphoma, glioblastoma and prostate.
- a 3 ARs are involved in tumor growth and cell cycle regulation (Gessi, S .; Merighi, S .; Varani, K .; Cattabriga, E .; Benini, A .; Mirandola, P .; Leung, E .; Mac Lennan, S .; Feo, O; Baraldi, S .; Borea, PA Adenosine receptors in colon carcinoma tissues and colon tumor cell Unes: focus on the A 3 adenosine subtype J. Cell. Physiol. 2007 , 21 1, 826-836).
- patent application US 200320387 discloses derivatives of 2,4-substituted tlazoles, having inhibitory properties on the production of pro-inflammatory cytokines and inhibition on said adenosine A 3 receptor.
- Patent application WO 9921555 discloses compounds derived from 1,3-azoles as antagonists of adenosine A 3 receptor and their use as a prophylactic or therapeutic agent for the treatment of asthma, allergies and inflammation, among others.
- aryl-pyridinyl-thiazoles are disclosed as adenosine A 3 receptor inhibitors and their use also as anti-inflammatory agents.
- US patent application 2012134945 discloses the use of adenosine A 3 receptor antagonists in the modulation of melanin production, secretion and / or accumulation, as well as methods of treating conditions such as skin hyperpigmentation.
- Patent application US 201 1 190324 discloses the use of adenosine A 3 receptor antagonists for the treatment of atherosclerosis and the combination of said antagonists with other anti-atherosclerotic agents.
- Patent application US 201 1171 130 discloses the use of antagonists and / or partial agonists of the adenosine A 3 receptor for the treatment of numerous diseases, including cancer, inflammatory diseases, asthma, glaucoma, among others.
- R 2 is selected from an alkyl, cycloalkyl, cycloalkylalkyl and alkylcycloalkyl radical.
- Such compounds are potent and selective adenosine Ai receptor antagonists, and have very low affinity for other adenosine receptors, among which is the A 3 receptor, as shown in the following table.
- the authors of the present invention have found that the introduction of an aryl or heteroaryl group at the R 2 position of the above general formula causes the compounds to become potent modulators of the adenosine A 3 receptor.
- the present application discloses new derivatives of 2-amido 1,3-thiazole carboxylic acids as potent modulators of the adenosine A 3 receptor.
- the present invention relates to derivatives of 2-amido-1,3-thiazole of formula (I):
- R 1 represents a 5 or 6-membered aryl or heteroaryl group optionally substituted by one or more substituents selected from the group consisting of halogen atom, linear or branched C ⁇ Ce alkyl, C 3 -C 12 cycloalkyl, hydroxy, C r alkoxy C 6 linear or branched and cyano group;
- R 2 is selected from the group consisting of halogen atom and a cyano group
- R 3 represents a 5- or 6-membered aryl or heteroaryl group optionally substituted by one or more substituents selected from the group consisting of halogen atom, cyano group, C 3 -C 12 cycloalkyl, hydroxy, linear Ci-C 6 alkoxy or branched optionally substituted by 1, 2 or 3 halogen atoms, C ⁇ ⁇ -C 6 alkylthio, amino, mono- or dialkylamino, CC 6 alkoxyalkyl, hydroxycarbonyl and C 2 -C 6 alkoxycarbonyl; Y
- R 5 and R 6 independently represent a C 3 -C 12 cycloalkyl or a linear or branched CC 4 alkyl group, substituted by a carboxyl group (-COOH); or ii) R 5 and R 6 form together with the N atom to which a saturated 5 or 6-membered cycle is attached which optionally comprises a heteroatom selected from N and O, which is substituted by a carboxyl group (-COOH).
- adenosine A 3 receptors such as neurological disorders, including Alzheimer's disease, Huntington's disease and Parkinson's disease, cardiovascular diseases such as atherosclerosis, respiratory diseases such as asthma, oncological diseases such as prostate cancer, kidney diseases such as acute renal failure, autoimmune diseases such as rheumatoid arthritis, diseases of the gastrointestinal system such as Crohn's disease, colitis or irritable bowel syndrome or ophthalmic diseases or pathological conditions such as glaucoma, dry eye syndrome or uveitis, d) procedures to treat a disease that can be improved by modulation of adenosine A 3 receptors such as neurological disorders such as Alzheimer's disease, Huntington's disease and Parkinson's disease, cardiovascular diseases such as atherosis, adenosine A 3 receptors, such as atherosis, respiratory diseases such as asthma, oncological diseases such as prostate cancer, kidney diseases such as acute renal failure, autoimmune diseases such as rheumatoid arthritis, diseases of the gastrointestinal system such as Crohn
- CC 6 alkyl group is used to designate linear or branched, optionally substituted hydrocarbon (C n H 2n + i) radicals having 1 to 6 carbon atoms.
- the alkyl groups preferably contain from 1 to 4 carbon atoms.
- Examples include methyl, ethyl, n-propyl, i-propyl, n-butyl, sec-butyl and tere-butyl, n-pentyl, 1-methylbutyl, 2-methylbutyl, isopentyl, 1-ethylpropyl, 1, 1- radicals dimethylpropyl, 1, 2- dimethylpropyl, n-hexyl, 1-ethylbutyl, 2-ethylbutyl, 1, 1-dimethylbutyl, 1, 2-dimethylbutyl, 1, 3- dimeti! butyl, 2,2-dimethylbutyl, 2,3-dimethylbutyl, 2-methylpentyl, 3-methylpentyl and iso-hexyl.
- -C 6 alkoxy group is used to designate radicals containing the CC 6 alkyl group attached to an oxygen atom (C 2 H 2n + i-0-) , linear or branched, optionally substituted, containing 1 to 6 carbon atoms.
- the alkyl groups contain 1 to 4 carbon atoms.
- Preferred alkoxy radicals include methoxy, ethoxy, n-propoxy, i-propoxy, n-butoxy, sec-butoxy, t-butoxy, trifluoromethoxy, difluoromethoxy, hydroxymethoxy, 2-hydroxyethoxy or 2-hydroxypropoxy.
- alkylthio includes radicals containing S and CrC 6 alkyl , optionally substituted, linear or branched from 1 to 6 carbon atoms. In a preferred embodiment of the present invention the alkyl groups contain from 1 to 4 carbon atoms.
- Preferred, optionally substituted alkylthio radicals include methylthio, ethylthio, n-propylthio, i-propylthio, n-butylthio, sec-butylthio, t-butylthio, trifluoromethylthio, difluoromethylthio, hydroxymethylthio, 2-hydroxyethylthio or 2-hydroxypropyl.
- C 2 -C 6 alkoxyalkyl group includes radicals containing an alkyl chain interrupted by at least one oxygen function. The number of carbon atoms indicates the total number of carbon atoms present in the radical. All structural isomers are included.
- alkoxycarbonyl group C 2 - C 6 embraces radicals containing alkoxyl group C2 - C6 as defined above linked by a carbon atom to a carbonyl group.
- C 3 -Ci 2 cycloalkyl group is used to designate saturated cyclic hydrocarbon radicals (C n H 2n-1 ) or monounsaturated (C n H 2n -3), optionally substituted, containing 3 to 12 carbon atoms.
- the cycloalkyl groups preferably contain from 3 to 8 carbon atoms.
- Preferred, optionally substituted cycloalkyl groups include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl and cycloheptyl. When a cycloalkyl group has two or more substituents, these may be the same or different.
- aryl group is used to designate an optionally substituted C 5 -C 6 aryl radical, such as, for example, phenyl.
- aryl radical carries 2 or more substituents, the substituents may be the same or different.
- heteroaryl group is used to designate a 5 or 6 membered ring with a heteroatom selected from O, S and N.
- the heteroaryl groups in the present invention may be optionally substituted.
- the preferred heteroaryl groups are thienyl and pyridyl.
- the substituents may be the same or different.
- halogen atom includes chlorine, fluorine, bromine or iodine atoms, typically a fluorine, chlorine or bromine atom, more preferably chlorine or fluorine.
- halo when used as a prefix has the same meaning.
- substituents for example 1, 2, 3 or 4 substituents, in which the hydrogen atoms attached to atoms, groups, radicals, moieties, chains or unsubstituted cycles they are substituted by halogen, C3-C12 cycloalkyl, hydroxy, linear or branched CiC 6 alkoxy, CC 6 alkyl, amino, mono- or dialkylamino, CC 6 alkoxy alkyl, hydroxycarbonyl and C 2 -C 6 alkoxycarbonyl. When two or more substituents are present, the substituents may be the same or different.
- the term "pharmaceutically acceptable salt” encompasses salts with a pharmaceutically acceptable acid or base.
- Pharmaceutically acceptable acids include inorganic acids, for example hydrochloric, sulfuric, phosphoric, diphosphoric, hydrobromic, iodine and nitric acids and organic acids, for example citric, maleic, malic, mandelic, ascorbic, oxalic, succinic, tartaric, acetic, methanesulfonic acids. , ethanesulfonic, benzenesulfonic or p-toluenesulfonic.
- Pharmaceutically acceptable bases include alkali metal hydroxides (for example, sodium or potassium and alkaline earth metals (for example, calcium or magnesium) and organic bases, for example alkylamines, arylalkylamines and heterocyclic amines.
- X- atom can be an anion of various mineral acids such as, for example, chloride, bromide, iodide, sulfate, nitrate, phosphate or an anion of an organic acid, such as acetate, maleate, fumarate, citrate, oxalate, succinate, tartrate, malate, mandelate, trifluoroacetate, methanesulfonate and p-toluenesulfonate.
- mineral acids such as, for example, chloride, bromide, iodide, sulfate, nitrate, phosphate or an anion of an organic acid, such as acetate, maleate, fumarate, citrate, oxalate, succinate, tartrate, malate, mandelate, trifluoroacetate, methanesulfonate and p-toluenesulfonate.
- X- is preferably an anion selected from chloride, bromide, iodide, sulfate, nitrate, acetate, maleate, oxalate, succinate or trifluoroacetate. More preferably X- is chloride, bromide, trifluoroacetate or methanesulfonate.
- R 3 represents a phenyl group optionally substituted by 1, 2 or 3 halogen atoms or by a C Ce alkoxy group optionally substituted by 1, 2 or 3 halogen atoms .
- R 3 represents a phenyl group optionally substituted by 1, 2 or 3 halogen atoms or by a C ⁇ -Ce alkoxy group.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by halogen atoms.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by 1, 2 or 3 halogen atoms.
- R 4 represents a hydroxyl group.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by halogen atoms, specifically by 1, 2 or 3 halogen atoms and R 3 represents a phenyl group optionally substituted by 1, 2 or 3 halogen atoms or by a CC 6 alkoxy group optionally substituted by 1, 2 or 3 halogen atoms.
- R 3 represents a phenyl group optionally substituted by 1, 2 or 3 halogen atoms or by a dC 6 alkoxy group.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by halogen atoms, specifically by 1, 2 or 3 halogen atoms.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by 1, 2 or 3 halogen atoms
- R 4 represents a hydroxyl group and R 2 represents a halogen atom.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by halogen atoms, specifically by 1, 2 or 3 halogen atoms, R 4 represents a hydroxyl group and R 2 represents a cyano group.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by halogen atoms, specifically by 1, 2 or 3 halogen atoms and R 4 is selected from the group consisting of [-N (R 5 ) (R 6 )], as defined above.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by 1, 2 or 3 halogen atoms and R 4 is selected from the group consisting in [-N (R 5 ) (R 6 )], in which the groups R 5 and R 6 form, together with the nitrogen atom to which they are attached, a 5 or 6-membered saturated cycle optionally comprising a heteroatom selected from the group consisting of oxygen and nitrogen, and which is substituted by a carboxyl group (-COOH).
- R 4 represents a hydroxyl group
- R 3 represents a phenyl group optionally substituted by halogen atoms, specifically by 1, 2 or 3 halogen atoms or by a group Ci-Ce alkoxy optionally substituted by 1, 2 or 3 halogen atoms
- R represents a phenyl or thienyl group optionally substituted by 1, 2 or 3 halogen atoms.
- R 3 represents a phenyl group optionally substituted by halogen atoms or by a CC 6 alkoxy group optionally substituted by 1, 2 or 3 halogen atoms. In an even more preferred embodiment R 3 represents a phenyl group optionally substituted by 1, 2 or 3 halogen atoms or by a CC 6 alkoxy group.
- R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by halogen atoms. In an even more preferred embodiment R 1 is selected from the group consisting of a phenyl group and a thienyl group optionally substituted by 1, 2 or 3 halogen atoms.
- R is selected from the group consisting of [-N (R 5 ) (R 6 )] as defined above.
- R 4 is selected from the group consisting of [-N (R 5 ) (R 6 )], where R 5 and R 6 form, together with the atom of nitrogen to which they are attached, a saturated cycle of 5 or 6 members optionally comprising a heteroatom selected from the group consisting of oxygen and nitrogen, and which is substituted by a carboxyl group (-COOH).
- R 1 represents a phenyl group optionally substituted by 1, 2 or 3 halogen atoms
- R 2 is selected from the group consisting of a cyano group and an atom of halogen
- R 3 represents a phenyl group optionally substituted by 1, 2 or 3 halogen atoms or by a C-
- R 4 represents a hydroxyl group; more preferably R 3 represents a phenyl group optionally substituted with a methoxy group.
- R 1 represents a thienyl group optionally substituted by 1, 2 or 3 halogen atoms
- R 2 is selected from the group consisting of a cyano group and an atom of halogen
- R 3 represents a phenyl group optionally substituted by 1, 2 or 3 halogen atoms or by a CC 6 alkoxy group optionally substituted by 1, 2 or 3 halogen atoms
- R 4 represents a hydroxyl group; more preferably R 3 represents a phenyl group substituted by a methoxy group.
- Individual particular compounds of the invention include:
- the introduction of the remaining halogens is carried out using the corresponding N-halosuccinimides in DMF at room temperature or with the corresponding copper (II) salts in acetonitrile (J. Org. Chem. 2009; 74 (6): 2579-2580 ).
- the iodination instead is carried out according to the method described by P. Hebeisen (WO2009 / 068467A1), with iodine chloride in a mixture of acetic acid and dichloromethane at temperatures between 0 and 25 ° C.
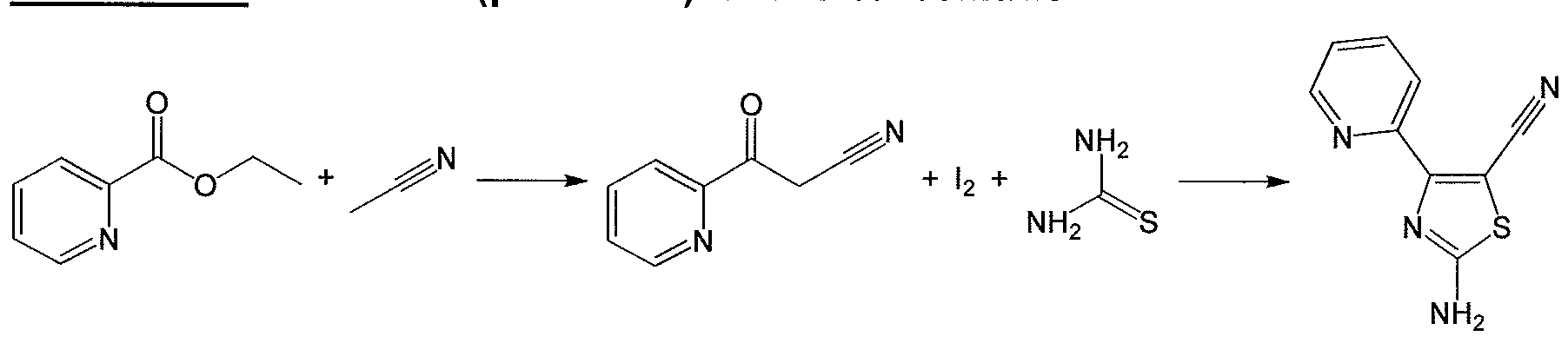
- the derivatives of 2-amino-1,3-thiazoles of formula (III) are not commercial, they can be obtained by the reaction between aryl or heteroaryl ketones of formula (II), where Y is an atom of halogen, with thiourea at temperatures between 40 ° to 100 ° C in ethanol or acetonitrile as solvent as shown in scheme 1.
- R 2 represents a cyano group
- the corresponding derivatives of 2-amino-1, 3-tlazoles of formula (IV) are obtained analogously by the reaction between commercial aryl or heteroaryl-cyanoketones of formula (VI), with iodine and thiourea at temperatures between 40 ° to 100 ° C using pyridine as the solvent, as shown in scheme 2.
- HATU hexafluorophosphate
- DIPEA ethyldiisopropylamine
- DMF dimethylformamide
- VIP activated dicarboxylic acid XOCR 1 COX
- the acid derivatives of formula (VIII) can be reacted with corresponding commercial amines or amino esters, such as with ethyl or methyl sonipecotate, in the presence of HATU to give rise to the amides or amido esters of formula (XI), these compounds are in turn hydrolyzed with sodium hydroxide resulting in the carboxylic acids of formula (XII) as shown in scheme 4, which are particular cases of the compounds of formula (I) according to the invention.
- Reagents and conditions h) HATU, DIPEA, DMF; g) NaOH (1 M), THF / H 2 0, room temperature, then precipitate with HCI.
- Table 1 shows the adenosine A 3 receptor binding constants obtained for some examples.
- Another aspect of the present invention is directed to the use of a compound of formula (I) according to the present invention for the manufacture of a medicament for the treatment of a disease or pathological condition susceptible of improvement by modulation of adenosine A 3 receptors .
- the compounds of the present invention are useful in the treatment or prevention of diseases that are known to be improved by treatment with a modulator of adenosine A 3 receptors.
- diseases are for example: diseases or pathological eye conditions such as glaucoma, dry eye syndrome or uveitis, neurological disorders such as Alzheimer's disease, cardiovascular diseases such as atherosclerosis, respiratory diseases such as asthma, kidney diseases such as acute renal failure, cancer diseases such as prostate cancer, autoimmune diseases such as rheumatoid arthritis or diseases of the gastrointestinal system such as irritable bowel syndrome.
- the compounds of the invention, the pharmaceutically acceptable salts thereof, and the pharmaceutical compositions comprising said compounds and / or the salts thereof can be used in a method of treating disorders of the human body comprising administering to a subject in need of said treatment an effective amount of a 2-amino-1,3-thiazole derivative of formula (I) of the invention or a pharmaceutically acceptable salt thereof.
- the present invention also provides pharmaceutical compositions comprising, as active ingredient, at least one 2-amino-1,3-thiazole derivative of formula (I) according to the present invention or a pharmaceutically acceptable salt thereof, together with a pharmaceutically excipient. acceptable, such as a vehicle or diluent.
- a pharmaceutically excipient such as a vehicle or diluent.
- the active ingredient may comprise from 0.001% to 99% by weight, preferably from 0.01% to 90% by weight of the composition, depending on the nature of the formulation and whether an additional dilution is made before application.
- the compositions are prepared in a form suitable for oral, topical, nasal, rectal, percutaneous or injectable administration.
- compositions of this invention are well known per se and the actual excipients used depend on the intended method of administration of the compositions.
- compositions of this invention are preferably adapted for injectable administration and per os.
- the compositions for oral administration may take the form of tablets, long-acting tablets, sublingual tablets, capsules, inhalation aerosols, inhalation solutions, dry inhalation powder or liquid preparations, such as mixtures, elixirs, syrups or suspensions, all of them containing the compound of the invention;
- Such preparations can be prepared by methods known in the art.
- Diluents that can be used in the preparation of the compositions include liquid and solid diluents that are compatible with the active ingredient, together with coloring or flavoring agents, if so desired.
- the tablets or capsules may conveniently contain between 2 and 500 mg of the active ingredient or the equivalent amount of a salt thereof.
- the liquid composition adapted for oral use may be in the form of solutions or suspensions.
- the solutions may be aqueous solutions of a soluble salt or other derivative of the active compound together with, for example, sucrose to form a syrup.
- the suspensions may comprise an insoluble active compound of the invention or a pharmaceutically acceptable salt thereof together with water, together with a suspending agent or a flavoring agent.
- compositions for parenteral injection may be prepared from soluble salts, which may or may not be dried by freezing and may be dissolved in a pyrogen-free aqueous medium or other fluid suitable for parenteral injection.
- Effective doses are usually in the range of 2-2000 mg of active ingredient per day.
- the daily dosage can be administered in one or more treatments, preferably 1 to 4 treatments, per day.
- Another aspect of the invention is directed to a combination product comprising a compound of formula (I) as defined above and other drugs approved to treat diseases of the central nervous system such as Alzheimer's disease, cardiovascular diseases such as for example, atherosclerosis, respiratory diseases such as asthma, kidney diseases such as acute renal failure, cancer diseases such as prostate cancer, autoimmune diseases such as rheumatoid arthritis or diseases of the gastrointestinal system such as colon syndrome irritable.
- cardiovascular diseases such as for example, atherosclerosis
- respiratory diseases such as asthma
- kidney diseases such as acute renal failure
- cancer diseases such as prostate cancer
- autoimmune diseases such as rheumatoid arthritis or diseases of the gastrointestinal system such as colon syndrome irritable.
- Another aspect of the invention is directed to a combination product comprising a compound of formula (I) as defined above and another drug, wherein said drug is selected from the group consisting of Montelukast, Bicalutamide and Flutamide, the Tofacitinib, diuretics such as Hydrochlorothiazide and Lubiprostone to treat eye diseases such as asthma, prostate cancer, rheumatoid arthritis, acute renal failure, irritable bowel syndrome or glaucoma.
- said drug is selected from the group consisting of Montelukast, Bicalutamide and Flutamide, the Tofacitinib, diuretics such as Hydrochlorothiazide and Lubiprostone to treat eye diseases such as asthma, prostate cancer, rheumatoid arthritis, acute renal failure, irritable bowel syndrome or glaucoma.
- the HPLC-MS were performed on a Gilson instrument equipped with a Gilson 321 piston pump, a Gilson 864 vacuum degasifier, a Gilson 189 injection module, a Gilson 1/1000 splitter, a Gilson 307 pump, a Gilson 170 detector, and a Thermoquest Fennigan aQa detector.
- General method for the synthesis of acid chlorides were performed on a Gilson instrument equipped with a Gilson 321 piston pump, a Gilson 864 vacuum degasifier, a Gilson 189 injection module, a Gilson 1/1000 splitter, a Gilson 307 pump, a Gilson 170 detector, and a Thermoquest Fennigan aQa detector.
- the desired acid precipitates when a solution of 4M HCI is added dropwise until a pH ⁇ 3 is reached.
- the precipitate formed is filtered, washed with cold water and dried. 0.22 g (71.4%) of the desired product is obtained as a light brown solid.
- Example 10 3- ⁇ 5-Cyano-4- [4- (trifluoromethoxy) phenyl] thiazol-2-ylcarbamoyl ⁇ benzoic acid
- Example 31 3 - ((5-Cano-4- (thiophen-2-yl) thiazol-2-yl) carbamoyl) benzoic acid
- Example 33 4 - ((5-Cyano-4- (furan-2-yl) thiazol-2-yl) carbamoyl) benzoic acid
- Example 34 3 - ((4- (4-Chlorothiophene-2-yl) -5-cyanothiazol-2- ⁇ ) carbamoyl) benzoic acid
- Example 36 5 - ((5-Cyano-4- (3-methoxyphenyl) thiazol-2-yl) carbamoyl) thiophene-2-carboxylic acid
- Example 46 1- (3 - ⁇ [5-Cyano-4- (4-methoxyphenyl) thiazol-2- yl] carbamoyl ⁇ benzoyl) piperidino-4-carboxylic acid
- the solid obtained is then suspended in a NaOH solution (5 ml, 1 M) and stirred at room temperature following the reaction by thin layer chromatography (TLC) until the ester is completely hydrolyzed.
- the aqueous phase is then washed 3 times with DCM in a separatory funnel. The phases were separated and 4M HCI was added until pH ⁇ 3.
- the precipitate formed was filtered, washed with cold water and dried. 0.083 g (58.4%) of the desired product is obtained as a light brown solid.
- Example 48 1- ⁇ 3 - [(5-cyano-4-phenylthiazol-2-yl) carbamoyl] benzoyl ⁇ piperidino-4- carboxylic acid
- Example 49 1- (5 - ((5-cyano-4-phenylthiazol-2-yl) carbamoyl) thiophene-2-carbonyl) piperidine-4-carboxylic acid
- Example 50 1 - (4 - ((5-cyano-4- (thiophen-2-yl) thiazol-2-yl) carbamoiI) benzoyl) piperidino-4- carboxylic acid
- Example 51 1 - (5 - ((5-cyano-4- (thiophen-2-yl) thiazol-2-yl) carbamoyl) thiophene-2-carbonyl) piperidino-4-carboxylic acid
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Ophthalmology & Optometry (AREA)
- Pulmonology (AREA)
- Rheumatology (AREA)
- Physical Education & Sports Medicine (AREA)
- Immunology (AREA)
- Urology & Nephrology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Thiazole And Isothizaole Compounds (AREA)
- Saccharide Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Description
Claims
Priority Applications (19)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CA2974596A CA2974596C (en) | 2015-01-22 | 2016-01-22 | Modulators of the adenosine a3 receptors |
| AU2016210091A AU2016210091B2 (en) | 2015-01-22 | 2016-01-22 | Modulators of the adenosine A3 receptors |
| MEP-2019-265A ME03570B (me) | 2015-01-22 | 2016-01-22 | Tiazolni modulatori a3 adenozinskih receptora |
| SI201630442T SI3248964T1 (sl) | 2015-01-22 | 2016-01-22 | Tiazolovi modulatorji A3 adenozinskega receptorja |
| MX2017009514A MX2017009514A (es) | 2015-01-22 | 2016-01-22 | Moduladores de los receptores a3 de adenosina. |
| PL16704680T PL3248964T3 (pl) | 2015-01-22 | 2016-01-22 | Tiazolowe modulatory receptorów adenozynowych a3 |
| JP2017538582A JP6637983B2 (ja) | 2015-01-22 | 2016-01-22 | アデノシンa3受容体の調節剤 |
| EP16704680.4A EP3248964B1 (en) | 2015-01-22 | 2016-01-22 | Thiazole modulators of a3 adenosine receptors |
| ES16704680T ES2750030T3 (es) | 2015-01-22 | 2016-01-22 | Moduladores De Los Receptores A3 De Adenosina |
| BR112017015597-4A BR112017015597B1 (pt) | 2015-01-22 | 2016-01-22 | Composto modulador do receptor da adenosina a3, composição farmacêutica, uso e combinação deste |
| RSP20191282 RS59388B1 (sr) | 2015-01-22 | 2016-01-22 | Tiazolni modulatori a3 adenozinskih receptora |
| US15/544,429 US10238637B2 (en) | 2015-01-22 | 2016-01-22 | Modulators of the adenosine A3 receptors |
| DK16704680.4T DK3248964T3 (da) | 2015-01-22 | 2016-01-22 | Thiazol-modulatorer af A3-adenosinreceptorer |
| KR1020177023348A KR102424575B1 (ko) | 2015-01-22 | 2016-01-22 | 아데노신 a₃수용체의 조절제 |
| EA201791657A EA031627B1 (ru) | 2015-01-22 | 2016-01-22 | Модуляторы аденозиновых рецепторов a |
| CN201680006653.8A CN107207445B (zh) | 2015-01-22 | 2016-01-22 | 腺苷a3受体的调节剂 |
| LTEP16704680.4T LT3248964T (lt) | 2015-01-22 | 2016-01-22 | A3 adenozino receptorių tiazolo moduliatoriai |
| HRP20191779TT HRP20191779T1 (hr) | 2015-01-22 | 2019-10-01 | Tiazolski modulatori adenozinskih receptora a3 |
| CY20191101070T CY1122172T1 (el) | 2015-01-22 | 2019-10-11 | Τροποποιητες θειαζολης των a3 υποδοχεων αδενοσινης |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| ESP201530085 | 2015-01-22 | ||
| ES201530085A ES2578363B1 (es) | 2015-01-22 | 2015-01-22 | Moduladores de los receptores A3 de adenosina |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2016116652A1 true WO2016116652A1 (es) | 2016-07-28 |
Family
ID=55359537
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/ES2016/070032 WO2016116652A1 (es) | 2015-01-22 | 2016-01-22 | Moduladores de los receptores a3 de adenosina |
Country Status (22)
| Country | Link |
|---|---|
| US (1) | US10238637B2 (es) |
| EP (1) | EP3248964B1 (es) |
| JP (1) | JP6637983B2 (es) |
| KR (1) | KR102424575B1 (es) |
| CN (1) | CN107207445B (es) |
| AU (1) | AU2016210091B2 (es) |
| BR (1) | BR112017015597B1 (es) |
| CA (1) | CA2974596C (es) |
| CY (1) | CY1122172T1 (es) |
| DK (1) | DK3248964T3 (es) |
| EA (1) | EA031627B1 (es) |
| ES (2) | ES2578363B1 (es) |
| HR (1) | HRP20191779T1 (es) |
| HU (1) | HUE046307T2 (es) |
| LT (1) | LT3248964T (es) |
| ME (1) | ME03570B (es) |
| MX (1) | MX2017009514A (es) |
| PL (1) | PL3248964T3 (es) |
| PT (1) | PT3248964T (es) |
| RS (1) | RS59388B1 (es) |
| SI (1) | SI3248964T1 (es) |
| WO (1) | WO2016116652A1 (es) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2676535A1 (es) * | 2017-01-20 | 2018-07-20 | Palobiofarma, S.L. | Moduladores de los receptores a3 de adenosina |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102155406B1 (ko) | 2017-08-18 | 2020-09-11 | 주식회사 엘지화학 | 아연철산화물 내 잔류 Cl의 정량분석 방법 |
| US11458974B2 (en) * | 2019-07-08 | 2022-10-04 | Toyota Motor Engineering & Manufacturing North America, Inc. | Fleet-based average lane change and driver-specific behavior modelling for autonomous vehicle lane change operation |
Citations (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999021555A2 (en) | 1997-10-27 | 1999-05-06 | Takeda Chemical Industries, Ltd. | Adenosine a3 receptor antagonists |
| WO1999064418A1 (en) | 1998-06-05 | 1999-12-16 | Novartis Ag | Aryl pyridinyl thiazoles |
| WO2000003741A2 (en) | 1998-07-16 | 2000-01-27 | The Trustees Of The University Of Pennsylvania | Methods for reducing intraocular pressure using a3-adenosine antagonists |
| EP1180518A1 (en) | 1999-04-23 | 2002-02-20 | Takeda Chemical Industries, Ltd. | 5-pyridyl-1,3-azole compounds, process for producing the same and use thereof |
| US20030020387A1 (en) | 2001-07-16 | 2003-01-30 | Wing Forrest F. | Refrigerator shelves with rolled hook for cantilever fastening |
| ES2204262A1 (es) | 1998-09-16 | 2004-04-16 | Medco Research Inc. | Moduladores de los receptores a 3 de adenosina. |
| WO2005009969A1 (en) | 2003-07-31 | 2005-02-03 | Sanofi-Aventis | Aminoquinoline derivatives and their use as adenosine a3 ligands |
| WO2008006369A1 (en) | 2006-07-14 | 2008-01-17 | Santaris Pharma A/S | Adenosine receptor antagonists |
| WO2008045330A2 (en) | 2006-10-06 | 2008-04-17 | The Trustees Of The University Of Pennsylvania | Effective delivery of cross-species a3 adenosine-receptor antagonists to reduce intraocular pressure |
| WO2008124000A2 (en) * | 2007-04-02 | 2008-10-16 | Ligand Pharmaceuticals Incorporated | Thiazole derivatives as androgen receptor modulator compounds |
| WO2009052310A1 (en) | 2007-10-16 | 2009-04-23 | Cv Therapeutics, Inc | A3 adenosine receptor antagonists |
| WO2009068467A1 (en) | 2007-11-30 | 2009-06-04 | F. Hoffmann-La Roche Ag | Aminothiazole derivatives |
| ES2360632T3 (es) | 2006-01-26 | 2011-06-07 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Moduladores alostéricos del receptor a3 de adenosina. |
| US20110171130A1 (en) | 2008-08-01 | 2011-07-14 | The United States of America, as represented by the Secretary ,Deptment of Health and HumanService | A3 adenosine receptor antagonists and partial agonists |
| US20110190324A1 (en) | 2008-07-16 | 2011-08-04 | Edward Leung | Methods of treating atherosclerosis |
| ES2366075T3 (es) | 2007-10-02 | 2011-10-17 | Palobiofarma, S.L. | Nuevos compuestos como antagonistas de receptores a1 de adenosina. |
| US20120053176A1 (en) | 2010-09-01 | 2012-03-01 | Ambit Biosciences Corp. | Adenosine a3 receptor modulating compounds and methods of use thereof |
| US20120134945A1 (en) | 2009-07-21 | 2012-05-31 | Oradin Pharmaceutical Ltd. | A3 adenosine receptor ligands for modulation of pigmentation |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6303619B1 (en) | 1998-03-12 | 2001-10-16 | University Of Virginia | Meta-substituted acidic 8-phenylxanthine antagonists of A3 human adenosine receptors |
| US6686366B1 (en) | 1998-06-02 | 2004-02-03 | Osi Pharmaceuticals, Inc. | Compounds specific to adenosine A3 receptor and uses thereof |
| JP2003525291A (ja) | 2000-03-01 | 2003-08-26 | ジヤンセン・フアーマシユーチカ・ナームローゼ・フエンノートシヤツプ | 2,4−二置換チアゾリル誘導体 |
| US6673802B2 (en) | 2000-12-01 | 2004-01-06 | Osi Pharmaceuticals, Inc. | Compounds specific to adenosine A3 receptor and uses thereof |
| AU2002304358B2 (en) | 2001-05-31 | 2007-08-23 | Sanofi-Aventis | Aminoquinoline and aminopyridine derivatives and their use as adenosine A3 ligands |
| HUP0105406A3 (en) | 2001-12-21 | 2003-12-29 | Sanofi Aventis | Imidazo[1,2-a]quinolin derivatives, process for their preparation, pharmaceutical compositions thereof and intermediates |
| EP3002283B1 (en) | 2003-12-26 | 2017-06-14 | Kyowa Hakko Kirin Co., Ltd. | Thiazole derivatives |
| WO2007116106A1 (es) * | 2006-04-12 | 2007-10-18 | Palobiofarma, S.L. | Nuevos compuestos como antagonistas de los receptores a1 de adenosina |
-
2015
- 2015-01-22 ES ES201530085A patent/ES2578363B1/es active Active
-
2016
- 2016-01-22 BR BR112017015597-4A patent/BR112017015597B1/pt active IP Right Grant
- 2016-01-22 ME MEP-2019-265A patent/ME03570B/me unknown
- 2016-01-22 AU AU2016210091A patent/AU2016210091B2/en active Active
- 2016-01-22 PL PL16704680T patent/PL3248964T3/pl unknown
- 2016-01-22 US US15/544,429 patent/US10238637B2/en active Active
- 2016-01-22 LT LTEP16704680.4T patent/LT3248964T/lt unknown
- 2016-01-22 SI SI201630442T patent/SI3248964T1/sl unknown
- 2016-01-22 RS RSP20191282 patent/RS59388B1/sr unknown
- 2016-01-22 KR KR1020177023348A patent/KR102424575B1/ko active IP Right Grant
- 2016-01-22 ES ES16704680T patent/ES2750030T3/es active Active
- 2016-01-22 JP JP2017538582A patent/JP6637983B2/ja active Active
- 2016-01-22 EP EP16704680.4A patent/EP3248964B1/en active Active
- 2016-01-22 EA EA201791657A patent/EA031627B1/ru not_active IP Right Cessation
- 2016-01-22 CA CA2974596A patent/CA2974596C/en active Active
- 2016-01-22 DK DK16704680.4T patent/DK3248964T3/da active
- 2016-01-22 WO PCT/ES2016/070032 patent/WO2016116652A1/es active Application Filing
- 2016-01-22 CN CN201680006653.8A patent/CN107207445B/zh active Active
- 2016-01-22 PT PT167046804T patent/PT3248964T/pt unknown
- 2016-01-22 MX MX2017009514A patent/MX2017009514A/es active IP Right Grant
- 2016-01-22 HU HUE16704680A patent/HUE046307T2/hu unknown
-
2019
- 2019-10-01 HR HRP20191779TT patent/HRP20191779T1/hr unknown
- 2019-10-11 CY CY20191101070T patent/CY1122172T1/el unknown
Patent Citations (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999021555A2 (en) | 1997-10-27 | 1999-05-06 | Takeda Chemical Industries, Ltd. | Adenosine a3 receptor antagonists |
| WO1999064418A1 (en) | 1998-06-05 | 1999-12-16 | Novartis Ag | Aryl pyridinyl thiazoles |
| WO2000003741A2 (en) | 1998-07-16 | 2000-01-27 | The Trustees Of The University Of Pennsylvania | Methods for reducing intraocular pressure using a3-adenosine antagonists |
| ES2204262A1 (es) | 1998-09-16 | 2004-04-16 | Medco Research Inc. | Moduladores de los receptores a 3 de adenosina. |
| EP1180518A1 (en) | 1999-04-23 | 2002-02-20 | Takeda Chemical Industries, Ltd. | 5-pyridyl-1,3-azole compounds, process for producing the same and use thereof |
| US20030020387A1 (en) | 2001-07-16 | 2003-01-30 | Wing Forrest F. | Refrigerator shelves with rolled hook for cantilever fastening |
| WO2005009969A1 (en) | 2003-07-31 | 2005-02-03 | Sanofi-Aventis | Aminoquinoline derivatives and their use as adenosine a3 ligands |
| ES2360632T3 (es) | 2006-01-26 | 2011-06-07 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Moduladores alostéricos del receptor a3 de adenosina. |
| WO2008006369A1 (en) | 2006-07-14 | 2008-01-17 | Santaris Pharma A/S | Adenosine receptor antagonists |
| WO2008045330A2 (en) | 2006-10-06 | 2008-04-17 | The Trustees Of The University Of Pennsylvania | Effective delivery of cross-species a3 adenosine-receptor antagonists to reduce intraocular pressure |
| WO2008124000A2 (en) * | 2007-04-02 | 2008-10-16 | Ligand Pharmaceuticals Incorporated | Thiazole derivatives as androgen receptor modulator compounds |
| ES2366075T3 (es) | 2007-10-02 | 2011-10-17 | Palobiofarma, S.L. | Nuevos compuestos como antagonistas de receptores a1 de adenosina. |
| WO2009052310A1 (en) | 2007-10-16 | 2009-04-23 | Cv Therapeutics, Inc | A3 adenosine receptor antagonists |
| WO2009068467A1 (en) | 2007-11-30 | 2009-06-04 | F. Hoffmann-La Roche Ag | Aminothiazole derivatives |
| US20110190324A1 (en) | 2008-07-16 | 2011-08-04 | Edward Leung | Methods of treating atherosclerosis |
| US20110171130A1 (en) | 2008-08-01 | 2011-07-14 | The United States of America, as represented by the Secretary ,Deptment of Health and HumanService | A3 adenosine receptor antagonists and partial agonists |
| US20120134945A1 (en) | 2009-07-21 | 2012-05-31 | Oradin Pharmaceutical Ltd. | A3 adenosine receptor ligands for modulation of pigmentation |
| US20120053176A1 (en) | 2010-09-01 | 2012-03-01 | Ambit Biosciences Corp. | Adenosine a3 receptor modulating compounds and methods of use thereof |
Non-Patent Citations (37)
| Title |
|---|
| BANKS, ERIC R. ET AL., J. CHEM SOC PERKIN, vol. 1, pages 2069 - 2076 |
| BAR-YEHUDA, S.; LUGER, D.; OCHAION, A.; COHEN, S.; PATOKAA, R.; ZOZULYA, G.; SILVER, P. B.; DE MORALES, J. M. G. R.; CASPI, R. R.;: "Inhibition of experimental auto-immune uveitis by the A3 adenosine receptor agonist CF101", INT. J. MOL. MED., vol. 28, 2011, pages 727 - 731 |
| BAR-YEHUDA, S.; SILVERMAN, M. H.; KERNS, W. D.; OCHAION, A.; COHEN, S.; FISHMAN, P: "The anti-inflammatory effect of A3 adenosine receptor agonists: a novel targeted therapy for rheumatoid arthritis", EXPERT OPIN. INVEST. DRUGS, vol. 16, 2007, pages 1601 - 1613 |
| BHATTACHARYA P ET AL: "Exploring QSAR of thiazole and thiadiazole derivatives as potent and selective human adenosine A3 receptor antagonists using FA and GFA techniques", BIOORGANIC & MEDICINAL CHEMISTRY, PERGAMON, GB, vol. 13, no. 4, 15 February 2005 (2005-02-15), pages 1159 - 1165, XP004776019, ISSN: 0968-0896, DOI: 10.1016/J.BMC.2004.11.022 * |
| BOISON, D.: "Adenosine as a modulator of brain activity", DRUG NEWS PERSPECT., vol. 20, 2007, pages 607 - 611 |
| BOISON, D: "Adenosine as a modulator of brain activity", DRUG NEWS PERSPECT., vol. 20, 2007, pages 607 - 611 |
| BORGHINI ET AL: "QSAR study on thiazole and thiadiazole analogues as antagonists for the adenosine A1 and A3 receptors", BIOORGANIC & MEDICINAL CHEMISTRY, PERGAMON, GB, vol. 13, no. 18, 15 September 2005 (2005-09-15), pages 5330 - 5337, XP005021037, ISSN: 0968-0896, DOI: 10.1016/J.BMC.2005.05.041 * |
| BURDETT, K.A., SINTESIS, 1991, pages 441 - 42 |
| BURDETT, KA, SYNTHESIS, 1991, pages 441 - 42 |
| BURNSTOCK, G.; FREDHOLM, B. B.; VERKHRATSKY, A: "Adenosine and A TP receptors in the brain", CURR. TOP. MED. CHEM, vol. 11, 2011, pages 973 - 1011 |
| BUTLER, M ET AL.: "Impairment of adenosine A3 receptor activity disrupts neutrophil migratory capacity and impacts innate immune function in vivo", JOURNAL OF IMMUNOLOGY, 26 September 2012 (2012-09-26) |
| DE SCHEPPER; H. U.; DE MAN, J. G.; MOREELS, T. G.; PELCKMANS, P. A.; DE WINTER, B. Y.: "Review article: gastrointestinal sensory and motor disturbances in inflammatory bowel disease: clinical relevance and pathophysiological mechanisms", ALIMENT. PHARMACOL. THER., vol. 27, 2008, pages 621 - 637 |
| GESSI, S.; FOGLI, E.; SACCHETTO, V.; MERIGHI, S.; VARANI, K.; PRETI, D.; LEUNG, E.; MACLENNAN, S.; BOREA, P. A: "Adenosine modulates HIF-1 {alpha}, VEGF, IL-8, and foam cell formation in a human model of hypoxic foam cells", ARTERIOSCLER., THROMB., VASE. BIOL, vol. 30, 2010, pages 90 - 97 |
| GESSI, S.; MERIGHI, S.; VARANI, K.; CATTABRIGA, E.; BENINI, A.; MIRANDOLA, P.; LEUNG, E.; MAC LENNAN, S.; FEO, C.; BARALDI, S.: "Adenosine receptors in colon carcinoma tissues and colon tumoral cell lines: focus on the A3 adenosine subtype", J. CELL. PHYSIOL., vol. 211, 2007, pages 826 - 836 |
| HANAUER, S. B.; PRESENT, D. H: "The state of the art in the management of inflammatory bowel disease", REV. GASTROENTEROL. DISORD., vol. 3, 2003, pages 81 - 92 |
| INAMDAR GAJANAN S ET AL: "New insight into adenosine receptors selectivity derived from a novel series of [5-substituted-4-phenyl-1,3-thiazol-2-yl] benzamides and furamides", EUROPEAN JOURNAL OF MEDICINAL CHEMISTRY, EDITIONS SCIENTIFIQUE ELSEVIER, PARIS, FR, vol. 63, 22 March 2013 (2013-03-22), pages 924 - 934, XP029234025, ISSN: 0223-5234, DOI: 10.1016/J.EJMECH.2013.03.020 * |
| J. ORG CHEM, vol. 74, no. 6, 2009, pages 2579 - 2580 |
| JAJOO, S.; MUKHERJEA, D.; WATABE, K.; RAMKUMAR, V: "Adenosine A3 receptor suppresses prostate cancer metastasis by inhibiting NADPH oxidase activity", NEOPLASIA, vol. 11, 2009, pages 1132 - 1145 |
| KOSCSO, B ET AL.: "Investigational A3 adenosine receptor targeting agents", EXPERT OPIN INVESTIG DRUGS, vol. 20, no. 6, June 2011 (2011-06-01), pages 757 - 768 |
| MABLEY, J.; SORIANO, F.; PACHER, P.; HASKO, G.; MARTON, A.; WALLACE, R.; SALZMAN, A.; SZABO, C.: "The adenosine A3 receptor agonist, N6-(3-iodobenzyl)-adenosine-5'-N-methyluronamide, is protective in two murine models of colitis", EUR. J. PHARMACOL., vol. 466, 2003, pages 323 - 329 |
| MUIJLWIJK-KOEZEN VAN J E ET AL: "Thiazole and Thiadiazole Analogues as a Novel class of Adenosine Receptor Antagonists", JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY, US, vol. 44, no. 5, 1 March 2001 (2001-03-01), pages 749 - 762, XP002318825, ISSN: 0022-2623, DOI: 10.1021/JM0003945 * |
| OCHAION, A ET AL.: "The anti-inflammatory target A(3) adenosine receptor is over-expressed in rheumatoid arthritis,-psoriasis and Crohn's disease", CELL IMMUNOL, vol. 258, no. 2, 7 May 2009 (2009-05-07), pages 115 - 22 |
| PUGLIESE, A. M.; LATINI, S.; CORRADETTI, R.; PEDATA, F.: "Brief, repeated, oxygen-glucose deprivation episodes protect neurotransmission from a longer ischemic episode in the in vitro hippocampus: role of adenosine receptors.", BR. J. PHARMACOL., vol. 140, 2003, pages 305 - 314 |
| SALVATORE, C. A.; TILLEY, S. L.; LATOUR, A. M.; FLETCHER, D. S.; KOLLER, B. H.; JACOBSON, M. A: "Disruption of the A3 adenosine receptor gene in mice and its effect on stimulated inflammatory cells", J. BIOL.CHEM., vol. 275, 2000, pages 4429 - 4434 |
| SCHLOTZER-SCHREHARDT, U; ZENKEL, M.; DECKING, U.; HAUBS, D.; KRUSE, F. E.; JUNEMANN, A; COCA-PRADOS, M.; NAUMANN, G. O: "Selective upregulation of the A3 adenosine receptor in eyes with pseudoexfoliation syndrome and glaucoma", INVEST. OPHTHALMOL. VISUAL SCI., vol. 46, 2005, pages 2023 - 2034 |
| SILVERMAN, M. H.; STRAND, V.; MARKOVITS, D.; NAHIR, M.; REITBLAT, T.; MOLAD, Y.; ROSNER, I. ET AL.: "Clinical evidence for utilization of the A3 adenosine receptor as a target to treat rheumatoid arthritis: data from a phase II clinical trial", J. RHEUMATOL., vol. 35, 2008, pages 41 - 48 |
| SILVERMAN, M. H.; STRAND, V.; MARKOVITS, D.; NAHIR, M.; REITBLAT, T.; MOLAD, Y.; ROSNER, I.; ROZENBAUM, M.; MADER, R.; ADAWI, M. E: "Clinical evidence for utilization of the A3 adenosine receptor as a target to treat rheumatoid arthritis: data from a phase II clinical trial", J. RHEUMATOL., vol. 35, 2008, pages 41 - 48 |
| THOMAS LEE, H ET AL.: "A3 adenosine receptor knockout mice are protected against ischemia- and myoglobinuria-induced renal failure", AM J PHYSIOL RENAL PHYSIOL., vol. 284, 2003, pages F267 - F273 |
| TIANHUA REN, MD, PHD ET AL.: "Impact of Disrupting Adenosine A3 Receptors (A3-/-AR) on Colonic Motility or Progression of Colitis in the Mouse", INFLAMM BOWEL DIS., vol. 17, no. 8, August 2011 (2011-08-01), pages 1698 - 1713 |
| VAN DER HOEVEN, D.; WAN, T. C.; AUCHAMPACH, J. A: "Activation of the A3 adenosine receptor suppresses superoxide production and chemotaxis of mouse bone marrow neutrophils", MOL. PHARMACOL., vol. 74, 2008, pages 685 - 696 |
| VON ARNIM, C. A.; SPOELGEN, R.; PELTAN, I. D.; DENG, M.; COURCHESNE, S.; KOKER, M.; MATSUI, T.; KOWA, H.; LICHTENTHALER, S. F.; IR: "GGA1 acts as a spatial switch altering amyloid precursor protein trafficking and processing", J. NEUROSCI., vol. 26, 2006, pages 9913 - 9922 |
| Y. ZHONG ET AL.: "Adenosine, adenosine receptors and glaucoma", AN UPDATED OVERVIEW, BIOCHIM. BIOPHYS. ACTA, 2013 |
| YANG, H.; AVILA, M. Y.; PETERSON-YANTORNO, K.; COCA-PRADOS, M.; STONE, R. A.; JACOBSON, K. A; CIVAN, M. M: "The cross-species adenosine-receptor antagonist MRS 1292 inhibits adenosine-triggered human nonpigmented ciliary epithelial cell fluid release and reduces mouse intraocular pressure", CURR. EYE RES., vol. 30, 2005, pages 747 - 754 |
| YOON, M. H.; BAE, H. B.; HOI, J. I.; KIM, S. J.; CHUNG, S. T.; KIM, C. M: "Roles of adenosine receptor subtypes in the antinociceptive effect of intrathecal adenosine in a rat formalin test", PHARMACOLOGY, vol. 78, 2006, pages 21 - 26 |
| YOUNG, H. W.; MOLINA, J. G; DIMINA, D.; ZHONG, H.; JACOBSON, M.; CHAN, L. N.; CHAN, T. S.; LEE, J. J.; BLACKBURN, M. R: "A adenosine receptor signaling contributes to airway inflammation and mucus production in adenosine deaminase-deficient mice", J. IMMUNOL., vol. 173, 2004, pages 1380 - 1389 |
| ZHANG, M.; HU, H. L.; ZHANG, X. L; LU, W. N.; LIM, J.; EYSTEINSSON, T.; JACOBSON, K. A.; LATIES, A. M.; MITCHELL, C. H: "The A3 adenosine receptor attenuates the calcium rise triggered by NMDA receptors in retinal ganglion cells", NEUROCHEM. INT., vol. 56, 2010, pages 35 - 41 |
| ZHONG, H.; SHLYKOV, S. G.; MOLINA, J. G.; SANBORN, B. M.; JACOBSON, M. A.; TILLEY, S. L.; BLACKBURN, M. R.: "Activation of murine lung mast cells by the adenosine A3 receptor", J. IMMUNOL., vol. 171, 2003, pages 338 - 345 |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2676535A1 (es) * | 2017-01-20 | 2018-07-20 | Palobiofarma, S.L. | Moduladores de los receptores a3 de adenosina |
| WO2018134464A1 (es) * | 2017-01-20 | 2018-07-26 | Palobiofarma, S.L. | Moduladores de los receptores a3 de adenosina |
| KR20190105226A (ko) * | 2017-01-20 | 2019-09-16 | 팔로바이오파마, 에스.엘. | 아데노신 a3 수용체의 조절제 |
| JP2020505349A (ja) * | 2017-01-20 | 2020-02-20 | パロビオファルマ、ソシエダッド、リミターダPalobiofarma S.L | アデノシンa3受容体の調節剤 |
| AU2018209271B2 (en) * | 2017-01-20 | 2021-03-11 | Palobiofarma, S.L. | Adenosine A3 receptor modulators |
| EA038011B1 (ru) * | 2017-01-20 | 2021-06-22 | Палобиофарма, С.Л. | Модуляторы аденозиновых рецепторов a3 |
| JP7032410B2 (ja) | 2017-01-20 | 2022-03-08 | パロビオファルマ、ソシエダッド、リミターダ | アデノシンa3受容体の調節剤 |
| KR102483091B1 (ko) | 2017-01-20 | 2023-01-02 | 팔로바이오파마, 에스.엘. | 아데노신 a3 수용체의 조절제 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2016210091B2 (en) | 2019-08-15 |
| EA201791657A1 (ru) | 2017-12-29 |
| US20180263963A1 (en) | 2018-09-20 |
| SI3248964T1 (sl) | 2019-11-29 |
| KR102424575B1 (ko) | 2022-07-25 |
| CN107207445B (zh) | 2021-03-16 |
| US10238637B2 (en) | 2019-03-26 |
| LT3248964T (lt) | 2019-10-10 |
| BR112017015597B1 (pt) | 2023-02-28 |
| JP2018502881A (ja) | 2018-02-01 |
| HUE046307T2 (hu) | 2020-02-28 |
| EP3248964B1 (en) | 2019-07-17 |
| EP3248964A1 (en) | 2017-11-29 |
| JP6637983B2 (ja) | 2020-01-29 |
| AU2016210091A1 (en) | 2017-08-17 |
| BR112017015597A2 (pt) | 2018-03-13 |
| RS59388B1 (sr) | 2019-11-29 |
| PT3248964T (pt) | 2019-10-28 |
| PL3248964T3 (pl) | 2020-02-28 |
| EA031627B1 (ru) | 2019-01-31 |
| MX2017009514A (es) | 2017-11-15 |
| CY1122172T1 (el) | 2020-11-25 |
| DK3248964T3 (da) | 2019-10-07 |
| ES2578363B1 (es) | 2017-01-31 |
| ME03570B (me) | 2020-07-20 |
| ES2578363A1 (es) | 2016-07-26 |
| CN107207445A (zh) | 2017-09-26 |
| HRP20191779T1 (hr) | 2019-12-27 |
| ES2750030T3 (es) | 2020-03-24 |
| KR20170104612A (ko) | 2017-09-15 |
| CA2974596A1 (en) | 2016-07-28 |
| CA2974596C (en) | 2022-11-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7407961B2 (en) | Pyrazine derivatives and pharmaceutical use thereof | |
| AU2011297889B2 (en) | Pharmaceutically active compounds as Axl inhibitors | |
| TWI438205B (zh) | 蛋白質酪胺酸激酶活性抑制劑 | |
| RU2733750C2 (ru) | Производные карбоксизамещенных (гетеро)ароматических колец, способ их получения и применение | |
| ES2346323T3 (es) | Bencimidazoles sustituidos y su uso para inducir apoptosis. | |
| ES2824801T3 (es) | Sal de compuesto heterocíclico sustituido con halógeno | |
| ES2750030T3 (es) | Moduladores De Los Receptores A3 De Adenosina | |
| ES2847385T3 (es) | Moduladores de los receptores A3 de adenosina | |
| CN108473496B (zh) | 杂环化合物及其用途 | |
| IL293388A (en) | History of benzylamide as a transforming growth factor inhibitor in the i/alk5 receptor cell |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 16704680 Country of ref document: EP Kind code of ref document: A1 |
|
| DPE1 | Request for preliminary examination filed after expiration of 19th month from priority date (pct application filed from 20040101) | ||
| REEP | Request for entry into the european phase |
Ref document number: 2016704680 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 15544429 Country of ref document: US |
|
| WWE | Wipo information: entry into national phase |
Ref document number: MX/A/2017/009514 Country of ref document: MX |
|
| ENP | Entry into the national phase |
Ref document number: 2017538582 Country of ref document: JP Kind code of ref document: A Ref document number: 2974596 Country of ref document: CA |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| REG | Reference to national code |
Ref country code: BR Ref legal event code: B01A Ref document number: 112017015597 Country of ref document: BR |
|
| ENP | Entry into the national phase |
Ref document number: 2016210091 Country of ref document: AU Date of ref document: 20160122 Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 201791657 Country of ref document: EA |
|
| ENP | Entry into the national phase |
Ref document number: 20177023348 Country of ref document: KR Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 112017015597 Country of ref document: BR Kind code of ref document: A2 Effective date: 20170720 |