WO2016047605A1 - 殺菌性組成物 - Google Patents
殺菌性組成物 Download PDFInfo
- Publication number
- WO2016047605A1 WO2016047605A1 PCT/JP2015/076720 JP2015076720W WO2016047605A1 WO 2016047605 A1 WO2016047605 A1 WO 2016047605A1 JP 2015076720 W JP2015076720 W JP 2015076720W WO 2016047605 A1 WO2016047605 A1 WO 2016047605A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- group
- carbon atoms
- repeating unit
- formula
- hydrogen atom
- Prior art date
Links
- 0 CCC(C)(C)CC(*)(C(N(*)*OC)O)C(C)(C)CC Chemical compound CCC(C)(C)CC(*)(C(N(*)*OC)O)C(C)(C)CC 0.000 description 2
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N33/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic nitrogen compounds
- A01N33/02—Amines; Quaternary ammonium compounds
- A01N33/12—Quaternary ammonium compounds
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/40—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having a double or triple bond to nitrogen, e.g. cyanates, cyanamides
- A01N47/42—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having a double or triple bond to nitrogen, e.g. cyanates, cyanamides containing —N=CX2 groups, e.g. isothiourea
- A01N47/44—Guanidine; Derivatives thereof
Definitions
- the present invention relates to a bactericidal composition.
- Bactericides are used in various fields such as daily necessities and medical supplies. For example, it is used for coating materials for medical and hygiene products, cleaning compositions for clothes, disinfectants and interior paints in food factories and hospitals. In addition, materials such as fibers, plastics and films imparted with bactericidal properties by blending bactericides are also widely used. In such a bactericidal agent, a bactericidal compound having a cationic group such as a cationic polymer described in Patent Document 1 is blended.
- the bactericidal compound having a cationic group generally comprises a cationic partial structure and a highly hydrophobic partial structure, for example, when the storage container is filled as an aqueous solution, the storage container Depending on the material, it adsorbs to the wall surface, and as a result, the concentration of the bactericidal compound may be lowered.
- content of the bactericidal compound contained in a composition reduces, there exists a possibility that bactericidal performance may reduce.
- the problem to be solved by the present invention is to provide a bactericidal composition in which a reduction in bactericidal performance due to adsorption of a bactericidal compound to a wall surface is suppressed.
- the present inventors have included a specific copolymer in the composition together with a bactericidal compound having a cationic group, thereby suppressing a reduction in bactericidal performance due to adsorption of the bactericidal compound.
- the present invention has been completed.
- the present invention provides the following ⁇ 1> to ⁇ 4>.
- Water-soluble polymer I having hydrophilic repeating unit (A) and hydrophobic repeating unit (B) having an HLB value of 1 to 15 (hereinafter also referred to as polymer I of the present invention), and acidic At least one selected from a water-soluble polymer II having a repeating unit (C) having a group and a repeating unit (D) derived from a (meth) acrylamide monomer (hereinafter also referred to as the polymer II of the present invention).
- a bactericidal compound having a cationic group hereinafter, also referred to as a bactericidal composition of the present invention).
- ⁇ 2> A sterilization method using a composition containing at least one polymer selected from the polymer I of the present invention and the polymer II of the present invention and a bactericidal compound having a cationic group.
- ⁇ 3> A composition comprising at least one polymer selected from the polymer I of the present invention and the polymer II of the present invention and a bactericidal compound having a cationic group, which is used for sterilization.
- ⁇ 4> Use of a composition comprising at least one polymer selected from the polymer I of the present invention and the polymer II of the present invention and a bactericidal compound having a cationic group for producing a bactericidal agent.
- a bactericidal composition in which a reduction in bactericidal performance due to adsorption of a bactericidal compound to a wall surface is suppressed.
- the bactericidal composition of the present invention is characterized by containing at least one polymer selected from the polymer I of the present invention and the polymer II of the present invention and a bactericidal compound having a cationic group.
- both the polymer I and the polymer II of the present invention are concepts that exclude a bactericidal compound having a cationic group.
- the bactericidal composition of the present invention will be described in detail.
- the polymer I of the present invention is a water-soluble polymer having a hydrophilic repeating unit (A) and a hydrophobic repeating unit (B) having an HLB value of 1 to 15.
- the polymer I of the present invention has a hydrophilic repeating unit (A).
- the polymer I of the present invention may have one or more repeating units corresponding to the repeating unit (A).
- the term “hydrophilic” means having a strong affinity for water. Specifically, when a homopolymer consisting of only one type of repeating unit (having a number average molecular weight of about 10,000 to 1,000,000 according to the measurement method of the example) is used for 100 g of pure water at room temperature (25 ° C.). When 1 g or more is dissolved, the repeating unit is hydrophilic.
- the HLB (Hydrophile-Lipophile Balance) value of the hydrophilic repeating unit (A) is preferably 10 or more, more preferably 12.5 or more, from the viewpoint of imparting hydrophilicity and the prevention of adsorption of the bactericidal compound. Preferably it is 15 or more, Especially preferably, it is 17 or more, Preferably it is 70 or less, More preferably, it is 50 or less.
- the HLB value means a value calculated from the ratio of the organic value and the inorganic value of the compound (Oda equation), and “Formation Design with Organic Concept Diagram” [1998, NIHON]. EMULSION CO. , LTD].
- the hydrophilic repeating unit (A) is preferably a hydrophilic repeating unit represented by the formula (A0).
- R 1 represents a hydrogen atom or a methyl group
- R 2 represents —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR 4 —, or * —NR 4 — (C ⁇ O) —
- R 4 represents a hydrogen atom Or an organic group having 1 to 10 carbon atoms, and * represents a position bonded to the carbon atom to which R 1 in the formula (A0) is bonded.
- R 3 represents an organic group.
- R 2 is * — (C ⁇ O) —NR 4 — or * —NR 4 — (C ⁇ O) —
- R 4 is an organic group having 1 to 10 carbon atoms.
- R 3 and R 4 may be combined to form a ring.
- the number of carbon atoms of the organic group represented by R 3 is preferably 1 to 50, more preferably 1 to 30.
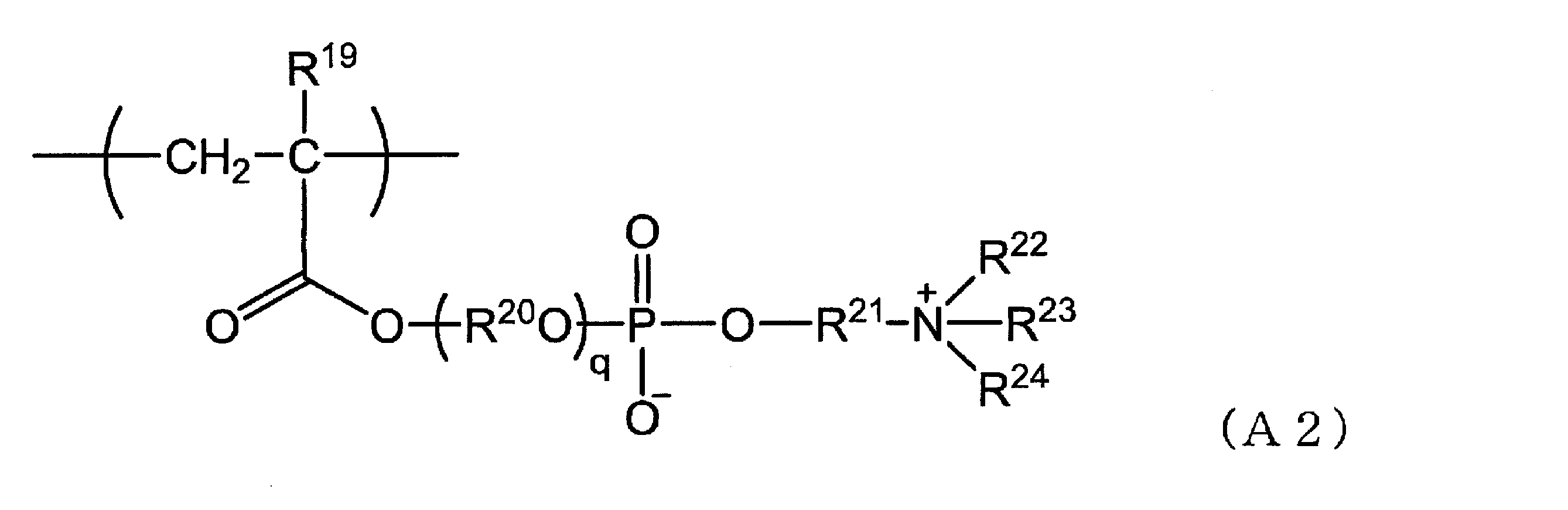
- the hydrophilic repeating unit (A) the repeating unit (A1) represented by the formula (A1), the repeating unit (A2) represented by the formula (A2), and the repeating unit represented by the formula (A3)
- a repeating unit (A4) represented by formula (A4) a repeating unit (A5) represented by formula (A5)
- a repeating unit (A6) represented by formula (A6) The above is preferable.
- the repeating units (A2) to (A6) are preferable, the repeating units (A2) and (A4) to (A6) are more preferable, and a composition that is resistant to hydrolysis and excellent in storage stability can be obtained.
- the repeating units (A4) to (A6) are particularly preferable.
- R a represents a hydrogen atom or a methyl group
- R b is —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR e —, or * —NR e — (C ⁇ O) —
- R e is a hydrogen atom Or an organic group having 1 to 10 carbon atoms, and * represents a position bonded to the carbon atom to which R a in the formula (A1) is bonded.
- R c represents a polyoxyalkylene group
- R d represents a hydrogen atom or an alkyl group having 1 to 4 carbon atoms.
- R 19 represents a hydrogen atom or a methyl group
- R 20 represents an alkanediyl group having 2 to 4 carbon atoms
- R 21 represents an alkanediyl group having 1 to 10 carbon atoms
- R 22 , R 23 and R 24 each independently represents a hydrogen atom or an alkyl group having 1 to 8 carbon atoms
- q represents an integer of 1 to 10.
- Y represents — (C ⁇ O) O ⁇ , — (O ⁇ S ⁇ O) O ⁇ , —O (O ⁇ S ⁇ O) O ⁇ , — (S ⁇ O) O ⁇ , —O (S ⁇ O).
- R 30 represents an alkyl group having 1 to 3 carbon atoms
- R 25 represents a hydrogen atom or a methyl group
- R 26 and R 27 each independently represents a divalent organic group having 1 to 10 carbon atoms
- R 28 and R 29 each independently represents an alkyl group having 1 to 10 carbon atoms.
- R 31 represents a hydrogen atom or a methyl group
- R 32 and R 33 each independently represent a hydrogen atom, an alkyl group having 1 to 6 carbon atoms, or a hydroxyalkyl group having 1 to 6 carbon atoms.
- R 34 represents a hydrogen atom or a methyl group
- R 35 and R 36 each independently represents an alkanediyl group having 1 to 2 carbon atoms.
- R 37 represents a hydrogen atom or a methyl group
- R 38 represents an alkanediyl group having 1 to 3 carbon atoms.
- R a represents a hydrogen atom or a methyl group.
- R b represents —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR e —, or * —NR e — (C ⁇ O) —.
- R e represents a hydrogen atom or an organic group having 1 to 10 carbon atoms, preferably a hydrogen atom or an alkyl group having 1 to 5 carbon atoms.
- the alkyl group may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, and an isopropyl group.
- R c represents a polyoxyalkylene group, and is preferably a group represented by — (R f O) p —.
- R f is an alkanediyl group having 2 to 6 carbon atoms, preferably an alkanediyl group having 2 to 4 carbon atoms.
- the alkanediyl group may be linear or branched. For example, ethane-1,2-diyl group, propane-1,3-diyl group, propane-1,2-diyl group, butane-1,4- A diyl group etc. are mentioned.
- the p R f s may be the same or different.
- R d represents a hydrogen atom or an alkyl group having 1 to 4 carbon atoms.
- the alkyl group may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, an isopropyl group, an n-butyl group, an isobutyl group, a sec-butyl group, and a tert-butyl group.
- R 19 represents a hydrogen atom or a methyl group.
- R 20 represents an alkanediyl group having 2 to 4 carbon atoms.
- the alkanediyl group may be linear or branched.
- R 21 represents an alkanediyl group having 1 to 10 carbon atoms.
- the alkanediyl group preferably has 2 to 8 carbon atoms, more preferably 2 to 6 carbon atoms.
- the alkanediyl group may be linear or branched.
- R 22 , R 23 and R 24 each independently represent a hydrogen atom or an alkyl group having 1 to 8 carbon atoms, preferably an alkyl group having 1 to 8 carbon atoms.
- the number of carbon atoms of the alkyl group is preferably 1-6, more preferably 1-4.
- the alkyl group may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, an isopropyl group, an n-butyl group, an isobutyl group, a sec-butyl group, and a tert-butyl group.
- q represents an integer of 1 to 10, preferably an integer of 1 to 8, and more preferably an integer of 1 to 6.
- Y represents — (C ⁇ O) O ⁇ , — (O ⁇ S ⁇ O) O ⁇ , —O (O ⁇ S ⁇ O) O ⁇ , — (S ⁇ O) O ⁇ , —O (S ⁇ O).
- — (C ⁇ O) O 2 — is preferable.
- the alkyl group having 1 to 3 carbon atoms represented by R 30 may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, and an isopropyl group.
- R 25 represents a hydrogen atom or a methyl group.
- R 26 and R 27 each independently represents a divalent organic group having 1 to 10 carbon atoms.
- As the organic group a divalent aliphatic hydrocarbon group is preferable, and an alkanediyl group is more preferable.
- the number of carbon atoms of the alkanediyl group is preferably 1 to 8, more preferably 1 to 6, and particularly preferably 1 to 4.
- the alkanediyl group may be linear or branched.
- R 28 and R 29 each independently represents an alkyl group having 1 to 10 carbon atoms. The number of carbon atoms of the alkyl group is preferably 1-6, more preferably 1-4.
- the alkyl group may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, an isopropyl group, an n-butyl group, an isobutyl group, a sec-butyl group, and a tert-butyl group. Can be mentioned. In addition, in this specification, what has an anion, a cation, or these both in a structure like the said repeating unit (A3) may have a counter ion.
- Counter ions include alkali metal ions such as sodium ion and potassium ion; alkaline earth metal ions such as calcium ion and magnesium ion; ammonium ion; hydrogen ion; fluoride ion, chloride ion, bromide ion, iodide ion, etc. Halogen ions; hydroxide ions and the like.
- R 31 represents a hydrogen atom or a methyl group.
- R 32 and R 33 each independently represent a hydrogen atom, an alkyl group having 1 to 6 carbon atoms, or a hydroxyalkyl group having 1 to 6 carbon atoms.
- the carbon number of the alkyl group represented by R 32 and R 33 is preferably 1 to 3, and the carbon number of the hydroxyalkyl group is preferably 1 to 4.
- the alkyl group and hydroxyalkyl group may be linear or branched.
- the substitution position of the hydroxy group contained in the hydroxyalkyl group is not particularly limited.
- alkyl group examples include methyl group, ethyl group, n-propyl group, isopropyl group, n-butyl group, isobutyl group, sec-butyl group, and tert-butyl group.
- hydroxyalkyl group examples include a hydroxymethyl group, a hydroxyethyl group, a hydroxypropyl group, and a hydroxybutyl group.
- R 34 represents a hydrogen atom or a methyl group.
- R 35 and R 36 each independently represents an alkanediyl group having 1 to 2 carbon atoms.
- the alkanediyl group may be linear or branched, but is preferably linear. Examples of the alkanediyl group include a methane-1,1-diyl group and an ethane-1,2-diyl group.
- R 37 represents a hydrogen atom or a methyl group, and is preferably a hydrogen atom.
- R 38 represents an alkanediyl group having 1 to 3 carbon atoms.
- the alkanediyl group may be linear or branched, but is preferably linear. Examples of the alkanediyl group include a methane-1,1-diyl group, an ethane-1,2-diyl group, a propane-1,3-diyl group, and a propane-1,2-diyl group.
- hydrophilic repeating unit (A) examples include (meth) acrylate polymer species, (meth) acrylamide polymer species, and other vinyl polymer species.
- monomers for deriving the hydrophilic repeating unit (A) hydroxyethyl (meth) acrylate, hydroxypropyl (meth) acrylate, glycerin mono (meth) acrylate, polyethylene glycol (meth) acrylate, polypropylene glycol (meth) acrylate, polyethylene Glycol polypropylene glycol (meth) acrylate, polyethylene glycol polytetramethylene glycol (meth) acrylate, polypropylene glycol polytetramethylene glycol (meth) acrylate, methoxypolyethylene glycol (meth) acrylate, ethoxypolyethylene glycol (meth) acrylate, 2- (meth) ) Acryloyloxyethyl-2 '-(trimethylammonio) ethyl phosphat
- the content of the hydrophilic repeating unit (A) in the polymer I of the present invention is preferably 65% by mass or more, more preferably 75 to 99% by mass, based on all the repeating units contained in the polymer I. 85 to 98% by mass is particularly preferable. Within the above numerical range, the polymer I is easily dissolved in water, and the adsorption of the bactericidal compound to a substrate such as a container is further suppressed.
- the content of the hydrophilic repeating unit (A) can be measured by 1 H-NMR or the like.
- the polymer I of the present invention has a hydrophobic repeating unit (B) having an HLB value of 1 to 15.
- hydrophobic means having a property of weak affinity with water. Specifically, when a homopolymer consisting of only one type of repeating unit (having a number average molecular weight of about 10,000 to 1,000,000 according to the measurement method of the example) is dissolved in 100 g of pure water at room temperature (25 ° C.). If the amount is less than 1 g, the repeating unit is hydrophobic.
- the repeating unit (B) of the polymer I used in the present invention is a hydrophobic repeating unit having an HLB value of 1 to 15, and has one or more repeating units corresponding to the repeating unit (B). It may be.
- the HLB value of the repeating unit (B) is 1 to 15, but the polymer I is easily adsorbed on a base material such as a container, and the bactericidal compound is less likely to be adsorbed on the base material. More preferably, it is 13 or less, More preferably, it is 10 or less, Most preferably, it is 8 or less, Preferably it is 2 or more. When such an HLB value exceeds 15, the effect which suppresses adsorption
- the hydrophobic repeating unit (B) is preferably a hydrophobic repeating unit represented by the formula (B1), (B2) or (B3) because the adsorption between the material and the bactericidal compound is easily suppressed.
- R 5 represents a hydrogen atom or a methyl group
- R 6 represents —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR 8 —, or * —NR 8 — (C ⁇ O) —
- R 8 represents a hydrogen atom Or an organic group having 1 to 10 carbon atoms, and * represents a position bonded to the carbon atom to which R 5 in the formula (B1) is bonded.
- R 7 represents an organic group having 4 to 30 carbon atoms.
- R 9 represents a hydrogen atom or a methyl group
- R 10 represents —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR 17 —, * —NR 17 — (C ⁇ O) —
- R 17 represents a hydrogen atom or An organic group having 1 to 10 carbon atoms, * represents a position bonded to the carbon atom to which R 9 in the formula (B2) is bonded) or a phenylene group
- R 11 represents a divalent organic group having 1 to 10 carbon atoms
- R 12 and R 13 each independently represents an organic group having 1 to 10 carbon atoms
- R 14 , R 15 and R 16 are each independently —OSi (R 18 ) 3
- R 18 is independently a hydrogen atom or an organic group having 1 to 8 carbon atoms) or 1 carbon atom
- Represents 10 organic groups, n represents an integer of 0 to 200.
- R 59 represents a hydrogen atom or a methyl group
- R 60 represents —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR 63 —, * —NR 63 — (C ⁇ O) —
- R 63 represents a hydrogen atom or An organic group having 1 to 10 carbon atoms, * represents a position bonded to the carbon atom to which R 59 in formula (B3) is bonded) or a phenylene group
- R 61 represents an alkanediyl group having 2 to 4 carbon atoms
- R 62 represents an alkyl group having 5 to 30 carbon atoms, an alkanoyl group having 5 to 30 carbon atoms, or an aryl group having 6 to 30 carbon atoms
- m represents an integer of 2 to 100.
- R 6 represents —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR 8 —, or * —NR 8 — (C ⁇ O) —. Show. Among these, * — (C ⁇ O) —O— and * — (C ⁇ O) —NR 8 — are preferable, and * — (C ⁇ O) —NR 8 — is more preferable.
- R 8 represents a hydrogen atom or an organic group having 1 to 10 carbon atoms, preferably a hydrogen atom or an alkyl group having 1 to 10 carbon atoms. The number of carbon atoms of the alkyl group is preferably 1 to 5, more preferably 1 to 3.
- the alkyl group may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, and an isopropyl group.
- R 7 represents an organic group having 4 to 30 carbon atoms.
- the organic group include a hydrocarbon group and a group having at least one selected from an ether bond, an imino group, an amide bond, and an ester bond between carbon-carbon atoms of the hydrocarbon group.
- the carbon number of such an organic group is preferably 4 to 24, more preferably 4 to 18.
- the “hydrocarbon group” in R 7 is a concept including an aliphatic hydrocarbon group, an alicyclic hydrocarbon group, and an aromatic hydrocarbon group, and an aliphatic hydrocarbon group is preferable.
- the aliphatic hydrocarbon group may be linear or branched.
- the aliphatic hydrocarbon group is preferably an alkyl group.
- the alkyl group preferably has 4 to 24 carbon atoms, more preferably 4 to 18 carbon atoms.
- n-butyl, isobutyl, sec-butyl, tert-butyl, pentyl, hexyl, heptyl, octyl, 2-ethylhexyl, nonyl, decyl, undecyl, dodecyl, etc. Can be mentioned.
- the group having at least one selected from an ether bond, an imino group, an amide bond and an ester bond between carbon-carbon atoms of the “hydrocarbon group” as described above is a carbon-carbon atom of the hydrocarbon group.
- a group having an ether bond is preferred.
- R 10 represents —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR 17 —, * —NR 17 — (C ⁇ O) — or phenylene. Indicates a group. Of these, * — (C ⁇ O) —O— and * — (C ⁇ O) —NR 17 — are preferable.
- R 17 represents a hydrogen atom or an organic group having 1 to 10 carbon atoms, preferably a hydrogen atom or an alkyl group having 1 to 10 carbon atoms. The number of carbon atoms of the alkyl group is preferably 1 to 5, more preferably 1 to 3.
- the alkyl group may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, and an isopropyl group.
- R 11 represents a divalent organic group having 1 to 10 carbon atoms.
- a divalent aliphatic hydrocarbon group is preferable, and an alkanediyl group is more preferable.
- the carbon number of the alkanediyl group is preferably 1-8, more preferably 1-6.
- the alkanediyl group may be linear or branched.
- methane-1,1-diyl group methane-1,1-diyl group, ethane-1,2-diyl group, propane-1,3-diyl group, propane-1,2- Examples thereof include a diyl group, a butane-1,4-diyl group, a pentane-1,5-diyl group, and a hexane-1,6-diyl group.
- R 12 and R 13 each independently represents an organic group having 1 to 10 carbon atoms.
- R 14 , R 15 and R 16 each independently represent —OSi (R 18 ) 3 or an organic group having 1 to 10 carbon atoms.
- the organic group represented by R 12 to R 16 is preferably a hydrocarbon group, and more preferably an aliphatic hydrocarbon group.
- the aliphatic hydrocarbon group may be linear or branched.
- the aliphatic hydrocarbon group is preferably an alkyl group.
- the alkyl group preferably has 1 to 6 carbon atoms, more preferably 1 to 4 carbon atoms.
- R 18 represents a hydrogen atom or an organic group having 1 to 8 carbon atoms.
- a hydrocarbon group is preferable, and an aliphatic hydrocarbon group is more preferable.
- the aliphatic hydrocarbon group may be linear or branched.
- the aliphatic hydrocarbon group is preferably an alkyl group.
- the alkyl group preferably has 1 to 6 carbon atoms, more preferably 1 to 4 carbon atoms, and particularly preferably 1 to 3 carbon atoms.
- methyl group, ethyl group, n-propyl group, isopropyl group and the like can be mentioned.
- n represents an integer of 0 to 200, preferably an integer of 0 to 100, more preferably an integer of 0 to 50, and still more preferably an integer of 0 to 25.
- R 60 represents —O—, * — (C ⁇ O) —O—, * — (C ⁇ O) —NR 63 —, * —NR 63 — (C ⁇ O) — or phenylene. Indicates a group. Of these, * — (C ⁇ O) —O— and * — (C ⁇ O) —NR 63 — are preferable.
- R 63 represents a hydrogen atom or an organic group having 1 to 10 carbon atoms, preferably a hydrogen atom or an alkyl group having 1 to 10 carbon atoms. The number of carbon atoms of the alkyl group is preferably 1 to 5, more preferably 1 to 3.
- the alkyl group may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, and an isopropyl group.
- the carbon number of the alkanediyl group in R 61 is preferably 2 or 3, and more preferably 2.
- the alkanediyl group represented by R 61 may be linear or branched, and specifically includes an ethane-1,2-diyl group, a propane-1,2-diyl group, a propane-1,3-diyl group.
- an ethane-1,2-diyl group is preferable from the viewpoint of availability.
- the m R 61 s may be the same or different.
- the carbon number of the alkyl group or alkanoyl group in R 62 is preferably 6 to 25, more preferably 7 to 20, and still more preferably 8 to 18 from the viewpoint of availability. More preferably, it is 9-18, and particularly preferably 10-18.
- the alkyl group in R 62 may be linear or branched, and specific examples include 2-ethylhexyl group, octyl group, decyl group, lauryl group, palmityl group, stearyl group and the like. Among these, 2-ethylhexyl group, lauryl group and stearyl group are preferable, and lauryl group and stearyl group are more preferable.
- examples of the alkanoyl group for R 62 include a 2-ethylhexanoyl group, a lauroyl group, and a stearoyl group.
- the carbon number of the aryl group in R 62 is preferably 6-12. Specific examples include a phenyl group.
- the aryl group may have an alkyl group having 1 to 24 carbon atoms as a substituent. Such an alkyl group preferably has 3 to 24 carbon atoms, more preferably 5 to 16 carbon atoms.
- the suitable number of substitution is 1 or 2.
- An example of such an aryl group having an alkyl group having 1 to 24 carbon atoms as a substituent is a nonylphenyl group.
- an alkyl group having 5 to 30 carbon atoms and an aryl group having 6 to 30 carbon atoms are preferable, and an alkyl group having 5 to 30 carbon atoms is more preferable from the viewpoint of availability.
- m is preferably an integer of 2 to 90, more preferably an integer of 4 to 90, still more preferably an integer of 9 to 60, and particularly preferably an integer of 10 to 40. is there.
- hydrophobic repeating unit (B) examples include (meth) acrylate polymer species, (meth) acrylamide polymer species, olefin-based, styrene-based, and vinyl ether-based polymer species. In these, since it is excellent in the storage stability of a composition, a (meth) acrylamide type polymer seed
- Examples of the monomer for deriving the hydrophobic repeating unit (B) include methyl (meth) acrylate, n-butyl (meth) acrylate, tert-butyl (meth) acrylate, cyclohexyl (meth) acrylate, 2-ethylhexyl (meth) acrylate, Octyl (meth) acrylate, lauryl (meth) acrylate, isodecyl (meth) acrylate, stearyl (meth) acrylate, benzyl (meth) acrylate, phenoxyethyl (meth) acrylate, isobornyl (meth) acrylate, dicyclopentanyl (meth) Acrylate, 3- [tris (trimethylsiloxy) silyl] propyl (meth) acrylate, 3- [bis (trimethylsiloxy) (methyl) silyl] propyl (meth) acrylate, silicone (meth) acryl
- (meth) acrylamide monomers are preferred, and specific examples include N, N-di-n-propyl (meth) acrylamide, N, N-diisopropyl (meth) acrylamide, and N, N-.
- the content of the hydrophobic repeating unit (B) in the polymer I of the present invention is preferably 0.1% by mass or more with respect to all the repeating units contained in the polymer I, and preferably 0.1 to 35% by mass. Is more preferably 0.1 to 25% by mass, particularly preferably 2 to 15% by mass. Within the above numerical range, the water-soluble property and the adsorptivity to the substrate surface are excellent.
- the content of the hydrophobic repeating unit (B) can be measured by 1 H-NMR or the like.
- the polymer I of the present invention may contain other repeating units in addition to the repeating units (A) and (B) as long as the effects of the present invention are not impaired.
- the polymer I does not contain substantially the repeating unit which has an acidic group as another repeating unit.
- the bactericidal compound is captured and adsorbed to the base material by the repeating unit (A), and the bactericidal property may be lowered.
- the total amount of the repeating unit (A) and the repeating unit (B) is 80% by mass or more with respect to all the repeating units contained in the polymer I. Is more preferable, 90 mass% or more is more preferable, and 95 mass% or more is further preferable.
- the polymer I of the present invention may be any of a block copolymer, a graft copolymer, a random copolymer, and an alternating copolymer.
- the weight average molecular weight (M w ) of the polymer I is such that the polymer I is easily adsorbed on a base material such as a container, and the bactericidal compound is difficult to adsorb on the base material. It is preferably 10,000 to 5,000,000, more preferably 10,000 to 3,000,000, still more preferably 10,000 to 2,000,000, and particularly preferably 10,000 to 500,000.
- the molecular weight distribution (M w / M n ) is preferably 1 to 10, more preferably 1 to 7, and still more preferably 1 to 5. In addition, what is necessary is just to measure a weight average molecular weight and molecular weight distribution according to the method as described in the Example mentioned later.
- the polymer I of the present invention is a water-soluble polymer, but is preferably a polymer that is soluble in a lower alcohol having about 1 to 4 carbon atoms.
- dissolving in water or lower alcohol means that when the polymer is added to and mixed with water or lower alcohol (25 ° C.) so that the polymer solid content is 0.5% by mass. It means to become transparent.
- the HLB value of the polymer I is an adsorption force to a substrate such as a container, and the adsorption suppression of the bactericidal compound. From the viewpoint, it is preferably 10 or more, more preferably 12.5 or more, further preferably 15 or more, particularly preferably 17 or more, and preferably 80 or less, more preferably 50 or less.
- the polymer I of the present invention is prepared, for example, as follows. That is, one or more monomers selected from the monomers for deriving each repeating unit are selected and mixed. This mixture is dissolved in a solvent such as water, acetonitrile, ethanol, butanol, 2-propanol, 1,4-dioxane, if necessary. And the target polymer I can be obtained by adding a polymerization initiator and carrying out radical polymerization.
- the polymerization initiator used when performing radical polymerization is not particularly limited as long as it is a normal radical polymerization initiator.
- the amount of the polymerization initiator used is preferably 0.001 to 10 parts by mass, more preferably 0.01 to 5 parts by mass with respect to 100 parts by mass of the monomer component.
- the polymerization temperature is preferably 20 to 100 ° C., and the polymerization time is preferably 0.5 to 48 hours.
- the polymer II of the present invention is a water-soluble polymer having a repeating unit (C) having an acidic group and a repeating unit (D) derived from a (meth) acrylamide monomer.
- C repeating unit
- D repeating unit derived from a (meth) acrylamide monomer.
- the adsorption of the bactericidal compound can be suppressed on a wide variety of wall surfaces such as glass and polypropylene, and further the reduction of the bactericidal performance due to this adsorption can be suppressed. Therefore, as the bactericidal composition of the present invention, those containing at least the polymer II of the present invention are particularly preferable.
- the polymer II of the present invention has a repeating unit (C) having an acidic group.
- the polymer II of the present invention may have one or more repeating units corresponding to the repeating unit (C).
- the repeating unit (C) may be any repeating unit having an acidic group, but is preferably derived from a monomer containing an ethylenically unsaturated bond from the viewpoint of ease of introduction and safety.
- an acidic group a carboxy group, a sulfo group, a phosphoric acid group, or these salts etc. are mentioned, These may have one and may have two or more.
- the salt include alkali metal salts such as sodium salt and potassium salt; alkaline earth metal salts such as magnesium salt and calcium salt; ammonium salt; organic ammonium salt and the like.
- the repeating unit (C) includes the repeating unit (C1) represented by the formula (C1), the repeating unit (C2) represented by the formula (C2), and the repeating unit represented by the formula (C3).
- One or more selected from (C3), the repeating unit (C4) represented by the formula (C4) and the repeating unit (C5) represented by the formula (C5) are preferred.
- the repeating unit (C3) is particularly preferable.
- R 40 represents a single bond or a divalent organic group.
- R 41 represents a single bond or a divalent organic group.
- R 42 represents a hydrogen atom or a methyl group
- R 43 represents a single bond or a divalent organic group.
- R 44 represents a hydrogen atom or a methyl group
- R 45 represents a single bond or a divalent organic group.
- R 46 represents a hydrogen atom or a methyl group
- R 47 represents a single bond or a divalent organic group.
- R 40 , R 41 , R 43 , R 45 and R 47 represent a single bond or a divalent organic group.
- the carbon number of the divalent organic group is preferably 1-20, more preferably 1-14, and particularly preferably 1-8.
- Examples of the divalent organic group include a divalent hydrocarbon group, a group represented by * — (C ⁇ O) —O—R 48 —, and a group represented by * — (C ⁇ O) —NR 49 —R 48 —.
- R 48 represents a divalent hydrocarbon group
- R 49 represents a hydrogen atom or an organic group having 1 to 10 carbon atoms.
- R 42 in the formula (C4) is bonded to the carbon atom to which R 42 is bonded, the carbon atom to which R 44 is bonded in the formula (C4), or R 46 in formula (C5) is bonded to the carbon atom. Indicates the position of bonding with an atom.
- the carbon number of the divalent hydrocarbon group represented by R 40 , R 41 , R 43 , R 45 , R 47 and R 48 is preferably 1-20, more preferably 1-14, and particularly preferably 1-8. preferable.
- the divalent hydrocarbon group is preferably a divalent aliphatic hydrocarbon group.
- the divalent aliphatic hydrocarbon group may be linear or branched.
- the divalent aliphatic hydrocarbon group is preferably an alkanediyl group, specifically, a methane-1,1-diyl group, an ethane-1,1-diyl group, an ethane-1,2-diyl group, Propane-1,1-diyl group, propane-1,2-diyl group, propane-1,3-diyl group, propane-2,2-diyl group, butane-1,2-diyl group, butane-1,3 -Diyl group, butane-1,4-diyl group, pentane-1,4-diyl group, pentane-1,5-diyl group, hexane-1,5-diyl group, hexane-1,6-diyl group, etc.
- R 49 is preferably a hydrogen atom or an alkyl group having 1 to 5 carbon atoms.
- the alkyl group may be linear or branched, and examples thereof include a methyl group, an ethyl group, an n-propyl group, and an isopropyl group.
- R 40 and R 43 are preferably a single bond.
- R 41 is preferably a divalent hydrocarbon group.
- R 45 is preferably a single bond, a divalent hydrocarbon group, or a group represented by * — (C ⁇ O) —NR 49 —R 48 —.
- R 47 is preferably a group represented by * — (C ⁇ O) —O—R 48 —.
- Examples of the monomer for deriving such a repeating unit (C) include unsaturated dicarboxylic acids such as fumaric acid, maleic acid and itaconic acid or salts thereof; unsaturated carboxylic acids such as (meth) acrylic acid or salts thereof; Sulfo group-containing polymerizable unsaturated monomers such as acid, allyl sulfonic acid, methallyl sulfonic acid, 2-sulfoethyl (meth) acrylate, 2- (meth) acrylamido-2-methylpropanesulfonic acid or salts thereof; 2- (meta And phosphoric acid group-containing polymerizable unsaturated monomers such as acryloyloxyethyl acid phosphate and 2- (meth) acryloyloxypropyl acid phosphate, or salts thereof.
- unsaturated dicarboxylic acids such as fumaric acid, maleic acid and itaconic acid or salts thereof
- unsaturated carboxylic acids
- monomers derived from modification include hydrolysates of acrylic acid esters; hydrolysates of anhydrides of unsaturated dicarboxylic acids such as maleic anhydride and itaconic anhydride; glycidyl methacrylate and (4-vinylbenzyl) Examples include adducts of acidic group-containing thiols to the epoxy group of glycidyl ether. These may be used alone or in combination of two or more. Among these, acrylic acid and methacrylic acid are preferable from the viewpoint of ease of introduction and reactivity.
- the content of the repeating unit (C) in the polymer II of the present invention is preferably 0.1 to 20% by mass with respect to all the repeating units contained in the polymer II, and has a moderate interaction with the bactericidal compound. In view of suppressing adsorption of the bactericidal compound, it is more preferably 0.5 to 15% by mass, further preferably 1 to 10% by mass, and particularly preferably 1 to 5% by mass.
- the content of the repeating unit (C) can be measured by 1 H-NMR, 13 C-NMR, electric conductivity, or the like.
- the polymer II of the present invention has a repeating unit (D) derived from a (meth) acrylamide monomer.
- the polymer II of the present invention may have one or more repeating units corresponding to the repeating unit (D).
- the repeating unit (D) is preferably a repeating unit derived from a hydrophilic (meth) acrylamide monomer.
- hydrophilic means having a property of having a strong affinity for water. Specifically, when a homopolymer consisting of only one type of repeating unit (having a number average molecular weight of about 10,000 to 1,000,000 according to the measurement method of the example) is used for 100 g of pure water at room temperature (25 ° C.).
- the repeating unit When 1 g or more is dissolved, the repeating unit is hydrophilic.
- the HLB value of the repeating unit (D) is preferably 10 or more, more preferably 15 or more, and still more preferably 17 or more in order to suppress adsorption of the bactericidal compound to the substrate surface.
- the HLB value of the repeating unit (D) is in the above range, the effect of preventing adsorption of the bactericidal compound to the substrate is excellent.
- the HLB value means a value calculated from the ratio of the organic value and the inorganic value of the compound (Oda equation), and “Formation Design with Organic Conception Diagram” [ In 1998, NIHON EMULSION CO. , LTD].
- the repeating unit (D) includes the repeating unit (D1) represented by the formula (D1), the repeating unit (D2) represented by the formula (D2), and the repeating unit represented by the formula (D3). 1 or more types chosen from a unit (D3) are preferable.
- R 51 represents a hydrogen atom or a methyl group
- R 52 and R 53 each independently represent a hydrogen atom, an alkyl group having 1 to 3 carbon atoms, or a hydroxyalkyl group having 1 to 3 carbon atoms.
- R 52 and R 53 each independently represent a hydrogen atom, an alkyl group having 1 to 3 carbon atoms, or a hydroxyalkyl group having 1 to 3 carbon atoms.
- the alkyl group represented by R 52 and R 53 may be linear or branched, and examples of the alkyl group include a methyl group, an ethyl group, an n-propyl group, and an isopropyl group.
- the number of carbon atoms of the hydroxyalkyl group represented by R 52 and R 53 is preferably 1 or 2.
- the alkyl group contained in the hydroxyalkyl group may be linear or branched, and examples of the hydroxyalkyl group include a hydroxymethyl group, a hydroxyethyl group, a hydroxypropyl group, and a hydroxyisopropyl group.
- the substitution position of the hydroxy group in the hydroxyalkyl group is arbitrary.
- Examples of the monomer for deriving such a repeating unit (D1) include dimethyl (meth) acrylamide, diethyl (meth) acrylamide, N-isopropyl (meth) acrylamide, N- (hydroxymethyl) (meth) acrylamide, N- (2 -Hydroxyethyl) (meth) acrylamide and the like, and the repeating unit (D1) may be a single unit or a combination of two or more types.
- R 54 represents a hydrogen atom or a methyl group
- R 55 and R 56 each independently represents an alkanediyl group having 1 to 3 carbon atoms.
- R 55 and R 56 each independently represents an alkanediyl group having 1 to 3 carbon atoms.
- the alkanediyl group preferably has 1 or 2 carbon atoms.
- the alkanediyl group may be linear or branched, but is preferably linear.
- Preferable specific examples include methane-1,1-diyl group and ethane-1,2-diyl group.
- Examples of the monomer that induces such a repeating unit (D2) include 4- (meth) acryloylmorpholine.
- R 57 represents a hydrogen atom or a methyl group
- R 58 represents an alkanediyl group having 1 to 5 carbon atoms.
- R 57 represents a hydrogen atom or a methyl group, and is preferably a hydrogen atom.
- R 58 represents an alkanediyl group having 1 to 5 carbon atoms.
- the alkanediyl group preferably has 3 to 5 carbon atoms.
- the alkanediyl group may be linear or branched, but is preferably linear.
- Preferable specific examples include a propane-1,3-diyl group, a butane-1,4-diyl group, and a pentane-1,5-diyl group.
- Examples of the monomer that induces such a repeating unit (D3) include 1-vinyl-2-pyrrolidone, N-vinyl- ⁇ -caprolactam, and the repeating unit (D3) may be used alone or in combination of two or more. It may be used in combination.
- repeating units (D1) to (D3) from the viewpoint of hydrophilicity, the repeating units (D1) and (D2) are preferable, and the repeating unit (D1) is particularly preferable.
- the content of the repeating unit (D) in the polymer II of the present invention is preferably 80 to 99.9% by mass with respect to all the repeating units contained in the polymer II. From the viewpoint of hydrophilicity, 85 to 99.5% by mass is more preferable, 90 to 99% by mass is further preferable, and 95 to 99% by mass is further preferable.
- the content of the repeating unit (D) can be measured by 1 H-NMR, 13 C-NMR or the like.
- the polymer II of the present invention may be any of a block copolymer, a graft copolymer, a random copolymer, and an alternating copolymer.
- the weight average molecular weight (Mw) of the polymer II of the present invention is preferably 10,000 to 10,000,000, more preferably 10,000 to 5,000,000, still more preferably 10,000 to 3,000,000, and 10,000 to 2,000,000. More preferably, 10,000 to 500,000 are more preferable, 10,000 to 250,000 are further preferable, and 10,000 to 150,000 are particularly preferable. By setting the weight average molecular weight within such a range, both the interaction with the bactericidal compound and the handling property are improved.
- the number average molecular weight (Mn) of the polymer II of the present invention is preferably 5,000 to 10,000,000, more preferably 5,000 to 5,000,000, still more preferably 5,000 to 3,000,000, and 5,000 to 2,000,000.
- the molecular weight distribution (Mw / Mn) is preferably 1 to 10, more preferably 1 to 7, and particularly preferably 1 to 5. In addition, what is necessary is just to measure the said weight average molecular weight, number average molecular weight, and molecular weight distribution according to the method as described in the Example mentioned later.
- the polymer II of the present invention is a water-soluble polymer.
- to dissolve in water means that the polymer becomes transparent when added to and mixed with water (25 ° C.) so that the polymer solid content is 0.5% by mass.
- the polymer II of the present invention is prepared, for example, as follows. That is, one or more monomers selected from the monomers for deriving each repeating unit are selected and mixed. This mixture is dissolved in a solvent such as water, acetonitrile, ethanol, butanol, 2-propanol, 1,4-dioxane, if necessary. And the target polymer II can be obtained by adding a polymerization initiator and carrying out radical polymerization.
- the polymerization initiator used when performing radical polymerization is not particularly limited as long as it is a normal radical polymerization initiator.
- the amount of the polymerization initiator used is preferably 0.001 to 10 parts by mass, more preferably 0.01 to 5 parts by mass with respect to 100 parts by mass of the monomer component.
- the polymerization temperature is preferably 20 to 100 ° C., and the polymerization time is preferably 0.5 to 48 hours.
- the content of at least one polymer selected from the polymer I and the polymer II is preferably 0.001 to 10% by mass, more preferably 0.01 to 5% by mass with respect to the total amount of the bactericidal composition. Preferably, 0.01 to 3% by mass is more preferable, and 0.05 to 1% by mass is particularly preferable.
- the composition has an excellent bactericidal action and bacteriostatic action.
- the content of the polymer I is preferably 0.001 to 5% by mass, more preferably 0.01 to 3% by mass, and particularly preferably 0.05 to 1% by mass with respect to the total amount of the bactericidal composition.
- the content of the polymer II is preferably 0.001 to 5% by mass, more preferably 0.01 to 3% by mass, and particularly preferably 0.01 to 1% by mass with respect to the total amount of the bactericidal composition.
- the mass ratio of the content of the polymer I and the polymer II is preferably 10: 1 to 1:10, more preferably 5: 1 to 1: 5. 3: 1 to 1: 3 is particularly preferred.
- the bactericidal composition of the present invention contains a bactericidal compound having a cationic group.
- the cationic group include a group represented by —NH—C ( ⁇ NH) —NH—C ( ⁇ NH) —NH— and a quaternary ammonium group.
- the bactericidal compound has a group represented by —NH—C ( ⁇ NH) —NH—C ( ⁇ NH) —NH—
- this compound may form a salt.
- the salt include acid addition salts such as hydrochloride, nitrate and sulfate.
- the bactericidal compound having a cationic group is not particularly limited, for example, polyhexamethylene biguanide derivatives such as polyhexanide hydrochloride (polyhexamethylene biguanide, PHMB), polydronium chloride derivatives such as polydronium chloride, polyquaternium derivatives such as polyquaternium, chlorhexidine, etc. Chlorhexidine derivatives, benzalkonium chloride derivatives such as benzalkonium chloride, and benzethonium chloride derivatives such as benzethonium chloride. One of these may be contained alone or in combination of two or more.
- polyhexamethylene biguanide derivatives polydronium chloride derivatives, polyquaternium derivatives, and benzalkonium chloride derivatives are preferable, and polyhexanide hydrochloride and polydronium chloride are particularly preferable from the viewpoint of obtaining sufficient bactericidal performance.
- the content of the bactericidal compound having a cationic group in the present invention is preferably 0.1 ppm or more, more preferably 0.5 ppm or more, still more preferably 0.75 ppm or more, particularly preferably based on the total amount of the bactericidal composition. Is not less than 0.9 ppm, preferably not more than 1500 ppm, more preferably not more than 1250 ppm, still more preferably not more than 1000 ppm, still more preferably not more than 750 ppm, still more preferably not more than 500 ppm, still more preferably not more than 100 ppm, particularly preferably not more than 50 ppm. It is.
- the content of the bactericidal compound having a cationic group is within the above range, the bactericidal action and bacteriostatic action of the bactericidal composition are improved. Moreover, it becomes difficult to adsorb the bactericidal compound.
- the bactericidal composition of the present invention comprises at least one polymer selected from polymer I and polymer II, bactericidal compound, bactericidal compound other than the above, surfactant, tonicity agent, chelate
- Known additives such as agents, pH adjusters, buffers and thickeners; may contain a solvent.
- the bactericidal composition of the present invention may contain an appropriate amount of various pharmacologically active components and physiologically active components in addition to the above components.
- Such ingredients are not particularly limited, and various additives described in, for example, over-the-counter drug manufacturing (import) approval standard 2000 edition (supervised by the Pharmaceutical Affairs Research Group), Pharmaceutical Additives Encyclopedia 2007 (edited by the Japan Pharmaceutical Additives Association) It can be illustrated.
- the bactericidal composition of this invention is particularly useful for inhibiting bacterial growth.
- bacteria include gram positive bacteria and gram negative bacteria.
- the Gram-positive bacteria include staphylococci such as Staphylococcus aureus, Listeria bacteria, Bacillus bacteria, and Alicyclobacillus bacteria.
- Gram-negative bacteria include Escherichia bacteria such as Escherichia coli, Salmonella bacteria, Vibrio bacteria, and Pseudomonas bacteria.
- the bactericidal composition of the present invention contains at least one polymer selected from the polymer I and the polymer II and a bactericidal compound having a cationic group, and is used in combination with other components as a solution. It may be a material in the form of a dispersion, gel, capsule, pellet, film, sheet, fiber or the like.
- the bactericidal composition of the present invention comprises a solvent such as water or an organic solvent; a surfactant such as anionic, cationic or nonionic; a thickener such as gelatin, polysaccharide or cellulose;
- a coating material for sterilization can be obtained.
- coating materials include, for example, coating materials for medical equipment such as medical equipment and medical equipment; coating materials for daily goods such as toilet goods and kitchen goods; interior paints in hospitals, elderly facilities, food factories, etc., and hulls and touches. It can be used as a coating material for screen panels.
- the bactericidal composition of the present invention is used in combination with organic polymer materials such as polyolefin, polyurethane, ABS, polystyrene, polycarbonate, polyester, polyamide, acrylic polymer, vinyl chloride, silicone, cellulose, etc.
- organic polymer materials such as polyolefin, polyurethane, ABS, polystyrene, polycarbonate, polyester, polyamide, acrylic polymer, vinyl chloride, silicone, cellulose, etc.
- Materials such as plastics, films, fibers, rubber, ceramics, and glass that have been given bactericidal properties by surface-treating molded products made from inorganic materials such as organic polymer materials, metals, and ceramics with a bactericidal composition It can be.
- Such materials include, for example, medical supplies such as masks, surgical clothes, surgical coverings, blood bags, wound dressings; daily items such as bed sheets, towels, trash cans, and triangular corners; smartphones, tablet terminals, car navigation systems, etc. It can be used for touch panel devices. It can also be used as a packaging material for building materials such as wallpaper and tiles; food and medical equipment.
- the bactericidal composition of the present invention can be used in a bactericidal method.
- the method is not particularly limited, for example, a method of applying the bactericidal composition of the present invention as a liquid and applying it to the surface of the object can be mentioned, thereby imparting bactericidal properties to the object. it can.
- the bactericidal composition of the present invention includes a surfactant, A thickener, a curable monomer, etc. can be mix
- application means usual application means such as spray coating, coater coating, dipping, brush coating, roll coating and the like can be employed.
- object include base materials such as films, resin substrates, fibers, ceramics, metals, glass, and wood; interiors such as walls, floors, and ceilings; medical treatments such as catheters, infusion tubes, blood bags, and dressing materials. Examples include instruments.
- the object can be given bactericidal properties or the object can be sterilized.
- the bactericidal composition of the present invention includes a surfactant, A fragrance
- a target object can also be sterilized and disinfected by impregnating the nonwoven fabric of this invention in a nonwoven fabric, and wiping off a target object.
- the bactericidal composition of the present invention includes a surfactant, A fragrance
- it can be set as materials, such as a plastic, a film, a fiber, and rubber
- Hydrophilic monomer N, N-dimethylacrylamide (hereinafter referred to as DMAA: manufactured by KJ Chemical), N- (2-hydroxy) ethylacrylamide (hereinafter referred to as HEAA: manufactured by KJ Chemical), N-vinyl-2 -Pyrrolidone (hereinafter referred to as NVP: manufactured by Wako Pure Chemical Industries), 2-methacryloyloxyethyl-2 '-(trimethylammonio) ethyl phosphate (hereinafter referred to as MPC: manufactured by NOF Corporation), methoxypolyethylene glycol (9 ) Monomethacrylate (hereinafter referred to as MPEGM: Shin-Nakamura Chemical Co., Ltd.), N-methacryloyloxyethyl-N, N-dimethylammonium- ⁇ -N-methylcarboxybetaine (hereinafter referred to as MPEGM: Shin-Nakamura Chemical Co., Ltd.), N-methacryloy
- the content of repeating units derived from DMAA was 95.0% by mass, and the content of repeating units derived from DDAA was 5.0% by mass. These contents were measured by 1 H-NMR.
- the weight average molecular weight of the obtained copolymer (I-1) was 156,000, the number average molecular weight was 37,000, and the molecular weight distribution was 4.2.
- reaction solution was poured into diethyl ether, washed three times with diethyl ether, and then vacuum dried to synthesize AB type block copolymer (I-11). Thereafter, it was dissolved in water to obtain a 0.5 mass% aqueous solution of copolymer (I-11).
- Copolymers (II-1) to (II-4) obtained in Synthesis Examples 12 to 15 correspond to the polymer II of the present invention.
- Example 1 0.5 parts by mass of the copolymer (I-1) obtained in Synthesis Example 1, 0.0001 parts by mass of polyhexamethylene biguanide (hereinafter referred to as PHMB), and 99.5 parts by mass of physiological saline were mixed.
- the obtained composition was stored in a polypropylene container and a glass container at room temperature (25 ° C.) for 24 hours. This is the composition of Example 1.
- Example 2-11 Comparative Examples 1-2
- copolymer (I-1) was changed to copolymers (I-2) to (I-11) and polymers (N-1) to (N-2)
- a composition was obtained in the same manner as in Example 1.
- Example 3 (Comparative Example 3) In Example 1, the composition was obtained like Example 1 except having changed the usage-amount of PHMB into 0.00001 mass part.
- Example 4 (Comparative Example 4) In Example 1, the composition was obtained like Example 1 except having changed the usage-amount of PHMB into 0.15 mass part and the usage-amount of the physiological saline into 99.35 mass part, respectively.
- Example 12 0.5 parts by mass of the copolymer (II-1) obtained in Synthesis Example 12, 0.0001 parts by mass of PHMB, and 99.5 parts by mass of physiological saline were mixed, and the resulting composition was mixed with polypropylene. Each container and glass container were stored at room temperature (25 ° C.) for 24 hours. This is the composition of Example 12.
- Example 13 to 15 Comparative Examples 5 to 6 Except that in Example 12, the copolymer (II-1) was changed to the copolymers (II-2) to (II-4) and the polymers (N-4) to (N-5). A composition was obtained in the same manner as in Example 12.
- Example 16 In Example 12, a composition was obtained in the same manner as in Example 12 except that 0.5 part by mass of copolymer (I-1) was further added and the amount of physiological saline used was changed to 99 parts by mass. .
- Example 7 (Comparative Example 7) In Example 12, the composition was obtained like Example 12 except having changed the usage-amount of PHMB into 0.00001 mass part.
- Comparative Example 8 A composition was obtained in the same manner as in Example 12, except that the amount of PHMB used was changed to 0.15 parts by mass and the amount of physiological saline used was changed to 99.35 parts by mass.
- the amount of bacteria is about 1.8 ⁇ 10 8 cfu / mL.
- 8 mL of the above liquid medium was further added to prepare a bacterial solution having a bacterial amount of 1.0 ⁇ 10 8 cfu / mL.
- ⁇ Turbidity evaluation> 100 ⁇ L of the composition of Example 1 was added to the well plate, and 5 ⁇ L of the bacterial solution obtained in the above “Preparation of bacterial solution” was further added. After incubation at 37 ° C. for 16 hours, the turbidity of the wells was visually observed, and the growth state of the bacteria was evaluated according to the following criteria.
- Example 1 when the composition of Example 1 was changed to the compositions of Examples 2 to 16 and Comparative Examples 1 to 8, the growth state of the fungus was evaluated in the same manner as described above. These evaluation results are shown in Tables 7-9. ⁇ Evaluation criteria> -: Transparent and no turbidity was observed (growth of bacteria was suppressed) +: Turbidity was observed (fungus grew)
- compositions of Examples 1 to 11 were able to suppress the growth of bacteria even after being stored in a polypropylene container. Moreover, adsorption
- compositions of Examples 12 to 16 were able to suppress the growth of bacteria even after being stored in polypropylene containers and glass containers. Moreover, the adsorption
Landscapes
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- Agronomy & Crop Science (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Toxicology (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
殺菌性化合物の壁面への吸着による殺菌性能の低減が抑制された殺菌性組成物を提供すること。 親水性繰り返し単位(A)とHLB値が1~15である疎水性繰り返し単位(B)とを有する水溶性の重合体I、及び酸性基を有する繰り返し単位(C)と(メタ)アクリルアミド系モノマーに由来する繰り返し単位(D)とを有する水溶性の重合体IIから選ばれる少なくとも1種の重合体と、カチオン性基を有する殺菌性化合物とを含むことを特徴とする、殺菌性組成物。
Description
本発明は、殺菌性組成物に関する。
殺菌剤は、日用品、医療用品等、様々な分野で使用されている。例えば、医療・衛生用品のコーティング材料、衣類の洗浄組成物、食品工場や病院内における消毒液や内装塗料に使用されている。また、殺菌剤を配合することにより殺菌性を付与した繊維、プラスチック、フィルム等の材料も広く利用されている。このような殺菌剤には、特許文献1に記載のカチオン性重合体などのカチオン性基を有する殺菌性化合物が配合されている。
しかしながら、カチオン性基を有する殺菌性化合物は、一般的にはカチオン性を有する部分構造と、疎水性の高い部分構造から構成されているため、例えば水溶液として保存容器に充填した際に、保存容器の材質によっては壁面に吸着し、その結果として、殺菌性化合物の濃度が低濃度化する場合がある。このようにして組成物中に含まれる殺菌性化合物の含有量が減少すると、殺菌性能が低減するおそれがある。
本発明が解決しようとする課題は、殺菌性化合物の壁面への吸着による殺菌性能の低減が抑制された殺菌性組成物を提供することにある。
本発明が解決しようとする課題は、殺菌性化合物の壁面への吸着による殺菌性能の低減が抑制された殺菌性組成物を提供することにある。
そこで、本発明者らは鋭意検討した結果、カチオン性基を有する殺菌性化合物とともに、特定の共重合体を組成物中に含有せしめることにより、殺菌性化合物の吸着による殺菌性能の低減が抑制されることを見出し、本発明を完成した。
したがって、本発明は、以下の<1>~<4>を提供するものである。
<1> 親水性繰り返し単位(A)とHLB値が1~15である疎水性繰り返し単位(B)とを有する水溶性の重合体I(以下、本発明の重合体Iともいう)、及び酸性基を有する繰り返し単位(C)と(メタ)アクリルアミド系モノマーに由来する繰り返し単位(D)とを有する水溶性の重合体II(以下、本発明の重合体IIともいう)から選ばれる少なくとも1種の重合体と、カチオン性基を有する殺菌性化合物とを含むことを特徴とする、殺菌性組成物(以下、本発明の殺菌性組成物ともいう)。
<2> 本発明の重合体I及び本発明の重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物とを含む組成物を用いることを特徴とする殺菌方法。
<3> 殺菌のために用いる、本発明の重合体I及び本発明の重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物とを含む組成物。
<4> 殺菌剤製造のための、本発明の重合体I及び本発明の重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物とを含む組成物の使用。
<1> 親水性繰り返し単位(A)とHLB値が1~15である疎水性繰り返し単位(B)とを有する水溶性の重合体I(以下、本発明の重合体Iともいう)、及び酸性基を有する繰り返し単位(C)と(メタ)アクリルアミド系モノマーに由来する繰り返し単位(D)とを有する水溶性の重合体II(以下、本発明の重合体IIともいう)から選ばれる少なくとも1種の重合体と、カチオン性基を有する殺菌性化合物とを含むことを特徴とする、殺菌性組成物(以下、本発明の殺菌性組成物ともいう)。
<2> 本発明の重合体I及び本発明の重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物とを含む組成物を用いることを特徴とする殺菌方法。
<3> 殺菌のために用いる、本発明の重合体I及び本発明の重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物とを含む組成物。
<4> 殺菌剤製造のための、本発明の重合体I及び本発明の重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物とを含む組成物の使用。
本発明により、殺菌性化合物の壁面への吸着による殺菌性能の低減が抑制された殺菌性組成物を提供することができる。
本発明の殺菌性組成物は、本発明の重合体I及び本発明の重合体IIから選ばれる少なくとも1種の重合体と、カチオン性基を有する殺菌性化合物とを含むことを特徴とする。なお、本発明の重合体I、重合体IIは、いずれも、カチオン性基を有する殺菌性化合物を除く概念である。以下、本発明の殺菌性組成物について詳細に説明する。
<重合体I>
本発明の重合体Iは、親水性繰り返し単位(A)とHLB値が1~15である疎水性繰り返し単位(B)とを有する水溶性の重合体である。
本発明の重合体Iは、親水性繰り返し単位(A)とHLB値が1~15である疎水性繰り返し単位(B)とを有する水溶性の重合体である。
〔繰り返し単位(A)〕
本発明の重合体Iは、親水性繰り返し単位(A)を有する。本発明の重合体Iは、繰り返し単位(A)に該当する繰り返し単位を1種又は2種以上有していてよい。
本明細書において、親水性とは、水との親和力が強い性質を持つことを意味する。具体的には1種の繰り返し単位のみからなるホモポリマー(実施例の測定法による数平均分子量が1万~100万程度のもの)とした際に、常温(25℃)において純水100gに対して1g以上溶解する場合にはその繰り返し単位は親水性である。
本発明の重合体Iは、親水性繰り返し単位(A)を有する。本発明の重合体Iは、繰り返し単位(A)に該当する繰り返し単位を1種又は2種以上有していてよい。
本明細書において、親水性とは、水との親和力が強い性質を持つことを意味する。具体的には1種の繰り返し単位のみからなるホモポリマー(実施例の測定法による数平均分子量が1万~100万程度のもの)とした際に、常温(25℃)において純水100gに対して1g以上溶解する場合にはその繰り返し単位は親水性である。
また、親水性繰り返し単位(A)のHLB(Hydrophile-Lipophile Balance)値は、親水性付与の観点及び殺菌性化合物の吸着防止の観点から、好ましくは10以上、より好ましくは12.5以上、更に好ましくは15以上、特に好ましくは17以上であり、また、好ましくは70以下、より好ましくは50以下である。
また、本明細書において、HLB値は、化合物の有機性の値と無機性の値の比率から算出されるもの(小田式)を意味し、「Formulation Design with Organic Conception Diagram」[1998年、NIHON EMULSION CO.,LTD]に記載の計算方法により算出できる。
また、本明細書において、HLB値は、化合物の有機性の値と無機性の値の比率から算出されるもの(小田式)を意味し、「Formulation Design with Organic Conception Diagram」[1998年、NIHON EMULSION CO.,LTD]に記載の計算方法により算出できる。
本発明において、親水性繰り返し単位(A)としては、式(A0)で表される親水性の繰り返し単位が好ましい。
〔式(A0)中、
R1は、水素原子又はメチル基を示し、
R2は、-O-、*-(C=O)-O-、*-(C=O)-NR4-、又は*-NR4-(C=O)-(R4は、水素原子又は炭素数1~10の有機基を示し、*は、式(A0)中のR1が結合している炭素原子と結合する位置を示す)を示し、
R3は、有機基を示す。
但し、R2が、*-(C=O)-NR4-、又は*-NR4-(C=O)-であり、且つR4が、炭素数1~10の有機基である場合は、R3とR4が一緒になって環を形成していてもよい。〕
R3で示される有機基の炭素数は、好ましくは1~50であり、より好ましくは1~30である。
R1は、水素原子又はメチル基を示し、
R2は、-O-、*-(C=O)-O-、*-(C=O)-NR4-、又は*-NR4-(C=O)-(R4は、水素原子又は炭素数1~10の有機基を示し、*は、式(A0)中のR1が結合している炭素原子と結合する位置を示す)を示し、
R3は、有機基を示す。
但し、R2が、*-(C=O)-NR4-、又は*-NR4-(C=O)-であり、且つR4が、炭素数1~10の有機基である場合は、R3とR4が一緒になって環を形成していてもよい。〕
R3で示される有機基の炭素数は、好ましくは1~50であり、より好ましくは1~30である。
さらに、親水性繰り返し単位(A)としては、式(A1)で表される繰り返し単位(A1)、式(A2)で表される繰り返し単位(A2)、式(A3)で表される繰り返し単位(A3)、式(A4)で表される繰り返し単位(A4)、式(A5)で表される繰り返し単位(A5)及び式(A6)で表される繰り返し単位(A6)から選ばれる1種以上が好ましい。これらの中では、繰り返し単位(A2)~(A6)が好ましく、繰り返し単位(A2)、(A4)~(A6)がより好ましく、加水分解しにくく保存安定性に優れた組成物が得られる点で、繰り返し単位(A4)~(A6)が特に好ましい。
〔式(A1)中、
Raは、水素原子又はメチル基を示し、
Rbは、-O-、*-(C=O)-O-、*-(C=O)-NRe-、又は*-NRe-(C=O)-(Reは、水素原子又は炭素数1~10の有機基を示し、*は、式(A1)中のRaが結合している炭素原子と結合する位置を示す)を示し、
Rcは、ポリオキシアルキレン基を示し、
Rdは、水素原子又は炭素数1~4のアルキル基を示す。〕
Raは、水素原子又はメチル基を示し、
Rbは、-O-、*-(C=O)-O-、*-(C=O)-NRe-、又は*-NRe-(C=O)-(Reは、水素原子又は炭素数1~10の有機基を示し、*は、式(A1)中のRaが結合している炭素原子と結合する位置を示す)を示し、
Rcは、ポリオキシアルキレン基を示し、
Rdは、水素原子又は炭素数1~4のアルキル基を示す。〕
〔式(A2)中、
R19は、水素原子又はメチル基を示し、
R20は、炭素数2~4のアルカンジイル基を示し、
R21は、炭素数1~10のアルカンジイル基を示し、
R22、R23及びR24は、それぞれ独立して、水素原子又は炭素数1~8のアルキル基を示し、
qは、1~10の整数を示す。〕
R19は、水素原子又はメチル基を示し、
R20は、炭素数2~4のアルカンジイル基を示し、
R21は、炭素数1~10のアルカンジイル基を示し、
R22、R23及びR24は、それぞれ独立して、水素原子又は炭素数1~8のアルキル基を示し、
qは、1~10の整数を示す。〕
〔式(A3)中、
Yは、-(C=O)O-、-(O=S=O)O-、-O(O=S=O)O-、-(S=O)O-、-O(S=O)O-、-O(P=O)(OR30)O-、-O(P=O)(R30)O-、-(P=O)(OR30)O-又は-(P=O)(R30)O-を示し(R30は炭素数1~3のアルキル基を示す)、
R25は、水素原子又はメチル基を示し、
R26及びR27は、それぞれ独立して、炭素数1~10の2価の有機基を示し、
R28及びR29は、それぞれ独立して、炭素数1~10のアルキル基を示す。〕
Yは、-(C=O)O-、-(O=S=O)O-、-O(O=S=O)O-、-(S=O)O-、-O(S=O)O-、-O(P=O)(OR30)O-、-O(P=O)(R30)O-、-(P=O)(OR30)O-又は-(P=O)(R30)O-を示し(R30は炭素数1~3のアルキル基を示す)、
R25は、水素原子又はメチル基を示し、
R26及びR27は、それぞれ独立して、炭素数1~10の2価の有機基を示し、
R28及びR29は、それぞれ独立して、炭素数1~10のアルキル基を示す。〕
〔式(A4)中、
R31は、水素原子又はメチル基を示し、
R32及びR33は、それぞれ独立して、水素原子、炭素数1~6のアルキル基又は炭素数1~6のヒドロキシアルキル基を示す。〕
R31は、水素原子又はメチル基を示し、
R32及びR33は、それぞれ独立して、水素原子、炭素数1~6のアルキル基又は炭素数1~6のヒドロキシアルキル基を示す。〕
〔式(A5)中、
R34は、水素原子又はメチル基を示し、
R35及びR36は、それぞれ独立して、炭素数1~2のアルカンジイル基を示す。〕
R34は、水素原子又はメチル基を示し、
R35及びR36は、それぞれ独立して、炭素数1~2のアルカンジイル基を示す。〕
〔式(A6)中、
R37は、水素原子又はメチル基を示し、
R38は、炭素数1~3のアルカンジイル基を示す。〕
R37は、水素原子又はメチル基を示し、
R38は、炭素数1~3のアルカンジイル基を示す。〕
ここで、上記式(A1)~(A6)中の各記号について詳細に説明する。
(式(A1))
Raは、水素原子又はメチル基を示す。
Rbは、-O-、*-(C=O)-O-、*-(C=O)-NRe-、又は*-NRe-(C=O)-を示す。中でも、*-(C=O)-O-が好ましい。
上記Reは、水素原子又は炭素数1~10の有機基を示すが、好ましくは水素原子、炭素数1~5のアルキル基である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
Rcは、ポリオキシアルキレン基を示すが、-(RfO)p-で表される基が好ましい。Rfは、炭素数2~6のアルカンジイル基であり、好ましくは炭素数2~4のアルカンジイル基である。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基等が挙げられる。なお、p個のRfは同一であっても異なっていてもよい。また、pは、2~100の整数であるが、2~75の整数が好ましく、2~50の整数がより好ましく、2~25の整数が特に好ましい。
Rdは、水素原子又は炭素数1~4のアルキル基を示す。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられる。
Rbは、-O-、*-(C=O)-O-、*-(C=O)-NRe-、又は*-NRe-(C=O)-を示す。中でも、*-(C=O)-O-が好ましい。
上記Reは、水素原子又は炭素数1~10の有機基を示すが、好ましくは水素原子、炭素数1~5のアルキル基である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
Rcは、ポリオキシアルキレン基を示すが、-(RfO)p-で表される基が好ましい。Rfは、炭素数2~6のアルカンジイル基であり、好ましくは炭素数2~4のアルカンジイル基である。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基等が挙げられる。なお、p個のRfは同一であっても異なっていてもよい。また、pは、2~100の整数であるが、2~75の整数が好ましく、2~50の整数がより好ましく、2~25の整数が特に好ましい。
Rdは、水素原子又は炭素数1~4のアルキル基を示す。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられる。
(式(A2))
R19は、水素原子又はメチル基を示す。
R20は、炭素数2~4のアルカンジイル基を示す。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基等が挙げられる。
R21は、炭素数1~10のアルカンジイル基を示す。当該アルカンジイル基の炭素数は、好ましくは2~8、より好ましくは2~6である。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基等が挙げられる。
R22、R23及びR24は、それぞれ独立して、水素原子又は炭素数1~8のアルキル基を示すが、炭素数1~8のアルキル基が好ましい。当該アルキル基の炭素数は、好ましくは1~6、より好ましくは1~4である。また当該アルキル基は、直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられる。
qは、1~10の整数を示すが、1~8の整数が好ましく、1~6の整数がより好ましい。
R20は、炭素数2~4のアルカンジイル基を示す。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基等が挙げられる。
R21は、炭素数1~10のアルカンジイル基を示す。当該アルカンジイル基の炭素数は、好ましくは2~8、より好ましくは2~6である。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基等が挙げられる。
R22、R23及びR24は、それぞれ独立して、水素原子又は炭素数1~8のアルキル基を示すが、炭素数1~8のアルキル基が好ましい。当該アルキル基の炭素数は、好ましくは1~6、より好ましくは1~4である。また当該アルキル基は、直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられる。
qは、1~10の整数を示すが、1~8の整数が好ましく、1~6の整数がより好ましい。
(式(A3))
Yは、-(C=O)O-、-(O=S=O)O-、-O(O=S=O)O-、-(S=O)O-、-O(S=O)O-、-O(P=O)(OR30)O-、-O(P=O)(R30)O-、-(P=O)(OR30)O-又は-(P=O)(R30)O-を示す。これらの中でも、-(C=O)O-が好ましい。また、上記R30で示される炭素数1~3のアルキル基は、直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基が挙げられる。
R25は、水素原子又はメチル基を示す。
R26及びR27は、それぞれ独立して、炭素数1~10の2価の有機基を示す。当該有機基としては、2価の脂肪族炭化水素基が好ましく、アルカンジイル基がより好ましい。アルカンジイル基の炭素数は、好ましくは1~8、より好ましくは1~6、特に好ましくは1~4である。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基、ペンタン-1,5-ジイル基、ヘキサン-1,6-ジイル基等が挙げられる。
R28及びR29は、それぞれ独立して、炭素数1~10のアルキル基を示す。当該アルキル基の炭素数は、好ましくは1~6、より好ましくは1~4である。また当該アルキル基は、直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられる。
なお、本明細書において、上記繰り返し単位(A3)のような、アニオン、カチオン、又はこれらの両方を構造中にもつものは、対イオンを有していてもよい。対イオンとしては、ナトリウムイオン、カリウムイオン等のアルカリ金属イオン;カルシウムイオン、マグネシウムイオン等のアルカリ土類金属イオン;アンモニウムイオン;水素イオン;フッ化物イオン、塩化物イオン、臭化物イオン、ヨウ化物イオン等のハロゲンイオン;水酸化物イオン等が挙げられる。
R25は、水素原子又はメチル基を示す。
R26及びR27は、それぞれ独立して、炭素数1~10の2価の有機基を示す。当該有機基としては、2価の脂肪族炭化水素基が好ましく、アルカンジイル基がより好ましい。アルカンジイル基の炭素数は、好ましくは1~8、より好ましくは1~6、特に好ましくは1~4である。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基、ペンタン-1,5-ジイル基、ヘキサン-1,6-ジイル基等が挙げられる。
R28及びR29は、それぞれ独立して、炭素数1~10のアルキル基を示す。当該アルキル基の炭素数は、好ましくは1~6、より好ましくは1~4である。また当該アルキル基は、直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられる。
なお、本明細書において、上記繰り返し単位(A3)のような、アニオン、カチオン、又はこれらの両方を構造中にもつものは、対イオンを有していてもよい。対イオンとしては、ナトリウムイオン、カリウムイオン等のアルカリ金属イオン;カルシウムイオン、マグネシウムイオン等のアルカリ土類金属イオン;アンモニウムイオン;水素イオン;フッ化物イオン、塩化物イオン、臭化物イオン、ヨウ化物イオン等のハロゲンイオン;水酸化物イオン等が挙げられる。
(式(A4))
R31は、水素原子又はメチル基を示す。
R32及びR33は、それぞれ独立して、水素原子、炭素数1~6のアルキル基又は炭素数1~6のヒドロキシアルキル基を示す。R32及びR33で示されるアルキル基の炭素数は、好ましくは1~3であり、ヒドロキシアルキル基の炭素数は、好ましくは1~4である。上記アルキル基、ヒドロキシアルキル基は、直鎖状でも分岐鎖状でもよい。また、ヒドロキシアルキル基に含まれるヒドロキシ基の置換位置は特に限定されない。アルキル基としては、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられる。ヒドロキシアルキル基としては、ヒドロキシメチル基、ヒドロキシエチル基、ヒドロキシプロピル基、ヒドロキシブチル基が挙げられる。
R32及びR33は、それぞれ独立して、水素原子、炭素数1~6のアルキル基又は炭素数1~6のヒドロキシアルキル基を示す。R32及びR33で示されるアルキル基の炭素数は、好ましくは1~3であり、ヒドロキシアルキル基の炭素数は、好ましくは1~4である。上記アルキル基、ヒドロキシアルキル基は、直鎖状でも分岐鎖状でもよい。また、ヒドロキシアルキル基に含まれるヒドロキシ基の置換位置は特に限定されない。アルキル基としては、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられる。ヒドロキシアルキル基としては、ヒドロキシメチル基、ヒドロキシエチル基、ヒドロキシプロピル基、ヒドロキシブチル基が挙げられる。
(式(A5))
R34は、水素原子又はメチル基を示す。
R35及びR36は、それぞれ独立して、炭素数1~2のアルカンジイル基を示す。当該アルカンジイル基は直鎖状でも分岐鎖状でもよいが、直鎖状が好ましい。アルカンジイル基としては、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基が挙げられる。
R35及びR36は、それぞれ独立して、炭素数1~2のアルカンジイル基を示す。当該アルカンジイル基は直鎖状でも分岐鎖状でもよいが、直鎖状が好ましい。アルカンジイル基としては、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基が挙げられる。
(式(A6))
R37は、水素原子又はメチル基を示すが、水素原子が好ましい。
R38は、炭素数1~3のアルカンジイル基を示す。当該アルカンジイル基は直鎖状でも分岐鎖状でもよいが、直鎖状が好ましい。アルカンジイル基としては、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基が挙げられる。
R38は、炭素数1~3のアルカンジイル基を示す。当該アルカンジイル基は直鎖状でも分岐鎖状でもよいが、直鎖状が好ましい。アルカンジイル基としては、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基が挙げられる。
上記親水性繰り返し単位(A)は、例えば、(メタ)アクリレート系のポリマー種、(メタ)アクリルアミド系のポリマー種、これら以外のビニル系ポリマー種が挙げられる。親水性繰り返し単位(A)を誘導するモノマーとしては、ヒドロキシエチル(メタ)アクリレート、ヒドロキシプロピル(メタ)アクリレート、グリセリンモノ(メタ)アクリレート、ポリエチレングリコール(メタ)アクリレート、ポリプロピレングリコール(メタ)アクリレート、ポリエチレングリコールポリプロピレングリコール(メタ)アクリレート、ポリエチレングリコールポリテトラメチレングリコール(メタ)アクリレート、ポリプロピレングリコールポリテトラメチレングリコール(メタ)アクリレート、メトキシポリエチレングリコール(メタ)アクリレート、エトキシポリエチレングリコール(メタ)アクリレート、2-(メタ)アクリロイルオキシエチル-2'-(トリメチルアンモニオ)エチルホスフェート、N-(メタ)アクリロイルオキシエチル-N,N-ジメチルアンモニウム-α-N-メチルカルボキシベタイン等の(メタ)アクリレート系モノマー;(メタ)アクリルアミド、N,N-ジメチル(メタ)アクリルアミド、N,N-ジエチル(メタ)アクリルアミド、N-メチル(メタ)アクリルアミド、N-エチル(メタ)アクリルアミド、N-イソプロピル(メタ)アクリルアミド、N-メチロール(メタ)アクリルアミド、N-エチロール(メタ)アクリルアミド、N-メチロールプロパン(メタ)アクリルアミド、N-メトキシメチル(メタ)アクリルアミド、N-(2-ヒドロキシ)エチル(メタ)アクリルアミド、N-(メタ)アクリロイルモルホリン、(メタ)アクリロイルピロリジン、(メタ)アクリロイルピペリジン等の(メタ)アクリルアミド系モノマー;N-ビニル-2-ピロリドン等のビニル化合物が挙げられる。上記のモノマーのうち1種を単独で、又は2種以上を組み合わせて用いてもよい。
上記モノマーの中でも、本発明においては、組成物の保存安定性に優れることから、N,N-ジメチル(メタ)アクリルアミド、N,N-ジエチル(メタ)アクリルアミド、N-エチル(メタ)アクリルアミド、N-イソプロピル(メタ)アクリルアミド、N-メチロール(メタ)アクリルアミド、N-エチロール(メタ)アクリルアミド、N-メチロールプロパン(メタ)アクリルアミド、N-メトキシメチル(メタ)アクリルアミド、N-(2-ヒドロキシ)エチル(メタ)アクリルアミド、N-(メタ)アクリロイルモルホリン、(メタ)アクリロイルピロリジン、(メタ)アクリロイルピペリジン等の(メタ)アクリルアミド系モノマー;N-ビニル-2-ピロリドン等が好ましい。
本発明の重合体I中における親水性繰り返し単位(A)の含有量としては、重合体Iに含まれる全繰り返し単位に対して、65質量%以上が好ましく、75~99質量%がより好ましく、85~98質量%が特に好ましい。上記の数値範囲内であると、重合体Iが水に溶解しやすくなり、また、容器等の基材への殺菌性化合物の吸着が更に抑制される。
なお、親水性繰り返し単位(A)の含有量は1H-NMR等により測定可能である。
なお、親水性繰り返し単位(A)の含有量は1H-NMR等により測定可能である。
〔繰り返し単位(B)〕
本発明の重合体Iは、HLB値が1~15である疎水性繰り返し単位(B)を有する。
本明細書において、疎水性とは、水との親和力が弱い性質を持つことを意味する。具体的には1種の繰り返し単位のみからなるホモポリマー(実施例の測定法による数平均分子量が1万~100万程度のもの)とした際に、常温(25℃)において純水100gに対する溶解量が1g未満である場合にはその繰り返し単位は疎水性である。
本発明で用いる重合体Iが有する繰り返し単位(B)は、HLB値が1~15である疎水性繰り返し単位であり、繰り返し単位(B)に該当する繰り返し単位を1種又は2種以上有していてよい。
本発明の重合体Iは、HLB値が1~15である疎水性繰り返し単位(B)を有する。
本明細書において、疎水性とは、水との親和力が弱い性質を持つことを意味する。具体的には1種の繰り返し単位のみからなるホモポリマー(実施例の測定法による数平均分子量が1万~100万程度のもの)とした際に、常温(25℃)において純水100gに対する溶解量が1g未満である場合にはその繰り返し単位は疎水性である。
本発明で用いる重合体Iが有する繰り返し単位(B)は、HLB値が1~15である疎水性繰り返し単位であり、繰り返し単位(B)に該当する繰り返し単位を1種又は2種以上有していてよい。
繰り返し単位(B)のHLB値は1~15であるが、容器等の基材に重合体Iが吸着しやすくなり、殺菌性化合物は基材に吸着しにくくなることから、好ましくは14以下、より好ましくは13以下、更に好ましくは10以下、特に好ましくは8以下であり、また、好ましくは2以上である。斯かるHLB値が15を超える場合、殺菌性化合物の吸着を抑制する効果が低下する。
本発明においては、基材の中でも疎水性が高いものへの吸着性に優れ、例えばポリプロピレンなどのポリオレフィン系基材への吸着性に優れること、すなわち、ポリオレフィン系基材などの疎水性の高い基材と殺菌性化合物との吸着が抑制されやすくなることから、疎水性繰り返し単位(B)としては、式(B1)、(B2)又は(B3)で表される疎水性の繰り返し単位が好ましい。
〔式(B1)中、
R5は、水素原子又はメチル基を示し、
R6は、-O-、*-(C=O)-O-、*-(C=O)-NR8-、又は*-NR8-(C=O)-(R8は、水素原子又は炭素数1~10の有機基を示し、*は、式(B1)中のR5が結合している炭素原子と結合する位置を示す)を示し、
R7は、炭素数4~30の有機基を示す。〕
R5は、水素原子又はメチル基を示し、
R6は、-O-、*-(C=O)-O-、*-(C=O)-NR8-、又は*-NR8-(C=O)-(R8は、水素原子又は炭素数1~10の有機基を示し、*は、式(B1)中のR5が結合している炭素原子と結合する位置を示す)を示し、
R7は、炭素数4~30の有機基を示す。〕
〔式(B2)中、
R9は、水素原子又はメチル基を示し、
R10は、-O-、*-(C=O)-O-、*-(C=O)-NR17-、*-NR17-(C=O)-(R17は、水素原子又は炭素数1~10の有機基を示し、*は、式(B2)中のR9が結合している炭素原子と結合する位置を示す)又はフェニレン基を示し、
R11は、炭素数1~10の2価の有機基を示し、
R12及びR13は、それぞれ独立して、炭素数1~10の有機基を示し、
R14、R15及びR16は、それぞれ独立して、-OSi(R18)3(R18は、それぞれ独立して、水素原子又は炭素数1~8の有機基を示す)又は炭素数1~10の有機基を示し、
nは0~200の整数を示す。〕
R9は、水素原子又はメチル基を示し、
R10は、-O-、*-(C=O)-O-、*-(C=O)-NR17-、*-NR17-(C=O)-(R17は、水素原子又は炭素数1~10の有機基を示し、*は、式(B2)中のR9が結合している炭素原子と結合する位置を示す)又はフェニレン基を示し、
R11は、炭素数1~10の2価の有機基を示し、
R12及びR13は、それぞれ独立して、炭素数1~10の有機基を示し、
R14、R15及びR16は、それぞれ独立して、-OSi(R18)3(R18は、それぞれ独立して、水素原子又は炭素数1~8の有機基を示す)又は炭素数1~10の有機基を示し、
nは0~200の整数を示す。〕
〔式(B3)中、
R59は、水素原子又はメチル基を示し、
R60は、-O-、*-(C=O)-O-、*-(C=O)-NR63-、*-NR63-(C=O)-(R63は、水素原子又は炭素数1~10の有機基を示し、*は、式(B3)中のR59が結合している炭素原子と結合する位置を示す)又はフェニレン基を示し、
R61は、炭素数2~4のアルカンジイル基を示し、
R62は、炭素数5~30のアルキル基、炭素数5~30のアルカノイル基又は炭素数6~30のアリール基を示し、
mは2~100の整数を示す。〕
R59は、水素原子又はメチル基を示し、
R60は、-O-、*-(C=O)-O-、*-(C=O)-NR63-、*-NR63-(C=O)-(R63は、水素原子又は炭素数1~10の有機基を示し、*は、式(B3)中のR59が結合している炭素原子と結合する位置を示す)又はフェニレン基を示し、
R61は、炭素数2~4のアルカンジイル基を示し、
R62は、炭素数5~30のアルキル基、炭素数5~30のアルカノイル基又は炭素数6~30のアリール基を示し、
mは2~100の整数を示す。〕
式(B1)中、R6は、-O-、*-(C=O)-O-、*-(C=O)-NR8-、又は*-NR8-(C=O)-を示す。中でも、*-(C=O)-O-、*-(C=O)-NR8-が好ましく、*-(C=O)-NR8-がより好ましい。
上記R8は、水素原子又は炭素数1~10の有機基を示すが、好ましくは水素原子、炭素数1~10のアルキル基である。当該アルキル基の炭素数は、好ましくは1~5、より好ましくは1~3である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
上記R8は、水素原子又は炭素数1~10の有機基を示すが、好ましくは水素原子、炭素数1~10のアルキル基である。当該アルキル基の炭素数は、好ましくは1~5、より好ましくは1~3である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
式(B1)中、R7は、炭素数4~30の有機基を示す。当該有機基としては、炭化水素基、当該炭化水素基の炭素-炭素原子間にエーテル結合、イミノ基、アミド結合及びエステル結合から選ばれる1種以上を有する基が挙げられる。斯様な有機基の炭素数は、好ましくは4~24、より好ましくは4~18である。
R7における「炭化水素基」は、脂肪族炭化水素基、脂環式炭化水素基、及び芳香族炭化水素基を包含する概念であるが、脂肪族炭化水素基が好ましい。当該脂肪族炭化水素基は直鎖状でも分岐鎖状でもよい。また、上記脂肪族炭化水素基としては、アルキル基が好ましい。アルキル基の炭素数は、好ましくは4~24、より好ましくは4~18である。例えば、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、2-エチルヘキシル基、ノニル基、デシル基、ウンデシル基、ドデシル基等が挙げられる。
また、上記のような「炭化水素基」の炭素-炭素原子間にエーテル結合、イミノ基、アミド結合及びエステル結合から選ばれる1種以上を有する基としては、炭化水素基の炭素-炭素原子間にエーテル結合を有する基が好ましい。
R7における「炭化水素基」は、脂肪族炭化水素基、脂環式炭化水素基、及び芳香族炭化水素基を包含する概念であるが、脂肪族炭化水素基が好ましい。当該脂肪族炭化水素基は直鎖状でも分岐鎖状でもよい。また、上記脂肪族炭化水素基としては、アルキル基が好ましい。アルキル基の炭素数は、好ましくは4~24、より好ましくは4~18である。例えば、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、2-エチルヘキシル基、ノニル基、デシル基、ウンデシル基、ドデシル基等が挙げられる。
また、上記のような「炭化水素基」の炭素-炭素原子間にエーテル結合、イミノ基、アミド結合及びエステル結合から選ばれる1種以上を有する基としては、炭化水素基の炭素-炭素原子間にエーテル結合を有する基が好ましい。
式(B2)中、R10は、-O-、*-(C=O)-O-、*-(C=O)-NR17-、*-NR17-(C=O)-又はフェニレン基を示す。中でも、*-(C=O)-O-、*-(C=O)-NR17-が好ましい。
上記R17は、水素原子又は炭素数1~10の有機基を示すが、好ましくは水素原子、炭素数1~10のアルキル基である。当該アルキル基の炭素数は、好ましくは1~5、より好ましくは1~3である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
上記R17は、水素原子又は炭素数1~10の有機基を示すが、好ましくは水素原子、炭素数1~10のアルキル基である。当該アルキル基の炭素数は、好ましくは1~5、より好ましくは1~3である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
式(B2)中、R11は、炭素数1~10の2価の有機基を示す。当該有機基としては、2価の脂肪族炭化水素基が好ましく、アルカンジイル基がより好ましい。アルカンジイル基の炭素数は、好ましくは1~8、より好ましくは1~6である。当該アルカンジイル基は直鎖状でも分岐鎖状でもよく、例えば、メタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-1,2-ジイル基、ブタン-1,4-ジイル基、ペンタン-1,5-ジイル基、ヘキサン-1,6-ジイル基等が挙げられる。
式(B2)中、R12及びR13は、それぞれ独立して、炭素数1~10の有機基を示す。
また、式(B2)中、R14、R15及びR16は、それぞれ独立して、-OSi(R18)3又は炭素数1~10の有機基を示す。
R12~R16で示される有機基としては、炭化水素基が好ましく、脂肪族炭化水素基がより好ましい。当該脂肪族炭化水素基は直鎖状でも分岐鎖状でもよい。また、上記脂肪族炭化水素基としては、アルキル基が好ましい。アルキル基の炭素数は、好ましくは1~6、より好ましくは1~4である。例えば、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基、ペンチル基等が挙げられる。
また、上記R18は、水素原子又は炭素数1~8の有機基を示す。当該有機基としては、炭化水素基が好ましく、脂肪族炭化水素基がより好ましい。当該脂肪族炭化水素基は直鎖状でも分岐鎖状でもよい。また、上記脂肪族炭化水素基としては、アルキル基が好ましい。アルキル基の炭素数は、好ましくは1~6、より好ましくは1~4であり、特に好ましくは1~3である。例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
また、式(B2)中、R14、R15及びR16は、それぞれ独立して、-OSi(R18)3又は炭素数1~10の有機基を示す。
R12~R16で示される有機基としては、炭化水素基が好ましく、脂肪族炭化水素基がより好ましい。当該脂肪族炭化水素基は直鎖状でも分岐鎖状でもよい。また、上記脂肪族炭化水素基としては、アルキル基が好ましい。アルキル基の炭素数は、好ましくは1~6、より好ましくは1~4である。例えば、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基、ペンチル基等が挙げられる。
また、上記R18は、水素原子又は炭素数1~8の有機基を示す。当該有機基としては、炭化水素基が好ましく、脂肪族炭化水素基がより好ましい。当該脂肪族炭化水素基は直鎖状でも分岐鎖状でもよい。また、上記脂肪族炭化水素基としては、アルキル基が好ましい。アルキル基の炭素数は、好ましくは1~6、より好ましくは1~4であり、特に好ましくは1~3である。例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
式(B2)中、nは0~200の整数を示すが、好ましくは0~100の整数、より好ましくは0~50の整数、更に好ましくは0~25の整数である。
式(B3)中、R60は、-O-、*-(C=O)-O-、*-(C=O)-NR63-、*-NR63-(C=O)-又はフェニレン基を示す。中でも、*-(C=O)-O-、*-(C=O)-NR63-が好ましい。
上記R63は、水素原子又は炭素数1~10の有機基を示すが、好ましくは水素原子、炭素数1~10のアルキル基である。当該アルキル基の炭素数は、好ましくは1~5、より好ましくは1~3である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
上記R63は、水素原子又は炭素数1~10の有機基を示すが、好ましくは水素原子、炭素数1~10のアルキル基である。当該アルキル基の炭素数は、好ましくは1~5、より好ましくは1~3である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
式(B3)中、R61におけるアルカンジイル基の炭素数は、好ましくは2又は3であり、より好ましくは2である。
R61で示されるアルカンジイル基は直鎖状でも分岐鎖状でもよく、具体的には、エタン-1,2-ジイル基、プロパン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-2,2-ジイル基、ブタン-1,2-ジイル基、ブタン-1,3-ジイル基、ブタン-1,4-ジイル基等が挙げられる。これらの中でも、入手容易性等の観点から、エタン-1,2-ジイル基が好ましい。
なお、m個のR61は同一でも異なっていてもよい。
R61で示されるアルカンジイル基は直鎖状でも分岐鎖状でもよく、具体的には、エタン-1,2-ジイル基、プロパン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-2,2-ジイル基、ブタン-1,2-ジイル基、ブタン-1,3-ジイル基、ブタン-1,4-ジイル基等が挙げられる。これらの中でも、入手容易性等の観点から、エタン-1,2-ジイル基が好ましい。
なお、m個のR61は同一でも異なっていてもよい。
式(B3)中、R62におけるアルキル基、アルカノイル基の炭素数は、入手容易性等の観点から、好ましくは6~25であり、より好ましくは7~20であり、更に好ましくは8~18であり、更に好ましくは9~18であり、特に好ましくは10~18である。
R62におけるアルキル基は直鎖状でも分岐鎖状でもよく、具体的には、2-エチルヘキシル基、オクチル基、デシル基、ラウリル基、パルミチル基、ステアリル基等が挙げられる。これらの中でも、2-エチルヘキシル基、ラウリル基、ステアリル基が好ましく、ラウリル基、ステアリル基がより好ましい。
また、R62におけるアルカノイル基としては、2-エチルヘキサノイル基、ラウロイル基、ステアロイル基が挙げられる。
R62におけるアルキル基は直鎖状でも分岐鎖状でもよく、具体的には、2-エチルヘキシル基、オクチル基、デシル基、ラウリル基、パルミチル基、ステアリル基等が挙げられる。これらの中でも、2-エチルヘキシル基、ラウリル基、ステアリル基が好ましく、ラウリル基、ステアリル基がより好ましい。
また、R62におけるアルカノイル基としては、2-エチルヘキサノイル基、ラウロイル基、ステアロイル基が挙げられる。
また、R62におけるアリール基の炭素数は、好ましくは6~12である。具体的には、フェニル基が挙げられる。
また、該アリール基は、炭素数1~24のアルキル基を置換基として有していてもよい。斯かるアルキル基の炭素数としては、3~24が好ましく、5~16がより好ましい。なお、斯かる置換アルキル基の置換位置および置換個数は任意であるが、好適な置換個数は1または2個である。
また、斯様な炭素数1~24のアルキル基を置換基として有するアリール基としては、ノニルフェニル基が挙げられる。
また、該アリール基は、炭素数1~24のアルキル基を置換基として有していてもよい。斯かるアルキル基の炭素数としては、3~24が好ましく、5~16がより好ましい。なお、斯かる置換アルキル基の置換位置および置換個数は任意であるが、好適な置換個数は1または2個である。
また、斯様な炭素数1~24のアルキル基を置換基として有するアリール基としては、ノニルフェニル基が挙げられる。
前述のR62の中でも、入手容易性等の観点から、炭素数5~30のアルキル基、炭素数6~30のアリール基が好ましく、炭素数5~30のアルキル基がより好ましい。
式(B3)中、mは、好ましくは2~90の整数であり、より好ましくは4~90の整数であり、更に好ましくは9~60の整数であり、特に好ましくは10~40の整数である。
また、上記疎水性繰り返し単位(B)は、例えば、(メタ)アクリレート系のポリマー種、(メタ)アクリルアミド系のポリマー種、オレフィン系、スチレン系、ビニルエーテル系のポリマー種等が挙げられる。これらの中では、組成物の保存安定性に優れることから、(メタ)アクリルアミド系のポリマー種が好ましい。
疎水性繰り返し単位(B)を誘導するモノマーとしては、メチル(メタ)アクリレート、n-ブチル(メタ)アクリレート、tert-ブチル(メタ)アクリレート、シクロヘキシル(メタ)アクリレート、2-エチルヘキシル(メタ)アクリレート、オクチル(メタ)アクリレート、ラウリル(メタ)アクリレート、イソデシル(メタ)アクリレート、ステアリル(メタ)アクリレート、ベンジル(メタ)アクリレート、フェノキシエチル(メタ)アクリレート、イソボルニル(メタ)アクリレート、ジシクロペンタニル(メタ)アクリレート、(メタ)アクリル酸3-[トリス(トリメチルシロキシ)シリル]プロピル、(メタ)アクリル酸3-[ビス(トリメチルシロキシ)(メチル)シリル]プロピル、シリコーン(メタ)アクリレート(X-22-2475(信越シリコーン社製)、FM-0711(JNC社製)等)、2-エチルヘキシルオキシポリエチレングリコール(メタ)アクリレート、ラウロキシポリエチレングリコール(メタ)アクリレート、ステアロキシポリエチレングリコール(メタ)アクリレート、フェノキシポリエチレングリコール(メタ)アクリレート、フェノキシポリプロピレングリコール(メタ)アクリレート、ノニルフェノキシポリプロピレングリコール(メタ)アクリレート、2-エチルヘキシルオキシポリエチレングリコールポリプロピレンレングリコール(メタ)アクリレート、ノニルフェノキシポリエチレングリコールポリプロピレンレングリコール(メタ)アクリレート等の(メタ)アクリレート系モノマー;N,N-ジ-n-プロピル(メタ)アクリルアミド、N,N-ジイソプロピル(メタ)アクリルアミド、N,N-ジ(n-ブチル)(メタ)アクリルアミド、N,N-ジ(tert-ブチル)(メタ)アクリルアミド、N-n-ブチル(メタ)アクリルアミド、N-tert-ブチル(メタ)アクリルアミド、N-n-ヘキシル(メタ)アクリルアミド、N-n-オクチル(メタ)アクリルアミド、N-tert-オクチル(メタ)アクリルアミド、N-ドデシル(メタ)アクリルアミド、N,N-ジグリシジル(メタ)アクリルアミド、N-(4-グリシドキシブチル)(メタ)アクリルアミド、N-(5-グリシドキシペンチル)(メタ)アクリルアミド、N-n-ブトキシメチル(メタ)アクリルアミド、N-tert-ブトキシメチル(メタ)アクリルアミド、N-イソブトキシメチル(メタ)アクリルアミド、N-フェニル(メタ)アクリルアミド等の(メタ)アクリルアミド系モノマー;アクリロニトリル、メタクリロニトリル、塩化ビニル、塩化ビニリデン、エチレン、プロピレン、ブテン等のオレフィン系モノマー;スチレン、α-メチルスチレン等のスチレン系モノマーの他、ブタジエン、イソプレン等が挙げられる。
上記モノマーのうち1種を単独で、又は2種以上を組み合わせて用いてもよい。
上記モノマーのうち1種を単独で、又は2種以上を組み合わせて用いてもよい。
上記モノマーの中でも、(メタ)アクリルアミド系モノマーが好ましく、特に好適な具体例としては、N,N-ジ-n-プロピル(メタ)アクリルアミド、N,N-ジイソプロピル(メタ)アクリルアミド、N,N-ジ(n-ブチル)(メタ)アクリルアミド、N,N-ジ(tert-ブチル)(メタ)アクリルアミド、N-n-ブチル(メタ)アクリルアミド、N-tert-ブチル(メタ)アクリルアミド、N-n-ヘキシル(メタ)アクリルアミド、N-n-オクチル(メタ)アクリルアミド、N-tert-オクチル(メタ)アクリルアミド、N-ドデシル(メタ)アクリルアミド、N,N-ジグリシジル(メタ)アクリルアミド、N-(4-グリシドキシブチル)(メタ)アクリルアミド、N-(5-グリシドキシペンチル)(メタ)アクリルアミド、N-n-ブトキシメチル(メタ)アクリルアミド、N-tert-ブトキシメチル(メタ)アクリルアミド、N-イソブトキシメチル(メタ)アクリルアミド、N-フェニル(メタ)アクリルアミドが挙げられる。
本発明の重合体I中における疎水性繰り返し単位(B)の含有量としては、重合体Iに含まれる全繰り返し単位に対して、0.1質量%以上が好ましく、0.1~35質量%がより好ましく、0.1~25質量%が更に好ましく、2~15質量%が特に好ましい。上記の数値範囲内であると、水溶性と基材表面への吸着性のバランスに優れたものとなる。
なお、疎水性繰り返し単位(B)の含有量は1H-NMR等により測定可能である。
なお、疎水性繰り返し単位(B)の含有量は1H-NMR等により測定可能である。
本発明の重合体Iは、上記繰り返し単位(A)、(B)の他に、本発明における効果を損なわない範囲で他の繰り返し単位を含んでいてもよい。なお、重合体Iは、他の繰り返し単位として酸性基を有する繰り返し単位を実質的に含まないことが好ましい。かかる繰り返し単位を有する場合、殺菌性化合物を捕捉した上で繰り返し単位(A)により基材に吸着してしまい、かえって殺菌性が低下することがあるためである。
本発明においては、本発明の重合体I中、上記繰り返し単位(A)と繰り返し単位(B)との総量が、重合体Iに含まれる全繰り返し単位に対して、80質量%以上であることが好ましく、90質量%以上であることがより好ましく、95質量%以上であることが更に好ましい。
本発明においては、本発明の重合体I中、上記繰り返し単位(A)と繰り返し単位(B)との総量が、重合体Iに含まれる全繰り返し単位に対して、80質量%以上であることが好ましく、90質量%以上であることがより好ましく、95質量%以上であることが更に好ましい。
本発明の重合体Iは、ブロック共重合体、グラフト共重合体、ランダム共重合体、交互共重合体のいずれであってもよい。
重合体Iの重量平均分子量(Mw)としては、容器等の基材に重合体Iが吸着しやすくなり、殺菌性化合物は基材に吸着しにくくなることから、0.5万~1000万が好ましく、1万~500万がより好ましく、1万~300万が更に好ましく、1万~200万が更に好ましく、1万~50万が特に好ましい。また、分子量分布(Mw/Mn)としては、1~10が好ましく、1~7がより好ましく、1~5が更に好ましい。
なお、重量平均分子量及び分子量分布は、後述する実施例に記載の方法に従い測定すればよい。
なお、重量平均分子量及び分子量分布は、後述する実施例に記載の方法に従い測定すればよい。
また、本発明の重合体Iは、水溶性の重合体であるが、炭素数1~4程度の低級アルコールにも溶解する重合体であるのが好ましい。ここで、本明細書において、水又は低級アルコールに溶解するとは、0.5質量%のポリマー固形分となるように重合体を水又は低級アルコール(25℃)に添加・混合したときに、目視で透明となることをいう。
より具体的には、上記重合体Iを含む組成物を、殺菌性組成物として用いる場合、重合体IのHLB値としては、容器等の基材への吸着力、殺菌性化合物の吸着抑制の観点から、好ましくは10以上、より好ましくは12.5以上、更に好ましくは15以上、特に好ましくは17以上であり、また、好ましくは80以下、より好ましくは50以下である。
より具体的には、上記重合体Iを含む組成物を、殺菌性組成物として用いる場合、重合体IのHLB値としては、容器等の基材への吸着力、殺菌性化合物の吸着抑制の観点から、好ましくは10以上、より好ましくは12.5以上、更に好ましくは15以上、特に好ましくは17以上であり、また、好ましくは80以下、より好ましくは50以下である。
また、本発明の重合体Iは、例えば、以下のようにして調製される。即ち、各繰り返し単位を誘導するモノマーからそれぞれ一種以上のものを選択し、混合する。この混合物を、必要に応じて、水、アセトニトリル、エタノール、ブタノール、2-プロパノール、1,4-ジオキサン等の溶媒に溶解する。そして、重合開始剤を加えてラジカル重合することにより、目的とする重合体Iを得ることができる。
また、ラジカル重合を行う際に用いられる重合開始剤としては、通常のラジカル重合開始剤であれば特に限定されるものではないが、例えば、過酸化ベンゾイル、過酸化ラウロイル、ジイソプロピルペルオキシジカーボネート、tert-ブチルペルオキシ-2-エチルヘキサノエート、tert-ブチペルオキシピバレート、tert-ブチルペルオキシジイソブチレート、アゾビスイソブチロニトリル、アゾビスイソジメチルバレロニトリル、2,2'-アゾビス[2-(2-イミダゾリン-2-イル)プロパン]二塩酸塩や、過硫酸塩及び過硫酸塩一亜硫酸水素塩系の重合開始剤等を挙げることができる。
また、重合開始剤の使用量は、モノマー成分100質量部に対して、0.001~10質量部が好ましく、0.01~5質量部がより好ましい。また、重合温度は20~100℃が好ましく、重合時間は0.5~48時間が好ましい。
<重合体II>
次に本発明の重合体IIについて詳細に説明する。本発明の重合体IIは、酸性基を有する繰り返し単位(C)と(メタ)アクリルアミド系モノマーに由来する繰り返し単位(D)とを有する水溶性の重合体である。本発明の重合体IIを用いた場合には、ガラスやポリプロピレンといった広範囲の種類の壁面に対して、殺菌性化合物の吸着を抑えることができ、更には、この吸着による殺菌性能の低減を抑制することができることから、本発明の殺菌性組成物としては、本発明の重合体IIを少なくとも含むものが特に好ましい。
次に本発明の重合体IIについて詳細に説明する。本発明の重合体IIは、酸性基を有する繰り返し単位(C)と(メタ)アクリルアミド系モノマーに由来する繰り返し単位(D)とを有する水溶性の重合体である。本発明の重合体IIを用いた場合には、ガラスやポリプロピレンといった広範囲の種類の壁面に対して、殺菌性化合物の吸着を抑えることができ、更には、この吸着による殺菌性能の低減を抑制することができることから、本発明の殺菌性組成物としては、本発明の重合体IIを少なくとも含むものが特に好ましい。
〔繰り返し単位(C)〕
本発明の重合体IIは、酸性基を有する繰り返し単位(C)を有する。本発明の重合体IIは、繰り返し単位(C)に該当する繰り返し単位を1種又は2種以上有していてよい。
繰り返し単位(C)は、酸性基を有する繰り返し単位であればよいが、導入の容易さ、安全性の観点から、エチレン性不飽和結合を含有するモノマーに由来するものが好ましい。また、酸性基としては、カルボキシ基、スルホ基、リン酸基、又はこれらの塩などが挙げられ、これらを1個有していてもよく、2個以上有していてもよい。なお、塩としては、ナトリウム塩、カリウム塩等のアルカリ金属塩;マグネシウム塩、カルシウム塩等のアルカリ土類金属塩;アンモニウム塩;有機アンモニウム塩等が挙げられる。
本発明の重合体IIは、酸性基を有する繰り返し単位(C)を有する。本発明の重合体IIは、繰り返し単位(C)に該当する繰り返し単位を1種又は2種以上有していてよい。
繰り返し単位(C)は、酸性基を有する繰り返し単位であればよいが、導入の容易さ、安全性の観点から、エチレン性不飽和結合を含有するモノマーに由来するものが好ましい。また、酸性基としては、カルボキシ基、スルホ基、リン酸基、又はこれらの塩などが挙げられ、これらを1個有していてもよく、2個以上有していてもよい。なお、塩としては、ナトリウム塩、カリウム塩等のアルカリ金属塩;マグネシウム塩、カルシウム塩等のアルカリ土類金属塩;アンモニウム塩;有機アンモニウム塩等が挙げられる。
本発明において、繰り返し単位(C)としては、式(C1)で表される繰り返し単位(C1)、式(C2)で表される繰り返し単位(C2)、式(C3)で表される繰り返し単位(C3)、式(C4)で表される繰り返し単位(C4)及び式(C5)で表される繰り返し単位(C5)から選ばれる1種以上が好ましい。中でも、繰り返し単位(C3)が特に好ましい。
〔式(C1)中、
R40は、単結合又は2価の有機基を示す。〕
R40は、単結合又は2価の有機基を示す。〕
〔式(C2)中、
R41は、単結合又は2価の有機基を示す。〕
R41は、単結合又は2価の有機基を示す。〕
〔式(C3)中、
R42は、水素原子又はメチル基を示し、
R43は、単結合又は2価の有機基を示す。〕
R42は、水素原子又はメチル基を示し、
R43は、単結合又は2価の有機基を示す。〕
〔式(C4)中、
R44は、水素原子又はメチル基を示し、
R45は、単結合又は2価の有機基を示す。〕
R44は、水素原子又はメチル基を示し、
R45は、単結合又は2価の有機基を示す。〕
〔式(C5)中、
R46は、水素原子又はメチル基を示し、
R47は、単結合又は2価の有機基を示す。〕
R46は、水素原子又はメチル基を示し、
R47は、単結合又は2価の有機基を示す。〕
R40、R41、R43、R45、R47は、単結合又は2価の有機基を示す。当該2価の有機基の炭素数は、好ましくは1~20、より好ましくは1~14、特に好ましくは1~8である。
2価の有機基としては、2価の炭化水素基、*-(C=O)-O-R48-で示される基、*-(C=O)-NR49-R48-で示される基が挙げられる。
上記R48は、2価の炭化水素基を示し、R49は、水素原子又は炭素数1~10の有機基を示す。また、*は、式(C1)中の水素原子が結合している炭素原子と結合する位置、式(C2)中のカルボキシ基が結合している炭素原子と結合する位置、式(C3)中のR42が結合している炭素原子と結合する位置、式(C4)中のR44が結合している炭素原子と結合する位置、又は式(C5)中のR46が結合している炭素原子と結合する位置を示す。
2価の有機基としては、2価の炭化水素基、*-(C=O)-O-R48-で示される基、*-(C=O)-NR49-R48-で示される基が挙げられる。
上記R48は、2価の炭化水素基を示し、R49は、水素原子又は炭素数1~10の有機基を示す。また、*は、式(C1)中の水素原子が結合している炭素原子と結合する位置、式(C2)中のカルボキシ基が結合している炭素原子と結合する位置、式(C3)中のR42が結合している炭素原子と結合する位置、式(C4)中のR44が結合している炭素原子と結合する位置、又は式(C5)中のR46が結合している炭素原子と結合する位置を示す。
R40、R41、R43、R45、R47及びR48で示される2価の炭化水素基の炭素数としては、1~20が好ましく、1~14がより好ましく、1~8が特に好ましい。当該2価の炭化水素基としては、2価の脂肪族炭化水素基が好ましい。当該2価の脂肪族炭化水素基は直鎖状でも分岐鎖状でもよい。
上記2価の脂肪族炭化水素基としては、アルカンジイル基が好ましく、具体的には、メタン-1,1-ジイル基、エタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,1-ジイル基、プロパン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-2,2-ジイル基、ブタン-1,2-ジイル基、ブタン-1,3-ジイル基、ブタン-1,4-ジイル基、ペンタン-1,4-ジイル基、ペンタン-1,5-ジイル基、ヘキサン-1,5-ジイル基、ヘキサン-1,6-ジイル基等が挙げられる。
R49は、好ましくは水素原子、炭素数1~5のアルキル基である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
上記2価の脂肪族炭化水素基としては、アルカンジイル基が好ましく、具体的には、メタン-1,1-ジイル基、エタン-1,1-ジイル基、エタン-1,2-ジイル基、プロパン-1,1-ジイル基、プロパン-1,2-ジイル基、プロパン-1,3-ジイル基、プロパン-2,2-ジイル基、ブタン-1,2-ジイル基、ブタン-1,3-ジイル基、ブタン-1,4-ジイル基、ペンタン-1,4-ジイル基、ペンタン-1,5-ジイル基、ヘキサン-1,5-ジイル基、ヘキサン-1,6-ジイル基等が挙げられる。
R49は、好ましくは水素原子、炭素数1~5のアルキル基である。当該アルキル基は直鎖状でも分岐鎖状でもよく、例えば、メチル基、エチル基、n-プロピル基、イソプロピル基等が挙げられる。
R40、R43としては、単結合が好ましい。R41としては、2価の炭化水素基が好ましい。R45としては、単結合、2価の炭化水素基、*-(C=O)-NR49-R48-で示される基が好ましい。R47としては、*-(C=O)-O-R48-で示される基が好ましい。
斯様な繰り返し単位(C)を誘導するモノマーとしては、フマル酸、マレイン酸、イタコン酸等の不飽和ジカルボン酸又はその塩;(メタ)アクリル酸等の不飽和カルボン酸又はその塩;エチレンスルホン酸、アリルスルホン酸、メタアリルスルホン酸、2-スルホエチル(メタ)アクリレート、2-(メタ)アクリルアミド-2-メチルプロパンスルホン酸等のスルホ基含有重合性不飽和モノマー又はその塩;2-(メタ)アクリロイルオキシエチルアシッドホスフェート、2-(メタ)アクリロイルオキシプロピルアシッドホスフェート等のリン酸基含有重合性不飽和モノマー又はその塩が挙げられる。また、修飾されて誘導するモノマーとしては、アクリル酸エステルの加水分解物;無水マレイン酸、無水イタコン酸等の不飽和ジカルボン酸の酸無水物の加水分解物;グリシジルメタクリレートや(4-ビニルベンジル)グリシジルエーテルのエポキシ基への酸性基含有チオールの付加物等が挙げられる。これらを単独で又は2種以上を組み合わせて用いたものでもよい。
これらの中でも、導入の容易さ、反応性の観点から、アクリル酸、メタアクリル酸が好ましい。
これらの中でも、導入の容易さ、反応性の観点から、アクリル酸、メタアクリル酸が好ましい。
本発明の重合体II中における繰り返し単位(C)の含有量としては、重合体IIに含まれる全繰り返し単位に対して、0.1~20質量%が好ましく、殺菌性化合物と適度な相互作用を示し、殺菌性化合物の吸着を抑制する観点から、0.5~15質量%がより好ましく、1~10質量%が更に好ましく、1~5質量%が特に好ましい。
なお、繰り返し単位(C)の含有量は1H-NMR、13C-NMR、電気伝導度等により測定可能である。
なお、繰り返し単位(C)の含有量は1H-NMR、13C-NMR、電気伝導度等により測定可能である。
〔繰り返し単位(D)〕
本発明の重合体IIは、(メタ)アクリルアミド系モノマーに由来する繰り返し単位(D)を有する。本発明の重合体IIは、繰り返し単位(D)に該当する繰り返し単位を1種又は2種以上有していてよい。また、繰り返し単位(D)は、親水性の(メタ)アクリルアミド系モノマーに由来する繰り返し単位であることが好ましい。
上記のとおり、本明細書において、親水性とは、水との親和力が強い性質を持つことを意味する。具体的には1種の繰り返し単位のみからなるホモポリマー(実施例の測定法による数平均分子量が1万~100万程度のもの)とした際に、常温(25℃)において純水100gに対して1g以上溶解する場合にはその繰り返し単位は親水性である。
繰り返し単位(D)のHLB値としては、基材表面への殺菌性化合物の吸着を抑制するため、10以上が好ましく、15以上がより好ましく、17以上が更に好ましい。繰り返し単位(D)のHLB値が上記の範囲であると、殺菌性化合物の基材への吸着防止効果に優れる。
また、上記のとおり、本明細書において、HLB値は、化合物の有機性の値と無機性の値の比率から算出されるもの(小田式)を意味し、「Formulation Design with Organic Conception Diagram」[1998年、NIHON EMULSION CO.,LTD]に記載の計算方法により算出できる。
本発明の重合体IIは、(メタ)アクリルアミド系モノマーに由来する繰り返し単位(D)を有する。本発明の重合体IIは、繰り返し単位(D)に該当する繰り返し単位を1種又は2種以上有していてよい。また、繰り返し単位(D)は、親水性の(メタ)アクリルアミド系モノマーに由来する繰り返し単位であることが好ましい。
上記のとおり、本明細書において、親水性とは、水との親和力が強い性質を持つことを意味する。具体的には1種の繰り返し単位のみからなるホモポリマー(実施例の測定法による数平均分子量が1万~100万程度のもの)とした際に、常温(25℃)において純水100gに対して1g以上溶解する場合にはその繰り返し単位は親水性である。
繰り返し単位(D)のHLB値としては、基材表面への殺菌性化合物の吸着を抑制するため、10以上が好ましく、15以上がより好ましく、17以上が更に好ましい。繰り返し単位(D)のHLB値が上記の範囲であると、殺菌性化合物の基材への吸着防止効果に優れる。
また、上記のとおり、本明細書において、HLB値は、化合物の有機性の値と無機性の値の比率から算出されるもの(小田式)を意味し、「Formulation Design with Organic Conception Diagram」[1998年、NIHON EMULSION CO.,LTD]に記載の計算方法により算出できる。
本発明において、繰り返し単位(D)としては、式(D1)で表される繰り返し単位(D1)、式(D2)で表される繰り返し単位(D2)、及び式(D3)で表される繰り返し単位(D3)から選ばれる1種以上が好ましい。
〔式(D1)中、
R51は、水素原子又はメチル基を示し、
R52及びR53は、それぞれ独立して、水素原子、炭素数1~3のアルキル基又は炭素数1~3のヒドロキシアルキル基を示す。〕
R51は、水素原子又はメチル基を示し、
R52及びR53は、それぞれ独立して、水素原子、炭素数1~3のアルキル基又は炭素数1~3のヒドロキシアルキル基を示す。〕
式(D1)中、R52及びR53は、それぞれ独立して、水素原子、炭素数1~3のアルキル基又は炭素数1~3のヒドロキシアルキル基を示す。
R52、R53で示されるアルキル基は直鎖状でも分岐鎖状でもよく、アルキル基としては、メチル基、エチル基、n-プロピル基、イソプロピル基が挙げられる。
また、R52、R53で示されるヒドロキシアルキル基の炭素数は、好ましくは1又は2である。ヒドロキシアルキル基に含まれるアルキル基は直鎖状でも分岐鎖状でもよく、ヒドロキシアルキル基としては、ヒドロキシメチル基、ヒドロキシエチル基、ヒドロキシプロピル基、ヒドロキシイソプロピル基が挙げられる。なお、ヒドロキシアルキル基におけるヒドロキシ基の置換位置は任意である。
R52、R53で示されるアルキル基は直鎖状でも分岐鎖状でもよく、アルキル基としては、メチル基、エチル基、n-プロピル基、イソプロピル基が挙げられる。
また、R52、R53で示されるヒドロキシアルキル基の炭素数は、好ましくは1又は2である。ヒドロキシアルキル基に含まれるアルキル基は直鎖状でも分岐鎖状でもよく、ヒドロキシアルキル基としては、ヒドロキシメチル基、ヒドロキシエチル基、ヒドロキシプロピル基、ヒドロキシイソプロピル基が挙げられる。なお、ヒドロキシアルキル基におけるヒドロキシ基の置換位置は任意である。
斯様な繰り返し単位(D1)を誘導するモノマーとしては、ジメチル(メタ)アクリルアミド、ジエチル(メタ)アクリルアミド、N-イソプロピル(メタ)アクリルアミド、N-(ヒドロキシメチル)(メタ)アクリルアミド、N-(2-ヒドロキシエチル)(メタ)アクリルアミド等が挙げられ、繰り返し単位(D1)は、これらを単独で又は2種以上を組み合わせて用いたものでもよい。
〔式(D2)中、
R54は、水素原子又はメチル基を示し、
R55及びR56は、それぞれ独立して、炭素数1~3のアルカンジイル基を示す。〕
R54は、水素原子又はメチル基を示し、
R55及びR56は、それぞれ独立して、炭素数1~3のアルカンジイル基を示す。〕
式(D2)中、R55及びR56は、それぞれ独立して、炭素数1~3のアルカンジイル基を示す。かかるアルカンジイル基の炭素数は、好ましくは1又は2である。また、上記アルカンジイル基は直鎖状でも分岐鎖状でもよいが、直鎖状が好ましい。好適な具体例としては、メタン-1,1-ジイル基、エタン-1,2-ジイル基が挙げられる。
斯様な繰り返し単位(D2)を誘導するモノマーとしては、4-(メタ)アクリロイルモルホリン等が挙げられる。
〔式(D3)中、
R57は、水素原子又はメチル基を示し、
R58は、炭素数1~5のアルカンジイル基を示す。〕
R57は、水素原子又はメチル基を示し、
R58は、炭素数1~5のアルカンジイル基を示す。〕
式(D3)中、R57は、水素原子又はメチル基を示すが、水素原子が好ましい。
式(D3)中、R58は、炭素数1~5のアルカンジイル基を示す。かかるアルカンジイル基の炭素数は、好ましくは3~5である。また、上記アルカンジイル基は直鎖状でも分岐鎖状でもよいが、直鎖状が好ましい。好適な具体例としては、プロパン-1,3-ジイル基、ブタン-1,4-ジイル基、ペンタン-1,5-ジイル基が挙げられる。
式(D3)中、R58は、炭素数1~5のアルカンジイル基を示す。かかるアルカンジイル基の炭素数は、好ましくは3~5である。また、上記アルカンジイル基は直鎖状でも分岐鎖状でもよいが、直鎖状が好ましい。好適な具体例としては、プロパン-1,3-ジイル基、ブタン-1,4-ジイル基、ペンタン-1,5-ジイル基が挙げられる。
斯様な繰り返し単位(D3)を誘導するモノマーとしては、1-ビニル-2-ピロリドン、N-ビニル-ε-カプロラクタム等が挙げられ、繰り返し単位(D3)は、これらを単独で又は2種以上を組み合わせて用いたものでもよい。
これら繰り返し単位(D1)~(D3)の中でも、親水性の観点から、繰り返し単位(D1)と(D2)が好ましく、繰り返し単位(D1)が特に好ましい。
本発明の重合体II中における繰り返し単位(D)の含有量としては、重合体IIに含まれる全繰り返し単位に対して、80~99.9質量%が好ましく、親水性の観点から、85~99.5質量%がより好ましく、90~99質量%が更に好ましく、95~99質量%が更に好ましい。
なお、繰り返し単位(D)の含有量は1H-NMR、13C-NMR等により測定可能である。
なお、繰り返し単位(D)の含有量は1H-NMR、13C-NMR等により測定可能である。
本発明の重合体IIは、ブロック共重合体、グラフト共重合体、ランダム共重合体、交互共重合体のいずれであってもよい。
また、本発明の重合体IIの重量平均分子量(Mw)としては、1万~1000万が好ましく、1万~500万がより好ましく、1万~300万が更に好ましく、1万~200万が更に好ましく、1万~50万が更に好ましく、1万~25万が更に好ましく、1万~15万が特に好ましい。重量平均分子量を斯様な範囲にすることにより、殺菌性化合物との相互作用とハンドリング性がともに向上する。
また、本発明の重合体IIの数平均分子量(Mn)としては、5千~1000万が好ましく、5千~500万がより好ましく、5千~300万が更に好ましく、5千~200万が更に好ましく、5千~50万が更に好ましく、5千~10万が特に好ましい。
また、分子量分布(Mw/Mn)としては、1~10が好ましく、1~7がより好ましく、1~5が特に好ましい。
なお、上記重量平均分子量、数平均分子量及び分子量分布は、後述する実施例に記載の方法に従い測定すればよい。
また、本発明の重合体IIの数平均分子量(Mn)としては、5千~1000万が好ましく、5千~500万がより好ましく、5千~300万が更に好ましく、5千~200万が更に好ましく、5千~50万が更に好ましく、5千~10万が特に好ましい。
また、分子量分布(Mw/Mn)としては、1~10が好ましく、1~7がより好ましく、1~5が特に好ましい。
なお、上記重量平均分子量、数平均分子量及び分子量分布は、後述する実施例に記載の方法に従い測定すればよい。
また、本発明の重合体IIは、水溶性の重合体である。ここで、本明細書において、水に溶解するとは、0.5質量%のポリマー固形分となるように重合体を水(25℃)に添加・混合したときに、目視で透明となることをいう。
また、本発明の重合体IIは、例えば、以下のようにして調製される。即ち、各繰り返し単位を誘導するモノマーからそれぞれ一種以上のものを選択し、混合する。この混合物を、必要に応じて、水、アセトニトリル、エタノール、ブタノール、2-プロパノール、1,4-ジオキサン等の溶媒に溶解する。そして、重合開始剤を加えてラジカル重合することにより、目的とする重合体IIを得ることができる。
また、ラジカル重合を行う際に用いられる重合開始剤としては、通常のラジカル重合開始剤であれば特に限定されるものではないが、例えば、過酸化ベンゾイル、過酸化ラウロイル、ジイソプロピルペルオキシジカーボネート、tert-ブチルペルオキシ-2-エチルヘキサノエート、tert-ブチペルオキシピバレート、tert-ブチルペルオキシジイソブチレート、アゾビスイソブチロニトリル、アゾビスイソジメチルバレロニトリル、2,2'-アゾビス[2-(2-イミダゾリン-2-イル)プロパン]二塩酸塩や、過硫酸塩及び過硫酸塩一亜硫酸水素塩系の重合開始剤等を挙げることができる。
また、重合開始剤の使用量は、モノマー成分100質量部に対して、0.001~10質量部が好ましく、0.01~5質量部がより好ましい。また、重合温度は20~100℃が好ましく、重合時間は0.5~48時間が好ましい。
重合体I及び重合体IIから選ばれる少なくとも1種の重合体の含有量としては、殺菌性組成物全量に対して、0.001~10質量%が好ましく、0.01~5質量%がより好ましく、0.01~3質量%が更に好ましく、0.05~1質量%が特に好ましい。重合体I及び重合体IIから選ばれる少なくとも1種の重合体の含有量が上記の範囲内であると、殺菌作用、静菌作用に優れた組成物となる。
重合体Iの含有量としては、殺菌性組成物全量に対して、0.001~5質量%が好ましく、0.01~3質量%がより好ましく、0.05~1質量%が特に好ましい。
重合体IIの含有量としては、殺菌性組成物全量に対して、0.001~5質量%が好ましく、0.01~3質量%がより好ましく、0.01~1質量%が特に好ましい。
重合体Iと重合体IIを両方使用する場合、重合体Iと重合体IIとの含有量の質量比率としては、10:1~1:10が好ましく、5:1~1:5がより好ましく、3:1~1:3が特に好ましい。
重合体IIの含有量としては、殺菌性組成物全量に対して、0.001~5質量%が好ましく、0.01~3質量%がより好ましく、0.01~1質量%が特に好ましい。
重合体Iと重合体IIを両方使用する場合、重合体Iと重合体IIとの含有量の質量比率としては、10:1~1:10が好ましく、5:1~1:5がより好ましく、3:1~1:3が特に好ましい。
<カチオン性基を有する殺菌性化合物>
本発明の殺菌性組成物は、カチオン性基を有する殺菌性化合物を含有する。カチオン性基としては、-NH-C(=NH)-NH-C(=NH)-NH-で示される基、第4級アンモニウム基などが挙げられる。殺菌性化合物が-NH-C(=NH)-NH-C(=NH)-NH-で示される基を有する場合、この化合物は塩を形成していてもよい。塩としては、塩酸塩、硝酸塩、硫酸塩等の酸付加塩等が挙げられる。また、殺菌性化合物が第4級アンモニウム基を有する場合、この化合物は対イオンを有していてもよい。対イオンとしては、フッ化物イオン、塩化物イオン、臭化物イオン、ヨウ化物イオン等のハロゲンイオン;CH3-C6H4-SO3 -(パラトルエンスルホナートアニオン)、C6H5-SO3 -(ベンゼンスルホナートアニオン)等のスルホナートアニオンの他、ClO4 -、BF4 -、CH3(C=O)O-、PF6 -等のスルホナートアニオン以外の酸の対アニオンが挙げられる。
カチオン性基を有する殺菌性化合物は特に限定されないが、例えば、塩酸ポリヘキサニド(ポリヘキサメチレンビグアニド、PHMB)等のポリヘキサメチレンビグアニド誘導体、塩化ポリドロニウム等の塩化ポリドロニウム誘導体、ポリクオタニウム等のポリクオタニウム誘導体、クロルヘキシジン等のクロルヘキシジン誘導体、塩化ベンザルコニウム等の塩化ベンザルコニウム誘導体、塩化ベンゼトニウム等の塩化ベンゼトニウム誘導体等が挙げられる。これらのうち1種を単独で、又は2種以上を組み合わせて含んでいてよい。
これらの中でも、ポリヘキサメチレンビグアニド誘導体、塩化ポリドロニウム誘導体、ポリクオタニウム誘導体、塩化ベンザルコニウム誘導体が好ましく、充分な殺菌性能を得る観点からは、塩酸ポリヘキサニド、塩化ポリドロニウムが特に好ましい。
本発明の殺菌性組成物は、カチオン性基を有する殺菌性化合物を含有する。カチオン性基としては、-NH-C(=NH)-NH-C(=NH)-NH-で示される基、第4級アンモニウム基などが挙げられる。殺菌性化合物が-NH-C(=NH)-NH-C(=NH)-NH-で示される基を有する場合、この化合物は塩を形成していてもよい。塩としては、塩酸塩、硝酸塩、硫酸塩等の酸付加塩等が挙げられる。また、殺菌性化合物が第4級アンモニウム基を有する場合、この化合物は対イオンを有していてもよい。対イオンとしては、フッ化物イオン、塩化物イオン、臭化物イオン、ヨウ化物イオン等のハロゲンイオン;CH3-C6H4-SO3 -(パラトルエンスルホナートアニオン)、C6H5-SO3 -(ベンゼンスルホナートアニオン)等のスルホナートアニオンの他、ClO4 -、BF4 -、CH3(C=O)O-、PF6 -等のスルホナートアニオン以外の酸の対アニオンが挙げられる。
カチオン性基を有する殺菌性化合物は特に限定されないが、例えば、塩酸ポリヘキサニド(ポリヘキサメチレンビグアニド、PHMB)等のポリヘキサメチレンビグアニド誘導体、塩化ポリドロニウム等の塩化ポリドロニウム誘導体、ポリクオタニウム等のポリクオタニウム誘導体、クロルヘキシジン等のクロルヘキシジン誘導体、塩化ベンザルコニウム等の塩化ベンザルコニウム誘導体、塩化ベンゼトニウム等の塩化ベンゼトニウム誘導体等が挙げられる。これらのうち1種を単独で、又は2種以上を組み合わせて含んでいてよい。
これらの中でも、ポリヘキサメチレンビグアニド誘導体、塩化ポリドロニウム誘導体、ポリクオタニウム誘導体、塩化ベンザルコニウム誘導体が好ましく、充分な殺菌性能を得る観点からは、塩酸ポリヘキサニド、塩化ポリドロニウムが特に好ましい。
本発明におけるカチオン性基を有する殺菌性化合物の含有量は、殺菌性組成物全量に対して、好ましくは0.1ppm以上、より好ましくは0.5ppm以上、更に好ましくは0.75ppm以上、特に好ましくは0.9ppm以上であり、また、好ましくは1500ppm以下、より好ましくは1250ppm以下、更に好ましくは1000ppm以下、更に好ましくは750ppm以下、更に好ましくは500ppm以下、更に好ましくは100ppm以下、特に好ましくは50ppm以下である。カチオン性基を有する殺菌性化合物の含有量が上記の範囲内であると、殺菌性組成物の殺菌作用、静菌作用が向上する。また、殺菌性化合物が吸着しにくくなる。
本発明の殺菌性組成物は、重合体I及び重合体IIから選ばれる少なくとも1種の重合体、殺菌性化合物の他に、上記以外の殺菌性化合物、界面活性剤、等張化剤、キレート化剤、pH調整剤、緩衝剤、増粘剤等の公知の添加剤;溶剤を含有していてもよい。
また、本発明の殺菌性組成物は、上記成分の他に、種々の薬理活性成分や生理活性成分を組み合わせて適当量含有していてもよい。かかる成分は特に限定されず、例えば、一般用医薬品製造(輸入)承認基準2000年版(薬事審査研究会監修)、医薬品添加物事典2007(日本医薬品添加剤協会編集)に記載された各種添加物が例示できる。
また、本発明の殺菌性組成物は、上記成分の他に、種々の薬理活性成分や生理活性成分を組み合わせて適当量含有していてもよい。かかる成分は特に限定されず、例えば、一般用医薬品製造(輸入)承認基準2000年版(薬事審査研究会監修)、医薬品添加物事典2007(日本医薬品添加剤協会編集)に記載された各種添加物が例示できる。
そして、本発明の殺菌性組成物によれば、殺菌性化合物の吸着による殺菌性能の低減が抑制できる。本発明の殺菌性組成物は、細菌の生育を抑制するのに特に有用である。
細菌としては、グラム陽性菌、グラム陰性菌等を挙げることができる。グラム陽性菌としては、例えば、黄色ブドウ球菌(Staphylococcus aureus)等のブドウ球菌、リステリア属細菌、バチルス属細菌、アリサイクロバチルス属細菌を挙げることができる。また、グラム陰性菌としては、例えば、大腸菌(Escherichia coli)等のエシェリキア属細菌、サルモネラ属細菌、ビブリオ属細菌、シュードモナス属細菌を挙げることができる。
細菌としては、グラム陽性菌、グラム陰性菌等を挙げることができる。グラム陽性菌としては、例えば、黄色ブドウ球菌(Staphylococcus aureus)等のブドウ球菌、リステリア属細菌、バチルス属細菌、アリサイクロバチルス属細菌を挙げることができる。また、グラム陰性菌としては、例えば、大腸菌(Escherichia coli)等のエシェリキア属細菌、サルモネラ属細菌、ビブリオ属細菌、シュードモナス属細菌を挙げることができる。
本発明の殺菌性組成物は、重合体I及び重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物を含有するものであり、他の成分と併用されて、溶液、分散液、ゲル、カプセル、ペレット、フィルム、シート、繊維等の形態にある材料であってもよい。
例えば、本発明の殺菌性組成物は、水、有機溶剤等の溶剤;アニオン性、カチオン性、ノニオン性等の界面活性剤;ゼラチン、多糖類、セルロース等の増粘剤;多官能アクリレート、多官能エポキシ化合物等の硬化性モノマー等と併用されることにより、殺菌のためのコーティング材料とすることができる。このようなコーティング材料は、例えば、医療機器、医療器具等医療用品のコーティング材料;トイレ用品、キッチン用品等日用品のコーティング材料;病院、高齢者施設、食品工場等における内装塗料の他、船体やタッチスクリーンパネルのコーティング材料として使用することができる。
また、本発明の殺菌性組成物は、ポリオレフィン、ポリウレタン、ABS、ポリスチレン、ポリカーボネート、ポリエステル、ポリアミド、アクリルポリマー、塩化ビニル、シリコーン、セルロース等の有機高分子材料と併用されることにより、また、これらの有機高分子材料や金属、セラミックス等の無機材料から製造された成形体を殺菌性組成物で表面処理することにより、殺菌性を付与したプラスチック、フィルム、繊維、ゴム、セラミックス、ガラス等の材料とすることができる。このような材料は、例えば、マスク、手術着、手術用覆布、血液バック、創傷被覆材等の医療用品;ベットシーツ、タオル、ゴミ箱、三角コーナー等の日用品;スマートフォン、タブレット端末、カーナビ等のタッチパネル機器に使用することができる。また、壁紙、タイル等の建築資材;食品、医療器具の包装材として使用することができる。
また、本発明の殺菌性組成物は殺菌方法に使用することができる。その方法は、特に限定されるものではないが、例えば、本発明の殺菌性組成物を液状として、対象物の表面に塗布する方法が挙げられ、これによって対象物に殺菌性を付与することができる。この際、本発明の殺菌性組成物には、重合体I及び重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物に加えて、溶剤の他、界面活性剤、増粘剤、硬化性モノマー等を配合することができる。塗布手段としては、スプレーコーティング、コーターコーティング、ディッピング、刷毛塗り、ロールコーティング等の通常の塗布手段を採用することができる。また、対象物としては、例えば、フィルム、樹脂基板、繊維、セラミックス、金属、ガラス、木材等の基材;壁、床、天井等の内装;カテーテル、輸液チューブ、血液バッグ、ドレッシング材等の医療器具が挙げられる。
また、本発明の殺菌性組成物を、スプレー等を用いて対象物に散布することにより、対象物に殺菌性を付与したり、対象物を殺菌したりすることもできる。この際、本発明の殺菌性組成物には、重合体I及び重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物に加えて、溶剤の他、界面活性剤、香料等を配合することができる。
また、本発明の殺菌性組成物を不織布に含浸させて、対象物をふき取ることにより、対象物を殺菌・消毒することもできる。この際、本発明の殺菌性組成物には、重合体I及び重合体IIから選ばれる少なくとも1種の重合体とカチオン性基を有する殺菌性化合物に加えて、溶剤の他、界面活性剤、香料、酵素、緩衝液等を配合することができる。
また、本発明の殺菌性組成物を有機高分子材料と配合することにより、殺菌性を付与したプラスチック、フィルム、繊維、ゴム等の材料とすることができる。
また、本発明の殺菌性組成物を有機高分子材料と配合することにより、殺菌性を付与したプラスチック、フィルム、繊維、ゴム等の材料とすることができる。
以下、実施例を挙げて本発明を詳細に説明するが、本発明はこれら実施例に限定されるものではない。
実施例における各分析条件は以下に示すとおりである。
<分子量測定>
重量平均分子量(Mw)及び数平均分子量(Mn)は、東ソー社製 TSKgel α-Mカラムを用い、流量:0.5ミリリットル/分、溶出溶媒:NMP溶媒(H3PO4:0.016M、LiBr:0.030M)、カラム温度:40℃の分析条件で、ポリスチレンを標準とするゲルパーミエーションクロマトグラフィー(GPC)により測定した。
<分子量測定>
重量平均分子量(Mw)及び数平均分子量(Mn)は、東ソー社製 TSKgel α-Mカラムを用い、流量:0.5ミリリットル/分、溶出溶媒:NMP溶媒(H3PO4:0.016M、LiBr:0.030M)、カラム温度:40℃の分析条件で、ポリスチレンを標準とするゲルパーミエーションクロマトグラフィー(GPC)により測定した。
<NMRスペクトル>
1H-NMRスペクトルは、溶媒としてd6-DMSO、内部標準物質として和光純薬社製DSS-d6を用いて、BRUKER製モデルAVANCE500(500MHz)により測定した。
1H-NMRスペクトルは、溶媒としてd6-DMSO、内部標準物質として和光純薬社製DSS-d6を用いて、BRUKER製モデルAVANCE500(500MHz)により測定した。
<電気伝導度測定>
カルボキシ基の含有量を、電気伝導度測定法(Metrohm社、794 Basic Titrino)を用いて測定した。
カルボキシ基の含有量を、電気伝導度測定法(Metrohm社、794 Basic Titrino)を用いて測定した。
<合成例1~11及び比較合成例1~3で使用した材料>
親水性モノマー:N,N-ジメチルアクリルアミド(以下、DMAAとする:KJケミカル社製)、N-(2-ヒドロキシ)エチルアクリルアミド(以下、HEAAとする:KJケミカル社製)、N-ビニル-2-ピロリドン(以下、NVPとする:和光純薬社製)、2-メタクリロイルオキシエチル-2'-(トリメチルアンモニオ)エチルホスフェート(以下、MPCとする:日油社製)、メトキシポリエチレングリコール(9)モノメタクリレート(以下、MPEGMとする:新中村化学工業社製)、N-メタクリロイルオキシエチル-N,N-ジメチルアンモニウム-α-N-メチルカルボキシベタイン(以下、GLBTとする:大阪有機化学工業社製)
疎水性モノマー:N-ドデシルアクリルアミド(以下、DDAAとする:東京化成工業社製)、N-(ブトキシメチル)アクリルアミド(以下、NBMAとする:MRCユニテック社製)、メタクリル酸3-[トリス(トリメチルシロキシ)シリル]プロピル(以下、TRISとする:チッソ社製)、ラウロキシポリエチレングリコール(30)モノメタクリレート(以下、LPEGMとする:日油社製)、2-エチルヘキシルアクリレート(以下、EHAとする:和光純薬社製)
重合開始剤:2,2'-アゾビス(イソブチロニトリル)(以下、AIBNとする:和光純薬社製)、2,2'-アゾビス[2-(2-イミダゾリン-2-イル)プロパン]二塩酸塩(以下、VA-044とする和光純薬社製)
溶媒:アセトニトリル(以下、ACNとする:和光純薬社製)、エタノール(以下EtOHとする:和光純薬社製)、tert-ブチルアルコール(以下、tBuOHとする:和光純薬社製)、水、1,4-ジオキサン(以下、DOXとする:和光純薬社製)
分子量調整剤:1-チオグリセロール(以下、TGとする:旭化学社製)
RAFT剤:2-[ドデシルチオ(チオカルボニル)チオ]-2-メチルプロピオン酸(以下、DTMPAとする:シグマ-アルドリッチ社製)
親水性モノマー:N,N-ジメチルアクリルアミド(以下、DMAAとする:KJケミカル社製)、N-(2-ヒドロキシ)エチルアクリルアミド(以下、HEAAとする:KJケミカル社製)、N-ビニル-2-ピロリドン(以下、NVPとする:和光純薬社製)、2-メタクリロイルオキシエチル-2'-(トリメチルアンモニオ)エチルホスフェート(以下、MPCとする:日油社製)、メトキシポリエチレングリコール(9)モノメタクリレート(以下、MPEGMとする:新中村化学工業社製)、N-メタクリロイルオキシエチル-N,N-ジメチルアンモニウム-α-N-メチルカルボキシベタイン(以下、GLBTとする:大阪有機化学工業社製)
疎水性モノマー:N-ドデシルアクリルアミド(以下、DDAAとする:東京化成工業社製)、N-(ブトキシメチル)アクリルアミド(以下、NBMAとする:MRCユニテック社製)、メタクリル酸3-[トリス(トリメチルシロキシ)シリル]プロピル(以下、TRISとする:チッソ社製)、ラウロキシポリエチレングリコール(30)モノメタクリレート(以下、LPEGMとする:日油社製)、2-エチルヘキシルアクリレート(以下、EHAとする:和光純薬社製)
重合開始剤:2,2'-アゾビス(イソブチロニトリル)(以下、AIBNとする:和光純薬社製)、2,2'-アゾビス[2-(2-イミダゾリン-2-イル)プロパン]二塩酸塩(以下、VA-044とする和光純薬社製)
溶媒:アセトニトリル(以下、ACNとする:和光純薬社製)、エタノール(以下EtOHとする:和光純薬社製)、tert-ブチルアルコール(以下、tBuOHとする:和光純薬社製)、水、1,4-ジオキサン(以下、DOXとする:和光純薬社製)
分子量調整剤:1-チオグリセロール(以下、TGとする:旭化学社製)
RAFT剤:2-[ドデシルチオ(チオカルボニル)チオ]-2-メチルプロピオン酸(以下、DTMPAとする:シグマ-アルドリッチ社製)
(合成例1 共重合体(I-1)の合成)
親水性モノマーとしてDMAA14.25gと、疎水性モノマーとしてDDAA0.75gと、重合開始剤としてAIBN0.3gと、溶媒としてACN61.2gとを混合しフラスコに入れた。これに窒素を吹き込み、70℃まで昇温し、8時間重合させ、その後室温に冷却した。得られた溶液を純水で透析することで、共重合体(I-1)の0.5質量%水溶液を得た。
得られた共重合体(I-1)において、DMAA由来の繰り返し単位の含有量は95.0質量%であり、DDAA由来の繰り返し単位の含有量は5.0質量%であった。なお、これら含有量は1H-NMRにより測定した。得られた共重合体(I-1)の重量平均分子量は156,000であり、数平均分子量は37,000であり、分子量分布は4.2であった。
親水性モノマーとしてDMAA14.25gと、疎水性モノマーとしてDDAA0.75gと、重合開始剤としてAIBN0.3gと、溶媒としてACN61.2gとを混合しフラスコに入れた。これに窒素を吹き込み、70℃まで昇温し、8時間重合させ、その後室温に冷却した。得られた溶液を純水で透析することで、共重合体(I-1)の0.5質量%水溶液を得た。
得られた共重合体(I-1)において、DMAA由来の繰り返し単位の含有量は95.0質量%であり、DDAA由来の繰り返し単位の含有量は5.0質量%であった。なお、これら含有量は1H-NMRにより測定した。得られた共重合体(I-1)の重量平均分子量は156,000であり、数平均分子量は37,000であり、分子量分布は4.2であった。
(合成例2~10 共重合体(I-2)~(I-10)の合成)
表1に示す重合条件にて、合成例1と同様にして共重合体(I-2)~(I-10)を合成し、共重合体(I-2)~(I-10)の0.5質量%水溶液を得た。
表1に示す重合条件にて、合成例1と同様にして共重合体(I-2)~(I-10)を合成し、共重合体(I-2)~(I-10)の0.5質量%水溶液を得た。
(合成例11 共重合体(I-11)の合成)
疎水性モノマーとしてEHA0.04g、RAFT剤としてDTMPA0.0326g、重合開始剤としてAIBN0.0007g、溶媒としてDOX10mLを窒素バブリングした後、70℃で13時間撹拌した。次いで、親水性モノマーとしてDMAA7.60g、溶媒としてDOX10mLを添加し、さらに70℃で24時間撹拌した。反応終了後、反応液をジエチルエーテルに投入し、ジエチルエーテルで3回洗浄した後、真空乾燥させ、A-B型ブロック共重合体(I-11)を合成した。その後、水に溶解させ、共重合体(I-11)の0.5質量%水溶液を得た。
疎水性モノマーとしてEHA0.04g、RAFT剤としてDTMPA0.0326g、重合開始剤としてAIBN0.0007g、溶媒としてDOX10mLを窒素バブリングした後、70℃で13時間撹拌した。次いで、親水性モノマーとしてDMAA7.60g、溶媒としてDOX10mLを添加し、さらに70℃で24時間撹拌した。反応終了後、反応液をジエチルエーテルに投入し、ジエチルエーテルで3回洗浄した後、真空乾燥させ、A-B型ブロック共重合体(I-11)を合成した。その後、水に溶解させ、共重合体(I-11)の0.5質量%水溶液を得た。
(比較合成例1~3 重合体(N-1)~(N-3)の合成)
表2に示す重合条件にて、合成例1と同様にして重合体(N-1)~(N-2)を合成し、重合体(N-1)~(N-2)の0.5質量%水溶液を得た。
また、表2に示す重合条件にて、合成例1と同様にして重合体(N-3)を合成した。重合体(N-3)を、濃度が0.5質量%となるように水に加えたところ、重合体(N-3)は白濁して水溶液を調製することができなかった。
表2に示す重合条件にて、合成例1と同様にして重合体(N-1)~(N-2)を合成し、重合体(N-1)~(N-2)の0.5質量%水溶液を得た。
また、表2に示す重合条件にて、合成例1と同様にして重合体(N-3)を合成した。重合体(N-3)を、濃度が0.5質量%となるように水に加えたところ、重合体(N-3)は白濁して水溶液を調製することができなかった。
合成例1~11及び比較合成例1~3で得た各重合体の物性等を以下の表3及び4に示す。合成例1~11で得た共重合体(I-1)~(I-11)は、本発明の重合体Iに該当する。
(合成例12 共重合体(II-1)の合成)
(メタ)アクリルアミド系モノマーとしてN-(2-ヒドロキシ)エチルアクリルアミド(HEAA(KJケミカルズ社製)、以下、HEAAと称する)14.7gと、酸性基含有モノマーとして80%アクリル酸((東亞合成社製)、以下、AAと称する)0.375gと、重合開始剤として2,2'-アゾビス[2-(2-イミダゾリン-2-イル)プロパン]二塩酸塩0.6gと、溶媒として純水141gとを混合しフラスコに入れた。これに窒素を吹き込み、62℃まで昇温し、6時間重合させ、その後室温に冷却した。得られた溶液を水酸化ナトリウムでpH7に中和した後、純水で透析することで、共重合体(II-1)の0.5質量%水溶液を得た。
得られた共重合体(II-1)において、HEAA由来の繰り返し単位の含有量は98質量%であり、AA由来の繰り返し単位の含有量は2質量%であった。なお、これら含有量は1H-NMR及び電気伝導度測定により算出した。得られた共重合体(II-1)の重量平均分子量は64,000であり、数平均分子量は34,000であり、分子量分布は1.9であった。
(メタ)アクリルアミド系モノマーとしてN-(2-ヒドロキシ)エチルアクリルアミド(HEAA(KJケミカルズ社製)、以下、HEAAと称する)14.7gと、酸性基含有モノマーとして80%アクリル酸((東亞合成社製)、以下、AAと称する)0.375gと、重合開始剤として2,2'-アゾビス[2-(2-イミダゾリン-2-イル)プロパン]二塩酸塩0.6gと、溶媒として純水141gとを混合しフラスコに入れた。これに窒素を吹き込み、62℃まで昇温し、6時間重合させ、その後室温に冷却した。得られた溶液を水酸化ナトリウムでpH7に中和した後、純水で透析することで、共重合体(II-1)の0.5質量%水溶液を得た。
得られた共重合体(II-1)において、HEAA由来の繰り返し単位の含有量は98質量%であり、AA由来の繰り返し単位の含有量は2質量%であった。なお、これら含有量は1H-NMR及び電気伝導度測定により算出した。得られた共重合体(II-1)の重量平均分子量は64,000であり、数平均分子量は34,000であり、分子量分布は1.9であった。
(合成例13~15 共重合体(II-2)~(II-4)の合成)
モノマー組成を表5に示すものに変更した以外は合成例12と同様にして共重合体(II-2)~(II-4)を合成し、共重合体(II-2)~(II-4)の0.5質量%水溶液を得た。
モノマー組成を表5に示すものに変更した以外は合成例12と同様にして共重合体(II-2)~(II-4)を合成し、共重合体(II-2)~(II-4)の0.5質量%水溶液を得た。
(比較合成例4~5 重合体(N-4)~(N-5)の合成)
モノマー組成を表5に示すものに変更した以外は合成例12と同様にして重合体(N-4)~(N-5)を合成し、重合体(N-4)~(N-5)の0.5質量%水溶液を得た。
モノマー組成を表5に示すものに変更した以外は合成例12と同様にして重合体(N-4)~(N-5)を合成し、重合体(N-4)~(N-5)の0.5質量%水溶液を得た。
合成例12~15及び比較合成例4~5で得た各重合体の物性等を以下の表6に示す。合成例12~15で得た共重合体(II-1)~(II-4)は、本発明の重合体IIに該当する。
(実施例1)
合成例1で得た共重合体(I-1)0.5質量部と、ポリヘキサメチレンビグアニド(以下、PHMB)0.0001質量部と、生理食塩水99.5質量部とを混合して、得られた組成物を、ポリプロピレン容器、ガラス容器にそれぞれ室温(25℃)で24時間保存した。これを実施例1の組成物とする。
合成例1で得た共重合体(I-1)0.5質量部と、ポリヘキサメチレンビグアニド(以下、PHMB)0.0001質量部と、生理食塩水99.5質量部とを混合して、得られた組成物を、ポリプロピレン容器、ガラス容器にそれぞれ室温(25℃)で24時間保存した。これを実施例1の組成物とする。
(実施例2~11、比較例1~2)
実施例1において、共重合体(I-1)を、共重合体(I-2)~(I-11)、重合体(N-1)~(N-2)に変更した以外は、実施例1と同様にして組成物を得た。
実施例1において、共重合体(I-1)を、共重合体(I-2)~(I-11)、重合体(N-1)~(N-2)に変更した以外は、実施例1と同様にして組成物を得た。
(比較例3)
実施例1において、PHMBの使用量を0.00001質量部に変更した以外は、実施例1と同様にして組成物を得た。
実施例1において、PHMBの使用量を0.00001質量部に変更した以外は、実施例1と同様にして組成物を得た。
(比較例4)
実施例1において、PHMBの使用量を0.15質量部に、生理食塩水の使用量を99.35質量部に、それぞれ変更した以外は、実施例1と同様にして組成物を得た。
実施例1において、PHMBの使用量を0.15質量部に、生理食塩水の使用量を99.35質量部に、それぞれ変更した以外は、実施例1と同様にして組成物を得た。
(実施例12)
合成例12で得た共重合体(II-1)0.5質量部と、PHMB0.0001質量部と、生理食塩水99.5質量部とを混合して、得られた組成物を、ポリプロピレン容器、ガラス容器にそれぞれ室温(25℃)で24時間保存した。これを実施例12の組成物とする。
合成例12で得た共重合体(II-1)0.5質量部と、PHMB0.0001質量部と、生理食塩水99.5質量部とを混合して、得られた組成物を、ポリプロピレン容器、ガラス容器にそれぞれ室温(25℃)で24時間保存した。これを実施例12の組成物とする。
(実施例13~15、比較例5~6)
実施例12において、共重合体(II-1)を、共重合体(II-2)~(II-4)、重合体(N-4)~(N-5)に変更した以外は、実施例12と同様にして組成物を得た。
実施例12において、共重合体(II-1)を、共重合体(II-2)~(II-4)、重合体(N-4)~(N-5)に変更した以外は、実施例12と同様にして組成物を得た。
(実施例16)
実施例12において、共重合体(I-1)0.5質量部を更に加え、生理食塩水の使用量を99質量部に変更した以外は、実施例12と同様にして組成物を得た。
実施例12において、共重合体(I-1)0.5質量部を更に加え、生理食塩水の使用量を99質量部に変更した以外は、実施例12と同様にして組成物を得た。
(比較例7)
実施例12において、PHMBの使用量を0.00001質量部に変更した以外は、実施例12と同様にして組成物を得た。
実施例12において、PHMBの使用量を0.00001質量部に変更した以外は、実施例12と同様にして組成物を得た。
(比較例8)
実施例12において、PHMBの使用量を0.15質量部に、生理食塩水の使用量を99.35質量部に、それぞれ変更した以外は、実施例12と同様にして組成物を得た。
実施例12において、PHMBの使用量を0.15質量部に、生理食塩水の使用量を99.35質量部に、それぞれ変更した以外は、実施例12と同様にして組成物を得た。
(試験例1 殺菌性能確認試験-微量液体希釈法による評価-)
<液体培地の調製>
三角フラスコにBD社製Difco Mueller-Hinton Bros培地を16.8g測りとり、滅菌水800mLに溶解させた。三角フラスコの口部分にアルミホイルで2重に蓋をし、インジケーターシールをはって、オートクレーブで120℃、15分処理することで、液体培地を調製した。
<菌液の調製>
上記「液体培地の調製」で得られた液体培地10mLにE. coli DH5α株(グラム陰性菌)を懸濁させOD600を1.0に調整した。OD600が1.0のとき、菌量は約1.8×108cfu/mLである。上記液体培地を更に8mLを加え、菌量1.0×108cfu/mLの菌液を調製した。
<濁度評価>
実施例1の組成物100μLをウェルプレートに添加し、さらに上記「菌液の調製」で得られた菌液を5μL添加した。37℃で16時間インキュベートした後、ウェルの濁度を目視で観察し、以下の基準で菌の生育状態を評価した。また、実施例1の組成物を、実施例2~16、比較例1~8の組成物に変更した場合についても、上記と同様にして、菌の生育状態を評価した。
これら評価結果を表7~9に示す。
<評価基準>
-:透明であり濁りが観察されなかった(菌の生育が抑制された)
+:濁りが観察された(菌が増殖した)
<液体培地の調製>
三角フラスコにBD社製Difco Mueller-Hinton Bros培地を16.8g測りとり、滅菌水800mLに溶解させた。三角フラスコの口部分にアルミホイルで2重に蓋をし、インジケーターシールをはって、オートクレーブで120℃、15分処理することで、液体培地を調製した。
<菌液の調製>
上記「液体培地の調製」で得られた液体培地10mLにE. coli DH5α株(グラム陰性菌)を懸濁させOD600を1.0に調整した。OD600が1.0のとき、菌量は約1.8×108cfu/mLである。上記液体培地を更に8mLを加え、菌量1.0×108cfu/mLの菌液を調製した。
<濁度評価>
実施例1の組成物100μLをウェルプレートに添加し、さらに上記「菌液の調製」で得られた菌液を5μL添加した。37℃で16時間インキュベートした後、ウェルの濁度を目視で観察し、以下の基準で菌の生育状態を評価した。また、実施例1の組成物を、実施例2~16、比較例1~8の組成物に変更した場合についても、上記と同様にして、菌の生育状態を評価した。
これら評価結果を表7~9に示す。
<評価基準>
-:透明であり濁りが観察されなかった(菌の生育が抑制された)
+:濁りが観察された(菌が増殖した)
(試験例2 PHMBの吸着抑制試験)
50mLの遠沈管に実施例1~16、比較例1~8の組成物をそれぞれ2mLずつ測りとり、これに1枚のガラス片と、1枚のポリプロピレン片を浸漬し、35℃の恒温槽で24時間静置した。その後、ガラス片とポリプロピレン片を取り出し、この組成物2mLにフルオレスカミンのアセトン溶液0.003w/v%を0.2ml添加し、30秒間混和後、日本分光社製分光蛍光光度計FP-6200を用いて、蛍光測定(励起波長:390nm、波長領域:220~730nm、測定モード:Emission)を行ない、最大の蛍光強度を示す波長における蛍光強度からPHMBの吸着の有無を観察した。評価結果を表7~9に示す。
50mLの遠沈管に実施例1~16、比較例1~8の組成物をそれぞれ2mLずつ測りとり、これに1枚のガラス片と、1枚のポリプロピレン片を浸漬し、35℃の恒温槽で24時間静置した。その後、ガラス片とポリプロピレン片を取り出し、この組成物2mLにフルオレスカミンのアセトン溶液0.003w/v%を0.2ml添加し、30秒間混和後、日本分光社製分光蛍光光度計FP-6200を用いて、蛍光測定(励起波長:390nm、波長領域:220~730nm、測定モード:Emission)を行ない、最大の蛍光強度を示す波長における蛍光強度からPHMBの吸着の有無を観察した。評価結果を表7~9に示す。
実施例1~11の組成物は、ポリプロピレン容器で保存した後でも菌の生育を抑制できた。また、ポリプロピレン基材へのPHMBの吸着はみられなかった。
実施例12~16の組成物は、ポリプロピレン容器、ガラス容器で保存した後でも菌の生育を抑制できた。また、ポリプロピレン基材、ガラス基材へのPHMBの吸着はみられなかった。
実施例12~16の組成物は、ポリプロピレン容器、ガラス容器で保存した後でも菌の生育を抑制できた。また、ポリプロピレン基材、ガラス基材へのPHMBの吸着はみられなかった。
Claims (13)
- 親水性繰り返し単位(A)とHLB値が1~15である疎水性繰り返し単位(B)とを有する水溶性の重合体I、及び酸性基を有する繰り返し単位(C)と(メタ)アクリルアミド系モノマーに由来する繰り返し単位(D)とを有する水溶性の重合体IIから選ばれる少なくとも1種の重合体と、
カチオン性基を有する殺菌性化合物とを含むことを特徴とする、
殺菌性組成物。 - 前記疎水性繰り返し単位(B)が、式(B1)、(B2)又は(B3)で表される繰り返し単位である、請求項1又は2に記載の組成物。
R5は、水素原子又はメチル基を示し、
R6は、-O-、*-(C=O)-O-、*-(C=O)-NR8-、又は*-NR8-(C=O)-(R8は、水素原子又は炭素数1~10の有機基を示し、*は、式(B1)中のR5が結合している炭素原子と結合する位置を示す)を示し、
R7は、炭素数4~30の有機基を示す。〕
R9は、水素原子又はメチル基を示し、
R10は、-O-、*-(C=O)-O-、*-(C=O)-NR17-、*-NR17-(C=O)-(R17は、水素原子又は炭素数1~10の有機基を示し、*は、式(B2)中のR9が結合している炭素原子と結合する位置を示す)又はフェニレン基を示し、
R11は、炭素数1~10の2価の有機基を示し、
R12及びR13は、それぞれ独立して、炭素数1~10の有機基を示し、
R14、R15及びR16は、それぞれ独立して、-OSi(R18)3(R18は、それぞれ独立して、水素原子又は炭素数1~8の有機基を示す)又は炭素数1~10の有機基を示し、
nは0~200の整数を示す。〕
R59は、水素原子又はメチル基を示し、
R60は、-O-、*-(C=O)-O-、*-(C=O)-NR63-、*-NR63-(C=O)-(R63は、水素原子又は炭素数1~10の有機基を示し、*は、式(B3)中のR59が結合している炭素原子と結合する位置を示す)又はフェニレン基を示し、
R61は、炭素数2~4のアルカンジイル基を示し、
R62は、炭素数5~30のアルキル基、炭素数5~30のアルカノイル基又は炭素数6~30のアリール基を示し、
mは2~100の整数を示す。〕 - 前記親水性繰り返し単位(A)が、式(A1)で表される繰り返し単位(A1)、式(A2)で表される繰り返し単位(A2)、式(A3)で表される繰り返し単位(A3)、式(A4)で表される繰り返し単位(A4)、式(A5)で表される繰り返し単位(A5)及び式(A6)で表される繰り返し単位(A6)から選ばれる1種以上である、請求項1~3のいずれか1項に記載の組成物。
Raは、水素原子又はメチル基を示し、
Rbは、-O-、*-(C=O)-O-、*-(C=O)-NRe-、又は*-NRe-(C=O)-(Reは、水素原子又は炭素数1~10の有機基を示し、*は、式(A1)中のRaが結合している炭素原子と結合する位置を示す)を示し、
Rcは、ポリオキシアルキレン基を示し、
Rdは、水素原子又は炭素数1~4のアルキル基を示す。〕
R19は、水素原子又はメチル基を示し、
R20は、炭素数2~4のアルカンジイル基を示し、
R21は、炭素数1~10のアルカンジイル基を示し、
R22、R23及びR24は、それぞれ独立して、水素原子又は炭素数1~8のアルキル基を示し、
qは、1~10の整数を示す。〕
Yは、-(C=O)O-、-(O=S=O)O-、-O(O=S=O)O-、-(S=O)O-、-O(S=O)O-、-O(P=O)(OR30)O-、-O(P=O)(R30)O-、-(P=O)(OR30)O-又は-(P=O)(R30)O-を示し(R30は炭素数1~3のアルキル基を示す)、
R25は、水素原子又はメチル基を示し、
R26及びR27は、それぞれ独立して、炭素数1~10の2価の有機基を示し、
R28及びR29は、それぞれ独立して、炭素数1~10のアルキル基を示す。〕
R31は、水素原子又はメチル基を示し、
R32及びR33は、それぞれ独立して、水素原子、炭素数1~6のアルキル基又は炭素数1~6のヒドロキシアルキル基を示す。〕
R34は、水素原子又はメチル基を示し、
R35及びR36は、それぞれ独立して、炭素数1~2のアルカンジイル基を示す。〕
R37は、水素原子又はメチル基を示し、
R38は、炭素数1~3のアルカンジイル基を示す。〕 - 前記疎水性繰り返し単位(B)が、(メタ)アクリルアミド系モノマー由来の繰り返し単位である、請求項1~4いずれか1項に記載の組成物。
- 前記重合体Iが、繰り返し単位(A)を65~99質量%、繰り返し単位(B)を0.1~35質量%含む、請求項1~5のいずれか1項に記載の組成物。
- 前記繰り返し単位(C)の酸性基が、カルボキシ基、スルホ基、リン酸基又はこれらの塩である、請求項1~6のいずれか1項に記載の組成物。
- 前記繰り返し単位(D)が、式(D1)で表される繰り返し単位(D1)、式(D2)で表される繰り返し単位(D2)、及び式(D3)で表される繰り返し単位(D3)から選ばれる1種以上である、請求項1~7のいずれか1項に記載の組成物。
R51は、水素原子又はメチル基を示し、
R52及びR53は、それぞれ独立して、水素原子、炭素数1~3のアルキル基又は炭素数1~3のヒドロキシアルキル基を示す。〕
R54は、水素原子又はメチル基を示し、
R55及びR56は、それぞれ独立して、炭素数1~3のアルカンジイル基を示す。〕
R57は、水素原子又はメチル基を示し、
R58は、炭素数1~5のアルカンジイル基を示す。〕 - 前記重合体IIが、繰り返し単位(C)を0.1~20質量%、繰り返し単位(D)を80~99.9質量%含む、請求項1~8のいずれか1項に記載の組成物。
- 前記重合体IIが、繰り返し単位(C)を0.1~15質量%、繰り返し単位(D)を85~99.9質量%含む、請求項1~8のいずれか1項に記載の組成物。
- 前記カチオン性基を有する殺菌性化合物の含有量が、0.5~1000ppmである、請求項10に記載の組成物。
- 前記カチオン性基を有する殺菌性化合物が、ポリヘキサメチレンビグアニド誘導体、塩化ポリドロニウム誘導体、ポリクオタニウム誘導体、及び塩化ベンザルコニウム誘導体から選ばれる1種以上である、請求項1~11のいずれか1項に記載の組成物。
- 前記重合体I及び重合体IIから選ばれる少なくとも1種の重合体の含有量が、0.001~10質量%である、請求項1~12のいずれか1項に記載の組成物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014-192139 | 2014-09-22 | ||
| JP2014192139A JP2017206441A (ja) | 2014-09-22 | 2014-09-22 | 殺菌性組成物 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2016047605A1 true WO2016047605A1 (ja) | 2016-03-31 |
Family
ID=55581132
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2015/076720 WO2016047605A1 (ja) | 2014-09-22 | 2015-09-18 | 殺菌性組成物 |
Country Status (2)
| Country | Link |
|---|---|
| JP (1) | JP2017206441A (ja) |
| WO (1) | WO2016047605A1 (ja) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017043500A1 (ja) * | 2015-09-07 | 2017-03-16 | Jsr株式会社 | 組成物、コンタクトレンズコーティング剤、コンタクトレンズの製造方法及びコンタクトレンズ |
| JP2017214346A (ja) * | 2015-09-30 | 2017-12-07 | 株式会社日本触媒 | 抗菌剤 |
| JP6264624B1 (ja) * | 2016-08-24 | 2018-01-24 | 株式会社ファインテック | 抗菌・防カビ・消臭剤、それを用いた気化式加湿器、ならびに抗菌・防カビ・消臭方法 |
| WO2018074334A1 (ja) * | 2016-10-17 | 2018-04-26 | 株式会社日本触媒 | 洗浄剤用共重合体 |
| US10907000B2 (en) * | 2015-05-21 | 2021-02-02 | Isp Investments Llc | Functionally versatile amphiphilic copolymers |
| CN114369201A (zh) * | 2022-01-30 | 2022-04-19 | 成都太合生物材料有限公司 | 一种双亲有机硅共聚物及其制备方法和应用 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107913303A (zh) * | 2017-12-01 | 2018-04-17 | 河北科技大学 | 一种复合聚六亚甲基双胍泡腾片及制备方法和应用 |
| EP3778673B1 (en) * | 2018-03-30 | 2022-11-02 | Kose Corporation | Phosphorylcholine group and silicone group-containing copolymer, powder coated with said copolymer and production method therefor, and use of said copolymer and said powder in cosmetics |
| US20240117094A1 (en) * | 2020-12-01 | 2024-04-11 | Nof Corporation | Modifier for ophthalmological device |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS61152605A (ja) * | 1984-12-26 | 1986-07-11 | Teikoku Chem Ind Corp Ltd | 安定な抗菌加工用液の製造方法 |
| JP2006528232A (ja) * | 2003-05-15 | 2006-12-14 | アーチ ユーケイ バイオサイドズ リミテッド | 酸コポリマー及び抗微生物剤を含む組成物、並びにその使用 |
| JP2007500737A (ja) * | 2003-05-15 | 2007-01-18 | アーチ ユーケイ バイオサイドズ リミテッド | 組成物及びその使用(1) |
| JP2012510534A (ja) * | 2008-12-02 | 2012-05-10 | ビーエーエスエフ ソシエタス・ヨーロピア | ランダムラジカルコポリマー、およびそれから得ることができる活性物質組成物の製造方法 |
| JP2014514354A (ja) * | 2011-05-13 | 2014-06-19 | ビーエーエスエフ ソシエタス・ヨーロピア | 農薬製剤用の分散剤としてのアクリレート−アクリルアミド−ampsターポリマー |
-
2014
- 2014-09-22 JP JP2014192139A patent/JP2017206441A/ja active Pending
-
2015
- 2015-09-18 WO PCT/JP2015/076720 patent/WO2016047605A1/ja active Application Filing
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS61152605A (ja) * | 1984-12-26 | 1986-07-11 | Teikoku Chem Ind Corp Ltd | 安定な抗菌加工用液の製造方法 |
| JP2006528232A (ja) * | 2003-05-15 | 2006-12-14 | アーチ ユーケイ バイオサイドズ リミテッド | 酸コポリマー及び抗微生物剤を含む組成物、並びにその使用 |
| JP2007500737A (ja) * | 2003-05-15 | 2007-01-18 | アーチ ユーケイ バイオサイドズ リミテッド | 組成物及びその使用(1) |
| JP2012510534A (ja) * | 2008-12-02 | 2012-05-10 | ビーエーエスエフ ソシエタス・ヨーロピア | ランダムラジカルコポリマー、およびそれから得ることができる活性物質組成物の製造方法 |
| JP2014514354A (ja) * | 2011-05-13 | 2014-06-19 | ビーエーエスエフ ソシエタス・ヨーロピア | 農薬製剤用の分散剤としてのアクリレート−アクリルアミド−ampsターポリマー |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10907000B2 (en) * | 2015-05-21 | 2021-02-02 | Isp Investments Llc | Functionally versatile amphiphilic copolymers |
| WO2017043500A1 (ja) * | 2015-09-07 | 2017-03-16 | Jsr株式会社 | 組成物、コンタクトレンズコーティング剤、コンタクトレンズの製造方法及びコンタクトレンズ |
| JP2017214346A (ja) * | 2015-09-30 | 2017-12-07 | 株式会社日本触媒 | 抗菌剤 |
| JP6264624B1 (ja) * | 2016-08-24 | 2018-01-24 | 株式会社ファインテック | 抗菌・防カビ・消臭剤、それを用いた気化式加湿器、ならびに抗菌・防カビ・消臭方法 |
| JP2018030805A (ja) * | 2016-08-24 | 2018-03-01 | 株式会社ファインテック | 抗菌・防カビ・消臭剤、それを用いた気化式加湿器、ならびに抗菌・防カビ・消臭方法 |
| WO2018074334A1 (ja) * | 2016-10-17 | 2018-04-26 | 株式会社日本触媒 | 洗浄剤用共重合体 |
| JPWO2018074334A1 (ja) * | 2016-10-17 | 2019-07-04 | 株式会社日本触媒 | 洗浄剤用共重合体 |
| CN114369201A (zh) * | 2022-01-30 | 2022-04-19 | 成都太合生物材料有限公司 | 一种双亲有机硅共聚物及其制备方法和应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2017206441A (ja) | 2017-11-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2016047605A1 (ja) | 殺菌性組成物 | |
| JP6329229B2 (ja) | 抗菌剤 | |
| US20090324536A1 (en) | Antimicrobial polymers and coatings | |
| WO2017043500A1 (ja) | 組成物、コンタクトレンズコーティング剤、コンタクトレンズの製造方法及びコンタクトレンズ | |
| KR20100014559A (ko) | 생체활성 성분을 위한 담체인 양이온성 라텍스 및 그의 제조 방법 및 사용 방법 | |
| US20070224161A1 (en) | Compositions and methods for making and using acyclic N-halamine-based biocidal polymeric materials and articles | |
| KR20140116133A (ko) | 아크릴계 폴리머를 제조하는 방법 및 이에 의해 생산된 제품 | |
| JP3332920B2 (ja) | 抗菌剤 | |
| JP2021528537A (ja) | 高性能、低コストかつ適用が容易な抗菌コーティングのためのn−ハラミン−ドーパミン共重合体のシステムおよび方法 | |
| JP5342126B2 (ja) | 漂白剤組成物 | |
| BRPI0416513B1 (pt) | Copolímero compreendendo óxido de polialquileno e nitrogênio quaternizado, e, uso do mesmo | |
| JP7341126B2 (ja) | 抗微生物性樹脂および塗材 | |
| US10131731B2 (en) | Antimicrobial surface coatings | |
| WO2016013370A1 (ja) | 抗菌剤、殺菌剤、抗菌材料、殺菌材料、抗菌方法及び殺菌方法 | |
| JP2003509546A (ja) | アクリロイルアミノアルキル化合物のコポリマー | |
| JPWO2018003821A1 (ja) | 共重合体およびその用途 | |
| JPH05269181A (ja) | 抗菌性樹脂成形体及びその製造方法 | |
| JP4689433B2 (ja) | 繊維製品への花粉付着抑制方法 | |
| JP2020152700A (ja) | 抗菌剤 | |
| JP4261636B2 (ja) | 吸水剤および衛生材料 | |
| JP3644813B2 (ja) | アクリルエマルジョンの製造方法 | |
| US20040092421A1 (en) | Microbicidal fluid systems using antimicrobial polymers | |
| US20240067843A1 (en) | Biocidal polymer for long-term surface protection | |
| JP6871266B2 (ja) | 洗浄剤用共重合体 | |
| EP0916682A1 (en) | Water-soluble antibacterial polymer and liquid formulation comprising it for contact lenses |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 15845211 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 15845211 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: JP |