WO2012165399A1 - イミダゾピリジン化合物 - Google Patents
イミダゾピリジン化合物 Download PDFInfo
- Publication number
- WO2012165399A1 WO2012165399A1 PCT/JP2012/063695 JP2012063695W WO2012165399A1 WO 2012165399 A1 WO2012165399 A1 WO 2012165399A1 JP 2012063695 W JP2012063695 W JP 2012063695W WO 2012165399 A1 WO2012165399 A1 WO 2012165399A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- compound
- group
- methylimidazo
- pyridine
- salt
- Prior art date
Links
- 0 CC1(*)C=C(*)c2nc(*)c(*)[n]2C=C1 Chemical compound CC1(*)C=C(*)c2nc(*)c(*)[n]2C=C1 0.000 description 4
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D453/00—Heterocyclic compounds containing quinuclidine or iso-quinuclidine ring systems, e.g. quinine alkaloids
- C07D453/02—Heterocyclic compounds containing quinuclidine or iso-quinuclidine ring systems, e.g. quinine alkaloids containing not further condensed quinuclidine ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
Definitions
- the present invention relates to a pharmaceutical composition such as imidazopyridine having an action of activating soluble guanylate cyclase (sGC) and useful as an active ingredient in pharmaceutical compositions for treating or preventing various cardiovascular diseases based on the improvement of cGMP signal. Relates to compounds.
- sGC soluble guanylate cyclase
- cGMP cyclic guanosine monophosphate
- GTP guanosine triphosphate
- particulate guanylate cyclase stimulated by peptidic messengers eg, atrial natriuretic peptide or brain natriuretic peptide
- sGC soluble guanylate cyclase
- NO nitric oxide
- sGC soluble guanylate cyclase
- NO nitric oxide
- the enzyme is composed of two subunits and has been reported to contain one heme per heterodimer, which plays a central role in the activation mechanism.
- NO is thought to change the enzyme into an active conformation by binding to the iron atom of heme.
- heme-free enzyme preparations cannot be stimulated by NO.
- CO Carbon monoxide
- sGC consists of ⁇ and ⁇ subunits.
- Several subunit subtypes have been reported that differ from each other in terms of sequence, tissue-specific distribution, and expression at different growth stages. The distribution of each subunit has been studied in mammals including humans, but the ⁇ 1 and ⁇ 1 subunits are expressed in most organs, and these ⁇ 1 ⁇ 1 forms are functionally dimorphic dimers. It is a widely accepted pattern.
- ⁇ 2 subunits have been confirmed, and it has been reported that they are expressed more than ⁇ 1 in the brain, lung, large intestine, heart, spleen, uterus, and placenta.
- Subunits called ⁇ 3 and ⁇ 3 have been isolated from human brain but are homologous to ⁇ 1 and ⁇ 1. More recent work has shown ⁇ 2i subunits containing insertions in the catalytic domain. All subunits show high homology in the catalytic domain region. In pathological conditions, it has been reported that suppression of the generation of sGC activators such as NO or promotion of degradation is caused due to the increase in generation of free radicals.
- the NO / sGC / cGMP signal decreases, leading to, for example, increased blood pressure, platelet activation, or increased cell proliferation and cell adhesion.
- various cardiovascular diseases namely hypertension (including pulmonary hypertension), atherosclerosis, lumbar spinal canal stenosis, peripheral arterial disease, intermittent claudication, severe leg ischemia, stable or unstable Angina pectoris, heart failure, thrombosis, stroke, sexual dysfunction may occur. Therefore, a novel drug based on the selective activation of this enzyme may be able to normalize cGMP production, and it becomes possible to treat or prevent such diseases.
- sGC activator examples include a “heme-dependent stimulator” that activates sGC depending on a heme group such as an NO donor described later, and a “heme-independent activator” that does not depend on a heme group. It is known (Non-Patent Document 2).
- NO donors such as organic nitrates
- heme-dependent stimulators that produce NO by being metabolized in the body and activate sGC when the NO binds to the central iron atom of heme.
- NO donors have serious drawbacks such as resistance and reduced effects, and new sGC activators that do not have these disadvantages are desired.
- Patent Document 1 As compounds having an sGC activation action, for example, compounds of the following formulas (a) to (c) have been reported (Patent Document 1).
- the compound of formula (a) is a pyrazolo [3,4] fused bicyclic compound, and the compounds of formula (b) and (c) are imidazo [1,5] fused bicyclic compounds.
- Q means a substituted heterocycle.
- This document does not disclose or suggest a compound having an imidazo [1,2-a] pyridine skeleton.
- pyrazole derivatives and pyrazolo [3,4-b] pyridine derivatives are disclosed in International Publications WO2000 / 06569, WO2000 / 21954, WO2001 / 83490, WO2003 / 004503, WO2003 / 095451, WO2003 / 086407, WO2003 / 097063, WO2007 / 124854, WO2007 / 128454, WO2008 / 031513, WO2008 / 061657, WO2010 / 078900 and WO2010 / 079120.
- none of these documents disclose or suggest a compound having an imidazo [1,2-a] pyridine skeleton.
- Patent Document 2 a compound of the following formula (d) has been reported as an sGC activator (Patent Document 2). Wherein Z is O, S or N (R 7 ), R 7 is H or alkyl, R 6 is aryl, arylalkenyl, heterocycle,-(alkenyl)-(heterocycle), or hetero Cycloalkyl.
- this document does not disclose or suggest a compound having an imidazo [1,2-a] pyridine skeleton.
- Non-Patent Document 1 1H-pyrazole-5-carboxylic acid derivatives (Patent Document 3), biaryl derivatives (Patent Document 4), and benzylindazole derivatives (Non-Patent Document 1) have been reported as sGC activators.
- Non-patent Document 3 a compound represented by the following formula (e) useful for the treatment of gastrointestinal ulcer has been reported as an H + / K + -ATPase enzyme inhibitor.
- R represents a substituted alkoxy group
- R ′ represents H or phenethyl
- R 2 represents H or lower alkyl
- R 3 represents a substituted alkyl, etc.
- the document does not disclose or suggest an sGC activator, and the compound of the formula (I) of the present invention described later has the structure of the compound of the formula (e) in that it has an aminocarbonyl group at the 3-position. Make it different.
- a compound of the following formula (f) useful for the treatment of allergy, inflammation, pain and the like has been reported (Patent Document 5).
- R 1 to R 3 are each hydrogen or lower alkyl
- R 4 is an aryl group optionally having a substituent
- Q is O or NH
- X 1 is N or CR 5
- Y 1 and Y 2 each represent a single bond or a lower alkylene group
- ring A represents various 6-membered nitrogen-containing heterocycles.
- This document does not disclose or suggest an sGC activator, and the compound of formula (I) of the present invention described below differs from the compound of formula (f) in that it has an aminocarbonyl group at the 3-position.
- Patent Document 8 a compound of the following formula (i) useful as a therapeutic agent for bacterial infections, particularly tuberculosis has been reported (Patent Document 8).
- X, Y and Z are CH and the like, n is 0 and the like, m is 1 and the like, R 1 is -C (O) N (R 4 ) 2 and the like, R 2 is C 1-10 alkyl and the like, R 3 is —OR 6 and the like, and R 6 is optionally substituted C 1-10 alkyl and the like.
- an imidazopyridine compound useful as an active ingredient of a pharmaceutical composition for example, a pharmaceutical composition for treating or preventing various cardiovascular diseases, which has sGC activation action and is based on the improvement of cGMP signal.
- imidazo [1,2-a] pyridine has a carbamoyl group at the 3-position and a substituent bonded via an oxygen atom at the 8-position.
- the compound of formula (I) and its salts which are compounds, have sGC activation action, and various cardiovascular diseases involving sGC, particularly peripheral arterial disease, intermittent claudication, severe lower limb ischemia and hypertension (lung) It was found useful as an active ingredient of a pharmaceutical composition for treatment or prevention of hypertension (including hypertension), and the present invention was completed.
- the present invention relates to a compound of formula (I) or a salt thereof, and a pharmaceutical composition containing the compound of formula (I) or a salt thereof and a pharmaceutically acceptable excipient.
- the symbols in the formula have the following meanings.
- a 1 R 0 , —R 00- (aryl), halogeno lower alkyl, optionally substituted cycloalkyl, optionally substituted heterocycloalkyl, optionally substituted aryl, or optionally substituted Good heteroaryl, R 0 : the same or different from each other, lower alkyl, R 00 : the same or different from each other, lower alkylene, R 1 : H, R 0 , halogen, —CN, —CO 2 H, —CO 2 R 0 , or —R 00 —OH, R 2 : H, R 0 , C 3-6 cycloalkyl or halogeno lower alkyl, R 3 : H, R 0 , -R 00 -CO 2 H or -R 00 -CO 2 R 0 , R 4 : united with -YA 2 or A 3 , or N atom to which R 3 and R 4 are bonded, and from the group consisting of -OH,
- the present invention also relates to a pharmaceutical composition for treating cardiovascular diseases involving sGC containing a compound of formula (I) or a salt thereof.
- the pharmaceutical composition includes a therapeutic agent for cardiovascular disease involving sGC containing a compound of formula (I) or a salt thereof.
- the present invention also relates to the use of a compound of formula (I) or a salt thereof for the manufacture of a pharmaceutical composition for the treatment or prevention of cardiovascular disease involving sGC, for the treatment or prevention of cardiovascular disease involving sGC.
- the present invention relates to a method for treating or preventing a cardiovascular disease involving sGC comprising administering to a subject.
- the “subject” is a human or other animal that requires treatment or prevention, and as a certain aspect, a human that requires treatment or prevention.
- the compound of formula (I) has a sGC activating action, and sGC-related cardiovascular diseases such as hypertension, atherosclerosis, lumbar spinal canal stenosis, peripheral arterial disease, intermittent claudication, severe lower limbs It can be used as an active ingredient of a pharmaceutical composition for treatment or prevention of ischemia, stable or unstable angina, heart failure, thrombosis, stroke, sexual dysfunction, pulmonary hypertension and the like.
- sGC-related cardiovascular disease is known to involve the NO / sGC / cGMP system, and is a cardiovascular disease that can be treated or prevented by sGC activation, such as hypertension ( Including pulmonary hypertension), atherosclerosis, lumbar spinal canal stenosis, peripheral arterial disease, intermittent claudication, severe leg ischemia, stable or unstable angina, heart failure, thrombosis, stroke, sexual dysfunction Etc.
- hypertension Including pulmonary hypertension
- atherosclerosis Including pulmonary hypertension
- lumbar spinal canal stenosis a cardiovascular disease that can be treated or prevented by sGC activation, such as hypertension ( Including pulmonary hypertension), atherosclerosis, lumbar spinal canal stenosis, peripheral arterial disease, intermittent claudication, severe leg ischemia, stable or unstable angina, heart failure, thrombosis, stroke, sexual dysfunction Etc.
- cardiac disease involving sGC is intermittent claudication and severe leg ischemia associated with peripheral arterial disease
- another aspect is intermittent claudication associated with peripheral arterial disease.
- there is severe limb ischemia associated with peripheral artery disease.
- examples of the peripheral arterial disease include obstructive thrombotic vasculitis, peripheral arterial occlusion, Raynaud's disease or Raynaud's syndrome.
- Peripheral arterial disease is caused by arteriosclerosis, thrombus formation, etc., resulting in stenosis / occlusion of the arteries, leading to ischemia in the periphery, especially the lower limbs, cold sensation, intermittent claudication, pain, severe limb ischemia It is a disease that presents symptoms such as necrosis.
- ischemia in the periphery
- the following documents can be referred to. Eur. J. Vasc. Endovasc. Surg, 2007, 33 (1), S1
- One aspect of “intermittent claudication” is intermittent claudication associated with peripheral artery disease, and another aspect is intermittent claudication associated with peripheral arterial occlusion.
- severe limb ischemia is severe limb ischemia associated with peripheral artery disease
- another embodiment is severe limb ischemia associated with peripheral artery occlusion.
- Another embodiment of “cardiovascular disease involving sGC” is hypertension or pulmonary hypertension.
- hypertension essential hypertension, abnormal blood pressure diurnal variation, renal parenchymal hypertension, renovascular hypertension, primary aldosteronism, Cushing syndrome, brown lipoma, or endocrine disease Associated with hypertension.
- pulmonary hypertension As an aspect of the above “pulmonary hypertension”, pulmonary arterial hypertension, pulmonary hypertension associated with heart disease, pulmonary hypertension associated with pulmonary disease such as chronic obstructive pulmonary disease or interstitial lung disease, chronic thrombotic or Pulmonary hypertension associated with obstructive disease.
- “Lower alkyl” is a monovalent group obtained by removing one hydrogen atom from a straight-chain or branched saturated hydrocarbon having 1 to 6 carbon atoms (hereinafter abbreviated as C 1-6 ). Specifically, methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl, n-pentyl, n-hexyl and the like. Another embodiment is C 1-4 alkyl, and yet another embodiment is methyl, ethyl, n-propyl or isopropyl.
- C 1-10 alkylene is a divalent group obtained by removing any two hydrogen atoms from a linear or branched saturated hydrocarbon having 1 to 10 carbon atoms, such as methylene, ethylene, trimethylene Tetramethylene, pentamethylene, hexamethylene, propylene, methylmethylene, ethylethylene, 1,2-dimethylethylene, 1,1,2,2-tetramethylethylene, and the like. Yet another embodiment is methylene or ethylene, and yet another embodiment is methylene. “Lower alkylene” means “C 1-6 alkylene” among the above “C 1-10 alkylene”, and in one embodiment, methylene, ethylene, trimethylene, etc., and in another embodiment, methylene or ethylene It is.
- C 2-10 alkenylene is a divalent group obtained by removing any two hydrogen atoms from a straight or branched hydrocarbon having 2 to 10 carbon atoms and having a double bond.
- One embodiment is ethylidene, propenylene, or butenylene, another embodiment is ethylidene, and yet another embodiment is trans-1,2-ethylidene.
- Cycloalkyl is a C 3-10 saturated hydrocarbon ring group, may have a bridge, may form a spiro ring with another cycloalkyl, and is partially unsaturated bond And may be condensed with a ring selected from a benzene ring, a furan ring, a thiophene ring and a pyrrole ring.
- cycloalkyl examples include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl, cyclooctyl, adamantyl, indanyl, tetrahydronaphthyl, indanyl, indenyl, cyclohexenyl, spiro [3.5] nonyl, dihydrocyclopentathienyl, dihydro
- cyclopentafuranyl, dihydrocyclopentapyrrolyl, etc. in one embodiment, monocyclic C 3-8 cycloalkyl, in another embodiment, cyclohexyl, and in another embodiment, Indanyl.
- cyclohexyl examples include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl, cyclooctyl, adamantyl, ind
- Halogen is F, Cl, Br, or I, and in some embodiments F or Cl.
- the “aryl” is a C 6-14 monocyclic to tricyclic aromatic hydrocarbon ring group, and in one embodiment, phenyl or naphthyl, and in another embodiment, phenyl.
- Heteroaryl is a monocyclic to tricyclic 5- to 14-membered aromatic ring group having 1 to 6 heteroatoms selected from N, O and S as ring members Means.
- One embodiment of “heteroaryl” is monocyclic heteroaryl, such as pyridyl, pyrimidinyl, triazinyl, furyl, thienyl, pyrrolyl, imidazolyl, pyrazolyl, tetrazolyl, oxazolyl, thiazolyl, isoxazolyl and the like.
- Another embodiment is bicyclic heteroaryl, such as indolyl, quinolyl, quinoxalinyl, and the like.
- Yet another embodiment is pyridyl, thienyl or indolyl.
- “Nitrogen-containing saturated heterocycle” is a 5- to 8-membered saturated atom having one nitrogen atom as a ring-constituting atom and may further contain 1 to 2 heteroatoms composed of N, O and S It is a heterocycle and may be condensed with a benzene ring.
- the nitrogen-containing saturated heterocyclic group include azetidinyl, pyrrolidinyl, piperidyl, piperazinyl, azepanyl, diazepanyl, azocanyl, morpholinyl, thiomorpholinyl, tetrahydropyridinyl, or those obtained by condensing a benzene ring to these ring groups. .
- pyrrolidinyl, piperidyl, piperazinyl or indolin-1-yl is used, and in another embodiment, pyrrolidinyl or indolin-1-yl is used.
- the “monocyclic nitrogen-containing heteroaryl” means a monocyclic one containing a nitrogen atom as a ring-constituting atom among the above “heteroaryl”.
- One embodiment is pyridyl, pyrimidinyl, thiazolyl, pyrazolyl, or oxadiazolyl, and another embodiment is pyridyl.
- Heterocycloalkyl means a monocyclic to tricyclic, saturated or partially unsaturated 3 to 6 ring having 1 to 6 heteroatoms selected from N, O and S as atoms constituting the ring. It is a 14-membered heterocyclic group and may be bridged or condensed.
- ⁇ heterocycloalkyl '' include azetidinyl, pyrrolidinyl, imidazolidinyl, piperidyl, pyrazolyl, piperazinyl, morpholinyl, thiomorpholyl, oxazolidinyl, tetrahydrofuranyl, tetrahydropyranyl, 1,3-dioxanyl, 1,4-dioxanyl, indolinyl, Dihydrobenzofuranyl or quinuclidinyl, and in another embodiment pyrrolidinyl, piperidyl or indolinyl.
- “It may be substituted” means unsubstituted or having 1 to 5 substituents. Some embodiments are unsubstituted, 1, 2 or 3 substituted, another embodiment is unsubstituted, 1 or 2 substituted, and yet another embodiment is unsubstituted or monosubstituted, and yet another embodiment. As 2 substitution, as another aspect, it is 1 substitution, and as another aspect, it is unsubstituted. When it has a plurality of substituents, these substituents may be the same or different from each other.
- substitution of the "cycloalkyl which may be substituted", “heterocycloalkyl optionally substituted", “aryl which may be substituted” or “heteroaryl which may be substituted” Certain embodiments of the group include groups selected from the group consisting of halogen, —CN, lower alkyl, and halogeno lower alkyl.
- cycloalkyl one or more heterocycloalkyl optionally substituted with F, optionally substituted with one or more F with aryl which may be substituted or one or more F Good heteroaryl.
- Still another embodiment of A 1 is unsubstituted cycloalkyl, unsubstituted heterocycloalkyl, unsubstituted aryl, or unsubstituted heteroaryl.
- the group include -OH, oxo, -OR 0 , -OR 00 -CO 2 R 0 , -OR 00 -CO 2 H, -CO-R 0 , -NH 2 , -NHR 0 , -N ( R 0 ) 2 , -NH-R 00 -OH, -CO 2 H, -CO 2 R 0 , -SO 2 -R 0 , -R 00 -CO 2 H, -R 00 -CO 2 R 0 , halogen, And groups selected from the group consisting of phenyl, morpholyl, (piperidyl optionally substituted with carboxy or alkoxycarbonyl), R 0 and halogeno lower alkyl.
- R 0 as an embodiment of the substituent in the “optionally substituted aryl” and the “optionally substituted heteroaryl”, R 0 , —OH, halogen, oxo, —CO 2 H and — A group selected from the group consisting of OR 0 ; Another embodiment of the substituent is methyl, F, Cl and methoxy. Further, some embodiments of the G 2 group are unsubstituted aryl and unsubstituted heteroaryl.
- a 1 is of cyclohexyl, 2-fluorophenyl, 2,3-difluorophenyl, 2,6-difluorophenyl or 2,3,6-trifluorophenyl.
- Compound or salt thereof (2) A compound of formula (I) or a salt thereof, wherein R 1 is H. (3) A compound of formula (I) or a salt thereof, wherein R 2 is methyl. (4) A compound of formula (I) or a salt thereof, wherein R 3 is H. (5) The compound of formula (I) or a salt thereof, wherein R 4 is -YA 2 . In another embodiment, the compound of formula (I) or a salt thereof, wherein R 4 is A 3 .
- R 4 is —YA 2 and A 2 is H, —OH or —CONH 2 , or —OH, oxo, —OR 0 , —OR 00 —CO 2 R 0 , —OR 00 — CO 2 H, -CO-R 0 , -NH 2 , -NHR 0 , -N (R 0 ) 2 , -NH-R 00 -OH, -CO 2 H, -CO 2 R 0 , -SO 2 -R From the group consisting of 0 , -R 00 -CO 2 H, -R 00 -CO 2 R 0 , halogen, phenyl, morpholyl (piperidyl optionally substituted with carboxy or alkoxycarbonyl), R 0 and halogeno lower alkyl Phenyl, pyridyl, pyrimidinyl, triazinyl, pyrrolyl, pyrazolyl,
- R 4 is —YA 2
- a 2 is substituted with one or more groups selected from the group consisting of H, pyridyl, or R 0 , halogen, and —CO 2 H.
- a compound of formula (I) or a salt thereof which is a good phenyl.
- R 4 is a -YA 2
- Y may be substituted with one or more groups selected from G 2 group, selected from C 1-10 alkylene, G 2 group C 2-10 alkenylene which may be substituted with the above group or —SO 2 — (lower alkylene which may be substituted with one or more groups selected from Group G 2 ) — Or a salt thereof.
- R 4 is a -YA 2
- Y is selected from one or more of which may be substituted with a group C 1-10 alkylene or G 2 groups selected from G 2 group 1 A compound of formula (I) or a salt thereof, which is C 2-10 alkenylene optionally substituted with the above groups.
- G 2 group phenyl, pyridyl, thienyl, cyclopentyl, cyclohexyl, which may be substituted with one or more groups selected from the group consisting of halogen, —OR 0 and R 0 , -CO 2 H, -CO 2 R 0 , -OH and -OR 0
- another embodiment of the G 2 group is pyridyl, phenyl and cyclohexyl, and still another embodiment is -CO 2 H, —CO 2 R 0 , —OH and —OR 0
- —CO 2 H, —CO 2 R 0 and —OH —CO 2 R 0 and —OH.
- R 4 is a A 3
- a 3 is one or more of which may be substituted with a group pyrrolidyl selected from Group G 1, one or more selected from Group G 1 it is also good piperazyl optionally substituted by one or more groups selected from are unprotected piperidyl or group G 1 also substituted with a group, compound of the formula (I).
- R 4 is a A 3, A 3 is C 3-8 cycloalkyl or Group G 1 of one or more optionally substituted with a group monocyclic selected from Group G 1 A compound of formula (I) or a salt thereof, which is indanyl optionally substituted with one or more groups selected from:
- R 4 is a A 3, 1 or more groups A 3 is selected from one or more of which may be piperidyl or Group G 1 substituted with a group selected from Group G 1 A compound of formula (I) or a salt thereof, which is pyrrolidyl optionally substituted by
- G 1 group examples include R 0 , -R 00 -OH, halogen, oxo, -OH, -OR 0 , -CO-R 0 , -CO-R 00 -OH, -CO 2 H, -CO 2 R 0, -CO-NH 2 , -CO 2 -R 00 - ( phenyl), - SO 2 -R 0, -SO 2 -NH 2, -SO 2 -NHR 0, -SO 2 -R 00 -CO 2 H, -SO 2 -R 00 -CO 2 R 0, -SO 2 - ( phenyl), - R 00 -CO 2 H , -R 00 -CO 2 R 0, -R 00 -CO 2 R 0, -R 00 -CO 2 R 0, -R 00 -CO 2 R 0, -R 00 -CO 2 R 0, -R 00 -CO 2 R 0, -R 00 - ( phenyl),
- R 4 is A 3
- a 3 is heterocycloalkyl
- G 1 group is R 0 , —R 00 —OH, halogen, oxo, —OH, —OR 0 , —CO—R 0, -CO-R 00 -OH, -CO 2 H, -CO 2 R 0, -CO-NH 2, -CO 2 -R 00 - ( phenyl), - SO 2 -R 0, -SO 2 -NH 2 , -SO 2 -NHR 0 , -SO 2 -R 00 -CO 2 H, -SO 2 -R 00 -CO 2 R 0 , -SO 2- (phenyl), -R 00 -CO 2 H, -R 00 -CO 2 R 0 , -R 00- (phenyl), cyclo
- R 4 is A 3 , A 3 is cycloalkyl, G 1 group is R 0 , halogen, —OH, —CO 2 H, —CO 2 R 0 , —CO 2 —R 00
- (5-7) A compound of the formula (I) or a salt thereof, wherein R 4 is A 3 , A 3 is cycloalkyl, and group G 1 is halogen and R 0 .
- R 4 is —YA 2
- Y is C 1-10 alkylene, C 2-10 alkenylene or —SO 2 —R 00 —
- G 2 group is —CO 2 H, —CO 2 R 0 , —OH and —OR 0 and A 2 is H, —OH or —CONH 2 , or —OH, oxo, —OR 0 , —OR 00 —CO 2 R 0 , —OR 00 —CO 2 H , -CO-R 0 , -NH 2 , -CO 2 H, -CO 2 R 0 , -SO 2 -R 0 , -R 00 -CO 2 H, halogen, phenyl, morpholyl, 4-carboxypiperidyl, 4- Phenyl, pyridyl, pyrimidinyl, triazinyl, pyrrolyl each optionally substituted with one or more groups selected from the group consisting of
- R 4 is A 3
- a 3 is selected from C 3-8 cycloalkyl or Group G 1 of one or more optionally substituted with a group monocyclic selected from Group G 1
- R 4 is A 3 and A 3 is a monocyclic C 3-8 cycloalkyl or indanyl each optionally substituted with one or more groups selected from Group G 1 A compound of formula (I) or a salt thereof, wherein G 1 is —CO 2 H, —OH, halogen and R 0 .
- R 4 is A 3
- a 3 is 1 or more may indanyl be each substituted with a group selected from Group G 1
- Group G 1 is halogen, -CO A compound of the formula (I) or a salt thereof, which is 2 H, —CO 2 R 0 , —R 00 —OH and —OH.
- R 4 is A 3
- a 3 is one or more good tetrahydronaphthyl substituted with a group selected from Group G 1, Group G 1 is -CO 2 H and A compound of formula (I) or a salt thereof which is —CO 2 R 0 .
- R 4 is A 3
- a 3 is one or more good dihydrobenzofuranyl optionally substituted with a group selected from Group G 1, Group G 1 is -CO 2
- R 4 is -YA 2
- Y is one or more selected from one or more good C 1-10 alkylene or G 2 group optionally substituted with a group selected from G 2 group C 2-10 alkenylene optionally substituted with a group
- G 2 group is —CO 2 H, —CO 2 R 0 and —OH
- a 2 is H, or R 0 , halogen and —CO 2
- R 4 is A 3 , A 3 is a group represented by the following formula (A) or (B), R 6 is H, halogen or lower alkyl, R 7 is -CO 2 H, -CO 2 R 0 , -CN, -NO 2 , -SO 3 H or -SO 3 R 0 , X is NH, A compound of formula (I) or a salt thereof, wherein NR 0 , O, S or —HC ⁇ CH— and n is 1 or 2.
- (5-14-1) The compound of the above (5-14) or a salt thereof, wherein R 4 is A 3 and A 3 is a group represented by the formula (A).
- R 4 is A 3 , A 3 is a group represented by formula (A) or formula (B), X is —HC ⁇ CH—, and n is 1.
- R 4 is A 3 , A 3 is a group represented by formula (A) or formula (B), X is —HC ⁇ CH—, and n is 2.
- R 4 is A 3 , A 3 is a group represented by formula (A) or (B), X is —HC ⁇ CH—, R 6 is H, F or methyl, and in another embodiment, F or methyl, in another embodiment, H, in another embodiment, F, and in another embodiment, methyl, 5-14) or a salt thereof.
- R 4 is A 3 , A 3 is a group represented by formula (A) or formula (B), X is —HC ⁇ CH—, and R 7 is —CO 2.
- (5-14-10) The compound of the above (5-14) or a salt thereof, wherein X is S or —HC ⁇ CH—.
- R 4 is -YA 2 , -YA 2 is a group represented by the following formula (C) or (D), A compound of formula (I) or a salt thereof, wherein R 8 is H or lower alkyl, and ring Z is unsubstituted pyridyl.
- R 4 is A 3
- a 3 is 1 or more may 1,3 dioxane substituted with a group selected from Group G 1, Group G 1 is substituted with R 0
- R 4 is -YA 2
- -YA 2 is a group represented by the following formula (E)
- R 4 is A 3
- a 3 is a group represented by the following formula (F)
- R 4 is -YA 2
- -YA 2 is a group represented by the following formula (G), A compound of formula (I) or a salt thereof, wherein R 12 is lower alkyl, cycloalkyl or phenyl.
- Examples of the compound that is a combination of two or more of the groups described in (1) to (6) above include the following compounds or salts thereof.
- (8) A compound of formula (I) or a salt thereof, wherein R 3 is H and R 5 is each H.
- (10) The compound of (9) or a salt thereof, wherein A 1 is cyclohexyl or phenyl optionally substituted with one or more Fs.
- (11a) A compound selected from the group consisting of the following (11-1), (11-2) and (11-3) or a salt thereof.
- R 4 is A 3
- a 3 is selected from one or more of which may be pyrrolidyl or Group G 1 substituted with a group selected from Group G 1
- (11-2) R 4 is A 3
- a 3 is an optionally indanyl optionally substituted by one or more groups selected from Group G 1, Group G 1 is halogen, -CO 2 H and -
- R 4 is -YA 2
- Y is one or more C 1-10 alkylene which may be substituted with a group selected from G 2 group, G 2 group -CO 2 H And -OH
- a 2 is H, or phenyl optionally substituted with -CO 2 H, or a salt thereof (10).
- (11b) A compound selected from the group consisting of the above (11-1), the following (11-4) and (11-5) or a salt thereof.
- R 4 is A 3, A 3 is 1 or more may indanyl optionally substituted with a group selected from Group G 1, halogen Group G 1, R 0, -CO 2 The compound of the above (10) or a salt thereof which is H and —OH.
- R 4 is -YA 2
- Y is one or more C 1-10 alkylene which may be substituted with a group selected from G 2 group, G 2 group -CO 2 H And -OH, wherein A 2 is H, or phenyl optionally substituted with one or more groups selected from the group consisting of R 0 , halogen and -CO 2 H, or Its salt.
- R 0 halogen and -CO 2 H
- Its salt is H.
- R 4 is A 3
- a 3 is cyclopentyl or piperidyl each optionally substituted with one or more groups selected from G 1 , and G 1 group is —OH, phenyl and —
- R 4 is A 3
- a 3 is indanyl each optionally substituted with one or more groups selected from G 1
- G 1 is —CO 2 H and —OH.
- a 1 is cyclohexyl, or phenyl optionally substituted with one or more F
- R 1 is H
- R 2 is R 0
- R 3 is H
- R 5 is H
- R 4 is -YA 2 or A 3
- Y is C 1-10 alkylene optionally substituted with one or more groups selected from Group G 2
- G 2 group is -CO 2 H and -OH
- a 2 is phenyl optionally substituted with H, cycloalkyl, pyridyl, or a group selected from lower alkyl and —CO 2 H
- a 3 may be substituted with one or more groups selected from Group G 1, cyclopentyl, indanyl, dihydro cyclopentanol Tachi enyl, dihydrocyclopenta furanyl and cycloalkyl selected from dihydrocyclopenta pyrrolyl, Or piperidyl or pyrrolidyl optionally substituted with one or more groups selected from group G
- a 1 is cyclohexyl, 2-fluorophenyl, 2,3-difluorophenyl, 2,6-difluorophenyl or 2,3,6-trifluorophenyl
- R 4 is represented by the following formula (A ), (B), (C), (D), (E), (F) or a group represented by (G),
- R 6 is H, halogen or R 0 and R 7 is —CO 2 H, —CO 2 R 0 , —CN, —NO 2 , —SO 3 H or —SO 3 R 0
- X is NH, NR 0 , O, S or —HC ⁇ CH—
- n is 1 or 2
- R 8 is H or lower alkyl
- Z is pyridyl
- R 9 is phenyl or lower
- R 10 is H or —OH
- R 11 is H or —OH
- a 1 is cyclohexyl, 2-fluorophenyl, 2,3-difluorophenyl, 2,6-difluorophenyl or 2,3,6-trifluorophenyl, R 1 is H, R 1 is R 0 , R 3 is H, R 4 is -YA 2 , and Y is C 1-10 alkylene optionally substituted with one or more groups selected from Group G 2 A compound of formula (I) or a salt thereof, wherein G 2 is —CO 2 H and —OH, and A 2 is H or phenyl optionally substituted with —CO 2 H.
- (12-2-1) The compound according to the above (12-1) or a salt thereof, wherein R 2 is methyl and R 4 is a group represented by the formula (C) or (D).
- (12-2-2) The compound or a salt thereof according to (12-1) above, wherein R 2 is methyl and R 4 is a group represented by the formula (E).
- a 1 is cyclohexyl, 2-fluorophenyl, 2,3-difluorophenyl, 2,6-difluorophenyl or 2,3,6-trifluorophenyl, R 1 is H, R 2 is R 0 , R 3 is H, R 4 is A 3 , A 3 is indanyl optionally substituted with one or more groups selected from Group G 1 , and G 1 A compound of formula (I) or a salt thereof, wherein the group is halogen, —CO 2 H and —OH.
- a 1 is cyclohexyl, 2-fluorophenyl, 2,3-difluorophenyl, 2,6-difluorophenyl or 2,3,6-trifluorophenyl, R 1 is H, R 2 is R 0 , R 3 is H, R 4 is A 3 , A 3 is cyclopentyl or piperidyl, and G 1 group is —OH, phenyl and —SO 2 —NH 2 .
- a 1 is cyclohexyl, 2-fluorophenyl, 2,3-difluorophenyl, 2,6-difluorophenyl or 2,3,6-trifluorophenyl, R 1 is H, R 2 is R 0 , R 3 is H, R 4 is A 3 , R 5 is H, and A 3 is substituted with one or more groups selected from Group G 1 A compound of formula (I) or a salt thereof which is a good indanyl and the G 1 group is —CO 2 H and —OH.
- (14) The compound or salt thereof according to (13) above, wherein R 6 is F.
- a 1 is cycloalkyl, R 1 is H, R 2 is methyl, R 3 is H, X is —HC ⁇ CH—, n is 1, R 5 Wherein each is H, R 6 is F or methyl, and R 7 is —CO 2 H, or a salt thereof.
- R 6 is F.
- a 1 is cyclohexyl or 2,6-difluorophenyl, R 2 is methyl, R 4 is A 3 , and A 3 is represented by formula (A) or formula (B).
- X is —HC ⁇ CH—, n is 1, R 5 is each H, R 6 is H, and R 7 is —CO 2 H above (12 -1) or a salt thereof.
- a 1 is 2,3,6-trifluorophenyl, R 1 is H, R 2 is methyl, R 3 is H, R 4 is A 3 and A 3 is A group represented by formula (A) or formula (B),
- a 1 is cycloalkyl, R 1 is H, R 2 is methyl, R 3 is H, R 4 is A 3 and A 3 is represented by formula (A) or ( B), X is —HC ⁇ CH—, n is 1, R 5 is each H, R 6 is H, and R 7 is —CO 2 H. , A compound of formula (I) or a salt thereof.
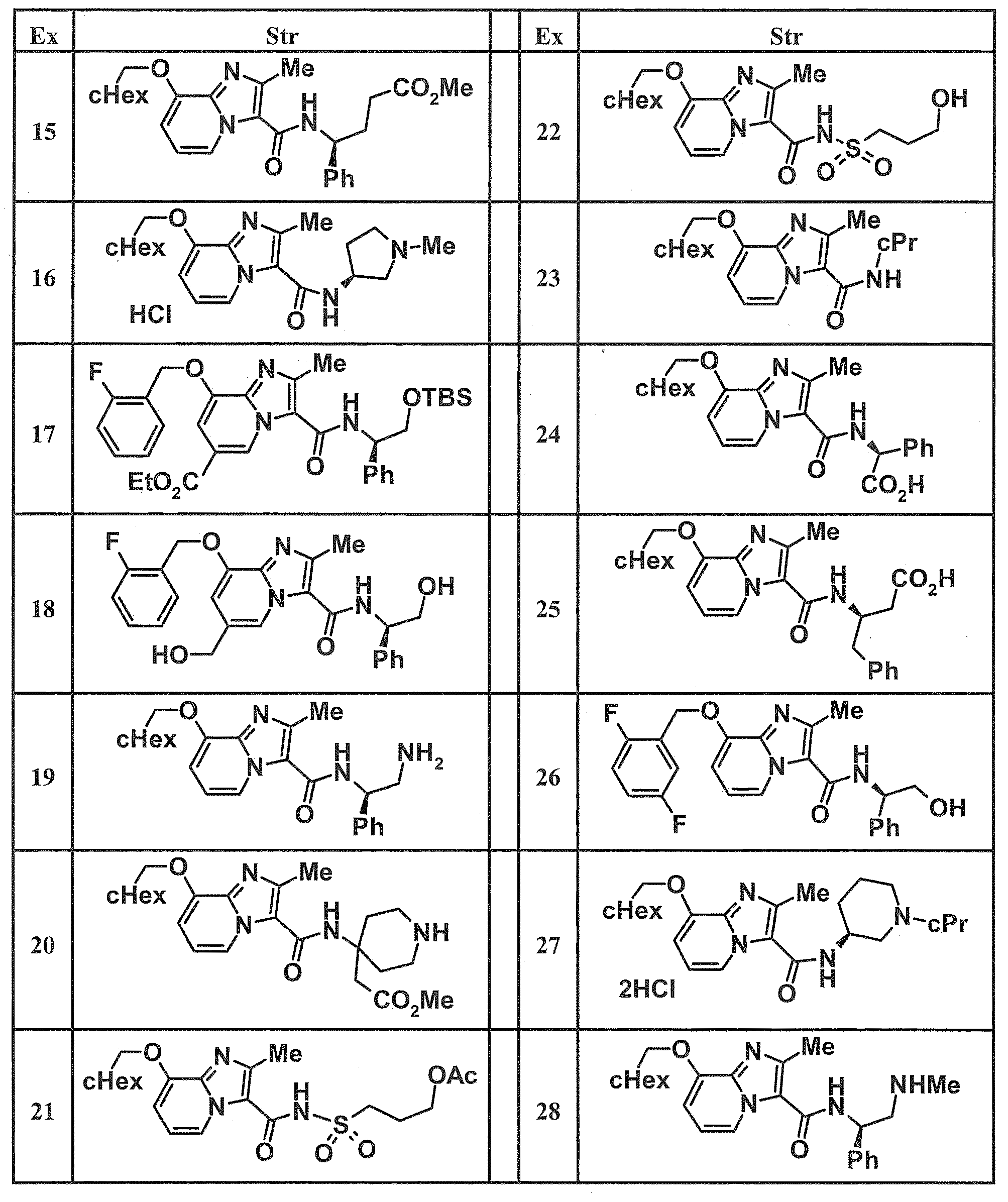
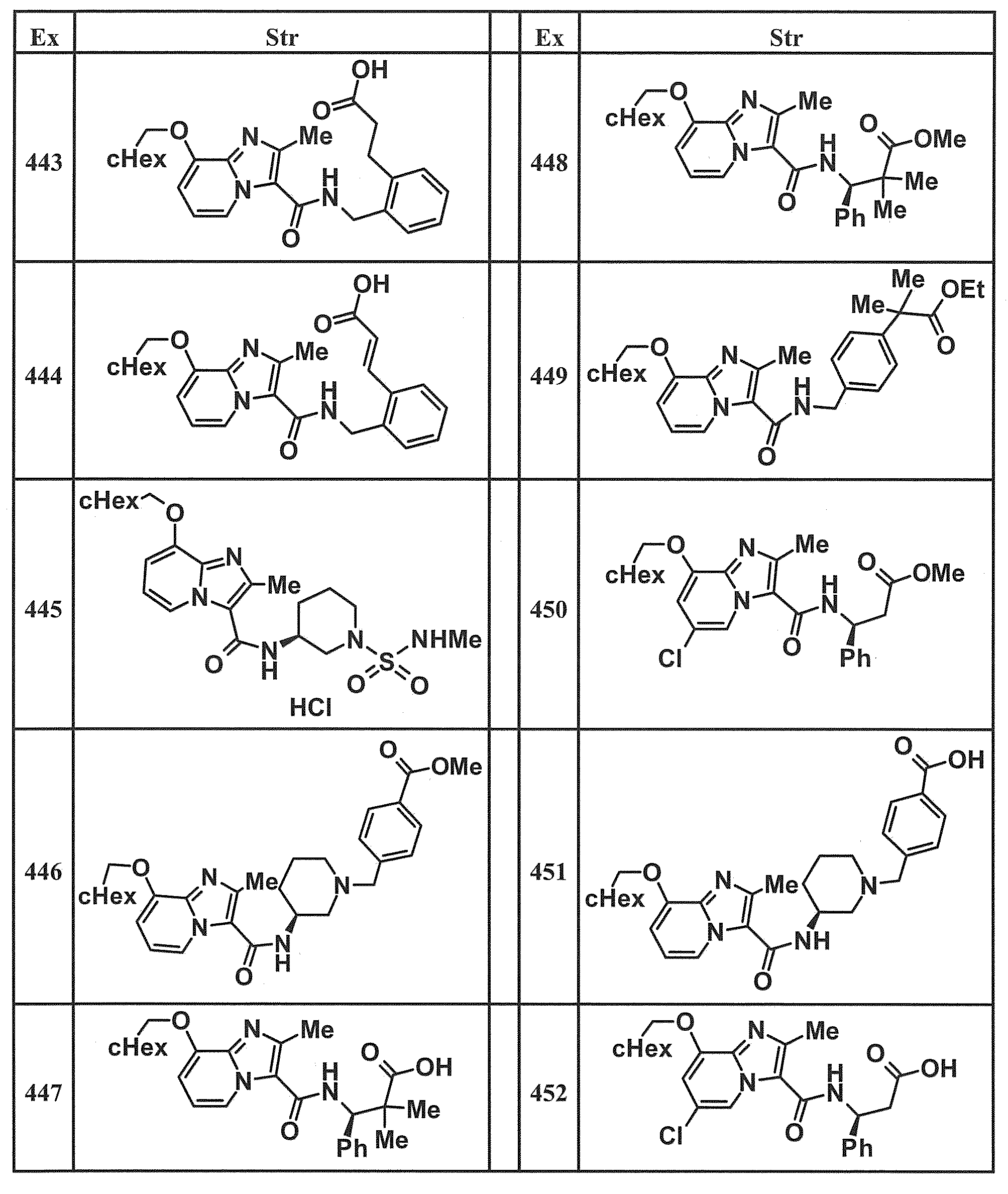
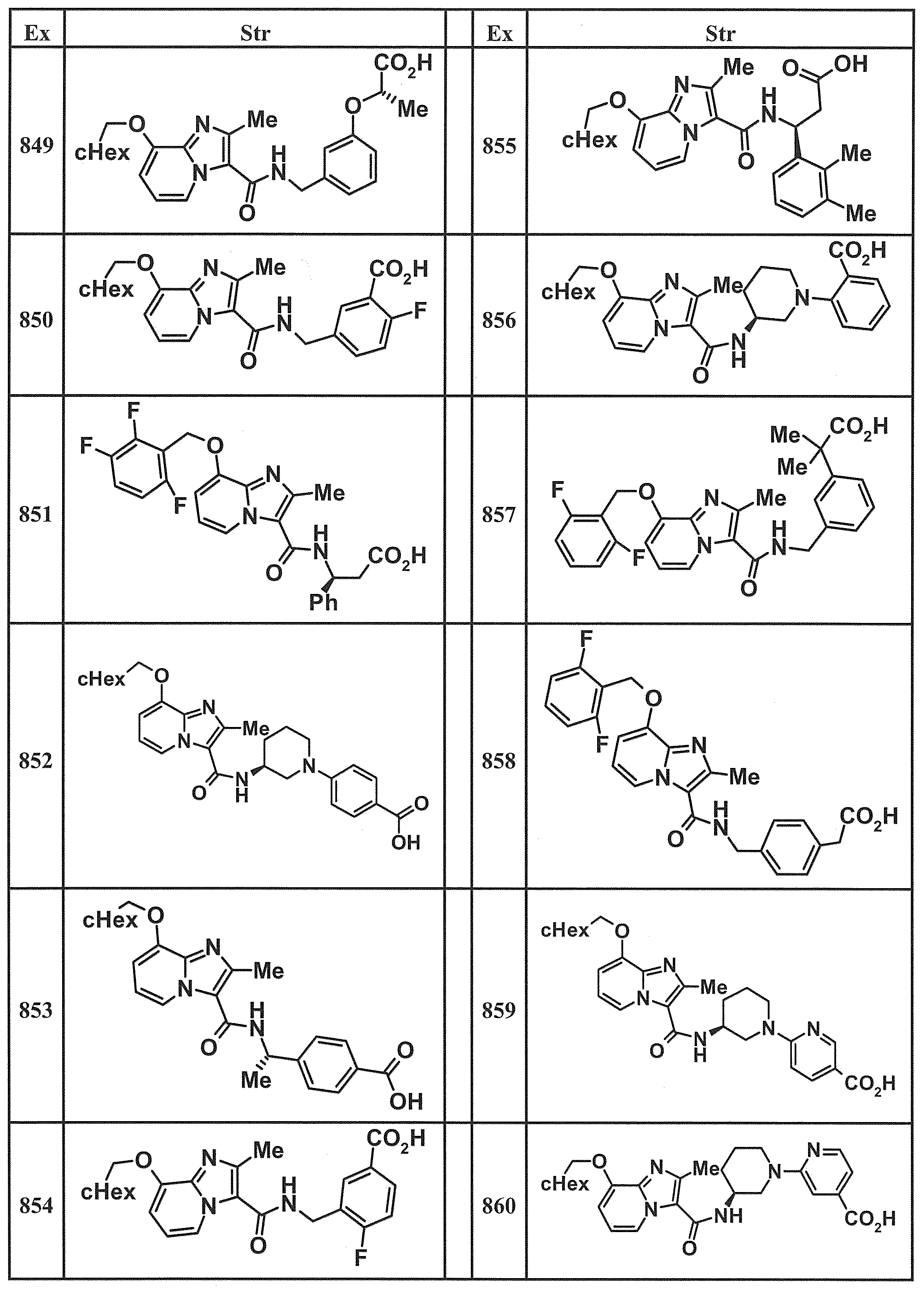
- Examples of specific compounds included in the present invention include the following compounds. (3S) -3-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇ amino) -3-phenylpropanoic acid, (1S, 2R) -1-[( ⁇ 8-[(2,6-Difluorobenzyl) oxy] -2-methylimidazo [1,2-a] pyridin-3-yl ⁇ carbonyl) amino] indan-2- carboxylic acid, (1S, 2R) -1-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇ amino) indan-2-carboxylic acid, (1R, 2S) -1-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇
- the compound of formula (I) may exist as a tautomer or a geometric isomer depending on the kind of the substituent.
- the compound of the formula (I) may be described in only one form of an isomer, but the present invention also includes other isomers, separated isomers, or those isomers. And mixtures thereof.
- the compound of formula (I) may have an asymmetric carbon atom or axial asymmetry, and optical isomers based on this may exist.
- the present invention also includes separated optical isomers of the compound of formula (I) or a mixture thereof.
- the present invention includes a pharmaceutically acceptable prodrug of the compound of formula (I).
- a pharmaceutically acceptable prodrug is a compound having a group that can be converted to an amino group, a hydroxyl group, a carboxyl group, or the like by solvolysis or under physiological conditions. Examples of the group that forms a prodrug include those described in Prog. Med., 5, 2157-2161 (1985) and “Development of Pharmaceuticals” (Yodogawa Shoten, 1990), Volume 7, Molecular Design 163-198. Is mentioned.
- the salt of the compound of the formula (I) is a pharmaceutically acceptable salt of the compound of the formula (I), and may form an acid addition salt or a salt with a base depending on the type of the substituent. is there.
- inorganic acids such as hydrochloric acid, hydrobromic acid, hydroiodic acid, sulfuric acid, nitric acid, phosphoric acid, formic acid, acetic acid, propionic acid, oxalic acid, malonic acid, succinic acid, fumaric acid, maleic acid Acid addition with organic acids such as lactic acid, malic acid, mandelic acid, tartaric acid, dibenzoyl tartaric acid, ditoluoyl tartaric acid, citric acid, methanesulfonic acid, ethanesulfonic acid, benzenesulfonic acid, p-toluenesulfonic acid, aspartic acid, glutamic acid Salts, salts with inorganic bases such as sodium, potassium, magnesium, calcium
- the present invention also includes various hydrates and solvates of the compound of formula (I) and salts thereof, and crystalline polymorphic substances.
- the present invention also includes compounds labeled with various radioactive or non-radioactive isotopes.
- the compound of the formula (I) and salts thereof can be produced by applying various known synthesis methods utilizing characteristics based on the basic skeleton or the type of substituent.
- it is effective in terms of production technology to replace the functional group with an appropriate protecting group (a group that can be easily converted into the functional group) at the raw material or intermediate stage.
- an appropriate protecting group a group that can be easily converted into the functional group
- Examples of such a functional group include a protecting group described in “Greene's Protective Groups in Organic Synthesis (4th edition, 2006)” by PGM Wuts and Green (TW Greene), These may be appropriately selected and used according to the reaction conditions.
- the desired compound after carrying out the reaction by introducing the protective group, the desired compound can be obtained by removing the protective group as necessary.
- the prodrug of the compound of the formula (I) introduces a specific group at the stage from the raw material to the intermediate, or reacts further using the obtained compound of the formula (I), like the above protecting group.
- the reaction can be carried out by applying a method known by those skilled in the art, such as ordinary esterification, amidation, dehydration and the like.
- typical production methods of the compound of the formula (I) will be described. Each manufacturing method can also be performed with reference to the reference attached to the said description.
- the manufacturing method of this invention is not limited to the example shown below.
- the compound of the formula (I) can be produced by reacting the compound (II) with the compound (III).
- the compound (II) and the compound (III) are used in an equal amount or in an excess amount, and a mixture thereof is preferably used in the presence of a condensing agent in a solvent inert to the reaction from cooling to heating. Is usually stirred at -20 ° C to 60 ° C for 0.1 hour to 5 days.
- solvent used here are not particularly limited, but are aromatic hydrocarbons such as benzene, toluene or xylene, halogenated hydrocarbons such as dichloromethane, 1,2-dichloroethane or chloroform, diethyl ether, tetrahydrofuran. (THF), ethers such as dioxane, dimethoxyethane, N, N-dimethylformamide (DMF), dimethyl sulfoxide (DMSO), ethyl acetate, acetonitrile or water, and mixtures thereof.
- aromatic hydrocarbons such as benzene, toluene or xylene
- halogenated hydrocarbons such as dichloromethane, 1,2-dichloroethane or chloroform
- diethyl ether diethyl ether
- ethers such as dioxane, dimethoxyethane, N, N-d
- condensing agents examples include 1- (3-dimethylaminopropyl) -3-ethylcarbodiimide (WSC), dicyclohexylcarbodiimide (DCC), 1,1′-carbonyldiimidazole (CDI), diphenyl phosphate azide (DPPA)
- WSC 1- (3-dimethylaminopropyl) -3-ethylcarbodiimide
- DCC dicyclohexylcarbodiimide
- CDI 1,1′-carbonyldiimidazole
- DPPA diphenyl phosphate azide
- Non-limiting examples include phosphorus oxychloride. It may be preferred for the reaction to use an additive (eg 1-hydroxybenzotriazole) (HOBt).
- the reaction can be performed in the presence of an organic base such as triethylamine (TEA), N, N-diisopropylethylamine (DIPEA) or N-methylmorpholine (NMM), or an inorganic base such as potassium carbonate, sodium carbonate or potassium hydroxide.
- an organic base such as triethylamine (TEA), N, N-diisopropylethylamine (DIPEA) or N-methylmorpholine (NMM)
- an inorganic base such as potassium carbonate, sodium carbonate or potassium hydroxide.
- Examples of reactive derivatives of compound (II) include acid halides obtained by reacting with halogenating agents such as phosphorus oxychloride and thionyl chloride, mixed acid anhydrides obtained by reacting with isobutyl chloroformate, etc. An active ester obtained by condensation with -hydroxybenzotriazole or the like.
- the reaction of these reactive derivatives with compound (III) is carried out in a solvent inert to the reaction such as halogenated hydrocarbons, aromatic hydrocarbons, ethers, etc., under cooling to heating, preferably ⁇ 20 It can be carried out at a temperature between 60 ° C and 60 ° C.
- SR Sandler and W can be referred to.
- the compound of the formula (I) can be produced by reacting the compound (IV) with the compound (Va) or the compound (Vb).
- a known method using a diazocarboxylic acid ester or diazocarboxylic acid amide with a known phosphine or a so-called Mitsunobu method using (tributylphosphoranylidene) acetonitrile (Kakuda reagent) or the like. Reactions or variations thereof, these are reactions well known to those skilled in the art.
- compound (IV) and compound (Vb) are used in equal amounts or in excess of one, and these mixtures are used in a solvent inert to the reaction in the presence of a base, Under cooling to heating under reflux, preferably at 0 ° C. to 80 ° C., the mixture is usually stirred for 0.1 hour to 5 days.
- solvent used here examples include, but are not limited to, aromatic hydrocarbons such as benzene, toluene and xylene, ethers such as diethyl ether, tetrahydrofuran, dioxane and dimethoxyethane, dichloromethane and 1,2-dichloroethane.
- Aroma hydrocarbons such as benzene, toluene and xylene
- ethers such as diethyl ether, tetrahydrofuran, dioxane and dimethoxyethane, dichloromethane and 1,2-dichloroethane.
- Halogenated hydrocarbons such as chloroform, N, N-dimethylformamide, dimethyl sulfoxide, ethyl acetate, acetonitrile, and mixtures thereof.
- bases include triethylamine, diisopropylethylamine, 1,8-diazabicyclo [5.4.0] -7-undecene, organic bases such as n-butyllithium, sodium carbonate, potassium carbonate, sodium hydride, potassium tert-butoxide, etc.
- organic bases such as n-butyllithium, sodium carbonate, potassium carbonate, sodium hydride, potassium tert-butoxide, etc.
- phase transfer catalyst such as tetra-n-butylammonium chloride.
- the starting compound (II) can be produced by producing compound (VIII) by the reaction of compound (VI) and compound (VII), followed by hydrolysis.
- the reaction for producing compound (VIII) can be carried out in the reaction solvent and temperature of the above-mentioned first production method (for details, refer to the examples described later).
- the starting compound (IV) can be produced by producing compound (X) by reaction of compound (IX) and compound (III), followed by deprotection.
- the reaction of compound (IX) and compound (III) can be carried out in the same manner as in the aforementioned first production method.
- the deprotection can be performed by a known method or a method obvious to those skilled in the art.
- the compounds of formula (I) are isolated and purified as free compounds, their salts, hydrates, solvates or crystalline polymorphic substances.
- the salt of the compound of the formula (I) can also be produced by a conventional salt formation reaction. Isolation and purification are performed by applying ordinary chemical operations such as extraction, fractional crystallization, fractional chromatography and the like.
- Various isomers can be produced by selecting an appropriate raw material compound, or can be separated by utilizing a difference in physicochemical properties between isomers.
- optical isomers can be obtained by general optical resolution of racemates (for example, fractional crystallization leading to diastereomeric salts with optically active bases or acids, chromatography using chiral columns, etc.) It can also be produced from a suitable optically active raw material compound.
- Test Example 1 sGC activation test (enzyme) The activity of sGC was evaluated by measuring the amount of cyclic guanosine monophosphate (cGMP) produced by purified human sGC.
- the test compound was dissolved in DMSO and diluted 20-fold with ultrapure water. 2 ⁇ L of diluted test compound solution (maximum concentration 100 ⁇ M), substrate solution [0.5 ⁇ M TEBA, 0.03 ⁇ M dithiothreitol, 0.01 ⁇ M GTP, 0.04 ⁇ M MgCl 2 , 0.03 ⁇ M sodium nitroprusside (SNP)] and human enzyme suspension 6 ⁇ L was added to a 384 well plate (Greiner bio-one) and incubated at room temperature for 1 hour. The amount of cGMP was determined based on HTRF that detects competition between cGMP labeled with a fluorescent dye molecule and its specific antibody.
- cGMP cyclic guanosine monophosphate
- the test results of several example compounds which are compounds of formula (I) of the present invention are shown below.
- the sGC activity of the test compound was calculated with the activity when no compound was added as 100%. Compounds with an sGC activity greater than 300% compared to the activity when no compound is added are recognized as having sGC activity.
- Ex represents an example number in which a test compound is described, and sGCactivation [%] represents sGC activity (%).
- the maximum activity at the time of Example 102 addition was taken as 100%, and an EC 50 [ ⁇ M] value indicating the concentration of the test compound giving the 50% activity was calculated.
- Test Example 2 In vivo blood flow increasing action
- the hindlimb blood flow increasing action in pentobarbital anesthetized rats was confirmed by the following test method. Wistar male rats were used. N, N-dimethylformamide, polyethylene glycol 400, TWEEN 80, 0.5% aqueous methylcellulose solution, 0.5M aqueous sodium hydrogen carbonate solution, and 0.1M hydrochloric acid were appropriately added to the test compound and dissolved according to the compound to prepare an administration solution. The prepared administration solution was orally administered, and 2 hours later, pentobarbital 60 mg / kg was intraperitoneally administered and anesthetized, and then the hindlimb blood flow increasing action was evaluated. The hindlimb blood flow was measured using a laser blood flow imaging device (PIM II; Integral).
- PIM II laser blood flow imaging device
- the compounds of Examples 244, 259 and 341 of the present invention showed an effect of increasing blood flow at a dose of 30 mg / kg.
- the compounds of Examples 12, 102, 119, 179, 247, 251, 321, 424, 430, 693, 698, 699, 702, 704, 706, 759, 760, 767 and 834 were 10 mg / kg. Increased blood flow at dose.
- Test Example 3 Measurement of hypotensive effect in vivo Wistar male rats were used as animals.
- a cannula PE-50, Nippon Becton Dickinson Co., Ltd.
- heparin saline 200 U / mL, Ajinomoto Pharma Co., Ltd.
- the other end of the cannula was exposed subcutaneously through the back of the neck.
- the indwelling cannula was connected to a pressure transducer (Life Kit DTS DX-100, Nihon Kohden Corporation), polygraph (AP-641G, Nihon Kohden Corporation), PowerLab (ML870 PowerLab8 / 30, AD) Blood pressure waveforms were recorded via Instruments Japan.
- the heart rate was calculated using a heart rate monitor (AT-601G, Nihon Kohden). After stabilization of blood pressure, the drug was administered orally once, and blood pressure and heart rate were measured over time.
- test compound was administered by dissolving N, N-dimethylformamide, polyethylene glycol 400, TWEEN 80, 0.5% methylcellulose aqueous solution, 0.5M sodium hydrogen carbonate aqueous solution and 0.1M hydrochloric acid as appropriate according to the compound.
- Example compounds of the present invention had an sGC activation action and a blood flow improvement action. Therefore, the compound of the formula (I) can be used for the treatment of cardiovascular diseases involving sGC, particularly peripheral arterial diseases and the accompanying intermittent claudication and severe limb ischemia.
- Example 3 it was confirmed that the plurality of Example compounds of the present invention have an antihypertensive action. Accordingly, the compound of formula (I) can be used for the treatment of hypertension and the like.
- a pharmaceutical composition containing one or more compounds of the formula (I) or a salt thereof as an active ingredient is an excipient normally used in the art, that is, a pharmaceutical excipient or a pharmaceutical carrier.
- Administration is orally by tablets, pills, capsules, granules, powders, solutions, etc., or injections such as intra-articular, intravenous, intramuscular, suppositories, eye drops, ophthalmic ointments, transdermal solutions, Any form of parenteral administration such as an ointment, a transdermal patch, a transmucosal liquid, a transmucosal patch, and an inhalant may be used.
- a solid composition for oral administration tablets, powders, granules and the like are used.
- one or more active ingredients are mixed with at least one inert excipient.
- the composition may contain an inert additive such as a lubricant, a disintegrant, a stabilizer and a solubilizing agent according to a conventional method. If necessary, tablets or pills may be coated with a sugar coating or a film of gastric or enteric material.
- Liquid compositions for oral administration include pharmaceutically acceptable emulsions, solutions, suspensions, syrups or elixirs and the like, and commonly used inert diluents such as purified water. Or it contains ethanol.
- the liquid composition may contain solubilizers, wetting agents, auxiliaries such as suspending agents, sweeteners, flavors, fragrances and preservatives in addition to the inert diluent.
- the injection for parenteral administration contains a sterile aqueous or non-aqueous solution, suspension or emulsion.
- aqueous solvent include distilled water for injection or physiological saline.
- water-insoluble solvent include alcohols such as ethanol.
- Such compositions may further contain isotonic agents, preservatives, wetting agents, emulsifiers, dispersants, stabilizers, or solubilizing agents. These are sterilized by, for example, filtration through a bacteria-retaining filter, blending with a bactericide or irradiation. These can also be used by producing a sterile solid composition and dissolving or suspending it in sterile water or a sterile solvent for injection before use.
- External preparations include ointments, plasters, creams, jellies, poultices, sprays, lotions, eye drops, eye ointments and the like.
- ointment bases commonly used ointment bases, lotion bases, aqueous or non-aqueous solutions, suspensions, emulsions, and the like.
- a transmucosal agent such as an inhalant or a nasal agent is used in a solid, liquid, or semi-solid state, and can be produced according to a conventionally known method.
- known excipients, and further pH adjusters, preservatives, surfactants, lubricants, stabilizers, thickeners and the like may be appropriately added.
- an appropriate device for inhalation or insufflation can be used.
- a known device such as a metered dose inhalation device or a nebulizer
- the compound is administered alone or as a powder in a formulated mixture or as a solution or suspension in combination with a pharmaceutically acceptable carrier. be able to.
- the dry powder inhaler or the like may be for single or multiple administration, and a dry powder or a powder-containing capsule can be used. Alternatively, it may be in the form of a pressurized aerosol spray using a suitable gas such as a suitable propellant such as chlorofluoroalkane, hydrofluoroalkane or carbon dioxide.
- a suitable gas such as a suitable propellant such as chlorofluoroalkane, hydrofluoroalkane or carbon dioxide.
- the appropriate daily dose is about 0.001 to 100 mg / kg, preferably 0.1 to 30 mg / kg, more preferably 0.1 to 10 mg / kg per body weight. Or in 2 to 4 divided doses.
- the appropriate daily dose is about 0.0001-10 mg / kg per body weight, and is administered once a day or in multiple doses.
- a transmucosal agent about 0.001 to 100 mg / kg per body weight is administered once to several times a day. The dose is appropriately determined according to individual cases in consideration of symptoms, age, sex, and the like.
- the pharmaceutical composition of the present invention is 0.01 to 100% by weight, and in one embodiment, 0.01 to 50% by weight of the active ingredient. Or a further compound of formula (I) or a salt thereof.
- the compound of the formula (I) can be used in combination with various therapeutic agents or preventive agents for diseases for which the compound of the formula (I) is considered to be effective.
- the combination may be administered simultaneously, separately separately, or at desired time intervals.
- the simultaneous administration preparation may be a compounding agent or may be separately formulated.
- the manufacturing method of the compound of Formula (I) is demonstrated in detail.
- this invention is not limited to the compound as described in the following Example.
- the manufacturing method of a raw material compound is shown to a manufacture example.
- the compound of the formula (I) is produced not only by the production methods described in the following examples, but also by a combination of these production methods or methods obvious to those skilled in the art.
- the compound having the Syn column of PEx1,16 means that the compound was produced in the same manner as the compound of Production Example 16 following the production method similar to the compound of Production Example 1), (cis): The relative configuration of the compound is a cis isomer, indicating that it is a racemate, (trans): The relative configuration of the compound is a trans isomer, indicating that it is a racemate, (rac): The compound is a racemic, Racemic to show that The first optically active substance and its enantiomer (enantiomer): a mixture of 1, means a compound in the optically inactive.
- concentration mol / l is expressed as M.
- a 1M aqueous sodium hydroxide solution means a 1 mol / l aqueous sodium hydroxide solution.
- the compounds of Production Examples 29 to 100, 103, 108, 118 to 128, 132 to 134, 138, 141 to 164, and 202 to 279 are the same as those of Production Examples 1 to 28, 101 to 102, 104 to 107, 109 described later. ⁇ 117, 129 to 131, 135 to 137, 139 to 140, and 165 to 201, they were produced in the same manner as described in the table below.
- the structures of the respective production example compounds are shown in Tables 2 to 20 below, and physicochemical data and production methods are shown in Tables 21 to 31 below.
- Production Example 18 Add 6M hydrochloric acid to 2 mL of dioxane (200 mL) of 8- (cyclohexylmethoxy) -N- (2,2-dimethoxyethyl) -2-methylimidazolo [1,2-a] pyridine-3-carboxamide for 7 hours. Stir. Saturated saline and ethyl acetate were added to the reaction solution, and a liquid separation operation was performed.
- reaction solution was filtered through Celite, and a saturated aqueous sodium hydrogen carbonate solution and ethyl acetate were added to the filtrate to carry out a liquid separation operation.
- organic layer was washed with saturated brine, dried over anhydrous magnesium sulfate, and the solvent was evaporated under reduced pressure.
- the obtained residue was purified by silica gel column chromatography to obtain 380 mg of methyl 3- ⁇ (3S) -3-[(tert-butoxycarbonyl) amino] piperidin-1-yl ⁇ benzoate.
- Production Example 129 In the same manner as in Production Example 112 above, using (S) -2-methyl-2-propanesulfinamide, tert-butyl 3- ⁇ 2-[(E)- ⁇ [(S) -tert-butyl Sulfinyl] imino ⁇ methyl] -3-fluorophenyl ⁇ propanoate was prepared.
- Production Example 130 In the same manner as in Production Example 112 described above, racemic tert-butyl 3- (2- ⁇ (E)-[(tert-butylsulfinyl)) was prepared using racemic 2-methyl-2-propanesulfinamide. Imino] methyl ⁇ -3-fluorophenyl) propanoate was prepared.
- Production Example 136 In the same manner as in Production Example 113, tert-butyl 3- ⁇ 2-[(E)- ⁇ [(R) -tert-butylsulfinyl] imino ⁇ methyl] -3-fluorophenyl ⁇ propanoic acid (Production Example 131) was used to prepare tert-butyl (1R, 2S) -1- ⁇ [(R) -tert-butylsulfinyl] amino ⁇ -7-fluoroindane-2-carboxylic acid.
- the compound of Production Example 136 and the compound of Production Example 113a are enantiomers (enantiomers).
- the solvent was distilled off under reduced pressure, and a saturated sodium hydrogen carbonate aqueous solution and chloroform were added to the resulting residue to carry out a liquid separation operation.
- the organic layer was washed with saturated brine and dried over anhydrous magnesium sulfate.
- the solvent was distilled off under reduced pressure, and the resulting residue was purified by silica gel column chromatography to obtain 165 mg of methyl (1S) -1-aminoindan-5-carboxylate.
- a saturated aqueous sodium hydrogen carbonate solution, water and ethyl acetate were added to the reaction solution to carry out a liquid separation operation, and the organic layer was dried over anhydrous magnesium sulfate.
- 61 mg of 10% palladium-carbon (water-containing product) was added to an ethyl acetate-methanol solution of the obtained intermediate product, and the mixture was stirred for 6 hours in a hydrogen atmosphere.
- the reaction solution was filtered through Celite, and then the solvent was distilled off under reduced pressure to obtain 0.51 g of methyl rac- (1R, 2R) -1-amino-2-hydroxyindan-1-carboxylate.
- the solvent was distilled off under reduced pressure, 5 ml of toluene was added to the resulting residue, and the mixture was stirred at 100 ° C. for 5 minutes. After allowing to cool, 0.7 ml of benzyl alcohol was added at room temperature, and the mixture was stirred at 100 ° C. for 19 hours. After allowing to cool, the solvent was distilled off under reduced pressure, and the resulting residue was purified by silica gel column chromatography to obtain benzyl [2,2-dimethyl-5- (pyridin-2-yl) -1,3-dioxane-5- Yl] carbamate 223 mg was obtained.
- Production Example 201 N-[(2R) -1- ⁇ [tert-butyl (dimethyl) silyl] oxy ⁇ -2-methylbutan-2-yl] -2-methylpropane-2- (S) -sulfinamide 97 mg methanol 1 ml To the solution, 1.3 ml of 4M hydrogen chloride / dioxane solution was added and stirred for 2 hours. The solvent was distilled off under reduced pressure to obtain 63 mg of (2R) -2-amino-2-methylbutan-1-ol hydrochloride. Production Example 239 The compound of Production Example 168a was used in the same manner as in Production Example 171 described above.
- Production Example 240 The compound of Production Example 239 was used in the same manner as in Production Example 172 described above.
- Production Example 278 The compound of Production Example 181a was used in the same manner as in Example 5 described later.
- Production Example 279 The compound of Production Example 181b was used in the same manner as in Example 5 described later.
- Examples 36 to 660, 662, 664 to 668, 670 to 672, 674 to 682, 686 to 692, 694, 696 to 697, 700 to 701, 706 to 708, and 715 to 885 are the compounds of Examples 1 to Since they were produced in the same manner as described in 35, 661, 663, and 709 to 714, they are described only in the table below.
- Example 1 8- (Cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridine-3-carboxylic acid 600 mg in DMF 10 ml solution in tert-butyl (3S) -3-aminopiperidine-1-carboxylate 500 mg, N- [3- (dimethylamino) propyl] -N′-ethylcarbodiimide hydrochloride (518 mg) and 1-hydroxybenzotriazole (366 mg) were added, and the mixture was stirred overnight. Water and ethyl acetate were added to the reaction solution to carry out a liquid separation operation.
- Example 2 N-[(1R) -2- ⁇ [tert-butyl (dimethyl) silyl] oxy ⁇ -1-phenylethyl] -8-hydroxy-2-methylimidazo [1,2-a] pyridine-3-carboxamide 120 mg , 60 ⁇ l of cyclopentylmethanol, 156 ⁇ l of (tributylphosphoranylidene) acetonitrile and 2.4 ml of toluene were stirred at 110 ° C. for 16 hours.
- Example 3 3- ⁇ [(1R) -2- ⁇ [tert-butyl (dimethyl) silyl] oxy ⁇ -1-phenylethyl] carbamoyl ⁇ -8-[(2-fluorobenzyl) oxy] -2-methylimidazo [1, To a 12 ml THF solution of 370 mg ethyl 2-a] pyridine-6-carboxylate was added 1.22 ml of a 1M tetrabutylammonium fluoride / THF solution and stirred for 30 minutes. Water and ethyl acetate were added to the reaction solution to carry out a liquid separation operation. The organic layer was dried over anhydrous magnesium sulfate and the solvent was distilled off under reduced pressure.
- Example 4 6-Bromo-8- (cyclohexylmethoxy) -N-[(1R) -2-hydroxy-1-phenylethyl] -2-methylimidazo [1,2-a] pyridine-3-carboxamide 90 mg N-methyl -2-pyrrolidone 1.8 ml solution, zinc cyanide 54 mg and [1,1-bis (diphenylphosphino) ferrocene] dichloropalladium (II) 27 mg were added and stirred at 180 ° C. for 30 minutes under microwave irradiation . To the reaction solution, 46 mg of zinc cyanide was added, and the mixture was again stirred at 180 ° C. for 30 minutes under microwave irradiation conditions.
- Example 6 8- (cyclohexylmethoxy) -2-methyl-N-[(3S) -pyrrolidin-3-yl] imidazo [1,2-a] pyridine-3-carboxamide dihydrochloride 400 mg, triethylamine 0.26 ml, and 37% To a suspension of 0.23 ml of formaldehyde aqueous solution in 11 ml of dichloroethane was added 592 mg of sodium triacetoxyborohydride under ice cooling, and the mixture was stirred at room temperature for 1 hour. Saturated sodium hydrogen carbonate aqueous solution and chloroform were added to the reaction liquid, and liquid separation operation was performed.
- Example 7 8- (cyclohexylmethoxy) -2-methyl-N-[(3S) -piperidin-3-yl] imidazo [1,2-a] pyridine-3-carboxamide dihydrochloride 307 mg, potassium carbonate 335 mg, acetonitrile 5 92 ⁇ l of ethyl bromoacetate was added to a suspension of 5 ml of DMF and 5 ml of DMF, and the mixture was stirred for 3 hours under ice cooling. Water and chloroform were added to the reaction solution to carry out a liquid separation operation. The organic layer was dried over anhydrous sodium sulfate and the solvent was distilled off under reduced pressure.
- Example 10 8- (cyclohexylmethoxy) -2-methyl-N-[(3S) -piperidin-3-yl] imidazo [1,2-a] pyridine-3-carboxamide dihydrochloride 200 mg in isopropyl alcohol 5 ml solution After adding 220 ⁇ l of triethylamine and 72 ⁇ l of (trimethylsilyl) isocyanate, the mixture was stirred for 6 hours. Water and ethyl acetate were added to the reaction solution to carry out a liquid separation operation. The organic layer was washed successively with water, saturated aqueous sodium hydrogen carbonate solution and saturated brine, and dried over anhydrous sodium sulfate.
- Example 11 8- (Cyclohexylmethoxy) -2-methyl-N-[(3S) -piperidin-3-yl] imidazo [1,2-a] pyridine-3-carboxamide dihydrochloride 200 mg plus pyridine 5 ml and sulfamide 217 mg And heated to reflux for 4 hours. After standing to cool at room temperature, water and chloroform were added to the reaction solution to carry out a liquid separation operation. The organic layer was dried over anhydrous sodium sulfate, the solvent was distilled off under reduced pressure, and the resulting residue was purified by silica gel column chromatography.
- Example 13 8- (cyclohexylmethoxy) -N-[(1S) -1- (2-fluorophenyl) -3-hydroxypropyl] -2-methylimidazo [1,2-a] pyridine-3-carboxamide 290 mg in dichloromethane 1,1,1-triacetoxy-1,1-dihydro-1,2-benziodoxol-3 (1H) -one (300 mg) was added to the mixture, and the mixture was stirred overnight. A saturated aqueous sodium bicarbonate solution, an aqueous sodium thiosulfate solution, and ethyl acetate were added to the reaction solution to carry out a liquid separation operation.
- Example 14 To a suspension of lithium aluminum hydride 20 mg in THF 5 ml, ice-cooled (2R) -2-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridine-3- A solution of 220 mg of methyl [yl] carbonyl ⁇ amino) -3- (2-methylphenyl) propanoate in 2 ml of THF was added, and the mixture was stirred for 7 hours under ice cooling. To the reaction solution, 160 mg of sodium sulfate decahydrate was added and stirred for a while. The reaction solution was filtered through Celite, the solvent was distilled off under reduced pressure, and the resulting residue was purified by silica gel column chromatography.
- Example 16 8- (cyclohexylmethoxy) -2-methyl-N-[(3S) -1-methylpyrrolidin-3-yl] imidazo [1,2-a] pyridine-3-carboxamide, 245 mg, ethyl acetate 12 ml, and 4M 364 ⁇ l of a hydrogen chloride / ethyl acetate solution was added and stirred. The resulting solid was collected by filtration and dried to give 8- (cyclohexylmethoxy) -2-methyl-N-[(3S) -1-methylpyrrolidin-3-yl] imidazo [1,2-a] pyridine-3- Carboxamide hydrochloride 258 mg was obtained.
- Example 17 In a solution of 280 mg ethyl 8-[(2-fluorobenzyl) oxy] -2-methylimidazo [1,2-a] pyridine-6-carboxylate, 208 mg 4- (dimethylamino) pyridine, and 5 ml chloroform Under ice-cooling, 191 ⁇ l of trichloroacetyl chloride was added, and the mixture was stirred at room temperature for 1 hour and at 65 ° C. overnight.
- Example 18 8-[(2-Fluorobenzyl) oxy] -3- ⁇ [(1R) -2-hydroxy-1-phenylethyl] carbamoyl ⁇ -2-methylimidazo [1,2-a] pyridine-6-carboxylic acid 100
- 4-methylmorpholine 28 ⁇ l and dimethoxyethane 0.7 ml was added ice-cooled isobutyl chloroformate 34 ⁇ l and stirred at room temperature overnight. After insoluble matter was removed by filtration, 16 mg of sodium borohydride and 210 ⁇ l of methanol were added to the filtrate under ice cooling, and the mixture was stirred for 30 minutes under ice cooling.
- Example 19 8- (Cyclohexylmethoxy) -N-[(1R) -2- (1,3-dioxo-1,3-dihydro-2H-isoindol-2-yl) -1-phenylethyl] -2-methylimidazo [ To a suspension of 1,2-a] pyridine-3-carboxamide 300 mg in ethanol 6 ml was added hydrazine monohydrate 0.13 ml and stirred at 85 ° C. for 1 hour.
- Example 20 4-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇ amino) -4- (2-methoxy-2-oxoethyl) piperidine-1-carboxyl
- benzyl acid a solution of 1.2 g of benzyl acid in 30 ml of methanol was added 300 mg of 10% palladium-carbon, and the mixture was stirred overnight under a hydrogen atmosphere.
- Example 21 To a suspension of 300 mg of 8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridine-3-carboxylic acid in 5 ml of THF, add 253 mg of 1,1'-carbonyldiimidazole at 60 ° C. Stir for 1 hour. Next, 283 mg of 3- (aminosulfonyl) propyl acetate and 389 ⁇ l of 1,8-diazabicyclo [5.4.0] -7-undecene were added under ice cooling, and the mixture was stirred at room temperature overnight. Water and ethyl acetate were added to the reaction solution to carry out a liquid separation operation.
- a saturated aqueous ammonium chloride solution and chloroform were added to the reaction solution to carry out a liquid separation operation.
- the organic layer was dried over anhydrous sodium sulfate and the solvent was distilled off under reduced pressure.
- the obtained residue was purified by silica gel column chromatography. Ethyl acetate and ethanol were added to the obtained product and stirred.
- the resulting solid was collected by filtration and dried, and acetic acid 3-[( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇ amino) sulfonyl] propyl 149 mg was obtained.
- Example 22 3-[( ⁇ [8- (Cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇ amino) sulfonyl] propyl acetate in 130 mg methanol 2 ml, THF 2 ml and 1M 1 ml of an aqueous sodium hydroxide solution was added and stirred for 8.5 hours. The solvent was distilled off under reduced pressure, and water and 1M hydrochloric acid were added to the resulting residue. The solvent was distilled off under reduced pressure, and the resulting residue was purified by silica gel column chromatography. Ethyl acetate and hexane were added to the purified product and stirred.
- Example 23 A mixture of 8.7 mg of 8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridine-3-carboxylic acid, 5.1 mg of cyclopropylamine, 4.1 mg of 1-hydroxybenzotriazole, 1 ml of DMF and 28 ⁇ l of diisopropylethylamine 50 mg of polystyrene / N-cyclohexylcarbodiimide-N′-propyloxymethyl (PS-Carbodiimide manufactured by Biotage) was added to the mixture and stirred at room temperature for 16 hours.
- PS-Carbodiimide manufactured by Biotage PS-Carbodiimide manufactured by Biotage
- Example 24 8- (Cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridine-3-carboxylic acid 5.8 mg, (S)-(+)-2-phenylglycine methyl ester hydrochloride 6.1 mg, 1-hydroxybenzo
- PS-Carbodiimide manufactured by Biotage polystyrene / N-cyclohexylcarbodiimide-N′-propyloxymethyl
- Example 25 8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridine-3-carboxylic acid 5.8 mg, tert-butyl (3R) -3-amino-4-phenylbutanoate 7.1 mg, 1-hydroxybenzo
- tert-butyl (3R) -3-amino-4-phenylbutanoate 7.1 mg, 1-hydroxybenzo
- 50 mg of polystyrene / N-cyclohexylcarbodiimide-N′-propyloxymethyl PS-Carbodiimide manufactured by Biotage
- Example 26 N-[(1R) -2- ⁇ [tert-butyl (dimethyl) silyl] oxy ⁇ -1-phenylethyl] -8-hydroxy-2-methylimidazo [1,2-a] pyridine-3-carboxamide 8.5 mg , ⁇ -bromo-2,5-difluorotoluene 5.6 mg, potassium carbonate 5.0 mg, and DMF 700 ⁇ l were stirred at a temperature of 28 ° C. for 28 hours. To the reaction mixture, 1 ml of water, 0.5 ml of saturated saline and 4 ml of chloroform were added to carry out a liquid separation operation.
- Example 27 8- (cyclohexylmethoxy) -2-methyl-N-[(3S) -piperidin-3-yl] imidazo [1,2-a] pyridine-3-carboxamide dihydrochloride 250 mg in methanol 10 ml Then, 157 ⁇ l of triethylamine, 300 mg of molecular sieves 3A, 323 ⁇ l of acetic acid, 1.53 ml of [(1-ethoxycyclopropyl) oxy] (trimethyl) silane and 146 mg of sodium cyanoborohydride were added, and the mixture was stirred for 6 hours while heating under reflux. . Insoluble material was removed by filtration, and the filtrate was concentrated under reduced pressure.
- Example 28 8- (Cyclohexylmethoxy) -2-methyl-N-[(1R) -2- ⁇ methyl [(2-nitrophenyl) sulfonyl] amino ⁇ -1-phenylethyl] imidazo [1,2-a] pyridine-3 -To a solution of carboxamide 200 mg in DMF 3 ml, potassium carbonate 140 mg and 4-methylbenzenethiol 50 mg were added and stirred for 3 hours. Water and chloroform / methanol (9/1) were added to the reaction solution to carry out a liquid separation operation. The organic layer was washed with saturated brine, dried over anhydrous magnesium sulfate, and the solvent was evaporated under reduced pressure.
- Example 30 N-[(6-chloropyridin-3-yl) methyl] -8- (cyclohexylmethoxy) -2-methylimidazolo [1,2-a] pyridine-3-carboxamide 32 mg N-methyl-2-pyrrolidone
- 0.05 ml of ethyl piperidine-4-carboxylate was added and reacted at 150 ° C. for 30 minutes and further at 200 ° C. for 30 minutes under microwave irradiation.
- Potassium carbonate 24 mg was added and reacted at 240 ° C. for 2 hours under microwave irradiation.
- a saturated aqueous ammonium chloride solution and ethyl acetate were added to the resulting reaction solution to carry out a liquid separation operation.
- the organic layer was washed with water and saturated brine, and dried over anhydrous sodium sulfate.
- the solvent was distilled off under reduced pressure, and the resulting residue was purified by silica gel column chromatography.
- Example 31 N-[(6-chloropyridin-3-yl) methyl] -8- (cyclohexylmethoxy) -2-methylimidazolo [1,2-a] pyridine-3-carboxamide 70 mg N-methyl-2-pyrrolidone Ethyl piperidine-3-carboxylate (0.12 mL) was added to a 1 mL solution and reacted at 240 ° C. for 50 minutes under microwave irradiation. A saturated aqueous ammonium chloride solution and ethyl acetate were added to the reaction solution to carry out a liquid separation operation. The organic layer was washed with saturated brine and dried over anhydrous magnesium sulfate.
- Example 32 Methyl N- ⁇ [8- (cyclohexylmethoxy) -2-methylimidazolo [1,2-a] pyridin-3-yl] carbonyl ⁇ selinate 270 mg in methanol 7 mL solution with biguanidine 210 mg and sodium methoxide 115 mg And stirred at 65 ° C. for 8 hours.
- Example 33 8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridine-3-carboxylic acid 860 mg, 1-benzyl-4-methylpiperidin-4-amine dihydrochloride 992 mg, O- (7- A mixture of azabenzotriazol-1-yl) -N, N, N ′, N ′,-tetramethyluronium hexafluorophosphate 170 mg, diisopropylethylamine 3 mL, and DMF 10 mL was stirred for 1 day. Water and ethyl acetate were added to the reaction solution to carry out a liquid separation operation.
- Example 34 N- (1-Benzyl-4-methylpiperidin-4-yl) -8- (cyclohexylmethoxy) -2-methylimidazolo [1,2-a] pyridine-3-carboxamide 1.15 g, 1-chloroethyl chloroformate A mixture of 0.4 mL and dichloroethane 15 mL was heated to reflux overnight. After allowing to cool at room temperature, the solvent was evaporated under reduced pressure, 15 mL of methanol was added to the residue, and the mixture was heated to reflux for 6 hours. After allowing to cool at room temperature, the solvent was distilled off under reduced pressure, and a saturated aqueous sodium hydrogen carbonate solution and chloroform were added to the residue to carry out a liquid separation operation.
- Example 35 (3S) -3-( ⁇ [8- (Cyclohexylmethoxy) -2-methylimidazolo [1,2-a] pyridin-3-yl] carbonyl ⁇ amino) -3-phenylpropanoic acid 100 mg DMF 1 mL To the solution, 43 mg of 1,1′-carbonyldiimidazole was added and stirred for 30 minutes. To the reaction solution, 24 mg of methanesulfonamide and 0.039 mL of 1,8-diazabicyclo [5.4.0] -7-undecene were added and stirred for 5 hours. 1M hydrochloric acid and ethyl acetate were added to the reaction liquid, and liquid separation operation was performed.
- Example 661 Methyl (1R, 2R) -1-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇ amino) -5-methylindan-2-carboxylate 6 ml of 3M hydrochloric acid was added to 6 ml suspension of 149 mg dioxane, and the mixture was stirred at 80 ° C. for 4 hours. After allowing to cool, the solvent was distilled off under reduced pressure, and a saturated sodium hydrogen carbonate aqueous solution, citric acid aqueous solution and chloroform were added to the resulting residue, followed by liquid separation operation.
- Example 669 In the same manner as in Example 1 above, using the compound of Production Example 123, methyl (1S, 2R) -1-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2- a] pyridin-3-yl] carbonyl ⁇ amino) -4-methylindan-2-carboxylic acid was prepared.
- Example 673 In the same manner as in Example 1, methyl (1S, 2R) -1-[( ⁇ 8-[(2,6-difluorobenzyl) oxy] -2-methylimidazo [ 1,2-a] pyridin-3-yl ⁇ carbonyl) amino] -4-methylindan-2-carboxylic acid was prepared.
- Example 674 In the same manner as in Example 1 above, using the compound of Production Example 115, methyl (1S, 2R) -1-[( ⁇ 8-[(2,6-difluorobenzyl) oxy] -2-methylimidazo [1,2-a] pyridin-3-yl ⁇ carbonyl) amino] -7-fluoroindane-2-carboxylic acid was prepared.
- Example 683 In the same manner as in Example 1 above, using the compound of Preparation Example 139, cis-racemic methyl rac- (1R, 2R) -1-( ⁇ [8- (cyclohexylmethoxy)- 2-Methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇ amino) -7-fluoroindane-2-carboxylic acid was prepared.
- Example 684 In the same manner as in Example 1 above, using the compound of Production Example 115, methyl (1S, 2R) -1-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2- a] Pyridin-3-yl] carbonyl ⁇ amino) -7-fluoroindane-2-carboxylic acid was prepared.
- Example 685 In the same manner as in Example 1 above, using the compound of Production Example 140, methyl (1R, 2S) -1-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2- a] Pyridin-3-yl] carbonyl ⁇ amino) -7-fluoroindane-2-carboxylic acid was prepared.
- the compound of Example 684 and the compound of Example 685 are enantiomers (enantiomers).
- Example 693 The compound of Example 669 was used in the same manner as in Example 661 above.
- Example 695 The compound of Example 663 was used in the same manner as in the above Example 661.
- Example 698 Using the compound of Example 673, it was prepared in the same manner as in the above Example 661.
- Example 699 Using the compound of Example 674, it was prepared in the same manner as in Example 661 described above.
- Example 702 The compound of Example 678 was used in the same manner as in Example 661 above.
- Example 703 Using the compound of Example 683, it was prepared in the same manner as in the above Example 661.
- Example 704 The compound of Example 684 was used in the same manner as in Example 661 above.
- Example 705 The compound of Example 685 was used in the same manner as in Example 661 above.
- Example 709 8-[(2,6-Difluorobenzyl) oxy] -N- [2,2-dimethyl5- (3-methylphenyl) -1,3-dioxane-5-yl] -2-methylimidazo [1,2 -a] Pyridine-3-carboxamide (301 mg) was added with 3 ml of dioxane, 3 ml of methanol, and 6 ml of 1M hydrochloric acid, and stirred for 14 hours. A saturated aqueous sodium hydrogen carbonate solution, water, and ethyl acetate were added to the reaction solution under ice-cooling, and a liquid separation operation was performed.
- Example 710 Diethyl [( ⁇ 8-[(2,6-difluorobenzyl) oxy] -2-methylimidazo [1,2-a] pyridin-3-yl ⁇ carbonyl) amino] malonate 252 mg plus ethanol 4 ml, 20% sodium Ethanol / ethanol solution 0.23 ml and 1-iodobutane 0.31 ml were added and stirred at 70 ° C. for 3 hours. Next, 11 mg of sodium ethoxide was added, and the mixture was stirred at 70 ° C. for 1 hour. To the reaction solution, a citric acid aqueous solution, a saturated aqueous sodium hydrogen carbonate solution and chloroform were added to carry out a liquid separation operation.
- Example 711 Diethyl butyl [( ⁇ 8-[(2,6-difluorobenzyl) oxy] -2-methylimidazo [1,2-a] pyridin-3-yl ⁇ carbonyl) amino] malonate 68 mg ethanol in 1.4 ml mixture A solution of 35 mg calcium chloride in 0.34 ml water was added. Next, 24 mg of sodium borohydride was added under ice cooling, and the mixture was stirred for 1 hour under ice cooling and 4 hours at room temperature. Furthermore, ethanol 2 ml, calcium chloride 35 mg water 0.34 ml solution and sodium borohydride 24 mg were added and stirred at room temperature for 15 hours.
- Example 713 1-( ⁇ [8- (cyclohexylmethoxy) -2-methylimidazo [1,2-a] pyridin-3-yl] carbonyl ⁇ oxy) -1H-benzotriazole (100 mg) and dichloromethane (1.7 ml, (S)-( -)-1-Phenylethylamine 0.065 ml and triethylamine 0.07 ml were added and stirred overnight. Water and chloroform were added to the reaction liquid, liquid separation operation was performed, and it dried with anhydrous sodium sulfate. The solvent was distilled off under reduced pressure, and the resulting residue was purified by silica gel column chromatography.
- Example 714 Sodium periodate was added to a mixture of 100 mg of the compound of Example 766 in 3.3 ml of THF and 1.7 ml of water under ice cooling, and the mixture was stirred at room temperature for 2 hours and at 50 ° C. for 3 hours. Water and ethyl acetate were added to the reaction solution to carry out a liquid separation operation.
- Example 758 Using the compound of Production Example 240, the compound was produced in the same manner as in Example 1 above.
- Example 759 The compound of Production Example 172 was used in the same manner as in Example 1 above.
- Example 766 Using the compound of Production Example 278, the product was produced in the same manner as in Example 1 above.
- Example 767 Using the compound of Production Example 279, the compound was produced in the same manner as in Example 1 above.
- Example 797 The compound of Production Example 172 was used in the same manner as in Example 1 above.
- Example 798 The compound of Production Example 172 was used in the same manner as in Example 1 above.
- the compound of the formula (I) has an sGC activation action, and sGC-related cardiovascular diseases such as hypertension, atherosclerosis, lumbar spinal canal stenosis, peripheral arterial disease and accompanying intermittent claudication And can be used as an active ingredient of a pharmaceutical composition for preventing or treating severe lower limb ischemia, stable or unstable angina, heart failure, thrombosis, stroke, sexual dysfunction or pulmonary hypertension.
- sGC-related cardiovascular diseases such as hypertension, atherosclerosis, lumbar spinal canal stenosis, peripheral arterial disease and accompanying intermittent claudication
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Reproductive Health (AREA)
- Endocrinology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Urology & Nephrology (AREA)
- Gynecology & Obstetrics (AREA)
- Hospice & Palliative Care (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
sGC(soluble guanylate cyclase)は、生体の恒常性維持に非常に重要な役割を果たしている情報伝達物質であるNOの最も重要な標的分子の一つであり、NO/sGC/cGMP系を形成している。本酵素は二つのサブユニットからなり、ヘテロダイマー一個につきヘム一個を含有することが報告されており、ヘムは活性化メカニズムにとって中心的役割を果たす。NOは、ヘムの鉄原子に結合することで、酵素が活性コンフォメーションに変化すると考えられている。したがって、ヘム不含の酵素調製物では、NOによって刺激され得ない。一酸化炭素(CO)も、ヘムの中心鉄原子に結合できるが、COによる刺激はNOによる刺激より顕著に低い。
sGCはα及びβサブユニットからなる。配列、組織特異的分布、及び異なる成長段階での発現に関してお互いに異なる、いくつかのサブユニットのサブタイプが報告されてきた。それぞれのサブユニットの分布がヒトも含めた哺乳類で研究されたが、α1及びβ1サブユニットがほとんどの臓器で発現しており、これらのα1β1の形が機能的に働いている異型二量体のパターンであることは広く認められていることである。α1β1と比較すると少数の臓器ではあるが、α2サブユニットが確認され、脳、肺、大腸、心臓、脾臓、子宮、胎盤においては,α1より多く発現していることが報告されている。α3及びβ3と呼ばれるサブユニットは、ヒト脳から単離されたが、α1及びβ1と相同である。さらに最近の研究によれば、触媒性ドメイン中に挿入を含むα2iサブユニットが示されている。すべてのサブユニットは、触媒性ドメイン領域において、高いホモロジーを示す。
病的条件化において、フリーラジカルの発生増加等の原因のため、NO等のsGC活性化因子の生成の抑制、もしくは分解の促進が引き起こされることが報告されている。活性化因子の減少に伴い、NO/sGC/cGMPシグナルが減弱し、例えば、血圧上昇、血小板活性化、又は細胞増殖及び細胞接着の増加につながる。結果として、種々の心血管疾患、すなわち、高血圧症(肺高血圧症を含む)、アテローム性動脈硬化症、腰部脊柱管狭窄症、末梢動脈疾患、間歇性跛行、重症下肢虚血、安定もしくは不安定狭心症、心不全、血栓症、脳卒中、性機能不全が起こる。したがって、本酵素の選択的活性化を機序とする新規薬剤は、cGMP産生を正常化する可能性が考えられ、かかる疾患の治療又は予防が可能となる。
当該文献は、イミダゾ[1,2-a]ピリジン骨格を有する化合物を開示又は示唆するものではない。
他にもsGCを活性化する化合物として、ピラゾール誘導体やピラゾロ[3,4-b]ピリジン誘導体が、国際公報WO2000/06569、WO2000/21954、WO2001/83490、WO2003/004503、WO2003/095451、WO2003/086407、WO2003/097063、WO2007/124854、WO2007/128454、WO2008/031513、WO2008/061657、WO2010/078900及びWO2010/079120に開示されている。しかしながらこれらの文献は、何れもイミダゾ[1,2-a]ピリジン骨格を有する化合物を開示又は示唆をするものではない。
更に、sGC活性化剤として、下記式(d)の化合物が報告されている(特許文献2)。
しかしながら当該文献はイミダゾ[1,2-a]ピリジン骨格を有する化合物を開示又は示唆するものではない。
当該文献は、sGC活性化剤を開示又は示唆するものではなく、また後記本発明の式(I)の化合物はその3位にアミノカルボニル基を有する点において、式(e)の化合物と構造を異にする。
当該文献はsGC活性化剤を開示又は示唆するものではなく、また後記本発明の式(I)の化合物はその3位にアミノカルボニル基を有する点において、式(f)の化合物と構造を異にする。
当該文献はsGC活性化剤を開示又は示唆するものではなく、また後記本発明の式(I)の化合物はその3位にアミノカルボニル基を有する点において、式(g)の化合物と構造を異にする。
当該文献はsGC活性化剤を開示又は示唆するものではなく、また後記本発明の式(I)の化合物はその3位にアミノカルボニル基を有する点において、式(h)の化合物と構造を異にする。
当該文献は、X、Y及びZがCHであり、nが0であり、R1が-C(O)N(R4)2であり、R2がC1-10アルキルであり、mが1であり、R3が-OR6であり、かつR6がH、メチル又はジフルオロメチルである化合物を具体的に開示する。しかしながら当該文献はsGC活性化剤を開示又は示唆するものではなく、また後記本発明の式(I)で示される化合物はその置換基A1が低級アルキルである点において、当該文献に開示される具体的化合物とは構造を異にする。
A1:R0、-R00-(アリール)、ハロゲノ低級アルキル、置換されていてもよいシクロアルキル、置換されていてもよいヘテロシクロアルキル、置換されていてもよいアリール又は置換されていてもよいヘテロアリール、
R0:同一又は互いに異なって、低級アルキル、
R00:同一又は互いに異なって、低級アルキレン、
R1:H、R0、ハロゲン、-CN、-CO2H、-CO2R0、又は-R00-OH、
R2:H、R0、C3-6シクロアルキル又はハロゲノ低級アルキル、
R3:H、R0、-R00-CO2H又は-R00-CO2R0、
R4:-Y-A2又はA3、或いはR3とR4が結合するN原子とともに一体となり、-OH、-R00-OH、-CO2H、-CO2R0及びフェニルからなる群より選択される1以上の基で置換されていてもよい含窒素飽和ヘテロ環を形成してもよい、
Y:G2群から選択される1以上の基で置換されていてもよいC1-10アルキレン、G2群から選択される1以上の基で置換されていてもよいC2-10アルケニレン又は-SO2-(G2群から選択される1以上の基で置換されていてもよい低級アルキレン)-、
G2群:-CO2H、-CO2R0、-OH、-OR0、-O-CO-R0、-OSi(R0)3、-NH2、-NHR0、-N(R0)2、-NH-CO-R0、-SR0、-CO-NH-SO2-R0、置換されていてもよいアリール及び置換されていてもよいヘテロアリール、
A2:H、-OH、-O-CO-R0、-O-(アリール)、-CO-R0、-CO-R00-OH、-CO2-R00-(アリール)、-CO-NH2、-CO-NHR0、-CO-N(R0)2、置換されていてもよいシクロアルキル、置換されていてもよいヘテロシクロアルキル、置換されていてもよいアリール又は置換されていてもよいヘテロアリール、
A3:H、G1群から選択される1以上の基で置換されていてもよいシクロアルキル、G1群から選択される1以上の基で置換されていてもよいヘテロシクロアルキル、G1群から選択される1以上の基で置換されていてもよいアリール又はG1群から選択される1以上の基で置換されていてもよいヘテロアリール、
G1群:R0、ハロゲノ低級アルキル、-R00-OH、ハロゲン、オキソ、-NO2、-OH、-OR0、-O-R00-N(R0)2、-NH2、-CO-R0、-CO-R00-OH、-CO2H、-CO2R0、-CO-NH2、-CO-NHR0、-CO-N(R0)2、-CO2-R00-(フェニル)、-SO2-R0、-SO2-NH2、-SO2-NHR0、-SO2-N(R0)2、-SO2-R00-CO2H、-SO2-R00-CO2R0、-SO2-(フェニル)、-SO2-R00-(フェニル)、-R00-CO2H、-R00-CO2R0、-R00-CO-NH2、-R00-CO-NHR0、-R00-CO-N(R0)2、-R00-NH2、-R00-NHR0、-R00-N(R0)2、-R00-(フェニル)、-R00-(フェニレン)-R0、-R00-(シクロアルキル)、-R00-(ヘテロシクロアルキル)、-R00-(単環式含窒素ヘテロアリール)、シクロアルキル、フェニル、-(フェニレン)-R0、-(フェニレン)-CO2H、-(フェニレン)-CO2R0、-(ピリジンジイル)-CO2H、-(ピリジンジイル)-CO2R0、-(ピペリジンジイル)-R0、-(フェニレン)-R00-CO2H、-R00-(フェニレン)-CO2H、-R00-(フェニレン)-CO2R0、単環式含窒素ヘテロアリール及びヘテロシクロアルキル、
R5:同一又は互いに異なって、H又はR0、
ただし、式(I)の化合物は、8-(ベンジロキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド及び8-(ベンジロキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル](ピペラジン-1-イル)メタノンであることはない。)
なお、特に記載がない限り、本明細書中にある化学式中の記号が他の化学式においても用いられる場合、同一の記号は同一の意味を示す。
また、本発明は、sGCが関与する心血管疾患の治療又は予防用医薬組成物の製造のための式(I)の化合物又はその塩の使用、sGCが関与する心血管疾患治療又は予防のための式(I)の化合物又はその塩の使用、sGCが関与する心血管疾患治療又は予防のための式(I)の化合物又はその塩、及び、式(I)の化合物又はその塩の有効量を対象に投与することからなるsGCが関与する心血管疾患の治療又は予防方法に関する。なお、「対象」とは、その治療又は予防を必要とするヒト又はその他の動物であり、ある態様としては、その治療又は予防を必要とするヒトである。
本明細書において、「心血管疾患」とは、心臓および血管など循環器の変調に基づく疾患である。これらのうち、「sGCが関与する心血管疾患」とは、NO/sGC/cGMP系が関与することが知られ、sGC活性化によって治療又は予防しうる心血管疾患であり、例えば、高血圧症(肺高血圧症を含む)、アテローム性動脈硬化症、腰部脊柱管狭窄症、末梢動脈疾患、間歇性跛行、重症下肢虚血、安定もしくは不安定狭心症、心不全、血栓症、脳卒中、性機能不全等である。「sGCが関与する心血管疾患」の別の態様としては末梢動脈疾患に伴う間歇性跛行及び重症下肢虚血であり、また別の態様としては末梢動脈疾患に伴う間歇性跛行であり、また別の態様としては末梢動脈疾患に伴う重症下肢虚血である。
ここに、末梢動脈疾患としては、閉塞性血栓性血管炎、末梢動脈閉塞症、レイノー病又はレイノー症候群が挙げられる。
「末梢動脈疾患」は動脈硬化、血栓形成等の原因により動脈が狭窄・閉塞し、末梢、特に下肢が阻血状態に陥り、冷感、間歇性跛行、疼痛、重症下肢虚血(下肢の潰瘍・壊死)などの症状を呈する疾患である。末梢動脈疾患の診断と治療のガイドラインについて、下記文献を参照することができる。
Eur. J. Vasc. Endovasc. Surg, 2007, 33(1), S1
「間歇性跛行」のある態様としては、末梢動脈疾患に伴う間歇性跛行であり、別の態様としては末梢動脈閉塞症に伴う間歇性跛行である。
「重症下肢虚血」のある態様としては、末梢動脈疾患に伴う重症下肢虚血であり、別の態様としては末梢動脈閉塞症に伴う重症下肢虚血である。
また、「sGCが関与する心血管疾患」の別の態様としては高血圧症又は肺高血圧症である。
上記の「高血圧症」のある態様としては、本態性高血圧症、血圧日内変動異常、腎実質性高血圧症、腎血管性高血圧症、原発性アルドステロン症、クッシング症候群、褐色脂肪腫、又は内分泌疾患に伴う高血圧症である。
上記「肺高血圧症」のある態様としては、肺動脈性肺高血圧症、心疾患に伴う肺高血圧症、慢性閉塞性肺疾患若しくは間質性肺疾患等肺疾患に伴う肺高血圧症、慢性血栓性若しくは閉塞性疾患に伴う肺高血圧症である。
「C1-10アルキレン」とは、直鎖又は分枝状の、炭素数が1から10の飽和炭化水素から任意の水素原子を2個除いた二価基であり、例えばメチレン、エチレン、トリメチレン、テトラメチレン、ペンタメチレン、ヘキサメチレン、プロピレン、メチルメチレン、エチルエチレン、1,2-ジメチルエチレン、1,1,2,2-テトラメチルエチレン等である。更に別の態様としては、メチレン又はエチレンであり、また更に別の態様としてはメチレンである。
「低級アルキレン」とは、上記「C1-10アルキレン」のうち、「C1-6アルキレン」を意味し、ある態様としてはメチレン、エチレン、トリメチレン等であり、別の態様としてはメチレン又はエチレンである。
「C2-10アルケニレン」とは、二重結合を有する、直鎖又は分枝状の、炭素数が2から10の炭化水素から任意の水素原子2個を除いた二価基である。ある態様としてはエチリデン、プロペニレン、又はブテニレンであり、別の態様としてはエチリデンであり、また更に別の態様としてはtrans-1,2-エチリデンである。
「シクロアルキル」とは、C3-10の飽和炭化水素環基であり、架橋を有していてもよく、もうひとつのシクロアルキルとスピロ環を形成していてもよく、一部不飽和結合を有していてもよく、ベンゼン環、フラン環、チオフェン環及びピロール環から選択される環と縮環していてもよい。「シクロアルキル」の例としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、アダマンチル、インダニル、テトラヒドロナフチル、インダニル、インデニル、シクロヘキセニル、スピロ[3.5]ノニル、ジヒドロシクロペンタチエニル、ジヒドロシクロペンタフラニル、ジヒドロシクロペンタピロリル等であり、ある態様としては、単環のC3-8シクロアルキルであり、別の態様としては、シクロへキシルであり、更に別の態様としては、インダニルである。ここで、上記のピロール環と縮合する場合は、ピロール環の炭素-炭素結合で縮合する。
「ハロゲノ低級アルキル」とは、1個以上のハロゲンで置換された、C1-6アルキルであり、ある態様としては、1~5個のハロゲンで置換されたC1-6アルキルであり、別の態様としては、ジフルオロメチル又はトリフルオロメチルである。
「アリール」とは、C6-14の単環から三環までの芳香族炭化水素環基であり、ある態様としてはフェニル又はナフチルであり、別の態様としてはフェニルである。
「ヘテロアリール」とは、環の構成原子として、N、O及びSから選択される1~6個のヘテロ原子を有する、単環から三環までの5~14員環の芳香族性環基を意味する。「ヘテロアリール」のある態様としては、単環のヘテロアリールであり、例えば、ピリジル、ピリミジニル、トリアジニル、フリル、チエニル、ピロリル、イミダゾリル、ピラゾリル、テトラゾリル、オキサゾリル、チアゾリル、イソオキサゾリル等である。別の態様としては、二環式ヘテロアリールであり、例えばインドリル、キノリル、キノキサリニル等である。更に別の態様としては、ピリジル、チエニル又はインドリルである。
「単環式含窒素ヘテロアリール」とは、上記「ヘテロアリール」のうち、環の構成原子として、窒素原子を含む単環のものを意味する。ある態様としては、ピリジル、ピリミジニル、チアゾリル、ピラゾリル、又はオキサジアゾリルであり、別の態様としてはピリジルである。
更にG2群のある態様としては、無置換のアリール及び無置換のヘテロアリールである。
(1)A1が、シクロアルキル、又は1以上のハロゲンで置換されていてもよいフェニルである式(I)の化合物又はその塩。別の態様としては、A1が、シクロへキシル、又は1以上のFで置換されていてもよいフェニルである式(I)の化合物又はその塩。更に別の態様としては、A1がシクロへキシルである、式(I)の化合物又はその塩。更に別の態様としては、A1が1以上のFで置換されていてもよいフェニルである式(I)の化合物又はその塩。更に別の態様としては、A1がシクロへキシル、2-フルオロフェニル、2,3-ジフルオロフェニル、2,6-ジフルオロフェニル又は2,3,6-トリフルオロフェニルである、式(I)の化合物又はその塩。
(2)R1がHである、式(I)の化合物又はその塩。
(3)R2がメチルである、式(I)の化合物又はその塩。
(4)R3がHである、式(I)の化合物又はその塩。
(5)R4が、-Y-A2である、式(I)の化合物又はその塩。別の態様としてはR4が、A3である、式(I)の化合物又はその塩。
(5-1)R4が、-Y-A2であり、A2がH、-OH又は-CONH2、或いは-OH、オキソ、-OR0、-O-R00-CO2R0、-O-R00-CO2H、-CO-R0、-NH2、-NHR0、-N(R0)2、-NH-R00-OH、-CO2H、-CO2R0、-SO2-R0、-R00-CO2H、-R00-CO2R0、ハロゲン、フェニル、モルホリル、(カルボキシ又はアルコキシカルボニルで置換されていてもよいピペリジル)、R0及びハロゲノ低級アルキルからなる群より選択される1以上の基でそれぞれ置換されていてもよい、フェニル、ピリジル、ピリミジニル、トリアジニル、ピロリル、ピラゾリル、チエニル、フリル、チアゾリル、オキサゾリル、イソオキサゾリル、イソキサジアゾリル、テトラゾリル、キノキサゾリル、ピペリジル、ピペラジル、モルホリル、チオモルホリル、テトラヒドロピラニル、テトラヒドロチオピラニル、キヌクリジル又は単環のC3-8シクロアルキルである、式(I)の化合物又はその塩。別の態様としては、R4が、-Y-A2であり、A2がH、ピリジル、或いはR0、ハロゲン及び-CO2Hからなる群より選択される1以上の基で置換されていてもよいフェニルである、式(I)の化合物又はその塩。更に別の態様としては、R4が-Y-A2であり、A2がH、ピリジル、或いは-CO2Hで置換されていてもよいフェニルである、式(I)の化合物又はその塩。
(5-2)R4が、-Y-A2であり、YがG2群から選択される1以上の基で置換されていてもよい、C1-10アルキレン、G2群から選択される1以上の基で置換されていてもよいC2-10アルケニレン又は-SO2-(G2群から選択される1以上の基で置換されていてもよい低級アルキレン)-である、式(I)の化合物又はその塩。別の態様としては、R4が、-Y-A2であり、YがG2群から選択される1以上の基で置換されていてもよいC1-10アルキレン又はG2群から選択される1以上の基で置換されていてもよいC2-10アルケニレンである、式(I)の化合物又はその塩。更に別の態様としては、R4が、-Y-A2であり、YがG2群から選択される1以上の基でそれぞれ置換されていてもよいC1-6アルキレンである、式(I)の化合物又はその塩。ここに、G2群のある態様としては、ハロゲン、-OR0及びR0からなる群より選択される1以上の基で置換されていてもよいフェニル、ピリジル、チエニル、シクロペンチル、シクロへキシル、-CO2H、-CO2R0、-OH及び-OR0であり、G2群の別の態様としては、ピリジル、フェニル及びシクロへキシルであり、更に別の態様としては、-CO2H、-CO2R0、-OH及び-OR0であり、更に別の態様としては、-CO2H、-CO2R0及び-OHである。
(5-3)R4が、A3であり、A3が、シクロアルキル又はヘテロシクロアルキルである、式(I)の化合物又はその塩。別の態様としては、R4がA3であり、A3がヘテロシクロアルキルである、式(I)の化合物又はその塩。更に別の態様としては、R4がA3であり、A3がシクロアルキルである、式(I)の化合物又はその塩。更に別の態様としては、R4が、A3であり、A3が、G1群から選択される1以上の基で置換されていてもよいピロリジル、G1群から選択される1以上の基で置換されていてもよいピペリジル又はG1群から選択される1以上の基で置換されていてもよいピペラジルである、式(I)の化合物又はその塩。更に別の態様としては、R4が、A3であり、A3がG1群から選択される1以上の基で置換されていてもよい単環のC3-8シクロアルキル又はG1群から選択される1以上の基で置換されていてもよいインダニルである、式(I)の化合物又はその塩。更に別の態様としては、R4が、A3であり、A3がG1群から選択される1以上の基で置換されていてもよいピペリジル又はG1群から選択される1以上の基で置換されていてもよいピロリジルである、式(I)の化合物又はその塩。更に別の態様としては、R4が、A3であり、A3がG1群から選択される1以上の基で置換されていてもよいインダニルである、式(I)の化合物又はその塩。ここに、
G1群のある態様としては、R0、-R00-OH、ハロゲン、オキソ、-OH、-OR0、-CO-R0、-CO-R00-OH、-CO2H、-CO2R0、-CO-NH2、-CO2-R00-(フェニル)、-SO2-R0、-SO2-NH2、-SO2-NHR0、-SO2-R00-CO2H、-SO2-R00-CO2R0、-SO2-(フェニル)、-R00-CO2H、-R00-CO2R0、-R00-(フェニル)、シクロアルキル、フェニル、-(フェニレン)-CO2R0、-(ピペリジンジイル)-R0、-R00-(フェニレン)-CO2H及び-R00-(フェニレン)-CO2R0であり、別の態様としては、G1群が、ハロゲン、-OH、-CO2H、-CO2R0、-CO2-R00-(フェニル)、-SO2-R00-CO2R0、-R00-CO2H、-R00-CO2R0、及びフェニル であり、更に別の態様としては、R0であり、更に別の態様としては、ハロゲン、R0、-CO2H及び-OHであり、更に別の態様としては、ハロゲン、R0、-CO2H及び-OHであり、更に別の態様としては、-OH、フェニル及び-SO2-NH2である、式(I)の化合物又はその塩。
(5-4)下記(5-5)及び(5-6)からなる化合物群から選択される式(I)の化合物又はその塩。
(5-5)R4がA3であり、A3がヘテロシクロアルキルであり、G1群がR0、-R00-OH、ハロゲン、オキソ、-OH、-OR0、-CO-R0、-CO-R00-OH、-CO2H、-CO2R0、-CO-NH2、-CO2-R00-(フェニル)、-SO2-R0、-SO2-NH2、-SO2-NHR0、-SO2-R00-CO2H、-SO2-R00-CO2R0、-SO2-(フェニル)、-R00-CO2H、-R00-CO2R0、-R00-(フェニル)、シクロアルキル、フェニル、-(フェニレン)-CO2R0、-(ピペリジンジイル)-R0、-R00-(フェニレン)-CO2H及び-R00-(フェニレン)-CO2R0である、式(I)の化合物又はその塩。
(5-7)R4がA3であり、A3がシクロアルキルであり、G1群がハロゲン及びR0である、式(I)の化合物又はその塩。
(5-9)下記(5-10)、(5-11)及び(5-13)からなる化合物群から選択される式(I)の化合物又はその塩。
(5-10)R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよいピロリジル、G1群から選択される1以上の基で置換されていてもよいピペリジル又はG1群から選択される1以上の基で置換されていてもよいピペラジルであり、G1群がR0である、式(I)の化合物又はその塩。
(5-11)R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよい単環のC3-8シクロアルキル又はG1群から選択される1以上の基で置換されていてもよいインダニルであり、G1群がハロゲン、-CO2H及び-OHである、式(I)の化合物又はその塩。
(5-12-2)R4がA3であり、A3がG1群から選択される1以上の基でそれぞれ置換されていてもよいインダニルであり、G1群が、ハロゲン、-CO2H、-CO2R0、-R00-OH及び-OHである、式(I)の化合物又はその塩。
(5-12-3)R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよいテトラヒドロナフチルであり、G1群が-CO2H及び-CO2R0である、式(I)の化合物又はその塩。
(5-12-4)R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよいジヒドロベンゾフラニルであり、G1群が-CO2H及び-CO2R0である、式(I)の化合物又はその塩。
(5-14-1)R4がA3であり、A3が式(A)で示される基である、上記(5-14)の化合物又はその塩。
(5-14-2)R4がA3であり、A3が式(B)で示される基である、上記(5-14)の化合物又はその塩。
(5-14-3)R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-である、上記(5-14)の化合物又はその塩。
(5-14-4)R4がA3であり、A3が式(A)で示される基であり、XがSである、上記(5-14)の化合物又はその塩。
(5-14-5)R4がA3であり、A3が式(B)で示される基であり、XがSである、上記(5-14)の化合物又はその塩。
(5-14-6)R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが1である、上記(5-14)の化合物又はその塩。
(5-14-7)R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが2である、上記(5-14)の化合物又はその塩。
(5-14-8)R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、R6が、H、F又はメチルであり、また別の態様としてはF又はメチルであり、また別の態様としてはHであり、また別の態様としてはFであり、また別の態様としてはメチルである、上記(5-14)の化合物又はその塩。
(5-14-9)R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、R7が-CO2H又は-CO2R0であり、また別の態様としては-CO2Hであり、また別の態様としては-CO2R0である、上記(5-14)の化合物又はその塩。
(5-14-10)XがS又は-HC=CH-である、上記(5-14)の化合物又はその塩。
(5-16)R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよい1,3-ジオキサンであり、G1群がR0で置換されていてもよいフェニル、R0及びピリジルである、式(I)の化合物又はその塩。
(5-18)R4がA3であり、A3が下記式(F)で示される基であり、
(5-19)R4が-Y-A2であり、-Y-A2が下記式(G)で示される基であり、
(7)上記(1)~(4)、(5)~(5-5)、(5-9)~(5-12)、(5-13)及び(6)に記載の基のうち、二以上の組み合わせからなる化合物又はその塩。
(8)R3がHであり、R5がそれぞれがHである、式(I)の化合物又はその塩。
(9)R2がメチルであり、R1がHである、上記(8)の化合物又はその塩。
(10)A1がシクロへキシル又は1以上のFで置換されていてもよいフェニルである上記(9)の化合物又はその塩。
(11a)下記(11-1)、(11-2)及び(11-3)からなる化合物群から選択される化合物又はその塩。
(11-1)R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよいピロリジル又はG1群から選択される1以上の基で置換されていてもよいピペリジルであり、G1群がR0である、上記(10)の化合物又はその塩。
(11-2)R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよいインダニルであり、G1群がハロゲン、-CO2H及び-OHである、上記(10)の化合物又はその塩。
(11-3)R4が-Y-A2であり、YがG2群から選択される1以上の基で置換されていてもよいC1-10アルキレンであり、G2群が-CO2H及び-OHであり、A2がH、或いは-CO2Hで置換されていてもよいフェニルである、上記(10)の化合物又はその塩。
(11b)上記(11-1)、下記(11-4)及び(11-5)からなる化合物群から選択される化合物又はその塩。
(11-4)R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよいインダニルであり、G1群がハロゲン、R0、-CO2H及び-OHである、上記(10)の化合物又はその塩。
(11-5)R4が-Y-A2であり、YがG2群から選択される1以上の基で置換されていてもよいC1-10アルキレンであり、G2群が-CO2H及び-OHであり、A2がH、或いはR0、ハロゲン及び-CO2Hからなる群より選択される1以上の基で置換されていてもよいフェニルである、上記(10)の化合物又はその塩。
(11-6)R4が-Y-A2であり、-Y-A2が式(C)で示される基であり、R8がHである、上記(10)の化合物又はその塩。
(11-7)R4がA3であり、A3がG1から選択される1以上の基でそれぞれ置換されていてもよいシクロペンチル又はピペリジルであり、G1群が-OH、フェニル及び-SO2-NH2である、上記(10)の化合物又はその塩。
(11-8)R4がA3であり、A3がG1から選択される1以上の基でそれぞれ置換されていてもよいインダニルであり、G1が-CO2H及び-OHである、上記(10)の化合物又はその塩。
(11-9)A1がシクロへキシル、又は1以上のFで置換されていてもよいフェニルであり、R1がHであり、R2がR0であり、R3がHであり、R5がHであり、
R4が-Y-A2又はA3であり、
Yが、G2群から選択される1以上の基で置換されていてもよいC1-10アルキレンであり、
G2群が-CO2H及び-OHであり、
A2がH、シクロアルキル、ピリジル、又は、低級アルキル及び-CO2Hから選択される基で置換されていてもよいフェニルであり、
A3が、G1群から選択される1以上の基で置換されていてもよい、シクロペンチル、インダニル、ジヒドロシクロペンタチエニル、ジヒドロシクロペンタフラニル及びジヒドロシクロペンタピロリルから選択されるシクロアルキル、又は、G1群から選択される1以上の基で置換されていてもよいピペリジル又はピロリジルであり、かつG1群がR0、ハロゲン、-CO2H、-OH、-CO2R0、-CN、-NO2、フェニル、-SO2-NH2、-SO3H及び-SO3R0である、式(I)の化合物又はその塩。
(12-1)A1がシクロへキシル、2-フルオロフェニル、2,3-ジフルオロフェニル、2,6-ジフルオロフェニル又は2,3,6-トリフルオロフェニルであり、R4が下記式(A)、(B)、(C)、(D)、(E)、(F)又は(G)の何れかで示される基であり、
(12-2)A1がシクロへキシル、2-フルオロフェニル、2,3-ジフルオロフェニル、2,6-ジフルオロフェニル又は2,3,6-トリフルオロフェニルであり、R1がHであり、R2がR0であり、R3がHであり、R4が-Y-A2であり、YがG2群から選択される1以上の基で置換されていてもよいC1-10アルキレンであり、G2群が-CO2H及び-OHであり、A2がH、或いは-CO2Hで置換されていてもよいフェニルである、式(I)の化合物又はその塩。
(12-2-1)R2がメチルであり、R4が式(C)又は(D)で示される基である、上記(12-1)に記載の化合物又はその塩。
(12-2-2)R2がメチルであり、R4が式(E)で示される基である、上記(12-1)に記載の化合物又はその塩。
(12-3)A1がシクロへキシル、2-フルオロフェニル、2,3-ジフルオロフェニル、2,6-ジフルオロフェニル又は2,3,6-トリフルオロフェニルであり、R1がHであり、R2がR0であり、R3がHであり、R4がA3であり、A3がG1群から選択される1以上の基で置換されていてもよいインダニルであり、G1群がハロゲン、-CO2H及び-OHである、式(I)の化合物又はその塩。
(12-4)A1がシクロへキシル、2-フルオロフェニル、2,3-ジフルオロフェニル、2,6-ジフルオロフェニル又は2,3,6-トリフルオロフェニルであり、R1がHであり、R2がR0であり、R3がHであり、R4がA3であり、A3がシクロペンチル又はピペリジルであり、G1群が-OH、フェニル及び-SO2-NH2である、式(I)の化合物又はその塩。
(12-5)A1がシクロへキシル、2-フルオロフェニル、2,3-ジフルオロフェニル、2,6-ジフルオロフェニル又は2,3,6-トリフルオロフェニルであり、R1がHであり、R2がR0であり、R3がHであり、R4がA3であり、R5がHであり、A3がG1群から選択される1以上の基で置換されていてもよいインダニルであり、G1群が-CO2H及び-OHである、式(I)の化合物又はその塩。
(13)A1が2,6-ジフルオロフェニルであり、R2がメチルであり、R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが1であり、R5がそれぞれがHであり、R6がF又はメチルであり、R7が-CO2Hである、上記(12-1)に記載の化合物又はその塩。
(14)R6がFである、上記(13)に記載の化合物又はその塩。
(15)R6がメチルである、上記(13)に記載の化合物又はその塩。
(16)A1がシクロアルキルであり、R1がHであり、R2がメチルであり、R3がHであり、Xが-HC=CH-であり、nが1であり、R5がそれぞれがHであり、R6がF又はメチルであり、R7が-CO2Hである、上記(12)に記載の化合物又はその塩。
(17)R6がFである、上記(16)に記載の化合物又はその塩。
(17-1)A1がシクロへキシル又は2,6-ジフルオロフェニルであり、R2がメチルであり、R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが1であり、R5がそれぞれがHであり、R6がHであり、R7が-CO2Hである、上記(12-1)に記載の化合物又はその塩。
(18)R6がメチルである、上記(16)に記載の化合物又はその塩。
(19)A1が2,3,6-トリフルオロフェニルであり、R1がHであり、R2がメチルであり、R3がHであり、R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが1であり、R5がそれぞれがHであり、R6がHであり、R7が-CO2Hである、式(I)の化合物又はその塩。
(20)A1がシクロアルキルであり、R1がHであり、R2がメチルであり、R3がHであり、R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが1であり、R5がそれぞれがHであり、R6がHであり、R7が-CO2Hである、式(I)の化合物又はその塩。
(21)A1が2,6-ジフルオロフェニルであり、R1がHであり、R2がメチルであり、R3がHであり、R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが1であり、R5がそれぞれがHであり、R6がHであり、R7が-CO2Hである、式(I)の化合物又はその塩。
(22)R2がメチルであり、R4が式(F)で示される基である、上記(12-1)に記載の化合物又はその塩。
(23)R2がメチルであり、R4が式(G)で示される基である、上記(12-1)に記載の化合物又はその塩。
(3S)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-3-フェニルプロパン酸、
(1S,2R)-1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a] ピリジン-3-イル}カルボニル)アミノ]インダン-2-カルボン酸、
(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)インダン-2-カルボン酸、
(1R,2S)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)インダン-2-カルボン酸、
8-[(2,6-ジフルオロベンジル)オキシ]-N-(1,3-ジヒドロキシ-2-フェニルプロパン-2-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
(1S,2R)-1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]-7-フルオロインダン-2-カルボン酸、
(1S,2R)-1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]-4-メチルインダン-2-カルボン酸、
(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-5-フルオロインダン-2-カルボン酸、
(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-7-フルオロインダン-2-カルボン酸、
(1R,2S)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-7-フルオロインダン-2-カルボン酸、
(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-4-メチルインダン-2-カルボン酸、
(1S,2R)-1-[({2-メチル-8-[(2,3,6-トリフルオロベンジル)オキシ]イミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]インダン-2-カルボン酸、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R)-2-ヒドロキシ-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル) オキシ-N-[(1R,2R)-2-ヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,3-ジフルオロベンジル)オキシ]-N-(1,3-ジヒドロキシ-2-フェニルプロパン-2-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[1,3-ジヒドロキシ-2-(ピリジン-2-イル)プロパン-2-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-(シクロへキシルメトキシ)-N-[(1R)-2-ヒドロキシ-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(2R)-1-ヒドロキシプロパン-2-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(2R)-1-ヒドロキシ-3-メチルブタン-2-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
N-(1,3-ジヒドロキシ-2-フェニルプロパン-2-イル)-8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R,2S,3S)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,3-ジフルオロベンジル)オキシ]-N-[(1R,2S,3S)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
N-[(1R,2S,3S)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R,2S,3R)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,3-ジフルオロベンジル)オキシ]-N-[(1R,2S,3R)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
N-[(1R,2S,3R)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1r,3R,4S)-3,4-ジヒドロキシ-1-フェニルシクロペンチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1s,3R,4S)-3,4-ジヒドロキシ-1-フェニルシクロペンチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその製薬学的に許容される塩。
8-(シクロへキシルメトキシ)-2-メチル-N-[(3S)-1-メチルピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド、
(3R)-3-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-5-メチルヘキサン酸、
8-(シクロへキシルメトキシ)-N-(1,3-ジヒドロキシプロパン-2-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-(シクロへキシルメトキシ)-2-メチル-N-[(3S)-1-メチルピロリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド、
3-[(1S)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)エチル]安息香酸、
8-[(2,6-ジフルオロベンジル)オキシ]-N-(1-ヒドロキシ-2-メチルプロパン-2-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R,2S)-2,3-ジヒドロキシ-1-フェニルプロピル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
(3R)-4-シクロブチル-3-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a] ピリジン-3-イル]カルボニル}アミノ)ブタン酸、
8-[(2,6-ジフルオロベンジル)オキシ]-2-メチル-N-[(3S)-1-スルファモイルピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
8-[(2,6-ジフルオロベンジル)オキシ]-2-メチル-N-[(3S)-ピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。
また、式(I)の化合物は、不斉炭素原子や軸不斉を有する場合があり、これに基づく光学異性体が存在しうる。本発明は、式(I)の化合物の光学異性体の分離したもの、あるいはそれらの混合物も包含する。
式(I)の化合物及びその塩は、その基本骨格あるいは置換基の種類に基づく特徴を利用し、種々の公知の合成法を適用して製造することができる。その際、官能基の種類によっては、当該官能基を原料乃至中間体の段階で適当な保護基(容易に当該官能基に転化可能な基)に置き換えておくことが製造技術上効果的な場合がある。このような官能基としては例えば、ウッツ(P. G. M. Wuts)及びグリーン(T. W. Greene)著、「Greene's Protective Groups in Organic Synthesis (第4版、2006年)」に記載の保護基等を挙げることができ、これらを反応条件に応じて適宜選択して用いればよい。このような方法では、当該保護基を導入して反応を行ったあと、必要に応じて保護基を除去することにより、所望の化合物を得ることができる。
また、式(I)の化合物のプロドラッグは、上記保護基と同様、原料から中間体へ至る段階で特定の基を導入、あるいは得られた式(I)の化合物を用いてさらに反応を行うことで製造できる。反応は通常のエステル化、アミド化、脱水等、当業者により公知の方法を適用することにより行うことができる。
以下、式(I)の化合物の代表的な製造法を説明する。各製法は、当該説明に付した参考文献を参照して行うこともできる。なお、本発明の製造法は以下に示した例には限定されない。
(第一製法)
本製法では、化合物(II)と化合物(III)とを等量若しくは一方を過剰量用い、これらの混合物を、縮合剤の存在下、反応に不活性な溶媒中、冷却下から加熱下、好ましくは-20℃~60℃において、通常0.1時間~5日間攪拌する。ここで用いられる溶媒の例としては、特に限定はされないが、ベンゼン、トルエン若しくはキシレン等の芳香族炭化水素類、ジクロロメタン、1,2-ジクロロエタン若しくはクロロホルム等のハロゲン化炭化水素類、ジエチルエーテル、テトラヒドロフラン(THF)、ジオキサン、ジメトキシエタン等のエーテル類、N,N-ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、酢酸エチル、アセトニトリル又は水、及びこれらの混合物が挙げられる。縮合剤の例としては、1-(3-ジメチルアミノプロピル)-3-エチルカルボジイミド(WSC)、ジシクロヘキシルカルボジイミド(DCC)、1,1’-カルボニルジイミダゾール(CDI)、ジフェニルリン酸アジド(DPPA)、オキシ塩化リンが挙げられるが、これらに限定されるものではない。添加剤(例えば1-ヒドロキシベンゾトリアゾール)(HOBt)を用いることが反応に好ましい場合がある。トリエチルアミン(TEA)、N,N-ジイソプロピルエチルアミン(DIPEA)若しくはN-メチルモルホリン(NMM)等の有機塩基、又は炭酸カリウム、炭酸ナトリウム若しくは水酸化カリウム等の無機塩基の存在下で反応を行うことが、反応を円滑に進行させる上で有利な場合がある。
また、化合物(II)を反応性誘導体へ変換した後に化合物(III)と反応させる方法も用いることができる。化合物(II)の反応性誘導体の例としては、オキシ塩化リン、塩化チオニル等のハロゲン化剤と反応して得られる酸ハロゲン化物、クロロギ酸イソブチル等と反応して得られる混合酸無水物、1-ヒドロキシベンゾトリアゾール等と縮合して得られる活性エステル等が挙げられる。これらの反応性誘導体と化合物(III)との反応は、ハロゲン化炭化水素類、芳香族炭化水素類、エーテル類等の反応に不活性な溶媒中、冷却下~加熱下、好ましくは、-20℃~60℃で行うことができる。本反応の参考文献としては、例えば、以下を参照することができる。
S. R. Sandler及びW. Karo著、「Organic Functional Group Preparations」、第2版、第1巻、Academic Press Inc.、1991年
日本化学会編「実験化学講座(第5版)」16巻(2005年)(丸善)
また、本製法で製造した式(I)の化合物を原料とし、更なる式(I)の化合物を製造することができる(詳細は後述の実施例を参照)。
また、式(I)の化合物は、化合物(IV)、及び化合物(Va)或いは化合物(Vb)との反応により製造することができる。
化合物(Va)を用いる製造法では、公知のジアゾカルボン酸エステル類又はジアゾカルボン酸アミド類を公知のホスフィン類とともに用いる方法、或いは(トリブチルホスホラニリデン)アセトニトリル(角田試薬)等を用いる、いわゆる光延反応又はその変法であり、これらは当業者によく知られた反応である。
本反応では、化合物(IV)と化合物(V)を等量若しくは一方を過剰量用い、これらの混合物を、反応に不活性な溶媒中、冷却下から加熱還流下、好ましくは0℃から150℃において、通常0.1時間~5日間攪拌する。ここで用いられる溶媒の例としては、特に限定はされないが、芳香族炭化水素類、エーテル類、ハロゲン化炭化水素類、DMF、DMSO、酢酸エチル、アセトニトリル及びこれらの混合物が挙げられる。
本反応の参考文献としては、例えば以下を参照することができる。
Mitsunobu, O.; Synthesis (1981), 1
Tsunoda, T. et al., Tetrahedron Letters (1995) 36, 2529, ibid, (1996) 37, 2463
一方で、化合物(Vb)を用いる製法では、化合物(IV)と化合物(Vb)とを等量若しくは一方を過剰量用い、これらの混合物を、塩基の存在下、反応に不活性な溶媒中、冷却下から加熱還流下、好ましくは0℃から80℃において、通常0.1時間~5日間攪拌する。ここで用いられる溶媒の例としては、特に限定はされないが、ベンゼン、トルエン、キシレン等の芳香族炭化水素類、ジエチルエーテル、テトラヒドロフラン、ジオキサン、ジメトキシエタン等のエーテル類、ジクロロメタン、1,2-ジクロロエタン、クロロホルム等のハロゲン化炭化水素類、N,N-ジメチルホルムアミド、ジメチルスルホキシド、酢酸エチル、アセトニトリル及びこれらの混合物が挙げられる。塩基の例には、トリエチルアミン、ジイソプロピルエチルアミン、1,8-ジアザビシクロ[5.4.0]-7-ウンデセン、n-ブチルリチウム等の有機塩基、炭酸ナトリウム、炭酸カリウム、水素化ナトリウム、カリウムtert-ブトキシド等の無機塩基が含まれる。塩化テトラ-n-ブチルアンモニウム等の相間移動触媒の存在下で反応を行うことが有利な場合がある。
本反応の参考文献としては、例えば以下を参照することができる。
S. R. Sandler及びW. Karo著、「Organic Functional Group Preparations」、第2版、第1巻、Academic Press Inc.、1991年
日本化学会編「実験化学講座(第5版)」14巻(2005年)(丸善)
原料化合物(II)は、化合物(VI)と化合物(VII)の反応により化合物(VIII)を製造し、次いで加水分解を行なうことにより製造することができる。
化合物(VIII)を製造する反応は、上記第一製法の反応溶媒及び温度で行なうことができる(詳細は後述の実施例を参照)。
原料化合物(IV)は、化合物(IX)及び化合物(III)の反応によって化合物(X)を製造し、次いで脱保護を行うことにより製造することができる。化合物(IX)及び化合物(III)の反応は前述の第一製法と同様にして行うことができる。また、脱保護は公知又は当業者に自明な方法によって行うことができる。
単離、精製は、抽出、分別結晶化、分画クロマトグラフィー等、通常の化学操作を適用して行われる。
各種の異性体は、適当な原料化合物を選択することにより製造でき、或いは異性体間の物理化学的性質の差を利用して分離することができる。例えば、光学異性体はラセミ体の一般的な光学分割法(例えば、光学活性な塩基または酸とのジアステレオマー塩に導く分別結晶化やキラルカラム等を用いたクロマトグラフィー等)により得られ、また、適当な光学活性な原料化合物から製造することもできる。
式(I)の化合物の薬理活性は、以下の試験により確認した。
sGCの活性を、精製ヒトsGCにより産生される環状グアノシン一リン酸(cGMP)量を測定することにより評価した。
被験化合物をDMSOに溶解し、超純水で20倍に希釈した。希釈された被験化合物溶液(最大100μM濃度)2 μL、基質溶液[0.5μM TEBA, 0.03μM dithiothreitol, 0.01μM GTP, 0.04μM MgCl2, 0.03μMニトロプルシドナトリウム(SNP)]2 μL及びヒト酵素懸濁液6 μLを384ウェルプレート(Greiner bio-one社製)に添加し、室温で1時間インキュベーションした。cGMP量の決定は、蛍光色素分子を標識したcGMPとその特異的抗体に対する競合を検出するHTRFに基づき行った。
また、sGC活性を表す別のパラメーターとして、実施例102添加時の最大活性を100%として、その50%活性を与える被験化合物濃度を示すEC50[μM]値を算出した。なお、上記試験例1に従って評価した公知のsGC活性化剤YC-1(lificiguat, [5-(1-benzyl-1H-indazol-3-yl)-2-furyl]methanol)添加時の最大活性は、実施例102添加時の最大活性の52%であった。なお「-」は未評価を意味する。
ペントバルビタール麻酔ラットにおける後肢血流増加作用は、以下の試験方法により確認した。
Wistar系雄性ラットを用いた。被験化合物にN,N-ジメチルホルムアミド、ポリエチレングリコール 400、TWEEN80、0.5%メチルセルロース水溶液、0.5M炭酸水素ナトリウム水溶液、0.1M塩酸を化合物に応じて適宜加え溶解して投与液を調製した。調製した投与液を経口投与し、その2時間後、ペントバルビタール 60 mg/kgを腹腔内投与し麻酔を施した後、後肢血流増加作用の評価を行った。後肢血流はレーザー血流画像化装置(PIM II; インテグラル)を用いて測定した。
試験例3:in vivoにおける降圧作用の測定
動物はWistar系雄性ラットを用いた。薬物投与3日前にペントバルビタール60 mg/kg i.p.麻酔下で総頚動脈よりヘパリン生理食塩水(200 U/mL,味の素ファルマ株式会社)を充填したカニューレ(PE-50,日本ベクトンディッキンソン株式会社)を挿入,留置した。カニューレ他端は皮下を通して,頚背部に露出した。回復期間後,留置カニューレを圧トランスデューサー(ライフキットDTS DX-100,日本光電株式会社)に接続し,ポリグラフ(AP-641G,日本光電株式会社),PowerLab(ML870 PowerLab8/30,エー・ディー・インスツルメンツ・ジャパン)を介して,血圧波形を記録した。心拍数は心拍計(AT-601G,日本光電)を用いて算出した。血圧の安定後,薬物を単回経口投与し,血圧および心拍数を経時的に測定した。被験化合物はN,N-ジメチルホルムアミド、ポリエチレングリコール 400、TWEEN80、0.5%メチルセルロース水溶液、0.5M炭酸水素ナトリウム水溶液、0.1M塩酸を化合物に応じて適宜加え溶解して投与した。
投与は錠剤、丸剤、カプセル剤、顆粒剤、散剤、液剤等による経口投与、又は、関節内、静脈内、筋肉内等の注射剤、坐剤、点眼剤、眼軟膏、経皮用液剤、軟膏剤、経皮用貼付剤、経粘膜液剤、経粘膜貼付剤、吸入剤等による非経口投与のいずれの形態であってもよい。
経口投与のための液体組成物は、薬剤的に許容される乳濁剤、溶液剤、懸濁剤、シロップ剤又はエリキシル剤等を含み、一般的に用いられる不活性な希釈剤、例えば精製水又はエタノールを含む。当該液体組成物は不活性な希釈剤以外に可溶化剤、湿潤剤、懸濁剤のような補助剤、甘味剤、風味剤、芳香剤、防腐剤を含有していてもよい。
投与経路、剤形、投与部位、賦形剤や添加剤の種類によって異なるが、本発明の医薬組成物は0.01~100重量%、ある態様としては0.01~50重量%の有効成分である1種またはそれ以上の式(I)の化合物又はその塩を含有する。
PEx:製造例番号、Ex:実施例番号、Str:構造式、Dat:物理学的データ(ESI+: ESI-MS[M+H]+またはESI-MS[M]+;ESI-:ESI-MS[M-H]-; FAB+:FAB-MS[M+H]+またはFAB-MS[M]+; EI+:EI[M]+; APCI/ESI+:APCI/ESI-MS[M+H]+またはAPCI/ESI-MS[M]+(APCI/ESIはAPCIとESIの同時測定を意味する); A/E-:APCI/ESI-MS[M-H]-(APCI/ESIはAPCIとESIの同時測定を意味する); NMR: 1HNMRにおけるピークのδ(ppm)、特に記載がない限りは400 MHz)、Me:メチル、Et:エチル、nPr:n-プロピル、iPr:イソプロピル、nBu:n-ブチル、iBu:イソブチル、tBu:tert-ブチル、cBu:シクロブチル、cPr:シクロプロピル、neoPen:ネオペンチル、cPen:シクロペンチル、nHex:n-ヘキシル、cHex:シクロへキシル、cHep:シクロへプチル、cOct:シクロオクチル、Ph:フェニル、Bn:ベンジル、Ac:アセチル、Boc:tert-ブトキシカルボニル、Z:ベンジルオキシカルボニル、TBS:tert-ブチルジメチルシリル、Syn:製造方法(Syn欄の番号は、当該化合物が、その番号を製造例化合物番号又は実施例化合物番号として有する化合物と同様の方法により、対応する原料を用いて製造したことを示す。例えばSyn欄がEx2である化合物は実施例2の化合物と同様の方法で製造し、Syn欄がPEx2である化合物は製造例2の化合物と同様の方法で製造し、Syn欄がPEx1,16である化合物は製造例1の化合物と同様の製造方法に次いで、製造例16の化合物と同様の製造方法と同様にして製造したことを意味する)、(cis):化合物の相対配置がシス体であり、ラセミ体であることを示す、(trans):化合物の相対配置がトランス体あり、ラセミ体であることを示す、(rac):化合物がラセミ体であることを示す、ラセミ体とは光学活性体及びそのエナンチオマー(鏡像異性体)の1:1の混合物であり、光学不活性の化合物を意味する。
また、本明細書の本文中において、不斉点を有する化合物について当該不斉点に結合する置換基の立体配置に関して何も説明表記がない場合は、当該置換基の立体配置は未決定であることを意味する。
また、後記の化合物表の構造式において、不斉点に結合する置換基が平面構造で描かれ、かつ当該置換基の立体配置に関して何も説明表記がない場合は、当該置換基の立体配置は未決定であることを意味する。
5-メチル-2-ニトロピリジン-3-オール1 g、(ブロモメチル)シクロヘキサン1.35 ml、及び炭酸カリウム1.79 gのDMF 10 ml懸濁液を78℃で12時間攪拌した。室温で放冷後、反応液に水及びヘキサン/酢酸エチルを加え、分液操作を行なった。有機層を水及び飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、3-(シクロヘキシルメトキシ)-5-メチル-2-ニトロピリジン1.8 gを得た。
製造例2
3-(シクロヘキシルメトキシ)-5-メチル-2-ニトロピリジン1.8 gのTHF 16 ml溶液に、10%パラジウム-炭素(含水品)325 mgを加え、水素雰囲気下3時間攪拌した。反応液をセライト濾過したのち、減圧下溶媒を留去し、3-(シクロヘキシルメトキシ)-5-メチルピリジン-2-アミン1.38 gを得た。
製造例3
3-(シクロヘキシルメトキシ)ピリジン-2-アミン2 gの酢酸10 ml溶液に氷冷下N-ブロモスクシンイミド1.90 gを30分以上かけて加え、氷冷下30分間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を水及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、5-ブロモ-3-(シクロヘキシルメトキシ)ピリジン-2-アミン2.25 gを得た。
3-(シクロヘキシルメトキシ)-5-メチルピリジン-2-アミン1.38 gのトルエン24 ml溶液に2-クロロ-3-オキソブタン酸エチル1.21 ml及びトリエチルアミン1.23 mlを加え110℃で3日間攪拌した。室温で放冷後、水及びジイソプロピルエーテルを加え分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、8-(シクロヘキシルメトキシ)-2,6-ジメチルイミダゾ[1,2-a]ピリジン-3-カルボン酸エチル1.52 gを得た。
製造例5
8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸エチル2.16 gにTHF 20 ml、エタノール40 ml、及び1M水酸化ナトリウム水溶液20 mlを加え、4日間攪拌した。減圧下溶媒を留去し、水及び1M塩酸を加え、不溶物を濾取して乾燥し、8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸1.99 gを得た。
製造例6
8-(ベンジルオキシ)-N-[(1R)-2-{[tert-ブチル(ジメチル)シリル]オキシ}-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド5.2 gのエタノール70 ml溶液に10%パラジウム-炭素(含水品)1.0 gを加え、水素雰囲気下3時間攪拌した。反応液をセライト濾過した後、減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物にヘキサン及びジイソプロピルエーテルを加えて攪拌し、生じた固体をろ取して乾燥し、N-[(1R)-2-{[tert-ブチル(ジメチル)シリル]オキシ}-1-フェニルエチル]-8-ヒドロキシ-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド3.5 gを得た。
3-シクロプロピル-3-オキソプロパン酸メチル2 gのジクロロメタン20 ml溶液に氷冷下、塩化スルフリル1.24 mlを滴下し、室温で5時間攪拌した。氷冷下、反応液に水を加え、更にクロロホルムを加えて分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧下溶媒を留去し、2-クロロ-3-シクロプロピル-3-オキソプロパン酸メチル2.48 gを得た。
製造例8
{4-アミノ-1-[(ベンジロキシ)カルボニル]ピペリジン-4-イル}酢酸300 mgのメタノール6 ml懸濁物に塩化チオニル150 μlを加え、2日間攪拌した。反応液を減圧下濃縮したのち、エーテルを加え、生じた固体をろ取して乾燥し、4-アミノ-4-(2-メトキシ-2-オキソエチル)ピペリジン-1-カルボン酸ベンジル 塩酸塩350 mgを得た。
製造例9
(ジエトキシホスホリル)酢酸 tert-ブチル1.07 gのTHF 50 ml溶液に、1.12M臭化メチルマグネシウム/THF溶液3.8 mlを加え、30分間攪拌した。得られた反応液にn-ペンタナール500 μlのTHF 5 ml溶液を加え、3時間加熱還流させた。反応液に飽和塩化アンモニウム水溶液及びエーテルを加え分液操作を行なった。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥して減圧下溶媒を留去し、(2E)-ヘプタ-2-エン酸tert-ブチル726 mgを得た。
(1R)-N-ベンジル-1-フェニルエタンアミン1.3 mlのTHF 15 ml溶液に、-78℃にて1.65M n-ブチルリチウム/ヘキサン溶液3.7 mlを滴下し、同温で1時間攪拌した。次いで同温で(2E)-ヘプタ-2-エン酸tert-ブチル710 mgのTHF 5 ml溶液をゆっくり滴下し、同温で3時間攪拌した。反応液に飽和塩化アンモニウム水溶液を加えたのち、室温まで昇温させ、酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、(3R)-3-{ベンジル[(1R)-1-フェニルエチル]アミノ}ヘプタン酸tert-ブチル1.27 gを得た。なお、生成物の構造はS.G.Davisらの文献(Tetrahedron Asymmetry, 17 (2006) 1793-1811など)を参考に決定した。
製造例11
(3R)-3-{ベンジル[(1R)-1-フェニルエチル]アミノ}ヘプタン酸tert-ブチル1.15 gのメタノール30 ml溶液に10%パラジウム-炭素450 mgを加え、4気圧水素雰囲気下、一終夜攪拌した。反応液をセライトろ過した後、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、(3R)-3-アミノヘプタン酸tert-ブチル460 mgを得た。
製造例12
8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸510 mgのジクロロメタン懸濁液に氷冷下、二塩化オキサリル0.30 mlおよびDMF 1滴 を加え、室温で30分間攪拌した。減圧下溶媒を留去し、8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸クロリド 塩酸塩603 mgを得た。
5-ヒドロキシ-6-ニトロニコチン酸メチル2 g、(2-フルオロフェニル)メタノール 1.62 ml、及びトリブチルホスフィン3.99 mlのTHF 40 ml溶液に、氷冷下、アゾジカルボン酸ジエチル2.54 mlを加え、氷冷下1時間、室温で2時間攪拌した。反応液に水及び酢酸エチルを加えて分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、5-[(2-フルオロベンジル)オキシ]-6-ニトロニコチン酸メチル2.58 gを得た。
製造例14
5-[(2-フルオロベンジル)オキシ]-6-ニトロニコチン酸メチル2.5 gのTHF 25 ml溶液にエタノール50 ml、水25 ml、塩化アンモニウム218 mg、及び鉄1.37 gを加え、2時間加熱還流した。室温放冷後、反応液をセライトろ過し、ろ液に飽和炭酸水素ナトリウム水溶液及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去し、6-アミノ-5-[(2-フルオロベンジル)オキシ]ニコチン酸メチル2.25 gを得た。
製造例15
6-アミノ-5-[(2-フルオロベンジル)オキシ]ニコチン酸メチル2.15 gのエタノール43 ml懸濁液にブロモアセトン1.09 mlを加え、80℃で4時間攪拌した。反応液にブロモアセトン 1.09 mlを加え、80℃で4時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加えた後、減圧下で溶媒を留去し、酢酸エチルで抽出し、飽和食塩水で洗浄した。無水硫酸マグネシウムで乾燥したのち、ろ過し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーにより精製し、メチル 8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-6-カルボキシラート 1.39 gを得た。
製造例16
8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-6-カルボン酸350 mgにエタノール18 mlおよび硫酸200 μlを加え、一終夜加熱還流させた。減圧下溶媒を1/3程まで留去したのち、飽和炭酸水素ナトリウム水溶液及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、エチル 8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-6-カルボキシラート330 mgを得た。
N-メチル-2-ニトロベンゼンスルホンアミド1 g、tert-ブチル [(1R)-2-ヒドロキシ-1-フェニルエチル]カルバマート2.3 g、トリフェニルホスフィン2.5 g、アゾジカルボン酸ジエチル4.2 ml、及びトルエン40 mlの混合物を80℃で2時間攪拌し、減圧下溶媒を留去した。得られた残渣のクロロホルム溶液にシリカゲルを加えてろ過し、ろ液を減圧下濃縮した。得られた残渣のジクロロメタン3 ml溶液にトリフルオロ酢酸3 mlを加え、1時間攪拌した。減圧下溶媒を留去したのち、炭酸ナトリウム水溶液及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸マグネシウムで乾燥して減圧下溶媒を留去た。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、N-[(2R)-2-アミノ-2-フェニルエチル]-N-メチル-2-ニトロベンゼンスルホンアミド890 mgを得た。
製造例18
8-(シクロヘキシルメトキシ)-N-(2,2-ジメトキシエチル)-2-メチルイミダゾロ[1,2-a]ピリジン-3-カルボキサミド200 mgのジオキサン2 mL溶液に6M塩酸を加え、7時間攪拌した。反応液に飽和食塩水及び酢酸エチルを加え、分液操作を行った。得られた水層に1M水酸化ナトリウム水溶液を加え、生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-2-メチル-N-(2-オキソエチル)イミダゾロ[1,2-a]ピリジン-3-カルボキサミド165 mgを得た。
製造例19
エチル 1-{(2R)-2-[(tert-ブトキシカルボニル)アミノ]-2-フェニルエチル}ピペリジン-4-カルボキシラート160 mgのジクロロメタン1.5 mL溶液にトリフルオロ酢酸0.7 mLを加え、1時間攪拌した。減圧下溶媒を留去したのち、飽和炭酸ナトリウム水溶液及びクロロホルム-メタノール混合溶液を順次加え、分液操作を行った。無水硫酸マグネシウムで乾燥して、減圧下溶媒を留去し、エチル 1-[(2R)-2-アミノ-2-フェニルエチル]ピペリジン-4-カルボキシラート120 mgを得た。
製造例20
(2R)-2-[(tert-ブトキシカルボニル)アミノ]-2-フェニルエチル メタンスルホナート1 gのTHF 5 mL溶液にエチル ピペリジン-4-カルボキシラート 0.4 mL及びジイソプロピルエチルアミン1 mLを加え、70℃で14時間攪拌した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、エチル 1-{(2R)-2-[(tert-ブトキシカルボニル)アミノ]-2-フェニルエチル}ピペリジン-4-カルボキシラート160 mgを得た。
tert-ブチル (2E)-3-(4-シアノフェニル)アクリラート223 mgにメタノール12 mL、THF 5 ml、酢酸 1 ml溶液及び10%パラジウム-炭素 90 mgを順次加え、3気圧の水素下3時間攪拌した。触媒をろ去し、ろ液を減圧下濃縮した。残渣に飽和炭酸水素ナトリウム水溶液及び酢酸エチルを加え、分液操作を行った。有機層を無水硫酸ナトリウムで乾燥し減て、圧下溶媒を留去し、tert-ブチル 3-[4-(アミノメチル)フェニル]プロパノアート 177 mgを得た。
製造例22
エチル 2-(4-シアノフェニル)-2-メチルプロパノアート280 mgのエタノール10 ml溶液に1M塩酸及び10%パラジウム-炭素120 mgを順次加え、3気圧の水素雰囲気下3時間攪拌した。触媒をろ去して、ろ液を減圧下濃縮て乾燥し、エチル2-[4-(アミノメチル)フェニル]-2-メチルプロパノアート 塩酸塩345 mgを得た。
製造例23
tert-ブチル (2-ブロモベンジル)カルバマート1 g、エチル (2E)-3-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)アクリラート1.12 g、酢酸パラジウム16 mg、ジシクロヘキシル(2',6'-ジメトキシビフェニル-2-イル)ホスフィン72 mg、リン酸カリウム1.5 g及びトルエン20 mLの混合液を100℃で5日間攪拌した。反応液にエーテルを加え、シリカゲルを通してろ過した。ろ液を減圧下濃縮して得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、エチル (2E)-3-(2-{[(tert-ブトキシカルボニル)アミノ]メチル}フェニル)アクリラート412 mgを得た。
製造例24
60%水素化ナトリウム320 mgのDMF 4 mL懸濁液に、氷冷下、エチル (4-シアノフェニル)アセタート500 mg及びヨウ化メチル0.41 mLのDMF 2 mL溶液を加え、室温で1日間攪拌した。反応液に水及び酢酸エチルを加え、分液操作を行った。有機層を水、及び飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。減圧下溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィーで精製し、エチル 2-(4-シアノフェニル)-2-メチルプロパノアート280 mgを得た。
(3S)-3-アミノ-2-ヒドロキシヘキサン酸 塩酸塩1 gのメタノール10 mL溶液に4M 塩化水素/ジオキサン溶液10 mLを加え、一終夜撹拌した。減圧下溶媒を留去し、飽和炭酸水素ナトリウム水溶液及びクロロホルムを加え、分液操作を行った。有機層を飽和食塩水で洗浄して、無水硫酸ナトリウムで乾燥し、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル (2R,3S)-3-アミノ-2-ヒドロキシヘキサノアート425 mg及びメチル (2S,3S)-3-アミノ-2-ヒドロキシヘキサノアート130 mgを得た。
製造例26
tert-ブチル (3S)-ピペリジン-3-イルカルバマート500 mg及び[3-(メトキシカルボニル)フェニル]ホウ酸900 mgのジクロロメタン10 mL溶液にモレキュラーシーブス4A、酢酸銅(II) 460 mg、及びトリエチルアミン0.70 mLを順次加え、一終夜攪拌した。反応液をセライトろ過したのち、ろ液に飽和炭酸水素ナトリウム水溶液及び酢酸エチルを加え、分液操作を行った。有機層を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 3-{(3S)-3-[(tert-ブトキシカルボニル)アミノ]ピペリジン-1-イル}ベンゾアート 380 mgを得た。
製造例27
tert-ブチル (3S)-ピペリジン-3-イルカルバマート300 mgのN-メチル-2-ピロリドン6 mL溶液にメチル 6-クロロピリジン-2-カルボキシラート310 mg及びジイソプロピルエチルアミン0.55 mLを加え、130℃で一終夜攪拌した。放冷後、反応液に水及び酢酸エチルを加え、分液操作を行った。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、
メチル 6-{(3S)-3-[(tert-ブトキシカルボニル)アミノ]ピペリジン-1-イル}ピリジン-2-カルボキシラート215 mgを得た。
製造例28
tert-ブチル (3S)-ピペリジン-3-イルカルバマート2.02 gに、スルファミド4.86 g及びジオキサン30 mLを加え、95℃で一終夜攪拌した。放冷後、減圧下溶媒を留去したのち、水及びクロロホルムを加え、分液操作を行った。有機層をクエン酸水溶液で洗浄し、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣に4M塩化水素-酢酸エチル溶液30 mLを加え、40分間攪拌した。生じた固体をろ取して乾燥し、(3S)-3-アミノピペリジン-1-スルファミド 塩酸塩 1.51 gを得た。
2a,3,4,8b-テトラヒドロナフト[1,2-b]アゼト-2(1H)-オン 2.36 gに10%塩化水素/メタノール溶液50 mlを加え、90℃で6時間撹拌した。放冷後、溶媒を減圧下留去した。得られた残渣にメタノール及びジエチルエーテルを加え、不溶物をろ取して乾燥し、メチル rac-(1S,2S)-1-アミノ-1,2,3,4-テトラヒドロナフタレン-2-カルボキシラート 塩酸塩 3.08 gを得た。
製造例102
rac-(1R,2R)-1-[(tert-ブトキシカルボニル)アミノ]インダン-2-カルボン酸 750 mgのメタノール 15 ml懸濁液に塩化チオニル 0.40 mlを加え、一終夜撹拌した。溶媒を約半量まで減圧下留去し、得られた残渣にジエチルエーテルを加え、不溶物をろ取して乾燥し、メチル rac-(1R,2R)-1-アミノインダン-2-カルボキシラート 塩酸塩512 mgを得た。
(2-ブロモ-5-メチルフェニル)メタノール 2.64 g、ビス(ジベンジリデンアセトン) パラジウム 246 mg、tert-ブチル アクリラート 2.95 ml、トリス(2-メチルフェニル)ホスフィン 442 mg、トリエチルアミン 2.5 ml及びDMF 24 ml の混合物を100℃で24時間撹拌した。室温で放冷後、水及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥し、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル (2E)-3-[2-(ヒドロキシメチル)-4-メチルフェニル]アクリラート 2.32 gを得た。
製造例105
tert-ブチル (2E)-3-[2-(ヒドロキシメチル)-4-メチルフェニル]アクリラート 2.32 gのTHF 46 ml溶液に、氷冷下、四臭化炭素 4.64 g及びトリフェニルホスフィン 3.67 gを加え、同温で2.5時間撹拌した。反応液に水及び酢酸エチルを加えて分液操作を行なった。有機層を水及び飽和食塩水で順次洗浄して無水硫酸マグネシウムで乾燥し、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル (2E)-3-[2-(ブロモメチル)-4-メチルフェニル]アクリラート 2.73 gを得た。
(1R)-N-ベンジル-1-フェニルエタンアミン 1.5 mlのTHF 40 ml溶液に-78℃でn-ブチルリチウム(1.62M ヘキサン溶液) 4.35 ml を加え、30分間撹拌した。同温でtert-ブチル (2E)-3-[2-(ブロモメチル)-4-メチルフェニル]アクリラート 1.00 gのTHF 5 ml溶液を加え、1.5時間撹拌した。反応液に水を加えて室温まで昇温した。減圧下溶媒を留去したのち、酢酸エチルを加え分液操作を行なった。有機層を1Mクエン酸水溶液、水及び飽和食塩水で順次洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル (1S,2R)-1-{ベンジル[(1R)-1-フェニルエチル]アミノ}-5-メチルインダン-2-カルボキシラート 1.17 gを得た。なお、本製造例はD.A.Priceの文献(Synlett, 1999, No.12, 1919-1920)に記載の方法に準じる。
製造例107
tert-ブチル (1S,2R)-1-{ベンジル[(1R)-1-フェニルエチル]アミノ}-5-メチルインダン-2-カルボキシラート 1.10 gに10%塩化水素/メタノール溶液 30 mlを加え、60℃で5時間撹拌した。放冷後、減圧下溶媒を留去し、飽和炭酸水素ナトリウム水溶液及び酢酸エチルを加えて分液操作を行なった。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去して得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル (1S,2R)-1-{ベンジル[(1R)-1-フェニルエチル]アミノ}-5-メチルインダン-2-カルボキシラート 828 mgを得た。
メチル (1S,2R)-1-{ベンジル[(1R)-1-フェニルエチル]アミノ}-6-メチルインダン-2-カルボキシラート 1.67 gの酢酸27 ml溶液に10%パラジウム-炭素(含水品)500 mgを加え、4気圧水素雰囲気下18時間撹拌した。反応液をセライトろ過した後、減圧下溶媒を留去した。得られた残渣に、飽和炭酸水素ナトリウム水溶液、クロロホルム及びメタノールを加え分液操作を行なった。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物のメタノール溶液に10%塩化水素/メタノール溶液 3 mlを加えた。減圧下溶媒を留去し、メチル (1S,2R)-1-アミノ-6-メチルインダン-2-カルボキシラート 塩酸塩 803 mgを得た。
製造例110
tert-ブチル (2E)-3-[2-(ヒドロキシメチル)-3-メチルフェニル]アクリラート 789 mgのメタノール 16 ml溶液に塩化ニッケル(II) 82 mgを加えた。次いで氷冷下で水素化ホウ素ナトリウム 240 mgを加え、氷冷下で4時間撹拌した。反応液に水、及び酢酸エチルを加えて分液操作を行なった。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、tert-ブチル 3-[2-(ヒドロキシメチル)-3-メチルフェニル]プロパノアート 790 mgを得た。
製造例111
tert-ブチル 3-[2-(ヒドロキシメチル)-3-メチルフェニル]プロパノアート 770 mgのジメチルスルホキシド 16 ml溶液に、トリエチルアミン 4 ml及び三酸化硫黄ピリジン錯体 1.24gを加え、室温で5時間撹拌した。反応液に希塩酸及び酢酸エチルを加え、分液操作を行なった。有機層を水、飽和炭酸水素ナトリウム水溶液、水及び飽和食塩水で順次洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル 3-(2-ホルミル-3-メチルフェニル)プロパノアート 707 mgを得た。
製造例112
tert-ブチル 3-(2-ホルミル-3-メチルフェニル)プロパノアート 305 mgのTHF 3 ml溶液に、(S)-2-メチル-2-プロパンスルフィンアミド 298 mg及びオルトチタン酸テトラエチル 0.62 mlを加え、室温で16時間撹拌した。反応液を氷水に注ぎ、不溶物をセライトろ過した。ろ液にクロロホルムを加え、分液操作を行った。有機層を水及び飽和食塩水で順次洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル 3-{2-[(E)-{[(S)-tert-ブチルスルフィニル]イミノ}メチル]-3-メチルフェニル}プロパノアート 336 mgを得た。
tert-ブチル 3-{2-[(E)-{[(S)-tert-ブチルスルフィニル]イミノ}メチル]-3-フルオロフェニル}プロパノアート(製造例129の化合物)1.122 gのTHF 26.7 ml溶液に-78℃にてリチウムビス(トリメチルシリル)アミド(1M THF溶液)9.5 mlを加え、同温度にて8.5時間撹拌した。反応液に飽和塩化アンモニウム水溶液、酢酸エチルを加え、分液操作を行った。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル (1S,2R)-1-{[(S)-tert-ブチルスルフィニル]アミノ}-7-フルオロインダン-2-カルボキシラート 390 mg(製造例113a)、tert-ブチル (1R,2R)-1-{[(S)-tert-ブチルスルフィニル]アミノ}-7-フルオロインダン-2-カルボキシラート及びtert-ブチル (1S,2S)-1-{[(S)-tert-ブチルスルフィニル]アミノ}-7-フルオロインダン-2-カルボキシラートをそれぞれ130 mgずつ(製造例113b、製造例113c)を得た。
製造例114
tert-ブチル (1S,2R)-1-{[(S)-tert-ブチルスルフィニル]アミノ}-7-メチルインダン-2-カルボキシラート 140 mgの酢酸エチル 9.1 ml溶液に4M塩化水素/酢酸エチル溶液 0.88 mlを加え、室温で2時間撹拌した。減圧下溶媒を留去し、得られた残渣に飽和炭酸水素ナトリウム水溶液、酢酸エチルを加え、分液操作を行った。有機層を水、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、tert-ブチル (1S,2R)-1-アミノ-7-メチルインダン-2-カルボキシラート 88 mgを得た。
製造例115
tert-ブチル (1S,2R)-1-{[(S)-tert-ブチルスルフィニル]アミノ}-7-フルオロインダン-2-カルボキシラート(製造例113aの化合物) 12 mgに、10%塩化水素/メタノール溶液 0.4 mlを加え、氷冷下にて1時間撹拌した。反応液に10%塩化水素/メタノール溶液 1 mlを加え、50℃で6時間撹拌した。放冷後、減圧下溶媒を留去したのち、得られた残渣に飽和炭酸水素ナトリウム水溶液、酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、メチル (1S,2R)-1-アミノ-7-フルオロインダン-2-カルボキシラート 6 mgを得た。
2-ブロモチフェン-3-カルバルデヒド1 g、tert-ブチル アクリラート 3.8 ml、酢酸パラジウム 120 mg、臭化テトラ-n-ブチルアンモニウム 420 mg、炭酸カリウム 610 mgのDMF 10 ml懸濁液を100℃で終夜撹拌した。放冷後、不溶物をセライト濾過し、濾液に水、酢酸エチルを加え、分液操作を行なった。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル (2E)-3-(3-ホルミル-2-チエニル)アクリラート 660 mgを得た。
製造例117
tert-ブチル (2E)-3-(3-ホルミル-2-チエニル)アクリラート 650 mgのメタノール 15 ml溶液に10%パラジウム-炭素 150 mgを加え、水素雰囲気下5時間撹拌した。セライト濾過したのち、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル 3-(3-ホルミル-2-チエニル)プロパノアート 530 mgを得た。
上述の製造例112と同様の方法で、(S)-2-メチル-2-プロパンスルフィンアミドを用いて、tert-ブチル 3-{2-[(E)-{[(S)-tert-ブチルスルフィニル]イミノ}メチル]-3-フルオロフェニル}プロパノアートを製造した。
製造例130
上述の製造例112と同様の方法で、ラセミ体の2-メチル-2-プロパンスルフィンアミドを用いて、ラセミ体のtert-ブチル 3-(2-{(E)-[(tert-ブチルスルフィニル)イミノ]メチル}-3-フルオロフェニル)プロパノアートを製造した。
製造例131
上述の製造例112と同様の方法で、(R)-2-メチル-2-プロパンスルフィンアミドを用いて、tert-ブチル 3-{2-[(E)-{[(R)-tert-ブチルスルフィニル]イミノ}メチル]-3-フルオロフェニル}プロパノアートを製造した。
上述の製造例113と同様の方法で、ラセミ体のtert-ブチル 3-(2-{(E)-[(tert-ブチルスルフィニル)イミノ]メチル}-3-フルオロフェニル)プロパン酸(製造例130の化合物)を用いて、tert-ブチル rac-(1R,2R)-1-[(tert-ブチルスルフィニル)アミノ]-7-フルオロインダン-2-カルボン酸を製造した。
製造例136
上述の製造例113と同様の方法で、tert-ブチル3-{2-[(E)-{[(R)-tert-ブチルスルフィニル]イミノ}メチル]-3-フルオロフェニル}プロパン酸(製造例131の化合物)を用いて、tert-ブチル (1R,2S)-1-{[(R)-tert-ブチルスルフィニル]アミノ}-7-フルオロインダン-2-カルボン酸を製造した。なお、製造例136の化合物と製造例113aの化合物は互いにエナンチオマー(鏡像異性体)である。
製造例137
tert-ブチル(4S,5R)-4-{[(S)-tert-ブチルスルフィニル] アミノ}-5,6-ジヒドロ-4H-シクロペンタ[b]チオフェン-5-カルボキシラート(製造例133の化合物) 120 mgの酢酸エチル7 ml溶液に、4M塩化水素/酢酸エチル溶液 0.7 mlを加え、2時間撹拌した。減圧下溶媒を留去後、得られた残渣にジイソプロピルエーテルを加え、不溶物を濾取、乾燥し、tert-ブチル (4S,5R)-4-アミノ-5,6-ジヒドロ-4H-シクロペンタ[b] チオフェン-5-カルボキシラート塩酸塩 95 mgを得た。
製造例139
製造例135の化合物を用いて、上述の製造例115と同様の方法で製造した。
製造例140
製造例136の化合物を用いて、上述の製造例115と同様の方法で製造した。なお、製造例140の化合物と製造例115の化合物は互いにエナンチオマー(鏡像異性体)である。
tert-ブチル [(1S)-1-(3-ブロモフェニル)エチル]カルバマート 820 mgに1,3-ビス(ジフェニルホスフィノ)プロパン 113 mg、酢酸パラジウム 62 mg、トリエチルアミン 0.84 ml、DMF 8 ml、メタノール 12 mlを加え室温にて1時間攪拌した。室温にて攪拌しながら一酸化炭素を10分間吹き込んだ後、一酸化炭素雰囲気下80 ℃にて終夜攪拌した。1,3-ビス(ジフェニルホスフィノ)プロパン 113 mg、酢酸パラジウム 62 mgを加え、80 ℃にて一終夜攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 3-{(1S)-1-[(tert-ブトキシカルボニル)アミノ]エチル}ベンゾアート 577 mgを得た。
製造例166
tert-ブチル [(1R,2R)-2-ヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]カルバマート 1 gのTHF 10 ml溶液に-78℃にて0.5M ヘキサメチルジシラザン カリウム/トルエン溶液 16.9 mlを加え、30分間攪拌した。-78℃にてクロロジメチルエーテル 0.92mlを加え、3時間かけて室温まで昇温した。-78℃にて0.5M ヘキサメチルジシラザン カリウム/トルエン溶液 4 mlおよびクロロジメチルエーテル 0.31 mlを加え、室温で2時間攪拌した。反応液に飽和塩化アンモニウム水溶液及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル [(1R,2R)-2-(メトキシメトキシ)-2,3-ジヒドロ-1H-インデン-1-イル](メトキシメチル)カルバマート 311 mgを得た。
製造例167
tert-ブチル [(1R,2R)-2-(メトキシメトキシ)-2,3-ジヒドロ-1H-インデン-1-イル](メトキシメチル)カルバマート 2.75 gの四塩化炭素 55 ml溶液を外温100℃で加熱し、N-ブロモスクシンイミド 1.53 gおよび2,2'-アゾジイソブチロニトリル 95 mgの混合物を5分おきに少量ずつ30分間かけて加え、外温100℃で1時間攪拌した。不溶物を濾過後、チオ硫酸ナトリウム水溶液、クロロホルムを加え、分液操作を行なった。無水硫酸ナトリウムで乾燥後、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル [(1R,2S)-3-ブロモ-2-(メトキシメトキシ)-2,3-ジヒドロ-1H-インデン-1-イル](メトキシメチル)カルバマート984 mgを得た。
製造例168
tert-ブチル [(1R,2S)-3-ブロモ-2-(メトキシメトキシ)-2,3-ジヒドロ-1H-インデン-1-イル](メトキシメチル)カルバマート 983 mgに酢酸カリウム 1.39 g、N-メチル-2-ピロリドン15 mlを加え、70℃で15時間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を水、飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、(2S,3R)-3-[(tert-ブトキシカルボニル)(メトキシメチル)アミノ]-2-(メトキシメトキシ)-2,3-ジヒドロ-1H-インデン-1-イル アセタートをインダン環1位立体配置未決定の2種の単一異性体としてそれぞれ436mg(製造例168a)および106 mg(製造例168b)を得た。
tert-ブチル (3aR,8aR)-8-アセトキシ-2-オキソ-8,8a-ジヒドロ-2H-インデノ[1,2-d][1,3]オキサゾール-3(3aH)-カルボキシラート 235 mgにTHF 2.4 ml、水 0.24 ml、及び水酸化ナトリウム 229 mgを加え、4時間攪拌した。反応液に水及びクロロホルムを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル [(1R,2R)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]カルバマートのをインダン環3位立体配置未決定の2種の単一異性体としてそれぞれ66 mg (製造例169a)および28 mg(製造例169b)を得た。
製造例170
tert-ブチル [(1R,2R)-3-{[tert-ブチル(ジメチル)キシル]オキシ}-2-ヒドロキシ-1-フェニルプロピル]カルバマート 700 mgのTHF 35 ml溶液に氷冷下、トリフェニルホスフィン 1.2 g、4-ニトロ安息香酸 766 mg、1.9M アゾジカルボン酸ジイソプロピル/トルエン溶液 2.4 ml、を加え、室温にて5時間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、(6S,7R)-2,2,3,3,11,11-ヘキサメチル-9-オキソ-7-フェニル-4,10-ジオキサ-8-アザ-3-シラドデカン-6-イル 4-ニトロベンゾアート 638 mgを得た。
製造例171
製造例168bの化合物106 mgのメタノール 6 ml溶液に炭酸カリウム 117 mgを加え、2時間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行ない、有機層を無水硫酸ナトリウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル [(1R,2S)-3-ヒドロキシ-2-(メトキシメトキシ)-2,3-ジヒドロ-1H-インデン-1-イル](メトキシメチル)カルバマート をインダン環3位立体配置未決定の単一異性体として82 mgを得た。
製造例172
製造例171の化合物190 mg のメタノール 3 ml溶液に4M 塩化水素/ジオキサン溶液 3 mlを加え、室温で20時間攪拌した。減圧下溶媒を留去し、(2S,3R)-3-アミノインダン-1,2-ジオール 塩酸塩をインダン環1位立体配置未決定の化合物として110 mgを得た。このものは精製せずにそのまま次の反応に用いた。
メチル 3-オキソインダン-1-カルボキシラート 1 gのトルエン 10 ml溶液に(1S)-1-(4-メトキシフェニル)エタンアミン 0.78 ml、及びp‐トルエンスルホン酸一水和物 100 mgを加え、Dean-Stark型還流装置を用いて5時間加熱還流した。次いで、硫酸マグネシウム 634 mgを加えてDean-Stark型還流装置を用いて5時間加熱還流した。更に硫酸マグネシウム 634 mgを加え、Dean-Stark型還流装置を用いて5時間加熱還流した。不溶物を濾去したのち、減圧下溶媒を留去し、中間生成物を得た。得られた中間生成物のエタノール 17 ml溶液に氷冷下、水素化ホウ素ナトリウム 209 mgを加え、氷冷下にて1時間攪拌した。減圧下溶媒を留去して得られた残渣に水、飽和炭酸水素ナトリウム水溶液、酢酸エチルを加え、分液操作を行なった。有機層を水、飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル (3S)-3-{[(1S)-1-(4-メトキシフェニル)エチル]アミノ}インダン-1-カルボキシラート 1.195 gを得た。
製造例174
メチル 1-オキソインダン-5-カルボキシラート 713 mgに(1S)-1-(4-メトキシフェニル)エタンアミン 612 mg、酢酸 0.23 ml、モレキュラーシーブス4A 600mg、及びトルエン 12 mlを加え、Dean-Stark型還流装置を用いて減圧下(213mbar)4時間加熱還流した。次いで、酢酸 0.23 ml、及びモレキュラーシーブス4A 300mgを加え、再度Dean-Stark型還流装置を用いて減圧下(213mbar)4時間加熱還流した。不溶物を濾去したのち、減圧下溶媒を留去し、中間生成物を得た。得られた中間生成物のエタノール 13 ml溶液に氷冷下、水素化ホウ素ナトリウム 161 mgを加え、氷冷下にて1時間攪拌した。減圧下溶媒を留去して得られた残渣に水、飽和炭酸水素ナトリウム水溶液、及び酢酸エチルを加え、分液操作を行なった。有機層を水、及び飽和食塩水で順次洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル (1S)-1-{[(1S)-1-(4-メトキシフェニル)エチル]アミノ}インダン-5-カルボキシラート 452 mgを得た。
製造例175
tert-ブチル [2-(3-ブロモフェニル)プロパン-2-イル]カルバマート 850 mgのTHF 8.5ml溶液に-78℃にて1.65M n-ブチルリチウム/ヘキサン溶液 4.1 mlを加え、同温にて30分間攪拌した。次いで-78℃にてクロロギ酸メチル 0.85 mlを滴下し、同温にて1時間攪拌した。反応液に飽和塩化アンモニウム水溶液及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 3-{2-[(tert-ブトキシカルボニル)アミノ]プロパン-2-イル}ベンゾアート 199 mgを得た。
製造例176
メチル (1S)-1-{[(1S)-1-(4-メトキシフェニル)エチル]アミノ}インダン-5-カルボキシラート 452 mgにトリフルオロ酢酸 34 mlおよびペンタメチルベンゼン 1.03 gを加え、70℃で4日間攪拌した。減圧下溶媒を留去し、得られた残渣に飽和炭酸水素ナトリウム水溶液及びクロロホルムを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル (1S)-1-アミノインダン-5-カルボキシラート 165 mgを得た。
1-メチル-3-(ニトロメチル)ベンゼン 1.55 gのエタノール 15mlおよびジオキサン 6 mlの混合溶液に1M 水酸化ナトリウム水溶液 0.05 ml、37%ホルマリン水溶液 1.89 mlを加え、15時間攪拌した。1M 水酸化ナトリウム水溶液 0.05 ml、37%ホルマリン水溶液 0.83 mlを加え、50℃で2時間攪拌した。減圧下溶媒を留去し、得られた残渣に酢酸エチルを加え、飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、2-(3-メチルフェニル)-2-ニトロプロパン-1,3-ジオール 1.91 gを得た。
製造例179
エチル ピリジン-3-イルアセタート 2 gのDMF 40 ml溶液にパラホルムアルデヒド 1.09 g、ナトリウムエトキシド 165 mgを加え、19時間攪拌した。氷冷下にて酢酸を加え、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、エチル 3-ヒドロキシ-2-(ヒドロキシメチル)-2-(ピリジン-3-イル) プロパノアート 1.29 gを得た。
製造例180
エチル 3-ヒドロキシ-2-(ヒドロキシメチル)-2-(ピリジン-3-イル) プロパノアート 1.25gのアセトン 13ml混合液に2,2-ジメトキシプロパン 0.75 ml、及びp‐トルエンスルホン酸一水和物 105 mgを加え、12時間攪拌した。次いで、p‐トルエンスルホン酸一水和物 1.06 gを加え、6時間攪拌した。更に2,2-ジメトキシプロパン 0.75 mlを加え、50℃で30分間攪拌した。減圧下溶媒を留去し、得られた残渣に室温にてアセトン 13 ml、及び2-メトキシ-1-プロペン 0.78 mlを加え、30分間攪拌した。得られた反応液に飽和炭酸水素ナトリウム水溶液及び酢酸エチルを加え分液操作を行なった。有機層を飽和炭酸水素ナトリウム水溶液、水、及び飽和食塩水で順次洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、エチル 2,2-ジメチル5-(ピリジン-3-イル)-1,3-ジオキサン-5-カルボキシラート 1.16 gを得た。
tert-ブチル (1-フェニルシクロペンタ-3-エン-1-イル)カルバマート 0.86 g、4-メチルモルホリン N-オキシド 0.47 gのTHF 22 mlおよび水8.7 mlの混合溶液に2.5%四酸化オスミウム/tert-ブタノール溶液 0.42 mlを加え、2時間攪拌し、4日間放置した。反応液にチオ硫酸ナトリウム水溶液及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル [(3R,4S)-3,4-ジヒドロキシ-1-フェニルシクロペンチル]カルバマートを1位立体配置未決定の2種の単一異性体としてそれぞれ 512 mg(製造例181a)および126 mg(製造例181b)を得た。
製造例182
tert-ブチル [(1R,2R)-2,3-ジヒドロキシ-1-フェニルプロピル]カルバマート 620 mg、tert-ブチルジメチルクロロシラン 0.37 g、イミダゾール 0.19 g、及びジクロロメタン 9.3 mlの混合液を2時間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル [(1R,2R)-3-{[tert-ブチル(ジメチル)シリル]オキシ}-2-ヒドロキシ-1-フェニルプロピル]カルバマート 705 mgを得た。
製造例183
メチル 6,6a-ジヒドロ-1aH-インデノ[1,2-b]オキシレン-1a-カルボキシラート 500 mgにアジ化ナトリウム 860 mg、塩化アンモニウム 309 mg、メタノール 4 ml、及び水 0.5 mlを加え、80℃で2時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液、水及び酢酸エチルを加え分液操作を行ない、有機層を無水硫酸マグネシウムで乾燥した。得られた中間生成物の酢酸エチル-メタノール溶液に10%パラジウム-炭素(含水品)61 mgを加え、水素雰囲気下6時間攪拌した。反応液をセライト濾過したのち、減圧下溶媒を留去し、メチル rac-(1R,2R)-1-アミノ-2-ヒドロキシインダン-1-カルボキシラート 0.51 gを得た。
製造例184
2,2-ジメチル5-(ピリジン-3-イル)-1,3-ジオキサン-5-カルボン酸 1.09 gにトルエン 20 ml、トリエチルアミン 0.9 ml、ベンジルアルコール 2.4 ml、ジフェニルホスホリル アジド 1.3 mlを加え、100℃で17時間攪拌した。放冷後、反応液に飽和炭酸水素ナトリウム水溶液及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、ベンジル [2,2-ジメチル5-(ピリジン-3-イル)-1,3-ジオキサン-5-イル]カルバマート 1.01 gを得た。
ナトリウム 2,2-ジメチル5-(ピリジン-2-イル)-1,3-ジオキサン-5-カルボキシラート340 mgのジオキサン 5 ml及び水 1mlの溶液に、氷冷下にてクロロギ酸イソブチル 0.21 mlを加え、1時間攪拌した。アジ化ナトリウム 850 mgの水 3 ml溶液を加え、氷冷下にて10分間攪拌した。反応液に水及びジエチルエーテルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣にトルエン5mlを加え、100℃で5分間攪拌した。放冷後室温にてベンジルアルコール 0.7 mlを加え、100℃にて19時間攪拌した。放冷後、減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、ベンジル [2,2-ジメチル5-(ピリジン-2-イル)-1,3-ジオキサン-5-イル]カルバマート 223 mgを得た。
製造例186
2,2-ジメチル5-(3-メチルフェニル)-5-ニトロ-1,3-ジオキサン 1.6 gのエタノール 24 ml混合液にラネーニッケル(Aldrich社製1ml水懸濁液を水およびエタノールで洗浄したもの)のエタノール9 ml懸濁液を加え、4気圧の水素雰囲気下22時間攪拌した。反応液をセライト濾過後、減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、2,2-ジメチル5-(3-メチルフェニル)-1,3-ジオキサン-5-アミン 1.55 gを得た。
製造例187
メチル 3-ホルミルベンゾアート 3.0 g、(R)-2-メチル-2-プロパンスルフィンアミド 2.25 g、及び硫酸銅(II)6.0gのジクロロメタン 50 ml懸濁液を一終夜攪拌した。反応液をセライト濾過後、減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 3-[(E)-{[(R)-tert-ブチルスルフィニル]イミノ}メチル]ベンゾアート 700 mgを得た。
製造例188
メチル 3-ホルミルベンゾアート 3.0 g、(S)-2-メチル-2-プロパンスルフィンアミド 2.5 g、ピリジニウム パラ-トルエンスルホナート 250 mg、及び硫酸マグネシウム 11 gのジクロロメタン 50 ml懸濁液を一終夜攪拌した。反応液をセライト濾過後、減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 3-[(E)-{[(S)-tert-ブチルスルフィニル]イミノ}メチル]ベンゾアート 3.0 gを得た。
メチル 3-[(E)-{[(R)-tert-ブチルスルフィニル]イミノ}メチル]ベンゾアート 170 mgのTHF 4 ml溶液に-50℃にて1M ジエチル亜鉛/ヘキサン溶液 0.16 mlを加え、同温にて10分間攪拌した。-50℃にて3M エチルマグネシウム ブロミド/ジエチルエーテル溶液 0.28 mlを加え、同温にて2時間攪拌した。反応液に飽和塩化アンモニウム水溶液及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 3-[(1R)-1-{[(R)-tert-ブチルスルフィニル]アミノ}プロピル]ベンゾアート 137 mgを得た。
製造例190
ジイソプロピルアミン 1 mlのTHF 5 ml溶液に氷冷下にて1.6M n-ブチルリチウム/ヘキサン溶液 4.4 mlを加え、同温にて15分間攪拌した。-78℃にて酢酸メチル 0.6 mlを加え、同温にて20分間攪拌した。クロロチタン(IV)トリイソプロポキシド 3.6 gのTHF 7 ml溶液を加え、同温にて20分間攪拌した。-78℃にてN-[(E)-(2,3-ジメチルフェニル)メチレン]-2-メチルプロパン-2-(R)-スルフィンアミド 500 mgのTHF 5 ml溶液を加え、同温にて4時間攪拌した。反応液に飽和塩化アンモニウム水溶液及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル (3S)-3-{[(R)-tert-ブチルスルフィニル]アミノ}-3-(2,3-ジメチルフェニル)プロパノアート 592 mgを得た。
製造例191
2,2-ジメチルスピロ[1,3-ジオキサン-5,2'-インデン]-1'(3'H)-オン 1 g、ヒドロキシルアミン塩酸塩 329 mg、及び酢酸ナトリウム 388 mgのエタノール5 ml懸濁液を12時間攪拌した。次いでトリエチルアミン 1.2 mlを加え、室温で3日間、更に50℃で1時間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を水、飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、N-ヒドロキシ-2,2-ジメチルスピロ[1,3-ジオキサン-5,2'-インデン]-1'(3'H)-イミン 1.0 gを得た。
製造例192
水素化リチウムアルミニウム384 mgのジエチルエーテル 22 ml懸濁液に、氷冷下にてN-ヒドロキシ-2,2-ジメチルスピロ[1,3-ジオキサン-5,2'-インデン]-1'(3'H)-イミン 0.5 g、及びTHF 5 mlを加え、40℃で8時間攪拌した。氷冷下にて水 0.55 ml、15%水酸化ナトリウム水溶液 0.55 ml、及び水 1.65 mlを加えた。セライト濾去後、減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、2,2-ジメチル-1',3'-ジヒドロスピロ[1,3-ジオキサン-5,2'-インデン]-1'-アミン 146 mgを得た。
tert-ブチル [(1S)-1-(3-ブロモフェニル)エチル]カルバマート 1g、ビス(トリ-tert-ブチルホスフィン)パラジウム(0) 18 mg、フッ化亜鉛 180 mg、[(1-メトキシ-2-メチルプロパ-1-エン-1-イル)オキシ](トリメチル)シラン 1 ml、及びDMF 10 mlの混合液を80℃にて一終夜、100℃にて5時間攪拌した。ビス(トリ-tert-ブチルホスフィン)パラジウム(0) 25 mg、[(1-メトキシ-2-メチルプロパ-1-エン-1-イル)オキシ](トリメチル)シラン 0.34 mlを加え、80℃にて3日間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 2-(3-{(1S)-1-[(tert-ブトキシカルボニル)アミノ]エチル}フェニル)-2-メチルプロパノアート 281 mgを得た。
製造例194
2-(トリメチルシリル)エチル rac-[(2R,3S)-2,3-ジヒドロキシ-1-メチル-2,3-ジヒドロ-1H-インデン-1-イル]カルバマート 130 mgのTHF 4 ml溶液に氷冷下にて55% 水素化ナトリウム 70 mgを加え、同温にて1時間攪拌した。反応液に飽和塩化アンモニウム水溶液及び酢酸エチルを加え分液操作を行ない、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、2-(トリメチルシリル)エチル rac-[(1R,2S,3R)-2,3-ジヒドロキシ-1-メチル-2,3-ジヒドロ-1H-インデン-1-イル]カルバマート 70 mgおよびrac-(3aR,8S,8aR)-8-ヒドロキシ-3a-メチル-3,3a,8,8a-テトラヒドロ-2H-インデノ[1,2-d][1,3]オキサゾール-2-オン 45 mgを得た。
製造例195
1-メチル-1H-インデン 3.4 gのエーテル 136 ml溶液に-78℃にて1.62M n-ブチルリチウム/ヘキサン溶液 16.2 ml加え、室温で30分間攪拌した。得られた反応液に-78℃にてチタン酸テトラ-iso-プロピル 15.5 mlおよびクロロギ酸メチル 2.41 mlを加え、-78℃で2時間攪拌した。反応液に1M 塩酸及び酢酸エチルを加え分液操作を行ない、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 1-メチル-1H-インデン-1-カルボキシラート 1.57 gを得た。
製造例196
tert-ブチル (3S)-ピペリジン-3-イルカルバマート 1.0 gのDMF 20 ml溶液にメチル 2-フルオロベンゾアート 0.77 mlおよび炭酸カリウム 1.4 gを加え、130℃で一終夜攪拌した。放冷後、反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 2-{(3S)-3-[(tert-ブトキシカルボニル)アミノ]ピペリジン-1-イル}ベンゾアート 590 mgを得た。
メチル 3-[(2S)-2-{[(1S)-1-フェニルエチル]アミノ}プロピル]ベンゾアート280 mgのエタノール 6.8 ml溶液に20%水酸化パラジウム-炭素(含水品)30 mg、及びギ酸アンモニウム 320 mgを加え、80℃で4時間攪拌した。反応液をセライト濾過したのち、減圧下溶媒を留去し、得られた残渣に飽和炭酸水素ナトリウム水溶液及びクロロホルムを加え分液操作を行ない、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、メチル 3-[(2S)-2-アミノプロピル]ベンゾアート 180 mgを得た。
製造例198
tert-ブチル [(1R,2S)-3-{[tert-ブチル(ジメチル)シリル]オキシ}-2-ヒドロキシ-1-フェニルプロピル]カルバマート 300 mgのメタノール 5 ml溶液に4M 塩化水素/ジオキサン溶液 5 mlを加え、2時間攪拌した。減圧下溶媒を留去し、(2S,3R)-3-アミノ-3-フェニルプロパン-1,2-ジオール 塩酸塩 171 mgを得た。
製造例199
(2R,3R)-3-アミノ-3-フェニルプロパン-1,2-ジオール 塩酸塩 448 mgにジクロロメタン 18 ml、トリエチルアミン 0.77 mlおよびジ-tert-ブチル ジカルボナート 0.53 gを加え、3時間攪拌した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル [(1R,2R)-2,3-ジヒドロキシ-1-フェニルプロピル]カルバマート 620 mgを得た。
製造例200
N-[(2E)-1-{[tert-ブチル(ジメチル)シリル]オキシ}プロパン-2-イリデン]-2-メチルプロパン-2-(S)-スルフィンアミド 300 mgのトルエン2 ml溶液に-78℃にて2.0M トリメチルアルミニウム/トルエン溶液 0.62 mlを加え、30分間攪拌した。更に-78℃にて0.5M エチルリチウム/ベンゼン-シクロヘキサン溶液 3.2 mlを加え、1時間攪拌した。反応液に飽和塩化アンモニウム水溶液及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、N-[(2R)-1-{[tert-ブチル(ジメチル)シリル]オキシ}-2-メチルブタン-2-イル]-2-メチルプロパン-2-(S)-スルフィンアミド 160 mgを得た。
N-[(2R)-1-{[tert-ブチル(ジメチル)シリル]オキシ}-2-メチルブタン-2-イル]-2-メチルプロパン-2-(S)-スルフィンアミド 97 mgのメタノール 1 ml溶液に4M 塩化水素/ジオキサン溶液 1.3 mlを加え、2時間攪拌した。減圧下溶媒を留去し、(2R)-2-アミノ-2-メチルブタン-1-オール 塩酸塩 63 mgを得た。
製造例239
製造例168aの化合物を用いて、上述の製造例171と同様の方法で製造した。
製造例240
製造例239の化合物を用いて、上述の製造例172と同様の方法で製造した。
製造例278
製造例181aの化合物を用いて、後述の実施例5と同様の方法で製造した。
製造例279
製造例181bの化合物を用いて、後述の実施例5と同様の方法で製造した。
8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸600 mgのDMF 10ml溶液にtert-ブチル (3S)-3-アミノピペリジン-1-カルボキシラート500 mg、N-[3-(ジメチルアミノ)プロピル]-N '-エチルカルボジイミド 塩酸塩518 mg、及び1-ヒドロキシベンゾトリアゾール366 mgを加え、一終夜撹拌した。反応液に水及び酢酸エチルを加えて分液操作を行なった。有機層を水及び飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、tert-ブチル(3S)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)ピペリジン-1-カルボキシラート808 mgを得た。
実施例2
N-[(1R)-2-{[tert-ブチル(ジメチル)シリル]オキシ}-1-フェニルエチル]-8-ヒドロキシ-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド120 mg、シクロペンチルメタノール60 μl、(トリブチルホスホラニリデン)アセトニトリル156 μl及びトルエン2.4 mlの混合物を110℃で16時間攪拌した。シリカゲルカラムクロマトグラフィーにより精製し、N-[(1R)-2-{[tert-ブチル(ジメチル)シリル]オキシ}-1-フェニルエチル]-8-(シクロペンチルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド100 mgを得た。
実施例3
3-{[(1R)-2-{[tert-ブチル(ジメチル)シリル]オキシ}-1-フェニルエチル]カルバモイル}-8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-6-カルボン酸エチル370 mgのTHF 12 ml溶液に1Mフッ化テトラブチルアンモニウム/THF溶液1.22 mlを加え、30分間攪拌した。反応液に水及び酢酸エチルを加えて分液操作を行なった。有機層を無水硫酸マグネシウムで乾燥して減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、8-[(2-フルオロベンジル)オキシ]-3-{[(1R)-2-ヒドロキシ-1-フェニルエチル]カルバモイル}-2-メチルイミダゾ[1,2-a]ピリジン-6-カルボン酸エチル20 mgを得た。
実施例4
6-ブロモ-8-(シクロヘキシルメトキシ)-N-[(1R)-2-ヒドロキシ-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド90 mgのN-メチル-2-ピロリドン1.8 ml溶液にシアン化亜鉛54 mg、及び[1,1-ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)27 mgを加え、マイクロ波照射条件下180℃で30分間攪拌した。反応液にシアン化亜鉛46 mgを加え、再度マイクロ波照射条件下180℃で30分間攪拌した。反応液に酢酸エチル及び飽和炭酸水素ナトリウム水溶液を加え、セライトろ過した。得られたろ液の分液操作を行ない、有機層を飽和炭酸水素ナトリウム水溶液及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、6-シアノ-8-(シクロヘキシルメトキシ)-N-[(1R)-2-ヒドロキシ-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド7 mgを得た。
tert-ブチル 4-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)ピペリジン-1-カルボキシラート1.44 gの酢酸エチル15 ml溶液に、4M塩化水素/酢酸エチル溶液3.8 mlを加え、1日攪拌した。反応液を減圧下濃縮して得られた残渣に酢酸エチル及びエタノールを加えた。生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-2-メチル-N-ピペリジン-4-イルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 二塩酸塩1.29 gを得た。
実施例6
8-(シクロヘキシルメトキシ)-2-メチル-N-[(3S)-ピロリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド 二塩酸塩400 mg、トリエチルアミン0.26 ml、及び37%ホルムアルデヒド水溶液0.23 mlのジクロロエタン11 ml懸濁液に、氷冷下トリアセトキシ水素化ホウ素ナトリウム592 mgを加え、室温で1時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、8-(シクロヘキシルメトキシ)-2-メチル-N-[(3S)-1-メチルピロリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド249 mgを得た。
実施例7
8-(シクロヘキシルメトキシ)-2-メチル-N-[(3S)-ピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド 二塩酸塩307 mg、炭酸カリウム335 mg、アセトニトリル5 ml、及びDMF 5 mlの懸濁液に、氷冷下ブロモ酢酸エチル92 μlを加え、氷冷下3時間攪拌した。反応液に水及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、エチル [(3S)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)ピペリジン-1-イル]アセタート299 mgを得た。
実施例8
メチル 4-[({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)メチル]ピペリジン-4-カルボキシラート 二塩酸塩150 mg、トリエチルアミン150 μl、及びジクロロメタン5 mlの混合液に氷冷下、塩化アセチル25 μlを加え、室温で2時間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 1-アセチル-4-[({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)メチル]ピペリジン-4-カルボキシラート135 mgを得た。
メチル 4-[({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)メチル]ピペリジン-4-カルボキシラート 二塩酸塩150 mg、トリエチルアミン150 μl、及びジクロロメタン5 mlの混合液に氷冷下、塩化メタンスルホニル35 μlを加え、室温で2時間攪拌した。反応液に水及び酢酸エチルを加えて分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥し減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、メチル 4-[({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)メチル]-1-(メチルスルホニル)ピペリジン-4-カルボキシラート85 mgを得た。
実施例10
8-(シクロヘキシルメトキシ)-2-メチル-N-[(3S)-ピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド 二塩酸塩200 mgのイソプロピルアルコール5 ml溶液に、トリエチルアミン220 μl及び(トリメチルシリル)イソシアナート72 μlを加え6時間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を水、飽和炭酸水素ナトリウム水溶液、及び飽和食塩水で順次洗浄して無水硫酸ナトリウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた固体を酢酸エチルに懸濁し、4M塩化水素/酢酸エチル溶液120 μlを加え攪拌した。生じた固体をろ取して乾燥し、N-[(3S)-1-カルバモイルピペリジン-3-イル]-8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 塩酸塩170 mgを得た。
実施例11
8-(シクロヘキシルメトキシ)-2-メチル-N-[(3S)-ピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド 二塩酸塩200 mgにピリジン5 ml及びスルファミド217 mgを加え、4時間加熱還流した。室温で放冷後、反応液に水及びクロロホルムを加えて分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた固体を酢酸エチルに懸濁し、4M塩化水素/酢酸エチル溶液120 μlを加えた。生じた固体をろ取して乾燥し、N-[(3S)-1-(アミノスルホニル)ピペリジン-3-イル]-8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 塩酸塩151 mgを得た。
実施例12
tert-ブチル (3R)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-5-メチルヘキサノアート216 mgのジクロロメタン2 ml溶液にトリフルオロ酢酸2 mlを加え、一終夜攪拌した。減圧下溶媒を留去し水、飽和炭酸水素ナトリウム水溶液、1M塩酸、及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物に酢酸エチル、及びジイソプロピルエーテルを加え、生じた固体をろ取して乾燥し、(3R)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a] ピリジン-3-イル]カルボニル}アミノ)-5-メチルヘキサン酸147 mgを得た。
8-(シクロヘキシルメトキシ)-N-[(1S)-1-(2-フルオロフェニル)-3-ヒドロキシプロピル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド290 mgのジクロロメタン溶液に1,1,1-トリアセトキシ-1,1-ジヒドロ-1,2-ベンズヨードキソール-3(1H)-オン300 mgを加え、一終夜攪拌した。反応液に飽和重曹水、チオ硫酸ナトリウム水溶液、及び酢酸エチルを加えて分液操作を行なった。有機層を飽和重曹水で洗浄して無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣及び2-メチル-2-ブテン230μlのジオキサン6.5 ml溶液に水浴下、亜塩素酸ナトリウム93 mg及びリン酸二水素ナトリウム315 mgの1.7 ml水溶液を加え、水浴下30分間攪拌した。反応液に水、1M塩酸及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸マグネシウムで乾燥して減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物にジイソプロピルエーテルを加え、生じた固体をろ過して乾燥し、(3S)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-3-(2-フルオロフェニル)プロパン酸80 mgを得た。
実施例14
水素化リチウムアルミニウム20 mgのTHF 5 ml懸濁液に、氷冷下、(2R)-2-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-3-(2-メチルフェニル)プロパン酸メチル220 mgのTHF 2 ml溶液を加え、氷冷下7時間攪拌した。反応液に硫酸ナトリウム十水和物160 mgを加え、しばらく攪拌した。反応液をセライトろ過したのち、減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物を酢酸エチルに溶解し、4M塩化水素/酢酸エチル溶液を加えた。減圧下溶媒を留去したのち、ジイソプロピルエーテルを加えて攪拌した。生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-N-[(1R)-2-ヒドロキシ-1-(2-メチルベンジル)エチル]-2-メチルイミダゾ[1,2-a] ピリジン-3-カルボキサミド 塩酸塩72 mgを得た。
実施例15
メチル (2E,4S)-4-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-4-フェニルブタ-2-エノアート185 mgの酢酸エチル3.7 ml溶液に10%パラジウム-炭素20 mgを加え、水素雰囲気下8時間攪拌した。反応液をセライトろ過して減圧下溶媒を留去し、(4S)-4-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-4-フェニルブタン酸メチル165 mgを得た。
実施例16
8-(シクロヘキシルメトキシ)-2-メチル-N-[(3S)-1-メチルピロリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド245 mgに酢酸エチル12 ml、及び4M塩化水素/酢酸エチル溶液364 μlを加え攪拌した。生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-2-メチル-N-[(3S)-1-メチルピロリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド 塩酸塩258 mgを得た。
8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-6-カルボン酸エチル280 mg、4-(ジメチルアミノ)ピリジン208 mg、及びクロロホルム5 mlの溶液に氷冷下、塩化トリクロロアセチル191 μlを加え、室温で1時間、65℃で一終夜攪拌した。室温で放冷後、減圧下溶媒を留去し、得られた残渣にアセトニトリル、及び(1R)-2-{[tert-ブチル(ジメチル)シリル]オキシ}-1-フェニルエタンアミン429 mgを加え、一終夜攪拌した。反応液に水及びクロロホルムを加え分液操作を行った。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、3-{[(1R)-2-{[tert-ブチル(ジメチル)シリル]オキシ}-1-フェニルエチル]カルバモイル}-8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-6-カルボン酸エチル370 mgを得た。
実施例18
8-[(2-フルオロベンジル)オキシ]-3-{[(1R)-2-ヒドロキシ-1-フェニルエチル]カルバモイル}-2-メチルイミダゾ[1,2-a]ピリジン-6-カルボン酸100 mg、4-メチルモルホリン28 μl及びジメトキシエタン0.7 mlの混合液に氷冷下、クロロギ酸イソブチル34 μlを加え、室温で一終夜攪拌した。不溶物をろ去したのち、ろ液に氷冷下、水素化ホウ素ナトリウム16 mg、及びメタノール210μl を加え、氷冷下30分間攪拌した。反応液に飽和塩化アンモニウム水溶液及びクロロホルムを加えて分液操作を行なった。有機層を無水硫酸マグネシウムで乾燥して減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、8-[(2-フルオロベンジル)オキシ]-6-(ヒドロキシメチル)-N-[(1R)-2-ヒドロキシ-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド21 mgを得た。
実施例19
8-(シクロヘキシルメトキシ)-N-[(1R)-2-(1,3-ジオキソ-1,3-ジヒドロ-2H-イソインドール-2-イル)-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド300 mgのエタノール6 ml懸濁液にヒドラジン一水和物0.13 mlを加え、85℃で1時間攪拌した。減圧下溶媒を留去してられた残渣をシリカゲルカラムクロマトグラフィーにより精製し、N-[(1R)-2-アミノ-1-フェニルエチル]-8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド200 mgを得た。
実施例20
4-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-4-(2-メトキシ-2-オキソエチル)ピペリジン-1-カルボン酸ベンジル1.2 gのメタノール30 ml溶液に10%パラジウム-炭素300 mgを加え、水素雰囲気下、一終夜攪拌した。反応液をセライトろ過した後、減圧下溶媒を留去し、[4-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)ピペリジン-4-イル]酢酸メチル900 mgを得た。
8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸300 mgのTHF 5 ml懸濁液に1,1'・カルボニルジイミダゾール253 mgを加えて60℃で1時間攪拌した。次いで氷冷下、酢酸3-(アミノスルホニル)プロピル283 mgおよび1,8-ジアザビシクロ[5.4.0]-7-ウンデセン389 μlを加え、室温で終夜攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。反応が完了しなかったため、再度、得られた精製物に酢酸3-(アミノスルホニル)プロピル57 mg、N-[3-(ジメチルアミノ)プロピル]-N'-エチルカルボジイミド 塩酸塩60 mg、4-(ジメチルアミノ)ピリジン38 mg及びDMF 2 mlを加え、室温で一終夜攪拌した。反応液に飽和塩化アンモニウム水溶液及びクロロホルムを加えて分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた生成物に酢酸エチル及びエタノールを加えて攪拌した。生じた固体をろ取して乾燥し、酢酸3-[({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)スルホニル]プロピル149 mgを得た。
実施例22
酢酸 3-[({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)スルホニル]プロピル130 mgにメタノール2 ml、THF 2 ml及び1M水酸化ナトリウム水溶液1 mlを加えて8.5時間攪拌した。減圧下溶媒を留去し、得られた残渣に水及び1M塩酸を加えた。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物に酢酸エチル及びヘキサンを加えて攪拌した。生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-N-[(3-ヒドロキシプロピル)スルホニル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド41 mgを得た。
実施例23
8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸8.7 mg、シクロプロピルアミン5.1 mg、1-ヒドロキシベンゾトリアゾール4.1 mg、DMF 1 ml及びジイソプロピルエチルアミン28μlの混合物にポリスチレン・N-シクロヘキシルカルボジイミド-N′-プロピルオキシメチル(Biotage社製PS-Carbodiimide)50 mgを加えて室温で16時間攪拌した。次いでDMF 1 ml及びマクロ多孔質トリエチルアンモニウムメチルポリスチレン炭酸塩(Biotage社製MP-Carbonate)50 mg及びポリスチレン・イソシアン酸メチル(Biotage社製PS-Isocyanate)50 mgを加えて室温で3時間攪拌した。反応液のレジンをろ去してろ液を減圧下濃縮した。得られた残渣を分取HPLC(高速液体クロマトグラフィー)で精製し、8-(シクロヘキシルメトキシ)-N-シクロプロピル-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド8.7 mgを得た。
実施例24
8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸5.8 mg、(S)-(+)-2-フェニルグリシンメチルエステル塩酸塩6.1 mg、1-ヒドロキシベンゾトリアゾール2.7 mg、DMF 700μl及びジイソプロピルエチルアミン19 μlの混合物にポリスチレン・N-シクロヘキシルカルボジイミド-N′-プロピルオキシメチル(Biotage社製PS-Carbodiimide)50 mgを加えて室温で20時間攪拌した。次いで、マクロ多孔質トリエチルアンモニウムメチルポリスチレン炭酸塩(Biotage社製MP-Carbonate)50 mg及びポリスチレン・イソシアン酸メチル(Biotage社製PS-Isocyanate)50 mgを加えて室温で2時間攪拌した。レジンをろ去してろ液を減圧下濃縮し、得られた残渣にTHF 100 μl、メタノール200 μl及び1M水酸化ナトリウム水溶液50 μlを加えて50℃で20時間攪拌した。室温まで放冷した反応混合物に水0.5ml及び1M塩酸50 μlを加え、減圧下濃縮した。得られた残渣を分取HPLCで精製し、(2S)-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)(フェニル)酢酸6.7 mgを得た。
8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸5.8 mg、(3R)-3-アミノ-4-フェニルブタン酸tert-ブチル7.1 mg、1-ヒドロキシベンゾトリアゾール2.7 mg、DMF 700 μl及びジイソプロピルエチルアミン19 μlの混合物にポリスチレン・N-シクロヘキシルカルボジイミド-N′-プロピルオキシメチル(Biotage社製PS-Carbodiimide)50 mgを加えて室温で20時間攪拌した。反応混合物にマクロ多孔質トリエチルアンモニウムメチルポリスチレン炭酸塩(Biotage社製MP-Carbonate)50 mg及びポリスチレン・イソシアン酸メチル(Biotage社製PS-Isocyanate)50 mgを加えて室温で2時間攪拌した。レジンをろ去してろ液を減圧下濃縮し、得られた残渣に1,4-ジオキサン100 μl及び4M塩化水素/1,4-ジオキサン溶液200 μlを加え室温で20時間攪拌した。反応混合物を減圧下濃縮して得られた残渣を分取HPLCにより精製し、(3R)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-4-フェニルブタン酸5.6 mgを得た。
実施例26
N-[(1R)-2-{[tert-ブチル(ジメチル)シリル]オキシ}-1-フェニルエチル]-8-ヒドロキシ-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド8.5 mg、α-ブロモ-2,5-ジフルオロトルエン5.6 mg、炭酸カリウム5.0 mg及びDMF 700 μlの混合物を・・℃で28時間攪拌した。反応混合物に水1 ml、飽和食塩水0.5 ml及びクロロホルム4mlを加えて分液操作を行なった。有機層を減圧下濃縮し、残渣にTHF 300 μl及び1M塩酸300 μlを加え、室温で6時間攪拌した。反応混合物に1M水酸化ナトリウム水溶液300 μl及び飽和重曹水100 μlを加え、クロロホルム3 mlで抽出した。減圧下溶媒を留去し、得られた残渣を分取HPLCで精製し、8-[(2,5-ジフルオロベンジル)オキシ]-N-[(1R)-2-ヒドロキシ-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド6.3 mgを得た。
実施例27
8-(シクロヘキシルメトキシ)-2-メチル-N-[(3S)-ピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド 二塩酸塩250 mgのメタノール10 ml溶液に氷冷下、トリエチルアミン157 μl、モレキュラーシーブス3A 300 mg、酢酸323 μl、[(1-エトキシシクロプロピル)オキシ](トリメチル)シラン1.53 ml、シアノ水素化ホウ素ナトリウム146 mgを加え、加熱還流下6時間攪拌した。不溶物をろ去してろ液を減圧下濃縮した。得られた残渣に飽和重曹水及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥して減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物、酢酸エチル、及びメタノールの混合物に氷冷下、4M塩化水素/酢酸エチル溶液を加えて減圧下溶媒を留去した。得られた残渣に酢酸エチル及びヘキサンを加えた攪拌した。生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-N-[(3S)-1-シクロプロピルピペリジン-3-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 二塩酸塩136 mgを得た。
実施例28
8-(シクロヘキシルメトキシ)-2-メチル-N-[(1R)-2-{メチル[(2-ニトロフェニル)スルホニル]アミノ}-1-フェニルエチル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド200 mgのDMF 3 ml溶液に炭酸カリウム140 mg及び4-メチルベンゼンチオール50 mgを加えて3時間攪拌した。反応液に水及びクロロホルム/メタノール(9/1)を加えて分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥し減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、8-(シクロヘキシルメトキシ)-2-メチル-N-[(1R)-2-(メチルアミノ)-1-フェニルエチル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド80 mgを得た。
(2S,4S)-4-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-1-メチルピロリジン-2-カルボン酸メチル150 mgのジクロロメタン4 ml溶液に氷冷下、1M水素化ジイソブチルアルミニウム/トルエン溶液1.5 mlを滴下し、氷冷下で2時間攪拌した。次いで1M塩酸を加えて反応液をセライトろ過してろ液に酢酸エチルを加えて分液操作を行なった。有機層を水及び飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物の酢酸エチル溶液に塩化水素/酢酸エチル溶液を加え、生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-N-[(3S,5S)-5-(ヒドロキシメチル)-1-メチルピロリジン-3-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 二塩酸塩25 mgを得た。
実施例30
N-[(6-クロロピリジン-3-イル)メチル]-8-(シクロヘキシルメトキシ)-2-メチルイミダゾロ[1,2-a]ピリジン-3-カルボキサミド32 mgのN-メチル-2-ピロリドン0.6 ml溶液に、エチル ピペリジン-4-カルボキシラート0.05 mlを加え、マイクロ波照射下150℃で30分間、更に200℃で30分間反応させた。炭酸カリウム24 mgを加え、マイクロ波照射下240℃で2時間反応させた。得られた反応液に飽和塩化アンモニウム水溶液及び酢酸エチルを加えて分液操作を行った。有機層を水及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物にヘキサン及びイソプロピルエーテルを加え、生じた固体をろ取して乾燥し、1-{5-[({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾロ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)メチル]ピリジン-2-イル}ピペリジン-4-カルボン酸14 mgを得た。
実施例31
N-[(6-クロロピリジン-3-イル)メチル]-8-(シクロヘキシルメトキシ)-2-メチルイミダゾロ[1,2-a]ピリジン-3-カルボキサミド70 mgのN-メチル-2-ピロリドン1 mL溶液にエチル ピペリジン-3-カルボキシラート0.12 mLを加え、マイクロ波照射下240℃で50分間反応させた。反応液に飽和塩化アンモニウム水溶液及び酢酸エチルを加え分液操作を行った。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、エチル 1-{5-[({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾロ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)メチル]ピリジン-2-イル}ピペリジン-3-カルボキシラート43 mgを得た。
実施例32
メチル N-{[8-(シクロヘキシルメトキシ)-2-メチルイミダゾロ[1,2-a]ピリジン-3-イル]カルボニル}セリナート270 mgのメタノール7 mL溶液にビグアニジン210 mg及びナトリウムメトキシド115 mgを加え、65℃で8時間撹拌した。放冷後、不溶物をろ取して、メタノール、水、及びヘキサンで順次洗浄し、8-(シクロヘキシルメトキシ)-N-[1-(4,6-ジアミノ-1,3,5-トリアジン-2-イル)-2-ヒドロキシエチル]-2-メチルイミダゾロ[1,2-a]ピリジン-3-カルボキサミド75 mgを得た。
8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボン酸860 mg、1-ベンジル-4-メチルピペリジン-4-アミン 二塩酸塩992 mg、O-(7-アザベンゾトリアゾール-1-イル)-N,N,N',N',-テトラメチルウロニウム ヘキサフルオロりん酸塩170 mg、ジイソプロピルエチルアミン3 mL、DMF 10 mLの混合液を1日間撹拌した。反応液に水及び酢酸エチルを加え分液操作を行った。有機層を水、及び飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、N-(1-ベンジル-4-メチルピペリジン-4-イル)-8-(シクロヘキシルメトキシ)-2-メチルイミダゾロ[1,2-a]ピリジン-3-カルボキサミド 1.25 gを得た。
実施例34
N-(1-ベンジル-4-メチルピペリジン-4-イル)-8-(シクロヘキシルメトキシ)-2-メチルイミダゾロ[1,2-a]ピリジン-3-カルボキサミド1.15 g、クロロぎ酸1-クロロエチル0.4 mL、及びジクロロエタン15 mLの混合液を一終夜加熱還流させた。室温で放冷後、溶媒を減圧下留去し、残渣にメタノール15 mLを加え、6時間加熱還流させた。室温で放冷後、溶媒を減圧下留去し、残渣に飽和炭酸水素ナトリウム水溶液及びクロロホルムを加えて分液操作を行った。有機層を無水硫酸マグネシウムで乾燥して、溶媒を減圧下留去し、残渣をシリカゲルカラムクロマトグラフィーで精製し、8-(シクロヘキシルメトキシ)-2-メチル-N-(4-メチルピペリジン-4-イル)イミダゾロ[1,2-a]ピリジン-3-カルボキサミド426 mgを得た。
実施例35
(3S)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾロ[1,2-a] ピリジン-3-イル]カルボニル}アミノ)-3-フェニルプロパン酸100 mgのDMF 1 mL溶液に1,1'-カルボニルジイミダゾール43 mgを加え、30分間攪拌した。反応溶液にメタンスルホンアミド24 mg及び1,8-ジアザビシクロ[5.4.0]-7-ウンデセン0.039 mLを加え、5時間攪拌した。反応液に1M塩酸及び酢酸エチルを加え、分液操作を行った。得られた有機層を水、及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒を減圧下留去し、残渣をシリカゲルカラムクロマトグラフィーで精製した。精製物に酢酸エチル及びヘキサンを加えて、生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-2-メチル-N-{(1S)-3-[(メチルスルホニル)アミノ]-3-オキソ-1-フェニルプロピル}イミダゾロ[1,2-a]ピリジン-3-カルボキサミド41 mgを得た。
メチル (1R,2R)-1-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-5-メチルインダン-2-カルボキシラート 149 mgのジオキサン6 ml懸濁液に3M塩酸 6 mlを加え、80℃で4時間撹拌した。放冷後、減圧下溶媒を留去したのち、得られた残渣に飽和炭酸水素ナトリウム水溶液、クエン酸水溶液、クロロホルムを加え、分液操作を行なった。有機層を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣にジイソプロピルエーテルを加え、不溶物を濾取、乾燥し、(1R,2R)-1-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-5-メチルインダン-2-カルボン酸 126 mgを得た。
実施例663
メタノール6 mlにナトリウム 4.5 mgを加え、溶解させた。メチル rac-(1R,2R)-1-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-1,2,3,4-テトラヒドロナフタレン-2-カルボキシラート 300 mgを加え、90℃で5時間撹拌した。放冷後、減圧下溶媒を留去したのち、得られた残渣に10%クエン酸水溶液、酢酸エチルを加え、分液操作を行なった。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、酢酸エチル-ヘキサンで洗浄し、メチル rac-(1R,2S)-1-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-1,2,3,4-テトラヒドロナフタレン-2-カルボキシラート 139 mgを得た。
上述の実施例1と同様の方法で、製造例123の化合物を用いて、メチル (1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-4-メチルインダン-2-カルボン酸を製造した。
実施例673
上述の実施例1と同様の方法で、製造例123の化合物を用いてメチル (1S,2R)-1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]-4-メチルインダン-2-カルボン酸を製造した。
実施例674
上述の実施例1と同様の方法で、製造例115の化合物を用いて、メチル(1S,2R)- 1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]-7-フルオロインダン-2-カルボン酸を製造した。
実施例683
上述の実施例1と同様の方法で、製造例139の化合物を用いて、シス体のラセミである、メチル rac-(1R,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-7-フルオロインダン-2-カルボン酸を製造した。
実施例684
上述の実施例1と同様の方法で、製造例115の化合物を用いて、メチル(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-7-フルオロインダン-2-カルボン酸を製造した。
実施例685
上述の実施例1と同様の方法で、製造例140の化合物を用いて、メチル(1R,2S)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-7-フルオロインダン-2-カルボン酸を製造した。なお、上記実施例684の化合物と本実施例685の化合物は互いにエナンチオマー(鏡像異性体)である。
実施例669の化合物を用いて、上述の実施例661と同様の方法で製造した。
実施例695
実施例663の化合物を用いて、上述の実施例661と同様の方法で製造した。
実施例698
実施例673の化合物を用いて、上述の実施例661と同様の方法で製造した。
実施例699
実施例674の化合物を用いて、上述の実施例661と同様の方法で製造した。
実施例702
実施例678の化合物を用いて、上述の実施例661と同様の方法で製造した。
実施例703
実施例683の化合物を用いて、上述の実施例661と同様の方法で製造した。
実施例704
実施例684の化合物を用いて、上述の実施例661と同様の方法で製造した。
実施例705
実施例685の化合物を用いて、上述の実施例661と同様の方法で製造した。
8-[(2,6-ジフルオロベンジル)オキシ]-N-[2,2-ジメチル5-(3-メチルフェニル)-1,3-ジオキサン-5-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 301 mgにジオキサン 3 ml、メタノール 3 ml、及び1M 塩酸 6 mlを加え、14時間攪拌した。氷冷下にて反応液に飽和炭酸水素ナトリウム水溶液、水、酢酸エチルを加え、分液操作を行なった。有機層を飽和炭酸水素ナトリウム水溶液、飽和食塩水で順次洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物にヘキサンおよび酢酸エチルを加え、不溶物を濾取、乾燥し、8-[(2,6-ジフルオロベンジル)オキシ]-N-[1,3-ジヒドロキシ-2-(3-メチルフェニル)プロパン-2-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 172 mgを得た。
実施例710
ジエチル [({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]マロナート 252 mgにエタノール 4 ml、20% ナトリウムエトキシド/エタノール溶液 0.23 ml、及び1-ヨードブタン 0.31 mlを加え70℃で3時間攪拌した。次いでナトリウムエトキシド 11mgを加え、70℃で1時間攪拌した。反応液にクエン酸水溶液、飽和炭酸水素ナトリウム水溶液及びクロロホルムを加え分液操作を行なった。有機層を無水硫酸ナトリウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、ジエチル ブチル[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]マロナート 69 mgを得た。
実施例711
ジエチル ブチル[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]マロナート 68 mgのエタノール 1.4 ml混合液に塩化カルシウム 35 mgの水0.34ml溶液を加えた。次いで、氷冷下にて水素化ホウ素ナトリウム 24 mgを加え、氷冷下にて1時間、室温にて4時間攪拌した。更に、エタノール 2ml、塩化カルシウム 35 mgの水0.34ml溶液、及び水素化ホウ素ナトリウム 24 mgを加え、室温にて15時間攪拌した。さらに塩化カルシウム 35 mgの水0.34ml溶液、水素化ホウ素ナトリウム 24 mgを加え、室温にて15時間攪拌した。得られた反応液に1M 塩酸、及び酢酸エチルを加え、分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、8-[(2,6-ジフルオロベンジル)オキシ]-N-[1-ヒドロキシ-2-(ヒドロキシメチル)ヘキサン-2-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 32 mgを得た。
実施例712
メチル rac-(1R,2R)-1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]-2-ヒドロキシインダン-1-カルボキシラート 229 mgのエタノール 3.4 mlおよびTHF 0.68 mlの溶液に氷冷下にて水素化ホウ素ナトリウム 68 mgを加え、室温にて4時間攪拌した。反応液に1M 塩酸及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物にジイソプロピルエーテルを加え、生じた固体をろ取して乾燥し、rac-8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R,2S)-2-ヒドロキシ-1-(ヒドロキシメチル)-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 74 mgを得た。
実施例713
1-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}オキシ)-1H-ベンゾトリアゾール100 mgにジクロロメタン1.7 ml、(S)-(-)-1-フェニルエチルアミン 0.065ml、及びトリエチルアミン0.07mlを加え、一終夜攪拌した。反応液に水及びクロロホルムを加え分液操作を行ない、無水硫酸ナトリウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物にジイソプロピルエーテルを加え、生じた固体をろ取して乾燥し、8-(シクロヘキシルメトキシ)-2-メチル-N-[(1S)-1-フェニルエチル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド 80 mgを得た。
実施例714
実施例766の化合物100 mg のTHF 3.3 ml及び水1.7 mlの混合物に氷冷下にて過よう素酸ナトリウムを加え、室温で2時間、50℃で3時間攪拌した。反応液に水及び酢酸エチルを加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧下溶媒を留去した。得られた残渣のTHF 2 ml及びメタノール 2 ml混合物に、氷冷下にて水素化ホウ素ナトリウム 39 mgを加え、氷冷下にて1時間、室温にて1時間攪拌した。反応液に飽和塩化アンモニウム水溶液、酢酸エチル、水を加え分液操作を行なった。有機層を飽和食塩水で洗浄して無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製した。得られた精製物を酢酸エチル及びヘキサンで洗浄し、8-[(2,6-ジフルオロベンジル)オキシ]-N-(1,5-ジヒドロキシ-3-フェニルペンタン-3-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド 33 mgを得た。
実施例758
製造例240の化合物を用いて、上述の実施例1と同様の方法で製造した。
実施例759
製造例172の化合物を用いて、上述の実施例1と同様の方法で製造した。
実施例766
製造例278の化合物を用いて、上述の実施例1と同様の方法で製造した。
実施例767
製造例279の化合物を用いて、上述の実施例1と同様の方法で製造した。
実施例797
製造例172の化合物を用いて、上述の実施例1と同様の方法で製造した。
実施例798
製造例172の化合物を用いて、上述の実施例1と同様の方法で製造した。
Claims (22)
- 式(I)の化合物又はその塩。
A1:R0、-R00-(アリール)、ハロゲノ低級アルキル、置換されていてもよいシクロアルキル、置換されていてもよいヘテロシクロアルキル、置換されていてもよいアリール又は置換されていてもよいヘテロアリール、
R0:同一又は互いに異なって、低級アルキル、
R00:同一又は互いに異なって、低級アルキレン、
R1:H、R0、ハロゲン、-CN、-CO2H、-CO2R0、又は-R00-OH、
R2:H、R0、C3-6シクロアルキル又はハロゲノ低級アルキル、
R3:H、R0、-R00-CO2H又は-R00-CO2R0、
R4:-Y-A2又はA3、或いはR3とR4が結合するN原子とともに一体となり、-OH、-R00-OH、-CO2H、-CO2R0及びフェニルからなる群より選択される1以上の基で置換されていてもよい含窒素飽和ヘテロ環を形成してもよい、
Y:G2群から選択される1以上の基で置換されていてもよいC1-10アルキレン、G2群から選択される1以上の基で置換されていてもよいC2-10アルケニレン又は-SO2-(G2群から選択される1以上の基で置換されていてもよい低級アルキレン)-、
G2群:-CO2H、-CO2R0、-OH、-OR0、-O-CO-R0、-OSi(R0)3、-NH2、-NHR0、-N(R0)2、-NH-CO-R0、-SR0、-CO-NH-SO2-R0、置換されていてもよいアリール及び置換されていてもよいヘテロアリール、
A2:H、-OH、-O-CO-R0、-O-(アリール)、-CO-R0、-CO-R00-OH、-CO2-R00-(アリール)、-CO-NH2、-CO-NHR0、-CO-N(R0)2、置換されていてもよいシクロアルキル、置換されていてもよいヘテロシクロアルキル、置換されていてもよいアリール又は置換されていてもよいヘテロアリール、
A3:H、G1群から選択される1以上の基で置換されていてもよいシクロアルキル、G1群から選択される1以上の基で置換されていてもよいヘテロシクロアルキル、G1群から選択される1以上の基で置換されていてもよいアリール又はG1群から選択される1以上の基で置換されていてもよいヘテロアリール、
G1群:R0、ハロゲノ低級アルキル、-R00-OH、ハロゲン、オキソ、-NO2、-OH、-OR0、-O-R00-N(R0)2、-NH2、-CO-R0、-CO-R00-OH、-CO2H、-CO2R0、-CO-NH2、-CO-NHR0、-CO-N(R0)2、-CO2-R00-(フェニル)、-SO2-R0、-SO2-NH2、-SO2-NHR0、-SO2-N(R0)2、-SO2-R00-CO2H、-SO2-R00-CO2R0、-SO2-(フェニル)、-SO2-R00-(フェニル)、-R00-CO2H、-R00-CO2R0、-R00-CO-NH2、-R00-CO-NHR0、-R00-CO-N(R0)2、-R00-NH2、-R00-NHR0、-R00-N(R0)2、-R00-(フェニル)、-R00-(フェニレン)-R0、-R00-(シクロアルキル)、-R00-(ヘテロシクロアルキル)、-R00-(単環式含窒素ヘテロアリール)、シクロアルキル、フェニル、-(フェニレン)-R0、-(フェニレン)-CO2H、-(フェニレン)-CO2R0、-(ピリジンジイル)-CO2H、-(ピリジンジイル)-CO2R0、-(ピペリジンジイル)-R0、-(フェニレン)-R00-CO2H、-R00-(フェニレン)-CO2H、-R00-(フェニレン)-CO2R0、単環式含窒素ヘテロアリール及びヘテロシクロアルキル、
R5:同一又は互いに異なって、H又はR0、
ただし、式(I)の化合物は、8-(ベンジロキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド及び8-(ベンジロキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル](ピペラジン-1-イル)メタノンであることはない。) - A1がシクロへキシル、又は1以上のFで置換されていてもよいフェニルであり、R1がHであり、R2がR0であり、R3がHであり、R5がHであり、
R4が-Y-A2又はA3であり、
Yが、G2群から選択される1以上の基で置換されていてもよいC1-10アルキレンであり、
G2群が-CO2H及び-OHであり、
A2がH、シクロアルキル、ピリジル、又は、低級アルキル及び-CO2Hから選択される基で置換されていてもよいフェニルであり、
A3が、G1群から選択される1以上の基で置換されていてもよい、シクロペンチル、インダニル、ジヒドロシクロペンタチエニル、ジヒドロシクロペンタフラニル及びジヒドロシクロペンタピロリルから選択されるシクロアルキル、又は、G1群から選択される1以上の基で置換されていてもよいピペリジル又はピロリジルであり、かつG1群がR0、ハロゲン、-CO2H、-OH、-CO2R0、-CN、-NO2、フェニル、-SO2-NH2、-SO3H及び-SO3R0である、請求項1に記載の化合物又はその塩。 - A1がシクロへキシル、2-フルオロフェニル、2,3-ジフルオロフェニル、2,6-ジフルオロフェニル又は2,3,6-トリフルオロフェニルであり、R4が下記式(A)、(B)、(C)、(D)、(E)、(F)又は(G)の何れかで示される基であり、
- A1が2,6-ジフルオロフェニルであり、R2がメチルであり、R4が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが1であり、R6がFであり、且つ、R7が-CO2Hである、請求項3に記載の化合物又はその塩。
- R2がメチルであり、R4が式(C)又は(D)で示される基である、請求項3に記載の化合物又はその塩。
- A1がシクロへキシル又は2,6-ジフルオロフェニルであり、R2がメチルであり、R4がA3であり、A3が式(A)又は式(B)で示される基であり、Xが-HC=CH-であり、nが1であり、R5がそれぞれがHであり、R6がHであり、R7が-CO2Hである、請求項3に記載の化合物又はその塩。
- R2がメチルであり、R4が式(E)で示される基である、請求項3記載の化合物又はその塩。
- R2がメチルであり、R4が式(F)で示される基である、請求項3に記載の化合物又はその塩。
- R2がメチルであり、R4が式(G)で示される基である、請求項3に記載の化合物又はその塩。
- 化合物が、下記群から選択される化合物である、請求項3に記載の化合物又はその塩。(3S)-3-({[8-(シクロヘキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-3-フェニルプロパン酸、
(1S,2R)-1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a] ピリジン-3-イル}カルボニル)アミノ]インダン-2-カルボン酸、
(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)インダン-2-カルボン酸、
(1R,2S)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)インダン-2-カルボン酸、
8-[(2,6-ジフルオロベンジル)オキシ]-N-(1,3-ジヒドロキシ-2-フェニルプロパン-2-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
(1S,2R)-1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]-7-フルオロインダン-2-カルボン酸、
(1S,2R)-1-[({8-[(2,6-ジフルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]-4-メチルインダン-2-カルボン酸、
(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-5-フルオロインダン-2-カルボン酸、
(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-7-フルオロインダン-2-カルボン酸、
(1R,2S)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-7-フルオロインダン-2-カルボン酸、
(1S,2R)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-4-メチルインダン-2-カルボン酸、
(1S,2R)-1-[({2-メチル-8-[(2,3,6-トリフルオロベンジル)オキシ]イミダゾ[1,2-a]ピリジン-3-イル}カルボニル)アミノ]インダン-2-カルボン酸、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R)-2-ヒドロキシ-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル) オキシ-N-[(1R,2R)-2-ヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,3-ジフルオロベンジル)オキシ]-N-(1,3-ジヒドロキシ-2-フェニルプロパン-2-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[1,3-ジヒドロキシ-2-(ピリジン-2-イル)プロパン-2-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-(シクロへキシルメトキシ)-N-[(1R)-2-ヒドロキシ-1-フェニルエチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(2R)-1-ヒドロキシプロパン-2-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(2R)-1-ヒドロキシ-3-メチルブタン-2-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
N-(1,3-ジヒドロキシ-2-フェニルプロパン-2-イル)-8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。 - 化合物が、下記群から選択される化合物である、請求項3に記載の化合物又はその塩。8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R,2S,3S)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,3-ジフルオロベンジル)オキシ]-N-[(1R,2S,3S)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
N-[(1R,2S,3S)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。 - 化合物が、下記群から選択される化合物である、請求項3に記載の化合物又はその塩。8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R,2S,3R)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、8-[(2,3-ジフルオロベンジル)オキシ]-N-[(1R,2S,3R)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
N-[(1R,2S,3R)-2,3-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1-イル]-8-[(2-フルオロベンジル)オキシ]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。 - 化合物が、下記群から選択される化合物である、請求項2に記載の化合物又はその塩。
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1r,3R,4S)-3,4-ジヒドロキシ-1-フェニルシクロペンチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1s,3R,4S)-3,4-ジヒドロキシ-1-フェニルシクロペンチル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。 - 化合物が、下記群から選択される化合物である、請求項2に記載の化合物又はその塩。
8-(シクロへキシルメトキシ)-2-メチル-N-[(3S)-1-メチルピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド、
(3R)-3-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)-5-メチルヘキサン酸、
8-(シクロへキシルメトキシ)-N-(1,3-ジヒドロキシプロパン-2-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-(シクロへキシルメトキシ)-2-メチル-N-[(3S)-1-メチルピロリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド、
3-[(1S)-1-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a]ピリジン-3-イル]カルボニル}アミノ)エチル]安息香酸、
8-[(2,6-ジフルオロベンジル)オキシ]-N-(1-ヒドロキシ-2-メチルプロパン-2-イル)-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
8-[(2,6-ジフルオロベンジル)オキシ]-N-[(1R,2S)-2,3-ジヒドロキシ-1-フェニルプロピル]-2-メチルイミダゾ[1,2-a]ピリジン-3-カルボキサミド、
(3R)-4-シクロブチル-3-({[8-(シクロへキシルメトキシ)-2-メチルイミダゾ[1,2-a] ピリジン-3-イル]カルボニル}アミノ)ブタン酸、
8-[(2,6-ジフルオロベンジル)オキシ]-2-メチル-N-[(3S)-1-スルファモイルピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド、及び
8-[(2,6-ジフルオロベンジル)オキシ]-2-メチル-N-[(3S)-ピペリジン-3-イル]イミダゾ[1,2-a]ピリジン-3-カルボキサミド、
からなる群から選択される化合物又はその塩。 - 請求項1に記載の化合物又はその塩、及び製薬学的に許容される賦形剤を含有する医薬組成物。
- 可溶性グアニル酸シクラーゼ活性化剤である、請求項16に記載の医薬組成物。
- 閉塞性血栓性血管炎、末梢動脈閉塞症、間歇性跛行、重症下肢虚血、レイノー病、レイノー症候群、高血圧症又は肺高血圧症の予防用若しくは治療用医薬組成物である請求項16に記載の医薬組成物。
- 閉塞性血栓性血管炎、末梢動脈閉塞症、間歇性跛行、重症下肢虚血、レイノー病、レイノー症候群、高血圧症又は肺高血圧症の予防若しくは治療用医薬組成物の製造のための請求項1に記載の化合物又はその塩の使用。
- 閉塞性血栓性血管炎、末梢動脈閉塞症、間歇性跛行、重症下肢虚血、レイノー病、レイノー症候群、高血圧症又は肺高血圧症の予防若しくは治療のための請求項1に記載の化合物又はその塩の使用。
- 閉塞性血栓性血管炎、末梢動脈閉塞症、間歇性跛行、重症下肢虚血、レイノー病、レイノー症候群、高血圧症又は肺高血圧症の予防若しくは治療のための請求項1に記載の化合物又はその塩。
- 請求項1に記載の化合物又はその塩の有効量を対象に投与することからなる閉塞性血栓性血管炎、末梢動脈閉塞症、間歇性跛行、重症下肢虚血、レイノー病、レイノー症候群、高血圧症又は肺高血圧症の予防若しくは治療方法。
Priority Applications (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CA2836202A CA2836202A1 (en) | 2011-05-30 | 2012-05-29 | Imidazopyridine compounds |
| ES12791965.2T ES2597034T3 (es) | 2011-05-30 | 2012-05-29 | Compuesto de imidazopiridina |
| BR112013030909A BR112013030909A2 (pt) | 2011-05-30 | 2012-05-29 | compostos de imidazopiridina |
| CN201280026953.4A CN103608347B (zh) | 2011-05-30 | 2012-05-29 | 咪唑并吡啶化合物 |
| EP12791965.2A EP2716642B1 (en) | 2011-05-30 | 2012-05-29 | Imidazopyridine compound |
| EA201391769A EA201391769A1 (ru) | 2011-05-30 | 2012-05-29 | Имидазопиридиновые соединения |
| MX2013014082A MX2013014082A (es) | 2011-05-30 | 2012-05-29 | Compuestos de imidazopiridina. |
| JP2013518087A JP5975025B2 (ja) | 2011-05-30 | 2012-05-29 | イミダゾピリジン化合物 |
| KR1020137034903A KR20140040774A (ko) | 2011-05-30 | 2012-05-29 | 이미다조피리딘 화합물 |
| IL229513A IL229513A0 (en) | 2011-05-30 | 2013-11-20 | imidazopyridine compounds |
| US14/090,074 US9447090B2 (en) | 2011-05-30 | 2013-11-26 | Imidazopyridine compounds |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011119826 | 2011-05-30 | ||
| JP2011-119826 | 2011-05-30 | ||
| JP2011-287682 | 2011-12-28 | ||
| JP2011287682 | 2011-12-28 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US14/090,074 Continuation-In-Part US9447090B2 (en) | 2011-05-30 | 2013-11-26 | Imidazopyridine compounds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2012165399A1 true WO2012165399A1 (ja) | 2012-12-06 |
Family
ID=47259254
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2012/063695 WO2012165399A1 (ja) | 2011-05-30 | 2012-05-29 | イミダゾピリジン化合物 |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US9447090B2 (ja) |
| EP (1) | EP2716642B1 (ja) |
| JP (1) | JP5975025B2 (ja) |
| KR (1) | KR20140040774A (ja) |
| CN (1) | CN103608347B (ja) |
| AR (1) | AR086589A1 (ja) |
| BR (1) | BR112013030909A2 (ja) |
| CA (1) | CA2836202A1 (ja) |
| EA (1) | EA201391769A1 (ja) |
| ES (1) | ES2597034T3 (ja) |
| IL (1) | IL229513A0 (ja) |
| MX (1) | MX2013014082A (ja) |
| PL (1) | PL2716642T3 (ja) |
| PT (1) | PT2716642T (ja) |
| TW (1) | TW201311685A (ja) |
| WO (1) | WO2012165399A1 (ja) |
Cited By (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013157528A1 (ja) * | 2012-04-16 | 2013-10-24 | トーアエイヨー株式会社 | 2環性化合物 |
| US20140128424A1 (en) * | 2012-11-05 | 2014-05-08 | Bayer Pharma Aktiengesellschaft | Hydroxy-substituted imidazo[1,2-a]-pyridinecarboxamides and their use |
| WO2014068095A1 (de) * | 2012-11-05 | 2014-05-08 | Bayer Pharma Aktiengesellschaft | Carboxy-substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung als stimulatoren der löslichen guanylatcyclase |
| WO2014068099A1 (de) | 2012-11-05 | 2014-05-08 | Bayer Pharma Aktiengesellschaft | Amino-substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung |
| WO2014084312A1 (ja) | 2012-11-30 | 2014-06-05 | アステラス製薬株式会社 | イミダゾピリジン化合物 |
| WO2014195333A1 (de) * | 2013-06-04 | 2014-12-11 | Bayer Pharma Aktiengesellschaft | 3-aryl-substituierte imidazo[1,2-a]pyridine und ihre verwendung |
| WO2015012328A1 (ja) * | 2013-07-24 | 2015-01-29 | 武田薬品工業株式会社 | 複素環化合物 |
| WO2015018808A1 (de) * | 2013-08-08 | 2015-02-12 | Bayer Pharma Aktiengesellschaft | Substituierte imidazo[1,2-a]pyrazincarboxamide und ihre verwendung |
| WO2015082411A1 (de) * | 2013-12-05 | 2015-06-11 | Bayer Pharma Aktiengesellschaft | Aryl- und hetaryl-substituierte imidazo[1,2-a]pyridin-3-carboxamide und ihre verwendung |
| WO2015106268A1 (en) | 2014-01-13 | 2015-07-16 | Ironwood Pharmaceuticals, Inc. | USE OF sGC STIMULATORS FOR THE TREATMENT OF NEUROMUSCULAR DISORDERS |
| WO2015124544A1 (de) * | 2014-02-19 | 2015-08-27 | Bayer Pharma Aktiengesellschaft | 3-(pyrimidin-2-yl)imidazo[1,2-a]pyridine |
| US9126998B2 (en) | 2012-11-05 | 2015-09-08 | Bayer Pharma AG | Amino-substituted imidazo[1,2-a]pyridinecarboxamides and their use |
| WO2015140254A1 (de) * | 2014-03-21 | 2015-09-24 | Bayer Pharma Aktiengesellschaft | Substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung |
| WO2015140199A1 (de) * | 2014-03-21 | 2015-09-24 | Bayer Pharma Aktiengesellschaft | Cyano-substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung |
| WO2015165930A1 (de) | 2014-05-02 | 2015-11-05 | Bayer Pharma Aktiengesellschaft | Enantiomere des n-(2-amino-5-fluor-2-methylpentyl)-8-[(2,6-difluorbenzyl)oxy]-2-methylimidazo[1,2-a]pyridin-3-carboxamids sowie der di- and tri-fluor-derivate zur behandlung von kardiovaskulären erkrankungen |
| WO2016087343A1 (de) | 2014-12-02 | 2016-06-09 | Bayer Pharma Aktiengesellschaft | Heteroaryl-substituierte imidazo[1,2-a]pyridine und ihre verwendung |
| JP2016529249A (ja) * | 2013-08-08 | 2016-09-23 | バイエル・ファルマ・アクティエンゲゼルシャフト | 置換ピラゾロ[1,5−a]ピリジン−3−カルボキサミドおよびその使用 |
| US9469637B2 (en) | 2012-04-25 | 2016-10-18 | Takeda Pharmaceutical Company Limited | Nitrogenated heterocyclic compound |
| WO2016177660A1 (en) | 2015-05-06 | 2016-11-10 | Bayer Pharma Aktiengesellschaft | The use of sgc stimulators, sgc activators, alone and combinations with pde5 inhibitors for the treatment of digital ulcers (du) concomitant to systemic sclerosis (ssc) |
| US9505786B2 (en) | 2012-01-11 | 2016-11-29 | Bayer Pharma Aktiengesellschaft | Substituted annulated triazines and use thereof |
| US9527841B2 (en) | 2012-07-13 | 2016-12-27 | Takeda Pharmaceutical Company Limited | Substituted pyrido[2,3-b]pyrazines as phosphodiesterase 2A inhibitors |
| WO2017013010A1 (de) | 2015-07-23 | 2017-01-26 | Bayer Pharma Aktiengesellschaft | Stimulatoren und/oder aktivatoren der löslichen guanylatzyklase (sgc) in kombination mit einem inhibitor der neutralen endopeptidase (nep inhibitor) und/oder einem angiotensin aii-antagonisten und ihre verwendung |
| US20170050961A1 (en) * | 2014-05-02 | 2017-02-23 | Bayer Pharma Aktiengesellschaft | Imidazo[1,2-a]pyridines as soluble guanylate cyclase stimulators for the treatment of cardiovascular diseases |
| US9605008B2 (en) | 2013-07-10 | 2017-03-28 | Bayer Pharma Aktiengesellschaft | Benzyl-1H-pyrazolo[3,4-b]pyridines and use thereof |
| WO2017106175A2 (en) | 2015-12-14 | 2017-06-22 | Ironwood Pharmaceuticals, Inc. | USE OF sGC STIMULATORS FOR THE TREATMENT OF GASTROINTESTINAL SPHINCTER DYSFUNCTION |
| US9834520B2 (en) | 2013-03-14 | 2017-12-05 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| WO2018069126A1 (de) | 2016-10-11 | 2018-04-19 | Bayer Pharma Aktiengesellschaft | Kombination enthaltend sgc stimulatoren und mineralocorticoid-rezeptor-antagonisten |
| WO2018111795A2 (en) | 2016-12-13 | 2018-06-21 | Ironwood Pharmaceuticals, Inc. | Use of sgc stimulators for the treatment of esophageal motility disorders |
| US10053468B2 (en) | 2013-07-03 | 2018-08-21 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| WO2018184976A1 (de) | 2017-04-05 | 2018-10-11 | Bayer Pharma Aktiengesellschaft | Substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung |
| WO2019081456A1 (en) | 2017-10-24 | 2019-05-02 | Bayer Aktiengesellschaft | USE OF SGC ACTIVATORS AND STIMULATORS COMPRISING A BETA2 SUBUNIT |
| EP3498298A1 (en) | 2017-12-15 | 2019-06-19 | Bayer AG | The use of sgc stimulators and sgc activators alone or in combination with pde5 inhibitors for the treatment of bone disorders including osteogenesis imperfecta (oi) |
| WO2019211081A1 (en) | 2018-04-30 | 2019-11-07 | Bayer Aktiengesellschaft | The use of sgc activators and sgc stimulators for the treatment of cognitive impairment |
| US10472376B2 (en) | 2013-07-03 | 2019-11-12 | Takeda Pharmaceutical Company Limited | Amide compound |
| WO2019219672A1 (en) | 2018-05-15 | 2019-11-21 | Bayer Aktiengesellschaft | 1,3-thiazol-2-yl substituted benzamides for the treatment of diseases associated with nerve fiber sensitization |
| EP3574905A1 (en) | 2018-05-30 | 2019-12-04 | Adverio Pharma GmbH | Method of identifying a subgroup of patients suffering from dcssc which benefits from a treatment with sgc stimulators and sgc activators in a higher degree than a control group |
| WO2020014504A1 (en) | 2018-07-11 | 2020-01-16 | Cyclerion Therapeutics, Inc. | USE OF sGC STIMULATORS FOR THE TREATMENT OF MITOCHONRIAL DISORDERS |
| WO2020148379A1 (en) | 2019-01-17 | 2020-07-23 | Bayer Aktiengesellschaft | Methods to determine whether a subject is suitable of being treated with an agonist of soluble guanylyl cyclase (sgc) |
| WO2020165010A1 (en) | 2019-02-13 | 2020-08-20 | Bayer Aktiengesellschaft | Process for the preparation of porous microparticles |
| US11331308B2 (en) | 2016-10-11 | 2022-05-17 | Bayer Pharma Aktiengesellschaft | Combination containing sGC activators and mineralocorticoid receptor antagonists |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103508918B (zh) * | 2012-06-18 | 2015-09-09 | 上海医药工业研究院 | 带有环丁基的α-羟基β-氨基酯类化合物及其制备方法 |
| EP3137465A1 (de) * | 2014-05-02 | 2017-03-08 | Bayer Pharma Aktiengesellschaft | 6-chlor-substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung als stimulatoren der löslichen guanylatcyclase |
| JP2017514899A (ja) * | 2014-05-02 | 2017-06-08 | バイエル・ファルマ・アクティエンゲゼルシャフト | ヘテロシクリル−およびヘテロアリール−置換イミダゾ[1,2−a]ピリジンおよびその使用 |
| CN103965193B (zh) * | 2014-05-30 | 2016-04-06 | 浙江司太立制药股份有限公司 | N-(苯氧烷基)咪唑并[1,2-a]吡啶-3-酰胺类化合物及其制备方法 |
| EP3227286B1 (de) * | 2014-12-02 | 2018-12-26 | Bayer Pharma Aktiengesellschaft | Substituierte pyrazolo[1,5-a]pyridine und imidazo[1,2-a]pyrazine und ihre verwendung |
| WO2016101118A1 (en) * | 2014-12-23 | 2016-06-30 | Merck Sharp & Dohme Corp. | Amidoethyl azole orexin receptor antagonists |
| KR20180011843A (ko) | 2015-06-11 | 2018-02-02 | 바실리어 파마슈티카 인터내셔널 리미티드 | 유출-펌프 억제제 및 이의 치료적 용도 |
| PE20181352A1 (es) * | 2015-09-17 | 2018-08-22 | Marvin J Miller | Compuestos heterociclicos que contienen bencilamina y composiciones utiles contra infeccion por micobacterias |
| CN111518061B (zh) * | 2019-02-01 | 2023-08-25 | 鲁南制药集团股份有限公司 | 一种(e)-3-(3-呋喃基)丙烯酸的制备方法 |
| CN110229067A (zh) * | 2019-06-05 | 2019-09-13 | 南京焕然生物科技有限公司 | 一种2-氨基茚制备方法 |
Citations (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07242666A (ja) | 1994-03-08 | 1995-09-19 | Fujisawa Pharmaceut Co Ltd | 複素環化合物 |
| WO1998037080A1 (en) | 1997-02-25 | 1998-08-27 | Astra Aktiebolag | Compounds for inhibition of gastric acid secretion |
| WO1999063940A2 (en) * | 1998-06-08 | 1999-12-16 | Advanced Medicine, Inc. | INHIBITORS OF H+K+-ATPase |
| WO2000006569A1 (de) | 1998-07-29 | 2000-02-10 | Bayer Aktiengesellschaft | Mit sechsgliedrigen heterocyclischen ringen kondensierte substituierte pyrazolderivate |
| WO2000021954A1 (de) | 1998-10-09 | 2000-04-20 | Bayer Aktiengesellschaft | Neue heterocyclyl-methyl-substituierte pyrazole |
| WO2000027394A1 (en) | 1998-11-05 | 2000-05-18 | University College London | Activators of soluble guanylate cyclase |
| WO2001032604A1 (en) | 1999-11-05 | 2001-05-10 | University College London | Activators of soluble guanylate cyclase |
| WO2001083490A1 (de) | 2000-04-28 | 2001-11-08 | Bayer Aktiengesellschaft | Substituiertes pyrazolderivat |
| WO2001096335A1 (en) | 2000-06-12 | 2001-12-20 | Cardiome Pharma Corp. | Imidazo[1,2-a]pyridine ether compounds as ion channel modulators |
| WO2003004503A1 (de) | 2001-07-04 | 2003-01-16 | Bayer Healthcare Ag | Morpholin-überbrückte pyrazolopyridinderivate |
| WO2003076408A2 (en) | 2002-03-08 | 2003-09-18 | Abbott Laboratories | Indazole derivatives that are activators of soluble guanylate cyclase |
| WO2003086407A1 (de) | 2002-04-12 | 2003-10-23 | Bayer Healthcare Ag | Verwendung von stimulatoren der löslichen guanylatcyclase zur behandlung von glaukom |
| WO2003095451A1 (de) | 2002-05-08 | 2003-11-20 | Bayer Healthcare Ag | Carbamat-substituierte pyrazolopyridine |
| WO2003097063A1 (de) | 2002-05-17 | 2003-11-27 | Bayer Healthcare Ag | Derivate-des 2- (1-benzyl-1h-pyrazolo (3, 4-b) pyridin-3-yl) -5-(4-pyridinyl) -4-pyrimidinamins und ihre verwendung als guanylatcyclase-stimulatoren |
| WO2007124854A1 (de) | 2006-04-27 | 2007-11-08 | Bayer Healthcare Ag | Heterocyclisch substituierte, anellierte pyrazol-derivate und ihre verwendung |
| WO2007128454A1 (de) | 2006-05-09 | 2007-11-15 | Bayer Healthcare Ag | 3-tetrazolylindazole und 3-tetrazolylpyrazolopyridine sowie ihre verwendung |
| WO2008031513A1 (de) | 2006-09-15 | 2008-03-20 | Bayer Schering Pharma Aktiengesellschaft | Pyrazolopyridin, indazol, imidazopyridin, imidazopyrimidin, pyrazolopyrazin und pyrazolopyridin derivate als stimulatoren der guanylatcyclase zur herz-kreislauferkrankungen |
| WO2008061657A1 (de) | 2006-11-21 | 2008-05-29 | Bayer Schering Pharma Aktiengesellschaft | Neue aza-bicyclische verbindungen und ihre verwendung als stimulatoren der löslichen guanylatcyclase |
| WO2010079120A1 (de) | 2009-01-09 | 2010-07-15 | Bayer Schering Pharma Aktiengesellschaft | Benzimidazol-und pyrazolopyridin-derivate zur behandlung und/oder prävention von herz-kreislauf-erkrankungen |
| WO2010078900A2 (de) | 2008-12-19 | 2010-07-15 | Bayer Schering Pharma Aktiengesellschaft | Neue aliphatisch substituierte pyrazolopyridine und ihre verwendung |
| WO2011113606A1 (en) | 2010-03-18 | 2011-09-22 | Institut Pasteur Korea | Anti-infective compounds |
-
2012
- 2012-05-29 EA EA201391769A patent/EA201391769A1/ru unknown
- 2012-05-29 MX MX2013014082A patent/MX2013014082A/es unknown
- 2012-05-29 CA CA2836202A patent/CA2836202A1/en not_active Abandoned
- 2012-05-29 BR BR112013030909A patent/BR112013030909A2/pt not_active IP Right Cessation
- 2012-05-29 KR KR1020137034903A patent/KR20140040774A/ko not_active Application Discontinuation
- 2012-05-29 CN CN201280026953.4A patent/CN103608347B/zh not_active Expired - Fee Related
- 2012-05-29 EP EP12791965.2A patent/EP2716642B1/en active Active
- 2012-05-29 JP JP2013518087A patent/JP5975025B2/ja not_active Expired - Fee Related
- 2012-05-29 AR ARP120101881A patent/AR086589A1/es not_active Application Discontinuation
- 2012-05-29 WO PCT/JP2012/063695 patent/WO2012165399A1/ja active Application Filing
- 2012-05-29 TW TW101119128A patent/TW201311685A/zh unknown
- 2012-05-29 PT PT127919652T patent/PT2716642T/pt unknown
- 2012-05-29 PL PL12791965T patent/PL2716642T3/pl unknown
- 2012-05-29 ES ES12791965.2T patent/ES2597034T3/es active Active
-
2013
- 2013-11-20 IL IL229513A patent/IL229513A0/en unknown
- 2013-11-26 US US14/090,074 patent/US9447090B2/en active Active
Patent Citations (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07242666A (ja) | 1994-03-08 | 1995-09-19 | Fujisawa Pharmaceut Co Ltd | 複素環化合物 |
| WO1998037080A1 (en) | 1997-02-25 | 1998-08-27 | Astra Aktiebolag | Compounds for inhibition of gastric acid secretion |
| WO1999063940A2 (en) * | 1998-06-08 | 1999-12-16 | Advanced Medicine, Inc. | INHIBITORS OF H+K+-ATPase |
| WO2000006569A1 (de) | 1998-07-29 | 2000-02-10 | Bayer Aktiengesellschaft | Mit sechsgliedrigen heterocyclischen ringen kondensierte substituierte pyrazolderivate |
| WO2000021954A1 (de) | 1998-10-09 | 2000-04-20 | Bayer Aktiengesellschaft | Neue heterocyclyl-methyl-substituierte pyrazole |
| WO2000027394A1 (en) | 1998-11-05 | 2000-05-18 | University College London | Activators of soluble guanylate cyclase |
| WO2001032604A1 (en) | 1999-11-05 | 2001-05-10 | University College London | Activators of soluble guanylate cyclase |
| WO2001083490A1 (de) | 2000-04-28 | 2001-11-08 | Bayer Aktiengesellschaft | Substituiertes pyrazolderivat |
| WO2001096335A1 (en) | 2000-06-12 | 2001-12-20 | Cardiome Pharma Corp. | Imidazo[1,2-a]pyridine ether compounds as ion channel modulators |
| WO2003004503A1 (de) | 2001-07-04 | 2003-01-16 | Bayer Healthcare Ag | Morpholin-überbrückte pyrazolopyridinderivate |
| WO2003076408A2 (en) | 2002-03-08 | 2003-09-18 | Abbott Laboratories | Indazole derivatives that are activators of soluble guanylate cyclase |
| WO2003086407A1 (de) | 2002-04-12 | 2003-10-23 | Bayer Healthcare Ag | Verwendung von stimulatoren der löslichen guanylatcyclase zur behandlung von glaukom |
| WO2003095451A1 (de) | 2002-05-08 | 2003-11-20 | Bayer Healthcare Ag | Carbamat-substituierte pyrazolopyridine |
| WO2003097063A1 (de) | 2002-05-17 | 2003-11-27 | Bayer Healthcare Ag | Derivate-des 2- (1-benzyl-1h-pyrazolo (3, 4-b) pyridin-3-yl) -5-(4-pyridinyl) -4-pyrimidinamins und ihre verwendung als guanylatcyclase-stimulatoren |
| WO2007124854A1 (de) | 2006-04-27 | 2007-11-08 | Bayer Healthcare Ag | Heterocyclisch substituierte, anellierte pyrazol-derivate und ihre verwendung |
| WO2007128454A1 (de) | 2006-05-09 | 2007-11-15 | Bayer Healthcare Ag | 3-tetrazolylindazole und 3-tetrazolylpyrazolopyridine sowie ihre verwendung |
| WO2008031513A1 (de) | 2006-09-15 | 2008-03-20 | Bayer Schering Pharma Aktiengesellschaft | Pyrazolopyridin, indazol, imidazopyridin, imidazopyrimidin, pyrazolopyrazin und pyrazolopyridin derivate als stimulatoren der guanylatcyclase zur herz-kreislauferkrankungen |
| WO2008061657A1 (de) | 2006-11-21 | 2008-05-29 | Bayer Schering Pharma Aktiengesellschaft | Neue aza-bicyclische verbindungen und ihre verwendung als stimulatoren der löslichen guanylatcyclase |
| WO2010078900A2 (de) | 2008-12-19 | 2010-07-15 | Bayer Schering Pharma Aktiengesellschaft | Neue aliphatisch substituierte pyrazolopyridine und ihre verwendung |
| WO2010079120A1 (de) | 2009-01-09 | 2010-07-15 | Bayer Schering Pharma Aktiengesellschaft | Benzimidazol-und pyrazolopyridin-derivate zur behandlung und/oder prävention von herz-kreislauf-erkrankungen |
| WO2011113606A1 (en) | 2010-03-18 | 2011-09-22 | Institut Pasteur Korea | Anti-infective compounds |
Non-Patent Citations (16)
| Title |
|---|
| "Courses in Experimental Chemistry (5h edition", vol. 16, 2005, MARUZEN |
| "Courses in Experimental Chemistry", vol. 14, 2005, MARUZEN |
| "Pharmaceutical Research and Development", vol. 7, 1990, HIROKAWA PUBLISHING COMPANY, pages: 163 - 198 |
| BLOOD, vol. 84, 1994, pages 4226 |
| D. A. PRICE, SYNLETT, 1999, pages 1919 - 1920 |
| JOURNAL OF CARDIOVASCULAR PHARMACOLOGY, vol. 56, 2010, pages 229 |
| JOURNAL OF MEDICINAL CHEMISTRY, vol. 28, 1985, pages 876 |
| KAMINSKI, J.J. ET AL.: "Antiulcer agents. 1. Gastric antisecretory and cytoprotective properties of substituted imidazo[1,2-a]pyridines", JOURNAL OF MEDICINAL CHEMISTRY, vol. 28, no. 7, 1985, pages 876 - 892, XP002919901 * |
| MITSUNOBU, 0., SYNTHESIS, 1981 |
| P. G. M. WUTS; T. W. GREENE: "Greene's Protective Groups in Organic Synthesis", 2006 |
| PROG. MED., vol. 5, 1985, pages 2157 - 2161 |
| S. G. DAVIS, TETRAHEDRON ASYMMETRY, vol. 17, 2006, pages 1793 - 1811 |
| S. R. SANDLER; W. KARO: "Organic Functional Group Preparations", vol. 1, 1991, ACADEMIC PRESS INC. |
| See also references of EP2716642A4 |
| TETRAHEDRON LETTERS, vol. 37, 1996, pages 2463 |
| TSUNODA, T. ET AL., TETRAHEDRON LETTERS, vol. 36, 1995, pages 2529 |
Cited By (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9505786B2 (en) | 2012-01-11 | 2016-11-29 | Bayer Pharma Aktiengesellschaft | Substituted annulated triazines and use thereof |
| WO2013157528A1 (ja) * | 2012-04-16 | 2013-10-24 | トーアエイヨー株式会社 | 2環性化合物 |
| JPWO2013157528A1 (ja) * | 2012-04-16 | 2015-12-21 | トーアエイヨー株式会社 | 2環性化合物 |
| RU2640416C2 (ru) * | 2012-04-16 | 2018-01-09 | Тоа Эйо Лтд. | Бициклическое соединение |
| US9469637B2 (en) | 2012-04-25 | 2016-10-18 | Takeda Pharmaceutical Company Limited | Nitrogenated heterocyclic compound |
| US10017508B2 (en) | 2012-04-25 | 2018-07-10 | Takeda Pharmaceutical Company Limited | Nitrogenated heterocyclic compound |
| US9527841B2 (en) | 2012-07-13 | 2016-12-27 | Takeda Pharmaceutical Company Limited | Substituted pyrido[2,3-b]pyrazines as phosphodiesterase 2A inhibitors |
| US8778964B2 (en) * | 2012-11-05 | 2014-07-15 | Bayer Pharma Aktiengesellschaft | Hydroxy-substituted imidazo[1,2-a]-pyridinecarboxamides and their use |
| JP2015535271A (ja) * | 2012-11-05 | 2015-12-10 | バイエル・ファルマ・アクティエンゲゼルシャフト | カルボキシ置換イミダゾ[1,2‐a]ピリジンカルボキサミドおよびその使用 |
| US10052312B2 (en) | 2012-11-05 | 2018-08-21 | Bayer Pharma Aktiengesellschaft | Amino-substituted imidazo[1,2-a]pyridinecarboxamides and their use |
| US8946215B2 (en) | 2012-11-05 | 2015-02-03 | Bayer Pharma Aktiengesellschaft | Hydroxy-substituted imidazo[1,2-a]pyridinecarboxamides and their use |
| EP3272749A1 (de) * | 2012-11-05 | 2018-01-24 | Bayer Pharma Aktiengesellschaft | Amino-substituierte imidazo[1,2-a]pyridin-3-carboxamide und ihre verwendung als stimulatoren der löslischen guanylatcyclase |
| JP2016500705A (ja) * | 2012-11-05 | 2016-01-14 | バイエル・ファルマ・アクティエンゲゼルシャフト | アミノ置換イミダゾ[1,2−a]ピリジンカルボキサミドおよびその使用 |
| WO2014068099A1 (de) | 2012-11-05 | 2014-05-08 | Bayer Pharma Aktiengesellschaft | Amino-substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung |
| US20140128424A1 (en) * | 2012-11-05 | 2014-05-08 | Bayer Pharma Aktiengesellschaft | Hydroxy-substituted imidazo[1,2-a]-pyridinecarboxamides and their use |
| WO2014068104A1 (de) * | 2012-11-05 | 2014-05-08 | Bayer Pharma Aktiengesellschaft | Hydroxy-substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung als stimulatoren der löslichen guanylatcyclase |
| US9126998B2 (en) | 2012-11-05 | 2015-09-08 | Bayer Pharma AG | Amino-substituted imidazo[1,2-a]pyridinecarboxamides and their use |
| US9624214B2 (en) | 2012-11-05 | 2017-04-18 | Bayer Pharma Aktiengesellschaft | Amino-substituted imidazo[1,2-a]pyridinecarboxamides and their use |
| US10662185B2 (en) | 2012-11-05 | 2020-05-26 | Bayer Pharma Aktiengesellschaft | Amino-substituted imidazo[1,2-A] pyridinecarboxamides and their use |
| WO2014068095A1 (de) * | 2012-11-05 | 2014-05-08 | Bayer Pharma Aktiengesellschaft | Carboxy-substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung als stimulatoren der löslichen guanylatcyclase |
| US8796305B2 (en) * | 2012-11-05 | 2014-08-05 | Bayer Pharma Aktiengesellschaft | Carboxy-substituted imidazo[1,2-a]pyridinecarboxamides and their use |
| JP2015535272A (ja) * | 2012-11-05 | 2015-12-10 | バイエル・ファルマ・アクティエンゲゼルシャフト | ヒドロキシ置換イミダゾ[1,2−a]ピリジンカルボキサミドおよびその使用 |
| KR20150090157A (ko) | 2012-11-30 | 2015-08-05 | 아스테라스 세이야쿠 가부시키가이샤 | 이미다조피리딘 화합물 |
| WO2014084312A1 (ja) | 2012-11-30 | 2014-06-05 | アステラス製薬株式会社 | イミダゾピリジン化合物 |
| US9278968B2 (en) | 2012-11-30 | 2016-03-08 | Astellas Pharma Inc. | Imidazopyridine compounds |
| EA027909B1 (ru) * | 2012-11-30 | 2017-09-29 | Астеллас Фарма Инк. | Имидазопиридиновые соединения |
| US9834520B2 (en) | 2013-03-14 | 2017-12-05 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| US20160122341A1 (en) * | 2013-06-04 | 2016-05-05 | Bayer Pharma Aktiengesellschaft | 3-aryl-substituted imidazo[1,2-a]pyridines and their use |
| CN105339368B (zh) * | 2013-06-04 | 2017-08-15 | 拜耳制药股份公司 | 3‑芳基‑取代的咪唑并[1,2‑a]吡啶及其用途 |
| US9776997B2 (en) | 2013-06-04 | 2017-10-03 | Bayer Pharma Aktiengesellschaft | 3-aryl-substituted imidazo[1,2-A]pyridines and their use |
| WO2014195333A1 (de) * | 2013-06-04 | 2014-12-11 | Bayer Pharma Aktiengesellschaft | 3-aryl-substituierte imidazo[1,2-a]pyridine und ihre verwendung |
| US10472376B2 (en) | 2013-07-03 | 2019-11-12 | Takeda Pharmaceutical Company Limited | Amide compound |
| US11053262B2 (en) | 2013-07-03 | 2021-07-06 | Takeda Pharmaceutical Company Limited | Heterocyclic amide compounds having RORyT inhibitory action |
| US11851449B2 (en) | 2013-07-03 | 2023-12-26 | Takeda Pharmaceutical Company Limited | Heterocyclic amide compounds having an RORvt inhibitory action |
| US10053468B2 (en) | 2013-07-03 | 2018-08-21 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| US9605008B2 (en) | 2013-07-10 | 2017-03-28 | Bayer Pharma Aktiengesellschaft | Benzyl-1H-pyrazolo[3,4-b]pyridines and use thereof |
| WO2015012328A1 (ja) * | 2013-07-24 | 2015-01-29 | 武田薬品工業株式会社 | 複素環化合物 |
| EP3026051A4 (en) * | 2013-07-24 | 2017-03-08 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| WO2015018808A1 (de) * | 2013-08-08 | 2015-02-12 | Bayer Pharma Aktiengesellschaft | Substituierte imidazo[1,2-a]pyrazincarboxamide und ihre verwendung |
| CN105992765A (zh) * | 2013-08-08 | 2016-10-05 | 拜耳制药股份公司 | 取代的吡唑并[1,5-a]吡啶-3-甲酰胺及其用途 |
| JP2016529249A (ja) * | 2013-08-08 | 2016-09-23 | バイエル・ファルマ・アクティエンゲゼルシャフト | 置換ピラゾロ[1,5−a]ピリジン−3−カルボキサミドおよびその使用 |
| JP2016527295A (ja) * | 2013-08-08 | 2016-09-08 | バイエル・ファルマ・アクティエンゲゼルシャフト | 置換イミダゾ[1,2−a]ピラジンカルボキサミドおよびその使用 |
| CN106414440A (zh) * | 2013-12-05 | 2017-02-15 | 拜耳制药股份公司 | 芳基和杂芳基取代的咪唑并[1,2-a]吡啶-3-羧酰胺及其用途 |
| JP2016539166A (ja) * | 2013-12-05 | 2016-12-15 | バイエル・ファルマ・アクティエンゲゼルシャフト | アリール−およびヘテロアリール置換イミダゾ[1,2−a]ピリジン−3−カルボキサミドおよびその使用 |
| WO2015082411A1 (de) * | 2013-12-05 | 2015-06-11 | Bayer Pharma Aktiengesellschaft | Aryl- und hetaryl-substituierte imidazo[1,2-a]pyridin-3-carboxamide und ihre verwendung |
| WO2015106268A1 (en) | 2014-01-13 | 2015-07-16 | Ironwood Pharmaceuticals, Inc. | USE OF sGC STIMULATORS FOR THE TREATMENT OF NEUROMUSCULAR DISORDERS |
| CN106459090A (zh) * | 2014-02-19 | 2017-02-22 | 拜耳制药股份公司 | 3‑(嘧啶‑2‑基)咪唑并[1,2‑a]吡啶 |
| US9688699B2 (en) | 2014-02-19 | 2017-06-27 | Bayer Pharma Aktiengesellschaft | 3-(pyrimidine-2-yl)imidazo[1,2-a]pyridines |
| WO2015124544A1 (de) * | 2014-02-19 | 2015-08-27 | Bayer Pharma Aktiengesellschaft | 3-(pyrimidin-2-yl)imidazo[1,2-a]pyridine |
| WO2015140254A1 (de) * | 2014-03-21 | 2015-09-24 | Bayer Pharma Aktiengesellschaft | Substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung |
| WO2015140199A1 (de) * | 2014-03-21 | 2015-09-24 | Bayer Pharma Aktiengesellschaft | Cyano-substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung |
| US9771360B2 (en) | 2014-03-21 | 2017-09-26 | Bayer Pharma Aktiengesellschaft | Cyano-substituted imidazo[1,2-A]pyridinecarboxamides and their use |
| US20170050961A1 (en) * | 2014-05-02 | 2017-02-23 | Bayer Pharma Aktiengesellschaft | Imidazo[1,2-a]pyridines as soluble guanylate cyclase stimulators for the treatment of cardiovascular diseases |
| WO2015165930A1 (de) | 2014-05-02 | 2015-11-05 | Bayer Pharma Aktiengesellschaft | Enantiomere des n-(2-amino-5-fluor-2-methylpentyl)-8-[(2,6-difluorbenzyl)oxy]-2-methylimidazo[1,2-a]pyridin-3-carboxamids sowie der di- and tri-fluor-derivate zur behandlung von kardiovaskulären erkrankungen |
| US10292970B2 (en) | 2014-12-02 | 2019-05-21 | Bayer Pharma Aktiengesellschaft | Heteroaryl-substituted imidazo[1,2-A]pyridines and their use |
| WO2016087343A1 (de) | 2014-12-02 | 2016-06-09 | Bayer Pharma Aktiengesellschaft | Heteroaryl-substituierte imidazo[1,2-a]pyridine und ihre verwendung |
| WO2016177660A1 (en) | 2015-05-06 | 2016-11-10 | Bayer Pharma Aktiengesellschaft | The use of sgc stimulators, sgc activators, alone and combinations with pde5 inhibitors for the treatment of digital ulcers (du) concomitant to systemic sclerosis (ssc) |
| WO2017013010A1 (de) | 2015-07-23 | 2017-01-26 | Bayer Pharma Aktiengesellschaft | Stimulatoren und/oder aktivatoren der löslichen guanylatzyklase (sgc) in kombination mit einem inhibitor der neutralen endopeptidase (nep inhibitor) und/oder einem angiotensin aii-antagonisten und ihre verwendung |
| US11166932B2 (en) | 2015-07-23 | 2021-11-09 | Bayer Pharma Aktiengesellschaft | Stimulators and/or activators of soluble guanylate cyclase (sGC) in combination with an inhibitor of neutral endopeptidase (NEP inhibitor) and/or an angiotensin AII antagonist and the use thereof |
| WO2017106175A2 (en) | 2015-12-14 | 2017-06-22 | Ironwood Pharmaceuticals, Inc. | USE OF sGC STIMULATORS FOR THE TREATMENT OF GASTROINTESTINAL SPHINCTER DYSFUNCTION |
| WO2018069126A1 (de) | 2016-10-11 | 2018-04-19 | Bayer Pharma Aktiengesellschaft | Kombination enthaltend sgc stimulatoren und mineralocorticoid-rezeptor-antagonisten |
| US11684621B2 (en) | 2016-10-11 | 2023-06-27 | Bayer Pharma Aktiengesellschaft | Combination containing sGC stimulators and mineralocorticoid receptor antagonists |
| US11331308B2 (en) | 2016-10-11 | 2022-05-17 | Bayer Pharma Aktiengesellschaft | Combination containing sGC activators and mineralocorticoid receptor antagonists |
| US10918639B2 (en) | 2016-10-11 | 2021-02-16 | Bayer Pharma Aktiengesellschaft | Combination containing SGC stimulators and mineralocorticoid receptor antagonists |
| WO2018111795A2 (en) | 2016-12-13 | 2018-06-21 | Ironwood Pharmaceuticals, Inc. | Use of sgc stimulators for the treatment of esophageal motility disorders |
| WO2018184976A1 (de) | 2017-04-05 | 2018-10-11 | Bayer Pharma Aktiengesellschaft | Substituierte imidazo[1,2-a]pyridincarboxamide und ihre verwendung |
| WO2019081456A1 (en) | 2017-10-24 | 2019-05-02 | Bayer Aktiengesellschaft | USE OF SGC ACTIVATORS AND STIMULATORS COMPRISING A BETA2 SUBUNIT |
| EP3498298A1 (en) | 2017-12-15 | 2019-06-19 | Bayer AG | The use of sgc stimulators and sgc activators alone or in combination with pde5 inhibitors for the treatment of bone disorders including osteogenesis imperfecta (oi) |
| WO2019211081A1 (en) | 2018-04-30 | 2019-11-07 | Bayer Aktiengesellschaft | The use of sgc activators and sgc stimulators for the treatment of cognitive impairment |
| WO2019219672A1 (en) | 2018-05-15 | 2019-11-21 | Bayer Aktiengesellschaft | 1,3-thiazol-2-yl substituted benzamides for the treatment of diseases associated with nerve fiber sensitization |
| EP3574905A1 (en) | 2018-05-30 | 2019-12-04 | Adverio Pharma GmbH | Method of identifying a subgroup of patients suffering from dcssc which benefits from a treatment with sgc stimulators and sgc activators in a higher degree than a control group |
| WO2020014504A1 (en) | 2018-07-11 | 2020-01-16 | Cyclerion Therapeutics, Inc. | USE OF sGC STIMULATORS FOR THE TREATMENT OF MITOCHONRIAL DISORDERS |
| WO2020148379A1 (en) | 2019-01-17 | 2020-07-23 | Bayer Aktiengesellschaft | Methods to determine whether a subject is suitable of being treated with an agonist of soluble guanylyl cyclase (sgc) |
| WO2020165010A1 (en) | 2019-02-13 | 2020-08-20 | Bayer Aktiengesellschaft | Process for the preparation of porous microparticles |
Also Published As
| Publication number | Publication date |
|---|---|
| JP5975025B2 (ja) | 2016-08-23 |
| MX2013014082A (es) | 2014-03-21 |
| EA201391769A1 (ru) | 2014-04-30 |
| AR086589A1 (es) | 2014-01-08 |
| KR20140040774A (ko) | 2014-04-03 |
| EP2716642B1 (en) | 2016-07-20 |
| US9447090B2 (en) | 2016-09-20 |
| CN103608347B (zh) | 2016-04-27 |
| TW201311685A (zh) | 2013-03-16 |
| ES2597034T3 (es) | 2017-01-13 |
| PL2716642T3 (pl) | 2017-01-31 |
| EP2716642A1 (en) | 2014-04-09 |
| CA2836202A1 (en) | 2012-12-06 |
| IL229513A0 (en) | 2014-01-30 |
| CN103608347A (zh) | 2014-02-26 |
| JPWO2012165399A1 (ja) | 2015-02-23 |
| EP2716642A4 (en) | 2014-12-03 |
| BR112013030909A2 (pt) | 2016-12-06 |
| US20140088080A1 (en) | 2014-03-27 |
| PT2716642T (pt) | 2016-10-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5975025B2 (ja) | イミダゾピリジン化合物 | |
| JP6056872B2 (ja) | イミダゾピリジン化合物 | |
| JP7095106B2 (ja) | オキサジアゾール一過性受容器電位チャネル阻害剤 | |
| US20070099938A1 (en) | Antistress drug and medical use thereof | |
| JP7357617B2 (ja) | 心不全およびそれに関連する障害の治療または予防に有用なβ-3アドレナリン受容体のモジュレーター | |
| TW201018661A (en) | Heterocyclic rinf having nitrogen atom derivatives and medicament containing the derivatives as active ingredient | |
| JP2008514643A (ja) | 新規ピペリジニルアミノ−チエノ[2,3−d]ピリミジン化合物 | |
| WO2013161919A1 (ja) | Trk阻害化合物 | |
| JPWO2004026873A1 (ja) | トリアザスピロ[5.5]ウンデカン誘導体およびそれらを有効成分とする薬剤 | |
| EP2375899A1 (en) | Piperidine-containing compounds and use thereof | |
| JPWO2007116866A1 (ja) | ヘテロ化合物 | |
| JPWO2005047286A1 (ja) | スピロ複素環化合物 | |
| WO2019101086A1 (zh) | 卤代烯丙基胺类ssao/vap-1抑制剂及其应用 | |
| AU2018257203B2 (en) | Novel tetrahydronaphthyl urea derivatives | |
| JP2011518142A (ja) | Faah阻害剤として有用なエーテルベンジリデンピペリジン5員アリールカルボキサミド化合物 | |
| JP2013209425A (ja) | Crth2受容体拮抗薬としての複素環化合物 | |
| WO2014151630A2 (en) | Compounds and compositions for the treatment of parasitic diseases | |
| EP2976341A1 (en) | Acyclic cyanoethylpyrazolo pyridones as janus kinase inhibitors | |
| TW200911251A (en) | Tetrahydroisoquinolin-1-one derivatives or salt thereof | |
| JP2011518143A (ja) | Faah阻害剤として有用なエーテルベンジリデンピペリジンアリールカルボキサミド化合物 | |
| WO2022166860A1 (zh) | Pim激酶抑制剂 | |
| JP7043483B2 (ja) | 二環式プロリン化合物 | |
| JP2002020386A (ja) | ピラゾロピリジン誘導体 | |
| JP2021500416A (ja) | 疼痛及び疼痛関連状態を治療するための新規アルコキシアミノ誘導体 | |
| TW201922724A (zh) | 經取代之3-苯基喹唑啉-4(3h)-酮及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 201280026953.4 Country of ref document: CN |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 12791965 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2013518087 Country of ref document: JP Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 2836202 Country of ref document: CA |
|
| REEP | Request for entry into the european phase |
Ref document number: 2012791965 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2012791965 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: IDW00201305588 Country of ref document: ID Ref document number: MX/A/2013/014082 Country of ref document: MX |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2012263575 Country of ref document: AU Date of ref document: 20120529 Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 201391769 Country of ref document: EA |
|
| ENP | Entry into the national phase |
Ref document number: 20137034903 Country of ref document: KR Kind code of ref document: A |
|
| REG | Reference to national code |
Ref country code: BR Ref legal event code: B01A Ref document number: 112013030909 Country of ref document: BR |
|
| ENP | Entry into the national phase |
Ref document number: 112013030909 Country of ref document: BR Kind code of ref document: A2 Effective date: 20131129 |