RU2730520C2 - Твердые формы альфа, омега дизамещенного дигидроксициклопентильного соединения и способы их получения и применения - Google Patents
Твердые формы альфа, омега дизамещенного дигидроксициклопентильного соединения и способы их получения и применения Download PDFInfo
- Publication number
- RU2730520C2 RU2730520C2 RU2016123446A RU2016123446A RU2730520C2 RU 2730520 C2 RU2730520 C2 RU 2730520C2 RU 2016123446 A RU2016123446 A RU 2016123446A RU 2016123446 A RU2016123446 A RU 2016123446A RU 2730520 C2 RU2730520 C2 RU 2730520C2
- Authority
- RU
- Russia
- Prior art keywords
- crystalline form
- diluent
- days
- compound
- crystallization time
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/557—Eicosanoids, e.g. leukotrienes or prostaglandins
- A61K31/559—Eicosanoids, e.g. leukotrienes or prostaglandins having heterocyclic rings containing hetero atoms other than oxygen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/38—Heterocyclic compounds having sulfur as a ring hetero atom
- A61K31/381—Heterocyclic compounds having sulfur as a ring hetero atom having five-membered rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/26—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D333/28—Halogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Ophthalmology & Optometry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Изобретение относится к кристаллической форме 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1E-пентенил)циклопентил]-5Z-гептенамида:
представляющей собой гидрат (Форма В), имеющей диаграмму порошковой рентгеновской дифракции (Cu Kα, λ=1,54Å) с пиками около 11,64, 19,57, 21,99, 22,74 и 25,06 градусов 2θ, а так же способу ёё получения. 2 н. и 6 з.п. ф-лы, 4 табл., 7 пр., 8 ил.
Description
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] В настоящей заявке заявляется приоритет по предварительной заявке на патент США 61/915575 (номер дела 19333PROV (АР)) под наименованием "Solid Forms Of An Alpha, Omega Di-Substituted Dihydroxy Cyclopentenyl Compound And Methods For The Preparation And Use Thereof”, поданной 13 декабря 2013 года, полное содержание которой включено в настоящий документ посредством ссылки и служит основой для приоритета и/или привилегии настоящей заявки.
ОБЛАСТЬ ТЕХНИКИ
[2] Настоящее изобретение относится к твердым формам дигидроксидциклопентильного соединения и к способам их получения и применения. В одном аспекте настоящее изобретение относится к кристаллическим формам дигидроксициклопентильного соединения и к способам их получения и применения. В другом аспекте настоящее изобретение относится к по существу аморфным формам дигидроксициклопентильного соединения и к способам их получения и применения.
УРОВЕНЬ ТЕХНИКИ
[3] дигидроксициклопентильное соединение 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамид:
представляет собой эффективный глазной гипотензивный агент, особенно подходящий, inter alia, для лечения глаукомы (см., например, патент США 6602900).
[4] Многие лекарственные соединения существуют в одной или более кристаллических формах, называемых полиморфами. Указанные полиморфы одной молекулы демонстрируют разные физические свойства, такие как температура плавления, растворимость, твердость и т.д. В таких случаях существует опасность образования менее растворимых полиморфных форм, выпадающих в осадок из раствора, полученного из другой, более растворимой, но менее стабильной формы. Например, образование кристаллов в офтальмологическом растворе может вызывать серьезное повреждение глаз. Кроме того, осаждение лекарственного вещества может вызывать заметное снижение эффективности и биодоступности продукта.
[5] Соответственно, существует потребность в новых кристаллических формах соединений, таких как дигидроксициклопентильное соединение, описанных в настоящем документе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[6] В соответствии с настоящим изобретением предложены различные твердые формы дигидроксициклопентильного соединения и способы их получения и применения. В одном аспекте предложены кристаллические формы дигидроксициклопентильного соединения и способы их получения и применения. В другом аспекте предложены по существу аморфные формы оцсо-дизамещенного дигидроксициклопентильного соединения и способы их получения и применения.
[7] В соответствии с другим аспектом настоящего изобретения предложены композиции, содержащие указанное дигидроксициклопентильное соединение. В некоторых аспектах такие композиции подходят для доставки указанного дигидроксициклопентильного соединения субъекту, нуждающемуся в этом. В некоторых аспектах настоящее изобретение относится к способам лечения различных показаний, включая глаукому, глазную гипертензию и т.п.
[8] В соответствии с дополнительным аспектом настоящего изобретения, предложены наборы, содержащие указанное дигидроксициклопентильное соединение, и/или композиции, содержащие его.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
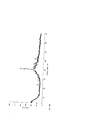
[9] На фиг. 1А и 1С представлены иллюстративные диаграммы порошковой рентгеновской дифракции (ПРД) для кристаллической Формы А дигидроксициклопентильного соединения, описанной в настоящем документе. Основные пики, уникальные для Формы А, включают пики при около 12,01, 14,09, 20,14, 20,47 и 23,72 градусов 20. На фиг. 1B и 1D представлены иллюстративные диаграммы порошковой рентгеновкой дифрации (ПРД) для кристаллических Форм В дигидроксициклопентильного соединения, описанных в настоящем документе. Основные пики, уникальные для Формы В, включают пики при около 11,64, 19,57, 21,99, 22,74 и 25,06 градусов 2θ.
[10] На фиг. 2 представлены кривые термогравиметрического анализа/дифференциальной сканирующей калориметрии (ТГА/ДСК) для кристаллической твердой Формы А дигидроксициклопентильного соединения, описанной в настоящем документе. Плавление Формы А начинается при около 37°C и заканчивается при около 65°C. Эндотермический пик при 254°C относится к разложению соединения.
[11] На фиг. 3 представлены кривые ТГА/ДСК кристаллической твердой Формы В дигидроксициклопентильного соединения, описанной в настоящем документе. Плавление Формы В начинается при около 25°C и заканчивается при около 60°C. Эндотермический пик при 254°C относится к разложению соединения.
[12] На фиг. 4А представлена диаграмма ПРД образца кристаллической Формы А после выдерживания при 22±2°C и относительной влажности 0% в течение 144 часов. На фиг. 4B представлена диаграмма ПРД образца кристаллической Формы А после выдерживания при 40°C в течение 25 минут.
[13] На фиг. 5 представлена диаграмма ПРД образца кристаллической Формы А после выдерживания при 22±2°C и относительной влажности 59% в течение 144 часов.
[14] На фиг. 6А представлена диаграмма ПРД образца кристаллической Формы В после выдерживания при 22±2°C и относительной влажности 59% в течение 120 часов. На фиг. 6B представлена диаграмма ПРД образца кристаллической Формы В после выдерживания при 40°C в течение 25 минут.
[15] На фиг. 7 представлена диаграмма ПРД образца кристаллической Формы В после выдерживания при 22±2°C и относительной влажности 0% в течение 120 часов.
[16] На фиг. 8 представлена диаграмма ПРД образца кристаллической Формы В после выдерживания при 40°C в течение 16 часов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[17] В соответствии с настоящим изобретение представлены твердые формы дигидроксициклопентильного соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида, т.е. соединения, имеющего структуру:
[18] В некоторых вариантах реализации изобретения твердая форма 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1E-пентенил)циклопентил]-5Z-гептенамида представляет собой кристаллический ангидрид (Форма А). Такие кристаллические формы могут быть дополнительно описаны их диаграммой порошковой рентгеновской дифракции (ПРД). Иллюстративная диаграмма ПРД кристаллической Формы А 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида имеет по меньшей мере следующие пики при около 12,01, 14,09, 20,14, 20,47 и 23,72 градусов 2θ.
[19] Иллюстративные диаграммы ПРД кристаллической Формы A 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида являются по существу такими, как показано на фиг. 1А и 1С. Специалистам в данной области техники понятно, что, в целом, положения пиков 20 на диаграмме ПРД могут варьироваться на около 0,1 и, следовательно, иллюстративные пики кристаллической формы, описанной в настоящем документе, возникают при около 12,01, 14,09, 20,14, 20,47 и 23,72 градусов 2θ, где термин «около» означает пики при 12,0±0,1, 14,1±0,1, 20,1±0,1, 20,5±0,1 и 23,7±0,1 градусов 2θ на диаграмме ПРД. Специалистам в данной области техники понятно также, что аналогичные вариации относятся к другим пикам 2θ на фиг. 1А и 1С, которые также могут варьироваться на около 0,1.
[20] В некоторых вариантах реализации изобретения кристаллическая Форма А 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида имеет эндотерму плавления при около 62°C и эндотерму разложения при около 254°C.
[21] Кристаллическая Форма А может быть дополнительно описана как форма, которая остается по существу неизменной при выдерживании при температуре в диапазоне около 25-40°C в сухих условиях, тогда как ее значительная часть превращается в Форму В при выдерживании при комнатной температуре и относительной влажности около 59% в течение по меньшей мере 72 часов. В данном контексте «по существу неизменна» означает, что признаки, которые демонстрирует образец в кристаллической Форме А (например, наличие уникальных пиков ПРД, указанных в настоящем документе), остаются четко различимыми. В данном контексте «ее значительная часть» относится к большей части рассматриваемого образца, т.е. более 50% образца подвергается превращению из Формы А в Форму В; в некоторых вариантах реализации более 60% образца подвергается превращению из Формы А в Форму В; в некоторых вариантах реализации более 70% образца подвергается превращению из Формы А в Форму В; в некоторых вариантах реализации более 80% образца подвергается превращению из Формы А в Форму В; в некоторых вариантах реализации более 90% образца подвергается превращению из Формы А в Форму В.
[22] Кристаллическая Форма А также может быть описана со ссылкой на ее профиль дифференциальной сканирующей калориметрии (ДСК); иллюстративный профиль ДСК указанной формы представлен на фиг. 2.
[23] В некоторых вариантах реализации настоящего изобретения кристаллическая Форма А по существу не содержит других твердых форм. В данном контексте «по существу не содержит» относится к образцам, в которых альтернативные твердые формы содержатся в количестве ниже предела обнаружения, т.е. менее около 10% указанного твердого вещества находится в форме, отличной от кристаллической Формы А.
[24] Кроме того, кристаллическая Форма А, описанная в настоящем документе, имеет профиль дифференциальной сканирующей калориметрии, представленный на фиг. 2, демонстрирующий плавление Формы А, начинающееся при около 37°C и заканчивающееся при около 65°C, с эндотермическим пиком при 254°C, относящимся к разложению соединения. Указанный профиль демонстрирует одно событие плавления, указывая на то, что Форма А представляет собой по существу чистый кристалл и не содержит никаких других кристаллических форм. Соответственно, специалистам в данной области техники понятно, что кристаллическая Форма А, описанная в настоящем документе, может по существу не содержать других кристаллических форм, на основании ее профиля ДСК.
[25] В некоторых вариантах реализации настоящего изобретения твердая форма 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида представляет собой кристаллический гидрат (Форма В). В некоторых вариантах реализации кристаллический гидрат представляет собой полугидрат.
[26] Иллюстративная диаграмма ПРД кристаллической Формы В 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида является по существу такой, как показано на фиг. 1B и 1D, и имеет пики по меньшей мере при около 11,64, 19,57, 21,99, 22,74 и 25,06 градусов 2θ.
[27] Иллюстративная диаграмма ПРД кристаллической Формы В 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида является по существу такой, как показано на фиг. 1B и 1D. Специалистам в данной области техники понятно, что, в целом, положения пиков 2θ на диаграмме ПРД могут варьироваться на около 0,1 и, следовательно, иллюстративные пики кристаллической формы, описанной в настоящем документе, возникают при около (2θ) 11,64, 19,57, 21,99, 22,74 и 25,06, где термин «около» означает пики при (20) 11,6±0,1, 19,6±0,1, 22,0±0,1, 22,7±0,1 и 25,1±0,1 на диаграмме ПРД. Специалистам в данной области техники понятно также, что аналогичные вариации относятся к другим пикам 2θ на фиг. 1B и 1D, которые также могут варьироваться на около 0,1.
[28] В некоторых вариантах реализации изобретения кристаллическая Форма В 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида имеет эндотерму плавления при около 50°C и эндотерму разложения при около 254°C.
[29] Кристаллическая Форма В может быть дополнительно описана как форма, которая остается по существу неизменной при выдерживании в течение до около 1 часа при относительной влажности около 59% и комнатной температуре или при температуре около 40°C, или в сухих условиях, тогда как ее значительная часть превращается в аморфную форму при выдерживании при температуре по меньшей мере около 40°C в течение по меньшей мере 12 часов. В данном контексте «по существу неизменна» означает, что признаки, которые демонстрирует образец в кристаллической Форме В (например, наличие уникальных пиков ПРД, указанных в настоящем документе), остаются четко различимыми. В данном контексте «ее значительная часть» относится к большей части рассматриваемого образца, т.е. более 50% образца подвергается превращению из Формы В в аморфную форму; в некоторых вариантах реализации более 60% образца подвергается превращению из Формы В в аморфную форму; в некоторых вариантах реализации более 70% образца подвергается превращению из Формы В в аморфную форму; в некоторых вариантах реализации более 80% образца подвергается превращению из Формы В в аморфную форму; в некоторых вариантах реализации более 90% образца подвергается превращению из Формы В в аморфную форму.
[30] Кристаллическая Форма В также может быть описана со ссылкой на ее профиль ДСК; иллюстративный профиль ДСК указанной формы представлен на фиг. 3.
[31] В некоторых вариантах реализации настоящего изобретения кристаллическая Форма В по существу не содержит других твердых форм. В данном контексте «по существу не содержит» относится к образцам, в которых альтернативные твердые формы содержатся в количестве ниже предела обнаружения, т.е. менее около 10% указанного твердого вещества находится в форме, отличной от кристаллической Формы В.
[32] Кроме того, кристаллическая Форма В, описанная в настоящем документе, имеет профиль дифференциальной сканирующей калориметрии, представленный на фиг. 3, демонстрирующий плавление Формы В, начинающееся при около 25°C и заканчивающееся при около 60°C, с эндотермическим пиком при 254°C, относящимся к разложению соединения. Указанный профиль демонстрирует одно событие плавления, указывая на то, что Форма В представляет собой по существу чистый кристалл и не содержит никаких других кристаллических форм. Соответственно, специалистам в данной области техники понятно, что кристаллическая Форма В, описанная в настоящем документе, может по существу не содержать других кристаллических форм, на основании ее профиля ДСК.
[33] В некоторых вариантах реализации изобретения твердая форма 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида является по существу аморфной. В данном контексте «по существу аморфные» относится к образцам, в которых основная часть активного соединения не имеет признаков кристаллической структуры, например, анализ ПРД которых не выявляет различимых пиков при их изучении с помощью ПРД.
[34] В соответствии с другим вариантом реализации настоящего изобретения предложены фармацевтические композиции, содержащие терапевтически эффективное количество:
- кристаллической Формы А 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида,
- кристаллической Формы В 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида,
- по существу аморфной формы 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида или
- комбинаций любых двух или более из них,
в офтальмологически приемлемом носителе для них.
[35] Специалисты в данной области техники могут легко определить офтальмологически приемлемые носители, подходящие для введения (или производства лекарственных средств, содержащих) дигидроксициклопентильных соединений, описанных в настоящем документе. В частности, лекарство для системного введения может быть получено в виде раствора, эмульсии, суспензии, аэрозоля или т.п.
[36] Жидкость, которая является офтальмологически приемлемой, составляют так, чтобы ее можно быть вводить локально в глаза. Комфорт субъекта, которому вводят композицию, должен быть максимальным, хотя иногда соображения, учитываемые при составлении композиции (например, стабильность лекарства), могут обусловливать неизбежность не вполне оптимального комфорта. В том случае, если комфорт не может быть максимизирован, жидкость должна быть составлена так, чтобы жидкость была приемлемой для локального офтальмологического применения пациентом. Кроме того, офтальмологически приемлемая жидкость должна быть либо упакована для однократного применения, либо должна содержать консервант для предотвращения загрязнения при многократном применении.
[37] Для офтальмологического применения растворы или лекарственные средства зачастую получают с применением физиологического солевого раствора в качестве основного носителя. рН офтальмологических растворов следует предпочтительно поддерживать при комфортном значении с помощью подходящей буферной системы. Составы также могут содержать обычные, фармацевтически приемлемые консерванты, стабилизаторы и поверхностно-активные вещества.
[38] Консерванты, которые могут быть использованы в фармацевтических композициях согласно настоящему изобретению, включают, но не ограничиваются ими, хлорид бензалкония, хлорбутанол, тимеросал, ацетат фенилртути, нитрат фенилртути и т.п. Подходящее поверхностно-активное вещество представляет собой, например, Tween 80. Точно так же, в офтальмологических препаратах согласно настоящему изобретению могут быть использованы различные подходящие носители. Указанные носители включают, но не ограничиваются ими, поливиниловый спирт, повидон, гидроксипропилметилцеллюлозу, полоксамеры, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, очищенную воду и т.п.
[39] При необходимости или для удобства могут быть добавлены регуляторы тоничности. Они включают, но не ограничиваются ими, соли, в частности, хлорид натрия, хлорид калия, маннит и глицерин или любой другой подходящий, офтальмологически приемлемый регулятор тоничности.
[40] Могут быть использованы различные буферы и средства для регулирования рН, при условии, что готовый препарат является офтальмологически приемлемым. Соответственно, для применения согласно настоящему изобретению подразумеваются буферы, включая ацетатные буферы, цитратные буферы, фосфатные буферы, боратные буферы и т.п. Для регулирования рН указанных составов при необходимости могут быть добавлены кислоты или основания.
[41] Таким же образом, офтальмологически приемлемый антиоксидант для применения в соответствии с настоящим изобретением включает, но не ограничивается ими, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол, бутилированный гидрокситолуол и т.п.
[42] Другие вспомогательные компоненты, которые могут быть включены в офтальмологические препараты, рассматриваемые в настоящем документе, представляют собой хелатирующие агенты. Подходящий хелатирующий агент представляет собой эдетат динатрия, хотя вместо него или вместе с ним могут быть использованы также другие хелатирующие агенты.
[43] Указанные ингредиенты обычно используют в следующих количествах:
[44] Количество вводимого дигидрдоксициклопентильного соединения зависит от требуемого терапевтического действия или действий, от конкретного млекопитающего, подлежащего лечению, от тяжести и природы патологического состояния млекопитающего, от способа введения, от эффективности и фармакодинамики конкретного используемого соединения или соединений и от решения лечащего врача. Терапевтически эффективные дозы, предполагаемые для дигидроксициклопентильных соединений согласно настоящему изобретению, могут составлять от около 0,5 или около 1 до около 100 мг/кг/сутки.
[45] В одном из вариантов реализации настоящего изобретения композиции, описанные в настоящем документе, упакованы во флакон-пипетку для офтальмологического применения.
[46] Соединения согласно настоящему изобретению подходят для лечения различных показаний, например, воспалительных состояний глаз (например, болезни сухости глаз, конъюнктивита и т.п.), глаукомы и т.п.
[47] В соответствии с одним аспектом настоящего изобретения, предусмотрено также применение соединений согласно настоящему изобретению при лечении и/или предупреждении, и/или для производства лекарственного средства для лечения и/или предупреждения любого из вышеуказанных заболеваний и/или патологических состояний.
[48] Следовательно, в соответствии с другим вариантом реализации настоящего изобретения предложены способы снижения глазной гипертензии, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества композиции, описанной в настоящем документе.
[49] В соответствии с другим вариантом реализации настоящего изобретения предложены способы лечения глаукомы, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества композиции, описанной в настоящем документе.
[50] В одном из вариантов реализации вышеуказанных способов, композиции согласно настоящему изобретению вводят локальным введением в глаза.
[51] «Лечение», «лечить» или другие формы указанных слов в данном контексте означают применение при диагностировании, исцелении, облегчении, лечении или предупреждении заболевания у человека или других животных.
[52] В соответствии с другим вариантом реализации настоящего изобретения предложены способы получения указанных твердых форм соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида с применением одной или более из следующих методик кристаллизации, например, испарения, охлаждения, суспендирования, диффузии паров и т.п.
[53] В соответствии с дополнительным вариантом реализации настоящего изобретения предложены способы получения Формы А соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида из его аморфного состояния, указанный способ включает:
(a) суспендирование и/или растворение указанного соединения в подходящем разбавителе,
(b) обработку полученной суспензии и/или раствора
(i) условиями, подходящими для испарения из него разбавителя, с последующим растиранием полученного маслянистого вещества с подходящим неполярным растворителем,
(ii) постепенным снижением его температуры, и
[54] (iii) (а) хранением его суспензии при комнатной температуре в течение времени, достаточного для образования кристаллов указанного соединения, или (b) постепенным добавлением к нему достаточного количества осадителя для ускорения образования из него осадка указанного соединения.
[55] В данном контексте «подходящий разбавитель» относится к среде, в которой может быть суспендировано и/или растворено соединение 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамид. Иллюстративные разбавители включают кетоны (например, ацетон, метилэтилкетон и т.п.), спирты (например, метанол, этанол, пропанол, бутанол и т.п.), сложные эфиры (например, этилацетат), нитрилы (например, ацетонитрил), простые эфиры (например, диэтиловый эфир, метил-трет-бутиловый эфир, тетрагидрофуран, 2-метилтетрагидрофуран, диоксан и т.п.), алканы (например, гексан, гептан и т.п.), хлорированные углеводороды (например, дихлорметан, хлороформ и т.п.), ароматические соединения (например, бензол, толуол и т.п.), а также смеси любых двух или более из них.
[56] В данном контексте «условия, подходящие для испарения из него растворителя» относятся к комбинации температурных и/или атмосферных условий, которые ускоряют удаление разбавителя из суспензии или раствора. Например, могут быть использованы повышенные температуры при атмосферном давлении; в альтернативном варианте может быть использована комнатная температура при пониженном давлении; или может быть использована комбинация повышенной температуры и пониженного давления для ускорения испарения разбавителя из суспензии или раствора, содержащего дигидроксициклопентильное соединение согласно настоящему изобретению.
[57] В данном контексте «подходящий неполярный растворитель» относится к растворителю с относительно низкой полярностью для инициации образования кристаллов полярного соединения, такого как соединение 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамид, например, к эфиру.
[58] В данном контексте «время, достаточное для образования … кристаллов» относится к количеству времени, необходимому для уравновешивания данного образца в твердой форме, предпочтительной в конкретных условиях. Количество времени, необходимого для этого, может варьироваться от нескольких минут до нескольких дней; обычно для этого достаточно 1-14 дней.
[59] В данном контексте «осадитель» относится к среде, в которой соединение 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамид не имеет заметной растворимости; следовательно, применение «достаточного» количества осадителя подразумевает добавление некоторого количества осадителя, достаточного для инициации осаждения и/или кристаллизации большей части указанного соединения из раствора или суспензии, содержащей его.
[60] В соответствии с дополнительным вариантом реализации настоящего изобретения предложены способы получения Формы В соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида из аморфного состояния, указанный способ включает:
(a) суспендирование и/или растворение указанного соединения в подходящем разбавителе,
(b) обработку полученной суспензии и/или раствора
(i) условиями, подходящими для испарения из него разбавителя, с последующим растиранием полученного маслянистого вещества с подходящим полярным растворителем,
(ii) постепенным снижением его температуры, и
(iii) (а) хранением его суспензии при комнатной температуре в течение времени, достаточного для образования кристаллов указанного соединения, или (b) постепенным добавлением к нему достаточного количества осадителя для ускорения образования из него осадка указанного соединения.
[61] В соответствии с дополнительным вариантом реализации настоящего изобретения предложены способы превращения Формы А соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида в его Форму В, указанный способ включает воздействие на Форму А указанного соединения относительной влажностью около 59% при комнатной температуре в течение по меньшей мере 72 часов.
[62] В соответствии с другим аспектом настоящего изобретения предложены наборы, содержащие композиции, описанные в настоящем документе, контейнер и инструкции по введению указанной композиции субъекту, нуждающемуся в этом, для облегчения глаукомы, глазной гипертензии или т.п.
[63] Фактическое доза активных соединений согласно настоящему изобретению зависит от конкретного соединения, и состояния, подлежащего лечению; выбор соответствующей дозы входит в объем знаний специалиста в данной области техники.
[64] Для лечения заболеваний, поражающих глаза, включая глаукому, указанные соединения могут быть введены локально, периокулярно, интраокулярно или с помощью любых других эффективных средств, известных в данной области техники.
[65] Для лечения глаукомы предусмотрено комбинированное лечение со следующими классами лекарств:
β-Блокаторы (или β-адренергические антагонисты), включая картеолол, левобунолол, метипаранолол, тимолола полугидрат, тимолола малеат, β1-селективные антагонисты, такие как бетаксолол и т.п., или их фармацевтически приемлемые соли или пролекарства;
Адренергические агонисты, включая
неселективные адренергические агонисты, такие как эпинефрина борат, эпинефрина гидрохлорид и дипивефрин и т.п., или их фармацевтически приемлемые соли или пролекарства; и
α2-селективные адренергические агонисты, такие как апраклонидин, бримонидин и т.п., или их фармацевтически приемлемые соли или пролекарства;
Ингибиторы карбоангидразы, включая ацетазоламид, дихлорфенамид, метазоламид, бринзоламид, дорзоламид и т.п., или их фармацевтически приемлемые соли или пролекарства;
Холинергические агонисты, включая
холинергические агонисты прямого действия, такие как карбахол, пилокарпина гидрохлорид, пилокарбина нитрат, пилокарпин и т.п., или их фармацевтически приемлемые соли или пролекарства;
ингибиторы холинэстеразы, такие как демекарий, эхотиофат, физостигмин и т.п., или их фармацевтически приемлемые соли или пролекарства;
Антагонисты глутамата, такие как мемантин, амантадин, римантадин, нитроглицерин, декстрофан, детрометрофан, CGS-19755, дигидропиридины, верапамил, эмопамил, бензотиазепины, бепридил, дифенилбутилпиперидины, дифенилпиперазины, НОЕ 166 и родственные лекарства, флуспирилен, элипродил, ифенпродил, СР-101606, тибалозин, 2309ВТ, и 840S, флунаризин, никардипин, нифедипин, нимодипин, барнидипин, верапамил, лидофлазин, прениламина лактат, амилорид и т.п., или их фармацевтически приемлемые соли или пролекарства;
Простамиды, такие как биматопрост, или их фармацевтически приемлемые соли или пролекарства; и
Простагландины, включая травопрост, UFO-21, клопростенол, флупростенол, 13,14-дигидроклопростенол, латанопрост и т.п.
ПРИМЕРЫ
[66] Различные аспекты настоящего изобретения иллюстрированы следующими неограничивающими примерами. Примеры предназначены для иллюстративных целей, а не ограничения каким-либо конкретным практическим осуществлением настоящего изобретения. Следует понимать, что могут быть сделаны вариации и модификации без отклонения от общей идеи и объема настоящего изобретения. Специалистам в данной области техники известны способы синтеза или коммерческого приобретения реагентов и компонентов, описанных в настоящем документе.
[67] Диаграммы порошковой рентгеновской дифракции (ПРД) получали для кристаллической формы, описанной в настоящем документе, при следующих условиях:
Оборудование: Rigaku Smart-Lab
Диапазон сканирования: от 2 до 40° (2θ)
Скорость сканирования: 3° (2θ) в минуту
Ширина шага: 0,02° (2θ)
[68] Около 5-10 мг образца осторожно нанесли на Si держатель с низким уровнем шума и подвергли сканированию ПРД.
[69] Дифференциальную сканирующую калориметрию проводили, загружая от 2 до 6 мг материала в стандартном, опрессованном алюминиевом тигле для ДСК образцов, а затем подвергая образец нагреванию от 20 до 350°C со скоростью 10°C в минуту.
[70] Соединение 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамид, описанное в настоящем документе, может быть синтезировано по способам, описанным в патенте США 6602900.
Пример 1
[71] Соединение 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамид растворяли в подходящем растворителе, таком как ацетонитрил, дихлорметан, этанол, этилацетат, 2-метилтетрагидрофуран, 1-пропанол или смесь толуола и метанола (25/1 об./об.). В результате испарения из него растворителя с последующим растиранием полученного маслянистого вещества с диэтиловым эфиром получали кристаллическую Форму А, которую определяли с помощью ПРД.
В альтернативном варианте в результате растирания полученного маслянистого вещества с ацетонитрилом получали кристаллическую Формул В, которую определяли с помощью ПРД.
Пример 2
[72] Теплый раствор соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида получали в разных растворителях, затем остывали медленно остывать до образования видимых кристаллов. Комбинация растворителей/условиях охлаждения, которая способствует образованию кристаллической Формы А, представлена в таблице 1:
[73] Комбинация растворителей/условиях охлаждения, которая способствует образованию кристаллической Формы В, представлена в таблице 2:
[74] Как показано в таблицах 1 и 2, кристаллическую форму соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида можно регулировать выбором растворителя, из которого соединение выпадает в осадок, а также температур, используемых для инициации кристаллизации.
Пример 3
[75] Суспензию соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида получали в разных средах, затем оставляли стоять при комнатной температуре в течение времени, достаточного для образования кристаллов. Разбавители, которые способствуют образованию кристаллической Формы А, представлены в таблице 3:
[76] Разбавители, которые способствуют образованию кристаллической Формы В, представлены в таблице 4:
[77] Как показано в таблицах 3 и 4, кристаллическую форму соединения 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамида можно регулировать выбором разбавителя, из которого кристаллизуют соединение с помощью способов кристаллизации из суспензии.
Пример 4
[78] Соединение 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамид также может быть кристаллизовано с помощью методик диффузии паров. Кристаллическая Форма А может быть получена посредством растворения указанного соединения в полярном растворителе, таком как ацетонитрил, с последующим воздействием неполярного растворителя, такого как толуол, при комнатной температуре.
[79] В альтернативном варианте кристаллическая Форма В может быть получена посредством растворения указанного соединения в полярном растворителе, таком как ацетон, с последующим воздействием неароматического, неполярного растворителя, такого как гексан, при комнатной температуре.
Пример 5
[80] Соединение 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1Е-пентенил)циклопентил]-5Z-гептенамид может быть получено в по существу аморфной форме посредством воздействия на указанное соединение температуры по меньшей мере 40°C в течение по меньшей мере 12 часов.
Пример 6
[81] Образец 5-10 мг кристаллической Формы А выдерживали при температуре 22±2°C и относительной влажности 0% в течение 144 часов, затем сравнили спектр ПРД образца после выдерживания при 22±2°C и относительной влажности 0% в течение 144 часов (см. фиг. 4А) со спектром ПРД образца до выдерживания при указанных условиях, на спектре ПРД не наблюдали существенных изменений в том отношении, что пики при около 12,01, 14,09, 20,14, 20,47 и 23,72 градусов 2θ все еще присутствовали, указывая на то, что кристаллическая Форма А осталась по существу неизменной. Аналогичное отсутствие существенных изменений на диаграмме ПРД наблюдали при выдерживании образца при 40°C в течение 25 минут (см. фиг. 4B).
[82] Кроме того, другой образец массой 5-10 мг кристаллической Формы А выдерживали при температуре 22±2°C и относительной влажности 59% в течение 144 часов. При сравнении спектра ПРД образца после выдерживания при 22±2°C и относительной влажности 59% в течение 144 часов (см. фиг. 5) со спектром ПРД образца до выдерживания при указанных условиях, спектр ПРД выявил наличие пиков при около 11,64, 19,57, 21,99, 22,74 и 25,06 градусов 2θ, указывая на то, что значительная часть кристаллической Формы А превратилась в кристаллическую Форму В.
Пример 7
[83] Образец массой 5-10 мг кристаллической Формы В выдерживали при температуре 22±2°C и относительной влажности 59% в течение 120 часов. При сравнении спектра ПРД образца после выдерживания при 22±2°C и относительной влажности 59% в течение 120 часов (см. фиг. 6А) со спектром ПРД образца до выдерживания при указанных условиях, не наблюдали существенных изменений спектра ПРД в том отношении, что пики при около 11,64, 19,57, 21,99, 22,74 и 25,06 градусов 2θ все еще присутствовали, указывая на то, что кристаллическая Форма В осталась по существу неизменной. Аналогичное отсутствие существенных изменений на диаграмме ПРД наблюдали при выдерживании образца при 40°C в течение 25 минут (см. фиг. 6B).
[84] Кроме того, другой образец массой 10-50 г кристаллической Формы В выдерживали при температуре 22±2°C и относительной влажности 0% в течение 120 часов. При сравнении спектра ПРД образца после выдерживания при 22±2°C и относительной влажности 0% в течение 120 часов (см. фиг. 7) со спектром ПРД образца до выдерживания при указанных условиях, спектр ПРД показал, что образец представляет собой слабокристаллическую смесь Форм А и В.
[85] Кроме того, аналогичный образец кристаллической Формы В выдерживали при температуре 40°C в течение 16 часов. При сравнении спектра ПРД образца после выдерживания при 40°C в течение 16 часов (см. фиг. 8) со спектром ПРД образца до выдерживания при указанных условиях, спектр ПРД выявил исчезновение пиков при около 11,64, 19,57, 21,99, 22,74 и 25,06 градусов 2θ, указывая на то, что значительная часть кристаллической Формы В превратилась в аморфную форму.
[86] Специалистам в той области техники, к которой относится изложенное выше описание, понятны различны модификации настоящего изобретения, помимо тех, которые представлены и описаны в настоящем документе. Указанные модификации также предполагаются входящими в объем прилагаемой формулы изобретения.
[87] Патенты и публикации, упомянутые в настоящей заявке, указывают на уровень специалистов в той области, к которой относится настоящее изобретение. Указанные патенты и публикации включены в настоящую заявку посредством ссылок в том же объеме, как если бы каждая отдельная заявка или публикация была специально и в отдельности включена в настоящий документ посредством ссылки.
[88] Изложенное выше описание является иллюстрацией конкретных вариантов реализации настоящего изобретения, но не является его ограничением при практическом осуществлении. Следующая формула изобретения, включая все ее эквиваленты, предназначена для определения объема настоящего изобретения.
Claims (24)
1. Кристаллическая форма 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1E-пентенил)циклопентил]-5Z-гептенамида:
представляющая собой гидрат (Форма В), имеющая диаграмму порошковой рентгеновской дифракции (Cu Kα, λ=1,54Å) с пиками при по меньшей мере около 11,64, 19,57, 21,99, 22,74 и 25,06 градусов 2θ.
2. Кристаллическая форма по п. 1, отличающаяся тем, что указанный гидрат представляет собой полугидрат.
3. Кристаллическая форма по п. 1, имеющая такую диаграмму порошковой рентгеновской дифракции, как показана на фиг. 1В.
4. Кристаллическая форма по п. 1, имеющая эндотерму плавления при около 50°С и эндотерму разложения при около 254°С.
5. Кристаллическая форма по п. 4, отличающаяся тем, что указанные пики порошковой рентгеновской дифракции указанной кристаллической формы остаются четко различимыми при выдерживании указанной формы в течение до около 1 часа при относительной влажности около 59% и комнатной температуре или при температуре около 40°С или в сухих условиях, но превращается в аморфную форму при выдерживании при температуре по меньшей мере около 40°С в течение по меньшей мере 12 часов.
6. Кристаллическая форма по п. 1, имеющая профиль ДСК, представленный на фиг. 3.
7. Кристаллическая форма по п. 1, где содержание других кристаллических форм составляет менее предела обнаружения.
8. Способ получения кристаллической формы по любому из пп. 1-7 из 7-[3α,5α-дигидрокси-2-(3α-гидрокси-5-(3-(2,5-дихлор)тиенил)-1E-пентенил)циклопентил]-5Z-гептенамида в аморфном состоянии, включающий:
(a) суспендирование указанного соединения в подходящем разбавителе, затем оставление суспензии при комнатной температуре в течение времени, достаточного для образования кристаллов, где указанный разбавитель и соответствующее время кристаллизации выбраны из следующих:
- разбавитель представляет собой диэтиловый эфир (влажный) и время кристаллизации составляет 4 дня;
- разбавитель представляет собой метилэтилкетон и время кристаллизации составляет 5 дней;
- разбавитель представляет собой 1-бутанол/метил-трет-бутиловый эфир (1/20 об./об.) и время кристаллизации составляет 4 дня;
- разбавитель представляет собой 1-бутанол/метил-трет-бутиловый эфир (1/20 об./об.; влажный) и время кристаллизации составляет 6 дней;
- разбавитель представляет собой диоксан/метил-трет-бутиловый эфир (1/4 об./об.) и время кристаллизации составляет 7 дней;
- разбавитель представляет собой этанол/толуол (1/40 об./об.) и время кристаллизации составляет 7 дней;
- разбавитель представляет собой метилэтилкетон (1/1 об./об.) и время кристаллизации составляет 5 дней;
- разбавитель представляет собой тетрагидрофуран/гексан (1/2 об./об.) и время кристаллизации составляет 4 дня; и
- разбавитель представляет собой толуол и время кристаллизации составляет 5 дней; или
(b) растворение указанного соединения в подходящем растворителе, затем обеспечение медленного остывания раствора до образования видимых кристаллов, где указанный растворитель и условия охлаждения выбраны из следующих:
- растворитель представляет собой диоксан/метил-трет-бутиловый эфир (1/4 об./об.), и раствор охлаждают с комнатной температуры до -20°C;
- растворитель представляет собой 2-метилтетрагидрофуран/гексан (3/2 об./об.), и раствор охлаждают с комнатной температуры до 5°C; и
- растворитель представляет собой 2-метилтетрагидрофуран/гексан (7/5 об./об.), и раствор охлаждают с 70°C до комнатной температуры.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361915575P | 2013-12-13 | 2013-12-13 | |
| US61/915,575 | 2013-12-13 | ||
| PCT/US2014/070156 WO2015089475A1 (en) | 2013-12-13 | 2014-12-12 | Solid forms of an alpha, omega di-substituted dihydroxy cyclopentyl compound and methods for the preparation and use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2730520C2 true RU2730520C2 (ru) | 2020-08-24 |
Family
ID=52282957
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016123446A RU2730520C2 (ru) | 2013-12-13 | 2014-12-12 | Твердые формы альфа, омега дизамещенного дигидроксициклопентильного соединения и способы их получения и применения |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US9353079B2 (ru) |
| EP (1) | EP3080096A1 (ru) |
| JP (2) | JP2016539994A (ru) |
| KR (1) | KR20160097310A (ru) |
| CN (1) | CN105814033B (ru) |
| AU (1) | AU2014361794B2 (ru) |
| BR (1) | BR112016013594A8 (ru) |
| CA (1) | CA2933556A1 (ru) |
| CL (2) | CL2016001448A1 (ru) |
| IL (2) | IL245917B (ru) |
| MX (1) | MX2016007717A (ru) |
| RU (1) | RU2730520C2 (ru) |
| SA (1) | SA516371307B1 (ru) |
| SG (2) | SG10201709702UA (ru) |
| UA (1) | UA121108C2 (ru) |
| WO (1) | WO2015089475A1 (ru) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10206813B2 (en) | 2009-05-18 | 2019-02-19 | Dose Medical Corporation | Implants with controlled drug delivery features and methods of using same |
| EP3658149B1 (en) * | 2017-07-25 | 2021-11-10 | Allergan, Inc. | Solid complex comprising (z)-7-((1r,2r,3r,5s)-2-((s,e)-5-(2,5-dichlorothiophen-3-yl)-3-hydroxypent-1-en-1-yl)-3,5-dihydroxycyclopentyl)hept-5-enamide, preparation and uses thereof |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU645563A3 (ru) * | 1972-07-13 | 1979-01-30 | Пфайзер Инк (Фирма) | Способ получени промежуточных соединений дл получени простагландинов |
| US5296504A (en) * | 1988-09-06 | 1994-03-22 | Kabi Pharmacia | Prostaglandin derivatives for the treatment of glaucoma or ocular hypertension |
| US6602900B2 (en) * | 1992-09-21 | 2003-08-05 | Allergan, Inc. | Cyclopentane heptan(ENE)oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents |
| RU2217145C2 (ru) * | 1997-11-19 | 2003-11-27 | Аллерган Сэйлс, Инк. | 2-гетероарилалкенилпроизводные циклопентангептан(ен)овой кислоты |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5834498A (en) * | 1992-09-21 | 1998-11-10 | Allergan | Cyclopentane heptan(ene)oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents |
| CA2221110C (en) * | 1995-05-18 | 2009-08-04 | Allergan | Cyclopentane heptan(ene)oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents for the treatment of ocular hypertension |
-
2014
- 2014-12-12 BR BR112016013594A patent/BR112016013594A8/pt not_active IP Right Cessation
- 2014-12-12 EP EP14824284.5A patent/EP3080096A1/en not_active Withdrawn
- 2014-12-12 SG SG10201709702UA patent/SG10201709702UA/en unknown
- 2014-12-12 UA UAA201606260A patent/UA121108C2/uk unknown
- 2014-12-12 KR KR1020167018489A patent/KR20160097310A/ko not_active Application Discontinuation
- 2014-12-12 JP JP2016538513A patent/JP2016539994A/ja active Pending
- 2014-12-12 CN CN201480067663.3A patent/CN105814033B/zh not_active Expired - Fee Related
- 2014-12-12 SG SG11201604787SA patent/SG11201604787SA/en unknown
- 2014-12-12 US US14/569,210 patent/US9353079B2/en active Active
- 2014-12-12 RU RU2016123446A patent/RU2730520C2/ru active
- 2014-12-12 CA CA2933556A patent/CA2933556A1/en not_active Abandoned
- 2014-12-12 WO PCT/US2014/070156 patent/WO2015089475A1/en active Application Filing
- 2014-12-12 AU AU2014361794A patent/AU2014361794B2/en not_active Ceased
- 2014-12-12 MX MX2016007717A patent/MX2016007717A/es unknown
-
2016
- 2016-05-05 US US15/147,700 patent/US20170087163A1/en not_active Abandoned
- 2016-05-30 IL IL245917A patent/IL245917B/en active IP Right Grant
- 2016-06-10 CL CL2016001448A patent/CL2016001448A1/es unknown
- 2016-06-13 SA SA516371307A patent/SA516371307B1/ar unknown
-
2019
- 2019-02-22 CL CL2019000471A patent/CL2019000471A1/es unknown
- 2019-12-23 JP JP2019231685A patent/JP2020073513A/ja active Pending
-
2021
- 2021-06-08 IL IL283810A patent/IL283810A/en unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU645563A3 (ru) * | 1972-07-13 | 1979-01-30 | Пфайзер Инк (Фирма) | Способ получени промежуточных соединений дл получени простагландинов |
| US5296504A (en) * | 1988-09-06 | 1994-03-22 | Kabi Pharmacia | Prostaglandin derivatives for the treatment of glaucoma or ocular hypertension |
| US6602900B2 (en) * | 1992-09-21 | 2003-08-05 | Allergan, Inc. | Cyclopentane heptan(ENE)oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents |
| RU2217145C2 (ru) * | 1997-11-19 | 2003-11-27 | Аллерган Сэйлс, Инк. | 2-гетероарилалкенилпроизводные циклопентангептан(ен)овой кислоты |
Non-Patent Citations (3)
| Title |
|---|
| Mino R. Caira, "Crystalline Polymorphism of Organic Compounds", Topics in Current Chemistry, Vol. 198, рр.163-208,1998, DOI: 10,1007/3-540-69178-2_5. * |
| Химический энциклопедический словарь под редакцией И.Л. Кнунянца, М. "Советская * |
| Химический энциклопедический словарь под редакцией И.Л. Кнунянца, М. "Советская Энциклопедия", 1983, с.130-131. * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20150166504A1 (en) | 2015-06-18 |
| US9353079B2 (en) | 2016-05-31 |
| EP3080096A1 (en) | 2016-10-19 |
| IL283810A (en) | 2021-07-29 |
| BR112016013594A2 (ru) | 2017-08-08 |
| MX2016007717A (es) | 2016-09-09 |
| SG10201709702UA (en) | 2018-01-30 |
| WO2015089475A1 (en) | 2015-06-18 |
| CL2019000471A1 (es) | 2019-07-12 |
| CA2933556A1 (en) | 2015-06-18 |
| CL2016001448A1 (es) | 2017-03-03 |
| KR20160097310A (ko) | 2016-08-17 |
| BR112016013594A8 (pt) | 2020-05-19 |
| AU2014361794A1 (en) | 2016-06-16 |
| SG11201604787SA (en) | 2016-07-28 |
| JP2016539994A (ja) | 2016-12-22 |
| US20170087163A1 (en) | 2017-03-30 |
| IL245917A0 (en) | 2016-08-02 |
| UA121108C2 (uk) | 2020-04-10 |
| CN105814033A (zh) | 2016-07-27 |
| SA516371307B1 (ar) | 2018-10-04 |
| AU2014361794B2 (en) | 2019-04-04 |
| CN105814033B (zh) | 2019-10-25 |
| JP2020073513A (ja) | 2020-05-14 |
| IL245917B (en) | 2021-06-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2016094471A (ja) | 結晶形態iiの7−[3,5−ジヒドロキシ−2−(3−ヒドロキシ−5−フェニル−ペント−1−エニル)−シクロペンチル]−n−エチル−ヘプト−5−エナミド(ビマトプロスト)、その調製方法、およびその使用方法 | |
| US11427586B2 (en) | 1,2,4-oxadiazole derivatives as liver X receptor agonists | |
| JP2020073513A (ja) | α,ω‐二置換ジヒドロキシシクロペンチル化合物の固体形態、並びにその製造及び使用方法 | |
| JP5550644B2 (ja) | (1r,2s,3r)−1−(2−(イソオキサゾール−3−イル)−1h−イミダゾール−4−イル)ブタン−1,2,3,4−テトラオールの固体形態及びその使用方法 | |
| JPH10509962A (ja) | 骨粗鬆症の治療および予防におけるトリアリール−エチレン誘導体の使用方法 | |
| US20200392099A1 (en) | Agents and methods for treating dysproliferative diseases | |
| TWI659041B (zh) | 類固醇樣化合物之多晶型形式以及其製備方法及用途 | |
| ES2733756T3 (es) | Agentes terapéuticos para el tratamiento de hipertensión ocular | |
| EP3107906B1 (en) | Reduced central corneal thickening by use of hydrophilic ester prodrugs of beta-chlorocyclopentanes | |
| US20230382897A1 (en) | Crystalline form of lifitegrast, and pharmaceutical composition comprising the same | |
| JPWO2006082820A1 (ja) | 性器ヘルペス治療剤 | |
| CN114436945B (zh) | 一种苯磺酰胺类化合物、制备方法及应用 | |
| JP2008001596A (ja) | ナトリウムチャネル阻害剤 | |
| KR20240004600A (ko) | (r)-옥시부티닌 d-말레이트의 고체 형태 | |
| JP2014524935A (ja) | N,n−ジアルキルアルキレニルエステル類、その組成物およびその使用方法 | |
| JPH11500754A (ja) | 新規化合物および多発性硬化症の処置法 | |
| WO2011140832A1 (zh) | 己烯酮类化合物及其医药用途 |