RU2727672C2 - Нацеливающие пептиды для направленной доставки аденоассоциированных вирусов (aav) - Google Patents
Нацеливающие пептиды для направленной доставки аденоассоциированных вирусов (aav) Download PDFInfo
- Publication number
- RU2727672C2 RU2727672C2 RU2018120736A RU2018120736A RU2727672C2 RU 2727672 C2 RU2727672 C2 RU 2727672C2 RU 2018120736 A RU2018120736 A RU 2018120736A RU 2018120736 A RU2018120736 A RU 2018120736A RU 2727672 C2 RU2727672 C2 RU 2727672C2
- Authority
- RU
- Russia
- Prior art keywords
- aav
- amino acids
- sequence
- seq
- php
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/02—Peptides of undefined number of amino acids; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/08—Peptides having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/185—Nerve growth factor [NGF]; Brain derived neurotrophic factor [BDNF]; Ciliary neurotrophic factor [CNTF]; Glial derived neurotrophic factor [GDNF]; Neurotrophins, e.g. NT-3
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2093—Leukaemia inhibitory factor [LIF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/47—Hydrolases (3) acting on glycosyl compounds (3.2), e.g. cellulases, lactases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/4813—Exopeptidases (3.4.11. to 3.4.19)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/50—Hydrolases (3) acting on carbon-nitrogen bonds, other than peptide bonds (3.5), e.g. asparaginase
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
- C07K14/01—DNA viruses
- C07K14/015—Parvoviridae, e.g. feline panleukopenia virus, human parvovirus
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1137—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/0102—Alpha-glucosidase (3.2.1.20)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/14—Dipeptidyl-peptidases and tripeptidyl-peptidases (3.4.14)
- C12Y304/14009—Tripeptidyl-peptidase I (3.4.14.9)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y305/00—Hydrolases acting on carbon-nitrogen bonds, other than peptide bonds (3.5)
- C12Y305/01—Hydrolases acting on carbon-nitrogen bonds, other than peptide bonds (3.5) in linear amides (3.5.1)
- C12Y305/01015—Aspartoacylase (3.5.1.15)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/12—Type of nucleic acid catalytic nucleic acids, e.g. ribozymes
- C12N2310/122—Hairpin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
- C12N2310/141—MicroRNAs, miRNAs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2330/00—Production
- C12N2330/50—Biochemical production, i.e. in a transformed host cell
- C12N2330/51—Specially adapted vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14142—Use of virus, viral particle or viral elements as a vector virus or viral particle as vehicle, e.g. encapsulating small organic molecule
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14171—Demonstrated in vivo effect
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- Zoology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Virology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Psychology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
Abstract
Изобретение относится к биотехнологии. Описаны пептидные последовательности, способные направлять доставку аденоассоциированных вирусов (AAV) для их нацеливания на определенные окружения, например нервную систему и сердце, в организме субъекта. Настоящее изобретение также относится к AAV, содержащим неприродные капсидные белки, содержащие раскрытые пептидные последовательности, и способам применения указанных AAV для лечения заболеваний. Изобретение расширяет арсенал средств для лечения заболеваний нервной системы и сердца. 5 н. и 67 з.п. ф-лы, 25 ил., 5 табл., 23 пр.
Description
РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет в соответствии с §119 (е) главы 35 Свода законов США согласно предварительной заявке на патент США №62/266184, поданной 11 декабря 2015 года, и предварительной заявке на патент США №62/421891, поданной 14 ноября 2016 года. Настоящая заявка также является родственной заявке на патент США №14/485024, поданной 12 сентября 2014 года. Содержание указанных родственных заявок явным образом полностью включено в настоящую заявку посредством ссылки.
ЗАЯВЛЕНИЕ ОБ ИССЛЕДОВАНИЯХ И РАЗРАБОТКАХ, ФИНАНСИРУЕМЫХ ФЕДЕРАЛЬНЫМИ ОРГАНАМИ США
[0002] Настоящее изобретение было выполнено при государственной поддержке в рамках грантов №№5R01AG047664, IDP2NS087949, 5U01NS090577 и 1R21MH103824-01, присужденных Национальными институтами здравоохранения США. Правительство США обладает определенными правами на настоящее изобретение.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0003] Настоящая заявка подана совместно с Перечнем последовательностей в электронном формате. Перечень последовательностей представлен в виде файла, озаглавленного SEQLISTING.TXT, созданного 9 декабря 2016 года, размер которого составляет 40 Кб. Информация, предоставленная в электронном формате в Перечне последовательностей, полностью включена в настоящую заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0004] Настоящая заявка относится в целом к области доставки генов. Более конкретно настоящая заявка относится к пептидным последовательностям, способным направлять аденоассоциированные вирусы (AAV) для нацеливания к тканям или органам, новым рекомбинантным AAV и способам применения указанных AAV для лечения различных заболеваний.
Описание предшествующего уровня техники
[0005] Рекомбинантные аденоассоциированные вирусы (rAAV) представляют собой векторы, используемые для переноса генов в условиях in vivo для осуществления разных видов генной терапии и облегчения переноса генов, важных для широкого круга фундаментальных научных исследований. Несколько характеристик делают rAAV привлекательными в качестве носителей для доставки генов: (i) они обеспечивают долгосрочную экспрессию трансгена, (ii) они не связаны с каким-либо известным заболеванием человека, (iii) они вызывают относительно слабые иммунные ответы, (iv) они способны к трансдукции различных типов делящихся и не делящихся клеток, и (v) геном rAAV может быть упакован в различные капсиды, или белковые оболочки вируса, которые имеют разные характеристики трансдукции и тропизма в отношении тканей. Виды генной терапии, в которых применяют векторы rAAV, были успешными в клинических исследованиях, включая лечение врожденного амавроза Лебера, гемофилии, связанной с дефицитом фактора IX и дефицитом липопротеинлипазы. Помимо этого генная терапия на основе rAAV была успешной в доклинических моделях при различных заболеваниях, включая синдром Ретта, врожденный боковой амиотрофический склероз (БАС), болезнь Паркинсона, болезнь Хантингтона и спинальную мышечную атрофию. Терапия на основе rAAV также была успешной при доставке нейтрализующих антител для лечения инфекционных заболеваний, таких как ВИЧ и грипп. rAAV также являются популярными векторами для доставки трансгенов в условиях in vivo для нетерапевтических научных исследований, таких как оптогенетические исследования. Однако успешное применение rAAV для лечения заболеваний и доставки генов в научных исследованиях для многих вариантов применения было ограничено отсутствием серотипов капсида, которые могут обеспечивать эффективную трансдукцию некоторых сложных типов клеток, а также отсутствием серотипов, которые могут обеспечивать эффективное и селективное нацеливание к желаемому типу клетки/органа после системной доставки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0006] Настоящее изобретение относится к вектору на основе аденоассоциированного вируса (AAV-вектору), содержащему аминокислотную последовательность, которая содержит по меньшей мере 4 смежные аминокислоты в последовательности QAVRTSL (SEQ ID NO: 37). Аминокислотная последовательность может быть, например, частью капсидного белка AAV-вектора. Согласно некоторым вариантам реализации настоящего изобретения последовательность QAVRTSL (SEQ ID NO: 37) вставлена между аминокислотами (AA) 588-589 последовательности AAV вектора (SEQ ID NO: 45). Согласно некоторым вариантам реализации настоящего изобретения последовательность QAVRTSL (SEQ ID NO: 37) вставлена между АА586-592 последовательности AAV вектора (SEQ ID NO: 45). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность дополнительно содержит по меньшей мере две из аминокислот 587, 588, 589 или 590 последовательности, представленной в SEQ ID NO: 45.
[0007] Настоящее изобретение также относится к AAV-вектору, содержащему последовательность из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11, где
X1 представляет собой D, А, Е, Q, N, G или S;
Х2 представляет собой G, N, S, Т, Q или V;
Х3 представляет собой Т, S или N;
Х4 представляет собой L или V;
Х5 представляет собой A, S, Q, Р или Т;
Х6 представляет собой V, Т, Q, N, L или М;
X7 представляет собой Р;
X8 представляет собой F, Y, V, L, С или S;
Х9 представляет собой K, R или S;
Х10 представляет собой А или N; и
Х11 представляет собой Q или Р, причем указанный AAV-вектор не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1). Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот является частью нацеливающего пептида или содержит его. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой D, Х2 представляет собой G, Х3 представляет собой Т, X4 представляет собой L, Х6 представляет собой V или Т, Х8 представляет собой F или любую их комбинацию. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой D, X2 представляет собой G, Х3 представляет собой Т, представляет собой L, Х6 представляет собой V или Т и X8 представляет собой F. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой D, Х2 представляет собой G, Х3 представляет собой Т, X4 представляет собой L, Х6 представляет собой V или Т и Х8 представляет собой F. Согласно некоторым вариантам реализации настоящего изобретения X4 представляет собой L, X5 представляет собой А, Х6 представляет собой V, Х7 представляет собой Р, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты X1X2X3 представляют собой DGT, GGT, EGT, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х1Х2 представляют собой AQ, Х6 представляет собой V, Х7 представляет собой Р, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q. Согласно некоторым вариантам реализации настоящего изобретения Х3 представляет собой Т и Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения X5 представляет собой А. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х5Х6Х7 представляют собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х1Х2Х3Х4Х5Х6 представляют собой AQTLAV и Х10Х11 представляют собой AQ. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х7Х8Х9 представляют собой PFK. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты X1X2X3X4X5X6X7X8 представляют собой AQTLAVPF. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х9Х10Х11 представляют собой KAQ, KAP или SNP. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот является частью капсидного белка AAV-вектора. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот вставлена между АА586-589 последовательности капсидного белка AAV, например, SEQ ID NO: 45, вектора. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот представляет собой одну из последовательностей, представленных в SEQ ID NO: 1-36.
[0008] Настоящее изобретение относится к фармацевтической композиции, содержащей один или более AAV-векторов, описанных в настоящем документе, и один или более фармацевтически приемлемых носителей.
[0009] Настоящее изобретение также относится к пептиду, причем указанный пептид содержит аминокислотную последовательность, приведенную в одной из SEQ ID NO: 1-44, 48-53, 65-68 и 80-93. Согласно некоторым вариантам реализации настоящего изобретения пептид конъюгирован с наночастицей, второй молекулой, вирусным капсидным белком или их комбинацией. Согласно некоторым вариантам реализации настоящего изобретения пептид является частью AAV. Например, пептид может быть капсидным белком AAV.
[00010] Согласно некоторым вариантам реализации, описанным в настоящем документе, предложена последовательность нуклеиновой кислоты, кодирующая все из пептидов, включая нацеливающие пептиды и их фрагменты.
[00011] Настоящее изобретение также относится к капсидному белку, содержащему еще один нацеливающий пептид, описанный в настоящем документе. Например, капсидный белок может содержать аминокислотную последовательность, которая содержит по меньшей мере 4 смежные аминокислоты из последовательности QAVRTSL (SEQ ID NO: 37). Согласно некоторым вариантам реализации настоящего изобретения капсидный белок содержит последовательность из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11, где
X1 представляет собой D, А, Е, Q, N, G или S;
Х2 представляет собой G, N, S, Т, Q или V;
Х3 представляет собой Т, S или N;
Х4 представляет собой L или V;
Х5 представляет собой A, S, Q, Р или Т;
Х6 представляет собой V, Т, Q, N, L или М;
Х7 представляет собой Р;
Х8 представляет собой F, Y, V, L, С или S;
Х9 представляет собой K, R или S;
X10 представляет собой А или N; и
Х11 представляет собой Q или Р, причем указанный капсидный белок не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1). Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой D, Х2 представляет собой G, Х3 представляет собой Т, Х4 представляет собой L, Х6 представляет собой V либо Т или Х8 представляет собой F. Согласно некоторым вариантам реализации настоящего изобретения Х4 представляет собой L, Х5 представляет собой А, Х6 представляет собой V, Х7 представляет собой Р, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты X1X2X3 представляют собой DGT, GGT, EGT, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х1Х2 представляют собой AQ, Х6 представляет собой V, Х7 представляет собой Р, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q. Согласно некоторым вариантам реализации настоящего изобретения Х3 представляет собой Т и Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения X5 представляет собой А. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х5Х6Х7 представляют собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х1Х2Х3Х4Х5Х6 представляют собой AQTLAV и Х10Х11 представляют собой AQ. Согласно некоторым вариантам реализации настоящего изобретения Х7Х8Х9 представляют собой PFK. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты X1X2X3X4X5X6X7X8 представляют собой AQTLAVPF. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х9Х10Х11 представляют собой KAQ, KAP или SNP. Настоящее изобретение также относится к последовательностям нуклеиновых кислот, кодирующим капсидные белки и их фрагменты, описанные в настоящем документе.
[00012] Настоящее изобретение также относится к способу доставки нуклеиновой кислоты в целевое окружение в организме субъекта, нуждающегося в этом. Способ, согласно некоторым вариантам реализации настоящего изобретения, включает: обеспечение композиции, содержащей AAV, причем указанный AAV содержит капсидный белок, который содержит последовательность из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11, и при этом указанный AAV содержит нуклеиновую кислоту, которая должна быть доставлена в целевое окружение в организме субъекта, где
X1 представляет собой D, А, Е, Q, N, G или S;
Х2 представляет собой G, N, S, Т, Q или V;
Х3 представляет собой Т, S или N;
Х4 представляет собой L или V;
Х5 представляет собой A, S, Q, Р или Т;
Х6 представляет собой V, Т, Q, N, L или М;
Х7 представляет собой Р;
X8 представляет собой F, Y, V, L, С или S;
Х9 представляет собой K, R или S;
Х10 представляет собой А или N; и
Х11 представляет собой Q или Р, причем указанный капсидный белок не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1); и введение композиции субъекту. Способ, согласно некоторым вариантам реализации настоящего изобретения, включает: обеспечение композиции, содержащей AAV, причем указанный AAV содержит капсидный белок, содержащий аминокислотную последовательность, которая содержит по меньшей мере 4 смежные аминокислоты из последовательности QAVRTSL (SEQ ID NO: 37), и при этом указанный AAV содержит нуклеиновую кислоту, которая должна быть доставлена в целевое окружение в организме субъекта; и введение композиции субъекту. Целевой окружение может, например, являться сердце, нервная система или их комбинация. Согласно некоторым вариантам реализации настоящего изобретения целевое окружение представляет собой центральную нервную систему, периферическую нервную систему, сердце или их комбинацию. Согласно некоторым вариантам реализации настоящего изобретения целевое окружение представляет собой нейроны, астроциты, кардиомиоциты или их комбинацию. Согласно некоторым вариантам реализации настоящего изобретения композиция представляет собой фармацевтическую композицию. Согласно некоторым вариантам реализации настоящего изобретения нуклеиновая кислота, которая должна быть доставлена в нервную систему, содержит одно или более из: а) последовательности нуклеиновой кислоты, кодирующей трофический фактор, фактор роста или растворимый белок; b) кДНК, которая восстанавливает функцию белка у человека или животных, несущих генетическую мутацию (мутации) указанного гена; с) кДНК, которая кодирует белок, который может быть использован для контроля или изменения активности или состояния клетки; d) кДНК, которая кодирует белок или нуклеиновую кислоту, используемую для оценки состояния клетки; е) кДНК и/или связанную с ней направляющую РНК для модификации генома; f) последовательности для редактирования генома посредством гомологичной рекомбинации; g) последовательности ДНК, кодирующей терапевтическую РНК; h) системы доставки короткой шпилечной РНК (кшРНК) или искусственной микроРНК (миРНК); и i) последовательности ДНК, которая влияет на сплайсинг эндогенного гена. Субъектом, который нуждается в этом, может быть, например, субъект, страдающий или подверженный риску развития одного или более из хронической боли, сердечной недостаточности, сердечной аритмии, атаксии Фридрейха, болезни Хантингтона (БХ), болезни Альцгеймера (БА), болезни Паркинсона (БП), бокового амиотрофического склероза (БАС), спинальной мышечной атрофии I и II (СМА I и II), атаксии Фридрейха (FA), спиноцеребеллярной атаксии, лизосомальных болезней накопления, которые поражают клетки в ЦНС. Лизосомальные болезни накопления могут включать, например, болезнь Краббе, болезнь Сандхоффа, болезнь Тея-Сакса, болезнь Гоше (типа I, II или III), болезнь Ниманна-Пика (дефицит NPC1 или NPC2), синдром Гурлера, болезнь Помпе или болезнь Баттена. Согласно некоторым вариантам реализации настоящего изобретения AAV вводят субъекту посредством внутривенного введения или системного введения. Нервная система может представлять собой, например, центральную нервную систему. Согласно некоторым вариантам реализации настоящего изобретения нуклеиновую кислоту доставляют в ганглии задних корешков спинного мозга, висцеральные органы или их комбинацию. Согласно некоторым вариантам реализации настоящего изобретения нуклеиновую кислоту доставляют в астроциты, нейроны или их комбинацию. Согласно некоторым вариантам реализации настоящего изобретения субъектом является взрослое животное.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00013] На ФИГ. 1 представлена схема стратегии диверсификации, которую применяли для получения библиотеки AAV-PHP.B-XXX. Капсид AAV, содержащий 7-членный AAV-PHP.B, был диверсифицирован в положениях 3 смежных аминокислот, обозначенных с помощью XXX, начиная с 2 аминокислот (далее называемых «АА») от вставки 7-членной последовательности и до +9 АА. Каждая библиотека XXX была сдвинута на 2АА. Всего было получено 5 библиотек XXX, чтобы охватить 11 АА. Затем фрагменты ПЦР AAV-PHP.B-XXX собирали в акцепторную плазмиду rAAV-Cap-in-cis, описанную в публикации заявки на патент США 2015/0079038. Полученный геном rAAV применяли для создания библиотеки AAV, которую затем вводили в дозе 1×1011 векторных геномов (в.г.)/мышь взрослым мышам GFAP-Cre, Vgat-IRES-Cre и Vglut-IRES-Cre для отбора вариантов, которые трансдуцируют астроциты, ГАМКергические нейроны и глутаматергические нейроны, соответственно. После двух раундов отбора было обнаружено, что многочисленные варианты обогащены последовательностями, выделенными из одной или более линий, несущих Cre. Одна из этих последовательностей, AAV-PHP.N (DGTLAVPFKAQ (SEQ ID NO: 4)), была выбрана для характеристики в качестве индивидуального варианта. Три аминокислоты AAV-PHP.N, которые отличались от AAV-PHP.B, представляют собой DGT, и последовательность, отличная от AAV-PHP.B, представляет собой DG.
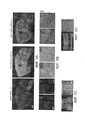
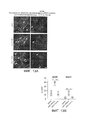
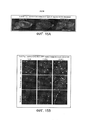
[00014] На ФИГ. 2 представлены результаты, свидетельствующие о том, что AAV-PHP.N более эффективно трансдуцирует нейроны ЦНС, чем AAV-PHP.B. Изображения получали через 2 недели после внутривенной инъекции низкой дозы (3,3×1010 в.г./мышь) AAV-CAG-mNeonGreen, упакованного в AAV-PHP.B (верхняя панель) или AAV-PHP.N (нижняя панель). Яркие пятна указывают на экспрессию белка mNeonGreen (и, следовательно, трансдукцию AAV). Изображения показывают более высокий уровень экспрессии AAV-PHP.N в коре головного мозга, мозжечке и зубчатой извилине по сравнению с экспрессией AAV-PHP.B. Следовательно, по сравнению с AAV-PHP.B, AAV-PHP.N обеспечивает более эффективную трансдукцию клеток с морфологией нейронов в нескольких областях мозга. Масштабные метки - 200 мкм.
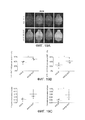
[00015] На ФИГ. 3A-3D представлены результаты, свидетельствующие об улучшенной трансдукции AAV-PHP.S в сердце и периферических нервах мышей по сравнению с AAV9. На ФИГ. 3А показаны сенсорные волокна, входящие в дорсальную часть спинного мозга у мышей через 3 недели после внутривенной инъекции 2×1012 в.г./мышь ssAAV9:CAG-NLS-GFP или ssAAV-PHP.S:CAG-NLS-GFP (NLS, сигнал ядерной локализации) взрослым мышам. AAV-PHP.S обеспечивает более сильную экспрессию GFP в сенсорных волокнах, чем AAV9, о чем свидетельствует более интенсивное окрашивание образца, обработанного AAV-PHP.S, по сравнению с образцом, обработанным AAV9. На ФИГ. 3В представлены изображения нативной флуоресценции в результате экспрессии белка GFP, о которой свидетельствуют интенсивные сигналы, в сердце через 3 недели после внутривенного введения 1×1012 векторных геномов (в.г.)/мышь рекомбинантных одноцепочечных (ss)AAV9:CAG-GFP-2A-Luc или ssAAV-PHP.S:CAG-GFP-2A-Luc. На ФИГ. 3С представлено трехмерное проекционное изображение, показывающее нативную флуоресценцию в ганглии заднего корешка спинного мозга мыши через 4 недели после инъекции смеси 1×1012 в.г. ssAAV-PHP.S:CAG-mNeonGreen и 1×1012 в.г. ssAAV-PHP.S:CAG-mTurquoise. Изображения, зарегистрированные на обоих каналах, совмещены на изображении в оттенках серого цвета. На ФИГ. 3D представлены изображения AAV-PHP.S-трансдуцированных клеток в кишечной нервной системе после внутривенной инъекции. Яркие пятна отмечают клетки, трансдуцированные AAV-PHP.S. На изображениях представлены результаты суммирования максимальной интенсивности флуоресценции (MIP) в кишечнике взрослой мыши, которую оценивали через 3 недели после внутривенного введения 1×1012 в.г./мышь ssAAV-PHP.S:CAG-mNeonGreen. Яркие пятна показывают экспрессию mNeon-Green из вектора AAV-PHP.S (см. левую панель и верхнюю правую панель). Нейроны из мышечно-кишечного сплетения помечены антителом к pgp9.5, и ядра, помеченные DAPI, показаны на нижней правой панели.
[00016] На ФИГ. 4A-4G представлено Cre-зависимое выделение капсидных последовательностей AAV из трансдуцированных клеток-мишеней. На ФИГ. 4А представлен обзор способа отбора CREATE. ПЦР использовали для введения разнообразия (вертикальная полоса полного видимого спектра) во фрагмент гена капсида. Фрагмент клонируют в геном rAAV, несущий оставшийся капсидный ген, и применяют для получения библиотеки вариантов вирусов. Библиотеку вводят Cre-трансгенным животным, и ПЦР применяют для селективного выделения капсидных последовательностей из клеток Cre+. На ФИГ. 4В представлен геном rAAV, rAAV-Cap-in-cis-lox. Cre инвертирует последовательность полиаденилирования (pA), фланкированную сайтами lox71 и lox66. Праймеры для ПЦР (полустрелки) применяют для селективной амплификации Cre-рекомбинированных последовательностей. На ФИГ. 4С представлены продукты ПЦР зависимой от Cre-рекомбинации (верхняя панель) и независимой от Cre-рекомбинации (нижняя панель) амплификации последовательностей библиотеки капсидов, выделенных из двух мышей Cre+ или Cre-. Стратегии ПЦР-амплификации представлены на схемах (нижняя панель) (подробности см. на ФИГ. 8А-8В). На ФИГ. 4D представлена схематическая иллюстрация генов AAV во вспомогательной плазмиде AAV, Rep-AAP, и белков, кодируемых геном cap. Стоп-кодоны, вставленные в ген cap, устраняют экспрессию капсидного белка VP1, VP2 и VP3. На ФИГ. 4Е представлены устойчивые к ДНКазе геномы AAV-векторов (в.г.), полученные с помощью разделенного генома AAV2/9 rep-ААР и rAAV-Cap-in-cis-lox (верхняя панель), по сравнению с в.г., полученным с помощью стандартной вспомогательной плазмиды AAV2/9 rep-cap и генома rAAV-UBC-mCherry (средняя панель) или с помощью генома AAV2/9 rep-ААР и rAAV-UBCmCherry (нижняя панель). N=3 независимых исследования на группу; среднее значение ± станд. откл. среднего; **р<0,01, ***р<0,001; однофакторный дисперсионный анализ и критерий множественных сравнений Тьюки. На ФИГ. 4F представлены результаты клонирования библиотеки 7-членных капсидных белков в вектор rAAV-ΔCap-in-cis. На ФИГ. 4G представлена модель поверхности AAV9. На ФИГ. 4F-4G показано расположение 7-членной последовательности, вставленной между АА588-589.
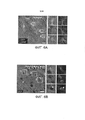
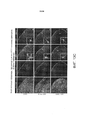
[00017] На ФИГ. 5A-5G представлены результаты AAV-PHP.B-опосредуемой доставки генов во всей ЦНС после внутривенной инъекции у взрослых мышей. На ФИГ. 5A-5F представлены результаты, полученные при внутривенном введении ssAAV9:CAG-GFP или ssAAV-PHP.B:CAG-GFP в дозе 1×1012 в.г./мышь или 1×1011 в.г./мышь взрослым мышам. На ФИГ. 5А представлены изображения экспрессии GFP (указывающие на экспрессию с геномов ssAAV, доставленных с помощью указанного капсида) у мышей, которым вводили AAV9 (левая панель), и мышей, которым вводили AAV-PHP.B (средняя и правая панель), соответственно, через три недели после инъекции. Интенсивные сигналы свидетельствуют об экспрессии GFP. На ФИГ. 5В представлены конфокальные изображения, полученные путем суммирования максимальной интенсивности флуоресценции (MIP) при оптической толщине сечения 50 мкм, указывающие на экспрессию GFP (о которой свидетельствуют интенсивные сигналы) в коре головного мозга или полосатом теле. На ФИГ. 5С показана экспрессия белка GFP (о которой свидетельствуют интенсивные сигналы) в PARS-очищенном поясничном отделе спинного мозга. На ФИГ. 5D показана экспрессия белка GFP (о которой свидетельствуют интенсивные сигналы) в сетчатке (слева: 20 мкм MIP, поперечное сечение, справа: MIP общего препарата). На ФИГ. 5E-5F показана экспрессия белков GFP (о которой свидетельствуют интенсивные сигналы) в трехмерных MIP-изображениях PARS-очищенной ткани из AAV-PHP.B-трансдуцированной коры головного мозга и полосатого тела и указанных органов мышей, трансдуцированных AAV9 (верхняя панель) и AAV-РНР.В (нижняя панель). На ФИГ. 5F стрелками выделены нервы, которые экспрессируют капсидные белки. Звездочки на изображении поджелудочной железы указывают на островковые клетки, экспрессирующие GFP. Основные отметки в трехмерных проекциях составляют 100 мкм. На ФИГ. 5G представлены результаты исследования биораспределения AAV в указанных областях ЦНС и органах через 25 дней после внутривенной инъекции 1×1011 в.г. взрослым мышам. N=3 для AAV-PHP.B и N=4 для AAV9; среднее значение ± станд. откл. среднего; **р<0,01, ***р<0,001, непарные t-тесты, скорректированные для множественных сравнений методом Холма-Сидака. Масштабные метки: 1 мм (ФИГ. 5А и 5С (слева)); 50 мкм (ФИГ. 5В, 5С (справа), 5D и 5Е). Основные отметки в трехмерных проекциях на ФИГ. 5С, 5Е и 5F составляют 100 мкм.
[00018] На ФИГ. 6A-6I представлены результаты, свидетельствующие о том, что AAV-PHP.B более эффективно трансдуцирует несколько типов клеток ЦНС, чем AAV9. На ФИГ. 6А-6Е представлены изображения, свидетельствующие о том, что AAV-PHP.B трансдуцирует астроциты, олигодендроциты и нейроны: экспрессия белков GFP через 3 недели после внутривенной инъекции 1×1011 (ФИГ. 6А) или 1×1012 (ФИГ. 6В-6Е) ssAAV-PHP.B:CAG-GFP взрослым мышам. На ФИГ. 6А представлено MIP-изображение окрашивания в гиппокампе. Интенсивные сигналы указывают на экспрессию конструкции AAV-PHP.B и слабые сигналы указывают на экспрессию GFAP. На ФИГ. 6В представлены результаты иммуногистохимического (ИГХ) исследования для определения экспрессии AAV-PHP.B и маркера СС1 в коре головного мозга. Пронумерованные блоки указывают на примеры двойных положительных клеток. Представлены соответствующие одноканальные изображения (справа). Звездочки указывают на клетки без детектируемой экспрессии GFP. На ФИГ. 6С представлены результаты иммуногистохимического исследования для детектирования трансдукции AAV-PHP.B и маркера NeuN в указанной области головного мозга. На ФИГ. 6D представлены MIP-изображения флуоресценции GFP, свидетельствующие о трансдукции AAV-PHP.B, и ИГХ-окрашивания ТН в среднем мозге. На ФИГ. 6Е представлены результаты, свидетельствующие о трансдукции AAV-PHP.B, и результаты иммуногистохимического исследования кальбиндина (Calb) в мозжечке. На ФИГ. 6F-6H представлены результаты количественной оценки процента клеток, положительных в отношении трансдукции AAV-PHP.B, в указанной области мозга через 3 недели после инъекции. На ФИГ. 6I показаны AAV-PHP.B-трансдуцированные спинальные моторные нейроны, содержащие холинацетилтрансферазу (ChAT). Яркие пятна свидетельствуют об экспрессии AAV-PHP.B. Более темные пятна характерны для иммуногистохимического окрашивания ChAT. Представлены изображения поперечных сечений целого спинного мозга (левая панель) или MIP-изображение вентрального рога (правая панель). Представлен процент ChAT в поперечных сечениях целого спинного мозга (левая панель) или на MIP-изображении вентрального рога (правая панель). Процент ChAT+ нейронов, которые экспрессировали AAV-PHP.B в каждой области спинного мозга, представлен ± 95% доверительный интервал (ДИ). Для количественной оценки N=5 на группу; среднее значение ± станд. откл. среднего. Было обнаружено, что все пары средних значений для AAV9 по сравнению с AAV-PHP.B статистически достоверно различаются (***р<0,001), как установлено с помощью непарных t-тестов, скорректированных для множественного сравнения методом Холма-Сидака. Масштабные метки: 20 мкм (ФИГ. 6А-6В и ФИГ. 6D), 50 мкм (ФИГ. 6С и 6I (правая панель)), 200 мкм (ФИГ. 6Е) и 1 мм (ФИГ. 6I (левая панель)).
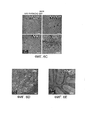
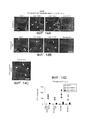
[00019] На ФИГ. 7A-7F представлены результаты исследования трансдукции с применением AAV-PHP.A астроцитов ЦНС и снижения тропизма в отношении периферических органов. На ФИГ. 7А-7С и 7Е показана экспрессия AAV-PHP.A через 3 недели после внутривенной инъекции 3×1011 ssAAV9:CAG-GFP или ssAAV-PHP.A:CAG-GFP взрослым мышам. На ФИГ. 7А-7В представлены типичные изображения ИГХ для ssAAV9:CAG-GFP и AAV-PHP.A:CAG-GFP. На ФИГ. 7С представлены результаты ИГХ-окрашивания белков GFP в гиппокампе. Слабые сигналы характерны для иммуногистохимического окрашивания GFAP в гиппокампе. Пронумерованные вставки указывают на примеры клеток, экспрессирующих белки GFP и GFAP. Соответствующие одноканальные изображения показаны справа. На ФИГ. 7D представлены результаты, полученные у взрослых мышей после внутривенного введения 2,5×1011 в.г. ssAAV-PHP.A:CAG-NLS-GFP. На графиках представлены результаты количественного определения процента клеток Aldhll1 и NeuN, положительных в отношении присутствия NLS-GFP. На ФИГ. 7Е показана экспрессия AAV-PHP.A (интенсивные сигналы) в печени (слабые сигналы характерны для аутофлуоресценции ткани). На ФИГ. 7F показано биораспределение AAV в области ЦНС и периферических органах через 25 дней после внутривенной инъекции 1×1011 в.г. взрослым мышам. На ФИГ. 7E-7F, N=4 на группу; среднее значение ± станд. откл. среднего: **р<0,05, **р<0,01, ***р<0,001, непарные t-тесты, скорректированные для множественных сравнений методом Холма-Сидака. Масштабные метки: 1 мм (ФИГ. 7А); 100 мкм (ФИГ. 7В); и 50 мкм (ФИГ. 1С).
[00020] На ФИГ. 8А-8В представлены схематические иллюстрации продуктов ПЦР и геном rAAV-Cap-in-cis. На ФИГ. 8А представлена схематическая иллюстрация продуктов ПЦР с 7 аминокислотами (обозначенными в настоящем документе «7АА») рандомизированной последовательности (представленной вертикальным столбиком полного видимого спектра), вставленной после аминокислоты 588. Праймеры, использованные для получения библиотеки, обозначены по имени и с помощью полустрелок. ПЦР-матрицу модифицировали, чтобы устранить природный сайт рестрикции Earl внутри фрагмента гена капсида (хЕ) (подробности см. в примерах). На ФИГ. 8В представлена схематическая иллюстрация генома rAAV-Cap-in-cis и праймеров, использованных для количественного определения векторных геномов и выделения последовательностей, которые трансдуцировали клетки, экспрессирующие Cre. Выделение на основе ПЦР выполняют в два этапа. Этап 1 обеспечивает выделение последовательности, специфичной для клеток-мишеней, путем селективной амплификации последовательностей Cap из геномов, которые подверглись Cre-зависимой инверсии последовательности полиаденилирования (рА), расположенной в направлении 3'-конца. Для выполнения этапа 1 9CapF использовали в качестве прямого праймера, и праймер CDF использовали в качестве обратного праймера на матрицах, рекомбинированных Cre. На этапе 2 применяли праймеры XF и AR для получения продукта ПЦР, который клонировали в плазмиду rAAV-ΔCap-in-cis (восстановление библиотеки) или в плазмиду AAV2/9 rep-cap-trans (характеристика вариантов). В таблице 1 приведены неограничивающие примеры последовательностей праймеров, которые можно применять в ПЦР, проиллюстрированной на ФИГ. 8А-8В.
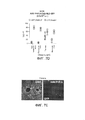
[00021] На ФИГ. 9А-9В представлены характеристики капсидов и эффективность выработки трех наиболее обогащенных вариантов (т.е. AAV-PHP.B, AAV-PHP.B2 и AAV-РНР.В3) из каждого раунда отбора. На ФИГ. 9А представлено изображение типичных сагиттальных срезов головного мозга мышей, которые оценивали через 2 недели после инъекции 3,3×1010 в.г./мышь ssAAV-CAG-фарнезилированный mNeonGreen (mNeGreen-f), упакованного в AAV-PHP.B или второй или третий наиболее обогащенные варианты, AAV-PHP.B2 и AAV-PHP-B3. Интенсивные сигналы указывают на экспрессию белков GFP. Данные являются типичными для 2 (AAV-PHP.B) и 3 (AAV-PHP.B2 и AAV-PHP.B3) мышей на группу. На ФИГ. 9В представлено количество устойчивых к ДНКазе в.г., полученных из препаратов отдельных вариантов, выделенных из отборов GFAP-Cre. Данные по выходу приведены как количество очищенных копий векторного генома на 150 мм чашку вырабатывающих клеток; среднее значение ± станд. откл. среднего. *р<0,05, однофакторный дисперсионный анализ и критерий множественных сравнений Тьюки. Количество независимых препаратов для каждого капсида представлено в столбике.
[00022] На ФИГ. 10A-10G представлены изображения, свидетельствующие о том, что AAV-PHP.B трансдуцирует несколько типов интернейронов и эндотелиальных клеток, но не трансдуцирует микроглию. На ФИГ. 10A-10D представлены результаты оценки экспрессии белка GFP у взрослых мышей через 3 недели после введения 1×1012 в.г. AAV-PHP.B.CAG-GFP путем инъекции. На типичном изображении представлены результаты ИГХ-окрашивания для выявления экспрессии AAV-PHP.B (ФИГ. 10А-10С) или нативной флуоресценции в результате экспрессии белка GFP (ФИГ. 10D) совместно с ИГХ-окрашиванием указанного антигена и области мозга. На ФИГ. 10Е представлены результаты, полученные у взрослых мышей через 2 недели после введения 3,3×1010 мкг ssAAV-PHP.B:CAG-mNeGrn-f путем инъекции. Нативная флуоресценция mNeGrn-f колокализована с CD31, экспрессируемым некоторыми эндотелиальными клетками. На ФИГ. 10F-10G представлены результаты оценки, полученные у взрослых мышей через 3 недели после введения 2×1012 в.г. ssAAV-PHP.B:CAG-NLS-GFP путем инъекции. Интенсивные сигналы указывают на экспрессию AAV-PHP.B, и слабый сигнал указывает на экспрессию Iba1. Звездочки указывают на клетки, которые экспрессируют указанный антиген, но не имеют детектируемой экспрессии AAV-PHP.B. Парвальбумин (PV), кальбиндин (Calb) и кальретинин (CR). Масштабные метки: 20 мкм (ФИГ. 10A-10D); 50 мкм (ФИГ. 10E-10F) и 500 мкм (ФИГ. 10G).
[00023] На ФИГ. 11 представлены результаты оценки долгосрочной экспрессии AAV-PHP.B в головном мозге после переноса генов с применением AAV-PHP.B. Взрослым мышам вводили внутривенно указанную дозу ssAAV-CAG-GFP, упакованного в AAV9 или AAV-PHP.B, и нативную флуоресценцию eGFP оценивали через 377 дней. Интенсивные сигналы указывают на экспрессию eGFP. N=1 на вектор/дозу.
[00024] На ФИГ. 12A-12D представлены типичные изображения нативной флуоресценции в результате экспрессии белка GFP и результаты ИГХ-окрашивания для нескольких типов нейронов и глиальных клеток после трансдукции AAV-PHP.B:CAG-NLS-GFP. На ФИГ. 12A-12D представлены результаты оценки, полученные у взрослых мышей через 3 недели после введения 2×1012 в.г. ssAAV-PHP.B:CAG-NLS-GFP путем инъекции. На изображениях представлена интенсивность нативной флуоресценции в результате экспрессии белка GFP совместно с ИГХ-окрашиванием указанного антигена в указанной области мозга. На всех панелях стрелки указывают на колокализацию экспрессии GFP с ИГХ-окрашиванием указанного антигена. На ФИГ. 12В-12С представлены одноплоскостные конфокальные изображения. На ФИГ. 12А и 12D представлены MIP-изображения. Мозолистое тело (сс), компактная часть черного вещества (SNc), вентральная область покрышки (VTA). Масштабные метки: 50 мкм.
[00025] На ФИГ. 13А-С представлены результаты исследования трансдукции с применением AAV-PHP.A и AAV-PHP.B кортикальных нейронов, происходящих из иПСК человека, и астроцитов в ассоциированных культурах и интактных трехмерных кортикальных культурах. На ФИГ. 13А представлены результаты, свидетельствующие о том, что AAV-PHP.B обеспечивает более эффективную трансдукцию нейронов и астроцитов человека в ассоциированных монослойных культурах. На типичных изображениях показана экспрессия кДНК GFP, доставленной с использованием капсидов AAV9, AAV-PHP.A и AAV-PHP.B, через пять дней после вирусной трансдукции (ssAAV-CAG-NLS-GFP, упакованный в AAV9, AAV-PHP.A или AAV-PHP.B; 1×109 в.г./лунку) диссоциированных кортикальных сфероидов, происходящих из иПСК человека, дифференцированных в условиях in vitro. Клетки, экспрессирующие белки GFP, колокализованы с астроцитами, окрашенными с использованием иммунной метки для GFAP, или нейронами, окрашенными с использованием иммунной метки для МАР2, как указано белыми стрелками. На ФИГ. 13В представлены результаты количественной оценки процента GFAP+ или МАР2+ клеток, инфицированных AAV9, AAV-PHP.A или AAV-PHP.B (n=3 дифференцировки в кортикальные сфероиды двух линий иПСК человека, полученных от двух субъектов, двухфакторный дисперсионный анализ, критерий множественных сравнений Тьюки, среднее значение ± станд. откл. среднего). На ФИГ. 13С представлены результаты, свидетельствующие о том, что AAV9, AAV-PHP.A и AAV-PHP.B трансдуцируют интактные трехмерные кортикальные культуры человека (кортикальные сфероиды, дифференцированные из иПСК человека). На изображениях криосрезов кортикальных сфероидов, происходящих из иПСК человека (205 день дифференцировки в условиях in vitro), трансдуцированных с применением ssAAV-CAG-NLS-GFP, упакованного в AAV9, AAV-PHP.A или AAV-PHP.B, показана нативная флуоресценция в результате экспрессии белка GFP совместно с иммунным окрашиванием GFAP и МАР2. Вставки показывают совместное мечение белка GFP с GFAP+ астроцитами (голубой) или МАР2+ нейронами. Масштабные метки: 40 мкм (ФИГ. 13А); и 100 мкм (ФИГ. 13С).
[00026] На ФИГ. 14A-14D представлены капсиды AAV-PHP.B и AAV-PHP.A, локализованные в сосудистой сети мозга после внутривенной инъекции и трансдукции клеток вдоль сосудистой сети через 24 часа после введения. Взрослым мышам вводили 1×1011 в.г. ssAAV-CAG-NLS-GFP, упакованного в AAV9, AAV-PHP.A или AAV-PHP.B, как указано. На ФИГ. 14А-14В представлены типичные изображения иммунного окрашивания капсидов (интенсивное окрашивание) с использованием антитела к VP3 AAV, В1, которое распознает общий внутренний эпитоп в мозжечке (ФИГ. 14А) или полосатом теле (ФИГ. 14В) в мозге мышей, которые получили внутривенную инъекцию за 1 час до фиксации с помощью перфузии сердца. Иммунное окрашивание капсидов детектировали в мозге всех мышей, получивших инъекцию AAV-PHP.A и AAV-PHP.B, но редко наблюдали в мозге мышей, которые получили аналогичную дозу AAV9. Ядра клеток были помечены DAPI (темное окрашивание). Автофлуоресценцию липофусцина можно отличить от окрашивания капсидов по ее присутствию как на зеленом, так и на красном канале. Вставка на ФИГ. 14А показывает трехмерное MIP-изображение области, выделенной на изображении AAV-PHP.B. Стрелки указывают на ИГХ-окрашивание капсида; звездочки указывают на просветы сосудов. Данные являются типичными для 2 (без вируса и AAV-PHP.A) или 3 (AAV9 и AAV-PHP.B) мышей на группу. На ФИГ. 14С представлено типичное изображение экспрессии GFP (яркое окрашивание) с DAPI (окрашивание в белый цвет) и CD31 (темное окрашивание) через 24 часа после введения AAV-PHP.B. Стрелки указывают на клетки, экспрессирующие GFP. На ФИГ. 14D представлены результаты оценки количества клеток, экспрессирующих GFP, присутствующих вдоль сосудистой сети в указанных областях мозга. N=3 на группу; среднее значение ± станд. откл. среднего: AAV-PHP.B по сравнению с AAV9 и AAV-PHP.A, ***р<0.001 для всех областей; AAV9 по сравнению с AAV-PHP.A, недостоверно; двухфакторный дисперсионный анализ, масштабные метки: 200 мкм (ФИГ. 14А); 50 мкм (ФИГ. 14В-14С); основные метки составляют 50 мкм во вставке с большим увеличением (ФИГ. 14А).
[00027] На ФИГ. 15А-15В представлены результаты оценки экспрессии репортера из трех лучших вариантов, выделенных из мышей GFAP-Cre. На ФИГ. 15А представлены изображения типичных сагиттальных срезов мозга мышей, которые оценивали через 2 недели после инъекции 3,3×1010 мкг/мышь ssAAV-CAG-фарнезилированный mNeon-Green (mNeGrn-f), упакованного в AAV-PHP.B или второй или третий наиболее обогащенные варианты, AAV-PHP.B2 и AAV-PHP.B3. Интенсивные сигналы указывают на экспрессию mNeGrn-f из кДНК, доставленной с помощью трех обогащенных вариантов: AAV-PHP.B (левая панель), AAV-PHP.B2 (средняя панель) и AAV-PHP.B3 (правая панель). На ФИГ. 15В представлены изображения в оттенках серого цвета с большим увеличением (40×) экспрессии NLS-GFP в срезах мозга, которые оценивали через 3 недели после инъекции 2×1012 в.г./мышь ssAAV-CAG-NLS-GFP, упакованного в AAV-PHP.B, AAV-PHP.B2 или AAV-B3.
[00028] На ФИГ. 16 представлены изображения, свидетельствующие об экспрессии репортера из вариантов AAV-PHP.B. Яркие пятна указывают на экспрессию репортера из вариантов AAV-PHP.B. Одноплоскостные конфокальные изображения участков мозга у мышей оценивали через 2 недели после внутривенной инъекции 1×1011 в.г. (всего)/мышь AAV-PHP.B или указанного варианта AAV-PHP.B. Каждый вариант применяли для упаковки смеси репортеров: ssAAV-CAG-mTurquoise2, mNeonGreen и mKate 2.5. Следует отметить, что mKate2.5, по-видимому, образует агрегаты в некоторых типах клеток, особенно в нейронах и эндотелиальных клетках.
[00029] На ФИГ. 17 представлены изображения, свидетельствующие об экспрессии репортера из вариантов AAV-PHP.B. Яркие пятна указывают на экспрессию репортера из вариантов AAV-PHP.B. Одноплоскостные конфокальные изображения участков мозга у мышей оценивали через 3 недели после инъекции 3×1011 в.г. (всего)/мышь указанного варианта AAV-PHP.B. Каждый вариант применяли для упаковки смеси репортеров: ssAAV-CAG-mTurquoise2, mNeonGreen и mRuby 2.
[00030] На ФИГ. 18 представлены изображения, свидетельствующие об экспрессии репортера из вариантов AAV-PHP.B. Яркие пятна указывают на экспрессию репортера из вариантов AAV-PHP.B. Одноплоскостные конфокальные изображения участков мозга у мышей оценивали через 11 дней после внутривенной инъекции 1×1011 в.г. (всего)/мышь указанного варианта AAV-PHP.B. Каждый вариант применяли для упаковки смеси репортеров: ssAAV-CAG-mTurquoise2, mNeonGreen и mRuby2.
[00031] На ФИГ. 19А-19С представлены результаты, свидетельствующие о том, что трансдукция ЦНС с применением AAV-PHP.B-DGT более эффективна, чем с применением AAV-PHP.B, после внутривенного введения взрослым мышам. На ФИГ. 19А представлены изображения цельного мозга (с дорсальной стороны), свидетельствующие об экспрессии ssAAV-CAG-NLS-GFP через 3 недели после в/в введения 1×1011 в.г./мышь ssAAV-CAG-NLS-GFP, упакованного в указанный капсид. Интенсивный сигнал, представленный на изображении в оттенках серого цвета, свидетельствует об экспрессии ssAAV-CAG-NLS-GFP. На ФИГ. 19В представлены графики, показывающие долю общего количества ядер (DAPI+) в моторной коре (левая панель) или полосатом теле (правая панель), которые экспрессируют GFP. На ФИГ. 19С представлены графики, показывающие среднюю экспрессию ssAAV-CAG-NLS-GFP на GFP+ ядро. N=4 животных на группу.
[00032] На ФИГ. 20A-20D представлены результаты оценки трансдукции периферических нервов с применением AAV-PHP.S по сравнению с AAV9. На ФИГ. 20А представлены изображения цельного мозга (дорсальная сторона, левая панель, и вентральная сторона, правая панель), свидетельствующие об экспрессии AAV-PHP.S через три недели после в/в введения 1×1012 в.г./мыши ssAAV-CAG-NLS-GFP, упакованного в указанный капсид. Экспрессия GFP показана в оттенках серого цвета. Следует отметить, что, несмотря на использование ядерно-локализованного GFP, экспрессия GFP достаточно сильна в аксонах периферических нейронов, входящих в спинной мозг и ствол мозга, чтобы быть видимой на представленных изображениях цельного мозга. На ФИГ. 20В представлено изображение поперечного среза спинного мозга после трансдукции с применением 3×1012 в.г. (всего) ssAAV-PHP.S:CAG-XFPmix. На ФИГ. 20С представлено трехмерное суммированное изображение нативной флуоресценции в ганглии заднего корешка спинного мозга мыши через 4 недели после инъекции смеси 1×1012 в.г. ssAAV-PHP.S:CAG-mNeonGreen и 1×1012 ssAAV-PHP.S:CAGmTurquoise. На ФИГ. 20D представлено изображение AAV-PHP.S-трансдуцированных клеток в кишечной нервной системе после внутривенной инъекции. Нативная флуоресценция mNeonGreen (интенсивный сигнал) отмечает клетки, трансдуцированные AAV-PHP.S. На изображениях представлены результаты суммирования максимальной интенсивности флуоресценции в кишечнике взрослой мыши, которую оценивали через 3 недели после внутривенного введения 1×1012 в.г./мышь ssAAV-PHP.S:CAG-mNeonGreen. Нейроны помечены антителом к pgp9.5 (серое окрашивание), и ядра, помеченные DAPI, показаны с помощью темного окрашивания. Справа показаны отдельные каналы. Верхнее правое изображение показывает экспрессию mNeonGreen в кишечной нервной системе, которая свидетельствует о трансдукции вектором AAV-PHP.S:CAG-mNeonGreen.
[00033] На ФИГ. 21 показана разработка 7-членного пептида AAV-PHP.B и фланкирующих последовательностей. 7-членный пептид РНР.В был вставлен между АА588-589 капсида AAV9. Пять библиотек насыщения сайта (XXX1-XXX5) были получены с помощью ПЦР, смешаны в равных количествах и использованы для получения ДНК. Затем ДНК применяли для получения библиотек капсидов AAV.
[00034] На ФИГ. 22А-22В представлены аминокислотные последовательности капсида VP1 AAV-PHP.N (ФИГ. 22А) и капсида VP1 AAV-PHP.S (ФИГ. 22В). ФИГ. 22А: подчеркнута вставка 7-членного AAV-PHP.S, и выделены две аминокислоты, отличные от 7-членного AAV-PHP.B. ФИГ. 22В: подчеркнут 7-членный AAV-PHP.S.
[00035] На ФИГ. 23А-23Е представлены результаты, свидетельствующие о том, что два капсида AAV, AAV-PHP.S и AAV-PHP.N, эффективно переносят гены в периферическую и центральную нервную систему, соответственно. Взрослым мышам внутривенно вводили указанную дозу вируса. На ФИГ. 23А представлены изображения, свидетельствующие об экспрессии GFP во всем мозге. На ФИГ. 23В-23С представлены изображения, свидетельствующие об экспрессии GFP в сагиттальном срезе мозга. На ФИГ. 23D-23E представлены изображения, свидетельствующие об экспрессии GFP в поперечных срезах спинного мозга. Интенсивные сигналы указывают на экспрессию GFP.
[00036] На ФИГ. 24A-24G представлены результаты, свидетельствующие о том, что AAV-PHP.N более эффективно трансдуцирует несколько групп нейронов, чем AAV-PHP.B. На ФИГ. 24А-24С представлены изображения нативной флуоресценции GFP в результате экспрессии белка GFP в срезах мозга взрослых мышей, которым путем инъекции вводили AAV-PHP.B (вверху) или AAV-PHP.N (внизу), в коре головного мозга (ФИГ. 24А), полосатом теле (ФИГ. 24В) и мозжечке (ФИГ. 24С). Интенсивный сигнал указывает на экспрессию GFP. На ФИГ. 24D представлен процент ядер клеток (DAPI+), которые экспрессировали GFP после инъекции AAV-PHP.B или AAV-PHP.N. На ФИГ. 24Е представлен процент NeuN+ нейронов (кора головного мозга или полосатое тело) или кальбиндин+ (Calb) нейронов Пуркинье в мозжечке, которые экспрессируют GFP. На ФИГ. 24F представлен процент S100b+ клеток, которые экспрессируют GFP. На ФИГ. 24G представлены значения средней интенсивности флуоресценции отдельных GFP+ ядер в указанной области мозга. Данные были получены путем вычисления среднего значения интенсивности флуоресценции для каждого ядра. *р<0,05, **р<0,01, непарный t-тест Стьюдента.
[00037] На ФИГ. 25A-25D представлены результаты, свидетельствующие о том, что AAV-PHP.S более эффективно трансдуцирует сенсорные нейроны, чем AAV9. На ФИГ. 25А представлены изображения нативной флуоресценции GFP после трансдукции 1×1012 в.г. ssAAV-CAG-NLS-GFP, упакованного в AAV9 или AAV-PHP.S. Интенсивный сигнал указывает на экспрессию GFP. На ФИГ. 25В представлен процент PGP9.5+ нейронов DRG, которые экспрессируют ядерный GFP. На ФИГ. 25С представлено средние значение медианы интенсивности флуоресценции GFP+ клеток, трансдуцированных указанным вектором. На ФИГ. 25D представлены изображения AAV-PHP.S-трансдуцированных сердечных ганглиев и сердечной мышцы. Интенсивный сигнал свидетельствует об экспрессии AAV-PHP.S. **р<0,01, ****р<0,0001, непарный t-тест Стьюдента.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00038] В приведенном ниже подробном описании делается ссылка на сопровождающие чертежи, которые являются частью данного описания. На чертежах аналогичные символы обычно указывают аналогичные компоненты, если из контекста не следует иное. Иллюстративные варианты реализации, описанные в подробном описании, чертежах и формуле изобретения, не являются ограничивающими. Могут быть использованы другие варианты реализации, и могут быть сделаны другие изменения, не отступая от сущности или объема объекта настоящего изобретения, раскрытого в настоящем документе. Следует понимать, что аспекты настоящего изобретения, описанные в настоящем документе в общих чертах и проиллюстрированные на фигурах, могут быть сгруппированы, заменены, объединены, отделены и сконструированы в самых разных конфигурациях, все из которых явным образом включены в настоящую заявку и являются частью настоящего изобретения.
[00039] Настоящая заявка относится к AAV, способным доставлять нуклеиновые кислоты в целевое окружение, например, клетку, популяцию клеток, ткань, орган или их комбинацию, у субъекта, которого трансдуцируют с применением AAV. Например, AAV можно применять для доставки нуклеиновых кислот в нервную систему, например, в центральную нервную систему (ЦНС) и/или периферическую нервную систему (ПНС) субъекта. Согласно некоторым вариантам реализации настоящего изобретения AAV можно применять для доставки нуклеиновых кислот в сердце субъекта. Настоящее изобретение также относится к пептидам, способным направлять AAV в целевое окружение (например, нервную систему, сердце или их комбинацию) у субъекта, капсидным белкам AAV, содержащим указанные пептиды, композициям (например, фармацевтическим композициям), содержащим AAV-векторы, имеющие капсидные белки, содержащие указанные пептиды, и последовательностям нуклеиновых кислот, кодирующим указанные пептиды и капсидные белки AAV. Помимо этого настоящее изобретение также относится к способам получения и применения AAV-векторов. Согласно некоторым вариантам реализации настоящего изобретения AAV-векторы применяют для предотвращения и/или лечения одного или более заболеваний и расстройств, например, заболеваний и расстройств, связанных с нервной системой и/или сердцем.
Определения
[00040] Если не указано иное, технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понятно специалисту в данной области техники, к которой принадлежит настоящее изобретение. См., например, Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, NY 1994); Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Springs Harbor Press (Cold Springs Harbor, NY 1989) Для целей настоящего изобретения следующие термины определены ниже.
[00041] В настоящем документе термин «вектор» может относиться к носителю для переноса или передачи нуклеиновой кислоты. Неограничивающие примеры векторов включают плазмиды и вирусы (например, AAV).
[00042] В настоящем документе термин «конструкция» относится к рекомбинантной нуклеиновой кислоте, которая была получена для экспрессии специфичной нуклеотидной последовательности (ей) или которая должна быть применена при конструировании других рекомбинантных нуклеотидных последовательностей.
[00043] В настоящем документе термин «плазмида» относится к нуклеиновой кислоте, которая может быть использована для репликации рекомбинантных последовательностей ДНК в организме-хозяине. Последовательность может представлять собой двухцепочечную ДНК.
[00044] В настоящем документе термины «нуклеиновая кислота» и «полинуклеотид» являются взаимозаменяемыми и относятся к любой нуклеиновой кислоте, независимо от того, состоит она из фосфодиэфирных связей или модифицированных связей, таких как фосфотриэфир, фосфоамидат, силоксан, карбонат, карбоксиметилэфир, ацетамидат, карбамат, тиоэфир, мостиковый фосфоамидат, мостиковый метиленфосфонат, мостиковый фосфоамидат, мостиковый метиленфосфонат, фосфотиоат, метилфосфонат, фосфодитиоат, мостиковый фосфотиоат или султоновые связи и комбинаций указанных связей. Термины «нуклеиновая кислота» и «полинуклеотид» также конкретно включают нуклеиновые кислоты, состоящие из оснований, отличных от пяти природных биологических оснований (аденина, гуанина, тимина, цитозина и урацила).
[00045] В настоящем документе термин аминокислота «Xn» или «Bn» пептидной последовательности из двух или более смежных аминокислот относится к аминокислоте в положении nth (n является положительным целым числом) пептидной последовательности. Например, в пептидной последовательности из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11 X1 представляет собой аминокислоту в положении 1 (т.е. в 1 положении) пептидной последовательности, Х2 представляет собой аминокислоту в положении 2 (т.е. во 2 положении) пептидной последовательности, Х3 представляет собой аминокислоту в положении 3 (т.е. в 3 положении) пептидной последовательности, Х4 представляет собой аминокислоту в положении 4 (т.е. в 4 положении) пептидной последовательности, X5 представляет собой аминокислоту в положении 5 (т.е. в 5 положении) пептидной последовательности, Х6 представляет собой аминокислоту в положении 6 (т.е. в 6 положении) пептидной последовательности, Х7 представляет собой аминокислоту в положении 7 (т.е., в 7 положении) пептидной последовательности, X8 представляет собой аминокислоту в положении 8 (т.е. в 8 положении) пептидной последовательности, Х9 представляет собой аминокислоту в положении 9 (т.е. в 9 положении) пептидной последовательности, Х10 представляет собой аминокислоту в положении 10 (т.е. в 10 положении) пептидной последовательности и Х11 представляет собой аминокислоту в положении 11 (т.е. в 11 положении) пептидной последовательности. Например, если в пептидной последовательности в положении 9 присутствует А, в положении 10 присутствует G и в положении 11 присутствует Q, описано, что аминокислоты Х9Х10Х11 представляют собой AGQ. В другом примере, в пептидной последовательности QAB3B4TSL В3 представляет собой аминокислоту в положении 3 пептидной последовательности, В4 представляет собой аминокислоту в положении 4 пептидной последовательности.
[00046] Термин «последовательность распознавания рекомбиназы» или «сайт распознавания рекомбиназы» относится к последовательности нуклеиновой кислоты, которая распознается рекомбиназой и может служить в качестве субстрата для рекомбинации, катализируемой указанной рекомбиназой. Последовательность может представлять собой, например, двухцепочечную ДНК.
[00047] Термин «вирусный геном» относится к последовательности нуклеиновой кислоты, которая фланкирована цис-действующими последовательностями нуклеиновых кислот, которые опосредуют упаковку нуклеиновой кислоты в вирусный капсид. Для AAV и парвовирусов, например, известно, что «инвертированные концевые повторы» (ITR), которые расположены на 5'- и 3'-конце вирусного генома, имеют эту функцию и что ITR могут опосредовать упаковку гетерологичных геномов, например, геномов вируса не дикого типа, в вирусный капсид.
[00048] Термин «элемент» относится к отдельной или отличающейся части чего-либо, например, последовательности нуклеиновой кислоты с отдельной функцией в более длинной последовательности нуклеиновой кислоты. Термины «регуляторный элемент» и «элемент, контролирующий экспрессию» используются в настоящем документе взаимозаменяемо и относятся к молекулам нуклеиновых кислот, которые могут влиять на экспрессию функционально соединенной кодирующей последовательности в конкретном организме-хозяине. Упомянутые термины широко используются и охватывают все элементы, которые способствуют или регулируют транскрипцию, включая промоторы, элементы ядра, необходимые для основного взаимодействия РНК-полимеразы и факторов транскрипции, элементы, расположенные против хода транскрипции, энхансеры и элементы ответа (см., например, Lewin, "Genes V" (Oxford University Press, Oxford) p. 847-873). Типичные регуляторные элементы у прокариот включают промоторы, последовательности операторов и сайты связывания рибосом. Регуляторные элементы, которые применяют в эукариотических клетках, могут включать, но не ограничиваются ими, последовательности, контролирующие транскрипцию и трансляцию, такие как промоторы, энхансеры, сигналы сплайсинга, сигналы полиаденилирования, терминаторы, сигналы разрушения белка, внутренний сайт посадки рибосомы (IRES), последовательности 2А, и т.п., которые обеспечивают и/или регулируют экспрессию кодирующей последовательности и/или выработку кодируемого полипептида в клетке-хозяине.
[00049] В настоящем документе термин «вариант» относится к полинуклеотиду или полипептиду, имеющему последовательность, которая по существу аналогична эталонному полинуклеотиду или полипептиду. В случае полинуклеотида вариант может содержать делеции, замены, добавления одного или более нуклеотидов на 5'-конце, 3'-конце и/или одном или более внутренних сайтах по сравнению с эталонным полинуклеотидом. Сходства и/или различия последовательностей варианта и эталонного полинуклеотида могут быть детектированы с использованием общепринятых методик, известных в данной области техники, например, с помощью полимеразной цепной реакции (ПЦР) и методик гибридизации. Варианты полинуклеотидов также включают синтетические полинуклеотиды, такие как те, которые получены, например, с использованием сайт-направленного мутагенеза. Обычно последовательность варианта полинуклеотида, включая, но не ограничиваясь этим, ДНК, может быть по меньшей мере приблизительно на 50%, приблизительно на 55%, приблизительно на 60%, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или более идентична последовательности эталонного полинуклеотида, согласно результатам определения с использованием программ сопоставления последовательностей, известных специалистам в данной области техники. В случае полипептида вариант может иметь делеции, замены, добавления одной или более аминокислот по сравнению с эталонным полипептидом. Сходства и/или различия последовательностей варианта и эталонного полипептида могут быть детектированы с использованием стандартных методик, известных в данной области техники, например, Вестерн-блоттинга. Обычно последовательность варианта полипептида может быть по меньшей мере приблизительно на 60%, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или более идентична последовательности эталонного полипептида, согласно результатам определения с помощью программ сопоставления последовательностей, известных специалистам в данной области техники.
[00050] Термин «AAV» или «аденоассоциированный вирус» относится к Dependoparvovirus в роду вирусов Parvoviridae. Например, AAV может представлять собой AAV, происходящий из природного вируса «дикого типа», AAV, происходящий из генома rAAV, упакованного в капсид, полученный из капсидных белков, кодируемых природным геном cap, и/или генома rAAV, упакованного в капсид, полученный из капсидных белков, кодируемых геном cap неприродного капсида, например, AAV-PHP.N и AAV-PHP.S. Как раскрыто в настоящем документе, термины «AAV-РНР.еВ», «AAV-PHP.N» и «AAV-РНР.В-DGT» используются взаимозаменяемо для обозначения варианта AAV, имеющего неприродный капсидный белок, содержащий 11-членную аминокислотную последовательность DGTLAVPFKAQ (SEQ ID NO: 4, которая называется в настоящем документе последовательность «РНР.еВ», «PHP.N» «РНР.В-DGT», соответственно).
[00051] Термин «rAAV» относится к «рекомбинантному AAV». Согласно некоторым вариантам реализации настоящего изобретения рекомбинантный AAV имеет геном AAV, в котором часть или все гены rep и cap заменены гетерологичными последовательностями.
[00052] Термин «вспомогательная плазмида rep-сар» относится к плазмиде, которая обеспечивает функции вирусных генов rep и cap. Такую плазмиду можно применять для получения AAV из геномов rAAV, не имеющих функциональных последовательностей гена rep и/или капсида.
[00053] Термин «вектор» определяется как носитель для переноса или передачи нуклеиновой кислоты. Неограничивающие примеры векторов включают плазмиды и вирусы.
[00054] Термин «ген сар» относится к последовательностям нуклеиновых кислот, которые кодируют капсидные белки, которые образуют или способствуют образованию, капсида, или белковой оболочки, вируса. В случае AAV капсидный белок может представлять собой VP1, VP2 или VP3. Для других парвовирусов названия и нумерация белков капсида могут отличаться.
[00055] Термин «ген rep» относится к последовательностям нуклеиновых кислот, которые кодируют неструктурные белки (rep78, rep68, rep52 и rep40), необходимые для репликации и выработки вируса.
[00056] «Библиотека» может быть в виде множества линейных нуклеиновых кислот, плазмид, вирусных частиц или вирусных векторов. Библиотека будет включать по меньшей мере две линейные нуклеиновые кислоты.
[00057] В случае если вставленные последовательности нуклеиновых кислот получены случайным образом, N=A, С, G или Т; K=G или Т; М=А или С.
[00058] Если не указано иное, левый конец любой одноцепочечной полинуклеотидной последовательности, обсуждаемой в настоящем документе, является 5'-концом; левое направление двухцепочечных полинуклеотидных последовательностей называется 5'-направлением.
[00059] В настоящем документе термин «природный» относится к материалам, которые встречаются в природе, или к форме материалов, которая встречается в природе.
[00060] Стандартные методики могут быть использованы для рекомбинантной ДНК, синтеза олигонуклеотидов и культивирования и трансформации тканей (например, электропорации, липофекции). Ферментативные реакции и методики очистки могут быть выполнены в соответствии с техническими описаниями изготовителя или как общепринято в данной области техники, или как описано в настоящем документе. Вышеупомянутые методики и процедуры обычно могут быть выполнены в соответствии с общепринятыми способами, хорошо известными в данной области техники и описанными в различных общих и более конкретных ссылках, которые цитируются и обсуждаются в настоящем описании. См., например, руководство Sambrook et al., Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)), которое включено в настоящий документ посредством ссылки для любых целей. Если не предоставлены конкретные определения, номенклатура, а также лабораторные процедуры и методики, используемые в отношении способов аналитической химии, синтетической органической химии и лекарственной и фармацевтической химии, описанные в настоящем документе, хорошо известны и обычно используются в данной области техники. Стандартные методики могут быть использованы для химического синтеза, химического анализа, фармацевтического препарата, состава и доставки, а также для лечения пациентов.
[00061] В настоящем документе термин «субъект» относится к животному, которое является объектом лечения, наблюдения или эксперимента. «Животное» включает холоднокровных и теплокровных позвоночных и беспозвоночных, таких как рыбы, моллюски, рептилии и, в частности, млекопитающие. В настоящем документе термин «млекопитающее» относится к индивиду, принадлежащему к классу Mammalia, и включает, но не ограничивается ими, человека, домашних и сельскохозяйственных животных, зоопарковых животных, спортивных и домашних животных. Неограничивающие примеры млекопитающих включают мышей; крыс; кроликов; морских свинок; собак; кошек; овец; коз; коров; лошадей; приматов, таких как обезьяны, шимпанзе и человекообразные обезьяны, и, в частности, человека. Согласно некоторым вариантам реализации настоящего изобретения млекопитающее является человеком. Однако согласно некоторым вариантам реализации настоящего изобретения млекопитающее не является человеком.
[00062] В настоящем документе термин «лечение» относится к вмешательству, сделанному в ответ на заболевание, нарушение или физиологическое состояние, проявляемое пациентом, особенно пациентом, страдающим одним или более заболеваниями, связанными с серотонином. Цель лечения может включать, но не ограничивается ими, одно или более из ослабления или предотвращения симптомов, замедления или остановки прогрессирования или ухудшения заболевания, расстройства или состояния и ремиссию заболевания, расстройства или состояния. Термин «лечить» и «лечение» включает, например, терапевтическое лечение, виды профилактического лечения и способы применения, которые приводят к снижению риска возникновения у субъекта расстройства или другого фактора риска. Лечение не требует полного излечения расстройства и включает варианты, в которых симптомы или первопричинные факторы риска уменьшаются. Согласно некоторым вариантам реализации настоящего изобретения «лечение» относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Те, кто нуждается в лечении, включают тех, кто уже поражен заболеванием или расстройством, или имеет нежелательное физиологическое состояние, а также тех, у кого необходимо предотвратить развитие заболевания или расстройства, или нежелательного физиологического состояния. Например, в некоторых вариантах лечение может повышать или понижать уровень серотонина у субъекта, тем самым снижая, облегчая или устраняя симптом (симптомы) заболевания (заболеваний). В настоящем документе термин «предотвращение» относится к любой активности, которая уменьшает нагрузку на индивидуума, у которого позднее проявляются такие симптомы заболевания, связанного с серотонином. Это может происходить на уровнях первичной, вторичной и/или третичной профилактики, при этом: а) первичная профилактика предотвращает развитие симптомов/расстройства/состояния; b) виды вторичной профилактической активности направлены на ранние стадии лечения состояния/расстройства/симптома, увеличивая тем самым возможности для вмешательства для предотвращения прогрессирования состояния/расстройства/симптома и появления симптомов; и с) третичная профилактика снижает негативное влияние уже присутствующего состояния/расстройства/симптома, например, путем восстановления функции и/или снижая тяжесть любого состояния/расстройства/симптома или связанных с ними осложнений. Термин «предотвращать» не требует 100% устранения возможности явления. Этот термин скорее означает, что вероятность возникновения явления была снижена в присутствии соединения или способа.
[00063] В настоящем документе термин «эффективное количество» относится к количеству, достаточному для осуществления благоприятных или желаемых биологических и/или клинических результатов.
[00064] «Фармацевтически приемлемые» носители представляют собой те, которые нетоксичны для клетки или млекопитающего, подвергнутого их воздействию в применяемых дозах и концентрациях. «Фармацевтически приемлемые» носители могут представлять собой, но не ограничиваются ими, органические или неорганические твердые или жидкие вспомогательные вещества, которые являются подходящими для выбранного способа применения, такого как пероральное введение или инъекция, и могут быть введены в форме стандартного фармацевтического препарата, например, в твердой форме, такой как таблетки, гранулы, порошки, капсулы, и жидкой форме, такой как раствор, эмульсия, суспензия и тому подобное. Часто физиологически приемлемый носитель представляет собой водный раствор с контролируемым рН, такой как фосфатный буфер или цитратный буфер. Физиологически приемлемый носитель также может содержать один или более из следующих агентов: антиоксиданты, включая аскорбиновую кислоту, низкомолекулярные (менее приблизительно 10 остатков) полипептиды, белки, такие как сывороточный альбумин, желатин, иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, углеводы, включая глюкозу, маннозу или декстрины, хелатирующие агенты, такие как ЭДТА, сахарные спирты, такие как маннит или сорбит, солеобразующие противоионы, такие как натрий, и неионные поверхностно-активные вещества, такие как твин™, полиэтиленгликоль (ПЭГ) и плюроновые кислоты™. К носителям также могут быть добавлены вспомогательные агенты, стабилизатор, эмульгатор, смазывающий агент, связывающий агент, регулятор рН или вещество для доведения рН, изотонический агент и другие обычные добавки.
Нацеливающие последовательности
[00065] Настоящее изобретение относится к нацеливающим пептидам, способным направлять AAV (например, направлять AAV для доставки одной или более нуклеиновых кислот) в целевое окружение в организме субъекта. Целевым окружением может, например, являться клетка, популяция клеток, одна или более тканей, один или более органов или их комбинация у субъекта. Согласно некоторым вариантам реализации настоящего изобретения целевое окружение представляет собой центральную нервную систему (ЦНС). Согласно некоторым вариантам реализации настоящего изобретения целевое окружение представляет собой периферическую нервную систему (ПНС). Согласно некоторым вариантам реализации настоящего изобретения целевое окружение представляет собой сердце. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид способен направлять AAV в или преимущественно в ЦНС субъекта (называемый в настоящем документе «пептид, нацеливающий к ЦНС»). Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид способен направлять AAV в или преимущественно в ПНС субъекта (называемый в настоящем документе «пептид, нацеливающий к ПНС»). Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид способен направлять AAV в или преимущественно в сердце субъекта (называемый в настоящем документе «пептид, нацеливающий к сердцу»). Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид представляет собой пептид, нацеливающий к ЦНС. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид представляет собой пептид, нацеливающий к ПНС. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид представляет собой пептид, нацеливающий к сердцу. Например, пептид, нацеливающий к ЦНС, может, согласно некоторым вариантам реализации настоящего изобретения, направлять AAV для доставки нуклеиновых кислот в нейроны, глию, эндотелиальные клетки, астроциты, клетки Пуркинье мозжечка или их комбинацию в ЦНС. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид способен направлять AAV для доставки нуклеиновой кислоты в ЦНС, сердце (например, кардиомиоциты в сердце), периферические нервы или их комбинацию у субъекта. Согласно некоторым вариантам реализации настоящего изобретения субъект является взрослым, например, является субъектом в возрасте трех лет и старше.
[00066] Нацеливающий пептид (например, пептид, нацеливающий к ЦНС, пептид, нацеливающий к ПНС, и пептид, нацеливающий к сердцу) может иметь различную длину. Например, нацеливающий пептид может содержать или содержит по меньшей мере три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, пятнадцать, восемнадцать, двадцать, двадцать пять, тридцать аминокислот или любое количество аминокислот в пределах указанного диапазона. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит или содержит приблизительно семь аминокислот. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит или содержит приблизительно одиннадцать аминокислот. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит или содержит приблизительно от семи до одиннадцати аминокислот.
[00067] Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит или состоит из последовательности из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11, где
X1 представляет собой D, А, Е, Q, N, G или S;
Х2 представляет собой G, N, S, Т, Q или V;
Х3 представляет собой Т, S или N;
Х4 представляет собой L или V;
Х5 представляет собой A, S, Q, Р или Т;
Х6 представляет собой V, Т, Q, N, L или М;
X7 представляет собой Р;
Х8 представляет собой F, Y, V, L, С или S;
Х9 представляет собой K, R или S; и
каждый из Х10 и Х11 независимо представляет собой любую аминокислоту.
[00068] Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид не является или не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1). Согласно некоторым вариантам реализации нацеливающего пептида X10 и Х11 могут независимо представлять собой любые аминокислоты, например, любую из стандартных аминокислот. В настоящем документе стандартные аминокислоты включают аланин (сокращенно обозначаемый «Ala» или «А»), аргинин (сокращенно обозначаемый «Arg» или «R»), аспарагин (сокращенно обозначаемый «Asn» или «N»), аспарагиновую кислоту (сокращенно обозначаемую «Asp» или «D»), цистеин (сокращенно обозначаемый «Cys» или «С»), глутаминовую кислоту (сокращенно обозначаемую «Glu» или «Е»), глутамин (сокращенно обозначаемый «Gln» или «Q»), глицин (сокращенно обозначаемый «Gly» или «G»), гистидин (сокращенно обозначаемый «His» или «Н»), изолейцин (сокращенно обозначаемый «Ile» или «I»), лейцин (сокращенно обозначаемый «Leu» или «L»), лизин (сокращенно обозначаемый «Lys» или «K»), метионин (сокращенно обозначаемый «Met» или «М»), фенилаланин (сокращенно обозначаемый «Phe» или «F»), пролин (сокращенно обозначаемый «Pro» или «Р»), серии (сокращенно обозначаемый «Ser» или «S»), треонин (сокращенно обозначаемый «Thr» или «Т»), триптофан (сокращенно обозначаемый «Trp» или «W»), тирозин (сокращенно обозначаемый «Tyr» или «Y»), валин (сокращенно обозначаемый «Val» или «V»). Согласно некоторым вариантам реализации настоящего изобретения Х10 представляет собой А или N. Согласно некоторым вариантам реализации настоящего изобретения X11 представляет собой Q или Р. Х10 и Х11 могут представлять собой одинаковые или различные аминокислоты. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой D. Согласно некоторым вариантам реализации настоящего изобретения Х2 представляет собой G. Согласно некоторым вариантам реализации настоящего изобретения Х3 представляет собой Т. Согласно некоторым вариантам реализации настоящего изобретения Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения Х6 представляет собой V или Т. Согласно некоторым вариантам реализации настоящего изобретения X8 представляет собой F. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х4Х5Х6Х7Х8Х9Х10Х11 представляет собой LAVPFKAQ (SEQ ID NO: 80). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х1Х2Х3 представляет собой DGT, GGT, EGT, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х1Х2 представляет собой AQ и аминокислоты Х6Х7Х8Х9Х10Х11 представляют собой VPFKAQ (SEQ ID NO: 81). Согласно некоторым вариантам реализации настоящего изобретения Х3 представляет собой Т и X4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения X5 представляет собой А. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х1Х2 представляет собой AQ, аминокислотная последовательность Х3Х4 представляет собой TL, и аминокислотная последовательность Х8Х9Х10Х11 представляет собой FKAQ (SEQ ID NO: 82). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность X5X6X7 представляет собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х1Х2Х3Х4Х5Х6 приставляет собой AQTLAV (SEQ ID NO: 83), и аминокислотная последовательность Х10Х11 представляет собой AQ. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х7Х8Х9 представляют собой PFK. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность X1X2X3X4X5X6X7X8 представляет собой AQTLAVPF (SEQ ID NO: 84). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х9Х10Х11 представляет собой KAQ, KAP или SNP. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11 представляет собой DGTLATPFKXX (X может быть любой аминокислотой, SEQ ID NO: 68). Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот X1X2X3X4X5X6X7X8X9X10X11 представляет собой GGTLATPFKAQ (SEQ ID NO: 10). Различные комбинации вариантов реализации, описанных в настоящем документе, включены в объем настоящего изобретения. Например, если Х10 представляет собой А, Х11 может представлять собой Q или Р; и если X1 представляет собой D, Х2 может быть любой аминокислотой из G, N, S, Т и V. В качестве другого примера, если Х3 представляет собой Т и X4 представляет собой L, X5 может представлять собой А.
[00069] Согласно некоторым вариантам реализации настоящего изобретения Х4, X5, Х6, Х7, X8, Х9, Х10 и Х11 представляют собой L, А, V, Р, F, K, А и Q, соответственно; и Х3 представляет собой Т, S или N. Согласно некоторым вариантам реализации настоящего изобретения предпочтительно Х3 представляет собой Т. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность X1X2X3 представляет собой AQT, DGT, GGT, EGT, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART.
[00070] Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А и Х2 представляет Q; Х6, Х7, X8, Х9, Х10 и Х11 представляют собой V, Р, F, K, A, Q, соответственно; и Х3 представляет собой Т и Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х3Х4Х5 представляет собой TLA.
[00071] Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q, и аминокислотная последовательность Х5Х6Х7 представляет собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP.
[00072] Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот представляет собой AQTLAVPFKAQ (SEQ ID NO: 1).
[00073] Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, X5 представляет собой А, Х6 представляет собой V, X7 представляет собой Р и X8 представляет собой F, и аминокислотная последовательность Х9Х10Х11 представляет собой KAQ, KAP или SNP.
[00074] Нацеливающий пептид также может содержать или состоит из по меньшей мере 4 смежных аминокислот любого из нацеливающих пептидов, описанных в настоящем документе, например, нацеливающего пептида, имеющего последовательность, представленную в SEQ ID NO: 1-44, 48-53 и 65-68. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит или состоит из 4, 5 или 6 смежных аминокислот одной из последовательностей, представленных в SEQ ID NO: 37-44 и 65-68. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит или состоит из 4, 5, 6, 7, 8, 9 или 10 смежных аминокислот одной из последовательностей, представленных в SEQ ID NO: 1-36.
[00075] Нацеливающий пептид также может содержать или состоит из по меньшей мере 4 смежных аминокислот последовательности QAVRTSL (SEQ ID NO: 37). Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит или состоит из 4, 5 или 6 смежных аминокислот последовательности QAVRTSL (SEQ ID NO: 37). Например, нацеливающий пептид может содержать или состоять из аминокислотной последовательности, выбранной из QAVR (SEQ ID NO: 85), AVRT (SEQ ID NO: 86), VRTS (SEQ ID NO: 87), RTSL (SEQ ID NO: 88), QAVRT (SEQ ID NO: 89), AVRTS (SEQ ID NO: 90), VRTSL (SEQ ID NO: 91), QAVRTS (SEQ ID NO: 92) и AVRTSL (SEQ ID NO: 93). Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид также может содержать или состоять из аминокислотной последовательности, которая имеет одно или два несоответствия с последовательностью, представленной в SEQ ID NO: 37. Например, нацеливающий пептид может содержать аминокислотную последовательность или состоять из аминокислотной последовательности QAB3B4TSL, где В3 и B4 могут независимо представлять собой любую из стандартных аминокислот. Согласно некоторым вариантам реализации настоящего изобретения В3 не является V, B4 не является R, или и то, и другое. В качестве еще одного примера, нацеливающий пептид может содержать или состоять из аминокислотной последовательности QAVRB5SL, где В5 может представлять собой любую из стандартных аминокислот. Согласно некоторым вариантам реализации настоящего изобретения В5 не является Т.
[00076] Нацеливающий пептид, описанный в настоящем документе, может представлять собой отдельный пептид, или может быть конъюгирован или являться частью наночастицы, второй молекулы, вирусного капсидного белка или их комбинации. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид вставлен между аминокислотами 588 и 589 последовательности капсидного белка AAV9 (SEQ ID NO: 45).
[00077] Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит или состоит из четырех или более смежных аминокислот одной из последовательностей, представленных в SEQ ID NO: 1-44, 48-53 и 65-68. Согласно некоторым вариантам реализации настоящего изобретения пептид, нацеливающий к ЦНС, содержит или состоит из 4, 5 или 6 аминокислот любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53 и 65-68. Согласно некоторым вариантам реализации настоящего изобретения 2 или меньше аминокислот могут быть заменены любой аминокислотой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53 и 65-68. Согласно некоторым вариантам реализации настоящего изобретения изменение представляет собой консервативное изменение (в любой из нацеливающих последовательностей согласно настоящему изобретению). Согласно некоторым вариантам реализации настоящего изобретения изменение представляет собой делецию или вставку одной или двух аминокислот (в любой из нацеливающих последовательностей согласно настоящему изобретению). Согласно некоторым вариантам реализации настоящего изобретения последовательность нацеливающего пептида может быть по меньшей мере на 75%, 80%, 85%, 90%, 95%, 98%, 99% или более идентична одной из нацеливающих последовательностей согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид может отличаться от одной из нацеливающих последовательностей, раскрытых в настоящем документе, одной, двумя, тремя, четырьмя, пятью, шестью или более аминокислотами.
[00078] Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид содержит, состоит или состоит по существу из любой одной или более из вышеуказанных последовательностей. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид вводят в более длинный пептид, описанный в настоящем документе. В таблице 1 приведены неограничивающие примеры нацеливающих пептидов.
[00079] Настоящее изобретение также относится к нуклеиновым кислотам, содержащим нуклеотидные последовательности, которые кодируют один или более нацеливающих пептидов, описанных в настоящем документе.
[00080] Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид является частью AAV, например, частью капсидного белка AAV (SEQ ID NO: 45). Настоящее изобретение относится к капсидным белкам AAV, содержащим один или более нацеливающих пептидов, описанных в настоящем документе. Например, капсидный белок AAV может содержать часть нацеливающего пептида, содержащую по меньшей мере 4 смежные аминокислоты из последовательности QAVRTSL (SEQ ID NO: 37). Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV содержит часть нацеливающего пептида, содержащую или состоящую из 4, 5 или 6 смежных аминокислот из последовательности QAVRTSL (SEQ ID NO: 37).
[00081] Настоящее изобретение также относится к капсидным белкам AAV, содержащим часть нацеливающего пептида, которая содержит последовательность из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11, где
X1 представляет собой D, А, Е, Q, N, G или S;
Х2 представляет собой G, N, S, Т, Q или V;
Х3 представляет собой Т, S или N;
Х4 представляет собой L или V;
Х5 представляет собой A, S, Q, Р или Т;
Х6 представляет собой V, Т, Q, N, L или М;
Х7 представляет собой Р;
X8 представляет собой F, Y, V, L, С или S;
Х9 представляет собой K, R или S; и
каждый из Х10 и Х11независимо представляет собой любую аминокислоту.
[00082] Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид не является или не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1). Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1). Как описано в настоящем документе, Х10 и Х11 могут независимо представлять собой любые аминокислоты, например, любую из стандартных аминокислот. Согласно некоторым вариантам реализации настоящего изобретения Х10 представляет собой А или N. Согласно некоторым вариантам реализации настоящего изобретения Х11 представляет собой Q или Р. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой D. Согласно некоторым вариантам реализации настоящего изобретения Х2 представляет собой G. Согласно некоторым вариантам реализации настоящего изобретения Х3 представляет собой Т. Согласно некоторым вариантам реализации настоящего изобретения X4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения Х6 представляет собой V или Т. Согласно некоторым вариантам реализации настоящего изобретения X8 представляет собой F. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х4Х5Х6Х7Х8Х9Х10Х11 представляет собой LAVPFKAQ (SEQ ID NO: 80). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х1Х2Х3 представляет собой DGT, GGT, EGT, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q и аминокислотная последовательность Х6Х7Х8Х9Х10Х11 представляет собой VPFKAQ (SEQ ID NO: 81). Согласно некоторым вариантам реализации настоящего изобретения Х3 представляет собой Т и Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения Х5 представляет собой А. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, и аминокислотная последовательность Х8Х9Х10Х11 представляет собой FKAQ (SEQ ID NO: 82). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х5Х6Х7 представляет собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х1Х2Х3Х4Х5Х6 представляет собой AQTLAV (SEQ ID NO: 83), Х10 представляет собой А и Х11 представляет собой Q. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х7Х8Х9 представляет собой PFK. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х1Х2Х3Х4Х5Х6Х7Х8 представляет собой AQTLAVPF (SEQ ID NO: 84). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х9Х10Х11 представляет собой KAQ, KAP или SNP. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11 представляет собой DGTLATPFKXX (X может быть любой аминокислотой, SEQ ID NO: 68). Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11 представляет собой GGTLATPFKAQ (SEQ ID NO: 10). Различные комбинации вариантов реализации, описанных в настоящем документе, включены в объем настоящего изобретения. Например, если Х10 представляет собой А, Х11 может представлять собой Q или Р; и если X1 представляет собой D, Х2 может представлять собой любую из G, N, S, Т и V. В качестве другого примера, если Х3 представляет собой Т и Х4 представляет собой L, Х5 может представлять собой А.
[00083] Согласно некоторым вариантам реализации настоящего изобретения Х4, Х5, Х6, Х7, X8, Х9, Х10 и Х11 представляют собой L, А, V, Р, F, K, А и Q, соответственно; и Х3 представляет собой Т, S или N. Согласно некоторым вариантам реализации настоящего изобретения предпочтительно Х3 представляет собой Т. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность X1X2X3 представляет собой AQT, DGT, GGT, EGT, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART.
[00084] Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А и Х2 представляет собой Q; Х6, Х7, Х8, Х9, Х10 и Х11 представляют собой V, Р, F, K, A, Q, соответственно, и Х3 представляет собой Т и Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х3Х4Х5 представляет собой TLA.
[00085] Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q, и аминокислотная последовательность Х5Х6Х7 представляет собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP.
[00086] Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот представляет собой AQTLAVPFKAQ (SEQ ID NO: 1).
[00087] Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, X4 представляет собой L, X5 представляет собой А, Х6 представляет собой V, Х7 представляет собой Р и X8 представляет собой F, и аминокислотная последовательность Х9Х10Х11 представляет собой KAQ, KAP или SNP.
[00088] Часть нацеливающего пептида капсидного белка может содержать или состоять из последовательности любого из нацеливающих пептидов, описанных в настоящем документе, или по меньшей мере 4 смежных аминокислот любого из нацеливающих пептидов, описанных в настоящем документе. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV содержит часть нацеливающего пептида, которая содержит или состоит из по меньшей мере 4 смежных аминокислот любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53 и 65-68. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV содержит часть нацеливающего пептида, которая содержит или состоит из 4, 5 или 6 смежных аминокислот из последовательностей, представленных в SEQ ID NO: 37-44 и 65-68. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV содержит часть нацеливающего пептида, которая содержит или состоит из 4, 5, 6, 7, 8, 9 или 10 смежных аминокислот из последовательностей, представленных в SEQ ID NO: 1-36.
[00089] Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид является частью последовательности капсидного белка AAV9, представленной в SEQ ID NO: 45. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид может быть соединен с любой молекулой, которая должна быть нацелена желаемым образом. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид может быть соединен или конъюгирован, но не ограничиваясь перечисленными, с рекомбинантным белком, антителом, клеткой, диагностическим агентом, терапевтическим агентом, наномолекулой или их комбинацией. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок содержит или состоит из последовательности SEQ ID NO: 46 или SEQ ID NO: 47.
[00090] Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид может быть вставлен в любой желаемый участок белка. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид может быть вставлен в капсидный белок. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид вставлен на поверхность желаемого белка. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид вставлен в первичную последовательность белка. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид соединен с белком. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид ковалентно соединен с белком. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид вставлен в неструктурированную петлю желаемого белка. Согласно некоторым вариантам реализации настоящего изобретения неструктурированная петля может быть идентифицирована с помощью структурной модели белка.
[00091] Настоящее изобретение также относится к нуклеиновым кислотам, содержащим нуклеотидные последовательности, которые кодируют один или более капсидных белков AAV, описанных в настоящем документе.
Аденоассоциированные вирусы (AAV) и рекомбинантные AAV
[00092] Аденоассоциированный вирус (AAV) представляет собой парвовирус дефицитный по репликации, одноцепочечный ДНК-геном которого составляет приблизительно 4,7 т.п.н., включая 145 нуклеотидов инвертированного концевого повтора (ITR). ITR участвуют в интеграции ДНК AAV в геном клетки-хозяина. Когда AAV инфицирует клетку-хозяина вирусный геном интегрируется в хромосому хозяина, что приводит к скрытой инфекции клетки. В природной системе вспомогательный вирус (например, аденовирус или герпесвирус) обеспечивает гены, которые делают возможной выработку вируса AAV в инфицированной клетке. В случае аденовируса гены Е1А, Е1В, Е2А, Е4 и VA обеспечивают вспомогательные функции. При инфицировании вспомогательным вирусом AAV-провирус восстанавливается и амплифицируется, что приводит к выработке обоих вирусов, AAV и аденовируса. В случае рекомбинантных AAV-векторов, не имеющих генов Rep и/или Cap, AAV может быть не способен к интеграции.
[00093] Настоящее изобретение относится к векторам AAV, которые содержат кодирующие области одного или более представляющих интерес белков. AAV-вектор, может содержать 5'-концевой инвертированный концевой повтор (ITR) из AAV, 3'-концевой ITR AAV, промотор и сайт рестрикции, расположенный в 3'-направлении относительно промотора, чтобы обеспечить вставку полинуклеотида, кодирующего один или более представляющих интерес белков, причем промотор и сайт рестрикции расположены в 3'-направлении относительно 5'-ITR AAV и в 5'-направлении относительно 3'-ITR AAV. Согласно некоторым вариантам реализации настоящего изобретения AAV-вектор содержат посттранскрипционный регуляторный элемент, расположенный в 3'-направлении относительно сайта рестрикции, и в 5'-направлении относительно 3'-ITR AAV. Согласно некоторым вариантам реализации настоящего изобретения AAV-векторы, описанные в настоящем документе, можно применять в качестве AAV-векторов для переноса, несущих трансген, кодирующий представляющий интерес белок, для выработки рекомбинантных AAV, которые могут экспрессировать представляющий интерес белок в клетке-хозяине.
[00094] Настоящее изобретение относится к геномам rAAV. Геном может, например, содержать по меньшей мере один инвертированный концевой повтор, сконструированный для обеспечения упаковки в вектор, и ген cap. Согласно некоторым вариантам реализации настоящего изобретения геном может дополнительно содержать последовательность в гене rep, необходимую для экспрессии и сплайсинга гена cap. Согласно некоторым вариантам реализации настоящего изобретения геном может дополнительно содержать последовательность, способную экспрессировать VP3. Согласно некоторым вариантам реализации настоящего изобретения единственным белком, который экспрессируется, является VP3 (самый маленький из структурных белков капсида, который составляет большую часть собранного капсида - собранный капсид состоит из 60 звеньев белков VP, ~50 из которых представляют собой VP3). Согласно некоторым вариантам реализации настоящего изобретения экспрессия VP3 по отдельности является достаточной, чтобы обеспечить надлежащий способ скрининга.
[00095] Получение вирусного вектора можно осуществлять с использованием любых подходящих методик генной инженерии, хорошо известных в данной области техники, включая, но не ограничиваясь ими, стандартные методики расщепления рестрикционными эндонуклеазами, лигирования, трансформации, очистки плазмиды и секвенирования ДНК, например, как описано в Sambrook et al. (Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, N.Y. (1989)).
[00096] Вирусный вектор может содержать последовательности из генома любого известного организма. Последовательности могут быть встроены в их нативной форме или могут быть модифицированы любым способом для получения желаемой активности. Например, последовательности могут содержать вставки, делеции или замены.
[00097] Согласно некоторым вариантам реализации настоящего изобретения вирусные векторы могут содержать дополнительные последовательности, которые делают векторы пригодными для репликации и интеграции у эукариот. Согласно другим вариантам реализации настоящего изобретения вирусные векторы, описанные в настоящем документе, могут включать элемент для переноса, который делает векторы пригодными для репликации и интеграции как у прокариот, так и у эукариот. Согласно некоторым вариантам реализации настоящего изобретения вирусные векторы могут содержать дополнительные последовательности инициации транскрипции и трансляции, такие как промоторы и энхансеры; и дополнительные терминаторы транскрипции и трансляции, такие как сигналы полиаденилирования. Различные регуляторные элементы, которые могут быть включены в AAV-вектор, были подробно описаны в публикации патента США 2012/0232133, которая полностью включена в настоящий документ посредством ссылки.
[00098] Настоящее изобретение относится к AAV-векторам, которые содержат нацеливающие пептиды, способные направлять AAV в целевое окружение (например, ЦНС, ПНС и сердце) у субъекта. Согласно некоторым вариантам реализации настоящего изобретения нацеливающий пептид является частью капсидного белка AAV-вектора. AAV-вектор может, согласно некоторым вариантам реализации настоящего изобретения, содержать белок, содержащий по меньшей мере 4 смежные аминокислоты из последовательности QAVRTSL (SEQ ID NO: 37). Согласно некоторым вариантам реализации настоящего изобретения капсид AAV может содержать аминокислотную последовательность, которая содержит по меньшей мере 4 смежные аминокислоты из последовательности QAVRTSL (SEQ ID NO: 37). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность является частью капсидного белка AAV-вектора. Согласно некоторым вариантам реализации настоящего изобретения последовательность QAVRTSL (SEQ ID NO: 37) вставлена между АА588-589 последовательности AAV вектора (SEQ ID NO: 45). Согласно некоторым вариантам реализации настоящего изобретения последовательность QAVRTSL (SEQ ID NO: 37) вставлена между АА586-592 последовательности AAV вектора (SEQ ID NO: 45). Согласно некоторым вариантам реализации настоящего изобретения последовательность QAVRTSL (SEQ ID NO: 37) дополнительно содержит по меньшей мере две из аминокислот 587, 588, 589 и 590 последовательности, представленной в SEQ ID NO: 45.
[00099] Согласно некоторым вариантам реализации настоящего изобретения AAV-вектор, например, капсидный белок AAV-вектора, содержит последовательность из 11 смежных аминокислот X1X2X3X4 Х5Х6Х7Х8Х9Х10Х11, где
X1 представляет собой D, А, Е, Q, N, G или S;
Х2 представляет собой G, N, S, Т, Q или V;
Х3 представляет собой Т, S или N;
Х4 представляет собой L или V;
Х5 представляет собой A, S, Q, Р или Т;
Х6 представляет собой V, Т, Q, N, L или М;
Х7 представляет собой Р;
Х8 представляет собой F, Y, V, L, С или S;
Х9 представляет собой K, R или S; и
каждый из Х10 и Х11 независимо представляет собой любую аминокислоту.
[000100] Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот не является или не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1). Согласно некоторым вариантам реализации настоящего изобретения капсидный белок не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1). Как описано в настоящем документе, Х10 и Х11 могут независимо представлять собой любые аминокислоты, например, любую из стандартных аминокислот. Согласно некоторым вариантам реализации настоящего изобретения Х10 представляет собой А или N. Согласно некоторым вариантам реализации настоящего изобретения Х11 представляет собой Q или Р. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой D. Согласно некоторым вариантам реализации настоящего изобретения Х2 представляет собой G. Согласно некоторым вариантам реализации настоящего изобретения Х3 представляет собой Т. Согласно некоторым вариантам реализации настоящего изобретения Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения Х6 представляет собой V или Т. Согласно некоторым вариантам реализации настоящего изобретения Х8 представляет собой F. Согласно некоторым вариантам реализации настоящего изобретения аминокислоты Х4Х5Х6Х7Х8Х9Х10Х11 представляют собой LAVPFKAQ (SEQ ID NO: 80). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность X1X2X3 представляет собой DGT, GGT, EGT, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q и аминокислотная последовательность Х6Х7Х8Х9Х10Х11 представляет собой VPFKAQ. Согласно некоторым вариантам реализации настоящего изобретения Х3 представляет собой Т и Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения X5 представляет собой А. Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, и аминокислотная последовательность Х8Х9Х10Х11 представляет собой FKAQ. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х5Х6Х7 представляет собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х1Х2Х3Х4Х5Х6 представляет собой AQTLAV (SEQ ID NO: 83), Х10 представляет собой А и Х11 представляет собой Q. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х7Х8Х9 представляет собой PFK. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность X1X2X3X4X5X6X7X8 представляет собой AQTLAVPF (SEQ ID NO: 84). Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х9Х10Х11 представляет собой KAQ, KAP или SNP. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11 представляет собой DGTLATPFKXX (X может быть любой аминокислотой, SEQ ID NO: 68). Согласно некоторым вариантам реализации настоящего изобретения последовательности из 11 смежных аминокислот Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11 представляет собой GGTLATPFKAQ (SEQ ID NO: 10). Различные комбинации вариантов реализации, описанных в настоящем документе, включены в объем настоящего изобретения. Например, если Х10 представляет собой А, Х11 может представлять собой Q или Р; и если X1 представляет собой D, Х2 может представлять собой любую аминокислоту из G, N, S, Т и V. В качестве другого примера, если Х3 представляет собой Т и Х4 представляет собой L, X5 может представлять собой А.
[000101] Согласно некоторым вариантам реализации настоящего изобретения Х4, X5, Х6, Х7, X8, Х9, Х10 и Х11 представляют собой L, А, V, Р, F, K, А и Q, соответственно; и Х3 представляет собой Т, S или N. Согласно некоторым вариантам реализации настоящего изобретения предпочтительно Х3 представляет собой Т. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность X1X2X3 представляет собой AQT, DGT, GGT, EGT, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART.
[000102] Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А и Х2 представляет собой Q; Х6, Х7, X8, Х9, Х10 и Х11 представляют собой V, Р, F, K, A, Q, соответственно; и Х3 представляет собой Т и Х4 представляет собой L. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность Х3Х4Х5 представляет собой TLA.
[000103] Согласно некоторым вариантам реализации настоящего изобретения X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, X8 представляет собой F, Х9 представляет собой K, Х10 представляет собой А и Х11 представляет собой Q, и аминокислотная последовательность Х5Х6Х7 представляет собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP.
[000104] Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот представляет собой AQTLAVPFKAQ (SEQ ID NO: 1).
[000105] X1 представляет собой А, Х2 представляет собой Q, Х3 представляет собой Т, Х4 представляет собой L, Х5 представляет собой А, Х6 представляет собой V, Х7 представляет собой Р и X8 представляет собой F, и аминокислотная последовательность Х9Х10Х11 представляет собой KAQ, KAP или SNP.
[000106] Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность является частью капсидного белка AAV-вектора. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот вставлена между АА586 и 589 последовательности капсидного белка AAV, представленной в SEQ ID NO: 45, вектора. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот дополнительно содержит по меньшей мере две из аминокислот 587, 588, 589 или 590 последовательности, представленной в SEQ ID NO: 45. Согласно некоторым вариантам реализации настоящего изобретения последовательность из 11 смежных аминокислот представляет собой одну из последовательностей, представленных в SEQ ID NO: 1-36. Согласно некоторым вариантам реализации настоящего изобретения AAV-вектор содержит по меньшей мере 4 смежные аминокислоты из одной из последовательностей, представленных в SEQ ID NO: 1-44, 48-53 и 65-68.
[000107] Как описано в настоящем документе, rAAV могут быть идентифицированы из библиотек капсидов, состоящих из вариантов, полученных путем вставки 7 аминокислот (АА) рандомизированной последовательности между АА588 и АА589 капсидного белка AAV. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV может содержать различные замены по сравнению с капсидным белком AAV дикого типа, включая, но не ограничиваясь ими, замену K449R, замену A587D, замену Q588G, замену A587G, замену Q588G, замену V592T, замену K595S, замену A595N, замену Q597P и любую их комбинацию. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV содержит последовательность, идентичную последовательности капсида AAV9 дикого типа, но с заменой K449R. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV9 содержит аминокислотные замены A587D и Q588G. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV9 содержит аминокислотные замены A587G и Q588G. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV9 содержит аминокислотную замену V592T. Согласно некоторым вариантам реализации настоящего изобретения капсидный белок AAV9 содержит аминокислотные замены K595S, A595N и Q597P.
[000108] Согласно некоторым вариантам реализации настоящего изобретения один или более нацеливающих пептидов можно применять в одной системе (например, в одном AAV-векторе, одном капсидном белке AAV или одном rAAV). Например, можно применять одну или более нацеливающих последовательностей, а также модифицировать другие сайты, чтобы уменьшить распознавание AAV уже существующими антителами, присутствующими у субъекта, такого как человек. Согласно некоторым вариантам реализации настоящего изобретения AAV-вектор может включать капсид, который влияет на тропизм/нацеливание, скорость экспрессии и возможный иммунный ответ. Вектор также может включать rAAV, геном которого переносит трансген/терапевтические агенты (например, последовательности) вместе с регуляторными последовательностями. Согласно некоторым вариантам реализации настоящего изобретения вектор может содержать последовательность, нацеливающую в/на субстрат, которая представляет собой или переносит желаемую молекулу (терапевтическую молекулу, диагностическую молекулу и т.д.).
[000109] Нацеливающие пептиды, описанные в настоящем документе, согласно некоторым вариантам реализации настоящего изобретения, могут повысить эффективность трансдукции rAAV в целевое окружение (например, ЦНС, ПНС, сердце или их комбинацию) у субъекта по сравнению с AAV, который не содержит нацеливающие пептиды. Например, встраивание одного или более нацеливающих пептидов, описанных в настоящем документе, в rAAV, может повысить эффективность трансдукции на или по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, в 1,5 раза, в 2 раза, в 2,5 раза, в 3 раза, в 3,5 раза, в 4 раза, в 4,5 раза, в 5 раз, в 5,5 раза, в 6 раз, в 6,5 раза, в 7 раз, в 7,5 раза, в 8 раз, в 10 раз, в 20 раз, в 30 раз, в 40 раз, в 50 раз, в 60 раз, в 70 раз, в 80 раз, в 90 раз, в 100 раз, или на величину, которая находится в диапазоне между любыми двумя из указанных значений, по сравнению с AAV, который не содержит нацеливающий пептид. Согласно некоторым вариантам реализации настоящего изобретения увеличение составляет по меньшей мере 2 раза. Согласно некоторым вариантам реализации настоящего изобретения увеличение составляет 40-90 раз. Согласно некоторым вариантам реализации настоящего изобретения эффективность трансдукции увеличивается в отношении трансдукции rAAV в ЦНС. Согласно некоторым вариантам реализации настоящего изобретения эффективность трансдукции увеличивается в отношении трансдукции rAAV в ПНС. Согласно некоторым вариантам реализации настоящего изобретения эффективность трансдукции увеличивается в отношении трансдукции rAAV в сердце. Согласно некоторым вариантам реализации настоящего изобретения эффективность трансдукции увеличивается в отношении трансдукции rAAV в кардиомиоциты, сенсорные нейроны, ганглии задних корешков спинного мозга, висцеральные органы или любую их комбинацию.
[000110] Согласно некоторым вариантам реализации предложена библиотека капсидных белков, которая содержит геномы AAV, содержащие полные последовательности rep и cap, которые были модифицированы так, чтобы не предотвратить репликацию вируса в условиях, при которых он обычно способен реплицироваться (совместное инфицирование клетки млекопитающего вспомогательным вирусом, таким как аденовирус). Геном псевдо-дикого типа («wt») может представлять собой геном, который содержит модифицированный ген cap в геноме «wt» AAV.
[000111] Согласно некоторым вариантам реализации настоящего изобретения библиотеку капсидных белков получают в геноме AAV «псевдо-дикого типа», содержащем вирусный ген репликации (rep) и ген капсида (cap), фланкированные инвертированными концевыми повторами (ITR). Согласно некоторым вариантам реализации настоящего изобретения библиотеку капсидных белков получают без применения генома AAV «псевдо-дикого типа», содержащего ген репликации вируса (rep) и ген капсида (cap), фланкированные инвертированными концевыми повторами (ITR).
[000112] Согласно некоторым вариантам реализации настоящего изобретения геном rAAV содержит ген cap и только те последовательности в гене rep, которые необходимы для экспрессии и сплайсинга продуктов гена cap. Согласно некоторым вариантам реализации настоящего изобретения последовательность распознавания рекомбиназы капсидного гена обеспечена совместно с инвертированными концевыми повторами, фланкирующими указанные последовательности.
[000113] Согласно некоторым вариантам реализации настоящего изобретения систему можно применять для разработки капсидов, которые проявляют повышенное нацеливание к специфичным клеткам/органам, отбора капсидов, которые уклоняются от иммунного надзора, отбора геномов, которые являются более многочисленными при гомологичной рекомбинации, отбора элементов генома, повышающих эффективность превращения одноцепочечного генома AAV в двухцепочечный ДНК-геном в клетке, и/или отбора элементов генома, которые увеличивают превращение генома AAV в постоянную кольцевую форму внутри клетки.
Варианты применения AAV-векторов и rAAV
[000114] AAV-векторы, описанные в настоящем документе, могут быть эффективно трансдуцированы в целевое окружение (например, ЦНС, ПНС, сердце, любую их комбинацию, и другую желаемую систему (системы)) субъекта, например, для доставки нуклеиновой кислоты. Согласно некоторым вариантам реализации настоящего изобретения предложен способ доставки последовательности нуклеиновой кислоты в нервную систему. Способ может включать обеспечение белка, содержащего любую одну или более из нацеливающих последовательностей согласно настоящему изобретению. Белок может быть частью капсида AAV. AAV может содержать последовательность нуклеиновой кислоты, которая должна быть доставлена в нервную систему. AAV затем может быть введен субъекту.
[000115] Согласно некоторым вариантам реализации настоящего изобретения последовательность нуклеиновой кислоты, которая будет доставлена в целевое окружение (например, нервную систему), содержит одну или более последовательностей, которые могут обеспечить определенную пользу или преимущество для нервной системы и/или места доставки или окружающей ткани или окружения. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой нуклеиновую кислоту, которая кодирует представляющий интерес белок, включая, но не ограничиваясь ими, трофический фактор, фактор роста или другие растворимые факторы, которые могут быть высвобождены из трансдуцированных клеток и влияют на выживание или функцию таких клеток и/или окружающих клеток. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой кДНК, которая восстанавливает функцию белка у человека или животных, несущих генетическую мутацию (мутации) этого гена. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой кДНК, которая кодирует белок, который может быть использован для контроля или изменения активности или состояния клетки. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой кДНК, которая кодирует белок или нуклеиновую кислоту, используемую для оценки состояния клетки. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой кДНК и/или ассоциированную РНК для выполнения модификации генома. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой последовательность для редактирования генома посредством гомологичной рекомбинации. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой последовательность ДНК, кодирующую терапевтическую РНК. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой систему доставки кшРНК или искусственной миРНК. Согласно некоторым вариантам реализации настоящего изобретения подходящая нуклеиновая кислота может представлять собой последовательность ДНК, которая влияет на сплайсинг эндогенного гена.
[000116] В настоящей заявке «представляющий интерес белок» может представлять собой любой белок, включая природные и неприродные белки. Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид, кодирующий один или более представляющих интерес белков, может присутствовать в одном из AAV-векторов, описанных в настоящем документе, в которых полинуклеотид функционально соединен с промотором. В некоторых случаях промотор может контролировать экспрессию белка (белков), представляющего интерес, в клетке-хозяине (например, нейроне человека). Согласно некоторым вариантам реализации настоящего изобретения представляющий интерес белок является антителом к тау, антителом к АВ, антителом к изоформе АроЕ.
[000117] Примеры белка, представляющего интерес, включают, но не ограничиваются ими, люциферазы; флуоресцентные белки (например, GFP); гормоны роста (ГР) и их варианты; инсулиноподобные факторы роста (ИФР) и их варианты; гранулоцитарные колониестимулирующие факторы (Г-КСФ) и их варианты; эритропоэтин (ЭПО) и его варианты; инсулин, такой как проинсулин, препроинсулин, инсулин, аналоги инсулина и тому подобное; антитела и их варианты, такие как гибридные антитела, химерные антитела, гуманизированные антитела, моноклональные антитела; антигенсвязывающие фрагменты антитела (фрагменты Fab), одноцепочечные вариабельные фрагменты антитела (фрагменты scFV); дистрофии и его варианты; факторы свертывания и их варианты; регулятор трансмембранной проводимости при муковисцидозе (CFTR) и его варианты; и интерфероны и их варианты.
[000118] Согласно некоторым вариантам реализации настоящего изобретения представляющий интерес белок представляет собой терапевтический белок или его вариант. Неограничивающие примеры терапевтических белков включают факторы крови, такие как β-глобин, гемоглобин, активатор тканевого плазминогена и факторы свертывания; колониестимулирующие факторы (КСФ); интерлейкины, такие как ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9 и т.д.; факторы роста, такие как фактор роста кератиноцитов (KGF), фактор стволовых клеток (SCF), фактор роста фибробластов (FGF, такой как основный FGF и кислый FGF), фактор роста гепатоцитов (HGF), инсулиноподобные факторы роста (IGF), костный морфогенетический белок (BMP), фактор роста эпидермиса (EGF), фактор роста и дифференцировки 9 (GDF-9), фактор роста, происходящий из гепатомы (HDGF), миостатин (GDF-8), фактор роста нервов (NGF), нейротрофины, фактор роста тромбоцитов (PDGF), тромбопоэтин (ТРО), трансформирующий фактор роста альфа (TGF-α), трансформирующий фактор роста бета (TGF-β) и тому подобное; растворимые рецепторы, такие как растворимые рецепторы TNF-α, растворимые рецепторы VEGF, растворимые рецепторы интерлейкинов (например, растворимые рецепторы ИЛ-1 и растворимые рецепторы ИЛ-1 типа II), растворимые рецепторы Т-клеток типа γ/δ, лигандсвязывающие фрагменты растворимого рецептора и тому подобное; ферменты, такие как α-глюкозидаза, имиглукараза, β-глюкоцереброзидаза и альглюцераза; активаторы ферментов, такие как активатор тканевого плазминогена; хемокины, такие как IP-10, монокин, индуцированный интерфероном-гамма (Mig), Groα/IL-8, RANTES, MIP-1α, MIP-1β, MCP-1, PF-4 и тому подобное; ангиогенные агенты, такие как факторы роста эндотелия сосудов (VEGF, например, VEGF 121, VEGF 165, VEGF-C, VEGF-2), трансформирующий фактор роста-бета, основный фактор роста фибробластов, фактор роста, происходящий из глиомы, ангиогенин, ангиогенин-2; и тому подобное; антиангиогенные агенты, такие как растворимый рецептор VEGF; белковая вакцина; нейроактивные пептиды, такие как фактор роста нервов (NGF), брадикинин, холецистокинин, гастин, секретин, окситоцин, гонадотропин-высвобождающий гормон, бета-эндорфин, энкефалин, вещество Р, соматостатин, пролактин, галанин, гормон, высвобождающий гормон роста, бомбезин, динорфин, варфарин, нейротензин, мотилин, тиротропин, нейропептид Y, лютеинизирующий гормон, кальцитонин, инсулин, глюкагоны, вазопрессин, ангиотензин II, тиреотропин-высвобождающий гормон, вазоактивный кишечный пептид, пептид сна и тому подобное; тромболитические агенты; предсердный натрийуретический пептид; релаксин; глиальный фибриллярный кислый белок; фолликулостимулирующий гормон (ФСГ); антитрипсин альфа-1 человека; ингибирующий лейкемию фактор (LIF); трансформирующие факторы роста (TGF); тканевые факторы, лютеинизирующий гормон; факторы активации макрофагов; фактор некроза опухоли (TNF); фактор хемотаксиса нейтрофилов (NCF); фактор роста нервов; тканевые ингибиторы металлопротеиназ; вазоактивный кишечный пептид; ангиогенин; ангиотропин; фибрин; гирудин; антагонисты рецептора ИЛ-1; и тому подобное. Некоторые другие неограничивающие примеры белка, представляющего интерес, включают цилиарный нейротрофический фактор (CNTF); нейротрофический фактор головного мозга (BDNF); нейротрофины 3 и 4/5 (NT-3 и 4/5); нейротрофический фактор глиальных клеток (GDNF); декарбоксилазу ароматических аминокислот (AADC); связанные с гемофилией белки свертывания, такие как фактор VIII, фактор IX, фактор X; дистрофии или мини-дистрофин; лизосомальную кислую липазу; фенилаланингидроксилазу (РАН); ферменты, связанные с гликогенозами, такие как глюкозо-6-фосфатаза, кислая мальтаза, фермент, линеаризующий гликоген, мышечная гликогенфосфорилаза, гликогенфосфорилаза печени, мышечная фосфофруктокиназа, киназа фосфорилазы (например, PHKA2), переносчик глюкозы (например, GLUT2), альдолаза, β-энолаза и гликогенсинтаза; лизосомальные ферменты (например, бета-N-ацетилгексозаминидаза А); и любые их варианты.
[000119] Согласно некоторым вариантам реализации настоящего изобретения представляющий интерес белок является активным фрагментом белка, такого как любой из вышеупомянутых белков. Согласно некоторым вариантам реализации настоящего изобретения представляющий интерес белок является гибридным белком, содержащим некоторые или все из двух или более белков. Согласно некоторым вариантам реализации настоящего изобретения гибридный белок может содержать все или часть любого из вышеупомянутых белков.
[000120] Согласно некоторым вариантам реализации настоящего изобретения вирусный вектор содержит полинуклеотид, содержащий кодирующие области для двух или более белков, представляющих интерес. Два или более представляющих интерес белков могут быть одинаковыми или различными. Согласно некоторым вариантам реализации настоящего изобретения два или более представляющих интерес белков представляют собой родственные полипептиды, например, легкую цепь (цепи) и тяжелую цепь (цепи) одного и того же антитела.
[000121] Согласно некоторым вариантам реализации настоящего изобретения представляющий интерес белок является мультисубъединичным белком. Например, представляющий интерес белок может содержать две или более субъединиц или две или более независимых полипептидных цепей. Согласно некоторым вариантам реализации настоящего изобретения представляющий интерес белок может быть антителом. Примеры антител включают, но не ограничиваются ими, антитела различных изотипов (например, IgG1, IgG2, IgG3, IgG4, IgA, IgD, IgE и IgM); моноклональные антитела, полученные любыми способами, известными специалистам в данной области техники, включая антигенсвязывающий фрагмент моноклонального антитела; гуманизированные антитела; химерные антитела; одноцепочечные антитела; фрагменты антител, такие как Fv, F(ab')2, Fab', Fab, Facb, scFv и тому подобное; при условии, что антитело способно связываться с антигеном. Согласно некоторым вариантам реализации настоящего изобретения антитело представляет собой полноразмерное антитело. Согласно некоторым вариантам реализации настоящего изобретения представляющий интерес белок не является иммуноадгезином.
[000122] Согласно некоторым вариантам реализации настоящего изобретения полученные нацеливающие молекулы можно применять в способах и/или способах лечения, связанных с вариантами применения переноса генов в популяции долгоживущих клеток в условиях in vivo. Согласно некоторым вариантам реализации настоящего изобретения нацеливающие молекулы можно применять для любой генной терапии на основе rAAV, включая, например, спинальную мышечную атрофию (СМА), боковой амиотрофический склероз (БАС), болезнь Паркинсона, атаксию Фридрейха, болезнь Помпе, болезнь Хантингтона, болезнь Альцгеймера, болезнь Баттена, лизосомальные болезни накопления, мультиформную глиобластому, синдром Ретта, врожденный амавроз Лебера, хроническую боль, инсульт, травму спинного мозга, травматическое повреждение головного мозга и лизосомальные болезни накопления. Помимо этого rAAV также можно применять для доставки трансгенов в условиях in vivo для нетерапевтических научных исследований, таких как оптогенетика, гиперэкспрессия генов, подавление генов с помощью кшРНК или миРНК, модуляция эндогенных миРНК с использованием губок или ловушек миРНК, доставка рекомбиназы для условной делеции генов, условной (зависимой от рекомбиназы) экспрессии, или редактирование гена с помощью CRISPR, TALEN и нуклеаз с цинковыми пальцами.
[000123] Настоящее изобретение относится к способам лечения и/или предотвращения болезни Хантингтона с применением способов и композиций, описанных в настоящем документе. Способ лечения и/или предотвращения болезни Хантингтона может включать выявление субъекта (субъектов), путем обеспечения вектора для доставки полинуклеотида в нервную систему субъекта, как предусмотрено в настоящем изобретении, введение вектора в эффективной дозе субъекту, обеспечивая тем самым лечение и/или предотвращение болезни Хантингтона у субъекта. Согласно некоторым вариантам реализации настоящего изобретения способы лечения субъекта с болезнью Хантингтона включают композиции, в которых вектор доставляет полинуклеотидную композицию, содержащую белок с цинковым пальцем (ZFP), модифицированный для подавления транскрипции гена хантингтина (НТТ). Согласно некоторым вариантам реализации настоящего изобретения ZFP селективно подавляет транскрипцию аллеля гена НТТ, который вовлечен в развитие болезни Хантингтона у субъекта, посредством связывания с областью повтора CAG гена НТТ путем, который зависит от длины повтора CAG. Согласно некоторым вариантам реализации настоящего изобретения ZNFTR селективно репрессирует транскрипцию обоих аллелей гена НТТ.
[000124] Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит короткую шпилечную РНК (кшРНК) или микроРНК (миРНК), которая подавляет экспрессию хантингтина путем индукции селективной деградации молекул РНК или путем ингибирования трансляции с молекул РНК, транскрибируемых с аллеля НТТ, вызывающего заболевание, путем связывания с повтором CAG. Согласно некоторым вариантам реализации настоящего изобретения способ лечения пациентов с болезнью Хантингтона включает встраивание в геном rAVV кассеты для экспрессии миРНК, специфичной в отношении хантингтина. Такой геном затем может быть упакован в один из описанных вариантов последовательностей для доставки через сосудистую сеть.
[000125] Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит короткую шпилечную РНК (кшРНК) или микроРНК (миРНК), которая подавляет экспрессию хантингтина путем индукции деградации молекул РНК или ингибирования трансляции с молекул РНК, транскрибированных с одного или обоих аллелей гена НТТ. Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит короткую шпилечную РНК (кшРНК) или микроРНК (миРНК), которая подавляет экспрессию хантингтина путем индукции селективной деградации молекул РНК или ингибирования трансляции с молекул РНК, транскрибируемых с аллеля НТТ, вызывающего заболевание, путем селективного распознавания одного или более полиморфизмов нуклеотидов, присутствующих в аллеле, вызывающем заболевание. Нуклеотидные полиморфизмы могут быть применены специалистом в данной области техники для того чтобы отличить нормальный аллель от вызывающего заболевание аллеля.
[000126] Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит полинуклеотид, который кодирует РНК или белок, который изменяет сплайсинг или выработку РНК НТТ. Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит полинуклеотид, который кодирует одну или более полипептидаз и/или РНК для редактирования генома с использованием эффекторной нуклеазы, сходной с активатором транскрипции (TALEN), нуклеазы с цинковыми пальцами или системы коротких палиндромных повторов, регулярно расположенных группами - гена cas9 (CRISPR/Cap9), модифицированной специалистом в данной области техники для индукции разрыва одной цепи ДНК или разрыва двухцепочечной ДНК внутри или рядом с геном НТТ, чтобы вызвать изменение последовательности гена НТТ. Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит полинуклеотид, кодирующий полипептид, который связывается с полипептидом, кодируемым геном НТТ, изменяет конформацию полипептида, кодируемого геном НТТ, или изменяет сборку в агрегаты полипептида, кодируемого геном НТТ, или изменяет период полужизни полипептида, кодируемого геном НТТ. Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит полинуклеотид, который кодирует РНК или полипептид, который вызывает или предотвращает посттранскрипционную модификацию полипептида, кодируемого геном НТТ. Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит полинуклеотид, который кодирует полипептид из белка-шаперона, известного специалистам в данной области техники, для влияния на конформацию и/или стабильность полипептида, кодируемого геном НТТ.
[000127] Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит регуляторные элементы, известные специалисту в данной области техники, чтобы влиять на экспрессию РНК и/или белковых продуктов, кодируемых полинуклеотидом, в желаемых клетках субъекта.
[000128] Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для введения субъекту содержит терапевтический продукт, применимый для любого выбранного заболевания или расстройства. Согласно некоторым вариантам реализации настоящего изобретения указанный терапевтический продукт может включать композиции для лечения и/или предотвращения болезни Альцгеймера с применением способов и композиций, описанных в настоящем документе, например АроЕ2 или АроЕ3 для лечения болезни Альцгеймера; SMN для лечения СМА; доставку фратаксина для лечения атаксии Фридрейха; и/или кшРНК или миРНК для лечения БАС.
[000129] В некоторых вариантах реализации варианты согласно настоящему изобретению можно применять в качестве эффективного средства для переноса гена в сердечную мышцу. Такой перенос можно применять при исследовании и лечении многих различных заболеваний и повреждений, включая атаксию Фридрейха, сердечную недостаточность, ишемическую болезнь сердца, гипертрофию сердца, хроническую боль и повреждение периферических нервов. В некоторых вариантах реализации варианты согласно настоящему изобретению можно применять для трансдукции периферических нервов при введении через сосудистую сеть.
[000130] Согласно некоторым вариантам реализации настоящего изобретения терапевтический продукт для доставки представляет собой белок (кодирует белок) или стратегию на основе РНК для снижения агрегации синуклеина для лечения болезни Паркинсона. Например, настоящее изобретение относится к доставке полинуклеотида, который кодирует вариант синуклеина, который устойчив к агрегации, и тем самым разрушает агрегацию эндогенного синуклеина.
[000131] Согласно некоторым вариантам реализации настоящего изобретения трансген, кодирующий трофический фактор для лечения БА, БП, БАС, СМА или БХ, может представлять собой терапевтический продукт, вовлеченный в патофизиологию указанных заболеваний. Согласно некоторым вариантам реализации настоящего изобретения можно применять трофический фактор, который может включать, например, BDNF, GDNF, NGF, LIF и/или CNTF.
[000132] Дозировки вирусного вектора могут зависеть в первую очередь от таких факторов как состояние, которое лечат, возраст, масса тела и состояние здоровья пациента, и, соответственно, могут изменяться у разных пациентов. Например, терапевтически эффективная доза вирусного вектора у человека обычно находится в диапазоне от приблизительно 0,1 мл до приблизительно 100 мл раствора, содержащего концентрации от приблизительно 1×109 до 1×1016 геномов вирусного вектора. Предпочтительная доза у человека может составлять приблизительно от 1×1013 до 1×1016 геномов AAV. Доза будет скорректирована, чтобы сбалансировать терапевтическую пользу с любыми побочными эффектами, и подходящие дозы могут варьироваться в зависимости от терапевтического применения, для которого применяют рекомбинантный вектор. Уровни экспрессии трансгена можно контролировать, чтобы определить частоту дозирования для конкретного вектора.
[000133] Согласно некоторым вариантам реализации настоящего изобретения вектор также может содержать регуляторные контрольные элементы, известные специалисту в данной области техники, чтобы влиять на экспрессию РНК и/или белковых продуктов, кодируемых полинуклеотидом в желаемых клетках субъекта.
[000134] Согласно некоторым вариантам реализации настоящего изобретения, функционально, экспрессия полинуклеотида поддается, по меньшей мере частично, контролю с помощью функционально соединенных регуляторных элементов так, что элемент (элементы) модулирует транскрипцию полинуклеотида, транспорт, процессинг и стабильность РНК, кодируемой полинуклеотидом, и, при необходимости, трансляцию транскрипта. Конкретным примером элемента, контролирующего экспрессию, является промотор, который обычно расположен в 5'-направлении относительно транскрибируемой последовательности. Другим примером элемента, контролирующего экспрессию, является энхансер, который может быть расположен в направлении 5'-конца или 3'-конца относительно транскрибируемой последовательности или внутри транскрибируемой последовательности. Другим примером регуляторного элемента является последовательность распознавания для микроРНК. Другим примером регуляторного элемента является интрон, а также донорные и акцепторные последовательности сплайсинга, которые регулируют сплайсинг указанного интрона. Другим примером регуляторного элемента является сигнал терминации транскрипции и/или последовательности полиаденилирования.
[000135] Элементы, контролирующие экспрессию, и промоторы включают те, которые активны в конкретной ткани или типе клеток, называемые в настоящем документе «тканеспецифичные элементы/промоторы, контролирующие экспрессию» Тканеспецифичные элементы, контролирующие экспрессию, обычно активны в определенной клетке или ткани (например, в печени, головном мозге, центральной нервной системе, спинном мозге, глазу, сетчатке или легком). Элементы, контролирующие экспрессию, обычно активны в указанных клетках, тканях или органах, поскольку они распознаются белками активатора транскрипции или другими регуляторами транскрипции, которые являются уникальными для определенной клетки, ткани или органа.
[000136] Элементы, контролирующие экспрессию, включают также повсеместные или смешанные промоторы/энхансеры, которые способны контролировать экспрессию полинуклеотида во многих различных типах клеток. Подходящие элементы включают, но не ограничиваются ими, последовательности немедленного раннего промотора/энхансера цитомегаловируса (ЦМВ), последовательности промотора/энхансера вируса саркомы (RSV) и другие вирусные промоторы/энхансеры, активные в различных типах клеток млекопитающих; последовательности промотора/энхансера из повсеместно или смешанно экспрессируемых генов млекопитающих, включая, но не ограничиваясь ими, бета-актин, убиквитин или EF1-α; или синтетические элементы, которые не обнаруживаются в природе.
[000137] Элементы, контролирующие экспрессию, также могут обеспечивать экспрессию регулируемым способом, т.е. сигнал или стимулы увеличивают или уменьшают экспрессию функционально соединенного полинуклеотида. Регулируемый элемент, который увеличивает экспрессию функционально соединенного полинуклеотида в ответ на сигнал или стимулы, также называется «индуцируемый элемент» (т.е. он индуцируется сигналом). Конкретные примеры включают, но не ограничиваются ими, индуцируемый гормоном (например, стероидом) промотор. Регулируемый элемент, который уменьшает экспрессию функционально соединенного полинуклеотида в ответ на сигнал или стимулы, называется «подавляемый элемент» (т.е. сигнал уменьшает экспрессию так, что при удалении или отсутствии сигнала экспрессия увеличивается). Как правило, степень увеличения или уменьшения в результате действия указанных элементов, пропорциональна интенсивности присутствующих сигналов или стимулов; чем более интенсивный сигнал или стимулы, тем больше степень увеличения или уменьшения экспрессии.
[000138] Согласно некоторым вариантам реализации настоящего изобретения rAAV, содержащий капсидный белок, содержащий один или более нацеливающих пептидов, описанных в настоящем документе, можно применять для эффективной трансдукции нервной системы. В этой связи rAAV является подходящим для доставки терапевтических средств для лечения, например, болезни Хантингтона (БХ), болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза, спинальной мышечной атрофии типов I и II, атаксии Фридрейха, спиноцеребеллярной атаксии и любой из лизосомальных болезней накопления, которые поражают клетки в ЦНС, включая, но не ограничиваясь ими, болезнь Краббе, болезнь Сандхоффа, болезнь Тея-Сакса, болезнь Гоше (типа I, II или III), болезнь Ниманна-Пика (дефицит NPC1 или NPC2), синдром Гурлера, болезнь Помпе и/или болезнь Баттена.
[000139] Согласно некоторым вариантам реализации настоящего изобретения rAAV, содержащий капсидный белок, содержащий один или более нацеливающих пептидов, описанных в настоящем документе, можно применять для эффективной трансдукции сердечной мышцы, периферических нервов или любой их комбинации. Соответственно, rAAV является подходящим для доставки терапевтических средств для лечения, например, атаксии Фридрейха, сердечной недостаточности, ишемической болезни сердца, гипертрофии сердца, хронической боли и/или повреждения периферических нервов.
[000140] Согласно некоторым вариантам реализации настоящего изобретения rAAV, содержащий капсидный белок, содержащий один или более нацеливающих пептидов, описанных в настоящем документе, можно применять для доставки генов в конкретные типы клеток в целевом окружении субъекта. Например, rAAV можно применять для доставки генов в нейроны и глию в нервной системе (включая ПНС, ЦНС или обе системы) субъекта (например, млекопитающего). Нацеливающий пептид может представлять собой, например, AAV-PHP.N (SEQ ID NO: 46). Композиции и способы, описанные в настоящем документе, можно применять, например, (i) при снижении экспрессии мутированного хантингтина у пациентов с болезнью Хантингтона путем, например, встраивания кассеты для экспрессии мРНК, специфичной в отношении хантингтина, в геном rAAV и упаковки генома rAAV в вариант rAAV (например, AAV-PHP.N) для доставки через, например, сосудистую сеть, (ii) при доставке функциональной копии гена фратаксина пациентам с атаксией Фридрейха, (iii) при восстановлении экспрессии фермента, существенного для нормальной функции лизосом у пациентов, лишенных экспрессии фермента вследствие генетической мутации (например, пациентов с болезнью Ниманна-Пика, мукополисахаридозом типа III и/или болезнью Гоше), (iv) при использовании rAAV (например, AAV-PHP.N) для получения моделей заболевания у животных или их комбинации.
Фармацевтические композиции и способы введения
[000141] Настоящее изобретение также относится к фармацевтическим композициям, содержащим один или более из rAAV, описанных в настоящем документе, и один или более фармацевтически приемлемых носителей. Композиции также могут содержать дополнительные ингредиенты, такие как разбавители, стабилизаторы, вспомогательные вещества и адъюванты. В настоящем документе «фармацевтически приемлемые» носители, вспомогательные вещества, разбавители, адъюванты или стабилизаторы являются нетоксичными (предпочтительно инертными) по отношению к клетке или субъекту, который подвергся их воздействию, в применяемых дозах и концентрациях, или которые имеют приемлемый уровень токсичности, определенный специалистами в данной области техники.
[000142] Носители, разбавители и адъюванты могут включать буферы, такие как фосфат, цитрат или другие органические кислоты; антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные полипептиды (например, содержащие менее 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как твин™, плюроновые кислоты™ или полиэтиленгликоль (ПЭГ). Согласно некоторым вариантам реализации настоящего изобретения физиологически приемлемый носитель представляет собой водный раствор с контролируемым рН.
[000143] Титры rAAV для введения будут варьироваться в зависимости, например, от конкретного rAAV, способа введения, цели лечения, индивидуума и типа (типов) клетки-мишени, и могут быть определены с помощью способов, стандартных в данной области техники.
[000144] Специалист в данной области техники поймет, что доза рекомбинантного вируса для введения, которую можно применять в условиях in vivo, и конкретный способ введения будут изменяться в зависимости от возраста, массы тела, степени тяжести недуга и вида животного, которое лечат, конкретного рекомбинантного вируса, экспрессирующего белок, представляющий интерес, конкретного использованного рекомбинантного вируса, экспрессирующего представляющий интерес белок, а также конкретного способа применения, в котором применяют рекомбинантный вирус. Определение эффективных уровней доз, т.е. уровней доз, необходимых для достижения желаемого результата, может быть выполнено специалистом в данной области техники с использованием стандартных фармакологических способов. Как правило, клиническое применение продуктов у человека начинают с более низких доз, при этом уровень доз увеличивают до момента достижения желаемого действия. В другом варианте, приемлемые исследования в условиях in vitro можно применять для установления подходящих доз и путей введения композиций, выявленных с помощью способов согласно настоящему изобретению, с использованием общепринятых фармакологических способов.
[000145] Несмотря на то, что точная доза будет определена в зависимости от конкретного лекарственного препарата, в большинстве случаев могут быть сделаны некоторые обобщения, касающиеся дозировки. Согласно некоторым вариантам реализации настоящего изобретения rAAV для доставки нуклеиновой кислоты в нервную систему (например, ЦНС) субъекта можно вводить субъекту, например, путем инъекции, в дозе от 1×1010 копий генома (к.г.) рекомбинантного вируса на кг массы тела субъекта до 2×1014 копий генома на кг, например, от 5×1011 копий генома/кг до 5×1012 копий генома/кг. Согласно некоторым вариантам реализации настоящего изобретения доза rAAV, введенная субъекту, не превышает 2×1014 копий генома/кг. Согласно некоторым вариантам реализации настоящего изобретения доза rAAV, введенная субъекту, не превышает 5×1012 копий генома/кг. Согласно некоторым вариантам реализации настоящего изобретения доза rAAV, введенная субъекту, не превышает 5×1011 копий генома/кг.
[000146] Рекомбинантные вирусы, описанные в настоящем документе, могут быть введены субъекту (например, человеку), нуждающемуся в этом. Путь введения не ограничен конкретными путями. Например, терапевтически эффективное количество рекомбинантных вирусов может быть введено субъекту посредством путей, стандартных в данной области техники. Неограничивающие примеры пути включают внутримышечный, внутривагинальный, внутривенный, внутрибрюшинный, подкожный, надкожный, внутрикожный, ректальный, внутриглазной, легочной, внутричерепной, внутрикостный, пероральный, буккальный, системный или назальный путь введения. Согласно некоторым вариантам реализации настоящего изобретения рекомбинантный вирус вводят субъекту посредством системной трансдукции. Согласно некоторым вариантам реализации настоящего изобретения рекомбинантный вирус вводят субъекту путем внутримышечной инъекции. Согласно некоторым вариантам реализации настоящего изобретения рекомбинантный вирус вводят субъекту путем интравагинальной инъекции. Согласно некоторым вариантам реализации настоящего изобретения rAAV вводят субъекту парентеральным путем (например, путем внутривенной, внутримышечной или подкожной инъекции), путем поверхностной скарификации или путем инокуляции в полость тела субъекта. Путь (пути) введения и серотип (серотипы) компонентов AAV в rAAV могут быть легко определены специалистом в данной области техники с учетом инфекции и/или патологического состояния, которое лечат, и целевых клеток/ткани (тканей), которые должны экспрессировать представляющий интерес белок. Согласно некоторым вариантам реализации настоящего изобретения введение rAAV посредством внутривенной инъекции может быть предпочтительным.
[000147] Фактическое введение rAAV может быть достигнуто с помощью любого физического способа, который будет транспортировать rAAV в ткань-мишень субъекта. Например, rAAV может быть введен внутривенно. Как описано в настоящем документе, капсидные белки rAAV могут быть модифицированы так, что rAAV нацелен к конкретному целевому окружению, представляющему интерес, такому как центральная нервная система, и для повышения тропизма в отношении целевого окружения, которое представляет интерес (например, тропизма в отношении ЦНС). Согласно некоторым вариантам реализации настоящего изобретения rAAV доставляет нуклеиновую кислоту в сердце, периферические нервы или их комбинацию. Фармацевтические композиции могут быть получены, например, в виде составов для инъекций.
[000148] Рекомбинантный вирус для применения может быть использован в жидкой или лиофилизированной форме (в комбинации с одним или более подходящими консервантами и/или защитными агентами для защиты вируса в процессе лиофилизации). Для генной терапии (например, неврологических расстройств, которые могут быть облегчены с помощью специфичного генного продукта) терапевтический эффективную дозу рекомбинантного вируса, экспрессирующего терапевтический белок, вводят хозяину, нуждающемуся в таком лечении. Применение рекомбинантного вируса, описанного в настоящем документе, при изготовлении лекарственного средства для индукции иммунитета у хозяина или обеспечения генной терапии хозяину включено в объем настоящей заявки.
[000149] В тех случаях, когда дозы rAAV у человека были установлены для по меньшей мере некоторых состояний, могут быть использованы те же дозы, или дозы, которые находятся в диапазоне от приблизительно 0,1% до 500%, более предпочтительно от приблизительно 25% до 250% от установленной дозы у человека. В тех случаях, когда доза у человека не установлена, как в случае недавно обнаруженных фармацевтических композиций, подходящая доза у человека может быть определена на оснований значений ЭД50 или ИД50 или других подходящих значений, полученных из исследований в условиях in vitro или в условиях in vivo, согласно результатам исследований токсичности и исследований эффективности у животных.
[000150] Терапевтически эффективное количество rAAV может быть введено субъекту в различных временных точках. Например, rAAV может быть введен субъекту до, во время или после возникновения у субъекта заболевания или расстройства. rAAV также может быть введен субъекту до, во время или после возникновения заболевания или расстройства (например, болезни Хантингтона (БХ), болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза, спинальной мышечной атрофии типа I и II, атаксии Фридрейха, спиноцеребеллярной атаксии и любых лизосомальных болезней накопления, которые поражают клетки в ЦНС, включая, но не ограничивается ими, болезнь Краббе, болезнь Санхоффа, болезнь Тея-Сакса, болезнь Гоше (типа I, II или III), болезнь Ниманна-Пика (дефицит NPC1 или NPC2), синдром Гурлера, болезнь Помпе, болезнь Баттена или любую их комбинацию), хронической боли, сердечной недостаточности, сердечных аритмий или их комбинации. Согласно некоторым вариантам реализации настоящего изобретения rAAV вводят субъекту во время ремиссии заболевания или расстройства. Согласно некоторым вариантам реализации настоящего изобретения rAAV вводят до начала заболевания или расстройства у субъекта. Согласно некоторым вариантам реализации настоящего изобретения rAAV вводят субъекту, подверженному риску развития заболевания или расстройства.
[000151] Частота дозирования rAAV может варьироваться. Например, rAAV можно вводить субъекту приблизительно один раз каждую неделю, приблизительно один раз каждые две недели, приблизительно один раз каждый месяц, приблизительно один раз каждые шесть месяцев, приблизительно один раз каждый год, приблизительно один раз каждые два года, приблизительно один раз каждые три года, приблизительно один раз каждые четыре года, приблизительно один раз каждые пять лет, приблизительно один раз каждые шесть лет, приблизительно один раз каждые семь лет, приблизительно один раз каждые восемь лет, приблизительно один раз каждые девять лет, приблизительно один раз каждые десять лет или приблизительно один раз каждые пятнадцать лет. Согласно некоторым вариантам реализации настоящего изобретения rAAV вводят субъекту не чаще приблизительно одного раза каждую неделю, не чаще приблизительно одного раза каждые две недели, не чаще приблизительно одного раза каждый месяц, не чаще приблизительно одного раза каждые шесть месяцев, не чаще приблизительно одного раза каждый год, не чаще приблизительно одного раза каждые два года, не чаще приблизительно одного раза каждые три года, не чаще приблизительно одного раза каждые четыре года, не чаще приблизительно одного раза каждые пять лет, не чаще приблизительно одного раза каждые шесть лет, не чаще приблизительно одного раза каждые семь лет, не чаще приблизительно одного раза каждые восемь лет, не чаще приблизительно одного раза каждые девять лет, не чаще приблизительно одного раза каждые десять лет или не чаще приблизительно одного раза каждые пятнадцать лет.
ПРИМЕРЫ
[000152] Некоторые аспекты вариантов реализации, описанных выше, описаны более подробно в следующих примерах, которые не предназначены для ограничения объема настоящего изобретения каким-либо образом.
Пример 1
Разработка AAV-PHP.B для создания вариантов
[000153] Для разработки вариантов AAV-PHP.B, которые обеспечивают более эффективную трансдукцию ЦНС и более селективную трансдукцию нейронов, 7-членную последовательность AAV-PHP.B (SEQ ID NO: 40), описанную в публикации патента США 2015/0079038 (содержание которого полностью включено в настоящий документ посредством ссылки), частично рандомизировали путем замены с перекрыванием 3 аминокислот 7-членной последовательности и 2 аминокислот, фланкирующих 7-членную последовательность, случайными аминокислотами. Обзор данной стратегии разработки AAV-PHP.B представлен на ФИГ. 1 (X представляет собой одну из 20 стандартных аминокислот).
AAV-PHP.N
[000154] После двух раундов отбора было установлено, что многочисленные варианты обогащены в последовательностях, выделенных из одной или более из линий Cre. Одну из указанных последовательностей, AAV-PHP.N (DGTLAVPFKAQ (SEQ ID NO: 4)), отбирали для характеристики в качестве индивидуального варианта.
[000155] Последовательность DGTLAVPFKAQ представляла 8,1% от общего количества последовательностей, выделенных у мышей Vgat-IRES-Cre, 4,4% от общего количества последовательностей, выделенных у мышей Vglut2-IRES-Cre, 0% от общего количества последовательностей, выделенных у мышей GFAP-Cre, и 0% от общего количества последовательностей, выделенных из печени (выделение, не зависящее от Cre). Исходя из полученных данных, полагали, что DGTLAVPFKAQ (SEQ ID NO: 4) будет более эффективной при селективной трансдукции нейронов по сравнению с астроцитами. Аминокислотную последовательность DGTLAVPFKAQ (SEQ ID NO: 4) независимо отбирали из 2 различных нуклеотидных последовательностей: (i) , (ii) . Обе последовательности с консенсусной последовательностью D/E S/G-TLAVPFK (SEQ ID NO: 40) составляли 18,9% от общего количества последовательностей, выделенных у мышей Vgat-IRES-Cre, 15,6% от общего количества последовательностей, выделенных у мышей Vglut2-IRES-Cre, 8,3% от общего количества последовательностей, выделенных у мышей GFAP-Cre, и 0% от общего количества последовательностей, выделенных из печени (выделение, не зависящее от Cre) после двух раундов отбора.
[000156] Данные для AAV-PHP.N (DGTLAVPFKAQ (SEQ ID NO: 4)) представлены на ФИГ. 2. Идентификация капсида, содержащего последовательность AAV-PHP.N (SEQ ID NO: 46), была возможной за счет применения способа CREATE, описанного в настоящем документе, чтобы одновременно выполнять отборы в нескольких линиях трансгенных мышей, несущих рекомбиназу Cre. В совокупности полученные результаты, свидетельствующие о том, что (i) последовательность AAV-PHP.N (SEQ ID NO: 46) селективно выделяли из нейронов ЦНС, но не из астроцитов ЦНС или печени, и (ii) капсид AAV-PHP.N обеспечивал селективное усиление трансдукции нейронов, но не глии и клеток печени (по сравнению с AAV-PHP.B), указывают на полезность осуществления отборов в нескольких типах клеток в условиях in vivo для разработки новых векторов с более желательными характеристиками трансдукции.
AAV-PHP.S
[000157] Вариант AAV-PHP.S (SEQ ID NO: 47) обнаружили путем отбора капсидов AAV, которые обеспечивали более эффективное нацеливание к GFAP-клеткам, экспрессирующим Cre. Вариант идентифицировали из библиотеки, в которой 7АА (7-членная последовательность) рандомизированной последовательности вставляли между аминокислотами 588-589 капсидного белка (нумерация VP1). AAV-PHP.S содержал 7-членную последовательность QAVRTSL (SEQ ID NO: 37), кодируемую последовательностью нуклеиновой кислоты .
[000158] AAV9 является основным вектором-кандидатом для переноса генов в сердечную мышцу, а также обеспечивает трансдукцию периферических нервов при введении через сосудистую систему. Данные, представленные на ФИГ. 3A-3D, указывают на то, что системно доставленный AAV-PHP.S (SEQ ID NO: 47) обеспечивал значительно более высокую экспрессию в сердце и сенсорных нервах, чем AAV9 (SEQ ID NO: 45), не содержащий нацеливающий пептид AAV-PHP.S.
Пример 2
Выделение новых последовательностей капсидного белка AAV с помощью нацеленной эволюции AAV на основе Cre-рекомбинации (CREATE)
[000159] Направленную эволюцию применяли для получения AAV, которые уклоняются от нейтрализующих антител (Maheshri et al 2006) и более эффективно нацелены к клеткам глиомы (McGuire et al. 2010), эпителию дыхательных путей (Excoffon et al. 2009) и фоторецепторам в сетчатке после интравитреальной инъекции (Dalkara et al 2013). Помимо этого, с помощью химерной модели печени человека/мыши Lisowski et al. разработали rAAV, который специфично и эффективно нацелен к гепатоцитам человека (2013). Согласно некоторым вариантам реализации, описанным в настоящем документе, предложены способы обогащения и селективного выделения последовательностей с желаемыми признаками из библиотек вариантов последовательностей с помощью стратегии выделения, зависящей от рекомбинации.
[000160] Один из подходов, который применяли для разработки rAAV с улучшенным нацеливанием к типу ткани/клетки, заключался в осуществлении направленной эволюции гена капсида AAV. Как правило, это осуществляют путем создания библиотеки компетентных по репликации AAV, которые модифицируют для введения случайных мутаций в ген cap AAV, который кодирует капсидные белки, определяющие тканевой тропизм. Затем библиотеку капсидов вируса AAV вводят животному или доставляют в клетки в культуре. Спустя определенный период времени выделяют капсидные последовательности, которые присутствуют в клетках/тканях, представляющих интерес. Полученные выделенные последовательности затем применяют для создания нового пула вирусов, и затем процесс повторяют. С помощью повторных раундов отбора/выделения последовательностей, те последовательности, которые обеспечивают капсиды с более предпочтительными функциями (т.е. те, которые многократно проходят процесс отбора), будут обогащены. Капсиды, которые проявляют улучшенную способность к трансдукции мишени, затем могут быть выделены и оценены как индивидуальные клоны или дополнительно мутированы и подвергнуты дополнительным раундам отбора.
[000161] В данном примере описаны способы и материалы, использованные в стратегии отбора, называемой нацеленной эволюцией AAV, основанной на Cre-рекомбинации (CREATE), которая позволяет разрабатывать капсиды AAV, которые более эффективно трансдуцируют определенные Cre-экспрессирующие популяции клеток в условиях in vivo. Как описано в настоящем документе, CREATE применяли для получения вариантов AAV, которые эффективно и повсеместно трансдуцируют центральную нервную систему (ЦНС) взрослых мышей после внутривенного введения. Варианты, полученные с помощью указанного способа, могут переносить гены во всей ЦНС с эффективностью, которая иногда в 40 раз превышает эффективность действующего стандарта, AAV914-17, и могут трансдуцировать большую часть астроцитов и нейронов в нескольких областях ЦНС. При применении в условиях in vivo варианты могут трансдуцировать нейроны и астроциты человека более эффективно, чем AAV9, это свидетельствует о способности CREATE обеспечивать получение оптимизированных AAV-векторов для вариантов биомедицинского применения.
Экспериментальные материалы и методы
Способ модификации плазмиды, несущей геном rAAV-Cap-in-cis-lox
[000162] Плазмида, несущая геном rAAV-Cap-in-cis-lox, содержит три основных элемента, фланкированных ITR AAV2: (i) кассету экспрессии mCherry, которая состоит из фрагмента, содержащего 398 п.н., из гена UBC человека, который расположен в 5'-направлении относительно кДНК mCherry, за которой расположена синтетическая последовательность полиаденилирования SV40; (ii) ген капсида AAV9 и регуляторные последовательности, которые состоят из последовательности промотора р41 AAV5 (1680-1974 GenBank AF085716.1) и последовательностей сплайсинга, взятых из гена rep AAV2; и (iii) Cre-зависимый переключатель, который состоит из последовательности полиаденилирования SV40 (рА), фланкированной инвертированными участками lox71 и lox66. Плазмиду, несущую геном rAAV-Cap-in-cis-lox, дополнительно модифицировали для введения двух уникальных сайтов рестрикции, XbaI и AgeI, в пределах последовательности капсида. Эти сайты фланкировали область (АА450-592), которую заменяли фрагментом рандомизированной библиотеки. Вставка сайта XbaI вводила мутацию K449R, которая не оказывала явного влияния на выработку или трансдукцию вектора. Мутации, необходимые для вставки сайта AgeI, являются молчащими. В случае акцепторной плазмиды rAAV-ΔCap-in-cis, использованной для клонирования библиотеки капсидов, удаляли кодирующую область между сайтами XbaI и AgeI, чтобы предотвратить выработку вируса из акцепторной плазмиды, не содержащей фрагмент библиотеки.
[000163] В качестве матрицы для фрагмента библиотеки область, охватывающую сайты XbaI и AgeI модифицированного AAV9, амплифицировали с помощью ПЦР. Указанную последовательность модифицировали для удаления уникального сайта рестрикции EarI и вставки уникального сайта KpnI (обе мутации являются молчащими) для создания фрагмента хЕ. Модифицированный фрагмент хЕ клонировали с помощью ТА-стратегии в pCRII (Life Technologies) для получения pCRII-9Cap-xE. Устранение сайта EarI обеспечило второй способ, который можно применять, если необходимо, для селективного расщепления загрязняющих капсидных последовательностей (AAV9), выделенных с помощью ПЦР, без расщепления последовательностей, полученных из библиотеки. Использование акцептора rAAV-ΔCap-in-cis для клонирования библиотек и принятие стандартных мер предосторожности для ПЦР (например, УФ-обработка реагентов и пипеток) в достаточной степени предотвращало загрязнение.
[000164] Вспомогательную плазмиду AAV2/9 REP-ААР конструировали путем введения пяти стоп-кодонов в кодирующую последовательность открытой рамки считывания гена VP AAV9 в положениях аминокислот VP1: 6, 10, 142, 148 и 216. Стоп-кодон в АА216 был сконструирован так, чтобы не нарушить кодирующую последовательность белка ААР, которая кодируется альтернативной открытой рамкой считывания.
[000165] В данном исследовании использовали несколько геномов rAAV. Каждый из геномов конструировали с использованием одноцепочечного (оц) генома rAAV с использованием репортера, контролируемого повсеместным гибридным промотором ЦМВ-β-актин-интрон-β-глобин (CAG). Для упрощения описания векторов в тексте были сокращены. ssAAV-CAG-GFP относится к ssAAV-CAG-eGFP-2A-Luc-WPRE-SV40 polyA. ssAAV-CAG-NLS-GFP относится к ssAAV-CAG-NLSGFP-WPRE-SV40 polyA, который конструировали путем вставки последовательности ядерной локализации PKKKRKV на N-конце и С-конце GFP. ssAAV-CAG-mNeGreen-f относится к ssAAV-CAGmNeonGreen-f-WPRE с сигналом полиаденилирования гормона роста человека. mNeonGreen модифицировали с использованием последовательности, нацеливающей к мембране (сигналы фарнезилирования и пальмитоилирования), из c-Ha-Ras.
Способ получения библиотеки капсидов
[000166] Случайный 7-членный фрагмент библиотеки (вставленный между аминокислотами 588 и 589) получали с помощью ПЦР с использованием ДНК- полимеразы Q5 Hot Start High-Fidelity (NEB; M0493), праймеров XF и 7xMNN и pCRII-9Cap-xE в качестве матрицы. Схемы, на которых представлены примерные сайты связывания праймеров, приведены на ФИГ. 8А-8В, и последовательности праймеров приведены в таблице 1. Для получения библиотеки на основе rAAV продукты ПЦР, содержащие библиотеку, и акцепторную плазмиду rAAV-ΔCap-in-cis, расщепленную XbaI и AgeI, собирали с использованием сборки по Гибсону (NEB; Е2611). Затем продукты реакции обрабатывали ДНКазой Plasmid Safe (PS) (Epicenter; E3105K) для расщепления любых несобранных фрагментов и очищали с использованием набора для очистки продуктов ПЦР QIAquick PCR Purification Kit (Qiagen). Выход данной реакции, как правило, составлял более 100 нг собранной плазмиды (определенный по количеству ДНК, оставшемуся после расщепления ДНКазой PS). 100 нг достаточно для трансфекции десяти 150 мм чашек для культивирования ткани при концентрации 10 нг/чашку. Следует отметить, что библиотеки также могут быть сконструированы путем лигирования или сборки по Гибсону, и затем амплифицированы в Е. coli, однако бактериальная трансформация уменьшает разнообразие библиотек. При непосредственной трансфекции собранных продуктов реакции разнообразие библиотек ограничено количеством успешно трансфецированных клеток-продуцентов HEK293.
Способы получения и очистки вирусов
[000167] Рекомбинантные AAV получали с помощью тройной трансфекции клеток 293Т (АТСС) с использованием полиэтиленимина (PEI). Вирусные частицы собирали из среды через 72 часа после трансфекции и через 120 часов из клеток и среды. Клеточные осадки ресуспендировали в 10 мМ Трис с 2 мМ MgCl2, рН=8, замораживали-размораживали три раза и обрабатывали 100 Ед./мл бензоназы (Epicentre) при 37°С в течение по меньшей мере 1 часа. Вирусные среды концентрировали путем осаждения с помощью 8% полиэтиленгликоля 8000 (Sigma-Aldrich) с 500 мМ хлорида натрия, ресуспендировали в трис-MgCl2 и затем добавляли к лизатам. Затем объединенные исходные суспензии корректировали 500 мМ NaCl, инкубировали при 37°С в течение 30 минут и осветляли центрифугированием при 2000 g. Далее осветленные исходные суспензии очищали с использованием ступенчатых градиентов йодиксанола (Optiprep, Sigma, D1556), (15%, 25%, 40% и 60%). Вирусы концентрировали и готовили в забуференном фосфатом физиологическом растворе (ФСБ). Титры вируса определяли путем измерения количества резистентных к ДНКазе вирусных геномов с помощью кПЦР, используя линеаризованную геномную плазмиду в качестве стандарта.
[000168] Для получения библиотеки вирусных капсидов две модификации вносили в вышеупомянутый протокол получения вируса, чтобы снизить выработку мозаичных капсидов, которые могут возникать вследствие присутствия множества последовательностей капсида в одной и той же клетке. Во-первых, для того чтобы увеличить вероятность того, что большинство трансфецированных клеток получили только один вариант последовательности капсида трансфецировали только 10 нг плазмиды, несущей библиотеку rAAV-Cap-in-cis (на 150 мм чашку). Во-вторых, вирус собирали через 48 часов (среды) и 60 часов (клетки и среды), а не через 72 часа и 120 часов, как описано выше, чтобы уменьшить до минимума вторичную трансдукцию клеток-продуцентов rAAV, несущим библиотеку, который высвобождается в среду.
Животные
[000169] Мышей линии GFAP-Cre, экспрессирующих Cre под контролем промотора GFAP мыши (012886), и мышей линии C57BL/6J (000664) приобрели в Jackson Laboratory (JAX). Внутривенное введение rAAV-векторов осуществляли путем инъекции вируса в ретроорбитальный синус. Мышей случайным образом распределяли в группы с заданным размером выборки. Данные ни одной из мышей не были исключены из анализов. Экспериментаторы были осведомлены о распределении мышей по группам выборок.
Отбор в условиях in vivo
[000170] Для проведения отборов у мышей GFAP-Cre по 1×1011 в.г. библиотек капсидов вводили внутривенно взрослым Cre+ мышам обоего пола. Через 7-8 дней после инъекции мышей подвергали эвтаназии и собирали головной мозг и спинной мозг. Векторную ДНК выделяли из одного полушария головного мозга и половины спинного мозга с использованием 4-5 мл Trizol (Life Technologies, 15596). Для очистки вирусной ДНК верхнюю водную фракцию собирали в соответствии с протоколом экстракции производителя. Было установлено, что водная фракция содержит значительную часть геномов вирусной ДНК, а также РНК. РНК затем расщепляли путем обработки 1 мкл РНКазы A (Qiagen) при 37°С в течение ночи. Затем для селективного выделения последовательностей Cap из Cre-рекомбинированных геномов использовали двухступенчатую стратегию амплификации с помощью ПЦР. Первый этап амплификации обеспечивал преимущественную амплификацию Cre-рекомбинированных последовательностей rAAV-Cap-in-cis-lox с использованием праймеров 9CapF и CDF (см. ФИГ. 8А-8В). ПЦР проводили в течение 20-26 циклов при 95°С в течение 20 с, 60°С в течение 20 секунд и 72°С в течение 30 с с использованием ДНК-полимеразы Q5 Hot Start High-Fidelity. Продукт ПЦР затем разбавляли в соотношении 1:10 или 1:100 и использовали в качестве матрицы для второй Cre-независимой реакции ПЦР с использованием праймеров XF и AR (ФИГ. 8А-8В и таблица 2). Второй этап ПЦР позволил получить фрагмент, который клонировали обратно в акцепторную плазмиду rAAV-ΔCap-in-cis, как описано выше. По 1 мкл реакционных продуктов сборки по Гибсону затем разбавляли в соотношении 1:10 и трансформировали в компетентные клетки SURE2 (Agilent, 200152) для получения индивидуальных клонов для секвенирования.
[000171] Варианты, которые проявили признаки обогащения, клонировали в плазмиду AAV Rep-Cap и трансформировали в компетентные клетки DH5α (NEB). Новые варианты AAV Rep-Сар или AAV2/9 Rep-Cap в качестве контроля затем оценивали с помощью одного из репортерных геномов, описанных выше.
Биораспределение вектора
[000172] Самкам мышей C57BL/6 в возрасте 6 недель внутривенно вводили 1×1011 в.г. вектора ssAAV-CAG-GFP, упакованного в указанный капсид AAV. Животных случайным образом распределяли в группы. Через 25 дней после инъекции мышей подвергали эвтаназии, и ткани указанных областей мозга собирали и замораживали при -80°С.ДНК выделяли из образцов ткани с использованием набора DNeasy Blood and Tissue (Qiagen). Векторные геномы детектировали с использованием праймеров для ПЦР, которые связываются с элементом WPRE, и нормировали к геномам мыши с использованием праймеров, специфичных для гена глюкагона мыши. Определение абсолютного количества проводили с использованием серийных разведений линеаризованных стандартных плазмид с известной концентрацией46. Данные одного случайно выбранного животного, которому вводили AAV-PHP.B путем инъекции, удаляли из гистологического анализа в исследовании биораспределения.
Получение образцов ткани, иммуногистохимические исследования и визуализация
[000173] Мышей анестезировали с использованием нембутала и транскардиально перфузировали с использованием 0,1 М фосфатного буфера (ФБ) при комнатной температуре (RT) при рН=7,4, и затем свежеприготовленным ледяным 4% параформальдегидом (ПФА) в ФБ. Головной мозг животных фиксировали в 4% ПФА в течение ночи и затем нарезали на срезы с помощью вибратома или обрабатывали криопротектором и нарезали на срезы с помощью криостата. ИГХ-исследование проводили на плавающих срезах с использованием первичных и вторичных антител в ФСБ, содержащем 10% сыворотки козы или осла и 0,5% тритона Х-100 (детергент не использовали для окрашивания GAD67). Использованные первичные антитела включали мышиное антитело к капсиду AAV (1:20, American Research Products, 03-65158, клон B1), кроличье антитело к GFP (1:1000, Invitrogen, A11122), куриное антитело к GFP (1:1000, Abcam, ab13970), мышиное антитело к СС1 (1:200, Calbiochem, ОР80), кроличье антитело к GFAP (1:1000, Dako, Z0334), мышиное антитело к NeuN (1:500, Millipore, МАВ377), кроличье антитело к IbaI (1:500, Biocare Medical, СР290), мышиное антитело к кальбиндину, D28K (1:200, Sigma, СВ-955), кроличье антитело к кальретинину (1:1000, Chemicon, АВ5054), мышиное антитело к GAD67 (1:1000, Millipore, МАВ5406), антитело морской свинки к МАР2 (1:1000, Synaptic Systems, 188004), мышиное антитело к парвальбумину (1:1000, Sigma), антитело к тирозингидроксилазе (1:1000, Aves) и кроличье антитело к CD31 (1:50, Abcam, ab28364). Инкубации первичных антител осуществляли в течение 16-24 часов при комнатной температуре. Срезы затем промывали и инкубировали с вторичными антителами, конъюгированными с Alexa (1:1000, Invitrogen), в течение 2-16 часов. Для детектирования капсида с использованием антитела B1, которое распознает внутренний эпитоп, плавающие срезы обрабатывали 2 М HCl в течение 15 минут при 37°С и затем интенсивно промывали ФСБ перед инкубацией с первичным антителом. Для получения некоторых изображений гамму 16-битного зеленого канала (GFP) корректировали, чтобы визуализировать (без перенасыщения) клетки, экспрессирующие GFP как с низкими уровнями, так и с высокими уровнями, присутствующие в одном поле зрения. Во всех случаях изменения гаммы или контраста, а также настроек микроскопа и лазера оставались одинаковыми для серий изображений. Изображения получали с помощью конфокального микроскопа Zeiss LSM 780, оснащенного следующими объективами: Fluar 5×/0,25 М27 Plan-Apochromat 10×/0,45 М27 (рабочее расстояние 2,0 мм), Plan-Apochromat 25×/0,8 Imm Corr DIC М27 для различных иммерсионных сред и LD CApochromat 40×/1,1 W Korr и масляно-иммерсионным объективом Plan-Apochromat 100×/1,46 DIC. Трехмерные MIP-изображения и дополнительные фильмы создавали с помощью Imaris (Bitplane).
Количественная оценка трансдукции, специфичной в отношении типа клеток
[000174] Самок мышей в возрасте 6 недель случайным образом распределяли в группы и внутривенно вводили 2×1012 в.г. ssAAV-CAG-NLS-GFP, упакованного в AAV9, AAV-PHP.B или AAV-PHP.A. Через три недели мышей перфузировали, и головной мозг обрабатывали и окрашивали иммунными агентами против указанного антигена, как описано выше. Количество животных на группу было установлено заранее; данные ни одного из животных не были исключены из анализа. Получали конфокальные одноплоскостные изображения специфичного для типа клеток иммунного окрашивания и нативной флуоресценции NLS-GFP. Чтобы предотвратить систематические ошибки оценки, изображения получали из указанных согласованных областей, идентифицированных путем просмотра только канала иммунного окрашивания, специфичного в отношении типа клеток, а не экспрессии GFP, до получения изображения. Аналогичным образом, подсчет клеток выполняли сначала путем подсчета и маркировки каждой клетки, окрашенной антигеном, специфичным для клетки, просматривая канал ИГХ. Затем подсчитывали те меченые ИГХ+ клетки, которые проявляли наивную флуоресценцию GFP. Вследствие резких различий эффективности трансдукции для различных капсидов подсчет осуществляли без маскировки группы животных.
Просветление тканей
[000175] Мышей перфузировали, как описано выше, с использованием 60-80 мл ледяного 4% ПФА в ФБ при скорости потока 14 мл/мин. Скорость потока затем уменьшали до 2-3 мл/мин и продолжали в течение 2 часов при комнатной температуре. Затем мышей помещали в отдельные оптимизированные камеры и перфузировали с использованием 200 мл рециркулирующего 4% акриламида в ФБ со скоростью 2-3 мл/мин при комнатной температуре в течение ночи с последующим двухчасовым перфузионным промыванием с использованием ФБ для удаления остаточных полимеров/мономеров из сосудистой сети. Процесс полимеризации инициировали путем помещения камер в водяную баню с температурой 42°С с последующей перфузией (2-3 мл/мин) 200 мл рециркулирующего дегазированного ФБ, содержащего 0,25% инициатора полимеризации VA-044, в течение 2-4 часов. Затем мышей перфузировали 8% ДСН в ФБ, рН=7,5 в течение 7 дней. Раствор, содержащий ДСН, обновляли два раза в течение 7 дней, и затем промывали путем перфузии с использованием 2 л нерециркулирующего ФБ в течение ночи. Просветленные образцы тканей закрепляли в растворе RIMS (показатель преломления 1,46) для визуализации.
Получение кортикальных сфероидов из иПСК человека
[000176] Кортикальные сфероиды человека получали из иПСК, как описано ранее. В общих чертах, линии иПСК, полученные от двух здоровых контрольных индивидуумов, размножали на поддерживающих слоях инактивированных эмбриональных фибробластов мыши в следующей среде: DMEM/F12, Knockout Serum™ 20%, 1 мМ незаменимых аминокислот (1:100), GlutaMax™ (1:200), β-меркаптоэтанол (0,1 мМ), пенициллин и стрептомицин (1:100) (Life Technologies). Культуры регулярно проверяли и поддерживали без микоплазмы. Колонии иПСК отделяли от подложки без повреждения с помощью диспазы (0,35 мг/мл, Invitrogen) и переносили в планшеты с низкой степенью прикрепления в среду для иПСК, дополненную дорсоморфином (5 мкМ, Sigma) и SB-431542 (10 мкМ, Tocris), среду заменяли ежедневно. На шестой день дифференцировки в условиях in vitro нейронные сфероиды переносили в среду NPC (Neurobasal А, В27 без витамина A, GlutaMax (1:100), пенициллин и стрептомицин, Life Technologies), которая была дополнена EGF (20 нг/мл) и FGF2 (20 нг/мл), и культивировали до 24 дня, и затем добавляли BDNF (20 нг/мл) и NT3 (20 нг/мл) с 25 дня по 42 день. С 43 дня и далее кортикальные сфероиды поддерживали в среде NPC, которую заменяли каждые 4 дня.
Диссоциация и вирусная инфекция кортикальных сфероидов
[000177] Для ферментативной диссоциации и культивирования в монослое кортикальные сфероиды на 170-200 день дифференцировки в условиях in vitro (две независимые нейронные дифференцировки одной линии иПСК от одного человека и одна дифференцировка линии иПСК от другого индивидуума) инкубировали с аккутазой (Innovative Cell Technologies) в течение 25 мин при 37°С, промывали три раза средами NPC и осторожно размельчали пипеткой Р-200. Клетки высевали на покрытые полиорнитином и ламинином стеклянные покровные стекла (15 мм) в плотности ~300000 клеток/лунку и поддерживали в среде NPC, дополненной BDNF (20 нг/мл) и NT3 (20 нг/мл), в течение первых 24 часов, и затем поддерживали в средах NPC без факторов роста.
[000178] Культуры, выращенные на покровных стеклах, инфицировали каждым из вирусов при титре 1×109 в.г./лунку и фиксировали через 5 дней с помощью 4% параформальдегида (ПФА) в течение 10 мин. Для иммуноцитохимического исследования клетки пермеабилизировали 0,2% тритоном Х-100 в течение 10 мин и блокировали 10% козьей сывороткой в ФСБ в течение 1 часа. Затем покровные стекла инкубировали с антителами, разведенными в блокирующем растворе, в течение 2 часов. Ядра визуализировали с помощью Hoechst 33258 (Life Technologies, 1:10000).
[000179] Изображения клеток получали с помощью микроскопа Zeiss M1 Axioscope с использованием 40× объектива. Долю клеток GFP+, имеющих также окрашивание GFAP или МАР2, определяли количественно на изображениях 10 случайных полей на покровное стекло для каждого экспериментального состояния. Представленные результаты являются средним значением для двух отдельных экспериментов по диссоциации и инфицированию.
[000180] Чтобы инфицировать AAV интактные трехмерные культуры, отдельные кортикальные сфероиды человека на 197 день дифференцировки в условиях in vitro переносили на 24 часа в 1,5 мл пробирки (Eppendorf), содержащие 6×109 в.г./400 мкл, в среды NPC и фиксировали через 7 дней в 4% ПФА в течение ночи. Фиксированные сфероиды затем переносили в 30% сахарозу в течение 24 часов, фиксировали в О.С.Т. (Fisher Scientific) и разрезали на срезы толщиной 14 мкм. Для иммуногистохимических исследований срезы блокировали с использованием 10% козьей сыворотки в ФСБ, содержащей 0,3% тритона Х-100, в течение 1 часа. Изображения получали с помощью конфокального микроскопа Leica TCS SP8.
Получение вариантов rAAV с помощью CREATE
[000181] Система CREATE основана на использовании генома капсида rAAV (rAAV-Cap-in-cis-lox), в котором полноразмерный ген Cap AAV, контролируемый регуляторными элементами гена Rep AAV (ФИГ. 4В), соединен с инвертируемым Cre-переключателем (ФИГ. 4В). Система обеспечивает селективную амплификацию и выделение последовательностей, которые трансдуцировали целевую популяцию, за счет создания библиотек капсидов на основе остова rAAV-Cap-in-cis-lox и доставки вирусных библиотек животным с экспрессией Cre в определенной популяции клеток (ФИГ. 4С). Поскольку в геноме rAAV-Cap-in-cis-lox отсутствует функциональный ген Rep, Rep должен быть предоставлен в транс-форме для выработки вирусов. Для этой цели плазмида AAV2/9 rep-cap может быть модифицирована, чтобы исключить экспрессию белка капсида путем вставки стоп-кодонов в пределах открытой рамки считывания для каждого капсидного белка, VP1-3 (ФИГ. 4D). Такие стоп-кодоны не изменяют аминокислотную последовательность белка, активирующего агрегацию (ААР), который экспрессируется с альтернативной рамки считывания в гене Сар. Упомянутое разделение генома rAAV-Cap-in-cis-lox и вспомогательной системы Rep-ААР AAV обеспечивает эффективное получение rAAV (ФИГ. 4Е) и представляет собой основу платформы для отбора CREATE, которая позволяет выделять последовательности капсидных белков из генетически определенных Cre-экспрессирующих клеточных популяций в образцах гетерогенных тканей (см. ФИГ. 8А-8В).
[000182] В случае акцепторного генома rAAV-Cap-in-cis-lox библиотеку вариантов AAV получали путем вставки 7 аминокислот (АА) рандомизированной последовательности (7-членной) между АА588-589 (положение VP1) капсида AAV9 (ФИГ. 4F-4G). Для отбора векторов, которые пересекали ГЭБ и трансдуцировали клетки по всей ЦНС, библиотеку капсидов вводили внутривенно взрослым мышам GFAP-Cre, которые экспрессировали Cre в астроцитах. Через одну неделю ДНК выделяли из ткани головного и спинного мозга и выделяли капсидные последовательности из вирусных геномов, которые подверглись Cre-опосредуемой рекомбинации, с помощью ПЦР. Полную библиотеку выделенных последовательностей Сар клонировали обратно в акцепторный геном rAAV-Cap-in-cis-lox для получения библиотеки GFAP1 и случайным образом выбирали 13 клонов для секвенирования. Все проверенные последовательности, выделенные из библиотеки GFAP1, были уникальными и, следовательно, плазмидную библиотеку GFAP1 использовали для получения второй вирусной библиотеки и проведения дополнительного раунда отбора у мышей GFAP-Cre. После второго раунда отбора несколько вариантов были обогащены (см. таблицу 3) и проявили повышенную трансдукцию ЦНС (ФИГ. 9А). Наиболее обогащенный вариант, AAV-PHP.B, отбирали для дальнейшей оценки тропизма в условиях in vivo. AAV-PHP.B представлял собой 25% выделенных последовательностей библиотеки и кодировал 7-членную последовательность TLAVPFK (SEQ ID NO: 40).
[000183] Капсиды AAV-PHP.B и AAV9 использовали для упаковки одноцепочечного (оц) вектора, несущего репортер GFP, контролируемый повсеместным промотором CAG (ssAAV-CAG-GFP). Оба вектора AAV-PHP.B и AAV9 обеспечивали выработку вируса с аналогичной эффективностью (ФИГ. 9В). Векторные геномы (в.г.) любого вектора вводили мышам в возрасте 6 недель в количестве 1×1012 путем внутривенной инъекции. Трансдукцию оценивали на основании экспрессии GFP через три недели. Полученные данные указывают на то, что AAV-PHP.B с высокой эффективностью трансдуцировал всю ЦНС взрослых мышей, согласно результатам иммуногистохимического окрашивания (ИГХ) GFP (ФИГ. 5А) или на основании нативной флуоресценции eGFP в нескольких областях головного мозга (ФИГ. 5В), спинного мозга (ФИГ. 5С) и сетчатки (ФИГ. 5D). Благодаря использованию методики CLARITY на основе PARS для просветления тканей всего тела24 нативную флуоресценцию eGFP детектировали через просветленные участки ткани из спинного мозга (ФИГ. 5С), коры головного мозга и полосатого тела (ФИГ. 5Е). Полученные трехмерные изображения указывают на повсеместную и эффективную трансдукцию ЦНС вектором AAV-PHP.B. За пределами центральной нервной системы тропизм AAV-PHP.B и AAV9 на клеточном уровне оказался сходным в нескольких органах, за исключением поджелудочной железы, где эффективность трансдукции AAV-PHP.B была снижена по сравнению с AAV9 (ФИГ. 5F).
[000184] Для того чтобы количественно определить эффективность переноса генов в ЦНС и периферические органы с помощью AAV-PHP.B по сравнению с AAV9, ряд присутствующих вирусных геномов измеряли в нескольких областях головного мозга и органах через 25 дней после инъекции (ФИГ. 5G). AAV-PHP.B обеспечивал значительно более эффективный перенос генов, чем AAV9, в каждую из исследованных областей ЦНС: кору головного мозга (40 раз), полосатое тело (92 раза), таламус (76 раз), мозжечок (41 раз) и спинной мозг (75 раз). Биораспределение векторного генома за пределами центральной нервной системы выявило, что AAV-PHP.B менее эффективно переносил гены в поджелудочную железу и надпочечники, чем AAV9 (ФИГ. 5G). Не было обнаружено существенных различий эффективности двух векторов в печени, сердце, скелетных мышцах и почках. При рассмотрении совместно с данными о биораспределении в ЦНС было установлено, что во всех областях ЦНС, за исключением мозжечка, количество вирусных геномов, обнаруженных у мышей, получавших AAV-PHP.B, было сходно с таковым, измеренным в печени, т.е. в органе, который был эффективно трансдуцирован AAV921,25, и больше, чем наблюдали в других органах. Напротив, AAV9-опосредуемый перенос генов в каждую из исследованных областей ЦНС был по меньшей мере в 120 раз ниже, чем в печени. Следовательно, несмотря на то, что тропизм AAV-PHP.B не является специфичным в отношении ЦНС, улучшенные характеристики переноса генов указанного вектора специфичны в отношении ЦНС.
[000185] AAV9 преимущественно трансдуцирует астроциты при внутривенной доставке взрослым мышам и приматам, отличным от человека, однако он также трансдуцирует нейроны в нескольких областях. Для того чтобы исследовать типы клеток, которые могут быть трансдуцированы AAV-PHP.B, исследовали совместную локализацию GFP с несколькими маркерами, специфичными для разных типов клеток. Благодаря высокой эффективности трансдукции отдельные экспрессирующие GFP астроциты было трудно различить у мышей, которые получили 1×1012 в.г. AAV-PHP.B (ФИГ. 5А), но они могли быть более легко идентифицированы морфологически на основании компактных, сильно разветвленных отростков у животных, которые получили в 10 раз меньше вируса (ФИГ. 5А-5В), и по совместной локализации с ИГХ-окрашиванием GFAP (ФИГ. 6А). Помимо астроцитов исследовали AAV-PHP.B-трансдуцированные олигодендроциты (ФИГ. 6В) и все подтипы нейронов, включая NeuN+ во всем головном мозге (ФИГ. 6С), а также содержащие тирозингидроксилазу (ТН)+ дофаминергические нейроны среднего мозга (ФИГ. 6D), кальбиндин+ клетки Пуркинье мозжечка (ФИГ. 6Е.) и несколько популяций интернейронов (ФИГ. 10A-10D). AAV-PHP.B также трансдуцировал CD31+ эндотелиальные клетки (ФИГ. 10Е), однако, по-видимому, не трансдуцировал Iba1+ микроглию (ФИГ. 10F-10G). Небольшое количество GFP+ микроглии, наблюдаемое после внутривенного введения AAV-PHP.B, согласуется с предыдущими сообщениями о редкой или несуществующей экспрессии генов, опосредуемой AAV, в этой популяции клеток14,27-30. Нативную флуоресценцию GFP в результате экспрессии белка GFP наблюдали во всем мозге в течение года после введения AAV-PHP.B, это указывает на то, что AAV-PHP.B может обеспечить длительную, ЦНС-направленную экспрессию трансгена (ФИГ. 11).
[000186] Затем количественно оценивали фракцию из нескольких типов клеток, трансдуцированных AAV-PHP.B, в сравнении с AAV9. Чтобы облегчить надежный подсчет отдельных клеток конструировали вектор, экспрессирующий локализованный в ядре GFP (NLS-GFP) под контролем промотора CAG, ssAAV-CAG-NLS-GFP. Однократная инъекция 2×1012 в.г./мышь ssAAV-PHP.B:CAG-NLS-GFP приводила к трансдукции большинства Aldh1L1+ астроцитов (ФИГ. 6F и 12А) и NeuN+ нейронов (ФИГ. 6G и 12В), а также небольшой фракции Olig2+ клеток олигодендроцитарной линии дифференцировки (ФИГ. 6Н и 12С) во всех исследованных областях головного мозга. Во всех случаях AAV-PHP.B обеспечивал значительно повышенную трансдукцию по сравнению с аналогичной дозой AAV9. Следует отметить, что AAV-PHP.B также трансдуцировал более 94% Chat+ двигательных нейронов во всем спинном мозге (ФИГ. 3I), 91,4±1,6% ТН+ дофаминергических нейронов среднего мозга (ФИГ. 12D) и 91,7±5,8% кальбиндин-положительных клеток Пуркинье (n=5). Подытоживая, следует отметить, что внутривенное введение AAV-PHP.B взрослым животным обеспечивало эффективное нацеливание ко многим типам нейронов и глиальных клеток у взрослых мышей.
[000187] Способ, использованный для идентификации AAV-PHP.B, позволял проводить отбор только на основании трансдукции популяции клеток-мишеней; он необязательно позволял проводить отбор на основании специфичности. Тем не менее, в отдельном исследовании у мышей GFAP-Cre (после двух раундов отбора в условиях in vivo) идентифицировали другой вариант капсида AAV, AAV-PHP.A. AAV-PHP.A содержал 7-членную последовательность, YTLSQGW (SEQ ID NO: 38), которая проявляла более эффективную и селективную трансдукцию астроцитов в ЦНС (ФИГ. 7A-7D), а также сниженный тропизм в отношении печени (ФИГ. 7E-7F) и других периферических органов (ФИГ. 7F) по сравнению с AAV9. Увеличение специфичности переноса генов в ЦНС, по сравнению с печенью, обеспечиваемое AAV-PHP.A по сравнению с AAV9, составляло от 400 до 1200 раз, что обусловлено комбинацией улучшенного переноса генов в ЦНС у взрослых субъектов (в 2,6-8 раз выше в зависимости от конкретной области) и сниженным переносом генов в печень (в 152 раза). Два других варианта, обогащенных в данном исследовании (ФИГ. 9А), не проявили повышенной экспрессии GFP в нейронах ЦНС или глии по сравнению с AAV9.
[000188] Для того чтобы определить возможность трансдукции нервных клеток человека векторами AAV-PHP.A и AAV-PHP.B, указанные варианты проверяли на кортикальных нейронах и астроцитах, происходящих из индуцированных плюрипотентных стволовых клеток человека (иПСК человека) с использованием способа трехмерной дифференцировки. Линии иПСК человека от двух индивидуумов дифференцировали в трехмерные структуры, сходные с корой головного мозга (кортикальные сфероиды) и поддерживали в условиях in vitro вплоть до 200 дней. Взрослые кортикальные сфероиды содержат поверхностные и глубокие кортикальные возбуждающие нейроны и до 20% астроцитов31. В диссоциированных кортикальных сфероидах, которые были подвергнуты воздействию трех вирусов в монослое, AAV-PHP.B более эффективно трансдуцировал как GFAP-экспрессирующие астроциты, так и МАР2-экспрессирующие нейроны по сравнению с AAV9 или AAV-PHP.A (ФИГ. 12; двухфакторный дисперсионный анализ, р<0,01, n=3). Помимо этого все три вируса были способны трансдуцировать интактные трехмерные кортикальные сфероиды (ФИГ. 5С).
[000189] В двух исследованиях нацеливания к астроцитам идентифицировали варианты AAV-PHP.B, В2 и В3 (ФИГ. 9). Указанные варианты обеспечивали повсеместную трансдукцию как нейронов, так и глии в ЦНС, причем AAV-PHP.A обеспечивал селективно более эффективную трансдукцию астроцитов. Выявление капсидов с различными свойствами из одной и той же схемы отбора было ожидаемым, учитывая, что использованный способ выделения обеспечивал отбор вариантов, трансдуцирующих астроциты, а не любого конкретного промежуточного этапа (этапов), например, связь с сосудистой сетью мозга, трансцитоз через ГЭБ или связывание/интернализацию астроцитами. Следовательно, варианты капсидов, которые более эффективны на любом из указанных промежуточных этапов, должны быть выделены в процессе отбора.
[000190] С помощью иммунного окрашивания капсидов было установлено, что AAV-РНР капсиды, в отличие от AAV9, легко локализуются в сосудистой сети мозга вскоре после внутривенного введения (ФИГ. 14А-14В). Помимо этого через 24 ч после введения значительно больше GFP-экспрессирующих клеток наблюдали вдоль сосудистой сети головного мозга у мышей, получивших AAV-PHP.B, по сравнению с теми, которые получили AAV9 или AAV-PHP.A (ФИГ. 14C-14D). При рассмотрении совместно с характеристиками трансдукции AAV-PHP.B и AAV-PHP.A в условиях in vivo (ФИГ. 5А-5G, 6A-6I и 7A-7F) и в культурах нейронов человека (ФИГ. 13А-С), полученные данные указывают на то, что хотя векторы AAV-PHP более эффективно связываются с сосудистой сетью мозга, они могут различаться на последующих этапах проникновения или транспорта в разных типах клеток.
[000191] С помощью CREATE разрабатывали новые варианты AAV, которые обеспечивали эффективный повсеместный перенос генов в ЦНС взрослых мышей после внутривенного введения. Важным преимуществом упомянутой системы является то, что она создает селективное давление для капсидов, которые опосредуют эффективный внутриклеточный перенос и превращение одноцепочечного вирусного генома в устойчивые двухцепочечные ДНК (дцДНК), необходимые для долгосрочной трансдукции (только геномы дцДНК должны быть использованы в качестве субстратов для Cre). Такое дополнительное селективное давление для функциональных капсидов могло способствовать выявлению вариантов AAV-PHP.A и AAV-PHP.B (описанных в настоящем документе) в независимых исследованиях после двух раундов отбора в условиях in vivo. Для сравнения, во многих предыдущих способах отбора капсидов AAV в условиях in vivo и in vitro применяли 3-10 раундов отбора для выявления вариантов капсидов с улучшенными свойствами.
[000192] Не желая быть связанными соответствием какой-либо конкретной теории, авторы настоящего изобретения полагают, что CREATE можно применять для обнаружения вариантов капсидов AAV, которые нацелены к определенным Cre-экспрессирующим типам клеток в любом органе. Следовательно, CREATE можно применять не только у трансгенных животных, как показано в настоящем документе, но также для разработки вариантов AAV, которые нацелены к (i) конкретным типам Cre+ клеток в культурах сфероидов или органоидных культурах, (ii) клеткам нетрансгенных животных, которые сделали Cre+ путем, например, вирусных инъекций, которые обеспечивают экспрессию Cre на основе популяции, проекции33 или активности, или (iii) Cre+ клеткам человека у химерных животных, содержащих клетки человека/мыши. Учитывая отмеченные различия тропизма AAV между моделями на животных и человеком, схемы отбора, в которых применяют Cre+ клетки человека в условиях in vivo, экспрессию Cre, специфичную для клеток, в трехмерных клеточных моделях, происходящих из иПСК человека, или будущие Cre-трансгенные игрунки могут быть желательными для разработки улучшенных векторов для вариантов клинического применения. Помимо этого успех способов генной терапии на основе AAV, особенно тех, которые требуют системной доставки, может быть затруднен из-за присутствия нейтрализующих антител к капсиду AAV у человека. Использование CREATE совместно с воздействием объединенных сывороток человека на библиотеки AAV может обеспечить одновременный отбор капсидов с сохраненными или улучшенными характеристиками трансдукции, которые также менее восприимчивы к нейтрализации, опосредуемой антителами.
[000193] CREATE также можно применять с секвенированием следующего поколения для более точного прогнозирования характеристик выделенных последовательностей перед индивидуальным исследованием вариантов. Секвенирование как всего пула вариантов, выделенных из Cre-экспрессирующих клеток-мишеней, так и из неотобранной библиотеки вирусов, должно обеспечивать количественную оценку относительной степени обогащения каждой выделенной последовательности. Более того, секвенирование капсидов, выделенных из множества экспрессирующих cre или неэкспрессирующих Cre популяций, может обеспечить средство для проведения как положительного, так и отрицательного отбора в нескольких типах клеток в одном эксперименте. Такие подходы отбора в условиях in vivo-in silico должны увеличить мощность CREATE для улучшения переноса генов в ЦНС и другие популяции клеток, сложные для нацеленного воздействия.
[000194] Настоящее изобретение относится к новым нацеливающим к ЦНС последовательностям, которые разрабатывали с применением способа CREATE. Согласно некоторым вариантам реализации настоящего изобретения создавали библиотеки ДНК, которые содержали 7-членные последовательности, вставленные между аминокислотами 588-599 капсидного белка AAV9. После создания библиотек вирусов из библиотек ДНК способ CREATE применяли для отбора и выделения новых капсидных последовательностей AAV, которые трансдуцировали Cre-экспрессирующие клетки через неделю после введения. Варианты, выделенные в ходе отбора, представлены в таблице 4.
[000195] CREATE применяли для определения трансдукции трех популяций в ЦНС: GFAP-Cre (астроциты), Vgat-IRES-Cre (ГАМКергические нейроны) и Vglut2-IRES-Cre (подгруппа глутаматергических нейронов). После выделения ДНК из головного мозга и спинного мозга выделенные варианты оценивали с помощью клонирования и/или секвенирования следующего поколения после 2 раундов отбора. Данный подход привел к выявлению векторов, для которых характерна эффективная трансдукция ЦНС (см. таблицу 5). Было обнаружено, что ряд выявленных векторов более эффективен при трансдукции ЦНС, чем РНР.В, например, PHP.B-DGT (PHP.N), PHP.B-EST и РНР.В-АТТ-Т.
Пример 3
Способ получения вариантов AAV-РНР.В для эффективной трансдукции Нейроны и глия ЦНС
[000196] 7-Членый пептид AAV-PHP.B и фланкирующие последовательности дополнительно изменяли с помощью сайт-насыщающего мутагенеза трех последовательных аминокислот (см. ФИГ. 13). Пять библиотек насыщения (ХХХ1-ХХХ5) получали с помощью ПЦР, смешивали в равных количествах и использовали для получения ДНК. ДНК использовали для получения библиотек капсидов AAV. Отбор выполняли параллельно с помощью CREATE для трансдукции трех популяций ЦНС: GFAP-Cre (астроциты), Vgat-IRES-Cre (ГАМКергические нейроны) и Vglut2-IRES-Cre (подгруппа глутаматергических нейронов). ДНК выделяли из головного мозга и спинного мозга. Выделенные варианты оценивали путем клонирования и/или секвенирования следующего поколения после 2 раундов отбора. Данный подход привел к выявлению дополнительных векторов, которые проявляли эффективную трансдукцию ЦНС (см. таблицы 3 и 4). Последовательности отбирали для индивидуальной проверки на основании одного или более из следующих критериев: (i) частота, с которой каждый вариант присутствует после двух раундов отбора (последовательности, присутствующие с высокой частотой, вероятно, были обогащены во время отбора в условиях in vivo) (ii) присутствие нескольких вариантов последовательности нуклеиновой кислоты, кодирующих одну и ту же аминокислотную последовательность, и (iii) наблюдаемое обогащение по сравнению с библиотекой вирусов.
Пример 4
Получение вариантов AAV-РНР.В
[000197] 7-Членный пептид AAV-PHP.B (SEQ ID NO: 40) частично рандомизировали, чтобы получить соответствующие варианты с помощью замены с перекрыванием 3 аминокислот последовательности 7-членного пептида и 2 аминокислот, фланкирующих 7-членный пептид, случайными аминокислотами. Обзор стратегии получения вариантов AAV-PHP.B представлен на ФИГ. 21.
[000198] После двух раундов отбора последовательность DGTLAVPFKAQ (SEQ ID NO: 4) отбирали для определения характеристик. Последовательность DGTLAVPFKAQ (SEQ ID NO: 4) независимо отбирали из 2 различных аминокислотных последовательностей: и (ii) .
[000199] Согласно некоторым вариантам реализации 7-аминокислотную последовательность (7-членный пептид) вставляли между аминокислотами 588-589 капсидного белка AAV9. Вставка 7-членного пептида AAV-PHP.S (SEQ ID NO: 37) имеет следующую 7-членную последовательность: QAVRTSL (SEQ ID NO 37). Указанную последовательность отбирали из нуклеотидной последовательности: .
Пример 5
Характеристика AAV-PHP.N (SEQ ID NO: 46) и AAV-PHP.S (SEQ ID NO: 47)
[000200] В данном примере представлена дополнительная характеристика двух вариантов AAV, AAV-PHP.N (SEQ ID NO: 46) и AAV-PHP.S (SEQ ID NO: 47). AAV-PHP.N отличается от AAV-PHP.B двумя заменами аминокислот (A587D и Q588G). Капсид ААР-РНР.В проявлял повышенную эффективность доставки генов в несколько популяций нейронов в ЦНС по сравнению с капсидом AAV-PHP.N, который может обеспечить перенос генов в большую фракцию клеток или более высокую частоту трансдукции при использовании более низких доз вируса.
[000201] Для того чтобы количественно оценить эффективность трансдукции AAV-PHP.N (SEQ ID NO: 46) и AAV-PHP.B, молодым взрослым мышам внутривенно вводили 1×1011 в.г. одноцепочечного (оц) AAV-CAG-NLS-GFP, упакованного в AAV-PHP.N (SEQ ID NO: 46) или AAV-PHP.B (ФИГ. 23A-E). Через три недели после введения оценивали долю DAPI+ клеток, которые экспрессировали локализованный в ядре GFP, в коре головного мозга и полосатом теле. AAV-PHP.N (SEQ ID NO: 46) трансдуцировал значительно большую долю DAPI+ клеток в коре головного мозга, чем AAV-PHP.B (ФИГ. 24А, 24D). Аналогичную тенденцию наблюдали в полосатом теле (р=0,054). Затем определяли долю нейронов, трансдуцированных каждым вектором в коре головного мозга и полосатом теле (NeuN+), а также нейронах Пуркинье в мозжечке (кальбиндин+) (ФИГ. 24В, 24Е). AAV-PHP.N обеспечил значительно более эффективную трансдукцию нейронов в каждой области. Повышенная эффективность трансдукции с помощью AAV-PHP.N по сравнению с AAV-PHP.B дополнительно подтверждалась обнаруженным значительным увеличением интенсивности флуоресценции GFP в клетке (среднее значение медианы интенсивности флуоресценции GFP на ядро) в головном мозге мышей, которые получили AAV-PHP.N (SEQ ID NO: 46) (ФИГ. 24G).
Пример 6
Количественная оценка трансдукции с применением AAV-PHP.S
[000202] Капсид AAV-PHP.S (SEQ ID NO: 47) обеспечивал эффективную трансдукцию периферических сенсорных нейронов в ганглиях задних корешков спинного мозга (DRG) и во внутренних органах, включая кишечную нервную систему. Исследовали эффективность трансдукции периферических нейронов с применением AAV-PHP.S (SEQ ID NO: 47) по сравнению с AAV9 (SEQ ID NO: 45). AAV-PHP.S и AAV9 использовали для упаковки одного и того же генома AAS-CAG-NLS-GFP, использованного ранее, и вирусы вводили путем внутривенной инъекции молодым взрослым мышам в дозе 1×1012 в.г. Через три недели определяли долю нейронов PGP9.5+ DRG, трансдуцированных обоими векторами. У мышей, получивших AAV-PHP.S, наблюдали значительное увеличение доли PGP9.5+ клеток, которые экспрессировали ядерный GFP, и значительное увеличение экспрессии GFP (согласно результатам измерения интенсивности флуоресценции) на клетку. Помимо этого средняя интенсивность флуоресценции GFP в клетках в сердечных ганглиях также была повышена по сравнению с AAV9 (ФИГ. 24A-G).
[000203] Не желая быть связанными соответствием какой-либо конкретной теории, авторы настоящего изобретения полагают, что AAV-PHP.S можно применять для исследования и лечения различных заболеваний и травм, включая, но не ограничиваясь ими, атаксию Фридрейха, сердечную недостаточность, ишемическую болезнь сердца, гипертрофию сердца, хроническую боль и повреждение периферических нервов.
Пример 7
Способ лечения с применением нацеливающих пептидов
[000204] Выявляют субъекта, имеющего расстройство, которое можно лечить путем применения нуклеиновой кислоты для экспрессии у субъекта. Затем субъекту вводят первое количество AAV-вектора, который содержал полинуклеотид, который должен быть экспрессирован. Полинуклеотид кодирует терапевтический белок. AAV-вектор содержит капсидный белок, который содержал часть нацеливающего пептида, содержащую или состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание белка, который должен быть экспрессирован, к соответствующей системе у субъекта. При необходимости субъекту вводят вторую или третью дозу вектора до момента достижения экспрессии терапевтически эффективного количества белка в соответствующей системе у субъекта.
Пример 8
Способ лечения болезни Хантингтона
[000205] Выявляют субъекта, имеющего болезнь Хантингтона. Затем субъекту вводят первое количество AAV-вектора, который содержит полинуклеотид, который должен быть экспрессирован. Полинуклеотид кодирует терапевтический белок. AAV-вектор содержал капсидный белок, который содержит часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить у субъекта правильное нацеливание белка, который должен быть экспрессирован, в нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до момента достижения экспрессии терапевтически эффективного количества белка в нервной системе субъекта.
Пример 9
Способ лечения болезни Хантингтона
[000206] Выявляют субъекта, имеющего болезнь Хантингтона. Затем субъекту вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий короткую некодирующую РНК (короткую шпилечную РНК (кшРНК) или микроРНК (миРНК)), сконструированную для уменьшения экспрессии белка хантингтина посредством ее последовательности). AAV-вектор содержит капсидный белок, который содержит часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание указанного полинуклеотида к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества короткой некодирующей РНК в нервной системе субъекта.
Пример 10
Способ лечения болезни Хантингтона
[000207] Выявляют субъекта, имеющего болезнь Хантингтона. Затем субъекту систематически вводят первое количество AAV-вектора, который содержал полинуклеотид, кодирующий белок с цинковым пальцем (ZFP), сконструированный для подавления транскрипции гена хантингтина (HTT). AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание ZFP к нервной системе, помимо других органов. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества ZFP в нервной системе субъекта.
Пример 11
Способ лечения болезни Хантингтона
[000208] Выявляют субъекта, имеющего болезнь Хантингтона. Затем субъекту систематически вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий короткую некодирующую РНК (короткую шпилечную РНК (кшРНК) или микроРНК (миРНК)), разработанную специалистом в данной области техники для снижения экспрессии белка хантингтина. AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание полинуклеотида к нервной системе, помимо других органов. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества короткой некодирующей РНК в нервной системе субъекта.
Пример 12
Способ лечения болезни Альцгеймера
[000209] Выявляют субъекта, имеющего болезнь Альцгеймера. Затем субъекту вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий антитела к Aβ или фрагменты антител. AAV вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание антитела или фрагмента антитела, который должен быть экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения терапевтически эффективного количества антитела или фрагмента антитела в нервной системе субъекта.
Пример 13
Способ лечения болезни Альцгеймера
[000210] Выявляют субъекта, имеющего болезнь Альцгеймера. Затем субъекту вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий белок аполипопротеина E (ApoE), предпочтительно полипептид apoE2 из apoE человека или модифицированный вариант apoE2. AAV-вектор, содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание антитела или фрагмента антитела, который должен быть экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения терапевтически эффективного количества белка ApoE в нервной системе субъекта.
Пример 14
Способ лечения СМА
[000211] Выявляют субъекта, имеющего спинальную мышечную атрофию (СМА). Затем субъекту вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий полипептид выживаемости моторных нейронов 1 (SMN1). AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание белка SMN, который должен быть экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения терапевтически эффективного количества белка SMN в нервной системе субъекта.
Пример 15
Способ лечения атаксии Фридрейха
[000212] Выявляют субъекта, имеющего атаксию Фридрейха. Затем субъекту систематически вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий белок фратаксин. AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание белка фратаксина, который должен быть экспрессирован, к нервной системе и сердцу, помимо других органов. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества белка фратаксина в нервной системе и сердце субъекта.
Пример 16
Способ лечения болезни Помпе
[000213] Выявляют субъекта, имеющего болезнь Помпе. Затем субъекту систематически вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий белок кислой альфа-глюкозидазы (GAA). AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание белка GAA, который должен быть экспрессирован, к нервной системе и сердцу, помимо других органов. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества белка GAA в нервной системе и сердце субъекта.
Пример 17
Способ лечения поздней инфантильной формы нейронального цероидного липофусциноза
[000214] Выявляют субъекта, имеющего позднюю инфантильную форму нейронального цероидного липофусциноза (LINCL). Затем субъекту систематически вводят первое количество AAV-вектора, который содержит полинуклеотид CLN2, кодирующий белок трипептидилпептидазы 1. Вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание белка трипептидилпептидазы 1, который должен быть экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества белка трипептидилпептидазы 1 в нервной системе субъекта.
Пример 18
Способ лечения болезни Баттена
[000215] Выявляют субъекта, имеющего ювенильную форму нейронального цероидного липофусциноза (NCL) (болезнь Баттена). Затем субъекту систематически вводят первое количество AAV-вектора, который содержит полинуклеотид CLN3, кодирующий белок баттенин. AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание белка баттенина, который должен быть экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества белка баттенина в нервной системе субъекта.
Пример 19
Способ лечения болезни Канавана
[000216] Выявляют субъекта, имеющего заболевание Канавана. Затем субъекту систематически вводят первое количество AAV-вектора, который содержит полинуклеотид ASPA, кодирующий белок аспартоацилазы. AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание белка аспартоацилазы, который должен быть экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества белка аспартоацилазы в нервной системе субъекта.
Пример 20
Способ лечения болезни Паркинсона
[000217] Выявляют субъекта, имеющего болезнь Паркинсона. Затем субъекту систематически вводят первое количество одного или более AAV-векторов, каждый из которых содержит один или более полинуклеотидов, кодирующих фермент(ы), необходимый для увеличения выработки дофамина из недофаминергических клеток. AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание указанного фермента (ов), который будет экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества фермента (ов) в нервной системе субъекта.
Пример 21
Способ лечения болезни Паркинсона
[000218] Выявляют субъекта, имеющего болезнь Паркинсона. Затем субъекту систематически вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий модифицированную, устойчивую к агрегации форму белка альфа-синуклеина, которая уменьшает агрегацию эндогенного альфа-синуклеина. AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание устойчивого к агрегации белка альфа-синуклеина, который должен быть экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества белка в нервной системе субъекта.
Пример 22
Способ лечения бокового амиотрофического склероза или деменции лобного типа
[000219] Выявляют субъекта, имеющего боковой амиотрофический склероз или деменцию лобного типа, вызванную мутацией в C9ORF72. Затем субъекту вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий некодирующую молекулу (молекулы) РНК, которая уменьшает очаги ядерной РНК, вызванные удлинением гексануклеотида (GGGGCC) в клетках субъектов. AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание молекулы (молекул) РНК, которые должны быть экспрессированы, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества молекулы (молекул) РНК в нервной системе субъекта.
Пример 23
Способ лечения рассеянного склероза
[000220] Выявляют субъекта, имеющего рассеянный склероз. Затем субъекту систематически вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий трофический или иммуномодулирующий фактор, например, ингибирующий лейкемию фактор (LIF) или цилиарный нейротрофический фактор (CNTF). AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание указанного фактора, который должен быть экспрессирован, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества фактора в нервной системе субъекта.
Пример 24
Способ лечения бокового амиотрофического склероза
[000221] Выявляют субъекта, имеющего боковой амиотрофический склероз, вызванный мутацией SOD1. Затем субъекту вводят первое количество AAV-вектора, который содержит полинуклеотид, кодирующий короткую некодирующую РНК (короткую шпилечную РНК (кшРНК) или микроРНК (миРНК)), разработанную специалистом в данной области техники для снижения экспрессии мутированного белка SOD1. AAV-вектор содержит капсидный белок, содержащий часть нацеливающего пептида, состоящую из любой из последовательностей, представленных в SEQ ID NO: 1-44, 48-53, 65-68, 74-93, так, чтобы обеспечить правильное нацеливание короткой некодирующей РНК, которая должна быть экспрессирована, к нервной системе. При необходимости субъекту вводят вторую или третью дозу вектора до достижения экспрессии терапевтически эффективного количества короткой некодирующей РНК в нервной системе субъекта.
[000222] Все ссылки, приведенные в настоящем документе, включая патенты, заявки на патенты, статьи, печатные издания, и тому подобное, и ссылки, приведенные в них, в той мере, в которой это еще не сделано, полностью включены в настоящий документ посредством ссылки. В тех случаях, когда любое из определений или терминов, представленных в ссылках, включенных в настоящий документ посредством ссылки, отличается от терминов и обсуждений, представленных в настоящем документе, настоящие термины и определения имеют приоритет.
[000223] Приведенный выше текст описания считается достаточным для реализации настоящего изобретения специалистом в данной области техники. В приведенном выше описании и примерах подробно описаны некоторые предпочтительные варианты реализации настоящего изобретения и описаны наилучшие способы, предусмотренные авторами настоящего изобретения. Однако следует понимать, что независимо от того, насколько подробно описано настоящее изобретение, настоящее изобретение может быть реализовано многими способами, и настоящее изобретение должно быть истолковано в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.
[000224] По меньшей мере некоторые из описанных выше вариантов реализации, один или более элементов, используемых в варианте реализации, могут быть взаимозаменяемо использованы в другом варианте реализации, за исключением случаев, когда такая замена не является технически осуществимой. Специалисты в данной области техники поймут, что различные другие исключения, добавления и модификации могут быть сделаны в способах и структурах, описанных выше, в пределах объема заявленного предмета изобретения. Подразумевается, что все такие модификации и изменения находятся в пределах объема заявленного предмета настоящего изобретения, как определено прилагаемой формулой изобретения.
[000225] В отношении использования по существу любых множественных и/или сингулярных терминов в настоящем документе специалисты в данной области техники могут осуществлять перевод из множественного числа в единственное число, и/или из единственного числа в множественное число в соответствии с контекстом и/или применением. Различные перестановки единственного/множественного числа могут быть явным образом упомянуты в настоящем документе для ясности.
[000226] Специалисты в данной области техники поймут, что, в целом, используемые в настоящем документе термины и особенно в прилагаемой формуле изобретения (например, части прилагаемой формулы изобретения) обычно обозначены как «открытые» термины (например, термин «включая» следует толковать как «включая, но не ограничиваясь», термин «имеющий» следует толковать как «имеющий по меньшей мере», термин «включает» следует толковать как «включает, но не ограничивается» и т.д.). Специалисты в данной области техники поймут, что если предполагается конкретное количество перечислений заявленных пунктов формулы изобретения, такое намерение будет явным образом указано в формуле настоящего изобретения, и при отсутствии такого перечисления такое намерение отсутствует. Например, чтобы облегчить понимание настоящего изобретения в нижеследующей прилагаемой формуле изобретения могут быть использованы вводные выражения «по меньшей мере один» и «один или более», чтобы заявить перечисления пунктов формулы настоящего изобретения. Однако использование таких выражений не должно быть истолковано как подразумевающее, что введение перечисления пунктов формулы настоящего изобретения с помощью неопределенного артикля «а» или «an» ограничивает любой конкретный пункт формулы настоящего изобретения, содержащий такое перечисление пунктов формулы, сводя его к вариантам реализации, содержащим только одно такое перечисление, даже в тех случаях, когда этот же пункт формулы настоящего изобретения содержит вводные выражения «один или более» или «по меньшей мере один» и неопределенные артикли, такие как «а» или «an» (например, «а» и/или «an» следует толковать как «по меньшей мере один» или «один или более»); то же самое справедливо и для использования определенного артикля, используемого для введения перечислений пунктов формулы изобретения. Помимо этого, даже если конкретное количество перечислений заявленных пунктов формулы изобретения раскрыто в явном виде, специалисты в данной области техники поймут, что такое перечисление следует толковать как означающее по меньшей мере перечисленное количество (например, безусловное перечисление «двух перечислений», без других модификаторов, означает по меньшей мере два перечисления, или два или более перечислений). Более того, в тех случаях, когда используется общепринятое определение, аналогичное «по меньшей мере один из А, В и С и т.д.», в целом такая конструкция подразумевает, что специалист в данной области техники понимает значение общепринятых определений (например, «система, имеющая по меньшей мере одно из А, В и С», будет включать, но не ограничивается системами, которые имеют только А, только В, только С, А и В вместе, А и С вместе, В и С вместе, и/или А, В и С вместе и т.д.). В тех случаях, когда используется общепринятое определение, аналогичное «по меньшей мере одно из А, В или С и т.д.», в целом такая конструкция подразумевает, что специалист в данной области техники понимает общепринятое определение (например, «система, имеющая по меньшей мере одно из А, В или С», будет включать, но не ограничивается системами, которые имеют только А, только В, только С, А и В вместе, А и С вместе, В и С вместе, и/или А, В и С вместе и т.д.). Специалисты в данной области техники поймут, что практически любое разделительное слово и/или выражение, представляющие два или более альтернативных терминов, будь то в описании, формуле изобретения или чертежах, следует понимать, как подразумевающее возможности включения одного из терминов, любого из терминов или обоих терминов. Например, выражение «А или В» следует понимать как включающее возможности «А» или «В» или «А и В».
[000227] Помимо этого, если признаки или аспекты настоящего изобретения описаны в терминах групп Маркуша, специалисты в данной области техники поймут, что настоящее изобретение также тем самым описано в терминах любого отдельного члена или подгруппы членов группы Маркуша.
[000228] Специалист в данной области техники поймет, что, для любых и всех целей, таких как предоставление письменного описания, все диапазоны, раскрытые в настоящем документе, также включают любые и все возможные поддиапазоны и комбинации поддиапазонов. Любой перечисленный диапазон может быть легко рассмотрен, как описывающий в достаточной степени и позволяющий разделить этот же диапазон на по меньшей мере равные половины, третьи, четвертые, пятые, десятые части и т.д. В качестве неограничивающего примера каждый диапазон, описанный в настоящем документе, может быть легко разбит на нижнюю треть, среднюю треть и верхнюю треть и т.д. Специалист в данной области техники поймет, что все выражения, такие как «вплоть до», «по меньшей мере», «более чем», «менее чем» и т.п., включают перечисленное число и относятся к диапазонам, которые впоследствии могут быть разбиты на поддиапазоны, как обсуждалось выше. В заключение, как будет понятно специалисту в данной области техники, диапазон включает каждый отдельный член. Так, например, группа, имеющая 1-3 изделия, относится к группам, имеющим 1, 2 или 3 изделия. Аналогичным образом, группа, имеющая 1-5 изделий, относится к группам, имеющим 1, 2, 3, 4 или 5 изделий и т.д.
[000229] Несмотря на то, что различные аспекты и варианты реализации настоящего изобретения были описаны в настоящем документе, другие аспекты и варианты реализации будут очевидны специалистам в данной области техники. Различные аспекты и варианты реализации настоящего изобретения, раскрытые в настоящем документе, предназначены для иллюстрации и не предназначены для ограничения, при этом истинная сущность и объем настоящего изобретения раскрыты в нижеследующей формуле изобретения.
Claims (105)
1. Пептид, способный нацеливать AAV, содержащий последовательность из 11 смежных аминокислот X1X2X3X4X5X6X7X8X9X10X11, где
X1 представляет собой D, A, E, Q, N, G или S;
X2 представляет собой G, N, S, T, Q, R или V;
X3 представляет собой T, S или N;
X4 представляет собой L или V;
X5 представляет собой A, S, Q, P или T;
X6 представляет собой V, T, Q, N, L или M;
X7 представляет собой P;
X8 представляет собой F, Y, V, L, C или S;
X9 представляет собой K, R или S;
X10 представляет собой A или N; и
X11 представляет собой Q или P, при этом указанный пептид, способный нацеливать AAV, не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1).
2. Пептид, способный нацеливать AAV, по п. 1, где аминокислоты X7X8X9X10X11 представляют собой PFKAQ или PFSNP.
3. Пептид, способный нацеливать AAV, по п. 1 или 2, где аминокислоты X4X5X6 представляют собой LAV, LAT, LAQ, LQQ или LSN.
4. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что X1 представляет собой D, X2 представляет собой G, X3 представляет собой T, X4 представляет собой L, X6 представляет собой V либо T или X8 представляет собой F.
5. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что X4 представляет собой L, X5 представляет собой A, X6 представляет собой V, X7 представляет собой P, X8 представляет собой F, X9 представляет собой K, X10 представляет собой A и X11 представляет собой Q.
6. Пептид, способный нацеливать AAV, по п. 5, отличающийся тем, что аминокислоты X1X2X3 представляют собой DGT, GGT, EGT, EGS, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART.
7. Пептид, способный нацеливать AAV, по п.1, где аминокислоты X1X2X3 представляют собой DGT, GGT, EGT, EGS, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT, AQT или ART.
8. Пептид, способный нацеливать AAV, по п.1, где указанные 11 смежных аминокислот представляют собой AQTLAVPFSNP (SEQ ID NO: 15).
9. Пептид, способный нацеливать AAV, по п.1, где аминокислоты X7X8X9X10X11 представляют собой PFKAQ, аминокислоты X4X5X6 представляют собой LAV и аминокислоты X1X2X3 представляют собой DGT, DST, EGT, EST, EGS, GGT, SGS, QGT, NQT, SGN или AVT.
10. Пептид, способный нацеливать AAV, по п.1, где аминокислоты X7X8X9X10X11 представляют собой PFKAQ, аминокислоты X4X5X6 представляют собой LAT и аминокислоты X1X2X3 представляют собой AQT, ATT, DGT или GGT .
11. Пептид, способный нацеливать AAV, по п.1, где аминокислоты X7X8X9X10X11 представляют собой PFKAQ, аминокислоты X1X2X3 представляют собой AQT и аминокислоты X4X5X6 представляют собой LAQ, LQQ, LSN, LST, LPQ, LSQ или LQL.
12. Пептид, способный нацеливать AAV, по п.11, где аминокислоты X4X5X6 представляют собой LAQ, LQQ или LSN.
13. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что аминокислоты X1X2 представляют собой AQ, X6 представляет собой V, X7 представляет собой P, X8 представляет собой F, X9 представляет собой K, X10 представляет собой A и X11 представляет собой Q.
14. Пептид, способный нацеливать AAV, по п. 13, отличающийся тем, что X3 представляет собой T и X4 представляет собой L.
15. Пептид, способный нацеливать AAV, по п. 13, отличающийся тем, что X5 представляет собой А.
16. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что X1 представляет собой A, X2 представляет собой Q, X3 представляет собой T, X4 представляет собой L, X8 представляет собой F, X9 представляет собой K, X10 представляет собой A и X11 представляет собой Q.
17. Пептид, способный нацеливать AAV, по п. 16, отличающийся тем, что аминокислоты X5X6X7 представляют собой ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP.
18. Пептид, способный нацеливать AAV, по п.1, где аминокислоты X5X6X7 представляют собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP.
19. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что аминокислоты X1X2X3X4X5X6 представляют собой AQTLAV и X10X11 представляют собой AQ.
20. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что аминокислоты X7X8X9 представляют собой PFK.
21. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что аминокислоты X1X2X3X4X5X6X7X8 представляют собой AQTLAVPF.
22. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что аминокислоты X9X10X11 представляют собой KAQ, KAP или SNP.
23. Пептид, способный нацеливать AAV, по п. 1, отличающийся тем, что указанная последовательность из 11 смежных аминокислот представляет собой одну из последовательностей SEQ ID NO: 2-36.
24. Пептид, способный нацеливать AAV, по п.1, где последовательность из 11 смежных аминокислот представляет собой одну из последовательностей SEQ ID NO: 4-26.
25. Пептид, способный нацеливать AAV, по п.1, где последовательность из 11 смежных аминокислот представляет собой одну из последовательностей SEQ ID NO: 4-15.
26. Пептид, способный нацеливать AAV, по п.1, где последовательность из 11 смежных аминокислот представляет собой последовательность SEQ ID NO: 4.
27. Пептид, способный нацеливать AAV, по п.1, где последовательность из 11 смежных аминокислот представляет собой последовательность SEQ ID NO: 5.
28. Пептид, способный нацеливать AAV, по п.1, где последовательность из 11 смежных аминокислот представляет собой последовательность SEQ ID NO: 6.
29. Пептид, способный нацеливать AAV, по п.1, где последовательность из 11 смежных аминокислот представляет собой последовательность SEQ ID NO: 9.
30. Фармацевтическая композиция для доставки нуклеиновой кислоты, содержащая пептид, способный нацеливать AAV, по любому из пп. 1-29.
31. Нуклеиновая кислота, кодирующая пептид, способный нацеливать AAV, по любому из пп. 1-29.
32. Белок капсида ААV, содержащий пептид, способный нацеливать AAV, по любому из пп. 1-29.
33. Способ доставки нуклеиновой кислоты в целевое окружение в организме субъекта, нуждающегося в этом, включающий:
обеспечение композиции, содержащей AAV, причем указанный AAV содержит капсидный белок, который содержит последовательность из 11 смежных аминокислот X1X2X3X4X5X6X7X8X9X10X11, и при этом указанный AAV содержит нуклеиновую кислоту для доставки в указанное целевое окружение в организме указанного субъекта, где
X1 представляет собой D, A, E, Q, N, G или S;
X2 представляет собой G, N, S, T, Q, R или V;
X3 представляет собой T, S или N;
X4 представляет собой L или V;
X5 представляет собой A, S, Q, P или T;
X6 представляет собой V, T, Q, N, L или M;
X7 представляет собой P;
X8 представляет собой F, Y, V, L, C или S;
X9 представляет собой K, R или S;
X10 представляет собой A или N; и
X11 представляет собой Q или P, причем указанный капсидный белок не содержит аминокислотную последовательность AQTLAVPFKAQ (SEQ ID NO: 1); и
введение указанной композиции указанному субъекту, при этом указанное целевое окружение представляет собой сердце, нервную систему или их комбинацию.
34. Способ по п. 33, отличающийся тем, что нервная система представляет собой центральную нервную систему, периферическую нервную систему или их комбинацию.
35. Способ по п. 33, отличающийся тем, что указанное целевое окружение включает нейроны, астроциты, кардиомиоциты или их комбинацию.
36. Способ по п. 33, отличающийся тем, что указанная композиция представляет собой фармацевтическую композицию.
37. Способ по любому из пп. 33-36, отличающийся тем, что указанная нуклеиновая кислота для доставки в указанное целевое окружение содержит одно или более из следующего:
а) последовательность нуклеиновой кислоты, кодирующую трофический фактор, фактор роста или растворимый белок;
b) кДНК, которая восстанавливает функцию белка у человека или животных, несущих генетическую мутацию (мутации) в указанном гене;
c) кДНК, которая кодирует белок, который можно применять для контроля или изменения активности или состояния клетки;
d) кДНК, которая кодирует белок или нуклеиновую кислоту, применяемую для оценки состояния клетки;
e) кДНК и/или связанную с ней направляющую РНК для осуществления модификации генома;
f) последовательность для редактирования генома посредством гомологичной рекомбинации;
g) последовательность ДНК, кодирующую терапевтическую РНК;
h) систему доставки кшРНК или искусственной миРНК; и
i) последовательность ДНК, которая влияет на сплайсинг эндогенного гена.
38. Способ по любому из пп. 33-37, отличающийся тем, что указанный субъект, нуждающийся в этом, является субъектом, страдающим от или подверженным риску развития одного или более из: хронической боли, сердечной недостаточности, сердечных аритмий, атаксии Фридрейха, болезни Хантингтона (БХ), болезни Альцгеймера (БА), болезни Паркинсона (БП), бокового амиотрофического склероза (БАС), спинальной мышечной атрофии типов I и II (СМА I и II), атаксии Фридрейха (FA), спиноцеребеллярной атаксии, лизосомальных болезней накопления, которые поражают клетки в ЦНС.
39. Способ по п. 38, отличающийся тем, что указанная лизосомальная болезнь накопления представляет собой болезнь Краббе, болезнь Сандхоффа, болезнь Тея-Сакса, болезнь Гоше (типа I, II или III), болезнь Ниманна-Пика (дефицит NPC1 или NPC2), синдром Гурлера, болезнь Помпе или болезнь Баттена.
40. Способ по любому из пп. 33-39, отличающийся тем, что указанный AAV вводят субъекту путем внутривенного введения или системного введения.
41. Способ по п. 33, отличающийся тем, что указанная нервная система представляет собой центральную нервную систему.
42. Способ по любому из пп. 33-40, отличающийся тем, что указанную нуклеиновую кислоту доставляют субъекту в ганглии задних корешков спинного мозга, внутренние органы или их комбинацию.
43. Способ по любому из пп. 33-40, отличающийся тем, что указанную нуклеиновую кислоту доставляют субъекту в астроциты, нейроны или их комбинацию.
44. Способ по любому из пп. 33-43, отличающийся тем, что указанный субъект является взрослым животным.
45. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X7X8X9X10X11 представляют собой PFKAQ или PFSNP.
46. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X4X5X6 представляют собой LAV, LAT, LAQ, LQQ или LSN.
47. Способ по любому из пп. 33-44, отличающийся тем, что X1 представляет собой D, X2 представляет собой G, X3 представляет собой T, X4 представляет собой L, X6 представляет собой V или T или X8 представляет собой F.
48. Способ по любому из пп. 33-44, отличающийся тем, что X4 представляет собой L, X5 представляет собой A, X6 представляет собой V, X7 представляет собой P, X8 представляет собой F, X9 представляет собой K, X10 представляет собой A и X11 представляет собой Q.
49. Способ по п. 48, отличающийся тем, что аминокислоты X1X2X3 представляют собой DGT, GGT, EGT, EGS, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT или ART.
50. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X1X2X3 представляют собой DGT, GGT, EGT, EGS, DST, EST, QGT, NQT, SGS, SGN, ATT, AVT, AQT или ART.
51. Способ по любому из пп. 33-44, отличающийся тем, что 11 смежных аминокислот представляют собой AQTLAVPFSNP (SEQ ID NO: 15).
52. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X7X8X9X10X11 представляют собой PFKAQ, аминокислоты X4X5X6 представляют собой LAV и аминокислоты X1X2X3 представляют собой DGT, DST, EGT, EST, EGS, GGT, SGS, QGT, NQT, SGN или AVT.
53. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X7X8X9X10X11 представляют собой PFKAQ, аминокислоты X4X5X6 представляют собой LAT и аминокислоты X1X2X3 представляют собой AQT, ATT, DGT или GGT.
54. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X7X8X9X10X11 представляют собой PFKAQ, аминокислоты X1X2X3 представляют собой AQT и аминокислоты X4X5X6 представляют собой LAQ, LQQ, LSN, LST, LPQ, LSQ или LQL.
55. Способ по п.54, отличающийся тем, что аминокислоты X4X5X6 представляют собой LAQ, LQQ или LSN.
56. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X1X2 представляют собой AQ, X6 представляет собой V, X7 представляет собой P, X8 представляет собой F, X9 представляет собой K, X10 представляет собой A и X11 представляет собой Q.
57. Способ по п. 56, отличающийся тем, что X3 представляет собой T и X4 представляет собой L.
58. Способ по п. 56, отличающийся тем, что X5 представляет собой A.
59. Способ по любому из пп. 33-44, отличающийся тем, что X1 представляет собой A, X2 представляет собой Q, X3 представляет собой T, X4 представляет собой L, X8 представляет собой F, X9 представляет собой K, X10 представляет собой A и X11 представляет собой Q.
60. Способ по п. 59, отличающийся тем, что аминокислоты X5X6X7 представляют собой ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP.
61. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X5X6X7 представляют собой AVP, ATP, AQP, QQP, PQP, SNP, STP, SQP, QLP, TMP или TTP.
62. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X1X2X3X4X5X6 представляют собой AQTLAV и X10X11 представляют собой AQ.
63. Способ по п. 62, отличающийся тем, что аминокислоты X7X8X9 представляют собой PFK.
64. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X1X2X3X4X5X6X7X8 представляют собой AQTLAVPF.
65. Способ по любому из пп. 33-44, отличающийся тем, что аминокислоты X9X10X11 представляют собой KAQ, KAP или SNP.
66. Способ по любому из пп. 33-44, отличающийся тем, что последовательность из 11 смежных аминокислот представляет собой одну из последовательностей SEQ ID NO: 2-36.
67. Способ по любому из пп. 33-44, отличающийся тем, что последовательность из 11 смежных аминокислот представляет собой одну из последовательностей SEQ ID NO: 4-26.
68. Способ по любому из пп. 33-44, отличающийся тем, что последовательность из 11 смежных аминокислот представляет собой одну из последовательностей SEQ ID NO: 4-15.
69. Способ по любому из пп. 33-44, отличающийся тем, что последовательность из 11 смежных аминокислот представляет собой последовательность SEQ ID NO: 4.
70. Способ по любому из пп. 33-44, отличающийся тем, что последовательность из 11 смежных аминокислот представляет собой последовательность SEQ ID NO: 5.
71. Способ по любому из пп. 33-44, отличающийся тем, что последовательность из 11 смежных аминокислот представляет собой последовательность SEQ ID NO: 6.
72. Способ по любому из пп. 33-44, отличающийся тем, что последовательность из 11 смежных аминокислот представляет собой последовательность SEQ ID NO: 9.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562266184P | 2015-12-11 | 2015-12-11 | |
| US62/266,184 | 2015-12-11 | ||
| US201662421891P | 2016-11-14 | 2016-11-14 | |
| US62/421,891 | 2016-11-14 | ||
| PCT/US2016/065969 WO2017100671A1 (en) | 2015-12-11 | 2016-12-09 | TARGETING PEPTIDES FOR DIRECTING ADENO-ASSOCIATED VIRUSES (AAVs) |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2018120736A3 RU2018120736A3 (ru) | 2020-01-13 |
| RU2018120736A RU2018120736A (ru) | 2020-01-13 |
| RU2727672C2 true RU2727672C2 (ru) | 2020-07-22 |
Family
ID=59013356
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2018120736A RU2727672C2 (ru) | 2015-12-11 | 2016-12-09 | Нацеливающие пептиды для направленной доставки аденоассоциированных вирусов (aav) |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US11499165B2 (ru) |
| EP (2) | EP3387137B1 (ru) |
| JP (1) | JP7066619B2 (ru) |
| KR (1) | KR102423442B1 (ru) |
| CN (1) | CN108699565B (ru) |
| AU (1) | AU2016366549B2 (ru) |
| BR (1) | BR112018011711A2 (ru) |
| CA (1) | CA3007495C (ru) |
| CL (1) | CL2018001522A1 (ru) |
| CO (1) | CO2018007203A2 (ru) |
| DK (1) | DK3387137T3 (ru) |
| ES (1) | ES2869284T3 (ru) |
| HK (1) | HK1257563A1 (ru) |
| IL (1) | IL259842B (ru) |
| MX (1) | MX2018006840A (ru) |
| RU (1) | RU2727672C2 (ru) |
| SG (1) | SG11201804713VA (ru) |
| WO (1) | WO2017100671A1 (ru) |
| ZA (1) | ZA201803808B (ru) |
Families Citing this family (125)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3561062A1 (en) | 2013-09-13 | 2019-10-30 | California Institute of Technology | Selective recovery |
| US10577627B2 (en) | 2014-06-09 | 2020-03-03 | Voyager Therapeutics, Inc. | Chimeric capsids |
| MX2017005834A (es) | 2014-11-05 | 2017-11-17 | Voyager Therapeutics Inc | Polinucleotidos aad para el tratamiento de la enfermedad de parkinson. |
| EP3218484A4 (en) | 2014-11-14 | 2018-05-30 | Voyager Therapeutics, Inc. | Compositions and methods of treating amyotrophic lateral sclerosis (als) |
| RU2749882C2 (ru) | 2014-11-14 | 2021-06-18 | Вояджер Терапьютикс, Инк. | Модулирующие полинуклеотиды |
| US11697825B2 (en) | 2014-12-12 | 2023-07-11 | Voyager Therapeutics, Inc. | Compositions and methods for the production of scAAV |
| AU2015364636B9 (en) * | 2014-12-16 | 2021-12-02 | Board Of Regents Of The University Of Nebraska | Gene therapy for Juvenile Batten Disease |
| GB201508026D0 (en) | 2015-05-11 | 2015-06-24 | Ucl Business Plc | Capsid |
| WO2017100671A1 (en) | 2015-12-11 | 2017-06-15 | California Institute Of Technology | TARGETING PEPTIDES FOR DIRECTING ADENO-ASSOCIATED VIRUSES (AAVs) |
| EP3448874A4 (en) | 2016-04-29 | 2020-04-22 | Voyager Therapeutics, Inc. | COMPOSITIONS FOR TREATING A DISEASE |
| US11299751B2 (en) | 2016-04-29 | 2022-04-12 | Voyager Therapeutics, Inc. | Compositions for the treatment of disease |
| JP7220080B2 (ja) | 2016-05-18 | 2023-02-09 | ボイジャー セラピューティクス インコーポレイテッド | ハンチントン病治療組成物及び方法 |
| RU2758488C2 (ru) | 2016-05-18 | 2021-10-28 | Вояджер Терапьютикс, Инк. | Модулирующие полинуклеотиды |
| EP3506817A4 (en) | 2016-08-30 | 2020-07-22 | The Regents of The University of California | METHOD FOR BIOMEDICAL TARGETING AND RELEASE, AND DEVICES AND SYSTEMS FOR IMPLEMENTING THEM |
| US10898585B2 (en) | 2017-04-14 | 2021-01-26 | Ptc Therapeutics .Inc. | Gene therapy for AADC deficiency |
| WO2018204786A1 (en) | 2017-05-05 | 2018-11-08 | Voyager Therapeutics, Inc. | Compositions and methods of treating amyotrophic lateral sclerosis (als) |
| WO2018204803A1 (en) | 2017-05-05 | 2018-11-08 | Voyager Therapeutics, Inc. | Compositions and methods of treating huntington's disease |
| JOP20190269A1 (ar) | 2017-06-15 | 2019-11-20 | Voyager Therapeutics Inc | بولي نوكليوتيدات aadc لعلاج مرض باركنسون |
| JP7229989B2 (ja) | 2017-07-17 | 2023-02-28 | ボイジャー セラピューティクス インコーポレイテッド | 軌道アレイガイドシステム |
| EP3662060A2 (en) * | 2017-08-03 | 2020-06-10 | Voyager Therapeutics, Inc. | Compositions and methods for delivery of aav |
| JP2020533968A (ja) * | 2017-08-25 | 2020-11-26 | オービッド・セラピューティクス・インコーポレイテッドOvid Therapeutics Inc. | 組換えアデノ随伴ベクター |
| MX2020003042A (es) * | 2017-09-29 | 2020-11-18 | Voyager Therapeutics Inc | Rescate del fenotipo neurológico central y periférico de la ataxia de friedreich mediante administración intravenosa. |
| EP4124658A3 (en) | 2017-10-16 | 2023-04-19 | Voyager Therapeutics, Inc. | Treatment of amyotrophic lateral sclerosis (als) |
| EP3697908A1 (en) | 2017-10-16 | 2020-08-26 | Voyager Therapeutics, Inc. | Treatment of amyotrophic lateral sclerosis (als) |
| US11376337B2 (en) | 2017-11-02 | 2022-07-05 | California Institute Of Technology | Expression of neuropeptides |
| WO2019090001A1 (en) | 2017-11-02 | 2019-05-09 | California Institute Of Technology | Neurokinin antagonists and uses thereof |
| US20190202866A1 (en) * | 2017-12-22 | 2019-07-04 | William Marsh Rice University | Viral nanoparticles and methods of use thereof |
| JP7378417B2 (ja) * | 2018-03-30 | 2023-11-13 | ザ ボード オブ トラスティーズ オブ ザ レランド スタンフォード ジュニア ユニバーシティー | 増強されたヒト膵臓トロピズムを有する新規な組換えアデノ随伴ウイルスキャプシド |
| BR112020020266A2 (pt) | 2018-04-03 | 2021-01-19 | Stridebio, Inc. | Vetores de vírus com evasão de anticorpos |
| MX2020010466A (es) | 2018-04-03 | 2021-01-08 | Vectores de virus que evitan anticuerpos. | |
| EP3773743A1 (en) | 2018-04-03 | 2021-02-17 | Stridebio, Inc. | Virus vectors for targeting ophthalmic tissues |
| AU2019253700A1 (en) * | 2018-04-09 | 2020-11-26 | Allen Institute | Rescuing voltage-gated sodium channel function in inhibitory neurons |
| US12054724B2 (en) | 2018-04-10 | 2024-08-06 | President And Fellows Of Harvard College | AAV vectors encoding clarin-1 or GJB2 and uses thereof |
| EP3773677A1 (en) * | 2018-04-12 | 2021-02-17 | Yissum Research Development Company of the Hebrew University of Jerusalem Ltd. | Anti-aging compositions and methods of use |
| MA52631A (fr) | 2018-05-15 | 2021-03-24 | Voyager Therapeutics Inc | Compositions et méthodes pour le traitement de la maladie de parkinson |
| WO2019222329A1 (en) | 2018-05-15 | 2019-11-21 | Voyager Therapeutics, Inc. | Compositions and methods for delivery of aav |
| EP3807404A1 (en) | 2018-06-13 | 2021-04-21 | Voyager Therapeutics, Inc. | Engineered 5' untranslated regions (5' utr) for aav production |
| CN112703198A (zh) | 2018-07-11 | 2021-04-23 | 布里格姆妇女医院 | 用于跨血脑屏障递送试剂的方法和组合物 |
| US20210355454A1 (en) | 2018-07-24 | 2021-11-18 | Voyager Therapeutics, Inc. | Systems and methods for producing gene therapy formulations |
| EP3830107A2 (en) | 2018-08-03 | 2021-06-09 | Voyager Therapeutics, Inc. | Aav variants with enhanced tropism |
| WO2020068990A1 (en) * | 2018-09-26 | 2020-04-02 | California Institute Of Technology | Adeno-associated virus compositions for targeted gene therapy |
| WO2020069461A1 (en) | 2018-09-28 | 2020-04-02 | Voyager Therapeutics, Inc. | Frataxin expression constructs having engineered promoters and methods of use thereof |
| WO2020072683A1 (en) | 2018-10-02 | 2020-04-09 | Voyager Therapeutics, Inc. | Redirection of tropism of aav capsids |
| US20210348242A1 (en) | 2018-10-04 | 2021-11-11 | Voyager Therapeutics, Inc. | Methods for measuring the titer and potency of viral vector particles |
| JP2022512621A (ja) | 2018-10-05 | 2022-02-07 | ボイジャー セラピューティクス インコーポレイテッド | Aav産生タンパク質をコードする操作された核酸コンストラクト |
| WO2020077165A1 (en) | 2018-10-12 | 2020-04-16 | Voyager Therapeutics, Inc. | Compositions and methods for delivery of aav |
| CA3116701A1 (en) | 2018-10-15 | 2020-04-23 | Voyager Therapeutics, Inc. | Expression vectors for large-scale production of raav in the baculovirus/sf9 system |
| HUE060949T2 (hu) | 2018-10-29 | 2023-04-28 | Inst Nat Sante Rech Med | Koleszterin 24-hidroláz expressziós vektor amiotrófiás laterálszklerózis kezelésében |
| CN113395975A (zh) * | 2018-11-20 | 2021-09-14 | 宾夕法尼亚州大学信托人 | 用于靶向血脑屏障的组合物和方法 |
| US20220064671A1 (en) | 2019-01-18 | 2022-03-03 | Voyager Therapeutics, Inc. | Methods and systems for producing aav particles |
| CA3128205A1 (en) * | 2019-01-30 | 2020-08-06 | The Broad Institute, Inc. | Systems for evolved adeno-associated viruses (aavs) for targeted delivery |
| CN110437317B (zh) * | 2019-01-30 | 2023-05-02 | 上海科技大学 | 具有变异衣壳蛋白的腺相关病毒及其用途 |
| AU2020223367A1 (en) * | 2019-02-15 | 2021-10-07 | Allen Institute | Artificial expression constructs for selectively modulating gene expression in selected neuronal cell populations |
| KR20220011616A (ko) | 2019-03-21 | 2022-01-28 | 스트라이드바이오 인코포레이티드 | 재조합 아데노 관련 바이러스 벡터 |
| KR20210143869A (ko) * | 2019-03-28 | 2021-11-29 | 더 제너럴 하스피탈 코포레이션 | 트랜스진 발현을 위한 조작된 아데노-연관 (aav) 벡터 |
| WO2020210655A1 (en) * | 2019-04-11 | 2020-10-15 | California Institute Of Technology | Virus compositions with enhanced specificity in the brain |
| GB201905301D0 (en) | 2019-04-15 | 2019-05-29 | Ospedale San Raffaele Srl | Gene therapy |
| WO2020223280A1 (en) | 2019-04-29 | 2020-11-05 | Voyager Therapeutics, Inc. | Aav variants with enhanced tropism |
| EP3962536A1 (en) | 2019-04-29 | 2022-03-09 | Voyager Therapeutics, Inc. | Systems and methods for producing baculoviral infected insect cells (biics) in bioreactors |
| JP2022530824A (ja) * | 2019-04-30 | 2022-07-01 | ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア | ポンペ病の治療のために有用な組成物 |
| EP3966227A1 (en) | 2019-05-07 | 2022-03-16 | Voyager Therapeutics, Inc. | Compositions and methods for the vectored augmentation of protein destruction, expression and/or regulation |
| WO2020234363A2 (en) | 2019-05-21 | 2020-11-26 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Expression vector for cholesterol 24-hydrolase in therapy of rett syndrome |
| US20220281922A1 (en) | 2019-08-02 | 2022-09-08 | Voyager Therapeutics, Inc. | Aav variants with enhanced tropism |
| EP4010465A1 (en) | 2019-08-09 | 2022-06-15 | Voyager Therapeutics, Inc. | Cell culture medium for use in producing gene therapy products in bioreactors |
| US20220364114A1 (en) | 2019-08-26 | 2022-11-17 | Voyager Therapeutics, Inc. | Controlled expression of viral proteins |
| CN115087738A (zh) * | 2019-08-29 | 2022-09-20 | 小利兰·斯坦福大学托管委员会 | 用于穿越人血脑屏障的腺相关病毒载体 |
| US20220333133A1 (en) | 2019-09-03 | 2022-10-20 | Voyager Therapeutics, Inc. | Vectorized editing of nucleic acids to correct overt mutations |
| GB201913974D0 (en) * | 2019-09-27 | 2019-11-13 | King S College London | Vector |
| US20210162002A1 (en) * | 2019-10-17 | 2021-06-03 | The Penn State Research Foundation | Regenerating functional neurons for treatment of spinal cord injury and als |
| CN114585743A (zh) * | 2019-10-17 | 2022-06-03 | 斯特里迪比奥公司 | Aav转移盒 |
| AU2020367532A1 (en) | 2019-10-17 | 2022-05-12 | Ginkgo Bioworks, Inc. | Adeno-associated viral vectors for treatment of Niemann-Pick disease type C |
| IL293068A (en) * | 2019-11-19 | 2022-07-01 | Asklepios Biopharmaceutical Inc | A therapeutic adeno-associated virus containing liver-specific promoters for the treatment of Pompe disease and lysosomal disorders |
| US11981705B2 (en) | 2020-01-10 | 2024-05-14 | The Brigham And Women's Hospital, Inc. | Methods and compositions for delivery of immunotherapy agents across the blood-brain barrier to treat brain cancer |
| WO2021163357A2 (en) | 2020-02-13 | 2021-08-19 | Tenaya Therapeutics, Inc. | Gene therapy vectors for treating heart disease |
| AU2021218411A1 (en) | 2020-02-13 | 2022-10-06 | Tenaya Therapeutics, Inc. | Gene therapy vectors for treating heart disease |
| CA3180202A1 (en) * | 2020-04-20 | 2021-10-28 | Tenaya Therapeutics, Inc. | Adeno-associated virus with engineered capsid |
| CN112011571A (zh) * | 2020-04-26 | 2020-12-01 | 辉大(上海)生物科技有限公司 | 一种用于治疗脊髓性肌萎缩的基因治疗药物 |
| AU2021265832A1 (en) | 2020-04-29 | 2022-11-24 | The Broad Institute, Inc. | Machine learning accelerated protein engineering through fitness prediction |
| WO2021222831A2 (en) * | 2020-05-01 | 2021-11-04 | The Broad Institute, Inc. | Engineered central nervous system compositions |
| BR112022023106A2 (pt) * | 2020-05-13 | 2023-01-17 | Voyager Therapeutics Inc | Redirecionamento de tropismo de capsídeos de aav |
| WO2021247995A2 (en) | 2020-06-04 | 2021-12-09 | Voyager Therapeutics, Inc. | Compositions and methods of treating neuropathic pain |
| GB202010981D0 (en) | 2020-07-16 | 2020-09-02 | Ucl Business Ltd | Gene therapy for neuromuscular and neuromotor disorders |
| WO2022017630A1 (en) | 2020-07-23 | 2022-01-27 | Ucl Business Ltd | GENE THERAPY VECTOR FOR eEF1A2 AND USES THEREOF |
| WO2022026410A2 (en) | 2020-07-27 | 2022-02-03 | Voyager Therapeutics, Inc | Compositions and methods for the treatment of niemann-pick type c1 disease |
| CN117120619A (zh) | 2020-07-27 | 2023-11-24 | 沃雅戈治疗公司 | 用于治疗与葡萄糖神经酰胺酶β缺陷相关的神经病症的组合物和方法 |
| EP4192962A1 (en) | 2020-08-05 | 2023-06-14 | Spacecraft Seven, LLC | Csrp3 (cysteine and glycine rich protein 3) gene therapy |
| WO2022032153A1 (en) | 2020-08-06 | 2022-02-10 | Voyager Therapeutics, Inc. | Cell culture medium for use in producing gene therapy products in bioreactors |
| KR20230043869A (ko) | 2020-08-07 | 2023-03-31 | 스페이스크래프트 세븐, 엘엘씨 | Aav 벡터를 사용한 플라코필린-2(pkp2) 유전자 요법 |
| US20230340041A1 (en) | 2020-08-17 | 2023-10-26 | Massachusetts Institute Of Technology | Shank3 gene therapy approaches |
| KR20230068444A (ko) | 2020-08-19 | 2023-05-17 | 사렙타 쎄러퓨틱스 인코퍼레이티드 | 레트 증후군의 치료를 위한 아데노 관련 바이러스 벡터 |
| WO2022040527A2 (en) * | 2020-08-21 | 2022-02-24 | Capsida, Inc. | Adeno-associated virus compositions having preferred expression levels |
| US20230365963A1 (en) * | 2020-09-21 | 2023-11-16 | Asklepios Biopharmaceutical, Inc. | Methods for treating neurological disease |
| CN113717248B (zh) * | 2020-09-30 | 2022-07-08 | 广州派真生物技术有限公司 | 腺相关病毒突变体及其应用 |
| US20220154223A1 (en) | 2020-10-15 | 2022-05-19 | Hoffmann-La Roche Inc. | Nucleic acid constructs for simultaneous gene activation |
| CN116648448A (zh) | 2020-11-11 | 2023-08-25 | 欧洲分子生物学实验室 | 用于基因治疗的修饰病毒粒子 |
| TW202237850A (zh) | 2020-12-01 | 2022-10-01 | 賓州大學委員會 | 具有組織特異性靶向基序的新穎構成物及含有其之組成物 |
| US20240141378A1 (en) | 2021-03-03 | 2024-05-02 | Voyager Therapeutics, Inc. | Controlled expression of viral proteins |
| WO2022187473A2 (en) | 2021-03-03 | 2022-09-09 | Voyager Therapeutics, Inc. | Controlled expression of viral proteins |
| WO2022221421A2 (en) * | 2021-04-13 | 2022-10-20 | Capsida, Inc. | Aav compositions with high brain expression for treating mucopolysaccharidosis ii |
| CA3216491A1 (en) | 2021-04-16 | 2022-10-20 | Asklepios Biopharmaceutical, Inc. | Rational polyploid aav virions that cross the blood brain barrier and elicit reduced humoral response |
| US20240207452A1 (en) | 2021-04-23 | 2024-06-27 | The Trustees Of The University Of Pennsylvania | Novel compositions with brain-specific targeting motifs and compositions containing same |
| JP2024523707A (ja) | 2021-07-08 | 2024-06-28 | テナヤ セラピューティクス, インコーポレイテッド | 遺伝子治療のための最適化された発現カセット |
| EP4405373A1 (en) * | 2021-09-21 | 2024-07-31 | California Institute of Technology | Viral compositions for targeting the nervous system and the lung |
| WO2023060264A1 (en) | 2021-10-08 | 2023-04-13 | Dyno Therapeutics, Inc. | Capsid variants and methods of using the same |
| WO2023073526A1 (en) | 2021-10-25 | 2023-05-04 | Novartis Ag | Methods for improving adeno-associated virus (aav) delivery |
| TW202334436A (zh) * | 2021-11-02 | 2023-09-01 | 美商航海家醫療公司 | Aav衣殼變異體及其用途 |
| EP4442830A1 (en) | 2021-11-29 | 2024-10-09 | Shanghai Regenelead Therapies Co., Ltd. | Aadc/gdnf polynucleotide, and use thereof in treating parkinson's disease |
| CN114107231B (zh) * | 2021-12-13 | 2023-08-18 | 重庆大学 | 实现全脑突触后神经元胞体标记的重组腺相关病毒及其应用 |
| WO2023147374A2 (en) | 2022-01-25 | 2023-08-03 | Voyager Therapeutics, Inc. | Baculovirus expression system |
| CN116554278A (zh) * | 2022-01-30 | 2023-08-08 | 上海玮美基因科技有限责任公司 | 变异型腺相关病毒及其在疾病治疗中的应用 |
| AU2023220237A1 (en) | 2022-02-21 | 2024-08-15 | Shanghai Regenelead Therapies Co., Ltd | Vegf-binding molecule and pharmaceutical use thereof |
| WO2023164545A1 (en) | 2022-02-23 | 2023-08-31 | Massachusetts Institute Of Technology | Methods for upregulating shank3 expression |
| WO2023205397A1 (en) * | 2022-04-22 | 2023-10-26 | The Children's Hospital Of Philadelphia | Human ependyma-specific promoter and uses thereof |
| WO2023240158A2 (en) * | 2022-06-07 | 2023-12-14 | Oregon Health & Science University | Mutant adeno-associated virus (aav) capsids |
| WO2023240236A1 (en) * | 2022-06-10 | 2023-12-14 | Voyager Therapeutics, Inc. | Compositions and methods for the treatment of spinal muscular atrophy related disorders |
| TW202421787A (zh) | 2022-09-06 | 2024-06-01 | 美商特納亞治療股份有限公司 | 保護心臟之心臟病療法 |
| WO2024054983A1 (en) | 2022-09-08 | 2024-03-14 | Voyager Therapeutics, Inc. | Controlled expression of viral proteins |
| GB2622629A (en) | 2022-09-23 | 2024-03-27 | Sania Rx Ltd | Method |
| WO2024100145A1 (en) | 2022-11-08 | 2024-05-16 | Ospedale San Raffaele S.R.L. | Polynucleotide and vector |
| WO2024175604A1 (en) | 2023-02-21 | 2024-08-29 | Institut National de la Santé et de la Recherche Médicale | Methods and pharmaceutical composition for the treatment of sanfilippo syndrome type iiib |
| WO2024186275A1 (en) * | 2023-03-09 | 2024-09-12 | Agency For Science, Technology And Research | Novel compositions of adeno-associated viruses engineered for enhanced tissue transduction and specificity |
| WO2024191778A1 (en) | 2023-03-10 | 2024-09-19 | Dyno Therapeutics, Inc. | Capsid polypeptides and methods of use thereof |
| WO2024194491A1 (en) | 2023-03-22 | 2024-09-26 | Ospedale San Raffaele S.R.L. | Gene therapy |
| WO2024199478A1 (en) * | 2023-03-31 | 2024-10-03 | Exegenesis Bio Co. | Variant aav9 capsid proteins and uses thereof |
| CN117264912A (zh) * | 2023-09-25 | 2023-12-22 | 中国科学院深圳先进技术研究院 | 一种重组腺相关病毒颗粒、重组腺相关病毒载体系统及其应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1290205B1 (en) * | 2000-06-01 | 2006-03-01 | University Of North Carolina At Chapel Hill | Duplexed parvovirus vectors |
| RU2457252C2 (ru) * | 2006-06-21 | 2012-07-27 | Амстердам Молекьюла Терапьютикс (Амт) Ип Б.В. | AAV ВЕКТОРЫ С УСОВЕРШЕНСТВОВАННЫМИ Rep-КОДИРУЮЩИМИ ПОСЛЕДОВАТЕЛЬНОСТЯМИ, ИСПОЛЬЗУЕМЫМИ В СИСТЕМАХ ПРОДУКЦИИ НА ОСНОВЕ КЛЕТОК НАСЕКОМЫХ |
| US20150079038A1 (en) * | 2013-09-13 | 2015-03-19 | California Institute Of Technology | Selective recovery |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5919676A (en) | 1993-06-24 | 1999-07-06 | Advec, Inc. | Adenoviral vector system comprising Cre-loxP recombination |
| US6379943B1 (en) | 1999-03-05 | 2002-04-30 | Merck & Co., Inc. | High-efficiency Cre/loxp based system for construction of adenovirus vectors |
| US7279313B2 (en) | 1995-09-15 | 2007-10-09 | Centelion | Circular DNA molecule having a conditional origin of replication, process for their preparation and their use in gene therapy |
| US6228646B1 (en) | 1996-03-07 | 2001-05-08 | The Regents Of The University Of California | Helper-free, totally defective adenovirus for gene therapy |
| AU722375B2 (en) | 1996-09-06 | 2000-08-03 | Trustees Of The University Of Pennsylvania, The | Methods using cre-lox for production of recombinant adeno-associated viruses |
| DE19933719A1 (de) | 1999-07-19 | 2001-01-25 | Medigene Ag | Strukturprotein in Adeno-assoziiertem Virus mit veränderten chromatographischen Eigenschaften, seine Herstellung und Verwendung |
| WO2001055361A2 (en) | 2000-01-26 | 2001-08-02 | Chiron Corporation | Recombinant aav packaging systems |
| US6410271B1 (en) | 2000-06-23 | 2002-06-25 | Genetastix Corporation | Generation of highly diverse library of expression vectors via homologous recombination in yeast |
| WO2004083441A2 (en) | 2003-03-19 | 2004-09-30 | Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts | Random peptide library displayed on aav vectors |
| US8927269B2 (en) | 2003-05-19 | 2015-01-06 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Avian adenoassociated virus and uses thereof |
| US9233131B2 (en) * | 2003-06-30 | 2016-01-12 | The Regents Of The University Of California | Mutant adeno-associated virus virions and methods of use thereof |
| ES2648241T3 (es) | 2003-09-30 | 2017-12-29 | The Trustees Of The University Of Pennsylvania | Clados de virus adenoasociados (AAV), secuencias, vectores que contienen el mismo, y usos de los mismos |
| WO2006099615A2 (en) | 2005-03-16 | 2006-09-21 | The Johns Hopkins University | Adenoviral fiber exchange shuttle system |
| WO2008103993A2 (en) | 2007-02-23 | 2008-08-28 | University Of Florida Research Foundation, Inc. | Compositions and methods for treating glycogen storage diseases |
| ES2615180T3 (es) | 2007-07-14 | 2017-06-05 | University Of Iowa Research Foundation | Métodos y composiciones para el tratamiento de enfermedades cerebrales |
| US9018138B2 (en) | 2007-08-16 | 2015-04-28 | The Johns Hopkins University | Compositions and methods for generating and screening adenoviral libraries |
| US20110223635A1 (en) | 2008-08-11 | 2011-09-15 | Karl Deisseroth | Method and Composition for Controlling Gene Expression |
| EP2561073B1 (en) | 2010-04-23 | 2016-08-24 | University of Massachusetts | Cns targeting aav vectors and methods of use thereof |
| CN103492574B (zh) | 2011-02-22 | 2015-12-09 | 加州理工学院 | 使用腺相关病毒(aav)载体递送蛋白 |
| RS62795B1 (sr) | 2011-04-22 | 2022-02-28 | Univ California | Adeno-povezani virioni virusa sa varijantama kapsida i postupci za njihovu primenu |
| WO2013029030A1 (en) | 2011-08-24 | 2013-02-28 | The Board Of Trustees Of The Leland Stanford Junior University | New aav capsid proteins for nucleic acid transfer |
| CA2923352C (en) | 2013-09-19 | 2022-05-03 | Crucell Holland B.V. | Stable adenovirus formulations |
| GB201403684D0 (en) * | 2014-03-03 | 2014-04-16 | King S College London | Vector |
| HUE054768T2 (hu) | 2014-05-02 | 2021-09-28 | Genzyme Corp | AAV vektorok retina és CNS génterápiára |
| WO2017100671A1 (en) | 2015-12-11 | 2017-06-15 | California Institute Of Technology | TARGETING PEPTIDES FOR DIRECTING ADENO-ASSOCIATED VIRUSES (AAVs) |
| WO2018204786A1 (en) | 2017-05-05 | 2018-11-08 | Voyager Therapeutics, Inc. | Compositions and methods of treating amyotrophic lateral sclerosis (als) |
| WO2018204797A1 (en) | 2017-05-05 | 2018-11-08 | Voyager Therapeutics, Inc. | Modulatory polynucleotides |
| WO2018204803A1 (en) | 2017-05-05 | 2018-11-08 | Voyager Therapeutics, Inc. | Compositions and methods of treating huntington's disease |
| EP3662060A2 (en) | 2017-08-03 | 2020-06-10 | Voyager Therapeutics, Inc. | Compositions and methods for delivery of aav |
-
2016
- 2016-12-09 WO PCT/US2016/065969 patent/WO2017100671A1/en active Application Filing
- 2016-12-09 RU RU2018120736A patent/RU2727672C2/ru active
- 2016-12-09 US US15/374,596 patent/US11499165B2/en active Active
- 2016-12-09 EP EP16873985.2A patent/EP3387137B1/en active Active
- 2016-12-09 CN CN201680081708.1A patent/CN108699565B/zh active Active
- 2016-12-09 CO CONC2018/0007203A patent/CO2018007203A2/es unknown
- 2016-12-09 KR KR1020187019747A patent/KR102423442B1/ko active IP Right Grant
- 2016-12-09 JP JP2018530606A patent/JP7066619B2/ja active Active
- 2016-12-09 CA CA3007495A patent/CA3007495C/en active Active
- 2016-12-09 EP EP21152352.7A patent/EP3875593A1/en active Pending
- 2016-12-09 BR BR112018011711A patent/BR112018011711A2/pt active Search and Examination
- 2016-12-09 MX MX2018006840A patent/MX2018006840A/es unknown
- 2016-12-09 SG SG11201804713VA patent/SG11201804713VA/en unknown
- 2016-12-09 ES ES16873985T patent/ES2869284T3/es active Active
- 2016-12-09 AU AU2016366549A patent/AU2016366549B2/en active Active
- 2016-12-09 DK DK16873985.2T patent/DK3387137T3/da active
- 2016-12-09 IL IL259842A patent/IL259842B/en unknown
-
2018
- 2018-06-07 CL CL2018001522A patent/CL2018001522A1/es unknown
- 2018-06-07 ZA ZA201803808A patent/ZA201803808B/en unknown
- 2018-12-27 HK HK18116620.4A patent/HK1257563A1/zh unknown
-
2022
- 2022-10-17 US US18/047,233 patent/US20230295659A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1290205B1 (en) * | 2000-06-01 | 2006-03-01 | University Of North Carolina At Chapel Hill | Duplexed parvovirus vectors |
| RU2457252C2 (ru) * | 2006-06-21 | 2012-07-27 | Амстердам Молекьюла Терапьютикс (Амт) Ип Б.В. | AAV ВЕКТОРЫ С УСОВЕРШЕНСТВОВАННЫМИ Rep-КОДИРУЮЩИМИ ПОСЛЕДОВАТЕЛЬНОСТЯМИ, ИСПОЛЬЗУЕМЫМИ В СИСТЕМАХ ПРОДУКЦИИ НА ОСНОВЕ КЛЕТОК НАСЕКОМЫХ |
| US20150079038A1 (en) * | 2013-09-13 | 2015-03-19 | California Institute Of Technology | Selective recovery |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2016366549A1 (en) | 2018-07-12 |
| KR102423442B1 (ko) | 2022-07-20 |
| AU2016366549B2 (en) | 2022-11-10 |
| DK3387137T3 (da) | 2021-05-03 |
| CN108699565B (zh) | 2023-08-08 |
| JP2019506141A (ja) | 2019-03-07 |
| CA3007495C (en) | 2023-04-11 |
| HK1257563A1 (zh) | 2019-10-25 |
| EP3387137B1 (en) | 2021-02-03 |
| EP3387137A4 (en) | 2019-06-12 |
| WO2017100671A1 (en) | 2017-06-15 |
| CO2018007203A2 (es) | 2018-09-20 |
| US20230295659A1 (en) | 2023-09-21 |
| MX2018006840A (es) | 2019-03-28 |
| EP3875593A1 (en) | 2021-09-08 |
| ZA201803808B (en) | 2020-11-25 |
| BR112018011711A2 (pt) | 2018-12-04 |
| ES2869284T3 (es) | 2021-10-25 |
| EP3387137A1 (en) | 2018-10-17 |
| KR20180097629A (ko) | 2018-08-31 |
| CL2018001522A1 (es) | 2018-12-21 |
| US11499165B2 (en) | 2022-11-15 |
| RU2018120736A3 (ru) | 2020-01-13 |
| JP7066619B2 (ja) | 2022-05-13 |
| CA3007495A1 (en) | 2017-06-15 |
| IL259842A (en) | 2018-07-31 |
| RU2018120736A (ru) | 2020-01-13 |
| US20170166926A1 (en) | 2017-06-15 |
| IL259842B (en) | 2022-08-01 |
| CN108699565A (zh) | 2018-10-23 |
| SG11201804713VA (en) | 2018-07-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2727672C2 (ru) | Нацеливающие пептиды для направленной доставки аденоассоциированных вирусов (aav) | |
| US11932668B2 (en) | Selective recovery | |
| JP2023123765A (ja) | 中枢神経系を標的化したaavベクター | |
| CN107438671B (zh) | 变体RNAi | |
| JP2022527917A (ja) | 導入遺伝子発現のための操作されたアデノ随伴(aav)ベクター | |
| WO2022235702A1 (en) | Recombinant aavs for delivery to central nervous system and brain vasculature | |
| JP2021534814A (ja) | アルファ−シヌクレインに対するバリアントRNAi | |
| RU2788605C2 (ru) | ОЛИГОДЕНДРОЦИТ-СПЕЦИФИЧНЫЙ ПРОМОТОР, микроРНК, СПЕЦИФИЧНАЯ К ГЕНУ PLP1, ВЕКТОР, СОДЕРЖАЩИЙ УКАЗАННЫЙ ПРОМОТОР И/ИЛИ УКАЗАННУЮ микроРНК, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННЫЙ ВЕКТОР | |
| CN116761812A (zh) | Neurod1和dlx2载体 |