RU2567856C2 - СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЕННЫХ-8-АЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-c]ПИРИМИДИН-2-АМИНОВ - Google Patents
СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЕННЫХ-8-АЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-c]ПИРИМИДИН-2-АМИНОВ Download PDFInfo
- Publication number
- RU2567856C2 RU2567856C2 RU2012156217/04A RU2012156217A RU2567856C2 RU 2567856 C2 RU2567856 C2 RU 2567856C2 RU 2012156217/04 A RU2012156217/04 A RU 2012156217/04A RU 2012156217 A RU2012156217 A RU 2012156217A RU 2567856 C2 RU2567856 C2 RU 2567856C2
- Authority
- RU
- Russia
- Prior art keywords
- triazolo
- formula
- alkoxy
- substituted
- pyrimidinylamino
- Prior art date
Links
- 0 CC1C(C(*)=C)*(C)=C*1 Chemical compound CC1C(C(*)=C)*(C)=C*1 0.000 description 2
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
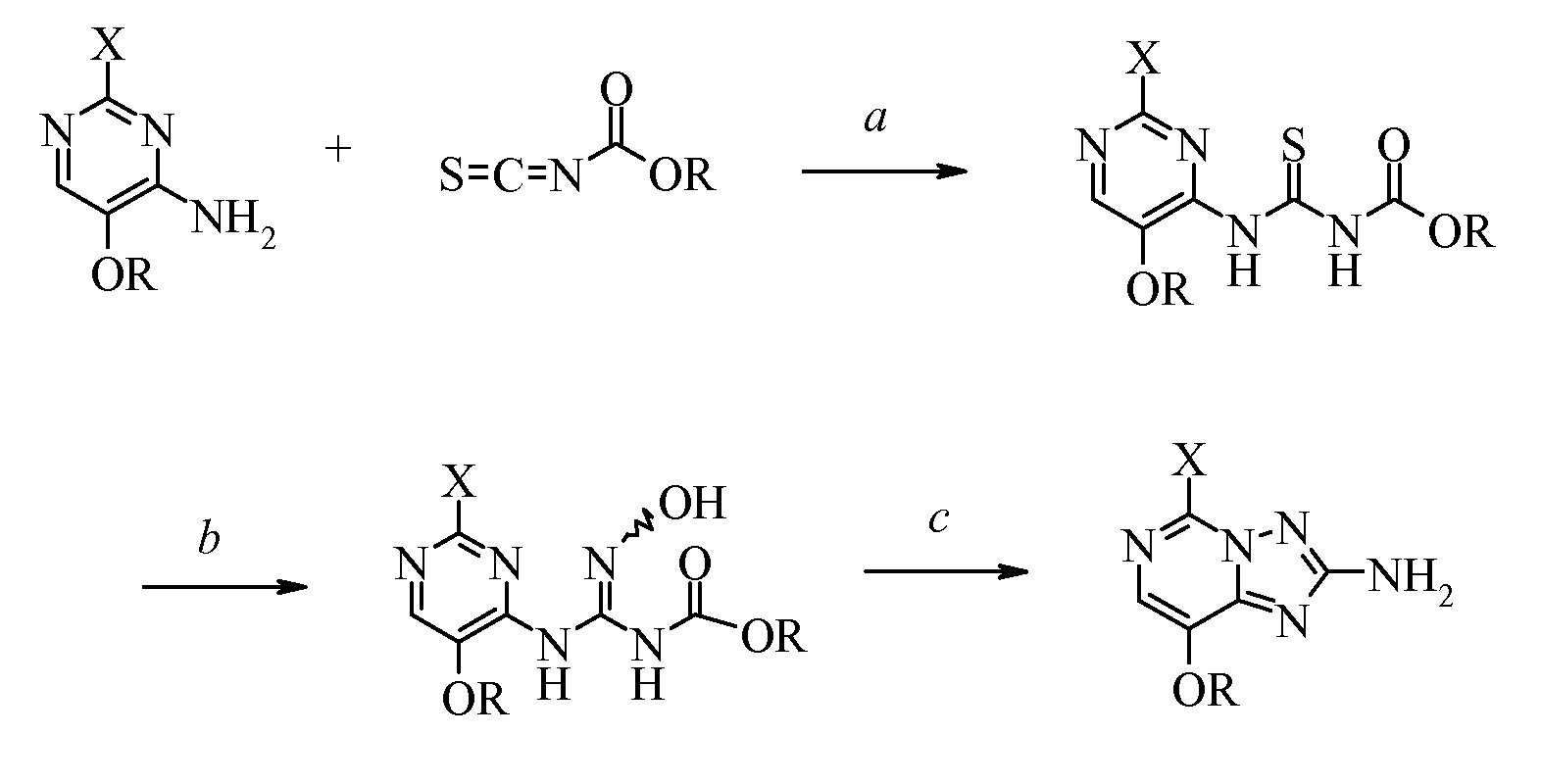
Изобретение относится к способу получения 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов формулы (I):, где X представляет собой галоген или OR; и R представляет собой C1-С4алкил; который включает: i) взаимодействие 2-замещенного-4-амино-5-алкоксипиримидина формулы: с изотиоцианатидокарбонатом формулы: в полярном апротонном растворителе с получением (пиримидиниламино)карбонотиоилкарбамата формулы: ; ii) приведение в контакт (пиримидиниламино)карбонотиоилкарбамата с гидроксиламином в присутствии основания с получением (пиримидиниламино)(гидроксиимино)метилкарбамата формулы: и iii) циклизацию (пиримидиниламино)(гидроксиимино)метилкарбамата нагреванием в инертном растворителе с получением 5-замещенного-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина. Изобретение относится также к способу получения 2-амино-5,8-алкокси[1,2,4]триазоло[1,5-с]пиримидинов формулы:, где R представляет собой C1-С4алкил; который включает приведение в контакт 5-галоген-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина формулы: , где Х представляет собой галоген; и R представляет собой C1-С4алкил; с алкоксидом щелочного металла в спиртовом растворителе. Изобретение также относится к соединениям формул:и , где X представляет собой галоген или OR; и R представляет собой C1-С4алкил. Технический результат: получение 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов с высоким выходом без использования гидразина и циангалогенида. 4 н. и 2 з.п. ф-лы, 7 пр.
Description
Настоящее изобретение относится к способу получения 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов.
В патенте США 6005108 описаны некоторые замещенные 5,8-дизамещенные-[1,2,4]триазоло[1,5-с]пиримидин-2-аминные соединения и их применение в качестве промежуточных соединений для получения сульфонамидных гербицидов. 5,8-Диметокси[1,2,4]триазоло[1,5-с]пиримидин-2-амин является полезным промежуточным соединением для получения пеноксулама. В Monatsh. Chem. 1983, 114, 789 описано получение некоторых (амино)карбонотиоилкарбаматов с последующим их взаимодействием с гидроксиламином и последующей циклизацией в [1,2,4]триазоло[1,5-а]пиримидин-2-амины. В WO 2009/047514 A1 описано получение некоторых (амино)карбонотиоилкарбаматов с последующим их взаимодействием с гидроксиламином и последующей циклизацией в [1,2,4]триазоло[1,5-а]пиридиновые и [1,2,4]триазоло[1,5-с]пиримидиновые соединения. В US 6559101 В2 описано получение некоторых (амино)карбонотиоилкарбаматов с последующим их взаимодействием с гидроксиламином и последующей циклизацией в пиримидинзамещенные [1,2,4]триазоло[1,5-а] пиримидин-2-амины.
5,8-Диметокси[1,2,4]триазоло[1,5-с]пиримидин-2-амин получают из 2,4-дихлор-5-метоксипиримидина в многостадийном способе, который включает как гидразин, так и циангалогенид. Гидразин представляет серьезную опасность взрыва и является токсичным при проглатывании, вдыхании и адсорбции кожей. Он классифицируется как канцероген и имеет TLV 0,1 ч./млн в воздухе. Циангалогениды являются сильными раздражителями и очень ядовиты. Было бы выгодно получать 5-замещенные-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амины эффективно и с высоким выходом в производственном процессе, который позволит избежать использования гидразина и циангалогенида.
Настоящее изобретение относится к получению 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов из 2-замещенных-4-амино-5-метоксипиримидинов. Более конкретно, настоящее изобретение относится к способу получения 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов формулы (I):
где
X представляет собой галоген или OR; и
R представляет собой C1-С4алкил;
который включает:
i) взаимодействие 2-замещенного-4-амино-5-алкоксипиримидина формулы:
где X и R являются такими, как определено выше,
с изотиоцианатидокарбонатом формулы:
где R является таким, как определено выше,
в полярном апротонном растворителе с получением (пиримидиниламино)карбонотиоилкарбамата формулы:
где X и R являются такими, как определено выше;
ii) приведение в контакт (пиримидиниламино)карбонотиоилкарбамата с гидроксиламином в присутствии основания с получением (пиримидиниламино)(гидроксиимино)метилкарбамата формулы:
где X и R являются такими, как определено выше; и
iii) циклизацию (пиримидиниламино)(гидроксиимино)метилкарбамата нагреванием в инертном растворителе с получением 5-замещенного-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина.
В другом варианте осуществления изобретения 5-галоген-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амины могут быть преобразованы в соответствующие 5,8-диалкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амины заменой галогена алкоксидом щелочного металла в спиртовом растворителе.
Другой вариант осуществления изобретения включает (пиримидиниламино)карбонотиоилкарбамат формулы:
где
X представляет собой галоген или OR; и
R представляет собой C1-С4алкил.
Еще один вариант осуществления изобретения включает (пиримидиниламино)(гидроксиимино)метилкарбамат формулы:
где
X представляет собой галоген или OR; и
R представляет собой C1-С4алкил.
Данное вещество может существовать в виде пары геометрических изомеров (E и Z), а также в различных таутомерных формах.
Дополнительный вариант осуществления изобретения включает 5-галоген-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амины формулы:
где
X представляет собой галоген; и
R представляет собой C1-С4алкил.
Термин алкил и производные термины, такие как алкокси, как используется в настоящем описании, относятся к группам с неразветвленной или разветвленной цепью. Конкретные алкильные группы представляют собой метил, этил, пропил, 1-метилэтил, бутил, 1,1-диметилэтил и 1-метилпропил. Метил и этил являются обычно предпочтительными. Термин галоген, как используется в настоящем описании, относится к фтору, хлору, брому и йоду. Группа хлора является обычно предпочтительной.
2-Замещенные-4-амино-5-алкоксипиримидиновые и алкилизотиоцианатидокарбонатные исходные вещества являются известными соединениями или могут быть получены способами, хорошо известными специалистам в данной области.
Настоящее изобретение относится к получению 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов из 2-замещенных-4-амино-5-метоксипиримидинов.
Первая стадия (а) настоящего изобретения касается преобразования 4-аминопиримидина, где
X представляет собой галоген или OR, и
R представляет собой С1-С4алкил,
в (пиримидиниламино)карбонотиоилкарбамат. Это достигается с помощью по меньшей мере одного эквивалента и, предпочтительно, избытка изотиоцианатидокарбоната в полярном апротонном растворителе, предпочтительно ацетонитриле или этилацетате. Также возможно проводить реакцию в присутствии дополнительных разбавителей при условии, что эти растворители не мешают протеканию желаемой реакции и химически инертны в отношении реагентов. Изотиоцианатидокарбонат добавляют при температуре от 0°C до комнатной температуры; смесь, как правило, нагревают до некоторой температуры в диапазоне от комнатной температуры до температуры кипения с обратным холодильником добавленного разбавителя, предпочтительно до температуры кипения с обратным холодильником. Продукт выделяют обычными способами, такими как фильтрование осажденного или кристаллизованного вещества.
В конкретной реакции аминопиримидин растворяют или суспендируют в этилацетате и затем обрабатывают соответствующим количеством изотиоцианатидокарбоната. После нагревания до температуры кипения с обратным холодильником реакционную смесь охлаждают до температуры, при которой целевое соединение осаждается, и отделяют фильтрованием и сушат. Необязательно, некоторая или большая часть растворителя может быть удалена перегонкой перед фильтрованием, для улучшения фильтрования кристаллов или снижения растворимости продукта в растворителе и, тем самым, улучшения выделения.
Вторая стадия (b) настоящего изобретения касается преобразования (пиримидиниламино)карбонотиоилкарбамата в его (пиримидиниламино)(гидроксиимино)метилкарбаматный эквивалент. Это достигается использованием по меньшей мере эквивалента гидроксиламина, предпочтительно в виде соли, и основания, такого как карбонат натрия или калия, гидроксид натрия или калия или триалкиламин. Карбонат натрия или гидроксид натрия являются предпочтительными вспомогательными основаниями. Обычно используют вплоть до 4 эквивалентов гидроксиламина и основания в этой реакции. Реакционную смесь разбавляют водой и полярным растворителем, предпочтительно этилацетатом или ацетонитрилом, и перемешивают при температуре от 0°C до 35°C, предпочтительно при комнатной температуре. Также возможно проводить реакцию в присутствии дополнительных разбавителей при условии, что эти разбавители не мешают протеканию желаемой реакции и химически инертны в отношении реагентов. Продукт необязательно охлаждают и выделяют обычными способами, такими как выделение фильтрованием и сушка, или флэш-хроматографией. Вещество может существовать в виде E/Z изомерной смеси и/или в различных таутомерных формах. Необязательно, вместо того чтобы выделять (пиримидиниламино)(гидроксиимино)метилкарбамат, реакция может быть продолжена в реакционной смеси при нагревании для осуществления циклизации в 5-замещенные-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амины и выделения в соответствии с подробным описанием ниже.
В конкретной реакции (пиримидиниламино)карбонотиоилкарбамат, гидроксиламин и основание растворяют в воде и либо в ацетонитриле, либо в этилацетате. Реакционную смесь перемешивают при комнатной температуре и затем либо нагревают для преобразования в 5-замещенный-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амин, либо фильтруют и перекристаллизовывают из ацетонитрила с выделением (пиримидиниламино)(гидроксиимино)метилкарбамата. Необязательно, некоторая или большая часть растворителя может быть удалена перегонкой перед фильтрованием для улучшения фильтрования кристаллов или снижения растворимости продукта в растворителе и тем самым улучшения выделения.
Третья стадия (с) настоящего изобретения касается преобразования необязательно выделенного (пиримидиниламино)(гидроксиимино)метилкарбамата в 5-замещенный-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амин при нагревании и в инертном растворителе. Часто предпочтительно преобразовывать (пиримидиниламино)(гидроксиимино)метилкарбамат в 5-замещенный-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амин без выделения. Это преобразование осуществляют нагреванием реакционной смеси. Продукт необязательно охлаждают и выделяют обычными методами, такими как выделение фильтрованием и сушка.
Другой вариант осуществления изобретения касается преобразования (d) 5-галоген-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина:
где
X представляет собой галоген; и
R представляет собой C1-С4алкил,
в его алкокси аналог, 5,8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амин, с использованием по меньшей мере одного эквивалента и предпочтительно избытка метоксида натрия или калия в спиртовом растворителе. Также возможно проводить реакцию в присутствии дополнительных разбавителей при условии, что эти разбавители не мешают протеканию желаемой реакции и химически инертны в отношении реагентов. Смесь перемешивают при некоторой температуре от 0°C до 50°C, предпочтительно при комнатой температуре. Продукт необязательно охлаждают и выделяют обычными методами, такими как выделение фильтрованием и сушка.
В конкретной реакции 5-хлор-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амин растворяют в ацетонитриле при комнатной температуре и обрабатывают 25% метоксидом натрия в метаноле. Полученную суспензию перемешивают при комнатной температуре несколько часов и затем фильтруют и сушат с получением 5-метокси-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина. Необязательно, некоторая или большая часть растворителя может быть удалена перегонкой перед фильтрованием, для улучшения фильтрования кристаллов или снижения растворимости продукта в растворителе и тем самым улучшения выделения.
Следующие примеры приведены для иллюстрации изобретения.
ПРИМЕРЫ
Все описанные реагенты были куплены и использовались без дополнительной очистки. Анализ ВЭЖХ проводили на приборе Perkin Elmer Series 200 с диодно-матричным ультрафиолетовым детектором. Использовали колонку Zorbax RX-C8 с различными соотношениями ацетонитрил-вода, модифицированную 0,1% фосфорную кислоту в качестве элюента при скорости потока 1 мл/мин и ультрафиолетовое детектирование при 220 нм. Спектры ядерного магнитного резонанса получали на спектрометре Bruker AC 300 NMR (300 МГц). Масс-спектральные данные получали с использованием точной масс-жидкостной хроматографии с электрораспылением-масс-спектрометрии (ESI/ЖХ/МС) в положительно ионном (PI) режиме и точной масс-жидкостной хроматографии с электрораспылением-масс-спектрометрии-масс-спектрометрии (ESI/ЖХ/МС/МС).
Пример 1. Получение этил[(2-хлор-5-метоксипиримидин-4-ил)амино]карбонотиоилкарбамата (2)
2-Хлор-5-метоксипиримидин-4-амин (1) (6,4 г, 0,040 моль) суспендировали в этилацетате (100 мл) и нагревали почти до температуры кипения с обратным холодильником. Добавляли сразу весь этилизотиоцианатидокарбонат (8,9 г, 1,7 экв.) и смесь кипятили с обратным холодильником в течение 10 часов. Полученную суспензию охлаждали до 15°C, твердый продукт выделяли фильтрованием и промывали осадок свежим этилацетатом с получением указанного в заголовке соединения несколькими порциями в виде твердого вещества (7,8 г, 67%): т.пл. 182°C;
1H ЯМР (ДМСО-d6): δ 11,97 (с, 1H), 11,72 (с, 1H), 8,50 (с, 1H), 4,22 (кв, 2H), 3,72 (с, 3H), 1,17 (т, 3H); 13C ЯМР (ДМСО-d6): 177,82, 153,58, 150,00, 149,01, 144,26, 142,63, 62,76, 57,56, 14,44; масс-спектр (точная масса): вычислено для C9H11ClN4O3S: 290,024039; найдено 290,0241.
Пример 2. Получение этил-(Z и E)-[(2-хлор-5-метоксипиримидин-4-ил)амино](гидроксиимино)метилкарбамата (3)
Объединяли гидрохлорид гидроксиламина (280 мг, 4 экв.) и бикарбонат натрия (335 мг, 4 экв.) и растворяли в воде (6 мл) при комнатной температуре. К полученному добавляли суспензию этил[(2-хлор-5-метоксипиримидин-4-ил)амино]карбонотиоилкарбамата (2; 290 мг, 1,0 ммоль) в ацетонитриле (15 мл). Полученную суспензию перемешивали при комнатной температуре в течение 1 часа и твердые частицы отделяли фильтрованием. Перекристаллизацией из ацетонитрила получали указанное в заголовке соединение в виде светло-желтого твердого вещества (170 мг, 59%): т.пл. 183-184°C (разл.);
1H ЯМР (ДМСО-d6) (смесь изомеров) δ 10,77 (с, 0,6H), 10,5 (с, 0,4H), 9,48 (с, 0,6H), 9,34 (с, 0,4H), 9,09 (с, 0,4H), 8,40 (с, 0,6H), 8,11 (с, 0,6H), 8,11 (с, 0,6H), 7,95 (с, 0,4H) 4,19-3,89 (м, 5H), 1,17-1,09 (м, 3H); 13C ЯМР (ДМСО-d6): δ: 154,4, 154,0, 149,9, 140,2, 140,0, 139,1, 138,6, 138,0, 61,2, 60,9, 57,3, 56,5, 14,8, 14,5; Масс-спектр (точная масса): вычислено для C9H12ClN5O4 289,05778; найдено 289,0577.
Пример 3. Получение 5-хлор-8-метокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина (4) без выделения (3)
Объединяли этил[(2-хлор-5-метоксипиримидин-4-ил)амино]карбонотиоилкарбамат (2) (290 мг, 1,0 ммоль), гидрохлорид гидроксиламина (143 мг, 2 экв.) и бикарбонат натрия (170 мг, 2 экв.). Добавляли воду (5 мл) и ацетонитрил (5 мл) при комнатной температуре. Полученную суспензию перемешивали при комнатной температуре в течение ночи, затем обрабатывали 20 каплями насыщенного водного раствора карбоната натрия. Полученный раствор продували азотом и охлаждали, получая продукт в виде известкового осадка, который отделяли фильтрованием (в двух порциях), промывали водой и сушили с получением указанного в заголовке соединения в виде твердого вещества (139 мг, 68%): т.пл. 251°C;
1H ЯМР (ДМСО-d6) δ 7,73 (с, 1H), 3,98 (с 3H); 6,63 (с, 2H); 13С ЯМР (ДМСО-d6): 166,30, 148,14, 128,91, 124,67, 57,51; Масс-спектр (точная масса): вычислено для C6H6ClN5O 199,026087; найдено 199,0256.
Пример 4. Получение 5-хлор-8-метокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина (4) без выделения (3)
Гидрохлорид гидроксиламина (280 мг, 4 экв.) и бикарбонат натрия (210 мг, 2,5 экв.) объединяли в воде (5 мл) и перемешивали в течение 5 минут. Добавляли при комнатной температуре этил[(2-хлор-5-метоксипиримидин-4-ил)амино]карбонотиоилкарбамат (2) (290 мг, 1,0 ммоль), суспендированный в трет-бутаноле (15 мл). Реакцию перемешивали при комнатной температуре в течение 5 часов и затем обрабатывали 10 каплями насыщенного водного раствора карбоната натрия. Реакционную суспензию затем фильтровали и полученные твердые частицы промывали водой и сушили с получением указанного в заголовке соединения в виде серовато-белого твердого вещества (330 мг, 83%), которое было идентичным по ВЭЖХ удерживанию описанному выше 5-хлор-8-метокси[1,2,4]триазоло[1,5-с]пиримидин-2-амину (4).
Пример 5. Получение 5,8-диметокси[1,2,4]триазоло[1,5-с] пиримидин-2-амина (5)
5-Хлор-8-метокси[1,2,4]триазоло[1,5-с]пиримидин-2-амин (4; 100 мг, 0,50 ммоль) суспендировали в ацетонитриле (5 мл) при комнатной температуре и обрабатывали 25% метоксидом натрия в метаноле (200 мг, 2 экв.). Полученную суспензию перемешивали при комнатной температуре в течение 1,5 часов и затем фильтровали. Твердые частицы промывали водой и сушили с получением указанного в заголовке соединения в виде вещества известкового цвета (87 мг, 88%), которое было идентичным по ВЭЖХ удерживанию подлинному 5,8-диметокси[1,2,4]триазоло[1,5-с]пиримидин-2-амину (5): т.пл. 185-186°C;
1H ЯМР (ДМСО-d6) 7,48 (с, 1H), 6,38 (ушир. с, 2H), 4,04 (с, 3H), 3,88 (с, 3H); EIMS m/z 195.
Пример 6. Получение этил[(2,5-диметоксипиримидин-4-ил)амино]карбонотиоилкарбамата
В 18 г этилацетата растворяли 2,5-диметоксипиримидин-4-амин (6) (3 г, 0,0193 моль). Добавляли этилизотиоцианатидокарбонат (2,77 г, 0,0208 моль) одной порцией. Раствор нагревали до 78°С и выдерживали при этой температуре в течение 11 ч. Добавляли дополнительные 1,4 г этилизотиоцианатидокарбоната и смесь нагревали в течение 2,5 ч. Смесь охлаждали до 22°C и фильтровали. Полученное твердое вещество промывали этилацетатом (20 мл) и сушили до постоянной массы в вытяжном шкафу с получением указанного в заголовке соединения в виде желтого твердого вещества (4,81 г, 89%):
13C ЯМР (ДМСО-d6, 100 МГц) δ 177,5, 158,4, 153,3, 149,5, 142,3, 139,5, 62,6, 57,6, 55,2, 14,4; HRMS (ESI), вычислено для C10H14N4O4S, 286,0736; найдено 286,0727.
Пример 7. Добавление гидроксиламина для получения соединения 8 и циклизация с образованием 5,8-диметокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина (5)
Этил[(2,5-диметоксипиримидин-4-ил)амино]карбонотиоилкарбамат (7; 4,30 г, 0,0154 моль) диспергировали в 24 г этилацетата. Затем к перемешиваемой суспензии добавляли гидрохлорид гидроксиламина (1,28 г, 0,0193 моль), воду (3,84 г) и 2М NaOH (12,61 г, 0,0252 моль). После добавления NaOH температура внутри поднялась до 26°C. Этил-(E/Z)-[(2-хлор-5-метоксипиримидин-4-ил)амино](гидроксиимино)метилкарбамат (8) не выделяли, но нагревали до 50°С для циклизации. Смесь охлаждали до комнатной температуры и перемешивали в течение ночи. Суспензию фильтровали при комнатной температуре, осадок промывали водой (3×8 г) и сушили до постоянной массы в вытяжном шкафу с получением указанного в заголовке соединения в виде рыжеватого твердого вещества (3,16 г, 105% выход по массе). Основной компонент имел время удерживания, идентичное подлинному 5,8-диметокси[1,2,4]триазоло[1,5-с]пиримидин-2-амину (5). В отдельном эксперименте этил-(E/Z)-[(2,5-диметоксипиримидин-4-ил)амино](гидроксиимино)метилкарбамат (8) выделяли хроматографией на силикагеле (хлороформ в качестве элюента) с получением белого твердого вещества (0,4 г, 13%), которое представляло собой ок. 77/23 смесь геометрических изомеров:
1H ЯМР (ДМСО-d6) (смесь изомеров) δ 10,65 (с, 1H), 10,34 (с, 0,3H), 9,56 (с, 1H), 8,98 (с, 0,3H), 8,94 (с, 0,3H), 8,20 (с, 1H), 8,00 (с, 1H), 7,82 (с, 0,3H), 4,25-3,90 (м, 2,6H), 3,88 (с, 3H), 3,81 (с, 0,9H), 3,78 (с, 3H), 3,22 (с, 0,9H), 1,20-1,15 (м, 3H); Масс-спектр (точная масса): вычислено для C9H12ClN5O4 289,0578; найдено 289,0571.
Claims (6)
1. Способ получения 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов формулы (I):
где
X представляет собой галоген или OR; и
R представляет собой C1-С4алкил;
который включает:
i) взаимодействие 2-замещенного-4-амино-5-алкоксипиримидина формулы:
где X и R являются такими, как определено выше,
с изотиоцианатидокарбонатом формулы:
где R является таким, как определено выше,
в полярном апротонном растворителе с получением (пиримидиниламино)карбонотиоилкарбамата формулы:
где X и R являются такими, как определено выше;
ii) приведение в контакт (пиримидиниламино)карбонотиоилкарбамата с гидроксиламином в присутствии основания с получением (пиримидиниламино)(гидроксиимино)метилкарбамата формулы:
где X и R являются такими, как определено выше; и
iii) циклизацию (пиримидиниламино)(гидроксиимино)метилкарбамата нагреванием в инертном растворителе с получением 5-замещенного-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина.
где
X представляет собой галоген или OR; и
R представляет собой C1-С4алкил;
который включает:
i) взаимодействие 2-замещенного-4-амино-5-алкоксипиримидина формулы:
где X и R являются такими, как определено выше,
с изотиоцианатидокарбонатом формулы:
где R является таким, как определено выше,
в полярном апротонном растворителе с получением (пиримидиниламино)карбонотиоилкарбамата формулы:
где X и R являются такими, как определено выше;
ii) приведение в контакт (пиримидиниламино)карбонотиоилкарбамата с гидроксиламином в присутствии основания с получением (пиримидиниламино)(гидроксиимино)метилкарбамата формулы:
где X и R являются такими, как определено выше; и
iii) циклизацию (пиримидиниламино)(гидроксиимино)метилкарбамата нагреванием в инертном растворителе с получением 5-замещенного-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина.
2. Способ по п.1, в котором X и R, оба представляют собой OCH3.
3. Способ по п.1, в котором (пиримидиниламино)(гидроксиимино)метилкарбамат стадии ii) используют без выделения для получения 2-амино-5-замещенного-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина на стадии iii).
4. Способ получения 2-амино-5,8-алкокси[1,2,4]триазоло[1,5-с]пиримидинов формулы:
где
R представляет собой C1-С4алкил;
который включает приведение в контакт 5-галоген-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина формулы:
где
Х представляет собой галоген; и
R представляет собой C1-С4алкил;
с алкоксидом щелочного металла в спиртовом растворителе.
где
R представляет собой C1-С4алкил;
который включает приведение в контакт 5-галоген-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-амина формулы:
где
Х представляет собой галоген; и
R представляет собой C1-С4алкил;
с алкоксидом щелочного металла в спиртовом растворителе.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US34796810P | 2010-05-25 | 2010-05-25 | |
| US61/347,968 | 2010-05-25 | ||
| PCT/US2011/037633 WO2011149861A1 (en) | 2010-05-25 | 2011-05-24 | Process for the preparation of 5-substituted-8-alkoxy[1,2,4]triazolo[1,5-c]pyrimidin-2-amines |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012156217A RU2012156217A (ru) | 2014-06-27 |
| RU2567856C2 true RU2567856C2 (ru) | 2015-11-10 |
Family
ID=44261752
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2012156217/04A RU2567856C2 (ru) | 2010-05-25 | 2011-05-24 | СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЕННЫХ-8-АЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-c]ПИРИМИДИН-2-АМИНОВ |
Country Status (18)
| Country | Link |
|---|---|
| US (2) | US8143395B2 (ru) |
| EP (2) | EP2576558B9 (ru) |
| JP (1) | JP5808396B2 (ru) |
| KR (1) | KR101888206B1 (ru) |
| CN (1) | CN103025735B (ru) |
| AU (1) | AU2011258555B2 (ru) |
| BR (2) | BR112012029919B8 (ru) |
| CA (1) | CA2800073C (ru) |
| ES (1) | ES2528145T3 (ru) |
| IL (2) | IL223222A (ru) |
| MX (2) | MX2012013648A (ru) |
| PH (1) | PH12014502007A1 (ru) |
| PL (2) | PL2851367T3 (ru) |
| PT (1) | PT2576558E (ru) |
| RU (1) | RU2567856C2 (ru) |
| UA (1) | UA109440C2 (ru) |
| WO (1) | WO2011149861A1 (ru) |
| ZA (1) | ZA201208894B (ru) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| UA109440C2 (ru) | 2010-05-25 | 2015-08-25 | ДАУ АГРОСАЙЄНСІЗ ЕлЕлСі | Способ получения 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов |
| AU2013315734B2 (en) * | 2012-09-14 | 2016-03-17 | Dow Agrosciences Llc | Process for the preparation of 2-amino-5,8-dimethoxy[1,2,4]triazolo[1,5-c]pyrimidine from 4-chloro-2,5-dimethoxypyrimidine |
| KR102120190B1 (ko) * | 2012-09-14 | 2020-06-08 | 다우 아그로사이언시즈 엘엘씨 | 4-아미노-2,5-디메톡시피리미딘으로부터의 2-아미노-5,8-디메톡시[1,2,4]트리아졸로[1,5-c]피리미딘의 개선된 제조 방법 |
| CN104736517A (zh) | 2012-10-10 | 2015-06-24 | 美国陶氏益农公司 | 制备烷氧羰基异硫氰酸酯的方法 |
| CN103232453A (zh) * | 2013-04-18 | 2013-08-07 | 黑龙江大学 | 2-氨基-5,8-二甲氧基[1,2,4]-三唑并[1,5-c]-嘧啶的合成方法 |
| CN103430949A (zh) * | 2013-07-20 | 2013-12-11 | 山东滨农科技有限公司 | 含有五氟磺草胺和嘧啶肟草醚的除草剂组合物 |
| CN103533811B (zh) * | 2013-10-22 | 2016-03-02 | 天津优瑞纳斯液压机械有限公司 | 促动器电子元件散热箱 |
| CN103739606B (zh) * | 2013-12-12 | 2016-09-14 | 江苏富鼎化学有限公司 | 2-氨基-5,8-二取代[1,2,4]三唑[1,5-c]嘧啶的环保合成方法 |
| CN105294697B (zh) * | 2015-11-20 | 2019-07-09 | 北京英力精化技术发展有限公司 | 2-氨基-5,8-二甲氧基[1,2,4]三唑并[1,5-c]嘧啶的合成方法 |
| CN107602566B (zh) * | 2017-09-26 | 2019-11-01 | 江苏省农用激素工程技术研究中心有限公司 | 双氟磺草胺中间体的合成方法 |
| CN110240601A (zh) * | 2019-07-22 | 2019-09-17 | 湖北广富林生物制剂有限公司 | 一种五氟磺草胺中间体的合成方法 |
| CN115417875B (zh) * | 2022-09-19 | 2024-05-31 | 山东华升新材料有限公司 | 一种5,8-二甲氧基-[1,2,4]三唑并[1,5-c]嘧啶-2-胺的合成方法 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3045015A (en) * | 1958-10-03 | 1962-07-17 | Ici Ltd | Triazolo-[2, 3-c]-pyrimidines |
| EP0132851A1 (en) * | 1983-07-28 | 1985-02-13 | American Cyanamid Company | 5-Substituted(1,2,4)triazolo(1,5-c)pyrimidin-2-amines |
| RU2131429C1 (ru) * | 1993-11-05 | 1999-06-10 | Дау Агросайнсис ЛЛС. | 5-алкокси [1,2,4]триазоло[1,5-c]пиримидин-2(3h)-тионовые соединения, 2,2'-дитиобис(5-алкокси[1,2,4]триазоло[1,5-c]пиримидин), способ получения 2,2'-дитиобис(5-алкокси[1,2,4]триазоло[1,5-c]пиримидина) и 2-хлоросульфонил-5-алкокси[1,2,4]триазоло[1,5-c]пиримидиновых соединений |
| EA001064B1 (ru) * | 1996-09-24 | 2000-10-30 | Дау Агросайенсез Ллс | N-([1,2,4]триазолазинил)бензолсульфонамиды и пиридинсульфонамиды и их применение в качестве гербицидов |
| WO2001098305A1 (en) * | 2000-06-16 | 2001-12-27 | Dow Agrosciences Llc | PROCESS FOR THE PREPARATION OF 2-AMINO-5,8-DIMETHOXY[1,2,4]TRIAZOLO[1,5-c]PYRIMIDINE |
| WO2009047514A1 (en) * | 2007-10-10 | 2009-04-16 | Cancer Research Technology Limited | [1,2,4]triazolo[1,5-a]pyridine and [1,2,4]triazolo[1,5-c]pyrimidine compounds and their use |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE60102215T2 (de) * | 2000-11-03 | 2004-07-22 | Dow Agrosciences Llc, Indianapolis | N-(5,7-dimethoxy[1,2,4]triazolo[1,5-a]pyrimidin-2-yl)arylsulfonamid verbindungen und deren verwendung als herbizide |
| ATE432935T1 (de) * | 2000-11-03 | 2009-06-15 | Dow Agrosciences Llc | N-(1,2,4-triazoloazinyl)thiophensulfonamid- verbindungen als herbizide |
| US8340056B2 (en) | 2009-09-25 | 2012-12-25 | Meteorcomm Llc | Systems and methods for interoperability positive train control |
| UA109440C2 (ru) | 2010-05-25 | 2015-08-25 | ДАУ АГРОСАЙЄНСІЗ ЕлЕлСі | Способ получения 5-замещенных-8-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-аминов |
-
2011
- 2011-05-24 UA UAA201214870A patent/UA109440C2/ru unknown
- 2011-05-24 BR BR112012029919A patent/BR112012029919B8/pt active IP Right Grant
- 2011-05-24 AU AU2011258555A patent/AU2011258555B2/en not_active Ceased
- 2011-05-24 MX MX2012013648A patent/MX2012013648A/es active IP Right Grant
- 2011-05-24 EP EP11724855.9A patent/EP2576558B9/en active Active
- 2011-05-24 KR KR1020127033378A patent/KR101888206B1/ko active IP Right Grant
- 2011-05-24 CA CA2800073A patent/CA2800073C/en not_active Expired - Fee Related
- 2011-05-24 MX MX2014011302A patent/MX350217B/es unknown
- 2011-05-24 EP EP14003824.1A patent/EP2851367B1/en active Active
- 2011-05-24 WO PCT/US2011/037633 patent/WO2011149861A1/en active Application Filing
- 2011-05-24 US US13/114,087 patent/US8143395B2/en active Active
- 2011-05-24 CN CN201180036570.0A patent/CN103025735B/zh active Active
- 2011-05-24 PL PL14003824T patent/PL2851367T3/pl unknown
- 2011-05-24 JP JP2013512134A patent/JP5808396B2/ja active Active
- 2011-05-24 ES ES11724855.9T patent/ES2528145T3/es active Active
- 2011-05-24 PL PL11724855T patent/PL2576558T3/pl unknown
- 2011-05-24 BR BR122017022221A patent/BR122017022221B8/pt not_active IP Right Cessation
- 2011-05-24 RU RU2012156217/04A patent/RU2567856C2/ru not_active IP Right Cessation
- 2011-05-24 PT PT11724855T patent/PT2576558E/pt unknown
- 2011-12-14 US US13/325,809 patent/US8338596B2/en active Active
-
2012
- 2012-11-22 IL IL223222A patent/IL223222A/en active IP Right Grant
- 2012-11-26 ZA ZA2012/08894A patent/ZA201208894B/en unknown
-
2013
- 2013-12-17 IL IL229993A patent/IL229993A/en active IP Right Grant
-
2014
- 2014-09-09 PH PH12014502007A patent/PH12014502007A1/en unknown
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3045015A (en) * | 1958-10-03 | 1962-07-17 | Ici Ltd | Triazolo-[2, 3-c]-pyrimidines |
| EP0132851A1 (en) * | 1983-07-28 | 1985-02-13 | American Cyanamid Company | 5-Substituted(1,2,4)triazolo(1,5-c)pyrimidin-2-amines |
| RU2131429C1 (ru) * | 1993-11-05 | 1999-06-10 | Дау Агросайнсис ЛЛС. | 5-алкокси [1,2,4]триазоло[1,5-c]пиримидин-2(3h)-тионовые соединения, 2,2'-дитиобис(5-алкокси[1,2,4]триазоло[1,5-c]пиримидин), способ получения 2,2'-дитиобис(5-алкокси[1,2,4]триазоло[1,5-c]пиримидина) и 2-хлоросульфонил-5-алкокси[1,2,4]триазоло[1,5-c]пиримидиновых соединений |
| EA001064B1 (ru) * | 1996-09-24 | 2000-10-30 | Дау Агросайенсез Ллс | N-([1,2,4]триазолазинил)бензолсульфонамиды и пиридинсульфонамиды и их применение в качестве гербицидов |
| WO2001098305A1 (en) * | 2000-06-16 | 2001-12-27 | Dow Agrosciences Llc | PROCESS FOR THE PREPARATION OF 2-AMINO-5,8-DIMETHOXY[1,2,4]TRIAZOLO[1,5-c]PYRIMIDINE |
| WO2009047514A1 (en) * | 2007-10-10 | 2009-04-16 | Cancer Research Technology Limited | [1,2,4]triazolo[1,5-a]pyridine and [1,2,4]triazolo[1,5-c]pyrimidine compounds and their use |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2567856C2 (ru) | СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЕННЫХ-8-АЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-c]ПИРИМИДИН-2-АМИНОВ | |
| RU2635352C2 (ru) | СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИМЕТОКСИ[1,2,4]ТРИАЗОЛО[1,5-c]ПИРИМИДИНА ИЗ 4-ХЛОР-2,5-ДИМЕТОКСИПИРИМИДИНА | |
| KR102305298B1 (ko) | 피리미딘 중간체의 제조 방법 | |
| JP5245408B2 (ja) | 1−置換−5−アシルイミダゾール化合物の製法 | |
| WO2013059572A1 (en) | Process for the preparation of etravirine and intermediates in the synthesis thereof | |
| US11518771B2 (en) | Process for manufacturing alkyl 7-amino-5-methyl-[1,2,5]oxadiazolo[3,4-b]pyridine-carboxylate | |
| CN109988172B (zh) | 一种吡唑并[1,5-a]嘧啶类杂环化合物及衍生物的合成方法 | |
| El Janati et al. | SYNTHESIS OF NEW HETEROCYCLIC SYSTEMS CONTAINING QUINOXALINE MOIETY | |
| EP2905024A1 (en) | Pyrido[2,3-d]pyrimidine-7(8H)-one derivatives for the treatment of infections caused by Flaviviridae | |
| CN101627041A (zh) | 合成(3-烷基-5-哌啶-1-基-3,3a-二氢-吡唑并[1,5-a]嘧啶-7-基)-氨基衍生物和中间体的方法和中间体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20170525 |