RU2427383C2 - Фармацевтические композиции с повышенной стабильностью - Google Patents
Фармацевтические композиции с повышенной стабильностью Download PDFInfo
- Publication number
- RU2427383C2 RU2427383C2 RU2008129201/15A RU2008129201A RU2427383C2 RU 2427383 C2 RU2427383 C2 RU 2427383C2 RU 2008129201/15 A RU2008129201/15 A RU 2008129201/15A RU 2008129201 A RU2008129201 A RU 2008129201A RU 2427383 C2 RU2427383 C2 RU 2427383C2
- Authority
- RU
- Russia
- Prior art keywords
- acid
- peptide
- polymer composition
- composition according
- polymer
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/08—Peptides having 5 to 11 amino acids
- A61K38/09—Luteinising hormone-releasing hormone [LHRH], i.e. Gonadotropin-releasing hormone [GnRH]; Related peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/2292—Thymosin; Related peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/22—Heterocyclic compounds, e.g. ascorbic acid, tocopherol or pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0031—Rectum, anus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0034—Urogenital system, e.g. vagina, uterus, cervix, penis, scrotum, urethra, bladder; Personal lubricants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/02—Suppositories; Bougies; Bases therefor; Ovules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5031—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Endocrinology (AREA)
- Dermatology (AREA)
- Gastroenterology & Hepatology (AREA)
- Reproductive Health (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Inorganic Chemistry (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Zoology (AREA)
- Pulmonology (AREA)
- Dispersion Chemistry (AREA)
- Otolaryngology (AREA)
- Gynecology & Obstetrics (AREA)
- Urology & Nephrology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
Abstract
Изобретение относится к области медицины и фармакологии и представляет собой инъецируемую полимерную композицию, содержащую: соль пептидного агента, образованную сильной кислотой, выбранной из группы, состоящей из соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, серной кислоты, азотной кислоты, хромовой кислоты, метансульфоновой кислоты, трифторметансульфоновой кислоты, трихлоруксусной кислоты, дихлоруксусной кислоты, бромуксусной кислоты, хлоруксусной кислоты, циануксусной кислоты, 2-хлорпропановой кислоты, 2-оксобутановой кислоты, 2-хлорбутановой кислоты, 4-цианобутановой кислоты, перхлорной кислоты и фосфорной кислоты; нерастворимый в воде биоразлагаемый полимер; фармацевтически приемлемый органический растворитель, который растворяет биоразлагаемый полимер и смешивается или диспергируется в водной или в биологической жидкости, и возможно один или более чем один фармацевтически приемлемый эксципиент, где пептидный агент имеет N-конец, который не является первичным амином, и где пептидный агент содержит по меньшей мере одну основную группу. Изобретение обеспечивает повышение стабильности и длительности хранения заявленной композиции. 23 з.п. ф-лы, 8 табл., 6 ил.
Description
В последние годы было обнаружено большое количество и широкое разнообразие пептидных агентов, таких как пептиды, олигопептиды, полипептиды и белки, которые привлекли большое внимание как кандидаты на роль лекарственных средств. Однако многие пептидные агенты являются нестабильными, поскольку они легко гидролизуются или разрушаются in vivo ферментами, что приводит к очень короткому времени полужизни в системе кровообращения. Поэтому большинство пептидных лекарственных средств вводили путем инъекции, обычно несколько раз в сутки.
Введение путем инъекции, однако, является болезненным, очень дорогостоящим и неудобным. Часто соблюдение пациентом схемы и режима лечения является очень затруднительным. Для многих пептидных агентов, особенно для гормонов, требуется непрерывная доставка лекарственного средства с контролируемой скоростью на протяжении длительного периода времени, и, таким образом, желательной является система контролируемой доставки. Такие системы могут быть получены путем включения пептидных агентов в биоразлагаемые и биосовместимые полимерные матрицы. При одном подходе данный полимер растворяют в органическом растворителе и затем смешивают с пептидными агентами, изготавливая этот продукт в форме микрокапсул, микрогранул или имплантируемых стержней путем удаления органического растворителя. Пептидный агент удерживается полимерными матрицами. Были успешно разработаны несколько продуктов с использованием биоразлагаемых полимеров в форме микрочастиц и имплантатов в виде твердых стержней, такие как люпрон, золадекс, трипторелин и пр. Несмотря на то, что эти продукты, по-видимому, являются эффективными, они имеют недостатки и ограничения, такие как большой объем суспендирующих жидкостей для микрочастиц или хирургического введения твердых имплантатов. Эти продукты не являются очень удобными для пациента. Кроме того, производственные способы получения стерильных и воспроизводимых продуктов являются сложными, что приводит к высокой стоимости изготовления. Очень желательно, чтобы композицию можно было легко изготавливать и применять.
При другом подходе биоразлагаемый полимер и пептидные агенты растворяют в биосовместимом органическом растворителе с получением жидкой композиции. Когда жидкую композицию инъецируют в организм, растворитель рассеивается в окружающей водной среде, и полимер образует твердое или гелевое депо, из которого биоактивный агент высвобождается в течение длительного периода времени. Представляется, что показательными в этой области являются следующие ссылки: патенты США №6565874, 6528080, RE37950, 6461631, 6395293. 6355657, 6261583, 6143314, 5990194, 5945115, 5792469, 5780044, 5759563, 5744153, 5739176, 5736152, 5733950, 5702716, 5681873, 5599552, 5487897, 5340849, 5324519, 5278202, 5278201 и 4938763, и они включены в данное описание изобретения посредством ссылки. Несмотря на некоторый успех, эти способы не были полностью удовлетворительными для большого числа пептидных агентов, которые могут быть эффективно доставлены посредством такого подхода.
В данной области хорошо известно, что биоактивный агент, содержащий основные функциональные группы, взаимодействует с биоразлагаемым полимером, катализируя (или ускоряя) разрушение данного полимера и образуя конъюгат с данным полимером и/или с его продуктами разрушения. Взаимодействие/реакция между основными биоактивными агентами и полимерными носителями может происходить: 1) во время приготовления в виде препарата, такого как микроинкапсуляция, литье по давлением, экструзия, смешивание с растворами полимера в органическом растворителе и тому подобное, когда основные биоактивные агенты включаются в полимерный носитель; 2) во время хранения и 3) во время процесса биоразрушения и высвобождения биоактивных агентов in vivo.
Известно, что деградация пептидных агентов и биоразлагаемых полимеров и реакции между ними обычно происходят гораздо быстрее в растворе, чем в сухом, твердом состоянии. Были описаны взаимодействие/реакция между биоактивными агентами, содержащими основные функциональные группы, т.е. аминами, и полимерами во время процесса образования микрочастиц с использованием методов выпаривания/экстракции растворителя, где биоактивный агент и полимер были раствореныви/диспергированы в неполярных органических растворителях [Krishnan M. and Flanagan D.R., J. Control Release. 2000 Nov 3; 69(2) : 273-81]. Образовалось значительное количество амидных группировок. Было ясно показано, что растворители, обычно используемые для изготовления систем доставки лекарственного средства на основе биоразлагаемогом полимера, могли обеспечивать быстрое взаимодействие между биоактивным агентом и полимером. В другом описании также сообщалось об ускоренном разрушении полимеров органическими аминами в полярном протонном органическом растворителе (например в метаноле) [Lin W.J., Flanagan D.R., Linhardt R.J. Pharm Res. 1994 Jul; 11(7) : 1030-4].
Поскольку системы контролируемой доставки обычно изготавливают через стадию, которая включает растворение/диспергирование пептидного агента в растворе биоразлагаемого полимера в органическом растворителе, стабилизация всех компонентов в композиции на этой стадии представляет собой очень важную проблему при приготовлении в виде препарата. Одним из обычных подходов, который использовали для преодоления проблемы стабильности пептидного агента и биоразлагаемого полимера в растворе или суспензии при изготовлении и хранении, является хранение пептидного агента и раствора полимера в двух отдельных контейнерах и смешивание их непосредственно перед применением. Предполагается, что органический растворитель может быть быстро отделен от полимерного матрикса посредством диффузии, экстракции или выпаривания после смешивания раствора полимера и пептидных агентов. Пример был раскрыт в патентах США 6565874 и 6773714, которые описывают препараты леупролида ацетата с полимерной доставкой, родственного имеющемуся в продаже продукту Элигард®, для лечения рака предстательной железы. Чтобы поддерживать стабильность препаратов, этот продукт поставляют в отдельных шприцах и содержимое шприцев смешивают непосредственно перед применением. Однако конечным потребителям часто сложно смешивать содержимое двух отдельных шприцев из-за вязких свойств полимерных препаратов. Однородность препаратов, приготовленных конечным потребителем, может значительно варьироваться, а также может иметь место загрязнение, и качество лечения может быть значительно скомпрометировано. Кроме того, этот подход не предотвращает взаимодействие между пептидным агентом и полимером во время смешивания и введения. Как раскрыто в US20060034923 А1, при объединении октреотида ацетата с раствором полилактид-со-гликолида в NMP (N-метил-2-пирролидоне) более 40% октреотида ацилировалось в пределах 5 часов. Такая модификация пептида может приводить к значительной потере активности или к изменению иммуногенности. Молекулярная масса полимера также значительно снижалась за тот же период времени. Такое быстрое разложение пептида и полимера будет изменять профиль высвобождения пептида и приводить к аномальному результату лечения. Следовательно, необходим точный контроль процесса и времени получения, и это значительно увеличивает сложность для конечного потребителя. Кроме того, образование имплантата in vivo из инъецируемой полимерной композиции не является мгновенным. Обычно процесс рассеяния растворителя может занимать от нескольких часов до нескольких суток в зависимости от используемых растворителей. В течение этого периода присутствие органического растворителя также может стимулировать взаимодействие/реакцию между пептидными агентами и полимером. Следовательно, существует потребность в разработке фармацевтической композиции, которая будет минимизировать или предотвращать взаимодействие/реакцию между пептидным агентом и полимером в органическом растворе. Существует дополнительная потребность в разработке фармацевтической композиции, которая является стабильной, имеет удовлетворительный срок хранения в форме готового к применению продукта.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Неожиданно обнаружилось, что инъецируемые биоразлагаемые полимерные композиции, содержащие пептидные агенты в форме соли, образованной сильной кислотой (например соляной кислотой), демонстрируют значительно более высокую стабильность, чем в форме соли, образованной слабой кислотой (например уксусной кислотой), или в форме свободного основания. Такие полезные соли пептидных агентов могут быть получены посредством нейтрализации любых основных групп пептидных агентов сильной кислотой. Когда такие полезные соли пептидных агентов, образованные сильной кислотой, готовили в виде препаратов инъецируемых биоразлагаемых полимерных композиций, взаимодействия/реакции между пептидными агентами и полимером минимизировались или предотвращались. Использование таких полезных солей пептидных агентов, образованных сильной кислотой, обеспечивает получение стабилизированной инъецируемой композиции, предварительно помешенной в один шприц, в готовой к применению форме с удовлетворительной стабильностью при хранении. Применение соли пептидного агента по настоящему изобретению, образованной сильной кислотой, для увеличения стабильности инъецируемых полимерных композиций не рассматривается в предшествующем уровне техники.
Соответственно, согласно настоящему изобретению предложена стабилизированная инъецируемая биоразлагаемая полимерная композиция для получения экономически выгодных, практичных и эффективных систем контролируемой доставки пептидных агентов. В настоящем изобретении также предложен способ ее изготовления и способ ее применения. Согласно настоящему изобретению систему доставки лекарственного средства легко изготовить и удобно доставлять субъекту, такому как млекопитающее или человек. Композиции доставляют терапевтическое количество пептидных агентов за желательный, длительный период времени, предпочтительно от нескольких недель до одного года. Композиции являются и биосовместимыми, и биоразлагаемыми, и безвредно исчезают после доставки дозы пептидных агентов.
Композиции по настоящему изобретению содержат а) полезную соль пептидного агента, образованную сильной кислотой, которая минимизирует или предотвращает взаимодействие/реакцию между пептидным агентом и полимером в органическом растворе; б) биоразлагаемый полимер; в) фармацевтически приемлемый органический растворитель. Согласно данному изобретению фармацевтическая композиция возможно может содержать эксципиенты для достижения оптимальной доставки пептидного агента. Фармацевтическая композиция может быть вязкой или невязкой жидкостью, гелем или полутвердым веществом, которое перемещается как жидкость так, что ее можно инъецировать с использованием шприца. Фармацевтическая композиция может быть предварительно помещена в один шриц с образованием продукта в готовой к применению форме.
Пептидный агент по настоящему изобретению содержит по меньшей мере одну основную группу. Пептидный агент может быть любым пептидом, олигопептидом, полипептидом или белком, который способен обеспечивать биологический, физиологический или терапевтический эффект у животного или у человека. Пептидный агент может быть любым одним или более чем одним из известных биологически активных пептидов, олигопептидов, полипептидов или белков, известных в любых документах, процитированных здесь, или известных в данной области иным способом. Пептидный агент также может стимулировать или ингибировать желательную биологическую или физиологическую активность у животного или человека, включая, без ограничения, стимуляцию иммуногенного или иммунологического ответа.
Согласно одному воплощению настоящего изобретения данный пептидный агент имеет N-конец, который не является первичным амином (например агонисты LHRH, такие как лейпрорелин, гозерелин, антагонисты LHRH, такие как цетрореликс, энфувиртид, тимозин α1, абареликс и тому подобное). В другом воплощении настоящего изобретения данный пептидный агент имеет либо N-концевую первичную аминогруппу, либо первичную аминогруппу боковой цепи, ковалентно модифицированные гидрофильными и/или липофильными группировками, которые могут быть получены посредством пэгилирования, ацилирования и тому подобного. Кроме того, и N-концевая первичный амин, и первичные аминогруппы боковой цепи пептидного агента также могут быть ковалентно модифицированы одновременно гидрофильной и/или липофильной группировками посредством пэгилирования, ацилирования и тому подобного.
Сильной кислотой может быть любая кислота, имеющая рКа в воде менее 3, предпочтительно менее 0, более предпочтительно менее -3. Например, сильная кислота может быть выбрана из группы, состоящей из соляной кислоты, бромистоводородной кислоты, серной кислоты, органических серных кислот, алкилсерных кислот с 1-40 атомами углерода, азотной кислоты, хромовой кислоты, метансульфоновой кислоты, трифторметансульфоновой кислоты, органических сульфоновых кислот, трихлоруксусной кислоты, дихлоруксусной кислоты, бромуксусной кислоты, хлоруксусной кислоты, циануксусной кислоты, 2-хлорпропановой кислоты, 2-оксобутановой кислоты, 2-хлорбутановой кислоты, 4-цианобутановой кислоты, перхлорной кислоты, фосфорной кислоты, йодистоводородной кислоты и тому подобного, но не ограничиваясь ими.
Биоразлагаемый полимер может представлять собой любые биосовместимые и фармацевтически приемлемые полимеры. Биоразлагаемые полимеры могут быть термопластичными, которые плавятся при нагревании и затвердевают при охлаждении. Биоразлагаемые полимеры по изобретению являются по существу нерастворимыми в водных жидкостях или в жидкостях организма, но способны в значительной степени растворяться или диспергироваться в смешивающемся с водой органическом растворителе с образованием раствора или суспензии. При контакте с водной жидкостью смешивающийся с водой органический растворитель диффундирует/рассеивается из композиции по изобретению, что вызывает коагуляцию полимера с образованием геля или твердого матрикса, инкапсулирующего пептидный агент. Примеры полимеров, подходящих для настоящей композиции, включают, без ограничения ими, полилактиды, полигликолиды, поликапролактоны, полиангидриды, полиуретаны, полиэфирамиды, полиортоэфиры, полидиоксаноны, полиацетали, поликетали, поликарбонаты, полиортокарбонаты, полифосфазены, полигидроксибутираты, полигидроксивалераты, полиалкиленоксалаты, полиалкиленсукцинаты, поли(яблочную кислоту), поли(малеиновый ангидрид) и сополимеры, тройные сополимеры или их комбинации или смеси. В настоящем изобретении предпочтительно используют полимеры на основе молочной кислоты и сополимеры молочной кислоты и гликолевой кислоты (PLGA), включая поли(D,L-лактид-со-гликолид) и поли(L-лактид-со-гликолид). В некоторых воплощениях полимеры PLGA имеют среднемассовые молекулярные массы от примерно 2000 до примерно 100000 и отношения мономеров молочной кислоты к гликолевой кислоте от примерно 50:50 до примерно 100:0.
Фармацевтически приемлемые органические растворители могут быть выбраны из группы, состоящей из N-метил-2-пирролидона, метоксиполиэтиленгликоля, алкоксиполиэтиленгликоля, сложных эфиров полиэтиленгликоля, гликофурола, глицеролформаля, метилацетата, этилацетата, метилэтилкетона, диметилформамида, диметилсульфоксида, тетрагидрофурана, капролактама, децилметилсульфоксида, бензилбензоата, этилбензоата, триацетина, диацетина, трибутирина, триэтилцитрата, трибутилцитрата, ацетилтриэтилцитрата, ацетилтрибутилцитрата, триэтилглицеридов, триэтилфосфата, диэтилфталата, диэтилтартрата, этиллактата, пропиленкарбоната, этиленкарбоната, бутиролактона, 1-додецилазациклогептан-2-она и их комбинаций.
Согласно настоящему изобретению в композицию по изобретению может быть включен один или более чем один эксципиент для достижения оптимальной доставки пептидного агента. Подходящие эксципиенты могут включать агенты, модифицирующие скорость высвобождения, вещества, снижающие взрывной эффект, буферные вещества, антиоксиданты и тому подобное.
Согласно настоящему изобретению подходящие агенты, модифицирующие скорость высвобождения, включают, без ограничения ими, амфифильные соединения или сополимеры, такие как алканкарбоновая кислота, олеиновая кислота, алкиловый спирт, полярные липиды, поверхностно-активные вещества, сополимеры полиэтиленгликоля и полилактида или поли(лактид-со-гликолид), полоксамеры, поливинилпирролидон, полисорбаты и тому подобное; сложные эфиры моно-, ди- и трикарбоновых кислот, такие как 2-этоксиэтилацетат, триэтилцитрат, ацетилтрибутилцитрат, ацетилтриэтилцитрат, глицеринтриацетат, ди(н-бутил)себацинат и тому подобное; полигидроксиспирты, такие как полиэтиленгликоль, сорбит и тому подобное; жирные кислоты; триэфиры глицерина, такие как триглицериды, среднецепочечные триглицериды, такие как MIGLYOL 810, 812, 818, 829, 840 и тому подобное. В полимерных системах по данному изобретению также можно использовать смеси агентов, модифицирующих скорость высвобождения.
Согласно настоящему изобретению подходящие буферные агенты включают, без ограничения ими, неорганические и органическими солями, включая карбонат кальция, гидроксид кальция, миристат кальция, олеат кальция, пальмитат кальция, стеарат кальция, фосфат кальция, карбонат магния, гидроксид магния, фосфат магния, миристат магния, олеат магния, пальмитат магния, стеарат магния, карбонат цинка, гидроксид цинка, миристат цинка, олеат цинка, пальмитат цинка, стеарат цинка, фосфат цинка и их комбинации.
Согласно настоящему изобретению подходящие антиоксиданты включают, без ограничения ими, d-альфа-токоферола ацетат, аскорбилпальмитат, бутилированный гидроксианидол, бутилированный гидроксианизол, бутилированный гидроксихинон, гидроксикумарин, бутилированный гидрокситолуол, этилгаллат, пропилгаллат, октилгаллат, лаурилгаллат, пропилгидроксибензоат, тригидроксибутилрофенон, витамин Е, пэгилированный витамин Е или витамин E-TPGS и тому подобное.
В настоящем изобретении дополнительно предложены способы получения и применения таких композиций. Например, способ получения таких композиций, включающий нейтрализацию основных аминогрупп пептидных агентов с получением полезной соли для минимизации или предотвращения взаимодействия/реакции основной аминогруппы с полимером; и комбинирование полезной соли с другими компонентами и возможно с одним или более эксципиентами. Предпочтительно сначала образуется полезная соль пептидного агента и затем ее объединяют с полимером, растворенным в органическом растворителе. Такие композиции являются физико-химически стабильными до и во время процесса изготовления системы контролируемой доставки, такой как образование микрочастиц или образование другого имплантируемого матрикса. Предпочтительно такие инъецируемые композиции являются физико-химически стабильными во время получения, хранения и последующего введения субъекту и образуют при введении в сайт ткани стойкие имплантаты с контролируемым высвобождением.
В настоящем изобретении дополнительно предложен набор для введения инъецируемой композиции с образованием стойкой системы депо с контролируемым высвобождением, включающий: биоразлагаемый полимер, растворенный в фармацевтически приемлемом растворителе; полезную соль пептидного агента, содержащего по меньшей мере одну основную аминогруппу, образованную сильной кислотой, растворенную или диспергированную в полимерном носителе; и возможно один или более чем один эксципиент. Однородную смесь всех компонентов упаковывают в один контейнер. Предочтительно данный контейнер представляет собой шприц. Соответственно, согласно настоящему изобретению также предложен способ, включающий стадию заполнения шприца данной композицией с образованием стабильного продукта в готовой к применению форме.
В настоящем изобретении дополнительно предложен способ образования имплантата in situ, способного функционировать у субъекта в качестве системы контролируемой доставки пептидного агента. Пептидный агент предпочтительно включен в образующийся in situ имплантат, и затем он высвобождается в окружающие тканевые жидкости и в подходящую ткань организма или в орган по мере разрушения данного полимера. Способ включает: введение инъецируемых композиций по настоящему изобретению в сайт имлантирования любым подходящим для внесения жидкости способом, например посредством шприца, иглы, канюли, катетера, работающего под давлением аппликатора и тому подобного.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 - Стабильность LA (леупролид) в композициях при 4°С через 16 месяцев.
Фиг.2 - Молекулярная масса PLGA в композициях при 4°С через 16 месяцев.
Фиг.3 - Влияние типа и концентрации PLGA на высвобождение леупролида.
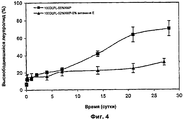
Фиг.4 - Влияние витамина Е на высвобождение LA из инъецируемых композиций.
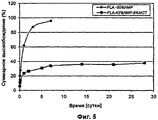
Фиг.5 - Влияние Migliol 812 на высвобождение LA из инъецируемых композиций.
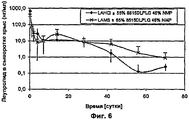
Фиг.6 - Профиль высвобождения LA из инъецируемых полимерных композиций после подкожного введения крысам.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложена стабилизированная инъецируемая биоразлагаемая полимерная композиция для получения экономически выгодной, практичной и эффективной системы контролируемой доставки пептидных агентов. В настоящем изобретении также предложен способ ее изготовления и способ ее применения.
Композиции по настоящему изобретению включают: а) полезную соль пептидного агента, образованную сильной кислотой, которая минимизирует или предотвращает взаимодействие/реакцию между данным пептидным агентом и полимером в органическом растворителе; б) биоразлагаемый полимер; в) фармацевтически приемлемый органический растворитель. Согласно данному изобретению фармацевтическая композиция возможно может включать один или более чем один эксципиент для достижения оптимальной доставки пептидного агента. Инъецируемая полимерная композиция по настоящему изобретению может быть вязкой или невязкой жидкостью, гелем или полутвердым веществом, которое перемещается как жидкость, так что его можно инъецировать, используя шприц. Инъецируемая полимерная композиция может быть предварительно помещена в один шприц с получением продукта - набора в готовой к применению форме.
Система контролируемой доставки по настоящему изобретению может быть получена в виде имплантируемого полимерного матрикса in vitro или, альтернативно, она может быть образована in situ в форме геля или твердого имплантата. При введении субъекту контролируемое высвобождение пептидного агента может поддерживаться в течение желательного периода времени в зависимости от композиции имплантата. Посредством выбора биоразлагаемого полимера и других компонентов продолжительность замедленного высвобождения пептидного агента можно контролировать в течение промежутка времени от нескольких недель до одного года.
Подразумевается, что термины, указывающие на единственное число и “один″ при использовании в данном описании изобретения следует интерпретировать как «один или более чем один» или «по меньшей мере один».
Термин «стабилизированный» при использовании в данном описании изобретения относится к значительному улучшению стабильности компонентов в инъецируемой полимерной композиции, которая необходима для достижения стабильного состояния, требующегося для разработки жизнеспособного продукта. Термин «стабилизированная инъецируемая полимерная композиция» при использовании в данном описании изобретения обозначает, что компоненты данной композиции, например полимер и пептидный агент, сохраняют по меньшей мере 80%, предпочтительно по меньшей мере 90% их исходной молекулярной массы, структуры и/или биологической активности во время изготовления и после хранения в течение длительного промежутка времени, например от месяцев до лет, предпочтительно в течение более чем 12 месяцев, при подходящих условиях.
Подразумевается, что термин «доставка с контролируемым высвобождением», как он определен в данном описании изобретения, относится к доставке пептидного агента in vivo в течение желательного длительного периода времени после введения, предпочтительно от по меньшей мере нескольких недель до одного года.
Термин «пептидный агент» при использовании в данном описании изобретения в общем смысле включает поли(аминокислоты), которые обычно в общем случае упоминаются как «пептиды», «олигопептиды» и «полипептиды» или «белки» - термины, используемые здесь взаимозаменимо. Данный термин также включает аналоги пептидного агента, производные, ацилированные производные, гликозилированные производные, пэгилированные производные, слитые белки и тому подобное. «Основной пептидный агент» представляет собой пептид, который является основным по природе, что происходит из-за присутствия основных аминокислот, например, аргинина или лизина, или проиходит из-за N-конца пептидного агента, или просто пептидный агент, который содержит по меньшей мере одну основную группу, возможно в присутствие одной или более чем одной кислых аминокислотных групп. Данный термин также включает синтетические аналоги пептидов, неприродные аминокислоты, имеющие основные функциональные группы, или любую другую форму введенной основности.
Подразумевается, что термин «пептидный агент» включает любые пептидные агенты, обладающие диагностическими и/или терапевтическими свойствами, включая, без ограничения ими, антиметаболические, противогрибковые, противовоспалительные, противоопухолевые, противоинфекционные, антибиотики, питательные, агонистические и антагонистические свойства.
Конкретно пептидные агенты по данному изобретению могут представлять собой любые пептиды, способные образовать полезную соль с сильной кислотой, в частности пептидные агенты, содержащие электронодонорную основную группу, такую как основной атом азота, например амин, имин или азот кольца. Пептидные агенты предпочтительно содержат одну или более чем одну экспонированную протонируемую аминную функциональную группу. Пептидные агенты, полезные в получении композиций по настоящему изобретению, включают, без ограничения ими, окситоцин, вазопрессин, адренокортикотропный гормон (АСТН), эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (PDGF), пролактин, лютеинизирующий гормон, высвобождающего фактор лютеинизирующего гормона (LHRH), агонисты LHRH, антагонисты LHRH, гормоны роста (включая гормоны человека, свиней и коров), высвобождающего фактор гормона роста, инсулин, эритропоэтин (включая все белки с эритропоэтической активностью), соматостатин, глюкагон, интерлейкин (который включает IL-2, IL-11, IL-12 и т.д.), интерферон-альфа, интерферон-бета, интерферон-гамма, гастрин, тетрагастрин, пентагастрин, урогастрон, секретин, кальцитонин, энкефалины, эндорфины, ангиотензины, тиреотропин-высвобождающий гормон (TRH), фактор некроза опухолей (TNF), паратиреоидный гормон (РТН), фактор роста нервов (NGF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), макрофагальный колониестимулирующий фактор (M-CSF), гепариназу, сосудистый эндотелиальный фактор роста (VEG-F), костный морфогенный белок (BMP), hANP, глюкагоноподобный пептид (GLP-1), эксенатид, пептид YY (PYY), ренин, брадикинин, бацитрацины, полимиксины, колистины, тироцидин, грамицидины, циклоспорины (включающие их синтетические аналоги и фармакологически активные фрагменты), цитокины, антитела, вакцины, антибиотики, антитела, гликопротеины, фолликулостимулирующий гормон, киоторфин, тафтсин, тимопоэтин, тимозин, тимостимулин, тимусный гуморальный фактор, сывороточный тимусный фактор, колониестимулирующие факторы, мотилин, бомбезин, динорфин, нейротензин, церулеин, урокиназу, калликреин, аналоги и антагонисты вещества Р, ангиотензин II, фактор свертывания крови VII и IX, грамицидины, меланоцитстимулирующий гормон, высвобождающего фактор тиреоидного гормона, тиреостимулирующий гормон, панкреозимин, холецистокинин, человеческий плацентарный лактоген, человеческий хорионический гонадотропин, пептид, стимулирующий синтез белка, желудочный ингибиторный пептид, вазоактивный пептид кишечника, тромбоцитарный фактора роста и их синтетические аналоги и модификации и фармакологически активные фрагменты.
Предпочтительные пептидные агенты, используемые здесь, включают пептидные агенты, где N-конец не является первичным амином. Например, N-конец пептидных агентов может быть пироглутаминовой кислотой, например LHRH и агонистами LHRH, такими как лейпрорелин, бусерелин, гонадорелин, деслорелин, фертирелин, гистрелин, лутрелин, гозерелин, нафарелин, трипторелин и тому подобное. Альтернативно N-концевая аминогруппа может быть кэппированной или ацилированной, например цетрореликс, энфувиртид, тимозин α1, абареликс и тому подобное.
Предпочтительные пептидные агенты, используемые здесь, также включают пептидные агенты, где N-концевой первичный амин ковалентно модифицирован гидрофильными и/или липофильными группировками например посредством пэгилирования, ацилирования и тому подобного. Пептидные агенты, используемые здесь, дополнительно включают пептидные агенты, где первичный(ые) амин(ы) боковой цепи ковалентно модифицированы гидрофильными и/или липофильными группировками, например, посредством пэгилирования, ацилирования и тому подобного. Предпочтительные пептидные агенты, используемые здесь, дополнительно включают пептидные агенты, где и N-концевая первичная аминная группа, и первичная аминная группа боковой цепи одновременно ковалентно модифицированы гидрофильными и/или липофильными группировками, например посредством пэгилирования, ацилирования и тому подобного.
Термин «гидрофильная группировка» относится к любому водорастворимому линейному или разветвленному олигомеру или полимеру, включая, но без ограничения ими, полиэтиленгликоль и полипропиленгликоль, и аналогичные линейные и разветвленные полимерыи. Предпочтительно молекулярная масса полимера варьируется от примерно 500 дальтон до примерно 50000 дальтон. Гидрофильные полимеры для применения в настоящем изобретении могут иметь реакционно-способную группу, включенную для присоединения к интересующему пептидному агенту через аминную, карбоксильную, гидроксильную или тиольную группы.
Используемый здесь термин «пэгилирование» относится к ковалентной конъюгации растворимого полиэтиленгликоля с пептидными агентами. Полиэтиленгликоль может быть получен согласно стандартным протоколам с одним кэппированным концом, например метокси группой, и другим концом, активированным для легкой конъюгации с активными группами на пептидных агентах. Например, в данной области описаны разные способы получения полиэтиленгликолей и их применение для пэгилирований: [например Roberts M.J., Bentley M.D., Harris J.M., Chemistry for peptide and protein PEGylation. Adv Drug Deliv Rev. 2002 Jun 17; 54(4): 459-76. Veronese FM. Peptide and protein PEGylation: a review of problems and solutions. Biomaterials. 2001 Mar; 22(5): 405-17 и патенты США №6113906, 5446090, 5880255], все из которых включены в данное описание изобретения посредством ссылки.
Термин «липофильная группировка» относится к любым молекулам, имеющим растворимость в воде при 20°С менее 5 мг/мл, предпочтительно менее 0,5 мг/мл, более предпочтительно менее 0,1 мг/мл. Такая липофильная группировка предпочтительно выбрана из С2-39алкильных, С2-39алкенильных, С2-39алкадиенильных и стероидных остатков. Подразумевается, что термин «С2-39алкил, С2-39алкенил, С2-39алкадиенил» включает углеводород с прямой цепью или разветвленный, предпочтительно с прямой цепью, насыщенный, мононенасыщенный и диненасыщенный из 2-39 атомов углерода.
Введение липофильной группировки, ковалентно связанной с пептидным агентом, приводит к получению липофильно модифицированного пептида, который может иметь улучшенный терапевтический эффект по сравнению с нативной молекулой. Это обычно можно сделать путем проведения реакции аминогруппы в пептидном агенте с кислой или другой реакционно-способной группой в липофильной молекуле. Альтернативно, конъюгацию между пептидным агентом и липофильной молекулой осуществляют посредством дополнительной группировки, такой как мостик, спейсер или связующая группировка, которая может быть деградируемой или недеградируемой. Некоторые примеры раскрыты в предшествующем уровне техники [например Hashimoto, M., et al., Pharmaceutical Research, 6:171-176 (1989) и Lindsay, D. G., et al., Biochemical J. 121:737-745 (1971), патент США №5693609, WO95/07931, патент США №5750497 и WO96/29342, WO98/08871, WO98/08872 и WO99/43708]. Эти раскрытия в прямой форме включены в данное описание изобретения посредством ссылки для описания липофильно модифицированных пептидов и для обеспечения их получения.
Подразумевается, что термин «сильная кислота», как он здесь определен, включает любые кислоты с рКа менее 3, предпочтительно менее 0 и более предпочтительно менее -3. Сильные кислоты, подходящие для настоящего изобретения, могут быть выбраны из группы, состоящей из соляной кислоты, бромистоводородной кислоты, азотной кислоты, хромовой кислоты, серной кислоты, метансульфоновой кислоты, трифторметансульфоновой кислоты, трихлоруксусной кислоты, дихлоруксусной кислоты, бромуксусной кислоты, хлоруксусной кислоты, циануксусной кислоты, 2-хлорпропановой кислоты, 2-оксобутановои кислоты, 2-хлорбутановой кислоты, 4-цианобутановой кислоты, памовой кислоты, перхлорной кислоты, фосфорной кислоты, йодистоводородной кислоты и тому подобных, но не ограничены ей.
«Сильная кислота» по настоящему изобретению также включает любые органические серные кислоты, такие как алкил-, арил- или алкиларилсерные кислоты из 1-40 атомов углерода, предпочтительно из менее чем 18 атомов углерода и более предпочтительно из менее чем 6 атомов углерода, и органические сульфоновые кислоты, такие как алкан-, арилалкан-, арен- или алкенсульфоновые кислоты из 1-40 атомов углерода, предпочтительно из менее чем 18 атомов углерода и более предпочтительно из менее чем 6 атомов углерода.
Подразумевается, что термин «полезная соль пептидного агента», как она здесь определена, включает любые соли пептидного агента, образованные сильной кислотой. Полезные соли пептидных агентов могут быть получены посредством простого титрования или нейтрализации кислотой и основанием. Полезные соли пептидных агентов можно получить в процессе их синтеза и очистки. Альтернативно, их можно получить из пептидного агента в форме свободного основания. Свободное основание растворено в подходящей жидкой среде. Этот раствор пептидного агента смешивают с раствором сильной кислоты с получением полезных солей путем удаления растворителя подходящими способами, такими как фильтрация или лиофилизация. Если пептидный агент находится в форме его обычной имеющейся в продаже соли, образованной слабой кислотой (т.е. с рКа>3), данную слабую кислоту можно заменить сильной кислотой посредством обычных ионообменных способов, таких как лиофилизация, осаждение или другие способы, известные в данной области. Например, леупролида ацетат растворяют в подходящей жидкой среде, например в воде. Этот раствор пептидного агента смешивают с водным раствором сильной кислоты, такой как соляная кислота. При растворении в воде ацетата пептида и сильной кислоты, такой как соляная кислота, пептид имеет тенденцию к ассоциации с хлоридным ионом, так как более сильная кислота HCI вытесняет более слабую карбоновую уксусную кислоту. Растворитель и высвобожденную уксусную кислоту (или другую слабую, но летучую карбоновую кислоту) можно удалить под вакуумом. Таким образом, раствор смеси лиофилизируют для удаления воды и более слабой кислоты с получением полезных солей. Если пептидный агент не является стабильным при низком рН, полезные соли данного пептидного агента можно получить посредством экстенсивного диализа против очень низкой концентрации сильной кислоты.
Инъецируемые полимерные композиции по настоящему изобретению могут содержать пептидный агент в диапазоне от 0,01 до 40% по массе. В общем случае оптимальная загрузка лекарственного средства зависит от желательного периода высвобождения и от эффективности данного пептидного агента. Очевидно, для пептидного агента с низкой эффективность, и более длительным периодом высвобождения могут потребоваться более высокие уровни включения.
Термин «биоразлагаемое» относится к веществу, которое постепенно распадается, растворяется, гидролизуется и/или разрушается in situ. Обычно «биоразлагаемые полимеры» здесь представляют собой полимеры, которые являются гидролизуемыми и/или биологически разрушаются in situ главным образом посредством гидролиза и/или ферментативного расщепления.
Подразумевается, что термин «биоразлагаемый полимер», как он используется здесь, включает любые биосовместимые и/или биоразлагаемые синтетические и природные полимеры, которые можно использовать in vivo, при условии что данный полимер по меньшей мере в значительной степени нерастворимый в водной среде или в жидкости организма. Термин «в значительной степени нерастворимый», как он используется здесь, указывает на то, что нерастворимость полимера должна быть достаточной для того, чтобы приводить к осаждению полимера в водной среде или в жидкости организма. Предпочтительно растворимость полимеров составляет менее 1% по массе и более предпочтительно менее 0,1%. При смешивании раствора полимера в смешивающемся или диспергирующемся в воде органическом растворителе с водным раствором полимер будет осаждаться с образованием твердого или гелевого матрикса по мере того, как органический растворитель рассеивается. Подходящие биоразлагаемые полимеры раскрыты, например, в патентах США №4938763, 5278201, 52782012, 5324519, 5702716, 5744153, 5990194 и 6773714. Некоторыми неограничивающими примерами данных полимеров являются полилактиды, полигликолиды, поликапролактоны, полидиоксаноны, поликарбонаты, полигидроксибутираты, полиалкиленоксалаты, полиангидриды, полиэфирамиды, полиуретаны, полиацетали, полиортокарбонаты, полифосфазены, полигидроксивалераты, полиалкиленсукцинаты, поли(яблочная кислота) и полиортоэфиры, и сополимеры, блоксополимеры, разветсвленные сополимеры, тройные сополимеры или их комбинации и смеси.
Блоксополимеры включают блоксополимеры А-В-А, блоксополимеры В-А-В и/или блоксополимеры А-В и/или разветвленные сополимеры. Предпочтительными блоксополимерами являются блоксополимеры, где блок А содержит гидрофобный полимер, и блок В содержит гидрофильный полимер. В частности при использовании одного из вышеупомянутых блоксополимеров наиболее предпочтительные полимерные матриксы определены как матриксы, где блок А представляет собой биоразлагаемый полимер, выбранный из группы, состоящей из полилактидов, полигликолидов, поли(лактид-со-гликолидов), полиангидридов, поли(ортоэфиров), полимеры с простой и сложной эфирной связью, поликапролактонов, полиэфирамидов, поли(е-капролактонов), поли(гидроксимасляных кислот) и их смесей и сополимеров, и блок В представляет собой полиэтиленгликоль или монофункциональное производное полиэтиленгликоля, такое как метоксиполиэтиленгликоль. Многие из этих комбинаций могут образовать приемлемые термообратимые гели.
Подходящие молекулярные массы полимеров может определить обычный специалист в данной области. Факторы, которые можно учитывать при определении молекулярных масс, включают желательную скорость разрушения полимера, механическую прочность и скорость растворения полимера в органических растворителях. Обычно подходящий интервал среднемассовых молекулярных масс полимеров составляет от примерно 2000 дальтон до примерно 100000 дальтон с полидисперсностью от 1,1 до 2,5 в зависимости от того, наряду с другими факторами, какой полимер выбран для применения.
Инъецируемые полимерные композиции по настоящему изобретению могут содержать биоразлагаемый полимер в интервале от 10% до 70% по массе. Вязкость инъецируемых композиций по изобретению зависит от молекулярной массы полимера и от используемого органического растворителя. Обычно, когда используется один и тот же растворитель, чем выше молекулярная масса и концентрация полимера, тем выше вязкость. Предпочтительно концентрация полимера в данных композициях составляет менее 70% по массе. Более конкретно концентрация полимера в данных композициях составляет от 30 до 60% по массе.
В настоящем изобретении предпочтительно используется поли(молочная кислота) и сополимеры молочной кислоты и гликолевой кислоты (PLGA), включая поли(D,L-лактид-со-гликолид) и поли(L-лактид-со-гликолид). Полимеры (или термопластические полиэфиры) имеют отношения мономеров молочной кислоты к гликолевой кислоте от примерно 50:50 до примерно 100:0 и среднемассовые молекулярные массы от примерно 2000 до примерно 100000. Биоразлагаемые термопластические полиэфиры можно получить, используя способы, известные в данной области, например посредством поликонденсации и полимеризации с раскрытием цикла (например патенты США №4443340, 5242910, 5310865, все из которых включены в данное описание изобретения посредством ссылки). Концевыми группами поли(D,L-лактид-со-гликолида) могут быть или гидроксильная, карбоксильная или эфирная, в зависимости от способа полимеризации. Подходящие полимеры могут включать монофункциональный спиртовой или полиольный остаток и могут не иметь карбоновокислотного конца. Примерами монофункциональных спиртов являются метанол, этанол или 1-додеканол. Полиолом может быть диол. триол, тетраол, пентаол и гексанол, включая этиленгликоль, 1,6-гександиол, полиэтиленгликоль, глицерин, сахариды, восстановленные сахариды, такие как сорбит, и тому подобное.
Многие подходящие PLGA имеются в продаже, и PLGA с конкретными составами могут быть легко получены согласно предшествующему уровню техники. PLGA с различыми соотношениями мономеров и молекулярными массами доступны от Boehringer-lngelheim (Petersburg, Va, США), Lakeshore Biomaterials (Birmingham, AL, США), DURECT Corporation (Pelham, AL).
Тип, молекулярная масса и количество биоразлагаемого полимера, присутствующего в композициях, могут влиять на доительность промежутка времени, за которое пептидный агент высвобождается из имплантата с контролируемым высвобождением. Выбор типа, молекулярной массы и количества биоразлагаемого полимера, присутствующего в композициях, для достижения желательных свойств имплантата с контролируемым высвобождением можно определить простым экспериментированием.
В одном предпочтительном воплощении настоящего изобретения можно использовать жидкую композицию для приготовления в виде препарата системы контролируемой доставки леупролида гидрохлорида. В таком воплощении биоразлагаемый термопластический полиэфир предпочтительно может представлять собой 85/15 поли(DL-лактид-со-гликолид), содержащий гидроксильную концевую группу и конец в виде лаурилового эфира, может присутствовать в количестве от примерно 30% до примерно 60% от массы композиции; и может иметь среднюю молекулярную массу от примерно 15000 до примерно 50000.
В другом предпочтительном воплощении настоящего изобретения жидкую композицию можно использовать для приготовления в виде препарата системы контролируемой доставки леупролида гидрохлорида. В таком воплощении биоразлагаемый термопластический полиэфир предпочтительно может представлять собой 85/15 поли(DL-лактид-со-гликолид), содержащий две гидроксильных концевых группы; может присутствовать в содержании от примерно 30% до примерно 60% от массы композиции; и может иметь среднюю молекулярную массу от примерно 15000 до примерно 50000.
В еще одном предпочтительном воплощении настоящего изобретения жидкую композицию можно использовать для приготовления в виде препарата системы контролируемой доставки леупролида гидрохлорида. В таком воплощении биоразлагаемый термопластический полиэфир предпочтительно может представлять собой 85/15 поли(DL-лактид-со-гликолид), содержащий карбоновокислотные концевые группы; может присутствовать в количестве от примерно 30% до примерно 60% от массы композиции; и может иметь среднюю молекулярную массу от примерно 15000 до примерно 50000.
В еще одном предпочтительном воплощении настоящего изобретения данную композицию можно использовать для приготовления в виде препарата системы контролируемой доставки леупролида. В таком воплощении биоразлагаемый полимер предпочтительно может представлять собой 100/0 поли(DL-лактид), содержащий/не содержащий карбоновокислотные концевые группы; может присутствовать в количестве от примерно 40% до примерно 60% от массы композиции; и может иметь среднюю молекулярную массу от примерно 8000 до примерно 50000.
Подразумевается, что термин «фармацевтически приемлемый органический растворитель» включает любые биосовместимые органические растворители, которые являются смешивающимися или диспергирующимися в водной жидкости или в жидкости организма. Термин «диспергирующийся» означает, что данный растворитель является частично растворимым или смешивающимся в воде. Предпочтительно один растворитель или смесь растворителей имеет растворимость или смешиваемость в воде больше, чем 0,1% по массе. Более предпочтительно растворитель имеет растворимость или смешиваемость в воде больше, чем 3% по массе. Наиболее предпочтительно растворитель имеет растворимость или смешиваемость в воде больше, чем 7% по массе. Подходящий органический растворитель должен быть способен диффундировать в жидкость организма так, чтобы жидкая композиция коагулировала или отверждалась. Можно использовать один растворитель и/или смесь таких растворителей; пригодность таких растворителей легко можно определить путем простого экспериментирования.
Примеры фармацевтически приемлемых органических растворителей включают, без ограничения ими, N-метил-2-пирролидон, метоксиполиэтиленгликоль, алкоксиполиэтиленгликоль, сложные эфиры полиэтиленгликоля, гликофурол, глицеролформаль, метилацетат, этилацетат, метилэтилкетон, диметилформамид, диметилсульфоксид, тетрагидрофуран, капролактам, децилметилсульфоксид, бензилбензоат, этилбензоат, триацетин, диацетин, трибутирин, триэтилцитрат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилглицериды, триэтилфосфат, диэтилфталат, диэтилтартрат, этиллактат, пропиленкарбонат, этиленкарбонат, бутиролактон, 1-додецилазациклогептан-2-он и их комбинации.
Растворимость биоразлагаемых полимеров в разных фармацевтически приемлемых органических растворителях будет отличаться в зависимости от характеристик полимеров и их совместимости с разными растворителями. Таким образом, один и тот же полимер не будет растворимым в одинаковой степени в разных растворителях. Например, PLGA имеет значительно более высокую растворимость в N-метил-2-пирролидоне (NMP), чем в триацетине. Однако, когда раствор PLGA в NMP находится в контакте с водным раствором, NMP будет очень быстро рассеиваться с образованием твердого полимерного матрикса из-за его высокой смешиваемости с водой. Высокая скорость диффузии данного растворителя может приводить к быстрому образованию твердого имплантата, однако, она также может приводить к сильному исходному взрывному высвобождению. Когда раствор PLGA в триацетине находится в контакте с водным раствором, триацетин будет рассеиваться очень медленно из-за его низкой смешиваемости с водой. Низкая скорость диффузии данного растворителя может требовать длительного времени для превращения из вязкой жидкости в твердый матрикс. Может иметь место оптимальный баланс, при котором растворитель диффундирует в окружающую жидкость и происходит коагуляция полимера с инкапсуляцией пептидных агентов. Следовательно, может быть полезным объединение разных растворителей для получения желательной системы доставки. Растворители с низкой и высокой смешиваемостью в воде можно объединять для улучшения растворимости полимера, модификации вязкости композиции, оптимизации скорости диффузии и снижения исходного взрывного высвобождения.
Инъецируемые полимерные композиции по настоящему изобретению обычно содержат органический растворитель в интервале от 30% до 80% по массе. Вязкость инъецируемых композиций по изобретению зависит от молекулярной массы полимера и используемого органического растворителя. Предпочтительно концентрация полимера в композициях составляет менее 70% по массе. Более предпочтительно концентрация полимера в растворах составляет от 30 до 60% по массе.
Подразумевается, что термин «эксципиенты», как он используется здесь, включает любой полезный ингредиент в композиции помимо пептидного агента или биоразлагаемых полимеров, используемых для образования данной композиции. Подходящие эксципиенты включают агенты, модифицирующие скорость высвобождения, вещества, уменьшающие взрывной эффект, буферные вещества, антиоксиданты и тому подобное.
Согласно настоящему изобретению подходящие агенты, модифицирующие скорость высвобождения, включают, без ограничения ими, амфифильные соединения или сополимеры, такие как алканкарбоновая кислота, олеиновая кислота, алкиловый спирт, полярные липиды, поверхностно-активные вещества, сополимеры полиэтиленгликоля и полилактида или поли(лактид-со-гликолид), полоксамеры, поливинилпирролидон, полисорбаты и тому подобное; сложные эфиры моно-, ди- и трикарбоновых кислот, такие как 2-этоксиэтилацетат, триэтилцитрат, ацетилтрибутилцитрат, ацетилтриэтилцитрат, глицеринтриацетат, ди(н-бутил)себацинат и тому подобное; полигидроксиспирты, такие как полиэтиленгликоль, сорбит и тому подобное; жирные кислоты; триэфиры глицерина, такие как триглицериды, среднецепочечные триглицериды, такие как MIGLYOL 810, 812, 818, 829, 840 и тому подобное. В полимерных системах по данному изобретению также можно использовать смеси агентов, модифицирующих скорость высвобождения.
Агенты, модифицирующие скорость высвобождения, могут присутствовать в инъецируемой полимерной композиции в количестве, эффективном для уменьшения исходного взрыва высвобождения пептидного агента из полимерной композиции на протяжении первых 24 часов после имплантации. Предпочтительно полимерная композиция включает от примерно 1% до примерно 50% по массе, более предпочтительно от примерно 2% до примерно 20% по массе агентов, модифицирующих скорость высвобождения.
Согласно настоящему изобретению подходящие буферы включают, без ограничения ими, неорганические и органические соли, включая карбонат кальция, гидроксид кальция, миристат кальция, олеат кальция, пальмитат кальция, стеарат кальция, фосфат кальция, карбонат магния, гидроксид магния, фосфат магния, миристат магния, олеат магния, пальмитат магния, стеарат магния, карбонат цинка, гидроксид цинка, миристат цинка, олеат цинка, пальмитат цинка, стеарат цинка, фосфат цинка и их комбинации.
Буферные агенты могут присутствовать в инъецируемой полимерной композиции в количестве, эффективном для стабилизации рН в имплантатах во время процесса разрушения. Предпочтительно полимерная композиция включает от примерно 1 мас.% до примерно 30 мас.%, более предпочтительно от примерно 2% мас.% до примерно 15 мас.% буферных агентов.
Согласно настоящему изобретению подходящие антиоксиданты включают, без ограничения ими, d-альфа-токоферола ацетат, аскорбилпальмитат, бутилированный гидроксианидол, бутилированный гидроксианизол, бутилированный гидроксихинон, гидроксикумарин, бутилированный гидрокситолуол, этилгаллат, пропилгаллат, октилгаллат, лаурилгаллат, пропилгидроксибензоат, тригидроксибутилрофенон, витамин Е, пэгилированный витамином Е или витамин E-TPGS и тому подобное.
Антиоксиданты могут присутствовать в инъецируемой полимерной композиции в количестве, эффективном для удаления любых радикалов или пероксидов, образующихся в имплантатах. Предпочтительно полимерная композиция включает от примерно 1 мас.% до примерно 30 мас.%, более предпочтительно от примерно 3 мас.% до примерно 15 мас.% антиоксидантов.
В одном аспекте настоящего изобретения предложена стабилизированная инъецируемая биоразлагаемая полимерная композиция для получения экономически выгодной, практичной и эффективной системы контролируемой доставки пептидных агентов, включающая: а) полезную соль пептидного агента, образованную сильной кислотой, которая минимизирует или предотвращает взаимодействие/реакцию между пептидным агентом и полимером в органическом растворе; б) биоразлагаемый полимер; в) фармацевтически приемлемый органический растворитель и г) возможно один или более чем один эксципиент для достижения оптимальной доставки пептидного агента. Предпочтительно инъецируемую композицию упаковывают в набор, с включением стадии помещения данной композиции в шприц в готовой для применения форме. Композиция в данном наборе является стабильной в течение приемлемого промежутка времени, предпочтительно в течение по меньшей мере одного года, для того, чтобы иметь подходящий срок хранения в контролируемых условиях хранения. Данную композицию предпочтительно инъецируют субъекту с образованием in situ имплантата, из которого пептидный агент высвобождается в терапевтически эффективном количестве в течение желательного длительного периода времени.
Стабилизированную инъецируемую биоразлагаемую полимерную композицию по настоящему изобретению можно получить путем подходящего объединения полезной соли пептидного агента, биоразлагаемого полимера, фармацевтически приемлемого органического растворителя и возможно эксципиента. Композиция для введения может быть удобно представлена в стандартной лекарственной форме и может быть получена любым из способов, известных в фармации. Одним предпочтительным способом получения композиции по настоящему изобретению является растворение биоразлагаемого полимера и/или эксципиента в фармацевтически приемлемом органическом растворителе с получением сначала однородного раствора/суспензии полимера. Затем к этому раствору/суспензии добавляют полезную соль пептидного агента. Компоненты тщательно смешивают, используя любые подходящие средства с получением однородного раствора или суспензии. Затем подходящее количество данного раствора или суспензии переносят в шприц с получением готового к применению продукта.
Уровень включения полезной соли и полимера в композицию по изобретению естественно будет варьироваться в зависимости от эффективности компонента - пептидного агента, периода времени, в течение которого является желательной доставка данного агента, растворимости полимера в растворителе и объема и вязкости той инъецируемой композиции, которую желательно вводить.
В определенных предпочтительных воплощениях настоящего изобретения инъецируемая биоразлагаемая полимерная композиция для получения экономически выгодной, практичной и эффективной системы контролируемой доставки пептидных агентов содержит примерно 0,01%-40% полезной соли пептидного агента и примерно 10%-70% поли(лактид-со-гликолидного) полимера. Данная композиция дополнительно содержит примерно 30%-70% фармацевтически приемлемого органического растворителя.
В предпочтительном воплощении настоящего изобретения композиция дополнительно содержит примерно 1%-40% подходящего эксципиента, включающего агенты, модифицирующие скорость высвобождения, вещества, снижающие взрывной эффект, буферные вещества, антиоксиданты, агенты, тканевого транспорта, и тому подобное, как определено выше.
Согласно настоящему изобретению инъецируемую композицию переносят в стерильный контейнер, подходящий для введения путем инъекции, например в шприц. Контейнер упаковывают для хранения, и компоненты композиции сохраняют по меньшей мере 80%, предпочтительно 90% от их исходной молекулярной массы, структуры и/или биологической активности во время процессов изготовления и хранения или до введения субъекту, такому как животное или человек.
Таким образом, согласно настоящему изобретению стабилизированные композиции можно вводить субъекту, когда желательной является контролируемая доставка пептидного агента. Подразумевается, что термин «субъект», как он используется здесь, включает теплокровных животных, предпочтительно млекопитающих, наиболее предпочтительно человека.
Подразумевается, что термин «введенный субъекту», как он используется здесь, относится к диспергированию, доставке или нанесению композиции (например фармацевтического препарата) субъекту любым подходящим для доставки данной композиции путем в желательное место у данного субъекта. Предпочтительно композицию по настоящему изобретению можно вводить путем инъекции и/или имплантации подкожно, внутримышечно, внутрибрюшинно или внутрикожно с получением желательной дозировки на основе известных параметров для лечения пептидным агентом разных медицинских состояний.
Подразумевается, что термин «доставка с контролируемым высвобождением», как он здесь определен, относится к непрерывной доставке пептидного агента in vivo на протяжении некоторого периода времени после введения, предпочтительно от по меньшей мере нескольких недель до одного года. Продолжительная контролируемая доставка данного агента может быть продемонстрирована, например, посредством длительного терапевтического эффекта данного агента во времени (например для аналога LHRH длительная доставка данного аналога может быть продемонстрирована посредством непрерывного подавления синтеза тестостерона во времени). Альтернативно, продолжительная доставка пептидного агента может быть продемонстрирована путем определением присутствия данного агента in vivo во времени.
Количество вводимой инъецируемой композиции обычно будет зависеть от желательных свойств имплантата с контролируемым высвобождением. Например, количество инъецируемой композиции может влиять на количество времени, в течение которого пептидный агент высвобождается из имплантата с контролируемым высвобождением.
В предпочтительном воплощении объем инъецируемой полимерной композиции по настоящему изобретению, подлежащей инъекции субъекту, варьируется от 0,1 мл до 2,0 мл; предпочтительно от 0,2 мл до 1,0 мл и более предпочтительно от 0,3 мл до 0,5 мл.
В настоящем изобретении дополнительно предложен способ образования у субъекта in situ имплантата, включающий введение субъекту эффективного количества инъецируемой композиции, содержащей: а) полезную соль пептидного агента, образованную сильной кислотой, которая минимизирует или предотвращает взаимодействие/реакцию между данным пептидным агентом и полимером в органическом растворе; б) биоразлагаемый полимер; в) фармацевтически приемлемый органический растворитель и г) возможно один или более чем один эксципиент для достижения оптимальной доставки пептидного агента, и обеспечения рассеяния растворителя в окружающей водной среде для превращения жидкой композиции в депо посредством разделения фаз. Депо может представлять собой вязкий гель, полутвердый или твердый матрикс. Депо также может быть пористым или непористым. Депо служит в качестве системы доставки, из которой пептидный агент высвобождается на протяжении желательного и продолжительного периода времени.
В другом предпочтительном воплощении инъецируемая композиция по настоящему изобретению может вводиться для помещения в полость тела с образованием системы депо. Такие полости включают полости, созданные после хирургического вмешательства, или природные полости тела, такие как влагалище, анус и тому подобное.
В другом аспекте настоящего изобретения предложена стабилизированная жидкая биоразлагаемая полимерная композиция для образования экономически выгодной, практичной и эффективной системы контролируемой доставки пептидных агентов, включающая: а) полезную соль пептидного агента, образованную сильной кислотой, которая минимизирует или предотвращает взаимодействие/реакцию между пептидным агентом и полимером в органическом растворе; б) биоразлагаемый полимер; в) органический растворитель и г) возможно один или более чем один эксципиент для достижения оптимальной доставки пептидного агента. Жидкая биоразлагаемая полимерная композиция может быть изготовлена в имплантируемых полимерных матриксах, где данная жидкая биоразлагаемая полимерная композиция сохраняет по меньшей мере 90%, предпочтительно 95% ее исходной молекулярной массы, структуры и/или биологической активности до или во время процесса изготовления.
Подразумевается, что термин «имплантируемые полимерные матриксы», как он используется здесь, включает частицы, пленки, гранулы, цилиндры, диски, микрокапсулы, микросферы, наносферы, микрочастицы, облатки и другие известные полимерные формы, используемые для доставки лекарственного средства.
Способы получения разных фармацевтически приемлемых полимерных носителей хорошо известны в данной области. Например, разные способы и вещества описаны в патентах США 6410044, 5698213, 6312679, 5410016, 5529914, 5501863 и публикации PCTWO 93/16687, 4938763, 5278201, 5278202, EP 0058481, все из которых включены в данное описание изобретения посредством ссылки.
Согласно настоящему изобретению имплантируемые полимерные матриксы в форме микросфер изготавливают путем инкапсуляции полезной соли пептидных агентов в полимер. Полезная соль пептидных агентов может быть инкапсулирована с использованием различных биосовместимых и/или биоразлагаемых полимеров, имеющих уникальные свойства, которые подходят для доставки в разные биологические среды или для осуществления специфических функций. Скорость растворения и, следовательно, доставки пептидного агента определяется конкретной методикой инкапсуляции, полимерной композицией, поперечным связыванием полимера, толщиной полимера, растворимостью полимера, размером и растворимостью комплекса биологически активное соединение/полианион.
Полезные соли пептидных агентов, подлежащих инкапсуляции, растворяют или суспендируют в растворе полимера в органическом растворителе. Раствор полимера должен быть достаточно концентрированным, чтобы полностью покрыть полезную соль после того, как их добавляют в раствор. Таким количеством является количество, которое обеспечивает отношение массы полезной соли пептидных агентов к полимеру от примерно 0,01 до примерно 50, предпочтительно от примерно 0,1 до примерно 30. Полезную соль пептидных агентов следует поддерживать в суспендированном состоянии и не давать агрегироваться, пока ее покрывают путем контакта с полимером.
Полимерный раствор полезных солей пептидных агентов, следовательно, может быть подвергнут целому ряду процедур микроинкапсуляции, включая распылительную сушку, замораживание спрея, эмульсию и эмульсию с упариванием растворителя.
Согласно одному воплощению данного изобретения полезную соль пептидных агентов растворяют или суспендируют в растворе полимера в органическом растворителе. Раствор или суспензию переносят в больший объем водного раствора, содержащего эмульгатор. В водном растворе органическая фаза эмульгируется, когда органический растворитель испаряется или диффундирует из полимера. Отвержденный полимер инкапсулирует полезную соль пептидных агентов с образованием полимерного матрикса. Эмульгатор помогает снизить межфазное поверхностное натяжение между разными фазами вещества в системе во время фазы отверждения данного процесса. Альтернативно, если инкапсулирующий полимер имеет некоторую присущую ему поверхностную активность, может не требоваться добавление отдельного поверхностно-активного агента.
Эмульгаторы, полезные для получения инкапсулированной полезной соли пептидных агентов согласно настоящему изобретению, включают полоксамеры и поливиниловый спирт, как приведено здесь в качестве примера, поверхностно-активные вещества и другие поверхностно-активные соединения, которые могут снизить поверхностное натяжение между инкапсулированной в полимере полезной солью пептидных агентов и раствором.
Органические растворители, полезные для получения микросфер по настоящему изобретению, за исключением растворителей, раскрытых выше, также включают уксусную кислоту, ацетон, метиленхлорид, этилацетат, хлороформ и другие нетоксичные растворители, которые будут зависеть от свойств полимера. Растворители следует выбирать так, чтобы они растворяли полимер, и в конечном счете они должны быть нетоксичными.
Таким образом, согласно настоящему изобретению эти имплантируемые полимерные матриксы можно вводить субъекту, когда является желательной длительная контролируемая доставка пептидного агента. Предпочтительно имплантируемые полимерные матриксы по изобретению можно вводить путем инъекции и/или имплантации подкожно, внутримышечно, внутрибрюшинно или внутрикожно для обеспечения желательной дозировки на основе известных параметров для лечения пептидным агентом разных медицинских состояний.
Все книги, статьи и патенты, упоминаемые здесь, полностью включены в данное описание изобретения посредством ссылки.
ПРИМЕРЫ
Следующие примеры иллюстрируют композиции и способы по настоящему изобретению. Следующие примеры не следует рассматривать как ограничения, они просто должны показывать, как делать полезные композиции для доставки лекарственного средства с контролируемым высвобождением.
Пример 1. Получение полезных солей пептидных агентов и пептидных производных, образованных сильными кислотами
Пептидный агент или пептидное производное, содержащее по меньшей мере одну основную функциональную группу, растворяют в воде. Добавляют к данному водному раствору пептидного агента стехиометрические количества сильной кислоты, что приводит к нейтрализации основных групп в пептидном агенте. Соль получают осаждением, фильтрацией и/или лиофилизацией.
Пример 2. Получение леупролида гидрохлорида
Леупролид представляет собой агонист высвобождающего фактора лютеинизирующего гормона (LHRH), содержащий 9 аминокислотных остатков и две основные функциональные группы (группу гистидина и аргинина). Его N-концевой амин блокирован в форме пироглутаминовой кислоты. Его использовали в лечении рака предстательной железы и эндометриоза. Леупролида ацетат (LA-Ac) получали от Polypeptides Laboratories, Inc. (PPL Lot#PPL-LEUP0401A). Леупролида гидрохлорид (LA-HCI) получали путем замещения уксусной кислоты на HCI через ионообменный и лиофилизирующий процесс. Обычно 1000 мг леупролида ацетата растворяли в 30 мл воды. Добавляли 3,19 мл 0,5 н. HCI (HCI:LA-2,2 :1) и хорошо перемешивали. Раствор лиофилизировали в течение 72 ч для удаления уксусной кислоты. Высушенный порошок снова растворяли в воде и лиофилизировали.
Пример 3. Получение леупролида мезилата
343,5 мг леупролида ацетата (PPL Lot#PPL-LEUP0401A) растворяли в 20 мл воды. Добавляли и хорошо перемешивали 32 мл метансульфоновой кислоты (молярное отношение леупролида ацетата к метансульфоновой кислоте ~1:2). Раствор лиофилизировали в течение 72 ч для удаления уксусной кислоты. Высушенный порошок снова растворяли в воде и лиофилизировали.
Пример 4. Получение гозерелина гидрохлорида
766 мг гозерелина ацетата (PPL Lot#0603-219) растворяли в 20 мл воды. Добавляли и хорошо перемешивали 2,12 мл 0,5 н. HCI (молярное отношение HCI:гозерелина ацетат - 2,2:1). Раствор лиофилизировали в течение 72 ч для удаления уксусной кислоты. Высушенный порошок снова растворяли в воде и лиофилизировали.
Пример 5. Получение пальмитоил-октреотида (PAL-OCT)
50 мг октреотида ацетата растворяли в 1000 мкл безводного DMSO (диметилсульфоксид), содержащего 100 мкл TEA (триэтилацетат). 17,1 мг сложного эфира М-гидроксисукцинимида пальмитиновой кислоты (М.м. (молекулярная масса) 353,50) растворяли в 3 мл безводного DMSO и добавляли посредством прямой инъекции в раствор пептида. Давали данной реакции идти в течение ночи при комнатной температуре. Смесь вливали в диэтиловый эфир для осаждения пальмитоилированного октреотида. Осадок дважды промывали диэтиловым эфиром и затем сушили под вакуумом. Образующийся ацилированный пептид находился в форме белого порошка. Полезную соль ацилированного пептида получали путем нейтрализации остаточных основных аминных групп с использованием сильной кислоты.
Пример 6. Получение деканаль-октреотида (DCL-OCT)
50 мг октреотида растворяли в 2 мл 20 мМ раствора цианоборгидрида натрия (М.м. 62,84, NaCNBH3) (2,51 мг) в 0,1 М ацетатном буфере при рН 5.13,7 мг деканаля (М.м. 156,27) (OCT:DCL=1:2) добавляли к раствору пептида путем прямой инъекции. Позволяли реакции идти в течение ночи при 4°С.Смесь разделяли центрифугированием. Осажденный PAL-OCT лиофилизировали. Полезную соль ацилированного пептида получали путем нейтрализации остаточных основных аминогрупп с использованием сильной кислоты.
Пример 7. Получение пэгилированного октреотида
Раствор октреотида ацетата (10 мг/мл) в воде добавляли в сосуд, содержащий сукцинимидилпропионат монометокси PEG (SPA-mPEG, М.м. 2000 дальтон) в количестве 2 молярных эквивалентов в 0,1 М фосфатном буфере, рН 7,4. Позволяли реакции идти в течение ночи при 4°С с перемешиванием. Затем реакционную смесь разделяли, используя обращенно-фазовую ВЭЖХ (ОФ-ВЭЖХ) на колонке С-18 (YMC ODS-A 4,6×250 мм, 5 мкм, Waters Corporation). Подвижная фаза состояла из 0,1%-ной TFA (трифторуксусная кислота) в воде (А) и CAN, содержащего 0,1%-ную TFA (Б). Подвижную фазу прогоняли с линейным градиентом элюента Б от 30 до 60% в течение 20 мин со скоростью потока 1 мл/мин, и поглощение в УФ элюата отслеживали при 215 нм. Элюированные фракции, совпадающие с соответствующими пиками, собирали по отдельности, продували азотом и лиофилизировали.
Альтернативно, можно получить сайт-специфичное пэгилирование октреотида. Раствор октреотида ацетата (10 мг/мл) в 20 мМ цианоборгидриде натрия (NаСNВН3) и 0,1 М ацетатном буфере, рН 5, добавляли в сосуд, содержащий 3 молярных эквивалента монометокси-РЕG-пропиональдегида (ALD-mPEG, М.м. 2000 дальтон) в воде. Позволяли реакции идти в течение ночи при 4°С с перемешиванием. Затем реакционную смесь разделяли, используя обращенно-фазовую ВЭЖХ (ОФ-ВЭЖХ) на колонке С-18 (YMC ODS-А 5 мкм, 4,6×250 мм, Waters Corporation). Подвижная фаза состояла из 0,1%-ной TFA в воде (А) и CAN, содержащего 0,1%-ную TFA (Б). Подвижную фазу прогоняли с линейным градиентом элюента Б от 30 до 60% в течение 20 мин со скоростью тока 1 мл/мин, и УФ-поглощение элюата отслеживали при 215 нм. Элюированные фракции, совпадающие с соответствующими пиками, собирали по отдельности, продували азотом и лиофилизировали. Полезная соль пэгилированного пептида образуется путем нейтрализации остаточных основных аминогрупп с использованием сильной кислоты.
Пример 8. Стабильность пептидного агента и биоразлагаемого полимера в инъецируемых полимерных композициях
Поли(DL-лактид-со-гликолид) (PLGA) с отношением лактида к гликолиду 85/15 (DLPLG85/15, IV: 0,28) и с концевой группой в виде лаурилового эфира растворяли в N-метил-2-пирролидоне (NMP) с получением 50%-ного раствора (по массе). Соли леупролида смешивали с раствором PLGA в NMP в соотношениях, указанных в Таблице 1, с получением однородной инъецируемой композиции. Инъецируемые композиции помещали в 1,2 мл полипропиленовые шприцы с наконечниками типа Луер. Затем предварительно наполненные шприцы закрывали с использованием колпачков типа Луер. Закрытые колпачками шприцы упаковывали в контейнер и герметично закрывали в пластиковой коробке под вакуумом и затем хранили при 4°С при комнатной температуре (~22°С) в течение вплоть до 18 месяцев. Пробы инъецируемой композиции отбирали в моменты времени 24 ч, 1, 2, 3, 6, 12 и 18 месяцев. Чистоту леупролида в пробе определяли посредством ВЭЖХ. Молекулярную массу полимера определяли посредством гель-фильтрационной хроматографии (GPC) с использованием стандартов полистирола с известными молекулярными массами.
Таблица 1: Протестированные инъецируемые полимерные препараты
| Пробы | Соль леупролида | DLPLG8515/NMP | Загрузка |
| (мг) | (мг) | лекарственного | |
| средства | |||
| (%, мас./мас.) | |||
| Контроль | 0 | 1000 | 0 |
| La-Ac | 50 | 890 | 5,3 |
| LA-MS | 54 | 960 | 5,3 |
| LA-HCI-1 | 106 | 940 | 10,1 |
| LA-HCI-2 | 41 | 730 | 5,3 |
Неожиданно обнаружено, что использование гидрохлоридной и мезилатной солей леупролида вместо ацетата значительно снижало разрушение во времени леупролида и полимера в растворах PLGA в NMP как при 4°С, так и при комнатной температуре. Таблицы 2 и 3 показывают разрушение во времени леупролида в растворах PLGA в NMP соответственно, при 4°С и при комнатной температуре. Через 18 месяцев при 4°С было разрушено вплоть до 23% леупролида в полимерной композиции, содержащей леупролида ацетат, и в то же время менее 2% леупролида было разрушено в препаратах, содержащих леупролида гидрохлорид и леупролида мезилат. Через 12 месяцев при комнатной температуре наблюдалось более чем 35%-ное разрушение леупролида для препаратов леупролида ацетата, и в то же время только примерно 11% для препаратов леупролида гидрохлорида и леупролида мезилата. Кроме того, при комнатной температуре наблюдалось изменение цвета (от молочного до желтого и до цвета ржавчины) и разделение фаз. Разделение фаз приводило к гетерогенным препаратам и к неравномерному разрушению пептида и полимера в препарате. Гетерогенность препаратов может быть причиной колебаний результатов, полученных в разные моменты времени.
Таблица 2. Стабильность леупролида в препарате PLGA/NMP при 4°С
| Время (мес.) | LA-AC | LA-HCI-1 | LA-MS |
| 0 | 100,0 | 100,0 | 100,0 |
| 1 | 89,3 | 100,0 | 100,0 |
| 3 | 100,0 | 100,0 | 100,0 |
| 6 | 94,1 | 100,0 | 100,0 |
| 12 | 88,2 | 100.0 | 98,9 |
| 18 | 76,9 | 98,5 | 98,3 |
Таблица 3. Стабильность леупролида в препарате PLGA/NMP при комнатной температуре
| Время (мес.) | LA-AC | LA-HCI-1 | LA-HCI-2 | LA-MS |
| 0 | 100 | 100 | 100 | 100 |
| 1 | 75 | 99 | 100 | 95 |
| 2 | 78 | 98 | 97 | 97 |
| 3 | 86 | 100 | 100 | 100 |
| 6 | 87 | 99 | 100 | 99 |
| 12 | 65 | 89 | 89 | 89 |
В Таблицах 4 и 5 показаны изменения молекулярной массы полимера в разных препаратах. По сравнению с контролем молекулярная масса PLGA в препарате леупролида ацетата через 6 месяцев снижалась более чем на 10% при 4°С и более чем на 90% при комнатной температуре. Молекулярная масса PLGA в препаратах леупролида гидрохлорида и леупролида мезилата была той же самой, что и молекулярная масса в контроле как при 4°С, так и при комнатной температуре даже через 12 месяцев. Однако через 12 месяцев более 90% полимера как из пустого контроля, так и из препаратов леупролида гидрохлорида и леупролида мезилата разрушалось. Данные результаты показывают, что соли леупролида, образованные сильной кислотой, такой как HCI и метансульфоновая кислота, полностью предотвращают взаимодействие/реакцию между данным пептидом и PLGA в растворе. В то время как слабая кислота, такая как уксусная кислота, не предотвращает вредного взаимодействия/реакции между данным пептидом и PLGA в растворе.
Таким образом, улучшение стабильности препарата путем применения соли пептида, образованной сильной кислотой, делает возможным изготовление готовой к применению инъецируемой композиции с удовлетворительной стабильностью при хранении в течение по меньшей мере одого года.
Таблица 4. Молекулярная масса PLGA в разных препаратах при 4°С с течением времени
| Время (мес.) | Контроль | LA-AC | LA-HCI-1 | LA-MS |
| 0 | 24655 | 23842 | 24369 | 24556 |
| 1 | 25214 | 24282 | 25203 | 24574 |
| 3 | 24567 | 22775 | 24833 | 24833 |
| 6 | 23935 | 21957 | 24661 | 24034 |
| 12 | 23905 | 18906 | 23837 | 23393 |
| 18 | 22178 | 16107 | 22802 | 22227 |
Таблица 5. Молекулярная масса PLGA в разных препаратах при комнатной температуре с течением времени
| Время (мес.) | Контроль | LA-AC | LA-HCI-1 | LA-HCI-2 | LA-MS |
| 0 | 24655.0 | 24282 | 24567 | 24468 | 24468 |
| 1 | 24282,2 | 20526 | 25022 | 25022 | 24832 |
| 2 | 22969,3 | 15459 | 23230 | 23230 | 22969 |
| 3 | 23227,7 | 11073 | 23228 | 23311 | 21872 |
| 6 | Н.О. | 3409 | 18998 | 17952 | 15114 |
| 12 | 3112,3 | 380 | 4236 | 3388 | 2531 |
Пример 9. Стабильность леупролида и полимера в инъецируемых полимерных композициях
Пoли(DL-пaктид-co-гликoлид) (PLGA) с отношением лактида к гликолиду 85/15 (DLPL85/15, IV: 0,28) с концевой группой в виде лаурилового эфира растворяли в диметилсульфоксиде (DMSO) с получением 50%-ного раствора по массе. Соли леупролида смешивали с раствором PLGA в DMSO с получением однородной инъецируемой композиции в соотношениях, показанных в Таблице 6. Инъецируемые композиции помещали в 1,2 мл полипропиленовые шприцы с наконечниками типа Луер. Затем предварительно наполненные шприцы закрывали с использованием колпачков типа Луер. Закрытые колпачками шприцы упаковывали в контейнер, герметично закрывали в пластиковой коробке под вакуумом и затем хранили при 4°С и при комнатной температуре (~22°С) в течение вплоть до 16 месяцев. Пробы инъецируемой композиции отбирали в заданные моменты времени. Чистоту леупролида в пробе определяли посредством ВЭЖХ. Молекулярную массу полимера определяли посредством гель-фильтрационной хроматографии (GPC) с использованием стандартов полистирола с известными молекулярными массами.
Таблица 6: Протестированные инъецируемые полимерные препараты
| Пробы | Соль леупролида | DLPLG 8515 | Загрузка |
| (мг) | В DMSO | лекарственного | |
| (мг) | средства | ||
| (%, мас./мас.) | |||
| Контроль | 0 | 4000 | 0 |
| LAAc | 200,4 | 4788 | 4 |
| LAMS-3 | 200,0 | 4806 | 4 |
| LAHCI-3 | 202,8 | 4810 | 4 |
Неожиданно обнаружилось, что использование гидрохлоридной и мезилатной солей леупролида вместо ацетата значительно снижало разрушение леупролида и полимера в растворах PLGA в DMSO при 4°С с течением времени. На Фиг.1 и 2 показано разрушение леупролида в PLGA в растворах в DMSO при 4°С во времени. Через 16 месяцев вплоть до примерно 20% леупролида было разрушено в случае леупролида ацетата, в то время как менее 5% леупролида было разрушено в препаратах леупролида гидрохлорида и леупролида мезилата. На Фиг.5 показаны изменения молекулярной массы PLGA в разных препаратах. По сравнению с контролем через 16 месяцев молекулярная масса PLGA в препарате леупролида ацетата снижалась примерно на 40% при 4°С.Через 16 месяцев при 4°С молекулярная масса PLGA в инъецируемых полимерных композициях, содержащих леупролида гидрохлорид и леупролида мезилат, была сопоставима с молекулярной массой контроля. Результаты показывают, что соли леупролида, образованные сильной кислотой, такой как НСI и метансульфоновая кислота, практически полностью предотвращают взаимодействие/реакцию между данным пептидом и PLGA в растворе DMSO. В то время как слабая кислота, такая как уксусная кислота, не предотвращает вредного взаимодействия/реакции между пептидом и PLGA в растворе DMSO.
Пример 10. Высвобождение леупролида in vitro из инъецируемых полимерных препаратов
Три раствора полимерных носителей готовили следующим образом: PLG 85/15 (0,28 IV) с концевой группой в виде лаурилового эфира растворяли в NMP в концентрации 50% и 55% по массе, и RG503 (0,42 IV) с карбоновокислотной концевой группой растворяли в NMP в концентрации 50% по массе. Затем подходящее количество леупролида гидрохлорида (LAHCI) и леупролида мезилата (LAMS) смешивали с растворами полимера с концентрацией каждого 6% по массе. Препараты тщательно перемешивали с получением однородных препаратов.
Аликвоту суспензии данного препарата (примерно 100 мг) инъецировали в 3 мл фосфатно-буферного солевого раствора, рН 7,4, с 0,1% азида натрия при 37°С.Принимающую жидкость заменяли в выбранные моменты времени раствором свежего буфера, и в удаленном буферном растворе, разведенном в 2 раза фосфатным буфером с рН 7,4, анализировали посредством ВЭЖХ концентрацию лекарственного средства. Рассчитывали высвободившееся количество в каждый момент времени. Фиг.3 показывает суммарное высвобождение лепролида для разных препаратов во времени.
Как показано на Фиг.3, нет значимого различия в высвобождении леупролида между LAHCI и LAMS. Однако тип и концентрация PLGA, по-видимому, значительно влияют на высвобождение леупролида. Скорость высвобождения леупролида из препарата RG503H была значительно выше, чем скорость высвобождения из препаратов PLG85/15. Таким образом, RG503H может подходить для более кратковременной доставки леупролида, в то время как PLG85/15 может быть полезным для более проложительной доставки данного пептида. Скорость высвобождения пептида также может быть дополнительно модифицирована путем изменения концентрации PLGA. По мере того, как концентрация PLG85/15 возрастала от 50% до 55%, начальная скорость высвобождения леупролида значительно снижалась. Таким образом, посредством простого экспериментирования легко можно получить параметры для достижения желательного профиля высвобождения для конкретного препарата пептида.
Пример 11. Влияние эксципиентов на высвобождение леупролида in vitro.
Растворы полимерного носителя с эксципиентами или без них получали следующим образом: PLA 100DLPL (0,26 IV, Lakeshore, AL) с концевой группой в виде лаурилового эфира и витамин E-TPGS растворяли в NMP в подходящем количестве согласно Таблице 7. Затем подходящее количество леупролида гидрохлорида (LAHCI) смешивали с растворами полимера в концентрации 15% по массе. Препараты тщательно перемешивали с получением однородных препаратов.
Таблица 7. Влияние эксципиентов на высвобождение леупролида in vitro
| Проба | PLA 100DLPL (%) | NMP (%) | Витамин Е TPGS (%) | LAHCI (%) |
| Препарат 1 | 47 | 38 | 0 | 15 |
| Препарат 2 | 44.5 | 36,4 | 4.2 | 15 |
Аликвоту суспензии препарата (примерно 100 мг) инъецировали в 3 мл фосфатно-буферного солевого раствора (PBS), рН 7,4, с 0,1% азида натрия при 37°С. Принимающую жидкость заменяли в выбранные моменты времени свежим раствором буфера, и в удаленном буферном растворе, разведенном в 10 раз PBS с рН 7,4, анализировали посредством ВЭЖХ концентрацию лекарственного средства. Рассчитывали количество, высвободившееся в каждый момент времени. Фиг.4 показывает суммарное высвобождение леупролида для разных препаратов во времени.
Как показано на Фиг.4, включение витамина E-TPGS не влияет на исходный взрыв, но, по-видимому, снижает скорость высвобождения леупролида на более поздних стадиях. Таким образом, витамин E-TPGS может быть полезен для увеличения продолжительности доставки данного пептида и также для функционирования в качестве антиоксиданта.
Пример 12. Влияние эксципиентов на высвобождение леупролида in vitro
Растворы полимерного носителя с эксципиентами или без них готовили следующим образом: PLA 100D040 (0,34 IV, Durect, CA) с концевой группой в виде лаурилового эфира и среднецепочечный триглицерид Miglyol 812 растворяли в NMP в подходящем количестве согласно Таблице 8. Затем подходящее количество леупролида гидрохлорида (LAHCI) смешивали с растворами полимера в концентрации 15% по массе. Данные препараты тщательно перемешивали с получением однородных препаратов.
Таблица 8. Влияние эксципиентов на высвобождение леупролида in vitro
| Проба | PLA100D040 (%) | NMP (%) | Miglyol 812 (%) | LAHCI (%) |
| Препарат 1 | 42,5 | 42,5 | 0 | 15 |
| Препарат 2 | 42,5 | 38,3 | 4,2 | 15 |
Аликвоту суспензии данного препарата (примерно 100 мг) инъецировали в сосуд, содержащий 3 мл фосфатно-буферного солевого раствора, рН 7,4, с 0,1% азида натрия при 37°С. Принимающую жидкость заменяли в выбранные моменты времени свежим раствором буфера, и в удаленном буферном растворе, разведенном в 10 раз PBS с рН 7,4, анализировали посредством ВЭЖХ концентрацию лекарственного средства. Количество, высвободившееся в каждый момент времени, рассчитывали по результатом измерений с использованием стандартной кривой. На Фиг.5 показано суммарное высвобождение лепролида для разных препаратов во времени.
Как показано на Фиг.5, включение Miglyol 812 значительно снижало исходный взрыв высвобождения леупролида, и, по-видимому, поддерживало скорость высвобождения леупролида на более поздних стадиях. Таким образом, Miglyol 812 может быть полезным для увеличения продолжительности доставки данного пептида. По сравнению с результатами в Примере 11 представляется, что молекулярная масса полимера также значительно влияет на исходное взрывное высвобождение леупролида. По-видимому, чем меньше молекулярная масса PLA, тем меньше исходное взрывное высвобождение леупролида.
Пример 13. Высвобождение леупролида in vivo
Поли(DL-лактид-со-гликолид) с отношением лактида к гликолиду 85/15 (DLPLG85/15, IV: 0,28), содержащий концевую группу в виде лаурилового эфира, растворяли в N-метил-2-пирролидоне (NMP) с получением 55%-ного раствора (по массе). Соль леупролида, т.е. леупролида мезилат или леупролид НСI, смешивали с раствором PLGA в NMP с получением однородного инъецируемого препарата с загрузкой лекарственного средства примерно 12%. Инъецируемые препараты переносили в 1,2 мл полипропиленовые шприцы с наконечниками типа Луер и присоединяли к ним тонкостенную иглу 19-го размера. Каждый препарат затем подкожно инъецировали крысам в объеме примерно 100 мкл 6 животным на группу. Пробы сыворотки берут у каждого животного в 3 часа, 1, 3, 7, 14, 28, 42, 56 и 70 суток после инъекции. Пробы сыворотки анализировали на концентрацию леупролида посредством ELISA (твердофазный иммуноферментный анализ) с использованием наборов от Peninsula Laboratories Inc. Леупролид, сохраняющийся в имплантатах в разные моменты времени, анализировали посредством ВЭЖХ.
На Фиг.6 показан профиль высвобождения леупролида из двух разных препаратов в течение вплоть до 70 суток. Оба препарата демонстрировали исходное взрывное высвобождение леупролида. Препарат, содержащий LAHCI, достигал Стах 661,6 нг/мл в 3 часа, и препарат, содержащий LAMS, достигал Стах 370,6 нг/мл также в 3 часа. Оба препарата демонстрировали замедленное высвобождение леупролида в течение длительного периода времени. Препарат, содержащий LAMS, показывал более постоянные уровни леупролида в сыворотке по сравнению с полученными от препарата, содержащего LAHCI.
Пример 14. Высвобождение леупролида in vivo
Пoли(DL-лaктид-co-гликoлид) с отношением лактида к гликолиду 85/15 (DLPLG85/15, IV: 0,27), содержащий 1,6-гександиольную группировку, растворяют в N-метил-2-пирролидоне (NMP) с получением 50%-ного раствора по массе. Соль леупролида, т.е. леупролида ацетат или леупролид HCI смешивают с раствором PLGA в NMP с получением однородного инъецируемого препарата с загрузкой лекарственного средства примерно 12%. Инъецируемые препараты переносят в 1,2 мл полипропиленовые шприцы с наконечниками типа Луер и присоединяют к ним тонкостенную иглу 19-го размера. Каждый препарат затем подкожно инъецируют крысам в объеме примерно 100 мкл 6 животным на группу. Пробы сыворотки берут у каждого животного в 3 часа, 1, 3, 7, 14, 28, 42, 56, 70, 91, 112, 133, 154, 175 и 206 суток после инъекции. В пробах сыворотки анализируют концентрацию леупролида ELISA с использованием наборов, имеющихся у Peninsula Laboratories Inc. и концентрацию тестостерона посредством ЖХ/МС/МС (жидкостная хроматография/масс-спектрометрия/масс-спектрометрия). Леупролид, остающийся в имплантатах в разные моменты времени, может быть проанализирован посредством ВЭЖХ.
Аналогичные эксперименты можно спланировать и осуществить, используя другие аналоги LHRH, такие как бусерелин, деслорелин, фертилерин, гистрелин, лутрелин, гозерелин, нафарелин, трипторелин, цетрореликс, абареликс и другие пептиды, такие как GLP-1, PYY и т.д., и другие полимеры и растворители.
Пример 15. Применение стабилизированных инъецируемых полимерных композиций
Введение стабилизированных инъецируемых полимерных композиций пациенту может быть осуществлено целым рядом способов. Биоразлагаемую полимерную композицию можно инъецировать подкожно или внутримышечно с образованием имплантата in situ, наносить в виде чрескожного крема, а также вводить пациенту в виде ректального или вагинального суппозитория.
Пример 16. Получение полимерных микросфер, содержащих LAHCI
Поли(лактид-со-гликолид)ные (PLGA) микросферы получают методом односторонней эмульсии масло-в-воде (М/В). PLGA растворяют в метиленхлориде (DCM). Для инкапсуляции LAHCI лекарственное средство смешивают с раствором PLGA в DCM. Перемешанный раствор или суспензию эмульгируют в 500 мл 0,5-1%-ного (мас./об.) раствора PVA (PVA, гидролизованный на 88%, средняя молекулярная масса 31000-50000, Sigma-Aldrich), предварительно охлажденного в холодильнике при 4°С. Эмульсию непрерывно перемешивают в течение 3 ч при комнатной температуре для выпаривания DCM. Затвердевшие микросферы собирают, промывают три раза деионизованной водой и затем лиофилизируют.
Пример 17. Применение стабилизированной жидкой полимерной композиции для получения имплантируемых полимерных матриц
Биоразлагаемый полимер, состоящий из поли(молочной кислоты-со-гликолевой кислоты) с отношением лактида к гликолиду от 50:50 до 100:0, такой как RG503H (Boehringer Ingelheim Chemicals, Inc. USA) растворяют в летучем органическом растворителе, таком как этилацетат или метиленхлорид. Подходящее количество полезной соли, как определено здесь, такой как гозерелина мезилат (0,01%-30% по массе по отношению к полимеру) растворяют/диспергируют в растворе полимера. Раствор тщательно смешивают с получением однородного раствора или суспензии. После окончания смешивания растворитель удаляют выпариванием. Это осуществляют методом распылительной сушки с образованием маленьких однородных частиц для инъекции. Это также можно сделать в форме с образованием имплантата. Образующиеся полимерные матрицы также можно растереть в порошок и приготовить в виде инъецируемого суспензионного препарата.
Твердые лекарственные формы, полученные таким образом, можно инъецировать подкожно или внутримышечно, или можно хирургически поместить под кожу в форме имплантата, или дать перорально в виде части пероральной системы доставки пептидных агентов. Твердые микрочастицы также можно получить в виде суспензии или неводного раствора, которые также можно вводить пациенту посредством ингаляции для легочной доставки лекарственного средства. Микрочастицы также можно суспендировать в масле и вводить пациенту в виде ректального или вагинального суппозитория.
Claims (24)
1. Инъецируемая полимерная композиция, содержащая:
а) соль пептидного агента, образованную сильной кислотой, выбранной из группы, состоящей из соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, серной кислоты, азотной кислоты, хромовой кислоты, метансульфоновой кислоты, трифторметансульфоновой кислоты, трихлоруксусной кислоты, дихлоруксусной кислоты, бромуксусной кислоты, хлоруксусной кислоты, циануксусной кислоты, 2-хлорпропановой кислоты, 2-оксобутановой кислоты, 2-хлорбутановой кислоты, 4-цианобутановой кислоты, перхлорной кислоты и фосфорной кислоты;
б) нерастворимый в воде биоразлагаемый полимер;
в) фармацевтически приемлемый органический растворитель, который растворяет биоразлагаемый полимер и смешивается или диспергируется в водной или в биологической жидкости и
г) возможно один или более чем один фармацевтически приемлемый эксципиент,
где пептидный агент имеет N-конец, который не является первичным амином, и где пептидный агент содержит по меньшей мере одну основную группу.
а) соль пептидного агента, образованную сильной кислотой, выбранной из группы, состоящей из соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, серной кислоты, азотной кислоты, хромовой кислоты, метансульфоновой кислоты, трифторметансульфоновой кислоты, трихлоруксусной кислоты, дихлоруксусной кислоты, бромуксусной кислоты, хлоруксусной кислоты, циануксусной кислоты, 2-хлорпропановой кислоты, 2-оксобутановой кислоты, 2-хлорбутановой кислоты, 4-цианобутановой кислоты, перхлорной кислоты и фосфорной кислоты;
б) нерастворимый в воде биоразлагаемый полимер;
в) фармацевтически приемлемый органический растворитель, который растворяет биоразлагаемый полимер и смешивается или диспергируется в водной или в биологической жидкости и
г) возможно один или более чем один фармацевтически приемлемый эксципиент,
где пептидный агент имеет N-конец, который не является первичным амином, и где пептидный агент содержит по меньшей мере одну основную группу.
2. Инъецируемая полимерная композиция по п.1 в форме раствора, суспензии, геля или полутвердого вещества.
3. Инъецируемая полимерная композиция по п.1, где пептидный агент выбран из группы, состоящей из окситоцина, вазопрессина, адренокортикотропного гормона (АСТН), эпидермального фактора роста (EGF), тромбоцитарного фактора роста (PDGF), пролактина, лютеинизирующего гормона, высвобождающего фактора лютеинизирующего гормона (LHRH), агонистов LHRH, антагонистов LHRH, гормонов роста, высвобождающего фактора гормона роста, инсулина, эритропоэтина, соматостатина, глюкагона, интерлейкина, интерферона-альфа, интерферона-бета, интерферона-гамма, гастрина, тетрагастрина, пентагастрина, урогастрона, секретина, кальцитонина, энкефалинов, эндорфинов, ангиотензинов, тиреотропин-высвобождающего гормона (TRH), фактора некроза опухолей (TNF), паратиреоидного гормона (РТН), фактора роста нервов (NGF), гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), макрофагального колониестимулирующего фактора (M-CSF), гепариназы, сосудистого эндотелиального фактора роста (VEG-F), костного морфогенного белка (BMP), hANP, глюкагоноподобного пептида (GLP-1), эксенатида, пептида YY (PYY), ренина, брадикинина, бацитрацинов, полимиксинов, колистинов, тироцидина, грамицидинов, циклоспоринов, ферментов, цитокинов, антител, вакцин, антибиотиков, гликопротеинов, фолликулостимулирующего гормона, киоторфина, тафтсина, тимопоэтина, тимозина, тимостимулина, тимусного гуморального фактора, сывороточного тимусного фактора, колониестимулирующих факторов, мотилина, бомбезина, динорфина, нейротензина, церулеина, урокиназы, калликреина, аналогов и антагонистов вещества Р, ангиотензина II, фактора свертывания крови VII и IX, грамицидинов, меланоцит-стимулирующего гормона, высвобождающего фактора тиреоидного гормона, тиреостимулирующего гормона, панкреозимина, холецистокинина, человеческого плацентарного лактогена, человеческого хорионического гонадотропина, пептида, стимулирующего синтез белка, желудочного ингибиторного пептида, вазоактивного пептида кишечника, тромбоцитарного фактора роста и их синтетических аналогов, модификаций и фармакологически активных фрагментов.
4. Инъецируемая полимерная композиция по п.1, где пептидный агент выбран из группы, состоящей из высвобождающего фактора лютеинизирующего гормона (LHRH), аналогов, агонистов и антагонистов LHRH.
5. Инъецируемая полимерная композиция по п.1, где пептидный агент выбран из группы, состоящей из лейпрорелина, бусерелина, гонадорелина, деслорелина, фертирелина, гистрелина, лутрелина, гозерелина, нафарелина, трипторелина, цетрореликса, энфувиртида, тимозина α1 и абареликса.
6. Инъецируемая полимерная композиция по п.1, где пептидный агент имеет N-концевой первичный амин и/или первичный(е) амин(ы) в боковой цепи, которые ковалентно модифицированы гидрофильными группировками.
7. Инъецируемая полимерная композиция по п.6, где гидрофильные группировки включают любые водорастворимые линейные или разветвленные олигомеры или полимеры со среднемассовой молекулярной массой в диапазоне от примерно 500 дальтон до примерно 50000 дальтон.
8. Инъецируемая полимерная композиция по п.6, где гидрофильные группировки представляют собой полиэтиленгликоль и/или его производные.
9. Инъецируемая полимерная композиция по п.1, где пептидный агент имеет N-концевой первичный амин и/или первичный(е) амин(ы) в боковой цепи, которые ковалентно модифицированы липофильными группировками.
10. Инъецируемая полимерная композиция по п.9, где липофильные группировки выбраны из группы, состоящей из С2-39алкильных, С2-39алкенильных, С2-39алкадиенильных и стероидных остатков.
11. Инъецируемая полимерная композиция по п.1, где пептидный агент присутствует в количестве от примерно 0,01% до примерно 40% от массы композиции.
12. Инъецируемая полимерная композиция по п.1, где биоразлагаемый полимер выбран из группы, состоящей из полилактидов, полигликолидов, поли(лактид-со-гликолид)ов, поликапролактонов, полидиоксанонов, поликарбонатов, полигидроксибутиратов, полиалкиленоксалатов, полиангидридов, полиэфирамидов, полиуретанов, полиацеталей, полиортокарбонатов, полифосфазенов, полигидроксивалератов, полиалкиленсукцинатов, полиортоэфиров, и их сополимеров, блок-сополимеров, разветвленных сополимеров, тройных сополимеров и комбинаций и смесей.
13. Инъецируемая полимерная композиция по п.1, где биоразлагаемый полимер представляет собой поли(лактид-со-гликолид)ные сополимеры с отношением молочной кислоты к гликолевой кислоте от примерно 50:50 до примерно 100:0 и среднемассовой молекулярной массой от примерно 2000 до примерно 100000.
14. Инъецируемая полимерная композиция по п.13, где поли(лактид-со-гликолид)ные сополимеры содержат гидроксильную, карбоксильную или сложноэфирную концевую группу.
15. Инъецируемая полимерная композиция по п.13, где поли(лактид-со-гликолид)ные сополимеры содержат монофункциональный спиртовой или полиольный остаток и не имеют карбоновокислотного конца.
16. Инъецируемая полимерная композиция по п.1, где биоразлагаемый полимер присутствует в количестве от примерно 30 до 70% от массы композиции.
17. Инъецируемая полимерная композиция по п.1, где фармацевтически приемлемый органический растворитель выбран из группы, состоящей из N-метил-2-пирролидона, диметилсульфоксида, глицеролформаля, гликофурола, метоксиполиэтиленгликоля 350, алкоксиполиэтиленгликоля, сложных эфиров полиэтиленгликоля, бензилбензоата, этилбензоата, сложных эфиров лимонной кислоты, триацетина, диацетина, триэтилцитрата, ацетилтриэтилцитрата и их смесей.
18. Инъецируемая полимерная композиция по п.1, где фармацевтически приемлемый органический растворитель присутствует в количестве от примерно 30% до примерно 80% от массы композиции.
19. Инъецируемая полимерная композиция по п.1, дополнительно содержащая один или более чем один агент, модифицирующий скорость высвобождения.
20. Инъецируемая полимерная композиция по п.19, где агенты, модифицирующие скорость высвобождения, выбраны из группы, состоящей из алканкарбоновой кислоты, олеиновой кислоты, алкилового спирта, полярных липидов, поверхностно-активных веществ, сополимеров полиэтиленгликоля и полилактида или поли(лактид-со-гликолид)ных полоксамеров, поливинилпирролидона, полисорбатов, 2-этоксиэтилацетата, триацетина, триэтилцитрата, ацетилтрибутилцитрата, ацетилтриэтилцитрата, глицеринтриацетата, ди(н-бутил)себацината, полиэтиленгликоля, сорбита, триглицеридов, среднецепочечных триглицеридов и их смесей.
21. Инъецируемая полимерная композиция по п.1, дополнительно содержащая один или более чем один буферный агент.
22. Инъецируемая полимерная композиция по п.21, где буферные агенты выбраны из группы, состоящей из карбоната кальция, гидроксида кальция, миристата кальция, олеата кальция, пальмитата кальция, стеарата кальция, фосфата кальция, карбоната магния, гидроксида магния, фосфата магния, миристата магния, олеата магния, пальмитата магния, стеарата магния, карбоната цинка, гидроксида цинка, миристата цинка, олеата цинка, пальмитата цинка, стеарата цинка, фосфата цинка и их комбинаций.
23. Инъецируемая полимерная композиция по п.1, дополнительно содержащая один или более чем один антиоксидант.
24. Инъецируемая полимерная композиция по п.23, где антиоксиданты выбраны из группы, состоящей из d-альфа-токоферола ацетата, аскорбилпальмитата, бутилированного гидроксианидола, бутилированного гидроксианизола, бутилированного гидроксихинона, гидроксикумарина, бутилированного гидрокситолуола, этилгаллата, пропилгаллата, октилгаллата, лаурилгаллата, пропилгидроксибензоата, тригидроксибутилрофенона, витамина Е, пэгилированного витамина Е и витамина E-TPGS.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US75989106P | 2006-01-18 | 2006-01-18 | |
| US60/759,891 | 2006-01-18 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008129201A RU2008129201A (ru) | 2010-02-27 |
| RU2427383C2 true RU2427383C2 (ru) | 2011-08-27 |
Family
ID=38288166
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008129201/15A RU2427383C2 (ru) | 2006-01-18 | 2007-01-16 | Фармацевтические композиции с повышенной стабильностью |
Country Status (14)
| Country | Link |
|---|---|
| US (5) | US20070196416A1 (ru) |
| EP (1) | EP1984009B1 (ru) |
| JP (1) | JP5242415B2 (ru) |
| KR (2) | KR101728868B1 (ru) |
| CN (1) | CN101400363B (ru) |
| AU (1) | AU2007207618B2 (ru) |
| CA (1) | CA2637569C (ru) |
| DK (1) | DK1984009T3 (ru) |
| ES (1) | ES2397712T3 (ru) |
| HK (1) | HK1126975A1 (ru) |
| MX (1) | MX2008009125A (ru) |
| RU (1) | RU2427383C2 (ru) |
| SI (1) | SI1984009T1 (ru) |
| WO (1) | WO2007084460A2 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2557925C1 (ru) * | 2014-03-17 | 2015-07-27 | Новиков Сергей Викторович | Биодеградируемый многослойный имплант для введения лекарственных веществ в витреальную полость глаза |
Families Citing this family (94)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6828415B2 (en) * | 1993-02-19 | 2004-12-07 | Zentaris Gmbh | Oligopeptide lyophilisate, their preparation and use |
| US7731947B2 (en) | 2003-11-17 | 2010-06-08 | Intarcia Therapeutics, Inc. | Composition and dosage form comprising an interferon particle formulation and suspending vehicle |
| WO2006083761A2 (en) | 2005-02-03 | 2006-08-10 | Alza Corporation | Solvent/polymer solutions as suspension vehicles |
| US11246913B2 (en) | 2005-02-03 | 2022-02-15 | Intarcia Therapeutics, Inc. | Suspension formulation comprising an insulinotropic peptide |
| US8852638B2 (en) | 2005-09-30 | 2014-10-07 | Durect Corporation | Sustained release small molecule drug formulation |
| KR101106510B1 (ko) | 2006-05-30 | 2012-01-20 | 인타르시아 세라퓨틱스 인코포레이티드 | 투피스, 내부채널 삼투압 전달 시스템 유동 조절기 |
| AU2007284759B2 (en) | 2006-08-09 | 2010-10-28 | Intarcia Therapeutics, Inc. | Osmotic delivery systems and piston assemblies |
| EP1917971A1 (en) * | 2006-10-27 | 2008-05-07 | Société de Conseils de Recherches et d'Applications Scientifiques ( S.C.R.A.S.) | Substained release formulations comprising very low molecular weight polymers |
| US8946200B2 (en) | 2006-11-02 | 2015-02-03 | Southwest Research Institute | Pharmaceutically active nanosuspensions |
| RU2440097C2 (ru) | 2007-04-23 | 2012-01-20 | Интарсия Терапьютикс, Инк. | Способ лечения диабета ii типа и ожирения, осмотическое устройство для доставки и способ его изготовления |
| AU2008254538B2 (en) | 2007-05-18 | 2013-11-07 | Durect Corporation | Improved depot formulations |
| BRPI0811319A2 (pt) | 2007-05-25 | 2015-02-10 | Tolmar Therapeutics Inc | Composição fluida, método de formação de uma composição fluida, implante biodegrádavel formado in situ, método de formação de um implante biodegradável in situ, kit, implante e método de trataento |
| EP2219666A4 (en) * | 2007-11-15 | 2011-05-25 | Univ North Carolina | PROSTATE ACID PHOSPHATASE FOR THE TREATMENT OF PAIN |
| US9161943B2 (en) * | 2007-12-31 | 2015-10-20 | Industrial Technology Research Institute | Sustained release composition and manufacturing method thereof |
| US20090196905A1 (en) * | 2008-02-06 | 2009-08-06 | Spada Lon T | Stabilization of mitochondrial membranes in ocular diseases and conditions |
| DK2240155T3 (da) | 2008-02-13 | 2012-09-17 | Intarcia Therapeutics Inc | Indretninger, formuleringer og fremgangsmåder til levering af flere gavnlige midler |
| US8404850B2 (en) | 2008-03-13 | 2013-03-26 | Southwest Research Institute | Bis-quaternary pyridinium-aldoxime salts and treatment of exposure to cholinesterase inhibitors |
| GB0810990D0 (en) * | 2008-06-16 | 2008-07-23 | Q Chip Ltd | Device and method of making solid beads |
| JP5622725B2 (ja) * | 2008-06-25 | 2014-11-12 | エンド ファーマスーティカルズ ソリューションズ インコーポレイテッド.Endo Pharmaceuticals Solutionsinc. | エキセナチド及び他のポリペプチド類の持続的送達 |
| US8722706B2 (en) | 2008-08-15 | 2014-05-13 | Southwest Research Institute | Two phase bioactive formulations of bis-quaternary pyridinium oxime sulfonate salts |
| EP2946770A1 (en) * | 2008-08-29 | 2015-11-25 | Genzyme Corporation | Controlled-released peptide formulations |
| US8309134B2 (en) | 2008-10-03 | 2012-11-13 | Southwest Research Institute | Modified calcium phosphate nanoparticle formation |
| EP3735944A1 (en) | 2009-09-28 | 2020-11-11 | Intarcia Therapeutics, Inc. | Rapid establishment and/or termination of substantial steady-state drug delivery |
| WO2011060352A1 (en) | 2009-11-16 | 2011-05-19 | Ipsen Pharma S.A.S. | Pharmaceutical compositions of melanocortin receptor ligands |
| US9028873B2 (en) | 2010-02-08 | 2015-05-12 | Southwest Research Institute | Nanoparticles for drug delivery to the central nervous system |
| EP2547351B1 (en) * | 2010-03-15 | 2016-04-27 | Ipsen Pharma S.A.S. | Pharmaceutical compositions of growth hormone secretagogue receptor ligands |
| ES2655592T3 (es) * | 2010-03-29 | 2018-02-20 | Evonik Corporation | Composiciones y métodos para la retención mejorada de una composición farmacéutica en un sitio de administración local |
| CN101810583B (zh) * | 2010-04-09 | 2013-09-11 | 佟丽 | Hiv融合抑制剂缓释微球 |
| WO2011161531A1 (en) * | 2010-06-24 | 2011-12-29 | Torrent Pharmaceuticals Limited | Pharmaceutical composition containing goserelin for in-situ implant |
| WO2012012460A1 (en) | 2010-07-19 | 2012-01-26 | Xeris Pharmaceuticals, Inc. | Stable glucagon formulations for the treatment of hypoglycemia |
| RU2446173C1 (ru) * | 2010-08-13 | 2012-03-27 | Зао "Биокад" | Новый функционально активный, высокоочищенный стабильный конъюгат гранулоцитарного колониестимулирующего фактора (г-ксф) с полиэтиленгликолем с пролонгированным биологическим действием, пригодный для медицинского применения, и иммунобиологическое средство на его основе |
| CN103221033A (zh) * | 2010-08-23 | 2013-07-24 | 耶路撒冷希伯来大学伊森姆研究发展有限公司 | 用于活性剂的胃部递送的组合物 |
| CN101934068B (zh) * | 2010-09-26 | 2012-07-25 | 武汉华龙生物制药有限公司 | 胸腺肽注射液的制备方法 |
| GB201016436D0 (en) | 2010-09-30 | 2010-11-17 | Q Chip Ltd | Method of making solid beads |
| GB201016433D0 (en) | 2010-09-30 | 2010-11-17 | Q Chip Ltd | Apparatus and method for making solid beads |
| US20120208755A1 (en) | 2011-02-16 | 2012-08-16 | Intarcia Therapeutics, Inc. | Compositions, Devices and Methods of Use Thereof for the Treatment of Cancers |
| CN102145160A (zh) * | 2011-03-07 | 2011-08-10 | 深圳市健元医药科技有限公司 | 一种lhrh拮抗剂注射用的缓释植入制剂 |
| BR112013023062B1 (pt) | 2011-03-10 | 2022-01-18 | Xeris Pharmaceuticals, Inc | Solução estável para a injeção parenteral e método de fabricação da mesma |
| KR101624592B1 (ko) | 2011-06-23 | 2016-05-27 | 브리티시 아메리칸 토바코 (인베스트먼츠) 리미티드 | 폴리락타이드 섬유를 포함한 필터 재료 |
| GB201112402D0 (en) | 2011-07-19 | 2011-08-31 | British American Tobacco Co | Cellulose acetate compositions |
| SG11201401921YA (en) | 2011-10-31 | 2014-05-29 | Xeris Pharmaceuticals Inc | Formulations for the treatment of diabetes |
| GB201208293D0 (en) * | 2012-05-11 | 2012-06-20 | Circassia Ltd | Hydrochlorice salt of peptide |
| US9125805B2 (en) | 2012-06-27 | 2015-09-08 | Xeris Pharmaceuticals, Inc. | Stable formulations for parenteral injection of small molecule drugs |
| UA116217C2 (uk) | 2012-10-09 | 2018-02-26 | Санофі | Пептидна сполука як подвійний агоніст рецепторів glp1-1 та глюкагону |
| HUE035803T2 (en) | 2012-12-21 | 2018-05-28 | Sanofi Sa | Dual GLP1 / GIP or trigonal GLP1 / GIP / glucagon agonists |
| US9018162B2 (en) | 2013-02-06 | 2015-04-28 | Xeris Pharmaceuticals, Inc. | Methods for rapidly treating severe hypoglycemia |
| US20140308352A1 (en) | 2013-03-11 | 2014-10-16 | Zogenix Inc. | Compositions and methods involving polymer, solvent, and high viscosity liquid carrier material |
| EP2986278A1 (en) | 2013-03-11 | 2016-02-24 | DURECT Corporation | Injectable controlled release composition comprising high viscosity liquid carrier |
| US9040034B2 (en) | 2013-04-09 | 2015-05-26 | International Business Machines Corporation | Vitamin functionalized gel-forming block copolymers for biomedical applications |
| US9642893B2 (en) * | 2013-07-03 | 2017-05-09 | Joseph Cummins | Method for reducing injury and stabilizing muscle using orally administered interferon |
| US9757330B2 (en) | 2013-10-18 | 2017-09-12 | Industrial Technology Research Institute | Recipe for in-situ gel, and implant, drug delivery system formed thereby |
| WO2015088990A1 (en) | 2013-12-09 | 2015-06-18 | Durect Corporation | Pharmaceutically active agent complexes, polymer complexes, and compositions and methods involving the same |
| WO2015086730A1 (en) | 2013-12-13 | 2015-06-18 | Sanofi | Non-acylated exendin-4 peptide analogues |
| EP3080149A1 (en) | 2013-12-13 | 2016-10-19 | Sanofi | Dual glp-1/glucagon receptor agonists |
| TW201609795A (zh) | 2013-12-13 | 2016-03-16 | 賽諾菲公司 | 作為雙重glp-1/gip受體促效劑的艾塞那肽-4(exendin-4)胜肽類似物 |
| TW201609799A (zh) | 2013-12-13 | 2016-03-16 | 賽諾菲公司 | 雙重glp-1/gip受體促效劑 |
| CN104073482A (zh) * | 2013-12-30 | 2014-10-01 | 江苏众红生物工程创药研究院有限公司 | 聚乙二醇化的组织激肽释放酶及其制备方法和应用 |
| DK3102184T3 (da) * | 2014-02-06 | 2019-05-06 | Xeris Pharmaceuticals Inc | Stabile formuleringer af peptider og fremgangsmåder til fremstilling |
| TW201625668A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 作為胜肽性雙重glp-1/昇糖素受體激動劑之艾塞那肽-4衍生物 |
| TW201625669A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 衍生自艾塞那肽-4(Exendin-4)之肽類雙重GLP-1/升糖素受體促效劑 |
| TW201625670A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 衍生自exendin-4之雙重glp-1/升糖素受體促效劑 |
| CN106456704A (zh) | 2014-04-16 | 2017-02-22 | Veyx-药物有限公司 | 兽药组合物和其应用 |
| US9932381B2 (en) | 2014-06-18 | 2018-04-03 | Sanofi | Exendin-4 derivatives as selective glucagon receptor agonists |
| CN106573106B (zh) | 2014-08-06 | 2021-06-22 | Xeris药物公司 | 用于皮内和/或皮下注射糊剂的注射器、试剂盒和方法 |
| US9889085B1 (en) | 2014-09-30 | 2018-02-13 | Intarcia Therapeutics, Inc. | Therapeutic methods for the treatment of diabetes and related conditions for patients with high baseline HbA1c |
| US20160106804A1 (en) * | 2014-10-15 | 2016-04-21 | Yuhua Li | Pharmaceutical composition with improved stability |
| WO2016059587A1 (en) * | 2014-10-16 | 2016-04-21 | Piramal Enterprises Limited | Stable injectable composition of pharmaceutically active agents and process for its preparation |
| WO2016059592A1 (en) * | 2014-10-16 | 2016-04-21 | Piramal Enterprises Limited | Stable injectable composition of peptide drugs and process for its preparation |
| US10046058B2 (en) | 2014-12-02 | 2018-08-14 | Rezolute, Inc. | Use of hydrophobic organic acids to increase hydrophobicity of proteins and protein conjugates |
| MA44390A (fr) | 2015-06-03 | 2019-01-23 | Intarcia Therapeutics Inc | Systèmes de mise en place et de retrait d'implant |
| US9649364B2 (en) | 2015-09-25 | 2017-05-16 | Xeris Pharmaceuticals, Inc. | Methods for producing stable therapeutic formulations in aprotic polar solvents |
| AR105319A1 (es) | 2015-06-05 | 2017-09-27 | Sanofi Sa | Profármacos que comprenden un conjugado agonista dual de glp-1 / glucagón conector ácido hialurónico |
| TW201706291A (zh) | 2015-07-10 | 2017-02-16 | 賽諾菲公司 | 作為選擇性肽雙重glp-1/升糖素受體促效劑之新毒蜥外泌肽(exendin-4)衍生物 |
| EA036951B1 (ru) * | 2015-08-03 | 2021-01-19 | Толмар Интернэшнл Лимитед | Жидкая полимерная система доставки для длительного введения лекарственных средств |
| US11590205B2 (en) | 2015-09-25 | 2023-02-28 | Xeris Pharmaceuticals, Inc. | Methods for producing stable therapeutic glucagon formulations in aprotic polar solvents |
| WO2017180781A1 (en) * | 2016-04-12 | 2017-10-19 | Trigemina, Inc. | Magnesium-containing oxytocin formulations and methods of use |
| WO2017200943A1 (en) | 2016-05-16 | 2017-11-23 | Intarcia Therapeutics, Inc. | Glucagon-receptor selective polypeptides and methods of use thereof |
| USD840030S1 (en) | 2016-06-02 | 2019-02-05 | Intarcia Therapeutics, Inc. | Implant placement guide |
| USD860451S1 (en) | 2016-06-02 | 2019-09-17 | Intarcia Therapeutics, Inc. | Implant removal tool |
| IL267736B2 (en) | 2017-01-03 | 2024-03-01 | Intarcia Therapeutics Inc | Methods involving continuous administration of a GLP-1 receptor agonist and co-administration of a drug |
| JP7074963B2 (ja) * | 2017-01-31 | 2022-05-25 | ヴェル インコーポレイテッド | ゴナドトロピン放出ホルモン(GnRH)拮抗薬の長期放出のための組成物および方法 |
| KR20240036128A (ko) | 2017-06-02 | 2024-03-19 | 엑스에리스 파머수티클스, 인크. | 침전 방지 저분자 약물 제제 |
| BR112020011774A2 (pt) * | 2017-12-18 | 2020-11-17 | Foresee Pharmaceuticals Co., Ltd. | composições farmacêuticas com duração de liberação selecionada |
| KR20210010490A (ko) * | 2018-05-16 | 2021-01-27 | 지앙수 헨그루이 메디슨 컴퍼니 리미티드 | Kor 수용체 작용제의 약학적 조성물 |
| CN109316371B (zh) * | 2018-09-21 | 2021-09-03 | 珀莱雅化妆品股份有限公司 | 一种芹菜素缓释制剂的制备方法 |
| KR20200051916A (ko) * | 2018-11-05 | 2020-05-14 | 주식회사 메디포럼제약 | 고세렐린을 포함하는 실리카 하이드로겔 조성물 |
| WO2020187712A1 (en) * | 2019-03-15 | 2020-09-24 | Novo Nordisk A/S | Process for spray drying a glp-1 peptide |
| KR102249104B1 (ko) * | 2019-04-30 | 2021-05-07 | (주)인벤티지랩 | 데슬로렐린을 포함하는 서방성 마이크로 입자 및 이의 제조 방법 |
| CA3141456A1 (en) * | 2019-05-27 | 2020-12-03 | Tolmar International Limited | Leuprolide acetate compositions and methods of using the same to treat breast cancer |
| US20220323603A1 (en) * | 2019-06-07 | 2022-10-13 | President And Fellows Of Harvard College | Compositions and methods relating to erythrocytes with adhered particles |
| JP2022553862A (ja) * | 2019-11-08 | 2022-12-26 | リンドラ セラピューティクス, インコーポレイティド | 活性剤投与用胃内滞留型システム |
| CN114246840B (zh) * | 2020-09-22 | 2024-10-11 | 鲁南制药集团股份有限公司 | 一种口服用紫杉醇胶囊 |
| AU2022323754A1 (en) | 2021-08-05 | 2024-02-08 | Medincell S.A. | Pharmaceutical composition |
| KR20240079177A (ko) * | 2022-11-28 | 2024-06-04 | 동국제약 주식회사 | 인-시튜 임플란트를 형성할 수 있는 서방형 약학 조성물 및 이의 제조방법 |
Family Cites Families (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US444340A (en) * | 1891-01-06 | Coupling-shoe | ||
| IE52535B1 (en) * | 1981-02-16 | 1987-12-09 | Ici Plc | Continuous release pharmaceutical compositions |
| US4443340A (en) | 1981-10-09 | 1984-04-17 | Betz Laboratories, Inc. | Control of iron induced fouling in water systems |
| JP2551756B2 (ja) | 1985-05-07 | 1996-11-06 | 武田薬品工業株式会社 | ポリオキシカルボン酸エステルおよびその製造法 |
| US6312679B1 (en) * | 1986-08-18 | 2001-11-06 | The Dow Chemical Company | Dense star polymer conjugates as dyes |
| DE3708916A1 (de) | 1987-03-19 | 1988-09-29 | Boehringer Ingelheim Kg | Verfahren zur reinigung resorbierbarer polyester |
| US4938763B1 (en) | 1988-10-03 | 1995-07-04 | Atrix Lab Inc | Biodegradable in-situ forming implants and method of producing the same |
| US5702716A (en) * | 1988-10-03 | 1997-12-30 | Atrix Laboratories, Inc. | Polymeric compositions useful as controlled release implants |
| US5349052A (en) | 1988-10-20 | 1994-09-20 | Royal Free Hospital School Of Medicine | Process for fractionating polyethylene glycol (PEG)-protein adducts and an adduct for PEG and granulocyte-macrophage colony stimulating factor |
| US5487897A (en) | 1989-07-24 | 1996-01-30 | Atrix Laboratories, Inc. | Biodegradable implant precursor |
| US5324519A (en) * | 1989-07-24 | 1994-06-28 | Atrix Laboratories, Inc. | Biodegradable polymer composition |
| JPH0818999B2 (ja) * | 1990-01-05 | 1996-02-28 | 藤沢薬品工業株式会社 | インシュリン様成長因子iの乾燥製剤 |
| DE4004430A1 (de) * | 1990-02-09 | 1991-08-14 | Schering Ag | Aus polyaldehyden aufgebaute kontrastmittel |
| EP0452111B1 (en) | 1990-04-13 | 1998-07-15 | Takeda Chemical Industries, Ltd. | Biodegradable high-molecular polymers, production and use thereof |
| USRE37950E1 (en) * | 1990-04-24 | 2002-12-31 | Atrix Laboratories | Biogradable in-situ forming implants and methods of producing the same |
| IE912365A1 (en) * | 1990-07-23 | 1992-01-29 | Zeneca Ltd | Continuous release pharmaceutical compositions |
| US5529914A (en) * | 1990-10-15 | 1996-06-25 | The Board Of Regents The Univeristy Of Texas System | Gels for encapsulation of biological materials |
| US5410016A (en) * | 1990-10-15 | 1995-04-25 | Board Of Regents, The University Of Texas System | Photopolymerizable biodegradable hydrogels as tissue contacting materials and controlled-release carriers |
| AU2605592A (en) * | 1991-10-15 | 1993-04-22 | Atrix Laboratories, Inc. | Polymeric compositions useful as controlled release implants |
| WO1993012160A1 (en) | 1991-12-19 | 1993-06-24 | Mitsui Toatsu Chemicals, Inc. | Polyhydroxy carboxylic acid and production thereof |
| EP0560014A1 (en) * | 1992-03-12 | 1993-09-15 | Atrix Laboratories, Inc. | Biodegradable film dressing and method for its formation |
| US5338822A (en) | 1992-10-02 | 1994-08-16 | Cargill, Incorporated | Melt-stable lactide polymer composition and process for manufacture thereof |
| US5242910A (en) * | 1992-10-13 | 1993-09-07 | The Procter & Gamble Company | Sustained release compositions for treating periodontal disease |
| EP0626170A3 (en) * | 1993-05-10 | 1996-03-27 | Sandoz Ltd | Stabilization of pharmacoligically active compounds in controlled release compositions. |
| PL178466B1 (pl) | 1993-09-17 | 2000-05-31 | Novo Nordisk As | Pochodna insuliny i kompozycja farmaceutyczna do leczenia cukrzycy |
| US5681873A (en) | 1993-10-14 | 1997-10-28 | Atrix Laboratories, Inc. | Biodegradable polymeric composition |
| US5919455A (en) * | 1993-10-27 | 1999-07-06 | Enzon, Inc. | Non-antigenic branched polymer conjugates |
| US5446090A (en) * | 1993-11-12 | 1995-08-29 | Shearwater Polymers, Inc. | Isolatable, water soluble, and hydrolytically stable active sulfones of poly(ethylene glycol) and related polymers for modification of surfaces and molecules |
| PT754032E (pt) * | 1994-04-08 | 2002-05-31 | Atrix Lab Inc | Composicoes liquidas para difusao |
| US5478921A (en) | 1994-08-25 | 1995-12-26 | United States Surgical Corporation | Method of purifying bioabsorable polymer |
| US5693609A (en) * | 1994-11-17 | 1997-12-02 | Eli Lilly And Company | Acylated insulin analogs |
| US5698213A (en) * | 1995-03-06 | 1997-12-16 | Ethicon, Inc. | Hydrogels of absorbable polyoxaesters |
| US5869602A (en) | 1995-03-17 | 1999-02-09 | Novo Nordisk A/S | Peptide derivatives |
| US6551610B2 (en) * | 1995-04-13 | 2003-04-22 | Poly-Med, Inc. | Multifaceted compositions for post-surgical adhesion prevention |
| US7033608B1 (en) | 1995-05-22 | 2006-04-25 | The United States Of America As Represented By The Secretary Of The Army | “Burst-free” sustained release poly-(lactide/glycolide) microspheres |
| US5736152A (en) | 1995-10-27 | 1998-04-07 | Atrix Laboratories, Inc. | Non-polymeric sustained release delivery system |
| EP1826216A1 (en) | 1996-08-30 | 2007-08-29 | Novo Nordisk A/S | Glp-1 derivatives |
| AU4112497A (en) | 1996-08-30 | 1998-03-19 | Novo Nordisk A/S | Glp-2 derivatives |
| US6126919A (en) | 1997-02-07 | 2000-10-03 | 3M Innovative Properties Company | Biocompatible compounds for pharmaceutical drug delivery systems |
| MY118835A (en) * | 1997-04-18 | 2005-01-31 | Ipsen Pharma Biotech | Sustained release compositions and the process for their preparation |
| JP2001522814A (ja) * | 1997-11-07 | 2001-11-20 | カイロン コーポレイション | 増大されたigf−i溶解性を提供する組成物 |
| JP2003522099A (ja) | 1998-02-27 | 2003-07-22 | ノボ ノルディスク アクティーゼルスカブ | 遅延作用プロファイルを有するglp−1のglp−1誘導体及びエキセンジン |
| US6410044B1 (en) * | 1998-03-19 | 2002-06-25 | Surmodics, Inc. | Crosslinkable macromers |
| US6261583B1 (en) | 1998-07-28 | 2001-07-17 | Atrix Laboratories, Inc. | Moldable solid delivery system |
| US6565874B1 (en) | 1998-10-28 | 2003-05-20 | Atrix Laboratories | Polymeric delivery formulations of leuprolide with improved efficacy |
| US6143314A (en) * | 1998-10-28 | 2000-11-07 | Atrix Laboratories, Inc. | Controlled release liquid delivery compositions with low initial drug burst |
| US6355657B1 (en) * | 1998-12-30 | 2002-03-12 | Atrix Laboratories, Inc. | System for percutaneous delivery of opioid analgesics |
| DE19908753C2 (de) | 1999-02-20 | 2003-10-02 | Jenapharm Gmbh | Bioabbaubare, injizierbare Oligomer-Polymer-Zusammensetzung |
| US6461631B1 (en) * | 1999-11-16 | 2002-10-08 | Atrix Laboratories, Inc. | Biodegradable polymer composition |
| FR2806727A1 (fr) * | 2000-03-23 | 2001-09-28 | Pf Medicament | Molecule d'interet pharmaceutique comprotant en son extremite n-terminale un acide glutamique ou une glutamine sous forme de sel d'addition d'acide fort physiologiquement acceptable |
| US6626870B1 (en) | 2000-03-27 | 2003-09-30 | Artix Laboratories, Inc. | Stoppering method to maintain sterility |
| ATE322513T1 (de) | 2000-08-07 | 2006-04-15 | Wako Pure Chem Ind Ltd | Milchsäurepolymer und verfahren zu dessen herstellung |
| US8470359B2 (en) | 2000-11-13 | 2013-06-25 | Qlt Usa, Inc. | Sustained release polymer |
| TW200526267A (en) | 2001-06-29 | 2005-08-16 | Takeda Chemical Industries Ltd | Controlled release composition and method of producing the same |
| TWI225416B (en) | 2001-06-29 | 2004-12-21 | Takeda Chemical Industries Ltd | Sustained-release composition and process for producing the same |
| US7098305B2 (en) * | 2001-09-06 | 2006-08-29 | Ardana Bioscience Limited | Sustained release of microcrystalline peptide suspensions |
| US20040001889A1 (en) | 2002-06-25 | 2004-01-01 | Guohua Chen | Short duration depot formulations |
| AU2002359397B2 (en) | 2002-07-31 | 2009-01-29 | Durect Corporation | Injectable depot compositions and uses thereof |
| US6966990B2 (en) | 2002-10-11 | 2005-11-22 | Ferro Corporation | Composite particles and method for preparing |
| UY28213A1 (es) | 2003-02-28 | 2004-09-30 | Bayer Pharmaceuticals Corp | Nuevos derivados de cianopiridina útiles en el tratamiento de cáncer y otros trastornos. |
| CA2819769C (en) | 2003-07-18 | 2016-06-28 | Oakwood Laboratories, L.L.C. | Prevention of molecular weight reduction of the polymer, impurity formation and gelling in polymer compositions |
| CA2552241C (en) * | 2003-12-30 | 2013-10-01 | Durect Corporation | Co-polymeric devices for controlled release of active agents |
| US7989490B2 (en) * | 2004-06-02 | 2011-08-02 | Cordis Corporation | Injectable formulations of taxanes for cad treatment |
| KR101231856B1 (ko) * | 2004-08-12 | 2013-02-08 | 큐피에스 엘엘씨 | 생물학적 활성 화합물의 제어 방출 전달용 약학 조성물 |
| US8313763B2 (en) | 2004-10-04 | 2012-11-20 | Tolmar Therapeutics, Inc. | Sustained delivery formulations of rapamycin compounds |
| ES2528720T3 (es) | 2004-11-10 | 2015-02-12 | Tolmar Therapeutics, Inc. | Sistema de suministro de polímero estabilizado |
| DE602006000381T2 (de) | 2005-04-28 | 2008-12-18 | Nipro Corp., Osaka | Bioabsorbierbare pharmazeutische Zusammensetzung enthaltend einen PLGA-Copolymer |
| US8076448B2 (en) | 2006-10-11 | 2011-12-13 | Tolmar Therapeutics, Inc. | Preparation of biodegradable polyesters with low-burst properties by supercritical fluid extraction |
| EP2079767B1 (en) | 2006-10-11 | 2014-08-27 | Tolmar Therapeutics, Inc. | Preparation of biodegradable polyesters with low-burst properties by supercritical fluid extraction |
| FI3660073T3 (fi) | 2007-02-15 | 2023-09-11 | Tolmar International Ltd | Matalan purskeen poly(laktidi-ko-glykolidi) |
| WO2009148581A1 (en) | 2008-06-03 | 2009-12-10 | Qlt Usa, Inc. | Biocompatible oligomer-polymer compositions |
| US8877225B2 (en) | 2008-06-03 | 2014-11-04 | Tolmar Therapeutics, Inc. | Controlled release copolymer formulation with improved release kinetics |
| PT3226941T (pt) | 2014-12-04 | 2019-03-20 | Tolmar Therapeutics Inc | Sistema de êmbolo de seringa com geometria roscada de auto-bloqueamento |
| EA036951B1 (ru) | 2015-08-03 | 2021-01-19 | Толмар Интернэшнл Лимитед | Жидкая полимерная система доставки для длительного введения лекарственных средств |
-
2007
- 2007-01-16 ES ES07718050T patent/ES2397712T3/es active Active
- 2007-01-16 KR KR1020087020179A patent/KR101728868B1/ko active IP Right Grant
- 2007-01-16 KR KR1020157002423A patent/KR20150017777A/ko not_active Application Discontinuation
- 2007-01-16 EP EP07718050A patent/EP1984009B1/en active Active
- 2007-01-16 WO PCT/US2007/001039 patent/WO2007084460A2/en active Search and Examination
- 2007-01-16 AU AU2007207618A patent/AU2007207618B2/en active Active
- 2007-01-16 US US11/653,636 patent/US20070196416A1/en not_active Abandoned
- 2007-01-16 CA CA2637569A patent/CA2637569C/en active Active
- 2007-01-16 CN CN2007800089333A patent/CN101400363B/zh active Active
- 2007-01-16 SI SI200731130T patent/SI1984009T1/sl unknown
- 2007-01-16 RU RU2008129201/15A patent/RU2427383C2/ru active
- 2007-01-16 MX MX2008009125A patent/MX2008009125A/es active IP Right Grant
- 2007-01-16 DK DK07718050.3T patent/DK1984009T3/da active
- 2007-01-16 JP JP2008551315A patent/JP5242415B2/ja active Active
-
2009
- 2009-07-15 HK HK09106419.1A patent/HK1126975A1/xx unknown
-
2016
- 2016-08-06 US US15/230,413 patent/US9572857B2/en active Active
-
2017
- 2017-01-13 US US15/406,321 patent/US9744207B2/en active Active
- 2017-07-27 US US15/661,066 patent/US10251956B2/en active Active
-
2019
- 2019-04-05 US US16/376,028 patent/US10646572B2/en active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2557925C1 (ru) * | 2014-03-17 | 2015-07-27 | Новиков Сергей Викторович | Биодеградируемый многослойный имплант для введения лекарственных веществ в витреальную полость глаза |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10646572B2 (en) | Pharmaceutical compositions with enhanced stability | |
| US20230346877A1 (en) | Pharmaceutical Compositions having a Selected Release Duration | |
| NZ766167B2 (en) | Pharmaceutical compositions having a selected release duration | |
| TWI376241B (en) | Pharmaceutical compositions with enhanced stability | |
| BRPI0706558B1 (pt) | Composição polimérica injetável, métodos para preparar uma composição polimérica injetável e métodos para preparar um sal de um análogo de hormônio de liberação de hormônio luteínico (lhrh) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20130322 |
|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20150728 |
|
| TK4A | Correction to the publication in the bulletin (patent) |
Free format text: AMENDMENT TO CHAPTER -PC4A- IN JOURNAL: 23-2015 FOR TAG: (73) |