RU2283309C2 - Способ получения дискодермолида и его аналогов и промежуточные соединения - Google Patents
Способ получения дискодермолида и его аналогов и промежуточные соединения Download PDFInfo
- Publication number
- RU2283309C2 RU2283309C2 RU2003105816/04A RU2003105816A RU2283309C2 RU 2283309 C2 RU2283309 C2 RU 2283309C2 RU 2003105816/04 A RU2003105816/04 A RU 2003105816/04A RU 2003105816 A RU2003105816 A RU 2003105816A RU 2283309 C2 RU2283309 C2 RU 2283309C2
- Authority
- RU
- Russia
- Prior art keywords
- formula
- compound
- alkyl
- labile hydroxyl
- protecting group
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C271/12—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C259/00—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups
- C07C259/04—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups without replacement of the other oxygen atom of the carboxyl group, e.g. hydroxamic acids
- C07C259/06—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups without replacement of the other oxygen atom of the carboxyl group, e.g. hydroxamic acids having carbon atoms of hydroxamic groups bound to hydrogen atoms or to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D309/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings
- C07D309/16—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D309/28—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D309/30—Oxygen atoms, e.g. delta-lactones
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/18—Compounds having one or more C—Si linkages as well as one or more C—O—Si linkages
- C07F7/1804—Compounds having Si-O-C linkages
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Steroid Compounds (AREA)
- Pyrane Compounds (AREA)
Abstract
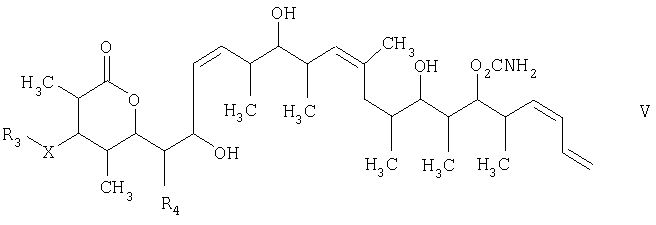
Изобретение относится к способу получения дискодермолида и его аналогов формулы V
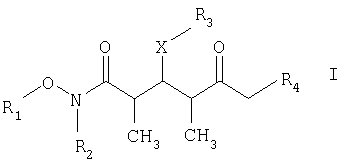
который включает на первой стадии реакцию сочетания кетонового соединения формулы I
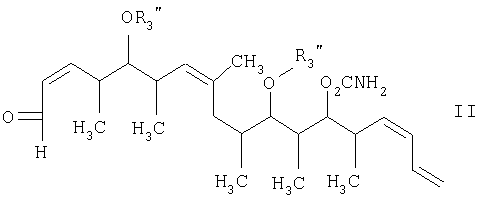
с альдегидным соединением формулы II
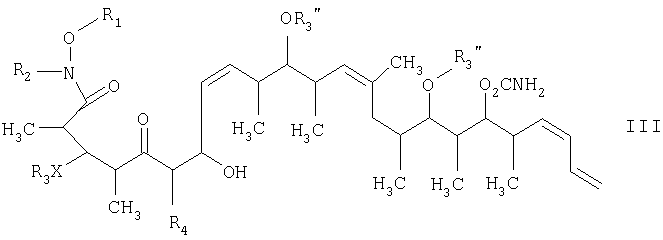
в присутствии диалкилборгалогенида или трифлата, аминового основания и полярного органического растворителя с получением β-гидроксикетона формулы III
на второй стадии восстановление кетонового соединения, полученного на первой стадии, его обработкой боргидридным реагентом в полярном органическом растворителе и протонном растворителе с получением 1,3-диола формулы IV
и на третьей стадии лактонизацию и удаление кислотнолабильной гидроксильной защитной группы 1,3-диола, полученного на второй стадии, его обработкой галогенидом водорода, растворенным в полярном растворителе или смеси растворителей, с получением целевого соединения формулы V, где R1 обозначает С1-С6алкил, R2 обозначает С1-С6алкил; R3 обозначает водородный атом или кислотнолабильную гидроксильную защитную группу; R3" обозначает кислотнолабильную гидроксильную защитную группу;
R4 обозначает водородный атом или метил; а Х обозначает О, при условии, что когда Х обозначает О и R3 обозначает кислотнолабильную гидроксильную защитную группу соединения формулы I, остаток -Х-R3 соединения формулы V представляет собой -ОН. Изобретение также относится к новым промежуточным соединениям формулы I, III и IV и способу получения соединения формулы I. Технический результат - новый способ получения ценного соединения - дискодермолида и его аналогов, позволяющий получать технически приемлемые количества. 5 н. и 11 з.п. ф-лы.
Description
Изобретение относится к способу получения дискодермолида и его аналогов, к новым соединениям, используемым в данном способе, и к новым соединениям, получаемым по этому способу.
Предпосылки создания изобретения
(+)-Дискодермолид представляет собой новый поликетидный природный продукт, который был выделен из экстрактов морской губки Discodermolide dissoluta исследователями Harbor Branch Oceanographic Institution (HBOI) (Gunasekera SP, Gunasekera M, Longley RE, Schulte GK. Discodermolide: a new bioactive polyhydroxylated lactone from the marine sponge Discodermolide dissoluta. [В опубликованном номере J.Org.Chem. 1991; 56:1346 содержится опечатка]. J.Org.Chem. 1990; 55:4912-15). У дискодермолида отсутствует явное структурное сходство с паклитакселем, но тем не менее он обладает общей с паклитакселем (активное вещество в лекарственном средстве таксол) способностью стабилизировать микротрубки. В испытаниях по изучению механизма действия дискодермолид оказывается более эффективным, чем паклитаксель. В самом деле, из небольшой группы соединений, которые известны тем, что инициируют полимеризацию очищенного тубулина, дискодермолид является самым эффективным. Однако микротрубки, основной структурный компонент клеток, не являются простыми равновесными полимерами тубулина. Они существуют как динамические ансамбли гетеродимеров α- и β-тубулина, движение которых контролирует ГТФ. Хотя на стадии интерфазы динамика в клетках относительно низка, с началом митоза скорость роста и ломки увеличивается от 20 до 100 раз, в среднем за каждые десять секунд микротрубки обменивают больше половины субъединиц тубулина. Эти изменения в скорости позволяют цитоскелетной сетке микротрубок разбираться и собираться в биполярные веретенообразные структуры. Веретена прикрепляются к хромосомам, и их раздвигают в разные стороны. Результатом полного подавления динамики микротрубок в клетках является гибель. Однако митотические клетки более чувствительны, и порог их толерантности зависит, по-видимому, от специфического типа клеток. Молекулы, подобные паклитакселю, которые связываются с микротрубками с высокой степенью сродства, нарушают динамический процесс в опухолевых клетках, что приводит к их гибели, даже когда соотношение связанное лекарственное средство : тубулин оказывается очень низким. Дискодермолид связывается с тубулином, конкурируя с паклитакселем. Поскольку доказано, что паклитаксель может быть использован при лечении некоторых видов рака, против гиперпролиферации могут быть использованы и другие соединения, действующие по механизму того же класса.
Перспективное расширение производства дискодермолида или структурно родственных аналогов затруднено из-за отсутствия надежного природного источника этого соединения или возможного пути синтеза. Встречающегося в природе дискодермолида недостаточно, и добывание организма-продуцента обуславливает проблемы, связанные с поставками. Таким образом, существует постоянно возрастающая потребность в усовершенствованных синтезах, осуществление которых давало бы возможность получения технически приемлемых количеств дискодермолида и структурно родственных аналогов.
Краткое изложение сущности изобретения
Настоящее изобретение относится к более практичному синтезу дискодермолида и его аналогов. По другому варианту настоящее изобретение относится к новым соединениям, которые могут быть использованы при получении дискодермолида и его аналогов. По еще одному варианту настоящее изобретение относится к новым соединениям, которые получают согласно способу по настоящему изобретению.
Подробное описание изобретения
В основе настоящего изобретения лежит разработка более практичного синтеза дискодермолида и его аналогов. Более конкретно было установлено, что дискодермолид и его аналоги могут быть получены трехстадийной реакцией следующим образом:
СТАДИЯ 1
СТАДИЯ 2
СТАДИЯ 3
где R1 обозначает C1-С6алкил, бензил или кислотнолабильную гидроксильную защитную группу; R2 обозначает C1-С6алкил или бензил; R3 обозначает водородный атом, C1-С6алкил, бензил, С(O)-С1-С12алкил, C(O)Ph, C(O)O-C1-С12алкил, C(O)OPh, С(O)NH-С1-С12алкил, C(O)NHPh или кислотнолабильную гидроксильную защитную группу; R3" обозначает кислотнолабильную гидроксильную защитную группу; R4 обозначает водородный атом или метил; а Х обозначает О, NH, NCH3, S или СН2 при условии, что когда Х обозначает О, а R3 обозначает кислотно-лабильную гидроксильную защитную группу соединения формулы I, остаток -Х-R3 соединения формулы V представляет собой -ОН.
Что касается отдельных стадий, то стадия 1 включает реакцию сочетания кетонового соединения формулы I с альдегидным соединением формулы II посредством реакции альдоля с получением β-гидроксикетонового соединения формулы III. Реакцию сочетания удобно проводить с использованием в пределах 1 и 20, предпочтительно в пределах 5 и 15 экв. кетонового соединения формулы I относительно альдегидного соединения формулы II. Реакцию сочетания проводят в присутствии: 1) диалкилборгалогенида или трифлата, предпочтительно хирального хлорида бора или трифлата, более предпочтительно β-хлордиизопинокамфенилборана; 2) основания, предпочтительно амина, более предпочтительно триэтиламина; и 3) полярного органического растворителя, предпочтительно простого эфира, более предпочтительно диэтилового эфира, при температуре в пределах -100 и 20°С, предпочтительно в пределах -78 и -20°С, в течение периода в пределах 2 и 72 ч, предпочтительно в течение 16 ч.
На стадии 2 осуществляют восстановление β-гидроксикетонового соединения формулы III, а более конкретно кетогруппы, общей для таких соединений, с получением 1,3-диолового соединения формулы IV. Восстановление проводят в присутствии: 1) кетонового восстановителя, предпочтительно боргидрида, такого, как тетраметиламмонийтриацетоксиборгидрид; 2) полярного органического растворителя, предпочтительно ацетонитрила; и 3) протонного растворителя, предпочтительно карбоновой кислоты, такой, как уксусная кислота, при температуре в пределах -78 и 20°С, предпочтительно в пределах -40 и -10°С, в течение периода в пределах 2 и 72 ч, предпочтительно в течение 16 ч.
Что касается стадии 3, то она включает лактонизацию и удаление кислотнолабильных гидроксильных защитных групп соединения формулы IV с получением соединения формулы V. Реакцию лактонизации и удаления защитных групп проводят в присутствии: 1) протонной кислоты, предпочтительно водного раствора протонной кислоты, предпочтительнее водного раствора галогенида водорода, такого, как водный хлорид водорода; и 2) полярного органического растворителя, предпочтительно смеси полярных органических растворителей, более предпочтительно смеси алифатического спирта и простого эфира, таких, как метанол и тетрагидрофуран, при температуре в пределах -20 и 40°С, предпочтительно в пределах 20 и 25°С, в течение периода от 8 ч до 7 дней, предпочтительно в пределах 16 и 72 ч, более предпочтительно в пределах 24 и 48 ч.
По другому варианту объектом настоящего изобретения являются новые кетоновые соединения формулы I:
где
R1 обозначает C1-С6алкил, бензил или кислотнолабильную гидроксильную защитную группу;
R2 обозначает C1-С6алкил или бензил;
R3 обозначает водородный атом, C1-С6алкил, бензил, С(O)-С1-С12алкил, C(O)Ph, С(O)O-С1-С12алкил, C(O)OPh, C(O)NH-C1-C12алкил, C(O)NHPh или кислотнолабильную гидроксильную защитную группу;
R4 обозначает водородный атом или метил; а Х обозначает О, NH, NCH3, S или CH2.
Предпочтительными соединениями являются соединения формулы Ia:
где
каждый из R1' и R2' обозначает C1-С6алкил; Х обозначает О или СН2; а R3 и R4 имеют такие же значения, как указанные выше.
Более предпочтительными соединениями являются соединения формулы Ib:
где
R3' обозначает C1-С6алкил, С(O)-С1-С12алкил, бензил, С(O)O-С1-С12алкил или кислотнолабильную гидроксильную защитную группу; а
R1' и R2' имеют такие же значения, как указанные выше.
Еще более предпочтительными соединениями являются соединения формулы Ic:
R3" обозначает кислотнолабильную гидроксильную защитную группу.
Среди вышеприведенных определений понятие "C1-С6алкил", использованное в настоящем описании, относится к прямоцепочечной или разветвленной группе, состоящей только из углеродных и водородных атомов и содержащей от 1 до 6 углеродных атомов, тогда как понятие "С1-С12алкил", использованное в настоящем описании, относится к прямоцепочечной или разветвленной группе, состоящей только из углеродных и водородных атомов и содержащей от 1 до 12 углеродных атомов. Примеры алкильных групп включают метил, этил, пропил, бутил, пентил, 3-метилпентил и т.д.
Понятие "кислотнолабильные гидроксильные защитные группы", использованное в настоящем описании, относится к любой связанной с кислородным атомом группе, которая может быть удалена под воздействием кислоты. Многочисленные примеры этих групп специалистам в данной области техники известны, их можно найти в работе Greene и Wuts, Protective Groups in Organic Synthesis, издание 2-ое, John Wiley & Sons, New York, 1991. Конкретные примеры включают, хотя ими их список не ограничен, трет-бутилдиметилсилил, триэтилсилил, трет-бутилдифенилсилил, триизопропилсилил, метоксиметил и тетрагидропиранил.
По еще одному варианту объектом настоящего изобретения является способ получения новых соединений формулы I. Более конкретно соединения формулы I могут быть получены так, как представлено ниже:
СТАДИЯ А
СТАДИЯ Б
где R1, R2, R3, R4 и Х имеют такие же значения, как указанные выше.
Что касается отдельных стадий, то стадия А включает присоединение метильной или этильной группы к альдегидному соединению формулы VI с получением спиртового соединения формулы VII. Это присоединение проводят в присутствии: 1) металлорганического реагента, предпочтительно литийалкил или магнийалкилгалогенида, такого, как магнийметилбромид; и 2) полярного органического растворителя, предпочтительно простого эфира, такого, как диэтиловый эфир, при температуре в пределах -78 и 40°С, предпочтительно -78 и 0°С, более предпочтительно при примерно -40°С, в течение периода в пределах от 5 мин до 24 ч, предпочтительно в пределах 30 мин и 2 ч, более предпочтительно в течение примерно 1 ч.
Стадия Б включает окисление спиртового соединения формулы VII с получением целевого кетонового соединения формулы I. Окисление проводят в присутствии: 1) окислителя, предпочтительно сочетания диметилсульфоксида и активирующего агента, более предпочтительно сочетания диметилсульфоксида и комплекса триоксида серы с пиридином; 2) основания, предпочтительно органического основания, более предпочтительно триалкиламина, такого, как триэтиламин; и 3) полярного органического растворителя, предпочтительно хлорированного углеводорода, такого, как дихлорметан. Окисление целесообразно проводить при температуре в пределах -78 и 40°С, предпочтительно в пределах 5 и 20°С, в течение периода в пределах 5 мин и 24 ч, предпочтительно в пределах 1 и 12 ч, более предпочтительно в пределах 4 и 6 ч.
Альдегидные соединения формул II и VI либо известны, либо могут быть получены аналогично способам, которые приведены в литературе для других структурно идентичных альдегидов.
Тем не менее по еще одному варианту объектом настоящего изобретения являются новые β-гидроксикетоновые соединения формулы III и новые 1,3-диоловые соединения формулы IV.
Хотя продукт каждой реакции, описанной выше, можно, если необходимо, очищать по обычным методам, таким, как хроматография или перекристаллизация (если твердое вещество), сырой продукт одной реакции целесообразно без очистки использовать в последующей реакции. Как очевидно для специалистов в данной области техники, соединения формул I и с III по V содержат асимметрические углеродные атомы и, таким образом, необходимо иметь в виду, что отдельные стереоизомеры следует рассматривать как охватываемые объемом настоящего изобретения.
Следующие примеры приведены только в иллюстративных целях, поэтому их нельзя рассматривать как ограничивающие каким-либо образом объем настоящего изобретения.
Пример 1
(2R,3S,4R)-3-[[(1,1-диметилэтил)диметилсилил]окси]-N-метокси-N,2,4-триметил-5-оксогексанамид
В раствор 13,1 г (39,5 ммоль) диастереоизомерной смеси, полученной на стадии 1.1, в смеси, включающей 150 мл метиленхлорида, 50 мл диметилсульфоксида и 25 мл триэтиламина, при 0°С с помощью капельной воронки по каплям добавляют 19,0 г (120 ммоль) комплекса пиридина стриоксидом серы в 150 мл диметилсульфоксида. Затем полученный раствор перемешивают в течение 1,5 ч при 0°С и по прошествии этого времени реакционную смесь концентрируют с помощью роторного испарителя на охлаждающей бане при <10°С. Затем раствор разбавляют 200 мл диэтилового эфира, после чего последовательно экстрагируют 200 мл 1 М раствора бисульфата натрия и 200 мл рассола. Далее органический слой сушат над сульфатом натрия и полученную сырую смесь очищают экспресс-хроматографией, используя при этом в качестве элюента первоначально гексан, а затем элюентную смесь из 5% этилацетата в гексане, с получением целевого соединения в виде прозрачного масла.
1H-ЯМР (300 МГц, CDCl3) δ: 4,23 (dd, J=7,5, 4,2 Гц, 2Н), 3,61 (s, 3H), 3,01 (s, 3H), 2,92 (m, 2H), 2,64 (m, 2Н), 2,08 (s, 3H), 1,03 (d, J=6,8 Гц, 3H), 0,98 (d, J=7,2 Гц, 3H), 0,81 (s, 9H), 0,00 (s, 6H).
Стадия 1.1: (2R,3S,4S)-3-[[(1,1-диметилэтил)диметилсилил]окси]-5-гидрокси-N-метокси-N,2,4-триметилгексанамид
В раствор 6,9 г (21,8 ммоль) (2R,3S,4R)-3-[[(1,1-диметилэтил)диметилсилил]окси]-N-метокси-N,2,4-триметил-5-оксопентанамида в 50 мл диэтилового эфира по каплям при -40°С добавляют 10,2 мл (30,5 ммоль) 3 М раствора метилмагнийбромида в диэтиловом эфире, после чего смесь перемешивают при -20°С в течение 1 ч. Затем реакционную смесь разбавляют 200 мл диэтилового эфира и реакцию гасят добавлением реакционной смеси к 20 г измельченного льда при 0°С. Затем смесь промывают 100 мл 1 М раствора бисульфата натрия и разделяют между двумя 150-миллилитровыми порциями диэтилового эфира. После этого органические слои объединяют и сушат над сульфатом натрия. Далее полученную сырую смесь хроматографируют, используя при этом первоначально элюентную смесь из 20% этилацетата в гексане, а затем элюентную смесь из 40% этилацетата в гексане с получением двух диастереоизомеров в виде светло-желтых масел, которые без дополнительной очистки применяют на следующей стадии.
Диастереоизомер 1: 1H-ЯМР (300 МГц, CDCl3) d: 4,08 (dd, J=9,8, 6,8 Гц, 2H), 3,64 (s, 3H), 3,54 (d, J=2,6 Гц, 2H), 3,08 (s, 3H), 3,00 (m, 2H), 1,48 (m, 2H), 1,07 (d, J=6,8 Гц, 3H), 1,05 (d, J=6,4 Гц, 3H), 0,81 (s, 9H), 0,76 (d, J=7,2 Гц, 2H), 0,01 (d, J=3,8 Гц, 6H).
Диастереоизомер 2: 1Н-ЯМР (300 МГц, CDCl3) d: 4,19 (dd, J=12,1, 6,0 Гц, 2Н), 3,86 (dd, J=9,0, 1,51 Гц, 2Н), 3,56 (s, 3Н), 3,18 (m, 2H), 3,01 (s, 3H), 1,28 (m, 2H), 1,06 (d, J=6,8 Гц, 3Н), 0,94 (d, 6,4 Гц, 3Н), 0,88 (d, 7,2 Гц, 3Н), 0,78 (s, 9H), 0,01 (d, 1,3 Гц, 6Н).
Пример 2
(2R,3S,4R,7S,8Z,10S,11S,12S,13Z,16S,17R,18R,19S,20S,21-E)-19-[(аминокарбонил)оксил]-3,11,17-трис[[(1,1-диметилэтил)диметилсилил]окси]-7-гидрокси-N-метокси-N,2,4,10,12,14,16,18,20-нонаметил-5-оксо-8,13,21,23-тетракозатетраенамид
В перемешиваемый раствор 2,18 г (6,79 ммоль, 10 экв.) (+)-β-хлордиизопинокамфенилборана в 4 мл диэтилового эфира при 0°С добавляют 1,04 мл триэтиламина (11 экв., перегоняли над гидридом кальция), а затем раствор 2,25 г (6,79 ммоль, 10 экв.) соединения примера 1 в 3 мл диэтилового эфира. После перемешивания в течение 2 ч при 0°С смесь охлаждают до -78°С и по прошествии этого времени посредством полой иглы добавляют предварительно охлажденный (-78°С) раствор 450 мг (0,679 ммоль) (2Z,4S,5S,6S,7Z,10S,11R,12R,13S,14S,15E)-13-[(аминокарбонил)оксил]-5,11-бис[[(1,1-диметилэтил)диметилсилил]окси]-4,6,8,10,12,14-гексаметил-2,7,15,17-октадекатетраеналя в 4 мл диэтилового эфира. После того как образовавшуюся смесь выдерживают при температуре -78°С в течение 3 ч, ее переносят в морозильную камеру (-27°С), где выдерживают в течение 16 ч. Затем реакцию гасят 8 мл метанола (значение рН которого доводят до 7 добавлением 12 мл буферного раствора) и 4 мл 50%-ного раствора пероксида водорода при 0°С. После перемешивания в течение 2 ч при 25°С органические слои отделяют. Далее водный слой пять раз экстрагируют 25-миллилитровыми порциями дихлорметана. После этого объединенные органические слои сушат над сульфатом магния, концентрируют с использованием роторного испарителя и хроматографируют (продукт Biotage, силикагель, этилацетат/гексан с градиентом от 10 до 30%) с получением целевого соединения в виде бесцветного высоковязкого масла.
[α]D=+12,56° (с=1,0, СН2Cl2); IR (СН2Cl2: 3547 (m, ОН), 3359 (m, CONH2), 2958 (vs), 2990 (vs), 1729 (vs, CO), 1664 (m), 1462 (s), 1385 (s), 1254 (s), 1037 (s), 1037 (s), 1004 (s), 835 (vs); 1H-ЯМР (500 МГц, CDCl3) d: 6,61 (1H, ddd, J=17,1, 10,5, 10,5 Гц, Н23), 6,03 (1H, dd, J=11,0, 11,0 Гц, Н22), 5,50 (1H, dd, J=10,6, 10,6 Гц, H9),5,37(1H, dd, J=10,6, 10,5 Гц, H21), 5,35 (1H, dd, J=10,8, 8,5 Гц, H8), 5,23 (1H, dd, J=15,3, 2,1 Гц, Н24А), 5,13 (1H, d, J=10,2 Гц, Н24В), 5,05 (1H, d, J=10,0 Гц, H13), 4,79 (1H, t, J=8,0 Гц, Н7), 4,72 (1H, t, J=5,9 Гц, H19), 4,60-4,50 (2Н, широкий, CONH2), 4,33 (1H, dd, J=6,9, 4,3 Гц, Н3), 3,74 (3Н, s, NOCН 3). 3,43 (1H, dd, J=5,0, 4,1 Гц, Н17), 3,31 (1H, dd, J=5,2, 5,1 Гц, Н11), 3,13 (3Н, s, NCH3), 3,08 (1H, широкий, ОН), 3,00 (1H, m, H20), 2,78-2,69 (2Н, m, Н4 + Н6A), 2,70-2,62 (1H, m, Н10), 2,66-2,54 (2Н, m, H2 + Н6В), 2,49-2.45 (1H, m, H12), 2,12 (1H, dd, J=12,4, 12,3 Гц, H15А), 1,93-1,86 (2Н, m, H16 + H18), 1,76-1,65 (1H, m, H15B), 1,62 (3Н, s, Me14), 1,14 (3Н, d, J=7,0 Гц, Me2), 1,11 (3Н, d, J=7,0 Гц, Ме4), 1,00 (3Н, d, J=3,1 Гц, Ме20), 0,99 (3Н, d, J=3,3 Гц, Ме10), 0,96-0,90 (21Н, m, Me18 + 2 × SiC(СН 3)3), 0,88 (3Н, d, J=6,6 Гц, Me12), 0,83 (9Н, s, SiC(СН 3)3), 0,73 (3Н, d, J=6,7 Гц, Me16), 0,10 и 0,08 и 0,04 и 0,03 и 0,03 и 0,01 (6×3Н, 3 × Si(СН 3)2);
13С ЯМР (100, 6 МГц, CDCl3) d: 212,9, 175,9, 156,9, 136,0, 133,7, 132,1, 131,9, 131,3, 129,8, 129,6, 117,9, 80,6, 78,7, 76,8, 73,6, 64,9, 62,1, 61,3, 54,7, 53,1, 51,7, 49,0, 45,1, 44,9, 37,9, 37,1, 36,2, 35,9, 35,0, 34,4, 30,0, 29,1, 26,26, 26,24, 25,97, 23,0, 18,51, 18,5, 18,43, 18,14, 17,43, 16,44, 13,5, 10,99, 10,1, -3,29, -3,4, 3,5, -3,9, -4,1, -4,4; m/z (ESI+) 1017 (100 (MNa+).
Пример 3
(2R,3S,4S,5S,7S,8Z,10S,11S,12S,13Z,16S,17R,18R,19S,20S,21E)-19-[(аминокарбонил)оксил]-3,11,17-трис[[(1,1-диметилэтил)диметилсилил]окси]-5,7-дигидрокси-N-метокси-N,2,4,10,12,14,16,18,20-нонаметил-8,13,21,23-тетракозатетраенамид
В раствор 1,02 г (3,9 ммоль) тетраметиламмонийтриацетоксиборгидрида в 2,2 мл безводного ацетонитрила добавляют 2,2 мл безводной уксусной кислоты и смесь перемешивают при комнатной температуре в течение 30 мин. Затем смесь охлаждают до -29°С и в холодную смесь добавляют раствор 450 мг (0,453 ммоль) соединения примера 2 в 1 мл безводного ацетонитрила. Далее образовавшуюся смесь перемешивают при -29°С в течение 18 ч и по прошествии этого времени реакцию гасят 2 мл 0,5н. водного натрийкалийтартрата. Затем смеси дают медленно нагреться до комнатной температуры, после чего ее разбавляют метиленхлоридом и промывают насыщенным раствором бикарбоната натрия. Затем водный слой четыре раза экстрагируют метиленхлоридом. После этого объединенные органические слои промывают рассолом, сушат сульфатом натрия и концентрируют под вакуумом. После этого полученный остаток очищают экспресс-хроматографией (продукт Biotage, силикагель, этилацетат/гексан с градиентом от 10 до 30%) с получением целевого соединения в виде белого твердого вещества.
[α]=+29,75° (с=0,87, CH2Cl2), 1H-ЯМР (499,87 МГц, CDCl3) d: 6,60 (1H, ddd, J=16,8, 10,5, 10,5 Гц, Н23), 6,02 (1H, t, J=11,0, Н22), 5,48 (1H, dd, J=10,0, 9,8 Гц, H9), 5,37(1H, dd, J=10,6, 11,2 Гц, H21), 5,35 (1H, dd, J=10,8, 8,5 Гц, Н8), 5,22 (1H, d, J=15,8 Гц, Н24A), 5,12 (1H, d, J=10,2 Гц, Н24B), 4,98 (1H, d, J=10,1 Гц, H13), 4,79 (1H, t, J=6,3 Гц, Н7), 4,65 (1H, t, J=5,9 Гц, H19), 4,60-4,50 (2Н, широкий, CONH2), 4,20 (1H, dd, J=7,7, 2,3 Гц, Н3), 3,92, (1H, m, H5), 3,73 (3H, s, NOCH 3), 3,45 (1H, широкий, ОН-5), 3,41 (1H, dd, J=10,9, 4,7 Гц, Н17), 3,31 (1H, dd, J=5,2, 5,1 Гц, Н11), 3,18 (3H, s, NCH3), 3,08 (1H, широкий, ОН), 2,99 (1H, m, Н20), 267 (1H, m, Н10), 2,43-2,41 (2Н, m), 2,11 (1H, t, J=12,3 Гц), 1,90-1,87 (2Н, m), 1,76-1,58 (10Н, m), 1,25 (3H, t, Me), 1,17 (3H, d, J=7,1 Гц, Me), 0,99 (3H, d, J=6,4 Гц, Me), 0,97 (3H, d, J=6,5 Гц, Me), 0,93-0,83 (30Н, m, Me + 3 × SiC(СН 3)3), 0,71 (3Н, d, J=6,8 Гц, Ме), 0,10, 0,08, 0,04, 0,03, 0,03 и 0,01 (6×3Н, 3 × Si(СН 3)2).
13С-ЯМР (100, 6 МГц, CDCl3) d: 156,88, 140,02, 134,19, 133,66, 132,10, 131,88, 131,40, 131,30, 131,11, 130,06, 129,79, 117,91, 115,44, 80,79, 80,69, 78,61, 78,32, 74,31, 70,68, 65,55, 61,66, 45,69, 40,38, 38,36, 37,92, 37,83, 37,29, 36,29, 35,07, 34,91, 34,45, 32,36, 29,68, 26,21, 26,12, 26,03, 25,95, 22,95, 18,52, 18,43, 18,12, 17,41, 17,07, 16,57, 13,44, 12,29, 10,32, 10,14, -3,20, -3,43, -3,96, -4,16, -4,48. m/z (ESI+) 1019 (100 (MNa+).
Пример 4
Получение (+)-дискодермолида
В раствор 450 мг (0,452 ммоль) соединения примера 3 в 56 мл тетрагидрофурана добавляют 56 мл 4н. водного раствора соляной кислоты. Затем полученный раствор перемешивают при комнатной температуре в течение 24 ч, далее добавляют 10 мл метанола, после чего этот раствор перемешивают в течение дополнительных 24 ч при комнатной температуре. Далее в этот раствор добавляют 50 мл этилацетата с последующим добавлением бикарбоната натрия при 0°С до значения рН 8. Затем органический раствор промывают рассолом. После этого водный слой три раза экстрагируют 30-миллилитровыми порциями этилацетата и объединенные экстракты сушат над сульфатом натрия. В результате фильтрования и концентрирования и последующей экспресс-хроматографии с использованием при этом первоначально элюентной смеси из 50% метиленхлорида в этилацетате, после чего 100% этилацетата получают (+)-дискодермолид.
[α]=+22,0° (с=1,41, МеОН); W 122-124°C; 13С-ЯМР (100,6 МГц, CDCl3) d: 176,8, 160,33, 134,17, 133,92, 133,88, 133,59, 133,28, 131,59, 131,00, 118,80, 80,66, 80,22, 78,48, 76,48, 73,66, 63,70, 44,56, 42,60, 38,79, 37,71, 36,92, 36,77, 36,69, 34,97, 34,62, 23,45, 19,73, 18,25, 18,11, 16,05, 15,84, 13,27, 9,44. m/z (ESI+) 594 (100(M+1+)).
Claims (16)
1. Способ получения соединения формулы V
который включает на первой стадии реакцию сочетания кетонового соединения формулы I
с альдегидным соединением формулы II
в присутствии диалкилборгалогенида или трифлата, аминового основания и полярного органического растворителя с получением β-гидроксикетона формулы III
на второй стадии, восстановление кетонового соединения, полученного на первой стадии, его обработкой боргидридным реагентом в полярном органическом растворителе и протонном растворителе с получением 1,3-диола формулы IV
и на третьей стадии лактонизацию и удаление кислотно-лабильной гидроксильной защитной группы 1,3-диола, полученного на второй стадии, его обработкой галогенидом водорода, растворенным в полярном растворителе или смеси растворителей, с получением целевого соединения формулы V, где R1 обозначает С1-С6алкил, R2 обозначает С1-С6алкил; R3 обозначает водородный атом или кислотно-лабильную гидроксильную защитную группу; R3" обозначает кислотно-лабильную гидроксильную защитную группу;
R4 обозначает водородный атом или метил; а Х обозначает О, при условии, что когда Х обозначает О и R3 обозначает кислотно-лабильную гидроксильную защитную группу соединения формулы I, остаток -Х-R3 соединения формулы V представляет собой -ОН.
2. Способ по п.1, в котором стадию реакции сочетания осуществляют в присутствии β-хлордиизопинокамфенилборана, триэтиламина и диэтилового эфира при температуре в пределах (-78) и (-20)°С.
3. Способ по п.1, в котором стадию восстановления осуществляют в присутствии тетраметиламмонийтриацетоксиборгидрида, ацетонитрила и уксусной кислоты при температуре в пределах (-40) и (-10)°С.
4. Способ по п.1, в котором стадию лактонизации и удаления кислотно-лабильных гидроксильных защитных групп осуществляют в присутствии водного хлорида водорода, метанола и тетрагидрофурана при температуре в пределах -20 и 40°С.
10. Способ получения соединения формулы I по п.5, который включает на первой стадии присоединение метил- или этилсодержащего металлорганического реагента к альдегиду формулы VI
в присутствии полярного органического растворителя с получением спирта формулы VII
и на второй стадии окисление спиртового соединения, полученного на первой стадии, его обработкой окислителем и основанием в полярном органическом растворителе с получением целевого соединения формулы I, в которой R1, R2, R3, R4 и Х имеют такие же значения, как указанные в п.5.
11. Способ по п.10, в котором стадию присоединения осуществляют в присутствии метилмагнийбромида и диэтилового эфира при температуре в пределах -78 и 40°С.
12. Способ по п.10, в котором стадию окисления осуществляют в присутствии комплекса триоксида серы с пиридином, триэтиламина и дихлорметана при температуре в пределах -78 и 40°С.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US63375300A | 2000-08-07 | 2000-08-07 | |
| US09/633,753 | 2000-08-07 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2003105816A RU2003105816A (ru) | 2004-08-20 |
| RU2283309C2 true RU2283309C2 (ru) | 2006-09-10 |
Family
ID=24540984
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2003105816/04A RU2283309C2 (ru) | 2000-08-07 | 2001-08-06 | Способ получения дискодермолида и его аналогов и промежуточные соединения |
Country Status (29)
| Country | Link |
|---|---|
| EP (1) | EP1309583B1 (ru) |
| JP (1) | JP2004505963A (ru) |
| KR (1) | KR100796396B1 (ru) |
| CN (1) | CN1293067C (ru) |
| AR (1) | AR032761A1 (ru) |
| AT (1) | ATE330948T1 (ru) |
| AU (2) | AU2001293726B2 (ru) |
| BR (1) | BR0112876A (ru) |
| CA (1) | CA2416769C (ru) |
| CY (1) | CY1105338T1 (ru) |
| CZ (1) | CZ300855B6 (ru) |
| DE (1) | DE60120991T2 (ru) |
| DK (1) | DK1309583T3 (ru) |
| EC (1) | ECSP034459A (ru) |
| ES (1) | ES2266266T3 (ru) |
| HU (1) | HUP0300742A3 (ru) |
| IL (2) | IL154109A0 (ru) |
| MX (1) | MXPA03001192A (ru) |
| MY (1) | MY127609A (ru) |
| NO (1) | NO328365B1 (ru) |
| NZ (1) | NZ523999A (ru) |
| PE (1) | PE20020263A1 (ru) |
| PL (1) | PL358839A1 (ru) |
| PT (1) | PT1309583E (ru) |
| RU (1) | RU2283309C2 (ru) |
| SK (1) | SK1562003A3 (ru) |
| TW (1) | TWI251591B (ru) |
| WO (1) | WO2002012220A2 (ru) |
| ZA (1) | ZA200300590B (ru) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2003251431A1 (en) * | 2002-07-22 | 2004-02-09 | Cambridge University Technical Services Ltd. | Synthesis of discodermolide |
| US7122686B2 (en) | 2002-09-06 | 2006-10-17 | University Of Pittsburgh | Analogs of discodermolide and dictyostatin-1, intermediates therefor and methods of synthesis thereof |
| US7321046B2 (en) | 2002-09-06 | 2008-01-22 | University Of Pittsburgh | Analogs of dictyostatin, intermediates therefor and methods of synthesis thereof |
| US7214708B2 (en) | 2004-11-18 | 2007-05-08 | Kosan Biosciences Incorporated | Synthetic discodermolide analogs |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4939168A (en) * | 1989-08-11 | 1990-07-03 | Harbor Branch Oceanographics Institution, Inc. | Discodermolide compounds, compositions containing same and methods of preparation and use |
| RU2114101C1 (ru) * | 1993-01-29 | 1998-06-27 | Санкио Компани Лимитед | Эфирные производные гексагидронафталина, их получение и фармацевтическая композиция на их основе |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9315802D0 (en) * | 1993-07-30 | 1993-09-15 | Roussel Lab Ltd | Chemical compounds |
| US5789605A (en) * | 1996-12-03 | 1998-08-04 | Trustees Of The University Of Pennsylvania | Synthetic techniques and intermediates for polyhydroxy, dienyl lactones and mimics thereof |
| US6096904A (en) * | 1996-12-03 | 2000-08-01 | The Trustees Of The University Of Pennsylvania | Synthetic techniques and intermediates for polyhydroxy, dienyl lactone derivatives |
| AU7267298A (en) * | 1997-04-30 | 1998-11-24 | Regents Of The University Of California, The | Synthesis of discodermolide and analogs |
| GB0101599D0 (en) * | 2001-01-22 | 2001-03-07 | Novartis Ag | Organic compounds |
-
2001
- 2001-08-02 MY MYPI20013637A patent/MY127609A/en unknown
- 2001-08-02 TW TW090118912A patent/TWI251591B/zh not_active IP Right Cessation
- 2001-08-03 PE PE2001000777A patent/PE20020263A1/es not_active Application Discontinuation
- 2001-08-03 AR ARP010103736A patent/AR032761A1/es active IP Right Grant
- 2001-08-06 CA CA002416769A patent/CA2416769C/en not_active Expired - Fee Related
- 2001-08-06 CN CNB018137679A patent/CN1293067C/zh not_active Expired - Fee Related
- 2001-08-06 EP EP01974118A patent/EP1309583B1/en not_active Expired - Lifetime
- 2001-08-06 SK SK156-2003A patent/SK1562003A3/sk unknown
- 2001-08-06 DE DE60120991T patent/DE60120991T2/de not_active Expired - Lifetime
- 2001-08-06 PT PT01974118T patent/PT1309583E/pt unknown
- 2001-08-06 ES ES01974118T patent/ES2266266T3/es not_active Expired - Lifetime
- 2001-08-06 RU RU2003105816/04A patent/RU2283309C2/ru not_active IP Right Cessation
- 2001-08-06 JP JP2002518197A patent/JP2004505963A/ja active Pending
- 2001-08-06 IL IL15410901A patent/IL154109A0/xx unknown
- 2001-08-06 CZ CZ20030330A patent/CZ300855B6/cs not_active IP Right Cessation
- 2001-08-06 BR BR0112876-0A patent/BR0112876A/pt not_active IP Right Cessation
- 2001-08-06 NZ NZ523999A patent/NZ523999A/en unknown
- 2001-08-06 KR KR1020037001704A patent/KR100796396B1/ko not_active Expired - Fee Related
- 2001-08-06 DK DK01974118T patent/DK1309583T3/da active
- 2001-08-06 WO PCT/EP2001/009068 patent/WO2002012220A2/en not_active Ceased
- 2001-08-06 AU AU2001293726A patent/AU2001293726B2/en not_active Ceased
- 2001-08-06 AT AT01974118T patent/ATE330948T1/de not_active IP Right Cessation
- 2001-08-06 MX MXPA03001192A patent/MXPA03001192A/es active IP Right Grant
- 2001-08-06 AU AU9372601A patent/AU9372601A/xx active Pending
- 2001-08-06 PL PL01358839A patent/PL358839A1/xx not_active Application Discontinuation
- 2001-08-06 HU HU0300742A patent/HUP0300742A3/hu unknown
-
2003
- 2003-01-22 ZA ZA200300590A patent/ZA200300590B/en unknown
- 2003-01-23 IL IL154109A patent/IL154109A/en not_active IP Right Cessation
- 2003-01-31 EC EC2003004459A patent/ECSP034459A/es unknown
- 2003-02-06 NO NO20030587A patent/NO328365B1/no not_active IP Right Cessation
-
2006
- 2006-09-07 CY CY20061101284T patent/CY1105338T1/el unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4939168A (en) * | 1989-08-11 | 1990-07-03 | Harbor Branch Oceanographics Institution, Inc. | Discodermolide compounds, compositions containing same and methods of preparation and use |
| RU2114101C1 (ru) * | 1993-01-29 | 1998-06-27 | Санкио Компани Лимитед | Эфирные производные гексагидронафталина, их получение и фармацевтическая композиция на их основе |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2283309C2 (ru) | Способ получения дискодермолида и его аналогов и промежуточные соединения | |
| US6506910B1 (en) | Process for preparing discodermolide and analogues thereof | |
| AU2001293726A1 (en) | Process for preparing discodermolide and analogues thereof | |
| RU2012555C1 (ru) | Способ получения оптически активного циклобутанона и производные циклобутанона | |
| HK1055962B (en) | Process for preparing discodermolide and analogues thereof | |
| EP0389244A1 (en) | Process for synthesis of FK-506 C10-C18 intermediates | |
| US4767853A (en) | Synthesis of 1-(allyloxycarbonyl)-methyl-3-(hydroxyethyl)-4-beta-naphthoxythiocarbonylthio-2-azetidinones and hydroxy protected analogs thereof | |
| US5053502A (en) | Anhydro penicillin derivatives | |
| US4948885A (en) | Synthesis of azetidinones | |
| JPH05229975A (ja) | シクロペンテノール誘導体 | |
| KR20020086852A (ko) | 알파-케톨 불포화지방산의 합성방법 | |
| Bagli et al. | Prostaglandin VIII—Synthesis of some 9-oxoprostynoic acids | |
| US5075438A (en) | Synthesis of azetidinones | |
| JPS60197662A (ja) | カ−バメ−ト及びその製法 | |
| JPH07238045A (ja) | フェニル置換ヒドロキシシクロペンテノン類及びその製造方法並びにフェニル置換ヒドロキシシクロペンタノンの製造方法 | |
| JPH0220616B2 (ru) | ||
| JPS6254789B2 (ru) | ||
| JPH06247957A (ja) | オクタヒドロナフトフラン化合物 | |
| JPH0662600B2 (ja) | プロスタサイクリン類の製造法 | |
| JPH0692886A (ja) | 6,7―二置換―2―ヒドロキシ―3―メチレンビシクロ[3.3.0]オクタン類の製造法 | |
| JPS63303956A (ja) | 3―メチレン―2,6,7―三置換ビシクロ[3.3.0]オクタン類 | |
| JPH0798796B2 (ja) | イソカルバサイクリン類の製造方法 | |
| JPH07242620A (ja) | ビタミンd3 誘導体及びその製造法 | |
| JPH0525089A (ja) | 2−ヒドロキシ酸誘導体の製造法 | |
| JPH0520417B2 (ru) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20100807 |