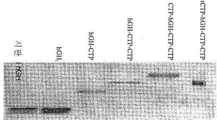
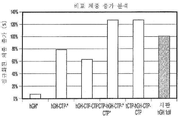
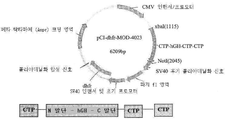
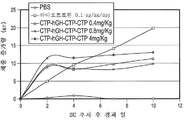
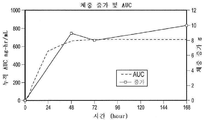
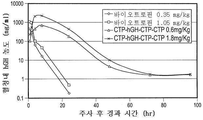
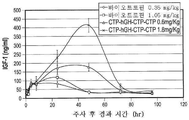
KR20190116526A - 장기 작용성 성장 호르몬 및 이의 제조 방법 - Google Patents
장기 작용성 성장 호르몬 및 이의 제조 방법 Download PDFInfo
- Publication number
- KR20190116526A KR20190116526A KR1020197028467A KR20197028467A KR20190116526A KR 20190116526 A KR20190116526 A KR 20190116526A KR 1020197028467 A KR1020197028467 A KR 1020197028467A KR 20197028467 A KR20197028467 A KR 20197028467A KR 20190116526 A KR20190116526 A KR 20190116526A
- Authority
- KR
- South Korea
- Prior art keywords
- ctp
- growth hormone
- another embodiment
- administered
- hgh
- Prior art date
Links
- 239000000122 growth hormone Substances 0.000 title claims abstract description 459
- 102000018997 Growth Hormone Human genes 0.000 title claims abstract description 458
- 108010051696 Growth Hormone Proteins 0.000 title claims abstract description 458
- 238000000034 method Methods 0.000 title claims abstract description 158
- 101800005309 Carboxy-terminal peptide Proteins 0.000 claims abstract description 375
- 108010062540 Chorionic Gonadotropin Proteins 0.000 claims abstract description 75
- 102000011022 Chorionic Gonadotropin Human genes 0.000 claims abstract description 72
- 229940015047 chorionic gonadotropin Drugs 0.000 claims abstract description 64
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims abstract description 55
- 241000282414 Homo sapiens Species 0.000 claims abstract description 49
- 230000001939 inductive effect Effects 0.000 claims abstract description 23
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 claims abstract description 16
- 102000013275 Somatomedins Human genes 0.000 claims abstract description 14
- 210000000577 adipose tissue Anatomy 0.000 claims abstract description 14
- 230000004580 weight loss Effects 0.000 claims abstract description 8
- 230000009467 reduction Effects 0.000 claims abstract description 4
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 179
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 170
- 229920001184 polypeptide Polymers 0.000 claims description 167
- 210000004899 c-terminal region Anatomy 0.000 claims description 53
- 230000012010 growth Effects 0.000 claims description 37
- 235000019786 weight gain Nutrition 0.000 claims description 32
- 230000004584 weight gain Effects 0.000 claims description 30
- 108010076504 Protein Sorting Signals Proteins 0.000 claims description 23
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 9
- 230000002829 reductive effect Effects 0.000 claims description 3
- 125000003275 alpha amino acid group Chemical group 0.000 claims 10
- 239000008194 pharmaceutical composition Substances 0.000 abstract description 44
- 108090000623 proteins and genes Proteins 0.000 abstract description 32
- 102000004169 proteins and genes Human genes 0.000 abstract description 27
- 108091033319 polynucleotide Proteins 0.000 abstract description 23
- 102000040430 polynucleotide Human genes 0.000 abstract description 23
- 239000002157 polynucleotide Substances 0.000 abstract description 23
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 abstract description 8
- 230000003247 decreasing effect Effects 0.000 abstract description 2
- 102000002265 Human Growth Hormone Human genes 0.000 description 149
- 108010000521 Human Growth Hormone Proteins 0.000 description 149
- 239000000854 Human Growth Hormone Substances 0.000 description 138
- 150000001413 amino acids Chemical group 0.000 description 84
- 241000700159 Rattus Species 0.000 description 71
- 239000000203 mixture Substances 0.000 description 60
- 239000007924 injection Substances 0.000 description 54
- 238000002347 injection Methods 0.000 description 54
- 101000599951 Homo sapiens Insulin-like growth factor I Proteins 0.000 description 47
- 102100037852 Insulin-like growth factor I Human genes 0.000 description 47
- 238000007920 subcutaneous administration Methods 0.000 description 46
- 238000011282 treatment Methods 0.000 description 35
- 210000004027 cell Anatomy 0.000 description 32
- 230000001965 increasing effect Effects 0.000 description 31
- 230000000694 effects Effects 0.000 description 28
- 230000001225 therapeutic effect Effects 0.000 description 24
- 108091028043 Nucleic acid sequence Proteins 0.000 description 23
- 238000009472 formulation Methods 0.000 description 23
- 108020004414 DNA Proteins 0.000 description 22
- 150000001875 compounds Chemical class 0.000 description 22
- 239000013604 expression vector Substances 0.000 description 22
- 238000001990 intravenous administration Methods 0.000 description 21
- 241001465754 Metazoa Species 0.000 description 20
- 238000004458 analytical method Methods 0.000 description 20
- 230000002950 deficient Effects 0.000 description 20
- 230000014509 gene expression Effects 0.000 description 20
- 238000001727 in vivo Methods 0.000 description 20
- 238000001802 infusion Methods 0.000 description 19
- 239000000243 solution Substances 0.000 description 19
- 206010062767 Hypophysitis Diseases 0.000 description 18
- 239000003814 drug Substances 0.000 description 18
- 238000002474 experimental method Methods 0.000 description 18
- 150000007523 nucleic acids Chemical class 0.000 description 18
- 210000003635 pituitary gland Anatomy 0.000 description 17
- 210000002966 serum Anatomy 0.000 description 16
- 239000013598 vector Substances 0.000 description 16
- 238000007918 intramuscular administration Methods 0.000 description 15
- 239000000047 product Substances 0.000 description 15
- RAUDKMVXNOWDLS-WDSKDSINSA-N Glu-Gly-Ser Chemical compound OC(=O)CC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O RAUDKMVXNOWDLS-WDSKDSINSA-N 0.000 description 14
- XZFYRXDAULDNFX-UHFFFAOYSA-N N-L-cysteinyl-L-phenylalanine Natural products SCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XZFYRXDAULDNFX-UHFFFAOYSA-N 0.000 description 14
- 229940079593 drug Drugs 0.000 description 14
- 239000012634 fragment Substances 0.000 description 14
- OQPAZKMGCWPERI-GUBZILKMSA-N Arg-Ser-Val Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O OQPAZKMGCWPERI-GUBZILKMSA-N 0.000 description 13
- 108010050848 glycylleucine Proteins 0.000 description 13
- 108010057821 leucylproline Proteins 0.000 description 13
- 210000003205 muscle Anatomy 0.000 description 13
- WDXYVIIVDIDOSX-DCAQKATOSA-N Ser-Arg-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)CCCN=C(N)N WDXYVIIVDIDOSX-DCAQKATOSA-N 0.000 description 12
- 239000004480 active ingredient Substances 0.000 description 12
- 230000004071 biological effect Effects 0.000 description 12
- 238000006243 chemical reaction Methods 0.000 description 12
- 108010031719 prolyl-serine Proteins 0.000 description 12
- 101100342977 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) leu-1 gene Proteins 0.000 description 11
- 230000001976 improved effect Effects 0.000 description 11
- 150000002632 lipids Chemical class 0.000 description 11
- 230000004048 modification Effects 0.000 description 11
- 238000012986 modification Methods 0.000 description 11
- 239000013612 plasmid Substances 0.000 description 11
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 10
- UILIPCLTHRPCRB-XUXIUFHCSA-N Leu-Arg-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)N UILIPCLTHRPCRB-XUXIUFHCSA-N 0.000 description 10
- OZPDGESCTGGNAD-CIUDSAMLSA-N Ser-Ser-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CO OZPDGESCTGGNAD-CIUDSAMLSA-N 0.000 description 10
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 238000010276 construction Methods 0.000 description 10
- 239000003937 drug carrier Substances 0.000 description 10
- 230000000670 limiting effect Effects 0.000 description 10
- 230000001817 pituitary effect Effects 0.000 description 10
- 229920001223 polyethylene glycol Polymers 0.000 description 10
- 239000003981 vehicle Substances 0.000 description 10
- DHBKYZYFEXXUAK-ONGXEEELSA-N Ala-Phe-Gly Chemical compound OC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=CC=C1 DHBKYZYFEXXUAK-ONGXEEELSA-N 0.000 description 9
- HBHMVBGGHDMPBF-GARJFASQSA-N Cys-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CS)N HBHMVBGGHDMPBF-GARJFASQSA-N 0.000 description 9
- YOBGUCWZPXJHTN-BQBZGAKWSA-N Gly-Ser-Arg Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CCCN=C(N)N YOBGUCWZPXJHTN-BQBZGAKWSA-N 0.000 description 9
- AUBMZAMQCOYSIC-MNXVOIDGSA-N Leu-Ile-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(O)=O AUBMZAMQCOYSIC-MNXVOIDGSA-N 0.000 description 9
- LXKNSJLSGPNHSK-KKUMJFAQSA-N Leu-Leu-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)O)N LXKNSJLSGPNHSK-KKUMJFAQSA-N 0.000 description 9
- SXOFUVGLPHCPRQ-KKUMJFAQSA-N Leu-Tyr-Cys Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CS)C(O)=O SXOFUVGLPHCPRQ-KKUMJFAQSA-N 0.000 description 9
- HUKLXYYPZWPXCC-KZVJFYERSA-N Met-Ala-Thr Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O HUKLXYYPZWPXCC-KZVJFYERSA-N 0.000 description 9
- 108010003201 RGH 0205 Proteins 0.000 description 9
- AHERARIZBPOMNU-KATARQTJSA-N Thr-Ser-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O AHERARIZBPOMNU-KATARQTJSA-N 0.000 description 9
- YVXIAOOYAKBAAI-SZMVWBNQSA-N Trp-Leu-Gln Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O)=CNC2=C1 YVXIAOOYAKBAAI-SZMVWBNQSA-N 0.000 description 9
- LMSBRIVOCYOKMU-NRPADANISA-N Val-Gln-Cys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CS)C(=O)O)N LMSBRIVOCYOKMU-NRPADANISA-N 0.000 description 9
- 108010052670 arginyl-glutamyl-glutamic acid Proteins 0.000 description 9
- 108010042598 glutamyl-aspartyl-glycine Proteins 0.000 description 9
- 108010082286 glycyl-seryl-alanine Proteins 0.000 description 9
- 108010076756 leucyl-alanyl-phenylalanine Proteins 0.000 description 9
- 238000004519 manufacturing process Methods 0.000 description 9
- -1 poly(ethylene glycol) Polymers 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 239000000725 suspension Substances 0.000 description 9
- 108010061238 threonyl-glycine Proteins 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- PXBFMLJZNCDSMP-UHFFFAOYSA-N 2-Aminobenzamide Chemical compound NC(=O)C1=CC=CC=C1N PXBFMLJZNCDSMP-UHFFFAOYSA-N 0.000 description 8
- 108091026890 Coding region Proteins 0.000 description 8
- CUXJIASLBRJOFV-LAEOZQHASA-N Glu-Gly-Ile Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(O)=O CUXJIASLBRJOFV-LAEOZQHASA-N 0.000 description 8
- OMNVOTCFQQLEQU-CIUDSAMLSA-N His-Asn-Asp Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N OMNVOTCFQQLEQU-CIUDSAMLSA-N 0.000 description 8
- XIRYQRLFHWWWTC-QEJZJMRPSA-N Leu-Ala-Phe Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 XIRYQRLFHWWWTC-QEJZJMRPSA-N 0.000 description 8
- FIDMVVBUOCMMJG-CIUDSAMLSA-N Ser-Asn-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CO FIDMVVBUOCMMJG-CIUDSAMLSA-N 0.000 description 8
- VQBCMLMPEWPUTB-ACZMJKKPSA-N Ser-Glu-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O VQBCMLMPEWPUTB-ACZMJKKPSA-N 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- VYEHBMMAJFVTOI-JHEQGTHGSA-N Thr-Gly-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(O)=O VYEHBMMAJFVTOI-JHEQGTHGSA-N 0.000 description 8
- CNLKDWSAORJEMW-KWQFWETISA-N Tyr-Gly-Ala Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(=O)N[C@@H](C)C(O)=O CNLKDWSAORJEMW-KWQFWETISA-N 0.000 description 8
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 8
- 108010040443 aspartyl-aspartic acid Proteins 0.000 description 8
- 230000037396 body weight Effects 0.000 description 8
- 230000001186 cumulative effect Effects 0.000 description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 8
- 239000002552 dosage form Substances 0.000 description 8
- 229940084986 human chorionic gonadotropin Drugs 0.000 description 8
- 238000000338 in vitro Methods 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- 210000004185 liver Anatomy 0.000 description 8
- 239000002609 medium Substances 0.000 description 8
- 238000011084 recovery Methods 0.000 description 8
- 239000003381 stabilizer Substances 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 208000024891 symptom Diseases 0.000 description 8
- 210000001519 tissue Anatomy 0.000 description 8
- LVCHEMOPBORRLB-DCAQKATOSA-N Glu-Gln-Lys Chemical compound NCCCC[C@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCC(O)=O)C(O)=O LVCHEMOPBORRLB-DCAQKATOSA-N 0.000 description 7
- 208000001132 Osteoporosis Diseases 0.000 description 7
- 238000012408 PCR amplification Methods 0.000 description 7
- 239000002202 Polyethylene glycol Substances 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 239000003995 emulsifying agent Substances 0.000 description 7
- 230000006872 improvement Effects 0.000 description 7
- 239000002502 liposome Substances 0.000 description 7
- 238000010369 molecular cloning Methods 0.000 description 7
- 102000039446 nucleic acids Human genes 0.000 description 7
- 108020004707 nucleic acids Proteins 0.000 description 7
- 230000008569 process Effects 0.000 description 7
- 230000014616 translation Effects 0.000 description 7
- OLVCTPPSXNRGKV-GUBZILKMSA-N Ala-Pro-Pro Chemical compound C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 OLVCTPPSXNRGKV-GUBZILKMSA-N 0.000 description 6
- YFWTXMRJJDNTLM-LSJOCFKGSA-N Arg-Ala-His Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N YFWTXMRJJDNTLM-LSJOCFKGSA-N 0.000 description 6
- WMEVEPXNCMKNGH-IHRRRGAJSA-N Arg-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N WMEVEPXNCMKNGH-IHRRRGAJSA-N 0.000 description 6
- 241000196324 Embryophyta Species 0.000 description 6
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- VZKBJNBZMZHKRC-XUXIUFHCSA-N Pro-Ile-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(O)=O VZKBJNBZMZHKRC-XUXIUFHCSA-N 0.000 description 6
- LNICFEXCAHIJOR-DCAQKATOSA-N Pro-Ser-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O LNICFEXCAHIJOR-DCAQKATOSA-N 0.000 description 6
- SNGZLPOXVRTNMB-LPEHRKFASA-N Pro-Ser-Pro Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CO)C(=O)N2CCC[C@@H]2C(=O)O SNGZLPOXVRTNMB-LPEHRKFASA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- YJCVECXVYHZOBK-KNZXXDILSA-N Thr-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H]([C@@H](C)O)N YJCVECXVYHZOBK-KNZXXDILSA-N 0.000 description 6
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 6
- 230000007423 decrease Effects 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 108010051242 phenylalanylserine Proteins 0.000 description 6
- 230000036470 plasma concentration Effects 0.000 description 6
- 108010077112 prolyl-proline Proteins 0.000 description 6
- 108010090894 prolylleucine Proteins 0.000 description 6
- 235000002639 sodium chloride Nutrition 0.000 description 6
- 235000000346 sugar Nutrition 0.000 description 6
- 239000000375 suspending agent Substances 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 208000016261 weight loss Diseases 0.000 description 6
- PNQWAUXQDBIJDY-GUBZILKMSA-N Arg-Glu-Glu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O PNQWAUXQDBIJDY-GUBZILKMSA-N 0.000 description 5
- NMRHDSAOIURTNT-RWMBFGLXSA-N Arg-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N NMRHDSAOIURTNT-RWMBFGLXSA-N 0.000 description 5
- MKJBPDLENBUHQU-CIUDSAMLSA-N Asn-Ser-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O MKJBPDLENBUHQU-CIUDSAMLSA-N 0.000 description 5
- UJGRZQYSNYTCAX-SRVKXCTJSA-N Asp-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(O)=O UJGRZQYSNYTCAX-SRVKXCTJSA-N 0.000 description 5
- UTLCRGFJFSZWAW-OLHMAJIHSA-N Asp-Thr-Asn Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC(=O)O)N)O UTLCRGFJFSZWAW-OLHMAJIHSA-N 0.000 description 5
- 101800001415 Bri23 peptide Proteins 0.000 description 5
- 101800000655 C-terminal peptide Proteins 0.000 description 5
- 102400000107 C-terminal peptide Human genes 0.000 description 5
- PQHYZJPCYRDYNE-QWRGUYRKSA-N Cys-Gly-Phe Chemical compound [H]N[C@@H](CS)C(=O)NCC(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O PQHYZJPCYRDYNE-QWRGUYRKSA-N 0.000 description 5
- 108010010803 Gelatin Proteins 0.000 description 5
- XZUUUKNKNWVPHQ-JYJNAYRXSA-N Gln-Phe-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(O)=O XZUUUKNKNWVPHQ-JYJNAYRXSA-N 0.000 description 5
- CGOHAEBMDSEKFB-FXQIFTODSA-N Glu-Glu-Ala Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O CGOHAEBMDSEKFB-FXQIFTODSA-N 0.000 description 5
- NNQDRRUXFJYCCJ-NHCYSSNCSA-N Glu-Pro-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(O)=O NNQDRRUXFJYCCJ-NHCYSSNCSA-N 0.000 description 5
- HAOUOFNNJJLVNS-BQBZGAKWSA-N Gly-Pro-Ser Chemical compound NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O HAOUOFNNJJLVNS-BQBZGAKWSA-N 0.000 description 5
- ABPRMMYHROQBLY-NKWVEPMBSA-N Gly-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)CN)C(=O)O ABPRMMYHROQBLY-NKWVEPMBSA-N 0.000 description 5
- 102000003886 Glycoproteins Human genes 0.000 description 5
- 108090000288 Glycoproteins Proteins 0.000 description 5
- 102000008100 Human Serum Albumin Human genes 0.000 description 5
- 108091006905 Human Serum Albumin Proteins 0.000 description 5
- HFBCHNRFRYLZNV-GUBZILKMSA-N Leu-Glu-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O HFBCHNRFRYLZNV-GUBZILKMSA-N 0.000 description 5
- IXHKPDJKKCUKHS-GARJFASQSA-N Lys-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCCN)N IXHKPDJKKCUKHS-GARJFASQSA-N 0.000 description 5
- IWWMPCPLFXFBAF-SRVKXCTJSA-N Lys-Asp-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O IWWMPCPLFXFBAF-SRVKXCTJSA-N 0.000 description 5
- YYRCPTVAPLQRNC-ULQDDVLXSA-N Phe-Arg-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](N)CC1=CC=CC=C1 YYRCPTVAPLQRNC-ULQDDVLXSA-N 0.000 description 5
- XZONQWUEBAFQPO-HJGDQZAQSA-N Pro-Gln-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XZONQWUEBAFQPO-HJGDQZAQSA-N 0.000 description 5
- FDMKYQQYJKYCLV-GUBZILKMSA-N Pro-Pro-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 FDMKYQQYJKYCLV-GUBZILKMSA-N 0.000 description 5
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 5
- IAORETPTUDBBGV-CIUDSAMLSA-N Ser-Leu-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CO)N IAORETPTUDBBGV-CIUDSAMLSA-N 0.000 description 5
- WGDYNRCOQRERLZ-KKUMJFAQSA-N Ser-Lys-Phe Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)N WGDYNRCOQRERLZ-KKUMJFAQSA-N 0.000 description 5
- JURQXQBJKUHGJS-UHFFFAOYSA-N Ser-Ser-Ser-Ser Chemical compound OCC(N)C(=O)NC(CO)C(=O)NC(CO)C(=O)NC(CO)C(O)=O JURQXQBJKUHGJS-UHFFFAOYSA-N 0.000 description 5
- FVFUOQIYDPAIJR-XIRDDKMYSA-N Ser-Trp-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)NC(=O)[C@H](CO)N FVFUOQIYDPAIJR-XIRDDKMYSA-N 0.000 description 5
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 5
- ZQUKYJOKQBRBCS-GLLZPBPUSA-N Thr-Gln-Gln Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N)O ZQUKYJOKQBRBCS-GLLZPBPUSA-N 0.000 description 5
- VTMGKRABARCZAX-OSUNSFLBSA-N Thr-Pro-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)[C@@H](C)O VTMGKRABARCZAX-OSUNSFLBSA-N 0.000 description 5
- KCPFDGNYAMKZQP-KBPBESRZSA-N Tyr-Gly-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(=O)N[C@@H](CC(C)C)C(O)=O KCPFDGNYAMKZQP-KBPBESRZSA-N 0.000 description 5
- OHOVFPKXPZODHS-SJWGOKEGSA-N Tyr-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CC=C(C=C2)O)N OHOVFPKXPZODHS-SJWGOKEGSA-N 0.000 description 5
- LJSZPMSUYKKKCP-UBHSHLNASA-N Val-Phe-Ala Chemical compound CC(C)[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C)C(O)=O)CC1=CC=CC=C1 LJSZPMSUYKKKCP-UBHSHLNASA-N 0.000 description 5
- 208000010399 Wasting Syndrome Diseases 0.000 description 5
- 238000010521 absorption reaction Methods 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 239000007864 aqueous solution Substances 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 5
- 239000002775 capsule Substances 0.000 description 5
- 230000015556 catabolic process Effects 0.000 description 5
- 229920002678 cellulose Polymers 0.000 description 5
- 239000001913 cellulose Substances 0.000 description 5
- 235000010980 cellulose Nutrition 0.000 description 5
- 239000007910 chewable tablet Substances 0.000 description 5
- 230000007812 deficiency Effects 0.000 description 5
- 238000006731 degradation reaction Methods 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 238000000605 extraction Methods 0.000 description 5
- 235000019197 fats Nutrition 0.000 description 5
- 239000008273 gelatin Substances 0.000 description 5
- 229920000159 gelatin Polymers 0.000 description 5
- 229940014259 gelatin Drugs 0.000 description 5
- 235000019322 gelatine Nutrition 0.000 description 5
- 235000011852 gelatine desserts Nutrition 0.000 description 5
- 238000001415 gene therapy Methods 0.000 description 5
- 108010034529 leucyl-lysine Proteins 0.000 description 5
- 230000004060 metabolic process Effects 0.000 description 5
- 150000002772 monosaccharides Chemical class 0.000 description 5
- 230000009753 muscle formation Effects 0.000 description 5
- 239000006186 oral dosage form Substances 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 239000003755 preservative agent Substances 0.000 description 5
- 230000002441 reversible effect Effects 0.000 description 5
- 230000002000 scavenging effect Effects 0.000 description 5
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 5
- 238000013519 translation Methods 0.000 description 5
- 108010015666 tryptophyl-leucyl-glutamic acid Proteins 0.000 description 5
- 239000013603 viral vector Substances 0.000 description 5
- BRPMXFSTKXXNHF-IUCAKERBSA-N (2s)-1-[2-[[(2s)-pyrrolidine-2-carbonyl]amino]acetyl]pyrrolidine-2-carboxylic acid Chemical compound OC(=O)[C@@H]1CCCN1C(=O)CNC(=O)[C@H]1NCCC1 BRPMXFSTKXXNHF-IUCAKERBSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 4
- ZPXCNXMJEZKRLU-LSJOCFKGSA-N Ala-His-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CN=CN1 ZPXCNXMJEZKRLU-LSJOCFKGSA-N 0.000 description 4
- XSTZMVAYYCJTNR-DCAQKATOSA-N Ala-Met-Leu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(C)C)C(O)=O XSTZMVAYYCJTNR-DCAQKATOSA-N 0.000 description 4
- OSRZOHXQCUFIQG-FPMFFAJLSA-N Ala-Phe-Pro Chemical compound C([C@H](NC(=O)[C@@H]([NH3+])C)C(=O)N1[C@H](CCC1)C([O-])=O)C1=CC=CC=C1 OSRZOHXQCUFIQG-FPMFFAJLSA-N 0.000 description 4
- NCQMBSJGJMYKCK-ZLUOBGJFSA-N Ala-Ser-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O NCQMBSJGJMYKCK-ZLUOBGJFSA-N 0.000 description 4
- GXXWTNKNFFKTJB-NAKRPEOUSA-N Arg-Ile-Ser Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O GXXWTNKNFFKTJB-NAKRPEOUSA-N 0.000 description 4
- MJINRRBEMOLJAK-DCAQKATOSA-N Arg-Lys-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCCN=C(N)N MJINRRBEMOLJAK-DCAQKATOSA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- YSYTWUMRHSFODC-QWRGUYRKSA-N Asn-Tyr-Gly Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(O)=O YSYTWUMRHSFODC-QWRGUYRKSA-N 0.000 description 4
- HBUJSDCLZCXXCW-YDHLFZDLSA-N Asn-Val-Tyr Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 HBUJSDCLZCXXCW-YDHLFZDLSA-N 0.000 description 4
- PBVLJOIPOGUQQP-CIUDSAMLSA-N Asp-Ala-Leu Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O PBVLJOIPOGUQQP-CIUDSAMLSA-N 0.000 description 4
- YNQIDCRRTWGHJD-ZLUOBGJFSA-N Asp-Asn-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CC(O)=O YNQIDCRRTWGHJD-ZLUOBGJFSA-N 0.000 description 4
- DWOGMPWRQQWPPF-GUBZILKMSA-N Asp-Leu-Glu Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O DWOGMPWRQQWPPF-GUBZILKMSA-N 0.000 description 4
- MYLZFUMPZCPJCJ-NHCYSSNCSA-N Asp-Lys-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O MYLZFUMPZCPJCJ-NHCYSSNCSA-N 0.000 description 4
- XXAMCEGRCZQGEM-ZLUOBGJFSA-N Asp-Ser-Asn Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O XXAMCEGRCZQGEM-ZLUOBGJFSA-N 0.000 description 4
- JDDYEZGPYBBPBN-JRQIVUDYSA-N Asp-Thr-Tyr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O JDDYEZGPYBBPBN-JRQIVUDYSA-N 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- 239000001856 Ethyl cellulose Substances 0.000 description 4
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 4
- CKNUKHBRCSMKMO-XHNCKOQMSA-N Gln-Asn-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)N)NC(=O)[C@H](CCC(=O)N)N)C(=O)O CKNUKHBRCSMKMO-XHNCKOQMSA-N 0.000 description 4
- MADFVRSKEIEZHZ-DCAQKATOSA-N Gln-Gln-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CCC(=O)N)N MADFVRSKEIEZHZ-DCAQKATOSA-N 0.000 description 4
- LFIVHGMKWFGUGK-IHRRRGAJSA-N Gln-Glu-Phe Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CCC(=O)N)N LFIVHGMKWFGUGK-IHRRRGAJSA-N 0.000 description 4
- NHMRJKKAVMENKJ-WDCWCFNPSA-N Gln-Thr-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O NHMRJKKAVMENKJ-WDCWCFNPSA-N 0.000 description 4
- ARYKRXHBIPLULY-XKBZYTNZSA-N Gln-Thr-Ser Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O ARYKRXHBIPLULY-XKBZYTNZSA-N 0.000 description 4
- XKPACHRGOWQHFH-IRIUXVKKSA-N Gln-Thr-Tyr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O XKPACHRGOWQHFH-IRIUXVKKSA-N 0.000 description 4
- KBKGRMNVKPSQIF-XDTLVQLUSA-N Glu-Ala-Tyr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O KBKGRMNVKPSQIF-XDTLVQLUSA-N 0.000 description 4
- DSPQRJXOIXHOHK-WDSKDSINSA-N Glu-Asp-Gly Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O DSPQRJXOIXHOHK-WDSKDSINSA-N 0.000 description 4
- PHONAZGUEGIOEM-GLLZPBPUSA-N Glu-Glu-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PHONAZGUEGIOEM-GLLZPBPUSA-N 0.000 description 4
- MWMJCGBSIORNCD-AVGNSLFASA-N Glu-Leu-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O MWMJCGBSIORNCD-AVGNSLFASA-N 0.000 description 4
- JDUKCSSHWNIQQZ-IHRRRGAJSA-N Glu-Phe-Glu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(O)=O)C(O)=O JDUKCSSHWNIQQZ-IHRRRGAJSA-N 0.000 description 4
- CQGBSALYGOXQPE-HTUGSXCWSA-N Glu-Thr-Phe Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CCC(=O)O)N)O CQGBSALYGOXQPE-HTUGSXCWSA-N 0.000 description 4
- OVSKVOOUFAKODB-UWVGGRQHSA-N Gly-Arg-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CCCN=C(N)N OVSKVOOUFAKODB-UWVGGRQHSA-N 0.000 description 4
- LBDXVCBAJJNJNN-WHFBIAKZSA-N Gly-Ser-Cys Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(O)=O LBDXVCBAJJNJNN-WHFBIAKZSA-N 0.000 description 4
- 101000659413 Homo sapiens Tricarboxylate transport protein, mitochondrial Proteins 0.000 description 4
- LRAUKBMYHHNADU-DKIMLUQUSA-N Ile-Phe-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)[C@@H](C)CC)CC1=CC=CC=C1 LRAUKBMYHHNADU-DKIMLUQUSA-N 0.000 description 4
- IVXJIMGDOYRLQU-XUXIUFHCSA-N Ile-Pro-Leu Chemical compound CC[C@H](C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(O)=O IVXJIMGDOYRLQU-XUXIUFHCSA-N 0.000 description 4
- NLZVTPYXYXMCIP-XUXIUFHCSA-N Ile-Pro-Lys Chemical compound CC[C@H](C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(O)=O NLZVTPYXYXMCIP-XUXIUFHCSA-N 0.000 description 4
- KTNGVMMGIQWIDV-OSUNSFLBSA-N Ile-Pro-Thr Chemical compound CC[C@H](C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(O)=O KTNGVMMGIQWIDV-OSUNSFLBSA-N 0.000 description 4
- PELCGFMHLZXWBQ-BJDJZHNGSA-N Ile-Ser-Leu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)O)N PELCGFMHLZXWBQ-BJDJZHNGSA-N 0.000 description 4
- SENJXOPIZNYLHU-UHFFFAOYSA-N L-leucyl-L-arginine Natural products CC(C)CC(N)C(=O)NC(C(O)=O)CCCN=C(N)N SENJXOPIZNYLHU-UHFFFAOYSA-N 0.000 description 4
- 241000880493 Leptailurus serval Species 0.000 description 4
- UCOCBWDBHCUPQP-DCAQKATOSA-N Leu-Arg-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O UCOCBWDBHCUPQP-DCAQKATOSA-N 0.000 description 4
- YORLGJINWYYIMX-KKUMJFAQSA-N Leu-Cys-Phe Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O YORLGJINWYYIMX-KKUMJFAQSA-N 0.000 description 4
- DLCXCECTCPKKCD-GUBZILKMSA-N Leu-Gln-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O DLCXCECTCPKKCD-GUBZILKMSA-N 0.000 description 4
- OGUUKPXUTHOIAV-SDDRHHMPSA-N Leu-Glu-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N1CCC[C@@H]1C(=O)O)N OGUUKPXUTHOIAV-SDDRHHMPSA-N 0.000 description 4
- BKTXKJMNTSMJDQ-AVGNSLFASA-N Leu-His-Gln Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N BKTXKJMNTSMJDQ-AVGNSLFASA-N 0.000 description 4
- DSFYPIUSAMSERP-IHRRRGAJSA-N Leu-Leu-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N DSFYPIUSAMSERP-IHRRRGAJSA-N 0.000 description 4
- WXUOJXIGOPMDJM-SRVKXCTJSA-N Leu-Lys-Asn Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(O)=O WXUOJXIGOPMDJM-SRVKXCTJSA-N 0.000 description 4
- XWEVVRRSIOBJOO-SRVKXCTJSA-N Leu-Pro-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(O)=O XWEVVRRSIOBJOO-SRVKXCTJSA-N 0.000 description 4
- UCBPDSYUVAAHCD-UWVGGRQHSA-N Leu-Pro-Gly Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O UCBPDSYUVAAHCD-UWVGGRQHSA-N 0.000 description 4
- CHJKEDSZNSONPS-DCAQKATOSA-N Leu-Pro-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O CHJKEDSZNSONPS-DCAQKATOSA-N 0.000 description 4
- TWPCWKVOZDUYAA-KKUMJFAQSA-N Lys-Phe-Asp Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O TWPCWKVOZDUYAA-KKUMJFAQSA-N 0.000 description 4
- WGBMNLCRYKSWAR-DCAQKATOSA-N Met-Asp-Lys Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN WGBMNLCRYKSWAR-DCAQKATOSA-N 0.000 description 4
- FYRUJIJAUPHUNB-IUCAKERBSA-N Met-Gly-Arg Chemical compound CSCC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCCNC(N)=N FYRUJIJAUPHUNB-IUCAKERBSA-N 0.000 description 4
- PZUUMQPMHBJJKE-AVGNSLFASA-N Met-Leu-Arg Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCCNC(N)=N PZUUMQPMHBJJKE-AVGNSLFASA-N 0.000 description 4
- KZNQNBZMBZJQJO-UHFFFAOYSA-N N-glycyl-L-proline Natural products NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 4
- WSXKXSBOJXEZDV-DLOVCJGASA-N Phe-Ala-Asn Chemical compound NC(=O)C[C@@H](C([O-])=O)NC(=O)[C@H](C)NC(=O)[C@@H]([NH3+])CC1=CC=CC=C1 WSXKXSBOJXEZDV-DLOVCJGASA-N 0.000 description 4
- WMGVYPPIMZPWPN-SRVKXCTJSA-N Phe-Asp-Asn Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC(=O)N)C(=O)O)N WMGVYPPIMZPWPN-SRVKXCTJSA-N 0.000 description 4
- MJAYDXWQQUOURZ-JYJNAYRXSA-N Phe-Lys-Gln Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(O)=O MJAYDXWQQUOURZ-JYJNAYRXSA-N 0.000 description 4
- XOHJOMKCRLHGCY-UNQGMJICSA-N Phe-Pro-Thr Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(O)=O XOHJOMKCRLHGCY-UNQGMJICSA-N 0.000 description 4
- SBVPYBFMIGDIDX-SRVKXCTJSA-N Pro-Pro-Pro Chemical compound OC(=O)[C@@H]1CCCN1C(=O)[C@H]1N(C(=O)[C@H]2NCCC2)CCC1 SBVPYBFMIGDIDX-SRVKXCTJSA-N 0.000 description 4
- GOMUXSCOIWIJFP-GUBZILKMSA-N Pro-Ser-Arg Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O GOMUXSCOIWIJFP-GUBZILKMSA-N 0.000 description 4
- OWQXAJQZLWHPBH-FXQIFTODSA-N Pro-Ser-Asn Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O OWQXAJQZLWHPBH-FXQIFTODSA-N 0.000 description 4
- GMJDSFYVTAMIBF-FXQIFTODSA-N Pro-Ser-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O GMJDSFYVTAMIBF-FXQIFTODSA-N 0.000 description 4
- AIOWVDNPESPXRB-YTWAJWBKSA-N Pro-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@@H]2CCCN2)O AIOWVDNPESPXRB-YTWAJWBKSA-N 0.000 description 4
- 108020004511 Recombinant DNA Proteins 0.000 description 4
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 4
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 4
- OBXVZEAMXFSGPU-FXQIFTODSA-N Ser-Asn-Arg Chemical compound C(C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CO)N)CN=C(N)N OBXVZEAMXFSGPU-FXQIFTODSA-N 0.000 description 4
- MMAPOBOTRUVNKJ-ZLUOBGJFSA-N Ser-Asp-Ser Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CO)N)C(=O)O MMAPOBOTRUVNKJ-ZLUOBGJFSA-N 0.000 description 4
- BTPAWKABYQMKKN-LKXGYXEUSA-N Ser-Asp-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O BTPAWKABYQMKKN-LKXGYXEUSA-N 0.000 description 4
- KCGIREHVWRXNDH-GARJFASQSA-N Ser-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CO)N KCGIREHVWRXNDH-GARJFASQSA-N 0.000 description 4
- IXZHZUGGKLRHJD-DCAQKATOSA-N Ser-Leu-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O IXZHZUGGKLRHJD-DCAQKATOSA-N 0.000 description 4
- UPLYXVPQLJVWMM-KKUMJFAQSA-N Ser-Phe-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(O)=O UPLYXVPQLJVWMM-KKUMJFAQSA-N 0.000 description 4
- NUEHQDHDLDXCRU-GUBZILKMSA-N Ser-Pro-Arg Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCN=C(N)N)C(O)=O NUEHQDHDLDXCRU-GUBZILKMSA-N 0.000 description 4
- 229920002472 Starch Polymers 0.000 description 4
- OJRNZRROAIAHDL-LKXGYXEUSA-N Thr-Asn-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O OJRNZRROAIAHDL-LKXGYXEUSA-N 0.000 description 4
- FIFDDJFLNVAVMS-RHYQMDGZSA-N Thr-Leu-Met Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(O)=O FIFDDJFLNVAVMS-RHYQMDGZSA-N 0.000 description 4
- KAJRRNHOVMZYBL-IRIUXVKKSA-N Thr-Tyr-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O KAJRRNHOVMZYBL-IRIUXVKKSA-N 0.000 description 4
- CYCGARJWIQWPQM-YJRXYDGGSA-N Thr-Tyr-Ser Chemical compound C[C@@H](O)[C@H]([NH3+])C(=O)N[C@H](C(=O)N[C@@H](CO)C([O-])=O)CC1=CC=C(O)C=C1 CYCGARJWIQWPQM-YJRXYDGGSA-N 0.000 description 4
- HRHYJNLMIJWGLF-BZSNNMDCSA-N Tyr-Ser-Phe Chemical compound C([C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=C(O)C=C1 HRHYJNLMIJWGLF-BZSNNMDCSA-N 0.000 description 4
- JXGWQYWDUOWQHA-DZKIICNBSA-N Val-Gln-Phe Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N JXGWQYWDUOWQHA-DZKIICNBSA-N 0.000 description 4
- XWYUBUYQMOUFRQ-IFFSRLJSSA-N Val-Glu-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](C(C)C)N)O XWYUBUYQMOUFRQ-IFFSRLJSSA-N 0.000 description 4
- VTIAEOKFUJJBTC-YDHLFZDLSA-N Val-Tyr-Asp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC(=O)O)C(=O)O)N VTIAEOKFUJJBTC-YDHLFZDLSA-N 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 4
- 239000002671 adjuvant Substances 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- 108010077245 asparaginyl-proline Proteins 0.000 description 4
- 230000027455 binding Effects 0.000 description 4
- 210000000988 bone and bone Anatomy 0.000 description 4
- 230000008468 bone growth Effects 0.000 description 4
- 150000001720 carbohydrates Chemical class 0.000 description 4
- 235000014633 carbohydrates Nutrition 0.000 description 4
- 239000001768 carboxy methyl cellulose Substances 0.000 description 4
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 4
- 238000003776 cleavage reaction Methods 0.000 description 4
- 239000013599 cloning vector Substances 0.000 description 4
- 238000013270 controlled release Methods 0.000 description 4
- 108010016616 cysteinylglycine Proteins 0.000 description 4
- 238000004520 electroporation Methods 0.000 description 4
- 230000008030 elimination Effects 0.000 description 4
- 238000003379 elimination reaction Methods 0.000 description 4
- 235000019325 ethyl cellulose Nutrition 0.000 description 4
- 229920001249 ethyl cellulose Polymers 0.000 description 4
- 229960004667 ethyl cellulose Drugs 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 108010055341 glutamyl-glutamic acid Proteins 0.000 description 4
- 235000011187 glycerol Nutrition 0.000 description 4
- 230000013595 glycosylation Effects 0.000 description 4
- 238000006206 glycosylation reaction Methods 0.000 description 4
- 108010077515 glycylproline Proteins 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 230000005847 immunogenicity Effects 0.000 description 4
- 108010044056 leucyl-phenylalanine Proteins 0.000 description 4
- 108010000761 leucylarginine Proteins 0.000 description 4
- 239000007937 lozenge Substances 0.000 description 4
- 108010009298 lysylglutamic acid Proteins 0.000 description 4
- 239000011159 matrix material Substances 0.000 description 4
- 108010005942 methionylglycine Proteins 0.000 description 4
- 239000011859 microparticle Substances 0.000 description 4
- 230000037257 muscle growth Effects 0.000 description 4
- 239000002105 nanoparticle Substances 0.000 description 4
- 230000003285 pharmacodynamic effect Effects 0.000 description 4
- 230000000144 pharmacologic effect Effects 0.000 description 4
- 108010012581 phenylalanylglutamate Proteins 0.000 description 4
- 108010053725 prolylvaline Proteins 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 230000007017 scission Effects 0.000 description 4
- 108010048818 seryl-histidine Proteins 0.000 description 4
- 108010026333 seryl-proline Proteins 0.000 description 4
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 235000019698 starch Nutrition 0.000 description 4
- 230000000638 stimulation Effects 0.000 description 4
- 238000010254 subcutaneous injection Methods 0.000 description 4
- 239000007929 subcutaneous injection Substances 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000003442 weekly effect Effects 0.000 description 4
- 208000030507 AIDS Diseases 0.000 description 3
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- 241000282693 Cercopithecidae Species 0.000 description 3
- 229920002261 Corn starch Polymers 0.000 description 3
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 3
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 3
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 3
- 238000008157 ELISA kit Methods 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- GGAPHLIUUTVYMX-QWRGUYRKSA-N Gly-Phe-Ser Chemical compound OC[C@@H](C([O-])=O)NC(=O)[C@@H](NC(=O)C[NH3+])CC1=CC=CC=C1 GGAPHLIUUTVYMX-QWRGUYRKSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 229920002907 Guar gum Polymers 0.000 description 3
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 3
- 241000282560 Macaca mulatta Species 0.000 description 3
- 229930195725 Mannitol Natural products 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- AZWNCEBQZXELEZ-FXQIFTODSA-N Ser-Pro-Ser Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O AZWNCEBQZXELEZ-FXQIFTODSA-N 0.000 description 3
- 229920002125 Sokalan® Polymers 0.000 description 3
- 235000021355 Stearic acid Nutrition 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- 241000723873 Tobacco mosaic virus Species 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 230000032683 aging Effects 0.000 description 3
- 235000010443 alginic acid Nutrition 0.000 description 3
- 239000000783 alginic acid Substances 0.000 description 3
- 229920000615 alginic acid Polymers 0.000 description 3
- 229960001126 alginic acid Drugs 0.000 description 3
- 150000004781 alginic acids Chemical class 0.000 description 3
- 239000003963 antioxidant agent Substances 0.000 description 3
- 235000006708 antioxidants Nutrition 0.000 description 3
- 235000021053 average weight gain Nutrition 0.000 description 3
- 210000001124 body fluid Anatomy 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 229960001631 carbomer Drugs 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 210000000349 chromosome Anatomy 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000003086 colorant Substances 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 239000002131 composite material Substances 0.000 description 3
- 239000008120 corn starch Substances 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 239000000665 guar gum Substances 0.000 description 3
- 235000010417 guar gum Nutrition 0.000 description 3
- 229960002154 guar gum Drugs 0.000 description 3
- 230000004217 heart function Effects 0.000 description 3
- 229940088597 hormone Drugs 0.000 description 3
- 239000005556 hormone Substances 0.000 description 3
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 3
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 3
- 229940071676 hydroxypropylcellulose Drugs 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Substances N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 3
- 238000001361 intraarterial administration Methods 0.000 description 3
- 238000001638 lipofection Methods 0.000 description 3
- 230000004130 lipolysis Effects 0.000 description 3
- 239000012669 liquid formulation Substances 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- 230000004199 lung function Effects 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 235000010355 mannitol Nutrition 0.000 description 3
- 239000000594 mannitol Substances 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 3
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 238000009521 phase II clinical trial Methods 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 229920005862 polyol Polymers 0.000 description 3
- 150000003077 polyols Chemical class 0.000 description 3
- 230000002035 prolonged effect Effects 0.000 description 3
- 230000036385 rapid eye movement (rem) sleep Effects 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000005070 sampling Methods 0.000 description 3
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 3
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000010532 solid phase synthesis reaction Methods 0.000 description 3
- 239000000600 sorbitol Substances 0.000 description 3
- 235000010356 sorbitol Nutrition 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 229940032147 starch Drugs 0.000 description 3
- 239000008117 stearic acid Substances 0.000 description 3
- 230000004936 stimulating effect Effects 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 238000001356 surgical procedure Methods 0.000 description 3
- 238000013268 sustained release Methods 0.000 description 3
- 239000012730 sustained-release form Substances 0.000 description 3
- 239000003765 sweetening agent Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 231100000331 toxic Toxicity 0.000 description 3
- 230000002588 toxic effect Effects 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- FBZGGPWZOUYLLV-IUKVLHSWSA-N (3s)-4-[[(2s)-4-amino-1-[[(1s)-1-carboxyethyl]amino]-1,4-dioxobutan-2-yl]amino]-3-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-amino-4-methylpentanoyl]amino]-3-hydroxypropanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-4-methylpentanoyl]amino]-3- Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(O)=O)CC1=CC=CC=C1 FBZGGPWZOUYLLV-IUKVLHSWSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- OYIFNHCXNCRBQI-UHFFFAOYSA-N 2-aminoadipic acid Chemical compound OC(=O)C(N)CCCC(O)=O OYIFNHCXNCRBQI-UHFFFAOYSA-N 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- PDIYGFYAMZZFCW-JIOCBJNQSA-N Asp-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC(=O)O)N)O PDIYGFYAMZZFCW-JIOCBJNQSA-N 0.000 description 2
- 108010011485 Aspartame Proteins 0.000 description 2
- 241000416162 Astragalus gummifer Species 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 206010006895 Cachexia Diseases 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 229920002785 Croscarmellose sodium Polymers 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 241001539473 Euphoria Species 0.000 description 2
- 206010015535 Euphoric mood Diseases 0.000 description 2
- HYPVLWGNBIYTNA-GUBZILKMSA-N Gln-Leu-Ala Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O HYPVLWGNBIYTNA-GUBZILKMSA-N 0.000 description 2
- JILRMFFFCHUUTJ-ACZMJKKPSA-N Gln-Ser-Ser Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O JILRMFFFCHUUTJ-ACZMJKKPSA-N 0.000 description 2
- 102000038461 Growth Hormone-Releasing Hormone Human genes 0.000 description 2
- 239000000095 Growth Hormone-Releasing Hormone Substances 0.000 description 2
- 206010056438 Growth hormone deficiency Diseases 0.000 description 2
- PMMMQRVUMVURGJ-XUXIUFHCSA-N Ile-Leu-Pro Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(O)=O PMMMQRVUMVURGJ-XUXIUFHCSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- NTYQUVLERIHPMU-HRCADAONSA-N Met-Phe-Pro Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N2CCC[C@@H]2C(=O)O)N NTYQUVLERIHPMU-HRCADAONSA-N 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 206010068871 Myotonic dystrophy Diseases 0.000 description 2
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 2
- 208000002193 Pain Diseases 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 2
- 208000020221 Short stature Diseases 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 101710142969 Somatoliberin Proteins 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 210000001789 adipocyte Anatomy 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 2
- 239000000605 aspartame Substances 0.000 description 2
- 235000010357 aspartame Nutrition 0.000 description 2
- 229960003438 aspartame Drugs 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000008366 buffered solution Substances 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 2
- 229940099112 cornstarch Drugs 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- FLKPEMZONWLCSK-UHFFFAOYSA-N diethyl phthalate Chemical compound CCOC(=O)C1=CC=CC=C1C(=O)OCC FLKPEMZONWLCSK-UHFFFAOYSA-N 0.000 description 2
- 239000007884 disintegrant Substances 0.000 description 2
- 239000002270 dispersing agent Substances 0.000 description 2
- 239000006196 drop Substances 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 238000013213 extrapolation Methods 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 238000000855 fermentation Methods 0.000 description 2
- 230000004151 fermentation Effects 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 238000010363 gene targeting Methods 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 125000005456 glyceride group Chemical group 0.000 description 2
- 238000009578 growth hormone therapy Methods 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 238000007689 inspection Methods 0.000 description 2
- 229940125396 insulin Drugs 0.000 description 2
- 230000010354 integration Effects 0.000 description 2
- 238000010255 intramuscular injection Methods 0.000 description 2
- 239000007927 intramuscular injection Substances 0.000 description 2
- 238000007914 intraventricular administration Methods 0.000 description 2
- 230000000366 juvenile effect Effects 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 230000036407 pain Effects 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 210000001322 periplasm Anatomy 0.000 description 2
- 229920001983 poloxamer Polymers 0.000 description 2
- 229920001987 poloxamine Polymers 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 229920001592 potato starch Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 108010015796 prolylisoleucine Proteins 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000003118 sandwich ELISA Methods 0.000 description 2
- 238000010187 selection method Methods 0.000 description 2
- 239000008159 sesame oil Substances 0.000 description 2
- 235000011803 sesame oil Nutrition 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 229960001866 silicon dioxide Drugs 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229940083542 sodium Drugs 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 230000000392 somatic effect Effects 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 238000003153 stable transfection Methods 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 238000011191 terminal modification Methods 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 2
- 229940033663 thimerosal Drugs 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 235000010487 tragacanth Nutrition 0.000 description 2
- 239000000196 tragacanth Substances 0.000 description 2
- 229940116362 tragacanth Drugs 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 238000003146 transient transfection Methods 0.000 description 2
- 150000003626 triacylglycerols Chemical class 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- SBQSMJWMEQRETE-HVYQYDHPSA-N (2r)-2-amino-3-[[(2r)-2-amino-2-carboxyethyl]disulfanyl]-4-oxopentanoic acid Chemical compound OC(=O)[C@@H](N)C(C(=O)C)SSC[C@H](N)C(O)=O SBQSMJWMEQRETE-HVYQYDHPSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- XOQABDOICLHPIS-UHFFFAOYSA-N 1-hydroxy-2,1-benzoxaborole Chemical compound C1=CC=C2B(O)OCC2=C1 XOQABDOICLHPIS-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- UOQHWNPVNXSDDO-UHFFFAOYSA-N 3-bromoimidazo[1,2-a]pyridine-6-carbonitrile Chemical compound C1=CC(C#N)=CN2C(Br)=CN=C21 UOQHWNPVNXSDDO-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-M 4-hydroxybenzoate Chemical compound OC1=CC=C(C([O-])=O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-M 0.000 description 1
- RMAWDDRDTRSZIR-ZLUOBGJFSA-N Ala-Ser-Asp Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O RMAWDDRDTRSZIR-ZLUOBGJFSA-N 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- UZSQXCMNUPKLCC-FJXKBIBVSA-N Arg-Thr-Gly Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O UZSQXCMNUPKLCC-FJXKBIBVSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- NAPNAGZWHQHZLG-ZLUOBGJFSA-N Asp-Asp-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CC(=O)O)N NAPNAGZWHQHZLG-ZLUOBGJFSA-N 0.000 description 1
- WWOYXVBGHAHQBG-FXQIFTODSA-N Asp-Met-Asp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(O)=O WWOYXVBGHAHQBG-FXQIFTODSA-N 0.000 description 1
- ZKAOJVJQGVUIIU-GUBZILKMSA-N Asp-Pro-Arg Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(O)=O ZKAOJVJQGVUIIU-GUBZILKMSA-N 0.000 description 1
- 241000701822 Bovine papillomavirus Species 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- 101100297347 Caenorhabditis elegans pgl-3 gene Proteins 0.000 description 1
- 101100408682 Caenorhabditis elegans pmt-2 gene Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 241000701489 Cauliflower mosaic virus Species 0.000 description 1
- 206010008723 Chondrodystrophy Diseases 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 208000013725 Chronic Kidney Disease-Mineral and Bone disease Diseases 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 206010056370 Congestive cardiomyopathy Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 201000010374 Down Syndrome Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 206010015150 Erythema Diseases 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 208000005050 Familial Hypophosphatemic Rickets Diseases 0.000 description 1
- 208000001640 Fibromyalgia Diseases 0.000 description 1
- 101800001586 Ghrelin Proteins 0.000 description 1
- 102400000442 Ghrelin-28 Human genes 0.000 description 1
- MWERYIXRDZDXOA-QEWYBTABSA-N Gln-Ile-Phe Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O MWERYIXRDZDXOA-QEWYBTABSA-N 0.000 description 1
- SJPMNHCEWPTRBR-BQBZGAKWSA-N Glu-Glu-Gly Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(O)=O SJPMNHCEWPTRBR-BQBZGAKWSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 1
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 1
- 206010053759 Growth retardation Diseases 0.000 description 1
- JBCLFWXMTIKCCB-UHFFFAOYSA-N H-Gly-Phe-OH Natural products NCC(=O)NC(C(O)=O)CC1=CC=CC=C1 JBCLFWXMTIKCCB-UHFFFAOYSA-N 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101001075374 Homo sapiens Gamma-glutamyl hydrolase Proteins 0.000 description 1
- 101000664737 Homo sapiens Somatotropin Proteins 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- LCWXJXMHJVIJFK-UHFFFAOYSA-N Hydroxylysine Natural products NCC(O)CC(N)CC(O)=O LCWXJXMHJVIJFK-UHFFFAOYSA-N 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 206010060378 Hyperinsulinaemia Diseases 0.000 description 1
- JRYQSFOFUFXPTB-RWRJDSDZSA-N Ile-Gln-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H]([C@@H](C)O)C(=O)O)N JRYQSFOFUFXPTB-RWRJDSDZSA-N 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 1
- ZGUNAGUHMKGQNY-ZETCQYMHSA-N L-alpha-phenylglycine zwitterion Chemical compound OC(=O)[C@@H](N)C1=CC=CC=C1 ZGUNAGUHMKGQNY-ZETCQYMHSA-N 0.000 description 1
- 150000008575 L-amino acids Chemical class 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- QVFGXCVIXXBFHO-AVGNSLFASA-N Leu-Glu-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O QVFGXCVIXXBFHO-AVGNSLFASA-N 0.000 description 1
- FLNPJLDPGMLWAU-UWVGGRQHSA-N Leu-Met-Gly Chemical compound OC(=O)CNC(=O)[C@H](CCSC)NC(=O)[C@@H](N)CC(C)C FLNPJLDPGMLWAU-UWVGGRQHSA-N 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 240000006240 Linum usitatissimum Species 0.000 description 1
- 235000004431 Linum usitatissimum Nutrition 0.000 description 1
- 206010024769 Local reaction Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- HEWWNLVEWBJBKA-WDCWCFNPSA-N Lys-Gln-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCCN HEWWNLVEWBJBKA-WDCWCFNPSA-N 0.000 description 1
- GRADYHMSAUIKPS-DCAQKATOSA-N Lys-Glu-Gln Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O GRADYHMSAUIKPS-DCAQKATOSA-N 0.000 description 1
- GHKXHCMRAUYLBS-CIUDSAMLSA-N Lys-Ser-Asn Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O GHKXHCMRAUYLBS-CIUDSAMLSA-N 0.000 description 1
- SQRLLZAQNOQCEG-KKUMJFAQSA-N Lys-Tyr-Ser Chemical compound NCCCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CO)C(O)=O)CC1=CC=C(O)C=C1 SQRLLZAQNOQCEG-KKUMJFAQSA-N 0.000 description 1
- UGCIQUYEJIEHKX-GVXVVHGQSA-N Lys-Val-Glu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O UGCIQUYEJIEHKX-GVXVVHGQSA-N 0.000 description 1
- 208000007466 Male Infertility Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 102000003792 Metallothionein Human genes 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- 208000029549 Muscle injury Diseases 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- NYWZBRWKDRMPAS-GRRZBWEESA-N N-acetyl-9-O-acetylneuraminic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)O[C@H]1[C@H](O)[C@H](O)COC(C)=O NYWZBRWKDRMPAS-GRRZBWEESA-N 0.000 description 1
- OVRNDRQMDRJTHS-KEWYIRBNSA-N N-acetyl-D-galactosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-KEWYIRBNSA-N 0.000 description 1
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 1
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 1
- SUHQNCLNRUAGOO-UHFFFAOYSA-N N-glycoloyl-neuraminic acid Natural products OCC(O)C(O)C(O)C(NC(=O)CO)C(O)CC(=O)C(O)=O SUHQNCLNRUAGOO-UHFFFAOYSA-N 0.000 description 1
- FDJKUWYYUZCUJX-UHFFFAOYSA-N N-glycolyl-beta-neuraminic acid Natural products OCC(O)C(O)C1OC(O)(C(O)=O)CC(O)C1NC(=O)CO FDJKUWYYUZCUJX-UHFFFAOYSA-N 0.000 description 1
- FDJKUWYYUZCUJX-KVNVFURPSA-N N-glycolylneuraminic acid Chemical compound OC[C@H](O)[C@H](O)[C@@H]1O[C@](O)(C(O)=O)C[C@H](O)[C@H]1NC(=O)CO FDJKUWYYUZCUJX-KVNVFURPSA-N 0.000 description 1
- 108010079364 N-glycylalanine Proteins 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 102000008763 Neurofilament Proteins Human genes 0.000 description 1
- 108010088373 Neurofilament Proteins Proteins 0.000 description 1
- 206010054107 Nodule Diseases 0.000 description 1
- 206010029748 Noonan syndrome Diseases 0.000 description 1
- BZQFBWGGLXLEPQ-UHFFFAOYSA-N O-phosphoryl-L-serine Natural products OC(=O)C(N)COP(O)(O)=O BZQFBWGGLXLEPQ-UHFFFAOYSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 206010033307 Overweight Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 108010043958 Peptoids Proteins 0.000 description 1
- SWZKMTDPQXLQRD-XVSYOHENSA-N Phe-Asp-Thr Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SWZKMTDPQXLQRD-XVSYOHENSA-N 0.000 description 1
- SXJGROGVINAYSH-AVGNSLFASA-N Phe-Gln-Asp Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N SXJGROGVINAYSH-AVGNSLFASA-N 0.000 description 1
- RSPUIENXSJYZQO-JYJNAYRXSA-N Phe-Leu-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC1=CC=CC=C1 RSPUIENXSJYZQO-JYJNAYRXSA-N 0.000 description 1
- BONHGTUEEPIMPM-AVGNSLFASA-N Phe-Ser-Glu Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(O)=O BONHGTUEEPIMPM-AVGNSLFASA-N 0.000 description 1
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 101710182846 Polyhedrin Proteins 0.000 description 1
- 229920000037 Polyproline Polymers 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- DIFXZGPHVCIVSQ-CIUDSAMLSA-N Pro-Gln-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O DIFXZGPHVCIVSQ-CIUDSAMLSA-N 0.000 description 1
- 102000003946 Prolactin Human genes 0.000 description 1
- 108010057464 Prolactin Proteins 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 108010003581 Ribulose-bisphosphate carboxylase Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- TYYBJUYSTWJHGO-ZKWXMUAHSA-N Ser-Asn-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O TYYBJUYSTWJHGO-ZKWXMUAHSA-N 0.000 description 1
- RJHJPZQOMKCSTP-CIUDSAMLSA-N Ser-His-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(N)=O)C(O)=O RJHJPZQOMKCSTP-CIUDSAMLSA-N 0.000 description 1
- MOINZPRHJGTCHZ-MMWGEVLESA-N Ser-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CO)N MOINZPRHJGTCHZ-MMWGEVLESA-N 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 206010049416 Short-bowel syndrome Diseases 0.000 description 1
- 206010072610 Skeletal dysplasia Diseases 0.000 description 1
- 102000005157 Somatostatin Human genes 0.000 description 1
- 108010056088 Somatostatin Proteins 0.000 description 1
- 201000010829 Spina bifida Diseases 0.000 description 1
- 208000006097 Spinal Dysraphism Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 240000006474 Theobroma bicolor Species 0.000 description 1
- KERCOYANYUPLHJ-XGEHTFHBSA-N Thr-Pro-Ser Chemical compound C[C@@H](O)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O KERCOYANYUPLHJ-XGEHTFHBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- DOOTYTYQINUNNV-UHFFFAOYSA-N Triethyl citrate Chemical compound CCOC(=O)CC(O)(C(=O)OCC)CC(=O)OCC DOOTYTYQINUNNV-UHFFFAOYSA-N 0.000 description 1
- IYHNBRUWVBIVJR-IHRRRGAJSA-N Tyr-Gln-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 IYHNBRUWVBIVJR-IHRRRGAJSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- ZEVNVXYRZRIRCH-GVXVVHGQSA-N Val-Gln-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCCCN)C(=O)O)N ZEVNVXYRZRIRCH-GVXVVHGQSA-N 0.000 description 1
- GUIYPEKUEMQBIK-JSGCOSHPSA-N Val-Tyr-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](Cc1ccc(O)cc1)C(=O)NCC(O)=O GUIYPEKUEMQBIK-JSGCOSHPSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 239000005862 Whey Substances 0.000 description 1
- 102000007544 Whey Proteins Human genes 0.000 description 1
- 108010046377 Whey Proteins Proteins 0.000 description 1
- 208000031878 X-linked hypophosphatemia Diseases 0.000 description 1
- 208000035724 X-linked hypophosphatemic rickets Diseases 0.000 description 1
- KBGAYAKRZNYFFG-BOHATCBPSA-N aceneuramic acid Chemical compound OC(=O)C(=O)C[C@H](O)[C@@H](NC(=O)C)[C@@H](O)[C@H](O)[C@H](O)CO KBGAYAKRZNYFFG-BOHATCBPSA-N 0.000 description 1
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 1
- 208000008919 achondroplasia Diseases 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 108010070783 alanyltyrosine Proteins 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 238000003277 amino acid sequence analysis Methods 0.000 description 1
- 230000001195 anabolic effect Effects 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 239000003945 anionic surfactant Substances 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 108010092854 aspartyllysine Proteins 0.000 description 1
- 230000037147 athletic performance Effects 0.000 description 1
- 238000013475 authorization Methods 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- OGBUMNBNEWYMNJ-UHFFFAOYSA-N batilol Chemical class CCCCCCCCCCCCCCCCCCOCC(O)CO OGBUMNBNEWYMNJ-UHFFFAOYSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000003833 bile salt Substances 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 238000002306 biochemical method Methods 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 238000010241 blood sampling Methods 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- 229940043253 butylated hydroxyanisole Drugs 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 230000023852 carbohydrate metabolic process Effects 0.000 description 1
- 235000021256 carbohydrate metabolism Nutrition 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 230000001925 catabolic effect Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 208000020832 chronic kidney disease Diseases 0.000 description 1
- 208000022831 chronic renal failure syndrome Diseases 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 239000013065 commercial product Substances 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229960005168 croscarmellose Drugs 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 229960000913 crospovidone Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 239000001767 crosslinked sodium carboxy methyl cellulose Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- 239000007857 degradation product Substances 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 108010005905 delta-hGHR Proteins 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 229950006137 dexfosfoserine Drugs 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 201000011304 dilated cardiomyopathy 1A Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 229940079360 enema for constipation Drugs 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 231100000321 erythema Toxicity 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- 210000003617 erythrocyte membrane Anatomy 0.000 description 1
- HQPMKSGTIOYHJT-UHFFFAOYSA-N ethane-1,2-diol;propane-1,2-diol Chemical compound OCCO.CC(O)CO HQPMKSGTIOYHJT-UHFFFAOYSA-N 0.000 description 1
- 235000010944 ethyl methyl cellulose Nutrition 0.000 description 1
- 239000001761 ethyl methyl cellulose Substances 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 238000013265 extended release Methods 0.000 description 1
- 239000010685 fatty oil Substances 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 239000008369 fruit flavor Substances 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- BGHSOEHUOOAYMY-JTZMCQEISA-N ghrelin Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)CN)C1=CC=CC=C1 BGHSOEHUOOAYMY-JTZMCQEISA-N 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 230000009229 glucose formation Effects 0.000 description 1
- 230000004190 glucose uptake Effects 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 1
- 230000009643 growth defect Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 231100000001 growth retardation Toxicity 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 235000020256 human milk Nutrition 0.000 description 1
- 210000004251 human milk Anatomy 0.000 description 1
- 238000006698 hydrazinolysis reaction Methods 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- QJHBJHUKURJDLG-UHFFFAOYSA-N hydroxy-L-lysine Natural products NCCCCC(NO)C(O)=O QJHBJHUKURJDLG-UHFFFAOYSA-N 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 230000003451 hyperinsulinaemic effect Effects 0.000 description 1
- 201000008980 hyperinsulinism Diseases 0.000 description 1
- 201000010072 hypochondroplasia Diseases 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 210000001822 immobilized cell Anatomy 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000003914 insulin secretion Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- LWYXLXAMDLNBFQ-UHFFFAOYSA-N iso-6-Carnavalin Natural products CC(O)CCCCCCCCCCC1CCC(O)C(C)N1 LWYXLXAMDLNBFQ-UHFFFAOYSA-N 0.000 description 1
- RGXCTRIQQODGIZ-UHFFFAOYSA-O isodesmosine Chemical compound OC(=O)C(N)CCCC[N+]1=CC(CCC(N)C(O)=O)=CC(CCC(N)C(O)=O)=C1CCCC(N)C(O)=O RGXCTRIQQODGIZ-UHFFFAOYSA-O 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 229940099563 lactobionic acid Drugs 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 239000002960 lipid emulsion Substances 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 239000003589 local anesthetic agent Substances 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 238000012792 lyophilization process Methods 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000005360 mashing Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 238000000120 microwave digestion Methods 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000003595 mist Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 230000021332 multicellular organism growth Effects 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 210000005044 neurofilament Anatomy 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 229940063149 nutropin Drugs 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000008012 organic excipient Substances 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 238000004816 paper chromatography Methods 0.000 description 1
- 235000016236 parenteral nutrition Nutrition 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- 239000007967 peppermint flavor Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 239000000816 peptidomimetic Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 238000011170 pharmaceutical development Methods 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- BZQFBWGGLXLEPQ-REOHCLBHSA-N phosphoserine Chemical compound OC(=O)[C@@H](N)COP(O)(O)=O BZQFBWGGLXLEPQ-REOHCLBHSA-N 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229960000502 poloxamer Drugs 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 108010026466 polyproline Proteins 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 1
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 229940116317 potato starch Drugs 0.000 description 1
- 229940069328 povidone Drugs 0.000 description 1
- 231100001271 preclinical toxicology Toxicity 0.000 description 1
- 238000002953 preparative HPLC Methods 0.000 description 1
- 239000000955 prescription drug Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 229940097325 prolactin Drugs 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 239000003223 protective agent Substances 0.000 description 1
- 238000012514 protein characterization Methods 0.000 description 1
- 230000022558 protein metabolic process Effects 0.000 description 1
- 230000006318 protein oxidation Effects 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 239000002510 pyrogen Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 230000002787 reinforcement Effects 0.000 description 1
- 201000006409 renal osteodystrophy Diseases 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 238000010517 secondary reaction Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 239000013605 shuttle vector Substances 0.000 description 1
- 238000012524 sialic acid analysis Methods 0.000 description 1
- 210000002363 skeletal muscle cell Anatomy 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000012475 sodium chloride buffer Substances 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- NHXLMOGPVYXJNR-ATOGVRKGSA-N somatostatin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CSSC[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N1)[C@@H](C)O)NC(=O)CNC(=O)[C@H](C)N)C(O)=O)=O)[C@H](O)C)C1=CC=CC=C1 NHXLMOGPVYXJNR-ATOGVRKGSA-N 0.000 description 1
- 229960000553 somatostatin Drugs 0.000 description 1
- 229960004532 somatropin Drugs 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008227 sterile water for injection Substances 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000005728 strengthening Methods 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000002511 suppository base Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000007939 sustained release tablet Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 238000012385 systemic delivery Methods 0.000 description 1
- 239000008399 tap water Substances 0.000 description 1
- 235000020679 tap water Nutrition 0.000 description 1
- UEUXEKPTXMALOB-UHFFFAOYSA-J tetrasodium;2-[2-[bis(carboxylatomethyl)amino]ethyl-(carboxylatomethyl)amino]acetate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]C(=O)CN(CC([O-])=O)CCN(CC([O-])=O)CC([O-])=O UEUXEKPTXMALOB-UHFFFAOYSA-J 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 238000012384 transportation and delivery Methods 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 239000001069 triethyl citrate Substances 0.000 description 1
- VMYFZRTXGLUXMZ-UHFFFAOYSA-N triethyl citrate Natural products CCOC(=O)C(O)(C(=O)OCC)C(=O)OCC VMYFZRTXGLUXMZ-UHFFFAOYSA-N 0.000 description 1
- 235000013769 triethyl citrate Nutrition 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- 239000004034 viscosity adjusting agent Substances 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 229920003169 water-soluble polymer Polymers 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/505—Erythropoietin [EPO]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/27—Growth hormone [GH], i.e. somatotropin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/59—Follicle-stimulating hormone [FSH]; Chorionic gonadotropins, e.g.hCG [human chorionic gonadotropin]; Luteinising hormone [LH]; Thyroid-stimulating hormone [TSH]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/24—Follicle-stimulating hormone [FSH]; Chorionic gonadotropins, e.g. HCG; Luteinising hormone [LH]; Thyroid-stimulating hormone [TSH]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Endocrinology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Molecular Biology (AREA)
- Toxicology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Reproductive Health (AREA)
- Child & Adolescent Psychology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명에서는, 체중 감소 또는 체지방 감소를 유도하는 방법, 인슐린 유사 성장 인자 (IGF-1)의 수준을 높이는 방법, 및 인간 개체에서 성장 호르몬의 투여 빈도를 낮추는 방법에 있어서의, 융모막성 고나도트로핀의 카르복시-말단 펩타이드 (CTP) 하나와 융모막성 고나도트로핀 CTP 2개가 아미노 말단과 카르복시 말단에 각각 부착된 성장 호르몬을 포함하는, 성장 호르몬 단백질 및 이를 코딩하는 폴리뉴클레오티드의 용도가 개시된다. 또한, 성장 호르몬 및 본 발명의 성장 호르몬을 코딩하는 폴리뉴클레오티드를 포함하는 약학 조성물, 및 이를 이용하는 방법이 개시된다.
Description
관련 출원에 대한 교차-참조
본 출원은 2011년 8월 2일자로 출원된 미국 출원번호 제 13/195,931호에 대해 우선권을 주장하며, 미국 출원번호 제 13/195,931호는 2009년 7월 24일자 미국 출원번호 12/509,188호에 대한 일부 계속 출원이며, 미국 출원번호 12/509,188호는 2009년 6월 2일자 미국 출원번호 12/476,916호의 일부 계속 출원이며, 미국 출원번호 12/476,916호는 2009년 3월 11일자 미국 출원번호 제 12/401,746호의 일부 계속 출원이며, 미국 출원번호 제 12/401,746호는 2007년 2월 1일자 미국 출원번호 제 11/700,911호의 일부 계속 출원이며, 미국 출원번호 제 11/700,911호는 2006년 2월 3일자 미국 가출원번호 제 60/764,761호를 우선권하는 출원이다. 이들 출원들은 그 전체가 원용에 의해 본 명세서에 포함된다.
본 명세서에서는, 체중 감소 또는 체지방 감소를 유도하는 방법, 인슐린 유사 성장 인자 (IGF-1)의 수준을 높이는 방법, 및 인간 개체에서 성장 호르몬의 투여 빈도를 낮추는 방법에 있어서의, 융모막성 고나도트로핀의 카르복시-말단 펩타이드 (CTP) 하나와 융모막성 고나도트로핀 CTP 2개가 아미노 말단과 카르복시 말단에 각각 부착된 성장 호르몬을 포함하는, 성장 호르몬 단백질 및 이를 코딩하는 폴리뉴클레오티드의 용도가 개시된다. 또한, 성장 호르몬 및 본 발명의 성장 호르몬을 코딩하는 폴리뉴클레오티드를 포함하는 약학 조성물, 및 이를 이용하는 방법이 개시된다.
폴리펩타이드는 혈액, 간 또는 신장에서 변성되거나 또는 효소적으로 분해되기 쉽다. 즉, 폴리펩타이드는 전형적으로 수 시간의 짧은 순환성 반감기를 가진다. 펩타이드 약물은, 이의 낮은 안정성으로 인해, 통상적으로 활성 펩타이드의 유효한 혈장 농도를 유지하기 위해서는 지속적인 빈도로 전달된다. 아울러, 펩타이드 약물들은 통상적으로 주입(infusion)에 의해 투여되기 때문에, 잦은 펩타이드 약물의 주입은 개체에게 상당한 불편함을 준다. 따라서, 치료 폴리펩타이드의 높은 약리학적 효능을 유지하면서도 반감기를 연장시킬 수 있는 기법들이 요구되고 있다. 또한, 이러한 바람직한 펩타이드는 혈청 안정성 강화, 고 활성 및 개체에 주입시 바람직하지 못한 면역 반응의 낮은 유발 가능성 등의 요건을 충족시켜야 한다.
짧은 혈청 반감기와 같은 비우호적인 약동학적 특성은 다수의 유망한 후보 약물들을 약학적으로 개발하는데 방해가 될 수 있다. 혈청 반감기는 분자의 실험적인 특징이므로, 각각의 새로운 잠재적인 약물에 대해 실험을 통해 평가하여야 한다. 예컨대, 저분자량의 폴리펩타이드 약물의 경우, 신장 여과와 같은 생리적인 소거 기전이, 필요한 투약 요법의 비용 또는 빈도로 인해, 약물을 치료학적 수준으로 유지하기 어렵게 만들 수 있다. 반대로, 약물 또는 이의 대사산물이 독성 부작용을 가진 경우, 긴 혈청 반감기도 부적절하다.
일 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를, 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 체중 감소 또는 체지방 감소가 유도되는, 인간 개체에서 체중 감소 또는 체지방 감소를 유도하는 방법을 제공한다.
다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를, 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 IGF-1 수준이 증가되는, 인간 개체에서 인슐린 유사 성장 인자 (IGF-1) 수준을 높이는 방법을 제공한다.
일 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 정상적인 치료학적 범위로 IGF-1이 유지되는, 개체에서 정상 치료학적 범위로 인슐린 유사 성장 인자 (IGF-1)를 유지하는 방법을 제공한다.
다른 구현예에서, 본 발명은, 성장 호르몬의 아미노 말단에 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나와 성장 호르몬의 카르복시 말단에 융모막성 고나도트로핀 CTP 2개를 부착하는 단계를 포함하며, 이로써 성장 호르몬의 투여 빈도가 감소되는, 인간 개체에서 성장 호르몬의 투여 빈도를 낮추는 방법을 제공한다.
일 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 성장 또는 체중 증가가 유도되는, 상기 개체가 어린이 또는 청소년인, 인간 개체에서 성장 또는 체중 증가를 유도하는 방법을 제공한다.
도 1은 hGH (서열번호 5), hGH-CTP (서열번호 9), hGH-CTP-CTP (서열번호 10), CTP-hGH-CTP-CTP (서열번호 11) 및 tCTP-hGH-CTP-CTP (서열번호 12)의 분자량 & 실체를 예시한 웨스턴 블롯이다. PAGE SDS 겔을 블롯팅하고, 항-hGH 단일클론 항체로 염색하였다. 사진은, 시판되는 야생형 hGH와 마찬가지로, CTP-변형된 hGH 변이체들이 항-hGH 항체에 의해 인지됨을 보여준다.
도 2는 본 발명의 GH-CTP 폴리펩타이드 (여러가지 MOD)를 투여한 후 뇌하수체 적출된 랫이 체중 증가됨을 예시한 막대 그래프이다.
도 3은 (1) CTP-hGH-CTP-CTP pCI-dhfr 플라스미드 지도와 (2) CTP-hGH-CTP-CTP의 단백질 구조식이다.
도 4는 랫에 CTP-hGH-CTP-CTP 또는 GH를 1회 i.v. 또는 s.c. 투여한 후, CTP-hGH-CTP-CTP 또는 GH의 혈장내 평균 농도 (pg/ml)를 나타낸 그래프이다 (n=3-6/투여/경로).
도 5는 뇌하수체 적출된 랫에 CTP-hGH-CTP-CTP (0.4, 0.8 및 4 mg/Kg)를 1회 s.c. 투여한 후, 평균 체중 증가를 매일 GH 주사 (0.1 mg/Kg/Day)와 비교하여 나타낸 그래프이다 (n=10 / 투여).
도 6은 CTP-hGH-CTP-CTP를 1회 주사한 이후의 곡선 하 면적이 랫에서의 체중 증가와 관련있음을 보여주는 그래프이다.
도 7은 뇌하수체 적출된 랫에 CTP-hGH-CTP-CTP (0.4, 0.8 및 4 mg/Kg)를 4일 간격으로 s.c. 투여한 후 체중 증가를 매일 GH 주사 (0.1 mg/Kg/Day)와 비교하여 나타낸 그래프이다 (n=10 / 투여).
도 8은 CTP-hGH-CTP-CTP와 시판 hGH를 SC 주사한 후 뇌하수체 적출된 랫에서의 hGH 혈청 농도를 나타낸 그래프이다. PK/PD 프로파일을 구하기 위해, CTP-hGH-CTP-CTP를 0.6 또는 1.8 mg/Kg로, 바이오트로핀을 0.35 또는 1.05 mg/Kg로 뇌하수체 적출된 랫에 1회 피하 투여하였다. 주사 후 혈청 hGH를 특수 ELISA 키트를 이용하여 측정하였다.
도 9는 CTP-hGH-CTP-CTP 및 시판 hGH를 SC 주사한 후 뇌하수체 적출된 랫에서의 IGF-1 혈청 농도를 나타낸 그래프이다. PK/PD 프로파일을 구하기 위해, CTP-hGH-CTP-CTP를 0.6 또는 1.8 mg/Kg로, 바이오트로핀을 0.35 또는 1.05 mg/Kg로 뇌하수체 적출된 랫에 1회 피하 투여하였다. 주사 후 혈청 IGF-1를 특수 ELISA 키트 (Roche Diagnostics)를 이용하여 측정하였다.
도 2는 본 발명의 GH-CTP 폴리펩타이드 (여러가지 MOD)를 투여한 후 뇌하수체 적출된 랫이 체중 증가됨을 예시한 막대 그래프이다.
도 3은 (1) CTP-hGH-CTP-CTP pCI-dhfr 플라스미드 지도와 (2) CTP-hGH-CTP-CTP의 단백질 구조식이다.
도 4는 랫에 CTP-hGH-CTP-CTP 또는 GH를 1회 i.v. 또는 s.c. 투여한 후, CTP-hGH-CTP-CTP 또는 GH의 혈장내 평균 농도 (pg/ml)를 나타낸 그래프이다 (n=3-6/투여/경로).
도 5는 뇌하수체 적출된 랫에 CTP-hGH-CTP-CTP (0.4, 0.8 및 4 mg/Kg)를 1회 s.c. 투여한 후, 평균 체중 증가를 매일 GH 주사 (0.1 mg/Kg/Day)와 비교하여 나타낸 그래프이다 (n=10 / 투여).
도 6은 CTP-hGH-CTP-CTP를 1회 주사한 이후의 곡선 하 면적이 랫에서의 체중 증가와 관련있음을 보여주는 그래프이다.
도 7은 뇌하수체 적출된 랫에 CTP-hGH-CTP-CTP (0.4, 0.8 및 4 mg/Kg)를 4일 간격으로 s.c. 투여한 후 체중 증가를 매일 GH 주사 (0.1 mg/Kg/Day)와 비교하여 나타낸 그래프이다 (n=10 / 투여).
도 8은 CTP-hGH-CTP-CTP와 시판 hGH를 SC 주사한 후 뇌하수체 적출된 랫에서의 hGH 혈청 농도를 나타낸 그래프이다. PK/PD 프로파일을 구하기 위해, CTP-hGH-CTP-CTP를 0.6 또는 1.8 mg/Kg로, 바이오트로핀을 0.35 또는 1.05 mg/Kg로 뇌하수체 적출된 랫에 1회 피하 투여하였다. 주사 후 혈청 hGH를 특수 ELISA 키트를 이용하여 측정하였다.
도 9는 CTP-hGH-CTP-CTP 및 시판 hGH를 SC 주사한 후 뇌하수체 적출된 랫에서의 IGF-1 혈청 농도를 나타낸 그래프이다. PK/PD 프로파일을 구하기 위해, CTP-hGH-CTP-CTP를 0.6 또는 1.8 mg/Kg로, 바이오트로핀을 0.35 또는 1.05 mg/Kg로 뇌하수체 적출된 랫에 1회 피하 투여하였다. 주사 후 혈청 IGF-1를 특수 ELISA 키트 (Roche Diagnostics)를 이용하여 측정하였다.
일 구현예에서, 본 발명은 장기 작용성 성장 호르몬 및 이의 제조 및 이용 방법을 제공한다. 다른 구현예에서, 장기 작용성 성장 호르몬은 카르복시 말단 펩타이드 (CTP, 또한 CTP 유닛으로도 지칭됨)를 포함한다. 다른 구현예에서, 장기 작용성 폴리펩타이드는 인간 융모막성 고나도트로핀 (hCG)의 카르복시 말단 펩타이드 (CTP)를 포함한다. 다른 구현예에서, CTP는 대상 성장 호르몬 또는 폴리펩타이드를 분해로부터 보호하는 보호제로서 작용한다. 다른 구현예에서, CTP는 대상 성장 호르몬 또는 폴리펩타이드의 Cmax를 증가시킨다. 다른 구현예에서, CTP는 대상 성장 호르몬 또는 폴리펩타이드의 Tmax를 증가시킨다. 다른 구현예에서, CTP는 대상 성장 호르몬 또는 폴리펩타이드의 순환성 반감기를 연장시킨다. 일부 구현예들에서, CTP는 대상 성장 호르몬 또는 폴리펩타이드의 효능을 강화한다.
다른 구현예들에서, 아미노 말단에 부착된 1개의 CTP와 카르복시 말단에 탠덤으로 부착된 2개의 CTP 펩타이드를 포함하는, 본 발명의 대상인 조작된 성장 호르몬 또는 폴리펩타이드는, 생물 활성 측면에서, 대상의 CTP로 비-변형된 성장 호르몬 또는 폴리펩타이드와 적어도 등가이다. 다른 구현예들에서, 아미노 말단에 부착된 1개의 CTP와 카르복시 말단에 탠덤으로 부착된 2개의 CTP 펩타이드를 포함하는 본 발명의 대상인 조작된 성장 호르몬 또는 폴리펩타이드는, 약동학 및 약력학 등의 약리학적 특성 측면에서, 대상의 CTP로 비-변형된 성장 호르몬 또는 폴리펩타이드와 적어도 등가이다.
다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 하나 이상의 CTP 펩타이드 및 성장 호르몬의 카르복시 말단에 부착된 2 이상의 융모막성 고나도트로핀 카르복시 말단 펩타이드를 포함하는 폴리펩타이드를 제공한다. 다른 구현예에서, 본 발명은 성장 호르몬의 아미노 말단에 부착된 1개의 융모막성 고나도트로핀 카르복시 말단 펩타이드와 성장 호르몬의 카르복시 말단에 부착된 2 이상의 융모막성 고나도트로핀 카르복시 말단 펩타이드를 포함하는 폴리펩타이드를 제공한다.
다른 구현예에서, 용어 "CTP 펩타이드," "카르복시 말단 펩타이드" 및 "CTP 서열"은 본원에서 상호 호환적으로 사용된다. 다른 구현예에서, 카르복시 말단 펩타이드는 전장 CTP이다. 다른 구현예에서, 카르복시 말단 펩타이드는 절단형 (truncated) CTP이다. 각 가능성은 본 발명의 개별 구현예를 나타낸다.
다른 구현예에서, "신호 서열" 및 "신호 펩타이드"는 본원에서 상호 호환적으로 사용된다. 다른 구현예에서, "서열"은 폴리뉴클레오티드에 대해 사용되는 경우 코딩부를 지칭할 수 있다. 각 가능성은 본 발명의 개별 구현예를 나타낸다.
다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 1개의 융모막성 고나도트로핀 카르복시 말단 펩타이드, 및 성장 호르몬의 카르복시 말단에 부착된 2개의 융모막성 고나도트로핀 카르복시 말단 펩타이드로 구성된 폴리펩타이드를 제공한다. 다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 1개의 융모막성 고나도트로핀 카르복시 말단 펩타이드, 성장 호르몬의 카르복시 말단에 부착된 2개의 융모막성 고나도트로핀 카르복시 말단 펩타이드, 및 하나의 융모막성 고나도트로핀 카르복시 말단 펩타이드의 아미노 말단에 부착된 신호 펩타이드로 구성된 폴리펩타이드를 제공한다.
다른 구현예에서, 본원에 기술된 CTP들을 포함하는 성장 호르몬은 CTP가 없는 동일한 성장 호르몬과 비교하여 강화된 생체내 생물학적 활성을 가진다. 다른 구현예에서, 아미노 말단에 부착된 하나 이상의 CTP와 카르복시 말단에 부착된 2 이상의 CTP를 포함하는 성장 호르몬은 CTP가 없는 동일한 성장 호르몬과 비교하여 강화된 생체내 생물학적 활성을 가진다. 다른 구현예에서, 아미노 말단에 부착된 1개의 CTP와 카르복시 말단에 부착된 2개의 CTP를 포함하는 성장 호르몬은 CTP가 없는 동일한 성장 호르몬과 비교하여 강화된 생체내 생물학적 활성을 가진다.
다른 구현예에서, 개체는 인간 개체이다. 다른 구현예에서, 개체는 애완 동물이다. 다른 구현예에서, 개체는 포유류이다. 다른 구현예에서, 개체는 농장 동물이다. 다른 구현예에서, 개체는 원숭이이다. 다른 구현예에서, 개체는 말이다. 다른 구현예에서, 개체는 소이다. 다른 구현예에서, 개체는 마우스이다. 다른 구현예에서, 개체는 랫이다. 일 구현예에서, 개체는 남성이다. 다른 구현예에서, 개체는 여성이다.
다른 구현예에서, 본원에 기술된 CTP-성장 호르몬-CTP-CTP의 배열 (configuration)은 펩타이드 결합을 통해 하나 이상의 CTP 단위가 연결된 성장 호르몬 또는 이의 활성 단편을 포함한다. 다른 구현예에서, 본원에 기술된 CTP-성장 호르몬-CTP-CTP는 펩타이드 결합을 통해 추가적인 CTP 단위와 연결된, 하나 이상의 CTP 단위가 펩타이드 결합을 통해 연결된, 성장 호르몬 또는 이의 활성 단편을 포함한다. 다른 구현예에서, 성장 호르몬 및/또는 이의 단편과 CTP 단위 및/또는 이들의 단편을 포함하는 본원에 기술된 폴리펩타이드는 펩타이드 결합을 통해 상호 연결된다. 다른 구현예에서, 하나의 핵산 분자는 성장 호르몬 및/또는 이의 단편, 및 CTP 단위 및/또는 이의 단편을 포함하는 본원에 기술된 폴리펩타이드를 코딩한다.
다른 구현예에서, 카르복시-말단 펩타이드 (CTP)는 링커를 통해 성장 호르몬에 부착된다. 다른 구현예에서, 상기 CTP 서열을 성장 호르몬에 연결시키는 링커는 공유 결합이다. 다른 구현예에서, CTP 서열을 성장 호르몬에 연결시키는 링커는 펩타이드 결합이다. 다른 구현예에서, CTP를 성장 호르몬에 연결시키는 링커는 치환된 펩타이드 결합이다. 다른 구현예에서, 카르복시-말단 펩타이드 (CTP) 서열은 서열번호 1 및 서열번호 2에 기재된 서열들로부터 선택되는 아미노산 서열을 포함한다.
다른 구현예에서, 서열번호 1은 다음의 아미노산 (AA) 서열: DPRFQDSSSSKAPPPSLPSPSRLPGPSDTPILQ (서열번호 1)를 포함한다. 다른 구현예에서, 서열번호 2는 다음의 아미노산 (AA) 서열: SSSSKAPPPSLPSPSRLPGPSDTPILPQ (서열번호 2)를 포함한다.
다른 구현예에서, 카르복시-말단 펩타이드 (CTP) 서열은 절단된 형태이다. 다른 구현예에서, 절단형 CTP는 다음의 아미노산 서열: SSSSKAPPPSLP (서열번호 4)를 포함한다.
다른 구현예에서, 본 발명의 카르복시 말단 펩타이드 (CTP)는, 천연 인간 융모막성 고나도트로핀 펩타이드의 아미노산 112 - 145번 위치의 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 CTP 서열은 인간 융모막성 고나도트로핀 펩타이드의 아미노산 118 - 145번 위치의 아미노산 서열을 포함한다. 다른 구현예에서, CTP 서열은 또한 인간 융모막성 고나도트로핀 펩타이드의 112-118번 위치 중 임의의 위치에서 시작되며 145번 위치에서 종결된다. 일부 구현예들에서, CTP 서열은 28, 29, 30, 31, 32, 33 또는 34개의 아미노산 길이이고, 유전자은행에 기탁된 CTP 아미노산 서열의 112, 113, 114, 115, 116, 117 또는 118번의 위치에서 종결된다.
다른 구현예에서, CTP 펩타이드는 원용에 의해 그 전체가 본 명세서에 포함되는 미국 특허에 기술된 CTP 펩타이드이다. 다른 구현예에서, CTP 펩타이드는, 미국 특허 5,712,122호에 기술된 바와 같이, 천연 CTP와 1-5개의 보존적인 아미노산 치환 차이가 있는 융모막성 고나도트로핀 CTP의 변이체이며, 상기 미국 특허는 원용에 의해 그 전체가 본 명세서에 포함된다. 다른 구현예에서, CTP 펩타이드는 천연 CTP와 1개의 보존적인 아미노산 치환 차이가 있는 융모막성 고나도트로핀 CTP의 변이체이다. 다른 구현예에서, CTP 펩타이드는 천연 CTP와 2개의 보존적인 아미노산 치환 차이가 있는 융모막성 고나도트로핀 CTP의 변이체이다. 다른 구현예에서, CTP 펩타이드는 천연 CTP와 3개의 보존적인 아미노산 치환 차이가 있는 융모막성 고나도트로핀 CTP의 변이체이다. 다른 구현예에서, CTP 펩타이드는 천연 CTP와 4개의 보존적인 아미노산 치환 차이가 있는 융모막성 고나도트로핀 CTP의 변이체이다. 다른 구현예에서, CTP 펩타이드는 천연 CTP와 5개의 보존적인 아미노산 치환 차이가 있는 융모막성 고나도트로핀 CTP의 변이체이다. 다른 구현예에서, 본 발명의 CTP 펩타이드 아미노산 서열은 천연적인 CTP 아미노산 서열 또는 그것의 펩타이드와 70% 이상 상동하다. 다른 구현예에서, 본 발명의 CTP 펩타이드 아미노산 서열은 천연적인 CTP 아미노산 서열 또는 그것의 펩타이드와 80% 이상 상동하다. 다른 구현예에서, 본 발명의 CTP 펩타이드 아미노산 서열은 천연적인 CTP 아미노산 서열 또는 그것의 펩타이드와 90% 이상 상동하다. 다른 구현예에서, 본 발명의 CTP 펩타이드 아미노산 서열은 천연적인 CTP 아미노산 서열 또는 그것의 펩타이드와 95% 이상 상동하다.
다른 구현예에서, 본 발명의 CTP 펩타이드의 DNA 서열은 천연적인 인간 CTP의 DNA 서열 또는 그것의 펩타이드와 70% 이상 상동하다. 다른 구현예에서, 본 발명의 CTP 펩타이드의 DNA 서열은 천연적인 인간 CTP의 DNA 서열 또는 그것의 펩타이드와 80% 이상 상동하다. 다른 구현예에서, 본 발명의 CTP 펩타이드의 DNA 서열은 천연적인 인간 CTP의 DNA 서열 또는 그것의 펩타이드와 90% 이상 상동하다. 다른 구현예에서, 본 발명의 CTP 펩타이드의 DNA 서열은 천연적인 인간 CTP의 DNA 서열 또는 그것의 펩타이드와 95% 이상 상동하다.
일 구현예에서, 절단형 CTP는 서열번호 4의 앞에서 11개의 아미노산을 포함한다. 일 구현예에서, 절단형 CTP는 서열번호 4의 앞에서 8개의 아미노산을 포함한다. 일 구현예에서, 절단형 CTP는 서열번호 4의 앞에서부터 13개의 아미노산을 포함한다. 일 구현예에서, 절단형 CTP는 서열번호 4의 앞에서부터 6개의 아미노산을 포함한다. 일 구현예에서, 절단형 CTP는 서열번호 4의 앞에서부터 5개의 아미노산을 포함한다.
일 구현예에서, 하나 이상의 융모막성 고나도트로핀 CTP 아미노산 서열은 당화된다. 다른 구현예에서, 융모막성 고나도트로핀 CTP 아미노산 서열 양쪽이 당화된다. 다른 구현예에서, 2개의 융모막성 고나도트로핀 CTP 아미노산 서열이 당화된다. 다른 구현예에서, 2 이상의 융모막성 고나도트로핀 CTP 아미노산 서열이 당화된다. 다른 구현예에서, 융모막성 고나도트로핀 CTP 아미노산 서열들 모두 당화된다. 일 구현예에서, 본 발명의 CTP 서열은 하나 이상의 당화 부위를 포함한다. 일 구현예에서, 본 발명의 CTP 서열은 2개의 당화 부위를 포함한다. 일 구현예에서, 본 발명의 CTP 서열은 3개의 당화 부위를 포함한다. 일 구현예에서, 본 발명의 CTP 서열은 4개의 당화 부위를 포함한다.
다른 구현예에서, 하나 이상의 카르복시-말단 펩타이드 (CTP) 서열은 서열번호 1 및 서열번호 2에 기술된 서열들로부터 선택된다. 다른 구현예에서, 하나 이상의 카르복시-말단 펩타이드 (CTP)는 절단된 형태이다.
일 구현예에서, 용어 "말단 (termini, terminal, terminal end 및 terminus)은, 본원에 제공된 단백질 또는 펩타이드 또는 이들의 단편의 카르복시 또는 아미노 끝부분을 언급하는 경우, 본원에서 상호 호환적으로 사용된다. 다른 구현예에서, 용어 "C-말단", "카르복시 말단" 또는 "카르복실 말단"은 본원에서 상호 호환적으로 사용된다. 다른 구현예에서, 용어 "N-말단" 및 "아미노 말단"은 본원에서 상호 호환적으로 사용된다. 각 가능성은 본 발명의 개별 구현예를 나타낸다
다른 구현예에서, 성장 호르몬의 아미노 말단과 카르복시 말단 양쪽의 CTP 서열들은 성장 호르몬이 분해되지 않도록 강화된 보호를 제공한다. 다른 구현예에서, 성장 호르몬의 아미노 말단에 위치한 하나 이상의 CTP 서열과 성장호르몬의 카르복시 말단내 2개의 CTP 단위들은 소거에 대해 강화된 보호를 제공한다. 다른 구현예에서, 성장 호르몬의 아미노 말단에 위치한 하나 이상의 CTP 서열과 성장 호르몬의 카르복시 말단의 2개의 CTP 단위들은 소거 시간 연장 (prolonged clearance time)을 제공한다. 다른 구현예에서, 성장 호르몬의 아미노 말단에 위치한 하나 이상의 CTP 서열과 성장 호르몬의 카르복시 말단의 2개의 CTP 단위들은 성장 호르몬의 Cmax를 증가시킨다. 다른 구현예에서, 성장 호르몬의 아미노 말단에 위치한 하나 이상의 CTP 서열과 성장 호르몬의 카르복시 말단의 2개의 CTP 단위들은 성장 호르몬의 Tmax를 증가시킨다. 다른 구현예에서, 성장 호르몬의 아미노 말단에 위치한 하나 이상의 CTP 서열과 성장 호르몬의 카르복시 말단의 2개의 CTP 단위들은 성장 호르몬의 T1/2 (반감기)를 연장시킨다.
다른 구현예에서, 성장 호르몬의 아미노 말단과 카르복시 말단 양쪽에 위치한 CTP 서열들은 변형된 성장 호르몬의 반감기를 연장시킨다. 다른 구현예에서, 성장 호르몬의 아미노 말단에 위치한 하나 이상의 CTP 서열과 성장 호르몬의 카르복시 말단에 위치한 2 이상의 CTP 서열들은 변형된 성장 호르몬에게 반감기 연장을 제공한다. 다른 구현예에서, 성장 호르몬의 아미노 말단에 위치한 하나의 CTP 서열과 성장 호르몬의 카르복시 말단에 위치한 2개의 CTP 서열들은 부착된 성장 호르몬에 반감기 연장을 제공한다. 다른 구현예에서, 성장 호르몬의 아미노 말단에 위치한 하나의 CTP 서열과 성장 호르몬의 카르복시 말단에 탠덤으로 위치한 2개의 CTP 서열들은 변형된 성장 호르몬에 반감기 연장을 제공한다.
다른 구현예에서, 폴리펩타이드 아미노 말단에 위치한 CTP 서열, 성장 호르몬의 카르복시 말단에 위치한 CTP 서열, 및 카르복시 말단에 위치한 CTP 서열에 탠덤으로 부착된 하나 이상의 부가적인 CTP 서열은 성장 호르몬 분해에 대해 강화된 보호를 제공한다. 일부 구현예들에서, 성장 호르몬의 아미노 말단에 위치한 CTP 서열, 성장 호르몬의 카르복시 말단에 위치한 CTP 서열, 및 카르복시 말단에 위치한 CTP 서열에 탠덤으로 부착된 하나 이상의 부가적인 CTP 서열은 성장 호르몬의 반감기를 연장시킨다. 일부 구현예들에서, 성장 호르몬의 아미노 말단에 위치한 CTP 서열, 성장 호르몬의 카르복시 말단에 위치한 CTP 서열, 및 카르복시 말단에 위치한 CTP 서열에 탠덤으로 부착된 하나 이상의 부가적인 CTP 서열은 성장 호르몬의 생물학적 활성을 강화한다.
다른 구현예에서, 성장 호르몬은 신호 펩타이드를 추가로 포함한다. 일부 구현예들에서, 신호 서열은, 비제한적인 예로, 내인성 신호 서열을 포함한다. 일부 구현예들에서, 신호 서열은, 비제한적인 예로, 임의의 공지된 성장 호르몬 또는 성장 호르몬들의 내인성 신호 서열을 포함한다. 다른 구현예에서, 본 발명의 폴리펩타이드 및 방법은 다음과 같은 아미노산 서열을 포함하는 신호 펩타이드를 부가적으로 가진 성장 호르몬을 제공한다: MATGSRTSLLLAFGLLCLPWLQEGSA (서열번호 3).
다른 구현예에서, 본 발명의 접합된 성장 호르몬은 비-변형된 성장 호르몬과 동일한 방식으로 사용된다. 다른 구현예에서, 본 발명의 접합된 성장 호르몬은 순환성 반감기 증가, 혈장 체류 시간 연장, 소거 감소, 및 증가된 생체내 임상 활성을 가진다. 다른 구현예에서, 본원에 기술된 접합된 성장 호르몬의 특성 개선으로 인해, 이들 접합체들은 비-변형된 성장 호르몬 보다 적은 빈도로 투여된다. 다른 구현예에서, 본원에 기술된 접합된 성장 호르몬은 주 당 1회 - 2주 당 1회로 투여된다. 다른 구현예에서, 본원에 기술된 접합된 성장 호르몬은 2주 당 1회 - 3주 당 1회로 투여된다. 다른 구현예에서, 본원에 기술된 접합된 성장 호르몬은 1일 1회 - 주 당 3회로 투여된다. 다른 구현예에서, 투여 빈도 감소로 환자의 순응성이 개선될 것이며, 치료 성과 개선과 환자의 삶의 질 개선으로 이어질 것이다. 다른 구현예에서, 폴리(에틸렌 글리콜)이 연결된 기존의 성장 호르몬 접합체와 비교하여, 본 발명의 접합체의 분자량 및 링커 구조를 가진 성장 호르몬 CTP 접합체가, 개선된 효능, 개선된 안정성, 증가된 AUC 수준, 증가된 순환 반감기를 가지는 것으로 확인된다. 다른 구현예에서, 폴리(에틸렌 글리콜)이 연결된 기존의 성장 호르몬 접합체와 비교하여, 본 발명의 접합체의 분자량 및 링커 구조를 가진 성장 호르몬이, 개선된 효능, 개선된 안정성, 증가된 AUC 수준, 증가된 순환 반감기를 가지는 것으로 확인된다. 다른 구현예에서, 접합된 성장 호르몬의 치료학적 유효량은 생체내 측정가능한 생물학적 활성에 필요한 접합체의 양이다. 다른 구현예에서, 본 발명의 교시에 따라 이용되는 성장 호르몬은 증가된 효능을 나타낸다. 다른 구현예에서, 성장 호르몬의 아미노 말단과 카르복시 말단 양쪽에 CTP 서열의 부착으로, 생체내 활성이 연장된다.
다른 구현예에서, 접합된 성장 호르몬의 치료학적 유효량은 치료 중인 실제 병태 유형, 치료 중인 환자의 상태 뿐만 아니라 조성물의 기타 성분과 같은 인자에 따라 결정된다. 다른 구현예에서, 접합된 성장 호르몬의 치료학적 유효량은 주 당 1회로 투여되는 0.01 내지 10 ㎍ /체중 kg이다. 다른 구현예에서, 접합된 성장 호르몬의 치료학적 유효량은 주 당 1회로 투여되는 0.1 내지 1 ㎍ /체중 kg이다. 다른 구현예에서, 접합된 성장 호르몬을 포함하는 약학 조성물은 인간 환자에게 다양한 수단에 의해 투여하는데 유효한 효과 강도로 제형화된다.
다른 구현예에서, 성장 호르몬은 당해 기술 분야의 당업자에게 공지된 임의의 성장 호르몬이다. 다른 구현예에서, 성장 호르몬은 인간 성장 호르몬이다. 다른 구현예에서, 성장 호르몬의 뉴클레오티드 서열 및/또는 아미노산 서열은 유전자은행 데이타베이스에서 이용가능하다. 다른 구현예에서, 성장 호르몬은 상동체이다. 다른 구현예에서, 상동체는 또한 결손, 삽입 또는 아미노산 치환 등의 치환 변이체 및 이의 생물 활성 폴리펩타이드 단편을 지칭한다.
다른 구현예에서, 성장 호르몬은 엑손 2, 3, 4 또는 이들의 임의 조합이 생략된 hGH 변이체이다. 다른 구현예에서, 성장 호르몬은 신호 펩타이드를 포함한다. 다른 구현예에서, 성장 호르몬은 신호 절단 부위를 포함한다. 다른 구현예에서, 본 발명의 CTP로 변형된 GH를 포함하는 폴리펩타이드는 재조합 GH를 포함한다.
다른 구현예에서, 본원에 기술된 성장 호르몬은 성장 호르몬 (GH) 유사 사이토카인 슈퍼패밀리에 속한다. 다른 구현예에서, 본원에 기술된 성장 호르몬은 인간 성장 호르몬 (hGH)이다. 다른 구현예에서, 인간 성장 호르몬은 다음의 아미노산 서열을 포함한다 (유전자은행 등재 번호 P01241): MATGSRTSLLLAFGLLCLPWLQEGSAFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGF (서열번호 5). 다른 구현예에서, 인간 성장 호르몬은 다음의 아미노산 서열을 포함한다: MFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGF (서열번호 6). 다른 구현예에서, 인간 성장 호르몬은 다음의 아미노산 서열을 포함한다: MFPTIPLSRLFDNAMLRAHRLHQLA (서열번호 7). 다른 구현예에서, hGH는 다음의 아미노산 서열을 포함한다: MATGSRTSLLLAFGLLCLPWLQEGSAFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKVQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGF (서열번호 8). 다른 구현예에서, hGH는 hGH의 65번 글루타민이 발린으로 치환된 치환 변이체이다.
다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 AAA72260으로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 AAK69708로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 CAA01435로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 CAA01329로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 CAA00380으로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 AAA72555로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 NP_000506.2로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 NP_072053.1로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 NP_072054.1로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 NP_072055.1로 수탁된 유전자은행 아미노산 서열을 포함한다. 다른 구현예에서, 본 발명의 성장 호르몬은 등재 번호 NP_072056.1로 수탁된 유전자은행 아미노산 서열을 포함한다.
다른 구현예에서, 본원에 기술된 성장 호르몬을 코딩하는 핵산 분자는 당해 기술 분야의 당업자에게 공지된 임의의 성장 호르몬 아미노산 서열을 코딩한다. 다른 구현예에서, 본원에 기술된 성장 호르몬을 코딩하는 핵산 분자는 hGH를 코딩한다. 다른 구현예에서, 등재 번호 NM_000515.3로 유전자은행에 수탁된 핵산 서열을 포함한다. 다른 구현예에서, 등재 번호 NM_022559.2로 유전자은행에 수탁된 핵산 서열을 포함한다. 다른 구현예에서, 등재 번호 NM_022560.2로 유전자은행에 수탁된 핵산 서열을 포함한다. 다른 구현예에서, 등재 번호 NM_022561.2로 유전자은행에 수탁된 핵산 서열을 포함한다. 다른 구현예에서, 등재 번호 NM_022562.2로 유전자은행에 수탁된 핵산 서열을 포함한다.
다른 구현예에서, 본 발명의 성장 호르몬을 포함하는 폴리펩타이드는 성장 호르몬과 이의의 카르복시 말단에 부착된 CTP 하나 (hGH-CTP)를 포함하며, 다음과 같은 아미노산 서열을 가진다: MATGSRTSLLLAFGLLCLPWLQEGSAFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGFSSSSKAPPPSLPSPSRLPGPSDTPILPQ (서열번호 9).
다른 구현예에서, 본 발명의 성장 호르몬을 포함하는 폴리펩타이드는 성장 호르몬과 이의 카르복시 말단에 탠덤으로 부착된 2개의 CTP (hGH-CTP-CTP)를 포함하며 , 다음과 같은 서열을 가진다: MATGSRTSLLLAFGLLCLPWLQEGSAFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGFSSSSKAPPPSLPSPSRLPGPSDTPILPQSSSSKAPPPSLPSPSRLPGPSDTPILPQ (서열번호 10).
다른 구현예에서, 본 발명의 성장 호르몬을 포함하는 폴리펩타이드는 성장 호르몬과 이의 카르복시 말단에 탠덤으로 부착된 2개의 CTP와 성장 호르몬의 아미노 말단에 부착된 하나의 CTP (CTP-hGH-CTP-CTP)를 포함하며, 다음과 같은 서열을 가진다: MATGSRTSLLLAFGLLCLPWLQEGSASSSSKAPPPSLPSPSRLPGPSDTPILPQFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGFSSSSKAPPPSLPSPSRLPGPSDTPILPQSSSSKAPPPSLPSPSRLPGPSDTPILPQ (서열번호 11).
다른 구현예에서, 본 발명의 성장 호르몬을 포함하는 폴리펩타이드는, 성장 호르몬과 이의 카르복시 말단에 탠덤으로 부착된 CTP 2개 중 하나가 절단형인 2개의 CTP와 성장 호르몬의 아미노 말단에 부착된 하나의 부가적인 CTP (tCTP-hGH-CTP-CTP)를 포함하며, 다음과 같은 서열을 가진다: MATGSRTSLLLAFGLLCLPWLQEGSASSSSKAPPPSLPFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGFSSSSKAPPPSLPSPSRLPGPSDTPILPQSSSSKAPPPSLPSPSRLPGPSDTPILPQ (서열번호 12).
다른 구현예에서, 본 발명의 성장 호르몬을 포함하는 폴리펩타이드는 성장 호르몬과 이의 카르복시 말단에 부착된 1개의 CTP와 성장 호르몬의 아미노 말단에 부착된 1개의 CTP (CTP-hGH-CTP)를 포함하며, 다음과 같은 서열을 가진다: MATGSRTSLLLAFGLLCLPWLQEGSASSSSKAPPPSLPSPSRLPGPSDTPILPQFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGFSSSSKAPPPSLPSPSRLPGPSDTPILPQ (서열번호 13).
다른 구현예에서, 성장 호르몬과 하나의 CTP를 포함하는 폴리펩타이드는 다음의 아미노산 서열을 포함한다: MATGSRTSLLLAFGLLCLPWLQEGSASSSSKAPPPSLPSPSRLPGPSDTPILPQFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGF (서열번호 14).
다른 구현예에서, CTP-hGH-CTP를 가진 폴리펩타이드를 코딩하는 폴리뉴클레오티드 분자는 다음과 같은 핵산 서열을 포함한다: tctagaggacatggccaccggcagcaggaccagcctgctgctggccttcggcctgctgtgcctgccatggctgcaggagggcagcgccagctcttcttctaaggctccacccccatctctgcccagccccagcagactgccgggccccagcgacacacccattctgccccagttccccaccatccccctgagcaggctgttcgacaacgccatgctgagggctcacaggctgcaccagctggcctttgacacctaccaggagttcgaggaagcctacatccccaaggagcagaagtacagcttcctgcagaacccccagacctccctgtgcttcagcgagagcatccccacccccagcaacagagaggagacccagcagaagagcaacctggagctgctgaggatctccctgctgctgatccagagctggctggagcccgtgcagttcctgagaagcgtgttcgccaacagcctggtgtacggcgccagcgacagcaacgtgtacgacctgctgaaggacctggaggagggcatccagaccctgatgggccggctggaggacggcagccccaggaccggccagatcttcaagcagacctacagcaagttcgacaccaacagccacaacgacgacgccctgctgaagaactacgggctgctgtactgcttcagaaaggacatggacaaggtggagaccttcctgaggatcgtgcagtgcagaagcgtggagggcagctgcggcttcagctccagcagcaaggcccctcccccgagcctgccctccccaagcaggctgcctgggccctccgacacaccaatcctgcctcagtgatgaaggtctggatgcggccgc (서열번호 15).
다른 구현예에서, CTP-hGH-CTP-CTP를 가진 폴리펩타이드를 코딩하는 폴리뉴클레오티드 분자는 다음과 같은 핵산 서열을 포함한다: tctagaggacatggccaccggcagcaggaccagcctgctgctggccttcggcctgctgtgcctgccatggctgcaggagggcagcgccagctcttcttctaaggctccacccccatctctgcccagccccagcagactgccgggccccagcgacacacccattctgccccagttccccaccatccccctgagcaggctgttcgacaacgccatgctgagggctcacaggctgcaccagctggcctttgacacctaccaggagttcgaggaagcctacatccccaaggagcagaagtacagcttcctgcagaacccccagacctccctgtgcttcagcgagagcatccccacccccagcaacagagaggagacccagcagaagagcaacctggagctgctgaggatctccctgctgctgatccagagctggctggagcccgtgcagttcctgagaagcgtgttcgccaacagcctggtgtacggcgccagcgacagcaacgtgtacgacctgctgaaggacctggaggagggcatccagaccctgatgggccggctggaggacggcagccccaggaccggccagatcttcaagcagacctacagcaagttcgacaccaacagccacaacgacgacgccctgctgaagaactacgggctgctgtactgcttcagaaaggacatggacaaggtggagaccttcctgaggatcgtgcagtgcagaagcgtggagggcagctgcggcttcagctccagcagcaaggcccctcccccgagcctgccctccccaagcaggctgcctgggccctccgacacaccaatcctgccacagagcagctcctctaaggcccctcctccatccctgccatccccctcccggctgcctggcccctctgacacccctatcctgcctcagtgatgaaggtctggatgcggccgc (서열번호 16).
다른 구현예에서, CTP-hGH-CTP-CTP를 가진 폴리펩타이드를 코딩하는 폴리뉴클레오티드 분자는 다음과 같은 핵산 서열을 포함한다: tctagaggacatggccaccggcagcaggaccagcctgctgctggccttcggcctgctgtgcctgccatggctgcaggagggcagcgccagctcttcttctaaggctccacccccgagcctgcccttccccaccatccccctgagcaggctgttcgacaacgccatgctgagggctcacaggctgcaccagctggcctttgacacctaccaggagttcgaggaagcctacatccccaaggagcagaagtacagcttcctgcagaacccccagacctccctgtgcttcagcgagagcatccccacccccagcaacagagaggagacccagcagaagagcaacctggagctgctgaggatctccctgctgctgatccagagctggctggagcccgtgcagttcctgagaagcgtgttcgccaacagcctggtgtacggcgccagcgacagcaacgtgtacgacctgctgaaggacctggaggagggcatccagaccctgatgggccggctggaggacggcagccccaggaccggccagatcttcaagcagacctacagcaagttcgacaccaacagccacaacgacgacgccctgctgaagaactacgggctgctgtactgcttcagaaaggacatggacaaggtggagaccttcctgaggatcgtgcagtgcagaagcgtggagggcagctgcggcttcagctccagcagcaaggcccctcccccgagcctgccctccccaagcaggctgcctgggccctccgacacaccaatcctgccacagagcagctcctctaaggcccctcctccatccctgccatccccctcccggctgcctggcccctctgacacccctatcctgcctcagtgatgaaggtctggatgcggccgc (서열번호 17).
다른 구현예에서, 본 발명의 성장 호르몬은 성장 호르몬의 공지 서열과 상동적이다. 다른 구현예에서, 본 발명의 성장 호르몬은 본원에 기술된 성장 호르몬 서열과 상동적이다. 일부 구현예들에서, 본 발명에 따른 상동체는 또한 결손, 삽입 또는 아미노산 치환 등의 치료 변이체 및 이의 생물학적 활성 폴리펩타이드 단편을 포괄한다. 일 구현예에서, 치환 변이체는 hGH의 65번 위치의 글루타민이 발린으로 치환된 것이다 [Gellerfors et al., J Pharm Biomed Anal 1989, 7:173-83].
일 구현예에서, "인간 성장 호르몬" (hGH)은 hGH 활성 (즉, 성장 자극)을 나타내는 유전자은행 등재 번호 P01241에 기재된 것과 같은 폴리펩타이드를 지칭한다.
일 구현예에서, "인간 성장 호르몬" (hGH)은 hGH 활성 (즉, 성장 자극)을 나타내는 유전자은행 등재 번호 P01241에 기재된 것과 같은 폴리펩타이드를 지칭한다. 일 구현예에서, 본 발명의 hGH는 또한 상동체를 지칭한다. 일 구현예에서, 본 발명의 hGH 아미노산 서열은 국립 생물공학정보 (NCBI)의 BlastP 소프트웨어를 디폴트 파라미터로 이용하여 결정하였을 때, 유전자은행 등재번호 P01241에 기술된 hGH 서열과 상동성이 50% 이상이다. 일 구현예에서, 본 발명의 hGH 아미노산 서열은 국립 생물공학정보 (NCBI)의 BlastP 소프트웨어를 디폴트 파라미터로 이용하여 결정하였을 때, 유전자은행 등재번호 P01241에 기술된 hGH 서열과 상동성이 60% 이상이다. 일 구현예에서, 본 발명의 hGH 아미노산 서열은 국립 생물공학정보 (NCBI)의 BlastP 소프트웨어를 디폴트 파라미터로 이용하여 결정하였을 때, 유전자은행 등재번호 P01241에 기술된 hGH 서열과 상동성이 70% 이상이다. 일 구현예에서, 본 발명의 hGH 아미노산 서열은 국립 생물공학정보 (NCBI)의 BlastP 소프트웨어를 디폴트 파라미터로 이용하여 결정하였을 때, 유전자은행 등재번호 P01241에 기술된 hGH 서열과 상동성이 80% 이상이다. 일 구현예에서, 본 발명의 hGH 아미노산 서열은 국립 생물공학정보 (NCBI)의 BlastP 소프트웨어를 디폴트 파라미터로 이용하여 결정하였을 때, 유전자은행 등재번호 P01241에 기술된 hGH 서열과 상동성이 90% 이상이다. 일 구현예에서, 본 발명의 hGH 아미노산 서열은 국립 생물공학정보 (NCBI)의 BlastP 소프트웨어를 디폴트 파라미터로 이용하여 결정하였을 때, 유전자은행 등재번호 P01241에 기술된 hGH 서열과 상동성이 95% 이상이다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 지방세포에 결합하여, 트리글리세라이드를 분해하고 이의 흡수력을 억제하여 순환성 지질이 축적되게 자극한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 (실시예 부분에 나타낸 바와 같이) 인슐린 유사 성장 인자-I (IGF-1)에 의해 주로 매개되는 간접적인 효과를 발휘한다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 간 및 기타 조직들이 IGF-1을 방출하도록 자극함으로써 신체 성장을 자극한다. 다른 구현예에서, IGF-1는 연골세포의 증식을 자극하여, 골 성장을 일으킨다. 다른 구현예에서, IGF-1는 골격근 세포의 증식을 자극하여, 근육 발달을 일으킨다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 단백질, 지질 및 탄수화물 대사작용에 대해 대사 효과를 유도한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 직접 효과를 가진다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 IGH-1의 유도를 통해 간접 효과를 가진다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 리더 펩타이드를 더 포함한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 CTP 절단형 구조체를 포함한다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 조직에서 단백질의 동화 작용을 자극한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 아미노산 흡수, 단백질 합성 증가 및 단백질 산화 감소를 자극한다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 지방 대사작용을 자극한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 트리글리세라이드 분해 및 지방세포에서의 산화를 자극함으로써 지방의 이용을 자극한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 체지방을 낮춘다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 탄수화물의 대사작용을 자극한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 혈당을 정상 범위로 유지시킨다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 항-인슐린 활성을 포함한다. 다른 구현예에서 CTP로 변형된 hGH를 포함하는 폴리펩타이드는 말초 조직의 글루코스 흡수를 자극하고 간에서의 글루코스 합성을 강화하는 인슐린의 능력을 억제한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 인슐린 분비를 자극하여 고인슐린혈증을 유도한다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 개체에서 성장 호르몬의 제한된 생산 또는 비-생산을 보완하는데 사용된다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 성장 호르몬-방출 호르몬 (GHRH)의 제한된 생산 또는 비-생산을 보완한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 소마토스타틴의 증가된 활성을 보완한다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 그렐린의 제한된 생산 또는 비-생산을 보완한다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 시상하부, 뇌하수체 또는 타겟 세포에서 병변과 관련된 질환을 치료하는데 사용된다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 호르몬에 대한 타겟 세포의 반응 감소와 관련된 질환을 치료하는데 사용된다.
다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 심각한 성장 지연을 나타내는 어린이를 치료하는데 사용된다. 다른 구현예에서, CTP로 변형된 hGH를 포함하는 폴리펩타이드는 병리학적인 저신장을 보이는 어린이를 치료하는데 사용된다. 다른 구현예에서, 본 발명의 CTP로 변형된 hGH를 포함하는 폴리펩타이드는 운동 수행을 강화하는데 사용된다. 다른 구현예에서, 본 발명의 CTP로 변형된 hGH를 포함하는 폴리펩타이드는 노화 증상을 치료하는데 사용된다. 다른 구현예에서, 본 발명의 CTP로 변형된 hGH를 포함하는 폴리펩타이드는 미용적인 노화 징후들을 치료하는데 사용된다.
다른 구현예에서, GH 결핍성 어린이를 GH로 치료하면 성장이 강화되지만, GH 결핍성 성인의 경우에는, GH로 치료하면 실질 체중이 증가하고 체지방은 감소 또는 저하된다. 다른 구현예에서, CTP 변형된 GH 형태로 치료하면 어린이와 성인에서 이러한 효과가 강화된다. 다른 구현예에서, GH 결핍성 어린이를 CTP 변형된 hGH로 치료하면 시판되는 비-변형된 GH를 동일 용량으로 매일 복용한 GH 결핍성 어린이와 비교하여, 성장 강화가 이루어진다. 다른 구현예에서, 어린이를 CTP 변형된 hGH로 치료하면 시판되는 비-변형된 GH를 동일 용량으로 매일 복용한 어린이에 비해 성장 강화가 이루어진다. 다른 구현예에서, GH 결핍성 성인을 CTP 변형된 hGH로 치료하면 시판되는 비-변형된 GH를 동일 용량으로 매일 복용한 GH 결핍성 성인과 비교하여 실질체중 증가 및 체지방 감소가 이루어진다. 다른 구현예에서, 성인을 CTP 변형된 hGH로 치료하면 시판되는 비-변형된 GH를 동일 용량으로 매일 복용한 성인과 비교하여 실질체중 증가 및 체지방 감소가 이루어진다.
다른 구현예에서, 본 발명의 CTP로 변형된 hGH를 포함하는 폴리펩타이드는 암컷 개체에서 모유 생산을 증진시키기 위해 사용된다. 다른 구현예에서, 본 발명의 CTP/젖소-GH 접합체는 젖소에서 모유 생산을 증진시키기 위해 사용된다. 다른 구현예에서, 본 발명의 CTP/동물-GH 구조체는 혼합 농업 기법에 사용된다. 다른 구현예에서, 본 발명의 CTP/농장 동물-GH 구조체는 비제한적인 예로 돼지 등의 농장 동물의 성장을 강화하는데 사용된다.
다른 구현예에서, 본 발명의 방법은, 근육 성장의 자극, 심장 기능 증가, 뼈 성장 자극, 근육 온전성 (muscle integrity) 유지, 근육 대사작용의 균형 형성, 근육 형성 유도, 새로운 근육 형성(muscle buildup) 유도, 골 하중 강화, 골다공증과 관련된 증상의 치료, 소모성 질환의 치료, 지질분해 증가, 체액 밸런스의 개선, 골다공증 치료, 폐 기능 향상, 면역성 개선, 생명 유지 장기의 재증식, 행복감 증대, REM 수면 회복 또는 이들의 임의 조합을 위한, CTP로 변형된 hGH를 포함하는 폴리펩타이드를 제공한다. 다른 구현예에서, 본 발명의 방법을 근육 성장의 자극, 심장 기능 증가, 뼈 성장 자극, 근육 온전성 유지, 근육 대사작용의 균형 형성, 근육 형성 유도, 새로운 근육 형성 유도, 골 하중 강화, 골다공증과 관련된 증상의 치료, 소모성 질환의 치료, 지질분해 증가, 체액 밸런스의 개선, 골다공증 치료, 폐 기능 향상, 면역성 개선, 생명 유지 장기의 재증식, 행복감 증대, REM 수면 회복 또는 이들의 임의 조합을 위한 CTP로 변형된 hGH를 포함하는 폴리펩타이드를 제공한다.
다른 구현예에서, 본 발명의 방법은, 소모성 질환, AIDS, 악액질 또는 hGH 결핍증을 치료하기 위해, N-말단에 하나 이상의 CTP 아미노산 펩타이드와 C-말단에 하나 이상의 CTP 아미노산 펩타이드를 부가적으로 가진, hGH를 제공한다. 다른 구현예에서, 본 발명의 방법은 소모성 질환, AIDS, 악액질 또는 hGH 결핍증을 치료하기 위해, CTP로 변형된 hGH를 포함하는 폴리펩타이드를 제공한다.
일부 구현예들에서, 본 발명의 인간 성장 호르몬 폴리펩타이드는, 성장 결함 장애, AIDS 소모증, 노화, HIV 감염 개체의 면역 기능 손상, 이화대사 질병, 수술 회복, 울혈성 심근병증, 간 이식, 간 절제술 후 간 재생, 만성 신부전, 신성 골이영양증 (renal osteodystrophy), 골다공증, 연골무형성증 (achondroplasia)/연골저형성증 (hypochondroplasia), 골격 이형성증, 만성 염증 또는 영양 장애, 예컨대 크론 질환, 단장 증후군 (short bowel syndrome), 소아 만성 관절염, 낭포성 섬유증, 남성 불임증, X 염색체 연관 저인산혈증성 구루병 (X-linked hypophosphatemic rickets), 다운 증후군, 이분 척추증 (Spina bifida), 누난 증후군 (Noonan syndrome), 비만, 근력 손상 (impaired muscle strength) 및 섬유근통 등의, 성장 및 체중 관련한 병태를 앓고 있는 개체를 치료하는데 사용할 수 있다.
다른 구현예에서, 본 발명의 인간 성장 호르몬 폴리펩타이드는 다발성 경화증을 앓고 있는 개체를 치료하는데 사용될 수 있다. 다른 구현예에서, 본 발명의 인간 성장 호르몬 폴리펩타이드는 비만 개체의 체중 감소를 강화하는데 사용될 수 있다. 다른 구현예에서, 본 발명의 인간 성장 호르몬 폴리펩타이드는 비만 개체에서 체지방을 감소시키는데 사용될 수 있다. 다른 구현예에서, 본 발명의 인간 성장 호르몬 폴리펩타이드는 개체에서 실질체중을 높이는데 사용될 수 있다. 다른 구현예에서, 본 발명의 인간 성장 호르몬 폴리펩타이드는 심부전, 궤양성 대장염 및 화상을 앓고 있는 개체를 치료하는데 사용될 수 있다. 다른 구현예에서, 본 발명의 인간 성장 호르몬 폴리펩타이드는 근육량을 축적하는데 사용될 수 있다.
다른 구현예에서, 본 발명의 방법은 본원에 기술된 GH 단백질을 코딩하는 핵산 서열을 제공한다. 다른 구현예에서, 본 발명의 방법은, 근육 성장의 자극, 심장 기능 증가, 뼈 성장 자극, 근육 온전성 유지, 근육 대사작용의 균형 형성, 근육 형성 유도, 새로운 근육 형성 유도, 골 하중 강화, 골다공증과 관련된 증상의 치료, 소모성 질환의 치료, 지질분해 증가, 체액 밸런스의 개선, 골다공증 치료, 폐 기능 향상, 면역성 개선, 생명 유지 장기의 재증식, 행복감 증대, REM 수면 회복 또는 이들의 임의 조합을 위해, CTP로 변형된 hGH를 포함하는 폴리펩타이드를 코딩하는 핵산 서열을 제공한다.
일부 구현예들에서, 인간 성장 호르몬 (hGH)은 본 발명의 교시에 따라 이용된다. 일부 구현예들에서, hGH 단백질의 아미노 말단과 카르복시 말단 양쪽에 CTP 서열을 부착하면 효능이 증가된다 (도 2). 일부 구현예들에서, hGH 단백질의 아미노 말단과 카르복시 말단 양쪽에 CTP 서열을 부착하면 생체내 활성이 연장된다.
일부 구현예들에서, "폴리펩타이드" 또는 "단백질"은, 본원에서, 천연 펩타이드 (분해 산물, 합성에 의해 합성한 단백질 또는 재조합 단백질) 및 펩타이드 모방체 (전형적으로, 합성에 의해 합성한 단백질), 뿐만 아니라, 단백질 유사체이며, 일부 구현예들에서, 폴리펩타이드가 체내에서 보다 안정적이거나 세포로 더 잘 침투할 수 있게 하는 변형을 가진, 펩토이드 및 세미펩토이드를 포괄한다.
일부 구현예들에서, 변형은, 비제한적인 예로서, N 말단 변형, C 말단 변형, 폴리펩타이드 결합 변형, 비제한적인 예로, CH2-NH, CH2-S, CH2-S=O, O=C-NH, CH2-O, CH2-CH2, S=C-NH, CH=CH 또는 CF=CH, 벡본 변형, 및 잔기 변형을 포함한다. 펩타이드모방성 화합물의 제조 방법은 당해 기술 분야에 잘 알려져 있으며, 예를 들어 Quantitative Drug Design, C.A. Ramsden Gd., Chapter 17.2, F. Choplin Pergamon Press (1992)에 명시되어 있으며, 이 문헌은 본원에 충분히 기술된 것과 같이 원용에 의해 본 명세서에 포함된다. 이러한 측면들에 대한 보다 상세한 내용들은 아래에 제공된다.
일부 구현예들에서, 폴리펩타이드에서 폴리펩타이드 결합 (-CO-NH-)이 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 N-메틸화된 결합 (-N(CH3)-CO-)으로 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 에스테르 결합 (-C(R)H-C-O-O-C(R)-N-)으로 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 케토메틸렌 결합 (-CO-CH2-)으로 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 R이 임의의 알킬, 예컨대, 메틸인 α-아자 결합 (-NH-N(R)-CO-), 카르바 결합 (-CH2-NH-)으로 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 하이드록시에틸렌 결합 (-CH(OH)-CH2-)으로 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 티오아미드 결합 (-CS-NH-)으로 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 올레핀 이중 결합 (-CH=CH-)으로 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 레트로 아미드 결합 (-NH-CO-)으로 치환된다. 일부 구현예들에서, 폴리펩타이드 결합이 R이 탄소 원자 상에 천연적으로 제시되는 "정상" 측쇄인 폴리펩타이드 유도체 (-N(R)-CH2-CO-)로 치환된다. 일부 구현예들에서, 이들 변형들은 폴리펩타이드 체인을 따라 임의 결합부에서, 심지어 동시에 여러 곳 (2-3개의 결합)에서 이루어진다.
일부 구현예들에서, Trp, Tyr 및 Phe 등의 폴리펩타이드의 천연 방향족 아미노산은 페닐글리신, TIC, 나프틸렐아닌 (Nol), Phe의 고리-메틸화된 유도체, Phe의 할로겐화된 유도체 또는 o-메틸-Tyr 등의 합성한 비-천연 산으로 치환된다. 일부 구현예들에서, 본 발명의 폴리펩타이드는 하나 이상의 변형된 아미노산 또는 하나 이상의 비-아미노산 단량체들 (예, 지방산, 컴플렉스 탄수화물 등)을 포함한다.
일 구현예에서, "아미노산" 또는 "아미노산들"은 20개의 천연 아미노산; 예를 들어, 하이드록시프롤린, 포스포세린 및 포스포트레오닌 등의 생체내에서 번역 후 수정된 아미노산; 및 비제한적인 예로서, 2-아미노아디프산, 하이드록시라이신, 이소데스모신, 노르발린, 노르루신 및 오르니틴 등의 기타 특이 아미노산을 포괄하는 것으로 이해된다. 일 구현예에서, "아미노산"은 D-아미노산 및 L-아미노산 둘다를 포함한다.
일부 구현예들에서, 본 발명의 폴리펩타이드는 폴리펩타이드가 가용성 형태이어야 하는 치료제로 이용된다. 일부 구현예들에서, 본 발명의 폴리펩타이드는, 비제한적인 예로서, 하이드록시-함유 측쇄로 인해 폴리펩타이드의 용해성을 높일 수 있는, 세린 및 트레오닌 등의, 비-천연 또는 천연 극성 아미노산을 하나 이상 포함한다.
일부 구현예들에서, 당해 기술 분야의 당업자라면 환화가 CTP 특징으로 변형된 hGH를 심각하게 방해하지 않는 경우, 성장 호르몬의 사이클 형태들도 사용할 수 있다는 것을 알 것이지만, 본 발명의 CTP로 변형된 hGH를 포함하는 폴리펩타이드는 선형 형태로 이용된다.
일부 구현예들에서, 본 발명의 CTP로 변형된 hGH는 표준 고상 기법을 이용함으로써와 같이 생화학적으로 합성된다. 일부 구현예들에서, 이러한 생화학적 방법들로는 전용 고상 합성, 부분 고상 합성, 단편 축합 또는 고전적인 용액 합성을 포함한다. 일부 구현예들에서, 이들 방법은, 성장 호르몬이 상대적으로 짧거나 (약 5-15kDa) 및/또는 재조합 기법으로 제조할 수 없을 (즉, 핵산 서열에 의해 코딩되지 않는) 경우에, 사용되며, 따라서 다른 화학적 방법이 이용된다.
일부 구현예들에서, CTP에 의해 변형된 hGH의 고상 합성 공정은 당해 기술 분야의 당업자들에게 잘 알려져 있으며, John Morrow Stewart and Janis Dillaha Young, Solid Phase Protein Syntheses (2nd Ed., Pierce Chemical Company, 1984)에 추가로 기술되어 있다. 일부 구현예들에서, 합성 폴리펩타이드는 분취용 고성능 액체 크로마토그래피로 정제되며 [Creighton T. (1983) Proteins, structures and molecular principles. WH Freeman and Co. N.Y.], 이의 조성은 당해 기술 분야의 당업자에게 공지된 방법들로 아미노산 서열 분석을 통해 검증할 수 있다.
일부 구현예들에서, 재조합 단백질 기법이 본 발명의 CTP로 변형된 hGH를 제조하는데 사용된다. 일부 구현예들에서, 재조합 단백질 기법이 상대적으로 긴 (예, 아미노산 19-25개 보다 긴) 폴리펩타이드를 제조하는데 이용된다. 일부 구현예들에서, 재조합 단백질 기법들이 본 발명의 CTP로 변형된 hGH를 다량 제조하는데 사용된다. 일부 구현예들에서, 재조합 기법은 Bitter et al., (1987) Methods in Enzymol. 153:516-544, Studier et al. (1990) Methods in Enzymol. 185:60-89, Brisson et al. (1984) Nature 310:511-514, Takamatsu et al. (1987) EMBO J. 6:307-311, Coruzzi et al. (1984) EMBO J. 3:1671-1680 및 Brogli et al., (1984) Science 224:838-843, Gurley et al. (1986) Mol. Cell. Biol. 6:559-565 and Weissbach & Weissbach, 1988, Methods for Plant Molecular Biology, Academic Press, NY, Section VIII, pp 421-463에 기술되어 있다.
다른 구현예에서, 본 발명의 CTP로 변형된 hGH는 본 발명의 폴리펩타이드를 코딩하는 폴리뉴클레오티드를 이용하여 합성된다. 다른 구현예에서, 본 발명의 CTP로 변형된 hGH를 코딩하는 폴리뉴클레오티드는, cis-조절 서열 (예, 프로모터 서열)의 전사 통제를 포함하는 발현 벡터로 삽입된다. 다른 구현예에서, cis-조절 서열은 본 발명의 성장 호르몬의 구성적인 발현을 지시하는데 적합한 것이다. 다른 구현예에서, cis-조절 서열은 본 발명의 CTP로 변형된 hGH의 조직 특이적인 발현을 지시하는데 적합한 것이다. 다른 구현예에서, cis-조절 서열은 본 발명의 CTP로 변형된 hGH의 유도성 발현을 지시하는데 적합한 것이다.
다른 구현예에서, 본 발명에 사용하기 적합한 조직-특이적인 프로모터는 특정 세포 집단에서 기능하는 서열을 포함하며, 예컨대, 비제한적인 예로서, 간 특이적인 알부민 등의 프로모터 [Pinkert et al., (1987) Genes Dev. 1:268-277], 림프계 특이 프로모터 [Calame et al., (1988) Adv. Immunol. 43:235-275]; 특히 T 세포 수용체 [Winoto et al., (1989) EMBO J. 8:729-733] 및 면역글로불린 [Banerji et al. (1983) Cell 33729-740]의 프로모터, 뉴로필라멘트 프로모터 [Byrne et al. (1989) Proc. Natl. Acad. Sci. USA 86:5473-5477] 등의 뉴론-특이적인 프로모터, 췌장-특이적인 프로모터 [Edlunch et al. (1985) Science 230:912-916] 또는 유청 프로모터 (미국 특허 4,873,316 및 유럽 출원 공개 번호 264,166) 등의 유선-특이적인 프로모터가 있다. 본 발명에 사용하기 적합한 유도성 프로모터는 예컨대 테트라사이클린-유도성 프로모터 (Srour, M.A., et al., 2003. Thromb. Haemost. 90: 398-405)를 포함한다.
일 구현예에서, "폴리뉴클레오티드 분자"라는 표현은 RNA 서열, 상보적인 폴리뉴클레오티드 서열 (cDNA), 게놈 폴리뉴클레오티드 서열 및/또는 컴포지트 폴리뉴클레오티드 서열 (예, 전술한 것의 조합)의 형태로 분리 및 제공되는, 단일 가닥 또는 이중 가닥의 핵산 서열을 지칭한다.
일 구현예에서, "상보적인 폴리뉴클레오티드 서열"은 역전사효소 또는 임의의 다른 RNA 의존적인 DNA 중합효소를 이용하여 메신저 RNA의 역전사로부터 만들어지는 서열을 지칭한다. 일 구현예에서, 이 서열은 DNA 중합효소를 이용하여 이후에 생체내 또는 시험관내에서 증폭시킬 수 있다.
일 구현예에서, "게놈 폴리뉴클레오티드 서열"은 염색체로부터 유래된 (분리된) 서열을 지칭하며, 염색체의 연속된 영역을 나타낸다.
일 구현예에서, "컴포지트 폴리뉴클레오티드 서열"은 적어도 부분적으로 상보적이며 적어도 부분적으로 게놈인 서열을 지칭한다. 일 구현예에서, 컴포지트 서열은 본 발명의 폴리뉴클레오티드를 코딩하는데 필수적인 일부 엑손 서열 뿐만 아니라 그 사이에 있는 일부 인트론 서열을 포함할 수 있다. 일 구현예에서, 상기 인트론 서열은 다른 유전자의 것을 비롯하여 임의의 소스의 것일 수 있으며, 전형적으로 보존된 스플라이싱 신호 서열을 포함할 것이다. 일 구현예에서, 인트론 서열은 cis로 작용하는 발현 조절 인자를 포함한다.
다른 구현예에서, 본 발명의 폴리뉴클레오티드는 실시예 1에 기술된 PCR 기법 또는 당해 기술 분야의 당업자에게 공지된 임의의 다른 방법 또는 공정을 이용하여 제조된다. 일부 구현예들에서, 상기 공정은 2개의 다른 DNA 서열들을 연결하는 단계를 포함한다 (예, "Current Protocols in Molecular Biology", eds. Ausubel et al., John Wiley & Sons, 1992).
일 구현예에서, 본 발명의 폴리뉴클레오티드를 발현 벡터 (즉, 핵산 구조체)에 삽입하여, 재조합 폴리펩타이드를 발현시킬 수 있다. 일 구현예에서, 본 발명의 발현 벡터는 이 벡터를 원핵 생물에서의 복제 및 병합 (integration)에 적합할 수 있도록 해주는 부가적인 서열을 포함한다. 일 구현예에서, 본 발명의 발현 벡터는 이 벡터를 진핵 생물에서의 복제 및 병합에 적합할 수 있도록 해주는 부가적인 서열을 포함한다. 일 구현예에서, 본 발명의 발현 벡터는 이 벡터를 원핵 생물과 진핵 생물 둘다에서 복제 및 병합에 적합하게 하는 셔틀 벡터를 포함한다. 다른 구현예에서, 클론닝 벡터는 전사 및 번역 개시 서열 (예, 프로모터, 인핸서) 및 전사 및 번역 종결인자 (예, 폴리아데닐화 신호)를 포함한다.
일 구현예에서, 다양한 원핵 생물 또는 진핵 생물 세포는 본 발명의 CTP로 변형된 hGH를 발현시키기 위한 숙주-발현 시스템으로서 사용될 수 있다. 일부 구현예들에서, 이러한 것으로는, 비제한적인 예로서, 미생물, 예컨대, 폴리펩타이드 코딩 서열을 포함하는, 재조합 박테리오파지 DNA, 플라스미드 DNA 또는 코스미드 DNA 발현 벡터로 형질전환된 박테리아; 폴리펩타이드 코딩 서열을 포함하는 재조합 효모 발현 벡터로 형질전환된 효모; 폴리펩타이드 코딩 서열을 포함하는, 재조합 바이러스 발현 벡터(예, 콜리플라워 모자이크 바이러스, CaMV; 토바코 모자이크 바이러스, TMV) 또는 Ti 플라스미드 등의 재조합 플라스미드 발현 벡터로 형질전환된 식물 세포 시스템을 포함한다.
다른 구현예에서, 본 발명의 성장 인자를 발현시키기 위해 비-박테리아성 발현 시스템 (예, CHO 세포 등의 포유류 발현 시스템)이 사용된다. 일 구현예에서, 본 발명의 폴리뉴클레오티드를 포유류 세포에서 발현시키기 위해 사용되는 발현 벡터는, CMV 프로모터와 네오마이신 내성 유전자를 포함하는 pCI-DHFR 벡터이다. pCI-dhfr 벡터의 구축은 실시예 1에서 일 실시예로 기술된다.
다른 구현예에서, 본 발명의 박테리아 시스템에서, 발현되는 폴리펩타이드에 대해 의도된 용도에 따라 다수의 발현 벡터들을 유리하게 선택될 수 있다. 일 구현예에서, 다량의 폴리펩타이드가 바람직하다. 일 구현예에서, 아마, 발현되는 산물을 박테리아의 원형질막 공간 (periplasm)으로 또는 단백질 산물이 쉽게 정제되는 배양 배지로 향하게 하는, 소수성 신호 서열과의 융합체로서, 단백질 산물을 높은 수준으로 발현되게 하는 벡터가 바람직할 것이다. 일 구현예에서, 특정 융합 단백질은 폴리펩타이드의 회수를 돕기 위해 특이적인 절단 부위를 구비하도록 조작된다. 일 구현예에서, 이러한 조작으로 개조가능한 벡터로는, E. coli 발현 벡터의 pET 시리즈가 있으나, 이로 한정되지 않는다 [Studier et al., Methods in Enzymol. 185:60-89 (1990)].
일 구현예에서, 효모 발현 시스템이 사용된다. 일 구현예에서, 구성적인 프로모터 또는 유도성 프로모터를 포함하는 다수의 벡터들이 미국 특허 출원 제 5,932,447호에 기술된 바와 같이 효모에 사용될 수 있다. 다른 구현예에서, 효모 염색체로의 외래 DNA 서열의 병합을 촉진시키는 벡터가 사용된다.
일 구현예에서, 본 발명의 발현 벡터는, 예컨대, 내부 리보좀 도입부 (IRES)와 같은 단일 mRNA 및 프로모터-키메라 폴리펩타이드의 게놈 병합을 위한 서열로부터 수종의 단백질 번역을 허용하는, 추가적인 폴리뉴클레오티드 서열들을 더 포함할 수 있다.
일부 구현예들에서, 포유류 발현 벡터로는, 인비트로겐 사로부터 입수가능한, pcDNA3, pcDNA3.1(+/-), pGL3, pZeoSV2(+/-), pSecTag2, pDisplay, pEF/myc/cyto, pCMV/myc/cyto, pCR3.1, pSinRep5, DH26S, DHBB, pNMT1, pNMT41 및 pNMT81, 프로메가 사로부터 입수가능한 pCI, 스트라테진 사로부터 입수가능한, pMbac, pPbac, pBK-RSV 및 pBK-CMV, 클론텍사로부터 입수가능한 pTRES, 및 이들의 유도체가 있으나, 이들로 한정되는 것은 아니다.
다른 구현예에서, 본 발명에서는 레트로바이러스와 같이, 진핵 생물 바이러스 유래의 조절 인자를 포함하는 발현 벡터가 사용된다. SV40 벡터로는 pSVT7 및 pMT2가 있다. 일부 구현예들에서, 소 파필로마 바이러스 유래 벡터로는 pBV-1MTHA가 있으며, 엡스타인 바 바이러스 유래의 바이러스로는 pHEBO 및 p2O5가 있다. 다른 예시적인 벡터로는, pMSG, pAV009/A+, pMTO10/A+, pMAMneo-5, 베큘로바이러스 pDSVE, 및 SV-40 초기 프로모터, SV-40 후기 프로모터, 메탈로티오네인 프로모터, 뮤라인 유방암 바이러스 프로모터, 라우스 육종 바이러스 프로모터, 폴리헤드린 프로모터 또는 진핵 생물 세포에서의 발현에 유효한 것으로 입증된 그외 프로모터의 지시 하에, 단백질의 발현을 허용하는, 임의의 다른 벡터를 포함한다.
다른 구현예에서, 재조합 바이러스 벡터는 측면 감염(lateral infection) 및 타겟팅 특이성과 같은 이점을 제공하기 때문에, 본 발명의 CTP로 변형된 GH를 생체내 발현시키는데 사용가능하다. 일 구현예에서, 측면 감염은 예컨대 레트로바이러스의 생활 주기에에 내재되어 있으며, 감염된 단일 세포가 출아되어 이웃한 세포를 감염하는 자손 비리온을 만들어내는 프로세스이다. 다른 구현예에서, 그 결과 거대 면적이 급속도로 감염되게 되며, 대부분은 처음에 오리지날 바이러스 입자로 감염되지 않았다. 일 구현예에서, 옆으로 전파할 수 없는 바이러스 벡터가 제조된다. 다른 구현예에서, 이러한 특징은, 원하는 목적이 국한된 수의 타겟 세포에만 특정된 유전자를 도입하고자 하다면, 유용할 수 있다.
다른 구현예에서, 다양한 방법을 이용하여, 본 발명의 발현 벡터를 세포내로 도입할 수 있다. 이러한 방법들은 일반적으로 Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992), in Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1989), Chang et al., Somatic Gene Therapy, CRC Press, Ann Arbor, Mich. (1995), Vega et al., Gene Targeting, CRC Press, Ann Arbor Mich. (1995), Vectors: A Survey of Molecular Cloning Vectors and Their Uses, Butterworths, Boston Mass. (1988) 및 Gilboa et at. [Biotechniques 4 (6): 504-512, 1986]에 기술되어 있으며, 예컨대, 안정적인 또는 일시적인 형질감염, 리포펙션, 전기천공 및 재조합 바이러스 벡터로의 감염을 포함한다. 또한, 파지티브-네거티브 선별 방법에 대해 미국 특허 5,464,764 및 5,487,992를 참조한다.
다른 구현예에서, 바이러스 감염을 통한 핵산의 도입은, 바이러스의 감염 특성으로 인해 보다 높은 형질감염 효율을 달성할 수 있기 때문에, 리포펙션 및 전기천공 등의 다른 방법들에 비해 몇가지 이점을 제공해준다.
일 구현예에서, 본 발명의 CTP로 변형된 GH가, 또한 전술한 임의의 적합한 투여 방식 (즉, 생체내 유전자 요법)을 채택하여 개체에게 투여되는 핵산 구조체로부터 발현될 수 있음은 자명할 것이다. 일 구현예에서, 핵산 구조체를, 적절한 유전자 전달 비히클/방법 (형질감염, 형질전이, 상동성 재조합 등)과 필요에 따라서는 발현 시스템을 통해 적절한 세포로 도입한 후, 변형된 세포를 배양을 통해 증폭시키고 개체에게로 다시 회귀시킨다 (즉, 생체외 유전자 요법).
일 구현예에서, 성장 호르몬을 이용한 생체내 유전자 요법은 동물 모델들에서 수행된 바 있다.
일 구현예에서, 식물 발현 벡터를 이용한다. 일 구현예에서, 폴리펩타이드 코딩 서열의 발현은 다수의 프로모터에 의해 구동된다. 일부 구현예들에서, CaMV의 35S RNA 및 19S RNA 프로모터들 [Brisson et al., Nature 310:511-514 (1984)], 또는 TMV의 막 단백질 프로모터 [Takamatsu et al., EMBO J. 6:307-311 (1987)] 등의 바이러스 프로모터가 사용된다. 다른 구현예에서, 예컨대, RUBISCO의 소형 서브유닛 [Coruzzi et al., EMBO J. 3:1671-1680 (1984); 및 Brogli et al., Science 224:838-843 (1984)] 또는 열 충격 프로모터, 예컨대 soybean hsp17.5-E 또는 hsp17.3-B [Gurley et al., Mol. Cell. Biol. 6:559-565 (1986)]와 같은 식물 프로모터들이 사용된다. 일 구현예에서, 구조체는 Ti 플라스미드, Ri 플라스미드, 식물 바이러스 벡터, DNA의 직접 형질전환, 미세주입, 전기천공 및 그외 당업자에게 잘 공지된 기법을 이용하여 식물 세포로 도입된다. 예로, Weissbach & Weissbach [Methods for Plant Molecular Biology, Academic Press, NY, Section VIII, pp 421-463 (1988)]를 참조한다. 곤충 및 포유류 숙주 세포 시스템과 같이 당해 기술 분야에 잘 공지된 다른 발현 시스템들도 본 발명에서 사용될 수 있다.
삽입된 코딩 서열 (폴리펩타이드 코딩 서열)의 전사 및 번역에 필수적인 요소를 포함하는 것 이외에도, 본 발명의 발현 구조체는 또한 발현된 폴리펩타이드의 안정성, 생산, 정제, 수율 또는 활성을 최적화하도록 조작된 서열을 포함할 수 있음은 자명할 것이다.
일부 구현예들에서, 숙주 세포 시스템에 본 발명의 발현 벡터를 도입하기 위해 다양한 방법들이 사용될 수 있다. 일부 구현예들에서, 이러한 방법들은 일반적으로 Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992), in Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1989), Chang et al., Somatic Gene Therapy, CRC Press, Ann Arbor, Mich. (1995), Vega et al., Gene Targeting, CRC Press, Ann Arbor Mich. (1995), Vectors: A Survey of Molecular Cloning Vectors and Their Uses, Butterworths, Boston Mass. (1988) 및 Gilboa et at. [Biotechniques 4 (6): 504-512, 1986]에 기술되어 있으며, 예컨대 안정적인 또는 일시적인 형질감염, 리포펙션, 전기천공 및 재조합 바이러스 벡터에 의한 감염을 포함한다. 또한, 파지티브-네거티브 선별 방법에 대해 미국 특허 5,464,764 및 5,487,992를 참조한다.
일 구현예에서, 형질전환된 세포는, 재조합 폴리펩타이드를 다량 발현시킬 수 있는, 유효 조건 하에 배양된다. 다른 구현예에서, 유효 배양 조건은, 비제한적인 예로서, 단백질 생산을 허용하는 유효 배지, 생물반응기, 온도, pH 및 산소 조건을 포함한다. 일 구현예에서, 유효 배지는 본 발명의 재조합 폴리펩타이드를 생산하기 위해 세포를 배양하는, 모든 배지를 지칭한다. 다른 구현에에서, 배지는 전형적으로 동화가능한 탄소원, 질소원 및 인원, 및 적절한 염, 미네랄, 금속 및 비타민 등의 그외 영양분을 포함하는 수계 용액이다. 다른 구현예에서, 본 발명의 세포는 기존의 발효 생물반응기, 교반 플라스크, 시험관, 마이크로타이터 디쉬 및 페트리 플레이트에서 배양할 수 있다. 다른 구현예에서, 배양은 재조합 세포에게 적합한 온도, pH 및 산소 함유율 조건에서 수행된다. 다른 구현예에서, 배양 조건은 당해 기술 분야의 당업자의 지식내에 포함된다.
다른 구현예에서, 생산에 사용되는 벡터 및 숙주 시스템에 따라, 본 발명의 제조되는 성장 인자는 재조합 세포 안에 체류하거나, 발효 배지로 분비되거나, E. coli와 같이 페리플라스믹 공간 등의 2개의 세포막 사이 공간으로 분비되거나, 또는 세포나 바이러스의 막의 외부 표면 상에 유지된다.
일 구현예에서, 소정의 시간동안 배양한 후, 재조합 폴리펩타이드를 회수한다.
일 구현예에서, "재조합 폴리펩타이드의 회수"라는 표현은 본원에서 폴리펩타이드를 함유한 전체 발현 배지를 수집하는 것을 지칭하며, 추가적인 분리 또는 정제 단계를 내포하지 않을 수 있다.
일 구현예에서, 본 발명의 성장 호르몬은, 비제한적인 예로서, 친화성 크로마토그래피, 이온 교환 크로마토그래피, 여과, 전기영동, 소수성 상호작용 크로마토그래피, 겔 여과 크로마노그래피, 역상 크로마토그래피, 콘카나발린 A 크로마토그래피, 크로마토포커싱 및 차별적인 가용화 등의 다양한 단백질 정제 표준 기법을 이용하여 정제된다.
일 구현예에서, 용이한 회수를 위해, 발현된 코딩 서열은 본 발명의 폴리펩타이드 및 융합된 절단성 모이어티를 코딩하도록 조작될 수 있다. 일 구현예에서, 융합 단백질은, 폴리펩타이드가 친화성 크로마토그래피, 예컨대 절단가능한 모이어티에 대해 특이적인 컬럼 상에서의 고정화에 의해 쉽게 분리될 수 있도록, 설계될 수 있다. 일 구현예에서, 절단 부위는 폴리펩타이드와 절단가능한 모이어티 사이에 위치되게 조작되며, 폴리펩타이드는 그 부위에서 융합 단백질을 특이적으로 절단시키는 적정 효소나 제제 처리에 의해 크로마토그래피 컬럼으로부터 분리시킬 수 있다 [예, Booth et al., Immunol. Lett. 19:65-70 (1988); 및 Gardella et al., J. Biol. Chem. 265:15854-15859 (1990)].
일 구현예에서, 본 발명의 폴리펩타이드는 "실질적으로 순수한" 형태로 회수된다.
일 구현예에서, "실질적으로 순수한"이라는 표현은 본원에 기술된 용도로 단백질을 효과적으로 사용할 수 있는 순도를 지칭한다.
일 구현예에서, 본 발명의 폴리펩타이드는 또한 시험관내 발현 시스템을 이용하여 합성할 수 있다. 일 구현예에서, 시험관내 합성 방법은 당해 기술 분야에 잘 알려져 있으며, 시스템의 구성들은 상업적으로 입수가능하다.
일 구현예에서, CTP 변형된 GH 생산은 재조합 DNA 기법을 이용하여 수행된다.
다른 구현예에서, 재조합 폴리펩타이드를 합성 및 정제하고, 이의 치료학적 효능을 생체내 또는 시험관내에서 분석할 수 있다. 일 구현예에서, 본 발명의 CTP로 변형된 재조합 GH의 결합 활성은 다양한 분석을 이용하여 확인할 수 있다.
일 구현예에서, 본 발명은 CTP-hGH-CTP-CTP 폴리펩타이드를 포함한다. 일 구현예에서, 재조합 DNA 기법들은 실시예 1에 예시된 바와 같이 CTP-hGH-CTP-CTP 폴리펩타이드들을 제조하는데 사용된다. 일 구현예에서, 본 발명의 CTP-hGH-CTP-CTP 폴리펩타이드의 치료학적 효과는 생체내에서 평가된다. 일 구현예에서, 본 발명의 CTP-hGH-CTP-CTP 폴리펩타이드의 치료학적 효과는 시험관내에서 평가된다. 일 구현예에서, 본 발명의 재조합 hGH 폴리펩타이드의 결합 활성은, 사전에 인간 성장 호르몬 수용체로 형질감염시킨, Nb2 (프로락틴-의존형 랫 림프종 세포주 (ECACC 세포은행)) 또는 FCD-P1 뮤라인 세포주를 이용하여 측정된다. 일 구현예에서, 이들 수용체로의 hGH의 결합은, 일 구현예에서, hGH 활성의 함수로서 MTT 세포 염색 수준에 의해 측정되는, 세포 증식을 유도한다. 일 구현예에서, 생체내 활성은 치료받은 성장 호르몬 결핍 동물에서 경시적으로 체증 증가를 측정함으로써 추정된다.
일 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀의 카르보시 말단 펩타이드 (CTP) 하나, 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 성장 또는 체증 증가가 유도되는, 개체에서 성장 또는 체중 증가를 유도하는 방법을 제공한다.
다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 성장이 유도되는, 인간 개체의 성장을 유도하는 방법을 제공한다. 일 구현예에서, 상기 인간 개체는 청소년이다. 다른 구현예에서, 상기 인간 개체는 어린이이다. 다른 구현예에서, 상기 인간 개체는 GH-결핍성 어린이다.
다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 체중 증가가 유도되는, 인간 개체에서 체중 증가를 유도하는 방법을 제공한다. 일 구현예에서, 상기 인간 개체는 청소년이다. 다른 구현예에서, 상기 인간 개체는 어린이이다. 다른 구현예에서, 상기 인간 개체는 GH-결핍성 어린이다.
다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 체중 감소 또는 체지방 감소가 유도되는, 인간 개체에서 체중 감소 또는 체지방 감소를 유도하는 방법을 제공한다. 일 구현예에서, 상기 개체는 비만이다. 다른 구현예에서, 상기 개체는 과체중이다. 다른 구현예에서, 상기 개체는 성인이다. 다른 구현예에서, 상기 인간 개체는 GH-결핍성 성인이다.
다른 구현예에서, 본 발명은, 개체의 지방 축적을 낮추는 방법을 제공한다. 다른 구현예에서, 본 발명은, 개체에서 근량을 높이는 방법을 제공한다. 다른 구현예에서, 본 발명은, 개체에서 근육 성장을 촉진하는 방법을 제공한다. 다른 구현예에서, 상기 개체는 성인이다. 다른 구현예에서, 상기 인간 개체는 GH-결핍성 성인이다. 다른 구현예에서, 본 발명은, 근육/지방 비율을 높이는 방법을 제공한다. 다른 구현예에서, 본 발명은, 체질량 지수 (BMI) 또는 케틀레 지수 (Quetelet index)를 낮추는 방법을 제공한다.
다른 구현예에서, 본 발명은 본원에 기술된 CTP로 변형된 성장 호르몬을 개체에게 투여하는 단계를 포함하는 개체에서 성장을 유도하는 방법을 제공한다. 일 구현예에서, CTP-변형된 성장 호르몬은 개체에 직접 투여되며, 다른 구현예로, 상기 CTP-변형된 성장 호르몬을 코딩하는 폴리뉴클레오티드가 개체에게 투여된다. 다른 구현예에서, 본 발명은, 공지 부형제, 공지 비히클 및 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나와 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나토트로핀 카르복시 말단 펩타이드 2개를 포함하는 폴리펩타이드로 구성된 조성물을 개체에게 투여하는 단계를 포함하는 개체에서 성장을 유도하는 방법을 제공한다. 다른 구현예에서, 본 발명은, 공지 부형제, 공지 비히클 및 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나와 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나토트로핀 카르복시 말단 펩타이드 2개로 구성된 폴리펩타이드로 구성된 조성물을 개체에게 투여하는 단계를 포함하는 개체에서 성장을 유도하는 방법을 제공한다.
다른 구현예에서, 성장은 체중 증가로 측정된다. 다른 구현예에서, 성장은 키 증가로 측정된다. 다른 구현예에서, 성장은 체중 증가로 측정된다. 다른 구현예에서, 성장은 근량 증가로 측정된다. 다른 구현예에서, 성장은 체중 증가로 측정된다. 다른 구현예에서, 성장은 골량 증가로 측정된다. 다른 구현예에서, 성장은 체중 증가로 측정된다. 다른 구현예에서, 성장은 지방 증가로 측정된다. 다른 구현예에서, 성장은 당해 기술 분야의 당업자에게 공지된 임의의 방법으로 측정된다. 다른 구현예에서, 성장을 측정하는 개체는 어린이이다. 다른 구현예에서, 성장을 측정하는 개체는 GH-결핍성 어린이이다.
다른 구현예에서, 본 발명의 CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-90 ㎍ 용량으로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-50 ㎍ 용량으로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-25 ㎍ 용량으로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 50-90 ㎍ 용량으로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 10-50 ㎍ 용량으로 투여된다.
다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-90 ㎍ 용량으로 근육내 (IM) 주입, 피하 (SC) 주입, 또는 정맥내 (IV) 주입으로 주 당 1회로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-90 ㎍ 용량으로 근육내 (IM) 주입, 피하 (SC) 주입, 또는 정맥내 (IV) 주입으로 주당 2회로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-90 ㎍ 용량으로 근육내 (IM) 주입, 피하 (SC) 주입, 또는 정맥내 (IV) 주입으로 주당 3회로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-90 ㎍ 용량으로 근육내 (IM) 주입, 피하 (SC) 주입, 또는 정맥내 (IV) 주입으로 2주 당 1회로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-90 ㎍ 용량으로 근육내 (IM) 주입, 피하 (SC) 주입, 또는 정맥내 (IV) 주입으로 17일 당 1회로 투여된다. 다른 구현예에서, CTP로 변형된 GH를 포함하는 폴리펩타이드는 0.1-5 ml 용액 중의 1-90 ㎍ 용량으로 근육내 (IM) 주입, 피하 (SC) 주입, 또는 정맥내 (IV) 주입으로 19일 당 1회로 투여된다.
다른 구현예에서, 본 발명의 CTP로 변형된 GH와 같이 분자량이 50,000 달톤 보다 낮은 단백질 약물은 일반적으로 생체내에서 수명이 짧은 종이며, 수시간의 짧은 순환성 반감기를 가진다. 다른 구현예에서, 일반적으로 피하 투여 경로는 순환계로의 좀더 느린 방출을 제공한다. 다른 구현예에서, 본 발명의 CTP 변형된 폴리펩타이드는 GH와 같이 분자량이 50,000 달톤 보다 낮은 단백질 약물의 반감기를 연장시킨다. 다른 구현예에서, 본 발명의 CTP 변형된 폴리펩타이드는 보다 장기간 동안 GH가 유익한 효과를 발휘하게 할 수 있다.
다른 구현예에서, CTP 변형된 GH를 포함하는 CTP 변형된 폴리펩타이드의 면역원성은 분리된 GH와 동일하다. 다른 구현예에서, CTP 변형된 GH를 포함하는 CTP 변형된 폴리펩타이드의 면역원성은 분리된 GH와 비슷하다. 다른 구현예에서, 본원에 기술된 바와 같이 CTP 펩타이드를 이용한 GH 변형은 GH의 면역원성을 낮춘다. 다른 구현예에서, GH를 포함하는 CTP 변형된 폴리펩타이드는 분리된 GH 단백질과 같이 활성을 나타낸다. 다른 구현예에서, GH를 포함하는 CTP 변형된 폴리펩타이드는 분리된 GH 보다 활성이 높다. 다른 구현예에서, GH를 포함하는 CTP 변형된 폴리펩타이드는 생활성의 저하는 최소화되고 성장 호르몬의 보호력은 최대화된다.
다른 구현예에서, 본 발명의 CTP로 변형된 GH는 그대로 개체에게 제공된다. 일 구현예에서, 본 발명의 CTP로 변형된 GH는 약제학적으로 허용가능한 담체와 혼합되는 약학 조성물의 일부로서 개체에게 제공될 수 있다.
다른 구현예에서, "약학 조성물"은 생리학적으로 적합한 담체 및 부형제 등의 다른 화학 성분과 본원에 기술된 활성 성분 하나 이상으로 구성된 조제물을 지칭한다. 약학 조성물의 목적은 유기체에 화합물의 투여를 쉽게 하기 위한 것이다.
다른 구현예에서, "활성 성분"은 생물학적 효과를 담당하는 대상 폴리펩타이드 서열을 지칭한다.
일 구현예에서, 본 발명은 조합된 조제물 (combined preparation)을 제공한다. 일 구현예에서, "조합된 조제물"은, 전술한 조합 파트너를 독립적으로 투여하거나, 또는 상당량의 조합 파트너와의 여러가지 고정된 조합물들을 예를 들어, 동시에, 공동으로, 개별적으로 또는 순차적으로 사용함으로써 투여하는 의미에서, 특히 "부품 키트(kit of parts)"로 규정된다. 다른 구현예에서, 이후, 부품 키트의 구성 요소들을, 예컨대 동시에, 또는 연대적 시차적으로 (chronologically staggered), 즉, 여러가지 시간대에, 부품 키트를 구성하는 임의 구성 요소에 대해 동일한 또는 상이한 시간 간격으로 투여할 수 있다. 조합 파트너들의 총량 비율을 조합된 조제물로 투여할 수 있다. 조합된 조제물은, 예컨대, 당해 기술 분야의 당업자에게 자명할 수 있는 바와 같이, 치료할 환자 서브개체군의 요구, 또는 특정 질환, 질환의 중증도, 연령, 성별 또는 체중에 따라 차이가 필요한 단일 환자의 요구를 처리하기 위해, 다변화될 수 있다.
다른 구현예에서, "생리적으로 허용가능한 담체" 및 "약제학적으로 허용가능한 담체"라는 표현은 상호 호환적으로 유기체에 유의한 자극을 야기하지 않으며, 투여된 화합물의 생물 활성 및 특성을 방해하지 않는 담체 또는 희석제를 지칭한다. 보강제도 이러한 표현에 포함된다. 일 구현예에서, 약제학적으로 허용가능한 담체에 포함되는 성분들 중 한가지는, 예컨대 유기 매질과 수성 매질 둘다에 광범위한 용해성을 가진 생체친화적인 폴리머인 폴리에틸렌 글리콜(PEG)일 수 있다 (Mutter et al. (1979).
다른 구현예에서, "부형제"는 활성 성분의 투여를 더욱 쉽게 할 수 있도록 하기 위해 약학 조성물에 첨가되는 비활성 물질을 지칭한다. 일 구현예에서, 부형제는 칼슘 카보네이트, 칼슘 포스페이트, 다양한 당류 및 전분 타입들, 셀룰로스 유도체, 젤라틴, 식물성 오일 및 폴리에틸렌 글리콜을 포함한다.
약물의 제형화 및 투여 기법들은 "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, PA, latest edition에서 찾아볼 수 있으며, 이 문헌은 원용에 의해 본 명세서에 포함된다.
다른 구현예에서, 적정 투여 경로는, 예컨대, 경구, 직장, 경점막, 경비, 장 또는 비경구 전달, 예컨대 근육내, 피하 및 골수강내(intramedullary) 주입 뿐만 아니라 척수강내(intrathecal), 직접 뇌실내(intraventricular), 정맥내, 복막내, 코내 또는 안내 주입을 포함한다.
다른 구현예에서, 조제물은 전신 방식 보다는 국소로, 예컨대 환자 신체의 특정 부위에 직접 조제물을 주입함으로써 국소로 투여된다.
본 발명은 다양한 용량 범위의 구현예들을 포괄한다. 본 발명의 CTP로 변형된 GH의 투여량은, 일 구현예에서, 0.005-100 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.005-5 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.01-50 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.1-20 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.1-10 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.01-5 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.001-0.01 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.001-0.1 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.1-5 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.5-50 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.2-15 mg/day의 범위이다. 다른 구현예에서, 투여량은 0.8-65 mg/day의 범위이다. 다른 구현예에서, 투여량은 1-50 mg/day의 범위이다. 다른 구현예에서, 투여량은 5-10 mg/day의 범위이다. 다른 구현예에서, 투여량은 8-15 mg/day의 범위이다. 다른 구현예에서, 투여량은 10-20 mg/day의 범위이다. 다른 구현예에서, 투여량은 20-40 mg/day의 범위이다. 다른 구현예에서, 투여량은 60-120 mg/day의 범위이다. 다른 구현예에서, 투여량은 12-40 mg/day의 범위이다. 다른 구현예에서, 투여량은 40-60 mg/day의 범위이다. 다른 구현예에서, 투여량은 50-100 mg/day의 범위이다. 다른 구현예에서, 투여량은 1-60 mg/day의 범위이다. 다른 구현예에서, 투여량은 15-25 mg/day의 범위이다. 다른 구현예에서, 투여량은 5-10 mg/day의 범위이다. 다른 구현예에서, 투여량은 55-65 mg/day의 범위이다. 다른 구현예에서, 투여량은 1-5 mg/day의 범위이다.
본 발명의 CTP로 변형된 GH의 투여량은, 일 구현예에서, 0.005-100 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.005-5 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.01-50 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.05-7.2 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.05-7.2 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.05-7.2 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.1-20 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.1-10 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.01-5 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.001-0.01 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.001-0.1 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.1-5 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.5-50 mg/week의 범위이다. 다른 구현예에서, 투여량은 0.2-15mg/week의 범위이다. 다른 구현예에서, 투여량은 0.26-10.7mg/week의 범위이다. 다른 구현예에서, 투여량은 0.8-65 mg/week의 범위이다. 다른 구현예에서, 투여량은 1-50 mg/week의 범위이다. 다른 구현예에서, 투여량은 5-10 mg/week의 범위이다. 다른 구현예에서, 투여량은 8-15 mg/week의 범위이다. 다른 구현예에서, 투여량은 10-20 mg/week의 범위이다. 다른 구현예에서, 투여량은 20-40 mg/week의 범위이다. 다른 구현예에서, 투여량은 60-120 mg/week의 범위이다. 다른 구현예에서, 투여량은 12-40 mg/week의 범위이다. 다른 구현예에서, 투여량은 40-60 mg/week의 범위이다. 다른 구현예에서, 투여량은 50-100mg/week의 범위이다. 다른 구현예에서, 투여량은 1-60 mg/week의 범위이다. 다른 구현예에서, 투여량은 15-25 mg/week의 범위이다. 다른 구현예에서, 투여량은 5-10 mg/week의 범위이다. 다른 구현예에서, 투여량은 55-65 mg/week의 범위이다. 다른 구현예에서, 투여량은 1-5 mg/week의 범위이다.
다른 구현예에서, 개체에세 제공되는 GH 투여량은 동일 개체 집단 (예, 어린이, 노인층, 남성, 여성, GH 결핍, 특정 민족 등)의 기준 개체에게 제공되는 표준 투여량의 50%이다. 다른 구현예에서, 투여량은 특정 개체 집단의 개체에게 제공되는 투여량의 30%이다. 다른 구현예에서, 투여량은 특정 개체 집단의 개체에게 제공되는 투여량의 45%이다. 다른 구현예에서, 투여량은 특정 개체 집단의 개체에게 제공되는 투여량의 100%이다.
다른 구현예에서, 투여량은 1-5 mg/week이다. 다른 구현예에서, 투여량은 2 mg/week이다. 다른 구현예에서, 투여량은 4 mg/week이다. 다른 구현예에서, 투여량은 1.2 mg/week이다. 다른 구현예에서, 투여량은 1.8 mg/week이다. 다른 구현예에서, 투여량은 대략 본원에 기술된 투여량이다.
다른 구현예에서, 투여량은 1-5 mg/투여이다. 다른 구현예에서, 투여량은 2 mg/투여이다. 다른 구현예에서, 투여량은 4 mg/투여이다. 다른 구현예에서, 투여량은 1.2 mg/투여이다. 다른 구현예에서, 투여량은 1.8 mg/투여이다. 일 구현예에서, 조성물은 주 당 1회로 투여된다. 다른 구현예에서, 조성물은 2주 당 1회로 투여된다. 다른 구현예에서, 조성물은 매달 투여된다. 다른 구현예에서, 조성물은 매일 투여된다.
다른 구현예에서, CTP로 변형된 GH는 코내 투약 형태 (dosage form)로 제형화된다. 다른 구현예에서, CTP로 변형된 GH는 주사용 투약 형태로 제형화된다. 다른 구현예에서, CTP로 변형된 GH는 0.0001 mg - 0.6 mg 범위의 용량으로 개체에게 투여된다. 다른 구현예에서, CTP로 변형된 GH는 개체에게 0.001 mg - 0.005 mg 범위의 용량으로 개체에게 투여된다. 다른 구현예에서, CTP로 변형된 GH는 개체에게 0.005 mg - 0.01 mg 범위의 용량으로 개체에게 투여된다. 다른 구현예에서, CTP로 변형된 GH는 개체에게 0.01 mg - 0.3 mg 범위의 용량으로 개체에게 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 0.2 mg - 0.6 mg 범위의 용량으로 개체에게 투여된다.
다른 구현예에서, CTP로 변형된 GH는 개체에게 1-100 ㎍ 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 10-80 ㎍ 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 20-60 ㎍ 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 10-50 ㎍ 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 40-80 ㎍ 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 10-30 ㎍ 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 30-60 ㎍ 범위의 용량으로 투여된다.
다른 구현예에서, CTP로 변형된 GH는 개체에게 0.2 mg - 2 mg 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 2 mg - 6 mg 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 4 mg - 10 mg 범위의 용량으로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 5 mg - 15 mg 범위의 용량으로 투여된다.
다른 구현예에서, CTP 변형된 GH는 근육으로 주입된다 (근육내 주입). 다른 구현예에서, CTP 변형된 GH는 피부 아래에 주입된다 (피하 주입). 다른 구현예에서, CTP 변형된 GH는 근육으로 주입된다. 다른 구현예에서, CTP 변형된 GH는 피부 아래에 주입된다.
다른 구현예에서, 본 발명의 방법은, CTP 변형된 GH를 필요로 하는 개체에게 제공하는 단계를 포함하며, 이로써, 성장 호르몬 요법 사용에 대한 순응성을 높이는, GH 요법의 사용 순응성을 높이는 방법을 포함한다.
다른 구현예에서, 본 발명의 방법은 GH 요법이 필요한 만성 질환을 앓고 있는 환자의 순응성 증가를 포함한다. 다른 구현예에서, 본 발명의 방법은 전술한 바와 같이 CTP로 GH를 변형함으로써 투여 빈도를 낮출 수 있다. 다른 구현예에서, 용어 순응성은 충실성을 포함한다. 다른 구현예에서, 본 발명의 방법은 GH의 투여 빈도를 줄임으로써 GH 요법을 필요로 하는 환자의 순응성을 높이는 것을 포함한다. 다른 구현예에서, GH의 투여 빈도 감소는 CTP 변형된 GH를 보다 안정적이게 만드는 CTP 변형을 통해 달성된다. 다른 구현예에서, GH의 투여 빈도 감소는 성장 호르몬의 T1/2 증가의 결과로서 달성된다. 다른 구현예에서, GH의 투여 빈도 감소는 GH의 소거 시간 증가의 결과로서 달성된다. 다른 구현예에서, 성장 호르몬의 투여 빈도 감소는 성장 호르몬의 AUC 측정치 증가의 결과로서 달성된다.
따라서, 다른 구현예에서, 본 발명은, 성장 호르몬의 아미노 말단에 융모막성 고나도트로핀 카르복시 말단 펩타이드 하나와, 성장 호르몬의 카르복시 말단에 융모막성 고나도트로핀 카르복시 말단 펩타이드 2개를 부착하는 단계를 포함하며, 이로써 성장 호르몬의 곡선 하 면적 (AUC)을 개선시키는, 성장 호르몬의 곡선 하 면적 (AUC)을 개선시키는 방법을 추가로 제공한다.
이에, 다른 구현예에서, 본 발명은, 성장 호르몬의 아미노 말단에 융모막성 고나도트로핀 카르복시 말단 펩타이드 하나와, 성장 호르몬의 카르복시 말단에 융모막성 고나도트로핀 카르복시 말단 펩타이드 2개를 부착하는 단계를 포함하며, 이로써 성장 호르몬의 투여 빈도를 낮추는, 성장 호르몬의 투여 빈도를 낮추는 방법을 추가로 제공한다.
즉, 다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 개체에게 제공하는 단계를 포함하며, 이로써 성장 호르몬 요법의 사용 순응도를 높이는, 성장 호르몬의 사용 순응도를 높이는 방법을 제공한다.
다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 상기 개체에서 IGF-1 수준을 높이는, 인간 개체에서 인슐린 유사 성장 인자 (IGF-1) 수준을 높이는 방법을 제공한다. 다른 구현예에서, IGF-1 수준을 높이는 방법은 아래 실시예 6에 제공된다.
다른 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 IGF-1 수준을 개체에서 바람직한 치료학적 범위로 증가시키는, 인간 개체에서 인슐린 유사 성장 인자 (IGF-1) 수준을 바람직한 치료학적 범위로 높이는 방법을 제공한다. 다른 구현예에서, 상기 개체는 성인이다. 다른 구현예에서, 상기 인간 개체는 GH-결핍성 성인이다. 다른 구현예에서, 인간 개체는 정상 성인이다. 다른 구현예에서, IGF-1 수준을 바람직한 치료학적 수준으로 높이는 방법은 아래 실시예 9에 제공된다.
일 구현예에서, 본 발명은, 성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며, 이로써 개체에서 IGF-1 수준을 정상 치료학적 범위로 유지하는, 인슐린 유사 성장 인자 (IGF-1) 수준을 정상 치료학적 범위로 개체에서 유지하는 방법을 제공한다. 다른 구현예에서, IGF-1 수준을 정상 치료학적 범위로 유지하는 방법은 아래 실시예 9에 제공된다.
일 구현예에서, 인간 개체에서의 IGF-1의 수준 증가는, 1형 당뇨병, 2형 당뇨병, 근위축성 측색경화증 (amyotrophic lateral sclerosis) (ALS aka "Lou Gehrig's Disease"), 중증 화상 및 근긴장성 이영양증 (MMD)을 치료, 예방 또는 억제하는데 효과적일 수 있다. 다른 구현예에서, 인간 개체에서 IGF-1 수준의 정상 치료학적 범위로의 증가는, 1형 당뇨병, 2형 당뇨병, 근위축성 측색경화증 (ALS aka "Lou Gehrig's Disease"), 중증 화상 및 근긴장성 이영양증 (MMD)을 치료, 예방 또는 억제하는데 효과적일 수 있다.
일 구현예에서, 바람직한 치료학적 범위는, 아래에 추가로 제시된 바와 같이 (실시예 9 참조), 연령 그룹 및 성별로 계층화된, 정상 집단에서 예상되는 평균 IGF-1 수준으로부터 +/- 2 표준편차 내지 -2 표준편차로서 정의된다. 아울러, 실험에서는, 정상 범위에 속하는 환자들의 차이를 관찰하기 위한 목적으로, 표준편차 +/-1.5의 좁은 범위내에서 IGF-1 수준을 측정한다.
다른 구현예에서, CTP 변형된 GH는 개체에게 1일 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH를 포함하는 폴리펩타이드는 개체에게 2일 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 3일 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 4일 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 5일 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 6일 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 주 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 7-14일 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 10-20일 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 5-15일 당 1회로 투여된다. 다른 구현예에서, CTP 변형된 GH는 개체에게 15-30일 당 1회로 투여된다.
다른 구현예에서, 투여량은 50-500 mg/day의 범위이다. 다른 구현예에서, 투여량은 50-150 mg/day의 범위이다. 다른 구현예에서, 투여량은 100-200 mg/day의 범위이다. 다른 구현예에서, 투여량은 150-250 mg/day의 범위이다. 다른 구현예에서, 투여량은 200-300 mg/day의 범위이다. 다른 구현예에서, 투여량은 250-400 mg/day의 범위이다. 다른 구현예에서, 투여량은 300-500 mg/day의 범위이다. 다른 구현예에서, 투여량은 350-500 mg/day의 범위이다.
일 구현예에서, 투여량은 20 mg/day이다. 일 구현예에서, 투여량은 30 mg/day이다. 일 구현예에서, 투여량은 40 mg/day이다. 일 구현예에서, 투여량은 50 mg/day이다. 일 구현예에서, 투여량은 0.01 mg/day이다. 다른 구현예에서, 투여량은 0.1 mg/day이다. 다른 구현예에서, 투여량은 1 mg/day이다. 다른 구현예에서, 투여량은 0.530 mg/day이다. 다른 구현예에서, 투여량은 0.05 mg/day이다. 다른 구현예에서, 투여량은 50 mg/day이다. 다른 구현예에서, 투여량은 10 mg/day이다. 다른 구현예에서, 투여량은 20-70 mg/day이다. 다른 구현예에서, 투여량은 5 mg/day이다.
다른 구현예에서, 투여량은 1-90 mg/day이다. 다른 구현예에서, 투여량은 1-90 mg/2 day이다. 다른 구현예에서, 투여량은 1-90 mg/3 day이다. 다른 구현예에서, 투여량은 1-90 mg/4 day이다. 다른 구현예에서, 투여량은 1-90 mg/5 day이다. 다른 구현예에서, 투여량은 1-90 mg/6 day이다. 다른 구현예에서, 투여량은 1-90 mg/week이다. 다른 구현예에서, 투여량은 1-90 mg/9 day이다. 다른 구현예에서, 투여량은 1-90 mg/11 day이다. 다른 구현예에서, 투여량은 1-90 mg/14 day이다.
다른 구현예에서, 성장 호르몬 투여량은 10-50 mg/day이다. 다른 구현예에서, 투여량은 10-50 mg/2 day이다. 다른 구현예에서, 투여량은 10-50 mg/3 day이다. 다른 구현예에서, 투여량은 10-50 mg/4 day이다. 다른 구현예에서, 투여량은 10-50 mg/5 day이다. 다른 구현예에서, 투여량은 10-50 mg/6 day이다. 다른 구현예에서, 투여량은 10-50 mg/week이다. 다른 구현예에서, 투여량은 10-50 mg/9 day이다. 다른 구현예에서, 투여량은 10-50 mg/11 day이다. 다른 구현예에서, 투여량은 10-50 mg/14 days이다.
경구 투여는, 일 구현예에서, 정제, 캡슐제, 로젠제 (lozenges), 씹어먹는 정제, 현탁제, 에멀젼제 등을 포함하는 단위 투약 형태를 포함한다. 이러한 단위 투약 형태는 본 발명의 바람직한 성장 호르몬을 안전하고 유효한 양으로 포함하며, 이들 각각이 일 구현예에서, 약 0.7 또는 3.5 mg - 약 280 mg/70 kg이고, 또는 다른 구현예에서, 약 0.5 또는 10 mg - 약 210 mg/70 kg이다. 경구 투여를 위한 단위 투약 형태를 제조하는데 적합한 약제학적으로 허용가능한 담체는 당해 기술 분야에 잘 알려져 있다. 일부 구현예들에서, 정제는 통상적으로 칼슘 카보네이트, 소듐 카보네이트, 만니톨, 락토스 및 셀룰로스 등의 비활성 희석제; 전분, 젤라틴 및 슈크로스 등의 결합제; 전분, 알긴산 및 크로스카멜로스 등의 붕해제; 마그네슘 스테아레이트, 스테아르산 및 탈크 등의 윤활제와 같이 통상적인 약제학적으로 혼용가능한 보강제를 포함한다. 일 구현예에서, 분말-혼합물의 유동 특징을 개선시키기 위해 실리콘 다이옥사이드 등의 유동성 개선제(glidant)가 사용될 수 있다. 일 구현예에서, 착색제, 예컨대 FD&C 염료를 외양을 위해 첨가할 수 있다. 아스파르탐, 사카린, 멘톨, 페퍼민트 및 과일향과 같은 감미제 및 향제를 씹어먹는 정제에 사용가능한 보강제이다. 캡슐제는 전형적으로 전술한 하나 이상의 고형 희석제를 포함한다. 일부 구현예들에서, 담체 성분의 선택은, 본 발명의 목적에 있어 중요한 것은 아니지만, 맛, 비용 및 저장 안정성과 같은 부차적인 고려 사항에 따라 결정되며, 당해 기술 분야의 당업자라면 용이하게 실시할 수 있다.
일 구현예에서, 경구 투약 형태는 소정의 방출 프로파일을 포함한다. 일 구현예에서, 본 발명의 경구 투약 형태는 지속 방출 정제(extended release tablet), 캡슐제, 로젠제 또는 씹어 먹는 정제를 포함한다. 일 구현예에서, 본 발명의 경구 투약 형태는 서방형 정제, 캡슐제, 로젠제 또는 씹어 먹는 정제를 포함한다. 일 구현예에서, 본 발명의 경구 투약 형태는 즉시 방출 정제, 캡슐제, 로젠제 또는 씹어 먹는 정제를 포함한다. 일 구현예에서, 경구 투약 형태는 당해 기술 분야의 당업자에게 공지된 바와 같이 약학 활성 성분의 원하는 방출 프로파일에 따라 제형화된다.
경구 조성물 (Peroral composition)은, 일부 구현예들에서, 액체 용액, 에멀젼제, 현탁제 등을 포함한다. 일부 구현예들에서, 이러한 조성물을 제조하는데 적합한 약제학적으로 허용가능한 담체들은 당해 기술 분야에 잘 알려져 있다. 일부 구현예들에서, 액체 경구 조성물은 바람직한 화합물 또는 화합물들을 약 0.001% 내지 약 0.933%, 또는 다른 구현예에서, 약 0.01% 내지 약 10 %로 포함한다.
일부 구현예들에서, 본 발명의 방법에 사용하기 위한 조성물은 용액 또는 에멀젼제이며, 일부 구현예들에서는 본 발명의 화합물의 안전한 유효량과, 선택적으로 국소 코내 투여용으로 의도된 그외 화합물을 포함하는, 수계 용액 또는 에멀젼제를 포함한다. 일부 구현예들에서, 조성물은 CTP 변형된 GH? 약 0.001% 내지 약 10.0% w/v로, 더 바람직하게는, 약 00.1% 내지 약 2.0로 포함하며, 이는 코내 경로로 화합물을 전신 전달하기 위해 사용된다.
다른 구현예에서, 약학 조성물은 액체 조제물의 정맥내, 동맥내 또는 근육내 주입에 의해 투여된다. 일부 구현예들에서, 액체 제형은 용액제, 현탁제, 분산제, 에멀젼제, 오일제 등을 포함한다. 일 구현예에서, 약학 조성물은 정맥내로 투여되며, 따라서 이는 정맥내 투여에 적합한 형태로 제형화된다. 다른 구현예에서, 약학 조성물은 동맥내로 투여되며, 따라서 이는 동맥내 투여에 적합한 형태로 제형화된다. 다른 구현예에서, 약학 조성물은 근육내로 투여되며, 따라서 이는 근육내 투여에 적합한 형태로 제형화된다.
추가적으로, 다른 구현예에서, 약학 조성물은 신체 표면에 국소 투여되며, 따라서 이는 국소 투여에 적합한 형태로 제형화된다. 적합한 국소 제형으로는 겔제, 연고제, 크림제, 로션제, 점적제 등이 있다. 국소 투여를 위해, 본 발명의 화합물은, 약제학적 담체가 첨가 또는 무첨가된, 생리적으로 허용가능한 희석제 중의 용액제, 현탁제 또는 에멀젼제로서 제조 및 적용되는, 추가적인 적정 치료학적 제제 또는 제제들과 조합된다.
일 구현예에서, 본 발명의 약학 조성물은 당해 기술 분야에 공지된 프로세스들, 예컨대 통상적인 혼합, 용해, 과립화, 당의정-제조, 레비게이션 (levigating), 에멀젼화, 캡슐화, 포집화 (entrapping) 또는 동결건조 프로세스의 수단에 의해 제조된다.
일 구현예에서, 본 발명에 따라 사용하기 위한 약학 조성물은, 약제학적으로 사용될 수 있는 조제물로 활성 성분들을 가공하는 과정을 돕는, 부형제 및 보조제를 포함하는, 하나 이상의 생리학적으로 허용가능한 담체를 이용하여, 통상적인 방식으로 제형화된다. 일 구현예에서, 제형은 선택한 투여 경로에 따라 결정된다.
일 구현예에서, 본 발명의 주사제 (injectable)는 수용액으로 제형화된다. 일 구현예에서, 본 발명의 주사제는 행크 용액, 링거 용액 또는 생리 염 완충액 등의 생리적으로 친화적인 완충액 중에서 제형화된다. 일부 구현예들에서, 경점막 투여를 위해, 침투할 장벽에 적합한 침투제가 제형에 사용된다. 이러한 침투제는 일반적으로 당해 기술 분야에 공지되어 있다.
일 구현예에서, 본원에 기술된 조제물은 비경구 투여용으로, 예컨대 볼루스 주입 또는 연속 주입에 의한 투여용으로 제형화된다. 일부 구현예들에서, 주입용 제형은, 단위 투약 형태, 예컨대 앰플, 또는 다용량 (multidose) 용기내로, 선택적으로 첨가된 보존제와 함께, 제공된다. 일부 구현예들에서, 조성물은 오일성 또는 수계 비히클 중의 현탁액, 용액 또는 에멀젼제이며, 현탁화제, 안정화제 및/또는 분산화제와 같은 제형성 제제(formulatory agent)가 포함된다.
또한, 조성물은, 일부 구현예들에서, 벤즈알코늄 클로라이드 및 티메로살 등과 같은 보존제; 에데테이트 소듐 등의 킬레이트제; 포스페이트, 시트레이트 및 아세테이트 등의 완충액; 소듐 클로라이드, 포타슘 클로라이드, 글리세린, 만니톨 등의 긴장성 제제 (tonicity agent); 아스코르브산, 아세틸시스틴, 소듐 메타바이설포에이트 등의 항산화제; 방향성 제제; 셀룰로스 및 이의 유도체 등의 폴리머와 같은 점성 조정제; 및 폴리비닐 알코올 및 필요에 따라 이들 수계 조성물의 pH를 조절하기 위한 산과 염기를 포함한다. 또한, 조성물은, 일부 구현예들에서, 국소 마취제 또는 그외 활성제를 포함한다. 조성물은 스프레이제, 미스트제, 점적제 등으로 사용될 수 있다.
일부 구현예들에서, 비경구 투여용 약학 조성물은 수용성 형태의 활성 수계 용액 조제물을 포함한다. 추가적으로, 활성 성분의 현탁제는, 일부 구현예들에서, 적절한 오일 또는 수(water) 기반의 주입 현탁제로서 제조된다. 적합한 친지성 용매 또는 비히클로서, 일부 구현예들에서, 세사미 오일과 같은 지방 오일, 또는 에틸 올레이트, 트리글리세라이드 또는 리포좀 등의 합성 지방산 에스테르를 포함한다. 수성 주입 현탁제는, 일부 구현예들에서, 소듐 카르복시메틸 셀룰로스, 소르비톨 또는 덱스트란 등의, 현탁물의 점성을 증가시키는 물질을 포함한다. 다른 구현예에서, 현탁제는 또한 고도로 농축된 용액을 제조할 수 있도록 활성 성분들의 용해성을 증가시키는 적정 안정화제 또는 제제들을 포함한다.
다른 구현예에서, 활성 화합물은 비히클, 특히 리포좀 안에 포함된 형태로 전달될 수 있다 (Langer, Science 249:1527-1533 (1990); Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez- Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989); Lopez-Berestein, ibid., pp. 317-327; 일반적으로 상기 문헌들을 참조함).
다른 구현예에서, 조절된 방출 시스템 (controlled release system) 형태로 전달되는 약학 조성물은, 정맥내 주입, 이식가능한 삼투 펌프, 경피 패치, 리포좀 또는 그외 투여 방식용으로 제형화된다. 일 구현예에서, 펌프가 사용된다 (Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989) 참조). 다른 구현예에서, 폴리머 물질이 사용될 수 있다. 또 다른 구현예에서, 조절된 방출 시스템은 치료 타겟, 즉 뇌 근처에 위치시킬 수 있으며, 그에 따라 전신 투여량의 일부만 필요할 수 있다 (예, Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984) 참조). 다른 조절된 방출 시스템에 대해서는 Langer (Science 249:1527-1533 (1990)의 리뷰에 기술되어 있다.
일부 구현예들에서, 활성 성분은 사용 전에 적정 비히클, 예컨대, 멸균된, 발열원-제거된 수계 용액을 이용하여 만들기 위한 분말 형태이다. 조성물은, 일부 구현예들에서, 미립자화 및 흡입 투여용으로 제형화된다. 다른 구현예에서, 조성물은 미립자화 수단이 장착된 용기에 함유된다.
일 구현예에서, 본 발명의 조제물은, 예컨대, 코코아 버터 또는 그외 글리세라이드와 같은 통상적인 좌제 베이스를 이용하여, 좌제나 정체 관장제 (retention enemas) 등의 직장 조성물로 제형화된다.
일부 구현예들에서, 본 발명의 측면에 사용하기 적합한 약학 조성물은, 활성 성분들이 의도한 목적을 달성하는데 유효한 양으로 포함된 조성물을 포함한다. 다른 구현예에서, 치료학적 유효량은 치료 중인 개체의 질환 증상을 예방, 경감 또는 개선시키거나 또는 생존을 연장시키는데 유효한 활성 성분의 양을 의미한다.
일 구현예에서, 치료학적 유효량은 당해 기술 분야의 당업자의 능력내에서 충분히 결정된다.
약제학적으로 허용가능한 담체 또는 이의 구성 성분으로서 제공할 수 있는 물질의 일부 예는, 락토스, 글루코스 및 슈크로스 등의 당류; 옥수수 전분 및 감자 전분 등의 전분류; 소듐 카복시메틸 셀룰로스, 에틸 셀룰로스 및 메틸 셀룰로스 등의 셀룰로스 및 이의 유도체; 트라가칸트 분말; 말트; 젤라틴; 탈크; 스테아르산 및 마그네슘 스테아레이트 등의 고형 윤활제; 칼슘 설페이트; 땅콩 오일, 면실유, 세사미 오일, 올리브유, 옥수수유 및 테오브로마 오일 등의 식물성 오일; 프로필렌 글리콜, 글리세린, 소르비톨, 만니톨 및 폴리에틸렌 글리콜 등의 폴리올; 알긴산; Tween™ 상표의 유화제 등의 유화제; 소듐 라우릴 설페이트 등의 습윤제 (wetting agent); 착색제; 풍미제; 타정제 (tableting agent), 안정화제; 항산화제; 보존제; 발열원-결핍된 물; 등장성 식염수; 및 포스페이트 완충 용액이다. 화합물과 함께 사용되는 약제학적으로 허용가능한 담체의 선택은, 기본적으로, 화합물의 투여 방식에 따라 결정된다. 만일 대상 화합물을 주입하고자 한다면, 일 구현예에서, 약제학적으로 허용가능한 담체는, 혈액-친화적인 현탁화제가 첨가된 멸균된, 생리 식염수이며, 이의 pH는 약 7.4로 조정된 것이다.
아울러, 조성물은, 추가적으로, 결합제 (예, 아카시아, 옥수수 전분, 젤라틴, 카보머, 에틸 셀룰로스, 구아르 검, 하이드록시프로필 셀룰로스, 하이드록시프로필 메틸 셀룰로스, 포비돈), 붕해제 (예, 옥수수 전분, 감자 전분, 알긴산, 실리콘 다이옥사이드, 크로스카르멜로스 소듐, 크로스포비돈, 구아르 검, 소듐 전분 글리콜레이트), pH와 이온 세기가 다양한 완충액 (예, 트리스-HCl, 아세테이트, 포스페이트), 표면 흡수를 방지하기 위한 알부민 또는 젤라틴 등의 첨가제, 디터전트 (예, Tween 20, Tween 80, Pluronic F68, 담즙산염), 프로테아제 저해제, 계면활성제 (예, 소듐 라우릴 설페이트), 침투 강화제 (permeation enhancer), 가용화제 (예, 글리세롤, 폴리에틸렌 글리콜), 항산화제 (예, 아스코르브산, 소듐 메타바이설파이트, 부틸화된 하이드록시아니졸), 안정화제 (예, 하이드록시프로필 셀룰로스, 하이드록시프로필메틸 셀룰로스), 점성 증가제 (예, 카보머, 콜로이드형의 실리콘 다이옥사이드, 에틸 셀룰로스, 구아르 검), 감미제 (예, 아스파르탐, 시트르산), 보존제 (예, 티메로살, 벤질 알코올, 파라벤), 윤활제 (예, 스테아르산, 마그네슘 스테아레이트, 폴리에틸렌 글리콜, 소듐 라우릴 설페이트), 유동-보조제 (flow-aid)(예, 콜로이드형 실리콘 다이옥사이드), 가소화제 (예, 디에틸 프탈레이트, 트리에틸 시트레이트), 유화제 (예, 카보머, 하이드록시프로필 셀룰로스, 소듐 라우릴 설페이트), 폴리머 코팅제 (예, 폴록사머 또는 폴록사민), 코팅 및 막 형성제 (예, 에틸 셀룰로스, 아크릴레이트, 폴리메타크릴레이트) 및/또는 보강제를 포함한다.
시럽제, 엘릭서제, 에멀젼제 및 현탁제에 대한 전형적인 담체 성분으로는 에탄올, 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜, 액체 슈크로스, 소르비톨 및 물을 포함한다. 현탁제의 경우, 전형적인 현탁화제로서 메틸 셀룰로스, 소듐 카복시메틸 셀룰로스, 셀룰로스 (예, Avicel™, RC-591), 트라가칸트 및 소듐 알기레이트를 포함하며; 전형적인 습윤제로서 레시틴 및 폴리에틸렌 옥사이드 소르비탄 (예, 폴리소르베이트 80)을 포함한다. 전형적인 보존제로는 메틸 파라벤 및 소듐 벤조에이트를 포함한다. 다른 구현예에서, 경구 액체 조성물은 또한 전술한 감미제, 풍미제 및 착색제 등의 하나 이상의 성분들을 포함한다.
조성물은, 또한, 폴리락트산, 폴리글리콜산, 하이드로겔 등의 폴리머 화합물의 미립자 조제물 안으로 또는 상으로, 또는 리포좀, 마이크로에멀젼, 마이셀, 유니라멜라 또는 멀티라멜라 비히클, 에리트로사이트 고스트 또는 스페로플라스트 상으로의, 활성 물질의 합체를 포함한다. 이러한 조성물은 물리적 상태, 용해성, 안정성, 생체내 방출 속도 및 생체내 소거 속도에 영향을 미칠 것이다.
또한, 본 발명은, 폴리머(예, 폴록사머 또는 폴록사민)로 코팅된 미립자 조성물 및 조직-특이적인 수용체, 리간드 또는 항원에 대한 항체와 커플링되거나 조직-특이적인 수용체의 리간드와 커플링된 화합물을 포괄한다.
다른 구현예에서, 화합물은, 폴리에틸렌 글리콜, 폴리에틸렌 글리콜-폴리프로필렌 글리콜의 공중합체, 카르복시메틸 셀룰로스, 덱스트란, 폴리비닐 알코올, 폴리비닐피롤리돈 또는 폴리프롤린 등의 수용성 폴리머의 공유 결합에 의해 변형된다. 다른 구현예에서, 변형된 화합물은 대응되는 비변형된 화합물에 비해 정맥내 주입 후 실질적으로 연장된 혈중 반감기를 나타낸다. 일 구현예에서, 변형은 또한 화합물의 수용액 용해성을 증가시키고, 응집을 해소시키고, 화합물의 물리적 안정성과 화학적 안정성을 강화시키고, 화합물의 면역원성과 반응성을 크게 감소시킨다. 다른 구현예에서, 바람직한 생체내 생물 활성은, 이러한 폴리머-화합물 앱덕트(abduct)를 비변형된 화합물 보다 낮은 빈도로 또는 낮은 투여량으로 투여함으로써, 달성된다.
다른 구현예에서, 유효량 또는 투여량의 조제는 시험관내 분석으로 먼저 추정할 수 있다. 일 구현예에서, 투여량은 동물 모델에서 공식화될 수 있으며, 이러한 정보를 사용하여 인간에서 유용한 투여량을 보다 정확하게 결정할 수 있다.
일 구현예에서, 본원에 기술된 활성 성분들의 독성 및 치료학적 효능은 시험관내, 세포 배양 또는 실험 동물에서의 표준적인 약학 공정에 의해 측정할 수 있다. 일 구현예에서, 이러한 시험관내 및 세포 배양 분석 및 동물 실험으로부터 수득한 데이타는 인간에게 사용하기 위한 투여량 범위를 공식화하는데 이용할 수 있다. 일 구현예에서, 투여량은 채택되는 투약 형태 및 이용되는 투여 경로에 따라 달라진다. 일 구현예에서, 실제 제형, 투여 경로 및 투여량은 환자의 상태에 비추어 개개 의사가 선택할 수 있다 [예, Fingl, et al., (1975) "The Pharmacological Basis of Therapeutics", Ch. 1 p.1].
일 구현예에서, 치료할 증상의 중증도 및 반응성에 따라, 투약은 1회 투여 또는 다회 투여일 수 있으며, 치료 기간은 수일 내지 수개월이거나, 또는 치유가 구현되거나 질환 상태의 경감이 달성될 때까지이다.
일 구현예에서, 투여할 조성물의 양 역시 치료 중인 개체, 고통의 중증도, 투여 방식, 처방의의 판단 등에 따라 결정될 것이다.
일 구현예에서, 혼용가능한 약학 담체 중에 제형화된 본 발명의 조제물을 비롯한 조성물은, 또한, 제조하여, 적정 용기에 넣고, 치료 증상이 표시된 라벨이 첨부된다.
다른 구현예에서, CTP 변형된 GH는 전신 투여를 통해 투여된다. 다른 구현예에서, 본원에 기술된 성장 호르몬은 정맥내, 근육내 또는 피하 주입에 의해 투여된다. 다른 구현예에서, CTP 변형된 GH는 비이온성 계면 활성 제제 (즉, 계면활성제), 다양한 당류, 유기 폴리올 및/또는 인간 혈청 알부민과 같은 컴플렉스 유기 부형제 및 안정화제와 조합하여 동결건조된 (즉, 냉동-건조된) 조제물이다. 다른 구현예에서, 약학 조성물은 주사용 멸균수내에 기술된 동결건조된 CTP 변형된 GH를 포함한다. 다른 구현예에서, 약학 조성물은 주사용 멸균 PBS 중에 기술된 동결건조된 성장 호르몬을 포함한다. 다른 구현예에서, 약학 조성물은 주사용 멸균 0.9% NaCl 중에 기술된 동결건조된 성장 호르몬을 포함한다.
다른 구현예에서, 약학 조성물은, 본원에 기술된 CTP 변형된 GH와, 인간 혈청 알부민, 폴리올, 당류 및 음이온성 계면 활성 안정화제 등의 컴플렉스 담체를 포함한다. 예를 들어, WO 89/10756 (Hara et al.- 폴리머 및 p-하이드록시벤조에이트 함유)을 참조한다. 다른 구현예에서, 약학 조성물은 본원에 기술된 성장 호르몬, 락토바이온산 (lactobionic acid) 및 아세테이트/글리신 완충액을 포함한다. 다른 구현예에서, 약학 조성물은 본원에 기술된 CTP 변형된 GH와 인터페론 조성물의 수 용해성을 높이는 아미노산, 예컨대 아르기닌 또는 글루타메이트를 포함한다. 다른 구현예에서, 약학 조성물은, 본원에 기술된 동결건조된 CTP 변형된 GH와, 글리신 또는 인간 혈청 알부민 (HSA), 완충액 (예, 아세테이트) 및 등장성 제제 (예, NaCl)를 포함한다. 다른 구현예에서, 약학 조성물은 본원에 기술된 동결건조된 CTP 변형된 GH와 포스페이트 완충액, 글리신 및 HSA를 포함한다.
다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 pH 약 4 - 7.2의 완충화된 용액 중에 두었을 때 안정적이다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 안정화제로서 아미노산, 일부 경우에 염 (아미노산에 하전된 측쇄가 없는 경우)을 이용하여 안정화시킨다.
다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 아미노산인 안정화제를 약 0.3% 내지 5 중량%로 포함하는 액체 조성물이다.
다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 투약 정확성 및 산물 안전성을 제공한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 주입 용도로 사용하기 위한 생물학적인 활성형이며, 안정적인 액체 조성물을 제공한다. 다른 구현예에서, 약학 조성물은 본원에 기술된 비-동결건조된 CTP 변형된 GH를 포함한다.
다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 투여하기 전까지 저장 및 수송하기 용이한 액체 상태로 장기간 동안 저장할 수 있는 액체 제형을 제공한다.
다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 매트릭스 물질로서 고상 지질을 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 주입용 약학 조성물은 매트릭스 물질로서 고상 지질을 포함한다. 다른 구현예에서, 분무 응결 (spray congealing)에 의한 액체 미세입자의 제조는 Speiser (Speiser and al., Pharm. Res. 8 (1991) 47-54)에 기술되어 있으며, 경구 투여용 액체 나노펠렛이 개시되어 있다 (Speiser EP 0167825 (1990)). 다른 구현예에서, 사용되는 지질은 신체에 잘 허용된다 (예, 비경구 영양 공급을 위해 에멀젼에 존재하는 지방산으로 구성된 글리세라이드).
다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 리포좀 형태이다 (J. E. Diederichs and al., Pharm./nd. 56 (1994) 267- 275).
다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 폴리머 미세입자를 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 주입용 약학 조성물은 폴리머 미세입자를 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 나노입자를 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 리포좀을 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 지질 에멀젼을 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 마이크로스피어를 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 지질 나노입자를 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 양쪽성 지질 (amphiphilic lipid)을 포함하는 지질 나노입자를 포함한다. 다른 구현예에서, 본원에 기술된 CTP 변형된 GH를 포함하는 약학 조성물은 약물, 지질 매트릭스 및 계면활성제를 포함하는 지질 나노입자를 포함한다. 다른 구현예에서, 지질 매트릭스는 모노글리세라이드를 적어도 50% w/w로 포함한다.
일 구현예에서, 본 발명의 조성물은 팩 또는 분배 장치, 예컨대 FDA 승인 키트로 제공되며, 여기에는 활성 성분을 포함하는 하나 이상의 단위 투약 형태가 포함된다. 일 구현예에서, 팩은, 예컨대, 블리스터 팩 등의 금속 또는 플라스틱 호일을 포함한다. 일 구현예에서, 팩 또는 분배 장치는 투여 설명서를 수반한다. 일 구현예에서, 팩 또는 분배기는 약제의 제조, 사용 또는 판매를 규제하는 정부 기관으로부터 규정된 형태로 용기에 조합된 고지를 수반하며, 고지는 조성물의 형태 또는 인간이나 수의학적 투여 기관으로부터의 인가를 표시한다. 이러한 고지는, 일 구현예에서, 처방약에 대한 미국 식의약청에 의해 승인받은 표시이거나 또는 승인된 제품 인써트 (product insert)이다.
일 구현예에서, 본 발명의 CTP로 변형된 GH는 각 제제 자체를 이용한 치료와 비교하여 개선된 치료학적 효과를 달성하기 위해, 추가적인 활성 제제와 함께 개체에게 제공될 수 있다. 다른 구현예에서, 병용 요법(combination therapy)과 관련있는 부작용에 대해 조치 (예, 보완제의 투약 및 선택)가 취해진다.
본 발명의 추가적인 목적, 이점 및 새로운 특징들은 한정되는 것으로 의도되지 않은 아래 실시예들을 수행함으로써 당해 기술 분야의 당업자들에게 명확해질 것이다. 부가적으로, 상기에서 논의되고 하기 청구항에서 청구된 본 발명의 다양한 각각의 구현예들과 측면들은 후술되는 실시예들로부터 실험적으로 뒷받침된다.
실시예
일반적으로, 본원에 사용되는 명칭과 본원에서 이용되는 실험 공정들은 분자, 생화학, 미생물 및 재조합 DNA 기법들을 포함한다. 이러한 기법들은 문헌들에 잘 기술되어 있다. 예를 들어, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); 미국 특허들 4,666,828; 4,683,202; 4,801,531; 5,192,659 및 5,272,057에 기술된 방법들; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J. E., ed. (1994); "Culture of Animal Cells - A Manual of Basic Technique" by Freshney, Wiley-Liss, N. Y. (1994), Third Edition; "Current Protocols in Immunology" Volumes I-III Coligan J. E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Selected Methods in Cellular Immunology", W. H. Freeman and Co., New York (1980)을 참조하며, 이용가능한 면역분석법들은 특허 및 과학 문헌, 예컨대, 미국 특허 3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771 및 5,281,521에 광범위하게 기술되어 있으며; "Oligonucleotide Synthesis" Gait, M. J., ed. (1984); "Nucleic Acid Hybridization" Hames, B. D., and Higgins S. J., eds. (1985); "Transcription and Translation" Hames, B. D., and Higgins S. J., eds. (1984); "Animal Cell Culture" Freshney, R. I., ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, B., (1984) and "Methods in Enzymology" Vol. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA (1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996)을 참조하며, 이들 모두 원용에 의해 본 명세서에 포함된다. 그외 일반적인 참조문헌들도 이러한 문서 전반에 제시되어 있다.
실시예 1
hGH 구조체의 구축
재료 및 방법
4개의 hGH 클론들 (20kD의 단백질 변이체들)을 합성하였다. 4개의 클론들에서, hGH 서열을 함유한 XbaI - NotI 단편들을 진핵생물 발현 벡터이며 사전에 XbaI - NotI으로 절단한 pCI-dhfr에 연결하였다. 4가지 클론들 (401-0, 1, 2, 3 및 4)로부터 DNA를 수득하였다. 또한, 22kD 단백질로부터 다른 일부 hGH 클론 (1-242 bp)을 합성하였다 (0606114). 프라이머들은 Sigma-Genosys 사에서 주문하였다. 본 발명의 CTP 변형된 hGH 폴리펩타이드를 제조하는 사용된 프라이머 서열들은 아래 표 1에 요약 개시한다.
| 프라이머 번호 | 서열 번호 | 서열 | 제한효소 부위 (밑줄 서열) |
| 25 | 18 | 5' CTCTAGAGGACATGGCCAC 3' | XbaI |
| 32 R | 19 | 5' ACAGGGAGGTCTGGGGGTTCTGCA 3' | |
| 33 | 20 | 5' TGCAGAACCCCCAGACCTCCCTGTGC 3' | |
| 4 R | 21 | 5' CCAAACTCATCAATGTATCTTA 3' | |
| 25 | 22 | 5' CTCTAGAGGACATGGCCAC 3' | XbaI |
| 35 R | 23 | 5' CGAACTCCTGGTAGGTGTCAAAGGC 3' | |
| 34 | 24 | 5' GCCTTTGACACCTACCAGGAGTTCG 3' | |
| 37 R | 25 | 5'ACGCGGCCGCATCCAGACCTTCATCACTGAGGC 3' | NotI |
| 39 R | 26 | 5' GCGGCCGCGGACTCATCAGAAGCCGCAGCTGCCC 3' |
402-0-p69-1 (hGH) (서열번호 5)의 구축 : hGH는 아래 기술된 실험들에서 대조군으로 사용하기 위해 준비한 야생형의 재조합 인간 성장 호르몬이다 (CTP 없음).3번의 PCR 반응을 수행하였다. 1차 반응은 주형으로서 0606114 (hGH의 일부 클론 1-242 bp) 플라스미드 DNA를 대상으로 프라이머 25 및 프라이머 32R을 이용하여 수행하였으며, PCR 증폭 결과로 245 bp 산물이 형성되었다.
2차 반응은 주형으로서 401-0-p57-2 플라스미드 DNA를 대상으로 프라이머 33 및 프라이머 4R을 이용하여 수행하였으며, PCR 증폭 결과로 542 bp 산물이 형성되었다.
마지막 반응은 주형으로서 앞의 2가지 반응을 통해 수득한 산물들의 혼합물에 대해 프라이머 25 및 4R을 이용하여 수행하였고, PCR 증폭 결과로 705 bp 산물이 만들어졌으며, 이를 TA 클로닝 벡터 (Invitrogen, catalog K2000-01)에 삽입하였다. hGH-0 서열을 포함하는 XbaI- NotI 단편을 진핵 생물 발현 벡터 pCI-dhfr에 삽입하였다. 이 벡터를 DG-44 CHO 세포에 형질감염시켰다. 세포는 단백질 무첨가 배지에서 배양하였다.
402-1-p83-5 (hGH-CTP) - 서열번호 9 및 402-2-p72-3(hGH-CTPx2) - 서열번호 10 구축 : hGH-CTP는 인간 융모막성 고나도트로핀 (CTP)의 베타 체인의 C-말단 펩타이드 1 카피가 융합된 재조합 인간 성장 호르몬이다. hGH-CTP의 CTP 카세트는 C-말단 (카세트 1개)에 결합되어 있다. hGH-CTP-CTP는 인간 융모막성 고나도트로핀 (CTP)의 베타 체인의 C-말단 펩타이드 2 카피가 융합된 재조합 인간 성장 호르몬이다. hGH-CTP-CTP의 2개의 CTP 카세트들은 C-말단에 결합되어 있다 (카세트 2개).
hGH-CTP와 hGH-CTP-CTP의 구축은 hGH-0의 구축과 동일한 방식으로 수행하였다. pCI-dhfr-401-1-p20-1 (hGH*-ctp) 및 pCI-dhfr-401-2-p21-2 (hGH*-ctp x2)를 2차 PCR 반응의 주형으로 사용하였다.
hGH-CTP 및 hGH-CTP-CTP는 DG-44 CHO 세포에서 발현시켰다. 세포는 단백질 무첨가 배지에서 배양하였다. hGH-CTP의 분자량은 GH의 MW이 22 kD이고 "CTP 카세트" 각각이 8.5 kD이기 때문에 전체 분자량은 ~30.5 kD이다 (도 1). hGH-CTP-CTP의 분자량은 ~39 kD이다 (도 1).
402-3-p81-4 (CTP-hGH-CTP-CTP) - 서열번호 11 및 402-4-p82-9(CTP*hGH-CTP-CTP) - 서열번호 12의 구축 : CTP-hGH-CTP-CTP는 인간 융모막성 고나도트로핀 (CTP)의 베타 체인의 C-말단 펩타이드 3 카피가 융합된 재조합 인간 성장 호르몬이다. CTP-hGH-CTP-CTP의 3개의 CTP 카세트들은 N-말단 (카세트 1개)과 C-말단 (카세트 2개) 양쪽에 결합되어 있다. tCTP-hGH-CTP-CTP는 인간 융모막성 고나도트로핀 (CTP)의 베타 체인의 C-말단 펩타이드의 절단형 1 카피와 완전형 2 카피가 융합된 재조합 인간 성장 호르몬이다. tCTP-hGH-CTP-CTP의 절단형 CTP 카세트는 N-말단에 결합되고, CTP 카세프 2개는 C-말단 (카세트 2개)에 결합되어 있다.
3번의 PCR 반응을 수행하였다. 1차 반응은 프라이머 25 및 프라이머 35R 을 사용하여 p401-3-p12-5 또는 401-4-p22-1as의 플라스미드 DNA를 주형으로 하여 수행하였으며, PCR 증폭 결과로, 265 또는 220 bp 산물이 제조되었다. 2차 반응은 프라이머 34 및 프라이머 37R 을 사용하여 TA-hGH-2-q65-1의 플라스미드 DNA를 주형으로 하여 수행하였으며, PCR 증폭 결과로, 695 bp 산물이 제조되었다. 마지막 반응은 프라이머 25 및 프라이머 37R 을 사용하여 앞의 2가지 반응의 산물의 혼합물을 주형으로 하여 수행하였으며, PCR 증폭 결과로, 938 또는 891 bp 산물이 제조되었으며, 이를 TA 클로닝 벡터 (Invitrogen, catalog K2000-01)에 연결하였다. hGH 서열이 포함된 XbaI - NotI 단편을 진핵 생물 발현 벡터 pCI-dhfr에 삽입하였다.
CTP-hGH-CTP-CTP 및 tCTP-hGH-CTP-CTP는 DG-44 CHO 세포에서 발현시켰다. 세포는 단백질 무첨가 배지에서 배양하였다. CTP-hGH-CTP-CTP의 분자량은 ~47.5 kD (도 1)이고, tCTP-hGH-CTP-CTP의 분자량은 ~43.25 kD이다 (도 1).
402-6-p95a-8 (CTP-hGH-CTP) - 서열번호 13의 구축 : hGH-6 구축은 hGH-3을 구축하는 방법과 동일한 방식으로 수행하였다. 2차 PCR 반응에서 주형으로 pCI-dhfr-402-1-p83-5 (hGH-ctp)를 사용하였다.
402-5-p96-4 (CTP-hGH) - 서열번호 14의 구축 : PCR 반응은 프라이머 25 및 프라이머 39R 을 사용하여 pCI-dhfr- ctp-EPO-ctp (402-6-p95a-8)의 플라스미드 DNA를 주형으로 하여 수행하였으며, PCR 증폭 결과로, 763 bp 산물이 제조되었으며, 이를 TA 클로닝 벡터 (Invitrogen, catalog K2000-01)에 연결하였다. ctp-hGH 서열이 포함된 XbaI - NotI 단편을 진핵 생물 발현 벡터 pCI-dhfr에 삽입하여, 402-5-p96-4 클론을 제조하였다.
실시예 2
본 발명의 hGH-CTP 폴리펩타이드에 대한 생체내 생활성 검사
아래 실험은 시판되는 재조합 인간 GH 및 hGH와 비교하여, hGH-CTP 폴리펩타이드의 장기 작용성 생물 활성 가능성을 검사하기 위해 수행하였다.
재료 및 방법
뇌하수체 적출된 암컷 랫 (60-100 g)에 21.7 ㎍의 hGH-CTP 폴리펩타이드를 S.C.로 매주 주사하거나, 대조군 시판 rhGH 5 ㎍을 S.C.로 매일 주사하였다.
처리 전, 1차 주사한 지 24시간 후, 그리고 21일에, 실험을 종료할 때까지 2일마다, 동물 모두 체중을 측정하였다. 각 포인트는 그룹의 평균 체중 증가율을 나타낸다 ((체중 측정일 0 - 체중 측정 마지막일) / 체중 측정일 0). 평균 체중 증가를 시판 hGH의 매일 1회 주입에 대해 정규화하였다. 처리 스케줄을 표 2에 요약 개시한다.
| 번호 | 약물 | N | 경로 | 처리 스케줄 | 등몰 투여량(㎍/랫) | 누적 투여량(㎍/랫) | 투여 부피 (ml) |
| 1 | 비히클 | 7 | s.c. | 1, 7 및 13일; 1/W |
NA | NA | 0.25 |
| 2 | Mock | 7 | s.c | 1, 7 및 13일; 1/W | NA | NA | 0.25 |
| 3 | hGH 서열번호 5 |
7 | s.c | 1, 7 및 13일; 1/W | 21.7 | 65 | 0.25 |
| 4 | hGH-CTP 서열번호 9 |
7 | s.c. | 1, 7 및 13일; 1/W | 21.7 | 65 | 0.25 |
| 5 | hGH-CTP-CTP 서열번호 10 |
7 | s.c. | 1, 7 및 13일; 1/W | 21.7 | 65 | 0.25 |
| 6 | CTP-hGH-CTP-CTP 서열번호 11 |
7 | s.c. | 1, 7 및 13일; 1/W | 21.7 | 65 | 0.25 |
| 7 | tCTP-hGH-CTP-CTP 서열번호 12 |
7 | s.c. | 1, 7 및 13일; 1/W | 21.7 | 65 | 0.25 |
| 8 | 시판 hGH v.1 | 7 | s.c. | 1, 7 및 13일; 1/W | 21.7 | 65 | 0.25 |
| 9 | 시판 hGH v.1 | 7 | s.c. | 1-3일; d/W | 5 | 65 | 0.25 |
결과결과들은 도 2에 요약 개시한다. 이들 결과는, CTP-hGH-CTP-CTP (서열번호 11) 및 tCTP-hGH-CTP-CTP (서열번호 12)가 100%로 체중 증가를 유도하는 시판 rhGH와 비교하여, 120% 이상의 체중 증가를 유도하였다.
결론
CTP-hGH-CTP-CTP (서열번호 11) 및 tCTP-hGH-CTP-CTP (서열번호 12) 21.7 ㎍을 매주 3회 투여 (주사일: 1일, 7일 및 13일)하였을 때, 13일간 투여량 5 ㎍이 매일 1회 투여되는 동일한 누적 투여량으로 주사된 시판 rhGH와 비교하여, 뇌하수체 적출된 랫에서 30% 높은 체중 증가를 유도하였다.
실시예 3
CTP-변형된 GH의 약동학 연구
단회-투여량 약동학 연구를 스프라그-다우리 랫에서 수행하였다. 모든 동물 실험은 동물 복지법, 실험 동물의 관리 및 사용에 대한 지침에 따라, 모디진 바이오테크놀로지 제너랄 Ltd의 동물 실험 윤리 위원회의 감독 및 승인 하에, 수행하였다. 랫은 12-h 명/암 사이클로 실온에서 개별 또는 케이지 당 2마리씩 수용시켰다. 물 (수돗물)과 비공인된 설치류 사료에는 자유롭게 접근하게 제공하였다.
랫에서 CTP-hGH-CTP-CTP 및 GH의 약동학적 특성을 비교하기 위해, 4 그룹의 스프라그-다우리 랫 (270-290 g)으로 그룹 당 수컷 랫 3-6마리를 사용하였다. 랫을 무작위로 4가지의 처리 그룹으로 할당하였다 (표 3). 랫에 GH (50 ㎍/kg i.v. 또는 s.c.) 또는 CTP-hGH-CTP-CTP (108 ㎍/kg i.v. 또는 s.c.)를 1회 s.c. 또는 i.v. 주사로 투여하였다. 이소플루란 마취 하에 수집한 투여 전 샘플을 제외하고는, 채혈을 마취하지 않은 동물에서 수행하였다. 혈액 샘플 (대략 0.25 ml)은, 표 3에 나타낸 시간대에 CTP-hGH-CTP-CTP의 혈장 농도를 ELISA로 분석하기 위해, EDTA-코팅된 검체용기 (microtainer)에 수집하였다. 각각의 샘플링 후, 혈액 체적을 동일 부피의 멸균 0.9% 식염수 (식염수)로 교체하였다. 샘플들은 원심분리 및 혈장 회수 전 최대 1시간 동안 얼음 위에 보관하였다. 혈장 샘플은 분석하기 전까지 약 -20℃에 보관하였다.
표 3 . 랫 약동학 실험에 대한 실험 설계
| 처리군 | 검사 항목 | 동물 수 /그룹/시간대 |
투여 경로 | 성별 | 투여 수준(㎍/kg) | 주사 부피(㎕) | 농도(㎍/ml)/총 부피(ml) | 시간대* (투여 후 경과 시간) |
| 1 | 바이오트로핀 | 6# | SC | 수컷 | 50 | 500 | 20/5 | 0 (투여 전) 0.5,2, 4, 8, 24, 48 |
| 2 | CTP-hGH-CTP-CTP | 6# | SC | 수컷 | 108 | 500 | 43.2/5 | 0.5, 2, 4, 8, 24, 48, 72, 96 |
| 3 | 바이오트로핀 | 6# | IV | 수컷 | 50 | 300 | 20/3 | 0, 0.12, 2, 4, 8, 24 |
| 4 | CTP-hGH-CTP-CTP | 6# | IV | 수컷 | 108 | 300 | 43.2/3 | 0.12, 2, 4, 8, 24, 48,72 |
| 혈액 샘플의 부피/시간대 - 500 ㎕ | 종말 혈액 샘플 | |||||||
# 시간대 별 랫 3마리.인간 성장 호르몬을 검출하기 위한 특이적인 샌드위치 ELISA 시판 키트 (Roche Diagnostics)를 랫 혈장 샘플을 평가하는데 사용하였다. 이 키트는 항체 샌드위치 ELISA 포맷을 이용하여 혈장에서 인간 성장 호르몬을 검출한다. 이 키트는 랫 혈장에서 CTP-hGH-CTP-CTP 농도를 측정하기 위해 처음 사용하였다. 이들 혈장 샘플에 대해, CTP-hGH-CTP-CTP 표준 그래프 (1.2-00 ng/ml)를 사용하였으며, 랫 혈장내 CTP-hGH-CTP-CTP 농도를 상기 그래프로부터 구하였다.
소거 (CL 또는 CL/F), 분배 체적 (Vd 또는 Vd/F), 반감기 (t 1/2), 시간에 따른 혈장 농도 곡선 하 면적 (AUC), 최대 혈장 관찰 농도 (C max) 및 최대 혈장 관찰 농도에 도달하는 시간 (T max)을 비롯하여, 표준적인 약동학적 파라미터들을, 모델링 프로그램인 WinNonlin (Pharsight, version 3.1)을 이용한 비-구획 분석에 의해, 혈장 알부트로핀 (albutropin) 또는 GH 농도/시간 그래프로부터 구하였다. 이러한 분석을 위해 혈장내 CTP-hGH-CTP-CTP 또는 GH 농도 데이타를 일률적으로 가감하였다. AUC를 i.v. 데이타에 대한 로그-선형 사다리꼴 분석과 S.C. 데이타에 대한 선형-업/로그-다운 사다리꼴 방법을 이용하여 계산하였다. 각 랫 (s.c. 알부트로핀 데이타 제외) 또는 원숭이에 대한 혈장내 농도 프로파일을 각각 분석하였으며, 약동학적 파라미터들에 대한 평균 (S.E.M.) 값들의 평균 ± 표준 오차를 표 4 및 도 4에 기록한다.
CTP-hGH-CTP-CTP는 아미노산 275개와 O-연결된 탄수화물 최대 12개로 구성된 단쇄 단백질이다. 구조체는, 인간 융모막성 고나도트로핀 (hCG)의 베타 체인의 C-말단 펩타이드 (CTP) 3 카피가 부착된 변형된 인간 성장 호르몬 (소마트로핀(Somatropin))으로 구성되며; 1 카피는 N-말단에, 2 카피는 (앞뒤로) C 말단에 위치한다. 인간 성장 호르몬은 아미노산 191개로 구성된다. CTP는 아미노산 28개와 O-연결된 당쇄 4개로 구성된다.
실시예 4
SD 랫에서 CTP-변형된 GH의 약동학적 특성
CTP-hGH-CTP-CTP의 약동학적 특성을 시판 hGH (바이오트로핀)와 비교하여 평가하였다.
표 4 . 스프라그-다우리 랫에서 CTP-hGH-CTP-CTP 및 GH (바이오트로핀)를 1회 i.v. 및 s.c. 투여한 후 약동학적 파라미터들의 평균
| PK 통계 | |||||
| 파라미터 | 단위 | SC | IV | ||
| 바이오트로핀 | CTP-hGH-CTP-CTP | 바이오트로핀 | CTP-hGH-CTP-CTP | ||
| 투여량 | mg/Kg | 50 | 50 | 50 | 50 |
| AUClast | hr*ng/mL | 41 | 680 | 162.7 | 1568.3 |
| Cmax | ng/ml | 13 | 36.8 | 275.8 | 926 |
| Tmax | hr | 0.5 | 8 | 0 | 0 |
| MRT | hr | 2.5 | 12.9 | 0.5 | 9.9 |
| T1/2 alpha | hr | 1.58 | 0.74 | ||
| T1/2 beta | hr | 1.73 | 9 | 0.5 | 6.9 |
데이타의 통계적 분석각 샘플에 대해 구체적인 농도 수준을 측정하기 위해, 혈청 샘플에 대한 분석을 수행하였다. WinNonLin 비-구획 분석을 이용하여 농도 및 시간대 데이타를 가공하였다.
결정한 파라미터는 AUC, MRT, t1/2, Cmax 및 Tmax를 포함한다. 도 4는 랫 (n=3-6/투여/경로)에 CTP-hGH-CTP-CTP 또는 GH를 1회 i.v. 또는 s.c. 투여한 후 GH 농도 (pg/ml) 대비 우수한 약동학적 프로파일의 혈장내 CTP-hGH-CTP-CTP 농도를 나타낸다.
50 ㎍/kg을 1회 S.C. 주사한 후, SD 랫 혈액에서의 CTP-hGH-CTP-CTP 소거는 CTP-hGH-CTP 및 바이오트로핀 보다 현저하게 느리게 진행되었다. 대응되는 순환 반감기과 AUC는 다음과 같다:
바이오트로핀
T1/2 1.7h, AUC 41 hr*ng/mL
CTP-hGH-CTP
T1/2 8.5h, AUC 424 hr*ng/mL
CTP-hGH-CTP-CTP
T1/2 9.0h, AUC 680 hr*ng/mL
결론:
6가지의 다른 변이체들 중에서 최종 후보로 CTP-hGH-CTP-CTP가 선정되었다. CTP-hGH-CTP-CTP는 생물 활성 및 약동학적 특성 측면에서 우수한 성능이 입증되었다.
실시예 5
CTP-변형된 GH의 1회 투여/반복 투여에 따른 체중 증가 (WGA)
뇌하수체 적출된 (이간법 (interaural method)) 3-4주령의 수컷 랫을 CRL 레보레이토리즈에서 공급받았다. 모의-조작한 랫과 비슷한 체중 증가로 확인되는, 뇌하수체 적출이 불완전한 것으로 생각되는 동물들을 제외시키기 위해, 수술 후 3주간의 순화 기간 동안, 매주 2회 랫을 검사하고 체중을 측정하였다. 뇌하수체 적출이 불완전한 랫들은 본 실험에서 제외시켰다. 뇌하수체 적출 랫의 평균 체중은 실험 시 70-90 g이었다. 이는 hGH에 대한 USP 및 EP 생물분석의 기준이다. 뇌하수체 적출 랫 (뇌하수체가 제거된 랫)은 체중 증가 능력을 상실한다. hGH (및 CTP-hGH-CTP-CTP)를 이들 랫에 주사한 결과, 체중이 증가되었다. 지정된 기간 동안 주사한 hGH 양에 따른 측정되는 체중 증가를 기준으로, hGH (및 CTP-hGH-CTP-CTP)의 비활성을 구하였다. 랫에게 0.4, 0.8 및 4 mg/Kg을 1회 s.c.로, 또는 0.6 및 1.8 mg/Kg을 반복하여 s.c.로 3주간 4일 간격으로 투여하였다. 모든 동물은 각 체중을 1차 투여 전, 이후 2일 마다 또는 사망하는 경우 사망 시점에, 및 희생시키기 전에 무작위로 측정하였다.
1회 투여 및 반복 투여에 다른 체중 증가 분석
뇌하수체 적출 랫에서 CTP-hGH-CTP-CTP를 여러가지 투여 패턴으로 투여한 후 전신 성장 반응을 비교한 결과들을 도 5에 나타낸다. 그 결과, hGH-CTP의 투여량 0.4 & 0.8 mg/Kg/day 1회 주사가 바이오트로핀 0.1 mg/Kg/day 매일 주사 4회와 등가인 것으로 나타났다. hGH-CTP 효과를 나타낸 피크는 2일 후에 나타났다.
도 6은 CTP-hGH-CTP-CTP 1회 주사한 이후의 곡선하 면적이 랫에서 체중 증가와 상관성이 있다는 것을 추가로 보여준다. 즉, 수집된 데이타에 따르면, 체중 증가는 누적 AUC와 밀접한 관련성이 있다.
4일 간격으로 투여한 hGH-CTP 구조체는 도 7에서 확인되는 바와 같이 바이오트로핀의 매일 주사와 동일한 체중 증가를 촉진하였다. 인간의 경우 hGH 반감기는 랫 보다 5배 높을 것으로 예상된다 - 이는 1회 주사하는 경우, 10일 후 인간에서 잠재적인 피크 효과가 있음을 의미함. 이러한 결과들은, hGH-CTP 구조체, CTP-hGH-CTP-CTP를 인간에게 매주 또는 2주 마다 투여할 수 있음을 뒷받침해준다.
실시예 6
CTP-변형된 GH의 약력학적/약동학적 연구
뇌하수체 적출된 (이간법) 3-4주령의 수컷 랫을 CRL 레보레이토리즈에서 공급받았다. 모의-조작한 랫과 비슷한 체중 증가로 확인되는, 뇌하수체 적출이 불완전한 것으로 생각되는 동물들을 제외시키기 위해, 수술 후 3주간의 순화 기간 동안, 매주 2회 랫을 검사하고 체중을 측정하였다. 뇌하수체 적출이 불완전한 랫들은 본 실험에서 제외시켰다. 뇌하수체 적출 랫과 모의 랫의 평균 체중은 실험 시 각각 70 및 150 g이었다.
랫에게 CTP-hGH-CTP-CTP, 비히클, 인간 성장 호르몬 CTP-hGH-CTP-CTP 또는 인간 성장 호르몬 (20 ㎍/랫)을 1회 s.c.로, 주사 부피 0.2 ml/랫으로 투여하였다. GH 투여량은 0.35 및 1.05 ㎍/Kg이고, 성장 호르몬의 투여량은 CTP-hGH-CTP-CTP 투여량 0.6 및 1.8 ㎍/Kg에 해당되는 GH 양과 등몰 농도이다. 처리군을 표 4에 요약 기술한다. 주사한 후, 표 5에 기재된 시간에 IGF-1을 분석하기 위한 혈장 샘플을 취하였다. 샘플은 시판 ELISA (R&D systems)를 이용하여 IGF-1 농도를 분석하였다.
CTP-변형된 hGH를 매주 투여한 결과, 표준 GH로서 정상 범위내로 IGF-1을 유지시키는데 성공하였으며, 아울러 체중도 표준 GH로 유지되었다.
표 5. 뇌하수체 적출 랫 실험의 처리 스케줄
| 처리군 | 검사 항목 | 동물 수/그룹/시간대 | 투여 경로 | 등가 용량 (mg/랫) |
등가 투여량 (mg/Kg) |
CTP-hGH-CTP-CTP 농도, mg/ml | 투여 부피 (ml) | 시간대* (투여 후 경과 시간) |
| M7 | 바이오트로핀 | 9 | SC | 0.032 | 0.35 | 0.16 | 0.2 | 0 (투여 전) 0.5,2, 4, 8, 24, 48, 72, 96 |
| M8 | 바이오트로핀 | 9 | SC | 0.095 | 1.05 | 0.475 | 0.2 | 0 (투여 전) 0.5, 2, 4, 8, 24, 48, 72, 96 |
| M9 | EN648-01-08-005 | 12 | SC | 0.032 (0.055) | 0.35 (0.6) | 0.275 | 0.2 | 1, 2, 4, 8, 24, 48, 72, 96 |
| M10 | EN648-01-08-005 | 12 | SC | 0.095 (0.165) | 1.05 (1.8) | 0.825 | 0.2 | 1, 2, 4, 8, 24, 48, 72, 96 |
| 혈액 샘플 부피/시간대 - 500 ㎕ | 종말 혈액 샘플 | |||||||
각 그룹에 대해 시간 대비 평균 혈청 농도에 대한 비-구획 약동학적 분석을 수행하였다. CTP-hGH-CTP-CTP의 Cmax가 바이오트로핀의 Cmax 보다 현저하게 높았다. CTP-hGH-CTP-CTP의 종말 반감기는 바이오트로핀의 6배 였다.표 6: 뇌하수체 적출된 랫에서 1회 피하 주사 후 CTP-hGH-CTP-CTP 및 바이오트로핀의 약동학적 파라미터 평가
| 그룹 | 투여량 mg/kg |
성별 | Cmax ng/mL |
Tmax hr |
AUC0-8 ng-hr/mL |
AUC0-t ng-hr/mL |
CL/F mL/hr/kg |
T1/2 hr |
| CTP-hGH-CTP-CTP | 1.8 | M | 2,150 | 8 | 37,713 | 37,695 | 0.928 | 6.86 |
| hGH | 0.6 | M | 681 | 8 | 11,505 | 11,489 | 3.042 | 6.8 |
| 1.05 | M | 1,078 | 0.5 | 3,541 | 3,540 | 9.884 | 1 | |
| 0.35 | M | 439 | 0.5 | 1,279 | 1,279 | 27.36 | 1 |
AUC0-t와 AUC0-8은 매우 유사하였으므로, 샘플링 기간이 약동학적 프로파일을 특정하는데 적합하였다. CTP-hGH-CTP-CTP의 AUC는 바이오트로핀 보다 10배 높았다. 아울러, Cmax는 전체적으로 투여량에 비례하였으며, CTP-hGH-CTP-CTP의 경우, 바이오트로핀의 Cmax 보다 2배 높았다. 그러나, 도 8에 나타낸 바와 같이, CTP-hGH-CTP-CTP의 Tmax는 바이오트로핀의 0.5 시간과 비교하여, 8시간이었으며, 종말 반감기는 투여 수준에 따라 달라지는 것으로는 보이지 않았다. CTP-hGH-CTP-CTP의 T1/2는 바이오트로핀 보다 6.8배 길었다.GH의 간접 효과는 주로 인슐린 유사 성장 인자-I (IGF-1)에 의해 매개되는데, 이 호르몬은 간과 그외 조직들에서 성장 호르몬에 반응하여 분비된다. 성장 호르몬의 성장 촉진 작용 대부분은 실제 타겟 세포에 대한 IGF-1의 작용으로 인한 것이다. 이에 뇌하수체 적출된 랫에서 IGF-1 혈청 수준에 대한 CTP-hGH 구조체, CTP-hGH-CTP-CTP의 효과를 측정하였다. 도 9는 CTP-hGH-CTP-CTP 및 시판 hGH를 SC 주사한 후, 뇌하수체 적출된 랫에서의 IGF-1 혈청내 수준 결과를 도시한다.
PK/PD 프로파일을 구하기 위해, 뇌하수체 적출된 랫에 CTP-hGH-CTP-CTP를 0.6 또는 1.8 mg/Kg로, 바이오트로핀을 0.35 또는 1.05 mg/Kg로 1회 피하 주사하였다. 주사 후 혈청내 IGF-1를 특이적인 ELISA 키트 (Roche Diagnostics)를 이용하여 측정하였다.
CTP-hGH-CTP-CTP를 주사한 후 혈청 내 IGF-1 누적 수준은 바이오트로핀을 주사한 후 보다 현저하게 높았다. Cmax는 전반적으로 투여량에 비례하였으며, CTP-hGH-CTP-CTP의 경우 바이오트로핀의 Cmax의 3-4배였다. Tmax는 CTP-hGH-CTP-CTP가 36-48 시간으로, 바이오트로핀 20-24시간과 비교되었다. 결론적으로, 혈청내 높은 hGH 수준과 장기간의 존재는 IGF-1 수준을 현저하게 증가시킨다.
실시예 7
CTP-변형된 GH의 탄수화물 함량 및 시알산 함량
O-글리칸 분석에는 프로자임 키트 (Prozyme kit)를 이용한다. O-글리칸은 단백질로부터 화학적으로 효소적으로 절단시키고, 페이퍼 크로마토그래피를 이용하여 펩타이드들로부터 분리한다. O-글리칸 풀의 서열분석은 순차적인 효소적 절단 (엑소-글리코시다제)을 수행한 후 표준물질과 비교하여 HPLC 분석을 수행함으로써, 수행한다.
서열 분석을 이용한 글리코프로파일링
글리코프로파일링 (Glycoprofiling)은 Ludger Ltd에서 수행하였다. 샘플 2종 (EN648 및 RS0708)을 3세트로 방출시켜 취한 후, 각 방출물을 3세트로 HPLC로 분석하였다. EN648 및 RS0708 샘플 300 ㎍ 세트와, 시트레이트/소듐 클로라이드 완충액 100 ㎕ 샘플 1개, + 양성 대조군 페투인 (250㎍) 및 음성 대조군 물 100 ㎕을, 분자량 컷 오프가 10,000Da인 막을 이용하여 원심분리에 의해 한외여과하여, 완충액을 물로 교체한 다음, 0-모드 조건 (60℃에서 6시간)에서 하이드라지노분해 (hydrazinolysis)를 통해 취하였다. 방출된 글리칸들을 다시 N-아세틸화하고, LudgerClean CEX 카트리지를 이용하여 클린 업하였다. 방출된 글리칸 분액을 2-아미노벤즈아미드 (2AB)로 표지하고, Ludger Clean S 카트리지로 클린 업한 다음 LudgerSep-N2 HILIC-HPLC로 분석하였다.
단당류 함량
중성 단당류를 분석하기 위해서는 글리칸을 이를 구성하는 단당류 성분으로 가수분해시켜야 한다. 가수분해는 무손상 당단백질 샘플을 대상으로 Ludger Ltd에서 수행하였다. 구체적으로, 무손상 당단백질 50 ㎍을 산 가수분해하고, 2-AB (2-아미노벤즈아미드)로 표지한 후, 역상 HPLC 컬럼에서 분리하였다. 이 방법은 N 및 O 연결된 타입을 포함하여, 당단백질에 존재하는 모든 글리칸들을 가수분해시킨다.
시알산 프로파일링
샘플 2종 (EN648 및 RS0708)과 대조군 완충액을 분석하였다. 시알산 분석에는 단당류의 약산 방출과 이후 DMB 형광발색단 표지 및 LudgerSep-R1 컬럼에서의 HLPC 분석이 요구된다. 무손상 당단백질 50 ㎍을 각 분석을 위해 산 가수분해하였다.
CTP-hGH-CTP-CTP의 글리코 분석
표 7. 글리칸 분석. 피크들의 구조 할당 및 % 면적은 HPLC와 효소 어레이 분해를 기초로 한다.
단당류 프로파일에 따르면, CTP-hGH-CTP-CTP 당단백질 샘플들은 주로 O-연결된 타입의 글리칸들을 포함하고 있었다. 대부분의 O-글리칸 피크는 시알화된 코어 1 (Neu5Acα2-3Galβ1-3GalNAc)이다. 대부분의 시알산은 Neu5Ac이고, 디-아세틸화된 시알산 N-아세틸-9-O-아세틸뉴라민산 (Neu5, 9Ac2) 3-4% 및 N-글리콜릴뉴라민산 1% 미만이 존재하는 것으로 보이는 몇몇 작은 피크들이 존재하였다. 또한, Neu5Acα2-6(Galβ1-3)GalNAc도 소량 존재하였다.
실시예 8
레소스 원숭이에서 CTP-변형된 GH의 약동학/독성 동태학적 분석
시간에 따른 혈청 농도 그래프를 각 동물에 대해 구축하였다. 비-구획 분석을 WinNonlin professional version 5.2.1 (Pharsight Corporation, Mt View CA.)를 이용하여 수행하였다. 약동학적 파라미터들의 추정치들을 아래 표 8에 나타낸다.
표 8: 레소스 원숭이에게 1회 피하 주사한 후 비-구획 분석을 통한 CTP-hGH-CTP-CTP 약동학적 파라미터 추정치 (평균 ± SD)
| 파라미터 | 1.8 mg/kg | 90 mg/kg |
| Cmax (㎍/mL) | 2.073 ± 0.417 | 108.7 ± 46.0 |
| Tmax (hr) | 4 ± 0 | 11 ± 7 |
| AUC0-t (㎍-hr/mL) | 38.7 ± 7.4 | 2,444 ± 394 |
| AUC0-8 (㎍-hr/mL) | 39.0 ± 7.3 | 2,472 ± 388 |
| CL/F (mL/hr/kg) | 47.5 ± 9.0 | 37.04 ± 4.78 |
| T1/2 (hr) | 10.00 ± 1.47 | 9.85 ± 1.07 |
| Vz/F (mL/kg) | 701 ± 236 | 529 ± 104 |
AUC0-t와 AUC0-8은 매우 유사하였으므로, 샘플링 기간이 약동학적 프로파일을 특정하는데 적합하였다. Cmax는 투여량에 비례하였다. Tmax는 고용량에서 더 늦어졌다. Tmax는 저용량 군의 모든 동물들에서 4시간이었지만, 고용량 군에서는 8 또는 24시간이었다. 종말 반감기는 2가지 투여 군들 간에 비슷하였다.AUC는 투여량에 대략적으로 비례하였지만, 저용량 군과 비교하여, 고용량 군이 비례하는 AUC가 약간 더 컸으며, CL/F 및 Vz/F가 약간 낮게 평가되었다. CL 및 Vz가 고용량 군에서 낮거나 또는 F가 저용량 군에서 낮다고 말할 순 없다. 이들 군들은 중첩되므로, CL/F 및 Vz/F에 유의한 차이가 있다고 하기는 어렵다.
모델을 통해 평가한 약동학적 파라미터들은 비-구획 분석의 결과와 매우 비슷하였다. 흡수 반감기 및 소거 반감기를 아래 표 9에 나타낸다.
표 9: 레소스 원숭이에서의 약동학적 모델링을 통해 도출한, 피하 주사한 후 CTP-hGH-CTP-CTP의 흡수 및 소거 반감기 추정치 (평균 ± SD)
| 투여량 | T1/2 abs (hr) | T1/2 el (hr) |
| 1.8 mg/kg | 1.17 ± 0.40 | 10.41 ± 2.36 |
| 90 mg/kg | 6.49 ± 1.87 | 7.26 ± 1.85 |
데이타는, 소거 속도가 그룹들 간에 거의 비슷하며, 저용량 군에서 T1/2 el이 약간 더 길다는 것을 보여준다. 그러나, 흡수는 피하 90 mg/kg 투여하였을 때가 1.8 mg/kg으로 투여하였을 때 보다 5배 더 느렸다. 비-구획 분석 경우에서와 같이, 모델링에서는 고용량 군에서 보다 긴 Tmax가 확인되었다.GH 보충 공급은 어린이와 성인의 GH 결핍을 치료하는데 효과적이지만, 장기간에 걸친 매일 주사하는 문제점으로 인해 의사는 특정 환자 집단에서의 이의 사용을 제한할 뿐만 아니라, 투약 실수 위험성 증가, 관리 제공자의 수적 증가, 치료 비용 및/또는 비-순응성 증가가 발생한다. 처방된 GH 투약 용법의 불응 등의 의미들을 이해하지 못할 수 있는, 저신장 어린이 등의 특정 집단의 경우, 특히, GH 요법에 따른 최상의 효과를 달성하기 위해서는 순응이 필연적으로 중요하다. 매일 GH 주사에 대한 보다 적절한 대안책과 그에 따른 순응성을 확보하고자 하는 사안은, GH 결핍성 어린이가 지속적인 GH 치료가 필요한 성인으로 이행되기 때문에 더욱 중요하다. 매일 요법이 필요한 이유는 주로 재조합 GH이 혈장내 반감기가 짧기 때문이며, 그래서 서방형 GH의 개발로 이어지고 있다 (Reiter EO. Attire KM., Mashing TJ. Silverman BL. Kemp SF. Neolith RB. Ford KM. and Sanger P. A multimember study of the efficacy and safety of sustained release GH in the treatment of naive pediatric patients with GH deficiency. J. Clin. Endocrinol. Metab. 86 (2001), pp. 47004-4706.).
상기에서 언급한 재조합 인간 성장 호르몬-CTP 융합 단백질, GH-CTP는 GH 보다 체류 기간이 더 긴 약동학적 프로파일을 랫에서 나타낸다. 이러한 독특한 약동학적 프로파일로 인해, GH-CTP를 간혈적으로 투여하면, 혈장내 IGF-1 수준 증가 및 성장 각각으로 확인되는 바와 같이, 성장-호르몬 결핍 랫에서 약력학적 효과가 달성된다.
GH-CTP는 랫에 s.c. 투여하였을 때 GH에 비해 우수한 약동학적 프로파일을 제공한다. 혈장내 GH-CTP의 소거에도 GH 대비 상당한 차이가 존재한다. 구체적으로, GH-CTP는 혈장에서 s.c.로 투여한 후 GH 보다 6배 더 느리게 소거된다. GH-CTP의 종말 반감기과 평균 체류 시간은 랫에 s.c. 투여한 후 GH 보다 약 6배 길다. 아울러, s.c. 투여 후 Cl/F는 GH-CTP가 GH 보다 10배 낮다.
랫에서의 약동학적 이점이 약력학적 이점으로 이행되는지를 조사하기 위한 시도로, 매일 보다는 낮은 빈도로 용법을 수행하여, GH-CTP가 GH-결핍성 뇌하수체 적출 랫에서 성장을 자극할 수 있는지를, 등몰의 CTP-hGH-CTP-CTP 및 GH 투여량 수준들에서 테스트하였다. GH-CTP 1회 SC 주사는 체중 증가를 촉진하였으며, 이는 GH를 4일 매일 누적 주사한 결과와 동일하였다. 또한, GH-CTP를 4일 마다 투여하는 스케줄에서 GH 대비 강화된 체중 증가가 확인되었다.
약력학적으로, 뇌하수체 적출된 랫에서, GH 대비 GH-CTP의 상대적으로 긴 순환 시간으로 인해, s.c. 1회 주사한 후 혈장에서 측정되는 IGF-1 반응이 지속되었다. GH-CTP 1회 투여량을 피하 투여하면 뇌하수체 적출된 랫에서 용량-의존적인 방식으로 순환성 IGF-1 농도가 증가되었다. 알부트로핀 최고량에서, IGF-1 농도는 1회 투여한 후 75시간 만큼 긴 기간 동안 베이스라인 보다 높게 상승하였다. 즉, GH-CTP의 1회 투여시 순환 시간 증가는, GH 1회 투여에 비해 상당한 약력학적 향상을 초래하므로, GH-CTP가 표준적인 GH 처리 용법에 비해 적은 투여 빈도로도 유사한 성장 강화 및 체지방 감소를 제공할 수 있다는 것을 보여준다.
CTP-변형된 hGH의 1회 투여량, 즉 레소스의 경우 90 mg/kg, 랫의 경우 180 mg/kg은 양쪽 종들에서 충분히 허용되었다. 랫과 영장류 간의 상대생장 인수는 대략 X2이며, 이는 이들 동물에서 관여되는 단백질 소거를 토대로 한 것이다. 산업적으로 허용되는 외삽 모델에 따라, 치료학적 단백질의 반감기는 종 간에 증가한다 (FDA 지침). 영장류의 경우 90 mg/kg이, 랫에서의 CTP 변형된 hGH 180 mg/kg 보다 약간 우수한 PK 프로파일을 가진다. 즉, 인간에 대한 상대생장 외삽은 매주 또는 2주 당 1회 주사를 뒷받침해준다.
CTP-GH 구조체를 이용하는 본 발명의 컨셉은 시판 GH 재조합 제품에 비해 투여 빈도를 감소시킨다. 뉴트로핀 Depot®는 소아 집단에 대한 사용이 승인된 서방형 GH 제형이지만, 과거 대조군과의 비교를 통해, 1년 및 2년 성장율이 GH로 치료받은 어린이(1년 성장율 10.1±2.8 cm/year) 보다, 뉴트로핀 Depot®를 복용한 어린이(1년 성장율 8.2±1.8 cm/year)에서 유의하게 낮은 것으로 확인되었다 (Silverman BL. Blethen SL. Reiter EO. Attie KM. Neuwirth RB. and Ford KM. A long-acting human growth hormone (Nutropin Depot®: efficacy and safety following two years of treatment in children with growth hormone deficiency. J. Pediatr. Endocrinol. Metab. 15 (2002), pp. 715-722.). 피하 투여되는 뉴트로핀 Depot®의 국소 효과로 결절, 홍반, 주사 부위의 통증, 두통 및 구역질이 수반된다. 랫과 원숭이에 대한 전임상 독성 실험들에서, CTP-hGH-CTP-CTP를 s.c. 투여하면 비히클와 비교하여 국소 반응이 발생되지 않는 것으로 입증되었다. GH의 저 투여 빈도 형태가 필요한 의학적 필요성을 감안하면, 본 실험에서의, 랫에 대한 CTP-hGH-CTP-CTP의 약리학적 특성들은, 이 제품이 독성과 환자 순응성 측면에서도 우호적임을 시사해준다. 랫에서의 CTP-hGH-CTP-CTP의 지속적인 활성은, 현재 매일 투여로 달성되는 치료학적 효과를 구현하는데, 간헐적인 투여만으로도 충분한 제제로서의 이의 잠재적인 유용성을, 뒷받침해준다.
실시예 9
인간 성장 호르몬 (hGH-CTP)의 장기 작용성 CTP 변형된 버전은 성장 호르몬 결핍성 성인에서 매우 효과적임 - II상 임상 실험
무작위, 개방-표지형(open-label)의 II상 임상 실험을 수행하여, 현재 정상 호르몬을 매일 주사받고 있는 환자에서, hGH-CTP의 매주 또는 매달 2회 주사시, 이의 안전성, 허용성, 약동학적 특성 및 약력학적 특성을 조사하였다. 실험은 6개국 여러 곳에서 수행되었다. 실험에서 3가지 메인 코호트에는, 성장 호르몬-결핍 성인 환자가 매일 주사 형태로 7일간 복용하는, 시판 hGH의 누적 투여량에 대해 30%, 45% 또는 100%에 해당되는 투여량으로 hGH-CTP를 매주 1회 투여되었다 (각각, "30%, "45%" 및 "100%" 코호트로 지칭됨). 데이타는 각 코호트 당 13명으로 환자 39명의 결과이다. 각 코호트에는 여성 2명이 포함된다.
3가지 메인 코호트 외에도, 성장 호르몬 결핍 성인들을 4번째 실험 코호트에 등록시켰으며, 이는 정식 II상 실험의 번위로 수행하였다. 4번째 코호트 실험 환자에게는, 성장 호르몬-결핍 성인 환자가 매일 주사 형태로 2주간 복용하는, 시판 제품의 누적 투여량에 대해 50%에 해당되는 hGH-CTP를 2주 당 1회로 주사하였다.
hGH-CTP를 매주 1회 주사한 3가지 메인 코호트의 경우, 효과는 바람직한 치료학적 범위내에서 (실험에서 마지막 치료 주 동안) 7일간 매일 인슐린 유사 성장 인자 1(IGF-1) 수준을 측정함으로써, 확인하였다. 바람직한 치료학적 범위는, 연령 그룹 및 성별로 계층화된, 정상 집단에서 예상되는 평균 IGF-1 수준으로부터 + 2 표준편차 내지 -2 표준편차에 해당되는 범위로서 정의된다. 아울러, 본 실험에서는, 정상 범위에 속하는 환자들의 차이를 관찰하기 위한 목적으로, 표준편차 +/-1.5의 좁은 범위내에서 IGF-1 수준을 측정하였다.
결과 :
표 10은, 마지막 치료 주 동안 측정한, 수컷에서, IGF-1의, 정상 치료학적 범위 (+/- 2 SD)에 속하는 평균 일수 비율, 좁은 (+/- 1.5 SD) 정상 치료학적 범위에 속하는 평균 일수 비율, 및 평균 Cmax (최고 농도)를 나타낸 것으로, 이는 정상 집단의 평균 IGF-1 수준에 대한 표준 편차로 표시된다.
표 10: 인간 II 상 임상 실험의 결과
| 코호트 |
IGF-1의 좁은 정상 범위에 속하는 일수 %
(+/- 1.5 SD) |
IGF-1의 정상 범위에 속하는 일수 %
(+/- 2 SD) |
IGF-1의 평균 Cmax (바람직한 +2 SD 미만) |
| 30% | 57% | 100% | -0.9 |
| 45% | 100% | 100% | 0.1 |
| 100% | 86% | 100% | 0.4 |
성인 환자가 첫 치료 투여량으로서 통상적으로 처방받게 되는 hGH 누적 매주 투여량의 50%에 해당되는 2 mg/week의 hGH-CTP는, 성인 III상 실험에서 남성과 여성들에서 개시 투여량으로서 정해질 가능성이 매우 높다.안전성 및/또는 허용성 문제와 관련된 증거는 없으며, hGH-CTP가 고용량으로 사용시 환자에서 IGF-1을 과도한 수준으로, 또는 심지어 정상 범위 보다 높은 수준으로 유도한다는 징후도 없었다.
본 발명의 특정한 특징들이 본원에 예시 및 기술되어 있지만, 당해 기술 분야의 당업자라면 여러가지 변형, 치환, 변화 및 등가를 구현할 수 있을 것이다. 따라서, 첨부된 청구항은 본 발명의 실질적인 사상내에서 상기한 모든 변형들과 변화를 포괄하는 것으로 이해된다.
SEQUENCE LISTING
<110> Prolor Biotech Inc.
<120> LONG-ACTING GROWTH HORMONE AND METHODS OF PRODUCING SAME
<130> P-9520-PC4
<140> PCT/US12/999999
<141> 2012-08-01
<150> 12/476,916
<151> 2009-06-02
<150> 13/195,931
<151> 2011-08-02
<150> 12/509,188
<151> 2009-07-24
<150> 12/476,916
<151> 2009-06-02
<150> 12/401,746
<151> 2009-03-11
<150> 11/700,910
<151> 2007-02-01
<150> 60/764,761
<151> 2006-02-03
<160> 26
<170> PatentIn version 3.5
<210> 1
<211> 33
<212> PRT
<213> Homo sapiens
<400> 1
Asp Pro Arg Phe Gln Asp Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser
1 5 10 15
Leu Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu
20 25 30
Gln
<210> 2
<211> 28
<212> PRT
<213> Homo sapiens
<400> 2
Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg
1 5 10 15
Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln
20 25
<210> 3
<211> 26
<212> PRT
<213> Homo sapiens
<400> 3
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala
20 25
<210> 4
<211> 12
<212> PRT
<213> Homo sapiens
<400> 4
Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro
1 5 10
<210> 5
<211> 217
<212> PRT
<213> Homo sapiens
<400> 5
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Phe Pro Thr Ile Pro Leu
20 25 30
Ser Arg Leu Phe Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln
35 40 45
Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys
50 55 60
Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe
65 70 75 80
Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys
85 90 95
Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp
100 105 110
Leu Glu Pro Val Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val
115 120 125
Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu
130 135 140
Glu Gly Ile Gln Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg
145 150 155 160
Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser
165 170 175
His Asn Asp Asp Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe
180 185 190
Arg Lys Asp Met Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys
195 200 205
Arg Ser Val Glu Gly Ser Cys Gly Phe
210 215
<210> 6
<211> 192
<212> PRT
<213> Homo sapiens
<400> 6
Met Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu
1 5 10 15
Arg Ala His Arg Leu His Gln Leu Ala Phe Asp Thr Tyr Gln Glu Phe
20 25 30
Glu Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr Ser Phe Leu Gln Asn
35 40 45
Pro Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile Pro Thr Pro Ser Asn
50 55 60
Arg Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu Leu Leu Arg Ile Ser
65 70 75 80
Leu Leu Leu Ile Gln Ser Trp Leu Glu Pro Val Gln Phe Leu Arg Ser
85 90 95
Val Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser Asp Ser Asn Val Tyr
100 105 110
Asp Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln Thr Leu Met Gly Arg
115 120 125
Leu Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile Phe Lys Gln Thr Tyr
130 135 140
Ser Lys Phe Asp Thr Asn Ser His Asn Asp Asp Ala Leu Leu Lys Asn
145 150 155 160
Tyr Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met Asp Lys Val Glu Thr
165 170 175
Phe Leu Arg Ile Val Gln Cys Arg Ser Val Glu Gly Ser Cys Gly Phe
180 185 190
<210> 7
<211> 25
<212> PRT
<213> Homo sapiens
<400> 7
Met Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu
1 5 10 15
Arg Ala His Arg Leu His Gln Leu Ala
20 25
<210> 8
<211> 217
<212> PRT
<213> Homo sapiens
<400> 8
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Phe Pro Thr Ile Pro Leu
20 25 30
Ser Arg Leu Phe Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln
35 40 45
Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys
50 55 60
Val Gln Lys Tyr Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe
65 70 75 80
Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys
85 90 95
Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp
100 105 110
Leu Glu Pro Val Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val
115 120 125
Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu
130 135 140
Glu Gly Ile Gln Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg
145 150 155 160
Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser
165 170 175
His Asn Asp Asp Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe
180 185 190
Arg Lys Asp Met Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys
195 200 205
Arg Ser Val Glu Gly Ser Cys Gly Phe
210 215
<210> 9
<211> 245
<212> PRT
<213> Homo sapiens
<400> 9
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Phe Pro Thr Ile Pro Leu
20 25 30
Ser Arg Leu Phe Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln
35 40 45
Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys
50 55 60
Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe
65 70 75 80
Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys
85 90 95
Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp
100 105 110
Leu Glu Pro Val Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val
115 120 125
Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu
130 135 140
Glu Gly Ile Gln Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg
145 150 155 160
Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser
165 170 175
His Asn Asp Asp Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe
180 185 190
Arg Lys Asp Met Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys
195 200 205
Arg Ser Val Glu Gly Ser Cys Gly Phe Ser Ser Ser Ser Lys Ala Pro
210 215 220
Pro Pro Ser Leu Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr
225 230 235 240
Pro Ile Leu Pro Gln
245
<210> 10
<211> 273
<212> PRT
<213> Homo sapiens
<400> 10
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Phe Pro Thr Ile Pro Leu
20 25 30
Ser Arg Leu Phe Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln
35 40 45
Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys
50 55 60
Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe
65 70 75 80
Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys
85 90 95
Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp
100 105 110
Leu Glu Pro Val Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val
115 120 125
Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu
130 135 140
Glu Gly Ile Gln Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg
145 150 155 160
Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser
165 170 175
His Asn Asp Asp Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe
180 185 190
Arg Lys Asp Met Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys
195 200 205
Arg Ser Val Glu Gly Ser Cys Gly Phe Ser Ser Ser Ser Lys Ala Pro
210 215 220
Pro Pro Ser Leu Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr
225 230 235 240
Pro Ile Leu Pro Gln Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu
245 250 255
Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro
260 265 270
Gln
<210> 11
<211> 301
<212> PRT
<213> Homo sapiens
<400> 11
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Ser Ser Ser Ser Lys Ala
20 25 30
Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp
35 40 45
Thr Pro Ile Leu Pro Gln Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe
50 55 60
Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln Leu Ala Phe Asp
65 70 75 80
Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr
85 90 95
Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile
100 105 110
Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu
115 120 125
Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp Leu Glu Pro Val
130 135 140
Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser
145 150 155 160
Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln
165 170 175
Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile
180 185 190
Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser His Asn Asp Asp
195 200 205
Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met
210 215 220
Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys Arg Ser Val Glu
225 230 235 240
Gly Ser Cys Gly Phe Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu
245 250 255
Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro
260 265 270
Gln Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro Ser
275 280 285
Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln
290 295 300
<210> 12
<211> 285
<212> PRT
<213> Homo sapiens
<400> 12
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Ser Ser Ser Ser Lys Ala
20 25 30
Pro Pro Pro Ser Leu Pro Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe
35 40 45
Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln Leu Ala Phe Asp
50 55 60
Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr
65 70 75 80
Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile
85 90 95
Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu
100 105 110
Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp Leu Glu Pro Val
115 120 125
Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser
130 135 140
Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln
145 150 155 160
Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile
165 170 175
Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser His Asn Asp Asp
180 185 190
Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met
195 200 205
Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys Arg Ser Val Glu
210 215 220
Gly Ser Cys Gly Phe Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu
225 230 235 240
Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro
245 250 255
Gln Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro Ser
260 265 270
Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln
275 280 285
<210> 13
<211> 273
<212> PRT
<213> Homo sapiens
<400> 13
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Ser Ser Ser Ser Lys Ala
20 25 30
Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp
35 40 45
Thr Pro Ile Leu Pro Gln Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe
50 55 60
Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln Leu Ala Phe Asp
65 70 75 80
Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr
85 90 95
Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile
100 105 110
Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu
115 120 125
Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp Leu Glu Pro Val
130 135 140
Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser
145 150 155 160
Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln
165 170 175
Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile
180 185 190
Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser His Asn Asp Asp
195 200 205
Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met
210 215 220
Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys Arg Ser Val Glu
225 230 235 240
Gly Ser Cys Gly Phe Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu
245 250 255
Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro
260 265 270
Gln
<210> 14
<211> 245
<212> PRT
<213> Homo sapiens
<400> 14
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Ser Ser Ser Ser Lys Ala
20 25 30
Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp
35 40 45
Thr Pro Ile Leu Pro Gln Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe
50 55 60
Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln Leu Ala Phe Asp
65 70 75 80
Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr
85 90 95
Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile
100 105 110
Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu
115 120 125
Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp Leu Glu Pro Val
130 135 140
Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser
145 150 155 160
Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln
165 170 175
Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile
180 185 190
Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser His Asn Asp Asp
195 200 205
Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met
210 215 220
Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys Arg Ser Val Glu
225 230 235 240
Gly Ser Cys Gly Phe
245
<210> 15
<211> 853
<212> DNA
<213> Homo sapiens
<400> 15
tctagaggac atggccaccg gcagcaggac cagcctgctg ctggccttcg gcctgctgtg 60
cctgccatgg ctgcaggagg gcagcgccag ctcttcttct aaggctccac ccccatctct 120
gcccagcccc agcagactgc cgggccccag cgacacaccc attctgcccc agttccccac 180
catccccctg agcaggctgt tcgacaacgc catgctgagg gctcacaggc tgcaccagct 240
ggcctttgac acctaccagg agttcgagga agcctacatc cccaaggagc agaagtacag 300
cttcctgcag aacccccaga cctccctgtg cttcagcgag agcatcccca cccccagcaa 360
cagagaggag acccagcaga agagcaacct ggagctgctg aggatctccc tgctgctgat 420
ccagagctgg ctggagcccg tgcagttcct gagaagcgtg ttcgccaaca gcctggtgta 480
cggcgccagc gacagcaacg tgtacgacct gctgaaggac ctggaggagg gcatccagac 540
cctgatgggc cggctggagg acggcagccc caggaccggc cagatcttca agcagaccta 600
cagcaagttc gacaccaaca gccacaacga cgacgccctg ctgaagaact acgggctgct 660
gtactgcttc agaaaggaca tggacaaggt ggagaccttc ctgaggatcg tgcagtgcag 720
aagcgtggag ggcagctgcg gcttcagctc cagcagcaag gcccctcccc cgagcctgcc 780
ctccccaagc aggctgcctg ggccctccga cacaccaatc ctgcctcagt gatgaaggtc 840
tggatgcggc cgc 853
<210> 16
<211> 937
<212> DNA
<213> Homo sapiens
<400> 16
tctagaggac atggccaccg gcagcaggac cagcctgctg ctggccttcg gcctgctgtg 60
cctgccatgg ctgcaggagg gcagcgccag ctcttcttct aaggctccac ccccatctct 120
gcccagcccc agcagactgc cgggccccag cgacacaccc attctgcccc agttccccac 180
catccccctg agcaggctgt tcgacaacgc catgctgagg gctcacaggc tgcaccagct 240
ggcctttgac acctaccagg agttcgagga agcctacatc cccaaggagc agaagtacag 300
cttcctgcag aacccccaga cctccctgtg cttcagcgag agcatcccca cccccagcaa 360
cagagaggag acccagcaga agagcaacct ggagctgctg aggatctccc tgctgctgat 420
ccagagctgg ctggagcccg tgcagttcct gagaagcgtg ttcgccaaca gcctggtgta 480
cggcgccagc gacagcaacg tgtacgacct gctgaaggac ctggaggagg gcatccagac 540
cctgatgggc cggctggagg acggcagccc caggaccggc cagatcttca agcagaccta 600
cagcaagttc gacaccaaca gccacaacga cgacgccctg ctgaagaact acgggctgct 660
gtactgcttc agaaaggaca tggacaaggt ggagaccttc ctgaggatcg tgcagtgcag 720
aagcgtggag ggcagctgcg gcttcagctc cagcagcaag gcccctcccc cgagcctgcc 780
ctccccaagc aggctgcctg ggccctccga cacaccaatc ctgccacaga gcagctcctc 840
taaggcccct cctccatccc tgccatcccc ctcccggctg cctggcccct ctgacacccc 900
tatcctgcct cagtgatgaa ggtctggatg cggccgc 937
<210> 17
<211> 889
<212> DNA
<213> Homo sapiens
<400> 17
tctagaggac atggccaccg gcagcaggac cagcctgctg ctggccttcg gcctgctgtg 60
cctgccatgg ctgcaggagg gcagcgccag ctcttcttct aaggctccac ccccgagcct 120
gcccttcccc accatccccc tgagcaggct gttcgacaac gccatgctga gggctcacag 180
gctgcaccag ctggcctttg acacctacca ggagttcgag gaagcctaca tccccaagga 240
gcagaagtac agcttcctgc agaaccccca gacctccctg tgcttcagcg agagcatccc 300
cacccccagc aacagagagg agacccagca gaagagcaac ctggagctgc tgaggatctc 360
cctgctgctg atccagagct ggctggagcc cgtgcagttc ctgagaagcg tgttcgccaa 420
cagcctggtg tacggcgcca gcgacagcaa cgtgtacgac ctgctgaagg acctggagga 480
gggcatccag accctgatgg gccggctgga ggacggcagc cccaggaccg gccagatctt 540
caagcagacc tacagcaagt tcgacaccaa cagccacaac gacgacgccc tgctgaagaa 600
ctacgggctg ctgtactgct tcagaaagga catggacaag gtggagacct tcctgaggat 660
cgtgcagtgc agaagcgtgg agggcagctg cggcttcagc tccagcagca aggcccctcc 720
cccgagcctg ccctccccaa gcaggctgcc tgggccctcc gacacaccaa tcctgccaca 780
gagcagctcc tctaaggccc ctcctccatc cctgccatcc ccctcccggc tgcctggccc 840
ctctgacacc cctatcctgc ctcagtgatg aaggtctgga tgcggccgc 889
<210> 18
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> XbaI Forward primer for HGH-CTP constructs
<400> 18
ctctagagga catggccac 19
<210> 19
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse primer for HGH-CTP constructs
<400> 19
acagggaggt ctgggggttc tgca 24
<210> 20
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward primer for HGH-CTP constructs
<400> 20
tgcagaaccc ccagacctcc ctgtgc 26
<210> 21
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse primer for HGH-CTP constructs
<400> 21
ccaaactcat caatgtatct ta 22
<210> 22
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> XbaI Forward primer for HGH-CTP constructs
<400> 22
ctctagagga catggccac 19
<210> 23
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse primer for HGH-CTP constructs
<400> 23
cgaactcctg gtaggtgtca aaggc 25
<210> 24
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward primer for HGH-CTP constructs
<400> 24
gcctttgaca cctaccagga gttcg 25
<210> 25
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse primer for HGH-CTP constructs
<400> 25
acgcggccgc atccagacct tcatcactga ggc 33
<210> 26
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse primer for HGH-CTP constructs
<400> 26
gcggccgcgg actcatcaga agccgcagct gccc 34
Claims (58)
- 인간 개체에서 체중 감소 또는 체지방 감소를 유도하는 방법으로서,
성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를, 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며,
이로써, 상기 개체에서 체중 증가 또는 체지방 감소가 유도되는 것인, 방법. - 제1항에 있어서, 적어도 하나의 CTP의 서열이 서열번호 1 및 서열번호 2로 이루어진 군으로부터 선택되는 아미노산 서열에 의해 코딩되는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 폴리펩타이드가 신호 펩타이드를 더 포함하는 것을 특징으로 하는 방법.
- 제3항에 있어서, 상기 신호 펩타이드의 서열이 서열번호 3에 기재된 아미노산 서열을 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 적어도 하나의 CTP가 당화된 것임을 특징으로 하는 방법.
- 제1항에 있어서, 적어도 하나의 CTP가 절단형 (truncated)인 것을 특징으로 하는 방법.
- 제1항에 있어서, 적어도 하나의 CTP가 링커를 통해 상기 성장 호르몬에 부착된 것임을 특징으로 하는 방법.
- 제7항에 있어서, 상기 링커가 펩타이드 결합인 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 성장 호르몬이 주 당 1회 또는 2주 당 1회로 투여되는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 성장 호르몬이 1회 투여 당 0.05-7.2 mg의 투여량 (dose)으로 투여되는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 4 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 1.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 성장 호르몬이 상기 개체에게 피하로 투여되는 것을 특징으로 하는 방법.
- 인간 개체에서 인슐린 유사 성장 인자 (IGF-1)의 수준을 높이는 방법으로서,
성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를, 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며,
이로써 상기 개체에서 IGF-1의 수준이 증가되는 것을 특징으로 하는 방법. - 제15항에 있어서, 적어도 하나의 CTP의 서열이 서열번호 1 및 서열번호 2로 이루어진 군으로부터 선택되는 아미노산 서열에 의해 코딩되는 것을 특징으로 하는 방법
- 제15항에 있어서, 상기 폴리펩타이드가 신호 펩타이드를 더 포함하는 것을 특징으로 하는 방법.
- 제17항에 있어서, 상기 신호 펩타이드의 서열이 서열번호 3에 기재된 아미노산 서열을 포함하는 것을 특징으로 하는 방법.
- 제15항에 있어서, 상기 성장 호르몬이 주 당 1회 또는 2주 당 1회로 투여되는 것을 특징으로 하는 방법.
- 제15항에 있어서, 상기 성장 호르몬이 1회 투여 당 0.05-7.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제15항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제15항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 4 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제15항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 1.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제15항에 있어서, 상기 성장 호르몬이 상기 개체에게 피하로 투여되는 것을 특징으로 하는 방법.
- 인간 개체에 대한 성장 호르몬의 투여 빈도를 낮추는 방법으로서,
성장 호르몬의 아미노 말단에 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나와 성장 호르몬의 카르복시 말단에 융모막성 고나도트로핀 CTP 2개를 부착하는 단계를 포함하며,
이로써, 성장 호르몬의 투여 빈도가 감소되는 것을 특징으로 하는 방법. - 제25항에 있어서, 적어도 하나의 CTP의 서열이 서열번호 1 및 서열번호 2로 이루어진 군으로부터 선택되는 아미노산 서열에 의해 코딩되는 것을 특징으로 하는 방법.
- 제25항에 있어서, CTP의 상기 아미노 말단에 신호 서열을 부착하는 단계를 포함하는 것을 특징으로 하는 방법.
- 제27항에 있어서, 상기 신호 펩타이드의 서열이 서열번호 3에 기재된 아미노산 서열을 포함하는 것을 특징으로 하는 방법.
- 제25항에 있어서, 상기 성장 호르몬이 주 당 1회 또는 2주 당 1회로 투여되는 것을 특징으로 하는 방법.
- 제25항에 있어서, 상기 성장 호르몬이 1회 투여 당 0.05-7.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제25항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제25항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 4 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제25항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 1.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제25항에 있어서, 상기 성장 호르몬이 상기 개체에게 피하로 투여되는 것을 특징으로 하는 방법.
- 인간 개체에서 성장 또는 체중 증가를 유도하는 방법으로서,
성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를, 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며,
상기 개체가 어린이 또는 청소년이며,
이로써 상기 개체에서 성장 또는 체중 증가가 유도되는 것을 특징으로 하는 방법. - 제35항에 있어서, 적어도 하나의 CTP의 서열이 서열번호 1 및 서열번호 2로 이루어진 군으로부터 선택되는 아미노산 서열에 의해 코딩되는 것을 특징으로 하는 방법.
- 제35항에 있어서, 상기 폴리펩타이드가 신호 펩타이드를 더 포함하는 것을 특징으로 하는 방법.
- 제37항에 있어서, 상기 신호 펩타이드의 서열이 서열번호 3에 기재된 아미노산 서열을 포함하는 것을 특징으로 하는 방법.
- 제35항에 있어서, 상기 적어도 하나의 CTP가 당화된 것임을 특징으로 하는 방법.
- 제35항에 있어서, 적어도 하나의 CTP가 절단형 (truncated)인 것을 특징으로 하는 방법.
- 제35항에 있어서, 적어도 하나의 CTP가 링커를 통해 상기 성장 호르몬에 부착된 것임을 특징으로 하는 방법.
- 제41항에 있어서, 상기 링커가 펩타이드 결합인 것을 특징으로 하는 방법.
- 제35항에 있어서, 상기 성장 호르몬이 주 당 1회 또는 2주 당 1회로 투여되는 것을 특징으로 하는 방법.
- 제35항에 있어서, 상기 성장 호르몬이 1회 투여 당 0.05-7.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제35항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제35항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 4 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제35항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 1.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제35항에 있어서, 상기 성장 호르몬이 상기 개체에게 피하로 투여되는 것을 특징으로 하는 방법.
- 개체에서 인슐린 유사 성장 인자 (IGF-1)의 수준을 치료학적인 정상 범위로 유지하는 방법으로서,
성장 호르몬, 성장 호르몬의 아미노 말단에 부착된 융모막성 고나도트로핀 카르복시 말단 펩타이드 (CTP) 하나 및 성장 호르몬의 카르복시 말단에 부착된 융모막성 고나도트로핀 CTP 2개를 포함하는 폴리펩타이드를, 치료학적 유효량으로 개체에게 투여하는 단계를 포함하며,
이로써, 상기 개체에서 IGF-1이 치료학적인 정상 범위로 유지되는 것을 특징으로 하는 방법. - 제49항에 있어서, 적어도 하나의 CTP의 서열이 서열번호 1 및 서열번호 2로 이루어진 군으로부터 선택되는 아미노산 서열에 의해 코딩되는 것을 특징으로 하는 방법.
- 제49항에 있어서, 상기 폴리펩타이드가 신호 펩타이드를 더 포함하는 것을 특징으로 하는 방법.
- 제51항에 있어서, 상기 신호 펩타이드의 서열이 서열번호 3에 기재된 아미노산 서열을 포함하는 것을 특징으로 하는 방법.
- 제49항에 있어서, 상기 성장 호르몬이 주 당 1회 또는 2주 당 1회로 투여되는 것을 특징으로 하는 방법.
- 제49항에 있어서, 상기 성장 호르몬이 1회 투여 당 0.05-7.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제49항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제49항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 4 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제49항에 있어서, 상기 성장 호르몬이 1회 투여 당 약 1.2 mg의 투여량으로 투여되는 것을 특징으로 하는 방법.
- 제49항에 있어서, 상기 성장 호르몬이 상기 개체에게 피하로 투여되는 것을 특징으로 하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13/195,931 US8450269B2 (en) | 2006-02-03 | 2011-08-02 | Long-acting growth hormone and methods of producing same |
| US13/195,931 | 2011-08-02 | ||
| PCT/IL2012/050288 WO2013018098A2 (en) | 2011-08-02 | 2012-08-02 | Long-acting growth hormone and methods of producing same |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147005420A Division KR102028524B1 (ko) | 2011-08-02 | 2012-08-02 | 장기 작용성 성장 호르몬 및 이의 제조 방법 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020217002411A Division KR20210013300A (ko) | 2011-08-02 | 2012-08-02 | 장기 작용성 성장 호르몬 및 이의 제조 방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190116526A true KR20190116526A (ko) | 2019-10-14 |
Family
ID=47629749
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197028467A KR20190116526A (ko) | 2011-08-02 | 2012-08-02 | 장기 작용성 성장 호르몬 및 이의 제조 방법 |
| KR1020147005420A KR102028524B1 (ko) | 2011-08-02 | 2012-08-02 | 장기 작용성 성장 호르몬 및 이의 제조 방법 |
| KR1020217002411A KR20210013300A (ko) | 2011-08-02 | 2012-08-02 | 장기 작용성 성장 호르몬 및 이의 제조 방법 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147005420A KR102028524B1 (ko) | 2011-08-02 | 2012-08-02 | 장기 작용성 성장 호르몬 및 이의 제조 방법 |
| KR1020217002411A KR20210013300A (ko) | 2011-08-02 | 2012-08-02 | 장기 작용성 성장 호르몬 및 이의 제조 방법 |
Country Status (23)
| Country | Link |
|---|---|
| US (1) | US8450269B2 (ko) |
| EP (2) | EP2739298B1 (ko) |
| JP (1) | JP6153930B2 (ko) |
| KR (3) | KR20190116526A (ko) |
| CN (2) | CN107080835A (ko) |
| AU (1) | AU2012291617B2 (ko) |
| BR (1) | BR112014002491A2 (ko) |
| CA (1) | CA2843672A1 (ko) |
| CL (2) | CL2014000254A1 (ko) |
| CO (1) | CO7020850A2 (ko) |
| DK (2) | DK3482765T5 (ko) |
| EA (2) | EA035352B1 (ko) |
| ES (1) | ES2706734T3 (ko) |
| FI (1) | FI3482765T3 (ko) |
| HK (1) | HK1200349A1 (ko) |
| HR (1) | HRP20240635T1 (ko) |
| HU (2) | HUE066552T2 (ko) |
| MX (2) | MX360802B (ko) |
| PL (2) | PL2739298T3 (ko) |
| PT (2) | PT2739298T (ko) |
| SI (2) | SI3482765T1 (ko) |
| TR (1) | TR201821186T4 (ko) |
| WO (1) | WO2013018098A2 (ko) |
Families Citing this family (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007092252A2 (en) | 2006-02-03 | 2007-08-16 | Modigene Inc | Long-acting polypeptides and methods of producing same |
| US9458444B2 (en) | 2006-02-03 | 2016-10-04 | Opko Biologics Ltd. | Long-acting coagulation factors and methods of producing same |
| US8759292B2 (en) | 2006-02-03 | 2014-06-24 | Prolor Biotech, Llc | Long-acting coagulation factors and methods of producing same |
| US8048849B2 (en) | 2006-02-03 | 2011-11-01 | Modigene, Inc. | Long-acting polypeptides and methods of producing same |
| US20150038413A1 (en) | 2006-02-03 | 2015-02-05 | Opko Biologics Ltd. | Long-acting polypeptides and methods of producing and administering same |
| US9249407B2 (en) | 2006-02-03 | 2016-02-02 | Opko Biologics Ltd. | Long-acting coagulation factors and methods of producing same |
| US10221228B2 (en) | 2006-02-03 | 2019-03-05 | Opko Biologics Ltd. | Long-acting polypeptides and methods of producing and administering same |
| US20140113860A1 (en) | 2006-02-03 | 2014-04-24 | Prolor Biotech Ltd. | Long-acting polypeptides and methods of producing and administering same |
| US8946155B2 (en) | 2006-02-03 | 2015-02-03 | Opko Biologics Ltd. | Long-acting polypeptides and methods of producing and administering same |
| US8450269B2 (en) | 2006-02-03 | 2013-05-28 | Prolor Biotech Ltd. | Long-acting growth hormone and methods of producing same |
| US10351615B2 (en) | 2006-02-03 | 2019-07-16 | Opko Biologics Ltd. | Methods of treatment with long-acting growth hormone |
| US9663778B2 (en) | 2009-07-09 | 2017-05-30 | OPKO Biologies Ltd. | Long-acting coagulation factors and methods of producing same |
| BR112014025951A2 (pt) | 2012-04-19 | 2017-07-11 | Opko Biologics Ltd | variantes de oxintomodulina de longa ação e métodos de produção do mesmo |
| CN112661863A (zh) * | 2012-11-20 | 2021-04-16 | 奥普科生物制品有限公司 | 通过连接至促性腺激素羧基端肽来增加多肽的流体动力学体积的方法 |
| US20160024181A1 (en) | 2013-03-13 | 2016-01-28 | Moderna Therapeutics, Inc. | Long-lived polynucleotide molecules |
| CN103524626B (zh) * | 2013-09-27 | 2016-09-07 | 武汉龙科生物技术有限公司 | 重组双靶点蛋白药物及其应用 |
| US20150158926A1 (en) | 2013-10-21 | 2015-06-11 | Opko Biologics, Ltd. | Long-acting polypeptides and methods of producing and administering same |
| DK3060239T3 (da) * | 2013-10-21 | 2020-08-03 | Opko Biologics Ltd | Langtidsvirkende polypeptider og fremgangsmåder til fremstilling og indgivelse heraf |
| HUE056849T2 (hu) | 2014-11-21 | 2022-03-28 | Ascendis Pharma Endocrinology Div A/S | Hosszú hatástartalmú növekedési hormon adagolási formák |
| KR102527180B1 (ko) * | 2014-12-10 | 2023-04-27 | 옵코 바이오로직스 리미티드 | 장기간 작용성 ctp-변형된 성장 호르몬 폴리펩타이드의 제조 방법 |
| JP7000153B2 (ja) * | 2014-12-10 | 2022-01-19 | オプコ バイオロジクス リミテッド | 長時間作用性ctp修飾成長ホルモンポリペプチドを生成する方法 |
| EP3310347B1 (en) | 2015-06-19 | 2021-08-04 | OPKO Biologics Ltd. | Long-acting coagulation factors and methods of producing same |
| KR102373744B1 (ko) | 2016-01-08 | 2022-03-15 | 아센디스 파마 그로우쓰 디스오더스 에이/에스 | 낮은 npr-c 결합을 갖는 제어 방출성 cnp 작용제 |
| KR20180100624A (ko) | 2016-01-08 | 2018-09-11 | 아센디스 파마 그로우쓰 디스오더스 에이/에스 | 증가된 nep 안정성을 갖는 제어 방출성 cnp 작용제 |
| CA3007979C (en) | 2016-01-08 | 2023-12-19 | Ascendis Pharma Growth Disorders A/S | Cnp prodrugs with carrier attachment at the ring moiety |
| AU2017205693B2 (en) | 2016-01-08 | 2022-03-31 | Ascendis Pharma Growth Disorders A/S | Controlled-release CNP agonists with low initial NPR-B activity |
| EP3400065A1 (en) | 2016-01-08 | 2018-11-14 | Ascendis Pharma Growth Disorders A/S | Controlled-release cnp agonists with reduced side-effects |
| US10835578B2 (en) | 2016-01-08 | 2020-11-17 | Ascendis Pharma Growth Disorders A/S | CNP prodrugs with large carrier moieties |
| CN115025239A (zh) | 2016-03-01 | 2022-09-09 | 阿森迪斯药物骨疾病股份有限公司 | Pth前药 |
| KR20240006077A (ko) | 2016-07-11 | 2024-01-12 | 옵코 바이오로직스 리미티드 | 지속성 응고 인자 vii 및 그 제조 방법 |
| US11896671B2 (en) | 2016-07-13 | 2024-02-13 | Ascendis Pharma A/S | Conjugation method for carrier-linked prodrugs |
| SG10202111952PA (en) | 2016-09-29 | 2021-12-30 | Ascendis Pharma Growth Disorders As | Combination therapy with controlled-release cnp agonists |
| EP3518982A1 (en) | 2016-09-29 | 2019-08-07 | Ascendis Pharma Bone Diseases A/S | Incremental dose finding in controlled-release pth compounds |
| AU2017336249B2 (en) | 2016-09-29 | 2024-08-01 | Ascendis Pharma Bone Diseases A/S | Dosage regimen for a controlled-release PTH compound |
| AU2017336251B2 (en) | 2016-09-29 | 2024-02-22 | Ascendis Pharma Bone Diseases A/S | PTH compounds with low peak-to-trough ratios |
| WO2019185706A1 (en) | 2018-03-28 | 2019-10-03 | Ascendis Pharma A/S | Conjugates |
| EP3773680A1 (en) | 2018-03-28 | 2021-02-17 | Ascendis Pharma Oncology Division A/S | Il-2 conjugates |
| EP3793587A1 (en) | 2018-05-18 | 2021-03-24 | Ascendis Pharma Bone Diseases A/S | Starting dose of pth conjugates |
| CN108676096B (zh) * | 2018-05-22 | 2022-03-29 | 北京伟杰信生物科技有限公司 | 重组猪fsh-ctp融合蛋白及其制备方法与应用 |
| US20220047682A1 (en) * | 2018-10-26 | 2022-02-17 | Tami Bar | Compositions and methods for biodegrading alcohol |
| CN113423384B (zh) | 2019-02-11 | 2024-01-05 | 阿森迪斯药物生长障碍股份有限公司 | Cnp缀合物的干燥药物制剂 |
| WO2020165087A1 (en) | 2019-02-11 | 2020-08-20 | Ascendis Pharma Bone Diseases A/S | Liquid pharmaceutical formulations of pth conjugates |
| US20220088147A1 (en) | 2019-03-04 | 2022-03-24 | Ascendis Pharma Endocrinology Division A/S | Long-acting growth hormone dosage forms with superior efficacy to daily somatropin |
| AU2020296295A1 (en) | 2019-06-21 | 2021-12-23 | Ascendis Pharma A/S | Conjugates of an electron-donating nitrogen or tertiary amine comprising compounds |
| US20220305129A1 (en) | 2019-06-21 | 2022-09-29 | Ascendis Pharma A/S | Conjugates of heteroaromatic nitrogen-comprising compounds |
| EP3986477A1 (en) | 2019-06-21 | 2022-04-27 | Ascendis Pharma A/S | CONJUGATES OF pi-ELECTRON-PAIR-DONATING HETEROAROMATIC NITROGEN-COMPRISING COMPOUNDS |
| IL294327A (en) | 2020-01-03 | 2022-08-01 | Ascendis Pharma As | Conjugates undergoing intramolecular rearrangements |
| US20230042670A1 (en) | 2020-01-13 | 2023-02-09 | Ascendis Pharma Bone Diseases A/S | Hypoparathyroidism Treatment |
| KR20230019889A (ko) | 2020-06-03 | 2023-02-09 | 아센디스 파마 온콜로지 디비전 에이/에스 | Il-2 서열 및 이의 용도 |
| CA3184998A1 (en) | 2020-08-05 | 2022-02-10 | Samuel WEISBROD | Conjugates comprising reversible linkers and uses thereof |
| US20230340055A1 (en) | 2020-08-28 | 2023-10-26 | Ascendis Pharma Oncology Division A/S | Glycosylated il-2 proteins and uses thereof |
| IL301411A (en) | 2020-09-28 | 2023-05-01 | Ascendis Pharma Bone Diseases As | Improving the physical and mental condition of patients with hypoparathyroidism |
| CN112175964B (zh) * | 2020-10-23 | 2022-03-29 | 安徽中起生物科技有限公司 | 一种重组猪生长激素及其制备方法和应用 |
| KR20230164709A (ko) | 2021-04-01 | 2023-12-04 | 아센디스 파마 에이에스 | 염증 유발 질환을 치료하기 위한 지속형 성장 호르몬의 용도 |
| CN114010765A (zh) * | 2021-08-30 | 2022-02-08 | 上海延立药业有限公司 | 一种长效人生长激素 |
| IL311539A (en) | 2021-09-22 | 2024-05-01 | Ascendis Pharma Bone Diseases As | Long-term PTH compound treatments |
| CA3236278A1 (en) | 2021-12-13 | 2023-06-22 | Kennett Sprogoe | Effective doses of cnp conjugates |
| WO2023227505A1 (en) | 2022-05-23 | 2023-11-30 | Ascendis Pharma Growth Disorders A/S | Liquid pharmaceutical formulations of cnp compounds |
| WO2024094673A1 (en) | 2022-11-02 | 2024-05-10 | Ascendis Pharma Bone Diseases A/S | Pth treatment regimen comprising two pth compounds |
| WO2024104922A1 (en) | 2022-11-14 | 2024-05-23 | Ascendis Pharma Growth Disorders A/S | Method of improving skeletal muscle function |
| WO2024194300A1 (en) | 2023-03-20 | 2024-09-26 | Ascendis Pharma Growth Disorders A/S | Method of treatment of a thoracolumbar deformity in a human subject with achondroplasia |
Family Cites Families (84)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL154600B (nl) | 1971-02-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen. |
| NL154598B (nl) | 1970-11-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van laagmoleculire verbindingen en van eiwitten die deze verbindingen specifiek kunnen binden, alsmede testverpakking. |
| NL154599B (nl) | 1970-12-28 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen, alsmede testverpakking. |
| US3901654A (en) | 1971-06-21 | 1975-08-26 | Biological Developments | Receptor assays of biologically active compounds employing biologically specific receptors |
| US3853987A (en) | 1971-09-01 | 1974-12-10 | W Dreyer | Immunological reagent and radioimmuno assay |
| US3867517A (en) | 1971-12-21 | 1975-02-18 | Abbott Lab | Direct radioimmunoassay for antigens and their antibodies |
| NL171930C (nl) | 1972-05-11 | 1983-06-01 | Akzo Nv | Werkwijze voor het aantonen en bepalen van haptenen, alsmede testverpakkingen. |
| US3850578A (en) | 1973-03-12 | 1974-11-26 | H Mcconnell | Process for assaying for biologically active molecules |
| US3935074A (en) | 1973-12-17 | 1976-01-27 | Syva Company | Antibody steric hindrance immunoassay with two antibodies |
| US3996345A (en) | 1974-08-12 | 1976-12-07 | Syva Company | Fluorescence quenching with immunological pairs in immunoassays |
| US4034074A (en) | 1974-09-19 | 1977-07-05 | The Board Of Trustees Of Leland Stanford Junior University | Universal reagent 2-site immunoradiometric assay using labelled anti (IgG) |
| US3984533A (en) | 1975-11-13 | 1976-10-05 | General Electric Company | Electrophoretic method of detecting antigen-antibody reaction |
| US4098876A (en) | 1976-10-26 | 1978-07-04 | Corning Glass Works | Reverse sandwich immunoassay |
| US4879219A (en) | 1980-09-19 | 1989-11-07 | General Hospital Corporation | Immunoassay utilizing monoclonal high affinity IgM antibodies |
| JPS5781447A (en) | 1980-11-11 | 1982-05-21 | Toyo Jozo Co Ltd | Human chorionic gonadotropic hormone c-terminal fragment |
| US4853332A (en) | 1982-10-19 | 1989-08-01 | Cetus Corporation | Structural genes, plasmids and transformed cells for producing cysteine depleted muteins of biologically active proteins |
| US5011771A (en) | 1984-04-12 | 1991-04-30 | The General Hospital Corporation | Multiepitopic immunometric assay |
| DE3421468A1 (de) | 1984-06-08 | 1985-12-19 | Dr. Rentschler Arzneimittel Gmbh & Co, 7958 Laupheim | Lipidnanopellets als traegersystem fuer arzneimittel zur peroralen anwendung |
| US4666828A (en) | 1984-08-15 | 1987-05-19 | The General Hospital Corporation | Test for Huntington's disease |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4801531A (en) | 1985-04-17 | 1989-01-31 | Biotechnology Research Partners, Ltd. | Apo AI/CIII genomic polymorphisms predictive of atherosclerosis |
| DE122007000007I2 (de) | 1986-04-09 | 2010-12-30 | Genzyme Corp | Genetisch transformierte Tiere, die ein gewünschtes Protein in Milch absondern |
| US5118666A (en) | 1986-05-05 | 1992-06-02 | The General Hospital Corporation | Insulinotropic hormone |
| US4873316A (en) | 1987-06-23 | 1989-10-10 | Biogen, Inc. | Isolation of exogenous recombinant proteins from the milk of transgenic mammals |
| WO1989010756A1 (en) | 1988-05-06 | 1989-11-16 | Toray Industries, Inc. | STABLE INTERFERON beta COMPOSITION |
| US5272057A (en) | 1988-10-14 | 1993-12-21 | Georgetown University | Method of detecting a predisposition to cancer by the use of restriction fragment length polymorphism of the gene for human poly (ADP-ribose) polymerase |
| US5338835A (en) | 1989-02-21 | 1994-08-16 | Washington University | CTP-extended form of FSH |
| JP3045539B2 (ja) | 1989-02-21 | 2000-05-29 | ワシントン ユニバーシティ | 改変型生殖ホルモン |
| US5705478A (en) | 1989-02-21 | 1998-01-06 | Washington University | Covalently linked β subunits of the glycoprotein hormones as antagonists |
| US5792460A (en) | 1989-02-21 | 1998-08-11 | Washington University | Modified glycoprotein hormones having a CTP at the amino terminus |
| US6225449B1 (en) | 1991-10-04 | 2001-05-01 | Washington University | Hormone analogs with multiple CTP extensions |
| US5464764A (en) | 1989-08-22 | 1995-11-07 | University Of Utah Research Foundation | Positive-negative selection methods and vectors |
| US5192659A (en) | 1989-08-25 | 1993-03-09 | Genetype Ag | Intron sequence analysis method for detection of adjacent and remote locus alleles as haplotypes |
| US7217689B1 (en) | 1989-10-13 | 2007-05-15 | Amgen Inc. | Glycosylation analogs of erythropoietin |
| US5126324A (en) | 1990-06-07 | 1992-06-30 | Genentech, Inc. | Method of enhancing growth in patients using combination therapy |
| US6028177A (en) | 1991-10-04 | 2000-02-22 | Washington University | Methods of detecting single-chain forms of the glycoprotein hormone quartet |
| US5281521A (en) | 1992-07-20 | 1994-01-25 | The Trustees Of The University Of Pennsylvania | Modified avidin-biotin technique |
| DE69422169D1 (de) | 1993-04-20 | 2000-01-20 | Univ St Louis | Modifizierte proteine und peptide enthaltende pharmazeutische mittel |
| US6737515B2 (en) | 1993-11-19 | 2004-05-18 | Washington University | Follicle stimulating hormone-glycosylation analogs |
| US6238890B1 (en) | 1994-02-18 | 2001-05-29 | Washington University | Single chain forms of the glycoprotein hormone quartet |
| US5935924A (en) | 1994-04-15 | 1999-08-10 | Genentech, Inc. | Treatment of congestive heart failure |
| US5541110A (en) | 1994-05-17 | 1996-07-30 | Bristol-Myers Squibb | Cloning and expression of a gene encoding bryodin 1 from Bryonia dioica |
| BR9506313A (pt) | 1994-08-12 | 1997-08-05 | Univ Washington | Formas de cadeia simples do quarteto de hormônio de glicoproteína |
| US6083725A (en) | 1996-09-13 | 2000-07-04 | Transkaryotic Therapies, Inc. | Tranfected human cells expressing human α-galactosidase A protein |
| IL122732A0 (en) * | 1997-01-15 | 1998-08-16 | Akzo Nobel Nv | Liquid gonadotropin-containing formulation its preparation and a device containing same |
| US6310183B1 (en) | 1997-09-10 | 2001-10-30 | Novo Nordisk A/S | Coagulation factor VIIa composition |
| US6103501A (en) | 1997-11-17 | 2000-08-15 | Washington University | Single chain glycoprotein hormones comprising two β and one α subunits and recombinant production thereof |
| IL142350A0 (en) | 1998-10-16 | 2002-03-10 | Biogen Inc | Interferon-beta fusion proteins and pharmaceutical compositions containing the same |
| US6514729B1 (en) | 1999-05-12 | 2003-02-04 | Xencor, Inc. | Recombinant interferon-beta muteins |
| JO2291B1 (en) | 1999-07-02 | 2005-09-12 | اف . هوفمان لاروش ايه جي | Erythropoietin derivatives |
| US20020127652A1 (en) | 2000-02-11 | 2002-09-12 | Schambye Hans Thalsgard | Follicle stimulating hormones |
| US7094566B2 (en) | 2000-03-16 | 2006-08-22 | Amgen Inc., | IL-17 receptor like molecules and uses thereof |
| JP4409135B2 (ja) | 2000-12-01 | 2010-02-03 | 武田薬品工業株式会社 | 生理活性物質含有製剤の製造法 |
| CA2430934C (en) | 2000-12-01 | 2011-06-21 | Takeda Chemical Industries, Ltd. | A method of producing sustained-release preparations of a bioactive substance using high-pressure gas |
| KR20080085082A (ko) | 2000-12-07 | 2008-09-22 | 일라이 릴리 앤드 캄파니 | Glp-1 융합 단백질 |
| WO2002048194A1 (en) | 2000-12-11 | 2002-06-20 | Cheil Jedang Corporation | Fusion protein having the enhanced in vivo activity of erythropoietin |
| KR101229995B1 (ko) | 2000-12-11 | 2013-02-06 | 씨제이 주식회사 | 생체내 에리스로포이에틴 활성이 증진된 융합단백질 |
| JP5160005B2 (ja) | 2000-12-28 | 2013-03-13 | 武田薬品工業株式会社 | 徐放性製剤 |
| US8637077B2 (en) | 2000-12-28 | 2014-01-28 | Takeda Pharmaceutical Company Limited | Sustained-release preparation |
| US6887462B2 (en) | 2001-04-09 | 2005-05-03 | Chiron Corporation | HSA-free formulations of interferon-beta |
| US6824769B2 (en) | 2001-08-28 | 2004-11-30 | Vertex Pharmaceuticals Incorporated | Optimal compositions and methods thereof for treating HCV infections |
| GB0121709D0 (en) | 2001-09-07 | 2001-10-31 | Imp College Innovations Ltd | Food inhibition agent |
| ES2500918T3 (es) | 2001-12-21 | 2014-10-01 | Human Genome Sciences, Inc. | Proteínas de fusión de albúmina e interferón beta |
| US7173113B2 (en) | 2002-01-31 | 2007-02-06 | The Trustees Of Columbia University In The City Of New York | Long-acting hormone and growth factor compositions and uses thereof |
| US7081446B2 (en) | 2002-01-31 | 2006-07-25 | The Trustees Of Columbia University In The City Of New York | Long-acting follicle stimulating hormone analogues and uses thereof |
| US7459435B2 (en) | 2002-08-29 | 2008-12-02 | Hoffmann-La Roche Inc. | Treatment of disturbances of iron distribution |
| US7459436B2 (en) | 2002-11-22 | 2008-12-02 | Hoffmann-La Roche Inc. | Treatment of disturbances of iron distribution |
| CA2516339A1 (en) | 2003-02-19 | 2004-09-02 | Takeda Pharmaceutical Company Limited | Dispersing agent for sustained-release preparation |
| JP4683319B2 (ja) | 2003-02-19 | 2011-05-18 | 武田薬品工業株式会社 | 徐放性製剤用の分散剤 |
| CN1243022C (zh) * | 2003-10-17 | 2006-02-22 | 华东师范大学 | 生物修饰重组人生长激素复合物及其制备方法 |
| US7649084B2 (en) | 2003-11-12 | 2010-01-19 | University Of Georgia Research Foundation, Inc. | Recombinant glycoproteins related to feline thyrotropin |
| PL1696947T3 (pl) | 2003-12-19 | 2014-08-29 | Hoffmann La Roche | Zastosowanie erytropoetyny w leczeniu zaburzeń dystrybucji żelaza w przewlekłych chorobach zapalnych jelit |
| EP1755652B1 (en) | 2004-03-19 | 2010-11-24 | Baxter International Inc. | Factor ixa for the treatment of bleeding disorders |
| DE602005021509D1 (de) | 2004-08-17 | 2010-07-08 | Csl Behring Gmbh | Modifizierte vitamin-k-abhängige polypeptide |
| US8420602B2 (en) * | 2004-09-14 | 2013-04-16 | Landon C. G. Miller | Endocannabinoid conjugate and a pharmaceutical composition for treatment of neuronal disorders |
| EP1728798A1 (en) | 2005-06-01 | 2006-12-06 | ZLB Behring GmbH | Coagulation factor X polypeptides with modified activation properties |
| US8304386B2 (en) | 2006-02-03 | 2012-11-06 | Prolor Biotech, Inc. | Long-acting growth hormone and methods of producing same |
| US8476234B2 (en) | 2006-02-03 | 2013-07-02 | Prolor Biotech Inc. | Long-acting coagulation factors and methods of producing same |
| US8450269B2 (en) | 2006-02-03 | 2013-05-28 | Prolor Biotech Ltd. | Long-acting growth hormone and methods of producing same |
| US8048848B2 (en) | 2006-02-03 | 2011-11-01 | Prolor Biotech Ltd. | Long-acting interferons and derivatives thereof and methods thereof |
| US8048849B2 (en) | 2006-02-03 | 2011-11-01 | Modigene, Inc. | Long-acting polypeptides and methods of producing same |
| WO2007092252A2 (en) | 2006-02-03 | 2007-08-16 | Modigene Inc | Long-acting polypeptides and methods of producing same |
| KR100900784B1 (ko) * | 2007-01-03 | 2009-06-02 | 주식회사 하이닉스반도체 | 반도체메모리소자 |
| WO2009114959A1 (zh) * | 2008-03-20 | 2009-09-24 | 中国人民解放军军事医学科学院毒物药物研究所 | 可注射用缓释药物制剂及其制备方法 |
-
2011
- 2011-08-02 US US13/195,931 patent/US8450269B2/en active Active
-
2012
- 2012-08-02 DK DK18198355.2T patent/DK3482765T5/da active
- 2012-08-02 BR BR112014002491A patent/BR112014002491A2/pt not_active Application Discontinuation
- 2012-08-02 KR KR1020197028467A patent/KR20190116526A/ko active Application Filing
- 2012-08-02 AU AU2012291617A patent/AU2012291617B2/en active Active
- 2012-08-02 CA CA2843672A patent/CA2843672A1/en active Pending
- 2012-08-02 HR HRP20240635TT patent/HRP20240635T1/hr unknown
- 2012-08-02 EA EA201490393A patent/EA035352B1/ru unknown
- 2012-08-02 CN CN201710103795.2A patent/CN107080835A/zh active Pending
- 2012-08-02 ES ES12819794T patent/ES2706734T3/es active Active
- 2012-08-02 FI FIEP18198355.2T patent/FI3482765T3/fi active
- 2012-08-02 HU HUE18198355A patent/HUE066552T2/hu unknown
- 2012-08-02 EA EA202090577A patent/EA202090577A3/ru unknown
- 2012-08-02 KR KR1020147005420A patent/KR102028524B1/ko active IP Right Grant
- 2012-08-02 KR KR1020217002411A patent/KR20210013300A/ko not_active Application Discontinuation
- 2012-08-02 CN CN201280048492.0A patent/CN104010650A/zh active Pending
- 2012-08-02 TR TR2018/21186T patent/TR201821186T4/tr unknown
- 2012-08-02 DK DK12819794.4T patent/DK2739298T3/en active
- 2012-08-02 HU HUE12819794A patent/HUE042755T2/hu unknown
- 2012-08-02 MX MX2014001335A patent/MX360802B/es active IP Right Grant
- 2012-08-02 PL PL12819794T patent/PL2739298T3/pl unknown
- 2012-08-02 PT PT12819794T patent/PT2739298T/pt unknown
- 2012-08-02 SI SI201232065T patent/SI3482765T1/sl unknown
- 2012-08-02 EP EP12819794.4A patent/EP2739298B1/en active Active
- 2012-08-02 PT PT181983552T patent/PT3482765T/pt unknown
- 2012-08-02 EP EP18198355.2A patent/EP3482765B1/en active Active
- 2012-08-02 PL PL18198355.2T patent/PL3482765T3/pl unknown
- 2012-08-02 WO PCT/IL2012/050288 patent/WO2013018098A2/en active Application Filing
- 2012-08-02 JP JP2014523441A patent/JP6153930B2/ja active Active
- 2012-08-02 SI SI201231498T patent/SI2739298T1/sl unknown
-
2014
- 2014-01-31 MX MX2018014072A patent/MX2018014072A/es unknown
- 2014-01-31 CL CL2014000254A patent/CL2014000254A1/es unknown
- 2014-02-12 CO CO14029693A patent/CO7020850A2/es unknown
-
2015
- 2015-01-28 HK HK15100967.2A patent/HK1200349A1/xx unknown
-
2020
- 2020-07-31 CL CL2020002010A patent/CL2020002010A1/es unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102028524B1 (ko) | 장기 작용성 성장 호르몬 및 이의 제조 방법 | |
| US12029780B2 (en) | Long-acting polypeptides and methods of producing and administering same | |
| US8304386B2 (en) | Long-acting growth hormone and methods of producing same | |
| US20200131242A1 (en) | Methods of treatment with long-acting hormone | |
| JP7445695B2 (ja) | 長期活性型ポリペプチドならびに当該ポリペプチドの製造方法および投与方法 | |
| RU2798845C2 (ru) | Полипептиды длительного действия и способы их получения и введения | |
| US20150126444A1 (en) | Long-acting polypeptides and methods of producing and administering same | |
| EA045766B1 (ru) | Соматотропный гормон пролонгированного действия и способы его получения |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| X091 | Application refused [patent] | ||
| AMND | Amendment | ||
| X601 | Decision of rejection after re-examination | ||
| A107 | Divisional application of patent | ||
| J201 | Request for trial against refusal decision | ||
| J301 | Trial decision |
Free format text: TRIAL NUMBER: 2021101000198; TRIAL DECISION FOR APPEAL AGAINST DECISION TO DECLINE REFUSAL REQUESTED 20210125 Effective date: 20211202 |