KR20190015520A - 조합 치료법 - Google Patents
조합 치료법 Download PDFInfo
- Publication number
- KR20190015520A KR20190015520A KR1020197000309A KR20197000309A KR20190015520A KR 20190015520 A KR20190015520 A KR 20190015520A KR 1020197000309 A KR1020197000309 A KR 1020197000309A KR 20197000309 A KR20197000309 A KR 20197000309A KR 20190015520 A KR20190015520 A KR 20190015520A
- Authority
- KR
- South Korea
- Prior art keywords
- binding
- epitope
- domain
- mab
- molecule
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2806—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2815—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/283—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against Fc-receptors, e.g. CD16, CD32, CD64
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/58—Medicinal preparations containing antigens or antibodies raising an immune response against a target which is not the antigen used for immunisation
- A61K2039/585—Medicinal preparations containing antigens or antibodies raising an immune response against a target which is not the antigen used for immunisation wherein the target is cancer
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/626—Diabody or triabody
Abstract
본 발명은 암 및 병원체-관련 질환의 치료를 위한 조합 치료법에 관한 것으로, (1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자 (예컨대 디아바디, scFv, 항체, TandAb, 등), 및 (2) 질환 항원을 발현하는 표적 세포 (예컨대 암세포 또는 병원체-감염 세포, 등)의 재지정된 사멸을 매개할 수 있는 분자 (예컨대 디아바디, BiTe, 이중특이적 항체, CAR, 등)의 투여를 포함한다. 발명은 특히 표적 세포의 재지정된 사멸을 매개할 수 있는 분자가 이펙터 세포의 세포 표면 분자의 에피토프에 면역특이적으로 결합할 수 있는 제 1 에피토프-결합 부위 및 그러한 표적 세포 (즉 암 항원 또는 병원체-관련 항원과 같은 질환 항원)의 에피토프에 면역특이적으로 결합할 수 있는 제 2 에피토프-결합 부위를 포함하는 이중특이적 결합 분자인 구체예에 관한 것이다. 본 발명은 또한 그러한 분자(들)을 포함하는 제약학적 조성물에 관한 것이다.
Description
관련 출원에 대한 교차 참조
본 출원은 미국 특허 출원 일련 번호 62/346,854 (2016년 6월 7일에 출원됨; 계류중) 및 62/432,299 (2016년 12월 9일에 출원됨; 계류중)에 대한 우선권을 주장하며, 상기 출원은 각각 본원에 그 전문이 참조로 포함된다.
서열 목록에 대한 언급
본 출원은 컴퓨터-판독 가능한 매질에 개시된 (파일명: 1301_0142PCT_ST25.txt, 2017년 5월 31일에 생성되고, 225,335 바이트의 크기를 가짐) 37 C.F.R. 1.821 (이하 참조)에 따르는 하나 이상의 서열 목록을 포함하며, 상기 파일은 본원에 그 전문이 참조로 포함된다.
기술분야
본 발명은 암 및 병원체-관련 질환의 치료를 위한 조합 치료법에 관한 것으로, 그 치료법은 (1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자 (예컨대 디아바디(diabody), scFv, 항체, TandAb, 등), 및 (2) 질환 항원(disease antigen)을 발현하는 표적 세포의 재지정된 사멸(redirected killing)을 매개할 수 있는 분자 (예컨대 디아바디, BiTe, 이중특이적 항체, CAR, 등)의 투여를 포함한다. 발명은 특히 표적 세포의 재지정된 사멸을 매개할 수 있는 분자가 이펙터 세포의 세포 표면 분자의 에피토프에 면역특이적으로 결합할 수 있는 제 1 에피토프-결합 부위 및 그러한 표적 세포 (즉 암 항원 또는 병원체-관련 항원과 같은 질환 항원)의 에피토프에 면역특이적으로 결합할 수 있는 제 2 에피토프-결합 부위를 포함하는 이중특이적 결합 분자인 구체예에 관한 것이다. 본 발명은 또한 그러한 분자(들)을 포함하는 제약학적 조성물에 관한 것이다.
I. 포유류 면역 체계
포유류 면역 체계는 예컨대 손상, 감염 및 신생물을 포함하여, 다양한 질병에 대한 방어로서 작용한다. 인간 및 다른 포유류가 그것을 이용하여 병원체, 외래 물질 및 암 항원들에 대한 면역학적 반응을 발생시키는 효율은 두 가지 특징: 항원 인식에 대한 면역 반응의 정교한 특이성, 및 동일한 항원으로의 재활성화시에 더 빠르고 더 많은 활발한 반응들을 허용하는 면역학적 기억에 기초한다. (Portoles, P. et al. (2009) "The TCR/CD3 Complex: Opening the Gate to Successful Vaccination", Current Pharmaceutical Design 15:3290-3300; Guy, C.S. et al. (2009) "Organization of Proximal Signal Initiation at the TCR:CD3 Complex", Immunol Rev. 232(1):7-21; Topalian, S.L. et al. (2015) "Immune Checkpoint Blockade: A Common Denominator Approach to Cancer Therapy", Cancer Cell 27:450-461).
건강한 개체에서, 면역 체계는 다양한 억제 수용체 및 수용체 리간드의 레퍼토리에 의해 억제된 정지 상태에 있다. 암 항원, 미생물 병원체, 또는 알레르기 유발원을 인식할 때 활성화 수용체 및 수용체 리간드의 어레이가 면역 체계의 활성화를 유도하기 위해 촉발된다. 그러한 활성화는 대식세포, 자연 살해 (NK) 세포 및 항원-특이적, 세포독성, T-세포의 활성화로 이어지고, 다양한 사이토카인의 방출을 촉진하며, 그것들은 모두 대상체의 건강에 대한 인지된 위협에 대항하는 작용을 한다 (Dong, C. et al. (2003) "Immune Regulation by Novel Costimulatory Molecules", Immunolog. Res. 28(1):39-48; Viglietta, V. et al. (2007) "Modulating Co-Stimulation", Neurotherapeutics 4:666-675; Korman, A.J. et al. (2007) "Checkpoint Blockade in Cancer Immunotherapy", Adv. Immunol. 90:297-339). 면역 체계는 대항하는 억제성 면역 신호들이 활성화 면역 신호들보다 더 클 때 정상적인 정지 상태로 복귀할 수 있다.
그러므로, 암의 질환 상태 (및 실제로 감염성 질환들의 질환 상태)는 대상체의 면역 체계를 적당하게 활성화하지 못하는 실패를 반영하는 것으로 여겨질 수 있다. 그러한 실패는 활성화 면역 신호들의 부적당한 제공을 반영하는 것이거나, 대상체에서 억제성 면역 신호들을 경감시키는 능력의 부적당함을 반영하는 것일 수 있다. 일부 경우에, 연구자들은 암 세포가 면역 체계에 의해 검출되는 것을 피하기 위하여 면역 체계를 선임할 수 있는 것으로 측정하였다 (Topalian, S.L. et al. (2015) "Immune Checkpoint Blockade: A Common Denominator Approach to Cancer Therapy", Cancer Cell 27:450-461).
포유류 면역 체계는 두개의 별도의, 그러나 서로 밀접한 관계가 있는 체계: 체액성 면역 체계와 세포성 면역 체계에 의해 매개된다. 일반적으로 말하자면, 체액성 체계는 B 세포에 의해 생성된 가용성 분자들 (항체 또는 면역글로불린)에 의해 매개된다. 그러한 분자들은 신체에 대해 외래인 것으로 인식된 항원들과 조합하여 그것들을 중화시키는 능력을 가진다. 세포성 면역 체계는 다양한 치료 역할을 수행하는, "T 세포"로 명명된 특정 세포들의 고정화를 포함한다. T 세포들은 흉선에서 성숙하고 조직, 림프계 및 순환계 사이를 순환하는 림프구들이다. 외래 구조 (항원들)의 존재 및 인식에 대한 반응으로, T 세포들은 면역 반응을 개시하기 위해 "활성화"된다. 많은 경우에, 이 외래 항원들은 숙주 세포상에 신생물 또는 감염의 결과로서 발현된다. 비록 T 세포들이 그 자체로는 항체를 분비하지 않지만, 보통 제 2 부류의 림프구들인, B 세포들 (골수로부터 유래됨)에 의한 항체 분비에 필요하다. 결정적으로, T 세포들은 다른 것으로부터 항원을 알아볼 수 있도록 놀라운 면역학적 특이성을 나타낸다.
T 세포 활성화에는 두 가지 상호작용이 필요하다 (Viglietta, V. et al. (2007) "Modulating Co-Stimulation", Neurotherapeutics 4:666-675; Korman, A.J. et al. (2007) "Checkpoint Blockade in Cancer Immunotherapy", Adv. Immunol. 90:297-339). 첫 번째 상호작용으로, 세포는 세포의 I 또는 II 부류 주요 조직적합성 복합체 ("MHC")에 결합된 관련된 표적 항원을 나타냄으로써 나이브(naive) T 림프구의 T 세포 수용체 ("TCR")에 결합할 수 있어야 한다. 비록 거의 모든 세포 유형이 항원-제공 세포로서 작용할 수 있지만, 일부 세포, 예컨대 대식세포, B 세포, 및 수지상 세포들은 외래 항원을 제공하는 데 있어 특별하고, "전문적인" "항원-제공 세포"이다. 항원-제공 세포의 MHC I 분자들에 결합된 항원의 면역학적 감지(detection)는 세포독성 T 세포의 생성으로 이어진다. 항원-제공 세포의 MHC II 분자들에 결합된 항원의 면역학적 감지는 세포독성 T 세포의 생성으로 이어진다. 두 번째 상호작용에서, 항원-제공 세포의 리간드는 T 세포의 공동 수용체에 결합해야 한다 (Dong, C. et al. (2003) "Immune Regulation by Novel Costimulatory Molecules", Immunolog. Res. 28(1):39-48; Lindley, P.S. et al. (2009) "The Clinical Utility Of Inhibiting CD28-Mediated Costimulation", Immunol. Rev. 229:307-321). 두 가지 자극 신호에 영향을 받는 T 세포는 그런 후 사이토카인 (예컨대 인터류킨-2 및 인터류킨-12)에 대해 반응할 수 있다.
TCR 얽힘(engagement) 중에 두 가지 동시 자극 신호의 부재시에, T 세포는 클론 무반응으로 언급되는, 기능적으로 무반응 상태에 돌입한다 (Khawli, L.A. et al. (2008) "Cytokine, Chemokine, and Co-Stimulatory Fusion Proteins for the Immunotherapy of Solid Tumor", Exp. Pharmacol. 181:291-328). 병리적 상태에서, T 세포는 다양한 기관-특이적 자가면역 질환, 예컨대 제 1형 당뇨병, 류머티스성 관절염, 및 다발성 경화증의 핵심적인 참여자이다 (Dong, C. et al. (2003) "Immune Regulation by Novel Costimulatory Molecules", Immunolog. Res. 28(1):39-48).
이런 면역 "체크포인트(checkpoint)" 경로는 자가 내성(self-tolerance)을 유지하는데 (즉 그/그녀 자신의 세포에 대한 면역 체계 공격 ("자가면역" 반응)이 시작되는 것으로부터 대상체를 예방하는 데 및 항-미생물 또는 항-알레르기 면역 반응 중에 부수적인 조직 손상을 제한하는데 중요하다. T 세포의 접촉이 두 가지 필요한 신호들 중 하나만의 생성을 초래하는 경우에는, T 세포는 활성화되지 않고 적응성 면역 반응이 일어나지 않는다. 그러므로 T 세포 활성화의 "두 신호" 메커니즘은 원하지 않는 반응, 예컨대 그렇지 않은 경우 대상체 자신의 세포들에 대한 면역 체계 공격을 초래할 자가 항원에 대한 반응 ("자가면역" 반응)을 피하기 위한 면역 체계에 대한 방법을 제공한다.
II. 세포의 면역 체계의 세포 표면 분자들
A. CD3, CD4 및 CD8
면역 체계의 세포들은 특수화된 당단백질 세포 표면 분자들의 발현에 의해 특징지어진다. 그런 분자들과 다른 세포들의 분자들 사이의 상호작용은 면역 반응을 촉발시키거나, 유지하거나 약화시킨다. 특히, 모든 T 세포는 CD3의 발현을 특징으로 한다. CD3은 4개의 구별되는 사슬들로 구성된 T 세포 공동 수용체이다 (Wucherpfennig, K.W. et al. (2010) "Structural Biology Of The T-Cell Receptor: Insights into Receptor Assembly, Ligand Recognition, and Initiation of Signaling", Cold Spring Harb. Perspect. Biol. 2(4):a005140; pages 1-14; Chetty, R. et al. (1994) "CD3: Structure, Function, and Role Of Immunostaining In Clinical Practice", J. Pathol. 173(4):303-307; Guy, C.S. et al. (2009) "Organization Of Proximal Signal Initiation At The TCR:CD3 Complex", Immunol. Rev. 232(1):7-21).
포유류에서, 복합체는 CD3γ 사슬, CD3δ 사슬, 및 2개의 CD3ε 사슬을 함유한다. 이 사슬들은 T 림프구에서 활성화 신호를 생성하기 위하여 TCR과 회합한다 (Smith-Garvin, J.E. et al. (2009) "T Cell Activation", Annu. Rev. Immunol. 27:591-619). CD3이 없을 때, TCR은 적절하게 조립하지 못하고 분해된다 (Thomas, S. et al. (2010) "Molecular Immunology Lessons From Therapeutic T-Cell Receptor Gene Transfer", Immunology 129(2):170-177). CD3은 모든 성숙한 T 세포의 막에 결합되는 것으로 나타나고, 실제로 다른 세포 유형에는 결합되지 않는다 (Janeway, C.A. et al. (2005) In: Immunobiology: The Immune System In Health and Disease", 6th ed. Garland Science Publishing, NY, pp. 214- 216; Sun, Z. J. et al. (2001) "Mechanisms Contributing To T Cell Receptor Signaling and Assembly Revealed By The Solution Structure Of An Ectodomain Fragment Of The CD3ε:γ Heterodimer", Cell 105(7):913-923; Kuhns, M.S. et al. (2006) "Deconstructing The Form and Function Of The TCR/CD3 Complex", Immunity. 2006 Feb;24(2):133-139 참조).
T 세포상의 TCR 복합체의 변하지 않는 CD3ε 신호전달 구성요소는 T 세포와 암 세포 사이의 면역학적 시냅스의 형성을 강화하기 위한 표적으로서 사용되어 왔다. CD3과 종양 항원의 공동-얽힘은 T 세포를 활성화하여, 종양 항원을 발현하는 암 세포의 용해를 촉발한다 (Baeuerle et al. (2011) "Bispecific T Cell Engager For Cancer Therapy", In: Bispecific Antibodies, Kontermann, R.E. (Ed.) Springer-Verlag; 2011:273-287). 이런 접근법은 이중특이적 항체가 암 세포에 대한 고도의 특이성을 가진 T 세포 구획과 전체적으로 상호작용하는 것을 허용하고, 세포-표면 종양 항원의 광범위한 어레이에 광범위하에 접근가능하며 또한 표적 병원체-감염 세포에 대해 시행되어 왔다 (예컨대 Sloan et al. (2015) "Targeting HIV Reservoir in Infected CD4 T Cells by Dual-Affinity Re-targeting Molecules (DARTs) that Bind HIV Envelope and Recruit Cytotoxic T Cells", PLoS Pathog 11(11): e1005233. doi:10.1371/journal.ppat.1005233; WO 2014/159940; 및 WO 2016/054101 참조).
"헬퍼 T 세포"로 알려진, T 세포의 첫 번째 하위세트는 CD4의 발현을 특징으로 한다 (즉 그것들은 "CD4+"이다). CD4+ T 세포는 대부분의 포유류 면역 및 자가면역 반응의 필수적인 조직자들이다 (Dong, C. et al. (2003) "Immune Regulation by Novel Costimulatory Molecules", Immunolog. Res. 28(1):39-48). CD4+ T 세포의 활성화는 항원-제공 세포 (예컨대 B 세포, 대식세포 또는 수지상 세포)의 표면에 배열되는 항원:주요 조직적합성 부류 II (MHC II) 분자 복합체와 나이브 CD4+ T 세포의 표면에 배열되는 두 분자, TCR과 CD3 세포-표면 수용체 리간드의 복합체 사이의 동시자극 상호작용을 통해 매개되는 것으로 밝혀졌다. 활성화된 T 헬퍼 세포는 표적 세포에 대한 염증 반응을 매개할 수 있는 Th1 세포로 증식할 수 있다.
"세포독성 T 세포"로 알려져 있는 T 세포의 두 번째 하위세트는 CD8의 발현을 특징으로 한다 (즉 그것들은 CD3+일뿐만 아니라 "CD8+"이다). CD8은 세포독성 T-세포 상에 발현되는 2개의 구별되는 사슬들 (Leahy, D.J. (1995) "A Structural View of CD4 and CD8", FASEB J. 9:17-25)로 구성된 T-세포 공동 수용체이다. CD8+ T 세포의 활성화는 표적 세포의 표면에서 배열되는 항원:주요 조직적합성 부류 I (MHC I) 분자 복합체와 CD8+ T 세포의 표면에서 배열되는, CD8과 T 세포 수용체의 복합체 사이의 동시자극 상호작용을 통해 매개되는 것으로 밝혀졌다 (Gao, G. et al. (2000) "Molecular Interactions Of Coreceptor CD8 and MHC Class I: The Molecular Basis For Functional Coordination With The T-Cell Receptor", Immunol. Today 21:630-636). 오직 특정 면역 체계 세포들에 의해 발현되는 주요 조직적합성 부류 II (MHC II) 분자와 달리, MHC I 분자들은 매우 광범위하게 발현된다. 그러므로, 세포독성 T 세포는 광범위한 다양한 세포 유형에 결합할 수 있다. 활성화된 세포독성 T 세포는 세포독소 퍼포린(perforin), 그랜자임(granzyme), 및 그래뉼신(granulysin)의 방출을 통해 세포 사멸을 매개한다. 퍼포린의 작용을 통해, 그랜자임은 표적 세포의 세포질에 들어가고 그것들의 세린 프로테아제 기능은, 궁극적으로 표적화된 세포들의 세포자멸 (예정된 세포 사망)으로 이어지는 시스테인 프로테아제의 시리즈인, 카스파제(caspase) 캐스케이드를 촉발시킨다.
B. CD2
CD2는 T-세포들 및 자연 살해 (NK) 세포들의 표면에서 발견된 세포 부착 분자이다. CD2는 아마도 NK 세포 나노튜브 형성의 프로모터로서 NK 세포 세포독성을 향상시킨다 (Mace, E.M. et al. (2014) "Cell Biological Steps and Checkpoints in Accessing NK Cell Cytotoxicity", Immunol. Cell. Biol. 92(3):245-255; Comerci, C.J. et al. (2012) "CD2 Promotes Human Natural Killer Cell Membrane Nanotube Formation", PLoS One 7(10):e47664:1-12).
C. T 세포 수용체 ("TCR")
T 세포 수용체 ("TCR")는 CD4+ 또는 CD8+ T 세포들에 의해 천연적으로 발현되고, 그런 세포들이 항원-제공 세포의 부류 I 또는 부류 II MHC 단백질들에 의해 결합되고 제공된 항원성 펩타이드를 인지하는 것을 허용한다. TCR에 의한 pMHC (펩타이드-MHC) 복합체의 인식은 사이토카인의 생성 및 항원-제공 세포의 용해로 이어지는 세포 면역 반응의 전파를 개시한다 (예컨대, Armstrong, K.M. et al. (2008) "Conformational Changes and Flexibility In T-Cell Receptor Recognition Of Peptide-MHC Complexes", Biochem. J. 415(Pt 2):183-196; Willemsen, R. (2008) "Selection Of Human Antibody Fragments Directed Against Tumor T-Cell Epitopes For Adoptive T-Cell Therapy", Cytometry A. 73(11):1093-1099; Beier, K.C. et al. (2007) "Master Switches Of T-Cell Activation and Differentiation", Eur. Respir. J. 29:804-812; Mallone, R. et al. (2005) "Targeting T Lymphocytes For Immune Monitoring and Intervention In Autoimmune Diabetes", Am. J. Ther. 12(6):534-550 참조). CD3은 TCR에 결합하는 수용체이다 (Thomas, S. et al. (2010) "Molecular Immunology Lessons From Therapeutic T-Cell Receptor Gene Transfer", Immunology 129(2):170-177; Guy, C.S. et al. (2009) "Organization Of Proximal Signal Initiation At The TCR:CD3 Complex", Immunol. Rev. 232(1):7-21; St. Clair, E.W. (Epub 2009 Oct 12) "Novel Targeted Therapies For Autoimmunity", Curr. Opin. Immunol. 21(6):648-657; Baeuerle, P.A. et al. (Epub 2009 Jun 9) "Bispecific T-Cell Engaging Antibodies For Cancer Therapy", Cancer Res. 69(12):4941-4944; Smith-Garvin, J.E. et al. (2009) "T Cell Activation", Annu. Rev. Immunol. 27:591-619; Renders, L. et al. (2003) "Engineered CD3 Antibodies For Immunosuppression", Clin. Exp. Immunol. 133(3):307-309).
TCR ALC CD3 복합체는, CD3 ζ 사슬 제타 사슬 (또한 T Cell 수용체 T3 제타 사슬 또는 CD247로도 알려짐)과 함께 "TCR 복합체"를 포함한다 (van der Merwe, P.A. 등 (epub Dec. 3, 2010) "Mechanisms For T Cell Receptor Triggering", Nat. Rev. Immunol. 11:47-55; Wucherpfennig, K.W. et al. (2010) "Structural Biology of the T Cell Receptor: Insights into Receptor Assembly, Ligand Recognition, and Initiation of Signaling", Cold Spring Harb. Perspect. Biol. 2:a005140). 복합체는 특히 그것이 큰 수 (10)의 면역수용체 티로신-기반 활성화 모티프 (ITAM)를 함유하기 때문에 중요하다.
D. Fc 수용체: CD16, CD32 및 CD64
하기에서 상세하게 논의되는 바, 천연 IgG 항체들은 4개의 폴리펩티드 사슬: 두 개의 동일한 "경쇄" 및 두 개의 동일한 "중쇄"로 구성된다. 중쇄는 C-말단의 "CH2" 및 "CH3" 도메인을 함유하고, 두 중쇄의 회합은 면역 체계 세포들 (예컨대 B 림프구, 여포성 수지상 세포, 자연 살해 세포, 대식세포, 호중구, 호산성 세포, 호염기성 세포 및 비만 세포)의 다중 유형의 표면에서 발견된 수용체들 ("Fc 감마 수용체" "FcγR"과 같이 단수로 및 포괄적으로 "FcγRs"로도 언급됨)에 결찰(결합)할 수 있는 "Fc 도메인"을 생성한다. 그러한 수용체들은 "세포외" 부분 (따라서 Fc 도메인에 결찰할 수 있음), "경막" 부분 (세포막을 통해 뻗어나감), 및 "세포질" 부분 (세포 내부에 위치함)을 가진다. FcγRs의 다중 유형이 확인되어 있다: CD16A (FcγRIIIA), CD16B (FcγRIIIB), CD32A (FcγRIIA), CD32B (FcγRIIB), 및 CD64 (FcγRI). 그런 결합은 면역 체계에 대한 활성화 또는 억제 신호들의 변환을 초래한다.
CD16은 활성화 Fc 수용체들 FcγRIIIA (CD16A) 및 FcγRIIIB (CD16B)의 일반적인 명칭이다. CD16은 호중구, 호산성 세포, 자연 살해 (NK) 세포, 및 응집되지만 모노머가 아닌 인간 IgG에 결합하는 조직 대식세포에 의해 발현된다 (Peltz, G.A. et al. (1989) "Human Fc Gamma RIII: Cloning, Expression, and Identification Of The Chromosomal Locus Of Two Fc Receptors For IgG", Proc. Natl. Acad. Sci. (U.S.A.) 86(3):1013-1017; Bachanova, V. et al. (2014) "NK Cells In Therapy Of Cancer", Crit. Rev. Oncog. 19(1-2):133-141; Miller, J.S. (2013) "Therapeutic Applications: Natural Killer Cells In The Clinic", Hematology Am. Soc. Hematol. Educ. Program. 2013:247-253; Youinou, P. et al. (2002) "Pathogenic Effects Of Anti-Fc Gamma Receptor IIIB (CD16) On Polymorphonuclear Neutrophils In Non-Organ-Specific Autoimmune Diseases", Autoimmun Rev. 1(1-2):13-19; Peipp, M. et al. (2002) "Bispecific Antibodies Targeting Cancer Cells", Biochem. Soc. Trans. 30(4):507-511). 이 수용체들은 IgG 항체의 Fc 부분에 결합함으로써, 사이토카인의 방출을 촉발시킨다. 그런 항체들인 세포 (예컨대 암 세포, 병원체-감염된 세포 등) 표면에서 발현된 질환 하원에 결합되면, 그런 방출은 표적화된 세포의 사멸을 매개한다. 그런 사멸이 항체-의존적이기 때문에, 그것은 항체-의존성 세포-매개된 세포독성 (ADCC)으로 명명된다.
CD32A (FcγRIIA) (Brandsma, A.M. (2015) "Fc Receptor Inside-Out Signaling and Possible Impact On Antibody Therapy", Immunol Rev. 268(1):74-87; van Sorge, N.M. et al. (2003) "FcgammaR Polymorphisms: Implications For Function, Disease Susceptibility and Immunotherapy", Tissue Antigens 61(3):189-202; Selvaraj, P. et al. (2004) "Functional Regulation Of Human Neutrophil Fc Gamma Receptors", Immunol. Res. 29(1-3):219-230) 및 CD64 (FcγRI) (Lu, S. et al. (2015) "Structural Mechanism Of High Affinity FcγRI recognition Of Immunoglobulin G", Immunol. Rev. 268(1):192-200; Swisher, J.F. et al. (2015) "The Many Faces Of FcγRI: Implications For Therapeutic Antibody Function", Immunol. Rev. 268(1):160-174; Thepen, T. et al. (2009) "Fcgamma Receptor 1 (CD64), A Target Beyond Cancer", Curr. Pharm. Des. 15(23):2712-2718; Rouard, H. et al. (1997) "Fc Receptors As Targets For Immunotherapy", Int. Rev. Immunol. 16(1-2):147-185)는 대식세포, 호중구, 호산성 세포 및 수지상 세포들에서 (CD32A의 경우에는, 또한 혈소판 및 랑게르한 세포에서)발현되는 활성화 Fc 수용체들이다. 대조적으로, CD32B (FcγRIIB)는 B 림프구 (대식세포, 호중구, 및 호산성 세포) 상의 억제 Fc 수용체이다 (Stopforth, R.J. et al. (2016) "Regulation of Monoclonal Antibody Immunotherapy by FcγRIIB", J. Clin. Immunol. [2016 Feb 27 Epub], pp. 1-7; Bruhns, P. et al. (2009) "Specificity and Affinity Of Human Fcgamma Receptors and Their Polymorphic Variants For Human IgG Subclasses", Blood. 113(16):3716-3725; White, A.L. et al. (2014) "FcγRIIB As A Key Determinant Of Agonistic Antibody Efficacy", Curr. Top. Microbiol. Immunol. 382:355-372; Selvaraj, P. et al. (2004) "Functional Regulation Of Human Neutrophil Fc Gamma Receptors", Immunol. Res. 29(1-3):219-230).
상이한 FcγR들이 전혀 다른 반대되는 기능을 매개하는 능력은 구조적 차이, 특히 FcγR이 면역수용체 티로신-기반 활성화 모티프 ("ITAM") 또는 면역수용체 티로신-기반 억제 모티프 ("ITIM")를 가지는지를 반영한다. 이 구조들에의 상이한 세포질 효소들의 충원은 FcγR-매개된 세포 반응의 결과에 영향을 준다. ITAM-함유 FcγRs로는 FcγRI, FcγRIIA, FcγRIIIA가 있고, Fc 도메인들 (예컨대 면역 복합체에 존재하는 응집된 Fc 도메인들)에 결합될 때 면역 체계를 활성화한다. FcγRIIB는 현재 유일하게 알려져 있는 자연 ITIM-함유 FcγR이고; 응집된 Fc 도메인에 결합되었을 때 면역 체계를 약화시키거나 억제하는 작용을 한다.
E. NKG2D 수용체
자연 살해 그룹 2D ("NKG2D") 수용체는 모든 인간 (및 다른 포유류) 자연 살해 세포들에서 (Bauer, S. et al. (1999) "Activation Of NK Cells and T Cells By NKG2D, A Receptor For Stress-Inducible MICA", Science 285(5428):727-729; Jamieson, A.M. et al. (2002) "The Role Of The NKG2D Immunoreceptor In Immune Cell Activation and Natural Killing", Immunity 17(1):19-29)뿐만 아니라 모든 CD8+ T 세포들에서 발현된다 (Groh, V. et al. (2001) "Costimulation Of CD8αβ T Cells By NKG2D Via Engagement By MIC Induced On Virus-Infected Cells", Nat. Immunol. 2(3):255-260; Jamieson, A.M. et al. (2002) "The Role Of The NKG2D Immunoreceptor In Immune Cell Activation and Natural Killing", Immunity 17(1):19-29). NKG2D 리간드는 정상 세포 표면에서 완전히 없거나, 또는 단지 저수준으로 존재하지만, 감염된, 형질전환된, 노쇠한 또는 스트레스를 받은 세포들에 의해 과잉발현된다. 그러한 결합 리간드들, 및 특히 정상 세포들에서는 발현되지 않는 것들로는, 조직적합성 60 (H60) 분자, 레티노산 초기 유도성 유전자-1 (RAE-1)의 생성물, 및 쥐과의 UL16-결합 단백질-유사 전사물 1 ((MULT1)을 들 수 있다 (Raulet D.H. (2003) "Roles Of The NKG2D Immunoreceptor and Its Ligands", Nature Rev. Immunol. 3:781-790; Coudert, J.D. et al. (2005) "Altered NKG2D Function In NK Cells Induced By Chronic Exposure To Altered NKG2D Ligand-Expressing Tumor Cells", Blood 106:1711-1717).
III. 면역 체계 세포들의 상호작용 분자들
여러 상이한 종류의 항원-제공 세포 분자들 및 T 세포 분자들을 포함하는 상호작용은 면역 반응의 필요한 두 번째 상호작용에 영향을 미친다.
A. CD80/CD86 및 CD28/CTLA-4
항원-제공 세포들의 B7.1 (CD80) 및 B7.2 (CD86) 리간드와 CD4+ T 림프구들의 CD28 및 CTLA-4 수용체 사이의 결합은 면역 반응의 필요한 두 번째 상호작용에 특히 중요하다 (Sharpe, A.H. et al. (2002) "The B7-CD28 Superfamily", Nature Rev. Immunol. 2:116-126; Dong, C. et al. (2003) "Immune Regulation by Novel Costimulatory Molecules", Immunolog. Res. 28(1):39-48; Lindley, P.S. et al. (2009) "The Clinical Utility Of Inhibiting CD28-Mediated Costimulation", Immunol. Rev. 229:307-321). CD28에 대한 B7.1 또는 B7.2의 결합은 T-세포 활성화를 자극하고; CTLA-4에 대한 B7.1 또는 B7.2의 결합은 그러한 활성화를 억제한다 (Dong, C. et al. (2003) "Immune Regulation by Novel Costimulatory Molecules", Immunolog. Res. 28(1):39-48; Lindley, P.S. et al. (2009) "The Clinical Utility Of Inhibiting CD28-Mediated Costimulation", Immunol. Rev. 229:307-321; Greenwald, R.J. et al. (2005) "The B7 Family Revisited", Ann. Rev. Immunol. 23:515-548). CD28은 T-세포의 표면에서 본질적으로 발현되고 (Gross, J., et al. (1992) "Identification and Distribution Of The Costimulatory Receptor CD28 In The Mouse", J. Immunol. 149:380-388), 반면 CTLA-4 발현은 T-세포 활성화 후에 신속하게 상향조절된다 (Linsley, P. et al. (1996) "Intracellular Trafficking Of CTLA4 and Focal Localization Towards Sites Of TCR Engagement", Immunity 4:535-543). CTLA-4가 고도의 친화성 수용체이기 때문에 (Sharpe, A.H. et al. (2002) "The B7-CD28 Superfamily", Nature Rev. Immunol. 2:116-126; Topalian, S.L. et al. (2015) "Immune Checkpoint Blockade: A Common Denominator Approach to Cancer Therapy", Cancer Cell 27:450-461), 결합은 먼저 T-세포 증식을 개시하고 (CD28을 통하여) 그런 후 그것을 억제함으로써 (CTLA-4의 초기 발현을 통하여), 증식이 더 이상 필요하지 않게 될 때 효과를 약화시킨다.
B. PD-1 및 B7-H1 / B7-DC
예정된 사망-1 ("PD-1", 또한 "CD270"로도 알려져 있음)은 면역 반응을 광범위하게 음성적으로 조절하는 T-세포 조절자들의 팽창된 CD28/CTLA-4 패밀리의 유형 I 막 단백질 구성원이다 (Ishida, Y. et al. (1992) "Induced Expression Of PD-1, A Novel Member Of The Immunoglobulin Gene Superfamily, Upon Programmed Cell Death", EMBO J. 11:3887-3895; 미국 특허 출원 공개 번호 2007/0202100; 2008/0311117; 2009/00110667; 미국 특허 번호 6,808,710; 7,101,550; 7,488,802; 7,635,757; 7,722,868; PCT 공개 번호 WO 01/14557).
비록 PD-1 및 CTLA-4가 둘 다 억제성 면역 신호를 제공하지만, PD-1에 의해 제공된 신호들은 질환 과정에서 후기에 증가하고, 질환-반응성 T-세포의 초기 생성을 제한함으로써 ("파열(burst)") 면역 반응을 현저하게 감소시킬 수 있다. 그런 PD-1이 자체로 잠재적으로 효과적인 T-세포 반응을 내성적인 것으로 부분적으로 전환시킬 수 있다 (Topalian, S.L. et al. (2015) "Immune Checkpoint Blockade: A Common Denominator Approach to Cancer Therapy", Cancer Cell 27:450-461).
PD-1 시스템의 수용체-리간드 상호작용은 CD28/CTLA-4 시스템의 수용체-리간드 상호작용보다 더 훨씬 복잡한 것으로 나타난다. PD-1은 활성화된 T-세포, B-세포, 및 단핵세포의 세포 표면에서 발현되고 (Agata, Y. et al. (1996) "Expression Of The PD-1 Antigen On The Surface Of Stimulated Mouse T and B Lymphocytes", Int. Immunol. 8(5):765-772; Yamazaki, T. et al. (2002) "Expression Of Programmed Death 1 Ligands By Murine T-Cells and APC", J. Immunol. 169:5538-5545) 자연 살해 (NK) T-세포에서는 저수준으로 발현된다 (Nishimura, H. et al. (2000) "Facilitation Of Beta Selection and Modification Of Positive Selection In The Thymus Of PD-1-Deficient Mice", J. Exp. Med. 191:891-898; Martin-Orozco, N. et al. (2007) "Inhibitory Costimulation and Anti-Tumor Immunity", Semin. Cancer Biol. 17(4):288-298).
PD-1의 세포외 영역은 CTLA-4의 동등한 도메인에 23% 동일한 단일 면역글로불린 (Ig)V 도메인으로 구성된다 (Martin-Orozco, N. et al. (2007) "Inhibitory Costimulation and Anti-Tumor Immunity", Semin. Cancer Biol. 17(4):288-298). 세포외재성 IgV 도메인에는 경막 영역 및 세포내 꼬리(tail)가 이어진다. 세포내 꼬리는 면역수용체 티로신-기반 억제 모티프 및 면역수용체 티로신-기반 스위치 모티프에 위치한 두 개의 인산화 부위를 함유하고, 그것은 PD-1이 음성적으로 TCR 신호들을 조절하는 것을 시사한다 (Ishida, Y. et al. (1992) "Induced Expression Of PD-1, A Novel Member Of The Immunoglobulin Gene Superfamily, Upon Programmed Cell Death", EMBO J. 11:3887-3895; Blank, C. et al. (2006) "Contribution Of The PD-L1/PD-1 Pathway To T-Cell Exhaustion: An Update On Implications For Chronic Infections and Tumor Evasion Cancer", Immunol. Immunother. 56(5):739-745).
PD-1은 B7-H1 및 B7-DC (또한 PD-L1 및 PD-L2로도 알려져 있음)에 결합함으로써 면역 체계의 억제를 매개한다 (Flies, D.B. et al. (2007) "The New B7s: Playing a Pivotal Role in Tumor Immunity", J. Immunother. 30(3):251-260; 미국 특허 번호 6,803,192; 7,794,710; 미국 특허 출원 공개 번호 2005/0059051; 2009/0055944; 2009/0274666; 2009/0313687; PCT 공개 번호 WO 01/39722; WO 02/086083).
B7-H1 및 B7-DC는 많은 유형의 인간 및 쥐과 조직, 예컨대 심장, 태반, 근육, 태아 간, 비장, 림프절, 및 흉선뿐 아니라 쥐과의 간, 폐, 신장, 췌장 및 소장의 샘 세포의 표면에서 광범위하게 발현된다 (Martin-Orozco, N. et al. (2007) "Inhibitory Costimulation and Anti-Tumor Immunity", Semin. Cancer Biol. 17(4):288-298). 인간에서, B7-H1 단백질 발현은 인간 내피 세포에서 (Chen, Y. et al. (2005) "Expression of B7-H1 in Inflammatory Renal Tubular Epithelial Cells", Nephron. Exp. Nephrol. 102:e81-e92; de Haij, S. et al. (2005) "Renal Tubular Epithelial Cells Modulate T-Cell Responses Via ICOS-L and B7-H1" Kidney Int. 68:2091-2102; Mazanet, M.M. et al. (2002) "B7-H1 Is Expressed By Human Endothelial Cells and Suppresses T-Cell Cytokine Synthesis", J. Immunol. 169:3581-3588), 심근에서 (Brown, J.A. et al. (2003) "Blockade Of Programmed Death-1 Ligands On Dendritic Cells Enhances T-Cell Activation and Cytokine Production", J. Immunol. 170:1257-1266), 융합세포영양막에서 (Petroff, M.G. et al. (2002) "B7 Family Molecules: Novel Immunomodulators At The Maternal-Fetal Interface", Placenta 23:S95-S101) 밝혀졌다. 분자들은 또한 일부 조직의 거주 대식세포에 의해, 인터페론 (IFN)-γ 또는 종양 괴사 인자 (TNF)-α로 활성화된 대식세포들에 의해 (Latchman, Y. et al. (2001) "PD-L2 Is A Second Ligand For PD-1 and Inhibits T-Cell Activation", Nat. Immunol 2:261-268), 및 종양에서 발현된다 (Dong, H. (2003) "B7-H1 Pathway and Its Role In The Evasion Of Tumor Immunity", J. Mol. Med. 81:281-287).
B7-H1과 PD-1 사이의 상호작용은 T 및 B-세포에 대해 중대한 네거티브 동시자극 신호를 제공하고 (Martin-Orozco, N. et al. (2007) "Inhibitory Costimulation and Anti-Tumor Immunity", Semin. Cancer Biol. 17(4):288-298) 세포 사망 유도자로서 작용하는 것으로 밝혀졌다 (Ishida, Y. et al. (1992) "Induced Expression Of PD-1, A Novel Member Of The Immunoglobulin Gene Superfamily, Upon Programmed Cell Death", EMBO J. 11:3887-3895; Subudhi, S.K. et al. (2005) "The Balance Of Immune Responses: Costimulation Verse Coinhibition", J. Molec. Med. 83:193-202). 보다 구체적으로, 저농도의 PD-1 수용체와 B7-H1 리간드 사이의 상호작용은 항원-특이적 CD8+ T-세포의 증식을 강력하게 억제하는 억제 신호의 전파를 초래하는 것으로 밝혀졌고; 고농도에서는, PD-1과의 상호작용은 T-세포 증식을 억제하지는 못하지만 다중 사아토카인들의 생성을 현저하게 감소시키는 것으로 밝혀졌다 (Sharpe, A.H. et al. (2002) "The B7-CD28 Superfamily", Nature Rev. Immunol. 2:116-126). 정지기 및 이전에 활성화된 CD4 및 CD8 T-세포들, 및 심지어 제대혈로부터의 나이브 T-세포들에 의한 T-세포 증식 및 사이토카인 생성은 가용성 B7-H1-Fc 융합 단백질에 의해 억제되는 것으로 밝혀졌다 (Freeman, G.J. et al. (2000) "Engagement Of The PD-1 Immunoinhibitory Receptor By A Novel B7 Family Member Leads To Negative Regulation Of Lymphocyte Activation", J. Exp. Med. 192:1-9; Latchman, Y. et al. (2001) "PD-L2 Is A Second Ligand For PD-1 and Inhibits T-Cell Activation", Nature Immunol. 2:261-268; Carter, L. et al. (2002) "PD-1:PD-L Inhibitory Pathway Affects Both CD4(+) and CD8(+) T-cells And Is Overcome By IL-2", Eur. J. Immunol. 32(3):634-643; Sharpe, A.H. et al. (2002) "The B7-CD28 Superfamily", Nature Rev. Immunol. 2:116-126).
T-세포 활성화 및 증식을 억제하는 데 B7-H1 및 PD-1의 역할은 이 생물분자들이 염증 및 암을 치료하기 위한 치료적 표적으로서 작용할 것임을 시사하였다. 그러므로, 감염 및 종양을 치료하고 적응성 면역 반응을 상향 조절하기 위한 항-PD-1 항체들의 사용이 제안되었다 (미국 특허 출원 공개 번호 2010/0040614; 2010/0028330; 2004/0241745; 2008/0311117; 2009/0217401; 미국 특허 번호 7,521,051; 7,563,869; 7,595,048; PCT 공개 번호 WO 2004/056875; WO 2008/083174 참조). PD-1에 특이적으로 결합할 수 있는 항체들은 문헌에 보고되었다: Agata, T. et al. (1996) "Expression Of The PD-1 Antigen On The Surface Of Stimulated Mouse T And B Lymphocytes", Int. Immunol. 8(5):765-772; 및 Berger, R. et al. (2008) "Phase I Safety And Pharmacokinetic Study Of CT-011, A Humanized Antibody Interacting With PD-1, In Patients With Advanced Hematologic Malignancies", Clin. Cancer Res. 14(10):3044-3051 (또한 미국 특허 번호 8,008,449 및 8,552,154; US 특허 공개 번호 2007/0166281; 2012/0114648; 2012/0114649; 2013/0017199; 2013/0230514 및 2014/0044738; 및 PCT 특허 공개 번호 WO 2003/099196; WO 2004/004771; WO 2004/056875; WO 2004/072286; WO 2006/121168; WO 2007/005874; WO 2008/083174; WO 2009/014708; WO 2009/073533; WO 2012/135408, WO 2012/145549; 및 WO 2013/014668 참조).
포유류 면역 반응에 포함된 분자들을 확인하는 데 있어 그러한 진전에도 불구하고, 여전히 암 및 감염성 질환을 치료하기 위해 개선된 치료법에 대한 필요성이 남는다. 본 발명은 이 목표 및 기타 목표에 관한 것이다.
본 발명은 암 및 병원체-관련 질환의 치료를 위한 조합 치료법에 관한 것으로, (1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자 (예컨대 디아바디, scFv, 항체, TandAb, 등), 및 (2) 질환 항원(disease antigen)을 발현하는 표적 세포의 재지정된 사멸(redirected killing)을 매개할 수 있는 분자 (예컨대 디아바디, BiTe, 이중특이적 항체, CAR, 등)의 투여를 포함한다. 발명은 특히 표적 세포의 재지정된 사멸을 매개할 수 있는 분자가 이펙터 세포의 세포 표면 분자의 에피토프에 면역특이적으로 결합할 수 있는 제 1 에피토프-결합 부위 및 그러한 표적 세포 (즉 암 항원 또는 병원체-관련 항원과 같은 질환 항원)의 에피토프에 면역특이적으로 결합할 수 있는 제 2 에피토프-결합 부위를 포함하는 이중특이적 결합 분자인 구체예에 관한 것이다. 본 발명은 또한 그러한 분자(들)을 포함하는 제약학적 조성물에 관한 것이다.
상세하게 설명하면, 본 발명은 암 또는 병원체-관련 질환의 치료를 위한 방법을 제공하며, 그 방법은
(1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 및
(2) 표적 세포의 재지정된 사멸을 매개할 수 있는 분자
의 치료적 유효량을 그것을 필요로 하는 대상체에게 투여하는 단계를 포함하며, 상기 표적 세포는
(a) 암 항원을 발현하는 암 세포; 또는
(b) 병원체-관련 항원을 발현하는 병원체-감염 세포이다.
발명은 특히 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자가 PD-1과 PD-1의 천연 리간드 사이의 결합을 억제할 수 있는, 상기 방법의 구체예에 관련된다.
발명은 추가로 상기 방법의 구체예에 관련되며, 방법은 3개의 에피토프-결합 도메인을 점증적으로 포함하는 두 개의 결합 분자의 투여를 포함하고, 두 개의 결합 분자는:
(A) PD-1에 결합할 수 있는 항체의 에피토프-결합 도메인, 또는 PD-1의 천연 리간드에 결합할 수 있는 항체의 에피토프-결합 도메인을 포함하는 결합 분자; 및
(B) (1) 이펙터 세포의 세포 표면 분자에 결합할 수 있는 항체의 에피토프-결합 도메인; 및
(2) 표적 세포의 암 항원 또는 병원체 항원에 결합할 수 있는 항체의 에피토프-결합 도메인을 포함하는 결합 분자이며;
결합 분자 (A)의 에피토프-결합 도메인은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있고, 결합 분자 (B)의 에피토프-결합 도메인 (1) 및 (2)는 표적 세포의 재지정된 사멸을 매개할 수 있다.
발명은 추가로 상기 방법의 구체예에 관련되며, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 결합 분자는 디아바디, scFv, 항체 또는 TandAb를 포함하며, 결합 분자 (B)는 이중특이적 디아바디, CAR, BiTe, 또는 이중특이적 항체를 포함한다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 결합 분자가 PD-1에 결합하는 항체의 에피토프-결합 도메인을 포함하는 상기 방법의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 결합 분자가 PD-1의 천연 리간드에 결합하는 항체의 에피토프-결합 도메인을 포함하는, 상기 방법의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 결합 분자가 PD-1에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하고, 그런 에피토프-결합 도메인은
(a) PD-1의 동일한 에피토프에의 결합에 대해 경합하거나; 또는
(b) PD-1의 동일한 에피토프에의 결합에 대해 경합하지 않는, 상기 방법의 구체예에 관련된다.
발명은 추가로 PD-1-에피토프-결합 도메인들이 동일한 PD-1 분자에 동시에 결합할 수 있는, 상기 방법의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 결합 분자가 PD-1의 천연 리간드에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하고, 그런 에피토프-결합 도메인은
(a) 상기 PD-1의 천연 리간드의 동일한 에피토프에의 결합에 대해 경합하거나; 또는
(b) 상기 PD-1의 천연 리간드의 동일한 에피토프에의 결합에 대해 경합하지 않는, 상기 방법의 구체예에 관련된다.
발명은 추가로 PD-1 리간드-에피토프-결합 도메인들이 PD-1의 천연 리간드의 동일한 분자에 동시에 결합할 수 있는 상기 방법의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 결합 분자가 PD-1 또는 PD-1의 천연 리간드가 아닌 분자의 에피토프에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하는, 상기 방법의 구체예에 관련된다.
발명은 추가로 제 2 에피토프-결합 도메인이 CD137, LAG-3, OX40, TIGIT, TIM-3, 또는 VISTA의 에피토프에 결합하는, 상기 방법의 구체예에 관련된다.
발명은 추가로 표적 세포의 재지정된 사멸을 매개할 수 있는 결합 분자가 이펙터 세포의 세포 표면 분자에 결합할 수 있는 제 3 에피토프-결합 도메인을 포함하는, 상기 방법의 구체예에 관련된다.
발명은 추가로 표적 세포의 재지정된 사멸을 매개할 수 있는 결합 분자의 제 3 에피토프-결합-도메인이 이펙터 세포의 상이한 표면 분자에 결합할 수 있어서, 재지정된 사멸을 매개할 수 있는 결합 분자가 이펙터 세포의 두 개의 상이한 세포 표면 분자에 결합할 수 있는, 상기 방법의 구체예에 관련된다.
발명은 추가로 표적 세포의 재지정된 사멸을 매개할 수 있는 결합 분자가 표적 세포의 암 항원 또는 병원체-관련 항원에 결합할 수 있는 제 3 에피토프-결합 도메인을 포함하는, 상기 방법의 구체예에 관련된다.
발명은 추가로 표적 세포의 재지정된 사멸을 매개할 수 있는 결합 분자의 제 3 에피토프-결합-도메인이 표적 세포의 상이한 암 항원 또는 상이한 병원체 항원에 결합할 수 있어서, 재지정된 사멸을 매개할 수 있는 결합 분자가 표적 세포의 두 개의 상이한 암 항원 또는 두 개의 상이한 병원체 항원에 결합할 수 있는, 상기 방법의 구체예에 관련된다.
발명은 추가로 이펙터 세포의 세포 표면 분자가 CD2, CD3, CD8, CD16, TCR, 및 NKG2D로 구성되는 군으로부터 선택되는 상기 방법의 구체예에 관련된다.
발명은 추가로 암 항원이 암 항원: 19.9, 4.2, A33, ADAM-9, AH6, ALCAM, B1, B7-H3, BAGE, 베타-카테닌, 혈액 군 ALeb/Ley, 버킷 림프종 항원-38.13, C14, CA125, 카르복시펩티다제 M, CD5, CD19, CD20, CD22, CD23, CD25, CD27, CD28, CD33, CD36, CD40/CD154, CD45, CD56, CD46, CD52, CD56, CD79a/CD79b, CD103, CD123, CD317, CDK4, CEA, CEACAM5/CEACAM6, CO17-1A, CO-43, CO-514, CTA-1, CTLA-4, 사이토케라틴 8, D1.1, D156-22, DR5, E1 시리즈, EGFR, 에프린(Ephrin) 수용체, Erb, GAGE, GD2/GD3/GM2 강글리오시드, GICA 19-9, gp100, Gp37, gp75, gpA33, HER2/neu, HMFG, 인간 유두종 바이러스-E6/인간 유두종 바이러스-E7, HMW-MAA, I 항원, IL13Rα2, 인티그린 β6, JAM-3, KID3, KID31, KS 1/4 pan-암종 항원, L6,L20, LEA, LUCA-2, M1:22:25:8, M18, M39, MAGE, MART, 메소텔린(mesothelin), MUC-1, MUM-1, Myl, N-아세틸글루코사미닐트랜스퍼라제, 네오당단백질, NS-10, OFA-1, OFA-2, 온코스타틴 M, p15, p97, PEM, PEMA, PIPA, PSA, PSMA, 전립선 산 포스페이트, R24, ROR1, 스핑고지질, SSEA-1, SSEA-3, SSEA-4, sTn, T 세포 수용체 유래 펩타이드, T5A7, TAG-72, TL5, TNF-수용체, TNF-γ 수용체, TRA-1-85, 트란스페린 수용체, 5T4, TSTA, VEGF, a VEGF 수용체, VEP8, VEP9, VIM-D5, 및 Y 합텐, Ley로 구성되는 군으로부터 선택되는, 상기 방법의 구체예에 관련된다.
본 발명은 추가로 방법이 제약학적 조성물의 투여를 포함하고, 병원체-관련 항원이 병원체-관련 항원: 헤르페스 단순 바이러스 감염된 세포 단백질 (ICP)47, 헤르페스 단순 바이러스 gD, 엡스타인-바르 바이러스 LMP-1, 엡스타인-바르 바이러스 LMP-2A, 엡스타인-바르 바이러스 LMP-2B, 인간 면역결핍 바이러스 gp160, 인간 면역결핍 바이러스 gp120, 인간 면역결핍 바이러스 gp41, 등), 인간 유두종 바이러스 B6, 인간 유두종 바이러스 E7, 인간 T-세포 백혈병 바이러스 gp64, 인간 T-세포 백혈병 바이러스 gp46, 및 인간 T-세포 백혈병 바이러스 gp21로 구성되는 군으로부터 선택되는, 상기 방법의 구체예에 관련된다.
발명은 추가로
(A) (1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 및
(2) 암 항원 또는 병원체 항원을 발현하는 표적 세포의 재지정된 사멸을 매개할 수 있는 분자
의 치료적 유효량, 및
(B) 제약학적으로 허용되는 담체
를 포함하는 제약학적 조성물을 제공한다.
발명은 추가로 제약학적 조성물이 3개의 에피토프-결합 도메인을 점증적으로 포함하는 두 개의 결합 분자를 포함하며, 두 개의 결합 분자는:
(A) PD-1에 결합할 수 있는 항체의 에피토프-결합 도메인, 또는 PD-1의 천연 리간드에 결합할 수 있는 항체의 에피토프-결합 도메인을 포함하는 결합 분자; 및
(B) (1) 이펙터 세포의 세포 표면 분자에 결합할 수 있는 항체의 에피토프-결합 도메인; 및
(2) 표적 세포의 암 항원 또는 병원체-관련 항원에 결합할 수 있는 항체의 에피토프-결합 도메인
을 포함하는 결합 분자이며;
결합 분자 (A)의 에피토프-결합 도메인은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있고, 결합 분자 (B)의 에피토프-결합 도메인 (1) 및 (2)는 표적 세포의 재지정된 사멸을 매개할 수 있는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 결합 분자 (A)가 디아바디, scFv, 항체, 또는 TandAb를 포함하고, 결합 분자 (B)가 디아바디, CAR, BiTe, 또는 이중특이적 항체를 포함하는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자가 PD-1에 결합하는 항체의 에피토프-결합 도메인을 포함하는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자가 PD-1의 천연 리간드에 결합하는 항체의 에피토프-결합 도메인을 포함하는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자가 PD-1에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하며, 이때 그런 PD-1-에피토프-결합 도메인은
(a) PD-1의 동일한 에피토프에의 결합에 대해 경합하거나; 또는
(b) PD-1의 동일한 에피토프에의 결합에 대해 경합하지 않는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 PD-1-에피토프-결합 도메인이 동일한 PD-1 분자에 동시에 결합할 수 있는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 결합 분자가 PD-1의 천연 리간드에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하며, 이때 그런 에피토프-결합 도메인은
(a) 상기 PD-1의 천연 리간드의 동일한 에피토프에의 결합에 대해 경합하거나; 또는
(b) 상기 PD-1의 천연 리간드의 동일한 에피토프에의 결합에 대해 경합하지 않는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 PD-1 리간드-에피토프-결합 도메인들이 PD-1의 천연 리간드의 동일한 분자에 동시에 결합할 수 있는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 결합 분자가 PD-1 또는 PD-1의 천연 리간드가 아닌 분자의 에피토프에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 제 2 에피토프-결합 도메인이 CD137, LAG-3, OX40, TIGIT, TIM-3, 또는 VISTA의 에피토프에 결합하는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 표적 세포의 재지정된 사멸을 매개할 수 있는 분자가 제 3 에피토프-결합 도메인을 포함하고, 그러한 3개의 에피토프-결합 도메인은 동시에 결합할 수 있으며, 제 3 에피토프-결합 부위는 이펙터 세포의 세포 표면 분자의 에피토프에 결합할 수 있는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 표적 세포의 재지정된 사멸을 매개할 수 있는 결합 분자의 제 3 에피토프-결합-도메인이 이펙터 세포의 상이한 세포 표면 분자에 결합할 수 있어서, 재지정된 사멸을 매개할 수 있는 결합 분자는 이펙터 세포의 두 개의 상이한 세포 표면 분자에 결합할 수 있는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 표적 세포의 재지정된 사멸을 매개할 수 있는 결합 분자가 표적 세포의 암 항원 또는 병원체-관련 항원에 결합할 수 있는 제 3 에피토프-결합 도메인을 포함하는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 표적 세포의 재지정된 사멸을 매개할 수 있는 결합 분자의 제 3 에피토프-결합-도메인이 표적 세포의 상이한 암 항원 또는 상이한 병원체-관련 항원에 결합할 수 있어서, 재지정된 사멸을 매개할 수 있는 결합 분자는 표적 세포의 두 개의 상이한 암 항원 또는 두 개의 상이한 병원체-관련 항원에 결합할 수 있는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 이펙터 세포의 세포 표면 분자가 CD2, CD3, CD8, CD16, TCR, 및 NKG2D로 구성되는 군으로부터 선택되는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 암 항원이 암 항원: 19.9, 4.2, A33, ADAM-9, AH6, ALCAM, B1, B7-H3, BAGE, 베타-카테닌, 혈액 군 ALeb/Ley, 버킷 림프종 항원-38.13, C14, CA125, 카르복시펩티다제 M, CD5, CD19, CD20, CD22, CD23, CD25, CD27, CD28, CD33, CD36, CD40/CD154, CD45, CD56, CD46, CD52, CD56, CD79a/CD79b, CD103, CD123, CD317, CDK4, CEA, CEACAM5/CEACAM6, CO17-1A, CO-43, CO-514, CTA-1, CTLA-4, 사이토케라틴 8, D1.1, D156-22, DR5, E1 시리즈, EGFR, 에프린(Ephrin) 수용체, Erb, GAGE, GD2/GD3/GM2 강들리오시드, GICA 19-9, gp100, Gp37, gp75, gpA33, HER2/neu, HMFG, 인간 유두종 바이러스-E6/인간 유두종 바이러스-E7, HMW-MAA, I 항원, IL13Rα2, 인티그린 β6, JAM-3, KID3, KID31, KS 1/4 pan-암종 항원, L6,L20, LEA, LUCA-2, M1:22:25:8, M18, M39, MAGE, MART, 메소텔린(mesothelin), MUC-1, MUM-1, Myl, N-아세틸글루코사미닐트란스페라제, 네오당단백질, NS-10, OFA-1, OFA-2, 온코스타틴 M, p15, p97, PEM, PEMA, PIPA, PSA, PSMA, 전립선 산 포스페이트, R24, ROR1, 스핑고지질, SSEA-1, SSEA-3, SSEA-4, sTn, T 세포 수용체 유래 펩타이드, T5A7, TAG-72, TL5, TNF-수용체, TNF-γ 수용체, TRA-1-85, 트란스페린 수용체, 5T4, TSTA, VEGF, a VEGF 수용체, VEP8, VEP9, VIM-D5, 및 Y 합텐, Ley로 구성되는 군으로부터 선택되는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 병원체-관련 항원이 병원체 항원: 헤르페스 단순 바이러스 감염된 세포 단백질 (ICP)47, 헤르페스 단순 바이러스 gD, 엡스타인-바르 바이러스 LMP-1, 엡스타인-바르 바이러스 LMP-2A, 엡스타인-바르 바이러스 LMP-2B, 인간 면역결핍 바이러스 gp160, 인간 면역결핍 바이러스 gp120, 인간 면역결핍 바이러스 gp41, 등), 인간 유두종 바이러스 B6, 인간 유두종 바이러스 E7, 인간 T-세포 백혈병 바이러스 gp64, 인간 T-세포 백혈병 바이러스 gp46, 및 인간 T-세포 백혈병 바이러스 gp21로 구성되는 군으로부터 선택되는, 상기 제약학적 조성물의 구체예에 관련된다.
발명은 추가로 상기 기술된 제약학적 조성물들 중 임의의 것을 포함하는 키트를 제공하며, 여기서 그것의 결합 분자들은 하나 이상의 용기에 구획화된다.
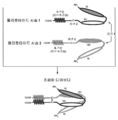
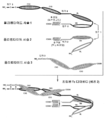
도 1은 각각이 E-코일 또는 K-코일 헤테로다이머-촉진 도메인 (대체 헤테로다이머-촉진 도메인들이 하기에 제공됨)을 가지는 두 개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 디아바디의 개략도를 도시한다. 시스테인 잔기가 도 3B에 도시된 것과 같이 링커에 및/또는 헤테로다이머-촉진 도메인에 존재할 수 있다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들이 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
도 2는 각각이 CH2 및 CH3 도메인을 가지는 두 개의 폴리펩타이드 사슬로 구성된 두 개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 디아바디 분자의 개략도를 도시한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들이 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
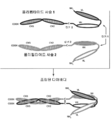
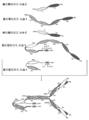
도 3A 내지 3C는 두 쌍의 폴리펩타이드 사슬로 구성된 (즉 모두 4개의 폴리펩타이드 사슬) 4개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 사가(tetravalent) 디아바디를 나타내는 개략도를 도시한다. 각각의 쌍의 하나의 폴리펩타이드는 CH2 및 CH3 도메인을 가짐으로써, 회합된 사슬들은 Fc 도메인의 전부 또는 일부를 형성한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들은 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다. 두 쌍의 폴리펩타이드 사슬은 동일할 수 있다. 두 쌍의 폴리펩타이드 사슬이 동일하고 VL 및 VH 도메인이 상이한 에피토프를 인식하는 (도 3A 내지 3B에 도시된 것과 같이) 그런 구체예에서, 결과적으로 형성된 분자는 4개의 에피토프-결합 도메인을 가지며 각각의 결합된 에피토프와 관련하여 이중특이적이고 이가(bivalent)이다. VL 및 VH 도메인이 동일한 에피토프를 인식하는 그런 구체예에서 (예컨대 동일한 VL 도메인 CDRs 및 동일한 VH 도메인 CDR이 두 사슬에서 모두 사용됨) 결과적으로 형성된 분자는 4개의 에피토프-결합 도메인을 가지며 단일 에피토프와 관련하여 단일특이적이고 사가이다. 대안적으로, 두 쌍의 폴리펩타이드는 상이할 수 있다. 두 쌍의 폴리펩타이드 사슬이 상이하고 각 쌍의 폴리펩타이드의 VL 및 VH 도메인이 상이한 에피토프를 인식하는 그런 구체예에서 (도 3C에서 상이한 쉐이딩 및 패턴에 의해 도시된 것과 같이), 결과적으로 형성된 분자는 4개의 에피토프-결합 도메인을 가지며 각각의 결합된 에피토프와 관련하여 사중특이적이고 일가이다. 도 3A는 시스테인 잔기를 포함하는 펩타이드 헤테로다이머-촉진 도메인을 함유하는 Fc 도메인-함유 디아바디를 도시한다. 도 3B는 시스테인 잔기 및 링커 (선택적인 시스테인 잔기를 가짐)를 포함하는 E-코일 및 K-코일 헤테로다이머-촉진 도메인을 함유하는, Fc 도메인-함유 디아바디를 도시한다. 도 3C는 항체 CH1 및 CL 도메인을 함유한 Fc 도메인-함유 디아바디를 도시한다.
도 4A 및 4B는 3개의 폴리펩타이드 사슬로 구성된 두 개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 디아바디 분자의 개략도를 도시한다. 폴리펩타이드 사슬 중 두 개는 CH2 및 CH3 도메인을 가져서 회합된 사슬들이 Fc 도메인의 전부 또는 일부를 형성한다. VL 및 VH 도메인을 포함하는 폴리펩타이드 사슬들은 헤테로다이머-촉진 도메인을 추가로 포함한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들은 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
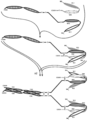
도 5는 5개의 폴리펩타이드 사슬로 구성된 4개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 디아바디 분자의 개략도를 도시한다. 폴리펩타이드 사슬 중 두 개는 CH2 및 CH3 도메인을 가져서. 회합된 사슬은 Fc 도메인의 전부 또는 일부를 포함하는 Fc 도메인을 형성한다. 결합된 VL 및 VH 도메인을 포함하는 폴리펩타이드 사슬은 추가로 헤테로다이머-촉진 도메인을 포함한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들은 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
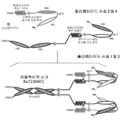
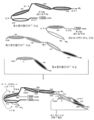
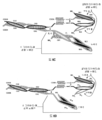
도 6A 내지 6F는 3개의 에피토프-결합 도메인을 가지는 대표적인 Fc 도메인-함유 삼가(trevalent) 결합 분자의 개략도를 도시한다. 도 6A 및 6B는 각각, 2개의 디아바디-형 결합 도메인 및 디아바디-형 결합 도메인들이 Fc 도메인에 대해 N-말단 또는 C-말단에 있는 상이한 도메인 방향을 가지는 Fab-형 결합 도메인을 포함하는 삼가 결합 분자의 도메인을 개략적으로 도시한다. 도 6A 및 6B의 분자들은 4개의 사슬을 포함한다. 도 6C 및 6D는 각각, Fc 도메인에 대해 N-말단에 있는 2개의 디아바디-형 결합 도메인, 및 경쇄 및 중쇄가 폴리펩타이드 스페이서를 통해 결합되어 있는 Fab-형 결합 도메인, 또는 scFv-형 결합 도메인을 포함하는 삼가 결합 분자의 도메인을 개략적으로 도시한다. 도 6E 및 6F의 삼가 결합 분자는, 각각, Fc 도메인에 대해 C-말단에 있는 두 개의 디아바디-형 결합 도메인, 및 경쇄 및 중쇄가 폴리펩타이드 스페이서를 통해 결합되어 있는 Fab-형 결합 도메인, 또는 scFv-형 결합 도메인을 포함하는 삼가 결합 분자의 도메인을 개략적으로 도시한다. 도 6C 내지 6F의 삼가 결합 분자는 3개의 사슬을 포함한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들은 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
도 7은 5 x 106개의 LOX-IMVI 인간 전이성 흑색종 암 세포 (ID) 및 인간화된 항-인간 PD-1 항체인 hPD-1 mAb7 (1.2) IgG4(P)를 포함한, CD3 x B7-H3 이중특이적 디아바디인 DART-A를 포함한, hPD-1 mAb7 (1.2) IgG4(P) 및 DART-A 둘 다를 포함한, 또는 비히클 단독 (대조군)을 포함한 106개의 인간 PBMC (IP)를 받은 공급받은 MHCI-/- 마우스의 결과를 도시한다.
도 8A 및 8B는 5 x 106개의 Detroit562 인간 전이성 인두 암종 암 세포 (ID) 및 인간화된 항-인간 PD-1 항체인 hPD-1 mAb7 (1.2) IgG4(P)를 포함한, CD3 x B7-H3 이중특이적 디아바디인 DART-A를 포함한, hPD-1 mAb7 (1.2) IgG4(P) 및 DART-A 둘 다를 포함한, 또는 비히클 단독 (대조군)을 포함한 106개의 인간 PBMC (IP)를 받은 공급받은 MHCI-/- 마우스의 결과를 도시한다. 도 8A는 비히클 대조군, hPD-1 mAb7 (1.2) IgG4(P) (Q7Dx5), DART-A (Q7Dx5), 및 hPD-1 mAb7 (1.2) IgG4(P) + DART-A (Q7Dx5)에 대한 결과를 도시한다. 도 8B는 비히클 대조군, hPD-1 mAb7 (1.2) IgG4(P) (Q7Dx5), DART-A (Q7Dx5), hPD-1 mAb7 (1.2) IgG4(P) + DART-A (Q7Dx5) 및 hPD-1 mAb7 (1.2) IgG4(P) + DART-A (Q14Dx3)에 대한 결과를 도시한다.
도 9는 본 발명의 조합 치료법의 투여 효과에 대한 연구 결과를 도시한다. 그 결과는 수용체 동물의 CD3+ 세포들의 농도의 증가에 의해 측정된 바 수용체 동물의 면역 반응의 향상을 나타낸다.
도 10A 내지 10B는 루시페라제 리포터 검정으로 T-세포 신호전달에 미치는 본 발명의 조합 치료법의 영향에 대한 연구 결과를 도시한다. PD-1 및 B7-H3을 발현하는 MDA-MB-231 종양 표적 세포가 MNFAT-luc2/PD-1 Jurkat T-세포와 1:1 (도 10A) 또는 3:1 (도 10B)의 이펙터:표적 세포 비율로 혼합되었고 단독으로 또는 고정 농도 (12.5 nM)의 PD-1 결합 분자 hPD-1 mAb7 (1.2) IgG4(P), DART-1, 또는 대조군 항체 (hIgG)와 함께, 증가하는 농도의 DART-A의 존재하에 배양되었다. 이 결과들은 증가된 발광에 의해 측정되는 바 두 분자의 존재하에 신호전달 활성의 향사을 나타낸다.
도 11A 내지 11B는 본 발명의 조합 치료법의 투여가 무력한 T-세포의 존재 하에 종양 재발을 감소시키는 것을 보여준다. NOG 마우스들은 5 x 106개의 A375 INFγ 처리된 흑색종 세포 및 비히클 단독, 0.5 mg/kg DART-2 (Q7Dx4), 0.5 mg/kg DART-B (QDx1), 또는 0.5 mg/kg DART-2 (Q7Dx4) 및 0.5 mg/kg DART-B (QDx1) 둘 다를 포함한 5 x 106 개의 활성화된 또는 무력한 인간 T-세포를 받았다. 도 11A는 활성화된 T 세포를 받은 마우스들에 대한 결과를 도시하고 도 11B는 무력한 T 세포를 받은 마우스들에 대한 결과를 도시한다.
도 12A 내지 12H는 분자 단독의 투여에 비교한, PD-1에 결합할 수 있는 분자 및 표적 세포의 재지정된 사멸을 매개할 수 있는 분자의 조합 치료의 예상치 못한 유익을 증명한다. A375 흑색종 세포에 의해 유발된 종양 부피가 시간의 함수로서 측정되었고 도 12A 내지 12H에 도표화된다. 도 12A는 50일에 걸쳐 그룹 1, 2, 5, 및 6에 대한 결과를 나타내고; 도 12B 내지 12H는 그룹 2 (도 12B), 그룹 5 (도 12C), 그룹 6 (도 12D), 그룹 3 (도 12E), 그룹 7 (도 12F), 그룹 4 (도 12G), 및 그룹 8 (도 12H)에서 개별적인 동물들에 대한, 80일에 걸친 스파이더 도표(spider plot)를 도시한다.
도 2는 각각이 CH2 및 CH3 도메인을 가지는 두 개의 폴리펩타이드 사슬로 구성된 두 개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 디아바디 분자의 개략도를 도시한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들이 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
도 3A 내지 3C는 두 쌍의 폴리펩타이드 사슬로 구성된 (즉 모두 4개의 폴리펩타이드 사슬) 4개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 사가(tetravalent) 디아바디를 나타내는 개략도를 도시한다. 각각의 쌍의 하나의 폴리펩타이드는 CH2 및 CH3 도메인을 가짐으로써, 회합된 사슬들은 Fc 도메인의 전부 또는 일부를 형성한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들은 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다. 두 쌍의 폴리펩타이드 사슬은 동일할 수 있다. 두 쌍의 폴리펩타이드 사슬이 동일하고 VL 및 VH 도메인이 상이한 에피토프를 인식하는 (도 3A 내지 3B에 도시된 것과 같이) 그런 구체예에서, 결과적으로 형성된 분자는 4개의 에피토프-결합 도메인을 가지며 각각의 결합된 에피토프와 관련하여 이중특이적이고 이가(bivalent)이다. VL 및 VH 도메인이 동일한 에피토프를 인식하는 그런 구체예에서 (예컨대 동일한 VL 도메인 CDRs 및 동일한 VH 도메인 CDR이 두 사슬에서 모두 사용됨) 결과적으로 형성된 분자는 4개의 에피토프-결합 도메인을 가지며 단일 에피토프와 관련하여 단일특이적이고 사가이다. 대안적으로, 두 쌍의 폴리펩타이드는 상이할 수 있다. 두 쌍의 폴리펩타이드 사슬이 상이하고 각 쌍의 폴리펩타이드의 VL 및 VH 도메인이 상이한 에피토프를 인식하는 그런 구체예에서 (도 3C에서 상이한 쉐이딩 및 패턴에 의해 도시된 것과 같이), 결과적으로 형성된 분자는 4개의 에피토프-결합 도메인을 가지며 각각의 결합된 에피토프와 관련하여 사중특이적이고 일가이다. 도 3A는 시스테인 잔기를 포함하는 펩타이드 헤테로다이머-촉진 도메인을 함유하는 Fc 도메인-함유 디아바디를 도시한다. 도 3B는 시스테인 잔기 및 링커 (선택적인 시스테인 잔기를 가짐)를 포함하는 E-코일 및 K-코일 헤테로다이머-촉진 도메인을 함유하는, Fc 도메인-함유 디아바디를 도시한다. 도 3C는 항체 CH1 및 CL 도메인을 함유한 Fc 도메인-함유 디아바디를 도시한다.
도 4A 및 4B는 3개의 폴리펩타이드 사슬로 구성된 두 개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 디아바디 분자의 개략도를 도시한다. 폴리펩타이드 사슬 중 두 개는 CH2 및 CH3 도메인을 가져서 회합된 사슬들이 Fc 도메인의 전부 또는 일부를 형성한다. VL 및 VH 도메인을 포함하는 폴리펩타이드 사슬들은 헤테로다이머-촉진 도메인을 추가로 포함한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들은 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
도 5는 5개의 폴리펩타이드 사슬로 구성된 4개의 에피토프-결합 도메인을 가지는 대표적인 공유 결합된 디아바디 분자의 개략도를 도시한다. 폴리펩타이드 사슬 중 두 개는 CH2 및 CH3 도메인을 가져서. 회합된 사슬은 Fc 도메인의 전부 또는 일부를 포함하는 Fc 도메인을 형성한다. 결합된 VL 및 VH 도메인을 포함하는 폴리펩타이드 사슬은 추가로 헤테로다이머-촉진 도메인을 포함한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들은 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
도 6A 내지 6F는 3개의 에피토프-결합 도메인을 가지는 대표적인 Fc 도메인-함유 삼가(trevalent) 결합 분자의 개략도를 도시한다. 도 6A 및 6B는 각각, 2개의 디아바디-형 결합 도메인 및 디아바디-형 결합 도메인들이 Fc 도메인에 대해 N-말단 또는 C-말단에 있는 상이한 도메인 방향을 가지는 Fab-형 결합 도메인을 포함하는 삼가 결합 분자의 도메인을 개략적으로 도시한다. 도 6A 및 6B의 분자들은 4개의 사슬을 포함한다. 도 6C 및 6D는 각각, Fc 도메인에 대해 N-말단에 있는 2개의 디아바디-형 결합 도메인, 및 경쇄 및 중쇄가 폴리펩타이드 스페이서를 통해 결합되어 있는 Fab-형 결합 도메인, 또는 scFv-형 결합 도메인을 포함하는 삼가 결합 분자의 도메인을 개략적으로 도시한다. 도 6E 및 6F의 삼가 결합 분자는, 각각, Fc 도메인에 대해 C-말단에 있는 두 개의 디아바디-형 결합 도메인, 및 경쇄 및 중쇄가 폴리펩타이드 스페이서를 통해 결합되어 있는 Fab-형 결합 도메인, 또는 scFv-형 결합 도메인을 포함하는 삼가 결합 분자의 도메인을 개략적으로 도시한다. 도 6C 내지 6F의 삼가 결합 분자는 3개의 사슬을 포함한다. 동일한 에피토프를 인식하는 VL 및 VH 도메인들은 동일한 쉐이딩 또는 충전 패턴을 사용하여 도시된다.
도 7은 5 x 106개의 LOX-IMVI 인간 전이성 흑색종 암 세포 (ID) 및 인간화된 항-인간 PD-1 항체인 hPD-1 mAb7 (1.2) IgG4(P)를 포함한, CD3 x B7-H3 이중특이적 디아바디인 DART-A를 포함한, hPD-1 mAb7 (1.2) IgG4(P) 및 DART-A 둘 다를 포함한, 또는 비히클 단독 (대조군)을 포함한 106개의 인간 PBMC (IP)를 받은 공급받은 MHCI-/- 마우스의 결과를 도시한다.
도 8A 및 8B는 5 x 106개의 Detroit562 인간 전이성 인두 암종 암 세포 (ID) 및 인간화된 항-인간 PD-1 항체인 hPD-1 mAb7 (1.2) IgG4(P)를 포함한, CD3 x B7-H3 이중특이적 디아바디인 DART-A를 포함한, hPD-1 mAb7 (1.2) IgG4(P) 및 DART-A 둘 다를 포함한, 또는 비히클 단독 (대조군)을 포함한 106개의 인간 PBMC (IP)를 받은 공급받은 MHCI-/- 마우스의 결과를 도시한다. 도 8A는 비히클 대조군, hPD-1 mAb7 (1.2) IgG4(P) (Q7Dx5), DART-A (Q7Dx5), 및 hPD-1 mAb7 (1.2) IgG4(P) + DART-A (Q7Dx5)에 대한 결과를 도시한다. 도 8B는 비히클 대조군, hPD-1 mAb7 (1.2) IgG4(P) (Q7Dx5), DART-A (Q7Dx5), hPD-1 mAb7 (1.2) IgG4(P) + DART-A (Q7Dx5) 및 hPD-1 mAb7 (1.2) IgG4(P) + DART-A (Q14Dx3)에 대한 결과를 도시한다.
도 9는 본 발명의 조합 치료법의 투여 효과에 대한 연구 결과를 도시한다. 그 결과는 수용체 동물의 CD3+ 세포들의 농도의 증가에 의해 측정된 바 수용체 동물의 면역 반응의 향상을 나타낸다.
도 10A 내지 10B는 루시페라제 리포터 검정으로 T-세포 신호전달에 미치는 본 발명의 조합 치료법의 영향에 대한 연구 결과를 도시한다. PD-1 및 B7-H3을 발현하는 MDA-MB-231 종양 표적 세포가 MNFAT-luc2/PD-1 Jurkat T-세포와 1:1 (도 10A) 또는 3:1 (도 10B)의 이펙터:표적 세포 비율로 혼합되었고 단독으로 또는 고정 농도 (12.5 nM)의 PD-1 결합 분자 hPD-1 mAb7 (1.2) IgG4(P), DART-1, 또는 대조군 항체 (hIgG)와 함께, 증가하는 농도의 DART-A의 존재하에 배양되었다. 이 결과들은 증가된 발광에 의해 측정되는 바 두 분자의 존재하에 신호전달 활성의 향사을 나타낸다.
도 11A 내지 11B는 본 발명의 조합 치료법의 투여가 무력한 T-세포의 존재 하에 종양 재발을 감소시키는 것을 보여준다. NOG 마우스들은 5 x 106개의 A375 INFγ 처리된 흑색종 세포 및 비히클 단독, 0.5 mg/kg DART-2 (Q7Dx4), 0.5 mg/kg DART-B (QDx1), 또는 0.5 mg/kg DART-2 (Q7Dx4) 및 0.5 mg/kg DART-B (QDx1) 둘 다를 포함한 5 x 106 개의 활성화된 또는 무력한 인간 T-세포를 받았다. 도 11A는 활성화된 T 세포를 받은 마우스들에 대한 결과를 도시하고 도 11B는 무력한 T 세포를 받은 마우스들에 대한 결과를 도시한다.
도 12A 내지 12H는 분자 단독의 투여에 비교한, PD-1에 결합할 수 있는 분자 및 표적 세포의 재지정된 사멸을 매개할 수 있는 분자의 조합 치료의 예상치 못한 유익을 증명한다. A375 흑색종 세포에 의해 유발된 종양 부피가 시간의 함수로서 측정되었고 도 12A 내지 12H에 도표화된다. 도 12A는 50일에 걸쳐 그룹 1, 2, 5, 및 6에 대한 결과를 나타내고; 도 12B 내지 12H는 그룹 2 (도 12B), 그룹 5 (도 12C), 그룹 6 (도 12D), 그룹 3 (도 12E), 그룹 7 (도 12F), 그룹 4 (도 12G), 및 그룹 8 (도 12H)에서 개별적인 동물들에 대한, 80일에 걸친 스파이더 도표(spider plot)를 도시한다.
본 발명은 암 및 병원체-관련 질환들의 치료를 위한 조합 치료법에 관한 것으로, (1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자 (예컨대 디아바디, scFv, 항체, TandAb, 등), 및 (2) 질환 항원(disease antigen)을 발현하는 표적 세포 (예컨대 암 세포 또는 병원체-감염 세포, 등)의 재지정된 사멸(redirected killing)을 매개할 수 있는 분자 (예컨대 디아바디, BiTe, 이중특이적 항체, CAR, 등)의 투여를 포함한다. 발명은 특히 표적 세포의 재지정된 사멸을 매개할 수 있는 분자가 이펙터 세포의 세포 표면 분자의 에피토프에 면역특이적으로 결합할 수 있는 제 1 에피토프-결합 부위 및 그러한 표적 세포 (즉 암 항원 또는 병원체-관련 항원과 같은 질환 항원)의 에피토프에 면역특이적으로 결합할 수 있는 제 2 에피토프-결합 부위를 포함하는 이중특이적 결합 분자인 구체예에 관한 것이다. 본 발명은 또한 그러한 분자(들)을 포함하는 제약학적 조성물에 관한 것이다.
본 발명의 분자들의 결합 도메인은 "면역특이적" 방식으로 에피토프에 결합한다. 본원에서 사용되는 항체, 디아바디 또는 다른 에피토프-결합 분자는 그것이 다른 분자의 영역 (즉 에피토프)에, 대체 에피토프들에 비해 더 빈번하게, 더 신속하게, 더 긴 기간으로 및/또는 더 큰 친화성으로 반응하거나 회합한다면, 그 에피토프에 "면역특이적으로" 결합한다고 말할 수 있다. 예를 들어, 바이러스 에피토프에 면역특이적으로 결합하는 항체는 이 바이러스 에피토프에 그것이 다른 바이러스 에피토프 또는 비-바이러스 에피토프에 면역특이적으로 결합하는 것보다 더 큰 친화성, 결합력으로, 더 쉽게, 및/또는 더 긴 기간으로 결합하는 항체이다. 또한 이 정의를 판독함으로써, 예를 들어, 제 1 표적에 면역특이적으로 결합하는 항체 (또는 모이어티 또는 에피토프)는 제 2 표적에 특이적으로 또는 우선적으로 결합할 수 있거나 결합하지 않을 수 있다는 것이 인지된다. 그러므로, "면역특이적 결합"은 배타적인 결합을 (포함할 수는 있지만) 반드시 필요로 하지는 않는다. 일반적으로, 반드시 그럴 필요는 없지만, 결합에 대한 언급은 "면역특이적" 결합을 의미한다. 이러한 결합이 수용체가 각자의 리간드와 결합하는 특이성을 나타낸다면, 2개의 분자는, "생리특이적(physiospecific)" 방식으로 서로 결합할 수 있다고 말할 수 있다.
상기에서 나타낸 것과 같이, 본 발명의 치료 분자들은 특히 이펙터 세포의 세포 표면 분자의 에피토프에 면역특이적으로 결합할 수 있는 에피토프-결합 부위 및 또한 질환 항원을 발현하는 표적 세포의 에피토프에 면역특이적으로 결합할 수 있는 에피토프-결합 부위를 포함한다. 본원에서 사용되는 바, 용어 "질환 항원"은 비정상 또는 감염된 세포의 표면에서 발현되는 항원 및 그런 감염의 비정상성이 특징이거나, 또는 외래 세포의 표면에서 발현되고 그런 외래 기원이 특징인 항원을 나타낸다. 본원에서 사용되는 바와 같이, 세포 표면에서 질환 항원을 발현하고, 따라서 본 발명의 치료 분자들에 의해 결합됨으로써 그런 치료 분자들에 의한 사멸에 대해 표적화될 수 있는 세포는 "표적 세포"이다. "암 항원" 또는 "병원체-관련 항원"인 질환 항원이 본 발명에 특히 관련이 있다.
I. 항체들 및 그것들의 결합 도메인들
본 발명의 결합 분자는 항체일 수 있다. "항체들"은 표적, 예컨대 탄수화물, 폴리뉴클레오타이드, 지질, 폴리펩타이드, 등에, 면역글로불린 분자의 가변 도메인에 위치한 적어도 하나의 항원 인식 부위를 통해 특이적으로 결합할 수 있는 면역글로불린 분자들이다. 본원에서 사용되는 용어 "항체" 및 "항체들"은 단클론성 항체, 다중특이적 항체, 인간 항체, 인간화된 항체, 합성 항체, 키메릭 항체, 다클론성 항체, 카멜화된 항체, 단일-사슬 Fvs (scFv), 단일-사슬 항체, Fab 단편, F(ab') 단편, 이황화-결합된 이중특이적 Fvs (sdFv), 인트라바디(intrabodies), 및 상기 중 임의의 것의 에피토프-결합 단편을 나타낸다. 특히, 용어 "항체"는 면역글로불린 분자들 및 면역글로불린 분자들의 면역학적 활성 단편들, 즉 에피토프-결합 부위를 함유하는 분자들을 포함한다. 면역글로불린 분자들은 임의의 유형 (예컨대 IgG, IgE, IgM, IgD, IgA 및 IgY), 부류 (예컨대 IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2) 또는 하위부류의 것일 수 있다. 항체는 폴리펩타이드 또는 단백질 또는 비-단백질에, 그런 분자상의 특정 도메인 또는 모이어티 또는 형태 ("에피토프")의 존재로 인해 "면역특이적으로 결합"할 수 있다. 에피토프-함유 분자는 면역원성 활성을 가질 수 있어서, 그것은 동물에서 항체 생성 반응을 유도하고; 그런 분자들은 "항원"으로 명명된다. 지난 수십년은 항체들의 치료적 가능성에서 관심이 회복되는 것을 볼 수 있었고, 항체들은 생명공학-유래 약물의 선두 부류 중 하나가 되었다 (Chan, C.E. et al. (2009) "The Use Of Antibodies In The Treatment Of Infectious Dseases", Singapore Med. J. 50(7):663-666). 200r가지를 넘는 항체-기반 약물이 사용하도록 승인되었거나 개발 중에 있다.
용어 "단클론성 항체"는 단클론성 항체가 항원의 선택적 결합에 포함된 아미노산들 (자연 발생적인 또는 자연 발생적이 아닌)로 구성되는 균일한 항체 집단을 나타낸다. 단클론성 항체는 고도로 특이적이며, 단일 에피토프 (또는 항원 부위)에 대해 지시된다. 용어 "단클론성 항체"는 온전한 단클론성 항체 및 전장(full-length) 단클론성 항체뿐만 아니라, 그것들의 단편 (예컨대 Fab, Fab', F(ab')2, Fv 단편, 등), 단일-사슬 (scFv) 결합 분자 및 그것들의 돌연변이, 항체 부분을 포함하는 융합 단백질, 인간화된 단클론성 항체, 키메릭 단클론성 항체, 및 필요한 특이성 및 항원에 대한 결합 능력의 항원 인식 분위를 포함하는 면역글로불린 분자의 임의의 다른 변형된 형태를 모두 포함한다. 용어는 항체의 공급원 또는 항체가 만들어지는 방식 (예컨대 하이브리도마, 파지 선택, 재조합 발현, 유전자 도입 동물, 등에 의한)에 대하여 제한되는 것으로 의도되지 않는다. 상기 용어는 전체 면역글로불린뿐만 아니라 "항체"의 정의 하에 상기 기술된 단편 등을 포함한다. 단클론성 항체의 제조 방법은 당업계에 알려져 있다. 사용될 수 있는 한 가지 방법은 Kohler, G. 등의 방법: Kohler, G. et al. (1975) "Continuous Cultures Of Fused Cells Secreting Antibody Of Predefined Specificity", Nature 256:495-497 또는 그것의 변형된 방법이다. 전형적으로, 단클론성 항체는 마우스, 래트 또는 토끼에서 발생된다. 항체는 동물을 원하는 에피토프를 함유한, 면역을 유도할 정도의 양(immunogenic amount)의 세포, 세포 추출물, 또는 단백질 조제물로 면역화함으로써 생성된다. 면역원은, 한정하는 것은 아니지만, 일차 세포, 배양 세포주, 암성 세포, 단백질, 펩타이드, 핵산, 또는 조직일 수 있다. 면역화에 사용된 세포는 일정 시간 (예컨대 적어도 24시간) 동안 배양된 후에 면역원으로서 사용될 수 있다. 세포는 자체로서 또는 비-변성 보조제, 예컨대 Ribi와 함께 면역원으로서 사용될 수 있다 (예컨대 Jennings, V.M. (1995) "Review of Selected Adjuvants Used in Antibody Production", ILAR J. 37(3):119-125 참조). 일반적으로, 세포들은 면역원으로서 사용될 때 온전하게, 바람직하게는 생존할 수 있게 유지되어야 한다. 온전한 세포는 항원이 파괴된 세포보다 더 양호하게 면역화된 동물에 의해 검출되는 것을 허용할 수 있다. 변성시키는 또는 엄격한 보조제들, 예컨대 프로인트 보조제의 사용은 세포를 파괴할 수 있고, 따라서 사용이 회피된다. 면역원은 주기적인 간격으로 여러 번, 예컨대 주 2회, 주 1회로 투여될 수 있고, 또는 동물에서 생존성을 유지하기 위한 방식으로 (예컨대 조직 재조합으로) 투여될 수 있다. 다르게는, 기존의 단클론성 항체 및 원하는 병원성 에피토프에 면역특이적인 임의의 다른 동등한 항체들이 서열분석되고 업계에 알려져 있는 임의의 방법에 의해 재조합에 의해 제조될 수 있다. 한 구체예에서, 그런 항체는 서열분석되고 그 후에 폴리뉴클레오타이드 서열이 발현 또는 증식을 위한 벡터로 클로닝된다. 관심의 항체를 암호화하는 서열은 숙주 세포에서 벡터에 유지될 수 있고 숙주 세포는 그 후에 팽창되고 미래 사용을 위해 냉동될 수 있다. 그런 항체들의 폴리뉴클레오타이드 서열은 항체의 친화성, 또는 다른 특징을 개선하기 위하여, 발명의 단일특이적 또는 다중특이적 (예컨대, 이중특이적, 삼중특이적 및 사중특이적) 분자들뿐만 아니라 친화성 최적화된, 키메릭 항체, 인간화된 항체, 및/또는 개과화된 항체를 생성하기 위한 유전자 조작에 사용될 수 있다. 항체를 인간화하는 데 일반적인 원리는 항체의 항원-결합 부분의 기본적인 서열을 보유하는 한편, 인간 항체 서열을 가지는 항체의 비-인간 나머지를 교체하는 것을 포함한다.
천연 항체들(예컨대 IgG 항체들)은 2개의 "중쇄"와 복합체를 형성하는 2개의 "경쇄"로 구성된다. 각각의 경쇄는 가변 도메인 ("VL") 및 불변 도메인 ("CL")을 함유한다. 각각의 중쇄는 가변 도메인 ("VH"), 3개의 불변 도메인 ("CH1", "CH2" 및 "CH3"), 및 CH1 및 CH2 도메인 사이에 위치한 "힌지" 영역 ("H")을 함유한다. 대조적으로, scFv는 경쇄 및 중쇄 가변 도메인을 짧은 연결 펩타이드를 통해 함께 결합시킴으로써 만들어진다.
자연적으로 발생하는 면역글로불린 (예컨대 IgG)의 기본적인 구조 단위는 그러므로 2개의 경쇄 및 2개의 중쇄를 가지는 테트라머이고, 보통 약 150,000 Da의 당단백질로서 표시된다. 각 사슬의 아미노 말단 ("N-말단") 부분은 주로 항원 인식에 기여하는 약 100 내지 110개 또는 그 이상의 아미노산의 가변 도메인을 포함한다. 각 사슬의 카르복시 말단 ("C-말단") 부분은 불변 영역을 규정하며, 경쇄는 단일 불변 도메인을 가지고 중쇄는 보통 3개의 불변 도메인 및 하나의 힌지 도메인을 가진다. 그러므로, IgG 분자의 경쇄들의 구조는 n-VL-CL-c이고 IgG 중쇄들의 구조는 n-VH-CH1-H-CH2-CH3-c (n 및 c는 각각 폴리펩타이드의 N-말단 및 C-말단을 나타냄)이다.
A. 항체 가변 도메인들의 특성화
IgG 분자의 가변 도메인들은 에피토프와 접촉하는 잔기들을 함유하는 상보성 결정 영역 ("CDR"), 및 일반적으로 그런 접촉을 허용하기 위하여 CDR 루프의 구조를 유지하고 위치를 결정하는 프레임워크 분절 ("FR")로 언급되는 (특정 프레임워크 잔기들은 또한 항원과 접촉할 수 있음), 비-CDR 절편으로 구성된다. 그러므로, VL 및 VH 도메인은 구조 n-FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4-c를 가진다. 항체의 경쇄의 제 1, 제 2 및 제 3 CDR인 (또는 그것들로서 작용할 수 있는) 폴리펩타이드는 여기서 CDR L 1 도메인, CDR L 2 도메인, 및 CDR L 3 도메인으로서 각각 불린다. 유사하게, 항체의 중쇄의 제 1, 제 2 및 제 3 CDR인 (또는 그것들로서 작용할 수 있는) 폴리펩타이드는 여기서 CDR H 1 도메인, CDR H 2 도메인, 및 CDR H 3 도메인으로서 각각 불린다. 그러므로, 용어 CDRL1 도메인, CDRL2 도메인, CDRL3 도메인, CDRH1 도메인, CDRH2 도메인, 및 CDRH3 도메인은 단백질로 통합될 때 그런 단백질이 경쇄 및 중쇄를 가지는 항체인지 또는 디아바디 또는 단일-사슬 결합 분자 (예컨대 scFv, BiTe, 등), 또는 또 다른 유형의 단백질인지와 관계없이 단백질이 특이적인 에피토프에 결합할 수 있게 되는 것을 유발하는 폴리펩타이드들에 관련된다. 따라서, 본원에서 사용되는 것과 같이, 용어 "에피토프-결합 단편"은 에피토프에 면역특이적으로 결합할 수 있는 분자의 단편을 나타낸다. 에피토프-결합 단편은 항체의 임의의 1, 2, 3, 4, 또는 5개의 CDR 도메인을 함유할 수 있거나, 또는 항체의 6개의 모든 CDR 도메인을 함유할 수 있고, 그런 에피토프에 면역특이적으로 결합할 수 있지만, 그런 항체의 것과는 상이한 그런 에피토프를 향한 면역특이성, 친화성 또는 선택성을 나타낼 수 있다. 그러나, 바람직하게는, 에피토프-결합 단편은 그런 항체의 6개의 모든 CDR 도메인들을 함유할 것이다. 항체의 에피토프-결합 단편은 단일 폴리펩타이드 사슬 (예컨대, scFv)일 수 있거나, 또는 두 개 이상의 폴리펩타이드 사슬을 포함할 수 있고, 각각은 아미노 말단 및 카르복시 말단을 가진다 (예컨대 디아바디, Fab 단편, Fab2 단편, 등). 구체적으로 주지되지 않는 한, 본원에 기술된 단백질 분자들의 도메인들의 순서는 "N-말단에서 C-말단" 방향이다.
발명은 또한 특히 인간화된 항체의 VL 및/또는 VH 도메인을 포함하는 에피토프-결합 분자를 포함한다. 용어 "인간화된 항체"는 일반적으로 재조합 기법을 사용하여 제조되고, 비-인간 종으로부터의 면역글로불린의 에피토프-결합 부위 및 인간 면역글로불린의 구조 및/또는 서열을 기반으로 한 분자의 나머지 면역글로불린 구조를 가지는 키메릭 분자를 나타낸다. 그런 항체들의 가변 도메인의 폴리뉴클레오타이드 서열은 그런 유도체를 생성하고 그런 항체들의 친화성, 또는 다른 특징을 개선하기 위하여 유전자 조작에 사용될 수 있다. 항체를 인간화할 때의 일반적인 원리는 항체의 에피토프-결합 부분의 기본적인 서열을 유지하는 한편, 인간 항체 서열로 항체의 비-인간 나머지를 교환하는 것을 포함한다. 단클론성 항체를 인간화하기 위해서는 4가지의 일반적인 단계가 있다. 그것들은 다음과 같다: (1) 출발 항체 경쇄 및 중쇄 가변 도메인들의 뉴클레오타이드 및 예측된 아미노산 서열을 측정하는 단계, (2) 인간화된 항체 또는 개과화된 항체를 설계하는 단계, 즉 인간화 또는 개과화 과정 중에 사용할 항체 프레임워크 영역을 결정하는 단계, (3) 실제로 인간화 또는 개과화하는 방법론/기법 단계, 및 (4) 인간화된 항체를 트랜스펙션하고 발현시키는 단계. 예를 들어 미국 특허 번호 4,816,567; 5,807,715; 5,866,692; 및 6,331,415 참조.
에피토프-결합 부위는 불변 도메인에 융합된 완전한 가변 도메인 또는 적절한 프레임워크 영역에 접합된(grafted) 그런 가변 도메인의 상보성 결정 영역들 (CDRs)을 포함할 수 있다. 에피토프-결합 도메인은 야생형 이거나 하나 이상의 아미노산 치환에 의해 변형될 수 있다. 이것은 인간 개체에서는 면역원으로서 불변 영역을 제거하지만, 외래 가변 도메인에 대한 면역 반응의 가능성은 유지된다 (LoBuglio, A.F. et al. (1989) "Mouse/Human Chimeric Monoclonal Antibody In Man: Kinetics And Immune Response", Proc. Natl. Acad. Sci. (U.S.A.) 86:4220-4224). 다른 접근법은 인간-유래 불변 영역들을 제공하는 것뿐만 아니라, 또한 그것들을 인간 형태와 가능한 가깝게 재형성(reshaped)하기 위하여 가변 도메인을 변형시키는 것에 초점을 맞춘다. 중쇄 및 경쇄 둘 다의 가변 도메인들은, 문제의 항원에 대한 반응으로 달라지고 결합 용량을 결정하는, 주어진 종에서 상대적으로 보존되고 CDR에 대한 스캐폴딩을 잠정적으로 제공하는 4개의 프레임워크 영역들 (FRs)이 양옆에 있는, 3개의 상보성 결정 영역 (CDR)을 함유하는 것으로 알려져 있다. 비-인간 항체들이 특정 항원과 관련하여 제조될 때, 가변 도메인들은 변형될 인간 항체에 존재하는 FR 상에 비-인간 항체로부터 유래된 CDR들을 접합시킴으로써 "재형성"되거나 "인간화"될 수 있다. 이런 접근법의 다양한 항체들에의 적용은 문헌들에 보고되어 있다: Sato, K. et al. (1993) Cancer Res 53:851-856. Riechmann, L. et al. (1988) "Reshaping Human Antibodies for Therapy", Nature 332:323-327; Verhoeyen, M. et al. (1988) "Reshaping Human Antibodies: Grafting An Antilysozyme Activity", Science 239:1534-1536; Kettleborough, C. A. et al. (1991) "Humanization Of A Mouse Monoclonal Antibody By CDR-Grafting: The Importance Of Framework Residues On Loop Conformation", Protein Engineering 4:773-3783; Maeda, H. et al. (1991) "Construction Of Reshaped Human Antibodies With HIV-Neutralizing Activity", Human Antibodies Hybridoma 2:124-134; Gorman, S. D. et al. (1991) "Reshaping A Therapeutic CD4 Antibody", Proc. Natl. Acad. Sci. (U.S.A.) 88:4181-4185; Tempest, P.R. et al. (1991) "Reshaping A Human Monoclonal Antibody To Inhibit Human Respiratory Syncytial Virus Infection in vivo", Bio/Technology 9:266-271; Co, M. S. et al. (1991) "Humanized Antibodies For Antiviral Therapy", Proc. Natl. Acad. Sci. (U.S.A.) 88:2869-2873; Carter, P. et al. (1992) "Humanization Of An Anti-p185her2 Antibody For Human Cancer Therapy", Proc. Natl. Acad. Sci. (U.S.A.) 89:4285-4289; 및 Co, M.S. et al. (1992) "Chimeric And Humanized Antibodies With Specificity For The CD33 Antigen", J. Immunol. 148:1149-1154. 일부 구체예에서, 인간화된 항체들은 모두 CDR 서열을 보존한다 (예를 들어, 인간화된 마우스 항체는 마우스 항체로부터의 6개의 모든 CDR을 함유한다). 다른 구체예에서, 인간화된 항체들은 원래의 항체에 비해 서열이 상이한 하나 이상 (1, 2, 3, 4, 5, 또는 6개)의 CDR을 가진다.
설치류 또는 변형된 설치류 가변 도메인 및 인간 불변 도메인에 융합된 그것들의 관련된 상보성 결정 영역 (CDR)을 가지는 키메릭 항체를 포함하여, 비-인간 면역글로불린으로부터 유래된 에피토프-결합 부위를 포함하는 다양한 인간화된 항체 분자들이 기술되어 있다 (예를 들어 Winter et al. (1991) "Man-made Antibodies", Nature 349:293-299; Lobuglio et al. (1989) "Mouse/Human Chimeric Monoclonal Antibody In Man: Kinetics And Immune Response", Proc. Natl. Acad. Sci. (U.S.A.) 86:4220-4224 (1989), Shaw et al. (1987) "Characterization Of A Mouse/Human Chimeric Monoclonal Antibody (17-1A) To A Colon Cancer Tumor-Associated Antigen", J. Immunol. 138:4534-4538, 및 Brown et al. (1987) "Tumor-Specific Genetically Engineered Murine/Human Chimeric Monoclonal Antibody", Cancer Res. 47:3577-3583 참조). 다른 참고문헌들은 적절한 인간 항체 불변 도메인과의 융합 전에 인간 지지 프레임워크 영역 (FR)에 접합된 설치류 CDR들을 기술한다 (예를 들어 Riechmann, L. et al. (1988) "Reshaping Human Antibodies for Therapy", Nature 332:323-327; Verhoeyen, M. et al. (1988) "Reshaping Human Antibodies: Grafting An Antilysozyme Activity", Science 239:1534-1536; 및 Jones et al. (1986) "Replacing The Complementarity-Determining Regions In A Human Antibody With Those From A Mouse", Nature 321:522-525 참조). 또 다른 참고문헌은 재조합에 의해 베니어된(veneered) 설치류 프레임워크 영역들에 의해 지지된 설치류 CDR을 기술한다. 예를 들어 유럽 특허 공개 공보 519,596 참조. 이 "인간화된" 분자들은 설치류 항-인간 항체 분자를 향한 원하지 않는 면역학적 반응을 최소화하기 위해 설계되고, 그것은 인간 수령체에서 그런 모이어티들의 치료 적용의 기간 및 유효성을 제한한다. 또한 활용될 수 있는 항체들을 인간화하는 다른 방법들은 문헌에서 개시된다: Daugherty et al. (1991) "Polymerase Chain Reaction Facilitates The Cloning, CDR-Grafting, And Rapid Expression Of A Murine Monoclonal Antibody Directed Against The CD18 Component Of Leukocyte Integrins", Nucl. Acids Res. 19:2471-2476 및 미국 특허 6,180,377; 6,054,297; 5,997,867; 및 5,866,692.
B. 항체 불변 영역의 특징들
본 명세서 전체에서, IgG 중쇄의 불변 영역의 잔기들의 넘버링은 Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, NH1, MD (1991)(본원에 참조로 포함됨)에서와 같이 EU 인덱스 (EU index)의 넘버링이다 ("Kabat"). 용어 "Kabat에서와 같은 EU 인덱스"는 인간 IgG1 EU 항체의 불면 도메인들의 넘버링을 나타낸다. 면역글로불린의 성숙한 중쇄 및 경쇄의 가변 도메인들로부터의 아미노산은 그 사슬의 아미노산의 위치에 의해 불린다. Kabat은 항체들에 대해 수많은 아미노산 서열을 기술하였고, 각 하위그룹에 대해 아미노산 공통 서열을 확인하였으며, 각각의 아미노산에 대해 잔기 번호를 배정하였고, CDR들은 Kabat에 의해 정의된 것과 같이 확인된다 (Chothia, C. & Lesk, A. M. ((1987) "Canonical structures for the hypervariable regions of immunoglobulins", J. Mol. Biol. 196:901-917)에 의해 정의된 것과 같이 CDRH1이 5개 잔기만큼 더 빨리 시작하는 것이 인지될 것이다). Kabat의 넘버링 도식은 그의 개요서에 포함되지 않은 항체들에도, 문제의 항체를 보존된 아미노산들에 대한 참조에 의해 Kabat의 공통 서열들 중 하나와 일렬배열함으로써 확대될 수 있다. 잔기 번호를 배정하기 위한 이 방법은 해당 분야에서 표준이 되었고 키메릭 또는 인간화된 변종을 포함하여, 상이한 항체들에서 동등한 위치의 아미노산을 쉽게 확인하게 한다. 예를 들어, 인간 항체 경쇄의 위치 50에서의 아미노산은 마우스 항체 경쇄의 위치 50에서의 아미노산에 대해 동등한 위치를 차지한다.
1. 중쇄의 불변 영역: Fc 도메인
항체의 2개의 중쇄의 CH1 도메인들은 항체의 경쇄의 "CL" 불변 영역과 복합체를 형성하고, 개입된(intervening) 힌지 도메인을 통해 중쇄 CH2 도메인들에 부착된다.
예시의 CH1 도메인은 인간 IgG1 CH1 도메인이다. 예시의 인간 IgG1 CH1 도메인의 아미노산 서열은 (SEQ ID NO:1):
ASTKGPSVFP LAPSSKSTSG GTAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS
GLYSLSSVVT VPSSSLGTQT YICNVNHKPS NTKVDKRV이다.
예시의 CH1 도메인은 인간 IgG2 CH1 도메인이다. 예시의 인간 IgG2 CH1 도메인의 아미노산 서열은 (SEQ ID NO:2):
ASTKGPSVFP LAPCSRSTSE STAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS
GLYSLSSVVT VPSSNFGTQT YTCNVDHKPS NTKVDKTV이다.
예시의 CH1 도메인은 인간 IgG4 CH1 도메인이다. 예시의 인간 IgG4 CH1 도메인의 아미노산 서열은 (SEQ ID NO:3):
ASTKGPSVFP LAPCSRSTSE STAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS
GLYSLSSVVT VPSSSLGTKT YTCNVDHKPS NTKVDKRV이다.
하나의 예시의 힌지 도메인은 인간 IgG1 힌지 도메인이다. 예시의 인간 IgG1 힌지 도메인의 아미노산 서열은 (SEQ ID NO:4): EPKSCDKTHTCPPCP이다.
다른 예시의 힌지 도메인은 인간 IgG2 힌지 도메인이다. 예시의 인간 IgG2 힌지 도메인의 아미노산 서열은 (SEQ ID NO:5): ERKCCVECPPCP이다.
또 다른 예시의 힌지 도메인은 인간 IgG4 힌지 도메인이다. 예시의 인간 IgG4 힌지 도메인의 아미노산 서열은 (SEQ ID NO:6): ESKYGPPCPSCP이다. 본원에서 기술된 것과 같이, IgG4 힌지 도메인은 S228P 치환과 같은 안정화 돌연변이(stabilizing mutation)를 포함할 수 있다. 예시의 S228P-안정화된 인간 IgG4 힌지 도메인의 아미노산 서열은 (SEQ ID NO:7): ESKYGPPCPPCP이다.
항체의 2개의 중쇄의 CH2 및 CH3 도메인들은 상호작용하여, 한정하는 것은 아니지만, Fc 감마 수용체 (FcγR)를 포함한, 세포의 Fc 수용체에 의해 인식되는 도메인인 "Fc 도메인"을 형성한다. 본원에서 사용되는 용어 "Fc 도메인"은 IgG 중쇄의 C-말단 영역을 정의하기 위해 사용된다. Fc 도메인은 만약 그것의 아미노산 서열이 다른 IgG 아이소타입에 비해 그 아이소타입에 가장 상동한다면 특정 IgG 아이소타입, 부류 또는 하위부류의 것이라 말할 수 있다. 진단에서의 알려진 용도에 더불어, 항체들은 치료제로서 유용한 것으로 밝혀졌다.
예시의 인간 IgG1의 CH2-CH3 도메인의 아미노산 서열은 (SEQ ID NO:8)이다:
231 240 250 260 270 280
APELLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVKFNWYVD
290 300 310 320 330
GVEVHNAKTK PREEQYNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKALPA
340 350 360 370 380
PIEKTISKAK GQPREPQVYT LPPSREEMTK NQVSLTCLVK GFYPSDIAVE
390 400 410 420 430
WESNGQPENN YKTTPPVLDS DGSFFLYSKL TVDKSRWQQG NVFSCSVMHE
440 447
ALHNHYTQKS LSLSPG X
Kabat에서 나타낸 것과 같이 EU 인덱스에 의해 넘버링되고, 이때 X는 as 리신 (K)이거나 없다.
예시의 인간 IgG2의 CH2-CH3 도메인의 아미노산 서열은 (SEQ ID NO:9)이다:
231 240 250 260 270 280
APPVA-GPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVQFNWYVD
290 300 310 320 330
GVEVHNAKTK PREEQFNSTF RVVSVLTVVH QDWLNGKEYK CKVSNKGLPA
340 350 360 370 380
PIEKTISKTK GQPREPQVYT LPPSREEMTK NQVSLTCLVK GFYPSDISVE
390 400 410 420 430
WESNGQPENN YKTTPPMLDS DGSFFLYSKL TVDKSRWQQG NVFSCSVMHE
440 447
ALHNHYTQKS LSLSPG X
Kabat에서 나타낸 것과 같이 EU 인덱스에 의해 넘버링되고, 이때 X는 as 리신 (K)이거나 없다.
예시의 인간 IgG3의 CH2-CH3 도메인의 아미노산 서열은 (SEQ ID NO:10)이다:
231 240 250 260 270 280
APELLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVQFKWYVD
290 300 310 320 330
GVEVHNAKTK PREEQYNSTF RVVSVLTVLH QDWLNGKEYK CKVSNKALPA
340 350 360 370 380
PIEKTISKTK GQPREPQVYT LPPSREEMTK NQVSLTCLVK GFYPSDIAVE
390 400 410 420 430
WESSGQPENN YNTTPPMLDS DGSFFLYSKL TVDKSRWQQG NIFSCSVMHE
440 447
ALHNRFTQKS LSLSPG X
Kabat에서 나타낸 것과 같이 EU 인덱스에 의해 넘버링되고, 이때 X는 as 리신 (K)이거나 없다.
예시의 인간 IgG4의 CH2-CH3 도메인의 아미노산 서열은 (SEQ ID NO:11)이다:
231 240 250 260 270 280
APEFLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSQED PEVQFNWYVD
290 300 310 320 330
GVEVHNAKTK PREEQFNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKGLPS
340 350 360 370 380
SIEKTISKAK GQPREPQVYT LPPSQEEMTK NQVSLTCLVK GFYPSDIAVE
390 400 410 420 430
WESNGQPENN YKTTPPVLDS DGSFFLYSRL TVDKSRWQEG NVFSCSVMHE
440 447
ALHNHYTQKS LSLSLG X
Kabat에서 나타낸 것과 같이 EU 인덱스에 의해 넘버링되고, 이때 X는 as 리신 (K)이거나 없다.
항체 불변 영역 내에서 많은 상이한 위치들에서 (예컨대, 한정하는 것은 아니지만, Kabat에서 나타낸 것과 같이 EU 인덱스에 의해 넘버링되는바 위치 270, 272, 312, 315, 356, 및 358을 포함하여, Fc 위치들에서) 다형성이 관찰되었고, 그러므로 표시된 서열과 선행 기술의 서열들 사이에 약간의 차이가 있을 수 있다. 인간 면역글로불린들의 다형태는 특성화가 잘 이루어져 있다. 현재, 18 Gm 동종형(allotype)이 알려져 있다: G1m (1, 2, 3, 17) 또는 G1m (a, x, f, z), G2m (23) 또는 G2m (n), G3m (5, 6, 10, 11, 13, 14, 15, 16, 21, 24, 26, 27, 28) 또는 G3m (b1, c3, b3, b0, b3, b4, s, t, g1, c5, u, v, g5) (Lefranc, et al., "The Human IgG Subclasses: Molecular Analysis Of Structure, Function And Regulation." Pergamon, Oxford, pp. 43-78 (1990); Lefranc, G. et al., 1979, Hum. Genet.: 50, 199-211). 특별히 본 발명의 항체들은 임의의 면역글로불린 유전자의 임의의 동종형, 아이소동종형, 또는 하플로타입(haplotype)을 포함할 수 있으며, 본원에 제공된 서열들의 동종형, 아이소동종형, 또는 하플로타입에 한정되지 않는 것으로 고려된다. 나아가, 일부 발현 시스템에서는 CH3 도메인의 C-말단 아미노산 잔기 (상기 굵은 글자)가 번역후에 제거될 수 있다. 따라서, CH3 도메인의 C-말단 잔기는 발명의 결합 분자에서는 선택적인 아미노산 잔기이다. 특별히 본 발명에는 CH3 도메인의 C-말단 잔기가 없는 결합 분자들이 포함된다. 또한 특별히 본 발명에는 CH3 도메인의 C-말단 리신 잔기를 포함하는 그런 구성물이 포함된다.
2. 경쇄의 불변 영역
상기에서 나타낸 것과 같이, 항체의 각각의 경쇄는 가변 도메인 ("VL") 및 불변 도메인 ("CL")을 함유한다.
바람직한 CL 도메인은 인간 IgG CL 카파 도메인이다. 예시의 인간 CL 카파 도메인의 아미노산 서열은 (SEQ ID NO:12)이다:
RTVAAPSVFI FPPSDEQLKS GTASVVCLLN NFYPREAKVQ WKVDNALQSG NSQESVTEQD
SKDSTYSLSS TLTLSKADYE KHKVYACEVT HQGLSSPVTK SFNRGEC
대안적으로, 예시의 CL 도메인은 인간 IgG CL 람다 도메인이다. 예시의 인간 CL 람다 도메인의 아미노산 서열은 (SEQ ID NO:13)이다:
QPKAAPSVTL FPPSSEELQA NKATLVCLIS DFYPGAVTVA WKADSSPVKA GVETTPSKQS
NNKYAASSYL SLTPEQWKSH RSYSCQVTHE GSTVEKTVAP TECS
II. 키메릭 항원 수용체
표적 세포 (즉, 암 세포, 병원체-감염 세포, 등)의 재지정된 사멸을 매개할 수 있는 본 발명의 결합 분자들은 대안적으로 암 항원 또는 병원체-관련 항원에 결합할 수 있는 단일 사슬 가변 단편 (scFv)을 통합하는 키메릭 항원 수용체 ("CARs")와 같은 단일특이적 단일-사슬 분자들일 수 있다. 상기에서 표시된 것과 같이, scFv는 짧은 연결 펩타이드를 통해 경쇄 및 중쇄 가변 도메인을 함께 연결시킴으로써 만들어진다. 제 1 세대 CAR은 전형적으로 내인성 TCR로부터의 신호의 일차 전달자인, CD3 ζ- 사슬로부터의 세포내 도메인을 가졌다. 제 2 세대 CAR은 T-세포에 추가의 신호를 제공하기 위하여 다양한 동시자극 단백질 수용체들 (예컨대 CD28, 41BB, ICOS, 등)로부터 CAR의 세포질 꼬리까지 추가의 세포내 신호전달 도메인들을 가졌다. 제 3 세대 CAR은 추가로 효능을 증대시키기 위하여 다중 신호전달 도메인, 예컨대 CD3z-CD28-41BB 또는 CD3z-CD28-OX40을 결합시킨다 (Tettamanti, S. et al. (2013) "Targeting Of Acute Myeloid Leukaemia By Cytokine-Induced Killer Cells Redirected With A Novel CD123-Specific Chimeric Antigen Receptor", Br. J. Haematol. 161:389-401; Gill, S. et al. (2014) "Efficacy Against Human Acute Myeloid Leukemia And Myeloablation Of Normal Hematopoiesis In A Mouse Model Using Chimeric Antigen Receptor-Modified T Cells", Blood 123(15): 2343-2354; Mardiros, A. et al. (2013) "T Cells Expressing CD123-Specific Chimeric Antigen Receptors Exhibit Specific Cytolytic Effector Functions And Antitumor Effects Against Human Acute Myeloid Leukemia", Blood 122:3138-3148; Pizzitola, I. et al. (2014) "Chimeric Antigen Receptors Against CD33/CD123 Antigens Efficiently Target Primary Acute Myeloid Leukemia Cells in vivo", Leukemia doi:10.1038/leu.2014.62).
본 발명의 CAR의 세포내 도메인은 바람직하게는 다음 중 어느 것의 세포내 도메인으로부터 선택된다: 41BB-CD3ζ, b2c-CD3ζ, CD28, CD28-4-1BB-CD3ζ, CD28-CD3ζ, CD28-FcεRIγ, CD28mut-CD3ζ, CD28-OX40-CD3ζ, CD28-OX40-CD3ζ, CD3ζ, CD4-CD3ζ, CD4-FcεRIγ, CD8-CD3ζ, FceRIγ, FcεRIγCAIX, 헤레굴린(Heregulin)-CD3ζ, IL-13-CD3ζ, 또는 Ly49H-CD3ζ (Tettamanti, S. et al. (2013) "Targeting Of Acute Myeloid Leukaemia By Cytokine-Induced Killer Cells Redirected With A Novel CD123-Specific Chimeric Antigen Receptor", Br. J. Haematol. 161:389-401; Gill, S. et al. (2014) "Efficacy Against Human Acute Myeloid Leukemia And Myeloablation Of Normal Hematopoiesis In A Mouse Model Using Chimeric Antigen Receptor-Modified T Cells", Blood 123(15): 2343-2354; Mardiros, A. et al. (2013) "T Cells Expressing CD123-Specific Chimeric Antigen Receptors Exhibit Specific Cytolytic Effector Functions And Antitumor Effects Against Human Acute Myeloid Leukemia", Blood 122:3138-3148; Pizzitola, I. et al. (2014) "Chimeric Antigen Receptors Against CD33/CD123 Antigens Efficiently Target Primary Acute Myeloid Leukemia Cells in vivo", Leukemia doi:10.1038/leu.2014.62).
III. 이중특이적 항체들 및 다중특이적 디아바디들
항체가 항원의 에피토프에 결합하는 능력은 항체의 VL 및 VH 도메인의 존재 및 아미노산 서열에 좌우된다. 항체의 경쇄 및 중쇄의 상호작용, 특히 그것의 VL 및 VH 도메인의 상호작용은 천연 항체, 예컨대 IgG의 2개의 에피토프-결합 도메인 중 하나를 형성한다. 천연 항체는 오직 하나의 에피토프 종에만 결합할 수 있지만 (즉 단일특이적임), 그 종의 다중 복사물에도 결합할 수 있다 (즉 이가 또는 다가를 나타냄).
항체들의 기능성은 2개의 별도의 구별되는 항원 (또는 동일한 항원의 상이한 에피토프)에 동시에 결합할 수 있는 다중특이적 항체-기반 분자를 생성함으로써 및/또는 동일한 에피토프 및/또는 항원에 대해 더 높은 결합가 (즉 2개 이상의 결합 부위)를 가지는 항체-기반 분자를 생성함으로써 향상될 수 있다.
천연 항체들보다 큰 용량을 가지는 분자들을 제공하기 위하여, 광범위한 재조합 이중특이적 항체 포맷이 개발되었고 (예컨대 PCT 공개공보 번호 WO 2008/003116, WO 2009/132876, WO 2008/003103, WO 2007/146968, WO 2009/018386, WO 2012/009544, WO 2013/070565 참조), 그것들 중 대부분은 추가의 에피토프-결합 단편 (예컨대 scFv, VL, VH, 등)을 항체 코어 (IgA, IgD, IgE, IgG 또는 IgM)에 또는 항체 코어 내에 융합시키기 위하여, 또는 다중 에피토프-결합 단편 (예컨대 2개의 Fab 단편 또는 scFv들)을 융합시키기 위하여 링커 펩타이드를 사용한다. 대체 포맷은 에피토프-결합 단편 (예컨대 scFv, VL, VH, 등)을 CH2-CH3 도메인과 같은 다이머화 도메인 또는 대체 폴리펩타이드에 융합시키기 위하여 링커 펩타이드를 사용한다 (WO 2005/070966, WO 2006/107786 WO 2006/107617, WO 2007/046893).
PCT 공개공보 번호 WO 2013/174873, WO 2011/133886 및 WO 2010/136172는 CL 및 CH1 도메인이 그것들의 각각의 자연적인 위치로부터 전환(switch)되고 VL 및 VH 도메인이 하나 이상의 항원에 결합하는 것을 허용하기 위해 다양해진 (WO 2008/027236; WO 2010/108127) 삼중특이적 항체를 개시한다. PCT 공개공보 번호 WO 2013/163427 및 WO 2013/119903은 결합 도메인을 포함하는 융합 단백질 부가물을 함유하도록 CH2 도메인을 변형시키는 것을 개시한다. PCT 공개공보 번호 WO 2010/028797, WO2010028796 및 WO 2010/028795는 Fc 도메인이 삼가 결합 분자를 형성하기 위하여, 추가의 VL 및 VH 도메인으로 대체되어 있는 재조합 항체들을 개시한다. PCT 공개공보 번호 WO 2003/025018 및 WO2003012069는 개별적인 사슬들이 scFv 도메인을 함유하는 재조합 디아바디들을 개시한다. PCT 공개공보 번호 WO 2013/006544는 단일 폴리펩타이드 사슬로서 합성된 후 단백질 가수분해되어 헤테로다이머 구조가 생성되는 다가 Fab 분자들을 개시한다. PCT 공개공보 번호 WO 2014/022540, WO 2013/003652, WO 2012/162583, WO 2012/156430, WO 2011/086091, WO 2008/024188, WO 2007/024715, WO 2007/075270, WO 1998/002463, WO 1992/022583 및 WO 1991/003493은 추가의 결합 도메인들 또는 작용 기들을 항체 또는 항체 부분에 첨가하는 것 (예컨대 디아바디를 항체의 경쇄에 첨가하는 것, 또는 추가의 VL 및 VH 도메인을 항체의 경쇄 및 중쇄에 첨가하는 것, 또는 이종성 융합 단백질 또는 사슬을 만드는 다가 Fab 도메인을 서로에게 첨가하는 것)을 개시한다.
업계는 둘 이상의 상이한 에피토프 종에 결합할 수 있다 (이가 또는 다가에 더불어 이중특이성 또는 다중특이성을 나타낸다)는 점에서 그런 천연 항체들과 상이한 디아바디들을 제조하는 능력을 또한 주지하였다 (예컨대 Holliger et al. (1993) "'Diabodies': Small Bivalent And Bispecific Antibody Fragments", Proc. Natl. Acad. Sci. (U.S.A.) 90:6444-6448; US 2004/0058400 (Hollinger et al.); US 2004/0220388 / WO 02/02781 (Mertens et al.); Alt et al. (1999) FEBS Lett. 454(1-2):90-94; Lu, D. et al. (2005) "A Fully Human Recombinant IgG-Like Bispecific Antibody To Both The Epidermal Growth Factor Receptor And The Insulin-Like Growth Factor Receptor For Enhanced Antitumor Activity", J. Biol. Chem. 280(20):19665-19672; WO 02/02781 (Mertens et al.); Olafsen, T. et al. (2004) "Covalent Disulfide-Linked Anti-CEA Diabody Allows Site-Specific Conjugation And Radiolabeling For Tumor Targeting Applications", Protein Eng. Des. Sel. 17(1):21-27; Wu, A. et al. (2001) "Multimerization Of A Chimeric Anti-CD20 Single Chain Fv-Fv Fusion Protein Is Mediated Through Variable Domain Exchange", Protein Engineering 14(2):1025-1033; Asano et al. (2004) "A Diabody For Cancer Immunotherapy And Its Functional Enhancement By Fusion Of Human Fc Domain", Abstract 3P-683, J. Biochem. 76(8):992; Takemura, S. et al. (2000) "Construction Of A Diabody (Small Recombinant Bispecific Antibody) Using A Refolding System", Protein Eng. 13(8):583-588; Baeuerle, P.A. et al. (2009) "Bispecific T-Cell Engaging Antibodies For Cancer Therapy", Cancer Res. 69(12):4941-4944 참조).
디아바디의 설계는 경쇄 및 중쇄 가변 도메인이 짧은 연결 펩타이드를 사용하여 서로에게 결합되는 단일-사슬 가변 도메인 단편 (scFv)의 구조를 기반으로 한다. Bird 등 (1988)("Single-Chain Antigen-Binding Proteins", Science 242:423-426)은 하나의 가변 도메인의 카르복시 말단과 다른 가변 도메인의 아미노 말단 사이의 대략 3.5 nm를 가교시키는 연결 펩타이드의 실례이다. 다른 서열들을 가진 링커들도 설계되어 있고 사용되고 있다 (Bird et al. (1988) "Single-Chain Antigen-Binding Proteins", Science 242:423-426). 링커는 추가의 기능, 예컨대 약물의 부착 또는 고체 지지체에의 부착을 위해 계속해서 변형될 수 있다. 단일-사슬 변종들은 재조합에 의해 또는 합성에 의해 제조될 수 있다. scFv의 합성 제조의 경우, 자동 합성기가 사용될 수 있다. scFv의 재조합 제조의 경우, scFv를 암호화하는 폴리뉴클레오타이드를 함유한 적합한 플라스미드가 진핵 세포, 예컨대 효모, 식물, 곤충 또는 포유류 세포, 또는 진핵 세포, 예컨대 대장균과 같은 적합한 숙주 세포에 도입될 수 있다. 관심의 scFv를 암호화하는 폴리뉴클레오타이드는 폴리뉴클레오타이드들의 결찰과 같은 기본적인 조작에 의해 만들어질 수 있다. 그 결과의 scFv는 당업계에 알려져 있는 표준 단백질 정제 기법들을 사용하여 분리될 수 있다.
이중특이적 결합 분자들 (예컨대 비-단일특이적 디아바디들)의 제공은 항체를 뛰어넘는 유의미한 장점, 이를테면, 한정하는 것은 아니지만, 상이한 에피토프를 발현하는 상이한 세포들을 공동 결찰 및/또는 공동 국지화하기에 충분한 "트랜스" 결합 능력 및/또는 동일한 세포에 의해 발현된 상이한 분자들을 공동 결찰 및/또는 공동 국지화하기에 충분한 "시스" 결합 능력을 제공한다. 그러므로 이중특이적 결합 분자들 (예컨대, 비-단일특이적 디아바디들)은 치료법 및 면역진단을 포함한 광범위한 적용을 가진다. 이중특이성은 다양한 적용에서 디아바디의 설계 및 엔지니어링에서 대단한 가요성을 허용함으로써, 멀티머 항원에 대한 향상된 결합력, 상이한 항원의 가교-결합, 및 두 표적 항원의 존재에 의존한 특이적 세포 유형으로의 재지정된 표적화를 제공한다. 증가된 결합가, 느린 분해 속도 및 순환으로부터의 신속한 제거 (약 50 kDa 이하에서 작은 크기의 디아바디들의 경우)로 인해, 당업계에 알려진 디아바디 분자들은 또한 종양 영상화 분야에서 특별한 사용을 나타냈다 (Fitzgerald et al. (1997) "Improved Tumour Targeting By Disulphide Stabilized Diabodies Expressed In Pichia pastoris", Protein Eng. 10:1221-1225).
이중특이적 디아바디들을 제조하는 능력은, 예를 들어, 상이한 세포들의 표면에 존재하는 수용체들을 가교 결합시킴으로써 (예컨대 세포독성 T 세포를 질환 항원을 발현하는 표적 세포, 예컨대 암 세포 또는 병원체-감염 세포에 가교 결합시킴으로써) 두 개의 세포를 함께 공동 결찰시키기 위한 사용 ("트란스")으로 이어진다 (Staerz et al. (1985) "Hybrid Antibodies Can Target Sites For Attack By T Cells", Nature 314:628-631, 및 Holliger et al. (1996) "Specific Killing Of Lymphoma Cells By Cytotoxic T-Cells Mediated By A Bispecific Diabody", Protein Eng. 9:299-305; Marvin et al. (2005) "Recombinant Approaches To IgG-Like Bispecific Antibodies", Acta Pharmacol. Sin. 26:649-658; Sloan et al. (2015) "Targeting HIV Reservoir in Infected CD4 T Cells by Dual-Affinity Re-targeting Molecules (DARTs) that Bind HIV Envelope And Recruit Cytotoxic T Cells", PLoS Pathog 11(11): e1005233. doi:10.1371/journal.ppat.1005233)). 대안적으로 (또는 추가적으로), 이중특이적 (또는 삼중- 또는 다중특이적) 디아바디들은 동일한 세포의 표면에 존재하는 분자들, 예컨대 수용체들을 공동 결찰시키기 위해 사용될 수 있다 ("시스"). 상이한 세포들 및/또는 수용체들의 공동 결찰은 이펙터 기능 및/또는 면역 세포 신호전달을 조절하기에 유용하다. 에피토프-결합 도메인을 포함한 다중특이적 분자들 (예컨대, 이중특이적 디아바디들)은 T 림프구, 자연 살해 (NK) 세포, 항원-제공 세포 또는 다른 단핵 세포 상에 발현된 CD2, CD3, CD8, CD16, TCR, NKG2D, 등과 같은 임의의 면역 세포의 표면 결정기에 대해 지시될 수 있다. 특히, 면역 이펙터 세포 상에 존재하는 세포 표면 수용체에 대해 지시된 에피토프-결합 도메인은 재지정된 세포 사멸을 매개할 수 있는 다중특이적 결합 분자들의 생성에 유용하다.
그러나, 상기 기술된 이중특이적 디아바디들의 장점은 가장 중요한 비용에 공략당한다. 그런 비-단일특이적 디아바디들의 형성은 둘 이상의 구별되고 상이한 폴리펩타이드의 성공적인 조립을 필요로 한다 (즉 그런 형성은 디아바디들이 상이한 폴리펩타이드 사슬 종의 헤테로다이머화를 통해 형성될 것을 필요로 한다). 이런 사실은 동일한 폴리펩타이드 사슬의 호모다이머화를 통해 형성되는 단일특이적 디아바디들과는 대조적이다. 적어도 2개의 유사하지 않은 폴리펩타이드 (즉 2개의 폴리펩타이드 종)이 비-단일특이적 디아바디를 형성하기 위해 제공되어야 하고, 그런 폴리펩타이드들의 호모다이머화는 비활성 분자로 이어지기 때문에 (Takemura, S. et al. (2000) "Construction Of A Diabody (Small Recombinant Bispecific Antibody) Using A Refolding System", Protein Eng. 13(8):583-588), 그런 폴리펩타이드들의 제조는 동일한 종의 폴리펩타이드들 사이의 공유 결합을 방지하기 위한 (즉 호모다이머화를 방지하기 위한) 방식으로 이루어져야 한다 (Takemura, S. et al. (2000) "Construction Of A Diabody (Small Recombinant Bispecific Antibody) Using A Refolding System", Protein Eng. 13(8):583-588). 그러므로 당업계는 그런 폴리펩타이드들의 비-공유 결합을 교시한다 (예컨대, Olafsen et al. (2004) "Covalent Disulfide-Linked Anti-CEA Diabody Allows Site-Specific Conjugation And Radiolabeling For Tumor Targeting Applications", Prot. Engr. Des. Sel. 17:21-27; Asano et al. (2004) "A Diabody For Cancer Immunotherapy And Its Functional Enhancement By Fusion Of Human Fc Domain", Abstract 3P-683, J. Biochem. 76(8):992; Takemura, S. et al. (2000) "Construction Of A Diabody (Small Recombinant Bispecific Antibody) Using A Refolding System", Protein Eng. 13(8):583-588; Lu, D. et al. (2005) "A Fully Human Recombinant IgG-Like Bispecific Antibody To Both The Epidermal Growth Factor Receptor And The Insulin-Like Growth Factor Receptor For Enhanced Antitumor Activity", J. Biol. Chem. 280(20):19665-19672 참조).
그러나, 당업계는 비-공유적으로 회합된 폴리펩타이드들로 구성된 이중특이적 디아바디들이 불안정하고 기능적이지 못한 모노머들로 쉽게 분해한다는 것을 인식하였다 (예컨대, Lu, D. et al. (2005) "A Fully Human Recombinant IgG-Like Bispecific Antibody To Both The Epidermal Growth Factor Receptor And The Insulin-Like Growth Factor Receptor For Enhanced Antitumor Activity", J. Biol. Chem. 280(20):19665-19672 참조).
이런 도전과 직면하여, 당업계는 DART® ( D ual- A ffinity R e- T argeting, 이중 친화성 재표적화) 디아바디로 명명된, 안정적이고, 공유 결합된 헤테로다이머 비-단일특이적 디아바디들의 개발에 성공하였다; 예컨대, 미국 특허출원 공개 번호 2013-0295121; 2010-0174053 및 2009-0060910; 유럽 특허 공개 번호 EP 2714079; EP 2601216; EP 2376109; EP 2158221 및 PCT 공개공보 번호 WO 2012/162068; WO 2012/018687; WO 2010/080538; 및 Sloan, D.D. et al. (2015) "Targeting HIV Reservoir in Infected CD4 T Cells by Dual-Affinity Re-targeting Molecules (DARTs) that Bind HIV Envelope And Recruit Cytotoxic T Cells", PLoS Pathog. 11(11):e1005233. doi: 10.1371/journal.ppat.1005233; Al Hussaini, M. et al. (2015) "Targeting CD123 In AML Using A T-Cell Directed Dual-Affinity Re-Targeting (DART®) Platform", Blood pii: blood-2014-05-575704; Chichili, G.R. et al. (2015) "A CD3xCD123 Bispecific DART For Redirecting Host T Cells To Myelogenous Leukemia: Preclinical Activity And Safety In Nonhuman Primates", Sci. Transl. Med. 7(289):289ra82; Moore, P.A. et al. (2011) "Application Of Dual Affinity Retargeting Molecules To Achieve Optimal Redirected T-Cell Killing Of B-Cell Lymphoma", Blood 117(17):4542-4551; Veri, M.C. et al. (2010) "Therapeutic Control Of B Cell Activation Via Recruitment Of Fcgamma Receptor IIb (CD32B) Inhibitory Function With A Novel Bispecific Antibody Scaffold", Arthritis Rheum. 62(7):1933-1943; Johnson, S. et al. (2010) "Effector Cell Recruitment With Novel Fv-Based Dual-Affinity Re-Targeting Protein Leads To Potent Tumor Cytolysis And in vivo B-Cell Depletion", J. Mol. Biol. 399(3):436-449 참조. 그러한 디아바디들은 둘 이상의 공유적으로 복합체를 형성한 폴리펩타이드를 포함하고, 이황화 결합이 형성되는 것을 허용하고 그로써 그런 폴리펩타이드 사슬의 하나 이상의 쌍이 서로에게 공유 결합되는 것을 허용하는 사용된 폴리펩타이드 종의 각각에 하나 이상의 시스테인 잔기를 엔지니어링하는 것을 포함한다. 예를 들어, 시스테인 잔기의 그런 구성물의 C-말단에의 첨가는 포함된 폴리펩타이드 사슬들 사이의 이황화 결합을 허용하여, 결과적으로 생성된 디아바디를 그 디아바디의 결합 특징을 간섭하지 않으면서 안정화시키는 것으로 밝혀졌다.
그러한 분자들의 많은 변화가 기술되었고 (예컨대, 미국 특허 공개공보 번호 2015/0175697; 2014/0255407; 2014/0099318; 2013/0295121; 2010/0174053; 2009/0060910; 2007-0004909; 유럽 특허 공개공보 번호 EP 2714079; EP 2601216; EP 2376109; EP 2158221; EP 1868650; 및 PCT 공개공보 번호 WO 2012/162068; WO 2012/018687; WO 2010/080538; WO 2006/113665 참조), 본원에 제공되었다.
이중특이적 또는 사가 분자가 바람직하지만 Fc는 필요하지 않은 적용에 대해 대체 구성물들, 이를테면, 한정하는 것은 아니지만, "BiTE"로도 언급되는 이중특이적 T 세포 인게이저(engager) 분자 (예컨대 PCT 공개공보 번호: WO 1993/11161; 및 WO 2004/106381) 및 "TandAb"로도 언급되는 사가 탠덤 항체 (예컨대 미국 특허 공개공보 번호: 2011-0206672; 유럽 특허 공개공보 번호 EP 2371866, 및; PCT 공개공보 번호 WO 1999/057150, WO 2003/025018, 및 WO 2013/013700)가 업계에 알려져 있다. BiTE는 탠덤 결합된 scFv를 포함하는 단일 폴리펩타이드 사슬로부터 형성되는 한편, TandAb는 각각이 VH1, VL2, VH2, 및 VL2 도메인을 갖고 있는 두 개의 동일한 폴리펩타이드 사슬의 호모다이머화에 의해 형성된다.
본 발명은 질환 항원을 발현하는 표적 세포 (예컨대, 암 세포 또는 병원체-감염 세포, 등)의 재지정된 사멸을 매개할 수 있는 이중특이적 결합 분자를 제공한다. 그러한 이중특이적 결합 분자는 "제 1 에피토프" 및 "제 2 에피토프"에 결합할 수 있고, 그런 에피토프들은 서로 동일하지 않다. 그러한 이중특이적 분자는 제 1 에피토프에 결합할 수 있는 "VL1" / "VH1" 도메인, 및 제 2 에피토프에 결합할 수 있는 "VL2" / "VH2" 도메인을 포함한다. 표기 "VL1" 및 "VH1"은 각각, 그러한 이중특이적 분자의 "제 1" 에피토프에 결합하는 가변 경쇄 도메인 및 가변 중쇄 도메인을 나타낸다. 유사하게, 표기 "VL2" 및 "VH2"는 각각 그러한 이중특이적 분자의 "제 2" 에피토프에 결합하는 경쇄 가변 도메인 및 중쇄 가변 도메인을 나타낸다. 특정 에피토프가 제 2 에피토프에 대비된 제 1 에피토프로서 지정되었는가의 여부는 무관하며; 그런 표기는 본 발명의 결합 분자의 폴리펩타이드 사슬의 도메인들의 존재 및 방향과만 관련성이 있다. 한 구체예에서, 그런 에피토프들 중 하나는 이펙터 세포, 예컨대 T 림프구, 자연 살해 (NK) 세포 또는 다른 단핵 세포의 표면에 존재하는 분자 (예컨대, CD2, CD3, CD8, CD16, T-세포 수용체 (TCR), NKG2D, 등)의 에피토프이며 다른 에피토프는 질환 항원 (예컨대, 암 항원 또는 병원체-관련 항원)의 에피토프이다. 특정 구체예에서, 이중특이적 분자는 둘 이상의 에피토프-결합 부위를 포함한다. 본 발명은 특히 본원에 제공된 임의의 방법을 사용하여 제조된 이중특이적 디아바디들, BiTE, 항체, 및 TandAb를 포함한다.
A. Fc 도메인이 결핍된 디아바디들
한 구체예에서, 발명의 디아바디들은 이중특이적이고 제 1 및 제 2 에피토프 둘 다에 결합할 수 있는 도메인들을 포함하겠지만, Fc 도메인이 결핍될 것이고, 그로써 FcγR 분자에 결합할 수 없을 것이다. 이중특이적 디아바디들의 그러한 구체예의 제 1 폴리펩타이드 사슬은, N-말단에서 C-말단 방향으로, N-말단, 제 1 또는 제 2 에피토프에 결합할 수 있는 단클론성 항체의 VL 도메인 (즉, VL에피토프 1 또는 VL에피토프 2), 제 1 개입 스페이서 펩타이드 (링커 1), 제 2 에피토프에 결합할 수 있는 단클론성 항체의 VH 도메인 (제 1 폴리펩타이드 사슬이 VL에피토프 1을 함유하는 경우) 또는 제 1 에피토프에 결합할 수 있는 단클론성 항체의 VH 도메인 (제 1 폴리펩타이드 사슬이 VL에피토프 2를 함유하는 경우), 시스테인 잔기를 선택적으로 함유하는 제 2 개입 스페이서 펩타이드 (링커 2), 헤테로다이머-촉진 도메인 및 C-말단을 포함한다 (도 1).
이중특이적 디아바디들의 이런 구체예의 제 2 폴리펩타이드 사슬은, N-말단에서 C-말단 방향으로, N-말단, N-말단에서 C-말단 방향으로, N-말단, 제 1 또는 제 2 에피토프에 결합할 수 있는 단클론성 항체의 VL 도메인 (즉, VL에피토프 1 또는 VL에피토프 2, 디아바디의 제 1 폴리펩타이드 사슬에 포함되기 위해 선택되지 않은 VL 도메인임), 개입 스페이서 펩타이드 (링커 1), 제 1 또는 제 2 에피토프에 결합할 수 있는 단클론성 항체의 VH 도메인 (즉, VH에피토프 1 또는 VH에피토프 2, 디아바디의 제 1 폴리펩타이드 사슬에 포함되기 위해 선택되지 않은 VH 도메인임), 시스테인 잔기를 선택적으로 함유하는 제 2 개입 스페이서 펩타이드 (링커 2), 헤테로다이머-촉진 도메인 및 C-말단을 포함한다 (도 1). 특정 에피토프에 특이적인 사용된 VL 및 VH 도메인은 바람직하게는 동일한 단클론성 항체로부터 얻어지거나 유래된다. 그러나, 그런 도메인들은, 그것들이 그런 에피토프에 면역특이적으로 결합할 수 있는 기능성 결합 부위를 형성하기 위해 회합한다면 상이한 단클론성 항체들로부터 유래될 수 있다. 그러한 상이한 항체들은 "상응하는" 항체로서 본원에서 언급된다.
제 1 폴리펩타이드 사슬의 VL 도메인은 에피토프들 중 하나 (예컨대, 제 1 에피토프)에 특이적인 제 1 기능성 에피토프-결합 부위를 형성하기 위하여 제 2 폴리펩타이드 사슬의 VH 도메인과 상호작용한다. 마찬가지로, 제 2 폴리펩타이드 사슬의 VL 도메인은 다른 에피토프 (즉 제 2 에피토프)에 특이적인 제 2 기능성 에피토프-결합 부위를 형성하기 위하여 제 1 폴리펩타이드 사슬의 VH 도메인과 상호작용한다. 그러므로, 제 1 및 제 2 폴리펩타이드 사슬의 VL 및 VH 도메인의 선택은 "상호협조적"이고, 그로써 디아바디의 2개의 폴리펩타이드 사슬은 포괄적으로 제 1 에피토프 및 제 2 에피토프 둘 다에 결합할 수 있는 VL 및 VH 도메인을 포함한다 (즉, 그것들은 포괄적으로 VL에피토프 1/VH에피토프 1 및 VL에피토프 2/VH에피토프 2를 포함한다).
가장 바람직하게는, 개입 스페이서 펩타이드 (즉 VL 및 VH 도메인을 분리시키는 "링커 1")의 길이는 폴리펩타이드 사슬의 VL 및 VH 도메인이 서로 결합되는 것을 실질적으로 또는 완전히 방지하기 위해 선택된다 (예를 들어 0, 1, 2, 3, 4, 5, 6, 7, 8 또는 9개의 개입 링커 아미노산 잔기로 구성됨). 그러므로 제 1 폴리펩타이드 사슬의 VL 및 VH 도메인은 실질적으로 또는 완전하게 서로와 결합될 수 없다. 마찬가지로, 제 2 폴리펩타이드 사슬의 VL 및 VH 도메인은 실질적으로 또는 완전하게 서로와 결합될 수 없다. 바람직한 개입 스페이서 펩타이드 (링커 1)는 서열 (SEQ ID NO:14): GGGSGGGG를 가진다.
제 2 개입 스페이서 펩타이드 ("링커 2")의 길이 및 조성은 그런 다이머화를 촉진하는 하나 이상의 폴리펩타이드 도메인 (즉 "헤테로다이머-촉진 도메인")의 선택을 기반으로 선택된다. 전형적으로, 제 2 개입 스페이서 펩타이드 (링커 2)는 3 내지 20개의 아미노산 잔기를 포함할 것이다. 특히, 사용된 헤테로다이머-촉진 도메인(들)이 시스테인 잔기를 포함하지 않는 경우에, 시스테인-함유 제 2 개입 스페이서 펩타이드 (링커 2)가 이용된다. 시스테인-함유 제 2 개입 스페이서 펩타이드 (링커 2)는 1, 2, 3개 또는 그 이상의 시스테인을 함유할 것이다. 바람직한 시스테인-함유 스페이서 펩타이드 (링커 2)는 서열 GGCGGG (SEQ ID NO:15)를 가진다. 대안적으로, 링커 2는 시스테인을 포함하지 않고 (예컨대, GGG, GGGS (SEQ ID NO:16), LGGGSG (SEQ ID NO:17), GGGSGGGSGGG (SEQ ID NO:18), ASTKG (SEQ ID NO:19), LEPKSS (SEQ ID NO:20), APSSS (SEQ ID NO:21), 등), 시스테인-함유 헤테로다이머-촉진 도메인이 아래에서 기술된 것과 같이 사용된다. 선택적으로, 시스테인-함유 링커 2 및 시스테인-함유 헤테로다이머-촉진 도메인이 둘 다 사용된다.
헤테로다이머-촉진 도메인은 한 폴리펩타이드 사슬에서 GVEPKSC (SEQ ID NO:22) 또는 VEPKSC (SEQ ID NO:23) 또는 AEPKSC (SEQ ID NO:24)일 수 있고 다른 폴리펩타이드 사슬에서 GFNRGEC (SEQ ID NO:25) 또는 FNRGEC (SEQ ID NO:26)일 수 있다 (US2007/0004909).
바람직한 구체예에서, 헤테로다이머-촉진 도메인은 반대 전하의, 나란히(tandemly) 반복된 코일 도메인을 포함할 것인데, 예를 들어 "E-코일" 헤테로다이머-촉진 도메인 (SEQ ID NO:27: E VAAL E K- E VAAL E K- E VAAL E K- E VAAL E K)은 그것의 글루타메이트 잔기가 pH 7에서 음전하를 형성할 것이고, 또는 "K-코일" 헤테로다이머-촉진 도메인 (SEQ ID NO:28: K VAAL K E- K VAAL K E- K VAAL K E- K VAAL K E)는 그것의 리신 잔기가 pH 7에서 양전하를 형성할 것이다. 그런 대전된 도메인들의 존재는 제 1 폴리펩타이드와 제 2 폴리펩타이드 사이의 회합을 촉진하고, 그로써 헤테로다이머 형성을 조성한다. 상기 기술된 E-코일 및 K-코일 서열의 변형을 포함하는 헤테로다이머-촉진 도메인이 하나 이상의 시스테인 잔기를 포함하기 위하여 이용될 수 있다. 그러한 시스테인 잔기의 존재는 한 폴리펩타이드 사슬에 존재하는 코일이 다른 폴리펩타이드 사슬에 존재하는 상보성 코일에 공유 결합되는 것을 허용하고, 그로써 폴리펩타이드 사슬들을 서로와 공유 결합시키고 디아바디의 안정성을 증가시킨다. 그런 특히 바람직한 헤테로다이머-촉진 도메인의 실례로는 아미노산 서열 E VAAC E K- E VAAL E K- E VAAL E K- E VAAL E K (SEQ ID NO:29)를 가지는 변형된E-코일, 및 아미노산 서열 K VAAC K E- K VAAL K E- K VAAL K E- K VAAL K E (SEQ ID NO:30)을 가지는 변형된 K-코일을 들 수 있다.
WO 2012/018687에서 개시된 것과 같이, 디아바디들의 생체내 약물동역학적 특성을 개선하기 위하여, 디아바디는 디아바디의 하나 이상의 말단에서 혈청-결합 단백질의 폴리펩타이드 부분을 함유하도록 변형될 수 있다. 가장 바람직하게는, 혈청-결합 단백질의 그러한 폴리펩타이드 부분은 디아바디의 폴리펩타이드 사슬의 C-말단에 자리잡을 것이다. 알부민은 혈장에서 가장 풍부한 단백질이고 인간에서 19일의 반감기를 가진다. 알부민은 다른 단백질에 비-공유적으로 결합하고 그로써 혈청내 반감기가 연장되는 것을 허용하는 여러 개의 작은 분자 결합 부위를 가진다. 스트렙토코쿠스 스트레인(Streptococcus strain) G418의 단백질 G의 알부민-결합 도메인 3 (ABD3)은 안정적인 3-나선 번들을 형성하는 46개의 아미노산 잔기로 구성되고 광범위한 알부민-결합 특이성을 가진다 (Johansson, M.U. et al. (2002) "Structure, Specificity, And Mode Of Interaction For Bacterial Albumin-Binding Modules", J. Biol. Chem. 277(10):8114-8120). 그러므로, 디아바디의 생체내 약물동역학적 특성을 개선하기 위한 혈청-결합 단백질의 특히 바람직한 폴리펩타이드 부분은 스트렙토코쿠스 단백질 G로부터의 알부민-결합 도메인 (ABD)이고, 보다 바람직하게, 스트렙토코쿠스 스트레인 G418의 단백질 G의 알부민-결합 도메인 3 (ABD3) (SEQ ID NO:31): LAEAKVLANR ELDKYGVSDY YKNLIDNAKS AEGVKALIDE ILAALP이다.
WO 2012/162068 (본원에 참조로 포함됨)에 개시된 것과 같이, SEQ ID NO:31의 "탈면역화된" 변종은 MHC 부류 II 결합을 약화 또는 제거하는 능력을 가진다. 조합 돌연변이 결과를 기반으로, 다음의 치환 조합이 그러한 탈면역화된 ABD를 형성하기 위한 바람직한 치환인 것으로 여겨진다: 66D/70S +71A; 66S/70S +71A; 66S/70S +79A; 64A/65A/71A; 64A/65A/71A+66S; 64A/65A/71A+66D; 64A/65A/71A+66E; 64A/65A/79A+66S; 64A/65A/79A+66D; 64A/65A/79A+66E. 변형 L64A, I65A 및 D79A 또는 변형 N66S, T70S 및 D79A를 가지는 변종 ABD. 아미노산 서열:
LAEAKVLANR ELDKYGVSDY YKNLI D 66NAK S 70 A 71EGVKALIDE ILAALP
(SEQ ID NO:32), 또는 아미노산 서열:
LAEAKVLANR ELDKYGVSDY YKN A 64 A 65NNAKT VEGVKALI A 79E ILAALP
(SEQ ID NO:33), 또는 아미노산 서열:
LAEAKVLANR ELDKYGVSDY YKNLI S 66NAK S 70 VEGVKALI A 79E ILAALP
(SEQ ID NO:34)를 가지는 변종 탈면역화된 ABD는 특히 바람직한데, 그러한 탈면역화된 ABD가 실질적으로 야생형 결합을 나타내는 한편, 약화된 MHC 부류 II 결합을 제공하기 때문이다. 그러므로, ABD를 가지는 그런 디아바디의 제 1 폴리펩타이드 사슬은 바람직하게는, E-코일 (또는 K-코일) 도메인과 ABD (바람직하게는 탈면역화된 ABD임) 사이에 개입하기 위하여, 그런 폴리펩타이드 사슬의 E-코일 (또는 K-코일) 도메인에 대해 C-말단쪽으로 위치한 제 3 링커 (링커 3)를 함유한다. 그런 링커 3에 대해 바람직한 서열은 SEQ ID NO:16: GGGS이다.
B. Fc 도메인을 포함하는 디아바디들
본 발명의 한 구체예는 Fc 도메인을 포함하는 제 1 및 제 2 에피토프 (동일한 항원 분자의 상이한 에피토프 또는 상이한 항원인 분자의 에피토프)에 동시에 결합할 수 있는 다중특이적 디아바디들 (예컨대, 이중특이적, 삼중특이적, 사중특이적, 등)에 관련된다. 그러한 분자들의 Fc 도메인은 임의의 아이소타입 (예컨대, IgG1, IgG2, IgG3, 또는 IgG4)의 것일 수 있다. 분자는 추가로 CH1 도메인 및/또는 힌지 도메인을 포함할 수 있다. 존재하는 경우, CH1 도메인 및/또는 힌지 도메인은 임의의 아이소타입 (예컨대, IgG1, IgG2, IgG3, 또는 IgG4)의 것일 수 있고, 바람직하게는 원하는 Fc 도메인과 동일한 아이소타입의 것이다.
IgG CH2-CH3 도메인은, 디아바디 사슬의 복합체화가 Fc 도메인의 형성을 초래하고, 디아바디의 생물학적 반감기를 증가시키며 및/또는 결합가를 변경시키도록 디아바디 폴리펩타이드 사슬들 중 하나 또는 둘 다에 첨가된다. 그러한 디아바디들은 둘 이상의 폴리펩타이드 사슬을 포함하고, 그것의 서열들은 폴리펩타이드 사슬이 서로 공유적으로 결합하여 제 1 에피토프 및 제 2 에피토프에 동시에 결합할 수 있는 공유적으로 결합된 디아바디를 형성하는 것을 허용한다. IgG CH2-CH3 도메인을 디아바디 폴리펩타이드들 둘 다에 통합시키는 것은 2-사슬 이중특이적 Fc 영역-함유 디아바디가 형성되는 것을 허용할 것이다 (도 2).
대안적으로, IgG CH2-CH3 도메인을 디아바디 폴리펩타이드들 중 하나에만 통합시키는 것은 보다 복잡한 4-사슬 이중특이적 Fc 도메인-함유 디아바디가 형성되는 것을 허용할 것이다 (도 3A-3C). 도 3C는 불변 경쇄 (CL) 도메인 및 불변 중쇄 CH1 도메인을 가지는 대표적인 4-사슬 디아바디를 나타내지만, 그러한 도메인들의 단편들뿐만 아니라 다른 폴리펩타이드들이 번갈아 사용될 수 있다 (예컨대, 도 3A 및 3B, 미국 특허 공개공보 번호 2013-0295121; 2010-0174053 및 2009-0060910; 유럽 특허 공개공보 번호 EP 2714079; EP 2601216; EP 2376109; EP 2158221 및 PCT 공개공보 번호 WO 2012/162068; WO 2012/018687; WO 2010/080538). 그러므로, 예를 들어, CH1 도메인 대신, 당업자는 인간 IgG의 힌지 도메인으로부터 유래된 아미노산 서열 GVEPKSC (SEQ ID NO:22), VEPKSC (SEQ ID NO:23), 또는 AEPKSC (SEQ ID NO:24)를 가지는 펩타이드를 사용할 수 있고, CL 도메인 대신, 당업자는 인간 카파 경쇄의 C-말단의 6개의 아미노산 GFNRGEC (SEQ ID NO:25) 또는 FNRGEC (SEQ ID NO:26)를 사용할 수 있다. 대표적인 펩타이드 함유 4-사슬 디아바디가 도 3A에 도시된다. 대안적으로, 또는 이에 더불어, 당업자는 "E-코일" 나선형 도메인 (SEQ ID NO:27: E VAAL E K- E VAAL E K- E VAAL E K- E VAAL E K 또는 SEQ ID NO:29: E VAAC E K- E VAAL E K- E VAAL E K- E VAAL E K); 및 "K-코일" 도메인 (SEQ ID NO:28: K VAAL K E- K VAAL K E- K VAAL K E- K VAAL K E 또는 SEQ ID NO:30: K VAAC K E- K VAAL K E- K VAAL K E- K VAAL K E)과 같이 반대 전하의 탠덤 코일 도메인을 포함하는 펩타이드를 사용할 수 있다. 대표적인 코일 도메인 함유 4-사슬 디아바디가 도 3B에 도시된다.
본 발명의 Fc 도메인-함유 디아바디 분자는 추가적인 개입 스페이서 펩타이드 (링커)를 포함할 수 있는데, 일반적으로 그런 링커는 헤테로다이머-촉진 도메인 (예컨대, E-코일 또는 K-코일)와 CH2-CH3 도메인 사이 및/또는 CH2-CH3 도메인과 가변 도메인 (즉, VH 또는 VL) 사이에 포함될 것이다. 전형적으로, 추가적인 링커는 3 내지 20개의 아미노산 잔기를 포함할 것이고 선택적으로 IgG 힌지 도메인의 전부 또는 일부 (바람직하게는 IgG 힌지 도메인의 시스테인-함유 부분)를 함유할 수 있다. 본 발명의 이중특이적 Fc 도메인-함유 디아바디 분자에 사용될 수 있는 링커로는 다음을 포함한다: GGGS (SEQ ID NO:16), LGGGSG (SEQ ID NO:17), GGGSGGGSGGG (SEQ ID NO:18), ASTKG (SEQ ID NO:19), LEPKSS (SEQ ID NO:20), APSSS (SEQ ID NO:21), APSSSPME (SEQ ID NO:35), VEPKSADKTHTCPPCP (SEQ ID NO:36), LEPKSADKTHTCPPCP (SEQ ID NO:37), DKTHTCPPCP (SEQ ID NO:38), GGC, 및 GGG. LEPKSS (SEQ ID NO:20)가 용이한 클로닝을 위해 GGG 또는 GGC 대신 사용될 수 있다. 추가적으로, 아미노산 GGG, 또는 LEPKSS (SEQ ID NO:20)가 대체 링커s: GGGDKTHTCPPCP (SEQ ID NO:39); 및 LEPKSSDKTHTCPPCP (SEQ ID NO:40)를 형성하기 위하여 DKTHTCPPCP (SEQ ID NO:38) 바로 뒤에 이어질 수 있다. 본 발명의 이중특이적 Fc 도메인-함유 분자는 링커에 더불어 또는 링커 대신 IgG 힌지 도메인을 포함할 수 있다. 예시의 힌지 도메인은 IgG1로부터의 EPKSCDKTHTCPPCP (SEQ ID NO:4) , IgG2로부터의 ERKCCVECPPCP (SEQ ID NO:5), IgG4로부터의 ESKYGPPCPSCP (SEQ ID NO:6) 및 가닥 교환을 줄이기 위해 안정화 S228P 치환 (Kabat에 나타낸 것과 같이 EU 인덱스에 의해 넘버링됨)을 포함하는 ESKYGPPCP P CP (SEQ ID NO:7) IgG4 힌지 변종을 포함한다.
도 3A 내지 3C에 제시된 것과 같이, 발명의 Fc 도메인-함유 디아바디들은 4개의 사슬을 포함할 수 있다. 그런 디아바디의 제 1 및 제 3 폴리펩타이드 사슬은 3개의 도메인: (i) VL1-함유 도메인, (ii) VH2-함유 도메인, (iii) 헤테로다이머-촉진 도메인, 및 (iv) CH2-CH3 서열을 함유하는 도메인을 함유한다. 제 2 및 제 4 폴리펩타이드 사슬은 (i) VL2-함유 도메인, (ii) VH1-함유 도메인, 및 (iii) 헤테로다이머-촉진 도메인을 함유하고, 여기서 헤테로다이머-촉진 도메인은 제 2/제 4 폴리펩타이드 사슬과 제 1/제 3 폴리펩타이드 사슬의 다이머화를 촉진한다. 제 3 및 제 4 폴리펩타이드 사슬의 VL 및/또는 VH 도메인, 및 제 1 및 제 2 폴리펩타이드 사슬의 VL 및/또는 VH 도메인은 단일특이적이거나, 이중특이적이거나 또는 사중특이적인 4가 결합을 허용하기 위하여 동일하거나 상이할 수 있다. 표기 "VL3" 및 "VH3"은 각각, 그런 디아바디의 "제 3" 에피토프에 결합하는 경쇄 가변 도메인 및 가변 중쇄 도메인을 표시한다. 유사하게, 표기 "VL4" 및 "VH4"는 각각, 그런 디아바디의 "제 4" 에피토프에 결합하는 경쇄 가변 도메인 및 가변 중쇄 도메인을 표시한다. 발명의 대표적인 4-사슬 이중특이적 Fc 도메인-함유 디아바디들의 폴리펩타이드 사슬의 일반적 구조를 표 1에 제시한다.
| 이중특이적 | 제2 사슬 | NH2-VL2-VH1-HPD-COOH |
| 제1 사슬 | NH2-VL1-VH2-HPD-CH2-CH3-COOH | |
| 제1 사슬 | NH2-VL1-VH2-HPD-CH2-CH3-COOH | |
| 제2 사슬 | NH2-VL2-VH1-HPD-COOH | |
| 사중특이적 | 제2 사슬 | NH2-VL2-VH1-HPD-COOH |
| 제1 사슬 | NH2-VL1-VH2-HPD-CH2-CH3-COOH | |
| 제3 사슬 | NH2-VL3-VH4-HPD-CH2-CH3-COOH | |
| 제4 사슬 | NH2-VL4-VH3-HPD-COOH |
HPD = 헤테로다이머-촉진 도메인
특정 구체예에서, 본 발명의 디아바디들은 총 4개의 폴리펩타이드 사슬로 구성된 이중특이적, 사가 (즉, 4개의 에피토프-결합 도메인을 가짐), Fc-함유 디아바디들이다 (도 3A-3C). 발명의 이중특이적, 사가, Fc-함유 디아바디들은 2개의 제 1 에피토프-결합 도메인 및 2개의 제 2 에피토프-결합 도메인을 포함한다.
추가의 구체예에서, 본 발명의 Fc 도메인-함유 디아바디들은 3개의 폴리펩타이드 사슬을 포함할 수 있다. 그런 디아바디의 1 폴리펩타이드는 3개의 도메인: (i) VL1-함유 도메인, (ii) VH2-함유 도메인 및 (iii) CH2-CH3 서열을 함유하는 도메이을 함유한다. 그런 디아바디의 제 2 폴리펩타이드는 (i) VL2-함유 도메인, (ii) VH1-함유 도메인 및 (iii) 디아바디의 제 1 폴리펩타이드 사슬과의 헤테로다이머화 및 공유 결합을 촉진하는 도메인을 함유한다. 그런 디아바디의 제 3 폴리펩타이드는 CH2-CH3 서열을 포함한다. 그러므로, 그런 디아바디의 제 1 및 제 2 폴리펩타이드 사슬은 함께 회합되어 제 1 또는 제 2 에피토프 중 하나에 결합할 수 있는 VL1/VH1 에피토프-결합 부위뿐만 아니라, 그런 에피토프들의 다른 하나에 결합할 수 있는 VL2/VH2 에피토프-결합 부위를 형성한다. 제 1 및 제 2 폴리펩타이드는 각각의 제 3 도메인에서 시스테인 잔기를 포함하는 이황화 결합을 통해 서로에게 결합된다. 특히, 제 1 및 제 3 폴리펩타이드 사슬은 서로와 복합체를 형성하여 이황화 결합을 통해 안정화되는 Fc 도메인을 형성한다. 그런 이중특이적 디아바디들은 향상된 효능을 가진다. 도 4A 및 4B는 그런 디아바디들의 구조를 예시한다. 그런 Fc 영역-함유 디아바디들은 2가지 방향 중 어느 하나를 가질 수 있다 (표 2).
| 제 1 방향 | 제 3 사슬 | NH2-CH2-CH3-COOH |
| 제 1 사슬 | NH2-VL1-VH2-HPD-CH2-CH3-COOH | |
| 제 2 사슬 | NH2-VL2-VH1-HPD-COOH | |
| 제 2 방향 | 제 3 사슬 | NH2-CH2-CH3-COOH |
| 제 1 사슬 | NH2-CH2-CH3-VL1-VH2-HPD-COOH | |
| 제 2 사슬 | NH2-VL2-VH1-HPD-COOH |
HPD = 헤테로다이머-촉진 도메인
특정 구체예에서, 본 발명의 디아바디들은 총 3개의 폴리펩타이드 사슬로 구성되는 이중특이적, 이가 (즉 2개의 에피토프-결합 도메인을 가짐), Fc-함유 디아바디들이다 (도 4A-4B). 발명의 이중특이적, 이가 Fc-함유 디아바디들은 제 1 또는 2 에피토프 중 어느 하나에 면역특이적인 하나의 에피토프-결합 부위뿐만 아니라, 그런 에피토프들 중 다른 하나에 결합할 수 있는 VL2/VH2 에피토프-결합 부위을 포함한다.
추가의 구체예에서, Fc 도메인-함유 디아바디들은 총 5개의 폴리펩타이드 사슬을 포함할 수 있다. 특정 구체예에서, 5개의 폴리펩타이드 사슬 중 2개는 동일한 아미노산 서열을 가진다. 그런 디아바디의 제 1 폴리펩타이드 사슬은 (i) VH1-함유 도메인, (ii) CH1-함유 도메인, 및 (iii) CH2-CH3 서열을 함유하는 도메인을 함유한다. 제 1 폴리펩타이드 사슬은 VH1 및 중쇄 불변 영역을 함유하는 항체의 중쇄일 수 있다. 그런 디아바디의 제 2 및 제 5 폴리펩타이드 사슬은 (i) VL1-함유 도메인, 및 (ii) CL-함유 도메인을 함유한다. 그런 디아바디의 제 2 및/또는 제 5 폴리펩타이드 사슬은 제 1/제 3 폴리펩타이드 사슬의 VH1에 상보하는 VL1을 함유하는 항체의 경쇄일 수 있다. 제 1, 제 2 및/또는 제 5 폴리펩타이드 사슬은 자연적으로 발생하는 항체로부터 분리될 수 있다. 대안적으로, 그것들은 재조합에 의해 구성될 수 있다. 그런 디아바디의 제 3 폴리펩타이드 사슬은 (i) VH1-함유 도메인, (ii) CH1-함유 도메인, (iii) CH2-CH3 서열을 함유하는 도메인, (iv) VL2-함유 도메인, (v) VH3-함유 도메인 및 (vi) 헤테로다이머-촉진 도메인을 함유하고, 여기서 헤테로다이머-촉진 도메인은 제 4 사슬과 제 3 사슬의 다이머화를 촉진한다. 그런 디아바디들의 제 4 폴리펩타이드는 (i) VL3-함유 도메인, (ii) VH2-함유 도메인 및 (iii) 디아바디의 제 3 폴리펩타이드 사슬과의 헤테로다이머화 및 공유 결합을 촉진하는 도메인을 암유한다.
그러므로, 그런 디아바디들의 제 1 및 제 2, 및 제 3 및 제 5, 폴리펩타이드 사슬은 함께 회합되어 제 1 에피토프에 결합할 수 있는 2개의 VL1/VH1 에피토프-결합 도메인을 형성한다. 그런 디아바디들의 제 3 및 제 4 폴리펩타이드 사슬은 함께 회합되어 제 2 에피토프에 결합할 수 있는 VL2/VH2 에피토프-결합 부위뿐만 아니라, 제 3 에피토프에 결합할 수 있는 VL3/VH3 결합 부위를 형성한다. 제 1 및 제 3 폴리펩타이드는 각각의 불변 영역에서 시스테인 잔기를 포함하는 이황화 결합을 통해 서로에게 결합된다. 특히, 제 1 및 제 3 폴리펩타이드 사슬은 서로와 복합체를 형성하여 Fc 도메인을 형성한다. 그러한 다중특이적 디아바디들은 향상된 효능을 가진다. 도 5는 그런 디아바디들의 구조를 예시한다. VL1/VH1, VL2/VH2, 및 VL3/VH3 도메인은 단일특이적이거나, 이중특이적이거나 또는 삼중특이적인 결합을 허용하기 위하여 동일하거나 상이할 수 있는 것이 인지될 것이다.
폴리펩타이드 사슬의 VL 및 VH 도메인은 원하는 에피토프에 특이적인 VL/VH 결합 부위를 형성하기 위하여 선택된다. 폴리펩타이드 사슬들의 회합에 의해 형성된 VL/VH 결합 부위는 단일특이적, 이중특이적, 삼중특이적 또는 사중특이적인 사가 결합을 허용하기 위해 동일하거나 상이할 수 있다. 특히, VL 및 VH 도메인은 다가 디아바디가 제 1 에피토프에 대한 2개의 결합 부위 및 제 2 에피토프에 대한 2개의 결합 부위, 또는 제 1 에피토프에 대한 3개의 결합 부위 및 제 2 에피토프에 대한 1개의 결합 부위, 또는 제 1 에피토프에 대한 2개의 결합 부위, 제 2 에피토프에 대한 1개의 결합 부위 및 제 3 에피토프에 대한 1개의 결합 부위를 포함할 수 있도록 선택될 수 있다 (도 5에 도시됨). 발명의 대표적인 5-사슬 Fc 도메인-함유 디아바디들의 폴리펩타이드 사슬의 일반적인 구조를 표 3에 제시한다:
| 이중특이적 (2x2) | 제 2 사슬 | NH2-VL1-CL-COOH |
| 제 1 사슬 | NH2-VH1-CH1-CH2-CH3-COOH | |
| 제 3 사슬 | NH2-VH1-CH1-CH2-CH3-VL2-VH2-HPD-COOH | |
| 제 5 사슬 | NH2-VL1-CL-COOH | |
| 제 4 사슬 | NH2-VL2-VH2-HPD-COOH | |
| 이중특이적 (3x1) | 제 2 사슬 | NH2-VL1-CL-COOH |
| 제 1 사슬 | NH2-VH1-CH1-CH2-CH3-COOH | |
| 제 3 사슬 | NH2-VH1-CH1-CH2-CH3-VL1-VH2-HPD-COOH | |
| 제 5 사슬 | NH2-VL1-CL-COOH | |
| 제 4 사슬 | NH2-VL2-VH1-HPD-COOH | |
| 삼중특이적 (2x1x1) | 제 2 사슬 | NH2-VL1-CL-COOH |
| 제 1 사슬 | NH2-VH1-CH1-CH2-CH3-COOH | |
| 제 3 사슬 | NH2-VH1-CH1-CH2-CH3-VL2-VH3-HPD-COOH | |
| 제 5 사슬 | NH2-VL1-CL-COOH | |
| 제 4 사슬 | NH2-VL3-VH2-HPD-COOH |
HPD = 헤테로다이머-촉진 도메인
특정 구체예에서, 본 발명의 디아바디들은 제 1 에피토프에 대해 면역특이적인 2개의 에피토프-결합 도메인, 및 제 2 에피토프에 대해 면역특이적인 2개의 에피토프-결합 도메인을 가지는 총 5개의 폴리펩타이드 사슬로 구성된 이중특이적, 사가 (즉, 4개의 에피토프-결합 도메인을 가짐), Fc-함유 디아바디들이다. 다른 구체예에서, 발명의 이중특이적, 사가, Fc-함유 디아바디들은 제 1 에피토프에 대해 면역특이적인 3개의 에피토프-결합 도메인 및 제 2 에피토프에 대해 면역특이적인 2개의 에피토프-결합 도메인을 포함한다. 상기에서 제공된 것과 같이, VL 및 VH 도메인은 삼중특이적 결합을 허용하기 위해 선택될 수 있다. 따라서, 발명은 또한 삼중특이적, 사가, Fc-함유 디아바디들을 포함한다. 발명의 삼중특이적, 사가, Fc-함유 디아바디들은 제 1 에피토프에 대해 면역특이적인 2개의 결합 부위, 제 2 에피토프에 대해 면역특이적인 1개의 결합 부위, 및 제 3 에피토프에 대해 면역특이적인 1개의 결합 부위를 포함한다.
전통적인 면역 기능에서, 면역 체계의 세포들과 항체-항원 복합체의 상호작용은 항체-의존성 세포독성, 비만 세포 탈과립화, 및 식세포 작용과 같은 이펙터 기능으로부터 조절 림프구 증식 및 항체 분비와 같은 면역조절 신호에 이르기까지, 광범위한 반응을 초래한다. 이런 상호작용들은 조혈 세포 상의 특수한 세포 표면 수용체에 대한 항체 또는 면역 복합체의 Fc 도메인의 결합을 통해 시작된다. 항체 및 면역 복합체에 의해 촉발된 세포 반응의 다양성은 3개의 Fc 수용체, FcγRI (CD64), FcγRII (CD32), 및 FcγRIII (CD16)의 구조적 이질성으로부터 유발된다. FcγRI (CD64), FcγRIIA (CD32A), 및 FcγRIII (CD16)은 활성화 (즉, 면역 체계 향상) 수용체이고; FcγRIIB (CD32B)는 억제 (즉, 면역 체계 약화) 수용체이다. 이에 더불어, 신생 Fc 수용체 (FcRn)와의 상호작용은 IgG 분자들의 엔도솜으로부터세포 표면으로의 재순환 및 혈액으로의 방출을 매개한다. 예시의 야생형 IgG1 (SEQ ID NO:8), IgG2 (SEQ ID NO:9), IgG3 (SEQ ID NO:10), 및 IgG4 (SEQ ID NO:11)의 아미노산 서열이 상기에 제시된다.
Fc 도메인의 변형은 변경된 표현형, 예를 들어 변경된 혈청 반감기, 변경된 안정성, 세포 효소들에 대한 변경된 민감성 또는 변경된 이펙터 기능으로 이어질 수 있다. 그러므로 본 발명의 Fc 도메인-함유 결합 분자를 이펙터 기능과 관련하여, 예를 들어 암 치료에 그런 분자의 유효성을 향상시키기 위하여 변형시키는 것이 바람직할 수 있다. Fc 도메인-매개된 이펙터 기능의 감소 또는 제거는 특정 경우에, 예를 들어 작용 메커니즘이 차단 또는 길항작용을 포함하지만, 세포들의 사멸은 표적 항원을 포함하는 항체들의 경우에 바람직하다. 증가된 이펙터 기능은 FcγR이 저수준으로 발현되는 바람직하지 못한 세포, 예컨대 종양 및 외래 세포, 예를 들어 저수준의 FcγRIIB를 가지는 종양-특이적 B 세포 (예컨대 비-호지킨 림프종, CLL, 및 버킷 림프종)에 대해 지시될 때 바람직하다. 그런 부여된 또는 변경된 이펙터 기능 활성을 가지는 발명의 분자들은 이펙터 기능 활성의 향상된 효능이 바람직한 질환, 장애 또는 감염의 치료 및/또는 예방에 유용하다.
따라서, 특정 구체예에서, 본 발명의 Fc 도메인-함유 분자들의 Fc 도메인은 엔지니어링된 변종 Fc 도메인일 수 있다. 본 발명의 이중특이적 Fc 도메인-함유 분자들의 Fc 도메인이 하나 이상의 Fc 수용체 (예컨대, FcγR(들))에 결합하는 능력을 가질 수 있긴 하지만, 보다 바람직하게는 그런 변종 Fc 도메인은 변경된 결합 FcγRIA (CD64), FcγRIIA (CD32A), FcγRIIB (CD32B), FcγRIIIA (CD16a) 또는 FcγRIIIB (CD16b) (야생형 Fc 도메인에 의해 나타나는 결합에 비해)을 가지며, 예컨대 향상된 결합 활성화 수용체를 가지거나 및/또는 억제 수용체(들)에 대한 실질적으로 감소된 결합 능력을 가지거나 결합 능력을 갖지 않을 것이다. 그러므로, 본 발명의 Fc 도메인-함유 분자들의 Fc 도메인은 완전한 Fc 도메인의 CH2 도메인의 일부 또는 전부 및/또는 CH3 도메인의 일부 또는 전부를 포함하거나, 또는 변종 CH2 및/또는 변종 CH3 서열 (예를 들어, 완전한 Fc 도메인의 CH2 또는 CH3 도메인과 관련하여 하나 이상의 삽입 및/또는 하나 이상의 결실을 포함할 수 있음)을 포함할 수 있다. 그러한 Fc 도메인은 비-Fc 폴리펩타이드 부분을 포함할 수 있거나, 비-자연적인 완전한 Fc 도메인의 부분들을 포함할 수 있거나, 또는 CH2 및/또는 CH3 도메인의 비-자연 발생적인 배향 (예컨대, 2개의 CH2 도메인 또는 2개의 CH3 도메인, 또는 N-말단에서 C-말단으로, CH2 도메인에 결합된 CH3 도메인, 등)을 포함할 수 있다.
결합 활성화 수용체 (예컨대, FcγRIIA (CD16A))를 증가시키고 결합 억제 수용체 (예컨대, FcγRIIB (CD32B))를 감소시키는 변형을 포함하여, 이펙터 기능을 변경시키는 것으로서 확인된 Fc 도메인 변형들이 당업계에 알려져 있다 (예컨대, Stavenhagen, J.B. et al. (2007) "Fc Optimization Of Therapeutic Antibodies Enhances Their Ability To Kill Tumor Cells In Vitro 및 Controls Tumor Expansion In Vivo Via Low-Affinity Activating Fcgamma Receptors", Cancer Res. 57(18):8882-8890 참조). 표 4는 결합 활성화 수용체를 증가시키거나 및/또는 결합 억제 수용체를 감소시키는 예시의 변형의 예시의 단일, 이중, 삼중, 사중 및 오중 치환 (넘버링 (EU 인덱스에 따름) 및 치환은 상기 제시된 것과 같이 SEQ ID NO:8의 아미노산 서열에 관련됨)을 열거한다.
| 바람직한 활성화 Fc 도메인들의 변이† | |||
| 단일-부위 변이 | |||
| F243L | R292G | D270E | R292P |
| Y300L | P396L | ||
| 이중-부위 변이 | |||
| F243L 및 R292P | F243L 및 Y300L | F243L 및 P396L | R292P 및 Y300L |
| D270E 및 P396L | R292P 및 V305I | P396L 및 Q419H | P247L 및 N421K |
| R292P 및 P396L | Y300L 및 P396L | R255L 및 P396L | R292P 및 P305I |
| K392T 및 P396L | |||
| 삼중-부위 변이 | |||
| F243L, P247L 및 N421K | P247L, D270E 및 N421K | ||
| F243L, R292P 및 Y300L | R255L, D270E 및 P396L | ||
| F243L, R292P 및 V305I | D270E, G316D 및 R416G | ||
| F243L, R292P 및 P396L | D270E, K392T 및 P396L | ||
| F243L, Y300L 및 P396L | D270E, P396L 및 Q419H | ||
| V284M, R292L 및 K370N | R292P, Y300L 및 P396L | ||
| 사중-부위 변이 | |||
| L234F, F243L, R292P 및 Y300L | F243L, P247L, D270E 및 N421K | ||
| L234F, F243L, R292P 및 Y300L | F243L, R255L, D270E 및 P396L | ||
| L235I, F243L, R292P 및 Y300L | F243L, D270E, G316D 및 R416G | ||
| L235Q, F243L, R292P 및 Y300L | F243L, D270E, K392T 및 P396L | ||
| P247L, D270E, Y300L 및 N421K | F243L, R292P, Y300L, 및 P396L | ||
| R255L, D270E, R292G 및 P396L | F243L, R292P, V305I 및 P396L | ||
| R255L, D270E, Y300L 및 P396L | F243L, D270E, P396L 및 Q419H | ||
| D270E, G316D, P396L 및 R416G | |||
| 오중-부위 변이 | |||
| L235V, F243L, R292P, Y300L 및 P396L | F243L, R292P, V305I, Y300L 및 P396L | ||
| L235P, F243L, R292P, Y300L 및 P396L | |||
| † 넘버링은 Kabat에서와 같이 EU 인덱스를 따름 | |||
감소된 결합 CD32B 및/또는 증가된 결합 CD16A를 가지는 인간 IgG1 Fc 도메인의 예시의 변종은 F243L, R292P, Y300L, V305I 또는 P296L 치환을 함유한다. 이 아미노산 치환들은 인간 IgG1 Fc 도메인에서 임의의 조합으로 존재할 수 있다. 한 구체예에서, 변종 인간 IgG1 Fc 도메인은 F243L, R292P 및 Y300L 치환을 함유한다. 다른 구체예에서, 변종 인간 IgG1 Fc 도메인은 F243L, R292P, Y300L, V305I 및 P296L 치환을 함유한다.
특정 구체예에서, 본 발명의 Fc 도메인-함유 분자들의 Fc 도메인은 감소된 (또는 실질적으로는 없는) 결합 FcγRIA (CD64), FcγRIIA (CD32A), FcγRIIB (CD32B), FcγRIIIA (CD16a) 또는 FcγRIIIB (CD16b) (야생형 IgG1 Fc 도메인 (SEQ ID NO:8)에 의해 나타난 결합에 비해)를 나타내는 것이 바람직하다. 특정 구체예에서, 본 발명의 Fc 도메인-함유 분자들은 감소된 ADCC 이펙터 기능을 나타내는 IgG Fc 도메인을 포함한다. 바람직한 구체예에서, 그러한 결합 분자들의 CH2-CH3 도메인은 치환: L234A, L235A, D265A, N297Q, 및 N297G 중에서 임의로 1, 2, 3, 또는 4개를 포함한다. 다른 구체예에서, CH2-CH3 도메인은 N297Q 치환, N297G 치환, L234A 및 L235A 치환 또는 D265A 치환을 함유하고, 이 돌연변이들은 FcR 결합을 제거한다. 대안적으로, 감소된 (또는 실질적으로는 없는) 결합 FcγRIIIA (CD16a) 및/또는 감소된 이펙터 기능 (야생형 IgG1 Fc 도메인 (SEQ ID NO:8)에 의해 나타난 결합 및 이펙터 기능에 비해)을 고유하게 나타내는 자연 발생적인 Fc 도메인의 CH2-CH3 도메인이 이용된다. 특정 구체예에서, 본 발명의 Fc 도메인-함유 분자들은 IgG2 Fc 도메인 (SEQ ID NO:9) 또는 IgG4 Fc 도메인 (SEQ ID NO:11)을 포함한다. IgG4 Fc 도메인이 이용될 때, 본 발명은 또한 안정화 돌연변이, 예컨대 상기 기술된 힌지 영역 S228P 치환 (예컨대, SEQ ID NO:7 참조)의 도입을 포함한다. N297G, N297Q, L234A, L235A 및 D265A 치환이 이펙터 기능을 제거하기 때문에, 이펙터 기능이 바람직한 상황에서, 이 치환들은 바람직하게는 사용되지 않을 것이다.
감소된 또는 제거된 이펙터 기능을 가지는 본 발명의 Fc 도메인-함유 분자들의 CH2 및 CH3 도메인에 대한 바람직한 IgG1 서열은 치환 L234A/L235A를 포함할 것이다 (SEQ ID NO:41):
APE AA GGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVKFNWYVD GVEVHNAKTK
PREEQYNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKALPA PIEKTISKAK GQPREPQVYT
LPPSREEMTK NQVSLTCLVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFLYSKL
TVDKSRWQQG NVFSCSVMHE ALHNHYTQKS LSLSPG X
여기서, X는 리신 (K)이거나 없다.
Fc 도메인을 포함하는 단백질의 혈청 반감기는 FcRn에 대한 Fc 도메인의 결합 친화성을 증가시킴으로써 증가될 수 있다. 본원에서 사용되는 용어 "반감기"는 분자들의 투여 후 평균 생존 시간의 척도인, 분자의 약물동역학적 특성을 의미한다. 반감기는 대상체의 신체 (예컨대 인간 환자 또는 다른 포유류) 또는 그것의 특정 구획으로부터 예를 들어, 혈청에서, 즉 순환 반감기로, 또는 다른 조직에서 측정되는 바와 같이, 분자의 공지된 양의 50 퍼센트 (50%)를 제거하는 데 필요한 시간으로서 표시될 수 있다. 일반적으로, 반감기의 증가는 투여된 분자에 대한 순환계에서의 평균 체류 시간 (MRT)의 증가를 초래한다.
일부 구체예에서, 본 발명의 Fc 도메인-함유 결합 분자들은 야생형 Fc 도메인에 비해 적어도 하나의 아미노산 변형을 포함하는 변종 Fc 도메인을 포함하여서, 분자는 증가된 반감기 (야생형 Fc 도메인을 포함한다면 그런 분자와 비교하여)를 가진다. 일부 구체예에서, 본 발명의 Fc 도메인-함유 결합 분자들은 238, 250, 252, 254, 256, 257, 256, 265, 272, 286, 288, 303, 305, 307, 308, 309, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424, 428, 433, 434, 435, 및 436으로 구성되는 군으로부터 선택된 하나 이상의 위치에서 반감기 연장 아미노산 치환을 포함한다. Fc 도메인-함유 분자의 반감기를 증가시킬 수 있는 많은 돌연변이가 당업계에 알려져 있고, 예를 들어 M252Y, S254T, T256E, 및 그것들의 조합을 포함한다. 예를 들어, 미국 특허 번호 6,277,375, 7,083,784; 7,217,797, 8,088,376; 미국 공개공보 번호 2002/0147311; 2007/0148164; 및 PCT 공개공보 번호 WO 98/23289; WO 2009/058492; 및 WO 2010/033279 (이것들은 본원에 그 전문이 참조로 포함됨)에서 기술된 돌연변이들을 참조한다.
일부 구체예에서, 향상된 반감기를 나타내는 본 발명의 Fc 도메인-함유 결합 분자들은 도메인 잔기 250, 252, 254, 256, 257, 288, 307, 308, 309, 311, 378, 428, 433, 434, 435 및 436 중 둘 이상에서의 치환을 포함하는 변종 Fc 도메인을 가진다. 특히, 둘 이상의 치환은 T250Q, M252Y, S254T, T256E, K288D, T307Q, V308P, A378V, M428L, N434A, H435K, 및 Y436I로부터 선택된다. 특정 구체예에서, 그러한 분자들은 다음의 치환을 포함하는 변종 IgG Fc 도메인을 가질 수 있다:
(A)
M252Y, S254T 및 T256E;
(B)
M252Y 및 S254T;
(C)
M252Y 및 T256E;
(D)
T250Q 및 M428L;
(E)
T307Q 및 N434A;
(F)
A378V 및 N434A;
(G)
N434A 및 Y436I;
(H)
V308P 및 N434A; 또는
(I)
K288D 및 H435K.
바람직한 구체예에서, 본 발명의 Fc 도메인-함유 결합 분자들은 치환: M252Y, S254T 및 T256E 중 임의로 1, 2 또는 3개의 치환을 포함하는 변종 IgG Fc 도메인을 가진다. 발명은 다음을 포함하는 변종 Fc 도메인을 가지는 그러한 결합 분자들을 추가로 포함한다:
(A) 이펙터 기능 및/또는 FcγR 결합을 변경시키는 하나 이상의 돌연변이; 및
(B) 혈청 반감기를 연장시키는 하나 이상의 돌연변이.
상이한 아미노산 서열의 Fc-도메인-함유 폴리펩타이드 사슬들 (예컨대 그것의 Fc 도메인-함유 제 1 및 제 3 폴리펩타이드 사슬이 동일하지 않은 것이 바람직함)을 가지는 것이 바람직한 특정 항체, 디아바디 및 삼가 결합 분자에 대해, 2개의 제 1 폴리펩타이드 사슬의 CH2-CH3 도메인 사이에서 또는 2개의 제 3 폴리펩타이드 사슬의 CH2-CH3 도메인 사이에서 호모다이머화가 발생하는 것이 감소되거나 방지되는 것이 바람직하다. 그러한 폴리펩타이드 사슬의 CH2 및/또는 CH3 도메인은 서열이 동일할 필요가 없고, 유익하게는 두 개의 폴리펩타이드 사슬 사이에서 복합체가 형성되는 것을 조성하기 위해 변형된다. 예를 들어, 아미노산 치환 (바람직하게는 "손잡이(knob)"를 형성하는 벌키한 측면 기를 포함하는 아미노산, 예컨대 트립토판으로의 치환)은 CH2 또는 CH3 도메인에 도입되어서 그 입체적인 간섭이 유사하게 돌연변이된 도메인과의 상호작용을 방지하고 돌연변이된 도메인이 상보성, 또는 수용적인 돌연변이 (예컨대 글리신으로의 치환)가 그 안으로 엔지니어링되어 있는 도메인과 쌍을 이루도록, 즉 "구멍(hole)"을 이루도록 강요하게 될 것이다. 그러한 돌연변이 세트는 헤테로다이머화를 조성하기 위하여 Fc 도메인을 형성하는 CH2-CH3 도메인을 포함하는 임의의 폴리펩타이드 쌍으로 엔지니어링될 수 있다. 호모다이머화보다 헤테로다이머화를 선호하도록 단백질을 엔지니어링하는 방법들은, 특히 면역글로불린-유사 분자들의 엔지니어링과 관련하여 업계에 잘 알려져 있고, 본원에 포함된다 (예컨대, Ridgway et al. (1996) "'Knobs-Into-Holes' Engineering Of Antibody CH3 Domains For Heavy Chain Heterodimerization", Protein Engr. 9:617-621, Atwell et al. (1997) "Stable Heterodimers From Remodeling The Domain Interface Of A Homodimer Using A Phage Display Library", J. Mol. Biol. 270: 26-35, 및 Xie et al. (2005) "A New Format Of Bispecific Antibody: Highly Efficient Heterodimerization, Expression And Tumor Cell Lysis", J. Immunol. Methods 296:95-101; 상기 문헌들은 각각 본원에 그 전문이 참조로 포함됨).
바람직한 손잡이는 변형 T366W를 함유하도록 IgG Fc 도메인 을 변형시킴으로써 생성된다. 바람직한 구멍은 변형 T366S, L368A 및 Y407V를 함유하도록 IgG Fc 도메인 을 변형시킴으로써 생성된다. 구멍-포함 제 3 폴리펩타이드 사슬 호모다이머를 최종 이중특이적 헤테로다이머 Fc 도메인-함유 분자로부터 정제하는 것을 보조하기 위하여, 제 3 폴리펩타이드 사슬의 구멍-포함 CH2 및 CH3 도메인의 단백질 A 결합 부위가 바람직하게 위치 435에서 아미노산 치환 (H435R)에 의해 돌연변이된다. 그러므로, 구멍-포함 제 3 폴리펩타이드 사슬 호모다이머는 단백질 A에 결합하지 않는 반면, 이중특이적 헤테로다이머는 제 1 폴리펩타이드 사슬 상의 단백질 A 결합 부위를 통해 단백질 A에 결합하는 능력을 보유할 것이다. 대체 구체예에서, 구멍-포함 제 3 폴리펩타이드 사슬은 위치 434 및 435에서 아미노산 치환 (N434A/N435K)을 포함할 수 있다.
본 발명의 Fc 도메인-함유 분자의 제 1 폴리펩타이드 사슬의 CH2 및 CH3 도메인에 대한 바람직한 IgG 아미노산 서열은 "손잡이-포함" 서열을 가질 것이다 (SEQ ID NO:42):
APE AA GGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVKFNWYVD GVEVHNAKTK
PREEQYNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKALPA PIEKTISKAK GQPREPQVYT
LPPSREEMTK NQVSL W CLVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFLYSKL
TVDKSRWQQG NVFSCSVMHE ALHNHYTQKS LSLSPG X
여기서, X는 리신 (K)이거나 없다.
2개의 폴리펩타이드 사슬을 가지는 본 발명의 Fc 도메인-함유 분자의 제 2 폴리펩타이드 사슬 (또는 3, 4, 또는 5개의 폴리펩타이드 사슬을 가지는 Fc 도메인-함유 분자의 제 3 폴리펩타이드 사슬)의 CH2 및 CH3 도메인에 대한 바람직한 IgG 아미노산 서열은 "구멍-포함" 서열을 가질 것이다 (SEQ ID NO:43):
APE AA GGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVKFNWYVD GVEVHNAKTK
PREEQYNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKALPA PIEKTISKAK GQPREPQVYT
LPPSREEMTK NQVSL S C A VK GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFL V SKL
TVDKSRWQQG NVFSCSVMHE ALHN R YTQKS LSLSPG X
여기서, X는 리신 (K)이거나 없다.
주지될 것과 같이, SEQ ID NO:42, 및 SEQ ID NO:43 의 CH2-CH3 도메인은 위치 234에서 알라닌으로의 치환, 및 235에서 알라닌으로의 치환을 포함하고, 그러므로 감소된 (또는 실질적으로는 없는) 결합 FcγRIA (CD64), FcγRIIA (CD32A), FcγRIIB (CD32B), FcγRIIIA (CD16a) 또는 FcγRIIIB (CD16b) (야생형 Fc 도메인 (SEQ ID NO:8)에 의해 나타난 결합에 비교하여)를 나타내는 Fc 도메인이 형성된다. 발명은 또한 야생형 알라닌 잔기, Fc 도메인의 이펙터 기능 및/또는 FγR 결합 활성을 변형시키는 대체 및/또는 추가적인 치환을 포함하는, 그러한 CH2-CH3 도메인을 포함한다. 발명은 또한 추가로 하나 이상의 반감기 연장 아미노산 치환을 포함하는, 그러한 CH2-CH3 도메인을 포함한다. 특히, 발명은 추가로 M252Y/S254T/T256E를 포함하는 그러한 구멍-포함 및 손잡이-포함 CH2-CH3 도메인들을 포함한다.
제 1 폴리펩타이드 사슬은 "손잡이-포함" CH2-CH3 서열, 예컨대 SEQ ID NO:42의 서열을 가지는 것이 바람직하다. 그러나, 인지하게 되는 것과 같이, "구멍-포함" CH2-CH3 도메인 (예컨대, SEQ ID NO:43이 제 1 폴리펩타이드 사슬에 사용될 수 있을 것이고, 그 경우에, "손잡이-포함" CH2-CH3 도메인 (예컨대, SEQ ID NO:42)은 2개의 폴리펩타이드 사슬을 가지는 본 발명의 Fc 도메인-함유 분자의 제 2 폴리펩타이드 사슬에 (또는 3, 4, 또는 5개의 폴리펩타이드 사슬을 가지는 Fc 도메인-함유 분자의 제 3 폴리펩타이드 사슬에) 사용될 수 있을 것이다.
다른 구체예에서, 발명은 당업계에 공지되어 있는 돌연변이, 예컨대 PCT 공개공보 번호 WO 2007/110205; WO 2011/143545; WO 2012/058768; WO 2013/06867 (모두 그 전문이 본원에 참조로 포함됨)에 개시되어 있는 것들을 사용하여 호모다이머화보다 헤테로다이머화를 선호하도록 엔지니어링되어 있는 CH2 및/또는 CH3 도메인을 포함하는 Fc 도메인-함유 결합 분자를 포함한다.
IV. Fc 도메인을 포함하는 삼가 결합 분자들
본 발명의 추가의 구체예는 제 1 에피토프, a 제 2 에피토프 및 a 제 3 에피토프에 동시에 결합할 수 있는 Fc 도메인을 포함하는 삼가 결합 분자들에 관한 것으로, 이때 그런 에피토프들 중 적어도 하나는 서로 동일하지 않다. 그러한 삼기 결합 분자는 3개의 에피토프-결합 도메인을 포함하고, 그중 두 개는 디아바디-형 결합 도메인으로, 결합 부위 A 및 결합 부위 B를 제공하며, 하나는 Fab-형 결합 도메인, 또는 scFv-형 결합 도메인으로, 결합 부위 C를 제공한다 (예컨대, 도 6A-6F, PCT 공개공보 번호 WO 2015/184207 및 WO 2015/184203 참조). 그러한 삼가 결합 분자들은 따라서 그러한 삼기 결합 분자의 제 1 에피토프에 결합할 수 있는 "VL1" / "VH1" 도메인 및 제 2 에피토프에 결합할 수 있는 "VL2" / "VH2" 도메인 및 제 3 에피토프에 결합할 수 있는 "VL3" / "VH3" 도메인을 포함한다. "디아바디-형 결합 도메인"은 상기에서 기술된 것과 같이, 디아바디에 존재하는 에피토프-결합 부위 유형이다. "Fab-형 결합 도메인" 및 "scFv-형 결합 도메인"의 각각은 면역글로불린 경쇄의 VL 도메인과 면역글로불린 중쇄의 상보하는 VH 도메인의 상호작용에 의해 형성된 에피토프-결합 도메인이다. Fab-형 결합 도메인은 Fab-형 결합 도메인을 형성하는 2개의 폴리펩타이드 사슬이 단지 단일 에피토프-결합 부위만을 포함하는 반면, 디아바디-형 결합 도메인을 형성하는 2개의 폴리펩타이드 사슬이 적어도 2개의 에피토프-결합 도메인을 포함한다는 점에서 디아바디-형 결합 도메인과 상이하다. 유사하게, scFv-형 결합 도메인은 또한 그것이 단일 에피토프-결합 부위만을 포함한다는 점에서 디아바디-형 결합 도메인과 상이하다. 그러므로, 본원에서 사용되는 것과 같이, Fab-형, 및 scFv-형 결합 도메인은 디아바디-형 결합 도메인과 구별된다.
전형적으로, 본 발명의 삼가 결합 분자들은 4개의 상이한 폴리펩타이드 사슬을 포함하겠지만 (도 6A-6B 참조), 분자들은, 예를 들어 그런 폴리펩타이드 사슬을 서로 융합시킴으로써 (예컨대 펩타이드 결합을 통해) 또는 그러한 폴리펩타이드 사슬을 나누어 추가적인 폴리펩타이드 사슬을 형성함으로써, 또는 더 작은 또는 추가적인 폴리펩타이드 사슬을 이황화 결합을 통해 회합시킴으로써 더 적거나 더 큰 수의 폴리펩타이드 사슬을 포함할 수 있다. 도 6C 내지 6F는 이런 본 발명의 측면을 3개의 폴리펩타이드 사슬을 가지는 그런 분자들을 개략적으로 묘사함으로써 예시한다. 도 6A 내지 6F에 제시된 것과 같이, 본 발명의 삼가 결합 분자들은 디아바디-형 결합 도메인이 Fc 도메인에 대해 N-말단에 있거나 (도 6A, 6C 및 6D) 또는 C-말단에 있는 (도 6B, 6E 및 6F) 대체 배향을 가질 수 있다. 삼가 결합 분자의 생성에 유용한 CH2 및 CH3 도메인은 상기에서 제공되고 손잡이-포함 및 구멍-포함 도메인을 포함한다.
특정 구체예에서, 본 발명의 그러한 삼가 결합 분자들의 제 1 폴리펩타이드 사슬은 (i) VL1-함유 도메인, (ii) VH2-함유 도메인, (iii) 헤테로다이머-촉진 도메인, 및 (iv) CH2-CH3 서열을 함유하는 도메인을 함유한다. VL1 및 VL2 도메인은 표 4 (또한, 도 6A 및 6B 참조)에 제시된 것과 같이 CH2-CH3-함유 도메인에 대해 N-말단 또는 C-말단에 위치한다. 그런 구체예들의 제 2 폴리펩타이드 사슬은 (i) VL2-함유 도메인, (ii) VH1-함유 도메인, 및 (iii) 헤테로다이머-촉진 도메인을 함유한다. 그런 구체예들의 제 3 폴리펩타이드 사슬은 (i) VH3-함유 도메인, (ii) CH1-함유 도메인 및 (iii) CH2-CH3 서열을 함유하는 도메인을 함유한다. 제 3 폴리펩타이드 사슬은 VH3 및 중쇄 불변 영역을 함유하는 항체의 중쇄, 또는 그런 도메인을 함유하는 폴리펩타이드일 수 있다. 그러한 구체예의 제 4 폴리펩타이드는 (i) VL3-함유 도메인 및 (ii) CL-함유 도메인을 함유한다. 제 4 폴리펩타이드 사슬은 제 3 폴리펩타이드 사슬의 VH3에 상보하는 VL3을 함유하는 항체의 경쇄, 또는 그러한 도메인을 함유하는 폴리펩타이드일 수 있다. 제 3 또는 제 4 폴리펩타이드 사슬은 자연적으로 발생하는 항체로부터 분리될 수 있다. 대안적으로, 그것들은 재조합에 의해, 합성에 의해 또는 다른 수단에 의해 구성될 수 있다.
제 1 및 제 2 폴리펩타이드 사슬의 경쇄 가변 도메인은, VL1/VH2 (또는 그것들의 VL2/VH1) 도메인이 제 1 또는 제 2 에피토프 중 어느 하나에 결합할 수 있는 에피토프-결합 부위를 형성하기 위하여 함께 회합하는 것을 허용하기에는 너무 짧은 길이를 가지는 개입 스페이서 펩타이드에 의하여, 그러한 폴리펩타이드 사슬의 중쇄 가변 도메인으로부터 분리된다. 이 목적에 바람직한 개입 스페이서 펩타이드 (링커 1)는 서열 (SEQ ID NO:14): GGGSGGGG를 가진다. 삼가 결합 분자의 다른 도메인은 선택적으로 시스테인 잔기를 포함하는 하나 이상의 개입 스페이서 펩타이드에 의해 분리될 수 있다. 특히, 상기에서 제공된 것과 같이, 그러한 링커들은 전형적으로 가변 도메인 (즉, VH 또는 VL)과 펩타이드 헤테로다이머-촉진 도메인 (예컨대, E-코일 K-코일) 사이에 및 그러한 펩타이드 헤테로다이머-촉진 도메인 (예컨대, E-코일 K-코일)과 CH2-CH3 도메인 사이에 통합될 것이다. 삼가 결합 분자들의 생성에 유용한 예시의 링커들은 상기에서 제공되며 또한 PCT 출원 번호 PCT/US15/33081; 및 PCT/US15/33076에도 제공되어 있다. 그러므로, 그러한 삼가 결합 분자의 제 1 및 제 2 폴리펩타이드 사슬은 제 1 에피토프에 결합할 수 있는 VL1/VH1 결합 부위, 뿐만 아니라 제 2 에피토프에 결합할 수 있는 VL2/VH2 결합 부위를 형성하기 위해 함께 회합된다. 그러한 삼가 결합 분자의 제 3 및 제 4 폴리펩타이드 사슬은 제 3 에피토프에 결합할 수 있는 VL3/VH3 결합 부위를 형성하기 위하여 함께 회합된다.
상기에서 기술된 것과 같이, 본 발명의 삼가 결합 분자는 3개의 폴리펩타이드를 포함할 수 있다. 3개의 폴리펩타이드를 포함하는 삼가 결합 분자는 제 3 폴리펩타이드의 VH3-함유 도메인에 대해 N-말단으로 제 4 폴리펩타이드의 도메인들을 결합시킴으로써 (예컨대, 개입 스페이서 펩타이드 (링커 4)를 사용하여) 얻어질 수 있다. 대안적으로, 다음의 도메인: (i) VL3-함유 도메인, (ii) VH3-함유 도메인, 및 (iii) CH2-CH3 서열을 함유하는 CH2-CH3 도메인을 함유하는 발명의 삼가 결합 분자의 제 3 폴리펩타이드 사슬이 이용되고, 여기서 VL3 및 VH3은 에피토프-결합 부위를 형성하기 위하여 이 도메인들의 회합을 허용하기 위해 충분히 긴 (적어도 9개 이상의 아미노산 잔기) 개입 스페이서 펩타이드에 의해 서로 떨어져 있다. 이 목적에 대해 하나의 바람직한 개입 스페이서 펩타이드는 서열: GGGGSGGGGSGGGGS (SEQ ID NO:44)를 가진다.
그러한 삼가 결합 분자들의 VL1/VH1, VL2/VH2, 및 VL3/VH3 도메인은 단일특이적, 이중특이적 또는 삼중특이적인 결합을 허용하기 위하여 상이할 수 있다. 특히, VL 및 VH 도메인은 삼가 결합 분자가 제 1 에피토프에 대한 2개의 결합 부위 및 제 2 에피토프에 대한 하나의 결합 부위, 또는 제 1 에피토프에 대한 하나의 결합 부위 및 제 2 에피토프에 대한 2개의 결합 부위, 또는 제 1 에피토프에 대한 하나의 결합 부위, 제 2 에피토프에 대한 하나의 결합 부위 및 제 3 에피토프에 대한 하나의 결합 부위를 포함하도록 선택될 수 있다.
발명의 대표적인 삼가 결합 분자들의 폴리펩타이드 사슬들의 일반적인 구조가 도 6A-6F 및 표 5에 제시된다:
| 4개 사슬 제 1 방향 |
제 2 사슬 | NH2-VL2-VH1-HPD-COOH |
| 제 1 사슬 | NH2-VL1-VH2-HPD-CH2-CH3-COOH | |
| 제 3 사슬 | NH2-VH3-CH1-CH2-CH3-COOH | |
| 제 2 사슬 | NH2-VL3-CL-COOH | |
| 4개 사슬 제 2 방향 |
제 2 사슬 | NH2-VL2-VH1-HPD-COOH |
| 제 1 사슬 | NH2-CH2-CH3-VL1-VH2-HPD-COOH | |
| 제 3 사슬 | NH2-VH3-CH1-CH2-CH3-COOH | |
| 제 2 사슬 | NH2-VL3-CL-COOH | |
| 3개 사슬 제 1 방향 |
제 2 사슬 | NH2-VL2-VH1-HPD-COOH |
| 제 1 사슬 | NH2-VL1-VH2-HPD-CH2-CH3-COOH | |
| 제 3 사슬 | NH2-VL3-VH3-HPD-CH2-CH3-COOH | |
| 3개 사슬 제 2 방향 |
제 2 사슬 | NH2-VL2-VH1-HPD-COOH |
| 제 1 사슬 | NH2-CH2-CH3-VL1-VH2-HPD-COOH | |
| 제 3 사슬 | NH2-VL3-VH3-HPD-CH2-CH3-COOH |
HPD = 헤테로다이머-촉진 도메인
상기에서 제공된 것과 같이, 그러한 삼가 결합 분자들은 3, 4, 5개, 또는 그 이상의 폴리펩타이드 사슬을 포함할 수 있다.
V. 발명의 구체예
상기에서 진술된 것과 같이, 본 발명은
(1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자; 및
(2) 표적 세포의 재지정된 사멸을 매개할 수 있는 분자 (예컨대, 디아바디, BiTe, 이중특이적 항체, 등)
의 투여를 포함하는 암의 치료를 위한 조합 치료법에 관한 것이다.
본원에서 사용되는 용어 "투여"는 PD-1 또는 PD-1의 천연 리간드의 결합, 및 표적 세포 (예컨대, 암 세포 또는 병원체-감염 세포)의 재지정된 사멸을 모두 수령체에게 제공하기 위하여 관련된 투여량으로 및 시간적으로 근접하게 그러한 분자들을 제공하는 것에 관련된다.
PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자와 관련하여, 발명은 특히 그러한 분자가 PD-1의 억제 활성을 억제 (즉 차단 또는 간섭)하기 위하여 PD-1의 에피토프에 면역특이적으로 결합하는 능력을 갖는 구체예에 관련된다. 예를 들어, 그러한 분자는 PD-1에 결합할 수 있음으로써 세포 신호전달을 억제하거나 및/또는 PD-1과 PD-1의 천연 리간드 사이의 결합을 억제할 수 있다. 대안적으로, 그러한 분자는 그러한 천연 리간의 억제 활성을 억제 (즉 차단 또는 간섭)하기 위하여 PD-1의 천연 리간드 (예컨대, B7-H1 또는 B7-DC)에 결합할 수 있다. 예를 들어, 그러한 분자는 세포 신호전달 및/또는 그런 리간드와 PD-1 사이의 결합을 억제하기 위하여 PD-1의 천연 리간드에 결합할 수 있다. 한 구체예에서, 그러한 분자들은 단지 단일 에피토프 (예컨대, PD-1의 에피토프 또는 PD-1의 천연 리간드의 에피토프)에 결합하는 능력을 갖기 위해 단일특이적일 것이다. 대안적으로, 그러한 분자들은 다중특이적일 수 있는데, 즉 PD-1의 둘, 또는 둘 이상의 에피토프 (예컨대, PD-1의 2, 3, 4개, 또는 4개 이상의 에피토프)에 결합할 수 있거나, 또는 PD-1의 하나 이상의 천연 리간드(들)의 둘, 또는 둘 이상 (예컨대 2, 3, 4개 또는 4개 이상)의 에피토프에 결합할 수 있거나, 또는 PD-1의 적어도 하나의 에피토프 및 PD-1의 천연 리간드의 적어도 하나의 에피토프에 결합할 수 있다. 대안적으로, 그러한 다중특이적 분자들은 PD-1의 적어도 하나의 에피토프에 결합할 수 있고 PD-1이 아닌 상이한 분자의 적어도 하나의 에피토프에 결합할 수 있거나, 또는 PD-1의 천연 리간드의 적어도 하나의 에피토프 및 PD-1의 천연 리간드가 아닌 상이한 분자의 적어도 하나의 에피토프에 결합할 수 있다. 바람직하게, 상이한 분자의 에피토프는 면역 세포의 표면에 존재하는 면역 체크포인트를 조절하는 데 포함된 분자의 에피토프이다 (예컨대, B7-H3, B7-H4, BTLA, CD40, CD40L, CD47, CD70, CD80, CD86, CD94, CD137, CD137L, CD226, CTLA-4, 갈렉틴-9, GITR, GITRL, HHLA2, ICOS, ICOSL, KIR, LAG-3, LIGHT, MHC 부류 I 또는 II, NKG2a, NKG2d, OX40, OX40L, PD1H, PVR, SIRPa, TCR, TIGIT, TIM-3 또는 VISTA, 및 특히 CD137, LAG-3, OX40, TIGIT, TIM-3, 또는 VISTA, 예를 들어 PCT 공개공보 번호 WO 2015/200119 및 WO 2011/159877 참조). 그러므로, 예를 들어, 그런 분자는
(1) PD-1의 단일 에피토프;
(2) PD-1의 둘 이상의 에피토프;
(3) PD-1의 천연 리간드의 단일 에피토프;
(4) 동일한 PD-1의 천연 리간드의 둘 이상의 에피토프;
(5) 제 1 PD-1의 천연 리간드의 에피토프 및 제 2 PD-1의 천연 리간드의 에피토프;
(6) 제 1 PD-1의 천연 리간드의 둘 이상의 에피토프 및 제 2 PD-1의 천연 리간드의 하나 이상의 에피토프;
(7) PD-1의 하나 이상의 에피토프 및 PD-1의 천연 리간드의 하나 이상의 에피토프;
(8) PD-1의 하나 이상의 에피토프 및 상이한 분자의 하나 이상의 에피토프; 또는
(9) PD-1의 천연 리간드의 하나 이상의 에피토프 및 상이한 분자의 하나 이상의 에피토프에 결합할 수 있다.
표적 세포 (예컨대, 암 세포 또는 병원체-감염 세포)의 재지정된 사멸을 매개할 수 있는 본 발명의 분자들과 관련하여, 발명은 특히 그러한 분자가 이펙터 세포의 세포 표면 분자의 에피토프에 면역특이적으로 결합할 수 있는 제 1 에피토프-결합 부위 및 그러한 표적 세포의 표면에 배열되는 질환 항원의 에피토프에 면역특이적으로 결합할 수 있는 제 2 에피토프-결합 부위를 포함하는 구체예에 관련된다. 한 구체예에서, 그러한 분자들은 이펙터 세포의 세포 표면 분자의 단일 에피토프에만 및 표적 세포의 표면에 배열되는 질환 항원의 단일 에피토프에만 결합하는 능력을 갖는다. 대안적으로, 어느 하나 또는 둘 다의 결합 특이성과 관련하여, 그러한 분자들은 이펙터 세포의 세포 표면 분자(들)의 하나, 둘, 또는 둘 이상의 에피토프에 결합할 수 있고, 질환 항원(들)의 하나, 둘, 또는 둘 이상의 에피토프에 결합할 수 있다. 그러므로, 예를 들어, 그러한 분자는 :
(1) 이펙터 세포의 세포 표면 분자의 유일한 단일 에피토프 및 표적 세포의 표면에 배열되는 질환 항원의 단일 에피토프;
(2) 그런 이펙터 세포의 그런 세포 표면 분자의 유일한 단일 에피토프 및 그런 질환 항원의 둘, 또는 둘 이상의 에피토프;
(3) 그런 이펙터 세포의 그런 세포 표면 분자의 유일한 단일 에피토프 및 그런 질환 항원의 하나, 둘, 또는 둘 이상의 에피토프 및 상이한 질환 항원의 하나, 둘, 또는 둘 이상의 에피토프;
(4) 그런 이펙터 세포의 그런 세포 표면 분자의 둘, 또는 둘 이상의 에피토프 및 표적 세포의 표면에 배열되는 질환 항원의 단일 에피토프;
(5) 그런 이펙터 세포의 그런 세포 표면 분자의 둘, 또는 둘 이상의 에피토프 및 그런 질환 항원의 둘, 또는 둘 이상의 에피토프;
(6) 그런 이펙터 세포의 그런 세포 표면 분자의 둘, 또는 둘 이상의 에피토프 및 그런 질환 항원의 하나, 둘, 또는 둘 이상의 에피토프 및 그런 상이한 질환 항원의 하나, 둘, 또는 둘 이상의 에피토프;
(7) 그런 이펙터 세포의 그런 세포 표면 분자의 하나, 둘, 또는 둘 이상의 에피토프 및 이펙터 세포 (동일한 유형의 이펙터 세포이거나 상이한 유형의 이펙터 세포일 수 있음)의 상이한 세포 표면 분자의 하나, 둘, 또는 둘 이상의 에피토프 및 표적 세포의 표면에 배열되는 질환 항원의 단일 에피토프;
(8) 그런 이펙터 세포의 그런 세포 표면 분자의 하나, 둘, 또는 둘 이상의 에피토프 및 이펙터 세포 (동일한 유형의 이펙터 세포이거나 상이한 유형의 이펙터 세포일 수 있음)의 상이한 세포 표면 분자의 하나, 둘, 또는 둘 이상의 에피토프 및 그런 질환 항원의 둘, 또는 둘 이상의 에피토프; 또는
(9) 그런 이펙터 세포의 그런 세포 표면 분자의 하나, 둘, 또는 둘 이상의 에피토프 및 이펙터 세포 (동일한 유형의 이펙터 세포이거나 상이한 유형의 이펙터 세포일 수 있음)의 상이한 세포 표면 분자의 하나, 둘, 또는 둘 이상의 에피토프 및 그런 질환 항원의 하나, 둘, 또는 둘 이상의 에피토프 및 그런 상이한 질환 항원의 하나, 둘, 또는 둘 이상의 에피토프에 결합할 수 있다.
예로서, 발명은 CD3 (이펙터 세포의 세포 표면 분자로서)의 에피토프에 면역특이적으로 결합할 수 있는 제 1 에피토프-결합 부위; 그런 표적 세포의 표면에 배열되는 질환 항원의 에피토프에 면역특이적으로 결합할 수 있는 제 2 에피토프-결합 부위; 및 CD8 (이펙터 세포의 상이한 세포 표면 분자로서)의 에피토프에 면역특이적으로 결합할 수 있는 제 3 에피토프-결합 부위를 포함하는 결합 분자를 고려한다.
표 6A는 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 발명의 예시의 분자들의 가능한 조합 결합 특이성을 예시한다. 표 6B는 PD-1 또는 PD-1의 천연 리간드 및 PD-1 또는 PD-1의 천연 리간드 이외의 분자에 결합할 수 있는 발명의 예시의 다중특이적 분자들의 가능한 조합 결합 특이성을 예시한다. 표 7은 표적 세포의 재지정된 사멸을 매개할 수 있는 발명의 예시의 분자들의 가능한 조합 RUFGGKQ 특이성을 예시한다.
| 표적 세포의 재지정된 사멸을 매개할 수 있는 발명의 예시의 분자에 의해 인식된 에피토프의 수 |
|||
| 이펙터 세포의 세포 표면 분자 | 질환 항원 | ||
| 제 1 표면 분자 | 제 2 표면 분자 | 제 1 질환 항원 | 제 2 질환 항원 |
| 1 | 0 | 1 | 0 |
| 1 | 0 | 1 | 1 |
| 1 | 0 | 2 | 0 |
| 1 | 0 | 2 | 1 |
| 1 | 0 | 2 | 2 |
| 1 | 0 | >2 | 0 |
| 1 | 0 | >2 | 1 |
| 1 | 0 | >2 | 2 |
| 2 | 0 | 1 | 0 |
| 2 | 0 | 1 | 1 |
| 2 | 0 | 2 | 0 |
| 2 | 0 | 2 | 1 |
| 2 | 0 | 2 | 2 |
| 2 | 0 | >2 | 0 |
| 2 | 0 | >2 | 1 |
| 2 | 0 | >2 | 2 |
| >2 | 0 | 1 | 0 |
| >2 | 0 | 1 | 1 |
| >2 | 0 | 2 | 0 |
| >2 | 0 | 2 | 1 |
| >2 | 0 | 2 | 2 |
| >2 | 0 | >2 | 0 |
| >2 | 0 | >2 | 1 |
| >2 | 0 | >2 | 2 |
| 1 | 1 | 1 | 0 |
| 1 | 1 | 1 | 1 |
| 1 | 1 | 2 | 0 |
| 1 | 1 | 2 | 1 |
| 1 | 1 | 2 | 2 |
| 1 | 1 | >2 | 0 |
| 1 | 1 | >2 | 1 |
| 1 | 1 | >2 | 2 |
| 2 | 1 | 1 | 0 |
| 2 | 1 | 1 | 1 |
| 2 | 1 | 2 | 0 |
| 2 | 1 | 2 | 1 |
| 2 | 1 | 2 | 2 |
| 2 | 1 | >2 | 0 |
| 2 | 1 | >2 | 1 |
| 2 | 1 | >2 | 2 |
| 2 | 2 | 1 | 0 |
| 2 | 2 | 1 | 1 |
| 2 | 2 | 2 | 0 |
| 2 | 2 | 2 | 1 |
| 2 | 2 | 2 | 2 |
| 2 | 2 | >2 | 0 |
| 2 | 2 | >2 | 1 |
| 2 | 2 | >2 | 2 |
| >2 | 1 | 1 | 0 |
| >2 | 1 | 1 | 1 |
| >2 | 1 | 2 | 0 |
| >2 | 1 | 2 | 1 |
| >2 | 1 | 2 | 2 |
| >2 | 1 | >2 | 0 |
| >2 | 1 | >2 | 1 |
| >2 | 1 | >2 | 2 |
| >2 | 2 | 1 | 0 |
| >2 | 2 | 1 | 1 |
| >2 | 2 | 2 | 0 |
| >2 | 2 | 2 | 1 |
| >2 | 2 | 2 | 2 |
| >2 | 2 | >2 | 0 |
| >2 | 2 | >2 | 1 |
| >2 | 2 | >2 | 2 |
| >2 | >2 | 1 | 0 |
| >2 | >2 | 1 | 1 |
| >2 | >2 | 2 | 0 |
| >2 | >2 | 2 | 1 |
| >2 | >2 | 2 | 2 |
| >2 | >2 | >2 | 0 |
| >2 | >2 | >2 | 1 |
| >2 | >2 | >2 | 2 |
그런 추가적인 결합 능력이 PD-1 또는 PD-1의 천연 리간드에 결합하는 것을 억제할 수 있는 분자를 그러한 결합으로부터 방해하지 않고 표적 세포의 재지정된 사멸을 매개할 수 있는 분자를 그러한 재지정된 사멸을 매개하는 것으로부터 방해하지 않는 것 외에 본 발명의 분자들에 의해 결합될 수 있는 에피토프 또는 추가적인 에피토프의 성질에 제한은 없다.
A. PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 예시의 분자
1. PD-1에 면역특이적인 결합 분자들
PD-1에 면역특이적인 항체들은 알려져 있고 본 발명에 따라 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자 (예컨대, 디아바디, scFv, 항체, CAR, TandAb, 등)로서 작용하기 위해 사용되거나 적응될 수 있다 (예컨대, 미국 특허 출원 번호 62/198,867; 62/239,559; 62/255,140, 미국 특허 번호 8,008,449; 8,552,154; PCT 특허 공개공보 WO 2012/135408; WO 2012/145549; 및 WO 2013/014668). PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 바람직한 분자들은 인간 PD-1 (CD279)의 연속적인 또는 불연속적인 (예컨대 입체 형태적인) 부분 (에피토프)에 결합하는 능력을 나타낼 것이고 바람직하게는 또한 하나 이상의 비-인간 종, 특히 영장류 종 (및 특히 시노몰구스 원숭이와 같은 영장류 종)의 PD-1 분자에 결합하는 능력을 나타낼 것이다. 추가적인 바람직한 항체는 PD-1 또는 그것의 펩타이드 단편을 사용하여 유도된 항체-분비 하이브리도마를 분리함으로써 만들어질 수 있다. 대표적인 인간 PD-1 폴리펩타이드 (NCBI 서열 NP_005009.2; 밑줄로 표시된 20개의 아미노산 잔기 신호 서열 및 268개의 아미노산 잔기 성숙 단백질을 포함함) 는 아미노산 서열 (SEQ ID NO:45)을 가진다:
MQIPQAPWPV VWAVLQLGWR PGWFLDSPDR PWNPPTFSPA LLVVTEGDNA
TFTCSFSNTS ESFVLNWYRM SPSNQTDKLA AFPEDRSQPG QDCRFRVTQL
PNGRDFHMSV VRARRNDSGT YLCGAISLAP KAQIKESLRA ELRVTERRAE
VPTAHPSPSP RPAGQFQTLV VGVVGGLLGS LVLLVWVLAV ICSRAARGTI
GARRTGQPLK EDPSAVPVFS VDYGELDFQW REKTPEPPVP CVPEQTEYAT
IVFPSGMGTS SPARRGSADG PRSAQPLRPE DGHCSWPL.
PD-1에 결합하기 위해 사용될 수 있는 바람직한 PD-1-결합 분자는 다음 기준 중 임의의 것 (하나 이상)을 특징으로 한다:
(1) 자극된 인간 T 세포의 표면에 내생적으로 발현된 인간 PD-1에 특이적으로 결합한다;
(2) 40 nM 이하의 평형 결합 상수 (KD)로 인간 PD-1에 특이적으로 결합한다;
(3) 5 nM 이하의 평형 결합 상수 (KD)로 인간 PD-1에 특이적으로 결합한다;
(4) 1.5 x 104 M-1min-1 이상의 온 속도(on rate) (ka)로 인간 PD-1에 특이적으로 결합한다;
(5) 90.0 x 104 M-1min-1 이상의 온 속도 (ka)로 인간 PD-1에 특이적으로 결합한다;
(6) 7 x 10-4 min-1 이하의 오프 속도(off rate) (kd)로 인간 PD-1에 특이적으로 결합한다;
(7) 2 x 10-4 min-1 이하의 오프 속도 (kd)로 인간 PD-1에 특이적으로 결합한다;
(8) 비-인간 영장류 PD-1 (예컨대 시노몰구스 원숭이의 PD-1)에 특이적으로 결합한다;
(9) PD-1에 대한 PD-1 리간드 (PD-L1/PD-L2)의 결합/억제 활성을 억제한다 (즉 차단 또는 간섭한다);
(10) 면역 반응을 자극한다; 및/또는
(11) 항원-특이적 T 세포 반응을 자극하기 위하여 항-인간 LAG-3 항체와 상조작용한다.
PD-1에 결합하기 위해 사용될 수 있는 본 발명의 바람직한 항-인간 PD-1-결합 분자들은 쥐과 항-인간 PD-1 단클론성 항체들 "PD-1 mAb 1", "PD-1 mAb 2", "PD-1 mAb 3", "PD-1 mAb 4", "PD-1 mAb 5", "PD-1 mAb 6", "PD-1 mAb 7", "PD-1 mAb 8", "PD-1 mAb 9", "PD-1 mAb 10", "PD-1 mAb 11", "PD-1 mAb 12", "PD-1 mAb 13", "PD-1 mAb 14", 또는 "PD-1 mAb 15"의 인간화된 VH 및/또는 VL 도메인을 가지며 보다 바람직하게는 그런 항체들의 VH 도메인의 1, 2 또는 3개 전부의 CDRH 및/또는 VL 도메인의 1, 2 또는 3개 전부의 CDRL을 가진다. 발명은 특히 다음:
(A)
(1) PD-1 mAb 1의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 1의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 1의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 1의 VL 도메인의 3개의 CDRL;
(4) hPD-1 mAb 1 VH1의 VH 도메인;
(5) hPD-1 mAb 1 VL1의 VL 도메인;
(6) hPD-1 mAb 1의 VH 및 VL 도메인;
(B)
(1) PD-1 mAb 2의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 2의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 2의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 2의 VL 도메인의 3개의 CDRL;
(4) hPD-1 mAb 2 VH1의 VH 도메인;
(5) hPD-1 mAb 2 VL1의 VL 도메인;
(6) hPD-1 mAb 2의 VH 및 VL 도메인;
(C)
(1) PD-1 mAb 3의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 3의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 3의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 3의 VL 도메인의 3개의 CDRL;
(D)
(1) PD-1 mAb 4의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 4의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 4의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 4의 VL 도메인의 3개의 CDRL;
(E)
(1) PD-1 mAb 5의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 5의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 5의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 5의 VL 도메인의 3개의 CDRL;
(F)
(1) PD-1 mAb 6의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 6의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 6의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 6의 VL 도메인의 3개의 CDRL;
(G)
(1) PD-1 mAb 7의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 7, 또는 hPD-1 mAb 7 VL2, 또는 hPD-1 mAb 7 VL3의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 7의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 7, 또는 hPD-1 mAb 7 VL2, hPD-1 mAb 7 VL3의 VL 도메인의 3개의 CDRL;
(4) hPD-1 mAb 7 VH1, 또는 hPD-1 mAb 7 VH2의 VH 도메인;
(5) hPD-1 mAb 7 VL1, 또는 hPD-1 mAb 7 VL2, 또는 hPD-1 mAb 7 VL 3의 VL 도메인;
(6) hPD-1 mAb 7(1.1), 또는 hPD-1 mAb 7(1.2), 또는 hPD-1 mAb 7(1.3), 또는 hPD-1 mAb 7(2.1), 또는 hPD-1 mAb 7(2.2), 또는 hPD-1 mAb 7(2.3)의 VH 및 VL 도메인;
(H)
(1) PD-1 mAb 8의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 8의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 8 의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 8의 VL 도메인의 3개의 CDRL;
(I)
(1) PD-1 mAb 9, 또는 hPD-1 mAb 9 VH2의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 9, 또는 hPD-1 mAb 9 VL2의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 9, 또는 hPD-1 mAb 9 VH2의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 9, 또는 hPD-1 mAb 9 VL2의 VL 도메인의 3개의 CDRL;
(4) hPD-1 mAb 9 VH1, 또는 hPD-1 mAb 9 VH2의 VH 도메인;
(5) hPD-1 mAb 9 VL1, 또는 hPD-1 mAb 9 VL2의 VL 도메인;
(6) hPD-1 mAb 9(1.1), 또는 hPD-1 mAb 9(1.2), 또는 hPD-1 mAb 9(2.1), 또는 hPD-1 mAb 9(2.2)의 VH 및 VL 도메인;
(J)
(1) PD-1 mAb 10의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 10의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 10의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 10의 VL 도메인의 3개의 CDRL;
(K)
(1) PD-1 mAb 11의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 11의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 11의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 11의 VL 도메인의 3개의 CDRL;
(L)
(1) PD-1 mAb 12의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 12의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 12의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 12의 VL 도메인의 3개의 CDRL;
(M)
(1) PD-1 mAb 13의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 13의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 13의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 13의 VL 도메인의 3개의 CDRL;
(N)
(1) PD-1 mAb 14의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 14의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 14의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 14의 VL 도메인의 3개의 CDRL;
(O)
(1) PD-1 mAb 15의 VH 도메인의 3개의 CDRH;
(2) PD-1 mAb 15의 VL 도메인의 3개의 CDRL;
(3) PD-1 mAb 15의 VH 도메인의 3개의 CDRH 및 PD-1 mAb 15의 VL 도메인의 3개의 CDRL;
(4) hPD-1 mAb 15 VH1의 VH 도메인;
(5) hPD-1 mAb 15 VL1의 VL 도메인;
(6) hPD-1 mAb 15의 VH 및 VL 도메인을 가지거나;
또는
PD-1 mAb 1, PD-1 mAb 2, PD-1 mAb 3, PD-1 mAb 4, PD-1 mAb 5, PD-1 mAb 6, PD-1 mAb 7, PD-1 mAb 8, PD-1 mAb 9, PD-1 mAb 10, PD-1 mAb 11, PD-1 mAb 12, PD-1 mAb 13, PD-1 mAb 14, 또는 PD-1 mAb 15와 동일한 에피토프에 결합하는, 또는 그것들과의 결합에 경합하는 PD-1 결합 도메인을 포함하는 그러한 PD-1-결합 분자들에 관련된다.
(a) PD-1 mAb 1
쥐과 항-인간 PD-1 mAb 1의 VH 도메인의 아미노산 서열 (SEQ ID NO:46)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
DVQLQESGPG RVKPSQSLSL TCTVTGFSIT NDYAWN WIRQ FPGNKLEWMG HITYSGSTSY
NPSLKS RISI TRDTSKNHFF LQLSSVTPED TATYYCAR DY GSGYPYTLDY WGQGTSVTVS S
PD-1 mAb 1의 CDRH1 (SEQ ID NO:47): NDYAWN
PD-1 mAb 1의 CDRH2 (SEQ ID NO:48): HITYSGSTSYNPSLKS
PD-1 mAb 1의 CDRH3 (SEQ ID NO:49): DYGSGYPYTLDY
쥐과 항-인간 PD-1 mAb 1의 VL 도메인의 아미노산 서열 (SEQ ID NO:50)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
QIVLTQSPAL MSASPGEKVT MTC SATSIVS YVY WYQQKPG SSPQPWIY LT SNLAS GVPAR
FSGSGSGTSY SLTISSMEAE DAATYYC QQW SDNPYT FGGG TKLEIK
CDRL1 of PD-1 mAb 1 (SEQ ID NO:51): SATSIVSYVY
CDRL2 of PD-1 mAb 1 (SEQ ID NO:52): LTSNLAS
CDRL3 of PD-1 mAb 1 (SEQ ID NO:53): QQWSDNPYT
상기 기술된 쥐과 항-인간 PD-1 항체 PD-1 mAb 1은 인간 수령체에 투여시 그것의 항원성을 감소시키기 위하여 항-인간 PD-1 항체를 인간화할 수 있는 능력을 증명하기 위하여 항원성 에피토프가 확인되었을 때 인간화되었고 추가로 탈면역화되었다. 인간화로 인해, 본원에서 "hPD-1 mAb 1 VH1"로서 불리는 하나의 인간화된 VH 도메인, 및 본원에서 "hPD-1 mAb 1 VL1"로서 불리는 하나의 인간화된 VL 도메인이 생성되었다. 따라서, 인간화된 VH 도메인과 쌍을 이룬 인간화된 VL 도메인들을 포함하는 항체는 "hPD-1 mAb 1"로서 언급된다.
hPD-1 mAb 1 VH1의 VH 도메인의 아미노산 서열 (SEQ ID NO:54)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
DVQLQESGPG LVKPSQTLSL TCTVSGFSIS NDYAWN WIRQ PPGKGLEWIG HITYSGSTSY
NPSLKS RLTI TRDTSKNQFV LTMTNMDPVD TATYYCAR DY GSGYPYTLDY WGQGTTVTVS S
hPD-1 mAb 1 VL1의 VL 도메인 (SEQ ID NO:55)의 아미노산 서열이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EIVLTQSPAT LSVSPGEKVT ITC SATSIVS YVY WYQQKPG QAPQPLIY LT SNLAS GIPAR
FSGSGSGTDF TLTISSLEAE DAATYYC QQW SDNPYT FGGG TKVEIK
(b) PD-1 mAb 2
쥐과 항-인간 PD-1 mAb 2의 VH 도메인의 아미노산 서열 (SEQ ID NO:56)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
DVQLVESGGG LVQPGGSRKL SCAASGFVFS SFGMH WVRQA PEKGLEWVA Y ISSGSMSISY
ADTVKG RFTV TRDNAKNTLF LQMTSLRSED TAIYYCAS LS DYFDY WGQGT TLTVSS
PD-1 mAb 2의 CDRH1 (SEQ ID NO:57): SFGMH
PD-1 mAb 2의 CDRH2 (SEQ ID NO:58): YISSGSMSISYADTVKG
PD-1 mAb 2의 CDRH3 (SEQ ID NO:59): LSDYFDY
쥐과 항-인간 PD-1 mAb 2의 VL 도메인의 아미노산 서열 (SEQ ID NO:60)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DVVMSQTPLS LPVSLGDQAS ISC RSSQSLV HSTGNTYLH W YLQKPGQSPK LLIY RVSNRF
S GVPDRFSGS GSGTDFTLKI SRVEAEDLGV FFC SQTTHVP WT FGGGTKLE IK
PD-1 mAb 2의 CDRL1 (SEQ ID NO:61): RSSQSLVHSTGNTYLH
PD-1 mAb 2의 CDRL2 (SEQ ID NO:62): RVSNRFS
PD-1 mAb 2의 CDRL3 (SEQ ID NO:63): SQTTHVPWT
상기 기술된 쥐과 항-인간 PD-1 항체 PD-1 mAb 2는 인간 수령체에 투여시 그것의 항원성을 감소시키기 위하여 항-인간 PD-1 항체를 인간화할 수 있는 능력을 증명하기 위하여 항원성 에피토프가 확인되었을 때 인간화되었고 추가로 탈면역화되었다. 인간화로 인해, 본원에서 "hPD-1 mAb 2 VH1"로서 불리는 하나의 인간화된 VH 도메인, 및 본원에서 "hPD-1 mAb 2 VL1"로서 불리는 하나의 인간화된 VL 도메인이 생성되었다. 따라서, 인간화된 VH 도메인과 쌍을 이룬 인간화된 VL 도메인들을 포함하는 항체는 "hPD-1 mAb 2"로서 언급된다.
hPD-1 mAb 2 VH1의 VH 도메인의 아미노산 서열 (SEQ ID NO:64)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAASGFVFS SFGMH WVRQA PGKGLEWVA Y ISSGSMSISY
ADTVKG RFTI SRDNAKNTLY LQMNSLRTED TALYYCAS LS DYFDY WGQGT TVTVSS
hPD-1 mAb 2 VL1의 VL 도메인의 아미노산 서열 (SEQ ID NO:65)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
DVVMTQSPLS LPVTLGQPAS ISC RSSQSLV HSTGNTYLH W YLQKPGQSPQ LLIY RVSNRF
S GVPDRFSGS GSGTDFTLKI SRVEAEDVGV YYC SQTTHVP WT FGQGTKLE IK
(c) PD-1 mAb 3
쥐과 항-인간 PD-1 mAb 3의 VH 도메인의 아미노산 서열 (SEQ ID NO:66)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
QVQLQQSGAE LVRPGASVTL SCKASGYTFT DYVMH WVKQT PVHGLEWIG T IDPETGGTAY
NQKFKG KAIL TADKSSNTAY MELRSLTSED SAVYYFTR EK ITTIVEGTYW YFDV WGTGTT VTVSS
PD-1 mAb 3의 CDRH1 (SEQ ID NO:67): DYVMH
PD-1 mAb 3의 CDRH2 (SEQ ID NO:68): TIDPETGGTAYNQKFKG
PD-1 mAb 3의 CDRH3 (SEQ ID NO:69): EKITTIVEGTYWYFDV
쥐과 항-인간 PD-1 mAb 3의 VL 도메인의 아미노산 서열 (SEQ ID NO:70)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DVLLTQTPLS LPVSLGDQAS ISC RSSQNIV HSNGDTYLE W YLQKPGQSPK LLIY KVSNRF
S GVPDRFSGS GSGTDFTLKI SRVEAEDLGV YYC FQGSHLP YT FGGGTKLE IK
PD-1 mAb 3의 CDRL1 (SEQ ID NO:71): RSSQNIVHSNGDTYLE
PD-1 mAb 3의 CDRL2 (SEQ ID NO:72): KVSNRFS
PD-1 mAb 3의 CDRL3 (SEQ ID NO:73): FQGSHLPYT
(d) PD-1 mAb 4
쥐과 항-인간 PD-1 mAb 4의 VH 도메인의 아미노산 서열 (SEQ ID NO:74)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
DVQLVESGGG LVQPGGSRKL SCAASGFVFS SFGMH WVRQA PEKGLEWVA Y ISSGSMSISY
ADTVKG RFTV TRDNAKNTLF LQMTSLRSED TAIYYCAS LT DYFDY WGQGT TLTVSS
PD-1 mAb 4의 CDRH1 (SEQ ID NO:75): SFGMH
PD-1 mAb 4의 CDRH2 (SEQ ID NO:76): YISSGSMSISYADTVKG
PD-1 mAb 4의 CDRH3 (SEQ ID NO:77): LTDYFDY
쥐과 항-인간 PD-1 mAb 4의 VL 도메인의 아미노산 서열 (SEQ ID NO:78)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DVVMSQTPLS LPVSLGDQAS ISC RSSQSLV HSTGNTYFH W YLQKPGQSPK LLIY RVSNRF
S GVPDRFSGS GSGTDFTLKI SRVEAEDLGV YFC SQTTHVP WT FGGGTKLE IK
PD-1 mAb 4의 CDRL1 (SEQ ID NO:79): RSSQSLVHSTGNTYFH
PD-1 mAb 4의 CDRL2 (SEQ ID NO:80): RVSNRFS
PD-1 mAb 4의 CDRL3 (SEQ ID NO:81): SQTTHVPWT
(e) PD-1 mAb 5
쥐과 항-인간 PD-1 mAb 5의 VH 도메인의 아미노산 서열 (SEQ ID NO:82)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
QVQLQQPGVE LVRPGASVKL SCKASGYSFT AYWMN WMKQR PGQGLEWIG V IHPSDSETWL
NQKFKD KATL TVDKSSSTAY MQLISPTSED SAVYYCAR EH YGSSPFAY WG QGTLVTVSA
PD-1 mAb 5의 CDRH1 (SEQ ID NO:83): AYWMN
PD-1 mAb 5의 CDRH2 (SEQ ID NO:84): VIHPSDSETWLNQKFKD
PD-1 mAb 5의 CDRH3 (SEQ ID NO:85): EHYGSSPFAY
쥐과 항-인간 PD-1 mAb 5의 VL 도메인의 아미노산 서열 (SEQ ID NO:86)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIVLTQSPAS LAVSLGQRAT ISC RANESVD NYGMSFMN WF QQKPGQPPKL LIY AASNQGS
GVPARFSGSG SGTDFSLNIH PMEEDDTAMY FC QQSKEVPY T FGGGTKLEI K
PD-1 mAb 5의 CDRL1 (SEQ ID NO:87): RANESVDNYGMSFMN
PD-1 mAb 5의 CDRL2 (SEQ ID NO:88): AASNQGS
PD-1 mAb 5의 CDRL3 (SEQ ID NO:89): QQSKEVPYT
(f) PD-1 mAb 6
쥐과 항-인간 PD-1 mAb 6의 VH 도메인의 아미노산 서열 (SEQ ID NO:90)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVKLVESGGG LVNPGGSLKL SCAASGFTFS SYGMS WVRQT PEKRLEWVA T ISGGGSDTYY
PDSVKG RFTI SRDNAKNNLY LQMSSLRSED TALYYCAR QK ATTWFAY WGQ GTLVTVST
PD-1 mAb 6의 CDRH1 (SEQ ID NO:91): SYGMS
PD-1 mAb 6의 CDRH2 (SEQ ID NO:92): TISGGGSDTYYPDSVKG
PD-1 mAb 6의 CDRH3 (SEQ ID NO:93): QKATTWFAY
쥐과 항-인간 PD-1 mAb 6의 VL 도메인의 아미노산 서열 (SEQ ID NO:94)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIVLTQSPAS LAVSLGQRAT ISC RASESVD NYGISFMN WF QQKPGQPPKL LIY PASNQGS
GVPARFSGSG SGTDFSLNIH PMEEDDAAMY FC QQSKEVPW T FGGGTKLEI K
PD-1 mAb 6의 CDRL1 (SEQ ID NO:95): RASESVDNYGISFMN
PD-1 mAb 6의 CDRL2 (SEQ ID NO:96): PASNQGS
PD-1 mAb 6의 CDRL3 (SEQ ID NO:97): QQSKEVPWT
(g) PD-1 mAb 7
쥐과 항-인간 PD-1 mAb 7의 VH 도메인의 아미노산 서열 (SEQ ID NO:98)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
QVQLQQPGAE LVRPGASVKL SCKASGYSFT SYWMN WVKQR PGQGLEWIG V IHPSDSETWL
DQKFKD KATL TVDKSSTTAY MQLISPTSED SAVYYCAR EH YGTSPFAY WG QGTLVTVSS
PD-1 mAb 7의 CDRH1 (SEQ ID NO:99): SYWMN
PD-1 mAb 7의 CDRH2 (SEQ ID NO:100): VIHPSDSETWLDQKFKD
PD-1 mAb 7의 CDRH3 (SEQ ID NO:101): EHYGTSPFAY
쥐과 항-인간 PD-1 mAb 7의 VL 도메인의 아미노산 서열 (SEQ ID NO:102)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIVLTQSPAS LAVSLGQRAT ISC RANESVD NYGMSFMN WF QQKPGQPPKL LIH AASNQGS
GVPARFSGSG FGTDFSLNIH PMEEDDAAMY FC QQSKEVPY T FGGGTKLEI K
PD-1 mAb 7의 CDRL1 (SEQ ID NO:103): RANESVDNYGMSFMN
PD-1 mAb 7의 CDRL2 (SEQ ID NO:104): AASNQGS
PD-1 mAb 7의 CDRL3 (SEQ ID NO:105): QQSKEVPYT
상기 기술된 쥐과 항-인간 PD-1 항체 PD-1 mAb 7은 인간 수령체에 투여시 그것의 항원성을 감소시키기 위하여 항-인간 PD-1 항체를 인간화할 수 있는 능력을 증명하기 위하여 항원성 에피토프가 확인되었을 때 인간화되었고 추가로 탈면역화되었다. 인간화로 인해, 본원에서 "hPD-1 mAb 7 VH1", 및 "hPD-1 mAb 7 VH2"로서 불리는 2개의 인간화된 VH 도메인, 및 본원에서 "hPD-1 mAb 7 VL1", "hPD-1 mAb 7 VL2", 및 "hPD-1 mAb 7 VL3"으로서 불리는 3개의 인간화된 VL 도메인이 생성되었다. 인간화된 VL 도메인들 중 어느 것이든지 인간화된 VH 도메인들 중 어느 하나와 쌍을 이룰 수 있다. 따라서, 인간화된 VH 도메인과 쌍을 이룬 인간화된 VL 도메인들 중 하나를 포함하는 임의의 항체는 일반적으로 "hPD-1 mAb 7"로서 언급되고, 인간화된 VH/VL 도메인의 특정 조합은 구체적인 VH/VL 도메인에 대한 언급에 의해 언급되는데, 예를 들어 hPD-1 mAb 7 VH1 및 hPD-1 mAb 1 VL2를 포함하는 인간화된 항체는 구체적으로 "hPD-1 mAb 7(1.2)"로서 언급된다.
hPD-1 mAb 7 VH1의 VH 도메인의 아미노산 서열 (SEQ ID NO:106)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVQSGAE VKKPGASVKV SCKASGYSFT SYWMN WVRQA PGQGLEWIG V IHPSDSETWL
DQKFKD RVTI TVDKSTSTAY MELSSLRSED TAVYYCAR EH YGTSPFAY WG QGTLVTVSS
hPD-1 mAb 7 VH2의 VH 도메인의 아미노산 서열 (SEQ ID NO:107)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVQSGAE VKKPGASVKV SCKASGYSFT SYWMN WVRQA PGQGLEWAG V IHPSDSETWL
DQKFKD RVTI TVDKSTSTAY MELSSLRSED TAVYYCAR EH YGTSPFAY WG QGTLVTVSS
hPD-1 mAb 7 VL1의 VL 도메인의 아미노산 서열 (SEQ ID NO:108)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EIVLTQSPAT LSLSPGERAT LSC RANESVD NYGMSFMN WF QQKPGQPPKL LIH AASNQGS
GVPSRFSGSG SGTDFTLTIS SLEPEDFAVY FC QQSKEVPY T FGGGTKVEI K
hPD-1 mAb 7 VL2의 VL 도메인의 아미노산 서열 (SEQ ID NO:109)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EIVLTQSPAT LSLSPGERAT LSC RASESVD NYGMSFMN WF QQKPGQPPKL LIH AASNQGS
GVPSRFSGSG SGTDFTLTIS SLEPEDFAVY FC QQSKEVPY T FGGGTKVEI K
hPD-1 mAb 7 VL3의 VL 도메인의 아미노산 서열 (SEQ ID NO:110)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EIVLTQSPAT LSLSPGERAT LSC RASESVD NYGMSFMN WF QQKPGQPPKL LIH AASNRGS
GVPSRFSGSG SGTDFTLTIS SLEPEDFAVY FC QQSKEVPY T FGGGTKVEI K
hPD-1 mAb 7 VL2 및 hPD-1 mAb 7 VL3 둘 다의 VL 도메인의 CDRL1은 아스파리긴의 세린으로의 아미노산 치환을 포함하고 아미노산 서열: RA S ESVDNYGMSFMN (SEQ ID NO:111)을 가지며, 치환된 세린은 및줄로 표시된다. 유사한 치환이 상기 기술된 PD-1 mAb 7 CDRL1 도메인들 중 임의의 것에 통합될 수 있는 것으로 여겨진다.
이에 더불어, hPD-1 mAb 7 VL3의 VL 도메인의 CDRL2는 글루타민의 아르기닌으로의 아미노산 치환을 포함하며 아미노산 서열: AASN R GS (SEQ ID NO:112)을 가지고, 치환된 아르기닌은 밑줄로 표시된다. 유사한 치환이 상기 기술된 PD-1 mAb 7 CDRL2 도메인들 중 임의의 것에 통합될 수 있는 것으로 여겨진다.
(h) PD-1 mAb 8
쥐과 항-인간 PD-1 mAb 8의 VH 도메인의 아미노산 서열 (SEQ ID NO:113)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EGQLQQSGPE LVKPGASVKI SCKASGYTFT DYYMN WVKQN HGKSLEWIG D INPKNGDTHY
NQKFKG EATL TVDKSSTTAY MELRSLTSED SAVYYCAS DF DY WGQGTTLT VSS
PD-1 mAb 8의 CDRH1 (SEQ ID NO:114): DYYMN
PD-1 mAb 8의 CDRH2 (SEQ ID NO:115): DINPKNGDTHYNQKFKG
PD-1 mAb 8의 CDRH3 (SEQ ID NO:116): DFDY
쥐과 항-인간 PD-1 mAb 8의 VL 도메인의 아미노산 서열 (SEQ ID NO:117)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DVVMTQTPLS LPVGLGDQAS ISC RSSQTLV YSNGNTYLN W FLQKPGQSPK LLIY KVSNRF
S GVPDRFSGS GSGTDFTLKI SRVEAEDLGV YFC SQSTHVP FT FGSGTKLE IK
PD-1 mAb 8의 CDRL1 (SEQ ID NO:118): RSSQTLVYSNGNTYLN
PD-1 mAb 8의 CDRL2 (SEQ ID NO:119): KVSNRFS
PD-1 mAb 8의 CDRL3 (SEQ ID NO:120): SQSTHVPFT
(i) PD-1 mAb 9
쥐과 항-인간 PD-1 mAb 9의 VH 도메인의 아미노산 서열 (SEQ ID NO:121)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVMLVESGGG LVKPGGSLKL SCAASGFTFS SYLVS WVRQT PEKRLEWVA T ISGGGGNTYY
SDSVKG RFTI SRDNAKNTLY LQISSLRSED TALYYCAR YG FDGAWFAY WG QGTLVTVSS
PD-1 mAb 9의 CDRH1 (SEQ ID NO:122): SYLVS
PD-1 mAb 9의 CDRH2 (SEQ ID NO:123): TISGGGGNTYYSDSVKG
PD-1 mAb 9의 CDRH3 (SEQ ID NO:124): YGFDGAWFAY
쥐과 항-인간 PD-1 mAb 9의 VL 도메인의 아미노산 서열 (SEQ ID NO:125)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPAS LSASVGDIVT ITC RASENIY SYLA WYQQKQ EKSPQLLVY N AKTLAA GVPS
RFSGSGSGTQ FSLTINSLQP EDFGNYYC QH HYAVPWT FGG GTRLEIT
PD-1 mAb 9의 CDRL1 (SEQ ID NO:126): RASENIYSYLA
PD-1 mAb 9의 CDRL2 (SEQ ID NO:127): NAKTLAA
PD-1 mAb 9의 CDRL3 (SEQ ID NO:128): QHHYAVPWT
상기 기술된 쥐과 항-인간 PD-1 항체 PD-1 mAb 9는 인간 수령체에 투여시 그것의 항원성을 감소시키기 위하여 항-인간 PD-1 항체를 인간화할 수 있는 능력을 증명하기 위하여 항원성 에피토프가 확인되었을 때 인간화되었고 추가로 탈면역화되었다. 인간화로 인해, 본원에서 "hPD-1 mAb 9 VH1", 및 "hPD-1 mAb 9 VH2"로서 불리는 2개의 인간화된 VH 도메인, 및 본원에서 "hPD-1 mAb 9 VL1", 및 "hPD-1 mAb 9 VL2"로서 불리는 2개의 인간화된 VL 도메인이 생성되었다. 인간화된 VL 도메인들 중 어느 것이든지 인간화된 VH 도메인들과 쌍을 이룰 수 있다. 따라서, 인간화된 VH 도메인과 쌍을 이룬 인간화된 VL 도메인들 중 하나를 포함하는 임의의 항체는 일반적으로 "hPD-1 mAb 9"로서 언급되고, 인간화된 VH/VL 도메인의 특정 조합은 구체적인 VH/VL 도메인에 대한 언급에 의해 언급되는데, 예를 들어 hPD-1 mAb 9 VH1 및 hPD-1 mAb 9 VL2를 포함하는 인간화된 항체는 구체적으로 "hPD-1 mAb 9(1.2)"로서 언급된다.
hPD-1 mAb 9 VH1의 VH 도메인의 아미노산 서열 (SEQ ID NO:129)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVRPGGSLKL SCAASGFTFS SYLVS WVRQA PGKGLEWVA T ISGGGGNTYY
SDSVKG RFTI SRDNAKNSLY LQMNSLRAED TATYYCAR YG FDGAWFAY WG QGTLVTVSS.
hPD-1 mAb 9 VH2의 VH 도메인의 아미노산 서열 (SEQ ID NO:130)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LARPGGSLKL SCAASGFTFS SYLVG WVRQA PGKGLEWTA T ISGGGGNTYY
SDSVKG RFTI SRDNAKNSLY LQMNSARAED TATYYCAR YG FDGAWFAY WG QGTLVTVSS.
hPD-1 mAb 9 VH2의 VH 도메인의 CDRH1은 세린의 글리신으로의 아미노산 치환을 포함하며 아미노산 서열: SYLV G ((SEQ ID NO:131)를 가지고, 치환된 글리신은 밑줄로 표시된다. 유사한 치환이 상기 기술된 PD-1 mAb 9 CDRH1 도메인들 중 임의의 것에 통합될 수 있는 것으로 여겨진다.
hPD-1 mAb 9 VL1의 VL 도메인의 아미노산 서열 (SEQ ID NO:132)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC RASENIY SYLA WYQQKP GKAPKLLIY N AKTLAA GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QH HYAVPWT FGQ GTKLEIK.
hPD-1 mAb 9 VL2의 VL 도메인의 아미노산 서열 (SEQ ID NO:133)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC RASENIY NYLA WYQQKP GKAPKLLIY D AKTLAA GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QH HYAVPWT FGQ GTKLEIK.
hPD-1 mAb 9 VL2의 VL 도메인의 CDRL1은 세린의 아스파라긴으로의 아미노산 치환을 포함하며 아미노산 서열: RASENIY N YLA (SEQ ID NO:134)를 가지고, 치환된 아스파라긴은 밑줄로 표시된다. 유사한 치환이 상기 기술된 PD-1 mAb 9 CDRL1 도메인들 중 임의의 것에 통합될 수 있는 것으로 여겨진다.
hPD-1 mAb 9 VL2의 VL 도메인의 CDRL2는 아스파라긴의 아스파테이트로의 아미노산 치환을 포함하며 아미노산 서열: D AKTLAA ((SEQ ID NO:135)를 가지고, 치환된 아스파테이트는 밑줄로 표시된다. 유사한 치환이 상기 기술된 PD-1 mAb 9 CDRL2 도메인들 중 임의의 것에 통합될 수 있는 것으로 여겨진다.
(j) PD-1 mAb 10
쥐과 항-인간 PD-1 mAb 10의 VH 도메인의 아미노산 서열 (SEQ ID NO:136)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVILVESGGG LVKPGGSLKL SCAASGFTFS NYLMS WVRQT PEKRLEWVA S ISGGGSNIYY
PDSVKG RFTI SRDNAKNTLY LQMNSLRSED TALYYCAR QE LAFDY WGQGT TLTVSS
PD-1 mAb 10의 CDRH1 (SEQ ID NO:137): NYLMS
PD-1 mAb 10의 CDRH2 (SEQ ID NO:138): SISGGGSNIYYPDSVKG
PD-1 mAb 10의 CDRH3 (SEQ ID NO:139): QELAFDY
쥐과 항-인간 PD-1 mAb 10의 VL 도메인의 아미노산 서열 (SEQ ID NO:140)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQTTSS LSASLGDRVT ISC RTSQDIS NFLN WYQQKP DGTIKLLIY Y TSRLHS GVPS
RFSGSGSGTD YSLTISNLEQ EDIATYFC QQ GSTLPWT FGG GTKLEII
PD-1 mAb 10의 CDRL1 (SEQ ID NO:141): RTSQDISNFLN
PD-1 mAb 10의 CDRL2 (SEQ ID NO:142): YTSRLHS
PD-1 mAb 10의 CDRL3 (SEQ ID NO:143): QQGSTLPWT
(k)
PD-1 mAb 11
쥐과 항-인간 PD-1 mAb 11의 VH 도메인의 아미노산 서열 (SEQ ID NO:144)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVQLQQSGTV LARPGASVKM SCKTSGYTFT GYWMH WVKQR PGQGLKWMG A IYPGNSDTHY
NQKFKG KAKL TAVTSASTAY MELSSLTNED SAIYYCTT GT YSYFDV WGTG TTVTVSS
PD-1 mAb 11의 CDRH1 (SEQ ID NO:145): GYWMH
PD-1 mAb 11의 CDRH2 (SEQ ID NO:146): AIYPGNSDTHYNQKFKG
PD-1 mAb 11의 CDRH3 (SEQ ID NO:147): GTYSYFDV
쥐과 항-인간 PD-1 mAb 11의 VL 도메인의 아미노산 서열 (SEQ ID NO:148)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DILLTQSPAI LSVSPGERVS FSC RASQSIG TSIH WYQHRT NGSPRLLIK Y ASESIS GIPS
RFSGSGSGTD FTLSINSVES EDIADYYC QQ SNSWLT FGAG TKLELK
PD-1 mAb 11의 CDRL1 (SEQ ID NO:149): RASQSIGTSIH
PD-1 mAb 11의 CDRL2 (SEQ ID NO:150): YASESIS
PD-1 mAb 11의 CDRL3 (SEQ ID NO:151): QQSNSWLT
(l) PD-1 mAb 12
쥐과 항-인간 PD-1 mAb 12의 VH 도메인의 아미노산 서열 (SEQ ID NO:152)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
QGHLQQSGAE LVRPGASVTL SCKASGFTFT DYEMH WVKQT PVHGLEWIG T IDPETGGTAY
NQKFKG KAIL TVDKSSTTTY MELRSLTSED SAVFYCSR ER ITTVVEGAYW YFDV WGTGTT VTVSS
PD-1 mAb 12의 CDRH1 (SEQ ID NO:153): DYEMH
PD-1 mAb 12의 CDRH2 (SEQ ID NO:154): TIDPETGGTAYNQKFKG
PD-1 mAb 12의 CDRH3 (SEQ ID NO:155): ERITTVVEGAYWYFDV
쥐과 항-인간 PD-1 mAb 12의 VL 도메인의 아미노산 서열 (SEQ ID NO:156)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DVLMTQTPLS LPVSLGDQAS ISC RSSQNIV HSNGNTYLE W YLQKPGQSPK LLIC KVSTRF
S GVPDRFSGS GSGTDFTLKI SRVEAEDLGV YYC FQGSHVP YT FGGGTKLE IK
PD-1 mAb 12의 CDRL1 (SEQ ID NO:157): RSSQNIVHSNGNTYLE
PD-1 mAb 12의 CDRL2 (SEQ ID NO:158): KVSTRFS
PD-1 mAb 12의 CDRL3 (SEQ ID NO:159): FQGSHVPYT
(m) PD-1 mAb 13
쥐과 항-인간 PD-1 mAb 13의 VH 도메인의 아미노산 서열 (SEQ ID NO:160)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVMLVESGGG LVKPGGSLKL SCAASGFTFS SHTMS WVRQT PEKRLEWVA T ISGGGSNIYY
PDSVKG RFTI SRDNAKNTLY LQMSSLRSED TALYYCAR QA YYGNYWYFDV WGTGTTVTVS S
PD-1 mAb 13의 CDRH1 (SEQ ID NO:161): SHTMS
PD-1 mAb 13의 CDRH2 (SEQ ID NO:162): TISGGGSNIYYPDSVKG
PD-1 mAb 13의 CDRH3 (SEQ ID NO:163): QAYYGNYWYFDV
쥐과 항-인간 PD-1 mAb 13의 VL 도메인의 아미노산 서열 (SEQ ID NO:164)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPAT QSASLGESVT ITC LASQTIG TWLA WYQQKP GKSPQLLIY A ATSLAD GVPS
RFSGSGSGTK FSFKISSLQA EDFVSYYC QQ LDSIPWT FGG GTKLEIK
PD-1 mAb 13의 CDRL1 (SEQ ID NO:165): LASQTIGTWLA
PD-1 mAb 13의 CDRL2 (SEQ ID NO:166): AATSLAD
PD-1 mAb 13의 CDRL3 (SEQ ID NO:167): QQLDSIPWT
(g) PD-1 mAb 14
쥐과 항-인간 PD-1 mAb 14의 VH 도메인의 아미노산 서열 (SEQ ID NO:168)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
QVQLQQPGAE LVKPGASVKM SCKASGYNFI SYWIT WVKQR PGQGLQWIG N IYPGTDGTTY
NEKFKS KATL TVDTSSSTAY MHLSRLTSED SAVYYCAT GL HWYFDV WGTG TTVTVSS
PD-1 mAb 14의 CDRH1 (SEQ ID NO:169): SYWIT
PD-1 mAb 14의 CDRH2 (SEQ ID NO:170): NIYPGTDGTTYNEKFKS
PD-1 mAb 14의 CDRH3 (SEQ ID NO:171): GLHWYFDV
쥐과 항-인간 PD-1 mAb 14의 VL 도메인의 아미노산 서열 (SEQ ID NO:172)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIVMTQSQKF MSTSVGDRVS VTC KASQSVG TNVA WYQQKP GQSPKALIY S ASSRFS GVPD
RFTGSGSGTD FTLTISNVQS EDLAEYFC QQ YNSYPYT FGG GTKLEIK
PD-1 mAb 14의 CDRL1 (SEQ ID NO:173): KASQSVGTNVA
PD-1 mAb 14의 CDRL2 (SEQ ID NO:174): SASSRFS
PD-1 mAb 14의 CDRL3 (SEQ ID NO:175): QQYNSYPYT
(o) PD-1 mAb 15
쥐과 항-인간 PD-1 mAb 15의 VH 도메인의 아미노산 서열 (SEQ ID NO:176)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVMLVESGGG LVKPGGSLKL SCAASGFIFS SYLIS WVRQT PEKRLEWVA A ISGGGADTYY
ADSVKG RFTI SRDNAKNTLY LQMSSLRSED TALYYCTR RG TYAMDY WGQG TSVTVSS
PD-1 mAb 15의 CDRH1 (SEQ ID NO:177): SYLIS
PD-1 mAb 15의 CDRH2 (SEQ ID NO:178): AISGGGADTYYADSVKG
PD-1 mAb 15의 CDRH3 (SEQ ID NO:179): RGTYAMDY
쥐과 항-인간 PD-1 mAb 15의 VL 도메인의 아미노산 서열 (SEQ ID NO:180)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPAS QSASLGESVT ITC LASQTIG TWLA WYQQKP GKSPQLLIY A ATSLAD GVPS
RFSGSGSGTK FSFKISSLQA EDFVNYYC QQ LYSIPWT FGG GTKLEIK
PD-1 mAb 15의 CDRL1 (SEQ ID NO:181): LASQTIGTWLA
PD-1 mAb 15의 CDRL2 (SEQ ID NO:182): AATSLAD
PD-1 mAb 15의 CDRL3 (SEQ ID NO:183): QQLYSIPWT
상기 기술된 쥐과 항-인간 PD-1 항체 PD-1 mAb 15는 인간 수령체에 투여시 그것의 항원성을 감소시키기 위하여 항-인간 PD-1 항체를 인간화할 수 있는 능력을 증명하기 위하여 항원성 에피토프가 확인되었을 때 인간화되었고 추가로 탈면역화되었다. 인간화로 인해, 본원에서 "hPD-1 mAb 15 VH1"로서 불리는 하나의 인간화된 VH 도메인, 및 본원에서 "hPD-1 mAb 15 VL1"로서 불리는 하나의 인간화된 VL 도메인이 생성되었다. 인간화된 VH 도메인과 쌍을 이룬 인간화된 VL 도메인을 포함하는 항체는 "hPD-1 mAb 15"로서 언급된다.
hPD-1 mAb 15 VH1의 VH 도메인의 아미노산 서열 (SEQ ID NO:184)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVRPGGSLRL SCAASGFTFS SYLIS WVRQA PGKGLEWVA A ISGGGADTYY
ADSVKG RFTI SRDNAKNSLY LQMNSLRAED TATYYCAR RG TYAMDY WGQG TLVTVSS.
hPD-1 mAb 15 VL1의 VL 도메인의 아미노산 서열 (SEQ ID NO:185)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC LASQTIG TWLA WYQQKP GKAPKLLIY A ATSLAD GVPS
RFSGSGSGTD FTFTISSLQP EDFATYYC QQ LYSIPWT FGQ GTKLEIK.
(p) 추가적인 항-PD-1 항체들
PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자들의 생성에 유용한 대안적인 항-PD-1 항체들은 항-인간 PD-1 단클론성 항체 니볼루맙(nivolumab) (CAS Reg. No.:946414-94-4, 5C4, BMS-936558, ONO-4538, MDX-1106으로도 알려지고, Bristol-Myers Squibb에 의해 OPDIVO®로 시판됨); 펨브롤리주맙(pembrolizumab) (이전에는 람브롤리주맙(lambrolizumab)으로서 알려져 있음) (MK-3475, SCH-900475로서 알려져 있는 CAS 등록 번호 1374853-91-4 (MK-3475, SCH-900475로서도 알려져 있고, Merck사에 의해 KEYTRUDA®로서 시판됨); EH12.2H7 (Dana Farber); 피디리주맙(pidilizuLmab) (CAS 등록 번호: 1036730-42-3, CT-011로도 알려짐, CureTech.), 또는 표 8의 항-PD-1 항체들 중 임의의 것의 VL 및/또는 VH 도메인을 가지며; 보다 바람직하게는 그러한 항-PD-1 단클론성 항체들의 VL 영역의 1, 2 또는 3개 전부의 CDRL 및/또는 VH 도메인의 1, 2 또는 3개 전부의 CDRH를 가진다. 니볼루맙 (WHO Drug Information, 2013, Recommended INN: List 69, 27(1):68-69), 펨브롤리주맙 (WHO Drug Information, 2014, Recommended INN: List 75, 28(3):407) 및 피디리주맙 (WHO Drug Information, 2013, Recommended INN: List 70, 27(3):303-304)의 완전한 중쇄 및 경쇄의 아미노산 서열은 당업계에 알려져 있다. 본 발명의 방법 및 조성물에 유용한 고유한 결합 특성을 가지는 추가적인 항-PD-1 항체들은 최근 확인되었다(미국 특허 출원 번호 62/198,867; 62/239,559; 62/255,140 참조).
| 추가적인 항-PD-1 항체 | |
| PD-1 항체 | 참고문헌 / 공급원 |
| PD1-17; PD1-28; PD1-33; PD1-35; 및 PD1-F2 | 미국 특허 번호 7,488,802; 7,521,051 및 8,088,905; PCT 특허 공개공보 WO 2004/056875 |
| 17D8; 2D3; 4H1; 5C4; 4A11; 7D3; 및 5F4 | 미국 특허 번호 8,008,449; 8,779,105 및 9,084,776; PCT 특허 공개공보 WO 2006/121168 |
| hPD-1.08A; hPD-1.09A; 109A; K09A; 409A; h409A11; h409A16; h409A17; 코돈 최적화된 109A; 및 코돈 최적화된 409A | 미국 특허 번호 8,354,509; 8,900,587 및 5,952,136; PCT 특허 공개공보 WO 2008/156712 |
| 1E3; 1E8; 및 1H3 | 미국 특허 공개공보 2014/0044738; PCT 특허 공개공보 WO 2012/145493 |
| 9A2; 10B11; 6E9; APE1922; APE1923; APE1924; APE1950; APE1963; 및 APE2058 | PCT 특허 공개공보 WO 2014/179664 |
| GA1; GA2; GB1; GB6; GH1; A2; C7; H7; SH-A4; SH-A9; RG1H10; RG1H11; RG2H7; RG2H10; RG3E12; RG4A6; RG5D9; RG1H10-H2A-22-1S; RG1H10-H2A-27-2S; RG1H10-3C; RG1H10-16C; RG1H10-17C; RG1H10-19C; RG1H10-21C; 및 RG1H10-23C2 | 미국 특허 공개공보 2014/0356363; PCT 특허 공개공보 WO 2014/194302 |
| H1M7789N; H1M7799N; H1M7800N; H2M7780N; H2M7788N; H2M7790N; H2M7791N; H2M7794N; H2M7795N; H2M7796N; H2M7798N; H4H9019P; H4xH9034P2; H4xH9035P2; H4xH9037P2; H4xH9045P2; H4xH9048P2; H4H9057P2; H4H9068P2; H4xH9119P2; H4xH9120P2; H4Xh9128p2; H4Xh9135p2; H4Xh9145p2; H4Xh8992p; H4Xh8999p; 및 H4Xh9008p; | 미국 특허 공개공보 2015/0203579; PCT 특허 공개공보 WO 2015/112800 |
| PD-1 mAb 1; PD-1 mAb 2; hPD-1 mAb 2; PD-1 mAb 3; PD-1 mAb 4; PD-1 mAb 5; PD-1 mAb 6; PD-1 mAb 7; hPD-1 mAb 7; PD-1 mAb 8; PD-1 mAb 9; hPD-1 mAb 9; PD-1 mAb 10; PD-1 mAb 11; PD-1 mAb 12; PD-1 mAb 13; PD-1 mAb 14; PD-1 mAb 15; 및 hPD-1 mAb 15 | 미국 특허 출원 번호 62/198,867 및 62/239,559 |
(q) 예시의 IgG4 PD-1 항체들
특정 구체예에서 본 발명의 방법 및 조성물에 유용한 항-PD-1 항체들은 상기 제공된 항체들 중 임의의 항체 (예컨대, PD-1 mAb 1, PD-1 mAb 2, PD-1 mAb 3, PD-1 mAb 4, PD-1 mAb 5, PD-1 mAb 6, PD-1 mAb 7, PD-1 mAb 8, 등, 또는 표 6의 항-PD-1 항체들 중 임의의 항체)의 VL 및 VH 도메인, 카파 CL 도메인 (SEQ ID NO:12), 및 IgG4 Fc 도메인을 포함하고, 선택적으로 C-말단 리신 잔기가 결핍되어 있다. 그러한 항체들은 바람직하게는 IgG4 CH1 도메인 (SEQ ID NO:3) 및 힌지 도메인을 포함할 것이고, 보다 바람직하게는 S228P 치환 (넘버링은 Kabat에서와 같이 EU 인덱스를 따름, SEQ ID NO:7)을 포함하는 안정화된 IgG4 힌지, 및 IgG4 CH2-CH3 도메인 (SEQ ID NO:7)을 포함한다.
"hPD-1 mAb 7 (1.2) IgG4 (P)"로 불리는 예시의 항-PD-1 항체는 인간화된 항-인간 PD-1 항체이다. 상기에서 나타낸 것과 같이, hPD-1 mAb 7(1.2)는 hPD-1 mAb 7 VH1의 VH 도메인 및 hPD-1 mAb 7 VL2의 VL 도메인을 포함한다.
hPD-1 mAb7 (1.2) IgG4 (P)의 완전한 중쇄의 아미노산 서열은 SEQ ID NO:186이다 (CDRH 잔기 및 S228P 잔기는 밑줄로 표시됨):
QVQLVQSGAE VKKPGASVKV SCKASGYSFT SYWMN WVRQA PGQGLEWIG V IHPSDSETWL
DQKFKD RVTI TVDKSTSTAY MELSSLRSED TAVYYCAR EH YGTSPFAY WG QGTLVTVSSA
STKGPSVFPL APCSRSTSES TAALGCLVKD YFPEPVTVSW NSGALTSGVH TFPAVLQSSG
LYSLSSVVTV PSSSLGTKTY TCNVDHKPSN TKVDKRVESK YGPPCP P CPA PEFLGGPSVF
LFPPKPKDTL MISRTPEVTC VVVDVSQEDP EVQFNWYVDG VEVHNAKTKP REEQFNSTYR
VVSVLTVLHQ DWLNGKEYKC KVSNKGLPSS IEKTISKAKG QPREPQVYTL PPSQEEMTKN
QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPVLDSD GSFFLYSRLT VDKSRWQEGN
VFSCSVMHEA LHNHYTQKSL SLSLG.
SEQ ID NO:186에서, 잔기 1 내지 119는 hPD-1 mAb 7 VH1 (SEQ ID NO:106)의 VH 도메인에 상응하고, 아미노산 잔기 120 내지 217은 인간 IgG4 CH1 도메인 (SEQ ID NO:3)에 상응하며, 아미노산 잔기 218 내지 229는 S228P 치환을 포함하는 인간 IgG4 힌지 도메인 (SEQ ID NO:7)에 상응하고, 아미노산 잔기 230 내지 245는 인간 IgG4 CH2-CH3 도메인 (SEQ ID NO:11, 여기서, X는 없다)에 상응한다.
항체 hPD-1 mAb7 (1.2) IgG4 (P)의 완전한 경쇄의 아미노산 서열은 카파 불변 영역을 가지며 (SEQ ID NO:187)이다:
EIVLTQSPAT LSLSPGERAT LSCRASESVD NYGMSFMNWF QQKPGQPPKL LIHAASNQGS
GVPSRFSGSG SGTDFTLTIS SLEPEDFAVY FCQQSKEVPY TFGGGTKVEI KRTVAAPSVF
IFPPSDEQLK SGTASVVCLL NNFYPREAKV QWKVDNALQS GNSQESVTEQ DSKDSTYSLS
STLTLSKADY EKHKVYACEV THQGLSSPVT KSFNRGEC.
SEQ ID NO:187에서, 아미노산 잔기 1 내지 111은 hPD-1 mAb 7 VL2의 VL 도메인 (SEQ ID NO:109)에 상응하고, 아미노산 잔기 112 내지 218은 경쇄 카파 불변 영역 (SEQ ID NO:12)에 상응한다.
IgG4 불변 영역을 가지는 다른 예시의 항-PD-1 항체는 인간 항체인 니볼루맙, 및 인간화된 항체인 펨브롤리주맙이다. 각각은 상기에서 기술된 것과 같이 카파 CL 도메인, IgG4 CH1 도메인, 안정화된 IgG4 힌지, 및 IgG4 CH2-CH3 도메인을 포함한다.
(r) PD-1 및 LAG-3에 결합할 수 있는 예시의 이중특이적 분자들
본원에 제공된 것과 같이, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자는 이중특이적 분자일 수 있다. 특정 구체예에서, 이중특이적 분자는 바람직하게는 상기 제공된 항-PD-1 항체들 중 임의의 항체 (예컨대, PD-1 mAb 1, PD-1 mAb 2, PD-1 mAb 3, PD-1 mAb 4, PD-1 mAb 5, PD-1 mAb 6, PD-1 mAb 7, PD-1 mAb 8, 등, 또는 표 6의 항-PD-1 항체들 중 임의의 항체)의 VL 및 VH 도메인, 및 CD137, LAG-3, OX40, TIGIT, TIM-3, 또는 VISTA의 에피토프에 결합하는 항체의 VL 및 VH 도메인을 포함할 것이다. 그런 이중특이적 분자들은 디아바디들, BITE®, 이중특이적 항체들, 또는 삼가 결합 분자들일 수 있다.
DART-1로 불리는, PD-1 및 LAG-3에 결합할 수 있는 예시의 이중특이적 분자는 4개의 폴리펩타이드 사슬을 포함하는 디아바디이다. DART-1은 PD-1에 특이적인 2개의 결합 부위, LAG-3에 특이적인 2개의 결합 부위, 연장된 반감기를 위해 엔지니어링된 변종 IgG4 Fc 영역, 및 시스테인-함유 E/K-코일 헤테로다이머-촉진 도메인을 가지는 이중특이적, 4개의 사슬, Fc 영역-함유 디아바디이다 (예컨대 도 3B 참조). DART-1의 제 1 및 제 3 폴리펩타이드 사슬은, N-말단에서 C-말단 방향으로: N-말단, LAG-3에 결합할 수 있는 단클론성 항체의 VL 도메인 (SEQ ID NO:274에서 밑줄); 개입 링커 펩타이드 (링커 1: GGGSGGGG (SEQ ID NO:14)); hPD-1 mAb 7 VH1의 VH 도메인 (SEQ ID NO:106); 시스테인-함유 개입 링커 펩타이드 (링커 2: GGCGGG (SEQ ID NO:15)); 시스테인-함유 헤테로다이머-촉진 (E-코일) 도메인 (EVAACEK-EVAALEK-EVAALEK-EVAALEK (SEQ ID NO:29)); 안정화된 IgG4 힌지 영역 (SEQ ID NO:7); 추가로 아미노산 치환 M252Y/S254T/T256E를 포함하고 C-말단 잔기가 없는 변종 IgG4 CH2-CH3 도메인 (SEQ ID NO:11); 및 C-말단을 포함한다. DART-1의 제 1 및 제 3 폴리펩타이드 사슬의 아미노산 서열은 (SEQ ID NO:274)이다:
DIQMTQSPSS LSASVGDRVT ITCRASQDVS SVVAWYQQKP GKAPKLLIYS ASYRYTGVPS
RFSGSGSGTD FTLTISSLQP EDFATYYCQQ HYSTPWTFGG GTKLEIK GGG SGGGGQVQLV
QSGAEVKKPG ASVKVSCKAS GYSFTSYWMN WVRQAPGQGL EWIGVIHPSD SETWLDQKFK
DRVTITVDKS TSTAYMELSS LRSEDTAVYY CAREHYGTSP FAYWGQGTLV TVSSGGCGGG
EVAACEKEVA ALEKEVAALE KEVAALEKES KYGPPCPPCP APEFLGGPSV FLFPPKPKDT
LYITREPEVT CVVVDVSQED PEVQFNWYVD GVEVHNAKTK PREEQFNSTY RVVSVLTVLH
QDWLNGKEYK CKVSNKGLPS SIEKTISKAK GQPREPQVYT LPPSQEEMTK NQVSLTCLVK
GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFLYSRL TVDKSRWQEG NVFSCSVMHE
ALHNHYTQKS LSLSLG
DART-1의 제 2 및 제 4 폴리펩타이드 사슬은, N-말단에서 C-말단 방향으로: N-말단, hPD-1 mAb 7 VL2의 VL 도메인 (SEQ ID NO:109); 개입 링커 펩타이드 (링커 1: GGGSGGGG (SEQ ID NO:14)); LAG-3에 결합할 수 있는 단클론성 항체의 VH 도메인 (SEQ ID NO:275에서 밑줄); 시스테인-함유 개입 링커 펩타이드 (링커 2: GGCGGG (SEQ ID NO:15)); 시스테인-함유 헤테로다이머-촉진 (K-코일) 도메인 (KVAACKE-KVAALKE-KVAALKE-KVAALKE (SEQ ID NO:30); 및 C-말단을 포함한다. DART-1의 제 2 및 제 4 폴리펩타이드 사슬의 아미노산 서열은 (SEQ ID NO:275)이다:
EIVLTQSPAT LSLSPGERAT LSCRASESVD NYGMSFMNWF QQKPGQPPKL LIHAASNQGS
GVPSRFSGSG SGTDFTLTIS SLEPEDFAVY FCQQSKEVPY TFGGGTKVEI KGGGSGGGG Q
VQLVQSGAEV KKPGASVKVS CKASGYTFTD YNMDWVRQAP GQGLEWMGDI NPDNGVTIYN
QKFEGRVTMT TDTSTSTAYM ELRSLRSDDT AVYYCAREAD YFYFDYWGQG TTLTVSS GGC
GGGKVAACKE KVAALKEKVA ALKEKVAALK E
"DART-2"로서 불리는, PD-1 및 LAG-3에 결합할 수 있는 또 다른 예시의 이중특이적 분자는 DART-1과 동일한 구조를 갖지만 대체 LAG-3 VL 및 VH 도메인을 포함한다.
2. PD-1의 천연 리간드에 대한 결합 분자들
상기에서 논의된 것과 같이, PD-1의 천연 리간드, 예를 들어, B7-H1 (PD-L1) 및 B7-DC (PD-L2)는 기술되어 있다 (Ohigashi et al. (2005) "Clinical Significance Of Programmed Death-1 Ligand And Programmed Death-1 Ligand-2 Expression In Human Esophageal Cancer", Clin. Cancer Res. 11:2947-2953; Dong, H. et al. (1999) "B7-H1, A 3rd Member Of The B7 Family, Co-Stimulates Cell Proliferation And Interleukin-10 Secretion", Nat. Med. 5:1365-1369; Freeman, G.J. et al. (2000) "Engagement Of The PD-1 Immunoinhibitory Receptor By A Novel B7 Family Member Leads To Negative Regulation Of Lymphocyte Activation", J. Exp. Med. 192:1027-1034; Tseng, S.Y. et al. (2001) "B7-DC, A New Dendritic Cell Molecule With Potent Costimulatory Properties For T Cells", J. Exp. Med 193:839-846; Latchman, Y. et al. (2001) "PD-L2 Is A 2nd Ligand For PD-1 And Inhibits T Cell Activation", Nat. Immunol. 2:261-268; Iwai et al. (2002) "Involvement Of PD-L1 On Tumor Cells In The Escape From Host Immune System And Tumor Immunotherapy By PD-L1 Blockade", Proc. Natl. Acad. Sci. (U.S.A.) 99:12293-12297).
대표적인 인간 B7-H1 (PD-L1) 폴리펩타이드 (NCBI 서열 NP_001254635.1, 예측된 18개의 아미노산 신호 서열을 포함함)는 아미노산 서열 (SEQ ID NO:188)을 가진다:
MRIFAVFIFM TYWHLLNAPY NKINQRILVV DPVTSEHELT CQAEGYPKAE VIWTSSDHQV
LSGKTTTTNS KREEKLFNVT STLRINTTTN EIFYCTFRRL DPEENHTAEL VIPELPLAHP
PNERTHLVIL GAILLCLGVA LTFIFRLRKG RMMDVKKCGI QDTNSKKQSD THLEET
대표적인 인간 B7-DC (PD-L2) 폴리펩타이드 (NCBI 서열 NP_079515.2; 예측된 18개의 아미노산 신호 서열을 포함함)는 아미노산 서열 (SEQ ID NO:189)을 가진다:
MIFLLLMLSL ELQLHQIAAL FTVTVPKELY IIEHGSNVTL ECNFDTGSHV NLGAITASLQ
KVENDTSPHR ERATLLEEQL PLGKASFHIP QVQVRDEGQY QCIIIYGVAW DYKYLTLKVK
ASYRKINTHI LKVPETDEVE LTCQATGYPL AEVSWPNVSV PANTSHSRTP EGLYQVTSVL
RLKPPPGRNF SCVFWNTHVR ELTLASIDLQ SQMEPRTHPT WLLHIFIPFC IIAFIFIATV
IALRKQLCQK LYSSKDTTKR PVTTTKREVN SAI
비록 B7-H1 및 B7-DC가 34%의 동일한 아미노산 서열을 공유하지만, 그것들의 발현은 차등적으로 조절되는 것으로 제안되었다 (Youngnak, P. et al. (2003) "Differential Binding Properties Of B7-H1 And B7-DC To Programmed Death-1", Biochem. Biophys. Res. Commun. 307:672-677; Loke, P. et al. (2003) "PD-L1 And PD-L2 Are Differentially Regulated By Th1 And Th2 Cells", Proc. Natl. Acad. Sci. (U.S.A.) 100:5336-5341). PD-L1이 항원-특이적 T 세포 클론들의 세포자멸을 증가시킴으로써 종양 면역력에서 역할을 담당하는 것으로 제안되었다 (Dong et al. (2002) "Tumor-Associated B7-H1 Promotes T-Cell Apoptosis: A Potential Mechanism Of Immune Evasion", Nat Med 8:793-800). 또한 B7-H1이 장 점막 염증에 포함되었고 B7-H1의 억제가 대장염과 관련된 소모성 질환을 억제하는 것으로 제안되었다 (Kanai et al. (2003) "Blockade Of B7-H1 Suppresses The Development Of Chronic Intestinal Inflammation", J. Immunol. 171:4156-4163). B7-H1 발현이 인간의 폐, 난소, 및 결장 암종에서 및 흑색종에서 보고되었다 (Dong et al. (2002) "Tumor-Associated B7-H1 Promotes T-Cell Apoptosis: A Potential Mechanism Of Immune Evasion", Nat Med 8:793-800). 다른 한편으로, 종양에서 B7-DC의 기능은 대부분 알려지지 않은 채로 남아 있다 (Liu, X. et al. (2003) "B7-DC/PD-L2 Promotes Tumor Immunity By A PD-1-Independent Mechanism", J. Exp. Med. 197:1721-1730; Radhakrishnan, S. et al. (2004) "Immunotherapeutic Potential Of B7-DC (PD-L2) Cross-Linking Antibody In Conferring Antitumor Immunity", Cancer Res 64:4965-4972). 암 세포 상에서 B7-DC 발현은 또한 항종양 면역력의 유도 및 이펙터 단계에서 모두 CD8 T 세포-매개된 거부반응을 촉진하는 것으로 밝혀졌다 (Liu, X. et al. (2003) "B7-DC/PD-L2 Promotes Tumor Immunity By A PD-1-Independent Mechanism", J. Exp. Med. 197:1721-1730).
항-B7-H1 항체들은 면역원으로서 상기 제공된 B7-H1 아미노산 서열을 가지는 단백질을 사용하여 얻어질 수 있다. 대안적으로, PD-1의 천연 리간드에 결합할 수 있는 분자들의 생성에 유용한 항-B7-H1 항체들은 항-인간 B7-H1 항체 아테졸리주맙(atezolizumab) (CAS 등록 번호 1380723-44-3, 또한 MPDL3280A로서 알려짐), 두르발루맙(durvalumab) (CAS 등록 번호 1428935-60-7, 또한 MEDI-4736으로서 알려짐), 아벨루맙(avelumab), MDX1105 (CAS 등록 번호 1537032-82-8, 또한 BMS-936559로서 알려짐), 5H1); (또한, 미국 특허 번호 9,273,135, 9,062,112, 8,981,063, 8,779,108, 8,609,089 및 8,460,927; McDermott, D.F. et al. (2016) "Atezolizumab, an Anti-Programmed Death-Ligand 1 Antibody, in Metastatic Renal Cell Carcinoma: Long-Term Safety, Clinical Activity, And Immune Correlates From a Phase Ia Study", J. Clin. Oncol. 34(8):833-842; Antonia, S. et al. (2016) "Safety And Antitumour Activity Of Durvalumab Plus Tremelimumab In Non-Small Cell Lung Cancer: A Multicentre, Phase 1b Study", Lancet Oncol. 17(3):299-308; Boyerinas, B. et al. (2015) "Antibody-Dependent Cellular Cytotoxicity Activity of a Novel Anti-PD-L1 Antibody Avelumab (MSB0010718C) on Human Tumor Cells", Cancer Immunol Res. 3(10):1148-1157; Katy, K. et al. (2014) "PD-1 And PD-L1 Antibodies For Melanoma", Hum. Vaccin. Immunother. 10(11):3111-3116; Voena, C. et al. (2016) "Advances In Cancer Immunology And Cancer Immunotherapy", Discov. Med. 21(114):125-133 참조) 및/또는 상업적으로 입수 가능한 항체 (예컨대, 토끼 항-인간 PDL-1 단클론성, 1:25, 클론 SP142; Ventana, Tuscon, AZ)의 VL 및/또는 VH 도메인을 가질 수 있다.
본 발명에 따라 사용될 수 있는 예시의 항-인간 B7-H1 항체들로는 아테졸리주맙, 두르발루맙 및 아벨루맙을 들 수 있다. 아테졸리주맙 (WHO Drug Information, 2015, Recommended INN: List 74, 29(3):387), 두르발루맙 (WHO Drug Information, 2015, Recommended INN: List 74, 29(3):393-394) 및 아벨루맙 (WHO Drug Information, 2016, Recommended INN: List 74, 30(1):100-101)의 완전한 중쇄 및 경쇄의 아미노산 서열은 당업계에 알려져 있다.
항-B7-DC 항체들은 면역원으로서 상기 제공된 B7-DC 아미노산 서열을 가지는 단백질을 사용하여 얻어질 수 있다. 대안적으로, 앞서 기술된 항-B7-DC 항체들 (예컨대, 2C9, MIH18, 등) 또는 상업적으로 입수 가능한 항-B7-DC 항체들 (예컨대, MIH18, Affymetrix eBioscience)이 본 발명에 따라 사용될 수 있다 (미국 특허 공개 공보 번호 2015/0299322; Ritprajak, P. et al. (2012) "Antibodies Against B7-DC With Differential Binding Properties Exert Opposite Effects", Hybridoma (Larchmt). 31(1):40-47; Tsushima, F. et al. (2003) "Preferential Contribution Of B7-H1 To Programmed Death-1-Mediated Regulation Of Hapten-Specific Allergic Inflammatory Responses", Eur. J. Immunol. 33(10):2773-2782).
본 발명에 따라 사용될 수 있는 예시의 항-인간 항-B7-DC 항체는 상업적으로 입수 가능한 항-B7-DC 항체 MIH18 (eBioscience, Inc.)이다.
B. 표적 세포의 재지정된 사멸을 매개할 수 있는 분자들
표적 세포 (예컨대, 암 세포 또는 병원체-감염 세포)의 재지정된 사멸을 매개하는 능력을 가지는 본 발명의 분자들은 바람직하게는 두 가지의 결합 친화성을 가질 것이다. 첫째, 그러한 분자들은 이펙터 세포의 세포 표면 분자의 에피토프에 면역특이적으로 결합하는 능력을 가질 것이다. 두 번째로, 그러한 분자들은 표적 세포의 표면에 배열되는 질환 항원 (예컨대, 암 항원 또는 병원체-관련 항원)의 에피토프에 면역특이적으로 결합하는 능력을 가질 것이다. 그러한 두 가지 결합 친화성의 조합된 존재는 표적 세포의 부위에 이펙터 세포를 국한시키는 (즉, 이펙터 세포를 "재지정(redirect)"하는) 작용을 함으로써 표적 세포의 사멸을 매개할 수 있다. 상기에서 논의된 것과 같이, 그러한 분자들은 이중특이적일 수 있거나, 또는 2개 이상의 에피토프에 결합할 수 있다.
1. 이펙터 세포의 예시의 세포 표면 분자들
본원에서 사용되는 용어 "이펙터 세포"는 표적 세포 (예컨대, 외래 세포, 또는 감염된 세포 또는 암 세포)의 사멸을 직접적으로 또는 간접적으로 매개하는 세포를 나타낸다. 이펙터 세포의 예로는 헬퍼 T 세포, 세포독성 T 세포, 자연 살해 (NK) 세포, 형질 세포 (항체-분비 B 세포), 대식세포 및 과립구를 들 수 있다. 그러한 세포들의 바람직한 세포 표면 분자로는 CD2, CD3, CD8, CD16, TCR, 및 NKG2D 수용체를 들 수 있다. 따라서, 그러한 분자의 에피토프에, 또는 다른 이펙터 세포 표면 분자에 면역특이적으로 결합할 수 있는 분자들은 본 발명의 원리에 따라 사용될 수 있다. 그것들의 VH 및 VL 도메인이 표적 세포의 재지정된 사멸을 매개할 수 있는 분자들을 구성하기 위해 사용될 수 있는 예시의 항체들이 아래에서 제공된다.
(a) CD2 결합 능력
한 구체예에서, 표적 세포의 재지정된 사멸을 매개할 수 있는 본 발명의 분자들은 이펙터 세포에, 그런 이펙터 세포의 표면에 존재하는 CD2의 에피토프에 면역특이적으로 결합함으로써 결합할 것이다. CD2에 특이적으로 결합하는 분자들은 항-CD2 항체 "CD2 mAb Lo-CD2a"를 포함한다.
CD2 mAb Lo-CD2a의 VH 도메인의 아미노산 서열 (ATCC 기탁 번호: 11423; SEQ ID NO:190)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLQQSGPE LQRPGASVKL SCKASGYIFT EYYMY WVKQR PKQGLELVG R IDPEDGSIDY
VEKFKK KATL TADTSSNTAY MQLSSLTSED TATYFCAR GK FNYRFAY WGQ GTLVTVSS.
CD2 mAb Lo-CD2a의 VL 도메인의 아미노산 서열 (ATCC 기탁 번호: 11423; SEQ ID NO:191)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DVVLTQTPPT LLATIGQSVS ISC RSSQSLL HSSGNTYLN W LLQRTGQSPQ PLIY LVSKLE
S GVPNRFSGS GSGTDFTLKI SGVEAEDLGV YYC MQFTHYP YT FGAGTKLE LK.
(b) CD3 결합 능력
한 구체예에서, 표적 세포의 재지정된 사멸을 매개할 수 있는 본 발명의 분자들은 이펙터 세포에, 그런 이펙터 세포의 표면에 존재하는 CD3의 에피토프에 면역특이적으로 결합함으로써 결합할 것이다. CD3에 특이적으로 결합하는 분자들은 항-CD3 항체 "CD3 mAb 1" 및 "OKT3"을 포함한다. 항-CD3 항체 CD3 mAb 1은 비-인간 영장류 (예컨대 시노몰구스 원숭이)에 결합할 수 있다.
CD3 mAb 1의 VH 도메인의 아미노산 서열 (SEQ ID NO:192)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAASGFTFS TYAMN WVRQA PGKGLEWVG R IRSKYNNYAT
YYADSVK DRF TISRDDSKNS LYLQMNSLKT EDTAVYYCVR HGNFGNSYVS WFAY WGQGTL
VTVSS.
CD3 mAb 1의 VL 도메인의 아미노산 서열 (SEQ ID NO:193)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
QAVVTQEPSL TVSPGGTVTL TC RSSTGAVT TSNYAN WVQQ KPGQAPRGLI G GTNKRAP WT
PARFSGSLLG GKAALTITGA QAEDEADYYC ALWYSNLWV F GGGTKLTVLG.
그런 항체의 바람직한 변종은 "CD3 mAb 1 (D65G)"로 명명되고, D65G 치환 (Kabat 위치 65, SEQ ID NO:192의 잔기 68에 해당함)을 가지는 CD3 mAb 1 VH 도메인 및 CD3 mAb 1의 VL 도메인 (SEQ ID NO:193)을 포함한다. CD3 mAb 1의 VH 도메인의 아미노산 서열 (D65G) (SEQ ID NO:194)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨, 치환된 위치 (D65G)는 이중 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAASGFTFS TYAMN WVRQA PGKGLEWVG R IRSKYNNYAT
YYADSVK GRF TISRDDSKNS LYLQMNSLKT EDTAVYYCVR HGNFGNSYVS WFAY WGQGTL
VTVSS.
대안적으로, CD3 mAb 1의 친화성 변종이 사용될 수 있다. 변종은 "CD3 mAb 1 Low"로 불리는 저친화성 변종 및 "CD3 mAb 1 Fast"로 불리는, 더 빠른 오프 속도를 가지는 변종을 포함한다. CD3 mAb 1 Low 및 CD3 mAb1 Fast의 각각의 VH 도메인의 아미노산 서열은 아래에서 제공된다.
항-인간 CD3 mAb 1 Low의 VH 도메인의 아미노산 서열 (SEQ ID NO:195)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAASGFTFS TYAMN WVRQA PGKGLEWVG R IRSKYNNYAT
YYADSVKG RF TISRDDSKNS LYLQMNSLKT EDTAVYYCVR HGNFGNSYVT WFAY WGQGTL
VTVSS.
항-인간 CD3 mAb 1 Fast의 VH 도메인의 아미노산 서열 (SEQ ID NO:196)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAAS GFTFS TYAMN WVRQA PGKGLEWVG R IRSKYNNYAT
YYADSVKG RF TISRDDSKNS LYLQMNSLKT EDTAVYYCVR HKNFGNSYVT WFAY WGQGTL
VTVSS.
CD3 mAb 1의 VL 도메인 (SEQ ID NO:193)은 CD3 mAb 1 Low 및 CD3 mAb1 Fast에 공통이고 상기에서 제공된다.
활용될 수 있는 다른 항-CD3 항체는 항체 뮤로모납(Muromonab)-CD3 "OKT3"이다 (Xu et al. (2000) "In Vitro Characterization Of Five Humanized OKT3 Effector Function Variant Antibodies", Cell. Immunol. 200:16-26); Norman, D.J. (1995) "Mechanisms Of Action And Overview Of OKT3", Ther. Drug Monit. 17(6):615-620; Canafax, D.M. et al. (1987) "Monoclonal Antilymphocyte Antibody (OKT3) Treatment Of Acute Renal Allograft Rejection", Pharmacotherapy 7(4):121-124; Swinnen, L.J. et al. (1993) "OKT3 Monoclonal Antibodies Induce Interleukin-6 And Interleukin-10: A Possible Cause Of Lymphoproliferative Disorders Associated With Transplantation", Curr. Opin. Nephrol. Hypertens. 2(4):670-678).
OKT3의 VH 도메인의 아미노산 서열 (SEQ ID NO:197)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLQQSGAE LARPGASVKM SCKASGYTFT RYTMH WVKQR PGQGLEWIG Y INPSRGYTNY
NQKFKD KATL TTDKSSSTAY MQLSSLTSED SAVYYCAR YY DDHYCL DYWG QGTTLTVSS.
OKT3의 VL 도메인의 아미노산 서열 (SEQ ID NO:198)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
QIVLTQSPAI MSASPGEKVT MTC SASSSVS YMN WYQQKSG TSPKRWIY DT SKLAS GVPAH
FRGSGSGTSY SLTISGMEAE DAATYYC QQW SSNPFTF GSG TKLEINR.
활용될 수 있는 추가적인 항-CD3 항체들은, 한정하는 것은 아니지만, PCT 공개공보 번호 WO 2008/119566; 및 WO 2005/118635에 기술된 것들을 포함한다.
(c) CD8 결합 능력
한 구체예에서, 표적 세포의 재지정된 사멸을 매개할 수 있는 본 발명의 분자들은 이펙터 세포에, 그런 이펙터 세포의 표면에 존재하는 CD8의 에피토프에 면역특이적으로 결합함으로써 결합할 것이다. CD8에 특이적으로 결합하는 항체들은 항-CD8 항체 "OKT8" 및 "TRX2"를 포함한다.
(i) OKT8
OKT8의 VH 도메인의 아미노산 서열 (SEQ ID NO:199)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLLESGPE LLKPGASVKM SCKA SGYTFT DYNMH WVKQS HGKSLEWIG Y IYPYTGGTGY
NQKFKN KATL TVDSSSSTAY MELRSLTSED SAVYYCARNF RYTYWYFDVW GQGTTVTVSS.
OKT8의 VL 도메인의 아미노산 서열 (SEQ ID NO:200)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIVMTQSPAS LAVSLGQRAT ISCRASESVD SYDNSLMH WY QQKPGQPPKV LIY LASNLES
GVPARFSGSG SRTDFTLTID PVEADDAATY YC QQNNEDPY T FGGGTKLEI KR.
(ii) TRX2
TRX2의 VH 도메인의 아미노산 서열 (SEQ ID NO:201)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVESGGG VVQPGRSLRL SCAASGFTFS DFGMN WVRQA PGKGLEWVA L IYYDGSNKFY
ADSVKG RFTI SRDNSKNTLY LQMNSLRAED TAVYYCAK PH YDGYYHFFDS WGQGTLVTVS S.
TRX2의 VL 도메인의 아미노산 서열 (SEQ ID NO:202)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC KGSQDIN NYLA WYQQKP GKAPKLLIY N TDILHT GVPS
RFSGSGSGTD FTFTISSLQP EDIATYYC YQ YNNGYT FGQG TKVEIK.
(d) CD16 결합 능력
한 구체예에서, 표적 세포의 재지정된 사멸을 매개할 수 있는 본 발명의 분자들은 이펙터 세포에, 그런 이펙터 세포의 표면에 존재하는 CD16의 에피토프에 면역특이적으로 결합함으로써 결합할 것이다. CD16에 특이적으로 결합하는 항체들은 항-CD16 항체 "3G8" 및 "A9"를 포함한다. 인간화된 A9 항체들은 PCT 공개 공보 WO 03/101485에 기술되어 있다.
(i) 3G8
3G8의 VH 도메인의 아미노산 서열 (SEQ ID NO:203)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVTLKESGPG ILQPSQTLSL TCSFSGFSLR TSGMGVG WIR QPSGKGLEWL A HIWWDDDKR
YNPALKS RLT ISKDTSSNQV FLKIASVDTA DTATYYCAQ I NPAWFAY WGQ GTLVTVSA.
3G8의 VL 도메인의 아미노산 서열 (SEQ ID NO:204)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DTVLTQSPAS LAVSLGQRAT ISC KASQSVD FDGDSFMN WY QQKPGQPPKL LIY TTSNLES
GIPARFSASG SGTDFTLNIH PVEEEDTATY YC QQSNEDPY T FGGGTKLEI K.
(i) A9
A9의 VH 도메인의 아미노산 서열 (SEQ ID NO:205)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLQQSGAE LVRPGTSVKI SCKASGYTFT NYWLG WVKQR PGHGLEWIG D IYPGGGYTNY
NEKFKG KATV TADTSSRTAY VQVRSLTSED SAVYFCAR SA SWYFD VWGAR TTVTVSS.
A9의 VL 도메인의 아미노산 서열 (SEQ ID NO:206)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQAVVTQES ALTTSPGETV TLTC RSNTGT VTTSNYAN WV QEKPDHLFTG LIG HTNNRAP
GVPARFSGSL IGDKAALTIT GAQTEDEAIY FC ALWYNNHW V FGGGTKLTVL.
활용될 수 있는 추가적인 항-CD19 항체들은, 한정하는 것은 아니지만, PCT 공개공보 번호 WO 03/101485; 및 WO 2006/125668에 기술되어 있는 것들을 포함한다.
(e) TCR 결합 능력
한 구체예에서, 표적 세포의 재지정된 사멸을 매개할 수 있는 본 발명의 분자들은 이펙터 세포에, 그런 이펙터 세포의 표면에 존재하는 TCR의 에피토프에 면역특이적으로 결합함으로써 결합할 것이다.
T 세포 수용체에 특이적으로 결합하는 분자들은 항-TCR 항체 "BMA 031"을 포함한다 (EP 0403156; Kurrle, R. et al. (1989) "BMA 031 - A TCR-Specific Monoclonal Antibody For Clinical Application", Transplant Proc. 21(1 Pt 1):1017-1019; Nashan, B. et al. (1987) "Fine Specificity Of A Panel Of Antibodies Against The TCR/CD3 Complex", Transplant Proc. 19(5):4270-4272; Shearman, C.W. et al. (1991) "Construction, Expression, And Biologic Activity Of Murine/Human Chimeric Antibodies With Specificity For The Human α/β T Cell", J. Immunol. 146(3):928-935; Shearman, C.W. et al. (1991) "Construction, Expression And Characterization of Humanized Antibodies Directed Against The Human α/β T Cell Receptor", J. Immunol. 147(12):4366-4373).
BMA 031의 VH 도메인의 아미노산 서열 (SEQ ID NO:207)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVQSGAE VKKPGASVKV SCKASGYKFT SYVMH WVRQA PGQGLEWIG Y INPYNDVTKY
NEKFKG RVTI TADKSTSTAY LQMNSLRSED TAVHYCAR GS YYDYDGFVY W GQGTLVTVSS.
BMA 031의 VL 도메인의 아미노산 서열 (SEQ ID NO:208)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
EIVLTQSPAT LSLSPGERAT LSC SATSSVS YMH WYQQKPG KAPKRWIY DT SKLAS GVPSR
FSGSGSGTEF TLTISSLQPE DFATYYC QQW SSNPLT FGQG TKLEIK.
(f) NKG2D 결합 능력
한 구체예에서, 표적 세포의 재지정된 사멸을 매개할 수 있는 본 발명의 분자들은 이펙터 세포에, 그런 이펙터 세포의 표면에 존재하는 NKG2D 수용체의 에피토프에 면역특이적으로 결합함으로써 결합할 것이다. NKG2D 수용체에 특이적으로 결합하는 항체들은 항-NKG2D 항체 "KYK-1.0" 및 "KYK-2.0"을 포함한다 (Kwong, KY et al. (2008) "Generation, Affinity Maturation, And Characterization Of A Human Anti-Human NKG2D Monoclonal Antibody With Dual Antagonistic And Agonistic Activity", J. Mol. Biol. 384:1143-1156; 및 PCT/US09/54911).
(i) KYK-1.0
KYK-1.0의 VH 도메인의 아미노산 서열 (SEQ ID NO:209)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG VVQPGGSLRL SCAASGFTFS SYGMH WVRQA PGKGLEWVA F IRYDGSNKYY
ADSVKG RFTI SRDNSKNTKY LQMNSLRAED TAVYYCAK DR FGYYLDY WGQ GTLVTVSS.
KYK-1.0의 VL 도메인의 아미노산 서열 (SEQ ID NO:210)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
QPVLTQPSSV SVAPGETARI PC GGDDIETK SVH WYQQKPG QAPVLVIY DD DDRPS GIPER
FFGSNSGNTA TLSISRVEAG DEADYYC QVW DDNNDEWV FG GGTQLTVL.
(ii) KYK-2.0
KYK-2.0의 VH 도메인의 아미노산 서열 (SEQ ID NO:211)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVESGGG LVKPGGSLRL SCAASGFTFS SYGMH WVRQA PGKGLEWVA F IRYDGSNKYY
ADSVKG RFTI SRDNSKNTLY LQMNSLRAED TAVYYCAK DR GLGDGTYFDY WGQGTTVTVS S.
KYK-2.0의 VL 도메인의 아미노산 서열 (SEQ ID NO:212)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
QSALTQPASV SGSPGQSITI SC SGSSSNIG NNAVN WYQQL PGKAPKLLIY YDDLLPS GVS
DRFSGSKSGT SAFLAISGLQ SEDEADYYC A AWDDSLNGPV FGGGTKLTVL.
C. 암 세포의 표면에 배열되는 예시의 암 항원
본원에서 사용되는 "암 항원"은 암 세포의 표면에서 특징적으로 발현되는 항원, 및 그로써 항체-기반 분자 또는 면역조절 분자로 처리될 수 있는 항원을 나타낸다. 암 항원의 예로는, 한정하는 것은 아니지만 다음을 포함한다: 결장암, 위암 뮤신에서 발견되는 19.9,; 4.2; A33 (대장 암종 항원; Almqvist, Y. (2006) "In vitro And in vivo Characterization of 177Lu-huA33: A Radioimmunoconjugate Against Colorectal Cancer", Nucl. Med. Biol. 33(8):991-998); ADAM-9 (미국 특허 공개공보 번호 2006/0172350; PCT 공개공보 번호 WO 06/084075); 위암에서 발견되는 AH6; ALCAM (PCT 공개공보 번호 WO 03/093443); APO-1 (악성 인간 림프구 항원) (Trauth, B.C. et al. (1989) "Monoclonal Antibody-Mediated Tumor Regression By Induction Of Apoptosis", Science 245:301-304); B1 (Egloff, A.M. et al. (2006) "Cyclin B1 And Other Cyclins As Tumor Antigens In Immunosurveillance And Immunotherapy Of Cancer", Cancer Res. 66(1):6-9); B7-H3 (Collins, M. et al. (2005) "The B7 Family Of Immune-Regulatory Ligands", Genome Biol. 6:223.1-223.7). Chapoval, A. et al. (2001) "B7-H3: A Costimulatory Molecule For T Cell Activation And IFN-γ Production", Nature Immunol. 2:269-274; Sun, M. et al. (2002) "Characterization of Mouse And Human B7-H3 Genes", J. Immunol. 168:6294-6297); BAGE (Bodey, B. (2002) "Cancer-Testis Antigens: Promising Targets For Antigen Directed Antineoplastic Immunotherapy", Expert Opin. Biol. Ther. 2(6):577-584); 베타-카테닌 (Prange W. et al. (2003) "Beta-Catenin Accumulation In The Progression Of Human Hepatocarcinogenesis Correlates With Loss Of E-Cadherin And Accumulation Of P53, But Not With Expression Of Conventional WNT-1 Target Genes", J. Pathol. 201(2):250-259); 결장 선암종에서 발견되는 혈액 군 ALe b /Le y ; 버킷 림프종 항원-38.13; 결장 선암종에서 발견되는 C14; CA125 (난소 암종 항원) (Bast, R.C. Jr. et al. (2005) "New Tumor Markers: CA125 And Beyond", Int. J. Gynecol. Cancer 15(Suppl 3):274-281; Yu et al. (1991) "Coexpression Of Different Antigenic Markers On Moieties That Bear CA 125 Determinants", Cancer Res. 51(2):468-475); 카르복시펩티다제 M (미국 특허 공개공보 번호 2006/0166291); CD5 (Calin, G.A. et al. (2006) "Genomics Of Chronic Lymphocytic Leukemia MicroRNAs As New Players With Clinical Significance", Semin. Oncol. 33(2):167-173; CD19 (Ghetie et al. (1994) "Anti-CD19 Inhibits The Growth Of Human B-Cell Tumor Lines In Vitro And Of Daudi Cells In SCID Mice By Inducing Cell Cycle Arrest", Blood 83:1329-1336; Troussard, X. et al. 1998 Hematol Cell Ther. 40(4):139-48); CD20 (Reff et al. (1994) "Depletion Of B Cells In Vivo By A Chimeric Mouse Human Monoclonal Antibody To CD20", Blood 83:435-445; Thomas, D.A. et al. 2006 Hematol Oncol Clin North Am. 20(5):1125-36); CD22 (Kreitman, R.J. (2006) "Immunotoxins For Targeted Cancer Therapy", AAPS J. 8(3):E532-51); CD23 (Rosati, S. et al. (2005) "Chronic Lymphocytic Leukaemia: A Review Of The Immuno-Architecture", Curr. Top. Microbiol. Immunol. 294:91-107); CD25 (Troussard, X. et al. (1998) "Hairy Cell Leukemia. What Is New Forty Years After The First Description?" Hematol. Cell. Ther. 40(4):139-148); CD27 (Bataille, R. (2006) "The Phenotype Of Normal, Reactive And Malignant Plasma Cells. Identification Of "Many And Multiple Myelomas" And Of New Targets For Myeloma Therapy", Haematologica 91(9):1234-1240); CD28 (Bataille, R. (2006) "The Phenotype Of Normal, Reactive And Malignant Plasma Cells. Identification Of "Many And Multiple Myelomas" And Of New Targets For Myeloma Therapy", Haematologica 91(9):1234-1240); CD33 (Sgouros et al. (1993) "Modeling And Dosimetry Of Monoclonal Antibody M195 (Anti-CD33) In Acute Myelogenous Leukemia", J. Nucl. Med. 34:422-430); CD36 (Ge, Y. (2005) "CD36: A Multiligand Molecule", Lab Hematol. 11(1):31-7); CD40/CD154 (Messmer, D. et al. (2005) "CD154 Gene Therapy For Human B-Cell Malignancies", Ann. N. Y. Acad. Sci. 1062:51-60); CD45 (Jurcic, J.G. (2005) "Immunotherapy For Acute Myeloid Leukemia", Curr. Oncol. Rep. 7(5):339-346); CD56 (Bataille, R. (2006) "The Phenotype Of Normal, Reactive And Malignant Plasma Cells. Identification Of "Many And Multiple Myelomas" And Of New Targets For Myeloma Therapy", Haematologica 91(9):1234-1240); CD46 (미국 특허 번호 7,148,038; PCT 공개공보 번호 WO 03/032814); CD52 (Eketorp, S.S. et al. (2014) "Alemtuzumab (Anti-CD52 Monoclonal Antibody) As Single-Agent Therapy In Patients With Relapsed/Refractory Chronic Lymphocytic Leukaemia (CLL)-A Single Region Experience On Consecutive Patients", Ann Hematol. 93(10):1725-1733; Suresh, T. et al. (2014) "New Antigen Approaches To Lymphoma Therapy", J. Hematol. Oncol. 7:58; Hoelzer, D. (2013) "Targeted Therapy With Monoclonal Antibodies In Acute Lymphoblastic Leukemia", Curr. Opin. Oncol. 25(6):701-706); CD56 (Bataille, R. (2006) "The Phenotype Of Normal, Reactive And Malignant Plasma Cells. Identification Of "Many And Multiple Myelomas" And Of New Targets For Myeloma Therapy", Haematologica 91(9):1234-1240); CD79a/CD79b (Troussard, X. et al. (1998) "Hairy Cell Leukemia. What Is New Forty Years After The First Description?" Hematol. Cell. Ther. 40(4):139-148; Chu, P.G. et al. (2001) "CD79: A Review", Appl. Immunohistochem. Mol. Morphol. 9(2):97-106); CD103 (Troussard, X. et al. (1998) "Hairy Cell Leukemia. What Is New Forty Years After The First Description?" Hematol. Cell. Ther. 40(4):139-148); CD317 (Kawai, S. et al. (2008) "Interferon-A Enhances CD317 Expression And The Antitumor Activity Of Anti-CD317 Monoclonal Antibody In Renal Cell Carcinoma Xenograft Models", Cancer Science 99(12):2461-2466; Wang, W. et al. (2009) HM1.24 (CD317) Is A Novel Target Against Lung Cancer For Immunotherapy Using Anti-HM1.24 Antibody", Cancer Immunology, Immunotherapy 58(6):967-976; Wang, W. et al. (2009) "Chimeric And Humanized Anti-HM1.24 Antibodies Mediate Antibody-Dependent Cellular Cytotoxicity Against Lung Cancer Cells. Lung Cancer", 63(1):23-31; Sayeed, A. et al. (2013) "Aberrant Regulation Of The BST2 (Tetherin) Promoter Enhances Cell Proliferation And Apoptosis Evasion In High Grade Breast Cancer Cells", PLoS ONE 8(6)e67191, pp. 1-10); CDK4 (Lee, Y.M. et al. (2006) "Targeting Cyclins 및 Cyclin-Dependent Kinases In Cancer: Lessons From Mice, Hopes For Therapeutic Applications In Human", Cell Cycle 5(18):2110-2114); CEA (암배아 항원; Foon et al. (1995) "Immune Response To The Carcinoembryonic Antigen In Patients Treated With An Anti-Idiotype Antibody Vaccine", J. Clin. Invest. 96(1):334-42); Mathelin, C. (2006) "Circulating Proteinic Biomarkers And Breast Cancer", Gynecol. Obstet. Fertil. 34(7-8):638-646; Tellez-Avila, F.I. et al. (2005) "The Carcinoembryonic Antigen: Apropos Of An Old Friend", Rev. Invest. Clin. 57(6):814-819); CEACAM5/CEACAM6 (Zheng, C. et al. (2011) "A Novel Anti-CEACAM5 Monoclonal Antibody, CC4, Suppresses Colorectal Tumor Growth 및 Enhances NK Cells-Mediated Tumor Immunity", PLoS One 6(6):e21146, pp. 1-11); CO17-1A (Ragnhammar et al. (1993) "Effect Of Monoclonal Antibody 17-1A And GM-CSF In Patients With Advanced Colorectal Carcinoma - Long-Lasting, Complete Remissions Can Be Induced", Int. J. Cancer 53:751-758); CO-43 (혈액 군 Leb); 선암종에서 발견되는 CO-514 (혈액 군 Lea); CTA-1; CTLA-4 (Peggs, K.S. et al. (2006) "Principles And Use Of Anti-CTLA4 Antibody In Human Cancer Immunotherapy", Curr. Opin. Immunol. 18(2):206-13); 사이토케라틴 8 (PCT 공개공보 번호 WO 03/024191); D1.1; D 1 56-22; DR5 (Abdulghani, J. et al. (2010) "TRAIL Receptor Signaling And Therapeutics", Expert Opin. Ther. Targets 14(10):1091-1108; Andera, L. (2009) "Signaling Activated By The Death Receptors Of The TNFR Family", Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech. Repub. 153(3):173-180; Carlo-Stella, C. et al. (2007) "Targeting TRAIL Agonistic Receptors for Cancer Therapy", Clin, Cancer 13(8):2313-2317; Chaudhari, B.R. et al. (2006) "Following the TRAIL to Apoptosis", Immunologic Res. 35(3):249-262); 췌장암에서 발견되는 E 1 시리즈 (혈액 군 B); EGFR (상피 성장 인자 수용체; Adenis, A. et al. (2003) "Inhibitors Of Epidermal Growth Factor Receptor And Colorectal Cancer", Bull. Cancer. 90 Spec No:S228-S232); 에프린 (Ephrin) 수용체 (및 특히 EphA2 (미국 특허 번호 7,569,672; PCT 공개공보 번호 WO 06/084226); Erb (ErbB1; ErbB3; ErbB4; Zhou, H. et al. (2002) "Lung Tumorigenesis Associated With Erb-B-2 And Erb-B-3 Overexpression In Human Erb-B-3 Transgenic Mice Is Enhanced By Methylnitrosourea", Oncogene 21(57):8732-8740; Rimon, E. et al. (2004) "Gonadotropin-Induced Gene Regulation In Human Granulosa Cells Obtained From IVF Patients: Modulation Of Genes Coding For Growth Factors And Their Receptors And Genes Involved In Cancer And Other Diseases", Int. J. Oncol. 24(5):1325-1338); GAGE (GAGE-1; GAGE-2; Akcakanat, A. et al. (2006) "Heterogeneous Expression Of GAGE, NY-ESO-1, MAGE-A and SSX Proteins In Esophageal Cancer: Implications For Immunotherapy", Int. J. Cancer. 118(1):123-128); GD2/GD3/GM2 (Livingston, P.O. et al. (2005) "Selection Of GM2, Fucosyl GM1, Globo H And Polysialic Acid As Targets On Small Cell Lung Cancers For Antibody-Mediated Immunotherapy", Cancer Immunol. Immunother. 54(10):1018-1025); 강글리오사이드 GD2 (GD2; Saleh et al. (1993) "Generation Of A Human Anti-Idiotypic Antibody That Mimics The GD2 Antigen", J. Immunol., 151, 3390-3398); 강글리오사이드 GD3 (GD3; Shitara et al. (1993) "A Mouse/Human Chimeric Anti-(Ganglioside GD3) Antibody With Enhanced Antitumor Activities", Cancer Immunol. Immunother. 36:373-380); 강글리오사이드 GM2 (GM2; Livingston et al. (1994) "Improved Survival In Stage III Melanoma Patients With GM2 Antibodies: A Randomized Trial Of Adjuvant Vaccination With GM2 Ganglioside", J. Clin. Oncol. 12:1036-1044); 강글리오사이드 GM3 (GM3; Hoon et al. (1993) "Molecular Cloning Of A Human Monoclonal Antibody Reactive To Ganglioside GM3 Antigen On Human Cancers", Cancer Res. 53:5244-5250); GICA 19-9 (Herlyn et al. (1982) "Monoclonal Antibody Detection Of A Circulating Tumor-Associated Antigen. I. Presence Of Antigen In Sera Of Patients With Colorectal, Gastric, And Pancreatic Carcinoma", J. Clin. Immunol. 2:135-140); gp100 (Lotem, M. et al. (2006) "Presentation Of Tumor Antigens By Dendritic Cells Genetically Modified With Viral And Nonviral Vectors", J. Immunother. 29(6):616-27); Gp37 (인간 백혈병 T 세포 항원; Bhattacharya-Chatterjee et al. (1988) "Idiotype Vaccines Against Human T Cell Leukemia. II. Generation And Characterization Of A Monoclonal Idiotype Cascade (Ab1, Ab2, and Ab3)", J. Immunol. 141:1398-1403); gp75 (흑색종 항원; Vijayasardahl et al. (1990) "The Melanoma Antigen Gp75 Is The Human Homologue Of The Mouse B (Brown) Locus Gene Product", J. Exp. Med. 171(4):1375-1380); gpA33 (Heath, J.K. et al. (1997) "The Human A33 Antigen Is A Transmembrane Glycoprotein And A Novel Member Of The Immunoglobulin Superfamily", Proc. Natl. Acad. Sci. (U.S.A.) 94(2):469-474; Ritter, G. et al. (1997) "Characterization Of Posttranslational Modifications Of Human A33 Antigen, A Novel Palmitoylated Surface Glycoprotein Of Human 위장 Epithelium", Biochem. Biophys. Res. Commun. 236(3):682-686; Wong, N.A. et al. (2006) "EpCAM and gpA33 Are Markers Of Barrett's Metaplasia", J. Clin. Pathol. 59(3):260-263); HER2 항원 (HER2/neu, p185HER2; Pal, S.K. et al. (2006) "Targeting HER2 Epitopes", Semin. Oncol. 33(4):386-391); HMFG (인간 유지방 구상체 항원; WO1995015171); 인간 유두종 바이러스-E6/인간 유두종 바이러스-E7 (DiMaio, D. et al. (2006) "Human Papillomaviruses And Cervical Cancer", Adv. Virus Res. 66:125-59; HMW-MAA (고분자량 흑색종 항원; Natali et al. (1987) "Immunohistochemical Detection Of Antigen In Human Primary And Metastatic Melanomas By The Monoclonal Antibody 140.240 And Its Possible Prognostic Significance", Cancer 59:55-63; Mittelman et al. (1990) "Active Specific Immunotherapy In Patients With Melanoma. A Clinical Trial With Mouse Antiidiotypic Monoclonal Antibodies Elicited With Syngeneic Anti-High-Molecular-Weight-Melanoma-Associated Antigen Monoclonal Antibodies", J. Clin. Invest. 86:2136-2144); I 항원 (분화 항원; Feizi (1985) "Demonstration By Monoclonal Antibodies That Carbohydrate Structures Of Glycoproteins And Glycolipids Are Onco-Developmental Antigens", Nature 314:53-57); IL13Rα2 (PCT 공개공보 번호 WO 2008/146911; Brown, C.E. et al. (2013) "Glioma IL13Rα2 Is Associated With Mesenchymal Signature Gene Expression And Poor Patient Prognosis", PLoS One. 18;8(10):e77769; Barderas, R. et al. (2012) "High Expression Of IL-13 Receptor A2 In Colorectal Cancer Is Associated With Invasion, Liver Metastasis, And Poor Prognosis", Cancer Res. 72(11):2780-2790; Kasaian, M.T. et al. (2011) "IL-13 Antibodies Influence IL-13 Clearance In Humans By Modulating Scavenger Activity Of IL-13Rα2", J. Immunol. 187(1):561-569; Bozinov, O. et al. (2010) "Decreasing Expression Of The Interleukin-13 Receptor IL-13Ralpha2 In Treated Recurrent Malignant Gliomas", Neurol. Med. Chir. (Tokyo) 50(8):617-621; Fujisawa, T. et al. (2009) "A novel role of interleukin-13 Receptor alpha2 in pancreatic Cancer invasion and metastasis", Cancer Res. 69(22):8678-8685); 인티그린 β6 (PCT 공개공보 번호 WO 03/087340); JAM-3 (PCT 공개공보 번호 WO 06/084078); KID3 (PCT 공개공보 번호 WO 05/028498); KID31 (PCT 공개공보 번호 WO 06/076584); KS 1/4 pan-암종 항원 (Perez et al. (1989) "Isolation And Characterization Of A cDNA Encoding The Ks1/4 Epithelial Carcinoma Marker", J. Immunol. 142:3662-3667; Moller et al. (1991) "Bi-specific-Monoclonal-Antibody-Directed Lysis Of Ovarian Carcinoma Cells By Activated Human T Lymphocytes", Cancer Immunol. Immunother. 33(4):210-216; Ragupathi, G. 2005 Cancer Treat Res. 123:157-80); L6 및 L20 (인간 폐 암종 항원; Hellstrom et al. (1986) "Monoclonal Mouse Antibodies Raised Against Human Lung Carcinoma", Cancer Res. 46:3917-3923); LEA; LUCA-2 (미국 특허 공보 2006/0172349; PCT 공개공보 번호 WO 06/083852); M1:22:25:8; M18; M39; MAGE (MAGE-1; MAGE-3; (Bodey, B. (2002) "Cancer-Testis Antigens: Promising Targets For Antigen Directed Antineoplastic Immunotherapy", Expert Opin. Biol. Ther. 2(6):577-584); MART (Kounalakis, N. et al. (2005) "Tumor Cell And Circulating Markers In Melanoma: Diagnosis, Prognosis, And Management", Curr. Oncol. Rep. 7(5):377-382; 메소텔린 (Chang, K. et al. (1996) "Molecular Cloning Of Mesothelin, A Differentiation Antigen Present On Mesothelium, Mesotheliomas, And Ovarian Cancers", Proc. Natl. Acad. Sci. (U.S.A.) 93:136-140); MUC-1 (Mathelin, C. (2006) "Circulating Proteinic Biomarkers And Breast Cancer", Gynecol. Obstet. Fertil. 34(7-8):638-646); MUM-1 (Castelli, C. et al. (2000) "T-Cell Recognition Of Melanoma-Associated Antigens", J. Cell. Physiol. 182(3):323-331); Myl; N-아세틸글루코사미닐트랜스퍼라제 (Dennis, J.W. (1999) "Glycoprotein Glycosylation And Cancer Progression", Biochim. Biophys. Acta. 6;1473(1):21-34); 네오당단백질; 선암종에서 발견되는 NS-10; OFA-1; OFA-2; 온코스타틴 M (온코스타틴 수용체 베타; 미국 특허 번호 7,572,896; PCT 공개공보 번호 WO 06/084092); p15 (Gil, J. et al. (2006) "Regulation Of The INK4b-ARF-INK4a Tumour Suppressor Locus: All For One Or One For All", Nat. Rev. Mol. Cell Biol. 7(9):667-677); p97 (흑색종-관련 항원; Estin et al. (1989) "Transfected Mouse Melanoma Lines That Express Various Levels Of Human Melanoma-Associated Antigen p97", J. Natl. Cancer Instit. 81(6):445-454); PEM (다형성 상피 뮤신; Hilkens et al. (1992) "Cell Membrane-Associated Mucins And Their Adhesion-Modulating Property", Trends in Biochem. Sci. 17:359-363); PEMA (다형성 상피 뮤신 항원); PIPA (미국 특허 번호 7,405,061; PCT 공개공보 번호 WO 04/043239); PSA (전립선-특이적 항원; Henttu et al. (1989) "cDNA Coding For The Entire Human Prostate Specific Antigen Shows High Homologies To The Human Tissue Kallikrein Genes", Biochem. Biophys. Res. Comm. 10(2):903-910; Israeli et al. (1993) "Molecular Cloning Of A Complementary DNA Encoding A Prostate-Specific Membrane Antigen", Cancer Res. 53:227-230; Cracco, C.M. et al. (2005) "Immune Response In Prostate Cancer", Minerva Urol. Nefrol. 57(4):301-311); PSMA (전립선-특이적 막 항원; Ragupathi, G. (2005) "Antibody Inducing Polyvalent Cancer Vaccines", Cancer Treat. Res. 123:157-180); 전립선 산 포스페이트 (Tailor et al. (1990) "Nucleotide Sequence Of Human Prostatic Acid Phosphatase Determined From A Full-Length cDNA Clone", Nucl. Acids Res. 18(16):4928); 흑색종에서 발견되는 것과 같은 R 24 ; ROR1 (미국 특허 번호 5,843,749); 스핑고지질; SSEA-1; SSEA-3; SSEA-4; sTn (Holmberg, L.A. (2001) "Theratope Vaccine (STn-KLH)", Expert Opin. Biol. Ther. 1(5):881-91); 피부 T 세포 림프종으로부터의 T 세포 수용체 유도 펩타이드 (Edelson (1998) "Cutaneous T-Cell Lymphoma: A Model For Selective Immunotherapy", Cancer J. Sci. Am. 4:62-71 참조); 골수종 세포에서 발견된 T 5 A 7 ; TAG-72 (Yokota et al. (1992) "Rapid Tumor Penetration Of A Single-Chain Fv And Comparison With Other Immunoglobulin Forms", Cancer Res. 52:3402-3408); TL5 (혈액 군 A); TNF-수용체 (TNF-α 수용체, TNF-β 수용체; TNF-γ 수용체 (van Horssen, R. et al. (2006) "TNF-Alpha In Cancer Treatment: Molecular Insights, Antitumor Effects, And Clinical Utility", Oncologist 11(4):397-408; Gardnerova, M. et al. (2000) "The Use Of TNF Family Ligands And Receptors And Agents Which Modify Their Interaction As Therapeutic Agents", Curr. Drug Targets 1(4):327-364); TRA-1-85 (혈액 군 H); 트랜스페린 수용체 (미국 특허 번호 7,572,895; PCT 공개공보 번호 WO 05/121179); 5T4 (TPBG, 영양막 당단백질; Boghaert, E.R. et al. (2008) "The Oncofetal Protein, 5T4, Is A Suitable Target For Antibody-Guided Anti-Cancer Chemotherapy With Calicheamicin", Int. J. Oncol. 32(1):221-234; Eisen, T. et al. (2014) "Naptumomab Estafenatox: Targeted Immunotherapy with a Novel Immunotoxin", Curr. Oncol. Rep. 16:370, pp. 1-6); TSTA (종양-특이적 이식 항원), 예컨대 T-항원 DNA 종양 바이러스 및 RNA 종양 바이러스의 엔벨로프 항원을 포함하는 바이러스-유도된 종양 항원, 결장의 CEA와 같은 종양태아 항원-알파-태아 단백질, 방광 종양 종양태아 항원 (Hellstrom et al. (1985) "Monoclonal Antibodies To Cell Surface Antigens Shared By Chemically Induced Mouse Bladder Carcinomas", Cancer. Res. 45:2210-2188); VEGF (Pietrantonio, F. et al. (2015) "Bevacizumab-Based Neoadjuvant Chemotherapy For Colorectal Cancer Liver Metastases: Pitfalls And Helpful Tricks In A Review For Clinicians", Crit. Rev. Oncol. Hematol. 95(3):272-281; Grabowski, J.P. (2015) "Current Management Of Ovarian Cancer", Minerva Med. 106(3):151-156; Field, K.M. (2015) "Bevacizumab And Glioblastoma: Scientific Review, Newly Reported Updates, And Ongoing Controversies", Cancer 121(7):997-1007; Suh, D.H. et al. (2015) "Major Clinical Research Advances In Gynecologic Cancer In 2014", J. Gynecol. Oncol. 26(2):156-167; Liu, K.J. et al. (2015) "Bevacizumab In Combination With Anticancer Drugs For Previously Treated Advanced Non-Small Cell Lung Cancer", Tumour Biol. 36(3):1323-1327; Di Bartolomeo, M. et al. (2015) "Bevacizumab Treatment In The Elderly Patient With Metastatic Colorectal Cancer", Clin. Interv. Aging 10:127-133); VEGF 수용체 (O'Dwyer. P.J. (2006) "The Present And Future Of Angiogenesis-Directed Treatments Of Colorectal Cancer", Oncologist 11(9):992-998); VEP8; VEP9; VIM-D5; 및 배아 암종 세포들에서 발견되는 Y 합텐, Le y . 추가적인 암 항원, 및 그것들에 결합하는 분자들 (예컨대, 항체들)이 표 10에 개시된다. 5T4, B7-H3, CEACAM5/CEACAM6, CD123, DR5, EGFR, 에프린 수용체, gpA33,HER2/neu, IL13Rα2, ROR1, 및 VEGF가 본 발명의 특히 바람직한 "암 항원들"이다.
D. 암 항원에 결합할 수 있는 예시의 항체들
그것의 VH 및 VL 도메인이 암 세포의 표면에 배열되는 암 항원에 결합할 수 있고 그러한 암 세포의 재지정된 사멸을 매개할 수 있는 분자들을 구성하기 위해 사용될 수 있는 예시의 항체들이 상기 표 10에 열거되고, 암 세포의 표면에 배열되는 암 항원에 결합할 수 있고 그러한 암 세포의 재지정된 사멸을 매개할 수 있는 분자들을 구성하기 위해 사용될 수 있는 추가적인 항체들이 아래에서 제시된다.
1. B7-H3에 결합하는 항체들
B7-H3은 광범위한 고체 종양 유형에서 과잉 발현되는 암 항원으로 면역 조절에 포함된 분자들의 B7 패밀리의 일원이다 (미국 특허 번호 8,802,091; US 2014/0328750; US 2013/0149236; Loo, D. et al. (2012) "Development Of An Fc-Enhanced Anti-B7-H3 Monoclonal Antibody With Potent Antitumor Activity", Clin. Cancer Res. 18(14):3834-3845 참조). 특히, 여러 독립적인 연구들이 인간 악성 암 세포 (예컨대, 신경모세포종 및 위암, 난소암 및 비-소세포 폐암의 암 세포들)이 B7-H3 단백질의 발현의 현저한 증가를 나타내고 이런 증가된 발현은 증가된 질환 심각성과 관련되었음을 밝혔으며 (Zang, X. et al. (2007) "The B7 Family And Cancer Therapy: Costimulation And Coinhibition", Clin. Cancer Res. 13:5271-5279), 이것은 B7-H3이 면역 회피 (immune evasion) 경로로서 종양에 의해 이용된다는 것을 시사하였다 (Hofmeyer, K. et al. (2008) "The Contrasting Role Of B7-H3", Proc. Natl. Acad. Sci. (U.S.A.) 105(30):10277-10278).
B7-H3은 또한 CD4+ 및 CD8+ T-세포 증식을 동시에 자극하는 것으로 밝혀졌다. B7-H3은 또한 IFN-γ 생성 및 CD8+ 용해 활성을 자극한다 (Chapoval, A. et al. (2001) "B7-H3: A Costimulatory Molecule For T Cell Activation and IFN-γ Production", Nature Immunol. 2:269-274; Sharpe, A.H. et al. (2002) "The B7-CD28 Superfamily", Nature Rev. Immunol. 2:116-126). 그러나, 이 단백질은 아마도 T 세포 활성화를 억제하기 위하여 NFAT (활성화된 T 세포를 위한 핵 인자), NF-κB (카파 B를 위한 핵 인자), 및 AP-1 (활성화 단백질-1) 인자를 통해 작용한다 (Yi. K.H. et al. (2009) "Fine Tuning The Immune Response Through B7-H3 And B7-H4", Immunol. Rev. 229:145-151). B7-H3은 또한 생체내에서 Th1, Th2, 또는 Th17을 억제하는 것으로 여겨진다 (Prasad, D.V. et al. (2004) "Murine B7-H3 Is A Negative Regulator Of T Cells", J. Immunol. 173:2500-2506; Fukushima, A. et al. (2007) "B7-H3 Regulates The Development Of Experimental Allergic Conjunctivitis In Mice", Immunol. Lett. 113:52-57; Yi. K.H. et al. (2009) "Fine Tuning The Immune Response Through B7-H3 And B7-H4", Immunol. Rev. 229:145-151).
바람직한 B7-H3-결합 분자들은 항-인간 B7-H3 단클론성 항체 "B7-H3 mAb 1", "B7-H3 mAb 2", 또는 "B7-H3 mAb 3", 또는 본원에서 제공된 임의의 항-B7-H3 항체들의 VL 및/또는 VH 도메인을 가지며; 보다 바람직하게는 그런 항-B7-H3 단클론성 항체들의 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 가진다. 특히 바람직한 것은, 한정하는 것은 아니지만 "에노블리투주맙(Enoblituzumab)" (MGA271로서도 알려짐; CAS 등록 번호 1353485-38-7)을 포함하는 인간화된 VH 및/또는 VL 도메인을 가지는 B7-H3-결합 분자이다. 에노블리투주맙은 HER2/neu에 결합하고 향상된 ADCC 활성을 매개하는 Fc-최적화된 단클론성 항체이다. 에노블리투주맙의 완전한 중쇄 및 경쇄의 아미노산 서열은 당업계에 알려져 있다 (예컨대 WHO Drug Information, 2017, Recommended INN: List 77, 31(1):49 참조).
본 발명은 구체적으로 B7-H3 및 CD3에 결합할 수 있는 B7-H3 x CD3 이중특이적 결합 분자, 특히 항-B7-H3 단클론성 항체들 B7-H3 mAb 1, B7-H3 mAb 2, 또는 B7-H3 mAb 3, 또는 본원에 제시된 임의의 B7-H3 x CD3 이중특이적 결합 분자, 또는 WO 2017/030926에 제시된 임의의 B7-H3 x CD3 이중특이적 결합 분자의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 이중특이적 결합 분자들을 포함하고 망라한다.
(a) B7-H3 mAb 1
B7-H3 mAb 1의 VH 도메인의 아미노산 서열 (SEQ ID NO:213)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
QVQLQQSGAE LARPGASVKL SCKASGYTFT SYWMQ WVKQR PGQGLEWIG T IYPGDGDTRY
TQKFKG KATL TADKSSSTAY MQLSSLASED SAVYYCAR RG IPRLWYFDV W GAGTTVTVSS.
B7-H3 mAb 1의 VL 도메인의 아미노산 서열 (SEQ ID NO:214)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQMTQTTSS LSASLGDRVT ISC RASQDIS NYLN WYQQKP DGTVKLLIY Y TSRLHS GVPS
RFSGSGSGTD YSLTIDNLEQ EDIATYFC QQ GNTLPPT FGG GTKLEIK.
본원에서 "hB7-H3 mAb 1 VH1", 및 "hB7-H3 mAb 1 VH2"로 불리는 B7-H3 mAb 1의 2개의 예시의 인간화된 VH 도메인, 및 본원에서 "hB7-H3 mAb 1 VL1", 및 "hB7-H3 mAb 1 VL2"로 불리는 B7-H3 mAb 1의 2개의 예시의 인간화된 VL 도메인이 아래에 제시된다. hB7-H3 mAb 1 VL2는 CDRL1 및 CDRL2에 아미노산 치환을 포함하고, hB7-H3 mAb 1 VH2는 CDRH2에 아미노산 치환을 포함하는 것이 주지될 것이다. 인간화된 VL 도메인들 중 어느 것이든지 B7-H3 결합 도메인을 생성하기 위하여 임의의 인간화된 VH 도메인과 쌍을 이룰 수 있다. 따라서, 인간화된 VH 도메인과 쌍을 이룬 인간화된 VL 도메인들 중 하나를 포함하는 임의의 항체는 일반적으로 "hB7-H3 mAb 1"로서 언급되고, 인간화된 VH/VL 도메인의 특정 조합은 구체적인 VH/VL 도메인에 대한 언급에 의해 언급되는데, 예를 들어, hB7-H3 mAb 1 VH1 및 hB7-H3 mAb 1 VL2를 포함하는 인간화된 항체는 구체적으로 "hB7-H3 mAb 1 (1.2)"로서 언급된다.
hB7-H3 mAb 1 VH1의 VH 도메인의 아미노산 서열은 (SEQ ID NO:215)이다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVQSGAE VKKPGASVKV SCKASGYTFT SYWMQ WVRQA PGQGLEWMG T IYPGDGDTRY
TQKFKG RVTI TADKSTSTAY MELSSLRSED TAVYYCAR RG IPRLWYFDV W GQGTTVTVSS.
hB7-H3 mAb 1 VH2의 VH 도메인의 아미노산 서열은 (SEQ ID NO:216)이다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVQSGAE VKKPGASVKV SCKASGYTFT SYWMQ WVRQA PGQGLEWMG T IYPGGGDTRY
TQKFQG RVTI TADKSTSTAY MELSSLRSED TAVYYCAR RG IPRLWYFDV W GQGTTVTVSS.
hB7-H3 mAb 1 VL1의 VL 도메인의 아미노산 서열 (SEQ ID NO:217)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQMTQSPSS LSASVGDRVT ITC RASQDIS NYLN WYQQKP GKAPKLLIY Y TSRLHS GVPS
RFSGSGSGTD FTLTISSLQP EDIATYYC QQ GNTLPPT FGG GTKLEIK.
hB7-H3 mAb 1 VL2의 VL 도메인의 아미노산 서열 (SEQ ID NO:218)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQMTQSPSS LSASVGDRVT ITC RASQSIS SYLN WYQQKP GKAPKLLIY Y TSRLQS GVPS
RFSGSGSGTD FTLTISSLQP EDIATYYC QQ GNTLPPT FGG GTKLEIK.
(b) B7-H3 mAb 2
B7-H3 mAb 2의 VH 도메인의 아미노산 서열 (SEQ ID NO:219)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
DVQLVESGGG LVQPGGSRKL SCAASGFTFS SFGMH WVRQA PEKGLEWVA Y ISSDSSAIYY
ADTVKG RFTI SRDNPKNTLF LQMTSLRSED TAMYYCGR GR ENIYYGSRLD Y WGQGTTLTV SS.
B7-H3 mAb 2의 VL 도메인의 아미노산 서열 (SEQ ID NO:220)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIAMTQSQKF MSTSVGDRVS VTC KASQNVD TNVA WYQQKP GQSPKALIY S ASYRYS GVPD
RFTGSGSGTD FTLTINNVQS EDLAEYFC QQ YNNYPFT FGS GTKLEIK.
본원에서 "hB7-H3 mAb 2 VH1", "hB7-H3 mAb 2 VH2", "hB7-H3 mAb 2 VH3", 및 "hB7-H3 mAb 2 VH4"로 불리는, B7-H3 mAb 2의 4개의 예시의 인간화된 VH 도메인, 및 본원에서 "hB7-H3 mAb 2 VL1", "hB7-H3 mAb 2 VL2", "hB7-H3 mAb 2 VL3", "hB7-H3 mAb 2 VL4", "hB7-H3 mAb 2 VL5", 및 "hB7-H3 mAb 2 VL6"로서 불리는 B7-H3 mAb 2의 6개의 예시의 인간화된 VL 도메인이 아래에 제시된다. 인간화된 VL 도메인들 중 어느 것이든지 B7-H3 결합 도메인을 생성하기 위하여 임의의 인간화된 VH 도메인과 쌍을 이룰 수 있다. 따라서, 인간화된 VH 도메인과 쌍을 이룬 인간화된 VL 도메인들 중 하나를 포함하는 임의의 항체는 일반적으로 "hB7-H3 mAb 2"로서 언급되고, 인간화된 VH/VL 도메인의 특정 조합은 구체적인 VH/VL 도메인에 대한 언급에 의해 언급되는데, 예를 들어, hB7-H3 mAb 2 VH1 및 hB7-H3 mAb 2 VL2를 포함하는 인간화된 항체는 구체적으로 "hB7-H3 mAb 2 (1.2)"로서 언급된다.
hB7-H3 mAb 2 VH1의 VH 도메인의 아미노산 서열 (SEQ ID NO:221)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVQLVESGGG LVQPGGSLRL SCAASGFTFS SFGMH WVRQA PGKGLEWVA Y ISSDSSAIYY
ADTVKG RFTI SRDNAKNSLY LQMNSLRDED TAVYYCAR GR ENIYYGSRLD Y WGQGTTVTV SS.
hB7-H3 mAb 2 VH2의 VH 도메인의 아미노산 서열 (SEQ ID NO:222)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVQLVESGGG LVQPGGSLRL SCAASGFTFS SFGMH WVRQA PGKGLEWVA Y ISSDSSAIYY
ADTVKG RFTI SRDNAKNSLY LQMNSLRDED TAVYYCGR GR ENIYYGSRLD Y WGQGTTVTV SS.
hB7-H3 mAb 2 VH3의 VH 도메인의 아미노산 서열 (SEQ ID NO:223)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVQLVESGGG LVQPGGSLRL SCAASGFTFS SFGMH WVRQA PGKGLEWVA Y ISSDSSAIYY
ADTVKG RFTI SRDNAKNSLY LQMNSLRDED TAMYYCGR GR ENIYYGSRLD Y WGQGTTVTV SS.
hB7-H3 mAb 2 VH4의 VH 도메인의 아미노산 서열 (SEQ ID NO:224)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVQLVESGGG LVQPGGSLRL SCAASGFTFS SFGMH WVRQA PGKGLEWVA Y ISSDSSAIYY
ADTVKG RFTI SRDNAKNSLY LQMNSLRSED TAVYYCAR GR ENIYYGSRLD Y WGQGTTVTV SS.
hB7-H3 mAb 2 VL1의 VL 도메인의 아미노산 서열 (SEQ ID NO:225)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQLTQSPSF LSASVGDRVT ITC KASQNVD TNVA WYQQKP GKAPKLLIY S ASYRYS GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QQ YNNYPFT FGQ GTKLEIK.
hB7-H3 mAb 2 VL2의 VL 도메인의 아미노산 서열 (SEQ ID NO:226)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQLTQSPSF LSASVGDRVT ITC KASQNVD TNVA WYQQKP GKAPKALIY S ASYRYS GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QQ YNNYPFT FGQ GTKLEIK.
hB7-H3 mAb 2 VL3의 VL 도메인의 아미노산 서열 (SEQ ID NO:227)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQLTQSPSF LSASVGDRVS VTC KASQNVD TNVA WYQQKP GKAPKLLIY S ASYRYS GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QQ YNNYPFT FGQ GTKLEIK.
hB7-H3 mAb 2 VL4의 VL 도메인의 아미노산 서열 (SEQ ID NO:228)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQLTQSPSF LSASVGDRVT ITC KASQNVD TNVA WYQQKP GQAPKLLIY S ASYRYS GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QQ YNNYPFT FGQ GTKLEIK.
hB7-H3 mAb 2 VL5의 VL 도메인의 아미노산 서열 (SEQ ID NO:229)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQLTQSPSF LSASVGDRVT ITC KASQNVD TNVA WYQQKP GQAPKALIY S ASYRYS GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QQ YNNYPFT FGQ GTKLEIK.
hB7-H3 mAb 2 VL6의 VL 도메인의 아미노산 서열 (SEQ ID NO:230)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQLTQSPSF LSASVGDRVT ITC KASQNVD TNVA WYQQKP GKAPKLLIY S ASYRYS GVPS
RFSGSGSGTD FTLTISSLQP EDFAEYYC QQ YNNYPFT FGQ GTKLEIK.
(c) B7-H3 mAb 3
B7-H3 mAb 3의 VH 도메인의 아미노산 서열 (SEQ ID NO:231)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨).
EVQQVESGGD LVKPGGSLKL SCAASGFTFS SYGMS WVRQT PDKRLEW VAT INSGGSNTYY
PDSLKG RFTI SRDNAKNTLY LQMRSLKSED TAMYYCAR HD GGAMDY WGQG TSVTVSS.
B7-H3 mAb 3의 VL 도메인의 아미노산 서열 (SEQ ID NO:232)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨).
DIQMTQSPAS LSVSVGETVT ITC RASESIY SYLA WYQQKQ GKSPQLLVY N TKTLPE GVPS
RFSGSGSGTQ FSLKINSLQP EDFGRYYC QH HYGTPPWT FG GGTNLEIK.
(d) 기타의 항-B7-H3 결합 분자들
상기 확인된 바람직한 항-B7-H3 결합 분자들 외에, 발명은 다음의 항-B7-H3 결합 분자들 중 임의의 것의 사용을 고려한다: LUCA1; BLA8; PA20; 또는 SKN2 (미국 특허 번호 7,527,969; 8,779,098 및 PCT 특허 공개공보 WO 2004/001381 참조); M30; cM30; M30-H1-L1; M30-H1-L2; M30-H1-L3; M30-H1-L4; M30-H1-L5; M30-H1-L6; M30-H1-L7; M30-H4-L1; M30-H4-L2; M30-H4-L3; 및 M30-H4-L4 (미국 특허 번호 7,666,424; 7,737,258; 7,740,845; 8,148,154; 8,414,892; 8,501,471; 9,062,110; 미국 특허 공개공보 2010/0143245 및 PCT 특허 공개공보 WO 2008/116219 참조).
2. CEACAM5 및 CEACAM6에 결합하는 항체들
암종배아 항원-관련된 세포 부착 분자 5 (CEACAM5) 및 6 (CEACAM6)은 갑상선 수질암, 대장암, 췌장암, 간세포 암종, 위암, 폐암, 두경부암, 방광암, 전립선암, 자궁암, 자궁내막암, 유방암, 조혈세포암, 백혈병 및 난소암 (PCT Pubmication No. WO 2011/034660), 및 특히 대장암, 위장암, 췌장암, 비-소세포 폐암 (NSCL), 유방암, 갑상선암, 위암, 난소암 및 자궁 암종을 포함하는 다양한 유형의 암과 관련이 있는 것으로 밝혀졌다 (Zheng, C. et al. (2011) "A Novel Anti-CEACAM5 Monoclonal Antibody, CC4, Suppresses Colorectal Tumor Growth and Enhances NK Cells-Mediated Tumor Immunity", PLoS One 6(6):e21146, pp. 1-11).
CEACAM5는 위장암, 대장암 및 췌장암의 90%에서, 비-소세포 폐암 세포의 70%에서 및 유방암의 50%에서 과잉발현하는 것으로 밝혀졌다 (Thompson, J.A. et al. (1991) "Carcinoembryonic Antigen Gene Family: Molecular Biology And Clinical Perspectives", J. Clin. Lab. Anal. 5:344-366). 과잉발현된 암종배아 항원-관련 세포 부착 분자 6 (CEACAM6)은 갑상선 수질암, 대장암, 췌장암, 간세포 암종, 위암, 폐암, 두경부암, 방광암, 전립선암, 자궁암, 자궁내막암, 유방암, 조혈세포암, 백혈병 및 난소암을 포함하는, 다양한 인간 암의 침습 및 전이에서 중요한 역할을 한다 (PCT 공개공보 번호 WO 2011/034660; Deng, X. et al. (2014) "Expression Profiling Of CEACAM6 Associated With The Tumorigenesis And Progression In Gastric Adenocarcinoma", Genet. Mol. Res. 13(3):7686-7697; Cameron, S. et al. (2012) "Focal Overexpression Of CEACAM6 Contributes To Enhanced Tumourigenesis In Head And Neck Cancer Via Suppression Of Apoptosis", Mol. Cancer 11:74, pp. 1-11; Chapin, C. et al. (2012) "Distribution And Surfactant Association Of Carcinoembryonic Cell Adhesion Molecule 6 In Human Lung", Amer. J. Physiol. Lung Cell. Mol. Physiol. 302(2):L216-L25; Riley, C.J. et al. (2009) "Design And Activity Of A Murine And Humanized Anti-CEACAM6 Single-Chain Variable Fragment In The Treatment Of Pancreatic Cancer", Cancer Res. 69(5):1933-1940; Lewis-Wambi, J.S. et al. (2008) "Overexpression Of CEACAM6 Promotes Migration And Invasion Of Oestrogen-Deprived Breast Cancer Cells", Eur. J. Cancer 44(12):1770-1779; Blumenthal, R.D. et al. (2007) "Expression Patterns Of CEACAM5 And CEACAM6 In Primary And Metastatic Cancers", BMC Cancer. 7:2, pp. 1-15). CEACAM5 및 CEACAM6에 면역특이적으로 결합하는 항체들은 상업적으로 입수 가능하다 (Santa Cruz Biotechnology, Inc., Novus Biologicals LLC; Abnova Corporation).
(a) 항체 16C3
인간화된 항- CEACAM5 / 항-CEACAM6 항체 16C3 (EP 2585476)의 VH 도메인의 아미노산 서열 (SEQ ID NO:233)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLQQSGPE VVRPGVSVKI SCKGSGYTFT DYAMH WVKQS HAKSLEWIG L ISTYSGDTKY
NQNFKG KATM TVDKSASTAY MELSSLRSED TAVYYCAR GD YSGSRYWFAY WGQGTLVTVS S.
인간화된 항-CEACAM5 / 항-CEACAM6 항체 16C3 (EP 2585476)의 VL 도메인의 아미노산 서열 (SEQ ID NO:234)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC GASENIY GALN WYQRKP GKSPKLLIW G ASNLAD GMPS
RFSGSGSGRQ YTLTISSLQP EDVATYY CQN VLSSPYT FGG GTKLEIK.
(b) 항체 hMN15
인간화된 항-CEACAM5 / CEACAM6 항체 hMN15 (WO 2011/034660)의 VH 도메인의 아미노산 서열 (SEQ ID NO:235)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVESGGG VVQPGRSLRL SCSSSGFALT DYYMS WVRQA PGKGLEWLG F IANKANGHTT
DYSPSVKG RF TISRDNSKNT LFLQMDSLRP EDTGVYFCAR DMGIRWNFDV WGQGTPVTVS S.
인간화된 항-CEACAM5 / CEACAM6 항체 hMN15 (WO 2011/034660)의 VL 도메인의 아미노산 서열 (SEQ ID NO:236)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQLTQSPSS LSASVGDRVT MTC SASSRVS YIH WYQQKPG KAPKRWIY GT STLAS GVPAR
FSGSGSGTDF TFTISSLQPE DIATYYC QQW SYNPPT FGQG TKVEIKR.
본 발명은 구체적으로 CEACAM5 및/또는 CEACAM6에 결합할 수 있는 CEACAM5/CEACAM6 결합 분자들 (예컨대, CEACAM5/CEACAM6 x CD3 이중특이적 결합 분자들), 특히 항-CEACAM5/CEACAM6 단클론성 항체 16C3 또는 hMN15의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다.
3. EGFR에 결합하는 항체들
상피 성장 인자 수용체 (EGFR)는 특정 전이성 대장암, 전이성 비-소세포 폐암 및 두경부암의 암 항원이다. 인간 EGRF에 결합하는 예시의 항체들은 "세툭시맙" 및 "파니투무맙"이다. 세툭시맙은 재조합 인간-마우스 키메릭 상피 성장 인자 수용체 (EGFR) IgG1 단클론성 항체이다 (Govindan R. (2004) "Cetuximab In Advanced Non-Small Cell Lung Cancer", Clin. Cancer Res. 10(12 Pt 2):4241s-4244s; Bou-Assaly, W. et al. (2010) "Cetuximab (Erbitux)", Am. J. Neuroradiol. 31(4):626-627). 파니투무맙 (Vectibix®, Amgen)은 전체 인간화된 상피 성장 인자 수용체 (EGFR) IgG2 단클론성 항체이다 (Foon, K.A. et al. (2004) "Preclinical And Clinical Evaluations Of ABX-EGF, A Fully Human Anti-Epidermal Growth Factor Receptor Antibody", Int. J. Radiat. Oncol. Biol. Phys. 58(3):984-990; Yazdi, M.H. et al. (2015) "A Comprehensive Review of Clinical Trials on EGFR Inhibitors Such as Cetuximab and Panitumumab as Monotherapy and in Combination for Treatment of Metastatic Colorectal Cancer", Avicenna J. Med. Biotechnol. 7(4):134-144).
(a) 세툭시맙
키메릭 항-EGFR 항체 세툭시맙의 VH 도메인의 아미노산 서열 (SEQ ID NO:237)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLKQSGPG LVQPSQSLSI TCTVS GFSLT NYGVH WVRQS PGKGLEWLG V IWSGGNTDYN
TPFTS RLSIN KDNSKSQVFF KMNSLQSNDT AIYYCAR ALT YYDYEFAY WG QGTLVTVSA.
키메릭 항-EGFR 항체 세툭시맙의 VL 도메인의 아미노산 서열 (SEQ ID NO:238)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DILLTQSPVI LSVSPGERVS FSC RASQSIG TNIH WYQQRT NGSPRLLIK Y ASESIS GIPS
RFSGSGSGTD FTLSINSVES EDIADYYC QQ NNNWPTT FGA GTKLELKR.
(b) 파니투무맙
파니투무맙의 VH 도메인의 아미노산 서열 (SEQ ID NO:239)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLQESGPG LVKPSETLSL TCTVS GGSVS SGDYY WTWIR QSPGKGLEWI G HIYYSGNTN
YNPSLKS RLT ISIDTSKTQF SLKLSSVTAA DTAIYYCVR D RVTGAFDI WG QGTMVTVSS.
파니투무맙의 VL 도메인의 아미노산 서열 (SEQ ID NO:240)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC QASQDIS NYLN WYQQKP GKAPKLLIY D ASNLET GVPS
RFSGSGSGTD FTFTISSLQP EDIATYFC QH FDHLPLA FGG GTKVEIKR.
본 출원은 구체적으로 EGFR에 결합할 수 있는 EGFR 결합 분자들 (예컨대, EGFR x CD3 이중특이적 결합 분자들), 특히 항-EGFR 단클론성 항체 세툭시맙 또는 파니투무맙의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다.
4. EphA2에 결합하는 항체들
수용체 티로신 키나아제인, 에프린 유형-A 수용체 2 (EphA2)는 일반적으로 성인 상피 조직에서 세포-대-세포 접촉 부위에서 발현되지만, 최근 연구들은 그것이 또한 다양한 유형의 상피 암종에서 과잉발현되고, 이때 전이성 병변에서 가장 큰 수준의 EphA2 발현이 관찰되는 것을 밝혔다. 고발현 수준의 EphA2는 전립선암, 유방암, 비-소세포 폐암 및 흑색종을 포함하는 광범위한 암 및 많은 암 세포주에서 발견되었다 (Xu, J. et al. (2014) "High EphA2 Protein Expression In Renal Cell Carcinoma Is Associated With A Poor Disease Outcome", Oncol. Lett. Aug 2014; 8(2): 687-692; Miao, B. et al. (2014) "EphA2 is a Mediator of Vemurafenib Resistance and a Novel Therapeutic Target in Melanoma", Cancer Discov. pii: CD-14-0295). EphA2는 단순히 암에 대한 마커인 것으로 나타나지 않으며, 오히려 많은 인간 암에서 영구적으로 과잉발현되고 기능적으로 변화하는 것으로 나타난다 (Chen, P. et al. (2014) "EphA2 Enhances The Proliferation And Invasion Ability Of LnCap Prostate Cancer Cells", Oncol. Lett. 8(1):41-46). 인간 EphA2에 결합하는 예시의 항체들은 "EphA2 mAb 1", "EphA2 mAb 2" 및 "EphA2 mAb 3"이다.
(a) EphA2 mAb 1
EphA2 mAb 1의 VH 도메인의 아미노산 서열 (SEQ ID NO:241)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLKESGPG LVAPSQSLSI TCTVSGFSLS RYSVH WVRQP PGKGLEWLG M IWGGGSTDYN
SALKS RLSIS KDNSKSQVFL KMNSLQTDDT AMYYCAR KHG NYYTMDY WGQ GTSVTVSS.
EphA2 mAb 1의 VL 도메인의 아미노산 서열 (SEQ ID NO:242)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQTTSS LSASLGDRIT ISC RASQDIS NYLN WYQQKP DGTVKLLIY Y TSRLHS GVPS
RFSGSGSGTD YSLTISNLEQ EDIATYFC QQ GYTLYT FGGG TKLEIK.
(b) EphA2 mAb 2
EphA2 mAb 2의 VH 도메인의 아미노산 서열 (SEQ ID NO:243)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QIQLVQSGPE LKKPGETVKI SCKASGFTFT NYGMN WVKQA PGKGLKWMG W INTYIGEPTY
ADDFKG RFVF SLETSASTAY LQINNLKNED MATYFCAR EL GPYYFDY WGQ GTTLTVSS.
EphA2 mAb 2의 VL 도메인의 아미노산 서열 (SEQ ID NO:244)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DVVMTQTPLS LPVSLGDQAS ISC RSSQSLV HSSGNTYLH W YLQKPGQSPK LLIY KVSNRF
S GVPDRFSGS GSGTDFTLKI SRVEAEDLGV YFC SQSTHVP T FGSGTKLEI K.
(c) EphA2 mAb 3
EphA2 mAb 3의 VH 도메인의 아미노산 서열 (SEQ ID NO:245)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG SVKPGGSLKL SCAASGFTFT DHYMY WVRQT PEKRLEWVA T ISDGGSFTSY
PDSVKG RFTI SRDIAKNNLY LQMSSLKSED TAMYYCTR DE SDRPFPY WGQ GTLVTVSS.
EphA2 mAb 3의 VL 도메인의 아미노산 서열 (SEQ ID NO:246)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIVLTQSHRS MSTSVGDRVN ITC KASQDVT TAVA WYQQKP GQSPKLLIF W ASTRHA GVPD
RFTGSGSGTD FTLTISSVQA GDLALYYC QQ HYSTPYT FGG GTKLEIK.
본 출원은 구체적으로 EphA2에 결합할 수 있는 EphA2 결합 분자들 (예컨대, EphA2 x CD3 이중특이적 결합 분자들), 특히 항-EphA2 단클론성 항체 EphA2 mAb 1, EphA2 mAb 2 및 EphA2 mAb 3의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다.
5. gpA33에 결합하는 항체들
43kD의 경막 당단백질 A33 (gpA33)은 95%를 넘는 모든 대장 암종에서 발현된다 (Heath, J.K. et al. (1997) "The Human A33 Antigen Is A Transmembrane Glycoprotein And A Novel Member Of The Immunoglobulin Superfamily", Proc. Natl. Acad. Sci. (U.S.A.) 94(2):469-474; Ritter, G. et al. (1997) "Characterization Of Posttranslational Modifications Of Human A33 Antigen, A Novel Palmitoylated Surface Glycoprotein Of Human Gastrointestinal Epithelium", Biochem. Biophys. Res. Commun. 236(3):682-686; Wong, N.A. et al. (2006) "EpCAM and gpA33 Are Markers Of Barrett's Metaplasia", J. Clin. Pathol. 59(3):260-263). 인간 gpA33에 결합하는 예시의 항체는 "gpA33 mAb 1"이다.
gpA33 mAb 1의 VH 도메인의 아미노산 서열 (SEQ ID NO:247)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLVQSGAE VKKPGASVKV SCKASGYTFT GSWMN WVRQA PGQGLEWIG R IYPGDGETNY
NGKFKD RVTI TADKSTSTAY MELSSLRSED TAVYYCAR IY GNNVYFDV WG QGTTVTVSS.
gpA33 mAb 1의 VL 도메인의 아미노산 서열 (SEQ ID NO:248)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQLTQSPSF LSASVGDRVT ITC SARSSIS FMY WYQQKPG KAPKLLIY DT SNLAS GVPSR
FSGSGSGTEF TLTISSLEAE DAATYYC QQW SSYPLT FGQG TKLEIK.
본 출원은 구체적으로 gpA33에 결합할 수 있는 gpA33 결합 분자들 (예컨대, gpA33x CD3 이중특이적 결합 분자들), 특히 항-gpA33 단클론성 항체 gpA33 mAb 1, 또는 WO 2015/026894에 제시된 임의의 항-gpA33 단클론성 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다.
6. HER2/neu에 결합하는 항체들
HER2/neu는 원래 화학적으로 처리된 래트의 신경모세포종으로부터의 형질전환 유전자의 생성물로서 확인된 185 kDa의 수용체 단백질이다. HER2/neu는 그것의 여러 인간 암종 및 포유류 발달에서의 역할로 인해 집중적으로 조사되어 왔다 (Hynes et al. (1994) Biochim. Biophys. Acta 1198:165-184; Dougall et al. (1994) Oncogene 9:2109-2123; Lee et al. (1995) Nature 378:394-398). 인간 HER2/neu에 결합하는 예시의 항체들로는 "마르게툭시맙", "트라스투주맙" 및 "페르투주맙"을 들 수 있다. 마르게툭시맙 (MGAH22로도 알려짐; CAS 등록 번호 1350624-75-7)은 HER2/neu에 결합하여 향상된 ADCC 활성을 매개하는 Fc-최적화된 단클론성 항체이다. 트라스투주맙 (rhuMAB4D5로도 알려지고, Herceptin®로서 시판됨; CAS 등록 번호 180288-69-1; 미국 특허 번호 5,821,337 참조)은 IgG1/카파 불변 영역을 가지는, 항체 4D5의 인간화된 버전이다. 페르투주맙 (rhuMAB2C4로도 알려지고, PERJETATM로서 시판됨; CAS 등록 번호 380610-27-5; 예를 들어 WO2001/000245 참조)은 IgG1/카파 불변 영역을 가지는, 항체 2C4의 인간화된 버전이다.
본 출원은 구체적으로 Her2/Neu에 결합할 수 있는 Her2/Neu 결합 분자 (예컨대, Her2/Neu x CD3 이중특이적 결합 분자들), 특히 항-Her2/Neu 단클론성 항체 마르게툭시맙, 트라스투주맙 또는 페르투주맙의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다.
(a) 마르게툭시맙
마르게툭시맙의 VH 도메인의 아미노산 서열은 (SEQ ID NO:249)이다 (CDRH 잔기들은 밑줄로 표시됨):
QVQLQQSGPE LVKPGASLKL SCTASGFNIK DTYIH WVKQR PEQGLEWIG R IYPTNGYTRY
DPKFQD KATI TADTSSNTAY LQVSRLTSED TAVYYCSR WG GDGFYAMDY W GQGASVTVSS.
마르게툭시맙의 VL 도메인의 아미노산 서열은 (SEQ ID NO:250)이다 (CDRL 잔기들은 밑줄로 표시됨):
DIVMTQSHKF MSTSVGDRVS ITC KASQDVN TAVA WYQQKP GHSPKLLIY S ASFRYT GVPD
RFTGSRSGTD FTFTISSVQA EDLAVYYC QQ HYTTPPT FGG GTKVEIK.
마르게툭시맙의 완전한 중쇄 및 경쇄의 아미노산 서열들을 당업계에 알려져 있다 (예컨대, WHO Drug Information, 2014, Recommended INN: List 71, 28(1):93-94 참조).
(b) 트라스투주맙
트라스투주맙의 VH 도메인의 아미노산 서열은 (SEQ ID NO:251)이다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAASGFNIK DT Y IH WVRQA PGKGLEWVA R IY PTN G Y T R Y
ADSVKG RFTI SADTSKNTAY LQMNSLRAED TAVYYCSR WG GDG F Y A MD Y W GQGTLVTVSS.
트라스투주맙의 VL 도메인의 아미노산 서열은 (SEQ ID NO:252)이다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC RASQ DVN TAVA WYQQKP GKAPKLLIY S AS F L Y SGVPS
RFSGSRSGTD FTLTISSLQP EDFATYYC QQ H Y T TPPT FGQ GTKVEIK.
(c) 페르투주맙
페르투주맙의 VH 도메인의 아미노산 서열은 (SEQ ID NO:253)이다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAASGFTFT DYTMD WVRQA PGKGLEWVA D VNPNSGGSIY
NQRFKG RFTL SVDRSKNTLY LQMNSLRAED TAVYYCAR NL GPSFYFDY WG QGTLVTVSS.
페르투주맙의 VL 도메인의 아미노산 서열은 (SEQ ID NO:254)이다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC KASQDVS IGVA WYQQKP GKAPKLLIY S ASYRYT GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QQ YYIYPYT FGQ GTKVEIK.
(d) 기타 항-HER2/neu 항체들
상기 확인된 바람직한 항-HER2/neu 결합 분자들 외에, 발명은 다음의 항-Her-2 결합 분자들 중 임의의 것의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 Her2/Neu 결합 분자들을 고려한다: 1.44.1; 1.140; 1.43; 1.14.1; 1.100.1; 1.96; 1.18.1; 1.20; 1.39; 1.24; 및 1.71.3 (미국 특허 번호 8,350,011; 8,858,942; 및 PCT 특허 공개공보 WO 2008/019290); F5 및 C1 (미국 특허 번호 7,892,554; 8,173,424; 8,974,792; 및 PCT 특허 공개공보 WO 99/55367); 및 또한 미국 특허 공개공보 US2013017114 및 PCT 특허 공개공보 WO2011/147986 및 WO 2012/143524의 항-Her-2 결합 분자들. 본 발명은 추가적으로 WO 2012/143524에 제시된 예시의 Her2/Neu x CD3 이중특이적 결합 분자들을 포함하고 망라한다.
7. VEGF에 결합하는 항체들
VEGF-A는 다양한 질환에서, 특히 전이성 결장암과 같은 특정 전이성 암에서, 및 특정 폐암, 신장암, 난소암, 및 뇌의 다형성 신경교모세포종에서 혈관형성을 자극하는 화학적 신호이다. 인간 VEGF-A에 결합하는 예시의 항체는 "베바시주맙" (Avastin®)이다. 베바시주맙은 재조합 인간화된 IgG1 단클론성 항체이다 (Midgley, R. et al. (2005) "Bevacizumab - Current Status And Future Directions", Ann. Oncol. 16(7):999-1004; Hall, R.D. et al. (2015) "Angiogenesis Inhibition As A Therapeutic Strategy In Non-Small Cell Lung Cancer (NSCLC)", Transl. Lung Cancer Res. 4(5):515-523; Narita, Y. (2015) "Bevacizumab For Glioblastoma", Ther. Clin. Risk Manag. 11:1759-1765).
베바시주맙의 VH 도메인의 아미노산 서열 (SEQ ID NO:255)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMN WVRQA PGKGLEWVG W INTYTGEPTY
AADFKR RFTF SLDTSKSTAY LQMNSLRAED TAVYYCA KYP HYYGSSHWYF DV WGQGTLVT VSS.
베바시주맙의 VL 도메인의 아미노산 서열 (SEQ ID NO:256)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC SASQDIS NYLN WYQQKP GKAPKVLIY F TSSLHS GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QQ YSTVPWT FGQ GTKVEIKR.
본 출원은 구체적으로 VEGF에 결합할 수 있는 VEGF 결합 분자들 (예컨대, VEGF x CD3 이중특이적 결합 분자들), 특히 항-VEGF 단클론성 항체 베바시주맙의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다.
8. Bind 5T4에 결합하는 항체들
종양태아 단백질인 5T4는 신장, 결장, 전립선, 폐 암종을 포함하는 많은 암종의 세포막에서 및 급성 림프구성 백혈병에서 나타나는 종양-관련 단백질이다 (Boghaert, E.R. et al. (2008) "The Oncofetal Protein, 5T4, Is A Suitable Target For Antibody-Guided Anti-Cancer Chemotherapy With Calicheamicin", Int. J. Oncol. 32(1):221-234; Eisen, T. et al. (2014) "Naptumomab Estafenatox: Targeted Immunotherapy with a Novel Immunotoxin", Curr. Oncol. Rep. 16:370, pp. 1-6 참조). 인간 5T4에 결합하는 예시의 항체들은 "5T4 mAb 1" 및 "5T4 mAb 2"를 포함한다.
(a) 5T4 mAb 1
5T4 mAb 1의 VH 도메인의 아미노산 서열 (SEQ ID NO:257)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
QVQLVQSGAE VKKPGASVKV SCKAS GYTFT SFWMH WVRQA PGQGLEWMG R IDPNRGGTEY
NEKAKS RVTM TADKSTSTAY MELSSLRSED TAVYYCAG GN PYYPMDY WGQ GTTVTVSS.
예시의 5T4 mAb 1의 VL 도메인의 아미노산 서열 (SEQ ID NO:258)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC RASQGIS NYLA WFQQKP GKAPKSLIY R ANRLQS GVPS
RFSGSGSGTD FTLTISSLQP EDVATYYC LQ YDDFPWT FGQ GTKLEIK.
(b) 5T4 mAb 2
5T4 mAb 2의 VH 도메인의 아미노산 서열 (SEQ ID NO:259)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
QVQLQQPGAE LVKPGASVKM SCKAS GYTFT SYWIT WVKQR PGQGLEWIG D IYPGSGRANY
NEKFKS KATL TVDTSSSTAY MQLSSLTSED SAVYNCAR YG PLFTTVVDPN SYAMDY WGQG
TSVTVSS.
5T4 mAb 2의 VL 도메인의 아미노산 서열 (SEQ ID NO:260)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
DVLMTQTPLS LPVSLGDQAS ISC RSSQSIV YSNGNTYLE W YLQKPGQSPK LLIY KVSNRF
S GVPDRFSGS GSGTDFTLKI SRVEAEDLGV YYC FQGSHVP FT FGSGTKLE IK.
본 툴원은 구체적으로 항-5T4 단클론성 항체들 5T4 mAb 1 또는 5T4 mAb 2, 또는 WO 2013/041687 또는 WO 2015/184203에서 제시된 임의의 항-5T4 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는, 5T4에 결합할 수 있는 5T4 결합 분자들 (예컨대, 5T4 x CD3 이중특이적 결합 분자들)을 포함하고 망라한다.
본 출원은 추가적으로 구체적으로 5T4에, CD3에 및 CD8에 결합할 수 있는 5T4 x CD3 x CD8 삼중특이적 결합 분자들, 특히 항-5T4 단클론성 항체들 5T4 mAb 1 또는 5T4 mAb 2 또는 WO 2015/184203에 제시된 임의의 항-5T4 단클론성 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH, 및/또는 WO 2015/184203에 제시된 임의의 항-CD8 단클론성 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 삼중특이적 결합 분자들을 포함하고 망라한다. 본 발명은 추가적으로 WO 2015/184203에 제시된 예시의 5T4 x CD3 x CD8 삼중특이적 분자들을 포함하고 망라한다.
9. IL13Rα2에 결합하는 항체들
인터류킨-13 수용체 α2 (IL13Rα2)는 신경교종, 대장암, 경부암, 췌장암, 다발성 흑색종, 골육종, 백혈병, 림프종, 전립선암 및 폐암을 포함하여, 다양한 암에서 과잉발현된다 (PCT 공개공보 번호 WO 2008/146911; Brown, C.E. et al. (2013) "Glioma IL13Rα2 Is Associated With Mesenchymal Signature Gene Expression And Poor Patient Prognosis", PLoS One. 18;8(10):e77769; Barderas, R. et al. (2012) "High Expression Of IL-13 Receptor A2 In Colorectal Ccancer Is Associated With Invasion, Liver Metastasis, And Poor Prognosis", Cancer Res. 72(11):2780-2790; Kasaian, M.T. et al. (2011) "IL-13 Antibodies Influence IL-13 Clearance In Humans By Modulating Scavenger Activity Of IL-13Rα2", J. Immunol. 187(1):561-569; Bozinov, O. et al. (2010) "Decreasing Expression Of The Interleukin-13 Receptor IL-13Ralpha2 In Treated Recurrent Malignant Gliomas", Neurol. Med. Chir. (Tokyo) 50(8):617-621; Fujisawa, T. et al. (2009) "A Novel Role Of Interleukin-13 Receptor Alpha2 In Pancreatic Cancer Invasion And Metastasis", Cancer Res. 69(22):8678-8685). IL13Rα2에 면역특이적으로 결합하는 항체들은 상업적으로 입수 가능하고 당업계에 기술되어 있다 (Abnova Corporation, Biorbyt, LifeSpan BioSciences, United States Biologicals; 또한 PCT 공개공보 번호 WO 2008/146911 참조). 인간 IL13Rα2에 결합하는 예시의 항체들은 "hu08"을 포함한다 (예컨대, PCT 공개공보 번호 WO 2014/072888 참조).
hu08의 VH 도메인의 아미노산 서열 (SEQ ID NO:261)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
EVQLVESGGG LVQPGGSLRL SCAAS GFTFS RNGMS WVRQA PGKGLEWVA T VSSGGSYIYY
ADSVKG RFTI SRDNAKNSLY LQMNSLRAED TAVYYCAR QG TTALATRFFD V WGQGTLVTV SS.
hu08의 VL 도메인의 아미노산 서열 (SEQ ID NO:262)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
DIQMTQSPSS LSASVGDRVT ITC KASQDVG TAVA WYQQKP GKAPKLLIY S ASYRST GVPS
RFSGSGSGTD FTLTISSLQP EDFATYYC QH HYSAPWT FGG GTKVEIK.
본 출원은 구체적으로 IL13Rα2에 결합할 수 있는 IL13Rα2 결합 분자들 (예컨대, IL13Rα2 x CD3 이중특이적 결합 분자들), 특히 항- IL13Rα2 단클론성 항체 hu08의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다.
10. CD123에 결합하는 항체들
CD123 (인터류킨 3 수용체 알파, IL-3Ra)은 40 kDa 분자이고 인터류킨 3 수용체 복합체의 부분이다 (Stomski, F.C. et al. (1996) "Human Interleukin-3 (IL-3) Induces Disulfide-Linked IL-3 Receptor Alpha- And Beta-Chain Heterodimerization, Which Is Required For Receptor Activation But Not High-Affinity Binding", Mol. Cell. Biol. 16(6):3035-3046). 인터류킨 3 (IL-3)은 만능 줄기 세포의 적혈구계, 골수계 및 림프계 전구세포들의 세포로의 초기 분화를 구동시킨다. CD123은 급성 골수성 백혈병 (AML) 및 골수이형성 증후군 (MDS)을 포함하는 광범위한 조혈계 악성종양의 악성 세포에서 과잉발현되는 것으로 보고되었다 (Munoz, L. et al. (2001) "Interleukin-3 Receptor Alpha Chain (CD123) Is Widely Expressed In Hematologic Malignancies", Haematologica 86(12):1261-1269). CD123의 과잉발현은 AML의 더 빈약한 예후와 관련된다 (Tettamanti, M.S. et al. (2013) "Targeting Of Acute Myeloid Leukaemia By Cytokine-Induced Killer Cells Redirected With A Novel CD123-Specific Chimeric Antigen Receptor", Br. J. Haematol. 161:389-401).
CD123에 결합하고, 본 발명에서 사용될 수 있는 예시의 항체는 "CD123 mAb 1"이다 (예컨대, PCT 특허 공개공보 WO 2015/026892 참조).
CD123 mAb 1의 VH 도메인의 아미노산 서열 (SEQ ID NO:263)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
EVQLVQSGAE LKKPGASVKV SCKASGYTFT DYYMK WVRQA PGQGLEWIG D IIPSNGATFY
NQKFKG RVTI TVDKSTSTAY MELSSLRSED TAVYYCAR SH LLRAS WFAYW GQGTLVTVSS.
CD123 mAb 1의 VL 도메인의 아미노산 서열 (SEQ ID NO:264)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
DFVMTQSPDS LAVSLGERVT MSC KSSQSLL NSGNQKNYLT WYQQKPGQPP KLLIY WASTR
ES GVPDRFSG SGSGTDFTLT ISSLQAEDVA VYYC QNDYSY PYT FGQGTKL EIK.
본 출원은 구체적으로 CD123에 결합할 수 있는 CD123 결합 분자들 (예컨대, CD123 x CD3 이중특이적 결합 분자들), 특히 항-CD123 단클론성 항체 CD123 mAb 1, 및 또한 US 2017/081424 및 WO 2016/036937에서 개시된 임의의 항-CD123 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다. 본 발명은 추가적으로 플로테투주맙 (flotetuzumab) (aka MGD007; CAS 등록 번호 1664355-28-5), JNJ-63709178 (Johnson & Johnson, 또한 WO 2016/036937 참조) 및 XmAb14045 (Xencor, 또한 US 2017/081424 참조)를 포함하는, 예시의 CD123 x CD3 이중특이적 결합 분자들을 포함하고 망라한다.
11. CD19에 결합하는 항체들
CD19 (B 림프구 표면 항원 B4, Genbank 기탁 번호 M28170)는 B 세포-수용체 (BCR) 복합체의 구성요소이고, B 세포 활성화 및 체액성 면역에 대한 한계값을 조절하는 B 세포 신호전달의 양성 조절자이다. CD19는 B 세포 계통에서 가장 흔하게 발현되는 항원들 중 하나이며 급성 림프모세포성 백혈병 (ALL), 만성 림프구성 백혈병 (CLL), 및 비-호지킨 림프종 (NHL)을 포함하는, 95%를 넘는 B 세포 악성에서 발현된다. 특히, CD19 발현은 항-CD20 치료법에 대해 내성이 되는 B 세포 림프종에서 유지된다 (Davis et al. (1999) "Therapy of B-cell Lymphoma With Anti-CD20 Antibodies Can Result In The Loss Of CD20 Antigen Expression." Clin Cancer Res, 5:611-615, 1999). CD19는 또한 자가면역 질환에 대한 치료제로서 제안되었다 (Tedder (2009) "CD19: A Promising B Cell Target For 류머티스성 관절염", Nat. Rev. Rheumatol. 5:572-577).
인간 CD19에 결합하고, 본 발명에서 사용될 수 있는 예시의 항체는 WO 2016/048938에서 개시된 항-CD19 항체 (본원에서 "CD19 mAb 1"로서 언급됨)이다.
CD19 mAb 1의 VH 도메인의 아미노산 서열 (SEQ ID NO:265)이 하기에 제시된다 (CDRH 잔기들은 밑줄로 표시됨):
QVTLRESGPA LVKPTQTLTL TCTFSGFSLS TSGMGVG WIR QPPGKALEWL A HIWWDDDKR
YNPALKS RLT ISKDTSKNQV FLTMTNMDPV DTATYYCAR M ELWSYYFDY W GQGTTVTVSS.
CD19 mAb 1의 VL 도메인의 아미노산 서열 (SEQ ID NO:266)이 하기에 제시된다 (CDRL 잔기들은 밑줄로 표시됨):
ENVLTQSPAT LSVTPGEKAT ITC RASQSVS YMH WYQQKPG QAPRLLIY DA SNRAS GVPSR
FSGSGSGTDH TLTISSLEAE DAATYYC FQG SVYPFT FGQG TKLEIK.
본 출원은 구체적으로 CD19에 결합할 수 있는 CD19 결합 분자들 (예컨대, CD19 x CD3 이중특이적 결합 분자들), 특히 항-CD19 단클론성 항체 CD19 mAb 1, 또는 미국 특허 US 7,112,324에서 개시된 임의의 항-CD19 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다. 본 발명은 구체적으로 블리나투모맙 (BLINCYTO®; WHO Drug Information, 2009, Recommended INN: List 62, 23(3):240-241에서 볼 수 있는 아미노산 서열) 및 두보르툭시주맙 (duvortuxizumab) (aka MGD011; WHO Drug Information, 2016, Proposed INN: List 116, 30(4):627-629에서 볼 수 있는 아미노산 서열)을 포함하는, 본 발명에서 사용될 수 있는 예시의 CD19 x CD3 이중특이적 결합 분자들을 포함하고 망라한다.
E. 예시의 병원체-관련 항원들
본원에서 사용되는 용어 "병원체 항원"은 병원체-감염된 세포의 표면에서 특징적으로 발현되고, 따라서 항체-기반 분자 또는 면역조절 분자로 치료될 수 있는 항원을 나타낸다. 병원체 항원의 실례로는, 한정하는 것은 아니지만, 다음의 것들로 감염된 세포의 표면에서 발현되는 항원들을 포함한다: 단순 포진 바이러스 (예컨대, 감염된 세포 단백질 (ICP)47, gD, 등), 수두 대상포진 바이러스, 카포시 육종-관련 포진 바이러스, 엡스타인-바르 바이러스 (예컨대, LMP-1, LMP-2A, LMP-2B, 등), 사이토메갈로바이러스 (예컨대, UL11, 등), 인간 면역결핍 바이러스 (예컨대, env 단백질 gp160, gp120, gp41, 등), 인간 유두종 바이러스 (예컨대, E6, E7, 등), 인간 T-세포 백혈병 바이러스 (예컨대, env 단백질 gp64, gp46, gp21, 등), A형 간염 바이러스, B형 간염 바이러스, C형 간염 바이러스, 수포성 구내염 바이러스 (VSV), 바실리(Bacilli), 시트로박터(Citrobacter), 콜레라(Cholera), 디프테리아(Diphtheria), 엔테로박터(Enterobacter), 고노코키(Gonococci), 헬리코박터 파일로리(Helicobacter pylori), 클레브시엘라(Klebsiella), 레지오넬라(Legionella), 메닝고코키(Meningococci), 미코박테리아, 슈도모나스(Pseudomonas), 뉴모노코키(Pneumonococci), 리케차균(rickettsia bacteria), 살모넬라(Salmonella), 세라티아(Serratia), 스타필로코키(Staphylococci), 스트렙토코키(Streptococci), 파상풍(Tetanus), 아스페르길루스(Aspergillus (푸미가투스, 니거, 등)), 블라스토마이세스 데마티티디스(Blastomyces dermatitidis), 칸디다(Candida (알비칸스, 크루세이, 글라브라타, 트로피칼리스, 등)), 크립토코쿠스 네오포르만스(Cryptococcus neoformans), 뮤코랄레스속(Genus Mucorales (뮤코, 압시디아, 리조푸스)), 스포로트릭스 스켄키이(Sporothrix schenkii), 파라코키디오이데스 브라실리엔시스(Paracoccidioides brasiliensis), 코키디오이데스 이미티스(Coccidioides immitis), 히스토플라스마 캡술라툼(Histoplasma capsulatum), 렙토스피로시스(Leptospirosis), 보렐리아 부르그도르페리(Borrelia burgdorferi), 장내 기생충(helminth parasite (십이지장충, 촌충, 디스토마류, 편형동물류 (예컨대 시스토소미아(Schistosomia), 기아르디아 람비아(Giardia lambia), 트리키넬라(t richinella), 디엔타모에바 프라길리스(Dientamoeba Fragilis), 트리파노소마 브루세이(Trypanosoma brucei), 트리파노소마 크루지(Trypanosoma cruzi), 및 레이슈마니아 도노바니(Leishmania donovani)). 그러한 항체들은 많은 공급체로부터 상업적으로 입수 가능하거나, 또는 마우스 또는 다른 동물을 그러한 항원들로 면역화함으로써 (단클론성 항체들의 생성에 대한 것을 포함하여) 얻어질 수 있다.
F. 병원체-관련 항원에 결합할 수 있는 예시의 항체들
그것의 VH 및 VL 도메인이 병원체-감염된 세포의 표면에서 배열되는 병원체 항원에 결합할 수 있는 분자들을 구성하기 위해 사용될 수 있는 예시의 항체들이 아래에서 제시되며, 추가적인 항체들은 당업계에 알려져 있다.
HIV의 env 단백질은 예시의 병원체-관련 항원이고, HIV의 env 단백질에 결합하는 항체들은 병원체-관련 항원에 결합할 수 있는 예시의 항체들이다.
HIV-1 감염의 초기 단계는 세포 표면 CD4의 경막 당단백질 (gp41)과 표면 당단백질 (gp120)의 헤테로다이머인 트라이머 HIV-1 엔벨로프 당단백질 (env)에의 결합으로 일어난다. gp120 및 gp41 당단백질은 초기에 단일 gp160 폴리펩타이드로서 합성되고 그것은 비-공유적으로 회합된 gp120/gp41 복합체를 생성하기 위해 계속해서 절단된다. env의 엑토도메인은 완전한 gp120 구성요소와, 대략 20 kDa의 gp41로 구성된, 질량이 대략 140 kDa인 헤테로다이머이다 (Harris, A. et al. (2011) "Trimeric HIV-1 Glycoprotein Gp140 Immunogens And Native HIV-1 Envelope Glycoproteins Display The Same Closed And Open Quaternary Molecular Architectures", Proc. Natl. Acad. Sci. (U.S.A.) 108(28):11440-11445). env 단백질에 면역특이적으로 결합하는 항체들은 상업적으로 입수 가능하고 당업계에 기술되어 있다 (예컨대, GenBank 기탁 번호. AFQ31503; Buchacher, A. et al. (1994) "Generation Of Human Monoclonal Antibodies Against HIV-1 Proteins; Electrofusion And Epstein-Barr Virus Transformation For Peripheral Blood Lymphocyte Immortalization", AIDS Res. Hum. Retroviruses 10(4):359-369; Shen, R. (2010) "GP41-Specific Antibody Blocks Cell-Free HIV Type 1 Transcytosis Through Human Rectal Mucosa And Model Colonic Epithelium", J. Immunol. 184(7):3648-3655; WO 2012/162068; 및 WO 2016/054101 참조). HIV env에 결합하는 예시의 항체들은 "7B2" (GenBank 기탁 번호 AFQ31503) 및 "A32" (PCT 공개공보 번호 WO 2014/159940)를 포함한다.
7B2의 VH 도메인의 아미노산 서열 (SEQ ID NO:267)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
QVQLVQSGGG VFKPGGSLRL SCEASGFTFT EYYMT WVRQA PGKGLEWLAY ISKNGEYSKY
SPSSNGRFTI SR DNAKNS VF LQLDRLSADD TAVYYCAR AD GLTYFSELLQ YIFDL WGQGA
RVTVSS.
7B2의 VL 도메인의 아미노산 서열 (SEQ ID NO:268)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
DIVMTQSPDS LAVSPGERAT IHCK SSQTLL YSSN NRHSIA WYQQRPGQPP KLLLYWASMR
LSGVPDRFSG S GSGTD FTLT INNLQAEDVA IYYCHQ YSSH PPT FGHGTRV EIK.
A32의 VH 도메인의 아미노산 서열 (SEQ ID NO:269)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
QVQLQESGPG LVKPSQTLSL SCTVSGGSSS SG AHYWS WIR QYPGKGLEWI G YIHYSGNTY
YNPSLKS RIT ISQHTSENQF SLKLNSVTVA DTAVYYCAR G TRLRTLRNAF DI WGQGTLVT VSS.
A32의 VL 도메인의 아미노산 서열 (SEQ ID NO:270)이 하기에 제시된다 (CDR 잔기들은 밑줄로 표시됨):
QSALTQPPSA SGSPGQSVTI SCT GTSSDVG GY NYVSWYQH HPGKAPKLII SEVNNRPSGV
PDRFSGS KSG NT ASLTVSGL QAEDEAEYYC SS YTDIHNFV FGGGTKLTVL.
본 출원은 구체적으로 HIV에 결합할 수 있는 HIV 결합 분자들 (예컨대, HIV x CD3 이중특이적 결합 분자들), 특히 항-HIV 단클론성 항체들 7B2, A32, 및 또한 WO 2016/054101, WO 2017/011413, WO 2017/011414에서 개시된 임의의 항-HIV 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 결합 분자들을 포함하고 망라한다. 본 발명은 구체적으로 WO 2014/159940, WO 2015/184203, WO 2017/011413, 및 WO 2017/011414에 제시된 예시의 HIV x CD3 이중특이적 결합 분자들을 포함하고 망라한다.
본 출원은 추가로 구체적으로 HIV, CD3 및 CD8에 결합할 수 있는 HIV x CD3 x CD8 삼중특이적 결합 분자들, 특히 항-HIV 단클론성 항체들 7B2 또는 A32 또는 WO 2015/184203, WO 2016/054101, WO 2017/011413, WO 2017/011414에 제공된 임의의 항-HIV 단클론성 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH, 및/또는 WO 2015/184203에 제시된 임의의 항-CD8 단클론성 항체의 VL 및/또는 VH 도메인, 및/또는 VL 영역의 하나, 둘 또는 3개 전부의 CDRL 및 VH 도메인의 하나, 둘 또는 3개 전부의 CDRH를 포함하는 그러한 삼중특이적 결합 분자들을 포함하고 망라한다. 본 발명은 구체적으로 WO 2015/184203, WO 2017/011413, 및 WO 2017/011414에 제시된 예시의 HIV x CD3 x CD8 삼중특이적 결합 분자들을 포함하고 망라한다.
G. 본 발명의 예시의 결합 분자들
하기에서 논의되는 것과 같이, 본 발명은 2개의 투여된 분자들의 조합 치료법을 사용하여 예시된다: PD-1에 결합할 수 있는 분자 (에컨대, 상기에서 기술된 hPD-1 mAb7 (1.2) IgG4 (P), DART-1 또는 DART-2), 및 종양 세포의 재지정된 사멸을 매개할 수 있는 분자 (예컨대, 하기에서 기술되는 "DART-A", 또는 "DART-B").
DART-A는 이펙터 세포의 CD3 세포 표면 분자 및 B7-H3 암 항원에 결합할 수 있는 이중특이적 디아바디이다. 그것은 B7-H3에 대한 하나의 결합 부위, B7-H3, 손잡이 및 구멍 포함 IgG1 Fc 영역에 대한 하나의 결합 부위, 및 E/K-코일 헤테로다이머-촉진 도메인을 가지는 3개의 폴리펩타이드 사슬로 구성된 Fc 영역-함유 디아바디이다 (예컨대, 도 4A 참조).
DART-A의 제 1 폴리펩타이드 사슬은 N-말단에서 C-말단 방향으로, N-말단, B7-H3에 결합할 수 있는 단클론성 항체의 VL 도메인 (hB7-H3 mAb 2 VL2) (SEQ ID NO:226), 개입 링커 펩타이드 (링커 1; GGGSGGGG (SEQ ID NO:14)), CD3에 결합할 수 있는 단클론성 항체의 VH 도메인 (CD3 mAb 1 VH) (SEQ ID NO:192), 개입 링커 펩타이드 (링커 2; GGCGGG (SEQ ID NO:15)), 헤테로다이머-촉진 (E-코일) 도메인 ( E VAAL E K- E VAAL E K- E VAAL E K- E VAAL E K (SEQ ID NO:27)), 개입 링커 펩타이드 (스페이서-링커 3; GGGDKTHTCPPCP (SEQ ID NO:39)), "손잡이-포함" Fc 도메인 (SEQ ID NO:42), 및 C-말단을 포함한다. 그러므로, DART-A의 제 1 폴리펩타이드 사슬은 SEQ ID NO:226 ─ SEQ ID NO:14 ─- SEQ ID NO:192 ─- SEQ ID NO:15 ─- SEQ ID NO:27 ─- SEQ ID NO:39 ─- SEQ ID NO:42로 구성된다. DART-A의 제 1 폴리펩타이드 사슬의 아미노산 서열은 (SEQ ID NO:271)이다:
DIQLTQSPSF LSASVGDRVT ITCKASQNVD TNVAWYQQKP GKAPKALIYS ASYRYSGVPS
RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YNNYPFTFGQ GTKLEIKGGG SGGGGEVQLV
ESGGGLVQPG GSLRLSCAAS GFTFSTYAMN WVRQAPGKGL EWVGRIRSKY NNYATYYADS
VKDRFTISRD DSKNSLYLQM NSLKTEDTAV YYCVRHGNFG NSYVSWFAYW GQGTLVTVSS
GGCGGGEVAA LEKEVAALEK EVAALEKEVA ALEKGGGDKT HTCPPCPAPE AAGGPSVFLF
PPKPKDTLMI SRTPEVTCVV VDVSHEDPEV KFNWYVDGVE VHNAKTKPRE EQYNSTYRVV
SVLTVLHQDW LNGKEYKCKV SNKALPAPIE KTISKAKGQP REPQVYTLPP SREEMTKNQV
SLWCLVKGFY PSDIAVEWES NGQPENNYKT TPPVLDSDGS FFLYSKLTVD KSRWQQGNVF
SCSVMHEALH NHYTQKSLSL SPGK.
DART-A의 제 2 폴리펩타이드 사슬은 N-말단에서 C-말단 방향으로, N-말단, CD3에 결합할 수 있는 단클론성 항체의 VL 도메인 (CD3 mAb 1 VL) (SEQ ID NO:193), 개입 링커 펩타이드 (링커 1; GGGSGGGG (SEQ ID NO:14)), B7-H3에 결합할 수 있는 단클론성 항체의 VH 도메인 (hB7-H3 mAb 2 VH2) (SEQ ID NO:222), 개입 링커 펩타이드 (링커 2; GGCGGG (SEQ ID NO:15)), 헤테로다이머-촉진 (K-코일) 도메인 ( K VAAL K E- K VAAL K E- K VAAL K E- K VAAL K E (SEQ ID NO:28)), 및 C-말단을 포함한다. 그러므로, DART-A의 제 2 폴리펩타이드는 SEQ ID NO:193 ─ SEQ ID NO:14 ─- SEQ ID NO:222 ─- SEQ ID NO:15 ─- SEQ ID NO:28로 구성된다. DART-A의 제 2 폴리펩타이드 사슬의 아미노산 서열은 (SEQ ID NO:272)이다:
QAVVTQEPSL TVSPGGTVTL TCRSSTGAVT TSNYANWVQQ KPGQAPRGLI GGTNKRAPWT
PARFSGSLLG GKAALTITGA QAEDEADYYC ALWYSNLWVF GGGTKLTVLG GGGSGGGGEV
QLVESGGGLV QPGGSLRLSC AASGFTFSSF GMHWVRQAPG KGLEWVAYIS SDSSAIYYAD
TVKGRFTISR DNAKNSLYLQ MNSLRDEDTA VYYCGRGREN IYYGSRLDYW GQGTTVTVSS
GGCGGGKVAA LKEKVAALKE KVAALKEKVA ALKE.
DART-A의 제 3 폴리펩타이드 사슬은 N-말단에서 C-말단 방향으로, N-말단, 펩타이드 (링커 3; DKTHTCPPCP (SEQ ID NO:38)), "구멍-포함" Fc 도메인 (SEQ ID NO:43), 및 C-말단을 포함한다. 그러므로, DART-A의 제 3 폴리펩타이드눈 SEQ ID NO:38 ─ SEQ ID NO:43으로 구성된다. DART-A의 제 3 폴리펩타이드 사슬의 아미노산 서열은 (SEQ ID NO:273)이다:
DKTHTCPPCP APEAAGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSHED PEVKFNWYVD
GVEVHNAKTK PREEQYNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKALPA PIEKTISKAK
GQPREPQVYT LPPSREEMTK NQVSLSCAVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS
DGSFFLVSKL TVDKSRWQQG NVFSCSVMHE ALHNRYTQKS LSLSPGK.
종양 세포의 재지정된 사멸을 매개할 수 있는 또 다른 예시의 분자는 DART-B이다. DART-B는 이펙터 세포의 CD3 세포 표면 분자 및 IL13Rα2 암 항원에 결합할 수 있는 이중특이적 디아바디이다. DART-B는 3개의 폴리펩타이드 사슬로 구성되고 DART-A와 동일한 일반 구조를 가진다.
본 발명의 방법에 사용될 수 있는 종양 세포의 재지정된 사멸을 매개할 수 있는 추가적인 예시의 분자들은 CD19 및 CD3 (예컨대, 미국 특허 번호 7,235,641 및 WO 2016/048938 참조); CD123 및 CD3 (예컨대, Kuo, S.R. et al. , (2012) "Engineering a CD123xCD3 Bispecific scFv immunofusion for the treatment of leukemia and elimination of leukemia stem cells", Protein Eng Des Sel. 25:561-9; PCT 공개공보 번호 WO 2015/026892 참조); gpA33 및 CD3 (예컨대, WO 2015/026894); CEA 및 CD3 (예컨대, WO 2013/012414); B7-H3 및 CD3 (예컨대, WO 2017/030926); HER2 및 CD3 (예컨대, WO 2012/143524); 5T4 및 CD3 (예컨대, WO 2015/184203 및 WO 2013/041687)에 결합할 수 있는 이중특이적 분자들, 및 삼중특이적 분자들 (예컨대, WO 2015/184203; 및 WO 2015/184207 참조)을 포함한다.
VI. 제조 방법
본 발명의 분자들은 가장 바람직하게는, 당업계에 잘 알려져 있는 것과 같이, 그러한 폴리펩타이드들을 암호화하는 핵산 분자들의 재조합 발현을 통해 제조된다.
발명의 폴리펩타이드는 편리하게는 고상 펩타이드 합성법을 사용하여 제조될 수 있다 (Merrifield, B. (1986) "Solid Phase Synthesis", Science 232(4748):341-347; Houghten, R.A. (1985) "General Method For The Rapid Solid-Phase Synthesis Of Large Numbers Of Peptides: Specificity Of Antigen-Antibody Interaction At The Level Of Individual Amino Acids", Proc. Natl. Acad. Sci. (U.S.A.) 82(15):5131-5135; Ganesan, A. (2006) "Solid-Phase Synthesis In The Twenty-First Century", Mini Rev. Med. Chem. 6(1):3-10).
항체들은 재조합에 의해 제조될 수 있고 당업계에 알려져 있는 임의의 방법을 사용하여 발현될 수 있다. 항체들은 먼저 숙주 동물로부터 만들어진 항체를 분리하고, 유전자 서열을 얻고, 숙주 세포 (예컨대 CHO 세포)에서 항체를 재조합적으로 발현하기 위해 그 유전자 서열을 사용함으로써 재조합적으로 제조될 수 있다. 사용될 수 있는 다른 방법은 식물 (예컨대 담배) 또는 형질전환 밀크에서 항체 서열을 발현시키는 것이다. 식물 또는 밀크에서 항체들을 재조합적으로 발현시키기에 적합한 방법은 개시되어 있다 (예를 들어, Peeters et al. (2001) "Production Of Antibodies And Antibody Fragments In Plants", Vaccine 19:2756; Lonberg, N. et al. (1995) "Human Antibodies From Transgenic Mice", Int. Rev. Immunol 13:65-93; 및 Pollock et al. (1999) "Transgenic Milk As A Method For The Production Of Recombinant Antibodies", J. Immunol. Methods 231:147-157 참조). 항체들의 유도체, 예컨대 인간화된, 단일-사슬, 등을 제조하기에 적합한 방법들은 당업계에 알려져 있고, 상기에서 기술된 바 있다. 또 다른 대안으로, 항체들은 파지 디스플레이 기술에 의해 재조합적으로 제조될 수 있다 (예를 들어 미국 특허 5,565,332; 5,580,717; 5,733,743; 6,265,150; 및 Winter, G. et al. (1994) "Making Antibodies By Phage Display Technology", Annu. Rev. Immunol. 12.433-455 참조).
관심의 폴리뉴클레오타이드 (예컨대 본 발명의 결합 분자들의 폴리펩타이드 사슬을 암호화하는 폴리뉴클레오타이드)를 함유하는 벡터는 전기천공법, 염화 칼슘, 염화 루비듐, 인산 칼슘, DEAE-덱스트란, 또는 기타 물질을 사용하는 트랜스펙션; 미세투사 폭발(microprojectile bombardment); 리포펙션; 및 감염 (예컨대 벡터가 백시니아 바이러스와 같은 감염성 병원체인 경우에)을 포함한, 다양한 적절한 수단 중 임의의 것에 의해 숙주 세포로 도입될 수 있다. 도입 벡터 또는 폴리뉴클레오타이드의 선택은 종종 숙주 세포의 특징에 따라 좌우될 것이다.
이종성 DNA를 과잉발현할 수 있는 임의의 숙주 세포는 관심의 폴리펩타이드 또는 단백질을 발현시킬 목적에 대해 사용될 수 있다. 적합한 푸유류 숙주 세포의 비-제한적인 실례로는, 한정하는 것은 아니지만, COS, HeLa, 및 CHO 세포를 포함한다.
발명은 본 발명의 결합 분자의 아미노산 서열을 포함하는 폴리펩타이드를 포함한다. 본 발명의 폴리펩타이드는 당업계에 알려져 있는 과정들에 의해 제조될 수 있다. 폴리펩타이드는 항체들의 단백질 가수분해성 분해 또는 다른 분해에 의해, 상기에서 기술된 재조합 방법에 의해 (즉 단일 또는 융합 폴리펩타이드) 또는 화학적 합성에 의해 제조될 수 있다. 항체들의 폴리펩타이드, 특히 최대 약 50개의 아미노산의 더 짧은 폴리펩타이드가 편리하게 화학적 합성에 의해 제조된다. 화학적 합성 방법은 당업계에 알려져 있고 상업적으로도 입수 가능하다.
발명은 향상된 또는 감소된 활성을 가지는 변종뿐만 아니라 그러한 분자들의 특성에 유의미하게 영향을 미치지 않는, 기능적으로 동등한 폴리펩타이드를 포함하여, 개시된 결합 분자들의 변종을 포함한다. 폴리펩타이드의 변형은 당업계에서 기본적인 실행이고 본원에서 상세하게 기술될 필요는 없다. 변형된 폴리펩타이드의 실례로는 아미노산 잔기들의 보존성 치환, 기능적 활성을 유의미하게 불리하게 변화시키지 않은 아미노산들의 하나 이상의 결실 또는 첨가가 포함된 폴리펩타이드, 또는 화학적 유사체의 사용을 들 수 있다. 서로에 대해 보존적으로 치환될 수 있는 아미노산 잔기들로는, 한정하는 것은 아니지만, 글리신/알라닌; 세린/트레오닌; 발린/아이소류신/류신; 아스파라긴/글루타민; 아스파르트산/글루탐산; 리신/아르기닌; 및 페닐알라닌/티로신을 포함한다. 이런 폴리펩타이드들은 또한 글리코실화된 및 글리코실화되지 않은 폴리펩타이드, 뿐만 아니라 기타 후-번역 변형, 예컨대 상이한 당으로의 글리코실화, 아세틸화, 및 인산화를 포함한다. 바람직하게, 아미노산 치환은 보존성일 수 있을 것이다, 즉 치환된 아미노산은 원래의 아미노산의 화학적 특성과 유사한 화학적 특성을 가질 수 있을 것이다. 그러한 보존성 치환은 당업계에 알려져 있고, 그 예는 상기에서 제시되었다. 아미노산 변형은 하나 이상의 아미노산을 바꾸거나 변형하는 것으로부터 영역, 예컨대 가변 도메인의 재설계를 완성하는 것까지 다양할 수 있다. 가변 도메인의 변화는 결합 친화성 및/또는 특이성을 변경시킬 수 있다. 변형의 다른 방법은 당업계에 알려져 있는 결합 기법, 이를테면, 한정하는 것은 아니지만, 효소적 수단, 산화성 치환 및 킬레이트화를 포함한다. 변형은, 예를 들어 면역검정을 위한 표지의 부착, 예컨대 방사성 면역검정을 위한 방사성 모이어티의 부착을 위해 사용될 수 있다. 변형된 폴리펩타이드는 당업계의 수립된 과정들을 사용하여 제조되고 당업계에 알려져 있는 표준 검정들을 사용하여 스크리닝될 수 있다.
발명은 PD-1 (또는 PD-1의 천연 리간드)에 결합하는 항체 또는 리펙터 세포의 세포 표면 분자에 결합하는 항체 또는 질환 항원 (예컨대, 암 항원 또는 병원체-관련 항원)에 결합하는 항체의 VH 및/또는 VL 도메인을 하나 이상 포함하는 융합 단백질을 포함한다. 한 구체예에서, 경쇄, 중쇄 또는 경쇄 및 중쇄 둘 다를 포함하는 융합 폴리펩타이드가 제공된다. 다른 구체예에서, 융합 폴리펩타이드는 이종성 면역글로불린 불변 영역을 함유한다. 또 다른 구체예에서, 융합 폴리펩타이드는 공공-기탁된 하이브리도마로부터 생성된 항체의 VH 및 VL 도메인을 함유한다. 본 발명의 목적에 대해, 항체 융합 단백질은 PD-1 (또는 PD-1의 천연 리간드)에 또는 이펙터 세포의 세포 표면 분자에 특이적으로 결합하고, 천연 분자에 부착되지 않은 또 다른 아미노산 서열, 예를 들어 이종성 서열 또는 또 다른 영역으로부터의 동종성 서열을 함유하는 하나 이상의 폴리펩타이드 도메인을 함유한다.
본 발명은 구체적으로 진단 또는 치료 모이어티에 콘쥬게이트된 그러한 결합 분자들 (예컨대, 항체들, 디아바디들, 삼가 결합 분자들, 등)을 포함한다. 진단 목적에 대해, 발명의 결합 분자들은 검출 가능한 물질에 결합될 수 있다. 그러한 결합 분자들은 임상 실험 과정의 일부로서 질환의 발달 또는 진행을 모니터링하거나 및/또는 예측하는데, 예컨대 특정 치료법의 효능을 측정하는데 유용하다. 검출 가능한 물질의 예를 들면 다양한 효소들 (예컨대 서양고추냉이 과산화효소, 베타-갈락토시다제, 등), 보결 분자들 (예컨대, 아비딘/비오틴), 형광 물질 (예컨대 움벨리페론, 플루오레세인, 또는 파이코에리트린), 발광 물질 (예컨대 루미놀), 생물발광 물질 (예컨대, 루시페라제 또는 에쿼린), 방사성 물질 (예컨대, 탄소-14, 망간-54, 스트론튬-85 또는 아연-65), 양전자 방출 금속, 및 비방사성 상자성 금속 이온을 들 수 있다. 검출 가능한 물질은 당업계에 공지되어 있는 기법을 사용하여 직접 결합 분자에, 또는 간접적으로 중간체 (예컨대 링커)를 통해 결합되거나 콘쥬게이트될 수 있다.
치료 목적에 대해, 발명의 결합 분자들은 세포독소, (예컨대 세포증식 억제제 또는 살세포제), 치료제 또는 방사성 금속 이온, 예컨대 알파-에미터와 같은 치료 모이어티에 콘쥬게이트될 수 있다. 세포독소 또는 세포독성제는 예를 들어, 슈도모나스 엑소독소, 디프테리아 독소, 보툴리눔 독소 A에서 F, 리신 아브린, 사포린, 및 그러한 작용제들의 세포독성 단편과 같이 세포에 유해한 임의의 작용제를 포함한다. 치료제는 장애를 예방적으로 또는 치료적으로 치료하기 위해 치료 효과를 가지는 임의의 작용제를 포함한다. 그러한 치료제는 화학적 치료제, 단백질 또는 폴리펩타이드 치료제일 수 있고, 원하는 생물학적 활성을 가지며 및/또는 주어진 생물학적 반응을 변형시키는 치료제들을 포함한다. 치료제의 예로는 알킬화제, 혈광형성 억제제, 유사분열 억제제, 호르몬 치료제, 및 세포 증식성 장애의 치료에 유용한 항체들을 들 수 있다. 치료 모이어티는 당업계에 공지되어 있는 기법을 사용하여 직접 결합 분자에, 또는 간접적으로 중간체 (예컨대 링커)를 통해 결합되거나 콘쥬게이트될 수 있다.
VII. 본 발명의 결합 분자들의 사용
상기에서 논의된 것과 같이, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자들 및 표적 세포 (즉, 암 세포, 또는 병원체-감염 세포)의 재지정된 세포 사멸을 매개할 수 있는 분자들은 치료 목적으로, 예를 들어 암 또는 감염에 걸린 대상체들에서 사용될 수 있다. 그러므로, 본 발명의 결합 분자들은 질환 항원, 특히 암 항원 또는 병원체-관련 항원의, 그러한 표적 세포의 표면에서의 발현과 관련된 또는 그것을 특징으로 하는 임의의 질환 또는 질병을 치료하는 능력을 가진다. 그러므로, 제한 없이, 본 발명의 결합 분자들은 암, 특히 암 항원의 발현을 특징으로 하는 암의 치료에 사용될 수 있다. 본 발명의 결합 분자들은 감염, 특히 병원체-관련 항원의 발현을 특징으로 하는 감염의 치료에 사용될 수 있다.
특히, 본 발명은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자가 PD-1에 결합할 수 있는 항체의 에피토프-결합 도메인 또는 PD-1의 천연 리간드에 결합할 수 있는 항체의 에피토프-결합 도메인을 포함하고 재지정된 사멸을 매개할 수 있는 분자가 이펙터 세포(예컨대, 헬퍼 T 세포, 세포독성 T 세포, 자연 살해 (NK) 세포, 혈장 세포 (항체-분비 B 세포), 대식세포 및 과립구)의 세포 표면 분자 (예컨대, CD2, CD3, CD8, CD16, TCR, NKG2D, 등)에 결합할 수 있는 에피토프-결합 분자를 포함하고 또한 표적 세포의 재지정된 사멸을 매개하기 위하여 (예를 들어, 재지정된 세포 사멸 (예컨대, 재지정된 T-세포 세포독성)을 매개함으로써) 표적 세포의 표면에서 질환 항원 (특히 암 항원 또는 병원체-관련 항원)에 결합할 수 있는 에피토프-결합 도메인을 포함하는, 그러한 방법을 포함한다.
특정 구체예에서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자는 항체이고 재지정된 세포 사멸을 매개할 수 있는 분자는 디아바디이다. 다른 특정 구체예에서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자는 항체이고 재지정된 세포 사멸을 매개할 수 있는 분자는 삼가 결합 분자이다.
특정 구체예에서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자는 디아바디이고 재지정된 세포 사멸을 매개할 수 있는 분자는 디아바디이다. 다른 특정 구체예에서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자는 디아바디이고 재지정된 세포 사멸을 매개할 수 있는 분자는 삼가 결합 분자이다.
한 구체예에서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 및 재지정된 세포 사멸을 매개할 수 있는 분자는 동시에 투여된다. 본원에서 사용되는 것과 같이, 그러한 "동시" 투여는 다음을 나타내는 것으로 의도된다:
(A) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 및 재지정된 세포 사멸을 매개할 수 있는 분자 두 가지를 모두 함유하는 단일 제약학적 조성물의 투여; 또는
(B) 둘 이상의 제약학적 조성물의 별도의 투여, 그 중 한 조성물은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자를 함유하고, 다른 하나의 조성물은 재지정된 세포 사멸을 매개할 수 있는 분자를 함유하며, 조성물은 48시간 간격 내에 투여된다.
제 2 구체예에서, 분자들은 "순차적으로" 투여된다 (예컨대 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자가 투여되고, 나중에, 재지정된 세포 사멸을 매개할 수 있는 분자가 투여되거나, 또는 그 역이다). 그런 순차적인 투여에서, 두 번째로 투여된 조성물은 첫 번째 투여된 조성물의 투여 후 적어도 48시간, 또는 그 이상의 시간 후에 투여된다.
"치료법을 제공하는 것" 또는 "치료하는 것"은, 제한 없이, 질환으로부터 유발되는 증상을 감소시키는 것, 감염의 증상 (예컨대 바이러스 부하, 열, 통증, 패혈증, 등)을 약화시키는 것, 종양의 크기 (암 맥락에서, 예를 들어, 유방종양, 위암 또는 전립선암에서)를 축소시키는 것, 암 세포 성장의 지연, 전이의 개시, 발달 또는 진행의 지연, 질환으로부터 유발되는 증상의 감소, 수령체 대상체의 삶의 질의 증가, 대상체의 질환을 치료하기 위해 제공되는 다른 약물의 용량의 감소, 표적화 및/또는 내부화를 통해서와 같은 또 다른 약물의 효과의 향상, 질환의 진행의 지연, 및/또는 수령체 대상체의 생존의 연장을 포함하여, 유익한 또는 바람직한 결과의 임의의 징후와 관련된 조성물의 임의의 투여를 나타낸다.
치료를 위한 대상체로는 동물, 가장 바람직하게는 포유류 종, 예컨대 비-영장류 (예컨대, 소, 말, 고양이, 개, 설치류, 등) 또는 영장류 (예컨대, 시노몰구스 원숭이와 같은 원숭이, 인간, 등)를 포함한다. 바람직한 구체예에서, 대상체는 인간이다.
본 발명의 다양한 구체예들에 의해 치료될 수 있는 예시의 장애는, 한정하는 것은 아니지만, 증식성 장애, 세포 증식성 장애, 및 암 (특히 재지정된 세포 사멸을 매개할 수 있는 분자에 의해 결합된 암 항원을 발현하는 암), 병원체-관련 질환 (특히 재지정된 세포 사멸을 매개할 수 있는 분자에 의해 결합된 병원체-관련 항원의 발현과 관련된 만성 바이러스 감염)을 포함한다. 다양한 구체예에서, 발명은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자 및 표적 세포 (예컨대 종양 세포, 병원체-감염 세포 또는 외래 세포)의 재지정된 사멸을 매개할 수 있는 분자의 치료적 유효량을 대상체에게 투여하는 것을 포함하는, 대상체에서 질환 또는 장애의 치료, 예방 또는 관리를 위한 방법 및 조성물을 포함한다. 그러한 분자들의 조합은 원발성 종양의 성장의 예방, 억제, 감소, 또는 원발성 종양의 퇴행 및 종양의 전이의 예방, 억제, 감소를 위해, 및 병원체 부하의 감소, 또는 병원체-감염 세포의 제거에 특히 유용하다. 특별한 작용 메커니즘에 의해 결합되는 것을 의도하지는 않지만, 그러한 분자들은 표적 세포에 대하여 이펙터 기능을 매개할 수 있고, 표적 세포에 대하여 면역 체계의 활성화를 촉진할 수 있으며, 표적 세포 상에서 세포-표면 항원 및/또는 수용체를 가교-결합시킬 수 있고, 세포자멸 또는 네거티브 성장 조절 신호전달을 향상시킬 수 있거나, 또는 그것들의 조합으로 표적 세포의 제거 및/또는 수의 감소를 초래한다.
본 발명의 분자들에 의해, 및 본 발명의 방법에 의해 치료될 수 있는 암으로는, 한정하는 것은 아니지만, 다음을 포함한다: 부신암, 이를테면, 한정하는 것은 아니지만, 크롬친화세포종 또는 부신피질 암종; AIDS-관련 암; 포상 연부 육종; 성상세포 종양; 기저암; 방광암, 이를테면, 한정하는 것은 아니지만, 이행 세포 암종, 편평세포 암, 선암종, 또는 암육종; 뼈 및 결합 조직 육종, 예컨대 한정하는 것은 아니지만, 골 육종, 골육종, 연골 육종, 유잉 육종, 악성 거대 세포 종양, 뼈의 섬유육종, 척삭종, 골막 육종, 연부 조직 육종, 혈관 육종 (혈관육종), 섬유육종, 카포시 육종, 평활근 육종, 지방육종, 림프관 육종, 신경집종(neurilemmoma), 횡문근 육종, 또는 활막 육종; 뇌암, 이를테면, 한정하는 것은 아니지만, 신경교종, 성상세포종, 뇌간 신경교종, 뇌실막세포종(ependymoma), 희돌기세포교종(oligodendroglioma), 비신경교종, 청신경접종(acoustic neurinoma), 두개인두종(craniopharyngioma), 수모세포종(medulloblastoma), 수막종(meningioma), 송과체세포종(pineocytoma), 송과모세포종(pineoblastoma), 또는 원발성 뇌 림프종; 뇌 및 척수암; 유방암, 이를테면, 한정하는 것은 아니지만, 선암종, 소엽(lobular) (소세포) 암종, 관내 암종(intraductal carcinoma), 수질 유방암, 점액성 유방암, 관형 유방암, 유두성 유방암, 파제트병, 또는 염증성 유방암; 경동맥 소체 종양; 경부 암, 이를테면, 한정하는 것은 아니지만, 편평 세포 암종, 또는 선암종; 담관암종, 이를테면, 한정하는 것은 아니지만, 유두성, 결절성, 또는 미만성 담관암종; 연골육종; 척삭종; 난염성 신장 세포 암종; 투명 세포 암종; 결장암; 대장암; 피부 양성 섬유 조직구종; 결합조직성 소원형 세포 종양; 뇌실막세포종; 눈 암, 이를테면, 한정하는 것은 아니지만, 눈의 흑색종, 예컨대 홍채 흑색종, 맥락막 흑색종, 및 모양체 흑색종, 및 망막모세포종; 식도암, 이를테면, 한정하는 것은 아니지만, 편평세포 암, 선암종, 선양 낭포 암종, 점액표피양 암종, 선편평상 암종, 육종, 흑색종, 형질세포종, 우췌상 암종, 및 귀리 세포 (소세포) 암종; 유잉 종양; 외골격 점액성 연골육종; 골성 불완전 섬유 생성증; 뼈의 섬유 이형성; 담낭 또는 담관암, 이를테면, 한정하는 것은 아니지만, 선암종; 위암; 임신성 영양막 질환; 생식 세포 종양; 두경부암; 간세포 암종; 중쇄 질환; 섬세포 종양; 카포시 육종; 백혈병, 이를테면, 한정하는 것은 아니지만, 급성 백혈병; 급성 림프구성 백혈병; 급성 골수성 백혈병, 예컨대, 한정하는 것은 아니지만, 골수모세포성, 전골수구성, 골수단핵구성, 단핵구성, 또는 적백혈병 백혈병 또는 골수이형성 증후군; 만성 백혈병, 예컨대 한정하는 것은 아니지만, 만성 골수구성 (과립구성) 백혈병, 만성 림프구성 백혈병, 털세포 백혈병; 지방종/양성 지방종성 종양; 지방육종/악성 지방종성 종양; 간암, 이를테면, 한정하는 것은 아니지만, 간세포 암종, 또는 간모세포; 림프종, 예컨대 한정하는 것은 아니지만, 호지킨 질환; 비-호지킨 질환; 폐암, 이를테면, 한정하는 것은 아니지만, 비-소세포 폐암, 편평 세포 암종 (유표피 암종), 선암종, 대-세포 암종 또는 소-세포 폐암; 수모세포종; 흑색종; 수막종; 양성 단클론성 감마글로불린병증; 유의미성이 측정되지 않은 단클론성 감마글로불린병증; 다발성 내분비 종양; 다발성 골수종, 예컨대 한정하는 것은 아니지만, 무증상(smoldering) 다발성 골수종, 비분비성 골수종, 골경화성 골수종, 형질 세포 백혈병, 고립성 형질세포종 및 골수외 형질세포종; 골수이형성 증후군; 신경모세포종; 신경내분비 종양; 구강암, 이를테면, 한정하는 것은 아니지만, 편평 세포 암종; 난소암, 이를테면, 한정하는 것은 아니지만, 난소 상피 암종, 경계선상 종양, 생식 세포 종양, 및 간질 종양; 췌장암, 이를테면, 한정하는 것은 아니지만, 인슐린종, 가스트린종, 글루카곤종, 비포마(vipoma), 소마토스타틴-분비 종양, 또는 유암종 또는 섬세포 종양; 부갑상선 종양; 소아과 암; 말초 신경초 종양; 크롬친화세포종; 인두암, 이를테면, 한정하는 것은 아니지만, 편평세포 암, 또는 사마귀 암; 뇌하수체암, 이를테면, 한정하는 것은 아니지만, 쿠싱병, 프로락틴-분비 종양, 말단비대증, 또는 요붕증 종양(diabetes insipius tumor); 전립선암, 이를테면, 한정하는 것은 아니지만, 선암종, 평활근 육종, 또는 횡문근 육종; 진성적혈구 증가증(polycythemia vera); 후방 포도막 흑색종; 희귀 혈액 장애; 신장암, 이를테면, 한정하는 것은 아니지만, 선암종, 부신종, 섬유육종, 신장 전이성 암, 또는 이행 세포 암 (신우 및/또는 요관); 횡문근양 종양; 횡문근육종; 침샘암, 이를테면, 한정하는 것은 아니지만, 선암종, 점액표피양 암종, 또는 선양낭포 암종; 육종; 피부암, 이를테면, 한정하는 것은 아니지만, 기저 세포 암종, 편평 세포 암종 및 흑색종, 표재 확장성 흑색종, 결절성 흑색종, 흑자성(lentigo malignant) 흑색종, 또는 말단 흑색점 흑색종; 연부 조직 육종; 편평 세포 암; 위암, 이를테면, 한정하는 것은 아니지만, 선암종, 용종형 (폴립형), 궤양형, 표재 확장성, 미만 확장성, 또는 악성 림프종, 지방육종, 섬유육종, 및 암육종; 활막 육종; 고환암, 이를테면, 한정하는 것은 아니지만, 생식세포 종양, 고환종, 악성, 고전형 (전형적인), 정모세포성, 고환종, 배아성 암종, 기형종 암종(teratoma carcinoma), 또는 융모막 암종(choriocarcinoma) (난황낭종(olk-sac tumor)); 흉선 암종; 흉선종; 갑상선 암, 예컨대 한정하는 것은 아니지만, 유두성 또는 여포성 갑상선 암, 전이성 갑상선 암, 갑상선 수질암 또는 악성 갑상선암; 자궁암, 이를테면, 한정하는 것은 아니지만, 자궁내막 암종 또는 자궁 육종; 질암, 이를테면, 한정하는 것은 아니지만, 편평 세포 암종, 선암종, 또는 흑색종; 외음부 암, 이를테면, 한정하는 것은 아니지만, 편평 세포 암종, 흑색종, 선암종, 기저 세포 암종, 육종, 또는 파제트병; 발덴스트롬 고분자글로불린혈증, 또는 빌름스 종양. 이에 더불어, 암은 점액육종, 골형성성 육종, 내피육종, 림프관-내피육종, 중피종, 활막종, 혈관모세포종, 내피 암종, 낭선암종(cystadenocarcinoma), 기관지원성 암종(bronchogenic carcinoma), 땀샘 암종, 피지선 암종(sebaceous gland carcinoma), 유두상 암종 및 유두상 선암종을 포함한다 (그러한 장애들의 리뷰에 대해, Fishman et al., 1985, Medicine, 2d Ed., J.B. Lippincott Co., Philadelphia and Murphy et al., 1997, Informed Decisions: The Complete Book of Cancer Diagnosis, Treatment, and Recovery, Viking Penguin, Penguin Books U.S.A., Inc. 참조).
특히, 본 발명의 결합 분자들은 부신암, 방광암, 유방암, 대장암, 위암, 신경고모세포종, 신장암, 비-소세포 폐암, 급성 림프구성 백혈병, 급성 골수성 백혈병, 만성 림프구성 백혈병, 만성 골수성 백혈병, 털세포 백혈병, 버킷 림프종, 미만성 큰 B 세포 림프종, 여포성 림프종, 외투세포 림프종, 변연부 림프종, 비-호지킨 림프종, 작은 림프구성 림프종, 다발성 골수종, 흑색종, 난소암, 췌장암, 전립선암, 피부암, 신장 세포 암종, 고환암, 및 자궁암의 치료에 사용될 수 있다.
본 발명의 LAG-3-결합 분자들에 의해 치료될 수 있는 병원체-관련 질환으로는 만성 바이러스성, 박테리아성, 진균성 및 기생충 감염을 포함한다. 본 발명의 LAG-3-결합 분자들에 의해 치료될 수 있는 만성 감염은 엡스타인 바르 바이러스 감염, A형 간염 바이러스 (HAV) 감염; B형 간염 바이러스 (HBV) 감염; C형 간염 바이러스 (HCV) 감염; 인간 면역결핍 바이러스 (HIV) 감염, 수포성 구내염 바이러스 (VSV) 감염, 바실리 감염, 시트로박터 감염, 콜레라 감염, 디프테리아 감염, 엔테로박터 감염, 고노코키 감염, 헬리코박터 파일로리 감염, 클레브시엘라 감염, 레지오넬라 감염, 메닝고코키 감염, 미코박테리아 감염, 슈도모나스 감염, 뉴모노코키 감염, 리케차균 감염, 살모넬라 감염, 세라티아 감염, 스타필로코키 감염, 스트렙토코키 감염, 파상풍 감염, 아스페르길루스 (푸미가투스, 니거, 등) 감염, 블라스토마이세스 데마티티디스 감염, 칸디다 (알비칸스, 크루세이, 글라브라타, 트로피칼리스, 등) 감염, 크립토코쿠스 네오포르만스 감염, 뮤코랄레스속 (뮤코, 압시디아, 리조푸스) 감염, 스포로트릭스 스켄키이 감염, 파라코키디오이데스 브라실리엔시스 감염, 코키디오이데스 이미티스 감염, 히스토플라스마 캡술라툼 감염, 렙토스피로시스 감염, 보렐리아 부르그도르페리 감염, 장내 기생충 (십이지장충, 촌충, 디스토마류, 편형동물류 (예컨대 시스토소미아, 기아르디아 람비아, 트리키넬라, 디엔타모에바 프라길리스, 트리파노소마 브루세이, 트리파노소마 크루지, 및 레이슈마니아 도노바니) 감염을 포함한다.
VIII. 제약학적 조성물
본 발명은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 종야 세포의 재지정된 사멸을 매개할 수 있는 분자, 또는 그러한 분자들의 조합을 포함하는 조성물을 포함한다. 발명의 조성물은 제약학적 조성물 (예컨대 순수하지 않은 또는 비-멸균성 조성물)의 제조에 유용한 벌크 약물 조성물 및 단위 투여 형태의 제조에 사용될 수 있는 제약학적 조성물 (즉 대상체 또는 환자에게 투여하기에 적합한 조성물)을 포함한다. 그러한 조성물은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 종양 세포 (예컨대 암 세포, 병원체-감염 세포, 등)의 재지정된 사멸을 매개할 수 있는 분자, 또는 그러한 직용제들의 조합의 예방적 또는 치료적 유효량 및 제약학적으로 허용되는 담체를 포함한다. 바람직하게, 발명의 조성물은 예방적 또는 치료적 유효량의 본 발명의 결합 분자들 및 제약학적으로 허용되는 담체를 포함한다. 바람직한 측면으로, 그러한 조성물은 실질적으로 정제된다 (즉, 그것의 효과를 제한하거나 바람직하지 못한 부작용을 생성하는 물질이 실질적으로 없다).
하나 이상의 치료제가 투여되는 경우에 작용제들은 동일한 제제로 함께 제제화되거나 별도의 제제로 제제화될 수 있다. 따라서, 일부 구체예에서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자 및 표적 세포 (예컨대 암 세포, 병원체-감염 세포, 등)의 재지정된 사멸을 매개할 수 있는 분자는 함께 동일한 제약학적 조성물로 제제화된다. 대체 구체예에서, 분자들은 별도의 제약학적 조성물로 제제화된다.
PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 표적 세포 (예컨대 암 세포, 병원체-감염 세포, 등)의 재지정된 사멸을 매개할 수 있는 분자, 또는 그러한 분자들의 조합의 다양한 제제가 투여에 사용될 수 있다. 약물학적 활성 작용제(들)에 더불어, 본 발명의 조성물은 당업계에 잘 알려져 있고 약물학적으로 유효한 물질의 투여를 용이하게 하거나 또는 작용 부위로의 전달을 위해 제약학적으로 사용될 수 있는 조제물로의 활성 화합물들의 가공을 용이하게 하는, 상대적으로 비활성의 물질인 부형제들 및 보조제들을 포함하는 적합한 제약학적으로 허용되는 담체를 함유할 수 있다. 예를 들어, 부형제는 형태 또는 일관성을 제공하거나, 또는 희석제로서 작용할 수 있다. 적합한 부형제로는, 한정하는 것은 아니지만, 안정화제, 습윤 및 유화제, 오스몰 농도를 다르게 하기 위한 염, 캡슐화제, 완충제, 및 피부 침투 향상제를 포함한다.
특정 구체예에서, "제약학적으로 허용되는"은 동물, 및 보다 구체적으로는 인간에서 사용하기 위하여, 미국 연방 규제 기관 또는 주정부에 의해 인가된 또는 미국 약전 또는 다른 일반적으로 인식되는 약전에 열거된 것을 의미한다. 용어 "담체"는 치료제와 함께 투여되는 희석제, 보조제 (예컨대 프로인트 보조제 (완전 및 불완전)), 부형제, 또는 비히클을 나타낸다. 일반적으로, 발명의 조성물의 성분들은 별도로 공급되거나 단위 투여 형태로, 예를 들어 활성 작용제의 양을 나타내는 앰플 또는 사셰트(sachette)와 같은 밀폐 밀봉된 용기 중의 건조 동결건조 분말 또는 수분 없는 농축물로서 함께 혼합된다. 조성물이 주입에 의해 투여되어야 하는 경우에, 조성물은 멸균된 제약학적 등급의 물 또는 염수를 함유한 주입 병으로 조제된다. 조성물이 주사에 의해 투여되어야 하는 경우에, 주사용 멸균수 또는 염수의 앰플이 제공되어서 성분들이 투여 전에 혼합될 수 있다.
발명은 또한 단독으로, 또는 상기의 제약학적으로 허용되는 담체와 함께 본 발명의 결합 분자로 채워진 하나 이상의 용기를 포함하는 제약학적 팩 또는 키트를 제공한다. 추가적으로, 질환의 치료에 유용한 하나 이상의 다른 예방적 또는 치료적 작용제들이 또한 제약학적 팩 또는 키트에 포함될 수 있다. 발명은 또한 발명의 제약학적 조성물의 하나 이상의 성분들로 채워진 하나 이상의 용기를 포함하는 제약학적 팩 또는 키트를 제공한다. 선택적으로 그러한 용기(들)과 관련하여 약제 또는 생물학적 제품의 제조, 사용 또는 판매를 규제하는 정부 기관에 의해 규정된 형태에서 주의사항이 있을 수 있고, 그 주의사항은 인간 투여를 위한 제조, 사용 또는 판매의 기관에 의한 승인을 반영한다.
본 발명은 상기 방법에 사용될 수 있는 키트를 제공한다. 키트는 본 발명의 결합 분자들 중 어느 것이든지 포함할 수 있다. 키트는 추가로 암의 치료에 유용한 하나 이상의 다른 예방제 및/또는 치료제를, 하나 이상의 용기에 포함할 수 있다.
IX. 투여 방법
본 발명의 조성물은 발명의 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자를 포함하는 제약학적 조성물, 및 발명의 종양 세포의 재지정된 사멸을 매개할 수 있는 분자를 포함하는 제약학적 조성물; 또는 발명의 그러한 분자들의 조합을 포함하는 제약학적 조성물의 유효량을 대상체에게 투여함으로써 질환, 장애 또는 감염과 관련된 하나 이상의 증상의 치료, 예방, 및 개선을 제공할 수 있다. 바람직한 측면으로, 그러한 조성물은 실질적으로 정제된다 (즉, 그것의 효과를 제한하거나 바람직하지 못한 부작용을 생성하는 물질이 실질적으로 없다). 특정 구체예에서, 대상체는, 동물, 바람직하게는 포유류, 예컨대 비-영장류 (예컨대 소, 말, 고양이, 개, 설치류, 등) 또는 영장류 (예컨대 시노몰구스 원숭이와 같은 원숭이, 인간, 등)이다. 바람직한 구체예에서, 대상체는 인간이다.
분자 또는 조성물의 투여 방법은, 한정하는 것은 아니지만, 비경구 투여 (예컨대 피내, 근육내, 복강내, 정맥내 및 피하), 경막외, 및 점막 (예컨대 비강내 및 구강 경로) 투여를 포함한다. 특정 구체예에서, 본 발명의 결합 분자들은 근육내로, 정맥내로, 또는 피하로 투여된다. 조성물은 임의의 편리한 경로에 의해, 예를 들어 주입 또는 볼루스 주사에 의해, 상피 또는 피부점막 라이닝 (예컨대 구강 점막, 직장 및 장 점막, 등)을 통한 흡수에 의해 투여될 수 있고, 다른 생물학적 활성 작용제들과 함께 투여될 수 있다. 투여는 전신적이거나 국소적일 수 있다.
발명은 또한 발명의 결합 분자들의 조제물이 분자의 양을 나타내는 앰플 또는 사셰트와 같은 밀폐 밀봉된 용기에 포장되는 것을 제공한다. 한 구체예에서, 그런 분자들은 밀폐 밀봉된 용기 중의 건조 동결건조 분말 또는 수분 없는 농축물로서 공급되고 대상체에 투여하기에 적절한 농도로, 예컨대, 물 또는 염수로 복원될 수 있다. 바람직하게, 본 발명의 결합 분자들은 밀폐 밀봉된 용기 중의 건조 멸균 동결건조 분말로서 공급된다.
본 발명의 결합 분자들의 동결건조된 조제물은 그것들의 원래 용기에서 2℃ 내지 8℃에서 저장되어야 하고 분자들은 복원된 후 12시간 이내에, 바람직하게는 6시간 이내에, 5시간 이내에, 3시간 이내에, 또는 1시간 이내에 투여되어야 한다. 대체 구체예에서, 그러한 분자들은 분자, 융합 단백질, 또는 콘쥬게이트된 분자의 양 및 농도를 나타내는 밀폐 밀봉된 용기 중의 액체 형태로 공급된다. 바람직하게, 그러한 결합 분자들은, 액체 형태로 제공될 때, 밀폐 밀봉된 용기로 공급된다.
장애와 관련된 하나 이상의 증상의 치료, 예방 또는 개선에 효과적인 발명의 그러한 조제물의 양은 표준 임상 기법에 의해 결정될 수 있다. 제제에 사용될 정확한 용량은 또한 투여 경로, 및 질병의 중증도에 따라 좌우될 것이고, 의사의 판단 및 각 환자의 상황에 따라 결정되어야 한다. 유효량은 시험관내 또는 동물 모델 테스트 시스템으로부터 유도된 용량-반응 곡선으로부터 추정될 수 있다.
본원에서 사용되는 것과 같이, 제약학적 조성물의 "유효량"은 제한 없이, 질환으로부터 유발된 증상들을 감소시키는 것, 감염의 증상 (예컨대 바이러스 부하, 열, 통증, 패혈증, 등) 또는 암의 증상 (예컨대 암 세포의 증식, 종양 존재, 종양 전이, 등)을 약화시키고, 그로써 질환에 걸린 대상체의 삶의 질을 증가시키고, 질환을 치료하기 위해 필요한 다른 약물의 용량을 감소시키며, 표적화 및/또는 내부화를 통한 것과 같은 다른 약물의 효과를 향상시키고, 질환의 진행을 지연시키며, 및/또는 개체의 생존을 연장시키는 것과 같은 임상 결과를 포함한 유익한 또는 바람직한 결과를 이루기에 충분한 양이다. 활성 성분이 단독으로 투여되어 개체에게 적용될 때, 그 용어는 그 구성성분 단독을 나타낸다. 조합으로 적용될 때, 그 용어는 조합하여 투여되거나, 연속적으로 투여되거나, 또는 동시에 투여되거나 간에, 치료 효과를 초래하는 활성 성분들의 조합된 양을 나타낸다.
유효량은 하나 이상의 투여로 투여될 수 있다. 본 발명의 목적에 대해, 약물, 화합물, 또는 제약학적 조성물의 유효량은 암세포를 사멸하고 및/또는 암세포의 증식을 감소시키기에 충분한 양, 및/또는 암의 원발성 부위로부터의 전이의 발달을 제거, 감소 및/또는 지연시키기에 충분한 양; 또는 감염성 병원체의 증식 (또는 효과)를 감소시키기에 충분한 양 및 병원체-매개된 질환의 발달을 직접 또는 간접저으로 감소 및/또는 지연시키기에 충분한 양이다. 일부 구체예에서, 약물, 화합물, 또는 제약학적 조성물의 유효량은 다른 약물, 화합물, 또는 제약학적 조성물과 함께 이루어질 수도 있고 또는 그렇지 않을 수도 있다. 그러므로, "유효량"은 하나 이상의 화학요법제의 투여의 맥락에서 고려될 수 있고, 단일 작용제는 하나 이상의 다른 작용제와 함께 바람직한 결과가 이루어질 수 있거나 이루어진다면, 유효량으로 제공된 것으로 여겨질 수 있다. 개별적인 필요성이 달라지는 한편, 각 성분의 유효량의 최적 범위의 결정은 당업계의 기술 내에서 이루어진다.
발명에 의해 포함되는 결합 분자들에 대해, 환자에게 투여되는 투여량은 바람직하게는 수령체 대상체의 체중 (kg)을 기반으로 결정된다. 발명에 의해 포함되는 결합 분자들에 대해, 환자에게 투여되는 투여량은 전형적으로 대상체의 체중 kg당 약 0.01 μg 내지 약 30 mg 이상이다.
본 발명의 결합 분자의 투여량 및 투여 빈도는 예를 들어 지질화와 같은 변형에 의해 분자의 흡수 및 조직 침투를 향상시킴으로써 감소 또는 변경될 수 있다.
환자에게 투여되는 본 발명의 결합 분자의 투여량은 단일 작용제 요법으로서의 사용에 대해 계산될 수 있다. 대안적으로, 분자는 다른 치료 조성물과 조합하여 사용될 수 있고 환자에게 투여되는 투여량은 상기 분자들이 단일 작용제 요법으로서 사용될 때보다 더 낮다.
발명의 제약학적 조성물은 치료가 필요한 영역에 국소적으로 투여될 수 있고; 이것은 예를 들어, 제한하는 것이 아니라, 국소 주입에 의해, 주사에 의해, 또는 임플란트에 의해 이루어질 수 있으며, 상기 임플란트는 막, 예컨대 시알라스틱 막(sialastic membranes), 또는 섬유를 포함하는, 다공성, 비-다공성, 또는 젤라틴성 물질의 것이다. 바람직하게, 발명의 분자가 투여될 때, 분자를 흡수하지 않는 물질을 사용하기 위해 주의가 취해져야 한다.
발명의 조성물은 소포체, 특히 리포좀으로 전달될 수 있다 (Langer (1990) "New Methods Of Drug Delivery", Science 249:1527-1533); Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353- 365 (1989); Lopez-Berestein, ibid., pp. 3 17-327 참조).
발명의 조성물이 본 발명의 결합 분자를 암호화하는 핵산인 경우에, 그 핵산은 그것의 암호화된 결합 분자의 발현을 촉진하기 위하여, 예컨대, 레트로바이러스 벡터의 사용에 의해, 그것을 적절한 핵산 발현 벡터의 일부로 구성하고 그것이 세포 내부에 있도록 투여함으로써 (미국 특허 번호 4,980,286 참조), 또는 직접 주사에 의하여, 또는 미세입자 (예컨대 유전자 총; Biolistic, Dupont) 폭발의 사용에 의하여, 또는 지질 또는 세포 표면 수용체 또는 트랜스펙션 작용제로의 코팅에 의하여, 또는 그것을 핵에 들어가는 것으로 알려져 있는 호메오박스(homeobox)-유사 펩타이드에 결합시켜 투여함으로써 (예컨대, Joliot et al. (1991) "Antennapedia Homeobox 펩타이드 Regulates Neural Morphogenesis", Proc. Natl. Acad. Sci. (U.S.A.) 88:1864-1868 참조), 등등에 의해 생체내로 투여될 수 있다. 대안적으로, 핵산은 상동성 재조합에 의한 발현을 위해 세포내로 도입될 수 있고 숙주 세포 DNA 내에 통합될 수 있다.
치료적 또는 예방적 유효량의 본 발명의 결합 분자로의 대상체의 치료는 단일 치료를 포함할 수 있거나, 또는 바람직하게는 일련의 치료를 포함할 수 있다. 바람직한 실례에서, 대상체는 발명의 제약학적 조성물로 약 1 내지 10주 동안, 바람직하게는 2 내지 8주, 보다 바람직하게는 약 3 내지 7주, 보다 더 바람직하게는 약 4, 5, 또는 6주 동안 치료된다. 발명의 제약학적 조성물은 1일에 1회 투여될 수 있고, 그러한 투여는 주 1회, 주 2회, 2주마다 1회, 월 1회, 6주마다 1회, 2개월마다 1회, 년 2회 또는 년 1회 등으로 일어날 수 있다. 대안적으로, 발명의 제약학적 조성물은 1일에 2회 투여될 수 있고, 그러한 투여는 주 1회, 주 2회, 2주마다 1회, 월 1회, 6주마다 1회, 2개월마다 1회, 년 2회 또는 년 1회 등으로 일어날 수 있다. 대안적으로, 발명의 제약학적 조성물은 1일에 3회 투여될 수 있고, 그러한 투여는 주 1회, 주 2회, 2주마다 1회, 월 1회, 6주마다 1회, 2개월마다 1회, 년 2회 또는 년 1회 등으로 일어날 수 있다. 또한 치료에 사용된 분자들의 유효량은 특별한 치료 과정에 걸쳐 증가하거나 감소할 수 있음이 인정될 것이다.
실시예
발명은 일반적으로 기술되었고, 발명은 이제 다음의 실시예들에 대한 언급을 통해 더 쉽게 이해될 것인데, 실시예들은 예시에 의해 제공되며 명시되지 않는 한 본 발명을 제한하는 것으로 의도되지 않는다.
실시예 1
조합 치료 연구: LOX-IMVI 종양 모델
본 발명의 원리를 예시하기 위하여, 조합 치료 연구를, 인간 PBMC로 복원한 MHCI-/- 마우스에 LOX-IMVI 인간 전이성 흑색종 암 세포를 피하 주사하는 복원 종양 모델을 사용하여 실시하였다. 마우스는 그런 후에 비히클을 투여하거나 또는 다음의 치료를 투여하였다:
(1) PD-1에 결합할 수 있는 분자인 인간화된 항-인간 PD-1 항체: hPD-1 mAb7 (1.2) IgG4(P); 및/또는
(2) 이펙터 세포 (즉 CD3)의 세포 표면 분자 및 암 항원 (즉 B7-H3)에 결합할 수 있고, 그로써 B7-H3을 발현하는 암 세포의 재지정된 사멸을 매개할 수 있는 분자인 CD3 x B7-H3 이중특이적 디아바디 DART-A.
그렇게 투여된 분자들의 아미노산 서열은 상기에서 기술된다. 표 11은 연구의 파라미터들을 나타낸다. 각 그룹은 6마리씩의 암컷 마우스로 구성되었다. 모든 그룹에 대해, 마우스들은 5 x 106개의 LOX-IMVI 암 세포 (ID; 연구일 33일에 투여함) 및 106개의 인간 PBMC (IP; 연구일 0일에 투여함)를 받았다. 치료 (연구일 42일에 시작된 투여된 분자(들) 또는 비히클)를 3 용량에 대해 주마다 제공하였고 (Q7Dx3); 용량은 정맥내 주사에 의해 투여하였다.
| 그룹 | 투여된 용량 (mg/kg) | |
| hPD-1 mAb7 (1.2) IgG4(P) | DART-A | |
| 1 | 0 | 0 |
| 2 | 0 | 0.5 |
| 3 | 1.0 | 0 |
| 4 | 1.0 | 0.5 |
종양 부피를 시간의 함수로서 측정하였다. 도 7은 이 연구의 결과를 나타낸 것으로, hPD-1 mAb7 (1.2) IgG4(P) 단독으로의 또는 DART-A 단독으로의 투여에 비해 조합 치료법의 예상치 못한 유익을 증명한다.
실시예 2
조합 치료 연구: Detroit562 종양 모델
본 발명의 원리를 추가로 예시하기 위하여, 인간 PBMC로 복원한 MHCI-/- 마우스에 Detroit562 인간 전이성 인두 암종 암 세포를 피하 주사한 복원 종양 모델을 사용하여 조합 치료 연구를 실시하였다. 그런 후 마우스들에 비히클 대조군, 1 mg/kg의 hPD-1 mAb7 (1.2) IgG4(P), 0.5 mg/kg의 DART-A, 또는 1 mg/kg의 hPD-1 mAb7 (1.2) IgG4(P) 및 0.5 mg/kg의 DART-A 둘 다를 투여하였다. 표 12는 연구의 파라미터들을 나타낸다. 각 그룹은 8마리씩의 수컷 마우스들로 구성되었다. 모든 그룹에 대해, 마우스들은 5 x 106개의 Detroit562 암 세포 (ID) 및 106개의 인간 PBMC (IP; 연구일 0일에 투여함)를 받았다. 치료 (연구일 7일에 시작된 투여된 분자(들) 또는 비히클)를 4 용량에 대해 주마다 제공하거나 (Q7Dx4) 또는 2 용량에 대해 14일마다 제공하였고 (Q14Dx2); 용량은 정맥내 주사에 의해 투여하였다.
| 그룹 | 투여 양생법 | 투여된 용량 (mg/kg) | |
| hPD-1 mAb7 (1.2) IgG4(P) | DART-A | ||
| 1 | Q7Dx4 | 0 | 0 |
| 2 | Q7Dx4 | 1.0 | 0 |
| 3 | Q7Dx4 | 0 | 0.5 |
| 4 | Q14Dx2 | 0 | 0.5 |
| 5 | Q7Dx4 | 1.0 | 0.5 |
| 6 | Q14Dx2 | 1.0 | 0.5 |
종양 부피를 시간의 함수로서 측정하였다. 도 8A-8B는 이 연구 결과를 나타내는 것으로, hPD-1 mAb7 (1.2) IgG4(P) 단독으로의 또는 DART-A 단독으로의 투여에 비해 조합 치료법의 예상치 못한 유익을 다시 한 번 증명한다. 도 8A는 그룹 1 내지 3 및 5에 대한 결과를 나타내고; 도 8B는 그룹 1 내지 4 및 6에 대한 결과를 나타낸다.
마우스에서 CD3+ 세포의 농도를 연구가 끝났을 때 측정하였다. 놀랍게도 그러한 세포의 농도는 조합 치료법을 받은 마우스들에서 증가하였고 (도 9), 그로써 본 발명의 치료법이 동물의 면역 반응을 향상시켰음을 나타낸다.
실시예 3
신호전달 모델
본 발명의 원리를 추가로 예시하기 위하여, 협력적인 T-세포 신호전달을 T-세포/종양 세포 공동 배양 시스템에서 Jurkat-luc-NFAT / 종양 세포 루시페라제 리포터 검정을 사용하여 조사하였다. 간단히 설명하면, PD-1 및 B7-H3을 발현하는 MDA-MB-231 종양 표적 세포를 1:1 (도 10A) 또는 3:1 (도 10B)의 이펙터:표적 세포 비율로 MNFAT-luc2/PD-1 Jurkat T-세포와 혼합하고, 단독으로 또는 고정 농도 (12.5 nM)의 PD-1 결합 분자들 hPD-1 mAb7 (1.2) IgG4(P), DART-1, 대조군 항체와 함께, 증가하는 농도의 DART-A의 존재하에 배양하였다. 발광을 세포 활성화 및 신호전달의 표시자로서 측정하였다. 도 10A-10B는 PD-1에 결합할 수 있는 분자 (예컨대, hPD-1 mAb7 (1.2) IgG4(P), DART-1) 및 표적 세포의 재지정된 사멸을 매개할 수 있는 분자 (예컨대, DART-A)의 조합이 이펙터 세포 신호전달 활성을 향상시키는 것을 증명하는, 이 연구 결과를 나타낸다.
실시예 4
조합 치료 연구: A375 종양 모델에서 무력한 T-세포에 대한 정상 세포 비교
본 발명의 원리를 추가로 예시하기 위하여, 활성화된 또는 무력한 인간 T-세포로 복원한 NOG 마우스에 A375 인간 흑색종 세포를 피하 주사한 복원 종양 모델을 사용하여 조합 치료 연구를 실시하였다. 마우스를 그런 후에 비히클 또는 다음의 치료를 투여하였다:
(1) PD-1에 결합할 수 있는 디아바디인 PD-1 x LAG-3 이중특이적 디아바디: DART-2; 및/또는
(2) 이펙터 세포 (즉 CD3)의 세포 표면 분자 및 암 항원 (즉 IL13Rα2)에 결합할 수 있고, 그로써 IL13Rα2를 발현하는 암 세포의 재지정된 사멸을 매개할 수 있는 디아바디인 CD3 x IL13Rα2 이중특이적 디아바디 DART-B.
활성화된 T-세포를, 정제된 인간 T-세포를 CD3/CD28 활성화 비드와 함께 IL-2의 존재 하에 2회의 배양에 의해 제조하였다. 무력한 T-세포를, 정제된 인간 T-세포를 CD3/CD28 활성화 비드와 함께 IL-2의 존재 하에 1회 배양한 후, IL-2 없이 CD3/CD28 활성화 비드와 함께 1회 배양함으로써 제조하였다. 마우스들의 그룹 (n=8마리 암컷)은 연구일 0일에 5 x 106개의 A375 흑색종 세포 (0.1 μg/mL의 IFNγ로 24시간 동안 사전처리됨) 및 5 x 106개의 인간 T-세포 (활성화되었거나 무력한)를 피하 접종으로 받았고, 그런 후 비히클 대조군, 0.5 mg/kg의 DART-2, 0.5 mg/kg의 DART-B, 또는 0.5 mg/kg의 DART-2 및 0.5 mg/kg의 DART-B 둘 다를 투여하였다. 치료 (투여된 분자(들) 또는 비히클)를 4 용량에 대해 주마다 제공하거나 (Q7Dx4) 또는 단일 치료로서 연구일 0일에 제공하였고 (QD (SD)); 용량을 정맥내 주사에 의해 투여하였다. 표 13은 연구의 파라미터들을 나타낸다.
| 그룹 | T-세포 | 치료 |
용량
(mg/kg) |
경로/스케줄 |
| 1 | 활성화됨 | 비히클 | 0 | IV/QD (SD0) |
| 2 | 활성화됨 | DART-B | 0.01 | IV/QD (SD0) |
| 3 | 활성화됨 | DART-BDART-2 | 0.01 0.5 |
IV/QD (SD0) IV/Q7Dx4 |
| 4 | 활성화됨 | DART-2 | 0.5 | IV/Q7Dx4 |
| 5 | 무력함 | 비히클 | 0 | IV/QD (SD0) |
| 6 | 무력함 | DART-B | 0.01 | IV/QD (SD0) |
| 7 | 무력함 | DART-B DART-2 | 0.01 0.5 |
IV/QD (SD0) IV/Q7Dx4 |
| 8 | 무력함 | DART-2 | 0.5 | IV/Q7Dx4 |
종양 부피를 시간의 함수로서 측정하였다. 도 11A-11B는 이 연구의 결과를 나타내며, PD-1에 결합할 수 있는 분자 (예컨대, hPD-1 mAb7 (1.2) IgG4(P), DART-1, DART-2) 및 표적 세포의 재지정된 사멸을 매개할 수 있는 분자 (예컨대, DART-A, DART-B)의 조합된 치료법이 무력한 T-세포의 존재하에 종양 재발을 감소시키는 것을 증명한다. 이런 결과는 어느 한 분자 단독의 투여에 비해 PD-1에 결합할 수 있는 분자 및 표적 세포의 재지정된 사멸을 매개할 수 있는 분자의 조합된 치료법의 예상치 못한 유익을 다시 한 번 증명한다. 도 11A는 정상적인 활성 T-세포로 접종된 그룹 1 내지 4에 대한 결과를 나타내고; 도 11B는 무력한 T-세포로 접종된 그룹 5 내지 8에 대한 결과를 나타낸다.
실시예 5
조합 치료 연구: A375 종양 모델
본 발명의 원리를 추가로 예시하기 위하여, 인간 T-세포로 복원한 NOG 마우스에 A375 인간 흑색종 세포를 피하 주사한 동시 혼합 종양 모델을 사용하여 조합 치료 연구를 실시하였다. 마우스를 그런 후에 비히클 또는 다음의 치료를 투여하였다:
(1) PD-1에 결합할 수 있는 디아바디인 PD-1 x LAG-3 이중특이적 디아바디: DART-2; 및/또는
(2) 이펙터 세포 (즉 CD3)의 세포 표면 분자 및 암 항원 (즉 IL13Rα2)에 결합할 수 있고, 그로써 IL13Rα2를 발현하는 암 세포의 재지정된 사멸을 매개할 수 있는 디아바디인 CD3 x IL13Rα2 이중특이적 디아바디 DART-B.
표 14는 연구의 파라미터들을 나타낸다. 각 그룹은 8마리씩의 암컷 마우스로 구성되었다. 모든 그룹에 대해, 마우스들은 1.25 x106개의 인간 T-세포 (120 μg/ml의 DART-2로 20분 동안 사전처리됨)와 동시 혼합된 1.25 x 106개의 A375 흑색종 세포 (24시간 동안 100 ng/ml의 IFNγ로 사전처리됨)를 받았다 (SC; 연구일 0일에 투여됨). 그룹 5 내지 8의 마우스들을 세포 주사 전 24시간 전에 (연구일 -1일) DART-2 (500 μg/kg)로 사전처리하고, 연구일 7일에 시작하여 DART-2 (500 μg/kg)의 추가 용량을, 7일마다, 총 10 용량으로 제공하였다. 그룹 2 내지 4 및 6 내지 8의 마우스들에게는 연구일 0일에 단일 용량의 ART-B (1, 5 또는 10 μg/kg)를 제공하였다. 그룹 1에는 비히클을 단독으로 제공하였다. 모든 용량을 정맥내 주사로 투여하였다.
| 그룹 | 수/성별 | 치료 | 용량 (μg/kg) | 경로/스케줄 |
| 1 | 8/암컷 | 비히클 | 0 | IV/QDx1 |
| 2 | 8/암컷 | DART-B | 1 | IV/QDx1 |
| 3 | 8/암컷 | DART-B | 5 | IV/QDx1 |
| 4 | 8/암컷 | DART-B | 10 | IV/QDx1 |
| 5 | 8/암컷 | DART-2 | 500 | IV/Q7Dx7 |
| 6 | 8/암컷 | DART-B | 1 | IV/QDx1 |
| DART-2 | 500 | IV/Q7Dx7 | ||
| 7 | 8/암컷 | DART-B | 5 | IV/QDx1 |
| DART-2 | 500 | IV/Q7Dx7 | ||
| 8 | 8/암컷 | DART-B | 10 | IV/QDx1 |
| DART-2 | 500 | IV/Q7Dx7 |
종양 부피를 시간의 함수로서 측정하고 도 12A 내지 12H에 도표화한다. 도 12A는 그룹 1, 2, 5 및 6에 대한 50일까지의 결과를 나타내고; 도 12B 내지 12H는 그룹 2 (도 12B), 그룹 5 (도 12C), 그룹 6 (도 12D), 그룹 3 (도 12E), 그룹 7 (도 12F), 그룹 4 (도 12G), 및 그룹 8 (도 12H)에서 개별적인 동물들에 대한, 80일 까지의 레이더 도표를 나나탠다. 이 연구의 결과는 어느 한 분자 단독의 투여에 비하여 PD-1에 결합할 수 있는 분자 및 표적 세포의 재지정된 사멸을 매개할 수 있는 분자의 조합된 치료법의 예상치 못한 유익을 증명한다.
본 명세서에서 언급된 모든 공개물 및 특허는 각각의 개별적인 공개물 또는 특허 출원이 그 전문을 언급함으로써 포함된 것으로 구체적으로 및 개별적으로 표시된 것과 같은 정도로 참조로 본원에 포함된다. 발명이 특정 구체예들과 관련하여 기술되었지만, 추가의 변형이 가능하고 본 출원은 일반적으로 발명의 원리를 따르고 본 개시로부터의 그러한 벗어남을 포함하는 발명의 임의의 변화, 사용, 또는 적응을 발명이 속하는 기술분야 내에서의 공지된 또는 관례적인 실시 내에 포함되는 것으로서 및 이제까지 설명된 본질적인 특징들에 적용될 수 있는 것으로서 포함하는 것으로 의도되는 것이 인지될 것이다.
SEQUENCE LISTING
<110> MacroGenics, Inc.
Bonvini, Ezio
Koenig, Scott
Johnson, Leslie S.
Moore, Paul A.
Alderson, Ralph F.
<120> Combination Therapy
<130> 1301.0142PCT
<150> US 62/432,299
<151> 2016-12-09
<150> US 62/346,854
<151> 2016-06-07
<160> 275
<170> PatentIn version 3.5
<210> 1
<211> 98
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(98)
<223> Exemplary Human IgG1 CH1 Domain
<400> 1
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 2
<211> 98
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(98)
<223> Exemplary Human IgG2 CH1 Domain
<400> 2
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val
<210> 3
<211> 98
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(98)
<223> Exemplary Human IgG4 CH1 Domain
<400> 3
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 4
<211> 15
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(15)
<223> Exemplary Human IgG1 Hinge Domain
<400> 4
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 5
<211> 12
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> Exemplary Human IgG2 Hinge Domain
<400> 5
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro
1 5 10
<210> 6
<211> 12
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> Exemplary Human IgG4 Hinge Domain
<400> 6
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 7
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Exemplary S228P-Stabilized Human IgG4 Hinge Domain
<400> 7
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 8
<211> 217
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(217)
<223> CH2-CH3 Domain of Exemplary Human IgG1
<220>
<221> MISC_FEATURE
<222> (217)..(217)
<223> XAA is Lysine (K) or Absent
<400> 8
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 9
<211> 216
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(216)
<223> CH2-CH3 Domain of Exemplary Human IgG2
<220>
<221> MISC_FEATURE
<222> (216)..(216)
<223> XAA is Lysine (K) or Absent
<400> 9
Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 10
<211> 217
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(217)
<223> CH2-CH3 Domain of Exemplary Human IgG3
<220>
<221> MISC_FEATURE
<222> (217)..(217)
<223> XAA is Lysine (K) or Absent
<400> 10
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 11
<211> 217
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(217)
<223> CH2-CH3 Domain of Exemplary Human IgG4
<220>
<221> MISC_FEATURE
<222> (217)..(217)
<223> XAA is Lysine (K) or Absent
<400> 11
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Xaa
210 215
<210> 12
<211> 107
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> Exemplary Human CL Kappa Domain
<400> 12
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 13
<211> 104
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(104)
<223> Exemplary Human CL Lambda Domain
<400> 13
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
50 55 60
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
65 70 75 80
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
85 90 95
Thr Val Ala Pro Thr Glu Cys Ser
100
<210> 14
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Preferred Intervening Spacer Peptide (Linker 1)
<400> 14
Gly Gly Gly Ser Gly Gly Gly Gly
1 5
<210> 15
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Preferred Cysteine-Containing Spacer Peptide (Linker 2)
<400> 15
Gly Gly Cys Gly Gly Gly
1 5
<210> 16
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Alternative Spacer Peptide (Linker 2)
<400> 16
Gly Gly Gly Ser
1
<210> 17
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Alternative Spacer Peptide (Linker 2)
<400> 17
Leu Gly Gly Gly Ser Gly
1 5
<210> 18
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Alternative Spacer Peptide (Linker 2)
<400> 18
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
1 5 10
<210> 19
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Alternative Spacer Peptide (Linker 2)
<400> 19
Ala Ser Thr Lys Gly
1 5
<210> 20
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Alternative Spacer Peptide (Linker 2)
<400> 20
Leu Glu Pro Lys Ser Ser
1 5
<210> 21
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Alternative Spacer Peptide (Linker 2)
<400> 21
Ala Pro Ser Ser Ser
1 5
<210> 22
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Heterodimer-Promoting Domain
<400> 22
Gly Val Glu Pro Lys Ser Cys
1 5
<210> 23
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Heterodimer-Promoting Domain
<400> 23
Val Glu Pro Lys Ser Cys
1 5
<210> 24
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Heterodimer-Promoting Domain
<400> 24
Ala Glu Pro Lys Ser Cys
1 5
<210> 25
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Heterodimer-Promoting Domain
<400> 25
Gly Phe Asn Arg Gly Glu Cys
1 5
<210> 26
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Heterodimer-Promoting Domain
<400> 26
Phe Asn Arg Gly Glu Cys
1 5
<210> 27
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> "E-coil" Heterodimer-Promoting Domain
<400> 27
Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val
1 5 10 15
Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
20 25
<210> 28
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> "K-coil" Heterodimer-Promoting Domain
<400> 28
Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val
1 5 10 15
Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
20 25
<210> 29
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> Cysteine-Containing "E-Coil" Heterodimer-Promoting Domain
<400> 29
Glu Val Ala Ala Cys Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val
1 5 10 15
Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
20 25
<210> 30
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> Cysteine-Containing "K-Coil" Heterodimer-Promoting Domain
<400> 30
Lys Val Ala Ala Cys Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val
1 5 10 15
Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
20 25
<210> 31
<211> 46
<212> PRT
<213> Streptococcus dysgalactiae
<220>
<221> MISC_FEATURE
<222> (1)..(46)
<223> Albumin-Binding Domain 3 (ABD3) of Protein G of Streptococcus
strain G148
<400> 31
Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly
1 5 10 15
Val Ser Asp Tyr Tyr Lys Asn Leu Ile Asp Asn Ala Lys Ser Ala Glu
20 25 30
Gly Val Lys Ala Leu Ile Asp Glu Ile Leu Ala Ala Leu Pro
35 40 45
<210> 32
<211> 46
<212> PRT
<213> Artificial Sequence
<220>
<223> Deimmunized Variant Albumin-Binding Domain 3 (ABD3) of Protein G
of Streptococcus strain G148
<400> 32
Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly
1 5 10 15
Val Ser Asp Tyr Tyr Lys Asn Leu Ile Asp Asn Ala Lys Ser Ala Glu
20 25 30
Gly Val Lys Ala Leu Ile Asp Glu Ile Leu Ala Ala Leu Pro
35 40 45
<210> 33
<211> 46
<212> PRT
<213> Artificial Sequence
<220>
<223> Deimmunized Variant Albumin-Binding Domain 3 (ABD3) of Protein G
of Streptococcus strain G148
<400> 33
Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly
1 5 10 15
Val Ser Asp Tyr Tyr Lys Asn Ala Ala Asn Asn Ala Lys Thr Val Glu
20 25 30
Gly Val Lys Ala Leu Ile Ala Glu Ile Leu Ala Ala Leu Pro
35 40 45
<210> 34
<211> 46
<212> PRT
<213> Artificial Sequence
<220>
<223> Deimmunized Variant Albumin-Binding Domain 3 (ABD3) of Protein G
of Streptococcus strain G148
<400> 34
Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly
1 5 10 15
Val Ser Asp Tyr Tyr Lys Asn Leu Ile Ser Asn Ala Lys Ser Val Glu
20 25 30
Gly Val Lys Ala Leu Ile Ala Glu Ile Leu Ala Ala Leu Pro
35 40 45
<210> 35
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Intervening Spacer Peptide (Linker)
<400> 35
Ala Pro Ser Ser Ser Pro Met Glu
1 5
<210> 36
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Intervening Spacer Peptide (Linker)
<400> 36
Val Glu Pro Lys Ser Ala Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 37
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Intervening Spacer Peptide (Linker)
<400> 37
Leu Glu Pro Lys Ser Ala Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 38
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Intervening Spacer Peptide (Linker)
<400> 38
Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10
<210> 39
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Alternative Linker
<400> 39
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10
<210> 40
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Alternative Linker
<400> 40
Leu Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 41
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<223> CH2-CH3 Domain of Exemplary Human IgG1 Having L234A/L235A
Substitutions
<220>
<221> MISC_FEATURE
<222> (217)..(217)
<223> XAA is Lysine (K) or Absent
<400> 41
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 42
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<223> "Knob-Bearing" IgG1 CH2-CH3 Domain
<220>
<221> MISC_FEATURE
<222> (217)..(217)
<223> XAA is Lysine (K) or Absent
<400> 42
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 43
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<223> "Hole-Bearing" IgG1 CH2-CH3 Domain
<220>
<221> MISC_FEATURE
<222> (217)..(217)
<223> XAA is Lysine (K) or Absent
<400> 43
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 44
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Preferred Intervening Spacer Peptide
<400> 44
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 45
<211> 288
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(288)
<223> Human PD-1 Protein (NCBI Sequence NP_005009.2), Including Signal
Sequence
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> Signal Sequence of Human PD-1 Protein (NCBI Sequence NP_005009.2)
<220>
<221> MISC_FEATURE
<222> (21)..(288)
<223> Human PD-1 Protein (NCBI Sequence NP_005009.2); Mature Protein
<400> 45
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 46
<211> 121
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(121)
<223> VH Domain of Murine Anti-Human PD-1 mAb 1
<400> 46
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Arg Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Phe Ser Ile Thr Asn Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly His Ile Thr Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn His Phe Phe
65 70 75 80
Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Ser Gly Tyr Pro Tyr Thr Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 47
<211> 6
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(6)
<223> CDRH1 of PD-1 mAb 1
<400> 47
Asn Asp Tyr Ala Trp Asn
1 5
<210> 48
<211> 16
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> CDRH2 of PD-1 mAb 1
<400> 48
His Ile Thr Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 49
<211> 12
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> CDRH3 of PD-1 mAb 1
<400> 49
Asp Tyr Gly Ser Gly Tyr Pro Tyr Thr Leu Asp Tyr
1 5 10
<210> 50
<211> 106
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> VL Domain of Murine Anti-Human PD-1 mAb 1
<400> 50
Gln Ile Val Leu Thr Gln Ser Pro Ala Leu Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Thr Ser Ile Val Ser Tyr Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Gln Pro Trp Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Asp Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 51
<211> 10
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> CDRL1 of PD-1 mAb 1
<400> 51
Ser Ala Thr Ser Ile Val Ser Tyr Val Tyr
1 5 10
<210> 52
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 1
<400> 52
Leu Thr Ser Asn Leu Ala Ser
1 5
<210> 53
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 1
<400> 53
Gln Gln Trp Ser Asp Asn Pro Tyr Thr
1 5
<210> 54
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human hPD-1 mAb 1 VH1
<400> 54
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Ile Ser Asn Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly His Ile Thr Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Leu Thr Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Val
65 70 75 80
Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Ser Gly Tyr Pro Tyr Thr Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 55
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human hPD-1 mAb 1 VL1
<400> 55
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Thr Ser Ile Val Ser Tyr Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Gln Pro Leu Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Asp Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 56
<211> 116
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(116)
<223> VH Domain of Murine Anti-Human PD-1 mAb 2
<400> 56
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Arg Lys Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Met Ser Ile Ser Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Val Thr Arg Asp Asn Ala Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Ser Leu Ser Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 57
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 2
<400> 57
Ser Phe Gly Met His
1 5
<210> 58
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 2
<400> 58
Tyr Ile Ser Ser Gly Ser Met Ser Ile Ser Tyr Ala Asp Thr Val Lys
1 5 10 15
Gly
<210> 59
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRH3 of PD-1 mAb 2
<400> 59
Leu Ser Asp Tyr Phe Asp Tyr
1 5
<210> 60
<211> 112
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> VL Domain of Murine Anti-Human PD-1 mAb 2
<400> 60
Asp Val Val Met Ser Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Thr Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Phe Phe Cys Ser Gln Thr
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 61
<211> 16
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> CDRL1 of PD-1 mAb 2
<400> 61
Arg Ser Ser Gln Ser Leu Val His Ser Thr Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 62
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 2
<400> 62
Arg Val Ser Asn Arg Phe Ser
1 5
<210> 63
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 2
<400> 63
Ser Gln Thr Thr His Val Pro Trp Thr
1 5
<210> 64
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human hPD-1 mAb 2 VH1
<400> 64
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Met Ser Ile Ser Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ser Leu Ser Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 65
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human hPD-1 mAb 2 VH1
<400> 65
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Thr Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Thr
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 66
<211> 125
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(125)
<223> VH Domain of Murine Anti-Human PD-1 mAb 3
<400> 66
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Thr Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Val Met His Trp Val Lys Gln Thr Pro Val His Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Ile Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Phe
85 90 95
Thr Arg Glu Lys Ile Thr Thr Ile Val Glu Gly Thr Tyr Trp Tyr Phe
100 105 110
Asp Val Trp Gly Thr Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 67
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 3
<400> 67
Asp Tyr Val Met His
1 5
<210> 68
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 3
<400> 68
Thr Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 69
<211> 16
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> CDRH3 of PD-1 mAb 3
<400> 69
Glu Lys Ile Thr Thr Ile Val Glu Gly Thr Tyr Trp Tyr Phe Asp Val
1 5 10 15
<210> 70
<211> 112
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> VL Domain of Murine Anti-Human PD-1 mAb 3
<400> 70
Asp Val Leu Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asp Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 71
<211> 16
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> CDRL1 of PD-1 mAb 3
<400> 71
Arg Ser Ser Gln Asn Ile Val His Ser Asn Gly Asp Thr Tyr Leu Glu
1 5 10 15
<210> 72
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<223> CDRL2 of PD-1 mAb 3
<400> 72
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 73
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 3
<400> 73
Phe Gln Gly Ser His Leu Pro Tyr Thr
1 5
<210> 74
<211> 116
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(116)
<223> VH Domain of Murine Anti-Human PD-1 mAb 4
<400> 74
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Arg Lys Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Met Ser Ile Ser Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Val Thr Arg Asp Asn Ala Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Ser Leu Thr Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 75
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 4
<400> 75
Ser Phe Gly Met His
1 5
<210> 76
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 4
<400> 76
Tyr Ile Ser Ser Gly Ser Met Ser Ile Ser Tyr Ala Asp Thr Val Lys
1 5 10 15
Gly
<210> 77
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRH3 of PD-1 mAb 4
<400> 77
Leu Thr Asp Tyr Phe Asp Tyr
1 5
<210> 78
<211> 112
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> VL Domain of Murine Anti-Human PD-1 mAb 4
<400> 78
Asp Val Val Met Ser Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Thr Gly Asn Thr Tyr Phe His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Thr
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 79
<211> 16
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> CDRL1 of PD-1 mAb 4
<400> 79
Arg Ser Ser Gln Ser Leu Val His Ser Thr Gly Asn Thr Tyr Phe His
1 5 10 15
<210> 80
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 4
<400> 80
Arg Val Ser Asn Arg Phe Ser
1 5
<210> 81
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 4
<400> 81
Ser Gln Thr Thr His Val Pro Trp Thr
1 5
<210> 82
<211> 119
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(119)
<223> VH Domain of Murine Anti-Human PD-1 mAb 5
<400> 82
Gln Val Gln Leu Gln Gln Pro Gly Val Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ala Tyr
20 25 30
Trp Met Asn Trp Met Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile His Pro Ser Asp Ser Glu Thr Trp Leu Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ile Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu His Tyr Gly Ser Ser Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 83
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 5
<400> 83
Ala Tyr Trp Met Asn
1 5
<210> 84
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 5
<400> 84
Val Ile His Pro Ser Asp Ser Glu Thr Trp Leu Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 85
<211> 10
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> CDRH3 of PD-1 mAb 5
<400> 85
Glu His Tyr Gly Ser Ser Pro Phe Ala Tyr
1 5 10
<210> 86
<211> 111
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(111)
<223> VL Domain of Murine Anti-Human PD-1 mAb 5
<400> 86
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Asn Glu Ser Val Asp Asn Tyr
20 25 30
Gly Met Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Thr Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 87
<211> 15
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(15)
<223> CDRL1 of PD-1 mAb 5
<400> 87
Arg Ala Asn Glu Ser Val Asp Asn Tyr Gly Met Ser Phe Met Asn
1 5 10 15
<210> 88
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 5
<400> 88
Ala Ala Ser Asn Gln Gly Ser
1 5
<210> 89
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 5
<400> 89
Gln Gln Ser Lys Glu Val Pro Tyr Thr
1 5
<210> 90
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Murine Anti-Human PD-1 mAb 6
<400> 90
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Asn Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Ser Asp Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Ala Thr Thr Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Thr
115
<210> 91
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 6
<400> 91
Ser Tyr Gly Met Ser
1 5
<210> 92
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 6
<400> 92
Thr Ile Ser Gly Gly Gly Ser Asp Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 93
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRH3 of PD-1 mAb 6
<400> 93
Gln Lys Ala Thr Thr Trp Phe Ala Tyr
1 5
<210> 94
<211> 111
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(111)
<223> VL Domain of Murine Anti-Human PD-1 mAb 6
<400> 94
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Pro Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Ala Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 95
<211> 15
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(15)
<223> CDRL1 of PD-1 mAb 6
<400> 95
Arg Ala Ser Glu Ser Val Asp Asn Tyr Gly Ile Ser Phe Met Asn
1 5 10 15
<210> 96
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 6
<400> 96
Pro Ala Ser Asn Gln Gly Ser
1 5
<210> 97
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 6
<400> 97
Gln Gln Ser Lys Glu Val Pro Trp Thr
1 5
<210> 98
<211> 119
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(119)
<223> VH Domain of Murine Anti-Human PD-1 mAb 7
<400> 98
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile His Pro Ser Asp Ser Glu Thr Trp Leu Asp Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Gln Leu Ile Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu His Tyr Gly Thr Ser Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 99
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 7
<400> 99
Ser Tyr Trp Met Asn
1 5
<210> 100
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 7
<400> 100
Val Ile His Pro Ser Asp Ser Glu Thr Trp Leu Asp Gln Lys Phe Lys
1 5 10 15
Asp
<210> 101
<211> 10
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> CDRH3 of PD-1 mAb 7
<400> 101
Glu His Tyr Gly Thr Ser Pro Phe Ala Tyr
1 5 10
<210> 102
<211> 111
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(111)
<223> VL Domain of Murine Anti-Human PD-1 mAb 7
<400> 102
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Asn Glu Ser Val Asp Asn Tyr
20 25 30
Gly Met Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile His Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Phe Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Ala Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 103
<211> 15
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(15)
<223> CDRL1 of PD-1 mAb 7
<400> 103
Arg Ala Asn Glu Ser Val Asp Asn Tyr Gly Met Ser Phe Met Asn
1 5 10 15
<210> 104
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 7
<400> 104
Ala Ala Ser Asn Gln Gly Ser
1 5
<210> 105
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 7
<400> 105
Gln Gln Ser Lys Glu Val Pro Tyr Thr
1 5
<210> 106
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human hPD-1 mAb 7 VH1
<400> 106
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile His Pro Ser Asp Ser Glu Thr Trp Leu Asp Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu His Tyr Gly Thr Ser Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 107
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human hPD-1 mAb 7 VH2
<400> 107
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ala
35 40 45
Gly Val Ile His Pro Ser Asp Ser Glu Thr Trp Leu Asp Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu His Tyr Gly Thr Ser Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 108
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human hPD-1 mAb 7 VL1
<400> 108
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Asn Glu Ser Val Asp Asn Tyr
20 25 30
Gly Met Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile His Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 109
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human hPD-1 mAb 7 VL2
<400> 109
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Met Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile His Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 110
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human hPD-1 mAb 7 VL3
<400> 110
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Met Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile His Ala Ala Ser Asn Arg Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 111
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> CDRL1 of the VL Domain of hPD-1 mAb 7 VL2 and hPD-1 mAb 7 VL3
<400> 111
Arg Ala Ser Glu Ser Val Asp Asn Tyr Gly Met Ser Phe Met Asn
1 5 10 15
<210> 112
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> CDRL2 of hPD-1 mAb 7 VL3
<400> 112
Ala Ala Ser Asn Arg Gly Ser
1 5
<210> 113
<211> 113
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(113)
<223> VH Domain of Murine Anti-Human PD-1 mAb 8
<400> 113
Glu Gly Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Asn His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Lys Asn Gly Asp Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Glu Ala Thr Leu Thr Val Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser
<210> 114
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 8
<400> 114
Asp Tyr Tyr Met Asn
1 5
<210> 115
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 8
<400> 115
Asp Ile Asn Pro Lys Asn Gly Asp Thr His Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 116
<211> 4
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(4)
<223> CDRH3 of PD-1 mAb 8
<400> 116
Asp Phe Asp Tyr
1
<210> 117
<211> 112
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> VL Domain of Murine Anti-Human PD-1 mAb 8
<400> 117
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Gly Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Val Tyr Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Asn Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 118
<211> 16
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> CDRL1 of PD-1 mAb 8
<400> 118
Arg Ser Ser Gln Thr Leu Val Tyr Ser Asn Gly Asn Thr Tyr Leu Asn
1 5 10 15
<210> 119
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 8
<400> 119
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 120
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 8
<400> 120
Ser Gln Ser Thr His Val Pro Phe Thr
1 5
<210> 121
<211> 119
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(119)
<223> VH Domain of Murine Anti-Human PD-1 mAb 9
<400> 121
Glu Val Met Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Leu Val Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Gly Asn Thr Tyr Tyr Ser Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Tyr Gly Phe Asp Gly Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 122
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 9
<400> 122
Ser Tyr Leu Val Ser
1 5
<210> 123
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 9
<400> 123
Thr Ile Ser Gly Gly Gly Gly Asn Thr Tyr Tyr Ser Asp Ser Val Lys
1 5 10 15
Gly
<210> 124
<211> 10
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> CDRH3 of PD-1 mAb 9
<400> 124
Tyr Gly Phe Asp Gly Ala Trp Phe Ala Tyr
1 5 10
<210> 125
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Murine Anti-Human PD-1 mAb 9
<400> 125
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Ile Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Glu Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Ala Ala Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Asn Tyr Tyr Cys Gln His His Tyr Ala Val Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Thr
100 105
<210> 126
<211> 11
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> CDRL1 of PD-1 mAb 9
<400> 126
Arg Ala Ser Glu Asn Ile Tyr Ser Tyr Leu Ala
1 5 10
<210> 127
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 9
<400> 127
Asn Ala Lys Thr Leu Ala Ala
1 5
<210> 128
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 9
<400> 128
Gln His His Tyr Ala Val Pro Trp Thr
1 5
<210> 129
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human hPD-1 mAb 9 VH1
<400> 129
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Leu Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Gly Asn Thr Tyr Tyr Ser Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Tyr Gly Phe Asp Gly Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 130
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human hPD-1 mAb 9 VH2
<400> 130
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Ala Arg Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Leu Val Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Thr
35 40 45
Ala Thr Ile Ser Gly Gly Gly Gly Asn Thr Tyr Tyr Ser Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Ala Arg Ala Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Tyr Gly Phe Asp Gly Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 131
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> CDRH1 of hPD-1 mAb 9 VH2
<400> 131
Ser Tyr Leu Val Gly
1 5
<210> 132
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human hPD-1 mAb 9 VL1
<400> 132
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Ala Lys Thr Leu Ala Ala Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Ala Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 133
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human hPD-1 mAb 9 VL2
<400> 133
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Lys Thr Leu Ala Ala Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Ala Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 134
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> CDRL1 of hPD-1 mAb 9 VL2
<400> 134
Arg Ala Ser Glu Asn Ile Tyr Asn Tyr Leu Ala
1 5 10
<210> 135
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> CDRL2 of hPD-1 mAb 9 VL2
<400> 135
Asp Ala Lys Thr Leu Ala Ala
1 5
<210> 136
<211> 116
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(116)
<223> VH Domain of Murine Anti-Human PD-1 mAb 10
<400> 136
Glu Val Ile Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Leu Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Ser Gly Gly Gly Ser Asn Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Gln Glu Leu Ala Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 137
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 10
<400> 137
Asn Tyr Leu Met Ser
1 5
<210> 138
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 10
<400> 138
Ser Ile Ser Gly Gly Gly Ser Asn Ile Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 139
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRH3 of PD-1 mAb 10
<400> 139
Gln Glu Leu Ala Phe Asp Tyr
1 5
<210> 140
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Murine Anti-Human PD-1 mAb 10
<400> 140
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Thr Ser Gln Asp Ile Ser Asn Phe
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Ile Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Ser Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Ile
100 105
<210> 141
<211> 11
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> CDRL1 of PD-1 mAb 10
<400> 141
Arg Thr Ser Gln Asp Ile Ser Asn Phe Leu Asn
1 5 10
<210> 142
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 10
<400> 142
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 143
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 10
<400> 143
Gln Gln Gly Ser Thr Leu Pro Trp Thr
1 5
<210> 144
<211> 117
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(117)
<223> VH Domain of Murine Anti-Human PD-1 mAb 11
<400> 144
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Lys Trp Met
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Ser Asp Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Asn Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Thr Thr Gly Thr Tyr Ser Tyr Phe Asp Val Trp Gly Thr Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 145
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 11
<400> 145
Gly Tyr Trp Met His
1 5
<210> 146
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 11
<400> 146
Ala Ile Tyr Pro Gly Asn Ser Asp Thr His Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 147
<211> 8
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(8)
<223> CDRH3 of PD-1 mAb 11
<400> 147
Gly Thr Tyr Ser Tyr Phe Asp Val
1 5
<210> 148
<211> 106
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> VL Domain of Murine Anti-Human PD-1 mAb 11
<400> 148
Asp Ile Leu Leu Thr Gln Ser Pro Ala Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln His Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Ser
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 149
<211> 11
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> CDRL1 of PD-1 mAb 11
<400> 149
Arg Ala Ser Gln Ser Ile Gly Thr Ser Ile His
1 5 10
<210> 150
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 11
<400> 150
Tyr Ala Ser Glu Ser Ile Ser
1 5
<210> 151
<211> 8
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(8)
<223> CDRL3 of PD-1 mAb 11
<400> 151
Gln Gln Ser Asn Ser Trp Leu Thr
1 5
<210> 152
<211> 125
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(125)
<223> VH Domain of Murine Anti-Human PD-1 mAb 12
<400> 152
Gln Gly His Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Thr Leu Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Lys Gln Thr Pro Val His Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Thr Thr Thr Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Phe Tyr Cys
85 90 95
Ser Arg Glu Arg Ile Thr Thr Val Val Glu Gly Ala Tyr Trp Tyr Phe
100 105 110
Asp Val Trp Gly Thr Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 153
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 12
<400> 153
Asp Tyr Glu Met His
1 5
<210> 154
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 12
<400> 154
Thr Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 155
<211> 16
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> CDRH3 of PD-1 mAb 12
<400> 155
Glu Arg Ile Thr Thr Val Val Glu Gly Ala Tyr Trp Tyr Phe Asp Val
1 5 10 15
<210> 156
<211> 112
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> VL Domain of Murine Anti-Human PD-1 mAb 12
<400> 156
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Cys Lys Val Ser Thr Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 157
<211> 16
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> CDRL1 of PD-1 mAb 12
<400> 157
Arg Ser Ser Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 158
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 12
<400> 158
Lys Val Ser Thr Arg Phe Ser
1 5
<210> 159
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 12
<400> 159
Phe Gln Gly Ser His Val Pro Tyr Thr
1 5
<210> 160
<211> 121
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(121)
<223> VH Domain of Murine Anti-Human PD-1 mAb 13
<400> 160
Glu Val Met Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Ser Asn Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Gln Ala Tyr Tyr Gly Asn Tyr Trp Tyr Phe Asp Val Trp Gly
100 105 110
Thr Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 161
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 13
<400> 161
Ser His Thr Met Ser
1 5
<210> 162
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 13
<400> 162
Thr Ile Ser Gly Gly Gly Ser Asn Ile Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 163
<211> 12
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> CDRH3 of PD-1 mAb 13
<400> 163
Gln Ala Tyr Tyr Gly Asn Tyr Trp Tyr Phe Asp Val
1 5 10
<210> 164
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Murine Anti-Human PD-1 mAb 13
<400> 164
Asp Ile Gln Met Thr Gln Ser Pro Ala Thr Gln Ser Ala Ser Leu Gly
1 5 10 15
Glu Ser Val Thr Ile Thr Cys Leu Ala Ser Gln Thr Ile Gly Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Ala Ala Thr Ser Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Lys Phe Ser Phe Lys Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Phe Val Ser Tyr Tyr Cys Gln Gln Leu Asp Ser Ile Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 165
<211> 11
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> CDRL1 of PD-1 mAb 13
<400> 165
Leu Ala Ser Gln Thr Ile Gly Thr Trp Leu Ala
1 5 10
<210> 166
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 13
<400> 166
Ala Ala Thr Ser Leu Ala Asp
1 5
<210> 167
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 13
<400> 167
Gln Gln Leu Asp Ser Ile Pro Trp Thr
1 5
<210> 168
<211> 117
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(117)
<223> VH Domain of Murine Anti-Human PD-1 mAb 14
<400> 168
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Asn Phe Ile Ser Tyr
20 25 30
Trp Ile Thr Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Gln Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Asp Gly Thr Thr Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Gly Leu His Trp Tyr Phe Asp Val Trp Gly Thr Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 169
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 14
<400> 169
Ser Tyr Trp Ile Thr
1 5
<210> 170
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 14
<400> 170
Asn Ile Tyr Pro Gly Thr Asp Gly Thr Thr Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 171
<211> 8
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(8)
<223> CDRH3 of PD-1 mAb 14
<400> 171
Gly Leu His Trp Tyr Phe Asp Val
1 5
<210> 172
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Murine Anti-Human PD-1 mAb 14
<400> 172
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Ser Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Ser Arg Phe Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 173
<211> 11
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> CDRL1 of PD-1 mAb 14
<400> 173
Lys Ala Ser Gln Ser Val Gly Thr Asn Val Ala
1 5 10
<210> 174
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 14
<400> 174
Ser Ala Ser Ser Arg Phe Ser
1 5
<210> 175
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 14
<400> 175
Gln Gln Tyr Asn Ser Tyr Pro Tyr Thr
1 5
<210> 176
<211> 117
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(117)
<223> VH Domain of Murine Anti-Human PD-1 mAb 15
<400> 176
Glu Val Met Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Tyr
20 25 30
Leu Ile Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ala Ile Ser Gly Gly Gly Ala Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Thr Arg Arg Gly Thr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 177
<211> 5
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> CDRH1 of PD-1 mAb 15
<400> 177
Ser Tyr Leu Ile Ser
1 5
<210> 178
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> CDRH2 of PD-1 mAb 15
<400> 178
Ala Ile Ser Gly Gly Gly Ala Asp Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 179
<211> 8
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(8)
<223> CDRH3 of PD-1 mAb 15
<400> 179
Arg Gly Thr Tyr Ala Met Asp Tyr
1 5
<210> 180
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Murine Anti-Human PD-1 mAb 15
<400> 180
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Gln Ser Ala Ser Leu Gly
1 5 10 15
Glu Ser Val Thr Ile Thr Cys Leu Ala Ser Gln Thr Ile Gly Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Ala Ala Thr Ser Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Lys Phe Ser Phe Lys Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Phe Val Asn Tyr Tyr Cys Gln Gln Leu Tyr Ser Ile Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 181
<211> 11
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> CDRL1 of PD-1 mAb 15
<400> 181
Leu Ala Ser Gln Thr Ile Gly Thr Trp Leu Ala
1 5 10
<210> 182
<211> 7
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> CDRL2 of PD-1 mAb 15
<400> 182
Ala Ala Thr Ser Leu Ala Asp
1 5
<210> 183
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> CDRL3 of PD-1 mAb 15
<400> 183
Gln Gln Leu Tyr Ser Ile Pro Trp Thr
1 5
<210> 184
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human hPD-1 mAb 15 VH1
<400> 184
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Leu Ile Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Ser Gly Gly Gly Ala Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Thr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 185
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human hPD-1 mAb 15 VL1
<400> 185
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Leu Ala Ser Gln Thr Ile Gly Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Thr Ser Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Tyr Ser Ile Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 186
<211> 445
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy Chain of Humanized Anti-Human PD-1 Antibody hPD-1 mAb7
(1.2) IgG4 (P)
<400> 186
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile His Pro Ser Asp Ser Glu Thr Trp Leu Asp Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu His Tyr Gly Thr Ser Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
<210> 187
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> Light Chain of Humanized Anti-Human PD-1 Antibody hPD-1 mAb7
(1.2) IgG4 (P)
<400> 187
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Met Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile His Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 188
<211> 176
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(176)
<223> Human B7-H1 (PD-L1) Polypeptide (NCBI Sequence NP_001254635.1),
Including Predicted 18 Amino Acid Signal Sequence
<220>
<221> MISC_FEATURE
<222> (1)..(18)
<223> Predicted Signal Sequence
<400> 188
Met Arg Ile Phe Ala Val Phe Ile Phe Met Thr Tyr Trp His Leu Leu
1 5 10 15
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
20 25 30
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
35 40 45
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
50 55 60
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
65 70 75 80
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
85 90 95
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
100 105 110
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His Leu Val
115 120 125
Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr Phe Ile
130 135 140
Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys Gly Ile
145 150 155 160
Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu Glu Thr
165 170 175
<210> 189
<211> 273
<212> PRT
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(273)
<223> Human B7-DC (PD-L2) Polypeptide (NCBI Sequence NP_079515.2);
Including Predicted 18 Amino Acid Signal Sequence
<220>
<221> MISC_FEATURE
<222> (1)..(18)
<223> Predicted Signal Sequence
<400> 189
Met Ile Phe Leu Leu Leu Met Leu Ser Leu Glu Leu Gln Leu His Gln
1 5 10 15
Ile Ala Ala Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile
20 25 30
Glu His Gly Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser
35 40 45
His Val Asn Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn
50 55 60
Asp Thr Ser Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu
65 70 75 80
Pro Leu Gly Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp
85 90 95
Glu Gly Gln Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr
100 105 110
Lys Tyr Leu Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr
115 120 125
His Ile Leu Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln
130 135 140
Ala Thr Gly Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val
145 150 155 160
Pro Ala Asn Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val
165 170 175
Thr Ser Val Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys
180 185 190
Val Phe Trp Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp
195 200 205
Leu Gln Ser Gln Met Glu Pro Arg Thr His Pro Thr Trp Leu Leu His
210 215 220
Ile Phe Ile Pro Phe Cys Ile Ile Ala Phe Ile Phe Ile Ala Thr Val
225 230 235 240
Ile Ala Leu Arg Lys Gln Leu Cys Gln Lys Leu Tyr Ser Ser Lys Asp
245 250 255
Thr Thr Lys Arg Pro Val Thr Thr Thr Lys Arg Glu Val Asn Ser Ala
260 265 270
Ile
<210> 190
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Anti-Human CD2 Antibody CD2 mAb Lo-CD2a
<400> 190
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Gln Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Glu Tyr
20 25 30
Tyr Met Tyr Trp Val Lys Gln Arg Pro Lys Gln Gly Leu Glu Leu Val
35 40 45
Gly Arg Ile Asp Pro Glu Asp Gly Ser Ile Asp Tyr Val Glu Lys Phe
50 55 60
Lys Lys Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Lys Phe Asn Tyr Arg Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 191
<211> 112
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> VL Domain of Anti-Human CD2 Antibody CD2 mAb Lo-CD2a
<400> 191
Asp Val Val Leu Thr Gln Thr Pro Pro Thr Leu Leu Ala Thr Ile Gly
1 5 10 15
Gln Ser Val Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu Asn Trp Leu Leu Gln Arg Thr Gly Gln Ser
35 40 45
Pro Gln Pro Leu Ile Tyr Leu Val Ser Lys Leu Glu Ser Gly Val Pro
50 55 60
Asn Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Met Gln Phe
85 90 95
Thr His Tyr Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 192
<211> 125
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(125)
<223> VH Domain of Anti-Human CD3 Antibody CD3 mAb 1
<400> 192
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 193
<211> 110
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(110)
<223> VL Domain of Anti-Human CD3 Antibody CD3 mAb 1
<400> 193
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 194
<211> 125
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(125)
<223> VH Domain of Anti-Human CD3 Antibody CD3 mAb 1 (D65G)
<400> 194
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 195
<211> 125
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(125)
<223> VH Domain of Anti-Human CD3 Antibody CD3 mAb 1 Low
<400> 195
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Thr Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 196
<211> 125
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(126)
<223> VH Domain of Anti-Human CD3 Antibody CD3 mAb 1 Fast
<400> 196
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Lys Asn Phe Gly Asn Ser Tyr Val Thr Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 197
<211> 119
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(119)
<223> VH Domain of Anti-Human CD3 Antibody OKT3
<400> 197
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Thr Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 198
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Anti-Human CD3 Antibody OKT3
<400> 198
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala His Phe Arg Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Gly Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Asn Arg
100 105
<210> 199
<211> 120
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(120)
<223> VH Domain of Anti-Human CD8 Antibody OKT8
<400> 199
Gln Val Gln Leu Leu Glu Ser Gly Pro Glu Leu Leu Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Tyr Thr Gly Gly Thr Gly Tyr Asn Gln Lys Phe
50 55 60
Lys Asn Lys Ala Thr Leu Thr Val Asp Ser Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Phe Arg Tyr Thr Tyr Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 200
<211> 112
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> VL Domain of Anti-Human CD8 Antibody OKT8
<400> 200
Asp Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Asp Asn Ser Leu Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Val Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 201
<211> 121
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(121)
<223> VH Domain of Anti-Human CD8 Antibody TRX2
<400> 201
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Phe
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Leu Ile Tyr Tyr Asp Gly Ser Asn Lys Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro His Tyr Asp Gly Tyr Tyr His Phe Phe Asp Ser Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 202
<211> 106
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> VL Domain of Anti-Human CD8 Antibody TRX2
<400> 202
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Gly Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Thr Asp Ile Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Tyr Gln Tyr Asn Asn Gly Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 203
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Anti-Human CD16 Antibody 3G8
<400> 203
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Arg Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Gln Ile Asn Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 204
<211> 111
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(111)
<223> VL Domain of Anti-Human CD16 Antibody 3G8
<400> 204
Asp Thr Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Phe Asp
20 25 30
Gly Asp Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Thr Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Ala Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 205
<211> 117
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(117)
<223> VH Domain of Anti-Human CD16 Antibody A9
<400> 205
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Gly Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Ala Asp Thr Ser Ser Arg Thr Ala Tyr
65 70 75 80
Val Gln Val Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Ala Ser Trp Tyr Phe Asp Val Trp Gly Ala Arg Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 206
<211> 111
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(111)
<223> VL Domain of Anti-Human CD16 Antibody A9
<400> 206
Asp Ile Gln Ala Val Val Thr Gln Glu Ser Ala Leu Thr Thr Ser Pro
1 5 10 15
Gly Glu Thr Val Thr Leu Thr Cys Arg Ser Asn Thr Gly Thr Val Thr
20 25 30
Thr Ser Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Asp His Leu Phe
35 40 45
Thr Gly Leu Ile Gly His Thr Asn Asn Arg Ala Pro Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile Thr
65 70 75 80
Gly Ala Gln Thr Glu Asp Glu Ala Ile Tyr Phe Cys Ala Leu Trp Tyr
85 90 95
Asn Asn His Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 207
<211> 120
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(129)
<223> VH Domain of Anti-Human TCR Antibody BMA 031
<400> 207
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Gly Ser Tyr Tyr Asp Tyr Asp Gly Phe Val Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 208
<211> 106
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> VL Domain of Anti-Human TCR Antibody BMA 031
<400> 208
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Ala Thr Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 209
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Anti-Human NKG2D Antibody KYK-1.0
<400> 209
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Lys Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Phe Gly Tyr Tyr Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 210
<211> 108
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(108)
<223> VL Domain of Anti-Human NKG2D Antibody KYK-1.0
<400> 210
Gln Pro Val Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly Glu
1 5 10 15
Thr Ala Arg Ile Pro Cys Gly Gly Asp Asp Ile Glu Thr Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Asp Asp Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Phe Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Ser Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Asp Asn Asn Asp Glu
85 90 95
Trp Val Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 211
<211> 121
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(121)
<223> VH Domain of Anti-Human NKG2D Antibody KYK-2.0
<400> 211
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Gly Leu Gly Asp Gly Thr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 212
<211> 110
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(110)
<223> VL Domain of Anti-Human NKG2D Antibody KYK-2.0
<400> 212
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Leu Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Pro Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Phe Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 213
<211> 120
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(120)
<223> VH Domain of Anti-Human B7-H3 Antibody B7-H3 mAb 1
<400> 213
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Pro Arg Leu Trp Tyr Phe Asp Val Trp Gly Ala
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 214
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Anti-Human B7-H3 Antibody B7-H3 mAb 1
<400> 214
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Asp Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 215
<211> 120
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(120)
<223> VH Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 1 VH1
<400> 215
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Pro Arg Leu Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 216
<211> 120
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(120)
<223> VH Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 1 VH2
<400> 216
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Tyr Pro Gly Gly Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Pro Arg Leu Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 217
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 1 VL1
<400> 217
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 218
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 1 VL2
<400> 218
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 219
<211> 122
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(122)
<223> VH Domain of Anti-Human B7-H3 Antibody B7-H3 mAb 2
<400> 219
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Arg Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Asp Ser Ser Ala Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Gly Arg Gly Arg Glu Asn Ile Tyr Tyr Gly Ser Arg Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 220
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Anti-Human B7-H3 Antibody B7-H3 mAb 2
<400> 220
Asp Ile Ala Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 221
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VH1
<400> 221
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Asp Ser Ser Ala Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Glu Asn Ile Tyr Tyr Gly Ser Arg Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 222
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VH2
<400> 222
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Asp Ser Ser Ala Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Gly Arg Gly Arg Glu Asn Ile Tyr Tyr Gly Ser Arg Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 223
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VH3
<400> 223
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Asp Ser Ser Ala Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Gly Arg Gly Arg Glu Asn Ile Tyr Tyr Gly Ser Arg Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 224
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VH4
<400> 224
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Asp Ser Ser Ala Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Glu Asn Ile Tyr Tyr Gly Ser Arg Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 225
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VL1
<400> 225
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 226
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VL2
<400> 226
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 227
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VL3
<400> 227
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 228
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VL4
<400> 228
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 229
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VL5
<400> 229
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 230
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human B7-H3 Antibody hB7-H3 mAb 2 VL6
<400> 230
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Glu Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 231
<211> 117
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(117)
<223> VH Domain of Anti-Human B7-H3 Antibody B7-H3 mAb 3
<400> 231
Glu Val Gln Gln Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Asn Ser Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Ser Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Arg Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg His Asp Gly Gly Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 232
<211> 108
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(108)
<223> VL Domain of Anti-Human B7-H3 Antibody B7-H3 mAb 3
<400> 232
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Thr Lys Thr Leu Pro Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Arg Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Pro
85 90 95
Trp Thr Phe Gly Gly Gly Thr Asn Leu Glu Ile Lys
100 105
<210> 233
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human CEACAM5 / ANTI-CEACAM6 Antibody
16C3
<400> 233
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Met His Trp Val Lys Gln Ser His Ala Lys Ser Leu Glu Trp Ile
35 40 45
Gly Leu Ile Ser Thr Tyr Ser Gly Asp Thr Lys Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Lys Ala Thr Met Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Ser Gly Ser Arg Tyr Trp Phe Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 234
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human CEACAM5 / ANTI-CEACAM6 Antibody
16C3
<400> 234
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gly Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Arg Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Trp Gly Ala Ser Asn Leu Ala Asp Gly Met Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Gln Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Asn Val Leu Ser Ser Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 235
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human CEACAM5 / ANTI-CEACAM6 Antibody
hMN15
<400> 235
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ser Ser Gly Phe Ala Leu Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Phe Ile Ala Asn Lys Ala Asn Gly His Thr Thr Asp Tyr Ser Pro
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly Val Tyr
85 90 95
Phe Cys Ala Arg Asp Met Gly Ile Arg Trp Asn Phe Asp Val Trp Gly
100 105 110
Gln Gly Thr Pro Val Thr Val Ser Ser
115 120
<210> 236
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human CEACAM5 / ANTI-CEACAM6 Antibody
hMN15
<400> 236
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Met Thr Cys Ser Ala Ser Ser Arg Val Ser Tyr Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr
35 40 45
Gly Thr Ser Thr Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Tyr Asn Pro Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 237
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Chimeric Anti-Human EGFR Antibody "Cetuximab"
<400> 237
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Gly Gly Asn Thr Asp Tyr Asn Thr Pro Phe Thr
50 55 60
Ser Arg Leu Ser Ile Asn Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ser Asn Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Ala Leu Thr Tyr Tyr Asp Tyr Glu Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 238
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Chimeric Anti-Human EGFR Antibody "Cetuximab"
<400> 238
Asp Ile Leu Leu Thr Gln Ser Pro Val Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Asn
20 25 30
Ile His Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Ser
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Gln Gln Asn Asn Asn Trp Pro Thr
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 239
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human EGFR Antibody "Panitumumab"
<400> 239
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 240
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human EGFR Antibody "Panitumumab"
<400> 240
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln His Phe Asp His Leu Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 241
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Anti-Human EphA2 Antibody EphA2 mAb 1
<400> 241
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Arg Tyr
20 25 30
Ser Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Gly Gly Ser Thr Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Lys His Gly Asn Tyr Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 242
<211> 106
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> VL Domain of Anti-Human EphA2 Antibody EphA2 mAb 1
<400> 242
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Ile Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Tyr Thr Leu Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 243
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Anti-Human EphA2 Antibody EphA2 mAb 2
<400> 243
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Ile Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Met Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Pro Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 244
<211> 111
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(111)
<223> VL Domain of Anti-Human EphA2 Antibody EphA2 mAb 2
<400> 244
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 245
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Anti-Human EphA2 Antibody EphA2 mAb 3
<400> 245
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Ser Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp His
20 25 30
Tyr Met Tyr Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Asp Gly Gly Ser Phe Thr Ser Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ile Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Asp Glu Ser Asp Arg Pro Phe Pro Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 246
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Anti-Human EphA2 Antibody EphA2 mAb 3
<400> 246
Asp Ile Val Leu Thr Gln Ser His Arg Ser Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asp Val Thr Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Phe Trp Ala Ser Thr Arg His Ala Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Gly Asp Leu Ala Leu Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 247
<211> 119
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(119)
<223> VH Domain of Anti-Human gpA33 Antibody gpA33 mAb 1
<400> 247
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Glu Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Tyr Gly Asn Asn Val Tyr Phe Asp Val Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 248
<211> 106
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> VL Domain of Anti-Human gpA33 Antibody gpA33 mAb 1
<400> 248
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Arg Ser Ser Ile Ser Phe Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 249
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Affinity-Optimized Anti-Human Her2/Neu Antibody
Margituximab
<400> 249
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Leu Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Asp Pro Lys Phe
50 55 60
Gln Asp Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Val Ser Arg Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Ala Ser Val Thr Val Ser Ser
115 120
<210> 250
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Affinity Optimized Anti-Human Her2/Neu Antibody
Margituximab
<400> 250
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly His Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 251
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human Her2/Neu Antibody Trastuzumab
<400> 251
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 252
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human Her2/Neu Antibody Trastuzumab
<400> 252
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 253
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human Her2/Neu Antibody Pertuzumab
<400> 253
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 254
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human Her2/Neu Antibody Pertuzumab
<400> 254
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 255
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Domain of Humanized Anti-Human VEGF Antibody Bevacizumab
<400> 255
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 256
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Domain of Humanized Anti-Human VEGF Antibody Bevacizumab
<400> 256
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 257
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Anti-Human 5T4 Antibody 5T4 mAb 1
<400> 257
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Phe
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Asn Arg Gly Gly Thr Glu Tyr Asn Glu Lys Ala
50 55 60
Lys Ser Arg Val Thr Met Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Gly Gly Asn Pro Tyr Tyr Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 258
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Anti-Human 5T4 Antibody 5T4 mAb 1
<400> 258
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asp Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 259
<211> 127
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(127)
<223> VH Domain of Anti-Human 5T4 Antibody 5T4 mAb 2
<400> 259
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile Thr Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Ser Gly Arg Ala Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Asn Cys
85 90 95
Ala Arg Tyr Gly Pro Leu Phe Thr Thr Val Val Asp Pro Asn Ser Tyr
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 125
<210> 260
<211> 112
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> VL Domain of Anti-Human 5T4 Antibody 5T4 mAb 2
<400> 260
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val Tyr Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 261
<211> 122
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(122)
<223> VH Domain of Anti-Human IL13Ra2 Antibody hu08
<400> 261
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Asn
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Val Ser Ser Gly Gly Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Gly Thr Thr Ala Leu Ala Thr Arg Phe Phe Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 262
<211> 107
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> VL Domain of Anti-Human IL13Ra2 Antibody hu08
<400> 262
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Ser Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Ser Ala Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 263
<211> 120
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(120)
<223> VH Domain of Anti-Human CD123 Antibody CD123 mAb 1
<400> 263
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 264
<211> 113
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(113)
<223> VL Domain of Anti-Human CD123 Antibody CD123 mAb 1
<400> 264
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 265
<211> 120
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(120)
<223> VH Domain of Anti-Human CD19 Antibody CD19 mAb 1
<400> 265
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Phe Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Met Glu Leu Trp Ser Tyr Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 266
<211> 106
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> VL Domain of Anti-Human CD19 Antibody CD19 mAb 1
<400> 266
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Ala Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Ala Ser Asn Arg Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 267
<211> 126
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(126)
<223> VH Domain of Anti-HIV env Antibody 7B2
<400> 267
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Phe Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Thr Glu Tyr
20 25 30
Tyr Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Tyr Ile Ser Lys Asn Gly Glu Tyr Ser Lys Tyr Ser Pro Ser Ser
50 55 60
Asn Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Val Phe
65 70 75 80
Leu Gln Leu Asp Arg Leu Ser Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asp Gly Leu Thr Tyr Phe Ser Glu Leu Leu Gln Tyr Ile
100 105 110
Phe Asp Leu Trp Gly Gln Gly Ala Arg Val Thr Val Ser Ser
115 120 125
<210> 268
<211> 113
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(113)
<223> VL Domain of Anti-HIV env Antibody 7B2
<400> 268
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile His Cys Lys Ser Ser Gln Thr Leu Leu Tyr Ser
20 25 30
Ser Asn Asn Arg His Ser Ile Ala Trp Tyr Gln Gln Arg Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Leu Tyr Trp Ala Ser Met Arg Leu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Leu Gln Ala Glu Asp Val Ala Ile Tyr Tyr Cys His Gln
85 90 95
Tyr Ser Ser His Pro Pro Thr Phe Gly His Gly Thr Arg Val Glu Ile
100 105 110
Lys
<210> 269
<211> 118
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> VH Domain of Anti-HIV env Antibody h3G8
<400> 269
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Gln Ile Asn Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 270
<211> 111
<212> PRT
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(111)
<223> VL Domain of Anti-HIV env Antibody h3G8
<400> 270
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Phe Asp
20 25 30
Gly Asp Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Thr Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 271
<211> 504
<212> PRT
<213> Artificial Sequence
<220>
<223> First Polypeptide Chain of DART-A
<400> 271
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly
100 105 110
Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
115 120 125
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
130 135 140
Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
145 150 155 160
Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr
165 170 175
Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser
180 185 190
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr
195 200 205
Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val
210 215 220
Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
Gly Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala
245 250 255
Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu
260 265 270
Glu Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
275 280 285
Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
290 295 300
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
305 310 315 320
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
325 330 335
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
340 345 350
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
355 360 365
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
370 375 380
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
385 390 395 400
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
405 410 415
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
420 425 430
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
435 440 445
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
450 455 460
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
465 470 475 480
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
485 490 495
Ser Leu Ser Leu Ser Pro Gly Lys
500
<210> 272
<211> 274
<212> PRT
<213> Artificial Sequence
<220>
<223> Second Polypeptide Chain od DART-A
<400> 272
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly
115 120 125
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
130 135 140
Phe Thr Phe Ser Ser Phe Gly Met His Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Lys Gly Leu Glu Trp Val Ala Tyr Ile Ser Ser Asp Ser Ser Ala Ile
165 170 175
Tyr Tyr Ala Asp Thr Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
180 185 190
Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Asp Glu Asp
195 200 205
Thr Ala Val Tyr Tyr Cys Gly Arg Gly Arg Glu Asn Ile Tyr Tyr Gly
210 215 220
Ser Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
225 230 235 240
Gly Gly Cys Gly Gly Gly Lys Val Ala Ala Leu Lys Glu Lys Val Ala
245 250 255
Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu
260 265 270
Lys Glu
<210> 273
<211> 227
<212> PRT
<213> Artificial Sequence
<220>
<223> Third Polypeptide Chain of DART-A
<400> 273
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn Arg Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 274
<211> 496
<212> PRT
<213> Artificial Sequence
<220>
<223> First and Third Polypeptide Chains of DART-1
<400> 274
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Ser Val
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly
100 105 110
Gly Gly Gly Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
115 120 125
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe
130 135 140
Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
145 150 155 160
Glu Trp Ile Gly Val Ile His Pro Ser Asp Ser Glu Thr Trp Leu Asp
165 170 175
Gln Lys Phe Lys Asp Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser
180 185 190
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
195 200 205
Tyr Tyr Cys Ala Arg Glu His Tyr Gly Thr Ser Pro Phe Ala Tyr Trp
210 215 220
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly
225 230 235 240
Glu Val Ala Ala Cys Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val
245 250 255
Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Ser Lys Tyr
260 265 270
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
275 280 285
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr
290 295 300
Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
305 310 315 320
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
325 330 335
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
340 345 350
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
355 360 365
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
370 375 380
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
385 390 395 400
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
405 410 415
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
420 425 430
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
435 440 445
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
450 455 460
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
485 490 495
<210> 275
<211> 271
<212> PRT
<213> Artificial Sequence
<220>
<223> Second and Fourth Polypeptide Chains of DART-1
<400> 275
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Met Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile His Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Gln Val Gln Leu Val Gln Ser Gly Ala
115 120 125
Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser
130 135 140
Gly Tyr Thr Phe Thr Asp Tyr Asn Met Asp Trp Val Arg Gln Ala Pro
145 150 155 160
Gly Gln Gly Leu Glu Trp Met Gly Asp Ile Asn Pro Asp Asn Gly Val
165 170 175
Thr Ile Tyr Asn Gln Lys Phe Glu Gly Arg Val Thr Met Thr Thr Asp
180 185 190
Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Arg Glu Ala Asp Tyr Phe Tyr Phe
210 215 220
Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Gly Gly Cys
225 230 235 240
Gly Gly Gly Lys Val Ala Ala Cys Lys Glu Lys Val Ala Ala Leu Lys
245 250 255
Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
260 265 270
Claims (38)
- 암 또는 병원체-관련 질환의 치료 방법으로서,
(1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 및
(2) 표적 세포의 재지정된 사멸을 매개할 수 있는 분자
의 치료적 유효량을 치료를 필요로 하는 대상체에게 투여하는 단계를 포함하며, 상기 표적 세포는
(a) 암 항원을 발현하는 암 세포; 또는
(b) 병원체-관련 항원을 발현하는 병원체-감염 세포인 방법. - 제 1 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 분자는 PD-1과 PD-1의 천연 리간드 사이의 결합을 억제할 수 있는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 상기 방법은 점증적으로 3개의 에피토프-결합 도메인을 포함하는 2개의 결합 분자의 투여를 포함하고, 상기 2개의 결합 분자는
(A) PD-1에 결합할 수 있는 항체의 에피토프-결합 도메인, 또는 PD-1의 천연 리간드에 결합할 수 있는 항체의 에피토프-결합 도메인을 포함하는 결합 분자; 및
(B) (1) 상기 이펙터 세포의 세포 표면 분자에 결합할 수 있는 항체의 에피토프-결합 도메인; 및
(2) 상기 표적 세포의 상기 암 항원 또는 상기 병원체 항원에 결합할 수 있는 항체의 에피토프-결합 도메인을 포함하는 결합 분자이며;
상기 결합 분자 (A)의 상기 에피토프-결합 도메인은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있고, 상기 결합 분자 (B)의 상기 에피토프-결합 도메인 (1) 및 (2)는 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 것을 특징으로 하는 방법. - 제 3 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 결합 분자는 디아바디, scFv, 항체 또는 TandAb를 포함하고, 상기 결합 분자 (B)는 이중특이적 디아바디, CAR, BiTe, 또는 이중특이적 항체를 포함하는 것을 특징으로 하는 방법.
- 제 3 항 또는 제 4 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 결합 분자는 PD-1에 결합하는 항체의 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 방법.
- 제 3 항 또는 제 4 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 결합 분자는 PD-1의 천연 리간드에 결합하는 항체의 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 방법.
- 제 5 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 결합 분자는 PD-1에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하고, 그러한 에피토프-결합 도메인은
(a) PD-1의 동일한 에피토프에의 결합에 대해 경합하거나; 또는
(b) PD-1의 동일한 에피토프에의 결합에 대해 경합하지 않는
것을 특징으로 하는 방법. - 제 7 항에 있어서, 상기 PD-1-에피토프-결합 도메인들은 동일한 PD-1 분자에 동시에 결합할 수 있는 것을 특징으로 하는 방법.
- 제 6 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 결합 분자는 상기 PD-1의 천연 리간드에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하고, 그러한 에피토프-결합 도메인은
(a) 그러한 PD-1의 천연 리간드의 동일한 에피토프에의 결합에 대해 경합하거나; 또는
(b) 그러한 PD-1의 천연 리간드의 동일한 에피토프에의 결합에 대해 경합하지 않는 것을 특징으로 하는 방법. - 제 9 항에 있어서, 상기 PD-1 리간드-에피토프-결합 도메인들은 상기 PD-1의 천연 리간드의 동일한 분자에 동시에 결합할 수 있는 것을 특징으로 하는 방법.
- 제 5 항 또는 제 6 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 결합 분자는 PD-1 또는 PD-1의 천연 리간드가 아닌 분자의 에피토프에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 방법.
- 제 11 항에 있어서, 상기 제 2 에피토프-결합 도메인은 CD137, LAG-3, OX40, TIGIT, TIM-3, 또는 VISTA의 에피토프에 결합하는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 12 항 중 어느 한 항에 있어서, 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 상기 결합 분자는 상기 이펙터 세포의 세포 표면 분자에 결합할 수 있는 제 3 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 방법.
- 제 13 항에 있어서, 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 상기 결합 분자의 상기 제 3 에피토프-결합-도메인은 상기 이펙터 세포의 상이한 세포 표면 분자에 결합할 수 있어서, 상기 재지정된 사멸을 매개할 수 있는 상기 결합 분자는 상기 이펙터 세포의 2개의 상이한 세포 표면 분자에 결합할 수 있는 것을 특징으로 하는 방법.
- 제 2 항 내지 제 12 항 중 어느 한 항에 있어서, 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 상기 결합 분자는 상기 표적 세포의 암 항원 또는 병원체-관련 항원에 결합할 수 있는 제 3 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 방법.
- 제 15 항에 있어서, 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 상기 결합 분자의 상기 제 3 에피토프-결합-도메인은 상기 표적 세포의 상이한 암 항원 또는 상이한 병원체 항원에 결합할 수 있어서, 상기 재지정된 사멸을 매개할 수 있는 상기 결합 분자는 상기 표적 세포의 2개의 상이한 암 항원 또는 2개의 상이한 병원체 항원에 결합할 수 있는 것을 특징으로 하는 방법.
- 제 2 항 내지 제 16 항 중 어느 한 항에 있어서, 상기 이펙터 세포의 상기 세포 표면 분자는 CD2, CD3, CD8, CD16, TCR, 및 NKG2D로 구성되는 군으로부터 선택되는 것을 특징으로 하는 방법.
- 제 2 항 내지 제 17 항 중 어느 한 항에 있어서, 상기 암 항원은 다음의 암 항원들: 19.9, 4.2, A33, ADAM-9, AH6, ALCAM, B1, B7-H3, BAGE, 베타-카테닌, 혈액 군 ALeb/Ley, 버킷 림프종 항원-38.13, C14, CA125, 카르복시펩티다제 M, CD5, CD19, CD20, CD22, CD23, CD25, CD27, CD28, CD33, CD36, CD40/CD154, CD45, CD56, CD46, CD52, CD56, CD79a/CD79b, CD103, CD123, CD317, CDK4, CEA, CEACAM5/CEACAM6, CO17-1A, CO-43, CO-514, CTA-1, CTLA-4, 사이토케라틴 8, D1.1, D156-22, DR5, E1 시리즈, EGFR, 에프린 수용체, Erb, GAGE, GD2/GD3/GM2 강글리오사이드, GICA 19-9, gp100, Gp37, gp75, gpA33, HER2/neu, HMFG, 인간 유두종 바이러스-E6/인간 유두종 바이러스-E7, HMW-MAA, I 항원, IL13Rα2, 인티그린 β6, JAM-3, KID3, KID31, KS 1/4 pan-암종 항원, L6,L20, LEA, LUCA-2, M1:22:25:8, M18, M39, MAGE, MART, 메소텔린, MUC-1, MUM-1, Myl, N-아세틸글루코사미닐트랜스퍼라제, 네오당단백질, NS-10, OFA-1, OFA-2, 온코스타틴 M, p15, p97, PEM, PEMA, PIPA, PSA, PSMA, 전립선산 포스페이트, R24, ROR1, 스핑고지질, SSEA-1, SSEA-3, SSEA-4, sTn, T 세포 수용체 유래 펩타이드, T5A7, TAG-72, TL5, TNF-수용체, TNF-γ 수용체, TRA-1-85, 트랜스페린 수용체, 5T4, TSTA, VEGF, VEGF 수용체, VEP8, VEP9, VIM-D5, 및 Y 합텐, Ley로 구성되는 군으로부터 선택되는 것을 특징으로 하는 방법.
- 제 2 항 내지 제 17 항 중 어느 한 항에 있어서, 상기 방법은 상기 제약학적 조성물의 상기 투여를 포함하고, 상기 병원체-관련 항원은 다음의 병원체-관련 항원들: 헤르페스 단순 바이러스 감염된 세포 단백질 (ICP)47, 헤르페스 단순 바이러스 gD, 엡스타인-바르 바이러스 LMP-1, 엡스타인-바르 바이러스 LMP-2A, 엡스타인-바르 바이러스 LMP-2B, 인간 면역결핍 바이러스 gp160, 인간 면역결핍 바이러스 gp120, 인간 면역결핍 바이러스 gp41, 등, 인간 유두종 바이러스 E6, 인간 유두종 바이러스 E7, 인간 T-세포 백혈병 바이러스 gp64, 인간 T-세포 백혈병 바이러스 gp46, 및 인간 T-세포 백혈병 바이러스 gp21로 구성된 군으로부터 선택되는 것을 특징으로 하는 방법.
- (A) (1) PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 분자, 및
(2) 암 항원 또는 병원체 항원을 발현하는 표적 세포의 재지정된 사멸을 매개할 수 있는 분자
의 치료적 유효량; 및
(B) 제약학적으로 허용되는 담체
를 포함하는 제약학적 조성물. - 제 20 항에 있어서, 상기 제약학적 조성물은 3개의 에피토프-결합 도메인을 점증적으로 포함하는 2개의 결합 분자를 포함하고, 상기 2개의 결합 분자는
(A) PD-1에 결합할 수 있는 항체의 에피토프-결합 도메인, 또는 PD-1의 천연 리간드에 결합할 수 있는 항체의 에피토프-결합 도메인을 포함하는 결합 분자; 및
(B) (1) 상기 이펙터 세포의 세포 표면 분자에 결합할 수 있는 항체의 에피토프-결합 도메인; 및
(2) 상기 표적 세포의 암 항원 또는 병원체-관련 항원에 결합할 수 있는 항체의 에피토프-결합 도메인
을 포함하는 결합 분자이며;
상기 결합 분자 (A)의 상기 에피토프-결합 도메인은 PD-1 또는 PD-1의 천연 리간드에 결합할 수 있고, 상기 결합 분자 (B)의 상기 에피토프-결합 도메인 (1) 및 (2)는 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 것을 특징으로 하는 제약학적 조성물. - 제 21 항에 있어서, 상기 결합 분자 (A)는 디아바디, scFv, 항체, 또는 TandAb를 포함하고, 상기 결합 분자 (B)는 디아바디, CAR, BiTe, 또는 이중특이적 항체를 포함하는 것을 특징으로 하는 제약학적 조성물.
- 제 21 항 또는 제 22 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 분자는 PD-1에 결합하는 항체의 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 제약학적 조성물.
- 제 21 항 또는 제 22 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 분자는 PD-1의 천연 리간드에 결합하는 항체의 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 제약학적 조성물.
- 제 23 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 분자는 PD-1에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하고, 그러한 PD-1-에피토프-결합 도메인은
(a) PD-1의 동일한 에피토프에의 결합에 대해 경합하거나; 또는
(b) PD-1의 동일한 에피토프에의 결합에 대해 경합하지 않는
것을 특징으로 하는 제약학적 조성물. - 제 25 항에 있어서, 상기 PD-1-에피토프-결합 도메인들은 동일한 PD-1 분자에 동시에 결합할 수 있는 것을 특징으로 하는 제약학적 조성물.
- 제 24 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 결합 분자는 상기 PD-1의 천연 리간드에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하고, 그러한 에피토프-결합 도메인은
(a) 그러한 PD-1의 천연 리간드의 동일한 에피토프에의 결합에 대해 경합하거나; 또는
(b) 그러한 PD-1의 천연 리간드의 동일한 에피토프에의 결합에 대해 경합하지 않는
것을 특징으로 하는 제약학적 조성물. - 제 27 항에 있어서, 상기 PD-1 리간드-에피토프-결합 도메인들은 상기 PD-1의 천연 리간드의 동일한 분자에 동시에 결합할 수 있는 것을 특징으로 하는 제약학적 조성물.
- 제 23 항 또는 제 24 항에 있어서, PD-1 또는 PD-1의 천연 리간드에 결합할 수 있는 상기 결합 분자는 PD-1 또는 PD-1의 천연 리간드가 아닌 분자의 에피토프에 결합할 수 있는 제 2 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 제약학적 조성물.
- 제 29 항에 있어서, 상기 제 2 에피토프-결합 도메인은 CD137, LAG-3, OX40, TIGIT, TIM-3, 또는 VISTA의 에피토프에 결합하는 것을 특징으로 하는 제약학적 조성물.
- 제 20 항 내지 제 29 항 중 어느 한 항에 있어서, 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 상기 분자는 제 3 에피토프-결합 도메인을 포함하고, 그러한 3개의 에피토프-결합 도메인은 동시에 결합할 수 있으며, 상기 제 3 에피토프-결합 부위는 상기 이펙터 세포의 세포 표면 분자의 에피토프에 결합할 수 있는 것을 특징으로 하는 제약학적 조성물.
- 제 31 항에 있어서, 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 상기 결합 분자의 상기 제 3 에피토프-결합-도메인은 상기 이펙터 세포의 상이한 세포 표면 분자에 결합할 수 있어서, 상기 재지정된 사멸을 매개할 수 있는 상기 결합 분자는 상기 이펙터 세포의 2개의 상이한 세포 표면 분자에 결합할 수 있는 것을 특징으로 하는 제약학적 조성물.
- 제 20 항 내지 제 30 항 중 어느 한 항에 있어서, 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 상기 결합 분자는 상기 표적 세포의 암 항원 또는 병원체-관련 항원에 결합할 수 있는 제 3 에피토프-결합 도메인을 포함하는 것을 특징으로 하는 제약학적 조성물.
- 제 33 항에 있어서, 상기 표적 세포의 재지정된 사멸을 매개할 수 있는 상기 결합 분자의 상기 제 3 에피토프-결합-도메인은 상기 표적 세포의 상이한 암 항원 또는 상이한 병원체 항원에 결합할 수 있어서, 상기 재지정된 사멸을 매개할 수 있는 상기 결합 분자는 상기 표적 세포의 2개의 상이한 암 항원 또는 2개의 상이한 병원체 항원에 결합할 수 있는 것을 특징으로 하는 제약학적 조성물.
- 제 21 항 내지 제 34 항 중 어느 한 항에 있어서, 상기 이펙터 세포의 상기 세포 표면 분자는 CD2, CD3, CD8, CD16, TCR, 및 NKG2D로 구성되는 군으로부터 선택되는 것을 특징으로 하는 제약학적 조성물.
- 제 20 항 내지 제 35 항 중 어느 한 항에 있어서, 상기 암 항원은 암 항원들: 19.9, 4.2, A33, ADAM-9, AH6, ALCAM, B1, B7-H3, BAGE, 베타-카테닌, 혈액 군 ALeb/Ley, 버킷 림프종 항원-38.13, C14, CA125, 카르복시펩티다제 M, CD5, CD19, CD20, CD22, CD23, CD25, CD27, CD28, CD33, CD36, CD40/CD154, CD45, CD56, CD46, CD52, CD56, CD79a/CD79b, CD103, CD123, CD317, CDK4, CEA, CEACAM5/CEACAM6, CO17-1A, CO-43, CO-514, CTA-1, CTLA-4, 사이토케라틴 8, D1.1, D156-22, DR5, E1 시리즈, EGFR, 에프린 수용체, Erb, GAGE, GD2/GD3/GM2 강글리오사이드, GICA 19-9, gp100, Gp37, gp75, gpA33, HER2/neu, HMFG, 인간 유두종 바이러스-E6/인간 유두종 바이러스-E7, HMW-MAA, I 항원, IL13Rα2, 인티그린 β6, JAM-3, KID3, KID31, KS 1/4 pan-암종 항원, L6,L20, LEA, LUCA-2, M1:22:25:8, M18, M39, MAGE, MART, 메소텔린, MUC-1, MUM-1, Myl, N-아세틸글루코사미닐트랜스퍼라제, 네오당단백질, NS-10, OFA-1, OFA-2, 온코스타틴 M, p15, p97, PEM, PEMA, PIPA, PSA, PSMA, 전립선산 포스페이트, R24, ROR1, 스핑고지질, SSEA-1, SSEA-3, SSEA-4, sTn, T 세포 수용체 유래 펩타이드, T5A7, TAG-72, TL5, TNF-수용체, TNF-γ 수용체, TRA-1-85, 트랜스페린 수용체, 5T4, TSTA, VEGF, VEGF 수용체, VEP8, VEP9, VIM-D5, 및 Y 합텐, Ley로 구성되는 군으로부터 선택되는 것을 특징으로 하는 제약학적 조성물.
- 제 20 항 내지 제 35 항 중 어느 한 항에 있어서, 상기 병원체-관련 항원은 병원체 항원들: 헤르페스 단순 바이러스 감염된 세포 단백질 (ICP)47, 헤르페스 단순 바이러스 gD, 엡스타인-바르 바이러스 LMP-1, 엡스타인-바르 바이러스 LMP-2A, 엡스타인-바르 바이러스 LMP-2B, 인간 면역결핍 바이러스 gp160, 인간 면역결핍 바이러스 gp120, 인간 면역결핍 바이러스 gp41, 등, 인간 유두종 바이러스 E6, 인간 유두종 바이러스 E7, 인간 T-세포 백혈병 바이러스 gp64, 인간 T-세포 백혈병 바이러스 gp46, 및 인간 T-세포 백혈병 바이러스 gp21로 구성되는 군으로부터 선택되는 것을 특징으로 하는 제약학적 조성물.
- 제 20 항 내지 제 37 항 중 어느 한 항의 제약학적 조성물을 포함하는 키트로서, 그것의 상기 결합 분자들이 하나 이상의 용기에 구획화되어 있는 키트.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662346854P | 2016-06-07 | 2016-06-07 | |
| US62/346,854 | 2016-06-07 | ||
| US201662432299P | 2016-12-09 | 2016-12-09 | |
| US62/432,299 | 2016-12-09 | ||
| PCT/US2017/036075 WO2017214092A1 (en) | 2016-06-07 | 2017-06-06 | Combination therapy |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190015520A true KR20190015520A (ko) | 2019-02-13 |
Family
ID=60578133
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197000309A KR20190015520A (ko) | 2016-06-07 | 2017-06-06 | 조합 치료법 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US20200255524A1 (ko) |
| EP (1) | EP3463464A4 (ko) |
| JP (1) | JP2019517539A (ko) |
| KR (1) | KR20190015520A (ko) |
| CN (1) | CN109310762A (ko) |
| AU (1) | AU2017278325A1 (ko) |
| BR (1) | BR112018075198A2 (ko) |
| IL (1) | IL263521A (ko) |
| MA (1) | MA45192A (ko) |
| MX (1) | MX2018014950A (ko) |
| RU (1) | RU2018145961A (ko) |
| SG (2) | SG11201810883TA (ko) |
| TW (1) | TW201742636A (ko) |
| WO (1) | WO2017214092A1 (ko) |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11053316B2 (en) | 2013-01-14 | 2021-07-06 | Xencor, Inc. | Optimized antibody variable regions |
| US9605084B2 (en) | 2013-03-15 | 2017-03-28 | Xencor, Inc. | Heterodimeric proteins |
| US10487155B2 (en) | 2013-01-14 | 2019-11-26 | Xencor, Inc. | Heterodimeric proteins |
| EP2943511B1 (en) | 2013-01-14 | 2019-08-07 | Xencor, Inc. | Novel heterodimeric proteins |
| US10968276B2 (en) | 2013-03-12 | 2021-04-06 | Xencor, Inc. | Optimized anti-CD3 variable regions |
| US10858417B2 (en) | 2013-03-15 | 2020-12-08 | Xencor, Inc. | Heterodimeric proteins |
| US10519242B2 (en) | 2013-03-15 | 2019-12-31 | Xencor, Inc. | Targeting regulatory T cells with heterodimeric proteins |
| MX2016012578A (es) | 2014-03-28 | 2017-04-13 | Xencor Inc | Anticuerpos biespecificos que se unen a cd38 y cd3. |
| LT3223845T (lt) | 2014-11-26 | 2021-08-25 | Xencor, Inc. | Heterodimeriniai antikūnai, kurie suriša cd3 ir cd20 |
| EA037065B1 (ru) | 2014-11-26 | 2021-02-01 | Ксенкор, Инк. | Гетеродимерные антитела, связывающие cd3 и cd38 |
| US10259887B2 (en) | 2014-11-26 | 2019-04-16 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and tumor antigens |
| EP3237449A2 (en) | 2014-12-22 | 2017-11-01 | Xencor, Inc. | Trispecific antibodies |
| US10227411B2 (en) | 2015-03-05 | 2019-03-12 | Xencor, Inc. | Modulation of T cells with bispecific antibodies and FC fusions |
| EA201890285A1 (ru) | 2015-07-13 | 2018-08-31 | Сайтомкс Терапьютикс, Инк. | Антитела против pd-1, активируемые антитела против pd-1 и способы их применения |
| KR20180085800A (ko) | 2015-12-07 | 2018-07-27 | 젠코어 인코포레이티드 | Cd3 및 psma에 결합하는 이종이합체성 항체 |
| AU2016370376B2 (en) | 2015-12-14 | 2023-12-14 | Macrogenics, Inc. | Bispecific molecules having immunoreactivity with PD-1 and CTLA-4, and methods of use thereof |
| AU2017285218A1 (en) | 2016-06-14 | 2018-12-06 | Xencor, Inc. | Bispecific checkpoint inhibitor antibodies |
| EP4050032A1 (en) | 2016-06-28 | 2022-08-31 | Xencor, Inc. | Heterodimeric antibodies that bind somatostatin receptor 2 |
| US10793632B2 (en) | 2016-08-30 | 2020-10-06 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| SG11201903302UA (en) | 2016-10-14 | 2019-05-30 | Xencor Inc | Bispecific heterodimeric fusion proteins containing il-15/il-15ralpha fc-fusion proteins and pd-1 antibody fragments |
| CA3060618A1 (en) | 2017-05-19 | 2018-11-22 | Wuxi Biologics (Shanghai) Co. Ltd. | Novel monoclonal antibodies to cytotoxic t-lymphocyte-associated protein 4 (ctla-4) |
| AU2018275109A1 (en) * | 2017-06-01 | 2020-01-02 | Xencor, Inc. | Bispecific antibodies that bind CD 123 CD3 |
| MA49517A (fr) | 2017-06-30 | 2020-05-06 | Xencor Inc | Protéines de fusion fc hétérodimères ciblées contenant il-15/il-15ra et domaines de liaison à l'antigène |
| SG11202000198QA (en) | 2017-08-04 | 2020-02-27 | Genmab As | Binding agents binding to pd-l1 and cd137 and use thereof |
| CN112272563A (zh) | 2017-11-08 | 2021-01-26 | Xencor股份有限公司 | 使用新颖抗pd-1序列的双特异性和单特异性抗体 |
| US10981992B2 (en) | 2017-11-08 | 2021-04-20 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| MA51291A (fr) | 2017-12-19 | 2020-10-28 | Xencor Inc | Protéines de fusion il-2 fc modifiées |
| JP2021518748A (ja) * | 2018-02-23 | 2021-08-05 | アールイーエムディー バイオセラピューティクス,インコーポレイテッドREMD Biotherapeutics,Inc | カルシトニン遺伝子関連ペプチド(cgrp)アンタゴニスト抗体 |
| EA202091982A1 (ru) * | 2018-03-14 | 2021-06-10 | Сиэтл Чилдрен'С Хоспитал (Дба Сиэтл Чилдрен'С Ресёрч Инститьют) | Химерный антигенный рецептор к рецептору il-13 альфа 2 (il13r2) для опухолеспецифической т-клеточной иммунотерапии |
| CA3096052A1 (en) | 2018-04-04 | 2019-10-10 | Xencor, Inc. | Heterodimeric antibodies that bind fibroblast activation protein |
| CN112867734A (zh) | 2018-04-18 | 2021-05-28 | Xencor股份有限公司 | 包含IL-15/IL-15Ra Fc融合蛋白和PD-1抗原结合结构域的靶向PD-1的异源二聚体融合蛋白及其用途 |
| JP2021520829A (ja) | 2018-04-18 | 2021-08-26 | ゼンコア インコーポレイテッド | IL−15/IL−15RA Fc融合タンパク質およびTIM−3抗原結合ドメインを含む、TIM−3標的化ヘテロ二量体融合タンパク質 |
| SG11202011355QA (en) * | 2018-05-18 | 2020-12-30 | Macrogenics Inc | Optimized gp41-binding molecules and uses thereof |
| CA3115096A1 (en) | 2018-10-03 | 2020-04-09 | Xencor, Inc. | Il-12 heterodimeric fc-fusion proteins |
| BR112021008283A2 (pt) * | 2018-10-30 | 2021-09-14 | Macrogenics, Inc. | Método de tratamento de uma malignidade hematológica quimiorrefratária em um paciente, e método para determinar se um paciente seria um respondedor adequado ao uso de uma molécula biespecífica cd123 x cd3 para tratar uma malignidade hematológica |
| US11472890B2 (en) | 2019-03-01 | 2022-10-18 | Xencor, Inc. | Heterodimeric antibodies that bind ENPP3 and CD3 |
| KR20220003567A (ko) * | 2019-04-26 | 2022-01-10 | 우시 바이올로직스 아일랜드 리미티드 | Pd-1 및 lag-3에 대한 이중특이적 항체 |
| JP2022534889A (ja) | 2019-05-24 | 2022-08-04 | ファイザー・インコーポレイテッド | Cdk阻害剤を使用した組合せ療法 |
| CN114502196A (zh) * | 2019-08-01 | 2022-05-13 | 因赛特公司 | Ido抑制剂的给药方案 |
| BR112022012437A2 (pt) * | 2019-12-23 | 2022-09-20 | Macrogenics Inc | Método de tratamento de um câncer compreendendo a administração de uma molécula biespecífica pd-1 x lag-3 a um indivíduo em necessidade deste e método de tratamento de um câncer em um indivíduo |
| WO2021143826A1 (zh) * | 2020-01-17 | 2021-07-22 | 信达生物制药(苏州)有限公司 | 重组抗程序性死亡受体1和抗分化抗原簇137双特异性抗体制剂及其用途 |
| EP4132581A4 (en) * | 2020-04-11 | 2024-04-10 | Univ Northwestern | HUMANIZED ANTIBODY DIRECTED AGAINST THE TUMOR-ASSOCIATED ANTIGEN IL13RA2 |
| WO2021231976A1 (en) | 2020-05-14 | 2021-11-18 | Xencor, Inc. | Heterodimeric antibodies that bind prostate specific membrane antigen (psma) and cd3 |
| CN112062859B (zh) * | 2020-07-24 | 2022-08-09 | 沣潮医药科技(上海)有限公司 | 用于病原体清除的嵌合抗原受体及其应用 |
| EP4200332A1 (en) | 2020-08-19 | 2023-06-28 | Xencor, Inc. | Anti-cd28 and/or anti-b7h3 compositions |
| US20220168293A1 (en) | 2020-12-02 | 2022-06-02 | Pfizer Inc. | Time to resolution of axitinib-related adverse events |
| CN114437218B (zh) * | 2021-01-12 | 2022-09-30 | 北京门罗生物科技有限公司 | 靶向cd276的嵌合抗原受体以及包含其的免疫细胞 |
| KR20230156079A (ko) | 2021-03-09 | 2023-11-13 | 젠코어 인코포레이티드 | Cd3과 cldn6에 결합하는 이종이량체 항체 |
| JP2024509274A (ja) | 2021-03-10 | 2024-02-29 | ゼンコア インコーポレイテッド | Cd3及びgpc3に結合するヘテロ二量体抗体 |
| CN115611982A (zh) * | 2021-07-14 | 2023-01-17 | 浙江大学 | 一种抗人MICA/Bα3区的单克隆抗体及其应用 |
| WO2023001987A2 (en) | 2021-07-22 | 2023-01-26 | University Of Dundee | Therapeutic muteins |
| TW202327595A (zh) | 2021-10-05 | 2023-07-16 | 美商輝瑞大藥廠 | 用於治療癌症之氮雜內醯胺化合物的組合 |
| WO2023079428A1 (en) | 2021-11-03 | 2023-05-11 | Pfizer Inc. | Combination therapies using tlr7/8 agonist |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2018248A1 (en) | 1989-06-07 | 1990-12-07 | Clyde W. Shearman | Monoclonal antibodies against the human alpha/beta t-cell receptor, their production and use |
| US7737258B2 (en) | 2000-10-18 | 2010-06-15 | Sloan-Kettering Institute For Cancer Research | Uses of monoclonal antibody 8H9 |
| US7666424B2 (en) | 2001-10-17 | 2010-02-23 | Sloan-Kettering Institute For Cancer Research | Methods of preparing and using single chain anti-tumor antibodies |
| US8501471B2 (en) | 2000-10-18 | 2013-08-06 | Sloan-Kettering Institute For Cancer Research | Uses of monoclonal antibody 8H9 |
| US8414892B2 (en) | 2000-10-18 | 2013-04-09 | Sloan-Kettering Institute For Cancer Research | Uses of monoclonal antibody 8H9 |
| US7740845B2 (en) | 2000-10-18 | 2010-06-22 | Sloan-Kettering Institute For Cancer Research | Uses of monoclonal antibody 8H9 |
| US7351803B2 (en) | 2002-05-30 | 2008-04-01 | Macrogenics, Inc. | CD16A binding proteins and use for the treatment of immune disorders |
| MXPA04012664A (es) | 2002-06-19 | 2005-08-15 | Raven Biotechnologies Inc | Objetivo de superficie celular raag10 novedoso y una familia de anticuerpos que reconocen ese objetivo. |
| WO2005118635A2 (en) | 2004-06-03 | 2005-12-15 | Novimmune S.A. | Anti-cd3 antibodies and methods of use thereof |
| GB0510790D0 (en) | 2005-05-26 | 2005-06-29 | Syngenta Crop Protection Ag | Anti-CD16 binding molecules |
| KR20100014527A (ko) | 2007-03-22 | 2010-02-10 | 슬로안-케테링인스티튜트퍼캔서리서치 | 단일클론항체 8h9의 용도 |
| WO2008119566A2 (en) | 2007-04-03 | 2008-10-09 | Micromet Ag | Cross-species-specific bispecific binders |
| JP2010190572A (ja) | 2007-06-01 | 2010-09-02 | Sapporo Medical Univ | IL13Ra2に対する抗体およびこれを含む診断・治療薬 |
| EP3009455A1 (en) | 2009-09-16 | 2016-04-20 | Immunomedics Inc. | Class i anti-cea antibodies and uses thereof |
| US8802091B2 (en) * | 2010-03-04 | 2014-08-12 | Macrogenics, Inc. | Antibodies reactive with B7-H3 and uses thereof |
| WO2011159877A2 (en) * | 2010-06-18 | 2011-12-22 | The Brigham And Women's Hospital, Inc. | Bi-specific antibodies against tim-3 and pd-1 for immunotherapy in chronic immune conditions |
| US20140170149A1 (en) * | 2011-04-20 | 2014-06-19 | Genmab A/S | Bispecific antibodies against her2 and cd3 |
| LT2703486T (lt) | 2011-04-25 | 2018-05-25 | Daiichi Sankyo Company, Limited | Anti-b7-h3 antikūnas |
| KR102060389B1 (ko) * | 2011-05-21 | 2019-12-31 | 마크로제닉스, 인크. | 사람 및 비-사람 cd3에 결합할 수 있는 cd3-결합 분자 |
| KR102030531B1 (ko) | 2011-05-21 | 2019-10-10 | 마크로제닉스, 인크. | 탈면역화된 혈청-결합 도메인 및 혈청 반감기를 연장하기 위한 그것의 용도 |
| WO2013041687A1 (en) | 2011-09-23 | 2013-03-28 | Amgen Research (Munich) Gmbh | Bispecific binding molecules for 5t4 and cd3 |
| US9828428B2 (en) | 2012-11-07 | 2017-11-28 | Pfizer Inc. | Anti-IL-13 receptor alpha 2 antibodies and antibody-drug conjugates |
| US9487587B2 (en) * | 2013-03-05 | 2016-11-08 | Macrogenics, Inc. | Bispecific molecules that are immunoreactive with immune effector cells of a companion animal that express an activating receptor and cells that express B7-H3 and uses thereof |
| PT2968520T (pt) | 2013-03-14 | 2021-08-19 | Macrogenics Inc | Moléculas biespecíficas que são imunorreativas com células efetoras imunitárias que expressam um recetor de ativação |
| EP2839842A1 (en) | 2013-08-23 | 2015-02-25 | MacroGenics, Inc. | Bi-specific monovalent diabodies that are capable of binding CD123 and CD3 and uses thereof |
| PE20210648A1 (es) * | 2013-12-17 | 2021-03-26 | Genentech Inc | Anticuerpos anti-cd3 y metodos de uso |
| MX2016007972A (es) * | 2013-12-17 | 2016-10-28 | Genentech Inc | Metodos para tratar canceres con antagonistas de union al eje pd-1 y taxanos. |
| US20170015758A1 (en) * | 2014-01-21 | 2017-01-19 | Medimmune, Llc | Compositions And Methods For Modulating And Redirecting Immune Responses |
| TWI681969B (zh) * | 2014-01-23 | 2020-01-11 | 美商再生元醫藥公司 | 針對pd-1的人類抗體 |
| BR112016027912A2 (pt) | 2014-05-29 | 2018-02-20 | Macrogenics, Inc. | molécula de ligação triespecífica capaz de se ligar de maneira imunoespecífica a três epítopos diferentes, composição farmacêutica, método de tratamento de câncer, método de tratamento de uma doença associada à presença de um patógeno, anticorpo anti-ror1, ou fragmento de ligação a ror1, fragmento de anticorpo biespecífico, bite ou anticorpo de cadeia simples, e método de tratamento de câncer |
| TWI693232B (zh) * | 2014-06-26 | 2020-05-11 | 美商宏觀基因股份有限公司 | 與pd-1和lag-3具有免疫反應性的共價結合的雙抗體和其使用方法 |
| SG11201701599UA (en) | 2014-09-05 | 2017-03-30 | Janssen Pharmaceutica Nv | Cd123 binding agents and uses thereof |
| SG11201702544WA (en) | 2014-09-29 | 2017-04-27 | Univ Duke | Bispecific molecules comprising an hiv-1 envelope targeting arm |
| KR20240024318A (ko) * | 2014-11-20 | 2024-02-23 | 에프. 호프만-라 로슈 아게 | T 세포 활성화 이중특이적 항원 결합 분자 CD3 ABD 엽산 수용체 1(FolR1) 및 PD-1 축 결합 길항물질의 조합 요법 |
| US10259887B2 (en) | 2014-11-26 | 2019-04-16 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and tumor antigens |
| WO2016115274A1 (en) * | 2015-01-14 | 2016-07-21 | Compass Therapeutics Llc | Multispecific immunomodulatory antigen-binding constructs |
| WO2017011413A1 (en) | 2015-07-10 | 2017-01-19 | Duke University | Bispecific molecules comprising an hiv-1 envelope targeting arm |
| WO2017011414A1 (en) | 2015-07-10 | 2017-01-19 | Duke University | Bispecific molecules comprising an hiv-1 envelope targeting arm |
-
2017
- 2017-06-06 MA MA045192A patent/MA45192A/fr unknown
- 2017-06-06 RU RU2018145961A patent/RU2018145961A/ru unknown
- 2017-06-06 BR BR112018075198-7A patent/BR112018075198A2/pt not_active IP Right Cessation
- 2017-06-06 WO PCT/US2017/036075 patent/WO2017214092A1/en unknown
- 2017-06-06 KR KR1020197000309A patent/KR20190015520A/ko not_active Application Discontinuation
- 2017-06-06 SG SG11201810883TA patent/SG11201810883TA/en unknown
- 2017-06-06 SG SG10201913326UA patent/SG10201913326UA/en unknown
- 2017-06-06 EP EP17810823.9A patent/EP3463464A4/en not_active Withdrawn
- 2017-06-06 MX MX2018014950A patent/MX2018014950A/es unknown
- 2017-06-06 JP JP2018563801A patent/JP2019517539A/ja active Pending
- 2017-06-06 CN CN201780035194.0A patent/CN109310762A/zh active Pending
- 2017-06-06 US US16/306,882 patent/US20200255524A1/en not_active Abandoned
- 2017-06-06 AU AU2017278325A patent/AU2017278325A1/en not_active Abandoned
- 2017-06-07 TW TW106118940A patent/TW201742636A/zh unknown
-
2018
- 2018-12-05 IL IL263521A patent/IL263521A/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| SG10201913326UA (en) | 2020-02-27 |
| MA45192A (fr) | 2019-04-10 |
| EP3463464A1 (en) | 2019-04-10 |
| AU2017278325A1 (en) | 2019-01-24 |
| RU2018145961A (ru) | 2020-07-14 |
| CN109310762A (zh) | 2019-02-05 |
| US20200255524A1 (en) | 2020-08-13 |
| SG11201810883TA (en) | 2019-01-30 |
| WO2017214092A1 (en) | 2017-12-14 |
| JP2019517539A (ja) | 2019-06-24 |
| IL263521A (en) | 2019-01-31 |
| BR112018075198A2 (pt) | 2019-03-19 |
| TW201742636A (zh) | 2017-12-16 |
| RU2018145961A3 (ko) | 2020-07-30 |
| EP3463464A4 (en) | 2020-07-01 |
| MX2018014950A (es) | 2019-04-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI788327B (zh) | 能夠結合cd137和腫瘤抗原的雙特異性結合分子及其用途 | |
| KR20190015520A (ko) | 조합 치료법 | |
| TWI691509B (zh) | Pd-1結合分子和其使用方法 | |
| EP3148580B1 (en) | Tri-specific binding molecules that specifically bind to multiple cancer antigens and methods of use thereof | |
| TWI773646B (zh) | 結合lag-3的分子和其使用方法 | |
| JP7337079B2 (ja) | 変異型cd3結合ドメイン、及び疾患の治療のための併用療法におけるその使用 | |
| TWI814758B (zh) | 雙特異性cd16-結合分子及其在疾病治療中的用途 | |
| US20220324995A1 (en) | ADAM9-Binding Molecules, and Methods of Use Thereof | |
| WO2020041404A1 (en) | Pd-l1-binding molecules and use of the same for the treatment of disease | |
| RU2810222C2 (ru) | Вариантные связывающие cd3 домены и их применение в комбинированной терапии при лечении заболеваний | |
| RU2805648C2 (ru) | Биспецифические связывающие молекулы, способные связывать cd137 и опухолевые антигены, и варианты их применения |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |