본원에서의 본 발명은 사이클로덱스트린을 제형에 첨가함으로써 폴리소르베이트를 포함하는 수성 제형에서 폴리소르베이트 분해를 감소시키는 방법에 관한 것이고, 여기서 사이클로덱스트린 대 폴리소르베이트의 생성된 w/w 비는 약 37.5:1 초과이다. 또한, 본 발명은 수성 용액에서 비가시적 및 가시적 입자의 양을 감소시키기 위한 방법 및 폴리소르베이트를 포함하는 폴리소르베이트 분해 생성물을 분해하고 가용화시키는 방법을 제공하고, 본 방법은 사이클로덱스트린을 용액에 첨가하고, 사이클로덱스트린 대 폴리소르베이트의 비는 약 37.5:1 초과이다. 본 발명은 추가로 폴리소르베이트, 및 사이클로덱스트린을 포함하는 안정한 수성 제형을 제공하고, 여기서 제형에서의 사이클로덱스트린 대 폴리소르베이트의 w/w 비는 적어도 약 37.5:1이다. 일부 구현예에서, 제형은 추가로 폴리펩티드를 포함한다.
I. 정의
용어 “약제학적 제제”는 활성 성분의 생물학적 활성을 효과적으로 만드는 형태이고, 제가 투여될 대상체에게 허용되지 않을 정도로 독성인 추가의 성분을 함유하지 않는 조제물을 지칭한다. 이러한 제제는 멸균이다.
“멸균” 제제는 무균이거나 또는 모든 살아있는 미생물 및 이들의 포자가 없거나 본질적으로 없다.
“안정한” 제제는 내부의 단백질의 보관시 그의 물리적 안정성 및/또는 화학적 안정성 및/또는 생물학적 활성을 본질적으로 유지하는 제제이다. 바람직하게는, 제제는 보관시 그의 물리적 및 화학적 안정성, 뿐만 아니라 그의 생물학적 활성을 본질적으로 유지한다. 안정한 제형은 또한 보관시 폴리소르베이트의 수준을 유지할 수 있다. 보관 기간은 일반적으로 제제의 의도된 유효 기간에 기초하여 선택된다. 단백질 안정성을 측정하기 위한 다양한 분석 기술이 당업계에서 이용가능하며, 예를 들어 하기에서 논의된다: Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) 및 Jones, Adv.Drug Delivery Rev.10:29-90 (1993). 안정성은 선택된 시간 동안 선택된 양의 빛 노출량 및/또는 온도에서 측정될 수 있다. 안정성은 응집물 형성의 평가 (예를 들어 크기 배제 크로마토그래피를 사용하여, 혼탁도 측정에 의해, 및/또는 육안 검사에 의해); ROS 형성의 평가 (예를 들어 빛 스트레스 분석 또는 2,2’-아조비스(2-아미도프로판) 디하이드로클로라이드 (AAPH) 스트레스 분석을 사용하여); 단백질의 특정 아미노산 잔기의 산화 (예를 들어, 단클론 항체의 Trp 잔기 및/또는 Met 잔기); 양이온 교환 크로마토그래피, 영상 모세관 등전점 포커싱 (icIEF) 또는 모세관 구역 전기영동을 사용한 전하 이종성을 평가함으로써; 아미노-말단 또는 카복시-말단 서열 분석; 질량 분광 분석; 감소되고 온전한 항체와 비교하는 SDS-PAGE 분석; 펩타이드 맵 (예를 들어, 트립신 또는 LYS-C) 분석; 단백질의 생물학적 활성 또는 표적 결합 기능을 평가하는 것 (예컨대, 항체의 항원 결합 기능); 등을 포함하는 다양한 상이한 방식으로 정성적으로 및/또는 정량적으로 평가될 수 있다. 불안정성은 하기 중 어느 하나 이상을 포함할 수 있다: 응집, 탈아미드화 (예컨대 Asn 탈아미드화), 산화 (예컨대 Met 산화 및/또는 Trp 산화), 이성질체화 (예컨대 Asp 이성질체화), 클리핑/가수분해/단편화 (예컨대 힌지 영역 단편화), 석신이미드 형성, 쌍을 형성하지 않은 시스테인(들), N-말단 연장, C-말단 가공, 당화 차이 등.
단백질은 색 및/또는 투명도의 육안 검사시, 또는 UV 빛 산란 또는 크기 배제 크로마토그래피에 의해 측정된 바와 같이, 응집, 침전, 및/또는 변성의 신호를 나타내지 않거나 이것이 거의 없는 경우 약제학적 제제에서 “그의 물리적 안정성을 유지한다”.
단백질은 주어진 시간에 화학적 안정성이 단백질이 하기에 정의된 바와 같이 그의 생물학적 활성을 여전히 유지하는 것으로 간주되면, 약제학적 제제에서 “그의 화학적 안정성을 유지한다”. 화학적 안정성은 단백질의 화학적으로 변형된 형태를 검출하고 정량함으로써 평가될 수 있다. 화학적 변형은 예를 들어 트립신 펩타이드 맵핑, 역상 고성능 액체 크로마토그래피 (HPLC) 및 액체 크로마토그래피-질량 분석법 (LC/MS)을 사용하여 평가될 수 있는 단백질 산화를 포함할 수 있다. 다른 유형의 화학적 변형은 예를 들어 이온 교환 크로마토그래피 또는 icIEF에 의해 평가될 수 있는 단백질의 전하 변화를 포함한다.
단백질은 주어진 시간에 단백질의 생물학적 활성이, 예를 들어 단클론 항체의 항원 결합 분석에서 결정된 바와 같이, 약제학적 제제가 제조된 시간에 나타낸 생물학적 활성의 약 10% 이내 (검정의 오차 내)인 경우, 약제학적 제제에서 “그의 생물학적 활성을 유지한다”.
본원에 사용된 바와 같이, 단백질의 “생물학적 활성”은 단백질이 그의 표적에 결합하는 능력, 예를 들어 단클론 항체가 항원에 결합하는 능력을 지칭한다. 그것은 시험관내 또는 생체내에서 측정될 수 있는 생물학적 반응을 추가로 포함할 수 있다. 이러한 활성은 길항적 또는 작용적일 수 있다.
“산화에 민감한” 단백질은 산화되기 쉬운 것으로 밝혀진 하나 이상의 잔기(들), 예컨대, 비제한적으로, 메티오닌 (Met), 시스테인 (Cys), 히스티딘 (His), 트립토판 (Trp), 및 티로신 (Tyr)을 포함하는 것이다. 예를 들어, 단클론 항체의 Fab 부분 내의 트립토판 아미노산 또는 단클론 항체의 Fc 부분 내의 메티오닌 아미노산은 산화에 민감할 수 있다.
“등장성”은 본 발명의 제제가 인간 혈액과 본질적으로 동일한 삼투압을 갖는 것을 의미한다. 등장성 제제는 일반적으로 약 250 내지 350 mOsm의 삼투압을 가질 것이다. 등장성은 예를 들어 증기압 또는 얼음 동결식 삼투압계를 사용하여 측정될 수 있다.
본원에 사용된 바와 같이, “완충제”는 그의 산-염기 접합체 성분의 작용에 의해 pH의 변화를 저항하는 완충된 용액을 지칭한다. 본 발명의 완충제는 바람직하게는 약 4.5 내지 약 8.0 범위의 pH를 갖는다. 예를 들어, 히스티딘 아세테이트는 pH를 이 범위로 조절하는 완충제의 예이다.
“보존제”는 내부의 박테리아 작용을 감소시켜, 예를 들어 다용도 제제의 생산을 용이하게 하기 위해 제제에 선택적으로 포함될 수 있는 화합물이다. 잠재적인 보존제의 예는 옥타데실디메틸벤질 암모늄 클로라이드, 헥사메토늄 클로라이드, 벤즈알코늄 클로라이드 (알킬 그룹이 장쇄 화합물인 알킬벤질디메틸암모늄 클로라이드의 혼합물), 및 벤제토늄 클로라이드를 포함한다. 다른 유형의 보존제는 방향족 알코올, 예컨대 페놀, 부틸 및 벤질 알콜, 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤, 카테콜, 레조르시놀 사이클로헥사놀, 3-펩타놀, 및 m-크레졸을 포함한다. 일 구현예에서, 본원에서 보존제는 벤질 알콜이다.
본원에 사용된 바와 같이, “계면활성제”는 표면활성제, 바람직하게는 비이온성 계면활성제를 지칭한다. 본원에서 계면활성제의 예는 하기를 포함한다: 폴리소르베이트 (예를 들어, 폴리소르베이트 20 및, 폴리소르베이트 80); 폴록사머 (예컨대 폴록사머 188); 트리톤; 나트륨 도데실 설페이트 (SDS); 나트륨 라우릴 설페이트; 나트륨 옥틸 글리코시드; 라우릴-, 미리스틸-, 리놀레일-, 또는 스테아릴-설포베타인; 라우릴-, 미리스틸-, 리놀레일- 또는 스테아릴-사르코신; 리놀레일-, 미리스틸-, 또는 세틸-베타인; 라우로아미도프로필-, 코카미도프로필-, 리놀레아미도프로필-, 미리스타미도 프로필-, 팔미도프로필-, 또는 이소스테아라미도프로필-베타인 (예컨대 라우로아미도프로필); 미리스타미도프로필-, 팔미도프로필-, 또는 이소스테아라미도프로필-디메틸아민; 나트륨 메틸 코코일-, 또는 디나트륨 메틸 올레일-타우레이트; 및 MONAQUATTM 시리즈 (Mona Industries, Inc., Paterson, N.J.); 폴리에틸 글리콜, 폴리프로필 글리콜, 및 에틸렌 및 프로필렌 글리콜의 공중합체 (예컨대 Pluronics, PF68 등); 등.
본원에 사용된 바와 같이 “약제학적으로 허용가능한” 부형제 또는 담체는 당업계에 공지된 약제학적으로 허용가능한 담체, 안정화제, 완충제, 산, 염기, 당, 보존제, 계면활성제, 등장화제 등을 포함한다 (Remington: The Science and Practice of Pharmacy, 22nd Ed., Pharmaceutical Press, 2012). 약제학적으로 허용가능한 부형제의 예는 완충제, 예컨대 포스페이트, 시트레이트, 아세테이트, 및 다른 유기산; 아스코브산, L-트립토판 및 메티오닌을 포함하는 항산화제; 저분자량 (약 10개 미만의 잔기) 폴리펩타이드; 단백질, 예컨대 혈청 알부민, 젤라틴, 또는 면역글로불린; 친수성 중합체, 예컨대 폴리비닐피롤리돈(PVP); 아미노산, 예컨대 글리신, 글루타민, 아스파라긴, 아르기닌 또는 리신; 단당류, 이당류, 및 글루코스, 만노스, 또는 덱스트린을 포함하는 다른 탄수화물; 금속 착물, 예컨대 Zn-단백질 착물; 킬레이트제, 예컨대 EDTA; 당알콜, 예컨대 만니톨 또는 소르비톨; 염 형성 반대이온, 예컨대 나트륨; 및/또는 비이온성 계면활성제 예컨대 폴리소르베이트, 폴록사머, 폴리에틸렌 글리콜 (PEG), 및 PLURONICS™을 포함한다. “약제학적으로 허용가능한” 부형제 또는 담체는 사용된 활성 성분의 유효량을 제공하기 위해 대상체에게 합리적으로 투여될 수 있고 사용된 투여량 및 농도에서 이에 노출되는 대상체에게 비독성인 것이다.
본원에 사용되는 용어 "폴리소르베이트" (또는 PS로 축약됨)는 지방산과 에스테르화된 페길화 소르비탄을 지칭하고, 폴리소르베이트 20 (폴리옥시에틸렌 (20) 소르비탄 모노라우레이트), 폴리소르베이트 40 (폴리옥시에틸렌 (20) 소르비탄 모노팔미테이트), 폴리소르베이트 60 (폴리옥시에틸렌 (20) 소르비탄 모노스테아레이트), 및 폴리소르베이트 80 (폴리옥시에틸렌 (20) 소르비탄 모노올레에이트)를 포함한다.
용어 "사이클로덱스트린"은 알파-(1,4) 글리코시드 결합으로 연결된 d-글루코파이라노스 단위를 갖는 고리-유사 구조로 결합된 글루코스 분자를 포함하는 부류의 화합물을 지칭한다. 예시적인 사이클로덱스트린은 하이드록시프로필-β-사이클로덱스트린 (HP-β-CD 또는 HP-베타-사이클로덱스트린), 2-하이드록시프로필-α-사이클로덱스트린 (HP-α-CD 또는 HP-알파-사이클로덱스트린), 2-하이드록시프로필-γ-사이클로덱스트린 (HP-γ-CD 또는 HP-감마-사이클로덱스트린), β-사이클로덱스트린 (β-CD 또는 베타-사이클로덱스트린), 설포부틸 에테르 β-사이클로덱스트린 (SBE-β-CD 또는 SBE-베타-사이클로덱스트린), α-사이클로덱스트린 (α-CD 또는 알파-사이클로덱스트린), 및 γ-사이클로덱스트린 (γ-CD 또는 감마-사이클로덱스트린)을 포함한다. 사이클로덱스트린에 대한 동의어는 카비트론(Cavitron), 환형 올리고당, 사이클로아물로오스, 및 사이클로글루칸을 포함한다.
용어 "등장화제"는 용액의 상대적인 농도를 조정하거나 또는 유지하기 위해 사용되는 제제를 지칭한다. 바람직한 등장화제는 다가 당 알코올, 바람직하게는 3가 또는 더 고도의 당 알코올, 예컨대 글리세린, 에리트리톨, 아라비톨, 자일리톨, 소르비톨 및 만니톨을 포함한다.
용어 "안정화제"는 큰 하전된 생체분자, 예컨대 단백질 및 항체를 안정화시키기 위한 제제를 지칭한다. 등장화제는 또한 큰 하전된 생체분자와 함께 사용되는 경우 안정화제로서 역할을 할 수 있다.
"감소된 폴리소르베이트 분해"는 일정 기간 이후 더 많은 폴리소르베이트가 유사한 저장 조건 하에 대조군과 비교하여 샘플에 잔류하는 조건을 지칭한다. 예를 들면, 일정 기간 이후 잔류된 95% 폴리소르베이트를 갖는 샘플은 동일한 기간 이후 잔류된 50%의 폴리소르베이트를 갖는 대조군 샘플과 비교하여 감소된 폴리소르베이트 분해를 나타낸다.
본원에 사용되는 용어 "분해하다"는 폴리소르베이트 분해에 의해 야기된 가시적 및/또는 비가시적 입자에서의 감소를 지칭한다. 예를 들면, 제제는 가시적 및/또는 비가시적인 입자의 양이 폴리소르베이트를 함유하는 용액에 첨가되는 경우에 감소되는 경우에 폴리소르베이트 분해 생성물을 분해하는데 유효한 것이다.
용어 "가용화하다"는 액체에 고체를 용해시키는 것을 지칭한다. 예를 들면, 제제는 화합물이 이 제제의 존재 하에 보다 용이하게 용해되는 경우에 화합물을 가용화시키는데 유효한 것이다.
용어 "w/w 비"는 질량 기준으로의 다른 용질의 양으로 나눈 질량 기준의 하나의 용질의 양을 지칭한다. 예를 들면, 100 mg의 사이클로덱스트린 및 1 mg의 폴리소르베이트를 함유하는 용액은 100:1의 사이클로덱스트린 대 폴리소르베이트의 w/w 비를 가진다. 일 구현예에 따라, 사이클로덱스트린 대 폴리소르베이트의 w/w 비는 약 37.5:1 초과이다.
"수성 제형"은 투여에 대해 적합한 수계 액체 제형을 지칭한다. 제형은 치료제, 예컨대 항체 또는 소분자를 포함하고, 바람직하게는 멸균된 것이다. 수성 제형은 또한 완충액, 안정화제, 등장화제, 및 부형제를 포함할 수 있다.
제형화된 단백질은 바람직하게는 본질적으로 순수하고 바람직하게는 본질적으로 균질하다 (예컨대, 오염 단백질 등이 없음). “본질적으로 순수한” 단백질은 조성물의 총량을 기준으로, 적어도 약 90 중량%, 바람직하게는 적어도 약 95 중량%의 단백질 (예컨대, 단클론 항체)을 포함하는 조성물을 의미한다. “본질적으로 균질한” 단백질은 조성물의 총량을 기준으로, 적어도 약 99 중량%의 단백질 (예컨대, 단클론 항체)을 포함하는 조성물을 의미한다.
용어 “단백질” “폴리펩타이드” 및 “펩타이드”는 임의의 길이의 아미노산의 중합체를 지칭하기 위해 본원에서 상호교환적으로 사용된다. 중합체는 선형 또는 분지형일 수 있고, 그것은 변형된 아미노산을 포함할 수 있으며, 그것은 비-아미노산에 의해 중단될 수 있다. 용어는 또한 자연적으로또는 개입에 의해 변형된 아미노산 중합체를 포함하며; 예를 들어, 디설파이드 결합 형성, 당화, 지질화, 아세틸화, 인산화, 또는 임의의 다른 조작 또는 변형, 예컨대 라벨링 성분과의 접합을 포함한다. 또한, 예를 들어, 아미노산 (예를 들어, 비천연 아미노산 등을 포함)의 하나 이상의 유사체, 뿐만 아니라 당업계에 알려진 다른 변형을 함유하는 단백질이 정의 내에 포함된다. 본원의 정의에 포함되는 단백질의 예는 하기를 포함한다: 포유동물 단백질, 예컨대, 레닌; 성장 호르몬, 예컨대 인간 성장 호르몬 및 소 성장 호르몬; 성장 호르몬 방출 인자; 부갑상선 호르몬; 갑상선 자극 호르몬; 지질단백질; 알파-1-항트립신; 인슐린 A-사슬; 인슐린 B-사슬; 프로인슐린; 여포 자극 호르몬; 칼시토닌; 황체 형성 호르몬; 글루카곤; 렙틴; 응고 인자, 예컨대 인자 VIIIC, 인자 IX, 조직 인자, 및 폰 빌레브란트 인자; 항응고 인자, 예컨대 단백질 C; 심방 나트륨이뇨 인자; 폐 계면활성제; 플라스미노겐 활성자, 예컨대 우로키나제 또는 인간 소변 또는 조직-유형 플라스미노겐 활성자 (t-PA); 봄베신; 트롬빈; 조혈 성장 인자; 종양 괴사 인자-알파 및 -베타; 종양 괴사 인자 수용체, 예컨대 사멸 수용체 5 및 CD120; TNF-관련 세포자멸사 유도 리간드 (TRAIL); B-세포 성숙 항원 (BCMA); B-림프구 자극자 (BLyS); 증식 유도 리간드 (APRIL); 엔케팔리나아제; RANTES (regulated on activation normally T-cell expressed and secreted); 인간 대식세포 염증성 단백질 (MIP-1-알파); 혈청 알부민, 예컨대 인간 혈청 알부민; 뮬러관 억제 물질; 릴랙신 A-사슬; 릴랙신 B-사슬; 프로릴랙신; 마우스 성선자극호르몬 관련 펩타이드; 미생물 단백질, 예컨대 베타-락타마제; DNase; IgE; 세포독성 T-림프구 관련 항원 (CTLA), 예컨대 CTLA-4; 인히빈; 액티빈; 혈소판 유래 내피 세포 성장 인자 (PD-ECGF); 혈관 내피 성장 인자 패밀리 단백질 (예컨대, VEGF-A, VEGF-B, VEGF-C, VEGF-D, 및 P1GF); 혈소판 유래 성장 인자 (PDGF) 패밀리 단백질 (예컨대, PDGF-A, PDGF-B, PDGF-C, PDGF-D, 및 이의 이량체); 섬유아세포 성장 인자 (FGF) 패밀리, 예컨대 aFGF, bFGF, FGF4, 및 FGF9; 표피 성장 인자 (EGF); 호르몬 또는 성장 인자에 대한 수용체, 예컨대 VEGF 수용체(들) (예컨대, VEGFR1, VEGFR2, 및 VEGFR3), 표피 성장 인자 (EGF) 수용체(들) (예컨대, ErbB1, ErbB2, ErbB3, 및 ErbB4 수용체), 혈소판 유래 성장 인자 (PDGF) 수용체(들) (예컨대, PDGFR-α 및 PDGFR-β), 및 섬유아세포 성장 인자 수용체(들); TIE 리간드 (안지오포이에틴, ANGPT1, ANGPT2); 안지오포이에틴 수용체, 예컨대 TIE1 및 TIE2; 단백질 A 또는 D; 류마티스 인자; 신경영양성 인자, 예컨대 골 유래 신경영양성 인자 (BDNF), 신경영양인자-3, -4, -5, 또는 -6 (NT-3, NT-4, NT-5, 또는 NT-6), 또는 신경 성장 인자, 예컨대 NGF-b; 형질전환 성장 인자 (TGF), 예컨대 TGF-알파 및 TGF-베타, 예컨대 TGF-β1, TGF-β2, TGF-β3, TGF-β4, 또는 TGF-β5; 인슐린-유사 성장 인자-I 및 -II (IGF-I 및 IGF-II); des(1-3)-IGF-I (뇌 IGF-I), 인슐린-유사 성장 인자 결합 단백질 (IGFBP); CD 단백질, 예컨대 CD3, CD4, CD8, CD19 및 CD20; 에리트로포이에틴; 골유도 인자; 면역독소; 골 형성 단백질 (BMP); 케모카인, 예컨대 CXCL12 및 CXCR4; 인터페론, 예컨대 인터페론-알파, -베타, 및 -감마; 집락 자극 인자 (CSF), 예컨대, M-CSF, GM-CSF, 및 G-CSF; 사이토카인, 예컨대 인터루킨 (IL), 예컨대, IL-1 내지 IL-10; 미드카인; 수퍼옥사이드 디스뮤타아제; T-세포 수용체; 표면 막 단백질; 붕괴 촉진 인자; 바이러스 항원, 예를 들어, AIDS 외피의 일부; 수송 단백질; 귀소 수용체; 아드레신; 조절 단백질; 인테그린, 예컨대 CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 및 VCAM; 에프린; Bv8; 델타-유사 리간드 4 (DLL4); Del-1; BMP9; BMP10; 폴리스타틴; 간세포 성장 인자 (HGF)/산란 인자 (SF); Alk1; Robo4; ESM1; 퍼레칸; EGF-유사 도메인, 다중 7 (EGFL7); CTGF 및 그의 패밀리의 구성원; 트롬보스폰딘, 예컨대 트롬보스폰딘1 및 트롬보스폰딘2; 콜라겐, 예컨대 콜라겐 IV 및 콜라겐 XVIII; 뉴로필린, 예컨대 NRP1 및 NRP2; 플레이오트로핀 (PTN); 프로그라눌린; 프로리페린; 노치 단백질, 예컨대 Notch1 및 Notch4; 세마포린, 예컨대 Sema3A, Sema3C, 및 Sema3F; 종양 관련 항원, 예컨대 CA125 (난소 암 항원); 면역부착소; 및 상기 열거된 단백질의 단편 및/또는 변이체뿐만 아니라, 예를 들어, 상기 열거된 단백질 중 어느 것을 포함하는, 하나 이상의 단백질에 결합하는 항체 단편을 포함하는 항체.
본원에서 용어 “항체”는 가장 넓은 의미로 사용되며, 특히 원하는 생물학적 활성을 나타내는 한 단클론 항체 (전장 단클론 항체 포함), 다클론 항체, 다중특이적 항체 (예컨대, 이중특이적 항체), 및 항체 단편을 포함한다.
“단리된” 단백질 (예컨대, 단리된 항체)은 그의 천연 환경의 성분으로부터 확인되고 분리되고/되거나 회수된 것이다. 그의 천연 환경의 오염 성분은 단백질의 연구, 진단 또는 치료 용도를 방해할 물질이며, 효소, 호르몬, 및 다른 단백질성 또는 비단백질성 용질을 포함할 수 있다. 단리된 단백질은 재조합 세포 내의 그 위치에 있는 단백질을 포함하는데 단백질의 천연 환경의 적어도 하나의 성분이 존재하지 않을 것이기 때문이다. 그러나, 통상적으로, 단리된 단백질은 적어도 하나의 정제 단계에 의해 제조될 것이다.
“원상태 항체”는 일반적으로 2개의 동일한 경쇄 (L) 및 2개의 동일한 중쇄 (H)로 구성된 약 150,000 달톤의 이종사량체성 당단백질이다. 각 경쇄는 하나의 공유 디설파이드 결합에 의해 중쇄에 연결되는 반면, 디설파이드 연결의 수는 상이한 면역글로불린 아이소타입의 중쇄 사이에서 다양하다. 각 중쇄 및 경쇄는 또한 규칙적으로 이격된 사슬내 디설파이드 브리지를 갖는다. 각 중쇄는 하나의 말단에 가변 도메인 (VH) 후 다수의 불변 도메인을 갖는다. 각 경쇄는 하나의 말단에 가변 도메인 (VL) 및 그의 다른 말단에 불변 도메인을 가지며; 경쇄의 불변 도메인은 중쇄의 제1 불변 도메인과 정렬되고, 경쇄 가변 도메인은 중쇄의 가변 도메인과 정렬된다. 특정 아미노산 잔기는 경쇄 및 중쇄 가변 도메인 사이에서 계면을 형성한다고 여겨진다.
용어 “불변 도메인”은 면역글로불린의 다른 부분인 항원 결합 부위를 함유하는 가변 도메인과 비교하여 보다 보존된 아미노산 서열을 갖는 면역글로불린 분자의 부분을 지칭한다. 불변 도메인은 중쇄의 CH1, CH2 및 CH3 도메인 (종합하여, CH) 및 경쇄의 CHL (또는 CL) 도메인을 함유한다.
항체의 “가변 영역” 또는 “가변 도메인”은 항체의 중쇄 또는 경쇄의 아미노-말단 도메인을 지칭한다. 중쇄의 가변 도메인은 “VH”로 지칭될 수 있다. 경쇄의 가변 도메인은 “VL”로 지칭될 수 있다. 이러한 도메인은 일반적으로 항체의 가장 가변적인 부분이며 항원-결합 부위를 함유한다.
용어 “가변”은 가변 도메인의 특정 부분이 항체 사이에서 서열이 광범위하게 상이하고 그의 특정 항원에 대한 각 특정 항체의 결합 및 특이성에서 사용된다는 사실을 지칭한다. 그러나, 가변성은 항체의 가변 도메인 전체에 고르게 분포되어 있지 않다. 경쇄 및 중쇄 가변 도메인 모두에서 초가변 영역 (HVR)으로 불리는 3개의 분절에 집중되어 있다. 일부 구현예에서, HVR은 상보성 결정부(CDR)이다.
가변 도메인의 보다 고도로 보존된 부분은 프레임워크 영역 (FR)으로 불린다. 원상태 중쇄 및 경쇄의 가변 도메인은 각각 베타-시트 구조를 연결하고 일부 경우 이의 부분을 형성하는, 3개의 HVR에 의해 연결된 주로 베타-시트 구조를 채택하는 4개의 FR 영역을 포함한다. 각 사슬의 HVR은 FR 영역에 의해 근접하여 함께 유지되고, 다른 사슬로부터의 HVR과 함께 항체의 항원-결합 부위의 형성에 기여한다 (Kabat 등, Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, Md.(1991)). 불변 도메인은 항체가 항원에 결합하는 것에 직접 관여하지 않지만, 항체-의존적 세포 독성에서 항체의 참여와 같은 다양한 효과기 기능을 나타낸다.
임의의 포유동물 종으로부터의 항체 (면역글로불린)의 “경쇄”는, 이들의 불변 도메인의 아미노산 서열에 기초하여, 카파 (“κ”) 및 람다 (“λ”)로 불리는 2개의 명확하게 구별되는 유형 중 하나에 할당될 수 있다.
본원에 사용된 바와 같이 용어 IgG “아이소타입” 또는 “서브클래스”는 그들의 불변 영역의 화학적 및 항원성 특징에 의해 정의된 면역글로불린의 임의의 서브클래스를 의미한다. 그들의 중쇄의 불변 도메인의 아미노산 서열에 따라, 항체 (면역글로불린)는 상이한 클래스에 할당될 수 있다. 면역글로불린의 5개의 주요 클래스가 있다: IgA, IgD, IgE, IgG, 및 IgM, 및 이들 중 몇 개는 하기로 추가로 분류될 수 있다: 서브클래스 (아이소타입), 예컨대, IgG1, IgG2, IgG3, IgG4, IgA1, 및 IgA2. 면역글로불린의 상이한 클래스에 상응하는 중쇄 불변 도메인은 각각 α, δ, ε, γ, 및 μ로 불린다. 상이한 클래스의 면역글로불린의 하위단위 구조 및 3차원 구조는 널리 알려져 있으며 일반적으로, 예를 들어, 하기에 기재되어 있다: Abbas 등 Cellular and Mol. Immunology, 4th ed., W.B. Saunders, Co. (2000). 항체는 항체와 하나 이상의 다른 단백질 또는 펩타이드와의 공유 또는 비-공유 결합에 의해 형성된 더 큰 융합 분자의 일부일 수 있다.
용어 “전장 항체,” “온전한 항체” 및 “전체 항체”는 하기에 정의된 바와 같은 항체 단편이 아니라 그의 실질적으로 온전한 형태의 항체를 지칭하기 위해 본원에서 상호교환적으로 사용된다. 상기 용어는 특히 Fc 영역을 함유하는 중쇄를 갖는 항체를 지칭한다.
“항체 단편”은 온전한 항체의 부분을 포함하며, 바람직하게는 이의 항원 결합 영역을 포함한다. 항체 단편의 예는 Fab, Fab’, F(ab’)2, 및 Fv 단편; 디아바디; 선형 항체; 단일-사슬 항체 분자; 및 항체 단편으로부터 형성된 다중특이적 항체를 포함한다.
항체의 파파인 소화는 각각 단일 항원-결합 부위를 갖는 “Fab” 단편으로 불리는 2개의 동일한 항원-결합 단편, 및 이름이 쉽게 결정화하는 능력을 반영하는 잔류 “Fc” 단편을 생산한다. 펩신 처리는 2개의 항원-결합 부위를 가지며 여전히 항원과 교차 결합할 수 있는 F(ab’)2 단편을 생성한다. Fab 단편은 중쇄- 및 경쇄 가변 도메인을 함유하며, 또한 경쇄의 불변 도메인 및 중쇄의 제1 불변 도메인 (CH1)을 함유한다. Fab’ 단편은 항체 힌지 영역으로부터의 하나 이상의 시스테인을 포함하는 중쇄 CH1 도메인의 카복시 말단에 몇 개의 잔기를 부가함으로써 Fab 단편과 상이하다. Fab’-SH는 불변 도메인의 시스테인 잔기(들)가 유리 티올 그룹을 갖는 Fab’에 대한 본원의 명칭이다. F(ab’)2 항체 단편은 본래 그들 사이의 힌지 시스테인을 갖는 Fab’ 단편의 쌍으로서 생산되었다. 항체 단편의 다른 화학적 커플링 또한 알려져 있다.
“Fv”는 완전한 항원-결합 부위를 함유하는 최소 항체 단편이다. 일 구현예에서, 2개의 사슬 Fv 종은 단단하게 비공유 결합된 하나의 중쇄 가변 도메인 및 하나의 경쇄 가변 도메인의 이합체로 구성된다. 단일-사슬 Fv (scFv) 종에서, 하나의 중쇄 가변 도메인 및 하나의 경쇄 가변 도메인은 가요성 펩타이드 링커에 의해 공유 결합될 수 있어서 경쇄 및 중쇄는 2개의 사슬 Fv 종에서의 것과 유사한 “이량체” 구조로 결합할 수 있다. 이 구조 내에서, 각 가변 도메인의 3개의 HVR은 상호작용하여 VH-VL 이량체의 표면 상의 항원-결합 부위를 정의한다. 종합적으로, 6개의 HVR이 항체에게 항원-결합 특이성을 부여한다그러나, 심지어 단일 가변 도메인 (또는 항원에 특이적인 3개의 HVR만을 포함하는 Fv의 절반)은 전체 결합 부위보다 낮은 친화성에도 불구하고 항원을 인식하고 결합하는 능력을 갖는다.
“단일-사슬 Fv” 또는 “scFv” 항체 단편은 항체의 VH 및 VL 도메인을 포함하며, 이들 도메인은 단일 폴리펩타이드 사슬에 존재한다. 일반적으로, scFv 폴리펩타이드는 VH 및 VL 도메인 사이에 폴리펩타이드 링커를 추가로 포함하며, 이는 scFv가 항원 결합을 위한 원하는 구조를 형성할 수 있게 해준다. scFv의 검토를 위해, 하기를 참고한다: 예컨대, Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg 및 Moore eds., Springer-Verlag, New York, pp. 269-315, 1994.
용어 “디아바디”는 동일한 폴리펩타이드 사슬 (VH-VL) 내에 경쇄 가변 도메인 (VL)에 연결된 중쇄 가변 도메인 (VH)을 포함하는 2개의 항원-결합 부위를 갖는 항체 단편을 지칭한다. 너무 짧아서 동일한 사슬 상의 2개의 도메인 사이에 쌍을 형성할 수 없는 링커를 사용함으로써, 도메인은 또 다른 사슬의 상보적 도메인과 쌍을 형성하여 2개의 항원-결합 부위를 생성한다. 디아바디는 2가 또는 이중특이적일 수 있다. 디아바디는 하기에 더 상세히 기재되어 있다: 예를 들어, EP 제404,097호; WO 제1993/01161호; Hudson 등, Nat. Med. 9:129-134 (2003); 및 Hollinger 등, Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993). 트리아바디 및 테트라바디는 또한 하기에 기재되어 있다: Hudson 등, Nat. Med. 9:129-134 (2003).
본원에 사용된 바와 같이 용어 “단클론 항체”는 실질적으로 균질한 항체의 집단으로부터 수득된 항체를 지칭하며, 예컨대, 상기 집단을 구성하는 개별 항체는 가능한 돌연변이, 예컨대, 소량으로 존재할 수 있는 자연발생 돌연변이를 제외하고 동일하다. 따라서, 수식어 “단클론”은 개별 항체의 혼합물이 아닌 항체의 특징을 나타낸다. 특정 구현예에서, 이러한 단클론 항체는 전형적으로 표적에 결합하는 폴리펩타이드 서열을 포함하는 항체를 포함하며, 표적-결합 폴리펩타이드 서열은 복수의 폴리펩타이드 서열로부터 단일 표적 결합 폴리펩타이드 서열을 선택하는 것을 포함하는 과정에 의해 수득되었다. 예를 들어, 선택 과정은 하이브리도마 클론, 파아지 클론, 또는 재조합 DNA 클론의 풀 (pool)과 같은 복수의 클론으로부터 독특한 클론을 선택하는 것일 수 있다. 선택된 표적 결합 서열은, 예를 들어, 표적에 대한 친화성을 개선하기 위해, 표적 결합 서열을 인간화하기 위해, 세포 배양에서 그의 생산을 개선하기 위해, 생체내에서 그의 면역원성을 감소시키기 위해, 다중특이적 항체를 생성하기 위해, 더 변경될 수 있고, 변경된 표적 결합 서열을 포함하는 항체는 또한 본 발명의 단클론 항체인 것으로 이해되어야 한다. 전형적으로 상이한 결정기 (에피토프)에 대한 상이한 항체를 포함하는 다클론 항체 제제와 달리, 단클론 항체 제제의 각 단클론 항체는 항원 상의 단일 결정기에 대한 것이다. 이들의 특이성 외에도, 단클론 항체 제제는 전형적으로 다른 면역글로불린에 의해 오염되지 않는다는 점에서 유리하다.
수식어 “단클론”은 실질적으로 균질한 항체의 집단으로부터 수득되는 항체의 특징을 나타내며 임의의 특정 방법에 의한 항체의 생산을 필요로 하는 것으로 해석되지 않아야 한다. 예를 들어, 본 발명에 따라 사용될 단클론 항체는 하기를 포함하는 다양한 기술에 의해 제조될 수 있다: 예를 들어, 하이브리도마 방법 (예컨대, Kohler and Milstein, Nature, 256:495-97 (1975); Hongo 등, Hybridoma, 14 (3): 253-260 (1995), Harlow 등, Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling 등, in:Monoclonal Antibodies and T-Cell Hybridomas pp. 563-681 Elsevier, N.Y. (1981)), 재조합 DNA 방법 (예컨대, 미국특허 제4,816,567호 참고), 파아지-디스플레이 기술 (예컨대, Clackson 등, Nature, 352:624-628 (1991); Marks 등, J. Mol. Biol. 222: 581-597 (1992); Sidhu 등, J. Mol. Biol. 338(2): 299-310 (2004); Lee 등, J. Mol. Biol.340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); 및 Lee 등, J. Immunol. Methods 284(1-2): 119-132 (2004), 및 인간 면역글로불린 유전자좌의 일부 또는 전부 또는 인간 면역글로불린 서열을 코딩하는 유전자를 갖는 동물에서 인간 또는 인간-유사 항체를 생산하는 기술 (예컨대, WO 제1998/24893호; WO 제1996/34096호; WO 제1996/33735호; WO 제1991/10741호; Jakobovits 등, Proc. Natl. Acad. Sci. USA 90:2551 (1993); Jakobovits 등, Nature 362:255-258 (1993); Bruggemann 등, Year in Immunol. 7:33 (1993); 미국특허 제5,545,807호; 제5,545,806호; 제5,569,825호; 제5,625,126호; 제5,633,425호; 및 제5,661,016호; Marks 등, Bio/Technology 10:779-783 (1992); Lonberg 등, Nature 368:856-859 (1994); Morrison, Nature 368:812-813 (1994); Fishwild 등, Nature Biotechnol. 14:845-851 (1996); Neuberger, Nature Biotechnol. 14:826 (1996); 및 Lonberg 및 Huszar, Intern. Rev. Immunol. 13:65-93 (1995)).
본원에서 단클론 항체는 구체적으로 중쇄 및/또는 경쇄의 일부가 특정 종으로부터 유래되거나 특정 항체 클래스 또는 하위클래스에 속하는 항체 내의 상응하는 서열과 동일하거나 상동인 반면, 사슬(들)의 나머지는 또 다른 종으로부터 유래되거나 또 다른 항체 클래스 또는 하위클래스에 속하는 항체 내의 상응하는 서열과 동일하거나 상동인 “키메라성” 항체, 뿐만 아니라 원하는 생물학적 활성을 나타내는 한 이러한 항체의 단편을 포함한다 (예컨대, 미국특허 제4,816,567호; 및 Morrison 등, Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984) 참고). 키메라성 항체는 항체의 항원-결합 영역이, 예컨대, 짧은꼬리 원숭이를 본 발명의 항원으로 면역화시킴으로써 생산된 항체로부터 유래된 PRIMATZED® 항체를 포함한다.
비-인간 (예컨대, 쥣과) 항체의 “인간화” 형태는 비-인간 면역글로불린으로부터 유래된 최소 서열을 함유하는 키메라성 항체이다. 일 구현예에서, 인간화 항체는 수여자의 HVR로부터의 잔기가 원하는 특이성, 친화성, 및/또는 능력을 갖는 마우스, 랫트, 토끼, 또는 비인간 영장류와 같은 비-인간 종 (공여자 항체)의 HVR로부터의 잔기에 의해 대체된 인간 면역글로불린 (수여자 항체)이다. 일부 경우, 인간 면역글로불린의 FR 잔기는 상응하는 비-인간 잔기에 의해 대체된다. 또한, 인간화 항체는 수여자 항체 또는 공여자 항체에서 발견되지 않는 잔기를 포함할 수 있다. 이러한 변형은 항체 성능을 더 향상시키기 위해 이뤄질 수 있다. 일반적으로, 인간화 항체는 적어도 하나, 및 전형적으로 2개의 가변 도메인의 실질적으로 전부를 포함할 것이고, 여기서 초가변 루프의 전부 또는 실질적으로 전부는 비-인간 면역글로불린의 것과 상응하고, FR의 전부 또는 실질적으로 전부는 인간 면역글로불린 서열의 것이다. 인간화 항체는 선택적으로 또한 면역글로불린 불변 영역 (Fc)의 적어도 일부, 전형적으로 인간 면역글로불린의 것을 포함할 것이다. 추가의 세부사항을 위해, 하기를 참고한다: 예컨대, Jones 등, Nature 321:522-525 (1986); Riechmann 등, Nature 332:323-329 (1988); 및 Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). 또한, 하기를 참고한다: 예컨대, Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem.Soc.Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994); 및 미국특허 제6,982,321호 및 제7,087,409호.
“인간 항체”는 인간에 의해 생산된 항체의 것과 상응하는 아미노산 서열을 갖고/갖거나 본원에 개시된 바와 같은 인간 항체를 제조하는 기술 중 어느 것을 사용하여 제조된 항체이다. 인간 항체의 이러한 정의는 구체적으로 비-인간 항원-결합 잔기를 포함하는 인간화 항체를 배제한다. 인간 항체는 파아지-디스플레이 라이브러리를 포함하는 당업계에 알려진 다양한 기술을 사용하여 생산될 수 있다. Hoogenboom 및 Winter, J. Mol. Biol., 227:381 (1991); Marks 등, J. Mol. Biol., 222:581 (1991). 또한 인간 단클론 항체의 제조에 이용가능한 것은 하기에 기재된 방법이다: Cole 등, Monoclonal Antibodies and Cancer Therapy, Alan R.Liss, p. 77 (1985); Boerner 등, J. Immunol., 147(1): 86-95 (1991). 또한 하기를 참고한다: van Dijk and 및 de Winkel, Curr. Opin. Pharmacol., 5:368-74 (2001). 인간 항체는 항원 투여에 반응하여 항체를 생산하도록 변형되었지만 내인성 유전자좌가 불능이 된 형질전환 동물, 예컨대, 면역화된 제노마우스에 항원을 투여함으로써 제조될 수 있다 (예컨대, 미국특허 제6,075,181호 및 제6,150,584호, XENOMOUSETM 기술에 관함). 또한, 하기를 참고한다: 예를 들어, Li 등, Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) (인간 B-세포 하이브리도마 기술을 통해 생성된 인간 항체에 관함).
본원에서 사용될 때 용어 “초가변 영역,” “HVR,” 또는 “HV”는 서열이 초가변이고/이거나 구조적으로 정의된 루프를 형성하는 항체 가변 도메인의 영역을 지칭한다. 일반적으로, 항체는 6개의 HVR; VH에서 3개 (H1, H2, H3), 및 VL에서 3개 (L1, L2, L3)를 포함한다. 원상태 항체에서, H3 및 L3은 6개의 HVR의 다양성을 가장 많이 나타내며, H3은 특히 항체에게 우수한 특이성을 부여하는 독특한 역할을 한다고 여겨진다. 하기를 참고한다: 예컨대, Xu 등, Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, N.J., 2003). 실제로, 중쇄만으로 구성된 자연발생 낙타과 항체는 경쇄의 부재하에 기능적이며 안정하다. 하기를 참고한다: 예컨대, Hamers-Casterman 등, Nature 363:446-448 (1993); Sheriff 등, Nature Struct. Biol. 3:733-736 (1996).
많은 HVR 설명이 사용되고 있으며 이는 본원에 포함되어 있다. 카바트 상보성 결정 영역 (CDR)은 서열 가변성에 기초하며 가장 흔하게 사용되는 것이다 (Kabat 등, Sequences of Proteins of Immunological Interest, 5th Ed.Public Health Service, National Institutes of Health, Bethesda, Md.(1991)). 초티아는 대신 구조적 루프의 위치를 언급한다 (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). AbM HVR은 카바트 HVR 및 초티아 구조적 루프 사이의 절충안이며, 옥스포드 분자 AbM 항체 모델링 소프트웨어에 의해 사용된다. “접촉” HVR은 이용가능한 복합 결정 구조의 분석에 기초한다. 이러한 HVR 각각으로부터의 잔기는 하기에 나타나 있다.
HVR은 하기와 같이 “연장된 HVR”을 포함할 수 있다: VL에서 24-36 또는 24-34 (L1), 46-56 또는 50-56 (L2) 및 89-97 또는 89-96 (L3) 및 VH에서 26-35 (H1), 50-65 또는 49-65 (H2) 및 93-102, 94-102, 또는 95-102 (H3). 가변 도메인 잔기는 이들 정의 각각에 대해 상기 카바트 등에 따라 넘버링된다.
“프레임워크” 또는 “FR” 잔기는 본원에 정의된 바와 같은 HVR 잔기 이외의 가변 도메인이다.
용어 “카바트에서와 같은 가변 도메인 잔기 넘버링” 또는 “카바트에서와 같은 아미노산 위치 넘버링,” 및 이의 변형은 상기 카바트 등에서 항체의 편집의 중쇄 가변 도메인 또는 경쇄 가변 도메인에 사용된 넘버링 시스템을 지칭한다. 이 넘버링 시스템을 사용하여, 실제 선형 아미노산 서열은 가변 도메인의 FR 또는 HVR의 단축 또는 가변 도메인의 FR 또는 HVR 내로의 삽입에 해당하는 더 적은 또는 추가의 아미노산을 함유할 수 있다. 예를 들어, 중쇄 가변 도메인은 H2의 잔기 52 이후에 단일 아미노산 삽입 (카바트에 따른 잔기 52a) 및 중쇄 FR 잔기 82 이후에 삽입된 잔기 (예컨대, 카바트에 따른 잔기 82a, 82b, 및 82c 등)를 포함할 수 있다. 잔기의 카바트 넘버링은 항체의 서열의 상동성 영역에서 “표준” 카바트 넘버링된 서열과 정렬함으로써 주어진 항체에 대해 결정될 수 있다.
카바트 넘버링 시스템은 일반적으로 가변 도메인 내의 잔기를 지칭할 때 사용된다 (경쇄의 약 잔기 1-107 및 중쇄의 잔기 1-113) (예컨대, Kabat 등, Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md.(1991)). “EU 넘버링 시스템” 또는 “EU 지수”는 일반적으로 면역글로불린 중쇄 불변 영역 내의 잔기를 지칭할 때 사용된다 (예컨대, 상기 카바트 등에서 보고된 EU 지수). “카바트에서와 같은 EU 지수”는 인간 IgG1 EU 항체의 잔기 넘버링을 지칭한다.
표현 "선형 항체"는 문헌[Zapata 등 (Protein Eng., 8(10):1057-1062 (1995))]에 기재된 항체를 지칭한다. 간략하게는, 이러한 항체는 한 쌍의 탠덤 Fc 세그먼트 (VH-CH1-VH-CH1)를 포함하고, 이는 상보성 경쇄 폴리펩티드와 함께 한 쌍의 항원 결합부를 형성한다. 선형 항체는 이중특이성 또는 단일특이성일 수 있다.
다클론성 항체는 바람직하게는 관련 항원 및 아쥬반트의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 증가된다. 면역화되는 종에서 면역성인 단백질에 대해 항원 (특히 합성 펩티드가 사용되는 경우)을 컨쥬게이션시키는 것이 유용할 수 있다. 예를 들면, 항원은 이중작용성 또는 유도화제 사용하여 키홀-림펫 헤모사이아닌 (KLH), 혈청 알부민, 소 티로글로불린, 또는 대두 트립신 억제제, 예를 들면 말레이미도벤조일 설포석신이미드 에스테르 (시스테인 잔기를 통한 컨주게이션), N-하이드록시석신이미드 (라이신 잔기를 통함), 글루타르알데하이드, 석신산 무수물, SOCl2, 또는 R1N=C=NR (여기서 R 및 R1은 상이한 알킬기임)에 컨쥬게이션될 수 있다.
용어 “다중특이적 항체”는 가장 넓은 의미로 사용되며, 특히 폴리에피토프 특이성을 갖는 (즉 하나의 생물학적 분자 상의 2개 이상의 상이한 에피토프에 특이적으로 결합할 수 있거나 또는 2개 이상의 상이한 생물학적 분자 상의 에피토프에 특이적으로 결합할 수 있는) 항원-결합 도메인을 포함하는 항체를 포함한다. 일부 구현예에서, 다중특이적 항체 (예컨대 이중특이적 항체)의 항원-결합 도메인은 2개의 VH/VL 단위를 포함하며, 제1 VH/VL 단위는 제1 에피토프에 특이적으로 결합하고 제2 VH/VL 단위는 제2 에피토프에 특이적으로 결합하며, 각 VH/VL 단위는 중쇄 가변 도메인 (VH) 및 경쇄 가변 도메인 (VL)을 포함한다. 이러한 다중특이적 항체는, 비제한적으로, 전장 항체, 2개 이상의 VL 및 VH 도메인을 갖는 항체, 항체 단편, 예컨대 Fab, Fv, dsFv, scFv, 디아바디, 이중특이적 디아바디 및 트리아바디, 공유 또는 비-공유 결합된 항체 단편을 포함한다. 중쇄 불변 영역의 적어도 일부 및/또는 경쇄 불변 영역의 적어도 일부를 추가로 포함하는 VH/VL 단위는 “헤미머” 또는 “절반 항체”로 지칭될 수도 있다. 일부 구현예에서, 절반 항체는 단일 중쇄 가변 영역의 적어도 일부 및 단일 경쇄 가변 영역의 적어도 일부를 포함한다. 일부 이러한 구현예에서, 2개의 절반 항체를 포함하고 2개의 항원에 결합하는 이중특이적 항체는 제1 항원 또는 제1 에피토프에 결합하지만 제2 항원 또는 제2 에피토프에는 결합하지 않는 제1 절반 항체 및 제2 항원 또는 제2 에피토프에 결합하나 제1 항원 또는 제1 에피토프에 결합하지 않는 제2 절반 항체를 포함한다. 일부 구현예에 따르면, 다중특이적 항체는 5 M 내지 0.001 pM, 3 M 내지 0.001 pM, 1 M 내지 0.001 pM, 0.5 M 내지 0.001 pM, 또는 0.1 M 내지 0.001 pM의 친화성으로 각 항원 또는 에피토프에 결합하는 IgG 항체이다. 일부 구현예에서, 헤미머는 제2 헤미머와 분자내 디설파이드 결합이 형성되게 하는 중쇄 가변 영역의 충분한 부분을 포함한다. 일부 구현예에서, 헤미머는, 예를 들어, 상보적 홀 돌연변이 또는 노브 돌연변이를 포함하는 제2 헤미머 또는 절반 항체와 이종이량체화를 허용하는, 노브 돌연변이 또는 홀 돌연변이를 포함한다. 노브 돌연변이 및 홀 돌연변이는 하기에 추가로 논의된다.
“이중특이적 항체”는 하나의 생물학적 분자 상의 2개의 상이한 에피토프에 특이적으로 결합하거나 또는 2개의 상이한 생물학적 분자 상의 에피토프에 특이적으로 결합하는 항원-결합 도메인을 포함하는 다중특이적 항체이다. 이중특이적 항체는 또한 “이중 특이성”을 갖거나 “이중 특이적”인 것으로 본원에 지칭될 수 있다. 달리 나타내지 않는 한, 이중특이적 항체 명칭에서 이중특이적 항체에 결합된 항원이 열거되는 순서는 임의적이다. 일부 구현예에서, 이중특이적 항체는 2개의 절반 항체를 포함하며, 각각의 절반 항체는 단일 중쇄 가변 영역 및 선택적으로 중쇄 불변 영역의 적어도 일부, 및 단일 경쇄 가변 영역 및 선택적으로 경쇄 불변 영역의 적어도 일부를 포함한다. 특정 구현예에서, 이중특이적 항체는 2개의 절반 항체를 포함하며, 각각의 절반 항체는 단일 중쇄 가변 영역 및 단일 경쇄 가변 영역을 포함하고 하나를 초과하는 단일 중쇄 가변 영역을 포함하지 않으며 하나를 초과하는 단일 경쇄 가변 영역을 포함하지 않는다. 일부 구현예에서, 이중특이적 항체는 2개의 절반 항체를 포함하며, 각각의 절반 항체는 단일 중쇄 가변 영역 및 단일 경쇄 가변 영역을 포함하고, 제1 절반 항체는 제1 항원에 결합하고 제2 항원에는 결합하지 않으며 제2 절반 항체는 제2 항원에 결합하고 제1 항원에는 결합하지 않는다.
본원에 사용된 바와 같이 용어 “노브-인투-홀” 또는 “KnH” 기술은 하나의 폴리펩타이드 내에 돌기 (노브)를 도입하고 이들이 상호작용하는 계면에 있는 다른 폴리펩타이드 내에 공동 (홀)을 도입함으로써 시험관내 또는 생체내에서 2개의 폴리펩타이드가 함께 쌍을 형성하게 하는 기술을 지칭한다. 예를 들어, KnH는 항체의 Fc:Fc 결합 계면, CL:CH1 계면 또는 VH/VL 계면에 도입되었다 (참고: 예컨대, US 제2011/0287009호, US제2007/0178552호, WO 제96/027011호, WO 제98/050431호, 및 Zhu 등, 1997, Protein Science 6:781-788). 일부 구현예에서, KnH는 다중특이적 항체의 제조 동안 2개의 상이한 중쇄의 쌍 형성을 유도한다. 예를 들어, 그들의 Fc 영역 내에 KnH를 갖는 다중특이적 항체는 각 Fc 영역에 연결된 단일 가변 도메인을 추가로 포함할 수 있거나, 또는 유사한 또는 상이한 경쇄 가변 도메인과 쌍을 형성하는 상이한 중쇄 가변 도메인을 추가로 포함한다. KnH 기술은 또한 2개의 상이한 수용체 세포외 도메인 또는 상이한 표적 인식 서열 (예컨대, 아피바디, 펩티바디 및 다른 Fc 융합 포함)을 포함하는 임의의 다른 폴리펩타이드 서열을 쌍을 형성시키는데 사용될 수 있다.
본원에 사용된 바와 같이 용어 “노브 돌연변이”는 폴리펩타이드가 또 다른 폴리펩타이드와 상호작용하는 계면에 있는 폴리펩타이드 내에 돌기 (노브)를 도입하는 돌연변이를 지칭한다. 일부 구현예에서, 다른 폴리펩타이드는 홀 돌연변이를 갖는다 (참고: 예컨대, US 제5,731,168호, US 제5,807,706호, US 제5,821,333호, US 제7,695,936호, US 제8,216,805호, 각각은 그 전체가 참고로 본원에 포함되어 있음).
본원에 사용된 바와 같이 용어 “홀 돌연변이”는 폴리펩타이드가 또 다른 폴리펩타이드와 상호작용하는 계면에 있는 폴리펩타이드 내에 공동 (홀)을 도입하는 돌연변이를 지칭한다. 일부 구현예에서, 다른 폴리펩타이드는 노브 돌연변이를 갖는다 (참고: 예컨대, US 제5,731,168호, US 제5,807,706호, US 제5,821,333호, US 제7,695,936호, US 제8,216,805호, 각각은 그 전체가 참고로 본원에 포함되어 있음).
본원에 사용된 바와 같이 용어 “약”은 당업자에 의해 결정된 바와 같이 각각의 값에 대한 허용가능한 오차 범위를 지칭하며, 이는 값이 측정되거나 결정되는 방법, 즉 측정 시스템의 한계에 일부 의존할 것이다. 예를 들어, “약”은 당업계의 관행에 따라 1 이내 또는 1 초과의 표준 편차를 의미할 수 있다. 본원에서 “약” 값 또는 매개변수에 대한 언급은 상기 값 또는 매개변수 자체에 관한 구현예를 포함하고 설명한다. 예를 들어, “약 X”에 관한 설명은 “X”의 설명을 포함한다.
본 명세서 및 첨부된 청구항에서 사용된 바와 같이, 단수형 “a”, “an” 및 “the”은 내용이 달리 지시하지 않는 한 복수 대상을 포함한다. 따라서, 예를 들어, “화합물”에 대한 언급은 선택적으로 2개 이상의 이러한 화합물의 조합 등을 포함한다.
II. 제형 및 제조
본원의 본 발명은 폴리소르베이트를 포함하는 수성 제형에서 폴리소르베이트 분해를 감소시키는 방법에 관한 것이고, 본 방법은 제형에 사이클로덱스트린을 첨가하는 단계를 포함하고, 사이클로덱스트린 대 폴리소르베이트의 생성된 w/w 비는 약 37.5:1 초과이다. 일부 구현예에서, 본 발명은 폴리소르베이트를 포함하는 수성 용액에서 비가시적 및 가시적 입자의 양을 감소시키기 위한 방법을 제공하며, 이는 사이클로덱스트린을 용액에 첨가하는 단계를 포함하고, 여기서 사이클로덱스트린 대 폴리소르베이트의 생성된 w/w 비는 약 37.5:1 초과이다. 일부 구현예에서, 사이클로덱스트린은 HP-β사이클로덱스트린, HP-γ 사이클로덱스트린 또는 설포부틸 에테르 베타-사이클로덱스트린이다. 일부 구현예에서, 사이클로덱스트린은 HP-α 사이클로덱스트린이다. 일부 구현예에서, 제형은 추가로 폴리렙티드를 포함한다.
일부 구현예에서, 본 방법은 폴리비닐피롤리돈 (PVP)을 제형에 첨가하는 단계를 포함하고, 여기서 PVP 대 폴리소르베이트의 생성된 w/w 비는 약 37.5:1 초과이다. 일부 구현예에서, 본 발명은 폴리소르베이트를 포함하는 수성 용액에서의 비가시적 및 가시적 입자의 양을 감소시키는 방법을 제공하며, 이는 용액에 PVP를 첨가하는 단계를 포함하며, 여기서 PVP 대 폴리소르베이트의 생성된 w/w 비는 약 37.5:1 초과이다. 일부 구현예에서, 본 발명은 수성 제형에서 폴리소르베이트 분해 생성물을 분해하고 가용화시키는 방법을 제공하고, 여기서 PVP 대 폴리소르베이트의 생성된 w/w 비는 약 37.5:1 초과이다.
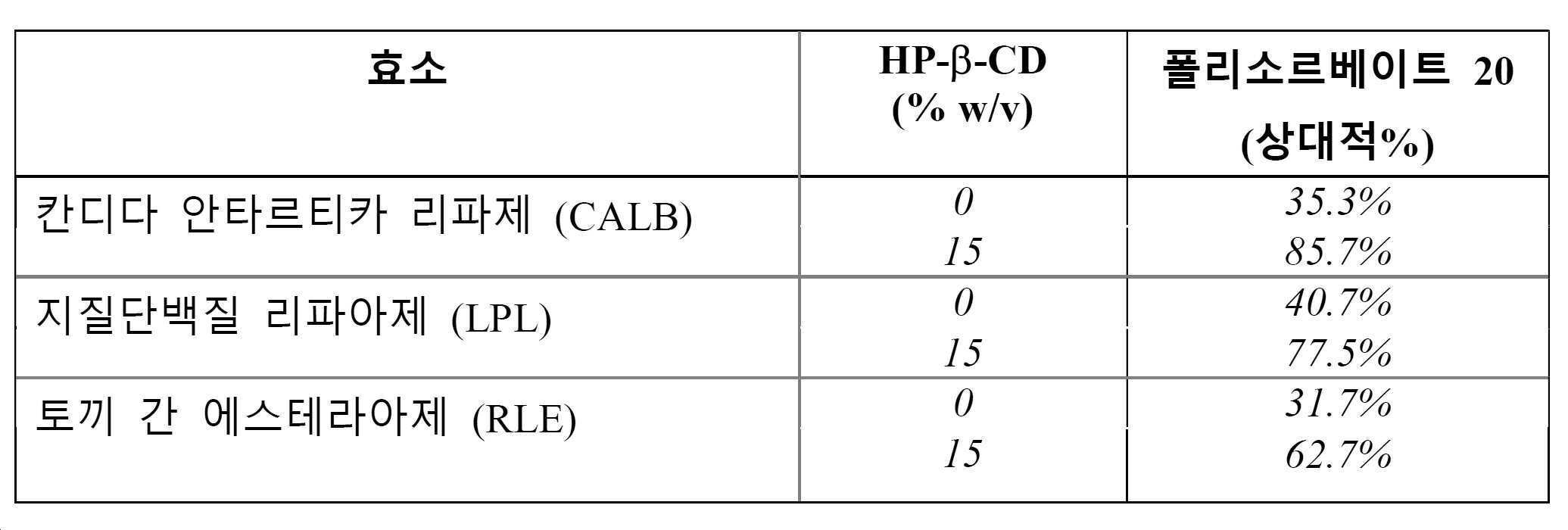
일부 구현예에서, 본 발명은 폴리소르베이트, 및 사이클로덱스트린을 포함하는 수성 제형을 제공하며, 여기서 1% 미만의 폴리소르베이트는 적어도 약 6개월 내지 적어도 약 48개월 동안 약 1℃ 내지 약 10℃에서의 저장 이후 분해되고, 제형에서의 사이클로덱스트린 대 폴리소르베이트의 w/w 비는 적어도 약 37.5:1이다. 일부 구현예에서, 본 발명은 폴리소르베이트 및 PVP를 포함하는 수성 제형을 제공하며, 1% 미만의 폴리소르베이트는 적어도 약 6개월 내지 적어도 약 48개월 동안 약 1℃ 내지 약 10℃에서의 저장 이후 분해되고, 제형에서의 PVP 대 폴리소르베이트의 w/w 비는 적어도 약 37.5:1이다. 일부 구현예에서, 제형은 적어도 약 6개월 내지 적어도 약 적어도 약 48개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 또는 적어도 약 48개월 동안 약 2℃ 내지 약 8℃에서 안정하다. 일부 구현예에서, 제형은 약 0.005%-0.4%의 폴리소르베이트를 포함한다. 일부 구현예에서, 제형은 약 0.005%-0.4%의 폴리소르베이트를 포함하고, 사이클로덱스트린은 약 0.01%-30%의 농도로 제형에 첨가된다. 일부 구현예에서, 사이클로덱스트린은 HP-β 사이클로덱스트린, HP-γ 사이클로덱스트린 또는 설포부틸 에테르 베타-사이클로덱스트린이다. 일부 구현예에서, 사이클로덱스트린은 HP-α 사이클로덱스트린이다. 일부 구현예에서, 폴리소르베이트 분해는 약 50%, 약 75%, 약 80%, 약 85%, 약 90%, 약 95%, 또는 약 99%까지 감소된다. 추가의 구현예에서, 1mL당 약 1,000, 약 750, 약 500, 약 250, 약 150, 약 100, 약 50, 또는 약 25개 미만의 폴리소르베이트 입자 (직경에 있어서 약 2 마이크론 초과)가 형성된다. 일부 구현예에서, 제형은 추가로 폴리펩티드를 포함한다. 일부 구현예에서, 단백질 농도는 약 1 mg/mL 내지 약 250 mg/mL이다. 일부 구현예에서, 단백질 농도는 약 250 mg/mL 초과이다. 일부 구현예에서, 제형은 약 4.5 내지 약 7.0 또는 약 4.5 내지 약 6.0, 또는 약 6.0의 pH를 가진다. 일부 구현예에서, 제형은 추가로 안정화제, 완충액, 계면활성제, 및 등장화제 중 하나 이상을 포함한다. 추가의 구현예에서, 제형은 대상체에의 정맥내, 피하 근육내, 또는 초자체내 투여를 위해 적합하다. 일부 구현예에서, 폴리펩티드는 다클론성 항체, 단클론성 항체, 인간화된 항체, 인간 항체, 키메라성 항체, 다중특이적 항체, 또는 항체 단편이다. 일부 구현예에서, 제형은 추가로 소분자, 핵산, 지질 및/또는 탄수화물을 포함한다.
제형에서의 단백질 및 항체는 본 기술분야에 공지된 방법을 사용하여 제조될 수 있다. 항체(예를 들면, 전장 항체, 항체 절편 및 다중특이적 항체)를 제조하기 위한 비제한적인 예시적인 방법이 본원에 제공된다. 수성 제형에서의 항체는 항체를 생성하기 위한 본 기술분야에서 이용가능한 기술을 사용하여 제조되고, 예시적인 이의 방법은 하기 섹션에 보다 상세하게 기재되어 있다. 본원의 방법은 다른 단백질 예컨대 펩티드계 억제제를 포함하는 제형의 제조를 위해 본 기술분야의 당업자에 의해 적용될 수 있다. 일반적으로 잘 이해하고, 치료적 단백질의 제조를 위해 일반적으로 잘 이해하고 일반적으로 이용되는 기술 및 과정에 대해 문헌[am Sambrook 등, Molecular Cloning: Laboratory Manual, 4th ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2012); Current Protocols in Molecular Biology, F.M. Ausubel, 등 eds. (2003); Short Protocols in Molecular Biology, Ausubel 등, eds., J. Wiley 및 Sons (2002); Horswill 등, Current Protocols in Protein Science, (2006); Antibodies, Laboratory Manual, Harlow 및 Lane, eds. (1988); R.I. Freshney, Culture of Animal Cells: Manual of Basic Technique 및 Specialized Application, 6th ed., J. Wiley 및 Sons (2010)]을 참조하며, 이는 그 전문이 본원에 참조로 포함되어 있다.
A. 항체 제조
본원에 제공된 수성 제제 내의 항체는 본 발명의 항원에 대한 것이다. 바람직하게는, 항원은 생물학적으로 중요한 폴리펩타이드이며, 항체를 장애를 겪고 있는 포유동물에게 투여하는 것은 상기 포유동물에서 치료 이점을 야기할 수 있다. 그러나, 비폴리펩타이드 항원에 대한 항체가 또한 고려된다.
항원이 폴리펩타이드인 경우, 그것은 막투과 분자 (예컨대 수용체) 또는 리간드, 예컨대 성장 인자일 수 있다. 예시적인 항원은 하기를 포함한다: 분자, 예컨대 혈관 내피 성장 인자 (VEGF); CD20; ox-LDL; ox-ApoB100; 레닌; 성장 호르몬, 예컨대 인간 성장 호르몬 및 소 성장 호르몬; 성장 호르몬 방출 인자; 부갑상선 호르몬; 갑상선 자극 호르몬; 지질단백질; 알파-1-항트립신; 인슐린 A-사슬; 인슐린 B-사슬; 프로인슐린; 여포 자극 호르몬; 칼시토닌; 황체 형성 호르몬; 글루카곤; 응고 인자, 예컨대 인자 VIIIC, 인자 IX, 조직 인자, 및 폰 빌레브란트 인자; 항응고 인자, 예컨대 단백질 C; 심방 나트륨이뇨 인자; 폐 계면활성제; 플라스미노겐 활성자, 예컨대 우로키나제 또는 인간 소변 또는 조직-유형 플라스미노겐 활성자 (t-PA); 봄베신; 트롬빈; 조혈 성장 인자; 종양 괴사 인자-알파 및 -베타; 엔케팔리나아제; RANTES (regulated on activation normally T-cell expressed and secreted); 인간 대식세포 염증성 단백질 (MIP-1-알파); 혈청 알부민, 예컨대 인간 혈청 알부민; 뮬러관 억제 물질; 릴랙신 A-사슬; 릴랙신 B-사슬; 프로릴랙신; 마우스 성선자극호르몬 관련 펩타이드; 미생물 단백질, 예컨대 베타-락타마제; DNase; IgE; 세포독성 T-림프구 관련 항원 (CTLA), 예컨대 CTLA-4; 인히빈; 액티빈; 호르몬 또는 성장 인자에 대한 수용체; 단백질 A 또는 D; 류마티스 인자; 신경영양성 인자, 예컨대 골-유래 신경영양성 인자 (BDNF), 신경영양인자-3, -4, -5, 또는 -6 (NT-3, NT4, NT-5, 또는 NT-6), 또는 신경 성장 인자, 예컨대 NGF-β; 혈소판-유래 성장 인자 (PDGF); 섬유아세포 성장 인자, 예컨대 aFGF 및 bFGF; 표피 성장 인자 (EGF); 형질전환 성장 인자 (TGF), 예컨대 TGF-알파 및 TGF-베타, 예컨대 TGF-β1, TGF-β2, TGF-β3, TGF-β4, 또는 TGF-β5; 인슐린-유사 성장 인자-I 및 -II (IGF-I 및 IGF-II); des (1-3)-IGF-I (뇌 IGF-I), 인슐린-유사 성장 인자 결합 단백질; CD 단백질, 예컨대 CD3, CD4, CD8, CD19 및 CD20; 에리트로포이에틴; 골유도 인자; 면역독소; 골 형성 단백질 (BMP); 인터페론, 예컨대 인터페론-알파, -베타, 및 -감마; 집락 자극 인자 (CSF), 예컨대, M-CSF, GM-CSF, 및 G-CSF; 인터루킨 (IL), 예컨대, IL-1 내지 IL-10; 수퍼옥사이드 디스뮤타아제; T-세포 수용체; 표면 막 단백질; 붕괴 촉진 인자; 바이러스 항원, 예를 들어, AIDS 외피의 일부; 수송 단백질; 귀소 수용체; 아드레신; 조절 단백질; 인테그린, 예컨대 CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 및 VCAM; 종양 관련 항원, 예컨대 HER2, HER3 또는 HER4 수용체; 및 상기 열거된 폴리펩타이드 중 어느 것의 단편.
(i) 항원 제조
선택적으로 다른 분자에 접합된 가용성 항원 또는 이의 단편은 항체를 생성하기 위한 면역원으로서 사용될 수 있다. 막투과 분자, 예컨대 수용체의 경우, 이들의 단편 (예컨대, 수용체의 세포외 도메인)이 면역원으로서 사용될 수 있다. 택일적으로, 막투과 분자를 발현하는 세포는 면역원으로서 사용될 수 있다. 이러한 세포는 천연 공급원 (예컨대 암 세포주)로부터 유래될 수 있거나 또는 막투과 분자를 발현하기 위한 재조합 기술에 의해 형질전환된 세포일 수 있다. 항체를 제조하는데 유용한 다른 항원 및 이의 형태는 당업자에게 명백할 것이다.
(ii) 특정 항체-기반 방법
다클론 항체는 바람직하게는 관련 항원 및 보조제의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 생성된다. 이관능성 또는 유도체화제, 예를 들어, 말레이미도벤조일 설포석신이미드 에스테르 (시스테인 잔기를 통한 접합), N-하이드록시석신이미드 (리신 잔기를 통한), 글루타르알데하이드, 무수 석신산, SOCl2, 또는 R1N=C=NR (여기서, R 및 R1은 상이한 알킬 그룹임)을 사용하여 면역화될 종에서 면역원성인 단백질, 예컨대, 키홀 림펫 헤모시아닌, 혈청 알부민, 소 티로글로불린, 또는 대두 트립신 억제제에 관련 항원을 접합하는 것이 유용할 수 있다.
동물은 하기에 의해 항원, 면역원성 접합체, 또는 유도체에 대해 면역화된다: 예컨대, 100 μg 또는 5 μg의 단백질 또는 접합체 (각각 토끼 또는 마우스의 경우)를 3 부피의 프로인트 완전 보조제와 조합하고 상기 용액을 다수의 부위에 피내 주사함으로써. 1개월 후, 동물은 다수의 부위에서의 피하 주사에 의해 프로인트 완전 보조제 중의 펩타이드 또는 접합체의 원래 양의 1/5 내지 1/10를 사용하여 부스트된다. 7 내지 14일 후, 동물을 출혈시키고 혈청을 항체 역가에 대해 분석하였다. 동물은 역가가 정체될 때까지 부스트된다. 바람직하게는, 동물은 상이한 단백질에 접합되고/되거나 상이한 가교 시약을 통해 접합된 동일한 항원의 접합체로 부스트된다. 접합체는 또한 단백질 융합으로서 재조합 세포 배양에서 제조될 수 있다. 또한, 명반과 같은 응집제가 면역 반응을 향상시키기 위해 적합하게 사용된다.
본 발명의 단클론 항체는 Kohler 등, Nature, 256:495 (1975)에 최초로 기재되고, 하기에 추가로 기재된 하이브리도마 방법을 사용하여 제조될 수 있다: 예컨대, Hongo 등, Hybridoma, 14 (3): 253-260 (1995), Harlow 등, Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling 등, in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981), 및 Ni, Xiandai Mianyixue, 26(4): 265-268 (2006) (인간-인간 하이브리도마에 관함). 추가의 방법은 하기에 기재된 것을 포함한다: 예를 들어, 미국특허 제7,189,826호 (하이브리도마 세포주로부터 단클론 인간 천연 IgM 항체의 생산에 관함). 인간 하이브리도마 기술 (트리오마 기술)은 문헌[Vollmers and Brandlein, Histology and Histopathology, 20(3): 927-937 (2005) 및 Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005)]에 기재되어 있다.
다양한 다른 하이브리도마 기술의 경우, 하기를 참고한다: 예컨대, US 제2006/258841호; US 제2006/183887호 (완전 인간 항체), US 제2006/059575호; US 제2005/287149호; US 제2005/100546호; US 제2005/026229호; 및 미국특허 제7,078,492호 및 제7,153,507호. 하이브리도마 방법을 사용하여 단클론 항체를 생산하는 예시적인 프로토콜이 하기와 같이 기재되어 있다. 일 구현예에서, 마우스 또는 다른 적절한 숙주 동물, 예컨대 햄스터는 면역화를 위해 사용된 단백질에 특이적으로 결합할 항체를 생산하거나 생산할 수 있는 림프구를 유발하기 위해 면역화된다. 항체는 본 발명의 폴리펩타이드 또는 이의 단편, 및 보조제, 예컨대 모노포스포릴 지질 A (MPL)/트레할로스 디크리노미콜레이트 (TDM)의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 생성된다 (Ribi Immunochem. Research, Inc., Hamilton, Mont.). 본 발명의 폴리펩타이드 (예컨대, 항원) 또는 이의 단편은 재조합 방법과 같이 당업계에 널리 알려진 방법을 사용하여 제조될 수 있고, 이들 중 일부는 본원에 추가로 기재되어 있다. 면역화된 동물로부터의 혈청은 항-항원 항체에 대해 분석되고, 부스터 면역화가 선택적으로 투여된다. 항-항원 항체를 생산하는 동물로부터 림프구가 단리된다. 택일적으로, 림프구는 시험관내에서 면역화될 수 있다.
이후, 림프구는 폴리에틸렌 글리콜과 같은 적합한 융합제를 사용하여 골수종 세포와 융합되어 하이브리도마 세포를 형성한다. 하기를 참고한다: 예컨대, Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 Academic Press, (1986). 효율적으로 융합하고, 선택된 항체-생산 세포에 의한 항체의 안정한 고수준 생산을 지원하며, HAT 배지와 같은 배지에 민감한 골수종 세포가 사용될 수 있다. 예시적인 골수종 세포는, 비제한적으로, 쥣과 골수종 주, 예컨대 하기로부터 이용가능한 MOPC-21 및 MPC-11 마우스 종양으로부터 유래된 것: Salk Institute Cell Distribution Center, San Diego, Calif. USA, 및 하기로부터 이용가능한 SP-2 또는 X63-Ag8-653 세포를 포함한다: American Type Culture Collection, Rockville, Md.USA.인간 골수종 및 마우스-인간 이종골수종 세포주가 또한 인간 단클론 항체의 생산을 위해 기술되었다 (Kozbor, J. Immunol., 133:3001 (1984); Brodeur 등, Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, (1987).
이렇게 제조된 하이브리도마 세포는 적합한 배양 배지, 예컨대, 융합되지 않은 모 골수종 세포의 성장 또는 생존을 억제하는 하나 이상의 물질을 함유하는 배지에 시딩되고 성장된다. 예를 들어, 모 골수종 세포가 효소 하이포잔틴 구아닌 포스포리보실 트랜스퍼라아제 (HGPRT 또는 HPRT)가 결여된 경우, 하이브리도마를 위한 배양 배지는 전형적으로 하이포잔틴, 아미노프테린, 및 티미딘 (HAT 배지)을 포함할 것이며, 이 물질은 HGPRT-결핍 세포의 성장을 방지한다. 바람직하게는, 무혈청 하이브리도마 세포 배양 방법은, 하기에 기재된 바와 같이 우태아 혈청과 같은 동물 유래 혈청의 사용을 감소시키기 위해 사용된다: 예를 들어, Even 등, Trends in Biotechnology, 24(3), 105-108 (2006).
하이브리도마 세포 배양의 생산성을 개선하기 위한 도구로서 올리고펩타이드는 문헌 [Franek, Trends in Monoclonal Antibody Research, 111-122 (2005)]에 기재되어 있다. 구체적으로, 표준 배양 배지는 특정 아미노산 (알라닌, 세린, 아스파라긴, 프롤린), 또는 단백질 가수분해물 분획으로 농축되고, 세포자멸사는 3개 내지 6개 아미노산 잔기로 구성된 합성 올리고뉴클레오타이드에 의해 유의하게 억제될 수 있다. 펩타이드는 밀리몰 이상의 농도로 존재한다.
하이브리도마 세포가 성장하는 배양 배지는 본 발명의 항체에 결합하는 단클론 항체의 생산에 대해 분석될 수 있다. 하이브리도마 세포에 의해 생산된 단클론 항체의 결합 특이성은 면역침전 또는 시험관내 결합 분석, 예컨대 방사선면역분석 (RIA) 또는 효소 결합 면역흡착 분석 (ELISA)에 의해 결정될 수 있다. 단클론 항체의 결합 친화성은, 예를 들어 Scatchard 분석에 의해 결정될 수 있다. 하기를 참고한다: 예컨대, Munson 등, Anal. Biochem., 107:220 (1980).
원하는 특이성, 친화성, 및/또는 활성의 항체를 생산하는 하이브리도마 세포가 확인된 후, 클론은 한계 희석 절차에 의해 서브클로닝되고 표준 방법에 의해 성장될 수 있다. 하기를 참고한다: 예컨대, 상기 Goding. 이 목적에 적합한 배양 배지는, 예를 들어, D-MEM 또는 RPMI-1640 배지를 포함한다. 또한, 하이브리도마 세포는 동물에서 복수 (ascite) 종양으로서 생체내에서 성장할 수 있다. 아클론에 의해 분비된 단클론 항체는 종래의 면역글로불린 정제 절차, 예를 들어, 단백질 A-세파로스, 하이드록실아파타이트 크로마토그래피, 겔 전기영동, 투석, 또는 친화성 크로마토그래피에 의해 배양 배지, 복수액, 또는 혈청으로부터 적합하게 분리된다. 하이브리도마 세포로부터 단백질을 단리하기 위한 하나의 절차는 하기에 기재되어 있다: US 제2005/176122호 및 미국특허 제6,919,436호. 상기 방법은 결합 과정에서 친액성 (lyotropic) 염과 같은 최소 염을 사용하는 것 및 바람직하게는 또한 용출 과정에서 소량의 유기 용매를 사용하는 것을 포함한다.
(iii) 특정 라이브러리 스크리닝 방법
본 발명의 항체는 조합 라이브러리를 사용하여 원하는 활성 또는 활성들을 갖는 항체를 스크리닝함으로써 제조될 수 있다. 예를 들어, 파아지 디스플레이 라이브러리를 생성하고 이러한 라이브러리에 대해 원하는 결합 특징을 갖는 항체를 스크리닝하는 다양한 방법이 당업계에 알려져 있다. 이러한 방법은 일반적으로 하기에 기재되어 있다: Hoogenboom 등, Methods in Molecular Biology 178:1-37 O’Brien 등, ed., Human Press, Totowa, N.J., (2001). 예를 들어, 본 발명의 항체를 생성하는 한 가지 방법은 하기에 기재된 바와 같이 파아지 항체 라이브러리를 사용하는 것이다: Lee 등, J. Mol. Biol., 340(5): 1073-93 (2004).
원칙적으로, 합성 항체 클론은 파아지 코트 단백질에 융합된 항체 가변 영역 (Fv)의 다양한 단편을 나타내는 파아지를 함유하는 파아지 라이브러리를 스크리닝함으로써 선택된다. 이러한 파아지 라이브러리는 원하는 항원에 대해 친화성 크로마토그래피에 의해 패닝 (panning)된다. 원하는 항원에 결합할 수 있는 Fv 단편을 발현하는 클론은 항원에 흡착되어 라이브러리 내의 비-결합 클론으로부터 분리된다. 이후, 결합 클론은 항원으로부터 용리되고, 항원 흡착/용리의 추가의 사이클에 의해 추가로 농축될 수 있다. 본 발명의 임의의 항체는 본 발명의 파아지 클론을 선택하는 적합한 항원 스크리닝 절차를 설계한 후, 본 발명의 파아지 클론으로부터의 Fv 서열 및 하기에 기재된 적합한 불변 영역 (Fc) 서열을 사용하여 전장 항체 클론을 구축함으로써 수득될 수 있다: Kabat 등, Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 1-3: 91-3242, Bethesda Md.(1991).
특정 구현예에서, 항체의 항원-결합 도메인은 경쇄 (VL) 및 중쇄 (VH)로부터 각각 하나의 약 110개 아미노산의 2개의 가변 (V) 영역으로부터 형성되고, 둘 모두는 3개의 초가변 루프 (HVR) 또는 상보성-결정 영역 (CDR)을 제시한다. 하기에 기재된 바와 같이, 가변 도메인은 VH 및 VL이 짧은 가요성 펩타이드를 통해 공유 결합된 단일-사슬 Fv (scFv) 단편으로서, 또는 이들이 불변 도메인에 각각 융합되어 비공유적으로 상호작용하는 Fab 단편으로서 파아지 상에서 기능적으로 디스플레이될 수 있다: Winter 등, Ann. Rev. Immunol., 12:433-455 (1994). 본원에 사용된 바와 같이, scFv를 코딩하는 파아지 클론 및 Fab를 코딩하는 파아지 클론은 종합하여 “Fv 파아지 클론” 또는 “Fv 클론”으로 지칭된다
VH 및 VL 유전자의 레퍼토리는 중합효소 연쇄 반응 (PCR)에 의해 별개로 클로닝되고 파아지 라이브러리에서 무작위로 재조합된 다음, 하기에 기재된 바와 같이 항원-결합 클론이 탐색될 수 있다: Winter 등, Ann. Rev. Immunol., 12:433-455 (1994). 면역화된 공급원으로부터의 라이브러리는 하이브리도마를 제조할 필요없이 면역원에 대한 고친화성 항체를 제공한다. 택일적으로, 순수한 레퍼토리는 하기에 기재된 바와 같이 임의의 면역화 없이 다양한 비-자기 및 또한 자기 항원에 인간 항체의 단일 공급원을 제공하도록 클로닝될 수 있다: Griffiths 등, EMBO J, 12:725-734 (1993). 마지막으로, 줄기 세포로부터 재배열되지 않은 V-유전자 분절을 클로닝하고, 무작위 서열을 함유하는 PCR 프라이머를 사용하여 고도의 가변적인 CDR3 영역을 코딩하고 하기에 기재된 바와 같이 시험관내 재배열을 달성함으로써 순수한 라이브러리가 또한 합성적으로 제조될 수 있다: Hoogenboom 및 Winter, J. Mol. Biol., 227:381-388 (1992).
특정 구현예에서, 사상 (filamentous) 파아지는 마이너 코트 단백질 pIII에의 융합에 의해 항체 단편을 디스플레이하는데 사용된다. 상기 항체 단편은, 예컨대 하기에 기재된 바와 같이, VH 및 VL 도메인이 가요성 폴리펩타이드 스페이서에 의해 동일한 폴리펩타이드 사슬에 연결된 단일 사슬 Fv 단편으로서: Marks 등, J. Mol. Biol., 222:581-597 (1991), 또는 예컨대 하기에 기재된 바와 같이, 하나의 사슬은 pIII에 융합되고 다른 사슬은 박테리아 숙주 세포 주변세포질 내로 분비되는 (여기서, 야생형 코트 단백질의 일부를 대체함으로서 Fab-코트 단백질 구조의 조립이 파아지 표면 상에 디스플레이됨) Fab 단편으로서 디스플레이될 수 있다: Hoogenboom 등, Nucl. Acids Res., 19:4133-4137 (1991).
일반적으로, 항체 유전자 단편을 코딩하는 핵산은 인간 또는 동물로부터 수확된 면역 세포로부터 수득된다. 항-항원 클론에 우호적인 편견을 가진 라이브러리를 원하는 경우, 대상체는 항체 반응을 생성하는 항원으로 면역화되고, 라이브러리 제작을 위해 비장 세포 및/또는 순환하는 B 세포 다른 말초 혈액 림프구 (PBL)가 회수된다. 일 구현예에서, 항-항원 클론에 우호적인 편견을 가진 인간 항체 유전자 단편 라이브러리는 기능적 인간 면역글로불린 유전자 집합체를 갖는 (그리고 기능적 내인성 항체 생산 시스템이 결여된) 형질전환 마우스에서 항-항원 항체 반응을 생성하여 항원 면역화가 항원에 대한 인간 항체를 생산하는 B 세포를 생성함으로써 수득된다. 인간 항체-생산 형질전환 마우스의 생성은 하기에 기재되어 있다.
항-항원 반응성 세포 집단에 대한 추가 농축은 항원-특이적 막 결합된 항체를 발현하는 B 세포를 단리시키는 적합한 스크리닝 절차를 사용하여 수득될 수 있으며, 예컨대, 항원 친화성 크로마토그래피를 사용한 세포 분리 또는 세포의 형광색소 표지 항원에의 흡착 후 유세포 분리 (FACS)에 의해 수득될 수 있다.
택일적으로, 면역화되지 않은 공여자로부터의 비장 세포 및/또는 B 세포 또는 다른 PBL의 사용은 가능한 항체 레퍼토리를 더 잘 나타내고, 또한 항원이 항원성이 아닌 임의의 동물 (인간 또는 비-인간) 종을 사용한 항체 라이브러리의 구축을 허용한다. 시험관내 항체 유전자 제작을 포함하는 라이브러리의 경우, 재배열되지 않은 항체 유전자 분절을 코딩하는 핵산을 제공하기 위해 줄기 세포가 대상체로부터 수확된다. 본 발명의 면역 세포는 다양한 동물 종, 예컨대 인간, 마우스, 랫트, 토끼목, 루프린(luprine), 개, 고양이, 돼지, 소, 말, 및 조류 종 등으로부터 얻을 수 있다.
항체 가변 유전자 분절 (VH 및 VL 분절 포함)을 코딩하는 핵산은 본 발명의 세포로부터 회수되고 증폭된다. 재배열된 VH 및 VL 유전자 라이브러리의 경우, 원하는 DNA는 하기에 기재된 바와 같이 림프구로부터 게놈 DNA 또는 mRNA를 단리한 후, 재배열된 VH 및 VL 유전자의 5’ 및 3’ 말단에 일치하는 프라이머를 사용하여 중합효소 연쇄 반응 (PCR)을 수행함으로써 얻을 수 있고: Orlandi 등, Proc. Natl. Acad. Sci. (USA), 86:3833-3837 (1989), 이로써 발현을 위한 다양한 V 유전자 레퍼토리를 만든다. V 유전자는 하기에 기재된 바와 같이 성숙한 V-도메인을 코딩하는 엑손의 5’ 말단에서 역방향 프라이머 및 J-분절 내에 기반한 전방향 프라이머를 사용하여 cDNA 및 게놈 DNA로부터 증폭될 수 있다: Orlandi 등 (1989) 및 in Ward 등, Nature, 341:544-546 (1989). 그러나, cDNA로부터의 증폭을 위해, 역방향 프라이머는 하기에 기재된 바와 같이 리더 엑손에 기반할 수 있고: Jones 등, Biotechnol. , 9:88-89 (1991), 전방향 프라이머는 하기에 기재된 바와 같이 불변 영역 내에 기반할 수 있다: Sastry 등, Proc. Natl. Acad. Sci. (USA), 86:5728-5732 (1989). 상보성을 최대화하기 위해, 하기에 기재된 바와 같이 프라이머 내에 축퇴성이 혼입될 수 있다: Orlandi 등 (1989) 또는 Sastry 등 (1989). 특정 구현예에서, 라이브러리 다양성은, 예컨대 하기의 방법에 기재된 바와 같이, 면역 세포 핵산 샘플에 존재하는 모든 이용가능한 VH 및 VL 배열을 증폭하기 위해 각 V-유전자 패밀리에 표적화된 PCR 프라이머를 사용함으로써 최대화된다: Marks 등, J. Mol. Biol., 222:581-597 (1991) 또는 Orum 등, Nucleic Acids Res., 21:4491-4498 (1993). 증폭된 DNA를 발현 벡터 내로 클로닝하기 위해, 하기에 기재된 바와 같이 드문 제한 부위가 하나의 말단에서 태그로서 PCR 프라이머 내에 도입될 수 있거나: Orlandi 등 (1989), 또는 하기에 기재된 바와 같이 태깅된 프라이머를 사용하여 추가의 PCR 증폭에 의해 도입될 수 있다: Clackson 등, Nature, 352:624-628 (1991).
합성적으로 재배열된 V 유전자의 레퍼토리는 시험관내에서 V 유전자 분절로부터 유래될 수 있다. 인간 VH-유전자 분절 대부분은 클로닝되었고 시퀀싱되었으며 (하기에 보고됨: Tomlinson 등, J. Mol. Biol., 227:776-798 (1992)), 맵핑되었고 (하기에 보고됨: Matsuda 등, Nature Genet., 3:88-94 (1993); 이러한 클로닝된 분절 (H1 및 H2 루프의 모든 주요 형태를 포함함)은 하기에 기재된 바와 같이 다양한 서열 및 길이의 H3 루프를 코딩하는 PCR 프라이머를 사용하여 다양한 VH 유전자 레퍼토리를 생성하는데 사용될 수 있다: Hoogenboom 및 Winter, J. Mol. Biol., 227:381-388 (1992). VH 레퍼토리는 또한, 하기에 기재된 바와 같이, 단일 길이의 긴 H3 루프에 초점을 맞춘 모든 서열 다양성을 이용하여 제조될 수 있다: Barbas 등, Proc. Natl. Acad. Sci. USA, 89:4457-4461 (1992). 인간 Vκ 및 Vλ 분절은 클로닝 및 시퀀싱되었고 (하기에 보고됨: Williams and Winter, Eur. J. Immunol., 23:1456-1461 (1993)), 합성 경쇄 레퍼토리를 제조하는데 사용될 수 있다. 다양한 VH 및 VL 접힘, 및 L3 및 H3 길이에 기초한 합성 V 유전자 레퍼토리는 상당한 구조적 다양성의 항체를 코딩할 것이다. V-유전자를 코딩하는 DNA의 증폭 후, 생식계열 V-유전자 분절은 하기의 방법에 따라 시험관내에서 재배열될 수 있다: Hoogenboom 및 Winter, J. Mol. Biol., 227:381-388 (1992).
항체 단편의 레퍼토리는 VH 및 VL 유전자 레퍼토리를 몇 가지 방법으로 함께 조합함으로써 제작될 수 있다. 각 레퍼토리는 상이한 벡터에서 생성될 수 있고, 상기 벡터는, 예컨대 하기에 기재된 바와 같이 시험관내에서 재조합되거나: Hogrefe 등, Gene, 128:119-126 (1993), 또는, 조합 감염, 예컨대 하기에 기재된 바와 같은 loxP 시스템에 의해 생체내에서 재조합된다: Waterhouse 등, Nucl. Acids Res., 21:2265-2266 (1993). 생체내 재조합 접근법은 E. 콜리 형질전환 효율에 의해 정해진 라이브러리 크기 한계를 극복하기 위해 Fab 단편의 2쇄 특성을 이용한다. 순수한 VH 및 VL 레퍼토리는 개별적으로, 하나는 파아지미지 내에 클로닝되고, 다른 하나는 파아지 벡터 내로 클로닝된다. 그후, 2개의 라이브러리는 파아지미드-함유 박테리아의 파아지 감염에 의해 조합되어, 각 세포는 상이한 조합을 함유하고 라이브러리 크기는 존재하는 세포의 수 (약 1012 클론)에 의해서만 제한된다. 두 벡터는 생체내 재조합 신호를 함유하고 있어서, VH 및 VL 유전자는 단일 레플리콘 상에서 재조합되고 파아지 비리온 내로 함께 패키징된다. 이러한 거대 라이브러리는 양호한 친화성 (약 10-8 M의 Kd -1)의 다수의 다양한 항체를 제공한다.
택일적으로, 레퍼토리는, 예컨대 하기에 기재된 바와 같이, 동일한 벡터 내로 순차적으로 클로닝될 수 있거나: Barbas 등, Proc. Natl. Acad. Sci. USA, 88:7978-7982 (1991), 또는, 예컨대 하기에 기재된 바와 같이 PCR에 의해 함께 조립된 다음 클로닝될 수 있다: Clackson 등, Nature, 352:624-628 (1991). PCR 조립은 또한 VH 및 VL DNA를 가요성 펩타이드 스페이서를 코딩하는 DNA와 결합시켜 단일 사슬 Fv (scFv) 레퍼토리를 형성하는데 사용될 수 있다. 또 다른 기술에서, 하기에 기재된 바와 같이 “세포내 PCR 조립”이 PCR에 의해 림프구 내에서 VH 및 VL 유전자를 결합시킨 다음 연결된 유전자의 레퍼토리를 클로닝하는데 사용된다: Embleton 등, Nucl. Acids Res., 20:3831-3837 (1992).
순수한 라이브러리 (천연 또는 합성)에 의해 생산된 항체는 중간 친화성 (약 106 내지 107 M-1의 Kd -1)일 수 있지만, 친화성 성숙은 하기에 기재된 바와 같이 또한 2차 라이브러리를 제작하고 이로부터 재선택에 의해 시험관내에서 모방될 수 있다: Winter 등 (1994), 상기. 예를 들어, 돌연변이가 하기의 방법에서 오류 유발 중합효소를 사용하여 시험관내에서 무작위로 도입될 수 있다 (Leung 등, Technique 1:11-15 (1989)에 보고됨): Hawkins 등, J. Mol. Biol., 226:889-896 (1992) 또는 Gram 등, Proc. Natl. Acad. Sci USA, 89:3576-3580 (1992). 또한, 친화성 성숙은, 예컨대 선택된 개별 Fv 클론에서 관심있는 CDR에 걸쳐 있는 무작위 서열을 갖는 프라이머를 사용한 PCR을 사용하여 하나 이상의 CDR을 무작위로 돌연변이시키고, 더 높은 친화성 클론을 스크리닝함으로써 수행될 수 있다. WO 제9607754호 (하기에 공개됨: 1996년 3월 14일)는 면역글로불린 경쇄의 상보성 결정 영역에서 돌연변이를 유발하여 경쇄 유전자의 라이브러리를 생성하는 방법을 기술하였다. 또 다른 효과적인 접근법은, 하기에 기재된 바와 같이, 파아지 디스플레이에 의해 선택된 VH 또는 VL 도메인을 면역화되지 않은 공여자로부터 얻은 자연발생 V 도메인 변이체의 레퍼토리와 재조합하고 몇 회의 사슬 재셔플링에서 더 높은 친화성을 스크리닝하는 것이다: Marks 등, Biotechnol. , 10:779-783 (1992). 이 기술은 약 10-9 M 이하의 친화성을 갖는 항체 및 항체 단편의 생산을 가능하게 한다.
라이브러리의 스크리닝은 당업계에 알려진 다양한 기술에 의해 달성될 수 있다. 예를 들어, 항원은 흡착 플레이트의 웰을 코딩하는데 사용되거나, 흡착 플레이트에 고정된 숙주 세포 상에서 발현되거나 또는 세포 분류에 사용되거나, 또는 스트렙타비딘-코팅된 비드로 포획하기 위해 바이오틴에 접합되거나, 또는 파아지 디스플레이 라이브러리를 패닝하는 임의의 다른 방법에서 사용될 수 있다.
파아지 라이브러리 샘플은 파아지 입자의 적어도 일부를 흡착제와 결합시키는데 적합한 조건하에 고정화된 항원과 접촉된다. 일반적으로, pH, 이온 강도, 온도 등을 포함하는 조건은 생리학적 조건을 모방하도록 선택된다. 고상에 결합된 파아지는 세척된 다음, 예컨대 하기에 기재된 바와 같이 산에 의해: Barbas 등, Proc. Natl. Acad. Sci USA, 88:7978-7982 (1991), 또는 하기에 기재된 바와 같이 알칼리에 의해: Marks 등, J. Mol. Biol., 222:581-597 (1991), 또는 항원 경쟁에 의해, 예컨대, 하기의 항원 경쟁 방법과 유사한 절차에서 용출된다: Clackson 등, Nature, 352:624-628 (1991). 파아지는 1회 선택으로 20-1,000배 농축될 수 있다. 또한, 농축된 파아지는 박테리아 배양에서 성장되고 추가 횟수의 선택을 거칠 수 있다.
선택 효율은 세척 동안의 해리 동력학, 및 단일 파아지 상의 다중 항체 단편이 항원과 동시에 결합할 수 있는지 여부를 포함하는 많은 인자에 따라 달라진다. 빠른 해리 동력학 (및 약한 결합 친화성)을 갖는 항체는 짧은 세척, 다가 파아지 디스플레이 및 고상에서 항원의 높은 코팅 밀도의 사용에 의해 유지될 수 있다. 높은 밀도는 다가 상호작용을 통해 파아지를 안정화시킬 뿐만 아니라, 해리된 파아지의 재결합을 촉진한다. 느린 해리 동력학 (및 양호한 결합 친화성)을 갖는 항체의 선택은 하기에 기재된 바와 같이 긴 세척 및 1가 파아지 디스플레이: Bass 등, Proteins, 8:309-314 (1990) 및 WO 제92/09690호, 및 하기에 기재된 바와 같이 항원의 낮은 코팅 밀도의 사용에 의해 촉진될 수 있다: Marks 등, Biotechnol. , 10:779-783 (1992).
항원에 대해, 상이한 친화성의 파아지 항체, 심지어 약간 상이한 친화성을 갖는 파아지 항체 사이에서 선택할 수 있다. 그러나, 선택된 항체의 무작위 돌연변이 (예컨대 일부 친화성 성숙 기술에서 수행된 바와 같음)는, 대부분은 항원에 결합하고 몇 가지는 더 높은 친화성을 갖는, 많은 돌연변이체를 발생시킬 가능성이 높다. 제한 항원을 사용하여, 희귀한 고친화성 파아지가 경쟁될 수 있다. 모든 더 높은 친화성 돌연변이체를 유지시키기 위해, 파아지는 과량의 바이오티닐화된 항체이지만 항원에 대한 목표 몰 친화성 상수보다 낮은 몰 농도의 바이오티닐화된 항원과 인큐베이션될 수 있다. 이후, 고친화성-결합 파아지는 스트렙타비딘-코팅된 상자성 비드에 의해 포획될 수 있다. 이러한 “평형 포획”은 더 낮은 친화성을 가진 과량의 파아지로부터 2배 정도의 더 높은 친화성을 갖는 돌연변이체 클론을 단리하게 해 주는 민감도로 결합하는 친화성에 따라 항체를 선택할 수 있게 해준다. 고상에 결합된 파아지를 세척하는데 사용된 조건은 또한 해리 동력학에 기초하여 구별하도록 조작될 수 있다.
항-항원 클론은 활성에 기초하여 선택될 수 있다특정 구현예에서, 본 발명은 자연적으로 항원을 발현하는 살아있는 세포에 결합하거나 또는 자유 부유 항원 또는 다른 세포 구조에 부착된 항원에 결합하는 항-항원 항체를 제공한다. 이러한 항-항원 항체에 상응하는 Fv 클론은 (1) 상기 기재된 바와 같은 파아지 라이브러리로부터 항-항원 클론을 단리시키고, 선택적으로 상기 단리된 파아지 클론의 집단을 적합한 박테리아 숙주에서 성장시켜 상기 집단을 증폭시키는 단계; (2) 각각 차단 및 비-차단 활성이 요구되는 항원 및 제2 단백질을 선택하는 단계; (3) 항-항원 파아지 클론을 고정화된 항원에 흡착시키는 단계; (4) 과량의 제2 단백질을 사용하여 제2 단백질의 결합 결정기와 중첩되거나 공유되는 항원-결합 결정기를 인식하는 임의의 원하지 않는 클론을 용출시키는 단계; 및 (5) 단계 (4) 후에 흡착된 상태로 있는 클론을 용출시키는 단계에 의해 선택될 수 있다. 선택적으로, 원하는 차단/비-차단 특성을 갖는 클론은 본원에 기재된 선택 절차를 1회 이상 반복함으로써 더 농축될 수 있다.
본 발명의 하이브리도마-유래 단클론 항체 또는 파아지 디스플레이 Fv 클론을 코딩하는 DNA는 종래의 절차를 사용하여 (예컨대 하이브리도마 또는 파아지 DNA 주형으로부터 관심있는 중쇄 및 경쇄 코딩 영역을 특이적으로 증폭하도록 설계된 올리고뉴클레오타이드 프라이머를 사용하여) 쉽게 단리되고 시퀀싱된다. 단리되면, DNA는 발현 벡터에 위치할 수 있고, 이후 상기 벡터는 면역글로불린 단백질을 생산하지 않는 E. 콜리 세포, 시미안 COS 세포, 차이니즈 햄스터 난소 (CHO) 세포, 또는 골수종 세포와 같은 숙주 세포 내로 형질감염되어, 재조합 숙주 세포에서 원하는 단클론 항체를 합성한다. 항체-코딩 DNA의 박테리아 내 재조합 발현에 관한 검토 논문은 하기를 포함한다: Skerra 등, Curr. Opinion in Immunol., 5:256 (1993) 및 Pluckthun, Immunol. Revs, 130:151 (1992).
본 발명의 Fv 클론을 코딩하는 DNA는 중쇄 및/또는 경쇄 불변 영역을 코딩하는 공지된 DNA 서열 (예컨대 적절한 DNA 서열은 상기 Kabat 등으로부터 수득될 수 있음)과 조합되어 전체 또는 부분 길이 중쇄 및/또는 경쇄를 형성할 수 있다. IgG, IgM, IgA, IgD, 및 IgE 불변 영역을 포함하는 임의의 아이소타입의 불변 영역이 이러한 목적을 위해 사용될 수 있으며, 이러한 불변 영역은 임의의 인간 또는 동물 종으로부터 수득될 수 있음이 이해될 것이다. 하나의 동물 (예컨대, 인간) 종의 가변 도메인 DNA로부터 유래된 다음 또 다른 동물 종의 불변 영역 DNA에 융합되어 “하이브리드” 전장 중쇄 및/또는 경쇄를 위한 코딩 서열(들)을 형성하는 Fv 클론은 본원에 사용된 바와 같은 “키메라성” 및 “하이브리드” 항체의 정의에 포함된다. 특정 구현예에서, 인간 가변 DNA로부터 유래된 Fv 클론은 인간 불변 영역 DNA에 융합되어 전체- 또는 부분-길이 인간 중쇄 및/또는 경쇄를 위한 코딩 서열(들)을 형성한다.
본 발명의 하이브리도마로부터 유래된 항-항원 항체를 코딩하는 DNA는 또한, 예를 들어, 하이브리도마 클론으로부터 유래된 상동성 쥣과 서열 대신에 인간 중쇄- 및 경쇄 불변 도메인에 대한 코딩 서열을 치환함으로써 변형될 수 있다 (예컨대 하기의 방법에서와 같음: Morrison 등, Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). 하이브리도마- 또는 Fv 클론-유래 항체 또는 단편을 코딩하는 DNA는 면역글로불린 코딩 서열을 비-면역글로불린 폴리펩타이드에 대한 코딩 서열의 전부 또는 일부와 공유결합함으로써 추가로 변형될 수 있다. 이러한 방식으로, Fv 클론 또는 본 발명의 하이브리도마 클론-유래 항체의 결합 특이성을 갖는 “키메라성” 또는 “하이브리드” 항체가 제조된다.
(iv) 인간화 및 인간 항체
비-인간 항체를 인간화하는 다양한 방법이 당업계에 알려져 있다. 예를 들어, 인간화 항체는 비-인간 공급원으로부터 인간화 항체 내로 도입된 하나 이상의 아미노산 잔기를 갖는다. 이러한 비-인간 아미노산 잔기는 종종 “수입” 잔기로 불리며, 이는 전형적으로 “수입” 가변 도메인으로부터 얻어진다. 인간화는 하기에 의해 하기의 방법에 따라 본질적으로 수행될 수 있다: Winter 및 동료 (Jones 등, Nature, 321:522-525 (1986); Riechmann 등, Nature, 332:323-327 (1988); Verhoeyen 등, Science, 239:1534-1536 (1988)), 설치류 CDR 또는 CDR 서열을 인간 항체의 상응하는 서열로 치환함으로써. 따라서, 이러한 “인간화” 항체는 키메라성 항체이며 (미국특허 제4,816,567호), 여기서 온전한 인간 가변 도메인보다 실질적으로 적은 부분이 비-인간 종으로부터의 상응하는 서열에 의해 치환되었다. 실제로, 인간화 항체는 전형적으로 일부 CDR 잔기 및 아마도 일부 FR 잔기가 설치류 항체의 유사 부위의 잔기에 의해 치환된 인간 항체이다.
인간화 항체를 제조하는데 사용되는 인간 가변 도메인 (경쇄 및 중쇄 모두)의 선택은 항원성을 감소시키는데 매우 중요하다. 소위 “최적-적합” 방법에 따르면, 설치류 항체의 가변 도메인의 서열은 알려진 인간 가변-도메인 서열의 전체 라이브러리에 대해 스크리닝된다. 이후, 설치류의 것과 가장 가까운 인간 서열은 인간화 항체에 대한 인간 프레임워크 (FR)로서 받아들여진다 (Sims 등, J. Immunol., 151:2296 (1993); Chothia 등, J. Mol. Biol., 196:901 (1987)). 또 다른 방법은 경쇄 또는 중쇄의 특정 하위그룹의 모든 인간 항체의 공통 서열로부터 유래된 특정 프레임워크를 사용한다. 동일한 프레임워크가 몇 개의 상이한 인간화 항체에 사용될 수 있다 (Carter 등, Proc. Natl. Acad Sci. USA, 89:4285 (1992); Presta 등, J. Immunol., 151:2623 (1993)).
항체가 항원에 대해 높은 친화성 및 다른 유리한 생물학적 특성을 유지하면서 인간화되는 것이 더욱 중요하다. 이러한 목표를 달성하기 위해, 본 방법의 일 구현예에 따르면, 인간화 항체는 모 서열 및 인간화 서열의 3차원 모델을 사용하여 모 서열 및 다양한 개념적 인간화 생성물을 분석하는 과정에 의해 제조된다. 3차원 면역글로불린 모델이 일반적으로 이용가능하며, 이는 당업자에게 익숙하다. 선택된 후보 면역글로불린 서열의 가능한 3차원 형태 구조를 나타내고 표시하는 컴퓨터 프로그램이 이용가능하다. 이러한 표시의 검사는 후보 면역글로불린 서열의 기능에서 잔기들의 가능한 역할의 분석, 즉 후보 면역글로불린이 그의 항원에 결합하는 능력에 영향을 미치는 잔기들의 분석을 허용한다. 이러한 방식으로, FR 잔기는 수여자 및 수입 서열로부터 선택되고 조합되어, 원하는 항체 특징, 예컨대 표적 항원(들)에 대한 증가된 친화성이 달성될 수 있다. 일반적으로, 초가변 영역 잔기는 직접적으로 그리고 가장 실질적으로 항원 결합에 영향을 미치는데 관여한다.
본 발명의 인간 항체는 인간-유래 파아지 디스플레이 라이브러리로부터 선택된 Fv 클론 가변 도메인 서열(들)을 상기 기재된 바와 같이 공지된 인간 불변 도메인 서열(들)과 조합함으로써 제작될 수 있다. 택일적으로, 본 발명의 인간 단클론 항체는 하이브리도마 방법에 의해 제조될 수 있다. 인간 단클론 항체의 생산을 위한 인간 골수종 및 마우스-인간 이종골수종 세포주는 하기에 기재되었다: 예를 들어, Kozbor J. Immunol., 133:3001 (1984); Brodeur 등, Monoclonal Antibody Production Techniques and Applications, (Marcel Dekker, Inc., New York, pp. 51-63 (1987); 및 Boerner 등, J. Immunol., 147:86 (1991).
면역화시 내인성 면역글로불린 생산의 부재하에 인간 항체의 완전한 레퍼토리를 생산할 수 있는 형질전환 동물 (예컨대, 마우스)을 생산할 수 있다. 예를 들어, 키메라성 및 생식계열 돌연변이체 마우스에서 항체 중쇄 결합 영역 (JH) 유전자의 동형접합 결실은 내인성 항체 생산의 완전한 억제를 초래한다고 기술되었다. 이러한 생식계열 돌연변이체 마우스에서 인간 생식계열 면역글로불린 유전자 어레이의 전달은 항원 투여시 인간 항체를 생산할 것이다. 하기를 참고한다: 예컨대, Jakobovits 등, Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits 등, Nature, 362:255-258 (1993); Bruggermann 등, Year in Immuno., 7:33 (1993); 및 Duchosal 등 Nature 355:258 (1992).
유전자 셔플링은 또한 비-인간, 예컨대 설치류 항체로부터 인간 항체를 유도하는데 사용될 수 있고, 여기서 인간 항체는 출발하는 비-인간 항체와 유사한 친화성 및 특이성을 갖는다. “에피토프 각인(imprinting)”으로도 불리는 이 방법에 따르면, 본원에 기재된 파아지 디스플레이 기술에 의해 수득된 비-인간 항체 단편의 중쇄 또는 경쇄 가변 영역은 인간 V 도메인 유전자의 레퍼토리로 대체되어, 비-인간 사슬/인간 사슬 scFv 또는 Fab 키메라의 집단을 생성한다. 항원을 이용한 선택은 비-인간 사슬/인간 사슬 키메라성 scFv 또는 Fab를 단리시키고, 여기서 인간 사슬은 일차 파아지 디스플레이 클론 내의 상응하는 비-인간 사슬의 제거시에 파괴된 항원 결합 부위를 회복시키며, 즉 에피토프는 인간 사슬 파트너의 선택을 지배 (각인)한다. 나머지 비-인간 사슬을 대체하기 위해 상기 과정이 반복되면, 인간 항체가 수득된다 (참고: PCT WO 제93/06213호, 1993년 4월1일에 공개됨). CDR 접목에 의한 비-인간 항체의 전통적인 인간화와 달리, 이 기술은 비-인간 기원의 FR 또는 CDR 잔기가 없는 완전 인간 항체를 제공한다.
(v) 항체 단편
항체 단편은 효소 소화와 같은 전통적인 수단에 의해, 또는 재조합 기술에 의해 생성될 수 있다. 특정한 경우, 전체 항체보다 항체 단편을 사용하는 것이 유리하다. 더 작은 크기의 단편은 빠르게 제거되며, 이는 고체 종양에 대한 개선된 접근으로 이어질 수 있다. 특정 항체 단편의 검토를 위해, 하기를 참고한다: Hudson 등 Nat. Med. 9:129-134 (2003).
항체 단편을 생산하기 위한 다양한 기술이 개발되었다. 전통적으로, 이들 단편은 온전한 항체의 단백질분해 소화를 통해 유래되었다 (참고: 예컨대, Morimoto 등, Journal of Biochemical and Biophysical Methods 24:107-117 (1992); 및 Brennan 등, Science, 229:81 (1985)). 그러나, 이러한 단편은 현재 재조합 숙주 세포에 의해 직접 생산될 수 있다. Fab, Fv 및 ScFv 항체 단편은 모두 E. 콜리에서 발현되거나 이로부터 분비될 수 있어서, 이러한 단편을 다량으로 쉽게 생산할 수 있다. 항체 단편은 상기 논의된 항체 파아지 라이브러리로부터 단리될 수 있다. 택일적으로, Fab’-SH 단편은 E. 콜리로부터 직접 회수될 수 있고 화학적으로 커플링되어 F(ab’)2 단편을 형성할 수 있다 (Carter 등, Bio/Technology 10:163-167 (1992)). 또 다른 접근법에 따르면, F(ab’) 2 단편은 재조합 숙주 세포 배양으로부터 직접 단리될 수 있다. 구제 (salvage) 수용체 결합 에피토프 잔기를 포함하는 생체내 반감기가 증가된 Fab 및 F(ab’) 2 단편이 하기에 기재되어 있다: 미국특허 제5,869,046호. 항체 단편을 생산하기 위한 다른 기술은 당업자에게 명백할 것이다. 특정 구현예에서, 항체는 단일 사슬 Fv 단편 (scFv)이다. 하기를 참고한다: WO 제93/16185호; 미국특허 제5,571,894호; 및 제5,587,458호. Fv 및 scFv는 불변 영역이 없는 온전한 결합 부위를 갖는 유일한 종이므로; 이들은 생체내 사용 동안 감소된 비특이적 결합에 적합할 수 있다. scFv 융합 단백질은 scFv의 아미노 또는 카복시 말단에서 효과기 단백질의 융합을 생성하도록 제작될 수 있다. 하기를 참고한다: Antibody Engineering, ed. Borrebaeck, 상기. 항체 단편은 또한 하기에 기재된 바와 같은 “선형 항체”일 수 있다: 예컨대, 미국특허 제5,641,870호. 이러한 선형 항체는 단일특이적 또는 이중특이적일 수 있다.
(vi) 다중특이적 항체
다중특이적 항체는 적어도 2개의 상이한 에피토프에 대한 결합 특이성을 가지며, 여기서 에피토프는 일반적으로 상이한 항원으로부터 유래된다. 이러한 분자는 통상 2개의 상이한 에피토프에만 결합할 것이지만 (즉, 이중특이적 항체, BsAb), 삼중특이적 항체와 같이 추가적인 특이성을 갖는 항체가 본원에 사용될 때 이 표현에 포함된다. 이중특이적 항체는 전장 항체 또는 항체 단편으로서 제조될 수 있다 (예컨대 F(ab’)2 이중특이적 항체).
이중특이적 항체를 제조하는 방법은 당업계에 알려져 있다. 전장 이중특이적 항체의 전통적인 생산은 2개의 면역글로불린 중쇄-경쇄 쌍의 공동발현에 기초하며, 여기서 2개의 사슬은 상이한 특이성을 갖는다 (Millstein 등, Nature, 305:537-539 (1983)). 면역글로불린 중쇄 및 경쇄의 무작위 배열 때문에, 이들 하이브리도마 (쿼드로마)는 10개의 상이한 항체 분자의 잠재적인 혼합물을 생성하며, 이들 중 오직 하나만 정확한 이중특이적 구조를 갖는다. 친화성 크로마토그래피 단계에 의해 일반적으로 수행되는 정확한 분자의 정제는 다소 번거로우며, 생성물 수율은 낮다. 유사한 절차가 하기에 기재되어 있다: WO 제93/08829호, 및 Traunecker 등, EMBO J., 10:3655-3659 (1991).
상이한 접근법에 따르면, 원하는 결합 특이성을 갖는 항체 가변 도메인 (항체-항원 결합 부위)은 면역글로불린 불변 도메인 서열에 융합된다. 융합은 바람직하게는 힌지, CH2, 및 CH3 영역 중 적어도 일부를 포함하는 면역글로불린 중쇄 불변 도메인과 함께 이루어진다. 적어도 하나의 융합물에 존재하는, 경쇄 결합에 필요한 부위를 함유하는 제1 중쇄 불변 영역 (CH1)을 갖는 것이 전형적이다. 면역글로불린 중쇄 융합 및, 원하는 경우, 면역글로불린 경쇄를 코딩하는 DNA는 별개의 발현 벡터에 삽입되고, 적합한 숙주 유기체에 공동 형질감염된다. 이것은 제작에 사용된 동일하지 않은 비율의 3개의 폴리펩타이드 사슬이 최적 수율을 제공할 때의 구현에서 3개의 폴리펩타이드 단편의 상호 비율을 조정하는데 큰 유연성을 제공한다. 그러나, 동일한 비율의 적어도 2개의 폴리펩타이드 사슬의 발현이 높은 수율을 초래하는 경우 또는 비율이 특별한 의미가 없는 경우, 하나의 발현 벡터에 2개 또는 모든 3개의 폴리펩타이드 사슬에 대한 코딩 서열을 삽입할 수 있다.
이 접근법의 일 구현예에서, 이중특이적 항체는 하나의 아암 (arm)에서 제1 결합 특이성을 갖는 하이브리드 면역글로불린 중쇄, 및 다른 아암에서 하이브리드 면역글로불린 중쇄-경쇄 쌍 (제2 결합 특이성 제공)으로 구성된다. 이중특이적 분자 중 오직 하나의 절반 내에 면역글로불린 경쇄가 존재하는 것이 용이한 분리 방법을 제공하므로, 이러한 비대칭 구조는 원하지 않는 면역글로불린 사슬 조합으로부터 원하는 이중특이적 화합물의 분리를 용이하게 하는 것으로 밝혀졌다. 이러한 접근법은 WO 제94/04690호에 개시되어 있다. 이중특이적 항체를 생성하는 추가의 세부사항을 위해, 하기를 참고한다: 예를 들어, Suresh 등, Methods in Enzymology, 121:210 (1986).
WO 제96/27011호에 기재된 또 다른 접근법에 따르면, 한 쌍의 항체 분자 사이의 계면은 재조합 세포 배양으로부터 회수된 이종이량체의 백분율을 최대화하도록 조작될 수 있다. 하나의 계면은 항체 불변 도메인의 CH 3 도메인 중 적어도 일부를 포함한다. 이 방법에서, 제1 항체 분자의 계면으로부터의 하나 이상의 작은 아미노산 측쇄는 더 큰 측쇄 (예컨대 티로신 또는 트립토판)로 대체된다. 큰 아미노산 측쇄를 더 작은 측쇄 (예컨대 알라닌 또는 트레오닌)로 대체함으로써 제2 항체 분자의 계면 상에 큰 측쇄(들)와 동일한 또는 유사한 크기의 보상성 “공동 (cavity)”이 생성된다. 이것은 동종이량체와 같은 다른 원하지 않는 최종 생성물에 비해 이종이량체의 수율을 증가시키는 기전을 제공한다.
이중특이적 항체는 교차결합 또는 “이종접합체” 항체를 포함한다. 예를 들어, 이종접합체 내의 항체 중 하나는 아비딘에 결합될 수 있고, 다른 하나는 바이오틴에 결합될 수 있다. 이러한 항체는, 예를 들어, 하기를 위해 제안되었다: 표적 면역 시스템 세포를 원하지 않는 세포에 표적화하기 위해 (미국특허 제4,676,980호), 그리고 HIV 감염을 치료하기 위해 (WO 제91/00360호, WO 제92/200373호, 및 EP 제03089호). 이종접합체 항체는 임의의 편리한 교차결합 방법을 사용하여 제조될 수 있다. 적합한 교차결합제는 당업계에 널리 알려져 있으며, 많은 교차결합 기술과 함께, 하기에 개시되어 있다: 미국특허 제4,676,980호.
항체 단편으로부터 이중특이적 항체를 생성하기 위한 기술은 또한 문헌에 기재되었다. 예를 들어, 이중특이적 항체는 화학적 결합을 사용하여 제조될 수 있다. Brennan 등, Science, 229:81 (1985)은 온전한 항체가 단백질분해로 절단되어 F(ab’)2 단편을 생성하는 절차를 기술한다. 이러한 단편은 디티올 복합제 나트륨 아르세나이트의 존재하에 환원되어 인접한 디티올을 안정화시키고 분자간 디설파이드 형성을 방지한다. 이후, 생성된 Fab’ 단편은 티오니트로벤조에이트 (TNB) 유도체로 전환된다. 이후, Fab’-TNB 유도체 중 하나는 머캅토에틸아민을 이용한 환원에 의해 Fab’-티올로 재전환되고, 등몰량의 다른 Fab’-TNB 유도체와 혼합되어 이중특이적 항체를 형성한다. 생성된 이중특이적 항체는 효소의 선택적 고정화를 위한 제제로서 사용될 수 있다.
최근의 진보는 E. 콜리로부터의 Fab’-SH 단편의 직접적인 회수를 용이하게 하였고, 이는 화학적으로 결합되어 이중특이적 항체를 형성할 수 있다. Shalaby 등, J. Exp. Med., 175:217-225 (1992)는 완전 인간화 이중특이적 항체 F(ab’)2 분자의 생산을 기술한다. 각 Fab’ 단편은 E. 콜리로부터 개별적으로 분비되고 시험관내에서 유도 화학적 결합되어 이중특이적 항체를 형성하였다.
재조합 세포 배양으로부터 직접 이중특이적 항체 단편을 제조하고 단리하기 위한 다양한 기술이 또한 기술되었다. 예를 들어, 이중특이적 항체는 류신 지퍼를 사용하여 생산되었다. Kostelny 등, J. Immunol., 148(5): 1547-1553 (1992). Fos 및 Jun 단백질로부터의 류신 지퍼 펩타이드는 유전자 융합에 의해 2개의 상이한 항체의 Fab’ 부분에 연결되었다. 항체 동종이량체는 힌지 영역에서 환원되어 단량체를 형성한 다음 재산화되어 항체 이종이량체를 형성한다. 이 방법은 또한 항체 동종이량체의 생산에 이용될 수 있다. 하기에 기재된 “디아바디” 기술: Hollinger 등, Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)은 이중특이적 항체 단편을 제조하기 위한 대안적인 기전을 제공하였다. 단편은 동일한 사슬 상의 2개의 도메인 사이에 쌍을 형성하게 하기에 너무 짧은 링커에 의해 경쇄 가변 도메인 (VL)에 연결된 중쇄 가변 도메인 (VH)을 포함한다. 따라서, 하나의 단편의 VH 및 VL 도메인은 또 다른 단편의 상보적 VL 및 VH 도메인과 쌍을 형성하게 되어, 2개의 항원-결합 부위를 형성한다. 단일-사슬 Fv (sFv) 이량체를 사용하여 이중특이적 항체 단편을 제조하기 위한 또 다른 전략이 또한 보고되었다. 하기를 참고한다: Gruber 등, J. Immunol, 152:5368 (1994).
2개를 초과하는 원자가를 갖는 항체가 고려된다. 예를 들어, 삼중특이적 항체가 제조될 수 있다. Tuft 등 J. Immunol. 147:60 (1991).
(vii) 단일-도메인 항체
일부 구현예에서, 본 발명의 항체는 단일-도메인 항체이다. 단일-도메인 항체는 항체의 중쇄 가변 도메인의 전부 또는 일부 또는 경쇄 가변 도메인의 전부 또는 일부를 포함하는 단일 폴리펩타이드 사슬이다. 특정 구현예에서, 단일-도메인 항체는 인간 단일-도메인 항체이다 (Domantis, Inc., Waltham, Mass.; 참고: 예컨대, 미국특허 제6,248,516호). 일 구현예에서, 단일-도메인 항체는 항체의 중쇄 가변 도메인의 전부 또는 일부로 구성된다.
(viii) 항체 변이체
일부 구현예에서, 본원에 기재된 항체의 아미노산 서열 변형(들)이 고려된다. 예를 들어, 항체의 결합 친화성 및/또는 다른 생물학적 특성을 개선시키는 것이 바람직할 수 있다. 항체의 아미노산 서열 변이체는 항체를 코딩하는 뉴클레오타이드 서열 내로 적절한 변화를 도입함으로써, 또는 펩타이드 합성에 의해 제조될 수 있다. 이러한 변형은, 예를 들어, 항체의 아미노산 서열 내의 잔기의 결실, 및/또는 삽입 및/또는 치환을 포함한다. 최종 제작물이 원하는 특징을 갖는 한, 최종 제작물에 도달하기 위해 결실, 삽입, 및 치환의 임의의 조합이 이뤄질 수 있다. 아미노산 변경은 서열이 만들어질 때 대상체 항체 아미노산 서열에 도입될 수 있다.
(ix) 항체 유도체
본 발명의 항체는 당업계에 알려지고 쉽게 이용가능한 추가의 비단백질성 모이어티를 함유하도록 추가로 변형될 수 있다. 특정 구현예에서, 항체의 유도체화에 적합한 모이어티는 수용성 중합체이다. 수용성 중합체의 비제한적인 예는, 비제한적으로, 폴리에틸렌 글리콜 (PEG), 에틸렌 글리콜/프로필렌 글리콜의 공중합체, 카복시메틸셀룰로오스, 덱스트란, 폴리비닐 알콜, 폴리비닐 피롤리돈, 폴리-1,3-디옥솔란, 폴리-1,3,6-트리옥산, 에틸렌/말레산 무수물 공중합체, 폴리아미노산 (동종중합체 또는 무작위 공중합체), 및 덱스트란 또는 폴리(n-비닐 피롤리돈)폴리에틸렌 글리콜, 프로프로필렌 글리콜 동종중합체, 프롤리프로필렌 옥사이드/에틸렌 옥사이드 공중합체, 폴리옥시에틸레이티드 폴리올 (예컨대, 글리세롤), 폴리비닐 알콜, 및 이의 혼합물을 포함한다. 폴리에틸렌 글리콜 프로피온알데하이드는 물에서의 그의 안정성으로 인해 제조시 장점을 가질 수 있다. 중합체는 임의의 분자량일 수 있고, 분지되거나 비분지될 수 있다. 항체에 부착된 중합체의 수는 다양할 수 있으며, 하나를 초과하는 중합체가 부착되는 경우, 이들은 동일하거나 상이한 분자일 수 있다. 일반적으로, 유도체화에 사용된 중합체의 수 및/또는 유형은, 비제한적으로, 개선될 항체의 특정 특성 또는 기능, 항체 유도체가 정의된 조건하에 요법에서 사용될지 여부 등을 포함한 고려 사항에 기초하여 결정될 수 있다.
(x) 벡터, 숙주 세포, 및 재조합 방법
항체는 또한 재조합 방법을 사용하여 생산될 수 있다. 항-항원 항체의 재조합 생산을 위해, 항체를 코딩하는 핵산이 단리되고 추가 클로닝 (DNA의 증폭) 또는 발현을 위해 복제가능한 벡터 내로 삽입된다. 항체를 코딩하는 DNA는 종래의 절차를 사용하여 (예컨대, 항체의 중쇄 및 경쇄를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오타이드 프로브를 사용하여) 쉽게 단리되고 시퀀싱될 수 있다. 많은 벡터가 이용가능하다. 벡터 성분은 일반적으로, 비제한적으로, 하기 중 하나 이상을 포함한다: 신호 서열, 복제 원점, 하나 이상의 마커 유전자, 인핸서 요소, 프로모터, 및 전사 종결 서열.
(a) 신호 서열 성분
본원에 기재된 제제 및 조성물 내의 항체는 직접적으로뿐만 아니라 바람직하게는 성숙한 단백질 또는 폴리펩타이드의 N-말단에 있는 특이적 절단 부위를 갖는 신호 서열 또는 다른 폴리펩타이드인 이종 폴리펩타이드와의 융합 폴리펩타이드로서 재조합적으로 생산될 수 있다. 선택된 이종 신호 서열은 바람직하게는 숙주 세포에 의해 인식되고 처리되는 (예컨대, 신호 펩티다아제에 의해 절단되는) 것이다. 천연 항체 신호 서열을 인식 및 처리하지 않는 원핵 숙주 세포의 경우, 신호 서열은, 예를 들어, 알칼리 포스파타아제, 페니실리나제, lpp, 또는 내열성 엔테로톡신 II 리더의 군으로부터 선택된 원핵 신호에 의해 치환된다. 효모 분비의 경우, 천연 신호 서열은 예컨대, 효모 인버타아제 리더, 인자 리더 (사카로마이세스 및 클루이베로마이세스 α-인자 리더 포함), 또는 산 포스파타아제 리더, C. 알비칸스 글루코아밀라아제 리더, 또는 WO 제90/13646호에 기재된 신호에 의해 치환될 수 있다. 포유동물 세포 발현에서, 포유동물 신호 서열뿐만 아니라 바이러스 분비 리더, 예를 들어, 단순 포진 gD 신호가 이용가능하다.
(b) 복제 원점
발현 및 클로닝 벡터 모두는 벡터가 하나 이상의 선택된 숙주 세포에서 복제할 수 있게 하는 핵산 서열을 함유한다. 일반적으로, 클로닝 벡터에서, 이 서열은 벡터가 숙주 염색체 DNA와 독립적으로 복제할 수 있게 하는 서열이며 복제 원점 또는 자율적으로 복제하는 서열을 포함한다. 이러한 서열은 다양한 박테리아, 효모, 및 바이러스에 대해 널리 알려져 있다. 플라스미드 pBR322로부터의 복제 원점은 대부분의 그램 음성 박테리아에 적합하며, 2μ 플라스미드 기원은 효모에 적합하고, 및 다양한 바이러스 복제 원점 (SV40, 폴리오마, 아데노바이러스, VSV 또는 BPV)은 포유동물 세포에서의 클로닝 벡터에 유용하다. 일반적으로, 복제 원점 성분은 포유동물 발현 벡터에 필요하지 않다 (SV40 원점은 전형적으로 단지 초기 프로모터를 함유하기 때문에 사용될 수 있다.
(c) 선택 유전자 성분
발현 및 클로닝 벡터는 선택 마커로도 불리는 선택 유전자를 함유할 수 있다. 전형적인 선택 유전자는 (a) 항생제 또는 다른 독소, 예컨대, 암피실린, 네오마이신, 메토트렉세이트, 또는 테트라사이클린에 내성을 부여하거나, (b) 영양요구성 결핍을 보충하거나, 또는 (c) 복합 배지로부터 이용할 수 없는 중요한 영양소를 공급하는 단백질을 코딩하며, 예컨대, D-알라닌 라세마아제를 코딩하는 유전자이다.
선택 계획의 한 가지 예는 숙주 세포의 성장을 정지시키는 약물을 이용한다. 이종유전자로 성공적으로 형질전환된 세포는 약물 내성을 부여하는 단백질을 생산하여 선택 요법에서 살아남는다. 이러한 우성 선택은 네오마이신, 미코페놀산 및 히그로마이신 약물을 사용한다.
포유동물 세포에 대한 적합한 선택 마커의 또 다른 예는 항체-코딩 핵산을 흡수하는 능력이 있는 세포를 확인할 수 있는 것, 예컨대 DHFR, 글루타민 합성효소 (GS), 티미딘 키나제, 메탈로티오네인-I 및 -II, 바람직하게는 영장류 메탈로티오네인 유전자, 아데노신 데아미나아제, 오르니틴 데카복실라제 등이다.
예를 들어, DHFR 유전자로 형질전환된 세포는 DHFR의 경쟁적 길항제인 메토트렉세이트 (Mtx)를 함유하는 배양 배지에서 형질전환체를 배양함으로써 확인된다. 이러한 조건하에, DHFR 유전자는 임의의 다른 공동-형질전환된 핵산과 함께 증폭된다. 내인성 DHFR 활성이 결핍된 차이니즈 햄스터 난소 (CHO) 세포주 (예컨대, ATCC CRL-9096)가 사용될 수 있다.
택일적으로, GS 유전자로 형질전환된 세포는 GS의 억제제인 L-메티오닌 설폭시민 (Msx)을 함유하는 배양 배지에서 형질전환체를 배양함으로써 확인된다. 이러한 조건 하에, GS 유전자는 임의의 다른 공동-형질전환된 핵산과 함께 증폭된다. GS 선택/증폭 시스템은 상기 기재된 DHFR 선택/증폭 시스템과 조합하여 사용될 수 있다.
택일적으로, 본 발명의 항체를 코딩하는 DNA 서열, 야생형 DHFR 유전자, 및 아미노글리코시드 3’-포스포트랜스퍼라아제 (APH)와 같은 또 다른 선택 마커로 형질전환된 또는 공동-형질전환된 숙주 세포 (특히 내인성 DHFR를 함유하는 야생형 숙주)는 아미노글리코시드 항생제, 예컨대, 카나마이신, 네오마이신, 또는 G418과 같은 선택 마커에 대한 선택제를 함유하는 배지에서 세포 성장에 의해 선택될 수 있다. 하기를 참고한다: 미국특허 제4,965,199호.
효모에서 사용하는데 적합한 선택 유전자는 효모 플라스미드 YRp7에 존재하는 trp1 유전자이다 (Stinchcomb 등, Nature, 282:39 (1979)). trp1 유전자는 트립토판에서 성장하는 능력이 결여된 효모의 돌연변이체 균주, 예를 들어 하기에 대한 선택 마커를 제공한다: ATCC 번호44076 또는 PEP4-1.Jones, Genetics, 85:12 (1977). 이후, 효모 숙주 세포 게놈에서 trp1 병변의 존재는 트립토판의 부재하에서의 성장에 의해 형질전환을 검출하기 위한 효과적인 환경을 제공한다. 유사하게, Leu2-결핍 효모 균주 (ATCC 20,622 또는 38,626)는 Leu2 유전자를 갖는 공지된 플라스미드에 의해 보완된다.
또한, 1.6 μm 원형 플라스미드 pKD1로부터 유래된 벡터는 클루이베로마이세스 효모의 형질전환에 사용될 수 있다. 택일적으로, 재조합 송아지 카이모마이신의 대량 생산을 위한 발현 시스템이 K. lactis에 대해 보고되었다. Van den Berg, Bio/Technology, 8:135 (1990). 클루이베로마이세스의 산업 균주에 의해 성숙한 재조합 인간 혈청 알부민을 분비하기 위한 안정한 다중 복제 발현 벡터가 또한 개시되었다. Fleer 등, Bio/Technology, 9:968-975 (1991).
(d) 프로모터 성분
발현 및 클로닝 벡터는 일반적으로 숙주 유기체에 의해 인식되고 항체를 코딩하는 핵산에 작동가능하게 연결된 프로모터를 함유한다. 원핵 숙주와 함께 사용하기에 적합한 프로모터는 phoA 프로모터, β-락타마제 및 락토오스 프로모터 시스템, 알칼리 포스파타아제 프로모터, 트립토판 (trp) 프로모터 시스템, 및 하이브리드 프로모터, 예컨대 tac 프로모터를 포함한다. 그러나, 다른 공지된 박테리아 프로모터가 적합하다. 박테리아 시스템에서 사용하기 위한 프로모터는 또한 항체를 코딩하는 DNA에 작동가능하게 연결된 샤인-달가노 (S.D.) 서열을 함유할 것이다.
프로모터 서열은 진핵생물에 대해 알려져 있다. 실질적으로 모든 진핵 유전자는 전사가 시작되는 부위로부터 약 25 내지 30 염기 상류에 위치한 AT-풍부 영역을 갖는다. 많은 유전자의 전사 시작으로부터 70 내지 80 염기 상류에서 발견되는 또 다른 서열은 CNCAAT 영역이며, 여기서 N은 임의의 뉴클레오타이드이다. 대부분의 진핵 유전자의 3’ 말단에는 코딩 서열의 3’ 말단에 폴리 A 테일을 첨가하기 위한 신호일 수 있는 AATAAA 서열이 있다. 이러한 모든 서열은 진핵 발현 벡터에 적합하게 삽입된다.
효모 숙주와 함께 사용하기 위한 적합한 프로모터 서열의 예는 3-포스포글리세레이트 키나제 또는 다른 당분해 효소, 예컨대 에놀라제, 글리세르알데히드-3-포스페이트 탈수소효소, 헥소키나제, 피루베이트 데카복실라제, 포스포프럭토키나제, 글루코스-6-포스페이트 이소머라아제, 3-포스포글리세레이트 뮤타아제, 피루베이트 키나제, 트리오스포스페이트 이소머라아제, 포스포글루코스 이소머라아제, 및 글루코키나제에 대한 프로모터를 포함한다.
성장 조건에 의해 제어되는 전사의 추가의 이점을 갖는 유도성 프로모터인 다른 효모 프로모터는 알콜 탈수소효소 2, 이소사이토크롬 C, 산 포스파타아제, 질소 대사와 관련된 분해 효소, 메탈로티오네인, 글리세르알데히드-3-포스페이트 탈수소효소, 및 말토스 및 갈락토오스 이용을 담당하는 효소에 대한 프로모터 영역이다. 효모 발현에서 사용하기 위한 적합한 벡터 및 프로모터는 EP 제73,657호에 더 기재되어 있다. 효모 인핸서는 또한 효모 프로모터와 함께 유리하게 사용된다.
포유동물 숙주 세포에서 벡터로부터의 항체 전사는, 이러한 프로모터가 숙주 세포 시스템과 양립가능한 한, 예를 들어, 폴리오마 바이러스, 계두 바이러스, 아데노바이러스 (예컨대 아데노바이러스 2), 소 파필로마 바이러스, 조류 육종 바이러스, 사이토메갈로바이러스, 레트로바이러스, B형 간염 바이러스, 시미안 바이러스 40 (SV40)와 같은 바이러스의 게놈으로부터 수득된 프로모터, 또는 이종 포유동물 프로모터, 예컨대, 액틴 프로모터 또는 면역글로불린 프로모터, 열충격 프로모터에 의해 제어될 수 있다.
SV40 바이러스의 초기 및 후기 프로모터는 또한 SV40 바이러스 복제 원점을 함유하는 SV40 제한 단편으로서 편리하게 수득된다. 인간 사이토메갈로바이러스의 극초기 프로모터는 HindIII E 제한 단편으로서 편리하게 수득된다. 벡터로서 소 파필로마 바이러스를 사용하여 포유동물 숙주에서 DNA를 발현하기 위한 시스템은 하기에 개시되어 있다: 미국특허 제4,419,446호. 이 시스템의 변형은 하기에 기재되어 있다: 미국특허 제4,601,978호.또한 하기를 참고한다: Reyes 등, Nature 297:598-601 (1982) (단순 포진 바이러스로부터 티미딘 키나제 프로모터의 제어하에 마우스 세포에서 인간 β-인터페론 cDNA의 발현에 대함). 택일적으로, Rous 육종 바이러스 긴 말단 반복이 프로모터로서 사용될 수 있다.
(e) 인핸서 요소 성분
고등 진핵생물에 의한 본 발명의 항체를 코딩하는 DNA의 전사는 종종 벡터 내로 인핸서 서열을 삽입함으로써 증가된다. 많은 인핸서 서열이 현재 포유동물 유전자로부터 알려져 있다(글로빈, 엘라스타제, 알부민, α-페토단백질, 및 인슐린). 그러나, 전형적으로, 진핵 세포 바이러스의 인핸서를 사용할 것이다. 예는 복제 원점의 후기 쪽의 SV40 인핸서 (bp 100-270), 사이토메갈로바이러스 초기 프로모터 인핸서, 복제 원점의 후기 쪽의 폴리오마 인핸서, 및 아데노바이러스 인핸서를 포함한다. 또한 하기를 참고한다: Yaniv, Nature 297:17-18 (1982) (진핵 프로모터의 활성화를 위한 인핸싱 요소에 관함). 인핸서는 항체-코딩 서열의 5’ 또는 3’ 위치에서 벡터에 접합될 수 있지만, 바람직하게는 프로모터로부터 5’ 부위에 위치한다.
(f) 전사 종결 성분
진핵 숙주 세포 (효모, 진균, 곤충, 식물, 동물, 인간, 또는 다른 다세포 유기체로부터의 유핵 세포)에서 사용된 발현 벡터는 또한 전사의 종결 및 mRNA의 안정화에 필요한 서열을 함유할 것이다. 이러한 서열은 일반적으로 진핵 또는 바이러스 DNA 또는 cDNA의 비번역 영역의 5’ 및 때로는 3’로부터 이용가능하다. 이러한 영역은 mRNA 코딩 항체의 비번역 부분에 폴리아데닐화된 단편으로서 전사된 뉴클레오타이드 분절을 함유한다. 한 가지 유용한 전사 종결 성분은 소 성장 호르몬 폴리아데닐화 영역이다. 하기를 참고한다: WO제94/11026호 및 그 안에 개시된 발현 벡터.
(g) 숙주 세포의 선택 및 형질전환
본원의 벡터 내의 DNA를 클로닝하거나 발현하기 위한 적합한 숙주 세포는 원핵생물, 효모, 또는 상기 기재된 고등 진핵생물 세포이다. 이 목적을 위한 적합한 원핵생물은 하기를 포함한다: 진정세균, 예컨대 그램 음성 또는 그램 양성 유기체, 예를 들어, 엔테로박테리아세애, 예컨대 에스케리치아, 예컨대, E. 콜리, 엔테로박터, 에르위니아, 클렙시엘라, 프로테오스, 살모넬라, 예컨대, 살모넬라 티피무리움, 세라티아, 예컨대, 세라티아 마르세스칸스, 및 쉬겔라, 뿐만 아니라 바실러스, 예컨대 B. 서브틸리스 및 B. 리케니포르미스 (예컨대, 하기에 개시된 B. 리케니포르미스 41P: DD 266,710, 1989년 4월 12일에공개됨), 슈도모나스, 예컨대 P. 애루지노사, 및 스트렙토마이세스. 한 가지 바람직한 E. 콜리 클로닝 숙주는 E. 콜리 294 (ATCC 31,446)이지만, 다른 균주, 예컨대 E. 콜리 B, E. 콜리 X1776 (ATCC 31,537), 및 E. 콜리 W3110 (ATCC 27,325)이 적합하다. 이러한 예는 제한하는 것이 아니라 예시적이다.
전장 항체, 항체 융합 단백질, 및 항체 단편은 특히 당화 및 Fc 효과기 기능이 필요하지 않은 경우, 예컨대 치료 항체가 그 자체로 종양 세포 파괴에서 효과를 나타내는 세포독성제 (예컨대, 독소)에 접합되는 경우, 박테리아에서 생산될 수 있다. 전장 항체는 순환에서 더 큰 반감기를 갖는다. E. 콜리에서의 생산은 더 빠르고 더 비용 효율적이다. 박테리아에서 항체 단편 및 폴리펩타이드의 발현은, 하기를 참고하며: 예컨대, 미국특허 제5,648,237호 (Carter 등), 미국특허 제5,789,199호 (Joly 등), 미국특허 제5,840,523호 (Simmons 등), 이는 번역 개시 영역 (TIR) 및 발현 및 분비를 최적화하기 위한 신호 서열을 기술한다. 또한 하기를 참고한다: Charlton, Methods in Molecular Biology, Vol. 248 B.K.C.Lo, ed., Humana Press, Totowa, N.J., pp. 245-254 (2003) (E. 콜리에서 항체 단편의 발현을 기술함). 발현 후, 항체는 가용성 분획에서 E. 콜리 세포 페이스트로부터 단리될 수 있고, 예컨대, 아이소타입에 따라 단백질 A 또는 G 컬럼을 통해 정제될 수 있다. 최종 정제는 예컨대, CHO 세포에서 발현된 항체를 정제하는 과정과 유사하게 수행될 수 있다.
원핵생물 이외에도, 진핵 미생물, 예컨대 사상 진균 또는 효모는 항체-코딩 벡터에 적합한 클로닝 또는 발현 숙주이다. 사카로마이세스 세레비지애, 또는 일반적인 빵 효모가 하등 진핵 숙주 미생물 중에서 가장 일반적으로 사용된다. 그러나, 많은 다른 속, 종, 및 균주, 예컨대 쉬조사카로마이세스 폼베; 클루이베로마이세스 숙주, 예컨대, K. 락티스, K. 프라질리스 (ATCC 12,424), K. 불가리쿠스 (ATCC 16,045), K. 윅케라미 (ATCC 24,178), K. 왈티 (ATCC 56,500), K. 드로소필라룸 (ATCC 36,906), K. 써모톨레란스, 및 K. 마르시아누스; 야로위아 (EP 402,226); 피키아 파스토리스 (EP 183,070); 칸디다; 트리코더마 레에시아 (EP 244,234); 뉴로스포라 크라사; 쉬완니오마이세스, 예컨대 쉬완니오마이세스 옥시덴탈리스; 및 사상 진균, 예컨대, 뉴로스포라, 페니실리움, 톨리포클라디움, 및 아스퍼질러스 숙주, 예컨대 A. 니둘란스 및 A. 니거가 본원에서 일반적으로 이용가능하며 유용하다. 치료 단백질의 생산을 위한 효모 및 사상 진균의 용도를 논의하는 검토를 위해, 하기를 참고한다: 예컨대, Gerngross, Nat. Biotech. 22: 1409-1414 (2004).
당화 경로가 “인간화”되어 부분적 또는 완전한 인간 당화 패턴을 갖는 항체를 생산하는 특정 진균 및 효모 균주가 선택될 수 있다. 하기를 참고한다: 예컨대, Li 등, Nat. Biotech. 24: 210-215 (2006) (피키아 파스토리스에서 당화 경로의 인간화를 기술함); 및 Gerngross 등, 상기.
당화된 항체의 발현을 위한 적합한 숙주 세포는 또한 다세포 유기체 (무척추동물 및 척추동물)로부터 유래된다. 무척추동물 세포의 예는 식물 및 곤충 세포를 포함한다. 많은 배큘로바이러스 균주 및 변이체 및 스포돕테라 프루지페르다 (애벌레), 애데스 애집티 (모기), 애데스 알보픽투스 (모기), 도로소필라 멜라노가스터 (초파리), 및 봄빅스 모리와 같은 숙주로부터의 상응하는 허용된 곤충 숙주 세포가 확인되었다. 형질감염을 위한 다양한 바이러스 균주, 예컨대, 아우토그라파 칼리포르니카 NPV의 L-1 변이체 및 봄빅스 모리 NPV의 Bm-5 균주가 공개적으로 이용가능하며, 이러한 바이러스는, 특히 스포돕테라 프루지페르다 세포의 형질감염을 위해, 본 발명에 따라 본원의 바이러스로서 사용될 수 있다.
면화, 옥수수, 감자, 대두, 페투니아, 토마토, 좀개구리밥 (Leninaceae), 알팔파 (M. truncatula), 및 담배의 식물 세포 배양이 또한 숙주로서 이용될 수 있다. 하기를 참고한다: 예컨대, 미국특허 제5,959,177호, 제6,040,498호, 제6,420,548호, 제7,125,978호, 및 제6,417,429호 (형질전환 식물에서 항체를 생산하기 위한 PLANTIBODIESTM 기술을 기술함).
척추동물 세포는 숙주로서 사용될 수 있고, 배양 (조직 배양)에서 척추동물 세포의 증식은 일상적인 절차가 되었다. 유용한 포유동물 숙주 세포주의 예는 하기이다: SV40에 의해 형질전환된 원숭이 신장 CV1 주 (COS-7, ATCC CRL 1651); 인간 배아 신장 주 (현탁 배양에서의 성장을 위해 서브클로닝된 293 또는 293 세포, Graham 등, J. Gen Virol. 36:59 (1977)); 아기 햄스터 신장 세포 (BHK, ATCC CCL 10); 마우스 세르톨리 세포 (TM4, Mather, Biol.Reprod.23:243-251 (1980)); 원숭이 신장 세포 (CV1 ATCC CCL 70); 아프리카 녹색 원숭이 신장 세포 (VERO-76, ATCC CRL-1587); 인간 자궁경부 암종 세포 (HELA, ATCC CCL 2); 개 신장 세포 (MDCK, ATCC CCL 34); 버팔로 쥐 간 세포 (BRL 3A, ATCC CRL 1442); 인간 폐 세포 (W138, ATCC CCL 75); 인간 간 세포 (Hep G2, HB 8065); 마우스 유선 종양 (MMT 060562, ATCC CCL51); TRI 세포 (Mather 등, Annals N.Y.Acad. Sci. 383:44-68 (1982)); MRC 5 세포; FS4 세포; 및 인간 간종양 주 (Hep G2). 다른 유용한 포유동물 숙주 세포주는 하기를 포함한다: 차이니즈 햄스터 난소 (CHO) 세포, 예컨대 DHFR- CHO 세포 (Urlaub 등, Proc. Natl. Acad. Sci. USA 77:4216 (1980)); 및 골수종 세포주, 예컨대 NS0 및 Sp2/0. 항체 생산에 적합한 특정 포유동물 숙주 세포주의 검토를 위해, 하기를 참고한다: 예컨대, Yazaki and Wu, Methods in Molecular Biology, 248:255-268 (2003).
숙주 세포는 항체 생산을 위한 상기 기재된 발현 또는 클로닝 벡터로 형질전환되고 프로모터를 유도하거나, 형질전환체를 선택하거나, 또는 원하는 서열을 코딩하는 유전자를 증폭하는데 적절하게 변형된 종래의 영양 배지에서 배양된다.
(h) 숙주 세포 배양
본 발명의 항체를 생산하는데 사용되는 숙주 세포는 다양한 배지에서 배양될 수 있다. Ham’s F10 (Sigma), 최소 필수 배지 ((MEM), (Sigma), RPMI-1640 (Sigma), 및 둘베코 변형 이글스 배지 ((DMEM), Sigma)와 같은 상업적으로 이용가능한 배지가 숙주 세포를 배양하는데 적합하다. 또한, Ham 등, Meth. Enz. 58:44 (1979), Barnes 등, Anal. Biochem. 102:255 (1980), 미국특허 제4,767,704호; 제4,657,866호; 제4,927,762호; 제4,560,655호; 또는 제5,122,469호; WO 제90/03430호; WO 제87/00195호; 또는 미국특허Re.30,985호에 기재된 임의의 배지가 숙주 세포를 위한 배양 배지로서 사용될 수 있다. 임의의 이러한 배지는 필요에 따라 호르몬 및/또는 다른 성장 인자 (예컨대 인슐린, 트랜스페린, 또는 표피 성장 인자), 염 (예컨대 염화나트륨, 칼슘, 마그네슘, 및 인산염), 완충제 (예컨대, HEPES), 뉴클레오타이드 (예컨대, 아데노신 및 티미딘), 항생제 (예컨대, GENTAMYCINTM 약물), 미량 원소 (일반적으로 마이크로몰 범위의 최종 농도로 존재하는 무기 화합물로서 정의됨), 및 글루코스 또는 동등한 에너지원으로 보충될 수 있다. 임의의 다른 필요한 보충물이 또한 당업자에게 알려진 적절한 농도로 포함될 수 있다. 배양 조건, 예컨대 온도, pH 등은 이전에 발현을 위해 선택된 숙주 세포와 함께 사용된 것이며, 이는 당업자에게 명백할 것이다.
(xi) 항체의 정제
재조합 기술을 사용할 때, 항체는 세포내로, 주변세포질 공간에서 생산되거나, 또는 배지에 직접 분비될 수 있다. 항체가 세포내에서 생산되면, 제1 단계로서, 미립자 파편인 숙주 세포 또는 용균 단편이, 예를 들어, 원심분리 또는 한외여과에 의해 제거된다. Carter 등, Bio/Technology 10:163-167 (1992)은 E. 콜리의 주변세포질 공간으로 분비되는 항체르 단리하는 절차를 기술한다. 간략하게, 세포 페이스트는 약 30분 동안 아세트산 나트륨 (pH 3.5), EDTA, 및 페닐메틸설포닐플루오라이드 (PMSF)의 존재하에 해동된다. 세포 파편은 원심분리에 의해 제거될 수 있다. 항체가 배지 내로 분비되는 경우, 이러한 발현 시스템으로부터의 상층액은 일반적으로 상업적으로 이용가능한 단백질 농도 필터, 예를 들어, Amicon 또는 Millipore Pellicon 한외여과 단위를 사용하여 먼저 농축된다. PMSF와 같은 프로테아제 억제제는 단백질분해를 억제하기 위한 임의의 전술한 단계에서 포함될 수 있고, 항생제가 우발적인 오염물의 성장을 방지하기 위해 포함될 수 있다.
세포로부터 제조된 항체 조성물은, 예를 들어, 하이드록실아파타이트 크로마토그래피, 소수성 상호작용 크로마토그래피, 겔 전기영동, 투석, 및 친화성 크로마토그래피를 사용하여 정제될 수 있고, 친화성 크로마토그래피는 전형적으로 바람직한 정제 단계 중 하나이다. 친화성 리간드로서 단백질 A의 적합성은 항체에 존재하는 임의의 면역글로불린 Fc 도메인의 종 및 아이소타입에 의존한다. 단백질 A는 인간 γ1, γ2, 또는 γ4 중쇄에 기초하여 항체를 정제하는데 사용될 수 있다 (Lindmark 등, J. Immunol. Meth.62:1-13 (1983)). 단백질 G는 모든 마우스 아이소타입에 대해 그리고 인간 γ3에 대해 권고된다 (Guss 등, EMBO J. 5:15671575 (1986)). 친화성 리간드가 부착되는 매트릭스는 가장 흔하게는 아가로스이지만, 다른 매트릭스도 이용가능하다. 제어된 기공 유리 또는 폴리(스티렌디비닐)벤젠과 같은 기계적으로 안정한 매트릭스는 아가로스가 달성할 수 있는 것보다 더 빠른 유속 및 더 짧은 처리 시간을 가능하게 한다. 항체가 CH3 도메인을 포함하는 경우, Bakerbond ABXTM 수지 (J. T. Baker, Phillipsburg, N.J.)가 정제에 유용하다. 단백질 정제를 위한 다른 기술, 예컨대 이온 교환 컬럼 상에서의 분획화, 에탄올 침전, 역상 HPLC, 실리카 상의 크로마토그래피, 음이온 또는 양이온 교환 수지 (예컨대, 폴리아스파트산 컬럼) 상의 헤파린 SEPHAROSETM 크로마토그래피, 크로마토포커싱, SDS-PAGE, 및 암모늄 설페이트 침전이 회수될 항체에 따라 또한 이용가능하다.
일반적으로, 연구, 시험, 및 임상에서 사용하기 위한 항체를 제조하는 다양한 방법론은 당업계에 널리 확립되어 있고, 상기 기재된 방법론과 일치하고/하거나, 관심있는 특정 항체에 대해 당업자에게 적절한 것으로 간주된 바와 같다.
B. 생물학적 활성 항체의 선택
상기 기재된 바와 같이 생산된 항체는 치료 관점에서 유익한 특성을 갖는 항체를 선택하기 위한 하나 이상의 “생물학적 활성” 분석에 적용될 수 있다. 항체는 그것이 생육된 항원에 결합하는 능력에 대해 스크리닝될 수 있다. 예를 들어, 항-DR5 항체 (예컨대, 드로지투맙)의 경우, 항체의 항원 결합 특성은 사멸 수용체 5 (DR5)에 결합하는 능력을 검출하는 분석에서 평가될 수 있다.
또 다른 구현예에서, 항체의 친화성은 하기에 의해 결정될 수 있다: 예를 들어, 포화 결합; ELISA; 및/또는 경쟁 분석 (예컨대 RIA).
또한, 항체는, 예컨대, 치료제로서의 그의 효과를 평가하기 위해, 다른 생물학적 활성 분석에 적용될 수 있다. 이러한 분석은 당업계에 알려져 있으며, 표적 항원 및 항체에 대한 의도된 용도에 좌우된다.
본 발명의 항원 상의 특정 에피토프에 결합하는 항체를 스크리닝하기 위해, 문헌[Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow 및 David Lane (1988)]에 기재된 것과 같은 일상적인 교차 차단 분석이 수행될 수 있다. 택일적으로, 예컨대 Champe 등, J. Biol.Chem.270:1388-1394 (1995)에 기재된 바와 같은 에피토프 맵핑이 항체가 관심있는 에피토프에 결합하는지 여부를 결정하는데 사용될 수 있다.
C. 제형의 제조
감소된 폴리소르베이트 분해를 갖는 폴리소르베이트 및 사이클로덱스트린을 포함하는 제형이 본원에 제공되어 있다. 일부 구현예에서, 사이클로덱스트린은 2-하이드록시프로필-β-사이클로덱스트린 (HP-β-CD)이다. 일부 구현예에서, 사이클로덱스트린은 2-하이드록시프로필-α-사이클로덱스트린 (HP-α-CD), 2-하이드록시프로필-γ-사이클로덱스트린 (HP-γ-CD)이다. 일부 구현예에서, 사이클로덱스트린은 β-사이클로덱스트린 (β-CD)이다. 일부 구현예에서, 사이클로덱스트린은 설포부틸 에테르 β-사이클로덱스트린 (SBE-β-CD)이다. 일부 구현예에서, 사이클로덱스트린은 β-사이클로덱스트린 (β-CD)이다. 일부 구현예에서, 사이클로덱스트린은 α-사이클로덱스트린 (α-CD)이다. 일부 구현예에서, 사이클로덱스트린은 γ-사이클로덱스트린 (γ-CD)이다. 일부 구현예에서, 제형은 폴리소르베이트 및 폴리비닐피롤리돈 (PVP)을 포함하고, 감소된 폴리소르베이트 분해를 가진다. 일부 구현예에서, 제형은 추가로 폴리펩티드를 포함한다. 일부 구현예에서, 폴리소르베이트는 약 0.001% 내지 약 15%의 범위 또는 이 값 사이의 임의의 범위이다. 특정 구현예에서, 폴리소르베이트는 약 0.001% 내지 약 0.4%, 0.01% 내지 약 0.4%, 약 0.01% 내지 약 0.3%, 약 0.01% 내지 약 0.2%, 약 0.01% 내지 약 0.1%의 범위이다. 일부 구현예에서, 제형은 약 0.001%, 약 0.005% 약 0.01%, 약 0.02% 약 0.03%, 약 0.04%, 약 0.05%, 약 0.06%, 약 0.07%, 약 0.08%, 약 0.09%, 약 0.1%, 약 0.4%, 약 1%, 약 5%, 또는 약 15% 폴리소르베이트를 포함한다. 일부 구현예에서, 폴리소르베이트는 폴리소르베이트 20이다. 일부 구현예에서, 폴리소르베이트는 폴리소르베이트 40이다. 일부 구현예에서, 폴리소르베이트는 폴리소르베이트 60이다. 일부 구현예에서, 폴리소르베이트는 폴리소르베이트 80이다.
일부 구현예에서, 폴리비날피롤리돈은 모노머 N-비닐피롤리돈으로부터 제조된 중합체 분자의 부류이다. 일부 구현예에서, 폴리비닐피롤리돈 (PVP)은 포비돈 (가용성 PVP)이다. 일부 구현예에서, PVP는 포비돈 K12 (대략 MW: 2.5 kDa)이다. 일부 구현예에서, PVP는 포비돈 K15 (대략 MW: 8 kDa)이다. 일부 구현예에서, PVP는 포비돈 K17 (대략 MW: 10 kDa)이다. 일부 구현예에서, PVP는 포비돈 K25 (대략 MW: 30 kDa)이다. 일부 구현예에서, PVP는 포비돈 K30 (대략 MW: 50 kDa)이다. 일부 구현예에서, PVP는 포비돈 K60 (대략 MW: 400 kDa)이다. 일부 구현예에서, PVP는 포비돈 K90 (대략 MW: 1,000 kDa)이다. 일부 구현예에서, PVP는 포비돈 K120 (3,000 kDa)이다. 일부 구현예에서, PVP는 크로스포비돈 (불용성 PVP)이다. 일부 구현예에서, PVP는 코포비돈이다.
일부 구현예에서, 사이클로덱스트린은 약 0.5% 내지 약 30%의 범위이다. 일부 구현예에서, 사이클로덱스트린은 약 1% 내지 약 25%, 또는 약 5% 내지 약 20%, 또는 약 10% 내지 약 15%의 범위이다. 추가의 구현예에서, 사이클로덱스트린은 약 0.5%, 약 1%, 약 5%, 약 10%, 약 15%, 약 20%, 약 25%, 또는 약 30%의 농도이다. 일부 구현예에서, PVP는 약 0.5% 내지 약 30%의 범위이다.
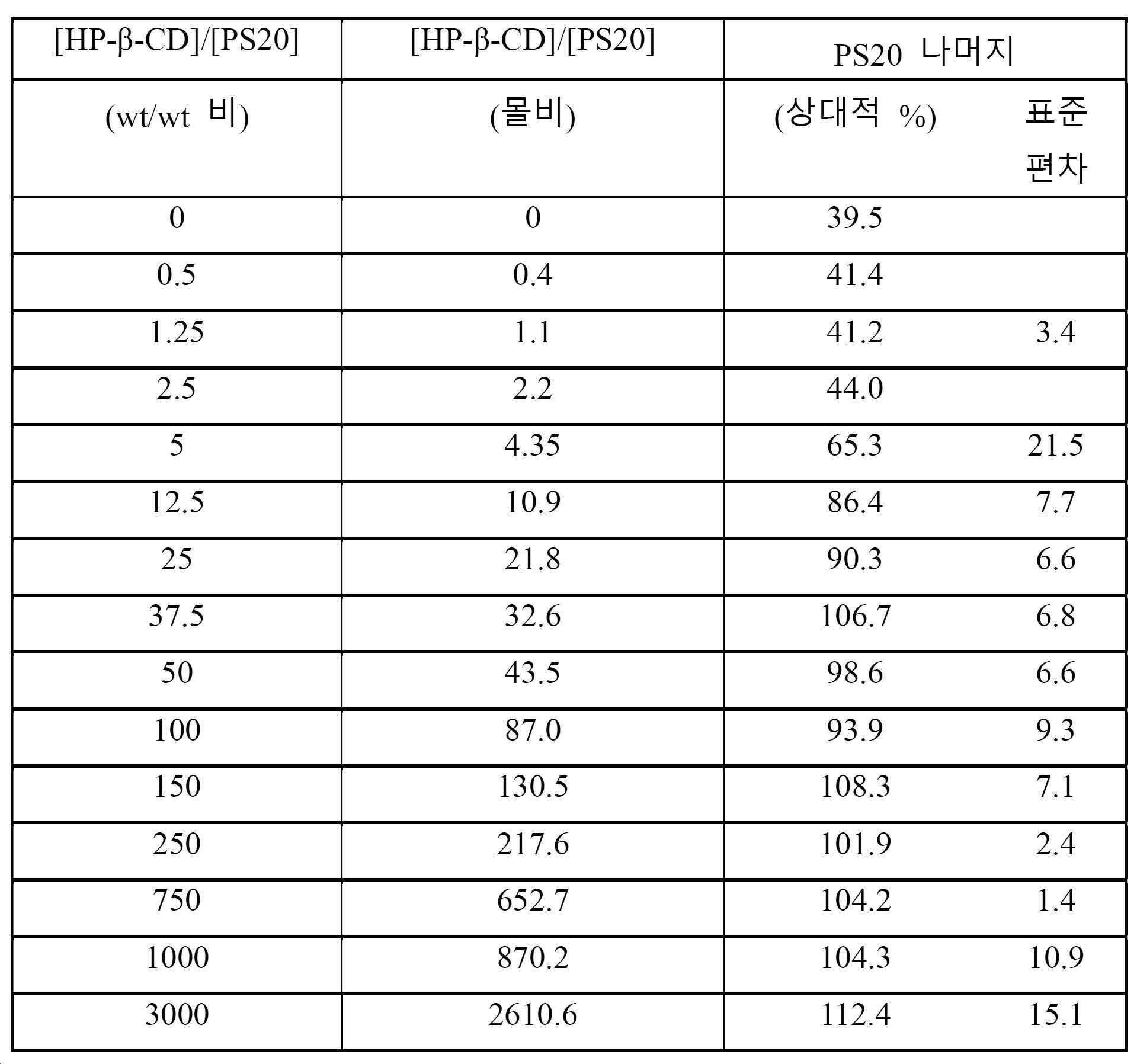
일부 구현예에서, 제형에서의 사이클로덱스트린 대 폴리소르베이트의 w/w 비는 약 37.5:1 초과이다. 일부 구현예에서, 제형에서의 사이클로덱스트린 대 폴리소르베이트의 w/w 비는 약 50:1 초과, 약 100:1 초과, 약 150:1 초과, 약 250:1 초과, 약 750:1 초과, 약 1000:1 초과, 또는 약 3000:1 초과이다. 일부 구현예에서, 사이클로덱스트린 대 폴리소르베이트의 w/w 비는 67:1 내지 1000:1가 아니다. 일부 구현예에서, 제형에서의 PVP 대 폴리소르베이트의 w/w 비는 약 37.5:1 초과이다.
일부 구현예에서, 수성 제형은 약 10 mg/mL 내지 약 250 mg/mL의 범위 또는 이 값 사이의 임의의 범위의 농도로 폴리펩티드를 포함한다. 일부 구현예에서, 폴리펩티드는 약 250 mg/mL 초과의 농도이다. 일부 구현예에서, 폴리펩티드는 약 10 mg/mL 내지 250 mg/mL, 50 mg/mL 내지 250 mg/mL, 100 mg/mL 내지 250 mg/mL, 150 mg/mL 내지 250 mg/mL, 200 mg/mL 내지 250 mg/mL, 10 mg/mL 내지 200 mg/mL, 50 mg/mL 내지 200 mg/mL, 100 mg/mL 내지 200 mg/mL, 150 mg/mL 내지 200 mg/mL, 10 mg/mL 내지 150 mg/mL, 50 mg/mL 내지 150 mg/mL, 100 mg/mL 내지 150 mg/mL, 10 mg/mL 내지 100 mg/mL, 50 mg/mL 내지 100 mg/mL, 10 mg/mL 내지 50 mg/mL의 범위 또는 이 범위 사이의 임의의 범위의 농도에서의 것이다.
일부 구현예에서, 수성 제형은 항체를 포함한다. 일부 구현예에서, 항체는 (VEGF); CD20; ox-LDL; ox-ApoB100; 수지; 인간 성장 호르몬 및 소 성장 호르몬을 포함하는 성장 호르몬; 성장 호르몬 방출 인자; 부갑상선 호르몬; 갑상선 자극 호르몬; 지질단백질; 알파-1-항트립신; 인슐린 A-사슬; 인슐린 B-사슬; 프로인슐린; 여포자극 호르몬; 칼시토닌; 황체형성 호르몬; 글루카곤; 응고 인자 예컨대 인자 VIIIC, 인자 IX, 조직 인자, 및 폰빌레브란트 인자; 항-응고 인자 예컨대 단백질 C; 심방나트륨 이뇨 인자; 폐 계면활성제; 플라스미노겐 활성제, 예컨대 우로키나제 또는 인간 소변 또는 조직-유형 플라스미노겐 활성제 (t-PA); 봄베신; 트롬빈; 조혈 성장 인자; 종양 괴사 인자-알파 및 -베타; 엔케팔리나제; RANTES (정상적으로 발현되고, 분비된 T-세포의 활성화 조절); 인간 대식세포 염증성 단백질 (MIP-1-알파); 혈청 알부민 예컨대 인간 혈청 알부민; 뮐러관 억제 물질; 릴렉신 A-사슬; 릴렉신 B-사슬; 프로릴락신; 마우스 성선자극 호르몬-관련된 펩타이드; 미생물 단백질, 예컨대 베타-락타마제; DNase; IgE; 세포독성 T-림프구 관련된 항원 (CTLA), 예컨대 CTLA-4; 인히빈; 액티빈; 호르몬 또는 성장 인자에 대한 수용체; 단백질 A 또는 D; 류마티스성 인자; 신경친화성 인자 예컨대 골-유래 신경친화성 인자 (BDNF), 뉴로트로핀-3, -4, -5, 또는 -6 (NT-3, NT4, NT-5, 또는 NT-6), 또는 신경 성장 인자 예컨대 NGF-β; 혈소판-유래된 성장 인자 (PDGF); 섬유아세포 성장 인자 예컨대 aFGF 및 bFGF; 표피 성장 인자 (EGF); 형질전환 성장 인자 (TGF) 예컨대 TGF-알파 및 TGF-베타 (TGF-β1, TGF-β2, TGF-β3, TGF-β4, 또는 TGF-β5 포함); 인슐린-유사 성장 인자-I 및 -II (IGF-I 및 IGF-II); des (1-3)-IGF-I (뇌 IGF-I), 인슐린-유사 성장 인자 결합 단백질; CD 단백질 예컨대 CD3, CD4, CD8, CD19 및 CD20; 에리트로포이에틴; 골유도성 인자; 면역독소; 골 형태형성 단백질 (BMP); 인터페론 예컨대 인터페론-알파, -베타, 및 -감마; 집락 자극 인자 (CSF), 예를 들어, M-CSF, GM-CSF, 및 G-CSF; 인터류킨 (IL), 예를 들어, IL-1 내지 IL-10; 초과산화물 디스무타제; T-세포 수용체; 표면 막 단백질; 붕괴 촉진 인자; 바이러스 항원 예컨대, 예를 들어, AIDS 엔빌로프의 일부; 수송 단백질; 귀소 수용체; 어드레신; 조절 단백질; 인테그린 예컨대 CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 및 VCAM; 종양 관련된 항원 예컨대 HER2, HER3 또는 HER4 수용체; 및 상기-열거된 폴리펩타이드의 임의의 절편에 관한 것이다. 일부 구현예에서, 항체는 항-CD20 항체가 아니다. 일부 구현예에서, 제형은 항-CD20 항체 및 0.2% 폴리소르베이트(예를 들면, 폴리소르베이트 80)를 포함하지 않는다. 일부 구현예에서, 제형은 10% HP-γ 사이클로덱스트린 및 0.03%의 폴리소르베이트 20을 포함하지 않는다. 일부 구현예에서, 제형은 항-CD20 항체, 10% HP-γ 사이클로덱스트린 및 0.03%의 폴리소르베이트 20을 포함하지 않는다.
일부 구현예에서, 수성 제형은 추가로 안정화제, 완충액, 계면활성제, 및 등장화제로 이루어진 군으로부터 선택된 하나 이상의 부형제를 포함한다. 본 발명의 수성 제형은 pH-완충된 용액에서 제조될 수 있다. 본 발명의 완충액은 약 pH 4.5 내지 약 9.0의 범위의 pH를 가진다. 특정 구현예에서, pH는 약 4.5 내지 약 7.0의 범위의 pH, 약 4.5 내지 약 6.6의 범위의 pH, 약 4.5 내지 약 6.0의 범위의 pH, 약 4.5 내지 약 5.5의 범위의 pH, 약 4.5 내지 약 5.0의 범위의 pH, 약 5.0 내지 약 7.0의 범위의 pH, 약 5.5 내지 약 7.0의 범위의 pH, 약 5.7 내지 약 6.8의 범위의 pH, 약 5.8 내지 약 6.5의 범위의 pH, 약 5.9 내지 약 6.5의 범위의 pH, 약 6.0 내지 약 6.5의 범위의 pH, 약 6.2 내지 약 6.5의 범위의 pH를 가진다. 특정 구현예에서, 액체 제형은 약 4.7 내지 약 5.2의 범위, 약 5.0 내지 6.0의 범위, 또는 약 5.2 내지 약 5.8의 범위의 pH를 가진다. 본 발명의 특정 구현예에서, 액체 제형은 6.2 또는 약 6.2의 범위의 pH를 가진다. 본 발명의 특정 구현예에서, 액체 제형은 6.0 또는 약 6.0의 pH를 가진다.
이러한 범위 내로 pH를 조절하는 완충액의 예는 유기산 및 무기산 및 이의 염을 포함한다. 예를 들면, 아세테이트 (예를 들어, 히스티딘 아세테이트, 아르기닌 아세테이트, 아세트산나트륨), 석시네이트 (예를 들어, 히스티딘 석시네이트, 아르기닌 석시네이트, 나트륨 석시네이트), 글루코네이트, 포스페이트, 푸마레이트, 옥살레이트, 락테이트, 시트레이트, 및 이들의 조합. 완충액 농도는 예를 들면 완충액 및 원하는 제형의 등장성에 따라 약 1 mM 내지 약 600 mM일 수 있다.
추가의 계면활성제는 임의로 수성 제형에 첨가될 수 있다. 예시적인 계면활성제는 비이온성 계면활성제 예컨대 폴록사머 (예를 들면 폴록사머 188 등)을 포함한다. 첨가되는 계면활성제의 양은 이것이 제형화된 항체의 응집을 감소시키고 및/또는 제형에서의 미립자의 형성을 최소화하고 및/또는 흡착을 감소시키게 되는 것이다. 예를 들면, 계면활성제는 약 0.001% 내지 약 0.5%, 약 0.005% 내지 약 0.2%, 약 0.01% 내지 약 0.1%, 또는 약 0.02% 내지 약 0.06%, 또는 약 0.03% 내지 약 0.05%의 양으로 제형에 존재할 수 있다. 특정 구현예에서, 계면활성제는 0.04% 또는 약 0.04%의 양으로 제형에 존재한다. 특정 구현예에서, 계면활성제는 0.02% 또는 약 0.02%의 양으로 제형에 존재한다. 일 구현예에서, 제형은 계면활성제를 포함하지 않는다.
종종 "안정화제"로서 알려진 등장화제는 조성물에서 액체의 등장성을 조정하거나 또는 유지하기 위해 존재한다. 큰 하전된 생체분자 예컨대 단백질 및 항체가 사용되는 경우, 이는 대개 "안정화제"로 명명되며, 이는 아미노산 측쇄의 하전된 기와 상호작용할 수 있고, 이에 의해 분자간 및 분자내 상호작용에 대한 잠재성이 줄어들기 때문이다. 등장화제는 다른 성분의 상대적인 양을 고려하여 0.1 중량% 내지 25 중량%, 또는 바람직하게는 1 중량% 내지 5 중량%의 양으로 존재할 수 있다. 바람직한 등장화제는 다가 당 알코올, 바람직하게는 3가 또는 더 고도의 당 알코올, 예컨대 글리세린, 에리트리톨, 아라비톨, 자일리톨, 소르비톨 및 만니톨을 포함한다.
일부 구현예에서, 제형은 생체내 투여를 위한 것이다. 일부 구현예에서, 제형은 멸균된 것이다. 제형은 멸균 여과막을 통한 여과에 의해 멸균될 수 있다. 본원에서의 치료적 제형은 일반적으로 멸균 접근 포트를 갖는 용기, 예를 들면 피하주사기 바늘에 의해 관통가능한 스토퍼를 갖는 정맥주사액 백 또는 바이알에 배치된다. 투여 경로는 공지되고 허가된 방법, 예컨대 피하, 정맥내, 복강내, 근육내, 동맥내, 병소내 또는 관절내 경로, 국소 투여, 흡입 또는 지속 방출 또는 연장-방출 수단에 의한 주사 또는 주입과 같은 적합한 방식으로 장기간에 걸쳐 단일 또는 복수의 볼러스 또는 주입에 의한 것이다.
본 발명에 의해 제공되는 수성 제형은 폴리펩티드, 폴리소르베이트, 및 사이클로덱스트린을 포함하고, 저장 기간 이후 향상된 폴리소르베이트 안정성을 나타낸다. 일 구현예에서, 폴리소르베이트 안정성은 저장 기간 이후 제형에 남아 있는 폴리소르베이트의 상대적 백분율로서 표현된다. 예를 들면, 제형이 0.1% 폴리소르베이트를 초기에 함유하고, 저장 기간 이후 0.09% 폴리소르베이트를 함유하는 경우, 10%의 폴리소르베이트가 분해된 것이다. 추가의 구현예에서, 용액에서의 폴리소르베이트의 양은 증기화 광산란 검출(RP-ELSD)을 사용하는 역상 고성능 액체 크로마토그래피에 의해 결정된다 (Kim, J & Qiu, J. 2014, Analytica Chimica Acta 806:144-151). 일부 구현예에서, 샘플에서의 폴리소르베이트의 농도는 상이한 폴리소르베이트 농도를 사용하여 생성된 표준 곡선에 대해 샘플 결과를 비교하여 결정된다.
일부 구현예에서, 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 1℃ 내지 약 10℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해된다. 일부 구현예에서, 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 2℃ 내지 약 8℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해된다. 일부 구현예에서, 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 4℃ 내지 약 6℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해된다.
일부 구현예에서, 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 1℃ 내지 약 10℃에서 제형이 저장된 이후에 1% 미만의 폴리소르베이트가 분해되었다. 일부 구현예에서, 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 2℃ 내지 약 8℃에서 제형이 저장된 이후, 1% 미만의 폴리소르베이트가 분해되었다. 일부 구현예에서, 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 4℃ 내지 약 6℃에서 제형이 저장된 이후, 1% 미만의 폴리소르베이트가 분해되었다.
일부 구현예에서, 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 1℃ 내지 약 10℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되었다. 일부 구현예에서, 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 2℃ 내지 약 8℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되었다. 일부 구현예에서, 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 4℃ 내지 약 6℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되었다.
일부 구현예에서, 적어도 약 1개월, 적어도 약 2개월, 적어도 약 3개월, 적어도 약 4개월, 적어도 약 5개월, 적어도 약 6개월, 적어도 약 7개월, 적어도 약 8개월, 적어도 약 9개월, 적어도 약 10개월, 적어도 약 11개월, 또는 적어도 약 12개월 동안 약 22℃ 내지 약 28℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해되었다. 일부 구현예에서, 적어도 약 1개월, 적어도 약 2개월, 적어도 약 3개월, 적어도 약 4개월, 적어도 약 5개월, 적어도 약 6개월, 적어도 약 7개월, 적어도 약 8개월, 적어도 약 9개월, 적어도 약 10개월, 적어도 약 11개월, 또는 적어도 약 12개월 동안 약 22℃ 내지 약 28℃에서 제형이 저장된 이후, 1% 미만의 폴리소르베이트가 분해되었다. 일부 구현예에서, 적어도 약 1개월, 적어도 약 2개월, 적어도 약 3개월, 적어도 약 4개월, 적어도 약 5개월, 적어도 약 6개월, 적어도 약 7개월, 적어도 약 8개월, 적어도 약 9개월, 적어도 약 10개월, 적어도 약 11개월, 또는 적어도 약 12개월 동안 약 22℃ 내지 약 28℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되었다.
일부 구현예에서, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 적어도 약 48개월, 적어도 약 54개월, 적어도 약 60개월, 적어도 약 66개월, 또는 적어도 약 72개월 동안 약 -15℃ 내지 약 -25℃에서 제형이 저장되는 경우, 5% 미만의 폴리소르베이트가 분해되었다. 일부 구현예에서, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 적어도 약 48개월, 적어도 약 54개월, 적어도 약 60개월, 적어도 약 66개월, 또는 적어도 약 72개월 동안 약 -15℃ 내지 약 -25℃에서 제형이 저장되는 경우, 1% 미만의 폴리소르베이트가 분해되었다. 일부 구현예에서, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월, 적어도 약 54개월, 적어도 약 60개월, 적어도 약 66개월, 또는 적어도 약 72개월 약 -15℃ 내지 약 -25℃에서 제형이 저장되는 경우, 0.1% 미만의 폴리소르베이트가 분해되었다.
일부 구현예에서, 제형은 약 -8℃ 내지 약 -80℃에서 저장된다. 일부 구현예에서, 제형은 약 -20℃, -40℃, -70℃, 또는 -80℃에서 저장된다.
본원의 본 발명에 의해 제공되는 제형은 폴리소르베이트 분해 생성물 예컨대 가시적 및 비가시적 입자를 감소시키는데 유효하다. 일 구현예에서, 가시적 입자는 유리 바이알에 샘플을 배치시키고, 틴들 광의 존재 하에 샘플을 회전시킴으로써 관찰된다. 일 구현예에서, 비가시적 입자는 고정확성 (HIAC) 입자 계수기를 사용하여 분석된다. 일부 구현예에서, HRDL-150 검출기 및 1 mL 주사기가 구비된 HIAC 9703 입자 계수기가 사용될 수 있다. 일부 구현예에서, 기기의 성능은 각 측정 기간 이전에 3000 수/mL에서 NIST-추적가능한 2 μm 폴리스티렌 비드 표준으로 증명될 수 있다. 일부 구현예에서, HIAC 기기는 10 mL/min 유량, 0.1 mL 테어 체적, 및 0.4 mL 샘플 체적으로 구성될 수 있다. 특정 구현예에서, 샘플은 0.4 mL 분량의 4회 실시를 사용하여 분석될 수 있고, 샘플 캐리 오버로 인한 측정 오차를 방지하기 위해 각 샘플의 최초 실시는 폐기된다. 2, 5, 10, 15, 및 25 μm의 필터 크기는 분석을 위해 사용될 수 있다.
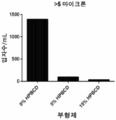
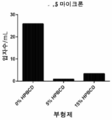
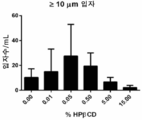
일부 구현예에서, 제형은 1mL당 약 10,000, 약 5,000, 약 1,000, 약 500, 약 250, 약 150, 약 100, 약 50, 또는 약 25개 미만의 입자 (1.4 μ 직경 초과임)를 가진다. 제형은 1mL당 약 10,000, 약 5,000, 약 1,000, 약 500, 약 250, 약 150, 약 100, 약 50, 또는 약 25개 미만의 입자 (2 μ 직경 초과임)를 가진다. 일부 구현예에서, 제형은 1mL당 약 1250, 약 150, 약 100, 약 50, 약 25, 약 20, 약 15, 약 10, 약 5, 약 4, 약 3, 약 2, 또는 약 1개 미만의 입자 (5 μ 직경 초과임)를 가진다. 일부 구현예에서, 제형은 1mL당 약 250, 약 150, 약 100, 약 50, 약 25, 약 20, 약 15, 약 10, 약 5, 약 4, 약 3, 약 2, 또는 약 1개 미만의 입자 (10 μ 직경 초과임)를 가진다. 일부 구현예에서, 제형은 1mL당 약 250, 약 150, 약 100, 약 50, 약 25, 약 20, 약 15, 약 10, 약 5, 약 4, 약 3, 약 2, 또는 약 1개 미만의 입자 (15 μ 직경 초과임)를 가진다. 일부 구현예에서, 제형은 1mL당 약 250, 약 150, 약 100, 약 50, 약 25, 약 20, 약 15, 약 10, 약 5, 약 4, 약 3, 약 2, 또는 약 1개 미만의 입자 (25 μ 직경 초과임)를 가진다.
III. 제형의 투여
수성 제형은 예컨대 볼러스와 같은 정맥내 투여 또는 시간에 걸친 연속 주입, 근육내, 복강내, 뇌척수내, 피하, 초자체내, 관절내, 활막내, 척추강내, 안구, 경구, 국소, 또는 흡입 경로에 의한 것과 같은 공지된 방법에 따라 단백질 (예를 들면, 항체)로의 치료를 필요로 하는 포유동물, 바람직하게는 인간에게 투여된다. 일 구현예에서, 수성 제형은 정맥내 투여에 의해 포유동물에게 투여된다. 이러한 목적을 위해, 제형은 예를 들면 주사기를 사용하여 또는 IV 라인을 통해 주입될 수 있다. 일 구현예에서, 액체 제형은 피하 투여에 의해 포유동물에 투여된다.
단백질의 적절한 복용량 ("치료적 유효량")은 예를 들면 치료되는 질병, 질병의 중증도 및 경과, 단백질이 예방적 또는 치료적 목적을 위해 투여된 것인지 여부, 이전의 요법, 환자의 병력 및 단백질에 대한 반응, 사용된 단백질의 유형, 및 주치의의 재량에 좌우될 것이다. 단백질은 한번에 또는 일련의 치료로 환자에게 적절하게 투여되며, 진단 이후의 임의의 시점에 환자에게 투여될 수 있다. 단백질은 단독 치료 또는 논의되는 질병의 치료에 유용한 다른 약물 또는 요법과 결합하여 투여될 수 있다. 본원에 사용되는 용어 "치료"는 치료목적 치료 및 예방 또는 방지적 조치 모두를 지칭한다. 치료를 필요로 하는 것은 이미 장애를 가진 것뿐만 아니라 장애가 예방되는 것을 포함한다. 본원에 사용되는 "장애"는 비제한적으로 논의되는 장애에 포유동물이 취약한 병리학적 질병을 포함하여 만성 및 급성 장애 또는 질환을 포함하는 치료로 유리할 것인 임의의 질병이다.
약리학적 의미에서, 본 발명의 맥락에서, 단백질 (예를 들면, 항체)의 "치료적 유효량"은 항체가 유효한 치료에 대한 장애의 예방 또는 치료에 있어서의 유효량을 지칭한다. 일반 명제로서, 치료적 유효량의 투여되는 단백질은 1회 이상의 투여와 무관하게 약 0.1 내지 약 50 mg/환자 체중 1 kg의 범위일 것이고, 사용되는 단백질의 전형적인 범위는 예를 들면 1일 투여되는 약 0.3 내지 약 20 mg/kg, 바람직하게는 약 0.3 내지 약 15 mg/kg이다. 예를 들면, 단백질은 매 1, 2, 3, 또는 4주 약 100 또는 400 mg의 용량으로 투여될 수 있거나 또는 매 1, 2, 3, 또는 4주 약 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5.0, 5.5, 6.0, 6.5, 7.0, 7.5, 8.0, 8.5, 9.0, 9.5, 10.0, 15.0, 또는 20.0 mg/kg의 용량으로 투여된다. 용량은 단일 용량 또는 다중 용량 (예를 들면, 2 또는 3 용량), 예컨대 주입으로서 투여될 수 있다. 이러한 요법의 진행은 종래의 기술에 의해 용이하게 모니터링된다.
IV. 폴리소르베이트의 분해의 감소 방법
폴리소르베이트를 포함하는 수성 제형에서 폴리소르베이트 분해를 감소시키는 방법이 본원에 제공되며, 이는 사이클로덱스트린을 제형에 첨가하는 단계를 포함한다. 또한, 폴리소르베이트를 포함하는 수용액에서 가시적 및 비가시적 입자의 양을 감소시키는 방법이 본원에 제공되며, 이는 사이클로덱스트린을 제형에 첨가하는 단계를 포함한다. 또한, 본 발명은 수용액에서 폴리소르베이트 분해 생성물을 분해하고, 가용화시키는 방법을 포함하며, 이는 사이클로덱스트린을 제형에 첨가하는 단계를 포함한다. 일부 구현예에서, 제형은 추가로 폴리펩티드, 핵산, 지질 및/또는 탄수화물을 포함한다.
폴리비닐피롤리돈 (PVP) 및 폴리소르베이트를 포함하는 수성 제형에서 폴리소르베이트를 감소시키는 방법이 본원에 제공된다. 또한, 폴리소르베이트를 포함하는 수용액에서 가시적 및 비가시적 입자의 양을 감소시키는 방법이 본원에 제공되며, 이는 PVP를 제형에 첨가하는 단계를 포함한다. 또한, 본 발명은 수용액에서 폴리소르베이트 분해 생성물을 분해하고, 가용화시키는 방법이 제공되며, 이는 PVP를 제형에 첨가하는 단계를 포함한다. 일부 구현예에서, 제형은 추가로 폴리펩티드, 핵산, 지질 및/또는 탄수화물을 포함한다.
일부 구현예에서, 폴리소르베이트는 약 0.001% 내지 약 0.4%의 범위 또는 이 값들 사이의 임의의 범위이다. 특정 구현예에서, 폴리소르베이트는 약 0.001% 내지 약 0.4%, 약 0.01% 내지 약 0.4%, 약 0.01% 내지 약 0.3%, 약 0.01% 내지 약 0.2%, 또는 약 0.01% 내지 약 0.1%의 범위이다. 일부 구현예에서, 제형은 약 0.001%, 약 0.005%, 약 0.01%, 약 0.02% 약 0.03% 약 0.04%, 약 0.05%, 약 0.06%, 약 0.07%, 약 0.08%, 약 0.09%, 약 0.1%, 또는 약 0.4%의 폴리소르베이트를 포함한다. 일부 구현예에서, 폴리소르베이트는 폴리소르베이트 20이다. 일부 구현예에서, 폴리소르베이트는 폴리소르베이트 40이다. 일부 구현예에서, 폴리소르베이트는 폴리소르베이트 60이다. 일부 구현예에서, 폴리소르베이트는 폴리소르베이트 80이다.
일부 구현예에서, 사이클로덱스트린은 약 0.5% 내지 약 30%의 농도로 첨가된다. 일부 구현예에서, 사이클로덱스트린은 약 1% 내지 약 25%, 약 5% 내지 약 20%, 또는 약 10% 내지 약 15%의 범위이다. 추가의 구현예에서, 사이클로덱스트린은 약 0.5%, 약 1%, 약 5%, 약 10%, 약 15%, 약 20%, 약 25%, 또는 약 30%의 농도로 첨가된다. 일부 구현예에서, PVP는 약 0.5% 내지 약 30%의 농도로 첨가된다.
일부 구현예에서, 제형은 10%의 HP-γ 사이클로덱스트린 및 0.03%의 폴리소르베이트 20을 포함하지 않는다. 일부 구현예에서, 제형은 항-CD20 항체, 10%의 HP-γ 사이클로덱스트린 및 0.03%의 폴리소르베이트 20을 포함하지 않는다.
일부 구현예에서, 제형에서의 사이클로덱스트린 대 폴리소르베이트의 생성된 w/w 비는 약 37.5:1 초과이다. 일부 구현예에서, 제형에서의 사이클로덱스트린 대 폴리소르베이트의 생성된 w/w 비는 약 50:1 초과, 약 100:1 초과, 약 150:1 초과, 약 250:1 초과, 약 750:1 초과, 약 1000:1 초과, 또는 약 3000:1 초과이다. 일부 구현예에서, 사이클로덱스트린 대 폴리소르베이트의 w/w 비는 67:1 내지 1000:1가 아니다. 일부 구현예에서, 제형에서의 PVP 대 폴리소르베이트의 w/w 비는 약 37.5:1 초과이다. 일부 구현예에서, 제형에서의 PVP 대 폴리소르베이트의 생성된 비는 250:1이다.
일부 구현예에서, 사이클로덱스트린은 2-하이드록시프로필-β-사이클로덱스트린 (HP-β-CD)이다. 일부 구현예에서, 사이클로덱스트린은 2-하이드록시프로필-α-사이클로덱스트린 (HP-α-CD), 2-하이드록시프로필-γ-사이클로덱스트린 (HP-γ-CD)이다. 일부 구현예에서, 사이클로덱스트린은 설포부틸 에테르 β-사이클로덱스트린 (SBE-β-CD)이다. 일부 구현예에서, 사이클로덱스트린은 β-사이클로덱스트린 (β-CD)이다. 일부 구현예에서, 사이클로덱스트린은 α-사이클로덱스트린 (α-CD)이다. 일부 구현예에서, 사이클로덱스트린은 γ-사이클로덱스트린 (γ-CD)이다.
일부 구현예에서, 수성 제형은 10 mg/mL 내지 250 mg/mL의 범위의 농도로 폴리펩티드를 포함한다. 일부 구현예에서, 폴리펩티드는 250 mg/mL 초과의 농도이다. 일부 구현예에서, 폴리펩티드는 30 mg/mL 내지 150 mg/mL, 50 mg/mL 내지 150 mg/mL, 또는 100 내지 150 mg/mL의 범위의 농도이다.
일부 구현예에서, 수성 제형은 항체를 포함한다. 일부 구현예에서, 항체는 (VEGF); CD20; ox-LDL; ox-ApoB100; 수지; 인간 성장 호르몬 및 소 성장 호르몬을 포함하는 성장 호르몬; 성장 호르몬 방출 인자; 부갑상선 호르몬; 갑상선 자극 호르몬; 지질단백질; 알파-1-항트립신; 인슐린 A-사슬; 인슐린 B-사슬; 프로인슐린; 여포자극 호르몬; 칼시토닌; 황체형성 호르몬; 글루카곤; 응고 인자 예컨대 인자 VIIIC, 인자 IX, 조직 인자, 및 폰빌레브란트 인자; 항-응고 인자 예컨대 단백질 C; 심방나트륨 이뇨 인자; 폐 계면활성제; 플라스미노겐 활성제, 예컨대 우로키나제 또는 인간 소변 또는 조직-유형 플라스미노겐 활성제 (t-PA); 봄베신; 트롬빈; 조혈 성장 인자; 종양 괴사 인자-알파 및 -베타; 엔케팔리나제; RANTES (정상적으로 발현되고 분비된 T-세포의 활성화에 대한 조절); 인간 대식세포 염증성 단백질 (MIP-1-알파); 혈청 알부민 예컨대 인간 혈청 알부민; 뮐러관 억제 물질; 릴렉신 A-사슬; 릴렉신 B-사슬; 프로릴락신; 마우스 성선자극 호르몬-관련된 펩타이드; 미생물 단백질, 예컨대 베타-락타마제; DNase; IgE; 세포독성 T-림프구 관련된 항원 (CTLA), 예컨대 CTLA-4; 인히빈; 액티빈; 호르몬 또는 성장 인자에 대한 수용체; 단백질 A 또는 D; 류마티스성 인자; 신경친화성 인자 예컨대 골-유래 신경친화성 인자 (BDNF), 뉴로트로핀-3, -4, -5, 또는 -6 (NT-3, NT4, NT-5, 또는 NT-6), 또는 신경 성장 인자 예컨대 NGF-β; 혈소판-유래된 성장 인자 (PDGF); 섬유아세포 성장 인자 예컨대 aFGF 및 bFGF; 표피 성장 인자 (EGF); 형질전환 성장 인자 (TGF) 예컨대 TGF-알파 및 TGF-베타 (TGF-β1, TGF-β2, TGF-β3, TGF-β4, 또는 TGF-β5 포함); 인슐린-유사 성장 인자-I 및 -II (IGF-I 및 IGF-II); des (1-3)-IGF-I (뇌 IGF-I), 인슐린-유사 성장 인자 결합 단백질; CD 단백질 예컨대 CD3, CD4, CD8, CD19 및 CD20; 에리트로포이에틴; 골유도성 인자; 면역독소; 골 형태형성 단백질 (BMP); 인터페론 예컨대 인터페론-알파, -베타, 및 -감마; 집락 자극 인자 (CSF), 예를 들어, M-CSF, GM-CSF, 및 G-CSF; 인터류킨 (IL), 예를 들어, IL-1 내지 IL-10; 초과산화물 디스무타제; T-세포 수용체; 표면 막 단백질; 붕괴 촉진 인자; 바이러스 항원 예컨대, 예를 들어, AIDS 엔빌로프의 일부; 수송 단백질; 귀소 수용체; 어드레신; 조절 단백질; 인테그린 예컨대 CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 및 VCAM; 종양 관련된 항원 예컨대 HER2, HER3 또는 HER4 수용체; 및 상기-열거된 폴리펩타이드의 임의의 절편에 관한 것이다. 일부 구현예에서, 항체는 항-CD20 항체가 아니다.
일부 구현예에서, 안정화제, 완충액, 계면활성제, 및 등장화제로 이루어진 군으로부터 선택되는 하나 이상의 부형제는 수성 제형에 포함된다. 본 발명의 방법은 pH-완충 용액에서 준비 실시된다. 본 발명의 완충액은 약 pH 4.5 내지 약 9.0의 범위의 pH를 가진다. 특정 구현예에서, pH는 약 4.5 내지 약 7.0의 범위의 pH, 약 4.5 내지 약 6.5의 범위의 pH, 약 4.5 내지 약 6.0의 범위의 pH, 약 4.5 내지 약 5.5의 범위의 pH, 약 4.5 내지 약 5.0의 범위의 pH, 약 5.0 내지 약 7.0의 범위의 pH, 약 5.5 내지 약 7.0의 범위의 pH, 약 5.7 내지 약 6.8의 범위의 pH, 약 5.8 내지 약 6.5의 범위의 pH, 약 5.9 내지 약 6.5의 범위의 pH, 약 6.0 내지 약 6.5의 범위의 pH, 약 6.2 내지 약 6.5의 범위의 pH를 가진다. 특정 구현예에서, 액체 제형은 약 4.7 내지 약 5.2의 범위, 약 5.0 내지 6.0의 범위, 또는 약 5.2 내지 약 5.8의 범위의 pH를 가진다. 본 발명의 특정 구현예에서, 액체 제형은 6.2 또는 약 6.2의 범위의 pH를 가진다. 본 발명의 특정 구현예에서, 액체 제형은 6.0 또는 약 6.0의 pH를 가진다.
이러한 범위 내에서 pH를 조절하는 완충액의 예는 유기산 및 무기산 및 이의 염을 포함한다. 예를 들면, 아세테이트 (예를 들어, 히스티딘 아세테이트, 아르기닌 아세테이트, 아세트산나트륨), 석시네이트 (예를 들어, 히스티딘 석시네이트, 아르기닌 석시네이트, 나트륨 석시네이트), 글루코네이트, 포스페이트, 푸마레이트, 옥살레이트, 락테이트, 시트레이트, 및 이들의 조합. 완충액 농도는 예를 들면 완충액 및 원하는 제형의 등장성에 따라 약 1 mM 내지 약 600 mM일 수 있다.
추가의 계면활성제는 임의로 수성 제형에 첨가될 수 있다. 예시적인 계면활성제는 비이온성 계면활성제 예컨대 폴록사머 (예를 들면 폴록사머 188 등)을 포함한다. 첨가되는 계면활성제의 양은 이것이 제형화된 항체의 응집을 감소시키고 및/또는 제형에서의 미립자의 형성을 최소화하고 및/또는 흡착을 감소시키게 되는 것이다. 예를 들면, 계면활성제는 약 0.001% 내지 약 0.5%, 약 0.005% 내지 약 0.2%, 약 0.01% 내지 약 0.1%, 또는 약 0.02% 내지 약 0.06%, 또는 약 0.03% 내지 약 0.05%의 양으로 제형에 존재할 수 있다. 특정 구현예에서, 계면활성제는 0.04% 또는 약 0.04%의 양으로 제형에 존재한다. 특정 구현예에서, 계면활성제는 0.02% 또는 약 0.02%의 양으로 제형에 존재한다. 일 구현예에서, 제형은 계면활성제를 포함하지 않는다.
종종 "안정화제"로서 알려진 등장화제는 조성물에서 액체의 등장성을 조정하거나 또는 유지하기 위해 존재한다. 큰 하전된 생체분자 예컨대 단백질 및 항체가 사용되는 경우, 이는 대개 "안정화제"로 명명되며, 이는 아미노산 측쇄의 하전된 기와 상호작용할 수 있고, 이에 의해 분자간 및 분자내 상호작용에 대한 잠재성이 줄어들기 때문이다. 등장화제는 다른 성분의 상대적인 양을 고려하여 0.1 중량% 내지 25 중량%, 또는 바람직하게는 1 중량% 내지 5 중량%의 양으로 존재할 수 있다. 바람직한 등장화제는 다가 당 알코올, 바람직하게는 3가 또는 더 고도의 당 알코올, 예컨대 글리세린, 에리트리톨, 아라비톨, 자일리톨, 소르비톨 및 만니톨을 포함한다.
일부 구현예에서, 본 방법은 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 1℃ 내지 약 10℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해되는 것을 야기한다. 일부 구현예에서, 적어도 약 6개월 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 2℃ 내지 약 8℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해된다. 일부 구현예에서, 본 방법은 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 4℃ 내지 약 6℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해된다.
일부 구현예에서, 본 방법은 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 1℃ 내지 약 10에서 제형이 저장된 이후, 1% 미만의 폴리소르베이트가 분해되는 것을 야기한다. 일부 구현예에서, 본 방법은 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 2℃ 내지 약 8℃에서 제형이 저장된 이후, 1% 미만의 폴리소르베이가 분해되는 것을 야기한다. 일부 구현예에서, 본 방법은 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월에 대한 약 4℃ 내지 약 6℃에서 제형이 저장된 이후 1% 미만의 폴리소르베이트가 분해되는 것을 야기한다.
일부 구현예에서, 본 방법은 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 1℃ 내지 약 10℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되는 것을 야기한다. 일부 구현예에서, 본 방법은 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 2℃ 내지 약 8℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되는 것을 야기한다. 일부 구현예에서, 본 방법은 적어도 약 6개월, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월 동안 약 4℃ 내지 약 6℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되는 것을 야기한다.
일부 구현예에서, 본 방법은 적어도 약 1개월, 적어도 약 2개월, 적어도 약 3개월, 적어도 약 4개월, 적어도 약 5개월, 적어도 약 6개월, 적어도 약 7개월, 적어도 약 8개월, 적어도 약 9개월, 적어도 약 10개월, 적어도 약 11개월, 또는 적어도 약 12개월 동안 약 22℃ 내지 약 28℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해되는 것을 야기한다. 일부 구현예에서, 본 방법은 적어도 약 1개월, 적어도 약 2개월, 적어도 약 3개월, 적어도 약 4개월, 적어도 약 5개월, 적어도 약 6개월, 적어도 약 7개월, 적어도 약 8개월, 적어도 약 9개월, 적어도 약 10개월, 적어도 약 11개월, 또는 적어도 약 12개월 동안 약 22℃ 내지 약 28℃에서 제형이 저장된 이후, 1% 미만의 폴리소르베이트가 분해되는 것을 야기한다. 일부 구현예에서, 본 방법은 적어도 약 1개월, 적어도 약 2개월, 적어도 약 3개월, 적어도 약 4개월, 적어도 약 5개월, 적어도 약 6개월, 적어도 약 7개월, 적어도 약 8개월, 적어도 약 9개월, 적어도 약 10개월, 적어도 약 11개월, 또는 적어도 약 12개월 동안 약 22℃ 내지 약 28℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되는 것을 야기한다.
일부 구현예에서, 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 적어도 약 48개월, 적어도 약 54개월, 적어도 약 60개월, 적어도 약 66개월, 또는 적어도 약 72개월 동안 약 -15℃ 내지 약 -25℃에서 제형이 저장된 이후, 5% 미만의 폴리소르베이트가 분해된다. 일부 구현예에서, 본 방법은 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 적어도 약 48개월, 적어도 약 54개월, 적어도 약 60개월, 적어도 약 66개월, 또는 적어도 약 72개월 동안 약 -15℃ 내지 약 -25℃에서 제형이 저장된 이후, 1% 미만의 폴리소르베이트가 분해된다. 일부 구현예에서, 본 방법은 적어도 약 12개월, 적어도 약 18개월, 적어도 약 24개월, 적어도 약 30개월, 적어도 약 36개월, 적어도 약 42개월, 또는 적어도 약 48개월, 적어도 약 54개월, 적어도 약 60개월, 적어도 약 66개월, 또는 적어도 약 72개월 동안 약 -15℃ 내지 약 -25℃에서 제형이 저장된 이후, 0.1% 미만의 폴리소르베이트가 분해되는 것을 야기한다.
본 방법은 비가시적 및 가시적 입자의 수를 감소시키는데 있어서 유효하다. 일부 구현예에서, 1mL당 약 10,000, 약 5,000, 약 1,000, 약 500, 약 250, 약 150, 약 100, 약 50, 또는 약 25개 미만의 입자 (1.4 μ 직경 초과)가 형성된다. 일부 구현예에서, 제형은 1mL당 약 10,000, 약 5,000, 약 1,000, 약 500, 약 250, 약 150, 약 100, 약 50, 또는 약 25개 미만의 입자 (2 μ 직경 초과)가 형성된다. 일부 구현예에서, 1mL당 약 1250, 약 150, 약 100, 약 50, 약 25, 약 20, 약 15, 약 10, 약 5, 약 4, 약 3, 약 2, 또는 약 1개 미만의 입자 (5 μ 직경 초과)가 형성된다. 일부 구현예에서, 1mL당 약 250, 약 150, 약 100, 약 50, 약 25, 약 20, 약 15, 약 10, 약 5, 약 4, 약 3, 약 2, 또는 약 1개 미만의 입자 (10 직경)가 형성된다. 일부 구현예에서, 1mL당 약 250, 약 150, 약 100, 약 50, 약 25, 약 20, 약 15, 약 10, 약 5, 약 4, 약 3, 약 2, 또는 약 1개 미만의 입자 (15 μ 직경 초과)가 형성된다. 일부 구현예에서, 1mL당 약 250, 약 150, 약 100, 약 50, 약 25, 약 20, 약 15, 약 10, 약 5, 약 4, 약 3, 약 2, 또는 약 1개의 입자 (25 μ 직경 초과)가 형성된다.
제형에 있어서 폴리소르베이트 분해 생성물을 재가용화시키는 방법이 또한 본원에 제공된다. 일부 구현예에서, 제형에 존재하는 직경이 1.4 μ 초과하는 입자의 수는 폴리소르베이트를 첨가한 이후에 100, 1000, 2000, 5000, 또는 10000배까지 감소된다. 일부 구현예에서, 제형에 존재하는 직경이 2 μ 초과하는 입자의 수는 폴리소르베이트를 첨가한 이후에 100, 1000, 2000, 5000, 또는 10000배까지 감소된다. 일부 구현예에서, 제형에 존재하는 직경이 5 μ 초과하는 입자의 수는 폴리소르베이트를 첨가한 이후에 100, 1000, 2000, 5000, 또는 10000배까지 감소한다. 일부 구현예에서, 제형에 존재하는 직경이 10 μ 초과하는 입자의 수는 폴리소르베이트를 첨가한 이후에 100, 1000, 2000, 5000, 또는 10000배까지 감소된다. 일부 구현예에서, 제형에 존재하는 직경이 15 μ 초과하는 입자의 수는 폴리소르베이트를 첨가한 이후에 100, 1000, 2000, 5000, 또는 10000배까지 감소된다. 일부 구현예에서, 제형에 존재하는 직경이 25 μ 초과하는 입자의 수는 폴리소르베이트를 첨가한 이후에 100, 1000, 2000, 5000, 또는 10000배까지 감소된다.
V. 제품
본 발명의 다른 구현예에서, 본 발명의 액체 제형을 유지하고, 임의로 이의 사용을 위한 지침을 제공하는 용기를 포함하는 제품이 제공된다. 적합한 용기는 예를 들면, 병, 바이알, 및 주사기를 포함한다. 용기는 다양한 물질 예컨대 유리 또는 플라스틱으로 형성될 수 있다. 예시적인 용기는 3-20 cc 일회용 유리 바이알이다. 대안적으로, 다중용량 제형의 경우, 용기는 3-100 cc 유리 바이알일 수 있다. 용기는 제형, 및 그 위에 또는 이와 결합된 라벨을 보유하고, 용기는 사용 방향을 나타낼 수 있다. 제품은 추가로 상업적 및 사용자 견지로부터 바람직한 다른 물질을 포함할 수 있고, 이는 다른 완충액, 희석액, 필터, 바늘, 주사기, 및 사용 지시를 갖는 패키지 삽입물을 포함한다.
VI. 키트
본 발명의 다른 구현예에서, 폴리소르베이트 분해를 감소시키기 위한 키트가 제공된다. 일부 구현예에서, 본 발명은 본원에 기재된 방법에 의해 폴리소르베이트 분해를 감소시키는데 사용하기 위한 키트를 제공한다. 일부 구현예에서, 본원에 제공된 임의의 제형을 포함하는 키트가 제공된다. 일 구현예에서, 이러한 키트는 치료적 펩티드 또는 항체의 수성 제형 및 수성 제형에 첨가될 수 있는 사이클로덱스트린의 용액의 용기를 포함하며, 여기서 사이클로덱스트린 대 폴리소르베이트의 비는 37.5:1 초과이다. 일 구현예에서, 이러한 키트는 치료적 펩티드 또는 항체의 수성 제형 및 수성 제형에 대해 첨가될 수 있는 폴리비닐피롤리돈 (PVP)의 용액의 용기를 포함하고, 여기서 PVP 대 폴리소르베이트의 비는 37.5:1 초과이다.
명세서는 당업자가 발명을 수행할 수 있기에 충분한 것으로 고려된다. 본원에 나타내고 기재된 것들뿐만 아니라 발명의 다양한 변형은 이전의 기재로부터 당업자에게 자명하게 되고 첨부된 청구범위 내에 속한다. 모든 공개물, 특허 및 특허 출원은 모든 목적을 위해 이의 전문이 참조로 본원에 인용된다.
실시예
본 발명은 하기의 실시예를 참조로 보다 완전하게 이해된다. 이들은 그러나 본 발명의 범위를 제한하는 것으로서 해석되지 말아야 한다. 본원에 기재된 실시예 및 구현예가 단지 설명을 목적하는 것이고 이의 관점에서 다양한 변형 또는 변화가 당업자에게 제안되고 본원의 취지 및 이해의 범위 내 및 첨부된 청구범위 내에 포함되어야 하는 것으로 이해된다.
물질 및 방법
물질
하이드록시프로필-β-사이클로덱스트린 (HP-β-CD)을 Ashland Inc. (애슐랜드, 켄터키주 소재)로부터 Cavitron W7 HP5 Pharma로서 구입하였다. 설포부틸에테르-β-사이클로덱스트린 (SBE-β-CD)을 Ligand Pharmaceuticals (라호야, 캘리포니아주 소재)로부터 Captisol로서 구입하였다. 하이드록시프로필-알파-사이클로덱스트린 (HP-α-CD), 하이드록시프로필-γ-사이클로덱스트린 (HP-γ-CD), 폴리에틸렌 글리콜 (PEG 1500), 및 메티오닌을 Sigma Aldrich (세인트 루이스, 미주리주 소재)로부터 구입하였다. 폴리비닐피롤리돈 (PVP)을 Spectrum Chemical (가디너, 캘리포니아주 소재)로부터 KollidonPovidone K-157로부터 구입하였다. 폴리소르베이트 20 (PS20)을 Croda Inc. (뉴캐슬, 델라웨어주 소재)로부터 구입하였다. 돼지 췌장 리파아제 (PPL), Burkholderia sp.로부터의 지질단백질 리파아제 (LPL), 칸디다 안타르티카 리파제 B (CALB), 토끼 간 에스테라아제 (RLE), 및 2,2'-아조비스(2-메틸프로피온아미딘) 디하이드로클로라이드 (AAPH)를 Sigma Aldrich (세인트 루이스, 미주리주 소재)로부터 구입하였다.
HIAC에 의한 비가시적 입자 수의 결정
비가시적 입자를 HRDL-150 검출기 및 1 mL 주사기가 구비된 HIAC 9703 입자 계수기를 사용하여 측정하였다. 기기의 성능을 각 측정 기간 이전에 3000 수/mL에서 NIST-추적가능한 2 μm 폴리스티렌 비드 표준으로 증명하였다. HIAC 기기를 10 mL/min 유량, 0.1 mL 테어 체적, 및 0.4 mL 샘플 체적으로 구성하였다. 샘플은 0.4 mL 분량의 4회 실시를 사용하여 분석될 수 있고, 샘플 캐리 오버로 인한 측정 오차를 방지하기 위해 각 샘플의 최초 실시는 폐기하였다. 1.4, 2, 5, 10, 15, 및 25, 50 μm 분석 필터 크기에 대해 평균 값으로서 결과를 기록하였다.
폴리소르베이트 농도의 결정
폴리소르베이트 농도를 증기화 광산란 검출(RP-ELSD)을 사용하는 역상 고성능 액체 크로마토그래피를 사용하여 결정하였다. 샘플을 Waters Oasis MAX 카트리지 컬럼 (20 x 2.1 mm, 30 μm 입자크기)가 고정된 Agilent 1100 시리즈 고성능 액체 크로마토그래피 시스템 (HPLC)을 사용하여 분석하였다. HPLC 시스템은 컬럼 흐름을 100℃로 설정된 폐기물 또는 Varian 380-LC 증기화 광산란 검출기로 유도하는 스위칭 밸브를 사용하여 설정하였다. 이동상은 수중에서 2% 포름산 (펌프 A) 및 이소프로판올 중의 2% 포름산 (펌프 B)로 이루어져 있다. 펌프 구배는 평형화 과정에서 10% 펌프 B에서 등용매(isocratic), 1분 동안 20% 펌프 B에 대해 선형(linear), 2.4분 동안 20% 펌프 B에 대해 등용매, 0.1분 동안 100% 펌프 B에 대해 선형, 1.1분 동안 100% 펌프 B에 대해 등용매, 0.1분 동안 10% 펌프 B에 대해 선형, 최종적으로 1.9분 동안 10% 펌프 B에 대해 등용매이었다. 스위칭 밸브는 매 주입 초기마다 컬럼 흐름을 폐기물로 유도하였고, 이후 흐름을 구배의 종료시까지 2.4분 이후에 검출기로 유도하였다. PS20 농도를 정량화하기 위해, 표준 곡선을 0% w/v 내지 0.4% w/v PS20을 함유하는 20μL의 용액을 주입하여 생성하였다. 컬럼을 통한 PS20의 이동 시간에 영향을 주는 부형제의 경우, 관련 부형제를 포함하는 PS20 표준 곡선 용액은 정확한 정량화를 용이하게 위해 분석시 포함되었다.
Seidenader에 의한 가시적 입자 이미지화
60도로 기울어진 바이알 캐리지가 구비된 Seidenader V90-T 육안 검사 유닛 (Markt Schwaben, 독일)을 사용하여 바이알을 가시적 미립자에 대해 조사하였다. 홀더에 유리 바이알을 배치하고, 바이알의 바닥을 통해 유도되는 틴들 광의 존재 하에 회전시켜 샘플의 가시적 입자 조사를 수행하였다. 예비 회전 (즉, 급속 회전)을 우선 수행하여 액체를 진탕시키고, 현탁시키고, 입자를 순환시켰다. 회전 및 광조사 이후, 입자는 움직이고, 광은 입자의 반사로 이들이 가시적이게 하였다 (즉, 틴들 효과). 가시적 입자는 이후 확대 렌즈를 사용하여 관찰되었다. 비디오 및 사진은 삼성 (서울, 한국 소재) 갤럭시 장치를 사용하여 얻었다.
혼탁도의 결정
혼탁도를 UV 분광학을 사용하여 결정하였다. Chemstation 소프트웨어 (Agilent Technologies, 산타 클라라, CA 소재)를 사용하는 Agilent 8453 분광 광도계 상에서 1-cm 경로 길이를 갖는 석영 큐벳에서 279 nm 및 320 nm에서의 흡수도를 기록함으로써 각 샘플의 UV 흡수도를 측정하였다 .
단백질 농도의 결정
단백질 농도를 Chemstation 소프트웨어 (Agilent Technologies, 산타 클라라, CA 소재)를 사용하는 Agilent 8453 분광 광도계 상에서 1-cm 경로 길이를 갖는 석영 큐벳에서 340 nm 내지 360 nm의 평균 흡수도를 기록하여 측정되는 각 샘플의 UV 흡수도에 의해 측정하였다. UV 농도 결정값을 각 단백질에 대해 실험적으로 결정된 흡수율을 사용하여 계산하였다. 측정값을 적절한 완충액에 대해 참조하였다.
실시예 1: 폴리소르베이트의 산화적 분해
산화적 PS20 분해를 억제하는 사이클로덱스트린의 능력을 2,2'-아조비스이소부티르아미디늄 (AAPH)을 사용하여 평가하였고, 이는 PS20를 분해하는 것으로 종래에 알려져 있다 (Borisov 등, J. Pharm. Sci. 104:1005-1018 (2015)). PS20의 산화를 억제하는 사이클로덱스트린의 능력을 평가하기 위해, 15% (w/v) HP-β-CD 또는 15% (w/v) 수크로오스를 포함하는 샘플을 대조군 샘플 (임의의 추가적인 부형제 없음)과 비교하였다. 폴리소르베이트 20 분해를 24시간 동안 40℃에서 5 mM AAPH로 산화된 부형제 없음 (대조군), 15% (w/v) 수크로오스, 및 15% (w/v) HP-β-CD를 포함하는 샘플에 대해 RP-ELSD에 의해 결정하였다.
도 1에 나타난 바와 같이, 데이터는 HP-β-CD 및 수크로오스 모두가 PS20의 분해 양을 감소시키는 것을 입증한다. AAPH와의 인큐베이션 이후, PS20 분해의 상대적 백분율에 있어서의 17.9의 감소는 대조군 샘플에서 관측되었다. 반대로, PS20 분해 백분율에서의 9.8 및 3.6의 더 작은 감소가 각각 15% (w/v) 수크로오스 및 HP-β-CD를 포함하는 샘플에 대해 관측되었다.
실시예 2: 폴리소르베이트 20의 효소적 분해에 대한 HP-β-CD의 억제 효과
PS20의 효소적 분해에 대한 15% HP-β-CD의 효과를 측정하였다. 추가의 부형제 없음, 15% 수크로오스, 또는 15% HP-β-CD를 포함하는 pH 5.5 완충액에서의 0.02% PS20의 샘플을 실온에서 효소 돼지 췌장 리파아제 (PPL), 지질단백질 리파아제 (LPL), 칸디다 안타르티카 리파제 B (CALB), 및 토끼 간 에스테라아제 (RLE) 각각으로 증해시켰다. PPL은 4.5 시간 동안 15 μg/mL 효소로 증해시켰다. LPL 샘플을 5 시간 동안 70 μg/mL 효소로 증해시켰다. CALB 샘플을 1시간 동안 0.1 mg/mL 고정화 효소로 증해시켰다. RLE 샘플을 5시간 동안 15 μg/mL 효소로 증해시켰다. 모든 증래를 실온에서 실시하였다.
PPL 증해를 30분 동안 85℃ 수조에서 열 불활성화에 의해 중지하였다. LPL 및 RLE 증해는 샘플이 PS20 함량에 대해 즉각적으로 분석되도록 열 불활성화에 의해 중지할 수 없었다. CALB 증해를 고정화 효소 비드를 여과 제거함으로써 중지하였다. 입자 형성이 가능하도록, CALB 샘플을 5℃에서 밤새 정치하였다. RLE 및 LPL 샘플을 -20 ℃에서 밤새 냉동시켜 효소 활성을 지연시키고, 입자 분석 직전에 얼음을 해동시켰다.
상기 논의된 바와 같이, 모든 샘플을 인라인 증기화 광산란 검출기 (Varian 380-LC 시리즈)를 갖는 고성능 액체 크로마토그래피 (Agilent 1100 시리즈)에 의해 PS20 함량에 대해 분석하였다. 시각적 입자 검사를 Seidenader 시각 검사 기기 상에서 실시하였다. 비가시적 입자 분석을 HIAC 9703 입자 계수기 상에서 실시하였다.
CALB, RLE, 및 LPL로 처리된 샘플은 PS20에 있어서 59.2% - 68.3% 감소를 나타내었다 (도 2). 반면, 15%의 HP-β-CD를 함유하는 샘플은 PS20 분해의 상당한 억제를 나타내었다. 구체적으로, 이러한 샘플에 대해, PS20 농도는 14.3% - 37.4%까지 감소하였다 (도 2 및 표 1).
표 1 - CALB, LPL, 및 RLE에 의한 폴리소르베이트 20의 효소적 분해
추가적으로, HIAC 데이터는 15% (w/v) HP-β-CD가 비가시적 미립자 (SVP)의 형성을 감소시켰음을 입증한다. 복수개의 효소 (CALB, LPL, 및 RLE)로의 효소적 분해 이후, 15% (w/v) HP-β-CD이 샘플에 포함되는 경우에, 소수의 SVP/mL이 모든 입자 크기 분류 (≥2, ≥5, ≥10, 및 ≥25 마이크론 입자)에 대해 관찰되었다. 유사한 결과가 LPL 및 RLE에 대해 얻어졌고; 그러나, 매우 소량의 ≥10 및 ≥25 마이크론 입자는 ≥10 및 ≥25 마이크론 입자수 측정값의 해석에서 배제된다 (도 3a-3d).
이러한 발견은 HP-β-CD, 대표적인 사이클로덱스트린 복합체가 복수개의 효소에 의해 PS20의 효소적 분해를 억제할 수 있음을 입증한다. 이론에 구속됨 없이, 이는 사이클로덱스트린 분자에 의한 PS20의 보호의 주요 메커니즘이 사이클로덱스트린과 폴리소르베이트 분자들 사이의 직접 상호작용에 관련됨을 제시할 수 있다.
실시예 3: 폴리소르베이트
80의 효소적 분해에 대한 HP-β-CD의 억제 효과
PS80의 효소적 분해에 대한 15% (w/v) HP-β-CD의 효과를 측정하였다. 0% 및 15% (w/v) HP-β-CD를 포함하는 pH 5.5 완충액에서의 0.02% (w/v) PS80의 샘플을 실온에서 5시간 동안 15 μg/mL의 돼지 췌장 리파아제(PPL)로 증해시켰다. PPL 증해를 30분 동안 85℃ 수조에서의 열 불활성화에 의해 중지시켰다.
PPL 증해 이후, RP-ELSD는 PS80에서 대략 19의 상대적 백분율의 감소를 나타내었다 (도 4). 반면, 대략 4%의 PS80 분해의 감소가 15% (w/v)의 HP-β-CD를 포함하는 샘플에서 관찰되었다.
추가적으로, HIAC 데이터는 15% (w/v)의 HP-β-CD가 비가시적 미립자 (SVP)의 평균 (n=3) 정량을 감소시켰음을 입증한다. PPL로의 효소적 분해 이후, 15% (w/v)의 HP-β-CD가 샘플에 포함된 경우에, 소수의 SVP/mL이 모든 입자 크기 분류 (≥1.4, ≥2, ≥5, ≥10 및 ≥25 마이크론 입자)에 대해 관찰되었다 (도 5a-5f).
이러한 발견은 HP-β-CD, 대표적인 사이클로덱스트린 복합체는 PS80의 효소적 분해를 억제할 수 있음을 입증한다. 이러한 결과는 폴리소르베이트 분해를 감소시키고, 입자 형성을 감소시키고, 존재하는 입자를 가용화시키는 사이클로덱스트린의 능력이 일반적으로 폴리소르베이트 분자의 부류 (예를 들면, PS20, PS40, PS60, PS80 등)에 적용가능함을 제시한다. 이론에 구속됨 없이, 이는 사이클로덱스트린 분자에 의한 폴리소르베이트의 보호의 주요 메커니즘이 사이클로덱스트린과 모든 폴리소르베이트 분자를 포함하는 전환된 화학 구조 하위유닛 (예를 들면, 지방산)과의 직접적 상호작용을 수반한다는 것을 제시할 수 있다.
실시예 4: 폴리소르베이트 20의 효소적 분해의 키네틱
효소적 PS20 분해의 키네틱을 평가하기 위해, 샘플을 실온에서 15 μg/mL의 PPL으로 증해시켰고, 0.02% (w/v) PS20 및 15% 수크로오스, 15% HP-β-CD, 또는 15% HP-α-CD를 포함하는 단백질 무함유 샘플을 약 25 ℃에서 180시간 동안 인큐베이션시킨 PPL을 사용하여 증해시켰다. 상기에 기재된 바와 같이, 모든 샘플을 인라인 증기화 광산란 검출기 (Varian 380-LC 시리즈)를 갖는 고성능 액체 크로마토그래피 (Agilent 1100 시리즈)에 의해 PS20 함량에 대해 분석하였다. 비가시적 입자 분석을 HIAC 9703 입자 계수기 상에서 실시하였다.
도 6에서의 15% 수크로오스 곡선은 PS20 분해는 일단계 지수함수형 붕괴(one phase exponential decay)로 기재될 수 있다. 반감기는 44%의 플래토(plateau)와 함께 32.91시간이다 (도 6). 이러한 분해 키네틱은 후속 연구를 위해 4.5 시간 동안 25℃에서 PPL을 사용하는 4.5 시간 증해 모델의 사용을 제시한다.
실시예 5: 폴리소르베이트의 효소적 분해에 대한 사이클로덱스트린 및 다른 부형제의 억제 효과
HP-α-CD, HP-β-CD, HP-γ-CD, SBE-β-CD, PVP, PEG 1500, 수크로오스, 및 메티오닌을 포함하는 효소적 가수분해에 대해 PS20을 보호하는 이의 능력에 대해 다수의 부형제가 시험되었다. 효소 첨가 이후 0.02%의 PS20의 최종 농도를 포함하는 pH 5.5 완충액 중의 각각의 부형제의 용액을 제조하였다. 부형제 용액에서의 HP-α-CD, HP-β-CD, HP-γ-CD, 및 SBE-β-CD의 농도는 106 mM이었다. 메티오닌 샘플은 용해도 제한으로 인해 10 mg/mL 메티오닌을 포함하였다. 나머지 부형제 (PVP, PEG 1500, 수크로오스)를 HP-β-CD의 %w/v를 일치시키기 위해 15% w/v로 첨가하였다. 샘플을 실온에서 4.5시간 동안 15 μg/mL의 PPL 효소로 증해시켰고, 이후 85℃에서 30분의 열 불활성화를 후속하였다. 각 샘플을 인라인 증기화 광산란 검출기가 구비된 고성능 액체 크로마토그래피를 사용하여 PS20 농도에 대해 분석하였다. 샘플을 이후 5℃에서 밤새 정치시켜 입자가 형성되게 하였고, 앞서 기재된 바와 같이 가시적 및 비가시적 입자에 대해 분석하였다.
RP-ELSD 결과는 부형제 부류가 효소적 PS20 분해의 정도를 결정하는데 중요함을 입증한다 (도 7). 효소 증해 이후, 대조군 샘플 (즉, 부형제 없음)은 PS20 분해에 있어서 58% 감소를 가졌다. 58%의 PS20의 동등한 감소가 15% (w/v) 수크로오스를 포함하는 샘플에 대해 관찰되었다. 이러한 발견은 수크로오스, 아크릴 이당 (즉, 수크로오스)가 효소적 PS20 분해에 대해 억제 효과를 가지지 않음을 입증한다. 사이클로덱스트린의 억제 효과는 단독으로 질량 희석 효과(mass dilution effect)에 기여할 수 없고, 이는 결과가 동등 질량의 다른 부형제 (예를 들면, 수크로오스)가 촉매적 폴리소르베이트 분해를 완화하지 못함을 입증하기 때문이다.
마찬가지로, 메티오닌을 포함하는 샘플은 효소적 PS20 분해 또는 SVP 형성에 대해 억제 효과를 가지지 못하였다 (도 7 및 8a-8d). 아마도, 메티오닌은 산화적 PS20 분해를 방지할 것이나, 효소적 PS20 분해를 방지하지 못할 것이다. 이론에 구속됨 없이, 이러한 실험에서 재생성된 PS20 분해의 메커니즘은 가수분해와 유사하며, 산화적 PS20 분해와는 별개의 것이다.
그 결과는 PEG가 대조군 샘플에 대해 상대적으로 PS20 분해에 대해 작은 억제 효과를 가지는 것을 입증한다. 51% PS20의 감소는 5% (w/v)의 PEG 1500을 포함하는 샘플에 대해 관찰되었다.
모든 평가된 사이클로덱스트린 분자 (HP-α-CD, HP-β-CD, 및 SBE-β-CD)는 효소적 PS20 분해 및 SVP 형성에 대해 상당한 억제 효과를 가졌다 (도 7 및 8a-8d). 흥미롭게도, 당 하위유닛의 수는 사이클로덱스트린에 의한 억제의 범위를 결정함에 있어 중요할 수 있다. 예를 들면, 1% 및 7%의 PS20의 감소는 각각 HP-α-CD 및 HP-β-CD에 대해 관찰되었다.
추가의 연구는 사이클로덱스트린 고리 크기의 중요성을 추가로 이해하기 위해 HP-α-CD, HP-β-CD, 및 HP-γ-CD의 중요성을 평가하기 위해 수행되었다. 도 9에 나타난 데이터는 상당한 PS20 분해가 HP-α-CD 및 HP-β-CD를 함유하는 샘플에 대해 관찰되지 않았음을 나타내고; 반면, PS20 분해에서의 ~82%는 15%의 HP-γ-CD를 포함하는 샘플에서 관찰되었다. 마찬가지로, PS20 농도에서의 상당한 감소는 대조군 샘플에서 관찰되었다 (즉, 부형제 없음 및 15% 수크로오스) (도 9). 이러한 발견은 더 작은 사이클로덱스트린 HP-α-CD (공극 직경: 4.7-5.2 Å; 공극 체적: 174 Å3) 및 HP-β-CD (공극 직경: 6.0-6.5 Å; 공극 체적: 262 Å3)이 HP-γ-CD (공극 직경: 7.5-8.3 Å; 공극 체적: 472 Å3)보다 폴리소르베이트 20 분해에 있어서 더 효과적인 억제제임을 입증한다.
각 사이클로덱스트린에 대한 공극의 치수 및 체적은 각 사이클로덱스트린의 물리 화학적 특성 이외에 효소적 PS20 분해의 분자 억제제로서의 이의 유효성을 결정할 수 있다. 이론에 구속됨 없이, 이러한 발견은 보호의 메커니즘은 사이클로덱스트린과 폴리소르베이트 20 반응 부위 사이에서 호스트-게스트 복합체형성(host-guest complexation)을 수반할 수 있음을 제시한다.
실시예 6: 사이클로덱스트린 및 부형제에 의한 효소적 폴리소르베이트 20 분해와 관련된 가시적 및 비가시적 입자의 가용화
다수의 부형제를 효소적 PS20 분해의 결과로서 생성된 입자를 가용화하는 이의 능력에 대해 시험하였다. 농축된 HP-α-CD, HP-β-CD, HP-γ-CD, SBE-β-CD, PVP, PEG 1500, 수크로오스, 및 메티오닌의 용액을 pH 5.5 완충액에서 3회 제조하였다. 효소적 PS20 분해로부터의 입자를 제조하였다. pH 5.5 완충액에서의 0.05%의 PS20의 3개의 용액을 실온에서 4.5 시간 동안 37.5 μg/mL PPL을 사용하여 분해하였고, 이후 85℃에서 30분의 열 불활성화를 후속하였다. 분해된 PS20 용액을 5℃에서 정치시키고, 이후 입자를 결정화시켰다.
분해된 PS20 용액에서의 입자의 형성 이후, 나머지 샘플 제조를 5℃ 냉각실에서 실시하여 PS20 유래 입자가 용해되는 것을 방지하였다. 각각의 분해된 PS20 용액을 11개의 앨리쿼트로 나누었고, 농축된 부형제를 각 앨리쿼트로 스파이킹시켰다. 각 샘플에서의 부형제의 최종 농도는 하기와 같았다: 5% 수크로오스, 10 mg/mL 메티오닌, 5% PVP, 5% PEG 1500, 15% HP-β-CD, 5% HP-β-CD, 0.5% HP-β-CD, 35.5 mM HP-α-CD, 35.5 mM HP-γ-CD, 및 35.5 mM SBE-CD. 각 부형제의 첨가 이후, 샘플을 5℃에 밤새 두었다. 다음날, 바이알을 Seidenader 시각 검사 기기 하에 가시적 입자에 대해 조사하였다. 비가시적 입자수를 HIAC 9703 입자 계수기를 사용하여 측정하였다.
결과는 사이클로덱스트린 (HP-α-CD, HP-β-CD, 및 HP-γ-CD)이 대조군 및 다른 부형제 샘플에 비해 SVP의 양을 상당하게 감소시킬 수 있음을 입증한다 (도 10a 및 10b). 이러한 결과는 효소적 폴리소르베이트 분해 이외에, 사이클로덱스트린은 또한 폴리소르베이트 20의 효소적 증해로부터 생성된 PS20 분해물을 가용화시킬 수 있다는 것을 확립하였다.
추가적으로, 사진을 15% (w/v)의 HP-β-CD의 첨가 직전 및 직후에 촬영하였다. 사진은 15% (w/v) HP-β-CD의 첨가 이전 (도 11a) 및 이후 (도 11b) PS20-관련된 가시적 입자의 가용화를 보여준다. 사진에 나타낸 가시적 입자의 직각적 가용화는 사이클로덱스트린이 PS20 분해와 관련된 가시적 및 비가시적 입자의 용해도를 증가시킬 수 있다는 강력한 증거를 제공한다.
실시예 7: 사이클로덱스트린에 의한 산화적 폴리소르베이트 20 분해와 관련된 가시적 및 비가시적 입자의 가용화
상이한 농도의 HP-β-CD를 산화적 PS20 분해의 결과로서 생성된 입자를 가용화시키는 이의 능력에 대해 시험하였다. 농축된 HP-β-CD의 용액을 pH 5.5 완충액에서 3회 제조하였다. 0.02% (w/v)의 PS20을 포함하는 단백질 무함유 샘플을 5℃에서 27개월 동안 저장하였고, 이는 산화적 PS20 분해 및 PS20 분해 생성물과 관련된 가시적 및 비가시적 입자의 형성을 야기한다. 각 분해된 PS20 용액을 3개의 앨리쿼트로 나누었고, 농축된 부형제는 각 앨리쿼트로 스파이킹시켰다. 각 샘플에서의 부형제의 최종 농도는 하기와 같았다: 0% (w/v) HP-β-CD (대조군), 5% (w/v) HP-β-CD, 및 15% (w/v) HP-β-CD. HP-β-CD 농도 조정 이후, 샘플을 밤새 5℃에서 두었다. 다음날, 비가시적 입자수를 HIAC 9703 입자 계수기를 사용하여 측정하였다.
SVP의 재가용화에 대한 HP-β-CD의 0%, 5% 및 15% (w/v) 농도의 효과를 시험하였다. 그 결과는 대조군 샘플 (0% HP-β-CD)에 대한 HP-β-CD를 포함하는 샘플에서의 SVP에서의 상당한 감소가 존재하는 것을 입증한다. 도 12a-12f에 나타난 바와 같이, 15% HP-β-CD는 1.4 마이크론 이상의 입자를 효과적으로 재가용화시키고, 반면 5%의 HP-β-CD는 2 마이크론 이상의 입자를 효과적으로 재가용화시킨다.
이러한 결과는 효소적 폴리소르베이트 분해를 방지하고, 폴리소르베이트 20의 효소적 분해로부터 생성된 PS20 분해물을 가용화시키는 것 이외에, 사이클로덱스트린은 폴리소르베이트 20의 산화적 증해로부터 야기된 PS20 분해 생성물을 가용화시킬 수 있음을 확립한다.
실시예 8: PS20 분해에 대한 HP-β-CD 농도 및 HP-β-CD:PS20 비의 효과
PS20 분해에 대한 HP-β-CD 농도의 효과를 결정하기 위해, 0.001, 0.01, 0.1, 1, 5, 또는 15%의 PS20을 포함하는 샘플을 4.5 시간 동안 15 μg/mL의 PPL을 사용하여 증해시켰다. 도 13에 나타낸 바와 같이, HP-β-CD의 양을 증가시키는 것은 PS20 분해를 감소시켰다.
PS20의 효소적 분해에 대한 상이한 PS20 농도에서의 HP-β-CD 농도의 효과를 효소적 PS20 분해의 억제에 대한 최적 농도를 확인하기 위해 평가하였다. HP-β-CD 농도에 대한 PS20 분해의 종속성을 평가하기 위해, PS20 함량을 다양한 PS20 농도에서 상이한 HP-β-CD 농도를 갖는 3개의 샘플에 대해 RP-ELSD를 사용하여 결정하였다. 0.005% (도 14a), 0.02% (도 14b), 0.1% (도 14c), 및 0.4% PS20 (도 14d)를 포함하는 샘플을 실온에서 4.5 시간 동안 15 μg/mL의 PPL 효소를 사용하여 부형제 없음 (대조군), 0, 0.5, 5, 및 15% (w/v) HP-β-CD를 함유하는 단백질 무함유 샘플에서 증해시켰다. PPL을 PS20의 mg당 75 mg의 PPL의 비로 처리 용액 각각에 첨가하였고, 동일 체적의 완충액을 대조군 용액 첨가하여 효소적 분해에 대한 HP-β-CD 대 폴리소르베이트 비의 효과를 결정하였다. 30분 동안의 85℃에서의 열 활성화에 의해 증해를 중지시켰다. 각 샘플을 상기 기재된 바와 같이 인라인 증기화 광산란 검출기를 갖는 고성능 액체 크로마토그래피를 사용하여 PS20 농도에 대해 분석하였다. 샘플을 이후 5℃에서 밤새 정치시켜 입자가 형성되게 하고, 상기 기재된 바와 같이 가시적 및 비가시적 입자에 대한 분석 과정에서 얼음 위에서 정치시켰다.
표 2 - HP-β-CD 대 PS20 비
일정 양의 사이클로덱스트린이 PS20의 농도에 따라 효소적 PS20 분해의 완전한 억제에 대해 요구되었다 (도 13 및 14a-d). 더 낮은 PS20 농도 (예를 들면, 0.005% PS20 (도 14a)에서, 0.5% HP-β-CD만이 PS20 분해를 완전하게 억제하는데 요구되고, 반면 15% HP-β-CD는 0.1% PS20을 포함하는 샘플에 대해 요구된다 (도 14c). 마찬가지로, 직경이 2, 5, 또는 10 μ보다 큰 비가시적 입자의 형성은 사이클로덱스트린 대 폴리소르베이트의 비에 좌우된다. 0.02% PS20을 포함하는 샘플은 비가시적 입자 형을을 부분적으로 억제하는데 0.5% HP-β-CD을 요구하고, 비가시적 입자 형을을 완전하게 억제하는데 15% HP-β-CD를 요구한다 (도 15a-15c).
이러한 결과는 HP-β-CD 대 PS20 비 (w/w)의 맥락에서 해석될 수 있다 (도 16 및 표 2). PS20 데이터는 충분한 HP-β-CD:PS20 (≥37.5 w/w)가 효소적 PS20 분해를 억제하는데 요구된다 (표 2). 결과는 HP-β-CD 대 PS20 비가 PS20 및 HP-β-CD에 대한 광범위한 농도 범위에 걸쳐 PS20 분해를 결정하는데 있어서 중요하다.
또한, 결과는 HP-β-CD에 의한 PS20 의 억제의 가능한 메커니즘을 설명한다. 이러한 경우, PS20 분해의 양은 억제제 (즉, HP-β-CD) 농도가 고정된 기재 (즉, PS20) 농도에서 증가됨에 따라 에스자형으로 변화된다 (도 13). 이에 따라, 이론에 구속됨 없이, 사이클로덱스트린 농도를 증가시키는 것은 용액에서의 자유 기재 농도를 효과적으로 감소시킬 수 있고, 이는 PS20 분해의 속도를 감소시킨다. 대안적으로, PS20 분해 속도는 기재-억제제 복합체에 의해 억제된다.
실시예 9: 항체 저장 조건 하의
폴리소르베이트 분해
다양한 단백질 분자 부류 (예를 들면, 단클론성 항체 (mAb), 단일-Fab 항체 (sFAb), 및 이중특이적 항체(BsAb))의 영향을 효소적 PS20 분해를 감소시키는 사이클로덱스트린의 능력에 대해 평가하였다. mAb, sFAb, 및 BsAb 약물 기재 샘플을 이의 본래 제형에 제공하였다. 샘플을 투석하고, 20 mg/mL의 최종 단백질 농도로 0.02% PS20를 사용하여 pH 5.5에서 20 mM 히스티딘 아세테이트의 표적 제형으로 컨디셔닝시켰다. 대조군 샘플을 20 mM 히스티딘 아세테이트, pH 5.5, 0.02% PS20을 포함하도록 제조하였다. 각각의 mAb, sFAb, BsAb, 및 대조군 샘플을 하위-앨리쿼트로 나누고, 상이한 양의 (0%, 5%, 및 15%) HPCD를 포함하도록 컨디셔닝 완충액을 사용하여 조정하였다. 샘플을 실온에서 4.5 시간 동안 15 μg/mL의 PPL 효소를 사용하여 증해시켰고, 이후 30분의 85℃의 열 불활성화를 후속하였다. 각각의 샘플을 인라인 증기화 광산란 검출기를 갖는 고성능 액체 크로마토그래피를 사용하여 PS20 농도에 대해 분석하였다. 샘플을 이후 5℃에서 밤새 정치시켜 입자가 형성되게 하였고, 상기 기재된 바와 같이 가시적 및 비가시적 입자에 대해 분석하였다.
결과는 0% HPβCD를 포함하는 각 샘플이 상이한 양의 PS20 분해를 가지는 것을 입증한다. 결과는 단백질을 포함하는 0% HPβCD 샘플 (도 17b-d)는 대조군 샘플에 비해 더 많은 양의 PS20 분해를 가지는 것을 나타낸다 (도 17a). 단백질이 중국 햄스터 난소 (CHO) 또는 E. 콜리 세포로 발현되기 때문에, 단백질 샘플은 다른 불순물 (즉, 리파아제 등)을 포함할 수 있고, 이는 PS20 분해의 전체 양에 기여한다.
0% HPCD 단백질-포함 샘플이 더 많은 양의 PS20 분해를 가지는 것으로 관찰되었지만, 결과는 5% 및 15% HPCD를 포함하는 샘플에서 관찰되는 PS20 분해의 비슷한 양이 존재하는 것을 입증한다. 이러한 결과는 HPCD가 촉매적으로 PS20을 분해하는 불순물의 상이한 양을 가짐에도 불구하고, 평가되는 모든 분자 형태에 대해 촉매적 PS20 분해를 완화하는데 동등하게 유효한 것을 입증한다 (도 17a-d). 이는 단백질 분자의 존재 및 이의 본래 불순물 프로파일은 PS20 분해를 완화하는데 필수적인 사이클로덱스트린 대 단백질 비에 상당하게 영향을 미치지 않음을 확립한다. 이론에 구속됨 없이, 이러한 발견은 촉매적 억제의 메커니즘이 폴리소르베이트를 분해하고 있는 효소가 아닌, PS20와 직접적으로 상호작용하는 사이클로덱스트린 분자를 수반한다는 것을 제시한다. 그렇지 않으면, 폴리소르베이트를 분해하는 추가적인 효소를 갖는 단백질 함유 샘플은 대조군과 비교하여 PS20 분해를 완화하기 위해 더 많은 HPCD를 요구한다. 따라서, 본원에 기재된 사이클로덱스트린 대 PS20 비는 상이한 단백질 분자 및 불순물 프로파일을 포함하는 넓은 범위의 제형에 폭넓게 적용가능할 것이다.
결론
수행된 연구는 폴리소르베이트 (PS20 및 PS80)의 효소적 및 산화적 분해를 억제하는 사이클로덱스트린의 억제를 나타낸다. 결과는 PVP 및 사이클로덱스트린 (즉, HP-α-CD, HP-β-CD, HP-γ-CD, SBE-β-CD)이 PS20의 효소적 분해를 방지할 수 있었음을 증명한다. 추가의 실험은 HP-β-CD가 복수개의 효소 (즉, CALB, RLE, LPL, 및 PLL)의 존재 하에서 폴리소르베이트를 보호하는 것을 입증한다. 이론에 구속됨 없이, 억제 메커니즘은 억제제 (즉, 사이클로덱스트린)와 기재 (즉, 폴리소르베이트) 사이의 상호작용을 수반할 수 있다. 포접 복합체 형성은 자유 기재의 농도를 감소시키고, 또한 포접 복합체(inclusion complex)는 활성 부위와 기재와의 상호작용을 직접적으로 입체적으로 억제할 수 있다. 추가적으로, 농도 연구는 효소적 PS20 분해의 완전한 억제를 제공하는데 필요한 HP-β-CD 대 PS20 비 (≥37.5 w/w)의 최적 범위가 존재하는 것을 확립한다.
효소적 PS20 분해를 억제하는 것 이외에, 결과는 사이클로덱스트린은 비가시적 및 가시적 입자의 양을 효과적으로 감소시키는 것을 입증한다. 이러한 방식으로, 사이클로덱스트린은 용액에서의 비가시적 및 가시적 입자를 분해하고 용해한다. 입자의 형성을 효과적으로 방지하는 것 이외에, 결과는 사이클로덱스트린은 또한 폴리소르베이트 분해와 관련된 존재하는 입자를 효과적으로 가용화시킬 수 있음을 입증한다. 아마도, 사이클로덱스트린은 또한 폴리소르베이트 분해의 생성물인 자유 지방산의 가용성을 증가시킨다.
본 연구로부터의 발견은 확장적 실시 결과를 가진다. 결과는 사이클로덱스트린을 포함하는 제형이 효소적 폴리소르베이트 분해를 방지하기 위해 사용될 수 있다는 강력한 증거를 제공한다. 추가적으로, 사이클로덱스트린은 산화적 및 효소적 분해 모두로부터의 폴리소르베이트 분해와 관련된 자유 지방산을 가용화시키기 위해 사용될 수 있다. 이에 따라, 사이클로덱스트린은 또한 폴리소르베이트 분해와 관련된 분해물 및 입자를 용해하기 위한 의약품에 대한 희석제 또는 재구성 완충액으로서 유용할 수 있다.