KR20170083534A - 키메라 항원 수용체 - Google Patents
키메라 항원 수용체 Download PDFInfo
- Publication number
- KR20170083534A KR20170083534A KR1020177010023A KR20177010023A KR20170083534A KR 20170083534 A KR20170083534 A KR 20170083534A KR 1020177010023 A KR1020177010023 A KR 1020177010023A KR 20177010023 A KR20177010023 A KR 20177010023A KR 20170083534 A KR20170083534 A KR 20170083534A
- Authority
- KR
- South Korea
- Prior art keywords
- human
- region gene
- tcr
- car
- cell
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0278—Humanized animals, e.g. knockin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2833—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3069—Reproductive system, e.g. ovaria, uterus, testes, prostate
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/90—Stable introduction of foreign DNA into chromosome
- C12N15/902—Stable introduction of foreign DNA into chromosome using homologous recombination
- C12N15/907—Stable introduction of foreign DNA into chromosome using homologous recombination in mammalian cells
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2207/00—Modified animals
- A01K2207/15—Humanized animals
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/072—Animals genetically altered by homologous recombination maintaining or altering function, i.e. knock in
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/15—Animals comprising multiple alterations of the genome, by transgenesis or homologous recombination, e.g. obtained by cross-breeding
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/105—Murine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/01—Animal expressing industrially exogenous proteins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/50—Fusion polypeptide containing protease site
Abstract
면역글로불린(Qg)으로부터 유래되는 항원 결합 도메인 및 T 세포 수용체(TCR)로부터 유래되는 불변 도메인을 갖는 키메라 항원 수용체(CAR)와 관련된 방법 및 조성물이 본원에 제공된다.
Description
관련 출원
본 출원은 2015년 5월 28일자로 출원된 가출원 제62/167,650호, 2014년 12월 19일자로 출원된 가출원 제62/094,603호, 2014년 11월 7일자로 출원된 가출원 제62/076,836호, 2014년 9 월 19일자로 출원된 가출원 제62/052,947호 및 2014년 9 월 19일자로 출원된 가출원 제62/052,901호에 대한 우선권의 이익을 주장하며, 이들 각각은 그 전체가 본원에 참조로 포함된다.
서열 목록
본원은 ASCII 포맷으로 전자적으로 제출된 서열 목록을 포함하며, 그 전체가 본원에 참조로 포함된다. 2015년 9월 16일자로 작성된 상기 ASCII 사본은 파일명이 RPB-010.25_SL.txt이며, 크기가 42,074 바이트이다.
유전자 변형 설치류는 많은 항원에 특이적인 치료용 항체의 귀중한 자료가 되는 것으로 입증되었지만, 일부 항원은 표적으로 하기가 어려운 것으로 판명되었다. 따라서, 신규한 치료용 항원 결합 단백질 및 이러한 항원 결합 단백질의 생성에 유용한 방법 및 조성물에 대한 요구가 강하다.
키메라 항원 수용체(CAR)와 관련된 방법 및 조성물이 본원에 제공된다. 예를 들어, CAR 및 CAR 폴리펩티드, CAR 및 CAR 폴리펩티드를 발현하는 비인간 동물 및 CAR 및 CAR 폴리펩티드를 인코딩하는 핵산, 및 이러한 CAR, CAR 발현 비인간 동물 및 CAR 인코딩 핵산의 제조 및 용도에 유용한 조성물 및 방법이 본원에 제공된다.
본원에 기재된 바와 같이, CAR은 면역글로불린(Ig) 가변 도메인으로부터 유래되는 항원 결합 도메인 및 T 세포 수용체(TCR)로부터 유래되는 불변 도메인을 갖는 항원 결합 단백질이다. 일반적으로, 본원에 제공되는 CAR은 2개의 CAR 폴리펩티드 쇄를 포함하며, 그 중 하나는 TCRα 불변 도메인을 포함하고, 그 중 하나는 TCRβ 불변 도메인을 포함한다. 각각의 폴리펩티드 쇄는 Ig 가변 도메인을 포함하며, 하나의 폴리펩티드 쇄는 중쇄 Ig 가변 도메인을 포함하고, 다른 폴리펩티드 쇄는 Ig 경쇄(κ 또는 λ) 가변 도메인을 포함한다. 일부 실시 형태에서, 본원에 제공되는 CAR은 주요 조직 적합성 복합체(MHC) 단백질(예를 들어, 클래스 I MHC 단백질 또는 클래스 II MHC 단백질)에 의해 제시되는 펩티드에 대한 결합 특이성을 갖는다.
특정 측면에서, CAR 폴리펩티드를 발현하는 유전자 변형 비인간 동물(예를 들어, 마우스 또는 래트와 같은 설치류)이 본원에 제공된다. 일부 실시 형태에서, 비인간 동물은 이의 생식세포계열에, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트(예를 들어, 재배열되지 않은 V, D 및 J 중쇄 유전자 세그먼트, 재배열되지 않은 V κ 및 J κ 경쇄 유전자 세그먼트 또는 재배열되지 않은 V λ 및 J λ 경쇄 유전자 세그먼트)를 포함하는 재배열되지 않은 가변 영역 유전자좌 및 TCR 불변 영역 유전자(예를 들어, TCRα 불변 영역 유전자 또는 TCRβ 불변 영역 유전자)를 포함하는 CAR 유전자좌를 포함한다. 일부 실시 형태에서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 TCR 불변 영역 유전자에 작동가능하게 연결되어, 유전자 변형 비인간 동물은 재배열되지 않은 가변 영역 유전자 세그먼트로부터 유래되는 재배열된 Ig 가변 영역 유전자에 의해 인코딩되는 Ig 가변 도메인 및 TCR 불변 영역 유전자에 의해 인코딩되는 TCR 불변 도메인을 포함하는 CAR 폴리펩티드를 발현한다. 일부 실시 형태에서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 가변 영역 유전자 세그먼트이다. 일부 실시 형태에서, TCR 불변 영역 유전자는 내인성 종에서 유래된다. 일부 실시 형태에서, TCR 불변 도메인은 인간 또는 설치류(예를 들어, 마우스 또는 래트) 유래이다. 일부 실시 형태에서, TCR 불변 영역 유전자는 마우스 또는 래트 TCR 불변 영역 유래이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 Ig 가변 영역 유전자간 서열(예를 들어, 중쇄 유전자간 서열, κ 유전자간 서열 또는 λ 유전자간 서열)을 포함한다. 일부 실시 형태에서, Ig 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 TCR 가변 영역 유전자간 서열(예를 들어, TCRβ 유전자간 서열 또는 TCRα 유전자간 서열)을 포함한다. 일부 실시 형태에서, TCR 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다.
일부 측면에서, CAR을 발현하는 유전자 변형 비인간 동물(예를 들어, 마우스 또는 래트와 같은 설치류)이 본원에 제공된다. 일부 실시 형태에서, 상기 비인간 동물은 제1 CAR 유전자좌 및 제2 CAR 유전자좌를 생식세포계열에 포함한다. 일부 실시 형태에서, 제1 CAR 유전자좌는 재배열되지 않은 인간 Ig VH, DH 및 JH 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌 및 내인성 종에서 유래되는(예를 들어, 래트 또는 마우스에서 유래되는) TCRβ 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig VH, DH 및 JH 유전자 세그먼트는 TCRβ 불변 영역 유전자에 작동가능하게 연결되어, 유전자 변형 비인간 동물은 재배열되지 않은 Ig VH, DH 및 JH 유전자 세그먼트로부터 유래되는 재배열된 중쇄 가변 영역 유전자에 의해 인코딩되는 Ig 중쇄 가변 도메인 및 TCRβ 불변 영역 유전자에 의해 인코딩되는 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드 쇄를 발현한다. 일부 실시 형태에서, 제1 CAR 유전자좌는 Ig 중쇄 가변 영역 유전자(유니버셜(universal) 중쇄 가변 영역)를 포함하는 재배열된 가변 영역 유전자좌 및 내인성 종에서 유래되는(예를 들어, 래트 또는 마우스에서 유래되는) TCRβ 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 유전자 변형 비인간 동물은 재배열된 중쇄 가변 영역 유전자에 의해 인코딩되는 Ig 중쇄 가변 도메인 및 TCRβ 불변 영역 유전자에 의해 인코딩되는 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드 쇄를 발현한다. 일부 실시 형태에서, 제2 CAR 유전자좌는 재배열되지 않은 인간 Ig Vκ 및 Jκ를 포함하는 재배열되지 않은 가변 영역 유전자좌 및 내인성 종에서 유래되는(예를 들어, 래트 또는 마우스에서 유래되는) TCRα 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig Vκ 및 Jκ 유전자 세그먼트는 TCRα 불변 영역 유전자에 작동가능하게 연결되어, 유전자 변형 비인간 동물은 재배열되지 않은 Ig Vκ 및 Jκ 유전자 세그먼트로부터 유래되는 재배열된 Ig κ 가변 영역 유전자에 의해 인코딩되는 Ig κ 가변 도메인 및 TCRα 불변 영역 유전자에 의해 인코딩되는 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드 쇄를 발현한다. 일부 실시 형태에서, 제2 CAR 유전자좌는 재배열되지 않은 인간 Vλ 및 Jλ를 포함하는 재배열되지 않은 가변 영역 유전자좌 및 내인성 종에서 유래되는(예를 들어, 래트 또는 마우스에서 유래되는) TCRα 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig Vλ 및 Jλ 유전자 세그먼트는 TCRα 불변 영역 유전자에 작동가능하게 연결되어, 유전자 변형 비인간 동물은 재배열되지 않은 Ig Vλ 및 Jλ 유전자 세그먼트로부터 유래되는 재배열된 Ig λ 가변 영역 유전자에 의해 인코딩되는 Ig λ 가변 도메인 및 TCRα 불변 영역 유전자에 의해 인코딩되는 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드 쇄를 발현한다. 일부 실시 형태에서, 제2 CAR 유전자좌는 Ig 경쇄 κ 또는 λ 가변 영역 유전자(유니버셜 경쇄 가변 영역)를 포함하는 재배열된 가변 영역 유전자좌 및 내인성 종에서 유래되는(예를 들어, 래트 또는 마우스에서 유래되는) TCRα 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 유전자 변형 비인간 동물은 재배열된 경쇄 가변 영역 유전자에 의해 인코딩되는 Ig 경쇄 가변 도메인 및 TCRα 불변 영역 유전자에 의해 인코딩되는 TCRα 불변 영역을 포함하는 제2 CAR 폴리펩티드 쇄를 발현한다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 제1 CAR 폴리펩티드 쇄 및 제2 CAR 폴리펩티드 쇄를 포함하는 CAR을 발현한다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌 중 하나 또는 둘 다는 Ig 가변 영역 유전자간 서열(예를 들어, 중쇄 유전자간 서열, κ 유전자간 서열 또는 λ 유전자간 서열)을 포함한다. 일부 실시 형태에서, Ig 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌 중 하나 또는 둘 다는 TCR 가변 영역 유전자간 서열(예를 들어, TCRβ 유전자간 서열 또는 TCRα 유전자간 서열)을 포함한다. 일부 실시 형태에서, TCR 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다.
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물은 CAR을 발현한다. 일부 실시 형태에서, CAR은 비인간 동물의 T 세포(예를 들어, CD4 및/또는 CD8 T 세포) 상에서 발현된다. 일부 실시 형태에서, T 세포를 발현하는 CAR은 유전자 변형 비인간 동물의 흉선에서의 양성 및/또는 음성 선택을 거쳤다. 일부 실시 형태에서, CAR은 펩티드/MHC 복합체(즉, MHC 단백질의 홈(groove)에 제시된 펩티드)에 대한 결합 특이성을 갖는다. 일부 실시 형태에서, CAR은 클래스 I MHC 단백질에 의해 제시되는 펩티드에 대한 결합 특이성을 갖는다. 일부 실시 형태에서, CAR은 클래스 II MHC 단백질에 의해 제시되는 펩티드에 대한 결합 특이성을 갖는다.
본원에 기재된 유전자 변형 비인간 동물의 일부 실시 형태에서, CAR 유전자좌는 내인성 TCR 유전자좌(예를 들어, 내인성 TCRα 유전자좌 또는 내인성 TCRβ 유전자좌)에 위치된다. 일부 실시 형태에서, CAR 유전자좌의 TCR 불변 영역 유전자는 내인성 TCR 불변 영역 유전자이다. 일부 실시 형태에서, 내인성 TCRα 유전자좌 및/또는 TCRβ 유전자좌의 가변 영역 전체 또는 일부가 Ig 유전자좌의 가변 영역 전체 또는 일부로 치환되어, CAR 유전자좌를 형성한다. 일부 실시 형태에서, TCR 가변 영역 전체가 Ig 가변 영역으로 치환된다. 일부 실시 형태에서, TCR 가변 영역 유전자 세그먼트는 Ig 가변 영역 유전자 세그먼트로 치환된다. 예를 들어, 일부 실시 형태에서, 내인성 TCRβ 유전자좌의 V, D 및 J 유전자 세그먼트는 Ig 중쇄 V, D 및 J 유전자 세그먼트로 치환된다. 일부 실시 형태에서, 내인성 TCRα 유전자좌의 V 및 J 유전자 세그먼트는 Ig 경쇄(예를 들어, κ 또는 λ) V 및 J 유전자 세그먼트로 치환된다. 일부 실시 형태에서, CAR 유전자좌는 내인성 TCR 유전자좌의 외측에 위치한다.
본원에 기재된 유전자 변형 비인간 동물의 일부 실시 형태에서, CAR 유전자좌의 가변 영역 유전자좌의 내인성 TCR 가변 영역 유전자 세그먼트 전체가 Ig 가변 영역 유전자 세그먼트로 치환된다. 일부 실시 형태에서, CAR 유전자좌의 가변 영역 유전자좌의 실질적으로 모든 TCR 가변 영역 유전자 세그먼트가 Ig 가변 영역 유전자 세그먼트로 치환된다. 일부 실시 형태에서, 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10개 이하의 TCR 가변 영역 유전자 세그먼트가 CAR 유전자좌의 가변 영역 유전자좌에 있고/있거나 TCR 불변 영역 유전자에 작동가능하게 연결되어 있다. 일부 실시 형태에서, 기능적 TCR 가변 영역 유전자 세그먼트는 CAR 유전자좌의 TCR 불변 영역 유전자에 작동가능하게 연결되어 있지 않다. 일부 실시 형태에서, TCR 가변 영역 유전자 세그먼트는 CAR 유전자좌의 TCR 불변 영역 유전자에 작동가능하게 연결되어 있지 않다. 일부 실시 형태에서, CAR 유전자좌는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17,18, 19, 20, 30, 40, 50, 60, 70 또는 80개 이상의 Ig 가변 영역 유전자 세그먼트를 포함한다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 기능적 αβ TCR을 발현하지 않는다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 기능적 TCRα 쇄 및/또는 기능적 TCRβ 쇄를 발현하지 않는다. 일부 실시 형태에서, 내인성 TCRα 가변 영역 유전자좌 및/또는 TCRβ 가변 영역 유전자좌는 유전자 변형 비인간 동물에서 불활성화된다. 예를 들어, 일부 실시 형태에서, 내인성 TCRα 가변 영역 유전자좌 및/또는 TCRβ 가변 영역 유전자좌는 내인성 유전자좌 전체 또는 일부의 결실에 의해 불활성화된다. 일부 실시 형태에서, TCRα 가변 영역 유전자좌 및/또는 TCRβ 가변 영역 유전자좌는 TCR 가변 영역 유전자좌와 TCR 불변 영역 유전자좌 사이의 작동가능한 연결의 파괴에 의해(예를 들어, 비코딩 조절 요소의 결실, TCR 가변 영역 유전자좌 또는 이의 부분의 역전 및/또는 TCR 가변 영역 유전자좌의 가변 영역 유전자 세그먼트와 TCR 불변 영역 유전자좌의 TCR 불변 영역 유전자 사이의 핵산 서열, 예컨대 재배열되지 않은 Ig 가변 영역 또는 이의 부분을 인코딩하는 핵산 서열의 삽입에 의해) 불활성화된다.
일부 실시 형태에서, 비인간 동물은 TCRδ 유전자좌를 포함하지 않는다. TCRδ는 TCRα 유전자좌 내에 TCRα V 유전자 세그먼트와 TCRα J 유전자 세그먼트 사이에 위치된다. 따라서, 일부 실시 형태에서, 비인간 동물은 TCRα 불변 영역에 작동가능하게 연결되는 Ig 경쇄 V 및 J 유전자 세그먼트를 포함하는 Ig 경쇄 가변 영역을 TCRα 유전자좌에 포함하며, TCRδ 유전자좌는 결실되거나 변형되어, 비인간 동물은 기능적 δ/γ TCR을 발현하지 않는다. 일부 실시 형태에서, TCRδ 유전자좌는 보존되며, 비인간 동물은 기능적 δ/γ TCR을 발현한다.
본원에 제공된 유전자 변형 비인간 동물의 일부 실시 형태에서, CAR 유전자좌의 재배열되지 않은 가변 영역은 하나 이상의 트립시노겐(TRY) 유전자(예를 들어, 통상 TCRβ 가변 영역 유전자좌에 존재하는 TRY 유전자 및/또는 위유전자)를 포함한다. 일부 실시 형태에서, TRY 유전자는 내인성 종에서 유래된다. 일부 실시 형태에서, 상기 TRY 유전자는 마우스 TRY 유전자이다. 일부 실시 형태에서, 마우스 TRY 유전자는 Try1, Try2, Try3, Try4, Try5, Try6, Try7, Try8, Try9, Try10, Try11, Try12, Try13, Try14, Try15, Try16, Try17, Try18, Try19 및 Try20으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 하나 이상의 TRY 유전자는 재배열되지 않은 가변 영역의 V 세그먼트의 상류에 위치한다. 일부 실시 형태에서, 하나 이상의 TRY 유전자는 재배열되지 않은 가변 영역의 V 세그먼트의 하류에(예를 들어, V 세그먼트의 하류와, D 및/또는 J 세그먼트의 상류에) 위치한다. 일부 실시 형태에서, Try 1 내지 7은 재배열되지 않은 가변 영역의 V 세그먼트의 상류에 위치하며, Try 8 내지 20은 재배열되지 않은 가변 영역의 V 세그먼트의 하류에(예를 들어, V 세그먼트의 하류와, D 및/또는 J 세그먼트의 상류에) 위치한다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 하나 이상의 인간화 MHC 클래스 I α 쇄 폴리펩티드를 발현한다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 폴리펩티드는 인간 세포외 도메인(인간 α1, α2, 및 α3 도메인) 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 클래스 I α 쇄 폴리펩티드는 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-g, HLA-K 또는 HLA-L이다. 일부 실시 형태에서, 비인간 동물은 인간화 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-g, HLA-K 및/또는 HLA-L 폴리펩티드를 발현한다. 일부 실시 형태에서, 비인간 동물은 인간화 MHC 클래스 I α 쇄 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 인간화 MHC 클래스 I α 쇄 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 유전자좌는 내인성 MHC 클래스 I α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 동물의 하나 이상의(예를 들어, 모든) 내인성 MHC 클래스 I α 쇄 유전자좌는 인간화 MHC 클래스 I α 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 완전히 내인성 종에서 유래되는 MHC 클래스 I α 쇄 폴리펩티드를 발현하지 않는다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 인간화 β-2-마이크로글로불린 폴리펩티드를 발현한다. 일부 실시 형태에서, 인간화 β-2-마이크로글로불린 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 비인간 동물은 인간화 β-2-마이크로글로불린 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 인간화 β-2-마이크로글로불린 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 β-2-마이크로글로불린 유전자좌는 내인성 β-2-마이크로글로불린 유전자좌에 위치한다. 일부 실시 형태에서, 내인성 β-2-마이크로글로불린 유전자좌는 인간화 β-2-마이크로글로불린 유전자좌로 치환된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 완전히 내인성 종에서 유래되는 β-2-마이크로글로불린 폴리펩티드를 발현하지 않는다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 하나 이상의 인간화 MHC 클래스 II α 쇄 폴리펩티드를 발현한다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 폴리펩티드는 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 클래스 II α 쇄 폴리펩티드는 HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA 또는 HLA-DRA이다. 일부 실시 형태에서, 비인간 동물은 인간화 HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA 및/또는 HLA-DRA 폴리펩티드를 발현한다. 일부 실시 형태에서, 비인간 동물은 인간화 MHC 클래스 II α 쇄 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 인간화 MHC 클래스 II α 쇄 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 유전자좌는 내인성 MHC 클래스 II α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 동물의 하나 이상의(예를 들어, 모든) 내인성 MHC 클래스 II α 쇄 유전자좌는 인간화 MHC 클래스 II α 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 완전히 내인성 종에서 유래되는 MHC 클래스 II α 쇄 폴리펩티드를 발현하지 않는다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 하나 이상의 인간화 MHC 클래스 II β 쇄 폴리펩티드를 발현한다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 폴리펩티드는 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 클래스 II β 쇄 폴리펩티드는 HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB 또는 HLA-DRB이다. 일부 실시 형태에서, 비인간 동물은 인간화 HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB 및/또는 HLA-DRB 폴리펩티드를 발현한다. 일부 실시 형태에서, 비인간 동물은 인간화 MHC 클래스 II β 쇄 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 인간화 MHC 클래스 II β 쇄 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 유전자좌는 내인성 MHC 클래스 II β 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 동물의 하나 이상의(예를 들어, 모든) 내인성 MHC 클래스 II β 쇄 유전자좌는 인간화 MHC 클래스 II β 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 완전히 내인성 종에서 유래되는 MHC 클래스 II β 쇄 폴리펩티드를 발현하지 않는다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 인간화 CD8 α 쇄 폴리펩티드를 발현한다. 일부 실시 형태에서, 인간화 CD8 α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD8 α 쇄 폴리펩티드는 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 비인간 동물은 인간화 CD8 α 쇄 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 인간화 CD8 α 쇄 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD8 α 쇄 유전자좌는 내인성 CD8 α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 동물의 내인성 CD8 α 쇄 유전자좌는 인간화 CD8 α 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 완전히 내인성 종에서 유래되는 CD8 α 쇄 폴리펩티드를 발현하지 않는다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 인간화 CD8 β 쇄 폴리펩티드를 발현한다. 일부 실시 형태에서, 인간화 CD8 β 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD8 β 쇄 폴리펩티드는 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 비인간 동물은 인간화 CD8 β 쇄 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 인간화 CD8 β 쇄 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD8 β 쇄 유전자좌는 내인성 CD8 β 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 동물의 내인성 CD8 β 쇄 유전자좌는 인간화 CD8 β 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 완전히 내인성 종에서 유래되는 CD8 β 쇄 폴리펩티드를 발현하지 않는다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 인간화 CD4 폴리펩티드를 발현한다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 적어도 하나의 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 적어도 인간 D1 면역글로불린 도메인, 인간 D2 면역글로불린 도메인 및 인간 D3 면역글로불린 도메인, 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 인간 D1 면역글로불린 도메인, 인간 D2 면역글로불린 도메인, 인간 D3 면역글로불린 도메인, 내인성 종에서 유래되는 D4 면역글로불린 도메인, 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 비인간 동물은 인간화 CD4 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 인간화 CD4 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD4 유전자좌는 내인성 CD4 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 동물의 내인성 CD4 유전자좌는 인간화 CD4 유전자좌로 치환된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 완전히 내인성 종에서 유래되는 CD4 폴리펩티드를 발현하지 않는다.
특정 측면에서, CAR을 발현하는 T 세포의 생성 방법이 본원에 제공된다. 일부 실시 형태에서, CAR은 펩티드/MHC 복합체(예를 들어, 펩티드/클래스 I MHC 복합체 및/또는 펩티드/클래스 II MHC 복합체)에 대한 항원 특이성을 갖는다. 일부 실시 형태에서, 상기 방법은 본원에 기재된 유전자 변형 비인간 동물을 펩티드를 포함하는 항원에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 펩티드/MHC 복합체에 특이적인 CAR을 발현하는 T 세포를 유전자 변형 비인간 동물로부터 얻는 단계를 포함한다. 일부 실시 형태에서, 본원에 기재된 방법에 따라 생성되고/되거나 이로부터 얻어질 수 있는 T 세포가 본원에 제공된다.
특정 측면에서, CAR을 발현하는 T 세포 하이브리도마의 생성 방법이 본원에 제공된다. 일부 실시 형태에서, CAR은 펩티드/MHC 복합체(예를 들어, 펩티드/클래스 I MHC 복합체 및/또는 펩티드/클래스 II MHC 복합체)에 대한 항원 특이성을 갖는다. 일부 실시 형태에서, 상기 방법은 본원에 기재된 유전자 변형 비인간 동물을 펩티드를 포함하는 항원에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 펩티드/MHC 복합체에 특이적인 CAR을 발현하는 T 세포를 유전자 변형 비인간 동물로부터 얻는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 T 세포 하이브리도마를 T 세포로부터 생성하는 단계를 포함한다. 일부 실시 형태에서, 본원에 제공된 방법에 따라 생성되고/되거나 이로부터 얻어질 수 있는 T 세포 하이브리도마가 본원에 제공된다.
특정 측면에서, Ig 가변 도메인(예를 들어, Ig 중쇄 가변 도메인, Ig κ 가변 도메인 및/또는 Ig λ 가변 도메인)을 인코딩하는 핵산의 제조 방법이 본원에 제공된다. 일부 실시 형태에서, Ig 가변 도메인은 단독으로 또는 다른 Ig 가변 도메인과 조합하는 경우, 펩티드/MHC 복합체(예를 들어, 펩티드/클래스 I MHC 복합체 및/또는 펩티드/클래스 II MHC 복합체)에 대한 결합 특이성을 갖는다. 일부 실시 형태에서, 상기 방법은 본원에 기재된 비인간 동물을 펩티드를 포함하는 항원에 노출시켜, 펩티드를 비인간 동물의 MHC 상에 제시하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 펩티드/MHC 복합체에 특이적인 CAR을 발현하는 T 세포를 유전자 변형 비인간 동물로부터 얻는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 CAR의 Ig 가변 도메인을 인코딩하는 핵산을 T 세포로부터 단리하는 단계를 포함한다. 일부 실시 형태에서, CAR의 각각의 가변 도메인을 인코딩하는 헥산은 T 세포로부터 단리된다. 일부 실시 형태에서, 본원에 제공된 방법에 따라 제조되고/되거나 이로부터 얻어질 수 있는 Ig 가변 도메인을 인코딩하는 핵산이 본원에 제공된다.
특정 측면에서, 항체 또는 항체 단편의 제조 방법이 본원에 제공된다. 일부 실시 형태에서, 항체 또는 항체 단편은 펩티드/MHC 복합체(예를 들어, 펩티드/클래스 I MHC 복합체 및/또는 펩티드/클래스 II MHC 복합체)에 대한 결합 특이성을 갖는다. 일부 실시 형태에서, 상기 방법은 본원에 기재된 비인간 동물을 펩티드를 포함하는 항원에 노출시켜, 펩티드를 비인간 동물의 MHC 상에 제시하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 펩티드/MHC 복합체에 특이적인 CAR을 발현하는 T 세포를 유전자 변형 비인간 동물로부터 얻는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 CAR의 중쇄 Ig 가변 도메인 및/또는 경쇄 Ig 가변 도메인을 인코딩하는 핵산을 T 세포로부터 단리하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 숙주 세포를 중쇄 Ig 가변 도메인 및 경쇄 Ig 가변 도메인을 인코딩하는 하나 이상의 벡터로 트랜스펙션시켜, 숙주 세포가 중쇄 가변 도메인 및 경쇄 가변 도메인을 포함하는 항체 또는 항체 단편을 발현하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 숙주 세포에서 중쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 중쇄 Ig 불변 도메인을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 숙주 세포가 Ig 중쇄 가변 도메인 및 Ig 중쇄 불변 도메인을 포함하는 Ig 중쇄 폴리펩티드를 발현하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 숙주 세포에서 경쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 경쇄 Ig 불변 도메인을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 숙주 세포가 Ig 경쇄 가변 도메인 및 Ig 중쇄 불변 도메인을 포함하는 Ig 경쇄 폴리펩티드를 발현하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 숙주 세포에서 중쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 중쇄 Ig 불변 도메인을 인코딩하는 핵산 서열과 작동가능하게 연결시키고, 숙주 세포에서 경쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 경쇄 Ig 불변 도메인을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 숙주 세포가 중쇄 Ig 가변 도메인 및 중쇄 Ig 불변 도메인을 포함하는 중쇄와, 경쇄 Ig 가변 도메인 및 경쇄 Ig 불변 도메인을 포함하는 경쇄를 갖는 항체를 발현하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 숙주 세포가 항체 또는 항체 단편을 발현하도록 하는 조건하에 숙주 세포를 배양하는 단계를 포함한다. 일부 실시 형태에서, Ig 경쇄 및/또는 중쇄 불변 도메인은 인간 Ig 불변 도메인이다. 일부 실시 형태에서, 본원에 제공된 방법에 따라 제조되고/되거나 이로부터 얻어질 수 있는 항체 또는 항체 단편이 본원에 제공된다.
특정 실시 형태에서, 본원에 기재된 항체 또는 항체 단편(예를 들어, 펩티드/MHC 복합체에 대한 결합 특이성을 갖고/갖거나 본원에 기재된 방법에 따라 생성된 항체)을 대상에게 투여하는 단계를 포함하는, 대상의 암을 치료하는 방법이 본원에 제공된다. 일부 실시 형태에서, 본원에 기재된 방법은 임의의 암성 또는 전암성 종양을 치료하는데 사용될 수 있다. 본원에 기재된 방법 및 조성물에 의해 치료될 수 있는 암은 방광, 혈액, 뼈, 골수, 뇌, 유방, 결장, 식도, 위장, 잇몸, 두부, 신장, 간, 폐, 비인두, 경부, 난소, 전립선, 피부, 위, 고환, 혀 또는 자궁의 암세포을 포함하나 이에 한정되지 않는다. 또한, 암은 구체적으로 하기 조직형일 수 있으나, 이에 한정되지 않는다: 악성 신생물; 암종; 미분화 암; 거대세포암종 및 방추세포암종; 소세포암종; 유두암종; 편평상피암종; 림프상피암종; 기저세포암종; 모기질 암종(pilomatrix carcinoma); 이행세포암종; 유두상 이행세포암종; 선암; 악성 가스트린종; 담관암; 간세포암; 혼합형 간세포암-담관암; 육주형 선암(trabecular adenocarcinoma); 선양낭포암; 선종성 폴립 내의 선암(adenocarcinoma in adenomatous polyp); 선암, 가족성 대장 폴립증; 고형암; 악성 카르시노이드 종양; 기관지폐포선암; 유두선암; 혐색소성 암종; 호산성 암종; 호산성 선암; 호염기성 암종; 투명세포선암; 과립세포암종; 여포선암; 유두-여포 선암; 비피막성 경화성 암종(nonencapsulating sclerosing carcinoma); 부신피질암; 자궁내막암; 피부 부속기 암종; 아포크린 선암; 피지 선암; 귀지선 선암; 점액표피양 암종; 낭포선암; 유두상 낭포선암; 유두상 장액성 낭포선암; 점액성 낭포선암; 점액성 선암; 반지세포암; 침윤성 도관암; 수질암; 소엽암; 염증성 암종; 유방 파제트병; 선방세포암; 선편평상피암; 편평상피화생을 동반한 선암; 악성 흉선종; 악성 난소 간질 종양; 악성 난포막세포종; 악성 과립막세포종; 악성 남성모세포종(androblastoma); 세르톨리 세포 암종; 악성 라이디히 세포종; 악성 지질 세포 종양; 악성 부신경절종; 악성 유방외 부신경절종; 크롬친화세포종; 사구맥관육종(glomangiosarcoma); 악성 흑색종; 멜라닌 결핍 흑색종; 표재 확장성 흑색종; 거대 색소성 모반에서의 악성 흑색종; 상피모양 세포 흑색종; 악성 청색모반; 육종; 섬유육종; 악성 섬유성 조직구종; 점액육종; 지방육종; 평활근육종; 횡문근육종; 배아형 횡문근육종; 폐포 횡문근육종; 간질 육종; 악성 혼합 종양; 뮬러리안 혼합 종양; 신장모세포종; 간모세포종; 암육종; 악성 간엽종; 악성 브렌너 종양; 악성 엽상 종양; 활막 육종; 악성 중피종; 미분화 배세포종; 배아 암종; 악성 기형종; 악성 난소 갑상선종; 융모막암; 악성 중신종; 혈관육종; 악성 혈관내피종; 카포시 육종; 악성 혈관주위세포종; 림프관 육종; 골육종; 방골성 골육종; 연골육종; 악성 연골모세포종; 간엽성 연골육종; 골 거대세포종; 유윙육종(ewing's sarcoma); 악성 치원성 종양; 사기질모세포 치아육종(ameloblastic odontosarcoma); 악성 사기질모세포종; 사기질모세포 섬유육종; 악성 송과체종; 척삭종; 악성 신경교종; 뇌실막세포종; 성상세포종; 원형질성 성상세포종; 원섬유성 성상세포종; 성상모세포종; 교모세포종; 희소돌기아교세포종; 희소돌기아교모세포종; 원시신경외배엽종양; 소뇌 육종; 신경절모세포종; 신경모세포종; 망막모세포종; 후신경원성 종양; 악성 수막종; 신경섬유육종; 악성 신경초종; 악성 과립세포종; 악성 림프종; 호지킨병; 호지킨 림프종; 파라육아종; 악성 소림프구 림프종; 악성 미만성 대세포 림프종; 악성 여포성 림프종; 균상식육종; 다른 특정된 비호지킨 림프종; 악성 조직구증; 다발성 골수종; 비만세포육종; 면역증식성 소장 질환; 백혈병; 림프구성 백혈병; 형질세포 백혈병; 적백혈병; 림프육종 세포 백혈병; 골수성 백혈병; 호염기구성 백혈병; 호산구성 백혈병; 단구성 백혈병; 비만세포 백혈병; 거핵모구성 백혈병; 골수성 육종; 및 모발상 세포 백혈병.
특정 실시 형태에서, 본원에 기재된 항체 또는 항체 단편(예를 들어, 펩티드/MHC 복합체에 대한 결합 특이성을 갖고/갖거나 본원에 기재된 방법에 따라 생성된 항체)을 대상에게 투여하는 단계를 포함하는, 바이러스 감염증, 세균 감염증, 연충 감염증 또는 원충 감염증을 비롯한 감염증에 걸린 대상을 치료하는 방법이 본원에 제공된다. 예를 들어, 일부 실시 형태에서, HPV, HBV, C형 간염 바이러스(HCV), 인간 면역 결핍 바이러스(HIV-1 및 HIV-2)와 같은 레트로바이러스, 엡스타인 바 바이러스(EBV)와 같은 헤르페스 바이러스, 사이토메갈로바이러스(CMV), HSV-1 및 HSV-2, 인플루엔자 바이러스를 비롯한 바이러스 감염증을 치료하는 방법이 본원에 제공된다. 일부 실시 형태에서, 치료되는 병원균은 말라리아와 같은 기생충이다. 아스페르길루스(Aspergillus), 브루기아(Brugia), 칸디다(Candida), 클라미디아(Chlamydia), 콕시디아(Coccidia), 크립토코쿠스(Cryptococcus), 디로필라리아(Dirofilaria), 고노코쿠스(Gonococcus), 히스토플라즈마( Histoplasma), 리슈마니아(Leishmania), 마이코박테리움(Mycobacterium), 마이코플라즈마(Mycoplasma), 파라메시움(Paramecium), 퍼투시스(Pertussis), 플라스모듐(Plasmodium), 뉴모코쿠스(Pneumococcus), 뉴모시스티스(Pneumocystis), 리케차(Rickettsia), 살모넬라(Salmonella), 시겔라(Shigella), 스타필로코쿠스(Staphylococcus), 스트렙토코쿠스(Streptococcus), 톡소플라즈마(Toxoplasma) 및 콜레라균(Vibriocholerae)과 같은 세균성, 진균성 및 다른 병원성 질환의 치료법이 본원에 제공된다. 예시적인 종으로는 나이세리아 고노리아(Neisseria gonorrhea), 마이코박테리움 투베르쿨로시스(Mycobacterium tuberculosis), 칸디다 알비칸스(Candida albicans), 칸디다 트로피칼리스(Candida tropicalis), 트리코모나스 바지날리스(Trichomonas vaginalis), 헤모필루스 바지날리스(Haemophilus vaginalis), B군 스트렙토코쿠스 속(Group B Streptococcus sp.), 마이코플라즈마 호미니스(Mycoplasma hominis), 헤모필루스 듀크레이(Hemophilus ducreyi), 그라눌로마 인귀네일(Granuloma inguinale), 림포패씨아 베네레움(Lymphopathia venereum), 트레포네마 팔리둠(Treponema pallidum), 브루셀라 아보투스(Brucella abortus), 브루셀라 멜리텐시스(Brucella melitensis), 브루셀라 수이스(Brucella suis), 브루셀라 카니스(Brucella canis), 캄필로박터 페투스(Campylobacter fetus), 캄필로박터 페투스 인테스티날리스(Campylobacter fetus intestinalis), 렙토스피라 포모나(Leptospira pomona), 리스테리아 모노사이토제네스(Listeria monocytogenes), 브루셀라 오비스(Brucella ovis), 클라미디아 프시타시(Chlamydia psittaci), 트리코모나스 피투스(Trichomonas foetus), 톡소플라즈마 곤디(Toxoplasma gondii), 에스세리키아 콜리(Escherichia coli), 악티노바실루스 에쿠울리(Actinobacillus equuli), 살모넬라 아보투스 오비스(Salmonella abortus ovis), 살모넬라 아보투스 에쿠이(Salmonella abortus equi), 슈도모나스 에루지노사(Pseudomonas aeruginosa), 코리네박테리움 에쿠이(Corynebacterium equi), 코리네박테리움 파이오게네스(Corynebacterium pyogenes), 악티노바실루스 세미니스(Actinobaccilus seminis), 마이코플라즈마 보비제니탈륨(Mycoplasma bovigenitalium), 아스페르길루스 푸미가투스(Aspergillus fumigatus), 압시디아 라모사(Absidia ramosa), 트리파노소마 에퀴페르둠(Trypanosoma equiperdum), 바베시아 카발리(Babesia caballi), 클로스트리듐 테타니(Clostridium tetani), 클로스트리듐 보툴리눔(Clostridium botulinum); 또는 예를 들어, 파라콕시디오이데스 브라질리엔시스(Paracoccidioides brasiliensis)와 같은 진균; 또는 예를 들어, 플라스모듐 팔시파룸(Plasmodium falciparum)과 같은 다른 병원균을 들 수 있다.
일부 측면에서, CAR을 발현하는 세포(예를 들어, 인간 세포, 예컨대 인간 T 세포)의 생성 방법이 본원에 제공된다. 일부 실시 형태에서, 항체 또는 항체 단편은 펩티드/MHC 복합체(예를 들어, 펩티드/클래스 I MHC 복합체 및/또는 펩티드/클래스 II MHC 복합체)에 대한 결합 특이성을 갖는다. 일부 실시 형태에서, 상기 방법은 본원에 기재된 비인간 동물을 펩티드를 포함하는 항원에 노출시켜, 펩티드를 비인간 동물의 MHC 상에 제시하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 MHC 상에 제시된 펩티드에 특이적인 CAR을 발현하는 T 세포를 유전자 변형 비인간 동물로부터 얻는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 CAR의 중쇄 Ig 가변 도메인 및/또는 경쇄 Ig 가변 도메인을 인코딩하는 핵산을 T 세포로부터 단리하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 세포(예를 들어, 인간 세포, 예컨대 인간 T 세포)에서 중쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 TCR 불변 도메인(예를 들어, TCRβ 불변 도메인 또는 TCRα 불변 도메인)을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 상기 세포가 Ig 중쇄 가변 도메인 및 TCR 불변 도메인을 포함하는 CAR 폴리펩티드를 발현하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 세포(예를 들어, 인간 세포, 예컨대 인간 T 세포)에서 경쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 TCR 불변 도메인(예를 들어, TCRβ 불변 도메인 또는 TCRα 불변 도메인)을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 상기 세포가 Ig 경쇄 가변 도메인 및 TCR 불변 도메인을 포함하는 CAR 폴리펩티드를 발현하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 세포(예를 들어, 인간 세포, 예컨대 인간 T 세포)에서 중쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 제1 TCR 불변 도메인(예를 들어, TCRβ 불변 도메인 또는 TCRα 불변 도메인)과 작동가능하게 연결시키고, 상기 세포에서 경쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 제2 TCR 불변 도메인(예를 들어, 제1 TCR 불변 도메인이 TCRα 불변 도메인인 경우에 TCRβ 불변 도메인 또는 제1 TCR 불변 도메인이 TCRβ 불변 도메인인 경우에 TCRα 불변 도메인)과 작동가능하게 연결시켜, 상기 세포가 중쇄 Ig 가변 도메인 및 제1 TCR 불변 도메인을 포함하는 제1 CAR 쇄 폴리펩티드와, 경쇄 Ig 가변 도메인 및 제2 TCR 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 갖는 CAR을 발현하는 단계를 포함한다. 일부 실시 형태에서, 상기 TCR 불변 도메인은 인간 TCR 불변 도메인이다. 일부 실시 형태에서, 상기 세포는 생체외 세포(예를 들어, 생체외 인간 세포, 예컨대 생체외 인간 T 세포)이다. 일부 실시 형태에서, 본원에 제공된 방법에 따라 생성되고/되거나 이로부터 얻어질 수 있는 CAR을 발현하는 세포가 본원에 제공된다.
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물을 펩티드를 포함하는 항원에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하는 임의의 방법이 사용될 수 있다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 항원을 인코딩하는 핵산 서열을 포함하는 바이러스(예를 들어, 레트로바이러스, 아데노바이러스 또는 렌티바이러스)로 상기 비인간 동물을 감염시킴으로써 항원에 노출된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 펩티드를 인코딩하는 핵산을 상기 동물에게 투여함으로써 항원에 노출되어, 펩티드가 상기 비인간 동물에 발현된다. 일부 실시 형태에서, 상기 비인간 동물에게 단일쇄 펩티드/MHC 복합체를 인코딩하는 핵산이 투여된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 펩티드/MHC 복합체를 유전자 변형 비인간 동물에게 투여함으로써 항원에 노출된다. 일부 실시 형태에서, 상기 비인간 동물에게 단일쇄 펩티드/MHC 복합체(예를 들어, 단일쇄 엑토(ecto)-MHC/β-2-마이크로글로불린/펩티드 단백질 복합체)가 투여된다. 일부 실시 형태에서, 펩티드/MHC 복합체는 다량체(예를 들어, 사량체)로 투여된다. 일부 실시 형태에서, 펩티드/MHC 복합체는 세포(예를 들어, 항원제시세포, 예컨대 대식세포 또는 수지상 세포) 표면 상에 존재한다. 일부 실시 형태에서, B7.1, B7.2 또는 ICOS-L이 세포 표면 상에 존재한다. 일부 실시 형태에서, 세포는 T 세포 자극성 사이토카인(예를 들어, IL-1, IL-2, IL-4, IL-6, IL-12, IL-13, IFN-γ, TNF-α, TGF-β, IFN-α 및/또는 IFN-β)을 발현한다.
본원에 기재된 방법의 일부 실시 형태에서, 임의의 방법을 사용하여, Ig 가변 도메인을 인코딩하는 핵산을 단리할 수 있다. 일부 실시 형태에서, 핵산을 단리하는 단계는 T 세포로부터 T 세포 하이브리도마를 생성하여, 핵산을 T 세포 하이브리도마로부터 단리하는 것을 포함한다. 일부 실시 형태에서, 핵산은 핵산 증폭 과정(예를 들어, PCR)을 이용하여 단리된다. 일부 실시 형태에서, 핵산은 T 세포 또는 T 세포 하이브리도마의 CAR 유전자좌의 재배열된 Ig 가변 영역 유전자를 시퀀싱하여, 재배열된 Ig 가변 영역 유전자를 포함하는 핵산 서열을 합성함으로써 단리된다.
특정 측면에서, 본원에 기재된 유전자 변형 비인간 동물로부터 얻어지거나 얻어질 수 있는 CAR을 발현하는 세포가 본원에 제공된다. 일부 실시 형태에서, 상기 세포는 T 세포이다. 일부 실시 형태에서, 상기 세포는 T 세포 하이브리도마이다. 일부 실시 형태에서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 갖는다.
특정 측면에서, 본원에 기재된 유전자 변형 비인간 동물 또는 세포로부터 얻어지거나 얻어질 수 있는 재배열된 Ig 가변 영역 유전자(예를 들어, 중쇄 Ig 가변 영역 유전자 또는 경쇄 중쇄 가변 영역 유전자)를 포함하는 핵산이 본원에 제공된다. 일부 실시 형태에서, 핵산은 TCR 불변 영역 유전자(예를 들어, TCRα 불변 영역 유전자 또는 TCRβ 불변 영역 유전자)를 추가로 포함한다. 일부 실시 형태에서, 핵산은 CAR 폴리펩티드를 인코딩한다. 일부 실시 형태에서, Ig 가변 영역 유전자는 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 Ig 가변 도메인을 인코딩한다.
특정 측면에서, 본원에 기재된 유전자 변형 비인간 동물 또는 세포로부터 얻어지거나 얻어질 수 있는 CAR 또는 CAR 폴리펩티드가 본원에 제공된다. 일부 실시 형태에서, CAR 또는 CAR 폴리펩티드는 펩티드/MHC 복합체에 대한 결합 특이성을 갖는다.
특정 측면에서, CAR 유전자좌를 게놈에 포함하는 비인간 배아 줄기(ES) 세포(예를 들어, 설치류 ES 세포, 예컨대 마우스 ES 세포 또는 래트 ES 세포)가 본원에 제공된다. 일부 실시 형태에서, CAR 유전자좌는 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트(예를 들어, 재배열되지 않은 V, D 및 J 중쇄 유전자 세그먼트, 재배열되지 않은 V κ 및 J κ 경쇄 유전자 세그먼트 또는 재배열되지 않은 V λ 및 J λ 경쇄 유전자 세그먼트) 및 TCR 불변 영역 유전자(예를 들어, TCRα 불변 영역 유전자 또는 TCRβ 불변 영역 유전자)를 포함하는 재배열되지 않은 가변 영역 유전자좌를 포함한다. 일부 실시 형태에서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 TCR 불변 영역 유전자에 작동가능하게 연결된다. 일부 실시 형태에서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 가변 영역 유전자 세그먼트이다. 일부 실시 형태에서, TCR 불변 영역 유전자는 내인성 종에서 유래된다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 Ig 가변 영역 유전자간 서열(예를 들어, 중쇄 유전자간 서열, κ 유전자간 서열 또는 λ 유전자간 서열)을 포함한다. 일부 실시 형태에서, Ig 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 TCR 가변 영역 유전자간 서열(예를 들어, TCRβ 유전자간 서열 또는 TCRα 유전자간 서열)을 포함한다. 일부 실시 형태에서, TCR 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다.
일부 측면에서, 제1 CAR 유전자좌 및 제2 CAR 유전자좌를 게놈에 포함하는 비인간 ES 세포(예를 들어, 설치류 ES 세포, 예컨대 마우스 ES 세포 또는 래트 ES 세포)가 본원에 제공된다. 일부 실시 형태에서, 제1 CAR 유전자좌는 재배열되지 않은 인간 Ig VH, DH 및 JH 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌와, 내인성 종에서 유래되는 TCRβ 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig VH, DH 및 JH 유전자 세그먼트는 TCRβ 불변 영역 유전자에 작동가능하게 연결된다. 일부 실시 형태에서, 제1 CAR 유전자좌는 Ig 중쇄 가변 영역 유전자(유니버셜 중쇄 가변 영역)를 포함하는 재배열된 가변 영역 유전자좌와, 내인성 종에서 유래되는 TCRβ 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함한다. 일부 실시 형태에서, 제2 CAR 유전자좌는 재배열되지 않은 인간 Ig Vκ 및 Jκ를 포함하는 재배열되지 않은 가변 영역 유전자좌와, 내인성 종에서 유래되는 TCRα 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig Vκ 및 Jκ 유전자 세그먼트는 TCRα 불변 영역 유전자에 작동가능하게 연결된다. 일부 실시 형태에서, 제2 CAR 유전자좌는 재배열되지 않은 인간 Ig Vλ 및 Jλ를 포함하는 재배열되지 않은 가변 영역 유전자좌와, 내인성 종에서 유래되는 TCRα 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig Vλ 및 Jλ 유전자 세그먼트는 TCRα 불변 영역 유전자에 작동가능하게 연결된다. 일부 실시 형태에서, 제2 CAR 유전자좌는 Ig 경쇄 κ 또는 λ 가변 영역 유전자(유니버셜 경쇄 가변 영역)를 포함하는 재배열된 가변 영역 유전자좌와, 내인성 종에서 유래되는 TCRα 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함한다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌 중 하나 또는 둘 다는 Ig 가변 영역 유전자간 서열(예를 들어, 중쇄 유전자간 서열, κ 유전자간 서열 또는 λ 유전자간 서열)을 포함한다. 일부 실시 형태에서, Ig 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌 중 하나 또는 둘 다는 TCR 가변 영역 유전자간 서열(예를 들어, TCRβ 유전자간 서열 또는 TCRα 유전자간 서열)을 포함한다. 일부 실시 형태에서, TCR 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다.
본원에 기재된 비인간 동물 ES 세포의 일부 실시 형태에서, CAR 유전자좌는 내인성 TCR 유전자좌(예를 들어, 내인성 TCRα 유전자좌 또는 내인성 TCRβ 유전자좌)에 위치된다. 일부 실시 형태에서, CAR 유전자좌의 TCR 불변 영역 유전자는 내인성 TCR 불변 영역 유전자이다. 일부 실시 형태에서, 내인성 TCRα 유전자좌 및/또는 TCRβ 유전자좌의 가변 영역 전체 또는 일부가 Ig 유전자좌의 가변 영역 전체 또는 일부로 치환되어, CAR 유전자좌를 형성한다. 일부 실시 형태에서, TCR 가변 영역 전체가 Ig 가변 영역으로 치환된다. 일부 실시 형태에서, TCR 가변 영역 유전자 세그먼트는 Ig 가변 영역 유전자 세그먼트로 치환된다. 예를 들어, 일부 실시 형태에서, 내인성 TCRβ 유전자좌의 V, D 및 J 유전자 세그먼트는 Ig 중쇄 V, D 및 J 유전자 세그먼트로 치환된다. 일부 실시 형태에서, 내인성 TCRα 유전자좌의 V 및 J 유전자 세그먼트는 Ig 경쇄(예를 들어, κ 또는 λ) V 및 J 유전자 세그먼트로 치환된다.
일부 실시 형태에서, 비인간 ES 세포는 기능적 TCR 유전자좌를 포함하지 않는다. 일부 실시 형태에서, 비인간 ES 세포는 기능적 TCRα 쇄 유전자좌 및/또는 기능적 TCRβ 쇄 유전자좌를 포함하지 않는다. 일부 실시 형태에서, 내인성 TCRα 유전자좌 및/또는 TCRβ 유전자좌는 유전자 변형 비인간 ES 세포에서 불활성화된다(예를 들어, 내인성 유전자좌 전체 또는 일부의 결실에 의해). 일부 실시 형태에서, 비인간 ES 세포는 기능적 TCRδ 유전자좌를 포함하지 않는다.
본원에 기재된 비인간 동물 ES 세포의 일부 실시 형태에서, CAR 유전자좌의 재배열되지 않은 가변 영역은 하나 이상의 트립시노겐(TRY) 유전자(예를 들어, 통상 TCRβ 가변 영역 유전자좌에 존재하는 TRY 유전자 및/또는 위유전자)를 포함한다. 일부 실시 형태에서, TRY 유전자는 내인성 종에서 유래된다. 일부 실시 형태에서, 상기 TRY 유전자는 마우스 TRY 유전자이다. 일부 실시 형태에서, 마우스 TRY 유전자는 Try1, Try2, Try3, Try4, Try5, Try6, Try7, Try8, Try9, Try10, Try11, Try12, Try13, Try14, Try15, Try16, Try17, Try18, Try19 및 Try20으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 하나 이상의 TRY 유전자는 재배열되지 않은 가변 영역의 V 세그먼트의 상류에 위치한다. 일부 실시 형태에서, 하나 이상의 TRY 유전자는 재배열되지 않은 가변 영역의 V 세그먼트의 하류에(예를 들어, V 세그먼트의 하류와, D 및/또는 J 세그먼트의 상류에) 위치한다. 일부 실시 형태에서, Try 1 내지 7은 재배열되지 않은 가변 영역의 V 세그먼트의 상류에 위치하며, Try 8 내지 20은 재배열되지 않은 가변 영역의 V 세그먼트의 하류에(예를 들어, V 세그먼트의 하류와, D 및/또는 J 세그먼트의 상류에) 위치한다.
일부 실시 형태에서, 비인간 ES 세포는 인간화 MHC 클래스 I α 쇄 폴리펩티드를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 폴리펩티드는 인간 세포외 도메인(인간 α1, α2, 및 α3 도메인) 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 클래스 I α 쇄 폴리펩티드는 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-g, HLA-K 또는 HLA-L이다. 일부 실시 형태에서, 비인간 ES 세포는 인간화 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-g, HLA-K 및/또는 HLA-L 폴리펩티드를 인코딩하는 유전자좌를 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 유전자좌는 내인성 MHC 클래스 I α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 ES 세포의 하나 이상의(예를 들어, 모든) 내인성 MHC 클래스 I α 쇄 유전자좌는 전체 또는 일부가 인간화 MHC 클래스 I α 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 비인간 ES 세포는 기능적 내인성 MHC 클래스 I α 쇄 유전자좌(예를 들어, 완전히 내인성 종에서 유래되는 MHC 클래스 I α 쇄를 인코딩하는 유전자좌)를 포함하지 않는다.
일부 실시 형태에서, 비인간 ES 세포는 인간화 β-2-마이크로글로불린 폴리펩티드를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 β-2-마이크로글로불린 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 β-2-마이크로글로불린 유전자좌는 내인성 β-2-마이크로글로불린 유전자좌에 위치한다. 일부 실시 형태에서, 내인성 β-2-마이크로글로불린 유전자좌는 전체 또는 일부가 인간화 β-2-마이크로글로불린 유전자좌로 치환된다. 일부 실시 형태에서, 비인간 ES 세포는 기능적 내인성 β-2-마이크로글로불린 유전자좌(예를 들어, 완전히 내인성 종에서 유래되는 β-2-마이크로글로불린 폴리펩티드를 인코딩하는 유전자좌)를 게놈에 포함하지 않는다.
일부 실시 형태에서, 비인간 ES 세포는 인간화 MHC 클래스 II α 쇄 폴리펩티드를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 폴리펩티드는 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 클래스 II α 쇄 폴리펩티드는 HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA 또는 HLA-DRA이다. 일부 실시 형태에서, 비인간 ES 세포는 인간화 HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA 및/또는 HLA-DRA 폴리펩티드를 인코딩하는 유전자좌를 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 유전자좌는 내인성 MHC 클래스 II α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 ES 세포의 하나 이상의(예를 들어, 모든) 내인성 MHC 클래스 II α 쇄 유전자좌는 전체 또는 일부가 인간화 MHC 클래스 II α 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 유전자 변형 비인간 ES 세포는 기능적 내인성 MHC 클래스 II α 쇄 유전자좌(예를 들어, 완전히 내인성 종에서 유래되는 MHC 클래스 II α 쇄를 인코딩하는 유전자좌)를 게놈에 포함하지 않는다.
일부 실시 형태에서, 비인간 ES 세포는 인간화 MHC 클래스 II β 쇄 폴리펩티드를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 폴리펩티드는 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 클래스 II β 쇄 폴리펩티드는 HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB 또는 HLA-DRB이다. 일부 실시 형태에서, 비인간 ES 세포는 인간화 HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB 및/또는 HLA-DRB 폴리펩티드를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 유전자좌는 내인성 MHC 클래스 II β 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 ES 세포의 하나 이상의(예를 들어, 모든) 내인성 MHC 클래스 II β 쇄 유전자좌는 전체 또는 일부가 인간화 MHC 클래스 II β 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 비인간 ES 세포는 기능적 내인성 MHC 클래스 II β 쇄 유전자좌(예를 들어, 완전히 내인성 종에서 유래되는 MHC 클래스 II β 쇄를 인코딩하는 유전자좌)를 게놈에 포함하지 않는다.
일부 실시 형태에서, 비인간 ES 세포는 인간화 CD8 α 쇄 폴리펩티드를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD8 α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD8 α 쇄 폴리펩티드는 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 CD8 α 쇄 유전자좌는 내인성 CD8 α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 ES 세포의 내인성 CD8 α 쇄 유전자좌는 전체 또는 일부가 인간화 CD8 α 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 비인간 ES 세포는 기능적 내인성 CD8 α 쇄 유전자좌(예를 들어, 완전히 내인성 종에서 유래되는 CD8 α 쇄를 인코딩하는 유전자좌)를 게놈에 포함하지 않는다.
일부 실시 형태에서, 비인간 ES 세포는 인간화 CD8 β 쇄 폴리펩티드를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD8 β 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD8 β 쇄 폴리펩티드는 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 CD8 β 쇄 유전자좌는 내인성 CD8 β 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 ES 세포의 내인성 CD8 β 쇄 유전자좌는 전체 또는 일부가 인간화 CD8 β 쇄 유전자좌로 치환된다. 일부 실시 형태에서, 비인간 ES 세포는 기능적 내인성 CD8 β 쇄 유전자좌(예를 들어, 완전히 내인성 종에서 유래되는 CD8 β 쇄를 인코딩하는 유전자좌)를 게놈에 포함하지 않는다.
일부 실시 형태에서, 비인간 ES 세포는 인간화 CD4 폴리펩티드를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 적어도 인간 D1 면역글로불린 도메인, 인간 D2 면역글로불린 도메인 및 인간 D3 면역글로불린 도메인, 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 인간 D1 면역글로불린 도메인, 인간 D2 면역글로불린 도메인, 인간 D3 면역글로불린 도메인, 내인성 종에서 유래되는 D4 면역글로불린 도메인, 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 CD4 유전자좌는 내인성 CD4 유전자좌에 위치한다. 일부 실시 형태에서, 비인간 ES 세포의 내인성 CD4 유전자좌는 전체 또는 일부가 인간화 CD4 유전자좌로 치환된다. 일부 실시 형태에서, 비인간 ES 세포는 기능적 내인성 CD4 쇄 유전자좌(예를 들어, 완전히 내인성 종에서 유래되는 CD4 쇄를 인코딩하는 유전자좌)를 게놈에 포함하지 않는다.
특정 측면에서, 본원에 기재된 ES 세포를 사용하여 생산되거나 이로부터 얻어질 수 있는 유전자 변형 비인간 동물이 본원에 제공된다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 설치류이다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 마우스 또는 래트이다. 일부 실시 형태에서, 본원에 기재된 비인간 ES 세포를 포함하는 비인간 배아가 본원에 제공된다.
특정 측면에서, CAR 및/또는 CAR 폴리펩티드를 발현하는 유전자 변형 비인간 동물의 생산 방법이 본원에 제공된다. 특정 실시 형태에서, 상기 방법은 본원에 기재된 비인간 ES 세포를 사용하여, 비인간 동물을 생산하는 것을 포함한다. 특정 실시 형태에서, 상기 비인간 ES 세포는 마우스 비인간 ES 세포이다. 일부 실시 형태에서, 상기 방법은 본원에 참조로 포함되는 미국 특허 제7,294,754호에 기재된 벨로시마우스(VELOCIMOUSE)® 방법을 이용하는 것을 포함한다. 특정 실시 형태에서, 본원에 기재된 방법을 사용하여 생산되거나 이로부터 얻어질 수 있는 유전자 변형 비인간 동물이 본원에 제공된다.
특정 측면에서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌; 및 설치류 TCR 불변 영역 유전자(예를 들어, 마우스 TCR 불변 영역 유전자 또는 래트 TCR 불변 영역 유전자)를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트가 TCR 불변 영역 유전자에 작동가능하게 연결되는 CAR 유전자좌가 본원에 제공된다. 일부 실시 형태에서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 중쇄(IgH) 가변 영역 유전자 세그먼트이다. 일부 실시 형태에서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 경쇄(IgL) 가변 영역 유전자 세그먼트(예를 들어, Ig κ 유전자 세그먼트 또는 Ig λ 유전자 세그먼트)이다. 일부 실시 형태에서, TCR 불변 영역 유전자는 TCRα 불변 영역 유전자이다. 일부 실시 형태에서, CAR 유전자좌는 내인성 TCRα 유전자좌에 위치한다. 일부 실시 형태에서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 내인성 TCRα 가변 영역 유전자 세그먼트를 대체한다. 일부 실시 형태에서, TCRα 불변 영역 유전자는 내인성 TCRα 불변 영역 유전자이다. 일부 실시 형태에서, TCR 불변 영역 유전자는 TCRβ 불변 영역 유전자이다. 일부 실시 형태에서, CAR 유전자좌는 내인성 TCRβ 유전자좌에 위치한다. 일부 실시 형태에서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 내인성 TCRβ 가변 영역 유전자 세그먼트를 대체한다. 일부 실시 형태에서, TCRβ 불변 영역 유전자는 내인성 TCRβ 불변 영역 유전자이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 하나 이상의 트립시노겐 유전자를 추가로 포함한다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 Ig 가변 영역 유전자간 서열(예를 들어, 중쇄 유전자간 서열, κ 유전자간 서열 또는 λ 유전자간 서열)을 포함한다. 일부 실시 형태에서, Ig 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 TCR 가변 영역 유전자간 서열(예를 들어, TCRβ 유전자간 서열 또는 TCRα 유전자간 서열)을 포함한다. 일부 실시 형태에서, TCR 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다.
특정 측면에서, 재배열되지 않은 인간 Ig VH, DH 및 JH 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌 및 설치류 TCRβ 불변 영역 유전자(예를 들어, 래트 TCRβ 불변 영역 유전자 또는 마우스 TCRβ 불변 영역 유전자)를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig VH, DH 및 JH 유전자 세그먼트가 TCRβ 불변 영역 유전자에 작동가능하게 연결되는 CAR 유전자좌가 본원에 제공된다. 특정 실시 형태에서, CAR 유전자좌는 내인성 TCRβ 유전자좌에 위치한다. 특정 실시 형태에서, 재배열되지 않은 인간 Ig VH, DH 및 JH 유전자 세그먼트는 내인성 TCRβ 가변 영역 유전자 세그먼트를 대체한다. 일부 실시 형태에서, TCRβ 불변 영역 유전자는 내인성 TCRβ 불변 영역 유전자이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 하나 이상의 트립시노겐 유전자를 추가로 포함한다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 Ig 가변 영역 유전자간 서열(예를 들어, 중쇄 유전자간 서열, κ 유전자간 서열 또는 λ 유전자간 서열)을 포함한다. 일부 실시 형태에서, Ig 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 TCR 가변 영역 유전자간 서열(예를 들어, TCRβ 유전자간 서열 또는 TCRα 유전자간 서열)을 포함한다. 일부 실시 형태에서, TCR 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다.
특정 측면에서, 재배열되지 않은 인간 Ig Vκ 및 Jκ 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌 및 설치류 TCRα 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 인간 Ig Vκ 및 Jκ 유전자 세그먼트가 TCRα 불변 영역 유전자에 작동가능하게 연결되는 CAR 유전자좌가 본원에 제공된다. 일부 실시 형태에서, CAR 유전자좌는 내인성 TCRα 유전자좌에 위치한다. 일부 실시 형태에서, 재배열되지 않은 인간 Ig Vκ 및 Jκ 유전자 세그먼트는 내인성 TCRα 가변 영역 유전자 세그먼트를 대체한다. 일부 실시 형태에서, TCRα 불변 영역 유전자는 내인성 TCRα 불변 영역 유전자이다. 일부 실시 형태에서, CAR 유전자좌는 기능적 TCRδ 유전자좌를 포함하지 않으며; 일부 실시 형태에서, TCRδ 유전자좌는 결실된다.
특정 측면에서, 본원에 기재된 CAR 유전자좌를 생식세포계열에 포함하는 설치류(예를 들어, 래트 또는 마우스)가 본원에 제공된다. 일부 측면에서, 본원에 기재된 CAR 유전자좌를 생식세포계열에 포함하는 설치류 세포(예를 들어, 래트 세포 또는 마우스 세포)가 본원에 제공된다. 일부 실시 형태에서, 상기 세포는 ES 세포이다. 일부 실시 형태에서, 본원에 기재된 CAR 유전자좌를 인코딩하는 핵산(예를 들어, 벡터)이 본원에 제공된다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 Ig 가변 영역 유전자간 서열(예를 들어, 중쇄 유전자간 서열, κ 유전자간 서열 또는 λ 유전자간 서열)을 포함한다. 일부 실시 형태에서, Ig 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다. 일부 실시 형태에서, 재배열되지 않은 가변 영역 유전자좌는 TCR 가변 영역 유전자간 서열(예를 들어, TCRβ 유전자간 서열 또는 TCRα 유전자간 서열)을 포함한다. 일부 실시 형태에서, TCR 가변 영역 유전자간 서열은 인간 서열, 마우스 서열 또는 래트 서열이다.
특정 측면에서, 본원에 기재된 CAR을 발현하는 비인간 동물(예를 들어, 마우스 또는 래트)의 생산 방법이 본원에 제공된다. 특정 실시 형태에서, 상기 방법은 비인간 동물을 유전자 변형시켜, 본원에 기재된 CAR 유전자좌를 생식세포계열에 포함시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 비인간 ES 세포(예를 들어, 마우스 ES 세포 또는 래트 ES 세포)를 유전자 변형시켜, 본원에 기재된 CAR 유전자좌를 포함시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 TCRα 불변 영역에 작동가능하게 연결되는 재배열되지 않은 Ig 경쇄 유전자 세그먼트(경쇄 V 및 J 세그먼트)를 포함하는 CAR 유전자좌를 비인간 ES 세포에 도입하며, TCRβ 불변 영역에 작동가능하게 연결되는 재배열되지 않은 Ig 중쇄 유전자 세그먼트(중쇄 V, D 및 J 세그먼트)를 포함하는 CAR 유전자좌를 비인간 ES 세포에 도입하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 비인간 동물 ES 세포의 TCRα 유전자좌를 변형시켜, TCRα 불변 영역에 작동가능하게 연결되는 재배열되지 않은 Ig 경쇄 유전자 세그먼트(경쇄 V 및 J 세그먼트)를 포함하며, 비인간 동물 ES 세포의 TCRβ 유전자좌를 변형시켜, TCRβ 불변 영역에 작동가능하게 연결되는 재배열되지 않은 Ig 중쇄 유전자 세그먼트(중쇄 V, D 및 J 세그먼트)를 포함하는 단계를 포함한다.
특정 측면에서, Ig 중쇄 가변 도메인 및 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하며, 여기서 CAR가 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 키메라 항원 수용체(CAR)가 본원에 제공된다(예를 들어, 도 1 참조). 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 I MHC 복합체이다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 II MHC 복합체이다. 일부 실시 형태에서, Ig 중쇄 가변 도메인 및/또는 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 설치류 불변 도메인(예를 들어, 래트 또는 마우스 불변 도메인)이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 인간 불변 도메인이다.
특정 측면에서, Ig 중쇄 가변 도메인 및 TCRα 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 TCRβ 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하며, 여기서 CAR가 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 키메라 항원 수용체(CAR)가 본원에 제공된다(예를 들어, 도 2 참조). 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 I MHC 복합체이다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 II MHC 복합체이다. 일부 실시 형태에서, Ig 중쇄 가변 도메인 및/또는 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 설치류 불변 도메인(예를 들어, 래트 또는 마우스 불변 도메인)이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 인간 불변 도메인이다.
특정 측면에서, 본원에 기재된 CAR을 발현하는 세포 또는 비인간 동물이 본원에 제공된다. 일부 실시 형태에서, 상기 세포는 T 세포이다. 일부 실시 형태에서, 상기 세포 또는 동물은 인간 또는 설치류(예를 들어, 래트 또는 마우스)이다. 특정 실시 형태에서, 본원에 기재된 세포를 포함하는 비인간 동물(예를 들어, 설치류, 예컨대 래트 또는 마우스)이 본원에 제공된다.
일부 측면에서, 대상에서 펩티드/MHC 복합체에 대한 면역 반응을 유도하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 인간 Ig 중쇄 가변 도메인 및 인간 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, 인간 Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 인간 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 CAR을 발현하는 세포(예를 들어, 인간 T 세포, 예컨대 CD4 T 세포 또는 CD8 T 세포)를 대상에게 투여하는 단계 - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 - 를 포함한다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 I MHC 복합체이다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 II MHC 복합체이다.
일부 측면에서, 대상(예를 들어, 인간 대상)에서 펩티드/MHC 복합체에 대한 면역 반응을 유도하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 인간 Ig 중쇄 가변 도메인 및 인간 TCRα 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, 인간 Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 인간 TCRβ 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 CAR을 발현하는 세포(예를 들어, 인간 T 세포, 예컨대 CD4 T 세포 또는 CD8 T 세포)를 대상에게 투여하는 단계 - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 - 를 포함한다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 I MHC 복합체이다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 II MHC 복합체이다.
특정 측면에서, 대상(예를 들어, 인간 대상)에서 펩티드/MHC 복합체에 대한 면역 반응을 유도하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 대상으로부터 T 세포(예를 들어, CD4 T 세포 또는 CD8 T 세포)를 단리하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 인간 Ig 중쇄 가변 도메인 및 인간 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, 인간 Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 인간 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 CAR의 T 세포에 의한 발현을 유도하는 단계 - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 - 를 포함한다. 일부 실시 형태에서, 상기 방법은 T 세포를 대상에게 투여하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 제1 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 제1 벡터와, 제2 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 제2 벡터로 T 세포를 트랜스펙션시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 제1 CAR 폴리펩티드를 인코딩하는 핵산 서열 및 제2 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 벡터로 T 세포를 트랜스펙션시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 내인성 TCRα 및/또는 TCRβ의 T 세포에 의한 발현을 억제하는 단계를 포함한다.
특정 측면에서, 대상(예를 들어, 인간 대상)에서 펩티드/MHC 복합체에 대한 면역 반응을 유도하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 대상으로부터 T 세포(예를 들어, CD4 T 세포 또는 CD8 T 세포)를 단리하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 인간 Ig 중쇄 가변 도메인 및 인간 TCRα 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, 인간 Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 인간 TCRβ 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 CAR의 T 세포에 의한 발현을 유도하는 단계 - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 - 를 포함한다. 일부 실시 형태에서, 상기 방법은 T 세포를 대상에게 투여하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 제1 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 제1 벡터와, 제2 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 제2 벡터로 T 세포를 트랜스펙션시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 제1 CAR 폴리펩티드를 인코딩하는 핵산 서열 및 제2 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 벡터로 T 세포를 트랜스펙션시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 내인성 TCRα 및/또는 TCRβ의 T 세포에 의한 발현을 억제하는 단계를 포함한다.
특정 측면에서, Ig 중쇄 가변 도메인 및 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드를 인코딩하는 제1 핵산 서열과, Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 인코딩하는 제2 핵산 서열을 포함하며, 여기서 제1 CAR 폴리펩티드 및 제2 CAR 폴리펩티드를 포함하는 CAR이 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 핵산 조성물이 본원에 제공된다. 특정 실시 형태에서, Ig 중쇄 가변 도메인 및/또는 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 설치류 불변 도메인(예를 들어, 래트 불변 도메인 또는 마우스 불변 도메인)이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 인간 불변 도메인이다. 일부 실시 형태에서, 제1 핵산 서열과 제2 핵산 서열은 단일 핵산 분자 상에 있다. 일부 실시 형태에서, 제1 핵산 서열과 제2 핵산 서열은 분리된 핵산 분자 상에 있다.
특정 측면에서, Ig 중쇄 가변 도메인 및 TCRα 불변 도메인을 포함하는 제1 CAR 폴리펩티드를 인코딩하는 제1 핵산 서열과, Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 TCRβ 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 인코딩하는 제2 핵산 서열을 포함하며, 여기서 제1 CAR 폴리펩티드 및 제2 CAR 폴리펩티드를 포함하는 CAR이 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 핵산 조성물이 본원에 제공된다. 특정 실시 형태에서, Ig 중쇄 가변 도메인 및/또는 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 설치류 불변 도메인(예를 들어, 래트 불변 도메인 또는 마우스 불변 도메인)이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 인간 불변 도메인이다. 일부 실시 형태에서, 제1 핵산 서열과 제2 핵산 서열은 단일 핵산 분자 상에 있다. 일부 실시 형태에서, 제1 핵산 서열과 제2 핵산 서열은 분리된 핵산 분자 상에 있다.
특정 측면에서, 본원에 기재된 핵산 조성물로 CAR을 발현하는 세포를 트랜스펙션시키는 단계를 포함하는, 상기 세포의 생성 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 세포는 인간 세포이다. 일부 실시 형태에서, 상기 세포는 설치류 세포(예를 들어, 래트 세포 또는 마우스 세포)이다. 일부 실시 형태에서, 상기 세포는 T 세포이다. 일부 실시 형태에서, 상기 세포는 생체외 T 세포이다. 일부 실시 형태에서, 본원에 기재된 방법에 따라 생성되거나 이로부터 얻어질 수 있는 세포가 본원에 제공된다.
특정 측면에서, 본원에 기재된 CAR을 발현하는 T 세포를 대상에게 투여하는 단계를 포함하는, 대상의 질환 또는 장애를 치료하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 질환 또는 장애는 암이며, CAR은 MHC로 제시된 암 항원에 대한 결합 특이성을 갖는다. 일부 실시 형태에서, 상기 질환 또는 장애는 감염증이며, CAR은 병원균 항원(예를 들어, 바이러스, 세균 또는 기생충 항원)에 대한 결합 특이성을 갖는다. 일부 실시 형태에서, 상기 질환 또는 장애는 자가면역질환 및/또는 염증성 질환이며, CAR은 자가면역 자가항원에 대하여 특이적이고, 조절 T 세포에 의해 발현된다. 일부 실시 형태에서, 상기 T 세포는 CD4+ T 세포이다. 일부 실시 형태에서, 상기 T 세포는 CD8+ T 세포이다.
도 1은 항원제시세포 상의 펩티드/MHC 복합체와 상호 작용하는 본원에 기재된 예시적인 CAR의 개략도를 나타낸다.
도 2은 항원제시세포 상의 펩티드/MHC 복합체와 상호 작용하는 본원에 기재된 예시적인 CAR의 개략도를 나타낸다.
도 3은 렌티바이러스 벡터를 사용하여 인간 Ig 가변 영역을 마우스 TCR 유전자좌에 연결시키기 위한 예시적인 도식을 나타낸다. 도면은 서열 번호 155로 "SGSG"를 개시한다.
도 4는 항원제시에 반응하여 CAR 발현 세포에 의한 사이토카인 분비를 나타낸다.
도 5는 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 큰 표적화 벡터(LTVEC)의 생성에 관한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한(예를 들어, 선택 카세트 등), 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 클로닝에 사용된 특정 제한 부위가 표시된다.
도 6은 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 태크만(TAQMAN) 프로브 혼성화 위치가 표시된다.
도 7은 추가의 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 태크만 프로브 혼성화 위치가 표시된다.
도 8은 추가의 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 태크만 프로브 혼성화 위치가 표시된다.
도 9는 추가의 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 태크만 프로브 혼성화 위치가 표시된다.
도 10은 Ig 중쇄 가변 영역 유전자 세그먼트를 마우스 내인성 TCRβ 유전자좌에 삽입하기 위한 LTVEC의 생성에 관한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다.
도 11은 Ig 중쇄 가변 영역 유전자 세그먼트를 마우스 내인성 TCRβ 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다.
도 12는 Ig 중쇄 가변 영역 유전자 세그먼트를 마우스 내인성 TCRβ 유전자좌에 삽입하는데 유용한 예시적인 LTVEC(정확한 축척이 아님)를 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다.
도 13은 Ig 중쇄 가변 영역 유전자 세그먼트를 마우스 내인성 TCRβ 유전자좌에 삽입하기 위한 도식에 관한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 단계 4는 TCR Vβ31 유전자 세그먼트를 제거하는 임의의 단계를 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다.
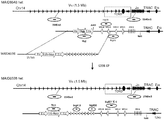
도 14는 내인성 TCRα 가변 영역 유전자좌가 재배열되지 않은 Ig κ 가변 영역 유전자 세그먼트(4개의 기능적 Vκ 및 5개의 기능적 Jκ)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 Ig κ/TCRα CAR 유전자좌의 재배열 시의 Vκ 및 Jκ 사용을 나타낸다. IGKV7-3은 위유전자이다.
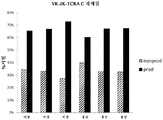
도 15는 내인성 TCRα 가변 영역 유전자좌가 재배열되지 않은 Ig κ 가변 영역 유전자 세그먼트(4개의 기능적 Vκ 및 5개의 기능적 Jκ)로 치환된 3마리의 트랜스제닉 마우스의 비장 T 세포에서의 Ig κ/TCRα CAR 유전자좌의 생산적 재배열 대 비생산적 재배열을 나타낸다. 생산적 재배열("prod")은 본원에서, 재배열된 핵산 서열이 작동가능한 결합으로 Vκ의 서열, 이어서 Jκ의 서열, 그 다음에 TCRα 불변 도메인의 서열을 갖는 단백질로 번역될 수 있는 재배열을 포함한다. 비생산적 재배열("nonprod")은 재배열된 VκJκ 엑손이 TCRα 불변 도메인을 인코딩하는 핵산 서열과 프레임을 벗어나거나, TCRα 도메인을 인코딩하는 서열과 프레임 내에 있지만 단백질로 번역될 수 없도록 종결 코돈을 포함하는 것들을 포함한다.
도 16은 내인성 TCRα 가변 영역 유전자좌가 재배열되지 않은 Ig κ 가변 영역 유전자 세그먼트(16개의 기능적 Vκ 및 5개의 기능적 Jκ)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 Ig κ/TCRα CAR 유전자좌의 재배열 시의 Vκ 및 Jκ 사용을 나타낸다.
도 17는 내인성 TCRα 가변 영역 유전자좌가 재배열되지 않은 Ig κ 가변 영역 유전자 세그먼트(16개의 기능적 Vκ 및 5개의 기능적 Jκ)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 Ig κ/TCRα CAR 유전자좌의 생산적 재배열 대 비생산적 재배열을 나타낸다. 생산적 재배열("prod")은 본원에서, 재배열된 핵산 서열이 작동가능한 결합으로 Vκ의 서열, 이어서 Jκ의 서열, 그 다음에 TCRα 불변 도메인의 서열을 갖는 단백질로 번역될 수 있는 재배열을 포함한다. 비생산적 재배열("nonprod")은 재배열된 VκJκ 엑손이 TCRα 불변 도메인을 인코딩하는 서열과 프레임을 벗어나거나, TCRα와 프레임 내에 있지만 단백질로 번역될 수 없도록 종결 코돈을 포함하는 것들을 포함한다.
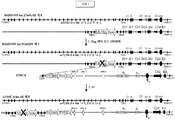
도 18은 내인성 TCRβ 가변 영역 유전자좌가 재배열되지 않은 IgH 가변 영역 유전자 세그먼트(3개의 기능적 VH 및 모든 기능적 D 및 JH)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 IgH/TCRβ CAR 유전자좌의 재배열 시의 VH 및 JH 사용을 나타낸다.
도 19는 내인성 TCRβ 가변 영역 유전자좌가 재배열되지 않은 IgH 가변 영역 유전자 세그먼트(3개의 기능적 VH 및 모든 기능적 D 및 JH)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 IgH/TCRβ CAR 유전자좌의 생산적 재배열 대 비생산적 재배열을 나타낸다. 생산적 재배열("prod")은 본원에서, 재배열된 핵산 서열이 작동가능한 결합으로 VH의 서열, 이어서 D의 서열, 그 다음에 JH의 서열, 그 후에 TCRβ 불변 도메인의 서열을 갖는 단백질로 번역될 수 있는 재배열을 포함한다. 비생산적 재배열("nonprod")은 재배열된 VDJ 엑손이 TCRβ 불변 도메인을 인코딩하는 서열과 프레임을 벗어나거나, TCRβ와 프레임 내에 있지만 단백질로 번역될 수 없도록 종결 코돈을 포함하는 것들을 포함한다.
도 2은 항원제시세포 상의 펩티드/MHC 복합체와 상호 작용하는 본원에 기재된 예시적인 CAR의 개략도를 나타낸다.
도 3은 렌티바이러스 벡터를 사용하여 인간 Ig 가변 영역을 마우스 TCR 유전자좌에 연결시키기 위한 예시적인 도식을 나타낸다. 도면은 서열 번호 155로 "SGSG"를 개시한다.
도 4는 항원제시에 반응하여 CAR 발현 세포에 의한 사이토카인 분비를 나타낸다.
도 5는 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 큰 표적화 벡터(LTVEC)의 생성에 관한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한(예를 들어, 선택 카세트 등), 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 클로닝에 사용된 특정 제한 부위가 표시된다.
도 6은 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 태크만(TAQMAN) 프로브 혼성화 위치가 표시된다.
도 7은 추가의 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 태크만 프로브 혼성화 위치가 표시된다.
도 8은 추가의 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 태크만 프로브 혼성화 위치가 표시된다.
도 9는 추가의 Ig κ 가변 영역 유전자 세그먼트를 마우스 내인성 TCRα 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다. 태크만 프로브 혼성화 위치가 표시된다.
도 10은 Ig 중쇄 가변 영역 유전자 세그먼트를 마우스 내인성 TCRβ 유전자좌에 삽입하기 위한 LTVEC의 생성에 관한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다.
도 11은 Ig 중쇄 가변 영역 유전자 세그먼트를 마우스 내인성 TCRβ 유전자좌에 삽입하기 위한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다.
도 12는 Ig 중쇄 가변 영역 유전자 세그먼트를 마우스 내인성 TCRβ 유전자좌에 삽입하는데 유용한 예시적인 LTVEC(정확한 축척이 아님)를 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다.
도 13은 Ig 중쇄 가변 영역 유전자 세그먼트를 마우스 내인성 TCRβ 유전자좌에 삽입하기 위한 도식에 관한 예시적인 도식(정확한 축척이 아님)을 나타낸다. 단계 4는 TCR Vβ31 유전자 세그먼트를 제거하는 임의의 단계를 나타낸다. 달리 명시되지 않는 한, 마우스 서열은 채워진 형태 및 단일선으로 표시되고, 인간 서열은 비어 있는 형태 및 이중선으로 표시된다.
도 14는 내인성 TCRα 가변 영역 유전자좌가 재배열되지 않은 Ig κ 가변 영역 유전자 세그먼트(4개의 기능적 Vκ 및 5개의 기능적 Jκ)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 Ig κ/TCRα CAR 유전자좌의 재배열 시의 Vκ 및 Jκ 사용을 나타낸다. IGKV7-3은 위유전자이다.
도 15는 내인성 TCRα 가변 영역 유전자좌가 재배열되지 않은 Ig κ 가변 영역 유전자 세그먼트(4개의 기능적 Vκ 및 5개의 기능적 Jκ)로 치환된 3마리의 트랜스제닉 마우스의 비장 T 세포에서의 Ig κ/TCRα CAR 유전자좌의 생산적 재배열 대 비생산적 재배열을 나타낸다. 생산적 재배열("prod")은 본원에서, 재배열된 핵산 서열이 작동가능한 결합으로 Vκ의 서열, 이어서 Jκ의 서열, 그 다음에 TCRα 불변 도메인의 서열을 갖는 단백질로 번역될 수 있는 재배열을 포함한다. 비생산적 재배열("nonprod")은 재배열된 VκJκ 엑손이 TCRα 불변 도메인을 인코딩하는 핵산 서열과 프레임을 벗어나거나, TCRα 도메인을 인코딩하는 서열과 프레임 내에 있지만 단백질로 번역될 수 없도록 종결 코돈을 포함하는 것들을 포함한다.
도 16은 내인성 TCRα 가변 영역 유전자좌가 재배열되지 않은 Ig κ 가변 영역 유전자 세그먼트(16개의 기능적 Vκ 및 5개의 기능적 Jκ)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 Ig κ/TCRα CAR 유전자좌의 재배열 시의 Vκ 및 Jκ 사용을 나타낸다.
도 17는 내인성 TCRα 가변 영역 유전자좌가 재배열되지 않은 Ig κ 가변 영역 유전자 세그먼트(16개의 기능적 Vκ 및 5개의 기능적 Jκ)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 Ig κ/TCRα CAR 유전자좌의 생산적 재배열 대 비생산적 재배열을 나타낸다. 생산적 재배열("prod")은 본원에서, 재배열된 핵산 서열이 작동가능한 결합으로 Vκ의 서열, 이어서 Jκ의 서열, 그 다음에 TCRα 불변 도메인의 서열을 갖는 단백질로 번역될 수 있는 재배열을 포함한다. 비생산적 재배열("nonprod")은 재배열된 VκJκ 엑손이 TCRα 불변 도메인을 인코딩하는 서열과 프레임을 벗어나거나, TCRα와 프레임 내에 있지만 단백질로 번역될 수 없도록 종결 코돈을 포함하는 것들을 포함한다.
도 18은 내인성 TCRβ 가변 영역 유전자좌가 재배열되지 않은 IgH 가변 영역 유전자 세그먼트(3개의 기능적 VH 및 모든 기능적 D 및 JH)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 IgH/TCRβ CAR 유전자좌의 재배열 시의 VH 및 JH 사용을 나타낸다.
도 19는 내인성 TCRβ 가변 영역 유전자좌가 재배열되지 않은 IgH 가변 영역 유전자 세그먼트(3개의 기능적 VH 및 모든 기능적 D 및 JH)로 치환된 트랜스제닉 마우스의 흉선세포 및 비장 T 세포에서의 IgH/TCRβ CAR 유전자좌의 생산적 재배열 대 비생산적 재배열을 나타낸다. 생산적 재배열("prod")은 본원에서, 재배열된 핵산 서열이 작동가능한 결합으로 VH의 서열, 이어서 D의 서열, 그 다음에 JH의 서열, 그 후에 TCRβ 불변 도메인의 서열을 갖는 단백질로 번역될 수 있는 재배열을 포함한다. 비생산적 재배열("nonprod")은 재배열된 VDJ 엑손이 TCRβ 불변 도메인을 인코딩하는 서열과 프레임을 벗어나거나, TCRβ와 프레임 내에 있지만 단백질로 번역될 수 없도록 종결 코돈을 포함하는 것들을 포함한다.
개요
면역글로불린(Ig)으로부터 유래되는 항원 결합 도메인 및 T 세포 수용체(TCR)로부터 유래되는 불변 도메인을 갖는 키메라 항원 수용체(CAR)와 관련된 방법 및 조성물이 본원에 제공된다. 일부 실시 형태에서, CAR은 주요 조직 적합성 복합체(MHC) 단백질에 의해 제시되는 펩티드에 대한 결합 특이성을 갖는다.
항체는 높은 친화도와 특이성을 가진 표적 항원에 대한 결합능 때문에 유효한 치료제인 것으로 입증되었다. 기존 항체 치료 기술의 약점 중 하나는 세포막을 통해 항체를 전달하는 것과 관련된 문제점으로 인해, 세포 내 항원과 같은 특정 항원을 표적으로 하는 것이 어렵다는 것이다. 따라서, 현재 항체 치료법은 일반적으로 세포 표면 단백질 및 사이토카인과 같은 가용성 인자와 같은 세포 외 항원에 관한 것이다. 반면에, 많은 종양 항원과 바이러스 항원을 포함한 세포 내 표적은 여전히 표적으로 하기가 어렵다.
주요 조직 적합성 복합체(MHC) 단백질에 제시된 펩티드 항원을 인식할 수 있는 항체를 사용함으로써, 세포막을 통해 항체를 전달하는 문제를 피할 수 있었다. 모든 유핵 포유류 세포는 내인성 세포 단백질을 가공 처리하여, 클래스 I MHC 단백질 상에 로딩되고 세포 표면 상에 제시되는 펩티드로 한다. 유사하게는, 수지상 세포 또는 대식세포와 같은 전문(professional) 항원제시세포(APC)는 외인성 항원을 가공 처리하여, 클래스 II MHC 단백질 상에 로딩되고 APC 세포 표면 상에 제시되는 펩티드로 한다. 흉선에서의 T 세포 발생 시에, T 세포는 양성 및 음성 선택을 거쳐, MHC에 대한 펩티드 비의존성 친화도가 매우 약한 TCR을 발현하는 소수의 T 세포 만이 흉선에서 출현하는(양성 선택) 반면에, 자가 펩티드/MHC에 친화도가 중간 내지 높은 TCR을 발현하는 T 세포가 아폽토시스에 이르는(음성 선택) 것으로 확인된다. TCR과 달리, 항체는 통상 MHC 기반의 양성 및 음성 선택을 거치지 않으며, 통상적인 항체 생성 기술을 사용하여 펩티드/MHC 복합체에 특이적인 항체를 생성하는 것이 어려운 것으로 입증되었다.
본원에 기재된 바와 같이, 일부 실시 형태에서, 펩티드/MHC 복합체에 특이적인 항체와 같은 가용성 항원 결합 분자는 Ig 가변 도메인 및 TCR 불변 도메인을 갖는 CAR을 발현하는 T 세포를 갖도록 유전자 조작된 유전자 변형 비인간 동물(예를 들어, 마우스)을 사용하여 생성될 수 있다. 이러한 비인간 동물은 TCRα 및 TCRβ 불변 영역에 작동가능하게 연결된 재배열되지 않은 Ig 경쇄 및 중쇄 가변(V(D)J) 유전자 세그먼트로부터 유래된 Ig 가변 도메인을 가지며, 항원(예를 들어, 펩티드/MHC)과 만나면, CAR 유전자좌에서 V(D)J 재배열을 거쳐 재배열된 CAR 분자를 생성시켜, T 세포 상에서의 CAR 발현을 일으킨다. 이러한 T 세포는 양성 및 음성 선택을 거치기 때문에, 발현된 CAR은 펩티드/MHC에 항원 특이성을 갖는다. 따라서, 이러한 마우스는 펩티드/MHC 복합체를 표적할 수 있는 항원 결합 단백질을 생성시키는데 사용될 수 있다. 예를 들어, 마우스는 펩티드/MHC 항원으로 면역화되어, 항원 특이적 T 세포를 생성할 수 있다. 항원 특이적 T 세포에서 발현되는 CAR의 Ig 가변 도메인을 인코딩하는 핵산은 숙주 세포에서 Ig 불변 도메인을 인코딩하는 핵산에 작동가능하게 연결될 수 있어서, 숙주 세포가 펩티드/MHC 특이적 항체를 발현한다.
정의
관사 "a" 및 "an"은 관사의 문법적 대상 중 하나 또는 하나 이상(즉, 적어도 하나)을 언급하기 위해 본원에 사용된다. 예로서, "하나의 요소"는 하나의 요소 또는 하나 이상의 요소를 의미한다.
용어 "아미노산"은 천연이든 합성이든, 아미노 작용기 및 산 작용기를 포함하고, 천연 유래 아미노산의 폴리머에 포함될 수 있는 모든 분자를 포함하도록 의도된다. 예시적인 아미노산은 천연 유래 아미노산; 이의 유사체, 유도체 및 동족체; 변형된 측쇄를 갖는 아미노산 유사체; 및 상술한 것 중 어느 하나의 모든 입체 이성질체를 포함한다.
본원에 사용되는 용어 "항체"는 온전한(intact) 항체 및 이의 항원 결합 단편을 지칭할 수 있다. 온전한 항체는 다이설파이드 결합에 의해 상호 연결되어 있는 적어도 2개의 중쇄(H) 쇄 및 2개의 경쇄(L)를 포함하는 당단백질이다. 각각의 중쇄는 중쇄 가변 도메인 및 중쇄 불변 도메인을 포함한다. 각각의 경쇄는 경쇄 가변 도메인 및 경쇄 불변 도메인을 포함한다. 중쇄 가변 도메인 및 경쇄 가변 도메인은 더욱 보전되고 프레임워크 영역(FR)으로 지칭되는 영역이 산재된 상보성 결정 영역(CDR)으로 지칭되는 초가변성 도메인으로 추가로 세분될 수 있다. 각각의 중쇄 가변 도메인 및 경쇄 가변 도메인은 아미노 말단에서 카르복시 말단으로 다음 순서로 배열된 3개의 CDR 및 4개의 FR로 구성된다: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. 중쇄 및 경쇄의 가변 도메인은 항원과 상호 작용하는 결합 도메인을 포함한다.
본원에 사용되는 항체의 "항원 결합 단편" 및 "항원 결합 부위"라는 용어는 항원에 결합하는 능력을 보유하는 항체의 하나 이상의 단편을 말한다. 항체의 "항원 결합 단편"이라는 용어 내에 포함되는 결합 단편의 예로는 Fab, Fab', F(ab')2, Fv, scFv, 다이설파이드 결합된 Fv, Fd, 단일쇄 항체, 단리된 CDRH3, 및 온전한 항체의 가변 도메인의 적어도 일부를 보유하는 다른 항체 단편을 포함한다. 이러한 항체 단편은 통상적인 재조합 및/또는 효소 기술을 사용하여 얻어질 수 있으며, 온전한 항체와 동일한 방법으로 항원 결합이 스크리닝될 수 있다.
본원에 사용 된 "키메라 항원 수용체" 또는 "CAR"은 면역글로불린 항원 결합 도메인(예를 들어, 면역글로불린 가변 도메인) 및 T 세포 수용체(TCR) 불변 도메인을 포함하는 항원 결합 단백질을 의미한다. 본원에 사용되는, TCR 폴리펩티드의 "불변 도메인"은 막근위(membrane-proximal) TCR 불변 도메인을 포함하고, 또한 TCR 막관통(transmembrane) 도메인 및/또는 TCR 세포질 꼬리(cytoplasmic tail)를 포함할 수 있다. 예를 들어, 일부 실시 형태에서, CAR은 TCRβ 불변 도메인에 연결된 면역글로불린 중쇄 가변 도메인을 포함하는 제1 폴리펩티드와, TCRα 불변 도메인에 연결된 면역글로불린 경쇄 가변 도메인(예를 들어, κ 또는 λ 가변 도메인)을 포함하는 제2 폴리펩티드를 포함하는 이량체이다. 일부 실시 형태에서, CAR은 TCRα 불변 도메인에 연결된 면역글로불린 중쇄 가변 도메인을 포함하는 제1 폴리펩티드와, TCRβ 불변 도메인에 연결된 면역글로불린 경쇄 가변 도메인(예를 들어, κ 또는 λ 가변 도메인)을 포함하는 제2 폴리펩티드를 포함하는 이량체이다.
재배열되지 않은 가변 영역 및/또는 재배열되지 않은 가변 영역 유전자 세그먼트 "로부터 유래된" 재배열된 가변 영역 유전자와 관련하여 사용될 때의 "(으)로부터 유래된"이라는 어구는 재배열된 가변 영역 유전자의 서열이 일련의 재배열되지 않은 가변 영역 유전자 세그먼트에서 유래하고 재배열되어, 가변 도메인을 발현하는 유전자를 형성하는 능력(적용가능한 경우, 스플라이스 차이(splice difference) 및 체세포 돌연변이를 고려함)을 지칭한다. 예를 들어, 체세포 돌연변이를 겪은 재배열된 가변 영역 유전자는 여전히 재배열되지 않은 가변 영역 유전자 세그먼트로부터 유래된다. 일부 실시 형태에서, 내인성 유전자좌가 유니버셜 경쇄 또는 중쇄 유전자좌로 치환되는 경우, "(으)로부터 유래된"이라는 용어는 서열이 체세포 돌연변이를 겪었을지라도 상기 재배열된 유전자좌로의 서열 유래를 추적하는 능력을 나타낸다.
본원에 사용되는 용어 "유전자좌"는 일련의 관련된 유전 요소(예를 들어, 유전자, 유전자 세그먼트, 조절 요소)를 포함하는 염색체 상의 위치를 지칭한다. 예를 들어, 재배열되지 않은 면역글로불린 유전자좌는 면역글로불린 가변 영역 유전자 세그먼트, 하나 이상의 면역글로불린 불변 영역 유전자, 및 V(D)J 재조합 및 면역글로불린 발현을 유도하는 관련 조절 요소(예를 들어, 프로모터, 인핸서, 스위치 요소 등)를 포함할 수 있다. 유사하게는, 재배열되지 않은 CAR 유전자좌는 면역글로불린 가변 영역 유전자 세그먼트, TCR 불변 영역 유전자, 및 V(D)J 재조합 및 CAR 발현을 유도하는 관련 조절 요소(예를 들어, 프로모터, 인핸서 등)를 포함할 수 있다. 유전자좌는 내인성 또는 비내인성일 수 있다. 용어 "내인성 유전자좌"는 특정 유전 요소가 자연적으로 발견되는 염색체 상의 위치를 말한다. 예를 들어, 내인성 마우스 TCRα 유전자좌는 야생형 마우스에서 TCRα 가변 영역 유전자 세그먼트 및 불변 영역 유전자를 포함하는 마우스 염색체 14 상의 위치를 지칭하는 반면에, 내인성 마우스 TCRβ 유전자좌는 야생형 마우스에서 TCRβ 가변 영역 유전자 세그먼트 및 불변 영역 유전자를 포함하는 마우스 염색체 6 상의 위치를 지칭한다.
재배열되지 않은 가변 영역 유전자 세그먼트가 항원 결합 단백질의 폴리펩티드 쇄로서 불변 영역 유전자와 함께 발현되는 재배열된 가변 영역 유전자를 형성하도록 재배열될 수 있으면, 재배열되지 않은 가변 영역 유전자 세그먼트는 인접한 불변 영역 유전자에 "작동가능하게 연결"된다. 예를 들어, 재배열되지 않은 면역글로불린 가변 영역 유전자 세그먼트는 CAR 유전자좌의 TCR 불변 영역 유전자에 작동가능하게 연결된다.
용어 "폴리뉴클레오티드" 및 "핵산"은 상호교환적으로 사용된다. 이들은 임의의 길이의 뉴클레오티드의 중합체 형태, 데옥시리보뉴클레오티드 또는 리보뉴클레오티드, 또는 이들의 유사체를 지칭한다. 폴리뉴클레오티드는 임의의 3차원 구조를 가질 수 있으며, 임의의 기능을 행할 수 있다. 다음은 폴리뉴클레오티드의 비제한적인 예이다: 유전자 또는 유전자 단편의 코딩 또는 비코딩 영역, 연관 분석(linkage analysis)으로부터 정의된 유전자좌들(유전자좌), 엑손, 인트론, 메신저 RNA(mRNA), 전달 RNA, 리보솜 RNA, 리보자임, cDNA, 재조합 폴리뉴클레오티드, 분지형 폴리뉴클레오티드, 플라스미드, 벡터, 임의의 서열의 단리된 DNA, 임의의 서열의 단리된 RNA, 핵산 프로브 및 프라이머. 폴리뉴클레오티드는 변형된 뉴클레오티드, 예컨대 메틸화 뉴클레오티드 및 뉴클레오티드 유사체를 포함할 수 있다. 있다면, 뉴클레오티드 구조의 변형은 중합체의 어셈블리 전후에 주어질 수 있다. 폴리뉴클레오티드는 예를 들어, 표지 성분과의 접합에 의해 추가로 변형될 수 있다. 본원에 제공된 모든 핵산 서열에서, U 뉴클레오티드는 T 뉴클레오티드와 상호교환 가능하다.
본원에 사용되는 "특이적 결합"및 "항원 특이성"은 항원 결합 분자(예를 들어, 항체 또는 CAR)가 소정의 펩티드/MHC 복합체와 같은 소정의 표적에 결합할 수 있는 능력을 나타낸다. 전형적으로, 항원 결합 분자는 약 10-7 M 이하의 KD에 상당하는 친화도로 이의 소정의 표적에 특이적으로 결합하는데, 비특이적이고 관련이 없는 표적(예를 들어, BSA, 카제인)에 대한 이의 결합 친화도보다 적어도 10배, 적어도 100배 또는 적어도 1000배 적은 친화도(KD로 표시됨)로 상기 소정의 표적에 결합한다.
용어 "재배열되지 않은"은 면역글로불린, TCR 또는 CAR 가변 영역 유전자좌 또는 가변 영역 유전자 세그먼트의 상태를 포함하며, 여기서 V 유전자 세그먼트 및 J 유전자 세그먼트는(중쇄 또는 TCRβ 가변 영역의 경우, D 유전자 세그먼트도 또한) 별개로 유지되지만, V(D)J 레퍼토리(repertoire)의 단일 V, (D), J를 포함하는 재배열된 V(D)J 유전자 ("가변 영역 유전자")를 형성하도록 결합될 수 있다.
키메라 항원 수용체 유전자좌
특정 측면에서, 키메라 항원 수용체(CAR) 유전자좌가 본원에 제공된다. 이러한 CAR 유전자좌는 일반적으로 가변 영역 유전자좌 및 불변 영역 유전자좌를 포함한다. 가변 영역 유전자좌는 재배열되지 않은 Ig 가변 영역 유전자 세그먼트르 포함하는 반면에, 불변 영역 유전자좌는 TCR 불변 영역 유전자를 포함하며, 여기서 Ig 가변 영역 유전자 세그먼트는 불변 영역 유전자에 작동가능하게 연결된다. 일부 실시 형태에서, 가변 영역은 재배열되지 않은 가변 영역일 것이며, 따라서 재배열되지 않은 Ig 가변 영역 유전자 세그먼트를 포함할 것이다. 일부 실시 형태에서, 가변 영역은 재배열된 가변 영역일 것이며, 따라서 재배열된 가변 영역 유전자를 포함할 것이다. 특정 실시 형태에서, 상기 Ig 가변 영역 유전자 세그먼트는 인간 가변 영역 유전자 세그먼트이며, 상기 TCR 불변 영역 유전자는 비인간 불변 영역 유전자이다. 예를 들어, 일부 실시 형태에서, 상기 TCR 불변 영역 유전자는 설치류 불변 영역 유전자, 예컨대 래트 불변 영역 유전자 또는 마우스 불변 영역 유전자이다. 특정 실시 형태에서, 상기 Ig 가변 영역 유전자 세그먼트는 인간 가변 영역 유전자 세그먼트이며, 상기 TCR 불변 영역 유전자는 인간 불변 영역 유전자이다.
일부 실시 형태에서, 본원에 기재된 CAR 유전자좌는 내인성 TCR 유전자좌에 위치한다. 예를 들어, 일부 실시 형태에서, TCRα 불변 영역 유전자를 포함하는 CAR 유전자좌는 내인성 TCRα 불변 영역 유전자좌에 위치한다. 일부 실시 형태에서, 이러한 유전자좌는 재배열되지 않은 TCRα 가변 영역의 일부 또는 전체를 재배열되지 않은 Ig 가변 영역으로 치환함으로써 생성된다. 일부 실시 형태에서, TCRβ 불변 영역 유전자를 포함하는 CAR 유전자좌는 내인성 TCRβ 불변 영역 유전자좌에 위치한다. 일부 실시 형태에서, 이러한 유전자좌는 재배열되지 않은 TCRβ 가변 영역의 일부 또는 전체를 재배열되지 않은 Ig 가변 영역으로 치환함으로써 생성된다. 예시적인 CAR 유전자좌의 구축 방법은 본원의 실시예 2에 제공된다.
특정 실시 형태에서, CAR 가변 영역 유전자좌는 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트를 포함할 것이다. 인간 가변 영역 유전자 세그먼트를 포함함하는 예시적인 가변 영역 유전자좌가 당해 기술 분야에 기재되어 있다. 예를 들어, 이러한 유전자좌는 각각, 본원에 참조로 포함되는 미국 특허 제5,770,429호, 제5,814,318호, 제6,114,598호, 제6,998,514호, 제8,232,449호, 제8,502,018호 및 제8,697,940호에 기재되어 있으며, 각각, 본원에 참조로 포함되는 미국 특허 공개 제2008/0098490호, 제2012/0167237호, 제2013/0145484호, 제2013/0326647호, 제2014/013275호 및 제2014/093908호에 기재되어 있다.
특정 실시 형태에서, CAR 가변 영역 유전자좌는 재배열되지 않은 인간 Ig 중쇄 가변 영역 유전자 세그먼트를 포함한다. 일부 실시 형태에서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 복수의 인간 VH 세그먼트, 하나 이상의 인간 DH 세그먼트 및 하나 이상의 인간 JH 세그먼트를 포함한다. 일부 실시 형태에서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 3개 이상의 VH 유전자 세그먼트, 18개 이상의 VH 유전자 세그먼트, 20개 이상의 VH 유전자 세그먼트, 30개 이상의 VH 유전자 세그먼트, 40개 이상의 VH 유전자 세그먼트, 50개 이상의 VH 유전자 세그먼트, 60개 이상의 VH 유전자 세그먼트, 70개 이상의 VH 유전자 세그먼트 또는 80개 이상의 VH 유전자 세그먼트를 포함한다. 일부 실시 형태에서, 재배열되지 않은 인간 Ig 유전자 세그먼트는 모든 인간 DH 유전자 세그먼트를 포함한다. 일부 실시 형태에서, CAR 가변 영역은 TCRβ 가변 영역 유전자 세그먼트(예를 들어, V, D 및/또는 J 유전자 세그먼트)를 추가로 포함한다. 일 실시 형태에서, CAR 가변 영역은 원위 TCR Vβ 유전자 세그먼트, 예를 들어 TCR Vβ31 유전자 세그먼트를 추가로 포함한다. 다른 실시 형태에서, 원위 TCR Vβ 유전자 세그먼트, 예를 들어, TCR Vβ31 유전자 세그먼트는 기능적으로 불활성화되거나 결실되었다. 일부 실시 형태에서, 재배열되지 않은 인간 Ig 유전자 세그먼트는 모든 인간 JH 유전자 세그먼트를 포함한다. Ig 중쇄 유전자 세그먼트를 포함하는 예시적인 가변 영역은 예를 들어, 본원에 참조로 포함되는 문헌 [Macdonald et al., Proc . Natl . Acad . Sci . USA 111:5147-52] 및 보충 정보에 제공된다.
일부 실시 형태에서, 재배열되지 않은 인간 Ig 중쇄 가변 영역 유전자 세그먼트를 포함하는 CAR 가변 유전자좌는 또한 인간 Ig 중쇄 가변 영역 유전자간 서열을 포함한다. 일부 실시 형태에서, CAR 가변 유전자좌는 비인간(예를 들어, 설치류, 래트, 마우스) Ig 중쇄 가변 영역 유전자간 서열을 포함한다. 일부 실시 형태에서, CAR 가변 유전자좌는 인간 또는 비인간(예를 들어, 설치류, 래트, 마우스) TCRβ 가변 영역 유전자간 서열을 포함한다. 예를 들어, 일부 실시 형태에서, CAR 유전자좌의 재배열되지 않은 가변 영역은 하나 이상의(예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20개의) 트립시노겐(TRY) 유전자(예를 들어, 통상 TCRβ 가변 영역 유전자좌에 존재하는 TRY 유전자 및/또는 위유전자)를 포함한다. 일부 실시 형태에서, 상기 TRY 유전자는 마우스 TRY 유전자이다. 일부 실시 형태에서, 마우스 TRY 유전자는 Try1, Try2, Try3, Try4, Try5, Try6, Try7, Try8, Try9, Try10, Try11, Try12, Try13, Try14, Try15, Try16, Try17, Try18, Try19 및 Try20으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 하나 이상의 TRY 유전자는 재배열되지 않은 가변 영역의 VH 세그먼트의 상류에 위치한다. 일부 실시 형태에서, 하나 이상의 TRY 유전자는 재배열되지 않은 가변 영역의 VH 세그먼트의 하류 및 DH 세그먼트의 상류에 위치한다. 일부 실시 형태에서, Try 1 내지 7은 재배열되지 않은 가변 영역의 VH 세그먼트의 상류에 위치하며, Try 8 내지 20은 재배열되지 않은 가변 영역의 VH 세그먼트의 하류 및 재배열되지 않은 가변 영역의 DH 세그먼트의 상류에 위치한다. 인간 및/또는 마우스 TCRβ 유전자좌에 위치하는 TRY 유전자에 관한 부가 정보는 각각, 본원에 참조로 포함되는 문헌[Glusman et al., Immunity 15:337-349 (2001)] 및 문헌[Skok et al., Nature Immunology 8:378-387 (2007)]에 제공된다. 일부 실시 형태에서, CAR 유전자좌는 비인간 조절 요소(예를 들어, 비인간 프로모터 및/또는 인핸서)를 포함한다. 일부 실시 형태에서, 비인간 조절 요소는 설치류 조절 요소(예를 들어, 래트 또는 마우스 프로모터 또는 인핸서)이다. 일부 실시 형태에서, CAR 유전자좌는 IgM 인핸서(Eμ)를 포함한다. 일부 실시 형태에서, IgM 인핸서는 비인간 Eμ(예를 들어, 설치류 Eμ, 예컨대 마우스 또는 래트 Eμ)이다.
특정 실시 형태에서, CAR 가변 영역 유전자좌는 재배열되지 않은 인간 Ig κ 가변 영역 유전자 세그먼트를 포함한다. 일부 실시 형태에서, 재배열되지 않은 인간 면역글로불린 가변 영역 유전자 세그먼트는 복수의 인간 Vκ 세그먼트 및 하나 이상의 인간 Jκ 세그먼트를 포함한다. 일부 실시 형태에서, 상기 면역글로불린 가변 영역 유전자 세그먼트는 4개의 기능적 Vκ 세그먼트 및 모든 인간 Jκ 세그먼트를 포함한다. 일부 실시 형태에서, 상기 면역글로불린 가변 영역 유전자 세그먼트는 16개의 기능적 Vκ 세그먼트 및 모든 인간 Jκ 세그먼트를 포함한다. 일부 실시 형태에서, 재배열되지 않은 인간 면역글로불린 가변 영역 유전자 세그먼트는 모든 인간 Vκ 세그먼트 및 모든 인간 Jκ 세그먼트를 포함한다. Ig κ 유전자 세그먼트를 포함하는 예시적인 가변 영역은 예를 들어, 본원에 참조로 포함되는 문헌[Macdonald et al., Proc . Natl . Acad . Sci . USA 111:5147-52] 및 보충 정보에 제공된다. 일부 실시 형태에서, 재배열되지 않은 인간 면역글로불린 가변 영역 유전자 세그먼트는 모든 인간 Jκ 세그먼트를 포함한다. 일부 실시 형태에서, CAR 가변 영역은 TCRα 가변 영역 유전자 세그먼트(예를 들어, V, 및/또는 J 유전자 세그먼트)를 추가로 포함한다.
특정 실시 형태에서, CAR 가변 영역 유전자좌는 재배열되지 않은 인간 Ig λ 가변 영역 유전자 세그먼트를 포함한다. 일부 실시 형태에서, 재배열되지 않은 인간 면역글로불린 가변 영역 유전자 세그먼트는 복수의 인간 Vλ 세그먼트 및 하나 이상의 인간 Jλ 세그먼트를 포함한다. 일부 실시 형태에서, 재배열되지 않은 인간 면역글로불린 가변 영역 유전자 세그먼트는 모든 인간 Vλ 세그먼트를 포함한다. 일부 실시 형태에서, 재배열되지 않은 인간 면역글로불린 가변 영역 유전자 세그먼트는 모든 인간 Jλ 세그먼트를 포함한다. 일부 실시 형태에서, CAR 가변 영역은 TCRα 가변 영역 유전자 세그먼트(예를 들어, V, 및/또는 J 유전자 세그먼트)를 추가로 포함한다. Ig λ 유전자 세그먼트를 포함하는 예시적인 가변 영역은 예를 들어, 각각 본원에 참조로 포함되는 미국 특허 공개 제2012/0073004호 및 제2002/0088016호에 제공된다.
일부 실시 형태에서, 재배열되지 않은 인간 Ig 경쇄 가변 영역 유전자 세그먼트를 포함하는 CAR 가변 유전자좌는 또한 인간 Ig 경쇄 가변 영역 유전자간 서열(예를 들어, κ 가변 영역 유전자간 서열 및/또는 λ 가변 영역 유전자간 서열)을 포함한다. 일부 실시 형태에서, CAR 가변 유전자좌는 비인간(예를 들어, 설치류, 래트, 마우스) Ig 경쇄 가변 영역 유전자간 서열(예를 들어, κ 가변 영역 유전자간 서열 및/또는 λ 가변 영역 유전자간 서열)을 포함한다. 일부 실시 형태에서, CAR 가변 유전자좌는 인간 또는 비인간(예를 들어, 설치류, 래트, 마우스) TCRα 가변 영역 유전자간 서열을 포함한다. 일부 실시 형태에서, CAR 유전자좌는 비인간 조절 요소(예를 들어, 비인간 프로모터 및/또는 인핸서)를 포함한다. 일부 실시 형태에서, 비인간 조절 요소는 설치류 조절 요소(예를 들어, 래트 또는 마우스 프로모터 또는 인핸서)이다.
일부 실시 형태에서, CAR 가변 영역 유전자좌는 Ig 중쇄 가변 영역 유전자 (유니버셜 중쇄 가변 영역)를 포함하는 재배열된 가변 영역 유전자좌이다. 일부 실시 형태에서, 재배열된 Ig 중쇄 가변 영역 유전자는 재배열된 인간 Ig 중쇄 가변 영역 유전자이다. 유니버셜 경쇄 가변 영역을 사용하면, 하나 이상의 항원 결합 도메인이 펩티드/MHC 복합체에 대한 특이성을 갖는 이중 특이성 항체의 생성을 용이하게 한다. 예시적인 재배열된 Ig 중쇄 가변 영역은 본원에 참조로 포함되는 미국 특허 공개 제2014/0245468호에 제공된다.
일부 실시 형태에서, CAR 가변 영역 유전자좌는 Ig 경쇄 가변 영역 유전자 (유니버셜 경쇄 가변 영역)를 포함하는 재배열된 가변 영역 유전자좌이다. 일부 실시 형태에서, 재배열된 Ig 경쇄 가변 영역 유전자는 재배열된 인간 Ig 경쇄 가변 영역 유전자이다. 유니버셜 중쇄 가변 영역을 사용하면, 하나 이상의 항원 결합 도메인이 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 이중 특이성 항체의 생성을 용이하게 한다. 예시적인 재배열된 Ig 중쇄 가변 영역은 본원에 참조로 포함되는 미국 특허 공개 제2013/0185821호에 제공된다.
특정 실시 형태에서, CAR 불변 영역 유전자좌는 TCRα 또는 TCRβ 불변 영역 유전자를 포함한다. 일부 실시 형태에서, CAR 불변 영역 유전자좌는 면역글로불린 조절 서열(예를 들어, 인간 또는 내인성 종에서 유래되는 조절 서열)을 추가로 포함한다. 일부 실시 형태에서, CAR 불변 영역 유전자좌는 TCRβ C2의 상류에 마우스 또는 래트 IgM 인핸서(Eμ)를 포함한다. 일부 실시 형태에서, TCR 불변 영역 유전자는 또한 Ig 불변 영역 서열을 포함한다. 예를 들어, 일부 실시 형태에서, CAR 불변 영역 유전자좌는 Ig 중쇄 CH1 도메인을 인코딩하는 핵산 서열을 포함하는 TCRβ 불변 영역 유전자를 포함한다. 일부 실시 형태에서, CAR 불변 영역 유전자좌는 Ig λ 또는 Ig κ 불변 영역 또는 이의 부분을 인코딩하는 핵산 서열을 포함하는 TCRα 불변 영역 유전자를 포함한다.
인간화 MHC
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물 및 ES 세포는 인간화 MHC 클래스 I α 쇄 폴리펩티드(예를 들어, 인간화 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-g, HLA-K 및/또는 HLA-L)를 발현하고/하거나 이를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 폴리펩티드는 인간 세포외 도메인(예를 들어, 인간 α1, α2 및 α3 도메인) 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 인간화 MHC 클래스 I α 쇄 폴리펩티드, 인간화 MHC 클래스 I α 쇄 폴리펩티드를 인코딩하는 유전자좌 및 인간화 MHC 클래스 I α 쇄 폴리펩티드를 발현하는 비인간 동물은 각각, 본원에 참조로 포함되는 미국 특허 공개 제2013/0111617호, 제2013/0185819호 및 제2014/0245467호에 기재되어 있다.
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물 및 ES 세포는 인간화 β-2-마이크로글로불린 폴리펩티드를 발현하고/하거나 이를 인코딩하는 유전자좌를 게놈에 포함한다. 인간화 β-2-마이크로글로불린 폴리펩티드, 인간화 β-2-마이크로글로불린 폴리펩티드를 인코딩하는 유전자좌 및 인간화 β-2-마이크로글로불린 폴리펩티드를 발현하는 비인간 동물은 각각, 본원에 참조로 포함되는 미국 특허 공개 제2013/0111617호 및 제2013/0185819호에 기재되어 있다.
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물 및 ES 세포는 인간화 MHC 클래스 II α 쇄 폴리펩티드(예를 들어, 인간화 HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA 및/또는 HLA-DRA)를 발현하고/하거나 이를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 폴리펩티드는 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 인간화 MHC 클래스 II α 쇄 폴리펩티드, 인간화 MHC 클래스 II α 쇄 폴리펩티드를 인코딩하는 유전자좌 및 인간화 MHC 클래스 II α 쇄 폴리펩티드를 발현하는 비인간 동물은 각각, 본원에 참조로 포함되는 미국 특허 제8,847,005호 및 제9,043,996호, 및 미국 특허 공개 제2014/0245467호에 기재되어 있다.
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물 및 ES 세포는 인간화 MHC 클래스 II β 쇄 폴리펩티드(예를 들어, 인간화 HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB 및/또는 HLA-DRB)를 발현하고/하거나 이를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 폴리펩티드는 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 인간화 MHC 클래스 II β 쇄 폴리펩티드, 인간화 MHC 클래스 II β 쇄 폴리펩티드를 인코딩하는 유전자좌 및 인간화 MHC 클래스 II β 쇄 폴리펩티드를 발현하는 비인간 동물은 각각, 본원에 참조로 포함되는 미국 특허 제8,847,005호 및 제9,043,996호, 및 미국 특허 공개 제2014/0245467호에 기재되어 있다.
CAR 유전자좌 및 인간화 MHC I 및/또는 MHC II(MHC IIα /IIβ) 유전자좌를 포함하는 유전자 변형 비인간 동물은 통상적인 방법을 사용하여 육종함으로써 생산될 수 있거나; 이미 하나 이상의 유전자 조작된 유전자좌(예를 들어, CAR 유전자좌)를 포함하는 ES 세포에서 상동 재조합에 의해 생산될 수 있으며, 상기 ES 세포로부터 비인간 동물을 생산할 수 있다.
인간화 CD4 및 CD8 수용체
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물 및 ES 세포는 인간화 CD8 α 쇄 폴리펩티드를 발현하고/하거나 이를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD8 α 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD8 α 쇄 폴리펩티드는 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 인간화 CD8 α 쇄 폴리펩티드, 인간화 CD8 α 쇄 폴리펩티드를 인코딩하는 유전자좌 및 인간화 CD8 α 쇄 폴리펩티드를 발현하는 비인간 동물은 본원에 참조로 포함되는 미국 특허 공개 제2014/0245466호에 기재되어 있다.
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물 및 ES 세포는 인간화 CD8 β 쇄 폴리펩티드를 발현하고/하거나 이를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD8 β 쇄 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD8 β 쇄 폴리펩티드는 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 인간화 CD8 β 쇄 폴리펩티드, 인간화 CD8 β 쇄 폴리펩티드를 인코딩하는 유전자좌 및 인간화 CD8 β 쇄 폴리펩티드를 발현하는 비인간 동물은 본원에 참조로 포함되는 미국 특허 공개 제2014/0245466호에 기재되어 있다.
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물 및 ES 세포는 인간화 CD4 폴리펩티드를 발현하고/하거나 이를 인코딩하는 유전자좌를 게놈에 포함한다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 완전히 인간 유래의 것이다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는적어도 하나의 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 적어도 인간 D1 면역글로불린 도메인, 인간 D2 면역글로불린 도메인 및 인간 D3 면역글로불린 도메인, 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 일부 실시 형태에서, 인간화 CD4 폴리펩티드는 인간 D1 면역글로불린 도메인, 인간 D2 면역글로불린 도메인, 인간 D3 면역글로불린 도메인, 내인성 종에서 유래되는 D4 면역글로불린 도메인, 및 내인성 종에서 유래되는 세포질 도메인을 포함한다. 인간화 CD4 폴리펩티드, 인간화 CD4 폴리펩티드를 인코딩하는 유전자좌 및 인간화 CD4 폴리펩티드를 발현하는 비인간 동물은 본원에 참조로 포함되는 미국 특허 공개 제2014/0245466호에 기재되어 있다.
CAR 유전자좌 및 인간화 CD4 및/또는 CD8(CD8α/CD8β) 유전자좌를 포함하는 유전자 변형 비인간 동물은 통상적인 방법을 사용하여 육종함으로써 생산될 수 있거나; 이미 하나 이상의 유전자 조작된 유전자좌(예를 들어, CAR 유전자좌)를 포함하는 ES 세포에서 상동 재조합에 의해 생산될 수 있으며, 상기 ES 세포로부터 비인간 동물을 생산할 수 있다.
유전자 변형 비인간 동물 및 ES 세포
특정 측면에서, CAR 및/또는 CAR 펩티드, 및 유전자 변형 비인간 동물을 생산하는데 유용한 유전자 변형 비인간 동물 ES 세포를 발현하는 이러한 비인간 동물이 본원에 제공된다.
특정 측면에서, 본원에 기재된 CAR 유전자좌를 생식세포계열 및/또는 게놈에 포함하는 유전자 변형 비인간 동물 및 비인간 동물 ES 세포가 본원에 제공된다. 일부 실시 형태에서, 상기 비인간 동물 또는 ES 세포는 생식세포계열 및/또는 게놈에 2개의 CAR 유전자좌를 포함한다. 일부 실시 형태에서, 1개의 유전자좌는 TCRα 불변 영역 유전자를 포함하고, 1개의 유전자좌는 TCRβ 불변 영역 유전자를 포함한다. 일부 실시 형태에서, CAR 유전자좌는 내인성 TCR 유전자좌에 위치한다.
일부 실시 형태에서, 상기 비인간 동물은 임의의 비인간 동물일 수 있다. 일부 실시 형태에서, 상기 비인간 동물은 척추동물이다. 일부 실시 형태에서, 상기 비인간 동물은 포유류이다. 일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물은 마우스, 래트, 토끼, 돼지, 소(예를 들어, 암소, 황소, 버팔로), 사슴, 양, 염소, 라마, 닭, 고양이, 개, 흰족제비, 영장류(예를 들어, 마모셋, 붉은털 원숭이)로 이루어지는 군으로부터 선택될 수 있다. 적절한 유전자 변형가능한 ES 세포를 용이하게 입수할 수 없는 비인간 동물의 경우, 본원에 기재된 유전자 변형을 포함하는 비인간 동물을 생산하는데 다른 방법이 사용될 수 있다. 그러한 방법은 예를 들어, 비 ES(non-ES) 세포 게놈(예를 들어, 섬유아세포 또는 유도 만능성 세포)을 변형시키는 단계, 변형된 게놈을 핵이식을 이용하여 적절한 세포, 예컨대 난모세포에 이식시키는 단계 및 변형된 세포(예를 들어, 변형된 난모세포)를 적절한 조건 하에 비인간 동물에 임신시켜, 배아를 생성시키는 단계를 포함한다.
일부 실시 형태에서, 상기 비인간 동물은 포유류이다. 일부 실시 형태에서, 상기 비인간 동물은 예를 들어, 뛰는쥐상과(Dipodoidea) 또는 쥐상과(Muroidea)의 소형 포유류이다. 일부 실시 형태에서, 상기 비인간 동물은 설치류이다. 특정 실시 형태에서, 설치류는 마우스, 래트 또는 햄스터이다. 일부 실시 형태에서, 설치류는 쥐상과로부터 선택된다. 일부 실시 형태에서, 비인간 동물은 칼로미스쿠스과(Calomyscidae; 예를 들어, 마우스라이크햄스터(mouse-like hamster)), 비단털쥐과(Cricetidae; 예를 들어, 햄스터, 뉴월드(New World) 래트 및 마우스, 들쥐), 쥐과(Muridae; 예를 들어, 트루(true) 마우스 및 래트, 게르빌루스쥐(gerbil), 가시쥐(spiny mouse), 크레스티드 래트(crested rat)), 붉은숲쥐과(Nesomyidae; 예를 들어, 클라이밍(climbing) 마우스, 락(rock) 마우스, 흰꼬리쥐(white-tailed rat), 마다카스카르 래트 및 마우스), 가시겨울잠쥐과(Platacanthomyidae; 예를 들어, 가시겨울잠쥐(spiny dormouse)) 및 장님쥐과(Spalacidae; 예를 들어, 뒤쥐(mole rat), 대나무쥐 및 조커(zokor))로부터 선택되는 과에서 유래된다. 일부 실시 형태에서, 설치류는 트루 마우스 및 래트(쥐과), 게르빌루스쥐, 가시쥐 및 크레스티드 래트로부터 선택된다. 일부 실시 형태에서, 마우스는 쥐과의 구성원에서 유래된다. 일부 실시 형태에서, 상기 비인간 동물은 설치류이다. 일부 실시 형태에서, 설치류는 마우스 및 래트로부터 선택된다. 일부 실시 형태에서, 비인간 동물은 마우스이다.
일부 실시 형태에서, 비인간 동물은 C57BL 균주의 마우스이다. 일부 실시 형태에서, C57BL 균주는 C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr 및 C57BL/Ola로부터 선택된다. 일부 실시 형태에서, 비인간 동물은 129 균주의 마우스이다. 일부 실시 형태에서, 129 균주는 129P1, 129P2, 129P3, 129X1, 129S1(예를 들어, 129S1/SV, 129S1/SvIm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129S6(129/SvEvTac), 129S7, 129S8, 129T1, 129T2인 균주로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 유전자 변형 마우스는 129 균주와 C57BL 균주의 혼합체이다. 일부 실시 형태에서, 마우스는 129 균주의 혼합체 및/또는 C57BL/6 균주의 혼합체이다. 일부 실시 형태에서, 혼합체의 129 균주는 129S6(129/SvEvTac) 균주이다. 일부 실시 형태에서, 마우스는 BALB 균주(예를 들어, BALB/c)이다. 일부 실시 형태에서, 마우스는 BALB 균주와 다른 균주(예를 들어, C57BL 균주 및/또는 129 균주)의 혼합체이다. 일부 실시 형태에서, 본원에 기재된 비인간 동물은 상술한 균주의 임의의 조합에 유래하는 마우스일 수 있다.
일부 실시 형태에서, 본원에 제공된 비인간 동물은 래트이다. 일부 실시 형태에서, 래트는 위스타(Wistar) 래트, LEA 균주, 스프라그 돌리(Sprague Dawley) 균주, 피셔(Fischer) 균주, F344, F6 및 다크 아구티(Dark Agouti)로부터 선택된다. 일부 실시 형태에서, 래트 균주는 위스타, LEA, 스프라그 돌리, 피셔, F344, F6 및 다크 아구티로 이루어지는 군으로부터 선택되는 2개 이상의 혼합체이다.
특정 실시 형태에서, 유전자 변형 비인간 동물 또는 ES 세포는 이들의 게놈 및/또는 생식세포계열에, CAR 유전자좌, 인간화 MHC 클래스 I α 쇄 유전자좌, 인간화 β-2-마이크로글로불린 유전자좌, 인간화 MHC 클래스 II α 쇄 유전자좌, 인간화 MHC 클래스 II β 쇄 유전자좌, 인간화 CD8 α 쇄 유전자좌, 인간화 CD8 β 쇄 유전자좌 및/또는 인간화 CD4 유전자좌를 포함한다. 일부 실시 형태에서, 인간화 MHC 클래스 I α 쇄 유전자좌는 내인성 MHC 클래스 I α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 인간화 β-2-마이크로글로불린 유전자좌는 내인성 β-2-마이크로글로불린 유전자좌에 위치한다. 일부 실시 형태에서, 인간화 MHC 클래스 II α 쇄 유전자좌는 내인성 MHC 클래스 II α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 인간화 MHC 클래스 II β 쇄 유전자좌는 내인성 MHC 클래스 II β 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 인간화 CD8 α 쇄 유전자좌는 내인성 CD8 α 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 인간화 CD8 β 쇄 유전자좌는 내인성 CD8 β 쇄 유전자좌에 위치한다. 일부 실시 형태에서, 인간화 CD4 유전자좌는 내인성 CD4 유전자좌에 위치한다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 내인성 MHC 클래스 I α 쇄 폴리펩티드, 내인성 β-2-마이크로글로불린 폴리펩티드, 내인성 MHC 클래스 II α 쇄 폴리펩티드, 내인성 MHC 클래스 II β 쇄 폴리펩티드, 내인성 CD8 α 쇄 폴리펩티드, 내인성 CD8 β 쇄 폴리펩티드 및/또는 내인성 CD4 폴리펩티드를 발현하지 않는다. 이러한 동물은 예를 들어, 각각 본원에 참조로 포함되는 미국 특허 공개 제2013/0111617호, 제2013/0185819호, 제2014/0245466호 및 제2014/0245467호, 및 미국 특허 제8,847,005호 및 제9,043,996호에 기재되어 있다.
특정 측면에서, 유전자 변형 비인간 동물은 본원에 기재된 CAR 폴리펩티드를 발현한다. 일부 실시 형태에서, 유전자 변형 비인간 동물은 2개의 CAR 폴리펩티드를 포함하는 CAR을 발현한다. 특정 실시 형태에서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 갖는다. 일부 실시 형태에서, CAR은 비인간 동물의 T 세포(예를 들어, CD4 T 세포 또는 CD8 T 세포) 상에서 발현된다. 일부 실시 형태에서, 상기 비인간 동물은 αβ TCR을 발현하지 않는다. 일부 실시 형태에서, CAR 발현 T 세포는 T 세포 발생 시에 양성 선택을 거친다. 일부 실시 형태에서, CAR 발현 T 세포는 T 세포 발생 시에 음성 선택을 거친다.
유전자 변형 비인간 동물 및 ES 세포는 당업계에 공지된 임의의 적절한 방법을 사용하여 생산될 수 있다. 예를 들어, 이러한 유전자 변형 비인간 동물 ES 세포는 각각, 본원에 참조로 포함되는 미국 특허 제6,586,251호, 제6,596,541호, 제7,105,348호 및 문헌[Valenzuela et al. (2003) "High-throughput engineering of the mouse genome coupled with high-resolution expression analysis" Nat. Biotech. 21(6): 652-659]에 기재된 벨로시젠(VELOCIGENE) 기술을 사용하여 생성될 수 있다. 또한 게놈 표적화 뉴클레아제 시스템, 예컨대 CRISPR/Cas 시스템, 전사 활성화 인자 유사 이펙터 뉴클레아제(Transcription Activator-Like Effector Nuclease; TALEN) 시스템 또는 징크 핑거 뉴클레아제(ZFN) 시스템을 사용하여 변형될 수 있다. 일부 실시 형태에서, 예를 들어, 각각 본원에 참조로 포함되는 미국 특허 출원 제14/314,866호, 제14/515,503호, 제14/747,461호 및 제14/731,914호에 기재된 CRISPR/Cas 시스템을 사용하여 변형될 수 있다. 일부 실시 형태에서, 가변 영역 유전자 세그먼트는 큰 표적화 벡터가 확장하는 CAR 유전자좌에 연달아서 순차적으로 추가되는 일련의 표적화 이벤트를 통해 CAR 유전자좌에 연속적으로 추가된다. 일부 실시 형태에서, 다수의 큰 표적화 벡터(예를 들어, 2개 이상)가 단일 표적화 이벤트(예를 들어, 이중 표적화 이벤트)로 CAR 유전자좌에 동시에 혼입된다. 이러한 유전자 변형 비인간 동물 및 ES 세포를 생산하는 예시적인 방법은 본원의 실시예 2에 제공된다.
그 다음에 본원에 기재된 ES 세포는 당업계에 공지된 방법을 이용하여, 비인간 동물을 생산하는데 사용될 수 있다. 예를 들어, 본원에 기재된 마우스 비인간 동물 ES 세포는 각각, 본원에 참조로 포함되는 미국 특허 제7,294,754호 및 문헌[Poueymirou et al., Nature Biotech 25:91-99 (2007)]에 기재된 벨로시마우스® 방법을 이용하여, 유전자 변형 마우스를 생산하는데 사용될 수 있다. 얻어진 마우스는 동형접합성으로 번식될 수 있다.
유전자 변형 비인간 동물의 사용 방법
본원에 기재된 유전자 변형 비인간 동물은 CAR을 발현하는 동물이 유용할 수도 있는 임의의 방법에서 사용될 수 있다. 예를 들어, 이러한 비인간 동물을 사용하여, CAR을 생성하고, CAR을 발현하는 T 세포를 생산하고, CAR을 발현하는 T 세포 하이브리도마를 제조하고, 재배열된 Ig 가변 영역을 인코딩하는 핵산을 제조하고, 항체 또는 항체 단편을 제조할 수 있다.
본원에 기재된 방법의 특정 실시 형태는 펩티드/MHC 복합체에 대한 T 세포 면역 반응을 유도하기 위해 트랜스제닉 비인간 동물의 면역화를 포함한다. 일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물은 펩티드를 포함하는 항원에 노출되어, 펩티드가 상기 비인간 동물의 MHC 상에 제시된다.
일부 실시 형태에서, 본원에 기재된 유전자 변형 비인간 동물을 펩티드를 포함하는 항원에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하여, 펩티드에 대한 T 세포 반응을 상기 동물에 유도하는 방법이 사용될 수 있다.
일부 실시 형태에서, 펩티드가 제시되는 MHC는 클래스 I MHC이다. 일부 실시 형태에서, 클래스 I MHC는 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F 또는 HLA-G이다. 일부 실시 형태에서, 펩티드는 길이가 8 내지 10개의 아미노산으로 되어 있다.
일부 실시 형태에서, 펩티드가 제시되는 MHC는 클래스 II MHC이다. 일부 실시 형태에서, 클래스 II MHC는 HLA-DM, HLA-DO, HLA-DP, HLA-DQ 또는 HLA-DR이다. 일부 실시 형태에서, 펩티드는 길이가 10 내지 25개의 아미노산으로 되어 있다. 일부 실시 형태에서, 펩티드는 길이가 13 내지 25개의 아미노산으로 되어 있다. 일부 실시 형태에서, 펩티드는 길이가 15 내지 18개의 아미노산으로 되어 있다.
일부 실시 형태에서, 펩티드는 암 관련 항원의 에피토프를 포함한다. 암 관련 항원의 예로는 아디포필린(adipophilin), AIM-2, ALDH1A1, 알파-악티닌-4, 알파-페토단백질("AFP"), ARTC1, B-RAF, BAGE-1, BCLX (L), BCR-ABL 융합 단백질 b3a2, 베타 카테닌, BING-4, CA-125, CALCA, 암배아 항원("CEA"), CASP-5, CASP-8, CD274, CD45, Cdc27, CDK12, CDK4, CDKN2A, CEA, CLPP, COA-1, CPSF, CSNK1A1, CTAG1, CTAG2, 사이클린 D1, 사이클린-A1, dek-can 융합 단백질, DKK1, EFTUD2, 연장 인자 2, ENAH(hMena), Ep-CAM, EpCAM, EphA3, 상피성 종양 항원("ETA"), ETV6-AML1 융합 단백질, EZH2, FGF5, FLT3-ITD, FN1, G250/MN/CAIX, GAGE-1,2,8, GAGE-3,4,5,6,7, GAS7, 글리피칸-3, GnTV, gp100/Pmel17, GPNMB, HAUS3, 헵신(Hepsin), HER-2/neu, HERV-K-MEL, HLA-A11, HLA-A2, HLA-DOB, hsp70-2, IDO1, IGF2B3, IL13R알파2, 장내 카르복실에스테라아제, K-ras, 칼리크레인 4, KIF20A, KK-LC-1, KKLC1, KM-HN-1, CCDC110로도 알려진 KMHN1, LAGE-1, LDLR-푸코실트랜스페라아제, AS 융합 단백질, 렝신(Lengsin), M-CSF, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-C1, MAGE-C2, 말산 효소, 맘마글로빈(mammaglobin)-A, MART2, MATN, MC1R, MCSP, mdm-2, ME1, 멜란(Melan)-A/MART-1, 멜로(Meloe), 미드카인(Midkine), MMP-2, MMP-7, MUC1, MUC5AC, 무친, MUM-1, MUM-2, MUM-3, 미오신, 미오신 클래스 I, N-raw, NA88-A, neo-PAP, NFYC, NY-BR-1, NY-ESO-1/LAGE-2, OA1, OGT, OS-9, P 폴리펩티드, p53, PAP, PAX5, PBF, pml-RAR알파 융합 단백질, 다형성 상피 무친("PEM"), PPP1R3B, PRAME, PRDX5, PSA, PSMA, PTPRK, RAB38/NY-MEL-1, RAGE-1, RBAF600, RGS5, RhoC, RNF43, RU2AS, SAGE, 세세르닌(secernin) 1, SIRT2, SNRPD1, SOX10, Sp17, SPA17, SSX-2, SSX-4, STEAP1, 서바이빈(survivin), SYT-SSX1 또는 -SSX2 융합 단백질, TAG-1, TAG-2, 텔로머라아제, TGF-베타RII, TPBG, TRAG-3, 트라이오스포스페이트 아이소머라아제, TRP-1/gp75, TRP-2, TRP2-INT2, 티로시나아제, 티로시나아제("TYR"), VEGF, WT1, XAGE-1b/GAGED2a를 포함하나 이에 한정되지 않는다. 일부 실시 형태에서, 상기 항원은 신생항원이다.
일부 실시 형태에서, 펩티드는 감염성 병원균에 의해 발현되는 항원의 에피토프를 포함한다. 일부 실시 형태에서, 상기 병원균은 바이러스, 세균, 진균, 연충 또는 원충이다. 예를 들어, 일부 실시 형태에서, 상기 바이러스는 HPV, HBV, C형 간염 바이러스(HCV), 인간 면역 결핍 바이러스(HIV-1 및 HIV-2)와 같은 레트로바이러스, 엡스타인 바 바이러스(EBV)와 같은 헤르페스 바이러스, 사이토메갈로바이러스(CMV), HSV-1 및 HSV-2, 및 인플루엔자 바이러스이다. 일부 실시 형태에서, 기생충은 말라리아이다. 일부 실시 형태에서, 병원균은 아스페르길루스, 브루기아, 칸디다, 클라미디아, 콕시디아, 크립토코쿠스, 디로필라리아, 고노코쿠스, 히스토플라즈마, 리슈마니아, 마이코박테리움, 마이코플라즈마, 파라메시움, 퍼투시스, 플라스모듐, 뉴모코쿠스, 뉴모시스티스, 리케차, 살모넬라, 시겔라, 스타필로코쿠스, 스트렙토코쿠스, 톡소플라즈마 및 콜레라균이다. 예시적인 종으로는 나이세리아 고노리아, 마이코박테리움 투베르쿨로시스, 칸디다 알비칸스, 칸디다 트로피칼리스, 트리코모나스 바지날리스, 헤모필루스 바지날리스, B군 스트렙토코쿠스 속, 마이코플라즈마 호미니스, 헤모필루스 듀크레이, 그라눌로마 인귀네일, 림포패씨아 베네레움, 트레포네마 팔리둠, 브루셀라 아보투스. 브루셀라 멜리텐시스, 브루셀라 수이스, 브루셀라 카니스, 캄필로박터 페투스, 캄필로박터 페투스 인테스티날리스, 렙토스피라 포모나, 리스테리아 모노사이토제네스, 브루셀라 오비스, 클라미디아 프시타시, 트리코모나스 피투스, 톡소플라즈마 곤디, 에스세리키아 콜리, 악티노바실루스 에쿠울리, 살모넬라 아보투스 오비스, 살모넬라 아보투스 에쿠이, 슈도모나스 에루지노사, 코리네박테리움 에쿠이, 코리네박테리움 파이오게네스, 악티노바실루스 세미니스, 마이코플라즈마 보비제니탈륨, 아스페르길루스 푸미가투스, 압시디아 라모사, 트리파노소마 에퀴페르둠, 바베시아 카발리, 클로스트리듐 테타니, 클로스트리듐 보툴리눔; 또는 예를 들어, 파라콕시디오이데스 브라질리엔시스와 같은 진균; 또는 예를 들어, 플라스모듐 팔시파룸과 같은 다른 병원균을 들 수 있다.
일부 실시 형태에서, 펩티드는 염증성 질환, 피부 또는 장기 이식 거부, 이식편대숙주병(GVHD) 또는 자가면역질환에서 자가반응성 T 세포의 표적인 단백질의 에피토프를 포함한다. 자가면역질환의 예로는 예를 들어, 사구체신염, 관절염, 확장형 심근병증 유사 질환, 궤양성 대장염, 쇼그렌 증후군, 크론병, 전신성 홍반성 루푸스, 만성 류마티스 관절염, 다발성 결화증, 건선, 알러지성 접촉 피부염, 다발성 근염, 피부비후증, 결절성 동맥주위염, 류마티스열, 심상성 백반증, 인슐린 의존성 당뇨병, 베체트병, 하시모토병, 애디슨병, 피부근염, 중증 근무력증, 라이터 증후군, 그레이브스병, 악성 빈혈, 굿파스처 증후군(Goodpasture syndrome), 불임증, 만성 활동성 간염, 천포창, 자가면역성 혈소판 감소성 자반증 및 자가면역성 용혈성 빈혈, 활동성 만성 간염, 애디슨병, 항인지질 증후군, 아토피성 알러지, 자가면역성 위축성 위염, 자가면역성 무위산증, 셀리악병, 쿠싱 증후군, 피부근염, 원판상 홍반성 루푸스, 굿파스처 증후군, 하시모토 갑상선염, 특발성 부신 위축(idiopathic adrenal atrophy), 특발성 혈소판 감소증, 인슐린 의존성 당뇨병, 람베르트-이튼 증후군(Lambert-Eaton Syndrome), 루포이드 간염, 림프구 감소증의 몇가지 증례, 혼합결합조직병, 유사천포창, 심상성 천포창, 악성 빈혈, 수정체성 포도막염, 결절성 다발동맥염, 자가면역성 다선증후군, 원발성 담즙성 간경변증, 원발성 경화성 담관염, 레이노 증후군, 재발성 다발성 연골염, 슈미트 증후군(Schmidt's syndrome), 제한형 경피증 (또는 크레스트 증후군), 교감성 안염, 전신성 홍반성 루푸스, 다카야스 동맥염, 측두동맥염, 갑상선 중독증, b형 인슐린 저항성, 궤양성 대장염 및 베게너 육아종증을 들 수 있다. 자가반응성 T 세포에 의해 표적화된 예시적인 단백질에는 예를 들어, p205, 인슐린, 갑상선 자극 호르몬, 티로시나아제, TRP1 및 미엘린이 포함된다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 펩티드를 인코딩하는 핵산 서열을 포함하는 바이러스(예를 들어, 레트로바이러스, 아데노바이러스, 백시니아 바이러스 또는 렌티바이러스)에 감염된 상기 비인간 동물에게 투여함으로써 펩티드에 노출된다. 바이러스 예방접종 방법은 예를 들어, 각각 그 전체 내용이 본원에 참조로 포함되는 미국 특허 제6,001,349호, 제8,663,622호, 제8,691,502호, 제8,377,688호, 및 문헌[Precopio et al., JEM 204:1405-1416 (2007)]에 제공되어 있다. 일부 실시 형태에서, 상기 비인간 동물은 바이러스를 직접 투여하여, 상기 비인간 동물이 항원을 처리하여, 이의 MHC 상에 제시한다. 일부 실시 형태에서, 세포(예를 들어, 항원제시세포, 예컨대 수지상 세포)는 시험관 내 또는 생체외에서 바이러스에 감염된 다음에, 상기 비인간 동물에게 투여된다. 일부 실시 형태에서, 바이러스는 펩티드/MHC 복합체(예를 들어, 단일쇄 펩티드/MHC 복합체)를 인코딩한다. 단일쇄 펩티드/MHC 기반 백신의 예는 각각, 본원에 참조로 포함되는 문헌[Truscott et al., J. Immunol . 178:6280-6289 (2007)], EP1773383, 문헌[Kim et al., Vaccine 30:2178-2186 (2012)], 문헌[Kim et al., J. Immunol . 184:4423-4430 (2010)]에 제공되어 있다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 펩티드를 인코딩하는 핵산을 상기 동물에게 투여함으로써 펩티드에 노출되어, 펩티드가 상기 비인간 동물에 발현된다. 일부 실시 형태에서, 상기 비인간 동물에게 단일쇄 펩티드/MHC 복합체를 인코딩하는 핵산이 투여된다. 단일쇄 펩티드/MHC 기반 백신의 예는 각각, 본원에 참조로 포함되는 문헌[Truscott et al., J. Immunol . 178:6280-6289 (2007)], EP1773383, 문헌[Kim et al., Vaccine 30:2178-2186 (2012)], 문헌[Kim et al., J. Immunol. 184:4423-4430 (2010)]에 제공되어 있다. 특정 실시 형태에서, 핵산은 DNA 벡터이다. 핵산 도입은 바이러스 매개된 유전자 도입 및 리포솜 매개 유전자 도입을 포함하는 당업계에 공지된 임의의 기술에 의해 이루어질 수 있다. 대상으로 하는 폴리뉴클레오티드는 예를 들어, 각각 본원에 참조로 포함되는 미국 특허 제6,770,291호, 제7,001,614호, 제6,749,863호, 제5,512,295호 및 제7,112,338호에 기재되어 있는 바와 같이, 리포솜과 결합되어 유전자 도입 비히클을 형성한다. 일부 실시 형태에서, 핵산은 mRNA 벡터이다. mRNA 벡터의 생성 및 투여를 위한 예시적인 방법은 예를 들어, 각각 본원에 참조로 포함되는 미국 특허 제8,278,036호 및 미국 특허 공개 제2013/151736호 및 제2012/135805호에 기재되어 있다.
일부 실시 형태에서, 유전자 변형 비인간 동물은 펩티드/MHC 복합체를 유전자 변형 비인간 동물에게 투여함으로써 펩티드에 노출된다. 일부 실시 형태에서, 상기 비인간 동물에게 단일쇄 펩티드/MHC 복합체(예를 들어, 단일쇄 엑토-MHC/β-2-마이크로글로불린/펩티드 단백질 복합체)가 투여된다. 일부 실시 형태에서, 펩티드/MHC 복합체는 다량체(예를 들어, 이량체, 삼량체, 사량체)로 투여된다. 일부 실시 형태에서, 펩티드/MHC 복합체는 세포 표면 상에 존재한다. 펩티드/MHC 복합체의 생성 및 투여를 위한 예시적인 방법은 예를 들어, 각각 본원에 참조로 포함되는 미국 특허 제6,045,796호, 제5,869,270호 및 제7,141,656호, 및 문헌[Truscott et al., J. Immunol . 178:6280-6289 (2007)], EP1773383, 문헌[Kim et al., Vaccine 30:2178-2186 (2012)], 문헌[Kim et al., J. Immunol . 184:4423-4430 (2010)] 및 문헌[Livingstone Methods: A Companion to Methods in Enzymology 9:422-429 (1996)]에 제공되어 있다.
본원에 기재된 방법의 일부 실시 형태에서, 상기 방법은 펩티드/MHC 복합체에 특이적인 CAR을 발현하는 T 세포를 유전자 변형 비인간 동물로부터 얻는 단계를 포함한다. 특정 실시 형태에서, 당업계에 공지된 임의의 방법을 사용하여 이러한 T 세포를 얻을 수 있다. 예를 들어, 이러한 T 세포는 동물의 비장, 림프절 및/또는 말초 혈액으로부터 얻어질 수 있다. 이러한 T 세포는 당업계에서 이용가능한 방법을 사용하여 결합 특이성이 스크리닝될 수 있다. 예를 들어, 특정 펩티드/MHC 복합체에 특이적인 CAR을 발현하는 세포는 고체 지지체, 예컨대 컬럼 또는 비드, 예컨대 자성 비드 상에 로딩된 펩티드/MHC 복합체를 사용하여 정제될 수 있거나, 표지된 펩티드/MHC를 사용하여 이러한 T 세포를 염색한 다음에, 형광 활성화 세포 분류(FACS) 및/또는 자기 활성화 세포 분류(MACS)를 사용하여 정제될 수 있다.
일부 실시 형태에서, 본원에 기재된 방법은 T 세포 하이브리도마를 T 세포로부터 제조하는 단계를 포함한다. T 세포 하이브리도마를 제조하는데 유용한 방법은 당업계에 공지되어 있으며, 예를 들어, 각각 본원에 참조로 포함되는 문헌[Hedrick et al., Cell 30:141-152 (1982)] 및 문헌[Kruisbeek Curr . Protoc . Immunol. Chapter 3 (2001) and White et al., Methods in Molecular Biology 134:185-193 (2000)]에 기재되어 있다.
일부 실시 형태에서, 본원에 기재된 방법은 CAR의 Ig 가변 도메인을 인코딩하는 핵산을 T 세포로부터 단리하는 단계를 포함한다. 본원에 기재된 방법의 일부 실시 형태에서, 임의의 방법을 사용하여, Ig 가변 도메인을 인코딩하는 핵산을 단리할 수 있다.
일부 실시 형태에서, 핵산을 단리하는 단계는 T 세포로부터 T 세포 하이브리도마를 제조하여, 핵산을 T 세포 하이브리도마로부터 단리하는 것을 포함한다. 일부 실시 형태에서, 핵산은 핵산 증폭 과정을 이용하여 단리된다. 예를 들어, 일부 실시 형태에서, 핵산 증폭 과정은 폴리머라제 연쇄 반응(PCR), 리가제 연쇄 반응(LCR), 가닥 치환 증폭(strand displacement amplification; SDA), 전사 매개 증폭(transcription mediated amplification; TMA), 자가 유지 염기서열 복제(self-sustained sequence replication; 3SR), Qβ 레플리카제 기반 증폭(Qβ replicase based amplification), 핵산 서열 기반 증폭(nucleic acid sequence-based amplification; NASBA), 복구 연쇄 반응(repair chain reaction; RCR), 부메랑 DNA 증폭(boomerang DNA amplification; BDA) 또는 롤링 서클 증폭(rolling circle amplification; RCA)이다.
일부 실시 형태에서, 핵산은 T 세포 또는 T 세포 하이브리도마의 CAR 유전자좌의 재배열된 Ig 가변 영역 유전자를 시퀀싱하여, 재배열된 Ig 가변 영역 유전자를 포함하는 핵산 서열을 합성함으로써 단리된다. 예시적인 핵산 시퀀싱 프로세스는 연쇄 종결 시퀀싱, 라이게이션에 의한 시퀀싱, 합성에 의한 시퀀싱, 파이로시퀀싱(pyrosequencing), 이온 반도체 시퀀싱, 단일 분자 실시간 시퀀싱, 454 시퀀싱 및/또는 딜루트-'엔'-고 시퀀싱(Dilute-'N'-Go sequencing)을 포함하나 이에 한정되지 않는다.
일단 중쇄 및 경쇄 Ig 가변 영역 세그먼트를 인코딩하는 DNA 단편이 얻어지면, 이들 DNA 단편은 표준 재조합 DNA 기술에 의해, 예를 들어 가변 영역 유전자를 전장 항체 쇄 유전자, Fab 단편 유전자 또는 scFv 유전자로 변환시키도록 추가로 조작될 수 있다. 이러한 조작에서, 가변 도메인 인코딩 DNA 단편은 항체 불변 도메인 또는 가요성 링커와 같은 다른 단백질을 인코딩하는 다른 DNA 단편에 작동가능하게 연결된다. 이와 관련하여 사용된 용어 "작동가능하게 연결된"은 2개의 DNA 단편이 결합되어, 2개의 DNA 단편에 의해 인코딩된 아미노산 서열이 인프레임(in-frame)에 유지되는 것을 의미하고자 한다.
중쇄 가변 도메인을 인코딩하는 단리된 DNA는 가변 도메인 인코딩 DNA를 중쇄 불변 도메인(CH1, CH2 및 CH3)을 인코딩하는 다른 DNA 분자에 작동가능하게 연결시킴으로써 전장 중쇄 유전자로 변환될 수 있다. 인간 중쇄 불변 영역 유전자의 서열은 당업계에 공지되어 있으며(예를 들어, 문헌[Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]), 이들 영역을 포함하는 DNA 단편은 표준 PCR 증폭에 의해 얻어질 수 있다. 중쇄 불변 도메인은 IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM 또는 IgD 불변 도메인일 수 있지만, 가장 바람직하게는 IgG1 또는 IgG4 불변 도메인이다. Fab 단편 중쇄 유전자의 경우, VH 인코딩 DNA는 중쇄 CH1 불변 도메인 만을 인코딩하는 다른 DNA 분자에 작동가능하게 연결될 수 있다.
경쇄 Ig 가변 도메인을 인코딩하는 단리된 DNA는 가변 도메인 인코딩 DNA를 경쇄 불변 도메인, 예컨대 κ 또는 λ 불변 도메인을 인코딩하는 다른 DNA 분자에 작동가능하게 연결시킴으로써 전장 경쇄 유전자 (및 Fab 경쇄 유전자)로 변환될 수 있다. 인간 경쇄 불변 영역 유전자의 서열은 당업계에 공지되어 있으며(예를 들어, 문헌[Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]), 이들 영역을 포함하는 DNA 단편은 표준 PCR 증폭에 의해 얻어질 수 있다.
따라서, 일부 실시 형태에서, 본원에 기재된 방법은 숙주 세포에서 중쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 중쇄 Ig 불변 도메인을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 숙주 세포가 Ig 중쇄 가변 도메인 및 Ig 중쇄 불변 도메인을 포함하는 Ig 중쇄 폴리펩티드를 발현시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 숙주 세포에서 경쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 경쇄 Ig 불변 도메인을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 숙주 세포가 Ig 경쇄 가변 도메인 및 Ig 중쇄 불변 도메인을 포함하는 Ig 경쇄 폴리펩티드를 발현시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 숙주 세포에서 중쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 중쇄 Ig 불변 도메인을 인코딩하는 핵산 서열과 작동가능하게 연결시키고, 숙주 세포에서 경쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 경쇄 Ig 불변 도메인을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 숙주 세포가 중쇄 Ig 가변 도메인 및 중쇄 Ig 불변 도메인을 포함하는 중쇄와, 경쇄 Ig 가변 도메인 및 경쇄 Ig 불변 도메인을 포함하는 경쇄를 갖는 항체를 발현시키는 단계를 포함한다. Ig 가변 영역은 당업계에 공지된 표준 분자 생물학 기술을 사용하여 Ig 불변 영역과 연결될 수 있다. 일부 실시 형태에서, 면역글로불린 폴리펩티드를 발현할 수 있는 임의의 숙주 세포가 사용될 수 있다. 일부 실시 형태에서, 상기 세포는 CHO 세포, HEK-293 세포, BHK 세포, NS0 세포, SP2/0 세포 또는 베로 세포이다.
일부 실시 형태에서, 본원에 기재된 방법은 세포(예를 들어, 인간 세포, 예컨대 인간 T 세포)에서 중쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 TCR 불변 도메인(예를 들어, TCRβ 불변 도메인 또는 TCRα 불변 도메인)을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 상기 세포가 Ig 중쇄 가변 도메인 및 상기 TCR 불변 도메인을 포함하는 CAR 폴리펩티드를 발현시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 세포(예를 들어, 인간 세포, 예컨대 인간 T 세포)에서 경쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 TCR 불변 도메인(예를 들어, TCRβ 불변 도메인 또는 TCRα 불변 도메인)을 인코딩하는 핵산 서열과 작동가능하게 연결시켜, 상기 세포가 Ig 경쇄 가변 도메인 및 상기 TCR 불변 도메인을 포함하는 CAR 폴리펩티드를 발현시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 세포(예를 들어, 인간 세포, 예컨대 인간 T 세포)에서 중쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 제1 TCR 불변 도메인(예를 들어, TCRβ 불변 도메인 또는 TCRα 불변 도메인)과 작동가능하게 연결시키고, 상기 세포에서 경쇄 Ig 가변 도메인을 인코딩하는 핵산 서열을 제2 TCR 불변 도메인(예를 들어, 제1 TCR 불변 도메인이 TCRα 불변 도메인인 경우에 TCRβ 불변 도메인 또는 제1 TCR 불변 도메인이 TCRβ 불변 도메인인 경우에 TCRα 불변 도메인)과 작동가능하게 연결시켜, 상기 세포가 중쇄 Ig 가변 도메인 및 제1 TCR 불변 도메인을 포함하는 제1 CAR 쇄 폴리펩티드와, 경쇄 Ig 가변 도메인 및 제2 TCR 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 갖는 CAR을 발현시키는 단계를 포함한다. 일부 실시 형태에서, 상기 TCR 불변 도메인은 인간 TCR 불변 도메인이다. Ig 가변 영역은 당업계에 공지된 표준 분자 생물학 기술을 사용하여 TCR 불변 영역과 연결될 수 있다. 일부 실시 형태에서, 상기 세포는 대상으로부터 단리된 생체외 세포(예를 들어, 생체외 인간 세포, 예컨대 생체외 인간 T 세포)이다.
항체
특정 측면에서, 펩티드/MHC 복합체(예를 들어, 펩티드/클래스 I MHC 복합체 또는 펩티드/클래스 II MHC 복합체)에 결합 특이성을 갖는 항체가 본원에 제공된다. 일부 실시 형태에서, 항체는 완전히 인간 유래의 것이다. 일부 실시 형태에서, CAR은 본원에 기재된 방법에 따라(예를 들어, 본원에 기재된 CAR 유전자좌를 포함하는 비인간 동물을 사용하여) 얻어질 수 있고/있거나 얻어진다.
특정 실시 형태에서, 본원에 제공된 항체 및 항체 단편은 10-6, 10-7, 10-8 또는 10-9 M 이하의 해리 상수를 갖는 펩티드/MHC 복합체에 특이적으로 결합할 수 있다. 일부 실시 형태에서, 펩티드/MHC 복합체에 대한 항체의 결합 친화도(KD로 표시됨)는 관련이 없는 펩티드를 제시하는 동일한 MHC 단백질의 경우의 펩티드에 대한 항체의 친화도보다 적어도 10배, 적어도 100배 또는 적어도 1000배 적다.
예를 들어, ELISA, 웨스턴 블롯 및 RIA를 포함하여, 항체의 결합 능력을 평가하기 위한 표준 분석법이 당업계에 공지되어 있다. 항체의 결합 동역학(예를 들어, 결합 친화도)은 또한 비아코어(Biacore) 분석법과 같은 당업계에 공지된 표준 분석법에 의해 평가될 수 있다.
일부 실시 형태에서, 항체는 펩티드/MHC 클래스 I 복합체에 특이적이다. 일부 실시 형태에서, MHC 클래스 I은 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F 또는 HLA-G이다. 일부 실시 형태에서, 펩티드는 길이가 8 내지 10개의 아미노산으로 되어 있다.
일부 실시 형태에서, 항체는 펩티드/MHC 클래스 I 복합체에 특이적이다. 일부 실시 형태에서, MHC 클래스 II는 HLA-DM, HLA-DO, HLA-DP, HLA-DQ 또는 HLA-DR이다. 일부 실시 형태에서, 펩티드는 길이가 10 내지 25개의 아미노산으로 되어 있다. 일부 실시 형태에서, 펩티드는 길이가 13 내지 25개의 아미노산으로 되어 있다. 일부 실시 형태에서, 펩티드는 길이가 15 내지 18개의 아미노산으로 되어 있다.
일부 실시 형태에서, 펩티드는 암 관련 항원의 에피토프를 포함한다. 암 관련 항원의 예로는 아디포필린, AIM-2, ALDH1A1, 알파-악티닌-4, 알파-페토단백질("AFP"), ARTC1, B-RAF, BAGE-1, BCLX (L), BCR-ABL 융합 단백질 b3a2, 베타 카테닌, BING-4, CA-125, CALCA, 암배아 항원("CEA"), CASP-5, CASP-8, CD274, CD45, Cdc27, CDK12, CDK4, CDKN2A, CEA, CLPP, COA-1, CPSF, CSNK1A1, CTAG1, CTAG2, 사이클린 D1, 사이클린-A1, dek-can 융합 단백질, DKK1, EFTUD2, 연장 인자 2, ENAH(hMena), Ep-CAM, EpCAM, EphA3, 상피성 종양 항원("ETA"), ETV6-AML1 융합 단백질, EZH2, FGF5, FLT3-ITD, FN1, G250/MN/CAIX, GAGE-1,2,8, GAGE-3,4,5,6,7, GAS7, 글리피칸-3, GnTV, gp100/Pmel17, GPNMB, HAUS3, 헵신, HER-2/neu, HERV-K-MEL, HLA-A11, HLA-A2, HLA-DOB, hsp70-2, IDO1, IGF2B3, IL13R알파2, 장내 카르복실에스테라아제, K-ras, 칼리크레인 4, KIF20A, KK-LC-1, KKLC1, KM-HN-1, CCDC110로도 알려진 KMHN1, LAGE-1, LDLR-푸코실트랜스페라아제, AS 융합 단백질, 렝신, M-CSF, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-C1, MAGE-C2, 말산 효소, 맘마글로빈-A, MART2, MATN, MC1R, MCSP, mdm-2, ME1, 멜란-A/MART-1, 멜로, 미드카인, MMP-2, MMP-7, MUC1, MUC5AC, 무친, MUM-1, MUM-2, MUM-3, 미오신, 미오신 클래스 I, N-raw, NA88-A, neo-PAP, NFYC, NY-BR-1, NY-ESO-1/LAGE-2, OA1, OGT, OS-9, P 폴리펩티드, p53, PAP, PAX5, PBF, pml-RAR알파 융합 단백질, 다형성 상피 무친("PEM"), PPP1R3B, PRAME, PRDX5, PSA, PSMA, PTPRK, RAB38/NY-MEL-1, RAGE-1, RBAF600, RGS5, RhoC, RNF43, RU2AS, SAGE, 세세르닌 1, SIRT2, SNRPD1, SOX10, Sp17, SPA17, SSX-2, SSX-4, STEAP1, 서바이빈, SYT-SSX1 또는 -SSX2 융합 단백질, TAG-1, TAG-2, 텔로머라아제, TGF-베타RII, TPBG, TRAG-3, 트라이오스포스페이트 아이소머라아제, TRP-1/gp75, TRP-2, TRP2-INT2, 티로시나아제, 티로시나아제("TYR"), VEGF, WT1, XAGE-1b/GAGED2a를 포함하나 이에 한정되지 않는다. 일부 실시 형태에서, 상기 항원은 신생항원이다.
일부 실시 형태에서, 펩티드는 감염성 병원균에 의해 발현되는 항원의 에피토프를 포함한다. 일부 실시 형태에서, 상기 병원균은 바이러스, 세균, 진균, 연충 또는 원충이다. 예를 들어, 일부 실시 형태에서, 상기 바이러스는 HPV, HBV, C형 간염 바이러스(HCV), 인간 면역 결핍 바이러스(HIV-1 및 HIV-2)와 같은 레트로바이러스, 엡스타인 바 바이러스(EBV)와 같은 헤르페스 바이러스, 사이토메갈로바이러스(CMV), HSV-1 및 HSV-2, 및 인플루엔자 바이러스이다. 일부 실시 형태에서, 기생충은 말라리아이다. 일부 실시 형태에서, 병원균은 아스페르길루스, 브루기아, 칸디다, 클라미디아, 콕시디아, 크립토코쿠스, 디로필라리아, 고노코쿠스, 히스토플라즈마, 리슈마니아, 마이코박테리움, 마이코플라즈마, 파라메시움, 퍼투시스, 플라스모듐, 뉴모코쿠스, 뉴모시스티스, 리케차, 살모넬라, 시겔라, 스타필로코쿠스, 스트렙토코쿠스, 톡소플라즈마 및 콜레라균이다. 예시적인 종으로는 나이세리아 고노리아, 마이코박테리움 투베르쿨로시스, 칸디다 알비칸스, 칸디다 트로피칼리스, 트리코모나스 바지날리스, 헤모필루스 바지날리스, B군 스트렙토코쿠스 속, 마이코플라즈마 호미니스, 헤모필루스 듀크레이, 그라눌로마 인귀네일, 림포패씨아 베네레움, 트레포네마 팔리둠, 브루셀라 아보투스. 브루셀라 멜리텐시스, 브루셀라 수이스, 브루셀라 카니스, 캄필로박터 페투스, 캄필로박터 페투스 인테스티날리스, 렙토스피라 포모나, 리스테리아 모노사이토제네스, 브루셀라 오비스, 클라미디아 프시타시, 트리코모나스 피투스, 톡소플라즈마 곤디, 에스세리키아 콜리, 악티노바실루스 에쿠울리, 살모넬라 아보투스 오비스, 살모넬라 아보투스 에쿠이, 슈도모나스 에루지노사, 코리네박테리움 에쿠이, 코리네박테리움 파이오게네스, 악티노바실루스 세미니스, 마이코플라즈마 보비제니탈륨, 아스페르길루스 푸미가투스, 압시디아 라모사, 트리파노소마 에퀴페르둠, 바베시아 카발리, 클로스트리듐 테타니, 클로스트리듐 보툴리눔; 또는 예를 들어, 파라콕시디오이데스 브라질리엔시스와 같은 진균; 또는 예를 들어, 플라스모듐 팔시파룸과 같은 다른 병원균을 들 수 있다.
일부 실시 형태에서, 펩티드는 염증성 질환, 피부 또는 장기 이식 거부, 이식편대숙주병(GVHD) 또는 자가면역질환에서 자가반응성 T 세포의 표적인 단백질의 에피토프를 포함한다. 자가면역질환의 예로는 예를 들어, 사구체신염, 관절염, 확장형 심근병증 유사 질환, 궤양성 대장염, 쇼그렌 증후군, 크론병, 전신성 홍반성 루푸스, 만성 류마티스 관절염, 다발성 결화증, 건선, 알러지성 접촉 피부염, 다발성 근염, 피부비후증, 결절성 동맥주위염, 류마티스열, 심상성 백반증, 인슐린 의존성 당뇨병, 베체트병, 하시모토병, 애디슨병, 피부근염, 중증 근무력증, 라이터 증후군, 그레이브스병, 악성 빈혈, 굿파스처 증후군, 불임증, 만성 활동성 간염, 천포창, 자가면역성 혈소판 감소성 자반증 및 자가면역성 용혈성 빈혈, 활동성 만성 간염, 애디슨병, 항인지질 증후군, 아토피성 알러지, 자가면역성 위축성 위염, 자가면역성 무위산증, 셀리악병, 쿠싱 증후군, 피부근염, 원판상 홍반성 루푸스, 굿파스처 증후군, 하시모토 갑상선염, 특발성 부신 위축, 특발성 혈소판 감소증, 인슐린 의존성 당뇨병, 람베르트-이튼 증후군, 루포이드 간염, 림프구 감소증의 몇가지 증례, 혼합결합조직병, 유사천포창, 심상성 천포창, 악성 빈혈, 수정체성 포도막염, 결절성 다발동맥염, 자가면역성 다선증후군, 원발성 담즙성 간경변증, 원발성 경화성 담관염, 레이노 증후군, 재발성 다발성 연골염, 슈미트 증후군, 제한형 경피증 (또는 크레스트 증후군), 교감성 안염, 전신성 홍반성 루푸스, 다카야스 동맥염, 측두동맥염, 갑상선 중독증, b형 인슐린 저항성, 궤양성 대장염 및 베게너 육아종증을 들 수 있다. 자가반응성 T 세포에 의해 표적화된 예시적인 단백질에는 예를 들어, p205, 인슐린, 갑상선 자극 호르몬, 티로시나아제, TRP1 및 미엘린이 포함된다.
일부 실시 형태에서, 본원에 제공된 항체는 인간 중쇄 가변 도메인을 포함한다. 일부 실시 형태에서, 항체는 인간 중쇄 불변 도메인을 포함한다. 일부 실시 형태에서, 본원에 제공된 항체는 IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM 또는 IgD 불변 도메인을 포함한다. 인간 중쇄 불변 도메인의 서열은 당업계에 공지되어 있다(예를 들어, 문헌[Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242] 참조). 일부 실시 형태에서, 본원에 제공된 항체는 중쇄 불변 도메인 또는 이의 부분이 결여되어 있다.
일부 실시 형태에서, 본원에 제공된 항체는 변형된 Fc 도메인(예를 들어, Fc와 Fc 수용체 사이의 상호 작용을 변화시키는 돌연변이)을 포함한다. 예를 들어, 일부 실시 형태에서, 본원에 제공된 항체는 위치 235, 236, 237, 239, 265, 267, 268, 269, 270, 298, 326, 327, 330, 332, 350, 351, 366, 392, 394, 405 및/또는 407(EU 넘버링 시스템 사용)에서 이의 Fc 도메인에 대한 변형을 포함한다. 일부 실시 형태에서, 상기 변형은 L235A, G236E, G237F, S239E, S239D, D265E, D265S, S267E, S267D, S267G, H268E, H268D, E269L, D270N, D270E, S298A, K326A, K326D, A327H, A327V, A327L, A330I, A330S, I332E, T350V, L351Y, T366L, K392M, K392L, T394W, F405A 및/또는 Y407V(EU 넘버링 시스템 사용)로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 항체는 이의 Fc 도메인에 대한 다중 변형을 포함한다. 일부 실시 형태에서, 다중 변형은 D270N/K326D, S239E/S298A/K326A/A327H, L235A/S239E/D265E/A327H, G236E/G237F/S239E, G237F/S239E/D265E, G327F/S239E/H268D, G236E/D270N/A327V/I332E, G237F/S239E/A327H, G237F/A327L/A330I, S239D/D265S/S298A/I332E, S239E/D265S/H268D/I332E, S239E/D265S/I332E, S239E/S267E/H268D, S239E/A327L/A330I, D265E/S267D/A330S, S267G/H268E/D270E, H268D/E269L/S298A/K326A/A327H, H268D//K326A/A327H로 이루어진 군으로부터 선택된다. 추가의 Fc 변형 및 Fc 변형의 조합은 각각, 본원에 참조로 포함되는 미국 특허 제5,624,821호, 제5,648,260호, 제6,528,624호, 제6,737,056호, 제7,122,637호, 제7,183,387호, 제7,297,775호, 제7,317,091호, 제7,332,581호, 제7,632,497호, 제7,662,925호, 제7,695,936호, 제8,093,359호, 제8,216,805호, 제8,218,805호, 제8,388,955호 및 제8,937,158호, 및 미국 특허 공개 제2005/0054832호, 제2006/0222653호, 제2006/0275282호, 제2006/0275283호, 제2007/0190063호, 제2008/0154025호, 제2009/0042291호, 제2013/0108623호 및 제2013/0089541호에 제공되어 있다.
일부 실시 형태에서, 상기 항체는 이중 특이적 항체이다. 일부 실시 형태에서, 이중 특이적 항체의 2개의 항원 결합 도메인은 다른 중쇄 가변 도메인을 가지나, 동일한 경쇄 가변 도메인을 갖는다. 일부 실시 형태에서, 중쇄의 Fc 도메인은 중쇄 이종이량체 형성을 촉진시키고/시키거나 중쇄 동종이량체 형성을 억제시키는 변형을 포함한다. 이러한 변형은 예를 들어, 각각 본원에 참조로 포함되는 미국 특허 제5,731,168호, 제5,807,706호, 제5,821,333호, 제7,642,228호 및 제8,679,785호, 및 미국 특허 공개 제2013/0195849호에 제공되어 있다.
일부 실시 형태에서, 본원에 제공된 항체는 인간 경쇄 가변 도메인을 갖는다. 일부 실시 형태에서, 상기 경쇄 가변 도메인은 λ 경쇄 가변 도메인이다. 일부 실시 형태에서, 상기 경쇄 가변 도메인은 κ 경쇄 가변 도메인이다. 일부 실시 형태에서, 상기 항체는 인간 경쇄 불변 도메인을 갖는다. 일부 실시 형태에서, 상기 경쇄 불변 도메인은 λ 경쇄 불변 도메인이다. 일부 실시 형태에서, 상기 경쇄 불변 도메인은 κ 경쇄 불변 도메인이다. 인간 경쇄 불변 도메인의 서열은 당업계에 공지되어 있다(예를 들어, 문헌[Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242] 참조).
일부 실시 형태에서, 본원에 기재된 항체는 온전한 항체이다. 일부 실시 형태에서, 본원에 기재된 항체는 항원 결합을 보유하는 항체 단편이다. 일부 실시 형태에서, 항체 단편은 온전한 항체의 가변 도메인의 적어도 일부를 보유하는 Fab, Fab', F(ab')2, Fv, scFv, 다이설파이드 결합된 Fv, Fd, 단일쇄 항체, 단리된 CDRH3 또는 다른 항체 단편이다.
키메라 항원 수용체
특정 측면에서, 펩티드/MHC 복합체(예를 들어, 펩티드/클래스 I MHC 복합체 또는 펩티드/클래스 II MHC 복합체)에 결합 특이성을 갖는 키메라 항원 수용체(CAR)가 본원에 제공된다. 일부 실시 형태에서, CAR는 완전히 인간 유래의 것이다. 일부 실시 형태에서, CAR은 본원에 기재된 방법에 따라(예를 들어, 본원에 기재된 CAR 유전자좌를 포함하는 비인간 동물을 사용하여) 얻어질 수 있고/있거나 얻어진다.
일부 실시 형태에서, CAR은 10-7 M, 10-8 M 또는 10-9 M 미만의 KD에 상당하는 친화도로 펩티드/MHC 복합체에 결합한다. 일부 실시 형태에서, 펩티드/MHC 복합체에 대한 CAR의 결합 친화도(KD로 표시됨)는 MHC에 의해 제시되지 않는 경우의 펩티드에 대한 CAR의 친화도보다 적어도 10배, 적어도 100배 또는 적어도 1000배 적다. 일부 실시 형태에서, 펩티드/MHC 복합체에 대한 CAR의 결합 친화도(KD로 표시됨)는 관련이 없는 펩티드를 제시하는 동일한 MHC 단백질의 경우의 펩티드에 대한 CAR의 친화도보다 적어도 10배, 적어도 100배 또는 적어도 1000배 적다. 예를 들어, ELISA, 웨스턴 블롯 및 RIA를 포함하여, CAR의 결합 능력을 평가하기 위한 표준 분석법이 당업계에 공지되어 있다. CAR의 결합 동역학(예를 들어, 결합 친화도)은 또한 비아코어 분석법과 같은 당업계에 공지된 표준 분석법에 의해 평가될 수 있다.
일부 실시 형태에서, CAR는 펩티드/MHC 클래스 I 복합체에 특이적이다. 일부 실시 형태에서, MHC 클래스 I은 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F 또는 HLA-G이다. 일부 실시 형태에서, 펩티드는 길이가 8 내지 10개의 아미노산으로 되어 있다.
일부 실시 형태에서, CAR는 펩티드/MHC 클래스 I 복합체에 특이적이다. 일부 실시 형태에서, MHC 클래스 II는 HLA-DM, HLA-DO, HLA-DP, HLA-DQ 또는 HLA-DR이다. 일부 실시 형태에서, 펩티드는 길이가 10 내지 25개의 아미노산으로 되어 있다. 일부 실시 형태에서, 펩티드는 길이가 13 내지 25개의 아미노산으로 되어 있다. 일부 실시 형태에서, 펩티드는 길이가 15 내지 18개의 아미노산으로 되어 있다.
일부 실시 형태에서, 펩티드는 암 관련 항원의 에피토프를 포함한다. 암 관련 항원의 예로는 아디포필린, AIM-2, ALDH1A1, 알파-악티닌-4, 알파-페토단백질("AFP"), ARTC1, B-RAF, BAGE-1, BCLX (L), BCR-ABL 융합 단백질 b3a2, 베타 카테닌, BING-4, CA-125, CALCA, 암배아 항원("CEA"), CASP-5, CASP-8, CD274, CD45, Cdc27, CDK12, CDK4, CDKN2A, CEA, CLPP, COA-1, CPSF, CSNK1A1, CTAG1, CTAG2, 사이클린 D1, 사이클린-A1, dek-can 융합 단백질, DKK1, EFTUD2, 연장 인자 2, ENAH(hMena), Ep-CAM, EpCAM, EphA3, 상피성 종양 항원("ETA"), ETV6-AML1 융합 단백질, EZH2, FGF5, FLT3-ITD, FN1, G250/MN/CAIX, GAGE-1,2,8, GAGE-3,4,5,6,7, GAS7, 글리피칸-3, GnTV, gp100/Pmel17, GPNMB, HAUS3, 헵신, HER-2/neu, HERV-K-MEL, HLA-A11, HLA-A2, HLA-DOB, hsp70-2, IDO1, IGF2B3, IL13R알파2, 장내 카르복실에스테라아제, K-ras, 칼리크레인 4, KIF20A, KK-LC-1, KKLC1, KM-HN-1, CCDC110으로도 알려진 KMHN1, LAGE-1, LDLR-푸코실트랜스페라아제, AS 융합 단백질, 렝신, M-CSF, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-C1, MAGE-C2, 말산 효소, 맘마글로빈-A, MART2, MATN, MC1R, MCSP, mdm-2, ME1, 멜란-A/MART-1, 멜로, 미드카인, MMP-2, MMP-7, MUC1, MUC5AC, 무친, MUM-1, MUM-2, MUM-3, 미오신, 미오신 클래스 I, N-raw, NA88-A, neo-PAP, NFYC, NY-BR-1, NY-ESO-1/LAGE-2, OA1, OGT, OS-9, P 폴리펩티드, p53, PAP, PAX5, PBF, pml-RAR알파 융합 단백질, 다형성 상피 무친("PEM"), PPP1R3B, PRAME, PRDX5, PSA, PSMA, PTPRK, RAB38/NY-MEL-1, RAGE-1, RBAF600, RGS5, RhoC, RNF43, RU2AS, SAGE, 세세르닌 1, SIRT2, SNRPD1, SOX10, Sp17, SPA17, SSX-2, SSX-4, STEAP1, 서바이빈, SYT-SSX1 또는 -SSX2 융합 단백질, TAG-1, TAG-2, 텔로머라아제, TGF-베타RII, TPBG, TRAG-3, 트라이오스포스페이트 아이소머라아제, TRP-1/gp75, TRP-2, TRP2-INT2, 티로시나아제, 티로시나아제("TYR"), VEGF, WT1, XAGE-1b/GAGED2a를 포함하나 이에 한정되지 않는다. 일부 실시 형태에서, 상기 항원은 신생항원이다.
일부 실시 형태에서, 펩티드는 감염성 병원균에 의해 발현되는 항원의 에피토프를 포함한다. 일부 실시 형태에서, 상기 병원균은 바이러스, 세균, 진균, 연충 또는 원충이다. 예를 들어, 일부 실시 형태에서, 상기 바이러스는 HPV, HBV, C형 간염 바이러스(HCV), 인간 면역 결핍 바이러스(HIV-1 및 HIV-2)와 같은 레트로바이러스, 엡스타인 바 바이러스(EBV)와 같은 헤르페스 바이러스, 사이토메갈로바이러스(CMV), HSV-1 및 HSV-2, 및 인플루엔자 바이러스이다. 일부 실시 형태에서, 기생충은 말라리아이다. 일부 실시 형태에서, 병원균은 아스페르길루스, 브루기아, 칸디다, 클라미디아, 콕시디아, 크립토코쿠스, 디로필라리아, 고노코쿠스, 히스토플라즈마, 리슈마니아, 마이코박테리움, 마이코플라즈마, 파라메시움, 퍼투시스, 플라스모듐, 뉴모코쿠스, 뉴모시스티스, 리케차, 살모넬라, 시겔라, 스타필로코쿠스, 스트렙토코쿠스, 톡소플라즈마 및 콜레라균이다. 예시적인 종으로는 나이세리아 고노리아, 마이코박테리움 투베르쿨로시스, 칸디다 알비칸스, 칸디다 트로피칼리스, 트리코모나스 바지날리스, 헤모필루스 바지날리스, B군 스트렙토코쿠스 속, 마이코플라즈마 호미니스, 헤모필루스 듀크레이, 그라눌로마 인귀네일, 림포패씨아 베네레움, 트레포네마 팔리둠, 브루셀라 아보투스. 브루셀라 멜리텐시스, 브루셀라 수이스, 브루셀라 카니스, 캄필로박터 페투스, 캄필로박터 페투스 인테스티날리스, 렙토스피라 포모나, 리스테리아 모노사이토제네스, 브루셀라 오비스, 클라미디아 프시타시, 트리코모나스 피투스, 톡소플라즈마 곤디, 에스세리키아 콜리, 악티노바실루스 에쿠울리, 살모넬라 아보투스 오비스, 살모넬라 아보투스 에쿠이, 슈도모나스 에루지노사, 코리네박테리움 에쿠이, 코리네박테리움 파이오게네스, 악티노바실루스 세미니스, 마이코플라즈마 보비제니탈륨, 아스페르길루스 푸미가투스, 압시디아 라모사, 트리파노소마 에퀴페르둠, 바베시아 카발리, 클로스트리듐 테타니, 클로스트리듐 보툴리눔; 또는 예를 들어, 파라콕시디오이데스 브라질리엔시스와 같은 진균; 또는 예를 들어, 플라스모듐 팔시파룸과 같은 다른 병원균을 들 수 있다.
일부 실시 형태에서, 펩티드는 염증성 질환, 피부 또는 장기 이식 거부, 이식편대숙주병(GVHD) 또는 자가면역질환에서 자가반응성 T 세포의 표적인 단백질의 에피토프를 포함한다. 자가면역질환의 예로는 예를 들어, 사구체신염, 관절염, 확장형 심근병증 유사 질환, 궤양성 대장염, 쇼그렌 증후군, 크론병, 전신성 홍반성 루푸스, 만성 류마티스 관절염, 다발성 결화증, 건선, 알러지성 접촉 피부염, 다발성 근염, 피부비후증, 결절성 동맥주위염, 류마티스열, 심상성 백반증, 인슐린 의존성 당뇨병, 베체트병, 하시모토병, 애디슨병, 피부근염, 중증 근무력증, 라이터 증후군, 그레이브스병, 악성 빈혈, 굿파스처 증후군, 불임증, 만성 활동성 간염, 천포창, 자가면역성 혈소판 감소성 자반증 및 자가면역성 용혈성 빈혈, 활동성 만성 간염, 애디슨병, 항인지질 증후군, 아토피성 알러지, 자가면역성 위축성 위염, 자가면역성 무위산증, 셀리악병, 쿠싱 증후군, 피부근염, 원판상 홍반성 루푸스, 굿파스처 증후군, 하시모토 갑상선염, 특발성 부신 위축, 특발성 혈소판 감소증, 인슐린 의존성 당뇨병, 람베르트-이튼 증후군, 루포이드 간염, 림프구 감소증의 몇가지 증례, 혼합결합조직병, 유사천포창, 심상성 천포창, 악성 빈혈, 수정체성 포도막염, 결절성 다발동맥염, 자가면역성 다선증후군, 원발성 담즙성 간경변증, 원발성 경화성 담관염, 레이노 증후군, 재발성 다발성 연골염, 슈미트 증후군, 제한형 경피증 (또는 크레스트 증후군), 교감성 안염, 전신성 홍반성 루푸스, 다카야스 동맥염, 측두동맥염, 갑상선 중독증, b형 인슐린 저항성, 궤양성 대장염 및 베게너 육아종증을 들 수 있다. 자가반응성 T 세포에 의해 표적화된 예시적인 단백질에는 예를 들어, p205, 인슐린, 갑상선 자극 호르몬, 티로시나아제, TRP1 및 미엘린이 포함된다.
일부 실시 형태에서, 이러한 CAR은 Ig 중쇄 가변 도메인 및 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함한다. 일부 실시 형태에서, Ig 중쇄 가변 도메인 및/또는 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 비인간 불변 도메인(예를 들어, 래트 또는 마우스 불변 도메인)이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 인간 불변 도메인이다. CAR의 Ig 가변 도메인은 본원에 기재된 방법을 사용하거나 당업계에 공지된 임의의 다른 방법을 사용하여 생성될 수 있다. 예를 들어, 항 펩티드/MHC 항체는 당업계에 공지된 방법을 사용하여(예를 들어, 파지 디스플레이(phage display) 또는 이스트 디스플레이(yeast display)를 사용하여) 생성될 수 있고, 이어서 상기 항체의 가변 도메인을 인코딩하는 핵산 서열은 TCR 불변 도메인 유전자에 연결될 수 있다. 펩티드/MHC 복합체에 대하여 결합 특이성을 갖는 항체 및 이러한 항체의 생산 방법의 예는 예를 들어, 각각 본원에 참조로 포함되는 미국 특허 제6,992,176호, 제7,718,777호 및 제8,815,528호, 및 문헌[Stewart-Jones et al., Proc. Nat'l. Acad. Sci. USA 106:5784-88 (2009)] 및 문헌[Hulsmeyer et al., J. Biol. Chem. 280:2972-80 (2005)]에 제공되어 있다.
약제학적 조성물
특정 실시 형태에서, 약제학적으로 허용가능한 담체와 함께 제제화된, 본원에 기재된 하나 이상의 제제(예를 들어, 본원에 기재된 항체 및/또는 본원에 기재된 CAR)를 함유하는 조성물, 예를 들어 약제학적 조성물이 본원에 제공된다.
본원에 제공된 약제학적 조성물은 하기 투여에 적합한 형태를 포함하여, 고체 또는 액체 형태로의 투여를 위해 특별히 제형화될 수 있다: (1) 경구 투여, 예를 들어 드렌치(drench)(수용액 또는 비수용액 또는 현탁액), 정제(예를 들어, 구강, 설하, 및 전신 흡수를 표적으로 한 것들), 볼루스, 분말, 과립, 혀에의 적용을 위한 페이스트; 또는 (2) 예를 들어, 멸균 용액 또는 현탁액 또는 서방성 제제와 같은 피하, 근육 내, 정맥 내 또는 경막 외 주사에 의한 비경구 투여.
비경구 투여에 적합한 본원에 제공된 약제학적 조성물은 당, 알코올, 산화방지제, 완충액, 정균제, 제제를 대상으로 하는 수용자의 혈액과 등장성으로 만드는 용질 또는 현탁화제 또는 증점제를 함유할 수 있는, 하나 이상의 약제학적으로 허용가능한 멸균 등장성 수용액 또는 비수용액, 분산액, 현탁액 또는 에멀젼, 또는 사용하기 직전에 멸균 주사액 또는 분산액으로 재구성될 수 있는 멸균 분말과 병용하여, 본원에 기재된 하나 이상의 제제를 포함한다.
본원에 제공된 약제학적 조성물에 사용될 수 있는 적절한 수성 및 비수성 담체의 예로는 물, 에탄올, 폴리올(예를 들어, 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등) 및 이들의 적절한 혼합물, 식물유, 예를 들어 올리브유 및 주사가능한 유기 에스테르, 예컨대 올레산에틸이 포함된다. 적절한 유동성은 예를 들어, 레시틴과 같은 코팅제의 사용, 분산액의 경우 필요한 입자 크기의 유지 및 계면활성제의 사용에 의해 유지될 수 있다.
특정 실시 형태에서, 상기 조성물은 원하는 투여량에 적합한 w/v를 얻는 농도로 본원에 기재된 항체 및/또는 CAR을 포함한다. 항체 및/또는 CAR은 1 mg/mL 이상, 5 mg/mL 이상, 10 mg/mL 이상, 15 mg/mL 이상, 20 mg/mL 이상, 25 mg/mL 이상, 30 mg/mL 이상, 35 mg/mL 이상, 40 mg/mL 이상, 45 mg/mL 이상, 50 mg/mL 이상, 55 mg/mL 이상, 60 mg/mL 이상, 65 mg/mL 이상, 70 mg/mL 이상, 75 mg/mL 이상, 80 mg/mL 이상, 85 mg/mL 이상, 90 mg/mL 이상, 95 mg/mL 이상, 100 mg/mL 이상, 105 mg/mL 이상, 110 mg/mL 이상, 115 mg/mL 이상, 120 mg/mL 이상, 125 mg/mL 이상, 130 mg/mL 이상, 135 mg/mL 이상, 140 mg/mL 이상, 150 mg/mL 이상, 200 mg/mL 이상, 250 mg/mL 이상 또는 300 mg/mL 이상의 농도로 상기 조성물에 존재할 수 있다.
일부 실시 형태에서, 상기 조성물은 치료되는 특정 징후용으로, 필요에 따라 하나 이상의 활성 화합물, 전형적으로 서로 악영향을 미치지 않는 상보적 활성을 갖는 활성 화합물을 포함한다. 이러한 추가의 활성 화합물은 의도된 목적에 효과적인 양으로 적절하게 조합하여 존재한다.
일부 실시 형태에서, 상기 조성물은 완충제, 당류, 염, 계면활성제, 가용화제, 폴리올, 희석제, 결합제, 안정제, 염, 친유성 용매, 아미노산, 킬레이트제, 방부제 등을 포함하지만 이에 한정되지 않는 임의의 생리학적으로 허용가능한 담체, 부형제 또는 안정제와 본원에 기재된 항체 및/CAR을 혼합함으로써, 원하는 최종 농도의 동결 건조된 조성물 또는 수용액의 형태로 제조된다(Goodman and Gilman's The Pharmacological Basis of Therapeutics, 12th edition, L. Brunton, et al. and Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1999)). 허용가능한 담체, 부형제 또는 안정제는 사용된 용량 및 농도에서 수용자에게 비독성이며, 히스티딘, 포스페이트, 시트레이트, 글리신, 아세테이트 및 기타 유기산과 같은 완충제; 아스코르브산 및 메티오닌을 포함하는 산화방지제; 보존제(예를 들어, 옥타데실다이메틸벤질 암모늄 클로라이드, 헥사메토늄 클로라이드, 벤잘코늄 클로라이드, 벤제토늄 클로라이드; 페놀, 부틸 또는 벤질 알코올; 메틸 또는 프로필 파라벤과 같은 알킬 파라벤; 카테콜, 레조르시놀; 사이클로헥산올; 3-펜탄올; 및 m-크레졸); 저분자량(약 10개 미만의 잔기) 폴리펩티드; 혈청 알부민, 젤라틴 또는 면역글로불린과 같은 단백질; 폴리비닐피롤리돈과 같은 친수성 중합체; 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌 또는 라이신과 같은 아미노산; 단당류, 이당류, 및 트레할로스, 글루코스, 만노스 또는 덱스트린을 비롯한 기타 탄수화물; EDTA와 같은 킬레이트제; 수크로스, 만니톨, 트레할로스 또는 소르비톨과 같은 당; 나트륨과 같은 염 형성 반대 이온; 금속 착물(예를 들어, Zn-단백질 복합체); 및/또는 트윈(TWEEN), 폴리소르베이트 80, 플루로닉스(PLURONICS)® 또는 폴리에틸렌 글리콜(PEG)과 같은 비이온성 계면활성제를 포함한다.
일부 실시 형태에서, 완충제는 히스티딘, 시트레이트, 포스페이트, 글리신 또는 아세테이트이다. 당류 부형제는 트레할로스, 수크로스, 만니톨, 말토스 또는 라피노스일 수 있다. 계면활성제는 폴리소르베이트 20, 폴리소르베이트 40, 폴리소르베이트 80 또는 플루로닉 F68일 수 있다. 염은 NaCl, KCl, MgCl2 또는 CaCl2일 수 있다.
일부 실시 형태에서, 상기 조성물은 개선된 pH 조절을 제공하기 위해 완충제 또는 pH 조절제를 포함한다. 이러한 조성물은 pH가 약 3.0 내지 약 9.0, 약 4.0 내지 약 8.0, 약 5.0 내지 약 8.0, 약 5.0 내지 약 7.0, 약 5.0 내지 약 6.5, 약 5.5 내지 약 8.0, 약 5.5 내지 약 7.0, 또는 약 5.5 내지 약 6.5일 수 있다. 추가의 실시 형태에서, 이러한 조성물은 pH가 약 3.0, 약 3.5, 약 4.0, 약 4.5, 약 5.0, 약 5.1, 약 5.2, 약 5.3, 약 5.4, 약 5.5, 약 5.6, 약 5.7, 약 5.8, 약 5.9, 약 6.0, 약 6.1, 약 6.2, 약 6.3, 약 6.4, 약 6.5, 약 6.6, 약 6.7, 약 6.8, 약 6.9, 약 7.0, 약 7.5, 약 8.0, 약 8.5 또는 약 9.0이다. 구체적인 실시 형태에서, 조성물은 pH가 약 6.0이다. 당해 분야의 숙련가는 조성물의 pH가 일반적으로 조성물에 사용되는 특정 항체 또는 CAR의 등전점과 같아서는 안된다는 것을 이해한다. 전형적으로, 완충제는 유기 또는 무기산 또는 염기로부터 제조되는 염이다. 대표적인 완충제는 시트르산, 아스코르브산, 글루콘산, 탄산, 타르타르산, 석신산, 아세트산, 또는 프탈산의 염과 같은 유기산염; 트리스(Tris), 트로메타민 하이드로클로라이드, 또는 포스페이트 완충제를 포함하나 이에 한정되지 않는다. 게다가, 아미노산 성분은 또한 완충능의 기능을 할 수 있다. 조성물에 완충제로서 사용될 수 있는 대표적인 아미노산 성분으로는 글리신 및 히스티딘이 포함되나, 이에 한정되는 것은 아니다. 특정 실시 형태에서, 완충제는 히스티딘, 시트레이트, 포스페이트, 글리신 및 아세테이트로부터 선택된다. 구체적인 실시 형태에서, 완충제는 히스티딘이다. 다른 구체적인 실시 형태에서, 완충제는 시트레이트이다. 또 다른 구체적인 실시 형태에서, 완충제는 글리신이다. 완충제의 순도는 98% 이상, 99% 이상 또는 99.5% 이상이어야 한다. 히스티딘 및 글리신과 관련하여 본원에 사용되는 용어 "순도"는 예를 들어, 문헌[The Merck Index, 13th ed., O'Neil et al. ed. (Merck & Co., 2001)]에 기재된 바와 같이 당업계에서 이해되는 바와 같이 히스티딘 또는 글리신의 화학적 순도를 나타낸다.
특정 실시 형태에서, 조성물은 완충제로서 히스티딘을 포함한다. 특정 실시 형태에서, 히스티딘은 약 1 mM 이상, 약 5 mM 이상, 약 10 mM 이상, 약 20 mM 이상, 약 30 mM 이상, 약 40 mM 이상, 약 50 mM 이상, 약 75 mM 이상, 약 100 mM 이상, 약 150 mM 이상 또는 약 200 mM 이상의 히스티딘의 농도로 조성물에 존재한다. 다른 실시 형태에서, 조성물은 약 1 mM 내지 약 200 mM, 약 1 mM 내지 약 150 mM, 약 1 mM 내지 약 100 mM, 약 1 mM 내지 약 75 mM, 약 10 mM 내지 약 200 mM, 약 10 mM 내지 약 150 mM, 약 10 mM 내지 약 100 mM, 약 10 mM 내지 약 75 mM, 약 10 mM 내지 약 50 mM, 약 10 mM 내지 약 40 mM, 약 10 mM 내지 약 30 mM, 약 20 mM 내지 약 75 mM, 약 20 mM 내지 약 50 mM, 약 20 mM 내지 약 40 mM, 또는 약 20 mM 내지 약 30 mM의 히스티딘을 포함한다. 추가의 실시 형태에서, 조성물은 약 1 mM, 약 5 mM, 약 10 mM, 약 20 mM, 약 25 mM, 약 30 mM, 약 35 mM, 약 40 mM, 약 45 mM, 약 50 mM, 약 60 mM, 약 70 mM, 약 80 mM, 약 90 mM, 약 100 mM, 약 150 mM 또는 약 200 mM의 히스티딘을 포함한다. 구체적인 실시 형태에서, 조성물은 약 10 mM, 약 25 mM의 히스티딘을 포함할 수 있거나, 히스티딘을 포함하지 않을 수 있다.
일부 실시 형태에서, 조성물은 탄수화물 부형제를 포함한다. 탄수화물 부형제는 예를 들어, 점도 증진제, 안정제, 증량제(bulking agent), 가용화제 및/또는 이와 유사한 것으로서 작용할 수 있다. 탄수화물 부형제는 일반적으로, 중량 또는 체적 기준으로 약 1% 내지 약 99%, 예를 들어 약 0.1% 내지 약 20%, 약 0.1% 내지 약 15%, 약 0.1% 내지 약 5%, 약 1% 내지 약 20%, 약 5% 내지 약 15%, 약 8% 내지 약 10%, 약 10% 내지 약 15%, 약 15% 내지 약 20%, 0.1% 내지 20%, 5% 내지 15%, 8% 내지 10%, 10% 내지 15%, 15% 내지 20%, 약 0.1% 내지 약 5%, 약 5% 내지 약 10%, 또는 약 15% 내지 약 20%로 존재한다. 또 다른 구체적인 실시 형태에서, 탄수화물 부형제는 1%, 1.5%, 2%, 2.5%, 3%, 4%, 5%, 10%, 15% 또는 20%로 존재한다.
일부 실시 형태에서, 조성물은 탄수화물 부형제를 포함한다. 본 발명에 사용하기에 적합한 탄수화물 부형제는 예를 들어, 프럭토스, 말토스, 갈락토스, 글루코스, D-만노스, 소르보스 등의 단당류; 락토스, 수크로스, 트레할로스, 셀로비오스 등의 이당류; 라피노스, 멜레지토스, 말토덱스트린, 덱스트란, 전분 등의 다당류; 만니톨, 자일리톨, 말티톨, 락티톨, 자일리톨, 소르비톨(글루시톨) 등의 알디톨을 포함하나 이에 한정되지 않는다. 특정 실시 형태에서, 본원에 제공된 조성물에 사용하기 위한 탄수화물 부형제는 수크로스, 트레할로스, 락토스, 만니톨 및 라피노스로부터 선택된다. 구체적인 실시 형태에서, 탄수화물 부형제는 트레할로스이다. 다른 구체적인 실시 형태에서, 탄수화물 부형제는 만니톨이다. 또 다른 구체적인 실시 형태에서, 탄수화물 부형제는 수크로스이다. 또 다른 구체적인 실시 형태에서, 탄수화물 부형제는 라피노스이다. 탄수화물 부형제의 순도는 98% 이상, 99% 이상 또는 99.5% 이상이어야 한다.
일부 실시 형태에서, 조성물은 트레할로스를 포함한다. 특정 실시 형태에서, 조성물은 약 1% 이상, 약 2% 이상, 약 4% 이상, 약 8% 이상, 약 20% 이상, 약 30% 이상 또는 약 40% 이상의 트레할로스를 포함한다. 다른 실시 형태에서, 조성물은 약 1% 내지 약 40%, 약 1% 내지 약 30%, 약 1% 내지 약 20%, 약 2% 내지 약 40%, 약 2% 내지 약 30%, 약 2% 내지 약 20%, 약 4% 내지 약 40%, 약 4% 내지 약 30%, 또는 약 4% 내지 약 20%의 트레할로스를 포함한다. 추가의 실시 형태에서, 조성물은 약 1%, 약 2%, 약 4%, 약 6%, 약 8%, 약 15%, 약 20%, 약 30% 또는 약 40%의 트레할로스를 포함한다. 구체적인 실시 형태에서, 조성물은 약 4%, 약 6% 또는 약 15%의 트레할로스를 포함한다.
특정 실시 형태에서, 조성물은 부형제를 포함한다. 구체적인 실시 형태에서, 조성물은 당, 염, 계면활성제, 아미노산, 폴리올, 킬레이트제, 유화제 및 보존제로부터 선택되는 적어도 하나의 부형제를 포함한다. 특정 실시 형태에서, 조성물은 염, 예를 들어 NaCl, KCl, CaCl2, 및 MgCl2로부터 선택되는 염을 포함한다. 구체적인 실시 형태에서, 조성물은 NaCl을 포함한다.
일부 실시 형태에서, 조성물은 아미노산, 예를 들어, 라이신, 아르기닌, 글리신, 히스티딘 또는 아미노산염을 포함한다. 조성물은 약 1 mM 이상, 약 10 mM 이상, 약 25 mM 이상, 약 50 mM 이상, 약 100 mM 이상, 약 150 mM 이상, 약 200 mM 이상, 약 250 mM 이상, 약 300 mM 이상, 약 350 mM 이상 또는 약 400 mM 이상의 아미노산을 포함할 수 있다. 다른 실시 형태에서, 조성물은 약 1 mM 내지 약 100 mM, 약 10 mM 내지 약 150 mM, 약 25 mM 내지 약 250 mM, 약 25 mM 내지 약 300 mM, 약 25 mM 내지 약 350 mM, 약 25 mM 내지 약 400 mM, 약 50 mM 내지 약 250 mM, 약 50 mM 내지 약 300 mM, 약 50 mM 내지 약 350 mM, 약 50 mM 내지 약 400 mM, 약 100 mM 내지 약 250 mM, 약 100 mM 내지 약 300 mM, 약 100 mM 내지 약 400 mM, 약 150 mM 내지 약 250 mM, 약 150 mM 내지 약 300 mM, 또는 약 150 mM 내지 약 400 mM의 아미노산을 포함할 수 있다. 추가의 실시 형태에서, 조성물은 약 1 mM, 1.6 mM, 25 mM, 약 50 mM, 약 100 mM, 약 150 mM, 약 200 mM, 약 250 mM, 약 300 mM, 약 350 mM 또는 약 400 mM의 아미노산을 포함한다.
일부 실시 형태에서, 조성물은 계면활성제를 포함한다. 본원에 사용되는 용어 "계면활성제"는 양친매성 구조를 갖는 유기 물질을 의미하며; 즉, 이들은 반대되는 용해 경향의 그룹, 전형적으로 유용성 탄화수소 쇄 및 수용성 이온기로 구성된다. 계면활성제는 계면 활성 부분의 전하에 따라, 음이온성, 양이온성 및 비이온성 계면활성제로 분류될 수 있다. 계면활성제는 종종 다양한 생물학적 물질의 약제학적 조성물 및 제제의 습윤제, 유화제, 가용화제 및 분산제로서 사용된다. 폴리소르베이트(예를 들어, 폴리소르베이트 20 또는 80)와 같은 약제학적으로 허용가능한 계면활성제; 폴록사머(예를 들어, 폴록사머 188); 트리톤(Triton); 나트륨 옥틸 글리코시드; 라우릴-, 미리스틸-, 리놀레일- 또는 스테아릴-설포베타인; 라우릴-, 미리스틸-, 리놀레일- 또는 스테아릴-사르코신; 리놀레일-, 미리스틸- 또는 세틸-베타인; 라우라미도프로필-, 코카미도프로필-, 리놀레아미도프로필-, 미리스트아미도프로필-, 팔미타미도프로필- 또는 아이소스테아라미도프로필-베타인(예를 들어, 라우라미도프로필); 미리스트아미도프로필-, 팔미타미도프로필- 또는 아이소스테아라미도프로필-다이메틸아민; 나트륨 메틸 코코일 - 또는 이나트륨 메틸 올레일-타우레이트; 및 모나쿠아(MONAQUA)® 시리즈(모나 인데스트리즈, 인코포레이티드(Mona Industries, Inc.(미국 뉴저지주 패터슨 소재)), 폴리에틸 글리콜, 폴리프로필 글리콜, 및 에틸렌과 프로필렌 글리콜의 공중합체(예를 들어, 플루로닉스® PF68 등)가 응집을 감소시키기 위해 조성물에 임의로 첨가될 수 있다. 특정 실시 형태에서, 상기 조성물은 폴리소르베이트 20, 폴리소르베이트 40, 폴리소르베이트 60 또는 폴리소르베이트 80을 포함한다. 계면활성제는 펌프 또는 플라스틱 용기를 사용하여 조성물을 투여하는 경우에 특히 유용하다. 약제학적으로 허용가능한 계면활성제의 존재는 단백질 응집 경향을 완화시킨다. 상기 조성물은 약 0.001% 내지 약 1%, 약 0.001% 내지 약 0.1%, 또는 약 0.01% 내지 약 0.1% 범위의 농도의 폴리소르베이트를 포함할 수 있다. 다른 구체적인 실시 형태에서, 상기 조성물은 0.001%, 0.002%, 0.003%, 0.004%, 0.005%, 0.006%, 0.007%, 0.008%, 0.009%, 0.01%, 0.015% 또는 0.02%의 농도의 폴리소르베이트를 포함한다.
일부 실시 형태에서, 상기 조성물은 희석제, 결합제, 안정제, 친유성 용매, 보존제, 보조제 등을 포함하지만 이에 한정되지 않는 다른 부형제 및/또는 첨가제를 포함한다. 약제학적으로 허용가능한 부형제 및/또는 첨가제는 본원에 제공된 조성물에 사용될 수 있다. 통상적으로 사용되는 부형제/첨가제, 예컨대 약제학적으로 허용가능한 킬레이트제(예를 들어, EDTA, DTPA 또는 EGTA가 있으나 이에 한정되는 것은 아님)는 임의로 조성물에 첨가되어 응집을 감소시킬 수 있다. 이러한 첨가제는 펌프 또는 플라스틱 용기를 사용하여 조성물을 투여하는 경우에 특히 유용하다.
일부 실시 형태에서, 상기 조성물은 보존제를 포함한다. 보존제, 예컨대 페놀, m-크레졸, p-크레졸, o-크레졸, 클로로크레졸, 벤질 알콜, 아질산페닐제이수은(phenylmercuric nitrite), 페녹시에탄올, 포름알데히드, 클로로부탄올, 염화마그네슘(예를 들어, 육수화물이지만 이에 한정되지 않음), 알킬파라벤(메틸, 에틸, 프로필, 부틸 등), 벤잘코늄 클로라이드, 벤제토늄 클로라이드, 데하이드로아세트산나트륨 및 티메로살 또는 이들의 혼합물은 적절한 농도, 예를 들어 약 0.001% 내지 약 5%, 또는 임의의 범위 또는 그 안의 값으로 조성물에 임의로 첨가될 수 있다. 조성물에 사용되는 보존제의 농도는 미생물 효과를 발생시키기에 충분한 농도이다. 그러한 농도는 선택된 보존제에 따라 달라지며, 숙련된 당업자에 의해 용이하게 결정된다.
일부 실시 형태에서, 조성물은 인간 혈액과 등장성이며, 조성물은 인간 혈액과 기본적으로 동일한 삼투압을 갖는다. 이러한 등장성 조성물은 일반적으로 약 250 mOSm 내지 약 350 mOSm의 삼투압을 가질 것이다. 등장성은 예를 들어, 증기압 또는 결빙형 삼투압계를 사용하여 측정될 수 있다. 조성물의 긴장성(tonicity)은 긴장성 조절제(tonicity modifier)를 사용하여 조절된다. "긴장성 조절제"는 조성물의 등장성을 제공하기 위해 조성물에 첨가될 수 있는 약제학적으로 허용가능한 불활성 물질이다. 본원에 제공된 조성물에 적합한 긴장성 조절제는 당류, 염 및 아미노산을 포함하지만 이에 한정되지는 않는다.
특정 실시 형태에서, 조성물은 내독소 및/또는 관련 발열물질을 실질적으로 함유하지 않는 발열물질 비함유 조성물이다. 내독소는 미생물 내부에 한정되고, 미생물이 분해되거나 사멸되는 경우에만 방출되는 독소를 포함한다. 발열물질은 또한 세균 및 다른 미생물의 외막 유래의 내열성 발열물질을 포함한다. 이들 물질은 모두 인간에게 투여하는 경우, 발열, 저혈압 및 쇼크를 일으킬 수 있다. 잠재적인 유해 작용 때문에, 적은 양이더라도 내독소는 정맥 내 투여되는 약제 용액으로부터 제거되어야 한다. 미국 식품 의약국(FDA)은 정맥 내 약물 적용을 위해 단 1시간 동안에 체중 1 킬로그램 당 용량 당 5개의 내독소 단위(EU)의 상한선을 설정하였다(The United States Pharmacopeial Convention, Pharmacopeial Forum 26 (1):223 (2000)). 치료용 단백질이 체중 1 킬로그램 당 수백 또는 수천 밀리그램의 양으로 투여되는 경우에, 대상으로 하는 단백질(예를 들어, 항체)의 경우와 같이, 미량이더라도 유해하고 위험한 내독소는 제거되어야 한다. 일부 실시 형태에서, 조성물 중의 내독소 및 발열물질 레벨은 10 Eu/mg 미만, 5 Eu/mg 미만, 1 Eu/mg 미만, 0.1 Eu/mg 미만, 0.01 Eu/mg 미만 또는 0.001 Eu/mg 미만이다.
생체 내 투여에 사용될 때, 본원에 기재된 조성물은 무균이어야 한다. 조성물은 무균 여과, 방사선 등을 포함하는 다양한 멸균법에 의해 멸균될 수 있다. 특정 실시 형태에서, 조성물은 미리 멸균된 0.22 마이크미터 필터로 여과 멸균된다. 주사용 무균 조성물은 문헌["Remington: The Science & Practice of Pharmacy", 21st ed., Lippincott Williams & Wilkins, (2005)]에 기재된 바와 같이, 통상적인 약무에 따라 제제화될 수 있다. 본원에 개시된 바와 같은 대상으로 하는 단백질(예를 들어, 항체 또는 CAR)을 포함하는 조성물은 통상적으로 동결 건조된 형태 또는 용액으로 저장될 것이다. 대상으로 하는 단백질(예를 들어, 항체 또는 CAR)을 포함하는 무균 조성물이 멸균 액세스 포트를 갖는 용기, 예를 들어 조성물을 회수할 수 있는 어댑터, 예컨대 피하 주사침으로 찌를 수 있는 마개를 갖는 정맥 주사용 용액 백 또는 바이알에 주입되는 것으로 고려된다. 특정 실시 형태에서, 조성물은 미리 충전된 주사기로서 제공된다.
특정 실시 형태에서, 조성물은 동결 건조 제제이다. 용어 "동결 건조된" 또는 "냉동 건조된"은 적어도 50%의 수분이 제거된 동결 건조와 같은 건조 절차를 거친 물질의 상태를 포함한다.
선택되는 투여 경로에 관계없이, 적절한 수화된 형태로 사용될 수 있는 본원에 제공된 제제 및/또는 본원에 제공된 약제학적 조성물은 당업자에게 공지된 통상적인 방법에 의해 약제학적으로 허용가능한 투여 형태로 제형화된다.
치료법
특정 측면에서, 본원에 기재된 항체 또는 CAR(예를 들어, 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 완전히 인간 유래의 항체, 또는 펩티드/MHC에 대한 결합 특이성을 갖는 완전히 인간 유래의 CAR)을 대상에게 투여하는 단계를 포함하는, 질환 또는 장애의 치료 방법이 본원에 제공된다. 일부 실시 형태에서, 항체 및/또는 CAR은 본원에 기재된 방법을 사용하여(예를 들어, 본원에 기재된 CAR 유전자좌를 포함하는 비인간 동물을 사용하여) 얻어지거나 얻어질 수 있는 항체 및/또는 CAR이다.
특정 실시 형태에서, 본원에 기재된 약제학적 조성물(예를 들어, 본원에 기재된 항체, 예컨대 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 완전히 인간 유래의 항체를 포함하는 약제학적 조성물)을 대상에게 투여하는 단계를 포함하는, 대상의 암을 치료하는 방법이 본원에 제공된다. 일부 실시 형태에서, 본원에 기재된 방법은 임의의 암성 또는 전암성 종양을 치료하는데 사용될 수 있다. 본원에 기재된 방법 및 조성물에 의해 치료될 수 있는 암은 방광, 혈액, 뼈, 골수, 뇌, 유방, 결장, 식도, 위장, 잇몸, 두부, 신장, 간, 폐, 비인두, 경부, 난소, 전립선, 피부, 위, 고환, 혀 또는 자궁의 암세포을 포함하나 이에 한정되지 않는다. 또한, 암은 구체적으로 하기 조직형일 수 있으나, 이에 한정되지 않는다: 악성 신생물; 암종; 미분화 암; 거대세포암종 및 방추세포암종; 소세포암종; 유두암종; 편평상피암종; 림프상피암종; 기저세포암종; 모기질 암종; 이행세포암종; 유두상 이행세포암종; 선암; 악성 가스트린종; 담관암; 간세포암; 혼합형 간세포암-담관암; 육주형 선암; 선양낭포암; 선종성 폴립 내의 선암; 선암, 가족성 대장 폴립증; 고형암; 악성 카르시노이드 종양; 기관지폐포선암; 유두선암; 혐색소성 암종; 호산성 암종; 호산성 선암; 호염기성 암종; 투명세포선암; 과립세포암종; 여포선암; 유두-여포 선암; 비피막성 경화성 암종; 부신피질암; 자궁내막암; 피부 부속기 암종; 아포크린 선암; 피지 선암; 귀지선 선암; 점액표피양 암종; 낭포선암; 유두상 낭포선암; 유두상 장액성 낭포선암; 점액성 낭포선암; 점액성 선암; 반지세포암; 침윤성 도관암; 수질암; 소엽암; 염증성 암종; 유방 파제트병; 선방세포암; 선편평상피암; 편평상피화생을 동반한 선암; 악성 흉선종; 악성 난소 간질 종양; 악성 난포막세포종; 악성 과립막세포종; 악성 남성모세포종; 세르톨리 세포 암종; 악성 라이디히 세포종; 악성 지질 세포 종양; 악성 부신경절종; 악성 유방외 부신경절종; 크롬친화세포종; 사구맥관육종; 악성 흑색종; 멜라닌 결핍 흑색종; 표재 확장성 흑색종; 거대 색소성 모반에서의 악성 흑색종; 상피모양 세포 흑색종; 악성 청색모반; 육종; 섬유육종; 악성 섬유성 조직구종; 점액육종; 지방육종; 평활근육종; 횡문근육종; 배아형 횡문근육종; 폐포 횡문근육종; 간질 육종; 악성 혼합 종양; 뮬러리안 혼합 종양; 신장모세포종; 간모세포종; 암육종; 악성 간엽종; 악성 브렌너 종양; 악성 엽상 종양; 활막 육종; 악성 중피종; 미분화 배세포종; 배아 암종; 악성 기형종; 악성 난소 갑상선종; 융모막암; 악성 중신종; 혈관육종; 악성 혈관내피종; 카포시 육종; 악성 혈관주위세포종; 림프관 육종; 골육종; 방골성 골육종; 연골육종; 악성 연골모세포종; 간엽성 연골육종; 골 거대세포종; 유윙육종; 악성 치원성 종양; 사기질모세포 치아육종; 악성 사기질모세포종; 사기질모세포 섬유육종; 악성 송과체종; 척삭종; 악성 신경교종; 뇌실막세포종; 성상세포종; 원형질성 성상세포종; 원섬유성 성상세포종; 성상모세포종; 교모세포종; 희소돌기아교세포종; 희소돌기아교모세포종; 원시신경외배엽종양; 소뇌 육종; 신경절모세포종; 신경모세포종; 망막모세포종; 후신경원성 종양; 악성 수막종; 신경섬유육종; 악성 신경초종; 악성 과립세포종; 악성 림프종; 호지킨병; 호지킨 림프종; 파라육아종; 악성 소림프구 림프종; 악성 미만성 대세포 림프종; 악성 여포성 림프종; 균상식육종; 다른 특정된 비호지킨 림프종; 악성 조직구증; 다발성 골수종; 비만세포육종; 면역증식성 소장 질환; 백혈병; 림프구성 백혈병; 형질세포 백혈병; 적백혈병; 림프육종 세포 백혈병; 골수성 백혈병; 호염기구성 백혈병; 호산구성 백혈병; 단구성 백혈병; 비만세포 백혈병; 거핵모구성 백혈병; 골수성 육종; 및 모발상 세포 백혈병.
특정 실시 형태에서, 대상에게 투여되는 약제학적 조성물 중의 항체 및/또는 CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가지며, 여기서 펩티드는 암 관련 항원의 에피토프(예를 들어, 치료되는 암에 의해 발현되는 에피토프)를 포함한다. 암 관련 항원의 예로는 아디포필린, AIM-2, ALDH1A1, 알파-악티닌-4, 알파-페토단백질("AFP"), ARTC1, B-RAF, BAGE-1, BCLX (L), BCR-ABL 융합 단백질 b3a2, 베타 카테닌, BING-4, CA-125, CALCA, 암배아 항원("CEA"), CASP-5, CASP-8, CD274, CD45, Cdc27, CDK12, CDK4, CDKN2A, CEA, CLPP, COA-1, CPSF, CSNK1A1, CTAG1, CTAG2, 사이클린 D1, 사이클린-A1, dek-can 융합 단백질, DKK1, EFTUD2, 연장 인자 2, ENAH(hMena), Ep-CAM, EpCAM, EphA3, 상피성 종양 항원("ETA"), ETV6-AML1 융합 단백질, EZH2, FGF5, FLT3-ITD, FN1, G250/MN/CAIX, GAGE-1,2,8, GAGE-3,4,5,6,7, GAS7, 글리피칸-3, GnTV, gp100/Pmel17, GPNMB, HAUS3, 헵신, HER-2/neu, HERV-K-MEL, HLA-A11, HLA-A2, HLA-DOB, hsp70-2, IDO1, IGF2B3, IL13R알파2, 장내 카르복실에스테라아제, K-ras, 칼리크레인 4, KIF20A, KK-LC-1, KKLC1, KM-HN-1, CCDC110로도 알려진 KMHN1, LAGE-1, LDLR-푸코실트랜스페라아제, AS 융합 단백질, 렝신, M-CSF, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-C1, MAGE-C2, 말산 효소, 맘마글로빈-A, MART2, MATN, MC1R, MCSP, mdm-2, ME1, 멜란-A/MART-1, 멜로, 미드카인, MMP-2, MMP-7, MUC1, MUC5AC, 무친, MUM-1, MUM-2, MUM-3, 미오신, 미오신 클래스 I, N-raw, NA88-A, neo-PAP, NFYC, NY-BR-1, NY-ESO-1/LAGE-2, OA1, OGT, OS-9, P 폴리펩티드, p53, PAP, PAX5, PBF, pml-RAR알파 융합 단백질, 다형성 상피 무친("PEM"), PPP1R3B, PRAME, PRDX5, PSA, PSMA, PTPRK, RAB38/NY-MEL-1, RAGE-1, RBAF600, RGS5, RhoC, RNF43, RU2AS, SAGE, 세세르닌 1, SIRT2, SNRPD1, SOX10, Sp17, SPA17, SSX-2, SSX-4, STEAP1, 서바이빈, SYT-SSX1 또는 -SSX2 융합 단백질, TAG-1, TAG-2, 텔로머라아제, TGF-베타RII, TPBG, TRAG-3, 트라이오스포스페이트 아이소머라아제, TRP-1/gp75, TRP-2, TRP2-INT2, 티로시나아제, 티로시나아제("TYR"), VEGF, WT1, XAGE-1b/GAGED2a를 포함하나 이에 한정되지 않는다. 일부 실시 형태에서, 상기 항원은 신생항원이다.
특정 실시 형태에서, 본원에 기재된 약제학적 조성물(예를 들어, 본원에 기재된 항체, 예컨대 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 완전히 인간 유래의 항체를 포함하는 약제학적 조성물)을 대상에게 투여하는 단계를 포함하는, 바이러스 감염증, 진균 감염증, 세균 감염증, 연충 감염증 또는 원충 감염증을 비롯한 감염증에 걸린 대상을 치료하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 HPV, HBV, C형 간염 바이러스(HCV), 인간 면역 결핍 바이러스(HIV-1 및 HIV-2)와 같은 레트로바이러스, 엡스타인 바 바이러스(EBV)와 같은 헤르페스 바이러스, 사이토메갈로바이러스(CMV), HSV-1 및 HSV-2, 인플루엔자 바이러스를 비롯한 바이러스 감염증의 치료를 포함한다. 일부 실시 형태에서, 상기 방법은 말라리아와 같은 기생충의 치료를 포함한다. 일부 실시 형태에서, 상기 방법은 아스페르길루스, 브루기아, 칸디다, 클라미디아, 콕시디아, 크립토코쿠스, 디로필라리아, 고노코쿠스, 히스토플라즈마, 리슈마니아, 마이코박테리움, 마이코플라즈마, 파라메시움, 퍼투시스, 플라스모듐, 뉴모코쿠스, 뉴모시스티스, 리케차, 살모넬라, 시겔라, 스타필로코쿠스, 스트렙토코쿠스, 톡소플라즈마 및 콜레라균과 같은 세균성, 진균성 및 다른 병원성 질환의 치료를 포함한다. 예시적인 종으로는 나이세리아 고노리아, 마이코박테리움 투베르쿨로시스, 칸디다 알비칸스, 칸디다 트로피칼리스, 트리코모나스 바지날리스, 헤모필루스 바지날리스, B군 스트렙토코쿠스 속, 마이코플라즈마 호미니스, 헤모필루스 듀크레이, 그라눌로마 인귀네일, 림포패씨아 베네레움, 트레포네마 팔리둠, 브루셀라 아보투스. 브루셀라 멜리텐시스, 브루셀라 수이스, 브루셀라 카니스, 캄필로박터 페투스, 캄필로박터 페투스 인테스티날리스, 렙토스피라 포모나, 리스테리아 모노사이토제네스, 브루셀라 오비스, 클라미디아 프시타시, 트리코모나스 피투스, 톡소플라즈마 곤디, 에스세리키아 콜리, 악티노바실루스 에쿠울리, 살모넬라 아보투스 오비스, 살모넬라 아보투스 에쿠이, 슈도모나스 에루지노사, 코리네박테리움 에쿠이, 코리네박테리움 파이오게네스, 악티노바실루스 세미니스, 마이코플라즈마 보비제니탈륨, 아스페르길루스 푸미가투스, 압시디아 라모사, 트리파노소마 에퀴페르둠, 바베시아 카발리, 클로스트리듐 테타니, 클로스트리듐 보툴리눔; 또는 예를 들어, 파라콕시디오이데스 브라질리엔시스와 같은 진균; 또는 예를 들어, 플라스모듐 팔시파룸과 같은 다른 병원균을 들 수 있다.
특정 실시 형태에서, 대상에게 투여되는 약제학적 조성물 중의 항체 및/또는 CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가지며, 여기서 펩티드는 감염성 병원균에 의해 발현되는 항원의 에피토프(예를 들어, 치료되는 감염성 병원균에 의해 발현되는 에피토프)를 포함한다.
일부 실시 형태에서, 본원에 기재된 약제학적 조성물(예를 들어, 본원에 기재된 항체, 예컨대 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 완전히 인간 유래의 항체를 포함하는 약제학적 조성물)을 대상에게 투여하는 단계를 포함하는, 염증성 질환, 피부 또는 장기 이식 거부, 이식편대숙주병(GVHD), 또는 자가면역질환을 치료하는 방법이 본원에 제공된다. 자가면역질환의 예로는 예를 들어, 사구체신염, 관절염, 확장형 심근병증 유사 질환, 궤양성 대장염, 쇼그렌 증후군, 크론병, 전신성 홍반성 루푸스, 만성 류마티스 관절염, 다발성 결화증, 건선, 알러지성 접촉 피부염, 다발성 근염, 피부비후증, 결절성 동맥주위염, 류마티스열, 심상성 백반증, 인슐린 의존성 당뇨병, 베체트병, 하시모토병, 애디슨병, 피부근염, 중증 근무력증, 라이터 증후군, 그레이브스병, 악성 빈혈, 굿파스처 증후군, 불임증, 만성 활동성 간염, 천포창, 자가면역성 혈소판 감소성 자반증 및 자가면역성 용혈성 빈혈, 활동성 만성 간염, 애디슨병, 항인지질 증후군, 아토피성 알러지, 자가면역성 위축성 위염, 자가면역성 무위산증, 셀리악병, 쿠싱 증후군, 피부근염, 원판상 홍반성 루푸스, 굿파스처 증후군, 하시모토 갑상선염, 특발성 부신 위축, 특발성 혈소판 감소증, 인슐린 의존성 당뇨병, 람베르트-이튼 증후군, 루포이드 간염, 림프구 감소증의 몇가지 증례, 혼합결합조직병, 유사천포창, 심상성 천포창, 악성 빈혈, 수정체성 포도막염, 결절성 다발동맥염, 자가면역성 다선증후군, 원발성 담즙성 간경변증, 원발성 경화성 담관염, 레이노 증후군, 재발성 다발성 연골염, 슈미트 증후군, 제한형 경피증 (또는 크레스트 증후군), 교감성 안염, 전신성 홍반성 루푸스, 다카야스 동맥염, 측두동맥염, 갑상선 중독증, b형 인슐린 저항성, 궤양성 대장염 및 베게너 육아종증을 들 수 있다.
특정 실시 형태에서, 대상에게 투여되는 약제학적 조성물 중의 항체 및/또는 CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가지며, 여기서 펩티드는 치료되는 질환의 자가반응성 T 세포의 표적인 단백질의 에피토프(예를 들어, 자가면역질환의 자가반응성 T 세포의 표적으로 되는 에피토프)를 포함한다. 자가반응성 T 세포에 의해 표적화된 예시적인 단백질에는 예를 들어, p205, 인슐린, 갑상선 자극 호르몬, 티로시나아제, TRP1 및 미엘린이 포함된다.
본원에 기재되는 약제학적 조성물은 경구로, 비강 내로 - 예를 들어 스프레이에 의해서와 같이 -, 직장 내로, 질내로, 비경구적으로, 수조내에, 및 구강 및 설하를 비롯하여 국소적으로 - 분말, 연고 또는 점적약에 의해서와 같이 - 를 포함하는 임의의 적절한 투여 경로에 의해 전달될 수 있다. 특정 실시 형태에서, 약제학적 조성물은 일반적으로 (예를 들어, 경구 또는 비경구 투여를 통해) 전달된다.
본원에 기재된 약제학적 조성물 중의 활성 성분의 실제 투여량 레벨은 환자에게 독성을 나타내지 않고 특정 환자, 조성물 및 투여 방법에 대하여 원하는 치료 반응을 달성하는데 효과적인 활성 성분의 양을 얻도록 달라질 수 있다.
선택된 투여량 레벨은 사용된 특정 약제의 활성, 투여 경로, 투여 시간, 사용되는 특정 화합물의 배설 또는 대사 속도, 치료 기간, 사용되는 특정 화합물과 병용되는 기타 약물, 화합물 및/또는 물질, 치료를 받고 있는 환자의 연령, 성별, 체중, 상태, 전반적인 건강 및 이전의 병력, 및 의학 분야에 잘 알려진 유사 인자를 비롯한 다양한 인자들에 좌우될 것이다.
당업계의 통상적인 기술을 가진 의사 또는 수의사는 필요한 약제학적 조성물의 유효량을 용이하게 결정하여 처방할 수 있다. 예를 들어, 의사 또는 수의사는 원하는 치료 효과를 달성하기 위해 요구되는 것보다 낮은 레벨로 약제학적 조성물에 사용되는 항체 및/또는 CAR의 용량을 처방 및/또는 투여할 수 있으며, 원하는 효과가 나타날 때까지 점차적으로 투여량을 증가시킬 수 있을 것이다.
일부 실시 형태에서, 본원에 기재된 CAR 수용체는 T 세포 기반 요법에 사용된다. 예를 들어, 특정 실시 형태에서, 본원에 기재된 CAR을 발현하는 T 세포를 대상에게 투여하여 대상에서의 T 세포에 의한 면역 반응을 유도시킨다. T 세포 기반 요법에 유용한 방법은 예를 들어, 각각, 본원에 참조로 포함되는 문헌[Schumacher Nat. Rev. Immunol . 2:512-519 (2002)] 및 문헌[Bitton et al., Frontiers in Bioscience 4:d386-393 (1999)]에 기재되어 있다.
일부 측면에서, 대상에서 면역 반응 (예를 들어, T 세포에 의한 면역 반응)을 유도하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 인간 Ig 중쇄 가변 도메인 및 인간 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, 인간 Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 인간 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 CAR을 발현하는 세포(예를 들어, 인간 T 세포, 예컨대 CD4 T 세포 또는 CD8 T 세포)를 대상에게 투여하는 단계 - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 - 를 포함한다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 I MHC 복합체이다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 II MHC 복합체이다.
일부 실시 형태에서, 상기 대상은 이를 필요로 하는 대상이다. 일부 실시 형태에서, 상기 대상은 암에 걸린 대상이다. 이러한 실시 형태에서, CAR에 의해 인식되는 펩티드/MHC 복합체 중의 펩티드는 암 항원의 펩티드이다.
특정 실시 형태에서, 본원에 기재된 CAR을 발현하는 T 세포를 대상에게 투여하는 단계를 포함하는, 암을 치료하는 방법이 본원에 제공된다. 일부 실시 형태에서, 본원에 기재된 방법은 임의의 암성 또는 전암성 종양을 치료하는데 사용될 수 있다. 본원에 기재된 방법 및 조성물에 의해 치료될 수 있는 암은 방광, 혈액, 뼈, 골수, 뇌, 유방, 결장, 식도, 위장, 잇몸, 두부, 신장, 간, 폐, 비인두, 경부, 난소, 전립선, 피부, 위, 고환, 혀 또는 자궁의 암세포을 포함하나 이에 한정되지 않는다. 또한, 암은 구체적으로 하기 조직형일 수 있으나, 이에 한정되지 않는다: 악성 신생물; 암종; 미분화 암; 거대세포암종 및 방추세포암종; 소세포암종; 유두암종; 편평상피암종; 림프상피암종; 기저세포암종; 모기질 암종; 이행세포암종; 유두상 이행세포암종; 선암; 악성 가스트린종; 담관암; 간세포암; 혼합형 간세포암-담관암; 육주형 선암; 선양낭포암; 선종성 폴립 내의 선암; 선암, 가족성 대장 폴립증; 고형암; 악성 카르시노이드 종양; 기관지폐포선암; 유두선암; 혐색소성 암종; 호산성 암종; 호산성 선암; 호염기성 암종; 투명세포선암; 과립세포암종; 여포선암; 유두-여포 선암; 비피막성 경화성 암종; 부신피질암; 자궁내막암; 피부 부속기 암종; 아포크린 선암; 피지 선암; 귀지선 선암; 점액표피양 암종; 낭포선암; 유두상 낭포선암; 유두상 장액성 낭포선암; 점액성 낭포선암; 점액성 선암; 반지세포암; 침윤성 도관암; 수질암; 소엽암; 염증성 암종; 유방 파제트병; 선방세포암; 선편평상피암; 편평상피화생을 동반한 선암; 악성 흉선종; 악성 난소 간질 종양; 악성 난포막세포종; 악성 과립막세포종; 악성 남성모세포종; 세르톨리 세포 암종; 악성 라이디히 세포종; 악성 지질 세포 종양; 악성 부신경절종; 악성 유방외 부신경절종; 크롬친화세포종; 사구맥관육종; 악성 흑색종; 멜라닌 결핍 흑색종; 표재 확장성 흑색종; 거대 색소성 모반에서의 악성 흑색종; 상피모양 세포 흑색종; 악성 청색모반; 육종; 섬유육종; 악성 섬유성 조직구종; 점액육종; 지방육종; 평활근육종; 횡문근육종; 배아형 횡문근육종; 폐포 횡문근육종; 간질 육종; 악성 혼합 종양; 뮬러리안 혼합 종양; 신장모세포종; 간모세포종; 암육종; 악성 간엽종; 악성 브렌너 종양; 악성 엽상 종양; 활막 육종; 악성 중피종; 미분화 배세포종; 배아 암종; 악성 기형종; 악성 난소 갑상선종; 융모막암; 악성 중신종; 혈관육종; 악성 혈관내피종; 카포시 육종; 악성 혈관주위세포종; 림프관 육종; 골육종; 방골성 골육종; 연골육종; 악성 연골모세포종; 간엽성 연골육종; 골 거대세포종; 유윙육종; 악성 치원성 종양; 사기질모세포 치아육종; 악성 사기질모세포종; 사기질모세포 섬유육종; 악성 송과체종; 척삭종; 악성 신경교종; 뇌실막세포종; 성상세포종; 원형질성 성상세포종; 원섬유성 성상세포종; 성상모세포종; 교모세포종; 희소돌기아교세포종; 희소돌기아교모세포종; 원시신경외배엽종양; 소뇌 육종; 신경절모세포종; 신경모세포종; 망막모세포종; 후신경원성 종양; 악성 수막종; 신경섬유육종; 악성 신경초종; 악성 과립세포종; 악성 림프종; 호지킨병; 호지킨 림프종; 파라육아종; 악성 소림프구 림프종; 악성 미만성 대세포 림프종; 악성 여포성 림프종; 균상식육종; 다른 특정된 비호지킨 림프종; 악성 조직구증; 다발성 골수종; 비만세포육종; 면역증식성 소장 질환; 백혈병; 림프구성 백혈병; 형질세포 백혈병; 적백혈병; 림프육종 세포 백혈병; 골수성 백혈병; 호염기구성 백혈병; 호산구성 백혈병; 단구성 백혈병; 비만세포 백혈병; 거핵모구성 백혈병; 골수성 육종; 및 모발상 세포 백혈병.
특정 실시 형태에서, 대상에게 투여되는 T 세포에 의해 발현되는 CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가지며, 여기서 펩티드는 암 관련 항원의 에피토프(예를 들어, 치료되는 암에 의해 발현되는 에피토프)를 포함한다. 암 관련 항원의 예로는 아디포필린, AIM-2, ALDH1A1, 알파-악티닌-4, 알파-페토단백질("AFP"), ARTC1, B-RAF, BAGE-1, BCLX (L), BCR-ABL 융합 단백질 b3a2, 베타 카테닌, BING-4, CA-125, CALCA, 암배아 항원("CEA"), CASP-5, CASP-8, CD274, CD45, Cdc27, CDK12, CDK4, CDKN2A, CEA, CLPP, COA-1, CPSF, CSNK1A1, CTAG1, CTAG2, 사이클린 D1, 사이클린-A1, dek-can 융합 단백질, DKK1, EFTUD2, 연장 인자 2, ENAH(hMena), Ep-CAM, EpCAM, EphA3, 상피성 종양 항원("ETA"), ETV6-AML1 융합 단백질, EZH2, FGF5, FLT3-ITD, FN1, G250/MN/CAIX, GAGE-1,2,8, GAGE-3,4,5,6,7, GAS7, 글리피칸-3, GnTV, gp100/Pmel17, GPNMB, HAUS3, 헵신, HER-2/neu, HERV-K-MEL, HLA-A11, HLA-A2, HLA-DOB, hsp70-2, IDO1, IGF2B3, IL13R알파2, 장내 카르복실에스테라아제, K-ras, 칼리크레인 4, KIF20A, KK-LC-1, KKLC1, KM-HN-1, CCDC110로도 알려진 KMHN1, LAGE-1, LDLR-푸코실트랜스페라아제, AS 융합 단백질, 렝신, M-CSF, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-C1, MAGE-C2, 말산 효소, 맘마글로빈-A, MART2, MATN, MC1R, MCSP, mdm-2, ME1, 멜란-A/MART-1, 멜로, 미드카인, MMP-2, MMP-7, MUC1, MUC5AC, 무친, MUM-1, MUM-2, MUM-3, 미오신, 미오신 클래스 I, N-raw, NA88-A, neo-PAP, NFYC, NY-BR-1, NY-ESO-1/LAGE-2, OA1, OGT, OS-9, P 폴리펩티드, p53, PAP, PAX5, PBF, pml-RAR알파 융합 단백질, 다형성 상피 무친("PEM"), PPP1R3B, PRAME, PRDX5, PSA, PSMA, PTPRK, RAB38/NY-MEL-1, RAGE-1, RBAF600, RGS5, RhoC, RNF43, RU2AS, SAGE, 세세르닌 1, SIRT2, SNRPD1, SOX10, Sp17, SPA17, SSX-2, SSX-4, STEAP1, 서바이빈, SYT-SSX1 또는 -SSX2 융합 단백질, TAG-1, TAG-2, 텔로머라아제, TGF-베타RII, TPBG, TRAG-3, 트라이오스포스페이트 아이소머라아제, TRP-1/gp75, TRP-2, TRP2-INT2, 티로시나아제, 티로시나아제("TYR"), VEGF, WT1, XAGE-1b/GAGED2a를 포함하나 이에 한정되지 않는다. 일부 실시 형태에서, 상기 항원은 신생항원이다.
일부 실시 형태에서, 상기 대상은 병원균에 감염된 대상이다. 이러한 실시 형태에서, CAR에 의해 인식되는 펩티드/MHC 복합체 중의 펩티드는 병원성 항원의 펩티드이다.
따라서, 특정 실시 형태에서, 본원에 기재된 CAR을 발현하는 T 세포를 대상에게 투여하는 단계를 포함하는, 바이러스 감염증, 세균 감염증, 연충 감염증 또는 원충 감염증을 비롯한 감염증에 걸린 대상을 치료하는 방법이 본원에 제공된다. 예를 들어, 일부 실시 형태에서, HPV, HBV, C형 간염 바이러스(HCV), 인간 면역 결핍 바이러스(HIV-1 및 HIV-2)와 같은 레트로바이러스, 엡스타인 바 바이러스(EBV)와 같은 헤르페스 바이러스, 사이토메갈로바이러스(CMV), HSV-1 및 HSV-2, 인플루엔자 바이러스를 비롯한 바이러스 감염증을 치료하는 방법이 본원에 제공된다. 일부 실시 형태에서, 치료된 병원균은 말라리아와 같은 기생충이다. 일부 실시 형태에서, 아스페르길루스, 브루기아, 칸디다, 클라미디아, 콕시디아, 크립토코쿠스, 디로필라리아, 고노코쿠스, 히스토플라즈마, 리슈마니아, 마이코박테리움, 마이코플라즈마, 파라메시움, 퍼투시스, 플라스모듐, 뉴모코쿠스, 뉴모시스티스, 리케차, 살모넬라, 시겔라, 스타필로코쿠스, 스트렙토코쿠스, 톡소플라즈마 및 콜레라균과 같은 세균성, 진균성 및 다른 병원성 질환의 치료법이 본원에 제공된다. 예시적인 종으로는 나이세리아 고노리아, 마이코박테리움 투베르쿨로시스, 칸디다 알비칸스, 칸디다 트로피칼리스, 트리코모나스 바지날리스, 헤모필루스 바지날리스, B군 스트렙토코쿠스 속, 마이코플라즈마 호미니스, 헤모필루스 듀크레이, 그라눌로마 인귀네일, 림포패씨아 베네레움, 트레포네마 팔리둠, 브루셀라 아보투스. 브루셀라 멜리텐시스, 브루셀라 수이스, 브루셀라 카니스, 캄필로박터 페투스, 캄필로박터 페투스 인테스티날리스, 렙토스피라 포모나, 리스테리아 모노사이토제네스, 브루셀라 오비스, 클라미디아 프시타시, 트리코모나스 피투스, 톡소플라즈마 곤디, 에스세리키아 콜리, 악티노바실루스 에쿠울리, 살모넬라 아보투스 오비스, 살모넬라 아보투스 에쿠이, 슈도모나스 에루지노사, 코리네박테리움 에쿠이, 코리네박테리움 파이오게네스, 악티노바실루스 세미니스, 마이코플라즈마 보비제니탈륨, 아스페르길루스 푸미가투스, 압시디아 라모사, 트리파노소마 에퀴페르둠, 바베시아 카발리, 클로스트리듐 테타니, 클로스트리듐 보툴리눔; 또는 예를 들어, 파라콕시디오이데스 브라질리엔시스와 같은 진균; 또는 예를 들어, 플라스모듐 팔시파룸과 같은 다른 병원균을 들 수 있다.
특정 실시 형태에서, 대상에게 투여되는 T 세포에 의해 발현되는 CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가지며, 여기서 펩티드는 감염성 병원균에 의해 발현되는 항원의 에피토프(예를 들어, 치료되는 감염성 병원균에 의해 발현되는 에피토프)를 포함한다.
특정 측면에서, 대상(예를 들어, 인간 대상)에서 펩티드/MHC 복합체에 대한 면역 반응을 유도하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 대상으로부터 T 세포(예를 들어, CD4 T 세포 또는 CD8 T 세포)를 단리하는 단계를 포함한다. 일부 실시 형태에서, 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 CAR의 T 세포에 의한 발현을 유도하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 T 세포를 대상에게 투여하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 제1 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 제1 벡터와, 제2 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 제2 벡터로 T 세포를 트랜스펙션시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 제1 CAR 폴리펩티드를 인코딩하는 핵산 서열 및 제2 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 벡터로 T 세포를 트랜스펙션시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 내인성 TCRα 및/또는 TCRβ의 T 세포에 의한 발현을 억제하는 단계를 포함한다.
일부 실시 형태에서, 상기 대상은 자가면역질환에 걸린 대상이다. 이러한 실시 형태에서, T 세포는 조절 T 세포(즉, 억제 T 세포)이며, CAR에 의해 인식되는 펩티드/MHC 복합체 중의 펩티드는 대상에게 자가면역반응을 유발시키는 자가항원이다.
일부 측면에서, 대상에서 면역 반응을 억제하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 인간 Ig 중쇄 가변 도메인 및 인간 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, 인간 Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 인간 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 CAR을 발현하는 조절 T 세포(예를 들어, CD4+, CD-25+ 및 Foxp3+ 조절 T 세포 또는 Treg17 T 세포)를 대상에게 투여하는 단계 - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 - 를 포함한다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 I MHC 복합체이다. 일부 실시 형태에서, 상기 펩티드/MHC 복합체는 펩티드/클래스 II MHC 복합체이다.
특정 측면에서, 대상(예를 들어, 인간 대상)에서 펩티드/MHC 복합체에 대한 면역 반응을 억제하는 방법이 본원에 제공된다. 일부 실시 형태에서, 상기 방법은 대상으로부터 조절 T 세포(예를 들어, CD4+, CD-25+ 및 Foxp3+ 조절 T 세포 또는 Treg17 T 세포)를 단리하는 단계를 포함한다. 일부 실시 형태에서, 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 CAR의 T 세포에 의한 발현을 유도하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 T 세포를 대상에게 투여하는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 제1 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 제1 벡터와, 제2 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 제2 벡터로 T 세포를 트랜스펙션시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 제1 CAR 폴리펩티드를 인코딩하는 핵산 서열 및 제2 CAR 폴리펩티드를 인코딩하는 핵산 서열을 포함하는 벡터로 T 세포를 트랜스펙션시키는 단계를 포함한다. 일부 실시 형태에서, 상기 방법은 내인성 TCRα 및/또는 TCRβ의 T 세포에 의한 발현을 억제하는 단계를 포함한다.
일부 실시 형태에서, 상기 대상은 자가면역질환에 걸린 대상이다. 이러한 실시 형태에서, T 세포는 조절 T 세포(즉, 억제 T 세포)이며, CAR에 의해 인식되는 펩티드/MHC 복합체 중의 펩티드는 대상에게 자가면역반응을 유발시키는 자가항원이다.
따라서, 일부 실시 형태에서, 본원에 기재된 방법은 천식, 염증성 질환, 피부 또는 장기 이식, 이식편대숙주병(GVHD) 또는 자가면역질환과 같은 유해한 면역 반응과 관련된 질환 또는 장애를 치료하는데 사용될 수 있다. 자가면역질환의 예로는 예를 들어, 사구체신염, 관절염, 확장형 심근병증 유사 질환, 궤양성 대장염, 쇼그렌 증후군, 크론병, 전신성 홍반성 루푸스, 만성 류마티스 관절염, 다발성 결화증, 건선, 알러지성 접촉 피부염, 다발성 근염, 피부비후증, 결절성 동맥주위염, 류마티스열, 심상성 백반증, 인슐린 의존성 당뇨병, 베체트병, 하시모토병, 애디슨병, 피부근염, 중증 근무력증, 라이터 증후군, 그레이브스병, 악성 빈혈, 굿파스처 증후군, 불임증, 만성 활동성 간염, 천포창, 자가면역성 혈소판 감소성 자반증 및 자가면역성 용혈성 빈혈, 활동성 만성 간염, 애디슨병, 항인지질 증후군, 아토피성 알러지, 자가면역성 위축성 위염, 자가면역성 무위산증, 셀리악병, 쿠싱 증후군, 피부근염, 원판상 홍반성 루푸스, 굿파스처 증후군, 하시모토 갑상선염, 특발성 부신 위축, 특발성 혈소판 감소증, 인슐린 의존성 당뇨병, 람베르트-이튼 증후군, 루포이드 간염, 림프구 감소증의 몇가지 증례, 혼합결합조직병, 유사천포창, 심상성 천포창, 악성 빈혈, 수정체성 포도막염, 결절성 다발동맥염, 자가면역성 다선증후군, 원발성 담즙성 간경변증, 원발성 경화성 담관염, 레이노 증후군, 재발성 다발성 연골염, 슈미트 증후군, 제한형 경피증 (또는 크레스트 증후군), 교감성 안염, 전신성 홍반성 루푸스, 다카야스 동맥염, 측두동맥염, 갑상선 중독증, b형 인슐린 저항성, 궤양성 대장염 및 베게너 육아종증을 들 수 있다.
특정 실시 형태에서, 대상에게 투여되는 T 세포에 의해 발현되는 CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가지며, 여기서 펩티드는 치료되는 질환의 자가반응성 T 세포의 표적인 단백질의 에피토프(예를 들어, 자가면역질환의 자가반응성 T 세포의 표적으로 되는 에피토프)를 포함한다. 자가반응성 T 세포에 의해 표적화된 예시적인 단백질에는 예를 들어, p205, 인슐린, 갑상선 자극 호르몬, 티로시나아제, TRP1 및 미엘린이 포함된다.
핵산 분자
본원에 기재된 항체, CAR, 및 항체와 CAR의 일부를 인코딩하는 핵산 분자가 본원에 제공된다. 일부 실시 형태에서, 핵산은 본원에 기재된 항체 또는 CAR의 가변 도메인(예를 들어, 중쇄 및/또는 경쇄 가변 도메인)을 인코딩한다. 핵산은 예를 들어, 전세포, 세포 용해물에 존재하거나, 부분적으로 정제되거나 실질적으로 순수한 형태로 존재할 수 있다.
특정 측면에서, 본원에 기재된 항체 및/또는 CAR 폴리펩티드 또는 그 일부를 인코딩하는 핵산이 본원에 제공된다. 핵산은 예를 들어, 전세포, 세포 용해물에 존재하거나, 부분적으로 정제되거나 실질적으로 순수한 형태로 존재할 수 있다. 본원에 기재된 핵산은 표준 분자 생물학 기술을 이용하여 얻어질 수 있다. 예를 들어, 본원에 기재된 핵산 분자는 표준 PCR 기술을 이용하여 클로닝될 수 있거나 화학적으로 합성될 수 있다. 하이브리도마에 의해 발현되는 CAR 또는 항체를 인코딩하는 핵산의 경우, 하이브리도마에 의해 제조된 항체 또는 CAR의 각각의 쇄를 인코딩하는 cDNA는 표준 PCR 증폭 또는 cDNA 클로닝 기술에 의해 얻어질 수 있다.
특정 측면에서, Ig 중쇄 가변 도메인 및 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드를 인코딩하는 제1 핵산 서열과, Ig 경쇄 가변 도메인(예를 들어, Ig κ 가변 도메인 또는 Ig λ 가변 도메인) 및 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 인코딩하는 제2 핵산 서열을 포함하며, 여기서 제1 CAR 폴리펩티드 및 제2 CAR 폴리펩티드를 포함하는 CAR이 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 핵산 조성물이 본원에 제공된다. 특정 실시 형태에서, Ig 중쇄 가변 도메인 및/또는 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 설치류 불변 도메인(예를 들어, 래트 불변 도메인 또는 마우스 불변 도메인)이다. 일부 실시 형태에서, TCRβ 불변 도메인 및/또는 TCRα 불변 도메인은 인간 불변 도메인이다. 일부 실시 형태에서, 제1 핵산 서열과 제2 핵산 서열은 단일 핵산 분자 상에 있다. 일부 실시 형태에서, 제1 핵산 서열과 제2 핵산 서열은 분리된 핵산 분자 상에 있다.
특정 측면에서, 본원에 기재된 항체의 중쇄를 인코딩하는 제1 핵산 서열과, 본원에 기재된 항체의 경쇄(예를 들어, Ig κ 경쇄 또는 Ig λ 경쇄)를 인코딩하는 제2 핵산 서열을 포함하며, 여기서 중쇄 및 경쇄를 포함하는 항체가 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 핵산 조성물이 본원에 제공된다. 특정 실시 형태에서, Ig 중쇄 가변 도메인 및/또는 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인이다. 일부 실시 형태에서, Ig 중쇄 불변 도메인 및/또는 Ig 경쇄 불변 도메인은 설치류 불변 도메인(예를 들어, 래트 불변 도메인 또는 마우스 불변 도메인)이다. 일부 실시 형태에서, Ig 중쇄 불변 도메인 및/또는 Ig 경쇄 불변 도메인은 인간 불변 도메인이다. 일부 실시 형태에서, 제1 핵산 서열과 제2 핵산 서열은 단일 핵산 분자 상에 있다. 일부 실시 형태에서, 제1 핵산 서열과 제2 핵산 서열은 분리된 핵산 분자 상에 있다.
특정 실시 형태에서, 본원에 기재된 핵산 분자를 포함하는 벡터가 본원에 제공된다. 본원에 사용되는 용어 "벡터"는 그것이 연결된 다른 핵산을 수송할 수 있는 핵산 분자를 말한다. 벡터의 한 유형은 추가 DNA 세그먼트가 연결될 수 있는 원형 이중 가닥 DNA 루프를 나타내는 "플라스미드"이다. 또 다른 유형의 벡터는 바이러스 벡터이며, 추가의 DNA 세그먼트는 바이러스 게놈에 연결될 수 있다. 특정 벡터는 그들이 도입되는 숙주 세포에서 자가 복제할 수 있다(예를 들어, 박테리아 복제 기점을 가진 박테리아 벡터 및 에피솜 포유류 벡터). 다른 벡터(예를 들어, 비에피솜 포유류 벡터)는 숙주 세포 내로 도입 시에 숙주 세포의 게놈 내로 통합되어, 숙주 게놈과 함께 복제될 수 있다. 또한, 특정 벡터는 유전자의 발현을 유도할 수 있다. 이러한 벡터는 본원에서 "재조합 발현 벡터"(또는 단순히 "발현 벡터")로 지칭된다.
특정 실시 형태에서, 본원에 기재된 핵산(예를 들어, 본원에 기재된 항체 또는 CAR 또는 그 일부를 인코딩하는 핵산)을 함유하는 세포가 본원에 제공된다. 세포는 예를 들어, 원핵생물, 진핵생물, 포유류, 조류, 뮤린 및/또는 인간일 수 있다. 특정 실시 형태에서, 본원에 기재된 핵산은 프로모터와 같은 전사 조절 인자에 작동가능하게 연결된다. 일부 실시 형태에서, 세포는 본원에 기재된 핵산을 전사하여, 그에 따라 항체, 이의 항원 결합 단편 또는 폴리펩티드를 발현한다. 핵산 분자는 세포의 게놈에 통합되거나 염색체외일 수 있다.
본원에 제공된 핵산 분자는 표준 분자 생물학 기술을 사용하여 얻을 수 있다. 예를 들어, 본원에 기재된 핵산 분자는 표준 PCR 기술을 이용하여 클로닝될 수 있거나 화학적으로 합성될 수 있다.
일단 VH 및 VL 세그먼트를 인코딩하는 DNA 단편이 얻어지면, 이들 DNA 단편은 표준 재조합 DNA 기술에 의해, 예를 들어 가변 영역 유전자를 전장 항체 쇄 유전자, Fab 단편 유전자 또는 scFv 유전자로 변환시키도록 추가로 조작될 수 있다. 이러한 조작에서, VL- 또는 VH 인코딩 DNA 단편은 항체 불변 영역 또는 가요성 링커와 같은 다른 단백질을 인코딩하는 다른 DNA 단편에 작동가능하게 연결된다. 이와 관련하여 사용된 용어 "작동가능하게 연결된"은 2개의 DNA 단편이 결합되어, 2개의 DNA 단편에 의해 인코딩된 아미노산 서열이 인프레임에 유지되는 것을 의미하고자 한다.
중쇄 가변 영역을 인코딩하는 단리된 DNA는 중쇄 가변 영역 DNA를 중쇄 불변 영역(예를 들어, CH1, CH2 및 CH3)을 인코딩하는 다른 DNA 분자에 작동가능하게 연결시킴으로써 전장 중쇄 유전자로 변환될 수 있다. 인간 중쇄 불변 영역 유전자의 서열은 당업계에 공지되어 있으며(예를 들어, 문헌[Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]), 이들 영역을 포함하는 DNA 단편은 표준 PCR 증폭에 의해 얻어질 수 있다. 중쇄 불변 영역은 IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM 또는 IgD 불변 영역일 수 있지만, 가장 바람직하게는 IgG1 또는 IgG4 불변 영역이다. Fab 단편 중쇄 유전자의 경우, VH 인코딩 DNA는 중쇄 CH1 불변 영역 만을 인코딩하는 다른 DNA 분자에 작동가능하게 연결될 수 있다.
경쇄 가변 영역을 인코딩하는 단리된 DNA는 경쇄 가변 영역 인코딩 DNA를 경쇄 불변 영역을 인코딩하는 다른 DNA 분자에 작동가능하게 연결시킴으로써 전장 경쇄 유전자 (및 Fab 경쇄 유전자)로 변환될 수 있다. 인간 경쇄 불변 영역 유전자의 서열은 당업계에 공지되어 있으며(예를 들어, 문헌[Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]), 이들 영역을 포함하는 DNA 단편은 표준 PCR 증폭에 의해 얻어질 수 있다. 경쇄 불변 영역은 κ(kappa) 또는 λ(lambda) 불변 영역일 수 있지만, 가장 바람직하게는 κ 불변 영역이다.
실시예
실시예
1.
키메라
항원 수용체를 지닌 T 세포의 활성화
펩티드-MHC 복합체를 인식하는 항체의 VH 및 VL 도메인을 인코딩하는 서열(NY-ESO-1 및 MAGE-1 펩티드, 각각 본원에 참조로 포함되는 문헌[Stewart-Jones et al. (2009) Rational development of high-affinity T-cell receptor-like antibodies, Proc . Nat'l . Acad . Sci . USA 106:5784-88] 및 문헌[ (2005) A Major Histocompatibility Complex Peptide-restricted Antibody and T Cell Receptor Molecules Recognize Their Target by Distinct Binding Modes, J. Biol. Chem . 280:2972-80] 참조)을 합성적으로 생성된 1.9 kb 뉴클레오티드 서열에 혼입하였고, 여기서 면역글로불린 Vκ 및 VH 도메인 서열은 각각, TCRA C 및 TCRB C 서열의 상류에 위치하였다(도 3). 스튜어트- 존스(Stewart-Jones) 등은 HLA-A2와 복합체를 형성하는 NY-ESO-1 펩티드(SLLMWITQVNY, 서열 번호 1)를 인식하는 항체를 기술하며; 휠스마이어() 등은 HLA-A1과 복합체를 형성하는 MAGE-1 펩티드(EADPTGHSY, 서열 번호 2)를 인식하는 항체를 기술하고 있다.
항 NY-ESO-1/A2 및 항 MAGE-1/A1 VH 및 VL을 포함하는 합성된 서열은 또한 퓨린(furin) 절단 부위 및 및 2시스트론성(bicistronic) 발현을 위한 자가 절단 F2A 펩티드(문헌[Yang et al. (2008) Development of optimal bicistronic lentiviral vectors facilitates high-level TCR gene expression and tumor cell recognition, Gene Ther. 15:1411-1423], 본원에 참조로 포함됨)와 함께, Vκ 및 VH의 상류에 ROR 리더 부위(leader site; 미국 특허 제7,534,604호, 본원에 참조로 포함됨)를 포함하였다. 합성된 DNA를 블루 헤론(Blue Heron)으로부터 얻었다. 음성 대조군으로서, 생식세포계열 Vκ1-39Jκ5 [ULC1-39] 또는 Vκ3-20Jκ1 [ULC3-20] 및 VH3-23JH4 [UHC]를 각각, TCRA C 및 TCRA B의 상류의 렌티바이러스 벡터에 혼입시켰다(ULC1-39 및 ULC3-20에 관해서는 미국 특허 출원 공개 제US 2011/0195454호, UHC에 관해서는 미국 특허 출원 공개 제US 2014/0245468호를 참조함, 이들 모두 본원에 참조로 포함됨).
각각의 합성된 1.9 kb DNA 서열(즉, MAGE-1 CAR, NY-ESO-1 CAR, ULC1-39UHC 및 ULC3-20UHC CAR을 인코딩하는 서열)을 pLVX EF1a IRES-PURO 렌티바이러스 벡터 (Clontech)의 다중 클로닝 부위로 라이게이션하였다. 구축물을 293T 세포의 일시적 트랜스펙션을 통해 델타 8.9와 PMDG로 패키징하고, 바이러스 상청액을 생성한 후에, 저캇(Jurkat) T 세포로부터 유래되나 TCRαβ 이종이량체를 생성하거나 이의 원형질막 상에 CD3를 발현하는 능력이 부족한 J.RT3-T3.5 (T3) 세포를 형질 도입하는데 사용하였다. 저캇 (CD4+CD8- T) 세포를 대조군으로서 사용하였다. 형질 도입 후, 세포 표면의 CD3 발현 능력에 대한 FACS 분류를 통해 T3 세포를 스크리닝하였더니, 모든 CAR 형질 도입 T3 세포가 CD3 발현을 나타내므로, CAR 분자가 세포 표면에 발현되었음을 보여준다.
NY-ESO-1의 VL 및 VH를 포함하는 CAR, 또는 MAGE-1의 VL 및 VH를 포함하는 CAR로 형질 도입된 T3 세포의 T 세포 활성화를 인간 IL-2의 분비를 검출하는 ELISPOT 분석(문헌[Czerkinsky et al. (1983) A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells, J. Immunol . Methods 65:109-121] 및 문헌[Miyahira et al. (1995) Quantification of antigen specific CD8+ T cells using an ELISPOT assay. J. Immunol. Methods, 181: 45-54], 본원에 참조로 포함됨)에 의해 측정하였다. 인간 IL-2 ELISPOT 키트를 BD 바이오사이언시즈 (BD Biosciences; Catalog # 551282)로부터 얻었다.
특히, 단독 또는 발현 MAGE-1 CAR (A1MAGECAR), NY-ESO-1 CAR (A1NYESOCAR) 또는 ULC1-39UHC CAR을 발현하는 T3 세포를 ELISPOT 플레이트의 웰에 5×105 세포/웰의 농도로 첨가하였다. 단독 또는 인간 HLA-A1 (K562_A1) 또는 인간 HLA-A2 (K562_A2)를 발현하는 표적 K562 세포 (MHC 비함유 세포주)를 1×105 세포/웰 (이펙터 대 표적 세포의 비 5:1)의 농도로 첨가하였다. 적절한 펩티드 (MAGE-1, 제한 HLA-A1 또는 NY-ESO-1, 제한 HLA-A2)를 제조사의 설명서에 따라, 10 ㎍/mL의 농도로 웰에 첨가하고, 플레이트를 37℃에서 16 내지 20시간 동안 인큐베이션하여 발현시켰다.
T 세포의 활성화를 사이토카인 국소화 부위에서 형성되는 짙은 남색 침전물에 의해 검출된 사이토카인 분비 세포의 수에 기초하여 평가하였다. 도 4에 도시된 바와 같이, 활성화는 HLA-A1 (K562_A1)을 발현하는 이펙터 세포의 존재 하에 MAGE-1 HLA-A1 제한 펩티드 (MAGE-A1)로 처리된 A1MAGECAR을 발현하는 세포에서만 일어나며, HLA-A2 (K562_A2) 또는 야생형 K562 세포 (K562WT)를 발현하는 이펙터 세포에서는 일어나지 않았다. 또한, A1MAGECAR을 발현하는 T3 세포는 비관련 펩티드의 존재 하에 HLA-A1을 발현하는 K562 세포에 의해 활성화되지 않았다. 유사하게는, IL-2 분비에 의해 명백한 바와 같이, HLA-A2 (K562_A2)를 발현하는 이펙터 세포의 존재 하에 NY-ESO-1 제한 펩티드 (ESO-1)로 처리한 A2NYESOCAR을 발현하는 T3 세포 만이 활성화되었다. ULC1-39UHC CAR (음성 대조군)을 발현하는 T3 세포는 어떤 펩티드-MHC 복합체에 의해서도 활성되지 않았다.
실시예
2.
키메라
항원 수용체를 발현하는 유전자 변형 마우스의 생산
실시예
2.1.
키메라
인간
Igκ
가변 ― 마우스
TCRA
불변
유전자좌의
구축
모든 인간 Jκ 세그먼트와 4개의 기능적 인간 Vκ 세그먼트를 포함하는 벨로크이뮨(VELOCIMMUNE)® Igκ 큰 표적화 벡터 (LTVEC) ("VI-1", 문헌[Macdonald et al. (2014) Precise and in situ genetic humanization of 6 mB of mouse immunoglobulin genes, Proc . Natl Acad . Sci USA 111:5147-52] 및 추가 정보 참조)를 세균 동종 재조합(BHR)에 의해 변형시켜, 5' 마우스 κ 암 및 neo-tk-loxp 카세트를 특이적 I-CeuI 및 AsiSI 부위가 플랭킹된 클로람페니콜(CM) 내성 카세트로 치환하였다 (도 5, 단계 1). 단계 2에서, 단계 1에서 생성된 구축물을 BHR에 의해 추가로 변형시켜, 3' 마우스 κ 암 및 Spec 카세트를 특이적 NotI 및 PI-SceI 부위가 플랭킹된 loxp-neo-loxp 카세트로 치환하였다. 이어서(단계 3), 16 kb 원위 마우스 Tcra 암 및 Frt-Hyg-Frt 카세트를 포함하는 I-CeuI-AsiSI 핵산 단편을 단계 2의 구축물에 라이게이션하여, CM 카세트를 치환하였다. 최종적으로 (단계 4), 24 kb 근위 마우스 Tcra 암 및 Spec 카세트를 포함하는 NotI-PI-SceI 핵산 단편을 단계 3의 구축물의 NotI 및 PI-SceI 부위에 라이게이션하여, loxp-loxp 카세트를 치환하여, MAID 6548로 지정된 최종 LTVEC를 생성하였다.
최종 LTVEC는 5'에서 3'의 방향으로 다음을 포함하였다: (1) ES 세포에서 상동 재조합을 위한 16kb 5' 마우스 Tcra 암 (게놈 위치 14:52411629-52427793, 마우스 어셈블리 GRCm38에 기초한 모든 좌표), (2) 대장균(E. coli) 또는 ES 세포에서 선택하기 위한 Frt-Hyg-Frt 카세트, (3) 가장 근접한 4개의 Vκ 세그먼트 및 모든 5개의 Jκ 단편(J1-J5), (4) TCRA 불변 유전자를 포함하는 ES 세포에서의 상동 재조합을 위한 24kb 3' 마우스 TCRA 암 (게놈 위치 14:54218920-54243117) 및 (5) 대장균에서의 선택을 위한 Spec 카세트.
LTVEC (MAID6548)는 하기의 결합 서열 (junction sequence)을 가지며, 여기서 마우스 서열은 괄호 안에 표기되고, 인간 서열은 일반 글꼴로 표기되며, 다중 클로닝 부위는 볼드체로 표기되고, Frt 서열은 이탤릭체로 표기되어 있다 (표 1).
[표 1]
MAID6548을 사용하여 MAID1540 het ES 세포 내로 일렉트로포레이션(electroporation)하였으며(본원에 참조로 포함되는 미국 특허 제9,113,616호의 도 4a 참조), 여기서 모든 마우스 TCRAV 및 J 세그먼트는 결실되고 Neo 카세트로 치환되었다(도 6). 얻어진 유전자좌의 결합 서열은 상기 표 1에 기재된 것과 동일하다. Hyg 내성 ES 세포를 태크만® 분석을 사용하여 스크리닝하여, 정확하게 표적화된 클론을 동정하였다(예를 들어, 본원에 참조로 포함되는 문헌[Lie and Petropoulos, 1998. Curr. Opin. Biotechnology 9:43-48] 참조) (표 2; LOA = 대립유전자 결실; GOA = 대립유전자 획득, 인식된 영역은 도 6에 나타냄).
[표 2]
필요에 따라, 추가의 인간 Vκ 세그먼트는 초기 삽입과 오버랩되는 인간 Igκ 서열에 연결되는 상술한 동일한 16 kb 5' 마우스 Tcra 상동성 암을 갖는 LTVEC를 사용하여, TCR 가변 영역 유전자좌에 부가될 수 있다.
이러한 ES 세포를 생성시키는데 다양한 전략이 이용될 수 있다. 도 7에 요약된 하나의 접근법은 2개의 상이한 큰 표적화 벡터의 ES 세포로의 이중 표적화 또는 코일렉트로포레이션(co-electroporation)을 포함한다. 이러한 접근법에서, 제1 큰 표적화 벡터(본원에 참고로 포함되는 미국 특허 출원 공개 제2012/0096512A1호에 기재된 바와 같이 구축된 벡터의 제한효소에서의 소화에서 유래되는 MAID 1710으로 표지됨)는 인간 Vκ1-5 및 Vκ1-6 유전자 세그먼트의 서열을 포함하는 3' 30 kb 상동성 암, 인간 Vκ3-7 내지 Vκ3-15 유전자 세그먼트를 포함하는 120 kb 서열, 및 인간 Vκ1-16 유전자 세그먼트를 포함하는 5' 20 kb 영역("오버랩 영역")을 포함한다. 제2 큰 표적화 벡터(MAID 6600로 표지됨, 또한 미국 특허 출원 공개 제2012/0096512A1호에 기재된 바와 같이 구축된 벡터로부터 유래됨)는 3' 20 kb 오버랩 영역(제1 벡터에서와 동일한 인간 Vκ1-16 유전자 세그먼트를 포함하는 영역), 인간 Vκ1-17 내지 Vκ2-30 유전자 세그먼트를 포함하는 140 kb 서열, FRT-Ub-Neo-FRT 선택 카세트 및 15.5 kb 3' 마우스 TCR A 상동성 암을 포함한다. 도 6에서 생성된 ES 세포(MAID 6548, 모든 인간 Jκ 세그먼트 및 4개의 기능적 인간 Vκ 유전자 세그먼트에 대하여 이형 접합체)를 뉴클레오티드 서열 TGCGATCGCTGCGGCCGAtcttagCCAGACGAGCGGGTTCGG(소문자의 절단 부위를 가짐; 서열 번호 24)에서 하이그로마이신 유전자를 표적으로 하며, Hyg 서열에서 이중 가닥 절단을 촉진하는 변형된 징크 핑거 뉴클레아제(ZFN)를 인코딩하는 핵산과 함께 상술한 2개의 큰 표적화 벡터로 일렉트로포레이션하였다. 2개의 코일렉트로포레이션된 큰 표적화 벡터는 상동 재조합에 의해 DNA 서열에 삽입되어, Hyg 선택 카세트를 포함하고 이를 둘러싸는 영역을 치환하였다. 생성된 ES 세포는 인간 Jκ1 내지 Jκ5 및 Vκ4-1 내지 Vκ2-30 유전자 세그먼트를 포함하는 인간 면역글로불린 가변 영역을 내인성 TCRα 유전자좌에 포함하였다. 2개의 큰 표적화 벡터의 성공적인 혼입은 도 7에 나타내고 하기 표 3에 열거된 프로브 및 프라이머를 사용하여, 상술한 태크만® 분석법 (Lie and Petropoulos, 상기 참조)을 사용하여 확인되었다(GOA=대립유전자 획득; LOA=대립유전자 결실; 카피수(copy number) = 트랜스제닉 통합 대 표적화 통합을 추적하는 서열 카피수의 검사; hArm1 = 제1 큰 표적화 벡터(MAID 1710)의 30kb 3' 상동성 암; hArm2 = 제1 큰 표적화 벡터(MAID 1710) 및 제2 큰 표적화 벡터(MAID 6600)의 20kb 오버랩, mArm = 제2 표적화 벡터(MAID 6600)의 15.5kb 5' 상동성 암, WT(야생형) 마우스 대조군 - 마우스 TCRα 유전자좌에 존재하는 서열).
[표 3]
ES 세포의 얻어진 표적화 유전자좌는 하기의 결합 서열을 가지며, 여기서 마우스 서열은 괄호 안에 표기되고, 인간 서열은 일반 글꼴로 표기되며, 다중 클로닝 부위는 볼드체로 표기되고, Frt 서열은 이탤릭체로 표기되어 있다 (표 4).
[표 4]
추가의 면역글로불린 가변 영역 유전자 세그먼트를 포함하는 TCRα 유전자좌를 생성하기 위한 대체 전략은 추가의 가변 유전자 세그먼트를 포함하는 큰 표적화 벡터를 이용한 연속 표적화를 포함한다(예를 들어, 도 8 참조). 모든 인간 Jκ 유전자 세그먼트 및 4개의 기능적 인간 Vκ 유전자 세그먼트에 이형 접합체인 ES 세포(MAID 6548; 도 6 참조)는 5'에서 3'의 방향으로, 15.5 kb 5' 마우스 상동성 암, Frt-Ub-Neo-Frt 선택 카세트, Vκ3-7 내지 Vκ3-15 유전자 세그먼트를 포함하는 120 kb 단편, 및 Vκ1-5 및 Vκ1-6 유전자 세그먼트를 포함하는 30 kb 3' 인간 상동성 암(MAID 6548 서열에도 존재함)을 포함하는 큰 표적화 벡터로 일렉트로포레이션된다. 성공적인 혼입은 상기 표 3에 열거되고 도 8에 나타낸 프로브 및 프라이머를 사용하여, 상술한 태크만 분석법으로 확인된다: Hyg, hIgK5, hIgK6, hIgK12, Neo, 모 1540m3, 모 1540m1. 프라이머와 프로브의 추가 세트인 hIgK10도 성공적인 혼입을 확인하는데 사용된다: 정방향 프라이머 - CGATTATGACTGGTTAGGTAGAAAGGTG (서열 번호 71); 프로브 - GCCACTGGTTTCTCCAAATGTTTTCAATCCAT (서열 번호 72); 역방향 프라이머 - GGGAGTACTTGGAGATCCCTAAGC (서열 번호 73).
ES 세포의 얻어진 표적화 유전자좌는 하기의 결합 서열을 가지며, 여기서 마우스 서열은 괄호 안에 표기되고, 인간 서열은 일반 글꼴로 표기되며, 다중 클로닝 부위는 볼드체로 표기되고, Frt 서열은 이탤릭체로 표기되어 있다 (표 5).
[표 5]
도 8에 나타낸 단일 표적화 또는 도 7에 나타낸 이중 표적화의 완료 시에, ES 세포는 기능적 인간 면역글로불린 Vκ 유전자 세그먼트의 완전한 레퍼토리, 예를 들어 근위 V 클러스터의 모든 기능적 인간 Vκ 유전자 세그먼트를 통합하기 위해 추가의 Vκ 유전자 세그먼트를 포함하는 큰 표적화 벡터로 연속적으로 표적화될 수 있다. 도 8 및 도 7에 나타낸 이중 또는 연속적 단일 표적화 방법의 대안으로서, 삼중 표적화 방법을 사용하여 기능적 인간 면역글로불린 Vκ 유전자 세그먼트의 완전한 레퍼토리에 이르기까지, 예를 들어 근위 V 클러스터의 모든 기능적 인간 Vκ 유전자 세그먼트를 포함하는 ES 세포를 생성시킬 수 있다. 도 9에 나타낸 이러한 접근법에서, 제1 큰 표적화 벡터(MAID 1710, AscI 및 NotI 제한 효소로 트리밍(trimming)됨, 상기 참조)는 인간 Vκ1-5 및 Vκ1-6 유전자 세그먼트 서열을 포함하는 3' 30kb 상동성 암, 인간 Vκ3-7 내지 Vκ3-15 유전자 세그먼트 서열을 포함하는 120 kb 서열, 및 인간 Vκ1-16 유전자 세그먼트를 포함하는 5' 20kb 영역("오버랩 영역")을 포함한다. 제2 큰 표적화 벡터(MAID 6600, AscI 및 NotI 제한 효소로 트리밍됨, 상기 참조)는 3' 20 kb 오버랩 영역(제1 벡터에서와 동일한 인간 Vκ1-16 유전자 세그먼트를 포함하는 영역), 인간 Vκ1-17 내지 Vκ2-24 유전자 세그먼트를 포함하는 80 kb 서열, 및 인간 Vκ3-25 내지 Vκ2-30 유전자 세그먼트를 포함하는 5' 60 kb 영역("오버랩 영역")을 포함한다. 최종적으로, 제3 큰 표적화 벡터((MAID6647, 또한 참조로 포함되는 미국 특허 출원 공개 제2012/0096512A1호에 기재된 바와 같이 구축된 벡터로부터 유래됨)는 인간 Vκ3-25 내지 Vκ2-30을 포함하는 5' 60 kb 오버랩 영역, Vκ3-31 내지 Vκ2-40을 포함하는 90 kb 서열, FRT-Ub-Neo-FRT 선택 카세트, 및 15.5 kb 3' 마우스 TCR A 상동성 암을 포함한다. 도 6에 생성된 ES 세포(MAID 6548, 모든 인간 Jκ 세그먼트 및 4개의 기능적 인간 Vκ 유전자 세그먼트에 대하여 이형 접합체)를 뉴클레오티드 서열 TGCGATCGCTGCGGCCGAtcttagCCAGACGAGCGGGTTCGG(소문자의 절단 부위를 가짐; 서열 번호 76)에서 하이그로마이신 유전자를 표적으로 하며, Hyg 서열에서 이중 가닥 절단을 촉진하는 변형된 징크 핑거 뉴클레아제(ZFN)를 인코딩하는 핵산과 함께 상술한 3개의 큰 표적화 벡터로 일렉트로포레이션한다. 3개의 코일렉트로포레이션된 큰 표적화 벡터는 상동 재조합에 의해 DNA 서열에 삽입되어, Hyg 선택 카세트를 포함하고 이를 둘러싸는 영역을 치환한다. 생성된 ES 세포는 인간 Jκ1 내지 Jκ5 및 Vκ4-1 내지 Vκ2-40 유전자 세그먼트 (즉, 근위 Vκ 클러스터의 모든 기능적 인간 Vκ 유전자 세그먼트)를 포함하는 인간 면역글로불린 가변 도메인을 내인성 TCRα 유전자좌에 포함한다. 3개의 큰 표적화 벡터의 성공적인 혼입은 도 9에 나타내고 하기 표 6에 열거된 프로브 및 프라이머를 사용하여, 상술한 태크만® 분석법 (Lie and Petropoulos, 상기 참조)을 사용하여 확인되었다(GOA=대립유전자 획득; LOA=대립유전자 결실; 카피수 = 트랜스제닉 통합 대 표적화 통합을 추적하는 서열 카피수의 검사; hArm1 = 제1 큰 표적화 벡터(MAID 1710)의 30kb 3' 상동성 암; hArm2 = 제1 큰 표적화 벡터(MAID 1710) 및 제2 큰 표적화 벡터(MAID 6600)의 20kb 오버랩, mArm = 제2 표적화 벡터(MAID 6600)의 15.5kb 5' 상동성 암, hArm3 = 제2 표적화 벡터(MAID 6600) 및 제3 표적화 벡터(MAID6647)의 60kb 오버랩, WT 마우스 대조군 - 마우스 TCRα 유전자좌에 존재하는 서열).
[표 6]
ES 세포의 얻어진 표적화 유전자좌는 하기의 결합 서열을 가지며, 여기서 마우스 서열은 괄호 안에 표기되고, 인간 서열은 일반 글꼴로 표기되며, 다중 클로닝 부위는 볼드체로 표기되고, Frt 서열은 이탤릭체로 표기되어 있다 (표 7).
[표 7]
또 다른 대체 전략에서, 연속적인 추가의 인간 Ig Vκ 유전자 세그먼트의 도 6에 나타낸 유전자좌로의 삼중, 이중 또는 단일 표적화는 선택(예를 들어, 하이그로마이신) 카세트의 징크 핑거 뉴클레아제- 또는 CRISPR 매개 파괴를 포함하는 삼중(3개의 큰 표적화 벡터), 이중(2개의 큰 표적화 벡터) 또는 단일(1개의 큰 표적화 벡터) 표적화 도식(targeting scheme)을 이용하여 달성될 수 있다.
상술한 표적화된 ES 세포를 공여자 ES 세포로 사용하여, 벨로시마우스® 방법에 의해 8세포기의 마우스 배아에 도입하였다(예를 들어, 미국 특허 제7,294,754호 및 문헌[Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1):91-99] 참조). 독립적으로 키메라 인간 Igκ V - 마우스 Tcra C 유전자를 갖는 벨로시마우스®(완전히 공여자 ES 세포에서 유래된 F0 마우스)를 특이적 유전자 서열의 존재를 검출하는 대립유전자 분석 변형을 이용하여 유전자형 결정에 의해 동정하였다.
실시예
2.2.
키메라
인간
IgH
가변 ― 마우스
TCRB
불변
유전자좌의
구축
키메라 인간 IgH 가변 - 마우스 TCRB 불변 유전자좌는 몇 가지 상이한 전략 중 하나에 의해 구축된다.
전략 1은 도 11에 나타낸다. 이러한 전략에 사용하기 위한 큰 표적화 벡터(LTVEC A)를 얻기 위해, 모든 인간 면역글로불린 중쇄 JH 및 DH 세그먼트 및 하나의 근위 VH 세그먼트 ("VI-2")를 포함하는 벨로크이뮨® 면역글로불린 중쇄 LTVEC를 도 10에 나타낸 다수의 BHR 및 제한 소화/라이게이션 단계에서 변형시켜, 모든 인간 면역글로불린 JH 및 DH 세그먼트를 포함하는 구축물(LTVEC B [MAID 6555])을 생성하였다. LTVEC B의 5' 마우스 암은 트립시노겐 유전자(Try15-Try20)를 포함하며, 3' 암은 마우스 TCRB C2 및 Vβ31 유전자를 포함하였다. LTVEC B는 또한 CAR 유전자좌에서 면역글로불린 중쇄 가변 영역 재조합을 향상시키기 위한 마우스 IgM 인핸서(Eμ)를 포함하였다.
다음 단계에서, LTVEC B를 BHR, 제한 소화/라이게이션 및 CRISPR/Cas9 매개 등온 BAC 어셈블리(2015년 6월 23일자로 출원된 미국 특허 출원 제14/747,461호, 본원에 참조로 포함됨)의 여러 단계를 통해 추가로 변형시켜, 5'에서 3'의 방향으로 다음을 포함하는 큰 표적화 벡터(LTVEC A)를 생성하였다: (1) 대장균에서의 선택을 위한 Em7-Hyg 카세트; (2) 트립시노겐 유전자를 포함하는 ES 세포에서 상동 재조합을 위한 20 kb 5' 마우스 암(Try20, 게놈 위치 6:41504907-41525442); (3) 대장균 또는 ES 세포에서 선택하기 위한 Frt-Neo-loxP-Frt 카세트; (4) 가장 근접한 3개의 VH 세그먼트 및 모든 DH 및 JH 세그먼트를 포함하는 145 kb의 인간 IgH 유전자좌; (5) IgM 인핸서(Eμ)를 포함하는 1296 bp의 마우스 IgH 유전자좌(게놈 위치 12:113427167-113428462) (또는 이 서열은 제외됨); 및 (6) Trbc2 불변 유전자를 포함하는 ES 세포에서의 상동 재조합을 위한 40 kb 3' 마우스 암(게놈 위치 6:41543957-41584559) (도 10 참조).
LTVEC A는 하기의 결합 서열을 가지며, 여기서 마우스 서열은 괄호 안에 표기되고, 인간 서열은 일반 글꼴로 표기되며, 다중 클로닝 부위는 볼드체로 표기되고, Frt 서열은 이탤릭체로 표기되어 있다 (표 8).
[표 8]
전략 1에서, LTVEC A를 생성하기 위한 클로닝 단계 후에, 단일 표적화 단계에서 키메라 유전자좌를 ES 세포로 도입하였다. 도 11에 나타낸 바와 같이, 인간 IgH V, D 및 J 세그먼트를, 2개의 트립시노겐 반복체 사이의 모든 마우스 TCRB V 세그먼트의 결실을 포함하는 TCRB 유전자좌를 지닌 ES 세포에서 마우스의 3' 트립시노겐(TRY) 유전자의 하류(마우스 TRY 유전자는 정확한 축적으로 나타내지 않고, TCR B 유전자좌는 다수의 TRY 유전자를 포함함) 및 마우스 TCRB C2의 상류에 삽입하였다(MAID 1545, 본원에 참조로 포함되는 미국 특허 제9,113,616호의 도 8a 참조). 따라서, 마우스 TCRB D1-J1-C1 및 D2-J2는 인간 V, D 및 J 세그먼트로 치환되는 반면에, 대부분의 마우스 V 세그먼트는 결실되었다. 마우스 IgM 인핸서(Eμ)도 TCRB C2의 5'에 삽입되었지만, 예를 들어 당업계에 공지된 방법을 사용하여 일렉트로포레이션에 사용되는 표적화 벡터에서 결실될 수도 있다. 선택적으로, 마우스 TCR Vβ31 유전자도 결실될 수 있다.
추가로 인간 IgH VH 세그먼트를 삽입하기 위해, MAID 1545의 Hyg 유전자는 불활성화된다(또한 도 11 참조). 이것은 (1) 기능적 Hyg 단백질이 더 이상 만들어질 수 없도록 CRISPR/Cas9 또는 징크 핑거 뉴클레아제 (ZFH)를 사용하여 Hyg 코딩 서열에 작은 indel(삽입, 결실) 돌연변이를 도입시키거나(2015년 6월 5일자로 출원된 미국 특허 출원 제14/731,914호 참조, 본원에 참조로 포함됨); (2) 상동 재조합에 의해 Loxp-Neo-Loxp 카세트로 치환한 다음에, 카세트를 Cre로 제거함으로써 표적화 전후 어느 쪽에서나 행해질 수 있다.
얻어진 CAR 유전자좌의 결합 서열은 상기 표 8에 기재된 것과 동일하다. Neo 내성 ES 세포를 태크만® 분석으로 스크리닝하여, 정확히 표적화된 클론을 동정한다. 1545 대립 유전자가 상류 Hyg-Loxp 카세트를 포함하기 때문에, LTVEC A의 Loxp 부위에 의해 1545het ES 세포에서 표적화되는 TCRB 대립유전자를 결정할 수 있으며; 따라서, 2개의 Loxp 부위 사이의 영역의 Cre 결실은 야생형 Tcrb 대립유전자와 대조적으로 1545 대립유전자를 표적으로 하는 클론을 결정하는데 사용된다.
전략 2에서, Tcrb 유전자좌의 기본 구성(5'과 3' Try 유전자 클러스터 사이의 V 세그먼트, 및 3' Try 유전자 클러스터와 Tcrb2 불변 영역 사이의 D 및 J 세그먼트)이 보존된다. 구체적으로, 14개의 인간 TCRB V 세그먼트 및 모든 인간 TCRB D 및 J 세그먼트를 포함하는 ES 세포(본원에 참조로 포함된 미국 특허 제9,113,616호의 도 7 참조)는 먼저, 5'에서 3'의 방향으로 다음을 포함하는 큰 표적화 벡터(LTVEC B, 도 12 참조)를 이용하여, 인간 TCRB D 및 J 세그먼트를 포함하는 영역을 면역글로불린 중쇄 D 및 J 세그먼트로 치환하여 변형시켰다: (1) 마우스 Try 유전자를 포함하는 5' 상동성 암(마우스 Try 유전자는 정확한 축적으로 나타내지 않고; TCR B 유전자좌는 다수의 Try 유전자를 포함함), (2) HYG 선택 카세트, 및 (3) 모든 인간 면역글로불린 중쇄 D 및 J 세그먼트, (4) 마우스 Eμ 유전자 서열 및 (5) 마우스 TCR B 불변 영역, 마우스 Eβ 유전자 및 마우스 TCR Vβ31 유전자 세그먼트를 포함하는 3' 상동성 암(도 13의 단계 1).
이러한 변형 및 선택 카세트의 제거 후에, ES 세포를 5'에서 3'의 방향으로 다음을 포함하는 큰 표적화 벡터(LTVEC D, 도 12 참조)를 사용하여 일렉트로포레이션에 의해 추가로 변형시켰다: (1) 마우스 Try 유전자(Try7)를 포함하는 5' 상동성 암, (2) NEO 선택 카세트, (3) 3개의 인간 면역글로불린 중쇄 가변 유전자 세그먼트, 및 (4) 마우스 Try 유전자(Try4)를 포함하는 3' 상동성 암(도 13의 단계 3 참조).
얻어진 ES 세포는 인간 면역글로불린 중쇄 V 유전자 세그먼트 VH1-3, VH1-2 및 VH6-1, 모든 인간 면역글로불린 중쇄 D 및 J 유전자 세그먼트뿐만 아니라, 마우스 면역글로불린 Eμ 인핸서, 마우스 TCR B 불변 영역, 마우스 TCR B 인핸서 및 원위 3' 마우스 TCR Vβ31 유전자 세그먼트를 포함한다. 상기 전략의 각 단계에서, 특정 LTVEC의 성공적인 도입은 상술한 태크만® 분석을 사용하여 확인되었다.
ES 세포의 최종 TCR B 유전자좌는 하기의 결합 서열을 포함하였으며, 여기서 마우스 서열은 괄호 안에 표기되고, 인간 서열은 일반 글꼴로 표기되며, 다중 클로닝 부위는 볼드체로 표기되고, Frt 서열은 이탤릭체로 표기되어 있다.
[표 9]
상술한 전략 2의 대안으로서, LTVEC B를 도입하는 대신에, 마우스 Eμ를 포함하지 않는 LTVEC C(도 12 참조)가 도입되었다. 키메라 TCR B CAR 유전자좌를 생성하기 위한 추가의 전략은 본원에 참조로 포함된 미국 특허 출원 제62/052,947호, 제62/076,836호, 제62/094,603호, 제62/167,650호에 기술되어 있다. 최종적으로, 도 13에 나타낸 바와 같이, 원위 3' TCR Vβ31은 CRISPR/Cas9 기술을 사용하는 것을 비롯한 다양한 전략을 사용하여 결실될 수 있다.
남아있는 임의의 선택 카세트는 Cre 또는 Flpo 효소를 사용하여 제거될 수 있다(도 13 참조). 전략 1 또는 전략 2의 경우에 필요에 따라, 추가의 인간 VH 세그먼트는 초기 삽입과 오버랩되는 인간 IgH 서열에 연결되는 상술한 5' 마우스 Tcrb 상동성 암을 갖는 LTVEC를 사용하여, TCR 가변 영역 유전자좌에 부가된다.
상술한 표적화된 ES 세포를 공여자 ES 세포로 사용하여, 벨로시마우스® 방법에 의해 8세포기의 마우스 배아에 도입하였다. 독립적으로 키메라 인간 IgH V - 마우스 Tcrb C 유전자를 갖는 벨로시마우스®(완전히 공여자 ES 세포에서 유래된 F0 마우스)를 특이적 유전자 서열의 존재를 검출하는 대립유전자 분석 변형을 이용하여 유전자형 결정에 의해 동정하였다.
실시예
2.3.
키메라
항원 수용체 마우스의 구축
키메라 인간 Igκ V - 마우스 Tcra C 유전자 및 키메라 인간 IgH V ― 마우스 Tcrb C 유전자를 갖는 마우스를 함께 사육하여, 양쪽 키메라 유전자좌를 포함하는 마우스를 생산한다. 이러한 양쪽 키메라 유전자좌를 포함하는 마우스는 T 세포 수용체 불변 도메인 및 면역글로불린 가변 도메인(마우스 T 세포 수용체 불변 도메인 및 인간 면역글로불린 가변 도메인)을 포함하는 키메라 항원 수용체(CAR)를 T 세포 표면에 발현한다. 자손은 각 키메라 유전자에 대해 동형접합성으로 번식된다.
대안적으로, 키메라 인간 Igκ - 마우스 Tcra C 유전자 또는 키메라 인간 IgH V - 마우스 Tcrb C 유전자를 포함하는 ES 세포를 사용하여, 다른 하나의 키메라 유전자(각각, 키메라 인간 IgH V - 마우스 Tcrb C 유전자 또는 키메라 인간 Igκ - 마우스 Tcra C 유전자)를 포함하는 표적화 벡터를 도입하고, 두 가지의 키메라 유전자를 갖는 마우스를 상술한 벨로시마우스® 방법에 의해 이러한 ES 세포로부터 생산한다.
키메라 인간 Igκ - 마우스 Tcra C/키메라 인간 IgH V - 마우스 Tcrb C 항원 수용체의 발현은 세포 표면에서 검출된다. 하나의 검출 방법은 (1) 표준 기술을 이용하여 TCR 불변 영역 발현(항TCR 알파 항체 F1 (3A8) # TCR1145, 써모 피어스(Thermo-Pierce); 항TCR 베타 항체 F1 (8A3) # TCR1151, 써모 피어스; 항TCR 알파-베타 이종이량체 항체 클론 T10B9.1A-31, 비디 파밍겐(BD-Pharmigen); 항TCR 알파-베타 이종이량체 항체 클론 IP26, 이바이오사이언스(eBioscience))을 검출하는 FACS 분석을, (2) 동일한 항체를 사용하여 키메라 단백질의 크기를 확인하기 위한 웨스턴 블로팅(Western blotting)과, (3) 면역글로불린 가변 세그멘트 서열에 어닐링하는 정방향 프라이머 복합체 및 키메라 전사물의 발현을 확인하기 위해 TCR 불변 영역 서열에 어닐링하는 프라이머를 사용하는 RT-PCT와 조합한다. 게다가, 항CD3 및 항TCR 알파-베타 항체의 조합을 사용하여, 세포 표면에서 TCR/CD3 복합체의 형성을 확인할 수 있다. 또한 상술한 차세대 시퀀싱 기술을 사용하여, 키메라 전사물의 발현을 확인한다.
실시예
3.
Igκ
/
TCRα
키메라
항원 수용체
유전자좌를
갖는 마우스의 T 세포에서의 인간
Igκ
가변 영역
세그먼트
사용
TCRα 가변 영역이 부분 인간 Igκ 가변 영역(도 14 및 15의 4개의 기능적 Vκ 및 5개의 기능적 Jκ - 도 6에 나타낸 바와 같이 생산된 마우스 참조; 도 16 및 17의 16개의 기능적 Vκ 및 5개의 기능적 Jκ - 도 7에 나타낸 바와 같이 생산된 마우스 참조)으로 치환된 CAR 유전자좌를 게놈에 포함하는 3마리의 마우스로부터 흉선세포 및 비장세포를 채취하였다. T 세포는 전체 비장세포로부터, 항 CD90.2 자기 비드 및 MACS® 컬럼(밀텐이 바이오텍(Miltenyi Biotech))을 사용하여 자성 세포 분류에 의해 확실히 풍부하게 되었다. 정제된 비장 T 세포 및 흉선세포로부터 알엔이지 플러스(RNeasy Plus) RNA 단리 키트(퀴아젠(Qiagen))를 사용하여 제조사의 설명서에 따라 전체 RNA를 단리하였다.
스마터(SMARTer)™ 레이스(RACE) cDNA 증폭 키트(클론텍) 및 TCRα 특이적 프라이머(5'-TCAAAGTCGGTGAACAGGCAGAG-3'; 서열 번호 143)를 사용하여 역전사를 행하여 TCRα 불변 영역 서열을 포함하는 cDNA를 생성하였다. 이러한 과정 시에, DNA 서열(PIIA: 5'-CCCATGTACTCTGCGTTGATACCACTGCTT-3'; 서열 번호 144)을 새로 합성된 cDNA의 3' 말단에 부착시켰다. cDNA를 뉴클레오스핀(NUCLEOSPIN)® 겔(Gel)과 PCR 클린업(Clean-Up) 키트(클론텍)로 정제하였다.
그 다음에 정제된 cDNA를 PIIA 특이적 프라이머 (5'-GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCTAAGCAGTGGTATCAACGCAGAGT-3'; 서열 번호 145) 및 TCRα 특이적 프라이머 (5'-ACACTCTTTCCCTACACGACGCTCTTCCGATCTACAGCAGGTTCTGGGTTCTGGATG-3'; 서열 번호 146)를 사용하여 PCR로 증폭시켰다. PCR 산물을 2% 아가로스 겔에서 분리하고, 길이가 400 내지 700 bp인 단편을 겔 추출 키트(퀴아젠)를 사용하여 단리 정제하였다. 이들 단편을 추가로 하기 프라이머: 5'-AATGATACGGCGACCACCGAGATCTACACXXXXXXACACTCTTTCCCTACACGACGCTCTTCCGATC-3' 및 5'-CAAGCAGAAGACGGCATACGAGATXXXXXGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT-3'(각각, 서열 번호 147 및 서열 번호 148; "XXXXXX"는 시퀀싱을 위해 샘플 다중화를 가능하게 하는 6bp 인덱스 서열을 나타냄)를 사용하여 PCR에 의해 증폭시켰다. 400bp 내지 600bp의 PCR 산물을 단리 정제하고, 시퀀싱을 위해 Miseq 시퀀서(일루미나(Illumina))에 로딩하기 전에 카파 라이브러리 정량화 키트(KAPA Library Quantification Kit; 카파 바이오시스템즈(KAPA Biosystems))를 사용하여 qPCR로 정량화하였다.
생물 정보학 분석을 위해, 얻어진 일루미나 시퀀스를 샘플 인덱스 완전 일치에 기초하여 분류하여, 품질을 위해 트리밍하였다. 이어서, 오버래핑 메이트 페어(mate-pair)를 어셈블리하고, igblast(NCBI, v2.2.25+)의 로컬 인스톨레이션(local installation)을 사용하여 인간 생식세포계열 V 및 J 세그먼트 데이터베이스에 대한 재배열된 Igκ 서열의 정렬 및 마우스 생식세포계열 V 및 J 세그먼트 데이터베이스에 대한 재배열된 TCRα 서열의 정렬에 기초하여 주석을 달았다. 서열이 모호한 것으로 표시되고, 동일한 스코어를 가진 다수의 베스트 히트(best hit)가 검출된 경우 분석에서 제거하였다. 결과를 분석하고 데이터를 mysql 데이터베이스에 저장하기 위한 펄 스크립트 세트를 개발하였다.
4개의 기능적 Vκ 및 5개의 기능적 Jκ를 포함하는 마우스의 경우, 도 14에 나타낸 바와 같이, 서열 분석에 의해, CAR 유전자좌의 Ig κ 가변 도메인이 CAR 트랜스제닉 마우스의 T 세포 및 흉선세포에서 VJ 재조합을 거쳐, 리드(read) 중 약 80%가 비장과 흉선에서 다른 Jκ 유전자 세그먼트와 함께 재배열된 가장 근접한 Vκ 유전자 세그먼트(IGVK4-1)를 포함하는 것으로 나타났다. 도 15에 나타낸 바와 같이, 비장 T 세포로부터 증폭된 대부분의 재배열된 인간 Igκ VJ 서열은 생산적이었다.
16개의 기능적 Vκ 및 5개의 기능적 Jκ를 포함하는 마우스의 경우, 도 16에 나타낸 바와 같이, 서열 분석에 의해, CAR 유전자좌의 Ig κ 가변 도메인이 CAR 트랜스제닉 마우스의 비장 T 세포 및 흉선세포에서 VJ 재조합을 거치는 것으로 나타났다. 이러한 재배열은 모든 기능적 인간 Vκ 및 Jκ 세그먼트를 포함하며, 리드 중 약 40%는 가장 근접한 Vκ 유전자 세그먼트 (IGVK4-1)를 포함하였다. 도 17에 나타낸 바와 같이, 비장 T 세포 및 흉선으로부터 증폭된 재배열된 인간 Ig κ VJ 서열 중 약 2/3가 생산적이었다.
실시예
4.
IgH
/
TCRβ
키메라
항원 수용체
유전자좌를
갖는 마우스의 T 세포에서의 인간 IgH 가변 영역 세그먼트 사용
TCRβ 가변 영역이 부분 인간 IgH 가변 영역(3개의 기능적 인간 VH 및 모든 기능적 인간 D 및 JH 유전자 세그먼트, 도 13 참조)으로 치환된 CAR 유전자좌를 게놈에 포함하는 4마리의 마우스로부터 흉선세포와, 동일한 CAR (IgH+TCRCβ) 유전자좌를 게놈에 포함하는 3마리의 마우스로부터 비장세포를 채취하였다. T 세포는 전체 비장세포로부터, 항 CD90.2 자기 비드 및 MACS® 컬럼(밀텐이 바이오텍)을 사용하여 자성 세포 분류에 의해 확실히 풍부하게 되었다. 정제된 비장 T 세포 및 흉선세포로부터 알엔이지 플러스 RNA 단리 키트(퀴아젠)를 사용하여 제조사의 설명서에 따라 전체 RNA를 단리하였다.
스마터™ 레이스 cDNA 증폭 키트(클론텍) 및 TCRβ 특이적 프라이머 (5'-CGAGGGTAGCCTTTTGTTTGTTTGC-3'; 서열 번호 149)를 사용하여 역전사를 행하여 TCRβ 불변 영역 서열을 포함하는 cDNA를 생성하였다. 이러한 과정 시에, DNA 서열(5'-CCCATGTACTCTGCGTTGATACCACTGCTT-3'; 서열 번호 150)을 새로 합성된 cDNA의 3' 말단에 부착시켰다. cDNA를 뉴클레오스핀® 겔과 PCR 클린업 키트(클론텍)로 정제하였다.
그 다음에 정제된 cDNA를 프라이머 5'-ACACTCTTTCCCTACACGACGCTCTTCCGATCTGACCTTGGGTGGAGTCACATTTCTC-3' 및 5'-GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCTAAGCAGTGGTATCAACGCAGAGT-3'(각각, 서열 번호 151 및 152)를 사용하여 PCR로 증폭시켰다. 이들 단편을 추가로 하기 프라이머: 5'-AATGATACGGCGACCACCGAGATCTACACXXXXXXACACTCTTTCCCTACACGACGCTCTTCCGATCT-3' 및 5'-CAAGCAGAAGACGGCATACGAGATXXXXXXGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT-3'("XXXXXX"는 6개의 뉴클레오티드 바코드 서열임; (각각, 서열 번호 153 및 154))를 사용하여 PCR에 의해 증폭시켰다. 490bp 내지 710bp의 PCR 산물을 단리 정제하고, 시퀀싱을 위해 Miseq 시퀀서(일루미나)에 로딩하기 전에 카파 라이브러리 정량화 키트(카파 바이오시스템즈)를 사용하여 qPCR로 정량화하였다.
생물 정보학 분석을 위해, 얻어진 일루미나 시퀀스를 역다중화하여, 품질을 위해 트리밍하였다. 이어서, 오버래핑 페어드-엔드(paired-end) 리드를 어셈블리하고, igblast(NCBI, v2.2.25+)의 로컬 인스톨레이션을 사용하여 인간 생식세포계열 V, D 및 J 세그먼트 데이터베이스에 대한 재배열된 IgH 서열의 정렬에 기초하여 주석을 달았다. 서열이 모호한 것으로 표시되고, 동일한 스코어를 가진 다수의 베스트 히트가 검출된 경우 분석에서 제거하였다. 결과를 분석하고 데이터를 mysql 데이터베이스에 저장하기 위한 펄 스크립트 세트를 개발하였다.
3개의 기능적 인간 VH 및 모든 기능적 인간 D 및 JH를 포함하는 마우스의 경우, 도 18에 나타낸 바와 같이, 서열 분석에 의해, CAR 유전자좌의 IgH 가변 영역이 CAR 트랜스제닉 마우스의 비장 및 흉선에서 VJ 재조합을 거치는 것으로 나타났다. VH 및 JH 세그먼트의 분석을 나타낸다. 도 19에 나타낸 바와 같이, 비장 또는 흉선으로부터 증폭된 대부분의 재배열된 인간 IgH VDJ 서열은 생산적이었다.
실시예
5:
키메라
항원 수용체
유전자좌를
갖는 마우스로부터의 항원 결합 단백질의 생성
실시예 2에서 상술한 바와 같이, 유전자 조작된 키메라 항원 수용체 유전자좌 인간 Igκ - 마우스 Tcra C 및 인간 IgHV - 마우스 Tcrb C를 포함하는 마우스를 사육시킨 후, 선택된 마우스를 대상으로 하는 항원(예를 들어, MHC 상에 제시되는 항원, 예컨대 바이러스 펩티드-MHC 항원; 종양 펩티드-MHC 항원; 자가 면역 펩티드-MHC 항원)으로 면역화시켰다. 항원 투여 후, 항원 특이적 T 세포를 면역원의 표지된 사량체화된 버전으로 분류함으로써 동물로부터 회수한다. 분류된 CAR T 세포의 Igκ 및 IgH 가변 영역의 서열을 결정하고, 이들 가변 영역 서열을 각각, 인간 TCRα 및 TCRβ 불변 영역의 상류에 작동가능한 결합으로 클로닝한다. 키메라 핵산 서열을 리포터 T 세포주에 도입한다. 리포터 T 세포주를 면역화에 사용된 펩티드-MHC 복합체를 발현하는 표적 세포에서 스크리닝하고, 대상으로 하는 항원에 대하여 원하는 특성, 예를 들어 친화도, 선택성, 에피토프 등을 갖는 CAR을 선택한다. 선택된 CAR의 Igκ 및 IgH 가변 영역의 서열을 결정하고, 이들 가변 영역 서열을 표적화된 펩티드-MHC 복합체에 특이적인 인간 항체의 생성을 위해 각각, 인간 Igκ 및 IgH 불변 영역의 상류에 작동가능한 결합으로 클로닝한다. 이러한 항체는 파괴를 위해 대상으로 하는 펩티드-MHC를 발현하는 감염 또는 종양 세포를 표적화하는데 사용될 수 있다. 대안적으로, 펩티드-MHC 표적이 자가 면역 유도에 관여하는 경우, 이들 항체는 자가 면역 T 세포의 활성화를 저해하여 질환의 증상을 완화시키는데 사용될 수 있다. 또한, 본원에 기재된 CAR 마우스의 면역화로부터 얻어진 키메라 인간 CAR 클론은 예를 들어, 적응성 T 세포 전달을 위해 인간 환자로부터 얻어진 T 세포 내로 도입하는데 사용될 수 있다.
참고 문헌의 포함
본원에 언급된 모든 간행물, 특허 및 특허 출원은 각각의 개별 간행물, 특허 또는 특허 출원이 구체적으로 개별적으로 참조로 포함되도록 지시된 것처럼 그 전체가 본원에 참조로 포함된다. 상충될 경우, 본원의 모든 정의를 비롯하여, 본원에 따라 좌우될 것이다.
등가물
당업자는 단지 일반적인 실험을 사용하여, 본원에 기술된 본 발명의 구체적인 실시 형태에 대한 많은 등가물을 인식하거나 확인할 수 있을 것이다. 이러한 등가물은 하기 청구범위에 포함되는 것으로 의도된다.
SEQUENCE LISTING
<110> REGENERON PHARMACEUTICALS, INC.
<120> CHIMERIC ANTIGEN RECEPTORS
<130> RPB-010.25
<140>
<141>
<150> 62/167,650
<151> 2015-05-28
<150> 62/094,603
<151> 2014-12-19
<150> 62/076,836
<151> 2014-11-07
<150> 62/052,947
<151> 2014-09-19
<150> 62/052,901
<151> 2014-09-19
<160> 155
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 1
Ser Leu Leu Met Trp Ile Thr Gln Val Asn Tyr
1 5 10
<210> 2
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 2
Glu Ala Asp Pro Thr Gly His Ser Tyr
1 5
<210> 3
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 3
atggagtagt cagaacacac tcttcagaag ggactcctga tttcaaaggg gggtaccggg 60
ccccccctcg agaagttcct attccgaagt tcctattctc 100
<210> 4
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 4
tccgaagttc ctattctcta gaaagtatag gaacttccta gggcgatcgc gtgcatggca 60
ctgacatagg ccattgttaa cagggtccca gcagctggtc 100
<210> 5
<211> 124
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 5
gataaattat tttgtcagac aacaataaaa atcaatagca cgccctaaga gcggccgcca 60
ccgcggtgga gctcaggttt ccggtactta acaacagagc acagatttag tggtgaggga 120
ctct 124
<210> 6
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 6
ggtggagagg ctattcggc 19
<210> 7
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 7
tgggcacaac agacaatcgg ctg 23
<210> 8
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 8
gaacacggcg gcatcag 17
<210> 9
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 9
tgcggccgat cttagcc 17
<210> 10
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 10
acgagcgggt tcggcccatt c 21
<210> 11
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 11
ttgaccgatt ccttgcgg 18
<210> 12
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 12
gtcaagcact gctggcacac 20
<210> 13
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 13
aacccttgtg ctattgaatt gctatgctgt cag 33
<210> 14
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 14
tgttgtagac cctccgccac 20
<210> 15
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 15
ccccgtcctc ctcctttttc 20
<210> 16
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 16
tcatgtccat taacccattt accttttgcc ca 32
<210> 17
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 17
tgcaagtgct gccagcaag 19
<210> 18
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 18
cagtaaggga agagactaca acagcat 27
<210> 19
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 19
tgcacactgc tcaccactgc aagctat 27
<210> 20
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 20
tgctggtggc cccatct 17
<210> 21
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 21
gaactcagct atgatagtgt cgaatgta 28
<210> 22
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 22
cagcccagca gctgtgggtt ctc 23
<210> 23
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 23
gctcagggag aacacagaac ttaga 25
<210> 24
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
oligonucleotide"
<400> 24
tgcgatcgct gcggccgatc ttagccagac gagcgggttc gg 42
<210> 25
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 25
tgcggccgat cttagcc 17
<210> 26
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 26
acgagcgggt tcggcccatt c 21
<210> 27
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 27
ttgaccgatt ccttgcgg 18
<210> 28
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 28
cgacgtctgt cgagaagttt ctg 23
<210> 29
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 29
agttcgacag cgtgtccgac ctga 24
<210> 30
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 30
cacgccctcc tacatcgaa 19
<210> 31
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 31
tgtcgggcgt acacaaatcg 20
<210> 32
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 32
ccgtctggac cgatggctgt gt 22
<210> 33
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 33
gggcgtcggt ttccactatc 20
<210> 34
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 34
caaatggaag tagcacgtct cact 24
<210> 35
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 35
ctcgtgcaga tggacagcac cgc 23
<210> 36
<211> 15
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 36
ccgctgcccc aaagg 15
<210> 37
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 37
gtcaagcact gctggcacac 20
<210> 38
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 38
aacccttgtg ctattgaatt gctatgctgt cag 33
<210> 39
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 39
tgttgtagac cctccgccac 20
<210> 40
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 40
ttgcctttct cacacctgca g 21
<210> 41
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 41
cagcccatcc tgtcacttcg ctgga 25
<210> 42
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 42
tggcccaaca gtacagctca g 21
<210> 43
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 43
tcagtcaatc acctttccca gc 22
<210> 44
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 44
tccccaggta gcctcatgaa ccaatgtt 28
<210> 45
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 45
cacattactg agtccccaca ggg 23
<210> 46
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 46
accattgcag tttacccacg gttaggattt tt 32
<210> 47
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 47
tcttgcaatg ggatcatcag atg 23
<210> 48
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 48
ggtggagagg ctattcggc 19
<210> 49
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 49
tgggcacaac agacaatcgg ctg 23
<210> 50
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 50
gaacacggcg gcatcag 17
<210> 51
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 51
gttcaggccc cacagactct c 21
<210> 52
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 52
tcctctctgg agcaaccatg aagttccct 29
<210> 53
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 53
cctgaagcca tgagggcag 19
<210> 54
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 54
agggtaggct ctcctgaatc g 21
<210> 55
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 55
acaggcgccg gacctctggt 20
<210> 56
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 56
ccaaagaaac tgacgcctca c 21
<210> 57
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 57
gcgccacatg aatttgacca g 21
<210> 58
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 58
tgtacccaat cttccaaaga aagagctg 28
<210> 59
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 59
ggcatcctgt cctcccttc 19
<210> 60
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 60
cagtaaggga agagactaca acagcat 27
<210> 61
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 61
tgcacactgc tcaccactgc aagctat 27
<210> 62
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 62
tgctggtggc cccatct 17
<210> 63
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 63
gaactcagct atgatagtgt cgaatgta 28
<210> 64
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 64
cagcccagca gctgtgggtt ctc 23
<210> 65
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 65
gctcagggag aacacagaac ttaga 25
<210> 66
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 66
ccccgtcctc ctcctttttc 20
<210> 67
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 67
tcatgtccat taacccattt accttttgcc ca 32
<210> 68
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 68
tgcaagtgct gccagcaag 19
<210> 69
<211> 156
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 69
gtcttttttg ttcttcacag ttgagcttca tcaaagtcac atgggttaaa ctctatggag 60
tagtcagaac acactcttca gaagggactc ctgatttcaa agggtaccga agttcctatt 120
ccgaagttcc tattctctag aaagtatagg aacttc 156
<210> 70
<211> 132
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 70
gaagttccta ttccgaagtt cctattctct agaaagtata ggaacttcct agggtttcac 60
cggtggcgcg cctaacagag aggaaagtca aattataaag aatatgagat tcagaattct 120
gattaactgt gg 132
<210> 71
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 71
cgattatgac tggttaggta gaaaggtg 28
<210> 72
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 72
gccactggtt tctccaaatg ttttcaatcc at 32
<210> 73
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 73
gggagtactt ggagatccct aagc 24
<210> 74
<211> 136
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 74
ttgagcttca tcaaagtcac atgggttaaa ctctatggag tagtcagaac acactcttca 60
gaagggactc ctgatttcaa agggtaccga agttcctatt ccgaagttcc tattctctag 120
aaagtatagg aacttc 136
<210> 75
<211> 132
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 75
gaagttccta ttccgaagtt cctattctct agaaagtata ggaacttcct agggtttcac 60
cggtggcgcg ccaggaccca ggctctgaca ctcaggctgc caatacaatt gccatgaaga 120
cagatgttga tg 132
<210> 76
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
oligonucleotide"
<400> 76
tgcgatcgct gcggccgatc ttagccagac gagcgggttc gg 42
<210> 77
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 77
tgcggccgat cttagcc 17
<210> 78
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 78
acgagcgggt tcggcccatt c 21
<210> 79
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 79
ttgaccgatt ccttgcgg 18
<210> 80
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 80
cgacgtctgt cgagaagttt ctg 23
<210> 81
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 81
agttcgacag cgtgtccgac ctga 24
<210> 82
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 82
cacgccctcc tacatcgaa 19
<210> 83
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 83
tgtcgggcgt acacaaatcg 20
<210> 84
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 84
ccgtctggac cgatggctgt gt 22
<210> 85
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 85
gggcgtcggt ttccactatc 20
<210> 86
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 86
gtcaagcact gctggcacac 20
<210> 87
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 87
aacccttgtg ctattgaatt gctatgctgt cag 33
<210> 88
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 88
tgttgtagac cctccgccac 20
<210> 89
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 89
ttgcctttct cacacctgca g 21
<210> 90
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 90
cagcccatcc tgtcacttcg ctgga 25
<210> 91
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 91
tggcccaaca gtacagctca g 21
<210> 92
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 92
tcagtcaatc acctttccca gc 22
<210> 93
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 93
tccccaggta gcctcatgaa ccaatgtt 28
<210> 94
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 94
cacattactg agtccccaca ggg 23
<210> 95
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 95
cattgtcaaa gaagcactgg aaatg 25
<210> 96
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 96
accattgcag tttacccacg gttaggattt tt 32
<210> 97
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 97
tcttgcaatg ggatcatcag atg 23
<210> 98
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 98
ggtggagagg ctattcggc 19
<210> 99
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 99
tgggcacaac agacaatcgg ctg 23
<210> 100
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 100
gaacacggcg gcatcag 17
<210> 101
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 101
caggtgcaaa ggtgaccaca g 21
<210> 102
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 102
tgggtcctgc ccatccatgc a 21
<210> 103
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 103
ggcagcctga gtgtcagagc 20
<210> 104
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 104
gttcaggccc cacagactct c 21
<210> 105
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 105
tcctctctgg agcaaccatg aagttccct 29
<210> 106
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 106
cctgaagcca tgagggcag 19
<210> 107
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 107
gcgccacatg aatttgacca g 21
<210> 108
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 108
tgtacccaat cttccaaaga aagagctg 28
<210> 109
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 109
ggcatcctgt cctcccttc 19
<210> 110
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 110
cagtaaggga agagactaca acagcat 27
<210> 111
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 111
tgcacactgc tcaccactgc aagctat 27
<210> 112
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 112
tgctggtggc cccatct 17
<210> 113
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 113
gaactcagct atgatagtgt cgaatgta 28
<210> 114
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 114
cagcccagca gctgtgggtt ctc 23
<210> 115
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 115
gctcagggag aacacagaac ttaga 25
<210> 116
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 116
ccccgtcctc ctcctttttc 20
<210> 117
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 117
tcatgtccat taacccattt accttttgcc ca 32
<210> 118
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 118
tgcaagtgct gccagcaag 19
<210> 119
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 119
tggctccaag aacagtttgc c 21
<210> 120
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 120
ccctgacttt gctgctcaac tcacagcc 28
<210> 121
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 121
ggtccagtgg aatctgccat g 21
<210> 122
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 122
catttggcta catatcaaag ccg 23
<210> 123
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 123
cctgagccag ggaacagccc actgata 27
<210> 124
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 124
acatggctga ggcagacacc 20
<210> 125
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 125
tgggccgtta tgctagtacc a 21
<210> 126
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 126
tggctttacc ccttttgaag ggccc 25
<210> 127
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 127
cacagctgaa gcaggatgag c 21
<210> 128
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 128
tctctgagca gccatcccc 19
<210> 129
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
probe"
<400> 129
ttctcctttg gtgtagaggg caccagc 27
<210> 130
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 130
accaggcatg gcagaaagg 19
<210> 131
<211> 156
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 131
gtcttttttg ttcttcacag ttgagcttca tcaaagtcac atgggttaaa ctctatggag 60
tagtcagaac acactcttca gaagggactc ctgatttcaa agggtaccga agttcctatt 120
ccgaagttcc tattctctag aaagtatagg aacttc 156
<210> 132
<211> 130
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 132
gaagttccta ttccgaagtt cctattctct agaaagtata ggaacttcct agggtttcac 60
cggtggcgcg cctgagtagt gctttaggtg tgtaatcacc aaagatttag tgaagtccct 120
gtgcaaggag 130
<210> 133
<211> 119
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 133
ataataatta ataataataa atagtaaatt tctgtagaat cataatgagg tctagacccc 60
cgggctcgat aactataacg gtcctaaggt agcggtaccg aagttcctat tccgaagtt 119
<210> 134
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 134
tctagaaagt ataggaactt cctagggttt caccggtggc gcgccgagct ttctggttca 60
gccagggaca cagaaccagg aagacatcgt ggcttttcta 100
<210> 135
<211> 106
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 135
ctttggaaaa tgggactcag gttgggtgcg tctgatggag taactgagcc tctagactga 60
gcattgcaga ctaatcttgg atatttgtcc ctgagggagc cggctg 106
<210> 136
<211> 152
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 136
aaacttctta aaattactct attattcttc cctctgatta ttggtctcca ctcgagtgcc 60
atttcattac ctctttctcc gcacccgaca tagataaagc ttggagacag ctctcaactt 120
caccctttct gggggagcgg gatgaaaagg ga 152
<210> 137
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 137
gggggggtgg ggtggaggag gagggtacag catctcctct ccttcctctc tggtaccgaa 60
gttcctattc cgaagttcct attctctaga aagtatagga 100
<210> 138
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 138
tattctctag aaagtatagg aacttcctag ggtttcaccg gtgcgatcgc atatccatgt 60
gtgtccattc tggttcagcc agggacacag aaccaggaag 100
<210> 139
<211> 108
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 139
caggcttgca gtcctgggca gactccgtca cctctctatg cctcagcctt ggcgcgcctt 60
tcaaattgtt gttgagttca aagtgggcaa cagaaaaggg ggtgtgag 108
<210> 140
<211> 200
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 140
aataattaat aataataaat agtaaatttc tgtagaatca taatgaggtc tagacccccg 60
ggctcgataa ctataacggt cctaaggtag cgaaccggta taacttcgta taaggtatcc 120
tatacgaagt tatctcgagg gggggcccgg taccgattca atgtccacac ccggggctgg 180
agcgtagcca tgagccacgc 200
<210> 141
<211> 106
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 141
ctttggaaaa tgggactcag gttgggtgcg tctgatggag taactgagcc tctagactga 60
gcattgcaga ctaatcttgg atatttgtcc ctgagggagc cggctg 106
<210> 142
<211> 152
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 142
aaacttctta aaattactct attattcttc cctctgatta ttggtctcca ctcgagtgcc 60
atttcattac ctctttctcc gcacccgaca tagataaagc ttggagacag ctctcaactt 120
caccctttct gggggagcgg gatgaaaagg ga 152
<210> 143
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 143
tcaaagtcgg tgaacaggca gag 23
<210> 144
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
oligonucleotide"
<400> 144
cccatgtact ctgcgttgat accactgctt 30
<210> 145
<211> 57
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 145
gtgactggag ttcagacgtg tgctcttccg atctaagcag tggtatcaac gcagagt 57
<210> 146
<211> 57
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 146
acactctttc cctacacgac gctcttccga tctacagcag gttctgggtt ctggatg 57
<210> 147
<211> 67
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<220>
<221> modified_base
<222> (30)..(35)
<223> a, c, t, g, unknown or other
<400> 147
aatgatacgg cgaccaccga gatctacacn nnnnnacact ctttccctac acgacgctct 60
tccgatc 67
<210> 148
<211> 63
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<220>
<221> modified_base
<222> (25)..(29)
<223> a, c, t, g, unknown or other
<400> 148
caagcagaag acggcatacg agatnnnnng tgactggagt tcagacgtgt gctcttccga 60
tct 63
<210> 149
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 149
cgagggtagc cttttgtttg tttgc 25
<210> 150
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
oligonucleotide"
<400> 150
cccatgtact ctgcgttgat accactgctt 30
<210> 151
<211> 58
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 151
acactctttc cctacacgac gctcttccga tctgaccttg ggtggagtca catttctc 58
<210> 152
<211> 57
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<400> 152
gtgactggag ttcagacgtg tgctcttccg atctaagcag tggtatcaac gcagagt 57
<210> 153
<211> 68
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<220>
<221> modified_base
<222> (30)..(35)
<223> a, c, t, g, unknown or other
<400> 153
aatgatacgg cgaccaccga gatctacacn nnnnnacact ctttccctac acgacgctct 60
tccgatct 68
<210> 154
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
primer"
<220>
<221> modified_base
<222> (25)..(30)
<223> a, c, t, g, unknown or other
<400> 154
caagcagaag acggcatacg agatnnnnnn gtgactggag ttcagacgtg tgctcttccg 60
atct 64
<210> 155
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 155
Ser Gly Ser Gly
1
Claims (133)
- 재배열되지 않은 면역글로불린(Ig) 가변 영역 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌; 및
T 세포 수용체(TCR) 불변 영역을 포함하는 불변 영역 유전자좌를 포함하는 키메라 항원 수용체(CAR) 유전자좌를 생식세포계열에 포함하는 유전자 변형 비인간 동물로서,
재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 TCR 불변 영역 유전자에 작동가능하게 연결되어, 유전자 변형 비인간 동물은 재배열되지 않은 Ig 가변 영역 유전자 세그먼트로부터 유래되는 재배열된 Ig 가변 영역 유전자에 의해 인코딩되는 Ig 가변 도메인 및 TCR 불변 영역 유전자에 의해 인코딩되는 TCR 불변 도메인을 포함하는 CAR 폴리펩티드를 발현시키는 유전자 변형 비인간 동물. - 제1항에 있어서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 유래인 유전자 변형 비인간 동물.
- 제1항 또는 제2항에 있어서, TCR 불변 영역 유전자는 내인성 종에서 유래되는 유전자 변형 비인간 동물.
- 제1항 또는 제2항에 있어서, 상기 TCR 불변 영역 유전자는 마우스 TCR 불변 영역 유전자 또는 래트 TCR 불변 영역 유전자인 유전자 변형 비인간 동물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 중쇄(IgH) 가변 영역 유전자 세그먼트인 유전자 변형 비인간 동물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 경쇄(IgL) 가변 영역 유전자 세그먼트인 유전자 변형 비인간 동물.
- 제6항에 있어서, IgL 가변 영역 유전자 세그먼트는 인간 κ 유전자 세그먼트인 유전자 변형 비인간 동물.
- 제6항에 있어서, IgL 가변 영역 유전자 세그먼트는 λ 유전자 세그먼트인 유전자 변형 비인간 동물.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 TCR 불변 영역 유전자는 TCRα 불변 영역 유전자인 유전자 변형 비인간 동물.
- 제9항에 있어서, 기능적 TCRα 쇄를 발현하지 않는 유전자 변형 비인간 동물.
- 제9항에 있어서, CAR 유전자좌는 내인성 TCRα 유전자좌에 위치하는 유전자 변형 비인간 동물.
- 제9항에 있어서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 내인성 TCRα 가변 영역 유전자 세그먼트를 대체하는 유전자 변형 비인간 동물.
- 제11항에 있어서, 상기 TCRα 불변 영역 유전자는 내인성 TCRα 불변 영역 유전자인 유전자 변형 비인간 동물.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 TCR 불변 영역 유전자는 TCRβ 불변 영역 유전자인 유전자 변형 비인간 동물.
- 제14항에 있어서, 기능적 TCRβ 쇄를 발현하지 않는 유전자 변형 비인간 동물.
- 제14항에 있어서, CAR 유전자좌는 내인성 TCRβ 유전자좌에 위치하는 유전자 변형 비인간 동물.
- 제16항에 있어서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 내인성 TCRβ 가변 영역 유전자 세그먼트를 대체하는 유전자 변형 비인간 동물.
- 제16항에 있어서, 상기 TCRβ 불변 영역 유전자는 내인성 TCRβ 불변 영역 유전자인 유전자 변형 비인간 동물.
- 제1 CAR 유전자좌 및 제2 CAR 유전자좌를 생식세포계열에 포함하는 유전자 변형 비인간 동물로서,
제1 CAR 유전자좌는 재배열되지 않은 면역글로불린(Ig) VH, DH 및 JH 유전자 세그먼트를 포함하는 제1 재배열되지 않은 가변 영역 유전자좌 및 T 세포 수용체 β(TCRβ) 불변 영역 유전자를 포함하는 제1 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 Ig VH, DH 및 JH 유전자 세그먼트는 TCRβ 불변 영역 유전자에 작동가능하게 연결되어, 유전자 변형 비인간 동물은 재배열되지 않은 Ig VH, DH 및 JH 유전자 세그먼트로부터 유래되는 재배열된 중쇄 가변 영역 유전자에 의해 인코딩되는 Ig 중쇄 가변 도메인 및 TCRβ 불변 영역 유전자에 의해 인코딩되는 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드 쇄를 발현하고,
제2 CAR 유전자좌는 재배열되지 않은 Ig Vκ 및 Jκ 유전자 세그먼트를 포함하는 제2 재배열되지 않은 가변 영역 유전자좌 및 T 세포 수용체 α(TCRα) 불변 영역 유전자를 포함하는 제2 불변 영역 유전자좌를 포함하며, 여기서 재배열되지 않은 Ig Vκ 및 Jκ 유전자 세그먼트는 TCRα 불변 영역 유전자에 작동가능하게 연결되어, 유전자 변형 비인간 동물은 재배열되지 않은 Ig Vκ 및 Jκ 유전자 세그먼트로부터 유래되는 재배열된 Ig κ 가변 영역 유전자에 의해 인코딩되는 Ig κ 가변 도메인 및 TCRα 불변 영역 유전자에 의해 인코딩되는 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드 쇄를 발현하고,
제1 CAR 폴리펩티드 쇄 및 제2 CAR 폴리펩티드 쇄를 포함하는 CAR을 발현하는 유전자 변형 비인간 동물. - 제19항에 있어서, 상기 Ig VH, DH 및 JH 유전자 세그먼트 및/또는 상기 Ig Vκ 및 Jκ 유전자 세그먼트는 인간 유래인 유전자 변형 비인간 동물.
- 제19항 또는 제20항에 있어서, TCRβ 불변 영역 유전자 및/또는 TCRα 불변 영역 유전자는 내인성 종에서 유래되는 유전자 변형 비인간 동물.
- 제19항 또는 제20항에 있어서, TCRβ 불변 영역 유전자 및/또는 TCRα 불변 영역 유전자는 마우스 유전자 또는 래트 유전자인 유전자 변형 비인간 동물.
- 제19항 내지 제22항 중 어느 한 항에 있어서, 기능적 TCRα 쇄 및/또는 기능적 TCRβ 쇄를 발현하지 않는 유전자 변형 비인간 동물.
- 제19항 내지 제23항 중 어느 한 항에 있어서, 제2 CAR 유전자좌는 내인성 TCRα 유전자좌에 위치하는 유전자 변형 비인간 동물.
- 제24항에 있어서, 재배열되지 않은 Ig Vκ 및 Jκ 유전자 세그먼트는 내인성 TCRα 가변 영역 유전자 세그먼트를 대체하는 유전자 변형 비인간 동물.
- 제24항 또는 제25항에 있어서, 상기 TCRα 불변 영역 유전자는 내인성 TCRα 불변 영역 유전자인 유전자 변형 비인간 동물.
- 제19항 내지 제26항 중 어느 한 항에 있어서, 제1 CAR 유전자좌는 내인성 TCRβ 유전자좌에 위치하는 유전자 변형 비인간 동물.
- 제27항에 있어서, 재배열되지 않은 Ig VH, DH 및 JH 유전자 세그먼트는 내인성 TCRβ 가변 영역 유전자 세그먼트를 대체하는 유전자 변형 비인간 동물.
- 제27항 또는 제28항에 있어서, 상기 TCRβ 불변 영역 유전자는 내인성 TCRβ 불변 영역 유전자인 유전자 변형 비인간 동물.
- 제1항 내지 제29항 중 어느 한 항에 있어서, 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 하나 이상의 키메라 MHC 클래스 I α 쇄 폴리펩티드를 발현하는 유전자 변형 비인간 동물.
- 제30항에 있어서, 하나 이상의 키메라 클래스 I α 쇄 폴리펩티드는 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-g, HLA-K 및 HLA-L로 이루어진 군으로부터 선택되는 유전자 변형 비인간 동물.
- 제1항 내지 제31항 중 어느 한 항에 있어서, 인간 β-2-마이크로글로불린 폴리펩티드를 발현하는 유전자 변형 비인간 동물.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 하나 이상의 키메라 MHC 클래스 II α 쇄 폴리펩티드 및/또는 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 하나 이상의 키메라 MHC 클래스 II β 쇄 폴리펩티드를 발현하는 유전자 변형 비인간 동물.
- 제33항에 있어서, 하나 이상의 키메라 MHC 클래스 II α 쇄 폴리펩티드는 HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA 및 HLA-DRA로 이루어진 군으로부터 선택되고/되거나, 하나 이상의 키메라 MHC 클래스 II β 쇄 폴리펩티드는 HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB 및 HLA-DRB로 이루어진 군으로부터 선택되는 유전자 변형 비인간 동물.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 CD8 α 쇄 폴리펩티드 및/또는 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 CD8 β 쇄 폴리펩티드를 발현하는 유전자 변형 비인간 동물.
- 제1항 내지 제35항 중 어느 한 항에 있어서, 인간 D1 면역글로불린 도메인, 인간 D2 면역글로불린 도메인, 인간 D3 면역글로불린 도메인, D4 면역글로불린 도메인, 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 CD4 폴리펩티드를 발현하는 유전자 변형 비인간 동물.
- 제1항 내지 제36항 중 어느 한 항에 있어서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 유전자 변형 비인간 동물.
- 제1항 내지 제37항 중 어느 한 항에 있어서, CAR을 T 세포 상에 발현하는 유전자 변형 비인간 동물.
- 제38항에 있어서, T 세포는 흉선에서 양성 선택 및 음성 선택을 거치는 유전자 변형 비인간 동물.
- 제1항 내지 제39항 중 어느 한 항에 있어서, 설치류인 유전자 변형 비인간 동물.
- 제40항에 있어서, 설치류가 마우스인 유전자 변형 비인간 동물.
- (a) 제1항 내지 제41항 중 어느 한 항의 유전자 변형 비인간 동물을 펩티드를 포함하는 항원 또는 펩티드를 포함하는 항원을 인코딩하는 핵산에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하는 단계; 및
(b) MHC 상에 제시된 펩티드에 특이적인 CAR을 발현하는 T 세포를 (a)의 유전자 변형 비인간 동물로부터 얻는 단계를 포함하는, MHC 상에 제시된 펩티드에 특이적인 CAR을 발현하는 T 세포의 생성 방법. - 제42항의 방법에 따라 생성된 T 세포.
- (a) 제1항 내지 제41항 중 어느 한 항의 유전자 변형 비인간 동물을 펩티드를 포함하는 항원 또는 펩티드를 포함하는 항원을 인코딩하는 핵산에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하는 단계;
(b) MHC 상에 제시된 펩티드에 특이적인 CAR을 발현하는 T 세포를 (a)의 유전자 변형 비인간 동물로부터 얻는 단계; 및
(c) 단계 (b)의 T 세포로부터 T 세포 하이브리도마를 생성시키는 단계를 포함하는, MHC 상에 제시된 펩티드에 특이적인 CAR을 발현하는 T 세포 하이브리도마의 생성 방법. - 제44항의 방법에 따라 생성된 T 세포 하이브리도마.
- (a) 제1항 내지 제41항 중 어느 한 항의 비인간 동물을 펩티드를 포함하는 항원 또는 펩티드를 포함하는 항원을 인코딩하는 핵산에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하는 단계;
(b) MHC 상에 제시된 펩티드에 특이적인 CAR을 발현하는 T 세포를 (a)의 유전자 변형 비인간 동물로부터 얻는 단계; 및
(c) CAR의 Ig 가변 도메인을 인코딩하는 핵산을 T 세포로부터 단리하는 단계를 포함하는, MHC 상에 제시된 펩티드에 특이적인 Ig 가변 도메인을 인코딩하는 핵산의 생성 방법. - 제46항의 방법에 따라 생성된, MHC 상에 제시된 펩티드에 특이적인 Ig 가변 도메인을 인코딩하는 핵산.
- (a) 제1항 내지 제41항 중 어느 한 항의 비인간 동물을 펩티드를 포함하는 항원 또는 펩티드를 포함하는 항원을 인코딩하는 핵산에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하는 단계;
(b) MHC 상에 제시된 펩티드에 특이적인 CAR을 발현하는 T 세포를 (a)의 유전자 변형 비인간 동물로부터 얻는 단계;
(c) CAR의 Ig 가변 도메인을 인코딩하는 핵산을 T 세포로부터 단리하는 단계;
(d) 숙주 세포에서 Ig 가변 도메인을 인코딩하는 핵산을 Ig 불변 도메인과 작동가능하게 연결시키는 단계; 및
(e) 숙주 세포가 Ig 가변 도메인 및 Ig 불변 도메인을 포함하는 항체를 발현하도록 하는 조건하에 숙주 세포를 배양하는 단계를 포함하는, MHC 상에 제시된 펩티드에 특이적인 항체의 생성 방법. - 제48항에 있어서, 상기 Ig 불변 도메인은 인간 Ig 불변 도메인인 방법.
- 제48항 또는 제49항의 방법에 따라 생성된, MHC 상에 제시된 펩티드에 특이적인 항체.
- (a) 제1항 내지 제41항 중 어느 한 항의 비인간 동물을 펩티드를 포함하는 항원 또는 펩티드를 포함하는 항원을 인코딩하는 핵산에 노출시켜, 펩티드를 상기 비인간 동물의 MHC 상에 제시하는 단계;
(b) MHC 상에 제시된 펩티드에 특이적인 CAR을 발현하는 비인간 동물 T 세포를 (a)의 유전자 변형 비인간 동물로부터 얻는 단계;
(c) CAR의 Ig 가변 도메인을 인코딩하는 핵산을 비인간 동물 T 세포로부터 단리하는 단계; 및
(d) 인간 세포에서 Ig 가변 도메인을 인코딩하는 핵산을 인간 TCR 불변 도메인을 인코딩하는 핵산과 작동가능하게 연결시켜, 인간 세포가 Ig 가변 도메인 및 인간 TCR 불변 도메인을 포함하는 CAR를 발현하는 단계를 포함하는, 인간 Ig 가변 도메인 및 인간 TCR 불변 도메인을 포함하는 CAR을 발현하는 인간 세포의 생성 방법. - 제51항에 있어서, 상기 인간 세포는 인간 T 세포인 방법.
- 제52항에 있어서, 상기 인간 T 세포는 생체외 단리된 인간 T 세포인 방법.
- 제51항 내지 제53항 중 어느 한 항의 방법에 따라 제조된, 인간 Ig 가변 도메인 및 인간 TCR 불변 도메인을 포함하는 CAR을 발현하는 인간 세포.
- 제1항 내지 제41항 중 어느 한 항의 유전자 변형 비인간 동물로부터 얻어지거나 얻어질 수 있는 CAR을 발현하는 세포.
- 제55항에 있어서, T 세포인 세포.
- 제55항에 있어서, T 세포 하이브리도마인 세포.
- 제1항 내지 제41항 중 어느 한 항의 유전자 변형 비인간 동물로부터 얻어지거나 얻어질 수 있는 재배열된 Ig 가변 영역 유전자를 포함하는 핵산.
- 제58항에 있어서, CAR을 인코딩하는 핵산.
- 제55항 내지 제57항 중 어느 한 항의 세포로부터 얻어지거나 얻어질 수 있는 재배열된 Ig 가변 영역 유전자를 포함하는 핵산.
- 제60항에 있어서, CAR을 인코딩하는 핵산.
- 제60항 또는 제61항에 있어서, 재배열된 Ig 가변 영역 유전자는 MHC 상에 제시된 펩티드에 특이적인 Ig 가변 도메인을 인코딩하는 핵산.
- 제1항 내지 제41항 중 어느 한 항의 유전자 변형 비인간 동물로부터 얻어지거나 얻어질 수 있는 MHC 상에 제시된 펩티드에 특이적인 CAR.
- 제55항 내지 제57항 중 어느 한 항의 세포로부터 얻어지거나 얻어질 수 있는 MHC 상에 제시된 펩티드에 특이적인 CAR.
- 재배열되지 않은 면역글로불린(Ig) 가변 영역 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌; 및
T 세포 수용체(TCR) 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하는 키메라 항원 수용체(CAR) 유전자좌를 게놈에 포함하며;
여기서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 TCR 불변 영역 유전자에 작동가능하게 연결되는 비인간 배아 줄기(ES) 세포. - 제65항에 있어서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 유래인 비인간 ES 세포.
- 제65항 또는 제66항에 있어서, TCR 불변 영역 유전자는 내인성 종에서 유래되는 비인간 ES 세포.
- 제65항 또는 제66항에 있어서, TCR 불변 영역 유전자는 마우스 불변 영역 유전자 또는 래트 불변 영역 유전자인 비인간 ES 세포.
- 제65항 내지 제68항 중 어느 한 항에 있어서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 중쇄(IgH) 가변 영역 유전자 세그먼트인 비인간 ES 세포.
- 제65항 내지 제68항 중 어느 한 항에 있어서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 경쇄(IgL) 가변 영역 유전자 세그먼트인 비인간 ES 세포.
- 제70항에 있어서, IgL 가변 영역 유전자 세그먼트는 인간 κ 유전자 세그먼트인 비인간 ES 세포.
- 제70항에 있어서, IgL 가변 영역 유전자 세그먼트는 λ 유전자 세그먼트인 비인간 ES 세포.
- 제65항 내지 제72항 중 어느 한 항에 있어서, 상기 TCR 불변 영역 유전자는 TCRα 불변 영역 유전자인 비인간 ES 세포.
- 제73항에 있어서, CAR 유전자좌는 내인성 TCRα 유전자좌에 위치하는 비인간 ES 세포.
- 제74항에 있어서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 내인성 TCRα 가변 영역 유전자 세그먼트를 대체하는 비인간 ES 세포.
- 제74항 또는 제75항에 있어서, 상기 TCRα 불변 영역 유전자는 내인성 TCRα 불변 영역 유전자인 비인간 ES 세포.
- 제68항 내지 제72항 중 어느 한 항에 있어서, 상기 TCR 불변 영역 유전자는 TCRβ 불변 영역 유전자인 비인간 ES 세포.
- 제77항에 있어서, CAR 유전자좌는 내인성 TCRβ 유전자좌에 위치하는 비인간 ES 세포.
- 제78항에 있어서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 내인성 TCRβ 가변 영역 유전자 세그먼트를 대체하는 비인간 ES 세포.
- 제78항 또는 제79항에 있어서, 상기 TCRβ 불변 영역 유전자는 내인성 TCRβ 불변 영역 유전자인 비인간 ES 세포.
- 재배열되지 않은 면역글로불린(Ig) VH, DH 및 JH 유전자 세그먼트를 포함하는 제1 재배열되지 않은 가변 영역 유전자좌 및 T 세포 수용체 β(TCRβ) 불변 영역 유전자를 포함하는 제1 불변 영역 유전자좌를 포함하는 제1 CAR 유전자좌 - 여기서, 재배열되지 않은 Ig VH, DH 및 JH 유전자 세그먼트는 TCRβ 불변 영역 유전자에 작동가능하게 연결됨 -, 및
재배열되지 않은 Ig Vκ 및 Jκ 유전자 세그먼트를 포함하는 제2 재배열되지 않은 가변 영역 유전자좌 및 T 세포 수용체 α(TCRα) 불변 영역 유전자를 포함하는 제2 불변 영역 유전자좌를 포함하는 제2 CAR 유전자좌 - 여기서 재배열되지 않은 Ig Vκ 및 Jκ 유전자 세그먼트는 TCRα 불변 영역 유전자에 작동가능하게 연결됨 - 를 게놈에 포함하는 비인간 ES 세포. - 제65항 내지 제81항 중 어느 한 항에 있어서, 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 MHC 클래스 I α 쇄 폴리펩티드를 인코딩하는 하나 이상의 핵산 서열을 게놈에 포함하는 비인간 ES 세포.
- 제82항에 있어서, MHC 클래스 I α 쇄 폴리펩티드는 HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-g, HLA-K 및 HLA-L로 이루어진 군으로부터 선택되는 비인간 ES 세포.
- 제65항 내지 제83항 중 어느 한 항에 있어서, 인간 β-2-마이크로글로불린 폴리펩티드를 인코딩하는 핵산 서열을 게놈에 포함하는 비인간 ES 세포.
- 제65항 내지 제84항 중 어느 한 항에 있어서, 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 MHC 클래스 II α 쇄 폴리펩티드를 인코딩하는 하나 이상의 핵산 서열 및/또는 인간 세포외 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 MHC 클래스 II β 쇄 폴리펩티드를 인코딩하는 하나 이상의 핵산 서열을 게놈에 포함하는 비인간 ES 세포.
- 제85항에 있어서, 키메라 MHC 클래스 II α 쇄 폴리펩티드는 HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA 및 HLA-DRA로 이루어진 군으로부터 선택되고/되거나, MHC 클래스 II β 쇄 폴리펩티드는 HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB 및 HLA-DRB로 이루어진 군으로부터 선택되는 비인간 ES 세포.
- 제65항 내지 제86항 중 어느 한 항에 있어서, 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 CD8 α 쇄 폴리펩티드를 인코딩하는 핵산 서열 및/또는 인간 세포외 면역글로불린 도메인 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 CD8 β 쇄 폴리펩티드를 인코딩하는 핵산 서열을 게놈에 포함하는 비인간 ES 세포.
- 제65항 내지 제87항 중 어느 한 항에 있어서, 인간 D1 면역글로불린 도메인, 인간 D2 면역글로불린 도메인, 인간 D3 면역글로불린 도메인, D4 면역글로불린 도메인, 및 내인성 종에서 유래되는 세포질 도메인을 포함하는 키메라 CD4 폴리펩티드를 인코딩하는 핵산 서열을 게놈에 포함하는 비인간 ES 세포.
- 제65항 내지 제88항 중 어느 한 항에 있어서, 설치류 ES 세포인 비인간 ES 세포.
- 제89항에 있어서, 설치류 ES 세포는 마우스 ES 세포인 비인간 ES 세포.
- 제65항 내지 제90항 중 어느 한 항의 비인간 ES 세포를 사용하는 것을 포함하는, CAR을 발현하는 유전자 변형 비인간 동물의 생산 방법.
- 제91항의 방법을 사용하여 생산되거나 이로부터 얻어질 수 있는 유전자 변형 비인간 동물.
- 제65항 내지 제90항 중 어느 한 항의 비인간 ES 세포를 포함하는 비인간 배아.
- 재배열되지 않은 면역글로불린(Ig) 가변 영역 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌; 및
T 세포 수용체(TCR) 불변 영역을 포함하는 불변 영역 유전자좌를 포함하며;
여기서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 TCR 불변 영역 유전자에 작동가능하게 연결되는 키메라 항원 수용체(CAR) 유전자좌. - 제94항에 있어서, 상기 Ig 가변 영역 유전자 세그먼트는 인간 유래인 CAR 유전자좌.
- 제94항 또는 제95항에 있어서, 상기 TCR 불변 영역 유전자는 설치류 TCR 불변 영역 유전자인 CAR 유전자좌.
- 제96항에 있어서, 설치류 TCR 불변 영역은 마우스 TCR 불변 영역인 CAR 유전자좌.
- 재배열되지 않은 면역글로불린(Ig) VH, DH 및 JH 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌 및 T 세포 수용체 β(TCRβ) 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하는 CAR 유전자좌 - 여기서, 재배열되지 않은 Ig VH, DH 및 JH 유전자 세그먼트는 TCRβ 불변 영역 유전자에 작동가능하게 연결됨 -.
- 제98항에 있어서, 상기 Ig VH, DH 및 JH 유전자 세그먼트는 인간 유래인 CAR 유전자좌.
- 제98항 또는 제99항에 있어서, 상기 TCRβ 불변 영역 유전자는 마우스 TCRβ 불변 영역 유전자인 CAR 유전자좌.
- 재배열되지 않은 Ig Vκ 및 Jκ 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌 및 T 세포 수용체 α(TCRα) 불변 영역 유전자를 포함하는 불변 영역 유전자좌를 포함하는 CAR 유전자좌 - 여기서, 재배열되지 않은 인간 Ig Vκ 및 Jκ 유전자 세그먼트는 TCRα 불변 영역 유전자에 작동가능하게 연결됨 -.
- 제101항에 있어서, 상기 Ig Vκ 및 Jκ 유전자 세그먼트는 인간 유래인 CAR 유전자좌.
- 제101항 또는 제102항에 있어서, 상기 TCRα 불변 영역 유전자는 마우스 TCRα 불변 영역 유전자인 CAR 유전자좌.
- Ig 중쇄 가변 도메인 및 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, Ig 경쇄 가변 도메인 및 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 키메라 항원 수용체(CAR) - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 -.
- 제104항에 있어서, Ig 경쇄 가변 도메인은 Ig κ 가변 도메인인 CAR.
- 제104항에 있어서, Ig 경쇄 가변 도메인은 Ig λ 가변 도메인인 CAR.
- 제104항 또는 제105항에 있어서, Ig 중쇄 가변 도메인 및 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인인 CAR.
- Ig 중쇄 가변 도메인 및 TCRα 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, Ig 경쇄 가변 도메인 및 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 키메라 항원 수용체(CAR) - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 -.
- 제108항에 있어서, Ig 경쇄 가변 도메인은 Ig κ 가변 도메인인 CAR.
- 제108항에 있어서, Ig 경쇄 가변 도메인은 Ig λ 가변 도메인인 CAR.
- 제108항 내지 제110항 중 어느 한 항에 있어서, Ig 중쇄 가변 도메인 및 Ig 경쇄 가변 도메인은 인간 Ig 가변 도메인인 CAR.
- 제103항 내지 제111항 중 어느 한 항의 CAR을 발현하는 세포.
- 제112항에 있어서, T 세포인 세포.
- 인간 Ig 중쇄 가변 도메인 및 인간 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드와, 인간 Ig 경쇄 가변 도메인 및 인간 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 포함하는 키메라 항원 수용체(CAR)를 발현하는 인간 T 세포를 대상에게 투여하는 단계 - 여기서, CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 가짐 - 를 포함하는, 대상에서 펩티드/MHC 복합체에 대한 면역 반응을 유도하는 방법.
- Ig 중쇄 가변 도메인 및 TCRβ 불변 도메인을 포함하는 제1 CAR 폴리펩티드를 인코딩하는 제1 핵산 서열과, Ig 경쇄 가변 도메인 및 TCRα 불변 도메인을 포함하는 제2 CAR 폴리펩티드를 인코딩하는 제2 핵산 서열을 포함하며, 여기서 제1 CAR 폴리펩티드 및 제2 CAR 폴리펩티드를 포함하는 CAR은 펩티드/MHC 복합체에 대한 결합 특이성을 갖는 핵산 조성물.
- 키메라 항원 수용체(CAR) 유전자좌를 생식세포계열에 포함하도록 비인간 동물을 유전자 조작하는 단계를 포함하는, 유전자 변형을 포함하는 비인간 동물의 생산 방법으로서, 상기 CAR 유전자좌는,
재배열되지 않은 면역글로불린(Ig) 가변 영역 유전자 세그먼트를 포함하는 재배열되지 않은 가변 영역 유전자좌; 및
T 세포 수용체(TCR) 불변 영역을 포함하는 불변 영역 유전자좌를 포함하며;
여기서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 TCR 불변 영역 유전자에 작동가능하게 연결되어, 유전자 변형 비인간 동물은 재배열되지 않은 Ig 가변 영역 유전자 세그먼트로부터 유래되는 재배열된 Ig 가변 영역 유전자에 의해 인코딩되는 Ig 가변 도메인 및 TCR 불변 영역 유전자에 의해 인코딩되는 TCR 불변 도메인을 포함하는 CAR 폴리펩티드를 발현하는 방법. - 제116항에 있어서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 유래인 방법.
- 제116항 또는 제117항에 있어서, TCR 불변 영역 유전자는 내인성 종에서 유래되는 방법.
- 제116항 또는 제117항에 있어서, 상기 TCR 불변 영역 유전자는 마우스 TCR 불변 영역 유전자 또는 래트 TCR 불변 영역 유전자인 방법.
- 제116항 내지 제119항 중 어느 한 항에 있어서, 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 중쇄(IgH) 가변 영역 유전자 세그먼트인 방법.
- 제116항 내지 제119항 중 어느 한 항에 있어서, 상기 재배열되지 않은 Ig 가변 영역 유전자 세그먼트는 인간 Ig 경쇄(IgL) 가변 영역 유전자 세그먼트인 방법.
- 제121항에 있어서, IgL 가변 영역 유전자 세그먼트는 인간 κ 유전자 세그먼트인 방법.
- 제121항에 있어서, IgL 가변 영역 유전자 세그먼트는 λ 유전자 세그먼트인 방법.
- 제116항 내지 제123항 중 어느 한 항에 있어서, 상기 TCR 불변 영역 유전자는 TCRα 불변 영역 유전자인 방법.
- 제124항에 있어서, CAR 유전자좌는 내인성 TCRα 유전자좌에 위치하는 방법.
- 제125항에 있어서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 내인성 TCRα 가변 영역 유전자 세그먼트를 대체하는 방법.
- 제125항에 있어서, 상기 TCRα 불변 영역 유전자는 내인성 TCRα 불변 영역 유전자인 방법.
- 제116항 내지 제123항 중 어느 한 항에 있어서, 상기 TCR 불변 영역 유전자는 TCRβ 불변 영역 유전자인 방법.
- 제128항에 있어서, CAR 유전자좌는 내인성 TCRβ 유전자좌에 위치하는 방법.
- 제129항에 있어서, 재배열되지 않은 인간 Ig 가변 영역 유전자 세그먼트는 내인성 TCRβ 가변 영역 유전자 세그먼트를 대체하는 방법.
- 제129항에 있어서, 상기 TCRβ 불변 영역 유전자는 내인성 TCRβ 불변 영역 유전자인 방법.
- 제116항 내지 제131항 중 어느 한 항에 있어서, 상기 비인간 동물은 설치류인 방법.
- 제132항에 있어서, 설치류는 마우스인 방법.
Applications Claiming Priority (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462052947P | 2014-09-19 | 2014-09-19 | |
| US201462052901P | 2014-09-19 | 2014-09-19 | |
| US62/052,901 | 2014-09-19 | ||
| US62/052,947 | 2014-09-19 | ||
| US201462076836P | 2014-11-07 | 2014-11-07 | |
| US62/076,836 | 2014-11-07 | ||
| US201462094603P | 2014-12-19 | 2014-12-19 | |
| US62/094,603 | 2014-12-19 | ||
| US201562167650P | 2015-05-28 | 2015-05-28 | |
| US62/167,650 | 2015-05-28 | ||
| PCT/US2015/050975 WO2016044745A1 (en) | 2014-09-19 | 2015-09-18 | Chimeric antigen receptors |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170083534A true KR20170083534A (ko) | 2017-07-18 |
Family
ID=54261082
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177010023A KR20170083534A (ko) | 2014-09-19 | 2015-09-18 | 키메라 항원 수용체 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20160081314A1 (ko) |
| EP (1) | EP3193592A1 (ko) |
| JP (1) | JP2017529841A (ko) |
| KR (1) | KR20170083534A (ko) |
| CN (1) | CN107072184A (ko) |
| AU (1) | AU2015317370A1 (ko) |
| BR (1) | BR112017005245A2 (ko) |
| CA (1) | CA2959428A1 (ko) |
| IL (1) | IL250536A0 (ko) |
| MX (1) | MX2017003640A (ko) |
| RU (1) | RU2017113134A (ko) |
| SG (1) | SG11201701040XA (ko) |
| WO (1) | WO2016044745A1 (ko) |
Families Citing this family (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20150064153A1 (en) | 2013-03-15 | 2015-03-05 | The Trustees Of Princeton University | High efficiency microfluidic purification of stem cells to improve transplants |
| EP2971279B1 (en) | 2013-03-15 | 2019-11-13 | The Trustees of Princeton University | Methods and devices for high throughput purification |
| US11493428B2 (en) | 2013-03-15 | 2022-11-08 | Gpb Scientific, Inc. | On-chip microfluidic processing of particles |
| KR102235202B1 (ko) * | 2014-03-05 | 2021-04-05 | 유씨엘 비즈니스 리미티드 | T 세포 수용체 베타 불변 영역에 대한 항원 결합 도메인을 갖는 키메라 항원 수용체(car) |
| US11385233B2 (en) | 2015-03-05 | 2022-07-12 | Autolus Limited | Methods of depleting malignant T-cells |
| US20230021548A1 (en) | 2014-03-05 | 2023-01-26 | Autolus Limited | Methods |
| FR3029449B1 (fr) * | 2014-12-03 | 2017-10-13 | Pole De Plasturgie De Lest | Dispositif de moulage pour la fabrication de pieces en materiau composite a partir de resine polymere liquide. |
| EP3232774B1 (en) * | 2014-12-19 | 2019-10-09 | Regeneron Pharmaceuticals, Inc. | Methods and compositions for targeted genetic modification through single-step multiple targeting |
| CN114099712A (zh) | 2015-05-06 | 2022-03-01 | 斯尼普技术有限公司 | 改变微生物种群和改善微生物群 |
| US10976232B2 (en) | 2015-08-24 | 2021-04-13 | Gpb Scientific, Inc. | Methods and devices for multi-step cell purification and concentration |
| CA3001008A1 (en) | 2015-10-05 | 2017-04-13 | Precision Biosciences, Inc. | Engineered meganucleases with recognition sequences found in the human t cell receptor alpha constant region gene |
| AU2016333898B2 (en) | 2015-10-05 | 2020-11-12 | Precision Biosciences, Inc. | Genetically-modified cells comprising a modified human T cell receptor alpha constant region gene |
| IL303785A (en) | 2016-04-01 | 2023-08-01 | Kite Pharma Inc | Chimeric antigen and T cell receptors and methods of use |
| JP2019513370A (ja) | 2016-04-01 | 2019-05-30 | カイト ファーマ インコーポレイテッドKite Pha | キメラ受容体及びその使用方法 |
| PE20190120A1 (es) | 2016-04-01 | 2019-01-17 | Kite Pharma Inc | Moleculas de union a bcma y metodos de uso de las mismas |
| KR102437015B1 (ko) | 2016-04-15 | 2022-08-29 | 메모리얼 슬로안 케터링 캔서 센터 | 유전자이식 t 세포 및 키메라 항원 수용체 t 세포 조성물 및 관련 방법 |
| IL263160B2 (en) * | 2016-06-03 | 2024-01-01 | Regeneron Pharma | Non-human animals expressing exogenous terminal deoxynucleotidyl transferase |
| GB201609811D0 (en) | 2016-06-05 | 2016-07-20 | Snipr Technologies Ltd | Methods, cells, systems, arrays, RNA and kits |
| US20190297861A1 (en) * | 2016-07-12 | 2019-10-03 | Kymab Limited | Animals, cells, ligands, polypeptides & methods |
| AU2017316649A1 (en) | 2016-08-23 | 2019-03-07 | The Regents Of The University Of California | Proteolytically cleavable chimeric polypeptides and methods of use thereof |
| WO2018075586A1 (en) * | 2016-10-18 | 2018-04-26 | Memorial Sloan-Kettering Cancer Center | Antigen-binding proteins targeting melanoma differentiation antigens and uses thereof |
| AR110424A1 (es) | 2016-12-23 | 2019-03-27 | Macrogenics Inc | Moléculas de unión a adam9 y métodos de uso de las mismas |
| WO2018148454A1 (en) * | 2017-02-09 | 2018-08-16 | The Regents Of The University Of California | Chimeric t cell antigen receptors and methods of use thereof |
| TW201837175A (zh) | 2017-03-13 | 2018-10-16 | 美商凱特製藥公司 | 用於黑色素瘤之嵌合抗原受體及其用途 |
| CN108690136B (zh) * | 2017-04-05 | 2022-09-20 | 凯惠科技发展(上海)有限公司 | 一种人源化抗tpbg抗体及其制备方法、其偶联物和应用 |
| JOP20180042A1 (ar) | 2017-04-24 | 2019-01-30 | Kite Pharma Inc | نطاقات ربط مولد ضد متوافقة مع البشر وطرق الاستخدام |
| WO2019005957A1 (en) | 2017-06-30 | 2019-01-03 | Precision Biosciences, Inc. | GENETICALLY MODIFIED T CELLS COMPRISING A MODIFIED INTRON IN THE ALPHA T CELL RECEPTOR GENE |
| CA3068072A1 (en) | 2017-07-31 | 2019-02-07 | Regeneron Pharmaceuticals, Inc. | Methods and compositions for assessing crispr/cas-mediated disruption or excision and crispr/cas-induced recombination with an exogenous donor nucleic acid in vivo |
| AU2018309716A1 (en) | 2017-07-31 | 2020-01-16 | Regeneron Pharmaceuticals, Inc. | Cas-transgenic mouse embryonic stem cells and mice and uses thereof |
| JP7393328B2 (ja) | 2017-09-01 | 2023-12-06 | ジーピービー・サイエンティフィック・インコーポレイテッド | マイクロ流体を使用した治療的に活性な細胞を調製する方法 |
| KR20200055740A (ko) | 2017-09-22 | 2020-05-21 | 우시 바이올로직스 아일랜드 리미티드 | 신규한 이중특이적 cd3/cd19 폴리펩티드 복합체 |
| WO2019057122A1 (en) * | 2017-09-22 | 2019-03-28 | Wuxi Biologics (Shanghai) Co., Ltd. | NEW BISPECIFIC POLYPEPTIDE COMPLEXES |
| CN111655719A (zh) | 2017-10-27 | 2020-09-11 | 加利福尼亚大学董事会 | 内源性t细胞受体的靶向置换 |
| EP3710471A1 (en) | 2017-11-16 | 2020-09-23 | Kite Pharma, Inc. | Modified chimeric antigen receptors and methods of use |
| US11419318B2 (en) | 2017-11-30 | 2022-08-23 | Regeneran Pharmaceuticals, Inc. | Genetically modified rat comprising a humanized TRKB locus |
| CA3177757A1 (en) | 2018-02-16 | 2019-08-22 | Kite Pharma, Inc. | Modified pluripotent stem cells and methods of making and use |
| KR102647714B1 (ko) | 2018-03-19 | 2024-03-18 | 리제너론 파마슈티칼스 인코포레이티드 | CRISPR/Cas 시스템을 사용한 동물에서의 전사 조절 |
| BR112020019026A2 (pt) * | 2018-03-24 | 2020-12-29 | Regeneron Pharmaceuticals, Inc. | Animal não humano geneticamente modificado, métodos para produzir o animal não humano geneticamente modificado, para geração de uma proteína de ligação a antígeno, para obtenção de um ácido nucleico, e, para obtenção de uma célula que expressa um domínio variável de cadeia pesada de imunoglobulina humana e/ou um domínio variável de cadeia leve de imunoglobulina humana, método in vitro de produção de um domínio variável de imunoglobulina humana, ácido nucleico, célula hospedeira, célula isolada, e, domínio variável de cadeia pesada de imunoglobulina humana |
| US10760075B2 (en) | 2018-04-30 | 2020-09-01 | Snipr Biome Aps | Treating and preventing microbial infections |
| CN108424931A (zh) * | 2018-03-29 | 2018-08-21 | 内蒙古大学 | CRISPR/Cas9技术介导山羊VEGF基因定点整合的方法 |
| JP7304888B2 (ja) | 2018-04-12 | 2023-07-07 | プレシジョン バイオサイエンシズ,インク. | ヒトt細胞受容体アルファ定常領域遺伝子に特異性を有する最適化された操作されたヌクレアーゼ |
| US11851663B2 (en) | 2018-10-14 | 2023-12-26 | Snipr Biome Aps | Single-vector type I vectors |
| WO2020123691A2 (en) | 2018-12-12 | 2020-06-18 | Kite Pharma, Inc | Chimeric antigen and t cell receptors and methods of use |
| EP3904374A4 (en) * | 2018-12-27 | 2022-09-21 | Kyoto University | OBJECT MODIFIED BY A T LYMPHOCYTE RECEPTOR |
| US11737435B2 (en) | 2019-04-04 | 2023-08-29 | Regeneron Pharmaceuticals, Inc. | Non-human animals comprising a humanized coagulation factor 12 locus |
| US11891618B2 (en) | 2019-06-04 | 2024-02-06 | Regeneron Pharmaceuticals, Inc. | Mouse comprising a humanized TTR locus with a beta-slip mutation and methods of use |
| TW202112229A (zh) | 2019-06-07 | 2021-04-01 | 美商雷傑納榮製藥公司 | 包含人化白蛋白基因座之非人的動物 |
| CN114302733A (zh) * | 2019-07-03 | 2022-04-08 | 里珍纳龙药品有限公司 | 抗纽约食管鳞状细胞癌1(ny-eso-1)抗原结合蛋白及其使用方法 |
| US20220267726A1 (en) | 2019-07-18 | 2022-08-25 | Gpb Scientific, Inc. | Ordered processing of blood products to produce therapeutically active cells |
| CN115209996A (zh) | 2019-12-28 | 2022-10-18 | Gpb科学有限公司 | 用于处理颗粒和细胞的微流体盒 |
| CN111320703A (zh) * | 2020-03-11 | 2020-06-23 | 北京双赢科创生物科技有限公司 | 靶向cd22的嵌合抗原受体及其应用 |
| WO2021190580A1 (en) * | 2020-03-26 | 2021-09-30 | Wuxi Biologics (Shanghai) Co., Ltd. | Bispecific polypeptide complexes, compositions, and methods of preparation and use |
| CN114746152A (zh) * | 2020-08-23 | 2022-07-12 | 应用干细胞有限公司 | Hla-f修饰的细胞和方法 |
| EP4333892A1 (en) * | 2021-05-07 | 2024-03-13 | Senti Biosciences, Inc. | Chimeric antigen receptors and methods of use |
| EP4215042A1 (en) * | 2022-01-21 | 2023-07-26 | Max-Delbrück-Centrum für Molekulare Medizin | A non-human mammal comprising in its genome at least two human leukocyte antigen (hla) class i alleles, methods of making such mammal and uses thereof |
| CN116138212B (zh) * | 2023-01-11 | 2024-03-05 | 江苏省中医院 | 一种制备细胞因子释放综合征小鼠模型的方法及应用 |
Family Cites Families (68)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0307434B2 (en) | 1987-03-18 | 1998-07-29 | Scotgen Biopharmaceuticals, Inc. | Altered antibodies |
| JPS6463394A (en) * | 1987-09-04 | 1989-03-09 | Kyowa Hakko Kogyo Kk | Novel chimera polypeptide |
| IL86278A (en) * | 1988-05-04 | 2003-06-24 | Yeda Res & Dev | Endowing cells with antibody specificity using chimeric t cell receptor |
| SG48759A1 (en) | 1990-01-12 | 2002-07-23 | Abgenix Inc | Generation of xenogenic antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US6045796A (en) | 1992-12-17 | 2000-04-04 | Anergen, Inc. | Vaccination with peptide of MHC class II molecules for treatment of autoimmune disease |
| US5512295A (en) | 1994-11-10 | 1996-04-30 | The Board Of Trustees Of The Leland Stanford Junior University | Synthetic liposomes for enhanced uptake and delivery |
| US6001349A (en) | 1995-02-22 | 1999-12-14 | Therion Biologics Corporation | Generation of human cytotoxic T-cells specific for carcinoma self-associated antigens and uses thereof |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5869270A (en) | 1996-01-31 | 1999-02-09 | Sunol Molecular Corporation | Single chain MHC complexes and uses thereof |
| US7001614B2 (en) | 1996-08-19 | 2006-02-21 | The United States Of America As Represented By The Department Of Health And Human Services | Liposome complexes for increased systemic delivery |
| US6770291B2 (en) | 1996-08-30 | 2004-08-03 | The United States Of America As Represented By The Department Of Health And Human Services | Liposome complexes for increased systemic delivery |
| EP2305027B1 (en) | 1996-12-03 | 2014-07-02 | Amgen Fremont Inc. | Transgenic mammals having human Ig loci including plural VH and Vkappa regions and antibodies produced therefrom |
| US7112338B2 (en) | 1997-03-12 | 2006-09-26 | The Regents Of The University Of California | Cationic liposome delivery of taxanes to angiogenic blood vessels |
| US6749863B1 (en) | 1997-11-19 | 2004-06-15 | Georgetown University | Targeted liposome gene delivery |
| US6528624B1 (en) | 1998-04-02 | 2003-03-04 | Genentech, Inc. | Polypeptide variants |
| GB9823930D0 (en) | 1998-11-03 | 1998-12-30 | Babraham Inst | Murine expression of human ig\ locus |
| US7183387B1 (en) | 1999-01-15 | 2007-02-27 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US6586251B2 (en) | 2000-10-31 | 2003-07-01 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US7105348B2 (en) | 2000-10-31 | 2006-09-12 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US6992176B2 (en) | 2002-02-13 | 2006-01-31 | Technion Research & Development Foundation Ltd. | Antibody having a T-cell receptor-like specificity, yet higher affinity, and the use of same in the detection and treatment of cancer, viral infection and autoimmune disease |
| WO2003070752A2 (en) * | 2002-02-20 | 2003-08-28 | Dyax Corporation | Mhc-peptide complex binding ligands |
| US8093357B2 (en) | 2002-03-01 | 2012-01-10 | Xencor, Inc. | Optimized Fc variants and methods for their generation |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| US20090042291A1 (en) | 2002-03-01 | 2009-02-12 | Xencor, Inc. | Optimized Fc variants |
| US7317091B2 (en) | 2002-03-01 | 2008-01-08 | Xencor, Inc. | Optimized Fc variants |
| US20040072262A1 (en) | 2002-10-11 | 2004-04-15 | Montero-Julian Felix A. | Methods and systems for detecting MHC class I binding peptides |
| JP2006514549A (ja) | 2002-12-16 | 2006-05-11 | アメリカ合衆国 | Il−15を発現する組換えワクチンウイルスおよびその使用方法 |
| US20090010920A1 (en) | 2003-03-03 | 2009-01-08 | Xencor, Inc. | Fc Variants Having Decreased Affinity for FcyRIIb |
| US8388955B2 (en) | 2003-03-03 | 2013-03-05 | Xencor, Inc. | Fc variants |
| US20100069614A1 (en) | 2008-06-27 | 2010-03-18 | Merus B.V. | Antibody producing non-human mammals |
| US8218805B2 (en) | 2003-10-11 | 2012-07-10 | Charles Hornback | Wireless speaker system for use with ceiling fans |
| WO2005063815A2 (en) | 2003-11-12 | 2005-07-14 | Biogen Idec Ma Inc. | Fcϝ receptor-binding polypeptide variants and methods related thereto |
| US7534604B2 (en) | 2004-01-16 | 2009-05-19 | Regeneron Pharmaceuticals, Inc. | Fusion polypeptides capable of activating receptors |
| WO2005116072A2 (en) | 2004-05-27 | 2005-12-08 | Weidanz Jon A | Antibodies as t cell receptor mimics, methods of production and uses thereof |
| DK1802193T3 (da) | 2004-10-19 | 2014-06-10 | Regeneron Pharma | Fremgangsmåde til frembringelse af en homozygot mus til genetisk modifikation |
| CA2587766A1 (en) | 2004-11-10 | 2007-03-01 | Macrogenics, Inc. | Engineering fc antibody regions to confer effector function |
| WO2007001457A2 (en) | 2004-11-12 | 2007-01-04 | Xencor, Inc. | Antibodies operably linked to selected chemoattractants |
| EP1858925A2 (en) | 2005-01-12 | 2007-11-28 | Xencor, Inc. | Antibodies and fc fusion proteins with altered immunogenicity |
| WO2007022520A2 (en) | 2005-08-19 | 2007-02-22 | Cerus Corporation | Antibody-mediated enhancement of immune response |
| LT2578685T (lt) | 2005-08-23 | 2019-06-10 | The Trustees Of The University Of Pennsylvania | Rnr, apimančios modifikuotus nukleozidus ir jų panaudojimo būdai |
| US7910798B2 (en) | 2006-03-31 | 2011-03-22 | Medarex, Inc. | Transgenic animals expressing chimeric antibodies for use in preparing human antibodies |
| CA2702586C (en) | 2007-10-18 | 2017-08-01 | Bn Immunotherapeutics Inc. | Use of mva to treat prostate cancer |
| US8225343B2 (en) | 2008-01-11 | 2012-07-17 | Sony Computer Entertainment America Llc | Gesture cataloging and recognition |
| US8691502B2 (en) | 2008-10-31 | 2014-04-08 | Tremrx, Inc. | T-cell vaccination with viral vectors via mechanical epidermal disruption |
| US20120204278A1 (en) | 2009-07-08 | 2012-08-09 | Kymab Limited | Animal models and therapeutic molecules |
| ES2728942T3 (es) | 2010-02-08 | 2019-10-29 | Regeneron Pharma | Cadena ligera común de ratón |
| US20130185821A1 (en) | 2010-02-08 | 2013-07-18 | Regeneron Pharmaceuticals, Inc. | Common Light Chain Mouse |
| EP2552957A4 (en) | 2010-03-29 | 2013-11-20 | Zymeworks Inc | ANTIBODIES HAVING ENHANCED OR DELETED EFFECTIVE FUNCTION |
| BR122020013427B1 (pt) | 2010-06-22 | 2021-08-03 | Regeneron Pharmaceuticals, Inc | Método para fazer um camundongo, uma célula ou tecido derivado de um camundongo e um hibridoma |
| US8539547B2 (en) | 2010-08-18 | 2013-09-17 | Certes Networks, Inc. | Policy selector representation for fast retrieval |
| PL2738258T5 (pl) | 2011-02-25 | 2023-05-15 | Regeneron Pharmaceuticals, Inc. | Myszy adam6 |
| JP5893258B2 (ja) | 2011-03-31 | 2016-03-23 | フェリカネットワークス株式会社 | 情報処理装置および方法、並びにプログラム |
| US9591835B2 (en) | 2011-10-28 | 2017-03-14 | Regeneron Pharmaceuticals, Inc. | Genetically modified major histocompatibility complex animals |
| US9043996B2 (en) | 2011-10-28 | 2015-06-02 | Regeneron Pharmaceuticals, Inc. | Genetically modified major histocompatibility complex animals |
| PT3424947T (pt) * | 2011-10-28 | 2021-03-01 | Regeneron Pharma | Ratinhos com recetores de células t geneticamente modificados |
| PT3262932T (pt) | 2011-10-28 | 2019-08-26 | Regeneron Pharma | Ratinhos de complexo principal de histocompatibilidade modificados geneticamente |
| JP6285361B2 (ja) | 2011-10-28 | 2018-02-28 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | キメラ主要組織適合複合体(mhc)ii分子を発現する遺伝子改変されたマウス |
| WO2013063702A1 (en) | 2011-11-04 | 2013-05-10 | Zymeworks Inc. | Stable heterodimeric antibody design with mutations in the fc domain |
| US9547499B2 (en) | 2011-12-09 | 2017-01-17 | Microsoft Technology Licensing, Llc | Device configuration with cached pre-assembled driver state |
| WO2013126726A1 (en) * | 2012-02-22 | 2013-08-29 | The Trustees Of The University Of Pennsylvania | Double transgenic t cells comprising a car and a tcr and their methods of use |
| JP5920830B2 (ja) | 2012-09-28 | 2016-05-18 | シスメックス株式会社 | 試料調製装置および細胞分析装置 |
| AU2014218915B2 (en) | 2013-02-20 | 2017-01-19 | Regeneron Pharmaceuticals, Inc. | Non-human animals with modified immunoglobulin heavy chain sequences |
| JP6444895B2 (ja) | 2013-02-20 | 2018-12-26 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | ヒト化t細胞補助受容体を発現するマウス |
| DK2958937T3 (en) | 2013-02-22 | 2018-11-26 | Regeneron Pharma | Mice expressing humanized major histocompatibility complex |
-
2015
- 2015-09-18 EP EP15775854.1A patent/EP3193592A1/en not_active Withdrawn
- 2015-09-18 SG SG11201701040XA patent/SG11201701040XA/en unknown
- 2015-09-18 MX MX2017003640A patent/MX2017003640A/es unknown
- 2015-09-18 BR BR112017005245A patent/BR112017005245A2/pt not_active Application Discontinuation
- 2015-09-18 KR KR1020177010023A patent/KR20170083534A/ko unknown
- 2015-09-18 WO PCT/US2015/050975 patent/WO2016044745A1/en active Application Filing
- 2015-09-18 US US14/858,597 patent/US20160081314A1/en not_active Abandoned
- 2015-09-18 RU RU2017113134A patent/RU2017113134A/ru not_active Application Discontinuation
- 2015-09-18 JP JP2017515087A patent/JP2017529841A/ja active Pending
- 2015-09-18 CN CN201580050602.0A patent/CN107072184A/zh active Pending
- 2015-09-18 CA CA2959428A patent/CA2959428A1/en not_active Abandoned
- 2015-09-18 AU AU2015317370A patent/AU2015317370A1/en not_active Abandoned
-
2017
- 2017-02-09 IL IL250536A patent/IL250536A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| US20160081314A1 (en) | 2016-03-24 |
| RU2017113134A (ru) | 2018-10-19 |
| WO2016044745A1 (en) | 2016-03-24 |
| CN107072184A (zh) | 2017-08-18 |
| JP2017529841A (ja) | 2017-10-12 |
| EP3193592A1 (en) | 2017-07-26 |
| IL250536A0 (en) | 2017-03-30 |
| BR112017005245A2 (pt) | 2017-12-12 |
| CA2959428A1 (en) | 2016-03-24 |
| MX2017003640A (es) | 2017-10-31 |
| AU2015317370A1 (en) | 2017-03-23 |
| SG11201701040XA (en) | 2017-03-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20170083534A (ko) | 키메라 항원 수용체 | |
| JP7274018B2 (ja) | 外因性ターミナルデオキシヌクレオチジルトランスフェラーゼを発現する非ヒト動物 | |
| KR102557834B1 (ko) | 신규의 세포 태그의 발현 | |
| AU2018207281A1 (en) | Modulating expression of polypeptides via new gene switch expression systems | |
| CN114746109A (zh) | 靶向肿瘤新抗原性肽的免疫疗法 | |
| NZ788749A (en) | Non-human animals expressing exogenous terminal deoxynucleotidyltransferase | |
| US20220312748A1 (en) | Humanized transgenic mouse model | |
| NZ788750A (en) | Non-human animals expressing exogenous terminal deoxynucleotidyltransferase | |
| US20130291134A1 (en) | Humanized transgenic mouse model |