KR20150114984A - 디케토피페라진 및 디케토피페라진을 포함하는 조성물을 생산하는 방법 - Google Patents
디케토피페라진 및 디케토피페라진을 포함하는 조성물을 생산하는 방법Info
- Publication number
- KR20150114984A KR20150114984A KR1020157023636A KR20157023636A KR20150114984A KR 20150114984 A KR20150114984 A KR 20150114984A KR 1020157023636 A KR1020157023636 A KR 1020157023636A KR 20157023636 A KR20157023636 A KR 20157023636A KR 20150114984 A KR20150114984 A KR 20150114984A
- Authority
- KR
- South Korea
- Prior art keywords
- albumin
- dkp
- stream
- reaction
- composition
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/76—Albumins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/05—Dipeptides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P17/00—Preparation of heterocyclic carbon compounds with only O, N, S, Se or Te as ring hetero atoms
- C12P17/10—Nitrogen as only ring hetero atom
- C12P17/12—Nitrogen as only ring hetero atom containing a six-membered hetero ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/38—Albumins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/38—Albumins
- A61K38/385—Serum albumin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/36—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings condensed with carbocyclic rings or ring systems
- C07D241/50—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings condensed with carbocyclic rings or ring systems with hetero atoms directly attached to ring nitrogen atoms
- C07D241/52—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/06—Preparation of peptides or proteins produced by the hydrolysis of a peptide bond, e.g. hydrolysate products
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/14—Dipeptidyl-peptidases and tripeptidyl-peptidases (3.4.14)
- C12Y304/14005—Dipeptidyl-peptidase IV (3.4.14.5)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/62—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating the ionisation of gases, e.g. aerosols; by investigating electric discharges, e.g. emission of cathode
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
- G01N30/26—Conditioning of the fluid carrier; Flow patterns
- G01N30/28—Control of physical parameters of the fluid carrier
- G01N30/36—Control of physical parameters of the fluid carrier in high pressure liquid systems
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
- G01N30/62—Detectors specially adapted therefor
- G01N30/72—Mass spectrometers
Abstract
단백질 및 펩티드의 약학적 조성물에서 DA-DKP와 같은 디케토피페라진(diketopiperazines) (DKP)의 증가된 양을 만드는 방법을 개시한다. 본 개시는 (1) 알부민으로부터 한 쌍의 N-말단 아미노산을 절단하는 효소(예를 들면 디펩티디딜 펩티다제 IV (DPP-IV))와 알부민을 접촉하는 단계, 및 (2) DKP 형성의 원인이 되는 효과적인 조건하에서 알부민을 가열하는 단계를 포함하는, DKP를 만드는 방법을 추가적으로 제공한다. 추가적으로, 치료 사용을 위하여 개선된, 더 높은 값, DKP 조성물 및 정제된 알부민 조성물을 생산하기 위해 DKP- 및 알부민-포함하는 흐름의 처리가 또한 개시된다. 낮은 알부민 함유량을 포함하는 첫 번째 치료 DKP 조성물 이외에, 두 번째 가치있는 치료 조성물은 높은 알부민 농도에 의해 특징지어져 생산된다.
Description
방법은 디펩티디딜 펩티다제 IV(DPP-IV)와 같은 펩티다제(peptidases)를 사용하는 방법을 포함하는, 아스파르테이트-알라닌(aspartate-Alanine) 디케토피페라진(DIKETOPIPERAZINE) (DA-DKP)와 같은, 디케토피페라진 생산을 제공한다. 또한, 방법은 조성물에서 디케토피페라진(DIKETOPIPERAZINES)의 함유량을 증가시키는 단백질 및 펩티드의 약학적 조성물을 만드는 것을 제공한다. 추가적으로, 방법은 치료 사용을 위한 디케토피페라진(DIKETOPIPERAZINE)조성물 및 정제된 알부민 조성물을 생산하기 위해서 디케토피페라진(DIKETOPIPERAZINE)- 및 알부민-포함 흐름의 처리를 제공한다. 낮은 알부민 함유량을 포함하는 첫 번째 치료 디케토피페라진 조성물에 추가로, 두 번째 치료 조성물은 높은 알부민 농도에 의해 특징된 것으로 생산될 수 있다.
알부민은 수용성, 단량체의(monomeric), 구형의(globular) 단백질 (약 66 kDa의 분자량)이고, 밀리리터(milliliter) 당 0.03부터 0.05그램까지 범위의 정상농도에 존재하는, 포유류 혈액혈장에서 발견되는 가장 풍부한 단백질이다. 알부민은 삼투압(oncotic pressure) 유지를 포함하는 심장혈관 시스템에서 몇 가지 필수적 역할을 수행한다. 높은 농도의 알부민은 혈관내(intravascular)시스템으로, 주위조직(surrounding tissue)의 세포내 공간으로부터 유동체 이동에 의해 혈액혈장부피의 확장을 초래한다. 추가로, 알부민은 스테로이드호르몬, 헤민(hemin) 및 지방산(fatty acids)을 운반하는 운반단백질로서 수행한다. 또한 알부민은 혈액 pH 유지를 돕고 응고 경로에 포함된다.
상기 필수적 기능 때문에, 혈액 흐름에 있는 정상 알부민 농도는 항상성(homeostasis) 유지를 위해 필수적이다. 혈액 알부민 농도에서 감소 또는 증가는 심각한 건강 이슈를 유도할 수 있다. 혈액에서 낮은 알부민 농도, 저알부민혈증 (hypoalbuminaemia)는 트라우마(trauma), 심각한 불에 탐(burns), 및 패혈증(sepsis)로부터 뿐만아니라, 간 기능장애 및 신장(renal)장애와 같은 질병으로부터 원인이 될 수 있다. 알부민 치료로부터 혜택을 나타내는 다른 상황은 영양실조(malnutrition), 굶주림(starvation), 신장 증후군(nephrotic syndrome), 췌장염(pancreatitis) 및 복막염(peritonitis)을 포함하나, 제한하지 않는다. 상기 이유로 인하여, 용액을 포함하는 저온살균(pasteurized) 알부민은 소생시키는 유동체(fluids)로서 수술실(operating room) 및 응급의료 상황에서 종종 투여될 수 있다.
위독한 병에 상업용 인간 혈청 알부민 (HSA) 용액의 사용은 탐(burn), 급성폐손상(acute lung injury (ALI)), 및 쇼크(shock)와 같은 특정 상황에서 혈액 부피 회복을 위해 지시된다. 상기 환자에 대하여, HSA 투여는 염분(saline)과 같은 더 싼 대안체(cheaper alternatives)와 비교하여 사망률에서 감소가 전혀 없는 최근의 증거로 인하여, 논란의 여지가 있다. 추가로, 상업용 HSA 용액의 이종(heterogeneity)은 HSA 분자의 산화(oxidation) 및 절단(truncation)을 나타내고 포함한다. 상업용 HSA 용액의 진행(processing) 및 저장 중에, 단백질 절단(truncation)은 단백질의 N-말단에서 발생하고 HSA, Asp-Ala의 첫 번째 2개 아미노산의 절단(cleavage)을 초래한다. HSA의 N-말단의 고유의 본질에 기인하여, 상기 디펩티드는 아스파르테이트-알라닌 디케토피페라진(aspartate-alanine diketopiperazine)(DA-DKP)라고 불리우고, 또한 3-메틸-2,5-디케토피페라진-6-아세트산(3-methyl-2,5-diketopiperazine-6-acetic acid)으로도 알려진 사이클릭 디펩티드로 추가적으로 전환된다. DA-DKP는 상업용 HSA 용액에서 현저한 양으로 발견되었고 시험관 내 활성화된 PBMC 및 T-림프구에서 면역억제 효과를 가진다.
HSA로부터 DA-DKP의 형성 기전은 현재 알려져 있지 않으나, 펩티다제를 포함하는 N-말단 및/또는 효소 반응의 자가-분해는 이론적으로 기여할 수 있다. 또한 아데노신 디아미나제(adenosine deaminase) 복합(complexing) 단백질 2 또는 CD26 (분화 26의 클러스터(cluster))으로서 알려져 있는 디펩티디딜 펩티다제 IV (DPP-IV)는 단백질의 N-말단으로부터 Xaa-Pro 및 Xaa-Ala 디펩티드를 우선적으로 절단하는 펩티다제이다. DPP-IV 활성은 수용성 형태로서 혈액 혈청에서뿐만 아니라 면역 및 내피세포의 세포 표면상으로 보고되었다. DPP-IV의 주요 기능은 면역 반응 및 세포 분화를 조절하는 목적을 위하여 생물학적으로 활성 펩티드, 사이토카인, 및 다른 세포 표면 단백질의 수정(modification)으로 여겨진다. 또한, 신규한 기전은 콜라겐 매트릭스(collagenous matrices)로 내피세포의 침입을 유도하는 세포외 기질(extracellular matrix) (ECM)의 DPP-IV-매개된 분해를 포함하는 것을 명료하게 하였다.
DKPs는 인간 자가면역 장애를 치료하기 위한 잠재성을 포함하는, 자신의 고유의 치료 사용을 가지는 것을 나타냈다. 예를 들면, DA-DKP는 활성화된 말초 혈액 단핵 세포 및 T-림프구상에 현저한 면역억제 효과를가지는 것을 나타낸다. 미국 특허 제 6,555,543호; 미국 특허 제 7,732,403호 및 미국 특허 공개 제 US 2013-0090292 A1에 발견되는 앞에 언급된 것과 함께 연관된 HSA, DA-DKP 및 치료 처리에 관한 추가 개시 모두는 자체의 전문으로 참조로써 본 명세서에 혼합되어 있다.
따라서, 자가면역 및 다른 장애 치료를 위한 잠재성 치료 사용 및 저알부민혈증 (hypoalbuminaemia), 저혈량증(hypovolemia) 및 다양한 다른 장애를 치료하기 위한 알부민의 중요성에 주여져, 높은 질적 치료 DKP 조성물 및 높은 질적 알부민 소생시키는 유동체(fluids) 모두에 대한 필요성이 있다. 상기 개시는 효율적, 높은-산출 과정에서 상기 치료 조성물 모두를 생산하기 위한 방법과 관련이 있다.
수반되는 도면은 측면, 실시형태, 또는 구성이 어떻게 만들어지고 사용될 수 있는지의 실시예를 도해하는 설명서의 부분으로 혼합되고 형성되고 실시예에 단지 삽화를 넣고 및 설명되는 측면, 실시형태, 또는 구성을 제한하는 것으로서 이해되지 않는다. 추가적으로 특성 및 장점은 하기의, 더욱 상세히 설명된, 다양한 측면, 실시형태, 또는 구성의 설명로부터 명백하게 될 것이다.
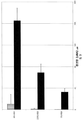
도 1은 5% 상업용 HSA 용액에 있는 DPP-IV 활성을 설명한다. DPP-IV 활성 (N=3)는 37℃에서 24 시간 배양동안 생산된 p-니트로아닐린(p-nitroaniline (pNA, μM))의 총 양으로서 대표된다. DPP-IV 억제제 (diprotin A)의 사용은 PP-IV 활성의 완전한 억제를 초래한다(데이타를 나타내지 않음).
도 2는 5% 상업용 HSA (CSL Behring)의 용액에서 DPP-IV 활성의 온도 영향을 설명한다. DPP-IV 활성 (N=3)은 37℃ (고체 바) 및 60℃ (수직선)에서 2 시간 배양 동안 생산된 p-니트로아닐린(p-nitroaniline (pNA, μM))의 총 양으로서 대표된다.
도 3은 상이한 제작 방법에 의해 생산된 HSA 용액에서 DPP-IV 활성을 설명한다. DPP-IV 활성 (N=3)는 37℃에서 24 시간 배양 동안 생산된 p-니트로아닐린(pNA, μM)의 총 양으로서 대표된다. DPP-IV 활성은 Cohn 분획(fractionation) (고체 바, cHSA)를 사용하여 생산된 상업용 HSA 용액에서 및 쌀(수직 선, rHSA)에서 생산된 재조합 HSA 용액에서 측정된다.
도 4는 60℃에서 가열되는 5% 상업용 HSA에서 DA-DKP 생산을 설명한다. DA-DKP 생산 (N=3)은 DPP-IV 억제제의 존재 (▲) 또는 부재 (■)에서 60℃에서 가열되는 5% 상업용 HSA 용액에서 상이한 시간 포인트에서 측정된다. 5% 상업용 HSA 용액의 낮은 분자량 일부 (<5kDa)은 DA-DKP 함유량에 대하여 LCMS에 의해 분리되고 분석된다. 별표(asterisk) (*)는 통계 유의성 (p<0.05) 대 물을 타지 않은(neat) 5% HSA를 대표한다.
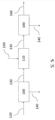
도 5는 2개 별도의 DKP-포함하는 생산물 흐름 및 하나의 알부민-포함하는 생산물 흐름을 생산하는, 2개 진행 단계 및 하나의 반응 단계를 포함하는, 본 개시의 하나의 실시형태를 설명한다.
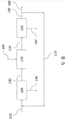
도 6는 알부민-포함하는 재생(recycle) 흐름을 포함하는, 도 5에 유사한, 본 개시의 하나의 실시형태를 설명한다.
도 7은 두 번째 진행 단계 동안 DKP 회수를 돕는 희석 흐름을 포함하는, 도 5에 유사한, 본 개시의 실시형태를 설명한다.
도 1은 5% 상업용 HSA 용액에 있는 DPP-IV 활성을 설명한다. DPP-IV 활성 (N=3)는 37℃에서 24 시간 배양동안 생산된 p-니트로아닐린(p-nitroaniline (pNA, μM))의 총 양으로서 대표된다. DPP-IV 억제제 (diprotin A)의 사용은 PP-IV 활성의 완전한 억제를 초래한다(데이타를 나타내지 않음).
도 2는 5% 상업용 HSA (CSL Behring)의 용액에서 DPP-IV 활성의 온도 영향을 설명한다. DPP-IV 활성 (N=3)은 37℃ (고체 바) 및 60℃ (수직선)에서 2 시간 배양 동안 생산된 p-니트로아닐린(p-nitroaniline (pNA, μM))의 총 양으로서 대표된다.
도 3은 상이한 제작 방법에 의해 생산된 HSA 용액에서 DPP-IV 활성을 설명한다. DPP-IV 활성 (N=3)는 37℃에서 24 시간 배양 동안 생산된 p-니트로아닐린(pNA, μM)의 총 양으로서 대표된다. DPP-IV 활성은 Cohn 분획(fractionation) (고체 바, cHSA)를 사용하여 생산된 상업용 HSA 용액에서 및 쌀(수직 선, rHSA)에서 생산된 재조합 HSA 용액에서 측정된다.
도 4는 60℃에서 가열되는 5% 상업용 HSA에서 DA-DKP 생산을 설명한다. DA-DKP 생산 (N=3)은 DPP-IV 억제제의 존재 (▲) 또는 부재 (■)에서 60℃에서 가열되는 5% 상업용 HSA 용액에서 상이한 시간 포인트에서 측정된다. 5% 상업용 HSA 용액의 낮은 분자량 일부 (<5kDa)은 DA-DKP 함유량에 대하여 LCMS에 의해 분리되고 분석된다. 별표(asterisk) (*)는 통계 유의성 (p<0.05) 대 물을 타지 않은(neat) 5% HSA를 대표한다.
도 5는 2개 별도의 DKP-포함하는 생산물 흐름 및 하나의 알부민-포함하는 생산물 흐름을 생산하는, 2개 진행 단계 및 하나의 반응 단계를 포함하는, 본 개시의 하나의 실시형태를 설명한다.
도 6는 알부민-포함하는 재생(recycle) 흐름을 포함하는, 도 5에 유사한, 본 개시의 하나의 실시형태를 설명한다.
도 7은 두 번째 진행 단계 동안 DKP 회수를 돕는 희석 흐름을 포함하는, 도 5에 유사한, 본 개시의 실시형태를 설명한다.
상기출원은 자체의 전문의 참조로써 본 명세서에 혼합된, 2013년 2월 1일에 출원된, 미국가출원 제 61/759,922호의 혜택을 청구한다.
요약
상업용 인간 혈청 알부민 (HSA)의 투여는 다수-트라우마(trauma) 환자와 같은 환자에서 잠재적으로 나타내어진다. 이질적(heterogeneous) 본질에 기인하여, 다른 구성요소는 프로테아제(proteases)와 같은, 상업용 HSA의 치료효과에 기여할 수 있다. 하나의 상기 프로테아제, 디펩티디딜 펩티다제 IV (DPP-IV)는, 아스파르테이트-알라닌 디케토피페라진(aspartate-alanine diketopiperazine) (DA-DKP), 알부민의 N-말단으로부터 알려진 면역조절인자 분자를 배출할 수 있다. 예를 들면, 콘 분획(Cohn fractionation)에 의해, 제조된 상업용 HSA 용액은 DPP-IV 활성을 가지는 것을 나타낸다.
본 개시의 일측면은 DA-DKP와 같은, DKP의 생산이다. 실시형태에서, DA-DKP는 DPP-IV의 존재에서 알부민으로부터 생산된다. 실시형태에서, DPP-IV는 인간 혈장 또는 HSA와 같은, 내인성(endogenous)이다. 실시형태에서, 혈장 또는 HSA는 가열된다. 임의의 이론으로 결합되는 것으로 바라지 않는 반면에, 가열은 DPP-IV 활성을 위한 최적 온도에 가까운 용액 온도를 높임으로써 및/또는 열(thermal) 분해에 의해 DPP-IV의 농도를 증가시킬 수 있다.
본 개시의 다른 측면은 조성물을 생산하기 위하여, DA-DKP와 같은, 알부민 및 DKP을 포함하는 공급 흐름(feed stream)을 처리하는 방법, 첫 번째 알부민-빈약 흐름 및 첫 번째 알부민-풍부 흐름을 생산하기 위하여 공급 흐름(feed stream)을 진행하는 것을 포함하는 방법이고, 상기 첫 번째 알부민-빈약 흐름은 공급 흐름(feed stream)에 존재하는 DKP의 첫 번째 부분을 포함하고, 첫 번째 알부민-풍부 흐름은 공급 흐름(feed stream)에 존재하는 DKP의 두 번째 부분을 포함한다. 첫 번째 알부민-풍부 흐름은 추가 DKP를 생산하기 위해서 반응되고, 알부민 및 DKP를 포함하는 반응 흐름을 초래한다. 반응 흐름은 두 번째 알부민-빈약 흐름 및 두 번째 알부민-풍부 흐름을 생산하기 위한 과정이고, 상기 두 번째 알부민-빈약 흐름은 반응 흐름에 존재하는 DKP의 부분을 포함하고, 두 번째 알부민-풍부 흐름은 반응 흐름에 존재하는 DKP의 두 번째 부분을 포함한다.
본 개시의 일부 실시형태에서, 알부민-풍부 흐름은 저알부민혈증 (hypoalbuminaemia) 및 저혈량증(hypovolemia)을 치료하는데 효과성을 포함하나 제한하지 않는, 치료값(therapeutic value)을 가질 수 있다. 본 개시의 일부 실시형태에서, 알부민-빈약, 생산된 DKP-포함 흐름은 염증 증상을 치료하는데 효과성을 포함하나 제한하지 않는, 치료값(therapeutic value)을 가질 수 있다.
본 개시의 추가 측면은, 상기에서 설명한 바와 같이, 분석단계를 추가적으로 포함하는, 치료 조성물을 생산하기 위한 알부민 및 DKP를 포함하는 공급 흐름(feed stream)을 처리하기 위한 방법이고, 상기 분석단계는 적어도 하나의 참조 값에 적어도 하나의 미터(metric)와 비교하여, 적어도 하나의 미터(metric)를 산출하기 위하여 알부민-풍부 흐름을 분석하는 것을 포함하고, 여기서 적어도 하나의 미터(metric)가 참조 값보다 크거나 적을 때, 반응 및 진행 단계는 후속의 알부민-풍부 흐름의 적어도 하나의 미터(metric)가 적어도 하나의 참조 값과 동등하거나 또는 미만 또는 이상일 때까지 반복된다. 예를 들면, 미터(metric)는 DA-DKP의 흐름 또는 양에서 알부민의 양일 수 있다.
본 개시의 추가 측면은 25 wt% 알부민 용액에서 5 wt% 알부민 용액 또는 약 250 g/L으로 HSA (g/L)의 리터 당 약 50 그램 알부민인, 상업용 인간 혈청 알부민 (“HSA”) 제제에서 알부민의 대략 농도의 미만을 포함하는 DKP를 포함하는 조성물이다. 본 개시의 일부 실시형태에서, DKP-포함 조성물에서 알부민의 농도는 약 250 g/L 미만, 약 200 g/L 미만, 약 100 g/L 미만, 약 50 g/L 미만, 약 40 g/L 미만, 약 30 g/L 미만, 약 20 g/L 미만, 약 10 g/L 미만, 약 5 g/L 미만, 약 4 g/L 미만, 약 3 g/L 미만, 약 2 g/L 미만, 약 1 g/L 미만, 약 0.9 g/L 미만, 약 0.8 g/L 미만, 약 0.7 g/L 미만, 약 0.6 g/L 미만, 약 0.5 g/L 미만, 약 0.4 g/L 미만, 약 0.3 g/L 미만, 약 0.2 g/L 미만, 약 0.1 g/L 미만, 약 0.09 g/L 미만, 약 0.08 미만 g/L, 약 0.07 g/L 미만, 약 0.06 g/L 미만, 약 0.05 g/L 미만, 약 0.04 g/L 미만, 약 0.03 g/L 미만, 약 0.02 g/L 미만, 약 0.01 g/L, 약 0.009 g/L 미만, 약 0.008 g/L 미만, 약 0.007 g/L 미만, 약 0.006 g/L 미만, 또는 약 0.005 g/L 미만일 수 있다. 본 개시의 더욱 추가 실시형태에서, DKP-포함 조성물의 알부민의 농도는 약 제로(zero) g/L, 또는 검출할 수 없는 양일 수 있다.
본 개시의 일부 실시형태에서, DKP를 포함하는 조성물은 염증 증상을 치료하는데 효과성을 포함하나 제한하지 않는, 치료값을 가질 수 있다.
추가로, 본 개시는 DKPs를 합성하는 방법을 제공한다. 하나의 실시형태에서, 상기 방법은 DKP의 형성에 원인이 되는데 효과적인 상황하에서 포유류 혈장을 가열하는 것을 포함한다. 실시형태에서, 상기 방법은 혈장을 DKP를 생산하는데 효과적인 상황하에서 단백질 또는 펩티드의 2개 N-말단 아미노산을 절단하는 효소와 접촉하는 것을 포함한다. 실시형태에서, 상기 방법은 혈장을 DA-DKP를 생산하는데 효과적인 상황하에서 단백질 또는 펩티드의 2개 N-말단 아미노산을 절단하는 DPP-IV와 접촉하는 것을 포함한다.
본 개시는 단백질 또는 펩티드의 개선된 약학적 조성물을 만드는 방법을 추가적으로 제공한다. 상기 방법은 단백질 또는 펩티드의 약학적 조성물에 있는 DA-DKP와 같은 DKPs의 함유량을 증가시키기 위해서 혈장을 처리하는 것을 포함한다.
또한 본 개시는 단백질 또는 펩티드의 개선된 약학적 조성물을 제공한다. 상기 개선은 DKPs의 증가된 함유량을 포함한다.
상기 선행은 본 명세서에 개시된 측면, 실시형태 및 구성의 초기 이해를 제공하기 위한 간단한 요약이다. 상기 요약은 측면, 실시형태, 또는 구성의 광범위하거나 포괄적인 개요가 아니다. 이것은 측면, 실시형태, 또는 구성의 핵심 또는 필수 요소를 인식하거나, 또는 범위를 묘사하는 것이 아닌, 하기에 기술된 더욱 상세히 설명된 설명에 도입으로서 간단한 형태로 선택되는 개념을 제시하고자 하는 것이다. 주목하게 될 것과 같이, 다른 측면, 실시형태, 및 구성은 상기에서 제시되거나 또는 하기에 상세히 설명된 하나 이상의 특성을 단독 또는 조합으로 활용하게 할 수 있다.
참조 숫자
# - 구성요소
100 - 진행 단계(processing step)
110 - 반응하는 단계(reacting step)
120 - 공급 흐름(feed stream)
130 - 알부민-풍부 흐름(albumin-rich streeam)
140 - 알부민-빈약 흐름(albumin-lean streeam)
150 - 효소 또는 촉매
160 - 최종 알부민-풍부 생산 물 흐름(final albumin-rich product stream)
170 - 알부민-풍부 재생(recycle) 흐름
180 - 희석 흐름(diluent stream)
실시형태의 상세한 설명
하기의 상세한 설명은 제한 방식이 아닌 실시예 방식으로 본 발명을 설명한다. 상기 설명은 본 발명을 만들고 사용하기 위하여 당업자에게 명백하게 할 것이다.
"하나의 실시형태," "실시형태," "실시예 실시형태," 등에 특정화된 참조는 설명된 실시형태가 특정한 특색, 구조, 또는 특성을 포함할 수 있으나, 매 실시형태가 특정한 특색, 구조, 또는 특성을 필수적으로 포함할 수는 없다는 것을 나타낸다. 추가적으로, 상기 용어는 동일한 실시형태를 참조하게 하는 것을 반드시 필료로 하는 것은 아니다. 추가적으로, 특정한 특색, 구조, 또는 특성이 실시형태로 연걸되어 설명될 때, 이것은 분명히 설명되거나 설명되지 않거나 간에 다른 실시형태와 관련되어 상기 특색, 구조, 또는 특성에 영향을 주는 하나의 당업계의 기술의 지식 내에 있다는 것을 제시한다.
본 명세서에서 사용된 바와 같이, "적어도 하나(at least one)", "하나 이상(one or more)", 및 "및/또는(and/or)" 은 작동에서 접합적(conjunctive)이고 분리적인(disjunctive) 개방-폐쇄(open-ended) 발현이다. 예를 들면, 각각의 표현 "A, B 및 C의 적어도 하나", "A, B, 또는 C의 적어도 하나", "A, B, 및 C의 하나 이상", "A, B, 또는 C의 하나 이상" 및 "A, B, 및/또는 C"는 A 단독, B 단독, C 단독, A 및 B 함께, A 및 C 함께, B 및 C 함께, 또는 A, B 및 C 함께를 의미한다.
인간 혈청 알부민 (HSA)은 리간드 결합 및 운반 성질, 산화방지제 기능, 및 효소 활성을 가지는 가장 풍부한 순환 단백질이다. HSA는 위독한 상황에서 혈액부피 및 삼투압 조절에 중요하기 때문에, 이것은 약학 산업에 의해 질량 정량적으로 생산된다. 상업용 HSA의 바람직한 제작 기술은 찬 에탄올 분획 과정(cold ethanol fractionation process)를 사용하여 HSA를 분리하는 Cohn 및 그의 동료의 방법에 기반한다. HSA의 상업용 제조는 HSA의 0.08 mmol/g의 농도에서 안정제(stabilizers) N-아세틸-트립토판(N-acetyl-tryptophan(NAT)) 및 소듐 카프릴레이트(sodium caprylate)를 항상 포함한다. HSA의 상업용 용액의 유효기간은 일반적으로 3 년이다. 활성 산소(reactive oxygen species)의 생산에 가장 가능성에 기인하여, 용액 성질에 있는 일부 나이-관련 변화는 색깔 변화, 단백질 산화(oxidation), 단백질 가수 분해(proteolysis), 응집, 및 침전과 같은 것을 관찰되었다. 결과적으로, 안정제 NAT는 시간에 걸쳐 산화되고 알려지지 않은 이용가능한 독성 데이타를 가지는 2개 주요 분해 생산물의 생산을 초래한다.
Cohn 분획(fractionation) 과정은 HSA에 대하여 특정적이지 않기 때문에, 일부 단백질 및 펩티드는 HSA로 공동-정제되고 따라서 상업용 용액에 존재한다. 추가적으로, HSA는 다수의 리간드에 결합하는 고유의 능력을 가지기 때문에, 알려진 생물학적 활성을 가지는 다른 펩티드 및 단백질은 프로테옴 기술을 사용하여 HSA의 상업용 용액에서 확인된다. 상기 공동-정제 또는 결합된 단백질은 프로테아제 (칼리크레인(kallikrein), 카텝신(cathepsin), 카르복시펩티다제(peptidases), 및 디펩티다제(peptidases)), 프로테아제 억제제(kininogen), 세포 표면 부착 단백질 (셀렉틴(selectin)), 카드헤린(cadherins), 및 ICAMs), 및 면역력에 포함된 단백질(면역글로불린 사슬(immunoglobulin chains) 및 보완 시스템의 구성요소)을 포함한다. 최근에는, 환원 조건하에서 HSA 분자의 고유의 본질적 단백질 가수 분해의 활성이 입증되었다. 따라서, 이질적(heterogeneous) 본질에 기인하여, HSA의 투여는 위독한 환자의 잠재적 부적절한 부작용을 소개할 수 있다.
단백질에 추가로, HSA의 상업용 용액은 HSA,아스파르테이트-알라닌디케토피페라진(DIKETOPIPERAZINE) 또는 DA-DKP의 첫 번째 2개 N-말단 아미노산으로부터 유래된 작은 면역억제 분자를 포함한다. DA-DKP는 Rap1 활성 증가 및 T-세포 수용체 신호 전달 경로(T-cell receptor signal transduction pathway)에 관련된 활성 인자를 감소시켜 T-세포 사이토카인 생산을 조절하는 것으로 여겨진다. HSA의 상업용 용액에서 DA-DKP의 형성 기전은 N-말단의 자가-분해 및 N-말단의 고유의 화학(chemical) 특성에 기인한 후속의 DA-DKP의 형성을 제시하는 하나의 이론으로 현재 알려져 있지 않다.
본 개시는 HSA의 상업용 용액에 있는 프로테아제의 존재, 특히 디펩티디딜 펩티다제 IV (DPP-IV)에 기반한다. 하기의 실시예에서 나타낸 바와 같이, 알려진 색소(chromogenic) 분석을 사용하여, DPP-IV 활성을 HSA의 세개의 상업용 용액에서 측정하였다. 또한, 상기 활성은 diprotin A, DPP-IV의 알려진 억제제의 사용에 의해 없애게 된다. 따라서, DPP-IV 단백질의 존재에 추가로, DPP-IV 활성은 HSA의 상업용 용액에 존재한다. 상기 활성이 재조합 HSA에 존재하지 않으므로 이것은 관찰된 DPP-IV 활성이 Cohn 분획(fractionation) 과정의 결과라는 것을 제시한다.
상업용 HSA의 생산 중에, 상기 생산물은 60℃에서 가열에 의해 10-11 시간 동안 저온살균(pasteurized)된다. 최적의 DPP-IV 활성은 65℃의 활성에서 점진적 손실을 가지는 혈청, 재조합, 및 정관(seminal) DPP-IV에서 50와 60℃사이로 보고되었다. 상기 DPP-IV의 고유의 특성은 상업용 HSA 용액에서 DA-DKP의 생산을 위한 후보로 만든다. 또한, 낮은 분자량 구성요소(HSA에 결합된 것 이외에)는 저온살균(pasteurization) 단계 이전에 대부분 제거되는 것 같다. 따라서, HSA의 상업용 용액에서 측정된 대부분의 DA-DKP는 줄곧 저온살균(pasteurization) 단계부터 처음 생산된다. 연구된 상업용 HSA 용액에서, 현저한 DPP-IV 활성은 60℃에서 측정된다. 그러나, 총 활성은 37° 배양에 존재하는 활성의 단지 70-80%이었다.
60℃에서 상업용 HSA에서 DA-DKP의 생산을 DA-DKP를 검출하기 위한 LCMS 방법을 사용하여 실험하였다. 상업용 HSA의 정동된 용액에서, DA-DKP를 60℃에서 24 시간에 걸쳐 현저한 양을 생산하였다. DPP-IV 억제제 diprotin A가 상업용 HSA 용액에 첨가되었을 때, 60℃에 생산된 DA-DKP의 양은 24 시간 기간에 걸쳐 ~3 배 감소하였다. 따라서, 상기 발견은 DPP-IV가 HSA의 상업용 용액에서 DA-DKP의 형성에 대해 부분적으로 책임이 있다는 것을 나타낸다. Diprotin A는 60℃에서 DA-DKP 형성을 완전하게 없애지 않는다. Diprotin A는 DPP-IV의 활성 부위 안에 있는 Ser630에 공유결합으로 결합된 테트라헤드럴 중간체(tetrahedral intermediate)로서 가두게 된다. Diprotin A (Ile-Pro-Ile)는 명백한 경쟁억제(competitive inhibition)로 이어지는 낮은 교체(turnover)를 가지는 DPP-IV의 기질이다. Diprotin A는 다른 DPP-IV 기질을 HSA의 N-말단과 같은 활성 부위로 허용하기 위해 60℃에서 24 시간 배양 후에 충분한 정도로 가수분해되는 것이 가능하다. DA-DKP의 효소 형성과 조합하여, DA-DKP는 HSA의 N-말단의 자가-분해를 경우하여 형성되는 것이 가능하다.
DPP-IV의 알려진 기질은 몇 가지 케모카인(chemokines), 사이토카인, 신경펩티드, 순환호르몬 및 생물활성 펩티드를 포함한다. 최대한 연구된 DPP-IV 기질의 하나는 순환 혈장 글루코오스 수준을 조절하고 따라서 제 II형 당뇨병의 병인에서 중요한 글루콘-같은(glucagon-like) 펩티드 1 (GLP-1)이다. 이전에 알려진 DPP-IV 기질은 폴리펩티드이고, HSA의 N-말단은 본 발명에 의해 기질로서 처음으로 설명된다. DPP-IV 활성 부위에 대한 HSA의 N-말단의 접근은 입체장애(steric hindrance)에 기인하여 자체 고유 확인으로 HSA와 같이 발생할 것 같지 않다. 그러나, HSA N-말단의 현저한 부분은 DA-DKP를 형성하기 위해서 DPP-IV 활성 부위에 접근하기 쉽게 되는 것이 필요하다.
임의의 이론으로 결합되지 않도록 바래는 반면, HSA의 N-말단이 DPP-IV의 활성 부위에 존재될 수 있는 적어도 2개의 방식이 있다. 첫째, 저장 동안에 상업용 용액의 HSA의 산화(oxidation)는 DPP-IV 활성 부위에 대해 더 나은 기질인 N-말단 펩티드의 생산을 초래하는 HSA 절단의 원인이 될 수 있다. 철(iron) 및 구리(copper)와 같은 산화 환원 반응 활발한 금속을 상업용 HSA의 용액에서 현저한 양으로 발견하였다. 정말로, HSA의 N-말단은 HSA N-말단 펩티드의 절단으로 유도하는 것이 가능한 활성 산소(reactive oxygen species) (ROS)의 원위치 생산을 초래할 수 있는 구리(copper)와 결합한다. 둘째, HSA의 느린 변성은 DPP-IV 기질에 더욱 접근하기 쉽게 만드는 N-말단의 펼쳐짐(unfolding)을 초래할 수 있다. 상기는 60℃에서 HSA가 N-말단 노출이 가능한 가역적 펼쳐진(unfolded) 형태에 있다는 사실에 의해 부분적으로 지지된다. 상기 가역적 펼쳐진(unfolded) 형태는 DA-DKP의 증가된 생산으로 유도하는 HSA 용액의 연장된 저장 동안에 더욱 일반적일 수 있다.
투여된 HSA의 면역억제 역량은 잘 기록되어 있다. 출혈 쇼크(hemorrhagic shock)의 래트 모델에서, HSA는 농도-의존적 패션으로 폐 삼투성 및 호중구(neutrophil) 격리를 감소시킨다. 쇼크의 유사한 래트 모델에서, 투여된 HSA는 내피(endothelium)에 면역 세포의 부착에 포함된 인자인, 인테그린(integrins) 및 ICAM-1의 발현을 현저하게 하향조절한다. 또한 HSA는 TNFα에 반응하는 호중구(neutrophils)의 호흡폭발(respiratory burst) 또는 호중구(neutrophil) 퍼짐의 선택적 및 가역적 저해를 초래하는 보완적 노출(complement exposure)을 억제한다. 최종적으로, HSA는 출혈 쇼크 모델에서 활용되는 소생시키는 유동체(resuscitation fluids)의 최소의 전-염증성(pro-inflammatory)인 것으로 발견되었다. 본 발명에 의하여, 이전의 면역학적 연구에 기반하여, DA-DKP는 HSA의 면역억제 역량에 대해 부분적으로 책임이 있는 것으로 나타난다.
HSA의 상업용 용액의 이종(heterogeneity)은 환자의 면역 상태에 의존된 위독한 환자에서 많은 유익하거나 또는 해로운 효과의 원인일 수 있다. HSA의 상업용 용액에서 확인된 최근 화합물의 일부는 면역 조절 및 기능에 포함된다. 추가적으로, 안정제(stabilizer) NAT는 혈관 삼투성 뿐만아니라 면역 및 면역 반응의 중요한 매개체, 뉴로키닌-1 수용체(neurokinin-1 receptor)의 잘-알려진 억제제이다. 본 개시는 HSA의 상업용 용액에서 마이크로몰라 농도에서 발견된 항-염증 DA-DKP의 형성의 기전을 다룬다. HSA의 상업용 용액은 알려진 DPP-IV 억제제, diprotin A에 의해 억제되는 DPP-IV 활성의 현저한 수준을 포함한다. 또한, DPP-IV 활성은 DPP-IV와 같은 다른 혈장 구성요소를 분리하는 Cohn 제작 과정에 기인하여 고유하다. 최종적으로 가열된 상업용 HSA 용액의 DA-DKP의 처음 형성은 diprotin A의 존재에서 형성의 해당 저해로 관찰되었다. 따라서, HSA의 상업용 용액에서, 펩티다제 DPP-IV는 알려진 항-염증 화합물, DA-DKP의 형성에 포함되어 있는 것으로 보인다.
본 개시의 다른 측면은 조성물을 생산하기 위한 DA-DKP와 같은, 알부민 및 DKP를 포함하는 공급 흐름(feed stream)을 처리하는 방법을 포함하고, 상기 방법은 첫 번째 알부민-빈약 흐름 및 첫 번째 알부민-풍부 흐름을 생산하기 위한 공급 흐름(feed stream)을 진행하는 것을 포함하고, 상기 첫 번째 알부민-빈약 흐름은 공급 흐름(feed stream)에 존재하는 DKP의 첫 번째 부분을 포함하고, 첫 번째 알부민-풍부 흐름은 공급 흐름에 존재하는 DKP의 두 번째 부분을 포함한다. 첫 번째 알부민-풍부 흐름은 알부민 및 DKP를 포함하는 반응 흐름을 초래하는, 추가 DKP를 생산하기 위해서 반응된다. 상기 반응 흐름은 두 번째 알부민-빈약 흐름 및 두 번째 알부민-풍부 흐름을 생산하기 위하여 진행되고, 상기 두 번째 알부민-빈약 흐름은 반응 흐름에 존재하는 DKP의 일부를 포함하고, 두 번째 알부민-풍부 흐름은 반응 흐름에 존재하는 DKP의 두 번째 일부를 포함한다.
본 개시의 일부 실시형태에서, 생산된 알부민-풍부 흐름은 저알부민혈증 (hypoalbuminaemia) 및 혈량저하증(hypovolemia)을 치료하는데 효과성을 포함하나 제한하지 않는, 상업용 HSA 제제에 의해 통상적으로 처리된 치료 상황의 치료값(therapeutic value) 일 수 있다. 본 개시의 일부 실시형태에서, 상기 생산된 알부민-빈약, DKP-포함 흐름은 염증 증상을 치료하는데 효과성을 포함하나 제한하지 않는, 치료값을 가질 수 있다.
본 개시의 일부 실시형태에서, DKP를 포함하는 적어도 2개 알부민-빈약 흐름은 단일 흐름으로 조합된다.
공급 흐름에 대한 본 명세서의 참조는 알부민 및 DKP을 포함하는 임의의 수용성 용액이다. 예를 들어, 용어 “알부민”은 인간 또는 동물 사용을 위한 치료 단백질을 생산하기 위하여 Cohn 과정, 이의 변형(variations) , 크로마토그래피, 및 임의의 다른 적절한 수단에 의한 생산된 알부민 용액과 같은, 상업용으로 이용가능한 알부민 제제를 포함한다. 또한 용어 “알부민”은 인간 및 소(bovine) 알부민을 포함하나 제한없이, 임의의 종으로부터의 알부민을 의미한다. 또한“알부민”은 박테리아 또는 포유류 발현 숙주를 사용하여 재조합 기술 및/또는 세포 발현 시스템과 같은 합성 방법에 의해 생산된다.
본 개시의 일부 실시형태에서, 알부민- 및 DKP-포함하는 공급 흐름에서 알부민의 농도는 약 1 wt. %부터 약 35 wt. %까지 범위일 수 있다. 일부 추가 실시형태에서, 공급 흐름에서 알부민의 농도는 약 2 wt. %부터 약 30 wt. %까지 범위에 있다. 더욱 추가 실시형태에서, 공급 흐름에 있는 알부민의 농도는 약 4 wt. %부터 약 26 wt. %까지의 범위에 있다. 특정 실시형태에서, 알부민의 농도는 약 5 wt. % 또는 약 25 wt. %일 수 있다.
“디케토페라진(diketopiperazine)” 또는 DKP에 대한 본 명세서의 참조는, 하기의 제제를 가지는 임의의 화합물을 의미한다:
상기 R1 및 R2는 동일하거나 또는 상이할 수 있고, 각각은 아미노산의 측쇄이고, 상기 아미노산은 글라이신(glycine), 알라닌, 발린(valine), 노르발린(norvaline)), a-아미노이소부티르산(a-aminoisobutyric acid), 2,4-디아미노부티르산(2,4-diaminobutyric acid), 2,3-디아미노부티르산 (2,3-diaminobutyric acid), 루신(leucine), 이소루신(isoleucine), 노르루신(norleucine), 세린(serine), 호모세린(homoserine), 쓰레오닌(threonine), 아스파르트산(aspartic acid), 아스파라긴(asparagine), 글루탐산(glutamic acid), 글루타민(glutamine), 라이신(lysine), 하이드록시라이신(hydroxylysine), 히스티딘(histidine), 아르기닌(arginine), 호모아르기닌(homoarginine), 시트룰린(citrulline), 페닐알라닌(phenyl alanine), p-아미노페닐 알라닌(p-aminophenyl alanine), 타이로신(tyrosine), 트립토판(tryptophan), 티록신(thyroxine), 시스테인(cysteine), 호모시스테인(homocysteine), 메티오닌(methionine), 페니실라민(penicillamine) 또는 오르니틴(ornithine)이고; 그러나, R1이 아스파라긴 (asparagine) 또는 글루타민 (glutamine)의 측쇄일 때, R2는 라이신(lysine) 또는 오르니틴 (ornithine)의 측쇄일 수 없고, R1이 라이신(lysine) 또는 오르니틴일 때, R2는 아스파라긴 또는 글루타민의 측쇄일 수 없다는 것을 제공한다.
본 개시의 일부 실시형태에서, DKP (예를 들면,존재하는 in 적어도 하나의 of 공급 흐름(feed stream), 알부민-포함하는 흐름, DKP-포함하는 흐름, 알부민-풍부 흐름, 알부민-빈약-흐름, 및 이의 조합)은 아스파르트산(aspartic acid)-알라닌 디케토피페라진(DA-DKP), 메티오닌-아르기닌 디케토피페라진(MR-DKP), 글루탐산(glutamic acid)-알라닌 디케토피페라진(EA-DKP), 타이로신-글루탐산 디케토피페라진(YE-DKP), 글라이신-루신 디케토피페라진(GL-DKP), 프롤린-페닐알라닌 디케토피페라진(PF-DKP) 알라닌-프롤린 디케토피페라진(AP-DKP) 및 이의 조합의 적어도 하나를 포함할 수 있다. 본 개시의 일부 실시형태에서, DKP(예를 들면, 공급 흐름(feed stream), 알부민-포함하는 흐름, DKP-포함하는 흐름, 알부민-풍부 흐름, 알부민-빈약-흐름, 및 이의 조합의 적어도 하나에 존재하는)는 3-메틸-2,5-디케토피페라진-6-아세트산으로 알려진, DA-DKP, 상기 R1은 -CH2-COOH이고 R2는 -CH3를 포함할 수 있다.
본 개시의 일부 실시형태에서, 공급 흐름은 약 0 μM DKP부터 약 200 μM DKP까지의 범위의 DKP 농도를 포함할 수 있다. 본 개시의 더욱 추가적 실시형태에서, 공급 흐름은 약50 μM DKP부터 약100 μM DKP까지의 DKP 농도 범위를 포함할 수 있다. 본 개시의 일부 실시형태에서, DKP는 적어도 50% DA-DKP, 적어도 60% DA-DKP, 적어도 70% DA-DKP, 적어도 80% DA-DKP, 적어도 90% DA-DKP, 적어도 95% DA-DKP, 적어도 98% DA-DKP, 적어도 99% DA-DKP, 적어도 99.9% DA-DKP 또는 100% DA-DKP이다.
본 개시의 일부 실시형태에서, 공급 흐름(feed stream) 및 반응 흐름의 진행은 유입 흐름(incoming stream)에서 단백질 풍부 흐름으로 단백질, 예를 들면 알부민을 분리하는 단백질 분리 기술을 포함할 수 있다. 상기 기술은 여과, 크로마토그래피, 침전, 추출, 및 이의 조합의 적어도 하나를 포함할 수 있다. 본 개시의 일부 실시형태에서, 공급 흐름(feed stream) 및 반응 흐름의 적어도 하나의 진행은 여과를 포함할 수 있다. 더 추가적 실시형태에서, 공급 흐름(feed stream) 및 반응 흐름의 적어도 하나의 진행은 접선의 여과(tangential filteration)를 포함할 수 있다.
여과에 대한 본 명세서의 참조는 여과 배지를 가로질러 압력 강하(pressure drop)의 사용에 의해 남아있는 일부로부터 알부민-포함하는 공급 흐름의 하나의 분획을 분리하는 기계적 및/또는 물리적 작동이다. 본 명세서에서 사용된 바와 같이 용어 “기계적 여과(mechanical filteration)”는 크기 배제여과를 포함하나, 제한하지 않는 것을 의미한다. 본 명세서에서 사용된 바와 같이 용어 “물리적 여과(physical filteration)”는 충전 끌림(charge attraction) 및 척력(repulsion forces), 수소결합(hydrogen bonding), 및 쌍극자 상호작용(dipole interactions)과 같은 분자 간섭(molecular interacton)을 포함하나, 제한하지 않는 것을 의미한다. 여과 배지는 여과 종이, 유리섬유(glass fibers), 소결된 유리(sintered glass), sintered 소결된 금속(sintered metal), 단일체 세라믹(monolithic ceramics), 폴리메릭 멤브린(polymeric membranes), 및 규조토(diatomaceous earth)와 같은, 그러나 제한하지 않는, 여과 지원(filter aid)으로 또는 없이 이들의 임의의 하나를 포함할 수 있으나, 제한하지 않는다. 여과 배지는 친수성(hydrophilic) 및/또는 소수성(hydrophobic)일 수 있다.
본 개시의 일부 실시형태에서, 여과는 접선 유동 여과(tangential flow filteration)는 포함할 수 있다. 본 명세서에서 사용된 바와 같이, 용어 "접선 유동 여과"는 여과 배지에 관하여 알부민-포함하는 공급 흐름의 유동 방향을 의미한다. 상기 유동(flow) 방향은 접선의(tangential) (또한 “교차 유동(cross flow)”또는 “정상 유동(normal flow)”, 또는 모두의 조합일 수 있다. 접선의 유동(tangential flow)은 여과 배지 표면을 가로질러 흐름 유동의 대부분에 의해 특징된 알부민-포함하는 공급 흐름을 의미하고, 상기 정상 유동(normal flow)는 여과 배지 표면에 관하여 90°각도에서, 여과 배지를 통하여 흐름 유동(stream flowing)의 대부분에 특징화된 알부민-포함하는 공급 흐름을 의미한다.
본 개시의 일부 실시형태에서, 여과의 유형, 또는 다른 진행 유닛 작동 (예를 들면, 크로마토그래피)을 통하여 유동의 원인이 되는 압력 강하(pressure drop)는 펌프를 사용하여 공급 흐름(feed stream) 및 반응 흐름의 적어도 하나를 주입(압력을 가하여)하여, 또는 진공에 여과 배지의 하향-흐름-면(down-stream-side)을 당하게 하여, 또는 여과 배지 및 원심력(centrifugal forces)에 공급 흐름 및 반응 흐름의 적어도 하나를 당하게 하여, 또는 임의의 다른 적절한 수단, 또는 이의 조합으로 완성될 수 있다. 본 명세서에서 사용된 바와 같이, 농축물(retentate) (“알부민 풍부” 및 “알부민-포함하는 면”으로서 언급됨)을 포함하는 여과 배지(filter media)의 면을 의미하는, “상향-흐름-면” 또는 알부민-포함하는 흐름에 비해, “하향-흐름-면(down-stream-side)”은 DKP-포함하는 흐름, 또는 여과액 (또한“알부민 빈약” 및 “DKP-포함하는 면”으로서 언급되는)을 포함하는 여과 배지의 면을 의미한다. 본 명세서에서 사용된 바와 같이, “진공”은 평방인치 당 절대(square inch absolute (psia)) 14.7 파운드 미만의 절대 압력을 의미한다.
본 개시의 일부 실시형태에서, 진행(processing)은 크로마토그래피를 포함할 수 있다. “크로마토그래피”에 대한 본 명세서의 참조는 정지기(stationary phase)를 가로질러 압력 강하(pressure drop)의 사용에 의해 잔여 일부로부터 공급 흐름(feed stream) 및 반응 흐름의 적어도 하나의 하나의 일부를 분리하는 기계적 및/또는 물리적 작동인 것이다. 본 명세서에서 사용된 바와 같이 용어 “mechanical 크로마토그래피”는 크기 배제크로마토그래피를 의미하나, 제한하는 것은 아니다. 본 명세서에서 사용된 바와 같이 용어 “물리적(physical) 크로마토그래피”는 친화 크로마토그래피, 이온 교환 크로마토그래피, 고속 단백질 액체 크로마토그래피 및 면역 친화 크로마토그래피를 의미하나, 제한하는 것은 아니다.
크로마토그래피 단계의 정지기(stationary phase)는 수지(resins) (예를 들면, 폴리스티렌(polystyrene), 폴리스티렌 디비닐벤젠(polystyrene divinylbenzene) 및 폴리 아크릴아미이드(polyacrylamide)), 이온 교환 수지(에를 들면, 술폰화(sulfonated), 4차 암모늄(quaternary ammonium), 카르복실레이트 및 디에틸 암모늄 기능기), 교차-연결 아가로우즈(cross-linked agarose), 교차-연결 덱스트란(cross-linked dextrans), 포스포셀룰로오스(phosphocellulose), 다공성 유리(porous glass) 및 실리카, 알루미나(alumina) 및 지르코니아 매트릭스(zirconia matrices)를 포함할 수 있으나, 제한하지 않는다. 추가적으로, 정지기(stationary phase)는 물리적 끌림, 화학적 결합에 의해, 및 또는 코팅 후 원위치 중합(polymerization)에 의해, 고체 지지 입자,또는 실린더의 내부 벽에 고정괼 수 있다. 고정된 정지기(stationary phase)는 입자 및 실린더의 외부 표면을 코팅(coat) 할 수 있고, 및/또는 고체 입자 내에 임의의 이용가능한 기공을 채울 수 있다. 접착된 정지기(bonded stationary phase)는 폴리메릭-접착(polymeric-bonded), 폴리머-이식(polymer-grafted), 뚜껑있는 정지기(capped stationary), 알킬-접착(alkyl-bonded), 페닐-접착(phenyl-bonded), 시아노-접착(cyano-bonded), 디올-접착(diol-bonded), 및 아미노-결합된정지기(amino-bonded stationary phases)로 구성되는 군으로부터 선별괼 수 있으나, 제한하지 않고, 이들의 모두는 크로마토그래피의 평범한 기술의 하나로 알려진 용어이다. 추가적으로, 정지기(stationary phase)는 항체, 단백질 수용체, 스테로이드호르몬, 비타민 및 효소 억제제를 포함하나, 제한하지 않는, 생물특정 리간드로 기능할 수 있다.
본 개시의 일부 실시형태에서, 정지기(stationary phase)는 크로마토그래피 컬럼에 정착되고 고정될 수 있다. 적어도 하나의 공급 흐름(feed stream) 및 반응 흐름은 컬럼의 유출구(outlet)에서 나가는(exiting) 알부민-풍부 및 알부민-빈약 흐름을 가지는, 크로마토그래피 컬럼의 유입구(inlet)로 공급될 수 있고, 상기 알부민-풍부 및 알부민-빈약 흐름의 분리는 용리 시간(elution times)을 다르게 하여 완성될 수 있다. 크로마토그래피 컬럼을 통하여 공급 흐름을 운반하는 압력 강하(pressure drop)는 적어도 하나의 펌프를 사용하여 적어도 하나의 공급 흐름(feed stream) 및 반응 흐름을 압력을 가하여 완성될 수 있다.
본 개시의 일부 실시형태에서, 진행은 크기 배제과정을 포함할 수 있고 상기 공급 흐름(feed stream) 또는 반응 흐름 또는 모두는 DKP를 포함하는 알부민-풍부 농축물(retentate) 흐름 및 알부민-빈약 여과액 흐름으로 분리된다. 본 개시의 일부 실시형태에서 농축물(retentate)은 약 10 kDa, 20 kDa, 30 kDa, 40 kDa, 50 kDa, 60 kDa, 70kDa, 80 kDa, 90 kDa 또는 100 kDa 이상의 분자량을 가지는 단백질을 포함하는, 알부민- 및 DKP-포함하는 공급 흐름(feed stream)에 존재하는 단백질의, 약80wt% 이상(greater than), 약 85wt% 이상, 약 90wt% 이상, 약 95wt% 이상, 또는 약 99wt% 이상을 유지한다.
본 개시의 일부 실시형태에서, DKP를 반응시키는 것은 열(thermal), 화학(chemical), 효소 진행, 및 이의 조합의 적어도 하나를 포함할 수 있다.
본 개시의 일부 실시형태에서, 알부민-포함하는 흐름을 반응시키는 것은 열-처리, 저온살균(pasteurizing), 효소 반응, 화학 반응, 및 이의 조합의 적어도 하나를 포함할 수 있다. 본 개시의 일부 실시형태에서, 알부민-포함하는 흐름을 반응하는 것은 약 40℃부터 약 80℃까지의 범위의 평균 대량 온도에 알부민-포함하는 흐름을 가열하는 것을 포함할 수 있다. 본 개시의 일부 실시형태에서, 알부민-포함하는 흐름을 반응하는 것은 약 50℃부터 약 70℃까지의 범위의 평균 대량 온도로 알부민-포함하는 흐름을 가열하는 것을 포함할 수 있다. 본 개시의 일부 실시형태에서, 알부민-포함하는 흐름을 반응하는 것은 약 55℃부터 약 65℃까지의 범위의 평균 대량 온도로 알부민-포함하는 흐름을 가열하는 것을 포함할 수 있다. 본 개시의 일부 실시형태에서, 알부민-포함하는 흐름을 반응하는 것은 약 57.5℃부터 약 62.5℃까지의 범위의 평균 대량 온도로 알부민-포함하는 흐름을 가열하는 것을 포함할 수 있다. 본 개시의 일부 실시형태에서, 알부민-포함하는 흐름을 반응하는 것은 약 60℃의 범위의 평균 대량 온도로 알부민-포함하는 흐름을 가열하는 것을 포함할 수 있다.
본 개시의 일부 실시형태에서, 알부민-포함하는 흐름을 반응하는 것은 적어도 하나의 디펩티다제, 칼리크레인(kallikrein), 카텝신(cathepsin), 카르복시펩티다제, 및 이의 조합으로 알부민-포함하는 흐름을 효소 반응하는 것을 포함할 수 있다. 본 개시의 일부 추가적 실시형태에서, 알부민-포함하는 흐름을 반응하는 것은 적어도 디펩티디딜 펩티다제 IV으로 흐름을 효소 반응하는 것을 포함할 수 있다.
본 개시의 일부 실시형태에서, 적어도 하나의 디펩티다제, 칼리크레인(kallikrein), 카텝신(cathepsin), 카르복시펩티다제, 및 이의 조합은 상업용 알부민 공급체, 또는 비-상업용 알부민 공급체로부터 받은 것과 같이 공급 흐름에 존재될 수 있다. 예를 들면, 알부민-포함하는 공급재고는 주위 상황에서 저장되어 있는 동안, 후속 반응 단계, 또는 시간 경과에 걸쳐 추가적으로 DKP를 생산할 수 있는 효소적으로 활성 디펩티다제(dipeptidases)를 포함할 수 있다. 본 개시의 일부 실시형태에서, 공급 흐름(feed stream)은 디펩티다제를 포함할 수 있고 실시예에 설명된 바와 같은 색소(chromogenic) 기질, Gly-Pro-pNA을 사용하여 분석에 측정한 바와 같이, 상기 디펩티다제 활성은 0 μM pNA 이상 부터 약 200 μM pNA까지의 범위이다. 본 개시의 일부 추가적 실시형태에서, 공급 흐름은 공급 흐름은 디펩티다제를 포함할 수 있고 상기 디펩티다제 활성은 약 40 μM pNA부터 약 140 μM pNA의 범위이다.
본 개시의 일부 추가적 실시형태에서, 적어도 하나의 디펩티다제, 칼리크레인(kallikrein), 카텝신(cathepsin), 카르복시펩티다제, 및 이의 조합은 공급 흐름(feed stream), 첫 번째 알부민-풍부 흐름, 두 번째 알부민-풍부 흐름, 임의의 이어서 알부민-풍부 흐름, 및 이의 조합의 적어도 하나에 추가될 수 있다. 본 개시의 일부 실시형태에서, 디펩티다제는 공급 흐름(feed stream), 첫 번째 알부민-풍부 흐름, 두 번째 알부민-풍부 흐름, 임의의 후속의 알부민-풍부 흐름, 및 이의 조합의 적어도 하나에 추가될 수 있다. 본 개시의 더욱 추가적 실시형태에서, 디펩티다제는 공급 흐름(feed stream), 첫 번째 알부민-풍부 흐름, 두 번째 알부민-풍부 흐름, 임의의 이어서 알부민-풍부 흐름, 및 이의 조합의 적어도 하나에 추가될 수 있고, 상기 펩티다제 활성은 0 μM pNA부터 약 200 μM pNA까지로 증가될 수 있다. 더 추가적 실시형태에서, 상기 펩티다제 활성은 약 40 μM pNA부터 약 150 μM pNA까지 증가될 수 있다.
본 개시의 일부 추가적 실시형태에서, 알부민-풍부 흐름을 반응하는 것은 철(iron) 및 구리(copper)와같은, 적어도 하나의 산화 환원 반응 활발한(redox-active) 금속을 가지는 알부민-풍부 흐름에 존재하는 알부민의 촉매 반응을 포함할수 있다. 다른 잠재성 금속 촉매는 리튬(lithium), 포타슘(potassium), 칼슘(calcium), 소듐(sodium), 마그네슘(magnesium), 알루미늄(aluminum), 아연(zinc), 니켈(nickel), 납(lead), 망간(manganese), 주석(tin), 은(silver), 백금(platinum), 금(gold), 및 이의 조합을 포함하나, 제한하지 않는다. 본 개시의 일부 실시형태에서, 알부민-풍부 흐름을 반응하는 것은 동질적(homogeneous) 촉매, 이질적(heterogeneous) 촉매, 또는 모두로서 존재하는 환원 반응 활발한(redox-active) 금속의 적어도 하나를 포함할 수 있다. 본 개시의 일부 추가적 실시형태에서, 알부민-풍부 흐름을 반응하는 것은 기질 상에 지지된 적어도 하나의 산화 환원 반응 활발한 금속을 포함하는 고체 촉매를 포함하는 충전층 반응기(packed-bed 반응기)를 통하여 흐름을 지나가게 하는 것을 포함할 수 있다. 본 개시의 일부 추가적 실시형태에서, 알부민-풍부 흐름을 반응하는 것은 슬러리 반응기에서 알부민을 반응하는 것을 포함할 수 있고, 상기 산화 환원 반응 활발한 금속은 액체 혼합물에 현탁되고 및/또는 혼합을 위한 수단을 사용하여 혼합된다.
본 개시의 일부 실시형태에서, 알부민-풍부 흐름 반응을 위한 반응기는 회분식(batch) 반응기, 연속식 반응기, 및 이의 조합을 포함할 수 있다. 일부 추가적 실시형태에서, 반응기는 젓는-탱크 반응기, 연속식 젓는-탱크 반응기, 충전층 반응기, 플러그-유동(plug flow) 반응기, 및 이의 조합을 포함할 수 있다.
본 개시의 일부 실시형태에서, 알부민-풍부 흐름을 반응하는 것은 주위 온도보다 높은 대량 온도로 알부민-풍부 흐름을 가열하는 것을 포함할 수 있다. 예를 들면, 일부 실시형태에서, 알부민-풍부 흐름을 반응하는 것은 알부민 및 DKP가 변성(denatured)되는 온도 미만 및 약 20℃ 이상, 약 30℃ 이상, 약 40℃ 이상, 약 50℃ 이상, 약 60℃ 이상, 약 70℃ 이상, 또는 약 80℃ 이상인 온도로 흐름을 가열하는 것을 포함할 수 있다. 본 개시의 일부 더욱 추가적 실시형태에서, 알부민-풍부 흐름을 반응하는 것은 알부민-풍부 흐름을 가열하는 것 및 알부민-풍부 흐름을 적어도 효소 반응 및/또는 화학 반응하는 것 모두를 포함할 수 있다.
본 개시의 일부 실시형태에서, 알부민 및 DKP 이외에, 공급 흐름은 얼마간의 추가 구성요소를 포함할 수 있다. 상기 구성요소는 알부민 용액이 생산되거나, 또는 그들이 합성적으로 생산된 알부민의 합성 방법으로부터 일어나는 종(species) 는 Cohn 과정 및 이의 변형(variations)을 사용하여 혈액 혈장의 정제를 제한하지 않는, 고유 생산물을 정제하는 동안 소개되거나 생산되는 종일 수 있는 것으로부터의 혈액으로부터 유래되는 종에서 자연적으로 발생될 수 있다. 알부민-포함하는 공급 흐름에 도입된 종은 알부민-포함하는 공급 흐름, 합성 알부민의 전- 또는 후-합성, 또는 알부민을 발생시키는 전- 또는 후-정제에 의도적으로 첨가된 첨가제를 포함할 수 있다. 상기 첨가제는 소듐(sodium), 포타슘(potassium), N-아세틸트립토판(N-acetyltryptophan), 소듐 카프릴레이트(sodium caprylate) 및/또는 카프릴산(caprylic acid)를 포함하나, 제한하지 않는다. 고유 알부민 생산물의 정제 동안 생산된 종은 아미노산, DKPs 및 임의의 다른 화합물 또는 열(thermal), 물리적, 효소 또는 혈장 단백질을 선천적으로 발생하는 화학(chemical) 분해로부터 초래되는 종을 포함하나, 제한하지 않는다.
본 개시의 일부 실시형태에서, 첫 번째 알부민-풍부 흐름은 공급 흐름에서 적어도 약 10 중량%, 적어도 약 20 중량%, 적어도 약 30 중량%, 적어도 약 40 중량%, 적어도 약 50 중량%, 적어도 약 60 중량%, 적어도 약 70 중량%, 적어도 약 80 중량%, 적어도 약 90 중량%, 적어도 약 99 중량%, 적어도 약 99.1 중량%, 적어도 약 99.2 중량%, 적어도 약 99.3 중량%, 적어도 약 99.4 중량%, 적어도 약 99.5 중량%, 적어도 약 99.6 중량%, 적어도 약 99.7 중량%, 적어도 약 99.8 중량%, 적어도 약 99.9 중량%, 적어도 약 99.91 중량%, 적어도 약 99.92 중량%, 적어도 약 99.93 중량%, 적어도 약 99.94 중량%, 적어도 약 99.95 중량%, 적어도 약 99.96 중량%, 적어도 약 99.97 중량%, 적어도 약 99.98 중량%, 적어도 약 99.99 중량%의 알부민을 포함할 수 있다.
실시예 방식에 의해, 알부민-포함하는 공급 흐름을 진행하는 것은 공급 흐름에서 적어도 약 90 중량% 알부민을 포함하는 알부민-포함하는 흐름을 초래하는 경우에 있어서, 만약 알부민-포함하는 공급 흐름이 밀리리터(milliliter) 당 0.03 그램 알부민의 알부민 농도에서, 100 밀리리터의 알부민-포함하는 공급을 포함한다면, 진행 단계 (예를 들면,여과, 크로마토그래피, 등)로부터 초래되는 생산물 흐름은 적어도 2.7 그램의 알부민을 포함한다. 실시예에 의해 유사하게, 만약 알부민-포함하는 공급 흐름이 밀리리터 당 0.5 그램 알부민의 알부민 농도에서, 알부민-포함하는 공급의 100 밀리리터를 포함한다면, 결과물 알부민-포함하는 흐름은 적어도 45그램의 알부민을 포함한다. 상기 실시예 부피 및/또는 퍼센트 상향 또는 하향을 스케일링하는 것이, 단순한 수학을 사용하여 계산된 바와 같이, 알부민-풍부 및 알부민-빈약 흐름에 존재하는 알부민의 양으로 해당 변화를 초래할 것이라는 것은 당업계에서 보통 기술의 하나에 명백하다.
본 개시의 일부 실시형태에서, 두 번째 알부민-풍부 흐름은 반응 흐름에서 적어도 약 10 중량%, 적어도 약 20 중량%, 적어도 약 30 중량%, 적어도 약 40 중량%, 적어도 약 50 중량%, 적어도 약 60 중량%, 적어도 약 70 중량%, 적어도 약 80 중량%, 적어도 약 90 중량%, 적어도 약 99 중량%, 적어도 약 99.1 중량%, 적어도 약 99.2 중량%, 적어도 약 99.3 중량%, 적어도 약 99.4 중량%, 적어도 약 99.5 중량%, 적어도 약 99.6 중량%, 적어도 약 99.7 중량%, 적어도 약 99.8 중량%, 적어도 약 99.9 중량%, 적어도 약 99.91 중량%, 적어도 약 99.92 중량%, 적어도 약 99.93 중량%, 적어도 약 99.94 중량%, 적어도 약 99.95 중량%, 적어도 약 99.96 중량%, 적어도 약 99.97 중량%, 적어도 약 99.98 중량%, 적어도 약 99.99 중량%의 알부민을 포함할 수 있다.
본 개시의 일부 실시형태에서, 첫 번째 2개 진행 단계 이외의 진행 단계에 의해 생산된, 후속 알부민-풍부 흐름은 첫 번째 2개 진행 단계 이외의 진행 단계를 공급하는 알부민-풍부 흐름에 존재하는, 적어도 약 10 중량%, 적어도 약 20 중량%, 적어도 약 30 중량%, 적어도 약 40 중량%, 적어도 약 50 중량%, 적어도 약 60 중량%, 적어도 약 70 중량%, 적어도 약 80 중량%, 적어도 약 90 중량%, 적어도 약 99 중량%, 적어도 약 99.1 중량%, 적어도 약 99.2 중량%, 적어도 약 99.3 중량%, 적어도 약 99.4 중량%, 적어도 약 99.5 중량%, 적어도 약 99.6 중량%, 적어도 약 99.7 중량%, 적어도 약 99.8 중량%, 적어도 약 99.9 중량%, 적어도 약 99.91 중량%, 적어도 약 99.92 중량%, 적어도 약 99.93 중량%, 적어도 약 99.94 중량%, 적어도 약 99.95 중량%, 적어도 약 99.96 중량%, 적어도 약 99.97 중량%, 적어도 약 99.98 중량%, 적어도 약 99.99 중량%의 알부민을 포함할 수 있다.
본 개시의 일부 실시형태에서, 첫 번째 알부민-빈약 흐름에 존재하는 DKP의 첫 번째 부분은 공급 흐름에 존재하는, 적어도 약 5 중량%, 적어도 약 10 중량%, 적어도 약 20 중량%, 적어도 약 30 중량%, 적어도 약 40 중량%, 적어도 약 50 중량%, 적어도 약 60 중량%, 적어도 약 70 중량%, 적어도 약 80 중량%, 적어도 약 90 중량%, 또는 적어도 약 99 중량%의 DKP를 포함할 수 있다.
본 개시의 일부 실시형태에서, 두 번째 알부민-빈약 흐름에 존재하는 DKP의 첫 번째 일부는 반응 흐름에서 존재하는, 적어도 약 5 중량%, 적어도 약 10 중량%, 적어도 약 20 중량%, 적어도 약 30 중량%, 적어도 약 40 중량%, 적어도 약 50 중량%, 적어도 약 60 중량%, 적어도 약 70 중량%, 적어도 약 80 중량%, 적어도 약 90 중량%, 또는 적어도 약 99 중량%의 DKP를 포함할 수 있다.
본 개시의 일부 실시형태에서, 첫 번째 2개 진행 단계 이외의 진행 단계에 기인하여, 후속 알부민-빈약 흐름에서 존재하는 DKP의 후속 일부는 첫 번째 2개 진행 단계 이외의 진행 단계를 공급하는 알부민-풍부 흐름에 존재하는, 적어도 약 5 중량%, 적어도 약 10 중량%, 적어도 약 20 중량%, 적어도 약 30 중량%, 적어도 약 40 중량%, 적어도 약 50 중량%, 적어도 약 60 중량%, 적어도 약 70 중량%, 적어도 약 80 중량%, 적어도 약 90 중량%, 또는 적어도 약 99 중량%의 DKP를 포함할 수 있다.
본 개시의 일부 실시형태에서 첫 번째 알부민-빈약 흐름은 적어도 약 10 μM, 적어도 약20 μM, 적어도 약 30 μM, 적어도 약 40 μM, 적어도 약 50 μM, 적어도 약 60 μM, 적어도 약 70 μM, 적어도 약 80 μM, 적어도 약 90 μM, 적어도 약 100 μM, 적어도 약 110 μM, 적어도 약 120 μM, 적어도 약 130 μM, 적어도 약 140 μM, 적어도 약 150 μM, 적어도 약 160 μM, 적어도 약 170 μM, 적어도 약 180 μM, 적어도 약 190 μM, 적어도 약 200 μM, 적어도 약 250 μM, 적어도 약 300 μM, 적어도 약 350 μM, 적어도 약 400 μM, 적어도 약 450 μM, 또는 적어도 약 500 μM의 DKP 농도를 포함할 수 있다. 더 추가적 실시형태에서, 두 번째 알부민-빈약 흐름은 적어도 약 10 μM, 적어도 약 20 μM, 적어도 약 30 μM, 적어도 약 40 μM, 적어도 약 50 μM, 적어도 약 60 μM, 적어도 약 70 μM, 적어도 약 80 μM, 적어도 약 90 μM, 적어도 약 100 μM, 적어도 약 110 μM, 적어도 약 120 μM, 적어도 약 130 μM, 적어도 약 140 μM, 적어도 약 150 μM, 적어도 약 160 μM, 적어도 약 170 μM, 적어도 약 180 μM, 적어도 약 190 μM, 적어도 약 200 μM, 적어도 약 250 μM, 적어도 약 300 μM, 적어도 약 350 μM, 적어도 약 400 μM, 적어도 약 450 μM, 또는 적어도 약 500 μM의 DKP 농도를 포함할 수 있다.
본 개시의 추가 측면은 상기에서 설명한 바와 같이, 분석단계를 추가적으로 포함하는 치료조성물을 생산하기 위하여 알부민 및 DKP를 포함하는 공급 흐름(feed stream)을 처리하는 방법이고, 상기 분석단계는 적어도 하나의 참조 값에 대하여 적어도 하나의 미터(metric)와 비교하여, 적어도 하나의 미터(metric)을 산출하기 위하여 알부민-풍부 흐름을 분석하는 것을 포함하고, 여기서 적어도 하나의 미터(metric)이 참조 값보다 크거나 미만일 때, 반응 및 진행 단계는 후속 알부민-풍부 흐름의 적어도 하나의 미터(metric)이 적어도 하나의 참조 값과 동등하거나 또는 미만 또는 이상일때까지 반복된다.
본 개시의 일부 실시형태에서, 분석단계는 고압력크로마토그래피 및 질량-분석(mass-spectroscopy), 또는 관심있는 미터(metric)를 측정하기 위한 임의의 다른 적절한 분석 방법을 포함할 수 있다. 본 개시의 일부 실시형태에서, 적어도 하나의 미터는 적어도 하나의 진행 단계 후의 남아있는 전장의 알부민 질량이고, 참조 값은 DA-DKP를 생산하기 위하여 진행될 수 있는 알부민의 이론적 최대 질량의 일부이다. 다른 실시형태에서, 적어도 하나의 미터(metric)는 적어도 하나의 진행 단계에서 생산되는 DKP의 질량이고, 참조 값은 공급 흐름에서 알부민으로부터 생산될 수 있는 DKP의 이론적 최대 질량의 일부이다.
본 개시의 일부 실시형태에서, 치료조성물을 생산하기 위한 알부민 및 DKP를 포함하는 공급 흐름을 처리하기 위한 방법은 알부민-풍부 흐름의 pH를 조정하는 것을 추가적으로 포함할 수 있다. 본 개시의 일부 실시형태에서, 공급 흐름은 pH 조정될 수 있다. 일부 추가적 실시형태에서, 알부민-풍부 흐름은 반응하는 단계 이전에 및/또는 반응하는 단계 동안에 pH 조정될 수 있다. 일부 추가적 실시형태에서, 알부민-풍부 흐름은 진행 단계 이전에 및/또는 동안 진행 단계 동안에 pH 조정될 수 있다. 알부민-풍부 흐름의 pH는 효소 반응, 촉매 반응, 열 분해, 및 이의 조합의 적어도 하나를 개선하는데 조정될 수 있다. 본 개시의 일부 실시형태에서, 알부민-풍부 흐름의 pH를 조정하는 것은 약 1.5부터 약 10.0까지의 범위로 pH 조정하는 것을 포함할 수 있다. 본 개시의 일부 추가적 실시형태에서, 알부민-풍부 흐름의 pH를 조정하는 것은 약 4.0부터 약 8.0까지의 범위로 pH 조정하는 것을 포함할 수 있다. 본 개시의 더욱 추가적 실시형태에서, 알부민-풍부 흐름의 pH는 약 생리학적 pH, 예를 들면, 약 pH 7.3-7.4로 조정될 수 있다.
본 개시의 일부 실시형태에서, 치료조성물을 생산하기 위하여 알부민 및 DKP를 포함하는 공급 흐름을 처리하기 위한 방법은 알부민-풍부 흐름을 희석하는 것을 추가적으로 포함할 수 있다. 본 개시의 일부 추가적 실시형태에서 공급 흐름(feed stream) 및 반응 흐름의 적어도 하나는 희석될 수 있다. 본 개시의 더욱 추가적 실시형태에서, 희석은 염분(saline), 락테이트 링거(Lactated Ringer’s)용액, 링거 아세테이트(Ringer’s acetate) 용액, 하이드록시에틸 전분(hydroxyethyl starch) 용액 및 덱스트로오스(dextrose) 용액으로부터 구성되는 군으로부터 선별되는 희석을 사용하여 얻을 수 있다.
희석 단계는 다양한 추가 치료값을 가지는, 알부민-빈약 흐름 및/또는 알부민-풍부 흐름에, 추가 구성요소를 참가하는 수단을 제공할 수 있다. 예를 들면, 락테이트 링거(Lactated Ringer’s)용액은 면역 반응 따위가 제대로 발휘되지 못하는 환자에서 대사성 산성 혈액증(metabolic acidosis)을 조절하는 것을 돕는, DKP에 풍부한, 알부민-빈약 흐름에 희석제로서 첨가될 수 있다. 다른 용액은 특정 환자 또는 인구(demographic)의 특정 치료 요구를 만나기 위하여, 알부민-풍부 흐름 및 알부민-빈약 흐름 중 하나 또는 모두에 첨가되는, 각각 또는 혼합물로서, 희석제로서 선택될 수 있다.
추가로, 희석 단계는 시작하는 회복 알부민 공급 물질에서 존재하는 DKP의 높은 회수 퍼센트를 가능하게 하는 대체 부피(displacement volume)를 제공하는 것을 제공할 수 있다. 본 개시의 일부 실시형태에서, 진행 단계는 크기 배제 분리를 포함할 수 있고, 상기 공급 흐름에 존재하는 알부민의 필수적 모두는 농축물(retentate)에서 보유된다. 거꾸로, 상기 실시형태에서, 필수적으로 공급 흐름에 존재하는 알부민의 아무것도 여과액으로 크기 배제 분리 유닛을 통하여 지나가지 못한다. 상기 시나리오에서, 알부민은 슬러리에 알부민 미립자를 현탁하는 액체로서 남아있는 DKP-포함하는 수용성 층으로, 슬러리에서 미립자로서 보여진다. 따라서, 여과액은 농축물(retentate)에 무엇이 남는 것으로서 필수적으로 동일한 DKP-포함하는 수용성 층이다. 추가적으로, 상기 시나리오에서, 단일-단계, 또는 심지어 다수의-단계된 크기 배제 유닛 작동은 알부민으로부터 DKP-포함하는 수용성 층의 모두를 완전하게 제거할 수 없다. 일부 도움없이, 알부민-풍부 흐름은 DKP-포함하는 수용성 층의 일부를 유지할 것이다. 희석제는 크기 배제 유닛 작동을 통하여 농축물(retentate), 또는 알부민-빈약 흐름으로, 알부민으로부터 상기 DKP-포함하는 수용성 층의 퍼센트를 으뜸이 되게하고 대체할 수 있는 액체 부피를 제공할 수 있다.
본 개시의 추가 측면은 10 중량 퍼센트 알부민 미만을 포함하는 DKP를 포함하는 조성물이다. 본 개시의 일부 실시형태에서, DKP-포함 조성물에 있는 알부민의 농도는 약 1 중량 퍼센트 미만 또는 약 0.1 중량 퍼센트 미만일 수 있다. 본 개시의 더욱 추가적 실시형태에서, DKP-포함 조성물에 있는 알부민의 농도는 약 제로 중량 퍼센트, 또는 검출불가능 한계일 수 있다.
본 개시의 일부 실시형태에서, DKP를 포함하는 조성물은 염증 증상을 치료하는데 효과성과 같은, 그러나 제한하지 않는, 치료혜택을 제공할 수 있다.
본 개시의 일부 실시형태에서, DKP는 아스파르트산-알라닌(aspartic acid-alanine) DKP, 메티오닌-아르기닌(methionine-arginine) DKP, 글루탐산(glutamic acid)-알라닌 DKP, 타이로신-글루탐산(tyrosine-glutamic acid) DKP, 글라이신-루신(glycine-leucine) DKP, 프롤린-페닐알라닌(proline-phenylalanine) DKP, 알라닌-프롤린 DKP, 및 이의 조합의 적어도 하나를 포함할 수 있다. 더 추가적 실시형태에서, DKP는 약 25 μM DKP부터 약200 μM DKP까지 범위의 농도에서 존재될 수 있다.
본 개시의 일부 실시형태에서, DKP를 포함하는 조성물은 염분(saline), 락테이트 링거(Lactated Ringer’s)용액, 링거 아세테이트(Ringer’s acetate) 용액, 하이드록시에틸 전분(hydroxyethyl starch) 용액, 덱스트로오스(dextrose) 용액, 및 이의 조합의 적어도 하나를 추가적으로 포함할 수 있다. 본 개시의 일부 실시형태에서, DKP를 포함하는 조성물은 소듐 아세틸트립토판에이트(sodium acetyltryptophanate), N-아세틸트립토판(N-acetyltryptophan), 카프릴산(caprylic acid ) 및 염 이의와같은소듐 카프릴레이트(sodium caprylate), 및 이의 조합으로 구성되는 군으로부터 선택되는 적어도 하나의 추가 구성요소를 추가적으로 포함할 수 있다. 상기 추가 구성요소는 상업용 HSA에서 통상적으로 발견되는 양으로 존재될 수 있다. 예를 들면, 상기 구성요소는 약 0.1 mM부터 약 30 mM까지의 양으로 또는 약 0.1 mM, 약 0.2 mM, 약 0.3 mM, 약 0.4 mM, 약 0.5 mM, 약 0.6 mM, 약 0.7 mM, 약 0.8 mM, 약 0.9 mM, 약 1 mM, 약 2 mM, 약 3 mM, 약 4 mM, 약 5 mM, 약 6 mM, 약 7 mM, 약 8 mM, 약 9 mM, 약 10 mM, 약 11 mM, 약 12 mM, 약 13 mM, 약 14 mM, 약 15 mM, 또는 약20 mM로부터 선택되는 범위의 낮은 끝(lower end of range)을 가지는 범위로 존재될 수 있다. 상기 범위는 약 1 mM, 약 2 mM, 약 3 mM, 약 4 mM, 약 5 mM, 약 6 mM, 약 7 mM, 약 8 mM, 약 9 mM, 약 10 mM, 약 11 mM, 약 12 mM, 약 13 mM, 약 14 mM, 약 15 mM, 약 16 mM, 약 17 mM, 약 18 mM, 약 19 mM, 약 20 mM, 약 21 mM, 약 22 mM, 약 23 mM, 약 24 mM, 약 25 mM, 약 26 mM, 약 27 mM, 약 28 mM, 약 29 mM, 약 30 mM, 약 31 mM, 약 32 mM, 약 33 mM, 약 34 mM, 또는 약 35 mM로부터 선택되는 범위의 높은 끝(higher end of range)을 가지는 범위를 가질수 있다.
본 개시의 방법은 기존에 알려진 DKPs를 합성하는 방법과 비교하여 더욱 효과적으로 DKPs의 증가된 양을 장점적으로 제공한다. 특정적으로, 본 개시의 방법의 상기 실시형태는 포유류혈장으로부터 DKP를 합성한다. 혈장은 래빗, 염소(goat), 개, 고양이, 말 또는 인간과 같은, 포유류로부터일 수 있다. 동물은 바람직하게는 인간이고, 혈장은 바람직하게는 인간 혈장이다.
혈장은 다른 단백질 및 펩티드뿐만아니라, 알부민, 면역글로불린, 및 에리트로포이에틴(erythropoietin)을 포함하는, DKPs의 합성을 위한 구성요소를 포함한다. 본 개시의 방법은 혈장으로부터 DKPs를 합성하는 것을 포함하고, 여기서 본 개시의 방법은 DKPs를 생산하는 이전의 방법과 비교하였을 때 합성된 DKPs의 양을 장점적으로 증가시킬 수 있다.
HSA는 585 아미노산 잔기를 포함하는 단일 사슬 폴리펩티드로 구성되는, 혈장에 존재하는 주요 단백질 구성요소이고, 약 66,000 달톤과 동등한 분자량을 가진다(Minghetti, P.P. et al. (1986), Molecular structure of the human albumin gene is revealed by nucleotide sequence within 11-22 of chromosome 4. J. Biol. Chem. 261, pp. 6747-6757를 참조). HSA는 HSA-포함하는 일부(HSA는 일부 V에서 분획된다)를 생산하기 위하여, Cohn 분획(fractionation), 낮은 온도 에탄올분획(fractionation) 방법, 또는 유사한 방법에 인간 혈장을 수행하고 그런 다음 다양한 정제 기술 사용을 통하여 일부를 정제하여 통상적으로 제조된다. HSA는 염석(salting out) 방법, 초여과 방법, 및 등전위 침전 방법, 전기영동 방법, 이온-교환 크로마토그래피 기술, 젤 여과 크로마토그래피 기술 및/또는 친화 크로마토그래피 기술의 하나 이상을 사용하여 정제된다.
혈장이 HSA 또는 단백질 및/또는 펩티드의 다른 용액을 생산하기 위하여 진행될 때, 상기 진행은 DKP를 형성하는데 이용가능한, 알부민, 면역글로불린, 및 에리트로포이에틴, 및 다른 단백질 및 펩티드의 양을 감소시킨다. 다른 말로 말하면, 혈장은 HSA 또는 펩티드 또는 단백질의 다른 정제된 용액과 비교하여, 다른 단백질 및 펩티드뿐만아니라, 알부민, 면역글로불린, 및 에리트로포이에틴의 양을 증가시킨다. 따라서, 본 명세서에서 설명된 본 개시의 방법의 일부는 DKPs를 생산하기 위하여 혈장을 사용한다.
따라서, 본 개시에서 사용을 위한 DKPs는 혈장을 가열하여 제조될 수 있다. “혈장”은 진행되지 않은 혈장, 또는 중성 pH에서 포스페이트 버퍼에서 혈장 용액을 언급할 수 있다. 바람직하게는, 혈장 용액은 N-말단 및/또는 C-말단 아미노산의 양성자 첨가(protonation)를 얻기 위하여 농축된 혈장용액이다(예를 들면, 약 100-500 mM). 상기 혈장은 DKPs의 형성을 일으키기 위하여, 적어도 약 2 시간, 3 시간, 4 시간, 5 시간, 6 시간, 7 시간, 8 시간, 9 시간, 10 시간, 11 시간, 12 시간, 13 시간, 14 시간, 15 시간, 16 시간, 17, 시간, 18 시간, 19 시간, 20 시간, 21 시간, 22 시간, 23 시간, 24 시간, 2 일, 3 일, 4 일, 5 일, 6 일, 7 일, 8 일, 9 일, 10 일 동안 60℃에서 가열될 수 있다. 단백질의 변성은, 바람직하게는, 피해야만 한다. 상기는 각각에 대하여, 짧은 시간을 사용하여 및/또는 약 0.02 M에서 카프릴산(caprylic acid) 또는 N-아세틸 트립토판(N-acetyl tryptophan)을 사용하여 완성될 수 있다.
본 개시에서 사용을 위한 DKPs는 혈장에서 단백질 또는 펩티드(예를 들면, 디펩티디딜 펩티다제(예를 들면, Dipeptidyl peptidases, 및 특정 DPP-IV에서)로부터 2개 N-말단 아미노산을 절단할 수 있는 효소, 또는 단백질 또는 펩티드 (예를 들면, 카르복시펩티다제)로부터 2개 C-말단 아미노산을 절단할 수 있는 효소를 가지는 혈장과 접촉하여 제조될 수 있다. 상기 반응은 단백질이 변성되는 그렇게 높지 않으나 반응 속도를 내기에 충분히 높은 온도에서, 바람직하게는 포스페이트 버퍼와 같은, 버퍼에서 pH 6-8에서 수행되어야만 한다.
실시형태에서, 원하는 DKP는 DA-DKP이고, 효소는 DPP-IV이고, 온도는 약 40℃부터 약 80℃까지, 바람직하게는 약 60℃이고, 반응 시간은 약 5시간부터 약 6 일까지이다. 실시형태에서 DPP-IV는 내인성이고 이미 혈장에 있고, 과정 또는 이의 조합 동안에 혈장에 첨가된다. 진행온도(process temperature)는 적어도 약 40, 약 41, 약 42, 약 43, 약 44, 약 45, 약 46, 약 47, 약 48, 약 49, 약 50, 약 51, 약 52, 약 53, 약 54, 약 55, 약 56, 약 57, 약 58, 약 59, 약 60, 약 61, 약 62, 약 63, 약 64, 약 65, 약 66, 약 67, 약 68, 약 69, 약 70, 약 71, 약 72, 약 73, 약 74, 약 75, 약 76, 약 77, 약 78, 약 79, 및 약 80℃일 수 있다. 반응 시간은 적어도 약 5, 약 6, 약 7, 약 8, 약 9, 약 10, 약 11, 약 12, 약 13, 약 14, 약 15, 약 16, 약 17, 약 18, 약 19, 약 20, 약 21, 약 22, 약 23 또는 more 시간, 약 1, 약 1.1, 약 1.2, 약 1.3, 약 1.4, 약 1.5, 약 1.6, 약 1.7, 약 1.8약1.9, 약 2, 약 2.1, 약 2.2, 약 2.3, 약 2.4, 약 2.5, 약 2.6, 약 2.7, 약 2.8, 약 2.9, 약 3, 약 3.1, 약 3.2, 약 3.3, 약 3.4, 약 3.5, 약 3.6, 약 3.7, 약 3.8, 약 3.9, 약 4, 약 4.1, 약 4.2, 약 4.3, 약 4.4, 약 4.5, 약 4.6, 약 4.7, 약 4.8, 약 4.9, 약 5, , 약 6, 약 7, 약 8, 약 9 또는 약 10 일 수 있다.
본 개시의 방법에 의해 만들어진 DKPs는 크기-배제 크로마토그래피(size-exclusion chromatography) (예를 들면, 센트리온(Centricon) 여과), 친화 크로마토그래피 (예를 들면, 원하는 DKP(s)에 직접적인 항체 또는 항체에 또는 끝을 잘라버린 단백질 또는 펩티드에 직접적인 항체 또는 항체에 부착된 것을 가지는 비드 컬럼을 사용하여), 음이온 교환 또는 양이온 교환과 같은 잘 알려진 방법에 의해, 이들을 포함하는, 알부민, 면역글로불린 및 에리트로포이에틴을 포함하는 상업용으로-이용가능한 약학적 조성물로부터 포함하는, 용액으로부터 정제될 수 있다. 정제된 DKPs는 상기에서 설명된 바와 같이 약학적 조성물로 사용 및 혼합될 수 있다.
DKPs는 각각의 키랄 중심(chiral centers), 축(axes) 또는 표면의 구조를 다양하게 하여 얻을 수 있다. 다른 말로 말하면, DKPs는 모든 광학 이성질체(optical isomers) (enantiomers)뿐만아니라, 모든 가능한 부분입체이성질체(diastereomers)를 포함한다.
또한 본 개시의 DKPs의 생리학적을-받아들일 수 있는 염은 본 개시의 연습에서 사용될 수 있다. 생리학적으로-받아들일 수 있는 염은 무기산(inorganic acids) (염산(hydrochloric), 브롬화 수소의(hydrobromic), 황산(sulfuric), 인산(phosphoric), 질산(nitric), 및 등과 같은), 유기산(organic acids) (아세트산(acetic), 프로피온산(propionic), 숙신산(succinic), 글리콜산(glycolic), 스테아르산(stearic), 젖산(lactic), 말산(malic), 타르타르산(tartaric), 시트르산(citric), 글루탐산(glutamic), 아스파트산(aspartic), 벤조산(benzoic), 살리실산(salicylic), 옥살산(oxalic), 아스코르빈산(ascorbic acid), 및 등과 같은) 또는 염기(약학으로-받아들일 수 있는 금속 양이온의 하이드록사이드, 카보네이트(carbonate) 또는 바이카보네이트(bicarbonate) 또는 N,N-디벤질에틸렌디아민(N,N-dibenzyl ethylenediamine), D-글루코사민(D-glucosamine), 또는 에틸렌디아민(ethylenediamine)로부터 유래된 유기 양이온과 같은)로부터유래된 염과 같은 통상의 비-독성 염을 포함한다. 염은 통상의 방식, 예를 들면, 산을 가지는 화합물의 자유 염기 형태를 중성화하여 제조된다.
상기에서 나타낸 바와 같이, 본 개시의 DKP, 또는 이의 생리학적으로-허용가능한 염은, T-세포 매개된 질병을 치료하거나 또는 T-세포의 활성을 억제하는 데 사용될 수 있다. 그렇게 하기 위해서, DKP, 또는 이의 생리학적으로-허용가능한 염은 상기 치료의 필요에서 동물에게 투여된다. 바람직하게는, 동물은 래빗, 염소(goat), 개, 고양이, 말 또는 인간과 같은 포유류이다. 본 개시의 화합물을 위한 과적 용량 형태, 투여 모드 및 용량은 실증적으로 결정될 수 있고, 만드는 상기 결정은 당업계의 기술 내에 있다. 용량이 수행되는 특정 화합물, 치료되는 질병 또는 증상, 질병 또는 증상의 심각성, 투여 경로, 화합물의 배설율, 처리 기간, 동물에게 투여되는 임의의 다른 약물의 확인, 연령, 크기 및 동물의 종, 및 의학 및 수의학에서 알려진 인자로 다양할 것이라는 것은 당업자는 이해할 것이다. 일반적으로, 본 개시의 화합물의 적절한 매일 용량은 치료 효과를 생산하는데 효과적인 가장 낮은 용량인 화합물의 양일 것이다. 그러나, 매일 용량은 소리 의학 판단의 범위내(sound medical judgment)에서 내과의사 또는 수의사 참석으로 결정될 것이다. 원한다면, 효과적 매일 용량은 하루 동안 적절한 간격에서 별도로 투여되는, 2회, 3회, 4회, 5회, 6회 또는 용량 이하(more sub-dose)로서 투여될 수 있다. 화합물의 투여는 받아들일 수 있는 반응이 얻어질 때가지 계속되어야만 한다.
본 개시의 화합물(예, DKPs 및 이의 생리학적으로-받아들일 수 있는 염)은 경구로(orally), 비강으로(nasally), 직장으로(rectally), 질로(vaginally), 비경구로(parenterally) (예를 들면, 정맥내로(intravenously), 척수강내로(intraspinally), 복막내로(intraperitoneally), 피하의(subcutaneously), 또는 근육내의(intramuscularly)), 수조내(intracisternally), 경피의(transdermally), 두개내의(intracranially), 대뇌내(intracerebrally), 및 국소적으로(topically) (구강(buccally) 및 혀밑(sublingually)을 포함하는)를 포함하는, 투여의 임의의 적절한 경로로 치료를 위한 동물 환자에게 투여될 수 있다. 투여의 바람직한 경로는 경구(orally) 및 정맥내(intravenously)이다.
단독으로 투여되는 본 개시의 화합물이 가능한 반면에, 약학적 제제(조성물)로서 화합물을 투여하는 것이 바람직하다. 본 개시의 약학적 조성물은 하나 이상의 약학적으로-받아들일 수 있는 담체 및, 선택적으로, 하나 이상 다른 화합물, 약물 또는 다른 물질과 같이 혼합하여 유효 성분으로서 화합물 또는 본 개시의 화합물을 포함한다. 각각 담체는 제제의 다른 성분으로 호환성 있고 동물에 해롭지 않은 의미에서 "받아들일 수 있는" 임에 틀림없다. 약학적으로-받아들일 수 있는 담체는 당업계에 잘 알려져 있다. 선별된 투여 경로에 상관없이, 본 개시의 화합물은 당업자에게 알려진 통상의 방법에 의해 약학적으로-받아들일 수 있는 용량 형태로 제조된다. 예를 들면, Remington’s Pharmceutical Sciences를 참조하시오.
현재 일반적으로 설명된 본 발명은 하기의 실시예에 참조로 쉽게 이해될 것이고, 이는 본 발명의 실시형태의 특정 측면의 설명의 목적을 위하여 약하게 포함된다. 실시예는 당업계 기술의 하나가 다른 기술 및 방법이 청구항을 만족할 수 있고 청구된 발명의 범위로부터 출발 없이 수행될 수 있는 상기 기술 및 하기 실시예로부터 인식되기 때문에, 본 발명을 제한하고자 하는 것이 아니다
실시예
프로테옴 분석은 HSA 용액을 사용하여 처리에 포함되는 치료 효과, 부작용, 및 기전을 이해하기 위해서 상업용 HSA 용액에서 수행되었다. 상기 연구에서, HSA로부터 상이한 141 단백질에 해당하는 총 1219 펩티드가 확인되었다. 더욱 중요하게, 펩티다제 DPP-IV는 상업용 HSA 용액에서 긍정적으로 확인되었다. 따라서, 알라닌 잔기 후의 펩티드를 절단하는 자체의 능력에 기인하여, DPP-IV가 상업용 HSA 용액에서 DA-DKP의 형성에 포함된다는 것을 상상할 수 있다. 상기 가설을 테스트하기 위하여, HSA의 상업용으로 이용가능한 용액은 색소 기질 및 알려진 DPP-IV 억제제를 사용하여 DPP-IV 활성에 대하여 분석되었다. 또한 DPP-IV 활성의 존재는 Cohn 분획(fractionation) 과정을 경유하여 생산되지 않는 재조합 HSA 원천으로 테스트되었다. 최종적으로, HSA의 상업용 용액에서 DA-DKP 생산뿐만아니라 DPP-IV 활성에서 온도 영향을 평가하였다.
물질 및 방법
물질. 세 개의 상업적으로 이용가능한 250mL 5% HSA (w/v) 생산물(CSL Behring LLC, Kankakee, IL, USA; Grifols 생물학적s Inc., Los Angeles, CA, USA; Octapharma USA Inc., Hoboken, NJ, USA)를 연구를 걸쳐 사용되었다. N-말단 HSA 펩티드 (DAHK)는 Diosynth Inc. (Netherlands)에 의해 제작되었다. 재조합 HSA (ecoHSA™)를 Genlantis Inc. (San Diego, CA, USA)로부터 얻었고 아시아쌀(Asian Rice) (Oryza sativa)의 씨앗(seeds)에서 생산되었다. 합성 DA-DKP는 Syngene International Ltd. (India)에 의해 생산되었다. DPP-IV 기질 및 억제제를 포함하는 모든 다른 시약은 Sigma-Aldrich Co. LLC (St. Louis, MO, USA)로부터 얻었다.
DPP -IV 분석. DPP-IV 활성은 E. Nemoto, S. Sugawara, H. Takada, et al., Increase of CD26/dipeptidyl peptidase IV expression on human gingival fibroblasts upon stimulation with cytokines and bacterial components. Infect Immun 67 (1999) 6225-33에서 설명된 바와 같이, 색소 기질, Gly-Pro-pNA을 사용하여 분석되었다. 모든 반응은 0.1M HEPES, 0.12M NaCl, 5mM KCl, 8mM 글루코오스, 및 10mg/ml 소(bovine) 혈청 알부민 (BSA)로 구성되는 DPP-IV 분석 버퍼 (pH 7.6)에서 수행되었다. 5% 상업용 HSA, 재조합 HSA, 또는 버퍼 블랭크(blank) (0.9% NaCl)는 분석 버퍼 또는 분석 버퍼 단독 (-CON)에서 1mM Gly-Pro-pNA (DPP-IV 기질)로 조합된다. 배양은 2-24 시간 동안 37℃ 또는 60℃에서 수행되었다. DPP-IV 저해 연구를 위하여, 분석 버퍼에 있는 1mM diprotin A를 DPP-IV 기질 추가 이전에 37℃에서 15 분 동안 HSA 용액으로 미리 배양하였다. 모든 배양을 405nm (SpectraMax M2 spectrophotometer, Molecular Devices LLC, Sunnyvale, CA, USA)에서 읽었다. 405nm에서 각각 읽기(reading)는 테스트된 각각 HSA 용액을 위하여 -CON 배양에 대한 해당 A405로부터 DPP-IV 기질-포함 배양에 대한 A405를 빼서 정정되었다.
< 5kDa HSA 분획의 분리. DA-DKP 형성의 분석을 위하여, 엘리쿼트(aliquot)는 마이크로원심분리 여과 (Vivaspin 2, MWCO 5,000, Sartorius Stedim Biotech, Goet주석(tin)gen, Germany)에 첨가되었다. 여과는 상온에서 30 분 동안 3,500 rpm에서 원심분리되었다. <5kDa 분획은 수득되고 LCMS 분석을 위하여 별도의, 저장 튜브로 옮겨졌다.
LCMS 분석. 각각의 <5kDa 분획 & DA-DKP 합성 표준(20-2000 ng/mL)은 내부 표준(internal standard)으로서 사용된 0.01mM L-트립토판-d5 (indole-d5)으로 스파이크되었다. 50μL를 질량 분광계(spectrometer) (LCT-TOF, Micromass, UK)에 연결된 높은 성과 액체 크로마토그래피 (HPLC, Waters 2795 분리s Module, Milford, MA, USA)에 연결된 강한 음이온 교환 컬럼 (Spherisorb, S5 SAX 250 mm x 4.0 mm, Waters, Milford, MA, USA)로 주사하였다. dH2O (용매 A), 메탄올 (용매 B), 및 200mM 암모늄 포르메이트(ammonium formate) (pH 5.4, 용매 C)로 구성되는 삼중의 이동 층은 하기의 기울기를 사용하여 0.5mL/분의 유동율(flow rate)에서 사용되었다(표 1).
HPLC의 생산은 1:20 (v/v)으로 나뉘고 80 내지 1000 m/z의 스캔범위, 30 eV의 콘 전력(cone voltage), 100℃의 원천온도, 및 300℃의 가스온도로 음성전자분무이온화(negative electrospray ionization) (-ESI)를 사용하여 질량 분광계(spectrometer)로 주사되었다. DA-DKP는 DA-DKP 마이너스 단일 양성자(proton) (-H+)에 해당하는, 모니터링 [M-] = 185에 의하여 측정되었다. DA-DKP의 직쇄(straight chain), Asp-Ala는 모니터링 [M-] = 203에 의해 상기 방법으로 또한 분석될 수 있다.
통계 방법. μM로 생산된 pNA의 양은 HEPES 버퍼에 있는 pNA 몰라 흡광계수(molar extinction coefficients)에 기반하여 계산되었다. (R. Lottenberg, C.M. Jackson, Solution composition dependent variation in extinction coefficients for p-nitroaniline. Biochim Biophys Acta 742 (1983) 558-64를 참조하시오). 통계 분석은 소프트웨어 패케지 엑셀(packages Excel (Microsoft)) 및 Matlab R13 (MathWorks)을 사용하여 수행되었다. 군(group)은 p<0.05에서 유효한 수준을 가지는 2개 tailed students’ T-test를 사용하여 비교하였다. 모든 데이타는 평균 ± SD로서 보고되었다.
Results
디펩티디딜 펩티다제 IV (DPP-IV) 활성은 인간 혈청 알부민 (HSA)의 상업용 제제에서 분석되었다. 선택된 활성 분석은 문헌에서 잘 문서로 기록되어 있고 알려진 DPP-IV 기질, Gly-Pro-pNA의 절단을 포함한다. 얻어진 색원체, pNA의 해방(liberation)은 405nm에서 분광측색적(spectrophotometrically)으로 측정되었다. 5% HSA의 세개의 상업적으로 이용가능한 용액은 특정 제조사 참조없이 선택되었다. 단지 요구는 용액이 기한이 만료되지 않았고 Cohn 분획(fractionation) 과정을 사용하여 상이한 제조업체에 의해 생산되었다는 것이다. 효소 분석의 배양 온도를 위하여, 전자가 생리학적 상황을 대표하고 후자가 상업용 HSA 용액의 저온살균(pasteurization) 온도를 대표하기 때문에 37℃ 및 60℃가 선택되었다.
37℃에서 DPP-IV 활성은 모든 세개의 5% 상업용 HSA 용액에서 측정되었다. 모든 세개의 상업용 HSA 용액은 Octapharma 및 Grifols HSA 보다 약간 활성을 덜 가지는 CSL Behring HSA를 가지는 현저한 DPP-IV 활성을 포함한다(도 1). DPP-IV 활성의 양은 HSA 근원의 유효기간과 상관관계가 없다. DPP-IV는 알려진 DPP-IV 억제제 (diprotin A)의 존재에서 완전히 억제되었다. 상기는 -CON과 비교하여 전체 배양동안에 추가 색원체 생산을 초래하지 않았다(데이타를 나타내지 않음). 60℃에서 상업용 HSA 용액 (CSL Behring), DPP-IV 활성의 하나를 분석하였다. DPP-IV 활성은 현저한 수준에 존재한다도 2). 그러나, 60℃에서 DPP-IV 활성은 37℃에서 본래 DPP-IV 활성의 ~70-80%이었다. 모든 온도에서, DPP-IV 활성에 용량-반응은 HSA 용액의 증가하는 농도로 관찰되었다.
non-Cohn 분획(fractionation) 과정을 사용하여 분리된 HSA에서 DPP-IV 활성을 비교하기 위하여, 쌀에서 생산된 재조합 HSA (rHSA)를 분석하였다. Cohn 분획(fractionation) (cHSA)에 의해 생산된 상업용 HSA 용액의 하나는 또한 DPP-IV 활성 분석에 포함된다. HSA 유형 모두를 위하여, 농도는 물을 타지 않은(neat(5% w/v))부터 희석된 용액 (1% 및 2.5%)까지 범위이다. 모든 세 개의 농도에서, cHSA 용액에서 DPP-IV 활성의 양은 rHSA 용액보다 현저하게 높다(도 3). 또한, rHSA 용액에 있는 DPP-IV 활성은 분석 버퍼 단독 배양으로부터 통계적으로 현저하지 않았다. 따라서, 현저한 DPP-IV 활성은 rHSA 용액에서 존재하지 않는다.
DKP의 형성, DA-DKP를 알려진 DPP-IV 억제제 (diprotin A)의 존재 또는 부재에서 60℃에서 가열되는 상업용 HSA 용액으로 측정하였다. DA-DKP를 포함하는 HSA의 낮은 분자량 분획은 5kDa MWCO 스핀 컬럼을 사용하여 분리하였다. <5kDa 분획은 음성전자분무이온화(negative electrospray ionization) (-ESI)를 사용하여 LCMS에 의하여 DA-DKP 함유량에 대하여 분석하였다. 첫 번째 24 시간 동안, 억제제를 포함하지 않는 배양에 있는 DA-DKP 함유량은 기저선(baseline) DA-DKP 수준으로부터 30% 증가되었다(도 4). DPP-IV 억제제의 존재에서, DA-DKP 생산에서 단지 10% 증가는 60℃에서 24 시간에 걸쳐 관찰되었다.
상업용 인간 혈청 알부민 (HSA)의 투여는 다수-트라우마(trauma)환자와 같은 환자에서 잠재적으로 지시된다. 자체의 이질적(heterogeneous) 본질에 기인하여, 다른 구성요소는 프로테아제(proteases)와 같은, 상업용 HSA의 치료 효과에 기여할 수 있다. 하나의 상기 프로테아제, 디펩티디딜 펩티다제 IV (DPP-IV)는 알부민의 N-말단, 아스파르테이트-알라닌디케토피페라진(DIKETOPIPERAZINE) (DA-DKP)로부터 알려진 면역조절(immunomodulatory) 분자를 배출할 수 있다. 예를 들면, Cohn 분획(fractionation)에 의해 제조된 상업용 HSA 용액은 특정 DPP-IV 기질 및 억제제로 DPP-IV 활성을 위하여 분석되었다. 상업용 HSA 용액이 10-11 시간 동안 60℃에서 저온살균되기 때문에 DPP-IV 활성을 37℃ 및 60℃에서 분석하였다. 상업용 HSA 용액에서 DPP-IV 활성을 재조합 알부민과 같은 알부민의 다른 근원과 비교하였다. DPP-IV 활성의 현저한 수준은 상업용 HSA 용액에 존재하였다. 상기 활성은 특정 DPP-IV 억제제를 사용하여 없애고 이는 DPP-IV 활성이 상업용 HSA에 존재한다는 것을 제시한다. 또한 상기 활성은 37℃ 배양으로부터 남아있는 70-80% 활성으로 60℃에서 존재한다. DPP-IV 활성은 재조합 원천에 존재하지 않고 이는 DPP-IV 활성이 Cohn 분획(fractionation) 과정을 사용하여 생산된 알부민 용액에 단지 존재한다는 것을 제시한다. 최종적으로, DA-DKP의 형성에서 증가는 HSA 용액이 60℃에서 가열될 때 관찰되었다. 상기 형성은 DPP-IV 억제제의 존재에서 현저하게 감소되었다. HSA에서 DPP-IV 활성은 DA-DKP를 포함하는 위독한 환자를 위한 많은 부산물( by-products)의 생산을 초래한다.
실시예
2
도 5에 대하여 처음 언급하면, 본 개시의 하나의 실시형태를 치료조성물을 생산하기 위하여 알부민 및 선택적으로 DKP를 포함하는 공급 흐름(feed stream) 120을 처리하기 위한 방법, 블록 다이어그램(block diagram) 포맷에 나타낸다. 공급 흐름(feed stream) 120은 Cohn 과정에 의해 생산된 약 25 중량% 인간 혈청 알부민을 포함하고 알부민-없는 기초에서 약 50 μM DA-DKP부터 약 100 μM DA-DKP까지 범위의 농도에서 아스파르트산-알라닌디케토피페라진(DA-DKP)를 포함하는 염분(saline) 용액을 포함할 수 있다. 또한 공급 흐름(feed stream)은 다양한 농도의 소듐 아세틸트립토판에이트(sodium acetyltryptophanate), N-아세틸트립토판(N-acetyltryptophan), 및 소듐 카프릴레이트(sodium caprylate)를 포함할 수 있다. 공급 흐름은 크기 배제 분리를 제공하는 접선의 유동 여과(tangential flow filter)를 포함하는, 첫 번째 진행 단계 100에 공급되고, 상기 약 66부터 약 69 kDa 분자량 미만까지의 임의의 분자는 첫 번째 알부민-빈약 흐름 140 (여과액)에서 여과를 통하여 지나간다. 상기 실시예에서, 첫 번째 알부민-빈약 흐름은 알부민을 필수적으로 포함하지 않는다; ~0 중량% 알부민. 다른 말로 말하면, 공급 흐름(feed stream) 120에서 알부민의 약 100%는 첫 번째 알부민-풍부 흐름 130에서 보유된다. 첫 번째 알부민-빈약 흐름 140은 알부민-없는 기초 상에서, 약 50 μM DA-DKP부터 약 100 μM DA-DKP까지 DA-DKP농도 범위를 가지는 염분(saline) 용액을 포함한다. 농축물(retentate)은 접선 유동 여과를 통하여 강제적이지 않는 임의의 DKP-포함하는 염분(saline) 용액뿐만아니라, 첫 번째알부민-풍부 흐름 130에서, 약 66부터 약 69 kDa까지의 분자량을 가지는 임의의 분자를 유지한다.
상기 실시예에서, DA-DKP의 이론적 최대 양은 열(thermal), 화학(chemical), 및/또는 알부민의, N-말단 및/또는 C-말단 끝, 또는 연속적 끝의 효소 분해의 생산물로서, 또는 비반응된 알부민으로서, 공급 흐름(feed stream) 120에 존재한다.
도 5에 대하여 참조하면, 첫 번째 알부민-풍부 흐름 130은 반응하는 단계 110에 공급되었다. 반응하는 단계는 온도 및 pH 조절 반응기(controlled reactor), 예를 들면 젓는 탱크 반응기 또는 발효 용기(fermentation vessel)에 유사한 용기(vessel)를 포함할 수 있다. 상기 실시예에서, 효소 150은 황산 희석을 추가하여 약 5.0의 pH에서 유지되고 약 50℃에서 유지되는 가열된 반응기에 존재하고, 생산되고, 및/또는 계량된다(나타내지 않음). 상기 특정 실시예에서, 효소가 첨가된 150은 디펩티디딜 펩티다제 IV를 포함한다. 충분한 디펩티디딜 펩티다제 IV (DPP-IV)는 약 40 μM pNA 부터 약 150 μM pNA까지의 펩티다제 활성을 제공하기 위하여 반응하는 단계 110에 첨가된다. 상기 실시예에서 반응하는 단계 110은 회분식(batch) 반응기이고, 상기 반응체, 알부민 및 DPP-IV는 세트-포인트 온도 및 약 1 시간부터 약 24 시간까지의 pH 에서 반응기에서 유지된다. 결과물 반응 흐름, 두 번째 알부민-풍부 흐름 130은 두 번째 진행 단계 100에서 후속적으로 진행된다.
상기 특정 실시예에서, 반응하는 단계는 알부민의 N-말단 및/또는 C-말단 끝, 또는 연속적 끝의 효소 분해에 의해 추가 DA-DKP의 현저한 양을 생산한다. 상기는 알부민-없는 기초 상에서, 두 번째 알부민-풍부 흐름 130에서 DA-DKP의 농도에서 증가를 초래할 수 있다. 공급 흐름(feed stream) 120 DA-DKP농도가 알부민-없는 기초 상에서, 약 50 μM DKP부터 약 100 μM DA-DKP까지 범위를 가지는 반면에, 두 번째 알부민-풍부 흐름 130 DA-DKP 농도는 알부민-없는 기초 상에서, 약 100 μM DKP부터 약 150 μM DA-DKP까지의 범위일 수 있다.
두 번째 알부민-풍부 흐름 130은 두 번째 진행 단계 100에 공급된다. 상기 실시예에서, 두 번째 진행 단계 100은 두 번째 비의존적 유닛 작동이다. 따라서, 이것은 두 번째 접선의 유동 여과 유닛, 또는 일부 함께 상이한 기술; 예를 들면,크로마토그래피 컬럼일 수 있다. 대안적으로, 두 번째 진행 단계는 첫 번째 진행 단계에서 사용된 동일한 장비를 사용하여, 예를 들면, 회분식(batch) 또는 반-회분식 모드에서 진행을 달려, 완성될 수 있다. 상기 실시예에서, 두 번째 진행 단계 100는 상기 실시예 2에서 설명된 첫 번째 유닛으로서 동일한 원칙을 운영하는 두 번째로 헌신한 접선 유동 여과 유닛이다.
상기 실시예 2에서, 상기에서 설명한 바와 같이, 두 번째 알부민-풍부 흐름 130은 공급 흐름(feed stream) 120보다 더 높은 DA-DKP농도를 포함한다. 그러나, 첫 번째 진행 단계 100동안 제거된 염분(saline)에 기인하여 존재하는 알부민-없는 염분(saline) 용액이 적게있다. 따라서, 상기 실시예 2에서 DA-DKP의 이론적 양의 산출에 증대하는 이득(gain)은 본질적으로 크다.
두 번째 알부민-풍부 흐름 130의 여과는 알부민-없는 기초 상에서 약 100 μM DKP부터 약 150 μM DA-DKP까지의 DA-DKP농도 범위를 가지는 염분(saline) 용액을 포함하는, 최종 알부민-풍부 생산물 흐름 160, 첫 번째 치료조성물, 및 두 번째 알부민-빈약 (알부민-free in 상기 case) 흐름 140을 초래한다. 첫 번째 및 두 번째 알부민-빈약 DA-DKP-포함하는 흐름은 두 번째 치료조성물을 형성하는, 하나의 흐름으로 조합될 수 있다. 예를 들면, 알부민-풍부 생산물 흐름 160은 영양실조(malnutrition), 굶주림(starvation), 신장 증후군(nephrotic syndrome), 췌장염(pancreatitis) 및 복막염(peritonitis)와 같은, 그러나 제한하지 않는, 증상을 치료하는데 사용될 수 있다. 알부민-없는 흐름을 포함하는 조합된 DA-DKP는 인간 자가면역 장애을 치료하는데 사용될 수 있다.
비록 도 5가 단지 하나의 반응하는 단계 110 및 단지 2개 진행 단계 100를 설명한다 할지라도, 상기는 하나의 반응하는 단계 및 2개 진행 단계에 본 개시의 범위를 제한하는 것을 의도하는 것은 아니다. 추가 반응및 진행 단계는 DA-DKP 산출을 추가적으로 증가시킬 수 있다. 예를 들면, 누적 산출은 세 개의 반응하는 단계 110 및 4개 진행 단계 100 후에 얻을 수 있다. 당업계의 기술의 하나는 진행 및 반응하는 단계의 수, 및 하나의 다른에 관하여 그들의 배열(예를 들면, 연속으로, 평행으로, 재생 루프(recycle loops)로, 재생 루프 없이, 등)이 위치-대-위치(site-to-site)로부터 및 응용-대-응용(application-to-application)로부터 다양한 종합적 경제 분석(comprehensive economic analysis)에 의존할 것이라는 것을 이해할 것이다.
실시예
3
현재 도 6를 언급하면, 실시예 2의 변형은 치료 조성물을 생산하기 위하여, 추가적으로 알부민-풍부 재생(recycle) 흐름 170을 포함하는, 알부민 및 선택적으로 DKP를 포함하는 공급 흐름(feed stream) 120을 처리하기 위한 방법, 차단-다이아그램-포맷에서 설명된다.
또한 상기 실시예는 2개 진행 단계 100 및 하나의 반응하는 단계 110을 포함한다. 상기 실시예에서, 경우는 상기 단계 후에 DKP 산출이 받아들이기 어려울 정도로 낮은; 예를 들면, 50% 미만인 것으로 추정된다. 따라서, 두 번째 진행 단계 100으로 나가는 알부민-풍부 흐름 130은 50% 이상의 산출을 증가하기 위하여 시스템을 통하여 두 번째 패스를 알부민에게 주기 위하여, 첫 번째 진행 단계 100에 공급되기 전에 공급 흐름(feed stream) 120으로 조합되어 다시 재생되는 알부민-풍부 재생(recycle) 흐름 170으로 쪼개진다.
상기 실시예에서, 상기 진행이 연속 모드로 수행되는 것을 구성된다. 따라서, 최종 알부민-풍부 생산물 흐름 160은 진행으로부터 연속적으로 제거되고, 반면에 신선한 공급 물질 120은 진행으로부터 계속적으로 공급된다. 내부 재생(recycle) 루프 170은 진행 단계 100에서 얻어진 산출 당 의존하는 상기 흐름의 비율 및 실제 규모를 가지는, 공급 흐름(feed stream) 120 및 흐름 160보다 현저하게 클 수 있다.
실시예
4
현재 도 7을 언급하면, 하나의 추가적 실시형태는 치료조성물을 생산하기 위하여 선택적으로 DKP 및 알부민을 포함하는 공급 흐름(feed stream)을 처리하기 위한 방법을 설명하고, 상기 실시예 2는 두 번째 진행 단계 100으로 공급되는 희석 흐름 180을 포함하도록 수정된다.
상기 실시예는 진행 단계 동안 알부민으로부터 DKP-포함하는 수용성 층을 대체하는 이동 유동체를 제공하는 필요성을 구상한다. 상기 실시예에서, 락테이트 링거(Lactated Ringer’s)용액은 접선 유동 여과 유닛을 통하여 수용성 층에 존재하는 DKP 이상을 대체하는 희석 흐름 180으로서 사용된다.
본 명세서에서 적절하게 설명적으로 개시된 본 발명은 본 명세서에서 특정적으로 개시되지 않은, 임의의 요소 부재에서 실습될 수 있다. 그러나, 많은 변화, 변형(variations), 수정(modifications), 다른 사용, 및 방법에 대한 적용이 가능하고, 또한 하기의 청구항에 의해 단지 제한되는, 본 발명의 정신 및 범위로부터 출발하지 않는 변화, 변형(variations), 수정(modifications), 다른 사용, 및 적용은 본 발명에 의해 덮인 것으로 간주된다.
본 발명의 앞서 말한 논의는 삽화 및 설명의 목적을 위하여 존재된다. 앞서 말한 것은 본 명세서에 개시된 형태 또는 형태들에 본 발명을 제한하려는 의도가 아니다. 앞서 말한 상세한 설명에서 예를 들면, 본 발명의 다양한 특성은 본 개시를 능률화하는 목적을 위하여 하나 이상 실시형태에서 함께 그룹화된다. 본 발명의 실시형태의 특성은 상기에서 논의된 것보다 대체되는 실시형태에서 조합될 수 있다. 개시의 상기 방법은 청구된 발명이 각각의 청구항에서 명확히 재인용되는 것보다 더 특성을 요구하는 의도를 반영하는 것으로서 해석되지 않는다. 다소, 하기의 청구항을 반영하는 것으로서, 창의적 측면은 단일 앞서 말한 개시된 실시형태의 모든 특성 미만에 놓여있다. 따라서, 하기의 청구항은 본 발명의 별도의 바람직한 실시형태로서 자체의 자신에 위치한 각각의 청구항과 같이, 상기 상세한 설명으로써 혼합된다.
추가적으로, 본 발명의 설명이 하나 이상 실시형태 및 특정 변형(variations) 및 수정(modifications)의 설명을 포함하긴 하지만, 다른 변형(variations), 조합, 및 수정(modifications)은 예를 들면, 본 개시를 이해한 후, 당업자의 기술 및 지식 내에 있는 것처럼, 본 발명의 범위 내에 있다. 이것은 상기 대체되고, 교환가능하고 및/또는 동등한 구조, 기능, 범위 또는 단계가 임의의 특허가능한 주제를 공개적으로 전념하는 의도없이, 본 명세서에 개시되든지 아니든지, 청구된 것에 대체되고, 교환가능하고 및/또는 동등한 구조, 기능, 범위 또는 단계를 포함하는, 허용된 연장선에서 대안적 실시형태를 포함하는 권리를 얻는 것으로 의도된다.
Claims (54)
- 하기를 포함하는, 조성물을 생산하기 위한 알부민 및 아스파르트산(aspartic acid)-알라닌디케토피페라진(DIKETOPIPERAZINE) (DA-DKP)를 포함하는 공급 흐름(feed stream)을 처리하는 방법:
첫 번째 알부민-빈약 흐름 및 첫 번째 알부민-풍부 흐름을 생산하기 위한 공급 흐름(feed stream)을 진행하는 단계, 상기 첫 번째 알부민-빈약 흐름은 공급 흐름에 존재하는 DA-DKP의 첫 번째 부분을 포함하고, 첫 번째 알부민-풍부 흐름은 공급 흐름에 존재하는 DA-DKP의 두 번째 부분을 포함한다;
알부민 및 DA-DKP을 포함하는 반응 흐름(reaction stream)을 초래하는 DA- DKP를 생산하기 위해서 첫 번째 알부민-풍부 흐름을 반응시키는 단계; 및
두 번째 알부민-빈약 흐름 및 두 번째 알부민-풍부 흐름을 생산하기 위한 반응 흐름을 진행시키는 단계, 상기 두 번째 알부민-빈약 흐름은 반응 흐름에 존재하는 DA-DKP의 부분을 포함하고, 두 번째 알부민-풍부 흐름은 반응 흐름에 존재하는 DA-DKP의 두 번째 부분을 포함한다.
- 제1항에 있어서, 상기 첫 번째 및 두 번째 알부민-빈약(albimin-lean streams) 흐름의 적어도 하나는 치료값(therapeutic value)을 보유하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 첫 번째 및 두 번째 알부민-풍부 흐름(albimin-rich streams)의 적어도 하나는 치료값을 보유하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 공급 흐름(feed stream) 및 반응 흐름의 적어도 하나를 진행하는 단계는 여과, 크로마토그래피, 침전, 추출, 및 이의 조합의 적어도 하나를 포함하는 것을 특징으로 하는 방법.
- 제4항에 있어서, 상기 공급 흐름 및 반응 흐름의 적어도 하나를 진행하는 단계는 여과를 포함하고, 상기 여과는 접선의(tangential) 유동(flow) 여과를 포함하는 것을 특징으로 하는 방법.
- 제4항에 있어서, 상기 공급 흐름 및 반응 흐름의 적어도 하나를 진행하는 단계는 크로마토그래피를 포함하고, 상기 크로마토그래피는 크기-배제 크로마토그래피(size-exclusion chromatography), 친화 크로마토그래피, 음이온 교환 크로마토그래피 및 ion에리트로포이에틴(erythropoie주석(tin)) 크로마토그래피의 적어도 하나를 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 반응은 열 처리, 화학 반응, 효소 반응, 및 이의 조합의 적어도 하나를 포함하는 것을 특징으로 하는 방법.
- 제7항에 있어서, 상기 반응은 첫 번째 알부민-풍부 흐름(albumin-rich stream)을 약 40℃부터 약 80℃까지 범위의 평균 대량 온도(average bulk temperature)로 가열하는 것을 포함하는 것을 특징으로 하는 방법.
- 제7항에 있어서, 상기 반응은 디펩티다제, 칼리크레인(kallikrein), 카텝신(cathepsin), 카르복시펩티다제, 및 이의 조합의 적어도 하나를 가지는 첫 번째 알부민-풍부 흐름을 효소적으로 반응하는 것을 포함하는 것을 특징으로 하는 방법.
- 제7항에 있어서, 상기 반응은 적어도 디펩티디딜 펩티다제 IV(dipeptidyl peptidase IV)를 가지는 첫 번째 알부민-풍부 흐름을 효소적으로 반응하는 것을 포함하는 것을 특징으로 하는 방법.
- 제7항에 있어서, 상기 반응은 적어도 내인성 디펩티디딜 펩티다제 IV(endogenous dipeptidyl peptidase IV)을 가지는 첫 번째 알부민-풍부 흐름을 효소적으로 반응하는 것을 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 반응은 디펩티디딜 펩티다제 IV의 존재에서 약 40℃ 부터 약 80℃까지 범위의 평균 대량 온도로 첫 번째 알부민-풍부 흐름을 가열하는 것을 포함하는 것을 특징으로 하는 방법.
- 제12항에 있어서, 상기 디펩티디딜 펩티다제 IV는 내인성 디펩티디딜 펩티다제 IV인 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 공급 흐름(feed stream)은 소듐 아세틸트립토판에이트(sodium acetyltryptophanate), N-아세틸트립토판(N-acetyltryptophan), 소듐 카프릴레이트(sodium caprylate), 카프릴산(caprylic acid) 및 이의 조합으로 구성되는 군으로부터 선택되는 적어도 하나의 추가 구성요소를 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 DA-DKP는 수용성 DA-DKP, DA-DKP 염, 및 이의 조합으로부터 선택되는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 첫 번째 알부민-풍부 흐름은 공급 흐름(feed stream)에서 적어도 약 90 중량%의 알부민을 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 두 번째 알부민-풍부 흐름은 반응 흐름에서 적어도 약 90 중량%의 알부민을 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 첫 번째 알부민-빈약 흐름(albumin-lean stream)에서 존재하는 DA-DKP의 첫 번째 부분은, 공급 흐름에 존재하는 적어도 약 80 중량%의 DA-DKP를 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 두 번째 알부민-빈약 흐름(albumin-lean stream)에서 존재하는 DA-DKP의 첫 번째 부분은, 반응 흐름에 존재하는 적어도 약 90 중량%의 DA-DKP를 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 첫 번째 알부민-빈약 흐름은 적어도 약 50 μM의 DA-DKP 농도를 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 상기 두 번째 알부민-빈약 흐름은 적어도 약 50 μM의 DA-DKP 농도를 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 하기를 포함하는, 분석단계를 추가적으로 포함하는 것을 특징으로 하는 방법:
적어도 하나의 미터(metric)를 산출하기 위하여 두 번째 알부민-풍부 흐름을 분석하는 단계; 및
적어도 하나의 미터(metric)를 적어도 하나의 참조 값과 비교하는 단계, 여기서 적어도 하나의 미터가 참조 값 미만일 때, 반응 및 진행 단계는 후속의 알부민-풍부 흐름의 적어도 하나의 미터가 적어도 하나의 참조 값보다 동등하거나 또는 클(equal to or greater than)때까지 반복된다.
- 제22항에 있어서, 상기 분석단계는 고압력 액체 크로마토그래피(high-pressure liquid chromatography) 및 질량-분석(mass-spectroscopy)로부터 선택되는 과정(process)을 포함하는 것을 특징으로 하는 방법.
- 제22항에 있어서, 상기 적어도 하나의 미터는 진행 단계에서 생성된 DA-DKP의 질량이고, 상기 참조 값은 공급 흐름에서 알부민의 유닛 질량 당 생성될 수 있는 DA-DKP의 이론적 최대 질량의 일부인 것을 특징으로 하는 방법.
- 제1항에 있어서, 공급 흐름(feed stream)의 pH를 조정하는 것을 추가적으로 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 반응 흐름의 pH를 조정하는 것을 추가적으로 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 공급 흐름을 희석하는 것을 추가적으로 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 반응 흐름을 희석하는 것을 추가적으로 포함하는 것을 특징으로 하는 방법.
- 제1항에 있어서, 공급 흐름, 반응 흐름 또는 모두를 희석하는 것을 추가적으로 포함하고, 여기서 희석은 염분(saline), 락테이트 링거(Lactated Ringer’s)용액, 링거 아세테이트(Ringer’s acetate) 용액, 하이드록시에틸 전분(hydroxyethyl starch) 용액 및 덱스트로오스(dextrose) 용액으로 구성되는 군으로부터 선택되는 적어도 하나의 희석제(diluent)로 하는 것을 특징으로 하는 방법.
- 약 100 μM 이상(greater than) 농도에서 DA-DKP를 포함하는 조성물.
- 제30항에 있어서, 상기 알부민의 농도는 1 중량 퍼센트 미만인 것을 특징으로 하는 조성물.
- 제30항에 있어서, 상기 DA-DKP의 농도는 약 150 μM 이상(greater than)인 것을 특징으로 하는 조성물.
- 제30항에 있어서, 상기 DA-DKP의 농도는 약 200 μM 이상(greater than)인 것을 특징으로 하는 조성물.
- 제30항에 있어서, 상기 조성물은 인간 혈청 알부민조성물로부터 제조되는 것을 특징으로 하는 조성물.
- 제34항에 있어서, 상기 인간 혈청 알부민조성물은 상업용 인간 혈청 알부민조성물인 것을 특징으로 하는 조성물.
- 제34항에 있어서, 상기 제제는 DA-DKP를 생성하기 위하여 알부민의 효소 전환(enzymatic conversion)을 포함하는 것을 특징으로 하는 조성물.
- 제36항에 있어서, 상기 제제는 조성물로부터 알부민을 분리하는 것을 추가적으로 포함하는 것을 특징으로 하는 조성물.
- 제30항에 있어서, 염분(saline), 락테이트 링거(Lactated Ringer’s)용액, 링거 아세테이트(Ringer’s acetate) 용액, 하이드록시에틸 전분(hydroxyethyl starch) 용액, 덱스트로오스(dextrose) 용액, 및 이의 조합으로 구성되는 군으로부터 선택되는 적어도 하나의 추가 구성요소를 추가적으로 포함하는 것을 특징으로 하는 조성물.
- 제30항에 있어서, 소듐 아세틸트립토판에이트(sodium acetyltryptophanate), N-아세틸트립토판(N-acetyltryptophan), 소듐 카프릴레이트(sodium caprylate), 카프릴산(caprylic acid ) 및 이의 조합으로 구성되는 군으로부터 선택되는 적어도 하나의 추가 구성요소를 추가적으로 포함하는 것을 특징으로 하는 조성물.
- 하기를 포함하는, DA-DKP를 조성물을 만드는 방법:
혈장을 여과하기 전에, 하기를 수행하는:
a)비여과된 혈장을 혈장에 있는 단백질로부터 N-말단 디펩티드를 절단하는 효소와 접촉하는 단계, 및
b) DA-DKP, 또는 이의 생리학적으로-허용가능한 염의 형성을 일으키는데 효과적인 조건에서 혈장을 가열하는 단계.
- 제40항에 있어서, 상기 단백질은 알부민인 것을 특징으로 하는 방법.
- 제40항에 있어서, 상기 가열 단계는 약 40℃부터 약 80℃까지의 온도에서 실시되는 것을 특징으로 하는 방법.
- 제40항에 있어서, 상기 효소는 펩티디딜 펩티다제 IV를 포함하는 것을 특징으로 하는 방법.
- 제43항에 있어서, 상기 펩티디딜 펩티다제 IV는 혈장에 대해 내인성인 것을 특징으로 하는 방법.
- 제40항에 있어서, 혈장의 pH를 조정하는 것을 추가적으로 포함하는 것을 특징으로 하는 방법.
- 제40항에 있어서, 상기 혈장은 소듐 아세틸트립토판에이트(sodium acetyltryptophanate), N-아세틸트립토판(N-acetyltryptophan), 소듐 카프릴레이트(sodium caprylate), 카프릴산(caprylic acid) 및 이의 조합으로부터 구성되는 군으로부터 선택되는 적어도 하나의 추가 구성요소를 추가적으로 포함하는 것을 특징으로 하는 방법.
- 제40항에 있어서, 상기 생성물은 치료값(therapeutic value)을 소유하는 것을 특징으로 하는 방법.
- 하기를 포함하는, DA-DKP를 포함하는 조성물을 만드는 방법:
a) 알부민-포함하는 용액을 알부민으로부터 N-말단 아미노산의 쌍을 절단하는 효소와 접촉하는 단계, 및
b) DA-DKP, 또는 이의 생리학적으로-허용가능한 염을 일으키는데 효과적인 조건에서 알부민-포함 용액을 가열하는 단계.
- 제48항에 있어서, 상기 가열 단계는 약 40℃부터 약 80℃까지의 온도에서 실시되는 것을 특징으로 하는 방법.
- 제48항에 있어서, 상기 효소는 펩티디딜 펩티다제 IV를 포함하는 것을 특징으로 하는 방법.
- 제50항에 있어서, 상기 펩티디딜 펩티다제 IV는 알부민-포함 용액에 대해 내인성인 것을 특징으로 하는 방법.
- 제48항에 있어서, 알부민-포함 용액의 pH를 조정하는 것을 추가적으로 포함하는 것을 특징으로 하는 방법.
- 제48항에 있어서, 상기 알부민-포함 용액은 소듐 아세틸트립토판에이트(sodium acetyltryptophanate), N-아세틸트립토판(N-acetyltryptophan), 소듐 카프릴레이트(sodium caprylate), 카프릴산(caprylic acid) 및 이의 조합으로 구성되는 군로부터 선택되는 적어도 하나의 추가 구성요소를 추가적으로 포함하는 것을 특징으로 하는 방법.
- 제48항에 있어서, 상기 생성물은 치료값을 소유하는 것을 특징으로 하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361759922P | 2013-02-01 | 2013-02-01 | |
| US61/759,922 | 2013-02-01 | ||
| PCT/US2014/014478 WO2014121210A1 (en) | 2013-02-01 | 2014-02-03 | Methods for producing diketopiperazines and compositions containing diketopiperazines |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150114984A true KR20150114984A (ko) | 2015-10-13 |
Family
ID=51263032
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157023636A KR20150114984A (ko) | 2013-02-01 | 2014-02-03 | 디케토피페라진 및 디케토피페라진을 포함하는 조성물을 생산하는 방법 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US20150366932A1 (ko) |
| EP (1) | EP2950811A4 (ko) |
| JP (1) | JP6387019B2 (ko) |
| KR (1) | KR20150114984A (ko) |
| CN (1) | CN105188737A (ko) |
| AU (1) | AU2014212095B2 (ko) |
| BR (1) | BR112015017958A2 (ko) |
| CA (1) | CA2900050A1 (ko) |
| EA (1) | EA030414B1 (ko) |
| HK (1) | HK1214772A1 (ko) |
| IL (1) | IL240125A0 (ko) |
| MX (1) | MX2015009908A (ko) |
| PH (1) | PH12015501705A1 (ko) |
| SG (2) | SG10201706213RA (ko) |
| WO (1) | WO2014121210A1 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5048201B2 (ja) | 2000-08-04 | 2012-10-17 | ディーエムアイ バイオサイエンシズ インコーポレイテッド | ジケトピペラジン類の使用方法とジケトピペラジン類を含む組成物 |
| ES2572975T3 (es) | 2003-05-15 | 2016-06-03 | Ampio Pharmaceuticals, Inc. | Tratamiento de enfermedades mediadas por los linfocitos T |
| JP5856843B2 (ja) | 2008-05-27 | 2016-02-10 | アンピオ ファーマシューティカルズ,インコーポレイテッド | ジケトピペラジンを用いた医薬組成物 |
| WO2013055749A1 (en) | 2011-10-10 | 2013-04-18 | Ampio Pharmaceuticals, Inc. | Implantable medical devices with increased immune tolerance, and methods for making and implanting |
| KR102032400B1 (ko) | 2011-10-10 | 2019-10-15 | 앰피오 파마슈티컬스 인코퍼레이티드 | 퇴행성 관절 질환의 치료 |
| SG10201605205VA (en) | 2011-10-28 | 2016-08-30 | Ampio Pharmaceuticals Inc | Treatment of rhinitis |
| WO2014145729A2 (en) | 2013-03-15 | 2014-09-18 | Ampio Pharmaceuticals, Inc. | Compositions for the mobilization, homing, expansion and differentiation of stem cells and methods of using the same |
| RU2020136589A (ru) | 2014-08-18 | 2020-12-24 | Ампио Фармасьютикалз, Инк. | Лечение дегенеративных заболеваний суставов |
| US11389512B2 (en) | 2015-06-22 | 2022-07-19 | Ampio Pharmaceuticals, Inc. | Use of low molecular weight fractions of human serum albumin in treating diseases |
| US10426796B2 (en) * | 2016-06-13 | 2019-10-01 | SMART SURGICAL, Inc. | Compositions for biological systems and methods for preparing and using the same |
| US10456423B2 (en) | 2016-06-13 | 2019-10-29 | SMART SURGICAL, Inc. | Compositions for biological systems and methods for preparing and using the same |
| US20210016273A1 (en) * | 2019-07-19 | 2021-01-21 | University Of Utah Research Foundation | Rapid sperm separation based on sperm morphology and motility |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BE765030A (fr) * | 1970-04-02 | 1971-08-16 | Snam Progetti | Composes contenant un noyau de dicetopiperazine et leur procedede fabrication |
| US5561115A (en) * | 1994-08-10 | 1996-10-01 | Bayer Corporation | Low temperature albumin fractionation using sodium caprylate as a partitioning agent |
| US5811241A (en) * | 1995-09-13 | 1998-09-22 | Cortech, Inc. | Method for preparing and identifying N-substitued 1,4-piperazines and N-substituted 1,4-piperazinediones |
| JP2000005569A (ja) * | 1998-06-24 | 2000-01-11 | Asahi Chem Ind Co Ltd | 直列多段濾過法 |
| JP5048201B2 (ja) * | 2000-08-04 | 2012-10-17 | ディーエムアイ バイオサイエンシズ インコーポレイテッド | ジケトピペラジン類の使用方法とジケトピペラジン類を含む組成物 |
| ES2572975T3 (es) * | 2003-05-15 | 2016-06-03 | Ampio Pharmaceuticals, Inc. | Tratamiento de enfermedades mediadas por los linfocitos T |
| CN1791420A (zh) * | 2003-05-15 | 2006-06-21 | Dmi生物科学公司 | T-细胞介导的疾病的治疗 |
| US7790039B2 (en) * | 2003-11-24 | 2010-09-07 | Northwest Biotherapeutics, Inc. | Tangential flow filtration devices and methods for stem cell enrichment |
| US20050197496A1 (en) * | 2004-03-04 | 2005-09-08 | Gtc Biotherapeutics, Inc. | Methods of protein fractionation using high performance tangential flow filtration |
| AU2005277190B2 (en) * | 2004-08-20 | 2011-03-03 | American National Red Cross | Sequential protein isolation and purification schemes by affinity chromatography |
| WO2011051489A2 (en) * | 2009-10-30 | 2011-05-05 | Novozymes Biopharma Dk A/S | Albumin variants |
| WO2012174472A1 (en) * | 2011-06-17 | 2012-12-20 | Mannkind Corporation | High capacity diketopiperazine microparticles |
| KR102032400B1 (ko) * | 2011-10-10 | 2019-10-15 | 앰피오 파마슈티컬스 인코퍼레이티드 | 퇴행성 관절 질환의 치료 |
| WO2013055749A1 (en) * | 2011-10-10 | 2013-04-18 | Ampio Pharmaceuticals, Inc. | Implantable medical devices with increased immune tolerance, and methods for making and implanting |
| SG10201605205VA (en) * | 2011-10-28 | 2016-08-30 | Ampio Pharmaceuticals Inc | Treatment of rhinitis |
-
2014
- 2014-02-03 AU AU2014212095A patent/AU2014212095B2/en not_active Ceased
- 2014-02-03 JP JP2015556207A patent/JP6387019B2/ja not_active Expired - Fee Related
- 2014-02-03 CA CA2900050A patent/CA2900050A1/en not_active Abandoned
- 2014-02-03 SG SG10201706213RA patent/SG10201706213RA/en unknown
- 2014-02-03 SG SG11201505715RA patent/SG11201505715RA/en unknown
- 2014-02-03 US US14/765,018 patent/US20150366932A1/en not_active Abandoned
- 2014-02-03 CN CN201480015923.2A patent/CN105188737A/zh active Pending
- 2014-02-03 EP EP14745933.3A patent/EP2950811A4/en not_active Withdrawn
- 2014-02-03 EA EA201500783A patent/EA030414B1/ru not_active IP Right Cessation
- 2014-02-03 BR BR112015017958A patent/BR112015017958A2/pt not_active IP Right Cessation
- 2014-02-03 MX MX2015009908A patent/MX2015009908A/es unknown
- 2014-02-03 WO PCT/US2014/014478 patent/WO2014121210A1/en active Application Filing
- 2014-02-03 KR KR1020157023636A patent/KR20150114984A/ko not_active Application Discontinuation
-
2015
- 2015-07-23 IL IL240125A patent/IL240125A0/en unknown
- 2015-07-31 PH PH12015501705A patent/PH12015501705A1/en unknown
-
2016
- 2016-03-11 HK HK16102846.4A patent/HK1214772A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| EP2950811A1 (en) | 2015-12-09 |
| JP6387019B2 (ja) | 2018-09-05 |
| IL240125A0 (en) | 2015-09-24 |
| AU2014212095A1 (en) | 2015-09-10 |
| JP2016511238A (ja) | 2016-04-14 |
| SG11201505715RA (en) | 2015-08-28 |
| PH12015501705A1 (en) | 2015-10-12 |
| BR112015017958A2 (pt) | 2017-07-11 |
| US20150366932A1 (en) | 2015-12-24 |
| WO2014121210A1 (en) | 2014-08-07 |
| MX2015009908A (es) | 2015-09-24 |
| EA201500783A1 (ru) | 2016-05-31 |
| EP2950811A4 (en) | 2016-06-08 |
| CN105188737A (zh) | 2015-12-23 |
| AU2014212095B2 (en) | 2018-07-26 |
| EA030414B1 (ru) | 2018-08-31 |
| SG10201706213RA (en) | 2017-09-28 |
| CA2900050A1 (en) | 2014-08-07 |
| HK1214772A1 (zh) | 2016-08-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20150114984A (ko) | 디케토피페라진 및 디케토피페라진을 포함하는 조성물을 생산하는 방법 | |
| EP3298140B1 (en) | Compositions for treating pathological calcification conditions, and methods using same | |
| EP2537862B1 (en) | A process of purifying coagulation factor VIII | |
| JPH09509165A (ja) | ミルクからのラクトフェリンの分離 | |
| KR20080091441A (ko) | 인자 h 농축물의 제조방법 및 약물의 형태로서의 그의용도 | |
| JP2721830B2 (ja) | 改良された体組織結合特異性を有する薬剤活性抱合体 | |
| JP6876655B2 (ja) | タンパク質の精製方法 | |
| JP2009508822A (ja) | 慢性腎症の処置のためのh因子およびその製造 | |
| CN102924562A (zh) | 一种人凝血因子ⅷ的干热处理稳定剂及其用途 | |
| Di Stasi et al. | Neuronal fodrin proteolysis occurs independently of excitatory amino acid-induced neurotoxicity | |
| de Oliveira et al. | Anti-hypertensive peptides derived from caseins: mechanism of physiological action, production bioprocesses, and challenges for food applications | |
| JP2023100902A (ja) | ヘモペキシン製剤 | |
| JP4278028B2 (ja) | 炎症性サイトカイン産生抑制活性を有するペプチド | |
| CA2820871A1 (en) | Disease inhibiting agent | |
| BR112012020934B1 (pt) | Processo para purificação da alfa-manosidase lisossomal humana recombinante a partir de uma cultura celular, composição, processo em batelada alimentada ou produção contínua da alfa-manosidase lisossomal humana recombinante e uso da composição | |
| US20230287041A1 (en) | Improvements to wash solutions for anion exchange chromatography in a method of purification of recombinantly-produced rsv proteins | |
| JPH0532557A (ja) | 神経成長因子産生促進剤 | |
| KR20200038309A (ko) | 폰 빌레브란트 인자의 바이러스 여과 방법 | |
| US20050148647A1 (en) | Hemodialysis solutions and uses thereof | |
| AU2018318695A1 (en) | Compositions and methods for amino acid depletion therapy | |
| JP6989842B2 (ja) | 新規トリペプチドを含む骨芽細胞の分化促進および骨形成促進剤 | |
| JPH0482898A (ja) | 新規なペプチド及びアンジオテンシン変換酵素阻害剤 | |
| CN113045634A (zh) | 一种补体h因子制备方法 | |
| Groot et al. | Lactoferrin prevents dendritic cell-mediated HIV-1 transmission by blocking the DC-SIGN—gp120 interaction | |
| JP2007057246A (ja) | 蛋白質の安定化方法、蛋白質安定化剤および蛋白質含有溶液 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |