KR20120092567A - 항바이러스 화합물 및 이를 제조하는 방법 및 이의 이용 방법 - Google Patents
항바이러스 화합물 및 이를 제조하는 방법 및 이의 이용 방법 Download PDFInfo
- Publication number
- KR20120092567A KR20120092567A KR1020127005837A KR20127005837A KR20120092567A KR 20120092567 A KR20120092567 A KR 20120092567A KR 1020127005837 A KR1020127005837 A KR 1020127005837A KR 20127005837 A KR20127005837 A KR 20127005837A KR 20120092567 A KR20120092567 A KR 20120092567A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- group
- nitro
- branched
- linear
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D261/00—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings
- C07D261/02—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings
- C07D261/06—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members
- C07D261/10—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D261/18—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
- A61K31/422—Oxazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4965—Non-condensed pyrazines
- A61K31/497—Non-condensed pyrazines containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
Abstract
본원은 항바이러스 활성, 특히 항 인플루엔자 바이러스 활성을 나타내는 화합물, 이의 제조 방법 및 이의 이용 방법을 개시한다. 일 양태에서, 본 화합물은 피페라진과 이속사졸 고리를 함유하는 헤테로사이클 아미드로 하나 이상의 치환기로 임의로 치환된다. 본 화합물은 하나 이상의 약제학적으로 허용되는 담체와 함께 제형화되어 경구 또는 비경구 투여에 적합한 조성물을 형성한다. 본 화합물은 H1N1, H2N2, H3N2, H5N1, H7N7, H1N2, H9N2, H7N2, H7N3 및 H10N7과 같은 인플루엔자 감염을 치료하거나 예방하는 데 바람직하게 사용된다.
Description
본 출원은 2009년 8월 5일에 출원되고 발명의 명칭이 "항바이러스 화합물"인 U.S.S.N. 61/231,431; 2010년 5월 28일에 출원되고 발명의 명칭이 "바이러스 감염을 치료하기 위한 조성물 및 방법"인 U.S.S.N. 61/349,525; 및 2010년 5월 28일에 출원되고 발명의 명칭이 "증식성 질환 치료용 화합물 및 방법"인 U.S.S.N. 61/349,565에 우선권의 이익을 주장한다. 상기 출원 모두는 참조에 의해 이의 전체가 본원에 혼입된다.
발명의 분야
본 발명은 항바이러스 활성, 특히 항인플루엔자 활성을 갖는 소분자 분야 및 이의 제조 방법 및 이용 방법에 관한 것이다.
인플루엔자는 orthomyxoviridae류의 RNA 바이러스가 원인이다. 인플루엔자 바이러스에는 3가지 유형이 있다: A, B 및 C. 인플루엔자 A 바이러스는 포유류(예: 인간, 돼지, 페렛, 말) 및 조류에 감염된다. 인플루엔자 A 바이러스는 세계적으로 보건 분야의 관심 대상으로 1900년대 이후로 5,000 만명 이상의 인구가 이로 인해 사망하는 3대 주요 유행병의 원인이 되어 왔다. 예를 들어, 1918년에 대단한 파괴력을 지닌 "스페인 플루"(H1N1 인플루엔자 A 바이러스)는 전세계적으로 2,000 만명의 인구의 목숨을 앗아갔다. 1957년의 아시아 플루(H2N2), 1968년 홍콩 플루 유행병(H3N2), 1970년 H1N1의 재출현(러시아 플루), 1997년 및 2003년 조류 독감 바이러스 H5N1을 포함한 후속하는 유행병들은, 유행성 인플루엔자 또는 플루 바이러스를 이용한 생화학 테러리스트들의 공격이 전세계적 건강와 안전을 해하는 주요 위협물이 될 수 있음을 시사한다. 인류 역사를 거쳐 공중 보건에 대한 인플루엔자 바이러스의 막대한 영향에도 불구하고, 인플루엔자 감염에 대한 표준 치료법은 여전히 부적합한 상태이다.
인플루엔자 병원력(virulence)과 싸우는 소분자계 치료제의 가장 일반적인 표적물은 프로톤-선택적인 M2 이온 채널 및 단백질 뉴라미다제(NA)를 포함한다. 상기 M2 이온 채널은 인플루엔자 A 바이러스의 바이러스 엔벨롭(envelope)의 유지에 필수불가결한 반면, NA는 숙주 세포로부터 발생기 바이러스 입자의 출아를 촉진한다. 상기 2개의 표적물 모두에 대한 억제제에 있어 내성은 공통되며, 임상적 격리로 널리 만연하게 되었다. 2008년 인플루엔자 H1N1 바이러스(돼지 바이러스) 샘플의 약 100%가 뉴라미다제 억제제 오셀타미비르(oseltamivir)(타미플루)에 내성인 반면, H3N2 바이러스의 90% 초과가 M2 채널 차단제인 아다만탄에 내성이었다.
내성 외에도, 투여 방식 및 환경적 영향을 포함한 인자들이 효과적인 인플루엔자 치료제의 개발에 영향을 미친다. 예를 들어, 자나미비르(Zanamivir)(렐렌자)는 흡입에 의해서만 투여될 수 있으며 거의 공기가 통하지 않는 감염된 폐 조직에 도달하지 못할 수 있다. 더욱이, 널리 사용되며 비축된 약물인 오셀타미비르는 정상적인 하수 처리 과정 동안에 분해되지 않아 환경적 문제를 야기한다.
인플루엔자 복제를 억제하고, 인플루엔자 감염의 병원력을 감소시키고/감소시키거나 인플루엔자 감염을 예방하는 항바이러스 화합물을 개발할 필요가 있다.
따라서, 본 발명의 목적은 바이러스 감염, 특히 인플루엔자 감염을 효과적으로 치료하거나 예방하는 항바이러스 화합물, 상기 화합물의 제조 방법 및 상기 화합물을 이용하는 방법을 제공하는 데 있다.
발명의 요약
본원에서는 항바이러스 활성, 특히 항인플루엔자 활성을 갖는 화합물, 상기 화합물의 제조 및 이용 방법에 대해 기술한다. 일 양태에서, 상기 화합물은 화학식 I 내지 VI의 화합물 또는 이의 약제학적으로 허용되는 염이다.
바람직한 양태에서, 상기 NP 억제제는 화학식 I의 구조를 갖는다:
[화학식 I]
상기 식에서, Ar1, Ar2 및 Ar3 은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y 및 Z는 독립적으로 부재(즉, 직접 결합)이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R1)-, -C(R2)=C(R3)-, 및 -C(R4R5)n-으로 이루어진 군으로부터 선택되고,
여기서 n은 0 내지 6이고, 여기서, R1 내지 R5는 각각 독립적으로 수소, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시이고;
W는 선형 그룹이거나 5 내지 7원 치환되거나 비치환된 시클릭 또는 헤테로시클릭 그룹(Cy)이다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; Ar2는 메틸기로 치환되고; X는 C=O이고; Y 및 Z는 부재이며; Cy는 피페라진이고/이거나 Ar3은 할로기, 니트로기, 또는 할로기와 니트로기의 조합으로 치환된다.
특정 양태에서, Cy는 2개의 질소 원자를 함유하는 치환된 5 내지 7원-불포화 고리로, 여기서 하나의 질소 원자는 X에 결합되어 있고, 다른 질소 원자는 Z에 결합되어 있다.
바람직한 양태에서, Cy는 치환된 피페라진이며, 여기서 N1(1번 위치에서의 N)은 X에 결합하고 N4(4번 위치에서의 N)은 Z에 결합된다.
특정 양태에서, 상기 NP 억제제는 화학식 II의 구조를 갖는다:
[화학식 II]
상기 식에서, Ar1 및 Ar3 은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R13R14)n-으로 이루어진 군으로부터 선택되고,
n, g 및 m은 독립적으로 0 내지 6이고;
T, Q 및 R은 독립적으로 C(R8R9), 질소, 산소, 인, 규소, 황 및 비소로 이루어진 군으로부터 선택되고;
A 및 D는 각각 독립적으로 CR15R16 또는 NR17이고;
여기서, R4 및 R8-R17은 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택되거나, 여기서 -CR15R16-, -NR17-, 또는 이의 조합은 상기 임의의 브리지 메틸렌기와 함께 5-8원 시클릭 구조를 형성한다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; X는 -C=O이고; Y 및 Z는 부재이며; Ar3은 할로기, 니트로기, 또는 할로기와 니트로기의 조합으로 치환된다.
바람직한 양태에서, R4는 메틸이다.
특정 양태에서, Q는 탄소이고, T는 산소이고, R은 질소이다.
특정 양태에서, g 및 m은 1이고, A 및 D는 NR17이고, 여기서 A-D는 피페라진으로 정의된다.
특정 양태에서, 상기 NP 억제제는 화학식 III의 구조를 갖는다:
[화학식 III]
상기 식에서, Ar1 및 Ar3 은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R14R15)n-으로 이루어진 군으로부터 선택되고,
n, g 및 m은 독립적으로 0 내지 6이고;
A, D, T, Q 및 R은 C(R8R9), 질소, 산소, 인, 황, 규소 및 비소로 이루어진 군으로부터 독립적으로 선택되고;
여기서, R4 및 R8-R15는 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; X는 C=O이고; Y 및 Z는 부재이며; Ar3은 할로기, 니트로기, 또는 할로기와 니트로기의 조합으로 치환된다.
바람직한 양태에서, Q는 탄소이고, T는 산소이고, R은 질소이다.
특정 양태에서, A 및 D는 질소이다.
특정 양태에서, R4 및 R13은 독립적으로 수소 또는 메틸이다. 바람직한 양태에서, R4는 메틸이고 R13은 수소이다.
특정 양태에서, 상기 조성 NP 억제제는 화학식 IV의 구조를 갖는다:
[화학식 IV]
상기 식에서, X, Y 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R13R14)n-으로 이루어진 군으로부터 선택되고,
여기서 n은 0 내지 6이고;
T, Q 및 R은 C(R8R9), 질소, 산소, 인, 황, 규소 및 비소로 이루어진 군으로부터 독립적으로 선택되고;
Cy는 4-7원 치환되거나 비치환된 시클릭 또는 헤테로시클릭기이고;
여기서, R1-R14는 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다.
특정 양태에서, Cy는 2개의 질소 원자를 함유하는 치환된 5-7원 불포화 고리이고, 여기서, 하나의 질소 원자는 X에 결합되고, 다른 질소 원자는 Z에 결합된다.
바람직한 양태에서, Cy는 치환된 피페라진이며, 여기서 N1은 X에 결합하고 N4은 Z에 결합되며, Y 및 Z는 부재이고, X는 C=O이고, T는 산소이고, Q는 탄소이고, R은 질소이다.
특정 양태에서, R1-R3 및 R5-R7은 할로기, 니트로기, 또는 할로 및 니트로기의 조합으로 이루어진 군으로부터 독립적으로 선택된다.
바람직한 양태에서, R4는 메틸기이다.
특정 양태에서, 상기 NP 억제제는 화학식 V의 구조를 갖는다:
[화학식 V]
상기 식에서, Ar1, Ar2 및 Ar3 은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y 및 Z는 각각 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R1)=O, -C=C, 및 -C(R2R3)n-으로 이루어진 군으로부터 선택되고,
n, g 및 m은 독립적으로 0 내지 6이고;
Q 및 T는 질소 또는 CR4로 이루어진 군으로부터 독립적으로 선택되고;
R1-R4, R10, 및 R11은 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다.
특정 양태에서, Q 및 T는 모두 질소이다.
특정 양태에서, R10은 메틸기이고, R11은 수소이다. 다른 양태에서, R10 및 R11은 모두 수소이다.
특정 양태에서, Y 및 Z는 부재이고, X는 C=O이다.
특정 양태에서, g 및 m은 1이다.
바람직한 양태에서, Ar1 및 Ar3은 치환된 페닐이고, Ar2는 치환된 이속사졸이고, Y 및 Z는 부재이고, X는 C=O이고, Q 및 T는 질소이고, g 및 m은 1이고, R10은 메틸이고, R11은 수소이다.
특정 양태에서, 상기 NP 억제제는 화학식 VI의 구조를 갖는다:
[화학식 VI]
상기 식에서, X, Y 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R12)-, -C(R13)=C(R14)-, 및 -C(R15R16)n-으로 이루어진 군으로부터 선택되고,
n, g 및 m은 독립적으로 0 내지 6이고;
Q 및 T는 질소 또는 CR17로 이루어진 군으로부터 독립적으로 선택되고;
R1-R17은 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다.
특정 양태에서, Q 및 T는 모두 질소이다.
특정 양태에서, R10은 메틸기이고, R11은 수소이다. 다른 양태에서, R10 및 R11은 모두 수소이다.
특정 양태에서, Y 및 Z는 부재이고, X는 C=O이다.
특정 양태에서, g 및 m은 1이다.
특정 양태에서, R1-R3 및 R5-R7은 할로기, 니트로기, 또는 할로 및 니트로기의 조합으로 이루어진 군으로부터 독립적으로 선택된다.
본원에 기술된 특정 양태에서, Ar2은 탄소와 헤테로원자(예: 질소) 사이에 이중 결합을 포함하며, 1,2 또는 1,3 위치에 2개의 헤테로원자를 갖는 5원 헤테로아릴이다.
본원에 기술된 특정 양태에서, Ar2은 탄소와 질소 사이에 하나의 이중 결합을 포함하며, 1,2 또는 1,3 위치에 질소 원자 및 산소 원자를 갖는 5원 헤테로아릴이다.
본원에 기술된 특정 양태에서, Ar1 및 Ar3은 1, 2, 3, 4 또는 5개의 치환기, 바람직하게는 2,4 또는 2,6 위치에서 2개의 치환기, 및/또는 바람직하게는 2-위치에서 하나의 치환기로 치환된 페닐이다.
본 화합물은 인플루엔자와 같은 바이러스 감염을 예방하고/예방하거나 치료하기 위해 투여될 수 있다. 본 화합물은 용액 또는 현탁액과 같은 형태로 비경구적으로 투여되거나 정제 또는 캡슐 형태와 같이 경구로 투여될 수 있다.
본 약제학적 조성물은 본원에 기술된 하나 이상의 화합물의 유효량을 함유한다. 유효량의 범위는 개인별로 달라질 수 있으나, 최적 용량은 처방 의사와 같은 당업자에 의해 용이하게 결정될 수 있다. 용량은 총 투여량(예: 투여 용량별로 또는 1일 투여량별로) 또는 농도로 측정될 수 있다. 일 양태에서, 0.01, 0.05, 0.1, 0.2, 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 100, 250, 500 및 1000 mg/kg/1일의 투여량이 치료에 적합할 수 있다. 다른 양태에서, 상기 1일 용량은 0.2 내지 250 mg/kg이다.
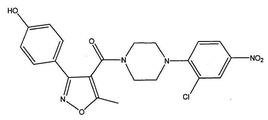
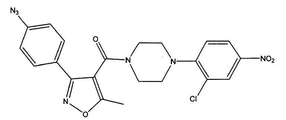
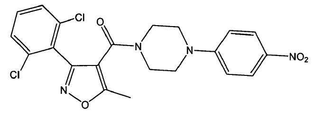
도 1a는 화합물 1의 화학식을 도시한다.
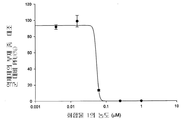
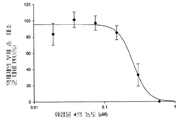
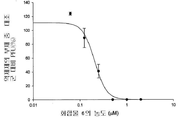
도 1b는 화합물 1의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 2a는 화합물 2의 화학식을 도시한다.
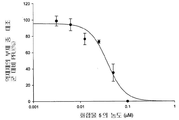
도 2b는 화합물 2의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
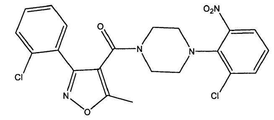
도 3a는 화합물 3의 화학식을 도시한다.
도 3b는 화합물 3의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
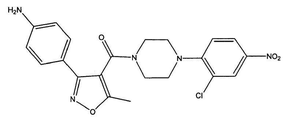
도 4a는 화합물 4의 화학식을 도시한다.
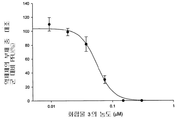
도 4b는 화합물 4의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 5a는 화합물 5의 화학식을 도시한다.
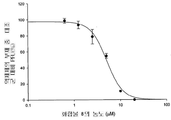
도 5b는 화합물 5의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 6a는 화합물 6의 화학식을 도시한다.
도 6b는 화합물 6의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 7a는 화합물 7의 화학식을 도시한다.
도 7b는 화합물 7의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 8a는 화합물 8의 화학식을 도시한다.
도 8b는 화합물 8의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 9a는 화합물 9의 화학식을 도시한다.
도 9b는 화합물 9의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 10a는 화합물 10의 화학식을 도시한다.
도 10b는 화합물 10의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
발명의 상세한 설명
1. 정의
본원에 일반적으로 사용된 바와 같은 "알킬" 또는 이의 잔기는 직쇄 알킬, 분지쇄 알킬, 시클로알킬, 알킬 치환된 시클로알킬 및 시클로알킬 치환된 알킬을 포함한다. 다른 언급이 없다면, 알킬은 일반적으로 1-30개의 탄소수, 1-20개의 탄소수, 1-10개의 탄소수, 1-6개의 탄소수, 1-5개의 탄소수를 가지며, 바람직하게는 메틸, 에틸 또는 프로필이다. 직쇄 또는 분지쇄 알킬은 일반적으로 이의 백본에 30개 이하(예: 직쇄에서는 C1-C30, 분지쇄에서는 C3-C30), 바람직하게 20개 이하, 바람직하게 10개 이하, 더욱 바람직하게 6개 이하, 가장 바람직하게 5개 이하의 탄소 원자를 가진다. 유사하게, 시클로알킬은 이의 고리 구조 내 3-20개의 탄소수, 바람직하게는, 이의 고리 구조 내 3-10개의 탄소수, 가장 바람직하게는 고리 구조 내 5, 6 또는 7개의 탄소를 갖는다. 알킬의 예로는, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, t-부틸, 이소부틸, sec-부틸, 시클로헥실, (시클로헥실)메틸, 시클로프로필메틸 및 예를 들어, n-펜틸, n-헥실, n-헵틸, n-옥틸의 동족체 및 이성질체를 포함하나, 이에 제한되는 것은 아니다.
용어 "알킬"은 헤테로알킬 뿐만 아니라 탄화수소 라디칼의 하나 이상의 탄소 원자에서 하나 이상의 치환기를 포함한다. 적합한 치환기로는, 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR( 여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에서 일반적으로 사용된 바와 같은 "알케닐" 또는 이의 잔기는 직쇄 또는 분지쇄 알케닐, 시클로알케닐, 알킬 치환된 시클로알케닐을 포함하고, 본원에서 일반적으로 사용된 바와 같은 "알키닐" 또는 이의 잔기는 직쇄 또는 분지쇄 알키닐기 또는 시클로알키닐(알리시클릭) 기, 알킬 치환된 시클로알케닐, 시클로알키닐기 또는 시클로알킬 치환된 알키닐기를 포함한다. 다른 언급이 없다면, 알케닐 및 알키닐은 일반적으로 2-30개의 탄소 원자, 2-20개의 탄소 원자, 2-10개의 탄소 원자, 2-6개의 탄소 원자, 2-5개의 탄소 원자를 갖는다. 직쇄 또는 분지쇄 알케닐 또는 알키닐은 일반적으로 이의 백본에 30개 이하의 탄소 원자(예: 직쇄에서는 C1-C30, 분지쇄에서는 C3-C30), 바람직하게는 20개 이하, 바람직하게는 10개 이하, 더욱 바람직하게는 6개 이하, 가장 바람직하게는 5개 이하의 탄소 원자를 갖는다. 알케닐 또는 알키닐은 일반적으로 쇄 내에 2-30개의 탄소들, 바람직하게는 쇄 내 2-20개의 탄소들, 바람직하게는 쇄 내 2-10개의 탄소들, 더욱 바람직하게는 2-6개의 탄소들, 가장 바람직하게는 2-5개의 탄소들을 갖는다. 유사하게, 시클로알케닐 또는 시클로알키닐은 고리 구조 내 3-20개의 탄소 원자들, 바람직하게는 고리 구조 내 3-10개의 탄소 원자들, 가장 바람직하게는 고리 구조 내 5, 6 또는 7개의 탄소들을 갖는다. 시클로알케닐 또는 시클로알키닐기의 예로는 비닐, 2-프로페닐, 크로틸, 2-이소펜테닐, 2-(부타디에닐), 2,4-펜타디에닐, 3-(1,4-펜타디에닐), 에티닐, 1- 및 3-프로피닐, 3-부티닐을 포함하나, 이에 제한되는 것은 아니다.
용어 "알케닐" 및 "알키닐"은 탄화수소 라디칼의 하나 이상의 탄소 원자에서 하나 이상의 치환기를 포함한다. 적합한 치환기로는, 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR( 여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에서 일반적으로 사용된 바와 같은 "아릴" 또는 이의 잔기는 6 내지 30개의 탄소 원자, 바람직하게 6 내지 18개의 탄소 원자를 갖는 방향족 고리계 탄소를 말하며, 하나의 방향족 고리 또는 복수개의 융합된 방향족 고리로 구성된다. 이의 예로는 페닐, 바이페닐, 나프틸, 아세나프테닐, 아세나프틸레닐, 안트라세닐, 플루오레닐, 페날레닐, 페난트레닐을 포함할 수 있다. 상기 아릴기는, 예를 들어, 문헌[Greene, et al., Protective Groups in Organic Synthesis, John Wiley 및 Sons, Third Edition, 2002]에 기술된 당업자에게 공지된 바와 같이 필요에 따라 보호되거나 비보호된, 알킬, -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다), 아지드, 히드록실, 아실, 아미노, 할로, 알킬아미노, 알콕시, 아릴옥시, 니트로, 시아노, 황산, 설페이트, 인산, 포스페이트, 포스포네이트로 이루어진 군으로부터 선택된 하나 이상의 잔기로 임의 치환될 수 있다. 특정 양태에서, 상기 알킬은 C1-C10 알킬, C1-C6 알킬, C1-C3 알킬, 메틸, 에틸 및/또는 프로필 등을 포함한다. 용어 "아릴"은 탄화수소 라디칼의 하나 이상의 탄소 원자에서 하나 이상의 치환기를 포함한다. 적합한 치환기들로, 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR( 여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에 일반적으로 사용된 바와 같은 "결합 포켓" 또는 "결합 부위"는 이의 배열의 결과로써 동일한 분자 또는 분자 복합체의 잔기 또는 영역, 또는 상이한 분자, 분자 복합체 및/또는 화학적 화합물의 잔기 또는 영역과 우선적으로 연합하거나 상기 잔기 또는 영역을 선점하는 분자 또는 분자 복합체의 영역을 말한다. 당업자에게 이해되는 바와 같이, 결합 포켓 내부의 공동(cavity)의 특성은 분자마다 다를 수 있다.
본원에 일반적으로 사용된 바와 같은 "뉴클레오진(nucleozin) 결합 부위"는 인플루엔자 A NP의 후면 상의 바디 도메인(body domain)에 위치한 인플루엔자 뉴클레오단백질(NP) A 상의 부위를 말한다. 이러한 변형에서, 상기 뉴클레오진은 그루브(groove) 내 280번 잔기와 311번 잔기 사이에 위치한다. 당업자라면 상기 뉴클레오진 결합 부위가 여기에 결합된 화합물에 따라 약간씩 달라질 수 있으며, 본원에 기술된 것을 대체하여/대체하거나 이에 추가하여 다른 접촉점을 포함할 수 있음을 이해할 것이다.
본원에 일반적으로 사용된 바와 같은 "헤테로사이클" 또는 이의 잔기 또는 "헤테로시클릭"은 불포화 또는 방향족 특성을 갖거나 갖지 않으며, 탄소가 아닌 하나 이상의 고리 원자를 갖는 5-12개 원자, 바람직하게는 5-7개 원자의 하나 이상의 고리를 말한다. 바람직한 헤테로원자는 황, 산소 및 질소를 포함한다. 다중 고리는 퀴놀린 또는 벤조푸란에서와 같이 융합될 수 있다. 특히 바람직한 헤테로사이클기는 O, S, P, Si, As 및 N으로 이루어진 군으로부터 선택된 1-3개의 헤테로원자를 갖는 5-10원 고리이다. 헤테로사이클은, 아졸리딘, 피롤, 옥솔란, 푸란, 티올란, 티오펜, 포스폴란, 포스폴, 실란, 실롤, 아르솔란, 아르솔, 이미다졸린, 피라졸리딘, 이미다졸, 이미다졸린, 피라졸, 피라졸린, 옥사졸리딘, 이속사졸리딘, 옥사졸, 옥사졸린, 이속사졸, 이속사졸린, 티아졸리딘, 이소티아졸리딘, 티아졸, 티아졸린, 이소티아졸, 이소티아졸린, 디옥솔란, 옥사티올란, 디티올란, 티아졸, 디티아졸, 푸라잔, 옥사디아졸, 티아디아졸, 테트라졸, 피페리딘, 피리딘, 피란, 테트라하이드로피란, 티안, 티오피란, 피페라진, 디아진, 모폴린, 옥사진, 티아진, 디티안, 디옥산, 디옥신, 트리아진, 트리옥산, 테트라진, 아자판, 아제핀, 옥세판, 옥세핀, 티에판, 티에핀, 아조칸, 아조신, 옥세칸 및 티오칸을 포함하나, 이에 제한되는 것은 아니다. 헤테로사이클 또는 헤테로시클릭은 또한 "아릴" 또는 "알킬"에서 정의한 바와 같은 치환된 고리들을 말한다. 특정 양태에서, 상기 "헤테로사이클" 또는 "헤테로시클릭"은 탄소와 헤테로원자, 예를 들어 질소 사이에 이중 결합을 포함한다.
용어 "헤테로사이클"은 하나 이상의 탄소 또는 헤테로원자에서 하나 이상의 치환기를 포함한다. 적합한 치환기로는 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR(여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에 일반적으로 사용된 바와 같은 "헤테로아릴" 또는 이의 잔기는 N, O, P, Si, As 또는 S 원자(들) 또는 이의 조합으로 이루어진 군으로부터 선택된 1 내지 4개의 헤테로원자를 함유하는 방향족기를 말하며, 여기서, 상기 헤테로아릴기는 탄소 또는 질소 원자(들)에서 임의로 치환될 수 있다. 헤테로아릴 고리는 또한 하나 이상의 시클릭 탄화수소, 헤테로시클릭, 아릴 또는 헤테로아릴 고리와 융합될 수 있다. 헤테로아릴은, 하나의 헤테로원자를 갖는 5-원 헤테로아릴(예: 티오펜, 피롤, 푸란); 1,2 또는 1,3 위치에 2개의 헤테로원자를 갖는 5-원 헤테로아릴(예: 옥사졸, 피라졸, 이미다졸, 티아졸, 푸린); 3개의 헤테로원자를 갖는 5-원 헤테로아릴(예: 트리아졸, 티아디아졸); 3개의 헤테로원자를 갖는 5-원 헤테로아릴; 하나의 헤테로원자를 갖는 6-원 헤테로아릴(예: 피리딘, 퀴놀린, 이소퀴놀린, 페난트린, 5,6-시클로헵테노피리딘); 2개의 헤테로원자를 갖는 6-원 헤테로아릴(예: 피리다진, 신놀린, 프탈라진, 피라진, 피리미딘, 퀴나졸린); 3개의 헤테로원자를 갖는 6-원 헤테로아릴(예: 1,3,5-트리아진); 및 4개의 헤테로원자를 갖는 6-원 헤테로아릴을 포함하나, 이에 제한되는 것은 아니다. 특히 바람직한 헤테로아릴기는 O, S 및 N으로부터 선택된 1-3개의 헤테로원자를 갖는 5-10원 고리이다. 특정 양태에서, 상기 "헤테로아릴"은 탄소와, 상기 헤테로원자, 예를 들어 질소 사이에 이중 결합을 포함할 수 있다.
용어 "헤테로아릴"은 하나 이상의 탄소 또는 헤테로원자들에서 하나 이상의 치환기를 포함한다. 적합한 치환기로는 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR(여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에서 일반적으로 사용된 바와 같은 "인플루엔자 A"는 포유류 인플루엔자 A 바이러스, 예를 들어, H3N2, H1N1, H2N2, H7N7 및 H5N1(조류 독감 바이러스) 균종 및 이의 변이체를 포함한다.
본원에서 일반적으로 사용된 바와 같은 "낮은 에너지, 안정한 복합체"는 공유 결합, 수소 결합, 디설피드 결합, 염 브릿지, 이온 결합, 금속 배위 결합, 소수성 힘, 반 데르 발스 상호작용, 양이온-pi 상호작용, pi-스태킹(stacking) 및 이의 조합을 포함하나 이에 제한되지 않는 약한 내지 강한 분자간 힘에 의해 핵단백질의 결합 부위에서 약물이 결합된 복합체를 말한다.
본원에 일반적으로 사용된 바와 같은 "핵단백질" 또는 "NP"는 핵산과 구조적으로 연합된 임의의 단백질을 말한다. 예시적 핵단백질은 특정 균주의 인플루엔자 바이러스에서 동정되고 시퀀싱된다. 다수의 핵단백질의 서열들이 NCBI 데이터베이스에서 발견될 수 있다. 인플루엔자 타입 A로부터의 특정 예시적 NP 서열의 유전자뱅크 접근 번호는 서브타입 H1N1에 대해서는 NP 040982(AAA43467), 서브타입 H3N2에 대해서는 AAZ38620(YP308843); 및 서브타입 H5N1에 대해서는 AY856864 및 AAF02400이 있다.
NP 040982 (AAA43467)[서열 목록 번호: 5]:
MASQGTKRSYEQMETDGERQNATEIRASVGKMIGGIGRFYIQMC
TELKLSDYEGRLIQNSLTIERMVLSAFDERRNKYLEEHPSAGKDPKK
TGGPIYRRVNG
KWMRELILYDKEEIRRIWRQANNGDDATAGLTHMMIWHSNLNDAT
YQRTRALVRTGMD
PRMCSLMQGSTLPRRSGAAGAAVKGVGTMVMELVRMIKRGINDRN
FWRGENGRKTRIA
YERMCNILKGKFQTAAQKAMMDQVRESRDPGNAEFEDLTFLARSAL
ILRGSVAHKSCL
PACVYGPAVASGYDFEREGYSLVGIDPFRLLQNSQVYSLIRPNENPA
HKSQLVWMACH
SAAFEDLRVLSFIKGTKVVPRGKLSTRGVQIASNENMETMESSTLELR
SRYWAIRTRS
GGNTNQQRASAGQISIQPTFSVQRNLPFDRTTVMAAFTGNTEGRTSD
MRTEIIRMMES
ARPEDVSFQGRGVFELSDEKAASPIVPSFDMSNEGSYFFGDNAEEYD
N
AAZ38620 (YP308843) [서열 목록 번호:6]:
MASQGTKRSYEQMETDGDRQNATEIRASVGKMIDGIGRFYIQMC
TELKLSDHEGRLIQNSLTIEKMVLSAFDERRNKYLEEHPSAGKDPKK
TGGPIYRRVDG
KWMRELVLYDKEEIRRIWRQANNGEDATAGLTHIMIWHSNLNDAT
YQRTRALVRTGMD
PRMCSLMQGSTLPRRSGAAGAAVKGIGTMVMELIRMVKRGINDRNF
WRGENGRKTRSA
YERMCNILKGKFQTAAQRAMVDQVRESRNPGNAEIEDLIFLARSALI
LRGSVAHKSCL
PACAYGPAVSSGYDFEKEGYSLVGIDPFKLLQNSQIYSLIRPNENPAH
KSQLVWMACH
SAAFEDLRLLSFIRGTKVSPRGKLSTRGVQIASNENMDNMGSSTLELR
SGYWAIRTRS
GGNTNQQRASAGQTSVQPTFSVQRNLPFEKSTIMAAFTGNTEGRTSD
MRAEIIRMMEG
AKPEEVSFRGRGVFELSDEKATNPIVPSFDMSNEGSYFFGDNAEEYD
N
AY856864[서열 목록 번호:7]:
MASQGTKRSYEQMETGGERQNATEIRASVGRMVSGIGRFYIQMC
TELKLSDYEGRLIQNSITIERMVLSAFDERRNRYLEEHPSAGKDPKKT
GGPIYRRRDG
KWVRELILYDKEEIRRIWRQANNGEDATAGLTHLMIWHSNLNDATY
QRTRALVRTGMD
PRMCSLMQGSTLPRRSGAAGAAVKGVGTMVMELIRMIKRGINDRNF
WRGENGRRTRIA
YERMCNILKGKFQTAAQRAMMDQVRESRNPGNAEIEDLIFLARSALI
LRGSVAHKSCL
PACVYGLAVASGYDFEREGYSLVGIDPFRLLQNSQVFSLIRPNENPAH
KSQLVWMACH
SAAFEDLRVSSFIRGTRVVPRGQLSTRGVQIASNENMEAMDSNTLEL
RSRYWAIRTRS
GGNTNQRRASAGQISVQPTFSVQRNLPFERATIMAAFTGNTEGRTSD
MRTEIIGMMES
ARPEDVSFQGRGVFELSDEKATNPIVPSFDMNNEGSYFFGDNAEEYD
N
AAF02400[서열 목록 번호:8]:
MASQGTKRSYEQMETGGERQNATEIRASVGRMVGGIGRFYIQMC
TELKLSDQEGRLIQNSITVERMVLSAFDERRNRYLEEHPSAGKDPKK
TGGPIYRRRNG
KWVRELILYDKEEIRRIWRQANNGEDATAGLTHMMIWHSNLNDAT
YQRTRALVRTGMD
PRMCSLMQGSTLPRRSGAAGAAIKGVGTMVMELIRMIKRGINDRNF
WRGENGRRTRIA
YERMCNILKGKFQTAAQKAMMDQVRESRNPGNAEIEDLIFLARSALI
LRGSVAHKSCL
PACVYGLAVASGYDFEREGYSLVGIDPFRLLQNSQVFSLIRPKENPAH
KSQLVWMACH
SAAFEDLRVSSFIRGTRVIPRGQLSTRGVQIASNENVEAMDSSTLELR
SRYWAIRTRS
GGNTNQQRASAGQISVQPTFSVQRNLPFERVTIMAAFKGNTEGRTSD
MRTEIIRMMES
ARPEDVSFQGRGVFELSDEKATNPIVPSFDMSNEGSYFFGDNAEEYD
N
본원에서 일반적으로 언급되는 "뉴클레오진(Nucleozin)"은 다음 화학식을 갖는다:
본원에서 일반적으로 언급된 바와 같은 "약제학적으로 허용되는"은 과도한 독성, 자극, 알러지 반응, 또는 적정한 이익/위험 비에 상응하는 다른 문제 또는 합병증 없이, 인간 및 동물의 조직과 접촉하여 사용하기에 적합한 정상적인 의학적 판단 범주 내의 화합물들, 물질들, 조성물들 및/또는 투여 형태(dosage forms)를 말한다.
본원에서 일반적으로 언급된 바와 같은 "약제학적으로 허용되는 염"은 모 화합물이 이의 산 또는 염기 염이 되도록 변형된 본원에 기술된 화합물들의 유도체들을 말한다. 약제학적으로 허용되는 염의 예는, 아민과 같은 염기 잔기의 미네랄 또는 유기산염; 카복실산과 같은 산 잔기의 알칼리 또는 유기 염을 포함하나, 이에 제한되는 것은 아니다. 상기 약제학적으로 허용되는 염은 예를 들어, 비-독성 무기산 또는 유기산으로부터 형성된 모 화합물의 통상적인 비-독성 염 또는 4차 암모늄 염을 포함한다. 예를 들어, 그러한 통상적인 비-독성 염들은 염산, 브롬화수소산, 황산, 설팜산, 인산, 질산 등과 같은 무기산으로부터 유도된 염들; 및 아세트산, 프로피온산, 석신산, 글리콜산, 스테아린산, 락트산, 말릭산, 타타르산, 시트르산, 아스코르브산, 파모익산, 말레익산, 히드록시말레산, 페닐아세트산, 글루탐산, 벤조산, 살리실산, 설파닐산, 2-아세톡시벤조산, 푸마르산, 톨루엔설폰산, 나프탈렌설폰산, 메탄설폰산, 에탄디설폰산, 옥살산 및 이세티온산과 같은 유기산으로부터 제조된 염들을 포함한다.
본원에서 일반적으로 사용된 바와 같은 “치환된”은 알킬, 알케닐, 알키닐, C3-C8 시클로알킬, 할로(예; 플루오로, 클로로, 브로모 및 요오도); 시아노; 알콕시; 히드록시, 페닐; 치환된 페닐을 포함하나, 이에 제한되지 않는 하나 이상의 치환기로 치환된 잔기(예: 알킬기)를 말한다.
본원에서 일반적으로 사용된 바와 같은 “치환된 아릴”은 치환기로서 하나 이상의 비-간섭기를 갖는 아릴기를 말한다. 페닐 고리 상에서의 치환에 대해 치환기들은 임의의 위치일 수 있다(즉, 오쏘, 메타, 및/또는 파라). 특정 양태에서, 상기 치환된 아릴은 2,6-이치환된 페닐을 포함하며, 여기서, 상기 2개의 치환기들은 정의된 바와 같이, 바람직하게는 이중 하나는 할로겐, 특히 Cl이고, 다른 하나는 니트로(NO2)이거나, 2개 치환기 모두가 할로겐, 특히 Cl이다.
II . 화합물들
항바이러스 활성, 특히 항인플루엔자 바이러스 활성을 갖는 화합물들이 본원에서 기술된다.
특정 양태에서, 상기 화합물들은 아래 화학식 I 내지 VI의 화합물 또는 약제학적으로 허용되는 이의 염이다.
바람직한 양태에서, 상기 NP 억제제들은 화학식 I의 구조를 갖는다:
[화학식 I]
상기 식에서, Ar1, Ar2, 및 Ar3은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y, 및 Z은 독립적으로 부재(즉, 직접 결합)이거나, -C(=O)-, -S(=O)-, -SO2-, -N(R1)-, -C(R2)=C(R3)-, 및 -C(R4R5)n-으로 이루어진 군으로부터 선택되고,
여기서, n은 0 내지 6이고, 여기서, R1 내지 R5는 각각 독립적으로, 수소, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시이고;
W는 선형 그룹이거나 5-7 원의 치환되거나 비치환된 시클릭 또는 헤테로시클릭기(Cy)이다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; Ar2는 메틸기로 치환되고; X는 C=O이고; Y 및 Z는 부재이고; Cy는 피페라진이고; Ar3은 할로기, 니트로기 또는 할로 및 니트로기의 조합으로 치환된다.
특정 양태에서, Cy는 2개의 질소 원자를 함유하는 치환된 5-7원 불포화 고리로, 여기서, 하나의 질소 원자가 X에 결합되고, 다른 질소 원자는 Z에 결합된다.
바람직한 양태에서, Cy는 치환된 피페라진이고, 여기서, N1은 X에 결합되고, N4는 Z에 결합된다.
특정 양태에서, 상기 NP 억제제들은 화학식 II의 구조를 갖는다:
[화학식 II]
상기 식에서, Ar1 및 Ar3은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y, 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R13R14)n-으로 이루어진 군으로부터 선택되고,
n, g, 및 m은 독립적으로 0 내지 6이고;
T, Q, 및 R은 독립적으로 C(R8R9), 질소, 산소, 인, 규소, 황 및 비소로 이루어진 군으로부터 선택되고;
A 및 D는 각각 독립적으로 CR15R16 또는 NR17이고;
여기서, R4 및 R8-R17은 독립적으로 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트, 및 티오에테르로 이루어진 군으로부터 선택되거나, 여기서, -CR15R16-, -NR17-, 또는 이의 조합은 임의 브릿지 메틸렌기와 함께 5-8-원 시클릭 구조를 형성한다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노, 또는 아지드로 치환되고; X는 -C=O이고; Y 및 Z는 부재이고, Ar3은 할로기, 니트로기 또는 할로기와 니트로기의 조합으로 치환된다.
바람직한 양태에서, R4는 메틸이다.
특정 양태에서, Q는 탄소이고, T는 산소이고, R은 질소이다.
특정 양태에서, g 및 m은 1이고, A 및 D는 NR17이고, 여기서 A-D는 피페라진을 정의한다.
특정 양태에서, 상기 NP 억제제들은 화학식 III의 구조를 갖는다:
[화학식 III]
상기 식에서, Ar1 및 Ar3은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y, 및 Z는 독립적으로 부재이거나, -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R14R15)n-으로 이루어진 군으로부터 선택되고,
n, g, 및 m은 독립적으로 0 내지 6이고;
A, D, T, Q, 및 R은 독립적으로 C(R8R9), 질소, 산소, 인, 황, 규소 및 비소로 이루어진 군으로부터 선택되고;
여기서, R4 및 R8-R15는 독립적으로 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트, 및 티오에테르로 이루어진 군으로부터 선택된다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; X C=O이고; Y 및 Z는 부재이고, Ar3은 할로기, 니트로기, 또는 할로 및 니트로기의 조합으로 치환된다.
바람직한 양태에서, Q는 탄소이고, T는 산소이고, R은 질소이다.
특정 양태에서, A 및 D는 질소이다.
특정 양태에서, R4 및 R13은 독립적으로 수소 또는 메틸이다. 바람직한 양태에서, R4는 메틸이고, R13은 수소이다.
특정 양태에서, 상기 조성물 상기 NP 억제제들은 화학식 IV의 구조를 갖는다:
[화학식 IV]
상기 식에서, X, Y, 및 Z는 독립적으로 부재이거나, -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R13R14)n-로 이루어진 군으로부터 선택되고;
여기서, n은 0 내지 6이고;
T, Q, 및 R은 독립적으로 C(R8R9), 질소, 산소, 인, 규소, 황 및 비소로 이루어진 군으로부터 선택되고;
Cy는 4-7원 치환되거나 비치환된 시클릭 또는 헤테로시클릭기이고;
여기서, R1-R14는 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 선택된다.
특정 양태에서, Cy는 2개의 질소 원자를 함유하는 치환된 5-7원 불포화 고리이고, 여기서, 하나의 질소 원자는 X에 결합되고, 다른 질소 원자는 Z에 결합된다.
바람직한 양태에서, Cy는 치환된 피페라진이고, 여기서, N1은 X에 결합되고, N4는 Z에 결합되고, Y 및 Z는 부재이고, X는 C=0이고, T는 산소이고, Q는 탄소이고, R은 질소이다.
특정 양태에서, R1-R3 및 R5-R7은 독립적으로, 할로기, 니트로기 또는 할로와 니트로기의 조합으로부터 독립적으로 선택된다.
바람직한 양태에서, R4는 메틸기이다.
특정 양태에서, 상기 NP 억제제는 화학식 V의 구조를 갖는다:
[화학식 V]
상기 식에서, Ar1, Ar2, 및 Ar3은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y, 및 Z는 독립적으로 부재이거나, -C=O, -S=O, -SO2, -N(R1)=O, -C=C, 및 -C(R2R3)n으로 이루어진 군으로부터 선택되고,
n, g, 및 m은 독립적으로 0 내지 6이고;
Q 및 T는 질소 또는 CR4로부터 독립적으로 선택되고;
R1-R4, R10, 및 R11는 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트, 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다.
특정 양태에서, Q 및 T는 모두 질소이다.
특정 양태에서, R10은 메틸기이고, R11은 수소이다. 다른 양태에서, R10 및 R11은 모두 수소이다.
특정 양태에서, Y 및 Z는 부재이고, X는 C=O이다.
특정 양태에서, g 및 m은 1이다.
바람직한 양태에서, Ar1 및 Ar3은 치환된 페닐이고, Ar2는 치환된 이속사졸이고, Y 및 Z는 부재이고, X는 C=O이고, Q 및 T는 질소이고, g 및 m은 1이고, R10은 메틸이고, R11는 수소이다.
특정 양태에서, 상기 NP 억제제들은 화학식 VI의 구조를 갖는다:
[화학식 VI]
상기 식에서, X, Y, 및 Z는 독립적으로 부재이거나, -C(=O)-, -S(=O)-, -SO2-, -N(R12)-, -C(R13)=C(R14)-, 및 -C(R15R16)n-로 이루어진 군으로부터 선택되고,
n, g, 및 m은 독립적으로 0 내지 6이고;
Q 및 T는 독립적으로 질소 또는 CR17로부터 선택되고;
R1-R17은 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트, 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다.
특정 양태에서, Q 및 T는 모두 질소이다.
특정 양태에서, R10은 메틸기이고, R11은 수소이다. 다른 양태에서, R10 및 R11은 모두 수소이다.
특정 양태에서, Y 및 Z는 부재이고, X는 C=O이다.
특정 양태에서, g 및 m은 1이다.
특정 양태에서, R1-R3 및 R5-R7은 할로기, 니트로기 또는 할로 및 니트로기의 조합으로부터 독립적으로 선택된다.
바람직한 양태에서, R4는 메틸기이다.
본원에 기술된 예시적으로 언급된 화합물들은 다음과 같다:
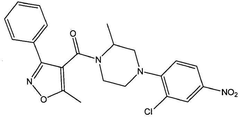
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-히드록시-페닐)-5-메틸이속사졸-4-일]-메탄온 (화합물 1, 화학식은 도 1a에 도시된다);
[4-(2-클로로-4-니트로-페닐)-피페라진-l-일]-[3-페닐-5-메틸-이속사졸-4-일]-메탄온 (화합물 2, 화학식은 도 2a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-아미노-페닐)-메틸이속사졸-4-일]-메탄온 (화합물 3, 화학식은 도 3a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-아지도-페닐)-5-메틸이속사졸-4-일]-메탄온 (화합물 4, 화학식은 도 4a에 도시되어 있다);
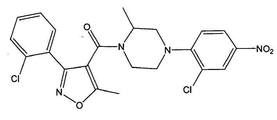
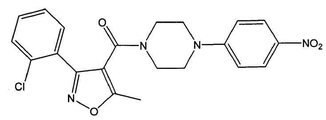
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸이속사졸-4-일]-메탄온 (화합물 5, 화학식은 도 5a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-2-메틸-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온 (화합물 6, 화학식은 도 6a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-2-메틸-피페라진-1-일]-[3-페닐-5-메틸이속사졸-4-일]-메탄온 (화합물 7, 화학식은 도 7a에 도시되어 있다);
[4-(4-니트로-페닐)-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온 (화합물 8, 화학식은 도 8a에 도시되어 있다); 및
[4-(4-니트로-페닐)-피페라진-l-일]-[3-(2,6-디클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온 (화합물 9, 화학식은 도 9a에 도시되어 있다).
[4-(2-니트로-6-클로로-페닐)-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온 (화합물 10, 화학식은 도 10a에 도시되어 있다).
본원에 기술된 화합물들은 유리 산 또는 유리 염기 또는 약제학적으로 허용되는 염으로 투여될 수 있다. 본 화합물들의 약제학적으로 허용되는 염들은 염기성 또는 산성 잔기를 함유하는 모 화합물로부터 통상적인 화학적 방법에 의해 합성될 수 있다. 일반적으로, 상기 염들은 이들 화합물의 유리 산 또는 염기 형태를 수중 또는 유기 용매 중 또는 이 둘의 혼합물 중, 화학당량의 적합한 염기 또는 산과 반응시켜 제조될 수 있다; 일반적으로, 에테르, 에틸 아세테이트, 에탄올, 이소프로판올, 또는 아세토니트릴과 같은 비-수성 매질이 바람직하다. 적합한 염들의 목록은 문헌[Remington's Pharmaceutical Sciences, 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, p. 704]에 기재되어 있다.
B. 약제학적 조성물
본원에 기술된 화합물들 및/또는 이의 약제학적으로 허용되는 염들은 당업자에게 알려진 기술을 사용하여 경구 및 비경구 투여에 적합한 투여 형태(dosage form)로 제형화될 수 있다.
상기 약제학적 조성물은 본원에 기술된 하나 이상의 화합물의 유효량을 함유한다.
본원에 일반적으로 사용된 바와 같은 “유효량”은 일반적으로 제공 또는 처방되는 범위 내의, 예를 들어, in vitro 또는 in vivo로 항바이러스 효과를 나타내는 것으로 입증된 양, 또는 용량을 나타낸다. 유효량의 범위는 개인마다 다를 수 있다; 그러나, 최적 용량은 처방 의사와 같은 당업계의 숙련된 기술자에 의해 용이하게 결정될 수 있다. 그러한 범위는 통상의 임상적 실습에 의해 잘 확립될 수 있으며 따라서, 당업계의 숙련된 기술자에 의해 용이하게 결정될 수 있다. 용량은 제공된 총량(예를 들어, 매용량 또는 매일)으로 또는 농도로 측정될 수 있다. 0.01, 0.05, 0.1, 0.2, 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 100, 250, 500 및 1000 mg/kg/일의 용량이 치료를 위해 적합할 수 있다. 일 양태에서, 1일 용량은 0.2 내지 250mg/kg이다.
본원에 기술된 화합물들은 안전하고 효과적인 것으로 간주되며 바람직하지 않은 생물학적 부작용 또는 원치 않는 상호작용을 일으키지 않고 개인에게 투여될 수 있는, 하나 이상의 약제학적으로 허용되는 담체 및/또는 부형제와 조합될 수 있다. 상기 담체는 활성 성분 또는 성분들 외에 약제학적 제형 내 존재하는 모든 성분들이다.
1. 비경구 제형
본원에 기술된 화합물들은 비경구 제형으로 제형화될 수 있다. 본원에 기술된 바와 같은 “비경구 투여”는 소화관 또는 비-침습적 국소 또는 국부적 경로 외에 임의의 방법에 의해 투여되는 것을 의미한다. 예를 들어, 비경구 투여는 환자에게 주사 또는 주입에 의해 정맥내, 피부내, 복강내, 늑막내, 기관내, 근육내, 피하내를 포함할 수 있다.
비경구 제형은 당업자에게 공지된 기술을 이용하여 수성 조성물로 제조될 수 있다. 일반적으로, 그러한 조성물은 주사가능한 제형, 예를 들어, 용액 또는 현탁액; 마이크로- 또는 나노입자와 같이 주사 전에 재구성 매질의 추가시 용액 또는 현탁액으로 제조되도록 사용하기에 적합한 고체 형태; 유중수(w/o) 에멀젼, 수중유(o/w) 에멀젼과 같은 에멀젼, 및 이의 마이크로에멀젼, 리포좀, 또는 에멀좀으로 제조될 수 있다.
담체는 예를 들어, 물, 에탄올, 하나 이상의 폴리올(예: 글리세롤, 프로필렌 글리콜, 및 액상 폴리에틸렌 글리콜), 오일(예: 식물성 오일(예: 땅콩유, 옥수수유, 참기름 등)), 및 이의 조합을 함유하는 용매 또는 분산 매질일 수 있다. 적합한 유동성은, 예를 들어, 레시틴과 같은 코팅물을 사용함으로써, 분산액의 경우 요구되는 입자 크기를 유지함으로써, 및/또는 계면활성제를 사용함으로써 유지될 수 있다. 다수의 경우에서, 예를 들어, 설탕 또는 염(예: 염화나트륨)의 등장화제를 포함하는 것이 바람직할 것이다.
활성 화합물들의 유리 산 또는 유리 염기 또는 약제학적으로 허용되는 염으로서의 용액 또는 분산액은 예를 들어, 계면활성제, 분산제, 유화제, pH 조절제 및 이의 조합을 포함하나, 이에 제한되지 않는 하나 이상의 약제학적으로 허용되는 부형제와 적절히 혼합된 물 또는 다른 용매 또는 분산 매질 중에 제조될 수 있다.
적합한 계면활성제는 음이온성, 양이온성, 양쪽성 또는 비이온성 표면 활성제일 수 있다. 적합한 음이온성 계면활성제는, 카복실레이트, 설포네이트 및 설페이트 이온을 함유하는 것을 포함하나, 이에 제한되는 것은 아니다. 음이온성 계면활성제의 예는 나트륨 도데실벤젠 설포네이트와 같은 장쇄 알킬 설포네이트 및 알킬 아릴 설포네이트의 나트륨, 칼륨, 암모늄; 나트륨 도데실벤젠 설포네이트와 같은 디알킬 나트륨 설포석시네이트; 나트륨 비스-(2-에틸티옥실)-설포석시네이트 와 같은 디알킬 나트륨 설포석시네이트; 및 나트륨 라우릴 설페이트와 같은 알킬 설페이트를 포함한다. 양이온성 계면활성제는 염화벤잘코늄, 염화벤제토늄, 브롬화세트리모늄, 스테아릴 디메틸벤질 암모늄 클로라이드, 폴리옥시에틸렌 및 코코넛 아민과 같은 4차 암모늄 화합물을 포함하나, 이에 제한되는 것은 아니다. 비이온성 계면활성제의 예는 에틸렌 글리콜 모노스테아레이트, 프로필렌 글리콜 미리스테이트, 글리세릴 모노스테아레이트, 글리세릴 스테아레이트, 폴리글리세릴-4-올레에이트, 소비탄 아실레이트, 수크로스 아실레이트, PEG-150 라우레이트, PEG-400 모노라우레이트, 폴리옥시에틸렌 모노라우레이트, 폴리소르베이트, 폴리옥시에틸렌 옥틸페닐에테르, PEG-1000 세틸 에테르, 폴리옥시에틸렌 트리데실 에테르, 폴리프로필렌 글리콜 부틸 에테르, 폴록사머401, 스테아로일 모노이소프로판올아미드 및 폴리옥시에틸렌 수소화된 탈로우 아미드를 포함한다. 양쪽성 계면활성제의 예는 나트륨 N-도데실- -알라닌, 나트륨 N-라우릴- -이미노디프로피오네이트, 미리스토암포아세테이트, 라우릴 베타인 및 라우릴 설포베타인을 포함한다.
제형은 미생물의 성장을 억제하는 방부제를 함유할 수 있다. 적합한 방부제로, 파라벤, 클로로부탄올, 페놀, 소르브산 및 티메로살을 포함하나, 이에 제한되는 것은 아니다. 상기 제형은 또한 활성 성분(들)의 분해를 방지할 수 있는 항산화제를 함유할 수 있다.
본 조성물은 일반적으로 재구성시 비경구 투여를 위해 pH 3-8로 완충된다. 적합한 완충제는 인산염 완충제, 아세트산염 완충제, 및 구연산염 완충제를 포함하나, 이에 제한되는 것은 아니다.
수용성 중합체가 빈번하게 비경구 투여 제형에 사용된다. 적합한 수용성 고분자는 폴리비닐피롤리돈, 덱스트란, 카복시메틸세룰로스 및 폴리에틸렌 글리콜을 포함하나, 이에 제한되는 것은 아니다.
무균의 주사가능한 용액들이 적합한 용매 또는 분산 매질 중 필요한 양의 활성 화합물들을, 필요에 따라 상기 나열된 하나 이상의 부형제와 함께 혼입시키고, 여과된 멸균을 행함으로써 제조될 수 있다. 일반적으로, 분산액은 다양한 무균화된 활성 성분들을, 염기성 분산 매질 및 상기 나열된 것과 같은 기타 필요한 성분들을 함유하는 무균 비히클 내에 혼입시켜 제조된다. 무균 주사가능한 용액의 제조에 있어서 무균 분말의 경우, 제조의 바람직한 방법은 진공-건조 및 동결-건조 기술이며, 이로써 이전 단계의 무균-여과된 이의 용액으로부터 활성 성분 및 임의의 추가적인 목적하는 성분의 분말을 수득한다. 상기 분말은 입자들이 본질상 다공성이 되게 하는 방식으로 제조될 수 있으며, 이로써 입자들의 용해도를 증가시킬 수 있다. 다공성 입자들을 제조하는 방법이 또한 당업자들에게 잘 알려져 있다.
본원에 기술된 비경구 제형은 즉시 방출, 지연 방출, 연장된 방출, 박동성 방출, 및 이의 조합을 포함하는 조절된 방출을 갖도록 제형화될 수 있다.
비경구 투여에서, 하나 이상의 NP 억제제, 및 임의로 하나 이상의 추가적 활성 성분들이 조절된 방출을 제공하는 마이크로입자, 나노입자 또는 이의 조합 내에 혼입될 수 있다. 제형이 2개 이상의 약물을 함유하는 양태에서, 상기 약물들은 동일한 유형의 조절된 방출(예: 지연된, 연장된, 즉시 또는 박동성)을 갖도록 제형화되거나, 상기 약물들은 상이한 유형의 방출(예: 즉시 및 지연된, 즉시 및 연장된, 지연된 및 연장된, 지연된 및 박동성 등)을 갖도록 독립적으로 제형화될 수 있다.
예를 들어, 본 화합물들 및/또는 하나 이상의 추가적 활성 성분들은 당해 약물(들)의 조절된 방출을 제공하는 중합성 마이크로입자 내로 혼입될 수 있다. 상기 약물(들)의 방출은 상기 마이크로입자 밖으로의 상기 약물(들)의 확산 및/또는 가수분해 및/또는 효소적 분해에 의한 상기 중합성 입자들의 분해에 의해 조절된다. 적합한 중합체는 에틸세룰로오스 및 기타 천연 또는 합성 세룰로오스 유도체를 포함한다.
수성 환경에서 서서히 용해하여 수성 환경에서 겔을 형성하는 히드록시프로필 메틸세룰로오스 또는 폴리에틸렌 옥시드와 같은 중합체가 또한 약물 함유 마이크로입자의 재료로서 적합할 수 있다. 기타 중합체들은 폴리락티드(PLA), 폴리글리콜리드(PGA), 폴리(락티드-코-글리콜리드)(PLGA), 폴리-3-히드록시부티레이트(PHB) 및 이의 공중합체, 폴리-4-히드록시부티레이트(P4HB) 및 이의 공중합체, 폴리카프로락톤 및 이의 공중합체, 및 이의 조합과 같은, 폴리안하이드리드, 폴리(에스테르 안하이드리드), 폴리히드록시 산을 포함하나, 이에 제한되는 것은 아니다.
또는, 상기 약물(들)은 수성 용액에 불용성이거나 수성 용액에 서서히 용해되나, GI 장관 내에서 효소적 분해, 담즙산의 계면활성 작용 및/또는 기계적 부식을 포함하는 수단에 의해 분해될 수 있는 물질로부터 제조된 마이크로입자 내로 혼입될 수 있다. 본원에서 사용된 바와 같은, 용어 "물에 서서히 용해되는"은 30분의 기간 내에 물에 용해되지 않는 물질을 말한다. 바람직한 예로는, 지방, 지방 성분, 왁스, 왁스-유사 성분 및 이의 혼합물을 포함한다. 적합한 지방 및 지방 성분들은 지방 알코올(예: 라우릴, 미리스틸 스테아릴, 세틸 또는 세토스테아릴 알코올), 지방산 및 유도체(예: 지방산 에스테르, 지방산 글리세리드(1-, 2- 및 3-글리세리드), 이에 제한되지 않음), 및 수소화된 지방을 포함한다. 구체적 예로, 수소화된 식물유, 수소화된 면실유, 수소화된 피마자유, 상표 Sterotex로 시판되는 수소화된 오일, 스테아르산, 코코아버터 및 스테아릴 알코올을 포함하나, 이에 제한되는 것은 아니다. 적합한 왁스 및 왁스-유사 물질은 천연 또는 합성 왁스, 하이드로카본 및 노멀 왁스를 포함한다. 왁스의 구체적인 예로, 밀납, 글리코왁스, 캐스터 왁스, 카나우바 왁스, 파라핀 및 칸델릴라 왁스를 포함한다. 본원에서 사용된 바와 같은, 왁스-유사 물질은 실온에서 일반적으로 고체이며, 약 30 내지 300℃의 융점을 갖는 임의의 물질로서 정의된다.
일부 경우에서, 마이크로입자 내로의 물의 침투 속도를 조절하는 것이 바람직할 수 있다. 이러한 목적을 위해, 속도-조절(wicking(흡수))제가 상기 열거된 지방 또는 왁스와 함께 제형화될 수 있다. 속도-조절 물질의 예로, 특정 전분 유도체(예: 왁시 말토덱스트린 및 드럼 건조된 옥수수 전분), 세룰로오스 유도체(예: 히드록시프로필메틸-세룰로오스, 히드록시프로필세룰로오스, 메틸세룰로오스, 및 카복시메틸-세룰로오스), 알긴산, 락토스 및 탈크를 포함한다. 추가적으로, 약제학적으로 허용되는 계면활성제(예를 들어, 레시틴)이 상기 마이크로입자의 분해를 돕기 위해 첨가될 수 있다.
제인(Zein)과 같이 수 불용성 단백질들이 또한 약물 함유 마이크로입자의 형성을 위한 물질로 사용될 수 있다. 추가적으로, 수용성인 단백질, 다당류 및 이의 조합이, 약물과 함께 마이크로입자 내에 제형화되고, 이어서 교차-결합을 형성하여 불용성 넷트워크를 형성할 수 있다. 예를 들어, 시클로덱스트린은 개별 약물 분자와 착체를 형성하고 이어서 교차-결합될 수 있다.
약물을 담체 물질 내로 캡슐화하거나 혼입하여 약물을 함유하는 마이크로입자를 형성하는 것은 알려진 약제학적 제형화 기술을 통해 성취될 수 있다. 지방, 왁스 또는 왁스-유사 물질의 제형의 경우, 상기 담체 물질은 일반적으로 이의 용융 온도보다 높게 가열되고, 상기 약물이 첨가되어 상기 담체 물질 중에 현탁된 약물 입자, 담체 물질 중에 용해된 약물, 또는 이의 혼합을 포함하는 혼합물이 형성된다. 마이크로입자는 이후, 응결, 압출, 분사 냉각 또는 수성 분산 과정을 포함하나, 이에 제한되는 것은 아닌 몇몇의 방법들을 통해 제형화될 수 있다. 한 바람직한 과정에서, 왁스가 이의 용융 온도 이상으로 가열되고, 약물이 첨가되고, 용융된 왁스-약물 혼합물이 지속적 교반하에 혼합물을 냉각시킴에 따라 응결된다. 또는, 상기 용융된 왁스-약물 혼합물이 압출되고 구형화되어 펠렛 또는 비드를 형성할 수 있다. 상기 과정의 상세한 설명이 문헌[Remington- The science and practice of pharmacy", 20th Edition, Jennaro et. al., (Phila, Lippencott, Williams, 및 Wilkens, 2000]에서 발견될 수 있다.
일부 담체 물질에서, 용매 증발 기술을 사용하여 약물 함유 마이크로입자를 제조하는 것이 바람직할 수 있다. 이 경우, 약물 및 담체 물질은 공동 용매에 동시 용해되고, 마이크로입자들은 이후 물이나 기타 적합한 매질 중에 에멀젼을 형성, 분사 건조, 또는 벌크 용액으로부터 용매를 증발시켜고 생성된 물질을 분쇄하는 것을 포함하나 이에 제한되지 않는 몇몇 기술들에 의해 제조될 수 있다.
특정 양태에서, 입자 형태의 약물은 수-불용성 또는 물에 서서히 용해하는 물질 중에 균질하게 분산된다. 조성물 내 약물 입자의 크기를 최소화시키기 위해, 약물 분말 자체를 분쇄하여 제형화 이전에 미세 입자를 생성시킬 수 있다. 약제학적 분야에서 알려진 젯트 분쇄 과정이 이 목적을 위해 사용될 수 있다. 특정 양태에서, 입자 형태의 약물은 왁스나 왁스-유사 성분을 이의 용융 온도 이상으로 가열하고, 혼합물을 교반하면서 약물 입자를 첨가함으로써, 왁스 또는 왁스-유사 성분 내 균질하게 분산된다. 이 경우, 약제학적으로 허용되는 계면활성제가 상기 혼합물 내에 첨가되어 약물 입자의 분산을 용이하게 할 수 있다.
입자들은 또한 하나 이상의 개질된 방출 코팅제로 피복될 수 있다. 리파제에 의해 가수분해되는 지방산의 고체 에스테르가 마이크로입자 또는 약물 입자에 분사 코팅될 수 있다. 제인(zein)은 천연적으로 수불용성인 단백질의 한 예이다. 이는 분사 코팅에 의해 또는 습식 과립화 기술에 의해 약물 함유 마이크로입자 또는 약물 입자에 피복될 수 있다. 천연적으로 수불용성인 물질에 추가하여, 소화성 효소의 일부 기질들이 교차-결합 공정으로 처리되어 불용성 넷트워크를 형성할 수 있다. 화학적 및 물리적 수단 모두에 의해 개시되는 다수의 단백질의 교차-결합방법들이 보고되어 왔다. 교차-결합을 수득하는 가장 일반적인 방법들 중 하나는 화학적 교차-결합제를 사용하는 것이다. 화학적 교차-결합제의 예는 알데히드(글루터알데히드 및 포름알데히드), 에폭시 화합물들, 카보디이미드, 및 제니핀을 포함한다. 이들 교차-결합제 외에, 산화된 및 천연 슈거가 젤라틴을 교차-결합시키기 위해 사용되어 왔다[참조: Cortesi, R., et al., Biomaterials 19 (1998) 1641-1649]. 교차-결합은 또한 효소적 수단을 사용하여 수행될 수 있다; 예를 들어, 트랜스글루타미나제가 해산물 제품을 가교-결합시키는 GRAS 성분으로 승인되었다. 마지막으로, 교차-결합은 열 처리, UV 조사 및 감마 조사와 같은 물리적 수단에 의해 개시될 수 있다.
약물 함유 마이크로입자 또는 약물 입자를 에워싸는 교차-결합된 단백질의 코팅층을 형성하기 위해, 수용성 단백질이 상기 마이크로 입자 상에 분사 피복되고, 이후 상기한 방법들 중 어느 하나에 의해 가교- 결합될 수 있다. 또는, 약물 함유 마이크로입자는 코아세르베이션 상 분리(예: 염의 첨가에 의한) 및 후속하는 교차-결합에 의해 단백질 내에 마이크로캡슐화될 수 있다. 이 목적에 적합한 특정 단백질은 젤라틴, 알부민, 카세인 및 글루텐을 포함한다.
다당류가 또한 교차-결합되어 수불용성 넷트워크를 형성할 수 있다. 다수의 다당류에 있어서, 이는 주요 중합체 쇄들을 가교-결합시키는 칼슘염 또는 다가 양이온과의 반응에 의해 성취될 수 있다. 펙틴, 알기네이트, 덱스트란, 아밀로스 및 구아검이 다가 양이온의 존재에서 가교-결합된다. 반대 전하를 띠는 다당류들 사이에 착체가 또한 형성될 수 있다; 예를 들어, 펙틴 및 키토산이 정전기적 상호작용에 의해 착화될 수 있다.
2. 내복 제형들
적합한 경구 투여 제형들은 정제, 캡슐, 용액, 현탁액, 시럽 및 라진즈를 포함한다. 정제는 당업자에게 잘 알려진 압축 또는 성형 기술을 사용하여 제조될 수 있다. 젤라틴 또는 비-젤라틴 캡슐들은 당업자에게 잘 알려진 기술을 이용하여, 액체, 고체 및 반고체 충진 물질들을 캡슐화시킬 수 있는 경질 또는 연질 캡슐 쉘로 제조될 수 있다.
제형들은 약제학적으로 허용되는 담체를 사용하여 제조될 수 있다. 본원에서 일반적으로 사용된 "담체"는 희석제, 방부제, 결합제, 윤활제, 붕괴제, 팽윤제, 충진제, 안정화제 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
담체는 또한 가소제, 색소, 색료, 안정화제 및 유동화제를 포함할 수 있는 코팅 조성물의 모든 성분들을 포함할 수 있다. 지연된 방출 투여 제형이 문헌[ "Pharmaceutical dosage form tablets", eds. Liberman 등 (New York, Marcel Dekker, Inc., 1989), "Remington - The science and practice of pharmacy", 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, 및 "Pharmaceutical dosage forms and drug delivery systems", 6th Edition, Ansel 등, (Media, PA: Williams 및 Wilkins, 1995)]과 같은 표준 참고서에 기재된 바와 같이 제조될 수 있다. 이들 참고서들은 정제, 캡슐, 및 정제, 캡슐의 지연된 방출 투여 형태, 및 과립을 제조하기 위한 담체, 물질, 장비 및 과정에 대한 정보를 제공한다.
적합한 코팅 물질의 예로는 세룰로오스 아세테이트 프탈레이트, 히드록시프로필 세룰로오스, 히드록시프로필 메틸세룰로오스, 히드록시프로필 메틸세룰로오스 프탈레이트 및 히드록시프로필 메틸세룰로오스 아세테이트 석시네이트와 같은 세룰로오스 중합체; 폴리비닐 아세테이트 프탈레이트, 아크릴산 중합체 및 공중합체, 및 상표명 EUDRAGIT로 시판되는 메타크릴수지(독일, 베스터슈트, 로스 파마), 제인, 셀락 및 다당류를 포함하나, 이에 제한되는 것은 아니다.
추가적으로, 상기 코팅 물질은 가소제, 색소, 색료, 유동화제, 안정화제, 다공 형성제 및 계면활성제와 같은 통상적인 담체를 함유할 수 있다.
임의의 약제학적으로 허용되는 부형제는 희석제, 결합제, 윤활제, 붕괴제, 색료, 안정화제 및 계면활성제를 포함하나, 이에 제한되는 것은 아니다. "충진제"로 또한 언급되는 희석제는 일반적으로 고체 투여 형태의 부피를 증가시키는 데 필요하며, 이로써 정제의 압축 또는 비드 및 과립의 형성을 위한 입자 크기가 제공된다. 적합한 희석제는, 이칼슘 포스페이트 이수화물, 황산칼슘, 락토스, 수크로스, 만니톨, 소비톨, 세룰로오스, 미결정질 세룰로오스, 카올린, 염화나트륨, 건조 전분, 가수분해된 전분, 전호화 전분, 이산화규소, 산화티탄, 마그네슘 알루미늄 실리케이트 및 분말화된 슈거를 포함하나, 이에 제한되는 것은 아니다.
결합제는 고체 투여 제형에 접착 특성을 부여하여 정제 또는 비드 또는 과립이 투여 형태로 조성된 후에도 손상되지 않은 채로 존재하는 것을 보장하기 위해 사용된다. 적합한 결합 물질은, 전분, 전호화 전분, 젤라틴, 슈거(수크로스, 글루코스, 덱스트로스, 락토스 및 소비톨을 포함하는), 폴리에틸렌 글리콜, 왁스, 아카시아, 트래거컨트, 알긴산나트륨과 같은 천연 및 합성 검, 히드록시프로필메틸세룰로오스, 히드록시프로필세룰로오스, 에틸세룰로오스, 및 비검(veegum)을 포함한 세룰로오스, 아크릴산 및 메타크릴산 공중합체, 메트아크릴산 공중합체, 메틸 메타크릴레이트 공중합체, 아미노알킬 메타크릴레이트 공중합체, 폴리아크릴산/폴리메타크릴산 및 폴리비닐피롤리돈과 같은 합성 중합체를 포함하나, 이에 제한되는 것은 아니다.
윤활제는 정제 제조를 용이하게 하기 위해 사용된다. 적합한 윤활제의 예는, 마그네슘 스테아레이트, 칼슘 스테아레이트, 스테아르산, 글리세롤 베헤네이트, 폴리에틸렌 글리콜, 탈크 및 미네랄 오일을 포함하나, 이에 제한되는 것은 아니다.
붕괴제는 투여 후 투여 형태의 붕괴 또는 "부서짐"을 용이하게 하기 위해 사용되며, 일반적으로, 전분, 나트륨 전분 글리콜레이트, 나트륨 카복시메틸 전분, 나트륨 카복시메틸세룰로오스, 히드록시프로필 세룰로오스, 전호화 전분, 점토, 세룰로오스, 알기닌, 검 또는 가교결합된 PVP(GAF 케미컬(주)의 Polyplasdone XL)와 같은 가교-결합된 중합체를 포함하나, 이에 제한되는 것은 아니다.
안정화제는 예로 산화 반응을 포함한 약물 분해 반응을 억제하거나 지연시키기 위해 사용된다. 적합한 안정화제는, 항산화제, 부틸화된 히드록시톨루렌(BHT), 아스코르브산, 이의 염 및 에스테르; 비타민 E, 토코페롤 및 이의 염; 나트륨 메타바이설파이트와 같은 설파이트; 시스테인 및 이의 유도체; 구연산; 프로필 갈레이트, 및 부틸화된 히드록시아니솔(BHA)를 포함하나, 이에 제한되는 것은 아니다.
캡슐, 정제, 용액 및 현탁액과 같은 경구 투여 제형은 조절된 방출을 갖도록 제형화될 수 있다. 예를 들어, 하나 이상의 화합물들 및 임의로 하나 이상의 추가적 활성 성분들이 나노 입자, 마이크로 입자, 및 이의 조합으로 제형화되어, 연질 또는 경질 젤라틴 또는 비-젤라틴 캡슐로 캡슐화되거나 분산 매질 내 분산되어 경구 현탁액 또는 시럽을 형성할 수 있다. 상기 입자들은 약물 및 조절된 방출 중합체 또는 매트릭스로 형성될 수 있다. 또는, 상기 약물 입자들은 완성된 투여 형태로 혼입되기 전에 하나 이상의 조절된 방출 코팅제로 피복될 수 있다.
다른 양태에서, 하나 이상의 화합물 및 임의로 하나 이상의 추가적인 활성 성분이 매트릭스 물질 내 분산되고, 이것이 생리적 용액과 같은 수성 매질과 접촉되었을 때 겔화되거나 에멀젼화될 수 있다. 겔의 경우, 활성 성분들을 포획하는 상기 매트릭스는 팽창하고, 이로써 매트릭스 물질의 확산 및/또는 분해에 의해 시간이 지남에 따라 서서히 방출된다. 그러한 매트릭스는 정제로서 또는 경질 및 연질 캡슐용 충전 물질로 제형화될 수 있다.
또 다른 양태에서, 상기 하나 이상의 화합물 및 임의로 하나 이상의 추가적 활성 성분은 정제 또는 캡슐과 같은 고체 경구 투여 형태로 제형화되고, 상기 고체 투여 형태는 지연된 방출 코팅 또는 연장된 방출 코팅과 같은 하나 이상의 조절된 방출 코팅제로 피복된다. 상기 코팅제 또는 코팅제들은 또한 본 화합물 및/또는 추가적 활성 성분을 함유할 수 있다.
연장된 방출 제형은 일반적으로, 예를 들어, 문헌[ "Remington - The science and practice of pharmacy" (20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000]에 기술된 확산 또는 삼투 시스템으로 제조될 수 있다. 확산 시스템은 일반적으로 2개 유형의 장치, 즉, 저장소 및 매트릭스로 이루어지며, 이는 당업자에게 잘 알려져 있으며, 기술되어 있다. 상기 매트릭스 장치는 일반적으로 약물을, 서서히 용해하는 중합체 담체와 함께 정제 형태로 압축함으로서 제조된다. 매트릭스 장치의 제조에 사용되는 3가지 주요 유형의 물질들은 불용성 플라스틱, 친수성 중합체 및 지방 화합물들이다. 플라스틱 매트릭스는, 메틸 아크릴레이트-메틸 메타크릴레이트, 폴리비닐 클로라이드 및 폴리에틸렌을 포함하나, 이에 제한되는 것은 아니다. 친수성 중합체는, 메틸 및 에틸 세룰로오스와 같은 세룰로오스 중합체, 히드록시프로필-세룰로오스, 히드록시프로필메틸세룰로오스, 나트륨 카복시메틸세룰로오스 및 Carbopol 934와 같은 히드록시알킬세룰로오스, 폴리에틸렌 옥시드 및 이의 혼합물을 포함하나, 이에 제한되는 것은 아니다. 지방 화합물들은, 카나우바 왁스 및 글리세릴 트리스테아레이트와 같은 다양한 왁스, 및 수소화된 피마자유 또는 수소화된 식물유를 포함하는, 왁스-타입 성분, 또는 이의 혼합물을 포함하나, 이에 제한되는 것은 아니다.
특정 바람직한 양태에서, 상기 플라스틱 물질은 아크릴산 및 메타크릴산 공중합체, 메틸 메타크릴레이트, 메틸 메타크릴레이트 공중합체, 에톡시에틸 메타크릴레이트, 시아노에틸 메타크릴레이트, 아미노알킬 메타크릴레이트 공중합체, 폴리(아크릴산), 폴리(메타그릴산), 메타크릴산 알킬아민 공중합체 폴리(메틸메타크릴레이트), 폴리(메타크릴산)(안하이드리드), 폴리메타크릴레이트, 폴리아크릴아미드, 폴리(메타크릴산 안하이드리드), 및 글리시딜 메타크릴레이트 공중합체를 포함하나, 이에 제한되는 것은 아닌 약제학적으로 허용되는 아크릴 중합체이다.
특정 바람직한 양태에서, 상기 아크릴 중합체는 하나 이상의 암모니오 메타크릴레이트 공중합체로 구성된다. 암모니오 메타크릴레이트 공중합체는 당업자에게 잘 알려져 있으며, 이는 낮은 함량의 4차 암모늄기를 포함하는 아크릴산과 메타크릴산 에스테르의 완전 중합된 공중합체로서 NF XVII에 기재되어 있다.
한 바람직한 양태에서, 상기 아크릴 중합체는 상표명 Eudragit으로 로움 파마에서 시판하는 것과 같은 아크릴 수지 광택제(lacquer)이다. 추가의 바람직한 양태에서, 상기 아크릴 중합체는 상표명 Eudragit RL30D 및 Eudragit RS30D로 각각 로움 파마에서 시판되는 2개의 아크릴 수지 광택제들의 혼합물을 포함한다. Eudragit RL30D 및 Eudragit RS30D는 낮은 함량의 4차 암모늄기를 가진 아크릴 및 메타크릴 에스테르의 공중합체로, Eudragit RL30D 중 암모늄기와 잔여 중성(메트)아크릴 에스테르의 몰비는 1:20이고, Eudragit RS30D은 1:40이다. 평균 분자량은 약 150,000이다. Eudragit S-100 및 Eudragit L-100이 또한 바람직하다. 상기 코드명 RL(높은 투과성) 및 RS(낮은 투과성)은 이들 제제의 투과 특성을 나타낸다. Eudragit RL/RS 혼합물들은 물 및 소화액에 불용성이다. 그러나, 이를 포함하도록 형성된 다중입자 시스템이 수성 용액 및 소화액 내에서 팽창하여 투과성이 될 수 있다.
Eudragit RL/RS과 같은 상술한 중합체들이 임의의 적합한 비율로 함께 혼합되어 궁극적으로 바람직한 용해 프로파일을 갖는 지연된 방출 제형을 수득할 수있다. 바람직한 지연된-방출 다중입자 시스템은 예를 들어, 100% Eudragit RL, 50% Eudragit® RL 및 50% Eudragit® RS, 및 10% Eudragit® RL 및 90% Eudragit® RS로부터 수득될 수 있다. 당업자는 예를 들어 Eudragit® L과 같은 다른 아크릴 중합체가 사용될 수 있음을 이해할 것이다.
또는, 연장된 방출 제형이 삼투 시스템을 사용하거나, 투여 형태에 반-투과성 코팅을 적용함으로써 제조될 수 있다. 후자의 경우, 바람직한 약물 방출 프로파일은 낮은 투과성 및 높은 투과성 코팅 물질을 적합한 비율로 결합시킴으로써 얻어질 수 있다.
상기한 상이한 약물 방출 메카니즘의 장치들을 단일 또는 다수의 단위를 함유하는 최종 투여 형태 내 조합시킬 수 있다. 다수의 단위들의 예로, 다층 정제 및 정제, 비드 또는 과립을 함유하는 캡슐을 포함하나, 이에 제한되는 것은 아니다. 즉시 방출부는 코팅 또는 압축 과정을 이용하여 연장된 방출 코어의 상단 상에 즉시 방출 층을 적용하거나, 연장된 및 즉시 방출되는 비드를 함유하는 캡슐과 같은 다중 단위 시스템에 의해 연장된 방출 시스템에 첨가될 수 있다.
친수성 중합체를 함유하는 연장된 방출 정제는 직접 압축, 습윤 과립화, 또는 건조 과립화와 같은 당업자에게 일반적으로 알려진 기술에 의해 제조된다. 이들의 제형은 일반적으로, 활성 약제학적 성분 뿐만 아니라 중합체, 희석제, 결합제 및 윤활제를 포함한다. 통상적인 희석제로는 전분, 분말화된 세룰로오스, 특히 결정성 및 미결정성 세룰로오스, 과당, 만노톨 및 수크로스와 같은 슈거, 밀가루 및 유사한 식용 분말과 같은 불활성 분말 성분을 포함한다. 전형적인 희석제로 예를 들어, 다양한 종류의 전분, 락토스, 만니톨, 카올린, 인산칼슘 또는 황산칼슘, 염화나트륨과 같은 무기염 및 분말화된 슈거를 포함한다. 분말화된 세룰로오스 유도체가 또한 유용하다. 전형적인 정제 결합제로는 전분, 젤라틴과 같은 성분들, 락토스, 과당, 및 포도당과 같은 슈거를 포함한다. 아카시아, 알기네이트, 메틸세룰로오스, 및 폴리비닐피롤리돈을 포함한 천연 및 합성 검이 또한 사용될 수 있다. 폴리에틸렌 글리콜, 친수성 중합체, 에틸세룰로오스 및 왁스가 또한 결합제로 제공된다. 윤활제는 정제 및 펀치가 다이에 접착하는 것을 방지하기 위해 정제 제형에 필요하다. 윤활제는 탈크, 마그네슘 및 칼슘 스테아레이트, 스테아르산 및 수소화된 식물유와 같은 미끄러운 고체로부터 선택된다.
왁스 물질을 함유하는 연장된 방출 정제는 일반적으로 직접 혼합법, 응결법, 및 수성 분산법과 같은 당업자에게 공지된 방법들을 사용하여 제조된다. 응결법에서, 약물은 왁스 물질과 혼합되고, 분사-응결 혹은 응결되고, 스크리닝되고, 공정을 거치게 된다.
지연된 방출 제형은 고체 투여 형태를 중합체 필름으로 피복함으로써 제조될 수 있으며, 상기 중합체 필름은 위의 산성 환경에서는 불용성이나 소장의 중성 환경에서는 가용성이다.
지연된 방출 투여 단위는 예를 들어, 약물 또는 약물-함유 조성물을 선택된 코팅 물질로 코팅함으로써 제조될 수 있다. 상기 약물-함유 조성물은 예를 들어, 캡슐 내로 혼입되기 위한 정제, "코팅된 코어" 투여 형태에서 내부 코어로서 사용되는 정제, 또는 정제 또는 캡슐 내로 혼입되기 위한 복수개의 약물-함유 비드들, 입자들 또는 과립들일 수 있다. 바람직한 코팅 물질은 생분해성, 점진적으로 가수분해되는, 점진적으로 수용해되는 및/또는 효소적으로 분해되는 중합체를 포함하며, 통상적인 "장용성" 중합체일 수 있다. 당업자에게 이해되는 바와 같이 장용성 중합체는 더 낮은 위장관의 더 높은 pH 환경에서 가용성이 되거나, 투여 형태가 위장관을 통과함에 따라 서서히 분해되는 반면, 효소적으로 분해가능한 중합체는 더 낮은 위장관, 특히 결장에 존재하는 세균성 효소에 의해 분해된다. 지연된 방출을 나타내기에 적합한 코팅 물질로는 히드록시프로필 세룰로오스, 히드록시에틸 세룰로오스, 히드록시메틸 세룰로오스, 히드록시프로필 메틸 세룰로오스, 히드록시프로필 메틸 세룰로오스 아세테이트 석시네이트, 히드록시프로필메틸 세룰로오스 프탈레이트, 메틸세룰로오스, 에틸 세룰로오스, 세룰로오스 아세테이트, 세룰로오스 아세테이트 프탈레이트, 세룰로오스 아세테이트 트리멜리테이트 및 카복시메틸세룰로오스 나트륨과 같은 세룰로오스 중합체; 바람직하게 아크릴산, 메타크릴산, 메틸 아크릴레이트, 에틸 아크릴레이트, 메틸 메타크릴레이트 및/또는 에틸 메타크릴레이트로부터 형성된 아크릴산 중합체 및 공중합체, 및 Eudragit® L30D-55 및 L100-55 (pH 5.5 이상에서 가용성), Eudragit® L-1OO (pH 6.0 이상에서 가용성), Eudragit® S (높은 정도의 에스테르화의 결과로 pH 7.0 이상에서 가용성), 및 Eudragits® NE, RL 및 RS (상이한 정도의 투과성 및 팽창성을 가진 수불용성 중합체)을 포함한 상표명 Eudragit®(독일, 바이스터슈타트, 로움 파마)으로 시판되는 기타 메타크릴 수지; 폴리비닐 피롤리돈, 비닐 아세테이트, 비닐아세테이트 프탈레이트, 비닐아세테이트 크로톤산 공중합체, 및 에틸렌-비닐 아세테이트 공중합체와 같은, 비닐 중합체 및 공중합체; 아조 중합체, 펙틴, 키토산, 아밀로스 및 구아검과 같은 효소적으로 분해가능한 중합체; 제인 및 셀락을 포함하나, 이에 제한되는 것은 아니다. 상이한 코팅 물질의 배합이 또한 사용될 수 있다. 상이한 중합체를 이용한 다층 코팅이 또한 적용될 수 있다.
특정 코팅 물질에 대한 바람직한 코팅 중량은 다양한 코팅 물질의 상이한 양으로 제조된 정제, 비드 및 과립의 개별 방출 프로파일을 평가함으로써 당업자에 의해 용이하게 결정될 수 있다. 이는 목적하는 방출 특성을 나타내는 물질, 방법 및 적용 형태의 조합이며, 이는 당업자가 오직 임상적 연구로부터 결정할 수 있는 것이다 .
코팅 조성물은 가소제, 색소, 색료, 안정화제, 유동화제 등과 같은 통상적인 첨가제를 포함할 수 있다. 가소제는 일반적으로 코팅의 취약성을 감소시키기 위해 존재하며, 일반적으로 중합체의 건조 중량에 대해 약 10 중량% 내지 50 중량%로 존재할 것이다. 일반적인 가소제의 예로는, 폴리에틸렌 글리콜, 프로필렌 글리콜, 트리아세틴, 디메틸 프탈레이트, 디에틸 프탈레이트, 디부틸 프탈레이트, 디부틸 세바케이트, 트리에틸 시트레이트, 트리부틸 시트레이트, 트리에틸 아세틸 시트레이트, 피마자유 및 아세틸화된 모노글리세리드를 포함한다. 안정화제는 분산액 중 입자를 안정화시키기 위해 바람직하게 사용된다. 일반적인 안정화제는 소비탄 에스테르, 폴리소르베이트 및 폴리비닐피롤리돈과 같은 음이온성 유화제이다. 유동화제는 필름 형성 및 건조 동안에 끈적이는 효과를 감소시키기 위해 권장되며, 일반적으로 코팅 용액 중 중합체 중량의 대략 25 중량% 내지 100 중량%를 나타낼 것이다. 한 효과적인 유동화제는 탈크이다. 마그네슘 스테아레이트 및 글리세롤 모노스테아레이트와 같은 기타 유동화제가 또한 사용될 수 있다. 이산화티탄과 같은 색소가 또한 사용될 수 있다. 실리콘(예: 시메티콘)과 같은 소량의 항-포움제가 또한 상기 코팅 조성물에 첨가될 수 있다.
III . 화합물의 제조 방법
본원에 기술된 화합물들을 합성하는 예가 첨부된 반응식 1 내지 3에 도시되어 있다. 각 경우에서, 출발 물질은 1,2-디클로로-4-니트로벤젠 및 피페라진이고, 이것이 반응하여 본원에 기술된 화합물들을 제조하기에 적합한 1-(4-니트로-1-클로로페닐)피페라진을 형성한다.
상기 벤젠 시약 상의 치환기들은 제조하려고 하는 최종 생성물에 따라 적합하게 달라질 수 있다. 그렇게 하여 형성된 상기 치환된 피페라진은 제조하려고 하는 최종 생성물에 따라 적합하게 치환된 3-페닐-4-카복시-이속사졸 화합물과 반응한다. 상기 3-페닐-4-카복시-이속사졸 화합물은 히드록실아민 하이드로클로라이드과의 반응, 및 이후 반응식 1 내지 3에서 예시된 화학 반응 단계에 의해 보호된 1,4-디하이드록시 벤젠으로부터 제조될 수 있다. 화합물 1 내지 10의 제조 과정이 실시예에 기술된다.
반응식 1. 화합물 1(YD-04)의 합성
반응식 2. 화합물 2(YD-01)의 합성
반응식 3. 화합물 3(YD-03) 및 화합물 4(YD-07)의 합성
IV . 사용 방법
본원에 기술된 항-바이러스제는 바이러스 성장, 감염성, 짐(burden), 씨앗(shed), 항-바이러스 저항성의 개발을 감소시키기 위해 및/또는전통적인 항-바이러스 치료의 효능을 개선시키기 위해 사용될 수 있다.
네가티브-센스 RNA 게놈을 갖는 모든 바이러스들은 단일 가락 RNA-결합 핵단백질(NP)을 인코딩한다. 핵단백질들은 구조적으로 핵산(DNA 또는 RNA)과 관련된 단백질들이다. 인플루엔자 핵단백질은 핵과 세포질 사이의 서틀링 및 RNA 전사를 위한 바이러스 게놈의 엔켑시데이션(encapsidation), 복제 및 팩키징을 포함한 다중 기능을 가지며 감염 과정 동안에 가장 풍부하게 발현되는 단백질이다. NP는 폭넓은 종류의 바이러스 및 숙주 세포 거대분자 모두와 상호작용하며, 예를 들어, 그 자체, RNA, 바이러스 RNA-의존성 RNA 폴리머라제, 및 바이러스 매트릭스 단백질과 상호작용한다. NP는 또한 숙주 폴리펩티드(액틴과 같은), 핵수송 및 핵외 유출 기구의 성분, 및 핵 RNA 헬리카제와 상호작용한다. 인플루엔자 A NP 상의 3개의 잠재적인 신규 결합부위는, 소 그루브(groove), RNA 결합 포켓 그루브, 및 테일 루프 그루브를 포함한다.
임의의 특정 이론에 얽매이지 않으면서, 본원에 기술된 화합물들의 작용 메카니즘의 가설은 인플루엔자 바이러스와 같은 바이러스의 핵단백질(NP)에의 결합과 이로 인해 in vivo에서 바이러스 복제의 방해가 관여하는 것이다.
일 양태에서, 본원에 기술된 항-바이러스제는 인플루엔자 A 핵 단백질의 몸체 후면에 있는 소 그루브(뉴클레오진 결합 그루브라 불리는)에 결합하며, 잔기 280 내지 311이 관여한다(VYGSAVASGYDFEREGYSLVGIDPFRLLQNSQ) (서열 목록 번호: 1). 이들 잔기의 제2 구조는 헬릭스 사이의 잔기들에 의해 형성된 루프로 연결된 3개의 짧은 헬릭스(280-287, 291~294, 및 301-309)를 포함한다.
상기 NP 억제제는 상기 몸체 후면 상의 소 그루브 내 위치할 수 있으며, 수소 결합에 의해 잔기 N309와 상호작용하고, 소수성 상호작용에 의해 Y289와 상호작용할 수 있다. 여기서, 화합물의 페닐 고리는 Y289의 페닐 고리와 평행할 수 있고, 이들 2개의 고리 사이의 거리는 ~ 3.2-4.3 Å 사이이다.
특정 양태에서, 상기 NP 억제제는 소 그루브에 결합하고 화합물은 잔기 S287과 수소 결합을 형성한다. 특정 양태에서, 항-바이러스제는 상기 나열된 접촉점과 조합하여 또는 단독으로 결합 접촉점을 만들 수 있다. 특히, 항-바이러스 화합물들은 잔기 465~470 (서열: ELSDEK) (서열 목록 번호: 2), 잔기 22-26 (서열: ATEIR) (서열 목록 번호: 3), 잔기 A22-47L (서열 : ATEIRASVGKMIDGIGRFYIQMCTEL) (서열 목록 번호:4), R55, 또는 이의 조합과 접촉할 수 있다.
다른 양태에서, NP 억제제들은 인플루엔자 A 핵단백질의 RNA 결합 그루브에 결합한다. 이 양태에서, 상기 NP 억제제는 RNA 결합 도메인 내에 위치하며, 여기서 핵단백질의 몸체 및 두부 사이의 내부 그루브가 신장하여 잔기 Q364 및 V363와 수소 결합을 형성한다. 이로써 RNA가 아르기닌 풍부 그루브에 진입하는 것이 방지된다. Y148은 RNA의 제1 염기의 고정으로써 기능하는 것으로 간주되었다.
다른 양태에서, 예시적 NP 억제제는 인플루엔자의 테일 루프 그루브에 결합한다. 이 양태에서, NP 억제제는 잔기 E339 근처의 테일 루프 결합 도메인 내에 위치하고 잔기 V186, R267, 및 G268과 수소 결합을 형성한다. 이 결합 포켓에서의 NP 억제제는 다른 단량체로부터 E339 및 R416 사이에 형성된 염 브리지를 절단한다.
B. 치료되는 장애들
동물, 척추동물, 포유류 및 인간 환자를 감염시키는 것을 포함하여, 엔벨롭 및 비-엔벨롭 모두에 의해 야기되는 바이러스 감염들은 본원에 기술된 화합물들 또는 조성물들로 예방되거나 치료될 수 있다. 본 화합물들은 척추동물, 특히 인간을 감염시키는 모든 바이러스들, 및 특히 동물 및 인간에 병원성인 바이러스들을 치료하기에 적합하다. 치료될 수 있는 바이러스 감염 및 관련된 생성 질환으로는, CMV, RSV, 아레나바이러스 및 HIV 감염, 및 질환들, 간염, 인플루엔자, 폐렴, 라싸열 및 AIDS를 포함하나, 이에 제한되는 것은 아니다. 바이러스 분류에 대한 국제 위원회는 당업자에게 알려진 모든 바이러스 균주의 목록을 함유하며, 이는 참조에 의해 이의 전체가 본원에 혼입된다.
특정 양태에서, 예방되거나 치료되는 질환은 바이러스 감염을 포함한다. 바람직한 양태에서, 본 화합물 및 제형은 인플루엔자 A 바이러스 감염을 치료하거나 예방하는 데 사용된다. 본 방법의 제형으로 예방되거나 치료될 수 있는 인플루엔자 A 바이러스는 HlNl, H2N2, H3N2, H5N1, H7N7, H1N2, H9N2, H7N2, H7N3, 및 H10N7을 포함한다. 바람직한 양태에서, 본 제형은 HlNl 또는 H3N2에 의해 야기되는 인플루엔자 감염 A 균주의 치료에 유용하다.
C. 용량
바이러스 성장 및 증식을 예방하는 데 필요한 항-바이러스 제형의 용량은 존재할 수 있는 바이러스의 종류, 제형이 사용되는 환경, 및 제형이 투여된 부위에서 잔류할 것으로 예상되는 시간을 포함한 다수의 인자에 의해 변할 수 있다.
바람직한 화합물들은 실제 스크리닝(virtual screen)에 의해 확인된 것들이다. 예시적 화합물들은 화학식 I 내지 VI에 속한다. 바이러스 감염을 치료하기 위한 전형적인 용량은 약 0.1 mg 내지 250mg/kg/1일이고, 바람직하게는 0.2 내지 250mg/kg/1일이다.
본 화합물들은 바이러스 감염의 치료를 위해 경구 또는 비경구 경로에 의해 인간에게 투여되거나 1일 1회 또는 1일 2회, 약 0.1 내지 약 500mg/kg의 용량 수준, 바람직하게는 약 0.5 내지 250mg/kg/1일의 용량 수준으로 경구로 투여될 수 있다.
용량 및 제형에 있어서의 변화는 당업자에게 알려진 바와 같이 치료되는 대상체의 체중 및 상태 및 선택된 투여의 특정 경로에 기초하여 결정될 것이다.
실시예
물질 및 방법
바이러스
인플루엔자 A\WSN\33 바이러스를 매딘-다비 개 신장(Madin-Darby canine kidney (MDCK)) 세포에서 번식시켰다. 완전한 세포 변성 효과를 감염된 MDCK 세포 배양물에서 진행시킨 후, 바이러스 입자들을 수집하여 사용할 때까지 -70℃ 냉동고에서 저장하였다. 인플루엔자 A 바이러스 균주, A/베트남/1194/04를 부화계란에서 성장시키고, 상기 수집된 바이러스-함유 요막 유액을 사용할 때까지 -70℃에서 분취량으로 저장하였다.
플라그 감소 검사(PRA)
본 화합물들의 보호 효과를 플라그 감소 검사를 이용하여 항-인플루엔자 A H1N1\WSN\33에 대해 MDCK 세포 상에서 측정하였다.
상기 PRA 검사를 24-웰 조직 배양 플레이트에서 3차례 실시하였다. MDCK 세포를 바이러스 첨가 하루 전에 10% 소태아 혈청(FBS)을 함유한 EMEM(Eagle's minimal essential medium)를 사용하여 1×105 세포/웰로 씨딩하였다. 16 내지 24시간 후에, 인플루엔자 A\WSN\33 바이러스의 100 내지 200개의 플라그 형성 단위(PFU)를 본 화합물과 함께 또는 본 화합물 없이 상기 세포 단일층에 첨가하였다. 화합물 1 내지 10의 각각의 농도는 상이한 실험에서 달라졌다. 흡인에 의해 미결합된 바이러스 입자를 제거하기 전에 바이러스를 5% CO2, 37℃에서 1.5 내지 2 시간 동안 세포에 감염시켰다. 상기 세포 단일층을 EMEM과 함께 1회 세정하고 1% FBS 및 1 μg/ml TPCK 트립신을 함유하는 EMEM 중 1% 저융점 아가로스로 덮어씌웠다. 화합물들은 또한 필요할 때 아가로스 오버레이 내 존재하였다.
상기 플레이트를 72시간 동안 5% CO2, 37℃에서 배양하였다. 72시간 감염시킨 후, 세포를 3시간 동안 10% 포름알데히드를 이용하여 고정시키고 플레이트를 5분간 1% Virkon 살균제에 담갔다. 이후 아가로즈 플러그를 제거하고 세포 단일층을 0.7% 크리스탈 바이올렛으로 염색하였다. 바이러스 감염에 의해 형성된 플라그를 계수하였다. 대조군(본 화합물을 첨가하지 않은) 대비 플라그 억제율(%)을 각 화합물 농도에 대해 측정하였다. 시험 화합물의 농도의 함수로서 억제제 부재 중의 대조군 대비 각 화합물의 플라그 형성 단위(PFU)(PFU의 감소율(%))의 플롯을 만들었다. 바이러스 PFU를 50% 감소시키는 데 필요한 약물의 농도를 나타내는 중간 유효 농도, EC50을 상기 플롯팅된 그래프로부터 계산하였다. 결과를 화합물의 부재중의 대조군의 백분율로써 나타내고 이를 도면에 도시하였다. 평균 값은 표준 편차와 함께 나타내었다.
세포독성 검사
화합물 1-10의 세포독성을 3-(4,5-디메틸티아졸-2-일)-2,5-디페닐테트라졸륨 브로마이드(MTT, 시그마-알드리치, 미국) 검사에 의해 측정하였다. 상기 검사는 평평 바닥의 96-웰 미세적정 플레이트 내에서 10% FBS를 함유한 총 용적 100 μl EMEM 중 20,000 세포/웰로 Vero 세포 또는 MDCK 세포를 씨딩하여 실시하였다. 24시간 배양 후, 세포를 PBS로 2회 세정하고 이후 본 화합물을 첨가하기 전에 신선한 EMEM으로 보충하였다. 본 화합물을 첨가한 후, 세포를 추가로 24 시간 동안 5% CO2, 37℃에서 배양하였다. MTT를 각 웰에 첨가하여 최종 농도를 0.5 mg/ml가 되게 하였다. 플레이트를 4시간 동안 5% CO2, 37℃에서 추가로 배양하였다. 배양 기간의 종기에, 0.01M의 염산(HCl) 중 10% 라우릴 설페이트(SDS) 100 μl를 각 웰에 첨가하여 세포를 가용화시켰다. 밤새 배양한 후, 플레이트를 참조 파장을 640nm로 하여 570nm에서 리딩(reading)하였다. MTT 리딩을 50% 감소시키는 데 필요한 화합물의 농도를 나타내는 중앙 독성 농도, TC50을 상기 MTT 데이터로부터 측정하였다.
실시예 1. 화합물 1의 합성( YD -04)
화합물 1을 반응식 1에 제시된 합성식에 따라 합성하였다. 화합물 2, 3 및 4를 합성하기 위한 다양한 합성식의 변형 예들이 반응식 2 및 3에 제시되어 있어 화합물 1의 다른 유사체들의 합성에서 약간의 변화가 있음을 보여준다.
YD-041의 합성
무수 디클로로메탄(50 mL) 중 p-히드록시벤즈알데히드 (3.7 g, 30.0 mmol) 및 트리에틸아민 (6.3 mL, 45.0 mmol)의 용액에 무수 디클로로메탄(50 mL) 중 t-부틸디메틸실릴 클로라이드 (6.8 g, 45.0 mmol) 용액을 점적 첨가하였다. 생성된 혼합물을 2시간 동안 실온에서 교반하고 이후 물(100 mL)을 첨가하였다. 유기 층을 분리하고 수성 층을 디클로로메탄으로 추출하였다. 결합된 유기층을 물 및 포화 염수로 세정하고 황산마그네슘으로 건조하였다. 여과 및 농축 후, 수득된 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 9:1)로 추가 정제하여 노란색 오일의 조 생성물 YD-041 (7.29 g)를 수득하였다.
화합물 YD-042의 합성
YD-041 (1.18 g, 5 mmol) 및 히드록실아민 하이드로클로라이드 (1.15 g, 16.5 mmol)를 실온에서 무수 에탄올(10 mL)에 용해시키고, 이후 교반하면서 피리딘 (20 mL)을 점적 첨가하였다. 생성된 혼합물을 30분 동안 실온에서 교반하고 이후 40분간 환류 가열하였다. 종결시, 반응 혼합물을 실온으로 냉각하고, 37%의 하이드로클로라이드 용액 (2 mL) 및 물 (7.5 mL)의 혼합물을 첨가하였다. 생성된 혼합물을 총 용적의 1/3이 남을 때까지 농축시켰다. 디클로로메탄으로 추출한 후, 유기 층을 포화 염수로 세정하고 황산마그네슘으로 건조시켰다. 용매를 제거한 후, 남아있는 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 1:1)로 정제하여 노란색 오일의 YD-042 (0.862 g, 78%)를 수득하였다.
화합물 YD-043의 합성
YD-042 (810 mg, 3.2 mmol)을 무수 디메틸포름아미드 (4 mL)에 용해시키고, 이후 0℃로 냉각시켰다. 교반하면서 N-클로로석신이미드 (NCS, 452 mg, 3.2 mmol)를 부분씩 첨가하였다. 냉각 배쓰를 제거하고 반응 혼합물을 실온에서 1 시간 동안 교반하였다. 종결시, 반응 혼합물의 용적의 4배 양의 물을 첨가하고 생성된 혼합물을 디에틸 에테르로 추출하였다. 유기 층을 물로 3회 세정하고 황산마그네슘으로 건조하였다. 여과 및 농축 후, 노란색 오일의 조 YD-043(884mg, 96%)를 수득하였다.
화합물 YD-044의 합성
아세토니트릴(40mL) 중 YD-06 (737 mg, 3.8 mmol) 용액에 0℃에서 아세토니트릴(8mL) 중 조 YD-043(884mg, 3.1mmol)의 용액을 점적 첨가하였다. 생성된 혼합물을 2시간 동안 0℃에서 교반하였다. 종결시, 얼음물(4mL)를 첨가하고 대부분을 용매를 감압 하 제거하였다. 물을 첨가하고 생성된 혼합물을 디에틸 에테르로 추출하였다. 유기 층을 물로 3회 및 포화 염수로 1회 세정하고 황산마그네슘으로 건조하였다. 감압 하 여과 및 농축 후, 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 15:1)로 정제하여 노란색 오일의 YD-044(627 mg, 52%)를 수득하였다.
화합물 YD-045의 합성
YD-044 (3.23 g, 8.3 mmol)를 트리플루오로아세트산 (10 mL)에 용해시키고, 생성된 용액을 30분간 실온에서 교반하였다. 이후 트리플루오로아세트산을 감압하 제거하고 잔류물을 디에틸 에테르에 용해시켰다. 페트롤륨 에테르를 참가하여 생성물을 결정화하였다. 여과 및 진공 건조 후, 백색의 편상 결정의 YD-045 (1.327 g, 48%)를 수득하였다.
화합물 YD-046의 합성
무수 디클로로메탄 (8 mL) 중 YD-045 (177 mg, 0.53 mmol)의 용액에 N,N-디이소프로필에틸아민 (DIEA, 103 mg, 0.80 mmol), YD-05 (128 mg, 0.53 mmol) 및 1-에틸-3-(3-디메틸아미노프로필) 카보디이미드 (EDCI, 406 mg, 2.13 mmol)를 순서대로 첨가하였다. 생성된 혼합물을 3시간 동안 실온에서 교반하고, 이후 디클로로메탄으로 희석시켰다. 유기 층을 분리하고 2M 수산화나트륨 용액, 물 및 포화 염수로 세정하고, 황산나트륨으로 건조하고 여과 및 농축하였다. 수득된 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 3:1)로 정제하여 연노란색 바늘 결정의 YD-046(141 mg, 48%)을 수득하였다.
화합물 1(YD-04)의 합성
YD-046 (67 mg, 0.12 mmol)을 무수 테트라하이드로푸란 (4 mL)에 용해시키고, 테트라-n-부틸암모늄 플루오라이드 (TBAF, 63 mg, 0.24 mmol)를 첨가하였다. 생성된 혼합물을 실온에서 30분간 교반하였다. 농축 후, 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 1:1)로 정제하여 밝은 노란색 분말의 YD-04(31 mg, 58%)을 수득하였다. 235 내지 240℃에서 분해됨.
실시예 2. 화합물 2(YD-01)의 합성
화합물 2(YD-01)의 합성은 반응식 2에 구조적으로 도시되어 있다.
화합물 YD-011의 합성
벤즈알데히드 (10.60 g, 0.10 mol) 및 히드록실아민 하이드로클로라이드 (22.94 g, 0.33 mol)를 90% 에탄올 (330 mL)에 용해시켰다. 수산화나트륨 분말을 첨가함으로써 이 용액의 pH를 5로 조정하였다. 생성된 용액을 30분간 실온에서 교반하고 추가적인 30분 동안 환류 가열하였다. 반응 혼합물을 주위 온도로 냉각하고 농축된 염산(40 mL)과 물(150 mL)의 혼합물에 첨가하고, 본래 용적의 1/3이 되게 농축하였다. 상기 농축된 혼합물을 디클로로메탄으로 추출하고, 유기 층을 포화 염수로 세정하고 무수 황산마그네슘으로 건조한 후, 진공 하 증발시켜 노란색 조 오일을 수득하였다. 상기 조 오일을 진공 증류(40 mm Hg, 150-155℃)에 의해 정제하여 연노란색 오일, YD-O11 (9.87 g, 82% 수율)을 수득하였다. 상기 오일은 냉동시 황백색(off-white)의 결정을 형성하였다. 시스 및 트랜스 이성질체 모두가 TLC에 의해 검출되었다.
화합물 YD-012의 합성
0℃에서 무수 디클로로메탄 중 YD-O11 (2 g, 16.53 mmol) 용액에 N-클로로석신이미드 (NCS, 8.79 g, 66 mmol)를 교반하면서 소량씩 첨가하였다. 혼합물을 주위 온도로 가온시키고 2시간 동안 교반하였다. 물 (50 mL)을 반응 혼합물에 첨가하고 층을 분리하였다. 수성 층을 디클로로메탄 (20 mL×3)으로 추출하고 결합된 유기 층을 포화 염수로 세정하고, 무수 황산마그네슘으로 건조한 후, 여과 및 진공 농축하였다. 조 생성물을 에틸 아세테이트 중 페트롤룸 에테르가 감소하는 농도 구배(100:150:1)로 용출시키면서 컬럼 크로마토그래피하여 YD-012 (1.02 g, 40% 수율)를 수득하였다. 시스 및 트랜스 이성질체가 TLC로 검출되었다. YD-012의 불안정성으로 인해, 추가 정제없이 이를 다음 단계에 바로 사용하였다.
화합물 YD-06의 합성
에테르 (100 mL) 중 t-부틸 아세토아세테이트 (5.2 mL) 용액에 테트라하이드로푸란(THF) 중 칼륨 헥사메틸디실라지드 (1 M, 28.64 mL) 용액을 점적 첨가하였다. 반응 혼합물을 농축하고, n-헥산을 첨가하여 침전시켰다. 침전물을 여과하고 건조하여 조 생성물 YD-06을 수득하였다.
화합물 YD-013의 합성
상기 조 YD-06 (1.0 g, 5.1 mmol)을 아세토니트릴 (50 mL)에 용해시키고, 혼합물을 0℃로 냉각하였다. 아세토니트릴 (10 mL) 중 화합물 YD-012 (0.65 g, 4.2 mmol) 용액을 교반하면서 상기 YD-06의 용액에 점적 첨가하였다. 반응 혼합물을 0℃에서 2시간 동안 교반하고 얼음물 (4 mL)을 첨가하였다. 혼합물을 진공 하 증발시켰다. 잔류물을 물에 재용해시키고 디클로로메탄으로 추출하였다. 유기 층을 포화 염수로 세정하고 무수 황산마그네슘으로 건조하고, 여과 및 진공 농축하여 조 잔류물을 수득하였다. 이를 용출제로 페트롤륨 에테르(60-90℃)를 사용하여 컬럼 크로마토그래피로 정제하여 황백색 고체로서 YD-013(510 mg, 47% 수율)을 수득하였다.
화합물 YD-014의 합성
화합물 YD-013 (186 mg, 0.718 mmol)을 트리플루오로아세트산 (5 mL)에 용해시키고, 당해 용액을 실온에서 4시간 동안 교반하였다. 생성된 용액을 진공 하 증발시켜 트리플루오로아세트산을 제거하였다. 디클로로메탄을 첨가하고, 용액을 2회 재증류하였다. 잔류물을 에테르에 용해시키고, 페트롤륨 에테르를 첨가하여 재결정화를 실시하였다. 백색 결정의 화합물 YD-014가 여과 및 진공 하 건조에 의해 분리되었다. 모액을 농축하고, 페트롤룸 에테르-에틸 아세테이트 (3:1) 중에서 1% 용적 빙초산으로 용출하면서 컬럼 크로마토그래피로 정제하여 백색 고체인 YD-014를 수득하였다. 상기 결정성 화합물의 결합된 중량은 115mg이었다(79% 수율).
화합물 YD-05의 합성
실온에서 교반하면서 N,N-디메틸포름아미드 (11 mL) 중 피페라진 (3.73 g, 43.4 mmol) 용액에 3,4-디클로로니트로벤젠 (1.64 g, 8.6 mmol)의 N,N-디메틸포름아미드 (15 mL) 용액을 점적 첨가하였다. 생성된 혼합물을 100℃로 가열하고, 5시간 동안 상기 온도를 유지시켰다. 반응 혼합물을 실온으로 냉각하고, 진공 농축하여 N,N-디메틸포름아미드를 제거하였다. 생성된 잔류물을 디클로로메탄 (25 mL)으로 희석하였다. 유기 층을 포화 중탄산나트륨 수용액으로 세정하고 무수 황산나트륨으로 건조하고, 여과 및 농축하였다. 클로로포름 및 메탄올(3:1)로부터의 잔류물의 재결정화로 노란색 결정의 화합물 YD-05 (1.77 g, 85% 수율)이 수득되었다.
화합물 2 (YD-Ol)의 합성
무수 디클로로메탄 (10mL) 중 YD-014 (320 mg, 1.58 mmol) 용액에 디이소프로필에틸아민 (DIEA, 305 mg, 2.36 mmol), YD-05 (380 mg, 1.58 mmol) 및 1-(3-디메틸아미노프로필)-3-에틸카보디이미드(EDCI, 1.2g, 6.30mmol)을 순서대로 첨가하였다. 생성된 혼합물을 2시간 동안 실온에서 교반하였다. 반응 혼합물을 디클로로메탄으로 희석하고 수성 수산화나트륨(2M), 물 및 포화 염수 순서로 세정하였다. 유기 층을 무수 황산나트륨으로 건조시키고, 여과 및 농축하였다. 에틸 아세테이트 중 페트롤룸 에테르(3:1)로 용출시키는 컬럼 크로마토그래피에 의해 잔류물을 정제하여 연노란색 고체인 YD-Ol (290 mg, 43% 수율)을 수득하였다.
실시예 3. 화합물 3 (YD-07)의 합성
화합물 3 (YD-07)의 합성은 반응식 3에 구조적으로 나타내져 있다.
화합물 YD-031의 합성
p-니트로벤즈알데히드 (4.53 g, 0.03 mol) 및 히드록실아민 하이드로클로라이드 (6.87 g, 0.099 mol)를 실온에서 90% 에탄올 (100 mL)에 용해시켰다. 반응 혼합물의 pH를 수산화나트륨 분말을 첨가함으로써 5로 조정하고 생성된 용액을 30분간 실온에서 교반한 후 4시간 동안 환류 가열하였다. 완결시, 반응 혼합물을 실온으로 냉각하고 에탄올을 감압하 제거하였다. 물을 첨가하고 생성된 혼합물을 디클로로메탄으로 추출하였다. 결합된 유기 층을 포화 염수로 세정하고 황산마그네슘으로 건조하였다. 용매를 제거한 후 분광학적으로 순수한 노란색 무정형의 분말의 YD-031 (4.831 g, 97%)을 수득하였다.
화합물 YD-032의 합성
YD-031 (887 mg, 5.3 mmol)을 무수 디메틸포름아미드 (4.6 mL)에 용해시키고 용액을 0℃로 냉각시켰다. 교반하면서 N-클로로석신이미드 (800 mg, 6.0 mmol)를 소량씩 첨가하였다. 냉각 배쓰를 제거하고 생성된 혼합물을 실온에서 4시간 동안 교반하였다. 완결시, 얼음물 (20 mL)을 첨가하고 생성된 혼합물을 디에틸에테르로 추출하였다. 유기 층을 물로 3회 및 포화 염수로 1회 세정하고 황산마그네슘으로 건조하였다. 여과한 후에 용매를 제거하여 백색 고체의 YD-032 (1.064 g, 100%)가 수득되었다.
화합물 YD-033의 합성
교반하면서 아세토니트릴 (60mL) 중 조 YD-06 (1.213 g, 6.2 mmol)의 용액에 0℃에서 아세토니트릴 (25 mL) 중 조 YD-032 (1 g, 5.0 mmol) 용액을 첨가하였다. 생성된 용액을 2시간 동안 0℃에서 교반하였다. 완결시, 얼음물(4mL)을 첨가하고 대부분의 용매를 감압하 제거하였다. 잔류하는 용액을 물로 희석하고 디클로로메탄으로 추출하였다. 유기 층을 포화 염수로 세정하고 황산마그네슘으로 건조하였다. 여과 및 용매를 제거한 후, 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르: 에틸 아세테이트=10:1)로 정제하여 연노란색 정육면체 결정의 YD-033 (1.239 g, 78%)을 수득하였다.
화합물 YD-034의 합성
YD-033 (100 mg, 0.33 mmol) 및 틴(II) 클로라이드 디하이드레이트 (371 mg, 1.64 mmol)를 무수 에탄올 (7 mL)에 용해시키고, 생성된 용액을 1.5시간 동안 환류 가열하였다. 반응 혼합물을 실온으로 냉각하고 적합한 양의 얼음물을 첨가하였다. 생성된 혼합물의 pH를 20% 탄산나트륨 수용액을 첨가함으로써 8로 조정하였다. 에틸 아세테이트로 추출한 후, 유기 층을 염수로 세정하고 황산나트륨으로 건조하였다. 여과 및 농축 후 생성된 잔류물을 실리카겔 컬럼(페트롤룸 에테르: 에틸 아세테이트=5:1)을 사용하여 정제하여 백색 바늘 결정의 YD-034 (72 mg, 80%)를 수득하였다.
화합물 YD-038의 합성
YD-034 (1.0 g, 3.65 mmol)를 트리플루오로아세트산 (5 mL)에 용해시키고 실온에서 1시간 동안 교반하였다. 트리플르오로아세트산을 감압 하 제거하고 잔류물을 디클로로메탄으로 2회 공비혼합하여 백색 고체인 조 YD-038 (810 mg)을 수득하였다.
화합물 3 (YD-03)의 합성
무수 디클로로메탄 (8 mL) 중 조 YD-038 (157 mg, 0.72 mmol) 용액에 N,N-디이소프로필에틸아민 (DIEA, 138 mg, 1.08 mmol), YD-05 (207 mg, 0.86 mmol) 및 EDCI (550 mg, 2.88 mmol)을 순서대로 첨가하였다. 생성된 혼합물을 실온에서 4시간 동안 교반하고, 이후 디클로로메탄으로 희석하였다. 이 혼합물을 2M 수산화나트륨 용액, 물 및 포화 염수로 세정하였다. 유기 층을 황산나트륨으로 건조하고 여과 및 농축하였다. 수득된 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르: 에틸 아세테이트=2:1)로 정제하여 밝은 노란색 분말의 YD-03 (173 mg, 49%)를 수득하였다.
실시예 4. 화합물 4 (YD-07)의 합성
화합물 YD-03 (50 mg, 0.1134 mmol)을 6M 황산 (1mL)에 용해시키고, 생성된 용액을 0℃로 냉각하였다. 수(0.5mL) 중 질산나트륨 용액 (7.2 mg, 0.136 mmol)을 교반하면서 점적 첨가하였다. 온도를 5℃ 미만으로 유지하면서 생성된 혼합물을 추가의 30분간 교반하였다. 수중(1mL) 나트륨 아지드(125 mg, 1.923 mmol) 용액을 첨가하고 온도를 실온으로 올렸다. 혼합물을 추가의 2시간 동안 교반하고 물로 희석시켰다. 에틸 아세테이트로 추출한 후, 결합된 유기 층을 포화 염수로 세정하고 황산나트륨으로 건조하였다. 농축후, 수득된 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르: 에틸 아세테이트=4:1)로 정제하여 밝은 노란색 분말의 YD-07 (38 mg, 72%)을 수득하였다.
실시예 5. 화합물 5-10의 합성
화합물 5는 벤즈알데히드 대신 o-클로로벤즈알데히드로 시작하여 반응식 2에 따라 제조된다.
화합물 6은 화합물 5와 같이 반응식 2에 따라 제조되나, 피페라진 대신 2-메틸피페라진으로부터 제조된 YD-05의 2-메틸 유도체를 사용한다.
화합물 7은 반응식 2를 이용하는 화합물 6에서와 같이 반응식 2에 따라 제조되나, o-클로로벤즈알데히드 대신 벤즈알데히드로 시작한다.
화합물 8은 3,4-디클로로니트로벤젠 대신 4-클로로니트로벤젠을 사용하여 화합물 2에서와 같이 반응식 2에 따라 제조된다.
화합물 9는 벤즈알데히드 대신 출발 물질로 2,6-디클로로벤즈알데히드를 사용하여 화합물 2에서와 같이 반응식 2에 따라 제조된다.
화합물 10은 출발 물질로서 3,4-디클로로니트로벤젠 대신 2,3-디클로로니트로벤젠을 사용하여 화합물 8에서와 같이 반응식 2에 따라 제조된다.
실시예 6. 화합물 1 내지 10의 항바이러스 활성
화합물 1 내지 10에 의한 보호를 정량적으로 측정하기 위해 플라그 감소 검사를 실시하였다. 본 화합물들은 MDCK 세포에서의 인플루엔자 A 바이러스 플라그 형성을 억제하였으며, 화합물 1 내지 10 각각의 EC50은 0.05, 0.06, 0.56, 0.25, 0.04, 0.21, 0.8, 5.1, 12, 및 25 μM이었다(참조: 도 1b, 2b, 3b, 4b, 5b, 6b, 7b, 8b, 9b, 및 10b).
MDCK 및 Vero 세포에 대한 화합물 1 내지 10의 세포 독성을 검사하였다. 테스트된 화합물 농도는 0 내지 250 μM의 범위이었으며, 결과를 표 1에 나타내었다. 상기 결과는 화합물 1 내지 10의 TC50이 MDCK 및 Vero 세포 모두에 있어서 250 μM 초과임을 보여준다. 화합물 1 내지 10의 MDCK 세포에서의 TC50/EC50의 비로 정의되는 선택성 지수(SI)가 표 1에 나타내져 있다. 상기 결과는 이 종류의 아미드들이 포유동물 세포에 일반적으로 비-독성임을 보여준다.
[표 1] 화합물 1 내지 10의 항바이러스 활성
다르게 정의하지 않는다면, 본원에 사용된 모든 기술적 및 과학적 용어들은 본 발명이 속한 기술 분야의 당업자에 의해 일반적으로 이해되는 것과 동일한 의미를 나타낸다. 본원에서 인용된 공개본 및 당해 공개본에서 인용된 자료들은 참조에 의해 구체적으로 본원에 혼입된다.
당업자는 과도한 실험 없이도 본원에 기술된 본 발명의 구체적 양태들에 대해 다수의 균등물이 있음을 인식하거나 확인할 수 있을 것이다. 그러한 균등물을 아래 청구항에 포함시키고자 한다.
도 1b는 화합물 1의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 2a는 화합물 2의 화학식을 도시한다.
도 2b는 화합물 2의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 3a는 화합물 3의 화학식을 도시한다.
도 3b는 화합물 3의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 4a는 화합물 4의 화학식을 도시한다.
도 4b는 화합물 4의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 5a는 화합물 5의 화학식을 도시한다.
도 5b는 화합물 5의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 6a는 화합물 6의 화학식을 도시한다.
도 6b는 화합물 6의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 7a는 화합물 7의 화학식을 도시한다.
도 7b는 화합물 7의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 8a는 화합물 8의 화학식을 도시한다.
도 8b는 화합물 8의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 9a는 화합물 9의 화학식을 도시한다.
도 9b는 화합물 9의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
도 10a는 화합물 10의 화학식을 도시한다.
도 10b는 화합물 10의 농도의 함수로서 플라그 형성 단위(PFU)에 있어서 감소율(%)을 보여주는 그래프이다.
발명의 상세한 설명
1. 정의
본원에 일반적으로 사용된 바와 같은 "알킬" 또는 이의 잔기는 직쇄 알킬, 분지쇄 알킬, 시클로알킬, 알킬 치환된 시클로알킬 및 시클로알킬 치환된 알킬을 포함한다. 다른 언급이 없다면, 알킬은 일반적으로 1-30개의 탄소수, 1-20개의 탄소수, 1-10개의 탄소수, 1-6개의 탄소수, 1-5개의 탄소수를 가지며, 바람직하게는 메틸, 에틸 또는 프로필이다. 직쇄 또는 분지쇄 알킬은 일반적으로 이의 백본에 30개 이하(예: 직쇄에서는 C1-C30, 분지쇄에서는 C3-C30), 바람직하게 20개 이하, 바람직하게 10개 이하, 더욱 바람직하게 6개 이하, 가장 바람직하게 5개 이하의 탄소 원자를 가진다. 유사하게, 시클로알킬은 이의 고리 구조 내 3-20개의 탄소수, 바람직하게는, 이의 고리 구조 내 3-10개의 탄소수, 가장 바람직하게는 고리 구조 내 5, 6 또는 7개의 탄소를 갖는다. 알킬의 예로는, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, t-부틸, 이소부틸, sec-부틸, 시클로헥실, (시클로헥실)메틸, 시클로프로필메틸 및 예를 들어, n-펜틸, n-헥실, n-헵틸, n-옥틸의 동족체 및 이성질체를 포함하나, 이에 제한되는 것은 아니다.
용어 "알킬"은 헤테로알킬 뿐만 아니라 탄화수소 라디칼의 하나 이상의 탄소 원자에서 하나 이상의 치환기를 포함한다. 적합한 치환기로는, 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR( 여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에서 일반적으로 사용된 바와 같은 "알케닐" 또는 이의 잔기는 직쇄 또는 분지쇄 알케닐, 시클로알케닐, 알킬 치환된 시클로알케닐을 포함하고, 본원에서 일반적으로 사용된 바와 같은 "알키닐" 또는 이의 잔기는 직쇄 또는 분지쇄 알키닐기 또는 시클로알키닐(알리시클릭) 기, 알킬 치환된 시클로알케닐, 시클로알키닐기 또는 시클로알킬 치환된 알키닐기를 포함한다. 다른 언급이 없다면, 알케닐 및 알키닐은 일반적으로 2-30개의 탄소 원자, 2-20개의 탄소 원자, 2-10개의 탄소 원자, 2-6개의 탄소 원자, 2-5개의 탄소 원자를 갖는다. 직쇄 또는 분지쇄 알케닐 또는 알키닐은 일반적으로 이의 백본에 30개 이하의 탄소 원자(예: 직쇄에서는 C1-C30, 분지쇄에서는 C3-C30), 바람직하게는 20개 이하, 바람직하게는 10개 이하, 더욱 바람직하게는 6개 이하, 가장 바람직하게는 5개 이하의 탄소 원자를 갖는다. 알케닐 또는 알키닐은 일반적으로 쇄 내에 2-30개의 탄소들, 바람직하게는 쇄 내 2-20개의 탄소들, 바람직하게는 쇄 내 2-10개의 탄소들, 더욱 바람직하게는 2-6개의 탄소들, 가장 바람직하게는 2-5개의 탄소들을 갖는다. 유사하게, 시클로알케닐 또는 시클로알키닐은 고리 구조 내 3-20개의 탄소 원자들, 바람직하게는 고리 구조 내 3-10개의 탄소 원자들, 가장 바람직하게는 고리 구조 내 5, 6 또는 7개의 탄소들을 갖는다. 시클로알케닐 또는 시클로알키닐기의 예로는 비닐, 2-프로페닐, 크로틸, 2-이소펜테닐, 2-(부타디에닐), 2,4-펜타디에닐, 3-(1,4-펜타디에닐), 에티닐, 1- 및 3-프로피닐, 3-부티닐을 포함하나, 이에 제한되는 것은 아니다.
용어 "알케닐" 및 "알키닐"은 탄화수소 라디칼의 하나 이상의 탄소 원자에서 하나 이상의 치환기를 포함한다. 적합한 치환기로는, 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR( 여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에서 일반적으로 사용된 바와 같은 "아릴" 또는 이의 잔기는 6 내지 30개의 탄소 원자, 바람직하게 6 내지 18개의 탄소 원자를 갖는 방향족 고리계 탄소를 말하며, 하나의 방향족 고리 또는 복수개의 융합된 방향족 고리로 구성된다. 이의 예로는 페닐, 바이페닐, 나프틸, 아세나프테닐, 아세나프틸레닐, 안트라세닐, 플루오레닐, 페날레닐, 페난트레닐을 포함할 수 있다. 상기 아릴기는, 예를 들어, 문헌[Greene, et al., Protective Groups in Organic Synthesis, John Wiley 및 Sons, Third Edition, 2002]에 기술된 당업자에게 공지된 바와 같이 필요에 따라 보호되거나 비보호된, 알킬, -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다), 아지드, 히드록실, 아실, 아미노, 할로, 알킬아미노, 알콕시, 아릴옥시, 니트로, 시아노, 황산, 설페이트, 인산, 포스페이트, 포스포네이트로 이루어진 군으로부터 선택된 하나 이상의 잔기로 임의 치환될 수 있다. 특정 양태에서, 상기 알킬은 C1-C10 알킬, C1-C6 알킬, C1-C3 알킬, 메틸, 에틸 및/또는 프로필 등을 포함한다. 용어 "아릴"은 탄화수소 라디칼의 하나 이상의 탄소 원자에서 하나 이상의 치환기를 포함한다. 적합한 치환기들로, 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR( 여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에 일반적으로 사용된 바와 같은 "결합 포켓" 또는 "결합 부위"는 이의 배열의 결과로써 동일한 분자 또는 분자 복합체의 잔기 또는 영역, 또는 상이한 분자, 분자 복합체 및/또는 화학적 화합물의 잔기 또는 영역과 우선적으로 연합하거나 상기 잔기 또는 영역을 선점하는 분자 또는 분자 복합체의 영역을 말한다. 당업자에게 이해되는 바와 같이, 결합 포켓 내부의 공동(cavity)의 특성은 분자마다 다를 수 있다.
본원에 일반적으로 사용된 바와 같은 "뉴클레오진(nucleozin) 결합 부위"는 인플루엔자 A NP의 후면 상의 바디 도메인(body domain)에 위치한 인플루엔자 뉴클레오단백질(NP) A 상의 부위를 말한다. 이러한 변형에서, 상기 뉴클레오진은 그루브(groove) 내 280번 잔기와 311번 잔기 사이에 위치한다. 당업자라면 상기 뉴클레오진 결합 부위가 여기에 결합된 화합물에 따라 약간씩 달라질 수 있으며, 본원에 기술된 것을 대체하여/대체하거나 이에 추가하여 다른 접촉점을 포함할 수 있음을 이해할 것이다.
본원에 일반적으로 사용된 바와 같은 "헤테로사이클" 또는 이의 잔기 또는 "헤테로시클릭"은 불포화 또는 방향족 특성을 갖거나 갖지 않으며, 탄소가 아닌 하나 이상의 고리 원자를 갖는 5-12개 원자, 바람직하게는 5-7개 원자의 하나 이상의 고리를 말한다. 바람직한 헤테로원자는 황, 산소 및 질소를 포함한다. 다중 고리는 퀴놀린 또는 벤조푸란에서와 같이 융합될 수 있다. 특히 바람직한 헤테로사이클기는 O, S, P, Si, As 및 N으로 이루어진 군으로부터 선택된 1-3개의 헤테로원자를 갖는 5-10원 고리이다. 헤테로사이클은, 아졸리딘, 피롤, 옥솔란, 푸란, 티올란, 티오펜, 포스폴란, 포스폴, 실란, 실롤, 아르솔란, 아르솔, 이미다졸린, 피라졸리딘, 이미다졸, 이미다졸린, 피라졸, 피라졸린, 옥사졸리딘, 이속사졸리딘, 옥사졸, 옥사졸린, 이속사졸, 이속사졸린, 티아졸리딘, 이소티아졸리딘, 티아졸, 티아졸린, 이소티아졸, 이소티아졸린, 디옥솔란, 옥사티올란, 디티올란, 티아졸, 디티아졸, 푸라잔, 옥사디아졸, 티아디아졸, 테트라졸, 피페리딘, 피리딘, 피란, 테트라하이드로피란, 티안, 티오피란, 피페라진, 디아진, 모폴린, 옥사진, 티아진, 디티안, 디옥산, 디옥신, 트리아진, 트리옥산, 테트라진, 아자판, 아제핀, 옥세판, 옥세핀, 티에판, 티에핀, 아조칸, 아조신, 옥세칸 및 티오칸을 포함하나, 이에 제한되는 것은 아니다. 헤테로사이클 또는 헤테로시클릭은 또한 "아릴" 또는 "알킬"에서 정의한 바와 같은 치환된 고리들을 말한다. 특정 양태에서, 상기 "헤테로사이클" 또는 "헤테로시클릭"은 탄소와 헤테로원자, 예를 들어 질소 사이에 이중 결합을 포함한다.
용어 "헤테로사이클"은 하나 이상의 탄소 또는 헤테로원자에서 하나 이상의 치환기를 포함한다. 적합한 치환기로는 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR(여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에 일반적으로 사용된 바와 같은 "헤테로아릴" 또는 이의 잔기는 N, O, P, Si, As 또는 S 원자(들) 또는 이의 조합으로 이루어진 군으로부터 선택된 1 내지 4개의 헤테로원자를 함유하는 방향족기를 말하며, 여기서, 상기 헤테로아릴기는 탄소 또는 질소 원자(들)에서 임의로 치환될 수 있다. 헤테로아릴 고리는 또한 하나 이상의 시클릭 탄화수소, 헤테로시클릭, 아릴 또는 헤테로아릴 고리와 융합될 수 있다. 헤테로아릴은, 하나의 헤테로원자를 갖는 5-원 헤테로아릴(예: 티오펜, 피롤, 푸란); 1,2 또는 1,3 위치에 2개의 헤테로원자를 갖는 5-원 헤테로아릴(예: 옥사졸, 피라졸, 이미다졸, 티아졸, 푸린); 3개의 헤테로원자를 갖는 5-원 헤테로아릴(예: 트리아졸, 티아디아졸); 3개의 헤테로원자를 갖는 5-원 헤테로아릴; 하나의 헤테로원자를 갖는 6-원 헤테로아릴(예: 피리딘, 퀴놀린, 이소퀴놀린, 페난트린, 5,6-시클로헵테노피리딘); 2개의 헤테로원자를 갖는 6-원 헤테로아릴(예: 피리다진, 신놀린, 프탈라진, 피라진, 피리미딘, 퀴나졸린); 3개의 헤테로원자를 갖는 6-원 헤테로아릴(예: 1,3,5-트리아진); 및 4개의 헤테로원자를 갖는 6-원 헤테로아릴을 포함하나, 이에 제한되는 것은 아니다. 특히 바람직한 헤테로아릴기는 O, S 및 N으로부터 선택된 1-3개의 헤테로원자를 갖는 5-10원 고리이다. 특정 양태에서, 상기 "헤테로아릴"은 탄소와, 상기 헤테로원자, 예를 들어 질소 사이에 이중 결합을 포함할 수 있다.
용어 "헤테로아릴"은 하나 이상의 탄소 또는 헤테로원자들에서 하나 이상의 치환기를 포함한다. 적합한 치환기로는 불소, 염소, 브롬 또는 요오드와 같은 할로겐; 히드록실; -NR1R2(여기서 R1 및 R2는 독립적으로, 수소, 알킬, 또는 아릴이고, 여기서, 상기 질소 원자는 임의로 4차화된다); -SR(여기서, R은 수소, 알킬 또는 아릴이다); -CN; -NO2; -COOH; 카복실레이트; -COR, -COOR, 또는 -CONR2 (여기서, R은 수소, 알킬 또는 아릴이다); 아지드, 아르알킬, 알콕실, 이미노, 포스포네이트, 포스피네이트, 실릴, 에테르, 설포닐, 설폰아미도, 헤테로시클릴, 방향족 또는 헤테로방향족 잔기, --CF3; -NCOCOCH2CH2; -NCOCOCHCH; -NCS; 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
본원에서 일반적으로 사용된 바와 같은 "인플루엔자 A"는 포유류 인플루엔자 A 바이러스, 예를 들어, H3N2, H1N1, H2N2, H7N7 및 H5N1(조류 독감 바이러스) 균종 및 이의 변이체를 포함한다.
본원에서 일반적으로 사용된 바와 같은 "낮은 에너지, 안정한 복합체"는 공유 결합, 수소 결합, 디설피드 결합, 염 브릿지, 이온 결합, 금속 배위 결합, 소수성 힘, 반 데르 발스 상호작용, 양이온-pi 상호작용, pi-스태킹(stacking) 및 이의 조합을 포함하나 이에 제한되지 않는 약한 내지 강한 분자간 힘에 의해 핵단백질의 결합 부위에서 약물이 결합된 복합체를 말한다.
본원에 일반적으로 사용된 바와 같은 "핵단백질" 또는 "NP"는 핵산과 구조적으로 연합된 임의의 단백질을 말한다. 예시적 핵단백질은 특정 균주의 인플루엔자 바이러스에서 동정되고 시퀀싱된다. 다수의 핵단백질의 서열들이 NCBI 데이터베이스에서 발견될 수 있다. 인플루엔자 타입 A로부터의 특정 예시적 NP 서열의 유전자뱅크 접근 번호는 서브타입 H1N1에 대해서는 NP 040982(AAA43467), 서브타입 H3N2에 대해서는 AAZ38620(YP308843); 및 서브타입 H5N1에 대해서는 AY856864 및 AAF02400이 있다.
NP 040982 (AAA43467)[서열 목록 번호: 5]:
MASQGTKRSYEQMETDGERQNATEIRASVGKMIGGIGRFYIQMC
TELKLSDYEGRLIQNSLTIERMVLSAFDERRNKYLEEHPSAGKDPKK
TGGPIYRRVNG
KWMRELILYDKEEIRRIWRQANNGDDATAGLTHMMIWHSNLNDAT
YQRTRALVRTGMD
PRMCSLMQGSTLPRRSGAAGAAVKGVGTMVMELVRMIKRGINDRN
FWRGENGRKTRIA
YERMCNILKGKFQTAAQKAMMDQVRESRDPGNAEFEDLTFLARSAL
ILRGSVAHKSCL
PACVYGPAVASGYDFEREGYSLVGIDPFRLLQNSQVYSLIRPNENPA
HKSQLVWMACH
SAAFEDLRVLSFIKGTKVVPRGKLSTRGVQIASNENMETMESSTLELR
SRYWAIRTRS
GGNTNQQRASAGQISIQPTFSVQRNLPFDRTTVMAAFTGNTEGRTSD
MRTEIIRMMES
ARPEDVSFQGRGVFELSDEKAASPIVPSFDMSNEGSYFFGDNAEEYD
N
AAZ38620 (YP308843) [서열 목록 번호:6]:
MASQGTKRSYEQMETDGDRQNATEIRASVGKMIDGIGRFYIQMC
TELKLSDHEGRLIQNSLTIEKMVLSAFDERRNKYLEEHPSAGKDPKK
TGGPIYRRVDG
KWMRELVLYDKEEIRRIWRQANNGEDATAGLTHIMIWHSNLNDAT
YQRTRALVRTGMD
PRMCSLMQGSTLPRRSGAAGAAVKGIGTMVMELIRMVKRGINDRNF
WRGENGRKTRSA
YERMCNILKGKFQTAAQRAMVDQVRESRNPGNAEIEDLIFLARSALI
LRGSVAHKSCL
PACAYGPAVSSGYDFEKEGYSLVGIDPFKLLQNSQIYSLIRPNENPAH
KSQLVWMACH
SAAFEDLRLLSFIRGTKVSPRGKLSTRGVQIASNENMDNMGSSTLELR
SGYWAIRTRS
GGNTNQQRASAGQTSVQPTFSVQRNLPFEKSTIMAAFTGNTEGRTSD
MRAEIIRMMEG
AKPEEVSFRGRGVFELSDEKATNPIVPSFDMSNEGSYFFGDNAEEYD
N
AY856864[서열 목록 번호:7]:
MASQGTKRSYEQMETGGERQNATEIRASVGRMVSGIGRFYIQMC
TELKLSDYEGRLIQNSITIERMVLSAFDERRNRYLEEHPSAGKDPKKT
GGPIYRRRDG
KWVRELILYDKEEIRRIWRQANNGEDATAGLTHLMIWHSNLNDATY
QRTRALVRTGMD
PRMCSLMQGSTLPRRSGAAGAAVKGVGTMVMELIRMIKRGINDRNF
WRGENGRRTRIA
YERMCNILKGKFQTAAQRAMMDQVRESRNPGNAEIEDLIFLARSALI
LRGSVAHKSCL
PACVYGLAVASGYDFEREGYSLVGIDPFRLLQNSQVFSLIRPNENPAH
KSQLVWMACH
SAAFEDLRVSSFIRGTRVVPRGQLSTRGVQIASNENMEAMDSNTLEL
RSRYWAIRTRS
GGNTNQRRASAGQISVQPTFSVQRNLPFERATIMAAFTGNTEGRTSD
MRTEIIGMMES
ARPEDVSFQGRGVFELSDEKATNPIVPSFDMNNEGSYFFGDNAEEYD
N
AAF02400[서열 목록 번호:8]:
MASQGTKRSYEQMETGGERQNATEIRASVGRMVGGIGRFYIQMC
TELKLSDQEGRLIQNSITVERMVLSAFDERRNRYLEEHPSAGKDPKK
TGGPIYRRRNG
KWVRELILYDKEEIRRIWRQANNGEDATAGLTHMMIWHSNLNDAT
YQRTRALVRTGMD
PRMCSLMQGSTLPRRSGAAGAAIKGVGTMVMELIRMIKRGINDRNF
WRGENGRRTRIA
YERMCNILKGKFQTAAQKAMMDQVRESRNPGNAEIEDLIFLARSALI
LRGSVAHKSCL
PACVYGLAVASGYDFEREGYSLVGIDPFRLLQNSQVFSLIRPKENPAH
KSQLVWMACH
SAAFEDLRVSSFIRGTRVIPRGQLSTRGVQIASNENVEAMDSSTLELR
SRYWAIRTRS
GGNTNQQRASAGQISVQPTFSVQRNLPFERVTIMAAFKGNTEGRTSD
MRTEIIRMMES
ARPEDVSFQGRGVFELSDEKATNPIVPSFDMSNEGSYFFGDNAEEYD
N
본원에서 일반적으로 언급되는 "뉴클레오진(Nucleozin)"은 다음 화학식을 갖는다:
본원에서 일반적으로 언급된 바와 같은 "약제학적으로 허용되는"은 과도한 독성, 자극, 알러지 반응, 또는 적정한 이익/위험 비에 상응하는 다른 문제 또는 합병증 없이, 인간 및 동물의 조직과 접촉하여 사용하기에 적합한 정상적인 의학적 판단 범주 내의 화합물들, 물질들, 조성물들 및/또는 투여 형태(dosage forms)를 말한다.
본원에서 일반적으로 언급된 바와 같은 "약제학적으로 허용되는 염"은 모 화합물이 이의 산 또는 염기 염이 되도록 변형된 본원에 기술된 화합물들의 유도체들을 말한다. 약제학적으로 허용되는 염의 예는, 아민과 같은 염기 잔기의 미네랄 또는 유기산염; 카복실산과 같은 산 잔기의 알칼리 또는 유기 염을 포함하나, 이에 제한되는 것은 아니다. 상기 약제학적으로 허용되는 염은 예를 들어, 비-독성 무기산 또는 유기산으로부터 형성된 모 화합물의 통상적인 비-독성 염 또는 4차 암모늄 염을 포함한다. 예를 들어, 그러한 통상적인 비-독성 염들은 염산, 브롬화수소산, 황산, 설팜산, 인산, 질산 등과 같은 무기산으로부터 유도된 염들; 및 아세트산, 프로피온산, 석신산, 글리콜산, 스테아린산, 락트산, 말릭산, 타타르산, 시트르산, 아스코르브산, 파모익산, 말레익산, 히드록시말레산, 페닐아세트산, 글루탐산, 벤조산, 살리실산, 설파닐산, 2-아세톡시벤조산, 푸마르산, 톨루엔설폰산, 나프탈렌설폰산, 메탄설폰산, 에탄디설폰산, 옥살산 및 이세티온산과 같은 유기산으로부터 제조된 염들을 포함한다.
본원에서 일반적으로 사용된 바와 같은 “치환된”은 알킬, 알케닐, 알키닐, C3-C8 시클로알킬, 할로(예; 플루오로, 클로로, 브로모 및 요오도); 시아노; 알콕시; 히드록시, 페닐; 치환된 페닐을 포함하나, 이에 제한되지 않는 하나 이상의 치환기로 치환된 잔기(예: 알킬기)를 말한다.
본원에서 일반적으로 사용된 바와 같은 “치환된 아릴”은 치환기로서 하나 이상의 비-간섭기를 갖는 아릴기를 말한다. 페닐 고리 상에서의 치환에 대해 치환기들은 임의의 위치일 수 있다(즉, 오쏘, 메타, 및/또는 파라). 특정 양태에서, 상기 치환된 아릴은 2,6-이치환된 페닐을 포함하며, 여기서, 상기 2개의 치환기들은 정의된 바와 같이, 바람직하게는 이중 하나는 할로겐, 특히 Cl이고, 다른 하나는 니트로(NO2)이거나, 2개 치환기 모두가 할로겐, 특히 Cl이다.
II . 화합물들
항바이러스 활성, 특히 항인플루엔자 바이러스 활성을 갖는 화합물들이 본원에서 기술된다.
특정 양태에서, 상기 화합물들은 아래 화학식 I 내지 VI의 화합물 또는 약제학적으로 허용되는 이의 염이다.
바람직한 양태에서, 상기 NP 억제제들은 화학식 I의 구조를 갖는다:
[화학식 I]
상기 식에서, Ar1, Ar2, 및 Ar3은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y, 및 Z은 독립적으로 부재(즉, 직접 결합)이거나, -C(=O)-, -S(=O)-, -SO2-, -N(R1)-, -C(R2)=C(R3)-, 및 -C(R4R5)n-으로 이루어진 군으로부터 선택되고,
여기서, n은 0 내지 6이고, 여기서, R1 내지 R5는 각각 독립적으로, 수소, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시이고;
W는 선형 그룹이거나 5-7 원의 치환되거나 비치환된 시클릭 또는 헤테로시클릭기(Cy)이다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; Ar2는 메틸기로 치환되고; X는 C=O이고; Y 및 Z는 부재이고; Cy는 피페라진이고; Ar3은 할로기, 니트로기 또는 할로 및 니트로기의 조합으로 치환된다.
특정 양태에서, Cy는 2개의 질소 원자를 함유하는 치환된 5-7원 불포화 고리로, 여기서, 하나의 질소 원자가 X에 결합되고, 다른 질소 원자는 Z에 결합된다.
바람직한 양태에서, Cy는 치환된 피페라진이고, 여기서, N1은 X에 결합되고, N4는 Z에 결합된다.
특정 양태에서, 상기 NP 억제제들은 화학식 II의 구조를 갖는다:
[화학식 II]
상기 식에서, Ar1 및 Ar3은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y, 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R13R14)n-으로 이루어진 군으로부터 선택되고,
n, g, 및 m은 독립적으로 0 내지 6이고;
T, Q, 및 R은 독립적으로 C(R8R9), 질소, 산소, 인, 규소, 황 및 비소로 이루어진 군으로부터 선택되고;
A 및 D는 각각 독립적으로 CR15R16 또는 NR17이고;
여기서, R4 및 R8-R17은 독립적으로 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트, 및 티오에테르로 이루어진 군으로부터 선택되거나, 여기서, -CR15R16-, -NR17-, 또는 이의 조합은 임의 브릿지 메틸렌기와 함께 5-8-원 시클릭 구조를 형성한다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노, 또는 아지드로 치환되고; X는 -C=O이고; Y 및 Z는 부재이고, Ar3은 할로기, 니트로기 또는 할로기와 니트로기의 조합으로 치환된다.
바람직한 양태에서, R4는 메틸이다.
특정 양태에서, Q는 탄소이고, T는 산소이고, R은 질소이다.
특정 양태에서, g 및 m은 1이고, A 및 D는 NR17이고, 여기서 A-D는 피페라진을 정의한다.
특정 양태에서, 상기 NP 억제제들은 화학식 III의 구조를 갖는다:
[화학식 III]
상기 식에서, Ar1 및 Ar3은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y, 및 Z는 독립적으로 부재이거나, -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R14R15)n-으로 이루어진 군으로부터 선택되고,
n, g, 및 m은 독립적으로 0 내지 6이고;
A, D, T, Q, 및 R은 독립적으로 C(R8R9), 질소, 산소, 인, 황, 규소 및 비소로 이루어진 군으로부터 선택되고;
여기서, R4 및 R8-R15는 독립적으로 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트, 및 티오에테르로 이루어진 군으로부터 선택된다.
특정 양태에서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; X C=O이고; Y 및 Z는 부재이고, Ar3은 할로기, 니트로기, 또는 할로 및 니트로기의 조합으로 치환된다.
바람직한 양태에서, Q는 탄소이고, T는 산소이고, R은 질소이다.
특정 양태에서, A 및 D는 질소이다.
특정 양태에서, R4 및 R13은 독립적으로 수소 또는 메틸이다. 바람직한 양태에서, R4는 메틸이고, R13은 수소이다.
특정 양태에서, 상기 조성물 상기 NP 억제제들은 화학식 IV의 구조를 갖는다:
[화학식 IV]
상기 식에서, X, Y, 및 Z는 독립적으로 부재이거나, -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R13R14)n-로 이루어진 군으로부터 선택되고;
여기서, n은 0 내지 6이고;
T, Q, 및 R은 독립적으로 C(R8R9), 질소, 산소, 인, 규소, 황 및 비소로 이루어진 군으로부터 선택되고;
Cy는 4-7원 치환되거나 비치환된 시클릭 또는 헤테로시클릭기이고;
여기서, R1-R14는 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 선택된다.
특정 양태에서, Cy는 2개의 질소 원자를 함유하는 치환된 5-7원 불포화 고리이고, 여기서, 하나의 질소 원자는 X에 결합되고, 다른 질소 원자는 Z에 결합된다.
바람직한 양태에서, Cy는 치환된 피페라진이고, 여기서, N1은 X에 결합되고, N4는 Z에 결합되고, Y 및 Z는 부재이고, X는 C=0이고, T는 산소이고, Q는 탄소이고, R은 질소이다.
특정 양태에서, R1-R3 및 R5-R7은 독립적으로, 할로기, 니트로기 또는 할로와 니트로기의 조합으로부터 독립적으로 선택된다.
바람직한 양태에서, R4는 메틸기이다.
특정 양태에서, 상기 NP 억제제는 화학식 V의 구조를 갖는다:
[화학식 V]
상기 식에서, Ar1, Ar2, 및 Ar3은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y, 및 Z는 독립적으로 부재이거나, -C=O, -S=O, -SO2, -N(R1)=O, -C=C, 및 -C(R2R3)n으로 이루어진 군으로부터 선택되고,
n, g, 및 m은 독립적으로 0 내지 6이고;
Q 및 T는 질소 또는 CR4로부터 독립적으로 선택되고;
R1-R4, R10, 및 R11는 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트, 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다.
특정 양태에서, Q 및 T는 모두 질소이다.
특정 양태에서, R10은 메틸기이고, R11은 수소이다. 다른 양태에서, R10 및 R11은 모두 수소이다.
특정 양태에서, Y 및 Z는 부재이고, X는 C=O이다.
특정 양태에서, g 및 m은 1이다.
바람직한 양태에서, Ar1 및 Ar3은 치환된 페닐이고, Ar2는 치환된 이속사졸이고, Y 및 Z는 부재이고, X는 C=O이고, Q 및 T는 질소이고, g 및 m은 1이고, R10은 메틸이고, R11는 수소이다.
특정 양태에서, 상기 NP 억제제들은 화학식 VI의 구조를 갖는다:
[화학식 VI]
상기 식에서, X, Y, 및 Z는 독립적으로 부재이거나, -C(=O)-, -S(=O)-, -SO2-, -N(R12)-, -C(R13)=C(R14)-, 및 -C(R15R16)n-로 이루어진 군으로부터 선택되고,
n, g, 및 m은 독립적으로 0 내지 6이고;
Q 및 T는 독립적으로 질소 또는 CR17로부터 선택되고;
R1-R17은 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트, 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다.
특정 양태에서, Q 및 T는 모두 질소이다.
특정 양태에서, R10은 메틸기이고, R11은 수소이다. 다른 양태에서, R10 및 R11은 모두 수소이다.
특정 양태에서, Y 및 Z는 부재이고, X는 C=O이다.
특정 양태에서, g 및 m은 1이다.
특정 양태에서, R1-R3 및 R5-R7은 할로기, 니트로기 또는 할로 및 니트로기의 조합으로부터 독립적으로 선택된다.
바람직한 양태에서, R4는 메틸기이다.
본원에 기술된 예시적으로 언급된 화합물들은 다음과 같다:
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-히드록시-페닐)-5-메틸이속사졸-4-일]-메탄온 (화합물 1, 화학식은 도 1a에 도시된다);
[4-(2-클로로-4-니트로-페닐)-피페라진-l-일]-[3-페닐-5-메틸-이속사졸-4-일]-메탄온 (화합물 2, 화학식은 도 2a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-아미노-페닐)-메틸이속사졸-4-일]-메탄온 (화합물 3, 화학식은 도 3a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-아지도-페닐)-5-메틸이속사졸-4-일]-메탄온 (화합물 4, 화학식은 도 4a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸이속사졸-4-일]-메탄온 (화합물 5, 화학식은 도 5a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-2-메틸-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온 (화합물 6, 화학식은 도 6a에 도시되어 있다);
[4-(2-클로로-4-니트로-페닐)-2-메틸-피페라진-1-일]-[3-페닐-5-메틸이속사졸-4-일]-메탄온 (화합물 7, 화학식은 도 7a에 도시되어 있다);
[4-(4-니트로-페닐)-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온 (화합물 8, 화학식은 도 8a에 도시되어 있다); 및
[4-(4-니트로-페닐)-피페라진-l-일]-[3-(2,6-디클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온 (화합물 9, 화학식은 도 9a에 도시되어 있다).
[4-(2-니트로-6-클로로-페닐)-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온 (화합물 10, 화학식은 도 10a에 도시되어 있다).
본원에 기술된 화합물들은 유리 산 또는 유리 염기 또는 약제학적으로 허용되는 염으로 투여될 수 있다. 본 화합물들의 약제학적으로 허용되는 염들은 염기성 또는 산성 잔기를 함유하는 모 화합물로부터 통상적인 화학적 방법에 의해 합성될 수 있다. 일반적으로, 상기 염들은 이들 화합물의 유리 산 또는 염기 형태를 수중 또는 유기 용매 중 또는 이 둘의 혼합물 중, 화학당량의 적합한 염기 또는 산과 반응시켜 제조될 수 있다; 일반적으로, 에테르, 에틸 아세테이트, 에탄올, 이소프로판올, 또는 아세토니트릴과 같은 비-수성 매질이 바람직하다. 적합한 염들의 목록은 문헌[Remington's Pharmaceutical Sciences, 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, p. 704]에 기재되어 있다.
B. 약제학적 조성물
본원에 기술된 화합물들 및/또는 이의 약제학적으로 허용되는 염들은 당업자에게 알려진 기술을 사용하여 경구 및 비경구 투여에 적합한 투여 형태(dosage form)로 제형화될 수 있다.
상기 약제학적 조성물은 본원에 기술된 하나 이상의 화합물의 유효량을 함유한다.
본원에 일반적으로 사용된 바와 같은 “유효량”은 일반적으로 제공 또는 처방되는 범위 내의, 예를 들어, in vitro 또는 in vivo로 항바이러스 효과를 나타내는 것으로 입증된 양, 또는 용량을 나타낸다. 유효량의 범위는 개인마다 다를 수 있다; 그러나, 최적 용량은 처방 의사와 같은 당업계의 숙련된 기술자에 의해 용이하게 결정될 수 있다. 그러한 범위는 통상의 임상적 실습에 의해 잘 확립될 수 있으며 따라서, 당업계의 숙련된 기술자에 의해 용이하게 결정될 수 있다. 용량은 제공된 총량(예를 들어, 매용량 또는 매일)으로 또는 농도로 측정될 수 있다. 0.01, 0.05, 0.1, 0.2, 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 100, 250, 500 및 1000 mg/kg/일의 용량이 치료를 위해 적합할 수 있다. 일 양태에서, 1일 용량은 0.2 내지 250mg/kg이다.
본원에 기술된 화합물들은 안전하고 효과적인 것으로 간주되며 바람직하지 않은 생물학적 부작용 또는 원치 않는 상호작용을 일으키지 않고 개인에게 투여될 수 있는, 하나 이상의 약제학적으로 허용되는 담체 및/또는 부형제와 조합될 수 있다. 상기 담체는 활성 성분 또는 성분들 외에 약제학적 제형 내 존재하는 모든 성분들이다.
1. 비경구 제형
본원에 기술된 화합물들은 비경구 제형으로 제형화될 수 있다. 본원에 기술된 바와 같은 “비경구 투여”는 소화관 또는 비-침습적 국소 또는 국부적 경로 외에 임의의 방법에 의해 투여되는 것을 의미한다. 예를 들어, 비경구 투여는 환자에게 주사 또는 주입에 의해 정맥내, 피부내, 복강내, 늑막내, 기관내, 근육내, 피하내를 포함할 수 있다.
비경구 제형은 당업자에게 공지된 기술을 이용하여 수성 조성물로 제조될 수 있다. 일반적으로, 그러한 조성물은 주사가능한 제형, 예를 들어, 용액 또는 현탁액; 마이크로- 또는 나노입자와 같이 주사 전에 재구성 매질의 추가시 용액 또는 현탁액으로 제조되도록 사용하기에 적합한 고체 형태; 유중수(w/o) 에멀젼, 수중유(o/w) 에멀젼과 같은 에멀젼, 및 이의 마이크로에멀젼, 리포좀, 또는 에멀좀으로 제조될 수 있다.
담체는 예를 들어, 물, 에탄올, 하나 이상의 폴리올(예: 글리세롤, 프로필렌 글리콜, 및 액상 폴리에틸렌 글리콜), 오일(예: 식물성 오일(예: 땅콩유, 옥수수유, 참기름 등)), 및 이의 조합을 함유하는 용매 또는 분산 매질일 수 있다. 적합한 유동성은, 예를 들어, 레시틴과 같은 코팅물을 사용함으로써, 분산액의 경우 요구되는 입자 크기를 유지함으로써, 및/또는 계면활성제를 사용함으로써 유지될 수 있다. 다수의 경우에서, 예를 들어, 설탕 또는 염(예: 염화나트륨)의 등장화제를 포함하는 것이 바람직할 것이다.
활성 화합물들의 유리 산 또는 유리 염기 또는 약제학적으로 허용되는 염으로서의 용액 또는 분산액은 예를 들어, 계면활성제, 분산제, 유화제, pH 조절제 및 이의 조합을 포함하나, 이에 제한되지 않는 하나 이상의 약제학적으로 허용되는 부형제와 적절히 혼합된 물 또는 다른 용매 또는 분산 매질 중에 제조될 수 있다.
적합한 계면활성제는 음이온성, 양이온성, 양쪽성 또는 비이온성 표면 활성제일 수 있다. 적합한 음이온성 계면활성제는, 카복실레이트, 설포네이트 및 설페이트 이온을 함유하는 것을 포함하나, 이에 제한되는 것은 아니다. 음이온성 계면활성제의 예는 나트륨 도데실벤젠 설포네이트와 같은 장쇄 알킬 설포네이트 및 알킬 아릴 설포네이트의 나트륨, 칼륨, 암모늄; 나트륨 도데실벤젠 설포네이트와 같은 디알킬 나트륨 설포석시네이트; 나트륨 비스-(2-에틸티옥실)-설포석시네이트 와 같은 디알킬 나트륨 설포석시네이트; 및 나트륨 라우릴 설페이트와 같은 알킬 설페이트를 포함한다. 양이온성 계면활성제는 염화벤잘코늄, 염화벤제토늄, 브롬화세트리모늄, 스테아릴 디메틸벤질 암모늄 클로라이드, 폴리옥시에틸렌 및 코코넛 아민과 같은 4차 암모늄 화합물을 포함하나, 이에 제한되는 것은 아니다. 비이온성 계면활성제의 예는 에틸렌 글리콜 모노스테아레이트, 프로필렌 글리콜 미리스테이트, 글리세릴 모노스테아레이트, 글리세릴 스테아레이트, 폴리글리세릴-4-올레에이트, 소비탄 아실레이트, 수크로스 아실레이트, PEG-150 라우레이트, PEG-400 모노라우레이트, 폴리옥시에틸렌 모노라우레이트, 폴리소르베이트, 폴리옥시에틸렌 옥틸페닐에테르, PEG-1000 세틸 에테르, 폴리옥시에틸렌 트리데실 에테르, 폴리프로필렌 글리콜 부틸 에테르, 폴록사머401, 스테아로일 모노이소프로판올아미드 및 폴리옥시에틸렌 수소화된 탈로우 아미드를 포함한다. 양쪽성 계면활성제의 예는 나트륨 N-도데실- -알라닌, 나트륨 N-라우릴- -이미노디프로피오네이트, 미리스토암포아세테이트, 라우릴 베타인 및 라우릴 설포베타인을 포함한다.
제형은 미생물의 성장을 억제하는 방부제를 함유할 수 있다. 적합한 방부제로, 파라벤, 클로로부탄올, 페놀, 소르브산 및 티메로살을 포함하나, 이에 제한되는 것은 아니다. 상기 제형은 또한 활성 성분(들)의 분해를 방지할 수 있는 항산화제를 함유할 수 있다.
본 조성물은 일반적으로 재구성시 비경구 투여를 위해 pH 3-8로 완충된다. 적합한 완충제는 인산염 완충제, 아세트산염 완충제, 및 구연산염 완충제를 포함하나, 이에 제한되는 것은 아니다.
수용성 중합체가 빈번하게 비경구 투여 제형에 사용된다. 적합한 수용성 고분자는 폴리비닐피롤리돈, 덱스트란, 카복시메틸세룰로스 및 폴리에틸렌 글리콜을 포함하나, 이에 제한되는 것은 아니다.
무균의 주사가능한 용액들이 적합한 용매 또는 분산 매질 중 필요한 양의 활성 화합물들을, 필요에 따라 상기 나열된 하나 이상의 부형제와 함께 혼입시키고, 여과된 멸균을 행함으로써 제조될 수 있다. 일반적으로, 분산액은 다양한 무균화된 활성 성분들을, 염기성 분산 매질 및 상기 나열된 것과 같은 기타 필요한 성분들을 함유하는 무균 비히클 내에 혼입시켜 제조된다. 무균 주사가능한 용액의 제조에 있어서 무균 분말의 경우, 제조의 바람직한 방법은 진공-건조 및 동결-건조 기술이며, 이로써 이전 단계의 무균-여과된 이의 용액으로부터 활성 성분 및 임의의 추가적인 목적하는 성분의 분말을 수득한다. 상기 분말은 입자들이 본질상 다공성이 되게 하는 방식으로 제조될 수 있으며, 이로써 입자들의 용해도를 증가시킬 수 있다. 다공성 입자들을 제조하는 방법이 또한 당업자들에게 잘 알려져 있다.
본원에 기술된 비경구 제형은 즉시 방출, 지연 방출, 연장된 방출, 박동성 방출, 및 이의 조합을 포함하는 조절된 방출을 갖도록 제형화될 수 있다.
비경구 투여에서, 하나 이상의 NP 억제제, 및 임의로 하나 이상의 추가적 활성 성분들이 조절된 방출을 제공하는 마이크로입자, 나노입자 또는 이의 조합 내에 혼입될 수 있다. 제형이 2개 이상의 약물을 함유하는 양태에서, 상기 약물들은 동일한 유형의 조절된 방출(예: 지연된, 연장된, 즉시 또는 박동성)을 갖도록 제형화되거나, 상기 약물들은 상이한 유형의 방출(예: 즉시 및 지연된, 즉시 및 연장된, 지연된 및 연장된, 지연된 및 박동성 등)을 갖도록 독립적으로 제형화될 수 있다.
예를 들어, 본 화합물들 및/또는 하나 이상의 추가적 활성 성분들은 당해 약물(들)의 조절된 방출을 제공하는 중합성 마이크로입자 내로 혼입될 수 있다. 상기 약물(들)의 방출은 상기 마이크로입자 밖으로의 상기 약물(들)의 확산 및/또는 가수분해 및/또는 효소적 분해에 의한 상기 중합성 입자들의 분해에 의해 조절된다. 적합한 중합체는 에틸세룰로오스 및 기타 천연 또는 합성 세룰로오스 유도체를 포함한다.
수성 환경에서 서서히 용해하여 수성 환경에서 겔을 형성하는 히드록시프로필 메틸세룰로오스 또는 폴리에틸렌 옥시드와 같은 중합체가 또한 약물 함유 마이크로입자의 재료로서 적합할 수 있다. 기타 중합체들은 폴리락티드(PLA), 폴리글리콜리드(PGA), 폴리(락티드-코-글리콜리드)(PLGA), 폴리-3-히드록시부티레이트(PHB) 및 이의 공중합체, 폴리-4-히드록시부티레이트(P4HB) 및 이의 공중합체, 폴리카프로락톤 및 이의 공중합체, 및 이의 조합과 같은, 폴리안하이드리드, 폴리(에스테르 안하이드리드), 폴리히드록시 산을 포함하나, 이에 제한되는 것은 아니다.
또는, 상기 약물(들)은 수성 용액에 불용성이거나 수성 용액에 서서히 용해되나, GI 장관 내에서 효소적 분해, 담즙산의 계면활성 작용 및/또는 기계적 부식을 포함하는 수단에 의해 분해될 수 있는 물질로부터 제조된 마이크로입자 내로 혼입될 수 있다. 본원에서 사용된 바와 같은, 용어 "물에 서서히 용해되는"은 30분의 기간 내에 물에 용해되지 않는 물질을 말한다. 바람직한 예로는, 지방, 지방 성분, 왁스, 왁스-유사 성분 및 이의 혼합물을 포함한다. 적합한 지방 및 지방 성분들은 지방 알코올(예: 라우릴, 미리스틸 스테아릴, 세틸 또는 세토스테아릴 알코올), 지방산 및 유도체(예: 지방산 에스테르, 지방산 글리세리드(1-, 2- 및 3-글리세리드), 이에 제한되지 않음), 및 수소화된 지방을 포함한다. 구체적 예로, 수소화된 식물유, 수소화된 면실유, 수소화된 피마자유, 상표 Sterotex로 시판되는 수소화된 오일, 스테아르산, 코코아버터 및 스테아릴 알코올을 포함하나, 이에 제한되는 것은 아니다. 적합한 왁스 및 왁스-유사 물질은 천연 또는 합성 왁스, 하이드로카본 및 노멀 왁스를 포함한다. 왁스의 구체적인 예로, 밀납, 글리코왁스, 캐스터 왁스, 카나우바 왁스, 파라핀 및 칸델릴라 왁스를 포함한다. 본원에서 사용된 바와 같은, 왁스-유사 물질은 실온에서 일반적으로 고체이며, 약 30 내지 300℃의 융점을 갖는 임의의 물질로서 정의된다.
일부 경우에서, 마이크로입자 내로의 물의 침투 속도를 조절하는 것이 바람직할 수 있다. 이러한 목적을 위해, 속도-조절(wicking(흡수))제가 상기 열거된 지방 또는 왁스와 함께 제형화될 수 있다. 속도-조절 물질의 예로, 특정 전분 유도체(예: 왁시 말토덱스트린 및 드럼 건조된 옥수수 전분), 세룰로오스 유도체(예: 히드록시프로필메틸-세룰로오스, 히드록시프로필세룰로오스, 메틸세룰로오스, 및 카복시메틸-세룰로오스), 알긴산, 락토스 및 탈크를 포함한다. 추가적으로, 약제학적으로 허용되는 계면활성제(예를 들어, 레시틴)이 상기 마이크로입자의 분해를 돕기 위해 첨가될 수 있다.
제인(Zein)과 같이 수 불용성 단백질들이 또한 약물 함유 마이크로입자의 형성을 위한 물질로 사용될 수 있다. 추가적으로, 수용성인 단백질, 다당류 및 이의 조합이, 약물과 함께 마이크로입자 내에 제형화되고, 이어서 교차-결합을 형성하여 불용성 넷트워크를 형성할 수 있다. 예를 들어, 시클로덱스트린은 개별 약물 분자와 착체를 형성하고 이어서 교차-결합될 수 있다.
약물을 담체 물질 내로 캡슐화하거나 혼입하여 약물을 함유하는 마이크로입자를 형성하는 것은 알려진 약제학적 제형화 기술을 통해 성취될 수 있다. 지방, 왁스 또는 왁스-유사 물질의 제형의 경우, 상기 담체 물질은 일반적으로 이의 용융 온도보다 높게 가열되고, 상기 약물이 첨가되어 상기 담체 물질 중에 현탁된 약물 입자, 담체 물질 중에 용해된 약물, 또는 이의 혼합을 포함하는 혼합물이 형성된다. 마이크로입자는 이후, 응결, 압출, 분사 냉각 또는 수성 분산 과정을 포함하나, 이에 제한되는 것은 아닌 몇몇의 방법들을 통해 제형화될 수 있다. 한 바람직한 과정에서, 왁스가 이의 용융 온도 이상으로 가열되고, 약물이 첨가되고, 용융된 왁스-약물 혼합물이 지속적 교반하에 혼합물을 냉각시킴에 따라 응결된다. 또는, 상기 용융된 왁스-약물 혼합물이 압출되고 구형화되어 펠렛 또는 비드를 형성할 수 있다. 상기 과정의 상세한 설명이 문헌[Remington- The science and practice of pharmacy", 20th Edition, Jennaro et. al., (Phila, Lippencott, Williams, 및 Wilkens, 2000]에서 발견될 수 있다.
일부 담체 물질에서, 용매 증발 기술을 사용하여 약물 함유 마이크로입자를 제조하는 것이 바람직할 수 있다. 이 경우, 약물 및 담체 물질은 공동 용매에 동시 용해되고, 마이크로입자들은 이후 물이나 기타 적합한 매질 중에 에멀젼을 형성, 분사 건조, 또는 벌크 용액으로부터 용매를 증발시켜고 생성된 물질을 분쇄하는 것을 포함하나 이에 제한되지 않는 몇몇 기술들에 의해 제조될 수 있다.
특정 양태에서, 입자 형태의 약물은 수-불용성 또는 물에 서서히 용해하는 물질 중에 균질하게 분산된다. 조성물 내 약물 입자의 크기를 최소화시키기 위해, 약물 분말 자체를 분쇄하여 제형화 이전에 미세 입자를 생성시킬 수 있다. 약제학적 분야에서 알려진 젯트 분쇄 과정이 이 목적을 위해 사용될 수 있다. 특정 양태에서, 입자 형태의 약물은 왁스나 왁스-유사 성분을 이의 용융 온도 이상으로 가열하고, 혼합물을 교반하면서 약물 입자를 첨가함으로써, 왁스 또는 왁스-유사 성분 내 균질하게 분산된다. 이 경우, 약제학적으로 허용되는 계면활성제가 상기 혼합물 내에 첨가되어 약물 입자의 분산을 용이하게 할 수 있다.
입자들은 또한 하나 이상의 개질된 방출 코팅제로 피복될 수 있다. 리파제에 의해 가수분해되는 지방산의 고체 에스테르가 마이크로입자 또는 약물 입자에 분사 코팅될 수 있다. 제인(zein)은 천연적으로 수불용성인 단백질의 한 예이다. 이는 분사 코팅에 의해 또는 습식 과립화 기술에 의해 약물 함유 마이크로입자 또는 약물 입자에 피복될 수 있다. 천연적으로 수불용성인 물질에 추가하여, 소화성 효소의 일부 기질들이 교차-결합 공정으로 처리되어 불용성 넷트워크를 형성할 수 있다. 화학적 및 물리적 수단 모두에 의해 개시되는 다수의 단백질의 교차-결합방법들이 보고되어 왔다. 교차-결합을 수득하는 가장 일반적인 방법들 중 하나는 화학적 교차-결합제를 사용하는 것이다. 화학적 교차-결합제의 예는 알데히드(글루터알데히드 및 포름알데히드), 에폭시 화합물들, 카보디이미드, 및 제니핀을 포함한다. 이들 교차-결합제 외에, 산화된 및 천연 슈거가 젤라틴을 교차-결합시키기 위해 사용되어 왔다[참조: Cortesi, R., et al., Biomaterials 19 (1998) 1641-1649]. 교차-결합은 또한 효소적 수단을 사용하여 수행될 수 있다; 예를 들어, 트랜스글루타미나제가 해산물 제품을 가교-결합시키는 GRAS 성분으로 승인되었다. 마지막으로, 교차-결합은 열 처리, UV 조사 및 감마 조사와 같은 물리적 수단에 의해 개시될 수 있다.
약물 함유 마이크로입자 또는 약물 입자를 에워싸는 교차-결합된 단백질의 코팅층을 형성하기 위해, 수용성 단백질이 상기 마이크로 입자 상에 분사 피복되고, 이후 상기한 방법들 중 어느 하나에 의해 가교- 결합될 수 있다. 또는, 약물 함유 마이크로입자는 코아세르베이션 상 분리(예: 염의 첨가에 의한) 및 후속하는 교차-결합에 의해 단백질 내에 마이크로캡슐화될 수 있다. 이 목적에 적합한 특정 단백질은 젤라틴, 알부민, 카세인 및 글루텐을 포함한다.
다당류가 또한 교차-결합되어 수불용성 넷트워크를 형성할 수 있다. 다수의 다당류에 있어서, 이는 주요 중합체 쇄들을 가교-결합시키는 칼슘염 또는 다가 양이온과의 반응에 의해 성취될 수 있다. 펙틴, 알기네이트, 덱스트란, 아밀로스 및 구아검이 다가 양이온의 존재에서 가교-결합된다. 반대 전하를 띠는 다당류들 사이에 착체가 또한 형성될 수 있다; 예를 들어, 펙틴 및 키토산이 정전기적 상호작용에 의해 착화될 수 있다.
2. 내복 제형들
적합한 경구 투여 제형들은 정제, 캡슐, 용액, 현탁액, 시럽 및 라진즈를 포함한다. 정제는 당업자에게 잘 알려진 압축 또는 성형 기술을 사용하여 제조될 수 있다. 젤라틴 또는 비-젤라틴 캡슐들은 당업자에게 잘 알려진 기술을 이용하여, 액체, 고체 및 반고체 충진 물질들을 캡슐화시킬 수 있는 경질 또는 연질 캡슐 쉘로 제조될 수 있다.
제형들은 약제학적으로 허용되는 담체를 사용하여 제조될 수 있다. 본원에서 일반적으로 사용된 "담체"는 희석제, 방부제, 결합제, 윤활제, 붕괴제, 팽윤제, 충진제, 안정화제 및 이의 조합을 포함하나, 이에 제한되는 것은 아니다.
담체는 또한 가소제, 색소, 색료, 안정화제 및 유동화제를 포함할 수 있는 코팅 조성물의 모든 성분들을 포함할 수 있다. 지연된 방출 투여 제형이 문헌[ "Pharmaceutical dosage form tablets", eds. Liberman 등 (New York, Marcel Dekker, Inc., 1989), "Remington - The science and practice of pharmacy", 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, 및 "Pharmaceutical dosage forms and drug delivery systems", 6th Edition, Ansel 등, (Media, PA: Williams 및 Wilkins, 1995)]과 같은 표준 참고서에 기재된 바와 같이 제조될 수 있다. 이들 참고서들은 정제, 캡슐, 및 정제, 캡슐의 지연된 방출 투여 형태, 및 과립을 제조하기 위한 담체, 물질, 장비 및 과정에 대한 정보를 제공한다.
적합한 코팅 물질의 예로는 세룰로오스 아세테이트 프탈레이트, 히드록시프로필 세룰로오스, 히드록시프로필 메틸세룰로오스, 히드록시프로필 메틸세룰로오스 프탈레이트 및 히드록시프로필 메틸세룰로오스 아세테이트 석시네이트와 같은 세룰로오스 중합체; 폴리비닐 아세테이트 프탈레이트, 아크릴산 중합체 및 공중합체, 및 상표명 EUDRAGIT로 시판되는 메타크릴수지(독일, 베스터슈트, 로스 파마), 제인, 셀락 및 다당류를 포함하나, 이에 제한되는 것은 아니다.
추가적으로, 상기 코팅 물질은 가소제, 색소, 색료, 유동화제, 안정화제, 다공 형성제 및 계면활성제와 같은 통상적인 담체를 함유할 수 있다.
임의의 약제학적으로 허용되는 부형제는 희석제, 결합제, 윤활제, 붕괴제, 색료, 안정화제 및 계면활성제를 포함하나, 이에 제한되는 것은 아니다. "충진제"로 또한 언급되는 희석제는 일반적으로 고체 투여 형태의 부피를 증가시키는 데 필요하며, 이로써 정제의 압축 또는 비드 및 과립의 형성을 위한 입자 크기가 제공된다. 적합한 희석제는, 이칼슘 포스페이트 이수화물, 황산칼슘, 락토스, 수크로스, 만니톨, 소비톨, 세룰로오스, 미결정질 세룰로오스, 카올린, 염화나트륨, 건조 전분, 가수분해된 전분, 전호화 전분, 이산화규소, 산화티탄, 마그네슘 알루미늄 실리케이트 및 분말화된 슈거를 포함하나, 이에 제한되는 것은 아니다.
결합제는 고체 투여 제형에 접착 특성을 부여하여 정제 또는 비드 또는 과립이 투여 형태로 조성된 후에도 손상되지 않은 채로 존재하는 것을 보장하기 위해 사용된다. 적합한 결합 물질은, 전분, 전호화 전분, 젤라틴, 슈거(수크로스, 글루코스, 덱스트로스, 락토스 및 소비톨을 포함하는), 폴리에틸렌 글리콜, 왁스, 아카시아, 트래거컨트, 알긴산나트륨과 같은 천연 및 합성 검, 히드록시프로필메틸세룰로오스, 히드록시프로필세룰로오스, 에틸세룰로오스, 및 비검(veegum)을 포함한 세룰로오스, 아크릴산 및 메타크릴산 공중합체, 메트아크릴산 공중합체, 메틸 메타크릴레이트 공중합체, 아미노알킬 메타크릴레이트 공중합체, 폴리아크릴산/폴리메타크릴산 및 폴리비닐피롤리돈과 같은 합성 중합체를 포함하나, 이에 제한되는 것은 아니다.
윤활제는 정제 제조를 용이하게 하기 위해 사용된다. 적합한 윤활제의 예는, 마그네슘 스테아레이트, 칼슘 스테아레이트, 스테아르산, 글리세롤 베헤네이트, 폴리에틸렌 글리콜, 탈크 및 미네랄 오일을 포함하나, 이에 제한되는 것은 아니다.
붕괴제는 투여 후 투여 형태의 붕괴 또는 "부서짐"을 용이하게 하기 위해 사용되며, 일반적으로, 전분, 나트륨 전분 글리콜레이트, 나트륨 카복시메틸 전분, 나트륨 카복시메틸세룰로오스, 히드록시프로필 세룰로오스, 전호화 전분, 점토, 세룰로오스, 알기닌, 검 또는 가교결합된 PVP(GAF 케미컬(주)의 Polyplasdone XL)와 같은 가교-결합된 중합체를 포함하나, 이에 제한되는 것은 아니다.
안정화제는 예로 산화 반응을 포함한 약물 분해 반응을 억제하거나 지연시키기 위해 사용된다. 적합한 안정화제는, 항산화제, 부틸화된 히드록시톨루렌(BHT), 아스코르브산, 이의 염 및 에스테르; 비타민 E, 토코페롤 및 이의 염; 나트륨 메타바이설파이트와 같은 설파이트; 시스테인 및 이의 유도체; 구연산; 프로필 갈레이트, 및 부틸화된 히드록시아니솔(BHA)를 포함하나, 이에 제한되는 것은 아니다.
캡슐, 정제, 용액 및 현탁액과 같은 경구 투여 제형은 조절된 방출을 갖도록 제형화될 수 있다. 예를 들어, 하나 이상의 화합물들 및 임의로 하나 이상의 추가적 활성 성분들이 나노 입자, 마이크로 입자, 및 이의 조합으로 제형화되어, 연질 또는 경질 젤라틴 또는 비-젤라틴 캡슐로 캡슐화되거나 분산 매질 내 분산되어 경구 현탁액 또는 시럽을 형성할 수 있다. 상기 입자들은 약물 및 조절된 방출 중합체 또는 매트릭스로 형성될 수 있다. 또는, 상기 약물 입자들은 완성된 투여 형태로 혼입되기 전에 하나 이상의 조절된 방출 코팅제로 피복될 수 있다.
다른 양태에서, 하나 이상의 화합물 및 임의로 하나 이상의 추가적인 활성 성분이 매트릭스 물질 내 분산되고, 이것이 생리적 용액과 같은 수성 매질과 접촉되었을 때 겔화되거나 에멀젼화될 수 있다. 겔의 경우, 활성 성분들을 포획하는 상기 매트릭스는 팽창하고, 이로써 매트릭스 물질의 확산 및/또는 분해에 의해 시간이 지남에 따라 서서히 방출된다. 그러한 매트릭스는 정제로서 또는 경질 및 연질 캡슐용 충전 물질로 제형화될 수 있다.
또 다른 양태에서, 상기 하나 이상의 화합물 및 임의로 하나 이상의 추가적 활성 성분은 정제 또는 캡슐과 같은 고체 경구 투여 형태로 제형화되고, 상기 고체 투여 형태는 지연된 방출 코팅 또는 연장된 방출 코팅과 같은 하나 이상의 조절된 방출 코팅제로 피복된다. 상기 코팅제 또는 코팅제들은 또한 본 화합물 및/또는 추가적 활성 성분을 함유할 수 있다.
연장된 방출 제형은 일반적으로, 예를 들어, 문헌[ "Remington - The science and practice of pharmacy" (20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000]에 기술된 확산 또는 삼투 시스템으로 제조될 수 있다. 확산 시스템은 일반적으로 2개 유형의 장치, 즉, 저장소 및 매트릭스로 이루어지며, 이는 당업자에게 잘 알려져 있으며, 기술되어 있다. 상기 매트릭스 장치는 일반적으로 약물을, 서서히 용해하는 중합체 담체와 함께 정제 형태로 압축함으로서 제조된다. 매트릭스 장치의 제조에 사용되는 3가지 주요 유형의 물질들은 불용성 플라스틱, 친수성 중합체 및 지방 화합물들이다. 플라스틱 매트릭스는, 메틸 아크릴레이트-메틸 메타크릴레이트, 폴리비닐 클로라이드 및 폴리에틸렌을 포함하나, 이에 제한되는 것은 아니다. 친수성 중합체는, 메틸 및 에틸 세룰로오스와 같은 세룰로오스 중합체, 히드록시프로필-세룰로오스, 히드록시프로필메틸세룰로오스, 나트륨 카복시메틸세룰로오스 및 Carbopol 934와 같은 히드록시알킬세룰로오스, 폴리에틸렌 옥시드 및 이의 혼합물을 포함하나, 이에 제한되는 것은 아니다. 지방 화합물들은, 카나우바 왁스 및 글리세릴 트리스테아레이트와 같은 다양한 왁스, 및 수소화된 피마자유 또는 수소화된 식물유를 포함하는, 왁스-타입 성분, 또는 이의 혼합물을 포함하나, 이에 제한되는 것은 아니다.
특정 바람직한 양태에서, 상기 플라스틱 물질은 아크릴산 및 메타크릴산 공중합체, 메틸 메타크릴레이트, 메틸 메타크릴레이트 공중합체, 에톡시에틸 메타크릴레이트, 시아노에틸 메타크릴레이트, 아미노알킬 메타크릴레이트 공중합체, 폴리(아크릴산), 폴리(메타그릴산), 메타크릴산 알킬아민 공중합체 폴리(메틸메타크릴레이트), 폴리(메타크릴산)(안하이드리드), 폴리메타크릴레이트, 폴리아크릴아미드, 폴리(메타크릴산 안하이드리드), 및 글리시딜 메타크릴레이트 공중합체를 포함하나, 이에 제한되는 것은 아닌 약제학적으로 허용되는 아크릴 중합체이다.
특정 바람직한 양태에서, 상기 아크릴 중합체는 하나 이상의 암모니오 메타크릴레이트 공중합체로 구성된다. 암모니오 메타크릴레이트 공중합체는 당업자에게 잘 알려져 있으며, 이는 낮은 함량의 4차 암모늄기를 포함하는 아크릴산과 메타크릴산 에스테르의 완전 중합된 공중합체로서 NF XVII에 기재되어 있다.
한 바람직한 양태에서, 상기 아크릴 중합체는 상표명 Eudragit으로 로움 파마에서 시판하는 것과 같은 아크릴 수지 광택제(lacquer)이다. 추가의 바람직한 양태에서, 상기 아크릴 중합체는 상표명 Eudragit RL30D 및 Eudragit RS30D로 각각 로움 파마에서 시판되는 2개의 아크릴 수지 광택제들의 혼합물을 포함한다. Eudragit RL30D 및 Eudragit RS30D는 낮은 함량의 4차 암모늄기를 가진 아크릴 및 메타크릴 에스테르의 공중합체로, Eudragit RL30D 중 암모늄기와 잔여 중성(메트)아크릴 에스테르의 몰비는 1:20이고, Eudragit RS30D은 1:40이다. 평균 분자량은 약 150,000이다. Eudragit S-100 및 Eudragit L-100이 또한 바람직하다. 상기 코드명 RL(높은 투과성) 및 RS(낮은 투과성)은 이들 제제의 투과 특성을 나타낸다. Eudragit RL/RS 혼합물들은 물 및 소화액에 불용성이다. 그러나, 이를 포함하도록 형성된 다중입자 시스템이 수성 용액 및 소화액 내에서 팽창하여 투과성이 될 수 있다.
Eudragit RL/RS과 같은 상술한 중합체들이 임의의 적합한 비율로 함께 혼합되어 궁극적으로 바람직한 용해 프로파일을 갖는 지연된 방출 제형을 수득할 수있다. 바람직한 지연된-방출 다중입자 시스템은 예를 들어, 100% Eudragit RL, 50% Eudragit® RL 및 50% Eudragit® RS, 및 10% Eudragit® RL 및 90% Eudragit® RS로부터 수득될 수 있다. 당업자는 예를 들어 Eudragit® L과 같은 다른 아크릴 중합체가 사용될 수 있음을 이해할 것이다.
또는, 연장된 방출 제형이 삼투 시스템을 사용하거나, 투여 형태에 반-투과성 코팅을 적용함으로써 제조될 수 있다. 후자의 경우, 바람직한 약물 방출 프로파일은 낮은 투과성 및 높은 투과성 코팅 물질을 적합한 비율로 결합시킴으로써 얻어질 수 있다.
상기한 상이한 약물 방출 메카니즘의 장치들을 단일 또는 다수의 단위를 함유하는 최종 투여 형태 내 조합시킬 수 있다. 다수의 단위들의 예로, 다층 정제 및 정제, 비드 또는 과립을 함유하는 캡슐을 포함하나, 이에 제한되는 것은 아니다. 즉시 방출부는 코팅 또는 압축 과정을 이용하여 연장된 방출 코어의 상단 상에 즉시 방출 층을 적용하거나, 연장된 및 즉시 방출되는 비드를 함유하는 캡슐과 같은 다중 단위 시스템에 의해 연장된 방출 시스템에 첨가될 수 있다.
친수성 중합체를 함유하는 연장된 방출 정제는 직접 압축, 습윤 과립화, 또는 건조 과립화와 같은 당업자에게 일반적으로 알려진 기술에 의해 제조된다. 이들의 제형은 일반적으로, 활성 약제학적 성분 뿐만 아니라 중합체, 희석제, 결합제 및 윤활제를 포함한다. 통상적인 희석제로는 전분, 분말화된 세룰로오스, 특히 결정성 및 미결정성 세룰로오스, 과당, 만노톨 및 수크로스와 같은 슈거, 밀가루 및 유사한 식용 분말과 같은 불활성 분말 성분을 포함한다. 전형적인 희석제로 예를 들어, 다양한 종류의 전분, 락토스, 만니톨, 카올린, 인산칼슘 또는 황산칼슘, 염화나트륨과 같은 무기염 및 분말화된 슈거를 포함한다. 분말화된 세룰로오스 유도체가 또한 유용하다. 전형적인 정제 결합제로는 전분, 젤라틴과 같은 성분들, 락토스, 과당, 및 포도당과 같은 슈거를 포함한다. 아카시아, 알기네이트, 메틸세룰로오스, 및 폴리비닐피롤리돈을 포함한 천연 및 합성 검이 또한 사용될 수 있다. 폴리에틸렌 글리콜, 친수성 중합체, 에틸세룰로오스 및 왁스가 또한 결합제로 제공된다. 윤활제는 정제 및 펀치가 다이에 접착하는 것을 방지하기 위해 정제 제형에 필요하다. 윤활제는 탈크, 마그네슘 및 칼슘 스테아레이트, 스테아르산 및 수소화된 식물유와 같은 미끄러운 고체로부터 선택된다.
왁스 물질을 함유하는 연장된 방출 정제는 일반적으로 직접 혼합법, 응결법, 및 수성 분산법과 같은 당업자에게 공지된 방법들을 사용하여 제조된다. 응결법에서, 약물은 왁스 물질과 혼합되고, 분사-응결 혹은 응결되고, 스크리닝되고, 공정을 거치게 된다.
지연된 방출 제형은 고체 투여 형태를 중합체 필름으로 피복함으로써 제조될 수 있으며, 상기 중합체 필름은 위의 산성 환경에서는 불용성이나 소장의 중성 환경에서는 가용성이다.
지연된 방출 투여 단위는 예를 들어, 약물 또는 약물-함유 조성물을 선택된 코팅 물질로 코팅함으로써 제조될 수 있다. 상기 약물-함유 조성물은 예를 들어, 캡슐 내로 혼입되기 위한 정제, "코팅된 코어" 투여 형태에서 내부 코어로서 사용되는 정제, 또는 정제 또는 캡슐 내로 혼입되기 위한 복수개의 약물-함유 비드들, 입자들 또는 과립들일 수 있다. 바람직한 코팅 물질은 생분해성, 점진적으로 가수분해되는, 점진적으로 수용해되는 및/또는 효소적으로 분해되는 중합체를 포함하며, 통상적인 "장용성" 중합체일 수 있다. 당업자에게 이해되는 바와 같이 장용성 중합체는 더 낮은 위장관의 더 높은 pH 환경에서 가용성이 되거나, 투여 형태가 위장관을 통과함에 따라 서서히 분해되는 반면, 효소적으로 분해가능한 중합체는 더 낮은 위장관, 특히 결장에 존재하는 세균성 효소에 의해 분해된다. 지연된 방출을 나타내기에 적합한 코팅 물질로는 히드록시프로필 세룰로오스, 히드록시에틸 세룰로오스, 히드록시메틸 세룰로오스, 히드록시프로필 메틸 세룰로오스, 히드록시프로필 메틸 세룰로오스 아세테이트 석시네이트, 히드록시프로필메틸 세룰로오스 프탈레이트, 메틸세룰로오스, 에틸 세룰로오스, 세룰로오스 아세테이트, 세룰로오스 아세테이트 프탈레이트, 세룰로오스 아세테이트 트리멜리테이트 및 카복시메틸세룰로오스 나트륨과 같은 세룰로오스 중합체; 바람직하게 아크릴산, 메타크릴산, 메틸 아크릴레이트, 에틸 아크릴레이트, 메틸 메타크릴레이트 및/또는 에틸 메타크릴레이트로부터 형성된 아크릴산 중합체 및 공중합체, 및 Eudragit® L30D-55 및 L100-55 (pH 5.5 이상에서 가용성), Eudragit® L-1OO (pH 6.0 이상에서 가용성), Eudragit® S (높은 정도의 에스테르화의 결과로 pH 7.0 이상에서 가용성), 및 Eudragits® NE, RL 및 RS (상이한 정도의 투과성 및 팽창성을 가진 수불용성 중합체)을 포함한 상표명 Eudragit®(독일, 바이스터슈타트, 로움 파마)으로 시판되는 기타 메타크릴 수지; 폴리비닐 피롤리돈, 비닐 아세테이트, 비닐아세테이트 프탈레이트, 비닐아세테이트 크로톤산 공중합체, 및 에틸렌-비닐 아세테이트 공중합체와 같은, 비닐 중합체 및 공중합체; 아조 중합체, 펙틴, 키토산, 아밀로스 및 구아검과 같은 효소적으로 분해가능한 중합체; 제인 및 셀락을 포함하나, 이에 제한되는 것은 아니다. 상이한 코팅 물질의 배합이 또한 사용될 수 있다. 상이한 중합체를 이용한 다층 코팅이 또한 적용될 수 있다.
특정 코팅 물질에 대한 바람직한 코팅 중량은 다양한 코팅 물질의 상이한 양으로 제조된 정제, 비드 및 과립의 개별 방출 프로파일을 평가함으로써 당업자에 의해 용이하게 결정될 수 있다. 이는 목적하는 방출 특성을 나타내는 물질, 방법 및 적용 형태의 조합이며, 이는 당업자가 오직 임상적 연구로부터 결정할 수 있는 것이다 .
코팅 조성물은 가소제, 색소, 색료, 안정화제, 유동화제 등과 같은 통상적인 첨가제를 포함할 수 있다. 가소제는 일반적으로 코팅의 취약성을 감소시키기 위해 존재하며, 일반적으로 중합체의 건조 중량에 대해 약 10 중량% 내지 50 중량%로 존재할 것이다. 일반적인 가소제의 예로는, 폴리에틸렌 글리콜, 프로필렌 글리콜, 트리아세틴, 디메틸 프탈레이트, 디에틸 프탈레이트, 디부틸 프탈레이트, 디부틸 세바케이트, 트리에틸 시트레이트, 트리부틸 시트레이트, 트리에틸 아세틸 시트레이트, 피마자유 및 아세틸화된 모노글리세리드를 포함한다. 안정화제는 분산액 중 입자를 안정화시키기 위해 바람직하게 사용된다. 일반적인 안정화제는 소비탄 에스테르, 폴리소르베이트 및 폴리비닐피롤리돈과 같은 음이온성 유화제이다. 유동화제는 필름 형성 및 건조 동안에 끈적이는 효과를 감소시키기 위해 권장되며, 일반적으로 코팅 용액 중 중합체 중량의 대략 25 중량% 내지 100 중량%를 나타낼 것이다. 한 효과적인 유동화제는 탈크이다. 마그네슘 스테아레이트 및 글리세롤 모노스테아레이트와 같은 기타 유동화제가 또한 사용될 수 있다. 이산화티탄과 같은 색소가 또한 사용될 수 있다. 실리콘(예: 시메티콘)과 같은 소량의 항-포움제가 또한 상기 코팅 조성물에 첨가될 수 있다.
III . 화합물의 제조 방법
본원에 기술된 화합물들을 합성하는 예가 첨부된 반응식 1 내지 3에 도시되어 있다. 각 경우에서, 출발 물질은 1,2-디클로로-4-니트로벤젠 및 피페라진이고, 이것이 반응하여 본원에 기술된 화합물들을 제조하기에 적합한 1-(4-니트로-1-클로로페닐)피페라진을 형성한다.
상기 벤젠 시약 상의 치환기들은 제조하려고 하는 최종 생성물에 따라 적합하게 달라질 수 있다. 그렇게 하여 형성된 상기 치환된 피페라진은 제조하려고 하는 최종 생성물에 따라 적합하게 치환된 3-페닐-4-카복시-이속사졸 화합물과 반응한다. 상기 3-페닐-4-카복시-이속사졸 화합물은 히드록실아민 하이드로클로라이드과의 반응, 및 이후 반응식 1 내지 3에서 예시된 화학 반응 단계에 의해 보호된 1,4-디하이드록시 벤젠으로부터 제조될 수 있다. 화합물 1 내지 10의 제조 과정이 실시예에 기술된다.
반응식 1. 화합물 1(YD-04)의 합성
반응식 2. 화합물 2(YD-01)의 합성
반응식 3. 화합물 3(YD-03) 및 화합물 4(YD-07)의 합성
IV . 사용 방법
본원에 기술된 항-바이러스제는 바이러스 성장, 감염성, 짐(burden), 씨앗(shed), 항-바이러스 저항성의 개발을 감소시키기 위해 및/또는전통적인 항-바이러스 치료의 효능을 개선시키기 위해 사용될 수 있다.
네가티브-센스 RNA 게놈을 갖는 모든 바이러스들은 단일 가락 RNA-결합 핵단백질(NP)을 인코딩한다. 핵단백질들은 구조적으로 핵산(DNA 또는 RNA)과 관련된 단백질들이다. 인플루엔자 핵단백질은 핵과 세포질 사이의 서틀링 및 RNA 전사를 위한 바이러스 게놈의 엔켑시데이션(encapsidation), 복제 및 팩키징을 포함한 다중 기능을 가지며 감염 과정 동안에 가장 풍부하게 발현되는 단백질이다. NP는 폭넓은 종류의 바이러스 및 숙주 세포 거대분자 모두와 상호작용하며, 예를 들어, 그 자체, RNA, 바이러스 RNA-의존성 RNA 폴리머라제, 및 바이러스 매트릭스 단백질과 상호작용한다. NP는 또한 숙주 폴리펩티드(액틴과 같은), 핵수송 및 핵외 유출 기구의 성분, 및 핵 RNA 헬리카제와 상호작용한다. 인플루엔자 A NP 상의 3개의 잠재적인 신규 결합부위는, 소 그루브(groove), RNA 결합 포켓 그루브, 및 테일 루프 그루브를 포함한다.
임의의 특정 이론에 얽매이지 않으면서, 본원에 기술된 화합물들의 작용 메카니즘의 가설은 인플루엔자 바이러스와 같은 바이러스의 핵단백질(NP)에의 결합과 이로 인해 in vivo에서 바이러스 복제의 방해가 관여하는 것이다.
일 양태에서, 본원에 기술된 항-바이러스제는 인플루엔자 A 핵 단백질의 몸체 후면에 있는 소 그루브(뉴클레오진 결합 그루브라 불리는)에 결합하며, 잔기 280 내지 311이 관여한다(VYGSAVASGYDFEREGYSLVGIDPFRLLQNSQ) (서열 목록 번호: 1). 이들 잔기의 제2 구조는 헬릭스 사이의 잔기들에 의해 형성된 루프로 연결된 3개의 짧은 헬릭스(280-287, 291~294, 및 301-309)를 포함한다.
상기 NP 억제제는 상기 몸체 후면 상의 소 그루브 내 위치할 수 있으며, 수소 결합에 의해 잔기 N309와 상호작용하고, 소수성 상호작용에 의해 Y289와 상호작용할 수 있다. 여기서, 화합물의 페닐 고리는 Y289의 페닐 고리와 평행할 수 있고, 이들 2개의 고리 사이의 거리는 ~ 3.2-4.3 Å 사이이다.
특정 양태에서, 상기 NP 억제제는 소 그루브에 결합하고 화합물은 잔기 S287과 수소 결합을 형성한다. 특정 양태에서, 항-바이러스제는 상기 나열된 접촉점과 조합하여 또는 단독으로 결합 접촉점을 만들 수 있다. 특히, 항-바이러스 화합물들은 잔기 465~470 (서열: ELSDEK) (서열 목록 번호: 2), 잔기 22-26 (서열: ATEIR) (서열 목록 번호: 3), 잔기 A22-47L (서열 : ATEIRASVGKMIDGIGRFYIQMCTEL) (서열 목록 번호:4), R55, 또는 이의 조합과 접촉할 수 있다.
다른 양태에서, NP 억제제들은 인플루엔자 A 핵단백질의 RNA 결합 그루브에 결합한다. 이 양태에서, 상기 NP 억제제는 RNA 결합 도메인 내에 위치하며, 여기서 핵단백질의 몸체 및 두부 사이의 내부 그루브가 신장하여 잔기 Q364 및 V363와 수소 결합을 형성한다. 이로써 RNA가 아르기닌 풍부 그루브에 진입하는 것이 방지된다. Y148은 RNA의 제1 염기의 고정으로써 기능하는 것으로 간주되었다.
다른 양태에서, 예시적 NP 억제제는 인플루엔자의 테일 루프 그루브에 결합한다. 이 양태에서, NP 억제제는 잔기 E339 근처의 테일 루프 결합 도메인 내에 위치하고 잔기 V186, R267, 및 G268과 수소 결합을 형성한다. 이 결합 포켓에서의 NP 억제제는 다른 단량체로부터 E339 및 R416 사이에 형성된 염 브리지를 절단한다.
B. 치료되는 장애들
동물, 척추동물, 포유류 및 인간 환자를 감염시키는 것을 포함하여, 엔벨롭 및 비-엔벨롭 모두에 의해 야기되는 바이러스 감염들은 본원에 기술된 화합물들 또는 조성물들로 예방되거나 치료될 수 있다. 본 화합물들은 척추동물, 특히 인간을 감염시키는 모든 바이러스들, 및 특히 동물 및 인간에 병원성인 바이러스들을 치료하기에 적합하다. 치료될 수 있는 바이러스 감염 및 관련된 생성 질환으로는, CMV, RSV, 아레나바이러스 및 HIV 감염, 및 질환들, 간염, 인플루엔자, 폐렴, 라싸열 및 AIDS를 포함하나, 이에 제한되는 것은 아니다. 바이러스 분류에 대한 국제 위원회는 당업자에게 알려진 모든 바이러스 균주의 목록을 함유하며, 이는 참조에 의해 이의 전체가 본원에 혼입된다.
특정 양태에서, 예방되거나 치료되는 질환은 바이러스 감염을 포함한다. 바람직한 양태에서, 본 화합물 및 제형은 인플루엔자 A 바이러스 감염을 치료하거나 예방하는 데 사용된다. 본 방법의 제형으로 예방되거나 치료될 수 있는 인플루엔자 A 바이러스는 HlNl, H2N2, H3N2, H5N1, H7N7, H1N2, H9N2, H7N2, H7N3, 및 H10N7을 포함한다. 바람직한 양태에서, 본 제형은 HlNl 또는 H3N2에 의해 야기되는 인플루엔자 감염 A 균주의 치료에 유용하다.
C. 용량
바이러스 성장 및 증식을 예방하는 데 필요한 항-바이러스 제형의 용량은 존재할 수 있는 바이러스의 종류, 제형이 사용되는 환경, 및 제형이 투여된 부위에서 잔류할 것으로 예상되는 시간을 포함한 다수의 인자에 의해 변할 수 있다.
바람직한 화합물들은 실제 스크리닝(virtual screen)에 의해 확인된 것들이다. 예시적 화합물들은 화학식 I 내지 VI에 속한다. 바이러스 감염을 치료하기 위한 전형적인 용량은 약 0.1 mg 내지 250mg/kg/1일이고, 바람직하게는 0.2 내지 250mg/kg/1일이다.
본 화합물들은 바이러스 감염의 치료를 위해 경구 또는 비경구 경로에 의해 인간에게 투여되거나 1일 1회 또는 1일 2회, 약 0.1 내지 약 500mg/kg의 용량 수준, 바람직하게는 약 0.5 내지 250mg/kg/1일의 용량 수준으로 경구로 투여될 수 있다.
용량 및 제형에 있어서의 변화는 당업자에게 알려진 바와 같이 치료되는 대상체의 체중 및 상태 및 선택된 투여의 특정 경로에 기초하여 결정될 것이다.
실시예
물질 및 방법
바이러스
인플루엔자 A\WSN\33 바이러스를 매딘-다비 개 신장(Madin-Darby canine kidney (MDCK)) 세포에서 번식시켰다. 완전한 세포 변성 효과를 감염된 MDCK 세포 배양물에서 진행시킨 후, 바이러스 입자들을 수집하여 사용할 때까지 -70℃ 냉동고에서 저장하였다. 인플루엔자 A 바이러스 균주, A/베트남/1194/04를 부화계란에서 성장시키고, 상기 수집된 바이러스-함유 요막 유액을 사용할 때까지 -70℃에서 분취량으로 저장하였다.
플라그 감소 검사(PRA)
본 화합물들의 보호 효과를 플라그 감소 검사를 이용하여 항-인플루엔자 A H1N1\WSN\33에 대해 MDCK 세포 상에서 측정하였다.
상기 PRA 검사를 24-웰 조직 배양 플레이트에서 3차례 실시하였다. MDCK 세포를 바이러스 첨가 하루 전에 10% 소태아 혈청(FBS)을 함유한 EMEM(Eagle's minimal essential medium)를 사용하여 1×105 세포/웰로 씨딩하였다. 16 내지 24시간 후에, 인플루엔자 A\WSN\33 바이러스의 100 내지 200개의 플라그 형성 단위(PFU)를 본 화합물과 함께 또는 본 화합물 없이 상기 세포 단일층에 첨가하였다. 화합물 1 내지 10의 각각의 농도는 상이한 실험에서 달라졌다. 흡인에 의해 미결합된 바이러스 입자를 제거하기 전에 바이러스를 5% CO2, 37℃에서 1.5 내지 2 시간 동안 세포에 감염시켰다. 상기 세포 단일층을 EMEM과 함께 1회 세정하고 1% FBS 및 1 μg/ml TPCK 트립신을 함유하는 EMEM 중 1% 저융점 아가로스로 덮어씌웠다. 화합물들은 또한 필요할 때 아가로스 오버레이 내 존재하였다.
상기 플레이트를 72시간 동안 5% CO2, 37℃에서 배양하였다. 72시간 감염시킨 후, 세포를 3시간 동안 10% 포름알데히드를 이용하여 고정시키고 플레이트를 5분간 1% Virkon 살균제에 담갔다. 이후 아가로즈 플러그를 제거하고 세포 단일층을 0.7% 크리스탈 바이올렛으로 염색하였다. 바이러스 감염에 의해 형성된 플라그를 계수하였다. 대조군(본 화합물을 첨가하지 않은) 대비 플라그 억제율(%)을 각 화합물 농도에 대해 측정하였다. 시험 화합물의 농도의 함수로서 억제제 부재 중의 대조군 대비 각 화합물의 플라그 형성 단위(PFU)(PFU의 감소율(%))의 플롯을 만들었다. 바이러스 PFU를 50% 감소시키는 데 필요한 약물의 농도를 나타내는 중간 유효 농도, EC50을 상기 플롯팅된 그래프로부터 계산하였다. 결과를 화합물의 부재중의 대조군의 백분율로써 나타내고 이를 도면에 도시하였다. 평균 값은 표준 편차와 함께 나타내었다.
세포독성 검사
화합물 1-10의 세포독성을 3-(4,5-디메틸티아졸-2-일)-2,5-디페닐테트라졸륨 브로마이드(MTT, 시그마-알드리치, 미국) 검사에 의해 측정하였다. 상기 검사는 평평 바닥의 96-웰 미세적정 플레이트 내에서 10% FBS를 함유한 총 용적 100 μl EMEM 중 20,000 세포/웰로 Vero 세포 또는 MDCK 세포를 씨딩하여 실시하였다. 24시간 배양 후, 세포를 PBS로 2회 세정하고 이후 본 화합물을 첨가하기 전에 신선한 EMEM으로 보충하였다. 본 화합물을 첨가한 후, 세포를 추가로 24 시간 동안 5% CO2, 37℃에서 배양하였다. MTT를 각 웰에 첨가하여 최종 농도를 0.5 mg/ml가 되게 하였다. 플레이트를 4시간 동안 5% CO2, 37℃에서 추가로 배양하였다. 배양 기간의 종기에, 0.01M의 염산(HCl) 중 10% 라우릴 설페이트(SDS) 100 μl를 각 웰에 첨가하여 세포를 가용화시켰다. 밤새 배양한 후, 플레이트를 참조 파장을 640nm로 하여 570nm에서 리딩(reading)하였다. MTT 리딩을 50% 감소시키는 데 필요한 화합물의 농도를 나타내는 중앙 독성 농도, TC50을 상기 MTT 데이터로부터 측정하였다.
실시예 1. 화합물 1의 합성( YD -04)
화합물 1을 반응식 1에 제시된 합성식에 따라 합성하였다. 화합물 2, 3 및 4를 합성하기 위한 다양한 합성식의 변형 예들이 반응식 2 및 3에 제시되어 있어 화합물 1의 다른 유사체들의 합성에서 약간의 변화가 있음을 보여준다.
YD-041의 합성
무수 디클로로메탄(50 mL) 중 p-히드록시벤즈알데히드 (3.7 g, 30.0 mmol) 및 트리에틸아민 (6.3 mL, 45.0 mmol)의 용액에 무수 디클로로메탄(50 mL) 중 t-부틸디메틸실릴 클로라이드 (6.8 g, 45.0 mmol) 용액을 점적 첨가하였다. 생성된 혼합물을 2시간 동안 실온에서 교반하고 이후 물(100 mL)을 첨가하였다. 유기 층을 분리하고 수성 층을 디클로로메탄으로 추출하였다. 결합된 유기층을 물 및 포화 염수로 세정하고 황산마그네슘으로 건조하였다. 여과 및 농축 후, 수득된 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 9:1)로 추가 정제하여 노란색 오일의 조 생성물 YD-041 (7.29 g)를 수득하였다.
화합물 YD-042의 합성
YD-041 (1.18 g, 5 mmol) 및 히드록실아민 하이드로클로라이드 (1.15 g, 16.5 mmol)를 실온에서 무수 에탄올(10 mL)에 용해시키고, 이후 교반하면서 피리딘 (20 mL)을 점적 첨가하였다. 생성된 혼합물을 30분 동안 실온에서 교반하고 이후 40분간 환류 가열하였다. 종결시, 반응 혼합물을 실온으로 냉각하고, 37%의 하이드로클로라이드 용액 (2 mL) 및 물 (7.5 mL)의 혼합물을 첨가하였다. 생성된 혼합물을 총 용적의 1/3이 남을 때까지 농축시켰다. 디클로로메탄으로 추출한 후, 유기 층을 포화 염수로 세정하고 황산마그네슘으로 건조시켰다. 용매를 제거한 후, 남아있는 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 1:1)로 정제하여 노란색 오일의 YD-042 (0.862 g, 78%)를 수득하였다.
화합물 YD-043의 합성
YD-042 (810 mg, 3.2 mmol)을 무수 디메틸포름아미드 (4 mL)에 용해시키고, 이후 0℃로 냉각시켰다. 교반하면서 N-클로로석신이미드 (NCS, 452 mg, 3.2 mmol)를 부분씩 첨가하였다. 냉각 배쓰를 제거하고 반응 혼합물을 실온에서 1 시간 동안 교반하였다. 종결시, 반응 혼합물의 용적의 4배 양의 물을 첨가하고 생성된 혼합물을 디에틸 에테르로 추출하였다. 유기 층을 물로 3회 세정하고 황산마그네슘으로 건조하였다. 여과 및 농축 후, 노란색 오일의 조 YD-043(884mg, 96%)를 수득하였다.
화합물 YD-044의 합성
아세토니트릴(40mL) 중 YD-06 (737 mg, 3.8 mmol) 용액에 0℃에서 아세토니트릴(8mL) 중 조 YD-043(884mg, 3.1mmol)의 용액을 점적 첨가하였다. 생성된 혼합물을 2시간 동안 0℃에서 교반하였다. 종결시, 얼음물(4mL)를 첨가하고 대부분을 용매를 감압 하 제거하였다. 물을 첨가하고 생성된 혼합물을 디에틸 에테르로 추출하였다. 유기 층을 물로 3회 및 포화 염수로 1회 세정하고 황산마그네슘으로 건조하였다. 감압 하 여과 및 농축 후, 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 15:1)로 정제하여 노란색 오일의 YD-044(627 mg, 52%)를 수득하였다.
화합물 YD-045의 합성
YD-044 (3.23 g, 8.3 mmol)를 트리플루오로아세트산 (10 mL)에 용해시키고, 생성된 용액을 30분간 실온에서 교반하였다. 이후 트리플루오로아세트산을 감압하 제거하고 잔류물을 디에틸 에테르에 용해시켰다. 페트롤륨 에테르를 참가하여 생성물을 결정화하였다. 여과 및 진공 건조 후, 백색의 편상 결정의 YD-045 (1.327 g, 48%)를 수득하였다.
화합물 YD-046의 합성
무수 디클로로메탄 (8 mL) 중 YD-045 (177 mg, 0.53 mmol)의 용액에 N,N-디이소프로필에틸아민 (DIEA, 103 mg, 0.80 mmol), YD-05 (128 mg, 0.53 mmol) 및 1-에틸-3-(3-디메틸아미노프로필) 카보디이미드 (EDCI, 406 mg, 2.13 mmol)를 순서대로 첨가하였다. 생성된 혼합물을 3시간 동안 실온에서 교반하고, 이후 디클로로메탄으로 희석시켰다. 유기 층을 분리하고 2M 수산화나트륨 용액, 물 및 포화 염수로 세정하고, 황산나트륨으로 건조하고 여과 및 농축하였다. 수득된 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 3:1)로 정제하여 연노란색 바늘 결정의 YD-046(141 mg, 48%)을 수득하였다.
화합물 1(YD-04)의 합성
YD-046 (67 mg, 0.12 mmol)을 무수 테트라하이드로푸란 (4 mL)에 용해시키고, 테트라-n-부틸암모늄 플루오라이드 (TBAF, 63 mg, 0.24 mmol)를 첨가하였다. 생성된 혼합물을 실온에서 30분간 교반하였다. 농축 후, 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르:에틸 아세테이트 = 1:1)로 정제하여 밝은 노란색 분말의 YD-04(31 mg, 58%)을 수득하였다. 235 내지 240℃에서 분해됨.
실시예 2. 화합물 2(YD-01)의 합성
화합물 2(YD-01)의 합성은 반응식 2에 구조적으로 도시되어 있다.
화합물 YD-011의 합성
벤즈알데히드 (10.60 g, 0.10 mol) 및 히드록실아민 하이드로클로라이드 (22.94 g, 0.33 mol)를 90% 에탄올 (330 mL)에 용해시켰다. 수산화나트륨 분말을 첨가함으로써 이 용액의 pH를 5로 조정하였다. 생성된 용액을 30분간 실온에서 교반하고 추가적인 30분 동안 환류 가열하였다. 반응 혼합물을 주위 온도로 냉각하고 농축된 염산(40 mL)과 물(150 mL)의 혼합물에 첨가하고, 본래 용적의 1/3이 되게 농축하였다. 상기 농축된 혼합물을 디클로로메탄으로 추출하고, 유기 층을 포화 염수로 세정하고 무수 황산마그네슘으로 건조한 후, 진공 하 증발시켜 노란색 조 오일을 수득하였다. 상기 조 오일을 진공 증류(40 mm Hg, 150-155℃)에 의해 정제하여 연노란색 오일, YD-O11 (9.87 g, 82% 수율)을 수득하였다. 상기 오일은 냉동시 황백색(off-white)의 결정을 형성하였다. 시스 및 트랜스 이성질체 모두가 TLC에 의해 검출되었다.
화합물 YD-012의 합성
0℃에서 무수 디클로로메탄 중 YD-O11 (2 g, 16.53 mmol) 용액에 N-클로로석신이미드 (NCS, 8.79 g, 66 mmol)를 교반하면서 소량씩 첨가하였다. 혼합물을 주위 온도로 가온시키고 2시간 동안 교반하였다. 물 (50 mL)을 반응 혼합물에 첨가하고 층을 분리하였다. 수성 층을 디클로로메탄 (20 mL×3)으로 추출하고 결합된 유기 층을 포화 염수로 세정하고, 무수 황산마그네슘으로 건조한 후, 여과 및 진공 농축하였다. 조 생성물을 에틸 아세테이트 중 페트롤룸 에테르가 감소하는 농도 구배(100:150:1)로 용출시키면서 컬럼 크로마토그래피하여 YD-012 (1.02 g, 40% 수율)를 수득하였다. 시스 및 트랜스 이성질체가 TLC로 검출되었다. YD-012의 불안정성으로 인해, 추가 정제없이 이를 다음 단계에 바로 사용하였다.
화합물 YD-06의 합성
에테르 (100 mL) 중 t-부틸 아세토아세테이트 (5.2 mL) 용액에 테트라하이드로푸란(THF) 중 칼륨 헥사메틸디실라지드 (1 M, 28.64 mL) 용액을 점적 첨가하였다. 반응 혼합물을 농축하고, n-헥산을 첨가하여 침전시켰다. 침전물을 여과하고 건조하여 조 생성물 YD-06을 수득하였다.
화합물 YD-013의 합성
상기 조 YD-06 (1.0 g, 5.1 mmol)을 아세토니트릴 (50 mL)에 용해시키고, 혼합물을 0℃로 냉각하였다. 아세토니트릴 (10 mL) 중 화합물 YD-012 (0.65 g, 4.2 mmol) 용액을 교반하면서 상기 YD-06의 용액에 점적 첨가하였다. 반응 혼합물을 0℃에서 2시간 동안 교반하고 얼음물 (4 mL)을 첨가하였다. 혼합물을 진공 하 증발시켰다. 잔류물을 물에 재용해시키고 디클로로메탄으로 추출하였다. 유기 층을 포화 염수로 세정하고 무수 황산마그네슘으로 건조하고, 여과 및 진공 농축하여 조 잔류물을 수득하였다. 이를 용출제로 페트롤륨 에테르(60-90℃)를 사용하여 컬럼 크로마토그래피로 정제하여 황백색 고체로서 YD-013(510 mg, 47% 수율)을 수득하였다.
화합물 YD-014의 합성
화합물 YD-013 (186 mg, 0.718 mmol)을 트리플루오로아세트산 (5 mL)에 용해시키고, 당해 용액을 실온에서 4시간 동안 교반하였다. 생성된 용액을 진공 하 증발시켜 트리플루오로아세트산을 제거하였다. 디클로로메탄을 첨가하고, 용액을 2회 재증류하였다. 잔류물을 에테르에 용해시키고, 페트롤륨 에테르를 첨가하여 재결정화를 실시하였다. 백색 결정의 화합물 YD-014가 여과 및 진공 하 건조에 의해 분리되었다. 모액을 농축하고, 페트롤룸 에테르-에틸 아세테이트 (3:1) 중에서 1% 용적 빙초산으로 용출하면서 컬럼 크로마토그래피로 정제하여 백색 고체인 YD-014를 수득하였다. 상기 결정성 화합물의 결합된 중량은 115mg이었다(79% 수율).
화합물 YD-05의 합성
실온에서 교반하면서 N,N-디메틸포름아미드 (11 mL) 중 피페라진 (3.73 g, 43.4 mmol) 용액에 3,4-디클로로니트로벤젠 (1.64 g, 8.6 mmol)의 N,N-디메틸포름아미드 (15 mL) 용액을 점적 첨가하였다. 생성된 혼합물을 100℃로 가열하고, 5시간 동안 상기 온도를 유지시켰다. 반응 혼합물을 실온으로 냉각하고, 진공 농축하여 N,N-디메틸포름아미드를 제거하였다. 생성된 잔류물을 디클로로메탄 (25 mL)으로 희석하였다. 유기 층을 포화 중탄산나트륨 수용액으로 세정하고 무수 황산나트륨으로 건조하고, 여과 및 농축하였다. 클로로포름 및 메탄올(3:1)로부터의 잔류물의 재결정화로 노란색 결정의 화합물 YD-05 (1.77 g, 85% 수율)이 수득되었다.
화합물 2 (YD-Ol)의 합성
무수 디클로로메탄 (10mL) 중 YD-014 (320 mg, 1.58 mmol) 용액에 디이소프로필에틸아민 (DIEA, 305 mg, 2.36 mmol), YD-05 (380 mg, 1.58 mmol) 및 1-(3-디메틸아미노프로필)-3-에틸카보디이미드(EDCI, 1.2g, 6.30mmol)을 순서대로 첨가하였다. 생성된 혼합물을 2시간 동안 실온에서 교반하였다. 반응 혼합물을 디클로로메탄으로 희석하고 수성 수산화나트륨(2M), 물 및 포화 염수 순서로 세정하였다. 유기 층을 무수 황산나트륨으로 건조시키고, 여과 및 농축하였다. 에틸 아세테이트 중 페트롤룸 에테르(3:1)로 용출시키는 컬럼 크로마토그래피에 의해 잔류물을 정제하여 연노란색 고체인 YD-Ol (290 mg, 43% 수율)을 수득하였다.
실시예 3. 화합물 3 (YD-07)의 합성
화합물 3 (YD-07)의 합성은 반응식 3에 구조적으로 나타내져 있다.
화합물 YD-031의 합성
p-니트로벤즈알데히드 (4.53 g, 0.03 mol) 및 히드록실아민 하이드로클로라이드 (6.87 g, 0.099 mol)를 실온에서 90% 에탄올 (100 mL)에 용해시켰다. 반응 혼합물의 pH를 수산화나트륨 분말을 첨가함으로써 5로 조정하고 생성된 용액을 30분간 실온에서 교반한 후 4시간 동안 환류 가열하였다. 완결시, 반응 혼합물을 실온으로 냉각하고 에탄올을 감압하 제거하였다. 물을 첨가하고 생성된 혼합물을 디클로로메탄으로 추출하였다. 결합된 유기 층을 포화 염수로 세정하고 황산마그네슘으로 건조하였다. 용매를 제거한 후 분광학적으로 순수한 노란색 무정형의 분말의 YD-031 (4.831 g, 97%)을 수득하였다.
화합물 YD-032의 합성
YD-031 (887 mg, 5.3 mmol)을 무수 디메틸포름아미드 (4.6 mL)에 용해시키고 용액을 0℃로 냉각시켰다. 교반하면서 N-클로로석신이미드 (800 mg, 6.0 mmol)를 소량씩 첨가하였다. 냉각 배쓰를 제거하고 생성된 혼합물을 실온에서 4시간 동안 교반하였다. 완결시, 얼음물 (20 mL)을 첨가하고 생성된 혼합물을 디에틸에테르로 추출하였다. 유기 층을 물로 3회 및 포화 염수로 1회 세정하고 황산마그네슘으로 건조하였다. 여과한 후에 용매를 제거하여 백색 고체의 YD-032 (1.064 g, 100%)가 수득되었다.
화합물 YD-033의 합성
교반하면서 아세토니트릴 (60mL) 중 조 YD-06 (1.213 g, 6.2 mmol)의 용액에 0℃에서 아세토니트릴 (25 mL) 중 조 YD-032 (1 g, 5.0 mmol) 용액을 첨가하였다. 생성된 용액을 2시간 동안 0℃에서 교반하였다. 완결시, 얼음물(4mL)을 첨가하고 대부분의 용매를 감압하 제거하였다. 잔류하는 용액을 물로 희석하고 디클로로메탄으로 추출하였다. 유기 층을 포화 염수로 세정하고 황산마그네슘으로 건조하였다. 여과 및 용매를 제거한 후, 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르: 에틸 아세테이트=10:1)로 정제하여 연노란색 정육면체 결정의 YD-033 (1.239 g, 78%)을 수득하였다.
화합물 YD-034의 합성
YD-033 (100 mg, 0.33 mmol) 및 틴(II) 클로라이드 디하이드레이트 (371 mg, 1.64 mmol)를 무수 에탄올 (7 mL)에 용해시키고, 생성된 용액을 1.5시간 동안 환류 가열하였다. 반응 혼합물을 실온으로 냉각하고 적합한 양의 얼음물을 첨가하였다. 생성된 혼합물의 pH를 20% 탄산나트륨 수용액을 첨가함으로써 8로 조정하였다. 에틸 아세테이트로 추출한 후, 유기 층을 염수로 세정하고 황산나트륨으로 건조하였다. 여과 및 농축 후 생성된 잔류물을 실리카겔 컬럼(페트롤룸 에테르: 에틸 아세테이트=5:1)을 사용하여 정제하여 백색 바늘 결정의 YD-034 (72 mg, 80%)를 수득하였다.
화합물 YD-038의 합성
YD-034 (1.0 g, 3.65 mmol)를 트리플루오로아세트산 (5 mL)에 용해시키고 실온에서 1시간 동안 교반하였다. 트리플르오로아세트산을 감압 하 제거하고 잔류물을 디클로로메탄으로 2회 공비혼합하여 백색 고체인 조 YD-038 (810 mg)을 수득하였다.
화합물 3 (YD-03)의 합성
무수 디클로로메탄 (8 mL) 중 조 YD-038 (157 mg, 0.72 mmol) 용액에 N,N-디이소프로필에틸아민 (DIEA, 138 mg, 1.08 mmol), YD-05 (207 mg, 0.86 mmol) 및 EDCI (550 mg, 2.88 mmol)을 순서대로 첨가하였다. 생성된 혼합물을 실온에서 4시간 동안 교반하고, 이후 디클로로메탄으로 희석하였다. 이 혼합물을 2M 수산화나트륨 용액, 물 및 포화 염수로 세정하였다. 유기 층을 황산나트륨으로 건조하고 여과 및 농축하였다. 수득된 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르: 에틸 아세테이트=2:1)로 정제하여 밝은 노란색 분말의 YD-03 (173 mg, 49%)를 수득하였다.
실시예 4. 화합물 4 (YD-07)의 합성
화합물 YD-03 (50 mg, 0.1134 mmol)을 6M 황산 (1mL)에 용해시키고, 생성된 용액을 0℃로 냉각하였다. 수(0.5mL) 중 질산나트륨 용액 (7.2 mg, 0.136 mmol)을 교반하면서 점적 첨가하였다. 온도를 5℃ 미만으로 유지하면서 생성된 혼합물을 추가의 30분간 교반하였다. 수중(1mL) 나트륨 아지드(125 mg, 1.923 mmol) 용액을 첨가하고 온도를 실온으로 올렸다. 혼합물을 추가의 2시간 동안 교반하고 물로 희석시켰다. 에틸 아세테이트로 추출한 후, 결합된 유기 층을 포화 염수로 세정하고 황산나트륨으로 건조하였다. 농축후, 수득된 잔류물을 컬럼 크로마토그래피(페트롤룸 에테르: 에틸 아세테이트=4:1)로 정제하여 밝은 노란색 분말의 YD-07 (38 mg, 72%)을 수득하였다.
실시예 5. 화합물 5-10의 합성
화합물 5는 벤즈알데히드 대신 o-클로로벤즈알데히드로 시작하여 반응식 2에 따라 제조된다.
화합물 6은 화합물 5와 같이 반응식 2에 따라 제조되나, 피페라진 대신 2-메틸피페라진으로부터 제조된 YD-05의 2-메틸 유도체를 사용한다.
화합물 7은 반응식 2를 이용하는 화합물 6에서와 같이 반응식 2에 따라 제조되나, o-클로로벤즈알데히드 대신 벤즈알데히드로 시작한다.
화합물 8은 3,4-디클로로니트로벤젠 대신 4-클로로니트로벤젠을 사용하여 화합물 2에서와 같이 반응식 2에 따라 제조된다.
화합물 9는 벤즈알데히드 대신 출발 물질로 2,6-디클로로벤즈알데히드를 사용하여 화합물 2에서와 같이 반응식 2에 따라 제조된다.
화합물 10은 출발 물질로서 3,4-디클로로니트로벤젠 대신 2,3-디클로로니트로벤젠을 사용하여 화합물 8에서와 같이 반응식 2에 따라 제조된다.
실시예 6. 화합물 1 내지 10의 항바이러스 활성
화합물 1 내지 10에 의한 보호를 정량적으로 측정하기 위해 플라그 감소 검사를 실시하였다. 본 화합물들은 MDCK 세포에서의 인플루엔자 A 바이러스 플라그 형성을 억제하였으며, 화합물 1 내지 10 각각의 EC50은 0.05, 0.06, 0.56, 0.25, 0.04, 0.21, 0.8, 5.1, 12, 및 25 μM이었다(참조: 도 1b, 2b, 3b, 4b, 5b, 6b, 7b, 8b, 9b, 및 10b).
MDCK 및 Vero 세포에 대한 화합물 1 내지 10의 세포 독성을 검사하였다. 테스트된 화합물 농도는 0 내지 250 μM의 범위이었으며, 결과를 표 1에 나타내었다. 상기 결과는 화합물 1 내지 10의 TC50이 MDCK 및 Vero 세포 모두에 있어서 250 μM 초과임을 보여준다. 화합물 1 내지 10의 MDCK 세포에서의 TC50/EC50의 비로 정의되는 선택성 지수(SI)가 표 1에 나타내져 있다. 상기 결과는 이 종류의 아미드들이 포유동물 세포에 일반적으로 비-독성임을 보여준다.
[표 1] 화합물 1 내지 10의 항바이러스 활성
다르게 정의하지 않는다면, 본원에 사용된 모든 기술적 및 과학적 용어들은 본 발명이 속한 기술 분야의 당업자에 의해 일반적으로 이해되는 것과 동일한 의미를 나타낸다. 본원에서 인용된 공개본 및 당해 공개본에서 인용된 자료들은 참조에 의해 구체적으로 본원에 혼입된다.
당업자는 과도한 실험 없이도 본원에 기술된 본 발명의 구체적 양태들에 대해 다수의 균등물이 있음을 인식하거나 확인할 수 있을 것이다. 그러한 균등물을 아래 청구항에 포함시키고자 한다.
<110> THE UNIVERSITY OF HONGKONG
<120> Antiviral compounds and methods of making and using there of
cross reference to related applications
<130> P12-4017
<150> US 61/231431
<151> 2009-08-05
<160> 8
<170> KopatentIn 2.0
<210> 1
<211> 32
<212> PRT
<213> Virus
<400> 1
Val Tyr Gly Ser Ala Val Ala Ser Gly Tyr Asp Phe Glu Arg Glu Gly
1 5 10 15
Tyr Ser Leu Val Gly Ile Asp Pro Phe Arg Leu Leu Gln Asn Ser Gln
20 25 30
<210> 2
<211> 6
<212> PRT
<213> Virus
<400> 2
Glu Leu Ser Asp Glu Lys
1 5
<210> 3
<211> 5
<212> PRT
<213> Virus
<400> 3
Ala Thr Glu Ile Arg
1 5
<210> 4
<211> 26
<212> PRT
<213> Virus
<400> 4
Ala Thr Glu Ile Arg Ala Ser Val Gly Lys Met Ile Asp Gly Ile Gly
1 5 10 15
Arg Phe Tyr Ile Gln Met Cys Thr Glu Leu
20 25
<210> 5
<211> 498
<212> PRT
<213> Virus
<400> 5
Met Ala Ser Gln Gly Thr Lys Arg Ser Tyr Glu Gln Met Glu Thr Asp
1 5 10 15
Gly Glu Arg Gln Asn Ala Thr Glu Ile Arg Ala Ser Val Gly Lys Met
20 25 30
Ile Gly Gly Ile Gly Arg Phe Tyr Ile Gln Met Cys Thr Glu Leu Lys
35 40 45
Leu Ser Asp Tyr Glu Gly Arg Leu Ile Gln Asn Ser Leu Thr Ile Glu
50 55 60
Arg Met Val Leu Ser Ala Phe Asp Glu Arg Arg Asn Lys Tyr Leu Glu
65 70 75 80
Glu His Pro Ser Ala Gly Lys Asp Pro Lys Lys Thr Gly Gly Pro Ile
85 90 95
Tyr Arg Arg Val Asn Gly Lys Trp Met Arg Glu Leu Ile Leu Tyr Asp
100 105 110
Lys Glu Glu Ile Arg Arg Ile Trp Arg Gln Ala Asn Asn Gly Asp Asp
115 120 125
Ala Thr Ala Gly Leu Thr His Met Met Ile Trp His Ser Asn Leu Asn
130 135 140
Asp Ala Thr Tyr Gln Arg Thr Arg Ala Leu Val Arg Thr Gly Met Asp
145 150 155 160
Pro Arg Met Cys Ser Leu Met Gln Gly Ser Thr Leu Pro Arg Arg Ser
165 170 175
Gly Ala Ala Gly Ala Ala Val Lys Gly Val Gly Thr Met Val Met Glu
180 185 190
Leu Val Arg Met Ile Lys Arg Gly Ile Asn Asp Arg Asn Phe Trp Arg
195 200 205
Gly Glu Asn Gly Arg Lys Thr Arg Ile Ala Tyr Glu Arg Met Cys Asn
210 215 220
Ile Leu Lys Gly Lys Phe Gln Thr Ala Ala Gln Lys Ala Met Met Asp
225 230 235 240
Gln Val Arg Glu Ser Arg Asp Pro Gly Asn Ala Glu Phe Glu Asp Leu
245 250 255
Thr Phe Leu Ala Arg Ser Ala Leu Ile Leu Arg Gly Ser Val Ala His
260 265 270
Lys Ser Cys Leu Pro Ala Cys Val Tyr Gly Pro Ala Val Ala Ser Gly
275 280 285
Tyr Asp Phe Glu Arg Glu Gly Tyr Ser Leu Val Gly Ile Asp Pro Phe
290 295 300
Arg Leu Leu Gln Asn Ser Gln Val Tyr Ser Leu Ile Arg Pro Asn Glu
305 310 315 320
Asn Pro Ala His Lys Ser Gln Leu Val Trp Met Ala Cys His Ser Ala
325 330 335
Ala Phe Glu Asp Leu Arg Val Leu Ser Phe Ile Lys Gly Thr Lys Val
340 345 350
Val Pro Arg Gly Lys Leu Ser Thr Arg Gly Val Gln Ile Ala Ser Asn
355 360 365
Glu Asn Met Glu Thr Met Glu Ser Ser Thr Leu Glu Leu Arg Ser Arg
370 375 380
Tyr Trp Ala Ile Arg Thr Arg Ser Gly Gly Asn Thr Asn Gln Gln Arg
385 390 395 400
Ala Ser Ala Gly Gln Ile Ser Ile Gln Pro Thr Phe Ser Val Gln Arg
405 410 415
Asn Leu Pro Phe Asp Arg Thr Thr Val Met Ala Ala Phe Thr Gly Asn
420 425 430
Thr Glu Gly Arg Thr Ser Asp Met Arg Thr Glu Ile Ile Arg Met Met
435 440 445
Glu Ser Ala Arg Pro Glu Asp Val Ser Phe Gln Gly Arg Gly Val Phe
450 455 460
Glu Leu Ser Asp Glu Lys Ala Ala Ser Pro Ile Val Pro Ser Phe Asp
465 470 475 480
Met Ser Asn Glu Gly Ser Tyr Phe Phe Gly Asp Asn Ala Glu Glu Tyr
485 490 495
Asp Asn
<210> 6
<211> 498
<212> PRT
<213> Virus
<400> 6
Met Ala Ser Gln Gly Thr Lys Arg Ser Tyr Glu Gln Met Glu Thr Asp
1 5 10 15
Gly Asp Arg Gln Asn Ala Thr Glu Ile Arg Ala Ser Val Gly Lys Met
20 25 30
Ile Asp Gly Ile Gly Arg Phe Tyr Ile Gln Met Cys Thr Glu Leu Lys
35 40 45
Leu Ser Asp His Glu Gly Arg Leu Ile Gln Asn Ser Leu Thr Ile Glu
50 55 60
Lys Met Val Leu Ser Ala Phe Asp Glu Arg Arg Asn Lys Tyr Leu Glu
65 70 75 80
Glu His Pro Ser Ala Gly Lys Asp Pro Lys Lys Thr Gly Gly Pro Ile
85 90 95
Tyr Arg Arg Val Asp Gly Lys Trp Met Arg Glu Leu Val Leu Tyr Asp
100 105 110
Lys Glu Glu Ile Arg Arg Ile Trp Arg Gln Ala Asn Asn Gly Glu Asp
115 120 125
Ala Thr Ala Gly Leu Thr His Ile Met Ile Trp His Ser Asn Leu Asn
130 135 140
Asp Ala Thr Tyr Gln Arg Thr Arg Ala Leu Val Arg Thr Gly Met Asp
145 150 155 160
Pro Arg Met Cys Ser Leu Met Gln Gly Ser Thr Leu Pro Arg Arg Ser
165 170 175
Gly Ala Ala Gly Ala Ala Val Lys Gly Ile Gly Thr Met Val Met Glu
180 185 190
Leu Ile Arg Met Val Lys Arg Gly Ile Asn Asp Arg Asn Phe Trp Arg
195 200 205
Gly Glu Asn Gly Arg Lys Thr Arg Ser Ala Tyr Glu Arg Met Cys Asn
210 215 220
Ile Leu Lys Gly Lys Phe Gln Thr Ala Ala Gln Arg Ala Met Val Asp
225 230 235 240
Gln Val Arg Glu Ser Arg Asn Pro Gly Asn Ala Glu Ile Glu Asp Leu
245 250 255
Ile Phe Leu Ala Arg Ser Ala Leu Ile Leu Arg Gly Ser Val Ala His
260 265 270
Lys Ser Cys Leu Pro Ala Cys Ala Tyr Gly Pro Ala Val Ser Ser Gly
275 280 285
Tyr Asp Phe Glu Lys Glu Gly Tyr Ser Leu Val Gly Ile Asp Pro Phe
290 295 300
Lys Leu Leu Gln Asn Ser Gln Ile Tyr Ser Leu Ile Arg Pro Asn Glu
305 310 315 320
Asn Pro Ala His Lys Ser Gln Leu Val Trp Met Ala Cys His Ser Ala
325 330 335
Ala Phe Glu Asp Leu Arg Leu Leu Ser Phe Ile Arg Gly Thr Lys Val
340 345 350
Ser Pro Arg Gly Lys Leu Ser Thr Arg Gly Val Gln Ile Ala Ser Asn
355 360 365
Glu Asn Met Asp Asn Met Gly Ser Ser Thr Leu Glu Leu Arg Ser Gly
370 375 380
Tyr Trp Ala Ile Arg Thr Arg Ser Gly Gly Asn Thr Asn Gln Gln Arg
385 390 395 400
Ala Ser Ala Gly Gln Thr Ser Val Gln Pro Thr Phe Ser Val Gln Arg
405 410 415
Asn Leu Pro Phe Glu Lys Ser Thr Ile Met Ala Ala Phe Thr Gly Asn
420 425 430
Thr Glu Gly Arg Thr Ser Asp Met Arg Ala Glu Ile Ile Arg Met Met
435 440 445
Glu Gly Ala Lys Pro Glu Glu Val Ser Phe Arg Gly Arg Gly Val Phe
450 455 460
Glu Leu Ser Asp Glu Lys Ala Thr Asn Pro Ile Val Pro Ser Phe Asp
465 470 475 480
Met Ser Asn Glu Gly Ser Tyr Phe Phe Gly Asp Asn Ala Glu Glu Tyr
485 490 495
Asp Asn
<210> 7
<211> 498
<212> PRT
<213> Virus
<400> 7
Met Ala Ser Gln Gly Thr Lys Arg Ser Tyr Glu Gln Met Glu Thr Gly
1 5 10 15
Gly Glu Arg Gln Asn Ala Thr Glu Ile Arg Ala Ser Val Gly Arg Met
20 25 30
Val Ser Gly Ile Gly Arg Phe Tyr Ile Gln Met Cys Thr Glu Leu Lys
35 40 45
Leu Ser Asp Tyr Glu Gly Arg Leu Ile Gln Asn Ser Ile Thr Ile Glu
50 55 60
Arg Met Val Leu Ser Ala Phe Asp Glu Arg Arg Asn Arg Tyr Leu Glu
65 70 75 80
Glu His Pro Ser Ala Gly Lys Asp Pro Lys Lys Thr Gly Gly Pro Ile
85 90 95
Tyr Arg Arg Arg Asp Gly Lys Trp Val Arg Glu Leu Ile Leu Tyr Asp
100 105 110
Lys Glu Glu Ile Arg Arg Ile Trp Arg Gln Ala Asn Asn Gly Glu Asp
115 120 125
Ala Thr Ala Gly Leu Thr His Leu Met Ile Trp His Ser Asn Leu Asn
130 135 140
Asp Ala Thr Tyr Gln Arg Thr Arg Ala Leu Val Arg Thr Gly Met Asp
145 150 155 160
Pro Arg Met Cys Ser Leu Met Gln Gly Ser Thr Leu Pro Arg Arg Ser
165 170 175
Gly Ala Ala Gly Ala Ala Val Lys Gly Val Gly Thr Met Val Met Glu
180 185 190
Leu Ile Arg Met Ile Lys Arg Gly Ile Asn Asp Arg Asn Phe Trp Arg
195 200 205
Gly Glu Asn Gly Arg Arg Thr Arg Ile Ala Tyr Glu Arg Met Cys Asn
210 215 220
Ile Leu Lys Gly Lys Phe Gln Thr Ala Ala Gln Arg Ala Met Met Asp
225 230 235 240
Gln Val Arg Glu Ser Arg Asn Pro Gly Asn Ala Glu Ile Glu Asp Leu
245 250 255
Ile Phe Leu Ala Arg Ser Ala Leu Ile Leu Arg Gly Ser Val Ala His
260 265 270
Lys Ser Cys Leu Pro Ala Cys Val Tyr Gly Leu Ala Val Ala Ser Gly
275 280 285
Tyr Asp Phe Glu Arg Glu Gly Tyr Ser Leu Val Gly Ile Asp Pro Phe
290 295 300
Arg Leu Leu Gln Asn Ser Gln Val Phe Ser Leu Ile Arg Pro Asn Glu
305 310 315 320
Asn Pro Ala His Lys Ser Gln Leu Val Trp Met Ala Cys His Ser Ala
325 330 335
Ala Phe Glu Asp Leu Arg Val Ser Ser Phe Ile Arg Gly Thr Arg Val
340 345 350
Val Pro Arg Gly Gln Leu Ser Thr Arg Gly Val Gln Ile Ala Ser Asn
355 360 365
Glu Asn Met Glu Ala Met Asp Ser Asn Thr Leu Glu Leu Arg Ser Arg
370 375 380
Tyr Trp Ala Ile Arg Thr Arg Ser Gly Gly Asn Thr Asn Gln Arg Arg
385 390 395 400
Ala Ser Ala Gly Gln Ile Ser Val Gln Pro Thr Phe Ser Val Gln Arg
405 410 415
Asn Leu Pro Phe Glu Arg Ala Thr Ile Met Ala Ala Phe Thr Gly Asn
420 425 430
Thr Glu Gly Arg Thr Ser Asp Met Arg Thr Glu Ile Ile Gly Met Met
435 440 445
Glu Ser Ala Arg Pro Glu Asp Val Ser Phe Gln Gly Arg Gly Val Phe
450 455 460
Glu Leu Ser Asp Glu Lys Ala Thr Asn Pro Ile Val Pro Ser Phe Asp
465 470 475 480
Met Asn Asn Glu Gly Ser Tyr Phe Phe Gly Asp Asn Ala Glu Glu Tyr
485 490 495
Asp Asn
<210> 8
<211> 498
<212> PRT
<213> Virus
<400> 8
Met Ala Ser Gln Gly Thr Lys Arg Ser Tyr Glu Gln Met Glu Thr Gly
1 5 10 15
Gly Glu Arg Gln Asn Ala Thr Glu Ile Arg Ala Ser Val Gly Arg Met
20 25 30
Val Gly Gly Ile Gly Arg Phe Tyr Ile Gln Met Cys Thr Glu Leu Lys
35 40 45
Leu Ser Asp Gln Glu Gly Arg Leu Ile Gln Asn Ser Ile Thr Val Glu
50 55 60
Arg Met Val Leu Ser Ala Phe Asp Glu Arg Arg Asn Arg Tyr Leu Glu
65 70 75 80
Glu His Pro Ser Ala Gly Lys Asp Pro Lys Lys Thr Gly Gly Pro Ile
85 90 95
Tyr Arg Arg Arg Asn Gly Lys Trp Val Arg Glu Leu Ile Leu Tyr Asp
100 105 110
Lys Glu Glu Ile Arg Arg Ile Trp Arg Gln Ala Asn Asn Gly Glu Asp
115 120 125
Ala Thr Ala Gly Leu Thr His Met Met Ile Trp His Ser Asn Leu Asn
130 135 140
Asp Ala Thr Tyr Gln Arg Thr Arg Ala Leu Val Arg Thr Gly Met Asp
145 150 155 160
Pro Arg Met Cys Ser Leu Met Gln Gly Ser Thr Leu Pro Arg Arg Ser
165 170 175
Gly Ala Ala Gly Ala Ala Ile Lys Gly Val Gly Thr Met Val Met Glu
180 185 190
Leu Ile Arg Met Ile Lys Arg Gly Ile Asn Asp Arg Asn Phe Trp Arg
195 200 205
Gly Glu Asn Gly Arg Arg Thr Arg Ile Ala Tyr Glu Arg Met Cys Asn
210 215 220
Ile Leu Lys Gly Lys Phe Gln Thr Ala Ala Gln Lys Ala Met Met Asp
225 230 235 240
Gln Val Arg Glu Ser Arg Asn Pro Gly Asn Ala Glu Ile Glu Asp Leu
245 250 255
Ile Phe Leu Ala Arg Ser Ala Leu Ile Leu Arg Gly Ser Val Ala His
260 265 270
Lys Ser Cys Leu Pro Ala Cys Val Tyr Gly Leu Ala Val Ala Ser Gly
275 280 285
Tyr Asp Phe Glu Arg Glu Gly Tyr Ser Leu Val Gly Ile Asp Pro Phe
290 295 300
Arg Leu Leu Gln Asn Ser Gln Val Phe Ser Leu Ile Arg Pro Lys Glu
305 310 315 320
Asn Pro Ala His Lys Ser Gln Leu Val Trp Met Ala Cys His Ser Ala
325 330 335
Ala Phe Glu Asp Leu Arg Val Ser Ser Phe Ile Arg Gly Thr Arg Val
340 345 350
Ile Pro Arg Gly Gln Leu Ser Thr Arg Gly Val Gln Ile Ala Ser Asn
355 360 365
Glu Asn Val Glu Ala Met Asp Ser Ser Thr Leu Glu Leu Arg Ser Arg
370 375 380
Tyr Trp Ala Ile Arg Thr Arg Ser Gly Gly Asn Thr Asn Gln Gln Arg
385 390 395 400
Ala Ser Ala Gly Gln Ile Ser Val Gln Pro Thr Phe Ser Val Gln Arg
405 410 415
Asn Leu Pro Phe Glu Arg Val Thr Ile Met Ala Ala Phe Lys Gly Asn
420 425 430
Thr Glu Gly Arg Thr Ser Asp Met Arg Thr Glu Ile Ile Arg Met Met
435 440 445
Glu Ser Ala Arg Pro Glu Asp Val Ser Phe Gln Gly Arg Gly Val Phe
450 455 460
Glu Leu Ser Asp Glu Lys Ala Thr Asn Pro Ile Val Pro Ser Phe Asp
465 470 475 480
Met Ser Asn Glu Gly Ser Tyr Phe Phe Gly Asp Asn Ala Glu Glu Tyr
485 490 495
Asp Asn
Claims (39)
- 화학식 I의 항바이러스 화합물.
[화학식 I]
상기 식에서, Ar1, Ar2 및 Ar3 은 각각 독립적으로, 임의로 탄소와 질소 사이에 이중 결합을 포함하는 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y 및 Z는 독립적으로 부재(즉, 직접 결합)이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R1)-, -C(R2)=C(R3)-, 및 -C(R4R5)n-으로 이루어진 군으로부터 선택되고,
여기서 n은 0 내지 6이고, 여기서, R1 내지 R5는 각각 독립적으로 수소, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시이고;
W는 선형, 사이클릭 또는 헤테로사이클릭 기이다. - 제1항에 있어서, Ar1은 수소, 히드록실, 니트로, 아미노 및 아지드로 이루어진 군으로부터 선택된 하나 이상의 치환기로 치환되고; Ar2는 메틸기로 치환되고; X는 C=O이고; Y 및/또는 Z는 부재이며; 및/또는 Ar3은 할로겐, 니트로기, 및 할로겐과 니트로기의 조합으로 이루어진 군으로부터 선택된 하나 이상의 치환기로 치환되는, 화합물.
- 제1항에 있어서, W는 2개의 질소 원자를 함유하는 치환된 5 내지 7원-불포화 고리로, 여기서 하나의 질소 원자는 X에 결합되어 있고, 다른 질소 원자는 Z에 결합되어 있는, 화합물.
- 제3항에 있어서, W가 치환된 피페라진이며, 여기서 N1은 X에 결합되고 N4는 Z에 결합되는, 화합물.
- 제1항에 있어서, 상기 화합물이 화학식 II를 갖는, 화합물
[화학식 II]
상기 식에서, Ar1 및 Ar3 은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y 및 Z는 독립적으로 부재이거나 -C=O-, -S=O, -SO2, -N(R10)=O, -C=C, 및 -C(R11R12)n으로 이루어진 군으로부터 선택되고,
n, g 및 m은 독립적으로 0 내지 6이고;
T, Q 및 R은 독립적으로 C(R8R9), 질소, 산소, 인, 규소, 황 및 비소로 이루어진 군으로부터 선택되고;
A 및 D는 각각 독립적으로 CR15R16 또는 NR17이고;
여기서, R4 및 R8-R17은 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택되거나, 여기서 -CR15R16-, -NR17-, 또는 이의 조합은 상기 임의의 브리지 메틸렌기와 함께 5-8원 시클릭 구조를 형성한다. - 제5항에 있어서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; X는 -C=O이고; Y 및 Z는 부재이며; 및/또는 Ar3은 할로기, 니트로기, 또는 할로기와 니트로기의 조합으로 치환된, 화합물.
- 제5항에 있어서, R4가 메틸인, 화합물.
- 제5항에 있어서, Q는 탄소이고, T는 산소이고, 및/또는 R은 질소인, 화합물.
- 제5항에 있어서, g 및 m은 1인, 화합물.
- 제5항에 있어서, A 및 D는 NR15이고, 여기서 R15-R15는 A-D가 피페라진으로 정의되도록 -CH2-CH2- 링커를 나타내는, 화합물.
- 제1항에 있어서, 상기 화합물이 화학식 III을 갖는, 화합물.
[화학식 III]
상기 식에서, Ar1 및 Ar3 은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R14R15)n-으로 이루어진 군으로부터 선택되고,
n, g 및 m은 독립적으로 0 내지 6이고;
A, D, T, Q 및 R은 C(R8R9), 질소, 산소, 인, 규소, 황 및 비소로 이루어진 군으로부터 독립적으로 선택되고;
여기서, R4 및 R8-R15는 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다. - 제11항에 있어서, Ar1은 수소, 히드록실, 니트로, 아미노 또는 아지드로 치환되고; X는 C=O이고; Y 및 Z는 부재이며; 및/또는 Ar3은 할로기, 니트로기, 또는 할로기와 니트로기의 조합으로 치환된, 화합물.
- 제11항에 있어서, Q는 탄소이고, T는 산소이고, 및/또는 R은 질소인, 화합물.
- 제11항에 있어서, A 및 D가 질소인, 화합물.
- 제11항에 있어서, R4 및 R13은 독립적으로 수소 또는 메틸인, 화합물.
- 제15항에 있어서, R4가 메틸이고, 및/또는 R13은 수소인, 화합물.
- 제1항에 있어서, 상기 화합물이 화학식 IV를 갖는, 화합물.
[화학식 IV]
상기 식에서, X, Y 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R10)-, -C(R11)=C(R12)-, 및 -C(R13R14)n-으로 이루어진 군으로부터 선택되고,
여기서 n은 0 내지 6이고;
T, Q 및 R은 C(R8R9), 질소, 산소, 인, 황, 규소 및 비소로 이루어진 군으로부터 독립적으로 선택되고;
Cy는 4-7원 치환되거나 비치환된 시클릭 또는 헤테로시클릭기이고;
여기서, R1-R14는 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다. - 제17항에 있어서, Cy는 2개의 질소 원자를 함유하는 치환된 5-7원 불포화 고리이고, 여기서 하나의 질소 원자는 X에 결합되고, 다른 질소 원자는 Z에 결합된, 화합물.
- 제17항에 있어서, Cy는 치환된 피페라진이며, 여기서 N1은 X에 결합되고 N4은 Z에 결합되며, Y 및 Z는 부재이고, X는 C=O이고, T는 산소이고, Q는 탄소이고, 및/또는 R은 질소인, 화합물.
- 제17항에 있어서, R1-R3 및 R5-R7은 할로기, 니트로기, 또는 할로 및 니트로기의 조합으로 이루어진 군으로부터 독립적으로 선택된, 화합물.
- 제17항에 있어서, R4는 메틸기인, 화합물.
- 제1항에 있어서, 상기 화합물이 화학식 V를 갖는, 화합물.
[화학식 V]
상기 식에서, Ar1, Ar2 및 Ar3 은 각각 독립적으로 치환되거나 비치환된 아릴 또는 헤테로아릴기이고;
X, Y 및 Z는 각각 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R1)-, -C(R2)=C(R3)-, 및 -C(R4R5)n-으로 이루어진 군으로부터 선택되고,
n, g 및 m은 독립적으로 0 내지 6이고;
Q 및 T는 질소 또는 CR6으로부터 독립적으로 선택되고;
R1-R6, R10, 및 R11은 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다. - 제22항에 있어서, Q 및 T는 모두 질소인, 화합물.
- 제22항에 있어서, R10은 메틸기이고, 및/또는 R11은 수소인, 화합물.
- 제22항에 있어서, R10 및 R11은 모두 수소인, 화합물.
- 제22항에 있어서, Y 및 Z는 부재이고, g 및 m은 1이고, 및/또는 X는 C=O인, 화합물.
- 제22항에 있어서, Ar1 및 Ar3은 치환된 페닐이고, 및/또는 Ar2는 치환된 이속사졸인, 화합물.
- 제1항에 있어서, 상기 화합물이 화학식 VI을 갖는 화합물.
[화학식 VI]
상기 식에서, X, Y 및 Z는 독립적으로 부재이거나 -C(=O)-, -S(=O)-, -SO2-, -N(R12)-, -C(R13)=C(R14)-, 및 -C(R15R16)n-으로 이루어진 군으로부터 선택되고,
n, g 및 m은 독립적으로 0 내지 6이고;
Q 및 T는 질소 또는 CR17로 이루어진 군으로부터 독립적으로 선택되고;
R1-R17은 수소, 할로, 히드록실, 선형 또는 분지형 C1-C6 알킬, 선형 또는 분지형 C1-C6 알케닐, 선형 또는 분지형 C1-C6 알키닐, 또는 선형 또는 분지형 C1-C6 알콕시, 아미노, 아지드, 시아노, 니트로, 니트릴, 이소니트릴, 아미드, 카복실레이트, 우레아, 구아니딘, 이소시아네이트, 이소티오시아네이트 및 티오에테르로 이루어진 군으로부터 독립적으로 선택된다. - 제28항에 있어서, Q 및 T는 모두 질소인, 화합물.
- 제28항에 있어서, Y 및 Z는 부재이고, 및/또는 X는 C=O인, 화합물.
- 제28항에 있어서, R10은 메틸기이고, 및/또는 R11은 수소인, 화합물.
- 제36항에 있어서, g 및 m은 1인, 화합물.
- 제28항에 있어서, R1-R3 및 R5-R7은 할로기, 니트로기, 및 할로 및 니트로기의 조합으로 이루어진 군으로부터 독립적으로 선택되는, 화합물.
- 제1항에 있어서, 상기 화합물이,
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-히드록시-페닐)-5-메틸이속사졸-4-일]-메탄온;
[4-(2-클로로-4-니트로-페닐)-피페라진-l-일]-[3-페닐-5-메틸-이속사졸-4-일]-메탄온;
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-아미노-페닐)-메틸이속사졸-4-일]-메탄온;
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(4-아지도-페닐)-5-메틸이속사졸-4-일]-메탄온;
[4-(2-클로로-4-니트로-페닐)-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸이속사졸-4-일]-메탄온;
[4-(2-클로로-4-니트로-페닐)-2-메틸-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온;
[4-(2-클로로-4-니트로-페닐)-2-메틸-피페라진-1-일]-[3-페닐-5-메틸이속사졸-4-일]-메탄온;
[4-(4-니트로-페닐)-피페라진-1-일]-[3-(2-클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온; 및
[4-(4-니트로-페닐)-피페라진-l-일]-[3-(2,6-디클로로-페닐)-5-메틸-이속사졸-4-일]-메탄온으로 이루어진 군으로부터 선택되는, 화합물. - 바이러스 감염을 치료하거나 예방하기에 유효한 양으로 존재하는, 제1항, 제5항, 제11항, 제17항, 제23항, 제28항 및 제34항 중 어느 하나의 항에 따른 화합물 및 하나 이상의 약제학적으로 허용되는 부형제를 포함하는 약제학적 조성물.
- 제35항에 있어서, 바이러스 핵단백질의 핵 축적을 억제하는 화합물의 유효량을 포함하는, 약제학적 조성물.
- 제35항에 따른 조성물의 유효량을 환자에게 투여하는 것을 포함하는, 치료가 필요한 환자의 바이러스 감염을 치료하거나 예방하는 방법.
- 제37항에 있어서, 상기 인플루엔자는 H1N1, H3N2 및 H5N1로 이루어진 군으로부터 선택된, 방법.
- 제37항에 있어서, 상기 조성물이 성인 체중 Kg 당 1일 0.1mg 내지 250mg의 용량을 제공하는, 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US23143109P | 2009-08-05 | 2009-08-05 | |
| US61/231,431 | 2009-08-05 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120092567A true KR20120092567A (ko) | 2012-08-21 |
Family
ID=43543887
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127005837A KR20120092567A (ko) | 2009-08-05 | 2010-08-05 | 항바이러스 화합물 및 이를 제조하는 방법 및 이의 이용 방법 |
Country Status (13)
| Country | Link |
|---|---|
| EP (1) | EP2462138B1 (ko) |
| JP (1) | JP2013501008A (ko) |
| KR (1) | KR20120092567A (ko) |
| CN (1) | CN102596946B (ko) |
| AU (1) | AU2010281265A1 (ko) |
| BR (1) | BR112012002331A2 (ko) |
| CA (1) | CA2770140A1 (ko) |
| IL (1) | IL217745A0 (ko) |
| IN (1) | IN2012DN01254A (ko) |
| MX (1) | MX2012001504A (ko) |
| RU (1) | RU2012104214A (ko) |
| SG (1) | SG178106A1 (ko) |
| WO (1) | WO2011015037A1 (ko) |
Families Citing this family (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0918249D0 (en) | 2009-10-19 | 2009-12-02 | Respivert Ltd | Compounds |
| WO2011147198A1 (en) * | 2010-05-28 | 2011-12-01 | Versitech Limited | Compounds and methods for treatment of proliferative diseases |
| PL2614052T3 (pl) | 2010-09-08 | 2015-06-30 | Bristol Myers Squibb Co | Nowe analogi piperazyny jako środki przeciw wirusowi grypy o szerokim spektrum |
| WO2012044531A1 (en) * | 2010-09-28 | 2012-04-05 | Bristol-Myers Squibb Company | Novel piperazine analogs with substituted heteroaryl groups as broad-spectrum influenza antivirals |
| UY33337A (es) | 2010-10-18 | 2011-10-31 | Respivert Ltd | DERIVADOS SUSTITUIDOS DE 1H-PIRAZOL[ 3,4-d]PIRIMIDINA COMO INHIBIDORES DE LAS FOSFOINOSITIDA 3-QUINASAS |
| US8754114B2 (en) | 2010-12-22 | 2014-06-17 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of FGFR3 |
| GB201104267D0 (en) | 2011-03-14 | 2011-04-27 | Cancer Rec Tech Ltd | Pyrrolopyridineamino derivatives |
| WO2012134967A2 (en) * | 2011-03-25 | 2012-10-04 | Bristol-Myers Squibb Company | Three-dimensional structure of hin1 nucleoprotein in complex with antiviral compounds |
| KR101369584B1 (ko) * | 2011-04-19 | 2014-03-06 | 일양약품주식회사 | 페닐-이속사졸 유도체 및 그의 제조방법 |
| CN102432555A (zh) * | 2011-09-09 | 2012-05-02 | 中国科学院广州生物医药与健康研究院 | 1,2,3-三氮唑-4(5)羧酰胺类化合物及其应用 |
| ES2600705T3 (es) | 2012-03-13 | 2017-02-10 | Respivert Limited | Inhibidores de PI3 cinasa cristalinos |
| WO2013171334A1 (en) * | 2012-05-18 | 2013-11-21 | Vironova Ab | Methanethione compounds having antiviral activity |
| US9676734B2 (en) | 2012-05-18 | 2017-06-13 | Vironova Influenza Ab | Compounds and methods |
| ME03300B (me) | 2012-06-13 | 2019-07-20 | Incyte Holdings Corp | Supsтituisana triciklična jedinjenja као inhibiтori fgfr |
| WO2014026125A1 (en) | 2012-08-10 | 2014-02-13 | Incyte Corporation | Pyrazine derivatives as fgfr inhibitors |
| GB201216018D0 (en) | 2012-09-07 | 2012-10-24 | Cancer Rec Tech Ltd | Pharmacologically active compounds |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| US9227977B2 (en) | 2013-03-15 | 2016-01-05 | Respivert Ltd. | Phosphoinositide 3-kinase inhibitors |
| JO3279B1 (ar) | 2013-03-15 | 2018-09-16 | Respivert Ltd | مشتقات 2-((4- امينو -3- (3- فلورو-5- هيدروكسي فينيل)-h1- بيرازولو [d-3,4] بيرمدين-1-يل )ميثيل )- 3- (2- تراي فلورو ميثيل ) بينزيل ) كوينازولين -4 (h3)- واحد واستخدامها كمثبطات فوسفواينوسيتايد 3- كاينيز |
| DK2986610T5 (en) | 2013-04-19 | 2018-12-10 | Incyte Holdings Corp | BICYCLIC HETEROCYCLES AS FGFR INHIBITORS |
| JP6397912B2 (ja) * | 2013-07-30 | 2018-09-26 | ヤンセン・サイエンシズ・アイルランド・ユーシー | Rsv抗ウイルス化合物としての置換ピリジンピペラジニルアナログ |
| GB201314452D0 (en) | 2013-08-13 | 2013-09-25 | Ostara Biomedical Ltd | Embryo implantation |
| GB201415569D0 (en) | 2014-09-03 | 2014-10-15 | C4X Discovery Ltd | Therapeutic Compounds |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| GB201501302D0 (en) | 2015-01-27 | 2015-03-11 | Ostara Biomedical Ltd | Embryo implantation |
| EA038045B1 (ru) | 2015-02-20 | 2021-06-28 | Инсайт Корпорейшн | Бициклические гетероциклы в качестве ингибиторов fgfr |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| WO2016134294A1 (en) | 2015-02-20 | 2016-08-25 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| GB201517523D0 (en) | 2015-10-05 | 2015-11-18 | Ostara Biomedical Ltd | Methods and compositions for managing reproduction |
| GB201601703D0 (en) | 2016-01-29 | 2016-03-16 | C4X Discovery Ltd | Therapeutic compounds |
| CN107056762B (zh) * | 2016-12-22 | 2020-08-28 | 四川百利药业有限责任公司 | 一种用作抗流感病毒的双羰基类似物 |
| US11040963B2 (en) | 2017-02-02 | 2021-06-22 | Janssen Vaccines & Prevention B.V. | Piperazine derivatives for influenza virus inhibitions |
| WO2018141854A1 (en) | 2017-02-02 | 2018-08-09 | Janssen Vaccines & Prevention B.V. | Piperazine derivatives for influenza virus inhibition |
| AR111960A1 (es) | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| TWI793151B (zh) | 2017-08-23 | 2023-02-21 | 瑞士商諾華公司 | 3-(1-氧異吲哚啉-2-基)之氫吡啶-2,6-二酮衍生物及其用途 |
| EA202092649A1 (ru) | 2018-05-04 | 2021-06-21 | Инсайт Корпорейшн | Соли ингибитора fgfr |
| US11466004B2 (en) | 2018-05-04 | 2022-10-11 | Incyte Corporation | Solid forms of an FGFR inhibitor and processes for preparing the same |
| SG11202011872QA (en) | 2018-07-10 | 2021-01-28 | Novartis Ag | 3-(5-hydroxy-1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and their use in the treatment of ikaros family zinc finger 2 (ikzf2)-dependent diseases |
| AR116109A1 (es) | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| EA202191890A1 (ru) | 2019-01-18 | 2022-02-03 | Астразенека Аб | Ингибиторы pcsk9 и способы их применения |
| US11628162B2 (en) | 2019-03-08 | 2023-04-18 | Incyte Corporation | Methods of treating cancer with an FGFR inhibitor |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| TWI765323B (zh) * | 2019-08-22 | 2022-05-21 | 大陸商四川海思科製藥有限公司 | 抗流感病毒化合物及其製備方法和用途 |
| IL291901A (en) | 2019-10-14 | 2022-06-01 | Incyte Corp | Bicyclyl heterocycles as fgr suppressors |
| WO2021076728A1 (en) | 2019-10-16 | 2021-04-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| KR20220131900A (ko) | 2019-12-04 | 2022-09-29 | 인사이트 코포레이션 | Fgfr 억제제의 유도체 |
| WO2021113479A1 (en) | 2019-12-04 | 2021-06-10 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| TWI794742B (zh) | 2020-02-18 | 2023-03-01 | 美商基利科學股份有限公司 | 抗病毒化合物 |
| WO2021204923A1 (en) | 2020-04-09 | 2021-10-14 | Vironova Medical Ab | Antiviral agents |
| WO2021204924A1 (en) | 2020-04-09 | 2021-10-14 | Vironova Medical Ab | Compounds for use in the treatment of hypercytokinemia |
| WO2022221514A1 (en) | 2021-04-16 | 2022-10-20 | Gilead Sciences, Inc. | Methods of preparing carbanucleosides using amides |
| AR126102A1 (es) | 2021-06-09 | 2023-09-13 | Incyte Corp | Heterociclos tricíclicos como inhibidores de fgfr |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05117150A (ja) * | 1991-10-25 | 1993-05-14 | Sanwa Kagaku Kenkyusho Co Ltd | 抗ウイルス剤 |
| KR200293242Y1 (ko) * | 2002-04-18 | 2002-11-01 | 전이범 | 산소 절단기호스 |
| DE10236564A1 (de) * | 2002-08-08 | 2004-05-19 | Ursapharm Arzneimittel Gmbh & Co. Kg | Verwendung von papaverinartigem Vasodilatator und pharmazeutische Zusammensetzung |
| CN101142198B (zh) * | 2005-02-17 | 2012-10-31 | 辛塔制药公司 | 用于治疗疾病的异*唑坎布雷它斯丁衍生物 |
| EP2219646A4 (en) * | 2007-12-21 | 2010-12-22 | Univ Rochester | METHOD FOR MODIFYING THE LIFETIME OF EUKARYOTIC ORGANISMS |
-
2010
- 2010-08-05 AU AU2010281265A patent/AU2010281265A1/en not_active Abandoned
- 2010-08-05 BR BR112012002331A patent/BR112012002331A2/pt not_active IP Right Cessation
- 2010-08-05 CA CA2770140A patent/CA2770140A1/en not_active Abandoned
- 2010-08-05 MX MX2012001504A patent/MX2012001504A/es not_active Application Discontinuation
- 2010-08-05 RU RU2012104214/04A patent/RU2012104214A/ru not_active Application Discontinuation
- 2010-08-05 EP EP10805941.1A patent/EP2462138B1/en active Active
- 2010-08-05 CN CN201080044361.6A patent/CN102596946B/zh active Active
- 2010-08-05 SG SG2012005450A patent/SG178106A1/en unknown
- 2010-08-05 JP JP2012523184A patent/JP2013501008A/ja active Pending
- 2010-08-05 IN IN1254DEN2012 patent/IN2012DN01254A/en unknown
- 2010-08-05 KR KR1020127005837A patent/KR20120092567A/ko not_active Application Discontinuation
- 2010-08-05 WO PCT/CN2010/001187 patent/WO2011015037A1/en active Application Filing
-
2012
- 2012-01-26 IL IL217745A patent/IL217745A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| BR112012002331A2 (pt) | 2019-09-24 |
| EP2462138A1 (en) | 2012-06-13 |
| AU2010281265A2 (en) | 2012-04-05 |
| RU2012104214A (ru) | 2013-09-10 |
| SG178106A1 (en) | 2012-03-29 |
| IL217745A0 (en) | 2012-03-29 |
| AU2010281265A1 (en) | 2012-03-22 |
| WO2011015037A1 (en) | 2011-02-10 |
| EP2462138B1 (en) | 2014-09-24 |
| JP2013501008A (ja) | 2013-01-10 |
| CA2770140A1 (en) | 2011-02-10 |
| EP2462138A4 (en) | 2013-01-23 |
| MX2012001504A (es) | 2012-06-01 |
| CN102596946A (zh) | 2012-07-18 |
| IN2012DN01254A (ko) | 2015-05-15 |
| CN102596946B (zh) | 2015-06-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20120092567A (ko) | 항바이러스 화합물 및 이를 제조하는 방법 및 이의 이용 방법 | |
| US9212177B2 (en) | Antiviral compounds and methods of making and using thereof | |
| JP6804790B1 (ja) | N4−ヒドロキシシチジンおよび誘導体ならびにそれらに関連する抗ウイルス用途 | |
| CN104507481B (zh) | 用于治疗、改善或预防病毒疾病的7‑氧代‑4,7‑二氢‑吡唑并[1,5‑a]嘧啶衍生物 | |
| US20120149715A1 (en) | Compounds and methods for the treatment of viral infections | |
| TW201932113A (zh) | 經取代之多環性吡啶酮衍生物及含有其前體之醫藥組合物 | |
| CN109071567B (zh) | 抗流感小分子化合物及其制备方法和用途 | |
| WO2011147198A1 (en) | Compounds and methods for treatment of proliferative diseases | |
| JP5906244B2 (ja) | 哺乳類細胞中へのウイルスの侵入の阻害剤 | |
| JP2011502998A (ja) | ウイルス感染の治療および予防 | |
| JP2017500314A (ja) | A型インフルエンザrna依存性rnaポリメラーゼの低分子阻害剤 | |
| CN105777664B (zh) | 2‑(2‑苄亚肼基)噻唑‑5‑羧酸酯及其制备方法与医药用途 | |
| TW201446774A (zh) | 抗病毒化合物 | |
| JP2009179589A (ja) | 抗ウイルス剤 | |
| CN102329245A (zh) | 具有抗禽流感病毒活性的金刚烷衍生物及其制备方法 | |
| CN105669589B (zh) | 2‑(5‑酰基噻唑‑2‑亚氨基)‑4‑噻唑啉酮及其制备方法与应用 | |
| KR101990669B1 (ko) | 퀴나졸린 유도체, 이의 제조방법 및 이를 함유하는 인플루엔자 바이러스 치료용 약학적 조성물 | |
| CN107286149A (zh) | N‑(5‑胡椒基噻唑‑2‑基)哌啶基酰胺及其应用 | |
| KR102159164B1 (ko) | 안질환용 치료제 | |
| Liu et al. | Synthesis and biological evaluation of baloxavir marboxil analogs for the treatment of influenza A (H1N1) virus | |
| CN108948084A (zh) | 替诺福韦双-l-氨基酸酯及其制备方法 | |
| US20090048310A1 (en) | Agent for prevention/treatment of disease caused by acyclovir-resistant herpesvirus | |
| CN114057635A (zh) | 2-芳脲基-n-[2-(2-甲氧基苯氧基)乙基]烟酰胺类化合物及其应用 | |
| EA045093B1 (ru) | Производное n4-гидроксицитидина, содержащая его фармацевтическая композиция и связанные с этим противовирусные применения | |
| CN113979936A (zh) | 2-芳脲基-n-[3-(4-吗啉基)丙基]烟酰胺类化合物及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |