KR20100059789A - 배아줄기세포 배양을 위한 자동화 방법 및 장치 - Google Patents
배아줄기세포 배양을 위한 자동화 방법 및 장치 Download PDFInfo
- Publication number
- KR20100059789A KR20100059789A KR1020107002003A KR20107002003A KR20100059789A KR 20100059789 A KR20100059789 A KR 20100059789A KR 1020107002003 A KR1020107002003 A KR 1020107002003A KR 20107002003 A KR20107002003 A KR 20107002003A KR 20100059789 A KR20100059789 A KR 20100059789A
- Authority
- KR
- South Korea
- Prior art keywords
- cells
- cell
- medium
- population
- inhibitor
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0603—Embryonic cells ; Embryoid bodies
- C12N5/0606—Pluripotent embryonic cells, e.g. embryonic stem cells [ES]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/50—Means for positioning or orientating the apparatus
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M33/00—Means for introduction, transport, positioning, extraction, harvesting, peeling or sampling of biological material in or from the apparatus
- C12M33/04—Means for introduction, transport, positioning, extraction, harvesting, peeling or sampling of biological material in or from the apparatus by injection or suction, e.g. using pipettes, syringes, needles
- C12M33/06—Means for introduction, transport, positioning, extraction, harvesting, peeling or sampling of biological material in or from the apparatus by injection or suction, e.g. using pipettes, syringes, needles for multiple inoculation or multiple collection of samples
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M33/00—Means for introduction, transport, positioning, extraction, harvesting, peeling or sampling of biological material in or from the apparatus
- C12M33/04—Means for introduction, transport, positioning, extraction, harvesting, peeling or sampling of biological material in or from the apparatus by injection or suction, e.g. using pipettes, syringes, needles
- C12M33/07—Dosage or metering devices therefore
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M41/00—Means for regulation, monitoring, measurement or control, e.g. flow regulation
- C12M41/48—Automatic or computerized control
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/70—Enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/999—Small molecules not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2509/00—Methods for the dissociation of cells, e.g. specific use of enzymes
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Sustainable Development (AREA)
- Developmental Biology & Embryology (AREA)
- Gynecology & Obstetrics (AREA)
- Reproductive Health (AREA)
- Analytical Chemistry (AREA)
- Molecular Biology (AREA)
- Cell Biology (AREA)
- Computer Hardware Design (AREA)
- Clinical Laboratory Science (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Virology (AREA)
- Transplantation (AREA)
Abstract
본 발명은 사람 배아줄기세포 (ESC)와 같은 ESC의 자동화 배양을 위한 방법에 관한 것이다. 일부의 관점에서, 본 발명의 방법은 최적화된 배양 배지, 및 증식을 위해 세포 클러스터를 분리시키기 위한 세포의 제한된 단백분해적 처리를 이용한다. ESC의 계대 및 증식을 위한 자동화 시스템이 또한 제공된다.
Description
본 출원은 전체 기술내용이 어떤 단서도 없이 온전히 본 명세서에 구체적으로 참고로 포함되어 있는, 2007년 6월 29일에 출원된 미국 임시출원 제 60/947,013호를 우선권으로 주장한다.
본 발명은 국립과학재단 (National Science Foundation)에 의해서 수여된 SBIR#0712181에 따른 정부 보조 하에서 이루어졌다. 정부는 본 발명에 대하여 일정한 권리를 갖는다.
1. 발명의 분야
본 발명은 포유동물 조직세포 배양 시스템에 관한 것이다. 더욱 특히, 본 발명은 자동화 줄기세포 배양 시스템에 관한 것이다.
2. 관련 기술 설명
톰슨 (Thomson) 등에 의해 사람 배아줄기세포 (ESC)의 안정한 배양이 시작된 이래 (1998), 더 많은 수의 연구자들이 ESC의 가능한 치료학적 및 진단적 용도를 탐구하기 시작하였다. 그러나, ESC의 연구를 위한 용도조차도 ESC 배양물의 제한된 공급을 강요하였다. 배양 기술은 고도의 인적 능력 및 시간이 필요하기 때문에, 사람 ES 세포를 성장시키는 것은 매우 비효율적이고 가변적인 과정이다. 더구나, ESC 배양의 시간, 노력 및 복잡성은 이러한 배양을 위해서 매우 큰 비용을 야기하였다. 따라서, 줄기세포 배양을 위한 현행의 방법은 연구 집단의 요구를 충족시키는데 충분한 수의 ECS를 생산하는 데에도 부적절하다. ES 세포의 상업적으로 실용적인 치료학적 및 진단적 용도를 충족시키기 위해서는 훨씬 더 큰 수의 ESC가 필요할 것이다. 따라서, ESC의 배양을 위해서 비용 효과가 큰 개선된 방법이 필요하다.
이전에, ES 세포 배양의 자동화된 유지를 위한 방법이 기술되었다 [Terstegge et al., 2007]; 그러나, 이러한 방법은 ES 세포 배양이 증식되도록 하지 못하며, 따라서 대규모 ES 세포 생산과 연관된 문제에 대처하지 못하였다. 수동적인 절차의 큰 가변성 및 세포의 경제적 스케일-증대 (scale-up) 생산에 대한 그들의 제한성으로 인하여, 자동화에 의해 대량의 고품질 세포계를 경제적으로 생산하는 능력은 매우 역사가 짧고 전도 유망한 이 분야에서의 성공을 확정지을 수 있는 결정적인 기준이 될 것 같다. 분명하게, ES 세포의 배양 및 생산을 위한 개선된 방법 및 시스템에 대한 필요성이 존재한다.
발명의 요약
본 발명은 배아줄기세포의 효율적인 계대 및 증식을 위한 방법 및 조성물을 제공함으로써 선행기술의 한계를 극복한다. 특정의 구체예에서, 본 발명은 배아줄기세포의 효율적인 배양 및 증식을 위한 최적화된 자동화 시스템을 제공한다. 예를 들어, 첫 번째 구체예에서는 (a) 성장 배지 내에서 ES 세포의 첫 번째 집단을 수득하고, (b) 자동화 분리 시스템에 의해서 ES 세포를 분리하고, (c) 분리된 세포를 새로운 성장 배지 내에 현탁시켜 ES 세포의 증식된 집단을 제공하는 것을 포함하여 배아줄기 (ES) 세포의 자동화 증식 또는 계대 방법이 제공된다. 바람직한 관점에서, 이러한 방법은 사람 배아줄기세포 (hESC)의 계대 또는 증식을 위해서 사용될 수 있다. 본 명세서에서 사용된 것으로서 용어 세포의 "계대 (passage)"는, 세포는 생존가능하게 유지되지만 활발하게 분할될 수 있거나 분할될 수 없는 세포의 배양을 의미한다. 또한, 용어 "증식 (expansion)"은 세포의 수가 배양 시간에 따라서 증가하는 분할 세포의 성장을 의미한다. 사람 ESC와 같은 배아줄기세포를 수득하는 방법은 이전에 기술되었으며, 예를 들어, 각각 본 명세서에 참고로 포함된 미국 특허 제5,843,780, 6,200,806 및 7,029,913호를 참고로 한다.
특정의 관점에서, 본 발명은 세포 성장 배지에 관한 것이다. 예를 들어, 일부의 관점에서 성장 배지는 사람 또는 소 혈청과 같은 혈청을 포함할 수 있다. 다른 관점에서, 성장 배지는 무혈청 배지, 무혈청 단백질 배지 또는 무단백질 배지로 정의될 수 있다. 다양한 구체예에서, 배양된 증식된 ES 세포에서 분화는 나타나지 않거나 필수적으로 나타나지 않으며; 예를 들어, 이하의 실시예에서 배양된 증식된 ES 세포의 적어도 97%는 Oct4 발현을 기초로 하여 미분화된 상태로 잔존한다. 숙련된 전문가는 본 발명에 따르는 배지가 비타민, 완충제, 글루타민, 당류 (예를 들어, 피루베이트), 환원제 (예를 들어, 베타 머캅토에탄올), 항생제, 항진균제, 사이토카인 또는 성장인자를 포함한 (단, 이들로 제한되지는 않는다) 다수의 구성성분을 포함할 수 있다는 것을 이해할 것이다. 또한, 바람직한 관점에서 본 발명에 따라 사용하기 위한 배지는 해리된 ES 세포에서 아폽토시스를 감소시키는 성분을 포함할 수 있다. 예를 들어, 배지는 Y-27632, HA-100, H-1152 또는 이의 유도체와 같은 Rho-연관된 키나제 (ROCK) 억제제를 포함할 수 있다 [Watanabe et al., 2007]. 또한, 특정의 관점에서, 본 발명에 따르는 성장 배지는 세포 분리 중에서 대략 세포의 약 50%, 60%, 70%, 80%, 90% 또는 95% 이상에서 아폽토시스를 방지하는데 효과적인 양과 같은 ROCK 억제제의 유효량을 포함할 수 있다. 본 발명의 특정한 추가의 관점에서, 배지는 배지 제제의 정확한 구성성분이 공지되어 있는 "제한 배지 (defined media)"일 수 있으며; 예를 들어, 특정 배지는 배취들 간에 내용물에 차이가 있는 혈청과 같은 "비제한된 (undefined)" 동물 산물을 함유하지 않는다. 몇 가지의 매우 특정한 구체예에서, 본 발명에서 사용하기 위한 배지는 제한된 TeSR 배지와 같은 TeSR 배지일 수 있다 [표 1; Ludwig & Thompson, 2007; Ludwig et al., 2006].
줄기세포, 예를 들어, 사람 ESC를 배양하는 다양한 방법이 본 발명에 의해서 사용될 수 있다. 일반적으로, ESC는 조직배양 플레이트 상에서와 같은 부착성 배양 시스템 내에서 성장한다. 특정의 관점에서, 본 발명에서 사용하기 위한 배양 플레이트는 콜라겐 또는 하이드로겔 매트릭스 (예를 들어, 매트리겔 (MATRIGEL™))와 같은 겔 매트릭스를 포함할 수 있다. 다양한 구체예에서, 배양 플레이트는 예를 들어, 조합물로 콜라겐 IV, 피브로넥틴, 라미닌 및 비트로넥틴에 의해서 코팅될 수 있으며, 루드비히 등 [Ludwig et al., (2006)]에 의해서 기술된 바와 같이 배아세포 배양 및 유지를 위한 고체 지지체를 제공하기 위해서 사용될 수 있다. 조직 배양 플레이트를 코팅하기 위해서 본 발명에 의해 사용될 수 있는 매트릭스 성분에는 콜라겐, 예를 들어, 콜라겐 IV, 라미닌, 비트로넥틴, 매트리겔 (Matrigel™), 젤라틴, 폴리리신, 트롬보스폰딘 (예를 들어, TSP-1, -2, -3, -4 및/또는 -5), 및/또는 프로넥틴-F (ProNectin-F™)가 포함된다. 조직 배양에 사용하기 위한 삼차원적 지지체 매트릭스는 예를 들어, 각각 본 명세서에 참고로 포함된 미국 특허공개 제20060198827 및 20060210596호에 이미 기술되어 있다. 숙련된 전문가는, 특정의 관점에서 부착성 조직 배양 세포가 세포 밀도 또는 융합성 (confluency)에 의해서 한정될 수 있다는 것을 인식할 것이다. 따라서, 일부의 경우에 본 발명의 방법은 추가의 세포 증식이 용이하도록 증식성 세포를 고밀도로부터 저밀도로 증식시키는 것을 수반한다. 예를 들어, 본 발명에 따라 세포를 증식시키는 방법은 약 50% 내지 99% 사이의 융합성인 ES 세포의 제1 집단을 포함할 수 있다. 예를 들어, 특정의 관점에서 ES 세포의 제1 집단은 대략 약 60%, 70%, 80%, 90% 또는 95% 융합성 또는 그 미만일 수 있다. 또한, 특정의 관점에서 부착성 ES 세포의 증식 또는 계대는 새로운 성장 배지 내에 분리된 세포를 접종하는 것을 포함할 수 있다. 본 명세서에서 사용된 것으로서, 용어 세포의 "접종"은 생성된 세포 배양물(들)이 대략 균일한 밀도를 갖도록 성장 배지 내에 세포를 분산시키는 것을 의미한다. 따라서, 세포의 접종은 분리된 세포를 새로운 성장 배지와 혼합시키고/시키거나 분리된 세포를 조직 배양 플레이트의 표면 상에 공간적으로 분산시키는 것을 포함할 수 있다.
더구나, 특정의 관점에서 본 발명의 방법은 세포를 새로운 배지 내에 특정의 밀도로 접종하는 것을 포함할 수 있다. 예를 들어, 일부의 경우에 이 방법은 새로운 배지에 분리된 세포를 접종하기 위해서 사용된 상대적 밀도에 의해서 한정될 수 있다. 예를 들어, 분리된 세포는 ES 세포의 제1 집단으로 이루어진 표면적보다 더 큰 플레이트 표면적에 걸쳐서 접종될 수 있다. 바람직한 관점에서, 새로운 세포 배양 플레이트(들)의 표면적은 ES 세포의 제1 집단을 포함하는 플레이트의 표면적보다 약 5 내지 약 35, 약 10 내지 약 35, 약 15 내지 약 30, 또는 약 28 내지 약 34, 또는 약 30, 31 또는 32배 더 크다. 숙련된 전문가는, 특정의 관점에서 본 발명에 따르는 세포의 증식이 더 큰 배양 플레이트 상에 세포를 접종하는 것을 포함하지만, 일부의 경우에는 세포를 다수의 플레이트 상에 접종할 수 있다는 것을 인식할 것이며, 여기에서 새로운 플레이트 표면적은 분리된 세포가 접종되는 플레이트의 표면적의 합으로 정의된다. 따라서, 일부의 관점에서 본 발명의 방법은 출발 세포 배양 집단으로부터 다수의 세포 배양 집단을 생산하기 위해서 사용될 수 있다.
일부의 관점에서, 본 발명은 자동화 분리 시스템과 같은 세포의 분리를 위한 시스템에 관한 것이다. 특정의 관점에서, ES 세포는 기계적으로 또는 화학적으로 분리될 수 있다. 화학적 분리는 킬레이팅 분자 (예를 들어, EDTA, EGTA, 시트레이트 또는 칼슘 및/또는 마그네슘 이온을 효율적으로 킬레이팅 또는 착화시킬 수 있는 유사한 분자)를 사용함으로써 달성될 수 있다. 다른 구체예에서는, 우레아를 사용하여 세포 배양 플레이트로부터 세포를 분리하거나 제거할 수 있다. 이들 이온의 제거는 세포를 서로에 대해서 및 용기 표면에 대해 부착시키는데 필요한 단백질을 왜곡시킨다. EDTA는 세포를 탈착시키고 개별화시킬 목적으로 판매되는 대부분의 트립신 (Trypsin) 시약 내에 존재한다. 화학물질은 세포를 충분히 파괴하고 개별화시키기 위해 배지 내에서 약 0.01 mM 내지 약 100 mM의 최종 농도로 사용될 수 있다. 그러나, 특정의 경우에, 세포 분리는 세포를 단백분해 효소와 같은 효소와 접촉시킴으로써 촉진될 수 있다. 예를 들어, 단백분해 효소는 트립신 또는 트립신-유사 프로테이나제, 예를 들어, 정제 또는 재조합 프로테이나제일 수 있다. 따라서, 특정의 관점에서 본 발명에 따라 사용하기 위한 효소는 필수적으로 다른 사람 또는 동물 단백질 또는 핵산을 함유하지 않는 재조합 효소일 수 있다. 일부의 특정한 관점에서, 본 발명에서 사용하기 위한 프로테이나제는 트리플 (TRYPLE™)일 수 있다. 더욱이, 특정의 관점에서 세포는 1× 농도의 트리플 효소 용액과 접촉시킬 수 있다. 숙련된 전문가는, 본 발명의 방법에서 사용된 효소의 농도는 세포가 효소에 노출되는 시간 (즉, 세포가 활성 효소에 노출되는 시간)의 길이 및 노출/항온배양 중의 온도에 따라 좌우될 수 있음을 인식할 것이다. 또한, 배양 배지 내의 단백질은 세포 클러스터 (cluster)의 분리시에 단백분해 효소의 효능을 감소시킬 수 있으며, 따라서 특정의 관점에서 세포 성장 배지는 세포를 단백분해 효소와 접촉시키기 전에 제거될 수 있다. 따라서, 특정의 관점에서 본 발명의 방법은 (i) 제1 ES 세포 집단으로부터 배지를 제거하고, (ii) ES 세포 집단을 단백분해 효소와 접촉시키고, (iii) 세포 집단을 단백분해 효소와 함께 항온배양하여 세포 클러스터를 분리시키는 단계를 포함하는 세포 분리를 위한 시스템을 포함할 수 있다. 예를 들어, 일부의 경우에 ES 세포는 대략 또는 최대 약 3, 4, 5, 6, 7, 8 또는 9분 동안과 같은 약 2 내지 약 10분 동안 단백분해 효소 또는 화학물질과 함께 항온배양한다. 숙련된 전문가는 또한, 효소 활성이 일반적으로 온도 의존적이며, 따라서 활성은 항온배양 온도를 변화시킴으로써 변조될 수 있다는 것을 인식할 것이다. 따라서, 특정의 관점에서 ES 세포는 약 26℃, 27℃, 28℃, 29℃, 30℃, 31℃, 32℃, 33℃, 34℃, 35℃, 36℃, 37℃, 38℃ 또는 39℃와 같은 약 25℃ 내지 약 40℃에서 트립신과 같은 효소와 함께 항온배양될 수 있다.
숙련된 전문가는, 트립신과 같은 단백분해 효소에 대한 세포의 과도한 노출이 세포 생존도에 해로울 수 있음을 인식할 것이다. 따라서, 특정의 관점에서 프로테이나제 항온배양을 모니터하여 조직 배양 플레이트로부터 세포를 분리시키거나, 세포 클러스터를 분리시키는데 필요한 항온배양의 기간을 결정할 수 있다. 예를 들어, 항온배양은 (예를 들어, 세포 클러스터의 크기를 평가하기 위하여) 현미경 검사에 의해서, 또는 유동 세포분석법에 의해서 모니터될 수 있다. 세포 유동분석을 수행하는 방법은 본 기술분야에서 잘 알려져 있으며, 예를 들어, 미국 특허 제4,284,412, 4,989,977, 4,498,766, 5,478,722, 4,857,451, 4,774,189, 4,767,206, 4,714,682, 5,160,974, 및 4,661,913호를 참고한다. 일부의 바람직한 관점에서, 프로테이나제 항온배양은 컴퓨터에 의해서 모니터될 수 있으며, 항온배양은 최적 세포 분리가 달성되면 (예를 들어, 프로테이나제 억제제를 첨가함으로써) 중지될 수 있다. 따라서, 일부의 경우에 세포 희석 또는 접종을 위한 새로운 배지는 프로테아제 억제제와 같은 효소 억제제를 포함할 수 있다. 특정의 관점에서, 본 발명에 따라 사용하기 위한 새로운 배지는 세포 분리를 위해 사용된 단백분해 효소의 억제제를 포함할 수 있다. 예를 들어, 바람직한 관점에서 새로운 배지는 효소 활성의 대략 또는 적어도 약 70%, 80%, 90%, 95%, 98%, 99% 또는 실질적으로 모두를 억제하기에 충분한 양의 효소 억제제를 포함할 수 있다. 예를 들어, 트립신이 본 발명에 따르는 세포 분리 시스템에서 사용되는 경우에, 새로운 배지는 대두 트립신 억제제와 같은 트립신 억제제를 포함할 수 있다. 예를 들어, 일부의 매우 특정한 관점에서, 새로운 성장 배지는 약 0.5 ㎎/㎖의 대두 트립신 억제제를 포함할 수 있다. 다른 구체예에서는, 혈청 내에 존재하는 것과 같은 천연 트립신 억제제가 본 발명에 의해 사용되어, 예를 들어, 세포 분할 중에 배지 내에 포함되도록 할 수 있다. 또 다른 추가의 관점에서, 세포 성장 배지는 효소가 필수적으로 불활성화된 후에 효소 억제제를 포함하지 않는 배지로 더 대체될 수 있다.
그 밖의 다양한 프로테아제 억제제가 본 발명에 의해서 사용될 수 있다. 대부분의 경우에, 단백분해 효소의 희석은 세포에 대한 손상을 방지하는데 충분하다. 본 발명에 의해서 사용될 수 있는 프로테아제 억제제의 비제한적 예로는 혈청 (예를 들어, α1-항트립신, 약 52 kDa 혈청 트립신 억제제), 리마콩 (lima bean) (예를 들어, 약 8-10 kDa인 6개의 리마콩 억제제가 공지되어 있다), 소 췌장 (예를 들어, 아프로티닌으로 또한 공지되어 있는 쿠니츠 (Kunitz) 억제제, 약 6.5 kDa), 조류 난백 (예를 들어, 오보뮤코이드 (ovomucoids)는 조류 난백에서 발견되는 당단백 프로테아제 억제제이다, 약 8-10 kDa), 및/또는 대두 (몇 가지의 억제제가 공지되어 있다, 일반적으로 약 20.7-22.3 kDa)로부터 수득될 수 있는 것이 포함된다.
특정의 바람직한 관점에서, 본 발명에 따르는 방법은 자동화될 수 있다. 예를 들어, 액체 핸들러 로보트 (liquid handler robot)를 사용하여 본 발명에 기술된 방법을 자동화할 수 있다. 액체 핸들러 로보트의 광범한 어레이 (array)가 본 기술분야에서 공지되어 있고, 본 발명에 따라 사용될 수 있으며, 예를 들어, 본 명세서에 온전히 참고로 포함된 미국 특허 제6,325,114호를 참고로 한다. 일부의 관점에서, 본 발명에 따라 사용하기 위한 로보트는 베크만 코울터 바이오메크 (Beckman Coulter BIOMEK®) 2000 액체 핸들러 (B2K)일 수 있다. 또한, 본 발명에 따라 사용하기 위한 자동화 시스템 또는 장치는 유체 전달 및/또는 세포 접종이 펌프 또는 압력 구배에 의해서 매개되는 생물반응기를 포함할 수 있는 것으로 생각된다. 이하의 실시예에 나타낸 바와 같이, 자동화 장치 및 시스템은 사람 ESC를 유가배양하고 (feeding) 재현적으로 분할하기 위해서 생산되었으며; 이 장치 및 시스템을 사용하여 배양된 사람 ESC는 고품질의 것이었으며, 상당한 분화를 나타내지 않았다 (Oct4 FACS 분석에 의해서 측정된 것으로서 97% 이상이 미분화됨). 이하의 실시예에서 사용된 특정 세포는 사람 ESC였지만, 본 발명자들은 그 밖의 다른 사람 또는 포유동물 줄기세포 또는 iPS 세포를 본 발명에 따라 미분화된 상태로 배양, 증식 및 유지시킬 수 있는 것으로 예상한다.
다양한 구체예에서, 본 발명의 방법은 세포의 분화상태를 변조시킬 수 있는 화합물을 스크리닝하기 위해서 사용될 수 있다. 이하의 실시예에 나타낸 바와 같이, 본 발명자들은 이 기술이 정의된 배양조건을 사용하여 사람 ESC 세포 배양-기반 소분자 스크리닝을 위해서 사용될 수 있음을 성공적으로 입증하였다. 특정의 구체예에서, 본 발명의 방법, 장치 및 시스템은 세포의 분화상태에 영향을 미칠 수 있는 하나 이상의 후보 화합물(들)을 스크리닝하기 위해서 사용될 수 있다. 예를 들어, 후보 화합물은 줄기세포의 분화를 특정한 계 (예를 들어, 조혈제 등) 쪽으로 촉진시킬 수 있다. 다른 구체예에서, 후보 화합물은 세포에서 탈-분화를 촉진시키거나 탈-분화된 상태를 유지시킬 수 있다 (예를 들어, 섬유아세포 또는 그 밖의 다른 세포로부터 iPS 세포의 생성을 촉진시킬 수 있다).
또한, 추가의 관점에서 본 발명의 방법은 기계적 분리 또는 효소적 분리 또는 이들의 조합을 포함하는, 세포를 분리시키기 위한 장치 또는 시스템을 포함할 수 있다. 예를 들어, 일부의 경우에, 세포를 트립신과 같은 효소와 함께 항온배양하고, 이어서 기계적 교반하여 세포 클러스터를 더 분리시킬 수 있다. 예를 들어, 기계적 교반은 세포를 개구부 (aperture)를 통해서 반복적으로 피펫팅하는 것과 같이 세포를 전단력에 적용하는 것을 포함할 수 있다.
숙련된 전문가는, 다수의 ES 세포 배양 시스템이 ES 세포 성장 및/또는 분화를 매개하는 인자를 트랜스로 공급하는 "영양세포 (feeder cell)"를 포함한다는 것을 인식할 것이다. 그러나, 특정의 관점에서 본 발명의 방법은 비-ES 세포를 필수적으로 포함하지 않거나, 비-사람 세포를 필수적으로 함유하지 않는 ES 세포의 집단에 관한 것이다.
또한, 추가의 구체예에서, 본 발명의 방법은 (a) 성장 배지 내의 ES 세포의 제1 집단을 수득하고, (b) ES 세포를 자동화 분리 시스템에 의해서 분리하고, (c) 분리된 세포를 새로운 성장 배지 내에 현탁시켜 ES 세포의 증식된 집단을 제공하고, (d) 증식된 세포 집단을 세포 성장을 지지하는 조건 하에서 항온배양하고, (e) 단계 (b) 내지 (d)를 1회 이상 반복하여 ES 세포의 연속 증식된 집단을 제공하는 것을 포함하여 배아줄기 (ES) 세포의 연속 증식을 위한 자동화 방법으로 정의될 수 있다. 따라서, 본 발명의 방법은 초기 ES 배양물로부터 세포의 노화까지의 계대의 모든 수를 위해서 줄기세포의 집단을 계대 또는 증식시키기 위해 사용될 수 있다.
또한 본 발명의 추가의 구체예에서는, 항온배양기, 액체 핸들러 유니트, 및 세포 분리를 위한 운용 프로그램을 포함하는 ES 세포의 자동화 증식을 위한 시스템이 제공된다. 예를 들어, 운용 프로그램은 (i) 제1 ES 세포 집단으로부터 배지를 제거하고, (ii) ES 세포를 단백분해 효소와 접촉시키고, (iii) 세포를 단백분해 효소와 함께 항온배양하여 세포 클러스터를 분리시키고/시키거나, (iv) 항온배양된 세포를 기계적으로 교반시켜 세포 클러스터를 더 분리시키는 단계를 포함한다. 따라서, 일부의 관점에서는 운용 프로그램을 사용하여 시스템 내의 상이한 챔버들 사이에서 세포 및/또는 유체를 이동시킬 수 있다. 일부의 관점에서, 세포 배양 플레이트는 하나의 챔버로부터 또 다른 챔버로 (예를 들어, 항온배양기 내로 또는 밖으로) 이동될 수 있다. 따라서, 특정의 관점에서, 액체 핸들러는 그리퍼 (gripper) 도구 및 액체 취급 도구를 포함할 수 있다. 또한, 추가의 관점에서 액체 취급 도구는 세포 및/또는 유체가 압력 구배에 의해서 챔버들 사이에서 이동하는 필수적으로 밀폐된 시스템 또는 장치일 수 있다.
실질적으로 모든 만능 줄기세포 또는 세포주, 예를 들어, 사람 배아줄기세포 또는 유도된 만능 줄기세포 (iPS 세포)가 본 발명에 의해서 배양될 수 있는 것으로 예상된다. 예를 들어, 사람 배아줄기세포주 H1, H9, hES2, hES3, hES4, hES5, hES6, BG01, BG02, BG03, HSF1, HSF6, H1, H7, H9, H13B, 및/또는 H14 등이 본 발명에 의해 사용될 수 있다. 또한, 추후에 이용가능하게 되는 줄기세포주도 본 발명에 의해 사용될 수 있는 것으로 예상된다. 비록 사람 배아줄기세포가 본 발명에 의해서 바람직하게 사용되지만, 일부의 경우에는 또한 포유동물, 마우스, 영장류 등과 같은 다른 배아줄기세포가 본 발명에 따라 사용될 수도 있다.
숙련된 전문가에 의해서 이해될 수 있는 바와 같이, 통상적으로 iPS 세포 또는 iPSC로 약칭되는 유도된 만능 줄기세포는 특정의 유전자를 삽입함으로써 비-만능 세포, 일반적으로 성체 체세포로부터 인공적으로 유도된 만능 줄기세포의 유형이다. 유도된 만능 줄기세포는 특정의 줄기세포 유전자 및 단백질의 발현, 염색질 메틸화 패턴, 배가시간 (doubling time), 배아체 (embryoid body) 형성, 기형종 형성, 생존가능한 키메라 형성, 및 효력 및 분화가능성의 관점과 같은 다수의 관점에서 배아줄기세포와 같은 천연 만능 줄기세포와 동일한 것으로 믿어지지만, 천연 만능 줄기세포에 대한 그들의 상관관계의 완전한 정도는 여전히 평가되고 있다. iPS 세포는 이전에 기술되었다 [참조: 예를 들어, Takahashi et al., 2006; Takahashi et al ., 2007; Yu et al., 2007].
본 발명의 방법 및/또는 조성물과 관련하여 거론된 구체예는 본 발명에 기술된 어떤 다른 방법 또는 조성물과 관련하여서도 사용될 수 있다. 따라서, 한가지 방법 또는 조성물에 관한 구체예는 본 발명의 다른 방법 및 조성물에 대해서도 마찬가지로 적용될 수 있다.
본 명세서에서 사용된 것으로서, "a" 또는 "an"은 하나 이상을 의미할 수 있다. 특허청구범위(들)에서 사용된 것으로서, 단어 "포함하는 (comprising)"과 함께 사용되는 경우에 단어 "a" 또는 "an"은 하나 또는 하나 이상을 의미할 수 있다.
특허청구범위에서 용어 "또는 (or)"은 기술 내용이 단지 양자택일 및 "및/또는"을 나타내는 정의를 지지하더라도, 명백하게 양자택일만을 언급하고자 하거나 양자택일이 상호 배타적인 것이 아닌 한은 "및/또는"을 나타내기 위해서 사용된다. 본 명세서에서 사용된 것으로서, "또 다른 (another)"은 적어도 두 번째 또는 그 이상을 의미할 수 있다.
본 출원 전체에 걸쳐서, 용어 "약 (about)"은 값이 장치에 대한 오차의 고유편차, 값을 측정하기 위해서 사용된 방법, 또는 시험 대상체들 가운데 존재하는 편차를 포함하는 것을 나타내기 위해서 사용된다.
본 발명의 다른 목적, 특징 및 이점은 이하의 상세한 설명으로부터 명백해질 것이다. 그러나, 본 발명의 취지 및 범주 내에서의 다양한 변화 및 변형은 상세한 설명으로부터 본 기술분야에서 숙련된 전문가에게 명백해질 것이기 때문에, 상세한 설명 및 구체적인 실시예는 본 발명의 바람직한 구체예를 나타내고 있지만, 단지 설명을 위해서 제공된 것임을 이해하여야 한다.
이하의 도면은 본 명세서의 일부분이며, 본 발명의 특정한 관점을 더 설명하기 위해서 포함된다. 본 발명은 본 발명에 제시된 특정의 구체예의 상세한 설명과 함께 도면을 참고로 하여 더 잘 이해될 수 있다.
도 1은 배아줄기 증식의 자동화 방법의 예이다. 도시된 단계들 중의 하나 이상이 줄기세포 증식을 위한 시스템을 제어하기 위한 프로그램 내에 포함될 수 있다.
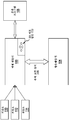
도 2A-B는 ES 세포의 자동화 증식을 위한 예시적인 장치 및 시스템의 도면이다.
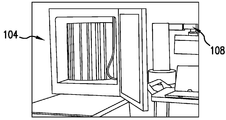
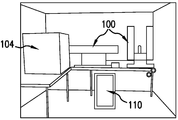
도 3A-B는 청정실 (clean room) 내의 자동화 사람 ES (HES) 배양 장치 및 시스템의 예를 도시한 것이다. 도 3A는 액체 핸들러 (Biomek2000)를 연결하는 플레이트크레인 (Platecrane) XT (Hudson)에 이어서 개방된 자동화 항온배양기 (Cytomat 6000)를 도시한 것이다. 도 3B는 시스템의 좌측에서 밀폐된 사이토매트 (Cytomat) 6000, 중앙에서 후면으로부터의 바이오메크2000 (Biomek2000), 및 이하의 온도 조절 유니트를 도시한 것이다. 바이오메크2000 시스템의 스택커 (stacker)는 시스템의 우측에 배치된다. 도 3C-D는 HES 세포를 분할 및 유가배양하기 위한 로보트 성분을 도시한 것이다. 도 3C는 폐배지를 흡인하고, 4웰 또는 8웰 플레이트를 유가배양하기 위하여 일차적으로 사용되는 단일 채널 세척 도구를 도시한 것이다. 4웰 플레이트의 뒤의 후면에서 6웰 플레이트를 사용하여 트립신에 대한 저장소로서 제공된다. 도 3D는 최종 분할시에 4웰 마더 (mother) 플레이트로부터 8웰 도터 (daughter) 플레이트로 트립신 처리되고 개별화된 HES 세포를 혼합 및 분배시키는 특정의 실시예에서 사용된 8채널 도구 (P200)를 도시한 것이다.
도 4A-C는 유가배양한 후의 사람 ES 세포의 상대비 현미경검사 (phase contrast microscopy) 사진이다. 도 4A는 단일의 2일된 사람 ES 세포 콜로니를 20× 배율로 나타낸 것이다. 도 4B는 배양된 세포의 분포 및 밀도를 나타내기 위하여 2일된 배양물을 4× 배율로 나타낸 것이다. 도 4C는 4× 배율로 나타낸, 유가배양한 지 5일 후의 H1 배양물이다.
도 5A-B는 1000배 증식시킨 후의 사람 ES 세포의 상대비 현미경검사 사진이다. 도 5A는 스케일-증대시의 두 번째 계대 후 6일에 사람 ES 세포 콜로니를 4× 배율로 나타낸 것이다. 도 5B는 FACS에 의한 Oct4 분석이다. 좌측 밴드는 배경을 나타내기 위하여 표지된 IgG 대조물로 처리된 세포를 나타내며, 솔리드 (solid) 밴드는 풀링되고 염색된 플레이트 2로부터의 Oct4 양성 집단을 나타낸다. 두 가지 분석은 모두 97% 이상의 Oct4 양성 집단을 나타내었으며, 이것은 자동화 절차가 만능 세포를 미분화된 상태로 효과적으로 유지시킴을 시사하는 것이다.
도 6은 자동화 세포 배양 시스템을 사용하여 1000배 증식시킨 후에 무작위적으로 선정된 플레이트로부터의 세포 수를 나타낸다. 플레이트를 트립신 처리하여, 트립판 블루로 염색하고, 혈구계 상에서 계수하였다. 전체 세포를 대표적인 샘플로부터 계산하였다. 평균값으로부터의 추정은 약 160×1600만 = 25.6억 사람 ES 세포가 생성되었음을 나타낸다.
도 1은 배아줄기 증식의 자동화 방법의 예이다. 도시된 단계들 중의 하나 이상이 줄기세포 증식을 위한 시스템을 제어하기 위한 프로그램 내에 포함될 수 있다.
도 2A-B는 ES 세포의 자동화 증식을 위한 예시적인 장치 및 시스템의 도면이다.
도 3A-B는 청정실 (clean room) 내의 자동화 사람 ES (HES) 배양 장치 및 시스템의 예를 도시한 것이다. 도 3A는 액체 핸들러 (Biomek2000)를 연결하는 플레이트크레인 (Platecrane) XT (Hudson)에 이어서 개방된 자동화 항온배양기 (Cytomat 6000)를 도시한 것이다. 도 3B는 시스템의 좌측에서 밀폐된 사이토매트 (Cytomat) 6000, 중앙에서 후면으로부터의 바이오메크2000 (Biomek2000), 및 이하의 온도 조절 유니트를 도시한 것이다. 바이오메크2000 시스템의 스택커 (stacker)는 시스템의 우측에 배치된다. 도 3C-D는 HES 세포를 분할 및 유가배양하기 위한 로보트 성분을 도시한 것이다. 도 3C는 폐배지를 흡인하고, 4웰 또는 8웰 플레이트를 유가배양하기 위하여 일차적으로 사용되는 단일 채널 세척 도구를 도시한 것이다. 4웰 플레이트의 뒤의 후면에서 6웰 플레이트를 사용하여 트립신에 대한 저장소로서 제공된다. 도 3D는 최종 분할시에 4웰 마더 (mother) 플레이트로부터 8웰 도터 (daughter) 플레이트로 트립신 처리되고 개별화된 HES 세포를 혼합 및 분배시키는 특정의 실시예에서 사용된 8채널 도구 (P200)를 도시한 것이다.
도 4A-C는 유가배양한 후의 사람 ES 세포의 상대비 현미경검사 (phase contrast microscopy) 사진이다. 도 4A는 단일의 2일된 사람 ES 세포 콜로니를 20× 배율로 나타낸 것이다. 도 4B는 배양된 세포의 분포 및 밀도를 나타내기 위하여 2일된 배양물을 4× 배율로 나타낸 것이다. 도 4C는 4× 배율로 나타낸, 유가배양한 지 5일 후의 H1 배양물이다.
도 5A-B는 1000배 증식시킨 후의 사람 ES 세포의 상대비 현미경검사 사진이다. 도 5A는 스케일-증대시의 두 번째 계대 후 6일에 사람 ES 세포 콜로니를 4× 배율로 나타낸 것이다. 도 5B는 FACS에 의한 Oct4 분석이다. 좌측 밴드는 배경을 나타내기 위하여 표지된 IgG 대조물로 처리된 세포를 나타내며, 솔리드 (solid) 밴드는 풀링되고 염색된 플레이트 2로부터의 Oct4 양성 집단을 나타낸다. 두 가지 분석은 모두 97% 이상의 Oct4 양성 집단을 나타내었으며, 이것은 자동화 절차가 만능 세포를 미분화된 상태로 효과적으로 유지시킴을 시사하는 것이다.
도 6은 자동화 세포 배양 시스템을 사용하여 1000배 증식시킨 후에 무작위적으로 선정된 플레이트로부터의 세포 수를 나타낸다. 플레이트를 트립신 처리하여, 트립판 블루로 염색하고, 혈구계 상에서 계수하였다. 전체 세포를 대표적인 샘플로부터 계산하였다. 평균값으로부터의 추정은 약 160×1600만 = 25.6억 사람 ES 세포가 생성되었음을 나타낸다.
사람 줄기세포는 현재, 다양한 치료학적 및 진단적 적용에서 사용하기 위해서 개발되고 있다. 특히, ESC는 아마도 다양한 세포 유형으로 분화될 수 있으며, 따라서 다양한 사람 조직의 질병을 치료하거나 시험하기 위해서 사용될 수 있다. 그러나, 다수의 배양된 사람 줄기세포의 이용가능성은 현장에서 주된 한계가 있는 것으로 판명되었다. 형질전환된 세포주의 통상적인 조직 배양과는 달리, ESC는 성장 조건에 매우 민감하며, 주변의 미세환경은 세포 생존도 및 ESC가 증식하는 속도를 변조시킬 수 있다. 추가로, ESC 배양은 매우 사람 노동 집약적이며, 이에 의해서 세포 집단을 증식시키는 비용을 증가시키고, 세포 배양물의 오염 가능성을 증가시킨다. 이러한 힘이 드는 세포 배양의 방법은 일반적으로, 단지 약 1:12 증식비를 가능하게 하였으며, 이에 의해서 특정한 기간에 걸쳐서 성장할 수 있는 세포의 수를 제한하고, 최대 세포 증식률을 유지하는데 필요한 세포 분할의 빈도를 증가시킨다.
본 발명은 ESC 세포 배양물을 계대 및 증식시키기 위한 자동화 방법을 제공하는데 있어서의 이전의 ESC 배양방법의 상당수의 결함에 대처하는 것이다. 이하의 실시예에 나타낸 바와 같이, HES 세포의 6웰 플레이트의 하나의 웰 (약 250만 세포)을 160 플레이트의 최종 수 (약 20-30억 세포)로 증식하도록 허용하는 ES 세포의 자동화 유가배양 및 분할을 가능하게 하는 장치 및 시스템이 생산되었다. 이것은 3주일에 걸친 1000배 증식에 해당하며, 이것은 다른 경우라면 한 사람에게 거의 불가능한 일이다. Oct4 염색에 의해서 나타나는 바와 같이, 이들 줄기세포의 대부분, 즉 97% 이상의 미분화된 상태로 잔류하였다.
본 발명은 새로운 플레이트 상에 접종하기 위한 세포를 분리시키기 위해 세포 클러스터의 제한된 효소 처리를 이용하는 자동화 ESC 배양 시스템을 제공하였다. 따라서, 일부의 관점에서 세포 배양물의 기계적 교반은 제한되며, 생존가능한 ESC의 더 큰 부분은 계대에서 계대로 통과된다. 특히, 본 발명에서 제공된 방법 및 조성물은 세포가 단일 분할시에 하나의 플레이트에서 30개의 플레이트로 (즉, 30× 더 큰 표면적으로) 증식하도록 할 수 있었으며, 이것은 일반적으로 어떤 소정의 시간에 12배 이하의 증식을 허용하는 수동-분할방법에 비해서 진보된 것이다. 추가로, 본 발명에 기술된 자동화 시스템은 사람의 노동에 대한 필요성 및, 이에 따라 세포를 배양하는 비용을 크게 감소시킨다. 이러한 자동화 장치 및 시스템은 오염되는 경향이 더 적을 수 있으며, 궁극적으로 치료제로 사용될 수 있는 줄기세포 생성물에 바람직하다. 따라서, 본 발명은 예를 들어, 수혈에 사용하기 위한 ESC 유도된 혈액과 같은 ESC 치료제의 빠른 상업적 개발을 가능하게 할 수 있다.
I. 세포 성장 배지
ES 세포 배양을 위한 다양한 배지, 배양조건은 본 기술분야에서 공지되어 있다. 특정의 관점에서, 세포는 섬유아세포와 같은 영양세포와 함께, 또는 섬유아세포 조건화된 배지 중에서 성장시킬 수 있다. 그러나, 일부의 경우에 ES 세포는 영양세포의 부재 하에서 성장시키는 것이 바람직할 수 있다. 또한, 더 바람직한 관점에서 세포는 TeSR (예를 들어, BD Biosciences로부터 입수할 수 있는 MTESR™1)과 같은 제한 배지 중에서 성장시킬 수 있다 [Ludwig et al., 2006a, 미국 출원 제2006/0084168호]. 이러한 배지는 ES 세포의 무혈청 배양을 위해서 사용될 수 있다. 예를 들어, 일부의 경우에 성장 배지는 표 1에 정의된 배지일 수 있다. 그러나, 특정의 경우에 무혈청 시스템의 고비용으로 인하여, 무혈청 배양을 위해서 사용된 성장인자는 루드비히 등 [Ludwig et al. (2006b)]에 의해서 기술된 것으로서 제브라피시 (zebra fish)로부터 클로닝된 FGF와 같이, 비용을 감소시키기 위한 대용 공급원으로부터 수득될 수 있다. 더욱이, 특정의 관점에서 배지는 필수적인 성장인자를 공급하기 위해서 소 또는 사람 혈청으로 보충될 수 있다 [Ludwig et al., 2006b]. 따라서, 특정의 경우에 ES 성장 배지는 표 1에 나타낸 바와 같은 성분들을 포함할 수 있으며, 여기에서 배지는 본 발명에 예시된 바와 같은 표시된 "성장인자 및 단백질" 대신에 소혈청으로 보충된다.
표 1.
TeSR1
배지를 위한 제제
무기 염류
mM
염화칼슘 (무수) 8.24E-01
HEPES 1.18E+01
염화리튬 (LiCl) 9.80E-01
염화마그네슘 (무수) 2.37E-01
황산마그네슘 (MgSO4) 3.19E-01
염화칼륨 (KCl) 3.26E+00
중탄산나트륨 (NaHCO3) 1.80E+01
염화나트륨 (NaCl) 9.46E+01
인산나트륨, 이염기성 (무수) 3.92E-01
인산나트륨, 일염기성 3.55E-01
(NaH2PO4-H2O)
미량물질
질산철 (Fe(NO3)3-9H2O) 9.71E-05
황산철 (FeSO4-7H2O) 1.18E-03
황산구리 (CuSO4-5H2O) 4.08E-06
황산아연 (ZnSO4-7H2O) 1.18E-03
암모늄 메타바나데이트 NH4VO3 1.09E-05
황산망간 MnSO4 H2O 1.97E-06
NiSO4 6H2O 9.70E-07
셀레늄 1.77E-04
나트륨 메타실리케이트 9.66E-04
Na2SiO3 9H2O
SnCl2 1.24E-06
몰리브드산 암모늄염 1.97E-06
CdCl2 1.22E-05
CrCl3 1.98E-06
AgNO3 9.81E-07
AlCl3 6H2O 4.87E-06
Ba(C2H3O2)2 9.79E-06
CoCl2 6H2O 9.81E-06
GeO2 4.97E-06
KBr 9.89E-07
KI 1.00E-06
NaF 9.83E-05
RbCl 9.81E-06
ZrOCl2 8H2O 9.80E-06
에너지 기질
D-글루코즈 1.37E+01
나트륨 피루베이트 3.92E-01
지질
리놀레산 1.88E-04
리포산 4.00E-04
아라키돈산 1.29E-05
콜레스테롤 1.12E-03
DL-알파 토코페롤-아세테이트 2.90E-04
리놀렌산 6.99E-05
미리스트산 8.59E-05
올레산 6.94E-05
팔미트산 7.65E-05
팔미톨레산 7.71E-05
스테아르산 6.89E-05
아미노산
mM
L-알라닌 1.37E-01
L-아르기닌 하이드로클로라이드 5.48E-01
L-아스파라긴-H2O 1.37E-01
L-아스파르트산 1.37E-01
L-시스테인-HCl-H2O 7.83E-02
L-시스틴 2HCl 7.83E-02
L-글루탐산 1.37E-01
L-글루타민 2.94E+00
글리신 2.94E-01
L-히스티딘-HCl-H2O 1.18E-01
L-이소류신 3.26E-01
L-류신 3.54E-01
L-리신 하이드로클로라이드 3.91E-01
L-메티오닌 9.06E-02
L-페닐알라닌 1.69E-01
L-프롤린 2.16E-01
L-세린 2.94E-01
L-트레오닌 3.52E-01
L-트립토판 3.46E-02
L-타이로신 2Na 2H2O 1.68E-01
L-발린 3.55E-01
비타민
아스코르브산 2.53E-01
비오틴 1.12E-05
B12 3.94E-04
콜린 클로라이드 5.03E-02
D-칼슘 판토테네이트 3.69E-03
엽산 4.71E-03
i-이노시톨 5.49E-02
니아신아미드 1.30E-02
피리독신 하이드로클로라이드 7.62E-03
리보플라빈 4.56E-04
티아민 하이드로클로라이드 2.42E-02
성장인자/단백질
GABA 9.79E-01
피페콜산 9.84E-04
bFGF 5.77E-06
TGF 베타 1 2.35E-08
사람 인슐린 3.92E-03
사람 홀로-트랜스페린 1.37E-04
사람 혈청 알부민 1.95E-01
글루타티온 (환원형) 6.38E-03
기타 성분
하이포크산틴 Na 1.18E-02
페놀 레드 1.69E-02
푸트레신-2HCl 3.95E-04
티미딘 1.18E-03
2-머캅토에탄올 9.80E-02
플루로닉 F-68 2.33E-02
트윈 80 3.29E-04
A.
ROCK
억제제
또한, 본 발명의 추가의 관점에서, ES 세포 성장 배지 내에는 세포가 해리되는 경우에 (예를 들어, 세포 집단의 분할 중에) ES 세포 아폽토시스를 감소시키는 분자와 같은 추가의 배지 성분이 포함될 수 있다. 예를 들어, 본 발명에서 사용하기 위한 배지는 Y-27632 또는 이의 유도체와 같은 하나 이상의 Rho-연관된 키나제 (ROCK) 억제제를 포함할 수 있다. 더욱이, 일부의 관점에서 본 발명의 배지는 HA-100 또는 이의 유도체를 포함할 수 있다:
HA-100은 ES 세포 성장 배지 내에, 예를 들어, 약 1-15 μM, 5-15 μM, 1-30 μM, 5-30 μM, 또는 약 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30 μM, 또는 이들 안에서 유도될 수 있는 어떤 범위의 농도로나 존재할 수 있다. 특정의 구체예에서, HA-100은 ES 세포 성장 배지 내에 약 10-20 μM로 존재한다.
본 발명에 따르는 ES 세포 성장 배지 내에 포함될 수 있는 그 밖의 다른 ROCK 억제제에는 H-1152 ((S)-(+)-2-메틸-1-[(4-메틸-5-이소퀴놀리닐)설포닐]호모피페라진)가 포함된다. H-1152는 HA-100보다 약 10배 더 큰 효력을 나타낸다. 따라서, H-1152는 ES 세포 성장 배지 내에, 예를 들어, 약 0.1-10 μM, 약 0.5-5 μM, 약 1-3 μM, 또는 약 0.5, 0.6, 0.7, 0.8, 0.9, 1, 2, 3, 4, 또는 5 μM, 또는 이들 안에서 유도될 수 있는 어떤 범위의 농도로나 존재할 수 있다. 특정의 구체예에서, HA-100은 ES 세포 성장 배지 내에 약 1 μM로 존재한다. H-1152는 96웰 플레이트 내에서 개별화된 사람 ES 세포의 매우 효율적인 접종을 허용한다 (HA-100과 유사하지만, 10배 더 작은 농도로). 세포 클럼프 (clump) 내에서 다른 식으로 계대된 개별화된 HES 세포는 세포-기반 소분자 스크리닝을 위한 엄격한 전제조건인 웰당 더 균일한 세포 밀도를 허용한다. 따라서, H-1152는 본 발명에 따르는 자동화 세포 배양을 수반하는 ES 세포-기반 소분자 스크리닝을 위한 프로토콜에서 사용될 수 있다. H-1152는 예를 들어, 본 명세서에 참고로 포함된 문헌 [Ikenoya et al. (2002) 및 Sasaki et al. (2002)]에 이미 기술되어 있다.
ES 세포 성장 배지 내에 포함될 수 있는 다른 ROCK 억제제에는 Y-27632, N-(4-피리딜)-N'-(2,4,6-트리클로로페닐)우레아, 3-(4-피리딜)-1H-인돌, 글리실-H1152 ((S)-(+)-2-메틸-4-글리실-1-(4-메틸이소퀴놀리닐-5-설포닐)호모피페라진) 및/또는 HA1100 (하이드록시파우스딜 (Hydroxyfausdil))이 포함된다. Y-27632 ((R)-(+)-트랜스-4-(1-아미노에틸)-N-(4-피리딜)사이클로헥산카복스아미드)는 시그마-앨드리히 (Sigma-Aldrich)로부터 상업적으로 입수할 수 있으며, 이전에 기술되었다 [참조: 예를 들어, Maekawa et al., 1999; Davies et al., 2000].
II
. 세포 배양 장치, 시스템 및 방법
일부의 관점에서, 본 발명은 생물반응기 기술을 이용할 수 있다. 생물반응기 내에서 본 발명에 따라 세포를 성장시키는 것은 최종 사용을 위해 더 분화시킬 수 있는 완전히 생물학적으로-활성인 세포의 대규모 생산을 허용한다. 생물반응기는 현탁 및 부착 (anchorage) 의존적 동물세포 배양 둘 다로부터 생물학적 생성물의 생산을 위해서 광범하게 사용되어 왔다. 교반 탱크 생물반응기에서 마이크로캐리어 (microcarrier) 세포 배양은 매우 큰 용적-특이적 배양 표면적을 제공하며, 바이러스성 백신의 생산을 위해서 사용되어 왔다 [Griffiths, 1986]. 더욱이, 교반 탱크 생물반응기는 스케일 가능한 것으로 입증되었지만, 이러한 기술은 단지 세포가 부착 비의존적 배양에서 성장할 수 있는 경우에 사용될 수 있다. 코닝-코스타 (Corning-Costar)에 의해서 제조된 멀티플레이트 셀큐브 (CELLCUBE™) 세포 배양 시스템은 또한, 매우 큰 용적-특이적 배양 표면적을 제공한다. 세포는 컴팩트 큐브 (compact cube)의 형상으로 함께 기밀하게 밀봉된 배양 플레이트의 양면 상에서 성장시킨다. 교반 탱크 생물반응기와는 달리, 셀큐브 (CELLCUBE™) 배양 유니트는 일회용이다. 이것은 일회용 시스템과 연관된 감소된 설비투자, 품질관리 및 품질보증 비용으로 인하여 임상적 생성물의 초기 단계 생산에 매우 바람직하다.
A. 비-관류 부착 시스템
전통적으로, 부착-의존적 세포 배양물은 본 발명에 기술된 바와 같이 소형 유리 또는 플라스틱 용기의 하부 상에서 증식된다. 실험실 규모에 적합한 고전적이고 전통적인 기술에 의해서 제공되는 제한된 표면-대-용적 비는 대규모로 세포 및 세포 생성물을 생산하는데 있어서의 장애를 야기하였다. 작은 배양 용적에서 세포 성장을 위해 접근가능한 큰 표면을 제공하는 시스템을 제공하기 위한 시도로, 다수의 기술이 제안되었다: 롤러 병 (roller bottle) 시스템, 스택 플레이트 증식기 (stack plates propagator), 나선형 필름 병 (spiral film bottle) 시스템, 중공 섬유 (hollow fiber) 시스템, 충진 베드 (packed bed), 플레이트 교환기 시스템, 및 막 튜빙 릴 (membrane tubing reel). 이들 시스템은 이들의 성질이 비-균질하고, 때때로 다수의 공정을 기본으로 하기 때문에, 이들은 다음의 단점을 겪는다 - 스케일-증대에 관한 제한된 잠재력, 세포 샘플을 채취하는데 있어서의 곤란성, 주요 공정 파라메터를 측정 및 제어하는데 관한 제한된 잠재력, 및 배양 전체에 걸쳐서 균질한 환경을 유지하는데 있어서의 곤란성.
이들 단점에도 불구하고, 대규모 부착-의존적 세포 생산을 위해서 통상적으로 사용되는 방법은 롤러 병이다. 상이하게 형상화된 큰 T-플라스크와 마찬가지로, 시스템의 단순성은 이것을 매우 신뢰성이 있고, 따라서 매력적으로 만든다. 1일에 수천 개의 롤러 병을 취급할 수 있으며, 따라서 다른 경우에 필요한 집약적인 사람 취급과 연관된 오염 및 비일관성 (inconsistency)의 위험을 제거할 수 있는 완전히 자동화된 로보트를 이용할 수 있다.
B.
마이크로캐리어
상에서의 배양
전통적인 부착-의존적 배양방법의 단점을 극복하기 위한 노력으로, 반 베젤 (van Wezel) (1967)은 마이크로캐리어 배양 시스템의 개념을 개발하였다. 이 시스템에서, 세포는 저속 교반에 의해 성장 배지 내에 현탁된 소형 고체 입자의 표면 상에서 증식한다. 세포는 마이크로캐리어에 부착하며, 마이크로캐리어 표면 상에 융합하도록 서서히 성장한다. 실제로, 이러한 대규모 배양 시스템은 단일 디스크 (disc) 공정으로부터의 부착 의존적 배양을 단일층 및 현탁 배양 둘 다가 함께 유도되는 단위 공정 (unit process)으로 업그레이드시킨다. 따라서, 세포를 성장시키는데 필요한 표면과 균질한 현탁 배양의 이점을 조합하여 생산을 증가시킨다.
대부분의 다른 부착-의존적인 대규모 배양방법에 대비한 마이크로캐리어 배양의 이점은 몇 배이다. 첫째로, 마이크로캐리어 배양은 큰 세포 밀도 수율, 및 고도로 농축된 세포 생성물을 수득하는 잠재력을 유도하는 큰 표면-대-용적 비 (담체 농도를 변화시킴으로써 변화될 수 있음)를 제공한다. 배양물이 관류된 반응기 모드로 증식되는 경우에 세포 수율은 1-2×107 세포/㎖까지이다. 둘째로, 세포는 다수의 소형 저-생산성 용기 (즉, 플라스크 또는 디쉬)를 사용하는 대신에 하나의 단위 공정 용기에서 증식될 수 있다. 이것은 훨씬 더 우수한 영양소 이용 및 배양 배지의 상당한 절약을 제공한다. 게다가, 단일 반응기에서의 증식은 설비 공간의 필요성 및 세포당 필요한 취급 단계의 수에 있어서의 감소를 유도하며, 이에 따라서 노동 비용 및 오염의 위험을 감소시킨다. 셋째로, 잘-혼합된 균질한 마이크로캐리어 현탁 배양은 환경적 조건 (예를 들어, pH, pO2, 및 배지 성분의 농도)을 모니터하고 제어함으로써 더 재현가능한 세포 증식 및 생성물 회수를 유도할 수 있다. 넷째로, 현미경 관찰, 화학적 시험 또는 계산을 위한 대표적인 샘플을 취할 수 있다. 다섯째로, 마이크로캐리어는 현탁액으로부터 빠르게 침전하기 때문에, 세포의 유가식 공정 (fed-batch process)의 사용 또는 세포의 수확은 비교적 쉽게 수행될 수 있다. 여섯째로, 마이크로캐리어 상에서의 부착-의존적 배양물 증식의 모드는 단백분해 효소의 사용이 없는 세포 이동, 세포의 공동배양, 동물 내로의 이식, 및 디캔터 (decanter), 칼럼, 유동상, 또는 마이크로캐리어 유지를 위한 중공 섬유를 사용한 배양물의 관류와 같은 다른 세포 조작을 위해 이 시스템을 사용할 수 있도록 한다. 일곱째로, 마이크로캐리어 배양은 현탁액 내에서 미생물 및 동물 세포의 배양을 위해서 사용된 통상적인 장치를 사용하여 비교적 쉽게 스케일 증대된다.
C. 포유동물 세포의
마이크로캅셀화
포유동물 세포를 배양하는데 특히 유용한 것으로 나타난 한가지 방법은 마이크로캅셀화 (microencapsulation)이다. 포유동물 세포는 반투과성 하이드로겔 막 내부에 유지된다. 캅셀을 둘러싸는 벌크 배지와 영양소, 가스 및 대사성 생성물의 교환을 허용하는 다공성 막이 세포 주위에 형성된다. 온화하고, 신속하며 비-독성인 몇 가지 방법이 개발되었으며, 여기에서 생성된 막은 배양의 기간 전체에 걸쳐서 성장하는 세포 매스를 견디기에 충분히 다공성이며 강력하다. 이들 방법은 모두 칼슘-함유 용액과의 소적 (droplet) 접촉에 의해서 겔화된 가용성 알기네이트를 기본으로 한다. 림 (Lim, 1982, 미국 특허 제4,352,883호, 본 명세서에 참고로 포함됨)은 작은 오리피스 (orifice)를 통해서 밀어낸 나트륨 알기네이트의 약 1% 용액 내에 농축되고, 소적을 형성하며, 약 1% 염화칼슘 용액 내로 방출된 세포를 기술하였다. 그 후, 소적은 표면 알기네이트에 이온적으로 결합한 폴리아미노산의 층으로 주조된다. 마지막으로, 알기네이트는 소적을 킬레이팅제 내에서 처리하여 칼슘 이온을 제거함으로써 재-액화된다. 그 밖의 다른 방법은 알기네이트 용액 내에 적하된 칼슘 용액 내의 세포를 사용함으로써 중공 알기네이트 구체를 발생시킨다. 유사한 접근방법은 알기네이트 내로 적하된 키토산 용액 중의 세포로 역시 중공 구체를 생성시키는 것을 포함한다.
마이크로캅셀화된 세포는 교반 탱크 반응기 내에서 쉽게 증식되며, 직경이 150-1500 ㎛ 범위인 비드 크기로 미세-체 스크린을 사용한 관류 반응기 내에서 쉽게 유지된다. 총 배지에 대한 칼슘 용적의 비는 1:2 내지 1:10 정도로 밀집한 상태로 유지될 수 있다. 108까지의 캅셀내 세포 밀도를 가지고, 배양물 내의 효과적인 세포 밀도는 1-5×107이다.
다른 방법과 대비한 마이크로캅셀화의 이점에는 살포 (sparging) 및 교반으로 인하여 발생하는 전단력의 해로운 영향으로부터의 보호, 관류 시스템을 사용할 목적으로 비드를 쉽게 유지시키는 능력, 비교적 간단한 스케일 증대, 및 이식을 위해 비드를 사용하는 능력이 포함된다.
D. 관류 부착 시스템
관류 부착 시스템은 본 발명의 바람직한 형태이다. 관류는 세포의 집단을 통해서나 그 위로 (생리학적 영양소 용액을) 정상 속도로 연속적으로 유동시키는 것을 의미한다. 이것은 세포를 인출된 배지에 의해서 세척하는 연속-유동과 반대되는 것으로 배양 유니트 내에 세포가 보존되는 것을 의미한다 (예를 들어, 케모스타트 (chemostat)). 관류의 개념은 세기의 시작 이래로 공지되어 왔으며, 장기간의 현미경 관찰을 위해서 조직의 작은 조각을 생존가능하게 유지시키는데 적용되어 왔다. 이 기술은 세포가 혈액, 림프 또는 그 밖의 다른 체액에 의해서 제공되는 생체내의 세포 환경을 모사하는 것으로 개시되었다. 관류가 없이, 배양 중의 세포는 급식 및 단식시키는 교대상을 통해서 진행시킴으로써 이들의 성장의 완전한 발현 및 대사 잠재력을 제한한다.
현재의 관류 배양의 사용은 고밀도 (즉, 0.1-5×108 세포/㎖)에서 세포를 성장시키는 과제에 대해 답하는 것이다. 2-4×106 세포/㎖ 이상으로 밀도를 증가시키기 위해서, 배지는 끊임없이 새로운 공급물로 대체시켜 영양소 결핍을 보충하고 독성 생성물을 제거하여야 한다. 관류는 배양 환경 (pH, pO2, 영양소 수준 등)의 훨씬 더 우수한 제어를 가능하게 하며, 세포 부착을 위한 배양물 내에서의 표면적의 이용을 현저하게 증가시키는 수단이다.
부직포의 베드 매트릭스를 사용한 관류 충진-베드 반응기의 개발은 관류 배양물을 베드 용적의 ㎖당 108 세포를 초과하는 밀도로 유지시키기 위한 수단을 제공하였다 [CELLIGEN™, New Brunswick Scientific, Edison, N.J.; Wang et al., 1992; Wang et al., 1993; Wang et al., 1994]. 간략하게 기술하여, 이 반응기는 부착 및 비부착-의존적 세포 둘 다의 배양을 위한 개선된 반응기를 포함한다. 반응기는 내부 재순환을 제공하기 위한 수단을 갖는 충진 베드로서 디자인된다. 바람직하게는, 섬유 매트릭스 담체는 반응기 용기 내의 바스켓 (basket) 내에 위치한다. 바스켓의 상부 및 하부 부분은 구멍 (hole)을 가지고 있어서 배지가 바스켓을 통해서 유동하도록 한다. 특별하게 디자인된 임펠러 (impeller)는 영양소의 균일한 공급 및 폐기물의 제거를 보장하기 위하여 섬유 매트릭스에 의해서 점유된 공간을 통한 배지의 재순환을 제공한다. 이것은 동시에, 무시할 수 있는 양의 총 세포 매스가 배지 내에 현탁되는 것을 보장한다. 바스켓과 재순환의 조합은 또한, 섬유 매트릭스를 통한 산소화된 배지의 무-거품 (bubble-free) 유동을 제공한다. 섬유 매트릭스는 10 ㎛ 내지 100 ㎛의 "공극 (pore)" 직경을 갖는 부직포로서, 개개 세포의 용적의 1 내지 20배에 해당하는 공극 용적을 갖는 큰 내부 용적을 제공한다.
다른 배양 시스템과 비교하여, 이 접근방법은 몇 가지의 중요한 이점을 제공한다. 섬유 매트릭스 담체에 의해서, 세포는 교반 및 발포 (foaming)로 인한 기계적 스트레스로부터 보호된다. 바스켓을 통한 자유 배지 유동은 세포에 최적으로 조절된 수준의 산소, pH 및 영양소를 제공한다. 생성물은 배양물로부터 연속적으로 제거될 수 있으며, 수확된 생성물은 세포를 함유하지 않고, 후속 정제단계를 용이하게 하는 저-단백질 배지 내에서 생산될 수 있다. 또한, 이 반응기 시스템의 독특한 디자인은 반응기의 스케일 증대시키는 더 쉬운 방법을 제공한다. 현재, 30리터까지의 크기를 이용할 수 있다. 100리터 및 300리터 형태가 개발 중에 있으며, 이론적 계산은 1000리터 반응기까지를 지지한다. 이 기술은 본 명세서에 온전히 참고로 포함된 WO 94/17178 (1994년 8월 4일, Freedman et al.)에 상세히 설명되어 있다.
셀큐브 (CELLCUBE™; Corning-Costar) 모듈은 기질 부착된 세포의 고정화 및 성장을 위한 큰 스티렌 표면적을 제공하다. 이것은 인접한 플레이트 사이에 밀봉된 얇은 층류 공간을 생성하도록 결합된 일련의 평행 배양 플레이트를 갖는 완전하게 캅셀화된 멸균 일회용 장치이다.
셀큐브 모듈은 서로 반대로 대각선으로 마주보며 배지의 유동을 조절하는 것을 돕는 유입 및 유출 포트를 갖는다. 성장의 처음 며칠 중에, 배양은 일반적으로 초기 접종 후에 시스템 내에 함유된 배지에 의해서 충족된다. 초기 접종과 배지 관류의 시작 사이의 시간의 양은 접종 접종물 내의 세포의 밀도 및 세포 성장률에 따라 좌우된다. 순환 배지 내의 영양소 농도의 측정은 배양의 상태에 대한 우수한 지표이다. 절차를 확립할 때는, 다양한 상이한 관류속도에서 영양소 조성물 모니터하여 가장 경제적이고 생산적인 운용 파라메터를 측정하는 것이 필요할 수 있다.
시스템 내의 세포는 통상적인 배양 시스템 내에서보다 더 큰 용액의 밀도 (세포/㎖)에 도달한다. 다수의 일반적으로 사용되는 기초 배지는 1-2×106 세포/㎖/일을 지지하도록 디자인된다. 표면적이 85,000 ㎠인 대표적인 셀큐브는 모듈 내에 약 6L 배지를 함유한다. 세포 밀도는 종종 배양 용기 내에서 107 세포/㎖를 초과한다. 융합상태에서는 1일에 2 내지 4 반응기 용적의 배지가 필요하다.
III
.
ES
세포의 자동화 증식을 위한 장치/시스템
본 발명의 특정한 관점은 도 2A 및 2B에 도표 형태로 도시되고, 도 3A-D에 통상적으로 이용가능한 하드웨어 요소로 설명된, ES 세포와 같은 만능 세포의 자동화 증식을 위한 장치 또는 시스템에 관한 것이다. 따라서, 이들에서 볼 수 있는 바와 같이, 예시적인 장치는 생존가능한 ES 세포 집단 (102), 항온배양기 (104) 및 세포 분리를 위한 운용 프로그램을 포함하는 컨트롤러 (controller) (106)와 유체가 교류하는 액체 핸들러 유니트 (100)를 포함할 수 있다.
본 발명의 장치에서 사용하기 위한 ES 세포 집단 (102)은 본 기술분야에서 숙련된 전문가에게 공지된 어떤 공급원으로부터 유도된 ES 세포 집단이라도 포함할 수 있다. 예를 들어, 사람 ESC와 같은 배아줄기세포를 수득하는 방법은 미국 특허 제5,843,780, 6,200,806 및 7,029,913호에 이미 기술되어 있다. 본 명세서에서 사용된 것으로서 용어 장치는 단일 하우징 (housing) 내의 장치로 제한되지 않고, 예를 들어, 전기적, 기계적 또는 다른 커플링 기전에 의해서 함께 연결된 다수의 장치를 포함할 수 있는 것으로 이해된다.
다양한 유형의 액체 핸들러 유니트 (100)는 상업적으로 이용할 수 있으며, 예를 들어, 특정의 관점에서 액체 핸들러는 해밀톤 마이크로랩 스타 (Hamilton MICROLAB® STAR) 워크스테이션 또는 베크만 코울터 바이오메크 (Beckman Coulter BIOMEK®) 2000 액체 핸들러 (B2K)와 같은 로보트 핸들러일 수 있다. 또한, 로보트 액체 핸들러에 관한 미국 특허 제6,325,114호를 참고로 한다. 또 다른 관점에서, 액체 핸들러는 유체 또는 마이크로유체 액체 핸들러와 같이, 로보트 팔을 포함하지 않지만, 대신에 밸브의 발동작용 (actuation) 및 압력 구배의 적용에 의해서 액체를 이동시키는 장치일 수도 있다.
항온배양기 (104)의 광범한 어레이 (array)는 본 기술분야에서 공지되어 있으며, 본 발명의 구체예에 따라 사용될 수 있다. 예를 들어, 특정의 구체예에서 항온배양기는 켄드로 사이토매트 (Kendro CYTOMAT™) 항온배양기일 수 있다.
더욱이, 본 발명의 특정한 구체예에서 만능 또는 ES 세포 증식 장치 및 시스템은 ES 세포 증식의 제어를 위한 컨트롤러 (106)를 포함할 수 있다. 이러한 프로그램은 액체 핸들러 유니트 (100), 유체 교류 장치 (108) 및/또는 항온배양기 (104)와 전자적 교류 상태일 수 있다. 숙련된 전문가는, 특정의 관점에서 운용 장치 또는 시스템이 컴퓨터 또는 컴퓨터-판독가능한 매체에 포함될 수 있음을 인식할 것이다. 본 발명의 구체예에서 사용하기 위한 운용 프로그램의 예는 도 1에 도시된 단계를 포함할 수 있다. 이 예시적 구체예에서, 운용 컨트롤러는 ES 세포 분리를 지시하는데, 이것은 (i) 배지를 제거하고; (ii) ES 세포 집단의 세포를 트립신과 같은 단백분해 화학물질 또는 효소와 접촉시키고; (iii) 세포를 항온배양 및 교반하여 세포의 해리를 확실하게 하고; (iv) 분리된 ES 세포를 새로운 배지에 접종함으로써 수행된다. 특정의 구체예에서, 상술한 공정을 반복하여 추가의 ES 세포를 생산할 수 있다.
이해될 수 있는 것으로서, 운용 장치는 컴퓨터 자동화에 의해서 실행될 수 있으며, 이렇게 함으로써 운용 장치는 본 발명의 특정한 구체예를 구성하는 다양한 하드웨어 장치를 통제하고 제어한다. 하드웨어 요소의 통합을 실행하기 위해서 사용될 수 있는 예시적인 운용 프로그램은 기구들 사이의 교류를 설정하기 위한 간단한 드래그-앤드-드롭 시스템 (drag-and-drop system)을 이용하는 오버로드 (OVERLORD™) 통합 소프트웨어 프로그램 (Biosero, Inc.)이다. 소프트웨어는 또한, 숫자 및 문자열 변수, 조건적 요소 (예를 들어, IF THEN, ELSE), 및 제어 루프 (예를 들어, FORNEXT)와 같은 프로그래밍 요소의 범위를 허용한다.
임의로, 본 발명에 따르는 장치는 항온배양기 (104)와 액체 핸들러 유니트 (100) 사이의 유체 교류를 용이하게 하는 액체 교류 장치 (108)을 포함할 수 있다. 예를 들어, 액체 핸들러가 로보트 핸들러인 경우에, 유체 교류 장치 (108)은 액체 핸들러 유니트와 항온배양기 사이에서 세포의 플레이트를 이동시키는 장치와 같은 로보트 장치일 수 있다. 예를 들어, 로보트 장치는 허드슨 플레이트크레인 (Hudson Platecrane) XL일 수 있다.
더욱이, 만능 또는 ES 세포 증식 시스템은 액체 핸들러 유니트 (100)을 위한 시약을 포함하는 하나 이상의 저장소 (110, 112, 114)를 포함할 수 있다. 예를 들어, 저장소는 프로테이나제 억제제가 있거나 없는 세포 성장 배지 (예를 들어, ROCK 억제제를 포함하는 배지); 세포 배양 플레이트; 단백분해 효소 용액; 포스페이트 완충 식염수 (PBS); 및/또는 피펫 팁 (pipette tip)을 포함할 수 있다. 특정의 관점에서, 추가의 로보트 장치를 사용하여 액체 핸들러 장치와 저장소 사이의 교류를 용이하게 할 수 있다. 특정의 구체예에서, 저장소는 임의로 ROCK 억제제 및/또는 대두 트립신 억제제와 같은 프로테아제 억제제와 혼합된 TeSR 배지를 함유할 수 있다. 다른 구체예에서, 저장소는 단백분해 효소 (예를 들어, 트립신, EDTA 등)를 포함하는 용액을 함유할 수 있다. 예를 들어, 일부의 관점에서 베크만 코울터 스택커 캐러셀 (Beckman Coulter Stacker Carousel)을 사용하여 저장소 (예를 들어, 플레이트 또는 피펫 저장소) 및 액체 핸들러 장치 사이의 교류를 용이하게 할 수 있다. 저장소는 냉장고와 같은 온도 제어 유니트 내에 수용될 수 있다. 온도 제어 유니트는 임의로, 용액을 원하는 농도 (예를 들어, 약 37℃)로 예열하기 위한 가열 유니트를 포함할 수 있다; 그러나, 본 발명자들은 간단한 냉장고가 이하의 실시예에서 성공적으로 사용되었기 때문에, 가열 유니트가 특정의 구체예에서는 필요하지 않음을 발견하였다.
도 2B를 참고로 하여, 자동화 세포 배양을 위한 장치 50의 상부도 (top view)는 스택커 캐러셀 (stacker carousel) (141), 액체 핸들러 유니트 (100), 항온배양기 (104), 유체 교류 장치 (108), 컨트롤러 (106), 및 일련의 저장소 (110, 112, 114)를 포함한다. 특정의 구체예에서, 스택커 캐러셀은 액체 핸들러 유니트 (100)에 기계적으로 커플링되거나, 이의 일부분을 포함한다. 본 명세서에서 사용된 것으로서, 용어 "저장소"는 다량의 유체를 보유할 수 있는 모든 장치를 포함한다. 또한, 도 2B에 나타낸 다양한 성분들은 조합되거나 분리될 수 있는 것으로 이해된다. 예를 들어, 저장소 (110, 112, 114)는 액체 핸들러 유니트 (100)과 일체화될 수 있거나, 액체 핸들러 유니트 (100)으로부터 분리될 수 있다. 특정의 구체예에서, 유체 교류 장치 (108)은 로보트 팔, 예를 들어, 허드슨 플레이트크레인 XT이다. 특정의 구체예에서, 액체 핸들러 유니트 (100)은 바이오메크2000 (Biomek2000)이고, 항온배양기 400은 사이토매트6000 (Cytomat6000) 모델이다.
제시된 구체예에서, 액체 핸들러 유니트 (100)은 추가로, 다양한 크기의 액체 취급 도구, 예를 들어, 상이한 용적의 액체를 피펫팅하기 위해서 사용될 수 있는 피펫팅 도구를 포함하는 도구 스테이션 (tool station) 121을 포함한다. 도구 스테이션 (121)은 또한, 예를 들어, 세포 배양 과정의 다양한 단계 중에 세포 배양 플레이트로부터 뚜껑 (lid)을 제거하고/하거나 설치하기 위해서 사용될 수 있는 그리퍼 (gripper) 도구를 포함할 수도 있다. 나타낸 특정의 구체예에서, 액체 핸들러 유니트 (100)은 스테이션의 MP200 피펫 도구 (121)에 의해서 사용될 수 있는 P250 배리어 팁 (barrier tip)을 포함하는 스테이션 (122)를 포함한다. 또한, 액체 핸들러 유니트 (100)은 공급원 (source) 플레이트를 위한 스테이션 (123), 도터 플레이트용 뚜껑을 위한 스테이션 (124), 및 도터 플레이트를 위한 스테이션 (125)를 포함한다.
도 2B에 나타낸 구체예에서, 액체 핸들러 유니트 (100)은 또한, 단백분해 효소 (예를 들어, 트립신 용액) 또는 화학물질 저장소로 작용하는 스테이션 (132), 공급원 플레이트용 뚜껑을 제공하는 스테이션 (133), 도터 플레이트용 뚜껑을 제공하는 스테이션 (134), 및 도터 플레이트를 제공하는 스테이션 (135)를 포함한다.
특정의 구체예에서, 자동화 계대공정은 다음의 예시적 프로토콜을 사용하여 달성될 수 있다: 유체 교류 장치 (108)에 의해서 항온배양기 (104)로부터 마더 플레이트를 회복시킨 후에, 스테이션 (121)로부터의 세척 도구는 폐배지를 제거한다. 그 후, 스테이션 (121)로부터의 피펫팅 도구 (예를 들어, 8채널 200 ㎕ 피펫팅 도구 MP200)는 스테이션 (132)로부터 약 3 ㎖의 트립신 (0.1%)을 첨가할 수 있다. 그 후, 유체 교류 장치는 플레이트를 항온배양기 104에 이동시킬 수 있다. 약 7분의 항온배양 후에, 유체 교류 장치 (108)은 처리된 플레이트를 역으로 액체 핸들러 유니트 (100)에 이동시킨다. 그 후, 2 μM H-1152 및 1 ㎎/㎖ 인비트로겐 (Invitrogen) 대두 트립신 억제제를 함유하는 3 ㎖ TeSR 배지의 혼합물을 하나 이상의 저장소 (110, 112, 114)로부터 각각의 웰에 첨가한다. 그 후, 세포를 플레이트 표면으로부터 씻어내고, 스테이션 121로부터의 피펫팅 도구를 사용하여 반복적으로 분배 및 흡인함으로써 혼합시킬 수 있다. 그 후, 세포를 스테이션 121로부터의 피펫팅 도구를 사용하여 스테이션 125 또는 135로부터 제공된 도터 플레이트에 분배할 수 있다.
그 후, 세포를 스택커 캐러셀 (131)로부터 액체 핸들러 (100) (예를 들어, 바이오메크2000)에 로딩된, 예비코팅된 매트리겔 (Matrigel) 플레이트 상에 예를 들어, 1:32의 비로 접종할 수 있다. 접종은 배지를 코팅하는 매트리겔을 흡인하고, 이것을 하나 이상의 저장소 (110, 112, 114)로부터 제공된 H-1152 및 대두 억제제를 함유하는 변형된 TeSR 배지 (예를 들어, 1 μM HA-1152 및 0.5 ㎎/㎖ 인비트로겐 대두 트립신 억제제를 함유하는 TeSR)로 대체시킨 후에 수행될 수 있다. 컨트롤러 (106)을 사용하여 액체 핸들러 유니트 (100), 유체 교류 장치 (108), 및/또는 항온배양기 (104)의 이동을 제어할 수 있다. 스테이션 121로부터의 그리퍼 도구를 또한 사용하여 자동화 세포 배양 방법에서 적절한 단계 중에 플레이트로부터 뚜껑을 제거하거나 설치할 수 있다.
상기 언급한 바와 같이, H-1152는 필요한 경우에, H-100과 같은 또 다른 ROCK 억제제로 대체될 수 있다. 이러한 방식으로, 세포는 성장 배지로부터 단백분해 효소를 물리적으로 제거할 필요가 없이 분리 및 분할시킬 수 있으며; 예를 들어, 이러한 접근방법을 사용하여 불활성화된 트립신을, 예를 들어, 원심분리에 의해서 배지로부터 물리적으로 제거할 필요가 없다.
다양한 구체예에서는, 다수의 로보트 성분을 이용하여 배양 프로토콜을 더 촉진시키고, 시스템의 높은 처리량을 증가시킬 수 있다. 예를 들어, 다수의 로보트 팔이 운용 분리 도구를 위해서 사용될 수 있으며, 다른 부착된 세포주의 유지를 위해서 성공적으로 설치되는 테칸 셀레리티 시스템 (Tecan Cellerity system)과 같은 액체 취급 시스템이 또한, 본 발명에 의해서 사용될 수도 있다.
실시예
이하의 실시예는 본 발명의 다양한 관점을 더 설명하기 위해서 포함된다. 이하의 실시예에 개시된 기술은 본 발명을 실행할 때에 잘 작동하는 것으로 본 발명자에 의해서 발견된 기술 및/또는 조성물을 나타낸 것이고, 따라서 이의 실행을 위해서 바람직한 방법을 구성하는 것으로 간주될 수 있다는 것은 본 기술분야에서 숙련된 전문가에 의해서 이해되어야 한다. 그러나, 본 기술분야에서 숙련된 전문가는 본 발명의 개시내용에 비추어서, 다수의 변화가 개시된 특정의 구체예에서 만들어질 수 있고, 본 발명의 취지 및 범주를 벗어남이 없이 동등하거나 유사한 결과를 수득한다는 것을 이해하여야 한다.
실시예
1
줄기세포의 자동화 계대 및 증식
H1 세포 계대 185 및 62를 TeSR 배지를 사용하여 배양하고, 베크만 코울터 바이오메크 2000 액체 핸들러 (B2K), 지브코 (Gibco) TrypLE 트립신, TeSR 배지 및 TeSR 플러스 (10 ㎛ HA-100 및 0.5 ㎎/㎖ 인비트로겐 대두 트립신 억제제를 함유)를 사용하여 분할시켰다. 약 70% 융합성의 H1 세포를 8.6 ㎍/㎠ 매트리겔 (MATRIGEL™) (BD Bioscience)로 코팅된 6웰 플레이트 및 트리플 (TRYPLE™) 트립신을 함유하는 저장소를 따라서 B2K 워크 표면 상에 배치하였다. 그리퍼 도구를 사용하여, 분할될 플레이트로부터 뚜껑을 제거하였다. 로보트는 그리퍼 도구를 버리고, 워시1 (Wash1) 도구를 장착하여 세포와 함께 플레이트로부터 배지를 흡인하였다. 다음으로, P1000 도구를 사용하여 트리플 효소를 분할되는 플레이트에 이동시켰다. 뚜껑을 플레이트 상에 재배치하고, 플레이트를 7분 동안 37℃ 사이토매트 (CYTOMAT™) 항온배양기 내로 이동시켜 세포가 플레이트로부터 해리하도록 허용하였다.
이 시간 중에, 매트리겔 코팅된 플레이트(들)로부터 뚜껑을 제거하고, 과량의 매트리겔을 워시1 도구를 사용하여 제거하였다. 적절한 용적의 TeSR 플러스 배지를 각각의 매트리겔 코팅된 플레이트의 웰당 분배하였다. 그 후, 항온배양기로부터 플레이트를 꺼내어 그리퍼 도구를 사용하여 덮개를 열었다. 트립신 처리된 웰 내의 트리플 (TRYPLE™)을 중화시키기 위해서 워시1 도구를 사용하여 플레이트에 TeSR 플러스 배지를 첨가하였다. 세포의 나머지 클럼프 (clump)를 서서히 혼합시키고, P1000 도구를 사용하여 파쇄하였다. 세포 현탁액을 각각의 플레이트의 웰에 걸쳐 세포를 간헐적으로 혼합시키고 서서히 분포 (접종)시키면서 새로운 매트리겔 코팅된 플레이트(들)에 이동시켰다. 이 과정은 모든 새로운 플레이트가 세포로 접종될 때까지 계속하였다. 그 후, 그리퍼 도구를 사용하여 뚜껑을 플레이트(들) 상에 다시 배치하고, 플레이트(들)를 37℃에서 24시간 동안 놓아두었다.
24시간 후에, 접종된 플레이트를 항온배양기로부터 꺼내고, 워시1 도구를 사용하여 TeSR 플러스 배지를 흡인하고, 새로운 정규의 TeSR 배지를 세포의 각각의 플레이트에 첨가하였다. 뚜껑을 재배치하고, 플레이트를 다시 항온배양기 내에 되돌려 놓고, 이들을 약 4-5일 후에 다시 분할하는 것이 필요할 때까지 매 24시간마다 정규의 TeSR 배지 (HA-100 및 대두 트립신 억제제가 없는 TeSR)를 유가배양하였다. 이 방법은 단일 분할시에 세포를 한 개의 플레이트로부터 30개의 플레이트로 (즉, 30× 더 큰 표면적으로) 증식시킬 수 있었다.
실시예
2
자동화
HES
세포 배양 및 유지 시스템
HES 세포의 노동 및 시간-집약적 유지를 개선시키기 위해서, 본 발명자들은 우선 HES 세포의 유가배양을 자동화하였다. 제안된 실험은 자동화 배지 교환에 의해서 10개의 6웰 플레이트를 유지시켜 멸균 및 재현가능한 조건을 확립시키기 위한 것이었다. 본 발명자들은 확립된 액체 취급 시스템을 사용하여 배지 교환을 성공적으로 자동화시킴으로써 이 목표를 달성하였다. 이것은 이 구체예에서 HES 세포 배양의 자동화에 관하여 중요한 단계였다.
도 3A-B는 예시적 구체예의 이하의 실험에서 사용된 자동화 시스템을 나타낸다. 이 시스템은 바이오메크2000 시스템 (핀 도구, 세척 도구, 스택커, 단일 및 8채널 20, 200 및 1000 마이크로리터 피펫팅 도구 (P20, P200, P1000, Beckman)), 허드슨 플레이트크레인 XT, 및 헤라우스 사이토매트 (Heraeus Cytomat) 6000을 포함한다. 이 구체예에서는, 간단한 소다 냉장고가 배지 저장을 위해서 사용되었으며, 이것으로부터 배지가 직접적으로 배양 웰에 전달되었다. 전달된 배지의 인-라인 (in-line) 가열은 실험을 기초로 하여 필요한 것으로 보이지 않았다. 통합은 오버로드 소프트웨어 (Overlord software)를 사용하여 바이오세로 (Biosero)와 협력하여 수행되었다. 완전한 시스템은 생물안전도 수준 (biosafety level) 2 (BSL2, 사람들에게 해로운 중등도의 잠재력을 갖는 약제의 취급 및 환경을 규제함) 규정에 순응하고, 표준 BSL2 조직 배양 후드 (hood)와 동등한 충분한 멸균성을 달성한 클래스100 (class100) 청정실 (즉, 평방 피트당 0.5 미크론보다 큰 입자 100개 미만) 내에 수용되었다.
눈크 (Nunc)로부터 구입한 직사각형 4웰 및 8웰 눈클론Δ (NunclonΔ) 플레이트가 수동작업에서 통상적으로 사용된 둥근 6웰 플레이트 대신에 사용되었다. 이에 대한 한가지 이유는 상업적으로 이용할 수 있는 모든 6웰 플레이트의 플레이트 높이가 스크리닝 및 자동화 액체 취급시에 사용된 정규의 마이크로웰 플레이트의 높이를 상당히 초과하기 때문이었다. 정규의 둥근 6웰 플레이트를 사용하는 것의 불이익은 100개 미만의 플레이트로 자동화 항온배양기의 수용력의 거의 절반을 감소시키는 것이었다. 더욱이, 6웰 플레이트는 접근하기 어려운 더 많은 영역을 함유하기 때문에, 플레이트의 직사각형 기하학은 8채널 액체 취급 도구의 사용을 허용하였다. 후자의 사실은 또한, 이용가능한 배양 표면적에서 1.46배 증가 (6웰 플레이트의 경우의 57.6 ㎠에 비해서 4웰 및 8웰 플레이트의 경우에는 84 ㎠)를 제공하였다. 유가배양 및 접종 시스템은 세척 도구 및 8채널 도구를 갖는 4웰 및 8웰 플레이트를 사용하였다 (도 3C-D).
이 구체예에서는, HES 세포를 분할하고 유가배양하기 위해서 로보트 성분이 사용되었다. 처음에는 단일 채널 세척 도구를 사용하여 폐배지를 흡인하고, 4웰 또는 8웰 플레이트를 유가배양하였다. 4웰 플레이트 뒤의 배면에서 6웰 플레이트를 사용하여 트립신에 대한 저장소를 제공하였다. 8채널 도구 P200을 사용하여 최종 분할시에 4웰 마더 플레이트로부터 8웰 도터 플레이트로 트립신 처리되고 개별화된 HES 세포를 혼합 및 분배하였다.
예시적 구체예에서, 표면은 눈크 (Nunc)에 의해서 제조된 눈클론Δ (NunclonΔ)이었으며, 매트리겔로 코팅되었다. HES 세포를 분할 및 유가배양하기 위해서는 이하의 로보트 성분이 사용될 수 있다: 플레이트크레인은 액체 취급 로보트 바이오메크2000을 항온배양기 사이토매트6000과 연결시킨다. 플레이트크레인의 그리퍼는 항온배양기의 턴테이블 (turntable)의 상부에 위치한다. 배지를 수용하는 냉장고는 세척 도구 (테이프를 갖는 상자)의 연동 펌프를 연결하는 배관을 가졌으며, 진공으로 인하여 나오는 폐배지를 위한 세척병은 하우스내 (in house) 진공 시스템에 의해서 제공된 세척 도구 내의 밸브에 의해서 제어되었다.
초기에, 옴니트레이 (Omnitray), 즉 전체 플레이트 내에서 구분이 없는 플레이트를 시험하고, 플레이트크레인과 사이토매트6000의 턴테이블에 의한 이동 중의 과도한 스플래싱 (splashing)으로 인하여 폐기하였다. 최종 유가배양 (feeding) 프로토콜 (최초에 취급된 6웰 플레이트)에서는, 2개의 8웰 플레이트를 사이토매트6000으로부터 한번에 하나씩 회복시키고, 플레이트크레인을 사용하여 바이오메크2000 데크 (deck)의 2개의 가장 바깥쪽 우측 위치에 이동시켰다. 바이오메크2000의 그리퍼 도구로 플레이트로부터 뚜껑을 제거하고, 이들을 데크 상의 인접한 왼쪽 위치에 놓았다. 8채널 세척 도구로 교환한 후에, 배지를 4웰 또는 8웰 플레이트에 걸쳐 8개의 위치에서 흡인하여 폐배지의 충분한 제거를 확실하게 하였다. 수동공정에서는, 플레이트를 폐배지의 충분한 제거를 위해서 하부에서 수집하게 하는 각도로 경사지게 할 수 있다. 이러한 각도는 신뢰성을 유지하도록 이들 로보트에 의해서 충족되었다. 새로운 배지 (웰당 각각 6 및 3 ㎖)는 다음의 웰 또는 플레이트 상으로 이동시키기 직전에 분배하였다. 뚜껑을 벗기고 다시 씌우는 공정뿐만 아니라 세척 도구의 높이 정렬은 비정기적인 조정이 필요하였다. 이들은 조작자의 존재 및 조정이 필요한 오차의 가장 두드러진 원인 (100회의 이동 중의 대략 1회)이었다. 세포는 세척 도구의 연동 펌프에 의해서 발생된 압력에 의해서 표면으로부터 세척될 수 없었기 때문에, 세척 도구의 유량은 배양물의 품질에 부정적으로 영향을 미치는 것 같지 않았다. 배양물의 품질은 배양 공정의 매일 매일 후에 배양물의 시각적 평가에 의해서 판단되었다 (도 4A-C).
자동화 절차는 5일의 실험 중에 분화의 어떤 증가된 출현도 나타내지 않았으며, 배양물은 정규의 매트리겔 플레이트 상에서 수동으로 성공적으로 분할될 수 있었다. 본 발명자들은 예열 칼럼의 부재 하에서 어떤 부정적인 효과도 관찰하지 못하였기 때문에, 냉각된 배지를 예열하기 위해서 인-라인 가열 칼럼을 사용한 초기 실험은 계속되지 않았다. 이러한 목적에서 주된 시간-소모적 작업은 유가배양 및 분할 중에 유사한 주된 이동 및 조작에 대하여 자동화 시스템을 터득하는 것이었다. 유가배양 단계를 위한 이 시스템의 처리량은 통합 소프트웨어에 의해서 실행가능한 동시 이동의 수에 있어서의 제한, 다수의 도구 (유가배양의 경우에 그리퍼 및 세척 도구)를 운용시키기 위해서 사용되는 바이오메크2000, 및 2개의 플레이트의 동시 처리를 허용하는 플레이트크레인 및 바이오메크2000의 이용가능한 데크 공간의 상대적 배치로 인하여 다소 제한되었다. 그러나, 더 진보된 액체 취급 시스템 및 더 정교한 통합 플랫폼 (다수의 팔, 호환성 소프트웨어, 다중작업화를 허용하는 통합가능한 로보트)에 의해서 제공된 더 큰 데크는 처리량을 상당히 개선시킬 수 있거나, 개선되어야 한다. 목표 2를 포함하는 본 시험의 종료시까지 본 발명자들은, 본 발명자들이 멸균 및 재현가능한 조건을 확립하기 위한 자동화 배지 교환에 의해서 계대들 사이에서 160개의 눈클론Δ 8웰 플레이트를 유지시킬 수 있다는 것을 성공적으로 입증할 수 있었다. 한 사람은 일상적으로, 배양물의 품질을 손상시킴이 없이 1일에 대략 20개의 눈클론Δ 6웰 플레이트를 취급할 수 있다. 상기 시스템은 명백하게, 수동적으로 유지된 세포 배양 기술에 필적하는 HES 세포 배양의 만능성 (pluripotency) (Oct4 수준), 속도, 재현가능성 및 경제적 효율의 유지에 중요한 우수한 배양 품질을 나타내었다.
실시예
3
hES
세포의 자동화 계대 및 증식
HES 세포의 계대는 HES 세포 배양에서 가장 노동 집약적이고 가변적인 단계이기 때문에, 이것은 기술자의 숙련도에 매우 의존적인 실험의 결과에 있어서의 매우 큰 가변성을 유도한다. 본 발명자들은 계대의 자동화가 더욱 활발하고 재현가능한 HES 세포 배양을 유도할 것으로 가정하였다. 비록 본 발명자들은 이 프로젝트에 대해 이용할 수 있는 제한된 시간으로 인하여 현행 시스템에 의해서 이 이론을 확인할 수 없었지만, 본 발명자들은 HES 세포의 6웰 플레이트 중의 하나의 웰 (약 250만 세포)을, 다른 식으로는 한 사람에게 거의 불가능한 업무인, 3주일에 걸친 1000배 증식에 해당하는 160 플레이트 (약 20-30억 세포)로 증식시킴으로써 원리의 증거를 증명할 수 있었다.
본 발명자들은 실시예 1에 기술된 시스템을 이용하였으며, 단순한 액체취급 프로토콜을 기초로 하는 HES 세포의 계대를 위한 절차를 개발하였다. 분할 기술에 있어서의 최근의 혁신은 다른 식으로는 수동 절차를 필요로 하는 이것의 효율적인 자동화를 가능하게 하였다. HES 세포는 TeSR 배지 내에서 생존을 위해 세포-세포 접촉이 필요하기 때문에, 이들을 자동화시키기에 매우 어려울 수 있는 절차인 부착된 세포의 스크래핑 (scraping)이 필요한 클럼프 내에 접종하는 것을 필요로 하였다. 그러나, 소분자 HA-100 및 이의 10배 더 특이적인 유도체 H-1152는 트립신 처리 후에 HES 세포의 생존을 허용하는 것으로 측정되었다. 0.1% 트립신에 의해 HES 세포를 탈착 및 개별화시키고, 후속으로 1 μM H-1152 및 0.5 ㎎/㎖ 인비트로겐 대두 트립신 억제제를 함유하는 약간 변형된, 제한된 TeSR 배지 내의 매트리겔 코팅된 눈클론Δ 플레이트 상에 접종하는 능력은 본 발명자들이 부착성 암 세포주를 덜 요구하기 위해서 다른 사람에 의해서 자동화된 기술을 채택하도록 허용하였다.
자동화 계대를 위해서, 이하의 절차가 개발되었다: 항온배양기로부터 마더 플레이트를 회복시킨 후에, 세척 도구로 목표 1에 기술된 바와 같이 폐배지를 제거한다. 8채널 200 ㎕ 피펫팅 도구 MP200을 사용하여 3 ㎖의 트립신 (0.1%)을 첨가한다. 사이토매트6000 내부에서 처리된 플레이트의 7분 항온배양 후에, 2 μM H-1152 및 1 ㎎/㎖ 인비트로겐 대두 트립신 억제제를 함유하는 3 ㎖ TeSR 배지의 혼합물을 웰에 첨가한다. 세포를 플레이트 표면으로부터 씻어내고, 8채널 MP200 도구를 사용하여 반복적 분배 및 흡인에 의해 혼합시킨다. 그 후, 세포를 MP200 도구를 사용하여 도터 플레이트에 분배시킨다. 그 후, 세포를 스택커로부터 바이오메크2000에 로딩된 예비코팅된 매트리겔 플레이트 상에 1에서 32까지 접종한다. 접종은 매트리겔 코팅 배지를 흡인하고, 이것을 상기의 유가배양 프로토콜에 기술된 바와 같은 H-1152 및 대두 억제제를 함유하는 변형된 TeSR 배지로 대체시킨 후에 수행된다. 일차적으로 사용된 옴니트레이 (Omnitray)의 전체 표면적은, 본 발명자들이 목표 2에서 HES 세포를 계대하는 방법을 시험하자마자 다음 분할의 단계에서 시스템의 처리량을 위해서는 너무 큰 것으로 밝혀졌다. 마더 플레이트로부터 25개의 도터 플레이트로 세포를 분포시키는데 소요되는 시간은 개별화된 세포가 이들이 접종될 수 있기 전에 현탁액 내에서 생존할 수 있는 시간을 초과하였다.
본 발명자들은 이들 새로운 프로토콜의 실현가능성을 확립하기 위하여 매우 활발하게 성장하는 세포를 사용한 로보트 프로토콜을 확립하는 시초에는 핵형적으로 정상적인 매우 높은 계대 (>p200)의 H1 HES 세포 배양물을 사용하였다. 이들 세포는 여전히 조혈성 전구체 및 심근세포를 생산하여 이들의 분화 잠재력을 나타내었다. 그러나, 확고한 프로토콜에 대한 요구는 더 낮은 계대 세포 배양물의 경우에 확실히 더 큰데, 이는 이들이 세포 배양시에 더 큰 가변성을 유도하는 최적하의 조건에 대해 더 민감하게 반응하기 때문이다. 나중의 실험에서, 본 발명자들은 또한, 3 내지 5 계대에 걸쳐 5개의 플레이트를 사용한 더 작은 규모의 실험에서 더 낮은 계대의 H1 세포 (>p60)에 의해 유도된 절차의 타당성을 확인할 수 있었다. 이 증거는 자동화 시스템을 사용하여 이들 더 낮은 계대 세포를 배양하는 능력을 지지한다.
초기에, 본 발명자들은 세포의 균질한 분포를 달성하기 위해서 웰의 다수의 위치에서 세포를 첨가함으로써 접종하기 위한 단일 채널 도구를 사용하였다. 비록 본 발명자들은 이것을 고 및 저 계대 HES 배양물에 의해서 성공적으로 수행할 수 없었지만, 본 발명자들이 160개의 8웰 플레이트로의 스케일-증대 실험의 최종 단계에서 세포를 증식시킨 경우에, 절차의 처리량은 8채널 P200 도구의 사용을 필요로 하였다. 비록 세포의 감소된 균질한 분포 및 세포 밀도의 감소가 도터 플레이트에서 관찰되었지만, 본 발명자들은 이 방법이 이들 특징을 개선하기 위해서 최적화될 수 있을 것으로 기대한다. 이 실험에서의 증식은 일차 계대에서는 6웰 플레이트의 단일 웰로부터 5개의 필요한 4웰 플레이트로, 그 다음에 이차 계대에서는 160개의 최종 8웰 플레이트로 이루어졌다. 본 발명자들은 상기 확립된 프로토콜에 의한 계대 후 2일 및 그 후에는 매일 유가배양함으로써 총 160개의 플레이트를 유지시켰다. 본 발명자들은 모든 플레이트를 분화 및 밀도에 관하여 시각적으로 검사하였다. 발명자들은 무작위로 30개의 플레이트를 선정하여 이들을 세포 분포의 스캐닝 및 평가를 위해 트립판 블루 염색에 의해서 염색하였다. 플레이트의 시각적 검사로부터, 높은 재현성을 위하여 균질성에 대한 추가의 개선이 이루어질 수 있으며, 이루어져야 한다는 것이 명백해졌다. 또한, 본 발명자들은 플레이트 2 및 10을 무작위로 선정하여 2 계대 및 20일에 걸친 1000배 증식 후에 세포의 Oct4 함량에 대해서 시험하였다. Oct4 FACS 분석은 이러한 첫 번째 스케일-증대 실험에서 높은 품질의 미분화된 세포를 나타내었다.
자동화 HES 세포 배양물의 표준 품질을 달성한 어떤 플레이트에서도 유의적인 양의 분화는 관찰되지 않았다. 이것은 더 낮은 계대 배양물을 사용한 더 작은 규모의 다수의 다른 실험에 의해서뿐만 아니라 FACS 분석에서 Oct4 양성 세포의 매우 높은 함량에 의해서 지지되었다. 현재의 세포 배양물까지의 계대 빈도 및 밀도는 이의 역사 및 주로 나이 (즉, 계대 수)에 따라 좌우된다. 수동 HES 세포 배양에 의한 실험으로부터, 본 발명자들은 더 어린 배양물이 더 오래된 세포보다 최적하의 조건 및 가혹한 처리에 대해서 더 민감하게 반응하는 경향을 갖는다는 것을 알게 되었다. 세포주의 거동은 첫 번째 몇 개의 계대에서 이것이 어떻게 해동되고 취급되는지에 따라서 달라질 수 있다. 이들 모든 인자는 단지 성장 및 분화의 정도를 모니터링함으로써 활용될 수 있는 더 큰 정도의 가변성의 원인이 될 수 있다. 이러한 측정은 본 발명에 기술된 시스템의 후속 변이 중에 자동화될 수 있다. 도 6에 나타낸 바와 같이, 플레이트들 사이에서 가변성이 관찰되었다. 개선된 혼합 절차 및 통합된 세포-계수는 미래의 시스템에서 더 나은 균질성을 제공할 수 있으며, 이들 변형은 이들이 이전에 다른 세포 배양에 의해서 달성되었었기 때문에 비교적 쉽게 수행되어야 한다.
1000배 증식시킨 후에 스케일-증대 실험으로부터 무작위로 선정한 플레이트를 검사하였다. 배지를 제거하고, 플레이트를 건조시킨 후에 플레이트를 트립판 블루로 염색하였다. 염료는 HES 세포 콜로니를 나타내었다. 분할 프로토콜을 최적화할 때에 개선된 세포 분포에 대한 필요성이 남아있지만, 본 발명자들은 플레이트에 걸친 분포에 있어서의 개선된 일관성 (consistency)이 프로토콜의 최적화에 의해서 달성될 수 있음을 예상한다.
1000배 증식시킨 후에 스케일-증대 실험으로부터 무작위로 선정한 플레이트를 세포 계수에 적용하였다. 플레이트를 트립신 처리하고, 트립판 블루로 염색하고, 혈구계 상에서 계수하였다. 전체 세포는 대표적인 샘플로부터 계산하였다. 이하의 요약 통계자료에서 나타낸 평균 결과로부터 추정하여 상기 실험으로부터 약 160×1600만 = 25.6억 세포가 생성되었다. 다양한 플레이트에서의 세포 증식은 도 6에 나타내었으며, 본 실험에 대한 세포 증식 요약 통계자료는 이하의 표 2에 제시하였다.
| 요약 통계자료 | |
| 평균 | 16023750 |
| 표준 오차 | 2615974.1 |
| 중앙값 | 13000000 |
| 모드 | 16500000 |
| 표준 편차 | 12815603.45 |
| 표본 분산 | 1.6424E+14 |
| 첨도 | 0.987042208 |
| 왜곡도 | 1.254713927 |
| 범위 | 44970000 |
| 최소 | 3000000 |
| 최대 | 47970000 |
| 합계 | 384570000 |
| 계수 | 24 |
실시예
4
세포-기반 스크리닝을 위한
96웰
포맷에 대한
HES
세포 배양물의 자동화 접종
본 발명자들은 개별화된 세포로부터 TeSR1 배지 내에서 HES 세포의 콜로니 형성을 활발하게 증가시키고, HA-100으로부터 유도된 제2 세대 소분자를 나타내는 신규한 화합물 H1152를 사용하였다. HA-100은 추적 시험에서 H1152와 같은 관련된 화합물의 개발을 이끄는 일차 HES 세포-기반 소분자 스크린 중의 하나에서 발견되었다. H-1152는 96웰 플레이트 내에서 개별화된 HES 세포의 매우 효율적인 접종이 이루어지도록 함으로써 (HA-100과 유사하지만, 10배 더 낮은 농도로), HES 세포-기반 소분자 스크리닝을 가능하게 한다. 다른 식으로는 세포 클럼프 내에서 계대되는 개별화된 HES 세포는 세포-기반 소분자 스크리닝을 위한 엄격한 전제조건인 웰당 더 균일한 세포 밀도를 제공한다. 본 발명자들은 또한, 현행 소분자 (HA-100) 및 관련된 화합물 H1152는 사람 ES 세포를 계대시키는데 충분하였다고 판단하였다.
본 발명자들은 조혈작용을 증가시키는 능력을 가질 수 있는 화합물을 스크리닝하기 위해서 소분자 라이브러리 (공지된 생물활성을 갖는 2000개의 화합물)를 사용하였다. 본 발명자들은 상술한 시스템이 96웰 포맷에서 HES 세포를 플레이팅 (plating)하여 소분자 스크리닝을 위한 플랫폼을 제공할 뿐만 아니라 다른 약제 및 조건을 스크리닝할 수 있음을 입증하였다. 본 발명자들은 조혈성 전구체를 이끌어내는 지시된 분화방법을 사용하는, 자동화에 적합한 스크리닝 시험 및 프로토콜을 추론하였다. 본 발명자들은 이들 조건 하에서 스크리닝을 성공적으로 수행하였으며, 현재 타당성을 확인하고 있는 28개의 초기 후보 화합물을 확인하였다. 스크리닝의 수행은 더 철저한 시험 개발을 통해서 더 개선될 수 있지만, 자동화 스크리닝을 위해 HES 세포를 플레이팅하는 주된 목적은 달성되었다. 이 플랫폼은 다른 식으로는 스크리닝, 독물학 시험 및 표적 검증에 관련된 시험에 필요한 양으로 수득하는 것이 어려운 이들 세포를 대량으로 생산할 수 있도록 한다. 대체 공급원 (혈액 및 골수로부터 분리된 세포)은 단지 제한된 양을 제공하며, 배취가 상이한 공여체로부터 풀링된다는 사실로 인하여 안정한 유전적 배경을 제공할 수 없다. 이들 방법을 사용하여, 재현가능한 양의 세포가 연구집단에 제공될 수 있다.
이 프로토콜에 사용된 시험방법은 2개의 특징적인 세포 표면 마커 (CD34 및 CD43)의 존재를 검출할 수 있는 ELISA 프로토콜을 기초로 하여 개발되었다. 이들 마커는 본 발명자들이 이어서 세포를 원하는 혈액계로 분화시키거나 출발물질과 같은 것을 제공하기 위해서 분리할 수 있는 강력한 조혈성 전구체를 식별한다. 본 발명자들은 자동화 플랫폼을 사용하여 96웰 플레이트 내에 개별화된 사람 ES 세포를 접종하고, 이들을 4일 동안 성장시켰다. 그 후, 배지를 제한된 분화 배지로 바꾸어주고, 스크리닝하기 위한 화합물을 로보트에 의해서 96채널 핀 도구를 사용하여 20 마이크로몰의 최종 농도로 첨가하였다. 2일 후에 배지를 첨가하는 것을 포함하여 화합물에 4일 노출시킨 후에, 배지를 성장인자 감소된 분화 배지로 교환하고, 최종 정보판독 (readout)을 위해서 세포를 ELISA 프로토콜에 적용할 때까지 추가로 6일 동안 더 유지시켰다 (격일로 배지를 교환하면서). 이 실험의 타임라인 (timeline)은 단지 분화 배지에 대해서만 개발되었다. 본 발명자들은 이 방법에 의해서 1-6% CD43 및 2-25% CD34 양성 세포를 수득하였다. 스크린은 강력한 조혈성 전구체의 집단을 더 증가시켜 생산을 증가시키는 화합물을 검출하도록 디자인되었다. CD34 항체에 의한 문제로 인하여, 단지 CD43 발현에 대한 데이터가 수득되었다. 그럼에도 불구하고, CD43 양성 세포의 집단은 혈액계에 대한 참여를 확인하기 위한 가장 중요한 마커일 것 같다.
본 발명자들은 멀티플렉스 ELISA에서 암플렉스울트라레드 (AmplexUltraRed) 및 센시플렉스 (SensiFlex) 시험 (Invitrogen)을 사용할 수 있었으며, 대조군을 사용하여 이들 시험이 적합하고, 2개의 세포 마커에 대해서 (프로토콜에서 별도의 세척 단계의 부가 후에, 표면 상에서 또는 세포 내부에서) 동시에 스크리닝하는 SCP에 대한 가능성을 제공하였음을 나타내었다. 이것은 충분한 인식을 위해서 한 개보다 많은 마커가 필요한 세포계에 대해 스크리닝할 때에 특히 중요하다. 일부 플레이트의 가장자리에서 대조 DMSO 웰 중에서의 거짓 양성의 높은 비율뿐만 아니라 일부 플레이트의 상부 및 하부 열 중에서의 히트 (hit)의 누적. 수행된 마지막 이 시험은 예비 데이터를 수득하였지만, 본 발명자는 다른 ELISA 스크린에서 입증된 바와 같이 이 스크리닝 시험이 더 우수한 세척절차를 통해서 최적화된 항체 및 농도를 사용하여 ELISA의 단계에서 최적화될 수 있음을 확인하였다. 그럼에도 불구하고, 96웰 플레이트에서 스크리닝을 위한 HES 세포를 성공적으로 제공하는 것은 중요한 성취를 나타낸다.
본 출원에서, 본 발명자들은 상기 확립된 변형된 절차를 사용하여 96웰 플레이트 내로 플레이팅시키는데 있어서의 매우 우수한 균일성을 수득할 수 있었다. 그러나, 이러한 목적으로, 본 발명자들은 자동화 절차에 의한 HES 세포의 정규의 증식 및 유지에서보다 5배 더 큰 접종 밀도인 웰당 16,000 세포로 플레이팅하였다. 매트리겔이 아닌 다른 대용의 독점적 매트릭스에 대한 부착에 순응시키기 위해서 이러한 특별한 변화가 사용되었으며, 이것은 분화 프로토콜에서 결정적인 단계인 것으로 밝혀졌다. 확고한 스크리닝을 용이하게 하기 위해서 96웰 포맷에서 성공적인 접종이 사용될 수 있다.
본 발명자들은 가까운 장래에 자동화 액체 취급 시스템에 의해 이 스크린을 위한 배지 교환을 수행하는 능력을 갖지만, 본 발명자들은 시간 및 비용을 위해서 진공 12채널 완드 (wand)를 사용하여 수동으로 흡인하고, 스택커가 없이 자동화 분배기를 사용하여 분배시킴으로써, 배지를 교환하고, ELISA 시험을 수행하도록 결정하였다. 본 발명자들은 완전히 자동화된 시스템의 재현성의 이점을 이용하지 않았지만, 본 발명자들은 시간 및 시약을 상당히 절약하였다. 매트릭스 웰메이트 (Matrix Wellmate) 자동화 분배기가 사용되었다.
상기 실시예는 성공적으로 자동화된 HES 세포 배양 및 유지를 나타낸다. 상기 데이터는, 본 발명자들이 HES 세포 배양을 위한 자동화 절차를 제공하기 위한 주된 과제를 해결할 수 있었음을 나타낸다. 본 발명자들은 또한, 추가의 처리량이 시스템의 최적화를 통해서 달성될 수 있는 것으로 예상한다. 본 발명자들은 개선된 품질 조절, 세포 성장의 모니터링, 및 개선된 계대가 상기 시스템을 사용하여 달성될 수 있는 것으로 예상한다. 최적화된 절차에 의해서는, 수동 절차에서 필요한 것과 같은 분화된 불순물을 확인하고 분리시키는 것이 필요하지 않을 수 있음이 예상된다.
상기 시스템은 다른 부착된 세포주의 유지를 위해서 성공적으로 확립된 테칸 셀레리티 시스템 (Tecan Cellerity system)과 같은 액체 취급 시스템을 포함하도록 쉽게 변형될 수 있다. 이러한 시스템의 적용을 위한 주된 단계는 세포를 계대시키기 위한 트립신의 사용이었다. 독자적인 문헌 [Watanabe et al. Nat Biotech (2007) "A ROCK inhibitor permits survival of dissociated human embryonic stem cells"]은 HES 세포 성장을 유지시키는 HA-100의 능력을 지지한다.
* * *
본 발명에 기술되고 특허청구된 모든 조성물 및 방법은 본 발명의 기술내용에 비추어서 과도한 실험이 없이 이루어지고 수행될 수 있다. 본 발명의 조성물 및 방법은 바람직한 구체예의 형식으로 기술되었지만, 본 발명의 개념, 취지 및 범위를 벗어남이 없이 본 발명에 기술된 조성물 및 방법 및 방법의 단계 또는 일련의 단계에서 변화가 적용될 수 있음은 본 기술분야에서 숙련된 전문가에게 명백할 것이다. 더욱 특히, 화학적으로 및 생리학적으로 모두 관련된 특정의 약제로 본 발명에 기술된 약제를 치환시킬 수 있지만, 동일하거나 유사한 결과가 달성될 수 있다는 것은 명백할 것이다. 본 기술분야에서 숙련된 전문가에게 명백한 이러한 유사한 치환 및 변형은 모두 첨부된 특허청구범위에 의해서 정의된 바와 같은 본 발명의 취지, 범위 및 개념 내에 포함되는 것으로 생각된다.
참고문헌
이하의 참고문헌은 본 발명에 기술된 것에 대한 보충으로 실험적 절차 또는 그 밖의 다른 상세한 사항을 제공하는 정도로 본 명세서에 구체적으로 참고로 포함된다.
미국 특허 제4,284,412호
미국 특허 제4,352,883호
미국 특허 제4,498,766호
미국 특허 제4,661,913호
미국 특허 제4,714,682호
미국 특허 제4,767,206호
미국 특허 제4,774,189호
미국 특허 제4,857,451호
미국 특허 제4,989,977호
미국 특허 제5,160,974호
미국 특허 제5,478,722호
미국 특허 제5,843,780호
미국 특허 제6,200,806호
미국 특허 제6,325,114호
미국 특허 제7,029,913호
미국 공개 제2006/0084168호
미국 공개 제2006/0198827호
미국 공개 제2006/0210596호
Davies et al ., Biochem . J., 351:95-105, 2000.
Griffiths, In: Animal Cell Biotechnology, 3:179-220, Spier and Griffiths (Eds.), Academic Press, London., 1986.
Ikenoya, et al ., J. Neurochem., 81:9, 2002.
Ludwig & Thompson, Human Cell Culture, 6:1-16, 2007.
Ludwig et al ., Nat . Biotechnol ., 24:185-187, 2006a.
Ludwig et al ., Nat . Methods , 3(8):637-646, 2006b.
Maekawa et al ., Science, 389:895-898, 1999
PCT 출원 WO 94/17178
Sasaki et al .; Pharmacol . Ther., 93:225, 2002.
Takahashi et al., Cell , 126(4):663-676, 2006.
Takahashi et al., Cell, 126(4):663-76, 2007.
Terstegge et al ., Biotech . Bioengin ., 96(1):195-201, 2007.
Thomson et al ., Science, 282(5391):1145-1147, 1998.
Van Wezel, Nature, 216(110):64-65, 1967.
Wang et al ., Am . J. Physiol ., 263(4 Pt 1):G480-486, 1992.
Wang et al ., FEBS Letters , 353:138-142, 1994.
Wang et al ., In: Animal Cell Technology : Basic & Applied Aspects, Kaminogawa et al . (Eds.), 5:463-469, Kluwer Academic Publishers, Netherlands, 1993.
Watanabe et al ., Nat . Biotech ., 25(6):681-6, 2007.
Yu et al ., Science, 318:1917-1920, 2007.
Claims (57)
- (a) 제한 성장 배지 내에서 만능 세포의 제1 집단을 수득하고;
(b) 상기 만능 세포를 자동화 분리 시스템에 의해서 분리시키고;
(c) 분리된 세포를 새로운 제한 성장 배지에 현탁시켜 만능 세포의 증식된 집단을 제공함
을 포함하여, 제한 배지 조건 하에서 만능 줄기세포를 자동화 증식시키는 방법. - 제1항에 있어서, 만능 세포가 ES 세포 또는 유도된 만능 세포 (iPS)인 방법.
- 제1항에 있어서, 세포가 사람 ES 세포인 방법.
- 제1항에 있어서, 배양된 증식된 만능 ES 세포의 적어도 97%에서 분화가 일어나지 않거나, 필수적으로 일어나지 않는 방법.
- 제1항에 있어서, 성장 배지가 TeSR 배지를 포함하는 방법.
- 제1항에 있어서, 만능 세포의 제1 집단이 세포 배양 플레이트 상에서 구성되는 방법.
- 제6항에 있어서, 세포 배양 플레이트가 겔 매트릭스를 포함하는 방법.
- 제6항에 있어서, 만능 세포의 제1 집단이 세포 분리의 시점에 약 50% 내지 약 99% 융합성인 방법.
- 제8항에 있어서, 만능 세포의 제1 집단이 세포 분리의 시점에 약 60%, 70%, 80% 또는 90% 융합성인 방법.
- 제6항에 있어서, 분리된 세포를 새로운 성장 배지 내에 현탁시킴이 세포를 하나 이상의 새로운 세포 배양 플레이트(들)에 접종함을 포함하는 방법.
- 제10항에 있어서, 새로운 세포 배양 플레이트(들)의 표면적이 ES 세포의 제1 집단을 포함하는 플레이트의 표면적보다 약 5 내지 약 35배 더 큰 방법.
- 제11항에 있어서, 새로운 세포 배양 플레이트(들)의 표면적이 ES 세포의 제1 집단을 포함하는 플레이트의 표면적보다 약 10 내지 약 35배 더 큰 방법.
- 제1항에 있어서, 자동화 분리 프로토콜이 만능 세포의 제1 집단을 단백분해 효소와 접촉시킴을 포함하는 방법.
- 제13항에 있어서, 단백분해 효소가 트립신인 방법.
- 제13항에 있어서, 단백분해 효소가 재조합 트립신, 트립신-유사 프로테이나제, 또는 트리플 (TRYPLE)인 방법.
- 제13항에 있어서, 단백분해 효소가 재조합 효소인 방법.
- 제1항에 있어서, 새로운 성장 배지가 단백분해 효소의 억제제를 포함하는 방법.
- 제13항에 있어서, 새로운 성장 배지가 세포 분리를 위해서 사용된 단백분해 효소의 억제제를 포함하는 방법.
- 제18항에 있어서, 단백분해 효소 억제제가 트립신 억제제인 방법.
- 제19항에 있어서, 단백분해 효소 억제제가 대두 트립신 억제제인 방법.
- 제20항에 있어서, 새로운 성장 배지가 약 0.5 ㎎/㎖의 대두 트립신 억제제를 포함하는 방법.
- 제1항에 있어서, 분리 시스템이 액체 핸들러 로보트에 의해서 자동화되는 방법.
- 제13항에 있어서, 자동화 분리 시스템이
(i) 제1 만능 세포 집단으로부터 배지를 제거하고;
(ii) 상기 만능 세포를 단백분해 효소와 접촉시키고;
(iii) 상기 세포를 단백분해 효소와 함께 항온배양하여 세포 클러스터를 분리시킴을 포함하는 방법. - 제23항에 있어서, 단백분해 효소 억제제 및 Rho-연관된 키나제 (ROCK) 억제제를 포함하는 제한 배지를 단계 (iii) 이후의 용액에 첨가하는 방법.
- 제23항에 있어서, ES 세포를 단백분해 효소와 함께 약 2 내지 약 10분 동안 항온배양하는 방법.
- 제23항에 있어서, ES 세포를 단백분해 효소와 함께 약 25℃ 내지 약 40℃에서 항온배양하는 방법.
- 제26항에 있어서, ES 세포를 단백분해 효소와 함께 약 37℃에서 항온배양하는 방법.
- 제23항에 있어서, 자동화 분리 시스템이
(iv) 항온배양된 세포를 기계적으로 교반시켜 세포 클러스터를 추가로 분리시킴
을 추가로 포함하는 방법. - 제28항에 있어서, 기계적 교반이 ES 세포를 전단력 또는 흡인에 적용함을 포함하는 방법.
- 제17항에 있어서, 단백분해 효소 억제제를 포함하는 성장 배지를 상기의 억제제를 필수적으로 포함하지 않는 성장 배지로 대체시킴을 추가로 포함하는 방법.
- 제1항에 있어서, 만능 세포의 집단이 비-만능 세포를 포함하지 않거나 필수적으로 포함하지 않는 방법.
- 제31항에 있어서, 만능 세포의 집단이 사람 ES 세포이고, 사람 ES 세포의 집단이 비-사람 세포를 포함하지 않거나 필수적으로 포함하지 않는 방법.
- 제1항에 있어서,
(a) 성장 배지 내에서 ES 세포의 제1 집단을 수득하고;
(b) 상기 ES 세포를 자동화 분리 시스템에 의해서 분리시키고;
(c) 분리된 세포를 새로운 성장 배지에 현탁시켜 ES 세포의 증식된 집단을 제공하고;
(d) 증식된 ES 세포 집단을 세포 성장을 지지하는 조건 하에서 항온배양하고;
(e) 단계 (b) 내지 (d)를 1회 이상 반복하여 ES 세포의 연속 증식된 집단을 제공함
을 포함하여, 배아줄기 (ES) 세포의 자동화 연속 증식을 위한 방법으로서 추가로 정의되는 방법. - 제33항에 있어서, (d) 증식된 ES 세포 집단을 세포 성장을 지지하는 조건 하에서 항온배양함이 세포를 배지 관류 배양으로 항온배양함을 포함하는 방법.
- 제1항에 있어서, 성장 배지가 유효량의 Rho-연관된 키나제 (ROCK) 억제제를 포함하는 방법.
- 제35항에 있어서, Rho-연관된 키나제 (ROCK) 억제제가 HA-100인 방법.
- 제36항에 있어서, HA-100이 약 10 μM의 농도로 존재하는 방법.
- 제35항에 있어서, Rho-연관된 키나제 (ROCK) 억제제가 H-1135인 방법.
- 제38항에 있어서, H-1135가 약 1 내지 3 μM의 농도로 존재하는 방법.
- a) 항온배양기;
b) 액체 핸들러 유니트;
c) i) 만능 세포의 생존가능한 집단, ii) 만능 세포가 미분화된 상태로 배양 및 유지될 수 있는 제한 배지, 및 iii) 하나 이상의 프로테아제, 프로테아제 억제제 및 Rho-연관된 키나제 (ROCK) 억제제를 포함하는 하나 이상의 저장소; 및
d) 액체 핸들러 유니트와 교류하며, 액체 핸들러 유니트가 만능 세포의 자동화 증식 및 유지를 수행하도록 유도하기 위해 배열된 컨트롤러
를 포함하는, 만능 세포의 자동화 유지 및 증식을 위한 장치. - 제40항에 있어서, 컨트롤러가 운용 프로그램을 포함하는 컴퓨터-판독가능한 매체를 포함하는 장치.
- 제40항에 있어서, 컨트롤러가 i) 만능 세포 집단으로부터 배지를 제거하고; ii) 만능 세포를 단백분해 효소와 접촉시키고; iii) 만능 세포를 단백분해 효소와 함께 항온배양하여 세포 클러스터를 분리시키도록 액체 핸들러 유니트, 하나 이상의 저장소, 및 항온배양기 중의 적어도 하나에게 지시하는 장치.
- 제40항에 있어서, 장치가 기계적 교반기 및 흡인기를 추가로 포함하고, 컨트롤러는 세포 클러스터를 추가로 분리시키기 위해서 만능 세포를 기계적 교반 또는 흡인에 적용하도록 액체 핸들러 유니트, 하나 이상의 저장소 및 항온배양기 중의 적어도 하나에게 추가로 지시하는 장치.
- 제40항에 있어서, 컨트롤러가 항온배양된 만능 세포를 프로테아제 억제제와 접촉시키도록 액체 핸들러 유니트, 하나 이상의 저장소, 및 항온배양기 중의 적어도 하나에게 추가로 지시하는 장치.
- 제44항에 있어서, 컨트롤러가 항온배양된 만능 세포를 Rho-연관된 키나제 (ROCK) 억제제와 접촉시키도록 액체 핸들러 유니트, 하나 이상의 저장소, 및 항온배양기 중의 적어도 하나에게 추가로 지시하는 장치.
- 제40항에 있어서, 액체 핸들러 유니트가 적어도 제1 저장소 및 제2 저장소를 포함하고, 여기에서 상기 제1 저장소는 TeSR 배지를 포함하고, 상기 제2 저장소는 TeSR 배지, Rho-연관된 키나제 (ROCK) 억제제 및 프로테아제 억제제를 포함하는 장치.
- 제40항에 있어서, Rho-연관된 키나제 (ROCK) 억제제가 H-1152 또는 H-100인 장치.
- 제40항에 있어서, 만능 세포가 ES 세포 또는 유도된 만능 세포 (iPS)인 장치.
- 제40항에 있어서, 액체 핸들러가 그리퍼 도구 및 액체 취급 도구를 포함하는 장치.
- 제40항에 있어서, 만능 세포가 사람 ES 세포인 장치.
- 제40항에 있어서, 액체 핸들러 유니트와 항온배양기 사이에서 유체 교류를 용이하게 하도록 배열된 로보트 장치를 추가로 포함하는 장치.
- 제40항에 있어서, 액체 핸들러 유니트와 교류하는 제2 또는 그 이상의 저장소를 추가로 포함하는 장치.
- 제52항에 있어서, 제2 저장소가 세포 배양 플레이트, 세포 성장 배지, 또는 단백분해 효소 용액을 포함하는 장치.
- 제40항에 있어서, 액체 핸들러가 적어도 제1 저장소 및 제2 저장소와 교류 상태이며, 여기에서 상기 제1 저장소는 TeSR 배지를 포함하고, 상기 제2 저장소는 Rho-연관된 키나제 (ROCK) 억제제 및 프로테아제 억제제를 추가로 포함하는 TeSR 배지를 포함하는 장치.
- 제40항에 있어서, 컨트롤러가 컴퓨터 내에 포함되는 장치.
- 제40항에 있어서, 상기 항온배양기가 상기 만능 세포의 일부분을 포함하고, 여기에서 장치는 증식된 만능 세포의 적어도 97%에서 세포의 추가의 분화가 없거나 필수적으로 없는 만능 세포의 증식을 제공하도록 배열되는 장치.
- 제40항에 있어서, 항온배양기가 상기 만능 세포의 일부분을 포함하고, 여기에서 상기 만능 세포는 사람 ES 세포인 장치.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US94701307P | 2007-06-29 | 2007-06-29 | |
| US60/947,013 | 2007-06-29 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157036767A Division KR20160005142A (ko) | 2007-06-29 | 2008-06-30 | 배아줄기세포 배양을 위한 자동화 방법 및 장치 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100059789A true KR20100059789A (ko) | 2010-06-04 |
Family
ID=39672032
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157036767A KR20160005142A (ko) | 2007-06-29 | 2008-06-30 | 배아줄기세포 배양을 위한 자동화 방법 및 장치 |
| KR1020107002003A KR20100059789A (ko) | 2007-06-29 | 2008-06-30 | 배아줄기세포 배양을 위한 자동화 방법 및 장치 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157036767A KR20160005142A (ko) | 2007-06-29 | 2008-06-30 | 배아줄기세포 배양을 위한 자동화 방법 및 장치 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US8815585B2 (ko) |
| EP (2) | EP3293256B1 (ko) |
| JP (4) | JP5991796B2 (ko) |
| KR (2) | KR20160005142A (ko) |
| AU (1) | AU2008272949B2 (ko) |
| CA (1) | CA2691793A1 (ko) |
| DK (2) | DK3293256T3 (ko) |
| WO (1) | WO2009006422A1 (ko) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101293300B1 (ko) * | 2011-04-05 | 2013-08-09 | (주)로고스바이오시스템스 | 세포의 분리시기를 판정하는 방법과, 이를 이용한 세포의 계대 배양 방법 및 계대 배양 장치 |
| KR20140101393A (ko) * | 2011-12-01 | 2014-08-19 | 더 뉴욕 스템 셀 파운데이션 | 유도 다능성 줄기 세포 또는 분화된 세포를 제조하기 위한 자동화 시스템 |
| KR20190124608A (ko) * | 2018-04-26 | 2019-11-05 | (주)세포바이오 | 세포배양 자동화 장치 및 방법 |
| US11136556B2 (en) | 2011-12-01 | 2021-10-05 | New York Stem Cell Foundation, Inc. | Systems and methods for producing stem cells and differentiated cells |
Families Citing this family (73)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3354723B1 (en) | 2005-08-29 | 2023-12-13 | Technion Research & Development Foundation Ltd. | Media for culturing stem cells |
| DK3441459T3 (da) | 2006-08-02 | 2021-06-07 | Technion Res & Dev Foundation | Fremgangsmåder til ekspansion af embryonale stamceller i en suspensionskultur |
| US9080145B2 (en) | 2007-07-01 | 2015-07-14 | Lifescan Corporation | Single pluripotent stem cell culture |
| CN101952415B (zh) | 2007-07-31 | 2017-06-27 | 生命扫描有限公司 | 人胚胎干细胞的分化 |
| WO2009105570A2 (en) | 2008-02-21 | 2009-08-27 | Centocor Ortho Biotech Inc. | Methods, surface modified plates and compositions for cell attachment, cultivation and detachment |
| SG188918A1 (ko) | 2008-03-17 | 2013-04-30 | Agency Science Tech & Res | |
| US8828720B2 (en) | 2008-03-17 | 2014-09-09 | Agency For Science, Technology And Research | Microcarriers for stem cell culture |
| US8691569B2 (en) | 2008-03-17 | 2014-04-08 | Agency For Science, Technology And Research | Microcarriers for stem cell culture |
| US9458431B2 (en) | 2008-03-17 | 2016-10-04 | Agency For Science, Technology And Research | Microcarriers for stem cell culture |
| SG10201607710UA (en) | 2008-03-17 | 2016-11-29 | Scripps Research Inst | Combined chemical and genetic approaches for generation of induced pluripotent stem cells |
| JP5734183B2 (ja) | 2008-06-30 | 2015-06-17 | ヤンセン バイオテツク,インコーポレーテツド | 多能性幹細胞の分化 |
| DK2295538T3 (en) * | 2008-07-07 | 2015-12-21 | Takara Bio Inc | Process for producing a pluripotent stem cell |
| RU2555538C2 (ru) | 2008-11-20 | 2015-07-10 | Сентокор Орто Байотек Инк. | Культура плюрипотентных стволовых клеток на микроносителях |
| AU2009316583B2 (en) | 2008-11-20 | 2016-04-21 | Janssen Biotech, Inc. | Methods and compositions for cell attachment and cultivation on planar substrates |
| CA2747398C (en) | 2008-12-17 | 2023-06-20 | The Scripps Research Institute | Generation and maintenance of stem cells |
| EP2398897B1 (en) | 2009-02-20 | 2017-06-28 | Cellular Dynamics International, Inc. | Methods and compositions for the differentiation of stem cells |
| EP2408903B1 (en) * | 2009-03-20 | 2014-08-06 | Agency For Science, Technology And Research | Culture of pluripotent and multipotent cells on microcarriers |
| EP2456862A4 (en) | 2009-07-20 | 2013-02-27 | Janssen Biotech Inc | DIFFERENTIATION OF HUMAN EMBRYONIC STEM CELLS |
| US9008406B2 (en) | 2009-10-09 | 2015-04-14 | Kawasaki Jukogyo Kabushiki Kaisha | Method and apparatus for discriminating undifferentiated pluripotent stem cells, and automated culture method and system |
| WO2011047300A1 (en) * | 2009-10-16 | 2011-04-21 | The Scripps Research Institute | Induction of pluripotent cells |
| ES2539487T3 (es) * | 2009-11-04 | 2015-07-01 | Cellular Dynamics International, Inc. | Reprogramación episómica con compuestos químicos |
| EP4166652A1 (en) | 2009-11-12 | 2023-04-19 | Technion Research & Development Foundation Ltd. | Culture media, cell cultures and methods of culturing pluripotent stem cells in an undifferentiated state |
| US8349609B2 (en) * | 2009-11-24 | 2013-01-08 | University Of Connecticut | Differentiation of human embryonic and induced pluripotent stem cells |
| CN102741395B (zh) | 2009-12-23 | 2016-03-16 | 詹森生物科技公司 | 人胚胎干细胞的分化 |
| AU2011223900A1 (en) | 2010-03-01 | 2012-09-13 | Janssen Biotech, Inc. | Methods for purifying cells derived from pluripotent stem cells |
| EP3936608A1 (en) | 2010-03-31 | 2022-01-12 | The Scripps Research Institute | Reprogramming cells |
| WO2011140231A1 (en) * | 2010-05-05 | 2011-11-10 | Caridianbct, Inc. | Method of reseeding adherent cells grown in a hollow fiber bioreactor system |
| US20130071927A1 (en) * | 2010-05-05 | 2013-03-21 | Sydney Ivf Limited | Media and methods for cell culture |
| WO2011159726A2 (en) | 2010-06-14 | 2011-12-22 | The Scripps Research Institute | Reprogramming of cells to a new fate |
| JP5696144B2 (ja) | 2010-06-25 | 2015-04-08 | 川崎重工業株式会社 | 多能性幹細胞コロニーの識別方法及び装置並びに多能性幹細胞の自動培養方法及び装置 |
| AU2011296381B2 (en) | 2010-08-31 | 2016-03-31 | Janssen Biotech, Inc. | Differentiation of human embryonic stem cells |
| CA2810488A1 (en) | 2010-09-07 | 2012-03-15 | Technion Research & Development Foundation Limited | Novel methods and culture media for culturing pluripotent stem cells |
| KR20140063501A (ko) | 2010-12-22 | 2014-05-27 | 페이트 세러퓨틱스, 인코포레이티드 | 단세포 분류 및 iPSC의 증강된 재프로그래밍을 위한 세포 배양 플랫폼 |
| US20140248698A1 (en) * | 2011-10-21 | 2014-09-04 | Arkray, Inc. | Method for culturing pluripotency-maintained singly dispersed cells by means of laminar flow |
| AU2012355698B2 (en) | 2011-12-22 | 2018-11-29 | Janssen Biotech, Inc. | Differentiation of human embryonic stem cells into single hormonal insulin positive cells |
| CN102604894B (zh) * | 2012-02-29 | 2014-07-30 | 中国科学院广州生物医药与健康研究院 | 用于制备神经干细胞的培养基及其用途 |
| CN108103006A (zh) | 2012-06-08 | 2018-06-01 | 詹森生物科技公司 | 人胚胎干细胞向胰腺内分泌细胞的分化 |
| KR102036780B1 (ko) | 2012-12-31 | 2019-10-25 | 얀센 바이오테크 인코포레이티드 | Hb9 조절제를 사용하는 인간 배아 줄기세포의 췌장 내분비 세포로의 분화 |
| JP6529440B2 (ja) | 2012-12-31 | 2019-06-12 | ヤンセン バイオテツク,インコーポレーテツド | 膵内分泌細胞への分化のためのヒト多能性細胞の懸濁及びクラスタリング |
| US10370644B2 (en) | 2012-12-31 | 2019-08-06 | Janssen Biotech, Inc. | Method for making human pluripotent suspension cultures and cells derived therefrom |
| KR102084561B1 (ko) | 2012-12-31 | 2020-03-04 | 얀센 바이오테크 인코포레이티드 | 췌장 내분비 세포로의 분화를 위한 공기-액체 계면에서의 인간 배아 줄기세포의 배양 |
| US9790465B2 (en) | 2013-04-30 | 2017-10-17 | Corning Incorporated | Spheroid cell culture well article and methods thereof |
| AU2014287013B2 (en) * | 2013-07-12 | 2020-01-23 | President And Fellows Of Harvard College | Systems and methods for cell culture device interconnection and fluidic device interconnection |
| WO2015023658A2 (en) * | 2013-08-12 | 2015-02-19 | Invivosciences Inc. | Automated cell culture system and method |
| EP3604499A1 (en) | 2014-03-04 | 2020-02-05 | Fate Therapeutics, Inc. | Improved reprogramming methods and cell culture platforms |
| CA2949056A1 (en) | 2014-05-16 | 2015-11-19 | Janssen Biotech, Inc. | Use of small molecules to enhance mafa expression in pancreatic endocrine cells |
| WO2016028880A1 (en) | 2014-08-19 | 2016-02-25 | Cellular Dynamics International, Inc. | Neural networks formed from cells derived from pluripotent stem cells |
| JP6930914B2 (ja) | 2014-10-29 | 2021-09-01 | コーニング インコーポレイテッド | 灌流バイオリアクタ・プラットフォーム |
| SG11201703493SA (en) | 2014-10-29 | 2017-05-30 | Corning Inc | Cell culture insert |
| EP3234109A4 (en) | 2014-12-19 | 2018-06-27 | Janssen Biotech, Inc. | Suspension culturing of pluripotent stem cells |
| US9944894B2 (en) | 2015-01-16 | 2018-04-17 | General Electric Company | Pluripotent stem cell expansion and passage using a rocking platform bioreactor |
| WO2016208755A1 (ja) * | 2015-06-25 | 2016-12-29 | 株式会社カネカ | 液体注入方法 |
| WO2017007278A1 (ko) * | 2015-07-09 | 2017-01-12 | 사회복지법인 삼성생명공익재단 | 자동 세포 배양기 및 그 배양기의 동작 방법 |
| CN114717183A (zh) | 2015-08-31 | 2022-07-08 | 爱平世股份有限公司 | 多能干细胞制造系统和生产诱导多能干细胞的方法 |
| CN108367290B (zh) | 2015-10-01 | 2021-06-04 | 伯克利之光生命科技公司 | 井孔板培养器 |
| JP7263005B2 (ja) | 2015-10-16 | 2023-04-24 | フェイト セラピューティクス,インコーポレイテッド | 基底状態の多能性の誘導及び維持に関するプラットフォーム |
| CN109069870B (zh) | 2016-02-24 | 2022-04-29 | 洛克菲勒大学 | 基于胚胎细胞的用于亨廷顿氏病的治疗候选物筛选系统、模型及它们的应用 |
| WO2017162467A1 (en) * | 2016-03-21 | 2017-09-28 | General Electric Company | Pluripotent stem cell expansion and passage using a stirred tank bioreactor |
| MA45479A (fr) | 2016-04-14 | 2019-02-20 | Janssen Biotech Inc | Différenciation de cellules souches pluripotentes en cellules de l'endoderme de l'intestin moyen |
| JP2018000130A (ja) * | 2016-07-05 | 2018-01-11 | 株式会社Ihi | 細胞培養装置 |
| IL303869A (en) * | 2016-07-19 | 2023-08-01 | Accellta Ltd | A medium for growing pluripotent stem cells in suspension |
| DE102016114043B3 (de) | 2016-07-29 | 2017-08-10 | Technische Universität Dresden | Vorrichtung zur Isolierung von Stammzellen aus fötalen Geweben |
| CN109689853B (zh) | 2016-08-27 | 2022-08-23 | 三维生物科技有限公司 | 生物反应器 |
| WO2018089681A1 (en) | 2016-11-10 | 2018-05-17 | Becton, Dickinson And Company | Timeline system for monitoring a culture media protocol |
| JP6968169B2 (ja) * | 2016-12-01 | 2021-11-17 | バークレー ライツ,インコーポレイテッド | ウェルプレートインキュベーター |
| US20190382706A1 (en) * | 2017-02-27 | 2019-12-19 | Koji Tanabe | Somatic cell production system |
| WO2019014610A1 (en) | 2017-07-14 | 2019-01-17 | Corning Incorporated | CELL CULTURE CONTAINER FOR 3D CULTURE AND METHODS OF CULTURING 3D CELLS |
| CN111065729B (zh) | 2017-07-14 | 2024-04-26 | 康宁股份有限公司 | 细胞培养容器 |
| JP7245222B2 (ja) | 2017-07-14 | 2023-03-23 | コーニング インコーポレイテッド | 手動又は自動で培地を交換するための3d細胞培養容器 |
| US11857970B2 (en) | 2017-07-14 | 2024-01-02 | Corning Incorporated | Cell culture vessel |
| JP7171695B2 (ja) | 2018-07-13 | 2022-11-15 | コーニング インコーポレイテッド | 液体培地送達面を含む側壁を有するマイクロキャビティ皿 |
| CN111065725B (zh) | 2018-07-13 | 2024-03-29 | 康宁股份有限公司 | 包括具有互联的壁的微板的流体装置 |
| WO2020013845A1 (en) | 2018-07-13 | 2020-01-16 | Corning Incorporated | Cell culture vessels with stabilizer devices |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4352883A (en) | 1979-03-28 | 1982-10-05 | Damon Corporation | Encapsulation of biological material |
| US4284412A (en) | 1979-07-13 | 1981-08-18 | Ortho Diagnostics, Inc. | Method and apparatus for automated identification and enumeration of specified blood cell subclasses |
| JPS58155087A (ja) * | 1982-03-12 | 1983-09-14 | Olympus Optical Co Ltd | 細胞の自動培養装置 |
| US4498766A (en) | 1982-03-25 | 1985-02-12 | Becton, Dickinson And Company | Light beam focal spot elongation in flow cytometry devices |
| US4661913A (en) | 1984-09-11 | 1987-04-28 | Becton, Dickinson And Company | Apparatus and method for the detection and classification of articles using flow cytometry techniques |
| US4767206A (en) | 1984-12-24 | 1988-08-30 | Flow Cytometry Standards Corporation | Calibration method for flow cytometry using fluorescent microbeads and synthesis thereof |
| US4774189A (en) | 1984-12-24 | 1988-09-27 | Flow Cytometry Standards Corp. | Fluorescent calibration microbeads simulating stained cells |
| US4857451A (en) | 1984-12-24 | 1989-08-15 | Flow Cytometry Standards Corporation | Method of compensating and calibrating a flow cytometer, and microbead standards kit therefor |
| US4989977A (en) | 1985-07-29 | 1991-02-05 | Becton, Dickinson And Company | Flow cytometry apparatus with improved light beam adjustment |
| US4714682A (en) | 1985-12-11 | 1987-12-22 | Flow Cytometry Standards Corporation | Fluorescent calibration microbeads simulating stained cells |
| US5160974A (en) | 1990-06-25 | 1992-11-03 | Flow Science, Inc. | Closed sample cell for use in flow cytometry |
| US5478722A (en) | 1991-02-17 | 1995-12-26 | The Curators Of The University Of Missouri | Preserved cell preparations for flow cytometry and immunology |
| EP0682697A4 (en) | 1993-01-29 | 1997-07-30 | New Brunswick Scientific Co | METHOD AND APPARATUS FOR CULTURING ANCHOR AND SUSPENSION CELLS. |
| US5843780A (en) | 1995-01-20 | 1998-12-01 | Wisconsin Alumni Research Foundation | Primate embryonic stem cells |
| US6325114B1 (en) | 2000-02-01 | 2001-12-04 | Incyte Genomics, Inc. | Pipetting station apparatus |
| AU2003218572B2 (en) * | 2002-04-08 | 2009-08-20 | Octane Biotech, Inc. | Automated tissue engineering system |
| DE102004043256B4 (de) * | 2004-09-07 | 2013-09-19 | Rheinische Friedrich-Wilhelms-Universität Bonn | Skalierbarer Prozess zur Kultivierung undifferenzierter Stammzellen in Suspension |
| MX2007002390A (es) | 2004-09-08 | 2007-04-23 | Wisconsin Alumni Res Found | Medio y cultivo de celulas progenitoras embrionarias. |
| WO2006084040A2 (en) | 2005-02-04 | 2006-08-10 | Massachusetts Institute Of Technology | Engineering vascularized muscle tissue |
| US20060199265A1 (en) | 2005-03-02 | 2006-09-07 | Wolf Michael F | Seeding implantable medical devices with cells |
-
2008
- 2008-06-30 DK DK17192886.4T patent/DK3293256T3/da active
- 2008-06-30 JP JP2010515226A patent/JP5991796B2/ja active Active
- 2008-06-30 US US12/164,969 patent/US8815585B2/en active Active
- 2008-06-30 KR KR1020157036767A patent/KR20160005142A/ko not_active Application Discontinuation
- 2008-06-30 AU AU2008272949A patent/AU2008272949B2/en active Active
- 2008-06-30 WO PCT/US2008/068814 patent/WO2009006422A1/en active Application Filing
- 2008-06-30 EP EP17192886.4A patent/EP3293256B1/en active Active
- 2008-06-30 KR KR1020107002003A patent/KR20100059789A/ko active Application Filing
- 2008-06-30 CA CA2691793A patent/CA2691793A1/en not_active Abandoned
- 2008-06-30 DK DK08781187.3T patent/DK2173863T3/en active
- 2008-06-30 EP EP08781187.3A patent/EP2173863B1/en active Active
-
2013
- 2013-03-19 US US13/847,349 patent/US20130316445A1/en not_active Abandoned
-
2014
- 2014-03-26 JP JP2014063625A patent/JP2014110817A/ja active Pending
-
2016
- 2016-06-24 JP JP2016125186A patent/JP2016168056A/ja active Pending
- 2016-11-08 JP JP2016217785A patent/JP2017023158A/ja active Pending
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101293300B1 (ko) * | 2011-04-05 | 2013-08-09 | (주)로고스바이오시스템스 | 세포의 분리시기를 판정하는 방법과, 이를 이용한 세포의 계대 배양 방법 및 계대 배양 장치 |
| KR20140101393A (ko) * | 2011-12-01 | 2014-08-19 | 더 뉴욕 스템 셀 파운데이션 | 유도 다능성 줄기 세포 또는 분화된 세포를 제조하기 위한 자동화 시스템 |
| US10968435B2 (en) | 2011-12-01 | 2021-04-06 | New York Stem Cell Foundation, Inc. | Automated system for producing induced pluripotent stem cells or differentiated cells |
| US11136556B2 (en) | 2011-12-01 | 2021-10-05 | New York Stem Cell Foundation, Inc. | Systems and methods for producing stem cells and differentiated cells |
| US11732242B2 (en) | 2011-12-01 | 2023-08-22 | New York Stem Cell Foundation, Inc. | Automated system for producing induced pluripotent stem cells or differentiated cells |
| KR20190124608A (ko) * | 2018-04-26 | 2019-11-05 | (주)세포바이오 | 세포배양 자동화 장치 및 방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3293256A1 (en) | 2018-03-14 |
| EP2173863B1 (en) | 2018-10-10 |
| AU2008272949A1 (en) | 2009-01-08 |
| US20090029462A1 (en) | 2009-01-29 |
| CA2691793A1 (en) | 2009-01-08 |
| JP2016168056A (ja) | 2016-09-23 |
| WO2009006422A1 (en) | 2009-01-08 |
| KR20160005142A (ko) | 2016-01-13 |
| DK3293256T3 (da) | 2019-08-12 |
| JP2014110817A (ja) | 2014-06-19 |
| AU2008272949B2 (en) | 2014-05-15 |
| JP2010532173A (ja) | 2010-10-07 |
| JP5991796B2 (ja) | 2016-09-14 |
| JP2017023158A (ja) | 2017-02-02 |
| EP3293256B1 (en) | 2019-05-22 |
| DK2173863T3 (en) | 2019-01-21 |
| EP2173863A1 (en) | 2010-04-14 |
| US8815585B2 (en) | 2014-08-26 |
| US20130316445A1 (en) | 2013-11-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2008272949B2 (en) | Automated method and apparatus for embryonic stem cell culture | |
| Kehoe et al. | Scalable stirred-suspension bioreactor culture of human pluripotent stem cells | |
| CN102307991B (zh) | 微载体上的多能干细胞培养 | |
| CA2595137C (en) | Scalable process for cultivating undifferentiated stem cells in suspension | |
| US11242503B2 (en) | Method for dissociating cell aggregates | |
| AU2014201955B2 (en) | Automated method and apparatus for embryonic stem cell culture | |
| US20190359946A1 (en) | Passaging and harvesting formulation for single-cell human pluripotent stem cells | |
| US20230059873A1 (en) | Expansion of stem cells in suspension in a bioreactor | |
| US20100136598A1 (en) | Novel mesenchymal progenitor cells derived from human blastocyst-derived stem cells | |
| Yamada et al. | Using piggyBac transposon gene expression vectors to transfect Zscan5b gene into mouse pluripotent stem cells | |
| EP3875581A1 (en) | Automated method for preparing keratinocytes | |
| Jing et al. | Stem cell bioprocessing for regenerative medicine | |
| Jacobson et al. | Large-Scale Culture of 3D Aggregates of Human Pluripotent Stem Cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment | ||
| J201 | Request for trial against refusal decision | ||
| A107 | Divisional application of patent | ||
| B601 | Maintenance of original decision after re-examination before a trial | ||
| J301 | Trial decision |
Free format text: TRIAL NUMBER: 2015101006990; TRIAL DECISION FOR APPEAL AGAINST DECISION TO DECLINE REFUSAL REQUESTED 20151125 Effective date: 20170428 |