KR20100055403A - 나노표면 - Google Patents
나노표면 Download PDFInfo
- Publication number
- KR20100055403A KR20100055403A KR1020107002403A KR20107002403A KR20100055403A KR 20100055403 A KR20100055403 A KR 20100055403A KR 1020107002403 A KR1020107002403 A KR 1020107002403A KR 20107002403 A KR20107002403 A KR 20107002403A KR 20100055403 A KR20100055403 A KR 20100055403A
- Authority
- KR
- South Korea
- Prior art keywords
- component
- range
- biocompatible
- titanium
- bone
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/30—Joints
- A61F2/30767—Special external or bone-contacting surface, e.g. coating for improving bone ingrowth
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61C—DENTISTRY; APPARATUS OR METHODS FOR ORAL OR DENTAL HYGIENE
- A61C8/00—Means to be fixed to the jaw-bone for consolidating natural teeth or for fixing dental prostheses thereon; Dental implants; Implanting tools
- A61C8/0012—Means to be fixed to the jaw-bone for consolidating natural teeth or for fixing dental prostheses thereon; Dental implants; Implanting tools characterised by the material or composition, e.g. ceramics, surface layer, metal alloy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/28—Materials for coating prostheses
- A61L27/30—Inorganic materials
- A61L27/306—Other specific inorganic materials not covered by A61L27/303 - A61L27/32
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y30/00—Nanotechnology for materials or surface science, e.g. nanocomposites
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23C—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; SURFACE TREATMENT OF METALLIC MATERIAL BY DIFFUSION INTO THE SURFACE, BY CHEMICAL CONVERSION OR SUBSTITUTION; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL
- C23C22/00—Chemical surface treatment of metallic material by reaction of the surface with a reactive liquid, leaving reaction products of surface material in the coating, e.g. conversion coatings, passivation of metals
- C23C22/05—Chemical surface treatment of metallic material by reaction of the surface with a reactive liquid, leaving reaction products of surface material in the coating, e.g. conversion coatings, passivation of metals using aqueous solutions
- C23C22/06—Chemical surface treatment of metallic material by reaction of the surface with a reactive liquid, leaving reaction products of surface material in the coating, e.g. conversion coatings, passivation of metals using aqueous solutions using aqueous acidic solutions with pH less than 6
- C23C22/46—Chemical surface treatment of metallic material by reaction of the surface with a reactive liquid, leaving reaction products of surface material in the coating, e.g. conversion coatings, passivation of metals using aqueous solutions using aqueous acidic solutions with pH less than 6 containing oxalates
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23C—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; SURFACE TREATMENT OF METALLIC MATERIAL BY DIFFUSION INTO THE SURFACE, BY CHEMICAL CONVERSION OR SUBSTITUTION; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL
- C23C26/00—Coating not provided for in groups C23C2/00 - C23C24/00
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23C—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; SURFACE TREATMENT OF METALLIC MATERIAL BY DIFFUSION INTO THE SURFACE, BY CHEMICAL CONVERSION OR SUBSTITUTION; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL
- C23C8/00—Solid state diffusion of only non-metal elements into metallic material surfaces; Chemical surface treatment of metallic material by reaction of the surface with a reactive gas, leaving reaction products of surface material in the coating, e.g. conversion coatings, passivation of metals
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23C—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; SURFACE TREATMENT OF METALLIC MATERIAL BY DIFFUSION INTO THE SURFACE, BY CHEMICAL CONVERSION OR SUBSTITUTION; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL
- C23C8/00—Solid state diffusion of only non-metal elements into metallic material surfaces; Chemical surface treatment of metallic material by reaction of the surface with a reactive gas, leaving reaction products of surface material in the coating, e.g. conversion coatings, passivation of metals
- C23C8/06—Solid state diffusion of only non-metal elements into metallic material surfaces; Chemical surface treatment of metallic material by reaction of the surface with a reactive gas, leaving reaction products of surface material in the coating, e.g. conversion coatings, passivation of metals using gases
- C23C8/08—Solid state diffusion of only non-metal elements into metallic material surfaces; Chemical surface treatment of metallic material by reaction of the surface with a reactive gas, leaving reaction products of surface material in the coating, e.g. conversion coatings, passivation of metals using gases only one element being applied
- C23C8/10—Oxidising
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23G—CLEANING OR DE-GREASING OF METALLIC MATERIAL BY CHEMICAL METHODS OTHER THAN ELECTROLYSIS
- C23G1/00—Cleaning or pickling metallic material with solutions or molten salts
- C23G1/02—Cleaning or pickling metallic material with solutions or molten salts with acid solutions
- C23G1/10—Other heavy metals
- C23G1/106—Other heavy metals refractory metals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61C—DENTISTRY; APPARATUS OR METHODS FOR ORAL OR DENTAL HYGIENE
- A61C8/00—Means to be fixed to the jaw-bone for consolidating natural teeth or for fixing dental prostheses thereon; Dental implants; Implanting tools
- A61C8/0018—Means to be fixed to the jaw-bone for consolidating natural teeth or for fixing dental prostheses thereon; Dental implants; Implanting tools characterised by the shape
- A61C8/0037—Details of the shape
- A61C2008/0046—Textured surface, e.g. roughness, microstructure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/30—Joints
- A61F2/3094—Designing or manufacturing processes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/30—Joints
- A61F2002/30001—Additional features of subject-matter classified in A61F2/28, A61F2/30 and subgroups thereof
- A61F2002/30667—Features concerning an interaction with the environment or a particular use of the prosthesis
- A61F2002/30719—Means for cleaning prostheses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/30—Joints
- A61F2/30767—Special external or bone-contacting surface, e.g. coating for improving bone ingrowth
- A61F2002/30906—Special external or bone-contacting surface, e.g. coating for improving bone ingrowth shot- sand- or grit-blasted
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/30—Joints
- A61F2/30767—Special external or bone-contacting surface, e.g. coating for improving bone ingrowth
- A61F2002/30925—Special external or bone-contacting surface, e.g. coating for improving bone ingrowth etched
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/30—Joints
- A61F2/30767—Special external or bone-contacting surface, e.g. coating for improving bone ingrowth
- A61F2002/30929—Special external or bone-contacting surface, e.g. coating for improving bone ingrowth having at least two superposed coatings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0092—Means for cleaning prostheses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2310/00—Prostheses classified in A61F2/28 or A61F2/30 - A61F2/44 being constructed from or coated with a particular material
- A61F2310/00005—The prosthesis being constructed from a particular material
- A61F2310/00011—Metals or alloys
- A61F2310/00023—Titanium or titanium-based alloys, e.g. Ti-Ni alloys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2310/00—Prostheses classified in A61F2/28 or A61F2/30 - A61F2/44 being constructed from or coated with a particular material
- A61F2310/00389—The prosthesis being coated or covered with a particular material
- A61F2310/00592—Coating or prosthesis-covering structure made of ceramics or of ceramic-like compounds
- A61F2310/00598—Coating or prosthesis-covering structure made of compounds based on metal oxides or hydroxides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2310/00—Prostheses classified in A61F2/28 or A61F2/30 - A61F2/44 being constructed from or coated with a particular material
- A61F2310/00389—The prosthesis being coated or covered with a particular material
- A61F2310/00592—Coating or prosthesis-covering structure made of ceramics or of ceramic-like compounds
- A61F2310/00598—Coating or prosthesis-covering structure made of compounds based on metal oxides or hydroxides
- A61F2310/00616—Coating made of titanium oxide or hydroxides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/12—Nanosized materials, e.g. nanofibres, nanoparticles, nanowires, nanotubes; Nanostructured surfaces
Abstract
본 발명은 a) 금속산화물에 의해 적어도 부분적으로 피복된 생체적합성 구성요소를 제공하는 단계; 및 b) 상기 금속산화물로 피복된 상기 구성요소의 적어도 일부를 옥살산을 포함하는 수성 조성물로 처리함으로써 변형된 금속산화물을 수득하는 단계를 포함하여 생체적합성 구성요소를 변형시키는 방법에 관한 것이다. 본 발명은 또한 a) 고평부 및/또는 융기부에 의해 분리된 소와를 포함하는 미세구조; 및 b) 파형 형상으로 배열된 함몰부를 포함하며 상기 미세구조 위에 중첩되는 제1나조구조를 포함하는 표면을 가진 기재를 포함하는 생체적합성 구성요소에 관한 것이다.
Description
본 발명은 골조직에 이식하기 위한 향상된 특성을 가진 생체적합성 구성요소(component)에 관한 것이다.
일반적으로는 금속성 임플란트인 정형외과용 또는 치과용 임플란트를 골조직에 이식하기 위해, 오늘날에는 종종 1단계 방법이 사용된다. 1단계 방법에서, 치과용 인공 치근(fixture)과 같은 제1임플란트 구성요소를 일반적으로 골조직에 외과적으로 배치한 다음, 치유용 덮개 또는 지대주(abutment)와 같은 제2임플란트를 외과적 수술후 제1임플란트 구성요소에 직접 부착한다. 그 후, 연조직이 치유용 덮개 또는 제2임플란트 구성요소 주변을 치유하게 한다. 치유용 덮개가 사용되는 경우, 임의의 외과적 방법 없이 수 주 내지 수 개월 후 캡을 제거하고, 지대주와 같은 제2임플란트 구성요소 및 임시 치관을 제1임플란트 구성요소에 부착한다. 1 단계 방법은 예를 들어 문헌[L Cooper et al: "A multicenter 12-month evaluation of single-tooth implants restored 3 weeks after 1-stage surgery", The International Journal of Oral & Maxillofacial Implants, Vol. 16, No 2 (2001)]에 개시되어 있다.
2 단계 방법은 일부 치과용의 경우 여전히 바람직하지만, 일반적으로는 주로 3 개월 이상의 치유기간 동안 부하되지 않고 움직이지 않게 되는 골조직에 제1임플란트 부품(part), 이를 테면 치과용 인공 치근을 외과적으로 배치하는 제1단계가 포함되는데, 이는 골조직이 임플란트 표면 위에서 성장하여 임플란트가 골조직에 잘 부착되도록 하기 위한 것이며, 임플란트 부위를 피복하는 연조직내 절단부(cut)는 임플란트를 치유하도록 한다. 제2단계에서, 임플란트를 피복하는 연조직이 개방되고 제2임플란트 부품, 이를 테면 치과용 지대주 및/또는 보철 치아가 제1임플란트 부품, 이를 테면 상기 인공 치근에 부착되어 최종 임플란트 구조를 형성한다. 본 방법은 예를 들어 문헌[Branemark et al: "Osseointegrated Implants in the Treatment of the Edentulous Jaw, Experience from a 10-year period", Almquist & Wiksell International, Stockholm, Sweden]에 개시되어 있다.
그러나, 치유기간 동안 임플란트가 부하되지 않아야 한다는 사실은 제2임플란트 부품이 치유기간 동안 제1임플란트 부품에 부착될 수 없고/없거나 사용될 수 없다는 것을 의미한다. 이와 관련된 장애의 측면에서, 상기 언급된 제1단계에 필요한 시간을 최소화하거나 심지어 단일 조작으로 모든 이식 절차를 수행하는 것, 즉 1단계 방법을 사용하는 것이 바람직하다.
일부 환자의 경우, 1단계 및 2단계 방법 둘 다 임플란트를 기능적으로 부하하기 전에 적어도 3 개월을 대기하는 것이 바람직한 것으로 고려될 수 있다. 그러나, 1단계 방법을 사용하는 대안법은 이식후 바로(즉시 부하) 또는 이식하고 수 주후(조기 부하) 임플란트를 배치하는 것이다. 이들 방법은 예를 들어 문헌[D M Esposito, pp 836-837, in "Titanium in Medicine, Material Science, Surface Science, Engineering, Biological Responses and Medical Application", Springer-Verlag (2001)]에 개시되어 있다.
임플란트는 임플란트와 골조직 사이의 충분한 안정성 및 결합을 확립하여 상기 개시된 임플란트의 즉시 부하 또는 조기 부하를 가능하게 하는 것이 필수적이다. 주목해야할 것은 임플란트의 즉시 또는 조기 부하는 골형성에 유리할 수 있다는 것이다.
골 임플란트에 사용되는 티타늄, 지르코늄, 하프늄, 탄탈, 니오븀 또는 이들의 합금과 같은 금속 또는 합금 중 일부는 골조직과 비교적 강한 결합을 형성할 수 있으며, 여기서 결합은 그 자체로 골조직만큼 강할 수 있고, 경우에 따라 심지어 더 강할 수 있다. 이러한 종류의 금속성 임플란트 물질 중 가장 주목할만한 예로는 티타늄 및 티타늄의 합금이며, 이러한 관점에서 이들의 특성은 1950년경부터 알려져 있다. 금속과 골조직 사이의 결합은 "골융합"으로 불려왔다(Albrektsson T, Branemark P I, Hansson H A, Lind-stroem J, "Osseointegrated titanium implants. Requirements for ensuring a long-lasting, direct bone anchorage in man", Acta Orthop Scand, 52:155-170 (1981)).
산소, 티타늄, 지르코늄, 하프늄, 탄탈, 니오븀 및 그의 합금과 접촉시 자연산화물로 즉시 피복된다는 것이 주목될 수 있다. 티타늄 임플란트 위의 이러한 자연산화물은 주로 소량의 Ti2O3, TiO 및 Ti3O4를 함유하는 이산화티탄(IV)(TiO2)으로 이루어진다.
(산화된) 금속, 예를 티타늄과 골조직 사이의 결합이 비교적 강할 수 있지만, 이러한 결합을 증강시키는 것이 바람직하다.
임플란트의 부착을 더 우수하게 하여 골융합을 향상시키기 위해, 지금까지 금속성 임플란트를 처리하는 몇 가지 방법이 있다. 이들 중 일부는 예를 들어 임플란트 표면 위를 불규칙하게 하여 미처리 표면에 비해 표면 조도를 증가시킴으로써 임플란트의 형태를 변화시키는 단계를 포함한다. 임플란트와 골조직 사이에 보다 넓은 접촉 및 부착 면적을 제공하는 증가된 표면 조도는 임플란트와 뼈 사이의 기계적 보존력 및 강도를 더욱 우수하게 한다. 표면 조도가 예를 들어 플라즈마 분무, 블라스팅(blasting) 또는 산 에칭에 의해 제공될 수 있다는 것이 당업계에 널리 알려져 있다.
또한, 골모세포, 즉 골형성 세포가 하층 표면의 다수의 화학적 및 물리적 성질에 감작 및 반응한다는 것이 알려져 있다. 임플란트 표면에서의 뼈의 형성은 예를 들어 문헌[Anselme K, "Osteoblast adhesion on biomaterials", Biomatehals 21, 667-681 (2000)]에 개시된 바와 같이, 비광물화 세포외기질(ECM, extracellular materix)을 생성하기 위한 전구 세포의 분비 골모세포로의 분화 및 후속적인 이러한 기질의 석회화를 필요로 한다.
임플란트 표면의 화학적 특성의 변화는 주로 골조직에 대한 임플란트의 보다 우수한 부착을 달성하기 위해 사용되어 왔다. 수산화인회석이 화학적으로 뼈와 관련이 있기 때문에, 몇 가지 방법은 임플란트 표면 위에 수산화인회석과 같은 세라믹 물질의 층을 도포하여 뼈와 임플란트의 결합을 향상시키는 것을 포함한다. 미국 특허 제7,169,317호(Beaty)에는 임플란트 표면으로부터 자연산화물을 제거하는 단계, 산 에칭 또는 생성된 임플란트 표면을 처리하여 실질적으로 균일한 표면 조도를 생성하는 단계 및 그 위에 수산화인회석, 골광물질 및 골 형태형성 단백질과 같은 불연속적인 입자의 골-성장 증강 물질을 침착시키는 단계를 포함하는 골 임플란트의 표면을 제조하는 방법이 개시되어 있다. 에칭 및 침착 단계는 바람직하게는 미반응 산소의 부재하에 불활성 대기를 사용함으로써 수행될 수 있다.
그러나, 수산화인회석을 포함하는 코팅의 공통의 불리한 점은, 임플란트와 코팅 사이보다 코팅과 골 사이에 더 강한 결합이 형성되기 때문에, 이들이 임플란트 표면으로부터 벗겨지거나 파열될 수 있고 쉽게 부서질 수 있어 궁극적으로는 이식의 실패를 유도할 수 있다는 것이다. 단백질 코팅의 사용과 관련하여, 추가의 일면을 고려해야 한다. 단백질의 화학적 성질 때문에, 단백질 코팅을 가진 표면은 그의 생물활성을 유지하기 위해서는 특정의 멸균 및 저장 조건을 요할 수 있다. 또한, 단백질과 같은 생체분자에 대한 숙주 조직 반응(예, 면역학적 반응)은 예측불능일 수 있다. 불활성 대기하의 작업은 불편하고 특수 장비를 요한다는 것을 고려하면, 미국 특허 제7,169,317호 방법의 또 다른 불리한 점은 산화물이 없는 표면을 요한다는 것이다.
US2007/01100890 및 관련 출원 US2007/0112353 및 WO2007/050938(Berckmans III et al)은 임플란트에 대한 세라믹 코팅의 부착 불량의 문제를 해결하기 위한 것이며, 임플란트 표면을 예를 들어 콜로이드 형태의 수산화인회석(HA) 나노결정 및 2-메톡시에탄올 용매를 포함하는 용액에 노출시키는 공정을 통해 조도화된 임플란트 표면에 불연속적인 나노입자를 침착시키는 방법을 개시한고 있다. HA 나노결정은 나노구조를 형성하도록 침착되며, 이는 임플란트의 골융합(osseointegration)을 촉진하도록 의도된다. 그러나, 이러한 방법의 하나의 부정적인 일면은 표면의 유기 오염물의 위험성에 기인한 바람직하지 않을 수 있는 유기 용매, 및 고기능 장비를 사용하는 몇 가지 공정 단계를 필요로 하는 나노결정-함유 조성물의 형성이다. 1 내지 4 시간의 배양시간을 요하는 침착은 실온에서 수행된다.
임플란트 표면의 조도는 세포 증식 및 또한 임플란트 주변의 세포에 의한 성장 인자의 국소 생산에 영향을 미치는 것으로 나타났다. 인간 골모세포의 시험관내 연구를 통해, 미소규모로 조도가 증가된 표면이 보다 평탄한 표면에 비해 세포의 수를 감소시키고 세포 증식을 낮추며 매트릭스 생성을 증가시키는 것으로 나타났다(Martin J Y et al, Proliferation, differentiation, and protein synthesis of human osteoblast-like cells (MG63) cultured on previously used titanium surfaces, Clin Oral Implants Res, Mar 7(1), 27-37, 1996). 또 다른 연구는 표면 조도가 세포증식은 감소시키는 반면 세포 분화를 증강시킨다는 것을 보여주었다(Kieswetter K, Schwartz Z, Hummert T W, Cochran D L, Simpson J, Dean D D, Boyan B D, "Surface roughness modulates the local production of growth factors and cytokines by osteoblast-like MG-63 cells", J Biomed Mater Res, Sep., 32(1), 55-63, 1996). 세포 분화의 증가는 골형성 속도를 증가시킬 가능성이 있다는 것을 내포한다.
최근, 세포 접착능의 조절을 통해 마이크로패턴화에서 나노패턴화 기술로 발전시켰다. 세포 기능은, 인테그린-매개 초점 접착 및 고정-의존성 세포 기능(anchorage-dependent)의 세포내 신호전달을 자극함으로써 나노구조의 물리적 신호에 의해 조절될 수 있는 것으로 여겨진다(Bershadsky A, Kozlov M, and Geiger B, "Adhesion-mediated mechanosensitivity: a time to experiment, and a time to theorize", Curr Opin Cell Biol, 18(5), 472-81, 2006).
EP 1440669B1 및 관련 US2004/0153154A1(Dinkelacker)은 세포 영역에 임플란트를 고정하기 위한 미세구조를 포함하도록 재형태화된 표면을 가진 골 임플란트를 개시하고 있다. 미리 조도화된 표면 위에 도포된 피복층의 형태로 제공되는 미세구조는 원형 빈틈(lacunae)에 의해 분리되는 고밀도 원형 돔의 배열을 포함하는데, 미세구조의 크기는 대략 세포 크기에 버금간다. 미세구조 피복층은 예를 들어 스퍼터링(sputtering)에 의해 도포될 수 있다. 추가로, 스퍼터링에 의해 수득되고 원형 빈틈에 의해 분리되는 원형 돔으로 이루어진 나노구조는 또한 미세구조 위에 제공되는데, 여기서 나노구조의 치수는 상응하는 미세구조의 치수보다 대략 0.1 배 정도로 작다. 그러나, 피복층의 안정성 및 피복층과 임플란트 본체 사이의 부착 융합성과 관련된 문제가 생길 가능성이 있다. 바람직한 표면 조도를 생성하는 또 다른 기술은 임플란트의 구조적 융합성을 유지하면서 마이크로미터- 또는 나노미터-규모의 표면 조도를 가진 금속성 정형외과용 임플란트를 제공하는 방법이 제공된 EP1449544A1(Wen et al)에 개시되어 있다. 이 방법에서, 임플란트 표면에 부착되어 다공성 표면 형상을 규정하는 금속성 요소를 가진 임플란트가 에칭되면 마이크로미터- 또는 나노미터-규모의 표면 조도가 생성된다. 예를 들어, 금속성 요소는 약 40 ㎛ 내지 수 mm의 크기를 가진 금속성 비드(bead)이다. 그러나, 이 방법은 금속성 요소가 코팅 기술에 의해 도포된 다음 소성처리에 의해 임플란트 표면 및 서로에 요소가 융합되기 때문에 고성능의 기술 장비를 사용할 필요가 있고 오히려 힘이 든다. 따라서, 이 방법은 또한 비용이 많이 든다.
요약하면, 현재 임플란트의 골융합을 향상시키기 위한 다수의 현존 기술이 존재하나, 이러한 방법들은 일반적으로 가공성, 비용효율적 및 생물학적 효과 및 이식후 안정성에 관한 결점이 있다. 따라서, 골융합을 더욱 촉진하는 특성을 가진 임플란트의 생성률을 향상시키는 기술이 요구된다.
본 발명의 목적은 골조직에 이식시 구성요소와 골조직 사이에 원하는 부착률을 가지며 상기 골조직과 기계적으로 강한 결합을 형성하는 생체적합성 구성요소를 제공하는 것이다.
본 발명의 또 다른 목적은 이러한 생체적합성 구성요소를 제조하는 방법을 제공하는 것이다.
통상적으로 티타늄, 지르코늄, 하프늄, 탄탈, 니오븀 및 이들의 합금을 다량 피복하는 부동태화 산화물은 주로 금속과 살아있는 조직 사이에 임의의 화학적 상호작용을 방지함으로써 이들 금속에 생체적합성을 제공한다. 그러나, 산화물 구조에 작은 결함을 일으킴으로써, 금속성 구성요소의 생체적합성은 실제로 더욱 증가될 수 있다. 본 발명자들은 금속산화물 표면을 가진 구성요소를 옥살산으로 처리하면 살아있는 뼈에의 이식에 대해 향상된 특성을 가진 구성요소의 변형된 표면 구조가 수득된다는 것을 밝혀내었다.
따라서, 하나의 일면으로 본 발명은 a) 금속산화물에 의해 적어도 부분적으로 피복된 생체적합성 구성요소를 제공하는 단계; 및 b) 상기 금속산화물에 의해 피복된 상기 구성요소의 적어도 일부를 옥살산을 포함하는 수성 조성물로 처리하여 변형된 금속산화물을 수득하는 단계를 포함하는 생체적합성 구성요소의 변형방법에 관한 것이다.
본 방법에 의해 수득된 구성요소는 미세구조 및 상기 미세구조 위에 중첩된 제1나노구조를 포함하는 계층적인 표면 지형을 가지며, 이는 거기에 부착된 골-형성 세포의 활성을 증가시키는 것으로 밝혀졌다.
이식학의 측면에서 심미성에 대한 중요성이 날로 증가하고 있는데, 종래의 산화티타늄 표면의 금속성 회색 광택은 환자의 잇몸을 통해 가시화될 수 있기 때문에, 종래의 티타늄 치과용 임플란트는 완벽한 심미학적 해결책에 대한 장애물로 존재한다. 유리하게도, 본 방법에 의해 수득된 변형된 산화물 표면은 본 발명에 따라 처리하기 전 구성요소 표면의 금속성 회색보다 더 밝고 더 흐린 백색을 가진다. 자연스러운 임플란트가 수득될 수 있기 때문에, 백색은 치과용 구성요소로 매우 바람직하다. 블라스팅처리된 구성요소에서 백색이 가장 잘 보인다. 구성요소의 색 변화는 단계 b)가 완료되었다는 지표로서 사용될 수 있다.
단계 b)의 조성물에서 옥살산의 농도는 0.001 내지 5 M의 범위, 바람직하게는 약 1 M일 수 있고; 단계 b)의 처리시간은 10 내지 60 분 범위, 바람직하게는 20 내지 40 분 범위, 더욱 바람직하게는 약 30 분이다. 단계 b)의 조성물의 온도는 전형적으로 약 20℃ 내지 약 100℃ 범위; 바람직하게는 60℃ 내지 90℃ 범위; 더욱 바람직하게는 약 80℃이다.
임의로 상기 방법은 c) 상기 변형된 산화물의 적어도 일부를 i) 이온화된 불소 및 이온화된 염소를 포함하는 그룹 중에서 선택된 적어도 하나의 물질; 및 ii) 적어도 하나의 산을 포함하는 제2 수성 조성물로 처리하는 단계를 추가로 포함한다.
특히, 단계 c)는 부동태화 산화물이 상기 변형된 금속산화물 위에 형성되기 전에 수행된다. 단계 b)에서 수득된 변형된 산화물이 부동태화 산화물에 의해 피복되기 전에 단계 c)를 수행함으로써, 균일하게 분포된 제2나노구조를 가진 표면이 수득될 수 있고, 이는 구성요소의 골융합을 촉진한다. 따라서, 구성요소가 산소 함유 대기 및 표준 대기압 하에 0℃ 이상, 예를 들어 실온의 온도로 유지되는 경우, 단계 b)와 단계 c) 사이의 간격은 바람직하게는 구성요소의 표면 위에 부동태화 산화물의 형성을 피하기 위해 가능한 한 짧다. 이러한 조건하에, 단계 c)는 단계 b)를 완료하고 180 시간 이하, 예를 들어 단계 b) 이후 72 시간, 36 시간, 24 시간 또는 1 시간 이내에 수행될 수 있다. 바람직하게는, 단계 c)는 단계 b)를 완료하고 30 분 이하 아내에, 바람직하게는 단계 b)를 완료하고 10 분 이하 이내에 수행된다.
제2 수성 조성물의 pH는 0.5 내지 5 범위, 바람직하게는 1 내지 3 범위, 더욱 바람직하게는 약 2일 수 있고; 이온화된 불소 및/또는 염소의 농도는 약 0.05 내지 0.5 M 범위, 바람직하게는 약 0.1 M일 수 있다. 단계 c)의 활성적 처리시간은 10 초 내지 60 분 범위, 바람직하게는 10 초 내지 3 분 범위, 더욱 바람직하게는 10 초 내지 50 초 범위이다. 단계 c)의 조성물의 온도는 전형적으로 15 내지 25℃ 범위; 바람직하게는 18 내지 23℃ 범위이다.
본 발명의 방법은 수용액만을 사용하며, 따라서 구성요소 표면에 남아있는 유기 잔류물과 같은 유기 용매와 관련된 문제를 피한다. 단계 c)에 사용된 수용액은 바람직하게는 불화수소산을 포함한다.
본 방법은 또한 간단한 장비를 사용하며, 쉽게 수행되고, 견고하다. 따라서, 본 발명에 따른 방법은 비용 효율성이 높아 산업적으로 이용하기에 적합하다. 또한, 처리시간은 유리하게 짧다.
추가로, 구성요소의 골융합은 구성요소의 표면에 골-성장 증강 물질을 함유시킴으로써 증강될 수 있다. 이러한 표면은 예를 들어 티타늄 이온, 마그네슘 이온, 칼슘 이온, 리튬 이온, 스트론튬 이온 또는 이들의 임의의 조합으로 이루어진 그룹 중에서 선택될 수 있는 금속 이온 또는 그의 염을 단계 b) 및/또는 단계 c)의 수성 조성물에 함유시킴으로써 달성될 수 있다. 특히, 본 발명자들은 골조직에 국소 투여된 리튬 또는 스트론튬 이온이 상기 골조직의 골형성 및 골질량에 대해 국소 효과를 가진다는 것을 밝혀내었다. 이온화된 리튬 또는 스트론튬을 함유 및/또는 방출하는 표면 산화물을 포함하는 임플란트가 예를 들어 이온화된 칼슘 또는 마그네슘을 함유하는 표면 산화물 층을 포함하는 임플란트에 비해 골형성 속도를 향상시킨다는 것을 추가로 밝혀내었다. 따라서, 단계 b)의 조성물 및/또는 단계 c)의 조성물은 리튬 및/또는 스트론튬 또는 그의 염을 포함할 수 있다. 골융합에 유리한 기재를 제공하기 위해, 생체적합성 구성요소는 바람직하게는 적어도 부분적으로 티타늄 또는 티타늄 합금으로 이루어진다. 따라서, 상기 금속산화물은 바람직하게는 산화티타늄을 포함한다. 금속산화물은 필수적으로 산화티타늄 또는 산화티타늄의 조합으로 이루어질 수 있다. 금속산화물은 부동태화 산화티타늄일 수 있다.
바람직한 초기 표면 조도 또는 바람직한 화학적 특징을 가진 구성요소를 제공하기 위해, 생체적합성 구성요소는 단계 b) 이전에 기계적 및/또는 화학적 표면 처리될 수 있다. 화학적 처리는 예를 들어 본 발명의 방법의 결과 또는 구성요소의 생체적합성에 악영향을 미칠 수 있는 원치않은 물질을 제거하는 세정 공정을 포함할 수 있다. 블라스팅과 같은 조도화 처리(roughening treatment)는 구성요소의 골융합을 더욱 증강시켜 그의 생체역학적 특성을 향상시킬 수 있다.
또 다른 일면으로, 본 발명은 상기 개시된 방법에 의해 수득가능한 구성요소에 관한 것이다.
본 발명자들은 미세구조 및 상기 미세구조 위에 중첩된 제1나노구조를 포함하는 계층적인 표면 지형을 가진 표면이 골조직과의 생체역학적 상호작용 및 골융합이 향상된 임플란트 표면을 제공한다는 것을 밝혀내었다. 따라서, 또 다른 일면으로, 본 발명은 a) 고평부(plateus) 및/또는 융기부(ridge)에 의해 분리된 미세소와(micropit)를 포함하는 미세구조; 및 b) 파형 형상으로 배열된 함몰부를 포함하며 상기 미세구조 위에 중첩되는 제1나조구조를 포함하는 표면을 가진 기재를 포함하는 생체적합성 구성요소에 관한 것이다.
본 발명자들은 상기 표면이 골 전구물질의 분비 및 골모세포 분화를 촉진한다는 것을 밝혀내었다. 미세구조는 기공형상의 소와(pit)를 포함하는 하층의 미세조도를 제공하는데, 이는 증식 및 분화하도록 세포를 자극하는 세포 배양 접시와 유사하다. 아마도, 미세구조 및 제1나노구조를 포함하는 표면 지형은 골흡수가 일어나는 살아있는 골내 부위의 지형과 유사하다. 본 발명에 따른 구성요소의 표면 지형은 임플란트 부위 주변에 존재하는 전골모세포와 일치하며, 골 재형성을 위해 파골세포에 의해 제조된 자연골의 표면을 모방함으로써 골모세포 활성이 본 발명에 따른 구성요소에 의해 신속하고 강하게 유도될 수 있는 것으로 여겨진다. 미세구조는 0.5 내지 15 ㎛, 바람직하게는 1 내지 10 ㎛ 범위의 소와 직경; 및 0.1 내지 2.5 ㎛, 바람직하게는 0.1 내지 1 ㎛ 범위의 깊이를 가질 수 있다. 인접하는 미세소와들 사이의 간격은 10 ㎛ 이하일 수 있다. 제1나노구조의 함몰부는 10 ㎚ 내지 1 ㎛ 범위, 바람직하게는 10 ㎚ 내지 600 ㎚ 범위, 더욱 바람직하게는 10 ㎚ 내지 500 ㎚ 범위의 직경을 가진다. 깊이는 10 ㎚ 내지 300 ㎚의 범위일 수 있고, 전형적으로는 그 범위가 30 내지 150 ㎚이다. 또한, 제1나노구조의 개개의 함몰부의 직경은 전형적으로 같은 함몰부의 깊이를 초과한다.
상기 언급된 바와 같이, 제1나노구조는 제1미세구조 위에 중첩된다. 또한, 제1나노구조의 각각의 직경 및 깊이는 각각 상응하는 미세구조 개개의 소와의 치수보다 작다. 따라서, 미세구조의 개개의 소와는 전형적으로 제1나노구조의 다수의 함몰부를 포함한다. 또한, 제1나노구조의 함몰부의 경계는 전형적으로 제1나노구조의 또 다른 함몰부의 경계를 구성한다.
또한, 상기 개시된 표면은 상기 제1나노구조 위에 균일하게 분포된 패턴으로 중첩되고 원형의 피크 형상을 가진 불연속 돌출부를 포함하는 제2나노구조를 추가로 포함할 수 있다. 제2나노요소는 하층 표면에의 세포의 고정을 향상시켜 세포 활성을 더욱 자극하는 것으로 여겨진다.
본 발명의 생체적합성 구성요소의 제2나노구조는 20 내지 550 ㎚, 바람직하게는 20 내지 150 ㎚ 범위의 피크 직경; 및 5 내지 200 ㎚, 바람직하게는 5 내지 100 ㎚ 범위의 평균 피크 높이를 가질 수 있다. 피크간 간격의 범위는 전형적으로 10 내지 450 ㎚, 바람직하게는 40 내지 200 ㎚이다. 피크 밀도의 범위는 전형적으로 15 내지 150 피크/㎛2, 바람직하게는 50 내지 130 피크/㎛2이다.
골조직-골 임플란트 계면에서, 감소량의 콜라겐 및 미네랄을 함유하는 조직층이 형성되며, 따라서 보통의 건강한 뼈에 비해 강도가 떨어진다. 이러한 조직층의 두께는 골-임플란트 계면의 기계적 강도를 결정한다(Albrektsson, T et al, "Ultrastructural analysis of the interface zone of titanium and gold implants", Advances in Biomatehals 4, 167-177, 1982; Albrektsson, T et al, "Interface analysis of titanium and zirconium bone implants", Biomaterials 6, 97-101, 1985; Albrektsson T, Hansson, H-A, "An ultrastructural characterization of the interface between bone and sputtered titanium or stainless steel surfaces", Biomaterials 7, 201-205, 1986; Hansson, H-A et al, "Structural aspects of the interface between tissue and titanium implants", Journal of Prosthetic Dentistry 50, 108-113, 1983; Johansson, C et al, "Ultrastructural differences of the interface zone between bone and Ti6A14V or commercially pure titanium", Journal of Biomedical Engineering 11, 3-8, 1989; Johansson, C. et al, "Qualitative, interfacial study between bone and tantalum, niobium or commercially pure titanium", Biomaterials 11, 277-280, 1990; Sennerby, L et al, "Structure of the bone-titanium interface in retrieved clinical oral implants", Clinical Oral Implants Research 2, 103-111, 1991; Sennerby, L et al, "infrastructure of the bone-titanium interface in rabbits", Journal of Materials Science: Material in Medicine 3, 262-271, 1992; Sennerby, L et al, "Early tissue response to titanium implants inserted in rabbit cortical bone, Part II: Ultrastructural observations", Journal of Materials Science: Material in Medicine 4, 494-502, 1993). 미세구조 및 제1나노구조를 포함하는 계층적인 표면 지형은 구성요소와 후속적으로 형성된 골조직 사이의 기계적 상호작용을 향상시키는데, 이는 강도가 감소된 덜 두꺼운 조직층을 형성하는 것으로 여겨진다. 제2나노구조는 생체적합성 구성요소와 이식후 주변 골조직 사이의 기계적 상호작용을 추가로 향상시킨다. 따라서, 본 발명의 생체적합성 구성요소는 전단 및 인장 강도가 향상된 골조직-임플란트 계면을 제공한다.
또한, 목적하는 초기 표면 조도 또는 목적하는 화학적 특징을 가진 구성요소를 제공하기 위해, 기재는 기계적 및/또는 화학적 표면 처리될 수 있다. 화학적 처리는 예를 들어 세정 공정을 포함할 수 있다. 블라스팅과 같은 조도화 처리는 후속적으로 형성된 미세구조의 직경 및 깊이, 및 제1나노구조의 직경이 덜 가변적인(즉, 표준 편차 값이 더 작은) 표면 구조를 제공할 수 있다. 본 발명에 따른 구성요소의 표면 균일성의 증가는 구성요소의 골융합을 더욱 증강시켜 그의 생체역학적 특성을 향상시킬 수 있다.
생체적합성 구성요소 기재는 전형적으로 적어도 부분적으로 티타늄 또는 티타늄 합금으로 이루어진다. 바람직하게도, 기재는 티타늄으로 이루어진다. 또한, 제2나노구조는 금속산화물, 바람직하게는 산화티타늄을 포함할 수 있다. 금속산화물로만 이루어질 수 있는 구성요소 표면의 균일성은 이식후 구성요소의 융합성(integrity) 및 장기 안정성 측면에서 매우 유리하다. 추가적으로, 구성요소의 표면 구조는 멸균 절차 및 선반 저장에 대해 안정하다.
본 발명에 따른 구성요소의 골융합은 구성요소의 표면에 골-성장 증강 물질을 포함시킴으로써 더욱 증강될 수 있다. 이러한 표면은 금속 이온, 예를 들어 티타늄 이온, 마그네슘 이온, 칼슘 이온, 리튬 이온, 스트론튬 이온 또는 이들의 임의의 조합으로 이루어진 그룹 중에서 선택된 것들을 함유시킴으로써 달성될 수 있다. 특히, 본 발명자들은 골조직에 국소 투여된 리튬 또는 스트론튬 이온이 상기 골조직의 골형성 및 골질량에 대해 국소 효과를 가진다는 것을 밝혀내었다. 따라서, 본 발명에 따른 구성요소의 표면은 리튬 및/또는 스트론튬 또는 이들의 염을 포함할 수 있다.
본 발명의 생체적합성 구성요소는 치과용 구성요소, 예를 들어 임플란트, 인공 치근, 지대주 또는 이들의 조합, 이를 테면 일체형 임플란트일 수 있다. 생체적합성 구성요소는 또한 정형외과용 구성요소, 이를 테면 환자의 대퇴골경부에 이식하기 위한 고관절 구성요소일 수 있다.
또 다른 일면으로, 본 발명은 상기 설명에 따른 생체적합성 구성요소를 제공하는 단계; 및 ii) 인간 또는 동물의 신체에 상기 생체적합성 구성요소를 이식하는 단계를 포함하여 인간 또는 동물의 신체에 생체적합성 구성요소를 이식하는 방법에 관한 것이다. 예를 들어, 구성요소는 인간 또는 동물의 신체 중 치주 영역에 이식될 수 있다.
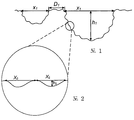
도 1은 미세구조에 대해 사용된 파라미터를 규정하는 개략도이다.
도 2는 제1나노구조에 대해 사용된 파라미터를 규정하는 개략도이다.
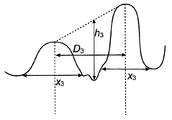
도 3은 제2나노구조에 대해 사용된 파라미터를 규정하는 개략도이다.
도 4는 미세구조와 제1나노구조 각각에 대하여 사용된 각을 규정하는 개략도이다.
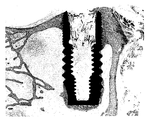
도 5a는 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 5b는 미세구조의 직경이 표시된 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 6a는 제1나노구조의 함몰부가 표시된 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 6b는 제1나노구조의 직경이 표시된 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 7은 종래의 블라스팅 기술로 처리한 티타늄 샘플의 주사전자현미경 사진이다.
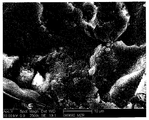
도 8은 본 발명에 따른 블라스팅처리된 티타늄 샘플의 주사전자현미경 사진이다.
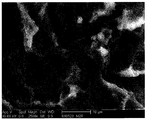
도 9는 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 10은 본 발명에 따른 티타늄 샘플의 원자힘 현미경 3D 이미지이다.
도 11은 미세구조의 요소가 표시된 본 발명에 따른 블라스팅처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 12a-b는 불화수소산과 옥살산의 혼합물에서 처리된 티타늄 대조 샘플의 주사전자현미경 사진이다.
도 12c는 불화수소산에 처리한 다음 옥살산에서 처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 13a-c는 본 발명에 따른 티타늄 샘플에서 미세구조의 소와 직경, 깊이 및 인접하는 미세소와들 사이의 간격 각각의 분포를 나타내는 그래프이다.
도 14a-c는 본 발명에 따른 블라스팅처리된 티타늄 샘플에서 미세구조의 소와 직경, 깊이 및 인접하는 미세소와들 사이의 간격 각각의 분포를 나타내는 그래프이다.
도 15a-b는 본 발명에 따른 티타늄 샘플에서 제1나노구조의 함몰부 직경 및 깊이 각각의 분포를 나타내는 그래프이다.
도 16a-b는 본 발명에 따른 블라스팅처리된 티타늄 샘플에서 제1나노구조의 함몰부 직경 및 깊이 각각의 분포를 나타내는 그래프이다.
도 17a-c는 본 발명에 따른 티타늄 샘플에서 제2나노구조의 피크 직경, 높이 및 피크간 간격 각각의 분포를 나타내는 그래프이다.
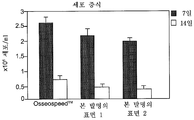
도 18은 상업적인 티타늄 임플란트 표면 및 본 발명에 따른 표면 각각에서 7 일간 성장시킨 세포의 증식을 나타내는 그래프이다.
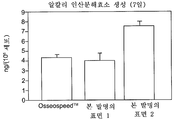
도 19는 상업적인 티타늄 임플란트 표면 및 본 발명에 따른 표면 각각에서 7 일간 세포 배양후 알칼리 인산분해효소의 생성을 나타내는 그래프이다.
도 20a는 36 시간 동안 상업적인 임플란트 표면에서 중심적으로 성장시킨 세포의 주사전자현미경 사진이다.
도 20b는 36 시간 동안 본 발명에 따른 구성요소의 표면에서 성장시킨 세포의 주사전자현미경 사진이다.
도 20c는 36 시간 동안 본 발명에 따른 구성요소의 표면에서 성장시킨 세포의 주사전자현미경 사진이다.
도 21은 상업적인 티타늄 임플란트 표면 및 본 발명에 따른 표면 각각에서 7 일 및 14일 동안 세포 배양후 프로스타글란딘 E2의 생성을 나타내는 그래프이다.
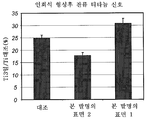
도 22는 토끼 모델에서 본 발명에 따른 임플란트 및 상업적인 티타늄 임플란트에 대한 제거 토크(removal torque) 시험 결과를 나타내는 그래프이다.
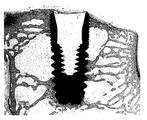
도 23a-b는 이식하고 6 주후 토끼 모델에서 본 발명에 따른 임플란트 및 상업적인 티타늄 임플란트 각각에 대한 조직 단면 사진이다.
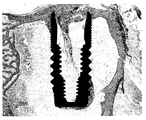
도 24a-b는 이식하고 6 주후 토끼 모델에서 본 발명에 따른 임플란트 및 상업적인 티타늄 임플란트 각각에 대한 조직 단면 사진이다.
도 25a는 상업적인 티타늄 임플란트의 표면을 나타내는 대조 티타늄 샘플의 주사전자현미경 사진이다.
도 25b는 유사체액(SBF)에 침지후 도 25a에 도시된 샘플의 주사전자현미경 사진이다.
도 26a는 본 발명의 단계 b)에 따라 처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 26b는 유사체액(SBF)에 침지후 도 26a에 도시된 샘플의 주사전자현미경 사진이다.
도 27a는 본 발명의 단계 b) 및 c)에 따라 처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 27b는 유사체액(SBF)에 침지후 도 27a에 도시된 샘플의 주사전자현미경 사진이다.
도 28은 에너지 분산형 분석기에 의해 측정된, 본 발명에 따라 처리된 샘플 및 대조 샘플의 인회석 형성후 잔류하는 티타늄 신호를 나타내는 그래프이다.
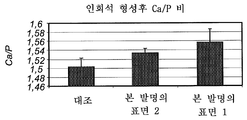
도 29는 본 발명에 따라 처리된 샘플 및 대조 샘플의 인회석 형성후 계산된 Ca/P 비를 나타내는 그래프이다.
도 2는 제1나노구조에 대해 사용된 파라미터를 규정하는 개략도이다.
도 3은 제2나노구조에 대해 사용된 파라미터를 규정하는 개략도이다.
도 4는 미세구조와 제1나노구조 각각에 대하여 사용된 각을 규정하는 개략도이다.
도 5a는 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 5b는 미세구조의 직경이 표시된 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 6a는 제1나노구조의 함몰부가 표시된 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 6b는 제1나노구조의 직경이 표시된 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 7은 종래의 블라스팅 기술로 처리한 티타늄 샘플의 주사전자현미경 사진이다.
도 8은 본 발명에 따른 블라스팅처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 9는 본 발명에 따른 티타늄 샘플의 주사전자현미경 사진이다.
도 10은 본 발명에 따른 티타늄 샘플의 원자힘 현미경 3D 이미지이다.
도 11은 미세구조의 요소가 표시된 본 발명에 따른 블라스팅처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 12a-b는 불화수소산과 옥살산의 혼합물에서 처리된 티타늄 대조 샘플의 주사전자현미경 사진이다.
도 12c는 불화수소산에 처리한 다음 옥살산에서 처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 13a-c는 본 발명에 따른 티타늄 샘플에서 미세구조의 소와 직경, 깊이 및 인접하는 미세소와들 사이의 간격 각각의 분포를 나타내는 그래프이다.
도 14a-c는 본 발명에 따른 블라스팅처리된 티타늄 샘플에서 미세구조의 소와 직경, 깊이 및 인접하는 미세소와들 사이의 간격 각각의 분포를 나타내는 그래프이다.
도 15a-b는 본 발명에 따른 티타늄 샘플에서 제1나노구조의 함몰부 직경 및 깊이 각각의 분포를 나타내는 그래프이다.
도 16a-b는 본 발명에 따른 블라스팅처리된 티타늄 샘플에서 제1나노구조의 함몰부 직경 및 깊이 각각의 분포를 나타내는 그래프이다.
도 17a-c는 본 발명에 따른 티타늄 샘플에서 제2나노구조의 피크 직경, 높이 및 피크간 간격 각각의 분포를 나타내는 그래프이다.
도 18은 상업적인 티타늄 임플란트 표면 및 본 발명에 따른 표면 각각에서 7 일간 성장시킨 세포의 증식을 나타내는 그래프이다.
도 19는 상업적인 티타늄 임플란트 표면 및 본 발명에 따른 표면 각각에서 7 일간 세포 배양후 알칼리 인산분해효소의 생성을 나타내는 그래프이다.
도 20a는 36 시간 동안 상업적인 임플란트 표면에서 중심적으로 성장시킨 세포의 주사전자현미경 사진이다.
도 20b는 36 시간 동안 본 발명에 따른 구성요소의 표면에서 성장시킨 세포의 주사전자현미경 사진이다.
도 20c는 36 시간 동안 본 발명에 따른 구성요소의 표면에서 성장시킨 세포의 주사전자현미경 사진이다.
도 21은 상업적인 티타늄 임플란트 표면 및 본 발명에 따른 표면 각각에서 7 일 및 14일 동안 세포 배양후 프로스타글란딘 E2의 생성을 나타내는 그래프이다.
도 22는 토끼 모델에서 본 발명에 따른 임플란트 및 상업적인 티타늄 임플란트에 대한 제거 토크(removal torque) 시험 결과를 나타내는 그래프이다.
도 23a-b는 이식하고 6 주후 토끼 모델에서 본 발명에 따른 임플란트 및 상업적인 티타늄 임플란트 각각에 대한 조직 단면 사진이다.
도 24a-b는 이식하고 6 주후 토끼 모델에서 본 발명에 따른 임플란트 및 상업적인 티타늄 임플란트 각각에 대한 조직 단면 사진이다.
도 25a는 상업적인 티타늄 임플란트의 표면을 나타내는 대조 티타늄 샘플의 주사전자현미경 사진이다.
도 25b는 유사체액(SBF)에 침지후 도 25a에 도시된 샘플의 주사전자현미경 사진이다.
도 26a는 본 발명의 단계 b)에 따라 처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 26b는 유사체액(SBF)에 침지후 도 26a에 도시된 샘플의 주사전자현미경 사진이다.
도 27a는 본 발명의 단계 b) 및 c)에 따라 처리된 티타늄 샘플의 주사전자현미경 사진이다.
도 27b는 유사체액(SBF)에 침지후 도 27a에 도시된 샘플의 주사전자현미경 사진이다.
도 28은 에너지 분산형 분석기에 의해 측정된, 본 발명에 따라 처리된 샘플 및 대조 샘플의 인회석 형성후 잔류하는 티타늄 신호를 나타내는 그래프이다.
도 29는 본 발명에 따라 처리된 샘플 및 대조 샘플의 인회석 형성후 계산된 Ca/P 비를 나타내는 그래프이다.
본원에 사용된 용어 "생체적합성 구성요소"는 그의 범위에서 살아있는 조직과 장기 또는 단기 접촉시키기 위해 의도된 것으로, 접촉시 조직의 생물학적 반응에 유의적으로 악영향을 초래하지 않는 임의의 구성요소가 포함된다. 생체적합성 구성요소의 일례는 임플란트, 이를 테면 치과용 임플란트이다.
본원에 사용된 용어 "임플란트"는 그 범위에서 적어도 일부가 척추동물, 특히 포유동물, 이를 테면 인간의 신체에 이식되는 임의의 장치이다. 임플란트는 생체구조를 대체하고/하거나 신체의 임의의 기능을 회복하기 위해 사용될 수 있다.
일반적으로, 임플란트는 하나 또는 몇 개의 임플란트 부품으로 구성된다. 예를 들어, 치과용 임플란트는 주로 제2임플란트 부품에 결합되는 치과용 인공 치근, 이를 테면 지대주 및/또는 보철 치아를 포함한다. 그러나, 다른 부품이 연결될 수 있지만, 이식을 목적으로 하는 임의의 장치, 이를 테면 치과용 인공 치근이 단독으로 임플란트로서 언급될 수 있다.
본원에 사용된 용어 "부동태화 (금속성) 산화물"은 자연적으로 형성된 산화물을 말하며, 또한 시간 경과에 따라 유의적으로 더 두껍게 성장하지 않으며 외부 제제와 하층 기재의 임의의 유의적인 화학적 반응을 방지하는 안정한 자연산화물로도 언급된다. 대기 산소와 접촉하여 티타늄 위에 형성된 부동태화 산화티타늄의 두께는 일반적으로 2-5 ㎚이다.
본원에 사용된 용어 "골-성장 증강 물질"은 그의 범위에서 단독 또는 다른 물질과 조합하여 골형성을 촉진(예, 골모세포 또는 전골모세포의 접착, 증식 및 분화의 촉진; 골기질 구성요소의 생성, 골기질 구성요소의 분비 및 골기질의 광물화의 촉진; 및 파골세포 활성의 억제)할 수 있는 임의의 물질을 포함한다.
본원에 사용된 용어 "미세구조"는 그 치수가 일반적으로 0.5 ㎛ 내지 100 ㎛ 범위인 물리적 구조를 말하며, 용어 "나노구조"는 그 치수가 일반적으로 0.1 ㎚ 내지 500 ㎚ 범위인 물리적 구조를 말한다.
본 발명의 생체적합성 구성요소는 치과용 구성요소, 예를 들어 임플란트, 인공 치근 및 지대주, 또는 이들의 조합, 이를 테면 일체의 임플란트일 수 있다. 생체적합성 구성요소는 또한 정형외과용 구성요소, 이를 테면 환자의 대퇴골 경부에 이식하기 위한 고관절 구성요소일 수 있다.
본 발명의 생체적합성 구성요소는 임의의 적합한 물질, 이를 테면 금속, 예를 들어 티타늄 또는 그의 합금, 지르코늄 또는 그의 합금, 하프늄 또는 그의 합금, 니오븀 또는 그의 합금, 탄탈 또는 그의 합금, 크로뮴-바나듐 합금 또는 이들 물질의 임의의 조합, 또는 비금속으로 이루어질 수 있다. 생체적합성 구성요소는 금속층, 예를 들어 비금속성 본체 또는 비금속성 물질로 부분적으로 이루어진 본체를 피복하는 도포된 금속성 표면층으로 제공될 수 있다. 비금속성 물질의 예는 세라믹, 플라스틱 및 복합 물질을 포함한다.
금속산화물은 자연 대기-형성된 산화물일 수 있거나, 본 발명의 따른 방법 이전에 임의 종류의 처리에서 형성될 수 있다.
생체적합성 구성요소는 본 발명에 따른 추가적 변형에 바람직한 기재 표면을 생성하기 위해 임의 종류의 전처리로 처리될 수 있다. 예를 들어, 구성요소는 바람직한 초기 표면 조성물 또는 조도를 수득하기 위해 기계적, 화학적 또는 열적 처리, 또는 이들의 임의의 조합에 의해 전처리될 수 있다. 기계적 처리는 예를 들어 블라스팅 공정을 포함할 수 있다. 화학적 처리는 예를 들어 세정 또는 탈지 공정을 포함할 수 있다.
하나의 일면으로, 본 발명은 생체적합성 구성요소의 변형 방법에 관한 것이다.
본 방법에 따르면, 생체적합성 구성요소의 적어도 일부를 옥살산을 포함하는 수성 조성물로 처리함으로써 변형된 금속산화물이 수득될 수 있다("단계 b)라 함"). 이러한 처리에서, 생체적합성 구성요소 위에 새로운 산화물이 형성되는 동안, 변형된 금속산화물은 용해되고 하층 기재는 에칭된다. 산화물의 용해 및 재산화 공정이 동시에 일어난다.
처리될 생체적합성 구성요소의 일부는 상기 금속산화물에 의해 적어도 부분적으로 피복된다. 본 발명의 구체예에서, 단계 b)는 상기 구성요소를 옥살산의 수성 용액 중에서 격렬한 교반하에 승온으로 특정 시간동안 배치함으로써 수행될 수 있다. 다르게는, 구성요소의 일부만 조성물에 예를 들어 딥핑(dipping)에 의해 침지할 수 있다. 처리를 원치않는 구성요소의 일부는 처리중 차폐될 수 있다.
단계 b)의 조성물의 pH는 산성, 이를 테면 pH 5 이하, pH 2 이하 또는 pH 0.7 이하이어야 한다. 바람직하게는, pH는 공정 편의성의 관점에서 가능한 한 낮다.
옥살산을 포함하는 수성 조성물은 농도 약 0.001 내지 약 5 M 범위의 옥살산을 포함하는 수성 용액, 예를 들어, 상기 범위 내 농도의 옥살산의 용액일 수 있다. 바람직하게도, 조성물 중 옥살산의 농도는 0.01 내지 2 M 범위, 더욱 바람직하게는 0.1 내지 2 M 범위, 가장 바람직하게는 약 1 M이다.
단계 b)를 위해, 생체적합성 구성요소의 적어도 일부는 약 5 내지 약 60 분 범위, 예를 들어 20 내지 40 분의 시간 동안 옥살산을 포함하는 조성물에 침지될 수 있다. 전형적으로, 단계 b)의 처리기간은 약 25 분 또는 약 30 분이다. 단계 b)의 처리는 옥살산을 포함하는 수성 조성물로부터 구성요소가 제거되는 바로 그때를 완료되는 것으로 고려된다.
수성 조성물의 온도 범위는 약 20℃ 내지 약 100℃ 일 수 있다. 전형적으로, 옥살산을 포함하는 수성 조성물의 온도는 60℃ 내지 90℃ 범위, 예를 들어 약 80℃일 수 있다.
예로서, 단계 b)의 처리는 약 1 M의 옥살산 농도를 사용하여 80℃의 온도에서 30 분 동안 수행될 수 있다.
티타늄 구성요소가 사용되는 경우, 단계 b)에서 수득된 변형된 산화물은 공기 중에서 형성된 부동태화 산화티타늄보다 더욱 반응적이며, 공기 중에서 형성된 부동태화 산화티타늄보다 수함량이 더 많다. 아마도, 본 발명의 변형된 산화티타늄은 공기 중에서 형성되거나 화학적 세정 전처리에서 형성된 부동태화 산화티타늄보다 더 무정형이다. 단계 b)에서 수득된 변형된 산화물의 표면 구조는 미세구조 및 제1나노구조를 포함하며, 그의 예가 도 5 및 도 6에 도시되어 있으며 이하에 더욱 상세히 설명될 것이다.
단계 b)에서 수득된 생체적합성 구성요소의 표면의 색은 본 발명의 방법에 따라 처리하기 전 구성요소의 표면의 금속성 회색보다 더 밝고 더 흐리다. 그러나, 블라스팅에 의해 전처리된 본 발명에 따른 구성요소와 단순하게 기계가공된 본 발명에 따른 구성요소 사이에 색 차이가 존재하며, 블라스팅처리된 구성요소는 기계가공된 구성요소보다 더 희다. 색의 변화는 단계 b)가 완료되었다는 지표로서 사용될 수 있다. 그러나, 색의 변화는 초음파욕에서 세척하고 2 분후에 보다 명확하게 나타난다.
단계 b) 이후, 변형된 산화물의 적어도 일부는 이온화된 불소 및 이온화된 염소로 이루어진 그룹 중에서 선택된 적어도 하나의 물질 및 적어도 하나의 산을 포함하는 제2 수성 조성물로 처리될 수 있다("단계 c)"라 함). 단계 c)에 의해, 단계 b)에서 형성된 변형된 금속산화물의 일부가 용해되고 침전되어, 상기 미세구조 및 제1나노구조 위에 중첩된 금속산화물의 균일 분포된 원형의 돌출부를 포함하는 제2나노구조를 형성한다. 다르게는, 용해화 금속산화물의 금속과 복합체를 형성하는 임의의 다른 화합물이 사용될 수 있다. 불소 및 염소가 공지된 티타늄 착화제이다.
구성요소가 공기와 같은 산소 함유 대기에서 표준 대기압하에 적어도 0℃의 온도로 유지되는 경우, 단계 c)는 단계 b)를 완료하고 비교적 짧은 시간 이내에 수행되어야 한다. 단계 b)의 수성 조성물로부터 구성요소가 제거되면 바로 단계 b)가 완료된 것으로 간주된다. 더욱 특히, 단계 c)는 단계 b)에서 수득된 변형된 금속산화물이 그 위에 형성된 부동태화 산화물에 의해 피복되기 전에 수행되어야 한다. 부동태화 산화물은 외부 제제와 하층 물질의 임의의 유의적인 화학적 반응을 방지할 때 형성되는 것으로 간주된다. 단계 b)에서 수득된 변형된 산화물의 반응성은 제2나노구조의 원형 피크의 균일한 분포를 달성하기 위해서는 필수불가결하다. 단계 c) 처리중, 산은 다수의 활성 부위에서 변형된 산화물을 공격하여 산화물을 용해시키는 것으로 여겨진다. 본 공정에서 발생한 수소 기체는 각 활성 부위에서 국소적으로 pH를 증가시킨다. 수성 조성물이 충분히 높은 농도의 금속성 물질을 가진다면, 국소적으로 상승한 pH는 활성 부위에 금속산화물이 침전되도록 한다. 단계 b)에서 수득된 변형된 산화티타늄의 용해는 산화티타늄이 침전되는데 충분히 높은 티타늄 농도를 제공할 수 있다. 부동태화 산화물은 산소의 존재하에 시간 경과에 따라 점차적으로 형성되는데, 구성요소가 산소 함유 대기에서 표준 대기압 하에 적어도 0℃의 온도, 예를 들어 실온(15 내지 25℃)으로 유지되는 경우, 단계 b)와 단계 c) 사이의 시간 간격이 짧을수록 단계 c)의 최종 결과를 향상시킬 것이다. 따라서, 이러한 조건하에 단계 b)와 단계 c)의 간격은 가능한 한 짧게 유지되는 것이 바람직하다. 단계 c)는 단계 b)를 완료하고 180 시간 이내, 예를 들어 단계 b)후 72 시간, 36 시간, 24 시간 또는 1 시간 이내에 수행될 수 있다. 바람직하게도, 단계 c)는 단계 b)를 완료하고 30 분 이하 이내, 더욱 바람직하게는 단계 b)를 완료하고 10 분 이하 이내, 가장 바람직하게는 단계 b)를 완료하고 3 분 이하 이내에 수행된다. 그러나, 구성요소가 불활성 대기하에 유지되거나 부동태화 산화물 표면의 형성을 방지한다면, 단계 b)와 단계 c) 사이의 시간 간격은 상당히 더 길어질 수 있다. 부동태화 산화물의 형성을 피하기 위해, 표준 대기에 비해 반응성 산소의 양이 감소된 임의의 대기가 사용될 수 있다. 예를 들어, 단계 b) 이후, 구성요소는 질소, 헬륨, 네온, 아르곤, 크립톤, 크세논 또는 라돈과 같은 불활성 기체 중에서 놓일 수 있다. 다르게는, 구성요소는 감압 대기하 또는 진공하에 놓일 수 있다. 다르게는, 구성요소는 냉각되거나 동결될 수 있다. 부동태화 산화물의 형성을 부분적으로 또는 완전히 억제하기 위한 상기 방법의 임의의 조합이 또한 사용될 수 있다. 예를 들어, 구성요소는 단계 b)로 처리한 다음 불활성 기체하에 연장 시간동안 동결시키거나 놓아 두고, 그 후 산소 함유 대기 중에서 표준 조건(표준 대기압에서 적어도 0℃의 온도)으로 저장된다. 이 경우, 산소 함유 대기 중에서 상기 표준 조건하에 구성요소에 의해 소비되는 단계 b) 및 단계 c) 사이의 시간은 180 시간 이하, 예를 들어 72 시간 이하, 36 시간 이하, 24 시간 이하, 1 시간 이하, 30 분 이하, 10 분 이하 또는 3 분 이하이어야 한다.
본 발명의 구체예에서, 단계 c)는 구성요소를 불화수소산의 수용액 중에 침지함으로써 수행될 수 있다. 다르게는, 구성요소의 일부만 조성물에 예를 들어 딥핑에 의해 침지할 수 있다. 처리를 원치않는 구성요소의 일부는 처리중 차폐될 수 있다.
수성 조성물은 이온화된 불소 및 이온화된 염소로 이루어진 그룹 중에서 선택된 적어도 하나의 물질 및 적어도 하나의 산을 포함한다. 수성 조성물은 그 범위가 0.5 내지 5 범위, 바람직하게는 1 내지 3 범위, 더욱 바람직하게는 약 2인 pH를 가진 수용액일 수 있다. 이온화된 불소 및/또는 염소의 농도 범위는 약 0.05 내지 0.5 M일 수 있다. 예를 들어, 조성물은 상기 범위 이내의 농도를 가진 불화수소산(HF)의 용액일 수 있다. 바람직하게도, 그 농도가 약 0.1 내지 0.3 M 범위, 더욱 바람직하게는 약 0.1 M인 불화수소산이 사용된다.
단계 c) 처리는 기재 표면 위에서 산이 작용하는 것이 관찰될 때 개시하도록 고려된다. 이러한 활성은 주로 실온에서 약 20-30 초후에 일어나는 구성요소 표면에서의 수소 기체의 형성에 의해 검출될 수 있다. 따라서, 용어 "활성적 처리"는 수소 기체의 최초 기포의 형성을 시작으로 하여 수행되는 처리를 의미한다. 단계 c)의 활성적 처리시간은 10 초 내지 60 분 범위; 이를 테면 10 초 내지 3 분, 10 초 내지 2 분, 10 내지 60 초, 10 내지 50 초, 10 내지 40 초 및 10 내지 30 초이다.
단계 c)는 주위 온도에서 수행될 수 있다. 전형적으로, 단계 c)의 수성 조성물은 15 내지 25℃ 범위의 온도, 예를 들어 18 내지 23℃ 범위의 온도를 가질 수 있다.
예로서, 단계 c)의 처리는 실온에서 40 초의 활성적 처리시간 동안 약 0.1 M의 농도의 불화수소산을 사용하여 수행될 수 있다.
파라미터인 처리시간, 온도, pH 및 농도 중 임의의 하나의 조정은 만족스러운 결과를 얻기 위해서 상기 언급된 범위 이내에서 상기 파라미터 중 임의의 다른 하나의 적절한 조정을 필요로 할 수 있다는 것이 인지될 것이다.
단계 c)에 의해, 더 미세한 구조가 부분적으로 용해될 수 있지만, 일반적으로 단계 b)에서 수득된 계층적인 표면 구조가 유지된다. 단계 c) 이후 수득된 표면 구조가 도 8 및 도 9에 도시되어 있으며 이하에 더욱 상세히 설명될 것이다. 본 발명의 구체예에서, 단계 b)에서 수득된 변형된 금속산화물의 용해에 기인한 금속산화물은 침전하여 미세구조 및 제1나노구조의 상부에 균일하게 분포된 원형 피크를 포함하는 제2나노구조를 형성한다. 본 발명의 구체예에서, 제2나노구조의 피크는 따라서 금속산화물로 이루어진다. 또한, 단계 c) 조성물의 금속 농도를 증가시키기 위해 단계 c)의 수성 조성물에 가용성 금속 화합물이 별도로 첨가될 수 있다.
임의로, 단계 b) 및 단계 c)에 사용되는 조성물은 골-성장 증강 물질을 포함할 수 있다. 골-성장 증강 물질은 금속 이온, 이를 테면 티타늄 이온, 마그네슘 이온, 칼슘 이온, 리튬 이온 및/또는 스트론튬 이온, 또는 이들의 염을 포함할 수 있다. 이들 이온은 조성물에 별도로 첨가될 수 있다. 예를 들어, 단계 b)의 조성물 또는 단계 c)의 조성물은 상기 금속 이온 중 어느 것을 포함할 수 있다. 다르게는, 두 조성물은 금속 이온을 포함할 수 있다. 두 조성물이 금속 이온을 포함하는 경우, 이들은 같은 종 또는 상이한 종의 금속 이온을 포함할 수 있다. 상기 금속 이온 또는 이들의 임의의 조합의 혼합에 의해, 화학적 특성이 변화된, 상기 이온 및/또는 그의 염(들)을 포함하는 변형된 표면이 수득될 수 있다. 따라서, 구성요소의 생체적합성이 향상될 수 있고, 구성요소의 골융합이 자극될 수 있다.
특히, 본 발명자들은 골조직에 국소 투여된 리튬 또는 스트론튬 이온이 상기 골조직에서의 골형성 및 골질량에 대해 국소 효과를 가진다는 것을 밝혀내었다. 이온화된 리튬 또는 스트론튬을 함유 및/또는 방출하는 표면을 포함하는 임플란트가 예를 들어 이온화된 칼슘 또는 마그네슘을 함유하는 표면 산화물을 포함하는 임플란트에 비해 골형성 속도를 향상시키며, 이로써 골조직과 임플란트 사이의 부착률을 향상시킨다는 것을 추가로 밝혀내었다. 따라서, 본 발명의 구체예에서, 단계 b) 및 단계 c)의 조성물 둘 다, 또는 단계 b)의 조성물만 이온화된 리튬 또는 스트론튬 또는 이들의 조합을 포함한다. 다르게는, 단계 c)의 조성물만 이온화된 리튬 또는 스트론튬 또는 이들의 조합을 포함한다.
다르게는, 골-성장 증강 물질, 이를 테면 이온화된 리튬 또는 스트론튬은 본 발명에 따른 단계 b) 또는 단계 c)의 수행 이후 구성요소의 표면 위에 도포될 수 있다.
또 다른 일면으로, 본 발명은 상술한 방법에 의해 수득가능한 생체적합성 구성요소 및 이 생체적합성 구성요소를 인간 또는 동물의 신체에 이식하는 방법에 관한 것이다. 예를 들어, 생체적합성 구성요소는 인간 또는 동물의 신체 중 치주 영역에 이식될 수 있다.
또 다른 일면으로, 본 발명은 미세구조, 상기 미세구조 위에 중첩된 제1나노구조 및 임의로 상기 제1나노구조 위에 중첩된 제2나노구조를 포함하는 계층적 표면 구조를 가진 생체적합성 구성요소에 관한 것이다.
미세구조의 프로파일에 대한 용어 "깊이(h1)", "직경(x1)" 및 "간격(D1)"은 도 1에 정의되어 있다. 소와의 깊이(h1)는 그의 최저점의 중간 표면과 두 개의 인접하는 피크 사이에 그은 가상선 사이의 간격으로서 정의된다. 명확한 피크가 존재하지 않는 경우, 가상선은 표면 프로파일이 본래 편평한 표면 프로파일(평탄역)로부터 벗어나기 시작하는 피크의 점들 사이에 그어진다. 소와의 직경(x1) 및 인접하는 소와들 사이의 간격(D1)은 도 1에 정의된 바와 같은 상기 인접한 점들 사이의 간격이다. 도 1에서, 중첩된 제1나노구조는 또한 미세구조 위에 도식적으로 제공된다. 제1나노구조에 대한 용어 "깊이(h2)" 및 "직경(x2)"은 도 2에 대응적으로 정의되어 있다.
제2나노구조에 대한 용어 "높이(h3)", "직경(x3)" 및 "피크간 간격"은 도 3에 정의되어 있다. 피크 높이는 그의 최저점의 중간 표면과 두 개의 인접하는 피크 사이에 그은 가상선 사이의 간격으로서 정의된다. 피크 직경(x3)은 표면 프로파일이 본래 편평한 표면 프로파일로부터 벗어나기 시작하는 피크의 점들 사이에서 측정된다.
도 4에서, 미세구조의 프로파일에 대한 각 α와 제1나노구조의 프로파일에 대한 각 β가 정의되어 있다. 각 α는 두 가상선 사이의 각으로서 정의되는데, 가상선 하나는 표면 프로파일이 본래 편평한 표면 프로파일로부터 벗어나기 시작하는 점(P1a)에서의 미세구조의 소와 벽의 경사선을 나타내고, 다른 하나는 표면 프로파일이 본래 편평한 표면 프로파일로부터 벗어나기 시작하는 점(P1b)에서의 미세구조의 인접하는 소와의 인접하는 벽의 경사선을 나타낸다. 따라서, 상기 서로 인접하는 소와는 고평부에 의해 분리될 수 있다. 따라서, 두 개의 인접하는 소와가 피크에 의해 분리되는 경우에, 가상선은 상기 피크에서 벽의 기울기를 나타낸다. 각 β는 각각 그의 변곡점(P2a)에서의 제1나노구조의 함몰부 벽의 경사선 및 그의 변곡점(P2b)에서의 제1나노구조의 인접하는 함몰부의 인접하는 벽의 경사선을 나타내는 두 가상선 사이의 각으로서 정의된다. 따라서, 두 개의 오목한 함몰부가 피크에 의해 분리되는 경우에, 변곡점은 상기 피크에 위치한다.
본 발명에 따른 구성요소의 미세구조 및 제1나노구조는 본래 상술한 방법의 단계 b)에서 수득된다. 상술한 바와 같이, 단계 b)는 두껍고 반응적이며 백색 또는 희끄무레한 색을 가진 변형된 산화물 표면을 제공한다. 도 5a는 상기 미세구조 및 상기 제1나노구조를 나타내는, 본 발명에 따른 방법의 단계 b) 이후의 구성요소의 SEM 사진이다. 구성요소는 블라스팅에 의해 전처리된다. 이 사진에 도시된 바와 같이, 미세구조는 크기가 다른 소와 또는 기공 형상의 함몰부를 포함한다. 도 5b는 미세구조의 소와 중 일부의 직경이 표시되어 있는, 본 발명에 따른 단계 b) 이후의 구성요소의 SEM 사진이다.
도 13 및 14는 소와 직경, 소와 깊이 및 미세구조의 서로 인접한 소와들 사이의 간격의 분포를 나타낸다. 예를 들어 미세구조의 소와는 0.5 내지 15 ㎛, 바람직하게는 1 내지 10 ㎛, 더욱 바람직하게는 1 내지 5 ㎛ 범위의 직경(x1); 및 0.1 내지 2.5 ㎛, 바람직하게는 0.1 내지 1 ㎛, 더욱 바람직하게는 0.1 내지 0.7 ㎛ 범위의 깊이(h1)를 가질 수 있다. 인접하는 소와는 전형적으로 고평부 또는 융기부에 의해 분리되는데, 이것은 10 ㎛ 이하, 바람직하게는 5 ㎛ 이하, 더욱 바람직하게는 3 ㎛ 이하의 직경을 가질 수 있다. 따라서, 인접하는 소와들 사이의 간격(D1)은 10 ㎛ 이하, 5 ㎛ 이하 또는 3 ㎛ 이하일 수 있다. 그러나, 분리 융기부를 가진 경우가 종종 있기 때문에, 두 인접하는 소와가 임의의 간격에 의해 전혀 분리되지 않는 것으로 고려될 수 있다.
도 5에 도시된 바와 같이, 미세구조의 개개의 소와의 전반적인 형태는 대략 원형 또는 타원형일 수 있거나 불규칙적일 수 있다. 미세구조는 또한 언더컷(undercut)을 포함할 수 있다. 또한, 더 큰 직경의 소와는 더 작은 직경의 소와 하나 또는 몇 개를 포함할 수 있다.
미세구조는 상기 또는 도 4에 정의된 바와 같이 20°내지 130°; 바람직하게는 30°내지 120°; 더욱 바람직하게는 40°내지 110°; 가장 바람직하게는 50°내지 100° 범위의 각 α를 가질 수 있다.
상술한 미세구조 위에는, 중첩된 제1나노구조가 제공된다. 제1나노구조는 도 5에서 볼 수 있으며, 제1나노구조의 요소가 표시되어 있는 도 6에 추가로 도시되어 있다. 제1나노구조는 파형 형상의 연속적인 구조로서 설명될 수 있다. 제1나노구조는 미세구조의 소와의 벽 및 바닥에 그리고 미세구조의 소와를 분리하는 고평부 및/또는 융기부에 다수의 얕은 함몰부를 포함한다. 제1나노구조의 함몰부의 직경(x2) 범위는 10 ㎚ 내지 1 ㎛, 바람직하게는 10 ㎚ 내지 600 ㎚, 더욱 바람직하게는 10 ㎚ 내지 500 ㎚ 일 수 있고; 제1나노구조의 함몰부의 깊이(h2) 범위는 10 내지 300 ㎚, 바람직하게는 30 내지 150 ㎚ 일 수 있다. 전형적으로, 함몰부는 얕은데, 이는 함몰부의 직경이 그의 깊이를 초과한다는 것을 의미한다. 제1나노구조의 함몰부는 본래 원형 또는 타원형의 형태를 가진다. 도 15 및 16은 제1나노구조의 함몰부의 직경 및 깊이 분포를 나타낸다.
제1나노구조의 함몰부는 명확한 경계 또는 에지를 가질 수 있다. 그러나, 제1나노구조의 함몰부는 또한 상기 함몰부의 바닥으로부터 올라와 그들 사이에 명확한 경계를 형성하지 않고 다음 함몰부로 부드럽게 통과하는 벽을 가질 수 있다. 그러나, 상기한 경우 중 하나에서, 제1나노구조의 함몰부의 경계를 또 다른 함몰부의 경계와 분리하는 한정가능한 간격이 존재하지 않는다. 오히려, 함몰부들이 나란히 놓여 매우 규칙적인 양상을 가진 파형 형상의 패턴을 형성한다. 제1나노구조는 상기 또는 도 4에 정의된 바와 같이 80°내지 160°; 바람직하게는 90°내지 150°; 더욱 바람직하게는 100°내지 140°; 가장 바람직하게는 110°내지 130° 범위의 각 β를 가질 수 있다.
상기 언급된 바와 같이, 제1나노구조는 제1미세구조 위에 중첩된다. 또한, 각각의 제1나노구조의 직경 및 깊이는 각각 미세구조의 개개의 소와의 상응하는 치수보다 작다. 따라서, 미세구조의 개개의 소와는 전형적으로 제1나노구조의 다수의 함몰부를 포함한다. 예를 들어, 미세구조의 소와는 약 5 내지 약 50 개의 함몰부를 포함할 수 있다. 또한, 제1나노구조의 함몰부의 경계 중 일부는 전형적으로 제1나노구조의 또 다른 함몰부의 경계 중 일부를 구성한다.
도 8 및 도 9는 본 발명에 따른 변형된 구성요소의 SEM 사진이다. 도 8에서 샘플은 블라스팅에 의해 전처리되었지만, 도 9에서 샘플은 단순한 기계가공되었다. 이들 도면에서, 상기 언급된 미세구조 및 제1나노구조에 중첩된 제2나노구조를 볼 수 있다. 도 10은 제2나노구조를 추가로 예시하는 원자힘 현미경 (AFM) 사진이다. 도 10에서 볼 수 있는 바와 같이, 제2나노구조는 둥근 피크의 형태를 가진 불연속적인 돌출 요소를 포함한다. 나노피크는 하층 표면 구조 위에 조밀하고 균일하게 분포된다. 예를 들어 단위 면적당 피크의 수는 15 내지 150 피크/㎛2, 바람직하게는 50 내지 130 피크/㎛2 범위일 수 있다.
도 17은 제2나노구조의 피크 직경, 평균 피크 높이 및 피크간 간격 분포를 나타낸다. 전형적으로, 제2나노구조의 평균 피크 높이(h3)의 범위는 5 내지 200 ㎚, 바람직하게는 5 내지 100 ㎚이다. 제2나노구조의 개개의 피크의 직경(x3) 범위는 전형적으로 20 내지 550 ㎚, 바람직하게는 20 내지 150 ㎚이다. 피크간 간격(D3) 범위는 전형적으로 10 내지 450 ㎚, 바람직하게는 40 내지 200 ㎚이다. 도 11은 미세구조, 제1나노구조 및 제2나노구조를 포함하는 구성요소의 SEM 사진을 나타낸 것으로, 여기에는 미세구조의 소와가 표시되어 있다.
본 발명의 구성요소가 옥살산 처리 이전에 블라스팅처리되는 본 발명의 구체예에서, 미세구조 위에 중첩되는 상부 표면 구조가 존재한다. 블라스팅에 의해 전처리된 본 발명에 따른 구성요소의 표면 구조는 전형적으로 10 내지 70 ㎛ 범위의 길이 및 3 내지 20 ㎛ 범위의 깊이를 가진 큰 소와를 포함한다. 전형적으로, 큰 소와는 일반적으로 타원형 형태를 가진다. 인접하는 소와들 사이의 간격 범위는 1 내지 20 ㎛ 일 수 있다. 이러한 큰 소와 구조 위에 상기 언급된 미세구조가 중첩된다. 따라서, 큰 소와들 사이의 표면 및 큰 소와들의 측면 및 바닥은 상기 언급된 미세구조를 분리하는 고평부 및/또는 융기부 및 소와를 포함한다. 종래의 블라스팅처리된 표면의 SEM 사진이 도 7에 도시되어 있다. 블라스팅 전처리는 후속적으로 형성되는 미세구조인 제1나노구조 및 임의의 제2나노구조의 크기에 영향을 미친다. 블라스팅처리된 본 발명에 따른 구성요소에서, 후속적으로 형성되는 미세구조의 크기는 일반적으로 단순히 기계가공된 본 발명에 따른 구성요소의 미세구조보다 약간 큰 치수를 가지며, 후속적으로 형성된 제1나노구조는 일반적으로 단순 기계가공된 본 발명에 따른 구성요소의 제1나노구조보다 약간 작은 치수를 가진다. 추가적으로, 미세구조 및 제1나노구조 모두의 직경 및 미세구조의 깊이는 표 1에 나타낸 표준편차값에 의해 입증되는 바와 같이, 기계가공된 구성요소의 상응하는 특징보다 블라스팅처리된 구성요소에서 더욱 균일하다.
또 다른 일면으로, 본 발명은 인간 또는 동물의 신체에 생체적합성 구성요소를 이식하는 방법에 관한 것이다. 이 방법은 i) 상술한 바와 같은 생체적합성 구성요소를 제공하는 단계 및 ii) 인간 또는 동물의 신체에 상기 구성요소를 이식하는 단계를 포함한다. 예를 들어, 생체적합성 구성요소는 인간 또는 동물의 신체 중 치주 영역에 이식될 수 있다.
실시예
실시예
1 - 표면 변형
(i) 샘플 제조
동전 형태의 티타늄 샘플(각각 기계가공된 것 및 블라스팅처리된 것), 인공 치근(블라스팅처리됨) 및 지대주(기계가공됨)를 통상의 화학적 처리에 의해 세정하였다. 샘플을 1M 옥살산 수용액에 침지하고 격렬한 교반하에 80℃에서 30 분동안 방치하였다. 30 분후, 옥살산 용액으로부터 샘플을 제거하고 물로 세정한 다음 초음파욕 중에서 2 분동안 물로 세정하였다. 세정하고 약 20 분후, 샘플을 활성적 용해가 개시될 때까지 이어 추가의 활성적 처리시간 40 초동안 교반하면서 실온에서 0.1M 불화수소산(HF)의 수용액에 침지하였다. 다음으로, HF 용액으로부터 샘플을 제거하고 물로 세정한 다음 초음파욕에서 5 분동안 물로 세정하였다. 샘플을 공기 중에서 실온으로 약 60 분 동안 건조시키고 멸균하였다.
(
ii
) 표면 지형 측정
단계 b) 이후 세정후 및 단계 c) 이후 건조후 샘플에 대해 ESEM XL 30 (FEI)을 사용하여 주사전자현미경법(SEM)을 수행하였다. 50Ox 내지 1500Ox 배 확대하여 입체 사진을 촬영하고 MeX 5.0 프로그램(앨리코나(Alicona))에 의해 평가하였다. 어떤 필터도 사용하지 않았다. 미세구조의 소와 및 제1나노구조의 함몰부의 깊이 및 직경, 및 미세구조의 인접하는 소와들 사이의 간격을 측정하였다. 결과를 제1미세구조에 대해서는 도 13a-c(기계가공된 샘플) 및 도 14a-c(블라스팅처리된 샘플) 및 제1나노구조에 대해서는 도 15a-b(기계가공된 샘플) 및 도 16a-b(블라스팅처리된 샘플)에 나타내었다. 단계 b) 이후 촬영한 SEM 사진은 도 5a-b 및 6a-b에 나타내었다. 멸균후 촬영한 SEM 사진은 도 8, 9 및 11에 나타내었다.
나노스코프 IIIa(디지털 인스트루먼츠(Digital Instruments))를 사용하여 탭핑모드(TappingModeTM) 원자힘 현미경(AFM)을 수행하였다. 본 발명에 따른 3 개의 샘플의 제2나노구조(기계가공됨)를 샘플당 2 개의 지점에서 분석하였는데, 각각의 지점은 시료의 에지로부터 대략 1 mm에 위치한 곳이다. 분석 면적은 2 ㎛ x 2 ㎛이었다. 피크 높이, 피크 직경, 피크간 간격 및 1 ㎛2 당 피크의 수를 측정하였다. 상기 치수는 mm로 측정되었고, 수득된 프로파일 플롯에 제공된 척도를 사용하여 nm로 전환시켰다. 피크 높이, 피크 직경 및 피크간 간격의 분포를 각각 도 17a-c에 나타내었다.
표 1에는 SEM/MeX 5.0에 의해 측정된, 블라스팅처리되고 기계가공된 구성요소 각각의 미세구조 및 제1나노구조에 대해 측정된 치수의 최대, 최소 및 평균값이 요약되어 있다. AFM에 의해, 기계가공된 구성요소의 제2나노구조에 대해 측정된 최대, 최소 및 평균값도 또한 나타내었다.
| 본 발명의 따라 블라스팅처리된 샘플 및 기계가공된 샘플의 표면 구조 치수 | |||
| 블라스팅처리된 샘플 | 기계가공된 샘플 | ||
| 미세구조 | |||
| 직경(x1) (㎛) |
최대 | 6.8 | 9.83 |
| 최소 | 0.9 | 3.74 | |
| 평균 | 2.97 | 2.24 | |
| SD | 1.26 | 1.59 | |
| 깊이(h1) (㎛) |
최대 | 2.1 | 1.27 |
| 최소 | 0.1 | 0.01 | |
| 평균 | 0.55 | 0.34 | |
| SD | 0.45 | 0.25 | |
| 간격(D1) (㎛) |
최대 | 3.3 | 7.99 |
| 최소 | 0.4 | 0.0 | |
| 평균 | 1.60 | 1.54 | |
| SD | 0.87 | 1.44 | |
| 제1나노구조 | |||
| 직경(x2) (㎚) |
최대 | 1130 | 890 |
| 최소 | 9 | 231 | |
| 평균 | 353 | 506 | |
| SD | 256 | 186 | |
| 깊이(h2) (㎚) |
최대 | 220 | 295 |
| 최소 | 9 | 33 | |
| 평균 | 74 | 117 | |
| SD | 46 | 48 | |
| 제2나노구조 | |||
| 직경(x3) (㎚) |
최대 | 없음 | 253.7 |
| 최소 | 없음 | 14.9 | |
| 평균 | 없음 | 32.4 | |
| SD | 없음 | 22.9 | |
| 높이(h3) (㎚) |
최대 | 없음 | 129.4 |
| 최소 | 없음 | 3.0 | |
| 평균 | 없음 | 32.4 | |
| SD | 없음 | 22.9 | |
| 피크간 간격(D2) (㎚) |
최대 | 없음 | 388.1 |
| 최소 | 없음 | 29.9 | |
| 평균 | 없음 | 128.4 | |
| SD | 없음 | 54.9 | |
비교실시예
1a
블라스팅처리된 티타늄 샘플(동전 형태)을 실온에서 각각 5, 15, 30 및 42 분 교반하에 0.1M 불화수소산 및 1M 옥살산을 포함하는 수용액에 침지하였다. 용액으로부터 샘플을 제거하고 물로 세정한 다음 초음파욕에서 2 분동안 물로 세정하였다. 샘플의 건조후, 표면 지형을 주사전자현미경(ESEM XL 30, FEI)에 의해 조사하였다.
그 결과, 5 분의 상기 처리를 통해 부분적으로 에칭된 영역 및 불균일하게 분포된 돌출 요소를 가진 샘플을 수득하였다. 15 분후 취한 샘플은 소량의 돌출 요소를 포함하는 비교적 편평한 에칭 표면 구조를 나타내었다. 30 분후 취한 샘플의 표면은 박리된 외관을 보였으며 적은 양의 돌출 요소 및 또한 일부 미확인 입자를 포함하였다. 5 분동안 처리한 건조 샘플의 SEM 사진을 도 12a에 나타내었고, 30 분동안 처리한 건조 샘플의 SEM 사진을 도 12b에 나타내었다.
비교실시예
1b
티타늄 샘플을 활성적 용해가 개시될 때까지 이어 추가의 처리시간 40 초동안 교반하면서 실온에서 0.1M HF 수용액에 침지하였다. 다음으로, HF 용액으로부터 샘플을 제거하고 물로 세정한 다음 초음파욕에서 5 분동안 물로 세정하였다. 세정하고 대략 10 분후, 샘플을 1M 옥살산 수용액에 침지하고 격렬한 교반하에 80℃에서 30 분동안 방치하였다. 30 분후, 옥살산 용액으로부터 샘플을 제거하고 물로 세정한 다음 초음파욕 중에서 2 분동안 물로 세정하였다. 샘플을 실온에서 1 시간 동안 건조시켰다.
건조 샘플의 사진을 주사전자현미경(ESEM XL 30, FEI)으로 촬영하였다. 결과를 도 12c에 나타내었다.
실시예
2 - 세포 증식 및 활성
세포 증식, 알칼리 인산분해효소(ALP)의 생성 및 프로스타글란딘 E2(PGE2)를 각각 상업적인 임플란트 표면(오세오스피드(OsseoSpeedTM); 아스타 테크 아베(Asta Tech AB), 스웨덴) 위에서 성장시킨 세포에 비해 본 발명에 따른 티타늄 표면 위에 시험관내 성장시킨 인간 골모세포에 대해 조사하였다.
(i) 세포 배양
MG-63은 골모세포의 시험관내 연구에 통상적으로 사용되는 인간 세포주이다. 본 연구에서, MG-63 세포(MG-63, ATCC No. CRL-1427, 미국)를 300 ㎖의 팔콘(Falcon) 세포 배양 플라스크(BD, WWR, 스웨덴)에서 동결 세포의 팽대부(ampulla)의 제2계대로부터의 1% 페니실린-스트렙토마이신(PEST; 키브코(Gibco), 영국) 및 5% 소태아혈청(FCS; 키브코(Gibco), 영국)을 함유하는 둘베코 최소 필수 배지(Dulbecco's Minimun Essential Medium, D-MEM)(키브코(Gibco), 영국)로 성장시켰다. 접착 세포가 컨플루언스로 성장되었을 때, 이들을 3 회의 계대 동안 0.05% 트립신-EDTA(키브코(Gibco), 영국)를 사용하여 계대하였다. 광학현미경을 사용하여 계수한 바, 세포 생존률이 높았다(>98%).
(
ii
) 세포 형태(
SEM
)
하나는 본 발명에 따른 단계 b)로 처리하고, 하나는 본 발명에 따른 단계 b) 및 단계 c)로 처리하며, 하나는 상업적으로 입수가능한 표면(오세오스피드(OsseoSpeedTM); 아스타 테크 아베(Asta Tech AB), 스웨덴)을 가진, 3 개의 동전 형태의 β-멸균 티타늄 샘플 본체를 각각 별도의 팔콘(Falcon) 24 웰 플레이트에 배치하였다. 각 웰에 20,000 개 세포/㎖의 세포 농도를 가진 1% PEST(키브코(Gibco), 영국) 및 5% FCS(키브코(Gibco), 영국)를 함유하는 1 ㎖ D-MEM(키브코(Gibco), 영국)을 첨가하였다. 플레이트를 37℃, 5% CO2 및 습도 100%에서 36 시간 동안 배양하였다. 샘플을 4℃에서 글루타르알데하이드를 사용하여 고정하며 오스뮴 사산화물 고정하고, 탈수한 다음 종래의 SEM 샘플 제조 절차에 따라 금 스퍼터링(sputtering)하였다. SEM(ESEM XL 30, FEI)에 의해 세포 형태를 조사하였다. 세포의 SEM 사진이 도 20a(종래의 표면 위에 성장시킨 세포), 도 20b(본 발명의 단계 b)에 따라 처리된 구성요소 위에 성장시킨 세포) 및 도 20c(본 발명에 단계 b) 및 단계 c)에 따라 처리된 구성요소 위에 성장시킨 세포)에 도시되어 있다.
(
iii
) 세포 증식,
ALP
활성 및
PGE2
활성의 평가
한 세트는 본 발명에 따른 단계 b)로 처리하고("본 발명의 표면 1 "), 한 세트는 본 발명에 따른 단계 b) 및 단계 c)로 처리하며("본 발명의 표면 2"), 한 세트는 상업적으로 입수가능한 표면(오세오스피드(OsseoSpeedTM); 아스타 테크 아베(Asta Tech AB), 스웨덴)을 가진, 3 세트(n=6)의 동전 형태의 β-멸균 티타늄 샘플 본체를 각각 별도의 팔콘(Falcon) 24 웰 플레이트(BD, WWR, 스웨덴)에 배치하였다. 각 웰에 20,000 개 세포/㎖의 MG-63 세포 농도를 가진 1% PEST(키브코(Gibco), 영국) 및 5% FCS(키브코(Gibco), 영국)를 함유하는 1 ㎖ D-MEM(키브코(Gibco), 영국)을 첨가하였다. 플레이트를 37℃, 5% CO2 및 습도 100%에서 14 일 동안 배양하였다.
배양 7 일후, 각 웰로부터의 샘플(50 ㎕)을 외인성 ALP에 대해 분석하였다. 접착 세포를 세포 용해, 이어 원심분리 및 제조업자의 지침에 따라 센조라이트(SenzoLyteTM) pNPP 알칼리 인산분해효소 에세이 키트 칼로리미터(Assay Kit Colorimetric, 바이오사이트(BioSite), 스웨덴)를 사용한 상청액 및 세포내 ALP 함량(ng/㎖)의 결정에 의해 외인성 ALP에 대하여 분석하였다. 7 일후, 본 발명에 따른 단계 b) 및 단계 c) 둘 다로 처리된 샘플(본 발명의 표면 2)은 대조 샘플(OsseoSpeedTM) 보다 세포당 ALP의 생성이 현저하게 높게 유도되었다. 결과를 도 19에 나타내었다.
배양 7 일 및 14 일후 각각 제조업자의 지침에 따라 뉴클레오카세트(NucleoCassette), 뉴클레오카운터(NucleoCounter)(케모메텍 에이/에스(ChemoMetec A/S) 덴마크)를 사용하여 웰 당 세포의 총수를 결정하였다. 결과를 도 18에 나타내었다.
배양 7 일 및 14 일후 각각 제조업자의 지침에 따라 엘리사 키트 알앤디 시스템 PGE2 이뮤노에세이(ELISA kit R&D Systems PGE2 Immunoassay)(알앤디 시스템즈(R&D Systems), 영국)를 사용하여 PGE2를 결정하기 위해, 각 웰로부터 300 ㎕의 상청액을 사용하였다. 배양 7 일후, PG2 생성은 대조 샘플에 비해 본 발명에 따른 샘플에서 약간 더 낮았다. 그러나, 14 일후에는 본 발명에 따른 샘플의 모든 세트에서 대조 샘플보다 세포당 PGE2의 생성이 현저하게 높게 유도되었다. 배양 7 일 및 14 일후의 결과를 각각 도 21에 나타내었다.
요약하면, 본 발명에 따른 샘플은 대조 표면에 비해 접착 세포의 수 및 세포 밀도를 더 낮게 유도하는 것으로 밝혀졌다. 그러나, 본 발명에 따른 표면 위에서 성장된 세포들 가운데, 다수의 세포들이 대조 표면 위에서 성장된 세포에 비해 증식적이었다. 도 20a-c에서 볼 수 있는 바와 같이, 본 발명에 따른 표면 위에서 성장된 세포는 또한 덜 세포자멸적이고 더욱 연장되며, 활성을 암시하는 다수의 작은 돌출부를 가진다.
본 발명에 따른 표면 둘 다에서 성장된 세포는 종래 표면 위에서 성장된 세포의 것에 비해 배양 14 일후 유의적으로 증가하는 PGE2 생성을 나타낸다. 또한, 본 발명에 따른 표면 위에서 성장시킨 세포는 종래의 표면 위에서 성장시킨 세포보다 현저하게 높은 ALP 활성을 가졌다. ALP 및/또는 PGE2의 활성 증가는 ECM의 광물화의 가속, 파골세포 활성의 감소 및 골모세포 활성의 증가와 관련이 있다. 따라서, 결론적으로 본 발명은 골형성 속도 및 골융합이 향상된 생체적합성 구성요소를 제공한다.
실시예
3 - 이식
본 발명에 따른 임플란트의 융합은 토끼 모델에서 시험되었다. 상업적으로 입수가능한 대조 임플란트에 대한 응답과 비교하여 본 발명에 따른 2 개의 임플란트 표면 변형에 대한 생체내 골조직 응답을 정성적으로 및 정량적으로 연구하는 것이 목적이다.
(i) 제거 토크 시험
실시예 1에 개시된 바와 같이(즉, 단계 b) 및 c) 포함) 옥살산 이어 HF에 침지하여 제조된 티타늄 토크 인공 치근(사각형의 제거 토크 설계, 3.5 x 8.2 mm)를 사용하였다(시험 임플란트 2라 함). 또한, 실시예 1에 따라 옥살산에 침지하여(즉, 단계 c)가 생략됨) 제조된 토크 인공 치근(3.5 x 8.2 mm)을 사용하였다(시험 임플란트 1이라 함). 추가로, 상업적으로 입수가능한 오세오스피드(OsseoSpeedTM) 구강 임플란트를 대표하는 토크 인공 치근(3.5 x 8.2 mm)을 대조 인공 치근으로서 사용하였다.
(
ii
) 조직학적 및
조직계측학적
연구를 위한 임플란트
상기 실시예 1에 개시된 바와 같이 제조된 구강 임플란트의 인간 설계 인공 치근(3.5 x 8 mm)을 사용하였다(시험 임플란트 2). 또한, HF 처리(즉, 단계 c))가 생략된 것을 제외하고 실시예 1에 개시된 바와 같이 제조된 인공 치근을 사용하였다(3.5 x 8 mm)(시험 임플란트 1). 추가로, 상업적으로 입수가능한 오세오스피드(OsseoSpeedTM) 구강 임플란트를 대표하는 인공 치근(3.5 x 8 mm)을 대조 인공 치근으로서 사용하였다.
(
iii
) 임플란트 삽입
12 마리의 성숙 수컷 뉴질랜드 백색 토끼의 수술 계획을 세웠다. 한 마리는 초기 마취 동안 죽었다(8 번). 수술은 평온하게 진행되었다. NaCl 냉각을 계속하면서 저속으로 천공하였다(천공을 위해 1500 rpg 및 임플란트 삽입을 위해 20 rpm).
하나의 임플란트(구강 임플란트의 인간 설계; 3.5 x 8 mm)는 각각의 대퇴골 관절구 영역에 삽입하였고, 3 개의 임플란트(사각형 제거 토크 설계; 3.5 x 8.2 mm)는 각각의 정강이뼈 조면에 삽입하였다. 대퇴골 임플란트는 조직계측학적 분석을 위해, 정강이뼈 임플란트는 제거 토크 시험을 위해 계획을 세웠다.
(
iv
) 제거 토크 시험
6 주후에 연구를 종료하였고 래트를 희생시켰다. 임플란트 및 주변 조직을 조사하였다. 정강이뼈 임플란트는 배치하기 쉬웠고 이들 모두 골막 골조직 성장의 신호를 나타내었다. 제거 토크 시험(RTQ)과 함께 임플란트-골 계면의 생체역학적 시험을 수행하였다. RTQ 기구(데텍토르 아베(Detektor AB), 스웨덴 괴테보르크)는 골층(bone bed)에서 임플란트 안정성(피크 이완 토크(Ncm))을 시험하는데 사용되는 스트레인 게이지 변환기(strain gauge transducer)를 포함하는 전자 장비로서, 대략적으로 골조직과 임플란트 사이의 계면 전단 강도를 반영하는 삼차원 시험으로서 간주될 수 있다(Johansson C. B., Albrektsson T., Clin Oral Implants Res 1991; 2:24-9). 융합의 실패가 수득될 때까지 임플란트의 동축 위에 선형으로 증가하는 토크를 인가하고 피크 값을 기록하였다. 대퇴골에 삽입된 임플란트는 골조직과 임플란트 헤드의 "완벽한 피복"을 빈번하게 나타내었다. 대퇴골 임플란트를 고정용액에 침지하고 조직학적 및 조직계측학적 조사를 위해 추가로 처리하였다.
제거 토크 시험에 대한 시험 임플란트 1, 시험 임플란트 2 및 대조 임플란트의 평균값을 도 22에 나타내었다. 시험 임플란트 1, 시험 임플란트 2 및 대조 임플란트 모두를 비교한 바 대조 임플란트에 비해 시험 임플란트 2에 대한 제거 토크 값이 25% 향상되었다. 이러한 차이는 통계학적으로 유의하였다(p < 0.05; 스튜던트 t-시험). 또한, 시험 임플란트 1의 제거 토크 값은 대조 임플란트의 것보다 크거나 같았다는 결과가 제시되었다.
(v) 조직학적 평가
6 주후에 연구를 종료하고 토끼를 희생시켰다. 1번 및 5번 토끼로부터 골조직 및 임플란트를 포함하는 대퇴골 임플란트의 샘플을 선택하고, 대퇴골로부터 회수한 임플란트 주위의 여러 영역에서 상응하는 거울상(mi, mirror image) 및 내부 나사산(inner thread) 내측의 골 면적(내부 면적(inner area), ia) 및 골-임플란트 접촉률(BIC, bone to implant contact)을 조직계측학적으로 평가하였다.
각 임플란트에 대한 BIC 및 골면적의 전체 평균값뿐만 아니라 임플란트의 상이한 영역의 BIC 및 골면적의 평균값을 아래 표 2 및 3에 기록하였다. 다음의 임플란트 영역을 평가하였다: (a) 마이크로-나사산; (b) 마크로-나사산; (c) 골수강 내 치근단 측벽(나사산 없음)을 따라; (d) 임플란트의 치근단 바닥에서(이 영역은 유일하게 골 임플란트 접촉율에 대해 보고되어 있다).
| 골 임플란트 접촉률( BIC )에 대한 평균값(총 접촉률의 %) | ||||||
| 샘플 | 마이크로- 나사산 |
마크로- 나사산 |
치근단 측벽 |
평균값 | 치근단 바닥 |
바닥을 포함하는 총 평균값 |
| 1번 토끼 시험 임플란트 2 |
14 | 30 | 15 | 20 | 30 | 22 |
| 1번 토끼 대조 |
5 | 3 | 10 | 6 | 9 | 7 |
| 5번 토끼 시험 임플란트 1 |
15 | 7.5 | 23 | 15 | 7 | 13 |
| 5번 토끼 대조 |
14 | 19 | 15 | 16 | 21 | 17 |
| 골면적의 평균값(총 면적의 %) | ||||
| 샘플 | 마이크로-나사산(ia/mi) | 마크로-나사산 (ia/mi) |
치근단 측벽 (ia/mi) |
평균값 (ia/mi) |
| 1번 토끼 시험 임플란트 2 |
29/35 | 29/31 | 69/43 | 42/36 |
| 1번 토끼 대조 |
13/26 | 10/8 | 29/10 | 17/15 |
| 5번 토끼 시험 임플란트 1 |
34/45 | 9/6 | 48/4 | 30/18 |
| 5번 토끼 대조 |
36/35 | 25/17 | 6/10 | 22/31 |
대조 임플란트의 5번 토끼의 경우, 모든 임플란트에 존재하는 절단부를 통해 단면이 우연히 만들어졌다. 이 샘플의 경우, 계산된 바닥 접촉 간격은 시험 임플란트 1인 3번 토끼 것의 총 간격의 근사치에 기초하였다(도 24a).
표 2 및 표 3에서 알 수 있는 바와 같이, 시험 임플란트 2는 대조 표면에 비해 나사산에서의 골면적이 더 크고 골-임플란트 접촉률도 더 큰 것으로 나타났다. 시험 임플란트 1의 골 임플란트 접촉률은 대조 표면과 거의 동등한 것으로 나타났다. 또한, 대조 임플란트의 것에 비해 나사산에서 더 큰 내부 골면적이 관찰되었다(표 2).
골형성을 정량적으로 나타내는 조직 단면 사진을 도 23-24에 나타내었다: 도 23a는 1번 토끼의 시험 임플란트 2를 나타내고; 도 23b는 1번 토끼의 대조 임플란트를 나타내며; 도 24a는 5번 토끼의 시험 임플란트 1을 나타내고; 도 24b는 5번 토끼의 대조 임플란트를 나타낸다.
거의 모든 샘플에서, 상부 마이크로-나사산 영역에서 임플란트에 밀착한 상태로 오래된 뼈가 아닌 새로운 뼈가 형성되었음을 보여 주었다. 치근단 바닥층, 골수강내 임플란트의 나사산이 없는 측벽 및 마크로-나사산에서 관찰된 골조직이 또한 새로 형성된 것이다.
1번 토끼에서, 대조 임플란트에 비해 많은 양의 골형성이 시험 임플란트 2 주위에서 진행중인 것으로 관찰되었다. 다양한 형태의 골모세포의 골모세포 띠를 가진 유골선이 빈번히 관찰되었다(도 23a, b).
5번 토끼에서, 대조 임플란트에 비해 많은 양의 골형성이 시험 임플란트 1 주위에서 진행중인 것으로 관찰되었다. 그러나, 1번 토끼의 시험 임플란트 2 주위 만큼 뚜렷하지는 않지만 골모세포가 자주 관찰되었다((도 24a, b).
임플란트 표면은 임플란트 표면에 상관없이 골수강의 지방 세포와 밀접하게 연결되어 있었는데, 이는 민감성 골수 세포에 대해 모든 표면의 생체적합성이 높다는 것을 나타내는 것이다.
실시예
4 -
시험관내
인회석 형성
골형성을 연구하기 위한 종래의 시험관 모델 하나는 유사체액(SBF)에 생체물질을 침지하는 것이다. SBF는 인간의 혈장의 것과 거의 동등한 이온 농도를 가진 용액이다(Kokubo T., Kushitani H., Sakka S., Kitsugi T., Yamamuro T., J Biomed Mater Res 1990; 24: 721-734; Oyane A., Kim H. K., Furuya T., Kokubo T., Miyazaki T., Nakamura T., J Biomed Mater Res 2003; 65A, 188-195). 생체물질의 핵형성 능력에 따라, 골유사 인산칼슘이 그의 표면 위에 침전될 것이다. 생체내 골의 생물활성과 SBF내 인회석 형성의 정량적 상관관계에 대해 보고되어 있다(Kokubo T., Takadama H., Biomaterials 2006; 27: 2907-2915). 현재는 SBF 시험관내 모델이 자주 사용되고 있으며, 국제 표준 ISO 23317:2007E에 의해 기술되어 있다.
(i)
SBF
침지
인간의 혈장(Vander A. J., Sherman J. H., Luciano D. S., "Human physiology The mechanisms of body function", 5th ed. McGraw-Hill Publishing Company, New York, 1990: 349-400)과 매우 유사한 전해질 농도를 가진 변경된 SBF(Oyane A. et al, J Biomed Mater Res 2003; 65A, 188-195)를 선택하였다. 10.806 g NaCl, 1.480 g NaHCO3, 4.092 g Na2CO3, 0.450 g KCl, 0.460 g K2HPO4·3H2O, 0.622 g MgCl2·6H2O, 23.856 g 2-(4-(2-하이드록시에틸)-1-피페라지닐)에탄설폰산(HEPES), 0.776 g CaCl2 및 0.144 g Na2SO4를 2000 ㎖의 탈이온수에 용해시켜 SBF를 제조하였다. HEPES를 200 ㎖ 탈이온수에 용해시킨 다음 상기 용액에 첨가하였다. 37℃에서 1.0M NaOH를 사용하여 최종 pH를 7.40으로 조정하였다. 모든 화학물질은 머크(Merck)(스웨덴)로부터 수득하였으며, 단 NaCl 및 Na2SO4는 플루카(Fluka)(스웨덴)로부터 수득하였다.
본 발명에 따른 단계 b)로 처리된 한 세트(본 발명의 표면 1이라 함), 본 발명에 따른 단계 b) 및 단계 c)로 처리된 한 세트(본 발명의 표면 2), 상업적으로 입수가능한 표면(오세오스피드(OsseoSpeedTM); 아스트라 테크 아베(Astra Tech AB), 스웨덴)을 나타내는 하나의 대조 세트인 3 세트의 동전 형태의 β-멸균 티타늄 샘플을 따로따로 37 ㎖의 SBF에 침지하고 37℃에서 50 ㎖ 폴리스티렌 바이얼(VWR, 스웨덴)을 밀봉하였다. 샘플을 바이얼 두껑에 매달아 둔 다음 분석할 동전의 측면을 임의의 다른 물체에 의해 접촉되지 않게 아래로 배향시킨다. 3 일후, SBF 침지를 중단하고 샘플을 탈이온수로 철저히 세정하여 느슨하게 부착된 임의의 인산칼슘 물질을 제거하였다. 그후, 샘플을 층류 벤치(laminar air flow bench)에서 실온으로 건조시켰다. 각 세트 중 세 개의 샘플은 SBF에 침지하지 않았고, 대조군으로써 제공하였다.
(
ii
) 형성된 인회석의 형태학(
SEM
)
가능한 인회석 형성의 분석은 환경제어형 주사전자현미경(ESEM, XL 30, FEI)을 사용하여 수행하였다. SBF 침지 이전 표면 구조의 SEM 사진을 도 25a(대조), 26a(본 발명의 표면 1) 및 27a(본 발명의 표면 2)에 나타내었다. SBF 침지 이후의 표면 구조를 연구한 바, 결론적으로 박층의 인산칼슘이 모든 세트의 샘플에 형성되었다; 대조(도 25b), 본 발명의 표면 1(도 26b) 및 본 발명의 표면 2 (도 27b).
(
iii
) 형성된 인회석의 화학적 평가(
EDS
)
인회석 형성 이전 및 이후의 화학적 분석을 위해 에너지 분산형 분석기(EDS, Apollo 40, EDAX)를 사용하였다. 티타늄 신호를 분석함으로써, 인산칼슘에 의한 샘플의 피복 정도를 간접적으로 평가할 수 있었다. 본 발명의 표면 2는 SBF 침지 이후 티타늄 신호가 가장 크게 감소된 것으로 나타났는데(도 28), 이는 조사된 샘플의 세트 중 인회석이 가장 많이 형성되었음을 나타내는 것이다.
또한, 무정형 및 결정성 인산칼슘의 상대적 빈도를 추정하기 위해 Ca/P 비를 계산하는데 EDS를 사용하였다. Ca/P 비를 도 29에 나타내었다. 생성된 Ca/P 비는 대조 표면보다 본 발명의 표면 1 및 본 발명의 표면 2에 형성된 인회석의 결정화도가 더 높다는 것을 나타낸다. 삼인산칼슘(Ca3(PO4)2) 및 수산화인회석(Ca5(PO4)3OH)의 화학양론적 Ca/P 원자비는 각각 1.5 및 1.67이다.
요약하면, 초기에 인회석 형성은 모든 세트의 샘플에 형성되었고, 티타늄 신호에 의해 결정된 바, 본 발명의 표면 2가 가장 높은 인회석 피복률를 나타냈다(도 28).
Claims (57)
- a) 금속산화물에 의해 적어도 부분적으로 피복된 생체적합성 구성요소를 제공하는 단계; 및
b) 상기 금속산화물에 의해 피복된 상기 구성요소의 적어도 일부를 옥살산을 포함하는 수성 조성물로 처리하여 변형된 금속산화물을 수득하는 단계
를 포함하는, 생체적합성 구성요소의 변형 방법. - 제1항에 있어서, 단계 b)의 조성물은 옥살산 농도가 0.001 내지 5 M 범위, 바람직하게는 약 1 M이고; 단계 b)의 처리가 10 내지 60 분 범위, 바람직하게는 20 내지 40 분 범위의 처리시간 동안 수행되는 것인 방법.
- 제2항에 있어서, 상기 처리시간이 20 내지 30 분 범위, 더욱 바람직하게는 약 25 분인 방법.
- 제1항 내지 제3항 중 어느 하나의 항에 있어서, 단계 b)의 조성물은 온도가 약 20℃ 내지 약 100℃ 범위; 바람직하게는 60℃ 내지 90℃ 범위; 더욱 바람직하게는 약 80℃인 방법.
- 제1항 내지 제4항 중 어느 하나의 항에 있어서, c) 상기 변형된 금속산화물의 적어도 일부를
i) 이온화된 불소 및 이온화된 염소를 포함하는 그룹 중에서 선택된 하나 이상의 물질; 및 ii) 하나 이상의 산
을 포함하는 제2 수성 조성물로 처리하는 단계를 더 포함하는 것인 방법. - 제5항에 있어서, 부동태화 산화물이 상기 변형된 금속산화물 위에 형성되기 전에 상기 단계 c)가 수행되는 것인 방법.
- 제5항 또는 제6항에 있어서, 상기 구성요소가 산소-함유 대기하에 표준 대기압에서 0℃ 이상으로 유지되는 시간으로서 계산시, 단계 b)를 완료한 후 180 시간 이하 이내에 상기 단계 c)가 수행되는 것인 방법.
- 제5항 내지 제7항 중 어느 하나의 항에 있어서, 상기 단계 c)가 단계 b)를 완료한 후 72 시간 이하 이내에 수행되는 것인 방법.
- 제5항 내지 제7항 중 어느 하나의 항에 있어서, 상기 단계 c)가 단계 b)를 완료한 후 24 시간 이하 이내에 수행되는 것인 방법.
- 제5항 내지 제7항 중 어느 하나의 항에 있어서, 상기 단계 c)가 단계 b)를 완료한 후 1 시간 이하 이내에 수행되는 것인 방법.
- 제5항 내지 제7항 중 어느 하나의 항에 있어서, 상기 단계 c)가 단계 b)를 완료한 후 10 분 이하 이내에 수행되는 것인 방법.
- 제5항 내지 제11항 중 어느 하나의 항에 있어서, 상기 제2 수성 조성물이 불화수소산을 포함하는 것인 방법.
- 제5항 내지 제12항 중 어느 하나의 항에 있어서, 상기 제2 수성 조성물은 pH가 0.5 내지 5 범위, 바람직하게는 1 내지 3 범위, 더욱 바람직하게는 약 2이고; 상기 이온화된 불소 및 이온화된 염소를 포함하는 그룹 중에서 선택된 하나 이상의 물질의 농도가 0.02 내지 0.5 M 범위, 바람직하게는 0.05 내지 0.3 M 범위, 더욱 바람직하게는 약 0.1 M이며; 단계 c)의 처리는 10 초 내지 3 분 범위, 더욱 바람직하게는 10 초 내지 50 초 범위의 활성적 처리시간 동안 수행되는 것인 방법.
- 제5항 내지 제13항 중 어느 하나의 항에 있어서, 상기 제2 수성 조성물은 온도가 15 내지 25℃ 범위; 바람직하게는 18 내지 23℃ 범위인 방법.
- 제1항 내지 제14항 중 어느 하나의 항에 있어서, 상기 단계 b)의 수성 조성물이 골-성장 증강 물질을 포함하는 것인 방법.
- 제5항 내지 제15항 중 어느 하나의 항에 있어서, 상기 제2 수성 조성물이 골-성장 증강 물질을 포함하는 것인 방법.
- 제15항 또는 제16항에 있어서, 상기 골-성장 증강 물질이 금속 이온 또는 그의 염을 포함하는 것인 방법.
- 제17항에 있어서, 상기 금속 이온이 티타늄 이온, 마그네슘 이온, 칼슘 이온, 리튬 이온, 스트론튬 이온 또는 이들의 임의의 조합으로 이루어진 그룹 중에서 선택된 이온을 포함하는 것인 방법.
- 제17항에 있어서, 상기 금속 이온이 리튬 이온을 포함하는 것인 방법.
- 제17항에 있어서, 상기 금속 이온이 스트론튬 이온을 포함하는 것인 방법.
- 제1항 내지 제20항 중 어느 하나의 항에 있어서, 상기 구성요소가 적어도 부분적으로 티타늄 또는 티타늄 합금으로 이루어지는 것인 방법.
- 제1항 내지 제21항 중 어느 하나의 항에 있어서, 상기 금속산화물이 산화티타늄을 포함하는 것인 방법.
- 제1항 내지 제22항 중 어느 하나의 항에 있어서, 상기 금속산화물이 실질적으로 산화티타늄 또는 산화티타늄의 조합으로 이루어진 것인 방법.
- 제1항 내지 제23항 중 어느 하나의 항에 있어서, 상기 금속산화물이 부동태화 산화티타늄을 포함하는 것인 방법.
- 제1항 내지 제24항 중 어느 하나의 항에 있어서, 단계 b) 이전에 상기 구성요소가 기계적 표면 처리되는 것인 방법.
- 제25항에 있어서, 상기 기계적 표면 처리가 블라스팅(blasting)을 포함하는 것인 방법.
- 제1항 내지 제26항 중 어느 하나의 항에 있어서, 단계 b) 이전에 상기 구성요소가 화학적 표면 처리되는 것인 방법.
- 제27항에 있어서, 상기 화학적 표면 처리가 탈지 또는 세정 처리를 포함하는 것인 방법.
- 제1항 내지 제28항 중 어느 하나의 항에 있어서, 상기 생체적합성 구성요소가 임플란트, 인공 치근(fixture), 지대주(abutment), 일체형 임플란트 또는 이들의 조합으로 이루어진 그룹 중에서 선택된 치과용 구성요소인 방법.
- 제1항 내지 제28항 중 어느 하나의 항에 있어서, 상기 생체적합성 구성요소가 정형외과용 구성요소인 방법.
- 제1항 내지 제30항 중 어느 하나의 항에 따른 방법에 의해 수득되는 구성요소.
- i) 제31항에 따른 생체적합성 구성요소를 제공하는 단계; 및
ii) 생체적합성 구성요소를 인간 또는 동물의 신체에 이식하는 단계
를 포함하는, 인간 또는 동물 신체에 생체적합성 구성요소를 이식하는 방법. - 제32항에 있어서, 상기 구성요소가 인간 또는 동물의 신체 중 치주 영역에 이식되는 것인 방법.
- a) 고평부(plateus) 및/또는 융기부(ridge)에 의해 분리된 소와(pit)를 포함하는 미세구조; 및
b) 파형 형상으로 배열된 함몰부를 포함하며 상기 미세구조 위에 중첩되는 제1나조구조
를 포함하는 표면을 가진 기재를 포함하는 것인 생체적합성 구성요소. - 제34항에 있어서, 상기 미세구조는 소와 직경이 0.5 내지 15 ㎛ 범위, 바람직하게는 1 내지 10 ㎛ 범위이고, 깊이가 0.1 내지 2.5 ㎛ 범위, 바람직하게는 0.1 내지 1 ㎛ 범위이며; 상호 인접한 소와간 간격은 O 내지 10 ㎛ 범위인 생체적합성 구성요소.
- 제34항 또는 제35항에 있어서, 상기 제1나노구조의 함몰부는 직경이 10 ㎚ 내지 1 ㎛ 범위, 바람직하게는 10 ㎚ 내지 600 ㎚ 범위, 더욱 바람직하게는 10 ㎚ 내지 500 ㎚ 범위이고; 깊이가 10 ㎚ 내지 300 ㎚ 범위, 바람직하게는 30 내지 150 ㎚ 범위인 생체적합성 구성요소.
- 제34항 내지 제36항 중 어느 하나의 항에 있어서, 상기 제1나노구조의 개개의 함몰부의 직경이 상기 개개의 함몰부의 깊이를 초과하는 것인 생체적합성 구성요소.
- 제34항 내지 제37항 중 어느 하나의 항에 있어서, 상기 제1나노구조의 함몰부의 직경이 상기 함몰부가 중첩되는 미세구조의 소와 직경 보다 작고; 상기 제1나노구조의 함몰부의 깊이가 함몰부가 중첩되는 미세구조의 소와 깊이보다 작은 것인 생체적합성 구성요소.
- 제33항 내지 제38항 중 어느 하나의 항에 있어서, 상기 제1나노구조의 함몰부의 경계 중 적어도 일부가 상기 제1나노구조의 또 다른 함몰부의 경계 중 적어도 일부를 구성하는 것인 생체적합성 구성요소.
- 제33항 내지 제39항 중 어느 하나의 항에 있어서, 상기 구성요소가 기계적 표면 처리되는 것인 생체적합성 구성요소.
- 제40항에 있어서, 상기 기계적 표면 처리가 블라스팅을 포함하는 것인 생체적합성 구성요소.
- 제34항 내지 제41항 중 어느 하나의 항에 있어서, 상기 기재가 적어도 부분적으로 티타늄 또는 티타늄 합금으로 이루어지는 것인 생체적합성 구성요소.
- 제34항 내지 제41항 중 어느 하나의 항에 있어서, 상기 기재가 티타늄으로 이루어지는 것인 생체적합성 구성요소.
- 제34항 내지 제43항 중 어느 하나의 항에 있어서, 상기 제1나노구조 위에 균일하게 분포된 패턴으로 중첩되고 둥근 피크 형상을 가진 분리된(discrete) 돌출부를 포함하는 제2나노구조를 더 포함하는 것인 생체적합성 구성요소.
- 제44항에 있어서, 상기 제2나노구조는 피크 직경이 20 내지 550 ㎚ 범위, 바람직하게는 20 내지 150 ㎚ 범위이고; 평균 피크 높이가 5 내지 200 ㎚ 범위, 바람직하게는 5 내지 100 ㎚ 범위이며; 피크 대 피크 거리가 10 내지 450 ㎚ 범위, 바람직하게는 40 내지 200 ㎚ 범위인 생체적합성 구성요소.
- 제44항 또는 제45항에 있어서, 상기 제2나노구조가 15 내지 150 피크/㎛2 범위, 바람직하게는 50 내지 130 피크/㎛2 범위의 피크 밀도를 포함하는 것인 생체적합성 구성요소.
- 제44항 내지 제46항 중 어느 하나의 항에 있어서, 상기 나노요소가 금속산화물을 포함하는 것인 생체적합성 구성요소.
- 제47항에 있어서, 상기 나노요소가 산화티타늄을 포함하는 것인 생체적합성 구성요소.
- 제34항 내지 제48항 중 어느 하나의 항에 있어서, 상기 표면이 골-성장 증강 물질을 포함하는 것인 생체적합성 구성요소.
- 제44항 내지 제49항 중 어느 하나의 항에 있어서, 상기 나노요소의 적어도 일부가 골-성장 증강 물질을 포함하는 것인 생체적합성 구성요소.
- 제49항 또는 제50항에 있어서, 상기 골-성장 증강 물질이 티타늄 이온, 마그네슘 이온, 칼슘 이온, 리튬 이온, 스트론튬 이온 또는 이들의 임의의 조합으로 이루어진 그룹 중에서 선택되는 금속 이온 또는 그의 염을 포함하는 것인 생체적합성 구성요소.
- 제49항 또는 제50항에 있어서, 상기 골-성장 증강 물질이 리튬 이온을 포함하는 것인 생체적합성 구성요소.
- 제49항, 제50항 또는 제52항 중 어느 하나의 항에 있어서, 상기 골-성장 증강 물질이 스트론튬 이온을 포함하는 것인 생체적합성 구성요소.
- 제34항 내지 제53항 중 어느 하나의 항에 있어서, 상기 구성요소가 임플란트, 인공 치근, 지대주, 일체형 임플란트 및 이들의 조합으로 이루어진 그룹 중에서 선택되는 치과용 구성요소인 생체적합성 구성요소.
- 제34항 내지 제53항 중 어느 하나의 항에 있어서, 상기 구성요소가 정형외과용 구성요소인 생체적합성 구성요소.
- i) 제34항 내지 제55항 중 어느 하나의 항에 따른 생체적합성 구성요소를 제공하는 단계; 및
ii) 상기 생체적합성 구성요소를 인간 또는 동물의 신체에 이식하는 단계
를 포함하는, 생체적합성 구성요소를 인간 또는 동물의 신체에 이식하는 방법. - 제56항에 있어서, 상기 구성요소가 상기 인간 또는 동물의 신체 중 치주 영역에 이식되는 것인 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP07112076A EP2022447A1 (en) | 2007-07-09 | 2007-07-09 | Nanosurface |
| EP07112076.0 | 2007-07-09 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100055403A true KR20100055403A (ko) | 2010-05-26 |
Family
ID=38740247
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107002403A KR20100055403A (ko) | 2007-07-09 | 2008-07-08 | 나노표면 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US8632836B2 (ko) |
| EP (4) | EP2022447A1 (ko) |
| JP (1) | JP5658561B2 (ko) |
| KR (1) | KR20100055403A (ko) |
| CN (2) | CN101686862B (ko) |
| AT (1) | ATE494861T1 (ko) |
| AU (1) | AU2008274303A1 (ko) |
| BR (1) | BRPI0814563B8 (ko) |
| CA (1) | CA2693478A1 (ko) |
| DE (1) | DE602008004546D1 (ko) |
| ES (3) | ES2358776T3 (ko) |
| WO (1) | WO2009007373A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013109078A1 (ko) * | 2012-01-20 | 2013-07-25 | 오스템임플란트 주식회사 | 거시-미세-나노규모의 삼중 구조를 지니는 임플란트의 골 유착 능력을 향상시키기 위한 다공성 표면과 그 제조 방법 |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8403991B2 (en) | 2005-05-06 | 2013-03-26 | Titan Spine Llc | Implant with critical ratio of load bearing surface area to central opening area |
| US8480749B2 (en) | 2005-05-06 | 2013-07-09 | Titan Spine, Llc | Friction fit and vertebral endplate-preserving spinal implant |
| US8562685B2 (en) | 2005-05-06 | 2013-10-22 | Titan Spine, Llc | Spinal implant and integration plate for optimizing vertebral endplate contact load-bearing edges |
| US8435302B2 (en) | 2005-05-06 | 2013-05-07 | Titan Spine, Llc | Instruments and interbody spinal implants enhancing disc space distraction |
| US8585765B2 (en) | 2005-05-06 | 2013-11-19 | Titan Spine, Llc | Endplate-preserving spinal implant having a raised expulsion-resistant edge |
| US8591590B2 (en) | 2005-05-06 | 2013-11-26 | Titan Spine, Llc | Spinal implant having a transverse aperture |
| US8545568B2 (en) | 2005-05-06 | 2013-10-01 | Titan Spine, Llc | Method of using instruments and interbody spinal implants to enhance distraction |
| US9168147B2 (en) | 2005-05-06 | 2015-10-27 | Titan Spine, Llc | Self-deploying locking screw retention device |
| US8585767B2 (en) | 2005-05-06 | 2013-11-19 | Titan Spine, Llc | Endplate-preserving spinal implant with an integration plate having durable connectors |
| US8262737B2 (en) | 2005-05-06 | 2012-09-11 | Titan Spine, Llc | Composite interbody spinal implant having openings of predetermined size and shape |
| US8551176B2 (en) | 2005-05-06 | 2013-10-08 | Titan Spine, Llc | Spinal implant having a passage for enhancing contact between bone graft material and cortical endplate bone |
| US8585766B2 (en) | 2005-05-06 | 2013-11-19 | Titan Spine, Llc | Endplate-preserving spinal implant with an integration plate having durable connectors |
| US8617248B2 (en) | 2005-05-06 | 2013-12-31 | Titan Spine, Llc | Spinal implant having variable ratios of the integration surface area to the axial passage area |
| US8814939B2 (en) | 2005-05-06 | 2014-08-26 | Titan Spine, Llc | Implants having three distinct surfaces |
| US11096796B2 (en) | 2005-05-06 | 2021-08-24 | Titan Spine, Llc | Interbody spinal implant having a roughened surface topography on one or more internal surfaces |
| US8758442B2 (en) | 2005-05-06 | 2014-06-24 | Titan Spine, Llc | Composite implants having integration surfaces composed of a regular repeating pattern |
| US8992622B2 (en) | 2005-05-06 | 2015-03-31 | Titan Spine, Llc | Interbody spinal implant having a roughened surface topography |
| US9125756B2 (en) | 2005-05-06 | 2015-09-08 | Titan Spine, Llc | Processes for producing regular repeating patterns on surfaces of interbody devices |
| US20120312779A1 (en) | 2005-05-06 | 2012-12-13 | Titian Spine, LLC | Methods for manufacturing implants having integration surfaces |
| US8758443B2 (en) | 2005-05-06 | 2014-06-24 | Titan Spine, Llc | Implants with integration surfaces having regular repeating surface patterns |
| US8562684B2 (en) | 2005-05-06 | 2013-10-22 | Titan Spine, Llc | Endplate-preserving spinal implant with an integration plate having a roughened surface topography |
| EP2022447A1 (en) * | 2007-07-09 | 2009-02-11 | Astra Tech AB | Nanosurface |
| US8696759B2 (en) * | 2009-04-15 | 2014-04-15 | DePuy Synthes Products, LLC | Methods and devices for implants with calcium phosphate |
| EP2556528B1 (en) * | 2010-04-09 | 2018-11-07 | Brown University | Nanostructured surfaces |
| EP2394602B1 (en) * | 2010-06-10 | 2016-05-18 | Dentsply IH AB | A dental fixture |
| JP2012143416A (ja) * | 2011-01-13 | 2012-08-02 | Gc Corp | 歯科用インプラント及び歯科用インプラントの表面処理方法 |
| KR20130032507A (ko) * | 2011-09-23 | 2013-04-02 | 포항공과대학교 산학협력단 | 유기 금속을 포함하는 자기조립성 고분자를 포함하는 전극 및 그 제조 방법 |
| US8992619B2 (en) | 2011-11-01 | 2015-03-31 | Titan Spine, Llc | Microstructured implant surfaces |
| TWI469762B (zh) * | 2011-11-25 | 2015-01-21 | Ind Tech Res Inst | 具有微奈米結構之電燒刀及其製造方法 |
| AU2013235264B2 (en) * | 2012-03-20 | 2017-09-28 | Titan Spine, Inc. | Friction-fit spinal endplate and endplate-preserving method |
| EP2716261A1 (en) | 2012-10-02 | 2014-04-09 | Titan Spine, LLC | Implants with self-deploying anchors |
| US9498349B2 (en) | 2012-10-09 | 2016-11-22 | Titan Spine, Llc | Expandable spinal implant with expansion wedge and anchor |
| US20160120625A1 (en) * | 2013-06-07 | 2016-05-05 | Straumann Holding Ag | Abutment |
| US9615935B2 (en) | 2014-01-30 | 2017-04-11 | Titan Spine, Llc | Thermally activated shape memory spring assemblies for implant expansion |
| US20170172711A1 (en) * | 2014-02-21 | 2017-06-22 | Maruemu Works Co., Ltd. | Dental member |
| US10687956B2 (en) | 2014-06-17 | 2020-06-23 | Titan Spine, Inc. | Corpectomy implants with roughened bioactive lateral surfaces |
| US20150366668A1 (en) * | 2014-06-23 | 2015-12-24 | Community Blood Center | Cellular-scale surface modification for increased osteogenic protein expression |
| CN105441960A (zh) * | 2014-08-22 | 2016-03-30 | 广州中国科学院先进技术研究所 | 钛牙种植体表面超亲水性微/纳分级结构的构建方法 |
| EP3034033A1 (en) | 2014-12-16 | 2016-06-22 | Nobel Biocare Services AG | Dental implant |
| JP6914266B2 (ja) | 2015-11-20 | 2021-08-04 | タイタン スパイン インコーポレイテッドTitan Spine,Inc. | 整形外科インプラントを付加製作するための方法 |
| TWI726940B (zh) | 2015-11-20 | 2021-05-11 | 美商泰坦脊柱股份有限公司 | 積層製造整形外科植入物之方法 |
| CN105537589B (zh) * | 2016-01-28 | 2018-12-25 | 佛山市安齿生物科技有限公司 | 一种slm成型钛种植体表面处理方法 |
| JP2019523092A (ja) | 2016-08-03 | 2019-08-22 | タイタン スパイン インコーポレイテッドTitan Spine,Inc. | αケースがなく、かつ骨誘導が増強されたチタンインプラント表面 |
| JP6455634B2 (ja) | 2016-11-10 | 2019-01-23 | 株式会社ナントー | 生体組織活着面の形成方法、インプラントの製造方法 |
| CN108096640A (zh) * | 2016-11-24 | 2018-06-01 | 重庆润泽医药有限公司 | 一种多孔材料 |
| JP6893838B2 (ja) * | 2017-07-12 | 2021-06-23 | 日本ピストンリング株式会社 | インプラントの表面構造およびインプラントの表面構造の製造方法 |
| WO2019063711A1 (en) * | 2017-09-27 | 2019-04-04 | Straumann Holding Ag | METHOD FOR PREPARING NANOSTRUCTURES ON A DENTAL IMPLANT |
| GB201802109D0 (en) * | 2018-02-09 | 2018-03-28 | Depuy Ireland Ultd Co | Medical implants comprising anti-infective surfaces |
| US20200306015A1 (en) * | 2018-06-07 | 2020-10-01 | Taiwan Shan Yin International Co., Ltd. | Implant device |
| US11485052B2 (en) | 2018-07-30 | 2022-11-01 | Canon Kabushiki Kaisha | Resin product, method of making resin product, interchangeable lens, and optical device |
| JP7423202B2 (ja) | 2018-07-30 | 2024-01-29 | キヤノン株式会社 | 樹脂製品、樹脂製品の製造方法、交換レンズ、および光学機器 |
| KR102399423B1 (ko) * | 2021-03-16 | 2022-05-19 | 주식회사 도이프 | 교정용 미니스크류의 제조 및 그 표면처리 방법 |
| EP4169485A1 (fr) * | 2021-10-21 | 2023-04-26 | Anthogyr | Implant a ancrage osseux et procede de fabrication d'un tel implant |
Family Cites Families (75)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4015A (en) * | 1845-04-26 | Hand-loom for weaving figured fabrics | ||
| CA962806A (en) * | 1970-06-04 | 1975-02-18 | Ontario Research Foundation | Surgical prosthetic device |
| US3707006A (en) * | 1970-08-26 | 1972-12-26 | Gulf Oil Corp | Orthopedic device for repair or replacement of bone |
| US3906550A (en) * | 1973-12-27 | 1975-09-23 | William Rostoker | Prosthetic device having a porous fiber metal structure |
| US4374669A (en) * | 1975-05-09 | 1983-02-22 | Mac Gregor David C | Cardiovascular prosthetic devices and implants with porous systems |
| US4101984A (en) * | 1975-05-09 | 1978-07-25 | Macgregor David C | Cardiovascular prosthetic devices and implants with porous systems |
| SE416175B (sv) * | 1979-03-07 | 1980-12-08 | Per Ingvar Branemark | For implantering i kroppsvevnad serskilt benvevnad, avsett material |
| GB2189815B (en) * | 1986-03-24 | 1990-10-10 | Permelec Electrode Ltd | Titanium composite materials coated with calcium phosphate compound and process for production thereof |
| ES2044211T3 (es) * | 1989-03-23 | 1994-01-01 | Straumann Inst Ag | Implante metalico. |
| JPH0428374A (ja) * | 1990-05-23 | 1992-01-30 | Tdk Corp | 複合インプラント |
| DE69022776T2 (de) | 1989-06-06 | 1996-05-30 | Tdk Corp | Verwendung von keramischen Materialen als Ersatzmaterialien für lebendes Gewebe. |
| JP2930619B2 (ja) * | 1989-10-30 | 1999-08-03 | 春幸 川原 | チタンもしくはチタン基合金製生体修復部材及びその表面処理法 |
| DE4028374A1 (de) | 1990-09-07 | 1992-03-12 | Abb Patent Gmbh | Verfahren zum verbinden von bauteilen |
| TW197475B (ko) | 1990-12-26 | 1993-01-01 | Eltech Systems Corp | |
| US5282861A (en) * | 1992-03-11 | 1994-02-01 | Ultramet | Open cell tantalum structures for cancellous bone implants and cell and tissue receptors |
| US5356516A (en) | 1993-02-26 | 1994-10-18 | Sandia Corporation | Process for etching mixed metal oxides |
| US5824651A (en) | 1993-05-10 | 1998-10-20 | Universite De Montreal | Process for modification of implant surface with bioactive conjugates for improved integration |
| US5368881A (en) * | 1993-06-10 | 1994-11-29 | Depuy, Inc. | Prosthesis with highly convoluted surface |
| EP0746273B1 (en) | 1993-11-02 | 2004-02-11 | Hospital For Joint Diseases | Control of cell growth |
| US7048870B1 (en) * | 1993-12-20 | 2006-05-23 | Astrazeneca Ab | Metallic implant and process for treating a metallic implant |
| ATE274861T1 (de) * | 1994-11-30 | 2004-09-15 | Implant Innovations Inc | Preparierung einer implantatoberfläche |
| US6491723B1 (en) | 1996-02-27 | 2002-12-10 | Implant Innovations, Inc. | Implant surface preparation method |
| US5863201A (en) | 1994-11-30 | 1999-01-26 | Implant Innovations, Inc. | Infection-blocking dental implant |
| US6652765B1 (en) | 1994-11-30 | 2003-11-25 | Implant Innovations, Inc. | Implant surface preparation |
| DE19506188C2 (de) | 1995-02-22 | 2003-03-06 | Miladin Lazarov | Implantat und dessen Verwendung |
| WO1997021393A1 (en) | 1995-12-08 | 1997-06-19 | Calcitek, Inc. | Dental implant having multiple tectured surfaces |
| CA2205104A1 (en) | 1996-05-10 | 1997-11-10 | Eugenia Ribeiro De Sousa Fidalgo Leitao | Device for incorporation and release of biologically active agents |
| EP0806212B1 (en) | 1996-05-10 | 2003-04-02 | IsoTis N.V. | Device for incorporation and release of biologically active agents |
| EP0806211B1 (en) | 1996-05-10 | 2002-10-23 | IsoTis N.V. | Implant material and process for producing it |
| UA53673C2 (uk) | 1996-11-19 | 2003-02-17 | Александр Константиновіч Камлюк | Лебідка з приводом від роздавальної коробки транспортного засобу |
| WO1998025761A1 (fr) | 1996-12-09 | 1998-06-18 | Nippon Sheet Glass Co., Ltd. | Article anti-buee et son procede de production |
| US20050031663A1 (en) | 1997-05-16 | 2005-02-10 | Cecilia Larsson | Implant element |
| JP3404286B2 (ja) | 1998-04-16 | 2003-05-06 | 日本パーカライジング株式会社 | 金属の表面処理方法、および該表面処理方法により得られた表面を有する金属部材 |
| US6261322B1 (en) * | 1998-05-14 | 2001-07-17 | Hayes Medical, Inc. | Implant with composite coating |
| SE514202C2 (sv) * | 1999-05-31 | 2001-01-22 | Nobel Biocare Ab | På implantat till ben- eller vävnadsstruktur anordnat skikt samt sådant implantat och förfarande för applicering av skiktet |
| TW491714B (en) * | 1999-12-08 | 2002-06-21 | Wen-Jing Shiue | Orthopedic implant having a porous surface and method of making same |
| US7048541B2 (en) | 2000-04-04 | 2006-05-23 | Nobel Biocare Ab | Implant having attachment and hole-insert parts, and method for producing such an implant |
| IT1317969B1 (it) * | 2000-06-09 | 2003-07-21 | Nora Elettrodi De | Elettrodo caratterizzato da elevata adesione di uno strato cataliticosuperficiale. |
| CH694935A5 (de) * | 2000-07-26 | 2005-09-30 | Straumann Holding Ag | Oberflaechenmodifizierte Implantate. |
| IL149700A0 (en) | 2000-09-19 | 2002-11-10 | Eduardo Anitua Aldecoa | Method for surface treatment of implants or prosthesis made of titanium or other materials |
| CN1237945C (zh) * | 2000-10-09 | 2006-01-25 | 刘宝林 | 改良的牙种植体表面的喷砂处理方法 |
| US6921544B2 (en) * | 2001-03-06 | 2005-07-26 | Rutgers, The State University | Magnesium-substituted hydroxyapatites |
| WO2002078759A1 (de) | 2001-04-02 | 2002-10-10 | Stratec Medical Ag | Bioaktive oberflächenschicht, insbesondere für medizinische implantate und prothesen |
| US6527938B2 (en) * | 2001-06-21 | 2003-03-04 | Syntheon, Llc | Method for microporous surface modification of implantable metallic medical articles |
| US7157096B2 (en) * | 2001-10-12 | 2007-01-02 | Inframat Corporation | Coatings, coated articles and methods of manufacture thereof |
| WO2003044383A1 (de) | 2001-11-23 | 2003-05-30 | Alcove Surfaces Gmbh | Lager und verbundaufbau |
| SE523288C2 (sv) * | 2002-07-19 | 2004-04-06 | Astra Tech Ab | Ett implantat och ett förfarande för behandling av en implantatyta |
| US7537664B2 (en) * | 2002-11-08 | 2009-05-26 | Howmedica Osteonics Corp. | Laser-produced porous surface |
| EP1440669B1 (de) | 2003-01-23 | 2006-11-22 | Dinkelacker, Wolfgang, Dr. med. dent. | Knochenimplantat und Verfahren zu seiner Herstellung |
| JP5079208B2 (ja) * | 2003-02-24 | 2012-11-21 | デピュイ・プロダクツ・インコーポレイテッド | 粗面を有する金属製インプラント及びその製造方法 |
| US20040167632A1 (en) | 2003-02-24 | 2004-08-26 | Depuy Products, Inc. | Metallic implants having roughened surfaces and methods for producing the same |
| EP1622629B1 (en) * | 2003-05-07 | 2013-07-10 | Osteologix A/S | Controlled-release composition containing a strontium salt |
| US8251700B2 (en) | 2003-05-16 | 2012-08-28 | Biomet 3I, Llc | Surface treatment process for implants made of titanium alloy |
| US20050119758A1 (en) | 2003-07-30 | 2005-06-02 | Bio-Lok International Inc. | Surgical implant for promotion of osseo-integration |
| DE602004029377D1 (de) * | 2004-03-04 | 2010-11-11 | Young-Taek Sul | Osseoinduktives magnesium-titan-implantat und herstellungsverfahren dafür |
| KR100714244B1 (ko) * | 2004-04-26 | 2007-05-02 | 한국기계연구원 | 생체용 골유도성 금속 임플란트 및 그 제조방법 |
| US8329202B2 (en) * | 2004-11-12 | 2012-12-11 | Depuy Products, Inc. | System and method for attaching soft tissue to an implant |
| EP1853394A4 (en) | 2005-02-24 | 2009-09-30 | Biomet 3I Llc | SURFACE TREATMENT METHOD FOR IMPLANTS MANUFACTURED IN TITANIUM OR TITANIUM ALLOY |
| US7601149B2 (en) | 2005-03-07 | 2009-10-13 | Boston Scientific Scimed, Inc. | Apparatus for switching nominal and attenuated power between ablation probes |
| WO2006102347A2 (en) | 2005-03-21 | 2006-09-28 | The Regents Of The University Of California | Controllable nanostructuring on micro-structured surfaces |
| US7368065B2 (en) * | 2005-06-23 | 2008-05-06 | Depuy Products, Inc. | Implants with textured surface and methods for producing the same |
| JP2007001826A (ja) | 2005-06-24 | 2007-01-11 | Hitachi Ltd | 金属酸化物材料とその製造方法及びその利用 |
| EP1764116A1 (en) * | 2005-09-16 | 2007-03-21 | Debiotech S.A. | Porous coating process using colloidal particles |
| US20090207790A1 (en) | 2005-10-27 | 2009-08-20 | Qualcomm Incorporated | Method and apparatus for settingtuneawaystatus in an open state in wireless communication system |
| ES2726355T3 (es) | 2005-11-14 | 2019-10-03 | Biomet 3I Llc | Deposición de nanopartículas discretas en una superficie de implante |
| US7749555B2 (en) * | 2006-01-25 | 2010-07-06 | Medtronic, Inc | Modification of chemical forces of bone constructs |
| US9327056B2 (en) * | 2006-02-14 | 2016-05-03 | Washington State University | Bone replacement materials |
| US20070264303A1 (en) * | 2006-05-12 | 2007-11-15 | Liliana Atanasoska | Coating for medical devices comprising an inorganic or ceramic oxide and a therapeutic agent |
| CA2671348A1 (en) * | 2006-12-22 | 2008-07-03 | Thommen Medical Ag | Dental implant and method for the production thereof |
| EP2022447A1 (en) * | 2007-07-09 | 2009-02-11 | Astra Tech AB | Nanosurface |
| US20090035723A1 (en) * | 2007-08-03 | 2009-02-05 | Claus Daniel | Material with a repetitive pattern of micro-features for application in a living organism and method of fabrication |
| ES2315194B1 (es) * | 2007-09-10 | 2010-02-26 | Francisco J. GARCIA SABAN | Procedimiento para obtener una nueva superficie de un implante metalico a base de titanio destinado a ser insertado en tejido oseo. |
| WO2009061887A2 (en) * | 2007-11-06 | 2009-05-14 | University Of Connecticut | Ceramic/structural protein composites and method of preparation thereof |
| AU2009222165B2 (en) * | 2008-02-29 | 2015-07-09 | Smith & Nephew, Inc. | Gradient coating for biomedical applications |
| US8436078B2 (en) * | 2008-04-28 | 2013-05-07 | Kuraray Noritake Dental Inc. | Dental composition and composite resin |
-
2007
- 2007-07-09 EP EP07112076A patent/EP2022447A1/en not_active Withdrawn
-
2008
- 2008-07-08 DE DE602008004546T patent/DE602008004546D1/de active Active
- 2008-07-08 KR KR1020107002403A patent/KR20100055403A/ko not_active Application Discontinuation
- 2008-07-08 US US12/298,884 patent/US8632836B2/en active Active
- 2008-07-08 EP EP08774897A patent/EP2178466B1/en active Active
- 2008-07-08 AT AT08774897T patent/ATE494861T1/de active
- 2008-07-08 CN CN200880024004.6A patent/CN101686862B/zh active Active
- 2008-07-08 ES ES08774897T patent/ES2358776T3/es active Active
- 2008-07-08 ES ES12179573.6T patent/ES2542243T3/es active Active
- 2008-07-08 JP JP2010515496A patent/JP5658561B2/ja active Active
- 2008-07-08 EP EP10194575A patent/EP2319461B1/en active Active
- 2008-07-08 ES ES10194575T patent/ES2397633T3/es active Active
- 2008-07-08 EP EP20120179573 patent/EP2537485B1/en active Active
- 2008-07-08 BR BRPI0814563A patent/BRPI0814563B8/pt active IP Right Grant
- 2008-07-08 CA CA2693478A patent/CA2693478A1/en not_active Abandoned
- 2008-07-08 CN CN201210472825.4A patent/CN102961193B/zh active Active
- 2008-07-08 WO PCT/EP2008/058860 patent/WO2009007373A1/en active Application Filing
- 2008-07-08 AU AU2008274303A patent/AU2008274303A1/en not_active Abandoned
-
2012
- 2012-09-14 US US13/620,079 patent/US9642708B2/en active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013109078A1 (ko) * | 2012-01-20 | 2013-07-25 | 오스템임플란트 주식회사 | 거시-미세-나노규모의 삼중 구조를 지니는 임플란트의 골 유착 능력을 향상시키기 위한 다공성 표면과 그 제조 방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| BRPI0814563A2 (pt) | 2015-01-06 |
| EP2537485B1 (en) | 2015-05-13 |
| WO2009007373A1 (en) | 2009-01-15 |
| ES2358776T3 (es) | 2011-05-13 |
| JP5658561B2 (ja) | 2015-01-28 |
| ATE494861T1 (de) | 2011-01-15 |
| BRPI0814563B1 (pt) | 2018-12-26 |
| CA2693478A1 (en) | 2009-01-15 |
| ES2397633T3 (es) | 2013-03-08 |
| ES2542243T3 (es) | 2015-08-03 |
| AU2008274303A1 (en) | 2009-01-15 |
| CN102961193B (zh) | 2016-05-18 |
| EP2022447A1 (en) | 2009-02-11 |
| US20100173264A1 (en) | 2010-07-08 |
| EP2537485A1 (en) | 2012-12-26 |
| DE602008004546D1 (en) | 2011-02-24 |
| CN101686862B (zh) | 2014-08-06 |
| BRPI0814563B8 (pt) | 2021-06-22 |
| CN101686862A (zh) | 2010-03-31 |
| EP2319461A1 (en) | 2011-05-11 |
| US9642708B2 (en) | 2017-05-09 |
| CN102961193A (zh) | 2013-03-13 |
| EP2178466A1 (en) | 2010-04-28 |
| US20130013081A1 (en) | 2013-01-10 |
| JP2011509098A (ja) | 2011-03-24 |
| US8632836B2 (en) | 2014-01-21 |
| EP2178466B1 (en) | 2011-01-12 |
| EP2319461B1 (en) | 2012-09-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2537485B1 (en) | Nanosurface | |
| AU2008274302B2 (en) | A bone tissue implant comprising strontium ions | |
| CA2629600C (en) | Deposition of discrete nanoparticles on an implant surface | |
| AU2008274301B2 (en) | A bone tissue implant comprising lithium ions | |
| Fouziya et al. | Surface modifications of titanium implants–The new, the old, and the never heard of options |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |