KR101395615B1 - 유기 화합물, 전하 수송 재료, 전하 수송 재료용 조성물 및유기 전계 발광 소자 - Google Patents
유기 화합물, 전하 수송 재료, 전하 수송 재료용 조성물 및유기 전계 발광 소자 Download PDFInfo
- Publication number
- KR101395615B1 KR101395615B1 KR1020087009361A KR20087009361A KR101395615B1 KR 101395615 B1 KR101395615 B1 KR 101395615B1 KR 1020087009361 A KR1020087009361 A KR 1020087009361A KR 20087009361 A KR20087009361 A KR 20087009361A KR 101395615 B1 KR101395615 B1 KR 101395615B1
- Authority
- KR
- South Korea
- Prior art keywords
- group
- ring
- substituent
- derived
- compound
- Prior art date
Links
- 0 *=C(N(c1ccccc11)c(cc2)ccc2-[n]2c(cccc3)c3c3ccccc23)N1c(cc1)ccc1N(c1ccccc1N1c(cc2)ccc2-c(cc2)ccc2N(c2ccccc2N2c(cc3)ccc3N(c3ccccc3N3c(cc4)ccc4-[n]4c5ccccc5c5c4cccc5)C3=O)C2=O)C1=O Chemical compound *=C(N(c1ccccc11)c(cc2)ccc2-[n]2c(cccc3)c3c3ccccc23)N1c(cc1)ccc1N(c1ccccc1N1c(cc2)ccc2-c(cc2)ccc2N(c2ccccc2N2c(cc3)ccc3N(c3ccccc3N3c(cc4)ccc4-[n]4c5ccccc5c5c4cccc5)C3=O)C2=O)C1=O 0.000 description 4
- FMXGBUISJLXQBT-UHFFFAOYSA-N O=C(N(c1ccccc11)c(cc2)ccc2N(c2ccccc2)c(cc2)ccc2-c2ccccc2)N1c(cc1)ccc1N(c1ccccc1)c(cc1)ccc1-c1ccccc1 Chemical compound O=C(N(c1ccccc11)c(cc2)ccc2N(c2ccccc2)c(cc2)ccc2-c2ccccc2)N1c(cc1)ccc1N(c1ccccc1)c(cc1)ccc1-c1ccccc1 FMXGBUISJLXQBT-UHFFFAOYSA-N 0.000 description 2
- WZAJJFSKAYHLDR-UHFFFAOYSA-N Brc1cccc(-[n]2c(cccc3)c3c3c2cccc3)n1 Chemical compound Brc1cccc(-[n]2c(cccc3)c3c3c2cccc3)n1 WZAJJFSKAYHLDR-UHFFFAOYSA-N 0.000 description 1
- ZKGHGKNHPPZALY-UHFFFAOYSA-N Brc1cccc(-[n]2c(cccc3)c3c3ccccc23)c1 Chemical compound Brc1cccc(-[n]2c(cccc3)c3c3ccccc23)c1 ZKGHGKNHPPZALY-UHFFFAOYSA-N 0.000 description 1
- MTLDXHHBNZZSEX-UHFFFAOYSA-N C=C(N(C1=CCCC=C1)c(cccc1)c1N)O Chemical compound C=C(N(C1=CCCC=C1)c(cccc1)c1N)O MTLDXHHBNZZSEX-UHFFFAOYSA-N 0.000 description 1
- JOGOURDUBXUROS-UHFFFAOYSA-N CC(N(C1=O)c2cc(-c(cc3)ccc3-[n]3c(cccc4)c4c4c3cccc4)ccc2)=C(CI)N1c1cc(-c(cc2)ccc2-[n]2c(cccc3)c3c3c2cccc3)ccc1 Chemical compound CC(N(C1=O)c2cc(-c(cc3)ccc3-[n]3c(cccc4)c4c4c3cccc4)ccc2)=C(CI)N1c1cc(-c(cc2)ccc2-[n]2c(cccc3)c3c3c2cccc3)ccc1 JOGOURDUBXUROS-UHFFFAOYSA-N 0.000 description 1
- FDTRDFXOYPHTKS-UHFFFAOYSA-N CC12c3ccccc3NC1C=CCC2 Chemical compound CC12c3ccccc3NC1C=CCC2 FDTRDFXOYPHTKS-UHFFFAOYSA-N 0.000 description 1
- OYYCPHHDGKZQGK-QRXDBQBNSA-N CC[C@@H](c1cc(N(c2ccccc2)c2ccccc2)cc(N(c(cccc2)c2N2c3cc(N(c4ccccc4)c4ccccc4)cc(N(c4ccccc4)c4ccccc4)c3)C2=O)c1)C1=CCCC=C1 Chemical compound CC[C@@H](c1cc(N(c2ccccc2)c2ccccc2)cc(N(c(cccc2)c2N2c3cc(N(c4ccccc4)c4ccccc4)cc(N(c4ccccc4)c4ccccc4)c3)C2=O)c1)C1=CCCC=C1 OYYCPHHDGKZQGK-QRXDBQBNSA-N 0.000 description 1
- DFRYLCNHOHRAPG-UHFFFAOYSA-N Cc(cc1)ccc1N(C(CC(c1ccccc1)=C1)C=C1N(c1ccccc1N1c2cc(N(c3ccc(C)cc3)c3ccc(C=[IH])cc3)cc(-c3ccccc3)c2)C1=O)c1ccc(C=[IH])cc1 Chemical compound Cc(cc1)ccc1N(C(CC(c1ccccc1)=C1)C=C1N(c1ccccc1N1c2cc(N(c3ccc(C)cc3)c3ccc(C=[IH])cc3)cc(-c3ccccc3)c2)C1=O)c1ccc(C=[IH])cc1 DFRYLCNHOHRAPG-UHFFFAOYSA-N 0.000 description 1
- JHTWZCBAASSQSF-UHFFFAOYSA-N Cc(cc1)ccc1N(c1ccc(C)cc1)c(cc1)ccc1N(c(cccc1)c1N1c(cc2)ccc2N(c2ccc(C)cc2)c2ccc(C)cc2)C1=O Chemical compound Cc(cc1)ccc1N(c1ccc(C)cc1)c(cc1)ccc1N(c(cccc1)c1N1c(cc2)ccc2N(c2ccc(C)cc2)c2ccc(C)cc2)C1=O JHTWZCBAASSQSF-UHFFFAOYSA-N 0.000 description 1
- NETBHBOQCJGDLM-UHFFFAOYSA-N O=C(N(C(c1ccccc1)=C1c2ccccc2)c(cc2)ccc2-c(cc2)ccc2N(C(c2ccccc2)=C(c2ccccc2)N2c(cc3)ccc3-[n]3c(cccc4)c4c4c3cccc4)C2=O)N1c(cc1)ccc1-[n]1c(cccc2)c2c2c1cccc2 Chemical compound O=C(N(C(c1ccccc1)=C1c2ccccc2)c(cc2)ccc2-c(cc2)ccc2N(C(c2ccccc2)=C(c2ccccc2)N2c(cc3)ccc3-[n]3c(cccc4)c4c4c3cccc4)C2=O)N1c(cc1)ccc1-[n]1c(cccc2)c2c2c1cccc2 NETBHBOQCJGDLM-UHFFFAOYSA-N 0.000 description 1
- CPASGKWVDYROSO-UHFFFAOYSA-N O=C(N(C=C1)c2cccc(-c3cc(-[n]4c5ccccc5c5c4cccc5)cc(-[n]4c5ccccc5c5c4cccc5)c3)c2)N1c1cc(-c2cc(-[n]3c(C=CCC4)c4c4c3cccc4)cc(-[n]3c(cccc4)c4c4c3cccc4)c2)ccc1 Chemical compound O=C(N(C=C1)c2cccc(-c3cc(-[n]4c5ccccc5c5c4cccc5)cc(-[n]4c5ccccc5c5c4cccc5)c3)c2)N1c1cc(-c2cc(-[n]3c(C=CCC4)c4c4c3cccc4)cc(-[n]3c(cccc4)c4c4c3cccc4)c2)ccc1 CPASGKWVDYROSO-UHFFFAOYSA-N 0.000 description 1
- WRVLKCXEGAROOU-UHFFFAOYSA-N O=C(N(c1c2cccc1)c(cc1)ccc1-c1cc(-[n]3c4ccccc4c4c3cccc4)cc(-[n]3c4ccccc4c4c3cccc4)c1)N2c1cccc(-c2ccccc2)c1 Chemical compound O=C(N(c1c2cccc1)c(cc1)ccc1-c1cc(-[n]3c4ccccc4c4c3cccc4)cc(-[n]3c4ccccc4c4c3cccc4)c1)N2c1cccc(-c2ccccc2)c1 WRVLKCXEGAROOU-UHFFFAOYSA-N 0.000 description 1
- SRIMBSKPUSYNCP-UHFFFAOYSA-N O=C(N(c1c2cccc1)c(cc1)ccc1N(c1ccccc1)c1ccccc1)N2c(cc1)ccc1N(c1ccccc1)c1ccccc1 Chemical compound O=C(N(c1c2cccc1)c(cc1)ccc1N(c1ccccc1)c1ccccc1)N2c(cc1)ccc1N(c1ccccc1)c1ccccc1 SRIMBSKPUSYNCP-UHFFFAOYSA-N 0.000 description 1
- KBBOECRNKPTMFE-UHFFFAOYSA-N O=C(N(c1c2cccc1)c1cc(-[n](c(ccc(-c3ccccc3)c3)c3c3c4)c3ccc4-c3ccccc3)ccc1)N2c1cc(-[n]2c(ccc(-c3ccccc3)c3)c3c3c2ccc(-c2ccccc2)c3)ccc1 Chemical compound O=C(N(c1c2cccc1)c1cc(-[n](c(ccc(-c3ccccc3)c3)c3c3c4)c3ccc4-c3ccccc3)ccc1)N2c1cc(-[n]2c(ccc(-c3ccccc3)c3)c3c3c2ccc(-c2ccccc2)c3)ccc1 KBBOECRNKPTMFE-UHFFFAOYSA-N 0.000 description 1
- RWKLAOCASMEOBC-UHFFFAOYSA-N O=C(N(c1c2cccc1)c1cccc(-c(cc3)ccc3N(c3ccccc3)c(cc3)ccc3-c3ccccc3)c1)N2c1cc(-c(cc2)ccc2N(c2ccccc2)c(cc2)ccc2-c2ccccc2)ccc1 Chemical compound O=C(N(c1c2cccc1)c1cccc(-c(cc3)ccc3N(c3ccccc3)c(cc3)ccc3-c3ccccc3)c1)N2c1cc(-c(cc2)ccc2N(c2ccccc2)c(cc2)ccc2-c2ccccc2)ccc1 RWKLAOCASMEOBC-UHFFFAOYSA-N 0.000 description 1
- ARTRVGXLNHTOGL-UHFFFAOYSA-N O=C(N(c1c2cccc1)c1ccccc1)N2c(cc1)ccc1N(c1ccccc1)c(cc1)ccc1N(c1ccccc1N1c2ccccc2)C1=O Chemical compound O=C(N(c1c2cccc1)c1ccccc1)N2c(cc1)ccc1N(c1ccccc1)c(cc1)ccc1N(c1ccccc1N1c2ccccc2)C1=O ARTRVGXLNHTOGL-UHFFFAOYSA-N 0.000 description 1
- WBSSFODIPAWHHI-UHFFFAOYSA-N O=C(N(c1c2cccc1)c1ccccc1)N2c1cccc(-c2cccc(-c3cccc(-[n]4c(cccc5)c5c5c4cccc5)c3)c2)c1 Chemical compound O=C(N(c1c2cccc1)c1ccccc1)N2c1cccc(-c2cccc(-c3cccc(-[n]4c(cccc5)c5c5c4cccc5)c3)c2)c1 WBSSFODIPAWHHI-UHFFFAOYSA-N 0.000 description 1
- SAWAIUSRFVPBCM-UHFFFAOYSA-N O=C(N(c1ccccc11)c(cc2)ccc2-c(cc(cc2)-[n]3c4ccccc4c4c3cccc4)c2-[n]2c3ccccc3c3ccccc23)N1c(cc1)ccc1N(c1ccccc1N1c(cc2)ccc2-c2cc(-[n]3c4ccccc4c4c3cccc4)ccc2-[n]2c3ccccc3c3c2cccc3)C1=O Chemical compound O=C(N(c1ccccc11)c(cc2)ccc2-c(cc(cc2)-[n]3c4ccccc4c4c3cccc4)c2-[n]2c3ccccc3c3ccccc23)N1c(cc1)ccc1N(c1ccccc1N1c(cc2)ccc2-c2cc(-[n]3c4ccccc4c4c3cccc4)ccc2-[n]2c3ccccc3c3c2cccc3)C1=O SAWAIUSRFVPBCM-UHFFFAOYSA-N 0.000 description 1
- RUQNRBHOQNNGPF-UHFFFAOYSA-N O=C(N(c1ccccc11)c(cc2)ccc2N(c(cccc2)c2N2c3cc(-c4cccc(-[n]5c6ccccc6c6c5cccc6)c4)ccc3)C2=O)N1c(cc1)ccc1N(c1ccccc1N1c2cc(-c3cc(-[n]4c5ccccc5c5c4cccc5)ccc3)ccc2)C1=O Chemical compound O=C(N(c1ccccc11)c(cc2)ccc2N(c(cccc2)c2N2c3cc(-c4cccc(-[n]5c6ccccc6c6c5cccc6)c4)ccc3)C2=O)N1c(cc1)ccc1N(c1ccccc1N1c2cc(-c3cc(-[n]4c5ccccc5c5c4cccc5)ccc3)ccc2)C1=O RUQNRBHOQNNGPF-UHFFFAOYSA-N 0.000 description 1
- BYULFMIDVZBTQV-UHFFFAOYSA-N O=C(N(c1ccccc11)c2cc(-c3cccc(CCC(c4ccccc4)c4ccccc4)c3)ccc2)N1c1cccc(-c2cc(N(c3ccccc3)c3ccccc3)ccc2)c1 Chemical compound O=C(N(c1ccccc11)c2cc(-c3cccc(CCC(c4ccccc4)c4ccccc4)c3)ccc2)N1c1cccc(-c2cc(N(c3ccccc3)c3ccccc3)ccc2)c1 BYULFMIDVZBTQV-UHFFFAOYSA-N 0.000 description 1
- GWOGGZPGFCGIEX-UHFFFAOYSA-N O=C(N(c1ccccc11)c2ccc(C3C=CC(N(C(CC4)=CC=C4c4ccccc4)c4ccccc4)=CC3)cc2)N1c(cc1)ccc1-c(cc1)ccc1N(c1ccccc1)c(cc1)ccc1C1=CC=CCC1 Chemical compound O=C(N(c1ccccc11)c2ccc(C3C=CC(N(C(CC4)=CC=C4c4ccccc4)c4ccccc4)=CC3)cc2)N1c(cc1)ccc1-c(cc1)ccc1N(c1ccccc1)c(cc1)ccc1C1=CC=CCC1 GWOGGZPGFCGIEX-UHFFFAOYSA-N 0.000 description 1
- SILNNFMWIMZVEQ-UHFFFAOYSA-N Oc1nc(cccc2)c2[nH]1 Chemical compound Oc1nc(cccc2)c2[nH]1 SILNNFMWIMZVEQ-UHFFFAOYSA-N 0.000 description 1
- PGDIPOWQYRAOSK-UHFFFAOYSA-N Oc1nc(nccc2)c2[nH]1 Chemical compound Oc1nc(nccc2)c2[nH]1 PGDIPOWQYRAOSK-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/56—Ring systems containing three or more rings
- C07D209/80—[b, c]- or [b, d]-condensed
- C07D209/82—Carbazoles; Hydrogenated carbazoles
- C07D209/86—Carbazoles; Hydrogenated carbazoles with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to carbon atoms of the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/24—Benzimidazoles; Hydrogenated benzimidazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D235/26—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/321—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3]
- H10K85/324—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3] comprising aluminium, e.g. Alq3
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/341—Transition metal complexes, e.g. Ru(II)polypyridine complexes
- H10K85/342—Transition metal complexes, e.g. Ru(II)polypyridine complexes comprising iridium
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/40—Organosilicon compounds, e.g. TIPS pentacene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/636—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising heteroaromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1088—Heterocyclic compounds characterised by ligands containing oxygen as the only heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
Abstract
내열성, 비정질성 및 전하 수송능이 우수하고, 또한 높은 일중항 및 삼중항 여기 준위를 가지며, 유기 용매에 대한 용해성도 우수한 유기 화합물은, 하기 식 (Ⅰ) 로 표시되는 유기 화합물.
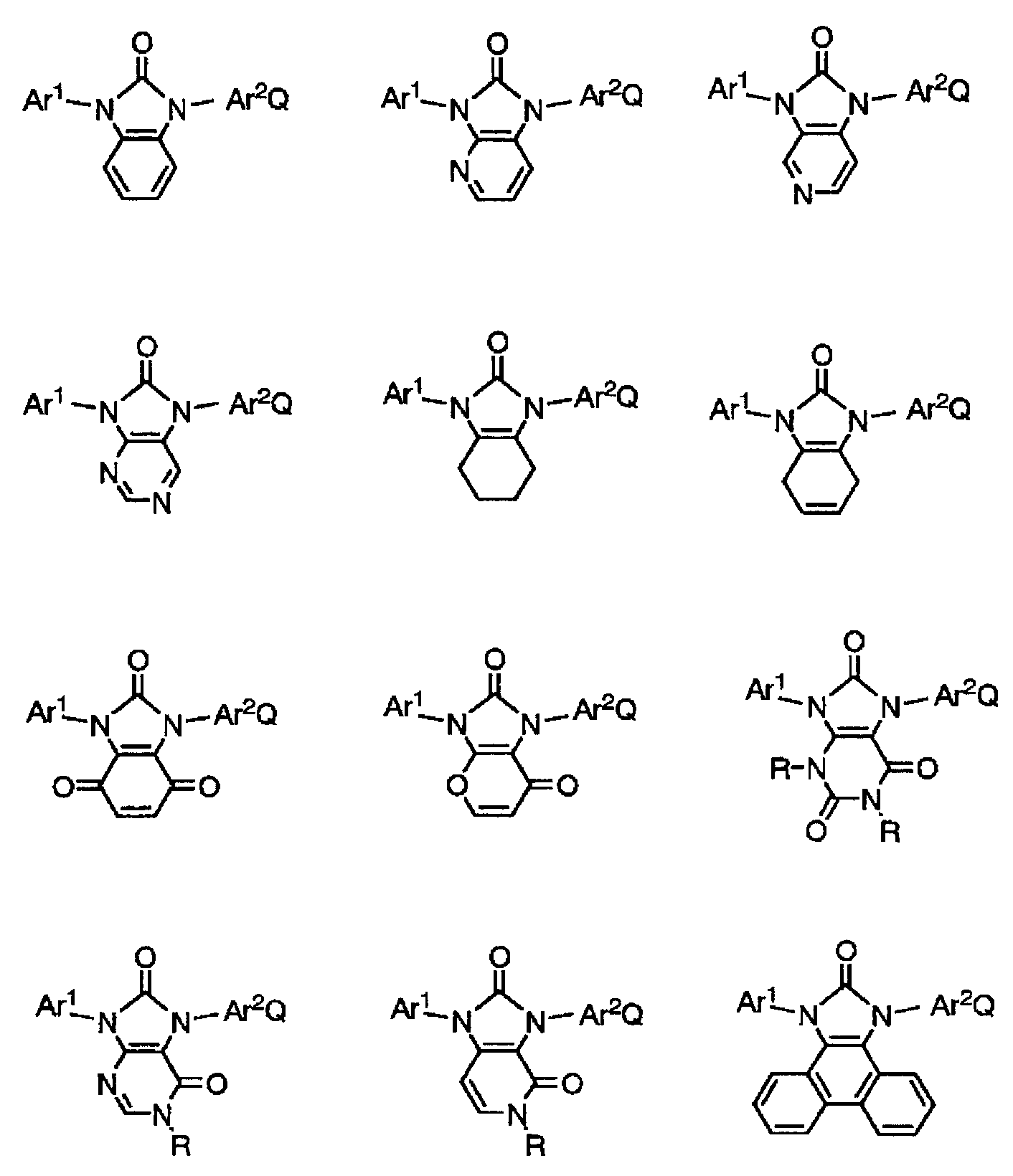
Ar1 은 치환기를 갖고 있어도 되는 방향족 탄화수소기, 방향족 복소환기, 또는 알킬기 ; Ar2 는 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 방향족 복소환기 ; R1, R2 는 수소 원자 또는 치환기. R1 과 R2 는 서로 결합하여 고리를 형성하고 있어도 된다. Q 는 하기 식 (Ⅰ-1) 또는 (Ⅰ-2) 로 표시된다.
Ar3∼Ar5 는 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 방향족 복소환기. Ar3 과 Ar4 는 서로 결합하여 고리를 형성하고 있어도 된다.
Description
본 발명은 신규 유기 화합물, 이 유기 화합물로 이루어지는 전하 수송 재료와, 이 전하 수송 재료를 함유하는 전하 수송 재료용 조성물에 관한 것이다.
본 발명은 또, 이 신규 유기 화합물로 이루어지는 전하 수송 재료를 사용한 고휘도, 고효율 또한 긴 수명의 유기 전계 발광 소자에 관한 것이다.
유기 박막을 사용한 전계 발광 소자의 개발이 실시되고 있다. 유기 박막을 사용한 전계 발광 소자, 즉 유기 전계 발광 소자는, 통상 기판 상에, 양극, 음극, 및 이들 양극 사이에 형성된 적어도 발광층을 포함하는 유기층을 갖는다. 유기층으로는, 발광층 이외에도, 정공 주입층, 정공 수송층, 정공 저지층, 전자 수송층, 전자 주입층 등이 사용된다. 통상, 이들 층을 적층함으로써, 유기 전계 발광 소자로서 사용되고 있다. 종래, 유기 전계 발광 소자는, 형광 발광을 이용해 왔는데, 소자의 발광 효율을 높이는 시도에서, 형광이 아니라 인광 발광을 사용하는 것이 검토되고 있다. 그러나, 인광 발광을 사용했다고 해도, 아직 충분한 발광 효율, 휘도 및 수명은 얻어지지 않고 있다.
하기 비특허 문헌 1 에는, 도전성 고분자인 폴리아닐린의 용해성을 향상시킬 목적으로, 하기 고분자 화합물 (C-1) 이 제안되어 있다.
[화학식 1]
그러나, 상기 화합물 (C-1) 과 같은, 고분자 재료에는 이하와 같은 문제가 있다.
고분자 재료는 중합도나 분자량 분포를 제어하는 것이 곤란하다.
연속 구동시에 말단 잔기에 의한 열화가 일어난다.
재료 자체의 고순도화가 곤란하여 불순물을 함유한다.
또한, 화합물 (C-1) 에 전하 수송성을 유기 (誘起) 하기 위해서는, 산화된 후, 프로톤산을 도프할 필요가 있고, 도프한 프로톤산 및 카운터 음이온이 확산될 우려가 있으므로, 화합물 (C-1) 은 유기 전계 발광 소자의 전하 수송 재료로서 문제가 있는 것으로 추측된다.
비특허 문헌 1 에는, 화합물 (C-1) 의 모델 화합물로서, 하기 화합물 (C-2) 가 개시되어 있다.
[화학식 2]
그러나, 상기 화합물 (C-2) 는 2급 아민 부위를 갖기 때문에, 내열성 및 비정질성이 부족하고, 화합물 (C-2) 를 함유하는 유기 박막은, 결정화나 응집 등에 의해 용이하게 열화된다는 과제를 갖는다. 또한, 2급 아민 부위에 HOMO 가 국재화되어 있으므로, 화합물 (C-2) 는 전하 수송성이 부족하다는 과제도 갖는다.
하기 특허 문헌 1 에는, 하기 화합물 (C-3) 을 전자 사진 감광체의 전하 수송 재료로서 사용하는 것이 제안되어 있다.
[화학식 3]
그러나, 상기 화합물 (C-3) 과 같은 화합물은, 1,3-디히드로이미다졸-2-온 고리의 질소 원자에 결합하는 기에, 방향족 고리가 1 개밖에 없기 때문에, 내열성이 낮고, 유기 전계 발광 소자의 전하 수송 재료로서 문제가 있는 경우가 있다.
이러한 점에서, 내열성 및 비정질성이 우수함과 함께, 전하 수송능이 우수한 재료가 요구되고 있었다.
특허 문헌 1 : 일본 공개특허공보 평10-246973호
비특허 문헌 1 : Macromolecules 2003 년, 36, 4368-4373 페이지
발명의 개요
본 발명은 내열성 및 비정질성이 우수하고, 전하 수송능이 우수한 전하 수송 재료의 제공, 또한 고휘도, 고효율 또한 긴 수명의 유기 전계 발광 소자를 형성하기 위한 조성물, 및 그것을 사용한 유기 전계 발광 소자를 제공하는 것을 목적으로 한다.
본 발명에 의하면, 하기 식 (Ⅰ) 로 표시되는 유기 화합물, 그 화합물로 이루어지는 전하 수송 재료, 하기 식 (Ⅱ-2) 로 표시되는 유기 전계 발광 소자용 전하 수송 재료, 그 재료를 함유하는 전하 수송 재료용 조성물이 제공된다.
본 발명에 의하면, 기판 상에, 양극, 음극, 및 이들 양극 사이에 형성된 발광층을 갖는 유기 전계 발광 소자에 있어서, 이 전하 수송 재료를 함유하여 이루어지는 층을 갖는 유기 전계 발광 소자가 제공된다.
[화학식 4]
Ar1 은 치환기를 갖고 있어도 되는 방향족 탄화수소기, 치환기를 갖고 있어도 되는 방향족 복소환기, 또는 치환기를 갖고 있어도 되는 알킬기를 나타낸다.
Ar2 는 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다.
R1, R2 는 각각 독립적으로 수소 원자 또는 치환기를 나타낸다. R1 과 R2 는 서로 결합하여 고리를 형성하고 있어도 된다.
Q 는 하기 식 (Ⅰ-1) 또는 (Ⅰ-2) 로 표시된다.
[화학식 5]
Ar3∼Ar5 는 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다. Ar3 과 Ar4 는 서로 결합하여 고리를 형성하고 있어도 된다.
[화학식 6]
고리 A1 은, 치환기를 갖고 있어도 되는 벤젠 고리, 또는 치환기를 갖고 있어도 되는 질소 함유 방향족 6 원자 고리를 나타낸다.
Ar1, Ar9 는 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다.
도 1 은 본 발명의 유기 전계 발광 소자의 일례를 나타낸 모식적 단면도이다.
도 2 는 본 발명의 유기 전계 발광 소자의 다른 예를 나타낸 모식적 단면도이다.
도 3 은 본 발명의 유기 전계 발광 소자의 다른 예를 나타낸 모식적 단면도이다.
도 4 는 본 발명의 유기 전계 발광 소자의 다른 예를 나타낸 모식적 단면도이다.
도 5 는 본 발명의 유기 전계 발광 소자의 다른 예를 나타낸 모식적 단면도이다.
도 6 은 본 발명의 유기 전계 발광 소자의 다른 예를 나타낸 모식적 단면도이다.
도 7 은 본 발명의 유기 전계 발광 소자의 다른 예를 나타낸 모식적 단면도이다.
도 8 은 본 발명의 유기 전계 발광 소자의 다른 예를 나타낸 모식적 단면도 이다.
상세한 설명
본 발명자들은 예의 검토한 결과, 상기 구조의 유기 화합물을 찾아냈다. 이 유기 화합물은, 내열성, 비정질성 및 전하 수송능이 우수하고, 또한 높은 일중항 및 삼중항 여기 (勵起) 준위를 가지며, 또한, 유기 용매에 대한 용해성도 우수하다.
이 때문에, 이 유기 화합물로 이루어지는 전하 수송 재료, 및 이 유기 화합물로 이루어지는 전하 수송 재료를 함유하는 전하 수송 재료용 조성물을 사용한 유기 전계 발광 소자에 의하면, 고휘도, 고효율 또한 긴 수명의 유기 전계 발광 소자가 제공된다.
본 발명의 유기 화합물, 그 화합물로 이루어지는 전하 수송 재료, 그 재료를 함유하는 전하 수송 재료용 조성물에 의하면, 전하 수송능이 높은 재료를 함유하는 균일한 유기 박막을 습식 막 제조법에 의해 형성하는 것이 가능하고, 유기 전계 발광 소자의 대면적화가 용이해진다. 또한, 본 발명의 전하 수송 재료, 그 재료를 함유하는 전하 수송 재료용 조성물을 사용한 유기 전계 발광 소자에 의하면, 낮은 전압, 또한 높은 효율로 발광시키는 것이 가능해진다.
또, 본 발명의 전하 수송 재료는, 우수한 막 제조성, 전하 수송성, 발광 특성, 내열성 면에서, 진공 증착법에도 습식 막 제조법에도 적용 가능하다.
또한, 본 발명의 전하 수송 재료, 그 재료를 함유하는 전하 수송 재료용 조성물은, 우수한 막 제조성, 전하 수송성, 발광 특성, 내열성에서, 소자의 층 구성 에 맞춰, 정공 주입 재료, 정공 수송 재료, 발광 재료, 호스트 재료, 전자 주입 재료, 전자 수송 재료 등으로도 적용 가능하다.
따라서, 본 발명의 전하 수송 재료, 그 재료를 함유하는 전하 수송 재료용 조성물을 사용한 본 발명의 유기 전계 발광 소자는 플랫 패널·디스플레이 (예를 들어 OA 컴퓨터용이나 벽걸이 텔레비전), 차재 표시 소자, 휴대전화 표시나 면발광체로서의 특징을 살린 광원 (예를 들어, 복사기의 광원, 액정 디스플레이나 계기류의 백라이트 광원), 표시판, 표지등에 대한 응용을 생각할 수 있어 그 기술적 가치는 큰 것이다.
본 발명의 전하 수송 재료, 그 재료를 함유하는 전하 수송 재료용 조성물은, 본질적으로 우수한 산화 환원 안정성을 가지므로, 유기 전계 발광 소자에 한정되지 않고, 그 밖에 전자 사진 감광체, 광전 변환 소자, 유기 태양 전지, 유기 정류 소자 등에도 유효하게 이용할 수 있다.
이하에 본 발명의 실시형태를 상세히 설명하는데, 이하에 기재하는 구성 요건의 설명은, 본 발명의 실시양태의 일례 (대표예) 이고, 본 발명은 그 요지를 벗어나지 않는 한, 이들 내용에 특정되지 않는다.
[유기 화합물]
본 발명의 유기 화합물은 하기 식 (Ⅰ) 로 표시된다.
[화학식 7]
Ar1 은 치환기를 갖고 있어도 되는 방향족 탄화수소기, 치환기를 갖고 있어도 되는 방향족 복소환기, 또는 치환기를 갖고 있어도 되는 알킬기를 나타낸다.
Ar2 는 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다.
R1, R2 는 각각 독립적으로 수소 원자 또는 치환기를 나타낸다. R1 과 R2 는 서로 결합하여 고리를 형성하고 있어도 된다.
Q 는 하기 식 (Ⅰ-1) 또는 (Ⅰ-2) 로 표시된다.
[화학식 8]
Ar3∼Ar5 는 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다. Ar3 과 Ar4 는 서로 결합하여 고리를 형성하고 있어도 된다.
[1] 구조 상의 특징
본 발명의 유기 화합물은, 우레아 결합 (-NR-CO-NR'-) 을 포함하는 5 원자 고리 (1,3-디히드로이미다졸-2-온) 구조를 갖기 때문에, 적절한 극성을 가지며, 비정질성이 높고, 내열성이 높다. 이 때문에, 여러 가지의 유기 용매에 가용이고, 용이하게는 결정화되지 않는 비정질의 유기 박막을 형성하는 것이 가능하다. 또, 그 구조는, 엄격한 평면 구조이기 때문에, 본 발명의 유기 화합물은 높은 일중항 및 삼중항 여기 준위를 갖는다. 또한, 본 발명의 유기 화합물은, 그 구조 외에, 3급 아민 부위 (-Ar2-N(Ar3)-Ar4) 또는 직접 결합된 2 개의 방향족기 (-Ar2-Ar5) 를 가지므로, 전하 수송성, 내열성이 더욱 향상되어 있다.
[2] 분자량 범위
본 발명의 유기 화합물의 분자량은 통상 5000 이하, 바람직하게는 3000 이하, 보다 바람직하게는 2000 이하이고, 또한 통상 300 이상, 바람직하게는 500 이상, 보다 바람직하게는 600 이상이다.
분자량이 상기 상한값을 초과하면, 불순물의 고분자량화에 의해 정제가 곤란해지는 경우가 있고, 또한 분자량이 상기 하한값을 밑돌면, 유리 전이 온도 및 융점, 기화 온도 등이 저하되기 때문에, 내열성이 현저히 저해될 우려가 있다.
[3] 물성
본 발명의 유기 화합물은 통상 40℃ 이상의 유리 전이 온도를 갖는데, 내열성의 관점에서, 80℃ 이상인 것이 바람직하고, 110℃ 이상인 것이 더욱 바람직하 다.
본 발명의 유기 화합물은 통상 300℃ 이상, 800℃ 이하의 기화 온도를 갖는다.
본 발명의 유기 화합물은, 통상 2.0eV 이상 4.0eV 이하의 여기 삼중항 상태와 기저 상태의 에너지차를 갖는데, 인광 발광을 사용한 유기 전계 발광 소자의 효율을 향상시키는 관점에서, 여기 삼중항 상태와 기저 상태의 에너지차가 2.3eV 이상인 것이 바람직하고, 2.6eV 이상인 것이 보다 바람직하고, 2.9eV 이상인 것이 더욱 바람직하다.
이 여기 삼중항 상태와 기저 상태의 에너지차 (최저 삼중항 여기 에너지) 를 구하는 방법은, 예를 들어 이하와 같다.
최저 삼중항 여기 에너지에는, 시료 화합물을 분광용으로 정제된 용매 (예를 들어, 2-메틸테트라히드로푸란) 에 녹인 용액을 통형상 석영 셀에 넣고, 액체 질소를 사용하여 77K 로 냉각시켜 포토루미네선스를 측정하고, 그 최대 에너지의 인광 발광 (0, 0 천이 피크 형상) 으로부터 구한다. 인광 발광과 형광 발광의 분별은, 여기광 입사 후, 포토루미네선스 관측 개시 시간을 늦춤으로써 실시한다. 포토루미네선스의 측정은, 재료의 흡수에 맞춰 N2 레이저 광원 (파장 337㎚) 을 사용하고, 이것을 여기광으로 하여 시료 화합물에 쬐여 실시한다.
[4] R1, R2
본 발명의 유기 화합물에 있어서의 R1, R2 는 각각 독립적으로 수소 원자 또 는 임의의 치환기를 나타내고, R1, R2 는 서로 결합하여 고리를 형성하고 있어도 된다.
임의의 치환기로는, 이하에 예시하는 유기기 등을 들 수 있고, 바람직하게는 분자량 500 이하의 기를 들 수 있다. 구체적으로는, 다음과 같은 것을 들 수 있다.
치환기를 갖고 있어도 되는 알킬기 (바람직하게는 탄소수 1∼8 의 직사슬 또는 분기의 알킬기이고, 예를 들어 메틸, 에틸, n-프로필, 2-프로필, n-부틸, 이소부틸, tert-부틸기 등을 들 수 있다),
치환기를 갖고 있어도 되는 알케닐기 (바람직하게는, 탄소수 2∼9 의 알케닐기이고, 예를 들어 비닐, 알릴, 1-부테닐기 등을 들 수 있다),
치환기를 갖고 있어도 되는 알키닐기 (바람직하게는, 탄소수 2∼9 의 알키닐기이고, 예를 들어 에티닐, 프로파르길기 등을 들 수 있다),
치환기를 갖고 있어도 되는 아르알킬기 (바람직하게는, 탄소수 7∼15 의 아르알킬기이고, 예를 들어 벤질기 등을 들 수 있다),
치환기를 갖고 있어도 되는 아미노기 [바람직하게는, 치환기를 갖고 있어도 되는 탄소수 1∼8 의 알킬기를 1 개 이상 갖는 알킬아미노기 (예를 들어 메틸아미노, 디메틸아미노, 디에틸아미노, 디벤질아미노기 등을 들 수 있다),
치환기를 갖고 있어도 되는 탄소수 6∼12 의 방향족 탄화수소기를 갖는 아릴아미노기 (예를 들어 페닐아미노, 디페닐아미노, 디톨릴아미노기 등을 들 수 있다 ),
치환기를 갖고 있어도 되는 5 또는 6 원자 고리의 방향족 복소환을 갖는 헤테로아릴아미노기 (예를 들어 피리딜아미노, 티에닐아미노, 디티에닐아미노기 등을 들 수 있다),
치환기를 갖고 있어도 되는 탄소수 2∼10 의 아실기를 갖는 아실아미노기 (예를 들어 아세틸아미노, 벤조일아미노기 등을 들 수 있다)],
치환기를 갖고 있어도 되는 알콕시기 (바람직하게는 치환기를 갖고 있어도 되는 탄소수 1∼8 의 알콕시기이고, 예를 들어 메톡시, 에톡시, 부톡시기 등을 들 수 있다),
치환기를 갖고 있어도 되는 아릴옥시기 (바람직하게는 탄소수 6∼12 의 방향족 탄화수소기를 갖는 것이고, 예를 들어 페닐옥시, 1-나프틸옥시, 2-나프틸옥시기 등을 들 수 있다),
치환기를 갖고 있어도 되는 헤테로아릴옥시기 (바람직하게는 5 또는 6 원자 고리의 방향족 복소환기를 갖는 것이고, 예를 들어 피리딜옥시, 티에닐옥시기 등을 들 수 있다),
치환기를 갖고 있어도 되는 아실기 (바람직하게는, 치환기를 갖고 있어도 되는 탄소수 2∼10 의 아실기이고, 예를 들어 포르밀, 아세틸, 벤조일기 등을 들 수 있다),
치환기를 갖고 있어도 되는 알콕시카르보닐기 (바람직하게는 치환기를 갖고 있어도 되는 탄소수 2∼10 의 알콕시카르보닐기이고, 예를 들어 메톡시카르보닐, 에톡시카르보닐기 등을 들 수 있다),
치환기를 갖고 있어도 되는 아릴옥시카르보닐기 (바람직하게는 치환기를 갖고 있어도 되는 탄소수 7∼13 의 아릴옥시카르보닐기이고, 예를 들어 페녹시카르보닐기 등을 들 수 있다),
치환기를 갖고 있어도 되는 알킬카르보닐옥시기 (바람직하게는 치환기를 갖고 있어도 되는 탄소수 2∼10 의 알킬카르보닐옥시기이고, 예를 들어 아세톡시기 등을 들 수 있다),
할로겐 원자 (특히, 불소 원자 또는 염소 원자),
카르복실기,
시아노기,
수산기,
메르캅토기,
치환기를 갖고 있어도 되는 알킬티오기 (바람직하게는 탄소수 1∼8 의 알킬티오기이고, 예를 들어 메틸티오기, 에틸티오기 등을 들 수 있다),
치환기를 갖고 있어도 되는 아릴티오기 (바람직하게는 탄소수 6∼12 의 아릴티오기이고, 예를 들어 페닐티오기, 1-나프틸티오기 등을 들 수 있다),
치환기를 갖고 있어도 되는 술포닐기 (예를 들어, 메실기, 토실기 등을 들 수 있다),
치환기를 갖고 있어도 되는 실릴기 (예를 들어, 트리메틸실릴기, 트리페닐실릴기 등을 들 수 있다),
치환기를 갖고 있어도 되는 보릴기 (예를 들어, 디메시틸보릴기 등을 들 수 있다),
치환기를 갖고 있어도 되는 포스피노기 (예를 들어, 디페닐포스피노기 등을 들 수 있다),
치환기를 갖고 있어도 되는 방향족 탄화수소기 (예를 들어, 벤젠 고리, 나프탈렌 고리, 안트라센 고리, 페난트렌 고리, 페릴렌 고리, 테트라센 고리, 피렌 고리, 벤즈피렌 고리, 크리센 고리, 트리페닐렌 고리, 플루오란텐 고리 등의, 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 1 가의 기를 들 수 있다)
치환기를 갖고 있어도 되는 복소환기 (예를 들어, 푸란 고리, 벤조푸란 고리, 티오펜 고리, 벤조티오펜 고리, 피롤 고리, 피라졸 고리, 이미다졸 고리, 옥사디아졸 고리, 인돌 고리, 카르바졸 고리, 피롤로이미다졸 고리, 피롤로피라졸 고리, 피롤로피롤 고리, 티에노피롤 고리, 티에노티오펜 고리, 푸로피롤 고리, 푸로푸란 고리, 티에노푸란 고리, 벤조이소옥사졸 고리, 벤조이소티아졸 고리, 벤조이미다졸 고리, 피리딘 고리, 피라진 고리, 피리다진 고리, 피리미딘 고리, 트리아진 고리, 퀴놀린 고리, 이소퀴놀린 고리, 시놀린 고리, 퀴녹살린 고리, 벤조이미다졸 고리, 페리미딘 고리, 퀴나졸린 고리, 이미다졸리논 고리, 벤조이미다졸리논 고리 등의, 5 또는 6 원자 고리의 단고리 또는 2∼4 축합 고리 유래의 1 가의 기를 들 수 있다)
또한, 상기 치환기가 추가로 치환기를 갖는 경우, 그 치환기로는, 상기 예시 치환기를 들 수 있다.
R1, R2 로는, 전기 화학적 내구성을 향상시키는 관점 및 내열성을 향상시키는 관점에서, 치환기를 갖고 있어도 되는 방향족 탄화수소기가 바람직하고, 치환기를 갖고 있어도 되는 페닐기가 보다 바람직하고, 비치환의 페닐기, 또는 1 또는 2 치환의 페닐기가 더욱 바람직하다.
R1, R2 로는, 용해성 및 비정질성을 더욱 향상시키는 관점에서, 치환기를 갖고 있어도 되는 알킬기가 바람직하고, 메틸기, 에틸기, n-프로필기, 2-프로필기, n-부틸기, 이소부틸기, tert-부틸기 등의 탄소수 1∼4 의 알킬기가 보다 바람직하고, 메틸기, 에틸기, n-프로필기가 더욱 바람직하다.
또한, R1, R2 로는, 삼중항 여기 준위의 저하를 방지하는 관점에서, 수소 원자가 바람직하다.
내열성을 더욱 향상시키는 관점에서, R1, R2 는 서로 결합하여 고리를 형성하고 있는 것이 바람직하다. R1, R2 가 서로 결합하여 고리를 형성한 경우의 식 (Ⅰ) 로 표시되는 유기 화합물의 예를 하기에 나타내는데, 본 발명은 이들에 한정되는 것은 아니다. 또, 이하에 있어서, R 로는, R1, R2 로서 예시한 치환기 또는 수소 원자를 들 수 있다.
[화학식 9]
전기 화학적 내구성을 향상시키는 관점, 삼중항 여기 준위의 저하를 방지하는 관점에서, R1, R2 는 서로 결합하여 벤젠 고리 또는 질소 함유 방향족 6 원자 고리를 형성하는 것이 바람직하다. 즉, 본 발명의 유기 화합물은 하기 식 (Ⅱ) 로 표시되는 것이 바람직하다.
[화학식 10]
Ar1, Ar2, Q 는, 상기 식 (Ⅰ) 에 있어서와 동일한 의미이다.
고리 A1 은 치환기를 갖고 있어도 되는 벤젠 고리, 또는 치환기를 갖고 있어도 되는 질소 함유 방향족 6 원자 고리를 나타낸다.
고리 A1 의 질소 함유 방향족 6 원자 고리로는, 피리딘 고리, 피라진 고리, 피리미딘 고리, 피리다진 고리, 트리아진 고리를 들 수 있고, 특히 피리딘 고리가 바람직하다.
고리 A1 의 치환기의 예로는, R1, R2 로서 예시한 치환기를 들 수 있고, 바람직한 치환기는 R1, R2 로서 바람직한 치환기와 동일하다.
[5] Ar1, Ar2
본 발명의 유기 화합물에 있어서의 Ar1 은, 임의의 치환기를 갖고 있어도 되는 방향족 탄화수소기, 임의의 치환기를 갖고 있어도 되는 방향족 복소환기, 또는 임의의 치환기를 갖고 있어도 되는 알킬기를 나타내고, Ar2 는, 임의의 치환기를 갖 고 있어도 되는 방향족 탄화수소기, 또는 임의의 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다.
Ar1, Ar2 가 갖고 있어도 되는 치환기의 예는, R1, R2 로서 예시한 치환기를 들 수 있다. Ar1 및 Ar2 의 치환기는, R1 및 R2 로서 예시한 치환기를 복수 연결하여 이루어지는 것이어도 된다. 또한, 그들 치환기는 인접하는 기와 결합하여 고리를 형성하고 있어도 된다. Ar1 은 그 치환기도 포함시켜, 바람직하게는 분자량 3000 이하, 더욱 바람직하게는 1000 이하이다. Ar2-Q 는, 그 치환기도 포함시켜, 바람직하게는 분자량 3000 이하, 바람직하게는 1000 이하이다.
Ar1, Ar2 가 갖고 있어도 되는 치환기로는, 내열성을 향상시키는 관점에서, 치환기를 갖고 있어도 되는 방향족 탄화수소기가 바람직하고, 보다 바람직하게는 치환기를 갖고 있어도 되는 페닐기이고, 더욱 바람직하게는 비치환의 페닐기, 1 또는 2 치환의 페닐기이다.
Ar1, Ar2 가 갖고 있어도 되는 치환기로는, 용해성 및 비정질성을 더욱 향상시키는 관점에서, 치환기를 갖고 있어도 되는 알킬기가 바람직하고, 보다 바람직하게는 메틸기, 에틸기, n-프로필기, 2-프로필기, n-부틸기, 이소부틸기, sec-부틸기, tert-부틸기 등의 탄소수 1∼4 의 알킬기, 더욱 바람직하게는 메틸기, 에틸기이다.
Ar1, Ar2 가 갖고 있어도 되는 치환기로는, 일중항 및 삼중항 여기 준위의 저하를 방지하면서, 더욱 내열성 및 전하 수송능을 향상시키는 점에서, 1,3-디히드로이미다졸-2-온 고리 유래의 기가 바람직하다.
Ar1, Ar2 에 적용 가능한 방향족 탄화수소기를 예시하면, 벤젠 고리, 나프탈렌 고리, 안트라센 고리, 페난트렌 고리, 페릴렌 고리, 테트라센 고리, 피렌 고리, 벤즈피렌 고리, 크리센 고리, 트리페닐렌 고리, 아세나프텐 고리, 플루오란텐 고리 등의, 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 기를 들 수 있다.
Ar1, Ar2 에 적용 가능한 방향족 복소환기를 예시하면, 푸란 고리, 벤조푸란 고리, 티오펜 고리, 벤조티오펜 고리, 피롤 고리, 피라졸 고리, 이미다졸 고리, 옥사디아졸 고리, 인돌 고리, 카르바졸 고리, 피롤로이미다졸 고리, 피롤로피라졸 고리, 피롤로피롤 고리, 티에노피롤 고리, 티에노티오펜 고리, 푸로피롤 고리, 푸로푸란 고리, 티에노푸란 고리, 벤조이소옥사졸 고리, 벤조이소티아졸 고리, 벤조이미다졸 고리, 피리딘 고리, 피라진 고리, 피리다진 고리, 피리미딘 고리, 트리아진 고리, 퀴놀린 고리, 이소퀴놀린 고리, 시놀린 고리, 퀴녹살린 고리, 페난트리딘 고리, 벤조이미다졸 고리, 페리미딘 고리, 퀴나졸린 고리, 퀴나졸리논 고리, 아줄렌 고리 등의, 5 또는 6 원자 고리의 단고리 또는 2∼4 축합 고리 유래의 기를 들 수 있다.
Ar1 에 적용 가능한 알킬기를 예시하면, 메틸, 에틸, n-프로필, 2-프로필, n-부틸, 이소부틸, sec-부틸기, tert-부틸기 등의 탄소수 1∼4 의 알킬기를 들 수 있다.
Ar1 은, 삼중항 여기 준위의 저하를 방지하는 점에서, 치환기를 갖고 있어도 되는 벤젠 고리 유래의 기, 치환기를 갖고 있어도 되는 피리딘 고리 유래의 기, 치환기를 갖고 있어도 되는 벤젠 고리 또는 치환기를 갖고 있어도 되는 피리딘 고리가 복수 (예를 들어 2∼10 개) 연결된 기 (예를 들어, 비페닐기, 터페닐기, 페닐피리딜기, 비피리딜기, 터피리딜기 등) 가 바람직하다.
Ar1 은, 합성이 용이한 점, 삼중항 여기 준위가 높아지는 경향이 있는 점에서, -Ar2-Q 와 동일한 것이 바람직하다.
Ar1 은, 용해성이 향상되는 점에서, -Ar2-Q 와는 다른 기인 것이 바람직하다.
Ar2 는, 삼중항 여기 준위의 저하를 방지하는 점에서, 치환기를 갖고 있어도 되는 벤젠 고리 유래의 기, 치환기를 갖고 있어도 되는 피리딘 고리 유래의 기, 치환기를 갖고 있어도 되는 벤젠 고리 또는 치환기를 갖고 있어도 되는 피리딘 고리가 복수 (예를 들어 2∼10 개) 연결된 2 가의 기 (예를 들어, 비페닐, 터페닐, 비피리딜, 터피리딜, 페닐피리딘, 디페닐피리딘, 디피리딜벤젠 유래의 2 가의 기 등) 가 바람직하다.
또, Ar2 는, 전기 화학적 내구성을 더욱 향상시키는 점에서, p-페닐렌기, 4,4'-비페닐렌기, 4,3'-비페닐렌기, 3,4'-비페닐렌기인 것이 더욱 바람직하다.
또한, Ar2 는, 용해성을 더욱 향상시키는 점에서, m-페닐렌기, 3,3'-비페닐렌기인 것이 더욱 바람직하다.
또, Ar2 는, 전하 (전자) 수송성을 더욱 향상시키는 점에서, 피리딘 고리를 포함하는 것이 바람직하고, 피리딘디일기, 또는 비피리딜, 터피리딜, 페닐피리딘, 디페닐피리딘, 디피리딜벤젠 유래의 2 가의 기인 것이 더욱 바람직하다.
Ar1 과 Ar2 가 모두 벤젠 고리 유래의 기인 것이, 용해성 및 내열성의 점에서, 삼중항 여기 준위의 저하를 방지하는 점에서 바람직하다.
즉, 본 발명의 유기 화합물은, 하기 식 (Ⅲ) 으로 표시되는 것이 바람직하다.
[화학식 11]
R1, R2, Q 는, 상기 식 (Ⅰ) 에 있어서와 동일한 의미이다.
고리 B1 은 치환기를 갖고 있어도 되는 벤젠 고리를 나타내고, 고리 C1 은 Q 이외에 치환기를 갖고 있어도 되는 벤젠 고리를 나타낸다.
고리 B1, 고리 C1 이 갖고 있어도 되는 치환기의 예 및 그 바람직한 예는, 각각 상기 Ar1, Ar2 가 갖고 있어도 되는 치환기와 동일하다.
또한, Ar1 과 Ar2 가 모두 피리딘 고리 유래의 기인 것이, 전하 수송성 및 내열성의 점에서, 삼중항 여기 준위의 저하를 방지하는 점에서 바람직하다.
즉, 본 발명의 유기 화합물은, 하기 식 (Ⅲ-2) 로 표시되는 것이 바람직하다.
[화학식 12]
R1, R2, Q 는, 상기 식 (Ⅰ) 에 있어서와 동일한 의미이다.
고리 D1 은 치환기를 갖고 있어도 되는 피리딘 고리를 나타내고, 고리 E1 은 Q 이외에 치환기를 갖고 있어도 되는 피리딘 고리를 나타낸다.
고리 D1, 고리 E1 이 갖고 있어도 되는 치환기의 예 및 그 바람직한 예는, 각각 상기 Ar1, Ar2 가 갖고 있어도 되는 치환기와 동일하다.
[6] Q
본 발명의 유기 화합물에 있어서의 Q 는, 하기 식 (Ⅰ-1) 또는 (Ⅰ-2) 에서 선택되는 기를 나타낸다.
[화학식 13]
Ar3∼Ar5 는 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다. Ar3 과 Ar4 는 서로 결합하여 고리를 형성하고 있어도 된다.
Ar3∼Ar5 가 갖고 있어도 되는 치환기의 예는, R1, R2 로서 예시한 치환기를 들 수 있다.
Ar3∼Ar5 가 갖고 있어도 되는 치환기로서 바람직한 예는 Ar1, Ar2 가 갖고 있어도 되는 치환기의 바람직한 예와 동일하다.
Ar3∼Ar5 에 적용 가능한 방향족 탄화수소기, 방향족 복소환기의 예는 Ar1, Ar2 에 적용 가능한 방향족 탄화수소기, 방향족 복소환기의 예와 동일하다.
Ar3, Ar4 는, 전기 화학적 내구성을 향상시키는 관점 및 내열성을 향상시키는 관점에서, 치환기를 갖고 있어도 되는 방향족 탄화수소기가 바람직하고, 보다 바람직하게는 치환기를 갖고 있어도 되는 페닐기이고, 더욱 바람직하게는 비치환의 페닐기, 1 또는 2 치환의 페닐기이다.
전하 수송능을 더욱 향상시키는 점에서, Q 는 식 (Ⅰ-1) 로 표시되는 것이 바람직하다.
식 (Ⅰ-1) 에 있어서, Ar3 과 Ar4 는 서로 결합하여, 치환기를 갖고 있어도 되는 고리를 형성하고 있어도 된다. Ar3 과 Ar4 는 서로 결합하여 고리를 형성한 경우의, Ar3Ar4N- 의 바람직한 예를 하기에 나타낸다. 이들 중, 높은 삼중항 여기 준위를 갖는 점에서, N-카르바졸릴기가 보다 바람직하다.
[화학식 14]
내열성을 향상시키는 점에서, Q 는 식 (Ⅰ-2) 로 표시되는 것이 바람직하다.
식 (Ⅰ-2) 에 있어서, Ar5 는, 삼중항 여기 준위의 저하를 방지하는 점에서, 치환기를 갖고 있어도 되는 벤젠 고리 유래의 기, 벤젠 고리가 복수 (예를 들어 2∼10 개) 연결된 기 (예를 들어, 비페닐렌기, 터페닐렌기 등) 가 바람직하다.
[7] 바람직한 구조
본 발명의 유기 화합물은, 높은 전하 수송능, 높은 전기 화학적 안정성, 높은 삼중항 여기 준위의 모두를 갖는 점에서, 하기 식 (Ⅳ) 로 표시되는 것이 바람직하다.
[화학식 15]
Ar2∼Ar4, R1, R2 는, 상기 식 (Ⅰ) 및 식 (Ⅰ-1) 에 있어서와 동일한 의미이다.
Ar6∼Ar8 은 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다. Ar7 과 Ar8 은 서로 결합하여 고리를 형성하고 있어도 된다.
Ar6 의 예 및 바람직한 예는, 각각 Ar2 와 동일하다. Ar7 및 Ar8 의 예 및 바람직한 예는, 각각 Ar3 또는 Ar4 와 동일하다.
또한, 높은 삼중항 여기 준위를 유지하면서, 내열성을 더욱 향상시키는 관점에서, 본 발명의 유기 화합물에 Ar1 의 부위, Ar2-Q 의 부위, R1 또는 R2 의 부위에, 하기 식 (Ⅰ-3) 으로 표시되는 N-카르바졸릴기를 1 개 이상, 바람직하게는 1∼6 개, 더욱 바람직하게는 2∼4 개 갖는 것이 바람직하다. 그 카르바졸릴기는, 치환기를 갖고 있어도 되는데, 비치환인 것이 바람직하다.
[화학식 16]
[8] 예시
이하에, 본 발명의 유기 화합물로서 바람직한 구체적인 예를 나타내는데, 본 발명은 이들에 한정되는 것은 아니다.
[화학식 17]
[화학식 18]
[화학식 19]
[화학식 20]
[화학식 21]
[화학식 22]
[화학식 23]
[화학식 24]
[화학식 25]
[화학식 26]
[화학식 27]
[화학식 28]
[화학식 29]
[화학식 30]
[화학식 31]
[화학식 32]
[9] 합성법
본 발명의 유기 화합물은, 목적으로 하는 화합물의 구조에 따라 원료를 선택하고, 공지된 수법을 사용하여 합성할 수 있다.
예를 들어, 다음과 같은 순서로 합성할 수 있다.
먼저, 식 (i) 로 표시되는 2-히드록시이미다졸 유도체와 할로겐화물 (Ar1-X1) 을, 구리 분말, 할로겐화 구리 (Ⅰ), 산화 구리 (Ⅰ), 팔라듐 착물 등의 천이 금속 촉매 (할로겐화물 (Ar1-X1) 의 할로겐 원자에 대하여 0.001∼5 당량 정도), 및 탄산 칼륨, 탄산 칼슘, 인산 칼륨, 탄산 세슘, tert-부톡시나트륨, 트리에틸아민 등의 염기성 물질 (할로겐화물 (Ar1-X1) 의 할로겐 원자에 대하여 1∼10 당량 정도) 의 존재하, 불활성 가스 기류하, 무용매 또는 방향족 용매, 에테르계 용매 등의 용매 중, 20∼300℃ 에서, 1∼60 시간 교반 혼합함으로써, 하기 식 (ii) 로 표시되는 화합물이 얻어진다. 다음으로, 하기 식 (ii) 로 표시되는 화합물과 할로겐화물 (X2-Ar2-Q) 을, 구리 분말, 할로겐화 구리 (Ⅰ), 산화 구리 (Ⅰ), 팔라듐 착물 등의 천이 금속 촉매 (할로겐화물 (X2-Ar2-Q) 의 할로겐 원자에 대하여 0.001∼5 당량 정도), 및 탄산 칼륨, 탄산 칼슘, 인산 칼륨, 탄산 세슘, tert-부톡시나트륨, 트리에틸아민 등의 염기성 물질 (할로겐화물 (X2-Ar2-Q) 의 할로겐 원자에 대하여 1∼10 당량 정도) 의 존재하, 불활성 가스 기류하, 무용매 또는 방향족 용매, 에테르계 용매 등의 용매 중, 20∼300℃ 에서, 1∼60 시간 교반 혼합함으로써, 하기 식 (Ⅰ) 로 표시되는 본 발명의 유기 화합물이 얻어진다. 또, 이하에 있어서, Ar1∼Ar5, R1, R2, Q 는 상기 식 (Ⅰ) 에 있어서와 동일한 의미이다. X1, X2 는 할로겐 원자를 나타낸다.
[화학식 33]
상기 식 (ii) 로 표시되는 화합물의 합성법으로는, Tetrahedron 1999 년, 55, 475-484 페이지, Tetrahedron Letters 2000 년, 41, 6387-6391 페이지, Tetrahedron 1990 년, 46, 1331-1342 페이지, European Journal of Organic Chemistry 1998 년, 183-187, The Journal of 0rganic Chemistry, 2004 년, 69, 7752-7754 페이지에 기재된 우레아 결합을 포함하는 5 원자 고리 (1,3-디히드로이 미다졸-2-온) 을 형성하는 방법도 적용할 수 있다.
Q=Ar5 의 경우, 할로겐화물 (X2-Ar2-Ar5) 은, 공지된 커플링 반응을 사용하여 합성하는 것이 가능하다. 공지된 커플링 수법으로는, 구체적으로는, 「Palladium in Heterocyclic Chemistry : A guide for the Synthetic Chemist」 (제 2 판, 2002, Jie Jack Li and Gordon W. Gribble, Pergamon 사), 「천이 금속이 만드는 유기 합성 그 다채로운 반응 형식과 최신의 성과」 (1997 년, 쯔지지로, 화학 동인사), 「볼하르트·쇼어 현대 유기 화학 하」 (2004 년, K.P.C.Vollhardt, 화학 동인사) 등에 기재 또는 인용되어 있는, 할로겐화 아릴과 아릴보레이트의 커플링 반응 등의, 고리끼리의 결합 (커플링) 반응을 사용할 수 있다.
Q=NAr3Ar4 의 경우, 할로겐화물 (X2-Ar2-NAr3Ar4) 은, 하기 식과 같이, 2급 아민 화합물 (Ar3Ar4NH) 과 디할로겐화물 (X2-Ar2-X3 (X2, X3=F, Cl, Br, I)) 로 합성된다. 사용 가능한 시약 등은, 상기 식 (i) 로 표시되는 화합물에서, 식 (ii) 로 표시되는 화합물을 합성하는 공정과 동일하다.
[화학식 34]
합성된 화합물의 정제 방법으로는, 「분리 정제 기술 핸드북」 (1993 년, (재) 일본 화학회 편), 「화학 변환법에 의한 미량 성분 및 난정제 물질의 고도 분 리」 (1988 년, (주) IPC 발행), 또는 「실험 화학 강좌 (제 4 판) 1」 (1990 년, (재) 일본 화학회 편) 의 「분리와 정제」 의 항에 기재된 방법을 비롯하여, 공지된 기술을 이용할 수 있다.
구체적으로는, 추출 (현탁 세정, 자비 (煮沸) 세정, 초음파 세정, 산염기 세정을 포함한다), 흡착, 흡장, 융해, 정석 (용매로부터의 재결정, 재침전을 포함한다), 증류 (상압 증류, 감압 증류), 증발, 승화 (상압 승화, 감압 승화), 이온 교환, 투석, 여과, 한외 여과, 역침투, 압침투, 대역 용해, 전기 영동, 원심 분리, 부상 분리, 침강 분리, 자기 분리, 각종 크로마토그래피 (형상 분류 : 칼럼, 페이퍼, 박층, 캐필러리. 이동상 분류 : 가스, 액체, 미셀, 초임계 유체. 분리 기구 : 흡착, 분배, 이온 교환, 분자 체, 킬레이트, 겔 여과, 배제, 어피니티) 등을 들 수 있다.
생성물의 확인이나 순도의 분석 방법으로는, 가스 크로마토그래프 (GC), 고속 액체 크로마토그래프 (HPLC), 고속 아미노산 분석계 (AAA), 캐필러리 전기 영동 측정 (CE), 사이즈 배제 크로마토그래프 (SEC), 겔 침투 크로마토그래프 (GPC), 교차 분별 크로마토그래프 (CFC) 질량 분석 (MS, LC/MS, GC/MS, MS/MS), 핵자기 공명 장치 (NMR (1HNMR, 13CNMR)), 푸리에 변환 적외 분광 고도계 (FT-IR), 자외 가시 근적외 분광 고도계 (UV. VIS, NIR), 전자 스핀 공명 장치 (ESR), 투과형 전자 현미경 (TEM-EDX) 전자선 마이크로 애널라이저 (EPMA), 금속 원소 분석 (이온 크로마토그래프, 유도 결합 플라즈마-발광 분광 (ICP-AES) 원자 흡광 분석 (AAS) 형광 X 선 분석 장치 (XRF)), 비금속 원소 분석, 미량 성분 분석 (ICP-MS, GF-AAS, GD-MS) 등을 필요에 따라 적용할 수 있다.
[10] 유기 화합물의 용도
본 발명의 유기 화합물은, 높은 전하 수송성을 갖기 때문에, 전하 수송 재료로서 전자 사진 감광체, 유기 전계 발광 소자, 광전 변환 소자, 유기 태양 전지, 유기 정류 소자 등에 바람직하게 사용할 수 있다.
또한, 높은 삼중항 여기 준위를 가지므로, 본 발명의 유기 화합물로 이루어지는 본 발명의 전하 수송 재료를 사용함으로써, 내열성이 우수하고, 장기간 안정적으로 구동 (발광) 하는 유기 전계 발광 소자가 얻어지기 때문에, 본 발명의 유기 화합물 및 전하 수송 재료는 유기 전계 발광 소자 재료로서 특히 바람직하다.
[전하 수송 재료]
본 발명의 전하 수송 재료는, 본 발명의 유기 화합물로 이루어지는 것, 또는 하기 식 (Ⅱ-2) 로 표시되는 것이고, 바람직하게는, 톨루엔에 대하여 2.0 중량% 이상, 보다 바람직하게는 5.0 중량% 이상 용해된다.
[화학식 35]
고리 A1 은, 치환기를 갖고 있어도 되는 벤젠 고리, 또는 치환기를 갖고 있 어도 되는 질소 함유 방향족 6 원자 고리를 나타낸다.
Ar1, Ar9 는 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다.
상기 식 (Ⅱ-2) 에 있어서, 고리 A1, Ar1 은 상기 식 (Ⅱ) 에 있어서의 A1, Ar1 과 동일한 의미이고, 그 치환기, 그 바람직한 예도 동일하다. Ar9 로는 Ar1 과 동일한 것을 들 수 있고, Ar9 가 갖고 있어도 되는 치환기에 대해서도 Ar1 이 갖고 있어도 되는 치환기와 동일하다.
상기 식 (Ⅱ-2) 로 표시되는 본 발명의 전하 수송 재료의 분자량은, 통상 5000 이하, 바람직하게는 3000 이하, 보다 바람직하게는 2000 이하이고, 또한 통상 300 이상, 바람직하게는 500 이상, 보다 바람직하게는 600 이상이다.
분자량이 상기 상한값을 초과하면, 불순물의 고분자량화에 의해 정제가 곤란해지는 경우가 있고, 또한 분자량이 상기 하한값을 밑돌면, 유리 전이 온도 및 융점, 기화 온도 등이 저하되므로, 내열성이 현저히 저해될 우려가 있다.
본 발명의 전하 수송 재료는, 통상 40℃ 이상의 유리 전이 온도를 갖는데, 내열성의 관점에서, 80℃ 이상인 것이 바람직하고, 110℃ 이상인 것이 더욱 바람직하다.
본 발명의 전하 수송 재료는, 통상 300℃ 이상, 800℃ 이하의 기화 온도를 갖는다.
본 발명의 전하 수송 재료는, 통상 2.0eV 이상 4.0eV 이하의 여기 삼중항 상태와 기저 상태의 에너지차를 갖는데, 인광 발광을 사용한 유기 전계 발광 소자의 효율을 향상시키는 관점에서, 여기 삼중항 상태와 기저 상태의 에너지차가 2.3eV 이상인 것이 바람직하고, 2.6eV 이상인 것이 보다 바람직하고, 2.9eV 이상인 것이 더욱 바람직하다.
후술하는 바와 같이, 전하 수송 재료용 조성물에 함유되는 용제로는 방향족 탄화수소가 바람직하다. 톨루엔은, 방향족 탄화수소의 대표예로서 예시되어 있고, 본 발명에 있어서는, 유기 화합물 (전하 수송 재료) 의 용해성을 나타내는 지표로 하고 있다.
본 발명의 전하 수송 재료의 톨루엔에 대한 용해도가 2.0 중량% 이상인 것에 의해, 습식 막 제조법에 의해 유기 전계 발광 소자를 구성하는 층을 용이하게 형성할 수 있어 바람직하다. 이 용해도의 상한에는 특별히 제한은 없지만, 통상 50 중량% 정도이다.
[전하 수송 재료용 조성물]
본 발명의 전하 수송 재료용 조성물은, 상기 서술한 본 발명의 전하 수송 재료를 함유하는 것이고, 통상 본 발명의 전하 수송 재료와 용제를 함유하고, 더욱 바람직하게는 인광 발광 재료를 함유하는 것이고, 바람직하게는, 유기 전계 발광 소자용으로 사용된다.
[1] 용제
본 발명의 전하 수송 재료용 조성물에 함유되는 용제로는, 용질인 본 발명의 전하 수송 재료 등이 양호하게 용해되는 용제이면 특별히 한정되지 않는다.
본 발명의 전하 수송 재료는 용해성이 높으므로, 여러 가지 용제를 적용할 수 있다. 예를 들어, 톨루엔, 자일렌, 메시틸렌, 시클로헥실벤젠, 테트랄린 등의 방향족 탄화수소 ; 클로로벤젠, 디클로로벤젠, 트리클로로벤젠 등의 할로겐화 방향족 탄화수소 ; 1,2-디메톡시벤젠, 1,3-디메톡시벤젠, 아니솔, 페네톨, 2-메톡시톨루엔, 3-메톡시톨루엔, 4-메톡시톨루엔, 2,3-디메틸아니솔, 2,4-디메틸아니솔 등의 방향족 에테르 ; 아세트산 페닐, 프로피온산 페닐, 벤조산 메틸, 벤조산 에틸, 벤조산 프로필, 벤조산 n-부틸 등의 방향족 에스테르 ; 시클로헥사논, 시클로옥타논 등의 지환을 갖는 케톤 ; 메틸에틸케톤, 디부틸케톤 등의 지방족 케톤 ; 메틸에틸케톤, 시클로헥산올, 시클로옥탄올 등의 지환을 갖는 알코올 ; 부탄올, 헥산올 등의 지방족 알코올 ; 에틸렌글리콜디메틸에테르, 에틸렌글리콜디에틸에테르, 프로필렌글리콜-1-모노메틸에테르아세테이트 (PGMEA) 등의 지방족 에테르 ; 아세트산 에틸, 아세트산 n-부틸, 락트산 에틸, 락트산 n-부틸 등의 지방족 에스테르 등을 이용할 수 있다. 이들 중, 물의 용해도가 낮은 점, 용이하게는 변질되지 않는 점에서, 톨루엔, 자일렌, 메티실렌, 시클로헥실벤젠, 테트랄린 등의 방향족 탄화수소가 바람직하다.
유기 전계 발광 소자에는, 음극 등의 수분에 의해 현저히 열화되는 재료가 많이 사용되고 있기 때문에, 조성물 중의 수분의 존재는, 건조 후의 막 중에 수분이 잔류하여, 소자의 특성을 저하시킬 가능성이 있어 바람직하지 않다.
조성물 중의 수분량을 저감시키는 방법으로는, 예를 들어 질소 가스 시일, 건조제의 사용, 용제를 미리 탈수하는 것, 물의 용해도가 낮은 용제를 사용하는 것 등을 들 수 있다. 그 중에서도, 물의 용해도가 낮은 용제를 사용하는 경우에는, 습식 막 제조 공정 중에, 용액막이 대기 중의 수분을 흡수하여 백화되는 현상을 방지할 수 있기 때문에 바람직하다. 이러한 관점에서는, 본 실시형태가 적용되는 전하 수송 재료용 조성물은, 예를 들어 25℃ 에서의 물의 용해도가 1 중량% 이하, 바람직하게는 0.1 중량% 이하인 용제를, 조성물 중 10 중량% 이상 함유하는 것이 바람직하다.
또한, 습식 막 제조시에 있어서의 조성물로부터의 용제 증발에 의한, 막 제조 안정성의 저하를 저감시키기 위해서는, 전하 수송 재료용 조성물의 용제로서, 비점이 100℃ 이상, 바람직하게는 비점이 150℃ 이상, 보다 바람직하게는 비점이 200℃ 이상인 용제를 사용하는 것이 효과적이다. 또한, 보다 균일한 막을 얻기 위해서는, 막 제조 직후의 액막으로부터 용제가 적당한 속도로 증발하는 것이 필요하고, 이를 위해서는 통상 비점 80℃ 이상, 바람직하게는 비점 100℃ 이상, 보다 바람직하게는 비점 120℃ 이상이고, 통상 비점 270℃ 미만, 바람직하게는 비점 250℃ 미만, 보다 바람직하게는 비점 230℃ 미만의 용제를 사용하는 것이 효과적이다.
상기 서술한 조건, 즉 용질의 용해성, 증발 속도, 물의 용해도의 조건을 만족하는 용제를 단독으로 사용해도 되는데, 2 종류 이상의 용제를 혼합하여 사용할 수도 있다.
[2] 발광 재료
본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물로서 사 용되는 전하 수송 재료용 조성물은, 발광 재료를 함유하는 것이 바람직하다.
발광 재료란, 본 발명의 전하 수송 재료용 조성물에 있어서, 주로 발광되는 성분을 가리키고, 유기 전계 발광 디바이스에 있어서의 도펀트 성분에 해당한다. 즉, 전하 수송 재료용 조성물로부터 발생되는 광량 (단위 : cd/㎡) 중, 통상 10∼100%, 바람직하게는 20∼100%, 보다 바람직하게는 50∼100%, 가장 바람직하게는 80∼100% 가, 어떤 성분 재료로부터의 발광과 동정되는 경우, 그것을 발광 재료로 정의한다.
발광 재료로는, 공지 재료를 적용할 수 있고, 형광 발광 재료 또는 인광 발광 재료를 단독 또는 복수를 혼합하여 사용할 수 있는데, 내부 양자 효율의 관점에서, 바람직하게는 인광 발광 재료이다.
본 발명의 전하 수송 재료용 조성물에 사용하는 경우, 이 발광 재료의 최대 발광 피크 파장은 390∼490㎚ 의 범위에 있는 것이 바람직하다.
또, 용제에 대한 용해성을 향상시킬 목적으로, 발광 재료 분자의 대칭성이나 강성을 저하시키거나, 또는 알킬기 등의 친유성 치환기를 도입하는 것도 중요하다.
청색 발광을 부여하는 형광 색소로는, 페릴렌, 피렌, 안트라센, 쿠마린, p-비스(2-페닐에테닐)벤젠 및 그들의 유도체 등을 들 수 있다. 녹색 형광 색소로는, 퀴나크리돈 유도체, 쿠마린 유도체 등을 들 수 있다. 황색 형광 색소로는, 루브렌, 페리미돈 유도체 등을 들 수 있다. 적색 형광 색소로는, DCM 계 화합물, 벤조피란 유도체, 로다민 유도체, 벤조티오크산텐 유도체, 아자벤조티오크산텐 등을 들 수 있다.
인광 발광 재료로는, 예를 들어 주기표 7 내지 11 족에서 선택되는 금속을 함유하는 유기 금속 착물을 들 수 있다.
주기표 7 내지 11 족에서 선택되는 금속을 함유하는 인광성 유기 금속 착물에 있어서의 금속으로서 바람직하게는, 루테늄, 로듐, 팔라듐, 은, 레늄, 오스뮴, 이리듐, 백금, 금 등을 들 수 있다. 이들 유기 금속 착물로서, 바람직하게는 하기 일반식 (Ⅴ) 또는 식 (Ⅵ) 으로 표시되는 화합물을 들 수 있다.
ML(q-j)L'j (Ⅴ)
일반식 (Ⅴ) 중, M 은 금속을 나타내고, q 는 상기 금속의 가수를 나타낸다. 또한, L 및 L' 는 2 좌 배위자를 나타낸다. j 는 0, 1 또는 2 를 나타낸다)
[화학식 36]
일반식 (Ⅵ) 중, Md 는 금속을 나타내고, T 는 탄소 또는 질소를 나타낸다. R92∼R95 는, 각각 독립적으로 치환기를 나타낸다. 단, T 가 질소인 경우에는, R94 및 R95 는 없다.
이하, 먼저, 일반식 (Ⅴ) 로 표시되는 화합물에 대하여 설명한다.
일반식 (Ⅴ) 중, M 은 임의의 금속을 나타내고, 바람직한 것의 구체예로는, 주기표 7 내지 11 족에서 선택되는 금속으로서 상기 서술한 금속을 들 수 있다.
또한, 일반식 (Ⅴ) 중의 2 좌 배위자 L 및 L' 는, 각각 이하의 부분 구조를 갖는 배위자를 나타낸다.
[화학식 37]
[화학식 38]
L' 로서, 착물의 안정성의 관점에서, 특히 바람직하게는 하기의 것을 들 수 있다.
[화학식 39]
상기 L, L' 의 부분 구조에 있어서, 고리 A1 은, 방향족 탄화수소기 또는 방향족 복소환기를 나타내고, 이들은 치환기를 갖고 있어도 된다. 또, 고리 A2 는, 질소 함유 방향족 복소환기를 나타내고, 이들은 치환기를 갖고 있어도 된다.
고리 A1, A2 가 치환기를 갖는 경우, 바람직한 치환기로는, 불소 원자 등의 할로겐 원자 ; 메틸기, 에틸기 등의 알킬기 ; 비닐기 등의 알케닐기 ; 메톡시카르보닐기, 에톡시카르보닐기 등의 알콕시카르보닐기 ; 메톡시기, 에톡시기 등의 알콕시기 ; 페녹시기, 벤질옥시기 등의 아릴옥시기 ; 디메틸아미노기, 디에틸아미노기 등의 디알킬아미노기 ; 디페닐아미노기 등의 디아릴아미노기 ; 카르바졸릴기 ; 아세틸기 등의 아실기 ; 트리플루오로메틸기 등의 할로알킬기 ; 시아노기 ; 페닐기, 나프틸기, 페난틸기 등의 방향족 탄화수소기 등을 들 수 있다.
일반식 (Ⅴ) 로 표시되는 화합물로서, 더욱 바람직하게는, 하기 일반식 (Ⅴa), (Ⅴb), (Ⅴc) 로 표시되는 화합물을 들 수 있다.
[화학식 40]
일반식 (Ⅴa) 중, Ma 는 M 과 동일한 금속을 나타내고, w 는 상기 금속의 가수를 나타낸다. 또한, 고리 A1 은 치환기를 갖고 있어도 되는 방향족 탄화수소 기를 나타내고, 고리 A2 는 치환기를 갖고 있어도 되는 질소 함유 방향족 복소환기를 나타낸다.
[화학식 41]
일반식 (Ⅴb) 중, Mb 는 M 과 동일한 금속을 나타내고, w 는 상기 금속의 가수를 나타낸다. 또한, 고리 A1 은 치환기를 갖고 있어도 되는 방향족 탄화수소기 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타내고, 고리 A2 는 치환기를 갖고 있어도 되는 질소 함유 방향족 복소환기를 나타낸다.
[화학식 42]
일반식 (Ⅴc) 중, Mc 는 M 과 동일한 금속을 나타내고, w 는 상기 금속의 가수를 나타낸다. 또한, j 는 0, 1 또는 2 를 나타낸다. 또한, 고리 A1 및 고리 A1' 는, 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다. 또한, 고리 A2 및 고리 A2' 는, 각각 독립적으로 치환기를 갖고 있어도 되는 질소 함유 방향족 복소환기를 나타낸다.
상기 일반식 (Ⅴa), (Ⅴb), (Ⅴc) 에 있어서, 고리 A1 및 고리 A1' 의 기로는, 바람직하게는, 예를 들어 페닐기, 비페닐기, 나프틸기, 안트릴기, 티에닐기, 푸릴기, 벤조티에닐기, 벤조푸릴기, 피리딜기, 퀴놀릴기, 이소퀴놀릴기, 카르바졸릴기 등을 들 수 있다.
또한, 고리 A2, 고리 A2' 의 기로는, 바람직하게는, 예를 들어 피리딜기, 피리미딜기, 피라질기, 트리아질기, 벤조티아졸기, 벤조옥사졸기, 벤조이미다졸기, 퀴놀릴기, 이소퀴놀릴기, 퀴녹살릴기, 페난트리딜기 등을 들 수 있다.
또한, 일반식 (Ⅴa), (Ⅴb), (Ⅴc) 로 표시되는 화합물이 갖고 있어도 되는 치환기로는, 불소 원자 등의 할로겐 원자 ; 메틸기, 에틸기 등의 알킬기 ; 비닐기 등의 알케닐기 ; 메톡시카르보닐기, 에톡시카르보닐기 등의 알콕시카르보닐기 ; 메톡시기, 에톡시기 등의 알콕시기 ; 페녹시기, 벤질옥시기 등의 아릴옥시기 ; 디메틸아미노기, 디에틸아미노기 등의 디알킬아미노기 ; 디페닐아미노기 등의 디아릴아미노기 ; 카르바졸릴기 ; 아세틸기 등의 아실기 ; 트리플루오로메틸기 등의 할로알킬기 ; 시아노기 등을 들 수 있다.
상기 치환기가 알킬기인 경우에는, 그 탄소수는 통상 1 이상 6 이하이다. 또한, 치환기가 알케닐기인 경우에는, 그 탄소수는 통상 2 이상 6 이하이다. 또, 치환기가 알콕시카르보닐기인 경우에는, 그 탄소수는 통상 2 이상 6 이하이다. 또한, 치환기가 알콕시기인 경우에는, 그 탄소수는 통상 1 이상 6 이하이다. 또, 치환기가 아릴옥시기인 경우에는, 그 탄소수는 통상 6 이상 14 이하이다. 또한, 치환기가 디알킬아미노기인 경우에는, 그 탄소수는 통상 2 이상 24 이하이다. 또, 치환기가 디아릴아미노기인 경우에는, 그 탄소수는 통상 12 이상 28 이하이다. 또한, 치환기가 아실기인 경우에는, 그 탄소수는 통상 1 이상 14 이하이다. 또, 치환기가 할로알킬기인 경우에는, 그 탄소수는 통상 1 이상 12 이하이다.
또, 이들 치환기는 서로 연결하여 고리를 형성해도 된다. 구체예로는, 고리 A1 이 갖는 치환기와 고리 A2 가 갖는 치환기가 결합하거나, 또는 고리 A1' 가 갖는 치환기와 고리 A2' 가 갖는 치환기가 결합하거나 하여, 하나의 축합 고리를 형성해도 된다. 이러한 축합 고리기로는, 7,8-벤조퀴놀린기 등을 들 수 있다.
그 중에서도, 고리 A1, 고리 A1', 고리 A2 및 고리 A2' 의 치환기로서, 보다 바람직하게는 알킬기, 알콕시기, 방향족 탄화수소기, 시아노기, 할로겐 원자, 할로알킬기, 디아릴아미노기, 카르바졸릴기를 들 수 있다.
또한, 일반식 (Ⅴa), (Ⅴb), (Ⅴc) 에 있어서의 Ma, Mb, Mc 로서 바람직하게는, 루테늄, 로듐, 팔라듐, 은, 레늄, 오스뮴, 이리듐, 백금 또는 금을 들 수 있다.
상기 일반식 (Ⅴ), (Ⅴa), (Ⅴb) 또는 (Ⅴc) 로 나타내는 유기 금속 착물의 구체예를 이하에 나타내는데, 하기의 화합물에 한정되는 것은 아니다 (이하에 있어서, Ph 는 페닐기를 나타낸다).
[화학식 43]
[화학식 44]
상기 일반식 (Ⅴ), (Ⅴa), (Ⅴb), (Ⅴc) 로 표시되는 유기 금속 착물 중에서도, 특히 배위자 L 및/또는 L' 로서 2-아릴피리딘계 배위자, 즉 2-아릴피리딘, 이것에 임의의 치환기가 결합된 것, 및 이것에 임의의 기가 축합하여 이루어지는 것 을 갖는 화합물이 바람직하다.
또한, WO2005/019373호에 기재된 화합물도 사용할 수 있다.
다음으로, 상기 일반식 (Ⅵ) 으로 표시되는 화합물에 대해서 설명한다.
일반식 (Ⅵ) 중, Md 는 금속을 나타내고, 구체예로는, 주기표 7 내지 11 족에서 선택되는 금속으로서 상기 서술한 금속을 들 수 있다. 그 중에서도 바람직하게는, 루테늄, 로듐, 팔라듐, 은, 레늄, 오스뮴, 이리듐, 백금 또는 금을 들 수 있고, 특히 바람직하게는, 백금, 팔라듐 등의 2 가의 금속을 들 수 있다.
또한, 일반식 (Ⅵ) 에 있어서, R92 및 R93 은, 각각 독립적으로 수소 원자, 할로겐 원자, 알킬기, 아르알킬기, 알케닐기, 시아노기, 아미노기, 아실기, 알콕시카르보닐기, 카르복실기, 알콕시기, 알킬아미노기, 아르알킬아미노기, 할로알킬기, 수산기, 아릴옥시기, 방향족 탄화수소기 또는 방향족 복소환기를 나타낸다.
또한, T 가 탄소인 경우, R94 및 R95 는, 각각 독립적으로 R92 및 R93 과 동일한 예시물로 표시되는 치환기를 나타낸다. 또한, 상기 서술한 바와 같이, T 가 질소인 경우에는 R94 및 R95 는 없다.
또, R92∼R95 는 추가로 치환기를 갖고 있어도 된다. 이 경우의 추가로 갖고 있어도 되는 치환기에는 특별히 제한은 없고, 임의의 기를 치환기로 할 수 있다.
또한, R92∼R95 는 서로 연결하여 고리를 형성해도 되고, 이 고리가 추가로 임의의 치환기를 갖고 있어도 된다.
일반식 (Ⅵ) 으로 표시되는 유기 금속 착물의 구체예 (T-1, T-10∼T-15) 를 이하에 나타내는데, 하기의 예시 화합물에 한정되는 것은 아니다. 또, 이하에 있어서, Me 는 메틸기를 나타내고, Et 는 에틸기를 나타낸다.
[화학식 45]
[3] 그 밖의 성분
본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물로서 사 용되는 전하 수송 재료용 조성물 중에는, 상기 서술한 용제 및 발광 재료 이외에도, 필요에 따라, 각종의 다른 용제를 함유하고 있어도 된다. 이러한 다른 용제로는, 예를 들어 N,N-디메틸포름아미드, N,N-디메틸아세트아미드 등의 아미드류, 디메틸술폭시드 등을 들 수 있다.
또한, 레벨링제나 소포제 등의 각종 첨가제를 함유하고 있어도 된다.
또, 2 층 이상의 층을 습식 막 제조법에 의해 적층할 때, 이들 층이 상용되는 것을 방지하기 위해, 막 제조 후에 경화시켜 불용화시킬 목적으로 광경화성 수지나, 열경화성 수지를 함유시켜 둘 수도 있다.
[4] 전하 수송 재료용 조성물 중의 재료 농도와 배합비
전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물 중의 전하 수송 재료, 발광 재료 및 필요에 따라 첨가 가능한 성분 (레벨링제 등) 등의 고형분 농도는, 통상 0.01 중량% 이상, 바람직하게는 0.05 중량% 이상, 보다 바람직하게는 0.1 중량% 이상, 더욱 바람직하게는 0.5 중량% 이상, 가장 바람직하게는 1 중량% 이상이고, 통상 80 중량% 이하, 바람직하게는 50 중량% 이하, 보다 바람직하게는 40 중량% 이하, 더욱 바람직하게는 30 중량% 이하, 가장 바람직하게는 20 중량% 이하이다. 이 농도가 하한을 밑돌면, 박막을 형성하는 경우, 후막을 형성하는 것이 곤란해지고, 상한을 초과하면, 박막을 형성하는 것이 곤란해질 우려가 있다.
또, 본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물에 있어서, 발광 재료/전하 수송 재료의 중량 혼합비는, 통상 0.1/99.9 이상이고, 보다 바람직하게는 0.5/99.5 이상이고, 더욱 바람직하게는 1/99 이상이고, 가장 바람 직하게는 2/98 이상이고, 통상 50/50 이하이고, 보다 바람직하게는 40/60 이하이고, 더욱 바람직하게는 30/70 이하이고, 가장 바람직하게는 20/80 이하이다. 이 비가 하한을 밑돌거나, 상한을 초과하면, 현저히 발광 효율이 저하될 우려가 있다.
[5] 전하 수송 재료용 조성물의 조제 방법
본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물은, 전하 수송 재료, 발광 재료, 및 필요에 따라 첨가 가능한 레벨링제나 소포제 등의 각종 첨가제로 이루어지는 용질을, 적당한 용제에 용해시킴으로써 조제된다. 용해 공정에 요하는 시간을 단축하기 위해, 및 조성물 중의 용질 농도를 균일하게 유지하기 위해, 통상 액을 교반하면서 용질을 용해시킨다. 용해 공정은 상온에서 실시해도 되는데, 용해 속도가 느린 경우에는 가열하여 용해시킬 수도 있다. 용해 공정 종료 후, 필요에 따라, 필터링 등의 여과 공정을 경유해도 된다.
[6] 전하 수송 재료용 조성물의 성상, 물성 등
[수분 농도]
유기 전계 발광 소자를, 본 발명의 전하 수송 재료용 조성물 (전하 수송 재료용 조성물) 을 사용한 습식 막 제조법에 의해 층 형성하여 제조하는 경우, 사용하는 전하 수송 재료용 조성물에 수분이 존재하면, 형성된 막에 수분이 혼입되어 막의 균일성이 저해되므로, 본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물 중의 수분 함유량은 가능한 한 적은 것이 바람직하다. 또한 일반적으로, 유기 전계 발광 소자는, 음극 등의 수분에 의해 현저히 열화되는 재료가 많이 사용되고 있기 때문에, 전하 수송 재료용 조성물 중에 수분이 존재한 경우, 건조 후의 막 중에 수분이 잔류하여 소자의 특성을 저하시킬 가능성이 있어 바람직하지 않다.
구체적으로는, 본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물 중에 함유되는 수분량은, 통상 1 중량% 이하, 바람직하게는 0.1 중량% 이하, 보다 바람직하게는 0.01 중량% 이하이다.
전하 수송 재료용 조성물 중의 수분 농도의 측정 방법으로는, 일본 공업 규격 「화학 제품의 수분 측정법」 (JIS K0068 : 2001) 에 기재된 방법이 바람직하고, 예를 들어 칼피셔 시약법 (JIS K0211-1348) 등에 의해 분석할 수 있다.
[균일성]
본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물은, 습식 막 제조 프로세스에서의 안정성, 예를 들어 잉크젯 막 제조법에 있어서의 노즐로부터의 토출 안정성을 높이기 위해서는, 상온에서 균일한 액상인 것이 바람직하다. 상온에서 균일한 액상이란, 조성물이 균일상으로 이루어지는 액체이고, 또한 조성물 중에 입경 0.1㎛ 이상의 입자 성분을 함유하지 않는 것을 말한다.
[물성]
본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물의 점도에 대해서는, 극단적으로 저점도인 경우에는, 예를 들어 막 제조 공정에서의 과도한 액막 유동에 의한 도포면 불균일, 잉크젯 막 제조에 있어서의 노즐 토출 불량 등이 일어나기 쉬워지고, 극단적으로 고점도인 경우에는, 잉크젯 막 제조에 있어서 의 노즐 막힘 등이 일어나기 쉬워진다. 이 때문에, 본 발명의 조성물의 25℃ 에서의 점도는, 통상 2mPa·s 이상, 바람직하게는 3mPa·s 이상, 보다 바람직하게는 5mPa·s 이상이고, 통상 1000mPa·s 이하, 바람직하게는 100mPa·s 이하, 보다 바람직하게는 50mPa·s 이하이다.
또, 본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물의 표면 장력이 높은 경우에는, 기판에 대한 막 제조용 액의 젖음성이 저하되고, 액막의 레벨링성이 나쁘고, 건조시의 막 제조면의 불균일이 일어나기 쉬워지는 등의 문제가 발생하는 경우가 있기 때문에, 본 발명의 조성물의 20℃ 에서의 표면 장력은, 통상 50mN/m 미만, 바람직하게는 40mN/m 미만이다.
또한, 본 발명의 전하 수송 재료용 조성물, 특히 전하 수송 재료용 조성물의 증기압이 높은 경우에는, 용제의 증발에 의한 용질 농도의 변화 등의 문제가 쉽게 일어나게 되는 경우가 있다. 이 때문에, 본 발명의 조성물의 25℃ 에서의 증기압은, 통상 50mmHg 이하, 바람직하게는 10mmHg 이하, 보다 바람직하게는 1mmHg 이하이다.
[7] 전하 수송 재료용 조성물의 보존 방법
본 발명의 전하 수송 재료용 조성물은, 자외선의 투과를 막을 수 있는 용기, 예를 들어 갈색 유리병 등에 충전하고, 마개로 밀봉하여 보관하는 것이 바람직하다. 보관 온도는, 통상 -30℃ 이상, 바람직하게는 0℃ 이상이고, 통상 35℃ 이하, 바람직하게는 25℃ 이하이다.
[유기 전계 발광 소자]
본 발명의 유기 전계 발광 소자는, 기판 상에 양극, 음극, 및 이들 양극 사이에 형성된 발광층을 갖는 것으로서, 본 발명의 전하 수송 재료를 함유하는 층을 갖는 것을 특징으로 한다. 그 전하 수송 재료를 함유하는 층은, 본 발명의 전하 수송 재료용 조성물을 사용하여 형성되는 것이 바람직하다. 그 전하 수송 재료를 함유하는 층은, 그 발광층인 것이 바람직하다. 또, 그 전하 수송 재료를 함유하는 층에, 유기 금속 착물이 도프되어 있는 것이 바람직하다. 이 유기 금속 착물로는, 상기 발광 재료로서 예시한 것을 사용할 수 있다.
도 1∼8 은 본 발명의 유기 전계 발광 소자에 바람직한 구조예를 나타내는 단면의 모식도이고, 도 1 에 있어서, 1 은 기판, 2 는 양극, 3 은 정공 주입층, 4 는 발광층, 5 는 전자 주입층, 6 은 음극을 각각 나타낸다.
[1] 기판
기판 (1) 은 유기 전계 발광 소자의 지지체가 되는 것이고, 석영이나 유리의 판, 금속판이나 금속박, 플라스틱 필름이나 시트 등이 사용된다. 특히 유리판이나, 폴리에스테르, 폴리메타크릴레이트, 폴리카보네이트, 폴리술폰 등의 투명한 합성 수지의 판이 바람직하다. 합성 수지 기판을 사용하는 경우에는 가스 배리어성에 유의할 필요가 있다. 기판의 가스 배리어성이 너무 작으면, 기판을 통과한 외기에 의해 유기 전계 발광 소자가 열화되는 경우가 있기 때문에 바람직하지 않다. 이 때문에, 합성 수지 기판의 적어도 편면에 치밀한 실리콘 산화막 등을 형성하여 가스 배리어성을 확보하는 방법도 바람직한 방법의 하나이다.
[2] 양극
기판 (1) 상에는 양극 (2) 이 형성된다. 양극 (2) 은 발광층측의 층 (정공 주입층 (3) 또는 발광층 (4) 등) 에 대한 정공 주입 역할을 하는 것이다.
이 양극 (2) 은, 통상 알루미늄, 금, 은, 니켈, 팔라듐, 백금 등의 금속, 인듐 및/또는 주석의 산화물 등의 금속 산화물, 요오드화 구리 등의 할로겐화 금속, 카본 블랙, 또는 폴리(3-메틸티오펜), 폴리피롤, 폴리아닐린 등의 도전성 고분자 등에 의해 구성된다.
양극 (2) 의 형성은 통상 스퍼터링법, 진공 증착법 등에 의해 실시되는 경우가 많다. 또한, 은 등의 금속 미립자, 요오드화 구리 등의 미립자, 카본 블랙, 도전성 금속 산화물 미립자, 도전성 고분자 미분말 등을 사용하여 양극을 형성하는 경우에는, 적당한 바인더 수지 용액에 분산시켜, 기판 (1) 상에 도포함으로써 양극 (2) 을 형성할 수도 있다. 또한, 도전성 고분자의 경우에는, 전해 중합에 의해 직접 기판 (1) 상에 박막을 형성하거나, 기판 (1) 상에 도전성 고분자를 도포하여 양극 (2) 을 형성할 수도 있다 (Appl. Phys. Lett., 60 권, 2711 페이지, 1992 년).
양극 (2) 은 통상은 단층 구조인데, 원하는 바에 따라 복수의 재료로 이루어지는 적층 구조로 하는 것도 가능하다.
양극 (2) 의 두께는, 필요로 하는 투명성에 따라 다르다. 투명성이 필요하게 되는 경우에는, 가시광의 투과율을 통상 60% 이상, 바람직하게는 80% 이상으로 하는 것이 바람직하다. 이 경우, 양극의 두께는 통상 5㎚ 이상, 바람직하게는 10㎚ 이상이고, 또한 통상 1000㎚ 이하, 바람직하게는 500㎚ 이하 정도이다. 불투명해도 되는 경우에는 양극 (2) 의 두께는 임의이고, 양극 (2) 은 기판 (1) 과 동일해도 된다. 또한, 나아가서는 상기 양극 (2) 상에 다른 도전 재료를 적층하는 것도 가능하다.
양극에 부착된 불순물을 제거하고, 이온화 포텐셜을 조정하여 정공 주입성을 향상시키는 것을 목적으로, 양극 표면을 자외선 (UV)/오존 처리하거나, 산소 플라즈마, 아르곤 플라즈마 처리하는 것은 바람직하다.
[3] 정공 주입층
정공 주입층 (3) 은 양극 (2) 으로부터 발광층 (4) 에 정공을 수송하는 층이므로, 정공 주입층 (3) 에는 정공 수송성 화합물을 함유하는 것이 바람직하다.
정공 주입층 (3) 에서는, 전기적으로 중성인 화합물로부터 전자가 하나 제거된 양이온 라디칼이, 근방의 전기적으로 중성인 화합물로부터 1 전자를 수용함으로써 정공이 이동한다. 소자 비(非)통전시의 정공 주입층 (3) 에 양이온 라디칼 화합물이 함유되지 않은 경우에는, 통전시에, 정공 수송성 화합물이 양극 (2) 에 전자를 부여함으로써 정공 수송성 화합물의 양이온 라디칼이 생성되고, 이 양이온 라디칼과 전기적으로 중성인 정공 수송성 화합물 사이에서 전자의 수수(授受)가 실시됨으로써 정공을 수송한다.
정공 주입층 (3) 에 양이온 라디칼 화합물이 함유되면, 양극 (2) 에 의한 산화에 의해 생성되는 이상의 농도로 정공 수송에 필요한 양이온 라디칼이 존재하게 되고, 정공 수송 성능이 향상되기 때문에, 정공 주입층 (3) 에 양이온 라디칼 화합물을 함유하는 것이 바람직하다. 양이온 라디칼 화합물의 근방에 전기적으로 중성인 정공 수송성 화합물이 존재하면, 전자의 주고 받음이 순조롭게 실시되므로, 정공 주입층 (3) 에 양이온 라디칼 화합물과 정공 수송성 화합물을 함유하는 것이 더욱 바람직하다.
여기에서, 양이온 라디칼 화합물이란, 정공 수송성 화합물로부터 1 전자 제거한 화학종인 양이온 라디칼과, 카운터 음이온으로 이루어지는 이온 화합물이고, 이동하기 쉬운 정공 (프리캐리어) 을 이미 갖고 있다.
또한, 정공 수송성 화합물에 전자 수용성 화합물을 혼합함으로써, 정공 수송성 화합물로부터 전자 수용성 화합물로의 1 전자 이동이 일어나고, 상기 서술한 양이온 라디칼 화합물이 생성된다. 이 때문에, 정공 주입층 (3) 에 정공 수송성 화합물과 전자 수용성 화합물을 함유하는 것이 바람직하다.
이상의 바람직한 재료에 대해서 정리하면, 정공 주입층 (3) 에 정공 수송성 화합물을 함유하는 것이 바람직하고, 정공 수송성 화합물과 전자 수용성 화합물을 함유하는 것이 더욱 바람직하다. 또, 정공 주입층 (3) 에 양이온 라디칼 화합물을 함유하는 것이 바람직하고, 양이온 라디칼 화합물과 정공 수송성 화합물을 함유하는 것이 더욱 바람직하다.
또한, 필요에 따라, 정공 주입층 (3) 에는 전하의 트랩이 되기 어려운 바인더 수지나, 도포성 개량제를 함유하고 있어도 된다.
단, 정공 주입층 (3) 으로서, 전자 수용성 화합물만, 또는 전자 수용성 화합물과 정공 수송성 화합물을 사용하여 습식 막 제조법에 의해 양극 (2) 상에 막 제조하고, 그 위에서 직접, 본 발명의 전하 수송 재료용 조성물을 도포, 또는 증착에 의해 적층하는 것도 가능하다. 이 경우, 본 발명의 전하 수송 재료용 조성물의 일부 또는 전부가 전자 수용성 화합물과 상호 작용함으로써, 도 7, 8 에 나타내는 바와 같이, 정공 주입성이 우수한 정공 수송층 (10) 이 형성된다.
[정공 수송성 화합물]
정공 수송성 화합물로는, 4.5eV∼6.0eV 의 이온화 포텐셜을 갖는 화합물이 바람직하다.
정공 수송성 화합물의 예로는, 본 발명의 전하 수송 재료 외에, 방향족 아민 화합물, 프탈로시아닌 유도체, 포르피린 유도체, 올리고티오펜 유도체, 폴리티오펜 유도체 등을 들 수 있다. 그 중에서도 비정질성, 가시광의 투과율 면에서, 방향족 아민 화합물이 바람직하다.
방향족 아민 화합물 중에서도, 특히 본 발명의 전하 수송 재료 등의 방향족 3급 아민 화합물이 바람직하다. 여기에서, 방향족 3급 아민 화합물이란, 방향족 3급 아민 구조를 갖는 화합물로서, 방향족 3급 아민 유래의 기를 갖는 화합물도 포함한다.
방향족 3급 아민 화합물의 종류는 특별히 제한되지 않지만, 표면 평활화 효과 면에서, 중량 평균 분자량이 1000 이상, 1000000 이하의 고분자 화합물 (반복 단위가 연속되는 중합형 유기 화합물) 이 더욱 바람직하다.
방향족 3급 아민 고분자 화합물의 바람직한 예로서, 하기 일반식 (Ⅶ) 로 표시되는 반복 단위를 갖는 고분자 화합물을 들 수 있다.
[화학식 46]
일반식 (Ⅶ) 중, Ar21, Ar22 는 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다. Ar23∼Ar25 는, 각각 독립적으로 치환기를 갖고 있어도 되는 2 가의 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 2 가의 방향족 복소환기를 나타낸다. Y 는, 하기의 연결기군 중에서 선택되는 연결기를 나타낸다. 또, Ar21∼Ar25 중, 동일한 N 원자에 결합되는 2 개의 기는 서로 결합하여 고리를 형성해도 된다.
[화학식 47]
상기 각 식 중, Ar31∼Ar41 은, 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소 고리, 또는 치환기를 갖고 있어도 되는 방향족 복소환 유래의 1 가 또는 2 가의 기를 나타낸다. R101 및 R102 는, 각각 독립적으로 수소 원자 또는 임의의 치환기를 나타낸다.
Ar21∼Ar25 및 Ar31∼Ar41 로는, 임의의 방향족 탄화수소 고리 또는 방향족 복소환 유래의, 1 가 또는 2 가의 기를 적용할 수 있다. 이들은 각각 동일해도, 서로 상이해도 된다. 또한, 임의의 치환기를 갖고 있어도 된다.
그 방향족 탄화수소 고리로는, 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리를 들 수 있다. 구체예로는, 벤젠 고리, 나프탈렌 고리, 안트라센 고리, 페난트렌 고리, 페릴렌 고리, 테트라센 고리, 피렌 고리, 벤즈피렌 고리, 크리센 고리, 트리페닐렌 고리, 아세나프텐 고리, 플루오란텐 고리, 플루오렌 고리 등을 들 수 있다.
또한, 그 방향족 복소환으로는, 5 또는 6 원자 고리의 단고리 또는 2∼4 축합 고리를 들 수 있다. 구체예로는, 푸란 고리, 벤조푸란 고리, 티오펜 고리, 벤조티오펜 고리, 피롤 고리, 피라졸 고리, 이미다졸 고리, 옥사디아졸 고리, 인돌 고리, 카르바졸 고리, 피롤로이미다졸 고리, 피롤로피라졸 고리, 피롤로피롤 고리, 티에노피롤 고리, 티에노티오펜 고리, 푸로피롤 고리, 푸로푸란 고리, 티에노푸란 고리, 벤조이소옥사졸 고리, 벤조이소티아졸 고리, 벤조이미다졸 고리, 피리딘 고리, 피라진 고리, 피리다진 고리, 피리미딘 고리, 트리아진 고리, 퀴놀린 고리, 이 소퀴놀린 고리, 시놀린 고리, 퀴녹살린 고리, 페난트리딘 고리, 벤조이미다졸 고리, 피리미딘 고리, 퀴나졸린 고리, 퀴나졸리논 고리, 아줄렌 고리 등을 들 수 있다.
또한, Ar23∼Ar25, Ar31∼Ar35, Ar37∼Ar40 으로는, 상기에 예시한 1 종류 또는 2 종류 이상의 방향족 탄화수소 고리 및/또는 방향족 복소환 유래의 2 가의 기를 2 개 이상 연결하여 사용할 수도 있다.
Ar21∼Ar41 의 방향족 탄화수소 고리 및/또는 방향족 복소환 유래의 기는, 추가로 치환기를 갖고 있어도 된다. 치환기의 분자량으로는, 통상 400 이하, 그 중에서도 250 이하 정도가 바람직하다. 치환기의 종류는 특별히 제한되지 않지만, 예로는, 다음의 치환기군 D 에서 선택되는 1 종 또는 2 종 이상을 들 수 있다.
[치환기군 D]
메틸기, 에틸기 등의, 탄소수가 통상 1 이상, 통상 10 이하, 바람직하게는 8 이하의 알킬기 ; 비닐기 등의, 탄소수가 통상 2 이상, 통상 11 이하, 바람직하게는 5 이하의 알케닐기 ; 에티닐기 등의, 탄소수가 통상 2 이상, 통상 11 이하, 바람직하게는 5 이하의 알키닐기 ; 메톡시기, 에톡시기 등의, 탄소수가 통상 1 이상, 통상 10 이하, 바람직하게는 6 이하의 알콕시기 ; 페녹시기, 나프톡시기, 피리딜옥시기 등의, 탄소수가 통상 4 이상, 바람직하게는 5 이상, 통상 25 이하, 바람직하게는 14 이하의 아릴옥시기 ; 메톡시카르보닐기, 에톡시카르보닐기 등의, 탄소수가 통상 2 이상, 통상 11 이하, 바람직하게는 7 이하의 알콕시카르보닐기 ; 디메틸아 미노기, 디에틸아미노기 등의, 탄소수가 통상 2 이상, 통상 20 이하, 바람직하게는 12 이하의 디알킬아미노기 ; 디페닐아미노기, 디톨릴아미노기, N-카르바졸릴기 등의, 탄소수가 통상 10 이상, 바람직하게는 12 이상, 통상 30 이하, 바람직하게는 22 이하의 디아릴아미노기 ; 페닐메틸아미노기 등의, 탄소수가 통상 6 이상, 바람직하게는 7 이상, 통상 25 이하, 바람직하게는 17 이하의 아릴알킬아미노기 ; 아세틸기, 벤조일기 등의, 탄소수가 통상 2 이상, 통상 10 이하, 바람직하게는 7 이하의 아실기 ; 불소 원자, 염소 원자 등의 할로겐 원자 ; 트리플루오로메틸기 등의, 탄소수가 통상 1 이상, 통상 8 이하, 바람직하게는 4 이하의 할로알킬기 ; 메틸티오기, 에틸티오기 등의, 탄소수가 통상 1 이상, 통상 10 이하, 바람직하게는 6 이하의 알킬티오기 ; 페닐티오기, 나프틸티오기, 피리딜티오기 등의, 탄소수가 통상 4 이상, 바람직하게는 5 이상, 통상 25 이하, 바람직하게는 14 이하의 아릴티오기 ; 트리메틸실릴기, 트리페닐실릴기 등의, 탄소수가 통상 2 이상, 바람직하게는 3 이상, 통상 33 이하, 바람직하게는 26 이하의 실릴기 ; 트리메틸실록시기, 트리페닐실록시기 등의, 탄소수가 통상 2 이상, 바람직하게는 3 이상, 통상 33 이하, 바람직하게는 26 이하의 실록시기 ; 시아노기 ; 페닐기, 나프틸기 등의, 탄소수가 통상 6 이상, 통상 30 이하, 바람직하게는 18 이하의 방향족 탄화수소 고리기 ; 티에닐기, 피리딜기 등의, 탄소수가 통상 3 이상, 바람직하게는 4 이상, 통상 28 이하, 바람직하게는 17 이하의 방향족 복소환기.
Ar21, Ar22 로는, 고분자 화합물의 용해성, 내열성, 정공 주입·수송성 면에 서, 벤젠 고리, 나프탈렌 고리, 페난트렌 고리, 티오펜 고리, 피리딘 고리 유래의 1 가의 기가 바람직하고, 페닐기, 나프틸기가 더욱 바람직하다.
또, Ar23∼Ar25 로는, 내열성, 산화 환원 전위를 포함시킨 정공 주입·수송성 면에서, 벤젠 고리, 나프탈렌 고리, 안트라센 고리, 페난트렌 고리 유래의 2 가의 기가 바람직하고, 페닐렌기, 비페닐렌기, 나프틸렌기가 더욱 바람직하다.
R101, R102 로는, 수소 원자 또는 임의의 치환기를 적용할 수 있다. 이들은 서로 동일해도 되고, 상이해도 된다. 치환기의 종류는, 특별히 제한되지 않지만, 적용 가능한 치환기를 예시하면, 알킬기, 알케닐기, 알키닐기, 알콕시기, 실릴기, 실록시기, 방향족 탄화수소기, 방향족 복소환기, 할로겐 원자를 들 수 있다. 이들의 구체예로는, 상기 치환기군 D 에서 예시한 각 기를 들 수 있다.
일반식 (Ⅶ) 로 표시되는 반복 단위를 갖는 방향족 3급 아민 고분자 화합물의 구체예로는, WO2005/089024호에 기재된 것을 들 수 있고, 그 바람직한 예도 동일하고, 예를 들어 하기 구조식으로 표시되는 화합물 (PB-1) 을 들 수 있는데, 조금도 그것들에 한정되는 것은 아니다.
[화학식 48]
다른 방향족 3급 아민 고분자 화합물의 바람직한 예로서, 하기 일반식 (Ⅷ) 및/또는 일반식 (Ⅸ) 로 표시되는 반복 단위를 포함하는 고분자 화합물을 들 수 있다.
[화학식 49]
일반식 (Ⅷ), (Ⅸ) 중, Ar45, Ar47 및 Ar48 은 각각 독립적으로 치환기를 갖고 있어도 되는 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 방향족 복소환기를 나타낸다. Ar44 및 Ar46 은 각각 독립적으로 치환기를 갖고 있어도 되는 2 가의 방향족 탄화수소기, 또는 치환기를 갖고 있어도 되는 2 가의 방향족 복소환기를 나타낸다. 또한, Ar45∼Ar48 중, 동일한 N 원자에 결합되는 2 개의 기는 서로 결합하여 고리를 형성해도 된다. R111∼R113 은 각각 독립적으로 수소 원자 또는 임의의 치환기를 나타낸다.
Ar45, Ar47, Ar48 및 Ar44, Ar46 의 구체예, 바람직한 예, 갖고 있어도 되는 치 환기의 예 및 바람직한 치환기의 예는, 각각 Ar21, Ar22 및 Ar23∼Ar25 와 동일하다. R111∼R113 은 바람직하게는 수소 원자 또는 [치환기군 D] 에 기재되어 있는 치환기이고, 더욱 바람직하게는, 수소 원자, 알킬기, 알콕시기, 아미노기, 방향족 탄화수소기, 방향족 탄화수소기이다.
일반식 (Ⅷ) 및/또는 (Ⅸ) 로 표시되는 반복 단위를 포함하는 방향족 3급 아민 고분자 화합물의 구체예로는, WO2005/089024호에 기재된 것을 들 수 있고, 그 바람직한 예도 동일한데, 조금도 그것들에 한정되는 것은 아니다.
또, 습식 막 제조법에 의해 정공 주입층을 형성하는 경우에는, 여러 가지의 용제에 용해되기 쉬운 정공 수송성 화합물이 바람직하다. 방향족 3급 아민 화합물로는, 예를 들어 비나프틸계 화합물 (일본 공개특허공보 2004-014187호) 및 비대칭 1,4-페닐렌디아민 화합물 (일본 공개특허공보 2004-026732호) 이 바람직하다.
또한, 종래, 유기 전계 발광 소자에 있어서의 정공 주입·수송성의 박막 정제 재료로서 이용되어 온 방향족 아민 화합물 중에서, 여러 가지의 용제에 용해되기 쉬운 화합물을 적절히 선택해도 된다. 정공 주입층의 정공 수송성 화합물에 적용 가능한 방향족 아민 화합물로는, 예를 들어 유기 전계 발광 소자에 있어서의 정공 주입·수송성의 층 형성 재료로서 이용되어 온, 종래 공지된 화합물을 들 수 있다. 예를 들어, 1,1-비스(4-디-p-톨릴아미노페닐)시클로헥산 등의 3급 방향족 아민 유닛을 연결한 방향족 디아민 화합물 (일본 공개특허공보 소59-194393호) ; 4,4'-비스[N-(1-나프틸)-N-페닐아미노]비페닐로 대표되는 2 개 이상의 3급 아민을 함유하고, 2 개 이상의 축합 방향족 고리가 질소 원자에 치환된 방향족 아민 화합물 (일본 공개특허공보 평5-234681호) ; 트리페닐벤젠의 유도체로 스타버스트 구조를 갖는 방향족 트리아민 화합물 (미국 특허 제4,923,774호) ; N,N'-디페닐-N,N'-비스(3-메틸페닐)비페닐-4,4'-디아민 등의 방향족 디아민 화합물 (미국 특허 제4,764,625호) ; α,α,α',α'-테트라메틸-α,α'-비스(4-디(p-톨릴)아미노페닐)-p-자일렌 (일본 공개특허공보 평3-269084호) ; 분자 전체로서 입체적으로 비대칭인 트리페닐아민 유도체 (일본 공개특허공보 평4-129271호) ; 피레닐기에 방향족 디아미노기가 복수개 치환된 화합물 (일본 공개특허공보 평4-175395호) ; 에틸렌기로 3급 방향족 아민 유닛을 연결한 방향족 디아민 화합물 (일본 공개특허공보 평4-264189호) ; 스티릴 구조를 갖는 방향족 디아민 (일본 공개특허공보 평4-290851호) ; 티오펜기로 방향족 3급 아민 유닛을 연결한 화합물 (일본 공개특허공보 평4-304466호) ; 스타버스트형 방향족 트리아민 화합물 (일본 공개특허공보 평4-308688호) ; 벤질페닐 화합물 (일본 공개특허공보 평4-364153호) ; 플루오렌기로 3급 아민을 연결한 화합물 (일본 공개특허공보 평5-25473호) ; 트리아민 화합물 (일본 공개특허공보 평5-239455호) ; 비스디피리딜아미노비페닐 (일본 공개특허공보 평5-320634호) ; N,N,N-트리페닐아민 유도체 (일본 공개특허공보 평6-1972호) ; 페녹사진 구조를 갖는 방향족 디아민 (일본 공개특허공보 평7-138562호) ; 디아미노페닐페난트리딘 유도체 (일본 공개특허공보 평7-252474호) ; 히드라존 화합물 (일본 공개특허공보 평2-311591호) ; 실라잔 화합물 (미국 특허 제4,950,950호) ; 시라나민 유도체 (일본 공개특허공보 평6-49079호) ; 포스파민 유도체 (일본 공개특허공보 평6-25659호) ; 퀴나크리돈 화합물 등을 들 수 있다. 이들 방향족 아민 화합물은, 필요에 따라 2 종 이상을 혼합하여 사용해도 된다.
또한, 정공 주입층의 정공 수송성 화합물에 적용 가능한 프탈로시아닌 유도체 또는 포르피린 유도체의 바람직한 구체예로는, 포르피린, 5,10,15,20-테트라페닐-21H,23H-포르피린, 5,10,15,20-테트라페닐-21H,23H-포르피린 코발트 (Ⅱ), 5,10,15,20-테트라페닐-21H,23H-포르피린 구리 (Ⅱ), 5,10,15,20-테트라페닐-21H,23H-포르피린 아연 (Ⅱ), 5,10,15,20-테트라페닐-21H,23H-포르피린 바나듐 (Ⅳ) 옥사이드, 5,10,15,20-테트라(4-피리딜)-21H,23H-포르피린, 29H,31H-프탈로시아닌 구리 (Ⅱ), 프탈로시아닌 아연 (Ⅱ), 프탈로시아닌 티탄, 프탈로시아닌 옥사이드마그네슘, 프탈로시아닌 납, 프탈로시아닌 구리 (Ⅱ), 4,4',4'',4'''-테트라아자-29H,31H-프탈로시아닌 등을 들 수 있다.
또, 정공 주입층의 정공 수송성 화합물로서 적용 가능한 올리고티오펜 유도체의 바람직한 구체예로는, α-터티오펜과 그 유도체, α-섹시티오펜과 그 유도체, 나프탈렌 고리를 함유하는 올리고티오펜 유도체 (일본 공개특허공보 평6-256341호) 등을 들 수 있다.
또한, 본 발명에 있어서의 정공 수송성 화합물로서 적용 가능한 폴리티오펜 유도체의 바람직한 구체예로는, 폴리(3,4-에틸렌디옥시티오펜) (PEDOT), 폴리(3-헥실티오펜) 등을 들 수 있다.
또, 이들 정공 수송성 화합물의 분자량은, 고분자 화합물 (반복 단위가 연속되는 중합성 화합물) 의 경우를 제외하고, 통상 9000 이하, 바람직하게는 5000 이 하, 또한, 통상 200 이상, 바람직하게는 400 이상의 범위이다. 정공 수송성 화합물의 분자량이 너무 높으면 합성 및 정제가 곤란하여 바람직하지 않은 반면, 분자량이 너무 낮으면 내열성이 낮아질 우려가 있어 역시 바람직하지 않다.
정공 주입층의 재료로서 사용되는 정공 수송성 화합물은, 이러한 화합물 중 어느 1 종을 단독으로 함유하고 있어도 되고, 2 종 이상을 함유하고 있어도 된다. 2 종 이상의 정공 수송성 화합물을 함유하는 경우, 그 조합은 임의인데, 방향족 3급 아민 고분자 화합물 1 종 또는 2 종 이상과, 그 밖의 정공 수송성 화합물 1 종 또는 2 종 이상을 병용하는 것이 바람직하다.
[전자 수용성 화합물]
전자 수용성 화합물이란, 산화력을 가지며, 상기 서술한 정공 수송성 화합물로부터 1 전자 수용하는 능력을 갖는 화합물이 바람직하고, 구체적으로는, 전자 친화력이 4eV 이상인 화합물이 바람직하고, 5eV 이상인 화합물이 더욱 바람직하다.
예로는, 4-이소프로필-4'-메틸디페닐요오드늄테트라키스(펜타플루오로페닐)보레이트 등의 유기기가 치환된 오늄염, 염화 철 (Ⅲ) (일본 공개특허공보 평11-251067호), 퍼옥소 2황산 암모늄 등의 고(高)원자가의 무기 화합물, 테트라시아노에틸렌 등의 시아노 화합물, 트리스(펜타플루오로페닐)보란 (일본 공개특허공보 2003-31365호) 등의 방향족 붕소 화합물, 풀러렌 유도체, 요오드 등을 들 수 있다.
상기 화합물 중, 강한 산화력을 갖는 점에서 유기기가 치환된 오늄염, 고원자가의 무기 화합물이 바람직하고, 여러 가지의 용제에 가용이며 습식 도포에 적용 가능한 점에서 유기기가 치환된 오늄염, 시아노 화합물, 방향족 붕소 화합물이 바 람직하다.
전자 수용성 화합물로서 바람직한 유기기가 치환된 오늄염, 시아노 화합물, 방향족 붕소 화합물의 구체예로는, WO2005/089024호에 기재된 것을 들 수 있고, 그 바람직한 예도 동일하고, 예를 들어 하기 구조식으로 표시되는 화합물 (A-2) 를 들 수 있는데, 조금도 그것들에 한정되는 것은 아니다.
[화학식 50]
[양이온 라디칼 화합물]
양이온 라디칼 화합물이란, 정공 수송성 화합물로부터 1 전자 제거한 화학종인 양이온 라디칼과, 카운터 음이온으로 이루어지는 이온 화합물이다. 단, 양이온 라디칼이 정공 수송성의 고분자 화합물 유래인 경우, 양이온 라디칼은 고분자 화합물의 반복 단위로부터 1 전자 제거한 구조가 된다.
양이온 라디칼은, 정공 수송성 화합물에 상기 서술한 화합물로부터 1 전자 제거한 화학종인 것이 바람직하고, 정공 수송성 화합물로서 더욱 바람직한 화합물로부터 1 전자 제거한 화학종인 것이 비정질성, 가시광의 투과율, 내열성, 용해성 등의 면에서 더욱 바람직하다.
양이온 라디칼 화합물은, 상기 서술한 정공 수송성 화합물과 전자 수용성 화합물을 혼합함으로써 생성시킬 수 있다. 즉, 상기 서술한 정공 수송성 화합물과 전자 수용성 화합물을 혼합함으로써, 정공 수송성 화합물로부터 전자 수용성 화합물로 전자 이동이 일어나고, 정공 수송성 화합물의 양이온 라디칼과 카운터 음이온으로 이루어지는 양이온 이온 화합물이 생성된다.
PEDOT/PSS (Adv. Mater., 2000 년, 12 권, 481 페이지) 나 에메랄딘 염산염 (J. Phys. Chem., 1990 년, 94 권, 7716 페이지) 등의 고분자 화합물 유래의 양이온 라디칼 화합물은, 산화 중합 (탈수소 중합), 즉, 모노머를 산성 용액 중에서, 퍼옥소 2황산염 등을 사용하여 화학적으로, 또는 전기 화학적으로 산화함으로써도 생성된다. 이 산화 중합 (탈수소 중합) 의 경우, 모노머가 산화됨으로써 고분자화됨과 함께, 산성 용액 유래의 음이온을 카운터 음이온으로 하는, 고분자의 반복 단위로부터 1 전자 제거된 양이온 라디칼이 생성된다.
정공 주입층 (3) 은, 습식 막 제조법 또는 진공 증착법에 의해 양극 (2) 상에 형성된다.
양극 (2) 으로서 일반적으로 사용되는 ITO (인듐·주석 산화물) 는, 그 표면 거침도가 10㎚ 정도의 거침도 (Ra) 를 갖는 것에 추가하여, 국소적으로 돌기를 갖는 것이 많아, 단락 결함을 발생시키기 쉽다는 문제가 있었다. 양극 (2) 상에 형성되는 정공 주입층 (3) 은 습식 막 제조법에 의해 형성하는 것은, 진공 증착법으로 형성하는 경우와 비교하여, 이들 양극 표면의 요철에서 기인되는 소자의 결함 의 발생을 저감시키는 이점을 갖는다.
습식 막 제조법에 의한 층 형성의 경우에는, 상기 서술한 각 재료 (정공 수송성 화합물, 전자 수용성 화합물, 양이온 라디칼 화합물) 의 1 종 또는 2 종 이상의 소정량을, 필요에 따라 전하의 트랩이 되지 않는 바인더 수지나 도포성 개량제를 첨가하여, 용제에 용해시켜 도포 용액을 조제하고, 스핀코트, 스프레이코트, 딥코트, 다이코트, 플렉소 인쇄, 스크린 인쇄, 잉크젯법 등의 습식 막 제조법에 의해 양극 상에 도포하고, 건조시켜 정공 주입층 (3) 을 형성시킨다.
습식 막 제조법에 의한 층 형성을 위해 사용되는 용제로는, 상기 서술한 각 재료 (정공 수송성 화합물, 전자 수용성 화합물, 양이온 라디칼 화합물) 를 용해하는 것이 가능한 용제이면, 그 종류는 특별히 한정되지 않지만, 정공 주입층에 사용되는 각 재료 (정공 수송성 화합물, 전자 수용성 화합물, 양이온 라디칼 화합물) 를 실활 (失活) 시킬 우려가 있는, 실활 물질 또는 실활 물질을 발생시키는 것을 포함하지 않는 것이 바람직하다.
이들 조건을 만족하는 바람직한 용제로는, 예를 들어 에테르계 용제 및 에스테르계 용제를 들 수 있다. 구체적으로는, 에테르계 용제로는, 예를 들어 에틸렌글리콜디메틸에테르, 에틸렌글리콜디에틸에테르, 프로필렌글리콜-1-모노메틸에테르아세테이트 (PGMEA) 등의 지방족 에테르 ; 1,2-디메톡시벤젠, 1,3-디메톡시벤젠, 아니솔, 페네톨, 2-메톡시톨루엔, 3-메톡시톨루엔, 4-메톡시톨루엔, 2,3-디메틸아니솔, 2,4-디메틸아니솔 등의 방향족 에테르 등을 들 수 있다. 에스테르계 용제로는, 예를 들어 아세트산 에틸, 아세트산 n-부틸, 락트산 에틸, 락트산 n-부틸 등의 지방족 에스테르 ; 아세트산 페닐, 프로피온산 페닐, 벤조산 메틸, 벤조산 에틸, 벤조산 프로필, 벤조산 n-부틸 등의 방향족 에스테르 등을 들 수 있다. 이들은 어느 1 종을 단독으로 사용해도 되고, 2 종 이상을 임의의 조합 및 비율로 사용해도 된다.
상기 서술한 에테르계 용제 및 에스테르계 용제 이외에 사용 가능한 용제로는, 예를 들어 벤젠, 톨루엔, 자일렌 등의 방향족 탄화수소계 용제, N,N-디메틸포름아미드, N,N-디메틸아세트아미드 등의 아미드계 용제, 디메틸술폭시드 등을 들 수 있다. 이들은 어느 1 종을 단독으로 사용해도 되고, 2 종 이상을 임의의 조합 및 비율로 사용해도 된다. 또, 이들 용제 중 1 종 또는 2 종 이상을, 상기 서술한 에테르계 용제 및 에스테르계 용제 중 1 종 또는 2 종 이상과 조합하여 사용해도 된다. 특히, 벤젠, 톨루엔, 자일렌 등의 방향족 탄화수소계 용제는, 전자 수용성 화합물 및 양이온 라디칼 화합물을 용해하는 능력이 낮으므로, 에테르계 용제 및 에스테르계 용제와 혼합하여 사용하는 것이 바람직하다.
도포 용액 중에 있어서의 용제의 농도는, 통상 10 중량% 이상, 바람직하게는 30 중량% 이상, 보다 바람직하게는 50 중량% 이상, 또한, 통상 99.999 중량% 이하, 바람직하게는 99.99 중량% 이하, 더욱 바람직하게는 99.9 중량% 이하의 범위이다. 또, 2 종 이상의 용제를 혼합하여 사용하는 경우에는, 이들 용제의 합계가 이 범위를 만족하도록 한다.
진공 증착법에 의한 층 형성의 경우에는, 상기 서술한 각 재료 (정공 수송성 화합물, 전자 수용성 화합물, 양이온 라디칼 화합물) 의 1 종 또는 2 종 이상을 진 공 용기 내에 설치된 도가니에 넣고 (2 종 이상 재료를 사용하는 경우에는 각각의 도가니에 넣고), 진공 용기 내를 적당한 진공 펌프로 10-4Pa 정도까지 배기한 후, 도가니를 가열하고 (2 종 이상 재료를 사용하는 경우에는 각각의 도가니를 가열하고), 증발량을 제어하여 증발시키고 (2 종 이상 재료를 사용하는 경우에는 각각 독립적으로 증발량을 제어하여 증발시키고), 도가니와 마주 보고 놓여진 기판의 양극 상에 정공 주입층을 형성시킨다. 또, 2 종 이상의 재료를 사용하는 경우에는, 그들의 혼합물을 도가니에 넣고, 가열하고 증발시켜 정공 주입층 형성에 사용할 수도 있다.
이렇게 하여 형성되는 양호한 정공 주입층 (3) 의 막두께는, 통상 5㎚ 이상, 바람직하게는 10㎚ 이상, 또한, 통상 1000㎚ 이하, 바람직하게는 500㎚ 이하의 범위이다.
또, 정공 주입층 (3) 은, 도 6 에 나타내는 바와 같이, 이것을 생략해도 된다.
[4] 발광층
정공 주입층 (3) 상에는 통상 발광층 (4) 이 형성된다. 발광층 (4) 은 발광 재료를 함유하는 층이고, 전계가 부여된 전극 사이에서, 양극 (2) 으로부터 정공 주입층 (3) 을 통하여 주입된 정공과, 음극 (6) 으로부터 전자 수송층 (5) 을 통하여 주입된 전자의 재결합에 의해 여기되어 주된 발광원이 되는 층이다. 발광층 (4) 은 발광 재료 (도펀트) 와 1 종 또는 2 종 이상의 호스트 재료를 함유하 는 것이 바람직하고, 발광층 (4) 은 본 발명의 전하 수송 재료를 호스트 재료로서 포함하는 것이 더욱 바람직하고, 진공 증착법으로 형성하고 있어도 되는데, 본 발명의 전하 수송 재료용 조성물을 사용하고, 습식 막 제조법에 의해 제조된 층인 것이 특히 바람직하다.
여기에서, 습식 막 제조법이란, 상기 용제를 함유하는 본 발명의 전하 수송 재료용 조성물을, 스핀코트, 스프레이코트, 딥코트, 다이코트, 플렉소 인쇄, 스크린 인쇄, 잉크젯법에 의해 도포하여 막 형성하는 것이다.
또, 발광층 (4) 은, 본 발명의 성능을 저해하지 않는 범위에서, 다른 재료, 성분을 함유하고 있어도 된다.
일반적으로 유기 전계 발광 소자에 있어서, 동일한 재료를 사용한 경우, 전극간의 막두께가 얇은 것이 실효 전계가 커지기 때문에, 주입되는 전류가 많아지므로, 구동 전압은 저하된다. 그 때문에, 전극간의 총 막두께는 얇은 것이 유기 전계 발광 소자의 구동 전압은 저하되는데, 너무 얇으면, ITO 등의 전극에서 기인되는 돌기에 의해 단락이 발생하기 때문에, 어느 정도의 막두께가 필요하게 된다.
본 발명에 있어서는, 발광층 (4) 이외에, 정공 주입층 (3) 및 후술하는 전자 수송층 (5) 등의 유기층을 갖는 경우, 발광층 (4) 과 정공 주입층 (3) 이나 전자 수송층 (5) 등의 다른 유기층을 합친 총 막두께는 통상 30㎚ 이상, 바람직하게는 50㎚ 이상이고, 더욱 바람직하게는 100㎚ 이상이고, 통상 1000㎚ 이하, 바람직하게는 500㎚ 이하이고, 더욱 바람직하게는 300㎚ 이하이다. 또한, 발광층 (4) 이외의 정공 주입층 (3) 이나 후술하는 전자 주입층 (5) 의 도전성이 높은 경우, 발 광층 (4) 에 주입되는 전하량이 증가하기 때문에, 예를 들어 정공 주입층 (3) 의 막두께를 두껍게 하여 발광층 (4) 의 막두께를 얇게 하고, 총 막두께를 어느 정도의 막두께를 유지한 채 구동 전압을 낮추는 것도 가능하다.
따라서, 발광층 (4) 의 막두께는, 통상 10㎚ 이상, 바람직하게는 20㎚ 이상이고, 통상 300㎚ 이하, 바람직하게는 200㎚ 이하이다. 또, 본 발명의 소자가, 양극 및 음극의 양극 사이에, 발광층 (4) 만을 갖는 경우의 발광층 (4) 의 막두께는, 통상 30㎚ 이상, 바람직하게는 50㎚ 이상, 통상 500㎚ 이하, 바람직하게는 300㎚ 이하이다.
[5] 전자 주입층
전자 주입층 (5) 은 음극 (6) 으로부터 주입된 전자를 효율적으로 발광층 (4) 에 주입하는 역할을 한다. 전자 주입을 효율적으로 실시하기 위해서는, 전자 주입층 (5) 을 형성하는 재료는, 일함수가 낮은 금속이 바람직하고, 나트륨이나 세슘 등의 알칼리 금속, 바륨이나 칼슘 등의 알칼리 토금속이 사용된다.
전자 주입층 (5) 의 막두께는 0.1∼5㎚ 가 바람직하다.
또한, 음극 (6) 과 발광층 (4) 또는 후술하는 전자 수송층 (8) 의 계면에 LiF, MgF2, Li2O, CsCO3 등의 극박 절연막 (0.1∼5㎚) 을 삽입하는 것도, 소자의 효율을 향상시키는 유효한 방법이다 (Appl. Phys. Lett., 70 권, 152 페이지, 1997 년 ; 일본 공개특허공보 평10-74586호 ; IEEETrans. Electron. Devices, 44 권, 1245 페이지, 1997 년 ; SID 04 Digest, 154 페이지).
또한, 후술하는 바소페난트롤린 등의 질소 함유 복소환 화합물이나 8-히드록시퀴놀린의 알루미늄 착물 등의 금속 착물로 대표되는 유기 전자 수송 재료에, 나트륨, 칼륨, 세슘, 리튬, 루비듐 등의 알칼리 금속을 도프하는 (일본 공개특허공보 평10-270171호, 일본 공개특허공보 2002-100478호, 일본 공개특허공보 2002-100482호 등에 기재) 것에 의해, 전자 주입·수송성이 향상되어 우수한 막질을 양립시키는 것이 가능해지기 때문에 바람직하다. 이 경우의 막두께는 통상 5㎚ 이상, 바람직하게는 10㎚ 이상이고, 통상 200㎚ 이하, 바람직하게는 100㎚ 이하이다.
전자 주입층 (5) 은, 발광층 (4) 과 동일하게 하여 습식 막 제조법, 또는 진공 증착법에 의해 발광층 (4) 상에 적층함으로써 형성된다. 진공 증착법의 경우에는, 진공 용기 내에 설치된 도가니 또는 금속 보트에 증착원을 넣고, 진공 용기 내를 적당한 진공 펌프로 10-4Pa 정도까지 배기한 후, 도가니 또는 금속 보트를 가열하여 증발시키고, 도가니 또는 금속 보트와 마주 보고 놓여진 기판 상에 전자 주입층을 형성한다.
알칼리 금속의 증착은, 크롬산 알칼리 금속과 환원제를 니크롬에 충전한 알칼리 금속 디스펜서를 사용하여 실시한다. 이 디스펜서를 진공 용기 내에서 가열함으로써, 크롬산 알칼리 금속이 환원되어 알칼리 금속이 증발된다. 유기 전자 수송 재료와 알칼리 금속을 공 (共) 증착하는 경우에는, 유기 전자 수송 재료를 진공 용기 내에 설치된 도가니에 넣고, 진공 용기 내를 적당한 진공 펌프로 10-4Pa 정도까지 배기한 후, 각각의 도가니 및 디스펜서를 동시에 가열하여 증발시키고, 도가니 및 디스펜서와 마주 보고 놓여진 기판 상에 전자 주입층을 형성한다.
이 때, 전자 주입층 (5) 의 막두께 방향에서 균일하게 공증착되는데, 막두께 방향에서 농도 분포가 있어도 된다.
또, 전자 주입층 (5) 은, 도 5, 6, 7, 8 에 나타내는 바와 같이, 이것을 생략해도 된다.
[6] 음극
음극 (6) 은, 발광층측의 층 (전자 주입층 (5) 또는 발광층 (4) 등) 에 전자를 주입하는 역할을 한다. 음극 (6) 으로서 사용되는 재료는, 상기 양극 (2) 에 사용되는 재료를 사용하는 것이 가능한데, 효율적으로 전자 주입을 실시하기 위해서는, 일함수가 낮은 금속이 바람직하고, 주석, 마그네슘, 인듐, 칼슘, 알루미늄, 은 등의 적당한 금속 또는 그들의 합금이 사용된다. 구체예로는, 마그네슘-은 합금, 마그네슘-인듐 합금, 알루미늄-리튬 합금 등의 저 (低) 일함수 합금 전극을 들 수 있다.
음극 (6) 의 막두께는 통상 양극 (2) 과 동일하다. 저일함수 금속으로 이루어지는 음극을 보호할 목적으로, 이 위에 추가로 일함수가 높고 대기에 대하여 안정된 금속층을 적층하는 것은 소자의 안정성을 증가시킨다. 이 목적을 위해, 알루미늄, 은, 구리, 니켈, 크롬, 금, 백금 등의 금속이 사용된다.
[7] 그 밖의 구성층
이상, 도 1 에 나타내는 층 구성의 소자를 중심으로 설명해 왔지만, 본 발명의 유기 전계 발광 소자에 있어서의 양극 (2) 및 음극 (6) 과 발광층 (4) 의 사이 에는, 그 성능을 저해하지 않는 한, 상기 설명에 있는 층 외에도, 임의의 층을 갖고 있어도 되고, 또한 발광층 (4) 이외의 임의의 층을 생략해도 된다.
갖고 있어도 되는 층으로는, 예를 들어 전자 수송층 (7) 을 들 수 있다. 전자 수송층 (7) 은 소자의 발광 효율을 더욱 향상시키는 것을 목적으로, 도 2 에 나타내는 바와 같이, 발광층 (4) 과 전자 주입층 (5) 사이에 형성된다.
전자 수송층 (7) 은, 전계가 부여된 전극 사이에서 음극 (6) 으로부터 주입된 전자를 효율적으로 발광층 (4) 의 방향으로 수송할 수 있는 화합물로 형성된다. 전자 수송층 (7) 에 사용되는 전자 수송성 화합물로는, 음극 (6) 또는 전자 주입층 (5) 으로부터의 전자 주입 효율이 높고, 또한 높은 전자 이동도를 가지며 주입된 전자를 효율적으로 수송할 수 있는 화합물인 것이 필요하다.
이러한 조건을 만족하는 재료로는, 8-히드록시퀴놀린의 알루미늄 착물 등의 금속 착물 (일본 공개특허공보 소59-194393호), 10-히드록시벤조[h]퀴놀린의 금속 착물, 옥사디아졸 유도체, 디스티릴비페닐 유도체, 실롤 유도체, 3- 또는 5-히드록시플라본 금속 착물, 벤즈옥사졸 금속 착물, 벤조티아졸 금속 착물, 트리스벤즈이미다졸릴벤젠 (미국 특허 제5,645,948호), 퀴녹살린 화합물 (일본 공개특허공보 평6-207169호), 페난트롤린 유도체 (일본 공개특허공보 평5-331459호), 2-t-부틸-9,10-N,N'-디시아노안트라퀴논디이민, n 형 수소화 비정질 탄화 실리콘, n 형 황화 아연, n 형 셀렌화 아연 등을 들 수 있다.
전자 수송층 (7) 의 막두께는, 통상 하한은 1㎚, 바람직하게는 5㎚ 정도이고, 상한은 통상 300㎚, 바람직하게는 100㎚ 정도이다.
전자 수송층 (7) 은, 정공 주입층 (3) 과 동일하게 하여 습식 막 제조법, 또는 진공 증착법에 의해 발광층 (4) 상에 적층함으로써 형성된다. 통상은, 진공 증착법이 사용된다.
또, 정공 수송층 (10) 을 갖는 것이 본 발명에서 바람직하고, 정공 수송층 (10) 에는, 본 발명의 전하 수송 재료를 함유하는 것이 바람직하다. 또한, 상기 정공 주입층의 정공 수송성 화합물로서 예시한 화합물을 사용할 수도 있다. 또한, 폴리비닐카르바졸, 폴리비닐트리페닐아민, 테트라페닐벤지딘을 함유하는 폴리아릴렌에테르술폰 등의 고분자 재료를 사용해도 된다. 정공 수송층 (10) 은, 이들 재료를 습식 막 제조법 또는 진공 증착법에 의해 정공 주입층 상에 적층함으로써 형성된다. 이렇게 하여 형성되는 정공 수송층 (10) 의 막두께는, 통상 10㎚ 이상, 바람직하게는 30㎚ 이상이다. 단, 통상 300㎚ 이하, 바람직하게는 100㎚ 이하이다.
또한, 특히, 발광 물질로서 인광 재료를 사용하거나, 청색 발광 재료를 사용하는 경우, 도 3 에 나타내는 바와 같이, 정공 저지층 (8) 을 형성하는 것도 효과적이다. 정공 저지층 (8) 은 정공과 전자를 발광층 (4) 내에 가둬 발광 효율을 향상시키는 기능을 갖는다. 즉, 정공 저지층 (8) 은, 발광층 (4) 으로부터 이동되어 오는 정공이 전자 수송층 (7) 에 도달하는 것을 저지함으로써, 발광층 (4) 내에서 전자와의 재결합 확률을 늘리고, 생성된 여기자 (勵起子) 를 발광층 (4) 내에 가두는 역할과, 전자 수송층 (8) 으로부터 주입된 전자를 효율적으로 발광층 (4) 의 방향으로 수송하는 역할이 있다.
정공 저지층 (8) 은, 양극 (2) 으로부터 이동되어 오는 정공을 음극 (6) 에 도달하는 것을 저지하는 역할과, 음극 (6) 으로부터 주입된 전자를 효율적으로 발광층 (4) 의 방향으로 수송할 수 있는 화합물에 의해, 발광층 (4) 상에 발광층 (4) 의 음극 (6) 측의 계면에 접하도록 적층 형성된다.
정공 저지층 (8) 을 구성하는 재료에 요구되는 물성으로는, 전자 이동도가 높고 정공 이동도가 낮은 것, 에너지 갭 (HOMO, LUMO 의 차이) 이 큰 것, 여기 삼중항 준위 (T1) 가 높은 것을 들 수 있다.
이러한 조건을 만족하는 정공 저지층 재료로는, 비스(2-메틸-8-퀴놀리놀라토)(페놀라토)알루미늄, 비스(2-메틸-8-퀴놀리놀라토)(트리페닐실라놀라토)알루미늄 등의 혼합 배위자 착물, 비스(2-메틸-8-퀴놀라토)알루미늄-μ-옥소-비스-(2-메틸-8-퀴놀리라토)알루미늄 2 핵 금속 착물 등의 금속 착물, 디스티릴비페닐 유도체 등의 스티릴 화합물 (일본 공개특허공보 평11-242996호), 3-(4-비페닐일)-4-페닐-5(4-tert-부틸페닐)-1,2,4-트리아졸 등의 트리아졸 유도체 (일본 공개특허공보 평7-41759호), 바소큐프로인 등의 페난트롤린 유도체 (일본 공개특허공보 평10-79297호) 를 들 수 있다.
또한, WO2005/022962호에 기재된 2,4,6 위치가 치환된 피리딘 고리를 적어도 1 개 갖는 화합물도 정공 저지 재료로서 바람직하다.
정공 저지층 (8) 의 막두께는, 통상 0.3㎚ 이상, 바람직하게는 0.5㎚ 이상이고, 통상 100㎚ 이하, 바람직하게는 50㎚ 이하이다.
정공 저지층 (8) 도 정공 주입층 (3) 과 동일한 방법으로 형성할 수 있는데, 통상은 진공 증착법이 사용된다.
전자 수송층 (7) 및 정공 저지층 (8) 은 필요에 따라 적절히 형성하면 되고, 1) 전자 수송층만, 2) 정공 저지층만, 3) 정공 저지층/전자 수송층의 적층, 4) 사용하지 않는다 등, 용법이 있다. 또한, 도 7 에 나타내는 바와 같이, 전자 주입층 (5) 을 생략하고 정공 저지층 (8) 과 전자 수송층 (7) 을 적층해도 되고, 또한, 도 8 에 나타내는 바와 같이, 전자 수송층 (7) 만이어도 된다.
정공 저지층 (8) 과 동일한 목적으로, 도 4 에 나타내는 바와 같이, 정공 주입층 (3) 과 발광층 (4) 사이에 전자 저지층 (9) 을 형성하는 것도 효과적이다. 전자 저지층 (9) 은, 발광층 (4) 으로부터 이동되어 오는 전자가 정공 주입층 (3) 에 도달하는 것을 저지함으로써, 발광층 (4) 내에서 정공과의 재결합 확률을 늘리고, 생성된 여기자를 발광층 (4) 내에 가두는 역할과, 정공 주입층 (3) 으로부터 주입된 정공을 효율적으로 발광층 (4) 의 방향으로 수송하는 역할이 있다.
전자 저지층 (9) 에 요구되는 특성으로는, 정공 수송성이 높고, 에너지 갭 (HOMO, LUMO 의 차이) 이 큰 것, 여기 삼중항 준위 (T1) 가 높은 것을 들 수 있다. 또한, 발광층 (4) 을 습식 막 제조법으로 형성하는 경우, 전자 저지층 (9) 도 습식 막 제조법으로 형성하는 것이 소자 제조가 용이해지므로 바람직하다.
이 때문에, 전자 저지층 (9) 도 습식 막 제조 적합성을 갖는 것이 바람직하고, 이러한 전자 저지층 (9) 에 사용되는 재료로는, F8-TFB 로 대표되는 디옥틸플루오렌과 트리페닐아민의 공중합체 (WO2004/084260호 기재) 등을 들 수 있다.
또, 도 1 과는 반대의 구조, 즉, 기판 (1) 상에 음극 (6), 전자 주입층 (5), 발광층 (4), 정공 주입층 (3), 양극 (2) 의 순서로 적층하는 것도 가능하고, 이미 서술한 바와 같이, 적어도 일방이 투명성이 높은 2 장의 기판 사이에 본 발명의 유기 전계 발광 소자를 형성하는 것도 가능하다. 마찬가지로, 도 2 ∼ 도 8 에 나타낸 상기 각 층 구성과는 반대의 구조에 적층하는 것도 가능하다.
또한, 도 1 에 나타내는 층 구성을 복수단 겹친 구조 (발광 유닛을 복수 적층시킨 구조) 로 하는 것도 가능하다. 그 때에는 단 사이 (발광 유닛 사이) 의 계면층 (양극이 ITO, 음극이 Al 인 경우에는 그 2 층) 대신에, 예를 들어 V2O5 등을 전하 발생층 (CGL) 으로서 사용하면 단 사이의 장벽이 적어지고, 발광 효율·구동 전압의 관점에서 보다 바람직하다.
본 발명은, 유기 전계 발광 소자가 단일의 소자, 어레이상으로 배치된 구조로 이루어지는 소자, 양극과 음극이 X-Y 매트릭스상으로 배치된 구조의 어느 것에도 적용할 수 있다.
다음으로, 본 발명을 실시예에 의해 더욱 구체적으로 설명하는데, 본 발명은 그 요지를 벗어나지 않는 한, 이하의 실시예의 기재에 한정되는 것은 아니다.
[본 발명의 유기 화합물의 합성예]
이하에 본 발명의 유기 화합물을 합성하는 실시예를 나타낸다.
또, 이하의 실시예에 있어서, 유리 전이 온도는 DSC 측정에 의해, 기화 온도는 TG-DTA 측정에 의해, 융점은 DSC 측정 또는 TG-DTA 측정에 의해 각각 구하였다.
[실시예 1 : 목적물 1, 2]
[화학식 51]
질소 기류 중, 카르바졸 (12.7g), p-디요오드벤젠 (25.0g), 구리 분말 (4.82g), 탄산 칼륨 (21.0g), 테트라글라임 (45㎖) 을, 145℃ 로 가열하, 5 시간 교반하고, 실온까지 방랭시켰다. 반응 혼합물에 클로로포름을 첨가하고, 불용물을 여과 분리하였다. 여과액에 함유되는 클로로포름을 감압 증류 제거하고, 실리카겔 칼럼 크로마토그래피 (n-헥산/톨루엔=4/1) 로 정제함으로써 목적물 1 (11.2g) 을 얻었다.
[화학식 52]
질소 기류 중, 목적물 1 (8.01g), 2-히드록시벤즈이미다졸 (1.04g), 구리 분말 (1.38g), 탄산 칼륨 (6.44g), 테트라글라임 (20㎖) 을, 200℃ 에서 8 시간 교반한 후, 방랭시키고, 구리 분말 (1.39g) 을 첨가하고, 200℃ 에서 6 시간 교반하였다. 방랭 후, 반응 혼합물에 클로로포름, 활성 백토를 첨가하고, 교반하고, 불 용물을 여과 분리하고, 메탄올 (200㎖) 에 첨가하고, 교반한 후, 침전을 여과 채취하였다. 얻어진 고형분을 실리카겔 칼럼 크로마토그래피 (톨루엔) 로 정제하고, 아세트산 에틸 및 클로로포름/메탄올 혼합액으로 세정함으로써 목적물 2 (1.33g) 를 얻었다.
DEI-MS m/z=616(M+)
이것의 유리 전이 온도는 146℃, 융점은 355℃, 기화 온도는 507℃ 이었다.
이것의 여기 삼중항 상태와 기저 상태의 에너지차는 3.04eV 이었다.
[실시예 2 : 목적물 3, 4]
[화학식 53]
질소 기류 중, 2-히드록시벤즈이미다졸 (5.41g), m-디브로모벤젠 (28.6g), 요오드화 구리 (Ⅰ) (15.3g), 탄산 칼륨 (22.3g), N,N-디메틸포름아미드 (130㎖) 를, 150℃ 로 가열하, 6.5 시간 교반하고, 실온까지 방랭시켰다. 반응 혼합물에 물을 첨가하고, 아세트산 에틸로 추출, 유기층을 황산 마그네슘으로 건조, 농축시켰다. 농축 잔류물에 톨루엔, 활성 백토를 첨가하고, 교반하고, 불용물을 여과 분리하였다. 여과액에 함유되는 클로로포름을 감압 증류 제거한 후, 메탄올을 첨가하고, 교반하고, 얻어진 석출물을 메탄올로 재결정함으로써 목적물 3 (4.36g) 을 얻었다.
[화학식 54]
질소 기류 중, 목적물 3 (4.36g), 카르바졸 (5.76g), 구리 분말 (1.88g), 탄산 칼륨 (8.15g), 테트라글라임 (20㎖) 을, 210℃ 에서 7.5 시간 교반하였다. 방랭 후, 반응 혼합물에 클로로포름을 첨가하고, 교반하고, 불용물을 여과 분리하고, 메탄올 (200㎖) 에 첨가하고, 교반한 후, 침전을 여과 채취하였다. 얻어진 고형분을 실리카겔 칼럼 크로마토그래피 (톨루엔) 로 정제하고, 디클로로메탄/메탄올 혼합액으로 세정함으로써 목적물 4 (2.29g) 를 얻었다.
DEI-MS m/z=616(M+)
이것의 유리 전이 온도는 125℃, 융점은 227℃, 기화 온도는 489℃ 이었다.
이것은 톨루엔에 대하여, 3 중량% 이상 용해되었다.
이것의 여기 삼중항 상태와 기저 상태의 에너지차는 2.99eV 이었다.
[실시예 3 : 목적물 5]
[화학식 55]
질소 기류 중, 1,3-비스(4-브로모페닐)-1,3-디히드로벤즈이미다졸-2-온 (2.60g), N-(4-비페닐)아닐린 (4.31g), tert-부톡시나트륨 (2.25g), 및 톨루엔 (35㎖) 의 용액에, 트리스(디벤질리덴아세톤)디팔라듐 (0) 클로로포름 착물 (0.12g), 트리-tert-부틸포스핀 (0.209g), 및 톨루엔 (5㎖) 을 질소 분위기하, 60℃ 에서 5 분간 교반하여 조제한 용액을 첨가하고, 가열 환류하, 9.5 시간 교반하였다. 방랭 후, 활성 백토 및 클로로포름을 첨가하고, 교반하였다. 불용물을 여과 분리하고, 메탄올 (200㎖) 에 첨가하고, 교반한 후, 침전을 여과 채취하였다. 얻어진 고형분을 실리카겔 칼럼 크로마토그래피 (톨루엔) 로 정제하고, 디클로로메탄/메탄올 혼합액으로 세정함으로써 목적물 5 (2.55g) 를 얻었다.
DEI-MS m/z=772(M+)
이것의 유리 전이 온도는 124℃, 융점은 관측되지 않고, 기화 온도는 527℃ 이었다. 이것은, 톨루엔에 대하여 5.0 중량% 이상 용해되었다.
[실시예 4 : 목적물 6]
[화학식 56]
질소 기류 중, 2-히드록시벤즈이미다졸 (1.03g), 3-브로모비페닐 (5.00g), 요오드화 구리 (Ⅰ) (2.92g), 탄산 칼륨 (4.23g), N,N-디메틸포름아미드 (10㎖) 를, 가열 환류하 8 시간 교반한 후, 방랭시켰다. 반응 혼합물에 클로로포름을 첨가하고, 교반하고, 불용물을 여과 분리하고, 여과액을 농축한 후, 실리카겔 칼럼 크로마토그래피로 정제하고, 메탄올로 현탁 세정함으로써 목적물 6 (2.68g) 을 얻었다.
EI-MS m/z=438(M+)
이것의 유리 전이 온도는 56℃, 융점은 150℃, 기화 온도는 391℃ 이었다. 이것은 톨루엔에 대하여 5.0 중량% 이상 용해되었다.
[실시예 5 : 목적물 7∼9]
[화학식 57]
질소 기류 중, 2-히드록시벤즈이미다졸 (6.53g), 요오드벤젠 (9.93g), 구리 분말 (3.11g), 탄산 칼륨 (13.5g), 및 테트라글라임 (15㎖) 을, 170℃ 에서 4 시간 교반한 후, 방랭시켰다. 반응 혼합물에 아세트산 에틸 및 물을 첨가하여 교반하고, 유기층을 황산 마그네슘으로 건조 후, 농축시키고, 실리카겔 칼럼 크로마토그래피 (n-헥산/아세트산 에틸 혼합액∼아세트산 에틸) 로 정제하고, n-헥산으로 현탁 세정함으로써 목적물 7 (3.87g) 을 얻었다.
[화학식 58]
질소 기류 중, 2-히드록시벤즈이미다졸 (7.58g), p-디브로모벤젠 (40.0g), 구리 분말 (10.8g), 탄산 칼륨 (46.9g), 및 테트라글라임 (40㎖) 을, 200℃ 에서 12 시간 교반한 후, 방랭시켰다. 반응 혼합물에 아세트산 에틸을 첨가하고, 가열 환류하, 30 분 교반하고, 방랭 후, 불용물을 여과 분리하고, 여과액을 농축시키고, 석출물을 에탄올로 현탁 세정하고, 실리카겔 칼럼 크로마토그래피 (n-헥산/톨루엔 혼합액∼톨루엔) 로 정제하고, 메탄올로 현탁 세정함으로써 목적물 8 (3.87g) 을 얻었다.
[화학식 59]
질소 기류 중, 목적물 8 (0.860g), 목적물 7 (1.22g), 구리 분말 (0.492g), 탄산 칼륨 (2.14g), 및 테트라글라임 (6㎖) 을, 200℃ 에서 14 시간 교반한 후, 방랭시켰다. 반응 혼합물에 클로로포름을 첨가하고, 30 분 교반하고, 불용물을 여과 분리하고, 여과액을 농축시키고, 석출물을 에탄올로 현탁 세정하고, 실리카겔 칼럼 크로마토그래피 (n-헥산/아세트산 에틸 혼합액) 로 정제하고, 아세트산 에틸/에탄올 혼합액으로 현탁 세정함으로써 목적물 9 (0.465g) 를 얻었다.
DEI-MS m/z=702(M+)
이것의 유리 전이 온도는 150℃, 융점은 328℃, 기화 온도는 527℃ 이었다.
이것의 여기 삼중항 상태와 기저 상태의 에너지차는 3.2eV 이상이었다.
[실시예 6 : 목적물 10, 11]
[화학식 60]
질소 기류 중, 카르바졸 (18.8g), 2,6-디브로모피리딘 (80.0g), 구리 분말 (14.4g), 탄산 칼륨 (31.2g), 및 테트라글라임 (80㎖) 을, 170℃ 로 가열하, 7 시간 교반하고, 실온까지 방랭시켰다. 반응 혼합물에 클로로포름을 첨가하고, 불용물을 여과 분리하였다. 여과액에 함유되는 클로로포름을 감압 증류 제거하고, 에탄올/물 (40/1) 혼합액을 첨가하고, 석출물을 여과 분리하였다. 여과액에 물을 첨가하고, 석출물을 여과 채취하고, 에탄올로 세정 후, 실리카겔 칼럼 크로마토그래피 (n-헥산/염화 메틸렌 혼합액) 로 정제함으로써 목적물 10 (17.7g) 을 얻었다.
[화학식 61]
질소 기류 중, 2-히드록시벤즈이미다졸 (0.724g), 목적물 10 (7.50g), 요오드화 구리 (Ⅰ) (2.06g), 탄산 칼륨 (2.99g), 및 N,N-디메틸포름아미드 (17㎖) 를, 가열 환류하, 10 시간 교반한 후, 방랭시켰다. 반응 혼합물에 염화 메틸렌, 활성 백토를 첨가하여 교반하고, 불용물을 여과 분리하고, 여과액을 농축한 후, 석출물을 메탄올로 현탁 세정하였다. 또한, 클로로포름/메탄올 혼합액 및 클로로포름으로 현탁 세정함으로써 목적물 11 (2.27g) 을 얻었다.
DEI-MS m/z=618(M+)
이것의 유리 전이 온도는 123℃, 융점은 317℃, 기화 온도는 500℃ 이었다.
이것의 여기 삼중항 상태와 기저 상태의 에너지차는 3.00eV 이었다.
[실시예 7 : 목적물 12]
[화학식 62]
질소 기류 중, 9H-피리도[3,4-b]인돌 (2.8g), 목적물 3 (2.47g), 구리 분말 (1.06g), 탄산 칼륨 (4.6g), 및 테트라글라임 (8㎖) 을 가열하, 180℃ 에서 8 시간 반응 교반하였다.
반응 종료 후, 반응 혼합물에 클로로포름을 첨가하고, 불용물을 여과 분리하였다. 여과액을 농축시킨 후, 석출물을 메탄올로 현탁 세정하고, 실리카겔 칼럼 크로마토그래피 (아세트산 에틸/염화 메틸렌 혼합액→에탄올/염화 메틸렌 혼합액) 로 정제함으로써 목적물 12 (1.27g) 를 얻었다.
DEI-MS m/z=617(M-H)+
DCI-MS m/z=619(M+H)+
이것의 유리 전이 온도는 135℃, 융점은 221℃, 기화 온도는 499℃ 이었다.
이것은 톨루엔에 대하여 3 중량% 이상 용해되었다.
이것의 여기 삼중항 상태와 기저 상태의 에너지차는 2.96eV 이었다.
[실시예 8 : 목적물 13, 14]
[화학식 63]
대기 중, 4-아미노-3-니트로벤젠트리플루오라이드 (20.06g), 및 에탄올 (400㎖) 의 현탁 용액에, 농염산 수용액 (120㎖) 을 첨가하고, 교반하면서 80℃ 로 승온시켰다. 여기에 환원 철 (27.09g) 을 15 분에 걸쳐서 서서히 투입한 후, 가열 환류하, 1 시간 교반하였다. 빙랭 후, 얻어진 용액을 수산화 암모늄 수용액으로 중화하고 나서, 디클로로메탄으로 추출하였다. 추출액을 수세 후, 농축시키고, 이것을 실리카겔 칼럼 크로마토그래피로 정제하고, 3,4-디아미노벤젠트리플루오라이드 (12.495g) 를 얻었다.
질소 기류 중, 빙랭하, 3,4-디아미노벤젠트리플루오라이드 (3.0g) 와 탈수 테트라히드로푸란 (100㎖) 의 용액에, 1,1'-카르보닐디이미다졸 (3.314g) 을 첨가하고, 실온에서 10.7 시간 교반하였다. 얻어진 용액을 농축 후, 메탄올을 첨가하여 초음파를 조사하고 나서 농축시키고, 석출된 침전물을 여과 채취하였다. 이것을 에탄올/헥산 혼합 용매 중에서의 현탁 세정, 아세트산 에틸로부터의 재결정에 의해 정제하여 목적물 13 (1.203g) 을 얻었다.
DEI-MS m/z=202(M+)
[화학식 64]
질소 기류 중, 목적물 13 (1.188g), 목적물 10 (5.125g), CuI (2.26g), 탄산 칼륨 (3.28g), 및 무수 N,N-디메틸포름아미드 (19㎖) 의 혼합 용액을, 가열 환류하, 6.2 시간 교반하였다. 이것에 추가로 목적물 10 (1.41g), CuI (1.15g), 및 탄산 칼륨 (1.8g) 을 추가 투입하고, 가열 환류하, 4.5 시간 교반하였다. 얻어진 용액에 메탄올 (30㎖) 과 물 (30㎖) 을 첨가한 후, 여과하고, 잔류물을 150㎖ 의 클로로포름에 투입하여 교반하였다. 이 용액에 활성 백토를 첨가하여 교반한 후, 여과하고, 여과액을 농축 후, 중성 구상 실리카겔의 칼럼 크로마토그래피 (전개 용매 : 헥산/염화 메틸렌) 로 정제하고, 그 후 메탄올 중에서의 현탁 세정, 아세트산 에틸과 에탄올의 혼합 용매 중에서의 열현세 (熱懸洗) 로 정제하여 목적물 14 (2.164g) 를 얻었다.
DEI-MS m/z=686(M+)
이것의 유리 전이 온도는 126℃, 융점은 282℃, 기화 온도는 399℃ 이었다.
이것의 여기 삼중항 상태와 기저 상태의 에너지차는 2.97eV 이었다.
[실시예 9 : 목적물 15, 16]
[화학식 65]
질소 기류 중, 빙랭하, 2,3-디아미노피리딘 (8.7g) 과 탈수 테트라히드로푸란 (500㎖) 의 용액에, 1,1'-카르보닐디이미다졸 (15.5g) 을 첨가하고, 실온에서 14 시간 교반하였다. 얻어진 용액을 농축 후, 메탄올을 첨가하여 가열 현세 (懸洗) 처리를 실시하고, 석출된 침전물을 여과 채취한 결과, 목적물 15 (4.9g) 를 얻었다.
DEI-MS m/z=135(M+)
[화학식 66]
질소 기류 중, 목적물 15 (1.0g), N-(3-브로모페닐)카르바졸 (6.8g), CuI (2.8g), 탄산 칼륨 (4.2g), 및 무수 N,N-디메틸포름아미드 (10㎖) 의 혼합 용액을, 가열 환류하, 6.2 시간 교반하였다. 이것에 추가로 목적물 10 (1.4g), CuI (1.15g), 및 탄산 칼륨 (1.8g) 을 추가 투입하고, 가열 환류하, 15 시간 교반하였다. 반응액을 디클로로메탄으로 희석 후 여과하고, 브라인, 1N 의 염산으로 세 정하여 황산 나트륨으로 건조시켰다. 감압 농축에 의해 갈색 오일상이 된 것을, 실리카겔의 칼럼 크로마토그래피 (전개 용매 : 톨루엔) 로 정제하고, 그 후 메탄올 중에서의 현탁 세정으로 정제하여 목적물 16 (1.1g) 을 얻었다.
DEI-MS m/z=617(M+)
이것의 유리 전이 온도는 125℃, 융점은 226℃, 기화 온도는 490℃ 이었다. 이것은 톨루엔에 대하여 3 중량% 이상 용해되었다.
이것의 여기 삼중항 상태와 기저 상태의 에너지차는 2.99eV 이었다.
[실시예 10 : 목적물 17]
[화학식 67]
질소 기류 중, 목적물 7 (1.6g), 6,6''-디브로모-2,2':6',2''-터피리딘 (1.0g), 구리 분말 (0.35g), 탄산 칼륨 (1.4g), 및 테트라글라임 (5㎖) 을 100mL 4 구 플라스크에 첨가하고, 170℃ 의 오일배스에 담궈 13 시간 가열 교반하였다. 디클로로메탄으로 희석하여 여과 후, 감압 증류 제거하여 얻어진 황백색 고체를 테트라히드로푸란으로 가열 현세함으로써, 백색 분말상의 목적물 17 (0.9g) 을 얻었다.
DEI-MS m/z=649(M+)
이것의 유리 전이 온도는 118℃, 융점은 276℃, 기화 온도는 451℃ 이었다.
이것의 여기 삼중항 상태와 기저 상태의 에너지차는 2.98eV 이었다.
[본 발명의 유기 전계 발광 소자의 제조예]
이하에 본 발명의 유기 전계 발광 소자를 제조하는 실시예를 나타낸다.
[실시예 11]
도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
유리 기판 (1) 상에 인듐·주석 산화물 (ITO) 투명 도전막 (2) 을 150㎚ 퇴적한 것 (스퍼터 막 형성품 ; 시트 저항 15Ω) 을 통상의 포토리소그래피 기술과 염산 에칭을 사용하여 2㎜ 폭의 스트라이프로 패터닝하여 양극 (2) 을 형성하였다. 패턴 형성한 ITO 기판을, 아세톤에 의한 초음파 세정, 순수에 의한 수세, 이소프로필알코올에 의한 초음파 세정의 순서로 세정 후, 질소 블로우로 건조시키고, 마지막에 자외선 오존 세정을 실시하였다.
정공 주입층 (3) 의 재료로서, 하기에 나타내는 구조식의 방향족 아미노기를 갖는 비공액계 고분자 화합물 (PB-2) 를 하기에 나타내는 구조식의 전자 수용성 화합물 (A-2) 와 함께 이하의 조건에서 스핀코트하였다.
[화학식 68]
스핀코트 조건
용매 아니솔
PB-2 의 농도 2[wt%]
PB-2 : A-2 10:2(중량비)
스피너 회전수 2000[rpm]
스피너 회전 시간 30[초]
건조 조건 230[℃] 15[분]
상기 스핀코트에 의해 막두께 30㎚ 의 균일한 박막이 형성되었다.
다음으로 정공 주입층 (3) 을 막 형성한 기판을 진공 증착 장치 내에 설치하 였다. 상기 장치의 조 (粗) 배기를 오일 회전 펌프에 의해 실시한 후, 장치 내의 진공도가 9.8×10-5Pa (약 7.5×10-7Torr) 이하가 될 때까지 크라이오 펌프를 사용하여 배기하였다. 상기 장치 내에 배치된 세라믹 도가니에 넣은, 하기에 나타내는 구조식의 아릴아민 화합물 (H-1) 을 도가니 주위의 탄탈선 히터로 가열하여 증착을 실시하였다. 이 때의 도가니의 온도는, 300∼314℃ 의 범위에서 제어하였다. 증착시의 진공도 9.0×10-5Pa (약 6.9×10-7Torr), 증착 속도는 0.1㎚/초로 막두께 40㎚ 의 정공 수송층 (10) 을 형성하였다.
[화학식 69]
이어서, 발광층 (4) 의 주성분 (호스트 재료) 으로서 실시예 2 에서 합성한 목적물 4 : 본 발명의 유기 화합물 (EM-1) 을, 부성분 (도펀트) 으로서 하기에 나타내는 구조식의 유기 이리듐 착물 (D-1) 을 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 70]
본 발명의 유기 화합물 (EM-1) 의 도가니 온도는 270∼284℃, 증착 속도는 0.1㎚/초로, 유기 이리듐 착물 (D-1) 의 도가니 온도는 230∼237℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-1) 이 약 12.5 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 7.4×10-5Pa (약 5.7×10-7Torr) 이었다.
또한, 정공 저지층 (8) 으로서, 하기에 나타내는 구조식의 트리아릴벤젠 유도체 (HB-2) 를 도가니 온도를 343∼350℃ 로 하여, 증착 속도 0.09㎚/초로 10㎚ 의 막두께로 적층하였다. 증착시의 진공도는 7.1×10-5Pa (약 5.5×10-7Torr) 이었다.
[화학식 71]
이어서, 정공 저지층 (8) 상에, 전자 수송층 (7) 으로서, 하기에 나타내는 구조식의 바소큐프로인 (ET-2) 를 동일하게 하여 증착하였다. 이 때의 바소큐프로인 (ET-2) 의 도가니 온도는 160∼172℃ 의 범위에서 제어하고, 증착시의 진공도는 6.6×10-5Pa (약 5.1×10-7Torr), 증착 속도는 0.1㎚/초이고 막두께는 30㎚ 로 하였다.
[화학식 72]
상기 정공 수송층 (10), 발광층 (4), 정공 저지층 (8) 및 전자 수송층 (7) 을 진공 증착할 때의 기판 온도는 실온으로 유지하였다.
여기에서, 전자 수송층 (7) 까지의 증착을 실시한 소자를 1 번 상기 진공 증착 장치 내로부터 대기 중으로 꺼내고, 음극 증착용 마스크로서 2㎜ 폭의 스트라이프상 섀도우마스크를, 양극 (2) 의 ITO 스트라이프와는 직교하도록 소자에 밀착시 키고, 별도의 진공 증착 장치 내에 설치하여 유기층과 동일하게 하여 장치 내의 진공도가 2.8×10-6Torr (약 3.6×10-4Pa) 이하가 될 때까지 배기하였다. 음극 (6) 으로서, 먼저, 불화 리튬 (LiF) 을 몰리브덴 보트를 사용하여, 증착 속도 0.03㎚/초, 진공도 2.8×10-6Torr (약 3.7×10-4Pa) 로, 0.5㎚ 의 막두께로 전자 수송층 (7) 상에 막 형성하였다. 다음으로, 알루미늄을 동일하게 몰리브덴 보트에 의해 가열하고, 증착 속도 0.2㎚/초, 진공도 9.8×10-6Torr (약 1.3×10-3Pa) 로 막두께 80㎚ 의 알루미늄층을 형성하여 음극 (6) 을 완성시켰다. 이상의 2 층형 음극 (6) 의 증착시의 기판 온도는 실온으로 유지하였다.
이상과 같이 하여, 2㎜×2㎜ 사이즈의 발광 면적 부분을 갖는 유기 전계 발광 소자가 얻어졌다. 이 소자의 발광 특성을 표 1, 2 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 473㎚, 반치폭 (full width at half maximum(FWHM)) 은 67㎚ 의 청녹색 발광이고, 유기 이리듐 착물 (D-1) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.18, 0.38) 이었다.
[실시예 12]
발광층 (4) 을 이하에 기재하는 방법으로 막 형성한 것 이외에는 실시예 11 에 나타내는 방법과 동일하게 하여, 도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
발광층 (4) 의 주성분 (호스트 재료) 으로서 실시예 9 에서 합성한 목적물 16 : 본 발명의 유기 화합물 (EM-3) 을, 부성분 (도펀트) 으로서 실시예 11 에서 사용한 유기 이리듐 착물 (D-1) 을 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 73]
본 발명의 유기 화합물 (EM-3) 의 도가니 온도는 400∼407℃, 증착 속도는 0.1㎚/초로, 유기 이리듐 착물 (D-1) 의 도가니 온도는 201∼207℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-1) 이 약 10.4 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 4.6×10-5Pa (약 3.5×10-7Torr) 이었다.
이 소자의 발광 특성을 표 2 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 471㎚, 반치폭은 53㎚ 의 청녹색 발광이고, 유기 이리듐 착물 (D-1) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.14, 0.31) 이었다.
[실시예 13]
발광층 (4) 을 이하에 기재하는 방법으로 막 형성한 것 이외에는 실시예 11 에 나타내는 방법과 동일하게 하여, 도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
발광층 (4) 의 주성분 (호스트 재료) 으로서 실시예 7 에서 합성한 목적물 12 : 본 발명의 유기 화합물 (EM-4) 를, 부성분 (도펀트) 으로서 실시예 11 에서 사용한 유기 이리듐 착물 (D-1) 을 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 74]
본 발명의 유기 화합물 (EM-4) 의 도가니 온도는 217∼242℃, 증착 속도는 0.09㎚/초로, 유기 이리듐 착물 (D-1) 의 도가니 온도는 213∼216℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-1) 이 약 13.1 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 5.0×10-5Pa (약 4.0×10-7Torr) 이었다.
이 소자의 발광 특성을 표 2 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 472㎚, 반치폭은 53㎚ 의 청녹색 발광이고, 유기 이리듐 착물 (D-1) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.15, 0.32) 이었다.
[비교예 1]
발광층 (4) 을 이하에 기재하는 방법으로 막 형성한 것 이외에는 실시예 11 에 나타내는 방법과 동일하게 하여, 도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
발광층 (4) 의 주성분 (호스트 재료) 으로서 하기 구조식에 나타내는 카르바졸 유도체 (CBP) 를, 부성분 (도펀트) 으로서 실시예 11 에서 사용한 유기 이리듐 착물 (D-1) 을 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 75]
카르바졸 유도체 (CBP) 의 도가니 온도는 406∼411℃, 증착 속도는 0.08㎚/초로, 유기 이리듐 착물 (D-1) 의 도가니 온도는 204∼209℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-1) 이 약 13.1 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 3.8×10-5Pa (약 2.9×10-7Torr) 이었다.
이 소자의 발광 특성을 표 1 과 표 2 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 490㎚, 반치폭은 59㎚ 의 청녹색 발광이고, 유기 이리듐 착물 (D-1) 로부터의 발광 이외에, 다른 재료 유래의 발광도 관측되었다. 색도는 CIE(x,y)=(0.19, 0.54) 이었다.
[실시예 14]
도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
유리 기판 (1) 상에 인듐·주석 산화물 (ITO) 투명 도전막 (2) 을 150㎚ 퇴적한 것 (스퍼터 막 형성품 ; 시트 저항 15Ω) 을 통상의 포토리소그래피 기술과 염산 에칭을 사용하여 2㎜ 폭의 스트라이프로 패터닝하여 양극 (2) 을 형성하였다. 패턴 형성한 ITO 기판을, 아세톤에 의한 초음파 세정, 순수에 의한 수세, 이소프로필알코올에 의한 초음파 세정의 순서로 세정 후, 질소 블로우로 건조시키고, 마지막에 자외선 오존 세정을 실시하였다.
정공 주입층 (3) 의 재료로서, 하기에 나타내는 구조식의 방향족 아미노기를 갖는 비공액계 고분자 화합물 (PB-1) (중량 평균 분자량 : 29400, 수평균 분자량 : 12600) 을 실시예 11 에서 사용한 전자 수용성 화합물 (A-2) 와 함께 이하의 조건에서 스핀코트하였다.
[화학식 76]
스핀코트 조건
용매 벤조산 에틸
PB-1 의 농도 2[wt%]
PB-1 : A-2 10:2(중량비)
스피너 회전수 1500[rpm]
스피너 회전 시간 30[초]
건조 조건 230[℃] 15[분]
상기 스핀코트에 의해 막두께 30㎚ 의 균일한 박막이 형성되었다.
다음으로 정공 주입층 (3) 을 막 형성한 기판을 진공 증착 장치 내에 설치하였다. 상기 장치의 조 (粗) 배기를 오일 회전 펌프에 의해 실시한 후, 장치 내의 진공도가 9.0×10-5Pa (약 6.8×10-7Torr) 이하가 될 때까지 크라이오 펌프를 사용하여 배기하였다. 상기 장치 내에 배치된 세라믹 도가니에 넣은, 실시예 11 에서 사용한 아릴아민 화합물 (H-1) 을 도가니 주위의 탄탈선 히터로 가열하여 증착을 실시하였다. 이 때의 도가니의 온도는, 300∼314℃ 의 범위에서 제어하였다. 증착시의 진공도 9.3×10-5Pa (약 7.0×10-7Torr), 증착 속도는 0.1㎚/초로 막두께 40㎚ 의 정공 수송층 (10) 을 형성하였다.
이어서, 발광층 (4) 의 주성분 (호스트 재료) 으로서 실시예 2 에서 합성한 목적물 4 : 본 발명의 유기 화합물 (EM-1) 을, 부성분 (도펀트) 으로서 하기에 나타내는 구조식의 유기 이리듐 착물 (D-2) 를 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 77]
본 발명의 유기 화합물 (EM-1) 의 도가니 온도는 270∼284℃, 증착 속도는 0.1㎚/초로, 유기 이리듐 착물 (D-2) 의 도가니 온도는 245∼246℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-2) 가 약 5.9 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 7.8×10-5Pa (약 5.9×10-7Torr) 이었다.
또한, 정공 저지층 (8) 으로서, 하기에 나타내는 구조식의 페닐피리딘 유도체 (HB-1) 을 도가니 온도를 343∼350℃ 로 하여, 증착 속도 0.09㎚/초로 10㎚ 의 막두께로 적층하였다. 증착시의 진공도는 7.1×10-5Pa (약 5.5×10-7Torr) 이었다.
[화학식 78]
이어서, 정공 저지층 (8) 상에, 전자 수송층 (7) 으로서, 하기에 나타내는 구조식의 트리스(8-히드록시퀴놀리나토)알루미늄 (Alq3) 을 동일하게 하여 증착하였다. 이 때의 트리스(8-히드록시퀴놀리나토)알루미늄 (Alq3) 의 도가니 온도는 296∼300℃ 의 범위에서 제어하고, 증착시의 진공도는 6.6×10-5Pa (약 5.1×10-7Torr), 증착 속도는 0.15㎚/초이고 막두께는 30㎚ 로 하였다.
[화학식 79]
상기 정공 수송층 (10), 발광층 (4), 정공 저지층 (8) 및 전자 수송층 (7) 을 진공 증착할 때의 기판 온도는 실온으로 유지하였다.
그 후, 실시예 11 과 동일하게 하여 2 층형 음극 (6) 을 증착하였다.
이 소자의 발광 특성을 표 3 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 514㎚, 반치폭은 70㎚ 의 녹색 발광이고, 유기 이리듐 착물 (D-2) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.31,0.62) 이었다.
[실시예 15]
발광층 (4) 을 이하에 기재하는 방법으로 막 형성한 것 이외에는 실시예 14 에 나타내는 방법과 동일하게 하여, 도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
발광층 (4) 의 주성분 (호스트 재료) 으로서 실시예 6 에서 합성한 목적물 11 : 본 발명의 유기 화합물 (EM-5) 를, 부성분 (도펀트) 으로서 실시예 14 에서 사용한 유기 이리듐 착물 (D-2) 를 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 80]
본 발명의 유기 화합물 (EM-5) 의 증착 속도는 0.1㎚/초로, 유기 이리듐 착물 (D-2) 의 도가니 온도는 255∼257℃ 로 각각 제어하고, 막두께 32㎚ 로 유기 이리듐 착물 (D-2) 가 약 6.2 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 1.5×10-4Pa 이었다.
이 소자의 발광 특성을 표 3 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 513㎚, 반치폭은 68㎚ 의 녹색 발광이고, 유기 이리듐 착물 (D-2) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.30, 0.62) 이었다.
[실시예 16]
정공 수송층 (10) 및 발광층 (4) 을 이하에 기재하는 방법으로 막 형성한 것 이외에는 실시예 14 에 나타내는 방법과 동일하게 하여, 도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
정공 주입층 (3) 을 막 형성한 기판을 진공 증착 장치 내에 설치하였다. 상기 장치의 조 (粗) 배기를 오일 회전 펌프에 의해 실시한 후, 장치 내의 진공도가 5.3×10-5Pa (약 4.0×10-7Torr) 이하가 될 때까지 크라이오 펌프를 사용하여 배기하였다. 상기 장치 내에 배치된 세라믹 도가니에 넣은, 하기에 나타내는 구조식의 아릴아민 화합물 (PPD) 을 도가니 주위의 탄탈선 히터로 가열하여 증착하였다. 이 때의 도가니의 온도는 260∼272℃ 의 범위에서 제어하였다. 증착시의 진공도 6.0×10-5Pa (약 4.9×10-7Torr), 증착 속도는 0.1㎚/초로 막두께 40㎚ 의 정공 수송층 (10) 을 형성하였다.
[화학식 81]
이어서, 발광층 (4) 의 주성분 (호스트 재료) 으로서 실시예 1 에서 합성한 목적물 2 : 본 발명의 유기 화합물 (EM-6) 을, 부성분 (도펀트) 으로서 실시예 14 에서 사용한 유기 이리듐 착물 (D-2) 를 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 82]
본 발명의 유기 화합물 (EM-6) 의 증착 속도는 0.1㎚/초로, 유기 이리듐 착물 (D-2) 의 도가니 온도는 268∼270℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-2) 가 약 6.1 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 6.3×10-5Pa (약 4.7×10-7Torr) 이었다.
이 소자의 발광 특성을 표 3 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 513㎚, 반치폭은 69㎚ 의 녹색 발광이고, 유기 이리듐 착물 (D-2) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.30, 0.58) 이었다.
[비교예 2]
발광층 (4) 을 이하에 기재하는 방법으로 막 형성한 것 이외에는 실시예 14 에 나타내는 방법과 동일하게 하여, 도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
발광층 (4) 의 주성분 (호스트 재료) 으로서 하기 구조식에 나타내는 카르바졸 유도체 (SiMCP) 를, 부성분 (도펀트) 으로서 실시예 14 에서 사용한 유기 이리듐 착물 (D-2) 를 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 83]
카르바졸 유도체 (SiMCP) 의 증착 속도는 0.1㎚/초로, 유기 이리듐 착물 (D-2) 의 도가니 온도는 268∼270℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-2) 가 약 5.9 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 6.3×10-5Pa (약 4.7×10-7Torr) 이었다.
이 소자의 발광 특성을 표 3 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 513㎚, 반치폭은 70㎚ 의 녹색 발광이고, 유기 이리듐 착물 (D-2) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.31,0.68) 이었다.
[실시예 17 및 비교예 3]
실시예 14∼16 및 비교예 2 에서 제조한 소자에, 전류 밀도 250mA/㎠ 에 상당하는 직류를 통전했을 때의 휘도 변화를 관찰하였다. 통전 40 초 후의 휘도, 통전 직후의 휘도, 및 통전 40 초 후의 휘도값을 통전 직후의 휘도값으로 나눈 값을 표 4 에 나타낸다.
이 결과로부터, 본 발명의 화합물 (EM-1), (EM-5) 및 (EM-6) 을 발광층의 주성분에 사용한 소자는, 카르바졸 유도체 (SiMCP) 를 발광층의 주성분에 사용한 소자보다, 통전시의 휘도 저하가 적은 것이 분명해졌다.
[실시예 18]
정공 수송층 (10) 및 발광층 (4) 을 이하에 기재하는 방법으로 막 형성한 것 이외에는 실시예 14 에 나타내는 방법과 동일하게 하여, 도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
정공 주입층 (3) 을 막 형성한 기판을 진공 증착 장치 내에 설치하였다. 상기 장치의 조 배기를 오일 회전 펌프에 의해 실시한 후, 장치 내의 진공도가 7.5×10-5Pa (약 5.6×10-7Torr) 이하가 될 때까지 크라이오 펌프를 사용하여 배기하였다. 상기 장치 내에 배치된 세라믹 도가니에 넣은, 하기에 나타내는 실시예 3 에서 합성한 목적물 5 : 본 발명의 유기 화합물 (EM-7) 을 도가니 주위의 탄탈선 히터로 가열하여 증착하였다. 증착시의 진공도 7.0×10-5Pa, 증착 속도는 0.1㎚/초로 막두께 40㎚ 의 정공 수송층 (10) 을 얻었다.
[화학식 84]
이어서, 발광층 (4) 의 주성분 (호스트 재료) 으로서 하기에 나타내는 카르바졸 유도체 (E-1) 을, 부성분 (도펀트) 으로서 실시예 14 에서 사용한 유기 이리듐 착물 (D-2) 를, 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 85]
카르바졸 유도체 (E-1) 의 도가니 온도는 300∼304℃, 증착 속도는 0.08㎚/초로, 유기 이리듐 착물 (D-2) 의 도가니 온도는 239∼242℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-2) 가 6.4 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 6.6×10-5Pa 이었다.
이 소자의 발광 특성을 표 5 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 513㎚, 반치폭은 69㎚ 의 녹색 발광이고, 유기 이리듐 착물 (D-2) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.31, 0.62) 이었다.
[비교예 4]
정공 수송층 (10) 을 이하에 기재하는 방법으로 막 형성한 것 이외에는 실시예 18 에 나타내는 방법과 동일하게 하여, 도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
하기에 나타내는 구조식의 아릴아민 화합물 (PPD) 을 세라믹 도가니에 넣고, 도가니 주위의 탄탈선 히터로 가열하여 증착을 실시하였다. 증착시의 진공도는 6.0×10-5Pa, 증착 속도는 0.08∼0.13㎚/초로 제어하고, 막두께 40㎚ 의 정공 수송층 (10) 을 얻었다.
[화학식 86]
이 소자의 발광 특성을 표 5 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 513㎚, 반치폭은 67㎚ 의 녹색 발광이고, 유기 이리듐 착물 (D-2) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.30,0.61) 이었다.
[실시예 19]
도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
실시예 14 에 나타내는 방법과 동일하게 하여, 정공 주입층 (3) 과 정공 수송층 (10) 을 막 형성한 후, 발광층 (4) 의 주성분 (호스트 재료) 으로서 실시예 2 에서 합성한 목적물 4 : 본 발명의 유기 화합물 (EM-1) 을, 부성분 (도펀트) 으로서 하기에 나타내는 구조식의 유기 이리듐 착물 (Facial 체 : D-3. Me 는 메틸기) 을 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
[화학식 87]
본 발명의 유기 화합물 (EM-1) 의 도가니 온도는 277∼283℃, 증착 속도는 0.07㎚/초로, 유기 이리듐 착물 (D-3) 의 도가니 온도는 279∼281℃ 로 각각 제어하고, 막두께 30㎚ 로 유기 이리듐 착물 (D-3) 이 약 5.8 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 5.0×10-5Pa (약 3.8×10-7Torr) 이었다.
또한, 정공 저지층 (8) 으로서, 본 발명의 유기 화합물 (EM-1) 만을, 도가니 온도를 283∼297℃ 로 하여, 증착 속도 0.09㎚/초로 10㎚ 의 막두께로 적층하였다. 증착시의 진공도는 4.5×10-5Pa (약 3.4×10-7Torr) 이었다.
이어서, 정공 저지층 (8) 상에, 전자 수송층 (7) 으로서, 실시예 11 에서 사용한 바소큐프로인 (ET-2) 를 동일하게 하여 증착하였다. 이 때의 바소큐프로인 (ET-2) 의 도가니 온도는 162∼183℃ 의 범위에서 제어하고, 증착시의 진공도는 4.4×10-5Pa (약 3.3×10-7Torr), 증착 속도는 0.09㎚/초이고 막두께는 30㎚ 로 하였다.
상기 정공 수송층 (10), 발광층 (4), 정공 저지층 (8) 및 전자 수송층 (7) 을 진공 증착할 때의 기판 온도는 실온으로 유지하였다.
그 후, 실시예 11 과 동일하게 하여 2 층형 음극 (6) 을 증착하였다.
이 소자의 발광 특성을 표 6 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 403㎚ 의 청색 발광이고, 유기 이리듐 착물 (D-3) 으로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.18,0.10) 이었다.
[실시예 20]
도 7 에 나타내는 구조를 갖는 유기 전계 발광 소자를 이하의 방법으로 제조하였다.
실시예 14 에 나타내는 방법과 동일하게 하여, 정공 주입층 (3) 과 정공 수송층 (10) 을 막 형성한 후, 발광층 (4) 의 주성분 (호스트 재료) 으로서 실시예 6 에서 합성한 목적물 11 : 본 발명의 유기 화합물 (EM-5) 를, 부성분 (도펀트) 으로서 실시예 11 에서 사용한 유기 이리듐 착물 (D-1) 을 별개의 세라믹 도가니에 설치하고, 2 원 동시 증착법에 의해 막 형성하였다.
본 발명의 유기 화합물 (EM-5) 의 증착 속도는 0.1㎚/초로, 유기 이리듐 착물 (D-1) 의 도가니 온도는 252∼260℃ 로 각각 제어하고, 막두께 33㎚ 로 유기 이리듐 착물 (D-1) 이 약 7.6 중량% 함유된 발광층 (4) 을 정공 수송층 (10) 상에 적층하였다. 증착시의 진공도는 4.2×10-5Pa 이었다.
또한, 정공 저지층 (8) 으로서, 실시예 14 에서 사용한 페닐피리딘 유도체 (HB-1) 을 도가니 온도 340∼341℃ 로 하여, 증착 속도 0.08∼0.09㎚/초로 5㎚ 의 막두께로 적층하였다. 증착시의 진공도는 4.6×10-5Pa 이었다.
이어서, 정공 저지층 (8) 상에, 전자 수송층 (7) 으로서, 하기에 나타내는 구조식의 비스(2-메틸8-히드록시퀴놀리나토)(p-페닐페놀레이트)알루미늄 (BAlq) 을 동일하게 하여 증착하였다. 이 때의 비스(2-메틸8-히드록시퀴놀리나토)(p-페닐페놀레이트)알루미늄 (BAlq) 의 도가니 온도는 190∼191℃ 의 범위에서 제어하고, 증착시의 진공도는 5.1×10-5Pa, 증착 속도는 0.08∼0.24m/초로 제어하고, 막두께는 30㎚ 로 하였다.
[화학식 88]
상기 정공 수송층 (10), 발광층 (4), 정공 저지층 (8) 및 전자 수송층 (7) 을 진공 증착할 때의 기판 온도는 실온으로 유지하였다.
그 후, 실시예 11 과 동일하게 하여 2 층형 음극 (6) 을 증착하였다.
이 소자의 발광 특성을 표 7 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 471㎚, 반치폭은 66㎚ 의 청녹색 발광이고, 유기 이리듐 착물 (D-1) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.17,0.36) 이었다.
[실시예 21]
도 3 에 나타내는 구조 (단, 전자 주입층은 갖지 않는다) 를 갖는 유기 전계 발광 소자를, 이하의 방법에 의해 제조하였다.
유리 기판 (1) 상에 인듐·주석 산화물 (ITO) 투명 도전막 (2) 을 150㎚ 퇴적한 것 (스퍼터 막 형성품 ; 시트 저항 15Ω) 을 통상의 포토리소그래피 기술과 염산 에칭을 사용하여 2㎜ 폭의 스트라이프로 패터닝하여 양극 (2) 을 형성하였다. 패턴 형성한 ITO 기판을, 아세톤에 의한 초음파 세정, 순수에 의한 수세, 이소프로필알코올에 의한 초음파 세정의 순서로 세정 후, 질소 블로우로 건조시키고, 마지막에 자외선 오존 세정을 실시하였다.
다음으로, 정공 주입층 (3) 을, 스핀코트시의 건조 조건을 230℃, 180 분으로 한 것 이외에는 실시예 11 과 동일하게 하여 형성하였다.
이어서, 정공 주입층 (3) 상에 발광층 (4) 을 이하와 같이 습식 막 제조법에 의해 형성하였다. 발광층 (4) 의 재료로서, 실시예 2 에서 합성한 목적물 4 : 본 발명의 유기 화합물 (EM-1) 및 실시예 11 에서 사용한 유기 이리듐 착물 (D-1) 을 사용하고, 이들을 용매로 하여 톨루엔에 용해시켜 유기 전계 발광 소자용 조성물을 조제하고, 이 유기 전계 발광 소자용 조성물을 사용하여 하기의 조건에서 스핀코트하였다.
스핀코트 조건
용매 톨루엔
EM-1 의 농도 2[wt%]
EM-1 : D-1 10:1(중량비)
스피너 회전수 1500[rpm]
스피너 회전 시간 60[초]
건조 조건 100[℃], 60[분] (감압하)
상기 스핀코트에 의해 막두께 65㎚ 의 균일한 박막이 형성되었다.
다음으로, 정공 저지층 (8), 전자 수송층 (7), 음극 (6) 을 실시예 11 과 동일하게 하여 형성하였다.
이상과 같이 하여, 2㎜×2㎜ 사이즈의 발광 면적 부분을 갖는 유기 전계 발광 소자가 얻어졌다. 이 소자의 발광 특성을 표 8 에 나타낸다.
이 소자의 전계 발광은, 극대 파장 471㎚, 반치폭은 67㎚ 의 청녹 발광이고, 유기 이리듐 착물 (D-1) 로부터의 것과 동정되었다. 색도는 CIE(x,y)=(0.18,0.36) 이었다.
본 발명을 특정한 양태를 사용하여 상세히 설명했는데, 본 발명의 의도와 범위를 벗어나지 않고 여러 가지 변경이 가능한 것은 당업자에게 분명하다.
또, 본 출원은, 2005 년 11 월 30 일자로 출원된 일본 특허출원 (일본국 특허출원 2005-346164호) 에 기초하고 있으며, 그 전체가 인용에 의해 원용된다.
Claims (18)
- 하기 식 (Ⅰ) 로 표시되는 유기 화합물.[화학식 89][식 (Ⅰ) 중, Ar1 은 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 질소 원자, 산소 원자 또는 황 원자의 헤테로원자를 함유하는 5 또는 6 원자 고리의 단고리 또는 2∼4 축합 고리 유래의 방향족 복소환기, 또는 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 탄소수 1∼4 의 알킬기를 나타낸다.Ar2 는 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 또는 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 질소 원자, 산소 원자 또는 황 원자의 헤테로원자를 함유하는 5 또는 6 원자 고리의 단고리 또는 2∼4 축합 고리 유래의 방향족 복소환기를 나타낸다.치환기 군 Z 는 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 탄소수 1∼4 의 알킬기 및 1,3-디히드로이미다졸-2-온 유래의 기이다.R1, R2 는 각각 독립적으로 수소 원자, 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기 또는 탄소수 1∼8 의 직사슬 또는 분기의 알킬기를 나타내거나, 또는 하기 식 (Ⅱ) 로 표시되도록 서로 결합하여 치환기로서 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기 및 탄소수 1∼8 의 직사슬 또는 분기의 알킬기로 이루어진 군으로부터 선택되는 하나 이상을 갖고 있어도 되는 벤젠 고리, 또는 치환기로서 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기 및 탄소수 1∼8 의 직사슬 또는 분기의 알킬기로 이루어진 군으로부터 선택되는 하나 이상을 갖고 있어도 되는 질소 함유 방향족 6 원자 고리 A1 을 형성하고 있어도 된다.[화학식 91](식 (Ⅱ) 중, Ar1, Ar2, Q 는 상기 식 (Ⅰ) 에 있어서와 동일한 의미이다.고리 A1 은 치환기로서 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기 및 탄소수 1∼8 의 직사슬 또는 분기의 알킬기로 이루어진 군으로부터 선택되는 하나 이상을 갖고 있어도 되는 벤젠 고리, 또는 치환기로서 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기 및 탄소수 1∼8 의 직사슬 또는 분기의 알킬기로 이루어진 군으로부터 선택되는 하나 이상을 갖고 있어도 되는 질소 함유 방향족 6 원자 고리를 나타낸다.)Q 는 하기 식 (Ⅰ-1) 로 표시된다.[화학식 90](식 (Ⅰ-1) 중, Ar3∼Ar4 는 각각 독립적으로 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 또는 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 질소 원자, 산소 원자 또는 황 원자의 헤테로원자를 함유하는 5 또는 6 원자 고리의 단고리 또는 2∼4 축합 고리 유래의 방향족 복소환기를 나타낸다. Ar3 과 Ar4 는 서로 결합하여 고리를 형성하고 있어도 된다.치환기 군 Z 는 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 탄소수 1∼4 의 알킬기 및 1,3-디히드로이미다졸-2-온 유래의 기이다.)]
- 삭제
- 제 1 항에 있어서,하기 식 (Ⅲ) 으로 표시되는 유기 화합물.[화학식 92][식 (Ⅲ) 중, R1, R2, Q 는 상기 식 (Ⅰ) 에 있어서와 동일한 의미이다.고리 B1 은 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 벤젠 고리를 나타내고, 고리 C1 은 Q 이외에 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 벤젠 고리를 나타낸다.치환기 군 Z 는 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 탄소수 1∼4 의 알킬기 및 1,3-디히드로이미다졸-2-온 유래의 기이다.]
- 제 1 항에 있어서,하기 식 (Ⅲ-2) 로 표시되는 유기 화합물.[화학식 93][식 (Ⅲ-2) 중, R1, R2, Q 는 상기 식 (Ⅰ) 에 있어서와 동일한 의미이다.고리 D1 은 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 피리딘 고리를 나타내고, 고리 E1 은 Q 이외에 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 피리딘 고리를 나타낸다.치환기 군 Z 는 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 탄소수 1∼4 의 알킬기 및 1,3-디히드로이미다졸-2-온 유래의 기이다.]
- 재 1 항에 있어서,하기 식 (Ⅳ) 로 표시되는 유기 화합물.[화학식 94][식 (Ⅳ) 중, Ar2∼Ar4, R1, R2 는 상기 식 (Ⅰ) 및 식 (Ⅰ-1) 에 있어서와 동일한 의미이다.Ar6∼Ar8 은 각각 독립적으로 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 또는 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 질소 원자, 산소 원자 또는 황 원자의 헤테로원자를 함유하는 5 또는 6 원자 고리의 단고리 또는 2∼4 축합 고리 유래의 방향족 복소환기를 나타낸다. Ar7 과 Ar8 은 서로 결합하여 고리를 형성하고 있어도 된다.치환기 군 Z 는 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 탄소수 1∼4 의 알킬기 및 1,3-디히드로이미다졸-2-온 유래의 기이다.]
- 제 1 항에 기재된 유기 화합물로 이루어지는 전하 수송 재료.
- 하기 식 (Ⅱ-2) 로 표시되는 유기 전계 발광 소자용 전하 수송 재료.[화학식 96][식 (Ⅱ-2) 중, 고리 A1 은 치환기로서 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기 및 탄소수 1∼8 의 직사슬 또는 분기의 알킬기로 이루어진 군으로부터 선택되는 하나 이상을 갖고 있어도 되는 벤젠 고리, 또는 치환기로서 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기 및 탄소수 1∼8 의 직사슬 또는 분기의 알킬기로 이루어진 군으로부터 선택되는 하나 이상을 갖고 있어도 되는 질소 함유 방향족 6 원자 고리를 나타낸다.Ar1, Ar9 는 각각 독립적으로 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 또는 치환기 군 Z 에서 선택되는 치환기를 갖고 있어도 되는 질소 원자, 산소 원자 또는 황 원자의 헤테로원자를 함유하는 5 또는 6 원자 고리의 단고리 또는 2∼4 축합 고리 유래의 방향족 복소환기를 나타낸다.치환기 군 Z 는 5 또는 6 원자 고리의 단고리 또는 2∼5 축합 고리 유래의 방향족 탄화수소기, 탄소수 1∼4 의 알킬기 및 1,3-디히드로이미다졸-2-온 유래의 기이다.]
- 제 7 항에 있어서,톨루엔에 대하여 2.0 중량% 이상 용해되는 전하 수송 재료.
- 제 8 항에 있어서,톨루엔에 대하여 2.0 중량% 이상 용해되는 전하 수송 재료.
- 제 7 항에 기재된 전하 수송 재료를 함유하는 전하 수송 재료용 조성물.
- 제 8 항에 기재된 전하 수송 재료를 함유하는 전하 수송 재료용 조성물.
- 제 11 항에 있어서,추가로 인광 발광 재료를 함유하는 전하 수송 재료용 조성물.
- 제 12 항에 있어서,추가로 인광 발광 재료를 함유하는 전하 수송 재료용 조성물.
- 기판 상에, 양극, 음극, 및 이들 양극 사이에 형성된 발광층을 갖는 유기 전계 발광 소자에 있어서, 제 7 항에 기재된 전하 수송 재료를 함유하여 이루어지는 층을 갖는 유기 전계 발광 소자.
- 기판 상에, 양극, 음극, 및 이들 양극 사이에 형성된 발광층을 갖는 유기 전계 발광 소자에 있어서, 제 8 항에 기재된 전하 수송 재료를 함유하여 이루어지는 층을 갖는 유기 전계 발광 소자.
- 제 15 항에 있어서,전하 수송 재료를 함유하여 이루어지는 층이, 제 11 항에 기재된 전하 수송 재료용 조성물을 사용하여 형성되는 층인 유기 전계 발광 소자.
- 제 16 항에 있어서,전하 수송 재료를 함유하여 이루어지는 층이, 제 12 항에 기재된 전하 수송 재료용 조성물을 사용하여 형성되는 층인 유기 전계 발광 소자.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JPJP-P-2005-00346164 | 2005-11-30 | ||
| JP2005346164 | 2005-11-30 | ||
| PCT/JP2006/323330 WO2007063760A1 (ja) | 2005-11-30 | 2006-11-22 | 有機化合物、電荷輸送材料、電荷輸送材料用組成物および有機電界発光素子 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20080074103A KR20080074103A (ko) | 2008-08-12 |
| KR101395615B1 true KR101395615B1 (ko) | 2014-05-16 |
Family
ID=38092095
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020087009361A KR101395615B1 (ko) | 2005-11-30 | 2006-11-22 | 유기 화합물, 전하 수송 재료, 전하 수송 재료용 조성물 및유기 전계 발광 소자 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US8022617B2 (ko) |
| EP (1) | EP1956008B1 (ko) |
| KR (1) | KR101395615B1 (ko) |
| CN (1) | CN101287713A (ko) |
| TW (1) | TWI388549B (ko) |
| WO (1) | WO2007063760A1 (ko) |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ITMI20051085A1 (it) * | 2005-06-10 | 2006-12-11 | Acs Dobfar Spa | Metodo di purificazione del cefotetan |
| WO2008153088A1 (ja) * | 2007-06-13 | 2008-12-18 | Ube Industries, Ltd. | 有機エレクトロルミネッセンス素子及び素子用材料 |
| GB2462410B (en) * | 2008-07-21 | 2011-04-27 | Cambridge Display Tech Ltd | Compositions and methods for manufacturing light-emissive devices |
| JP5540600B2 (ja) * | 2008-08-13 | 2014-07-02 | 三菱化学株式会社 | 電子デバイス、有機電界発光素子、有機el表示装置および有機el照明 |
| KR101069520B1 (ko) * | 2008-10-01 | 2011-09-30 | 주식회사 엘지화학 | 유기발광소자 및 이의 제조방법 |
| KR20110089128A (ko) * | 2008-10-28 | 2011-08-04 | 더 리젠츠 오브 더 유니버시티 오브 미시간 | 별개의 적색, 녹색 및 청색 서브엘리먼트를 갖는 적층형 백색 oled |
| WO2010119891A1 (ja) * | 2009-04-14 | 2010-10-21 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子 |
| JP4599469B1 (ja) * | 2009-08-31 | 2010-12-15 | 富士フイルム株式会社 | 有機電界発光素子用材料及び有機電界発光素子 |
| JP4579343B1 (ja) * | 2010-04-23 | 2010-11-10 | 富士フイルム株式会社 | 有機電界発光素子用材料及び有機電界発光素子 |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| US9067919B2 (en) | 2010-07-08 | 2015-06-30 | Basf Se | Use of dibenzofurans and dibenzothiophenes substituted by nitrogen-bonded five-membered heterocyclic rings in organic electronics |
| KR102070539B1 (ko) * | 2010-07-08 | 2020-01-28 | 유디씨 아일랜드 리미티드 | 질소 결합된 5원 복소환 고리로 치환된 디벤조푸란 및 디벤조티오펜의 유기 전자 소자에서의 용도 |
| US9159930B2 (en) | 2010-11-26 | 2015-10-13 | Merck Patent Gmbh | Formulations and electronic devices |
| JPWO2012105629A1 (ja) * | 2011-02-02 | 2014-07-03 | 出光興産株式会社 | 含窒素複素環誘導体、有機エレクトロルミネッセンス素子用電子輸送材料、及びそれを用いてなる有機エレクトロルミネッセンス素子 |
| CN103459375B (zh) * | 2011-04-07 | 2016-10-12 | 三菱化学株式会社 | 有机化合物、电荷传输材料、含有该化合物的组合物、有机场致发光元件、显示装置及照明装置 |
| JP6215211B2 (ja) * | 2011-10-18 | 2017-10-18 | エンパイア テクノロジー ディベロップメント エルエルシー | バリアおよびフィルム |
| CN103855309A (zh) * | 2012-11-30 | 2014-06-11 | 海洋王照明科技股份有限公司 | 有机电致发光装置及其制备方法 |
| WO2015014835A1 (en) | 2013-07-31 | 2015-02-05 | Basf Se | Luminescent diazabenzimidazole carbene metal complexes |
| CN103626405B (zh) * | 2013-11-28 | 2016-04-06 | 中国工程物理研究院化工材料研究所 | 单层荧光共轭聚合物膜及其制备方法 |
| US9666822B2 (en) | 2013-12-17 | 2017-05-30 | The Regents Of The University Of Michigan | Extended OLED operational lifetime through phosphorescent dopant profile management |
| JP6783254B2 (ja) * | 2015-06-30 | 2020-11-11 | ダウ グローバル テクノロジーズ エルエルシー | 電子デバイス用の環状尿素化合物 |
| KR102471110B1 (ko) | 2015-08-11 | 2022-11-28 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| TWI582081B (zh) * | 2016-03-25 | 2017-05-11 | 昱鐳光電科技股份有限公司 | 用於有機電激發光元件之化合物及使用該化合物之有機電激發光元件 |
| KR102603865B1 (ko) | 2016-04-21 | 2023-11-21 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| CN107759527B (zh) * | 2016-08-17 | 2022-03-04 | 北京鼎材科技有限公司 | 一种化合物及其用途和有机电致发光器件 |
| CN107759572B (zh) * | 2016-08-17 | 2020-11-03 | 北京鼎材科技有限公司 | 一种化合物及其用途和有机电致发光器件 |
| US11069856B2 (en) * | 2016-09-07 | 2021-07-20 | Joled Inc. | Solution for organic EL, method of producing organic EL device and organic EL device |
| JP2018194639A (ja) * | 2017-05-16 | 2018-12-06 | 京セラドキュメントソリューションズ株式会社 | 電子写真感光体 |
| CN114014742A (zh) * | 2021-11-01 | 2022-02-08 | 上海八亿时空先进材料有限公司 | 一种三芳基苯衍生物、发光材料、发光元件及消费型产品 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5276049A (en) * | 1991-03-12 | 1994-01-04 | Dr. Karl Thomae Gmbh | Cyclic urea derivatives, pharmaceutical compositions containing these compounds and methods of using the same |
| JPH09183769A (ja) * | 1995-02-17 | 1997-07-15 | Takeda Chem Ind Ltd | アゾール化合物およびその用途 |
| US5861420A (en) * | 1991-04-05 | 1999-01-19 | G. D. Searle & Co. | N-arylheteroarylalkyl imidazol-2-one compounds for treatment of circulatory disorders |
| WO2004011438A1 (de) * | 2002-07-25 | 2004-02-05 | Aventis Pharma Deutschland Gmbh | Diarylsubstituierte cyclische harnstoffderivate mit mch-modulatorischer wirkung |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4123245A1 (de) * | 1991-07-13 | 1993-01-14 | Basf Ag | Polyimid mit einheiten eines cyclischen harnstoffes |
| JP3039182B2 (ja) | 1993-03-08 | 2000-05-08 | 富士電機株式会社 | オリゴチオフェン誘導体およびその製造方法 |
| TW318841B (ko) * | 1995-02-17 | 1997-11-01 | Takeda Pharm Industry Co Ltd | |
| JPH10246973A (ja) | 1997-03-05 | 1998-09-14 | Mita Ind Co Ltd | 電子写真感光体 |
| GB0211649D0 (en) | 2002-05-21 | 2002-07-03 | Novartis Ag | Organic compounds |
| KR101035818B1 (ko) | 2003-01-24 | 2011-05-20 | 이데미쓰 고산 가부시키가이샤 | 유기 전기발광 소자 |
| EP1672961B1 (en) | 2003-07-31 | 2014-12-03 | Mitsubishi Chemical Corporation | Compound, charge transport material and organic electroluminescent device |
| JP2005123164A (ja) * | 2003-09-24 | 2005-05-12 | Fuji Photo Film Co Ltd | 発光素子 |
| US7175922B2 (en) * | 2003-10-22 | 2007-02-13 | Eastman Kodak Company | Aggregate organic light emitting diode devices with improved operational stability |
| US20060004197A1 (en) * | 2004-07-02 | 2006-01-05 | Thomas Thrash | Sulfonamide-based compounds as protein tyrosine kinase inhibitors |
| GB0510390D0 (en) | 2005-05-20 | 2005-06-29 | Novartis Ag | Organic compounds |
| WO2006136553A1 (en) | 2005-06-23 | 2006-12-28 | Janssen Pharmaceutica N.V. | Imidazolinone and hydantoine derivatives as novel inhibitors of histone deacetylase |
-
2006
- 2006-11-22 US US12/095,024 patent/US8022617B2/en active Active
- 2006-11-22 EP EP06833152A patent/EP1956008B1/en active Active
- 2006-11-22 WO PCT/JP2006/323330 patent/WO2007063760A1/ja active Application Filing
- 2006-11-22 CN CNA2006800380112A patent/CN101287713A/zh active Pending
- 2006-11-22 KR KR1020087009361A patent/KR101395615B1/ko active IP Right Grant
- 2006-11-30 TW TW095144358A patent/TWI388549B/zh active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5276049A (en) * | 1991-03-12 | 1994-01-04 | Dr. Karl Thomae Gmbh | Cyclic urea derivatives, pharmaceutical compositions containing these compounds and methods of using the same |
| US5861420A (en) * | 1991-04-05 | 1999-01-19 | G. D. Searle & Co. | N-arylheteroarylalkyl imidazol-2-one compounds for treatment of circulatory disorders |
| JPH09183769A (ja) * | 1995-02-17 | 1997-07-15 | Takeda Chem Ind Ltd | アゾール化合物およびその用途 |
| WO2004011438A1 (de) * | 2002-07-25 | 2004-02-05 | Aventis Pharma Deutschland Gmbh | Diarylsubstituierte cyclische harnstoffderivate mit mch-modulatorischer wirkung |
Also Published As
| Publication number | Publication date |
|---|---|
| US8022617B2 (en) | 2011-09-20 |
| EP1956008B1 (en) | 2012-03-28 |
| US20090284134A1 (en) | 2009-11-19 |
| CN101287713A (zh) | 2008-10-15 |
| WO2007063760A1 (ja) | 2007-06-07 |
| TWI388549B (zh) | 2013-03-11 |
| TW200736230A (en) | 2007-10-01 |
| EP1956008A4 (en) | 2010-12-01 |
| EP1956008A1 (en) | 2008-08-13 |
| KR20080074103A (ko) | 2008-08-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101395615B1 (ko) | 유기 화합물, 전하 수송 재료, 전하 수송 재료용 조성물 및유기 전계 발광 소자 | |
| KR101693138B1 (ko) | 유기 디바이스용 조성물, 고분자막 및 유기 전계 발광 소자 | |
| US9705091B2 (en) | Aromatic heterocycle derivative and organic electroluminescent element using same | |
| JP5168840B2 (ja) | 電荷輸送材料、有機電界発光素子用組成物及び有機電界発光素子 | |
| JP5499487B2 (ja) | キノリン系化合物、有機電界発光素子用材料、有機電界発光素子用組成物、有機電界発光素子、有機elディスプレイおよび有機el照明 | |
| KR101309502B1 (ko) | 탄화수소 화합물, 전하 수송 재료, 전하 수송 재료 조성물및 유기 전계 발광 소자 | |
| KR102055545B1 (ko) | 모노아민 화합물, 전하 수송 재료, 전하 수송막용 조성물, 유기 전계 발광 소자, 유기 el 표시 장치 및 유기 el 조명 | |
| JP5664128B2 (ja) | ピリミジン化合物、有機電界発光素子用材料、有機電界発光素子用組成物、有機電界発光素子、照明装置及び表示装置 | |
| JPWO2014024889A1 (ja) | イリジウム錯体化合物、並びに該化合物を含む組成物、有機電界発光素子、表示装置及び照明装置 | |
| CN112789273A (zh) | 新型化合物及包含其的有机发光器件 | |
| CN107257787B (zh) | 杂环化合物和包含其的有机发光元件 | |
| US11404652B2 (en) | Iridium complex compound, composition containing the compound and solvent, organic electroluminescent element containing the compound, display device, and illumination device | |
| CN114503297A (zh) | 第一和第二有机半导体层以及包括所述第一和第二有机半导体层的有机电子器件 | |
| JP5028934B2 (ja) | 炭化水素化合物、電荷輸送材料、電荷輸送材料組成物および有機電界発光素子 | |
| JP2008115131A (ja) | 有機化合物、電荷輸送材料、電荷輸送材料用組成物および有機電界発光素子 | |
| JP2008031068A (ja) | 有機化合物、電荷輸送材料、電荷輸送材料組成物および有機電界発光素子 | |
| CN114375506A (zh) | 有机薄膜和有机薄膜的制造方法、有机电致发光元件、显示装置、照明装置、有机薄膜太阳能电池、光电转换元件、薄膜晶体管、涂料组合物、有机电致发光元件用材料 | |
| WO2022250044A1 (ja) | イリジウム錯体化合物、イリジウム錯体化合物含有組成物及び有機電界発光素子とその製造方法 | |
| JP5685882B2 (ja) | 電荷輸送材料、電荷輸送膜用組成物、有機電界発光素子、有機電界発光素子表示装置及び有機電界発光素子照明装置 | |
| JP5250967B2 (ja) | 有機化合物、電荷輸送材料、電荷輸送材料用組成物および有機電界発光素子 | |
| CN111699178A (zh) | 化合物及包含其的有机发光器件 | |
| JP7206611B2 (ja) | 有機電界発光素子の発光層用組成物、有機電界発光素子、表示装置及び照明 | |
| CN112771036A (zh) | 新型化合物及包含其的有机发光器件 | |
| JP2021127325A (ja) | 芳香族ジアミン誘導体 | |
| CN114364678A (zh) | 化合物及包含其的有机发光器件 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20170420 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20180417 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20190417 Year of fee payment: 6 |