KR101229314B1 - 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물 - Google Patents
광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물 Download PDFInfo
- Publication number
- KR101229314B1 KR101229314B1 KR1020110010654A KR20110010654A KR101229314B1 KR 101229314 B1 KR101229314 B1 KR 101229314B1 KR 1020110010654 A KR1020110010654 A KR 1020110010654A KR 20110010654 A KR20110010654 A KR 20110010654A KR 101229314 B1 KR101229314 B1 KR 101229314B1
- Authority
- KR
- South Korea
- Prior art keywords
- group
- formula
- integer
- photoacid generator
- independently
- Prior art date
Links
- 0 *=*(c1ccccc1)c1ccccc1O Chemical compound *=*(c1ccccc1)c1ccccc1O 0.000 description 3
- CBFWPJWCAHWBKC-UHFFFAOYSA-N CCC(CC1C)C2C1C1CC2CC1 Chemical compound CCC(CC1C)C2C1C1CC2CC1 CBFWPJWCAHWBKC-UHFFFAOYSA-N 0.000 description 1
- LLEMOWNGBBNAJR-UHFFFAOYSA-N Oc1ccccc1-c1ccccc1 Chemical compound Oc1ccccc1-c1ccccc1 LLEMOWNGBBNAJR-UHFFFAOYSA-N 0.000 description 1
- INRCUHBLICDYBX-UHFFFAOYSA-N c1cc(cc2)c3c4c2[I]=CC=C4C=Cc3c1 Chemical compound c1cc(cc2)c3c4c2[I]=CC=C4C=Cc3c1 INRCUHBLICDYBX-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/02—Sulfonic acids having sulfo groups bound to acyclic carbon atoms
- C07C309/03—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton
- C07C309/07—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing oxygen atoms bound to the carbon skeleton
- C07C309/09—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing oxygen atoms bound to the carbon skeleton containing etherified hydroxy groups bound to the carbon skeleton
- C07C309/10—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing oxygen atoms bound to the carbon skeleton containing etherified hydroxy groups bound to the carbon skeleton with the oxygen atom of at least one of the etherified hydroxy groups further bound to an acyclic carbon atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C303/00—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides
- C07C303/32—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of salts of sulfonic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C381/00—Compounds containing carbon and sulfur and having functional groups not covered by groups C07C301/00 - C07C337/00
- C07C381/12—Sulfonium compounds
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/0045—Photosensitive materials with organic non-macromolecular light-sensitive compounds not otherwise provided for, e.g. dissolution inhibitors
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/0046—Photosensitive materials with perfluoro compounds, e.g. for dry lithography
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/0047—Photosensitive materials characterised by additives for obtaining a metallic or ceramic pattern, e.g. by firing
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/039—Macromolecular compounds which are photodegradable, e.g. positive electron resists
- G03F7/0392—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition
- G03F7/0395—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition the macromolecular compound having a backbone with alicyclic moieties
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/039—Macromolecular compounds which are photodegradable, e.g. positive electron resists
- G03F7/0392—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition
- G03F7/0397—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition the macromolecular compound having an alicyclic moiety in a side chain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/06—Systems containing only non-condensed rings with a five-membered ring
- C07C2601/08—Systems containing only non-condensed rings with a five-membered ring the ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2602/00—Systems containing two condensed rings
- C07C2602/36—Systems containing two condensed rings the rings having more than two atoms in common
- C07C2602/42—Systems containing two condensed rings the rings having more than two atoms in common the bicyclo ring system containing seven carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/56—Ring systems containing bridged rings
- C07C2603/58—Ring systems containing bridged rings containing three rings
- C07C2603/70—Ring systems containing bridged rings containing three rings containing only six-membered rings
- C07C2603/74—Adamantanes
Abstract
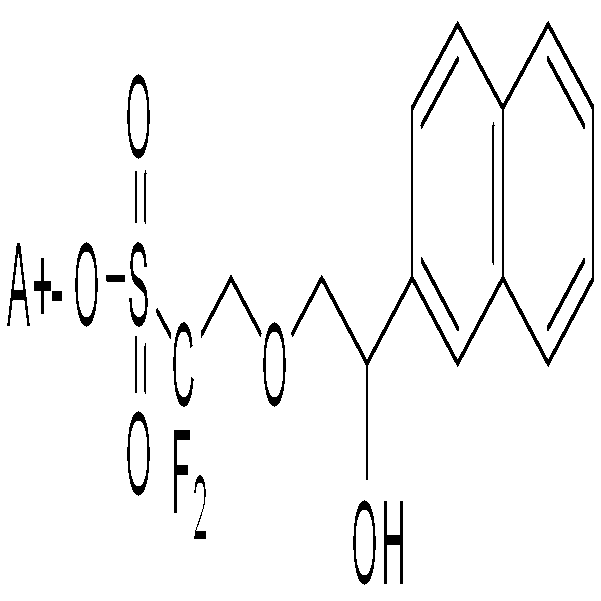
본 발명은 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물에 대한 것으로서, 상기 광산발생제는 하기 화학식 1로 표시된다.
[화학식 1]
상기 화학식 1에서, 상기 Y, X, R1, R2, n1, n2 및 A+의 정의는 상세한 설명에 기재한 것과 같다. 상기 광산발생제는 ArF 액침 노광시 적절한 접촉각을 유지할 수 있어 액침 노광시 발생되는 결함을 줄일 수 있고, 레지스트 용제에 대한 용해성 및 수지와의 상용성이 우수하다. 또한, 상기 광산발생제는 공업적으로 입수가 용이한 에폭시 화합물을 이용하여 효율적이면서도 간단한 방법으로 제조할 수 있다.
[화학식 1]
상기 화학식 1에서, 상기 Y, X, R1, R2, n1, n2 및 A+의 정의는 상세한 설명에 기재한 것과 같다. 상기 광산발생제는 ArF 액침 노광시 적절한 접촉각을 유지할 수 있어 액침 노광시 발생되는 결함을 줄일 수 있고, 레지스트 용제에 대한 용해성 및 수지와의 상용성이 우수하다. 또한, 상기 광산발생제는 공업적으로 입수가 용이한 에폭시 화합물을 이용하여 효율적이면서도 간단한 방법으로 제조할 수 있다.
Description
본 발명은 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물에 대한 것으로서, 보다 상세하게는 ArF 액침 노광시 적절한 접촉각을 유지할 수 있어 액침 노광시 발생되는 결함을 줄일 수 있고, 레지스트 용제에 대한 용해성 및 수지와의 상용성이 우수하며, 공업적으로 입수가 용이한 에폭시 화합물을 이용하여 효율적이면서도 간단한 방법으로 제조할 수 있는 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물에 관한 것이다.
리소그래피 공정을 포함하는 반도체 미세 가공에 사용되는 화학 증폭형 포지티브 레지스트 조성물은 빛의 조사에 의해 산을 발생시키는 화합물을 포함하는 산발생제(acid generator)를 함유한다.
상기 산발생제는 반도체 패터닝 공정상에서 사용되는 광에 대하여 빛을 흡수한다. 상기 산발생제로 주로 사용되는 오늄 염은 양이온 쪽이 라디칼 형태로 분해(degradation)되어 다른 형태의 분자로 존재하게 되며, 음이온 쪽은 산을 발생하여 조사후 웨이퍼의 베이킹시에 레지스트 필름상에서 확산이 일어나게 된다.
이러한 과정에서 산발생제는 빛을 흡수하는 능력, 빛의 흡수에 따라 발생시키는 산의 발생효율, 음이온에서 발생한 산의 확산능력, 음이온의 산의 강도등과 같은 여러가지 요인에 의해서 레지스트의 해상도와 라인에지조도 등에 직접적인 영향을 미치게 된다.
또한, 우수한 평활성을 얻기 위해서도, 이러한 화학증폭형 레지스트 재료에 사용되는 산발생제는 레지스트 조성물 내에서 균일하게 분산되어 있을 필요가 있다. 따라서 광산발생제의 레지스트 용제에 대한 용해성 및 수지와의 상용성은 매우 중요하다. 그러나, 종래의 광산발생제는 레지스트 용제에 대한 용해성 및 수지와의 상용성이 우수하지 못하고, 저렴하게 제조하는 것이 어렵다.
본 발명의 목적은 ArF 액침 노광시 적절한 접촉각을 유지할 수 있어 액침 노광시 발생되는 결함을 줄일 수 있고, 레지스트 용제에 대한 용해성 및 수지와의 상용성이 우수한 광산발생제를 제공하는 것이다.
본 발명의 다른 목적은 상기 광산발생제의 제조 방법을 제공하는 것이다.
본 발명의 또 다른 목적은 상기 광산발생제를 포함하는 레지스트 조성물을 제공하는 것이다.
본 발명의 일 실시예에 따른 광산발생제는 하기 화학식 1로 표시된다.
[화학식 1]
(상기 화학식 1에서, 상기 Y는 알킬기, 알케닐기, 알콕시기, 시클로알킬기, 헤테로시클로알킬기, 아릴기 및 헤테로아릴기로 이루어진 군에서 선택되는 어느 하나이고, 상기 X는 알칸디일, 알켄디일, NR', S, O, CO 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이고, 상기 R'는 수소기 및 알킬기로 이루어진 군에서 선택된 어느 하나이고, 상기 R1 및 R2는 각각 독립적으로 수소기, 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐기, 하이드록시기, 카르복시기, 시아노기, 니트로기, 아미노기 및 티오기로 이루어진 군에서 선택된 어느 하나이고, 상기 n1은 1 내지 2의 정수이며, 상기 n2는 0 내지 5의 정수이며, 상기 A+는 유기짝이온이다)
상기 Y는 알킬기, 알케닐기, 알콕시기, 시클로펜틸기, 시클로헥실기, 데카하이드로나프탈렌기, 옥타하이드로-1H-인덴기, 아다만틸기, 노보닐기, 테트라하이드로퓨란, 탄소수 10 내지 30의 노보닐기를 포함하는 다환식 시클로알킬기, 페닐기, 나프틸기, 바이페닐기, 안트릴기, 펜안트렌기, 플루오레닐기, 피렌기, 페날렌기, 인덴기, 바이페닐렌기, 다이페닐메틸기, 테트라하이드로나프틸기, 다이하이드로안트릴기, 테트라페닐메틸기 및 트리페닐메틸기로 이루어진 군에서 선택된 어느 하나일 수 있다.
상기 Y는 알킬기, 알케닐기, 알콕시기, 하기 화학식 1-a 내지 1-i 및 화학식 2-a 내지 2-l로 이루어진 군에서 선택되는 어느 하나일 수 있다.
[화학식 1-a] [화학식 1-b] [화학식 1-c]
[화학식 1-d] [화학식 1-e] [화학식 1-f]
[화학식 1-g] [화학식 1-h] [화학식 1-i]
(상기 화학식 1-a 내지 1-i에서, 상기 R11 및 R12은 각각 독립적으로 수소, 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐 원자, 하이드록시기, 카르복시기, 시아노기, 니트로기, 아미노기, 티오기, 메틸티오기, 메톡시기, OR', COR', COOR', O 및 S로 이루어진 군에서 선택된 어느 하나이고, 상기 R'는 알킬기 및 아릴기로 이루어진 군에서 선택된 어느 하나이고, 상기 R21은 CR24R25, O, CO, S 및 NR23로 이루어진 군에서 선택된 어느 하나이고, 상기 R23 내지 R25는 각각 독립적으로 수소, 알킬기 및 아릴기로 이루어진 군에서 선택되는 어느 하나이고, 상기 a, c 및 d는 각각 독립적으로 0 내지 9의 정수이고, 상기 b는 0 내지 11의 정수이고, 상기 e는 0 내지 15의 정수이고, 상기 f는 0 내지 7의 정수이고, 0≤c+d≤17이고, 0≤c+f≤15이다)
[화학식 2-a] [화학식 2-b] [화학식 2-c]
[화학식 2-d] [화학식 2-e] [화학식 2-f]
[화학식 2-g] [화학식 2-h] [화학식 2-i]
[화학식 2-j] [화학식 2-k] [화학식 2-l]
(상기 화학식 2-a 내지 2-l에서, 상기 R11, R12, R13 및 R14는 각각 독립적으로 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐 원자, 하이드록시기, 시아노기, 니트로기, 아미노기 및 티오기로 이루어진 군에서 선택된 어느 하나이고, 상기 R21 및 R22는 각각 독립적으로 CR24R25, O, CO, S 및 NR23로 이루어진 군에서 선택된 어느 하나이고, 상기 R23 내지 R25는 각각 독립적으로 수소, 알킬기 및 아릴기로 이루어진 군에서 선택되는 어느 하나이고, 상기 a, h 및 i는 각각 독립적으로 0 내지 5의 정수이고, 상기 b는 0 내지 3의 정수이고, 상기 c 및 d는 각각 독립적으로 0 내지 4의 정수이고, 상기 e, f 및 g는 각각 독립적으로 0 내지 2의 정수이고, 0≤c+d+e≤9이다)
상기 광산발생제는 하기 화학식 3-1 내지 3-12로 이루어진 군에서 선택되는 어느 하나일 수 있다.
[화학식 3-1] [화학식 3-2]
[화학식 3-3] [화학식 3-4]
[화학식 3-5] [화학식 3-6]
[화학식 3-7] [화학식 3-8]
[화학식 3-9] [화학식 3-10]
[화학식 3-11] [화학식 3-12]
본 발명의 다른 일 실시예에 따른 광산발생제의 제조 방법은 하이드록시 술폰산염과 옥시란을 반응시켜 하이드록시 에톡시 술폰산염을 제조하는 제1 단계, 그리고 상기 제조된 하이드록시 에톡시 술폰산염의 양이온을 치환 반응시켜 상기 화학식 1로 표시되는 화합물을 제조하는 제2 단계를 포함한다.
상기 하이드록시 술폰산염은 하기 화학식 6으로 표시되고, 상기 옥시란은 하기 화학식 7로 표시되고, 상기 하이드록시 에톡시 술폰산염은 하기 화학식 8로 표시될 수 있다.
[화학식 6]
[화학식 7]
[화학식 8]
(상기 화학식 6 내지 8에서, 상기 Y는 알킬기, 알케닐기, 알콕시기, 시클로알킬기, 헤테로시클로알킬기, 아릴기 및 헤테로아릴기로 이루어진 군에서 선택되는 어느 하나이고, 상기 X는 알칸디일, 알켄디일, NR', S, O, CO 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이고, 상기 R'는 수소기 및 알킬기로 이루어진 군에서 선택된 어느 하나이고, 상기 R1 및 R2는 각각 독립적으로 수소기, 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐기, 하이드록시기, 카르복시기, 시아노기, 니트로기, 아미노기 및 티오기로 이루어진 군에서 선택된 어느 하나이고, 상기 n1은 1 내지 5의 정수이며, 상기 n2는 0 내지 5의 정수이며, 상기 M+는 알칼리금속 이온이다)
상기 제1 단계는 상기 하이드록시 술폰산염과 상기 옥시란을 산성 촉매 하에서 반응시킬 수 있다.
상기 제1 단계는 상기 하이드록시 술폰산염과 상기 옥시란을 혼합한 후, 0 내지 100℃에서 1 내지 48 시간 동안 교반하여 반응시킬 수 있다.
본 발명의 또 다른 일 실시예에 따른 레지스트 조성물은 상기 광산발생제를 포함한다.
본 명세서에서 사용되는 용어의 정의는 하기와 같다.
본 명세서에서 특별한 언급이 없는 한 할로겐기는 플루오르, 염소, 브롬 및 요오드로 이루어진 군에서 선택된 어느 하나를 의미한다.
본 명세서에서 특별한 언급이 없는 한 알킬기는 1차 알킬기, 2차 알킬기 및 3차 알킬기를 포함한다.
본 명세서에서 특별한 언급이 없는 한 알칸디일(alkanediyl)은 알칸(alkane)에서 수소 원자 두 개를 뺀 2가의 원자단이며, 일반식 -CnH2n-으로 표시될 수 있고, 알켄디일(alkenediyl)은 알켄(alkene)에서 수소 원자 두 개를 뺀 2가의 원자단이며, 일반식 -CnHn-으로 표시될 수 있다.
본 명세서에서 특별한 언급이 없는 한 퍼플루오로알킬기는 일부의 수소 원자 또는 전체 수소 원자가 플루오르로 치환된 알킬기를 의미하고, 퍼플루오로알콕시기는 일부의 수소 원자 또는 전체 수소 원자가 플루오르로 치환된 알콕시기를 의미한다.
본 명세서에서 특별한 언급이 없는 한 모든 화합물 또는 치환기는 치환되거나 비치환된 것일 수 있다. 여기서, 치환된이란 수소가 할로겐기, 하이드록시기, 카르복시기, 시아노기, 니트로기, 아미노기, 티오기, 메틸티오기, 알콕시기, 나이트릴기, 알데하이드기, 에폭시기, 에테르기, 에스테르기, 카르보닐기, 아세탈기, 케톤기, 알킬기, 퍼플루오로알킬기, 시클로알킬기, 헤테로시클로알킬기, 알릴기, 벤질기, 아릴기, 헤테로아릴기, 이들의 유도체 및 이들의 조합으로 이루어진 군에서 선택되는 어느 하나로 대체된 것을 의미한다.
본 명세서에서 특별한 언급이 없는 한 접두어 헤테로는 N, O, S, P 및 CO로 이루어진 군에서 선택되는 1 내지 3개의 헤테로 원자가 탄소 원자를 치환하고 있는 것을 의미한다.
본 명세서에서 특별한 언급이 없는 한 알킬기는 직쇄 또는 분쇄의 탄소수 1 내지 10인 알킬기, 알칸디일은 탄소수 1 내지 10인 알칸디일, 알켄디일은 탄소수 2 내지 10인 알켄디일, 알콕시기는 탄소수 1 내지 10의 알콕시기, 퍼플루오로알킬기는 탄소수 1 내지 10의 퍼플루오로알킬기, 퍼플루오로알콕시기는 탄소수 1 내지 10의 퍼플루오로알콕시기, 시클로알킬기는 탄소수 3 내지 32인 시클로알킬기, 헤테로시클로알킬기는 탄소수 2 내지 32인 헤테로시클로알킬기, 아릴기는 탄소수 6 내지 30인 아릴기, 헤테로아릴기는 탄소수 2 내지 30인 헤테로아릴기를 의미한다.
이하, 본 발명을 보다 상세하게 설명한다.
상기 광산발생제는 하기 화학식 1로 표시된다.
[화학식 1]
상기 화학식 1에서, 상기 R1 및 R2는 각각 독립적으로 수소기, 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐기, 하이드록시기, 카르복시기, 시아노기, 니트로기, 아미노기 및 티오기로 이루어진 군에서 선택된 어느 하나이고, 바람직하게 수소기 또는 알킬기일 수 있다.
상기 n1은 1 내지 2의 정수이며, 상기 n2는 0 내지 5의 정수이며, 바람직하게는 0 내지 3의 정수일 수 있다.
상기 X는 알칸디일, 알켄디일, NR', S, O, CO 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이고, 상기 R'는 수소기 및 알킬기로 이루어진 군에서 선택된 어느 하나이다.
상기 X는 구체적으로 -O-, -OCH2-, -OCH(Cl)-, -CO-, -COCH2-, -COCH2CH2-, -CH2-, -CH2CH2-, -CH2-O-, -CH2-O-CH2-, -CH2CH2-O-, -CH2-O-CH2CH2-, -CH2CH2-O-CH2-, -CH2CH2CH2-O-, -CH2-O-CH2CH2CH2-, -CH2CH2-O-CH2CH2-, -CH2CH2CH2-O-CH2-, -CH(CH3)-, -C(CH3)2CH2-, -CH(CH3)CH2-, -CH(CH2CH3)-, -CH(OCH3)-, -C(CF3)(OCH3)-, -CH2-S-, -CH2-S-CH2-, -CH2CH2-S-, -CH2-S-CH2CH2-, -CH2CH2-S-CH2-, -CH2CH2CH2-S-, -CH2-S-CH2CH2CH2-, -CH2CH2-S-CH2CH2-, -CH2CH2CH2-S-CH2-, -CH(CH2)CH-, -C(CH2CH2)-, -CH2CO-, -CH2CH2CO-, -CH(CH3)CH2CO-, -CH(OH)-, -C(OH)(CH3)-, -CH(F)-, -CH(Br)-, -CH(Br)CH(Br)-, -CH=CH-, -CH2CH=CH-, -CH=CHCH2-, -CH=CH-O-, -CH=CH-S- 및 -CH=CHCO-으로 이루어진 군에서 선택된 어느 하나인 것일 수 있다.
상기 Y는 알킬기, 알케닐기, 알콕시기, 시클로알킬기, 헤테로시클로알킬기, 아릴기 및 헤테로아릴기로 이루어진 군에서 선택되는 어느 하나일 수 있다. 구체적으로, 상기 Y는 알킬기, 알케닐기, 알콕시기, 시클로펜틸기, 시클로헥실기, 데카하이드로나프탈렌기, 옥타하이드로-1H-인덴기, 아다만틸기, 노보닐기, 테트라하이드로퓨란, 탄소수 10 내지 30의 노보닐기를 포함하는 다환식 시클로알킬기, 페닐기, 나프틸기, 바이페닐기, 안트릴기, 펜안트렌기, 플루오레닐기, 피렌기, 페날렌기, 인덴기, 바이페닐렌기, 다이페닐메틸기, 테트라하이드로나프틸기, 다이하이드로안트릴기, 테트라페닐메틸기 및 트리페닐메틸기로 이루어진 군에서 선택된 어느 하나일 수 있다.
상기 Y의 탄소 중에서 1 내지 3개의 탄소는 -O-, -CO-, -S- 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나로 치환될 수도 있고, 상기 Y의 수소 중에서 1 내지 5개의 수소는 탄소수 1 내지 6의 알킬기, 탄소수 1 내지 6의 알콕시기, 탄소수 1 내지 4의 퍼플루오로알킬기, 탄소수 1 내지 4의 퍼플루오로알콕시기, 탄소수 1 내지 6의 하이드록시알킬기, 할로겐 원자, 하이드록시기, 시아노기, 니트로기, 아미노기, 티오기, 메틸티오기, 메톡시기, OR', COR', COOR', O 및 S로 이루어진 군에서 선택된 어느 하나로 치환된 것일 수도 있다. 상기 R'는 알킬기 및 아릴기로 이루어진 군에서 선택된 어느 하나이다.
보다 구체적으로, 상기 Y는 알킬기, 알케닐기, 알콕시기, 하기 화학식 1-a 내지 1-i 및 화학식 2-a 내지 2-l로 이루어진 군에서 선택되는 어느 하나일 수 있다.
[화학식 1-a] [화학식 1-b] [화학식 1-c]
[화학식 1-d] [화학식 1-e] [화학식 1-f]
[화학식 1-g] [화학식 1-h] [화학식 1-i]
상기 화학식 1-a 내지 1-i에서, 상기 R11 및 R12은 각각 독립적으로 수소, 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐 원자, 하이드록시기, 카르복시기, 시아노기, 니트로기, 아미노기, 티오기, 메틸티오기, 메톡시기, OR', COR', COOR', O 및 S로 이루어진 군에서 선택된 어느 하나이고, 상기 R'는 알킬기 및 아릴기로 이루어진 군에서 선택된 어느 하나이다. 상기 R11 또는 R12가 O 또는 S인 경우 상기 R11 또는 R12는 이중결합을 가지는 치환기이다.
상기 R21은 CR24R25, O, CO, S 및 NR23로 이루어진 군에서 선택된 어느 하나이고, 상기 R23 내지 R25는 각각 독립적으로 수소, 알킬기 및 아릴기로 이루어진 군에서 선택되는 어느 하나이다.
또한, 상기 a, c 및 d는 각각 독립적으로 0 내지 9의 정수이고, 상기 b는 0 내지 11의 정수이고, 상기 e는 0 내지 15의 정수이고, 상기 f는 0 내지 7의 정수이고, 0≤c+d≤17이고, 0≤c+f≤15이다.
구체적으로, 상기 화학식 1-a, 1-b, 1-d 및 1-g에서, 상기 R11은 수소, 탄소수 1 내지 6의 알킬기, 탄소수 1 내지 6의 알콕시기, 탄소수 1 내지 4의 퍼플루오로알킬기, 탄소수 1 내지 4의 퍼플루오로알콕시기, 탄소수 1 내지 6의 하이드록시알킬기, 할로겐 원자, 하이드록시기, 시아노기, 니트로기, 아미노기, 티오기, 메틸티오기 및 메톡시기로 이루어진 군에서 선택된 어느 하나일 수 있다.
또한, 상기 화학식 1-c, 1-e, 1-f, 1-h 및 1-i에서, 상기 R11 및 R12은 각각 독립적으로 수소, 탄소수 1 내지 6의 알킬기, 탄소수 1 내지 6의 알콕시기, 탄소수 1 내지 4의 퍼플루오로알킬기, 탄소수 1 내지 4의 퍼플루오로알콕시기, 탄소수 1 내지 6의 하이드록시알킬기, 할로겐 원자, 하이드록시기, 시아노기, 니트로기, 아미노기, 티오기, 메틸티오기, 메톡시기 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나일 수 있다.
[화학식 2-a] [화학식 2-b] [화학식 2-c]
[화학식 2-d] [화학식 2-e] [화학식 2-f]
[화학식 2-g] [화학식 2-h] [화학식 2-i]
[화학식 2-j] [화학식 2-k] [화학식 2-l]
상기 화학식 2-a 내지 2-l에서, 상기 R11, R12, R13 및 R14는 각각 독립적으로 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐 원자, 하이드록시기, 시아노기, 니트로기, 아미노기, 티오기, 메틸티오기, 메톡시기, OR, COR' 및 COOR'로 이루어진 군에서 선택된 어느 하나이고, 상기 R'는 알킬기 및 아릴기로 이루어진 군에서 선택된 어느 하나이다.
상기 R21 및 R22는 각각 독립적으로 CR24R25, O, CO, S 및 NR23로 이루어진 군에서 선택된 어느 하나이고, 상기 R23 내지 R25는 각각 독립적으로 수소, 알킬기 및 아릴기로 이루어진 군에서 선택되는 어느 하나이다.
상기 a, h 및 i는 각각 독립적으로 0 내지 5의 정수이고, 상기 b는 0 내지 3의 정수이고, 상기 c 및 d는 각각 독립적으로 0 내지 4의 정수이고, 상기 e, f 및 g는 각각 독립적으로 0 내지 2의 정수이고, 0≤c+d+e≤9이다.
구체적으로, 상기 광산발생제는 하기 화학식 3-1 내지 3-12로 이루어진 군에서 선택되는 어느 하나일 수 있다.
[화학식 3-1] [화학식 3-2]
[화학식 3-3] [화학식 3-4]
[화학식 3-5] [화학식 3-6]
[화학식 3-7] [화학식 3-8]
[화학식 3-9] [화학식 3-10]
[화학식 3-11] [화학식 3-12]
상기 광산발생제는 하이드록시 골격을 가지는 설포네이트 오늄염으로 대표되는 화합물로서, 이러한 화합물도 화학 증폭형 레지스트 재료용 광산발생제로서 효과적으로 작용할 수 있다. 또한, 상기 광산발생제는 ArF 액침 노광시 적절한 접촉각을 유지할 수 있어 액침 노광시 발생되는 결함을 줄일 수 있고, 레지스트 용제에 대한 용해성 및 수지와의 상용성이 우수하다.
또한, 상기 광산발생제는 활성 방사선, 특히 KrF 엑시머 레이저, ArF 엑시머 레이저 또는 EUV로 대표되는 원자외선이나 전자선 등에 감응(感應)하는 감방사선성 산발생제로서, 양호한 연소성을 나타내고, 인체 축적성에도 문제가 없으며, 발생하는 산(광 발생 산)의 산성도가 충분히 높고, 발생하는 산이 적절한 비점을 가질 뿐 아니라, 레지스트 피막 중에서의 확산길이가 적절히 짧아지며, 더 나아가서는 레지스트 용제에 대한 용해성 및 수지와의 상용성이 우수하고, 또한 저렴한 방법으로 용이하게 제조하는 것이 가능하다.
상기 화학식 1에서, 상기 A+는 유기짝이온으로서 본 발명에서 그 종류가 특별히 한정되지 않는다. 다만, 상기 유기짝이온으로 사용할 수 있는 것으로는 하기 화학식 4a 및 4b로 이루어진 군에서 선택된 어느 하나를 예로 들 수 있다.
[화학식 4a]
[화학식 4b]
상기 화학식 4a 및 4b에서, 상기 R1 및 R2는 각각 독립적으로 수소, 알킬기, 알릴기, 퍼플루오로알킬기, 아릴기 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이고, 상기 R1 및 R2는 서로 결합하여 탄소수 3 내지 30의 포화 또는 불포화 탄화수소 고리를 형성할 수 있다.
상기 R4는 할로겐 원자, 알킬기, 알콕시기, 아릴기, 티오알콕시기, 알콕시카르보닐메톡시기, 티오페녹시기 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이다.
상기 R3 및 R5는 각각 독립적으로 수소, 알킬기, 알릴기, 퍼플루오로알킬기, 아릴기 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이다.
상기 화학식 4a 및 4b에서, 상기 알킬기로는 메틸기, 에틸기, 프로필기, 이소프로필기, n-부틸기, 페닐기, 헥실기, 옥틸기 등을 예로들 수 있고, 상기 알콕시기로는 메톡시기, 에톡시기, 프로폭시기, 부톡시기, 헥실옥시기, 옥틸옥시기 등을 예로 들 수 있다.
상기 화학식 4a 또는 4b로 표시되는 유기짝이온은 하기 화학식 4-i 내지 4-xx으로 이루어진 군에서 선택된 어느 하나일 수 있다.
[화학식 4-i] [화학식 4-ii] [화학식 4-iii] [화학식 4-iv]
[화학식 4-v] [화학식 4-vi] [화학식 4-vii] [화학식 4-viii]
[화학식 4-ix] [화학식 4-x] [화학식 4-xi] [화학식 4-xii]
[화학식 4-xiii] [화학식 4-xiv] [화학식 4-xv] [화학식 4-xvi]
[화학식 4-xvii] [화학식 4-xviii] [화학식 4-xix] [화학식 4-xx]
또한, 상기 유기짝이온으로는 하기 화학식 5a 및 5b로 이루어진 군에서 선택된 어느 하나를 사용할 수 있다.
[화학식 5a]
[화학식 5b]
상기 화학식 5a 및 5b에서, 상기 R1은 수소, 알킬기, 알릴기, 퍼플루오로알킬기, 아릴기 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이다.
상기 R2 및 R3은 각각 독립적으로 수소, 알킬기, 알릴기, 퍼플루오로알킬기, 아릴기 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이다.
상기 R4는 할로겐 원자, 알킬기, 알콕시기, 아릴기, 티오알콕시기, 알콕시카르보닐메톡시기, 티오페녹시기 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나이다.
상기 화학식 5a 및 5b에서, 상기 알킬기로는 메틸기, 에틸기, 프로필기, 이소프로필기, n-부틸기, 페닐기, 헥실기, 옥틸기 등을 예로들 수 있고, 상기 알콕시기로는 메톡시기, 에톡시기, 프로폭시기, 부톡시기, 헥실옥시기, 옥틸옥시기 등을 예로 들 수 있다.
또한, 상기 화학식 5a 또는 5b로 표시되는 유기짝이온은 하기 화학식 5-i 내지 5-ix로 이루어진 군에서 선택된 어느 하나일 수 있다.
[화학식 5-i] [화학식 5-ii] [화학식 5-iii]
[화학식 5-iv] [화학식 5-v] [화학식 5-vi]
[화학식 5-vii] [화학식 5-viii] [화학식 5-ix]
상기 광산발생제의 제조 방법은 하이드록시 술폰산염과 옥시란을 반응시켜 하이드록시 에톡시 술폰산염을 제조하는 제1 단계, 그리고 상기 제조된 하이드록시 에톡시 술폰산염의 양이온을 치환 반응시켜 상기 화학식 1로 표시되는 화합물을 제조하는 제2 단계를 포함한다.
상기 제1 단계에서는 상기 하이드록시 술폰산염과 상기 옥시란을 반응시켜 하이드록시 에톡시 술폰산염을 제조한다. 상기 하이드록시 술폰산염은 하기 화학식 6으로 표시되고, 상기 옥시란은 하기 화학식 7로 표시되고, 상기 하이드록시 에톡시 술폰산염은 하기 화학식 8로 표시될 수 있다.
[화학식 6]
[화학식 7]
[화학식 8]
상기 화학식 6 내지 8에서, 상기 Y, X, R1, R2, n1, 및 n2에 대한 정의는 상기 화학식 1에서와 동일하므로 그 구체적인 기재는 생략한다.
다만, 상기 화학식 6 내지 8에서 상기 M+는 알칼리금속 이온으로서, 구체적으로, Li+, K+ 또는 Na+일 수 있고, 바람직하게 Na+일 수 있다.
상기 옥시란과 상기 하이드록시 술폰산염은 1:1 내지 1:3의 중량비로 반응시킬 수 있고, 바람직하게 1:1.1 내지 1:1.5의 중량비로 반응시킬 수 있다. 상기 중량비로 상기 옥시란과 하이드록시 술폰산염을 반응시킬 경우 두 가지 화합물을 모두 소진할 수 있어서 반응의 효율성을 높일 수 있다.
상기 제1 단계는 상기 하이드록시 술폰산염과 상기 옥시란을 산성 촉매 및 염기성 촉매로 이루어진 군에서 선택되는 어느 하나의 촉매 하에서 반응시킬 수 있으며, 상기 산성 촉매로는 황산, 염산, 인산, 질산, 루이스산(BF3, AlCl3 또는 FeCl3 등) 및 이들의 조합으로 이루어진 군에서 선택되는 어느 하나를 사용할 수 있고, 상기 염기성 촉매로는 NaH, KH, NaOMe, KOBut(potassium tert-butoxide), 유기염기(Et3N(Triethylamine), DIPEA(N,N-Diisopropylethylamine) 또는 DBU(1,8-Diazabicyclo[5.4.0]undec-7-ene) 등) 및 이들의 조합으로 이루어진 군에서 선택되는 어느 하나를 사용할 수 있다. 상기 제1 단계 반응에서 촉매를 사용하는 경우 최소한의 반응 시간으로 원하는 생성물을 획득할 수 있어서 반응의 수율을 높일 수 있다.
또한, 상기 하이드록시 술폰산염 및 상기 옥시란과 상기 촉매는 1:0.05 내지 1:2의 몰비로 반응시킬 수 있고, 바람직하게 1:0.1 내지 1:1의 몰비로 반응시킬 수 있다. 상기 하이드록시 술폰산염 및 상기 옥시란과 상기 촉매를 상기 몰비로 반응시키는 경우 반응 시간을 촉진시키고 잔류 촉매를 제거하는 것이 더욱 용이할 수 있다.
상기 제1 단계의 반응은 용매하에서 이루어질 수 있고, 상기 용매는 에스테르류, 에테르류, 락톤류, 케톤류, 아미드류, 알코올류 및 이들의 조합으로 이루어진 군에서 선택되는 어느 하나를 사용할 수 있으며, 바람직하게 상기 용매는 디클로로메탄, 클로로포름, 디클로로에탄, 아세트니트릴, 톨루엔, 메틸아세테이트, 에틸아세테이트 및 이들의 조합으로 이루어진 군에서 선택된 어느 하나일 수 있다.
상기 제1 단계 반응은 구체적으로, 상기 하이드록시 술폰산염과 상기 옥시란을 용매에 녹이고, 상기 촉매를 투입한 후, 교반하면서 반응시키는 과정을 포함할 수 있다.
상기 교반은 0 내지 100℃의 온도에서 1 내지 48 시간 동안 이루어질 수 있고, 바람직하게 0 내지 40℃의 온도에서 1 내지 12 시간 동안 이루어질 수 있다. 상기 온도와 시간의 범위에서 교반의 과정이 이루어지는 경우에 생성물의 수득률을 높일 수 있고 부 생성물의 형성을 최소화할 수 있다.
상기 반응이 종결된 반응액에서 용매를 제거하고, 에틸 에테르로 슬러리를 만들어 여과한 후, 에틸 에테르를 이용하여 세척하고 진공 건조하면 상기 하이드록시 에톡시 술폰산염을 제조할 수 있다.
상기 제2 단계에서는 상기 제조된 하이드록시 에톡시 술폰산염의 양이온을 치환 반응시켜 상기 화학식 1로 표시되는 화합물을 제조한다.
상기 하이드록시 에톡시 술폰산염에서 양이온을 치환시키는 반응은 상기 하이드록시 에톡시 술폰산염과 하기 화학식 9로 표시되는 화합물을 반응시켜 이루어질 수 있다.
[화학식 9]
A+Z-
상기 화학식 9에서, 상기 Z-는 (OSO2CF3)-, (OSO2C4F9)-, (OSO2C8F17)-, (N(CF3)2)-, (N(C2F5)2)-, (N(C4F9)2), (C(CF3)3)-, (C(C2F5)3)-, (C(C4F9)3)-, F-, Cl-, Br-, I-, BF4-, AsF6- 및 PF6- 으로 이루어진 군에서 선택된 어느 하나이다.
상기 A+는 유기짝이온으로, 상기 유기짝이온에 대한 정의는 상기 화학식 1에서와 동일하므로 그 구체적인 기재는 생략한다.
상기 하이드록시 에톡시 술폰산염과 상기 화학식 9로 표시되는 화합물은 1:1 내지 4:1 의 몰비로, 바람직하게 1:1 내지 2:1의 몰비로 사용될 수 있다. 상기 몰비로 사용되는 경우 반응 처리 시간을 최소화할 수 있으며 과도한 반응물의 사용으로 인한 부 반응을 억제할 수 있다.
상기 치환 반응은 재결정법이나 수득된 염을 잘 녹이는 용매(양용매)와 잘 녹이지 못하는 용매(빈용매)를 혼합하여 사용하여 고체화시켜 회수하는 방법을 사용할 수 있고, 용매로 추출하거나 농축 회수하는 방법도 사용할 수 있다.
바람직하게 디클로로메탄과 물에 녹여서 두개의 층을 형성한 후에 교반하여 치환반응이 일어나도록 할 수 있고, 이러한 두층 반응 방법을 사용하는 경우에는 생성물의 분리를 위한 추가의 방법이 필요하지 않다는 점에서 유리하다. 상기 교반은 2 내지 6시간 이루어질 수 있고, 2 내지 4시간 동안 이루어질 수도 있다. 상기 시간의 범위에서 반응이 이루어지는 경우 생성물의 수득률을 최대한 높일 수 있다는 효과가 있다.
상기 제조 방법을 통하여 상기 화학식1로 표시되는 화합물을 제조하는 경우 효율적이면서도 간단한 방법으로 상기 화학식1로 표시되는 화합물을 제조할 수 있으며, 공업적으로 입수가 용이한 에폭시 화합물을 이용하여 제조할 수 있다.
본 발명의 또 다른 일 실시예인 레지스트 조성물은 상기 화학식1로 표시되는 광산발생제를 포함한다. 상기 레지스트 조성물은 통상의 레지스트 조성물의 구성에 의하므로 그 구체적인 기재는 생략한다.
본 발명의 광산발생제는 ArF 액침 노광시 적절한 접촉각을 유지할 수 있어 액침 노광시 발생되는 결함을 줄일 수 있고, 레지스트 용제에 대한 용해성 및 수지와의 상용성이 우수하다. 또한, 상기 광산발생제는 공업적으로 입수가 용이한 에폭시 화합물을 이용하여 효율적이면서도 간단한 방법으로 제조할 수 있다.
이하, 본 발명이 속하는 기술 분야에서 통상의 지식을 가진 자가 용이하게 실시할 수 있도록 본 발명의 실시예에 대하여 상세히 설명한다. 그러나 본 발명은 여러 가지 상이한 형태로 구현될 수 있으며 여기에서 설명하는 실시예에 한정되지 않는다.
[광산발생제의 합성]
(합성예 1)
<제1 단계>
하기 반응식 1-1과 같이, 1,1-디플루오로-2-하이드록시 에탄 설포닉 산 나트륨 염(1,1-Difluoro-2-hydroxy-ethanesulfonic acid sodium salt) 20g과 2-아다만탄일 옥시란(2-Adamantan-1-yl-oxirane) 19.4g을 디클로로에탄 300ml에 녹이고, 상온에서 교반시켰다. 상기 혼합물에 황산 1ml를 상온에서 서서히 적가시킨 후 2시간 동안 교반시켰다.
반응종결 후 반응 용매를 제거하고 에틸 에테르에 슬러리를 만들어 여과하였다. 여과 후 증류수와 에틸 에테르를 사용하여 세척하여 주고, 진공 건조하여 2-(2-아다만탄-1-일-2-하이드록시-에톡시)-1,1-디플로우로에탄설포닉 산 나트륨 염(2-(2-Adamantan-1-yl-2-hydroxy-ethoxy)-1,1-difluoro-ethanesulfonic acid sodium salt)을 33.5g(수율 85%) 수득하였고, 그 구조를 1H-NMR에 의하여 확인하였다.
1H-NMR(디메틸설폭사이드-d6, 테트라메틸실란): (ppm) 1.11-1.64(m, 15H), 3.49-3.55 (m, 3H), 4.25(t, 2H)
[반응식 1-1]
<제2 단계>
하기 반응식 1-2에서와 같이, 상기 제1 단계에서 제조한 2-(2-아다만탄-1-일-2-하이드록시-에톡시)-1,1-디플로우로에탄설포닉 산 나트륨 염 10g과 디페닐 메틸페닐 설포늄 트리플루오로 메탄 설포네이트 염(dipenyl methylphenyl sulfonium trifluoro methane sulfonium salt) 10.5g을 디클로로메탄 100ml 및 물 100ml에 녹여 넣고, 격렬하게 3시간 동안 교반하여 두 층 반응을 시킨다.
교반이 끝나면 유기층을 취하여 19F NMR에 의하여 반응의 진행 정도를 확인하고, 반응이 종결되면 유기층을 모아 용매를 제거한 후, 양용매(good solvent)인 디클로로메탄과 빈용매(poor solvent)인 헥산을 사용하여 세척하고, 용매를 제거하고, 감압건조하여 2-(2-아다만탄-1-일-2-하이드록시-에톡시)-1,1-디플로우로에탄설포네이트 디페닐 플로오르페닐 설포늄 염(2-(2-Adamantan-1-yl-2-hydroxy-ethoxy)-1,1-difluoro-ethane-sulfonate diphenyl fluorophenyl sulfonium salt) 16g(수율 96%)을 수득하였고, 그 구조를 1H-NMR에 의하여 확인하였다.
1H-NMR(클로로포름-d3, 테트라메틸실란): (ppm) 1.11-1.64(m, 15H), 3.49-3.55(m, 3H), 4.25(t, 2H), 7.48(d, 2H), 7.65-7.76(m, 12H)
[반응식 1-2]
(합성예 2)
<제1 단계>
하기 반응식 2-1에서와 같이, 상기 합성예 1의 제1 단계에서 2-아다만탄일 옥시란 대신 2-페닐-옥시란(2-Phenyl-oxirane)을 사용한 것을 제외하고는 상기 합성예 1의 제1 단계와 동일하게 실시하여 1,1-디플루오로-2-(2-하이드록시-2-페닐-에톡시)-에탄설포닉 산 나트륨 염(1,1-Difluoro-2-(2-hydroxy-2-phenyl-ethoxy)-ethanesulfonic acid sodium salt)을 수득하였고, 그 구조를 1H-NMR에 의하여 확인하였다.
1H-NMR(디메틸설폭사이드-d6, 테트라메틸실란): (ppm) 3.86(dd, 2H), 4.26(t, 2H), 4.85(t, 1H), 7.18-7.23(m, 5H)
[반응식 2-1]
<제2 단계>
하기 반응식 2-2에서와 같이, 상기 제1 단계에서 제조한 1,1-디플루오로-2-(2-하이드록시-2-페닐-에톡시)-에탄설포닉 산 나트륨 염을 상기 합성예 1의 제2 단계와 동일하게 디페닐 메틸페닐 설포늄 트리플루오르 메탄 설포네이트 염과 반응시켜 1,1-디플루오로-2-(2-하이드록시-2-페닐-에톡시)-에탄설포네이트 디페닐 플로오르페닐 설포늄 염(1,1-Difluoro-2-(2-hydroxy-2-phenyl-ethoxy)-ethanesulfonate diphenyl fluorophenyl sulfonium salt)을 수득하였고, 그 구조를 1H-NMR에 의하여 확인하였다.
1H-NMR(클로로포름-d3, 테트라메틸실란): (ppm) 3.86(dd, 2H), 4.26(t, 2H), 4.85(t, 1H), 7.18-7.48(m, 7H), 7.65-7.76(m, 12H)
[반응식 2-2]
(합성예 3)
<제1 단계>
하기 반응식 3-1에서와 같이, 상기 합성예 1의 제1 단계에서 2-아다만탄일 옥시란 대신 2-헥실-옥시란(2-Hexyl-oxirane)을 사용한 것을 제외하고는 상기 합성예 1의 제1 단계와 동일하게 실시하여 1,1-디플루오로-2-(2-하이드록시-옥틸옥시)-에탄설포닉 산 나트륨 염(1,1-Difluoro-2-(2-hydroxy-octyloxy)-ethanesulfonic acid sodium salt)을 수득하였고, 그 구조를 1H-NMR에 의하여 확인하였다.
1H-NMR(디메틸설폭사이드-d6, 테트라메틸실란): (ppm) 0.95-1.45(m, 13H), 3.49-3.55(m, 3H), 4.25(t, 2H)
[반응식 3-1]
<2 단계>
하기 반응식 3-2에서와 같이, 상기 제1 단계에서 제조한 1,1-디플루오로-2-(2-하이드록시-옥틸옥시)-에탄설포닉 산 나트륨 염을 상기 합성예 1의 제2 단계와 동이랗게 디페닐 메틸페닐 설포늄 트리플루오르 메탄 설포네이트 염과 반응시켜 1-디플루오로-2-(2-하이드록시-옥틸옥시)-에탄설포네이트 디페닐 플로오르페닐 설포늄 염(1,1-Difluoro-2-(2-hydroxy-octyloxy)-ethanesulfonate diphenyl fluorophenyl sulfonium salt)을 수득하였고, 그 구조를 1H-NMR에 의하여 확인하였다.
1H-NMR(클로로포름-d3, 테트라메틸실란): (ppm) 10.95-1.45(m, 13H), 3.49-3.55(m, 3H), 4.25(t, 2H), 7.48(d, 2H), 7.65-7.76(m, 12H)
[반응식 3-2]
(합성예 4)
<제1 단계>
하기 반응식 4-1에서와 같이, 상기 합성예 1의 제1 단계에서 2-아다만탄일 옥시란 대신 2-아다만탄-1-일 메틸-옥시란(2-Adamantan-1-yl methyl-oxirane)을 사용한 것을 제외하고는 상기 합성예 1의 제1 단계와 동일하게 실시하여 2-(3-아다만탄-1-일-2-하이드록시-프로폭시)-1,1-디플로우로에탄설포닉 산 나트륨 염(2-(3-Adamantan-1-yl-2-hydroxy-propoxy)-1,1-difluoro-ethanesulfonic acid sodium salt)을 수득하였고, 그 구조를 1H-NMR에 의하여 확인하였다.
1H-NMR(디메틸설폭사이드-d6, 테트라메틸실란): (ppm) 1.17-1.58(m, 17H), 3.49-3.55 (m, 3H), 4.25(t, 2H)
[반응식 4-1]
<제2 단계>
하기 반응식 4-2에서와 같이, 상기 제1 단계에서 제조한 2-(3-아다만탄-1-일-2-하이드록시-프로폭시)-1,1-디플로우로에탄설포닉 산 나트륨 염을 상기 합성예 1의 제2 단계와 동일하게 디페닐 메틸페닐 설포늄 트리플루오르 메탄 설포네이트 염과 반응시켜 2-(3-아다만탄-1-일-2-하이드록시-프로폭시)-1,1-디플로우로에탄설포네이트 디페닐 플로오르페닐 설포늄 염(2-(3-Adamantan-1-yl-2-hydroxy-propoxy)-1,1-difluoro-ethanesulfonate diphenyl fluorophenyl sulfonium salt)을 수득하였고, 그 구조를 1H-NMR에 의하여 확인하였다.
1H-NMR(클로로포름-d3, 테트라메틸실란): (ppm) 1.17-1.58(m, 17H), 3.49-3.55(m, 3H), 4.25(t, 2H), 7.48(d, 2H), 7.65-7.76(m, 12H)
[반응식 4-2]
[수지 합성예]
3-바이시클로[2.2.1]헵트-5-엔-2-닐-3-하이드록시 프로피오닉 산 t-부틸 에스터(3-Bicyclo[2.2.1]hept-5-en-2-yl-3-hydroxy-propionic acid t-butyl ester, 이하 BHP라 한다), 1-메틸 아다만탄 아크릴레이트(1-methyl adamantane acrylate), 감마-부티로락톤 메틸 아크릴레이트(γ-butyrolactone acrylate)을 1:1:1의 몰비로 충진시키고, 중합 용매로 1,4-디옥산을 상기 반응 단량체 전체 100 중량부에 대하여 300 중량부를 첨가하고, 개시제로 아조비스이소부티로니트릴을 상기 반응 단량체 전체 100 몰부에 대하여 4 몰부로 첨가하여 65℃에서 16시간 동안 반응시켰다.
반응 후 반응용액을 n-헥산에서 침전시켜 제거하고, 진공 건조하여 하기 화학식 10으로 표시되며 중량 평균 분자량이 약 8,500g/mol인 공중합체를 얻었다.
[화학식 10]
[실험예]
(실시예 1)
상기 수지의 합성예에서 얻어진 수지 100 중량부, 광산발생제로 상기 합성예 1에서 제조된 만들어진 2-(2-아다만탄-1-일-2-하이드록시-에톡시)-1,1-디플로우로에탄설포네이트 디페닐 플로오르페닐 설포늄 염 4 중량부 및 염기성 첨가제로 테트라메틸 암모니움하이드록시드 0.5 중량부를 프로필렌 글리콜 메틸 에테르 아세테이트 1,000 중량부에 용해시킨 다음 0.2um 막 필터로 여과하여 레지스트 조성물을 제조하였다.
얻어진 레지스트 조성물을 스피너를 사용하여 기판에 도포하고 110℃에서 90초간 건조시켜 0.20um 두께의 피막을 형성하였다. 형성된 피막에 ArF 엑시머 레이저 스텝퍼(렌즈 개구수: 0.78)를 사용하여 노광시킨 후 110℃에서 90초간 열처리하였다. 이어서 2.38 중량% 테트라메틸암모늄하이드록시드 수용액으로 40초간 현상, 세척 및 건조하여 레지스트 패턴을 형성하였다.
(실시예 2)
상기 실시예 1에서 상기 합성예 1에서 제조된 광산발생제를 대신하여 상기 합성예 2에서 제조된 광산발생제를 사용한 것을 제외하고는 실시예 1과 동일하게 실시하여 레지스트 조성물을 제조하였고, 레지스트 패턴을 형성하였다.
(실시예 3)
상기 실시예 1에서 상기 합성예 1에서 제조된 광산발생제를 대신하여 상기 합성예 4에서 제조된 광산발생제를 사용한 것을 제외하고는 실시예 1과 동일하게 실시하여 레지스트 조성물을 제조하였고, 레지스트 패턴을 형성하였다.
(비교예)
상기 실시예 1에서 상기 합성예 1에서 제조된 광산발생제를 대신하여 트리페닐 설포늄 트리플레이트를 사용한 것을 제외하고는 실시예 1과 동일하게 실시하여 레지스트 조성물을 제조하였고, 레지스트 패턴을 형성하였다.
상기 실시예 1 내지 3에서 제조된 레지스트 패턴에 대하여 각종 평가를 실시하였고, 그 결과를 하기 표 1에 나타내었다.
하기 표 1에서 감도는 현상 후 형성된 0.10um 라인 앤드 스페이스(L/S) 패턴을 1대 1의 선폭으로 형성하는 노광량을 최적노광량으로 하고 이 최적노광량을 감도로 하였으며, 이때 해상되는 최소 패턴 치수를 해상도라 하였다.
또한, LER(line edge roughness)의 경우, 현상 후 형성된 0.10um 라인 앤드 스페이스 (L/S) 패턴에 대하여 패턴의 조도를 관찰하고, LER을 측정하였다(숫자가 작을수록 우수한 LER을 나타낸다).
| 수지 (100 중량부) |
PAG (중량부) |
Base (중량부) |
감도 (mJ/cm2) |
해상도 (nm) |
LER | |
| 실시예 1 | 수지 합성예 | 4.0 | 0.5 | 12 | 80 | 4 |
| 실시예 2 | 수지 합성예 | 4.0 | 0.5 | 13 | 80 | 5 |
| 실시예 3 | 수지 합성예 | 4.0 | 0.5 | 14 | 70 | 3 |
| 비교예 1 | 수지 합성예 | 4.0 | 0.5 | 17 | 100 | 7 |
실시예 1 내지 3에서 제조된 레지스트 조성물이 비교예 1에서 제조된 레지스트 조성물에 비하여 테트라메틸암모늄하이드록시드 수용액에 대한 현상성과 형성된 레지스트 패턴의 기판에 대한 접착성이 양호함을 확인하였으며, 상기 표 1의 결과를 통하여 실시예 1 내지 3에서 제조된 레지스트 조성물이 비교예 1에서 제조된 레지스트 조성물에 비하여 감도, 해상도 및 LER 특성이 우수한 것을 알 수 있다.
이상에서 본 발명의 바람직한 실시예에 대하여 상세하게 설명하였지만 본 발명의 권리범위는 이에 한정되는 것은 아니고 다음의 청구범위에서 정의하고 있는 본 발명의 기본 개념을 이용한 당업자의 여러 변형 및 개량 형태 또한 본 발명의 권리범위에 속하는 것이다.
Claims (9)
- 제1항에 있어서,
상기 Y는 알킬기, 알케닐기, 알콕시기, 시클로펜틸기, 시클로헥실기, 데카하이드로나프탈렌기, 옥타하이드로-1H-인덴기, 아다만틸기, 노보닐기, 테트라하이드로퓨란, 탄소수 10 내지 30의 노보닐기를 포함하는 다환식 시클로알킬기, 페닐기, 나프틸기, 바이페닐기, 안트릴기, 펜안트렌기, 플루오레닐기, 피렌기, 페날렌기, 인덴기, 바이페닐렌기, 다이페닐메틸기, 테트라하이드로나프틸기, 다이하이드로안트릴기, 테트라페닐메틸기 및 트리페닐메틸기로 이루어진 군에서 선택된 어느 하나인 것인 광산발생제. - 제1항에 있어서,
상기 Y는 알킬기, 알케닐기, 알콕시기, 하기 화학식 1-a 내지 1-i 및 화학식 2-a 내지 2-l로 이루어진 군에서 선택되는 어느 하나인 것인 광산발생제.
[화학식 1-a] [화학식 1-b] [화학식 1-c]
[화학식 1-d] [화학식 1-e] [화학식 1-f]
[화학식 1-g] [화학식 1-h] [화학식 1-i]
(상기 화학식 1-a 내지 1-i에서,
상기 R11 및 R12은 각각 독립적으로 수소, 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐 원자, 하이드록시기, 카르복시기, 시아노기, 니트로기, 아미노기, 티오기, 메틸티오기, 메톡시기, OR', COR', COOR', O 및 S로 이루어진 군에서 선택된 어느 하나이고, 상기 R'는 알킬기 및 아릴기로 이루어진 군에서 선택된 어느 하나이고,
상기 R21은 CR24R25, O, CO, S 및 NR23로 이루어진 군에서 선택된 어느 하나이고, 상기 R23 내지 R25는 각각 독립적으로 수소, 알킬기 및 아릴기로 이루어진 군에서 선택되는 어느 하나이고,
상기 a, c 및 d는 각각 독립적으로 0 내지 9의 정수이고, 상기 b는 0 내지 11의 정수이고, 상기 e는 0 내지 15의 정수이고, 상기 f는 0 내지 7의 정수이고, 0≤c+d≤17이고, 0≤c+f≤15이다)
[화학식 2-a] [화학식 2-b] [화학식 2-c]
[화학식 2-d] [화학식 2-e] [화학식 2-f]
[화학식 2-g] [화학식 2-h] [화학식 2-i]
[화학식 2-j] [화학식 2-k] [화학식 2-l]
(상기 화학식 2-a 내지 2-l에서,
상기 R11, R12, R13 및 R14는 각각 독립적으로 알킬기, 알콕시기, 퍼플루오로알킬기, 퍼플루오로알콕시기, 할로겐 원자, 하이드록시기, 시아노기, 니트로기, 아미노기 및 티오기로 이루어진 군에서 선택된 어느 하나이고,
상기 R21 및 R22는 각각 독립적으로 CR24R25, O, CO, S 및 NR23로 이루어진 군에서 선택된 어느 하나이고, 상기 R23 내지 R25는 각각 독립적으로 수소, 알킬기 및 아릴기로 이루어진 군에서 선택되는 어느 하나이고,
상기 a, h 및 i는 각각 독립적으로 0 내지 5의 정수이고, 상기 b는 0 내지 3의 정수이고, 상기 c 및 d는 각각 독립적으로 0 내지 4의 정수이고, 상기 e, f 및 g는 각각 독립적으로 0 내지 2의 정수이고, 0≤c+d+e≤9이다) - 하이드록시 술폰산염과 옥시란을 반응시켜 하이드록시 에톡시 술폰산염을 제조하는 제1 단계, 그리고
상기 제조된 하이드록시 에톡시 술폰산염의 양이온을 치환 반응시켜 하기 화학식 1로 표시되는 화합물을 제조하는 제2 단계
를 포함하는 광산발생제의 제조 방법.
[화학식 1]
(상기 화학식 1에서,
상기 Y는 알킬기, 알케닐기, 알콕시기, 시클로알킬기, 헤테로시클로알킬기, 아릴기 및 헤테로아릴기로 이루어진 군에서 선택되는 어느 하나이고,
상기 X는 알칸디일이고,
상기 R1 및 R2는 각각 독립적으로 수소기 또는 할로겐기이고,
상기 n1은 1 내지 2의 정수이며,
상기 n2는 0 내지 5의 정수이며,
상기 A+는 유기짝이온이다) - 제5항에 있어서,
상기 하이드록시 술폰산염은 하기 화학식 6으로 표시되고,
상기 옥시란은 하기 화학식 7로 표시되고,
상기 하이드록시 에톡시 술폰산염은 하기 화학식 8로 표시되는 것인 광산발생제의 제조 방법.
[화학식 6]
[화학식 7]
[화학식 8]
(상기 화학식 6 내지 8에서,
상기 Y는 알킬기, 알케닐기, 알콕시기, 시클로알킬기, 헤테로시클로알킬기, 아릴기 및 헤테로아릴기로 이루어진 군에서 선택되는 어느 하나이고,
상기 X는 알칸디일이고,
상기 R1 및 R2는 각각 독립적으로 수소기 또는 할로겐기이고,
상기 n1은 1 내지 2의 정수이며,
상기 n2는 0 내지 5의 정수이며,
상기 M+는 알칼리금속 이온이다) - 제5항에 있어서,
상기 제1 단계는 상기 하이드록시 술폰산염과 상기 옥시란을 산성 촉매 및 염기성 촉매로 이루어진 군에서 선택되는 어느 하나의 촉매 하에서 반응시키는 것인 광산발생제의 제조 방법. - 제5항에 있어서,
상기 제1 단계는 상기 하이드록시 술폰산염과 상기 옥시란을 혼합한 후, 0 내지 100℃에서 1 내지 48 시간 동안 교반하여 반응시키는 것인 광산발생제의 제조 방법. - 제1항 내지 제4항 중 어느 한 항에 따른 광산발생제를 포함하는 레지스트 조성물.
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020110010654A KR101229314B1 (ko) | 2011-02-07 | 2011-02-07 | 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물 |
| TW101103603A TWI465419B (zh) | 2011-02-07 | 2012-02-03 | 光酸產生劑、其製造方法以及含有其的抗蝕劑組成物 |
| SG2012008298A SG183620A1 (en) | 2011-02-07 | 2012-02-06 | Photoacid generator, method for producing the same, and resist composition comprising the same |
| CN201210028643.8A CN102627586B (zh) | 2011-02-07 | 2012-02-07 | 光酸产生剂、其制备方法及包含光酸产生剂的抗蚀剂组合物 |
| US13/367,762 US8889901B2 (en) | 2011-02-07 | 2012-02-07 | Photoacid generator, method for producing the same, and resist composition comprising the same |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020110010654A KR101229314B1 (ko) | 2011-02-07 | 2011-02-07 | 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20120090299A KR20120090299A (ko) | 2012-08-17 |
| KR101229314B1 true KR101229314B1 (ko) | 2013-02-04 |
Family
ID=46586012
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020110010654A KR101229314B1 (ko) | 2011-02-07 | 2011-02-07 | 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US8889901B2 (ko) |
| KR (1) | KR101229314B1 (ko) |
| CN (1) | CN102627586B (ko) |
| SG (1) | SG183620A1 (ko) |
| TW (1) | TWI465419B (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102924341A (zh) * | 2011-08-08 | 2013-02-13 | 住友化学株式会社 | 盐、光致抗蚀剂组合物和用于生产光致抗蚀剂图案的方法 |
| JP6074937B2 (ja) * | 2011-08-11 | 2017-02-08 | 住友化学株式会社 | レジスト組成物及び塩 |
| CN111978275B (zh) * | 2020-08-31 | 2023-01-13 | 宁波南大光电材料有限公司 | 3-丙烯酸酯-4-丁内酯的纯化方法 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2081085A1 (en) | 2008-01-18 | 2009-07-22 | Shin-Etsu Chemical Co., Ltd. | Positive resist compositions and patterning process |
| KR20090120866A (ko) * | 2008-05-21 | 2009-11-25 | 금호석유화학 주식회사 | 화학증폭형 레지스트 조성물용 산발생제 |
| US20100230136A1 (en) | 2009-03-12 | 2010-09-16 | Sumitomo Chemical Company, Limited | Method for producing resist pattern |
| US20100279226A1 (en) | 2007-12-28 | 2010-11-04 | Mitsuhiro Hata | Resist processing method |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2687671B1 (fr) | 1992-02-21 | 1994-05-20 | Centre Nal Recherc Scientifique | Monomeres derives de sultones perhalogenees et polymeres obtenus a partir de ces monomeres. |
| US6841333B2 (en) | 2002-11-01 | 2005-01-11 | 3M Innovative Properties Company | Ionic photoacid generators with segmented hydrocarbon-fluorocarbon sulfonate anions |
| JP5193513B2 (ja) * | 2007-02-23 | 2013-05-08 | 東京応化工業株式会社 | 化合物、酸発生剤、レジスト組成物およびレジストパターン形成方法 |
| KR100896046B1 (ko) | 2007-07-24 | 2009-05-11 | 엘지전자 주식회사 | 유기전계발광표시장치 |
| US8580486B2 (en) | 2008-03-13 | 2013-11-12 | Central Glass Company, Limited | Salt having fluorine-containing carbanion structure, derivative thereof, photoacid generator, resist material using the photoacid generator, and pattern forming method |
| JP4998746B2 (ja) * | 2008-04-24 | 2012-08-15 | 信越化学工業株式会社 | スルホニウム塩を含む高分子化合物、レジスト材料及びパターン形成方法 |
| JP5401910B2 (ja) | 2008-10-17 | 2014-01-29 | セントラル硝子株式会社 | 重合性アニオンを有する含フッ素スルホン塩類とその製造方法、含フッ素樹脂、レジスト組成物及びそれを用いたパターン形成方法 |
| KR100998503B1 (ko) | 2008-10-30 | 2010-12-07 | 금호석유화학 주식회사 | 방향족 환을 포함하는 산 발생제 |
-
2011
- 2011-02-07 KR KR1020110010654A patent/KR101229314B1/ko active IP Right Grant
-
2012
- 2012-02-03 TW TW101103603A patent/TWI465419B/zh active
- 2012-02-06 SG SG2012008298A patent/SG183620A1/en unknown
- 2012-02-07 US US13/367,762 patent/US8889901B2/en active Active
- 2012-02-07 CN CN201210028643.8A patent/CN102627586B/zh active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100279226A1 (en) | 2007-12-28 | 2010-11-04 | Mitsuhiro Hata | Resist processing method |
| EP2081085A1 (en) | 2008-01-18 | 2009-07-22 | Shin-Etsu Chemical Co., Ltd. | Positive resist compositions and patterning process |
| KR20090120866A (ko) * | 2008-05-21 | 2009-11-25 | 금호석유화학 주식회사 | 화학증폭형 레지스트 조성물용 산발생제 |
| US20100230136A1 (en) | 2009-03-12 | 2010-09-16 | Sumitomo Chemical Company, Limited | Method for producing resist pattern |
Also Published As
| Publication number | Publication date |
|---|---|
| US20120203030A1 (en) | 2012-08-09 |
| US8889901B2 (en) | 2014-11-18 |
| TW201233664A (en) | 2012-08-16 |
| CN102627586A (zh) | 2012-08-08 |
| KR20120090299A (ko) | 2012-08-17 |
| TWI465419B (zh) | 2014-12-21 |
| CN102627586B (zh) | 2014-12-10 |
| SG183620A1 (en) | 2012-09-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101332316B1 (ko) | 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물 | |
| JP5474867B2 (ja) | 光酸発生剤、この製造方法、及びこれを含むレジスト組成物 | |
| JP7361820B2 (ja) | ヨウ素含有光酸発生剤及びそれを含む組成物 | |
| KR101868636B1 (ko) | 신규 화합물 | |
| JP6005964B2 (ja) | レジスト組成物及びレジストパターンの製造方法 | |
| JP6589795B2 (ja) | スルホニウム塩、レジスト組成物及びパターン形成方法 | |
| KR101603359B1 (ko) | 술포늄염, 레지스트 재료 및 패턴 형성 방법 | |
| KR101572708B1 (ko) | 레지스트 조성물, 레지스트 패턴 형성 방법, 신규 화합물 및 산발생제 | |
| KR101565282B1 (ko) | 레지스트 조성물, 레지스트 패턴 형성 방법, 신규 화합물 및 산발생제 | |
| TWI657073B (zh) | 鋶化合物、光阻組成物及圖案形成方法 | |
| KR101559585B1 (ko) | 화학 증폭형 레지스트 조성물 및 액침 노광용 화학 증폭형 레지스트 조성물 | |
| KR101184901B1 (ko) | 화합물, 이를 포함하는 중합체 및 상기 중합체를 포함하는 화학증폭형 레지스트 조성물 | |
| KR101720352B1 (ko) | 레지스트 조성물, 레지스트 패턴 형성 방법 | |
| KR101839155B1 (ko) | 레지스트 조성물, 레지스트 패턴 형성 방법, 신규 화합물, 산 발생제 | |
| KR20110131904A (ko) | 광산발생제, 이의 제조방법 및 이를 포함하는 레지스트 조성물 | |
| KR101944290B1 (ko) | 설폰산 유도체, 그것을 사용한 광산발생제, 레지스트 조성물 및 디바이스의 제조 방법 | |
| KR101229314B1 (ko) | 광산발생제, 이의 제조 방법 및 이를 포함하는 레지스트 조성물 | |
| TWI423948B (zh) | 光酸產生劑及其製造方法,以及含有該光酸產生劑的光阻組合物 | |
| TWI591048B (zh) | 新穎鋶鹽、其製造方法及光酸產生劑 | |
| WO2022044706A1 (ja) | 感活性光線性又は感放射線性樹脂組成物、レジスト膜、パターン形成方法、電子デバイスの製造方法 | |
| JP2011251961A (ja) | 光酸発生剤、この製造方法、及びこれを含むレジスト組成物 | |
| KR101335313B1 (ko) | 화합물, 이를 포함하는 공중합체 및 상기 공중합체를 포함하는 레지스트 보호막 조성물 | |
| KR101791263B1 (ko) | 포지티브형 레지스트 조성물 및 레지스트 패턴 형성 방법 | |
| TWI708119B (zh) | 樹脂、光阻組合物及光阻圖案之製造方法 | |
| KR102632151B1 (ko) | 오늄염, 화학 증폭 네거티브형 레지스트 조성물 및 레지스트 패턴 형성 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20160112 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20170125 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20180112 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20181203 Year of fee payment: 7 |
|
| FPAY | Annual fee payment |
Payment date: 20191230 Year of fee payment: 8 |