KR100864743B1 - 비스포스포네이트의 투여 방법 - Google Patents
비스포스포네이트의 투여 방법 Download PDFInfo
- Publication number
- KR100864743B1 KR100864743B1 KR1020027017283A KR20027017283A KR100864743B1 KR 100864743 B1 KR100864743 B1 KR 100864743B1 KR 1020027017283 A KR1020027017283 A KR 1020027017283A KR 20027017283 A KR20027017283 A KR 20027017283A KR 100864743 B1 KR100864743 B1 KR 100864743B1
- Authority
- KR
- South Korea
- Prior art keywords
- treatment
- prevention
- bisphosphonate
- osteoporosis
- months
- Prior art date
Links
- 229940122361 Bisphosphonate Drugs 0.000 title claims abstract description 63
- 150000004663 bisphosphonates Chemical class 0.000 title claims abstract description 51
- 238000000034 method Methods 0.000 title description 5
- 210000000988 bone and bone Anatomy 0.000 claims abstract description 31
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 claims abstract description 29
- 208000001132 Osteoporosis Diseases 0.000 claims abstract description 16
- 208000006386 Bone Resorption Diseases 0.000 claims abstract description 15
- 230000024279 bone resorption Effects 0.000 claims abstract description 15
- 208000024891 symptom Diseases 0.000 claims abstract description 14
- 238000011282 treatment Methods 0.000 claims description 51
- 230000002265 prevention Effects 0.000 claims description 29
- 150000003839 salts Chemical class 0.000 claims description 24
- 208000029725 Metabolic bone disease Diseases 0.000 claims description 14
- 239000008194 pharmaceutical composition Substances 0.000 claims description 14
- 206010049088 Osteopenia Diseases 0.000 claims description 13
- 208000001685 postmenopausal osteoporosis Diseases 0.000 claims description 10
- 206010020850 Hyperthyroidism Diseases 0.000 claims description 8
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 8
- 208000037147 Hypercalcaemia Diseases 0.000 claims description 5
- 208000001164 Osteoporotic Fractures Diseases 0.000 claims description 5
- 230000000148 hypercalcaemia Effects 0.000 claims description 5
- 208000030915 hypercalcemia disease Diseases 0.000 claims description 5
- 201000008482 osteoarthritis Diseases 0.000 claims description 5
- 238000011321 prophylaxis Methods 0.000 claims description 5
- 208000000103 Anorexia Nervosa Diseases 0.000 claims description 4
- 206010051728 Bone erosion Diseases 0.000 claims description 4
- 201000002980 Hyperparathyroidism Diseases 0.000 claims description 4
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical class IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 claims description 4
- 208000021863 corticosteroid-induced osteoporosis Diseases 0.000 claims description 4
- 238000001647 drug administration Methods 0.000 claims description 4
- 238000002657 hormone replacement therapy Methods 0.000 claims description 4
- 208000013403 hyperactivity Diseases 0.000 claims description 4
- 210000000056 organ Anatomy 0.000 claims description 4
- 238000007911 parenteral administration Methods 0.000 claims description 4
- 201000000306 sarcoidosis Diseases 0.000 claims description 4
- 239000005495 thyroid hormone Substances 0.000 claims description 4
- 229940036555 thyroid hormone Drugs 0.000 claims description 4
- 238000002054 transplantation Methods 0.000 claims description 4
- 229930003231 vitamin Natural products 0.000 claims description 4
- 239000011782 vitamin Substances 0.000 claims description 4
- 229940088594 vitamin Drugs 0.000 claims description 4
- 235000013343 vitamin Nutrition 0.000 claims description 4
- 150000003722 vitamin derivatives Chemical class 0.000 claims description 4
- 239000002552 dosage form Substances 0.000 claims 4
- 230000008416 bone turnover Effects 0.000 claims 1
- 229960004276 zoledronic acid Drugs 0.000 abstract description 19
- 230000003389 potentiating effect Effects 0.000 abstract description 4
- 230000007774 longterm Effects 0.000 abstract 1
- 230000001629 suppression Effects 0.000 abstract 1
- 239000004480 active ingredient Substances 0.000 description 23
- -1 nitrogen-containing bisphosphonates Chemical class 0.000 description 15
- 150000001875 compounds Chemical class 0.000 description 13
- 238000001990 intravenous administration Methods 0.000 description 12
- 229940068196 placebo Drugs 0.000 description 12
- 239000000902 placebo Substances 0.000 description 12
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- 125000000217 alkyl group Chemical group 0.000 description 10
- 239000002775 capsule Substances 0.000 description 9
- 229910052739 hydrogen Inorganic materials 0.000 description 9
- 239000001257 hydrogen Substances 0.000 description 9
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 8
- 238000000576 coating method Methods 0.000 description 8
- 230000002401 inhibitory effect Effects 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- 239000002253 acid Substances 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 239000000454 talc Substances 0.000 description 7
- 235000012222 talc Nutrition 0.000 description 7
- 229910052623 talc Inorganic materials 0.000 description 7
- OGSPWJRAVKPPFI-UHFFFAOYSA-N Alendronic Acid Chemical compound NCCCC(O)(P(O)(O)=O)P(O)(O)=O OGSPWJRAVKPPFI-UHFFFAOYSA-N 0.000 description 6
- 102000003982 Parathyroid hormone Human genes 0.000 description 6
- 108090000445 Parathyroid hormone Proteins 0.000 description 6
- IIDJRNMFWXDHID-UHFFFAOYSA-N Risedronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CC1=CC=CN=C1 IIDJRNMFWXDHID-UHFFFAOYSA-N 0.000 description 6
- 125000003277 amino group Chemical group 0.000 description 6
- 239000011248 coating agent Substances 0.000 description 6
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 6
- 239000000199 parathyroid hormone Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000002202 Polyethylene glycol Substances 0.000 description 5
- 201000010099 disease Diseases 0.000 description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 5
- 239000008298 dragée Substances 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 229910052736 halogen Inorganic materials 0.000 description 5
- 150000002367 halogens Chemical group 0.000 description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 229920001223 polyethylene glycol Polymers 0.000 description 5
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 4
- 229930195725 Mannitol Natural products 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 description 4
- 229920002367 Polyisobutene Polymers 0.000 description 4
- 229920002472 Starch Polymers 0.000 description 4
- NPLHDPAQRZJWHX-UHFFFAOYSA-N [5,5-bis(diethoxyphosphoryl)-1,4-dihydropyrazol-3-yl]-phenylmethanone Chemical compound N1C(P(=O)(OCC)OCC)(P(=O)(OCC)OCC)CC(C(=O)C=2C=CC=CC=2)=N1 NPLHDPAQRZJWHX-UHFFFAOYSA-N 0.000 description 4
- 125000003545 alkoxy group Chemical group 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- 235000010980 cellulose Nutrition 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 210000004211 gastric acid Anatomy 0.000 description 4
- 238000001802 infusion Methods 0.000 description 4
- 229910052500 inorganic mineral Inorganic materials 0.000 description 4
- 239000000594 mannitol Substances 0.000 description 4
- 235000010355 mannitol Nutrition 0.000 description 4
- 239000011707 mineral Substances 0.000 description 4
- VMMKGHQPQIEGSQ-UHFFFAOYSA-N minodronic acid Chemical compound C1=CC=CN2C(CC(O)(P(O)(O)=O)P(O)(O)=O)=CN=C21 VMMKGHQPQIEGSQ-UHFFFAOYSA-N 0.000 description 4
- 229960001319 parathyroid hormone Drugs 0.000 description 4
- 239000008188 pellet Substances 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 235000019698 starch Nutrition 0.000 description 4
- 239000008107 starch Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 108060001064 Calcitonin Proteins 0.000 description 3
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical class [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- DKJJVAGXPKPDRL-UHFFFAOYSA-N Tiludronic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)SC1=CC=C(Cl)C=C1 DKJJVAGXPKPDRL-UHFFFAOYSA-N 0.000 description 3
- 125000001589 carboacyl group Chemical group 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 229940109239 creatinine Drugs 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 229940011871 estrogen Drugs 0.000 description 3
- 239000000262 estrogen Substances 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 150000004677 hydrates Chemical class 0.000 description 3
- 125000002883 imidazolyl group Chemical group 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Substances [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 3
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 3
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 3
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 230000002485 urinary effect Effects 0.000 description 3
- PMXAPNNYCFBALB-UHFFFAOYSA-N (1-hydroxy-1-phosphono-3-pyrrolidin-1-ylpropyl)phosphonic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CCN1CCCC1 PMXAPNNYCFBALB-UHFFFAOYSA-N 0.000 description 2
- RDFHOSXBGDLRQF-UHFFFAOYSA-N (2-anilino-1-phosphono-2-sulfanylideneethyl)phosphonic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)C(=S)NC1=CC=CC=C1 RDFHOSXBGDLRQF-UHFFFAOYSA-N 0.000 description 2
- AXTGDCSMTYGJND-UHFFFAOYSA-N 1-dodecylazepan-2-one Chemical compound CCCCCCCCCCCCN1CCCCCC1=O AXTGDCSMTYGJND-UHFFFAOYSA-N 0.000 description 2
- MXYOPVWZZKEAGX-UHFFFAOYSA-N 1-phosphonoethylphosphonic acid Chemical compound OP(=O)(O)C(C)P(O)(O)=O MXYOPVWZZKEAGX-UHFFFAOYSA-N 0.000 description 2
- NEAHTABRXFKZGG-UHFFFAOYSA-N 2-pyridin-4-yl-3h-imidazo[4,5-c]pyridine Chemical compound C1=NC=CC(C=2NC3=CN=CC=C3N=2)=C1 NEAHTABRXFKZGG-UHFFFAOYSA-N 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 102000055006 Calcitonin Human genes 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- DBVJJBKOTRCVKF-UHFFFAOYSA-N Etidronic acid Chemical compound OP(=O)(O)C(O)(C)P(O)(O)=O DBVJJBKOTRCVKF-UHFFFAOYSA-N 0.000 description 2
- 102220570135 Histone PARylation factor 1_L30D_mutation Human genes 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 208000034578 Multiple myelomas Diseases 0.000 description 2
- PQBAWAQIRZIWIV-UHFFFAOYSA-N N-methylpyridinium Chemical class C[N+]1=CC=CC=C1 PQBAWAQIRZIWIV-UHFFFAOYSA-N 0.000 description 2
- 229920005987 OPPANOL® Polymers 0.000 description 2
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical group OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- DOOTYTYQINUNNV-UHFFFAOYSA-N Triethyl citrate Chemical compound CCOC(=O)CC(O)(C(=O)OCC)CC(=O)OCC DOOTYTYQINUNNV-UHFFFAOYSA-N 0.000 description 2
- VADUXZPJGJBSLQ-UHFFFAOYSA-N [1-hydroxy-3-(1-methylpyridin-1-ium-3-yl)-1-phosphonopropyl]phosphonic acid;hydroxide Chemical compound [OH-].C[N+]1=CC=CC(CCC(O)(P(O)(O)=O)P(O)(O)=O)=C1 VADUXZPJGJBSLQ-UHFFFAOYSA-N 0.000 description 2
- QWCNOXMFNSYEKF-UHFFFAOYSA-N [1-hydroxy-3-[methyl(2-phenylsulfanylethyl)amino]-1-phosphonopropyl]phosphonic acid Chemical compound OP(=O)(O)C(O)(P(O)(O)=O)CCN(C)CCSC1=CC=CC=C1 QWCNOXMFNSYEKF-UHFFFAOYSA-N 0.000 description 2
- UGEPSJNLORCRBO-UHFFFAOYSA-N [3-(dimethylamino)-1-hydroxy-1-phosphonopropyl]phosphonic acid Chemical compound CN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O UGEPSJNLORCRBO-UHFFFAOYSA-N 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 229940062527 alendronate Drugs 0.000 description 2
- 229960004343 alendronic acid Drugs 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 125000004414 alkyl thio group Chemical group 0.000 description 2
- 239000002518 antifoaming agent Substances 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 229960004015 calcitonin Drugs 0.000 description 2
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 108010049937 collagen type I trimeric cross-linked peptide Proteins 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- KTGBYROLTNECAS-UHFFFAOYSA-L disodium;[2-anilino-1-[hydroxy(oxido)phosphoryl]-2-sulfanylideneethyl]-hydroxyphosphinate Chemical compound [Na+].[Na+].OP([O-])(=O)C(P(O)([O-])=O)C(=S)NC1=CC=CC=C1 KTGBYROLTNECAS-UHFFFAOYSA-L 0.000 description 2
- JFGHPLSPUGOSLV-UHFFFAOYSA-L disodium;[3-(dimethylamino)-1-hydroxy-1-[hydroxy(oxido)phosphoryl]propyl]-hydroxyphosphinate Chemical compound [Na+].[Na+].CN(C)CCC(O)(P(O)(O)=O)P([O-])([O-])=O JFGHPLSPUGOSLV-UHFFFAOYSA-L 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 125000001183 hydrocarbyl group Chemical group 0.000 description 2
- 229940015872 ibandronate Drugs 0.000 description 2
- 229960005236 ibandronic acid Drugs 0.000 description 2
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 2
- 239000003978 infusion fluid Substances 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 125000000842 isoxazolyl group Chemical group 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- PUUSSSIBPPTKTP-UHFFFAOYSA-N neridronic acid Chemical compound NCCCCCC(O)(P(O)(O)=O)P(O)(O)=O PUUSSSIBPPTKTP-UHFFFAOYSA-N 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 239000003791 organic solvent mixture Substances 0.000 description 2
- 230000001582 osteoblastic effect Effects 0.000 description 2
- 210000002997 osteoclast Anatomy 0.000 description 2
- 230000003256 osteocytic effect Effects 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 229920006267 polyester film Polymers 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229960004622 raloxifene Drugs 0.000 description 2
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 229940089617 risedronate Drugs 0.000 description 2
- 229960000759 risedronic acid Drugs 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 229940095743 selective estrogen receptor modulator Drugs 0.000 description 2
- 239000000333 selective estrogen receptor modulator Substances 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 235000002639 sodium chloride Nutrition 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 235000010356 sorbitol Nutrition 0.000 description 2
- 210000005065 subchondral bone plate Anatomy 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- WZDGZWOAQTVYBX-XOINTXKNSA-N tibolone Chemical compound C([C@@H]12)C[C@]3(C)[C@@](C#C)(O)CC[C@H]3[C@@H]1[C@H](C)CC1=C2CCC(=O)C1 WZDGZWOAQTVYBX-XOINTXKNSA-N 0.000 description 2
- 239000001069 triethyl citrate Substances 0.000 description 2
- VMYFZRTXGLUXMZ-UHFFFAOYSA-N triethyl citrate Natural products CCOC(=O)C(O)(C(=O)OCC)C(=O)OCC VMYFZRTXGLUXMZ-UHFFFAOYSA-N 0.000 description 2
- 235000013769 triethyl citrate Nutrition 0.000 description 2
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 2
- 229940038773 trisodium citrate Drugs 0.000 description 2
- 239000008215 water for injection Substances 0.000 description 2
- FBSQLNMIJFINOJ-UHFFFAOYSA-N (2-imidazol-1-yl-1-phosphonoethyl)phosphonic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)CN1C=CN=C1 FBSQLNMIJFINOJ-UHFFFAOYSA-N 0.000 description 1
- HLNJFEXZDGURGZ-UHFFFAOYSA-M 1-methylpyridin-1-ium;iodide Chemical compound [I-].C[N+]1=CC=CC=C1 HLNJFEXZDGURGZ-UHFFFAOYSA-M 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- HZLCGUXUOFWCCN-UHFFFAOYSA-N 2-hydroxynonadecane-1,2,3-tricarboxylic acid Chemical compound CCCCCCCCCCCCCCCCC(C(O)=O)C(O)(C(O)=O)CC(O)=O HZLCGUXUOFWCCN-UHFFFAOYSA-N 0.000 description 1
- SLRMQYXOBQWXCR-UHFFFAOYSA-N 2154-56-5 Chemical compound [CH2]C1=CC=CC=C1 SLRMQYXOBQWXCR-UHFFFAOYSA-N 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 241000972773 Aulopiformes Species 0.000 description 1
- 208000020084 Bone disease Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 101150116866 Dpyd gene Proteins 0.000 description 1
- 229920003134 Eudragit® polymer Polymers 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 101000741445 Homo sapiens Calcitonin Proteins 0.000 description 1
- 239000013032 Hydrocarbon resin Substances 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 208000030136 Marchiafava-Bignami Disease Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- LOJFGJZQOKTUBR-XAQOOIOESA-N NC(N)=NCCC[C@@H](C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCC(O)=O)C)CC1=CN=CN1 Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCC(O)=O)C)CC1=CN=CN1 LOJFGJZQOKTUBR-XAQOOIOESA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 229920002402 Oppanol® B 100 Polymers 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 102000004067 Osteocalcin Human genes 0.000 description 1
- 108090000573 Osteocalcin Proteins 0.000 description 1
- 201000000023 Osteosclerosis Diseases 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 208000027067 Paget disease of bone Diseases 0.000 description 1
- 239000005662 Paraffin oil Substances 0.000 description 1
- CXOFVDLJLONNDW-UHFFFAOYSA-N Phenytoin Chemical compound N1C(=O)NC(=O)C1(C=1C=CC=CC=1)C1=CC=CC=C1 CXOFVDLJLONNDW-UHFFFAOYSA-N 0.000 description 1
- 229920002594 Polyethylene Glycol 8000 Polymers 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- 241000209140 Triticum Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 229930003316 Vitamin D Natural products 0.000 description 1
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- SMEGJBVQLJJKKX-HOTMZDKISA-N [(2R,3S,4S,5R,6R)-5-acetyloxy-3,4,6-trihydroxyoxan-2-yl]methyl acetate Chemical compound CC(=O)OC[C@@H]1[C@H]([C@@H]([C@H]([C@@H](O1)O)OC(=O)C)O)O SMEGJBVQLJJKKX-HOTMZDKISA-N 0.000 description 1
- IKOGYRLPQONMFM-UHFFFAOYSA-N [1-amino-2-(1-benzylimidazol-4-yl)-1-phosphonoethyl]phosphonic acid Chemical compound C1=NC(CC(N)(P(O)(O)=O)P(O)(O)=O)=CN1CC1=CC=CC=C1 IKOGYRLPQONMFM-UHFFFAOYSA-N 0.000 description 1
- VGCUFGXAHRPSNF-UHFFFAOYSA-N [1-amino-2-(1-methylimidazol-4-yl)-1-phosphonoethyl]phosphonic acid Chemical compound CN1C=NC(CC(N)(P(O)(O)=O)P(O)(O)=O)=C1 VGCUFGXAHRPSNF-UHFFFAOYSA-N 0.000 description 1
- WXNDCAILNRCPMQ-UHFFFAOYSA-N [1-hydroxy-1-phosphono-2-(1,2,4-triazol-4-yl)ethyl]phosphonic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=NN=C1 WXNDCAILNRCPMQ-UHFFFAOYSA-N 0.000 description 1
- KXZAQOYIXOBXMR-UHFFFAOYSA-N [1-hydroxy-2-(1-methylimidazol-2-yl)-1-phosphonoethyl]phosphonic acid Chemical compound CN1C=CN=C1CC(O)(P(O)(O)=O)P(O)(O)=O KXZAQOYIXOBXMR-UHFFFAOYSA-N 0.000 description 1
- VSLQUGGYXRLUSL-UHFFFAOYSA-N [1-hydroxy-2-(1-methylimidazol-4-yl)-1-phosphonoethyl]phosphonic acid Chemical compound CN1C=NC(CC(O)(P(O)(O)=O)P(O)(O)=O)=C1 VSLQUGGYXRLUSL-UHFFFAOYSA-N 0.000 description 1
- JGERUCQQMGBXSJ-UHFFFAOYSA-N [1-phosphono-2-(1,3-thiazol-2-yl)ethyl]phosphonic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)CC1=NC=CS1 JGERUCQQMGBXSJ-UHFFFAOYSA-N 0.000 description 1
- VVTWQGRTVMQHIS-UHFFFAOYSA-N [2-(1-benzylimidazol-2-yl)-1-hydroxy-1-phosphonoethyl]phosphonic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CC1=NC=CN1CC1=CC=CC=C1 VVTWQGRTVMQHIS-UHFFFAOYSA-N 0.000 description 1
- IASQSZOLHNXZJJ-UHFFFAOYSA-N [2-(1-benzylimidazol-2-yl)-1-phosphonoethyl]phosphonic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)CC1=NC=CN1CC1=CC=CC=C1 IASQSZOLHNXZJJ-UHFFFAOYSA-N 0.000 description 1
- BDTDCXHWLYHYOO-UHFFFAOYSA-N [2-(1-methylimidazol-2-yl)-1-phosphonoethyl]phosphonic acid Chemical compound CN1C=CN=C1CC(P(O)(O)=O)P(O)(O)=O BDTDCXHWLYHYOO-UHFFFAOYSA-N 0.000 description 1
- XFDRFWQRYYEEEI-UHFFFAOYSA-N [2-(1h-imidazol-2-yl)-1-phosphonoethyl]phosphonic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)CC1=NC=CN1 XFDRFWQRYYEEEI-UHFFFAOYSA-N 0.000 description 1
- KWNLTXMGFAGRNR-UHFFFAOYSA-N [2-(4,5-dimethylimidazol-1-yl)-1-hydroxy-1-phosphonoethyl]phosphonic acid Chemical compound CC=1N=CN(CC(O)(P(O)(O)=O)P(O)(O)=O)C=1C KWNLTXMGFAGRNR-UHFFFAOYSA-N 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 229940081735 acetylcellulose Drugs 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 229940040563 agaric acid Drugs 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000003282 alkyl amino group Chemical group 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 125000004103 aminoalkyl group Chemical group 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 229960000817 bazedoxifene Drugs 0.000 description 1
- UCJGJABZCDBEDK-UHFFFAOYSA-N bazedoxifene Chemical compound C=1C=C(OCCN2CCCCCC2)C=CC=1CN1C2=CC=C(O)C=C2C(C)=C1C1=CC=C(O)C=C1 UCJGJABZCDBEDK-UHFFFAOYSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 208000016738 bone Paget disease Diseases 0.000 description 1
- 238000007470 bone biopsy Methods 0.000 description 1
- 230000010072 bone remodeling Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 210000001217 buttock Anatomy 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- ACSIXWWBWUQEHA-UHFFFAOYSA-N clodronic acid Chemical compound OP(O)(=O)C(Cl)(Cl)P(O)(O)=O ACSIXWWBWUQEHA-UHFFFAOYSA-N 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 235000013681 dietary sucrose Nutrition 0.000 description 1
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 1
- 235000011180 diphosphates Nutrition 0.000 description 1
- XQRLCLUYWUNEEH-UHFFFAOYSA-N diphosphonic acid Chemical compound OP(=O)OP(O)=O XQRLCLUYWUNEEH-UHFFFAOYSA-N 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000009547 dual-energy X-ray absorptiometry Methods 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229940009626 etidronate Drugs 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000010685 fatty oil Substances 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940045644 human calcitonin Drugs 0.000 description 1
- 229920006270 hydrocarbon resin Polymers 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 1
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 239000004922 lacquer Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004705 lumbosacral region Anatomy 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000011164 ossification Effects 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000005968 oxazolinyl group Chemical group 0.000 description 1
- 238000002638 palliative care Methods 0.000 description 1
- 229960003978 pamidronic acid Drugs 0.000 description 1
- 108010073509 parathyroid hormone (1-31) Proteins 0.000 description 1
- 108010073230 parathyroid hormone (1-38) Proteins 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 150000004686 pentahydrates Chemical class 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 229960002036 phenytoin Drugs 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 229940116317 potato starch Drugs 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000583 progesterone congener Substances 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000004080 punching Methods 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000009103 reabsorption Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 229940100486 rice starch Drugs 0.000 description 1
- 235000019515 salmon Nutrition 0.000 description 1
- 108010068072 salmon calcitonin Proteins 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 206010041569 spinal fracture Diseases 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000003270 steroid hormone Substances 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- OGBMKVWORPGQRR-UMXFMPSGSA-N teriparatide Chemical compound C([C@H](NC(=O)[C@H](CCSC)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)C(C)C)[C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CNC=N1 OGBMKVWORPGQRR-UMXFMPSGSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- 125000002769 thiazolinyl group Chemical group 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- 229960001023 tibolone Drugs 0.000 description 1
- 229940019375 tiludronate Drugs 0.000 description 1
- 229960005324 tiludronic acid Drugs 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 1
- 235000019166 vitamin D Nutrition 0.000 description 1
- 239000011710 vitamin D Substances 0.000 description 1
- 150000003710 vitamin D derivatives Chemical class 0.000 description 1
- 229940046008 vitamin d Drugs 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940100445 wheat starch Drugs 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/662—Phosphorus acids or esters thereof having P—C bonds, e.g. foscarnet, trichlorfon
- A61K31/663—Compounds having two or more phosphorus acid groups or esters thereof, e.g. clodronic acid, pamidronic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5026—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5073—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
- A61K9/7038—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer
- A61K9/7046—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds
- A61K9/7053—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds obtained by reactions only involving carbon to carbon unsaturated bonds, e.g. polyvinyl, polyisobutylene, polystyrene
Landscapes
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Physical Education & Sports Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
비정상적으로 증가된 골 교체 증상, 예를 들어 골다공증에서 골 재흡수를 오랫동안 억제하는데 있어서 비스포스포네이트, 특히 보다 강력한 N-비스포스포네이트, 예를 들어 졸레드론산 및 그의 유도체를 간헐적으로 투여하여 만족스러운 결과를 얻을 수 있으며, 비스포스포네이트 투여 사이의 기간은 종래에 적절한 것으로 고려되었던 기간, 예를 들어 약 6개월 이상 또는 그보다 덜 빈번한 투여 간격보다 더 길다.
비스포스포네이트, 골다공증.
Description
본 발명은 비스포스포네이트, 특히 비정상적으로 증가된 골 교체 증상, 예를 들어 골다공증의 치료에 있어서 비스포스포네이트의 제약적 용도에 관한 것이다.
비스포스포네이트는 골 재흡수가 증가되는 다양한 양성 및 악성 질환 모두에 있어서 파골세포의 활성을 저해할 목적으로 널리 사용된다. 이와 같이, 비스포스포네이트는 다발성 골수종 (MM)을 앓는 환자를 장기간에 걸쳐 치료하는데 최근까지 이용되어 왔다. 이러한 피로포스페이트 동족체는 골 관련 질환의 발생을 감소시킬뿐 아니라 환자에게 임상적으로 이로울 수 있어서 생존율을 향상시킨다. 비스포스포네이트는 생체내에서 골 재흡수를 방지할 수 있으며, 그의 치료 효능은 파제트 (Paget's) 골 질환, 종양-유도성 혈중칼슘과다증, 보다 최근에는 골 전이 및 다발성 골수종 (MM)의 치료에서 입증된 바 있다 (이에 대한 검토로는 문헌 (Fleisch H 1997 Bisphosphonates clinical. In Bisphosphonates in Bone Disease. From the Laboratory to the Patient. Eds: The Parthenon Publishing Group, New York/London pp 68-163)을 참조한다). 비스포스포네이트가 골 재흡수를 억제하는 기작은 아직까지 잘 이해되지 않고 있으며, 연구된 비스포스포네이트 종류에 따라 달라지는 것으로 보인다. 비스포스포네이트는 뼈의 수산화인회석 결정에 강하게 결합하여 골 교체 및 재흡수를 감소시키고, 혈중 히드록시프롤린 또는 알칼리 포스 파타제 수준을 감소시키며, 또한 파골세포의 활성화 및 활성 둘 다를 억제하는 것으로 알려져 있다.
또한, 비스포스포네이트는 골다공증의 치료에 사용되는 것으로 제안되었다. 즉, 예를 들어 미국 특허 제4,812,304호 (Procter & Gamble)에 기재된 바와 같이, (a) 골다공증을 앓거나 그럴 위험이 있는 대상에게 골세포 활성량의 골세포 활성 화합물을 투여하는, 약 1일 내지 약 5일의 골 활성화 기간; 이후에 (b) 상기 대상에게 에탄-1-히드록시-1,1-디포스폰산 또는 그의 제약상 허용되는 염 또는 에스테르를 매일 약 0.25 mgP/kg/일 내지 약 3.3 mgP/kg/일의 양으로 투여하는, 약 10일 내지 약 20일의 골 재흡수 억제 기간; 이후에 (c) 상기 대상에게 골세포 활성 화합물 및 골 재흡수 억제성 폴리포스포네이트 중 어느 것도 투여하지 않는, 약 70일 내지 약 180일의 휴지 기간으로 구성되는 사이클 1회 이상으로 이루어진 요법에 따라 상기 대상에게 상기 골세포 활성 화합물 및 골 재흡수 억제 폴리포스포네이트를 투여하는 것을 포함하는, 인간 골다공증의 치료 또는 억제 방법이 제안되었다.
또한, 예를 들어 미국 특허 제4,761,406호 (Procter & Gamble)는 (a) 골 재흡수 억제 폴리포스포네이트를 제한된 양으로 매일 투여하는, 약 1일 내지 약 90일의 기간; 이후에 (b) 약 50일 내지 약 120일의 휴지 기간; 및 (c) 골다공증을 앓거나 그럴 위험이 있는 인간 또는 하등 동물의 골 질량이 순 (net) 증가되는 상기 (a) 또는 (b) 기간을 2회 이상 반복하는 기간으로 이루어진 스케쥴에 따라 상기 인간 또는 하등 동물에게 유효량의 골 재흡수 억제 폴리포스포네이트를 투여하는 것을 포함하는, 골다공증의 치료 방법을 제안하고 있다.
놀랍게도, 비정상적으로 증가된 골 교체 증상에서 비스포스포네이트, 특히 보다 효능 있는 질소 함유 비스포스포네이트를 간헐적으로 투여하여 (비스포스포네이트 투여 사이의 기간은 종래에 만족스러운 치료 결과를 얻기에 적절한 것으로 고려되었던 것보다 더 김) 골 재흡수를 오랫동안 억제할 수 있다. 특히 예상과는 다르게, 본 발명자들은 투여 간격이 자연적인 골 재형성 주기를 크게 초과하는 경우에도 만족스러운 치료 결과가 얻어질 수 있음을 알아냈다.
따라서, 본 발명은 비정상적으로 증가된 골 교체 증상의 치료를 요하는 환자에게 유효량의 비스포스포네이트를 비스포스포네이트 투여 사이의 기간이 약 6개월 이상이 되도록 간헐적으로 투여하는 것을 포함하는, 상기 증상의 치료 방법을 제공한다.
본 발명은 또한 비스포스포네이트를 투여 사이의 기간이 약 6개월 이상이 되도록 간헐적으로 투여하는 비정상적으로 증가된 골 교체 증상의 치료에 사용하는 약물의 제조에 있어서 상기 비스포스포네이트의 용도를 제공한다.
본 발명에 따라 치료될 수 있는, 비정상적으로 증가된 골 교체 증상의 치료 또는 예방으로는, 예를 들어 골다공증성 골절 위험을 감소시키기 위한, 폐경후 골다공증의 치료; 폐경후 골다공증의 예방, 예를 들어 폐경후 골 감소증의 예방; 남성 골다공증의 치료 또는 예방; 코르티코스테로이드-유도성 골다공증, 및 디페닐히단토인과 같은 약물 투여 또는 갑상선 호르몬 대체 요법 이후 또는 그로 인하여 나타나는 다른 형태의 골 감소증의 치료 또는 예방; 고정 및 우주 비행과 관련된 골 감소증의 치료 또는 예방; 류마티스성 관절염, 불완전골형성증, 갑상선기능항진증, 신경성 식욕부진증, 장기 이식, 관절 보철의 이완; 및 다른 의학적 증상과 관련된 골 감소증의 치료 또는 예방을 들 수 있다. 예를 들어, 이러한 다른 의학적 증상의 치료 또는 예방에는 류마티스성 관절염에서 관절주위 골 침식의 치료 또는 예방; 골관절염의 치료, 예를 들어 연골하골의 골경화증, 연골하골의 골낭종, 골돌기체 형성의 예방/치료, 및 예를 들어 골내 압력의 감소에 의한 골관절통의 예방/치료; 부갑상선기능항진증, 갑상선기능항진증, 유육종증 또는 비타민(D)과다증 이후의 과도한 골 재흡수로부터 발병하는 혈중칼슘과다증의 치료 또는 예방이 포함된다.
따라서, 본원에서 "치료" 또는 "치료하다"라는 용어는 질병 보균의 위험이 있거나 질병 보균자로 의심되는 환자, 및 질병 또는 의학적 증상을 앓거나 앓는 것으로 진단된 환자의 치료를 포함하여 예방 또는 보존적 치료뿐 아니라 치유성 또는 질병 완화 치료를 의미한다. 특히 바람직한 실시양태에서, 본 발명은 골다공증 및 유사 질환의 예방적 치료를 위해 이용될 수 있다. 즉, 예를 들어 골다공증의 발병 위험이 있는 개인에게 투여 간격 약 6개월 이상의 규칙적인 기준으로 비스포스포네이트를 투여할 수 있는데, 예를 들어 폐경후 여성에게 비스포스포네이트를, 예컨대 연간 6개월마다 1회 또는 그보다 덜 빈번한 투여 간격으로 통상적으로 투여할 수 있다.
본 발명에 따라, 비스포스포네이트 투여 간격은 약 6개월 이상, 예를 들어 180일마다 1회, 또는 덜 빈번하게는 통상적으로 연간 1회, 또는 이들 사이의 임의의 간격, 예를 들어 7개월, 8개월, 9개월, 10개월 또는 11개월마다 1회이다. 연간 1회 초과의 투여 간격, 예를 들어 18개월마다 약 1회 또는 2년마다 약 1회, 또는 보다 덜 빈번하게는 예를 들어 3년마다 약 1회 또는 이보다 덜 빈번한 빈도를 이용할 수 있다.
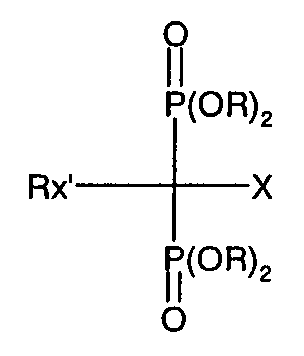
본 발명에서 사용되는 비스포스포네이트는 통상적으로 골 재흡수를 억제하는 것들이다. 이러한 화합물은 예를 들어 하기 화학식 I의 화합물 및 그의 제약상 허용되는 염 또는 임의의 수화물에서 하나의 탄소 원자에 결합된 2개의 포스포네이트기를 포함하여 "P-C-P" 구조를 형성하는 것을 특징으로 한다.
상기 식에서,
X는 수소, 히드록실, 아미노, 알카노일, 또는 C1-C4알킬에 의해 일치환 또는 이치환된 아미노기이고;
R은 수소 또는 C1-4알킬이며;
Rx는 임의로 치환된 히드로카르빌기이다.
따라서, 예를 들어 본 발명에 사용하기 적합한 비스포스포네이트로는 다음과 같은 화합물 또는 그의 제약상 허용되는 염, 또는 그의 임의의 수화물을 들 수 있 다: 3-아미노-1-히드록시프로판-1,1-디포스폰산 (파미드론산), 예를 들어 파미드로네이트 (APD); 3-(N,N-디메틸아미노)-1-히드록시프로판-1,1-디포스폰산, 예를 들어 디메틸-APD; 4-아미노-1-히드록시부탄-1,1-디포스폰산 (알렌드론산), 예를 들어 알렌드로네이트; 1-히드록시-에티덴-비스포스폰산, 예를 들어 에티드로네이트; 1-히드록시-3-(메틸펜틸아미노)-프로필리덴-비스포스폰산 (이반드론산), 예를 들어 이반드로네이트; 6-아미노-1-히드록시헥산-1,1-디포스폰산, 예를 들어 아미노-헥실-BP; 3-(N-메틸-N-n-펜틸아미노)-1-히드록시프로판-1,1-디포스폰산, 예를 들어 메틸-펜틸-APD (= BM 21.0955); 1-히드록시-2-(이미다졸-1-일)에탄-1,1-디포스폰산, 예를 들어 졸레드론산; 1-히드록시-2-(3-피리딜)에탄-1,1-디포스폰산 (리세드론산), 예를 들어 리세드로네이트 (그의 N-메틸 피리디늄 염, 예를 들어 NE-10244 또는 NE-10446와 같은 N-메틸 피리디늄 요오다이드를 포함); 1-(4-클로로페닐티오)메탄-1,1-디포스폰산 (틸루드론산), 예를 들어 틸루드로네이트; 3-[N-(2-페닐티오에틸)-N-메틸아미노]-1-히드록시프로판-1,1-디포스폰산; 1-히드록시-3-(피롤리딘-1-일)프로판-1,1-디포스폰산, 예를 들어 EB1053 (Leo); 1-(N-페닐아미노티오카르보닐)메탄-1,1-디포스폰산, 예를 들어 FR 78844 (Fujisawa); 5-벤조일-3,4-디히드로-2H-피라졸-3,3-디포스폰산 테트라에틸 에스테르, 예를 들어 U-81581 (Upjohn); 1-히드록시-2-(이미다조[1,2-a]피리딘-3-일)에탄-1,1-디포스폰산, 예를 들어 YM 529; 및 1,1-디클로로메탄-1,1-디포스폰산 (클로드론산), 예를 들어 클로드로네이트; YM175.
본 발명에 사용하기에 바람직한 비스포스포네이트는 N-비스포스포네이트, 즉 특징적인 제미널 (geminal) 비스포스포네이트 잔기 (예, "P-C-P")뿐 아니라 질소 함유 측쇄를 포함하는 화합물, 예를 들어 하기 화학식 I'의 화합물 및 그의 제약상 허용되는 염, 또는 그의 임의의 수화물이다.
상기 식에서,
X는 수소, 히드록실, 아미노, 알카노일, 또는 C1-C4알킬로 일치환 또는 이치환된 아미노기이고;
R은 수소 또는 C1-C4알킬이며;
Rx'은 임의로 치환된 아미노기를 포함하는 측쇄, 또는 질소 함유 헤테로고리 (방향족 질소 함유 헤테로고리 포함)이다.
따라서, 예를 들어 본 발명에 사용하기에 적합한 N-비스포스포네이트로는 다음과 같은 화합물 또는 그의 제약상 허용되는 염, 또는 그의 임의의 수화물을 들 수 있다: 3-아미노-1-히드록시프로판-1,1-디포스폰산 (파미드론산), 예를 들어 파미드로네이트 (APD); 3-(N,N-디메틸아미노)-1-히드록시프로판-1,1-디포스폰산, 예를 들어 디메틸-APD; 4-아미노-1-히드록시부탄-1,1-디포스폰산 (알렌드론산), 예를 들어 알렌드로네이트; 1-히드록시-3-(메틸펜틸아미노)-프로필리덴-비스포스폰산, 이반드론산, 예를 들어 이반드로네이트; 6-아미노-1-히드록시헥산-1,1-디포스폰산, 예를 들어 아미노-헥실-BP; 3-(N-메틸-N-n-펜틸아미노)-1-히드록시프로판-1,1-디포스폰산, 예를 들어 메틸-펜틸-APD (= BM 21.0955); 1-히드록시-2-(이미다졸-1-일)에탄-1,1-디포스폰산, 예를 들어 졸레드론산; 1-히드록시-2-(3-피리딜)에탄-1,1-디포스폰산 (리세드론산), 예를 들어 리세드로네이트 (그의 N-메틸 피리디늄 염, 예컨대 NE-10244 또는 NE-10446와 같은 N-메틸 피리디늄 요오다이드 포함); 3-[N-(2-페닐티오에틸)-N-메틸아미노]-1-히드록시프로판-1,1-디포스폰산; 1-히드록시-3-(피롤리딘-1-일)프로판-1,1-디포스폰산, 예를 들어 EB1053 (Leo); 1-(N-페닐아미노티오카르보닐)메탄-1,1-디포스폰산, 예를 들어 FR 78844 (Fujisawa); 5-벤조일-3,4-디히드로-2H-피라졸-3,3-디포스폰산 테트라에틸 에스테르, 예를 들어 U-81581 (Upjohn); 및 1-히드록시-2-(이미다조[1,2-a]피리딘-3-일)에탄-1,1-디포스폰산, 예를 들어 YM 529.
한 실시양태에서, 본 발명에 사용하기에 특히 바람직한 N-비스포스포네이트로는 하기 화학식 II의 화합물 및 그의 약리학적으로 허용되는 염이 포함된다.
상기 식에서,
Het는 이미다졸, 옥사졸, 이속사졸, 옥사디아졸, 티아졸, 티아디아졸, 피리딘, 1,2,3-트리아졸, 1,2,4-트리아졸 또는 벤즈이미다졸 라디칼 (알킬, 알콕시, 할로겐, 히드록실 또는 카르복실에 의해 임의로 치환됨), 아미노기 (알킬 또는 알카노일 라디칼에 의해 임의로 치환됨), 또는 벤질 라디칼 (알킬, 니트로, 아미노 또는 아미노알킬에 의해 임의로 치환됨)이고;
A는 1개 내지 8개의 탄소 원자를 포함하는, 직쇄 또는 분지쇄의 포화 또는 불포화 탄화수소 잔기이고;
X'은 알카노일에 의해 임의로 치환되는 수소 원자, 또는 알킬 또는 알카노일 라디칼에 의해 임의로 치환되는 아미노기이며;
R은 수소 원자 또는 알킬 라디칼이다.
다른 실시양태에서, 본 발명에 사용하기에 특히 바람직한 비스포스포네이트로는 하기 화학식 III의 화합물 및 그의 제약상 허용되는 염, 및 그의 이성질체가 포함된다.
상기 식에서,
Het'은 이미다졸릴, 이미다졸리닐, 이속사졸릴, 옥사졸릴, 옥사졸리닐, 티아 졸릴, 티아졸리닐, 트리아졸릴, 옥사디아졸릴 및 티아디아졸릴로 이루어진 군으로부터 선택되는 포화 또는 불포화 헤테로방향족 5원 고리이며, 이 고리는 부분적으로 할로겐화될 수 있고, 이들 치환기는 C1-C4알킬, C1-C4알콕시, 페닐, 시클로헥실, 시클로헥실메틸, 할로겐 및 아미노로 이루어진 군 중 하나 이상으로부터 선택되며, Het의 인접한 두 알킬 치환기는 함께 제2 고리를 형성할 수 있고;
Y는 수소 또는 C1-C4알킬이고;
X''은 수소, 히드록실, 아미노, 또는 C1-C4알킬로 치환된 아미노기이며;
R은 수소 또는 C1-C4알킬이다.
또 다른 실시양태에서, 본 발명에 사용하기에 특히 바람직한 비스포스포네이트로는 하기 화학식 IV의 화합물 또는 그의 제약상 허용되는 염이 포함된다.
상기 식에서,
Het'''은 이미다졸릴, 2H-1,2,3-, 1H-1,2,4- 또는 4H-1,2,4-트리아졸릴, 테트라졸릴, 옥사졸릴, 이속사졸릴, 옥사디아졸릴, 티아졸릴 또는 티아디아졸릴 라디칼 [비치환되거나, 저급 알킬, 저급 알콕시, 페닐 (저급 알킬, 저급 알콕시 및(또 는) 할로겐에 의해 일치환 또는 이치환될 수 있음), 히드록시, 2-저급 알킬아미노, 저급 알킬티오 및(또는) 할로겐에 의해 C-일치환 또는 -이치환됨]이며, 치환가능한 N-원자가 저급 알킬 또는 페닐-저급 알킬에 의해 N-치환되고 (즉, 페닐 잔기가 저급 알킬, 저급 알콕시 및(또는) 할로겐에 의해 일치환 또는 이치환될 수 있음);
R2는 수소, 히드록시, 아미노, 저급 알킬티오 또는 할로겐, 7개 이하의 탄소 원자를 포함하는 저급 라디칼이다.
본 발명에 사용하기에 특히 바람직한 N-비스포스포네이트의 예로는
2-(1-메틸이미다졸-2-일)-1-히드록시에탄-1,1-디포스폰산;
2-(1-벤질이미다졸-2-일)-1-히드록시에탄-1,1-디포스폰산;
2-(1-메틸이미다졸-4-일)-1-히드록시에탄-1,1-디포스폰산;
1-아미노-2-(1-메틸이미다졸-4-일)에탄-1,1-디포스폰산;
1-아미노-2-(1-벤질이미다졸-4-일)에탄-1,1-디포스폰산;
2-(1-메틸이미다졸-2-일)에탄-1,1-디포스폰산;
2-(1-벤질이미다졸-2-일)에탄-1,1-디포스폰산;
2-(이미다졸-1-일)-1-히드록시에탄-1,1-디포스폰산;
2-(이미다졸-1-일)에탄-1,1-디포스폰산;
2-(4H-1,2,4-트리아졸-4-일)-1-히드록시에탄-1,1-디포스폰산;
2-(티아졸-2-일)에탄-1,1-디포스폰산;
2-(이미다졸-2-일)에탄-1,1-디포스폰산;
2-(2-메틸이미다졸-4(5)-일)에탄-1,1-디포스폰산;
2-(2-페닐이미다졸-4(5)-일)에탄-1,1-디포스폰산;
2-(4,5-디메틸이미다졸-1-일)-1-히드록시에탄-1,1-디포스폰산;
2-(2-메틸이미다졸-4(5)-일)-1-히드록시에탄-1,1-디포스폰산; 및 이들의 약리학적으로 허용되는 염이 있다.
본 발명에 사용하기에 가장 바람직한 N-비스포스포네이트는 2-(이미다졸-1-일)-1-히드록시에탄-1,1-디포스폰산 (졸레드론산) 또는 그의 약리학적으로 허용되는 염이다.
약리학적으로 허용되는 염은 바람직하게는 염기와의 염, 통상적으로 원소의 주기율표의 Ia, Ib, IIa 및 IIb 족으로부터 유도된 금속 염 (알칼리 금속 염 포함), 예를 들어 칼륨, 특히 나트륨 염, 또는 알칼리 토금속 염, 바람직하게는 칼슘 또는 마그네슘 염이며, 또한 암모니아 또는 유기 아민과의 암모늄 염이다.
제약상 허용되는 특히 바람직한 염은 비스포스폰산의 산성 수소들 중 1개, 2개, 3개 또는 4개, 특히 1개 또는 2개가 제약상 허용되는 양이온, 특히 나트륨, 칼륨 또는 암모늄, 우선적으로는 나트륨에 의해 치환된 염이다.
제약상 허용되는 염의 매우 바람직한 군은 각각의 포스폰산 기에서 산성 수소 1개 및 제약상 허용되는 양이온 1개를 갖는 것을 특징으로 한다.
상기에서 구체적으로 언급된 비스포스폰산 유도체는 문헌에 잘 알려져 있다. 이 문헌은 그의 제법을 포함한다 (예를 들어, 문헌 (EP-A-513760, pp. 13-48)을 참조한다). 예를 들어, 3-아미노-1-히드록시프로판-1,1-디포스폰산은 예컨대 미국 특허 제3,962,432호에 기재된 바와 같이, 이나트륨 염은 미국 특허 제4,639,338호 및 동 제4,711,880호에 기재된 바와 같이 제조되며, 1-히드록시-2-(이미다졸-1-일)-에탄-1,1-디포스폰산은 예컨대 미국 특허 제4,939,130호에 기재된 바와 같이 제조된다.
비스포스포네이트 (이하, 본 발명의 물질이라 함)는 이성질체 형태, 또는 경우에 따라 통상적으로 에난티오머 또는 디아스테레오아이소머와 같은 광학 이성질체 또는 기하 이성질체, 통상적으로 시스-트랜스 이성질체로서 이성질체 혼합물 형태로 사용될 수 있다. 광학 이성질체는 순수한 반대 물질 (antipode) 및(또는) 라세미체 형태로 얻어진다.
본 발명의 물질은 또한 그의 수화물 형태로 사용되거나, 그의 결정화를 위해 사용되는 다른 용매를 포함할 수 있다.
본 발명의 물질은 바람직하게는 치료 유효량의 활성 성분을 임의로 투여에 적합한, 액상 또는 고상인 무기 또는 유기의 제약상 허용되는 담체와 함께 포함하는 제약 조성물 형태로 사용된다.
본 발명의 물질은 단독으로 투여되거나, 스테로이드 호르몬과 같은 호르몬, 예를 들어 에스트로겐; 부분 에스트로겐 아고니스트, 또는 에스트로겐-게스타겐 조합; 칼시토닌 또는 그의 동족체 또는 유도체, 예를 들어 연어, 뱀장어 또는 인간 칼시토닌 부갑상선 호르몬 또는 그의 동족체, 예를 들어 PTH(1-84), PTH(1-34), PTH(1-36), PTH(1-38), PTH(1-31)NH2, 또는 PTS 893; SERM (선택적인 에스트로겐 수용체 조절제), 예를 들어 랄록시펜, 라소폭시펜, TSE-424, FC1271, 티볼론 (Tibolone) (Livial, 등록상표); 비타민 D 또는 동족체를 비롯하여 다른 골 활성 약물과 함께 고정된 조합으로 또는 물리적 및 시간적으로 별도로 투여될 수 있다. 이러한 추가의 골 활성 약물은 비스포스포네이트보다 더 자주 투여될 수 있다.
제약 조성물은 예를 들어 장, 예컨대 경구, 직장, 에어로졸 흡입 또는 비내 흡입용 조성물, 비경구, 예컨대 정맥 또는 피하 투여용 조성물, 또는 경피 투여 (예, 수동 또는 전리 투여)용 조성물일 수 있다.
바람직하게는, 제약 조성물은 경구 또는 비경구 (특히, 정맥내, 피하, 근육내 또는 경피) 투여용으로 제제화된다. 정맥 및 경구, 무엇보다도 정맥내 투여가 특히 중요한 것으로 고려된다. 바람직하게는, 비스포스포네이트 활성 성분은 비경구 형태, 가장 바람직하게는 정맥내 형태이다.
특정 투여 방식 및 투여량은 경우에 따라 환자의 세부사항, 특히 연령, 체중, 생활 습관, 활성 수준, 호르몬 상태 (예, 폐경후) 및 골 미네랄 밀도를 고려하여 치료 담당 의사에 의해 선택될 수 있다.
본 발명의 물질의 투여량은, 예를 들어 사용된 비스포스포네이트의 상대적 효능, 투여 방식, 온혈 동물, 및(또는) 온혈 동물의 성별, 연령, 체중 및 개별 증상을 비롯하여 활성 성분의 효능 및 작용 기간과 같은 다양한 인자들에 따라 달라질 수 있다.
통상적으로 투여량은, 체중이 대략 75 kg인 온혈 동물에게 비스포스포네이트 활성 성분 0.005 내지 20 mg/kg, 특히 0.01 내지 10 mg/kg의 단일 투여량이 투여되는 양을 말한다.
"mg/kg"은 인간을 비롯한 치료될 포유동물의 체중 kg 당 약물 mg을 의미한다.
상기 언급한 투여량은 통상적으로 투여 사이에 약 6개월 이상의 기간을 두고 간헐적으로 투여된다. 비스포스포네이트 투여 사이의 기간은 더 길수 있으며, 예를 들어 편리하게는 연간 1회, 18개월마다 1회 또는 2년마다 1회, 또는 더 긴 기간, 또는 이들 사이의 임의의 기간일 수 있다.
단일한 투여 단위 형태의 제제는 활성 성분을 바람직하게는 약 1% 내지 약 90% 포함하며, 단일한 투여 단위 형태가 아닌 제제는 바람직하게는 활성 성분을 약 0.1% 내지 약 20% 포함한다. 주입 용액 제조를 위한 주입 용액 또는 고체의 앰플, 캡슐, 정제 또는 당의정제와 같은 단일한 투여 단위 형태는 예를 들어 활성 성분 약 0.5 mg 내지 약 500 mg을 포함한다. 사용되는 실제 단위 투여량은 무엇보다도 비스포스포네이트의 효능, 투여 간격 및 투여 경로에 의존할 것으로 생각된다. 따라서, 단위 투여량의 크기는 통상적으로 보다 강력한 비스포스포네이트의 경우 더 적고, 투여 간격은 더 길다. 예를 들어, 보다 강력한 N-비스포스포네이트, 예를 들어 졸레드론산의 경우, 비경구, 예를 들어 정맥내 투여에 있어서 약 1 내지 약 10 mg의 단위 투여량이 사용될 수 있다. 예를 들어, 또한 보다 강력한 N-비스포스포네이트의 경우 6개월마다 1회 투여할 때 약 1 내지 약 5 mg의 단위 투여량이 비경구적으로 사용될 수 있지만, 비경구 투여로 연간 1회 투여하는 경우에는 약 2 내지 약 10 mg의 투여량이 사용될 수 있다.
단위 투여량은 단일 또는 분할 투여로 투여될 수 있는데, 즉 단위 투여량은 같은 분량 또는 다른 분량으로 2회 이상으로 나누어지며, 이 분량은 중복 기간 동안 동시에 또는 별도의 시점에서 환자에게 투여된다. 단위 투여량이 별도의 시점에서 분할 투여로 투여되는 경우, 분할 투여의 각 투여 사이의 간격은 몇시간, 예를 들어 1시간에서 약 1개월 (약 30일)까지일 수 있다. 본 발명에 따라, 분할 투여의 마지막 투여 시기와 다음 분할 투여의 첫째 투여 사이의 시간 간격은 적어도 6개월 이상, 예를 들어 약 1년이다.
따라서, 예를 들어 10 mg의 단위 투여량이 분할 투여 사이에서 약 1주 내지 약 1개월, 예를 들어 약 2주의 간격으로 동등한 5 mg의 분량으로 2회 투여될 수 있다. 또는, 예를 들어 5 mg의 단위 투여량이 분할 투여 사이에서 1일 내지 3일부터 1주 내지 3주, 예를 들어 약 1주 간격으로 동등하지 않은 4 mg 및 1 mg (또는 3 mg 및 2 mg)의 2가지 분량으로 투여될 수 있다.
장용 및 비경구 투여용 제약 제제는, 예를 들어 투여 단위 형태, 예를 들어 당의정제, 정제 또는 캡슐제, 및 앰플 형태이다. 이들은 그 자체로 공지된 방식으로, 예를 들어 통상의 혼합, 과립화, 당제 조제 (confectioning), 용해 또는 동결건조 방법에 의해 제조된다. 예를 들어, 경구 투여용 제약 제제는 활성 성분을 고상 담체와 배합하여, 경우에 따라 생성된 혼합물을 과립화하고, 원한다면 또는 필요에 따라 적합한 보조제를 첨가한 다음에 혼합물 또는 과립을 정제 또는 당의정제 코어로 가공하여 얻을 수 있다.
적합한 담체는 특히 충전제, 예를 들어 당, 예컨대 락토스, 사카로스, 만니톨 또는 소르비톨, 셀룰로스 제제, 및 결합제, 예를 들어 전분 페이스트이며, 예를 들어 옥수수, 밀, 쌀 또는 감자 전분, 젤라틴, 트라가칸쓰, 메틸셀룰로스 및(또는) 폴리비닐피롤리돈 및, 원한다면 상기 언급한 전분과 같은 붕해제, 또한 카르복시메틸 전분, 가교결합된 폴리비닐피롤리돈, 아가 또는 알긴산 또는 그의 염, 예를 들어 알긴산나트륨을 사용한다. 보조제는 특히 유동성 조절제 및 윤활제, 예를 들어 규산, 탈크, 스테아르산 또는 그의 염, 예를 들어 마그네슘 또는 칼슘 스테아레이트, 및(또는) 폴리에틸렌글리콜이다. 특히, 임의로 아라비아검, 탈크, 폴리비닐피롤리돈, 폴리에틸렌글리콜 및(또는) 이산화티탄, 또는 적합한 유기 용매 또는 용매 혼합물 중 래커 용액을 포함하는 농축 당 용액을 사용하여 위산에 내성이 있는 적합한 코팅을 당의정제 코어에 제공하거나, 적합한 셀룰로스 제제, 예를 들어 아세틸셀룰로스 프탈레이트 또는 히드록시프로필메틸셀룰로스 프탈레이트의 용액을 사용하여 위산에 내성이 있는 코팅을 생성한다. 예를 들어 식별 목적으로 또는 활성 성분의 상이한 투여량을 나타내기 위해 착색 물질 또는 안료를 정제 또는 당의정제 코팅에 첨가할 수 있다.
경구로 투여가능한 다른 제약 제제는 젤라틴으로 이루어진 건조-충전 캡슐, 및 젤라틴 및 가소제, 예를 들어 글리세롤 또는 소르비톨로 이루어진 연질의 밀봉 캡슐제이다. 건조 충전된 캡슐은 예컨대 충전제, 예를 들어 락토스, 결합제, 예를 들어 전분, 및(또는) 활주제, 예를 들어 탈크 또는 마그네슘 스테아레이트, 및 경우에 따라 안정화제와 함께 과립 형태로 활성 성분을 포함할 수 있다. 연질 캡슐에서, 활성 성분을 바람직하게는 적합한 액체, 예를 들어 지방 오일, 파라핀 오일 또는 액상 폴리에틸렌글리콜 중에 용해시키거나 현탁시키며, 안정화제를 첨가할 수 도 있다.
비경구 제제는 다양한 방식으로, 예를 들어 근육내, 복강내, 비내, 피내, 피하 또는 바람직하게는 정맥내와 같은 방식으로 효과적이며, 특히 주사가능한 액체이다. 이러한 액체는 바람직하게는 사용에 앞서, 예를 들어 활성 성분을 단독으로 포함하거나, 또는 제약상 허용되는 담체와 함께 포함하는 동결건조된 제제, 또는 농축액으로부터 제조될 수 있는 등장성 수용액 또는 현탁액이다. 제약 제제는 멸균되고(되거나) 보조제, 예를 들어 보존제, 안정화제, 습윤제 및(또는) 유화제, 용해제, 삼투압 조절용 염 및(또는) 완충제를 포함할 수 있다.
경피 투여에 적합한 제제는 유효량의 활성 성분을 담체와 함께 포함한다. 유리한 담체는 숙주의 피부를 통한 통과를 보조하는, 흡수가능하며 약리학적으로 허용되는 용매를 포함한다. 특징적으로, 경피 장치는 배킹 부재, 화합물을 임의로 담체와 함께 포함하는 용기, 임의로 활성 성분을 장기간에 걸쳐 조절된 속도 및 정해진 속도로 숙주의 피부로 전달하는 속도 조절용 차단막, 및 피부에 장치를 보존하는 수단을 포함하는 붕대 (bandage) 형태이다.
하기 실시예는 상기 기술된 본 발명에 대한 설명이다.
하기 실시예에서 "활성 성분"이라는 용어는 본 발명에서 유용한 것으로 상기에 언급된 비스포스폰산 유도체 중 임의의 하나인 것으로 생각된다.
실시예 1: 활성 성분으로, 예를 들어 파미드론산이나트륨 5수화물의 코팅된 펠릿을 포함하는 캡슐:
코어 펠릿:
활성 성분 (분쇄) 197.3 mg
미세결정질 셀룰로스 52.7 mg
(Avicel (등록상표) PH 105) ---------
250.0 mg
+ 내부 코팅:
셀룰로스 HP-M 603 10.0 mg
폴리에틸렌글리콜 2.0 mg
탈크 8.0 mg
270.0 mg
+ 위산-내성 외부 코팅:
유드라지트 (등록상표) L30D (고상) 90.0 mg
트리에틸 시트레이트 21.0 mg
안티폼 (등록상표) AF 2.0 mg
물
탈크 7.0 mg
390.0 mg
파미드론산 이나트륨과 아비셀 (등록상표) PH 105의 혼합물을 물로 습윤화하고, 혼합하고 압출하여 구형으로 제조하였다. 이어서 건조된 펠릿을 유동층에서 내부 코팅 (셀룰로스 HP-M 603, 폴리에틸렌글리콜 (PEG) 8000 및 탈크로 이루어짐) 및 수성 위산-내성 코팅 (유드라지트 (등록상표) L30D, 트리에틸 시트레이트 및 안티폼 (등록상표) AF로 이루어짐)으로 성공적으로 코팅하였다. 코팅된 펠릿을 탈크로 분말화하고, 예를 들어 회플링거 (Hoeflinger) 및 카르크 (Karg)와 같은 시판되는 캡슐 충전기를 사용하여 캡슐 (캡슐 사이즈 O)내에 충전하였다.
실시예 2: 활성 성분으로, 예를 들어 1-히드록시-2-(이미다졸-1-일)-에탄-1,1-디포스폰산을 포함하는 단일형 접착제 경피계:
조성:
폴리이소부틸렌 (PIB) 300 5.0 g
(Oppanol B1, BASF)
PIB 35000 3.0 g
(Oppanol B10, BASF)
PIB 1200000 9.0 g
(Oppanol B100, BASF)
수소화 탄화수소 수지 43.0 g
(Escorez 5320, Exxon)
1-도데실아자시클로헵탄-2-온 20.0 g
(Azone, Nelson Res., Irvine/CA)
활성 성분 20.0 g
총 100.0 g
제조:
롤러 기어 베드상에서 회전시켜 상기 성분들을 함께 특정 비점의 석유 분획 (100-125) 150 g 중에 용해시켰다. 300 mm 닥터 블레이드를 사용하는 도포 장치에 의해 용액을 폴리에스테르 필름 (Hostaphan, Kalle)에 도포하여, 약 75 g/m2의 코팅을 얻었다. 건조 (60 ℃에서 15분) 후에, 실리콘-처리된 폴리에스테르 필름 (두께: 75 mm, Laufenberg)을 벗겨진 필름으로 이용하였다. 펀칭 기구를 사용하여, 마감처리된 시스템을 5 내지 30 cm2의 원하는 형태의 크기로 펀칭하였다. 완성된 시스템을 알루미늄 페이퍼의 자켓에 각각 밀봉하였다.
실시예 3: 무수의 동결건조된 1-히드록시-2-(이미다졸-1-일)에탄-1,1-디포스폰산 (그의 혼합 나트륨 염) 1.0 mg을 포함하는 바이알. 물 1 ml로 희석시킨 후, 정맥 주입용 용액 (농도 1 mg/ml)을 얻었다.
조성:
활성 성분 (유리 디포스폰산) 1.0 mg
만니톨 46.0 mg
시트르산 삼나트륨 ×2H2O 약 3.0 mg
물 1 ml
주사용수 1 ml
물 1 ml 중에서, 활성 성분을 시트르산 삼나트륨 ×2H2O (pH 6.0)로 적정하였다. 이어서, 만니톨을 첨가하고, 용액을 동결건조하고, 동결물을 바이알에 충전하였다.
실시예 4: 활성 성분, 예를 들어 물에 용해된 파미드론산 이나트륨 5수화물을 포함하는 앰플. 용액 (농도 3 mg/ml)은 희석 이후 정맥내 주입을 위한 것이다.
조성:
활성 성분: 19.73 mg
(무수 활성 성분 5.0 mg 또는 대략 그 정도의 양)
만니톨 250 mg
주사용수 5 ml
실시예 5: 환자 치료
"졸레드로네이트의 정맥내 환괴 주사를 이용한 폐경후 골다공증의 치료에서 다국적의 무작위적 이중 맹검 위약-조절된 유사 군의 투여량 범위, 안정성 및 효능 실험"
이 실험은 폐경후 골다공증을 앓는 환자에서 정맥내 졸레드론산의 투여 및 투여 요법-결과에 대한 12개월 동안의 실험이다. 351명의 환자를 무작위적으로 6개의 연구 군으로 나누었다. 최근에 골 활성 약물, 예를 들어 비스포스포네이트, 에스트로겐, 칼시토닌, 랄록시펜, 또는 대사성 골 질환의 병력에 노출된 적이 있는 환자는 제외시켰다. 모든 환자들은 기준 시점에서 평가하고, 3개월마다 내원하여 평가하였다. 내원시마다 졸레드론산 또는 위약을 5분 동안 말초 정맥내에 정맥내 환괴 주사로 투여하였다.
6개월, 9개월 및 12개월째에 이중 에너지 X-선 흡수계측 (DEXA)에 의해 측정된 골 미네랄 밀도 (BMD)의 기준 시점으로부터의 비율 변화를 위약과의 비교로 측정하여 효능을 조사하였다.
특유의 안전한 측정으로, 트랜스-장골의 골 생검을 12개월째 모든 연구 군의 환자 부분집합에서 얻었으며, 모든 연구 참여자들의 흉추 및 요추의 X-선 촬영 결과를 기준 시점 및 척추 골절 발생시의 12개월째에 평가하였다.
또한, 골 교체 부갑상선 호르몬 (PTH), 골 특이적 알칼리 포스파타제 (BSAP), 혈청 C-텔로펩티드 (CTX), 혈청 오스테오칼신, 요중 N-텔로펩티드 (NTX)/크레아티닌 비율, 요중 데옥시피리디놀린 (dpyd)/크레아티닌 비율, 요중 피리디놀린 (pyd)/크레아티닌 비율의 생화학적 마커의 억제 정도 및 기간을 3개월마다 얻고, 중앙 실험실에서 측정하였다.
연구 군
ㆍ위약
ㆍ졸레드론산 0.25 mg, 3개월마다
ㆍ졸레드론산 0.5 mg, 3개월마다
ㆍ졸레드론산 1.0 mg, 3개월마다
ㆍ졸레드론산 2.0 mg, 6개월마다
ㆍ졸레드론산 4.0 mg, 12개월마다
12개월의 결과는 모든 처리 군에 있어서 BMD의 기준으로부터의 비율 변화가 위약보다 유의하게 (p < 0.001) 더 크며, 서로 다르지 않다는 것을 입증하였다.
| 척추의 골 미네랄 밀도의 기준으로부터의 비율 변화에 대하여 활성 투여량의 졸레드로네이트 대 위약의 단계적인 여러 비교에 관한 요약; 12개월째 전후 (L1-L4) 확인 분석 ITT 집단 | |||||
| 단계 번호 | 가장 중요한 대조 | 차이 | 차이의 표준 오차 | 97.5% 신뢰 하한 | p-값 |
| 1 | 졸레드로네이트 4 ×0.25 mg - 위약 | 5.1 | 0.55 | 3.7 | < 0.001 |
| 2 | 졸레드로네이트 4 ×0.5 mg - 위약 | 4.9 | 0.56 | 3.5 | < 0.001 |
| 3 | 졸레드로네이트 1 ×4.0 mg - 위약 | 4.6 | 0.53 | 3.3 | < 0.001 |
| 4 | 졸레드로네이트 4 ×1.0 mg - 위약 | 4.5 | 0.55 | 3.2 | < 0.001 |
| 5 | 졸레드로네이트 2 ×2.0 mg - 위약 | 4.2 | 0.57 | 3.1 | < 0.001 |
| 주의: 1-측면의 여러 알파 수준 2.5%에서 활성 투여량의 졸레드로네이트 대 위약의 단계적인 여러 비교는 문헌 (Marcus, Peritz and Gabriel (1976))에 따른 여러가지 비교를 위해 조정하였다. | |||||
척추, 둔부, 요골 말단 및 "전신"의 골 미네랄 밀도는 위약에 비해 증가하였다. 골 형성 및 골 재흡수의 생화학적 마커의 억제는 6개월 및 12개월의 투여 간격에 걸쳐 골 교체를 폐경전 수준으로 억제하는 것으로 입증하는 BMD 결과를 확인 및 뒷받침하였다.
BMD 데이타는 6개월 또는 12개월마다와 같이 빈번하지 않은 졸레드론산의 투여가 통계적으로 유의하며 의학적으로 적절한 골 질량 증가를 안전하게 유발할 수 있음을 나타낸다. 이러한 데이타는 또한 추가의 투여 없이 1년 넘게 새로운 골을 지속적으로 보존하는 것이 가능하다는 것, 또는 추가의 골 질량 증가가 가능하다는 것을 암시하는 것으로 믿어진다. 또한, 6개월, 12개월마다 또는 그보다 덜 빈번하게 투여하는 투여 사이클의 재-처리는 추가의 BMD 증가를 초래할 것으로 생각된다. 골다공증성 골절 위험의 감소는 골 질량 증가를 수반할 것으로 예상된다.
Claims (18)
1-히드록시-2-(이미다졸-1-일)에탄-1,1-디포스폰산인 비스포스포네이트 또는 그의 제약상 허용되는 염 또는 그의 수화물을 포함하고, 상기 비스포스포네이트가 투여 사이의 기간이 6개월 이상이 되도록 간헐적으로 투여되는, 비정상적으로 증가된 골 교체(bone turnover) 증상 치료하기 위한,
여기서, 상기 비정상적으로 증가된 골 교체 증상 치료는
골다공증성 골절 위험을 감소시키기 위한, 폐경후 골다공증의 치료; 폐경후 골다공증의 예방; 남성 골다공증의 치료 또는 예방; 코르티코스테로이드-유도성 골다공증, 또는 약물 투여 또는 갑상선 호르몬 대체 요법 이후 또는 그로 인하여 나타나는 다른 형태의 골 감소증의 치료 또는 예방; 고정 또는 우주 비행과 관련된 골 감소증의 치료 또는 예방; 류마티스성 관절염, 불완전골형성증, 갑상선기능항진증, 신경성 식욕부진증, 장기 이식, 관절 보철의 이완과 관련된 골 감소증의 치료 또는 예방; 류마티스성 관절염에서 관절주위 골 침식의 치료 또는 예방; 골관절염의 치료; 또는 부갑상선기능항진증, 갑상선기능항진증, 유육종증 또는 비타민(D)과다증 이후의 과도한 골 재흡수로부터 발병하는 혈중칼슘과다증의 치료 또는 예방인, 제약조성물.
삭제
제1항에 있어서, 비스포스포네이트 투여 사이의 기간이 연간 1회 이상인 제약 조성물.
삭제
제1항에 있어서, 골다공증의 예방 치료를 위한 것으로 비스포스포네이트의 투여 사이의 기간이 연간 1회이거나, 그보다 덜 빈번하게 투여되는 제약 조성물.
삭제
제1항에 있어서, 골다공증의 예방 치료를 위한 것으로 비스포스포네이트의 투여 사이의 기간이 18개월마다 1회 또는 2년마다 1회이거나, 그보다 덜 빈번하게 투여되는 제약 조성물.
제1항에 있어서, 비스포스포네이트가 비경구적으로 투여되는 제약 조성물.
제1항 또는 제3항에 있어서, 비스포스포네이트가 정맥내, 피하, 근육내 또는 경피로 투여되는 제약 조성물.
삭제
1-히드록시-2-(이미다졸-1-일)에탄-1,1-디포스폰산인 N-비스포스포네이트 또는 그의 제약상 허용되는 염 또는 그의 수화물 1 mg 내지 10 mg을 포함하고, 비스포스포네이트 투여 사이의 기간이 6개월 이상인, 비경구 투여용으로 제제화되고 비정상적으로 증가된 골 교체 증상을 치료하기 위한,
여기서, 상기 비정상적으로 증가된 골 교체 증상 치료는
골다공증성 골절 위험을 감소시키기 위한, 폐경후 골다공증의 치료; 폐경후 골다공증의 예방; 남성 골다공증의 치료 또는 예방; 코르티코스테로이드-유도성 골다공증, 또는 약물 투여 또는 갑상선 호르몬 대체 요법 이후 또는 그로 인하여 나타나는 다른 형태의 골 감소증의 치료 또는 예방; 고정 또는 우주 비행과 관련된 골 감소증의 치료 또는 예방; 류마티스성 관절염, 불완전골형성증, 갑상선기능항진증, 신경성 식욕부진증, 장기 이식, 관절 보철의 이완과 관련된 골 감소증의 치료 또는 예방; 류마티스성 관절염에서 관절주위 골 침식의 치료 또는 예방; 골관절염의 치료; 또는 부갑상선기능항진증, 갑상선기능항진증, 유육종증 또는 비타민(D)과다증 이후의 과도한 골 재흡수로부터 발병하는 혈중칼슘과다증의 치료 또는 예방인, 단위 투여 형태의 제약 제제.
제11항에 있어서, N-비스포스포네이트 또는 그의 제약상 허용되는 염, 또는 그의 수화물 1 mg 내지 5 mg을 포함하고, 비스포스포네이트 투여 사이의 기간이 6개월마다 1회인 단위 투여 형태의 제약 제제.
제11항에 있어서, N-비스포스포네이트 또는 그의 제약상 허용되는 염, 또는 그의 수화물 2 mg 내지 10 mg을 포함하고, 비스포스포네이트 투여 사이의 기간이 연간 1회인 단위 투여 형태의 제약 제제.
삭제
1-히드록시-2-(이미다졸-1-일)에탄-1,1-디포스폰산인 N-비스포스포네이트 또는 그의 제약상 허용되는 염 또는 그의 수화물 1 내지 10 mg을 포함하고 비경구 투여용으로 제제화된 하나 이상의 단위 투여 형태를, 개개의 단위 투여량을 6개월 이상의 간격으로 투여하는 것에 관한 지침과 함께 포함하며, 비정상적으로 증가된 골 교체 증상을 치료하기 위한,
여기서, 상기 비정상적으로 증가된 골 교체 증상 치료는
골다공증성 골절 위험을 감소시키기 위한, 폐경후 골다공증의 치료; 폐경후 골다공증의 예방; 남성 골다공증의 치료 또는 예방; 코르티코스테로이드-유도성 골다공증, 또는 약물 투여 또는 갑상선 호르몬 대체 요법 이후 또는 그로 인하여 나타나는 다른 형태의 골 감소증의 치료 또는 예방; 고정 또는 우주 비행과 관련된 골 감소증의 치료 또는 예방; 류마티스성 관절염, 불완전골형성증, 갑상선기능항진증, 신경성 식욕부진증, 장기 이식, 관절 보철의 이완과 관련된 골 감소증의 치료 또는 예방; 류마티스성 관절염에서 관절주위 골 침식의 치료 또는 예방; 골관절염의 치료; 또는 부갑상선기능항진증, 갑상선기능항진증, 유육종증 또는 비타민(D)과다증 이후의 과도한 골 재흡수로부터 발병하는 혈중칼슘과다증의 치료 또는 예방인, 키트.
제15항에 있어서, 상기 단위 투여 형태가 1 mg 내지 5 mg을 포함하고, 비스포스포네이트 투여 사이의 기간이 6개월마다 1회인 키트.
제15항에 있어서, 상기 단위 투여 형태가 2 mg 내지 10 mg을 포함하고, 비스포스포네이트 투여 사이의 기간이 연간 1회인 키트.
삭제
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US59713500A | 2000-06-20 | 2000-06-20 | |
| US09/597,135 | 2000-06-20 | ||
| US26768901P | 2001-02-09 | 2001-02-09 | |
| US60/267,689 | 2001-02-09 | ||
| PCT/EP2001/006850 WO2001097788A2 (en) | 2000-06-20 | 2001-06-18 | Method of administering bisphosphonates |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20030015283A KR20030015283A (ko) | 2003-02-20 |
| KR100864743B1 true KR100864743B1 (ko) | 2008-10-22 |
Family
ID=26952565
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020027017283A KR100864743B1 (ko) | 2000-06-20 | 2001-06-18 | 비스포스포네이트의 투여 방법 |
Country Status (25)
| Country | Link |
|---|---|
| US (1) | US8052987B2 (ko) |
| EP (1) | EP1296689B3 (ko) |
| JP (2) | JP4722375B2 (ko) |
| KR (1) | KR100864743B1 (ko) |
| CN (1) | CN1272013C (ko) |
| AT (1) | ATE304856T1 (ko) |
| AU (2) | AU2001274109B2 (ko) |
| BR (1) | BR0111806A (ko) |
| CA (1) | CA2410201C (ko) |
| CY (2) | CY1113740T1 (ko) |
| CZ (1) | CZ301972B6 (ko) |
| DE (1) | DE60113537T3 (ko) |
| DK (1) | DK1296689T3 (ko) |
| ES (2) | ES2247123T7 (ko) |
| HK (1) | HK1072539A1 (ko) |
| HU (1) | HU228400B1 (ko) |
| IL (2) | IL153229A0 (ko) |
| MX (1) | MXPA02012682A (ko) |
| NO (1) | NO330459B1 (ko) |
| NZ (1) | NZ523086A (ko) |
| PL (1) | PL203087B1 (ko) |
| PT (1) | PT1591122E (ko) |
| SK (1) | SK287278B6 (ko) |
| TW (1) | TWI289451B (ko) |
| WO (1) | WO2001097788A2 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018190685A1 (ko) * | 2017-04-14 | 2018-10-18 | 연세대학교 산학협력단 | 비스포스포네이트를 포함하는 만성 이식신 기능부전 예방 또는 치료용 조성물 |
| KR20190007082A (ko) * | 2019-01-14 | 2019-01-21 | 연세대학교 산학협력단 | 비스포스포네이트를 포함하는 만성 이식신 기능부전 예방 또는 치료용 조성물 |
Families Citing this family (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070148228A1 (en) * | 1999-02-22 | 2007-06-28 | Merrion Research I Limited | Solid oral dosage form containing an enhancer |
| US8119159B2 (en) * | 1999-02-22 | 2012-02-21 | Merrion Research Iii Limited | Solid oral dosage form containing an enhancer |
| US7658938B2 (en) | 1999-02-22 | 2010-02-09 | Merrion Reasearch III Limited | Solid oral dosage form containing an enhancer |
| NZ523086A (en) | 2000-06-20 | 2007-07-27 | Novartis Ag | Method of administering bisphosphonates |
| EP1192945A3 (en) * | 2000-09-21 | 2004-03-03 | Pfizer Products Inc. | Use of an estrogen agonist/antagonist for treating osteoarthritis |
| WO2002080933A1 (en) * | 2001-04-03 | 2002-10-17 | The Royal Alexandra Hospital For Children | A drug for use in bone grafting |
| US20050070504A1 (en) * | 2001-12-21 | 2005-03-31 | The Procter & Gamble Co. | Risedronate compositions and their methods of use |
| GB0204756D0 (en) * | 2002-02-28 | 2002-04-17 | Novartis Ag | Organic compounds |
| JP2005522526A (ja) | 2002-05-10 | 2005-07-28 | エフ.ホフマン−ラ ロシュ アーゲー | 骨粗鬆症の治療および予防用のビスホスホン酸 |
| ES2376425T3 (es) * | 2002-09-16 | 2012-03-13 | Novartis Ag | �?cido zoledrónico para prevenir o reducir fracturas secundarias tras fractura de cadera. |
| CN1705485A (zh) * | 2002-10-15 | 2005-12-07 | 诺瓦提斯公司 | 施用双膦酸类化合物的方法 |
| EP1790347B1 (en) | 2002-12-20 | 2014-12-24 | F. Hoffmann-La Roche AG | High dose ibandronate formulation |
| US20070191311A1 (en) * | 2004-01-30 | 2007-08-16 | Shuichiro Kakimoto | P2x receptor inhibitor |
| EP1930011B1 (en) * | 2004-08-23 | 2011-08-17 | Teva Pharmaceutical Industries Ltd | Crystalline form of ibandronate sodium |
| WO2006062876A2 (en) * | 2004-12-09 | 2006-06-15 | Merck & Co., Inc. | Estrogen receptor modulators |
| US7709508B2 (en) | 2004-12-09 | 2010-05-04 | Merck Sharp & Dohme | Estrogen receptor modulators |
| US8071574B2 (en) * | 2005-02-22 | 2011-12-06 | John Dennis Bobyn | Implant improving local bone formation |
| US7473684B2 (en) * | 2005-09-16 | 2009-01-06 | Selamine Limited | Bisphosphonate formulation |
| MX2008012678A (es) * | 2006-04-07 | 2008-12-17 | Merrion Res Iii Ltd | Forma de dosis oral solida que contiene un mejorador. |
| WO2007124274A1 (en) * | 2006-04-21 | 2007-11-01 | The Uab Research Foundation | Treating neoplasms |
| US20080139514A1 (en) * | 2006-11-29 | 2008-06-12 | Subhash Pandurang Gore | Diphosphonic acid pharmaceutical compositions |
| US20100068211A1 (en) * | 2008-02-08 | 2010-03-18 | Bateman Ted A | Use of antiresorptive compounds to prevent ionizing radiation-induced activation of osteoclasts and resulting bone loss |
| MX2010012201A (es) * | 2008-05-07 | 2011-05-30 | Merrion Res Iii Ltd | Composiciones de péptidos y procedimientos de preparación de las mismas. |
| JP2012518686A (ja) * | 2009-02-25 | 2012-08-16 | メリオン・リサーチ・Iii・リミテッド | ビスホスホネート類の組成物および薬物送達 |
| JP5852569B2 (ja) | 2009-07-31 | 2016-02-03 | タール ファーマシューティカルズ,インコーポレイテッド | 結晶化方法および生物学的利用能 |
| US20160016982A1 (en) | 2009-07-31 | 2016-01-21 | Thar Pharmaceuticals, Inc. | Crystallization method and bioavailability |
| US9169279B2 (en) | 2009-07-31 | 2015-10-27 | Thar Pharmaceuticals, Inc. | Crystallization method and bioavailability |
| US9867838B2 (en) | 2009-09-01 | 2018-01-16 | Duke University | Methods for treating heart failure using bisphosphonate compositions |
| US20110182985A1 (en) * | 2010-01-28 | 2011-07-28 | Coughlan David C | Solid Pharmaceutical Composition with Enhancers and Methods of Preparing thereof |
| US9089484B2 (en) * | 2010-03-26 | 2015-07-28 | Merrion Research Iii Limited | Pharmaceutical compositions of selective factor Xa inhibitors for oral administration |
| US9340565B2 (en) | 2010-11-24 | 2016-05-17 | Thar Pharmaceuticals, Inc. | Crystalline forms |
| WO2012094598A2 (en) | 2011-01-07 | 2012-07-12 | Merrion Research Iii Limited | Pharmaceutical compositions of iron for oral administration |
| CN104010647A (zh) | 2011-11-16 | 2014-08-27 | 杜克大学 | 用于治疗和/或减轻心功能障碍的双膦酸盐组合物及方法 |
| CN103623465B (zh) * | 2013-11-21 | 2015-12-30 | 彭江 | 一种可局部调节成破骨活性的组织工程骨支架及制备方法 |
| WO2016120378A1 (en) | 2015-01-29 | 2016-08-04 | Novo Nordisk A/S | Tablets comprising glp-1 agonist and enteric coating |
| WO2017208070A1 (en) | 2016-05-31 | 2017-12-07 | Grünenthal GmbH | Bisphosphonic acid and coformers with lysin, glycin, nicotinamide for treating psoriatic arthritis |
| GB201716716D0 (en) | 2017-10-12 | 2017-11-29 | Univ Of Hertfordshire Higher Education Corporation | Method for coating particles |
| AU2019370565A1 (en) * | 2018-11-02 | 2021-06-24 | Ampersand Biopharmaceuticals, Inc. | Management of risk of cation overload and electrolyte imbalance with topically applied buffers |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6015801A (en) | 1997-07-22 | 2000-01-18 | Merck & Co., Inc. | Method for inhibiting bone resorption |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US594329A (en) * | 1897-11-23 | Socket or collet | ||
| DE3232959A1 (de) | 1982-09-04 | 1984-03-08 | Hoechst Ag, 6230 Frankfurt | Substituierte benzolsulfonsaeureester, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel |
| EP0381296B1 (en) | 1984-04-30 | 1994-11-30 | THE PROCTER & GAMBLE COMPANY | Kit for use in the treatment of osteoporosis |
| US4812304A (en) * | 1984-12-21 | 1989-03-14 | The Procter & Gamble Company | Treatment of osteoporosis |
| US4822609A (en) * | 1984-12-21 | 1989-04-18 | The Procter & Gamble Company | Treatment of osteoporosis |
| US4812311A (en) * | 1984-12-21 | 1989-03-14 | The Procter & Gamble Company | Kit for use in the treatment of osteoporosis |
| US4761406A (en) | 1985-06-06 | 1988-08-02 | The Procter & Gamble Company | Regimen for treating osteoporosis |
| ES2038692T4 (es) * | 1986-11-21 | 2012-02-10 | Novartis Ag | Procedimiento para la obtencion de acidos alcanodifosfonicos substituidos. |
| JPH07502507A (ja) * | 1991-12-17 | 1995-03-16 | プロクター、エンド、ギャンブル、ファーマスーティカルズ、インコーポレーテッド | ビスホスホネート類及び副甲状腺ホルモンを用いた骨粗鬆症の治療方法 |
| CA2138367C (en) | 1992-06-30 | 1998-09-22 | Marion David Francis | Use of phosphonates for the treatment of osteoporosis |
| AU670337B2 (en) * | 1992-11-30 | 1996-07-11 | Novartis Ag | Use of certain methanebisphosphonic acid derivatives in fracture healing |
| EP0600834A1 (en) | 1992-11-30 | 1994-06-08 | Ciba-Geigy Ag | Use of methanebisphosphonic acid derivatives for the manufacture of a medicament for fracture healing |
| US5366965A (en) * | 1993-01-29 | 1994-11-22 | Boehringer Mannheim Gmbh | Regimen for treatment or prophylaxis of osteoporosis |
| GB9408775D0 (en) * | 1994-05-04 | 1994-06-22 | Ciba Geigy Ag | Use of certain methanebisphosphonic acid derivatives to prevent prothesis loosening and prothesis migration |
| CN1157565A (zh) | 1994-09-09 | 1997-08-20 | 普罗克特和甘保尔公司 | 用骨活性膦酸盐和甲状旁腺激素治疗骨质疏松症的方法 |
| EP0779813A4 (en) | 1994-09-09 | 1998-05-06 | Procter & Gamble | PHOSPHONATES AND PARATHORMONE AGAINST OSTEOPOROSIS |
| PT854724E (pt) | 1995-09-29 | 2005-08-31 | Novartis Ag | Metodo de tratar a doenca navicular em cavalos |
| US5730715A (en) * | 1996-06-14 | 1998-03-24 | Becton Dickinson And Company | Method for the iontophoretic administration of bisphosphonates |
| US5735810A (en) | 1996-06-14 | 1998-04-07 | Becton Dickinson And Company | Device for the iontophoretic administration of bisphosphonates |
| SE9702401D0 (sv) | 1997-06-19 | 1997-06-19 | Astra Ab | Pharmaceutical use |
| KR100391732B1 (ko) | 1997-07-22 | 2003-07-16 | 한국 엠에스디 주식회사 | 골 흡수 억제를 위한 조성물 |
| US6432932B1 (en) * | 1997-07-22 | 2002-08-13 | Merck & Co., Inc. | Method for inhibiting bone resorption |
| US5994329A (en) | 1997-07-22 | 1999-11-30 | Merck & Co., Inc. | Method for inhibiting bone resorption |
| FI109088B (fi) * | 1997-09-19 | 2002-05-31 | Leiras Oy | Tabletti ja menetelmä sen valmistamiseksi |
| SE9703691D0 (sv) * | 1997-10-10 | 1997-10-10 | Astra Ab | Pharmaceutical compositions |
| IT1296495B1 (it) * | 1997-11-21 | 1999-06-25 | Prodotti Antibiotici Spa | Impiego di bisfosfonati nella preparazione di forme farmaceutiche per somministrazione intramuscolare |
| GB2336311A (en) | 1998-04-15 | 1999-10-20 | Merck & Co Inc | Bisphosphonate Dosing Regimen |
| CA2308532C (en) | 1999-05-12 | 2005-11-29 | Gador S.A. | Use of bisphosphonates for the treatment of osteogenesis imperfecta |
| PT1178810E (pt) * | 1999-05-21 | 2005-08-31 | Novartis Ag | Utilizacao de acidos bisfosfonicos para o tratamento de angiogenese |
| IL142515A0 (en) | 1999-12-20 | 2002-03-10 | Merck & Co Inc | Pharmaceutical kit |
| GB0012209D0 (en) | 2000-05-19 | 2000-07-12 | Novartis Ag | Organic compounds |
| NZ523086A (en) | 2000-06-20 | 2007-07-27 | Novartis Ag | Method of administering bisphosphonates |
-
2001
- 2001-06-18 NZ NZ523086A patent/NZ523086A/en not_active IP Right Cessation
- 2001-06-18 CZ CZ20024134A patent/CZ301972B6/cs not_active IP Right Cessation
- 2001-06-18 WO PCT/EP2001/006850 patent/WO2001097788A2/en active IP Right Grant
- 2001-06-18 ES ES01940580T patent/ES2247123T7/es active Active
- 2001-06-18 AU AU2001274109A patent/AU2001274109B2/en not_active Expired
- 2001-06-18 EP EP01940580A patent/EP1296689B3/en not_active Expired - Lifetime
- 2001-06-18 ES ES05012711T patent/ES2394211T3/es not_active Expired - Lifetime
- 2001-06-18 CN CNB018113680A patent/CN1272013C/zh not_active Ceased
- 2001-06-18 IL IL15322901A patent/IL153229A0/xx active IP Right Review Request
- 2001-06-18 HU HU0301164A patent/HU228400B1/hu active Protection Beyond IP Right Term
- 2001-06-18 KR KR1020027017283A patent/KR100864743B1/ko active IP Right Grant
- 2001-06-18 SK SK1808-2002A patent/SK287278B6/sk not_active IP Right Cessation
- 2001-06-18 DE DE60113537T patent/DE60113537T3/de not_active Expired - Lifetime
- 2001-06-18 AU AU7410901A patent/AU7410901A/xx active Pending
- 2001-06-18 AT AT01940580T patent/ATE304856T1/de active
- 2001-06-18 PT PT50127117T patent/PT1591122E/pt unknown
- 2001-06-18 DK DK01940580T patent/DK1296689T3/da active
- 2001-06-18 US US10/311,942 patent/US8052987B2/en not_active Expired - Lifetime
- 2001-06-18 MX MXPA02012682A patent/MXPA02012682A/es active IP Right Grant
- 2001-06-18 CA CA2410201A patent/CA2410201C/en not_active Expired - Lifetime
- 2001-06-18 BR BR0111806-4A patent/BR0111806A/pt not_active Application Discontinuation
- 2001-06-18 JP JP2002503265A patent/JP4722375B2/ja not_active Expired - Lifetime
- 2001-06-18 PL PL358224A patent/PL203087B1/pl unknown
- 2001-06-20 TW TW090114964A patent/TWI289451B/zh not_active IP Right Cessation
-
2002
- 2002-12-02 IL IL153229A patent/IL153229A/en active IP Right Grant
- 2002-12-19 NO NO20026117A patent/NO330459B1/no not_active IP Right Cessation
-
2005
- 2005-05-31 JP JP2005159852A patent/JP5005188B2/ja not_active Expired - Lifetime
- 2005-06-22 HK HK05105175A patent/HK1072539A1/xx not_active IP Right Cessation
-
2012
- 2012-12-14 CY CY20121101222T patent/CY1113740T1/el unknown
-
2013
- 2013-03-22 CY CY2013011C patent/CY2013011I1/el unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6015801A (en) | 1997-07-22 | 2000-01-18 | Merck & Co., Inc. | Method for inhibiting bone resorption |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018190685A1 (ko) * | 2017-04-14 | 2018-10-18 | 연세대학교 산학협력단 | 비스포스포네이트를 포함하는 만성 이식신 기능부전 예방 또는 치료용 조성물 |
| US11554129B2 (en) | 2017-04-14 | 2023-01-17 | Industry-Academic Cooperation Foundation, Yonsei University | Composition for treating chronic renal transplant dysfunction comprising bisphosphonate |
| KR20190007082A (ko) * | 2019-01-14 | 2019-01-21 | 연세대학교 산학협력단 | 비스포스포네이트를 포함하는 만성 이식신 기능부전 예방 또는 치료용 조성물 |
| KR102049233B1 (ko) | 2019-01-14 | 2019-11-28 | 연세대학교 산학협력단 | 비스포스포네이트를 포함하는 만성 이식신 기능부전 예방 또는 치료용 조성물 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100864743B1 (ko) | 비스포스포네이트의 투여 방법 | |
| US20070161603A1 (en) | Method of administering bisphosphonates | |
| KR100866025B1 (ko) | 통증 치료를 위한 비스포스포네이트의 용도 | |
| AU2001274109A1 (en) | Method of administering bisphosphonates | |
| RU2297229C2 (ru) | Фармацевтическое применение бисфосфонатов | |
| AU2002257802A1 (en) | Use of bisphosphonates in the treatment of bone metastasis associated with prostate cancer | |
| JPH09512816A (ja) | プロテーゼのゆるみ及びプロテーゼの移動を防止するための特定メタンビスホスホン酸誘導体の使用 | |
| CN1327844C (zh) | 包含双膦酸类化合物和hmg-coa还原酶抑制剂的组合疗法 | |
| RU2288722C2 (ru) | Способ введения бисфосфонатов |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| J201 | Request for trial against refusal decision | ||
| AMND | Amendment | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20120924 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20130926 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20140923 Year of fee payment: 7 |
|
| FPAY | Annual fee payment |
Payment date: 20150918 Year of fee payment: 8 |
|
| FPAY | Annual fee payment |
Payment date: 20160921 Year of fee payment: 9 |