KR100828668B1 - 활성제 전달용 화합물 및 조성물 - Google Patents
활성제 전달용 화합물 및 조성물 Download PDFInfo
- Publication number
- KR100828668B1 KR100828668B1 KR1020027017966A KR20027017966A KR100828668B1 KR 100828668 B1 KR100828668 B1 KR 100828668B1 KR 1020027017966 A KR1020027017966 A KR 1020027017966A KR 20027017966 A KR20027017966 A KR 20027017966A KR 100828668 B1 KR100828668 B1 KR 100828668B1
- Authority
- KR
- South Korea
- Prior art keywords
- insulin
- active agent
- biologically active
- hormone
- interferon
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/27—Growth hormone [GH] (Somatotropin)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C235/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms
- C07C235/42—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton
- C07C235/44—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton with carbon atoms of carboxamide groups and singly-bound oxygen atoms bound to carbon atoms of the same non-condensed six-membered aromatic ring
- C07C235/58—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton with carbon atoms of carboxamide groups and singly-bound oxygen atoms bound to carbon atoms of the same non-condensed six-membered aromatic ring with carbon atoms of carboxamide groups and singly-bound oxygen atoms, bound in ortho-position to carbon atoms of the same non-condensed six-membered aromatic ring
- C07C235/60—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton with carbon atoms of carboxamide groups and singly-bound oxygen atoms bound to carbon atoms of the same non-condensed six-membered aromatic ring with carbon atoms of carboxamide groups and singly-bound oxygen atoms, bound in ortho-position to carbon atoms of the same non-condensed six-membered aromatic ring having the nitrogen atoms of the carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0087—Galenical forms not covered by A61K9/02 - A61K9/7023
- A61K9/0095—Drinks; Beverages; Syrups; Compositions for reconstitution thereof, e.g. powders or tablets to be dispersed in a glass of water; Veterinary drenches
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Endocrinology (AREA)
- Diabetes (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
활성제 전달용 화합물 및 조성물이 제공된다. 투여 및 제조방법 또한 제공된다.
Description
본 발명은 표적에 생물학적 또는 화학적 활성제와 같은 활성제를 전달하기 위한 화합물에 관한 것이다. 이들 화합물은 동물에 대한 경구, 결장내 (intracolonic), 폐 또는 기타의 경로로 투여되는 활성제와 비공유 혼합물을 형성하는 데에 적합하다. 이러한 조성물의 제조 및 투여 방법 또한 개시된다.
활성제 전달을 위한 통상적인 수단은 종종 생물학적, 화학적 및 물리적 장벽에 의하여 심각하게 제한된다. 통상적으로, 이러한 장벽들은 전달이 이루어지는 동안에 거치는 환경, 전달하려는 표적의 환경 및/또는 표적 그 자체에 의하여 부과된다. 생물학적 및 화학적 활성제는 특히 그러한 장벽에 대하여 취약하다.
생물학적 및 화학적 활성 약제 및 치료제를 동물에 전달함에 있어서 장벽은 신체에 의하여 부과된다. 물리적 장벽의 예는 피부, 지질 이중층 및 순환계와 같이, 특정 활성제가 상대적으로 침투할 수 없지만, 표적에 도달하기 전에 반드시 통과하여야 하는, 다양한 장기의 막(organ membrane)이다. 화학적 장벽은 위장관에서의 pH 변화 및 분해효소를 포함하지만, 이에 한정되는 것은 아니다.
이들 장벽은 특히 경구 전달 시스템을 고안함에 있어서 중요하다. 생물학적, 화학적 및 물리적 장벽이 없다면, 많은 생물학적 또는 화학적 활성제의 경구 전달이 동물에 대한 투여 경로로서 선택될 것이다. 전형적으로 경구 투여에 적합하지 않은 많은 약제 중에는 칼시토닌 및 인슐린과 같은 생물학적 또는 화학적 활성 펩티드; 다당류 및 특히, 헤파린을 포함하지만 이에 한정되지는 않는 무코 다당류; 헤파리노이드; 항생물질; 및 기타의 유기 물질들이 있다. 이들 약제는 위장관 내에서 산 가수분해, 효소 등에 의하여 빠르게 무력화되거나 또는 파괴될 수 있다. 그 이외에도, 거대분자 약물의 크기 및 구조가 흡수를 방해할 수 있다.
경구 투여에 취약한 약제를 위한 초기의 방법은, 효소에 의한 분해를 억제하기 위하여 효소 억제제(예를 들면, 췌장 트립신 억제제, 디이소프로필플루오로포스페이트(DFF) 및 트라실롤)를 병용 투여하는 것과 더불어, 장벽의 투과도를 인위적으로 향상시키기 위하여 보조제(예를 들면, 레소시놀 및 폴리옥시에틸렌 올레일 에테르 및 n-헥사데실폴리에틸렌 에테르와 같은 비 이온성 계면활성제)를 병용 투여하는 것에 의지하여 왔다. 리포좀 또한 인슐린 및 헤파린을 위한 약물 전달 시스템으로서 설명되어져 왔다. 그러나, 이러한 약물 전달 시스템의 광범위한 사용은 (1) 이 체계가 독성량의 보조제 또는 억제제를 필요로 한다는 점, (2) 적합한 저분자량 화물, 즉 활성제를 구하기 어렵다는 점, (3) 이 체계는 안정성이 나빠서 선반 수명이 불충분하다는 점, (4) 이 체계의 생산이 어렵다는 점, (5) 이 체계가 활성제(화물)을 보호하지 못한다는 점, (6) 이 체계가 활성제를 불리하게 개조시킨다는 점, 또는 (7) 이 체계가 활성제의 흡수를 허용 또는 촉진하지 못한다는 점 때문에 불가능해진다.
보다 최근에는, 프로티노이드(proteinoid) 미소구체가 약물 전달에 사용되고 있다. 예로서 미국특허 제5,401,516호, 제5,443,841호 및 미국 RE35,862를 참조하라. 그 이외에도, 특정하게 변형된 아미노산이 약물 전달에 사용되고 있다. 예로서, 미국특허 제5,629,020호, 5,643,957호, 5,766,633호, 5,776,888호 및 5,866,536호를 참조하라. 그러나, 용이하게 제조되며, 다양한 경로를 통하여 광범위한 활성제를 전달할 수 있는, 간단하고, 저렴한 전달 시스템에 대한 요구가 아직 존재한다.
발명의 요약
활성제의 전달에 유용한 화합물 및 조성물이 제공된다. 본 발명은 다음의 식을 갖는 화합물 또는 이의 염, 또는 이들의 혼합물을 포함한다.
본 발명의 조성물은 하나 이상의 활성제, 바람직하게는 생물학적 또는 화학적 활성제, 및 하나 이상의 본 발명의 화합물 또는 이의 염을 포함한다. 상기 조성물의 제조 및 투여 방법 또한 제공된다.
상기 조성물을 포함하는 투여 단위 제형 또한 제공된다. 상기 투여 단위 제형은 고체(예를 들면, 정제, 캡슐 또는 분말 또는 1회용의 작은 봉지(sachet)와 같은 미립자) 또는 액제일 수 있다.
상기 조성물을 사용하는 치료 방법은 물론, 생물학적 활성제를 본 발명의 조성물과 함께 그 약제를 필요로 하는 동물에, 특히 경구, 결장내 또는 폐 경로로, 투여하는 방법 또한 제공된다. 본 발명의 조성물을 이를 필요로 하는 동물에 투여하는 것을 포함하는 동물의 질병 치료방법이 제공된다.
발명의 상세한 설명
화합물
화합물은 카르복시산 및/또는 이들의 염 형태일 수 있다. 염은 유기 및 무기염, 예를 들면, 소듐, 포타슘 및 리튬과 같은 알칼리 금속 염; 마그네슘, 칼슘 또는 바륨과 같은 알칼리 토금속 염; 암모늄염; 리신 또는 아르기닌과 같은 염기성 아미노산; 및 디메틸아민 또는 피리딘과 같은 유기 아민을 포함하지만, 이에 한정되는 것은 아니다. 바람직하게는, 상기 염은 소듐 염이다. 상기 염은 모노 소듐 염 및 디 소듐 염과 같은 1가 또는 다가 염일 수 있다. 상기 염은 또한 에탄올 용매 화합물(solvate)을 포함하는 용매 화합물일 수 있다.
그 이외에도, 이들 화합물을 하나 이상 포함하는 폴리아미노산 및 펩티드가 사용될 수 있다.
아미노산은 하나 이상의 유리 아미노기를 갖는 어떠한 카르복시산이라도 무방하며, 천연 또는 합성 아미노산을 포함한다. 폴리아미노산은 펩티드(둘 이상의 아미노산이 펩티드 결합에 의하여 결합된), 또는 둘 이상의 아미노산이, 결합될 수 있는 다른 그룹에 의하여 형성된 결합에 의하여 연결된 것, 예를 들면, 에스테르 또는 안하이드라이드 결합 중의 어느 하나이다. 펩티드는 두 개의 아미노산을 갖는 디펩티드부터 수백 개의 아미노산을 갖는 폴리펩티드까지 그 길이가 변할 수 있다. 하나 이상의 아미노산 또는 펩티드 단위가 아실화 또는 술폰화될 수 있다.
본 명세서에 기술된 화합물은 아미노산으로부터 유도될 수 있고, 본 명세서의 개시에 기초한 종래 기술 범위 내의 방법 및 국제공개공보 제96/30036호, 제97/36480호, 미국특허 제5.643,957호 및 미국특허 제5,650,386호에 기재된 방법에 의하여 아미노산으로부터 용이하게 제조될 수 있다. 예를 들면, 상기 화합물은 하나의 아미노산을 적합한 아실화제 또는 상기 아미노산에 존재하는 유리 아미노기와 반응하여 아미드를 형성하는 아민 변형제와 반응시켜 제조될 수 있다. 보호기가 본 발명이 속하는 기술 분야의 기술자에게 잘 알려져 있는 원하지 않는 부반응을 피하기 위하여 사용될 수 있다. 보호기와 관련하여 T.W. Greene의 Protecting Groups in Organic Synthesis, Wily, New York (1981)가 참조되며, 그 개시 부분은 본 명세서에 참고문헌으로서 병합되었다.
본 발명의 화합물의 염은 종래에 알려진 방법에 따라 제조될 수 있다. 예를 들면, 소듐 염은 상기 화합물을 에탄올에 용해시키고 수산화나트륨 수용액을 가하는 것에 의하여 제조될 수 있다.
상기 화합물은 재결정에 의하여, 또는 단독 또는 직렬로 연결된 하나 이상의 고체 크로마토그래피 지지(support) 상에서의 분리에 의하여 정제될 수 있다. 적합한 재결정 용매 시스템은 아세토니트릴, 메탄올 및 테트라하이드로퓨란을 포함하지만, 이에 한정되는 것은 아니다. 분리는 알루미나와 같은 적합한 크로마토그래피 지지 상에서 메탄올/n-프로판올 혼합물을 이동상으로 사용하여; 트리플루오로아세 트산/아세토니트릴 혼합물을 이동상으로 사용하여 역상 크로마토그래피로; 및 물 또는 적합한 완충 용액을 이동상으로 사용하여 이온 교환 크로마토그래피로 수행될 수 있다. 음이온 교환 크로마토그래피가 수행되는 경우, 바람직하게는 0 - 500 mM 염화나트륨 기울기(gradient)가 적용된다.
하나의 구체례에 따르면, 상기 화합물은 이의 무수물 형태(anhydrous form)로 사용된다.
활성제
본 발명에 사용하기에 적합한 활성제는, 살충제, 약제 및 치료제를 포함하지만 이에 한정되지는 않는, 생물학적 활성제 및 화학적 활성제를 포함한다.
예를 들면, 본 발명에 사용하기에 적합한 생물학적 또는 화학적 활성제는 단백질; 폴리펩티드; 펩티드; 호르몬; 다당류 및 특히, 무코 다당류의 혼합물; 탄수화물; 지방; 기타의 유기 화합물; 및 특히 스스로 위장 점막을 통과하지 못하는 (또는 투여량의 일부만이 통과하는) 화합물 및/또는 위장관 내의 산 및 효소에 의한 화학적 분해에 민감한 화합물; 또는 이들의 조합 중의 어떤 것을 포함하지만, 이에 한정되는 것은 아니다.
추가적인 예는 인간 성장 호르몬(hGH), 재조합 인간 성장 호르몬(rhGH), 소 성장 호르몬, 및 돼지 성장 호르몬을 포함하는 성장 호르몬; 성장 호르몬 방출 호르몬; α-, β- 및 γ-인터페론을 포함하는 인터페론; 인터루킨-1; 인터루킨-2; 돼지, 소, 인간 및 인간 재조합, 임의로 소듐, 아연, 칼슘 및 암모늄을 포함하는 상대 이온(counter ion)을 갖는, 인슐린을 포함하는 인슐린; IGF-1을 포함하는 인슐 린 유사 성장 인자; 단편화되지 않은 헤파린, 헤파리노이드, 더마탄, 콘드로이틴, 저 분자량 헤파린, 매우 낮은 분자량 헤파린 및 초저 분자량 헤파린을 포함하는 헤파린; 연어, 뱀장어, 돼지 및 인간 칼시토닌을 포함하는 칼시토닌; 에리쓰로포이에틴, 심방성 나트륨 이뇨 인자; 항원; 모노클로날 항체; 소마토스타틴; 프로테아제 억제제; 아드레노코르티코트로핀, 고나도트로핀 방출 호르몬; 옥시토신; 황체형성 호르몬 방출 호르몬; 여포 자극 호르몬; 글로코세레브로시다제; 트롬보포이에틴; 필그라스팀; 프로스타글란딘; 시클로스포린; 바소프레신; 크로몰린 소듐(소듐 또는 디소듐 크로모글리케이트); 반코마이신; 데스페리옥사민(DFO); 단편을 포함하는 부갑상선 호르몬(PTH); 항진균제를 포함하는 항미생물제; 이들 화합물의 동족체, 단편, 모방체 또는 폴리에틸렌글리콜(PEG) 변형 유도체; 또는 이들의 조합 중의 어떤 것과 같은 합성, 천연 또는 이들의 재조합 원천을 포함하지만 이에 한정되는 것은 아니다. 합성된 형태의 인슐린을 포함하지만 이에 한정되지는 않는 기타의 적합한 인슐린의 형태가 미국특허 제4,421,685호, 제5,474,978호 및 제5,534,488호에 기재되어 있으며, 이들은 본 명세서에 참고 문헌으로서 전체가 병합되어 있다.
전달 시스템
본 발명의 조성물은 전달제 및 하나 이상의 활성제를 포함한다. 하나의 구체례에 있어서, 투여 전에 활성제와 혼합되는 전달제로서, 하나 이상의 전달 화합물 또는 이들 화합물의 염, 또는 이들 화합물 또는 염이 하나 이상의 단위를 구성하는 폴리아미노산 또는 펩티드가 사용될 수 있다.
상기 투여 조성물은 액체 형태일 수 있다. 투약 운송 수단(vehicle)은 물(예 를 들면, 연어 칼시토닌, 부갑상선 호르몬 및 에리쓰로포이에틴의 경우), 25% 프로필렌 글리콜 수용액(예를 들면, 헤파린의 경우) 및 포스페이트 완충용액(에를 들면, rhGH의 경우)일 수 있다. 기타의 투약 운송 수단은 폴리에틸렌 글리콜, 소르비톨, 말티톨 및 수크로오스를 포함한다. 투약 용액은 전달제 화합물을 활성제 용액과 투여 직전에 혼합시킴으로써 제조될 수 있다. 대안으로서, 전달제 (또는 활성제) 용액을 고체 형태의 활성제 (또는 전달제)와 혼합시킬 수 있다. 상기 전달제 화합물 및 활성제는 건조 분말 상태로 혼합시킬 수도 있다. 상기 전달제 화합물 및 활성제는 생산 공정 중에 미리 혼합시킬 수도 있다.
투약 용액은 임의로 포스페이트 완충 염, 구연산, 글리콜 또는 기타의 분산제와 같은 첨가제를 함유할 수 있다. 안정화 첨가제가 용액 내에, 바람직하게는 약 0.1 내지 20% (중량/부피) 범위의 농도로 혼입될수 있다.
상기 투여 조성물은, 대안으로서, 정제, 캡슐, 또는 분말이나 1회용 봉지 형태의 미립자와 같은 고체 형태일 수 있다. 고체 투약 제형은 상기 화합물을 고체 형태의 활성제와 혼합시킴으로써 제조될 수 있다. 대안으로서, 화합물 및 활성제의 용액으로부터 동결 건조, 침전, 결정화 및 고체 분산(dispersion)과 같은, 종래에 알려진 방법으로 고체를 얻을 수 있다.
본 발명의 투여 조성물은 또한 하나 이상의 효소 억제제를 포함할 수 있다. 그러한 효소 억제제는 악티노닌 또는 에피악티토닌 및 이들의 유도체와 같은 화합물을 포함하지만, 이에 한정되는 것은 아니다. 기타의 효소 억제제는 아프로티닌(트라실롤) 및 바우만-비르크(Bowman-Birk) 억제제를 포함하지만, 이에 한정되는 것 은 아니다.
본 발명의 투여 조성물에 사용되는 활성제의 양은 표적 지시를 위한 특정 활성제의 목적 달성에 유효한 양이다. 통상적으로, 조성물 중의 활성제의 양은 약학적, 생물학적, 치료학적 또는 화학적 유효량이다. 그러나, 투약 단위 제형이 여러 개의 화합물/활성제 조성물을 함유하거나 또는 분할된 약학적, 생물학적, 치료학적 또는 화학적 유효량을 함유할 수 있으므로, 그 양은 조성물이 상기 투약 단위 제형으로 사용되는 경우보다 적은 양일 수 있다. 따라서, 총 유효량이, 전체로서 활성제를 유효량만큼 함유하는 누적적인 단위로 투여될 수 있다.
사용되는 활성제의 총량은 본 발명이 속하는 기술 분야의 기술자에게 알려진 방법으로 결정될 수 있다. 그러나, 상기 조성물은 종래의 조성물에 비하여 활성제를 보다 효과적으로 전달할 수 있으므로, 동일한 혈중 수준 및/또는 치료 효과를 달성하면서도, 종래의 투약 단위 제형 또는 전달 시스템에서 사용되는 양에 비하여 적은 양의 생물학적 또는 화학적 활성제가 대상에 투여될 수 있다.
본 발명에서 개시되는 화합물은 생물학적 및 화학적 활성제를, 혈액-뇌 장벽을 가로지르는 것은 물론, 특히 경구, 비강내(intranasal), 설하, 십이지장내, 피하, 구강, 결장내, 직장, 질, 점막, 폐, 경피(transdermal), 피내(intradermal), 비경구, 정맥내, 근육내 및 시각 시스템으로 전달한다.
투약 단위 제형은 또한 부형제, 희석제, 향미제, 미각 차단제, 당류, 감미료, 염, 및 물, 1,2-프로판디올, 에탄올, 올리브 오일 또는 이들의 조합 중의 어떤 것을 포함하지만 이에 한정되지는 않는 투약 운송수단 중의 어떤 것 또는 이들의 조합을 포함할 수 있다.
본 발명의 화합물 및 조성물은 생물학적 또는 화학적 활성제를, 닭과 같은 조류; 설치류, 소, 돼지, 개, 고양이, 영장류, 및 특히 인간과 같은 포유류; 및 곤충류를 포함하지만 이에 한정되지는 않는, 동물에 투여하는 데에 유용하다.
상기 시스템은 다른 방법에 의하는 경우에 활성제가 표적 영역(즉, 전달 조성물 중의 활성제가 방출되는 영역)에 도달하기 전에 만나는 조건들에 의하여 파괴되거나 또는 효과가 약화되는 화학적 또는 생물학적 활성제를 전달하는 데에 특히 유리하다. 특히, 본 발명의 화합물 및 조성물은 활성제, 특히 통상적으로는 경구로 투여될 수 없거나, 또는 향상된 전달이 필요한 활성제를 경구 투여하는 데에 유용하다.
상기 화합물 및 활성제를 포함하는 조성물은 선택된 생물학적 시스템에, 전달제 없이 활성제를 투여하는 것에 비하여 활성제의 생체 이용률이 향상 또는 개선된 상태로, 활성제를 전달한다는 점에서 유용성이 있다. 전달은 장기간에 걸쳐 더 많은 활성제를 전달하는 것을 통하여, 또는 특정 기간 동안(보다 빠른 또는 지연된 전달을 달성하는 것과 같은) 또는 장기간에 걸쳐(지속적인 전달과 같은) 활성제를 전달함에 있어서 개선될 수 있다.
투여 후에, 조성물 또는 투약 단위 제형 내에 존재하는 활성제는 순환계로 흡수된다. 약제의 생체 이용률은 공지된 혈액 내의 약학 활성, 예를 들면, 헤파린에 의하여 야기된 혈액 응고 시간의 증가, 또는 칼시토닌에 의하여 야기된 순환 칼슘 수준의 감소를 측정함으로써 용이하게 평가될 수 있다. 대안으로서, 활성제 그 자체의 순환 수준이 직접 측정될 수도 있다.
다음의 실시예에 의하여 본 발명을 설명하지만, 본 발명이 이에 한정되는 것은 아니다. 이하에서 모든 부(parts)는 다른 표시가 없는 한 중량부를 의미한다.
실시예 1 - 화합물 제조
1a. 화합물 1의 제조
4-클로로살리실산 (10.0g, 0.0579 mol)을 약 50ml의 메틸렌 클로라이드가 담긴 1구 250ml 둥근 바닥 플라스크에 가하였다. 그 다음 교반을 시작하고, 반응 시간 내내 계속 교반하였다. 커플링제(coupling agent) 1,1-카르보닐디이미다졸 (9.39g, 0.0579mol)을 고체 상태로 플라스크에 조금씩 가하였다. 커플링제가 모두 첨가된 다음 반응물을 약 20분 동안 실온에서 교반하고, 이어서 반응물을 교반하면서 에틸-4-아미노부티레이트 하이드로클로라이드 (9.7g, 0.0579mol)를 첨가하였다. 트리에틸아민 (10.49ml, 0.0752mol)을 첨가 깔때기를 사용하여 적가하였다. 첨가 깔때기를 메틸렌 클로라이드로 세정하였다. 그 다음, 반응물을 실온에서 밤새도록 교반하였다.
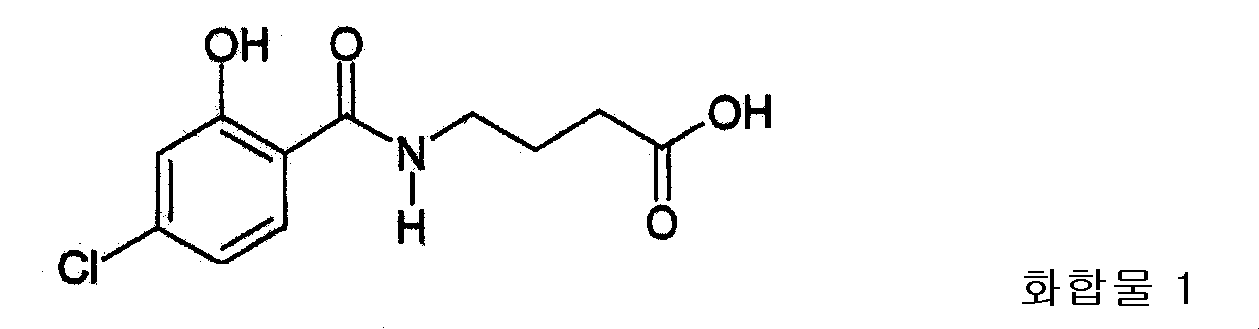
반응물을 분별 깔때기에 붓고, 2N HCl로 세정하였더니 에멀전이 형성되었다. 에멀전을 2일 동안 놓아두었다. 그 다음, 에멀전을 프릿화(fritted) 유리 깔때기를 사용하여 셀라이트를 통과시켜 여과하였다. 여과액을 다시 분별 깔때기에 붓고 층을 분리시켰다. 유기층을 소듐 설페이트로 건조시키고, 여과한 다음, 여과액을 회전 증발 (rotary evaporation) 장치로 농축시켰다. 얻어진 고체를 2N NaOH로 가수 분해시키고, 냉장 상태에서 밤새도록 보관한 다음, 다시 가수분해시켰다. 용액을 2N HCl로 산성화하고, 생성된 고체를 분리한 다음 진공 건조시키고, 메탄올/물로 두 차례 재결정시켰다. 고체를 밤새도록 침전시키고, 분리한 다음, 건조시켰다. 고체를 2N NaOH에 용해시키고, 2N HCl을 사용하여 pH 5가 되도록 하였다. 고체를 모았으며, HPLC에서 하나의 피크가 나타났다. 이 고체를 메탄올/물에서 재결정시켜 분리하고, 진공 건조시켜, 4.96g (33.0%)의 4-(4-클로로-2-히드록시벤조일)아미노부티르산을 얻었다.
(C11H12ClNO4); 분자량 257.67) 녹는점: 131-133℃. 원소 분석: %C: 51.27 (계산값), 51.27 (측정값); %H: 4.69 (계산값), 4.55 (측정값); %N: 5.44 (계산값), 5.30 (측정값). H NMR 분석: (d6-DMSO): δ13.0, s, 1H (COOH); δ12.1, s, 1H (OH); δ8.9, t, 1H (NH); δ7.86, d, 1H (아미드에 대해 오르토 H); δ6.98, d, 1H (페놀 OH에 대해 오르토 H); δ6.96, d, 1H, (아미드에 대해 메타 H); δ3.33, m, 2H (NH에 이웃한 CH2); δ2.28, t, 2H (COOH에 이웃한 CH2); δ1.80, m, 2H(NH에 대해 베타 지방족 CH2 및 COOH에 대해 베타 CH2).
1b. 화합물 1의 추가 제조
4-클로로살리실산 (25.0g, 0.1448mol)을 약 75-100ml의 메틸렌 클로라이드가 담긴 1구 250ml 둥근 바닥 플라스크에 넣었다. 그 다음 교반을 시작하고, 반응 시간 내내 계속 교반하였다. 커플링제 1,1-카르보닐디이미다졸 (23.5g, 0.1448mol)을 고체 상태로 플라스크에 조금씩 가하였다. 커플링제가 모두 첨가된 다음 반응물을 약 20분 동안 실온에서 교반하고, 이어서 반응물을 교반하면서 에틸-4-아미노부티레이트 하이드로클로라이드 (24.3g, 0.1448mol)를 첨가하였다. 트리에틸아민 (26.0ml, 0.18824mol)을 첨가 깔때기를 사용하여 적가하였다. 첨가 깔때기를 메틸렌 클로라이드로 세정하였다. 그 다음, 반응물을 실온에서 밤새도록 교반하였다.
반응물을 분별 깔때기에 붓고, 2N HCl로 세정하였더니 에멀전이 형성되었다. 에멀전을 프릿화(fritted) 유리 깔때기를 사용하여 셀라이트를 통과시켜 여과하였다. 여과액을 다시 분별 깔때기에 붓고 층을 분리시켰다. 유기층을 물과 브라인으로 세정하고, 소듐 설페이트로 건조시켜 여과한 다음, 여과액을 회전 증발 (rotary evaporation) 장치로 농축시켰다. 얻어진 고체를 2N NaOH로 밤새도록 가수분해시켰다. 용액을 2N HCl로 산성화하고, 생성된 갈색 고체를 메탄올/물로 재결정시키고, 불용성 흑색 물질을 뜨거운 상태로 여과(hot filtering)하여 제거하였다. 백색 고체를 침전시키고, 분리한 다음 건조시켜 11.68g (37.0%)의 4-(4-클로로-2-히드록시벤조일)아미노부티르산을 얻었다.
(C11H12ClNO4); 분자량 257.67) 녹는점: 129-133℃. 원소 분석: %C: 51.27 (계산값), 51.26 (측정값); %H: 4.69 (계산값), 4.75 (측정값); %N: 5.44 (계산값), 5.32 (측정값). H NMR 분석: (d6-DMSO): δ13.0, s, 1H (COOH); δ12.1, s, 1H (OH); δ8.9, t, 1H (NH); δ7.86, d, 1H (아미드에 대해 오르토 H); δ6.98, d, 1H (페놀 OH에 대해 오르토 H); δ6.96, d, 1H, (아미드에 대해 메타 H); δ3.33, m, 2H (NH에 이웃한 CH2); 6 2.28, t, 2H (COOH에 이웃한 CH2) ; δ1. 80, m, 2H (NH에 대해 베타인 지방족 CH2 및 COOH에 대해 베타인 CH2).
1c. 화합물 1의 추가 제조
(4-[(4-클로로-2-히드록시벤조일)아미노]부탄산
22L 5구 둥근 바닥 플라스크에 오버헤드(overhead) 교반기, 환류 냉각기와 연결시킨 1L 딘-스타크(Dean-Stark) 트랩, 열전대 온도 표시기(read out) 및 가열 맨틀을 장치하였다. 다음과 같은 반응을 건조 질소 분위기 하에서 수행하였다. 반응물 n-부탄올 (5000mL) 및 4-클로로살리실산 (2000g, 11.59mol)을 반응 플라스크에 넣었다. 딘-스타크 트랩에 n-부탄올 (1000mL)을 채웠다. 진한 황산 (50g)을 첨가하였다. 반응 혼합물을 약 120 시간 동안 가열 환류하였다. 약 206mL의 물이 상기 시간 동안에 모아졌다. 가열 맨틀을 치우고, 반응 혼합물을 상온까지 냉각되도록 하였다. 딘-스탁 트랩을 배수시키고, 제거하였다. 탈이온수 (1000mL)를 부었다. 2 상(biphasic) 혼합물을 10분 동안 교반하였다. 교반을 멈추고 상분리가 일어나도록 하였다. 아래 쪽의 수층을 빨아올려 폐기하였다. 10 중량% 소듐 바이카보네이트 수용액 (1000mL)을 반응 혼합물에 가하였다. 혼합물을 10분 동안 교반하였다. pH 페이퍼를 사용하여 반응 혼합물의 pH가 7을 초과하지 않는 것을 확인하였다. 물 (500mL)을 반응 혼합물에 가하였다. 교반을 멈추고 상분리가 일어나도록 하였다. 아래쪽의 수층을 빨아올려 폐기하였다. 반응 혼합물을 추가로 500mL의 탈이온수로 세정하였다. 반응기에 대기압 증류 장치를 설치하고, 용량 5L의 용기에 증류액을 받을 수 있도록 하였다. 혼합물을 포트(pot) 온도가 140 내지 150℃ 범위로 올라갈 때까지 증류하였다. 대기 하에서의 증류를 진공 증류로 전환하였다. 증류 장치의 압력을 서서히 100mmHg까지 낮추었다. 포트의 온도를 낮추고 n-부탄올과 n-부틸 에테르(반응 부산물)을 증류시켜 제거하였다. 가열을 멈춘 다음, 반응 혼합물이 상온까지 냉각되도록 하였다. 건조 질소를 가하여 진공 상태를 풀었다. 조(crude) 부틸 에스테르를 진공 증류 장치가 된 5L 포트 플라스크로 옮겼다. 조 부틸 에스테르를 0.2 내지 0.5 mmHg의 압력에서 증류하였다. 40℃ 미만의 헤드(head) 온도에서 모아진 초기 증류액은 폐기되었다. 부틸 4-클로로-2-히드록시벤조에이트 분획을 헤드 온도 104 내지 112℃에서 모았다. 이 분획의 중량은 2559g이었으며, 수율은 96%이었다.
22L 5구 둥근 바닥 플라스크에 오버헤드 교반기, 환류 냉각기, 열전대 온도 표시기 및 가열 맨틀을 장치하였다. 상기 반응기에 질소를 불어 넣었다. 부틸 4-클로로-2-히드록시벤조에이트 (2559g, 11.2mol) 및 반응물 메탄올 (10,000mL)을 반응 플라스크에 가한 다음, 용액이 얻어질 때까지 내용물을 교반하였다. 반응 혼합물을 뷰흐너 깔때기로 여과하고 반응기에 다시 넣었다. 교반 속도를 증가시키고 기체 암모니아를 반응기의 위쪽 공간에 신속하게 가하였다. 암모니아 기체를 반응기의 온도가 45℃에 도달할 때까지 계속 가하였다. 암모니아 기체 첨가를 중단하고 교반 속도를 늦추었다. 반응물이 상온으로 냉각되도록 하였다. 액체 크로마토그래피에서 반응이 완결된 것으로 나타날 때까지, 위와 같은 방법으로 암모니아 기체를 반복적으로 첨가하였다. 반응을 완결시키는 데에는 5일 동안 7 차례에 걸쳐 암모니아 기체를 가하는 것이 필요하였다. 대기압 하에서 증류하여 대략적으로 용매의 반을 제 거하였다. 반응 혼합물을 상온까지 냉각시키고, 5L의 탈이온수를 가하였다. 진한 염산 (약 500mL)을 반응 혼합물의 pH가 4 내지 5가 될 때까지 반응기에 서서히 가하였다. 여기서 얻어진 침전을 큰 규화 유리 깔때기를 사용하여 진공 여과하여 모았다. 생성물 필터 케이크(filter cake)를 2000mL의 탈이온수로 세정하고 50℃에서 32시간 동안 건조시켜 1797g의 4-클로로-2-히드록시벤즈아미드를 얻었으며, 수율은 94% 이었다.
22L 5구 둥근 바닥 플라스크에 오버헤드 교반기, 환류 냉각기, 첨가 깔때기, 열전대 온도 표시기 및 가열 맨틀을 장치하였다. 상기 반응기에 질소를 불어 넣었다. 아세토니트릴 (4700mL) 및 4-클로로-2-히드록시벤즈아미드 (1782g, 10.4mol)를 반응 플라스크에 넣고 교반을 시작하였다. 피리딘 (1133mL, 14.0mol)을 상기 반응기에 가하였다. 여기서 얻어진 반응물 슬러리를 얼음 중탕을 사용하여 10℃ 미만으로 냉각시켰다. 에틸 클로로포메이트 (1091mL, 1237g, 11.4mol)를 첨가 깔때기에 넣고, 교반 중안 반응 혼합물에 서서히 가하였으며, 첨가하는 동안 반응 혼합물의 온도가 15℃를 넘지 않게 하였다. 에틸 클로로포메이트의 첨가가 완료된 다음, 반응 혼합물의 온도를 30분 동안 10 내지 15℃로 유지하였다. 얼음 중탕을 치우고, 반응 혼합물의 온도가 서서히 상온까지 올라가도록 하였다. 그 다음, 반응 혼합물을 서서히 가열하여 환류시켰으며, 그 온도에서 18시간 동안 유지하였다. 액체 크로마토그래피로 반응 혼합물을 분석한 결과 반응이 80%만 완결되었음을 나타내었다. 대기압 하에서 증류하여 대략 용매의 반을 제거하였다. 반응 혼합물을 먼저 상온으로 냉각시키고, 그 다음 얼음 중탕을 사용하여 10℃ 미만으로 냉각시켰다. 추 가로 피리딘 (215mL, 2.65mol)을 반응 혼합물에 가하였다. 에틸 클로로포메이트 (235g, 2.17mol)를 첨가 깔때기를 사용하여 냉각된 반응 혼합물에 서서히 가하였다. 에틸 클로로포메이트의 첨가가 완료된 다음, 반응 혼합물을 30분 동안 10 내지 15℃로 유지하였다. 얼음 중탕을 치우고, 반응 혼합물의 온도가 서서히 상온까지 올라가도록 하였다. 그 다음, 반응 혼합물을 서서히 가열하여 환류시켰으며, 그 온도에서 18시간 동안 유지하였고, 이 때 액체 크로마토그래피 분석은 반응이 완결되었음을 나타내었다. 반응 혼합물을 먼저 상온으로 냉각시키고, 그 다음 얼음 중탕을 사용하여 10℃ 미만으로 냉각시켰다. 물 (1600mL)을 첨가 깔때기를 통하여 서서히 첨가하고, 얻어진 슬러리를 10℃ 미만의 온도에서 90분 동안 유지하였다. 고체 생성물을 큰 규화 유리 깔때기를 통하여 진공 여과하여 모았다. 생성물 필터 케이크를 탈이온수로 세정하고, 50℃에서 18시간 동안 진공 건조하여 1914g의 7-클로로-2H-1,3- 벤족사진-2,4(3H)-디온을 황갈색 고체로 얻었으며, 그 수율은 83% 이었다.
22L 5구 둥근 바닥 플라스크에 오버헤드 교반기, 환류 냉각기, 열전대 온도 표시기 및 가열 맨틀을 장치하였다. 건조 질소 분위기 하에서 다음과 같은 반응을 수행하였다. 7-클로로-2H-1,3-벤족사진-2,4(3H)-디온 (1904g, 9.64mol), 에틸 4-브로모부티레이트 (1313mL, 0.18mol) 및 N,N-디메틸아세트아미드 (4700mL)를 질소 분위기 하에서 플라스크에 넣었다. 반응 혼합물을 70℃로 가열하였다. 여기서 얻어진 투명한 용액에 소듐 카보네이트 (1119g, 10.55mol)를 약 40분 동안 동일한 양으로 나누어 5회에 걸쳐 첨가하였다. 반응 혼합물의 온도를 70℃로 밤새도록 유지하였 다. 반응물을 55℃로 냉각시켰다. 무기 고체 성분을 규화 유리 깔때기로 진공 여과하여 제거하였다. 반응 플라스크를 2B-에탄올 (2000mL)로 세정하고, 이 세정액을 필터 케이크를 세정하는 데에 사용하였다. 반응 플라스크를 탈이온수로 세정하였다. 여과액을 깨끗해진 반응 플라스크에 다시 담았다. 여과액을 얼음 중탕을 사용하여 냉각시켰다. 탈이온수 (9400mL)를 첨가 깔때기를 사용하여 서서히 첨가하였다. 냉각된 혼합물을 밤새도록 교반하였다. 얻어진 고체를 규화 유리 깔때기를 사용하여 진공 여과하여 회수하였다. 생성물 케이크를 탈이온수로 세정하였다. 에틸 3-(4-부타노에이트)-7-클로로-2H-1,3-벤족사진-2,4-(3H)-디온의 중량은 2476.0g 이었으며, 그 수율은 82.2% 이었다.
12L 스테인레스 반응기에 오버헤드 교반기, 환류 냉각기, 열전대 온도 표시기, 첨가 깔때기 및 가열 맨틀을 장치하였다. 건조 질소 분위기 하에서 다음과 같은 반응을 수행하였다. 물 (3L) 및 에틸 3-(4-부타노에이트)-7-클로로-2H-1,3-벤족사진 -2.4-(3H)-디온 (1118g, 3.58mol)을 반응기에 넣고, 교반을 시작하였다. 수산화나트륨 (574g, 14.34mol) 수용액 (2L)을 반응물 슬러리에 서서히 첨가하였다. 반응물을 70℃로 6 시간 동안 가열한 다음, 상온으로 서서히 냉각되도록 하였다. 반응 혼합물을 뷰흐너 깔때기를 사용하여 여과하였다.
22L 5구 둥근 바닥 플라스크에 오버헤드 교반기, 환류 냉각기, 열전대 온도 표시기 및 첨가 깔때기를 장치하였다. 이 반응기에 탈이온수 (1880mL) 및 진한 염산 (1197g, 12.04mol)을 넣었다. 앞에서 얻은 가수분해 산물을 첨가 깔때기를 사용하여 산 용액에 서서히 첨가하였다. 추가적으로 염산 (160mL, 1.61mol)을 가하여 여기서 얻어진 슬러리의 pH를 3으로 조절하였다. 생성물 고체를 규화 유리 깔때기를 사용하여 여과하여 모으고, 50℃의 진공 오븐에서 24시간 동안 건조시켜, 1109.3g의 4-[(4-클로로-2-히드록시-벤조일)아미노]부탄산을 연한 노란색을 띠는 백색(off-white) 고체로 얻었으며, 수율은 정량적이었다.
실시예 1d: 무수 소듐 4-[(4-클로로-2-히드록시벤조일)아미노]부타노에이트의 제조
22L 5구 둥근 바닥 플라스크에 오버헤드 교반기, 환류 냉각기, 열전대 온도 표시기 및 가열 맨틀을 장치하였다. 건조 질소 분위기 하에서 다음과 같은 반응을 수행하였다. 반응물 아세톤 (13000mL) 및 4-[(4-클로로-2-히드록시-벤조일)아미노]부탄산 (500.0g, 1.04mol)을 반응기에 넣고 교반을 시작하였다. 흐릿한 갈색 용액이 얻어질 때까지 반응물 슬러리를 50℃에서 가열하였다. 따뜻한 용액을 화트만(Whatman) #1 여과지를 깐 따뜻한 압력 필터를 통과시켜 깨끗한 22L 반응기에 받았다. 노란색의 투명한 여과액을 교반하면서 50℃로 가열하였다. 격렬하게 교반하면서 수산화나트륨 용액(50% 수용액; 155g, 1.94mol)을 반응기에 넣었다. 염기 용액이 모두 첨가된 다음, 반응기을 가열하여 2.5 시간 동안 환류하고, 상온으로 서서히 냉각되도록 하였다. 생성물을 규화 유리 깔때기를 통과시켜 진공 여과하고, 50℃의 진공 오븐에서 24시간 동안 건조시켜, 527.3g의 소듐 4-[(4-클로로-2-히드록시벤조일)아미노]부타노에이트를 연한 노란색을 띤 백색 고체 상태로 얻었으며, 수율은 97.2% 이었다.
실시예 1e: 소듐 4-[(4-클로로-2-히드록시벤조일)아미노]부타노에이트 1 수화물의 제조
22L 플라스크에 오버헤드 교반기를 장치하였다. 탈이온수 (2000mL) 및 4-[(4-클로로-2-히드록시벤조일)아미노]부탄산 (380.0g, 1.47mol)을 가하고, 교반을 시작하였다. 수산화나트륨 (59.0g, 1.48mol) 수용액 (500mL)을 반응기에 첨가하였다. 물 (1500mL)을 상기 반응기에 가하고, 얻어진 슬러리를 완전한 용액이 얻어질 때까지 가열하였다. 반응 혼합물을 상온으로 냉각시키고, 감압 하에서 건조시켜 농축하였다. 얻어진 고체를 플라스크에서 긁어내어 50℃에서 진공 건조시켜, 401.2g의 소듐 4-[(4-클로로-2-히드록시벤조일)아미노]부타노에이트를 연한 노란색을 띤 백색 고체 상태로 얻었으며, 수율은 96.9% 이었다.
실시예 1f: 이소프로판올 용매 화합물을 사용하는 소듐 4-[(4-클로로-2-히드록시벤조일)아미노]부타노에이트의 제조
1L 4구 둥근 바닥 플라스크에 오버헤드 교반기, 환류 냉각기, 열전대 온도 표시기 및 가열 맨틀을 장치하였다. 건조 질소 분위기 하에서 다음과 같은 반응을 수행하였다. 이소프로판올 (400mL) 및 4-[(4-클로로-2-히드록시벤조일)아미노]부탄산 (25.0g, 0.09mol)을 반응기에 넣고 교반을 시작하였다. 흐릿한 갈색 용액이 얻어질 때까지 반응물 슬러리를 50℃에서 가열하였다. 따뜻한 용액을 화트만(Whatman) #1 여과지를 깐 따뜻한 압력 필터를 통과시켜 깨끗한 1L 반응기에 받았다. 노란색의 투명한 여과액을 교반하면서 62℃로 가열하였다. 격렬하게 교반하면서 수산화나트륨 용액(50% 수용액; 7.2g, 0.09mol)을 반응기에 넣었다. 염기 용액이 모두 첨가된 다음, 반응기을 가열하여 2.5 시간 동안 환류(72℃) 하고, 상온으로 서서히 냉각되도록 하였다. 생성물을 규화 유리 깔때기를 통과시켜 진공 여과하고, 50℃의 진공 오븐에서 24시간 동안 건조시켜, 23.16g의 소듐 4-[(4-클로로-2-히드록시벤조일)아미노]부타노에이트를 연한 노란색을 띤 백색 고체 상태로 얻었으며, 수율은 92% 이었다.
실시예 1g. 캡슐 제조
화합물 1(실시예 1에서 제조된)의 모노 소듐염 및 인슐린을 함유하는 영장류 투약용 캡슐이 다음과 같은 방법으로 제조된다. 화합물 1의 모노 소듐염 및 QA307X 아연 인슐린 결정 인간: 프로인슐린 유도 (재조합 DNA 원천) (인디아나폴리스의 Eli-Lilly & Co.(인디아나)로부터 구입)을 먼저 35메시 타일러 표준 체로 거른 다음 필요한 양을 달았다. 체로 거른 화합물 1의 모노 소듐염 및 인슐린을 적합한 크기의 유리 모르타르 내에서 기하학적 시빙 법(geometirc sieving method)을 이용하여 배합하였다. 모르타르 내의 물질을 유리 막자로 고르게 섰었다. 모르타르 벽면을 긁어내는 데에는 약 주걱을 사용하였다. 얻어진 배합물을 캡슐 충진용 플라스틱 계량 보트(boat)로 옮겼다. 배합물을 사이즈 #0 토르팍(Torpac) 경질 젤라틴 캡슐 (Torpac, Inc., Fairfield, NJ 에서 구입)에 충진하였다. 각 캡슐의 충진 중량은 각 동물의 체중에 따라 달랐다. 화합물 1의 캡슐 투여량은 (모노 소듐 염으로서) 100mg/kg, 75mg/kg 및 50mg/kg 이었다. 인슐린의 캡슐 투여량은 kg 당 0.25 내지 0.5mg 이었다.
실시예 2 - 인슐린 - 경구 전달
A. 쥐(rat) 연구
(실시예 1a 또는 1b에서 제조된) 전달제 화합물 및 아연 인간 재조합 인슐린 (Calbiochem-Novabiochem Corp., La Jolla, CA 로부터 구입(카탈로그 번호 407694)의 경구 투여 (PO) 조성물을 탈이온수 중에서 제조하였다. 통상, 500mg의 전달제 화합물을 1.5mL의 물에 넣었다. 전달제 화합물의 유리산은 얻어진 용액을 교반하면서 1 당량의 수산화나트륨을 첨가하는 것에 의하여 소듐 염으로 전환된다. 용액을 와류시키고(vortexed), 이어서 가열(약 37℃) 및 초음파 처리하였다. NaOH 또는 HCl을 사용하여 pH를 약 7 내지 8.5로 조절하였다. 필요한 경우, 균일한 용해도를 달성하기 위하여 추가적으로 NaOH를 첨가하고, pH를 다시 조절하였다.(예를 들면, 화합물 1a의 경우, 물 1.5ml 중의 501mg의 화합물에 10N NaOH를 총 258.5ml 가하였으며, 최종 pH는 7.73이었다.) 그 다음, 총 부피가 2.4ml가 되도록 물을 첨가하고 와류시켰다. 인슐린 저장 용액(0.5409g의 인슐린과 18ml의 탈이온수로부터 제조되고, HCl과 NaOH로 pH가 8.15로 조절되고, 투명한 용액을 얻기 위하여 40ml의 진한 염산, 25ml의 10N NaOH 및 50ml의 1N NaOH을 사용한, 15mg/ml 용액)으로부터 약 1.25mg의 인슐린을 상기 용액에 가하고, 거꾸로 세워 혼합시켰다. 최종 전달제 화합물 투여량, 인슐린 투여량 및 투여 부피의 양은 아래의 표 1에 나타내었다.
투약 및 샘플링 절차는 다음과 같았다. 약 200-250g의 수컷 스프라그-다울리(Sprague-Dawley) 종의 쥐를 24 시간 동안 금식시키고, 투약 전에 및 마취를 유지하기 위해 필요한 경우 재차 케타민 (44mg/kg) 및 클로프로마진 (1.5mg/kg)을 투여하였다. 5 마리로 이루어진 하나의 투여군에게 투약 용액 중의 하나를 투여하였다. 경구 투여를 위하여 11cm 루쉬 8 프렌치 카테테르(11cm Rusch 8 French catheter)를 피펫 팁을 갖는 1ml 주시기에 연결하였다. 카테테르를 통하 여 용액을 끓어 들여 이 주사기에 투약 용액을 채운 다음, 카테테르를 닦아서 건조시켰다. 카테테르를, 앞니를 통과하는 1cm의 튜브를 남기고, 식도 아래에 넣었다. 그 다음 주사기의 플런저(plunger)를 눌러 용액을 투여하였다.
혈액 시료를, 통상적으로, 시간 = 15, 30, 60, 120 및 180분인 시점에, 말초 동맥으로부터 차례로 채취하였다. 혈청 인슐린 수준을, 감도 및 본 절차에서 사용되는 시료의 부피 및 농도에 대한 표준 커브의 직선 영역을 최적화하기 위하여 표준 절차를 변형시켜, 인슐린 엘리자(ELISA) 테스트 키트 (키트 번호 DSL-10-1600, Diagnostic Systems Laboratories, Inc., Webster, TX)로 결정하였다. 혈청 인간 인슐린 농도 (μU/ml)를 각 투여군 내의 5 마리의 동물 각각에 대하여 각 시점에서 측정하였다. 각 시점에서의 5 개의 값을 평균하였으며, 그 결과를 혈청 인슐린 농도 대 시간으로 도시하였다. 최대값(피크) 및 커브 아래 면적(AUC)을 아래의 표 1에 보고하였다. 이전의 실험 결과는 인간 인슐린만을 단독으로 경구 투약한 후에는 측정 가능한 수준으로 나타나지 않았다.
| 화합물 | 투여 부피 (ml/kg) | 화합물 투여량 (mg/kg) | 인슐린 투여량 (mg/kg) | 평균 피크 혈청 인간 인슐린 (μU/ml ±SE) | AUC |
| 1a | 1.0 | 200 | 0.5 | 1457 ±268 | 58935 |
| 1b | 1.0 | 200 | 0.5 | 183 ±89 | 8674 |
| 1b | 1.0 | 200 | 0.5 | 136 ±52 | 5533 |
| 1b | 1.0 | 200 | 0.5 | 205 ±61 | 7996 |
| 1b | 1.0 | 200 | 0.5 | 139 ±43 | 5271 |
B. 원숭이 연구
모든 동물에 대한 절차는 "Principles of Laboratory Animal Care"에 따랐으 며, 동물 보호 기관(Institutional Animal Care) 및 공인된 Use Committee (PACUC) 이었다.
각 동물에게 캡슐을 투여하기 위한 투약 절차는 다음과 같다. 기준선 (baseline) 혈장 (plasma) 시료를 투약 전에 동물로부터 취하였다. 체중이 2-3kg인 2 마리의 암컷과 2 마리의 수컷으로 구성된 4 마리의 시노몰구스(cynomolgus) 원숭이 군을 투약 전에 4 시간 및 투약 후에 최대 2 시간까지 금식시켰다. 투약 직전에 10mg/kg의 케타민 하이드로클로로이드를 근육 내 주사하여 이 동물들을 마취시켰다. 각 동물에는 화합물 1의 투여량 (25-100mg/kg)을, 인슐린 투여량을 0.25-0.5mg/kg 으로 변화시키는 것에 맞추어 변화시켜, 1개의 캡슐로 투여하였다. 투약 기간 동안 물을 이용할 수 있도록 하였고, 투약 전 밤새도록 및 투약 기간 동안 동물이 400ml의 쥬스를 이용할 수 있도록 하였다. 동물을 멜빵(sling) 감금 장치 내에 가두었다. 하나의 캡슐을 코켓(cocket) 플런저와 캡슐을 수용하는 갈라진 고무 팁(tip)을 갖는 플라스틱 장치인 환약 분무기(pill gun)에 넣었다. 환약 분무기를 동물의 식도에 넣었다. 환약 분무기의 플런저를 눌러서 고무 팁에 있는 캡슐을 식도 내로 밀어 넣었다. 그 다음, 환약 분무기를 치웠다. 동물의 입을 닫은 채로 유지하고, 연하 반사(swallowing reflex)를 유도하기 위하여, 약 5ml의 역삼투수 (reverse osmosis water)를 옆부분에서 입으로 투여하였다. 추가적인 연하 반사를 유도하기 위하여, 동물의 목구멍을 마찰시켰다.
구연산 첨가 혈액(citrated blood) 시료 (각각 1ml)를 정맥 천자(venipuncture)를 사용하여 투약 1 시간 전에, 및 투약 10, 20, 30, 40 및 50 분 후와 1, 1.5, 2, 3, 4 및 6 시간 후에 적당한 혈관으로부터 채취하였다. 각각 모아진 혈장 시료를 두 개의 부분(portion)으로 나누었다. 하나의 부분은 -80℃로 냉동시켜, 인슐린 분석을 위하여 다른 곳으로 보냈다. 다른 하나의 부분은 혈당 분석에 사용하였다. 4 마리의 원숭이는 또한 피하 투여(0.02mg/kg)를 받았다. 혈액 시료를 채취하여 상술한 방법으로 분석하였다.
인슐린 분석
혈청 인슐린 수준을 인슐린 엘리자 테스트 키트(DSL, Webster, TX)로 측정하였다.
혈당 분석
그 결과는 아래의 표 1A에 나타낸 것과 같다.
| 화합물 | 화합물 투여량 (mg/kg) | 인슐린 투여량 (mg/kg) | 평균 피크 혈청 인간 인슐린 (μU/ml ±SE) | 평균 피크 혈당 감소 (μU/ml ±SE) |
| 1d | 100 | 0.5 | 91.4 ±45 | -52.3 ±5.3 |
| 1d | 50 | 0.5 | 124.1 ±51.95 | -61 ±12.7 |
| 1d | 25 | 0.5 | 87.14 ±53.85 | -28.75 ±21.59 |
| 1d | 25 | 0.25 | 36.35 ±32.3 | -19 ±10.21 |
실시예 3 - 크로몰린 - 경구 전달
(실시예 1b에서 제조된) 전달제 화합물 및 크로몰린 디소듐 염(Sigma, Milwaukee, Wisconsin)을 함유하는 투약 용액을 탈이온수 중에서 제조하였다. 전달제 화합물의 유리 산을 1 당량의 수산화나트륨을 사용하여 소듐 염으로 전환하였 다. 이 혼합물을 와류시키고, 초음파 처리기(약 37℃)에 넣었다. pH를 NaOH 수용액을 사용하여 약 7-7.5로 조절하였다. 균일한 용해도를 달성하기 위하여 필요한 경우 추가로 NaOH를 첨가하고, pH를 다시 조절하였다. 이 혼합물을 와류시켜 균일한 용액을 생성시키고, 필요한 경우, 초음파 처리 및 가열하였다. 전달제 화합물 용액을 저장 용액(필요한 경우 NaOH 또는 HCl로 pH가 약 7.0으로 조절하여, 포일(foil)로 싸서 냉동시켜 보관한 저장 용액으로서, 해동시키고, 사용 전에 약 30℃로 가열한, 175mg 크로몰린/ml 탈이온수 용액) 중의 크로몰린과 혼합시켰다. 이 혼합물을 와류시켜 균일한 용액을 생성시키고, 필요한 경우, 초음파 처리 및 가열하였다. NaOH 수용액을 사용하여 pH를 약 7-7.5로 조절하였다. 그 다음, 용액을 원하는 부피 및 농도가 되도록 (통상 2.0ml) 물로 희석하고, 사용하기 전에 포일로 싸서 보관하였다. 최종 전달제 화합물 및 크로몰린 투여량 및 투여 부피는 아래의 표 2에서 보여주는 것과 같다.
통상적인 투약 및 샘플링 절차는 다음과 같다. 200-250g의 수컷 스프라그-다울리 종의 쥐를 24 시간 동안 금식시키고, 케타민 (44mg/kg) 및 클로프로마진 (1.5mg/kg)을 투약 15분 전 및 마취를 유지시키는 데 필요한 만큼 재차 투여하여 마취시켰다. 5 마리로 이루어진 하나의 투여군에 투약 용액 중의 하나를 투여하였다. 11cm 루쉬 8 프렌치 카테테르를 피펫 팁을 갖는 1ml 주시기에 연결하였다. 카테테르를 통하여 용액을 끓어 들여 이 주사기에 투약 용액을 채운 다음, 카테테르를 닦아서 건조시켰다. 카테테르를, 앞니를 통과하는 1cm의 튜브를 남기고, 식도 아래에 넣었다. 그 다음 주사기의 플런저를 눌러 용액을 투여하였다.
혈액 시료를, 통상적으로, 투약 후 0.25, 0.5, 1.0 및 1.5 시간 후에 말초 동맥으로부터 채취하였다. 혈청 크로몰린 농도를 HPLC로 측정하였다. 시료는 다음과 같은 방법으로 준비되었다. 에펜도르프 튜브 내에서, 100㎕의 혈청을 3N HCl 100㎕ 및 에틸 아세테이트 300㎕와 혼합시켰다. 튜브를 10분 동안 와류시킨 다음, 10,000rpm으로 10분 동안 원심 분리하였다. 200㎕의 에틸 아세테이트 층을 0.1M 포스페이트 완충용액 67㎕가 들어있는 에펜도르프 튜브로 옮겼다. 튜브를 10분 동안 와류시킨 다음, 10,000rpm으로 10분 동안 원심 분리하였다. 그 다음, 포스페이트 완충용액 층을 HPLC 바이알로 옮기고, 이를 HPLC (컬럼 = Keystone Exsil Amino 150 ×2mm i.d., 5㎛, 100Å(Keystone Scientific Products, Inc.); 이동상 = 35% 완충 용액 (85% H3PO4로 pH가 3으로 조절된 68mM KH2PO4)/65% 아세토니트릴; 주입 부피 = 10㎕; 이동 속도 = 0.30 ml/분; 크로몰린 머무름 시간 = 5.5분; 240nm에서 흡광도 검출)에 주입하였다. 이전의 연구는 기준값이 약 0 이라는 것을 나타내었다. 각 군내의 동물로부터 얻은 결과를 각 시점에 대하여 평균하고, 이 평균값 중의 최대값 (즉, 평균 피크 혈청 크로몰린 농도)을 아래의 표 2에 보고하였다.
| 화합물 | 투여 부피 (ml/kg) | 화합물 투여량 (mg/kg) | 크로몰린 투여량 (mg/kg) | 평균 피크 혈청 (크로몰린) ±SD(SE) |
| 1b | 1 | 200 | 25 | 0.70 ±0.36 (0.16) |
실시예 4: 재조합 인간 성장 호르몬 (rhGH) - 경구 전달
(아래의 표 3에 나타낸 것과 같은, 실시예 1a 또는 1b에서 제조된) 전달제 화합물 및 rhGH로 이루어진 경구 위관 (PO) 투약 용액을 포스페이트 완충 용액 중에서 제조하였다. 전달제 화합물의 유리 산은 1 당량의 수산화나트륨을 사용하여 소듐 염으로 전환하였다. 통상, 상기 화합물의 용액을 포스페이트 완충 용액 중에서 제조하고, 소듐 염으로 만드는 경우 1 당량의 수산화나트륨 (1.0N)을 첨가하여 교반하였다. 균일한 용해도를 달성하기 위하여 필요한 경우에는 추가로 NaOH를 첨가하고, pH를 다시 조절하였다. 최종적인 투약 용액은 상기 화합물 용액을 rhGH 저장 용액(15mg의 분말 상태의 rhGH, 75mg의 D-마니톨, 15mg의 글리신 및 3.39mg의 2가 소듐 포스페이트를 혼합시키고, 2% 글리세롤로 희석하여 만들어진 15mg rhGH/ml 용액)과 혼합시키고, 원하는 부피(대개 3.0ml)로 희석시켜 제조하였다. 상기 화합물 및 rhGH 투여량 및 투여 부피는 아래의 표 3에 나타내었다.
전형적인 투약 및 샘플링 절차는 다음과 같다. 200-250g의 수컷 스프라그-다울리 종의 쥐를 24 시간 동안 금식시키고, 케타민 (44mg/kg) 및 클로프로마진 (1.5mg/kg)을 투약 15분 전 및 마취를 유지시키는 데 필요한 만큼 재차 투여하여 마취시켰다. 5 마리로 이루어진 하나의 투여군에 투약 용액 중의 하나를 투여하였다. 11cm 루쉬 8 프렌치 카테테르를 피펫 팁을 갖는 1ml 주시기에 연결하였다. 카테테르를 통하여 용액을 끓어 들여 이 주사기에 투약 용액을 채운 다음, 카테테르를 닦아서 건조시켰다. 카테테르를, 앞니를 통과하는 1cm의 튜브를 남기고, 식도 아래에 넣었다. 그 다음 주사기의 플런저를 눌러 용액을 투여하였다.
혈액 시료를, 통상적으로, 투여 15, 30, 45 및 60 분 후에 말초 동맥으로부터 차례로 채취하였다. 혈청 rhGH 농도를 rhGH 면역 분석 시험 키트(키트 번호 KIF4015, Genzyme Corporation Inc., Cambridge, MA)로 정량하였다. 이전의 연구는 기준값이 약 0 이라는 것을 나타내었다.
각 군의 동물로부터 얻어진 결과를 각 시점에서 평균하였다. 이들 평균의 최대값(즉, 평균 피크 혈청 rhGH 농도)을 아래의 표 3에 보고하였다. (표준 편차(SD) 또는 표준 오차(SE)가 주어지지 않은 경우는 각 시점에서 얻어진 5 개의 시료가 분석 전에 합쳐진 것이다.)
| 화합물 | 투여 부피 (ml/kg) | 화합물 투여량 (mg/kg) | rhGH 투여량 (mg/kg) | 평균 피크 혈청 [rhGH] ±SD (SE) (ng/ml) |
| 1a | 1 | 200 | 3 | 99.35 |
| 1a | 1 | 200 | 3 | 42.62 |
| 1b | 1 | 200 | 3 | 84.01 ±73.57 (32.90) |
| 1b | 1 | 200 | 3 | 50.44 ±34.13 (15.26) |
실시예 5 - 인터페론 - 경구 전달
(실시예 1b에서 제조된) 전달제 화합물 및 인간 인터페론 (IFN)으로 이루어진 투약 용액을 탈이온수 중에서 제조하였다. 전달제 화합물의 유리 산을 1 당량의 수산화나트륨을 사용하여 소듐 염으로 전환하였다. 통상적으로, 전달제 화합물 용액을 수용액으로 제조하고, 소듐 염으로 만드는 경우 1 당량의 수산화나트륨 (1.0N)을 첨가하여 교반하였다. 이 혼합물을 와류시키고, 초음파 처리기(약 37℃)에 넣었다. NaOH 수용액을 사용하여 pH를 약 7.0 내지 8.5로 조절하였다. 이 혼합물을 와류시켜 균일한 현탁액 또는 용액을 생성시키고, 필요한 경우, 초음파 처리 및 가열하였다. 균일한 용해도를 달성하기 위하여 필요한 경우 추가로 NaOH를 첨가 하였으며, pH를 다시 조절하였다. 전달제 화합물 용액을 IFN 저장 용액 (약 22.0 내지 27.5mg/ml 포스페이트 완충 염류 용액)과 혼합시키고, 원하는 부피 (대개 3.0ml)로 희석시켰다. 최종 전달제 화합물 및 IFN 투여량, 및 투여 부피를 아래의 표 4에 나타내었다.
전형적인 투약 및 샘플링 절차는 다음과 같다. 200-250g의 수컷 스프라그-다울리 종의 쥐를 24 시간 동안 금식시키고, 케타민 (44mg/kg) 및 클로프로마진 (1.5mg/kg)을 투약 15분 전 및 마취를 유지시키는 데 필요한 만큼 재차 투여하여 마취시켰다. 5 마리로 이루어진 하나의 투여군에 투약 용액 중의 하나를 투여하였다. 11cm 루쉬 8 프렌치 카테테르를 피펫 팁을 갖는 1ml 주시기에 연결하였다. 카테테르를 통하여 용액을 끓어 들여 이 주사기에 투약 용액을 채운 다음, 카테테르를 닦아서 건조시켰다. 카테테르를, 앞니를 통과하는 1cm의 튜브를 남기고, 식도 아래에 넣었다. 그 다음 주사기의 플런저를 눌러 용액을 투여하였다.
혈액 시료를, 통상적으로, 투여 0, 15, 30, 45, 60 및 90 분 후에 말초 동맥으로부터 차례로 채취하였다. 혈청 IFN 농도를 인간 IFN-알파를 위한 세포 스크린 (cytoscreen) 면역 분석 키트(카탈로그 번호 KHC4012, Biosource International, Camarillo, CA)를 사용하여 정량하였다. 이전의 연구는 기준값이 약 0 이라는 것을 나타내었다. 각 군의 동물로부터 얻어진 결과를 각 시점에서 평균하였다. 이들 평균의 최대값(즉, 평균 피크 혈청 IFN 농도)을 아래의 표 3에 보고하였다.
| 화합물 | 투여 부피 (ml/kg) | 화합물 투여량 (mg/kg) | IFN 투여량 (mg/kg) | 평균 피크 혈청 [IFN] (ng/ml)±SD (SE) |
| 1b | 1.0 | 200 | 3 | 50.44 ±34.13 (15.26) |
상술한 특허, 출원, 시험 방법 및 공보는 본 명세서에 참고 문헌으로서 완전하게 병합되어 있다.
본 발명의 다양한 변형이 상술한 발명의 상세한 설명에 비추어 본 발명이 속하는 기술 분야의 당업자에게 시사될 것이다. 모든 그러한 명백한 변형은 첨부된 특허청구범위 내에 완전히 포함되는 것으로 의도된다.
Claims (20)
- 삭제
- 제2항에 있어서, 상기 생물학적 활성제는 하나 이상의 단백질, 폴리펩티드, 펩티드, 호르몬, 다당류, 무코 다당류, 탄수화물 또는 지방을 포함하는 것인, 생물학적 활성제의 전달 촉진용 조성물.
- 제2항에 있어서, 상기 생물학적 활성제는 성장 호르몬, 인간 성장 호르몬, 재조합 인간 성장 호르몬, 소 성장 호르몬, 돼지 성장 호르몬, 성장 호르몬 방출 호르몬, 인터페론, α-인터페론, β-인터페론, γ-인터페론, 인터루킨-1, 인터루킨-2, 인슐린, 돼지 인슐린, 소 인슐린, 인간 인슐린, 인간 재조합 인슐린, 인슐린 유사 성장 인자, 인슐린 유사 성장 인자-1, 헤파린, 단편화되지 않은 헤파린, 헤파리노이드, 더마탄, 콘드로이틴, 저 분자량 헤파린, 매우 낮은 분자량 헤파린, 초저 분자량 헤파린, 칼시토닌, 연어 칼시토닌, 뱀장어 칼시토닌, 인간 칼시토닌, 에리쓰로포이에틴 (EPO), 심방성 나트륨 이뇨 인자, 항원, 모노클로날 항체, 소마토스타틴, 프로테아제 억제제, 아드레노코르티코트로핀, 고나도트로핀 방출 호르몬, 옥시토신, 황체 형성 호르몬 방출 호르몬, 여포 자극 호르몬, 글루코세레브로시다아제, 트롬보포이에틴, 필그라스팀, 프로스타글란딘, 시클로스포린, 바소프레신, 크로몰린 소듐, 소듐 크로모글리케이트, 디소듐 크로모글리케이트, 반코마이신, 데스페리옥사민, 부갑상선 호르몬, 부갑상선 호르몬의 단편, 항미생물제, 항진균제, 비타민; 이 화합물들의 동족체, 단편, 모방체 및 폴리에틸렌글리콜-변형 유도체, 및 이들의 조합 중 어떤 것으로 구성된 군에서 선택되는 것인, 생물학적 활성제의 전달 촉진용 조성물.
- 제2항에 있어서, 상기 생물학적 활성제는 인슐린, 인간 성장 호르몬, 인터페론, 크로몰린 소듐 또는 이들의 조합을 포함하는 것인, 생물학적 활성제의 전달 촉진용 조성물.
- 제2항에 있어서, 상기 생물학적 활성제는 인슐린을 포함하는 것인, 생물학적 활성제의 전달 촉진용 조성물.
- 제2항에 있어서, 상기 생물학적 활성제는 인터페론을 포함하는 것인, 생물학적 활성제의 전달 촉진용 조성물.
- (A) 제2항에 따른 생물학적 활성제의 전달 촉진용 조성물, 및(B) (a) 부형제,(b) 희석제(c) 붕해제(d) 윤활제(e) 가소제(f) 착색제(g) 투약 운송 수단, 또는(h) 이들의 조합 중의 어떤 것을 포함하는, 투약 단위 제형.
- 삭제
- 제9항에 있어서, 상기 생물학적 활성제는 하나 이상의 단백질, 폴리펩티드, 펩티드, 호르몬, 다당류, 무코 다당류, 탄수화물 또는 지방을 포함하는 것인 투약 단위 제형.
- 제9항에 있어서, 상기 생물학적 활성제는 성장 호르몬, 인간 성장 호르몬, 재조합 인간 성장 호르몬, 소 성장 호르몬, 돼지 성장 호르몬, 성장 호르몬 방출 호르몬, 인터페론, α-인터페론, β-인터페론, γ-인터페론, 인터루킨-1, 인터루킨-2, 인슐린, 돼지 인슐린, 소 인슐린, 인간 인슐린, 인간 재조합 인슐린, 인슐린 유사 성장 인자, 인슐린 유사 성장 인자-1, 헤파린, 단편화되지 않은 헤파린, 헤파리노이드, 더마탄, 콘드로이틴, 저 분자량 헤파린, 매우 낮은 분자량의 헤파린, 초저 분자량 헤파린, 칼시토닌, 연어 칼시토닌, 뱀장어 칼시토닌, 인간 칼시토닌, 에리쓰로포이에틴, 심방성 나트륨 이뇨 인자, 항원, 모노클로날 항체, 소마토스타틴, 프로테아제 억제제, 아드레노코르티코트로핀, 고나도트로핀 방출 호르몬, 옥시토신, 황체 형성 호르몬 방출 호르몬, 여포 자극 호르몬, 글루코세레브로시다아제, 트롬보포이에틴, 필그라스팀, 프로스타글란딘, 시클로스포린, 바소프레신, 크로몰린 소듐, 소듐 크로모글리케이트, 디소듐 크로모글리케이트, 반코마이신, 데스페리옥사민, 부갑상선 호르몬, 부갑상선 호르몬의 단편, 항미생물제, 항진균제, 비타민; 이 화합물들의 동족체, 단편, 모방체 및 폴리에틸렌글리콜-변형 유도체, 및 이들의 조합 중 어떤 것으로 구성된 군에서 선택되는 것인 투약 단위 제형.
- 제9항에 있어서, 상기 생물학적 활성제는 인슐린, 인간 성장 호르몬, 인터페론, 크로몰린 소듐 또는 이들의 조합을 포함하는 것인 투약 단위 제형.
- 제9항에 있어서, 상기 생물학적 활성제는 인슐린을 포함하는 것인 투약 단위 제형.
- 제9항에 있어서, 상기 생물학적 활성제는 인터페론을 포함하는 것인 투약 단위 제형.
- 제9항에 있어서, 정제, 캡슐, 미립자, 분말, 1회용 약봉지 또는 액제 형태인 투약 단위 제형.
- 제9항에 있어서, 상기 투약 운송 수단은 물, 25% 프로필렌 글리콜 수용액, 포스페이트 완충 용액, 1,2-프로판 디올, 에탄올 및 이들의 조합 중의 어떤 것으로 구성된 군에서 선택되는 것인 투약 단위 제형.
- 제2항에 있어서, 생물학적 활성제를 필요로 하는 동물에게 경구로 투여하기 위한 것인 생물학적 활성제의 전달 촉진용 조성물.
- (A) 생물학적 활성제 1종 이상,(B) 제1항에 따른 화합물 및(C) 임의의 투약 운송 수단을 혼합하는 것을 포함하는, 생물학적 활성제의 전달 촉진용 조성물의 제조방법.
- 삭제
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US21489300P | 2000-06-29 | 2000-06-29 | |
| US60/214,893 | 2000-06-29 | ||
| PCT/US2001/021073 WO2002002509A1 (en) | 2000-06-29 | 2001-06-29 | Compounds and compositions for delivering active agents |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20030058958A KR20030058958A (ko) | 2003-07-07 |
| KR100828668B1 true KR100828668B1 (ko) | 2008-05-09 |
Family
ID=22800813
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020027017966A KR100828668B1 (ko) | 2000-06-29 | 2001-06-29 | 활성제 전달용 화합물 및 조성물 |
Country Status (24)
| Country | Link |
|---|---|
| US (1) | US7351741B2 (ko) |
| EP (1) | EP1299348B1 (ko) |
| JP (1) | JP2004521857A (ko) |
| KR (1) | KR100828668B1 (ko) |
| CN (1) | CN100482637C (ko) |
| AT (1) | ATE391708T1 (ko) |
| AU (3) | AU2001273153B2 (ko) |
| BR (1) | BR0112311A (ko) |
| CA (1) | CA2411754C (ko) |
| CY (1) | CY1108532T1 (ko) |
| CZ (1) | CZ303736B6 (ko) |
| DE (1) | DE60133555T2 (ko) |
| DK (1) | DK1299348T3 (ko) |
| ES (1) | ES2306719T3 (ko) |
| HK (1) | HK1054918A1 (ko) |
| IL (1) | IL153297A0 (ko) |
| MX (1) | MXPA02012855A (ko) |
| NZ (1) | NZ523017A (ko) |
| PT (1) | PT1299348E (ko) |
| RU (1) | RU2326110C2 (ko) |
| SK (1) | SK1182003A3 (ko) |
| UA (1) | UA80248C2 (ko) |
| WO (1) | WO2002002509A1 (ko) |
| ZA (1) | ZA200209946B (ko) |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6358504B1 (en) * | 1997-02-07 | 2002-03-19 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| DE60134245D1 (de) * | 2000-09-06 | 2008-07-10 | Emisphere Tech Inc | (5-(2-hydroxy-4-chlorbenzoyl)valeriansäure und deren salze, und zusammensetzungen zur zuführung von wirkstoffen, die diese verbindungen enthalten |
| WO2003045331A2 (en) | 2001-11-29 | 2003-06-05 | Emisphere Technologies, Inc. | Formulations for oral administration of cromolyn sodium |
| US20030198666A1 (en) * | 2002-01-07 | 2003-10-23 | Richat Abbas | Oral insulin therapy |
| EP2272501B1 (en) * | 2002-01-09 | 2013-03-20 | Emisphere Technologies, Inc. | Polymorphs of sodium 4-((4-chloro-2-hydroxybenzoyl) amino) butanoate |
| CN1332711C (zh) | 2002-02-20 | 2007-08-22 | 埃米球科技有限公司 | 施用glp-1分子的方法 |
| JP5452843B2 (ja) * | 2003-01-06 | 2014-03-26 | エミスフィアー テクノロジーズ インコーポレイテッド | 夜間の経口インスリン治療 |
| JP2006519881A (ja) * | 2003-03-06 | 2006-08-31 | エミスフィアー テクノロジーズ インコーポレイテッド | 経口インスリン治療及びプロトコール |
| EP1605895A4 (en) * | 2003-03-06 | 2011-08-24 | Emisphere Tech Inc | ORAL INSULIN THERAPY AND PROTOCOL |
| BR0318454A (pt) | 2003-08-08 | 2006-09-12 | Abgenix Inc | anticorpos dirigidos a hormÈnio da paratireóide (pth) e seus usos |
| US7318925B2 (en) * | 2003-08-08 | 2008-01-15 | Amgen Fremont, Inc. | Methods of use for antibodies against parathyroid hormone |
| CN100398536C (zh) | 2003-08-20 | 2008-07-02 | 爱密斯菲尔科技公司 | 用于口服传递glp-1化合物或mc4激动剂肽的化合物、方法和制剂 |
| JP4767850B2 (ja) | 2003-08-20 | 2011-09-07 | エミスフィアー テクノロジーズ インコーポレイテッド | グルカゴン様ペプチド(glp)−1化合物またはメラノコルチン4受容体(mc4)アゴニストペプチドの経口デリバリーのための化合物、方法および製剤 |
| US20050203001A1 (en) | 2004-03-05 | 2005-09-15 | Emisphere Technologies, Inc. | Oral insulin therapies and protocol |
| US20090029911A1 (en) * | 2003-09-25 | 2009-01-29 | Ashley Martin Williams | Liquid Human Growth Hormone Formulation Containing Polyethylene Glycol |
| US20060286129A1 (en) | 2003-12-19 | 2006-12-21 | Emisphere Technologies, Inc. | Oral GLP-1 formulations |
| MXPA06012841A (es) | 2004-05-06 | 2007-02-15 | Emisphere Tech Inc | Forma de dosificacion solida de heparina humeda. |
| ES2586423T3 (es) | 2004-05-14 | 2016-10-14 | Emisphere Technologies, Inc. | Compuestos de aril cetona y composiciones para administrar principios activos |
| EP1756039B1 (en) * | 2004-05-14 | 2012-10-17 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| NZ551455A (en) | 2004-05-19 | 2012-03-30 | Emisphere Tech Inc | Acyclovir formulations |
| JP4885856B2 (ja) | 2004-05-19 | 2012-02-29 | エミスフェアー・テクノロジーズ・インク | 局所クロモリン製剤 |
| AU2005271526B2 (en) * | 2004-08-03 | 2011-12-08 | Emisphere Technologies, Inc. | Antidiabetic oral insulin-biguanide combination |
| JP4636839B2 (ja) * | 2004-09-24 | 2011-02-23 | パナソニック株式会社 | 電子デバイス |
| GB0427603D0 (en) * | 2004-12-16 | 2005-01-19 | Novartis Ag | Organic compounds |
| GB0427600D0 (en) * | 2004-12-16 | 2005-01-19 | Novartis Ag | Organic compounds |
| MX2007008082A (es) | 2004-12-29 | 2007-09-05 | Emisphere Tech Inc | Formulaciones farmaceuticas de sales de galio. |
| US8110547B2 (en) | 2005-01-12 | 2012-02-07 | Emisphere Technologies, Inc. | Compositions for buccal delivery of parathyroid hormone |
| WO2007011958A2 (en) | 2005-07-15 | 2007-01-25 | Emisphere Technologies, Inc. | Intraoral dosage forms of glucagon |
| JP2009514856A (ja) * | 2005-11-04 | 2009-04-09 | ジェンタ インコーポレーテッド | 医薬品ガリウム組成物及び方法 |
| US8927015B2 (en) | 2006-04-12 | 2015-01-06 | Emisphere Technologies, Inc. | Formulations for delivering insulin |
| WO2007133944A2 (en) | 2006-05-09 | 2007-11-22 | Emisphere Technologies, Inc. | Topical administration of acyclovir |
| US9364502B2 (en) | 2006-06-28 | 2016-06-14 | Emisphere Technologies, Inc. | Gallium nitrate formulations |
| EP2057112B1 (en) | 2006-08-31 | 2018-12-19 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| WO2008112706A1 (en) | 2007-03-13 | 2008-09-18 | Nutrition 21, Inc. | Methods and compositions for the sustained release of chromium |
| WO2009002867A2 (en) | 2007-06-26 | 2008-12-31 | Nutrition 21, Inc. | Multiple unit dosage form having a therapeutic agents in combination with a nutritional supplement |
| JP5668476B2 (ja) * | 2007-10-08 | 2015-02-12 | オーリニア・ファーマシューティカルズ・インコーポレイテッドAurinia Pharmaceuticals Inc. | カルシニューリン阻害剤またはmTOR阻害剤を含む眼科用組成物 |
| IL188647A0 (en) | 2008-01-08 | 2008-11-03 | Orina Gribova | Adaptable structured drug and supplements administration system (for oral and/or transdermal applications) |
| US8980254B2 (en) * | 2008-08-21 | 2015-03-17 | Alvine Pharmaceuticals, Inc. | Formulation for oral administration of proteins |
| ES2537385T3 (es) * | 2009-06-09 | 2015-06-08 | Aurinia Pharmaceuticals Inc. | Sistemas de suministro tópico para uso oftálmico |
| BR112012000379A2 (pt) | 2009-07-09 | 2016-03-29 | Oshadi Drug Administration Ltd | composições de matriz carreadora, métodos e usos |
| JP5985985B2 (ja) | 2009-08-03 | 2016-09-06 | エミスフィアー テクノロジーズ インコーポレイテッドEmisphere Technologies,Inc. | 胃腸への影響が減少した即効型ナプロキセン組成物 |
| US20110177147A1 (en) * | 2010-01-21 | 2011-07-21 | General Electric Company | Stable biocidal delivery systems |
| US20130150323A1 (en) * | 2010-02-04 | 2013-06-13 | Urigen Pharmaceuticals, Inc | Use of oral heparin preparations to treat urinary tract diseases and conditions |
| JP5894726B2 (ja) * | 2010-07-13 | 2016-03-30 | 株式会社大塚製薬工場 | 膵島の分離方法および膵島組織を保護するための保護液 |
| KR101836957B1 (ko) | 2011-03-01 | 2018-03-09 | 제이디에스 테라퓨틱스, 엘엘씨 | 당뇨병, 저혈당 및 관련 장애를 치료 및 예방하기 위한 인슐린과 크롬을 포함하는 조성물 |
| RU2495866C1 (ru) * | 2012-06-19 | 2013-10-20 | Государственное бюджетное образовательное учреждение высшего профессионального образования "Волгоградский государственный медицинский университет" Министерства здравоохранения и социального развития Российской Федерации | Производное гамма-аминомасляной кислоты, обладающее ноотропной активностью в сочетании с транквилизирующим действием |
| RU2495867C1 (ru) * | 2012-07-11 | 2013-10-20 | Государственное бюджетное образовательное учреждение высшего профессионального образования "Волгоградский государственный медицинский университет" Министерства здравоохранения и социального развития Российской Федерации" | Дилитиевая соль n-салицилоилглицина, обладающая ноотропной активностью |
| ES2813340T3 (es) | 2012-09-21 | 2021-03-23 | Intensity Therapeutics Inc | Método de tratamiento del cáncer |
| CN112386604A (zh) | 2013-04-29 | 2021-02-23 | 纪念斯隆-凯特琳癌症中心 | cGAS的调节剂 |
| AU2017217466A1 (en) | 2016-02-11 | 2018-08-23 | Nutrition 21, Llc | Chromium containing compositions for improving health and fitness |
| RU2633769C1 (ru) * | 2016-05-16 | 2017-10-18 | Государственное бюджетное образовательное учреждение высшего профессионального образования "Волгоградский государственный медицинский университет" Министерства здравоохранения Российской Федерации ГБОУ ВПО ВолгГМУ МЗ РФ | Гамма-(N-гидроксибензоиламино)бутирохлориды, как полупродукты для получения потенциальных биологически активных производных гамма-аминомасляной кислоты |
| US20190224275A1 (en) | 2017-05-12 | 2019-07-25 | Aurinia Pharmaceuticals Inc. | Protocol for treatment of lupus nephritis |
| CN108689876B (zh) * | 2018-06-28 | 2020-11-27 | 苏州东南药业股份有限公司 | 一种8-(2-羟基苯甲酰胺基)辛酸钠的制备方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4610983A (en) | 1984-06-12 | 1986-09-09 | Toyama Chemical Co., Ltd. | N-acyl acidic amino acid diamide derivative, a salt thereof, and an anti-ulcer agent containing the same |
| WO1996030036A1 (en) * | 1995-03-31 | 1996-10-03 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
Family Cites Families (70)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR4446E (fr) | 1904-07-05 | 1905-08-25 | Jacques Pinatel | Étau serrant les pièces coniques |
| US3489793A (en) | 1966-05-16 | 1970-01-13 | Francia Formaceutici S R L | New benzamido butyric acid derivatives |
| ES369853A1 (es) | 1969-07-24 | 1971-07-16 | Bama S A Lab | Procedimiento para la obtencion de derivados del acido ep- silon-amino-caproico. |
| DE2260118C2 (de) | 1972-12-08 | 1982-06-03 | Bayer Ag, 5090 Leverkusen | Penicilline sowie ihre Verwendung als Arzneimittel |
| DE2517229A1 (de) | 1975-04-18 | 1976-10-28 | Boehringer Mannheim Gmbh | Phenylalkylcarbonsaeure-derivate und verfahren zu ihrer herstellung |
| NZ196349A (en) | 1980-03-07 | 1984-08-24 | Interx Research Corp | Enhancement of absorption rate of orally administered polar bioactive agents |
| US4442090A (en) | 1980-11-09 | 1984-04-10 | Kyoto Yakuhin Kogyo Kabushiki Kaisha | Absorption-promoting compounds, compositions thereof with pharmaceuticals and/or bases for rectal administration and method of use |
| US4900730A (en) | 1981-01-14 | 1990-02-13 | Toyo Jozo Co., Ltd. | Preparation which promotes the absorption of peptides |
| GB2092136B (en) | 1981-01-17 | 1985-06-05 | Mitsui Toatsu Chemicals | Production of n-substituted amide compounds |
| JPS58140026A (ja) | 1982-01-14 | 1983-08-19 | Toyo Jozo Co Ltd | 吸収性良好な製剤 |
| FR2509175B1 (fr) | 1981-03-06 | 1987-01-16 | Toyo Jozo Kk | Preparation therapeutique ayant d'excellentes proprietes d'absorption |
| DE3266360D1 (en) | 1981-06-16 | 1985-10-24 | Choay Sa | Medicines containing as active ingredients compounds of the arylbenzenesulfonamide-type, and processes for their preparation |
| US4757066A (en) | 1984-10-15 | 1988-07-12 | Sankyo Company Limited | Composition containing a penem or carbapenem antibiotic and the use of the same |
| LU86258A1 (fr) | 1986-01-21 | 1987-09-03 | Rech Dermatologiques C I R D S | Composes benzamido aromatique,leur procede de preparation et leur utilisation en medecine humaine ou veterinaire et en cosmetique |
| USRE35862E (en) | 1986-08-18 | 1998-07-28 | Emisphere Technologies, Inc. | Delivery systems for pharmacological agents encapsulated with proteinoids |
| FR2636238B1 (fr) | 1988-09-14 | 1994-01-21 | Morelle Jean | Nouvelles compositions antisudorales |
| JPH02239980A (ja) | 1989-03-15 | 1990-09-21 | Fuji Photo Film Co Ltd | 感熱記録材料 |
| US5629020A (en) | 1994-04-22 | 1997-05-13 | Emisphere Technologies, Inc. | Modified amino acids for drug delivery |
| US5714167A (en) | 1992-06-15 | 1998-02-03 | Emisphere Technologies, Inc. | Active agent transport systems |
| US6099856A (en) | 1992-06-15 | 2000-08-08 | Emisphere Technologies, Inc. | Active agent transport systems |
| US5447728A (en) | 1992-06-15 | 1995-09-05 | Emisphere Technologies, Inc. | Desferrioxamine oral delivery system |
| US5443841A (en) | 1992-06-15 | 1995-08-22 | Emisphere Technologies, Inc. | Proteinoid microspheres and methods for preparation and use thereof |
| US6221367B1 (en) | 1992-06-15 | 2001-04-24 | Emisphere Technologies, Inc. | Active agent transport systems |
| US5541155A (en) | 1994-04-22 | 1996-07-30 | Emisphere Technologies, Inc. | Acids and acid salts and their use in delivery systems |
| US5451410A (en) | 1993-04-22 | 1995-09-19 | Emisphere Technologies, Inc. | Modified amino acids for encapsulating active agents |
| US5811127A (en) | 1992-06-15 | 1998-09-22 | Emisphere Technologies, Inc. | Desferrioxamine oral delivery system |
| HU211995B (en) | 1992-06-30 | 1996-01-29 | Gyogyszerkutato Intezet | Process to prepare novel benzoyl amino acid derivs. and pharmaceutical compns. contg.them |
| US5583020A (en) | 1992-11-24 | 1996-12-10 | Ribozyme Pharmaceuticals, Inc. | Permeability enhancers for negatively charged polynucleotides |
| US5401516A (en) | 1992-12-21 | 1995-03-28 | Emisphere Technologies, Inc. | Modified hydrolyzed vegetable protein microspheres and methods for preparation and use thereof |
| US5709861A (en) | 1993-04-22 | 1998-01-20 | Emisphere Technologies, Inc. | Compositions for the delivery of antigens |
| US5643957A (en) | 1993-04-22 | 1997-07-01 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US5958457A (en) | 1993-04-22 | 1999-09-28 | Emisphere Technologies, Inc. | Compositions for the delivery of antigens |
| US20010003001A1 (en) | 1993-04-22 | 2001-06-07 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US6610329B2 (en) | 1993-04-22 | 2003-08-26 | Emisphere Technologies Inc. | Compositions for the delivery of antigens |
| IL109403A0 (en) | 1993-04-22 | 1994-07-31 | Emisphere Tech Inc | Oral drug delivery compositions and methods |
| US5935610A (en) | 1993-08-26 | 1999-08-10 | Mclean; Linsey | Composition having buffering properties |
| IL115693A (en) | 1994-10-25 | 2000-08-13 | Revlon Consumer Prod Corp | Cosmetic compositions with improved transfer resistance |
| US6090958A (en) | 1995-03-31 | 2000-07-18 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| CN1151836C (zh) | 1995-03-31 | 2004-06-02 | 艾米斯菲尔技术有限公司 | 用作传送活性剂的化合物和组合物 |
| US6001347A (en) | 1995-03-31 | 1999-12-14 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US5989539A (en) | 1995-03-31 | 1999-11-23 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US5866536A (en) | 1995-03-31 | 1999-02-02 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| DE19681560T1 (de) | 1995-09-11 | 1998-08-20 | Emisphere Tech Inc | Verfahren zur Herstellung von omega-Aminoalkansäure-Derivaten aus Cycloalkanonen |
| SI9720025A (sl) | 1996-03-29 | 1999-08-31 | Emishphere Technologies, Inc. | Spojine in sestavki za prenos aktivne snovi |
| IL118657A0 (en) | 1996-06-14 | 1996-10-16 | Arad Dorit | Inhibitors for picornavirus proteases |
| EP0886471A4 (en) | 1996-11-18 | 2002-07-17 | Emisphere Tech Inc | METHODS AND COMPOSITIONS FOR INDUCING ORAL TOLERANCE IN MUZZLES |
| US5939381A (en) | 1997-02-07 | 1999-08-17 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US5876710A (en) | 1997-02-07 | 1999-03-02 | Emisphere Technologies Inc. | Compounds and compositions for delivering active agents |
| DK0993831T3 (da) * | 1997-02-07 | 2008-03-25 | Emisphere Tech Inc | Forbindelser og præparater til tilförsel af aktive stoffer |
| US5773647A (en) | 1997-02-07 | 1998-06-30 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US5990166A (en) | 1997-02-07 | 1999-11-23 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US6313088B1 (en) | 1997-02-07 | 2001-11-06 | Emisphere Technologies, Inc. | 8-[(2-hydroxy-4-methoxy benzoyl) amino]-octanoic acid compositions for delivering active agents |
| US5776888A (en) * | 1997-02-07 | 1998-07-07 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US6051561A (en) | 1997-02-07 | 2000-04-18 | Emisphere Technologies Inc. | Compounds and compositions for delivering active agents |
| US5804688A (en) | 1997-02-07 | 1998-09-08 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US6358504B1 (en) | 1997-02-07 | 2002-03-19 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US5879681A (en) | 1997-02-07 | 1999-03-09 | Emisphere Technolgies Inc. | Compounds and compositions for delivering active agents |
| US6060513A (en) | 1997-02-07 | 2000-05-09 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US5863944A (en) | 1997-04-30 | 1999-01-26 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US5962710A (en) | 1997-05-09 | 1999-10-05 | Emisphere Technologies, Inc. | Method of preparing salicyloylamino acids |
| US6440929B1 (en) | 1998-07-27 | 2002-08-27 | Emisphere Technologies, Inc. | Pulmonary delivery of active agents |
| JP4675481B2 (ja) | 1998-07-27 | 2011-04-20 | エミスフェアー・テクノロジーズ・インク | 活性剤の肺性デリバリー |
| EP1102742B1 (en) * | 1998-08-07 | 2006-06-14 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| CN1338924A (zh) | 1999-01-08 | 2002-03-06 | 艾米斯菲尔技术有限公司 | 聚合物输送剂和输送剂化合物 |
| AU3357800A (en) | 1999-02-05 | 2000-08-25 | Emisphere Technologies, Inc. | Method of preparing alkylated salicylamides |
| AU3378100A (en) | 1999-02-26 | 2000-09-14 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| WO2001044199A1 (en) | 1999-12-16 | 2001-06-21 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
| US6384278B1 (en) | 2000-02-04 | 2002-05-07 | Emisphere Technologies, Inc. | Boron-mediated amidation of carboxylic acids |
| DE60134245D1 (de) | 2000-09-06 | 2008-07-10 | Emisphere Tech Inc | (5-(2-hydroxy-4-chlorbenzoyl)valeriansäure und deren salze, und zusammensetzungen zur zuführung von wirkstoffen, die diese verbindungen enthalten |
| EP1603869A1 (en) * | 2003-03-11 | 2005-12-14 | Pharmacia Corporation | S- 2- (1-iminoethyl)amino ethyl -2-methyl-l-c ysteine maleate form ii crystalline salt |
-
2001
- 2001-06-29 WO PCT/US2001/021073 patent/WO2002002509A1/en active IP Right Grant
- 2001-06-29 US US10/312,703 patent/US7351741B2/en not_active Expired - Lifetime
- 2001-06-29 CA CA002411754A patent/CA2411754C/en not_active Expired - Lifetime
- 2001-06-29 ES ES01952394T patent/ES2306719T3/es not_active Expired - Lifetime
- 2001-06-29 EP EP01952394A patent/EP1299348B1/en not_active Expired - Lifetime
- 2001-06-29 BR BR0112311-4A patent/BR0112311A/pt active Search and Examination
- 2001-06-29 CZ CZ20030275A patent/CZ303736B6/cs not_active IP Right Cessation
- 2001-06-29 AT AT01952394T patent/ATE391708T1/de active
- 2001-06-29 AU AU2001273153A patent/AU2001273153B2/en not_active Ceased
- 2001-06-29 JP JP2002507766A patent/JP2004521857A/ja active Pending
- 2001-06-29 NZ NZ523017A patent/NZ523017A/en not_active IP Right Cessation
- 2001-06-29 PT PT01952394T patent/PT1299348E/pt unknown
- 2001-06-29 RU RU2003102615/04A patent/RU2326110C2/ru not_active IP Right Cessation
- 2001-06-29 DE DE60133555T patent/DE60133555T2/de not_active Expired - Lifetime
- 2001-06-29 KR KR1020027017966A patent/KR100828668B1/ko not_active IP Right Cessation
- 2001-06-29 AU AU7315301A patent/AU7315301A/xx active Pending
- 2001-06-29 UA UA2003010772A patent/UA80248C2/uk unknown
- 2001-06-29 DK DK01952394T patent/DK1299348T3/da active
- 2001-06-29 MX MXPA02012855A patent/MXPA02012855A/es active IP Right Grant
- 2001-06-29 SK SK118-2003A patent/SK1182003A3/sk unknown
- 2001-06-29 CN CNB018119182A patent/CN100482637C/zh not_active Expired - Lifetime
- 2001-06-29 IL IL15329701A patent/IL153297A0/xx unknown
-
2002
- 2002-12-09 ZA ZA200209946A patent/ZA200209946B/en unknown
-
2003
- 2003-10-06 HK HK03107183A patent/HK1054918A1/xx not_active IP Right Cessation
-
2006
- 2006-02-17 AU AU2006200678A patent/AU2006200678B2/en not_active Ceased
-
2008
- 2008-06-19 CY CY20081100654T patent/CY1108532T1/el unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4610983A (en) | 1984-06-12 | 1986-09-09 | Toyama Chemical Co., Ltd. | N-acyl acidic amino acid diamide derivative, a salt thereof, and an anti-ulcer agent containing the same |
| WO1996030036A1 (en) * | 1995-03-31 | 1996-10-03 | Emisphere Technologies, Inc. | Compounds and compositions for delivering active agents |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100828668B1 (ko) | 활성제 전달용 화합물 및 조성물 | |
| US7208178B2 (en) | Polymorphs of sodium 4-[(4-chloro-2-hydroxybenzoyl) amino] butanoate | |
| KR100788970B1 (ko) | 활성제 전달용 페녹시 카르복시산 화합물 및 조성물 | |
| US6642411B1 (en) | Compounds and compositions for delivering active agents | |
| AU2001273153A1 (en) | Compounds and compositions for delivering active agents | |
| EP1156787B1 (en) | Oxadiazole compounds and compositions for delivering active agents | |
| US6846844B2 (en) | Compounds and compositions for delivering active agents | |
| US20030225300A1 (en) | Compounds and compositions for delivering active agents | |
| US7084279B1 (en) | Oxadiazole compounds and compositions for delivering active agents | |
| IL153297A (en) | Compounds and compositions for delivering active agents | |
| MXPA01000924A (en) | Compounds and compositions for delivering active agents | |
| ZA200100226B (en) | Compounds and compositions for delivering active agents. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E801 | Decision on dismissal of amendment | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20130429 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20140430 Year of fee payment: 7 |
|
| FPAY | Annual fee payment |
Payment date: 20160330 Year of fee payment: 9 |
|
| FPAY | Annual fee payment |
Payment date: 20170330 Year of fee payment: 10 |
|
| LAPS | Lapse due to unpaid annual fee |