JP7686870B2 - ピラゾール誘導体 - Google Patents
ピラゾール誘導体 Download PDFInfo
- Publication number
- JP7686870B2 JP7686870B2 JP2024224668A JP2024224668A JP7686870B2 JP 7686870 B2 JP7686870 B2 JP 7686870B2 JP 2024224668 A JP2024224668 A JP 2024224668A JP 2024224668 A JP2024224668 A JP 2024224668A JP 7686870 B2 JP7686870 B2 JP 7686870B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- compound
- ring
- substituted
- halogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01G—HORTICULTURE; CULTIVATION OF VEGETABLES, FLOWERS, RICE, FRUIT, VINES, HOPS OR SEAWEED; FORESTRY; WATERING
- A01G13/00—Protection of plants
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/50—1,3-Diazoles; Hydrogenated 1,3-diazoles
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/54—1,3-Diazines; Hydrogenated 1,3-diazines
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/56—1,2-Diazoles; Hydrogenated 1,2-diazoles
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/58—1,2-Diazines; Hydrogenated 1,2-diazines
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/72—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with nitrogen atoms and oxygen or sulfur atoms as ring hetero atoms
- A01N43/80—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with nitrogen atoms and oxygen or sulfur atoms as ring hetero atoms five-membered rings with one nitrogen atom and either one oxygen atom or one sulfur atom in positions 1,2
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/90—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having two or more relevant hetero rings, condensed among themselves or with a common carbocyclic ring system
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01P—BIOCIDAL, PEST REPELLANT, PEST ATTRACTANT OR PLANT GROWTH REGULATORY ACTIVITY OF CHEMICAL COMPOUNDS OR PREPARATIONS
- A01P13/00—Herbicides; Algicides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/32—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/325—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms with substituted hydrocarbon radicals directly attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/32—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/33—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms with substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/337—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/34—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Environmental Sciences (AREA)
- Wood Science & Technology (AREA)
- Plant Pathology (AREA)
- Engineering & Computer Science (AREA)
- Pest Control & Pesticides (AREA)
- Zoology (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Dentistry (AREA)
- Agronomy & Crop Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Toxicology (AREA)
- Plural Heterocyclic Compounds (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Description
を、テトラヒドロフランなどの適切な溶媒中でイソプロピルマグネシウムクロリド-塩化リチウムと-20℃で反応させることにより、式(A)の化合物から調製することができる。2時間後、1-ジメチルアミノ-2-ニトロエチレンを添加し、反応物を1時間かけて室温までゆっくりと温める。これにより、後処理及び精製の後に式(B)の望みのニトロビニルピラゾールが得られる(反応スキーム1)。式(A)の化合物は公知であり、或いは当該技術分野で周知の方法に従って調製することができる。
及び式(E)のピラゾロ-ラクタム-カルボン酸誘導体
を合成するために使用することができる。これらの新規な化合物は、本発明の更に別の態様を形成する。
反応スキーム1a
500mLのビーカー内で、化合物1-メチル-5-(トリフルオロメチル)ピラゾール-3-アミン(5.00g、30.3mmol)を、9Mの硫酸(818mmol、91mL)中で、オーバーヘッドスターラーを使用して、均質な混合物が得られるまで0℃(氷浴)で撹拌した。次いで、10mLの水中の亜硝酸ナトリウム(60.6mmol、4.18g)を5分間かけて滴下し、無色の溶液を得た。反応物を0℃で更に20分間撹拌した。20mLの水の中のヨウ化カリウム(75.7mmol、12.6g)を反応物に滴下し、その後混合物を更に4時間撹拌した。反応を、混合物が透明になるまで飽和チオ硫酸ナトリウムでクエンチした。その後、混合物をジクロロメタンで希釈し、相を分離した。水相を更にジクロロメタンで抽出し、合わせた有機抽出物を水で洗浄し、乾燥し(MgSO4)、濾過し、真空下で濃縮することで、淡黄色オイルを得た。粗生成物をカラムクロマトグラフィー(EtOAc/ヘキサンのグラジエントによる溶離)によって精製することで、3-ヨード-1-メチル-5-(トリフルオロメチル)ピラゾールを無色オイルとして3.9g(47%)得た。
1H NMR(400MHz,CDCl3)δ=6.76(s,1H)4.01(d,J=0.61Hz,3H).
THF中のイソプロピルマグネシウムクロリド-塩化リチウム(23.55mmol、1.3mol/L)を、THF(90mL)中の3-ヨード-1-メチル-5-(トリフルオロメチル)ピラゾール(5.0g、18.12mmol)に-20℃で滴下し、混合物を2時間撹拌した。1-ジメチルアミノ-2-ニトロエチレン(27.17mmol、3.321g)を添加し、反応物を1時間かけてゆっくりと室温まで温めた。その後、反応混合物を2MのHClで注意深くクエンチし、酢酸エチルで抽出した。有機抽出物を食塩水で洗浄し、乾燥し(MgSO4)、濾過し、濃縮し、クロマトグラフィー(EtOAc/シクロヘキサンのグラジエントにより溶離)により精製することで、1-メチル-3-[(E)-2-ニトロビニル]-5-(トリフルオロメチル)ピラゾール(74.6%)を黄色オイルとして2.99g(74.6%)得た。
1H NMR(400MHz,CDCl3)δ=7.89(d,J=13.7Hz,1H),7.63(d,J=13.7Hz,1H),6.88(s,1H),4.05(d,J=0.6Hz,3H).
トルエン(19.5mL)中の1-メチル-3-[(E)-2-ニトロビニル]-5-(トリフルオロメチル)ピラゾール(0.650g、2.94mmol)の溶液に、マロン酸ジエチル(0.676mL、4.41mmol)を添加し、続いてニッケル(II)ビス[(1R,2R)-N1,N2-ビス(フェニルメチル)-1,2-シクロヘキサンジアミン-N1,N2]ジブロミド(0.0588mmol、0.0472g)を添加し、混合物を周囲温度で20時間撹拌した。
1H NMR(400MHz,CDCl3)δ=6.53(s,1H),5.01(dd,1H),4.88(dd,J=4.3,13.9Hz,1H),4.35(ddd,J=4.4,7.7,9.0Hz,1H),4.22(q,2H),4.16(q,J=7.1Hz,2H),3.90(s,3H),3.89(d,1H),1.26(t,3H),1.20(t,J=7.2Hz,3H).
エタノール(42.1mL)中のジエチル2-[(1R)-1-[1-メチル-5-(トリフルオロメチル)ピラゾール-3-イル]-2-ニトロ-エチル]プロパンジオエート(1.07g、2.81mmol)の溶液に、窒素下で0~5℃(氷浴)まで冷却し、ジクロロニッケル六水和物(2.95mmol、0.700g)を添加した。次いで、水素化ホウ素ナトリウム(8.42mmol、0.325g)を、淡い緑がかった青色の溶液に少しずつ添加した。30分後、冷却を解除し、反応混合物を周囲温度まで温めた。周囲温度で5時間撹拌した後、反応混合物を氷水浴中で5~10℃まで冷却し、塩化アンモニウム溶液でゆっくりとクエンチし、混合物を更に20分間撹拌した。その後、混合物をEtOAc(20mL)で希釈し、セライトの床を通して濾過し、水及びEtOAcの一部で洗い流した。回収した二相混合物を濃縮して溶媒の大部分を除去し、残留物を分液漏斗に移し、EtOAc(20mL)で希釈し、有機相を分離した。水相を更にEtOAc(2×25mL)で抽出し、全ての有機抽出物を合わせ、相分離を通過させ、濃縮し、クロマトグラフィー(EtOAc/ヘキサンによるグラジエントで溶離)によって精製することで、0.61g(77%)の淡黄色オイルを得た。これは静置すると結晶化した。
1H NMR(400MHz,CDCl3)δ=6.91(br s,1H),6.47(s,1H),4.28(q,J=7.2Hz,2H),4.14(q,1H),3.94(d,3H),3.80(dt,J=1.0,9.0Hz,1H),3.63(d,J=9.3Hz,1H),3.52(dd,J=8.2,9.5Hz,1H),1.32(t,J=7.2Hz,3H).
エタノール(6.0mL)及び水(2.0mL)中のエチル(3R,4R)-4-[1-メチル-5-(トリフルオロメチル)ピラゾール-3-イル]-2-オキソ-ピロリジン-3-カルボキシレート(0.61g、2.0mmol)の溶液に、0℃(氷浴)で2Mの水酸化ナトリウム(3mL、6.0mmol)を添加した。反応混合物を0℃で30分間撹拌し、次いで水(15mL)で希釈し、EtOAc(25mL)で抽出した。有機抽出物を水(10mL)で洗浄し、水性抽出物を合わせ、希HClでpH2まで酸性にした。その後、酸性にした水性抽出物をEtOAc(3×20mL)で再抽出し、これらの有機抽出物を相分離カートリッジに通し、濃縮することで、0.54g(定量的)の淡黄色オイルを得た。これは静置すると結晶化した。
1H NMR(400MHz,CDCl3)δ=6.59(s,1H),4.09(q,1H),3.94(s,3H),3.85-3.77(m,1H),3.72(d,J=10.0Hz,1H),3.66-3.58(m,1H).
室温で、テトラヒドロフラン(16mL)中の(3R,4R)-4-[1-メチル-5-(トリフルオロメチル)ピラゾール-3-イル]-2-オキソ-ピロリジン-3-カルボン酸(0.57g、2.1mmol、0.57g)の撹拌されている溶液に、窒素雰囲気下、カリウムtertブトキシド(THF中1.0M)(4.5mL、4.5mmol)を添加して淡黄色の微細な懸濁液を得た。この懸濁液に、ヨードメタン(0.19mL、3.1mmol)を添加し、室温で20時間撹拌を継続した。撹拌されている反応混合物を希HClでpH2まで酸性にし、混合物を水(10mL)で希釈し、EtOAc(3×30mL)で抽出した。合わせた有機抽出物を食塩水(15mL)で洗浄し、硫酸マグネシウムで乾燥し、濾過し、濾液を濃縮することで、0.63g(定量的)の透明な琥珀色のガムを得た。
1H NMR:(400MHz,CDCl3)δ=6.68(s,1H),3.97(q,1H),3.94(s,3H),3.76-3.68(m,3H),2.99(s,3H).
ジクロロメタン(15mL)中の(3R,4R)-1-メチル-4-[1-メチル-5-(トリフルオロメチル)ピラゾール-3-イル]-2-オキソ-ピロリジン-3-カルボン酸(0.61g、2.1mmol)の溶液に、2,3-ジフルオロアニリン(0.21mL、2.1mmol)を添加した。次いで、酢酸エチル(2.3g、3.6mmol、2.1mL)中のプロピルホスホン酸無水物(50質量%)を添加し、その後反応混合物を室温の水浴に浸した。N,N-ジイソプロピルエチルアミン(1.1mL、6.3mmol)を滴下し、反応物を室温で2.5時間撹拌した。水(15mL)を添加することにより反応混合物をクエンチし、相分離カートリッジに移した。水相を更にDCM(2×10mL)で抽出し、合わせた有機抽出物を濃縮し、クロマトグラフィー(EtOAc/ヘキサンによるグラジエントで溶離)によって精製することで、ピンク色のオイルを得た。イソヘキサンでトリチュレーションすると、398mg(47%)の淡いピンク色の固体が得られた。
1H NMR:(400MHz,CDCl3)δ=10.16(br s,1H),8.08-8.01(m,1H),7.02(ddt,J=2.1,5.9,8.3Hz,1H),6.93-6.84(m,1H),6.69(s,1H),4.09(q,1H),3.94(s,3H),3.78(d,J=9.5Hz,1H),3.76-3.65(m,2H),2.98(s,3H).
除草性化合物(3S,4S)-N-(2,3-ジフルオロフェニル)-1-メチル-4-[1-メチル-5-(トリフルオロメチル)ピラゾール-4-イル]-2-オキソ-ピロリジン-3-カルボキサミドは、上の実施例1の(3S,4R)-N-(2,3-ジフルオロフェニル)-1-メチル-4-[1-メチル-5-(トリフルオロメチル)ピラゾール-3-イル]-2-オキソ-ピロリジン-3-カルボキサミドについて上述した方法と直接類似した方法で製造した。単一のエナンチオマーのNMRデータは以下の通りである:
1HNMR(CDCl3)δ=10.05(br s,1H),8.04-7.97(m,1H),7.46(s,1H),7.01(ddt,J=2.1,5.9,8.3Hz,1H),6.93-6.84(m,1H),4.21(q,J=8.8Hz,1H),4.00(s,3H),3.75(t,J=9.5Hz,1H),3.64(d,J=9.4Hz,1H),3.27(dd,J=8.1,9.9Hz,1H),2.97(s,3H).
本発明のまた別の態様は、以下のとおりであってもよい。
〔1〕式(B)の化合物:
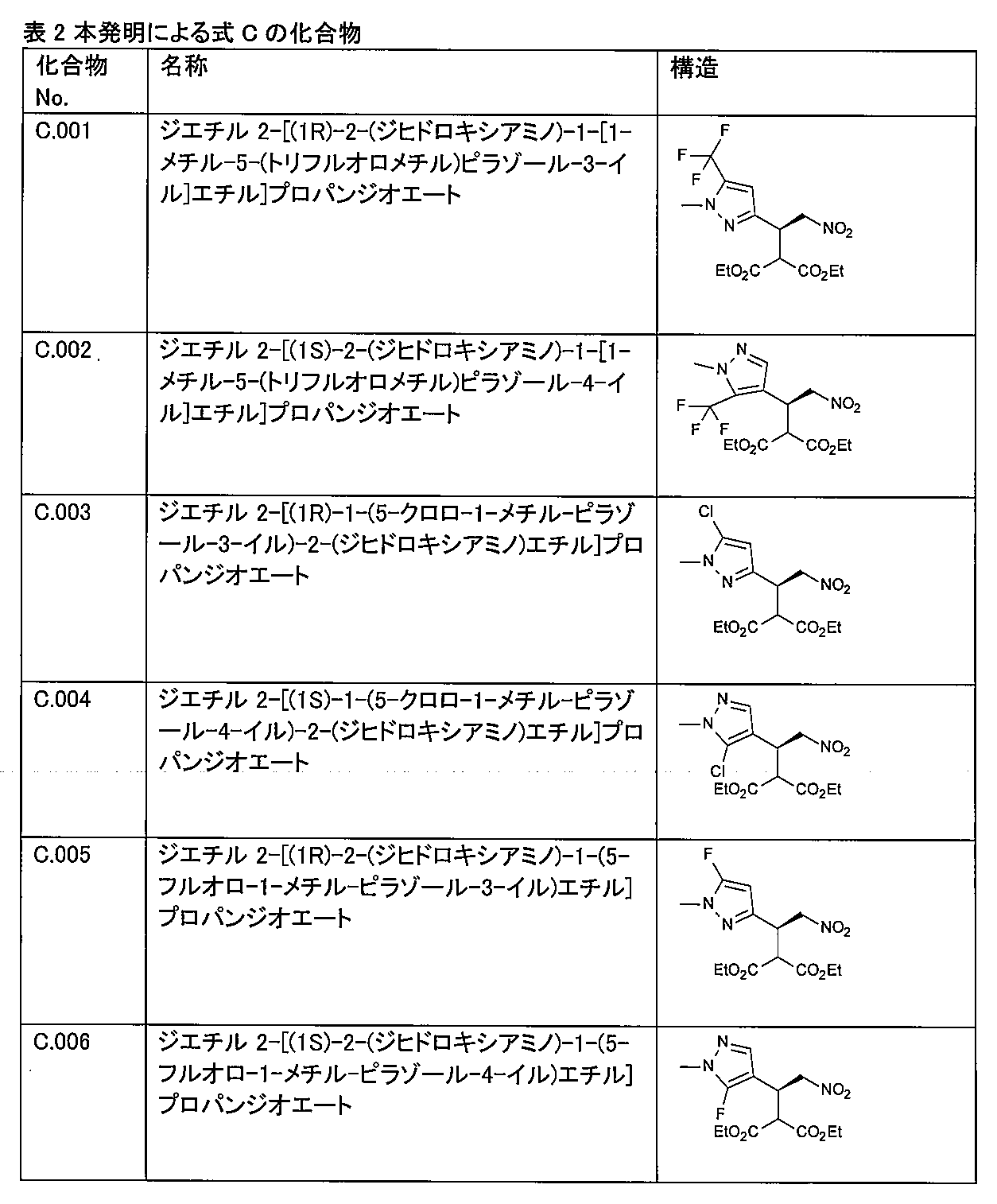
〔2〕式(C)の化合物:
〔3〕環AがA1、A2、A3、A4、又はA5である、前記〔1〕又は〔2〕に記載の化合物:
〔4〕R B2 が、メチル、エチル、n-プロピル、フルオロメチル、フルオロエチル、ジフルオロエチル、及びトリフルオロエチルからなる群から選択される、前記〔1〕~〔3〕のいずれか一項に記載の化合物。
〔5〕R B3 が、クロロ、フルオロ、ブロモ、メチル、エチル、ジフルオロメチル、トリフルオロメチルC 1 ~C 3 ハロアルコキシ、C 1 ~C 3 アルコキシ、及びC 1 ~C 3 アルキルからなる群から選択される、前記〔1〕~〔4〕のいずれか一項に記載の化合物。
〔6〕式(D)の化合物
のエナンチオ選択的製造方法であって、
(i)適切な溶媒中で、式(A)のハロゲン化ピラゾール
をイソプロピルマグネシウムクロリド-塩化リチウムと反応させ、続いて1-ジメチルアミノ-2-ニトロエチレンを添加して、式(B)の化合物
(ii)ステップ(i)からの式(B)の化合物を、エナンチオ選択的なニッケル触媒作用下で溶媒中でマロン酸エステルと反応させて、式(C)の化合物
(iii)ステップ2からの前記式(C)の化合物を、触媒の存在下で溶媒中で還元剤と反応させることで、式(D)の化合物
を含む方法。
〔7〕式(E)の化合物
のエナンチオ選択的製造方法であって、
(i)適切な溶媒中で、式(A)のハロゲン化ピラゾール
をイソプロピルマグネシウムクロリド-塩化リチウムと反応させ、続いて1-ジメチルアミノ-2-ニトロエチレンを添加して、式(B)の化合物
(ii)ステップ(i)からの前記式(B)の化合物を、エナンチオ選択的なニッケル触媒作用下で溶媒中でマロン酸エステルと反応させて、式(C)の化合物
(iii)ステップ2からの前記式(C)の化合物を、触媒の存在下で溶媒中で還元剤と反応させて、式(D)の化合物
(iv)水酸化物水溶液/エタノール混合物中でステップ(iii)からの前記式(D)の化合物を加水分解して、前記式(E)の化合物
を含む方法。
Claims (8)
- 式(B)の化合物:
(式中、環Aは、A1又はA2であり、
RB2はC1~C3アルキルであり、
RB3SNは、ハロゲン又はC1~C3フルオロアルキルであり、
ギザギザの線は、ニトロビニル部位への連結位置を示す)。 - 下記表に示される、B.001、B.002、B.003、B.004、B.005及びB.006から成る群から選択される、請求項1に記載の化合物。
- 式(C)の化合物:
(式中、環Aは、A1又はA2であり、
R B3SNは、ハロゲン又はC1~C3フルオロアルキルであり、
ギザギザの線は、分子の残りの部分への連結位置を示す)。 - 下記表に示される、C.001、C.002、C.003、C.004、C.005、及びC.006から成る群から選択される、請求項3に記載の化合物。
- 式(D)の化合物
(式中、環Aは、環窒素がRB2で置換されており且つ置換された環窒素に隣接する環炭素がRB3SNで置換されている二置換ピラゾールであり、
RB2はC1~C3アルキルであり、RB3SNは、ハロゲン、又はC1~C3フルオロアルキルである)
のエナンチオ選択的製造方法であって、
(i)テトラヒドロフラン溶媒中で、式(A)のハロゲン化ピラゾール
をイソプロピルマグネシウムクロリド-塩化リチウムと反応させ、続いて1-ジメチルアミノ-2-ニトロエチレンを添加して、請求項1で定義されている通りの式(B)の化合物
(ii)ステップ(i)からの式(B)の化合物を、エナンチオ選択的なニッケル触媒作用下でトルエン溶媒中でマロン酸エステルと反応させて、請求項3で定義されている通りの式(C)の化合物
(iii)ステップ2からの前記式(C)の化合物を、ニッケル触媒の存在下でエタノール溶媒中で水素化ホウ素ナトリウム還元剤と反応させることで、式(D)の化合物
を含む方法。 - 式(E)の化合物
(式中、環Aは、環窒素がRB2で置換されており且つ置換された環窒素に隣接する環炭素がRB3SNで置換されている二置換ピラゾールであり、RB2はC1~C3アルキルであり、RB3SNは、ハロゲン、又はC1~C3フルオロアルキルである)
のエナンチオ選択的製造方法であって、
(i)テトラヒドロフラン溶媒中で、式(A)のハロゲン化ピラゾール
をイソプロピルマグネシウムクロリド-塩化リチウムと反応させ、続いて1-ジメチルアミノ-2-ニトロエチレンを添加して、請求項1で定義されている通りの式(B)の化合物
(ii)ステップ(i)からの前記式(B)の化合物を、エナンチオ選択的なニッケル触媒作用下でトルエン溶媒中でマロン酸エステルと反応させて、請求項3で定義されている通りの式(C)の化合物
(iii)ステップ2からの前記式(C)の化合物を、ニッケル触媒の存在下でエタノール溶媒中で水素化ホウ素ナトリウム還元剤と反応させて、式(D)の化合物
(iv)水酸化物水溶液/エタノール混合物中でステップ(iii)からの前記式(D)の化合物を加水分解して、前記式(E)の化合物
を含む方法。 - 式(G)の化合物の製造のための請求項6に記載の方法の使用。
- 式(G)の化合物
のエナンチオ選択的製造方法であって、
(i)テトラヒドロフラン溶媒中で、式(A)のハロゲン化ピラゾール
をイソプロピルマグネシウムクロリド-塩化リチウムと反応させ、続いて1-ジメチルアミノ-2-ニトロエチレンを添加して、請求項1で定義されている通りの式(B)の化合物
(ii)ステップ(i)からの前記式(B)の化合物を、エナンチオ選択的なニッケル触媒作用下でトルエン溶媒中でマロン酸エステルと反応させて、請求項3で定義されている通りの式(C)の化合物
(iii)ステップ2からの前記式(C)の化合物を、ニッケル触媒の存在下でエタノール溶媒中で水素化ホウ素ナトリウム還元剤と反応させて、式(D)の化合物
(iv)水酸化物水溶液/エタノール混合物中でステップ(iii)からの前記式(D)の化合物を加水分解して、前記式(E)の化合物
(v)ステップ(iv)からの前記式(E)の化合物のラクタム窒素を、ヨウ化メチルをメチル化試薬、カリウムtertブトキシドを過剰塩基として、テトラヒドロフラン溶媒中で、メチル化して、式(F)の化合物
(vi)ステップ(v)からの前記式(F)のN-メチルラクタムを、式R2-NH2の化合物(式中、R2は上記式(G)の化合物について定義された通りである)を、ジクロロメタン溶媒中、プロパンホスホン酸無水物と塩基を含む標準的なアミドカップリング条件下で反応させて、式(G)の化合物
を含む方法。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB1901559.3A GB201901559D0 (en) | 2019-02-05 | 2019-02-05 | Herbicidal compositions |
| GB1901559.3 | 2019-02-05 | ||
| PCT/EP2020/052892 WO2020161199A1 (en) | 2019-02-05 | 2020-02-05 | Pyrazole derivatives |
| JP2021545830A JP2022519864A (ja) | 2019-02-05 | 2020-02-05 | ピラゾール誘導体 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021545830A Division JP2022519864A (ja) | 2019-02-05 | 2020-02-05 | ピラゾール誘導体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2025041760A JP2025041760A (ja) | 2025-03-26 |
| JP7686870B2 true JP7686870B2 (ja) | 2025-06-02 |
Family
ID=65997122
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021545787A Active JP7624394B2 (ja) | 2019-02-05 | 2020-02-04 | 除草性混合物 |
| JP2021545858A Active JP7584422B2 (ja) | 2019-02-05 | 2020-02-04 | ピラゾール誘導体 |
| JP2021545830A Withdrawn JP2022519864A (ja) | 2019-02-05 | 2020-02-05 | ピラゾール誘導体 |
| JP2024224668A Active JP7686870B2 (ja) | 2019-02-05 | 2024-12-20 | ピラゾール誘導体 |
Family Applications Before (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021545787A Active JP7624394B2 (ja) | 2019-02-05 | 2020-02-04 | 除草性混合物 |
| JP2021545858A Active JP7584422B2 (ja) | 2019-02-05 | 2020-02-04 | ピラゾール誘導体 |
| JP2021545830A Withdrawn JP2022519864A (ja) | 2019-02-05 | 2020-02-05 | ピラゾール誘導体 |
Country Status (18)
| Country | Link |
|---|---|
| US (11) | US11472792B2 (ja) |
| EP (3) | EP3921306A2 (ja) |
| JP (4) | JP7624394B2 (ja) |
| KR (1) | KR20210125022A (ja) |
| CN (7) | CN117700363A (ja) |
| AU (3) | AU2020219393B2 (ja) |
| BR (1) | BR112021015296A2 (ja) |
| CA (5) | CA3128447A1 (ja) |
| CL (1) | CL2021001983A1 (ja) |
| CO (1) | CO2021010365A2 (ja) |
| EA (1) | EA202192135A1 (ja) |
| ES (1) | ES2987804T3 (ja) |
| GB (1) | GB201901559D0 (ja) |
| IL (1) | IL284977B2 (ja) |
| MX (1) | MX2021009422A (ja) |
| PH (1) | PH12021551858A1 (ja) |
| PL (1) | PL3921307T3 (ja) |
| WO (3) | WO2020161148A2 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11589583B2 (en) | 2013-12-03 | 2023-02-28 | Fmc Corporation | Pyrrolidinones herbicides |
| GB201901559D0 (en) * | 2019-02-05 | 2019-03-27 | Syngenta Crop Protection Ag | Herbicidal compositions |
| CN113874365A (zh) * | 2019-05-24 | 2021-12-31 | Fmc公司 | 作为除草剂的吡唑取代的吡咯烷酮 |
| GB202012143D0 (en) * | 2020-08-05 | 2020-09-16 | Syngenta Crop Protection Ag | Herbicidal compounds |
| GB202012651D0 (en) * | 2020-08-13 | 2020-09-30 | Syngenta Crop Protection Ag | Herbicidal compositions |
| US20250066297A1 (en) | 2021-12-15 | 2025-02-27 | Adama Agan Ltd. | Compounds useful for the preparation of various agrochemicals and markers thereof |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017506210A (ja) | 2013-12-03 | 2017-03-02 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニーE.I.Du Pont De Nemours And Company | ピロリジノン除草剤 |
| WO2018177836A1 (de) | 2017-03-30 | 2018-10-04 | Bayer Aktiengesellschaft | N-cyclopropyl-2-oxopyrrolidin-3-carboxamid-derivate und verwandte verbindungen als herbizide pflanzenschutzmittel |
| JP2022519864A (ja) | 2019-02-05 | 2022-03-25 | シンジェンタ クロップ プロテクション アクチェンゲゼルシャフト | ピラゾール誘導体 |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4302239A (en) | 1980-02-19 | 1981-11-24 | Ppg Industries, Inc. | 3-(5- or 3-Substituted-5- or 3-isoxazolyl)-1-allyl or alkyl-4-substituted-5-substituted or unsubstituted-2-imidazolidinones for controlling weeds |
| CA1205077A (en) | 1983-03-28 | 1986-05-27 | Jay K. Rinehart | Herbicidally active 3-isoxazolyl-2-imidazolidinone derivatives |
| US4600430A (en) | 1985-02-22 | 1986-07-15 | Eli Lilly And Company | Pyridinylimidazolidinone compounds |
| US4874422A (en) | 1988-12-27 | 1989-10-17 | Ici Americas Inc. | 1-Phenyl-3-carboxyamidopyrrolidones and their use as herbicides |
| US5763470A (en) * | 1995-06-07 | 1998-06-09 | Sugen Inc. | Benzopyran compounds and methods for their use |
| CN1140528C (zh) | 1999-06-16 | 2004-03-03 | 辛根塔参与股份公司 | 制备除草剂衍生物的方法 |
| AR031027A1 (es) | 2000-10-23 | 2003-09-03 | Syngenta Participations Ag | Composiciones agroquimicas |
| AU2002340971B2 (en) | 2001-10-08 | 2007-04-26 | Ucb | Use of 2-oxo-1-pyrrolidine derivatives for the treatment of dyskinesia and movement disorders |
| PE20040609A1 (es) * | 2002-11-01 | 2004-10-29 | Takeda Pharmaceutical | Compuestos heterociclicos aromaticos como promotores de un factor neurotrofico |
| JP4145230B2 (ja) | 2002-11-01 | 2008-09-03 | 武田薬品工業株式会社 | 神経障害の予防・治療剤 |
| DE10300124A1 (de) * | 2003-01-07 | 2004-07-15 | Bayer Ag | Verfahren zur Herstellung von Arylalkinen |
| CH697574B1 (de) * | 2003-01-07 | 2008-12-15 | Lanxess Deutschland Gmbh | Pyrazolylarylalkine. |
| WO2004081035A1 (ja) | 2003-03-14 | 2004-09-23 | Teikoku Hormone Mfg. Co. Ltd. | Lyve-1のペプチドフラグメント及びそれに対する抗体 |
| US20070123508A1 (en) | 2005-05-27 | 2007-05-31 | Roger Olsson | PAR2-modulating compounds and their use |
| EP2459547B1 (en) | 2009-07-31 | 2016-04-20 | Syngenta Limited | Herbicidally active heteroaryl-substituted cyclic diones or derivatives thereof |
| US8957066B2 (en) * | 2011-02-28 | 2015-02-17 | Biomarin Pharmaceutical Inc. | Histone deacetylase inhibitors |
| CA2828524C (en) * | 2011-02-28 | 2020-01-07 | Repligen Corporation | Histone deacetylase inhibitors |
| UA118035C2 (uk) | 2013-10-07 | 2018-11-12 | Сінгента Партісіпейшнс Аг | Гербіцидні сполуки |
| GB201318863D0 (en) | 2013-10-25 | 2013-12-11 | Syngenta Ltd | Herbicidal compounds |
| BR112016014772A2 (pt) | 2013-12-23 | 2018-05-22 | Syngenta Ltd | derivados dihidro-hidantoína com atividade herbicida |
| TWI659019B (zh) | 2014-02-28 | 2019-05-11 | 日商帝人製藥股份有限公司 | 吡唑醯胺衍生物 |
| AR100776A1 (es) | 2014-06-16 | 2016-11-02 | Syngenta Participations Ag | Compuestos herbicidas |
| WO2016085987A1 (en) | 2014-11-26 | 2016-06-02 | Visolis, Inc. | Processes for conversion of biologically derived mevalonic acid |
| WO2016095089A1 (en) | 2014-12-15 | 2016-06-23 | Merck Sharp & Dohme Corp. | Erk inhibitors |
| EP3303321A1 (en) * | 2015-06-02 | 2018-04-11 | E. I. du Pont de Nemours and Company | Substituted cyclic amides and their use as herbicides |
| CN104844519A (zh) * | 2015-06-09 | 2015-08-19 | 浙江华海药业股份有限公司 | 一种制备依普罗沙坦杂质ep12a的方法 |
| GB201617050D0 (en) * | 2016-10-07 | 2016-11-23 | Syngenta Participations Ag | Herbicidal mixtures |
| MX2019011090A (es) | 2017-03-21 | 2019-11-18 | Fmc Corp | Mezcla herbicida, composición y método. |
| WO2018177837A1 (de) * | 2017-03-30 | 2018-10-04 | Bayer Aktiengesellschaft | 4-cyclopentyl- und 4-cyclopropyl-2-oxopyrrolidin-3-carboxami d-derivate und verwandte verbindungen als herbizide pflanzenschutzmittel |
| WO2019025156A1 (de) * | 2017-08-03 | 2019-02-07 | Bayer Aktiengesellschaft | Substituierte pyrrolidinone sowie deren salze und ihre verwendung als herbizide wirkstoffe |
| TWI834637B (zh) * | 2018-03-01 | 2024-03-11 | 日商武田藥品工業有限公司 | 六氫吡啶基-3-(芳氧基)丙醯胺及丙酸酯 |
| CN112449638A (zh) * | 2018-05-16 | 2021-03-05 | 英菲克斯治疗有限公司 | 抗菌化合物 |
| CN113874365A (zh) * | 2019-05-24 | 2021-12-31 | Fmc公司 | 作为除草剂的吡唑取代的吡咯烷酮 |
-
2019
- 2019-02-05 GB GBGB1901559.3A patent/GB201901559D0/en not_active Ceased
-
2020
- 2020-02-04 AU AU2020219393A patent/AU2020219393B2/en active Active
- 2020-02-04 KR KR1020217027433A patent/KR20210125022A/ko active Pending
- 2020-02-04 WO PCT/EP2020/052782 patent/WO2020161148A2/en not_active Ceased
- 2020-02-04 PH PH1/2021/551858A patent/PH12021551858A1/en unknown
- 2020-02-04 BR BR112021015296-2A patent/BR112021015296A2/pt active Search and Examination
- 2020-02-04 CA CA3128447A patent/CA3128447A1/en active Pending
- 2020-02-04 CN CN202311588227.8A patent/CN117700363A/zh active Pending
- 2020-02-04 CA CA3255695A patent/CA3255695A1/en active Pending
- 2020-02-04 EP EP20703984.3A patent/EP3921306A2/en active Pending
- 2020-02-04 EA EA202192135A patent/EA202192135A1/ru unknown
- 2020-02-04 EP EP20703983.5A patent/EP3920700A1/en active Pending
- 2020-02-04 MX MX2021009422A patent/MX2021009422A/es unknown
- 2020-02-04 CN CN202311588226.3A patent/CN117658988A/zh active Pending
- 2020-02-04 CA CA3254849A patent/CA3254849A1/en active Pending
- 2020-02-04 CN CN202080012476.0A patent/CN113423270B/zh active Active
- 2020-02-04 IL IL284977A patent/IL284977B2/en unknown
- 2020-02-04 AU AU2020218608A patent/AU2020218608B2/en active Active
- 2020-02-04 CN CN202080012473.7A patent/CN113412254B/zh active Active
- 2020-02-04 CA CA3128444A patent/CA3128444C/en active Active
- 2020-02-04 CA CA3255600A patent/CA3255600A1/en active Pending
- 2020-02-04 JP JP2021545787A patent/JP7624394B2/ja active Active
- 2020-02-04 CN CN202311588225.9A patent/CN117683024A/zh active Pending
- 2020-02-04 JP JP2021545858A patent/JP7584422B2/ja active Active
- 2020-02-04 WO PCT/EP2020/052780 patent/WO2020161147A1/en not_active Ceased
- 2020-02-04 CN CN202410524617.7A patent/CN118440059A/zh active Pending
- 2020-02-05 US US16/782,530 patent/US11472792B2/en active Active
- 2020-02-05 CN CN202080012471.8A patent/CN113423690B/zh active Active
- 2020-02-05 US US16/782,796 patent/US11059806B2/en active Active
- 2020-02-05 EP EP20704804.2A patent/EP3921307B1/en active Active
- 2020-02-05 WO PCT/EP2020/052892 patent/WO2020161199A1/en not_active Ceased
- 2020-02-05 ES ES20704804T patent/ES2987804T3/es active Active
- 2020-02-05 PL PL20704804.2T patent/PL3921307T3/pl unknown
- 2020-02-05 JP JP2021545830A patent/JP2022519864A/ja not_active Withdrawn
- 2020-02-05 US US16/782,866 patent/US10882846B2/en active Active
- 2020-02-05 AU AU2020217580A patent/AU2020217580B2/en active Active
- 2020-05-14 US US16/874,136 patent/US10851085B2/en active Active
- 2020-05-14 US US16/874,165 patent/US10947219B2/en active Active
- 2020-05-15 US US16/874,715 patent/US10865197B2/en active Active
- 2020-12-01 US US17/108,110 patent/US11548873B2/en active Active
-
2021
- 2021-01-29 US US17/161,788 patent/US11680057B2/en active Active
- 2021-07-28 CL CL2021001983A patent/CL2021001983A1/es unknown
- 2021-08-06 CO CONC2021/0010365A patent/CO2021010365A2/es unknown
-
2022
- 2022-09-15 US US17/945,221 patent/US12077525B2/en active Active
- 2022-12-07 US US18/062,744 patent/US11851420B2/en active Active
-
2023
- 2023-05-17 US US18/319,066 patent/US12454523B2/en active Active
-
2024
- 2024-12-20 JP JP2024224668A patent/JP7686870B2/ja active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017506210A (ja) | 2013-12-03 | 2017-03-02 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニーE.I.Du Pont De Nemours And Company | ピロリジノン除草剤 |
| WO2018177836A1 (de) | 2017-03-30 | 2018-10-04 | Bayer Aktiengesellschaft | N-cyclopropyl-2-oxopyrrolidin-3-carboxamid-derivate und verwandte verbindungen als herbizide pflanzenschutzmittel |
| JP2022519864A (ja) | 2019-02-05 | 2022-03-25 | シンジェンタ クロップ プロテクション アクチェンゲゼルシャフト | ピラゾール誘導体 |
Non-Patent Citations (1)
| Title |
|---|
| Encyclopedia of Reagents for Organic Synthesis,2001年,DOI: 10.1002/047084289X.rd307 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7686870B2 (ja) | ピラゾール誘導体 | |
| RU2753548C1 (ru) | Способ производства никотина | |
| JP5232230B2 (ja) | ボリコナゾールの製造方法 | |
| JP6633539B2 (ja) | 2−(2,4−ジフルオロフェニル)−1,1−ジフルオロ−1−(5−置換−ピリジン−2−イル)−3−(1h−テトラゾール−1−イル)プロパン−2−オールおよびその調製工程 | |
| US9051272B2 (en) | Process for the preparation of phenyl substituted 3-difluoromethyl-1-methyl-1H-pyrazole-4-carboxylic acid N-methoxy-[1-methyl-2 phenylethyl] amides | |
| JP2007326784A (ja) | 1−置換−5−フルオロアルキルピラゾール−4−カルボン酸エステルの製造方法 | |
| RU2844057C2 (ru) | Производные пиразола | |
| BR122025002306A2 (pt) | Processo enantiosseletivo para fabricar compostos derivados de pirazol | |
| CA3128449C (en) | Pyrazole derivatives | |
| BR112021015362B1 (pt) | Compostos derivados de pirazol e processos enantiosseletivos para fabricar um composto | |
| AU2017258668A1 (en) | Process for the preparation of herbicidal pyridinylimidazolone compounds | |
| EP1753726B1 (fr) | Procede de preparation de derives de l'acide 1,5-diphenylpyrazole carboxylique | |
| JPH0812655A (ja) | 置換アセチル化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241220 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20241220 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20241220 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20250206 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250421 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250521 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7686870 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |