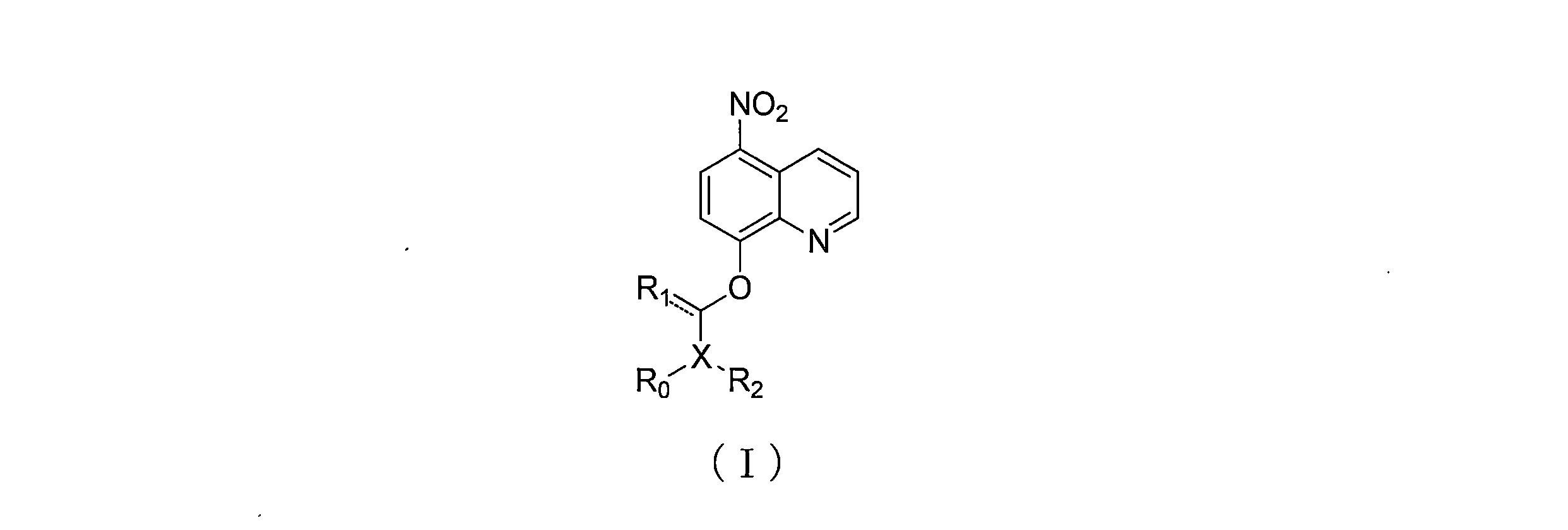
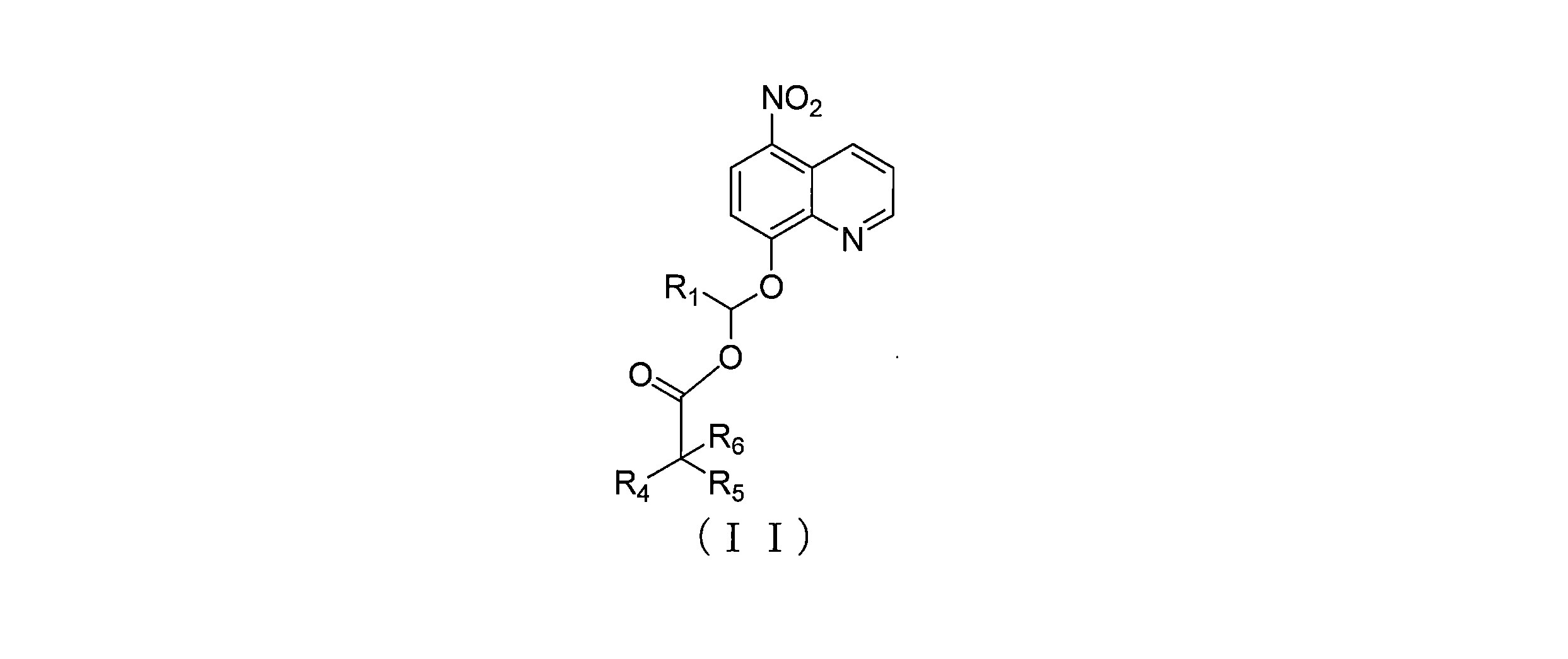
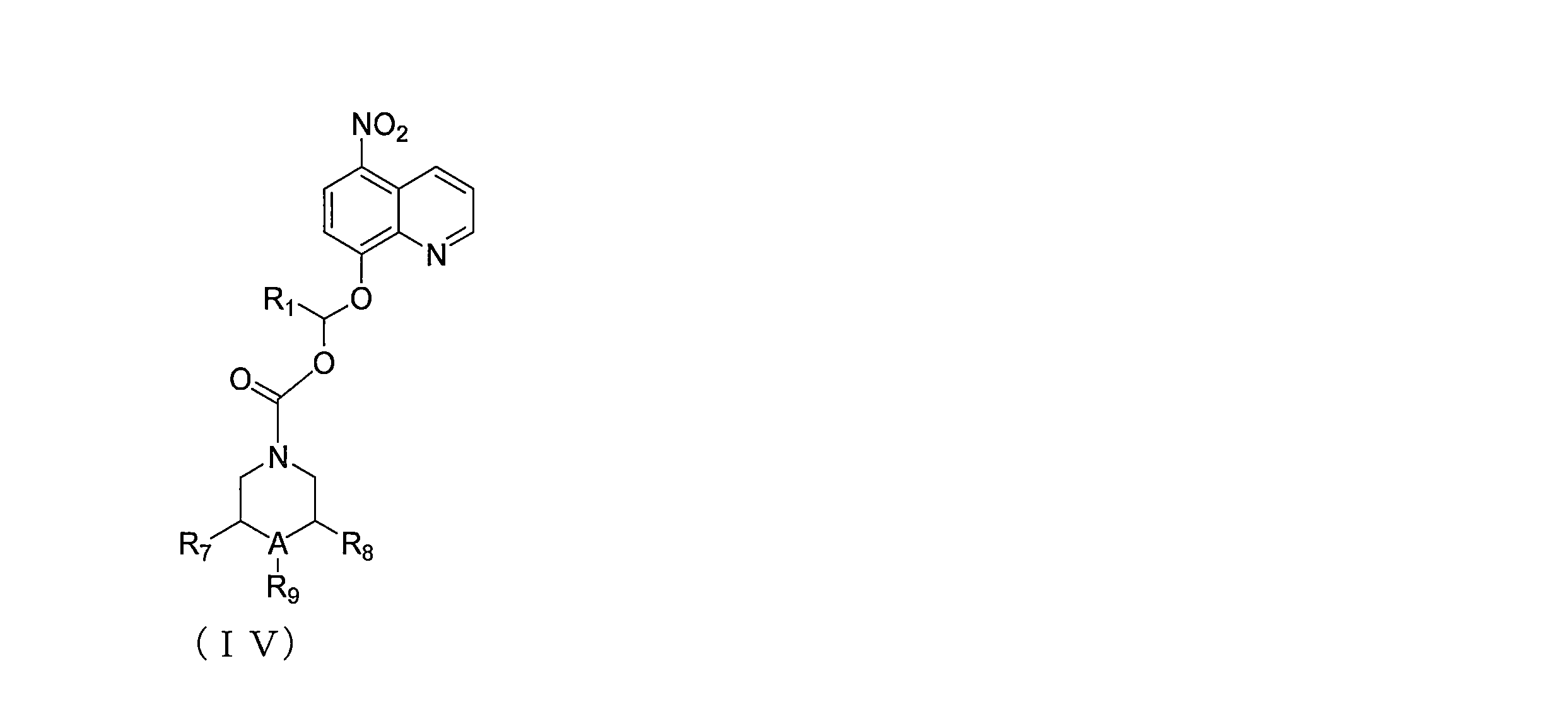
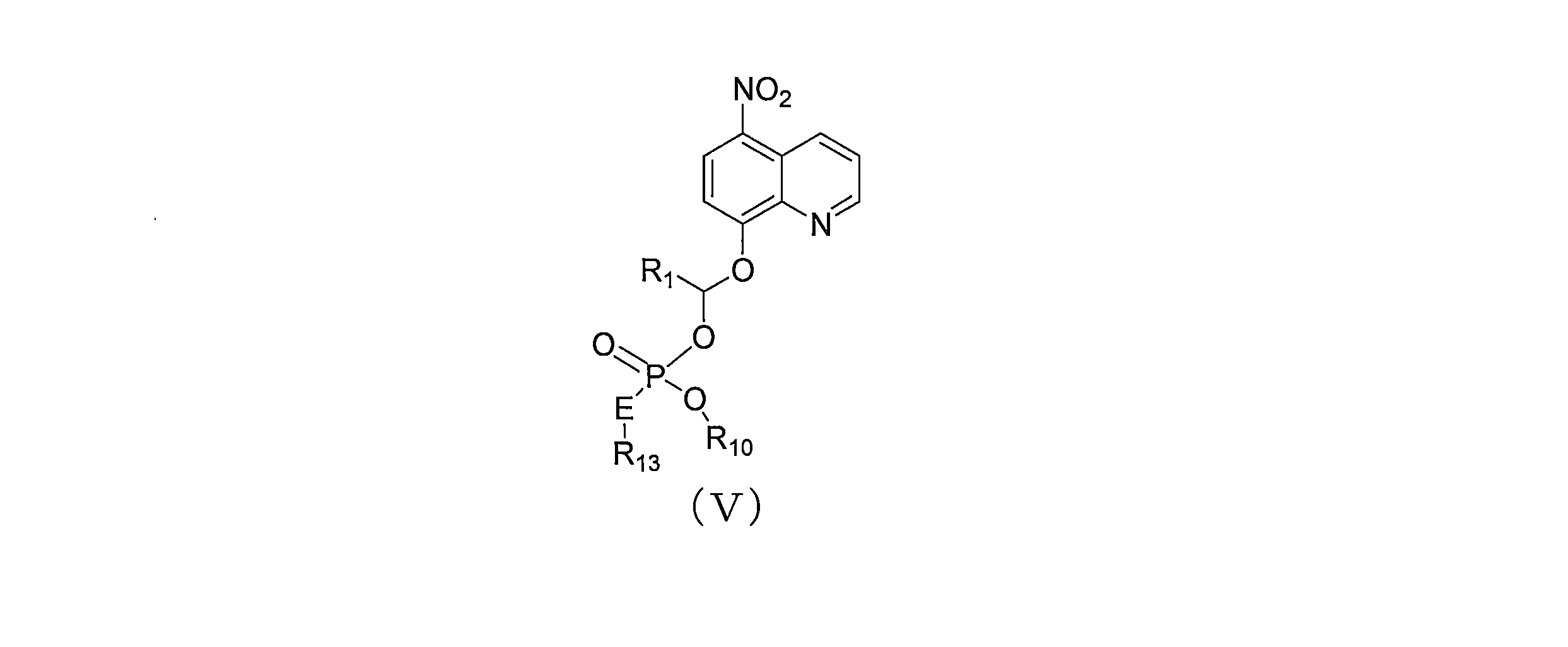
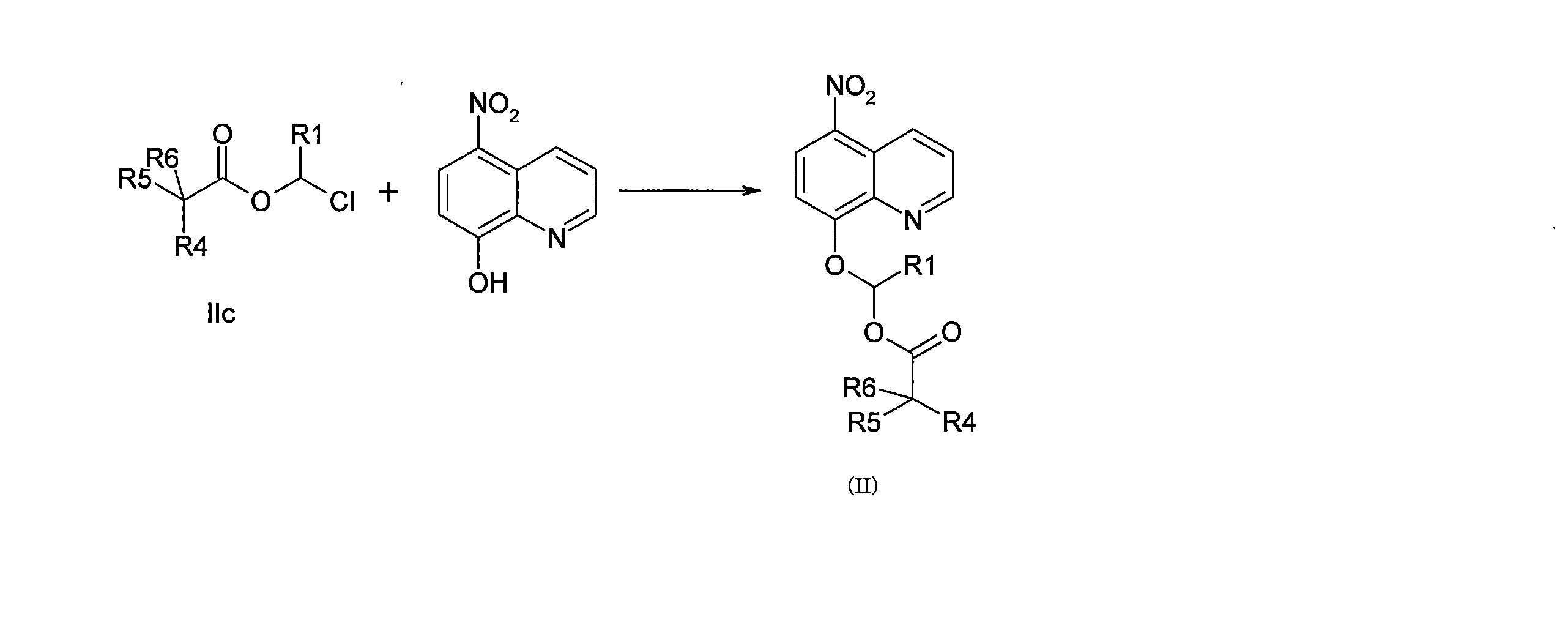
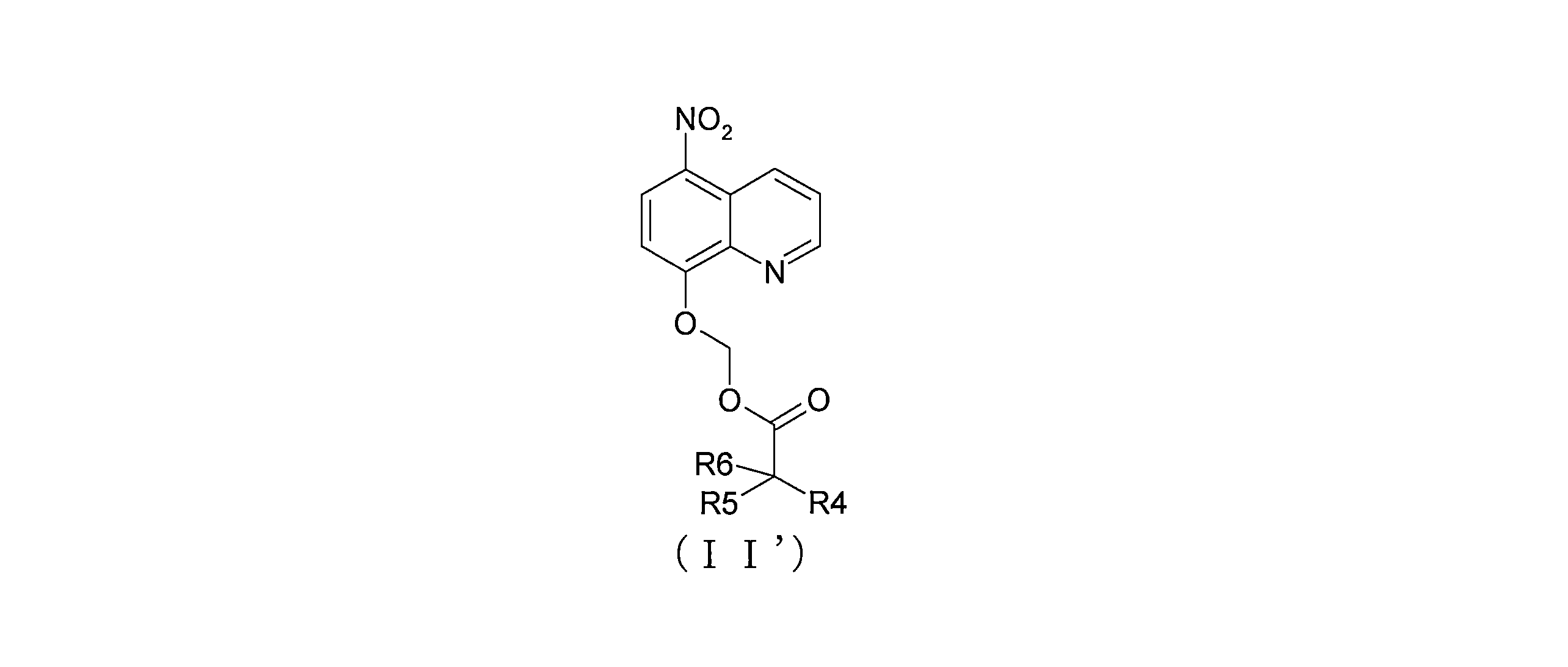
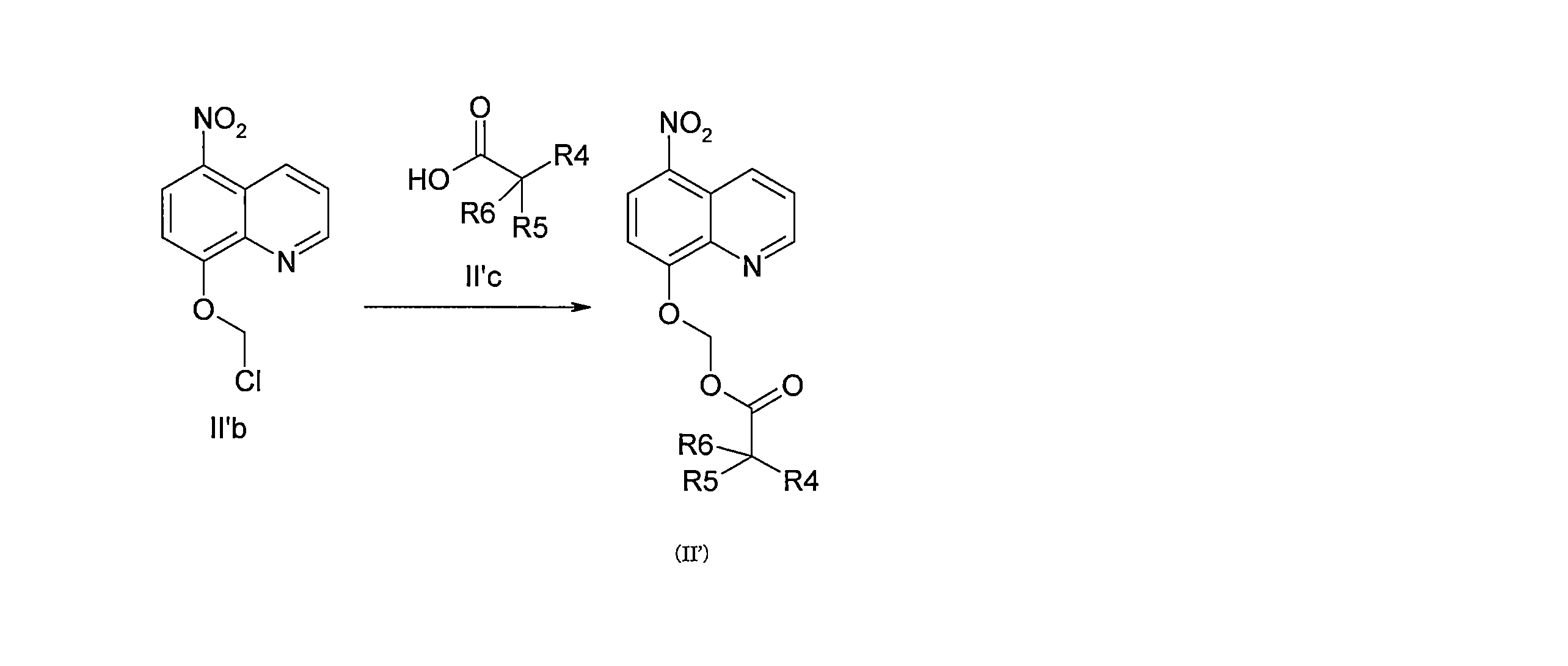
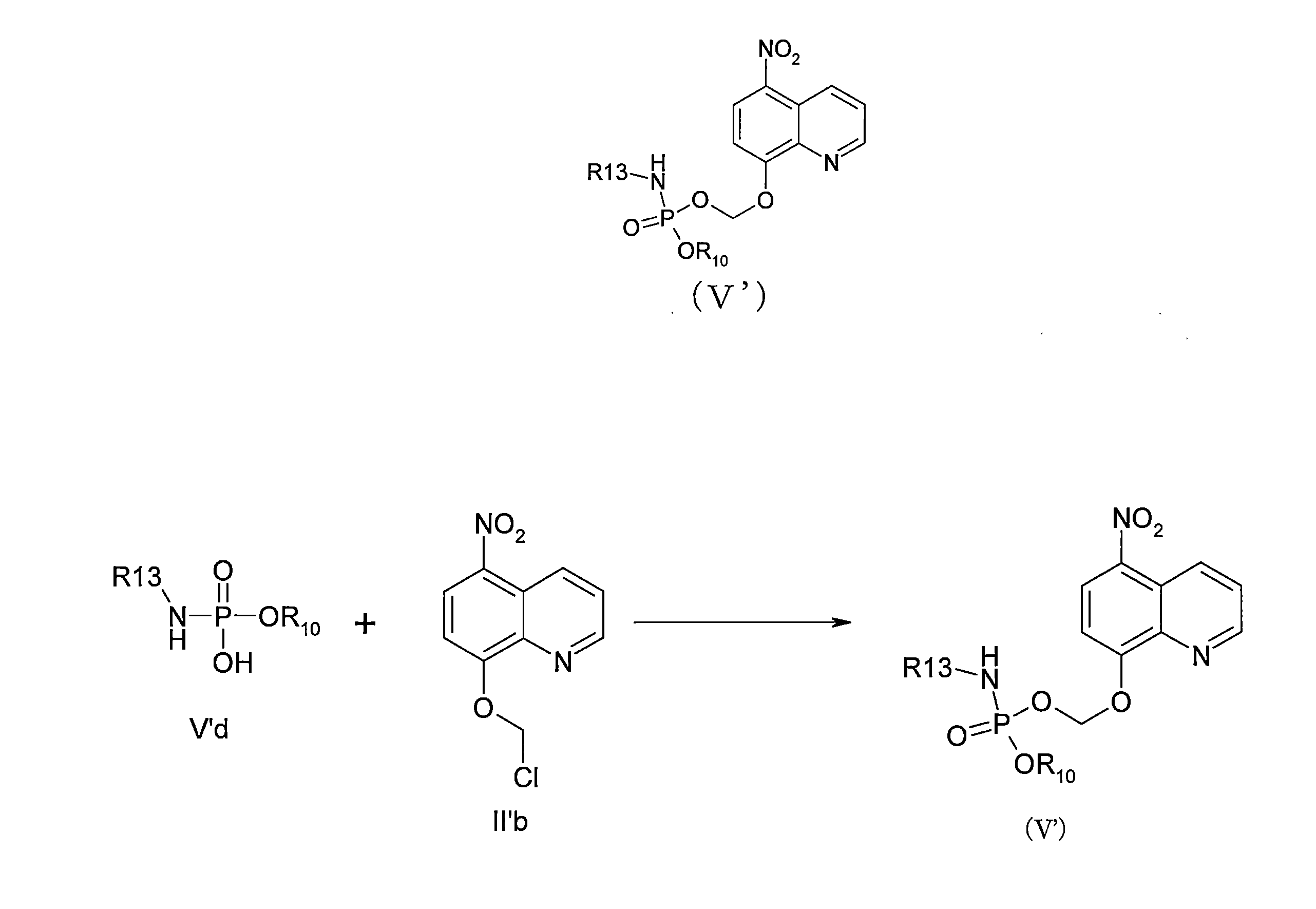
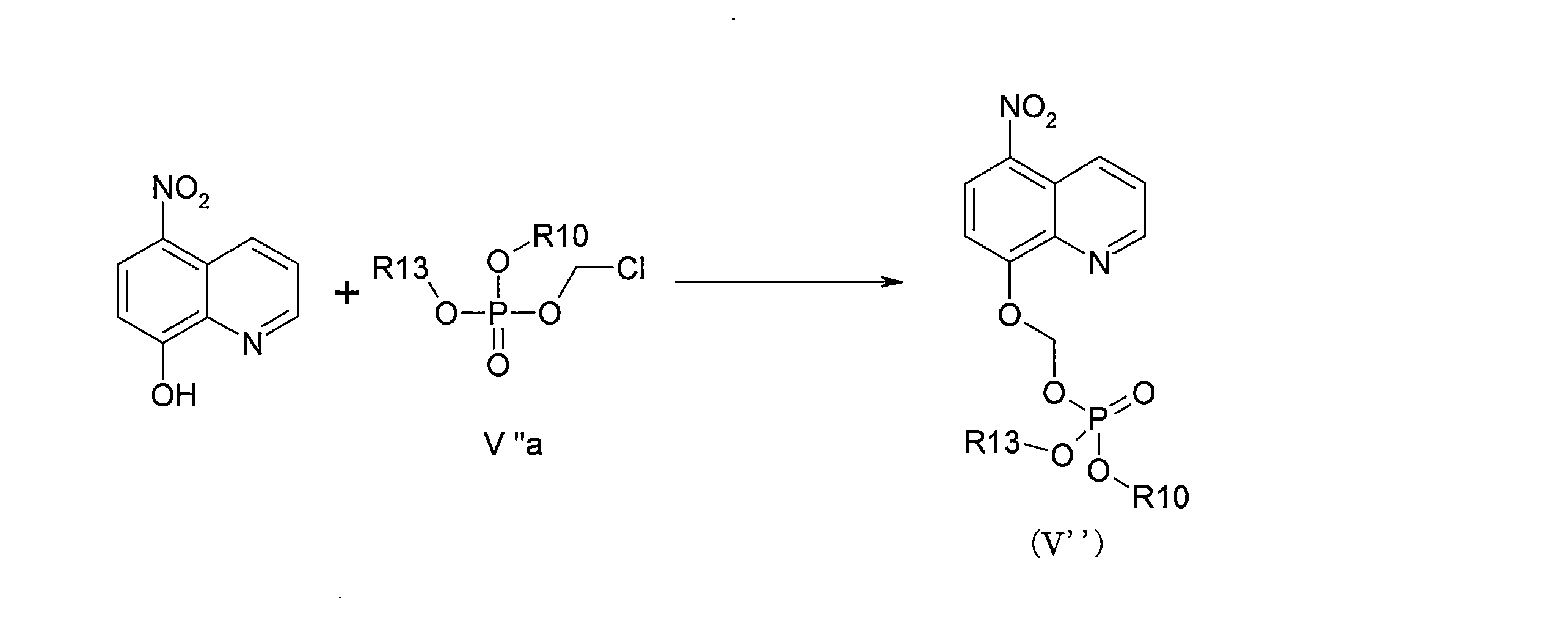
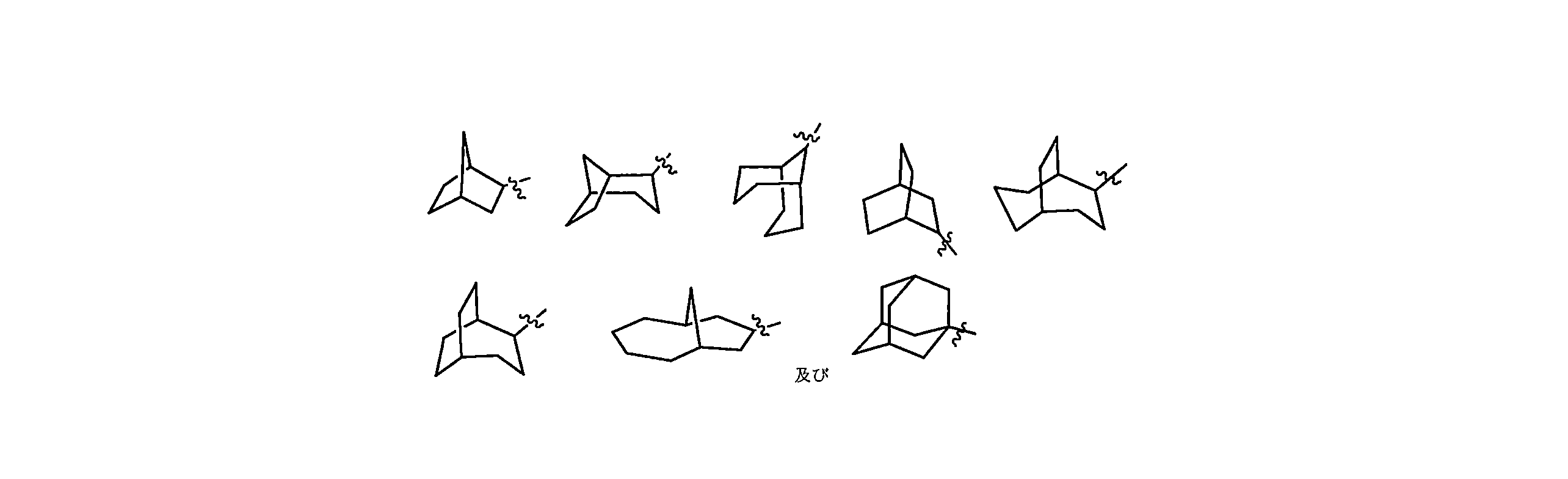
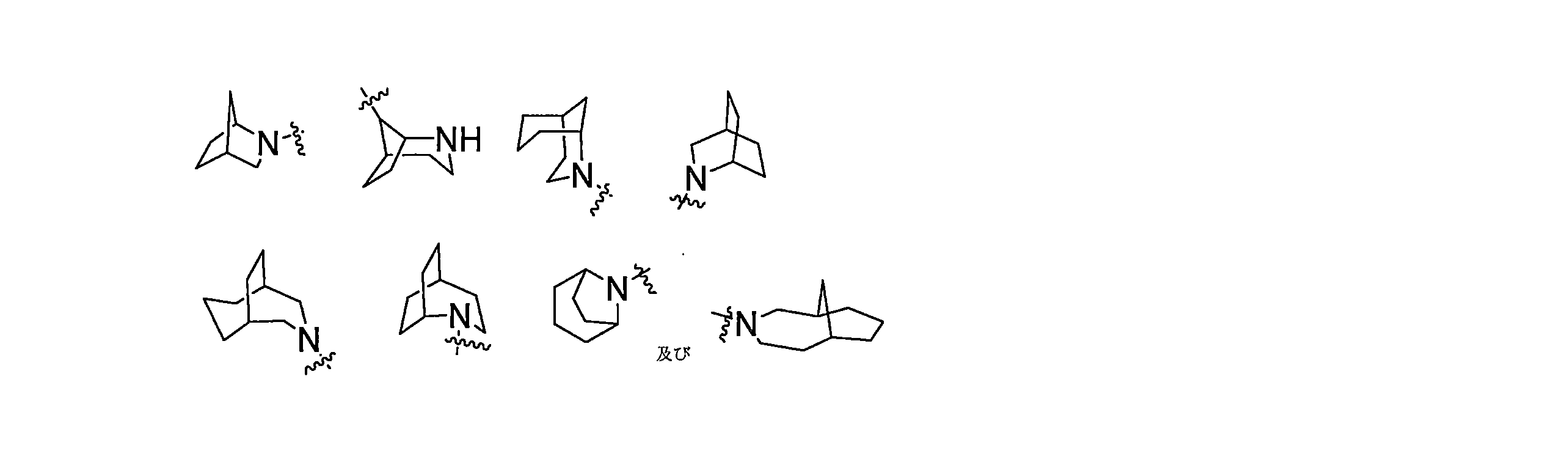
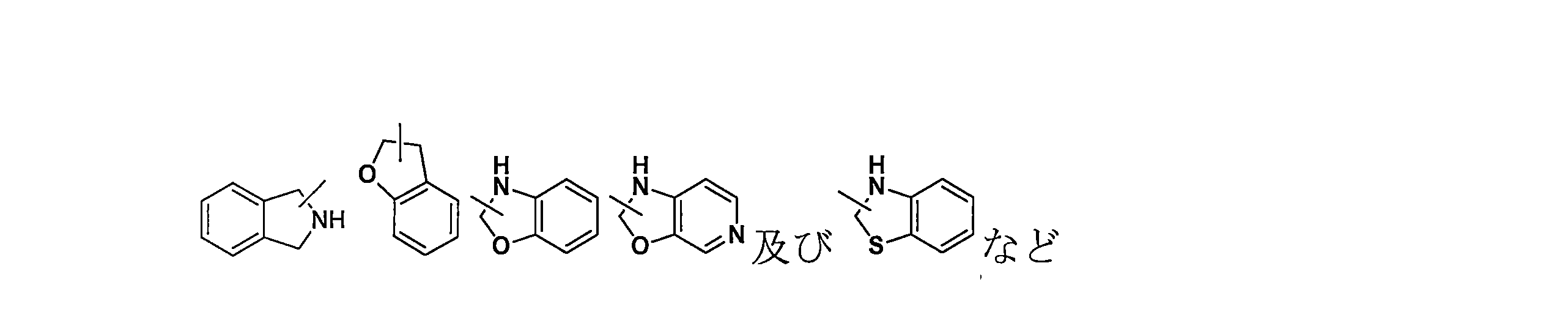
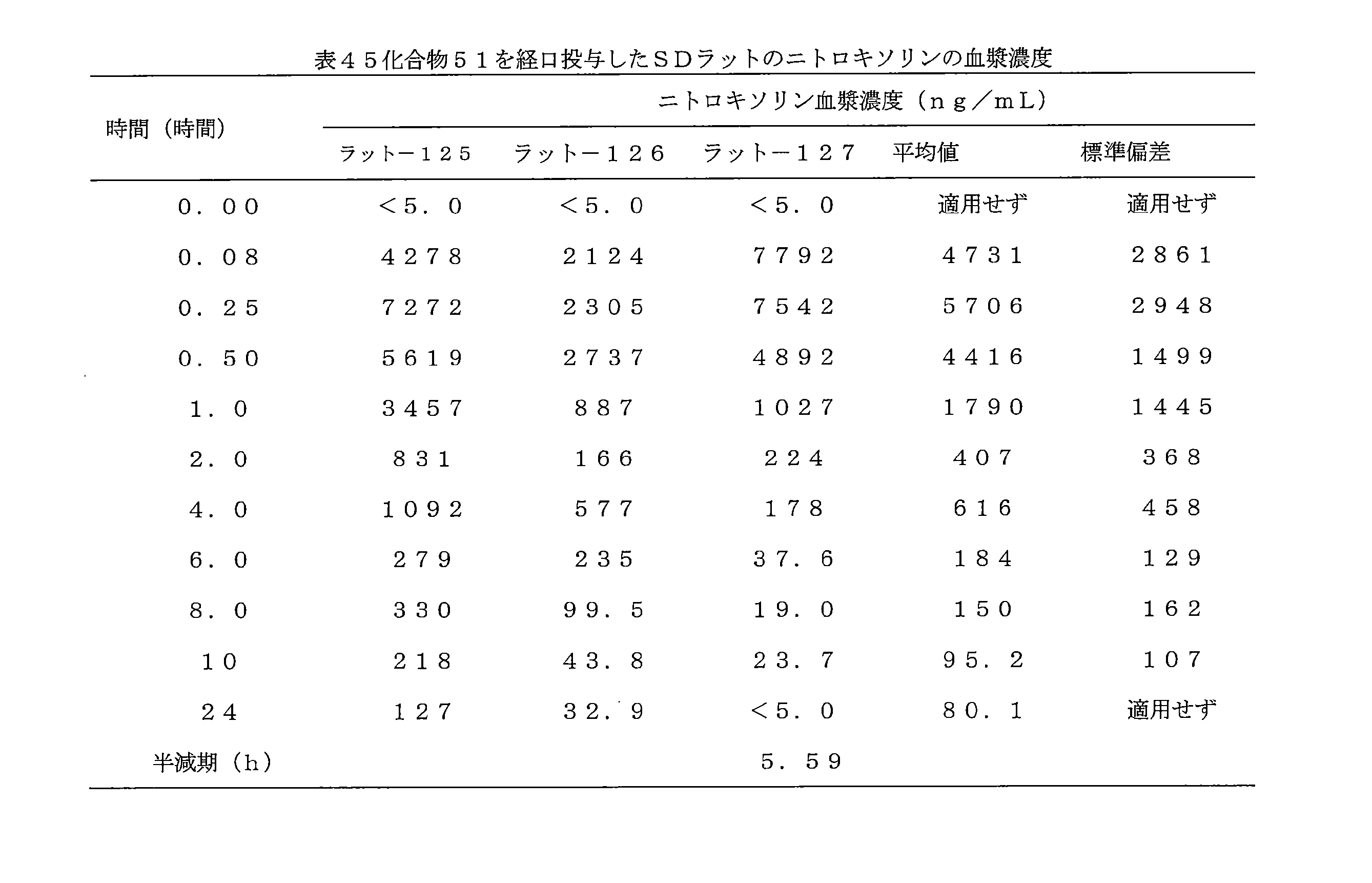
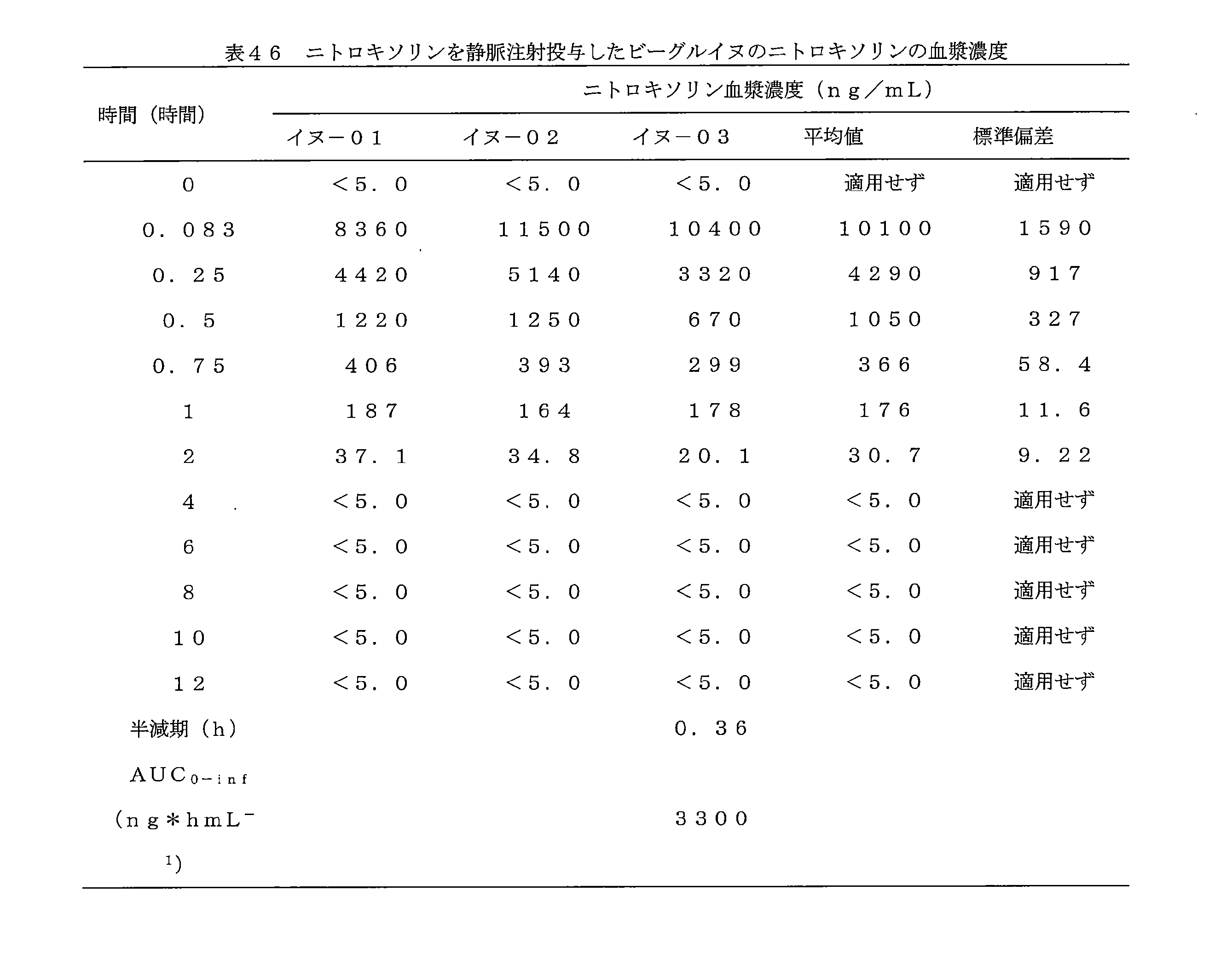
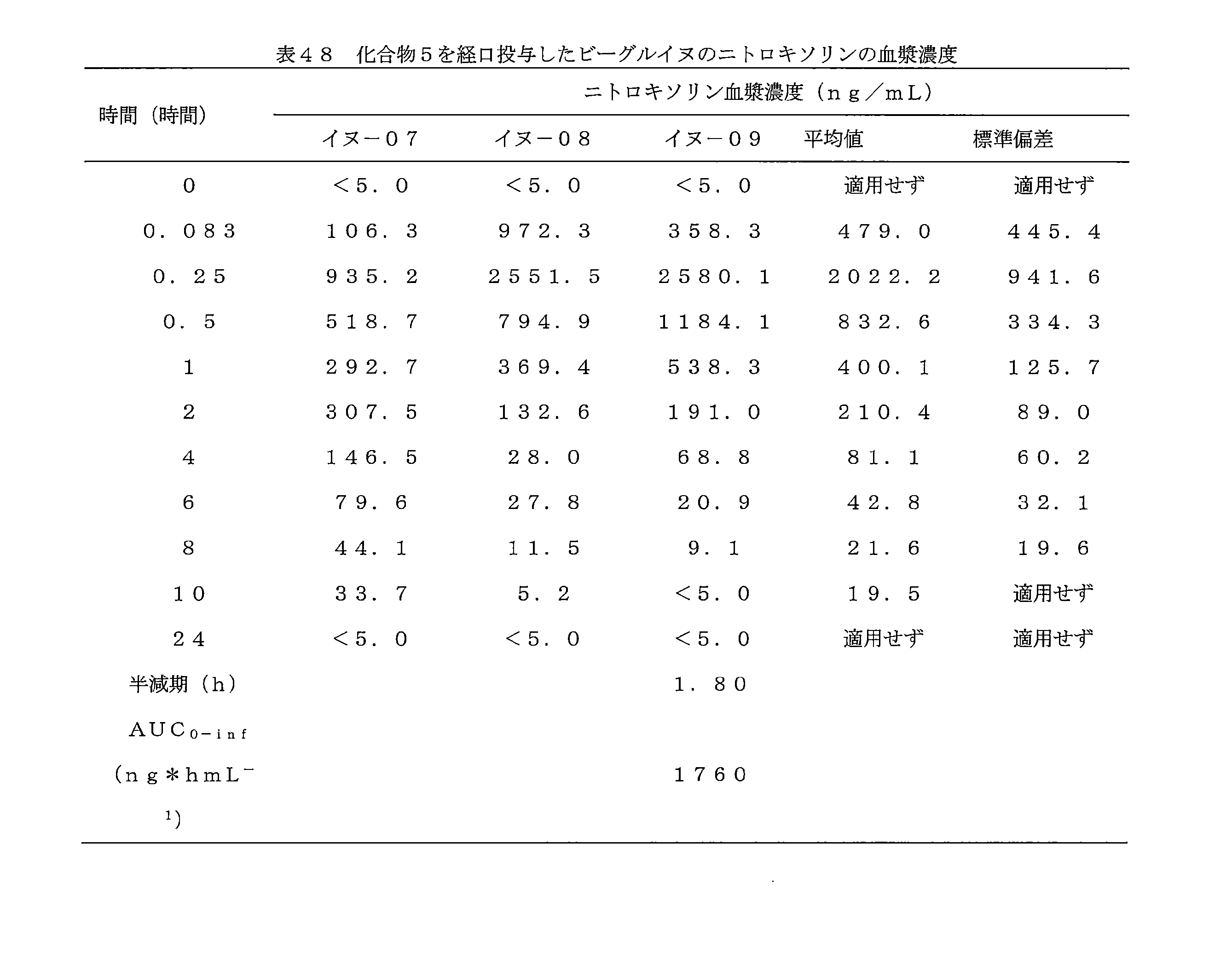
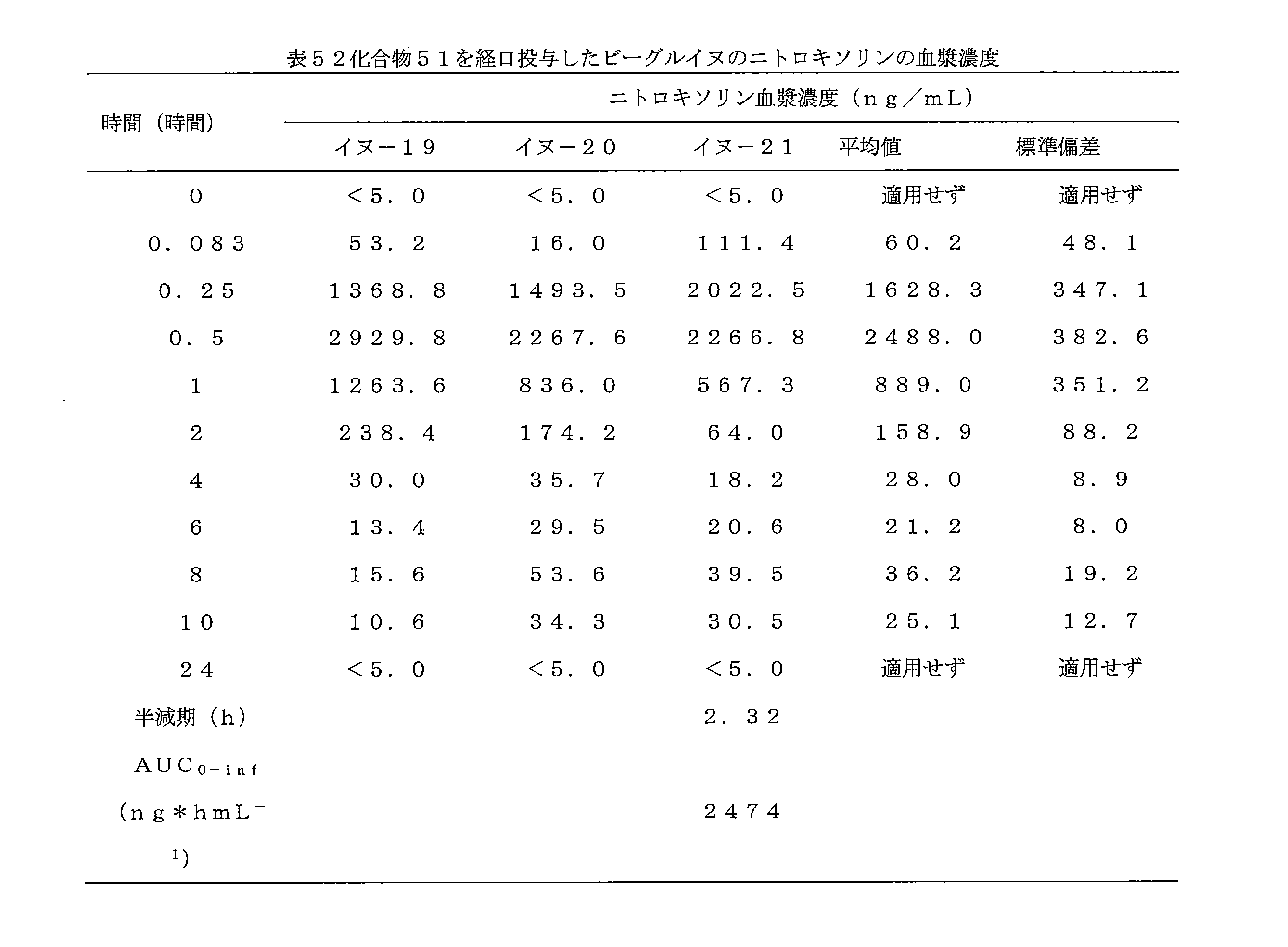
JP7624924B2 - ニトロキソリンプロドラッグ及びその使用 - Google Patents
ニトロキソリンプロドラッグ及びその使用 Download PDFInfo
- Publication number
- JP7624924B2 JP7624924B2 JP2021542249A JP2021542249A JP7624924B2 JP 7624924 B2 JP7624924 B2 JP 7624924B2 JP 2021542249 A JP2021542249 A JP 2021542249A JP 2021542249 A JP2021542249 A JP 2021542249A JP 7624924 B2 JP7624924 B2 JP 7624924B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- methyl
- nitroquinolin
- mmol
- yloxy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- RJIWZDNTCBHXAL-UHFFFAOYSA-N nitroxoline Chemical compound C1=CN=C2C(O)=CC=C([N+]([O-])=O)C2=C1 RJIWZDNTCBHXAL-UHFFFAOYSA-N 0.000 title claims description 57
- 229960005131 nitroxoline Drugs 0.000 title claims description 57
- 239000000651 prodrug Substances 0.000 title description 18
- 229940002612 prodrug Drugs 0.000 title description 18
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 309
- 150000001875 compounds Chemical class 0.000 claims description 129
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 claims description 119
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 claims description 114
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 claims description 72
- 239000001257 hydrogen Substances 0.000 claims description 60
- 229910052739 hydrogen Inorganic materials 0.000 claims description 60
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical compound FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 claims description 58
- 239000000203 mixture Substances 0.000 claims description 55
- 150000002431 hydrogen Chemical class 0.000 claims description 47
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 44
- 239000003513 alkali Substances 0.000 claims description 43
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 40
- 238000000034 method Methods 0.000 claims description 40
- 239000002904 solvent Substances 0.000 claims description 37
- 229910000027 potassium carbonate Inorganic materials 0.000 claims description 36
- 235000011181 potassium carbonates Nutrition 0.000 claims description 36
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 claims description 32
- 150000003839 salts Chemical class 0.000 claims description 26
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 22
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 21
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 20
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 claims description 16
- 238000004519 manufacturing process Methods 0.000 claims description 16
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 claims description 16
- 229910000029 sodium carbonate Inorganic materials 0.000 claims description 16
- 235000017550 sodium carbonate Nutrition 0.000 claims description 16
- 235000015497 potassium bicarbonate Nutrition 0.000 claims description 15
- 229910000028 potassium bicarbonate Inorganic materials 0.000 claims description 15
- 239000011736 potassium bicarbonate Substances 0.000 claims description 15
- 125000001424 substituent group Chemical group 0.000 claims description 14
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 claims description 13
- 239000008194 pharmaceutical composition Substances 0.000 claims description 13
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 12
- XOJVVFBFDXDTEG-UHFFFAOYSA-N pristane Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)C XOJVVFBFDXDTEG-UHFFFAOYSA-N 0.000 claims description 11
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 7
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 6
- 206010028980 Neoplasm Diseases 0.000 claims description 3
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 3
- 239000002246 antineoplastic agent Substances 0.000 claims description 3
- 229940041181 antineoplastic drug Drugs 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 125000000719 pyrrolidinyl group Chemical group 0.000 claims description 3
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 3
- 206010005003 Bladder cancer Diseases 0.000 claims description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 2
- 206010060862 Prostate cancer Diseases 0.000 claims description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 2
- 206010038389 Renal cancer Diseases 0.000 claims description 2
- 230000002924 anti-infective effect Effects 0.000 claims description 2
- 201000010982 kidney cancer Diseases 0.000 claims description 2
- 229910021386 carbon form Inorganic materials 0.000 claims 3
- 125000004400 (C1-C12) alkyl group Chemical group 0.000 claims 1
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims 1
- 125000003341 7 membered heterocyclic group Chemical group 0.000 claims 1
- 125000000623 heterocyclic group Chemical group 0.000 description 167
- 238000004949 mass spectrometry Methods 0.000 description 164
- 125000000217 alkyl group Chemical group 0.000 description 160
- 125000003118 aryl group Chemical group 0.000 description 158
- 125000000753 cycloalkyl group Chemical group 0.000 description 158
- -1 cloprocaine Chemical compound 0.000 description 154
- 125000001072 heteroaryl group Chemical group 0.000 description 151
- 238000006243 chemical reaction Methods 0.000 description 133
- 239000000243 solution Substances 0.000 description 126
- 125000003545 alkoxy group Chemical group 0.000 description 122
- 229910052736 halogen Inorganic materials 0.000 description 102
- 150000002367 halogens Chemical class 0.000 description 102
- 125000003342 alkenyl group Chemical group 0.000 description 100
- 125000000304 alkynyl group Chemical group 0.000 description 100
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 93
- 125000003277 amino group Chemical group 0.000 description 90
- 238000003786 synthesis reaction Methods 0.000 description 82
- 230000015572 biosynthetic process Effects 0.000 description 80
- 125000004093 cyano group Chemical group *C#N 0.000 description 80
- 238000002360 preparation method Methods 0.000 description 79
- 238000005259 measurement Methods 0.000 description 77
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 76
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 75
- 230000002829 reductive effect Effects 0.000 description 72
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 71
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 66
- 125000004185 ester group Chemical group 0.000 description 65
- 238000004364 calculation method Methods 0.000 description 60
- 125000003396 thiol group Chemical group [H]S* 0.000 description 59
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 56
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 54
- 239000012074 organic phase Substances 0.000 description 53
- 238000005481 NMR spectroscopy Methods 0.000 description 52
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 45
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 43
- 125000004043 oxo group Chemical group O=* 0.000 description 43
- 238000010898 silica gel chromatography Methods 0.000 description 38
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 35
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 35
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical class [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 33
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 30
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 30
- 238000005160 1H NMR spectroscopy Methods 0.000 description 29
- 229910020008 S(O) Inorganic materials 0.000 description 28
- 239000000047 product Substances 0.000 description 27
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 27
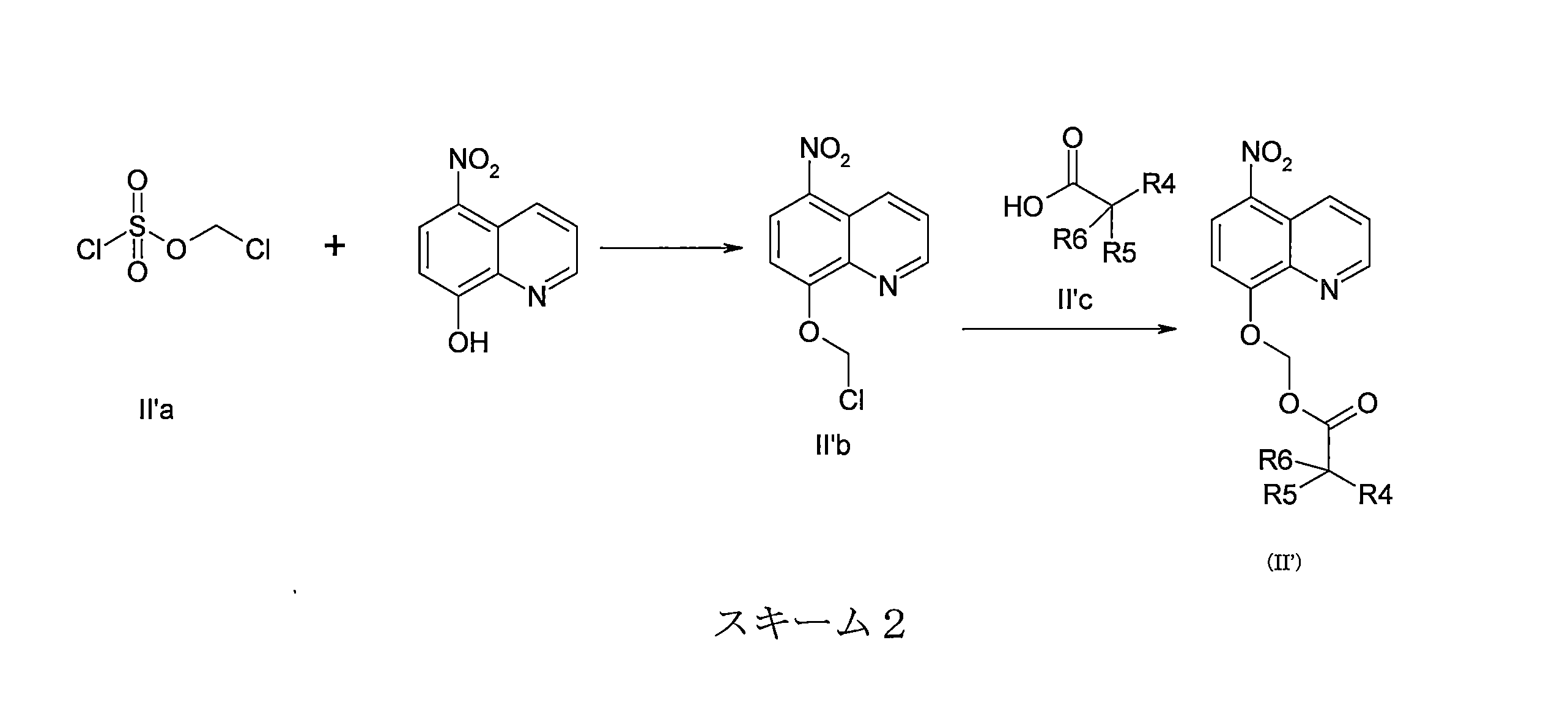
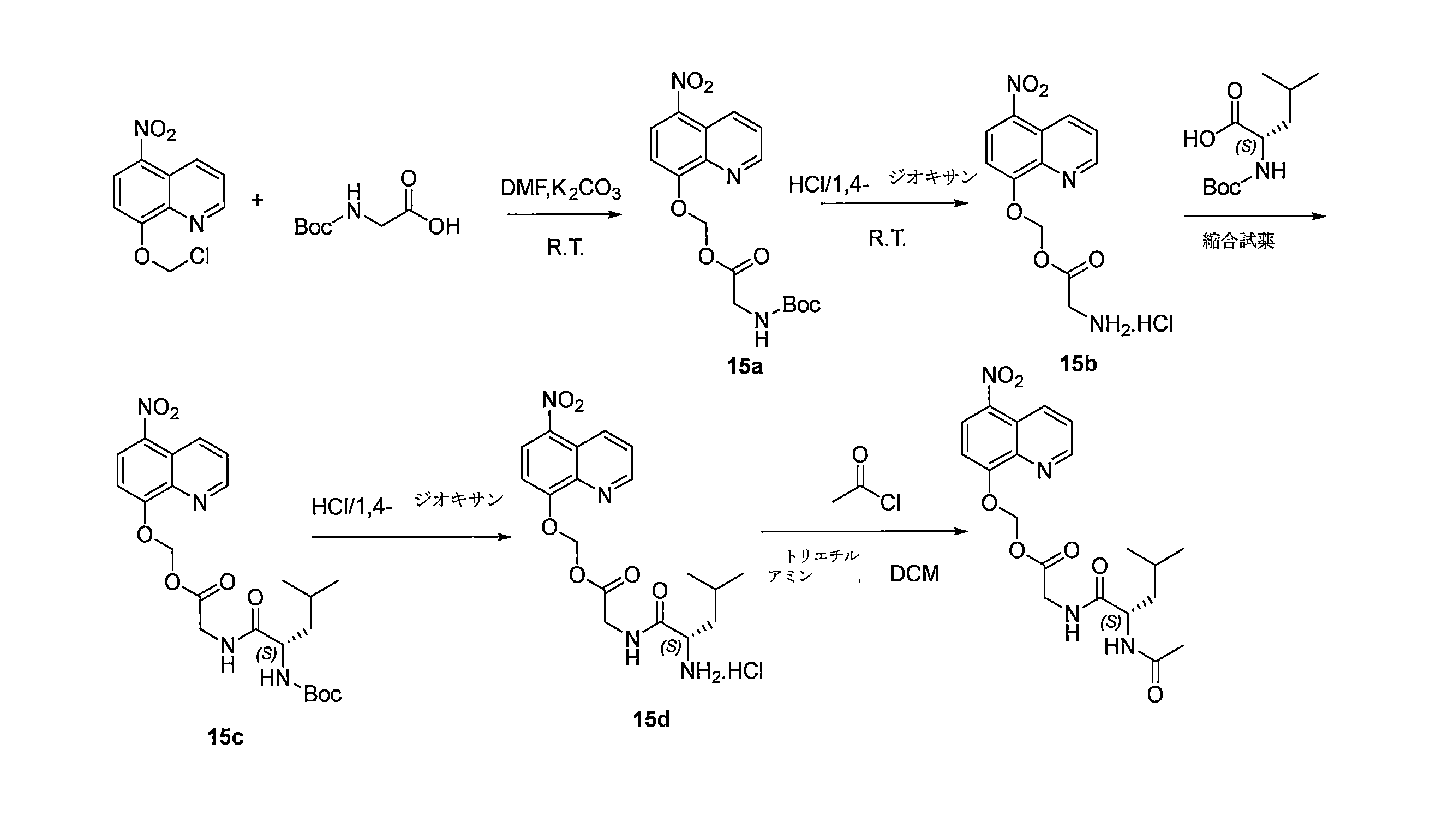
- DNGZECKJLHQYBR-UHFFFAOYSA-N 8-(chloromethoxy)-5-nitroquinoline Chemical compound C1=CC=C2C([N+](=O)[O-])=CC=C(OCCl)C2=N1 DNGZECKJLHQYBR-UHFFFAOYSA-N 0.000 description 25
- 229940079593 drug Drugs 0.000 description 22
- 239000003814 drug Substances 0.000 description 22
- 239000003480 eluent Substances 0.000 description 21
- 239000000706 filtrate Substances 0.000 description 21
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 21
- 235000011054 acetic acid Nutrition 0.000 description 18
- 235000017557 sodium bicarbonate Nutrition 0.000 description 17
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 17
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 16
- 238000010791 quenching Methods 0.000 description 16
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 16
- 239000004480 active ingredient Substances 0.000 description 15
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 14
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 13
- 239000012346 acetyl chloride Substances 0.000 description 13
- 125000004432 carbon atom Chemical group C* 0.000 description 13
- 125000006413 ring segment Chemical group 0.000 description 13
- 229910052799 carbon Inorganic materials 0.000 description 12
- 125000003710 aryl alkyl group Chemical group 0.000 description 11
- 125000004429 atom Chemical group 0.000 description 11
- 125000002619 bicyclic group Chemical group 0.000 description 11
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 11
- 125000005842 heteroatom Chemical group 0.000 description 11
- 229910052757 nitrogen Inorganic materials 0.000 description 11
- 229910052760 oxygen Inorganic materials 0.000 description 11
- 239000012071 phase Substances 0.000 description 11
- 125000003367 polycyclic group Chemical group 0.000 description 11
- 239000007787 solid Substances 0.000 description 11
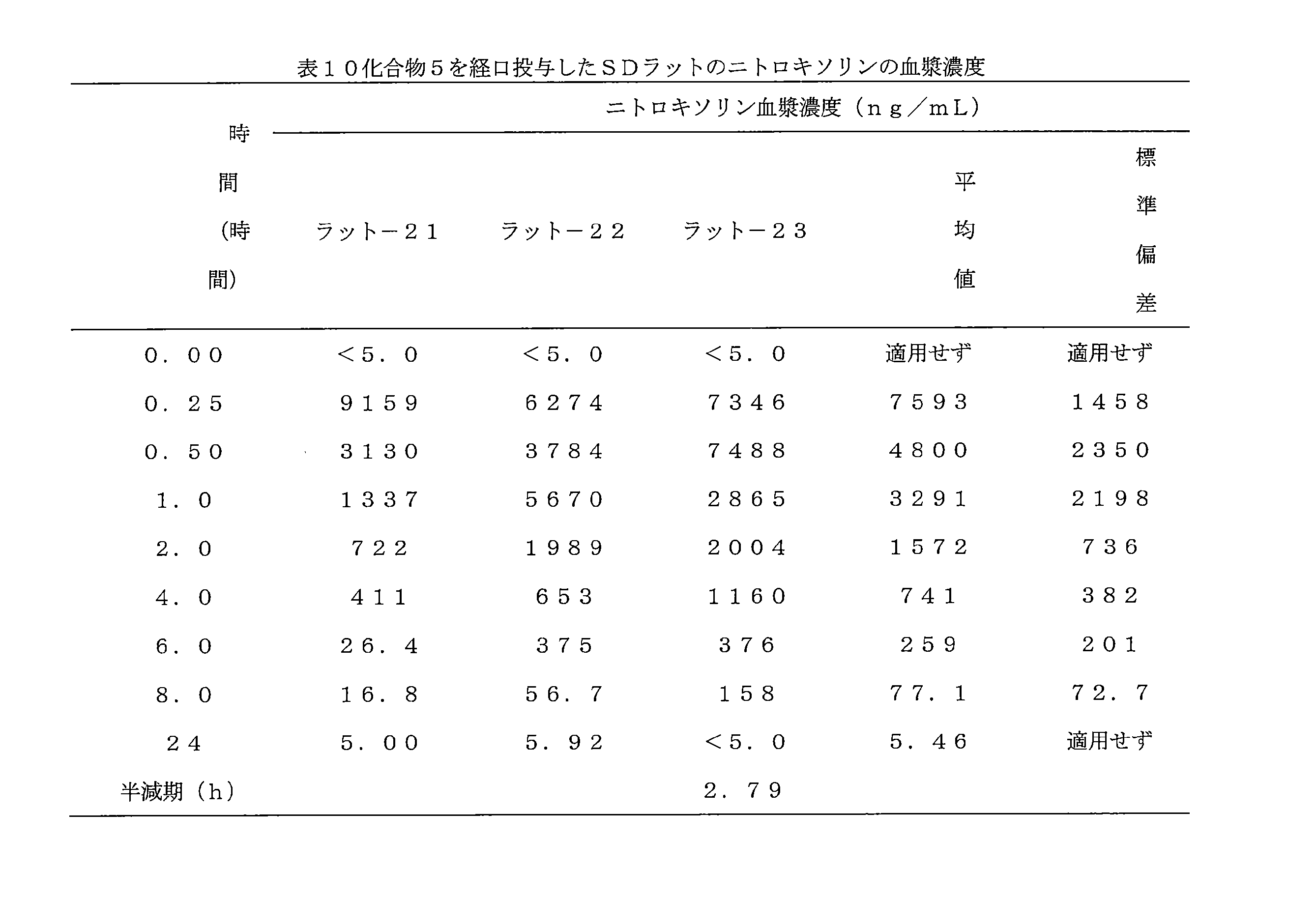
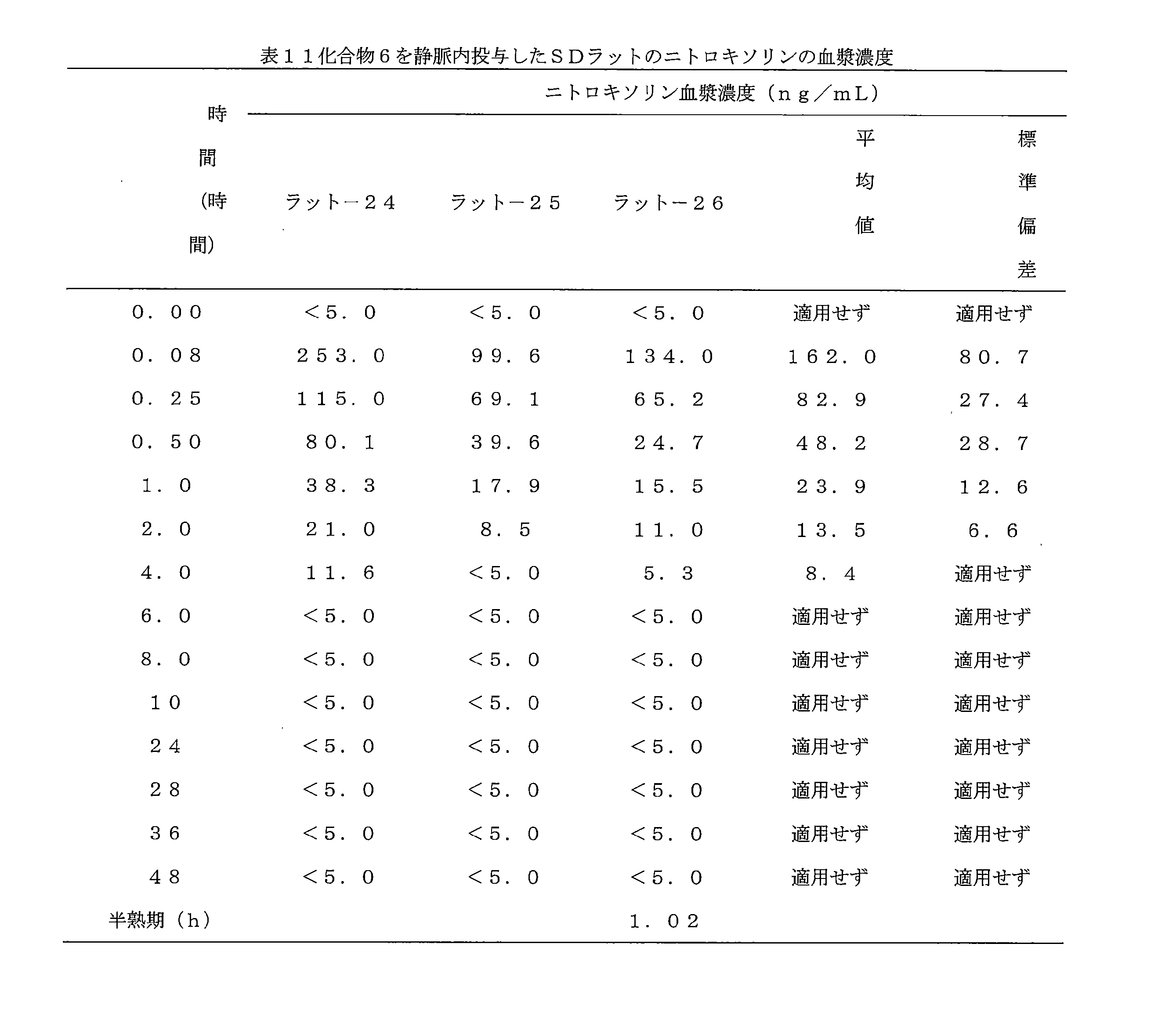
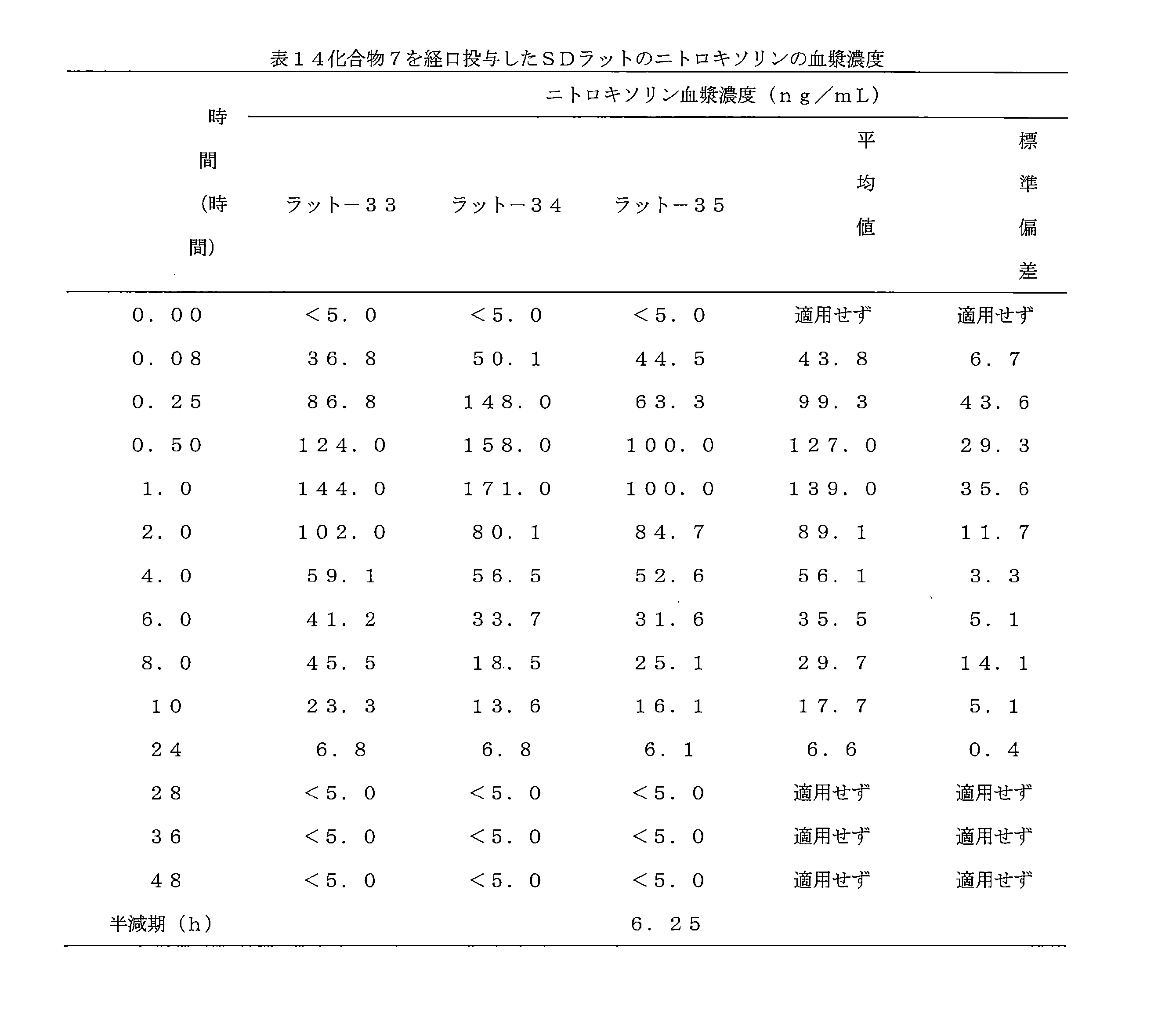
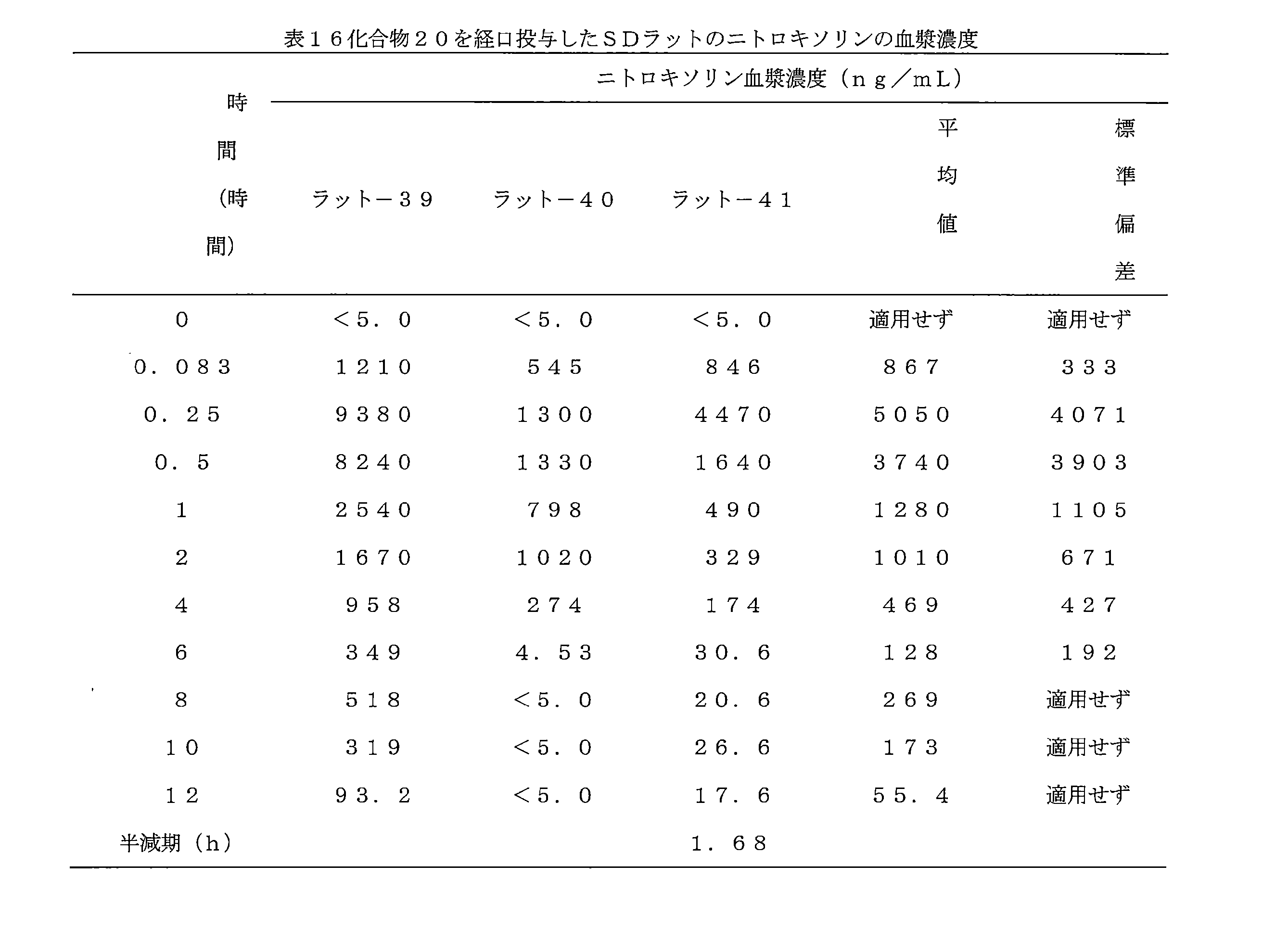
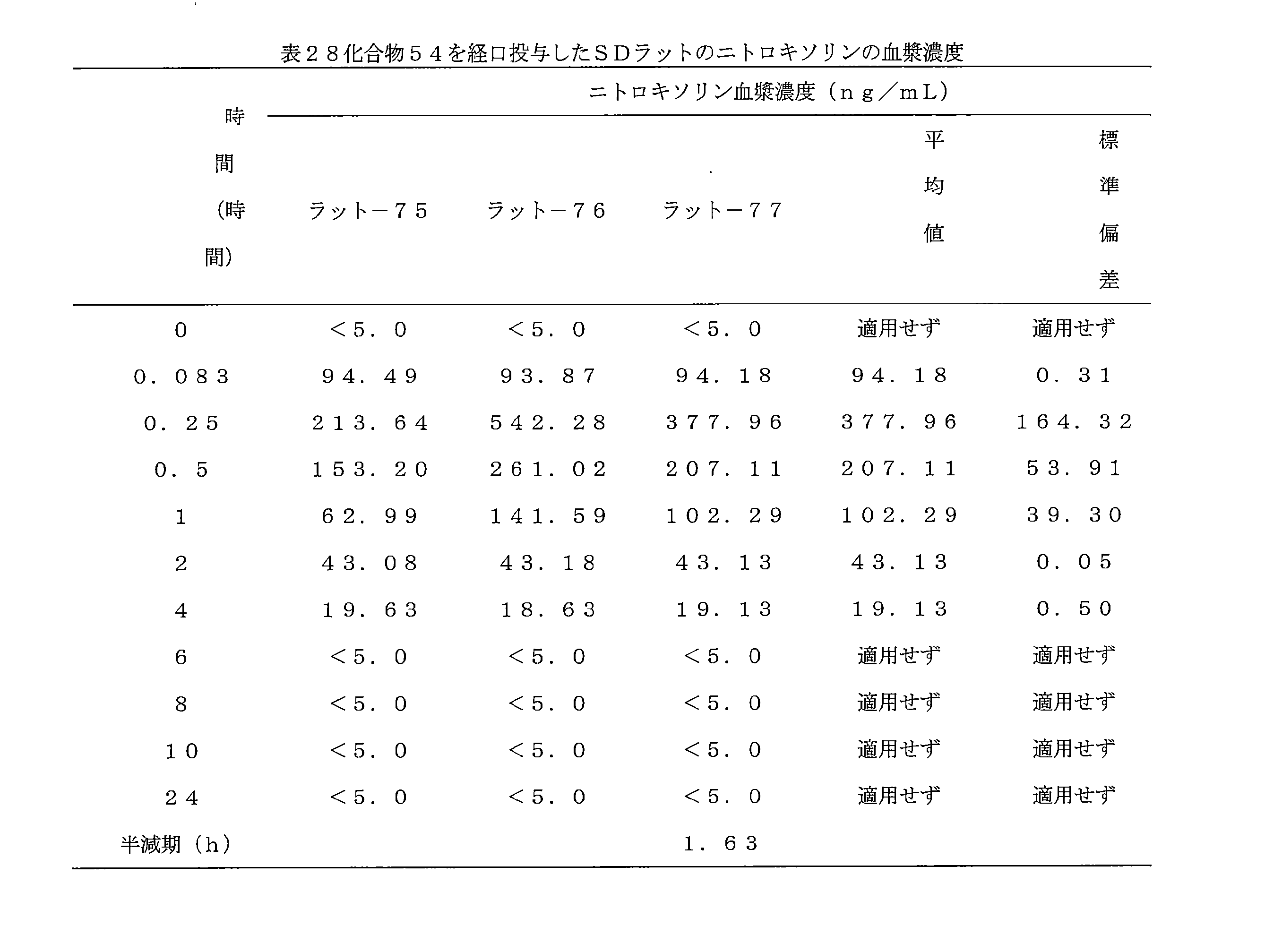
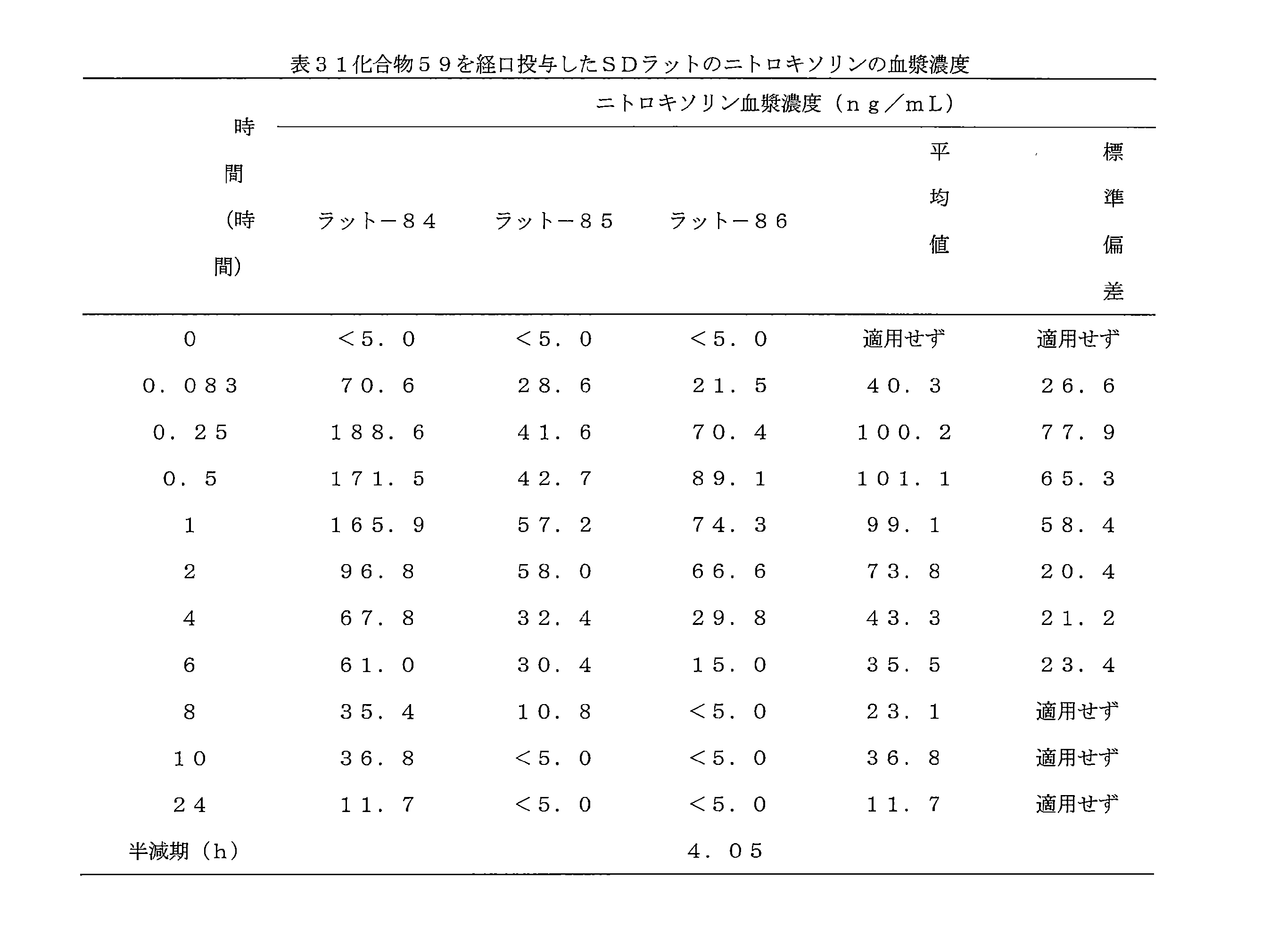
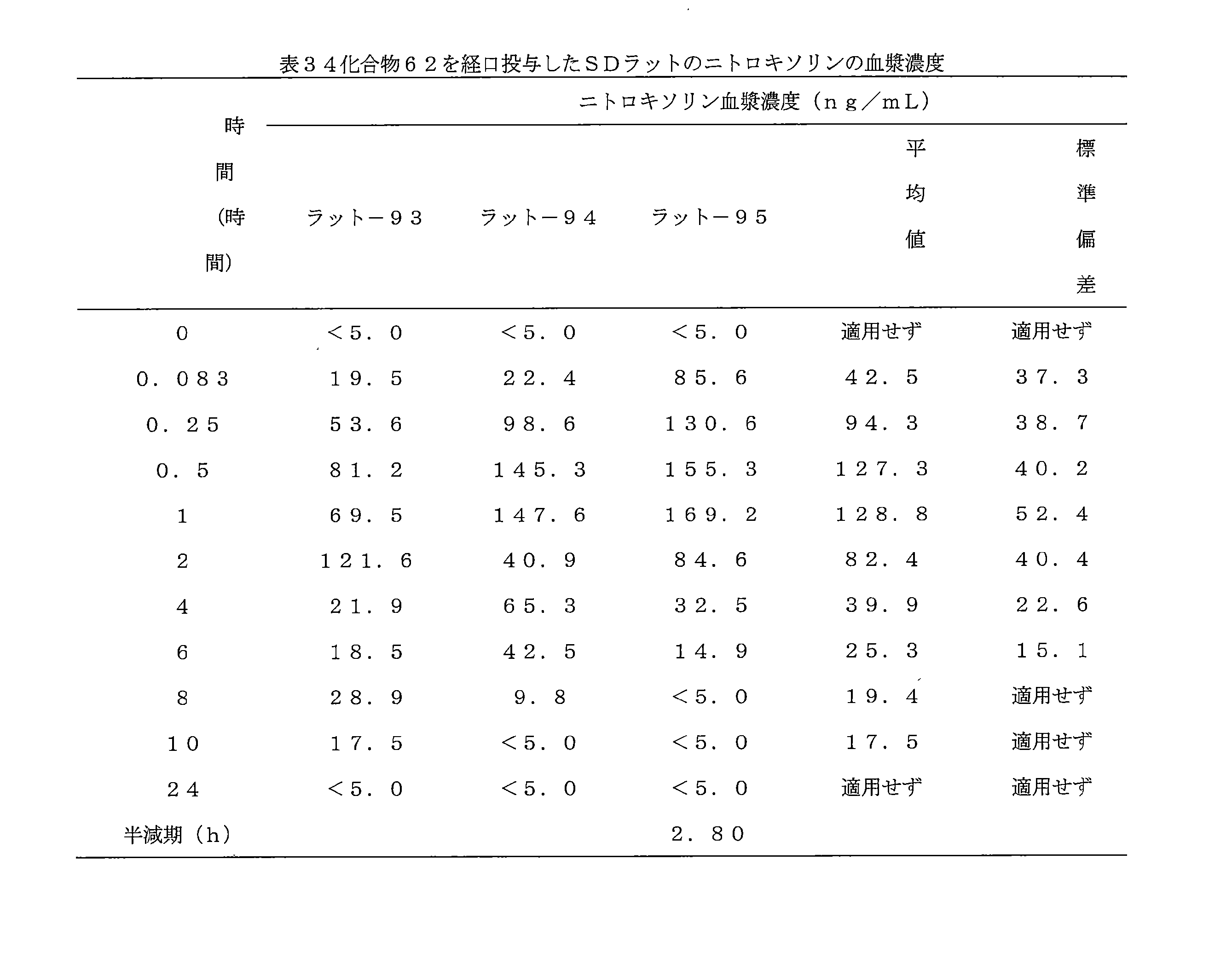
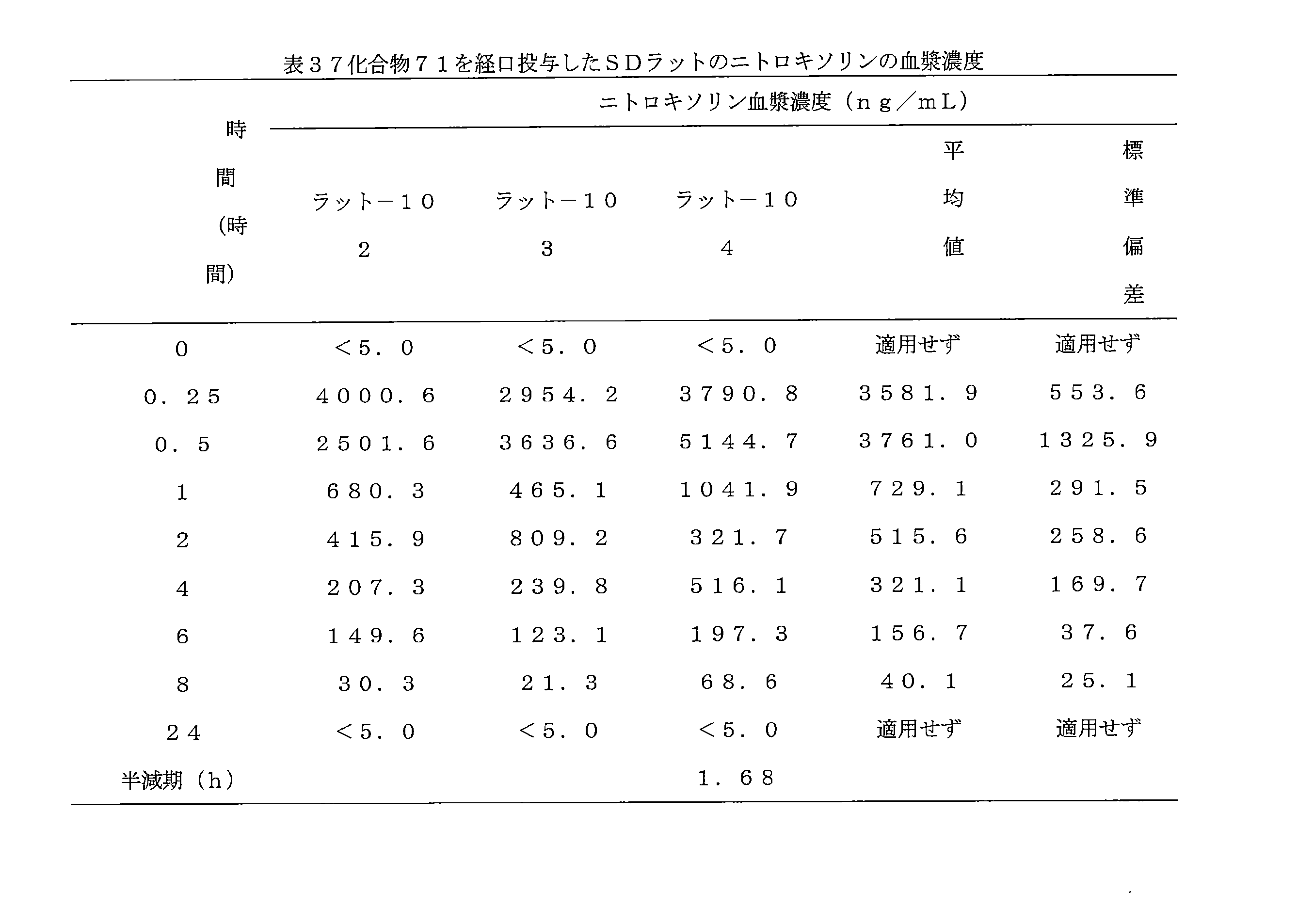
- 241000700159 Rattus Species 0.000 description 10
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 10
- 238000007344 nucleophilic reaction Methods 0.000 description 10
- 238000003756 stirring Methods 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 9
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 9
- 239000000546 pharmaceutical excipient Substances 0.000 description 9
- 235000009518 sodium iodide Nutrition 0.000 description 9
- HTSGKJQDMSTCGS-UHFFFAOYSA-N 1,4-bis(4-chlorophenyl)-2-(4-methylphenyl)sulfonylbutane-1,4-dione Chemical compound C1=CC(C)=CC=C1S(=O)(=O)C(C(=O)C=1C=CC(Cl)=CC=1)CC(=O)C1=CC=C(Cl)C=C1 HTSGKJQDMSTCGS-UHFFFAOYSA-N 0.000 description 8
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 8
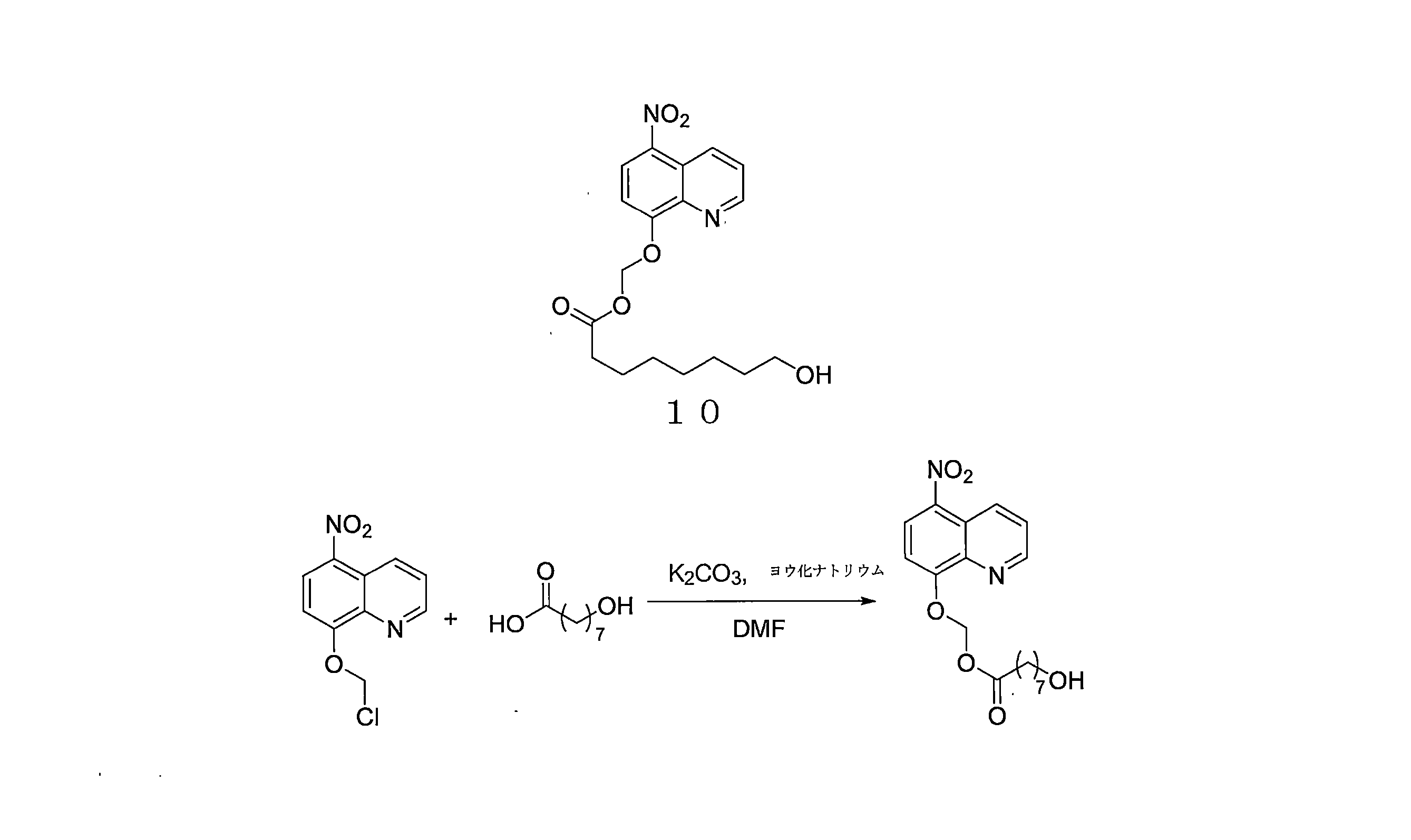
- KDMSVYIHKLZKET-UHFFFAOYSA-N 8-hydroxyoctanoic acid Chemical compound OCCCCCCCC(O)=O KDMSVYIHKLZKET-UHFFFAOYSA-N 0.000 description 8
- 125000003282 alkyl amino group Chemical group 0.000 description 8
- 125000004414 alkyl thio group Chemical group 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
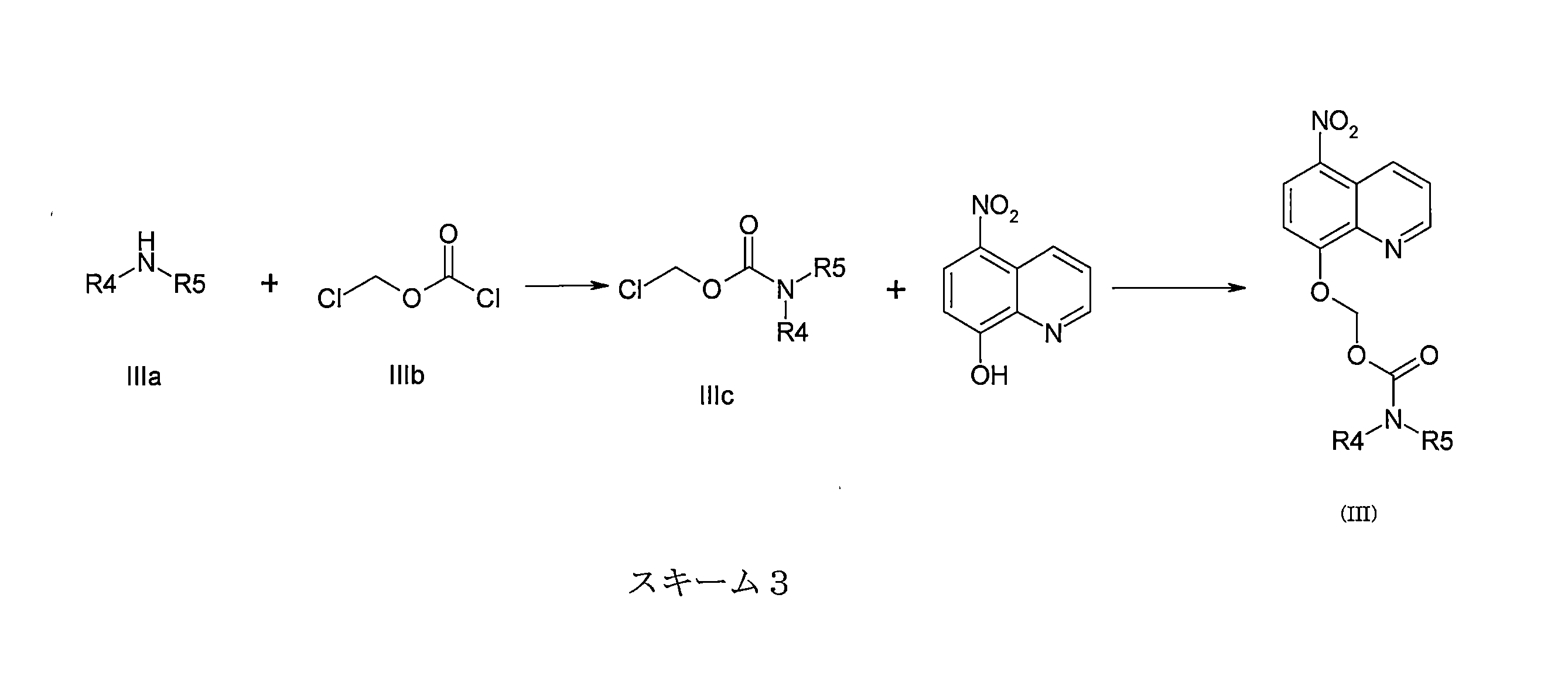
- JYWJULGYGOLCGW-UHFFFAOYSA-N chloromethyl chloroformate Chemical compound ClCOC(Cl)=O JYWJULGYGOLCGW-UHFFFAOYSA-N 0.000 description 8
- 125000000000 cycloalkoxy group Chemical group 0.000 description 8
- 125000005366 cycloalkylthio group Chemical group 0.000 description 8
- 235000019253 formic acid Nutrition 0.000 description 8
- HNBDRPTVWVGKBR-UHFFFAOYSA-N n-pentanoic acid methyl ester Natural products CCCCC(=O)OC HNBDRPTVWVGKBR-UHFFFAOYSA-N 0.000 description 8
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
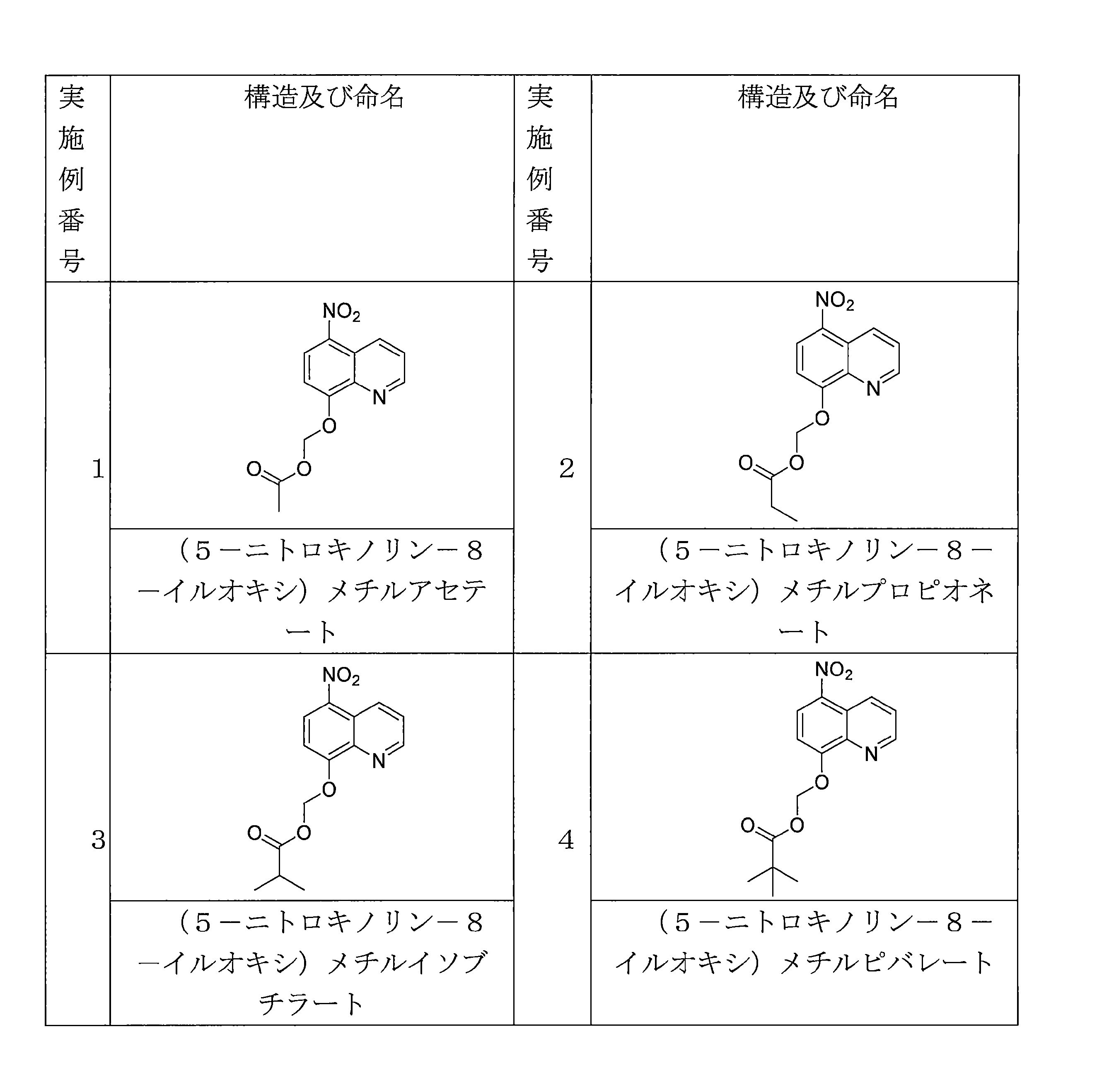
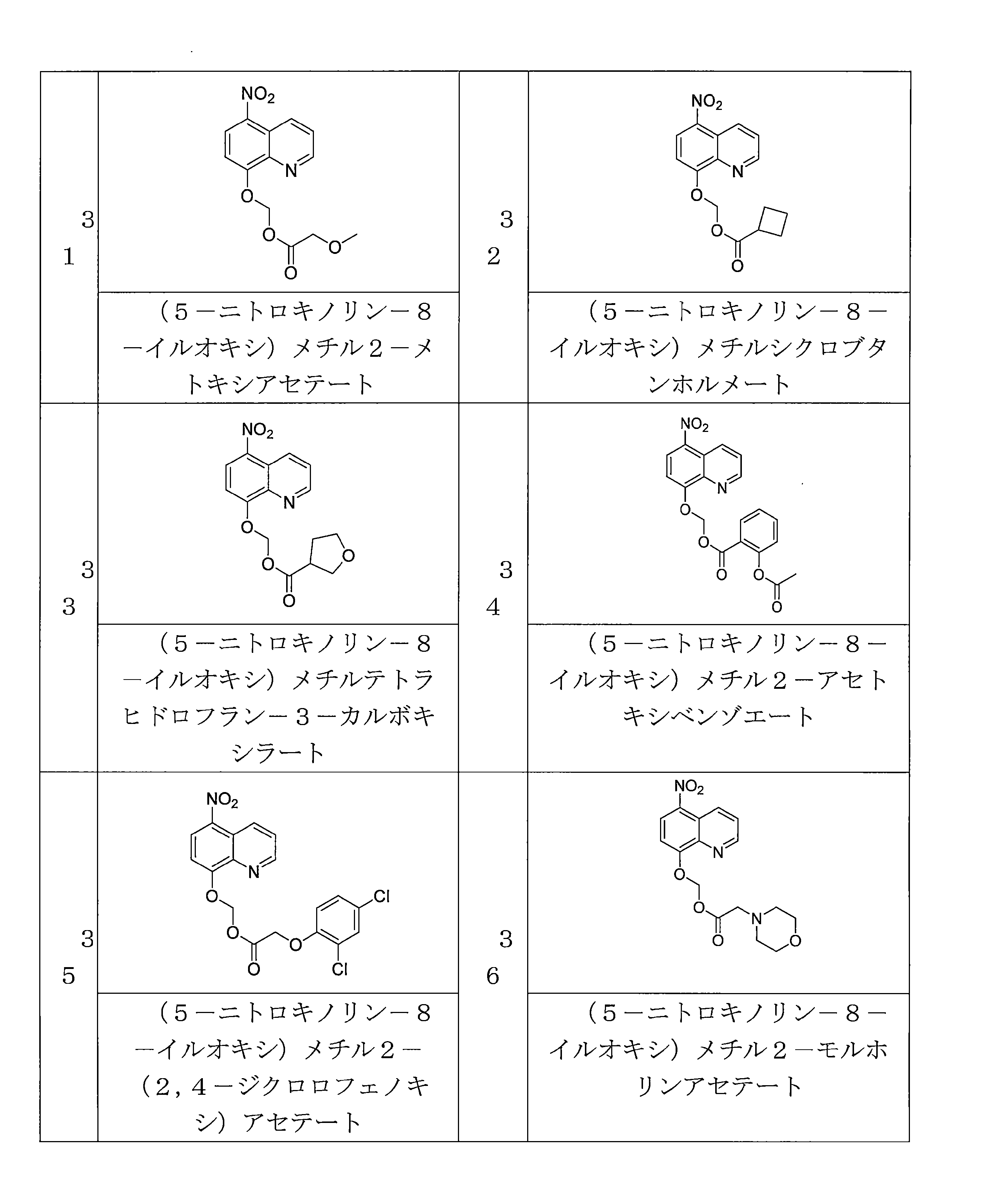
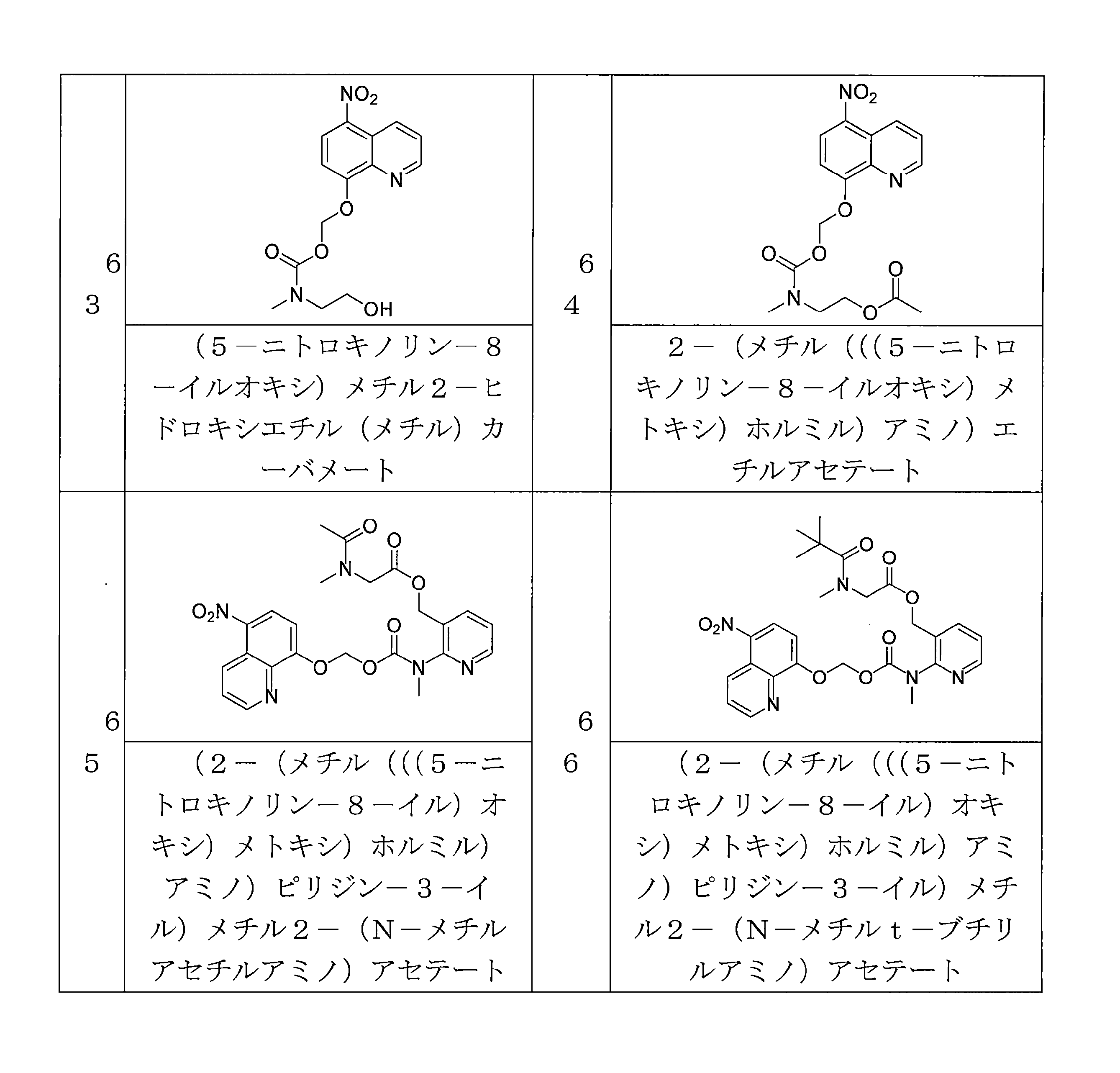
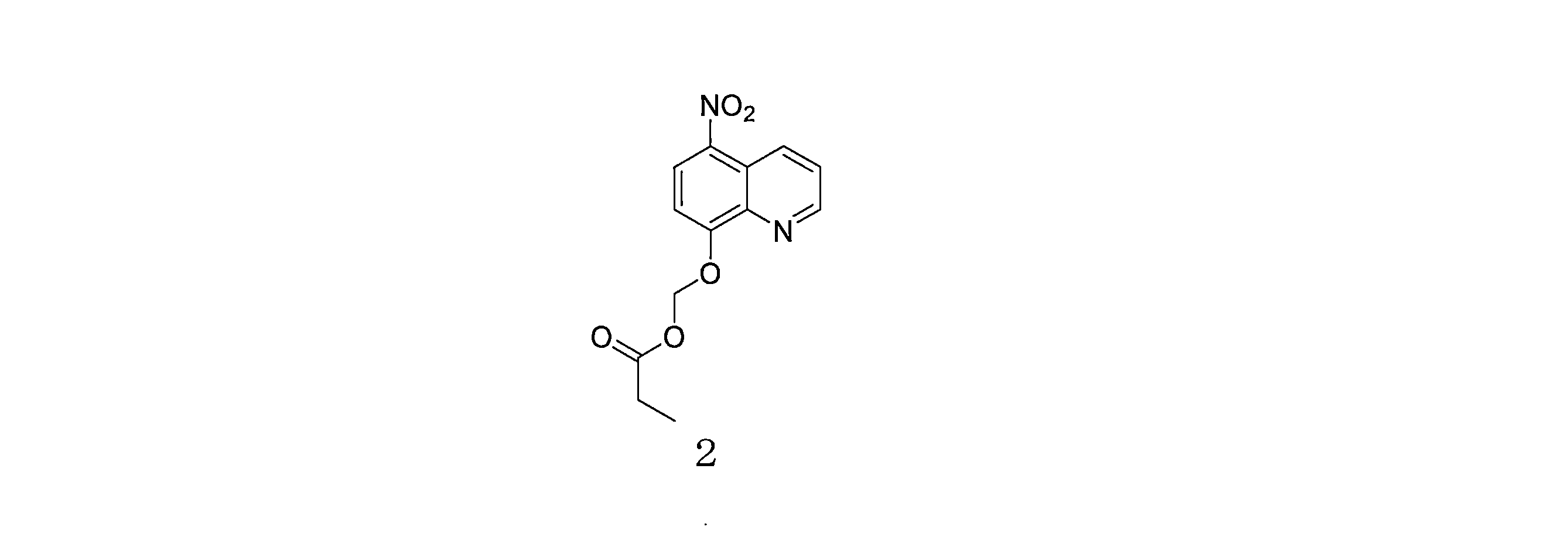
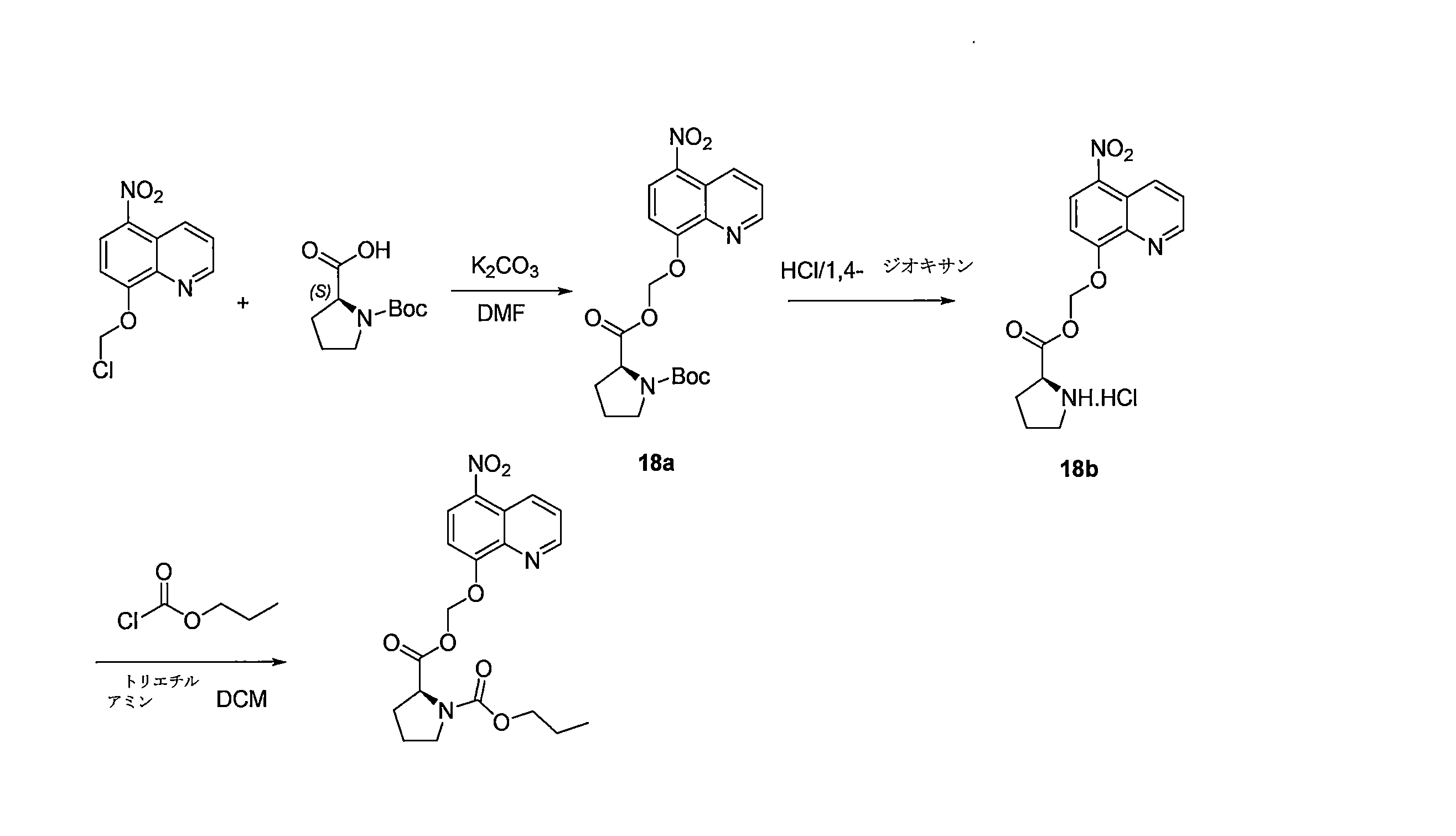
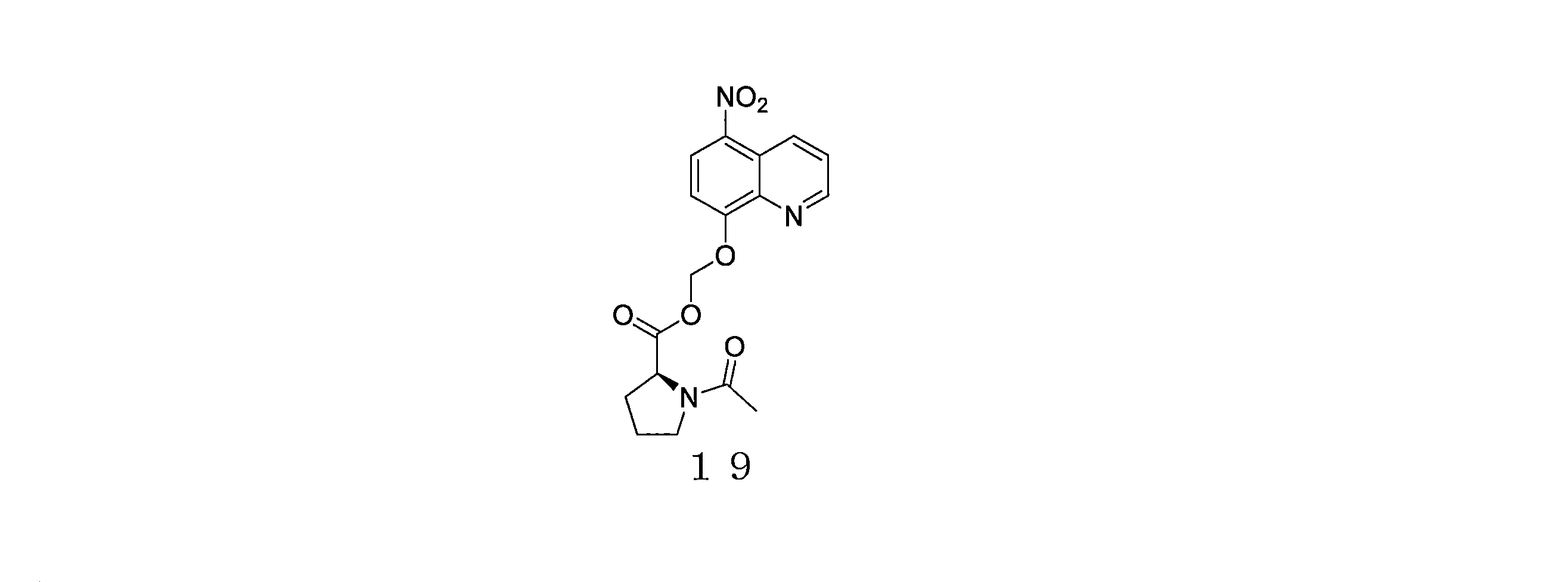
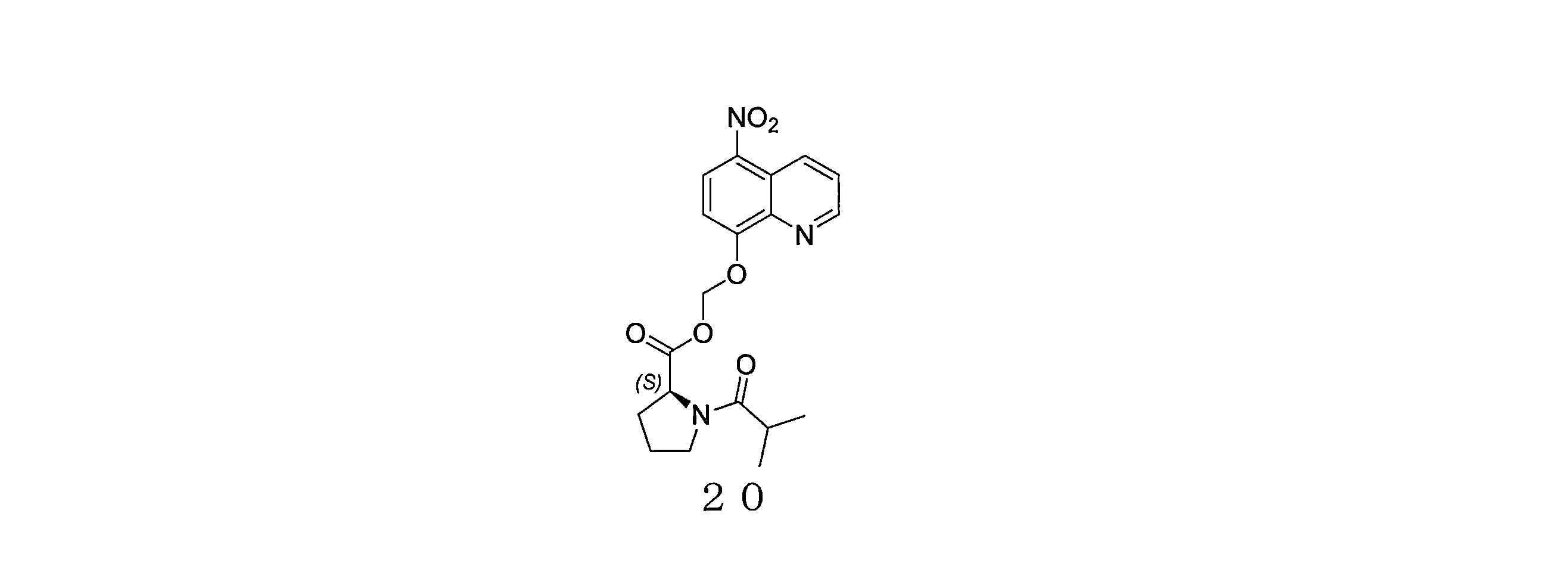
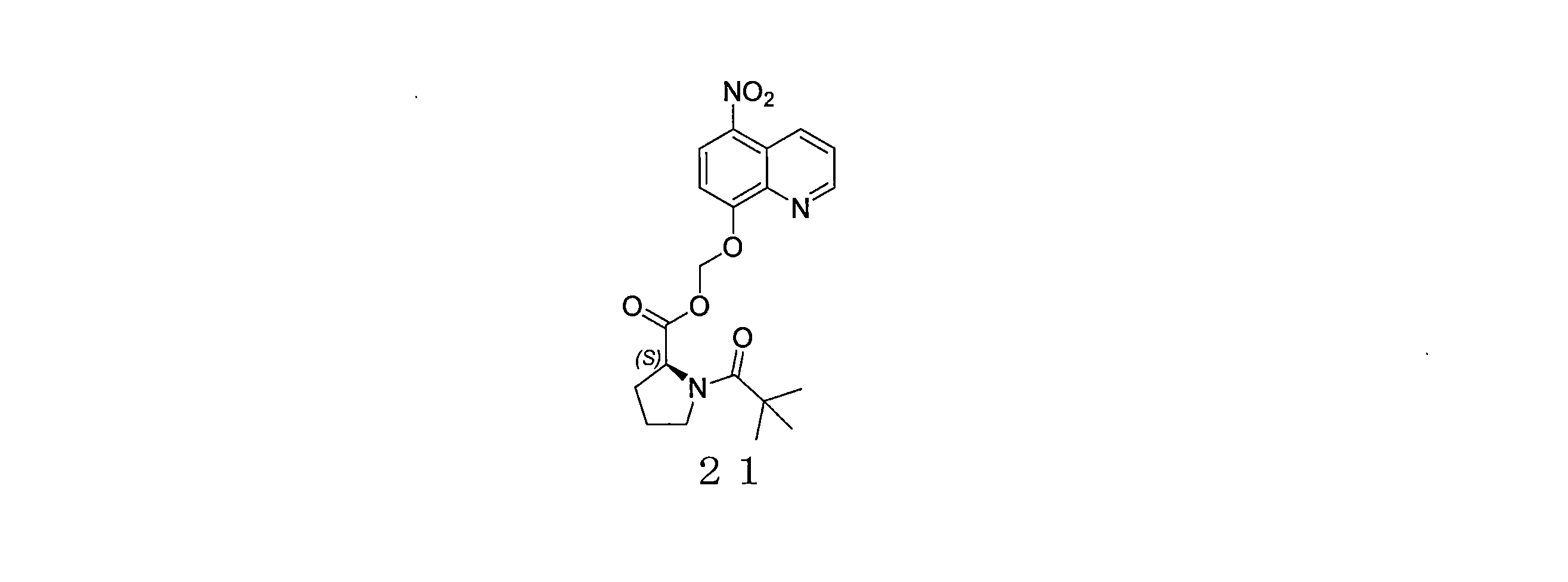
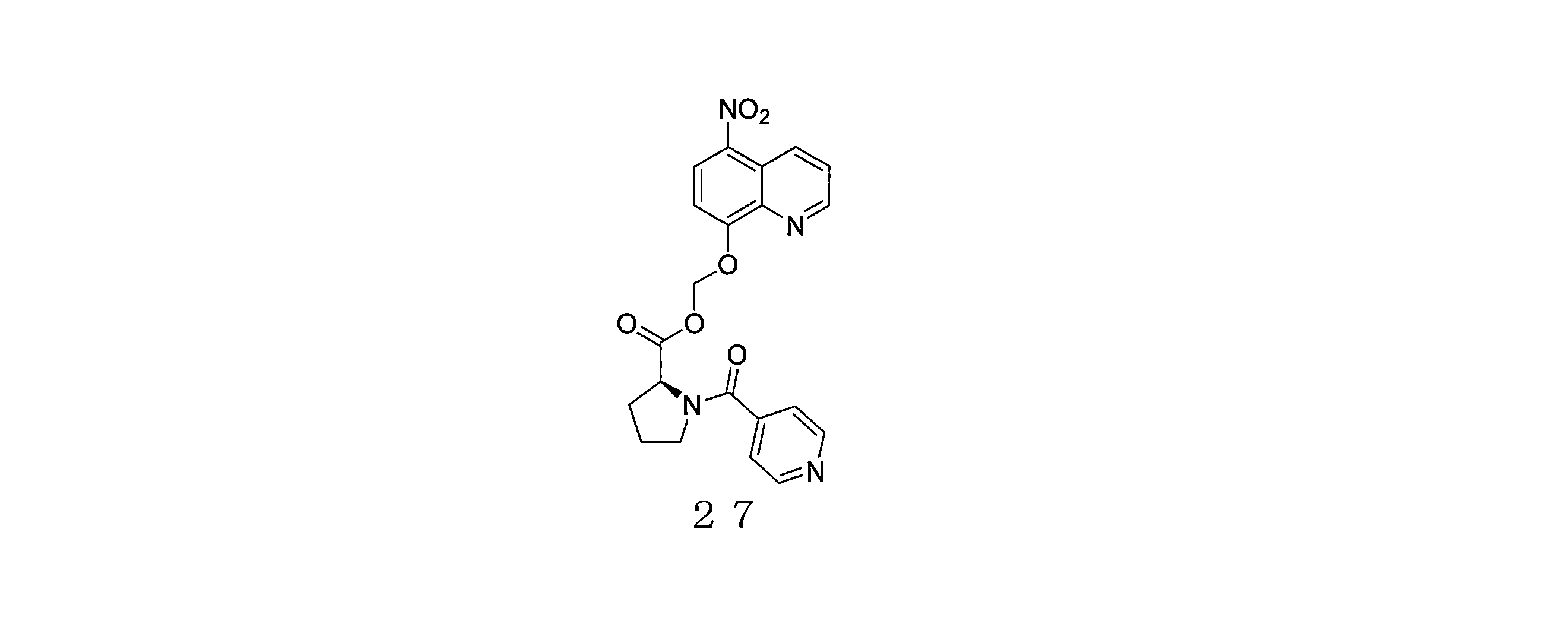
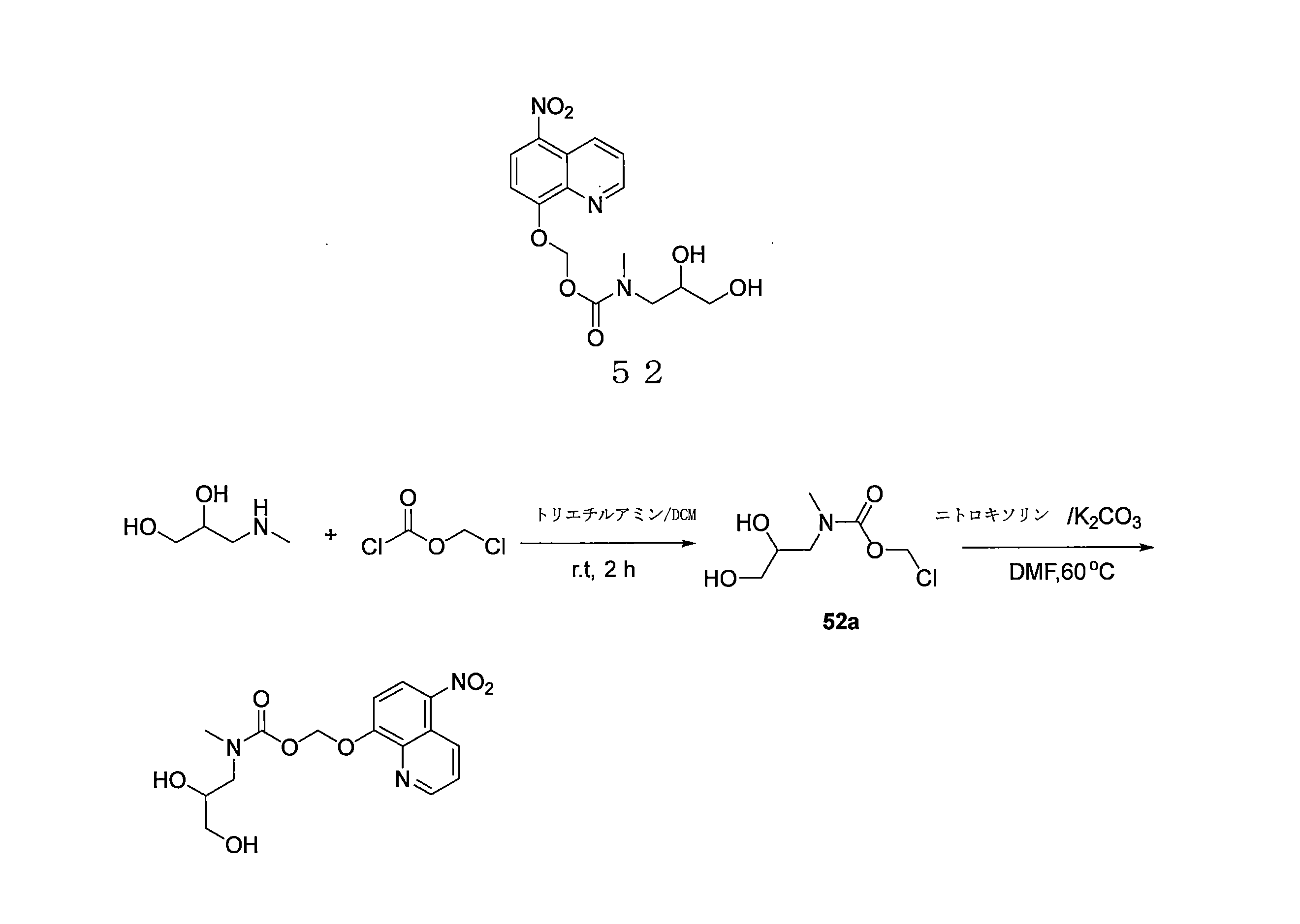
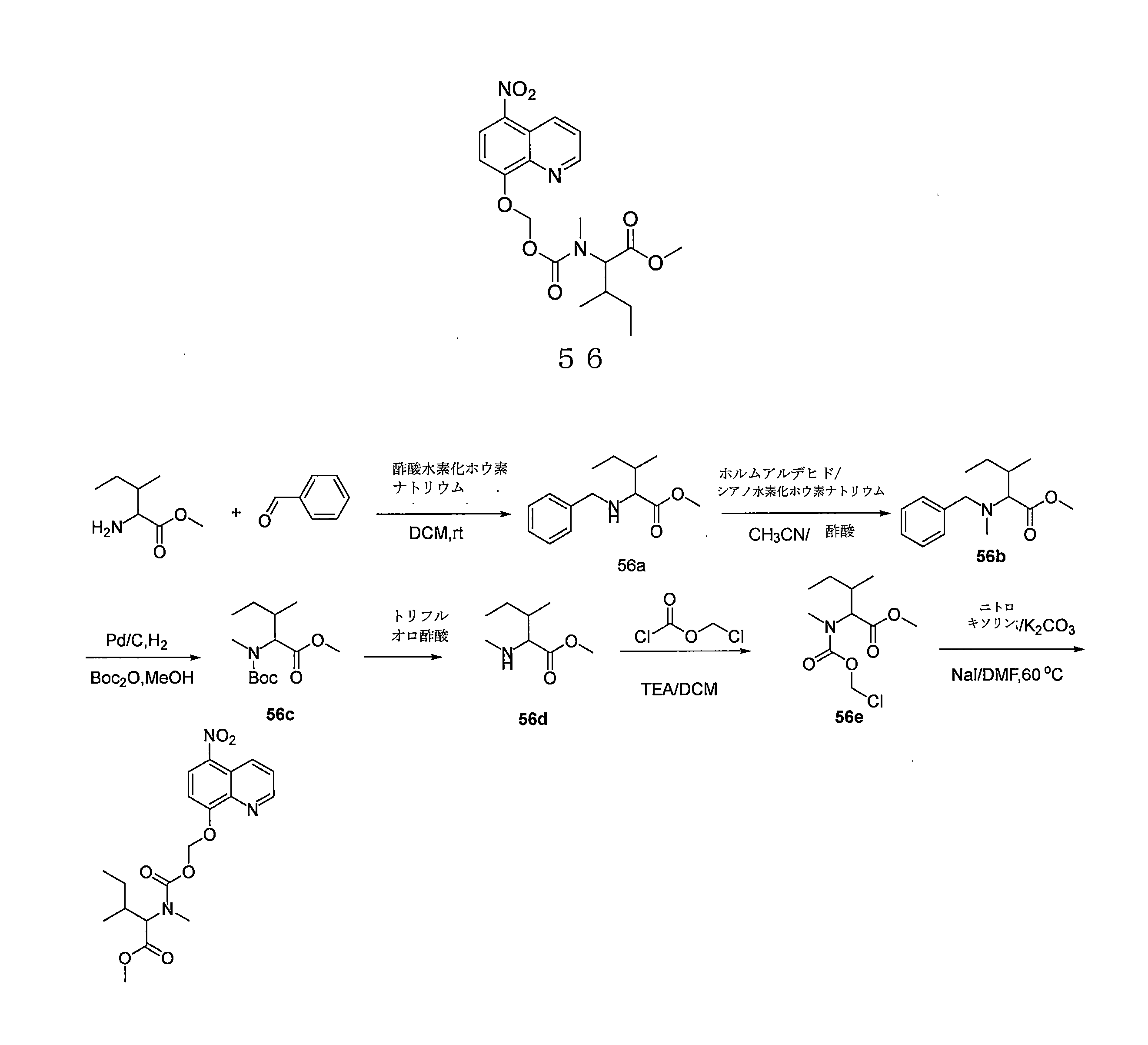
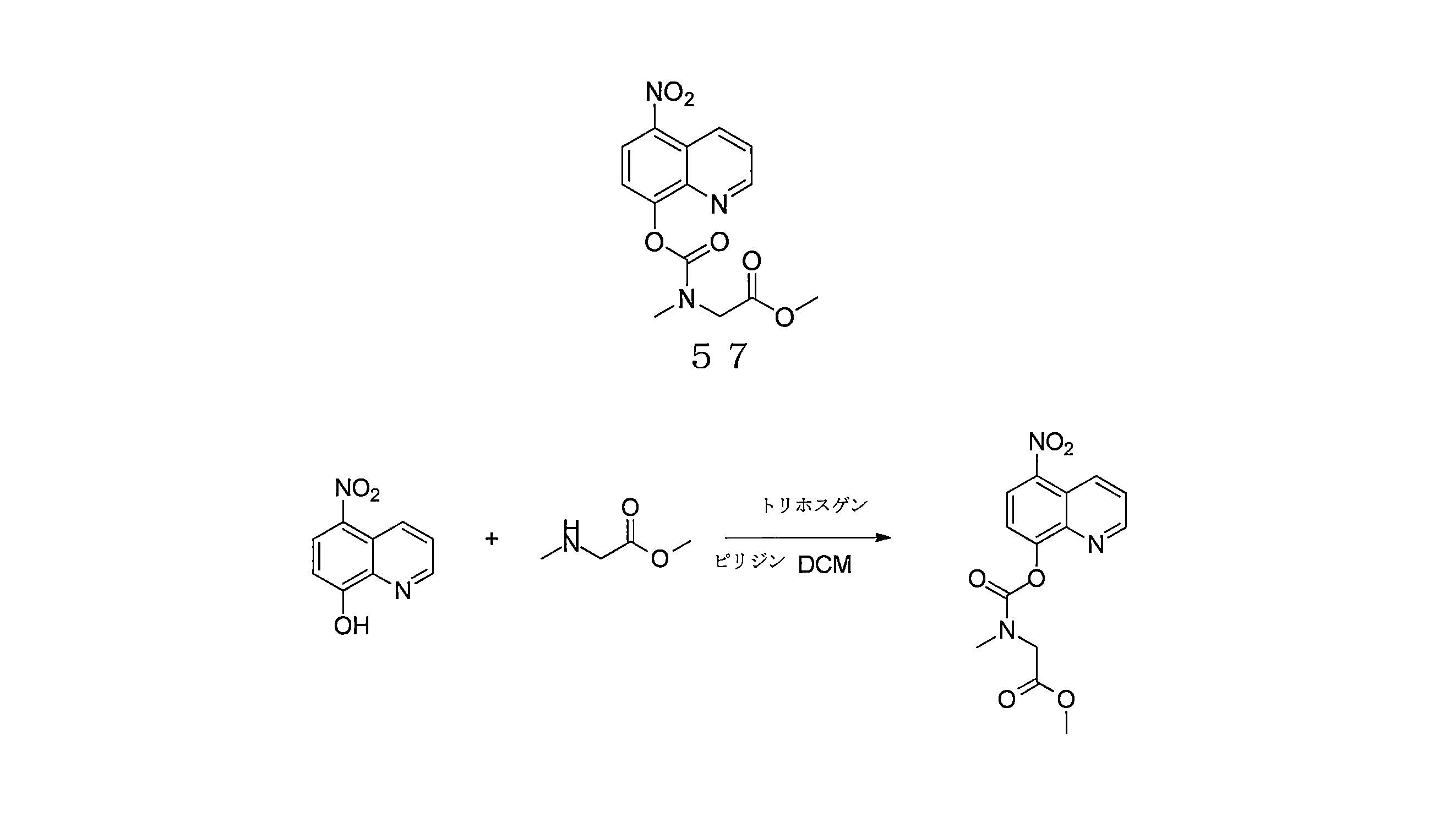
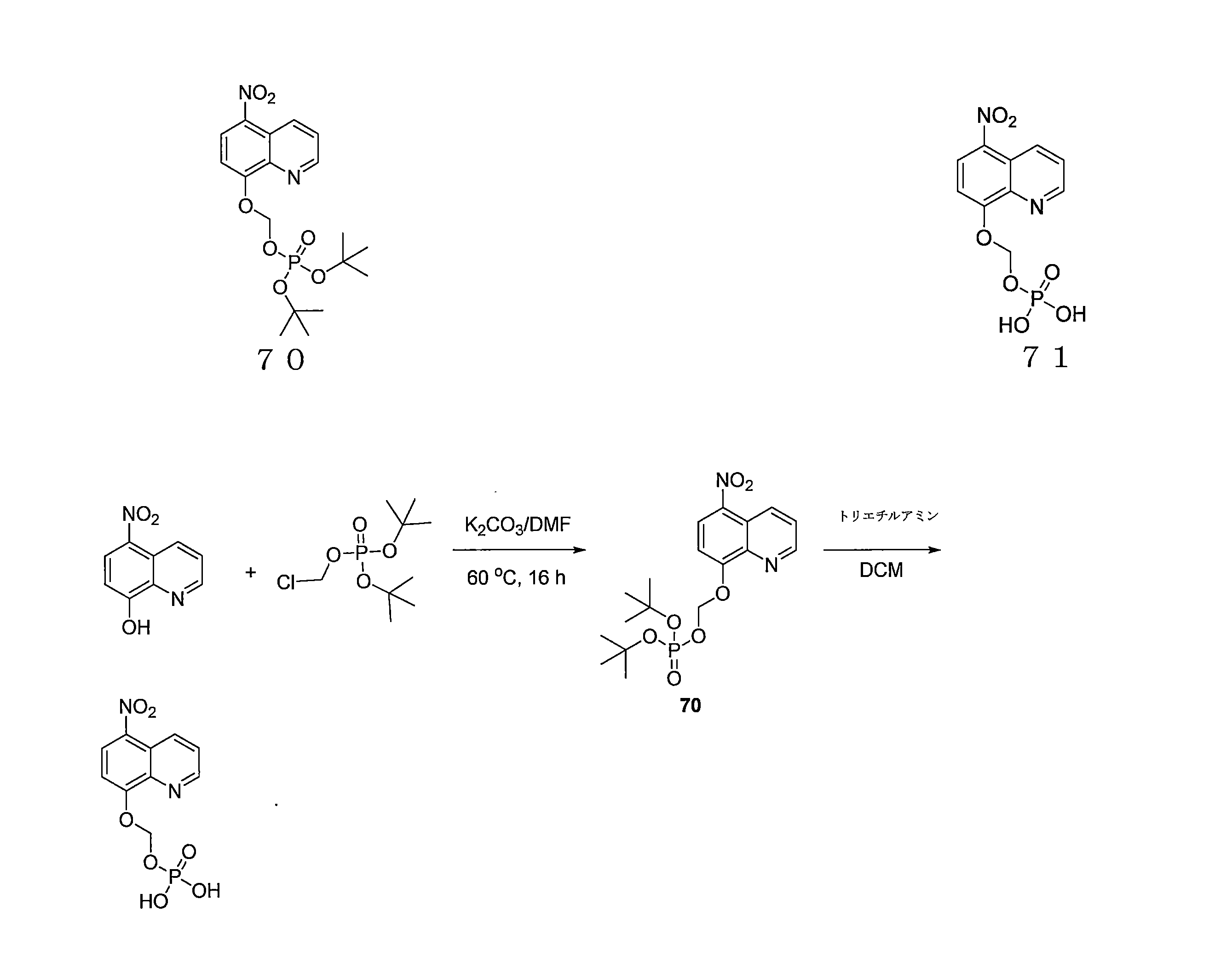
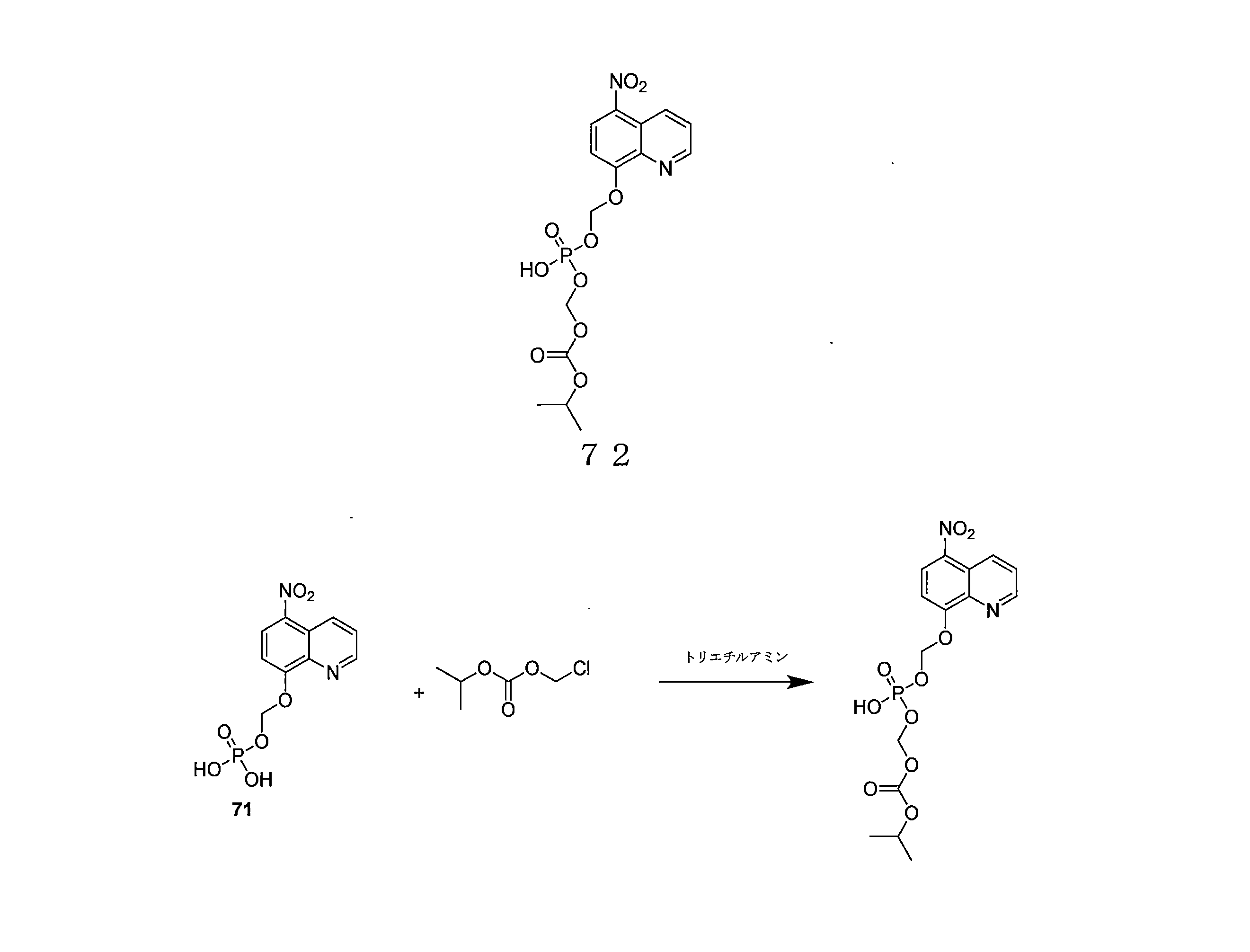
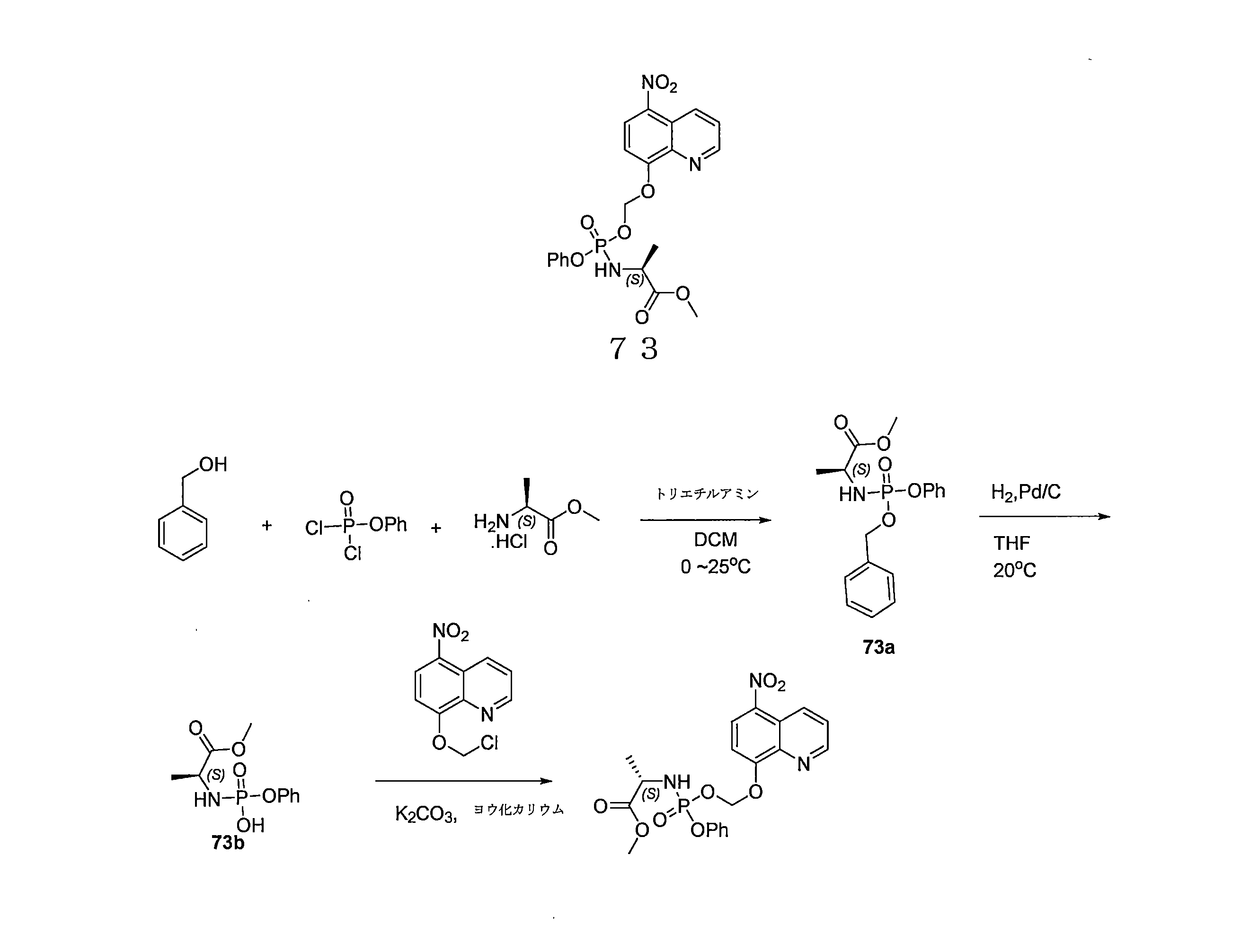
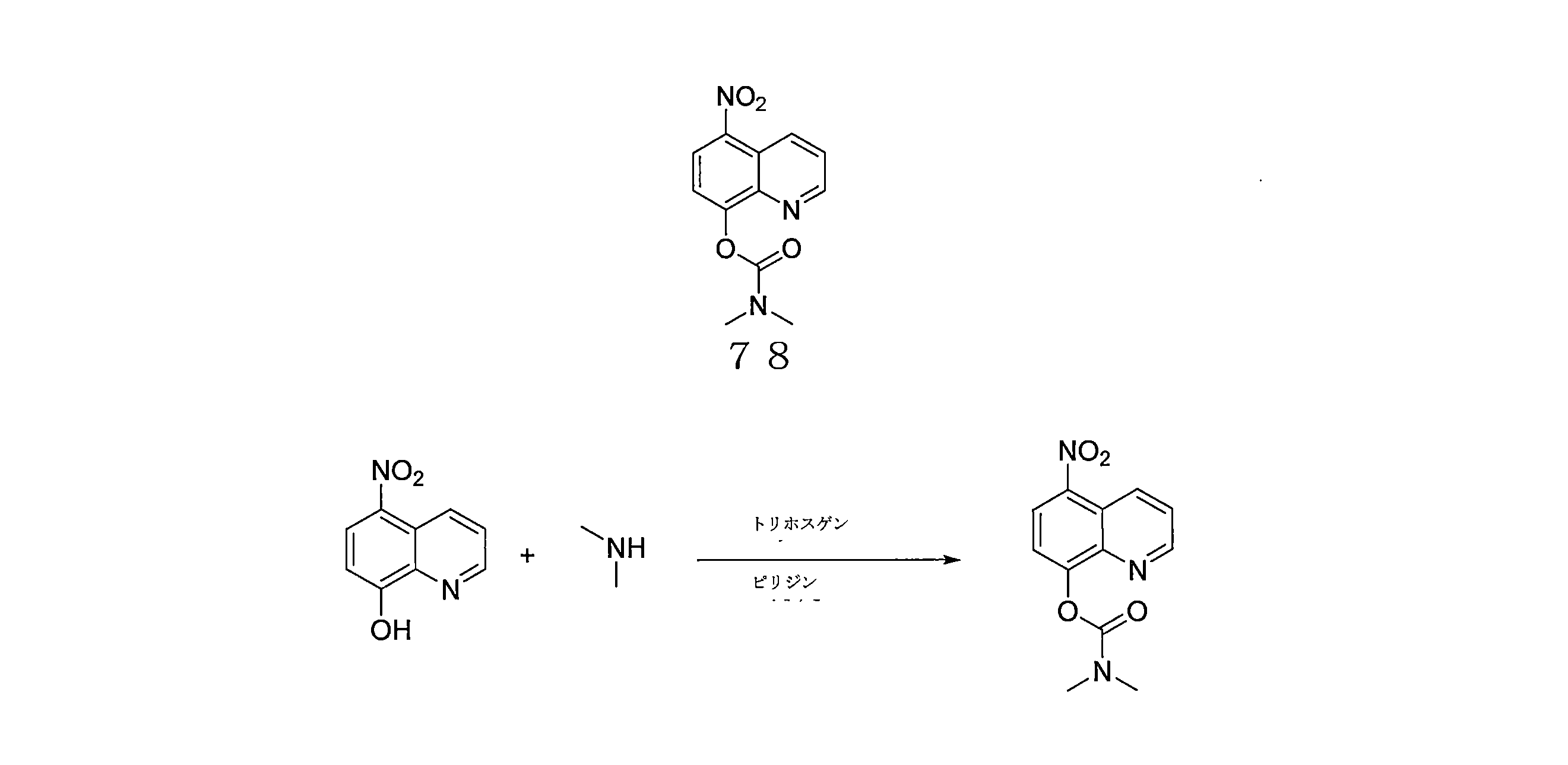
- QWBPYOCLSNWUMR-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl acetate Chemical compound C(C)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] QWBPYOCLSNWUMR-UHFFFAOYSA-N 0.000 description 7
- WJVRWIKHODGFDT-UHFFFAOYSA-N OCCN(C(OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])=O)C Chemical compound OCCN(C(OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])=O)C WJVRWIKHODGFDT-UHFFFAOYSA-N 0.000 description 7
- 239000004698 Polyethylene Substances 0.000 description 7
- 150000002148 esters Chemical class 0.000 description 7
- FJWLWIRHZOHPIY-UHFFFAOYSA-N potassium;hydroiodide Chemical compound [K].I FJWLWIRHZOHPIY-UHFFFAOYSA-N 0.000 description 7
- 239000012224 working solution Substances 0.000 description 7
- JHQHQZPTPIXPEF-LBPRGKRZSA-N (5-nitroquinolin-8-yl)oxymethyl (2R)-2-acetamido-3-methylsulfanylpropanoate Chemical compound C(C)(=O)N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CSC JHQHQZPTPIXPEF-LBPRGKRZSA-N 0.000 description 6
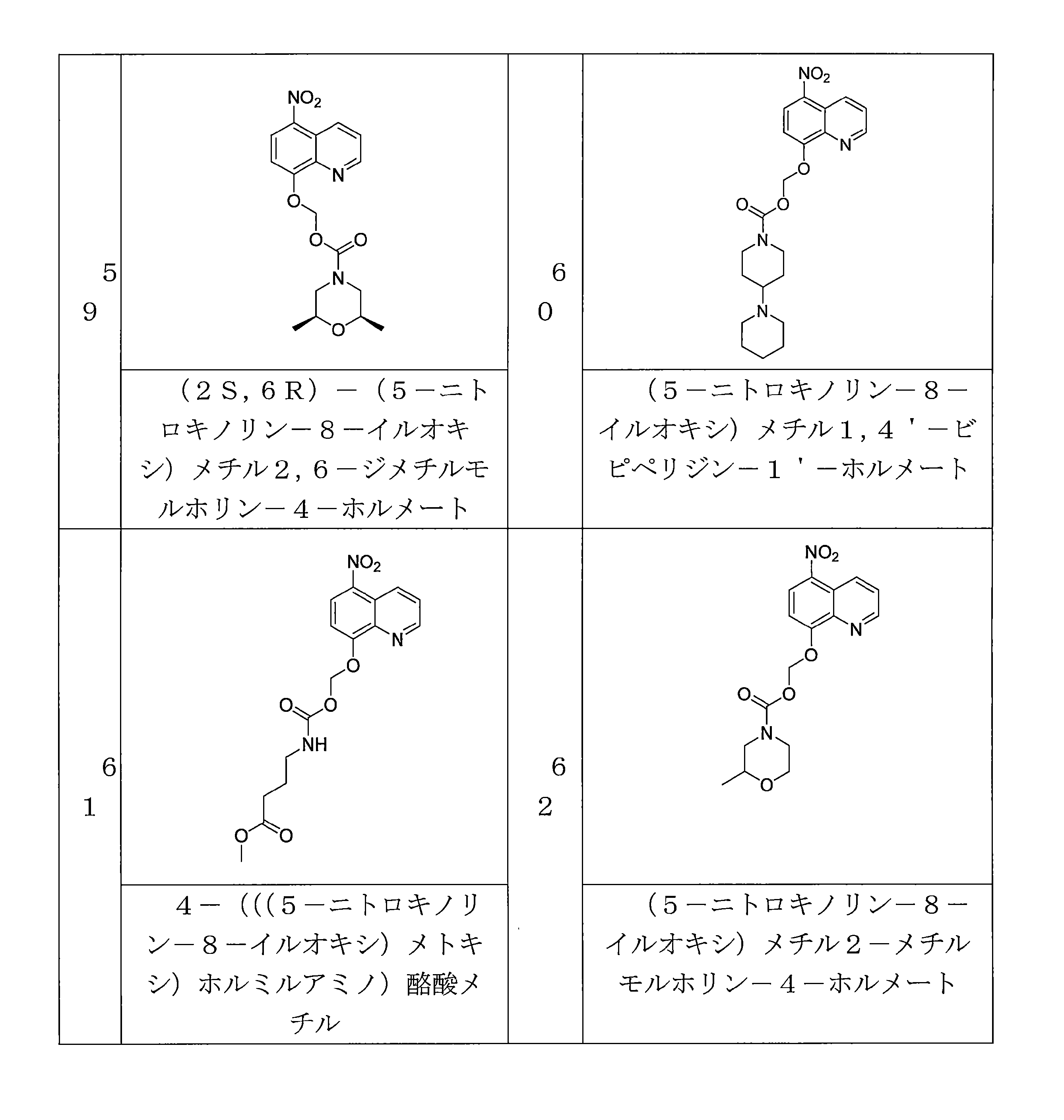
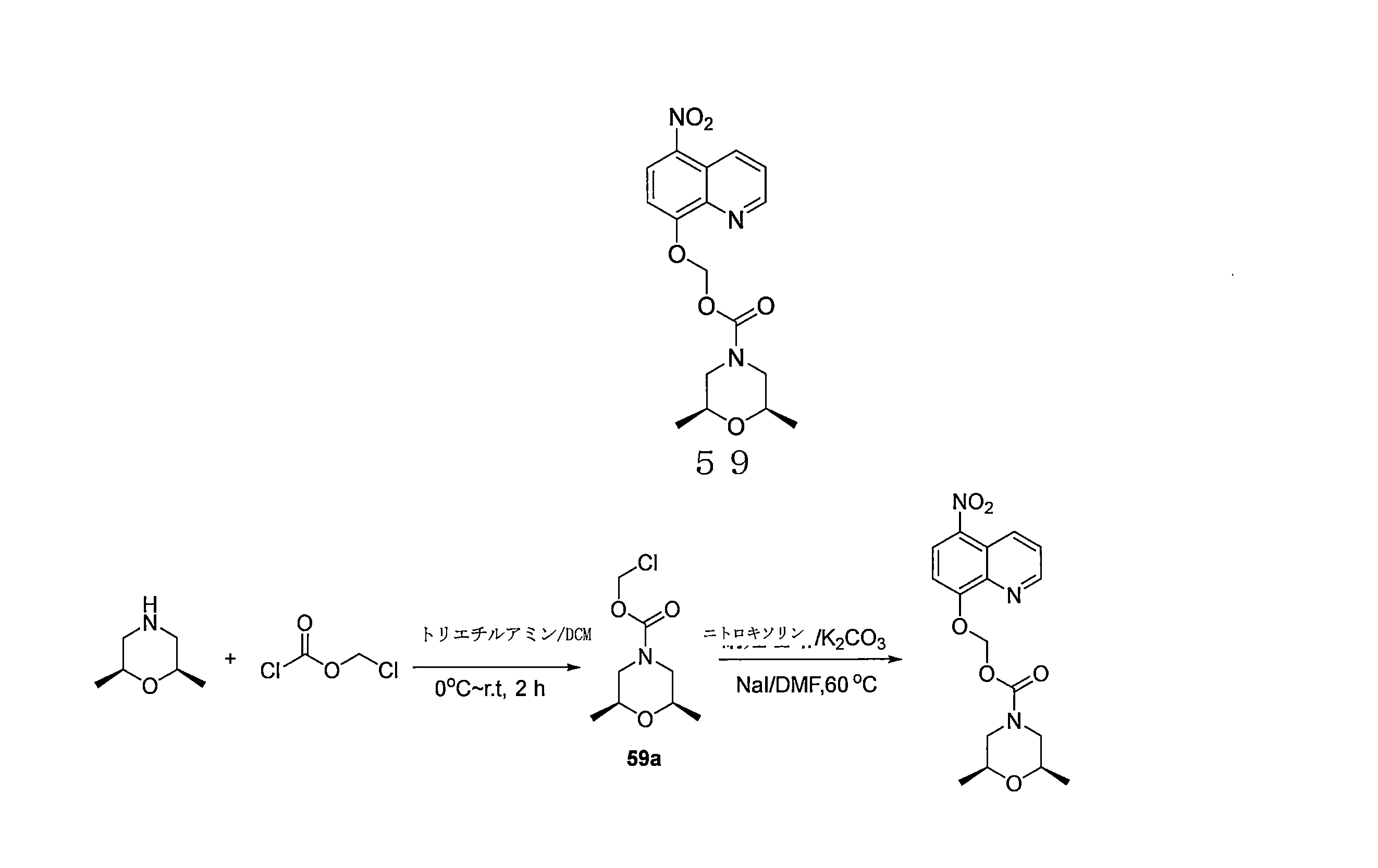
- OGZNJZZZKKJPCY-TXEJJXNPSA-N (5-nitroquinolin-8-yl)oxymethyl (2R,6S)-2,6-dimethylmorpholine-4-carboxylate Chemical compound C[C@H]1CN(C[C@H](O1)C)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] OGZNJZZZKKJPCY-TXEJJXNPSA-N 0.000 description 6
- CWDNLKPJWHRHFG-HNNXBMFYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-[[(2S)-2-acetamido-4-methylpentanoyl]amino]acetate Chemical compound C(C)(=O)N[C@H](C(=O)NCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(C)C CWDNLKPJWHRHFG-HNNXBMFYSA-N 0.000 description 6
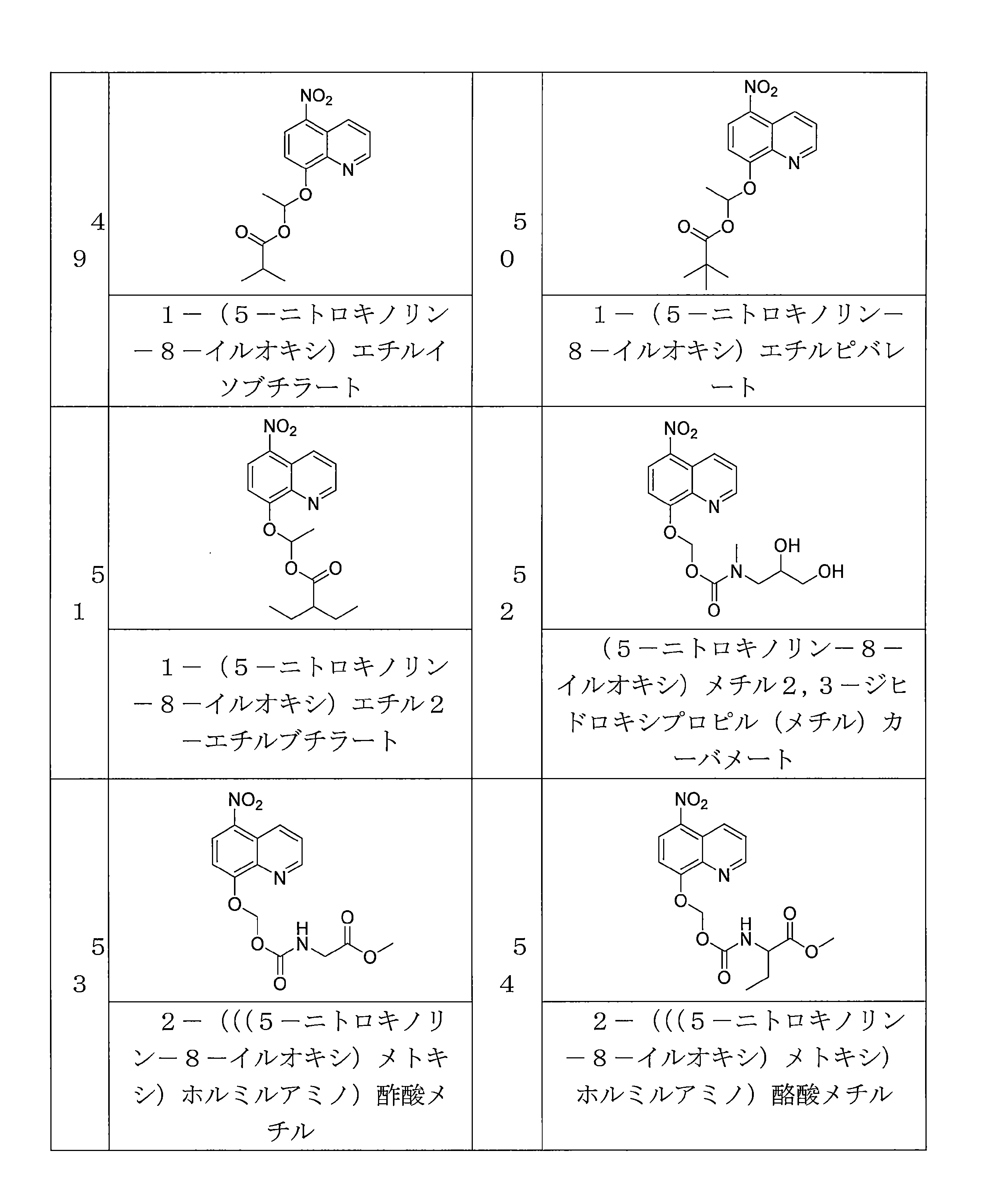
- NUQHYMANDKTZJC-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-methylpropanoate Chemical compound C(C(C)C)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] NUQHYMANDKTZJC-UHFFFAOYSA-N 0.000 description 6
- YUTHGMKIMNYVQJ-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl N-(2,3-dihydroxypropyl)-N-methylcarbamate Chemical compound OC(CN(C(OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])=O)C)CO YUTHGMKIMNYVQJ-UHFFFAOYSA-N 0.000 description 6
- VAQCXGOVNWWRHF-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl propanoate Chemical compound C(CC)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] VAQCXGOVNWWRHF-UHFFFAOYSA-N 0.000 description 6
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 6
- KRBLVJYUMIJYGA-UHFFFAOYSA-N 1-(5-nitroquinolin-8-yl)oxyethyl acetate Chemical compound C(C)(=O)OC(C)OC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] KRBLVJYUMIJYGA-UHFFFAOYSA-N 0.000 description 6
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 6
- LFQNPDUISWHMMJ-UHFFFAOYSA-N 3-[methyl-[(5-nitroquinolin-8-yl)oxymethoxycarbonyl]amino]propyl acetate Chemical compound C(C)(=O)OCCCN(C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])C LFQNPDUISWHMMJ-UHFFFAOYSA-N 0.000 description 6
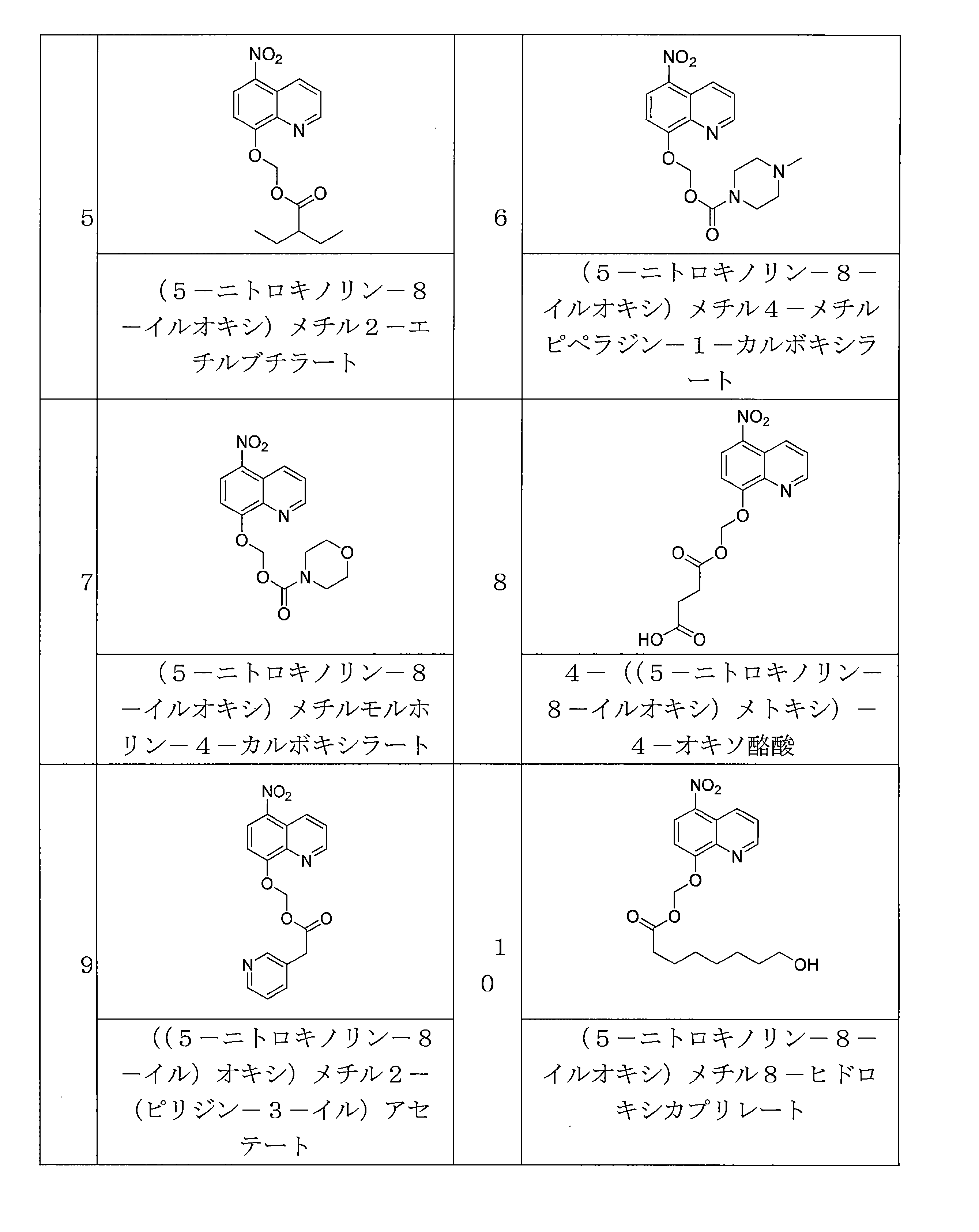
- WJHHFTCBUNHMSX-UHFFFAOYSA-N 4-[(5-nitroquinolin-8-yl)oxymethoxy]-4-oxobutanoic acid Chemical compound [N+](=O)([O-])C1=C2C=CC=NC2=C(C=C1)OCOC(CCC(=O)O)=O WJHHFTCBUNHMSX-UHFFFAOYSA-N 0.000 description 6
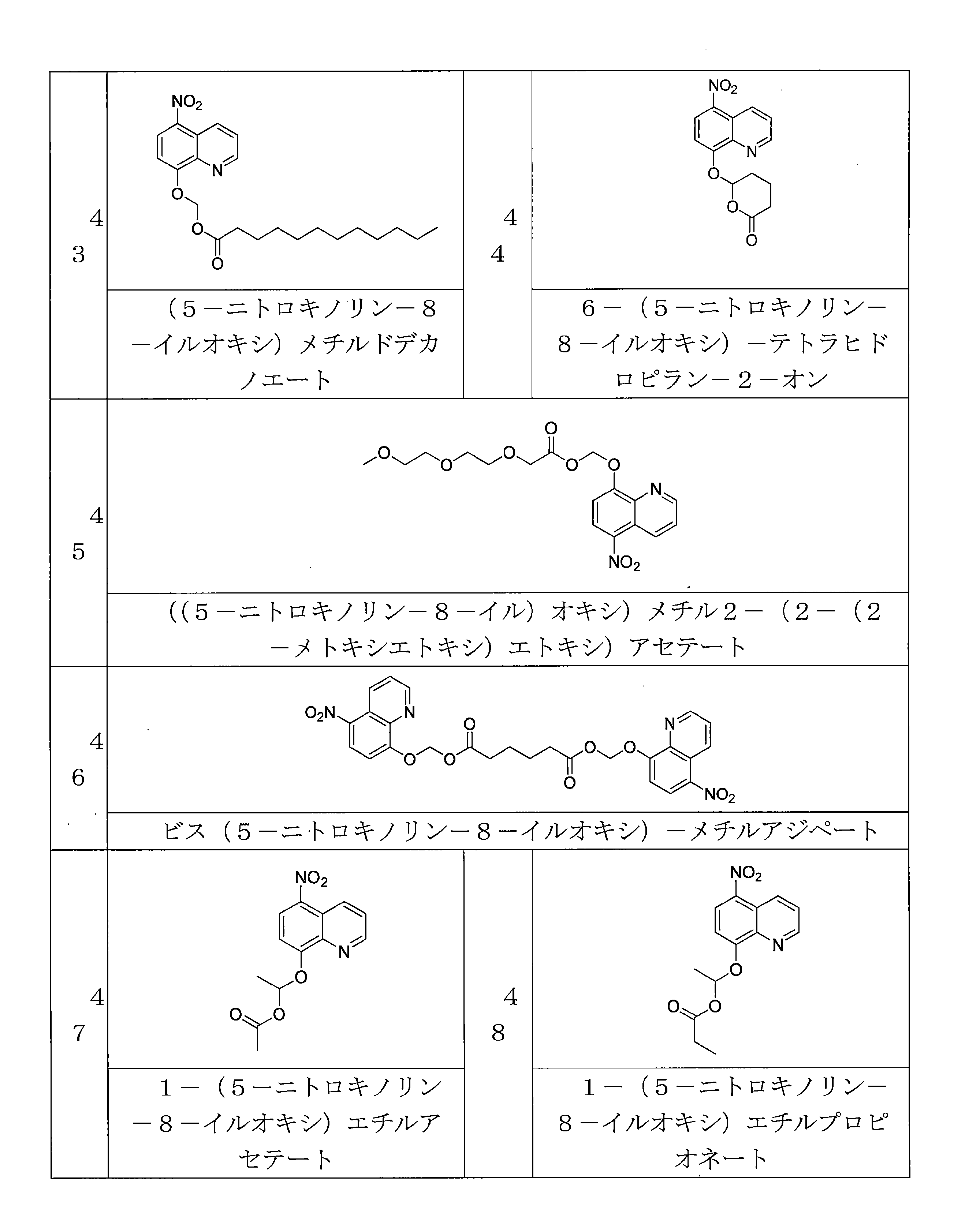
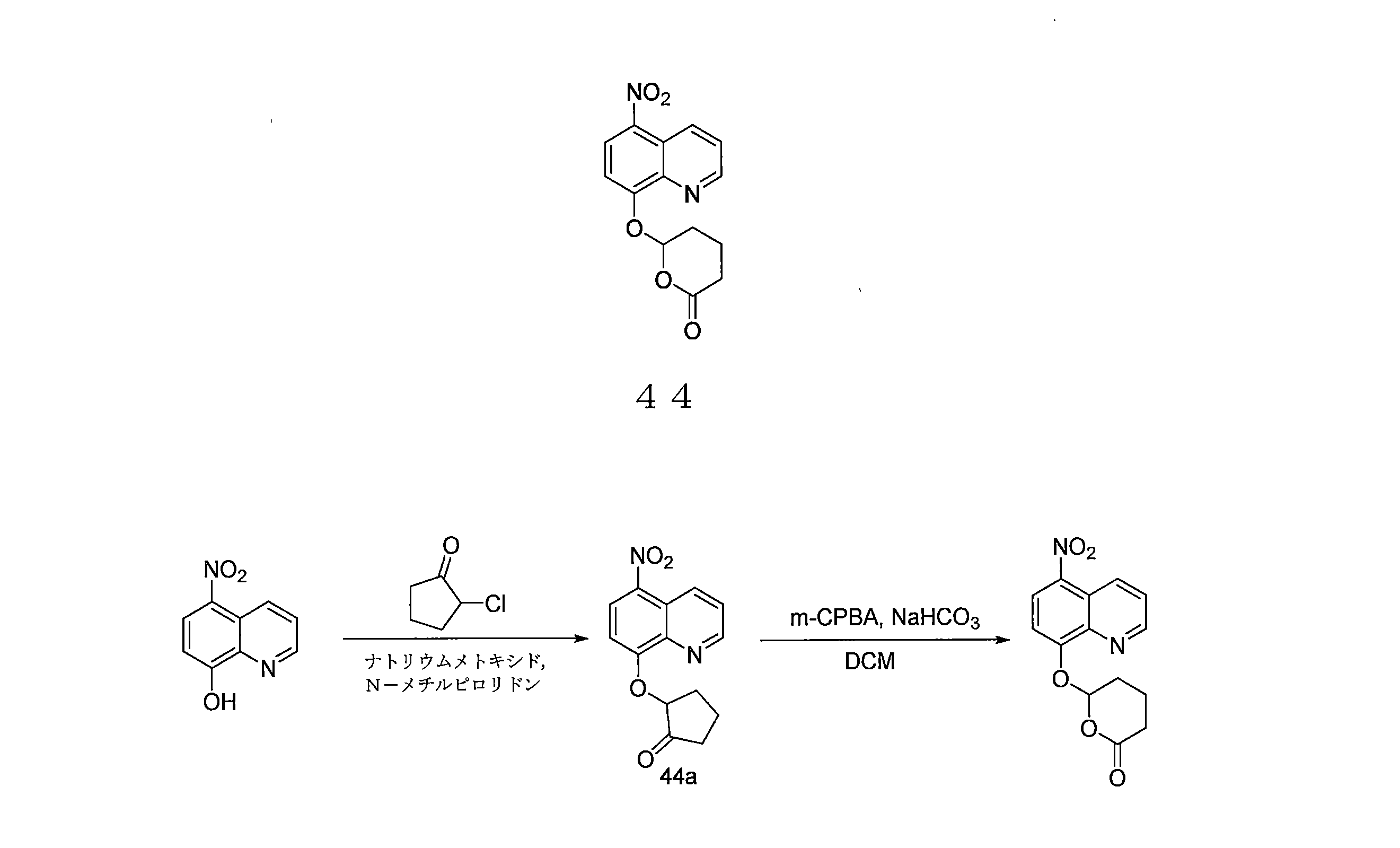
- JLYHUIVRPCLHJB-UHFFFAOYSA-N 6-(5-nitroquinolin-8-yl)oxyoxan-2-one Chemical compound [N+](=O)([O-])C1=C2C=CC=NC2=C(C=C1)OC1CCCC(O1)=O JLYHUIVRPCLHJB-UHFFFAOYSA-N 0.000 description 6
- AEQCSVOAXHIABW-UHFFFAOYSA-N CN1CCN(CC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] Chemical compound CN1CCN(CC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] AEQCSVOAXHIABW-UHFFFAOYSA-N 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- 238000010171 animal model Methods 0.000 description 6
- 239000007900 aqueous suspension Substances 0.000 description 6
- 239000012043 crude product Substances 0.000 description 6
- 235000014113 dietary fatty acids Nutrition 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 229930195729 fatty acid Natural products 0.000 description 6
- 239000000194 fatty acid Substances 0.000 description 6
- 230000000670 limiting effect Effects 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
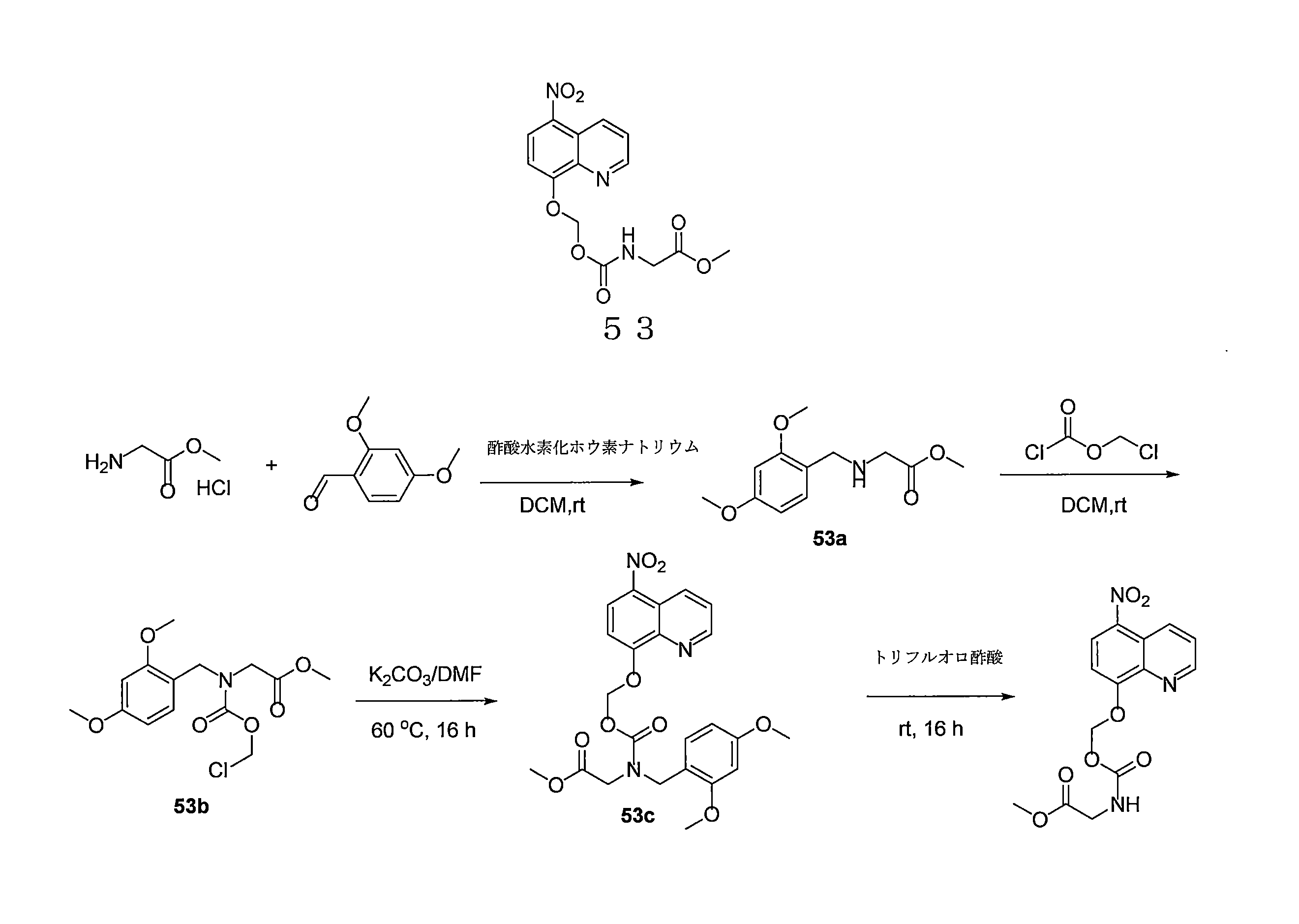
- AXFYZNJPRURHND-UHFFFAOYSA-N methyl 2-[(5-nitroquinolin-8-yl)oxymethoxycarbonylamino]acetate Chemical compound [N+](=O)([O-])C1=C2C=CC=NC2=C(C=C1)OCOC(=O)NCC(=O)OC AXFYZNJPRURHND-UHFFFAOYSA-N 0.000 description 6
- NHUKUPXSMWYYRG-UHFFFAOYSA-N methyl 3-methyl-2-[methyl-[(5-nitroquinolin-8-yl)oxymethoxycarbonyl]amino]pentanoate Chemical compound CC(C(C(=O)OC)N(C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])C)CC NHUKUPXSMWYYRG-UHFFFAOYSA-N 0.000 description 6
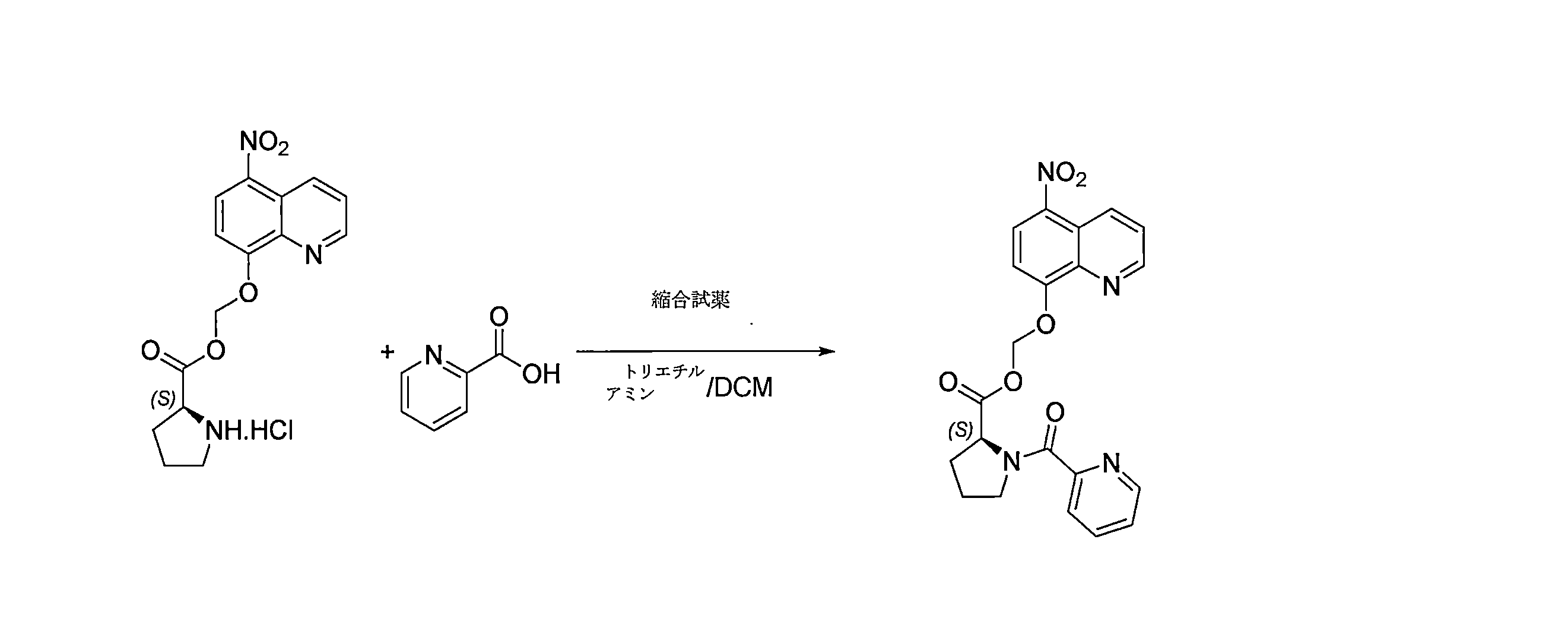
- SIOXPEMLGUPBBT-UHFFFAOYSA-N picolinic acid Chemical compound OC(=O)C1=CC=CC=N1 SIOXPEMLGUPBBT-UHFFFAOYSA-N 0.000 description 6
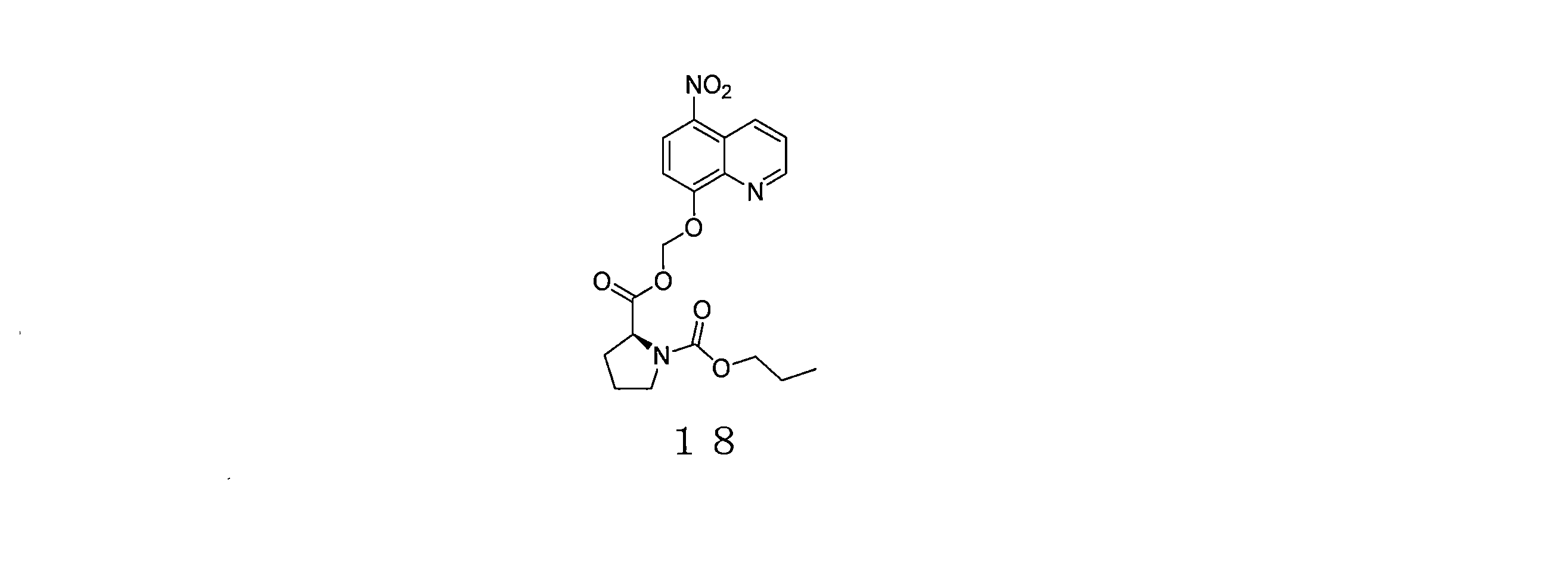
- QQKDTTWZXHEGAQ-UHFFFAOYSA-N propyl carbonochloridate Chemical compound CCCOC(Cl)=O QQKDTTWZXHEGAQ-UHFFFAOYSA-N 0.000 description 6
- 230000000171 quenching effect Effects 0.000 description 6
- 238000004007 reversed phase HPLC Methods 0.000 description 6
- 229910052717 sulfur Inorganic materials 0.000 description 6
- 239000003765 sweetening agent Substances 0.000 description 6
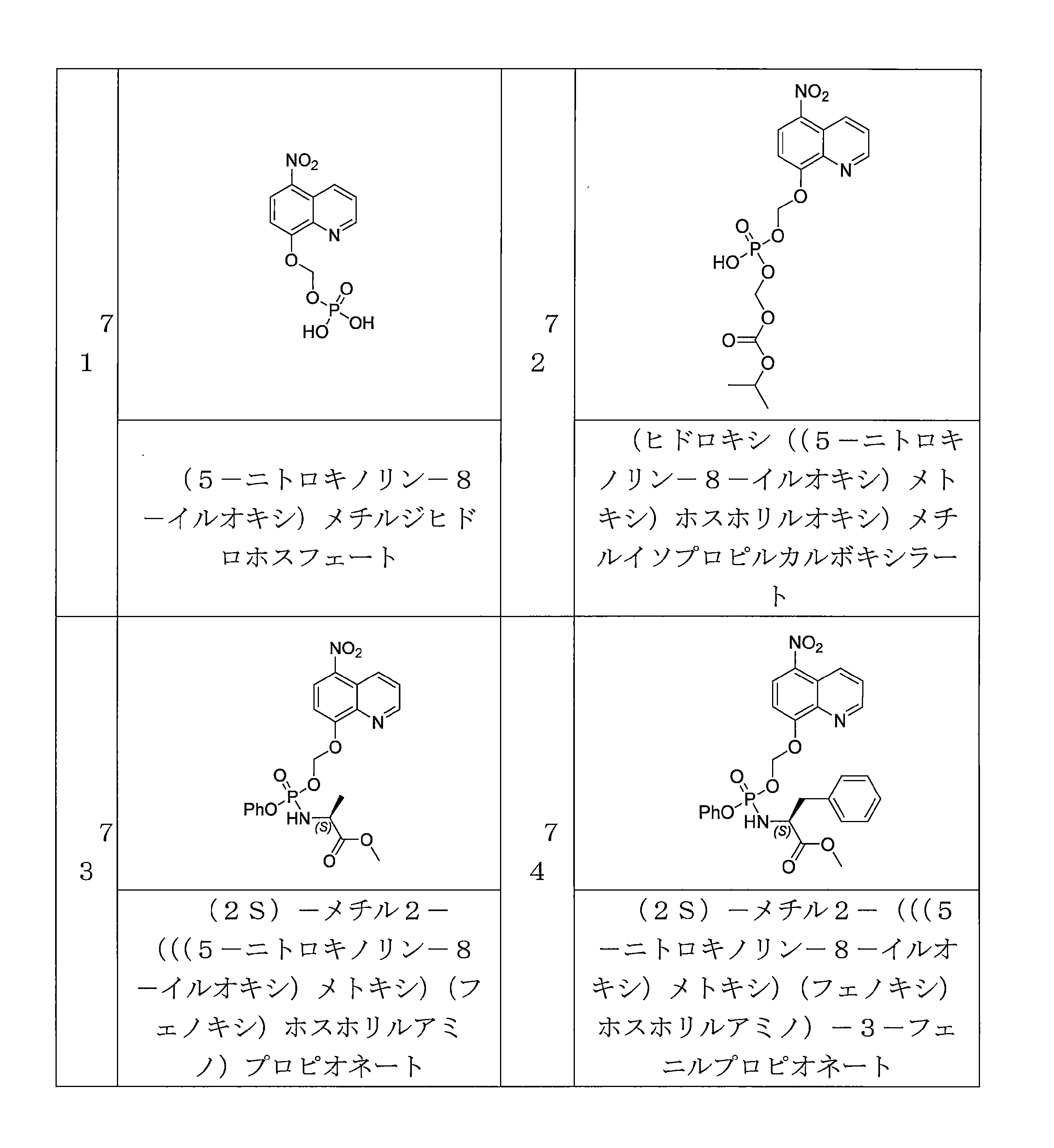
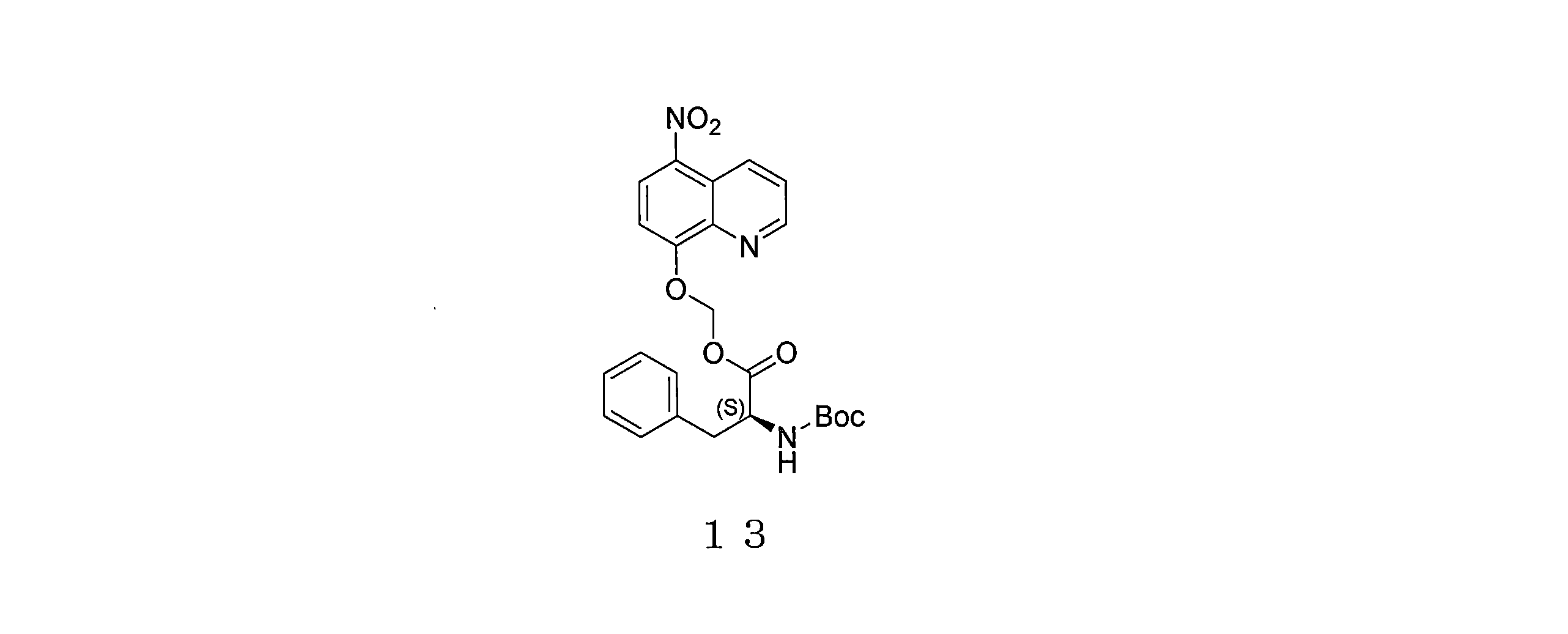
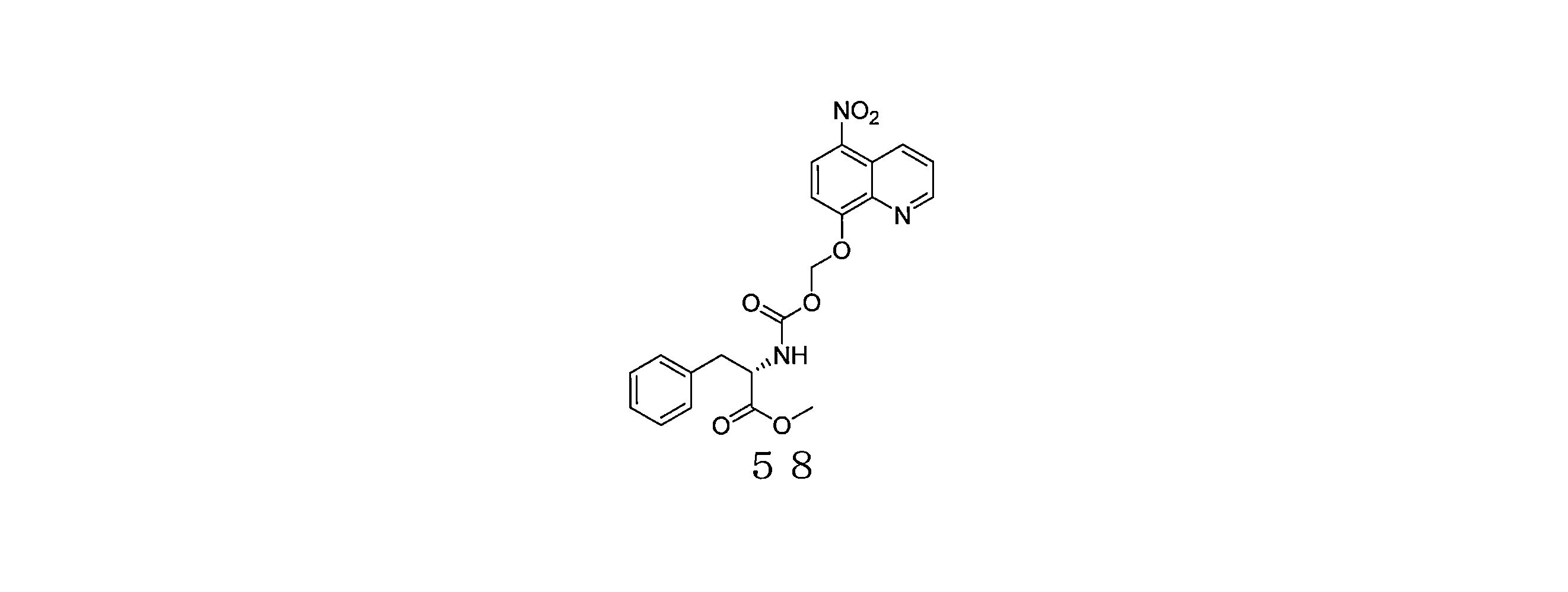
- TZKMXIIVWUAXGR-SFHVURJKSA-N (5-nitroquinolin-8-yl)oxymethyl (2S)-2-[(2-methylpropan-2-yl)oxycarbonylamino]-3-phenylpropanoate Chemical compound C(C)(C)(C)OC(=O)N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC1=CC=CC=C1 TZKMXIIVWUAXGR-SFHVURJKSA-N 0.000 description 5
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 5
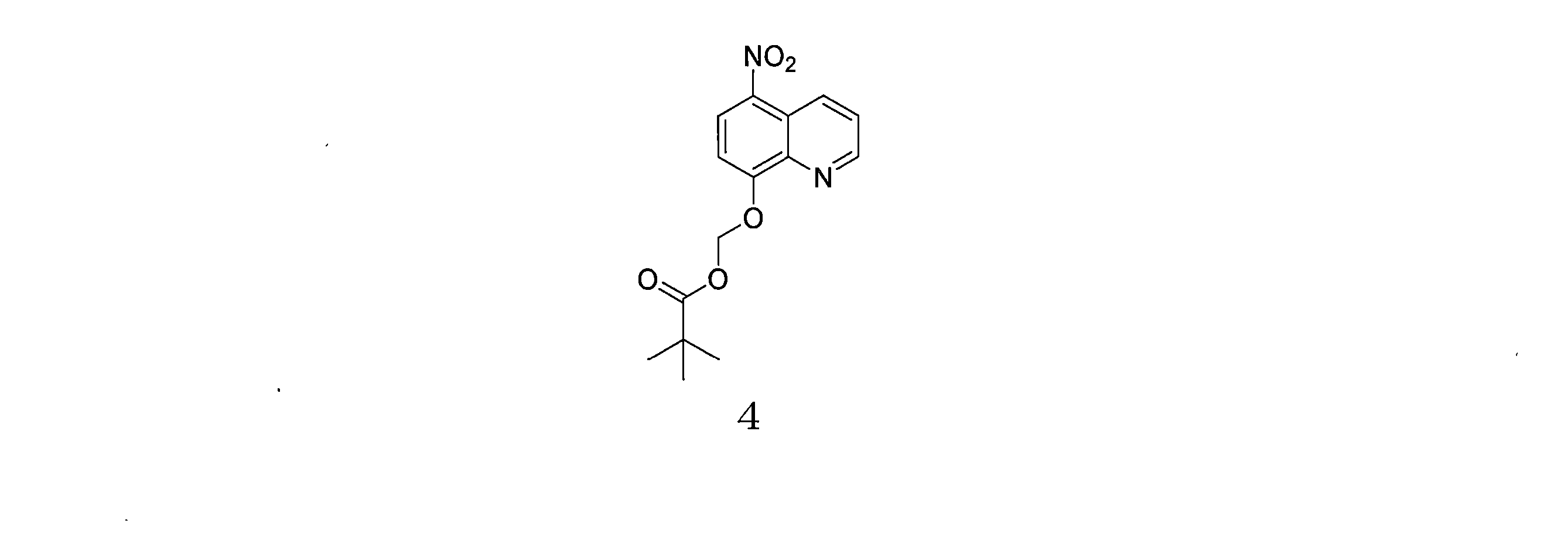
- DDKVMPBOESFNLA-UHFFFAOYSA-N C(C(C)(C)C)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] Chemical compound C(C(C)(C)C)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] DDKVMPBOESFNLA-UHFFFAOYSA-N 0.000 description 5
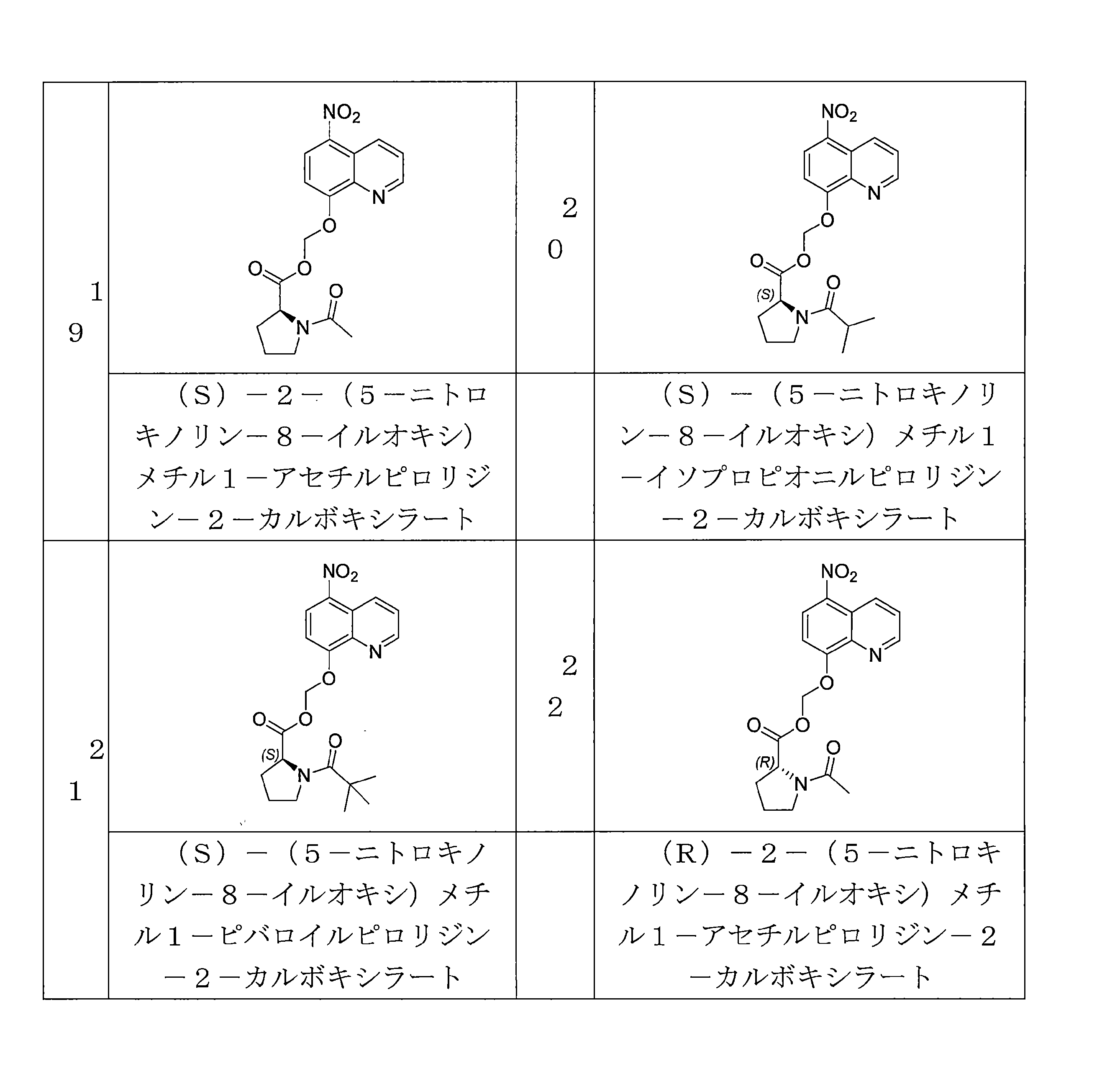
- ADRICTSLLVOARG-CQSZACIVSA-N C(C)(=O)N1[C@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] Chemical compound C(C)(=O)N1[C@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] ADRICTSLLVOARG-CQSZACIVSA-N 0.000 description 5
- 241000282472 Canis lupus familiaris Species 0.000 description 5
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 150000004665 fatty acids Chemical class 0.000 description 5
- 235000003599 food sweetener Nutrition 0.000 description 5
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 5
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 5
- COQRGFWWJBEXRC-UHFFFAOYSA-N hydron;methyl 2-aminoacetate;chloride Chemical compound Cl.COC(=O)CN COQRGFWWJBEXRC-UHFFFAOYSA-N 0.000 description 5
- BLWYXBNNBYXPPL-YFKPBYRVSA-N methyl (2s)-pyrrolidine-2-carboxylate Chemical compound COC(=O)[C@@H]1CCCN1 BLWYXBNNBYXPPL-YFKPBYRVSA-N 0.000 description 5
- 238000002156 mixing Methods 0.000 description 5
- 125000002950 monocyclic group Chemical group 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 235000019198 oils Nutrition 0.000 description 5
- 239000001301 oxygen Chemical group 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 238000004262 preparative liquid chromatography Methods 0.000 description 5
- 239000003755 preservative agent Substances 0.000 description 5
- 238000005070 sampling Methods 0.000 description 5
- 229920006395 saturated elastomer Polymers 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- PYVFYQFKWVQOOX-ZETCQYMHSA-N (2-hydroxyphenoxy)-[(2S)-1-methoxy-1-oxopropan-2-yl]imino-oxidophosphanium Chemical compound OC1=C(OP(=O)=N[C@H](C(=O)OC)C)C=CC=C1 PYVFYQFKWVQOOX-ZETCQYMHSA-N 0.000 description 4
- WTSLXGKYTSXEMQ-OAHLLOKOSA-N (5-nitroquinolin-8-yl)oxymethyl (2R)-1-(2,2-dimethylpropanoyl)pyrrolidine-2-carboxylate Chemical compound C(C(C)(C)C)(=O)N1[C@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] WTSLXGKYTSXEMQ-OAHLLOKOSA-N 0.000 description 4
- LGRZDKGIFYMOCS-ZDUSSCGKSA-N (5-nitroquinolin-8-yl)oxymethyl (2R)-2-[(2-methylpropan-2-yl)oxycarbonylamino]-3-methylsulfanylpropanoate Chemical compound C(C)(C)(C)OC(=O)N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CSC LGRZDKGIFYMOCS-ZDUSSCGKSA-N 0.000 description 4
- XMMYNSTZIVXLEC-JTQLQIEISA-N (5-nitroquinolin-8-yl)oxymethyl (2R)-2-amino-3-methylsulfanylpropanoate Chemical compound N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CSC XMMYNSTZIVXLEC-JTQLQIEISA-N 0.000 description 4
- LXTPHJQTYIDMLI-QGZVFWFLSA-N (5-nitroquinolin-8-yl)oxymethyl (2R)-2-hydroxy-2-phenylacetate Chemical compound O[C@@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])C1=CC=CC=C1 LXTPHJQTYIDMLI-QGZVFWFLSA-N 0.000 description 4
- WTSLXGKYTSXEMQ-HNNXBMFYSA-N (5-nitroquinolin-8-yl)oxymethyl (2S)-1-(2,2-dimethylpropanoyl)pyrrolidine-2-carboxylate Chemical compound C(C(C)(C)C)(=O)N1[C@@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] WTSLXGKYTSXEMQ-HNNXBMFYSA-N 0.000 description 4
- KXAKYOLRUIJBNW-KRWDZBQOSA-N (5-nitroquinolin-8-yl)oxymethyl (2S)-1-(pyridine-2-carbonyl)pyrrolidine-2-carboxylate Chemical compound N1=C(C=CC=C1)C(=O)N1[C@@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] KXAKYOLRUIJBNW-KRWDZBQOSA-N 0.000 description 4
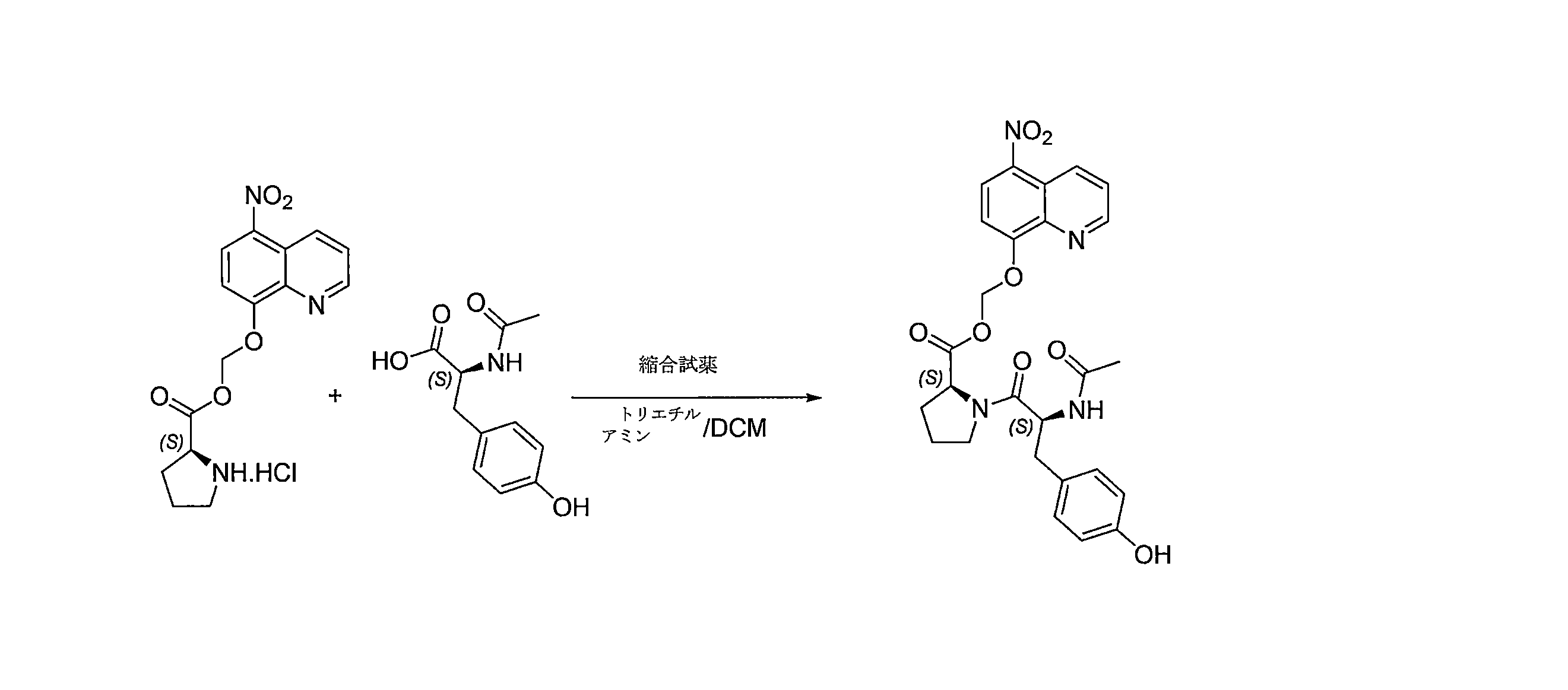
- BZZRCRYKUVDZSC-UNMCSNQZSA-N (5-nitroquinolin-8-yl)oxymethyl (2S)-1-[(2S)-2-acetamido-3-(4-hydroxyphenyl)propanoyl]pyrrolidine-2-carboxylate Chemical compound C(C)(=O)N[C@H](C(=O)N1[C@@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC1=CC=C(C=C1)O BZZRCRYKUVDZSC-UNMCSNQZSA-N 0.000 description 4
- VSZBSFODPYXPAI-HOCLYGCPSA-N (5-nitroquinolin-8-yl)oxymethyl (2S)-1-[(2S)-2-acetamido-3-hydroxypropanoyl]pyrrolidine-2-carboxylate Chemical compound C(C)(=O)N[C@H](C(=O)N1[C@@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CO VSZBSFODPYXPAI-HOCLYGCPSA-N 0.000 description 4
- DVOSNHJOTNFQLR-LJHODMEESA-N (5-nitroquinolin-8-yl)oxymethyl (2S)-1-[(2S,3R)-3-hydroxy-2-[(2-methylpropan-2-yl)oxycarbonylamino]butanoyl]pyrrolidine-2-carboxylate Chemical compound C(C)(C)(C)OC(=O)N[C@H](C(=O)N1[C@@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])[C@@H](C)O DVOSNHJOTNFQLR-LJHODMEESA-N 0.000 description 4
- LXTPHJQTYIDMLI-KRWDZBQOSA-N (5-nitroquinolin-8-yl)oxymethyl (2S)-2-hydroxy-2-phenylacetate Chemical compound O[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])C1=CC=CC=C1 LXTPHJQTYIDMLI-KRWDZBQOSA-N 0.000 description 4
- ZFXJSDQQRZMPRY-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-(2,4-dichlorophenoxy)acetate Chemical compound ClC1=C(OCC(=O)OCOC=2C=CC(=C3C=CC=NC=23)[N+](=O)[O-])C=CC(=C1)Cl ZFXJSDQQRZMPRY-UHFFFAOYSA-N 0.000 description 4
- RBBDTUSMUSNYHE-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-acetyloxybenzoate Chemical compound C(C)(=O)OC1=C(C(=O)OCOC=2C=CC(=C3C=CC=NC=23)[N+](=O)[O-])C=CC=C1 RBBDTUSMUSNYHE-UHFFFAOYSA-N 0.000 description 4
- DXQVFXGUZMDZRW-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-methoxyacetate Chemical compound COCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] DXQVFXGUZMDZRW-UHFFFAOYSA-N 0.000 description 4
- ITLACRVBYJISCT-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-methylmorpholine-4-carboxylate Chemical compound CC1CN(CCO1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] ITLACRVBYJISCT-UHFFFAOYSA-N 0.000 description 4
- QJLIADDBZLDFSR-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 4-piperidin-1-ylpiperidine-1-carboxylate Chemical compound N1(CCCCC1)C1CCN(CC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] QJLIADDBZLDFSR-UHFFFAOYSA-N 0.000 description 4
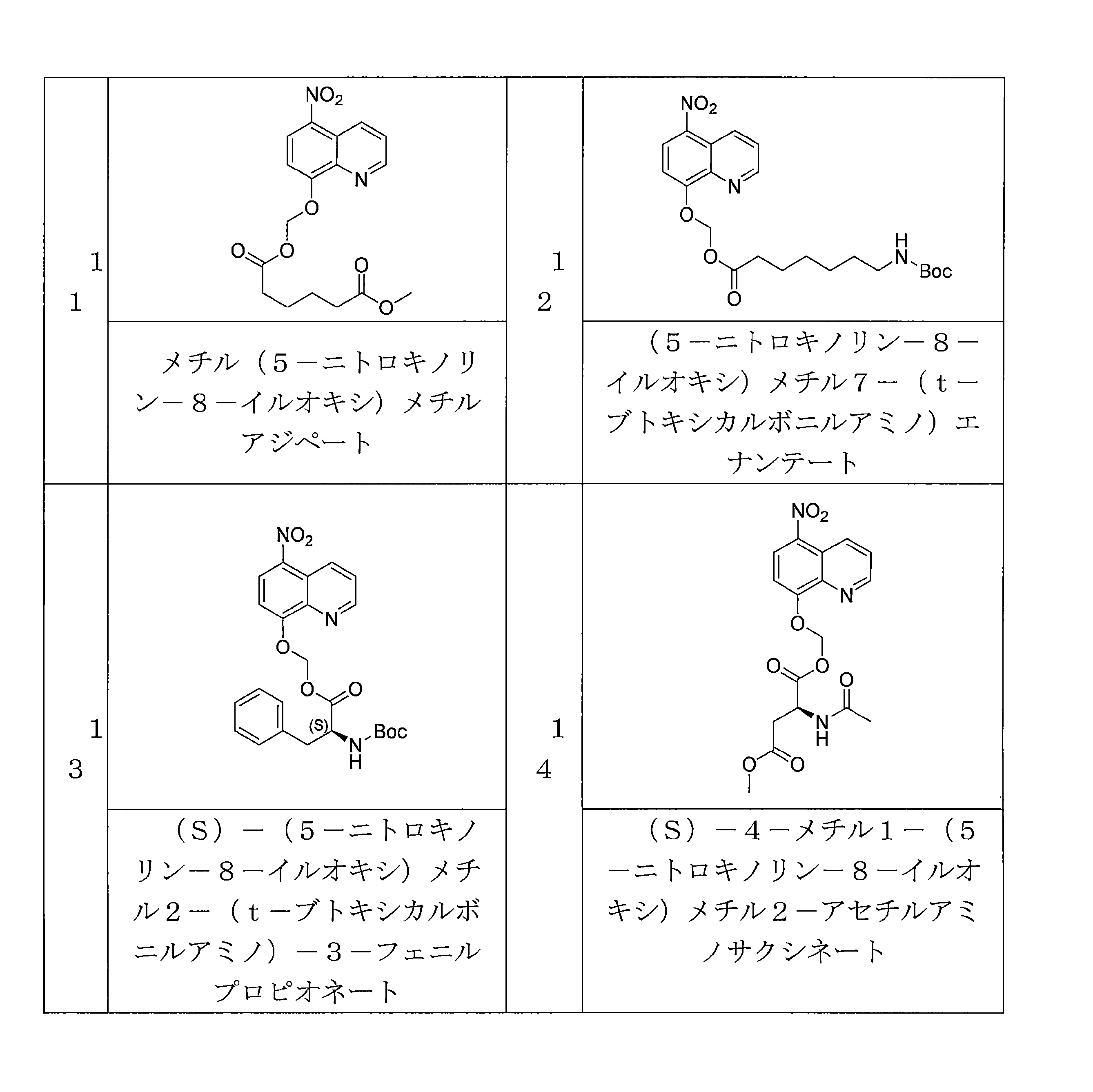
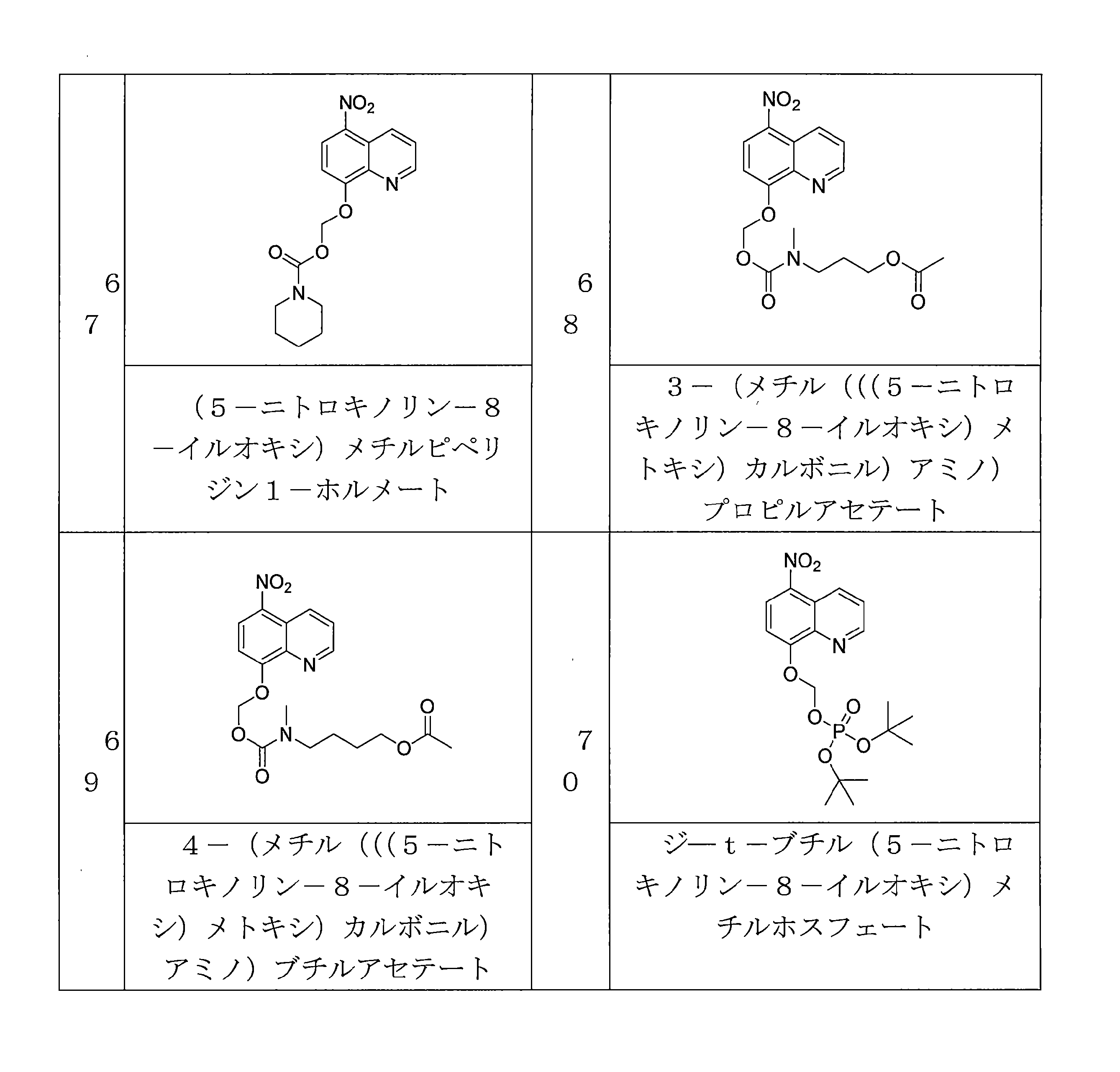
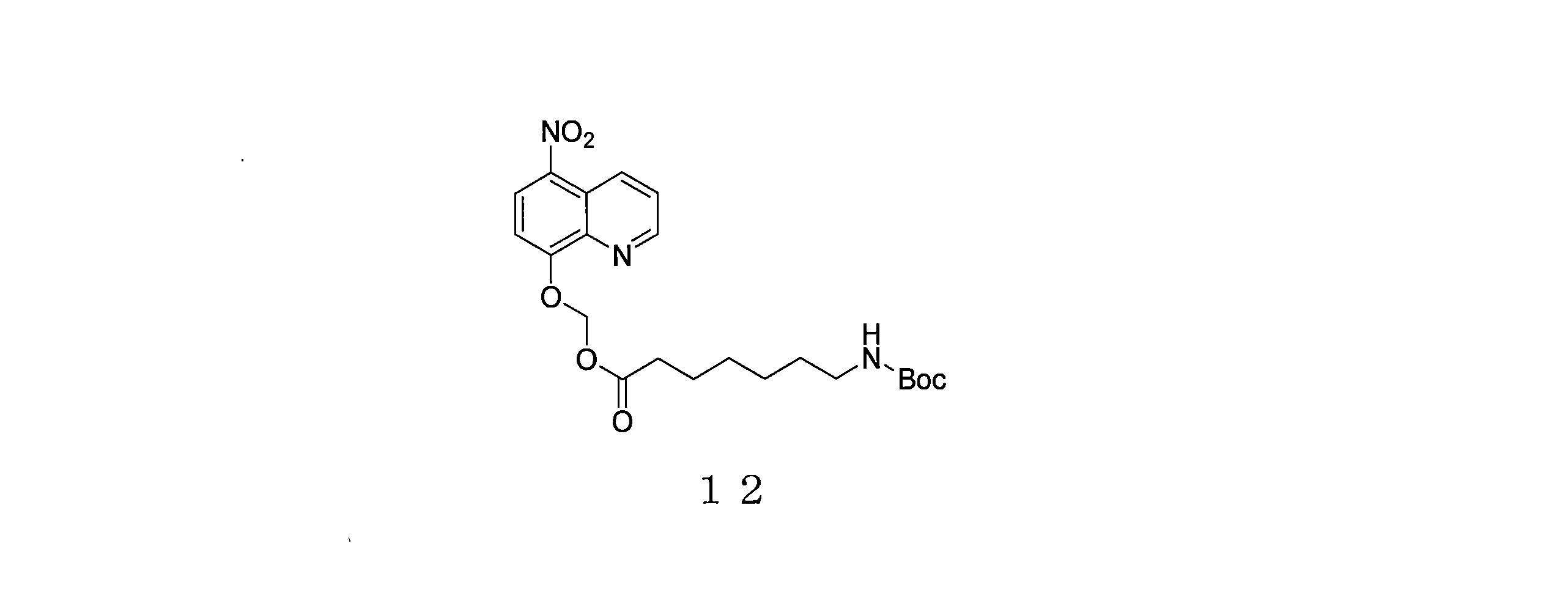
- RSMVNXRDTVWDFG-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 7-[(2-methylpropan-2-yl)oxycarbonylamino]heptanoate Chemical compound C(C)(C)(C)OC(=O)NCCCCCCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] RSMVNXRDTVWDFG-UHFFFAOYSA-N 0.000 description 4
- CFVBTZPEACRVDY-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl N-[2-[tert-butyl(dimethyl)silyl]oxyethyl]-N-methylcarbamate Chemical compound CC(C)(C)[Si](C)(C)OCCN(C)C(OCOC(C=C1)=C2N=CC=CC2=C1[N+]([O-])=O)=O CFVBTZPEACRVDY-UHFFFAOYSA-N 0.000 description 4
- GJALYRXTLJZJAU-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl butanoate Chemical compound C(CCC)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] GJALYRXTLJZJAU-UHFFFAOYSA-N 0.000 description 4
- QLIVZWHBXZXHOI-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl decanoate Chemical compound C(CCCCCCCCC)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] QLIVZWHBXZXHOI-UHFFFAOYSA-N 0.000 description 4
- ITONHLAHSJUVCR-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl dodecanoate Chemical compound C(CCCCCCCCCCC)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] ITONHLAHSJUVCR-UHFFFAOYSA-N 0.000 description 4
- BSBLBGLELPGUER-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl hexanoate Chemical compound C(CCCCC)(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] BSBLBGLELPGUER-UHFFFAOYSA-N 0.000 description 4
- UBPSQKQXUWBTNG-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl oxolane-3-carboxylate Chemical compound O1CC(CC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] UBPSQKQXUWBTNG-UHFFFAOYSA-N 0.000 description 4
- FLEZTCVLAYQBBW-UHFFFAOYSA-N 1-(5-nitroquinolin-8-yl)oxyethyl 2,2-dimethylpropanoate Chemical compound C(C(C)(C)C)(=O)OC(C)OC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] FLEZTCVLAYQBBW-UHFFFAOYSA-N 0.000 description 4
- NHFMPWKNWQTEEG-UHFFFAOYSA-N 1-(5-nitroquinolin-8-yl)oxyethyl 2-ethylbutanoate Chemical compound C(C)C(C(=O)OC(C)OC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC NHFMPWKNWQTEEG-UHFFFAOYSA-N 0.000 description 4
- BOTOHTNHLXRXJO-UHFFFAOYSA-N 1-(5-nitroquinolin-8-yl)oxyethyl 2-methylpropanoate Chemical compound C(C(C)C)(=O)OC(C)OC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] BOTOHTNHLXRXJO-UHFFFAOYSA-N 0.000 description 4
- FEKWWSDBIMEGKS-UHFFFAOYSA-N 1-(5-nitroquinolin-8-yl)oxyethyl propanoate Chemical compound C(CC)(=O)OC(C)OC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] FEKWWSDBIMEGKS-UHFFFAOYSA-N 0.000 description 4
- QYIISFBNOMTLEI-UHFFFAOYSA-N 1-O-methyl 6-O-[(5-nitroquinolin-8-yl)oxymethyl] hexanedioate Chemical compound C(CCCCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])(=O)OC QYIISFBNOMTLEI-UHFFFAOYSA-N 0.000 description 4
- JVSFQJZRHXAUGT-UHFFFAOYSA-N 2,2-dimethylpropanoyl chloride Chemical compound CC(C)(C)C(Cl)=O JVSFQJZRHXAUGT-UHFFFAOYSA-N 0.000 description 4
- UKFNOXMEPUMRDL-UHFFFAOYSA-N 2-(5-nitroquinolin-8-yl)oxycyclopentan-1-one Chemical compound [N+](=O)([O-])C1=C2C=CC=NC2=C(C=C1)OC1C(CCC1)=O UKFNOXMEPUMRDL-UHFFFAOYSA-N 0.000 description 4
- SUYZXRHABZCCPU-UHFFFAOYSA-N 2-[methyl-[(5-nitroquinolin-8-yl)oxymethoxycarbonyl]amino]ethyl acetate Chemical compound CN(CCOC(C)=O)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] SUYZXRHABZCCPU-UHFFFAOYSA-N 0.000 description 4
- GWQLMSTUGJQEAW-UHFFFAOYSA-N 2-[tert-butyl(dimethyl)silyl]oxy-n-methylethanamine Chemical compound CNCCO[Si](C)(C)C(C)(C)C GWQLMSTUGJQEAW-UHFFFAOYSA-N 0.000 description 4
- NXDPSADBEFMHTP-UHFFFAOYSA-N 3-(methylamino)propyl acetate Chemical compound CNCCCOC(C)=O NXDPSADBEFMHTP-UHFFFAOYSA-N 0.000 description 4
- DNIYUFDGFMNOAI-UHFFFAOYSA-N 3-[chloromethoxycarbonyl(methyl)amino]propyl acetate Chemical compound ClCOC(=O)N(C)CCCOC(C)=O DNIYUFDGFMNOAI-UHFFFAOYSA-N 0.000 description 4
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 4
- IBALKBLCLONLQP-UHFFFAOYSA-N 4-[methyl-[(5-nitroquinolin-8-yl)oxymethoxycarbonyl]amino]butyl acetate Chemical compound C(C)(=O)OCCCCN(C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])C IBALKBLCLONLQP-UHFFFAOYSA-N 0.000 description 4
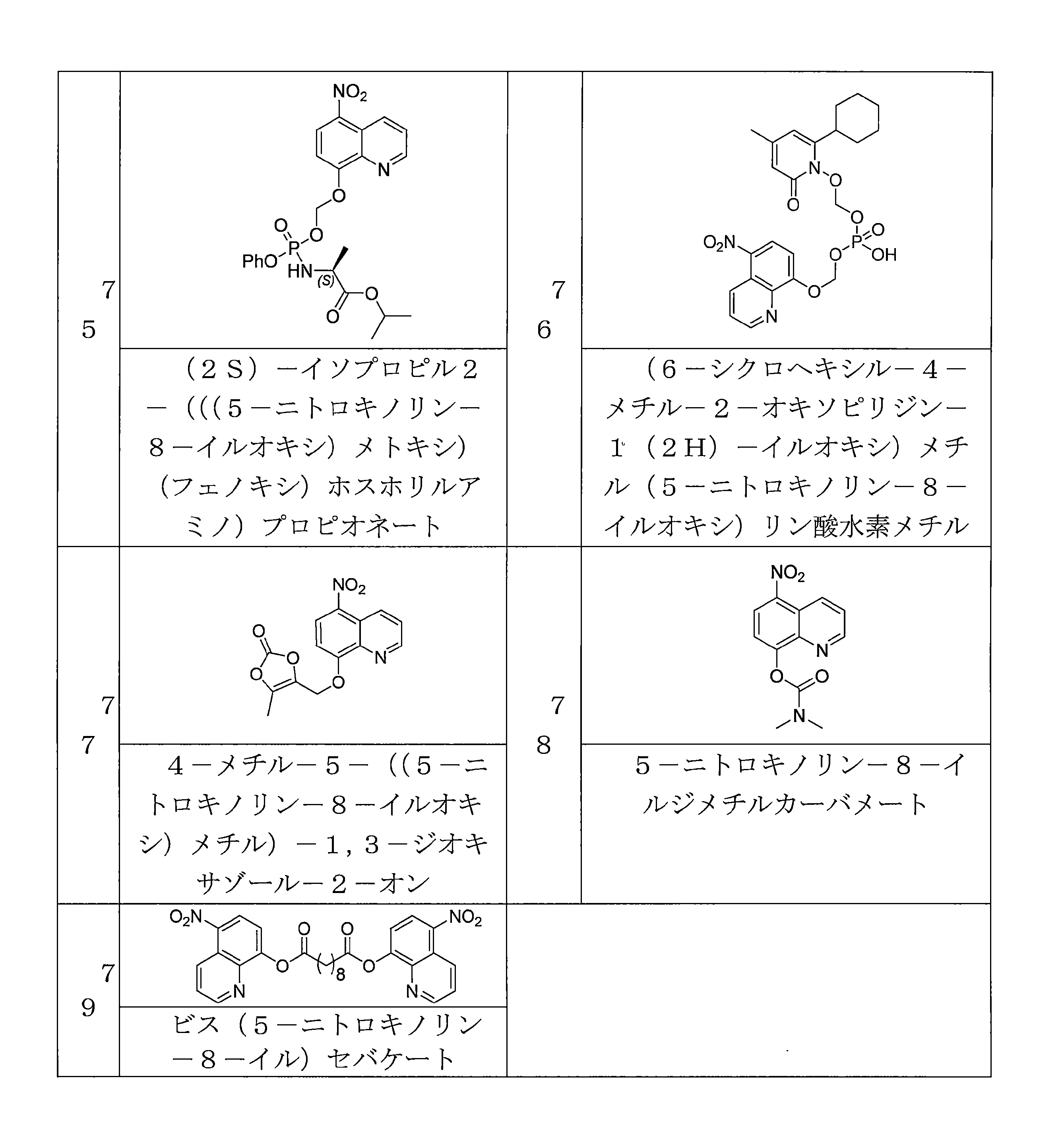
- RLTGCPKVLDQGAF-UHFFFAOYSA-N 6-[bis[(5-nitroquinolin-8-yl)oxy]methoxy]-6-oxohexanoic acid Chemical compound C1=CC2=C(C=CC(=C2N=C1)OC(OC3=C4C(=C(C=C3)[N+](=O)[O-])C=CC=N4)OC(=O)CCCCC(=O)O)[N+](=O)[O-] RLTGCPKVLDQGAF-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 4
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- ADRICTSLLVOARG-AWEZNQCLSA-N C(C)(=O)N1[C@@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] Chemical compound C(C)(=O)N1[C@@H](CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] ADRICTSLLVOARG-AWEZNQCLSA-N 0.000 description 4
- DCUBIMGBUKOFMN-LBPRGKRZSA-N C(C)(=O)N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(=O)OC Chemical compound C(C)(=O)N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(=O)OC DCUBIMGBUKOFMN-LBPRGKRZSA-N 0.000 description 4
- SREJHHORJXVQGX-UHFFFAOYSA-N C(C)(C)(C)OC(=O)N(CC(=O)OCC=1C(=NC=CC=1)NC)C Chemical compound C(C)(C)(C)OC(=O)N(CC(=O)OCC=1C(=NC=CC=1)NC)C SREJHHORJXVQGX-UHFFFAOYSA-N 0.000 description 4
- JQQKHJMKYJFJRX-ZDUSSCGKSA-N C(C)(C)(C)OC(=O)N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(=O)OC Chemical compound C(C)(C)(C)OC(=O)N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(=O)OC JQQKHJMKYJFJRX-ZDUSSCGKSA-N 0.000 description 4
- JTZKEYGIRHRTGO-UHFFFAOYSA-N CCC(CC)C(=O)OCOc1ccc([N+]([O-])=O)c2cccnc12 Chemical compound CCC(CC)C(=O)OCOc1ccc([N+]([O-])=O)c2cccnc12 JTZKEYGIRHRTGO-UHFFFAOYSA-N 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 4
- LKXSRZXFMBSCLJ-JTQLQIEISA-N N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(=O)OC Chemical compound N[C@H](C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(=O)OC LKXSRZXFMBSCLJ-JTQLQIEISA-N 0.000 description 4
- JSTWIXLTJCEIIC-UHFFFAOYSA-N OC(CN(C(OCCl)=O)C)CO Chemical compound OC(CN(C(OCCl)=O)C)CO JSTWIXLTJCEIIC-UHFFFAOYSA-N 0.000 description 4
- VKJQDKSUTWPFSY-UHFFFAOYSA-N P(=O)(O)(OCON1C(C=C(C=C1C1CCCCC1)C)=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] Chemical compound P(=O)(O)(OCON1C(C=C(C=C1C1CCCCC1)C)=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] VKJQDKSUTWPFSY-UHFFFAOYSA-N 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- KGEXRACMMHNGCT-UHFFFAOYSA-N [2-[chloromethoxycarbonyl(methyl)amino]pyridin-3-yl]methyl 2-(methylamino)acetate Chemical compound CNCC(=O)OCC=1C(=NC=CC=1)N(C)C(=O)OCCl KGEXRACMMHNGCT-UHFFFAOYSA-N 0.000 description 4
- LGOGDWONBHKFOG-UHFFFAOYSA-N [2-[chloromethoxycarbonyl(methyl)amino]pyridin-3-yl]methyl 2-[methyl-[(2-methylpropan-2-yl)oxycarbonyl]amino]acetate Chemical compound C(C)(C)(C)OC(=O)N(CC(=O)OCC=1C(=NC=CC=1)N(C)C(=O)OCCl)C LGOGDWONBHKFOG-UHFFFAOYSA-N 0.000 description 4
- 239000003963 antioxidant agent Substances 0.000 description 4
- 235000006708 antioxidants Nutrition 0.000 description 4
- LCHPDPCYDYAKHN-UHFFFAOYSA-N bis(5-nitroquinolin-8-yl) decanedioate Chemical compound C12=NC=CC=C2C([N+](=O)[O-])=CC=C1OC(=O)CCCCCCCCC(=O)OC1=CC=C([N+]([O-])=O)C2=CC=CN=C12 LCHPDPCYDYAKHN-UHFFFAOYSA-N 0.000 description 4
- 238000011088 calibration curve Methods 0.000 description 4
- OQIRSNSDSQVVFC-KNVOCYPGSA-N chloromethyl (2s,6r)-2,6-dimethylmorpholine-4-carboxylate Chemical compound C[C@H]1CN(C(=O)OCCl)C[C@@H](C)O1 OQIRSNSDSQVVFC-KNVOCYPGSA-N 0.000 description 4
- DSVRKTGMUDCFSY-UHFFFAOYSA-N chloromethyl N-[2-[tert-butyl(dimethyl)silyl]oxyethyl]-N-methylcarbamate Chemical compound [Si](C)(C)(C(C)(C)C)OCCN(C(OCCl)=O)C DSVRKTGMUDCFSY-UHFFFAOYSA-N 0.000 description 4
- 239000003086 colorant Substances 0.000 description 4
- FKQPXGDVWUFHFA-UHFFFAOYSA-N dibenzyl (2-cyclohexyl-4-methyl-6-oxopyridin-1-yl)oxymethyl phosphate Chemical compound C=1C=CC=CC=1COP(=O)(OCC=1C=CC=CC=1)OCON1C(=O)C=C(C)C=C1C1CCCCC1 FKQPXGDVWUFHFA-UHFFFAOYSA-N 0.000 description 4
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 4
- 239000000796 flavoring agent Substances 0.000 description 4
- SHFJWMWCIHQNCP-UHFFFAOYSA-M hydron;tetrabutylazanium;sulfate Chemical compound OS([O-])(=O)=O.CCCC[N+](CCCC)(CCCC)CCCC SHFJWMWCIHQNCP-UHFFFAOYSA-M 0.000 description 4
- 239000005457 ice water Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 238000004811 liquid chromatography Methods 0.000 description 4
- 210000004185 liver Anatomy 0.000 description 4
- 230000002101 lytic effect Effects 0.000 description 4
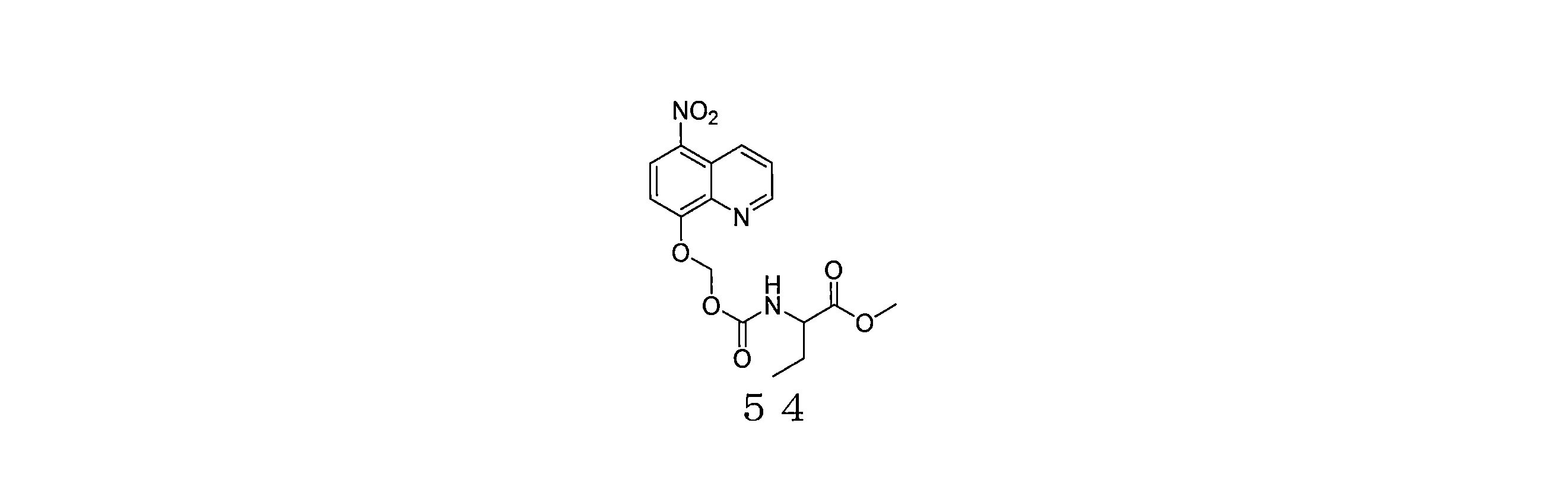
- VFLRKPFZXGWVOZ-INIZCTEOSA-N methyl (2S)-2-[(5-nitroquinolin-8-yl)oxymethoxycarbonylamino]-3-phenylpropanoate Chemical compound [N+](=O)([O-])C1=C2C=CC=NC2=C(C=C1)OCOC(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 VFLRKPFZXGWVOZ-INIZCTEOSA-N 0.000 description 4
- VQQJUUCDQNWNLW-LNYMIDHXSA-N methyl (2S)-2-[[phenoxy(phenylmethoxy)phosphoryl]amino]propanoate Chemical compound C(C1=CC=CC=C1)OP(=O)(OC1=CC=CC=C1)N[C@H](C(=O)OC)C VQQJUUCDQNWNLW-LNYMIDHXSA-N 0.000 description 4
- PGWYWMBWJLPUBC-UHFFFAOYSA-N methyl 2-[(2,4-dimethoxyphenyl)methylamino]acetate Chemical compound COC(=O)CNCC1=CC=C(OC)C=C1OC PGWYWMBWJLPUBC-UHFFFAOYSA-N 0.000 description 4
- GCEOMWKDEHEDAR-UHFFFAOYSA-N methyl 2-[(5-nitroquinolin-8-yl)oxymethoxycarbonylamino]butanoate Chemical compound [N+](=O)([O-])C1=C2C=CC=NC2=C(C=C1)OCOC(=O)NC(C(=O)OC)CC GCEOMWKDEHEDAR-UHFFFAOYSA-N 0.000 description 4
- GFDSURVSFHSDAI-UHFFFAOYSA-N methyl 2-[methyl-(5-nitroquinolin-8-yl)oxycarbonylamino]acetate Chemical compound CN(CC(=O)OC)C(=O)OC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] GFDSURVSFHSDAI-UHFFFAOYSA-N 0.000 description 4
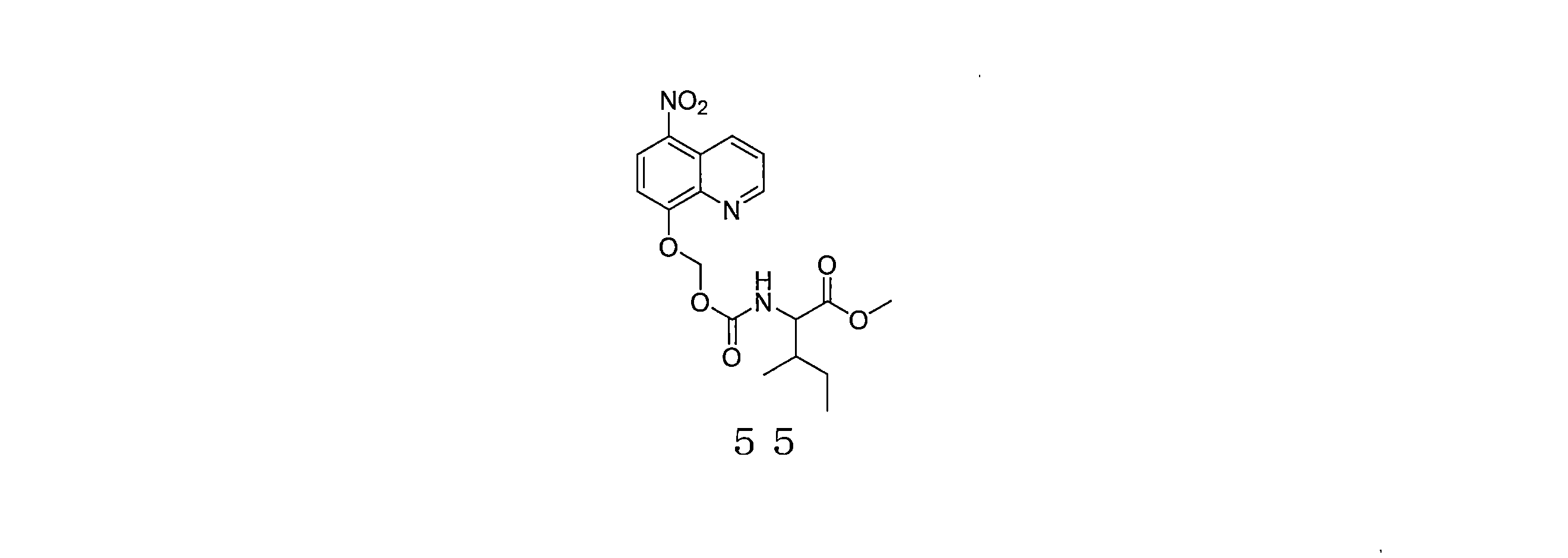
- QPZLODXRLJGMOA-UHFFFAOYSA-N methyl 3-methyl-2-[(5-nitroquinolin-8-yl)oxymethoxycarbonylamino]pentanoate Chemical compound CC(C(C(=O)OC)NC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC QPZLODXRLJGMOA-UHFFFAOYSA-N 0.000 description 4
- ICQYEBCLWNSAKW-UHFFFAOYSA-N methyl 4-[(5-nitroquinolin-8-yl)oxymethoxycarbonylamino]butanoate Chemical compound [N+](=O)([O-])C1=C2C=CC=NC2=C(C=C1)OCOC(=O)NCCCC(=O)OC ICQYEBCLWNSAKW-UHFFFAOYSA-N 0.000 description 4
- MNBHDOUEIXPMQE-UHFFFAOYSA-N methyl-[(5-nitroquinolin-8-yl)methyl]carbamic acid Chemical compound CN(CC1=C2C(=C(C=C1)[N+](=O)[O-])C=CC=N2)C(=O)O MNBHDOUEIXPMQE-UHFFFAOYSA-N 0.000 description 4
- 239000004530 micro-emulsion Substances 0.000 description 4
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 4
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Substances [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 4
- 239000000375 suspending agent Substances 0.000 description 4
- GJGLBUZZTLPCOT-UHFFFAOYSA-N tert-butyl n-(3-hydroxypropyl)-n-methylcarbamate Chemical compound OCCCN(C)C(=O)OC(C)(C)C GJGLBUZZTLPCOT-UHFFFAOYSA-N 0.000 description 4
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 4
- 125000000335 thiazolyl group Chemical group 0.000 description 4
- 238000004809 thin layer chromatography Methods 0.000 description 4
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 4
- HNVIQLPOGUDBSU-OLQVQODUSA-N (2s,6r)-2,6-dimethylmorpholine Chemical compound C[C@H]1CNC[C@@H](C)O1 HNVIQLPOGUDBSU-OLQVQODUSA-N 0.000 description 3
- LUCQQSZOANHGPU-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-[(2-methylpropan-2-yl)oxycarbonylamino]acetate Chemical compound C(C)(C)(C)OC(=O)NCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] LUCQQSZOANHGPU-UHFFFAOYSA-N 0.000 description 3
- NAEDBQGUKFDJTK-ZOWNYOTGSA-N (5-nitroquinolin-8-yl)oxymethyl 2-[[(2S)-2-amino-4-methylpentanoyl]amino]acetate hydrochloride Chemical compound Cl.N[C@H](C(=O)NCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(C)C NAEDBQGUKFDJTK-ZOWNYOTGSA-N 0.000 description 3
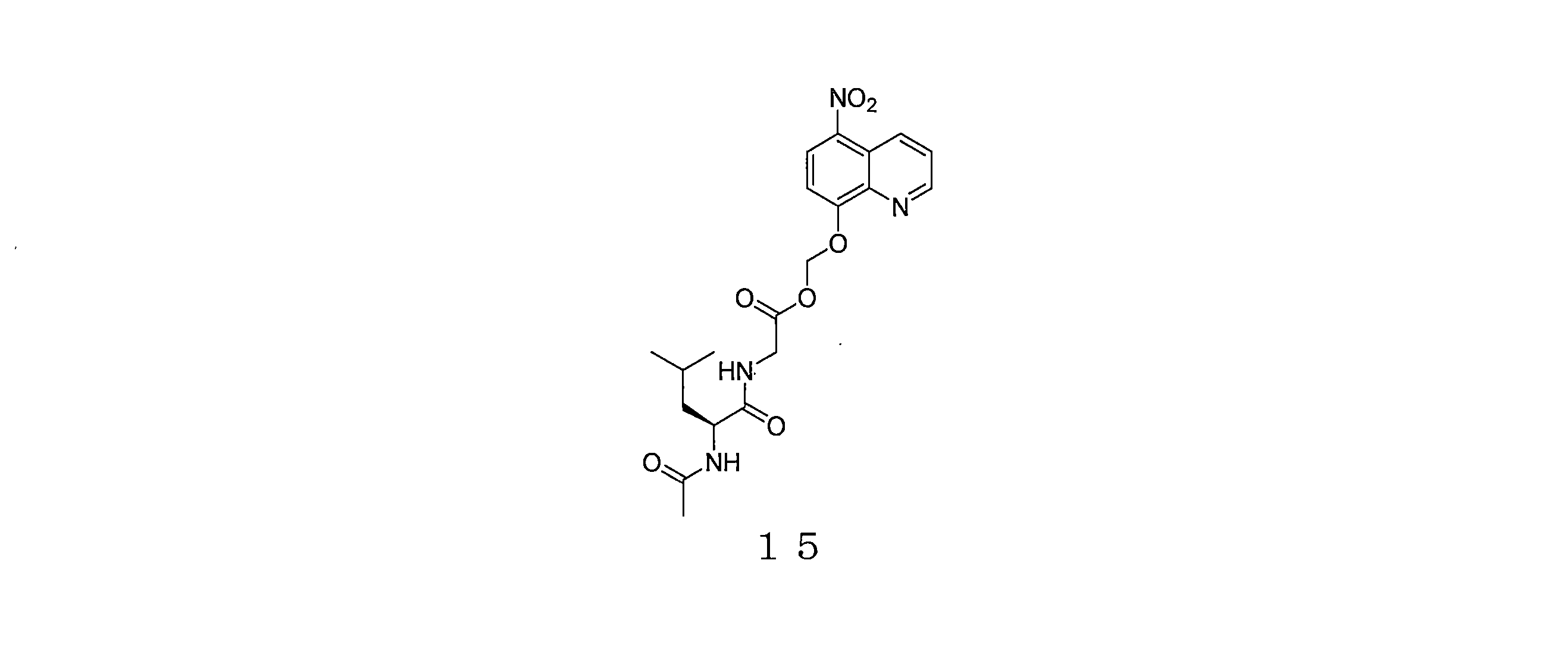
- ANAPUSDWLGBXMX-INIZCTEOSA-N (5-nitroquinolin-8-yl)oxymethyl 2-[[(2S)-4-methyl-2-[(2-methylpropan-2-yl)oxycarbonylamino]pentanoyl]amino]acetate Chemical compound C(C)(C)(C)OC(=O)N[C@H](C(=O)NCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-])CC(C)C ANAPUSDWLGBXMX-INIZCTEOSA-N 0.000 description 3
- KYSBHMDBQIMPQT-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-aminoacetate hydrochloride Chemical compound Cl.NCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] KYSBHMDBQIMPQT-UHFFFAOYSA-N 0.000 description 3
- SLHOEUNSKUEVTG-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 2-pyridin-3-ylacetate Chemical compound N1=CC(=CC=C1)CC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] SLHOEUNSKUEVTG-UHFFFAOYSA-N 0.000 description 3
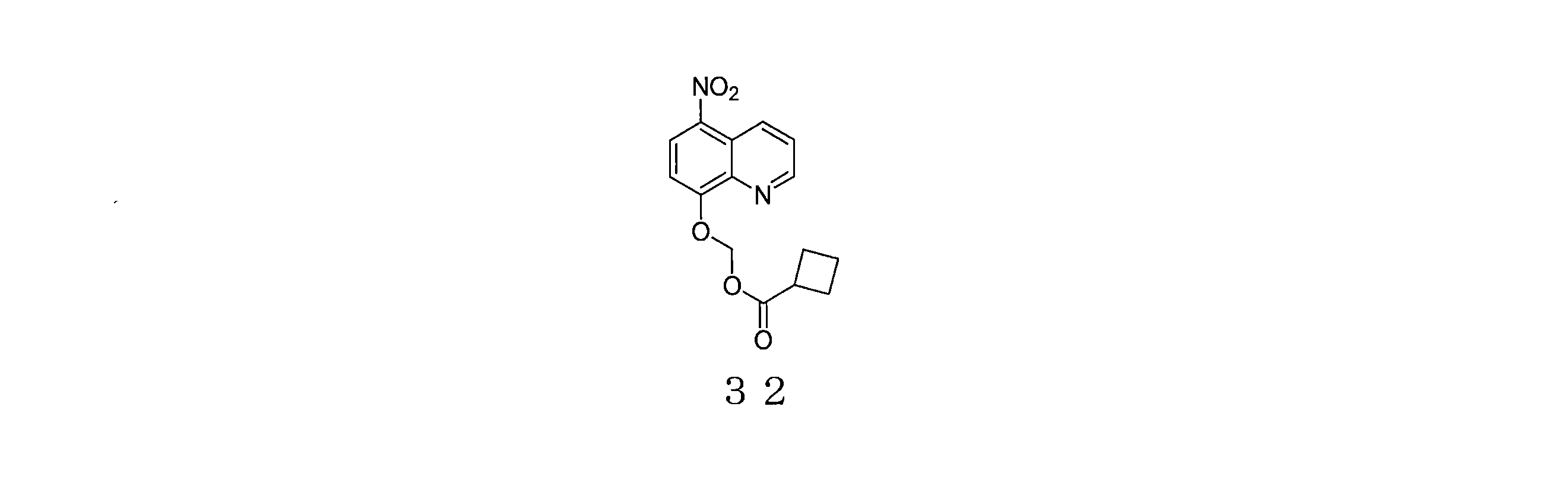
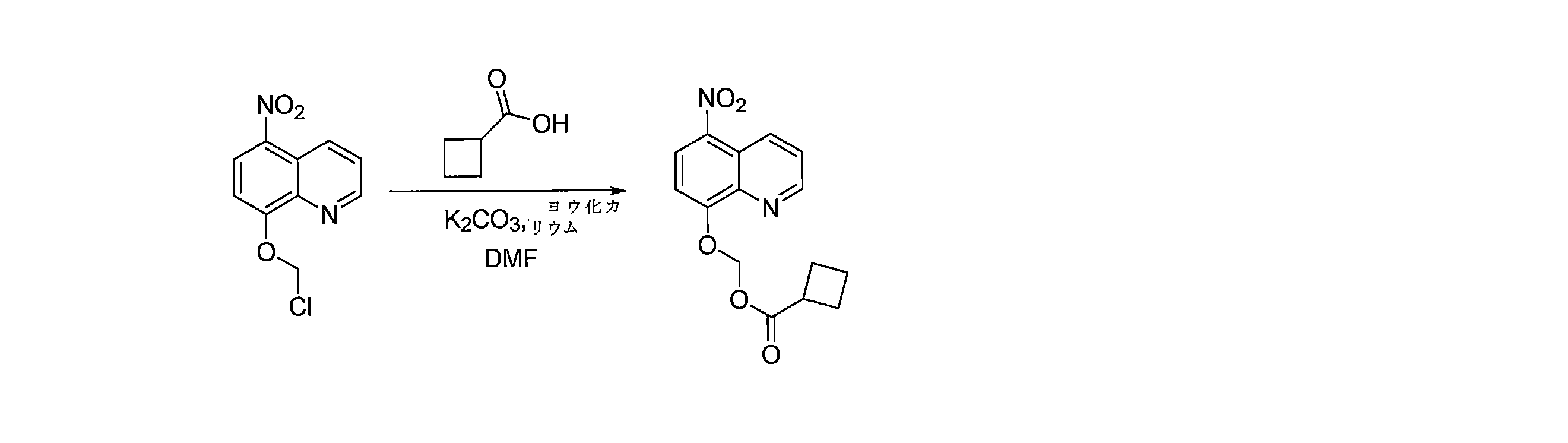
- GKEVNJQQKHUNKQ-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl cyclobutanecarboxylate Chemical compound C1(CCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] GKEVNJQQKHUNKQ-UHFFFAOYSA-N 0.000 description 3
- KIXDWMBLDVTTCO-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl morpholine-4-carboxylate Chemical compound N1(CCOCC1)C(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] KIXDWMBLDVTTCO-UHFFFAOYSA-N 0.000 description 3
- PVOAHINGSUIXLS-UHFFFAOYSA-N 1-Methylpiperazine Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 3
- DGMOBVGABMBZSB-UHFFFAOYSA-N 2-methylpropanoyl chloride Chemical compound CC(C)C(Cl)=O DGMOBVGABMBZSB-UHFFFAOYSA-N 0.000 description 3
- UDAIGHZFMLGNDQ-UHFFFAOYSA-N 2-nitroquinoline Chemical compound C1=CC=CC2=NC([N+](=O)[O-])=CC=C21 UDAIGHZFMLGNDQ-UHFFFAOYSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- KBPMGDQURPREKV-UHFFFAOYSA-N CC(C)(C)C(CC(O)=O)(COC(C=C1)=C2N=CC=CC2=C1[N+]([O-])=O)C(O)=O Chemical compound CC(C)(C)C(CC(O)=O)(COC(C=C1)=C2N=CC=CC2=C1[N+]([O-])=O)C(O)=O KBPMGDQURPREKV-UHFFFAOYSA-N 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- CAHKINHBCWCHCF-JTQLQIEISA-N N-acetyl-L-tyrosine Chemical compound CC(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 CAHKINHBCWCHCF-JTQLQIEISA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 235000019483 Peanut oil Nutrition 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 229910052786 argon Inorganic materials 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
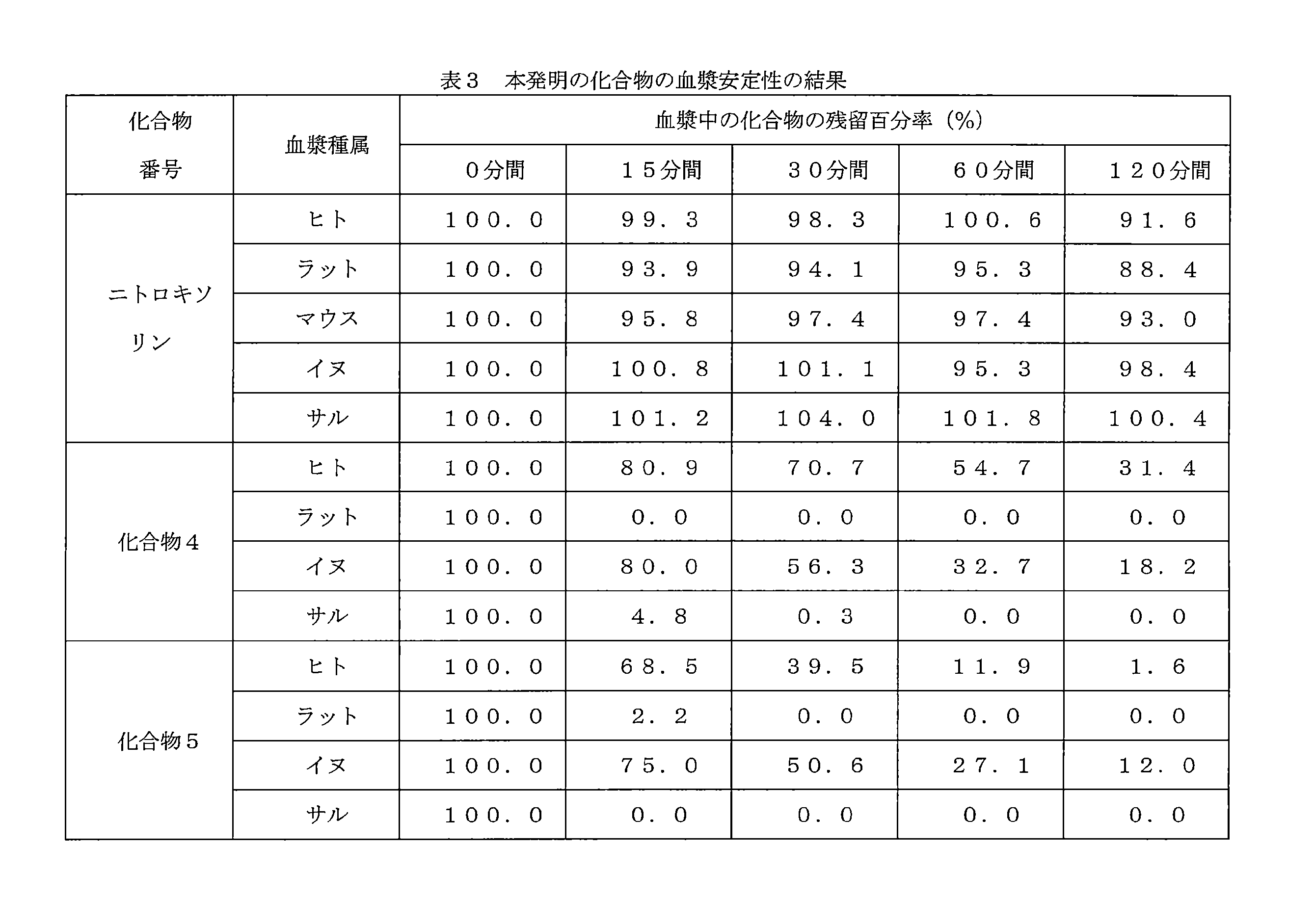
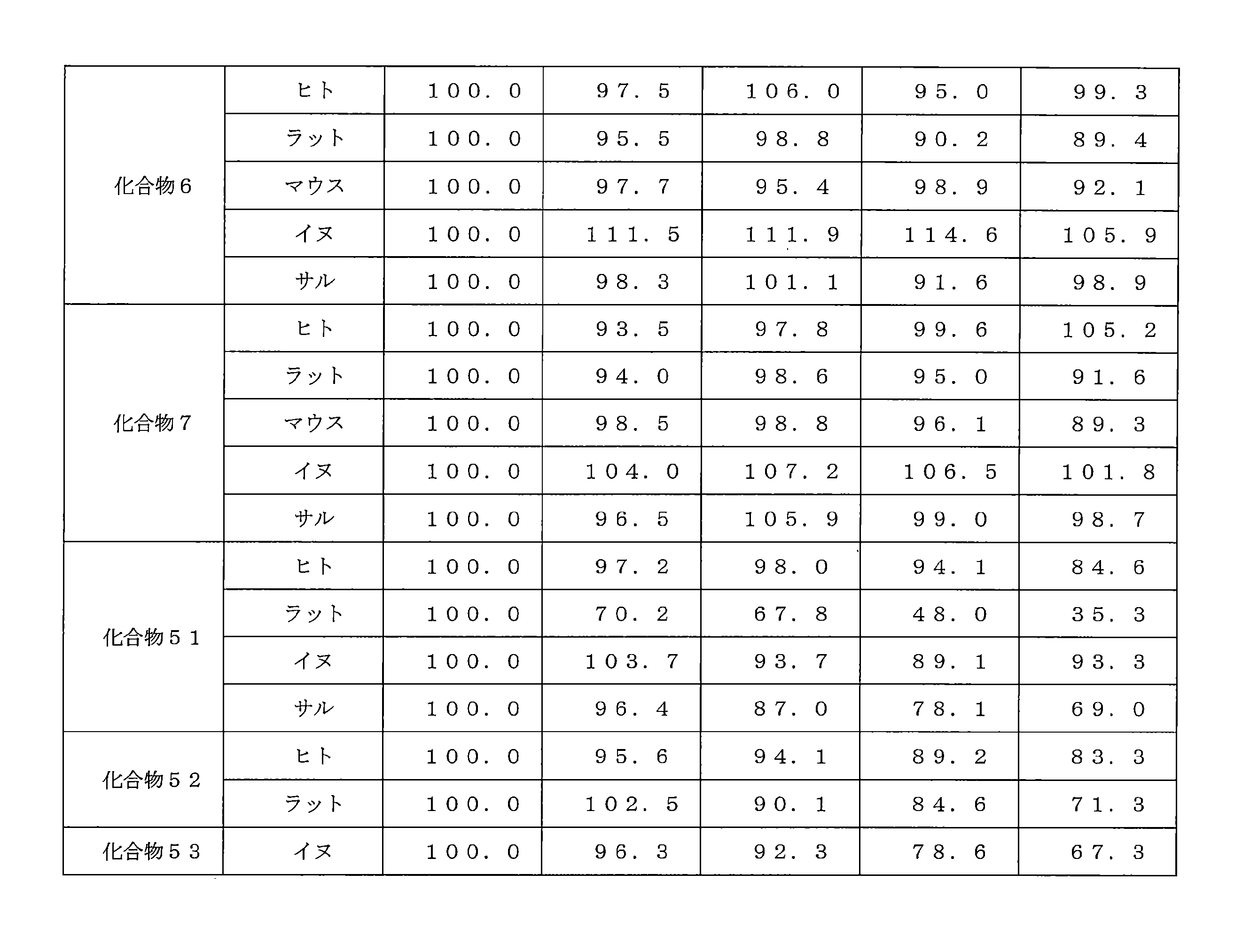
- 239000008280 blood Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 239000002270 dispersing agent Substances 0.000 description 3
- 238000000605 extraction Methods 0.000 description 3
- 235000013355 food flavoring agent Nutrition 0.000 description 3
- 238000005194 fractionation Methods 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 238000001294 liquid chromatography-tandem mass spectrometry Methods 0.000 description 3
- 229940057995 liquid paraffin Drugs 0.000 description 3
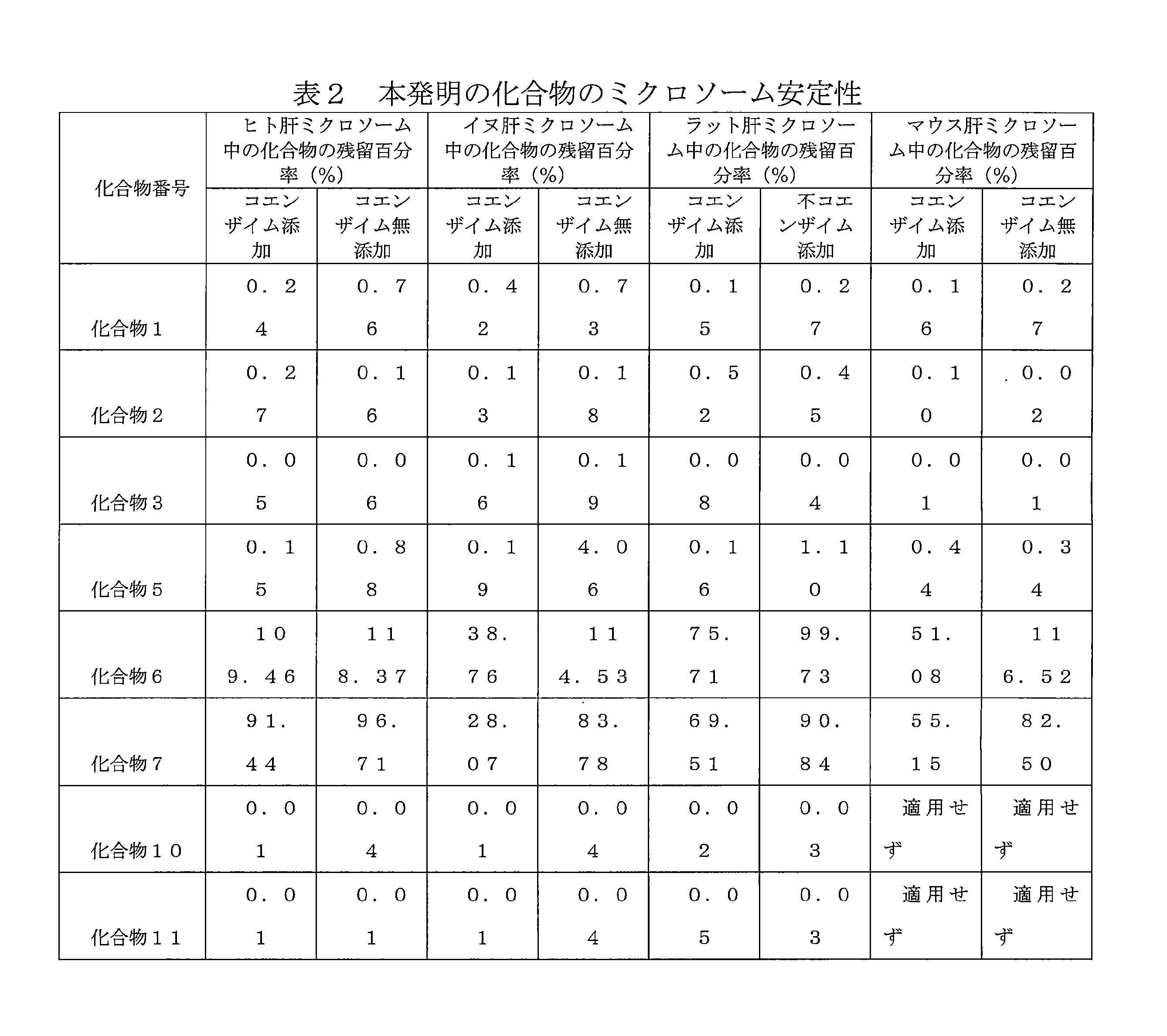
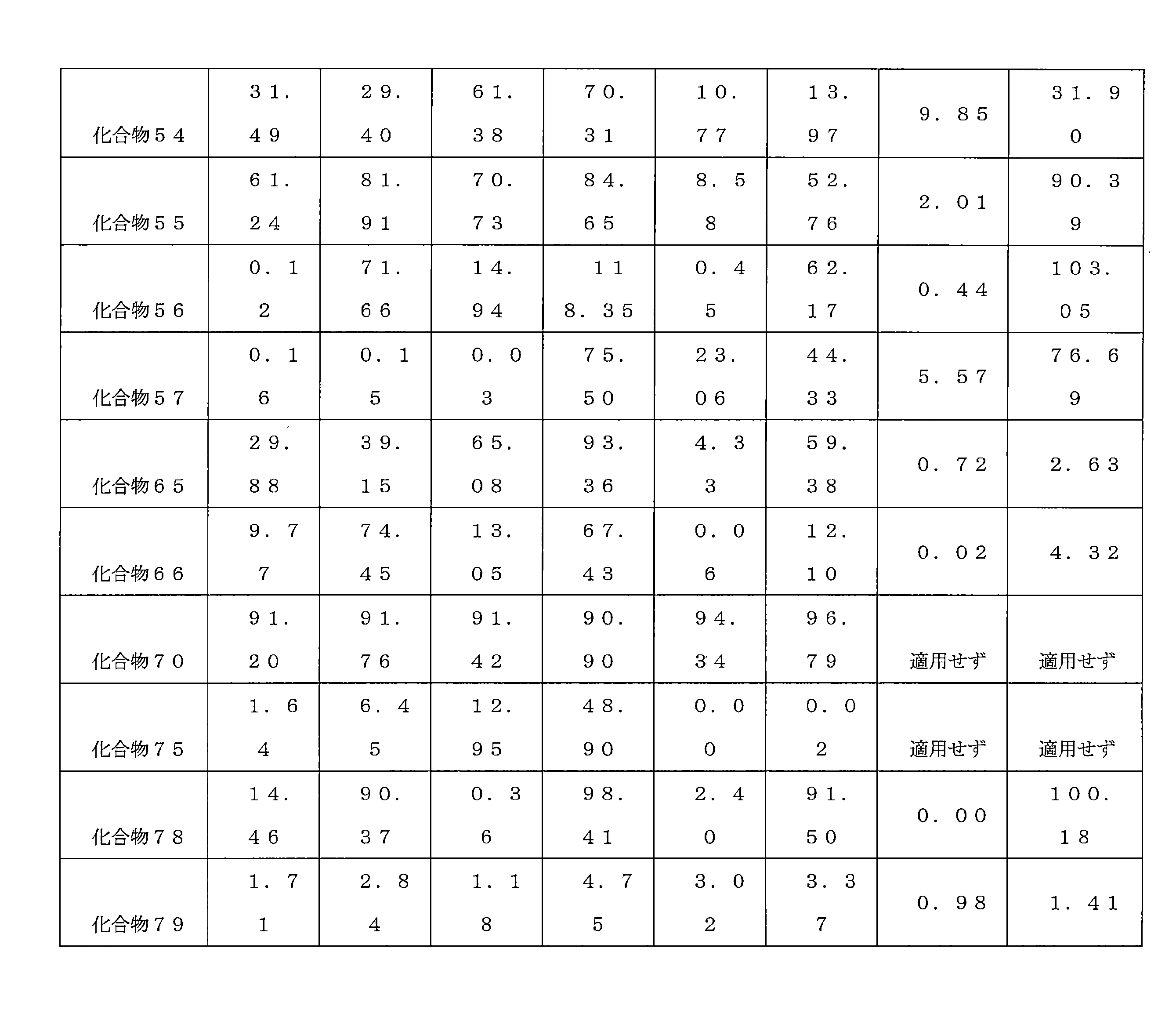
- 210000001853 liver microsome Anatomy 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- IYUKFAFDFHZKPI-DFWYDOINSA-N methyl (2s)-2-aminopropanoate;hydrochloride Chemical compound Cl.COC(=O)[C@H](C)N IYUKFAFDFHZKPI-DFWYDOINSA-N 0.000 description 3
- HPXXYVRPHLUUIB-UHFFFAOYSA-N methyl 2-[chloromethoxycarbonyl-[(2,4-dimethoxyphenyl)methyl]amino]acetate Chemical compound ClCOC(=O)N(CC(=O)OC)CC1=C(C=C(C=C1)OC)OC HPXXYVRPHLUUIB-UHFFFAOYSA-N 0.000 description 3
- LAWYTLVUHMZCFE-UHFFFAOYSA-N methyl 3-methyl-2-(methylamino)pentanoate Chemical compound CCC(C)C(NC)C(=O)OC LAWYTLVUHMZCFE-UHFFFAOYSA-N 0.000 description 3
- 229960001682 n-acetyltyrosine Drugs 0.000 description 3
- 239000004006 olive oil Substances 0.000 description 3
- 235000008390 olive oil Nutrition 0.000 description 3
- 239000000312 peanut oil Substances 0.000 description 3
- 239000003208 petroleum Substances 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 229940086066 potassium hydrogencarbonate Drugs 0.000 description 3
- 125000003226 pyrazolyl group Chemical group 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 238000011282 treatment Methods 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- NBNKJDVHAFIJRT-UHFFFAOYSA-N (5-nitroquinolin-8-yl)oxymethyl 8-hydroxyoctanoate Chemical compound OCCCCCCCC(=O)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] NBNKJDVHAFIJRT-UHFFFAOYSA-N 0.000 description 2
- IWYDHOAUDWTVEP-ZETCQYMHSA-N (S)-mandelic acid Chemical compound OC(=O)[C@@H](O)C1=CC=CC=C1 IWYDHOAUDWTVEP-ZETCQYMHSA-N 0.000 description 2
- 125000005918 1,2-dimethylbutyl group Chemical group 0.000 description 2
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 2
- CGKKDGMMKSOGLM-UHFFFAOYSA-N 1-chloroethyl acetate Chemical compound CC(Cl)OC(C)=O CGKKDGMMKSOGLM-UHFFFAOYSA-N 0.000 description 2
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 2
- LWRSYTXEQUUTKW-UHFFFAOYSA-N 2,4-dimethoxybenzaldehyde Chemical compound COC1=CC=C(C=O)C(OC)=C1 LWRSYTXEQUUTKW-UHFFFAOYSA-N 0.000 description 2
- YRXIMPFOTQVOHG-UHFFFAOYSA-N 2-[methyl-[(2-methylpropan-2-yl)oxycarbonyl]amino]acetic acid Chemical compound OC(=O)CN(C)C(=O)OC(C)(C)C YRXIMPFOTQVOHG-UHFFFAOYSA-N 0.000 description 2
- SPCKHVPPRJWQRZ-UHFFFAOYSA-N 2-benzhydryloxy-n,n-dimethylethanamine;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 SPCKHVPPRJWQRZ-UHFFFAOYSA-N 0.000 description 2
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 2
- 125000005916 2-methylpentyl group Chemical group 0.000 description 2
- KRGXWTOLFOPIKV-UHFFFAOYSA-N 3-(methylamino)propan-1-ol Chemical compound CNCCCO KRGXWTOLFOPIKV-UHFFFAOYSA-N 0.000 description 2
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 2
- 125000003542 3-methylbutan-2-yl group Chemical group [H]C([H])([H])C([H])(*)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000005917 3-methylpentyl group Chemical group 0.000 description 2
- 244000215068 Acacia senegal Species 0.000 description 2
- IKHGUXGNUITLKF-UHFFFAOYSA-N Acetaldehyde Chemical compound CC=O IKHGUXGNUITLKF-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Chemical compound CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 2
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 101710181812 Methionine aminopeptidase Proteins 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 229910003827 NRaRb Inorganic materials 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- 101100212791 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) YBL068W-A gene Proteins 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- WERKSKAQRVDLDW-ANOHMWSOSA-N [(2s,3r,4r,5r)-2,3,4,5,6-pentahydroxyhexyl] (z)-octadec-9-enoate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO WERKSKAQRVDLDW-ANOHMWSOSA-N 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 2
- 150000008064 anhydrides Chemical class 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 239000003146 anticoagulant agent Substances 0.000 description 2
- 229940127219 anticoagulant drug Drugs 0.000 description 2
- 230000003078 antioxidant effect Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000012300 argon atmosphere Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- HUMNYLRZRPPJDN-UHFFFAOYSA-N benzaldehyde Chemical compound O=CC1=CC=CC=C1 HUMNYLRZRPPJDN-UHFFFAOYSA-N 0.000 description 2
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- 235000010216 calcium carbonate Nutrition 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 229960000541 cetyl alcohol Drugs 0.000 description 2
- 239000005515 coenzyme Substances 0.000 description 2
- BGTOWKSIORTVQH-UHFFFAOYSA-N cyclopentanone Chemical compound O=C1CCCC1 BGTOWKSIORTVQH-UHFFFAOYSA-N 0.000 description 2
- GHVNFZFCNZKVNT-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 description 2
- TXFOLHZMICYNRM-UHFFFAOYSA-N dichlorophosphoryloxybenzene Chemical compound ClP(Cl)(=O)OC1=CC=CC=C1 TXFOLHZMICYNRM-UHFFFAOYSA-N 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 229960000520 diphenhydramine Drugs 0.000 description 2
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 2
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 2
- 239000003651 drinking water Substances 0.000 description 2
- 235000020188 drinking water Nutrition 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 230000029142 excretion Effects 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 125000004438 haloalkoxy group Chemical group 0.000 description 2
- 125000001188 haloalkyl group Chemical group 0.000 description 2
- 239000007902 hard capsule Substances 0.000 description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 125000005027 hydroxyaryl group Chemical group 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 229940102223 injectable solution Drugs 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- KQNPFQTWMSNSAP-UHFFFAOYSA-N isobutyric acid Chemical compound CC(C)C(O)=O KQNPFQTWMSNSAP-UHFFFAOYSA-N 0.000 description 2
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 2
- TWBYWOBDOCUKOW-UHFFFAOYSA-N isonicotinic acid Chemical compound OC(=O)C1=CC=NC=C1 TWBYWOBDOCUKOW-UHFFFAOYSA-N 0.000 description 2
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 235000010445 lecithin Nutrition 0.000 description 2
- 239000000787 lecithin Substances 0.000 description 2
- 229940067606 lecithin Drugs 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 230000037323 metabolic rate Effects 0.000 description 2
- YWOITFUKFOYODT-UHFFFAOYSA-N methanol;sodium Chemical compound [Na].OC YWOITFUKFOYODT-UHFFFAOYSA-N 0.000 description 2
- NOJFJSFYJMPWON-UHFFFAOYSA-N methyl 2-[(2,4-dimethoxyphenyl)methyl-[(5-nitroquinolin-8-yl)oxymethoxycarbonyl]amino]acetate Chemical compound COC1=C(CN(CC(=O)OC)C(=O)OCOC=2C=CC(=C3C=CC=NC=23)[N+](=O)[O-])C=CC(=C1)OC NOJFJSFYJMPWON-UHFFFAOYSA-N 0.000 description 2
- BDMCJNPMLSZYSL-UHFFFAOYSA-N methyl 2-[2-(2-methoxyethoxy)ethoxy]acetate Chemical compound COCCOCCOCC(=O)OC BDMCJNPMLSZYSL-UHFFFAOYSA-N 0.000 description 2
- 230000003228 microsomal effect Effects 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 125000002757 morpholinyl group Chemical group 0.000 description 2
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 2
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 239000012299 nitrogen atmosphere Substances 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000000346 nonvolatile oil Substances 0.000 description 2
- WWZKQHOCKIZLMA-UHFFFAOYSA-N octanoic acid Chemical compound CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 2
- 239000012053 oil suspension Substances 0.000 description 2
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 235000019260 propionic acid Nutrition 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 2
- 210000000664 rectum Anatomy 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 229910000033 sodium borohydride Inorganic materials 0.000 description 2
- 239000012279 sodium borohydride Substances 0.000 description 2
- 239000007901 soft capsule Substances 0.000 description 2
- 125000003003 spiro group Chemical group 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 2
- 210000001635 urinary tract Anatomy 0.000 description 2
- 208000019206 urinary tract infection Diseases 0.000 description 2
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 230000002861 ventricular Effects 0.000 description 2
- 239000011592 zinc chloride Substances 0.000 description 2
- 235000005074 zinc chloride Nutrition 0.000 description 2
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 2
- GGTBEWGOPAFTTH-UHFFFAOYSA-N (1-methoxy-3-methyl-1-oxopentan-2-yl)azanium;chloride Chemical compound Cl.CCC(C)C(N)C(=O)OC GGTBEWGOPAFTTH-UHFFFAOYSA-N 0.000 description 1
- LDDMACCNBZAMSG-BDVNFPICSA-N (2r,3r,4s,5r)-3,4,5,6-tetrahydroxy-2-(methylamino)hexanal Chemical compound CN[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO LDDMACCNBZAMSG-BDVNFPICSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- ZYJPUMXJBDHSIF-NSHDSACASA-N (2s)-2-[(2-methylpropan-2-yl)oxycarbonylamino]-3-phenylpropanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 ZYJPUMXJBDHSIF-NSHDSACASA-N 0.000 description 1
- VTSRCHXIIMBAKT-WNQIDUERSA-N (2s)-2-aminopropanoic acid;2-chloropropane Chemical compound CC(C)Cl.C[C@H](N)C(O)=O VTSRCHXIIMBAKT-WNQIDUERSA-N 0.000 description 1
- LLHOYOCAAURYRL-RITPCOANSA-N (2s,3r)-3-hydroxy-2-[(2-methylpropan-2-yl)oxycarbonylamino]butanoic acid Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)OC(C)(C)C LLHOYOCAAURYRL-RITPCOANSA-N 0.000 description 1
- WPGPRLVPWACBHW-UHFFFAOYSA-N (4-methoxy-4-oxobutyl)azanium;chloride Chemical compound Cl.COC(=O)CCCN WPGPRLVPWACBHW-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-SSDOTTSWSA-N (R)-mandelic acid Chemical compound OC(=O)[C@H](O)C1=CC=CC=C1 IWYDHOAUDWTVEP-SSDOTTSWSA-N 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- 125000004506 1,2,5-oxadiazolyl group Chemical group 0.000 description 1
- QDVBKXJMLILLLB-UHFFFAOYSA-N 1,4'-bipiperidine Chemical compound C1CCCCN1C1CCNCC1 QDVBKXJMLILLLB-UHFFFAOYSA-N 0.000 description 1
- WORJRXHJTUTINR-UHFFFAOYSA-N 1,4-dioxane;hydron;chloride Chemical compound Cl.C1COCCO1 WORJRXHJTUTINR-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 1
- JLPULHDHAOZNQI-ZTIMHPMXSA-N 1-hexadecanoyl-2-(9Z,12Z-octadecadienoyl)-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C/C\C=C/CCCCC JLPULHDHAOZNQI-ZTIMHPMXSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000003562 2,2-dimethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000003660 2,3-dimethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000003764 2,4-dimethylpentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 1
- VRPJIFMKZZEXLR-UHFFFAOYSA-N 2-[(2-methylpropan-2-yl)oxycarbonylamino]acetic acid Chemical compound CC(C)(C)OC(=O)NCC(O)=O VRPJIFMKZZEXLR-UHFFFAOYSA-N 0.000 description 1
- YHBWXWLDOKIVCJ-UHFFFAOYSA-N 2-[2-(2-methoxyethoxy)ethoxy]acetic acid Chemical compound COCCOCCOCC(O)=O YHBWXWLDOKIVCJ-UHFFFAOYSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- AXDZFGRFZOQVBV-UHFFFAOYSA-N 2-chlorocyclopentan-1-one Chemical compound ClC1CCCC1=O AXDZFGRFZOQVBV-UHFFFAOYSA-N 0.000 description 1
- SMUKODJVMQOSAB-UHFFFAOYSA-N 2-ethylbutanoyl chloride Chemical compound CCC(CC)C(Cl)=O SMUKODJVMQOSAB-UHFFFAOYSA-N 0.000 description 1
- 125000003229 2-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- LQMMFVPUIVBYII-UHFFFAOYSA-N 2-methylmorpholine Chemical compound CC1CNCCO1 LQMMFVPUIVBYII-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- 125000004336 3,3-dimethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000004337 3-ethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- WOMTYMDHLQTCHY-UHFFFAOYSA-N 3-methylamino-1,2-propanediol Chemical compound CNCC(O)CO WOMTYMDHLQTCHY-UHFFFAOYSA-N 0.000 description 1
- 125000003469 3-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- WGNUNYPERJMVRM-UHFFFAOYSA-N 3-pyridylacetic acid Chemical compound OC(=O)CC1=CC=CN=C1 WGNUNYPERJMVRM-UHFFFAOYSA-N 0.000 description 1
- ROLMZTIHUMKEAI-UHFFFAOYSA-N 4,5-difluoro-2-hydroxybenzonitrile Chemical compound OC1=CC(F)=C(F)C=C1C#N ROLMZTIHUMKEAI-UHFFFAOYSA-N 0.000 description 1
- QCLFSYYUWPUWQR-UHFFFAOYSA-N 4-(chloromethyl)-5-methyl-1,3-dioxol-2-one Chemical compound CC=1OC(=O)OC=1CCl QCLFSYYUWPUWQR-UHFFFAOYSA-N 0.000 description 1
- DBKSSENEKWOVKL-UHFFFAOYSA-N 4-(methylamino)butan-1-ol Chemical compound CNCCCCO DBKSSENEKWOVKL-UHFFFAOYSA-N 0.000 description 1
- PCOCFIOYWNCGBM-UHFFFAOYSA-N 4-[(2-methylpropan-2-yl)oxy]-4-oxobutanoic acid Chemical compound CC(C)(C)OC(=O)CCC(O)=O PCOCFIOYWNCGBM-UHFFFAOYSA-N 0.000 description 1
- HJENAZQPOGVAEK-UHFFFAOYSA-N 7-[(2-methylpropan-2-yl)oxycarbonylamino]heptanoic acid Chemical compound CC(C)(C)OC(=O)NCCCCCCC(O)=O HJENAZQPOGVAEK-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 108010009551 Alamethicin Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- IPCIHSFNFMQZTP-UHFFFAOYSA-N CC(C)(C)OC(C(CC(O)=O)COC(C=C1)=C2N=CC=CC2=C1[N+]([O-])=O)=O Chemical compound CC(C)(C)OC(C(CC(O)=O)COC(C=C1)=C2N=CC=CC2=C1[N+]([O-])=O)=O IPCIHSFNFMQZTP-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 238000012404 In vitro experiment Methods 0.000 description 1
- 241001441066 Kaimon Species 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 239000005639 Lauric acid Substances 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- MDXGYYOJGPFFJL-QMMMGPOBSA-N N(alpha)-t-butoxycarbonyl-L-leucine Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)OC(C)(C)C MDXGYYOJGPFFJL-QMMMGPOBSA-N 0.000 description 1
- VIWZVFVJPXTXPA-UHFFFAOYSA-N N-(2-Carboxymethyl)-morpholine Chemical compound OC(=O)CN1CCOCC1 VIWZVFVJPXTXPA-UHFFFAOYSA-N 0.000 description 1
- JJIHLJJYMXLCOY-UHFFFAOYSA-N N-acetyl-DL-serine Natural products CC(=O)NC(CO)C(O)=O JJIHLJJYMXLCOY-UHFFFAOYSA-N 0.000 description 1
- JJIHLJJYMXLCOY-BYPYZUCNSA-N N-acetyl-L-serine Chemical compound CC(=O)N[C@@H](CO)C(O)=O JJIHLJJYMXLCOY-BYPYZUCNSA-N 0.000 description 1
- OPKOKAMJFNKNAS-UHFFFAOYSA-N N-methylethanolamine Chemical compound CNCCO OPKOKAMJFNKNAS-UHFFFAOYSA-N 0.000 description 1
- ACFIXJIJDZMPPO-NNYOXOHSSA-N NADPH Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](OP(O)(O)=O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 ACFIXJIJDZMPPO-NNYOXOHSSA-N 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- VTQJQFXPURCPGF-UHFFFAOYSA-N P(=O)(OC(C)(C)C)(OC(C)(C)C)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] Chemical compound P(=O)(OC(C)(C)C)(OC(C)(C)C)OCOC=1C=CC(=C2C=CC=NC=12)[N+](=O)[O-] VTQJQFXPURCPGF-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- HDYANYHVCAPMJV-LXQIFKJMSA-N UDP-alpha-D-glucuronic acid Chemical compound C([C@@H]1[C@H]([C@H]([C@@H](O1)N1C(NC(=O)C=C1)=O)O)O)OP(O)(=O)OP(O)(=O)O[C@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O HDYANYHVCAPMJV-LXQIFKJMSA-N 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- VYPMWCUNCNMNOM-UHFFFAOYSA-N [2-(methylamino)pyridin-3-yl]methanol Chemical compound CNC1=NC=CC=C1CO VYPMWCUNCNMNOM-UHFFFAOYSA-N 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- LGHSQOCGTJHDIL-UTXLBGCNSA-N alamethicin Chemical compound N([C@@H](C)C(=O)NC(C)(C)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)NC(C)(C)C(=O)N[C@H](C(=O)NC(C)(C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NC(C)(C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NC(C)(C)C(=O)NC(C)(C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](CO)CC=1C=CC=CC=1)C(C)C)C(=O)C(C)(C)NC(=O)[C@@H]1CCCN1C(=O)C(C)(C)NC(C)=O LGHSQOCGTJHDIL-UTXLBGCNSA-N 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 229940124350 antibacterial drug Drugs 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 229960005261 aspartic acid Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- UPABQMWFWCMOFV-UHFFFAOYSA-N benethamine Chemical compound C=1C=CC=CC=1CNCCC1=CC=CC=C1 UPABQMWFWCMOFV-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 229920006217 cellulose acetate butyrate Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- PJBIHXWYDMFGCV-UHFFFAOYSA-N chloro(chlorosulfonyloxy)methane Chemical compound ClCOS(Cl)(=O)=O PJBIHXWYDMFGCV-UHFFFAOYSA-N 0.000 description 1
- JHYNXXBAHWPABC-UHFFFAOYSA-N chloromethyl propan-2-yl carbonate Chemical compound CC(C)OC(=O)OCCl JHYNXXBAHWPABC-UHFFFAOYSA-N 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 239000007859 condensation product Substances 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 239000001767 crosslinked sodium carboxy methyl cellulose Substances 0.000 description 1
- TXWOGHSRPAYOML-UHFFFAOYSA-N cyclobutanecarboxylic acid Chemical compound OC(=O)C1CCC1 TXWOGHSRPAYOML-UHFFFAOYSA-N 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000002188 cycloheptatrienyl group Chemical group C1(=CC=CC=CC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- WMPOZLHMGVKUEJ-UHFFFAOYSA-N decanedioyl dichloride Chemical compound ClC(=O)CCCCCCCCC(Cl)=O WMPOZLHMGVKUEJ-UHFFFAOYSA-N 0.000 description 1
- FVTHQGOGQRTOMY-UHFFFAOYSA-N dibenzyl chloromethyl phosphate Chemical compound C=1C=CC=CC=1COP(=O)(OCCl)OCC1=CC=CC=C1 FVTHQGOGQRTOMY-UHFFFAOYSA-N 0.000 description 1
- 229960001259 diclofenac Drugs 0.000 description 1
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 1
- 150000005690 diesters Chemical class 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 125000004852 dihydrofuranyl group Chemical group O1C(CC=C1)* 0.000 description 1
- 125000005047 dihydroimidazolyl group Chemical group N1(CNC=C1)* 0.000 description 1
- 125000005052 dihydropyrazolyl group Chemical group N1(NCC=C1)* 0.000 description 1
- 125000005054 dihydropyrrolyl group Chemical group [H]C1=C([H])C([H])([H])C([H])([H])N1* 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- LNJAJHJFSKUCIR-UHFFFAOYSA-N ditert-butyl chloromethyl phosphate Chemical compound CC(C)(C)OP(=O)(OCCl)OC(C)(C)C LNJAJHJFSKUCIR-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 230000035622 drinking Effects 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 239000013583 drug formulation Substances 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 239000003974 emollient agent Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 229960001617 ethyl hydroxybenzoate Drugs 0.000 description 1
- 239000004403 ethyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010228 ethyl p-hydroxybenzoate Nutrition 0.000 description 1
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000010579 first pass effect Methods 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 230000030279 gene silencing Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 229950007593 homonicotinic acid Drugs 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 239000008172 hydrogenated vegetable oil Substances 0.000 description 1
- 150000002440 hydroxy compounds Chemical class 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 238000006713 insertion reaction Methods 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 210000004731 jugular vein Anatomy 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229960000448 lactic acid Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000008263 liquid aerosol Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007721 medicinal effect Effects 0.000 description 1
- 230000037353 metabolic pathway Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- RMIODHQZRUFFFF-UHFFFAOYSA-N methoxyacetic acid Chemical compound COCC(O)=O RMIODHQZRUFFFF-UHFFFAOYSA-N 0.000 description 1
- SWVMLNPDTIFDDY-FVGYRXGTSA-N methyl (2s)-2-amino-3-phenylpropanoate;hydrochloride Chemical compound Cl.COC(=O)[C@@H](N)CC1=CC=CC=C1 SWVMLNPDTIFDDY-FVGYRXGTSA-N 0.000 description 1
- ZAVRRPHYCPAADQ-UHFFFAOYSA-N methyl 2-[benzyl(methyl)amino]-3-methylpentanoate Chemical compound CN(C(C(=O)OC)C(CC)C)CC1=CC=CC=C1 ZAVRRPHYCPAADQ-UHFFFAOYSA-N 0.000 description 1
- CQJIUOHCJCHCAG-UHFFFAOYSA-N methyl 2-[chloromethoxycarbonyl(methyl)amino]-3-methylpentanoate Chemical compound CN(C(C(=O)OC)C(CC)C)C(=O)OCCl CQJIUOHCJCHCAG-UHFFFAOYSA-N 0.000 description 1
- ZZWPOYPWQTUZDY-UHFFFAOYSA-N methyl 2-aminobutanoate Chemical compound CCC(N)C(=O)OC ZZWPOYPWQTUZDY-UHFFFAOYSA-N 0.000 description 1
- PZXIEBDIPWIRGB-UHFFFAOYSA-N methyl 2-pyridin-3-ylacetate Chemical compound COC(=O)CC1=CC=CN=C1 PZXIEBDIPWIRGB-UHFFFAOYSA-N 0.000 description 1
- PYPIBOGODRELFJ-UHFFFAOYSA-N methyl 3-methyl-2-[methyl-[(2-methylpropan-2-yl)oxycarbonyl]amino]pentanoate Chemical compound CN(C(C(=O)OC)C(CC)C)C(=O)OC(C)(C)C PYPIBOGODRELFJ-UHFFFAOYSA-N 0.000 description 1
- VSDUZFOSJDMAFZ-VIFPVBQESA-N methyl L-phenylalaninate Chemical compound COC(=O)[C@@H](N)CC1=CC=CC=C1 VSDUZFOSJDMAFZ-VIFPVBQESA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 210000001589 microsome Anatomy 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- 125000002911 monocyclic heterocycle group Chemical group 0.000 description 1
- UOBSVARXACCLLH-UHFFFAOYSA-N monomethyl adipate Chemical compound COC(=O)CCCCC(O)=O UOBSVARXACCLLH-UHFFFAOYSA-N 0.000 description 1
- ACTNHJDHMQSOGL-UHFFFAOYSA-N n',n'-dibenzylethane-1,2-diamine Chemical compound C=1C=CC=CC=1CN(CCN)CC1=CC=CC=C1 ACTNHJDHMQSOGL-UHFFFAOYSA-N 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 238000011369 optimal treatment Methods 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- BOTREHHXSQGWTR-UHFFFAOYSA-N oxolane-3-carboxylic acid Chemical compound OC(=O)C1CCOC1 BOTREHHXSQGWTR-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- QNGNSVIICDLXHT-UHFFFAOYSA-N para-ethylbenzaldehyde Natural products CCC1=CC=C(C=O)C=C1 QNGNSVIICDLXHT-UHFFFAOYSA-N 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229960003975 potassium Drugs 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- RZWZRACFZGVKFM-UHFFFAOYSA-N propanoyl chloride Chemical compound CCC(Cl)=O RZWZRACFZGVKFM-UHFFFAOYSA-N 0.000 description 1
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 230000006920 protein precipitation Effects 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 238000012797 qualification Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 239000006215 rectal suppository Substances 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 229910001467 sodium calcium phosphate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- RFOHRSIAXQACDB-UHFFFAOYSA-M sodium;2-(2,4-dichlorophenoxy)acetate Chemical compound [Na+].[O-]C(=O)COC1=CC=C(Cl)C=C1Cl RFOHRSIAXQACDB-UHFFFAOYSA-M 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000012265 solid product Substances 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 229940083466 soybean lecithin Drugs 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000008227 sterile water for injection Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229960001367 tartaric acid Drugs 0.000 description 1
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 1
- BCNZYOJHNLTNEZ-UHFFFAOYSA-N tert-butyldimethylsilyl chloride Chemical compound CC(C)(C)[Si](C)(C)Cl BCNZYOJHNLTNEZ-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- NQRYJNQNLNOLGT-UHFFFAOYSA-N tetrahydropyridine hydrochloride Natural products C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 229940005605 valeric acid Drugs 0.000 description 1
- 210000003556 vascular endothelial cell Anatomy 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 229960001722 verapamil Drugs 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/20—Oxygen atoms
- C07D215/24—Oxygen atoms attached in position 8
- C07D215/26—Alcohols; Ethers thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/20—Oxygen atoms
- C07D215/24—Oxygen atoms attached in position 8
- C07D215/26—Alcohols; Ethers thereof
- C07D215/28—Alcohols; Ethers thereof with halogen atoms or nitro radicals in positions 5, 6 or 7
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/20—Oxygen atoms
- C07D215/24—Oxygen atoms attached in position 8
- C07D215/26—Alcohols; Ethers thereof
- C07D215/32—Esters
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/20—Oxygen atoms
- C07D215/24—Oxygen atoms attached in position 8
- C07D215/26—Alcohols; Ethers thereof
- C07D215/32—Esters
- C07D215/34—Carbamates
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/553—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having one nitrogen atom as the only ring hetero atom
- C07F9/576—Six-membered rings
- C07F9/58—Pyridine rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/553—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having one nitrogen atom as the only ring hetero atom
- C07F9/576—Six-membered rings
- C07F9/60—Quinoline or hydrogenated quinoline ring systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
R1は水素、C1-6アルキル基、S又はOから選ばれ、
XはO、N、S、-(CH2)n-、アリール基、又は複素環基から選ばれ、
ここで、
XがNから選ばれる場合、R0及びR2は、それぞれ独立して、水素、C1-6アルキル基、アリール基、又は複素環基から選ばれ、
Xがアリール基又は複素環基から選ばれる場合、R0及びR2は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
XがO、S又は-(CH2)n-から選ばれる場合、R2は存在せず、R0はC1-6アルキル基、シクロアルキル基、複素環基、-COR11、-C(O)OR12、
ここで、
R0が
ここで、
ZがCから選ばれる場合、R4、R5及びR6は、それぞれ独立して、水素、ハロゲン、アルキル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基、-OR12、-SR12、-C(O)R11、-C(O)OR12、-C(O)-(CH)m-C(O)R11、-OC(O)R11、-NRaRb、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、-O(CH2)mO(CH2)qR12、-N(Rc)C(O)-(CH)m-N(Rc)C(O)Rdから選ばれ、ここで、前記アルキル基、シクロアルキル基、複素環基、アリール基又はヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、OR12、SR12、NRaRb、-COR11、-C(O)OR12、-OC(O)R11、-N(Rc)C(O)Rd、-O(CH2)mO(CH2)qR12、シクロアルキル基、複素環基、アリール基、アリールアルキル基、ヘテロアリール基、ヘテロアリールアルキル基から選ばれる1つ又は複数の基によって置換されてもよく、前記アリール基、アリールアルキル基、ヘテロアリール基又はヘテロアリールアルキル基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基から選ばれる1つ又は複数の基によって置換されてもよく、又は
R4、R5及びR6のうち、1つは水素であり、残りの2つはZと一緒にシクロアルキル基又は複素環基を形成し、前記シクロアルキル基又は複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、-C(O)R11、-C(O)OR12、-OC(O)R11、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
ZがNから選ばれる場合、R6は存在せず、R4及びR5は、それぞれ独立して、水素、ハロゲン、アルキル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基、-OR12、-SR12、-C(O)R11、-C(O)OR12、-OC(O)R11、-NRaRb、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、-O(CH2)mO(CH2)qR12、-N(Rc)C(O)-(CH)m-N(Rc)C(O)Rdから選ばれ、ここで、前記アルキル基、シクロアルキル基、複素環基、アリール基、又はヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、OR12、SR12、NRaRb、-C(O)R11、-C(O)OR12、-OC(O)R11、-(CH)m-OC(O)R11、シクロアルキル基、複素環基、アリール基、アリールアルキル基、ヘテロアリール基、ヘテロアリールアルキル基から選ばれる1つ又は複数の基によって置換されてもよく、又は
R4、R5はZと一緒にシクロアルキル基又は複素環基を形成し、前記シクロアルキル基又は複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、-C(O)R11、-C(O)OR12、-OC(O)R11、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
ZがOを示す場合、R5及びR6は存在せず、R4はC1-6アルキル基、アリール基又は複素環基から選ばれ、ここで、前記C1-6アルキル基、アリール基又は複素環基は、さらに、1つ又は複数の-OHによって置換されてもよく、
又は
XがO、N、S、又は-(CH2)n-から選ばれる場合、R2は存在せず、R1、X及びR0は一緒にシクロアルキル基又は複素環基を形成し、前記シクロアルキル基又は複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、-NRaRb、-ORd、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Ra及びRbは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
又はRa及びRbはこれらが連結する原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、オキソ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
nは1~8の整数から選ばれ、
mは0~6の整数から選ばれ、
pは0、1又は2から選ばれ、
qは0~6の整数から選ばれる。)
R1は水素又はC1-6アルキル基から選ばれ、
R4、R5及びR6は、それぞれ独立して、水素、ハロゲン、アルキル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基、-OR12、-SR12、-C(O)R11、-C(O)OR12、-C(O)-(CH)m-C(O)R11、-OC(O)R11、-NRaRb、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、-O(CH2)mO(CH2)qR12、-N(Rc)C(O)-(CH)m-N(Rc)C(O)Rdから選ばれ、ここで、前記アルキル基、シクロアルキル基、複素環基、アリール基、又はヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、OR12、SR12、NRaRb、-COR11、-C(O)OR12、-OC(O)R11、-N(Rc)C(O)Rd、-O(CH2)mO(CH2)qR12、シクロアルキル基、複素環基、アリール基、アリールアルキル基、ヘテロアリール基、ヘテロアリールアルキル基から選ばれる1つ又は複数の基によって置換されてもよく、前記アリール基、アリールアルキル基、ヘテロアリール基又はヘテロアリールアルキル基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基から選ばれる1つ又は複数の基によって置換されてもよく、又は
R4、R5及びR6のうち、1つは水素であり、残りの2つはZと一緒にシクロアルキル基又は複素環基を形成し、前記シクロアルキル基又は複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、-C(O)R11、-C(O)OR12、-OC(O)R11、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、-NRaRb、-ORd、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Ra及びRbは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
又はRa及びRbはこれらが連結する原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、オキソ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
mは0~6の整数から選ばれ、
pは0、1又は2から選ばれ、
qは0~6の整数から選ばれる。)
R4、R5及びR6は、それぞれ独立して、水素、アルキル基、アリール基、ヘテロアリール基、-OR12、-SR12、-C(O)R11、-C(O)OR12、-C(O)-(CH)m-C(O)R11、-OC(O)R11、-(CH)m-N(Rc)C(O)R11 、-NRaRb、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、-O(CH2)mO(CH2)qR12、-N(Rc)C(O)-(CH)m-N(Rc)C(O)Rdから選ばれ、ここで、前記アルキル基、アリール基又はヘテロアリール基は、さらに、ハロゲン、ヒドロキシ基、アルキル基、OR12、SR12、NRaRb、-COR11、-C(O)OR12、-O(O)CR11、-N(Rc)C(O)Rd、-O(CH2)mO(CH2)qR12、シクロアルキル基、複素環基、アリール基、アリールアルキル基、ヘテロアリール基、ヘテロアリールアルキル基から選ばれる1つ又は複数の基によって置換されてもよく、前記アリール基、アリールアルキル基、ヘテロアリール基又はヘテロアリールアルキル基は、さらに、ハロゲン、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基から選ばれる1つ又は複数の基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、アルキル基、アルコキシ基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ヒドロキシ基、アルキル基、アルコキシ基、-NRaRb、-ORd、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Ra及びRbは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
又はRa及びRbはこれらが連結する原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、オキソ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
mは0~6の整数から選ばれ、
pは0、1又は2から選ばれ、
qは0~6の整数から選ばれる。
R4、R5及びR6は、それぞれ独立して、水素、アルキル基、アリール基、ヘテロアリール基、-OR12、-SR12、-C(O)R11、-C(O)OR12、-C(O)-(CH)m-C(O)R11、-OC(O)R11、-(CH)m-N(Rc)C(O)R11から選ばれ、ここで、前記アルキル基、アリール基又はヘテロアリール基は、さらに、ハロゲン、ヒドロキシ基、アルキル基、OR12、SR12、NRaRb、-COR11、-C(O)OR12、-O(O)CR11、-N(Rc)C(O)Rd、-O(CH2)mO(CH2)qR12、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、前記アリール基、アリールアルキル基、ヘテロアリール基又はヘテロアリールアルキル基は、さらに、ハロゲン、ヒドロキシ基から選ばれる1つ又は複数の基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、アルキル基、アルコキシ基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ヒドロキシ基、アルキル基、-ORd、-N(Rc)C(O)Rd、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Ra及びRbは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
又はRa及びRbはこれらが連結する原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、オキソ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
mは0~6の整数から選ばれ、
qは0~6の整数から選ばれる。
R4、R5及びR6のうち、1つは水素であり、残りの2つは連結する炭素原子と一緒にシクロアルキル基又は複素環基を形成し、前記シクロアルキル基又は複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、-C(O)R11、-C(O)OR12、-OC(O)R11、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、-NRaRb、-ORd、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヒドロキシアリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Ra及びRbは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
又はRa及びRbはこれらが連結する原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、オキソ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
pは0、1又は2から選ばれる。
R4、R5及びR6のうち、1つは水素であり、残りの2つは連結する炭素原子と一緒にシクロアルキル基又は複素環基を形成し、前記シクロアルキル基又は複素環基は、さらに、-C(O)R11、-C(O)OR12から選ばれる1つ又は複数の基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、アルキル基、アルコキシ基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、ヒドロキシ基、アルキル基、-ORd、-N(Rc)C(O)Rd、アリール基、ヒドロキシアリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、アルキル基、アルコキシ基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、アリール基、及びヘテロアリール基は、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよい。
R1は、水素又はC1-6アルキル基から選ばれ、
R4及びR5は、それぞれ独立して、水素、ハロゲン、アルキル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基、-OR12、-SR12、-C(O)R11、-C(O)OR12、-OC(O)R11、-NRaRb、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、-O(CH2)mO(CH2)qR12、-N(Rc)C(O)-(CH)m-N(Rc)C(O)Rdから選ばれ、ここで、前記アルキル基、シクロアルキル基、複素環基、アリール基、又はヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、OR12、SR12、NRaRb、-C(O)R11、-C(O)OR12、-O(O)CR11、-(CH)m-OC(O)R11、シクロアルキル基、複素環基、アリール基、アリールアルキル基、ヘテロアリール基、ヘテロアリールアルキル基から選ばれる1つ又は複数の基によって置換されてもよく、又は
R4、R5はN原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、-C(O)R11、-C(O)OR12、-O(O)CR11、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、-NRaRb、-ORd、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Ra及びRbは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
又はRa及びRbはこれらが連結する原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、オキソ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
mは0~6の整数から選ばれ、
pは0、1又は2から選ばれ、
qは0~6の整数から選ばれる。)
R4及びR5は、それぞれ独立して、水素、アルキル基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アリール基、又はヘテロアリール基は、さらに、ハロゲン、ヒドロキシ基、メルカプト基、アルキル基、-C(O)R11、-C(O)OR12、-O(O)CR11、-(CH)m-OC(O)R11、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、アルキル基から選ばれ、ここで、前記アルキル基は、さらに、ハロゲン、-ORd、-N(Rc)C(O)Rdから選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、アルキル基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
mは0~6の整数から選ばれ、
pは0、1又は2から選ばれる。
R1は、水素又はC1-6アルキル基から選ばれ、
Aは、C、O又はNから選ばれ、
R7及びR8は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、アルキル基、アルコキシ基、ハロアルキル基、ハロアルコキシ基から選ばれ、
R9は、水素、ハロゲン、アミノ基、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、-C(O)R11、-C(O)OR12、-OC(O)R11、シクロアルキル基、複素環基から選ばれ、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、-NRaRb、-ORd、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Ra及びRbは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
又はRa及びRbはこれらが連結する原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、オキソ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
pは0、1又は2から選ばれる。)
EはO又はNR14から選ばれ、
R10、R13、R14は、それぞれ独立して、水素、C1-6アルキル基、又はアリール基から選ばれ、前記C1-6アルキル基又はアリール基は、さらに、ハロゲン、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、シクロアルキル基、複素環基、アリール基、アリールアルキル基、ヘテロアリール基、ヘテロアリールアルキル基、-OR12、-COR11、-C(O)OR12、-OC(O)R11、-OC(O)OR12から選ばれる1つ又は複数の置換基によって置換されてもよく、
R11及びR12は、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、-NRaRb、-ORd、-N(Rc)C(O)Rd、-C(O)N(Ra)(Rb)、-N(Rc)S(O)pRd、-S(O)pN(Ra)(Rb)、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Ra及びRbは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
又はRa及びRbはこれらが連結する原子と一緒に複素環基を形成し、前記複素環基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、オキソ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
Rc及びRdは、それぞれ独立して、水素、ハロゲン、ヒドロキシ基、シアノ基、アミノ基、カルボキシ基、エステル基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アミノ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、アルケニル基、アルキニル基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよく、
pは0、1又は2から選ばれる。)
R10、R13、R14は、それぞれ独立して、水素又はC1-6アルキル基から選ばれ、前記C1-6アルキル基は、さらに、ハロゲン、ヒドロキシ基、メルカプト基、アルキル基、アルコキシ基、アリール基、ヘテロアリール基、-OR12、-COR11、-C(O)OR12、-OC(O)OR11から選ばれる1つ又は複数の置換基によって置換されてもよく、
R11及びR12は、それぞれ独立して、アルキル基、アリール基、ヘテロアリール基から選ばれ、ここで、前記アルキル基、アリール基、及びヘテロアリール基は、さらに、ハロゲン、アミノ基、ニトロ基、シアノ基、ヒドロキシ基、メルカプト基、カルボキシ基、エステル基、オキソ基、アルキル基、アルコキシ基、シクロアルキル基、複素環基、アリール基、ヘテロアリール基から選ばれる1つ又は複数の基によって置換されてもよい。
前記アルカリは、好ましくは、炭酸カリウム、炭酸ナトリウム、炭酸水素カリウム、炭酸水素ナトリウム、トリエチルアミン、ピリジンから選ばれ、前記溶媒は、好ましくは、ジクロロメタン、N,N-ジメチルホルムアミド、テトラヒドロフラン、t-ブタノールメチルエーテルから選ばれ、
R1、R4、R5及びR6は一般式(II)において定義されたとおりである。
前記アルカリは、好ましくは、炭酸カリウム、炭酸ナトリウム、炭酸水素カリウム、炭酸水素ナトリウム、トリエチルアミン、ピリジンから選ばれ、前記溶媒は、好ましくは、ジクロロメタン、N,N-ジメチルホルムアミド、テトラヒドロフラン、t-ブタノールメチルエーテルから選ばれ、
R4及びR5は一般式(III)において定義されたとおりである。
R4、R5及びR6は一般式(II)において定義されたとおりである。
前記アルカリは、好ましくは、炭酸カリウム、炭酸ナトリウム、炭酸水素カリウム、炭酸水素ナトリウム、トリエチルアミン、ピリジンであり、前記溶媒は、好ましくは、ジクロロメタン、N,N-ジメチルホルムアミド、テトラヒドロフラン、t-ブタノールメチルエーテルであり、
R10及びR13は一般式(V)において定義されたとおりである。
R10及びR13は、一般式(V)において定義されたとおりである。
本発明の目的を達成するために、本発明は、下記合成スキームを用いて本発明の一般式(I)化合物を製造する。
室温で、炭酸水素ナトリウム水溶液(60mL,3.5mol/L)、テトラブチル硫酸水素アンモニウム(TBAHS)(1.78g,5.24mmol)を、ニトロキソリン(10.00g,52.59mmol)のジクロロメタン(DCM)(100mL)溶液に加えて、20分間撹拌した。クロロメチルクロロスルホネート(10.42g,63.15mmol)を反応系に滴下し、室温で16時間撹拌した。反応液をろ過して、有機相をそれぞれ炭酸カリウム溶液、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物を、シリカゲルカラムクロマトグラフィー(溶離剤:ジクロロメタン)により精製して、5-ニトロ-8-クロロメチルオキシキノリン(2.5g,収率20%)を得た。
ステップ2:(5-ニトロキノリン-8-イルオキシ)メチルアセテート(1)の製造
室温で、酢酸(38mg,0.63mmol)、炭酸カリウム(104mg,0.75mmol)、ヨウ素ナトリウム(9mg,0.06mmol)をN,N-ジメチルホルムアミド(3mL)に加えて、均一に撹拌した。反応系を60℃に昇温して、10分間撹拌した後、5-ニトロ-8-クロロメチルオキシキノリン(150mg,0.63mmol)を加えて、1時間撹拌した。水を加えて反応をクエンチし、酢酸エチルで抽出して、有機相を飽和食塩水溶液で洗浄し、無水硫酸ナトリウムで有機相を乾燥させ、ろ過後、減圧濃縮させた。残留物をシリカゲルクロマトグラフィー分取プレート(溶離剤:5%メタノール/95%ジクロロメタン)により精製して、(5-ニトロキノリン-8-イルオキシ)メチルアセテート(145mg,収率88%)を得た。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.51 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.36 (d, J = 8.8 Hz, 1H), 6.17 (s, 2H), 2.16 (s, 3H)。
MS計算:262.2;MS実測:263.1 [M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.37 (d, J = 8.8 Hz, 1H), 6.19 (s, 2H), 2.44 (q, J = 7.5 Hz, 2H), 1.17 (t, J = 7.5 Hz, 3H)。
MS計算: 276.2;MS実測: 277.1 [M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.20 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.51 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.37 (d, J = 8.8 Hz, 1H), 6.19 (s, 2H), 2.64 (hept, J = 7.0 Hz, 1H), 1.19 (d, J = 7.0 Hz, 6H)。
MS計算: 290.3;MS実測: 291.1 [M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.20 (dd, J = 8.9, 1.6 Hz, 1H), 9.08 (dd, J = 4.1, 1.6 Hz, 1H), 8.51 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.37 (d, J = 8.8 Hz, 1H), 6.19 (s, 2H), 1.22 (s, 9H)。
MS計算: 304.3;MS実測: 305.1 [M+H]+。
1H NMR (400 MHz, CD3OD): δ 9.17-9.14 (m, 1H), 8.97-8.95 (m, 1H), 8.55 (d, J = 8.8 Hz, 1H), 7.84-7.81 (m, 1H), 7.58 (d, J = 8.8 Hz, 1H), 6.21 (s, 2H), 2.34-2.27 (m, 1H), 1.67-1.47 (m, 4H), 0.815 (t, J = 7.2 Hz, 6H)。
MS計算: 318.1;MS実測: 319.1 [M+H]+。
1-メチルピペラジン(1g,10mmol)をジクロロメタン(30mL)に溶解して、氷水浴にてトリエチルアミン(1.21g,12mmol)とクロロギ酸クロロメチル(1.29g,10mmol)を順次緩やかに滴下した。反応液を0℃で30分間撹拌した後、25℃に昇温して16時間撹拌した。反応を水(50mL)でクエンチした後、反応液をジクロロメタン(100mLx3)で抽出し、有機相を合わせた後、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させ、4-メチルピペラジン-1-ギ酸クロロメチル(1.7g、収率89%)を得た。
ステップ2:(5-ニトロキノリン-8-イルオキシ)メチル4-メチルピペラジン-1-カルボキシラート(6)の製造
ニトロキソリン(600mg,3.16mmol)と4-メチルピペラジン-1-ギ酸クロロメチル(915mg,4.74mmol)をN,N-ジメチルホルムアミド(15mL)に溶解し、その後、0℃で炭酸カリウム(870mg,6.31mmol)とヨウ素ナトリウム(45mg,0.32mmol)を加えた。反応液を60℃で4時間撹拌した。反応液を室温に降温して、水で反応をクエンチした後、ジクロロメタン(100mLx3)で抽出し、有機相を合わせて、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:5%メタノール/95%ジクロロメタン)により精製して、黄色固体生成物として(5-ニトロキノリン-8-イルオキシ)メチル4-メチルピペラジン-1-カルボキシラート(150mg、収率14%)を得た。
1H NMR (400 MHz, CDCl3) δ: 9.20 (dd, J = 8.8, 1.6 Hz, 1H), 9.06 (dd, J = 4.0, 1.2 Hz, 1H), 8.51 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.8, 4.4 Hz, 1H), 7.41 (d, J = 8.4 Hz, 1H), 6.21 (s, 2H), 3.52 (dd, J =10.0, 4.8 Hz, 4H), 2.39 (t, J = 4.8 Hz, 2H), 2.32 (t, J = 4.8 Hz, 2H), 2.28 (s, 3H)。
MS計算: 346.13;MS実測: 347.1 [M+H]+。
ステップ1の1-メチルピペラジンの代わりとしてモルホリンを用いた以外、実施例6の製造方法と同様にして、(5-ニトロキノリン-8-イルオキシ)メチルモルホリン-4-カルボキシラートを得た。
1H NMR (400 MHz, CDCl3) δ: 9.20-9.18 (s, 1H), 9.07-9.06 (s, 1H),8.50 (d, J = 8.8 Hz, 1H), 7.73-7.70 (m, 1H), 7.40 (d, J = 8.8 Hz, 1H), 6.22 (s, 2H), 3.68 (s, 2H), 3.61 (s, 2H), 3.50 (s, 4H)。
MS計算: 333;MS実測: 334[M+H]+。
8-(クロロメトキシ)-5-ニトロキノリン(400mg,1.68mmol)と4-(t-ブトキシ)-4-オキソ酪酸(584mg,3.36mmol)をDMF(10mL)に溶解して、炭酸カリウム(463mg,3.36mmolを加えた。反応液を25℃で3時間撹拌した。反応を水(100mL)でクエンチした後、反応液を酢酸エチル(20mLx2)で抽出し、有機相を合わせた後、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(PE:EA=1:1)により精製して、生成物としてt-ブチル(((5-ニトロキノリン-8-イル)オキシ)メチル)コハク酸エステル310mgを得た。
ステップ2:4-((5-ニトロキノリン-8-イルオキシ)メトキシ)-4-オキソ酪酸(8)の製造
t-ブチル(((5-ニトロキノリン-8-イル)オキシ)メチル)コハク酸エステル(230mg,0.718mmol)をHCl/ジオキサン10mLに入れて、室温で20分間撹拌した。反応液を減圧濃縮させ、生成物として4-((5-ニトロキノリン-8-イルオキシ)メトキシ)-4-オキソ酪酸(128mg、収率65%)を黄色固体として得た。
1H-NMR (400 MHz, DMSO-d6) δ: 12.3 (br, 1H).9.05 (d, J = 2.8 Hz, 1H), 9.00 (d, J = 8.8 Hz, 1H), 8.55 (d, J = 8.8 Hz, 1H), 7.87 (dd, J = 8.8, 4.0 Hz, 1H), 7.54 (d, J = 8.8 Hz, 1H), 6.14 (s, 2H), 2.60~2.65 (m, 2 Hz, 4H), 2.50~2.55 (m, 2H)。
MS計算: 320.26;MS実測: 321.1 [M+H]+。
1H NMR (400 MHz,DMSO-d6) δ: 8.95~9.10 (d, 2H), 8.47~8.54 (d, 2H), 7.33~7.89 (m,4H), 7.54 (d, J = 8.4 Hz, 1H),6.18 (s, 2H), 3.89 (s,2H), 4.72~4.75 (m, 2H)。
MS計算: 339.31;MS実測: 340.1[M+H]+。
1H NMR (400 MHz, DMSO-d6) δ 9.04 (dd, J = 4.1, 1.6 Hz, 1H), 9.00 (dd, J = 8.9, 1.6 Hz, 1H), 8.56 (d, J = 8.8 Hz, 1H), 7.87 (dd, J = 8.9, 4.1 Hz, 1H), 7.55 (d, J = 8.9 Hz, 1H), 6.14 (s, 2H), 3.30 (t, J = 6.6 Hz, 2H), 2.39 (t, J = 7.3 Hz, 2H), 1.56 - 1.45 (m, 2H), 1.35 - 1.24 (m, 2H), 1.15 (s, 6H)。
MS計算: 362.4;MS実測: 363.3[M+H]+。
1H NMR (400 MHz, DMSO-d6) δ 10.03 (dd, J = 4.1, 1.6 Hz, 1H), 9.99 (dd, J = 8.9, 1.5 Hz, 1H), 9.55 (d, J = 8.8 Hz, 1H), 8.86 (dd, J = 8.9, 4.1 Hz, 1H), 8.54 (d, J = 8.9 Hz, 1H), 7.13 (s, 2H), 4.53 (s, 3H), 4.32 (s, 4H), 3.42 (t, J = 7.0 Hz, 2H), 3.25 (t, J = 7.1 Hz, 2H)。
MS計算: 362.3;MS実測: 363.3[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.36 (d, J = 8.8 Hz, 1H), 6.18 (s, 2H), 4.47 (s, 1H), 3.07 (d, J = 6.4 Hz, 2H), 2.40 (t, J = 7.5 Hz, 2H), 1.69 - 1.60 (m, 2H), 1.42 (d, J = 10.2 Hz, 11H), 1.35 - 1.25 (m, 4H)。
MS計算: 447.5;MS実測: 448.4[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.5 Hz, 1H), 9.08 (dd, J = 4.1, 1.5 Hz, 1H), 8.41 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.20 - 7.03 (m, 6H), 6.17 (dd, J = 63.5, 6.5 Hz, 2H), 4.95 (d, J = 7.7 Hz, 1H), 4.62 (dd, J = 13.8, 6.8 Hz, 1H), 3.06 (d, J = 6.3 Hz, 2H), 1.40 (s, 9H)。
MS計算: 467.5;MS実測: 468.3[M+H]+。
N-(t-ブトキシカルボニルL)-S-メチル-L-システイン(590mg,2.5mmol)、炭酸カリウム(580mg,4.2mmol)、ヨウ素カリウム(83mg,0.5mmol)をN,N-ジメチルホルムアミド(5mL)に加えて、均一に撹拌した。反応系を60℃に昇温して、10分間撹拌した後、5-ニトロ-8-クロロメトキシキノリン(1a)(500mg,2.1mmol)を加えて、1時間撹拌した。水を加えて反応をクエンチし、酢酸エチルで抽出して、有機相を飽和食塩水溶液で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルクロマトグラフィー分取プレート(展開剤:5%メタノール/95%ジクロロメタン)により精製して、(S)-4-メチル1-(5-ニトロキノリン-8-イルオキシ)メチル2-(t-ブトキシカルボニルアミノ)サクシネート(200mg,収率33%)を得た。
ステップ2:(S)-4-メチル1-(5-ニトロキノリン-8-イルオキシ)メチル2-アミノサクシネート(14b)の製造
室温で、トリフルオロ酢酸(5mL)を(S)-4-メチル1-(5-ニトロキノリン-8-イルオキシ)メチル2-(t-ブトキシカルボニルアミノ)サクシネート(200mg,0.46mmol)のジクロロメタン(5mL)溶液に滴下した。反応液を室温で2時間撹拌した後、減圧濃縮させ、粗製品として(S)-4-メチル1-(5-ニトロキノリン-8-イルオキシ)メチル2-アミノサクシネート(220mg、収率99%)を得た。
ステップ3:S)-4-メチル1-(5-ニトロキノリン-8-イルオキシ)メチル2-アセチルアミノサクシネート(14)の製造
(S)-4-メチル1-(5-ニトロキノリン-8-イルオキシ)メチル2-アミノサクシネート(200mg,0.68mmol)、塩化アセチル(80mg,1.0mmol)をジクロロメタン(10mL)に溶解して、氷水浴の条件下でトリエチルアミン(140mg,2.0mmol)を緩やかに滴下し、室温に昇温して1時間撹拌した。反応液をジクロロメタン(100mL)に加えて、水で1回洗浄し、有機相を合わせた後、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させ、生成物(178mg、収率57%)を得た。
1H-NMR (400 Hz, CDCl3) δ: 9.20 (dd, J = 8.8, 1.6 Hz, 1H), 9.10 (dd, J = 4, 1.6 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.77 (dd, J = 8.8 Hz, 4.4 Hz, 1H), 7.35 (d, J = 8.8 Hz, 1H), 6.49 (d, J = 8 Hz, 1H), 6.23-6.27 (m, 2H), 4.94-4.98 (m, 1H), 3.61 (s, 3H), 3.03-3.09 (m, 1H), 3.85-2.90 (m, 1H), 2.03 (s, 3H).
室温で、炭酸カリウム(0.65g,4.2mmol)をBoc-グリシン(700mg,4.1mmol)、5-ニトロ-8-(クロロメトキシ)キノリン(1a)(500mg,2.1mmol)のN,N-ジメチルホルムアミド(10mL)溶液に加えた。室温で2時間反応させ、水30mLとジクロロメタン(20mLx2)を加えて抽出し、有機相を食塩水で洗浄し、減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(PE:EA=1:1)により精製して、白色固体として、収率75.7%、純度95%で生成物を600mg得た。
ステップ2:(5-ニトロキノリン-8-イルオキシ)メチル2-アミノアセテート塩酸塩(15b)の製造
室温で、(5-ニトロキノリン-8-イルオキシ)メチル2-(t-ブトキシカルボニルアミノ)アセテート(600mg,1.59mmol)をHCl/ジオキサン溶液10mLに加えて、室温20分間撹拌した。反応液を減圧濃縮させ、白色固体としての生成物600mgを純度97%得た。
ステップ3:((S)-(5-ニトロキノリン-8-イルオキシ)メチル2-(2-(t-ブトキシカルボニルアミノ)-4-メチルバレリルアミノ)アセテート(15c)の製造
室温で、(5-ニトロキノリン-8-イルオキシ)メチル2-アミノアセテート塩酸塩(500mg,1.6mmol)とBoc-L-ロイシン(553mg,2.4mmol)をDMF 10mLに投入して、0℃に降温し、1-ヒドロキシ-ベンゾ-トリアゾール(HOBt)(342mmol,2.4mmol)、1-エチル-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩(EDCI)(480mg,2.4mmol)、及びTEA(500mg,4.8mmol)を順次加えて、室温で1時間撹拌した。反応液を減圧濃縮させ、残留物をシリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール=15:1)により精製して、生成物80mgを純度97%で得た。
ステップ4:(S)-(5-ニトロキノリン-8-イルオキシ)メチル2-(2-アミノ-4-メチルバレリルアミノ)アセテート塩酸塩(15d)の製造
((S)-(5-ニトロキノリン-8-イルオキシ)メチル2-(2-(t-ブトキシカルボニルアミノ)-4-メチルバレリルアミノ)アセテート(80mg,0.16mmol)をHCl/ジオキサン(4M)10mLに投入して、20分間撹拌した。反応液を減圧濃縮させ、白色固体として生成物70mgを純度95%で得た。
ステップ5:(S)-(5-ニトロキノリン-8-イルオキシ)メチル2-(2-アセチルアミノ-4-メチルバレリルアミノ)アセテート(15)の製造
(S)-(5-ニトロキノリン-8-イルオキシ)メチル2-(2-アミノ-4-メチルバレリルアミノ)アセテート塩酸塩(70mg,0.16mmol)をジクロロメタン10mLに投入して、氷浴で冷却し、塩化アセチル(39mg,0.48mmol)を加えて、次に、TEA(80mg,0.8mmol)を緩やかに加えて、10℃で10分間撹拌した。反応液を減圧濃縮させ、残留物をシリカゲルカラムクロマトグラフィー(DCM:MeOH=10:1)により精製して、生成物(S)-(5-ニトロキノリン-8-イルオキシ)メチル2-(2-アセチルアミノ-4-メチルバレリルアミノ)アセテート(40mg、57%収率)を得た。淡黄色固体、純度97%であった。
1H-NMR (400 MHz, DMSO-d6) δ: 9.05 (dd, J = 4.4 Hz,1.4Hz,1H), 9.00 (dd, J = 8.8 Hz,1.6Hz,1H), 8.55 (d, J=8.8 Hz, 1H), 8.41(t,J=6Hz,1H) , 8.00(d,J=8.8Hz,1H), 7.88(dd, J = 8.8 Hz, 4.0Hz,1H), 7.54 (d, J=8.8 Hz, 1H), 6.14-6.18 (m, 2H), 4.26-4.32 (m, 1H), 3.85-3.99 (m, 2H) , 1.825 (s,3H),1.52-1.58 (m, 1H),1.35-1.39(m, 2H) ,0.81 (d, J=6.8Hz,3H), 0.78 (d, J=6.4Hz,3H)。
MS計算: 432.16;MS実測: 433.2 [M+H]+。
室温で、N-(t-ブトキシカルボニル)-S-メチル-L-システイン(590mg,2.5mmol)、炭酸カリウム(580mg,4.2mmol)、ヨウ素カリウム(83mg,0.5mmol)をN,N-ジメチルホルムアミド(5mL)に加えて、均一に撹拌した。反応系を60℃に昇温して、10分間撹拌した後、5-ニトロ-8-クロロメトキシキノリン(1a)(500mg,2.1mmol)を加えて、撹拌しながら1時間反応させた。水を加えて反応をクエンチし、酢酸エチルで抽出して、有機相を飽和食塩水溶液で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルクロマトグラフィー分取プレート(展開剤:5%メタノール/95%ジクロロメタン)により精製して、(R)-(5-ニトロキノリン-8-イルオキシ)メチル2-(t-ブトキシカルボニルアミノ)-3-(メチルチオ)プロピオネート(300mg,収率33%)を得た。
ステップ2:(R)-(5-ニトロキノリン-8-イルオキシ)メチル2-アミノ-3-(メチルチオ)プロピオネート(16b)の製造
室温で、トリフルオロ酢酸(2mL)を(R)-(5-ニトロキノリン-8-イルオキシ)メチル2-(t-ブトキシカルボニルアミノ)-3-(メチルチオ)プロピオネート(200mg,0.46mmol)のジクロロメタン(5mL)溶液に滴下した。反応液を室温で2時間撹拌した後、減圧濃縮させ、(R)-(5-ニトロキノリン-8-イルオキシ)メチル2-アミノ-3-(メチルチオ)プロピオネート(150mg、収率99%)を得た。
ステップ3:(R)-(5-ニトロキノリン-8-イルオキシ)メチル2-アセチルアミノ-3-(メチルチオ)プロピオネート(16)の製造
0℃で、(R)-(5-ニトロキノリン-8-イルオキシ)メチル2-アミノ-3-(メチルチオ)プロピオネート(200mg,0.68mmol)、塩化アセチル(80mg,1.0mmol)をジクロロメタン(10mL)に溶解して、氷水浴にてトリエチルアミン(140mg,2.0mmol)を緩やかに滴下し、室温に昇温して1時間撹拌した。反応液をジクロロメタン(100mL)に加えて、水で1回洗浄し、有機相を合わせた後、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させた。残留物を逆相高速液体クロマトグラフィー(カラムはEclipse XDB-C18(21.2mm×250mm,7μm)、移動相はアセトニトリル-0.1%ギ酸、流速は20.0mL/minである)により分離して、生成物(R)-(5-ニトロキノリン-8-イルオキシ)メチル2-アセチルアミノ-3-(メチルチオ)プロピオネート(178mg、収率57%)を得た。
1H-NMR (400 Hz, CDCl3) δ: 9.37-9.41 (m, 1H), 9.17-9.19 (m, 1H), 8.60 (d, J = 8.8 Hz, 1H), 7.89 (dd, J = 8.8, 4.4 Hz, 1H), 7.48(d, J = 8.8 Hz, 1H), 6.56 (d, J = 6.8 Hz, 1H), 6.19-6.24 (m, 2H), 4.83-4.88 (m, 1H), 2.90-3.0 (m, 2H), 2.10 (s, 3H), 2.06 (s, 3H)。
MS計算: 379.39;MS実測: 380.1 [M+H]+。
1H-NMR (400Hz, CDCl3) δ: 9.23 (d, J = 8.8 Hz, 1H), 9.11 (d, J = 2.8 Hz, 1H), 8.53 (d, J = 8.8 Hz, 1H), 7.77 (dd, J = 8.8, 4.4 Hz, 1H), 7.40 (d, J = 8.8 Hz, 1H), 6.21 (s, 2H), 4.20 (s, 2H), 3.11(s, 3H), 2.16 (s, 3H)。
MS計算: 333.30;MS実測: 334.1 [M+H]+。
室温で、5-ニトロ-8-(クロロメトキシ)キノリン(1a)(1.5g,6.3mmol)とL-Bocプロリン(2.02g,9.4mmol)をDMF 15mLに溶解して、炭酸カリウム(1.73g,12.6mmol)を加えた。室温で3時間反応させ、水70mLを加えて、酢酸エチル(50mLx2)で抽出し、有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(PE:EA=1:1)により精製して、生成物1-(t-ブチル) 2-(((5-ニトロキノリン-8-イル)オキシ)メチル)(S)-ピロール-1,2-炭酸ジエステル(2.8g、収率106%)を得た。
ステップ2:((5-ニトロキノリン-8-イル)オキシ)メチルL-プロリンエステル塩酸塩(18b)の製造
0℃で、1-(t-ブチル) 2-(((5-ニトロキノリン-8-イル)オキシ)メチル)(S)-ピロール-1,2-炭酸ジエステル(2.8g、6.71mmol)をHCl/ジオキサン30mLに投入して、室温で20分間撹拌した。反応液を減圧濃縮させ、生成物((5-ニトロキノリン-8-イル)オキシ)メチルL-プロリンエステル塩酸塩(2.3g、収率97%)を得た。
ステップ3:(S)-2-(5-ニトロキノリン-8-イルオキシ)メチル1-プロピルピロリジン-1,2-二カルボキシラート(18)の製造
室温で、((5-ニトロキノリン-8-イル)オキシ)メチルL-プロリンエステル塩酸塩(150mg,0.424mmol)をDCM 10mLに投入して、氷浴で0~5℃に冷却し、クロロギ酸プロピル(104mg,0.85mmol)を加えて、次に、TEA(170mg,1.7mmol)を緩やかに加えた。添加終了後、室温で20分間撹拌した。反応液を減圧濃縮させ、残留物をシリカゲルカラムクロマトグラフィー(PE:EA=1:1)により精製して、生成物(S)-2-(5-ニトロキノリン-8-イルオキシ)メチル1-プロピルピロリジン-1,2-二カルボキシラート(70mg、収率40%)を得た。
1H-NMR (400 MHz, DMSO-d6): δ 9.05~9.06 (m, 1H), 9.01 (dd, J=8.8,1.6Hz,1H), 8.56 (dd, J = 8.8, 4.8Hz, 1H), 7.87 (d, J = 8.8, 4.0Hz, 1H), 7.55 (dd, J = 8.8,2.2Hz, 1H), 6.14~6.15 (m,2H), 4.29-4.31 (m, 1H), 3.88-3.81 (m, 1H) ,3.47-3.59 (m, 1H) , 3.40-3.45 (m, 2H) , 1.75-1.95(m, 3H), 1.51~1.45(m,1H),0.83-0.85(m, 2H) 0.50-0.51(m, 2H)。
MS計算: 403.39 MS実測: 426.1[M+Na+]。
1H-NMR (400 MHz, DMSO-d6): δ:9.05 (dd, J = 4.0 Hz,1.2Hz,1H), 9.00 (dd, J = 8.8 Hz,1.2Hz,1H), 8.55 (d, J=8.8 Hz, 1H), 7.88(dd, J = 4.0 Hz,8.8Hz,1H),7.55 (d, J=8.8 Hz, 1H), 6.11-6.24 (m, 2H), 4.34-4.31 (m, 1H), 3.55-3.35 (m, 2H) ,2.34-2.27 (m, 1H), 2.19-1.79(m, 3H) ,1.94 (s, 3H)。
MS計算: 359.3; MS 実測: 360.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:9.05 (d, J = 4.0 Hz,1H), 9.00 (d, J = 8.8 Hz, 1H), 8.56 (d, J=8.8 Hz, 1H), 7.89-7.86 (dd, J = 4.0 Hz,8.8Hz,1H),7.55 (d, J=8.8 Hz, 1H), 6.24-6.11 (m, 2H), 4.36-4.33 (m, 1H), 3.59-3.68 (m, 2H) , 2.51-2.66(m, 1H) , 2.14~2.19(m、1H),1.92-1.85(m, 2H) , 1.83-1.78(m, 1H) ,0.95 (d, J=6.8 Hz .3H), 0.89 (d, J=6.8 Hz .3H)。
MS計算: 387.3; MS 実測: 388.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:9.05 (m,1H), 9.00 (m, 1H), 8.56 (d, J=8.0 Hz, 1H), 7.88(d, J = 5.2Hz,1H),7.55 (d, J=7.6 Hz, 1H), 6.24-6.11 (m, 2H), 4.35 (m, 1H), 3.66 (m, 2H) , 2.08(m, 1H), 1.88(m, 2H) , 1.70(m, 1H) , 1.09 (s, 9H)。
MS計算: 401.4; MS 実測: 402.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ: 9.05 (dd, J = 4.0 Hz,1.2Hz,1H), 9.00 (dd, J = 8.8 Hz,1.2Hz,1H), 8.56(d, J=8.8 Hz, 1H), 7.88 (dd, J = 4.0 Hz,8.8Hz,1H),7.55 (d, J=8.8 Hz, 1H), 6.15 (m, 2H), 4.34-4.31 (m, 1H), 3.55-3.34 (m, 2H) ,2.18-2.14 (m, 1H), 1.91-1.78(m, 3H) ,1.94 (s, 3H)。
MS 計算: 359.3; MS 実測: 360.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:9.05 (d, J = 2.8 Hz,1H), 9.00 (d, J = 8.4 Hz, 1H), 8.56 (d, J=8.8 Hz, 1H), 7.88 (dd, J = 4.0 Hz,8.8Hz,1H),7.55 (d, J=8.8 Hz, 1H), 6.19 (d, J=6.4 Hz, 1H), 6.11 (d, J=6.4 Hz,1H), 4.36-4.33 (m, 1H), 3.58-3.55 (m, 2H) , 2.70-2.63(m, 1H), 2.19-2.14(m, 1H), 1.92-1.87(m, 2H) , 1.82-1.77(m, 1H) ,0.95 (d, J=6.8 Hz 、3H), 0.89 (d, J=6.8 Hz, 3H)。
MS 計算: 387.3; MS 実測: 388.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:9.06 (dd, J = 4.0 Hz,1.2Hz,1H), 9.00 (dd, J = 8.8 Hz,1.2Hz,1H), 8.55 (d, J=8.8 Hz, 1H), 7.88 (dd, J = 4.0 Hz,8.8Hz,1H),7.55 (d, J=8.8 Hz, 1H), 6.19 (d, J=6.8 Hz, 1H), 6.11 (d, J=6.8 Hz,1H), 4.36-4.33 (m, 1H), 3.67-3.64 (m, 2H) ,2.11-2.04 (m, 1H), 1.90-1.85(m, 2H) , 1.72-1.67(m, 1H),1.09 (s, 9H)。
MS計算: 401.2; MS 実測: 402.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:9.01~9.07 (m, 2H), 8.67~8.74 (m, 2H), 8.39~8.51 (m, 1H), 7.86~7.90 (m,1H), 7.30~7.60 (m,3H), 6.02~6.28(m,2H), 4.52-4.58 (m, 1H), 3.50-3.58 (m, 2H) ,2.29-2.33 (m, 1H), 1.79-1.96(m,3H)。
MS計算: 422.4; MS 実測: 423.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:8.98~9.06 (m, 2H), 8.67~8.74 (m, 2H), 8.39~8.51 (m, 1H), 7.86~7.90 (m,2H), 7.54~7.59 (m,2H), 6.17~6.28 (m,2H), 4.52-4.58 (m, 1H), 3.40-3.48 (m, 2H) ,2.29-2.33 (m, 1H), 1.79-1.96(m,3H)。
MS計算: 422.4; MS 実測: 423.1 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:8.98~9.07 (m, 2H), 8.67~8.74 (m, 2H), 8.39~8.51 (m, 1H), 7.86~7.90(m,1H), 7.30~7.60 (m,3H), 6.02~6.28 (m,2H), 4.52-4.58 (m, 1H), 3.40-3.48 (m, 2H) ,2.29-2.33 (m, 1H), 1.79-1.96(m,3H)。
MS計算: 422.4; MS 実測: 423.1 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:9.19(s,1H), 9.04~9.05(m,1H),8.98~9.07 (m, 2H), 8.48~8.55 (m, 1H), 8.19~8.24 (m, 1H), 7.86~7.90(m,1H), 7.52~7.56(m,1H), 6.95~6.97(m,2H), 6.61~6.65(m,2H), 6.02~6.28(m,2H), 4.53-4.57 (m, 1H), 4.37-4.40 (m, 1H) , 3.65-3.70 (m, 1H), 3.41-3.47(m,1H) , 2.61-2.67(m,1H) , 2.41-2.47(m,1H), 2.11-2.18(m,1H) , 1.80-1.81(m,3H), 1.72(s,3H)。
MS計算: 522.51; MS 実測: 523.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ:8.98~9.07 (m, 2H), 8.77(br,1H)8.54~8.56 (m, 1H), 8.19~8.24 (m, 1H), 7.86~7.90 (m,1H), 7.52~7.56 (m,1H), 615~6.16 (m,2H), 4.37-4.41 (m, 1H), 4.06-4.07 (m, 1H) ,3.65-3.70 (m, 3H), 2.16-2.20 (m,1H) , 1.78-1.90 (m,3H) ,1.36 (s,9H), 0.84(d,J = 8Hz , 3H)。
MS計算: 518.52; MS 実測: 519.2 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ: 8.98~9.07 (m, 2H), 8.48~8.55 (m, 1H), 8.19~8.24 (m, 1H), 7.86~7.90(m,1H),7.52~7.56(m,1H), 6.02~6.28(m,2H), 4.85-4.95 (m, 1H), 4.40-4.60 (m, 2H) ,3.65-3.70 (m, 3H), 1.80-2.01(m,7H)。
MS計算: 446.42; MS 実測: 447.1 [M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.49 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.37 (d, J = 8.8 Hz, 1H), 6.26 (s, 2H), 4.12 (s, 2H), 3.45 (s, 3H)。
MS計算: 292.2;MS実測: 293.1[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.5 Hz, 1H), 9.07 (dd, J = 4.1, 1.5 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.71 (dd, J = 8.9, 4.1 Hz, 1H), 7.36 (d, J = 8.8 Hz, 1H), 6.18 (s, 2H), 3.22 (p, J = 8.3 Hz, 1H), 2.37 - 2.16 (m, 4H), 2.06 - 1.84 (m, 2H)。
MS計算: 302.3;MS実測: 303.1[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.5 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.36 (d, J = 8.8 Hz, 1H), 6.21 (q, J = 6.5 Hz, 2H), 4.01 - 3.91 (m, 2H), 3.84 (qd, J = 14.9, 8.3 Hz, 2H), 3.18 (ddt, J = 8.9, 7.8, 5.9 Hz, 1H), 2.28 - 2.09 (m, 2H)。
MS計算: 318.3;MS実測: 319.1[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.30 (s, 1H), 9.17 (s, 1H), 8.55 (s, 1H), 8.03 (s, 1H), 7.81 (s, 1H), 7.61 (t, J = 7.3 Hz, 1H), 7.47 (s, 1H), 7.31 (s, 1H), 7.13 (d, J = 8.0 Hz, 1H), 6.40 (s, 2H), 2.31 (s, 3H)。
MS計算: 382.3;MS実測: 383.1[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.18 (dd, J = 8.9, 1.5 Hz, 1H), 9.06 (dd, J = 4.1, 1.5 Hz, 1H), 8.40 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.29 (d, J = 2.5 Hz, 1H), 7.24 (d, J = 8.8 Hz, 1H), 6.91 (dd, J = 8.8, 2.5 Hz, 1H), 6.68 (d, J = 8.8 Hz, 1H), 6.26 (s, 2H), 4.79 (s, 2H)。
MS計算: 423.2;MS実測: 423.0[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.49 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.37 (d, J = 8.8 Hz, 1H), 6.23 (s, 2H), 3.77 - 3.68 (m, 4H), 3.31 (s, 2H), 2.63 - 2.53 (m, 4H)。
MS計算: 347.3;MS実測: 348.2[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.14 (dd, J = 8.9, 1.6 Hz, 1H), 9.03 (dd, J = 4.1, 1.6 Hz, 1H), 8.24 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.9, 4.1 Hz, 1H), 7.35 (dd, J = 7.1, 2.4 Hz, 2H), 7.25 (dd, J = 5.2, 1.9 Hz, 2H), 6.91 (d, J = 8.8 Hz, 1H), 6.18 (dd, J = 31.0, 6.4 Hz, 2H), 5.24 (s, 1H), 3.39 (s, 1H)。
MS計算: 354.3;MS実測: 355.1[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.14 (dd, J = 8.9, 1.6 Hz, 1H), 9.03 (dd, J = 4.1, 1.6 Hz, 1H), 8.24 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.9, 4.1 Hz, 1H), 7.35 (dd, J = 7.1, 2.4 Hz, 2H), 7.25 (dd, J = 5.2, 1.9 Hz, 2H), 6.91 (d, J = 8.8 Hz, 1H), 6.18 (dd, J = 31.1, 6.4 Hz, 2H), 5.24 (s, 1H), 3.40 (s, 1H)。
MS計算: 354.3;MS実測: 355.1[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.37 (d, J = 8.8 Hz, 1H), 6.18 (s, 2H), 2.39 (t, J = 7.4 Hz, 2H), 1.69 (dt, J = 14.8, 7.4 Hz, 2H), 0.94 (t, J = 7.4 Hz, 3H)。
MS計算: 290.3;MS実測: 291.1[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.71 (dd, J = 8.9, 4.1 Hz, 1H), 7.36 (d, J = 8.8 Hz, 1H), 6.18 (s, 2H), 2.40 (t, J = 7.5 Hz, 2H), 1.68 - 1.60 (m, 2H), 1.33 - 1.22 (m, 4H), 0.91 - 0.79 (m, 3H)。
MS計算: 318.3;MS実測: 319.2[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.72 (dd, J = 8.9, 4.1 Hz, 1H), 7.37 (d, J = 8.8 Hz, 1H), 6.18 (s, 2H), 2.40 (t, J = 7.5 Hz, 2H), 1.64 (dd, J = 14.6, 7.4 Hz, 2H), 1.32 - 1.16 (m, 8H), 0.84 (t, J = 7.0 Hz, 3H)。
MS計算: 346.4;MS実測: 347.2[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.20 (dd, J = 8.9, 1.6 Hz, 1H), 9.07 (dd, J = 4.1, 1.6 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.71 (dd, J = 8.9, 4.1 Hz, 1H), 7.36 (d, J = 8.8 Hz, 1H), 6.18 (s, 2H), 2.40 (t, J = 7.5 Hz, 2H), 1.63 (dt, J = 15.2, 7.5 Hz, 2H), 1.32 - 1.17 (m, 12H), 0.86 (t, J = 6.9 Hz, 3H)。
MS計算: 374.4;MS実測: 375.2[M+H]+。
1H-NMR (400 Hz, CDCl3) δ: 9.22 (dd, J = 8.8, 1.2 Hz, 1H), 9.10 (dd, J = 4.0, 1.6 Hz, 1H), 8.52 (d, J = 8.8 Hz, 1H), 7.77 (dd, J = 8.8 Hz, 4.0 Hz, 1H), 7.35 (d, J = 9.2 Hz, 1H), 6.20 (s, 2H), 2.41 (t, J = 3.6 Hz, 2H), 1.61-1.68 (m, 2H), 1.23-1.25 (m, 12H), 0.87-0.91 (m, 3H), 0.05-0.09 (4H)。
MS計算: 402.49;MS実測: 403.3 [M+H]+。
室温で、メタノールナトリウム(170mg,3.15mmol)、ヨウ素カリウム(87mg,0.52mmol)をニトロキソリン(500mg,2.63mmol)のN-メチルピロリドン(12.5mL)溶液に加えた。反応系を60℃に昇温して、15分間撹拌した後、2-クロロシクロペンタノン(623mg,5.25mmol)を加えて、撹拌しながら7時間反応させた。水を加えて反応をクエンチし、酢酸エチルで抽出して、有機相を飽和食塩水溶液で洗浄し、無水硫酸ナトリウムで有機相を乾燥させ、ろ過後、濃縮させ、50%石油エーテル/50%酢酸エチルのシリカゲルカラムにより精製して、2-(5-ニトロキノリン-8-オキシ)-シクロペンタノン(240mg、収率34%)を得た。
ステップ2:6-(5-ニトロキノリン-8-イルオキシ)-テトラヒドロピラン-2-オン(44)の製造
室温で、炭酸水素ナトリウム(56mg,0.67mmol)を2-(5-ニトロキノリン-8-オキシ)-シクロペンタノン(44a)(140mg,0.51mmol)のジクロロメタン(2mL)溶液に加えた。反応系を0℃に降温し、m-クロロペルオキシ安息香酸(m-CPBA)(純度:85%,136mg,0.67mmol)を加えて、室温に自然昇温して、16時間撹拌した。水を加えて反応をクエンチし、ジクロロメタンで抽出し、有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルクロマトグラフィー分取プレート(展開剤:5%メタノール/95%ジクロロメタン)により精製して、6-(5-ニトロキノリン-8-イルオキシ)-テトラヒドロピラン-2-オン(94mg、収率63%)を得た。
1H NMR (400 MHz, CDCl3) δ 9.17 (dd, J = 8.9, 1.5 Hz, 1H), 9.04 (dd, J = 4.1, 1.5 Hz, 1H), 8.48 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.9, 4.1 Hz, 1H), 7.51 (d, J = 8.8 Hz, 1H), 6.39 (t, J = 3.3 Hz, 1H), 2.89 - 2.63 (m, 2H), 2.56 - 2.44 (m, 2H), 2.37 - 1.97 (m, 2H)。
MS計算: 288.3;MS実測: 289.1[M+H]+。
1H-NMR (400 Hz, CDCl3) δ: 9.20 (dd, J = 6.0 Hz, 1H), 9.08 (d, J = 2.8 Hz, 1H), 8.51 (d, J = 8.8 Hz, 1H), 7.77 (dd, J = 8.8 Hz, 4.0 Hz, 1H), 7.40 (d, J = 8.8 Hz, 1H), 6.26 (s, 2H), 4.27 (s, 2H), 3.75-3.76 (m, 2H), 3.69-3.70 (m, 2H), 3.63-3.65 (m, 2H), 3.53-3.55 (m, 2H), 3.37 (s,3H)。
MS計算: 380.35;MS実測: 381.1 [M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.18 (dd, J = 8.9, 1.6 Hz, 2H), 9.06 (dd, J = 4.1, 1.6 Hz, 2H), 8.49 (d, J = 8.8 Hz, 2H), 7.71 (dd, J = 8.9, 4.1 Hz, 2H), 7.34 (d, J = 8.8 Hz, 2H), 6.16 (s, 4H), 2.41 (s, 4H), 1.68 (t, J = 3.2 Hz, 4H)。
MS計算: 550.5;MS実測: 551.3[M+H]+。
0℃で、塩化アセチル(1.00g,12.74mmol)をアセトアルデヒド(0.56g,12.71mmol)と塩化亜鉛(0.17g,1.25mmol)のジクロロメタン(20mL)溶液に緩やかに加えて、反応液を0℃で10分間撹拌した後、室温に昇温して、16時間撹拌した。水を加えて反応をクエンチし、ジクロロメタンで抽出し、有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させ、粗製品として酢酸-1-クロロエチルエステル(1.39g)を得た。
ステップ2:1-(5-ニトロキノリン-8-イルオキシ)エチルアセテート(47)の製造
室温で、メタノールナトリウム(68mg,1.26mmol)、ヨウ素カリウム(17mg,0.10mmol)をニトロキソリン(200mg,1.05mmol)のN-メチルピロリドン(5mL)溶液に加えた。反応系を60℃に昇温して、15分間撹拌した後、酢酸-1-クロロエチルエステル(193mg,1.57mmol)を加えて、16時間撹拌した。水を加えて反応をクエンチし、酢酸エチルで抽出して、有機相を飽和食塩水溶液で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルクロマトグラフィー分取プレート(展開剤: 5%メタノール/95%ジクロロメタン)により精製して、1-(5-ニトロキノリン-8-イルオキシ)エチルアセテート(124mg、収率43%)を得た。
1H NMR (400 MHz, CDCl3) δ 9.18 (dd, J = 8.9, 1.6 Hz, 1H), 9.08 (dd, J = 4.1, 1.6 Hz, 1H), 8.47 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.9, 4.1 Hz, 1H), 7.21 (d, J = 8.8 Hz, 1H), 6.97 (q, J = 5.3 Hz, 1H), 2.10 (s, 3H), 1.87 (d, J = 5.3 Hz, 3H)。
MS 計算:276.2;MS 実測: 277.1 [M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.18 (dd, J = 8.9, 1.5 Hz, 1H), 9.08 (dd, J = 4.1, 1.5 Hz, 1H), 8.46 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.9, 4.1 Hz, 1H), 7.20 (d, J = 8.8 Hz, 1H), 6.99 (q, J = 5.2 Hz, 1H), 2.38 (q, J = 7.5 Hz, 2H), 1.87 (d, J = 5.3 Hz, 3H), 1.12 (t, J = 7.5 Hz, 3H)。
MS 計算.:290.3;MS実測 : 291.1 [M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.18 (dd, J = 8.9, 1.2 Hz, 1H), 9.08 (dd, J = 3.9, 1.1 Hz, 1H), 8.46 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.9, 4.1 Hz, 1H), 7.18 (d, J = 8.8 Hz, 1H), 6.98 (q, J = 5.2 Hz, 1H), 2.64 - 2.51 (m, 1H), 1.87 (d, J = 5.2 Hz, 3H), 1.14 (dd, J = 14.4, 7.0 Hz, 6H)。
MS 計算:304.3;MS 実測:305.2 [M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.19 (dd, J = 8.9, 1.5 Hz, 1H), 9.08 (dd, J = 4.1, 1.5 Hz, 1H), 8.45 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.9, 4.1 Hz, 1H), 7.15 (d, J = 8.8 Hz, 1H), 6.96 (q, J = 5.2 Hz, 1H), 1.88 (d, J = 5.2 Hz, 3H), 1.17 (s, 9H)。
MS 計算.:318.3;MS 実測: 319.2 [M+H]+。
1H NMR (400 MHz, CDCl3) δ: 9.20-9.17 (m, 1H), 9.08-9.07 (m, 1H), 8.45 (d, J = 8.4 Hz, 1H), 7.72-7.68 (m, 1H), 7.21 (d, J = 8.8 Hz, 1H), 7.03-7.01 (m, 1H), 2.25-2.11 (m, 1H), 1.88 (d, J = 5.2 Hz, 3H), 1.60-1.49 (m, 4H), 0.88-0.81 (m, 6H)。
MS計算: 332;MS実測: 333[M+H]+。
N-メチル-2,3-ジヒドロキシプロピルアミン(1g,10mmol)をアセトニトリル(40mL)とメタノール(8mL)の混合溶媒に溶解して、氷水浴にてトリエチルアミン(1.15g,11.4mmol)とクロロギ酸クロロメチル(1.35g,10.48mmol)を緩やかに順次滴下し、反応液を0℃で30分間撹拌した後、25℃に昇温して16時間撹拌した。反応液を水(50mL)でクエンチし、ジクロロメタン(100mLx3)で抽出し、有機相を合わせて、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させ、生成物としてクロロメチル2,3-ジヒドロキシプロピル(メチル)カーバメート(1.7g、収率89%)を得た。
ステップ2:(5-ニトロキノリン-8-イルオキシ)メチル2,3-ジヒドロキシプロピル(メチル)カーバメート(52)の製造
ニトロキソリン(600mg,3.16mmol)とクロロメチル2,3-ジヒドロキシプロピル(メチル)カーバメート(940mg,4.7mmol)をN,N-ジメチルホルムアミド(15mL)に溶解し、その後、0℃で炭酸カリウム(871mg,6.31mmol)とヨウ素ナトリウム(47mg,0.32mmol)を加えて、反応液を60℃で4時間撹拌した。反応を室温に回復して、水で反応をクエンチし、ジクロロメタン(100mLx3)で抽出し、有機相を合わせて、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:5%メタノール/95%ジクロロメタン)により精製して生成物(5-ニトロキノリン-8-イルオキシ)メチル2,3-ジヒドロキシプロピル(メチル)カーバメート(300mg、収率27%)を得た。
1H NMR (400 MHz, CDCl3) δ: 9.20-9.18 (m, 1H), 9.06 (dd, J = 4.0, 1.2 Hz, 1H), 8.51 (d, J = 8.8 Hz, 1H), 7.73-7.70 (m, 1H), 7.40 (d, J = 8.8 Hz, 1H), 6.21-6.13 (m, 2H), 3.88 (s, 1H), 3.67-3.40 (m, 4H), 3.04-2.95 (m, 5H)。
MS計算: 351.11;MS実測: 352.1 [M+H]+。
0℃で、2,4-ジメトキシベンズアルデヒド(720mg,4.34mmol)と酢酸水素化ホウ素ナトリウム(1.38g,6.51mmol)をトリエチルアミン(658mg,6.51mmol)と2-アミノ-酢酸メチル塩酸塩(1.00g,6.51mmol)のジクロロメタン(40mL)溶液に順次緩やかに加えた。反応液を60℃で2時間撹拌した後、室温に冷却した。水を加えて反応をクエンチし、反応液をジクロロメタン(100mLx3)で抽出し、有機相を1 M 塩酸、1 M炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:5%メタノール/95%ジクロロメタン)により精製して、2-(2,4-ジメトキシベンジルアミノ)酢酸メチル(1.1g、収率95%)を得た。
MS[M+H]+: 240.0。
ステップ2:2-(((クロロメトキシ)ホルミル)(2,4-ジメトキシベンジル)アミノ)酢酸メチル(53b)の製造
0℃で、クロロギ酸クロロメチル(595mg,4.60mmol)を2-(2,4-ジメトキシベンジルアミノ)酢酸メチル(1.0g,4.39mmol)とトリエチルアミン(485mg,4.80mmol)のジクロロメタン(20mL)溶液に緩やかに滴下した。反応液を50℃で2時間撹拌した後、室温に冷却した。水を加えて反応をクエンチし、次に、反応液をジクロロメタン(100mLx3)で抽出し、有機相を1 M 塩酸、1 M炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:5%n-ヘキサン/95%酢酸エチル)により精製して、2-(((クロロメトキシ)ホルミル)(2,4-ジメトキシベンジル)アミノ)酢酸メチル(1.00g、収率69%)を得た。
MS[M+H]+:332.1。
ステップ3:2-((2,4-ジメトキシベンジル)(((5-ニトロキノリン-8-イルオキシ)メトキシ)ホルミル)アミノ)酢酸メチル(53c)の製造
室温で、2-(((クロロメトキシ)ホルミル)(2,4-ジメトキシベンジル)アミノ)酢酸メチル(1.05g,2.79mmol)をニトロキソリン(360mg,1.9mmol)、炭酸カリウム(385mg,2.79mmol)、ヨウ素ナトリウム(30mg,0.19mmol)のN,N-ジメチルホルムアミド(15mL)溶液に加えた。反応液を50℃で2時間撹拌した後、室温に冷却した。水を加えて反応をクエンチし、次に、反応液をジクロロメタン(100mLx3)で抽出し、有機相を1 M 塩酸、1 M炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤: 5%n-ヘキサン/95%酢酸エチル)により精製して、2-((2,4-ジメトキシベンジル)(((5-ニトロキノリン-8-イルオキシ)メトキシ)ホルミル)アミノ)酢酸メチル(440mg、収率48%)を得た。
MS[M+H]+:486.0。
ステップ4:2-(((5-ニトロキノリン-8-イルオキシ)メトキシ)ホルミルアミノ)酢酸メチル(53)の製造
室温で、トリフルオロ酢酸(8mL)を2-((2,4-ジメトキシベンジル)(((5-ニトロキノリン-8-イルオキシ)メトキシ)ホルミル)アミノ)酢酸メチル(440mg,0.91mmol)のジクロロメタン(8mL)溶液に滴下した。反応液を室温で2時間撹拌した後、水を加えて反応をクエンチし、次に、反応液をジクロロメタン(100mLx3)で抽出し、有機相を1 M 塩酸、1 M炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:50%n-ヘキサン/50%酢酸エチル)により精製して、2-(((5-ニトロキノリン-8-イルオキシ)メトキシ)ホルミルアミノ)酢酸メチル(200mg、収率67%)を得た。
1H NMR (400 MHz, CDCl3) δ: 9.18 (dd, J = 8.8, 1.6 Hz, 1H), 9.06 (dd, J = 4.0, 1.6 Hz, 1H), 8.49 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.4, 4.4 Hz, 1H), 7.40 (d, J = 9.2 Hz, 1H), 6.18 (s, 2H), 5.41 (s, 1H), 4.01 (d, J = 5.6 Hz, 2H), 3.77 (s, 3H)。
MS計算: 335.08;MS実測: 336.1 [M+H]+。
1H NMR (400 MHz, CDCl3): δ 9.19 (dd, J = 8.8, 1.6 Hz, 1H), 9.06 (s, 1H), 8.49 (d, J = 8.8 Hz, 1H), 7.70 (d, J = 8.8 Hz, 1H), 7.40 (d, J = 8.8 Hz, 1H), 6.17 (d, J = 7.6 Hz, 2H), 5.43 (d, J = 8.0 Hz, 1H), 4.36 (d, J = 5.6 Hz, 1H), 3.75 (s, 3H), 1.90 (s, 1H), 1.72 (d, J = 7.2 Hz, 1H), 0.90 (d, J = 7.4 Hz, 3H)。
MS計算:363;MS実測:364。
1H NMR (400 MHz, CDCl3) δ: 9.19 (dd, J = 9.2, 1.2 Hz, 1H), 9.06 (dd, J = 4.0, 1.6 Hz, 1H), 8.49 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 9.2, 4.4 Hz, 1H), 7.40 (dd, J =8.8, 1.2 Hz, 1H), 6.18-6.16 (m, 2H), 5.38 (m, 1H), 4.45 (dd, J = 9.2, 4.0 Hz, 1H), 3.74 (s, 3H), 1.99-1.87 (m, 1H), 1.43-1.37 (m, 1H), 1.21-1.14 (m, 1H), 0.95-0.89 (m, 4H), 0.84-0.82 (d, J = 8.8 Hz, 2H)。
MS計算:391.14;MS実測:392.1 [M+H]+。
0℃で、2-アミノ-3-メチル吉草酸メチル塩酸塩(4.0g,21.9mmol)と酢酸水素化ホウ素ナトリウム(9.2g,43.4mmol)をベンズアルデヒド(1.6g,14.7mmol)とトリエチルアミン(2.2g,21.9mmol)のジクロロメタン(80mL)溶液に順次緩やかに加えた。反応液を0℃で30分間撹拌した後、室温に昇温して16時間撹拌しつづけた。飽和炭酸水素ナトリウム水溶液(20mL)で反応をクエンチし、反応液をジクロロメタン(150mLx3)で抽出し、有機相を合わせて、乾燥させ、減圧濃縮させて、粗製品としてN-ベンジル-2-アミノ-3-メチル吉草酸メチル。(4.2g、収率100%)を得た。
MS[M+H]+:236.0。
ステップ2:N-メチル-N-ベンジル-2-アミノ-3-メチル吉草酸メチル(56b)の製造
0℃で、37%ホルムアルデヒド(5.4g,179mmol)水溶液、シアノ水素化ホウ素ナトリウム(2.5g,39.4mmol)、及び酢酸(2mL)をN-ベンジル-2-アミノ-3-メチル吉草酸メチル(4.2g,17.9mmol)のアセトニトリル(100mL)溶液に順次加えた。反応液を室温で16時間撹拌した、次に、飽和炭酸水素ナトリウム(100mL)水溶液でクエンチした。反応液をジクロロメタン(150mLx3)で抽出し、有機相を硫酸マグネシウムで乾燥させ、ろ過して減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:5%メタノール/95%ジクロロメタン)により精製して、到N-メチル-N-ベンジル-2-アミノ-3-メチル吉草酸メチル(4.2g、収率93%)を得た。
MS[M+H]+:250.0。
ステップ3:N-メチル-N-Boc-2-アミノ-3-メチル吉草酸メチル(56c)の製造
N-メチル-N-ベンジル-2-アミノ-3-メチル吉草酸メチル(4.2g,16.8mmol)、Pd/C(900mg)、及びBoc2O(10mL)をメタノール(30mL)に加えた。水素雰囲気下、反応液を50℃で16時間撹拌した。固体をろ過により除去した後、減圧濃縮させて、粗製品としてN-メチル-N-Boc-2-アミノ-3-メチル吉草酸メチル(5.2g、収率100%)を得た。
MS[M+H]+:260.0。
ステップ4:N-メチル-2-アミノ-3-メチル吉草酸メチル(56d)の製造
0℃で、5 M塩酸の1,4ジオキサン(10mL)溶液をN-メチル-N-Boc-2-アミノ-3-メチル吉草酸メチル(5.2g,20mmol)のテトラヒドロフラン(50mL)溶液に加えた。反応液を室温で2時間撹拌し、減圧濃縮させて、N-メチル-2-アミノ-3-メチル吉草酸メチル(3.2g、収率82%)を得た。
MS[M+H]+:160.0。
ステップ5:N-メチル-N-クロロメトキシホルミル-2-アミノ-3-メチル吉草酸メチル(56e)の製造
0℃で、クロロギ酸クロロメチル(0.48mL,5.37mmol)をN-メチル-2-アミノ-3-メチル吉草酸メチル(1g,5.12mmol)とトリエチルアミン(1.8mL,12.8mmol)のジクロロメタン(30mL)の溶液に緩やかに滴下した。反応液を0℃で30分間撹拌した後、室温に昇温して16時間撹拌した。水(25mL)で反応をクエンチした後、反応液をジクロロメタン(100mLx3)で抽出し、有機相を硫酸マグネシウムで乾燥させ、ろ過し、ろ液を減圧濃縮させ、粗製品としてN-メチル-N-クロロメトキシホルミル-2-アミノ-3-メチル吉草酸メチル(638mg、収率49%)を得た。
MS[M+H]+:252.0。
ステップ6:3-メチル-2-(メチル(((5-ニトロキノリン-8-イルオキシ)メトキシ)ホルミル)アミノ)吉草酸メチル(56)の製造
室温で、N-メチル-N-クロロメトキシホルミル-2-アミノ-3-メチル吉草酸メチル(638mg,2.53mmol)をニトロキソリン(350mg,2.63mmol)、炭酸カリウム(464mg,3.36mmol)、及びヨウ素ナトリウム(27mg,0.18mmol)のN,N-ジメチルホルムアミド(10mL)溶液に緩やかに滴下した。反応液を60℃で2時間撹拌した。水(25mL)で反応をクエンチした後、反応液をジクロロメタン(100mLx3)で抽出し、有機相を硫酸マグネシウムで乾燥させ、ろ過し、ろ液を減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:5%メタノール/95%ジクロロメタン)により精製して、3-メチル-2-(メチル(((5-ニトロキノリン-8-イルオキシ)メトキシ)ホルミル)アミノ)吉草酸メチル(70mg、収率10%)を得た。
1H NMR (400 MHz, CDCl3) δ 9.20 (d, J = 8.8 Hz, 1H), 9.07 - 9.06 (m, 1H), 8.50 (dd, J = 8.8, 3.2 Hz, 1H), 7.72 (dd, J = 8.8, 4.0 Hz, 1H), 7.42 (d, J = 8.8 Hz, 1H), 6.25 - 6.21 (m, 2H), 4.61 - 4.30 (m, 1H), 3.71 - 3.58 (m, 3H), 2.94 - 2.89 (m, 3H), 1.98 (br s, 1H), 1.39 - 1.34 (m, 1H), 0.95 - 0.75 (m, 7H)。
MS計算: 405.15;MS実測: 406.1 [M+H]+。
1H NMR (400 MHz, CDCl3) δ: 9.10-9.04 (m, 2H), 8.47-8.43 (m, 1H), 7.68-7.60 (m, 2H), 4.30 (d, J = 84.8 Hz, 2H), 3.82 (d, J = 13.6 Hz, 3H), 3.27 (d, J = 88.0 Hz, 3H)。
MS計算: 319.08;MS実測: 320.0 [M+H]+。
1H-NMR (400 Hz, CDCl3) δ: 9.35 (dd, J = 8.8, 1.6 Hz, 1H), 9.15 (dd, J = 4.4, 1.6 Hz, 1H), 8.53 (d, J = 8.8 Hz, 1H), 7.83 (dd, J = 8.8 Hz, 4.4Hz, 1H), 7.56 (br, 1H), 7.40 (d, J = 8.8 Hz, 1H), 7.25-7.17 (m, 3H), 7.04-7.18 (m, 2H), 6.10 (s, 2H), 4.51-4.68 (m, 1H), 3.72 (s, 3H), 2.95-3.18 (m, 2H)。
MS計算: 425.40;MS実測: 426.3 [M+H]+。
0℃で、(2S,6R)-2,6-ジメチルモルホリン(0.46g,4mmol)をジクロロメタン(10mL)に溶解して、トリエチルアミン(1.1mL,8mmol)とクロロギ酸クロロメチル(0.6g,4.6mmol)を緩やかに順次滴下し、30分間撹拌後、室温に昇温して4時間撹拌した。水(50mL)でクエンチした後、ジクロロメタン(100mLx3)で抽出し、有機相を合わせた後、無水硫酸ナトリウムで乾燥させて、ろ過して減圧濃縮させ、生成物としてN-クロロメトキシホルミル-(2S,6R)-2,6-ジメチルモルホリン(0.5g、収率60%)を得た。
ステップ2:(2S,6R)-(5-ニトロキノリン-8-イルオキシ)メチル2,6-ジメチルモルホリン-4-ホルメート(59)の製造
室温で、ニトロキソリン(0.6g,3.1mmol)とN-クロロメトキシホルミル-(2S,6R)-2,6-ジメチルモルホリン(0.5g,2.4mmol)をN,N-ジメチルホルムアミド(10mL)に溶解し、その後、炭酸カリウム(0.7g,5.0mmol)とヨウ素カリウム(83mg,0.5mmol)を加えて、反応液を60℃で4時間撹拌した。反応を室温に冷却した後、水で反応をクエンチし、ジクロロメタン(100mLx3)で抽出し、有機相を合わせて、無水硫酸ナトリウムで乾燥させて、ろ過して減圧濃縮させた。残留物を逆相高速液体クロマトグラフィー(カラムはEclipse XDB-C18(21.2mm×250mm,7μm)、移動相はアセトニトリル-0.1%ギ酸、流速は20.0mL/min)により分離して、(2S,6R)-(5-ニトロキノリン-8-イルオキシ)メチル2,6-ジメチルモルホリン-4-ホルメート(90mg、収率11%)を得た。
1H-NMR (400 Hz, CDCl3) δ: 9.23 (dd, J = 8.8, 1.2 Hz, 1H), 9.10 (d, J = 3.2 Hz, 1H), 8.54 (d, J = 8.8 Hz, 1H), 7.77 (dd, J = 8.8 Hz, 4.0 Hz, 1H), 7.41 (d, J = 8.8 Hz, 1H), 6.49 (d, J = 8 Hz, 1H), 6.20-6.24 (m, 2H), 4.02 (d, J = 12.8 Hz, 1H), 3.87 (d, J = 12.8 Hz, 1H), 3.50-3.60 (m, 2H), 2.52-2.64 (m, 2H), 1.20 (d, J = 6.4 Hz, 3H), 1.16 (d, J = 6.0 Hz,3H)。
MS計算: : 361.35;MS実測: 362.3 [M+H]+。
1H-NMR (400 Hz, CDCl3) δ: 9.25-9.27 (m, 1H), 9.12-9.13 (m, 1H), 8.53-8.55 (m, 1H), 7.75-7.78 (m, 1H), 7.42-7.44 (m, 1H), 6.21-6.22 (s, 2H), 3.53-4.03 (m, 8H), 2.52-2.64 (m, 2H), 1.08-1.20 (m,9H)。
MS計算:414.46;MS実測:415.3 [M+H]+。
1H-NMR (400 Hz, CDCl3) δ: 9.23 (dd, J = 8.8, 0.8 Hz, 1H), 9.22 (dd, J = 4.4, 3.6 Hz, 1H), 8.60 (d, J = 9.2 Hz, 1H), 7.91 (dd, J = 8.8, 4.4Hz, 1H), 7.50 (d, J = 8.8 Hz, 1H), 6.11 (s, 2H), 5.27 (s, 1H), 3.67 (s, 3H), 3.25-3.30 (m, 2H), 2.36-2.39(m, 2H), 1.82-1.86 (m, 2H)。
MS計算: 363.33;MS実測: 364.3 [M+H]+。
1H-NMR (400 Hz, CDCl3) δ: 9.37-9.39 (m, 1H), 9.18-9.19 (m, 1H), 8.59 (d, J = 8.4 Hz, 1H), 7.75 (dd, J = 8.8 Hz, 4.4 Hz, 1H), 7.44 (d, J = 8.8 Hz, 1H), 6.15-6.22 (s, 2H ), 3.88-4.03 (m, 3H), 3.51-3.59 (m, 2H), 2.98-3.10 (m, 1H), 2.62-2.69 (m, 1H), 1.18-1.20 (m, 3H)。
MS計算: 347.33;MS実測: 338.3 [M+H]+。
0℃で、N-メチル-2-ヒドロキシエチルアミン(3.5g,46.6mmol)、t-ブチルジメチルクロロシラン(7.7g,51.2mmol)をジクロロメタン(100mL)に溶解して、トリエチルアミン(13mL,93mmol)を緩やかに滴下した。反応液を0℃で30分間撹拌した後、室温に昇温して一晩撹拌した。反応液を乾固まで濃縮させて、メチルt-ブチルエーテル(200mL)に溶解し、1 M炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させ、生成物としてN-[2-(t-ブチルジメチルシロキシ)エチル]メチルアミン(6g、収率68%)を得た。
ステップ2:N-(クロロメトキシホルミル)-N-[2-(t-ブチルジメチルシロキシ)エチル]メチルアミン(63b)の製造
0℃で、N-[2-(t-ブチルジメチルシロキシ)エチル]メチルアミン(3g,15.8mmol)をジクロロメタン(80mL)に溶解して、トリエチルアミン(4.5mL,31.6mmol)とクロロギ酸クロロメチル(2.6g,20.6mmol)を緩やかに順次滴下した。反応液を0℃で30分間撹拌した後、室温に昇温して一晩撹拌した。水(100mL)でクエンチした後、ジクロロメタン(200mLx3)で抽出し、有機相を合わせた後、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させ、N-(クロロメトキシホルミル)-N-[2-(t-ブチルジメチルシロキシ)エチル]メチルアミン(2g、収率29%)を得た。
ステップ3:(5-ニトロキノリン-8-イルオキシ)メチル2-(t-ブチルジメチルシロキシ)エチル(メチル)カーバメート(63c)の製造
室温で、ニトロキソリン(1.75g,9.2mmol)とN-(クロロメトキシホルミル)- N-[2-(t-ブチルジメチルシロキシ)エチル]メチルアミン(2.0g,7.1mmol)をN,N-ジメチルホルムアミド(10mL)に溶解し、その後、炭酸カリウム(2g,14.2mmol)とヨウ素カリウム(230mg,1.4mmol)を加えて、反応液を60℃で4時間撹拌した。反応液を室温に冷却した後、水で反応をクエンチし、ジクロロメタン(200mLx3)で抽出し、有機相を合わせて、無水硫酸ナトリウムで乾燥させて、ろ過して減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:5%メタノール/95%ジクロロメタン)により精製して、(5-ニトロキノリン-8-イルオキシ)メチル2-(t-ブチルジメチルシロキシ)エチル(メチル)カーバメート(500mg、収率16.2%)を得た。
ステップ4:(5-ニトロキノリン-8-イルオキシ)メチル2-ヒドロキシエチル(メチル)カーバメート(63)の製造
室温で、(5-ニトロキノリン-8-イルオキシ)メチル2-(t-ブチルジメチルシロキシ)エチル(メチル)カーバメート(0.5g,1.1mmol)、テトラブチルアンモニウムフルオリド(TBAF)(0.35g,1.3mmol)をジクロロメタン(20mL)に溶解して、4時間撹拌した。反応液をろ過して減圧濃縮させ、残留物を逆相高速液体クロマトグラフィー(カラムはEclipse XDB-C18(21.2mm×250mm,7μm)、移動相はアセトニトリル-0.1%ギ酸、流速は20.0mL/minである)により分離して、生成物として(5-ニトロキノリン-8-イルオキシ)メチル2-ヒドロキシエチル(メチル)カーバメート(0.2g、収率29%)を得た。
1H-NMR (400 Hz, CDCl3) δ: 9.21 (d, J = 8.0 Hz, 1H), 9.08 (d, J = 4 Hz, 1H), 8.53 (d, J = 8.0 Hz, 1H), 7.77 (dd, J = 8.0 Hz, 4.0 Hz, 1H), 7.44 (d, J = 8.8 Hz, 1H), 6.22 (s, 2H), 4.13-4.25 (m, 2H), 3.53-3.58 (m, 2H), 3.00 (s, 3H), 2.00 (s, 3H)。
MS計算: 363.33;MS実測: 364.1 [M+H]+。
室温で、2-メチルアミノ-3-ピリジンメタノール(2.8g,20.3mmol)、N-(t-ブトキシカルボニル)-N-メチルグリシン(5g,26.4mmol)、1-(3-ジメチルアミノプロピル)-3-エチルカルボジイミド塩酸塩(EDCI)(5.1g,26.4mmol)と4-ジメチルアミノピリジン(DMAP)(250mg,2mmol)をジクロロメタン(100mL)に加えて、一晩撹拌した。水を加えて反応をクエンチし、酢酸エチル(100mLx3)で抽出して、有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルクロマトグラフィー分取プレート(展開剤:5%メタノール/95%ジクロロメタン)により精製して、(2-(メチルアミノ)ピリジン-3-イル)メチル2-(t-ブトキシカルボニル(メチル)アミノ)アセテート(3g、収率49%)を得た。
ステップ2:(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(t-ブトキシカルボニル(メチル)アミノ)アセテート(65b)の製造
0℃で、(2-(メチルアミノ)ピリジン-3-イル)メチル2-(t-ブトキシカルボニル(メチル)アミノ)アセテート(3.4g,11mmol)をジクロロメタン(80mL)に溶解し、N,N-二イソプロピルエチルアミン(2.8g,22mmol)とクロロギ酸クロロメチル(2.1g,16.5mmol)を緩やかに順次滴下した。反応液を0℃で30分間撹拌した後、室温に昇温して一晩撹拌した。水(100mL)でクエンチした後、ジクロロメタン(200mLx3)で抽出し、有機相を合わせた後、無水硫酸ナトリウムで乾燥させて、ろ過して減圧濃縮させ、生成物として(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(t-ブトキシカルボニル(メチル)アミノ)アセテート(4g、収率91%)を得た。
ステップ3:(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(メチルアミノ)アセテート(65c)の製造
室温で、(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(t-ブトキシカルボニル(メチル)アミノ)アセテート(1.7g,5.6mmol)をジクロロメタン(50mL)に溶解して、塩酸ジオキサン(4.5mL,18mmol)を緩やかに滴下し、4時間撹拌した。反応液を減圧濃縮させ、生成物として(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(メチルアミノ)アセテート(1.27g、収率99%)を得た。
ステップ4:(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(N-メチルアセチルアミノ)アセテート(65d)の製造
0℃で、(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(メチルアミノ)アセテート(1g,3.3mmol)、塩化アセチル(390mg,5.0mmol)をジクロロメタン(50mL)に溶解して、トリエチルアミン(0.7mL,6.6mmol)を緩やかに滴下し、室温に昇温して2時間撹拌した。反応を室温に冷却した後、水で反応をクエンチし、ジクロロメタン(100mLx3)で抽出し、有機相を合わせた後、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させ、生成物として(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(N-メチルアセチルアミノ)アセテート(1.0g、収率91%)を得た。
ステップ5:(2-(メチル(((5-ニトロキノリン-8-イル)オキシ)メトキシ)ホルミル)アミノ)ピリジン-3-イル)メチル2-(N-メチルアセチルアミノ)アセテート(65)の製造
室温で、ニトロキソリン(1.5g,7.9mmol)と(2-(((クロロメトキシ)カルボニル)(メチル)アミノ)ピリジン-3-イル)メチル2-(N-メチルアセチルアミノ)アセテート(2.7g,7.9mmol)をN,N-ジメチルホルムアミド(10mL)に溶解し、その後、炭酸カリウム(2.2g,16.0mmol)とヨウ素カリウム(270mg,1.6mmol)を加えて、反応液を60℃で4時間撹拌した。反応液を室温に冷却した後、水で反応をクエンチし、ジクロロメタン(200mLx3)で抽出し、有機相を合わせて、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させた。残留物を逆相高速液体クロマトグラフィー(カラムはEclipse XDB-C18(21.2mm×250mm,7μm)、移動相はアセトニトリル-0.1%ギ酸、流速は20.0mL/minである)により分離して、生成物として(2-(メチル(((5-ニトロキノリン-8-イル)オキシ)メトキシ)ホルミル)アミノ)ピリジン-3-イル)メチル2-(N-メチルアセチルアミノ)アセテート(500mg、収率13%)を得た。
1H-NMR (400 Hz, CDCl3) δ: 9.05-9.18 (m, 2H), 8.32-8.57 (m, 2H), 7.79-7.83 (m, 2H), 7.29-7.32 (m, 2H), 6.06-6.30 (m, 2H), 5.00-5.11 (m, 2H), 4.01-4.06 (m, 2H), 3.34 (s,3H), 3.00 (s,3H), 2.13 (s,3H)。
MS計算: 497.46;MS実測: 498.2 [M+H]+。
1H-NMR (400Hz, CDCl3) δ: 9.05-9.18 (m, 2H), 8.32-8.57 (m, 2H), 7.79-7.83 (m, 2H), 7.29-7.32 (m, 2H), 6.06-6.30 (m, 2H), 5.04-5.12 (m, 2H), 4.01-4.06 (m, 2H), 3.340 (s, 3H), 3.00 (s, 3H), 1.31 (s,9H)。
MS計算: 539.55;MS実測: 540.2 [M+H]+。
1H-NMR (400 Hz, CDCl3) δ: 9.23 (dd, J = 8.8, 1.6 Hz, 1H), 9.09 (dd, J = 4.0, 1.6 Hz, 1H), 8.53 (d, J = 8.8 Hz, 1H), 7.77 (dd, J = 8.8 Hz, 4.0 Hz, 1H), 7.35 (d, J = 8.8 Hz, 1H), 6.22 (s, 2H), 3.42-3.47 (m, 4H), 1.35-1.63 (m, 6H)。
MS計算: 331.33;MS実測: 332.3 [M+H]+。
室温で、トリエチルアミン(1.36g,13.44mmol)を3-メチルアミノ-1-プロパノール(1.00g,11.22mmol)のメタノール(10mL)溶液に加えて、撹拌して透明とした。二炭酸ジ―t-ブチル(2.94g,13.47mmol)を滴下して、16時間撹拌した。反応液を減圧濃縮させ、ジクロロメタンで希釈し、有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過し、ろ液を減圧濃縮させ、t-ブチル(3-ヒドロキシプロピル)メチルカルバメート粗製品(2.20g)を得た。
ステップ2:3-(メチルアミノ)プロピルアセテート(68b)の製造
室温で、トリエチルアミン(0.64g,6.32mmol)をt-ブチル(3-ヒドロキシプロピル)メチルカルバメート(1.00g,5.28mmol)のジクロロメタン(5mL)溶液に加えて、撹拌して透明とした。反応系を0℃に降温し、塩化アセチル(0.50g,6.37mmol)を滴下して、室温に自然昇温した後、1時間撹拌した。反応液をろ過して、ジクロロメタンでリンスし、ろ液を濃縮させ、固体粗製品を得た。0℃で、粗製品に塩化水素のジオキサン溶液(3.3mL,4 M)を滴下し、16時間撹拌した。反応液を濃縮させて、3-(メチルアミノ)プロピルアセテート粗製品を得た。
ステップ3:3-(((クロロメトキシ)カルボニル)(メチル)アミノ)プロピルアセテート(68c)の製造
3-(メチルアミノ)プロピルアセテート粗製品をジクロロメタン(8mL)で透明とし、0℃で、溶液にトリエチルアミン(1.07g,10.57mmol)、クロロギ酸クロロメチル(0.68g,5.27mmol)を順次加えて、室温に自然昇温し、1時間撹拌した。水を加えて反応をクエンチし、ジクロロメタンで抽出し、有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:83%石油エーテル/17%酢酸エチル)により精製して、3-(((クロロメトキシ)カルボニル)(メチル)アミノ)プロピルアセテート(400mg、収率34%)を得た。
ステップ4:3-(メチル(((5-ニトロキノリン-8-イルオキシ)メトキシ)カルボニル)アミノ)プロピルアセテート(68)の製造
室温で、ニトロキソリン(340mg,1.79mmol)、炭酸カリウム(297mg,2.15mmol)、ヨウ素ナトリウム(27mg,0.18mmol)をN,N-ジメチルホルムアミド(8mL)に加えて、均一に撹拌した。反応系を60℃に昇温して、15分間撹拌した後、3-(((クロロメトキシ)カルボニル)(メチル)アミノ)プロピルアセテート(400mg,1.79mmol)を加えて、16時間撹拌した。水を加えて反応をクエンチし、酢酸エチルで抽出して、有機相を飽和食塩水溶液で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルクロマトグラフィー分取プレート(展開剤:5%メタノール/95%ジクロロメタン)により精製して、3-(メチル(((5-ニトロキノリン-8-イルオキシ)メトキシ)カルボニル)アミノ)プロピルアセテート(196mg、収率29%)を得た。
1H NMR (400 MHz, CDCl3) δ 9.20 (dd, J = 8.8, 2.4 Hz, 1H), 9.07 (d, J = 1.4 Hz, 1H), 8.64 - 8.46 (m, 1H), 7.81 - 7.66 (m, 1H), 7.52 - 7.38 (m, 1H), 6.21 (s, 2H), 4.05 (dd, J = 28.3, 3.6 Hz, 2H), 3.38 (dd, J = 14.3, 7.2 Hz, 2H), 3.02 - 2.89 (m, 3H), 2.03 (dd, J = 17.5, 3.7 Hz, 3H), 1.86 (d, J = 24.3 Hz, 2H)。
MS計算: 377.3;MS実測: 378.2[M+H]+。
1H NMR (400 MHz, CDCl3) δ 9.18 (dd, J = 8.9, 1.3 Hz, 1H), 9.06 (d, J = 4.0 Hz, 1H), 8.50 (d, J = 8.8 Hz, 1H), 7.70 (dd, J = 8.9, 4.1 Hz, 1H), 7.42 (dd, J = 8.8, 3.9 Hz, 1H), 6.20 (d, J = 4.7 Hz, 2H), 4.04 (dd, J = 27.3, 21.6 Hz, 2H), 3.36 - 3.22 (m, 2H), 2.96 - 2.86 (m, 3H), 2.01 (d, J = 19.7 Hz, 3H), 1.64 - 1.57 (m, 2H), 1.53 (s, 2H)。
MS計算: 391.4;MS実測: 392.2[M+H]+。
室温で、炭酸カリウム(1.45g,10.52mmol)をニトロキソリン(1.0g,5.26mmol)、ジ―t-ブチルクロロメチルホスフェート(2.04g,7.89mmol)のN,N-ジメチルホルムアミド(17mL)溶液に加えた。反応液を60℃で2時間撹拌した。水を加えて反応をクエンチし、ジクロロメタン(100mLx3)で抽出し、有機相を1 M 塩酸、1 M炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過し減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:5%n-ヘキサン/95%酢酸エチル)により精製して、ジ―t-ブチル(5-ニトロキノリン-8-イルオキシ)メチルホスフェート(570mg、収率: 26%)を得た。
MS[M+H]+:413.3。
ステップ2:(5-ニトロキノリン-8-イルオキシ)メチルジヒドロホスフェート(71)の製造
室温で、トリフルオロ酢酸(7ml)をジ―t-ブチル(5-ニトロキノリン-8-イルオキシ)メチルホスフェート(520mg,1.18mmol)のジクロロメタン(7ml)溶液に緩やかに滴下した。反応液を室温で2時間撹拌した後、減圧濃縮させた。飽和炭酸水素ナトリウム溶液でPH=7に調整した後、固体を沈殿して析出させ、ろ過して粗製品を得た。粗製品を分取液体クロマトグラフィー(アジレント1260分取液体クロマトグラフィー:アセトニトリル/水勾配95/5-50/50)により精製して、生成物(5-ニトロキノリン-8-イルオキシ)メチルジヒドロホスフェート(100.24mg、収率: 24%)を得た。
1H NMR (400 MHz, D2O): δ 8.97-8.94 (m, 1H), 8.76-8.75 (m, 1H), 8.42 (d, J = 8.8 Hz, 1H), 7.69-7.65 (m, 1H), 7.38 (d, J = 9.2 Hz, 1H), 5.76 (d, J = 11.2 Hz, 1H)。
MS計算: 300.0;MS実測: 301.0 [M+H] +。
(5-ニトロキノリン-8-イルオキシ)メチルジヒドロホスフェート塩酸塩(672mg,2mmol、合成ステップは実施例71を参照)、クロロメチル炭酸イソプロピル(1.22g,8mmol)、及びトリエチルアミン(1.01g、10mmol)をDMF 20mLに投入して、50℃で5時間撹拌した。反応液を減圧濃縮させ、残留物をpre-HPLC(アジレント1260分取液体クロマトグラフィー:アセトニトリル/水勾配95/5-50/50)により精製して、(ヒドロキシ((5-ニトロキノリン-8-イルオキシ)メトキシ)ホスホリルオキシ)メチルイソプロピルカルボキシラート(121mg、収率14.5%)を得た。
1H-NMR (400 MHz, DMSO-d6) δ: 9.05 (d, J = 2.8 Hz, 1H), 9.00 (d, J = 8.4 Hz, 1H), 8.55 (d, J = 8.4 Hz, 1H), 7.87 (dd, J = 8.4, 4.0 Hz, 1H), 7.54 (d, J = 8.4 Hz, 1H),5.91~5.94 (m, 2H), 5.45~5.49 (m,2H), 4.72~4.75 (m, 2H) ,1.18(d,J=6.0Hz,6H)。
MS計算:416.28;MS実測:417.1[M+H]+。
室温で、ベンジルアルコール(2g,18.49mmol)とフェニルジクロロホスフェート(4.29g,20.34mmol)を40mLジクロロメタンに加えて、反応液を氷浴で0~5℃に冷却し、トリエチルアミン(7.47g,73.96mmol)を緩やかに加えて、次に、L-アラニンメチルエステル塩酸塩(2.84,20.34mmol)を加えて、20分間撹拌した後、室温で5時間撹拌した。反応液を20mLx2水で洗浄し、有機相を減圧濃縮させ、残留物をシリカゲルカラムクロマトグラフィー(DCM:MeOH=10:1)により精製し、(2S)-メチル2-(ベンジルオキシ(フェノキシ)ホスホリルアミノ)プロピオネート(4.2g、収率: 65.6%)を得た。
ステップ2:(2S)-メチル2-(ヒドロキシ(フェノキシ)ホスホリルアミノ)プロピオネート(73b)の製造
室温で、(2S)-メチル2-(ベンジルオキシ(フェノキシ)ホスホリルアミノ)プロピオネート(2.5g,7.16mmol)をテトラヒドロフラン25mLに溶解し、500mgのウェットPd/Cを加えた。水素雰囲気下、反応液を室温で8時間撹拌した。次に、反応液をろ過して、ろ液を減圧濃縮させ、(2S)-メチル2-(ヒドロキシ(フェノキシ)ホスホリルアミノ)プロピオネート(1.5g、収率:81%)を得た。
ステップ3:(2S)-メチル2-(((5-ニトロキノリン-8-イルオキシ)メトキシ)(フェノキシ)ホスホリルアミノ)プロピオネート(73)の製造
室温で、(2S)-メチル2-(ヒドロキシ(フェノキシ)ホスホリルアミノ)プロピオネート(1.5g,5.79mmol)と5-ニトロ-8-(クロロメトキシ)キノリン(1a)(921mg,3.86mmol)をDMF 20mLに溶解し、次に、触媒量のKI(10mg)と炭酸カリウム(1.6g、11.58mmol)を加えて、室温で6時間撹拌した。反応液をろ過して、ろ液を減圧濃縮させ、残留物をシリカゲルカラムクロマトグラフィー(DCM:MeOH=40:1)により精製して、(2S)-メチル2-(((5-ニトロキノリン-8-イルオキシ)メトキシ)(フェノキシ)ホスホリルアミノ)プロピオネート(160mg、収率:8.9%)を得た。
1H-NMR (400 MHz, DMSO-d6): δ 9.05~9.06 (m, 1H), 8.99~9.01 (m, 1H), 8.54 (dd,J = 8.4, 3.2Hz, 1H), 7.87 (dd, J = 8.8 Hz, 4.0Hz, 1H), 7.50~7.55 (m, 1H), 7.25 ~ 7.30 (m, 2H), 7.09~7.18 (m,3H), 6.29~6.35 (m,1H), 6.03~6.11 (m,2H), 5.60 (br,1H), 3.88~3.97 (m, 1H), 3.54 (d,J = 10Hz, 3H), 1.18~1.21 (m,3H)。
MS計算: 461.37;MS実測: 462.2 [M+H] +。
1H-NMR (400 MHz, DMSO-d6): δ 9.03 (d,J=4Hz, 1H), 8.99 (dd, J = 8.8, 1.2Hz, 1H), 8.52 (dd,J = 8.4, 6.4 Hz, 1H), 7.87 (dd,J = 6.4Hz, 1.6Hz, 1H), 7.50~7.55 (m, 1H), 7.10~7.29 (m,6H), 7.00~709 (m, 2H), 6.98~6.99 (m, 2H), 6.40~6.51 (m,1H), 5.85~5.95 (m,2H), 3.98~4.02 (m,1H), 3.54 (s, 3H), 2.95~3.01 (m, 1H), 2.75~2.85 (m, 1H)。
MS計算: 537.46;MS実測: 538.3 [M+H]+。
1H-NMR (400 MHz, DMSO-d6): δ 9.05~9.06 (m, 1H), 8.99~9.01 (m, 1H), 8.54(dd,J=8.4,3.2Hz,1H), 7.87 (dd,J=8.8Hz,4.0Hz,1H), 7.50~7.55(m,1H), 7.25~7.30 (m,2H), 7.09~7.18(m,3H), 6.29~6.35(m,1H), 6.03~6.11(m,2H), 4.85~4.95 (m,1H), 3.88~3.97(m,1H), 1.18~1.21(m,9H)。
MS計算: 489.42;MS実測: 490.3 [M+H] +。
0℃で、水素化ナトリウム(純度:60%,0.42g,10.5mmol)を6-シクロヘキシル-4-メチル-ピリジン-1-ヒドロキシ-2-オン(達瑞化学社から購入)(2.00g,9.65mmol)のN,N-ジメチルホルムアミド(30mL)溶液に加えて、30分間撹拌後、ジベンジル(クロロメチル)ホスフェート(4.10g,12.55mmol)を加えて、室温に自然昇温し、5時間撹拌した。塩化アンモニウム水溶液を加えて反応をクエンチし、酢酸エチルで抽出して、有機相を飽和食塩水溶液で洗浄し、無水硫酸ナトリウムで乾燥させて、ろ過後、減圧濃縮させた。残留物をシリカゲルカラムクロマトグラフィー(溶離剤:75%石油エーテル/25%酢酸エチル)により精製して、ジベンジル(6-シクロヘキシル-4-メチル-2-オキソピリジン-1(2H)-イルオキシ)メチルホスフェート(1.58g、収率33%)を得た。
ステップ2:(6-シクロヘキシル-4-メチル-2-オキソピリジン-1(2H)-イルオキシ)メチルジヒドロホスフェート(76b)の製造
室温で、含有量10%のパラジウム炭素(0.20g)をジベンジル(6-シクロヘキシル-4-メチル-2-オキソピリジン-1(2H)-イルオキシ)メチルホスフェート(1.58g,3.18mmol)のテトラヒドロフラン(16mL)溶液に加えた。水素雰囲気下、3時間撹拌した。反応液をろ過して、テトラヒドロフランでリンスし、ろ液を減圧濃縮させ、(6-シクロヘキシル-4-メチル-2-オキソピリジン-1(2H)-イルオキシ)メチルジヒドロホスフェート(0.35g、収率35%)を得た。
ステップ3:(6-シクロヘキシル-4-メチル-2-オキソピリジン-1(2H)-イルオキシ)メチル(5-ニトロキノリン-8-イルオキシ)リン酸水素メチル(76)の製造
室温で、(6-シクロヘキシル-4-メチル-2-オキソピリジン-1(2H)-イルオキシ)メチルジヒドロホスフェート(350mg,1.10mmol)、炭酸カリウム(305mg,2.21mmol)、ヨウ素ナトリウム(28mg,0.19mmol)をN,N-ジメチルホルムアミド(7mL)に加えて、均一に撹拌した。反応系を40℃に昇温して、10分間撹拌した後、5-ニトロ-8-クロロメトキシキノリン(1a)(448mg,1.88mmol)を加えて、4時間撹拌した。水を加えて反応をクエンチし、酢酸エチルで不純物を逆抽出し、水相を凍結乾燥した後、逆相系95%水/5%アセトニトリルを分取液体クロマトグラフィー(アジレント1260分取液体クロマトグラフィー:アセトニトリル/水勾配95/5-50/50)により精製して、(6-シクロヘキシル-4-メチル-2-オキソピリジン-1(2H)-イルオキシ)メチル(5-ニトロキノリン-8-イルオキシ)リン酸水素メチル(66mg、収率12%)を得た。
1H NMR (400 MHz, CDCl3) δ 9.65 (d, J = 7.6 Hz, 1H), 9.21 (s, 1H), 8.66 (d, J = 8.4 Hz, 1H), 8.06 (s, 1H), 7.65 (d, J = 8.7 Hz, 1H), 6.36 (s, 1H), 6.07 (s, 1H), 6.00 (d, J = 15.2 Hz, 2H), 5.73 (d, J = 12.0 Hz, 2H), 2.15 (s, 3H), 1.94 (d, J = 10.2 Hz, 2H), 1.79 (d, J = 11.8 Hz, 2H), 1.75 - 1.68 (m, 1H), 1.47 - 1.13 (m, 6H)。
MS計算: 519.4;MS実測: 520.2[M+H]+。
1H-NMR (400 Hz, CDCl3) δ: 9.23 (dd, J = 8.8, 1.6 Hz, 1H), 9.09 (dd, J = 4.0, 1.6 Hz, 1H), 8.53 (d, J = 8.8 Hz, 1H), 7.77 (dd, J = 8.8, 4.0 Hz, 1H), 7.22 (d, J = 8.8 Hz, 1H), 5.22 (s, 2H), 2.26 (s, 3H)。
MS計算: 302.24;MS実測: 303.1 [M+H]+。
1H NMR (400 MHz, DMSO-d6) δ: 9.09 (dd, J = 4.0, 1.2 Hz, 1H), 8.93 (dd, J = 9.2, 1.6 Hz, 1H), 8.52 (d, J = 8.4 Hz, 1H), 7.86 (dd, J = 8.8, 4.0 Hz, 1H), 7.75 (d, J = 8.4 Hz, 1H), 3.21 (s, 3H), 2.96 (s, 3H)。
MS計算: 261.07;MS実測: 262.0 [M+H]+。
1H NMR (400 MHz, DMSO-d6) δ: 9.05 (dd, J = 4.4, 1.6 Hz, 2H), 8.92 (dd, J = 8.4, 1.6 Hz, 2H), 8.52 (d, J = 8.8 Hz, 2H), 7.85 (dd, J = 9.2, 4.4 Hz, 2H), 7.77 (d, J = 8.8 Hz, 2H), 2.80 (t, J = 7.2 Hz, 4H), 1.76 (d, J = 7.2 Hz, 4H), 1.52-1.41 (m, 8H)。
MS計算: 546.18;MS実測: 547.2 [M+H]+。
本発明に係る式(I)化合物は、人体に入ると、有効成分であるニトロキソリンを徐放することができ、ニトロキソリンは血管内皮細胞におけるメチオニンアミノペプチダーゼMetAP2とサイレンシング情報調節因子2関連酵素を同時に阻害し、腫瘍血管新生を阻害する相乗効果を発揮する。また、ニトロキソリンは腫瘍細胞の増殖を抑制する作用もある。このほか、放出された有効成分であるニトロキソリンは細菌のメチオニンアミノペプチダーゼMetAPを阻害することで静菌作用を発揮する。
本発明者らは、まず、ニトロキノリン及びニトロキノリンプロドラッグの水溶性について検討した。
実験器具:96穴フィルタプレート(MSHVN4510又はMSHVN4550、ミリポア社);電子デジタルボルテックスミキサー(MS3 Digital、IKA);循環水式多用真空ポンプ(SHB-III、鄭州長城科工貿易有限公司);天秤(XSLT05、メトラー・トレド社);快適型ミキサー(Eppendorf AG 22331 Hamburg、エッペンドルフ社);液体クロマトグラフィー(LC-30AD、島津社);質量分析法(API4000、米国のアプライドバイオシステムズ社);サンプラー(Anylytics A)GSystem、CTC)。ニトロキノリンは、Journal of Heterocyclic Chemistry,1971,vol.8,p821に開示されている方法により、海門慧聚社に合成を依頼した。
実験過程:500μLのリン酸緩衝液(pH=1.2、4.5、6.8又は7.4)をガラス瓶に入れ、化合物粉末2mgを加えて栓を入れ、ミキサー(VORTEX-GENIE2)にセットして室温で24時間混合した。その後、真空吸引ろ過し、ろ過液を処理した後、LC/MS/MSで化合物濃度を測定した。
本発明の化合物の溶解度の結果を表1に示す。
プロドラッグ分子の構造を最適化することによって、ニトロキソリンに比べてプロドラッグ分子の水溶性を著しく高めることができ、たとえば化合物18、20、23、30、52、65、66、70、72などの水溶性はいずれも数倍に向上し、通水部分の化合物の水溶性はpH値の変化によって変化せず、この特徴は薬物の製剤開発において特に重要である。
試験例2:本発明の化合物の肝ミクロソーム及び血漿安定性の測定
本発明の式(I)化合物は、インビボでニトロキソリンに分解され、抗がん作用を発揮することが期待される。肝ミクロソーム酵素及び血漿代謝酵素は化合物の体内代謝の重要な手段であるため、インビトロ実験を行い、本発明の化合物の肝ミクロソーム及び血漿中の安定性を測定した。
1.肝ミクロソーム安定性の測定
実験器具:恒温発振器(SHA-B、国華企業);遠心分離機(5810R、エッペンドルフ社)、質量分析装置(API4000、米国のアプライドバイオシステムズ社)、液体クロマトグラフィー(LC-30AD、島津社);サンプラー(CTC AはLytics AG Systemに適用せず、CTC)。
実験過程:100mMリン酸緩衝液に25μg/mLのアラメチシン(Aldrich試薬社)、5mM塩化マグネシウム、及び0.5mg/mLミクロソーム(XENOTECH)を加えて補酵素を含まない反応溶液を調製した。その後、一部を還元型ニコチンアミドアデニンジヌクレオチドリン酸1mM(Aldrich試薬社)とウリジン二リン酸グルクロン酸5mM(Aldrich試薬社)を加えて補酵素を含む反応溶液を調製した。その後、2つの反応溶液に本発明の化合物の作動溶液を加え、化合物の最終濃度を2μMとした。混合直後に50μLの溶液を取り出して0分サンプルとし、残りのサンプルを37℃で30分間インキュベートした後に50μLを取り出した。取り出したすべてのサンプルについて直ちにタンパク質を沈殿させ、遠心分離して上清を取った後、LC/MS/MSで化合物濃度を測定した。
本発明の化合物のミクロソーム安定性の結果を表2に示す。
プロドラッグ分子の構造を最適化することによって、異なるタイプのミクロソーム安定性化合物を得ることができ、化合物6、7、52、53などのミクロソーム安定性はこのような化合物が体内で更に長い半減期を持つ可能性があることを示している。ミクロソームが不安定である別の種類の化合物は、化合物が体内に入ると迅速にニトロキソリンに変換できることを示し、不要な生物毒性の可能性を低減する。2種類を分析した結果、いずれも薬物として開発する優位性及び特徴を持っている。
2.血漿安定性測定
実験器具:恒温発振器(SHA-B、国華企業);遠心分離機(5810R、エッペンドルフ社)、質量分析装置(API4000、米国のアプライドバイオシステムズ社)、液体クロマトグラフィー(LC-30AD、島津社);サンプラー(CTC AはLytics AG Systemに適用せず、CTC)。
実験動物:ヒト(ロット番号:BRH1343165)、ラット(ロット番号:RAT336728)、マウス(ロット番号:MSE280000)、イヌ(ロット番号:BGL99137)、サル(ロット番号:PH-Monkey-20180821)の血漿は上海斯信生物科技有限公司由来である。
実験過程:本発明の化合物を有機溶媒に溶解して1mMの作動液にし、次に、3μLを採取してプレインキュベートしたヒト又はラット血漿597μLに加え、均一に混合した。その後、速やかに50μLを取り出して0分サンプルとし、残りのサンプルを37℃で恒温インキュベートし、15、30、60、及び120分に50μLずつ取り、すべてのサンプルを取り出した直後に蛋白を沈殿させ、遠心分離して上清を取って、LC/MS/MSで化合物濃度を測定した。
本発明の化合物の血漿安定性の結果を表3に示す。
プロドラッグ分子の構造を最適化することによって、異なるタイプの血漿安定性化合物を得ることができ、化合物6、7、52、53、54、55、56、57、58、59、62、70、75などの血漿安定性はこのような化合物が体内で更に長い半減期を持つ可能性があることを示している。血漿が不安定である別の種類の化合物は、体内に入ると、化合物が迅速にニトロキソリンに変換されることを示し、不要な生物毒性の可能性を低減する。2種類を分析した結果、いずれも薬物として開発する優位性と特徴を持っている。
ニトロキソリンは主に肝を介して二相代謝を行い、代謝速度が速いため、体内での半減期が短い。本発明はその構造を改変し、化学合成法により式(I)化合物を13種類製造した。本試験はラットにニトロキソリン及び式(I)化合物をそれぞれ単回静脈或いは経口投与した後、ラット血漿中の化合物ニトロキソリンの濃度の変化を研究し、これにより、ニトロキソリン及び式(I)化合物のラット体内における薬物動態学的行為を評価した。
1.実験器具
タンデム四重極質量分析計(API4000、米国のアプライドバイオシステムズ社)、液体クロマトグラフィー(1200、アジレント社)、オートサンプラー(CTC Aはlytics HTC PALには適用せず)、米国のアプライドバイオシステムズ社Aはlyst v1.6.2には適用せず、低温冷凍遠心分離機(1-15PK、シグマ)、渦発振器(VX-III、北京踏錦科技有限公司)。
2.薬物動態学的実験
雄性SDラット(北京維通利華実験動物技術有限公司、実験動物生産許可証番号:SCXK(京)2016-0006、実験動物合格証番号:11400700325643)、各群ごとに3匹、体重180~250g、6~7週齢、投与前一夜断食、自由飲水、投与4時間後給餌。測定対象化合物をEPチューブに入れ、DMSO 1.017mL、solutol 2.035mL、及び滅菌注射用水(三者の体積比は1:2:17、v:v:v)を加え、20分超音波処理して十分に溶解させた(化合物の配合濃度:0.005mmol/mL)。静脈内投与量は0.01mmol/kg、経口投与量は0.1mmol/kgであった。投与前(0時間)と投与後0.0833、0.25、0.5、1、2、4、6、8、10、24、28、32、48時間(サンプリングポイントは状況により調整)に眼窩静脈叢から全血0.3mlを採取し、EDTA-K2(Aldrich試薬社)抗凝固を含む遠心チューブに入れ、採取後砕氷中に置いた。0.5時間以内に5000rpm条件下で5分間遠心分離し、血漿をすべて分離し、別のきれいな遠心管内に置き、100:3(血漿/安定液、v/v)の割合で安定液を加え、-20℃の冷蔵庫に置いて測定に備えた。
安定液の調製方法:ビタミンC(Aldrich社)200mgを生理食塩水8mLに溶解した後、ギ酸2mLを加えて十分に混和した。
3.サンプル濃度の測定
検量線:一連の検量線の作動液を調製し、空白ラット血漿50μLに5μLを加え、150μLの内標準作動液(ジフェンヒドラミン(Aldrich試薬社)のアセトニトリル溶液を2ng/mL含む)を加え、1分間ボルテックス振とうした。4℃、12000回転/分の条件で10分間遠心分離し、上清100μLをサンプリング管に採取し、10μLを液体クロマトグラフ質量分析計に注入して測定した。
測定対象サンプル:測定対象サンプル血漿50μLに作動液の希釈液5μLを加えた後、内標準作動液(ジフェンヒドラミン2ng/mLのアセトニトリル溶液を含む)150μLを加え、1分間ボルテックス振とうした。4℃、12000回転/分の条件で10分間遠心分離し、上清100μLをサンプリング管に採取し、10μLを液体クロマトグラフ質量分析計に注入して測定した。WinNonlin V6.2非房室モデルを用いて薬物動態学的パラメータを計算した。
測定結果を表4~表45に示す。
プロドラッグ分子の構造を最適化することによって、ラットにおいて、ニトロキソリンと比較して、プロドラッグ分子の吸収又は半減期が顕著に向上した。これにより、服用量や投与回数を低減する上で、薬物分子に対するコンプライアンスが良好に向上した。
ニトロキソリンは主に肝を介して二相代謝をされ代謝速度が速いため、体内での半減期が短い。本発明はその構造を改変し、化学合成法により式(I)化合物を13種類製造した。本試験は、ニトロキソリン及び式(I)化合物をそれぞれ単回静脈又は経口投与した後のイヌ血漿中の化合物ニトロキソリンの濃度変化を検討し、これにより、ニトロキソリン及び式(I)化合物の体内での薬物動態学的挙動を評価した。
1.実験器具
タンデム四重極質量分析計(API5500、米国のアプライドバイオシステムズ社)、液体クロマトグラフィー(1200、アジレント社)、オートサンプラー(CTC AはLytics HTC PALに適用せず)、米国のアプライドバイオシステムズ社AはLyst v1.6.2に適用されない。
2.薬物動態学的実験
雄性ビーグルイヌ(北京マーシャル生物技術有限公司、実験動物生産許可証番号:SCXK(京)2016-0001、実験動物品質証明証番号:11400600001728)、各群ごとに3匹、体重10~13kg、20~22ヶ月齢、投与前一夜断食、自由飲水、投与4時間後給餌。測定対象化合物をEPチューブに入れ、DMSO、solutol、及び滅菌注射水(三者の体積比は1:2:17、v:v:v)を加え、20分超音波処理して十分に溶解させた(化合物の配合濃度は:0.005mmol/mLであった。)。静脈投与量は0.01mmol/kg、経口投与量は0.1mmol/kgであった。投与前(0時間)と投与後0.0833、0.25、0.5、0.75、1、2、4、6、8、10、12時間(サンプリングポイントは状況により調整)に頸静脈から全血0.3mlを採取し、EDTA-K2(Aldrich試薬社)抗凝固を含む遠心チューブに入れ、採取後砕氷中に置き、0.5時間以内に1530gの条件で10分間遠心分離し、血漿をすべて分離し、別のきれいな遠心管内に置き、-20℃の冷蔵庫に入れて測定に備えた。
3.サンプル濃度の測定
一連の検量線の溶液を調製した。検量線溶液10μLとサンプルにそれぞれ1000μLの内標準作動液(ベラパミル5ng/mL(Aldrich社)、グリベンウレア50ng/mL(Aldrich社)、及びジクロフェナク50ng/mL(Aldrich社)を含むアセトニトリル溶液)を加え、5分間ボルテックス振とうした。4℃、3700回転/分の条件で10分間遠心分離し、上清60μLをサンプリング管に入れて120μLの水と混合し、10μLをボルテックス振とうに注入して測定した。WinNonlin V6.2非房室モデルを用いて薬物動態学的パラメータを計算した。
測定結果を次の表46~52に示す。
データから明らかなように、プロドラッグ分子化合物5、20、51は、ニトロキソリンに比べて、ビーグルイヌによく吸収されており、プロドラッグ分子により薬物分子の投与量を効果的に低下できることが示唆された。
Claims (9)
- 下記式(II)で表される化合物、又はそのメソ体、ラセミ体、エナンチオマー、ジアステレオマー、又はこれらの混合物、又はその医薬的に許容可能な塩。
R1は水素及びC1-6アルキル基からなる群から選ばれ、
R4、R5及びR6は、それぞれ独立して、水素、C1-C12アルキル基及び-O-C 1 -C 6 アルキル基からなる群から選ばれ、又は
R4、R5及びR6のうち、1つは水素であり、残りの2つは炭素と一緒にC3-C6シクロアルキル基又は5~7員複素環基を形成し、前記C3-C6シクロアルキル基又は5~7員複素環基は、-C(O)R11 からなる群から選ばれる1つ又は複数の基によってさらに置換され、
R11 は、C 1-C6アルキル基である。) - R 1 は水素及びC 1-6 アルキル基からなる群から選ばれ、
R 4 、R 5 及びR 6 は、それぞれ独立して、水素及びC 1 -C 6 アルキル基からなる群から選ばれ、又は
R 4 、R 5 及びR 6 のうち、1つは水素であり、残りの2つは炭素と一緒にピロリジニル基を形成し、前記ピロリジニル基は-C(O)R 11 からなる群から選択される1つまたは複数の置換基によってさらに置換され、
R11は、C 1-C6アルキル基である、請求項1に記載の式(II)で表される化合物、又はそのメソ体、ラセミ体、エナンチオマー、ジアステレオマー、又はこれらの混合物、又はその医薬的に許容可能な塩。 - R 1 は水素であり、
R4、R5及びR6のうち、1つは水素であり、残りの2つは炭素と一緒にピロリジニル基を形成し、前記ピロリジニル基は-C(O)R11 からなる群から選ばれる1つ又は複数の基によってさらに置換され、
R 11 は、C 1 -C 6 アルキル基である、請求項2に記載の式(II)で表される化合物、又はそのメソ体、ラセミ体、エナンチオマー、ジアステレオマー、又はこれらの混合物、又はその医薬的に許容可能な塩。 - 以下のものからなる群から選ばれる化合物、又はそのメソ体、ラセミ体、エナンチオマー、ジアステレオマー、又はこれらの混合物、又はその医薬的に許容可能な塩。
- 請求項1に記載の式(II)で表される化合物又はそのメソ体、ラセミ体、エナンチオマー、ジアステレオマー、又はこれらの混合物、又はその医薬的に許容可能な塩の製造方法であって、
- 前記アルカリは、炭酸カリウム、炭酸ナトリウム、炭酸水素カリウム、炭酸水素ナトリウム、トリエチルアミン、及びピリジンからなる群から選ばれ、前記溶媒は、ジクロロメタン、N,N-ジメチルホルムアミド、テトラヒドロフラン、及びt-ブタノールメチルエーテルからなる群から選ばれる、請求項5に記載の製造方法。
- 請求項1~4のいずれか1項に記載の化合物又はその医薬的に許容可能な塩と、少なくとも1種の医薬的に許容可能な担体とを含む医薬組成物。
- 請求項1~4のいずれか1項に記載の化合物又はその医薬的に許容可能な塩又は請求項7に記載の医薬組成物の、抗感染薬又は抗腫瘍薬の製造における使用。
- 前記腫瘍は膀胱癌、前立腺癌、及び腎臓癌からなる群から選ばれる、請求項8に記載の使用。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024132795A JP2024174864A (ja) | 2018-09-29 | 2024-08-08 | ニトロキソリンプロドラッグ及びその使用 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201811148314 | 2018-09-29 | ||
| CN201811148314.0 | 2018-09-29 | ||
| PCT/CN2019/108419 WO2020063824A1 (zh) | 2018-09-29 | 2019-09-27 | 硝羟喹啉前药及其用途 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024132795A Division JP2024174864A (ja) | 2018-09-29 | 2024-08-08 | ニトロキソリンプロドラッグ及びその使用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022502510A JP2022502510A (ja) | 2022-01-11 |
| JP7624924B2 true JP7624924B2 (ja) | 2025-01-31 |
Family
ID=69953367
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021542249A Active JP7624924B2 (ja) | 2018-09-29 | 2019-09-27 | ニトロキソリンプロドラッグ及びその使用 |
| JP2024132795A Pending JP2024174864A (ja) | 2018-09-29 | 2024-08-08 | ニトロキソリンプロドラッグ及びその使用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024132795A Pending JP2024174864A (ja) | 2018-09-29 | 2024-08-08 | ニトロキソリンプロドラッグ及びその使用 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US12152048B2 (ja) |
| EP (1) | EP3858814A4 (ja) |
| JP (2) | JP7624924B2 (ja) |
| KR (1) | KR102762016B1 (ja) |
| CN (1) | CN111295372B (ja) |
| AU (1) | AU2019351494B2 (ja) |
| BR (1) | BR112021005941A2 (ja) |
| CA (1) | CA3113463A1 (ja) |
| MX (1) | MX2021003724A (ja) |
| SG (1) | SG11202103134TA (ja) |
| WO (1) | WO2020063824A1 (ja) |
| ZA (1) | ZA202102155B (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2023519276A (ja) * | 2020-03-30 | 2023-05-10 | 江▲蘇▼▲亞▼虹医▲薬▼科技股▲フン▼有限公司 | ニトロキソリンプロドラッグの結晶形、それを含む医薬組成物、及びそれらの調製法及びそれらの適用 |
| JP2024174864A (ja) * | 2018-09-29 | 2024-12-17 | 江▲蘇▼▲亞▼虹医▲薬▼科技股▲フン▼有限公司 | ニトロキソリンプロドラッグ及びその使用 |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112402388A (zh) * | 2019-08-05 | 2021-02-26 | 江苏亚虹医药科技股份有限公司 | 一种用于治疗膀胱癌的口服固体制剂及其制备方法 |
| CN111514142B (zh) * | 2020-05-29 | 2021-04-06 | 江苏亚虹医药科技股份有限公司 | 含硝羟喹啉前药的药物组合物及其制备方法和应用 |
| CN111646936A (zh) * | 2020-06-22 | 2020-09-11 | 江苏亚虹医药科技有限公司 | 芳香醚类化合物的制备方法 |
| CN111773193A (zh) * | 2020-07-03 | 2020-10-16 | 江苏亚虹医药科技有限公司 | 含硝羟喹啉赖氨酸盐的药物组合物及其制备方法和用途 |
| CN114437033A (zh) * | 2020-10-30 | 2022-05-06 | 江苏亚虹医药科技股份有限公司 | 硝羟喹啉前药的盐、含其的药物组合物及其制备方法和用途 |
| CN112745334B (zh) * | 2021-02-07 | 2022-03-25 | 厦门一先药业有限公司 | 一种巴洛沙韦及其衍生物的前药、其制备方法和用途 |
| JP2024519988A (ja) | 2021-05-31 | 2024-05-21 | 江▲蘇▼▲亞▼虹医▲薬▼科技股▲フン▼有限公司 | 5-ニトロ-8-ヒドロキシキノリンの使用 |
| CN118059101A (zh) * | 2022-11-22 | 2024-05-24 | 江苏亚虹医药科技股份有限公司 | 8-羟基喹啉衍生物的用途 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002536435A (ja) | 1999-02-12 | 2002-10-29 | メディヴィル・アクチボラグ | 非ヌクレオシド逆転写酵素インヒビター |
| JP2010520923A (ja) | 2007-03-09 | 2010-06-17 | グリーン・クロス・コーポレイション | パーキンソン病の予防又は治療用の(+)−3−ヒドロキシモルヒナンの経口投与可能なプロドラッグ |
| JP2016514705A (ja) | 2013-03-15 | 2016-05-23 | アジエリス ファーマシューティカル テクノロジーズ コンパニー リミテッド | ニトロキソリンの塩基付加塩及びその使用 |
| JP2016520054A (ja) | 2013-05-09 | 2016-07-11 | スーチュアン ハイスーク ファーマシューティカル カンパニー リミテッド | フェノール誘導体及びその製造方法及び医薬的な応用 |
| WO2017210489A1 (en) | 2016-06-01 | 2017-12-07 | M3 Biotechnology, Inc. | Compounds |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA883837A (en) * | 1971-10-19 | Societe D'etudes De Produits Chimiques | Furoic esters of 5-nitro quinoline and to methods of preparing them | |
| FR1510067A (fr) * | 1966-12-06 | 1968-01-19 | Esters carbamiques dérivés de la quinoléine | |
| GB1168307A (en) * | 1967-08-14 | 1969-10-22 | Soc D Etudes Prod Chimique | Novel Esters of 5-Nitro-Quinoline |
| FR2197512B1 (ja) * | 1972-08-31 | 1977-01-14 | Roussel Uclaf | |
| US3828056A (en) * | 1972-09-11 | 1974-08-06 | Searle & Co | (2-(2-methyl-5-nitro-1-imidazolyl)ethyl)heteroaryloxy ethers |
| FR2355829A1 (fr) * | 1976-06-24 | 1978-01-20 | Debat Lab | Nouveaux derives de la nitroxoline utile en therapeutique |
| DE3225169A1 (de) * | 1982-07-06 | 1984-01-12 | Basf Ag, 6700 Ludwigshafen | Chinolinderivate, verfahren zu ihrer herstellung, diese enthaltende mikrobizide und ihre verwendung zur bekaempfung von pilzen |
| US4472404A (en) * | 1982-08-16 | 1984-09-18 | The Dow Chemical Company | 8-Quinolinyl carbamates and their use as urinary tract antimicrobials |
| DE3483081D1 (de) * | 1983-10-18 | 1990-10-04 | Ciba Geigy Ag | Verwendung von chinolinderivaten zum schuetzen von kulturpflanzen. |
| DE3621540A1 (de) * | 1986-06-27 | 1988-01-07 | Basf Ag | Chinolinderivate, verfahren zu ihrer herstellung, diese enthaltende mikrobizide und ihre verwendung zur bekaempfung von bakterien und pilzen |
| WO1993020094A1 (en) * | 1992-03-27 | 1993-10-14 | Abbott Laboratories | Haptens, tracers, immunogens and antibodies for quinoline |
| IT1317735B1 (it) * | 2000-01-26 | 2003-07-15 | Nicox Sa | Sali di agenti antimicrobici. |
| AU2006304906B8 (en) * | 2005-10-20 | 2011-11-03 | Catholic Healthcare West | Androsterone derivatives and method of use thereof |
| US20100078393A1 (en) * | 2008-10-01 | 2010-04-01 | Bei Yin | Biocidal compositions and methods of use |
| EP2350012B1 (en) | 2008-10-06 | 2017-06-28 | The Johns Hopkins University | Quinoline compounds as inhibitors of angiogenesis, human methionine aminopeptidase, and sirt1, and methods of treating disorders |
| CN101880239A (zh) * | 2009-05-08 | 2010-11-10 | 北京美倍他药物研究有限公司 | 丙泊酚的水溶性氨基酸酯衍生物 |
| GB201005589D0 (en) * | 2010-04-01 | 2010-05-19 | Respivert Ltd | Novel compounds |
| CN102464631B (zh) * | 2010-11-08 | 2016-08-10 | 中国科学院上海药物研究所 | 哌嗪取代的1,3-二取代脲类化合物及哌嗪取代的酰胺类化合物及其制备方法和用途 |
| EA035576B1 (ru) | 2013-12-30 | 2020-07-09 | КейТи ЭНД Джи ЛАЙФ САЙЕНСИЗ КОРПОРЕЙШН | Производное на основе 1,2-нафтохинона и способ его получения |
| ES2986814T3 (es) * | 2015-04-28 | 2024-11-12 | Shionogi & Co | Derivados de piridona policíclicos sustituidos y profármacos de los mismos |
| US10851123B2 (en) * | 2016-02-23 | 2020-12-01 | Concentric Analgesics, Inc. | Prodrugs of phenolic TRPV1 agonists |
| MA46839A (fr) * | 2016-11-18 | 2021-03-24 | Neurovive Pharmaceutical Ab | Promédicaments hépatiques d'ionophores de protons mitochondriaux |
| JP7624924B2 (ja) * | 2018-09-29 | 2025-01-31 | 江▲蘇▼▲亞▼虹医▲薬▼科技股▲フン▼有限公司 | ニトロキソリンプロドラッグ及びその使用 |
| TW202144329A (zh) * | 2020-03-30 | 2021-12-01 | 大陸商江蘇亞虹醫藥科技股份有限公司 | 硝羥喹啉前藥的晶型、含其的醫藥組成物及其製備方法和應用 |
-
2019
- 2019-09-27 JP JP2021542249A patent/JP7624924B2/ja active Active
- 2019-09-27 CA CA3113463A patent/CA3113463A1/en active Pending
- 2019-09-27 SG SG11202103134TA patent/SG11202103134TA/en unknown
- 2019-09-27 EP EP19864911.3A patent/EP3858814A4/en active Pending
- 2019-09-27 KR KR1020217012529A patent/KR102762016B1/ko active Active
- 2019-09-27 BR BR112021005941-5A patent/BR112021005941A2/pt unknown
- 2019-09-27 CN CN201980004913.1A patent/CN111295372B/zh active Active
- 2019-09-27 MX MX2021003724A patent/MX2021003724A/es unknown
- 2019-09-27 US US17/280,999 patent/US12152048B2/en active Active
- 2019-09-27 WO PCT/CN2019/108419 patent/WO2020063824A1/zh not_active Ceased
- 2019-09-27 AU AU2019351494A patent/AU2019351494B2/en active Active
-
2021
- 2021-03-30 ZA ZA2021/02155A patent/ZA202102155B/en unknown
-
2024
- 2024-08-08 JP JP2024132795A patent/JP2024174864A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002536435A (ja) | 1999-02-12 | 2002-10-29 | メディヴィル・アクチボラグ | 非ヌクレオシド逆転写酵素インヒビター |
| JP2010520923A (ja) | 2007-03-09 | 2010-06-17 | グリーン・クロス・コーポレイション | パーキンソン病の予防又は治療用の(+)−3−ヒドロキシモルヒナンの経口投与可能なプロドラッグ |
| JP2016514705A (ja) | 2013-03-15 | 2016-05-23 | アジエリス ファーマシューティカル テクノロジーズ コンパニー リミテッド | ニトロキソリンの塩基付加塩及びその使用 |
| JP2016520054A (ja) | 2013-05-09 | 2016-07-11 | スーチュアン ハイスーク ファーマシューティカル カンパニー リミテッド | フェノール誘導体及びその製造方法及び医薬的な応用 |
| WO2017210489A1 (en) | 2016-06-01 | 2017-12-07 | M3 Biotechnology, Inc. | Compounds |
Non-Patent Citations (1)
| Title |
|---|
| Current Pharmaceutical Design,2010年,Vol. 16, No. 18,pp. 2033-2052 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2024174864A (ja) * | 2018-09-29 | 2024-12-17 | 江▲蘇▼▲亞▼虹医▲薬▼科技股▲フン▼有限公司 | ニトロキソリンプロドラッグ及びその使用 |
| JP2023519276A (ja) * | 2020-03-30 | 2023-05-10 | 江▲蘇▼▲亞▼虹医▲薬▼科技股▲フン▼有限公司 | ニトロキソリンプロドラッグの結晶形、それを含む医薬組成物、及びそれらの調製法及びそれらの適用 |
| JP7780763B2 (ja) | 2020-03-30 | 2025-12-05 | 江▲蘇▼▲亞▼虹医▲薬▼科技股▲フン▼有限公司 | ニトロキソリンプロドラッグの結晶形、それを含む医薬組成物、及びそれらの調製法及びそれらの適用 |
Also Published As
| Publication number | Publication date |
|---|---|
| SG11202103134TA (en) | 2021-04-29 |
| KR20210070320A (ko) | 2021-06-14 |
| AU2019351494A1 (en) | 2021-05-20 |
| CA3113463A1 (en) | 2020-04-02 |
| JP2024174864A (ja) | 2024-12-17 |
| KR102762016B1 (ko) | 2025-02-05 |
| EP3858814A4 (en) | 2022-10-05 |
| AU2019351494B2 (en) | 2025-03-13 |
| EP3858814A1 (en) | 2021-08-04 |
| US20210363165A1 (en) | 2021-11-25 |
| CN111295372B (zh) | 2021-03-09 |
| JP2022502510A (ja) | 2022-01-11 |
| ZA202102155B (en) | 2025-07-30 |
| US12152048B2 (en) | 2024-11-26 |
| MX2021003724A (es) | 2021-05-14 |
| WO2020063824A1 (zh) | 2020-04-02 |
| BR112021005941A2 (pt) | 2021-06-29 |
| CN111295372A (zh) | 2020-06-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7624924B2 (ja) | ニトロキソリンプロドラッグ及びその使用 | |
| JP6947644B2 (ja) | 重水素化ケノデオキシコール酸誘導体およびこの化合物を含む薬物組成物 | |
| EP3046920B1 (en) | Glucosylceramide synthase inhibitors for the treatment of diseases | |
| JP2011522843A (ja) | 新規なカリウムチャンネルブロッカー及びその使用 | |
| JP2001505527A (ja) | ピリジル置換されたc▲下13▼側鎖を有するタキサン誘導体、その製造方法および抗腫瘍剤としてのその使用 | |
| BG98068A (bg) | Съединение с формула 4-(/2-бензотиазолил/метиламино)-алфа- (/3,4-дифлуорофенокси/метил)-1-пиперидинетанол, методи за получаване и използуването му, както и фармацевтични състави с това съединение и методи за тяхното получаване | |
| JP2005527518A (ja) | 新規なカルコン(chalcone)誘導体とその使用 | |
| RU2639875C2 (ru) | Производное фенила | |
| JP2020500920A (ja) | 置換ピラゾロアゼピン−4−オンおよびそれらのホスホジエステラーゼ阻害剤としての使用 | |
| CN112341377A (zh) | 一种杂环类化合物及其应用 | |
| CA3147471A1 (en) | Inhibitors of human atgl | |
| CN113880804A (zh) | 新型苯并咪唑化合物 | |
| CN120435467A (zh) | 补体因子b抑制剂及其药物组合物和应用 | |
| TWI874355B (zh) | 硝羥喹啉前藥及其用途 | |
| HK40047998A (en) | Nitroxoline prodrug and use thereof | |
| CN111356677B (zh) | 四氢异喹啉类衍生物及其制备方法和用途 | |
| CN114149395A (zh) | 一种苯并环戊烯酮衍生物、其制备方法及医药用途 | |
| TWI811901B (zh) | 一種嘧啶甲醯胺類化合物及其應用 | |
| WO2008157271A1 (en) | Deuterium-enriched escitalopram | |
| JP2006510688A (ja) | 新規アミノベンゾフェノン化合物 | |
| WO2008157653A1 (en) | Deuterium-enriched oseltamivir | |
| KR101881115B1 (ko) | 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 제조방법 및 이의 용도 | |
| TW202411231A (zh) | 用作泛素-特異性蛋白酶抑制劑的取代嘌呤酮衍生物 | |
| WO2023240378A1 (zh) | 咪唑烷基香草酸醚衍生物及其用途 | |
| TW202146406A (zh) | 新型吡嗪化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220926 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20230927 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231023 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240123 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20240408 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240808 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20240903 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250107 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250121 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7624924 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |