JP7590959B2 - 特定の殺線虫性スルホンアミドを調製するためのプロセス及び中間体 - Google Patents
特定の殺線虫性スルホンアミドを調製するためのプロセス及び中間体 Download PDFInfo
- Publication number
- JP7590959B2 JP7590959B2 JP2021517976A JP2021517976A JP7590959B2 JP 7590959 B2 JP7590959 B2 JP 7590959B2 JP 2021517976 A JP2021517976 A JP 2021517976A JP 2021517976 A JP2021517976 A JP 2021517976A JP 7590959 B2 JP7590959 B2 JP 7590959B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- acid
- formula
- compound
- cycloalkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D291/00—Heterocyclic compounds containing rings having nitrogen, oxygen and sulfur atoms as the only ring hetero atoms
- C07D291/08—Heterocyclic compounds containing rings having nitrogen, oxygen and sulfur atoms as the only ring hetero atoms condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C303/00—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides
- C07C303/02—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of sulfonic acids or halides thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C303/00—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides
- C07C303/02—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of sulfonic acids or halides thereof
- C07C303/04—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of sulfonic acids or halides thereof by substitution of hydrogen atoms by sulfo or halosulfonyl groups
- C07C303/06—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of sulfonic acids or halides thereof by substitution of hydrogen atoms by sulfo or halosulfonyl groups by reaction with sulfuric acid or sulfur trioxide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C303/00—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides
- C07C303/02—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of sulfonic acids or halides thereof
- C07C303/22—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of sulfonic acids or halides thereof from sulfonic acids, by reactions not involving the formation of sulfo or halosulfonyl groups; from sulfonic halides by reactions not involving the formation of halosulfonyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C303/00—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides
- C07C303/32—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of salts of sulfonic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C303/00—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides
- C07C303/36—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of amides of sulfonic acids
- C07C303/38—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of amides of sulfonic acids by reaction of ammonia or amines with sulfonic acids, or with esters, anhydrides, or halides thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/28—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C309/41—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton containing singly-bound oxygen atoms bound to the carbon skeleton
- C07C309/42—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton containing singly-bound oxygen atoms bound to the carbon skeleton having the sulfo groups bound to carbon atoms of non-condensed six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/28—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C309/45—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton containing nitrogen atoms, not being part of nitro or nitroso groups, bound to the carbon skeleton
- C07C309/49—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton containing nitrogen atoms, not being part of nitro or nitroso groups, bound to the carbon skeleton the carbon skeleton being further substituted by singly-bound oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/22—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound oxygen atoms
- C07C311/29—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound oxygen atoms having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Steroid Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Description
本出願は、米国仮特許出願第62/741877号(2018年10月5日出願)の利益及び優先権を主張するものである。上記出願の内容は、その全体が本明細書に参照により組み込まれる。
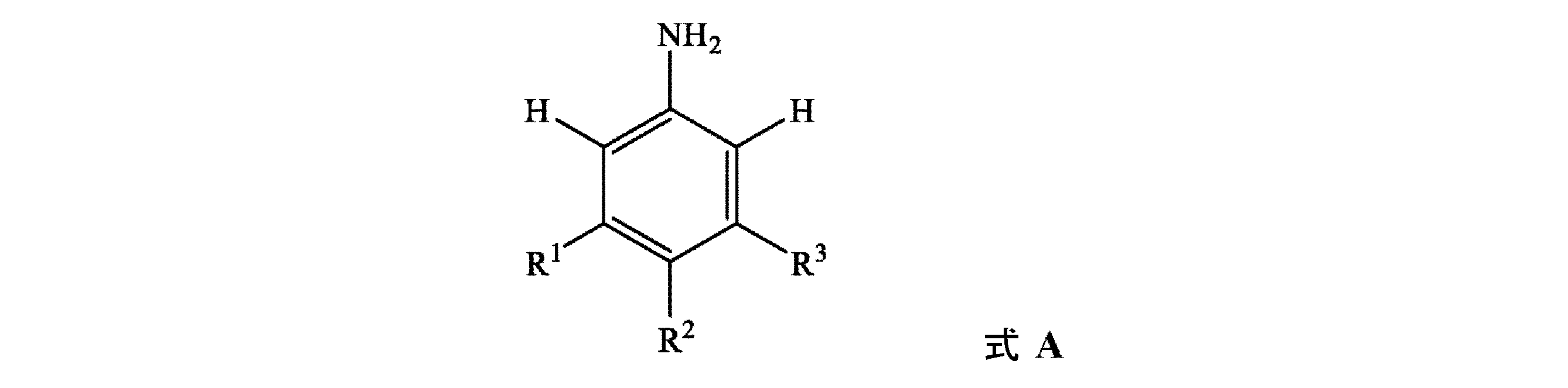
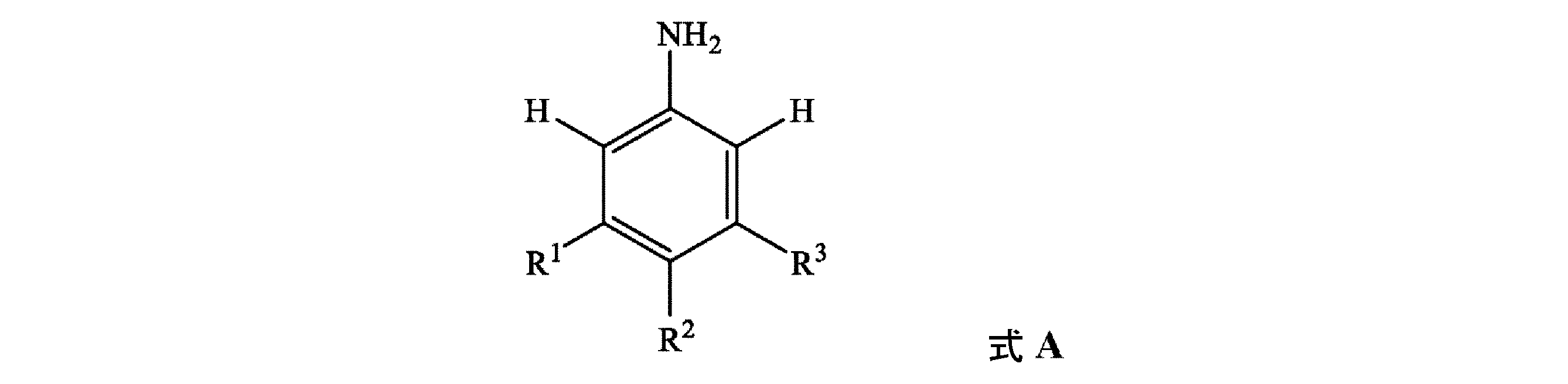
[式中、各R1、R2、及びR3は、独立して、H、SF5、N(C1~C8アルキル)(C1~C8アルキル)、C(=S)N(C1~C8アルキル)(C1~C8アルキル)、SO2N(C1~C8アルキル)(C1~C8アルキル)、OSO2(C1~C8アルキル)、OSO2N(C1~C8アルキル)(C1~C8アルキル)、N(C1~C8アルキル)SO2(C1~C8アルキル)、若しくはC1~C8アルキル、C1~C8ハロアルキル、C2~C8アルケニル、C2~C8アルキニル、C3~C10シクロアルキル、C3~C10ハロシクロアルキル、C4~C10アルキルシクロアルキル、C4~C10シクロアルキルアルキル、C6~C14シクロアルキルシクロアルキル、C5~C10アルキルシクロアルキルアルキル、C3~C8シクロアルケニル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C3~C8シクロアルコキシ、C3~C8ハロシクロアルコキシ、C4~C10シクロアルキルアルコキシ、C2~C8アルケニルオキシ、C2~C8アルキニルオキシ、C1~C8アルキルチオ、C1~C8アルキルスルフィニル、C1~C8アルキルスルホニル、C3~C8シクロアルキルチオ、C3~C8シクロアルキルスルフィニル、C3~C8シクロアルキルスルホニル、C4~C10シクロアルキルアルキルチオ、C4~C10シクロアルキルアルキルスルフィニル、C4~C10シクロアルキルアルキルスルホニル、C2~C8アルケニルチオ、C2~C8アルケニルスルフィニル、C2~C8アルケニルスルホニル、C2~C8アルキニルチオ、C2~C8アルキニルスルフィニル、C2~C8アルキニルスルホニル、若しくはフェニルであるか;又は
隣接環原子上のR1、R2、及びR3のうちの2個は、一緒になって、5~7員の炭素環若しくは複素環を形成してもよく、各環は、炭素原子並びに最大2個のO、最大2個のS、及び最大3個のNから独立して選択される最大3個のヘテロ原子から選択される環員を含有し、ここで最大2個の炭素原子環員は、C(=O)及びC(=S)から独立して選択され、このような環は、C1~C4アルキル、C1~C4ハロアルキル、C2~C4アルケニル、C2~C4ハロアルケニル、C2~C4アルキニル、C2~C4ハロアルキニル、C3~C7シクロアルキル、C3~C7ハロシクロアルキル、C4~C8アルキルシクロアルキル、C4~C8ハロアルキルシクロアルキル、C4~C8シクロアルキルアルキル、C4~C8ハロシクロアルキルアルキル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C2~C8アルコキシカルボニル、C2~C6ハロアルコキシカルボニル、C2~C6アルキルカルボニル、及びC2~C6ハロアルキルカルボニルからなる群から独立して選択される最大3個の置換基で任意選択的に置換されており;
Mは、無機カチオン又は有機カチオンである]
の化合物を調製するための方法であって、
(a)式A
の化合物を、o-ジクロロベンゼン(ODCB)、クロロアルカン、及びクロロアレーンから選択される溶媒、並びにスルホン酸(例えば、クロロスルホン酸ClSO3H)、硫酸(H2SO4)、及び発煙硫酸から選択される第1の酸と接触させて、式B:
の化合物を形成することと、
(b)式Bの化合物を、(i)亜硝酸塩MNO2[例えば、NaNO2]又は亜硝酸エステル(例えば、亜硝酸tert-ブチル(tBuNO2)を含む亜硝酸アルキル]及び(ii)少なくとも1つの無機酸(例えば、塩酸HCl)、少なくとも1つの有機酸、又はこれらの混合物から選択される第2の酸と接触させて、式C:
の化合物を形成することと、を含む、方法を提供する。
(c)工程(b)からの式Cの化合物を、銅(Cu)粉末及び銅塩(例えば、CuI、CuBr、CuCl、又はCuCl2)から選択される銅供給源、並びに任意選択的に、まだ提供されていない場合は、第1の塩化物供給源、続いて少なくとも1つの無機塩基(例えば、NaOH)、少なくとも1つの有機塩基、又はこれらの混合物から選択される第1の塩基と接触させて、式D:
の化合物を形成する工程。
(d)工程(c)からの式Dの化合物を、塩化チオニル(SOCl2)、POCl3、PCl5、塩化オキサリル、及びホスゲンから選択される第2の塩化物供給源、並びに溶媒S1中のN,N-二置換ホルムアミド(例えば、ジメチルホルムアミド(DMF)及び/又はN-ホルミルピペリジン)から選択される触媒と接触させて、式E:
の化合物を形成する工程。
(e)工程(d)からの式Eの化合物を、アンモニア(水酸化アンモニウム又はNH4OH)、トリメチルアミン、トリエチルアミン、及びこれらの混合物から選択される第2の塩基、並びに溶媒S2中の任意選択的な無機塩基又は有機塩基と接触させて、式F:
の化合物を形成する工程。
の化合物を調製するための方法であって、
(A)式2
の化合物を、o-ジクロロベンゼン(ODCB)、クロロアルカン、及びクロロアレーンから選択される溶媒、並びにスルホン酸(例えば、クロロスルホン酸ClSO3H)、硫酸(H2SO4)、及び発煙硫酸から選択される第1の酸と接触させて、式3:
の化合物を形成することと、
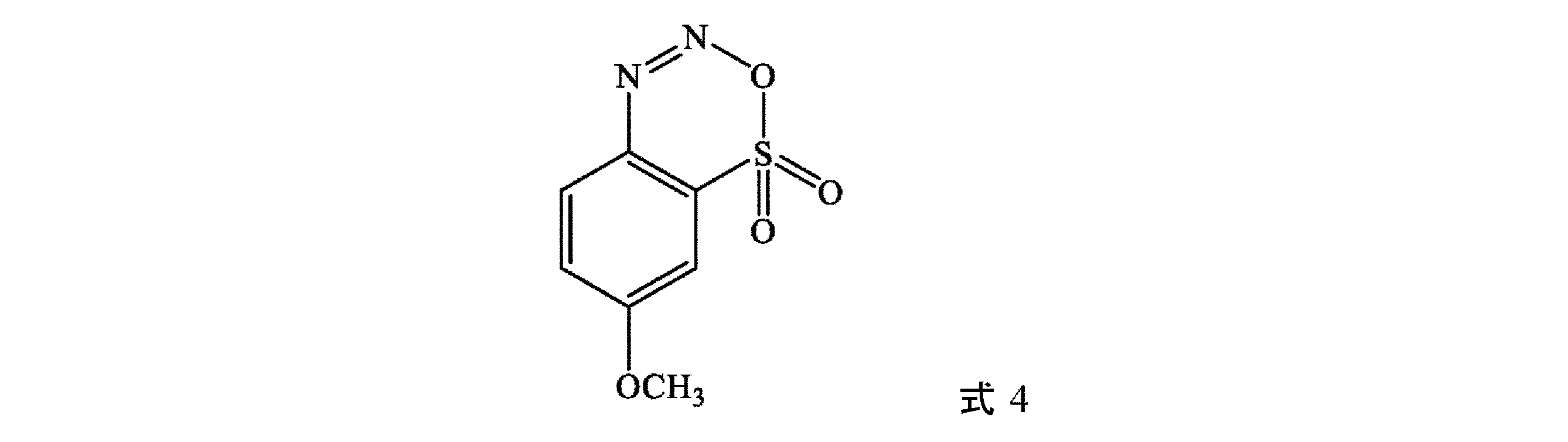
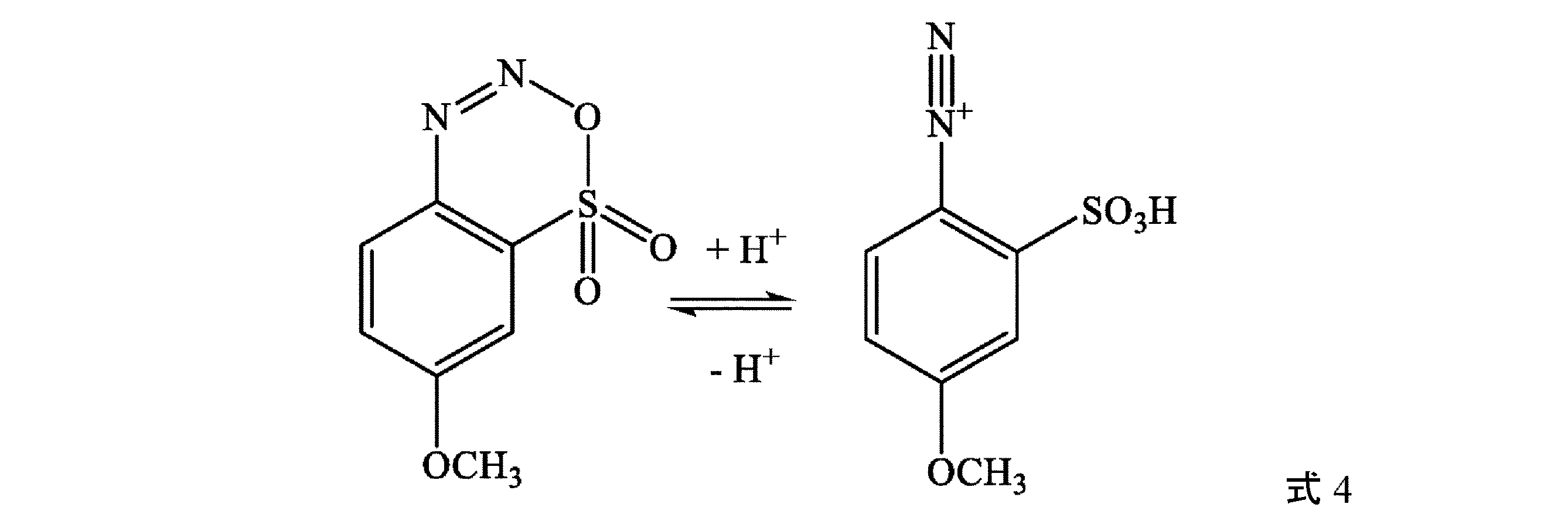
(B)式3の化合物を、(i)亜硝酸塩MNO2[例えば、NaNO2]又は亜硝酸エステル(例えば、亜硝酸tert-ブチル(tBuNO2)を含む亜硝酸アルキル]及び(ii)少なくとも1つの無機酸(例えば、塩酸HCl)、少なくとも1つの有機酸、又はこれらの混合物から選択される第2の酸と接触させて、式4:
[式中、Mは、無機カチオン又は有機カチオンである]の化合物を形成することと、
(C)式4の化合物を、銅(Cu)粉末及び銅塩(例えば、CuI、CuBr、CuCl、又はCuCl2)から選択される銅供給源、並びに任意選択的に、まだ提供されていない場合は、第1の塩化物供給源、続いて少なくとも1つの無機塩基(例えば、NaOH)、少なくとも1つの有機塩基、又はこれらの混合物から選択される第1の塩基と接触させて、式5:
の化合物を形成することと、
(D)工程(C)の式5の化合物を、塩化チオニル(SOCl2)、POCl3、PCl5、塩化オキサリル、及びホスゲンから選択される第2の塩化物供給源、並びに溶媒S1中のN,N-二置換ホルムアミド(例えば、ジメチルホルムアミド(DMF)及び/又はN-ホルミルピペリジン)から選択される触媒と接触させて、式6:
の化合物を形成することと、
(E)式6の化合物を、アンモニア(水酸化アンモニウム又はNH4OH)、トリメチルアミン、トリエチルアミン、及びこれらの混合物から選択される第2の塩基、並びに溶媒S2中の任意選択的な無機塩基又は有機塩基と接触させて、式1の化合物を形成することと、
を含む、方法を提供する。
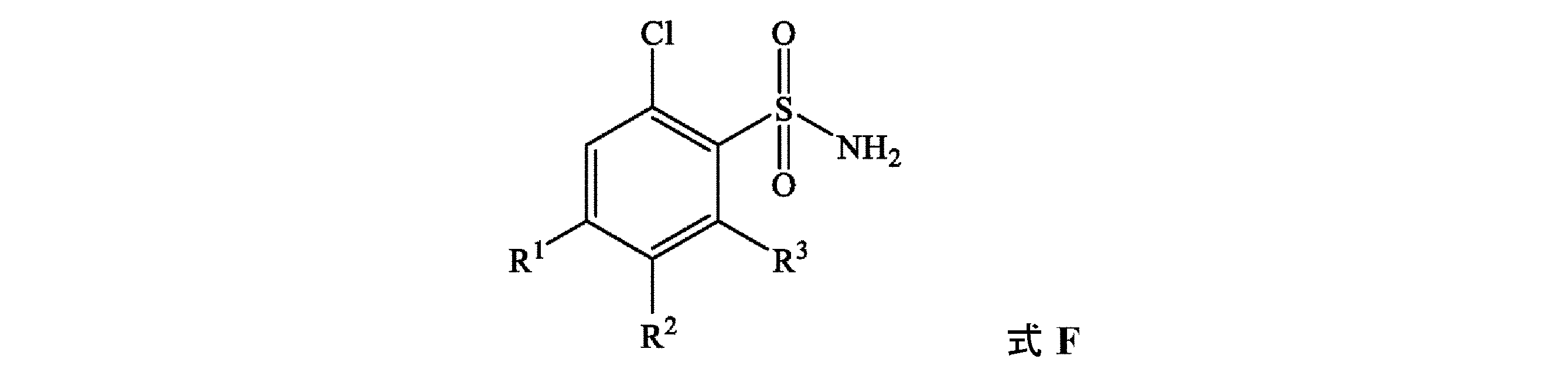
[式中、各R4、R5、R6、及びR7は、独立して、H、ハロゲン、SF5、C(=O)(C1~C8アルキル)、C(=O)O(C1~C8アルキル)、N(C1~C8アルキル)(C1~C8アルキル)、C(=O)N(C1~C8アルキル)(C1~C8アルキル)、C(=S)N(C1~C8アルキル)(C1~C8アルキル)、SO2N(C1~C8アルキル)(C1~C8アルキル)、OC(=O)(C1~C8アルキル)、OC(=O)O(C1~C8アルキル)、OC(=O)N(C1~C8アルキル)(C1~C8アルキル)、N(C1~C8アルキル)C(=O)O(C1~C8アルキル)、N(C1~C8アルキル)C(=O)N(C1~C8アルキル)(C1~C8アルキル)、OSO2(C1~C8アルキル)、OSO2N(C1~C8アルキル)(C1~C8アルキル)、N(C1~C8アルキル)SO2(C1~C8アルキル)、又はC1~C8アルキル、C1~C8ハロアルキル、C2~C8アルケニル、C2~C8アルキニル、C3~C10シクロアルキル、C3~C10ハロシクロアルキル、C4~C10アルキルシクロアルキル、C4~C10シクロアルキルアルキル、C6~C14シクロアルキルシクロアルキル、C5~C10アルキルシクロアルキルアルキル、C3~C8シクロアルケニル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C3~C8シクロアルコキシ、C3~C8ハロシクロアルコキシ、C4~C10シクロアルキルアルコキシ、C2~C8アルケニルオキシ、C2~C8アルキニルオキシ、C1~C8アルキルチオ、C1~C8アルキルスルフィニル、C1~C8アルキルスルホニル、C3~C8シクロアルキルチオ、C3~C8シクロアルキルスルフィニル、C3~C8シクロアルキルスルホニル、C4~C10シクロアルキルアルキルチオ、C4~C10シクロアルキルアルキルスルフィニル、C4~C10シクロアルキルアルキルスルホニル、C2~C8アルケニルチオ、C2~C8アルケニルスルフィニル、C2~C8アルケニルスルホニル、C2~C8アルキニルチオ、C2~C8アルキニルスルフィニル、C2~C8アルキニルスルホニル、若しくはフェニルであるか;又は
隣接環原子上のR4、R5、R6、及びR7のうちの2個は、一緒になって、5~7員の炭素環若しくは複素環を形成してもよく、各環は、炭素原子並びに最大2個のO、最大2個のS、及び最大3個のNから独立して選択される最大3個のヘテロ原子から選択される環員を含有し、ここで最大2個の炭素原子環員は、C(=O)及びC(=S)から独立して選択され、このような環は、C1~C4アルキル、C1~C4ハロアルキル、C2~C4アルケニル、C2~C4ハロアルケニル、C2~C4アルキニル、C2~C4ハロアルキニル、C3~C7シクロアルキル、C3~C7ハロシクロアルキル、C4~C8アルキルシクロアルキル、C4~C8ハロアルキルシクロアルキル、C4~C8シクロアルキルアルキル、C4~C8ハロシクロアルキルアルキル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C2~C8アルコキシカルボニル、C2~C6ハロアルコキシカルボニル、C2~C6アルキルカルボニル、及びC2~C6ハロアルキルカルボニルからなる群から独立して選択される最大3個の置換基で任意選択的に置換されている]
の化合物を調製するための方法であって、式H
の化合物を、(a)トリメチルアミン、トリエチルアミン、ピリジン、アルキルピリジン、及び3-ピコリン(即ち3-メチルピリジン)から選択される試薬A、並びに(b)溶媒S3の存在下で、塩化チオニル(SOCl2)、POCl3、PCl5、塩化オキサリル、及びホスゲンから選択される塩化物供給源と接触させて、式G:
の化合物を形成することとを含む、方法を提供する。
の化合物を調製するための方法であって、
(a)式8
の化合物を、溶媒S3の存在下で、トリメチルアミン、トリエチルアミン、ピリジン、アルキルピリジン、及び3-ピコリン(即ち3-メチルピリジン)から選択される試薬Aと接触させて、式9:
の化合物を形成することと、
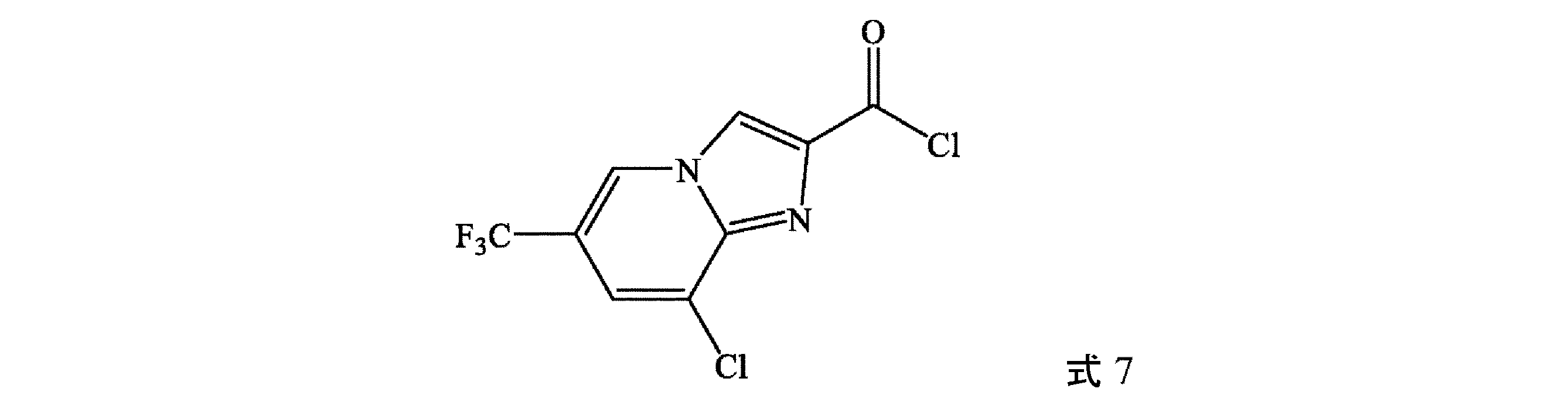
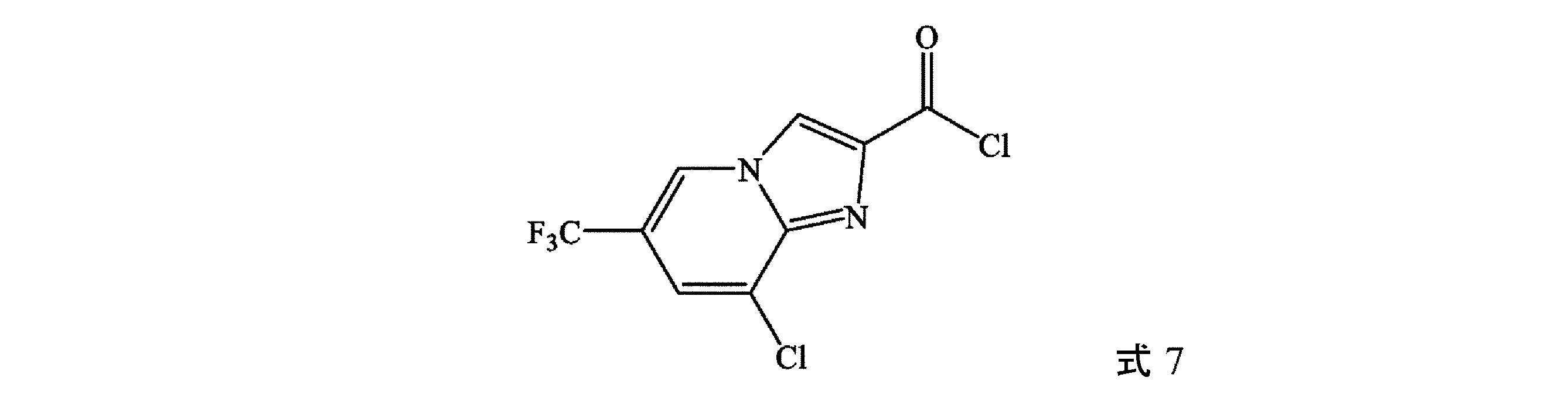
(b)式9の化合物を、塩化チオニル(SOCl2)、POCl3、PCl5、塩化オキサリル、及びホスゲンから選択される塩化物供給源と接触させて、式7の化合物を形成することを含む、方法に関する。
[式中、各R1、R2、及びR3は、独立して、H、SF5、N(C1~C8アルキル)(C1~C8アルキル)、C(=S)N(C1~C8アルキル)(C1~C8アルキル)、SO2N(C1~C8アルキル)(C1~C8アルキル)、OSO2(C1~C8アルキル)、OSO2N(C1~C8アルキル)(C1~C8アルキル)、N(C1~C8アルキル)SO2(C1~C8アルキル)、若しくはC1~C8アルキル、C1~C8ハロアルキル、C2~C8アルケニル、C2~C8アルキニル、C3~C10シクロアルキル、C3~C10ハロシクロアルキル、C4~C10アルキルシクロアルキル、C4~C10シクロアルキルアルキル、C6~C14シクロアルキルシクロアルキル、C5~C10アルキルシクロアルキルアルキル、C3~C8シクロアルケニル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C3~C8シクロアルコキシ、C3~C8ハロシクロアルコキシ、C4~C10シクロアルキルアルコキシ、C2~C8アルケニルオキシ、C2~C8アルキニルオキシ、C1~C8アルキルチオ、C1~C8アルキルスルフィニル、C1~C8アルキルスルホニル、C3~C8シクロアルキルチオ、C3~C8シクロアルキルスルフィニル、C3~C8シクロアルキルスルホニル、C4~C10シクロアルキルアルキルチオ、C4~C10シクロアルキルアルキルスルフィニル、C4~C10シクロアルキルアルキルスルホニル、C2~C8アルケニルチオ、C2~C8アルケニルスルフィニル、C2~C8アルケニルスルホニル、C2~C8アルキニルチオ、C2~C8アルキニルスルフィニル、C2~C8アルキニルスルホニル、若しくはフェニルであるか;又は
隣接環原子上のR1、R2、及びR3のうちの2個は、一緒になって、5~7員の炭素環若しくは複素環を形成してもよく、各環は、炭素原子並びに最大2個のO、最大2個のS、及び最大3個のNから独立して選択される最大3個のヘテロ原子から選択される環員を含有し、ここで最大2個の炭素原子環員は、C(=O)及びC(=S)から独立して選択され、このような環は、C1~C4アルキル、C1~C4ハロアルキル、C2~C4アルケニル、C2~C4ハロアルケニル、C2~C4アルキニル、C2~C4ハロアルキニル、C3~C7シクロアルキル、C3~C7ハロシクロアルキル、C4~C8アルキルシクロアルキル、C4~C8ハロアルキルシクロアルキル、C4~C8シクロアルキルアルキル、C4~C8ハロシクロアルキルアルキル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C2~C8アルコキシカルボニル、C2~C6ハロアルコキシカルボニル、C2~C6アルキルカルボニル、及びC2~C6ハロアルキルカルボニルからなる群から独立して選択される最大3個の置換基で任意選択的に置換されており、
各R4、R5、R6、及びR7は、独立して、H、ハロゲン、SF5、C(=O)(C1~C8アルキル)、C(=O)O(C1~C8アルキル)、N(C1~C8アルキル)(C1~C8アルキル)、C(=O)N(C1~C8アルキル)(C1~C8アルキル)、C(=S)N(C1~C8アルキル)(C1~C8アルキル)、SO2N(C1~C8アルキル)(C1~C8アルキル)、OC(=O)(C1~C8アルキル)、OC(=O)O(C1~C8アルキル)、OC(=O)N(C1~C8アルキル)(C1~C8アルキル)、N(C1~C8アルキル)C(=O)O(C1~C8アルキル)、N(C1~C8アルキル)C(=O)N(C1~C8アルキル)(C1~C8アルキル)、OSO2(C1~C8アルキル)、OSO2N(C1~C8アルキル)(C1~C8アルキル)、N(C1~C8アルキル)SO2(C1~C8アルキル)、若しくはC1~C8アルキル、C1~C8ハロアルキル、C2~C8アルケニル、C2~C8アルキニル、C3~C10シクロアルキル、C3~C10ハロシクロアルキル、C4~C10アルキルシクロアルキル、C4~C10シクロアルキルアルキル、C6~C14シクロアルキルシクロアルキル、C5~C10アルキルシクロアルキルアルキル、C3~C8シクロアルケニル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C3~C8シクロアルコキシ、C3~C8ハロシクロアルコキシ、C4~C10シクロアルキルアルコキシ、C2~C8アルケニルオキシ、C2~C8アルキニルオキシ、C1~C8アルキルチオ、C1~C8アルキルスルフィニル、C1~C8アルキルスルホニル、C3~C8シクロアルキルチオ、C3~C8シクロアルキルスルフィニル、C3~C8シクロアルキルスルホニル、C4~C10シクロアルキルアルキルチオ、C4~C10シクロアルキルアルキルスルフィニル、C4~C10シクロアルキルアルキルスルホニル、C2~C8アルケニルチオ、C2~C8アルケニルスルフィニル、C2~C8アルケニルスルホニル、C2~C8アルキニルチオ、C2~C8アルキニルスルフィニル、C2~C8アルキニルスルホニル、若しくはフェニルであるか;又は
隣接環原子上のR4、R5、R6、及びR7のうちの2個は、一緒になって、5~7員の炭素環若しくは複素環を形成してもよく、各環は、炭素原子並びに最大2個のO、最大2個のS、及び最大3個のNから独立して選択される最大3個のヘテロ原子から選択される環員を含有し、ここで最大2個の炭素原子環員は、C(=O)及びC(=S)から独立して選択され、このような環は、C1~C4アルキル、C1~C4ハロアルキル、C2~C4アルケニル、C2~C4ハロアルケニル、C2~C4アルキニル、C2~C4ハロアルキニル、C3~C7シクロアルキル、C3~C7ハロシクロアルキル、C4~C8アルキルシクロアルキル、C4~C8ハロアルキルシクロアルキル、C4~C8シクロアルキルアルキル、C4~C8ハロシクロアルキルアルキル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C2~C8アルコキシカルボニル、C2~C6ハロアルコキシカルボニル、C2~C6アルキルカルボニル、及びC2~C6ハロアルキルカルボニルからなる群から独立して選択される最大3個の置換基で任意選択的に置換されている]
の化合物を調製するための方法であって、(a)式F
の化合物を、溶媒S4中のトリメチルアミン、トリエチルアミン、ピリジン、アルキルピリジン、及び3-ピコリン(即ち3-メチルピリジン)から選択される試薬Bの存在下で、式G
の化合物と接触させて、式K:
の化合物を形成することと、
(b)式Kの化合物を、溶媒S5中の酸A1と接触させて、式Jの化合物を形成することと、を含む、方法を提供する。
の化合物を調製するための方法であって、(a)式1
の化合物を、溶媒S4中のトリメチルアミン、トリエチルアミン、ピリジン、アルキルピリジン、及び3-ピコリン(即ち3-メチルピリジン)から選択される試薬Bの存在下で、式7
の化合物と接触させて、式11:
の化合物を形成することと、
(b)式11の化合物を、溶媒S5中の酸A1と接触させて、式10の化合物を形成することと、を含む、方法に関する。
式3の化合物の合成
オーバーヘッド機械的撹拌機、10cmのガラススプリングパッキン、改良型ディーンスタークトラップ、温度計、冷却管、並びに窒素入口及び出口を取り付けた1Lの丸底フラスコに、p-アニシジン(67g;0.539mol)及びo-ジクロロベンゼン(ODCB、359.4mL、5.26vol)を充填する。70%の硫酸(98wt%、50.1g、27.2ml、0.501mol)を、20gの水中に添加し、次いで、<60℃の内部温度を維持しながら、反応器に滴加する。反応混合物を30分間かき混ぜた。得られた灰白色のスラリーを170℃まで加熱し、大気圧で水を除去するために還流蒸留した。p-アニシジンの含有量が<7%になるまで、反応集合体を170~176℃でかき混ぜた。反応集合体を濾過し、o-ジクロロベンゼンで洗浄する。式3の化合物である濡れた生成物(125.1g、約70wt%、0.431mol)を、HPLC(高速液体クロマトグラフィー)による>97.5%の純度を有する明灰色固体として得る。
式4及び5の化合物の合成
オーバーヘッド撹拌機、熱電対、及び窒素入口/出口を取り付けた1Lの丸底フラスコに、濃塩酸(30%wt%、314.2g、261.8mL、2,585mol)及び水(76.7mL、0.88vol)を充填する。式3の化合物である濡れた生成物(125.1g、約70wt%、0.431mol)を添加し、得られたスラリーを<10℃まで冷却する。水(87.6mL)中に溶解させた亜硝酸ナトリウム(31.2g、98%、0.444mol)の溶液をゆっくりと添加し、反応物を1時間撹拌する。次いで、スルファミン酸(2.1g、98%、0.222mol)を水(43.6mL)中に溶解させ、溶液を反応集合体に添加し、式4の化合物を形成する。
式6の化合物の合成
オーバーヘッド機械的撹拌機、ディーンスタークトラップ、温度計、及び冷却管を取り付けた1Lの丸底フラスコに、最後の実施例からの式5の化合物、続いてトルエン(432.1mL)を充填する。得られたスラリーを加熱し、含水量を除去する。スラリーを60~65℃まで冷却し、N,N-ジメチルホルムアミド(4.1mL、0.053mol)、続いて塩化チオニル(64.2mL、0.883mol)を反応器に添加する。2時間後、反応集合体を約1/2の体積まで蒸留し、トルエン(259.3mL)をスラリーに添加し、続いて更に蒸留する。得られたスラリーをセライトパッド(8.6g)に通して濾過し、パッドをトルエン(86.4mL)で洗浄し、ここで、濾液から式6の化合物を得る。
式1の化合物の合成
1Lの丸底フラスコに、窒素雰囲気下で、アンモニア水(28wt%、158.5mL、2.346mol)及びアセトニトリル(176.7ml)を充填する。最後の実施例からの式6の化合物を溶液に添加し、約2時間半かき混ぜ、2つの分離した層を得る。層を分離し、下の水層を更なる撹拌のためにトルエン(1.0vol)及びアセトニトリル(1.0vol)と混合し、再び2つの分離した層を得る。合わせた有機層を活性炭(3.0wt%)で処理し、次いでブフナー漏斗に通して濾過し、濃縮して、式1の化合物を得て、これを真空オーブン中で乾燥させて、HPLCによる>99%の純度を有する明茶色固体を得る。
式7の化合物の合成
冷却管、滴下漏斗、熱電対、加熱マントル、及び電磁撹拌器を取り付けた100mLの三口フラスコに、式8の化合物(10.01g、37.5mmol)、アセトニトリル(27mL)、及び3-ピコリン(2.824g、30.0mmol)を充填する。混合物を約65℃まで加熱し、次いで塩化チオニル(5.40g、44.9mmol)のアセトニトリル(3mL)中溶液を、63~71℃の温度を維持しながら、約20分にわたって滴加する。添加完了後、反応混合物を70℃で約2時間加熱し、次いで周囲温度まで放冷し、式7の化合物を、アセトニトリル中溶液として得る。
式10の化合物の合成-
式1及び7の化合物を使用したカップリング反応
電磁撹拌器、冷却管、熱電対、及び循環浴を取り付けた別の125mL4口ジャケット付き丸底フラスコに、式1の化合物(10.05g、44.9mmol)、3-ピコリン(8.462g、90.0mmol)、及びアセトニトリル(10mL)を充填する。混合物を約58℃まで加熱し、次いで式7の化合物を、55~60℃の反応温度を維持しながら、約1.5時間にわたって蠕動ポンプを介して滴加する。反応物を約60℃で約1時間加熱し、次いで濃塩酸(約37重量%、3.895g、39.4mmol)及び水(0.5mL)を添加して、次いで化合物10のアセトニトリル水溶液を得る。溶液を約70℃まで加熱し、次いで式10の種結晶(0.195g)の水(28g)中スラリーを約2時間にわたって添加する。更なる水(10g)の添加後、得られたスラリーを約1.5時間還流させ、周囲温度まで冷却し、次いで濾過する。ウェットケーキを水性アセトニトリルで洗浄し、乾燥させて、式10の化合物をオフホワイトから明茶色の固体として、約90%収率及び約98%純度で得る。
Claims (11)
- 式C:
[式中、各R1、R2、及びR3は、独立して、H、SF5、N(C1~C8アルキル)(C1~C8アルキル)、C(=S)N(C1~C8アルキル)(C1~C8アルキル)、SO2N(C1~C8アルキル)(C1~C8アルキル)、OSO2(C1~C8アルキル)、OSO2N(C1~C8アルキル)(C1~C8アルキル)、N(C1~C8アルキル)SO2(C1~C8アルキル)、若しくはC1~C8アルキル、C1~C8ハロアルキル、C2~C8アルケニル、C2~C8アルキニル、C3~C10シクロアルキル、C3~C10ハロシクロアルキル、C4~C10アルキルシクロアルキル、C4~C10シクロアルキルアルキル、C6~C14シクロアルキルシクロアルキル、C5~C10アルキルシクロアルキルアルキル、C3~C8シクロアルケニル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C3~C8シクロアルコキシ、C3~C8ハロシクロアルコキシ、C4~C10シクロアルキルアルコキシ、C2~C8アルケニルオキシ、C2~C8アルキニルオキシ、C1~C8アルキルチオ、C1~C8アルキルスルフィニル、C1~C8アルキルスルホニル、C3~C8シクロアルキルチオ、C3~C8シクロアルキルスルフィニル、C3~C8シクロアルキルスルホニル、C4~C10シクロアルキルアルキルチオ、C4~C10シクロアルキルアルキルスルフィニル、C4~C10シクロアルキルアルキルスルホニル、C2~C8アルケニルチオ、C2~C8アルケニルスルフィニル、C2~C8アルケニルスルホニル、C2~C8アルキニルチオ、C2~C8アルキニルスルフィニル、C2~C8アルキニルスルホニル、若しくはフェニルであるか;又は
隣接環原子上のR1、R2、及びR3のうちの2個は、一緒になって、5~7員の炭素環若しくは複素環を形成してもよく、各環は、炭素原子並びに最大2個のO、最大2個のS、及び最大3個のNから独立して選択される最大3個のヘテロ原子から選択される環員を含有し、ここで最大2個の炭素原子環員は、C(=O)及びC(=S)から独立して選択され、このような環は、C1~C4アルキル、C1~C4ハロアルキル、C2~C4アルケニル、C2~C4ハロアルケニル、C2~C4アルキニル、C2~C4ハロアルキニル、C3~C7シクロアルキル、C3~C7ハロシクロアルキル、C4~C8アルキルシクロアルキル、C4~C8ハロアルキルシクロアルキル、C4~C8シクロアルキルアルキル、C4~C8ハロシクロアルキルアルキル、C1~C8アルコキシ、C1~C8ハロアルコキシ、C2~C8アルコキシカルボニル、C2~C6ハロアルコキシカルボニル、C2~C6アルキルカルボニル、及びC2~C6ハロアルキルカルボニルからなる群から独立して選択される最大3個の置換基で任意選択的に置換されている]
の化合物を調製するための方法であって、
(a)式A
の化合物を、o-ジクロロベンゼン(ODCB)、クロロアルカン、及びクロロアレーンから選択される溶媒、並びにスルホン酸、硫酸(H2SO4)、及び発煙硫酸から選択される第1の酸と接触させて、式B:
の化合物を形成することと、
(b)式Bの前記化合物を、(i)亜硝酸塩MNO2 (Mは、無機カチオン又は有機カチオンである)又は亜硝酸エステル及び(ii)少なくとも1つの無機酸、少なくとも1つの有機酸、又はこれらの混合物から選択される第2の酸と接触させて、式C:
の化合物を形成することと、を含む、方法。 - 各R1、R2、及びR3が、独立して、H、C1~C6アルキル、C1~C6ハロアルキル、C1~C6アルコキシ、C1~C6ハロアルコキシ、又はフェニルである、請求項1に記載の方法。
- R2が、CH3、CH2CH3、CF3、OCH3、OCF3、又はOCH2CH3である、請求項1に記載の方法。
- 前記第2の酸が、塩酸(HCl)、臭化水素酸(HBr)、リン酸(H3PO4)、硫酸(H2SO4)、及びホウ酸(H3BO3)から選択される無機酸を含む、請求項1に記載の方法。
- 前記第2の酸が、ギ酸、酢酸、プロピオン酸、クエン酸、リンゴ酸、及びスルホン酸から選択される有機酸を含む、請求項1に記載の方法。
- 前記無機塩基が、アンモニア、水酸化ナトリウム、及び水酸化カリウムから選択される、請求項6に記載の方法。
- 前記有機塩基が、ナトリウムメトキシド、ナトリウムエトキシド、ナトリウムイソ-プロポキシド、ナトリウムn-プロポキシド、カリウムメトキシド、カリウムエトキシド、カリウム1-プロポキシド、カリウム2-プロポキシド、メチルアミン、エチルアミン、ジメチルアミン、トリメチルアミン、トリエチルアミン、及びピリジンから選択される、請求項6に記載の方法。
- Mが、ナトリウム、カリウム、アンモニウム、トリメチルアンモニウム、トリエチルアンモニウム、リチウム、又はこれらの混合物である、請求項10に記載の化合物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024200065A JP2025026926A (ja) | 2018-10-05 | 2024-11-15 | 特定の殺線虫性スルホンアミドを調製するためのプロセス及び中間体 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862741877P | 2018-10-05 | 2018-10-05 | |
| US62/741,877 | 2018-10-05 | ||
| PCT/US2019/054255 WO2020072616A1 (en) | 2018-10-05 | 2019-10-02 | Process and intermediates for the preparation of certain nematicidal sulfonamides |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024200065A Division JP2025026926A (ja) | 2018-10-05 | 2024-11-15 | 特定の殺線虫性スルホンアミドを調製するためのプロセス及び中間体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022501411A JP2022501411A (ja) | 2022-01-06 |
| JP7590959B2 true JP7590959B2 (ja) | 2024-11-27 |
Family
ID=70055692
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021517976A Active JP7590959B2 (ja) | 2018-10-05 | 2019-10-02 | 特定の殺線虫性スルホンアミドを調製するためのプロセス及び中間体 |
| JP2024200065A Pending JP2025026926A (ja) | 2018-10-05 | 2024-11-15 | 特定の殺線虫性スルホンアミドを調製するためのプロセス及び中間体 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024200065A Pending JP2025026926A (ja) | 2018-10-05 | 2024-11-15 | 特定の殺線虫性スルホンアミドを調製するためのプロセス及び中間体 |
Country Status (12)
| Country | Link |
|---|---|
| US (3) | US11339138B2 (ja) |
| EP (1) | EP3860997B1 (ja) |
| JP (2) | JP7590959B2 (ja) |
| KR (1) | KR102842997B1 (ja) |
| CN (2) | CN112805285B (ja) |
| AR (1) | AR116586A1 (ja) |
| AU (2) | AU2019354418B2 (ja) |
| BR (1) | BR112021006329B1 (ja) |
| CA (1) | CA3112349A1 (ja) |
| ES (1) | ES2955596T3 (ja) |
| IL (1) | IL280606B2 (ja) |
| WO (1) | WO2020072616A1 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112805285B (zh) * | 2018-10-05 | 2024-05-31 | 科迪华农业科技有限责任公司 | 用于制备某些杀线虫磺酰胺的方法和中间体 |
| CN116640136A (zh) * | 2023-04-07 | 2023-08-25 | 海利尔药业集团股份有限公司 | 一种磺酰胺类化合物或其作为农药可接受的盐、组合物及其用途 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012526125A (ja) | 2009-05-04 | 2012-10-25 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | 殺線虫性スルホンアミド |
| JP2014534194A (ja) | 2011-10-13 | 2014-12-18 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニーE.I.Du Pont De Nemours And Company | 殺線虫性スルホンアミドの固体形態 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1596652A (en) * | 1977-01-20 | 1981-08-26 | Roussel Lab Ltd | Imidazo (1,2-a) quinoline-2-carboxylic acid and derivatives |
| DE2943433A1 (de) * | 1979-10-26 | 1981-05-07 | Bayer Ag, 5090 Leverkusen | Verfahren zur herstellung von carbonsaeurehalogeniden |
| JPS5920242A (ja) * | 1982-07-27 | 1984-02-01 | Daikin Ind Ltd | 含フツ素脂肪族カルボン酸クロライドの製法 |
| GB0122503D0 (en) * | 2001-09-18 | 2001-11-07 | Astrazeneca Ab | Chemical compounds |
| JP2003321406A (ja) * | 2002-04-30 | 2003-11-11 | Mitsubishi Gas Chem Co Inc | 高純度フルオロアルキルベンゼン誘導体及びその製造法 |
| PA8854101A1 (es) * | 2008-12-18 | 2010-07-27 | Ortho Mcneil Janssen Pharm | Derivados de imidazol bicíclicos sustituidos como moduladores de gamma secretasa |
| CN103188934B (zh) | 2010-10-18 | 2015-08-26 | 纳幕尔杜邦公司 | 磺酰胺杀线虫剂 |
| JP2013202430A (ja) * | 2012-03-27 | 2013-10-07 | Shunichi Uchiyama | 酸化還元触媒及びこれを使用した燃料電池 |
| TWI605045B (zh) | 2013-01-14 | 2017-11-11 | 杜邦股份有限公司 | 殺線蟲磺醯胺之製備 |
| WO2017061497A1 (ja) * | 2015-10-06 | 2017-04-13 | 日本農薬株式会社 | 縮合複素環化合物又はその塩類及び該化合物を含有する農園芸用殺虫剤並びにその使用方法 |
| CN105481735B (zh) * | 2015-12-21 | 2018-01-02 | 沈阳化工研究院有限公司 | 一种制备邻氨基苯磺酸的方法 |
| CN108440447A (zh) * | 2018-04-24 | 2018-08-24 | 温州大学 | 1,2,3,4-苯并噁三嗪-1,1(2h)-二氧化物的制备方法 |
| CN112805285B (zh) * | 2018-10-05 | 2024-05-31 | 科迪华农业科技有限责任公司 | 用于制备某些杀线虫磺酰胺的方法和中间体 |
-
2019
- 2019-10-02 CN CN201980064915.XA patent/CN112805285B/zh active Active
- 2019-10-02 CA CA3112349A patent/CA3112349A1/en active Pending
- 2019-10-02 ES ES19869751T patent/ES2955596T3/es active Active
- 2019-10-02 CN CN202410607838.0A patent/CN118834177A/zh active Pending
- 2019-10-02 KR KR1020217009986A patent/KR102842997B1/ko active Active
- 2019-10-02 AU AU2019354418A patent/AU2019354418B2/en active Active
- 2019-10-02 IL IL280606A patent/IL280606B2/en unknown
- 2019-10-02 JP JP2021517976A patent/JP7590959B2/ja active Active
- 2019-10-02 US US17/281,370 patent/US11339138B2/en active Active
- 2019-10-02 EP EP19869751.8A patent/EP3860997B1/en active Active
- 2019-10-02 WO PCT/US2019/054255 patent/WO2020072616A1/en not_active Ceased
- 2019-10-02 BR BR112021006329-3A patent/BR112021006329B1/pt active IP Right Grant
- 2019-10-03 AR ARP190102816A patent/AR116586A1/es unknown
-
2022
- 2022-04-19 US US17/723,614 patent/US11897854B2/en active Active
-
2024
- 2024-01-03 US US18/402,892 patent/US20240132459A1/en not_active Abandoned
- 2024-11-15 JP JP2024200065A patent/JP2025026926A/ja active Pending
-
2025
- 2025-02-06 AU AU2025200798A patent/AU2025200798A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012526125A (ja) | 2009-05-04 | 2012-10-25 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | 殺線虫性スルホンアミド |
| JP2014534194A (ja) | 2011-10-13 | 2014-12-18 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニーE.I.Du Pont De Nemours And Company | 殺線虫性スルホンアミドの固体形態 |
Non-Patent Citations (1)
| Title |
|---|
| Derivatives of cymenes. I. Derivatives of .omicron.-cymene-4-sulfonic acid,Zhurnal Organicheskoi Khimii,1965年,Vol.1, No.10,pp.1832-1834 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2025200798A1 (en) | 2025-02-20 |
| KR102842997B1 (ko) | 2025-08-07 |
| JP2022501411A (ja) | 2022-01-06 |
| EP3860997B1 (en) | 2023-06-28 |
| US11897854B2 (en) | 2024-02-13 |
| JP2025026926A (ja) | 2025-02-26 |
| AU2019354418B2 (en) | 2024-11-07 |
| IL280606B2 (en) | 2023-10-01 |
| EP3860997A4 (en) | 2022-07-06 |
| BR112021006329B1 (pt) | 2023-04-18 |
| ES2955596T3 (es) | 2023-12-04 |
| BR112021006329A2 (pt) | 2021-07-06 |
| CN112805285A (zh) | 2021-05-14 |
| CN112805285B (zh) | 2024-05-31 |
| WO2020072616A1 (en) | 2020-04-09 |
| CN118834177A (zh) | 2024-10-25 |
| CA3112349A1 (en) | 2020-04-09 |
| IL280606B1 (en) | 2023-06-01 |
| IL280606A (en) | 2021-03-25 |
| EP3860997A1 (en) | 2021-08-11 |
| US20220242839A1 (en) | 2022-08-04 |
| AR116586A1 (es) | 2021-05-26 |
| US20240132459A1 (en) | 2024-04-25 |
| US20210309621A1 (en) | 2021-10-07 |
| KR20210070994A (ko) | 2021-06-15 |
| US11339138B2 (en) | 2022-05-24 |
| AU2019354418A1 (en) | 2021-02-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI393706B (zh) | 取代硫亞胺的製備方法 | |
| JP2025026926A (ja) | 特定の殺線虫性スルホンアミドを調製するためのプロセス及び中間体 | |
| CN102164898A (zh) | 用于合成卤化的环状化合物的方法 | |
| EP3265439B1 (en) | Process for preparing 3-chloro-2-vinylphenylsulfonates | |
| JP2008510745A (ja) | ビフェニルアミン類の製造方法 | |
| JP6310937B2 (ja) | 4−ハロアルキル−3−メルカプト−置換された2−ヒドロキシ安息香酸誘導体の製造方法 | |
| CA2649506C (en) | 2-alkenyl-3-aminothiophene derivative and process for producing thereof | |
| JP2009505997A (ja) | 高収率でのチオアルキルアミン類の調製 | |
| CN1368947A (zh) | 酰化1,3-二羰基化合物的制备方法 | |
| JP2020537680A (ja) | 除草性ピリダジノン化合物を製造するプロセス | |
| EP1244615B1 (de) | Verfahren zur herstellung von n-substituierten 2,4-diamino-5-fluor-benzonitrilen und neue zwischenprodukte | |
| TWI749046B (zh) | 製備經取代的2,3-二氫-1-苯并呋喃衍生物之方法 | |
| JP2003171359A (ja) | (2−ニトロ−フェニル)アセトニトリル誘導体の製造方法及びその合成中間体 | |
| CN101160288A (zh) | 烟酸衍生物或其盐的制造方法 | |
| JP2021524463A (ja) | 2−(ヒドロキシアルキル)−アニリンから置換4−アミノインダン誘導体を製造する方法 | |
| BR112019002829B1 (pt) | Método para preparação de derivados de 2,3-di-hidro-1-benzofurano substituído por ciclização de sais de etanol 2-(2-diazônio-6-fenil substituído) | |
| HK1258964B (zh) | 用於制备1,3-苯并间二氧杂环戊烯杂环化合物的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220929 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20230908 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230912 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20231208 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240308 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240514 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240809 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241022 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241115 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7590959 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |