JP6948064B2 - ミトコンドリア機能異常型遺伝子組換え絹糸虫 - Google Patents
ミトコンドリア機能異常型遺伝子組換え絹糸虫 Download PDFInfo
- Publication number
- JP6948064B2 JP6948064B2 JP2018002569A JP2018002569A JP6948064B2 JP 6948064 B2 JP6948064 B2 JP 6948064B2 JP 2018002569 A JP2018002569 A JP 2018002569A JP 2018002569 A JP2018002569 A JP 2018002569A JP 6948064 B2 JP6948064 B2 JP 6948064B2
- Authority
- JP
- Japan
- Prior art keywords
- gene expression
- gene
- silk
- mitochondrial
- subunit
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Description
(2)ミトコンドリア機能異常型絹糸虫作出用遺伝子発現ユニットであって、中部又は後部絹糸腺特異的に発現するタンパク質をコードする遺伝子のプロモーター、及び該プロモーターの下流に機能的に結合したミトコンドリア転写因子Aをコードする遺伝子又はその機能性断片をコードする核酸分子を含む前記遺伝子発現ユニット。
(3)前記ミトコンドリア転写因子Aをコードする遺伝子の3’末端側に連結された付加遺伝子又はその断片をさらに含む、(2)に記載の遺伝子発現ユニット。
(4)前記後部絹糸腺特異的に発現するタンパク質がフィブロインH鎖、フィブロインL鎖及びp25/FHXである、(2)又は(3)に記載の遺伝子発現ユニット。
(5)前記中部絹糸腺特異的に発現するタンパク質がセリシンである、(2)又は(3)に記載の遺伝子発現ユニット。
(6)前記ミトコンドリア転写因子Aが以下の(a)〜(d)のいずれかである、(2)〜(5)のいずれかに記載の遺伝子発現ユニット。
(a)配列番号1で示すアミノ酸配列からなるカイコ由来のミトコンドリア転写因子A、
(b)(a)に記載のアミノ酸配列において1若しくは複数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなるミトコンドリア転写因子A、
(c)(a)に記載のアミノ酸配列に対して90%以上のアミノ酸同一性を有するアミノ酸配列からなるミトコンドリア転写因子A、又は
(d)(a)に記載のミトコンドリア転写因子Aの他種オルソログタンパク質
(7)前記付加遺伝子が標識タンパク質をコードする遺伝子である、(3)〜(6)のいずれかに記載の遺伝子発現ユニット。
(8)前記遺伝子発現ユニットが第1及び第2サブユニットからなり、第1サブユニットは中部又は後部絹糸腺特異的に発現するタンパク質をコードする遺伝子のプロモーター及びその3’末端側に機能的に結合した転写調節因子をコードする遺伝子を含み、第2サブユニットは前記転写調節因子の標的プロモーター及びその3’末端側に機能的に結合したミトコンドリア転写因子Aをコードする遺伝子又はその機能性断片をコードする核酸分子を含む、(2)〜(7)のいずれかに記載の遺伝子発現ユニット。
(9)(2)〜(7)のいずれかに記載の遺伝子発現ユニットを含む遺伝子発現ベクター。
(10)(8)に記載の遺伝子発現ユニットを構成する第2サブユニットを含む遺伝子発現ベクター。
(11)(2)〜(8)のいずれかに記載のミトコンドリア機能異常型絹糸虫作出用遺伝子発現ユニットを含むミトコンドリア機能異常型遺伝子組換え絹糸虫。
(12)前記第1サブユニットと前記第2サブユニットが異なる染色体上に存在する、(8)に従属する(11)に記載の遺伝子組換え絹糸虫。
(13)前記絹糸虫がカイコである、(11)又は(12)に記載の遺伝子組換え絹糸虫。
(14)ミトコンドリア機能異常型遺伝子組換え絹糸虫の作出方法であって、(9)に記載の遺伝子発現ベクターを絹糸虫に導入する導入工程、及び導入工程後に前記遺伝子発現ベクターを含む個体を選抜する選抜工程を含む前記方法。
(15)ミトコンドリア機能異常型遺伝子組換え絹糸虫の作出方法であって、(8)に記載の第1サブユニットを含む第1サブユニット絹糸虫系統と(8)に記載の第2サブユニットを含む第2サブユニット絹糸虫系統とを交配する交配工程、前記交配工程後の絹糸虫から採卵する採卵工程、及び採卵工程で得た卵から前記第1及び第2サブユニットを含む個体を選抜する選抜工程を含む前記方法。
(16)ミトコンドリア病を治療する薬剤のスクリーニング方法であって、(11)〜(13)のいずれかに記載のミトコンドリア機能異常型遺伝子組換え絹糸虫に候補薬剤を投与する投与工程、投与工程後の遺伝子組換え絹糸虫における絹糸腺の形状を確認する確認工程、及び委縮した前記遺伝子組換え絹糸虫の絹糸腺形状が回復していた場合、前記候補薬剤をミトコンドリア病治療として選択する選択工程を含む前記方法。
(17)ミトコンドリア病治療薬の評価方法であって、(11)〜(13)のいずれかに記載のミトコンドリア機能異常型遺伝子組換え絹糸虫に既知のミトコンドリア病治療薬を投与する投与工程、投与工程後の遺伝子組換え絹糸虫における絹糸腺の形状を確認する確認工程、及び委縮した前記遺伝子組換え絹糸虫の絹糸腺形状が回復していた場合、前記ミトコンドリア病治療薬がミトコンドリア病の治療に効果的であると評価する評価工程を含む前記方法。
1−1.概要
本発明の第1の態様は、ミトコンドリア機能異常型絹糸虫を作出するための遺伝子発現ユニット(本明細書では、しばしば単に「遺伝子発現ユニット」と表記する)に関する。本発明の遺伝子発現ユニットは、中部又は後部絹糸腺特異的に発現するタンパク質をコードする遺伝子のプロモーターとミトコンドリア転写因子Aをコードする遺伝子又はその機能性断片をコードする核酸分子とを含み、それを絹糸虫に導入することによって、ミトコンドリア機能異常の症状を呈する遺伝子組換え絹糸虫を作出することができる。
本明細書で頻用する下記用語について定義する。
本発明の遺伝子発現ユニットは、中部又は後部絹糸腺特異的に発現する遺伝子プロモーター、及びミトコンドリア転写因子Aをコードする遺伝子又はその機能性断片をコードする核酸分子を必須の構成要素とし、また付加遺伝子又はその断片、ターミネーター及び5’UTR及び3’UTRを選択的構成要素として含む。さらに、遺伝子発現ユニットが後述する第1サブユニットと第2サブユニットの2つのサブユニットから構成される場合には、転写調節因子をコードする遺伝子及びその転写調節因子の標的プロモーターを必須の構成要素として含む。以下、各構成要素について具体的に説明をする。
(1)中部又は後部絹糸腺特異的プロモーター
「プロモーター」は、その制御下に配置された遺伝子等の核酸分子の発現を制御することのできる遺伝子発現調節領域である。本発明の遺伝子発現ユニットが含む中部又は後部絹糸腺特異的に発現する遺伝子プロモーター(本明細書では、しばしば「中部又は後部絹糸腺特異的プロモーター」と表記する)」は、中部又は後部絹糸腺で特異的に発現するタンパク質をコードする遺伝子の発現を制御する。
「ミトコンドリア転写因子A」(TFAM)とは、HMG(high mobility group)ファミリーに属するタンパク質で、mtDNA上の転写プロモーター領域に結合して遺伝子発現を促進する転写因子としての機能とmtDNAに非特異的に結合してmtDNAの構造と安定性を維持する構造タンパク質としての機能とを有する。
本明細書において「付加遺伝子」とは、遺伝子発現ユニットにおいて、TFAM遺伝子又はその機能性断片をコードする核酸分子の3’末端側に直接的に、又はスペーサー配列等を介して間接的に、連結される遺伝子であって、付加タンパク質をコードする。本明細書において、付加タンパク質の種類、アミノ酸数、及び活性の有無は特に限定はしない。様々なタンパク質を付加タンパク質とすることができる。
ターミネーターは、mRNA発現ベクターを導入する宿主の後部絹糸腺細胞内で、mRNAの転写を終結できる塩基配列で構成される。
5’UTR及び3’UTRは、それ自身がタンパク質やその断片、又は機能性核酸をコードしない非翻訳領域からなるポリヌクレオチドである。本発明の遺伝子発現ユニットでは、TFAM遺伝子又はTFAM-付加遺伝子(本明細書では、これらをまとめてしばしば「TFAM遺伝子等」と表記する)のmRNAコード領域の開始コドンの上流(5’末端側)及び終止コドンの下流(3’末端側)に配置される塩基配列で構成され、3’UTRは、ポリAシグナルを含むことができる。
「転写調節因子をコードする遺伝子」とは、転写調節因子の遺伝子をいう。この遺伝子は、遺伝子発現ユニットが、第1及び第2の2つのサブユニットで構成される場合に、第1サブユニットにおける必須の構成要素となる。本明細書でいう「転写調節因子」とは、後述する標的プロモーターに結合して、その標的プロモーターを活性化することのできるタンパク質因子をいう。例えば、酵母のガラクトース代謝活性化タンパク質であるGAL4タンパク質、及びテトラサイクリン制御性トランス活性化因子であるtTA及びその変異体等が挙げられる。
「転写調節因子(の)標的プロモーター」とは、第1サブユニットにコードされた前記転写調節因子が結合するプロモーターをいう。このプロモーターは、遺伝子発現ユニットが、第1及び第2の2つのサブユニットで構成される場合に、第2サブユニットにおける必須の構成要素となる。前記転写調節因子の結合によって、そのプロモーター制御領域下にある遺伝子発現を活性化することができる。前述のように、本発明の遺伝子発現ユニット第2サブユニットでは、その制御領域下にTFAM遺伝子又はその機能断片をコードする核酸分子が配置されるため、これらの遺伝子等の発現を活性化できる。
本発明の遺伝子発現ユニットは、単一ユニットで構成される場合と、2つのサブユニットで構成される場合がある。以下、それぞれの場合について説明をする。
遺伝子発現ユニットが単一ユニットで構成される場合、遺伝子発現ユニットは、必須構成要素である前記中部又は後部絹糸腺特異的プロモーター、及びTFAM遺伝子又はその機能断片をコードする核酸分子、並びに選択的構成要素である付加遺伝子又はその断片、及びターミネーター等、構成要素の全てを含み得る。したがって、この場合、単一ユニットのみでTFAM遺伝子等を過剰発現できる遺伝子発現ユニットとして機能し得る。
遺伝子発現ユニットが第1サブユニット及び第2サブユニットの2つのサブユニットで構成される場合、TFAM遺伝子等を過剰発現する上で必須の構成要素はそれぞれのサブユニットに存在する。それ故に、その2つのサブユニットが絹糸虫細胞内に同時に存在して初めて、TFAM遺伝子等を過剰発現できる1つの遺伝子発現ユニットとして機能することができる。各サブユニットの構成を以下で説明する。
第1サブユニットは、中部又は後部絹糸腺特異的プロモーター及びの3’末端側に機能的に結合した前述の転写調節因子をコードする遺伝子を含んでなる。このとき、1つのプロモーター制御下に同一の又は異なる2以上の転写調節因子を含んでいてもよい。
第2サブユニットは、第1サブユニットにコードされた転写調節因子の標的プロモーター及びその標的プロモーターの3’末端側に機能的に結合したTFAM遺伝子等を含んでなる。
2−1.概要
本発明の第2の態様は、遺伝子発現ベクターである。本発明の遺伝子発現ベクターは、前記第1態様に記載の遺伝子発現ユニットを含み、目的の宿主絹糸虫の細胞に導入することで、宿主絹糸虫の中部又は後部絹糸腺にmt機能異常に類似した症状を誘導することができる。
本明細書において「遺伝子発現ベクター」とは、母核に第1態様に記載の遺伝子発現ユニットを包含する遺伝子発現システムをいう。本発明の遺伝子発現ベクターは、必須の構成要素である母核及び遺伝子発現ユニットに加え、選択的構成要素として、標識遺伝子、トランスポゾンの逆位末端反復配列、及びインスレーター等を含む。以下、それぞれについて説明をする。
母核には、様々なベクターを利用することができる。例えば、プラスミド若しくはバクミド(Bacmid)のような自律複製可能な発現ベクター、ウイルスベクター、又は染色体中に相同又は非相同組換え可能な発現ベクター若しくはそれを宿主の染色体中に挿入した染色体の一部が挙げられる。また大腸菌等の他の細菌内でも複製可能なシャトルベクターとすることもできる。
遺伝子発現ベクターに含まれる遺伝子発現ユニットは、第1態様に記載の遺伝子発現ユニットである。この遺伝子発現ユニットの構成については第1態様で詳述していることから、ここでは遺伝子発現ベクターにおいて特徴的な構成についてのみ説明をする。
標識遺伝子は、選抜マーカーとも呼ばれる標識タンパク質をコードする塩基配列からなるポリヌクレオチドであって、遺伝子発現ベクターの選択的構成要素である。この標識遺伝子及び標識タンパク質の構成については、第1態様において、付加遺伝子及び付加タンパク質の一例として詳述しているため、ここではその具体的な説明を省略する。
「トランスポゾンの逆位末端反復配列(Inverted terminal repeat sequence)」は、本発明の遺伝子発現ベクターを相同組換えにより宿主ゲノムに挿入する場合に含まれるトランスポゾン由来の配列である。通常は2個1組で使用され、ゲノムの挿入する塩基配列は、それらの間に配置される。トランスポゾンは、遺伝子発現ベクターを導入する宿主の種によって異なる。例えば、宿主がカイコであれば、piggyBac、mariner、minos等を用いることができる(Shimizu,K. et al., 2000, Insect Mol. Biol., 9, 277-281;Wang W. et al.,2000, Insect Mol Biol 9(2):145-55)。
インスレーターは、周囲の染色体のクロマチンによる影響を受けることなく、その配列に挟まれた遺伝子の転写を、安定的に制御できる塩基配列である。例えば、ニワトリのcHS4配列やショウジョウバエのgypsy配列などが挙げられる。
本態様の遺伝子発現ベクターは、第1態様の遺伝子発現ユニット等を宿主絹糸虫の細胞内に導入し、遺伝子発現ユニットに包含されるTFAM遺伝子等を発現させることによって、宿主絹糸虫の中部又は後部絹糸腺にmt機能異常に類似した症状を誘導することができる。
3−1.概要
本発明の第3の態様は、mt機能異常型遺伝子組換え絹糸虫(本明細書では、しばしば単に「遺伝子組換え絹糸虫」と表記する)である。本発明の遺伝子組換え絹糸虫は、細胞内に前記第1態様に記載の遺伝子発現ユニットを含むことを特徴とする。本発明の遺伝子組換え絹糸虫は、TFAM遺伝子を中部又は後部絹糸腺で過剰発現させることが可能であり、中部又は後部絹糸腺特異的にmt機能異常に類似した症状を呈し得る。それにより本発明のmt機能異常型遺伝子組換え絹糸虫をミトコンドリア機能異常モデル動物として利用することができる。
本明細書において「mt機能異常型遺伝子組換え絹糸虫」とは、第1態様に記載の遺伝子発現ユニットを細胞内に含む宿主絹糸虫の形質転換体、又はその後代をいう。本明細書において「後代」とは、形質転換体第1世代の子孫であって、第1態様の遺伝子発現ユニットを細胞内に保持する個体をいう。細胞内に含まれる遺伝子発現ユニットは、第2態様に記載の遺伝子発現ベクターの状態であってもよい。後代は、第1態様の遺伝子発現ユニットを保持する限りその世代数を問わない。
遺伝子組換え絹糸虫が包含する遺伝子発現ユニットが前記単一ユニットで構成される場合、細胞内に少なくとも1種の遺伝子発現ユニットが包含されていればよい。単一ユニットであれば、前述のように単独でTFAM遺伝子等を過剰発現できるからである。
遺伝子組換え絹糸虫が包含する遺伝子発現ユニットが前記第1サブユニット及び第2サブユニットからなる1組のサブユニットで構成される場合、中部及び/又は後部絹糸腺内でTFAM遺伝子等を過剰発現させるためには、細胞内に少なくとも1組のサブユニットが存在しなければならない。前述の通り、1組のサブユニットが絹糸虫細胞内に存在して初めて、TFAM遺伝子等を過剰発現できる1つの遺伝子発現ユニットとして機能するからである。
本発明の遺伝子組換え絹糸虫によれば、特定の器官、すなわち中部及び/又は後部絹糸腺のみでTFAM遺伝子等を過剰発現し、それにより前記絹糸腺限定的にミトコンドリアDNAの欠損による細胞機能低下に類似した症状を呈することができる。本発明の遺伝子組換え絹糸虫であれば、従来のミトコンドリア機能異常モデル動物の課題であった症状の重篤化による個体致死を生じないという利点がある。
4−1.概要
本発明の第4の態様は、mt機能異常型遺伝子組換え絹糸虫の作出方法である。本発明の作出方法は、絹糸虫から第3態様に記載のmt機能異常型遺伝子組換え絹糸虫の系統を作出することができる。
本発明のmt機能異常型遺伝子組換え絹糸虫(本明細書では、しばしば「遺伝子組換え絹糸虫」と表記する)の作出方法は、(1)第2態様の遺伝子発現ベクターを宿主である絹糸虫に導入する方法、又は(2)第1サブユニット絹糸虫系統及び第2サブユニット絹糸虫系統を交配する方法がある。以下、それぞれの方法について説明をする。
本方法は、遺伝子発現ユニットが単一ユニットで構成される場合に、それを包含する遺伝子発現ベクターを宿主絹糸虫に導入することで達成し得る。本方法は、必須の工程として導入工程を、また選択工程として選抜工程を含む。以下、各工程について説明をする。
「導入工程」は、単一ユニットで構成される遺伝子発現ユニットを含む第2態様の遺伝子発現ベクターを宿主細胞内に導入する工程である。遺伝子発現ベクターを導入する宿主は、前記第1態様の「1−2.定義」に記載した絹糸虫である。特にカイコは、本発明の絹糸虫として好ましい。第2態様の遺伝子発現ベクターを絹糸虫に導入する場合、個体の発生ステージや雌雄の限定は特になく、胚、幼虫、蛹、又は成虫のいずれのステージであってもよい。好ましくは、より高い効果が期待できる胚時期である。
「選抜工程」は、前記導入工程後の絹糸虫から、第2態様の遺伝子発現ベクターを含む形質転換体を選抜する工程である。導入工程後の絹糸虫には、遺伝子発現ベクターを保有する形質転換体と、それを保有しない非形質転換体とが存在する。本工程では、それらを正確に判別して、目的の形質転換体のみを選抜することを目的とする。遺伝子発現ベクターが蛍光タンパク質等の標識遺伝子を含む場合、選抜は、その遺伝子等の発現の有無に基づいて行えばよい。得られた遺伝子組換え絹糸虫を必要に応じて兄妹交配又は同系交配を行い、染色体に挿入された発現ベクターのホモ接合体を得てもよい。
本方法は、遺伝子発現ユニットが1組の第1及び第2サブユニットで構成される場合に、それぞれのサブユニットを含む絹糸虫系統、すなわち第1サブユニット絹糸虫系統と第2サブユニット絹糸虫系統とを交配させて、両サブユニットを含む遺伝子組換え絹糸虫を得る方法である。本方法は、必須の工程として交配工程、及び採卵工程を、また選択工程として選抜工程を含む。以下、各工程について説明をする。
「交配工程」とは、第1サブユニット絹糸虫系統と第2サブユニット絹糸虫系統とを交配させる工程である。交配は、二つの絹糸虫系統を常法に基づいて交配させればよい。各サブユニットを有する絹糸虫系統は、予め兄妹交配又は同系交配を行い、ホモ接合体にしておくことが好ましい。
「採卵工程」とは、交配工程後の雌個体から卵を得る工程である。採卵方法は、当該分野で公知の方法で行えばよい。例えば、絹糸虫がカイコの場合、交尾後の雌個体は、雄個体と分離(割愛)した後、産卵台紙上に移し、室温暗所で一晩産卵させればよい。
本方法の「選択工程」は、標識遺伝子の発現に基づいて、その遺伝子がコードするタンパク質の活性により、目的の形質転換体を選抜する点において、基本的に前記選抜工程と同じである。ただし、本方法の選抜工程では、採卵工程後に得られるF1個体から、前記第1サブユニット及び第2サブユニットのそれぞれに連関する標識遺伝子の発現に基づいて、両サブユニットを有する個体を選抜する点で異なる。
5−1.概要
本発明の第5の態様は、ミトコンドリア病治療薬のスクリーニング方法である。本発明の方法は、ミトコンドリア病の治療又は予防に対して有効な薬剤を候補薬剤から選択することができる。
本態様及び後述する第6態様で使用する以下の用語について定義する。
「ミトコンドリア病」とは、ミトコンドリアの機能障害によって臨床症状を発症する病態の総称をいう。一般に、mtDNA又はゲノムDNAの変異(欠失、置換、付加等)等の質的変化やmtDNA量の減少等の量的変化によるミトコンドリアの機能異常が原因とされる。エネルギー生産の低下によるエネルギー代謝障害が多く、例えば、筋力の低下、ミオパチー、又は高クレアチンキナーゼ(CK)血症のような骨格筋症状、痙攣、偏頭痛、失調、知的退行、又は精神症状のような中枢神経症状、心伝導障害、又は心筋症のような心症状、糸球体病変、尿細管機能障害、又はミオグロビン尿のような腎症状、又は貧血のような血液症状が認められる。なお、本発明のmt機能異常型遺伝子組換え絹糸虫では、中部、及び/又は後部絹糸腺の細胞が、アポトーシスを起こさないものの生育停止状態となり、体積が増加せず、その結果、絹糸腺が著しく委縮した症状を呈する。このような絹糸虫における症状を、本明細書では「ミトコンドリア病様症状」と称する。
本発明の方法は、投与工程、確認工程、及び選択工程を必須の工程として含む。以下、各工程について説明をする。
「投与工程」とは、第3態様に記載のmt機能異常型遺伝子組換え絹糸虫に候補薬剤を投与する工程である。
候補薬剤の投与方法は、限定はしない。経口又は非経口のいずれであってもよい。
「確認工程」とは、投与工程後の遺伝子組換え絹糸虫における絹糸腺の形状を確認する工程である。
「選択工程」とは、前記遺伝子組換え絹糸虫の絹糸腺形状が委縮状態から回復していた場合、投与工程で使用した候補薬剤をミトコンドリア病治療薬として選択する工程である。
6−1.概要
本発明の第6の態様は、ミトコンドリア病治療薬の評価方法である。本発明の評価方法によれば、既知のミトコンドリア病治療薬の薬効を再確認、又は再評価することができる。
本発明の方法の基本構成は、前記第5態様に記載のミトコンドリア病治療薬のスクリーニング方法に類似する。例えば、投与工程は、投与する薬剤が第5態様では候補薬剤であるのに対して、本態様では既知ミトコンドリア治療薬、又は既知治療薬候補である点を除けば、基本的には同じである。ここで「既知ミトコンドリア治療薬」とは、医薬品として薬機法の承認を受けている薬剤であり、「治療候補薬」とは、承認を受けるための臨書試験段階にある薬剤等をいう。例えば、後述する実施例に記載のように、アミノレブリン酸(5-ALA)は、治験フェーズIII段階にあるミトコンドリア病治療候補薬である。
(目的)
本発明のmt機能異常型絹糸虫作出用遺伝子発現ユニット及びそれを含む遺伝子発現ベクターを調製する。
本実施例では、絹糸虫をカイコとする。まず、カイコのTFAMをコードするBmtfam遺伝子(配列番号2)をクローニングした。p50系統の胚由来総mRNAから作製したcDNAライブラリーを鋳型にBmtfam遺伝子のORF配列を特異的に増幅可能なプライマーペア、Bmtfam-for(5’- ATGACTACTTATACTCAATTACAGCG-3’:配列番号11)とBmtfam-rev(5’- CTATTGTGAACTATCAACTTTTTTGG-3’:配列番号12)を用いてPCRにより増幅した。PCR用DNAポリメラーゼには、Takara EX taq(Takara-Bio社)を用いた。PCR条件は、常法の条件で行った。pGEM-T ベクター(Novagen社)を利用して、PCR後の増幅産物をTAクローニング法によりクローニングした。得られたベクターを「pGEM-BmTFAM」とした。
(目的)
本発明のmt機能異常型遺伝子組換えカイコを作出する。
カイコ(Bombyx mori)は人工飼料(シルクメイト; Nosan)を用いて25℃、明期12時間、暗期12時間の条件下で飼育した。実験には、p50, w1-pnd, w1およびA3-GAL4(Uchino, K., et al., 2006, J. Insect Biotechnol. Sericology, 75: 89-97)、AyFib431a(Sezutsu, H., et al., 2009, J. Insect Biotechnol. Sericology 78: 1-10; Tsubota, T., et al., 2014, G3 (Bethesda) 4: 1347-1357)の各系統を使用した。
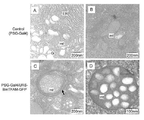
図2及び図3に上記結果を示す。
後部絹糸腺特異的にTFAM-GFPを過剰発現させた結果、図2Bで示すように、対照用の図2Aと比較すると破線白枠内の後部絹糸腺は、細胞の体積が増加せず、生育が停止して委縮した状態となった。ただし、後部絹糸腺での細胞死は起きていなかった。また、このようなTFAM-GFP過剰発現型個体は、後部絹糸腺に形態異常を有しながらも正常な成虫となる。このように、本発明のmt機能異常型遺伝子組換えカイコは、個体死させることなく、シビアな表現型を経時的に観察することが可能である。
(目的)
本発明のmt機能異常型遺伝子組換えカイコが、mt機能異常モデルマウス等に代わるモデル動物になり得ること、及びミトコンドリア病治療薬や治療候補薬の薬効評価が可能なことを検証する。
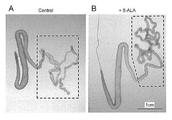
実施例1で作出したmt機能異常型遺伝子組換えカイコの5齢5日目の個体(n=15)に対して1頭あたり100μgのアミノレブリン酸(5-ALA)in NaCl溶液を10μL、腹脚にマイクロキャピラリーを用いて皮下注射した。5-ALAは、脳神経症状を中心とするヒトミトコンドリア病に対する有効な候補薬剤として開発され、現在日本では臨床試験のフェーズIII段階にあり、その長期投与によるミトコンドリア病への有効性や安全性が検証されている。投与5日後、実施例2と同じ方法でカイコを氷上麻酔にかけ、背側を切開してピンセットで絹糸腺を傷つけないように摘出した。
図4に5-ALAの投与結果を示す。5-ALAを投与した場合、9割の個体で図4Bに示すように後部絹糸腺の形態回復が認められた。この結果は、本発明のmt機能異常型遺伝子組換えカイコが哺乳動物のミトコンドリア病のモデル動物として機能し得ること、mt機能異常型遺伝子組換えカイコの絹糸腺における形態回復を指標に、ミトコンドリア機能治療薬のスクリーニングや治療候補薬の薬効評価ができることを示唆している。
Claims (14)
- ミトコンドリア機能異常型絹糸虫作出用遺伝子発現ユニットであって、
中部又は後部絹糸腺特異的に発現するタンパク質をコードする遺伝子のプロモーター、及び
該プロモーターの下流に機能的に結合したミトコンドリア転写因子Aをコードする遺伝子又はその機能性断片をコードする核酸分子
を含む前記遺伝子発現ユニット。 - 前記ミトコンドリア転写因子Aをコードする遺伝子の3’末端側に連結された付加遺伝子又はその断片をさらに含む、請求項1に記載の遺伝子発現ユニット。
- 前記中部又は後部絹糸腺特異的に発現するタンパク質がセリシン、フィブロインH鎖、フィブロインL鎖及びp25/FHXからなる群から選択されるタンパク質である、請求項1又は2に記載の遺伝子発現ユニット。
- 前記ミトコンドリア転写因子Aが以下の(a)〜(d)のいずれかである、請求項1〜3のいずれか1項に記載の遺伝子発現ユニット。
(a)配列番号1で示すアミノ酸配列からなるカイコ由来のミトコンドリア転写因子A、又は
(b)(a)に記載のアミノ酸配列に対して90%以上のアミノ酸同一性を有するアミノ酸配列からなるミトコンドリア転写因子A - 前記付加遺伝子が標識タンパク質をコードする遺伝子である、請求項2〜4のいずれか1項に記載の遺伝子発現ユニット。
- 前記遺伝子発現ユニットが第1及び第2サブユニットからなり、
第1サブユニットは中部又は後部絹糸腺特異的に発現するタンパク質をコードする遺伝子のプロモーター及びその3’末端側に機能的に結合した転写調節因子をコードする遺伝子を含み、
第2サブユニットは前記転写調節因子の標的プロモーター及びその3’末端側に機能的に結合したミトコンドリア転写因子Aをコードする遺伝子又はその機能性断片をコードする核酸分子を含む、
請求項1〜5のいずれか1項に記載の遺伝子発現ユニット。 - 請求項1〜5のいずれか1項に記載の遺伝子発現ユニットを含む遺伝子発現ベクター。
- 請求項6に記載の遺伝子発現ユニットを構成する第2サブユニットを含む遺伝子発現ベクター。
- 請求項1〜6のいずれか1項に記載のミトコンドリア機能異常型絹糸虫作出用遺伝子発現ユニットを含むミトコンドリア機能異常型遺伝子組換え絹糸虫。
- 前記第1サブユニットと前記第2サブユニットが異なる染色体上に存在する、請求項6に従属する請求項9に記載の遺伝子組換え絹糸虫。
- ミトコンドリア機能異常型遺伝子組換え絹糸虫の作出方法であって、
請求項7に記載の遺伝子発現ベクターを絹糸虫に導入する導入工程、及び
前記導入工程後に前記遺伝子発現ベクターを含む個体を選抜する選抜工程
を含む前記方法。 - ミトコンドリア機能異常型遺伝子組換え絹糸虫の作出方法であって、
請求項6に記載の第1サブユニットを含む第1サブユニット絹糸虫系統と請求項6に記載の第2サブユニットを含む第2サブユニット絹糸虫系統とを交配する交配工程、
前記交配工程後の絹糸虫から採卵する採卵工程、及び
前記採卵工程で得た卵から前記第1及び第2サブユニットを含む個体を選抜する選抜工程
を含む前記方法。 - ミトコンドリア病を治療する薬剤のスクリーニング方法であって、
請求項9又は10に記載のミトコンドリア機能異常型遺伝子組換え絹糸虫に候補薬剤を投与する投与工程、
前記投与工程後の遺伝子組換え絹糸虫における絹糸腺の形状を確認する確認工程、及び 委縮した前記遺伝子組換え絹糸虫の絹糸腺形状が回復していた場合、前記候補薬剤をミトコンドリア病治療として選択する選択工程
を含む前記方法。 - ミトコンドリア病治療薬の評価方法であって、
請求項9又は10に記載のミトコンドリア機能異常型遺伝子組換え絹糸虫に既知のミトコンドリア病治療薬を投与する投与工程、
前記投与工程後の遺伝子組換え絹糸虫における絹糸腺の形状を確認する確認工程、及び
委縮した前記遺伝子組換え絹糸虫の絹糸腺形状が回復していた場合、前記ミトコンドリア病治療薬がミトコンドリア病の治療に効果的であると評価する評価工程
を含む前記方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2018002569A JP6948064B2 (ja) | 2018-01-11 | 2018-01-11 | ミトコンドリア機能異常型遺伝子組換え絹糸虫 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2018002569A JP6948064B2 (ja) | 2018-01-11 | 2018-01-11 | ミトコンドリア機能異常型遺伝子組換え絹糸虫 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2019118334A JP2019118334A (ja) | 2019-07-22 |
| JP6948064B2 true JP6948064B2 (ja) | 2021-10-13 |
Family
ID=67305538
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018002569A Active JP6948064B2 (ja) | 2018-01-11 | 2018-01-11 | ミトコンドリア機能異常型遺伝子組換え絹糸虫 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6948064B2 (ja) |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5260915B2 (ja) * | 2007-08-20 | 2013-08-14 | 株式会社ゲノム創薬研究所 | 毒性試験方法 |
| CN104903445B (zh) * | 2012-12-25 | 2017-09-12 | 国立研究开发法人农业生物资源研究所 | 后部绢丝腺基因表达单元及具有其的转基因绢丝虫 |
-
2018
- 2018-01-11 JP JP2018002569A patent/JP6948064B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2019118334A (ja) | 2019-07-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6326703B2 (ja) | 外因性遺伝子発現増強剤 | |
| JP6497605B2 (ja) | 雌蚕致死カイコ系統 | |
| JP3939733B2 (ja) | 新規なアポトーシス誘導因子及びそれを利用するアポトーシスの誘導方法 | |
| JP6253109B2 (ja) | 後部絹糸腺遺伝子発現ユニット及びそれを有する遺伝子組換え絹糸虫 | |
| MX2008010285A (es) | Sistema de expresion genetica usando un empalme alternativo en insectos. | |
| BRPI0707579A2 (pt) | sistema de expressço de polinucleotÍdeos, mÉtodos de controle da populaÇço de um organismo em um meio ambiente natural para o mesmo, de controle biolàgico, e de separaÇço de sexos, e, mÉtodo ou controle biolàgico ou da populaÇço | |
| CN109844112B (zh) | 基因重组蓑蛾虫丝 | |
| JP2016084369A (ja) | 5量体crpの製造方法、5量体crpを製造する遺伝子組換えカイコとその製造方法、単量体イヌcrpをコードするdna及びそのdnaを含む発現ベクター | |
| JP6948064B2 (ja) | ミトコンドリア機能異常型遺伝子組換え絹糸虫 | |
| JP5997772B2 (ja) | カイコフィブロイン重鎖遺伝子の突然変異配列、及び突然変異を誘発する方法と応用 | |
| JP6871547B2 (ja) | ピエリシン1aのadpリボシル化ドメイン遺伝子及びセリシン繭 | |
| JP2011103816A (ja) | トランスジェニックカイコ | |
| Maenaka et al. | Silkworm Biofactory: Silk to Biology | |
| Takasu et al. | Fibroin heavy chain gene replacement with a highly ordered synthetic repeat sequence in Bombyx mori | |
| KR101634275B1 (ko) | 청색 형광 실크를 생산하는 형질전환 누에 | |
| Aramwit et al. | Transgenic modifications of silkworms as a means to obtain therapeutic biomolecules and protein fibers with exceptional properties | |
| WO2016125885A1 (ja) | 細胞死誘導ベクター及びそれを有する部位特異的細胞死誘導カイコ系統 | |
| KR101811518B1 (ko) | 초파리의 산화 스트레스 저항성을 조절하는 방법 | |
| JP6840323B2 (ja) | 哺乳動物型糖鎖付加遺伝子組換えカイコ | |
| JP5240756B2 (ja) | 軟骨疾患のモデル非ヒト動物 | |
| KR102114194B1 (ko) | 킬러레드 단백질을 발현하는 실크를 생산하는 형질전환 누에 | |
| JP2023084919A (ja) | 不妊性チョウ目昆虫の生産方法及びチョウ目昆虫の不妊化剤 | |
| Yu et al. | Mutation of a palmitoyltransferase ZDHHC18-like gene is responsible for the minute wing mutation in the silkworm (Bombyx mori) | |
| JP2024000343A (ja) | カイコ、非天然アミノ酸含有タンパク質の製造方法、及びシルクタンパク質 | |
| JP2012105598A (ja) | 形質転換カイコの作製方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200812 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210521 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210608 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210716 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210824 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210910 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6948064 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |