JP6282017B2 - P2x7受容体アンタゴニストとしての複素環アミド誘導体 - Google Patents
P2x7受容体アンタゴニストとしての複素環アミド誘導体 Download PDFInfo
- Publication number
- JP6282017B2 JP6282017B2 JP2015553217A JP2015553217A JP6282017B2 JP 6282017 B2 JP6282017 B2 JP 6282017B2 JP 2015553217 A JP2015553217 A JP 2015553217A JP 2015553217 A JP2015553217 A JP 2015553217A JP 6282017 B2 JP6282017 B2 JP 6282017B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- formula
- thiazole
- carboxamide
- diseases
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- -1 Heterocyclic amide Chemical class 0.000 title description 43
- 102100037602 P2X purinoceptor 7 Human genes 0.000 title description 19
- 101710189965 P2X purinoceptor 7 Proteins 0.000 title description 12
- 239000002464 receptor antagonist Substances 0.000 title description 6
- 229940044551 receptor antagonist Drugs 0.000 title description 6
- 150000001875 compounds Chemical class 0.000 claims description 149
- 150000003839 salts Chemical class 0.000 claims description 90
- 239000000203 mixture Substances 0.000 claims description 87
- 208000002193 Pain Diseases 0.000 claims description 52
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 44
- 229920006395 saturated elastomer Polymers 0.000 claims description 39
- 229910052739 hydrogen Inorganic materials 0.000 claims description 37
- 239000001257 hydrogen Substances 0.000 claims description 37
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 36
- 125000001153 fluoro group Chemical group F* 0.000 claims description 23
- 125000000623 heterocyclic group Chemical group 0.000 claims description 23
- 208000035475 disorder Diseases 0.000 claims description 21
- 230000002265 prevention Effects 0.000 claims description 21
- 229910052799 carbon Inorganic materials 0.000 claims description 19
- 201000010099 disease Diseases 0.000 claims description 19
- 125000001072 heteroaryl group Chemical group 0.000 claims description 17
- 239000003814 drug Substances 0.000 claims description 15
- 206010028980 Neoplasm Diseases 0.000 claims description 14
- 230000002757 inflammatory effect Effects 0.000 claims description 14
- 201000011510 cancer Diseases 0.000 claims description 13
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 12
- 125000003709 fluoroalkyl group Chemical group 0.000 claims description 10
- 125000006164 6-membered heteroaryl group Chemical group 0.000 claims description 9
- 208000010668 atopic eczema Diseases 0.000 claims description 9
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 9
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 8
- 229910052736 halogen Inorganic materials 0.000 claims description 8
- 150000002367 halogens Chemical class 0.000 claims description 8
- 208000017520 skin disease Diseases 0.000 claims description 8
- 208000018522 Gastrointestinal disease Diseases 0.000 claims description 7
- 230000001363 autoimmune Effects 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 7
- 125000006526 (C1-C2) alkyl group Chemical group 0.000 claims description 6
- 208000024172 Cardiovascular disease Diseases 0.000 claims description 6
- 208000036110 Neuroinflammatory disease Diseases 0.000 claims description 6
- 230000000172 allergic effect Effects 0.000 claims description 6
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 6
- 208000025609 Urogenital disease Diseases 0.000 claims description 5
- 230000003187 abdominal effect Effects 0.000 claims description 5
- 208000030533 eye disease Diseases 0.000 claims description 5
- 230000000626 neurodegenerative effect Effects 0.000 claims description 5
- 230000000414 obstructive effect Effects 0.000 claims description 5
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 4
- 208000023504 respiratory system disease Diseases 0.000 claims description 4
- 208000012659 Joint disease Diseases 0.000 claims description 3
- 239000004480 active ingredient Substances 0.000 claims description 3
- UULLWSUBJVMANU-UHFFFAOYSA-N n-[[1-(6-chloropyridin-3-yl)cyclohexyl]methyl]-4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxamide Chemical compound C1=NC(Cl)=CC=C1C1(CNC(=O)C2C=3SC=NC=3CCC2)CCCCC1 UULLWSUBJVMANU-UHFFFAOYSA-N 0.000 claims description 3
- IXCRMSPMULYANL-DZGCQCFKSA-N (8r)-n-[(1s)-1-cyclohexyl-2-hydroxyethyl]-5,6,7,8-tetrahydro-4h-cyclohepta[d][1,3]thiazole-8-carboxamide Chemical compound C1([C@H](NC(=O)[C@@H]2C=3SC=NC=3CCCC2)CO)CCCCC1 IXCRMSPMULYANL-DZGCQCFKSA-N 0.000 claims description 2
- IXCRMSPMULYANL-UKRRQHHQSA-N (8s)-n-[(1s)-1-cyclohexyl-2-hydroxyethyl]-5,6,7,8-tetrahydro-4h-cyclohepta[d][1,3]thiazole-8-carboxamide Chemical compound C1([C@H](NC(=O)[C@H]2C=3SC=NC=3CCCC2)CO)CCCCC1 IXCRMSPMULYANL-UKRRQHHQSA-N 0.000 claims description 2
- 208000020084 Bone disease Diseases 0.000 claims description 2
- RBTWDGAOSDKVFX-UHFFFAOYSA-N n-(1-cycloheptyl-2-hydroxyethyl)-5,6-dihydrofuro[2,3-d][1,3]thiazole-6-carboxamide Chemical compound C1OC=2N=CSC=2C1C(=O)NC(CO)C1CCCCCC1 RBTWDGAOSDKVFX-UHFFFAOYSA-N 0.000 claims description 2
- YZNYASUJOPBGGK-JTDNENJMSA-N n-[(1r)-1-cyclohexylethyl]-4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxamide Chemical compound C1([C@H](NC(=O)C2C=3SC=NC=3CCC2)C)CCCCC1 YZNYASUJOPBGGK-JTDNENJMSA-N 0.000 claims description 2
- XLUZKBXRUXOQFD-TYZXPVIJSA-N n-[(1s)-1-cyclohexyl-2-hydroxyethyl]-4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxamide Chemical compound C1([C@H](NC(=O)C2C=3SC=NC=3CCC2)CO)CCCCC1 XLUZKBXRUXOQFD-TYZXPVIJSA-N 0.000 claims description 2
- GAACWHVQIWIXAG-GLGOKHISSA-N n-[(1s)-1-cyclohexyl-2-hydroxyethyl]-5,6-dihydro-4h-cyclopenta[d][1,3]thiazole-6-carboxamide Chemical compound C1([C@H](NC(=O)C2C=3SC=NC=3CC2)CO)CCCCC1 GAACWHVQIWIXAG-GLGOKHISSA-N 0.000 claims description 2
- COFOVKYVFIPGIV-PIJUOVFKSA-N n-[(1s)-1-cyclohexyl-2-hydroxyethyl]-6,7-dihydro-5h-pyrano[2,3-d][1,3]thiazole-7-carboxamide Chemical compound C1([C@H](NC(=O)C2C=3SC=NC=3OCC2)CO)CCCCC1 COFOVKYVFIPGIV-PIJUOVFKSA-N 0.000 claims description 2
- APPXSLNVWVYDHR-UHFFFAOYSA-N n-[2-(2-methylpyrimidin-5-yl)-2-morpholin-4-ylethyl]-5,6-dihydro-4h-cyclopenta[d][1,3]thiazole-6-carboxamide Chemical compound C1=NC(C)=NC=C1C(N1CCOCC1)CNC(=O)C1C(SC=N2)=C2CC1 APPXSLNVWVYDHR-UHFFFAOYSA-N 0.000 claims description 2
- LZNHMGVDSMIJFY-UHFFFAOYSA-N n-[2-(2-methylpyrimidin-5-yl)-2-morpholin-4-ylethyl]-6,7-dihydro-5h-pyrano[2,3-d][1,3]thiazole-7-carboxamide Chemical compound C1=NC(C)=NC=C1C(N1CCOCC1)CNC(=O)C1C(SC=N2)=C2OCC1 LZNHMGVDSMIJFY-UHFFFAOYSA-N 0.000 claims description 2
- OLOYSGAAYHMWMM-UHFFFAOYSA-N n-[2-(4,4-difluoropiperidin-1-yl)-2-(2-methylpyrimidin-5-yl)ethyl]-5,6-dihydro-4h-cyclopenta[d][1,3]thiazole-6-carboxamide Chemical compound C1=NC(C)=NC=C1C(N1CCC(F)(F)CC1)CNC(=O)C1C(SC=N2)=C2CC1 OLOYSGAAYHMWMM-UHFFFAOYSA-N 0.000 claims description 2
- MWNYPZLZUURAMT-UHFFFAOYSA-N n-[2-(4,4-difluoropiperidin-1-yl)-2-(2-methylpyrimidin-5-yl)ethyl]-5,6-dihydrofuro[2,3-d][1,3]thiazole-6-carboxamide Chemical compound C1=NC(C)=NC=C1C(N1CCC(F)(F)CC1)CNC(=O)C1C(SC=N2)=C2OC1 MWNYPZLZUURAMT-UHFFFAOYSA-N 0.000 claims description 2
- JKSHNIZGCVXPFN-UHFFFAOYSA-N n-[2-(6-chloropyridin-3-yl)-2-(4,4-difluoropiperidin-1-yl)ethyl]-6,7-dihydro-5h-pyrano[2,3-d][1,3]thiazole-7-carboxamide Chemical compound C1CC(F)(F)CCN1C(C=1C=NC(Cl)=CC=1)CNC(=O)C1C(SC=N2)=C2OCC1 JKSHNIZGCVXPFN-UHFFFAOYSA-N 0.000 claims description 2
- HRFKBGNRLIATAU-UHFFFAOYSA-N n-[2-morpholin-4-yl-2-[2-(trifluoromethyl)pyrimidin-5-yl]ethyl]-4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxamide Chemical compound C1=NC(C(F)(F)F)=NC=C1C(N1CCOCC1)CNC(=O)C1C(SC=N2)=C2CCC1 HRFKBGNRLIATAU-UHFFFAOYSA-N 0.000 claims description 2
- FBNQMSCEOQSEST-UHFFFAOYSA-N n-[2-morpholin-4-yl-2-[6-(trifluoromethyl)pyridin-3-yl]ethyl]-5,6-dihydrofuro[2,3-d][1,3]thiazole-6-carboxamide Chemical compound C1=NC(C(F)(F)F)=CC=C1C(N1CCOCC1)CNC(=O)C1C(SC=N2)=C2OC1 FBNQMSCEOQSEST-UHFFFAOYSA-N 0.000 claims description 2
- JNESFIKVNXBWSS-UHFFFAOYSA-N n-[[1-(6-chloropyridin-3-yl)-4,4-difluorocyclohexyl]methyl]-4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxamide Chemical compound C1CC(F)(F)CCC1(C=1C=NC(Cl)=CC=1)CNC(=O)C1C(SC=N2)=C2CCC1 JNESFIKVNXBWSS-UHFFFAOYSA-N 0.000 claims description 2
- SEQAOMDPTYAIOC-UHFFFAOYSA-N n-[[1-(6-chloropyridin-3-yl)cyclohexyl]methyl]-5,6-dihydrofuro[2,3-d][1,3]thiazole-6-carboxamide Chemical compound C1=NC(Cl)=CC=C1C1(CNC(=O)C2C=3SC=NC=3OC2)CCCCC1 SEQAOMDPTYAIOC-UHFFFAOYSA-N 0.000 claims description 2
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 150000001721 carbon Chemical group 0.000 claims 4
- 210000000988 bone and bone Anatomy 0.000 claims 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 92
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 51
- WYURNTSHIVDZCO-UHFFFAOYSA-N tetrahydrofuran Substances C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 50
- 235000019439 ethyl acetate Nutrition 0.000 description 46
- 239000002904 solvent Substances 0.000 description 39
- YMWUJEATGCHHMB-UHFFFAOYSA-N dichloromethane Natural products ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 37
- 239000012044 organic layer Substances 0.000 description 34
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 33
- 239000012267 brine Substances 0.000 description 28
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 28
- 238000000034 method Methods 0.000 description 27
- 230000015572 biosynthetic process Effects 0.000 description 25
- 238000003786 synthesis reaction Methods 0.000 description 25
- 239000000243 solution Substances 0.000 description 23
- 125000004432 carbon atom Chemical group C* 0.000 description 22
- 239000003921 oil Substances 0.000 description 21
- 150000001412 amines Chemical class 0.000 description 20
- 230000001684 chronic effect Effects 0.000 description 18
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 16
- 238000000746 purification Methods 0.000 description 16
- 239000007787 solid Substances 0.000 description 16
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 15
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 15
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 14
- 210000004027 cell Anatomy 0.000 description 14
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 13
- 208000004296 neuralgia Diseases 0.000 description 13
- 208000021722 neuropathic pain Diseases 0.000 description 13
- 208000011580 syndromic disease Diseases 0.000 description 13
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- 208000006820 Arthralgia Diseases 0.000 description 11
- 208000004454 Hyperalgesia Diseases 0.000 description 11
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 11
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 11
- 239000011541 reaction mixture Substances 0.000 description 11
- 239000011734 sodium Substances 0.000 description 11
- 125000000217 alkyl group Chemical group 0.000 description 10
- 201000008482 osteoarthritis Diseases 0.000 description 10
- 238000010992 reflux Methods 0.000 description 10
- 101001098175 Homo sapiens P2X purinoceptor 7 Proteins 0.000 description 9
- 206010020751 Hypersensitivity Diseases 0.000 description 9
- 239000003480 eluent Substances 0.000 description 9
- 239000008194 pharmaceutical composition Substances 0.000 description 9
- ZKHQWZAMYRWXGA-KQYNXXCUSA-J ATP(4-) Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-J 0.000 description 8
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 8
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 description 8
- 208000035154 Hyperesthesia Diseases 0.000 description 8
- 230000001154 acute effect Effects 0.000 description 8
- 230000001419 dependent effect Effects 0.000 description 8
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 8
- 150000002825 nitriles Chemical class 0.000 description 8
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 8
- 230000035807 sensation Effects 0.000 description 8
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 8
- HNSDLXPSAYFUHK-UHFFFAOYSA-N 1,4-bis(2-ethylhexyl) sulfosuccinate Chemical compound CCCCC(CC)COC(=O)CC(S(O)(=O)=O)C(=O)OCC(CC)CCCC HNSDLXPSAYFUHK-UHFFFAOYSA-N 0.000 description 7
- 201000002481 Myositis Diseases 0.000 description 7
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 7
- 208000036142 Viral infection Diseases 0.000 description 7
- 208000006673 asthma Diseases 0.000 description 7
- 239000003054 catalyst Substances 0.000 description 7
- 208000014674 injury Diseases 0.000 description 7
- ZDYVRSLAEXCVBX-UHFFFAOYSA-N pyridinium p-toluenesulfonate Chemical compound C1=CC=[NH+]C=C1.CC1=CC=C(S([O-])(=O)=O)C=C1 ZDYVRSLAEXCVBX-UHFFFAOYSA-N 0.000 description 7
- 206010039073 rheumatoid arthritis Diseases 0.000 description 7
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 7
- 239000003643 water by type Substances 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 201000005569 Gout Diseases 0.000 description 6
- 206010065390 Inflammatory pain Diseases 0.000 description 6
- 206010059176 Juvenile idiopathic arthritis Diseases 0.000 description 6
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- 101100272976 Panax ginseng CYP716A53v2 gene Proteins 0.000 description 6
- 206010047115 Vasculitis Diseases 0.000 description 6
- 208000026935 allergic disease Diseases 0.000 description 6
- 239000005557 antagonist Substances 0.000 description 6
- 230000009400 cancer invasion Effects 0.000 description 6
- 239000003153 chemical reaction reagent Substances 0.000 description 6
- 229940079593 drug Drugs 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- 238000005984 hydrogenation reaction Methods 0.000 description 6
- 230000009610 hypersensitivity Effects 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- 208000002551 irritable bowel syndrome Diseases 0.000 description 6
- 229910052757 nitrogen Inorganic materials 0.000 description 6
- 230000008058 pain sensation Effects 0.000 description 6
- 125000006239 protecting group Chemical group 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 230000035945 sensitivity Effects 0.000 description 6
- 125000001424 substituent group Chemical group 0.000 description 6
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 6
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 6
- 230000008733 trauma Effects 0.000 description 6
- 230000009385 viral infection Effects 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- BDAGIHXWWSANSR-UHFFFAOYSA-N Formic acid Chemical compound OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 5
- 208000003456 Juvenile Arthritis Diseases 0.000 description 5
- 230000002159 abnormal effect Effects 0.000 description 5
- 206010003246 arthritis Diseases 0.000 description 5
- 125000001246 bromo group Chemical group Br* 0.000 description 5
- 239000000706 filtrate Substances 0.000 description 5
- 235000019253 formic acid Nutrition 0.000 description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 5
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 5
- 239000000543 intermediate Substances 0.000 description 5
- 125000002950 monocyclic group Chemical group 0.000 description 5
- 201000006417 multiple sclerosis Diseases 0.000 description 5
- 125000004433 nitrogen atom Chemical group N* 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 201000003068 rheumatic fever Diseases 0.000 description 5
- 206010039083 rhinitis Diseases 0.000 description 5
- 230000000638 stimulation Effects 0.000 description 5
- 206010044652 trigeminal neuralgia Diseases 0.000 description 5
- BKOOMYPCSUNDGP-UHFFFAOYSA-N 2-methylbut-2-ene Chemical compound CC=C(C)C BKOOMYPCSUNDGP-UHFFFAOYSA-N 0.000 description 4
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 4
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 4
- 208000000094 Chronic Pain Diseases 0.000 description 4
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 description 4
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 description 4
- 208000011231 Crohn disease Diseases 0.000 description 4
- 201000004624 Dermatitis Diseases 0.000 description 4
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 4
- 208000007465 Giant cell arteritis Diseases 0.000 description 4
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 4
- BAPJBEWLBFYGME-UHFFFAOYSA-N Methyl acrylate Chemical compound COC(=O)C=C BAPJBEWLBFYGME-UHFFFAOYSA-N 0.000 description 4
- 208000019695 Migraine disease Diseases 0.000 description 4
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 4
- 239000007868 Raney catalyst Substances 0.000 description 4
- NPXOKRUENSOPAO-UHFFFAOYSA-N Raney nickel Chemical compound [Al].[Ni] NPXOKRUENSOPAO-UHFFFAOYSA-N 0.000 description 4
- 229910000564 Raney nickel Inorganic materials 0.000 description 4
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 4
- ULHRKLSNHXXJLO-UHFFFAOYSA-L Yo-Pro-1 Chemical compound [I-].[I-].C1=CC=C2C(C=C3N(C4=CC=CC=C4O3)C)=CC=[N+](CCC[N+](C)(C)C)C2=C1 ULHRKLSNHXXJLO-UHFFFAOYSA-L 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 150000001408 amides Chemical group 0.000 description 4
- KQIADDMXRMTWHZ-UHFFFAOYSA-N chloro-tri(propan-2-yl)silane Chemical compound CC(C)[Si](Cl)(C(C)C)C(C)C KQIADDMXRMTWHZ-UHFFFAOYSA-N 0.000 description 4
- 208000019425 cirrhosis of liver Diseases 0.000 description 4
- 201000003146 cystitis Diseases 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 4
- 230000002458 infectious effect Effects 0.000 description 4
- 208000027866 inflammatory disease Diseases 0.000 description 4
- 150000002576 ketones Chemical class 0.000 description 4
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 4
- 206010027599 migraine Diseases 0.000 description 4
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 4
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 4
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 125000004076 pyridyl group Chemical group 0.000 description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 201000005671 spondyloarthropathy Diseases 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- 206010043207 temporal arteritis Diseases 0.000 description 4
- LEIMLDGFXIOXMT-UHFFFAOYSA-N trimethylsilyl cyanide Chemical compound C[Si](C)(C)C#N LEIMLDGFXIOXMT-UHFFFAOYSA-N 0.000 description 4
- 239000003039 volatile agent Substances 0.000 description 4
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 3
- ICETWLGKJXCIDX-UHFFFAOYSA-N 2,4-dichloro-1,3-thiazole Chemical compound ClC1=CSC(Cl)=N1 ICETWLGKJXCIDX-UHFFFAOYSA-N 0.000 description 3
- VDTIGYKLTROQAH-UHFFFAOYSA-N 4-bromo-1,3-thiazole Chemical compound BrC1=CSC=N1 VDTIGYKLTROQAH-UHFFFAOYSA-N 0.000 description 3
- 208000024827 Alzheimer disease Diseases 0.000 description 3
- 208000008035 Back Pain Diseases 0.000 description 3
- 206010006002 Bone pain Diseases 0.000 description 3
- 206010009900 Colitis ulcerative Diseases 0.000 description 3
- 208000034656 Contusions Diseases 0.000 description 3
- 206010011224 Cough Diseases 0.000 description 3
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 3
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 3
- 208000005171 Dysmenorrhea Diseases 0.000 description 3
- 206010013935 Dysmenorrhoea Diseases 0.000 description 3
- 206010014561 Emphysema Diseases 0.000 description 3
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 3
- 208000001640 Fibromyalgia Diseases 0.000 description 3
- 206010016654 Fibrosis Diseases 0.000 description 3
- 206010018364 Glomerulonephritis Diseases 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 206010018634 Gouty Arthritis Diseases 0.000 description 3
- 208000023105 Huntington disease Diseases 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- 208000003250 Mixed connective tissue disease Diseases 0.000 description 3
- 206010028391 Musculoskeletal Pain Diseases 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- 206010028836 Neck pain Diseases 0.000 description 3
- 206010062501 Non-cardiac chest pain Diseases 0.000 description 3
- 208000001132 Osteoporosis Diseases 0.000 description 3
- 206010036376 Postherpetic Neuralgia Diseases 0.000 description 3
- 208000004550 Postoperative Pain Diseases 0.000 description 3
- 201000004681 Psoriasis Diseases 0.000 description 3
- 208000008765 Sciatica Diseases 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 208000010040 Sprains and Strains Diseases 0.000 description 3
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 3
- 206010064390 Tumour invasion Diseases 0.000 description 3
- 201000006704 Ulcerative Colitis Diseases 0.000 description 3
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Natural products NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 208000005298 acute pain Diseases 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 206010053552 allodynia Diseases 0.000 description 3
- 238000002266 amputation Methods 0.000 description 3
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- 201000008937 atopic dermatitis Diseases 0.000 description 3
- CBHOOMGKXCMKIR-UHFFFAOYSA-N azane;methanol Chemical compound N.OC CBHOOMGKXCMKIR-UHFFFAOYSA-N 0.000 description 3
- 210000003169 central nervous system Anatomy 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000002512 chemotherapy Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 238000009833 condensation Methods 0.000 description 3
- 230000005494 condensation Effects 0.000 description 3
- 230000009519 contusion Effects 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 230000007850 degeneration Effects 0.000 description 3
- 229910052805 deuterium Inorganic materials 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000002158 endotoxin Substances 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 230000004761 fibrosis Effects 0.000 description 3
- 238000000589 high-performance liquid chromatography-mass spectrometry Methods 0.000 description 3
- 230000004968 inflammatory condition Effects 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 206010022000 influenza Diseases 0.000 description 3
- 229920006008 lipopolysaccharide Polymers 0.000 description 3
- 229910052744 lithium Inorganic materials 0.000 description 3
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- CYEBJEDOHLIWNP-UHFFFAOYSA-N methanethioamide Chemical compound NC=S CYEBJEDOHLIWNP-UHFFFAOYSA-N 0.000 description 3
- 125000002757 morpholinyl group Chemical group 0.000 description 3
- 230000003387 muscular Effects 0.000 description 3
- 208000031225 myocardial ischemia Diseases 0.000 description 3
- 230000004770 neurodegeneration Effects 0.000 description 3
- 201000001119 neuropathy Diseases 0.000 description 3
- 230000007823 neuropathy Effects 0.000 description 3
- PXHVJJICTQNCMI-UHFFFAOYSA-N nickel Substances [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 3
- 201000001245 periodontitis Diseases 0.000 description 3
- 208000033808 peripheral neuropathy Diseases 0.000 description 3
- 208000030062 persistent idiopathic facial pain Diseases 0.000 description 3
- 125000003386 piperidinyl group Chemical group 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 210000001525 retina Anatomy 0.000 description 3
- 201000000306 sarcoidosis Diseases 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 230000001953 sensory effect Effects 0.000 description 3
- 230000009155 sensory pathway Effects 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 239000011877 solvent mixture Substances 0.000 description 3
- 208000020431 spinal cord injury Diseases 0.000 description 3
- 230000003068 static effect Effects 0.000 description 3
- 238000001356 surgical procedure Methods 0.000 description 3
- 230000002889 sympathetic effect Effects 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 208000004371 toothache Diseases 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 3
- 201000008827 tuberculosis Diseases 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- RAIPHJJURHTUIC-UHFFFAOYSA-N 1,3-thiazol-2-amine Chemical compound NC1=NC=CS1 RAIPHJJURHTUIC-UHFFFAOYSA-N 0.000 description 2
- FPIRBHDGWMWJEP-UHFFFAOYSA-N 1-hydroxy-7-azabenzotriazole Chemical compound C1=CN=C2N(O)N=NC2=C1 FPIRBHDGWMWJEP-UHFFFAOYSA-N 0.000 description 2
- 238000005160 1H NMR spectroscopy Methods 0.000 description 2
- GNHGSSSQCHAIEL-UHFFFAOYSA-N 1h-azepine;hydrobromide Chemical compound Br.N1C=CC=CC=C1 GNHGSSSQCHAIEL-UHFFFAOYSA-N 0.000 description 2
- MVXVYAKCVDQRLW-UHFFFAOYSA-N 1h-pyrrolo[2,3-b]pyridine Chemical compound C1=CN=C2NC=CC2=C1 MVXVYAKCVDQRLW-UHFFFAOYSA-N 0.000 description 2
- MDEHBAMASAXISQ-UHFFFAOYSA-N 2-amino-2-cycloheptylethanol Chemical compound OCC(N)C1CCCCCC1 MDEHBAMASAXISQ-UHFFFAOYSA-N 0.000 description 2
- MWFMGBPGAXYFAR-UHFFFAOYSA-N 2-hydroxy-2-methylpropanenitrile Chemical compound CC(C)(O)C#N MWFMGBPGAXYFAR-UHFFFAOYSA-N 0.000 description 2
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 2
- DJORFAXPYNQDGG-UHFFFAOYSA-N 4-[(2,2-dimethyl-1,3-dioxolan-4-yl)methoxy]-1,3-thiazole Chemical compound O1C(C)(C)OCC1COC1=CSC=N1 DJORFAXPYNQDGG-UHFFFAOYSA-N 0.000 description 2
- YIXODCRXIBGFTB-UHFFFAOYSA-N 5,6-dihydrofuro[2,3-d][1,3]thiazole-6-carboxylic acid Chemical compound N1=CSC2=C1OCC2C(=O)O YIXODCRXIBGFTB-UHFFFAOYSA-N 0.000 description 2
- DWUPYMSVAPQXMS-UHFFFAOYSA-N 5-bromo-1,3-thiazole Chemical compound BrC1=CN=CS1 DWUPYMSVAPQXMS-UHFFFAOYSA-N 0.000 description 2
- 208000030507 AIDS Diseases 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 2
- 206010033646 Acute and chronic pancreatitis Diseases 0.000 description 2
- 208000026872 Addison Disease Diseases 0.000 description 2
- 208000035285 Allergic Seasonal Rhinitis Diseases 0.000 description 2
- 208000035939 Alveolitis allergic Diseases 0.000 description 2
- 208000003343 Antiphospholipid Syndrome Diseases 0.000 description 2
- 208000019901 Anxiety disease Diseases 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 208000023328 Basedow disease Diseases 0.000 description 2
- 208000009137 Behcet syndrome Diseases 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- 208000002691 Choroiditis Diseases 0.000 description 2
- 208000006344 Churg-Strauss Syndrome Diseases 0.000 description 2
- 208000006561 Cluster Headache Diseases 0.000 description 2
- 102100032373 Coiled-coil domain-containing protein 85B Human genes 0.000 description 2
- BZKFMUIJRXWWQK-UHFFFAOYSA-N Cyclopentenone Chemical compound O=C1CCC=C1 BZKFMUIJRXWWQK-UHFFFAOYSA-N 0.000 description 2
- 206010012438 Dermatitis atopic Diseases 0.000 description 2
- 206010012442 Dermatitis contact Diseases 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 2
- 208000006926 Discoid Lupus Erythematosus Diseases 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 206010053776 Eosinophilic cellulitis Diseases 0.000 description 2
- 206010014954 Eosinophilic fasciitis Diseases 0.000 description 2
- 208000018428 Eosinophilic granulomatosis with polyangiitis Diseases 0.000 description 2
- 208000027445 Farmer Lung Diseases 0.000 description 2
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 2
- 206010017533 Fungal infection Diseases 0.000 description 2
- 206010061459 Gastrointestinal ulcer Diseases 0.000 description 2
- 208000015023 Graves' disease Diseases 0.000 description 2
- 239000007821 HATU Substances 0.000 description 2
- 208000030836 Hashimoto thyroiditis Diseases 0.000 description 2
- 206010019233 Headaches Diseases 0.000 description 2
- 208000003695 Histiocytic Necrotizing Lymphadenitis Diseases 0.000 description 2
- 206010069070 Histiocytic necrotising lymphadenitis Diseases 0.000 description 2
- 101000868814 Homo sapiens Coiled-coil domain-containing protein 85B Proteins 0.000 description 2
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 2
- 206010061246 Intervertebral disc degeneration Diseases 0.000 description 2
- 208000015282 Kikuchi-Fujimoto disease Diseases 0.000 description 2
- 208000009829 Lewy Body Disease Diseases 0.000 description 2
- 201000002832 Lewy body dementia Diseases 0.000 description 2
- 208000000185 Localized scleroderma Diseases 0.000 description 2
- 201000009906 Meningitis Diseases 0.000 description 2
- 238000006751 Mitsunobu reaction Methods 0.000 description 2
- 208000021642 Muscular disease Diseases 0.000 description 2
- 208000000112 Myalgia Diseases 0.000 description 2
- 208000031888 Mycoses Diseases 0.000 description 2
- 201000009623 Myopathy Diseases 0.000 description 2
- 206010029164 Nephrotic syndrome Diseases 0.000 description 2
- 241001420836 Ophthalmitis Species 0.000 description 2
- 208000010191 Osteitis Deformans Diseases 0.000 description 2
- 206010031264 Osteonecrosis Diseases 0.000 description 2
- 208000027868 Paget disease Diseases 0.000 description 2
- 208000018737 Parkinson disease Diseases 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 206010065159 Polychondritis Diseases 0.000 description 2
- 208000003971 Posterior uveitis Diseases 0.000 description 2
- 206010037660 Pyrexia Diseases 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical class N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 208000021386 Sjogren Syndrome Diseases 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- 206010041591 Spinal osteoarthritis Diseases 0.000 description 2
- 238000007059 Strecker synthesis reaction Methods 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- 201000009594 Systemic Scleroderma Diseases 0.000 description 2
- 206010042953 Systemic sclerosis Diseases 0.000 description 2
- 208000001106 Takayasu Arteritis Diseases 0.000 description 2
- 208000000491 Tendinopathy Diseases 0.000 description 2
- 206010043255 Tendonitis Diseases 0.000 description 2
- 206010043269 Tension headache Diseases 0.000 description 2
- 208000008548 Tension-Type Headache Diseases 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- 208000025865 Ulcer Diseases 0.000 description 2
- 206010046996 Varicose vein Diseases 0.000 description 2
- 208000008526 Wells syndrome Diseases 0.000 description 2
- FXXACINHVKSMDR-UHFFFAOYSA-N acetyl bromide Chemical compound CC(Br)=O FXXACINHVKSMDR-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 229950003476 aminothiazole Drugs 0.000 description 2
- 206010002022 amyloidosis Diseases 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 229940054051 antipsychotic indole derivative Drugs 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 201000004984 autoimmune cardiomyopathy Diseases 0.000 description 2
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 208000024883 bone remodeling disease Diseases 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 206010006451 bronchitis Diseases 0.000 description 2
- HUCVOHYBFXVBRW-UHFFFAOYSA-M caesium hydroxide Chemical compound [OH-].[Cs+] HUCVOHYBFXVBRW-UHFFFAOYSA-M 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 125000002837 carbocyclic group Chemical group 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 201000001352 cholecystitis Diseases 0.000 description 2
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 description 2
- 230000007882 cirrhosis Effects 0.000 description 2
- 208000018912 cluster headache syndrome Diseases 0.000 description 2
- 206010009887 colitis Diseases 0.000 description 2
- 208000010247 contact dermatitis Diseases 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 208000037329 crystal arthropathy Diseases 0.000 description 2
- 208000004921 cutaneous lupus erythematosus Diseases 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 238000006114 decarboxylation reaction Methods 0.000 description 2
- 201000001981 dermatomyositis Diseases 0.000 description 2
- LVTYICIALWPMFW-UHFFFAOYSA-N diisopropanolamine Chemical compound CC(O)CNCC(C)O LVTYICIALWPMFW-UHFFFAOYSA-N 0.000 description 2
- 208000037765 diseases and disorders Diseases 0.000 description 2
- QGBQGMHXBSLYLZ-UHFFFAOYSA-N ditert-butyl-(1-naphthalen-1-ylnaphthalen-2-yl)phosphane Chemical group C1=CC=C2C(C3=C4C=CC=CC4=CC=C3P(C(C)(C)C)C(C)(C)C)=CC=CC2=C1 QGBQGMHXBSLYLZ-UHFFFAOYSA-N 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 208000022195 farmer lung disease Diseases 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 231100000869 headache Toxicity 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 150000003840 hydrochlorides Chemical class 0.000 description 2
- 230000003301 hydrolyzing effect Effects 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 201000006334 interstitial nephritis Diseases 0.000 description 2
- 230000001057 ionotropic effect Effects 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical class C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 208000027202 mammary Paget disease Diseases 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- OEAJVRCXSWAKPS-UHFFFAOYSA-N methyl 2-bromo-3-oxocyclohexane-1-carboxylate Chemical compound COC(=O)C1CCCC(=O)C1Br OEAJVRCXSWAKPS-UHFFFAOYSA-N 0.000 description 2
- LKVHTVRTQUBZDN-UHFFFAOYSA-N methyl cyclohex-2-ene-1-carboxylate Chemical compound COC(=O)C1CCCC=C1 LKVHTVRTQUBZDN-UHFFFAOYSA-N 0.000 description 2
- 150000004702 methyl esters Chemical class 0.000 description 2
- 206010063344 microscopic polyangiitis Diseases 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 210000005087 mononuclear cell Anatomy 0.000 description 2
- 230000036651 mood Effects 0.000 description 2
- 206010028417 myasthenia gravis Diseases 0.000 description 2
- OQJBFFCUFALWQL-UHFFFAOYSA-N n-(piperidine-1-carbonylimino)piperidine-1-carboxamide Chemical compound C1CCCCN1C(=O)N=NC(=O)N1CCCCC1 OQJBFFCUFALWQL-UHFFFAOYSA-N 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 201000009240 nasopharyngitis Diseases 0.000 description 2
- 201000008383 nephritis Diseases 0.000 description 2
- 210000005036 nerve Anatomy 0.000 description 2
- 230000003040 nociceptive effect Effects 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Chemical group 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 208000010403 panophthalmitis Diseases 0.000 description 2
- 208000012111 paraneoplastic syndrome Diseases 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 208000028169 periodontal disease Diseases 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 208000005987 polymyositis Diseases 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 238000002953 preparative HPLC Methods 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 208000005069 pulmonary fibrosis Diseases 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000002098 pyridazinyl group Chemical group 0.000 description 2
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 description 2
- 210000002345 respiratory system Anatomy 0.000 description 2
- 238000007363 ring formation reaction Methods 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 208000019116 sleep disease Diseases 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 229910052717 sulfur Chemical group 0.000 description 2
- 239000011593 sulfur Chemical group 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 2
- 210000001738 temporomandibular joint Anatomy 0.000 description 2
- 201000004415 tendinitis Diseases 0.000 description 2
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 2
- ZTQUQGRSCLFRFM-UHFFFAOYSA-N tert-butyl 2-amino-2-cycloheptylacetate Chemical compound CC(C)(C)OC(=O)C(N)C1CCCCCC1 ZTQUQGRSCLFRFM-UHFFFAOYSA-N 0.000 description 2
- IOGXOCVLYRDXLW-UHFFFAOYSA-N tert-butyl nitrite Chemical compound CC(C)(C)ON=O IOGXOCVLYRDXLW-UHFFFAOYSA-N 0.000 description 2
- 239000012414 tert-butyl nitrite Substances 0.000 description 2
- IXIFHSYPWJHZGH-UHFFFAOYSA-N tert-butyl-[3-(2,4-dichloro-1,3-thiazol-5-yl)-3-(oxan-2-yloxy)propoxy]-dimethylsilane Chemical compound S1C(Cl)=NC(Cl)=C1C(CCO[Si](C)(C)C(C)(C)C)OC1CCCCO1 IXIFHSYPWJHZGH-UHFFFAOYSA-N 0.000 description 2
- IKPSUQKZFYDWIC-UHFFFAOYSA-N tert-butyl-[3-(4-chloro-1,3-thiazol-5-yl)-3-(oxan-2-yloxy)propoxy]-dimethylsilane Chemical compound S1C=NC(Cl)=C1C(CCO[Si](C)(C)C(C)(C)C)OC1CCCCO1 IKPSUQKZFYDWIC-UHFFFAOYSA-N 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- 208000027185 varicose disease Diseases 0.000 description 2
- HRFKBGNRLIATAU-ZFWWWQNUSA-N (7r)-n-[(2r)-2-morpholin-4-yl-2-[2-(trifluoromethyl)pyrimidin-5-yl]ethyl]-4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxamide Chemical compound C1=NC(C(F)(F)F)=NC=C1[C@@H](N1CCOCC1)CNC(=O)[C@@H]1C(SC=N2)=C2CCC1 HRFKBGNRLIATAU-ZFWWWQNUSA-N 0.000 description 1
- UULLWSUBJVMANU-HNNXBMFYSA-N (7r)-n-[[1-(6-chloropyridin-3-yl)cyclohexyl]methyl]-4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxamide Chemical compound C1=NC(Cl)=CC=C1C1(CNC(=O)[C@@H]2C=3SC=NC=3CCC2)CCCCC1 UULLWSUBJVMANU-HNNXBMFYSA-N 0.000 description 1
- HRFKBGNRLIATAU-HIFRSBDPSA-N (7s)-n-[(2r)-2-morpholin-4-yl-2-[2-(trifluoromethyl)pyrimidin-5-yl]ethyl]-4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxamide Chemical group C1=NC(C(F)(F)F)=NC=C1[C@@H](N1CCOCC1)CNC(=O)[C@H]1C(SC=N2)=C2CCC1 HRFKBGNRLIATAU-HIFRSBDPSA-N 0.000 description 1
- 125000005962 1,4-oxazepanyl group Chemical group 0.000 description 1
- VYXHVRARDIDEHS-UHFFFAOYSA-N 1,5-cyclooctadiene Chemical compound C1CC=CCCC=C1 VYXHVRARDIDEHS-UHFFFAOYSA-N 0.000 description 1
- 239000004912 1,5-cyclooctadiene Substances 0.000 description 1
- IBODDUNKEPPBKW-UHFFFAOYSA-N 1,5-dibromopentane Chemical compound BrCCCCCBr IBODDUNKEPPBKW-UHFFFAOYSA-N 0.000 description 1
- XSYFSMJOWYRTFX-UHFFFAOYSA-N 1-(6-chloropyridin-3-yl)-4,4-difluorocyclohexane-1-carbonitrile Chemical compound C1CC(F)(F)CCC1(C#N)C1=CC=C(Cl)N=C1 XSYFSMJOWYRTFX-UHFFFAOYSA-N 0.000 description 1
- DEOPBRRGELVKHM-UHFFFAOYSA-N 1-(6-chloropyridin-3-yl)-4-oxocyclohexane-1-carbonitrile Chemical compound C1=NC(Cl)=CC=C1C1(C#N)CCC(=O)CC1 DEOPBRRGELVKHM-UHFFFAOYSA-N 0.000 description 1
- MICMHFIQSAMEJG-UHFFFAOYSA-N 1-bromopyrrolidine-2,5-dione Chemical compound BrN1C(=O)CCC1=O.BrN1C(=O)CCC1=O MICMHFIQSAMEJG-UHFFFAOYSA-N 0.000 description 1
- JZUMPNUYDJBTNO-UHFFFAOYSA-N 1-hydroxybenzotriazole;hydrate Chemical compound O.C1=CC=C2N(O)N=NC2=C1.C1=CC=C2N(O)N=NC2=C1 JZUMPNUYDJBTNO-UHFFFAOYSA-N 0.000 description 1
- 125000004066 1-hydroxyethyl group Chemical group [H]OC([H])([*])C([H])([H])[H] 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 description 1
- BLGUCBUETMYJTB-UHFFFAOYSA-N 2-(6-chloropyridin-3-yl)acetonitrile Chemical compound ClC1=CC=C(CC#N)C=N1 BLGUCBUETMYJTB-UHFFFAOYSA-N 0.000 description 1
- MLIREBYILWEBDM-UHFFFAOYSA-M 2-cyanoacetate Chemical compound [O-]C(=O)CC#N MLIREBYILWEBDM-UHFFFAOYSA-M 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- APOYTRAZFJURPB-UHFFFAOYSA-N 2-methoxy-n-(2-methoxyethyl)-n-(trifluoro-$l^{4}-sulfanyl)ethanamine Chemical compound COCCN(S(F)(F)F)CCOC APOYTRAZFJURPB-UHFFFAOYSA-N 0.000 description 1
- MSMLIBSQLHMWMS-UHFFFAOYSA-N 2h-pyrano[2,3-d][1,3]thiazole Chemical compound C1=COC2=NCSC2=C1 MSMLIBSQLHMWMS-UHFFFAOYSA-N 0.000 description 1
- 125000004361 3,4,5-trifluorophenyl group Chemical group [H]C1=C(F)C(F)=C(F)C([H])=C1* 0.000 description 1
- JSNZDMDUPKHAPO-UHFFFAOYSA-N 3-(4-chloro-1,3-thiazol-5-yl)-3-(oxan-2-yloxy)propan-1-ol Chemical compound S1C=NC(Cl)=C1C(CCO)OC1CCCCO1 JSNZDMDUPKHAPO-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- RVAZRLUBQRDUEB-UHFFFAOYSA-N 3-[tert-butyl(dimethyl)silyl]oxy-1-(2,4-dichloro-1,3-thiazol-5-yl)propan-1-ol Chemical compound CC(C)(C)[Si](C)(C)OCCC(O)C=1SC(Cl)=NC=1Cl RVAZRLUBQRDUEB-UHFFFAOYSA-N 0.000 description 1
- WGWCJTNWUFFGFH-UHFFFAOYSA-N 3-[tert-butyl(dimethyl)silyl]oxypropanal Chemical compound CC(C)(C)[Si](C)(C)OCCC=O WGWCJTNWUFFGFH-UHFFFAOYSA-N 0.000 description 1
- RRRCPCOJPQLWEP-UHFFFAOYSA-N 3-hydroxytriazolo[4,5-b]pyridine Chemical compound C1=CN=C2N(O)N=NC2=C1.C1=CN=C2N(O)N=NC2=C1 RRRCPCOJPQLWEP-UHFFFAOYSA-N 0.000 description 1
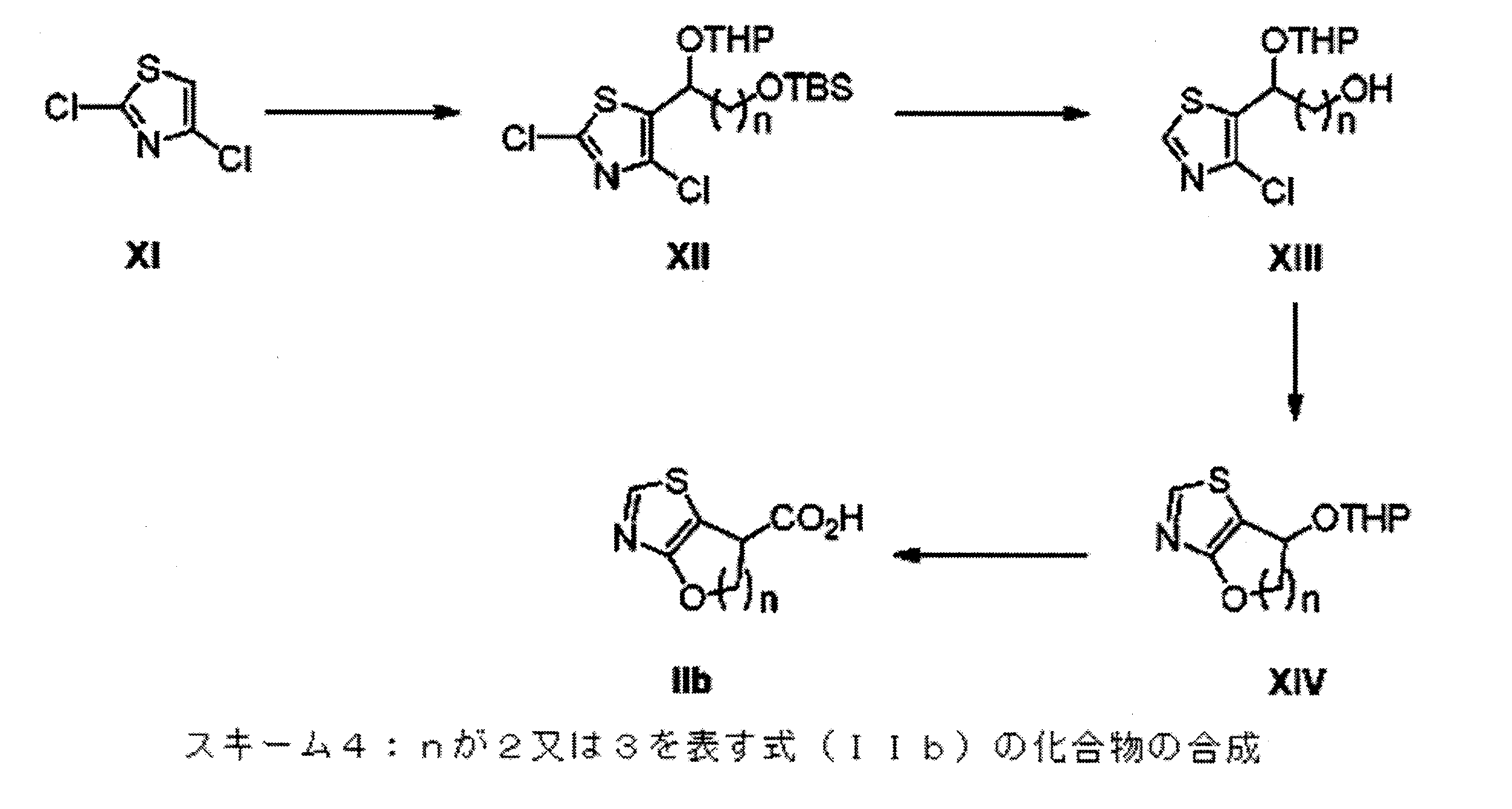
- ZLDYXIBJPUNUPD-UHFFFAOYSA-N 4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxylic acid Chemical compound OC(=O)C1CCCC2=C1SC=N2 ZLDYXIBJPUNUPD-UHFFFAOYSA-N 0.000 description 1
- DOHGFFVYNCRCEV-UHFFFAOYSA-N 4-[tert-butyl(dimethyl)silyl]oxybutanal Chemical compound CC(C)(C)[Si](C)(C)OCCCC=O DOHGFFVYNCRCEV-UHFFFAOYSA-N 0.000 description 1
- OZYVUMHKFRDYOK-UHFFFAOYSA-N 5,6,7,8-tetrahydro-4h-cyclohepta[d][1,3]thiazole-8-carboxylic acid Chemical compound OC(=O)C1CCCCC2=C1SC=N2 OZYVUMHKFRDYOK-UHFFFAOYSA-N 0.000 description 1
- BRIRCZHMOFTJIO-UHFFFAOYSA-N 5,6-dihydro-4h-cyclopenta[d][1,3]thiazole-6-carboxylic acid Chemical compound N1=CSC2=C1CCC2C(=O)O BRIRCZHMOFTJIO-UHFFFAOYSA-N 0.000 description 1
- IVNXTKLTOSDIKZ-UHFFFAOYSA-N 5-bromo-4-(oxiran-2-ylmethoxy)-1,3-thiazole Chemical compound S1C=NC(OCC2OC2)=C1Br IVNXTKLTOSDIKZ-UHFFFAOYSA-N 0.000 description 1
- ZBROSAGCPIFNJH-UHFFFAOYSA-N 5-bromo-4-[(2,2-dimethyl-1,3-dioxolan-4-yl)methoxy]-1,3-thiazole Chemical compound O1C(C)(C)OCC1COC1=C(Br)SC=N1 ZBROSAGCPIFNJH-UHFFFAOYSA-N 0.000 description 1
- DACBRWLHVMIACW-UHFFFAOYSA-N 6,7-dihydro-5h-pyrano[2,3-d][1,3]thiazol-7-ol Chemical compound OC1CCOC2=C1SC=N2 DACBRWLHVMIACW-UHFFFAOYSA-N 0.000 description 1
- WPUSJZGBZYJFDI-UHFFFAOYSA-N 6,7-dihydro-5h-pyrano[2,3-d][1,3]thiazole-7-carboxylic acid Chemical compound OC(=O)C1CCOC2=C1SC=N2 WPUSJZGBZYJFDI-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 208000002874 Acne Vulgaris Diseases 0.000 description 1
- 206010000748 Acute febrile neutrophilic dermatosis Diseases 0.000 description 1
- 208000032671 Allergic granulomatous angiitis Diseases 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- 206010068172 Anal pruritus Diseases 0.000 description 1
- 208000028185 Angioedema Diseases 0.000 description 1
- 206010002921 Aortitis Diseases 0.000 description 1
- 206010053555 Arthritis bacterial Diseases 0.000 description 1
- 208000036487 Arthropathies Diseases 0.000 description 1
- 201000002909 Aspergillosis Diseases 0.000 description 1
- 208000036641 Aspergillus infections Diseases 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 206010003827 Autoimmune hepatitis Diseases 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 206010056377 Bone tuberculosis Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 206010007882 Cellulitis Diseases 0.000 description 1
- 206010065559 Cerebral arteriosclerosis Diseases 0.000 description 1
- 208000015943 Coeliac disease Diseases 0.000 description 1
- 208000009248 Congenital Hip Dislocation Diseases 0.000 description 1
- 206010010741 Conjunctivitis Diseases 0.000 description 1
- 206010010744 Conjunctivitis allergic Diseases 0.000 description 1
- 241000711573 Coronaviridae Species 0.000 description 1
- 108010091326 Cryoglobulins Proteins 0.000 description 1
- 241001649012 Cypselea humifusa Species 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- 206010011793 Cystitis haemorrhagic Diseases 0.000 description 1
- 102000002004 Cytochrome P-450 Enzyme System Human genes 0.000 description 1
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 206010051055 Deep vein thrombosis Diseases 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 208000016192 Demyelinating disease Diseases 0.000 description 1
- 206010012434 Dermatitis allergic Diseases 0.000 description 1
- 238000006646 Dess-Martin oxidation reaction Methods 0.000 description 1
- 238000006228 Dieckmann condensation reaction Methods 0.000 description 1
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical compound C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 1
- 238000007355 Double Michael addition reaction Methods 0.000 description 1
- 208000019872 Drug Eruptions Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 206010014950 Eosinophilia Diseases 0.000 description 1
- 206010065563 Eosinophilic bronchitis Diseases 0.000 description 1
- 206010014989 Epidermolysis bullosa Diseases 0.000 description 1
- 208000010228 Erectile Dysfunction Diseases 0.000 description 1
- 206010015218 Erythema multiforme Diseases 0.000 description 1
- 208000010201 Exanthema Diseases 0.000 description 1
- 208000001860 Eye Infections Diseases 0.000 description 1
- 206010016207 Familial Mediterranean fever Diseases 0.000 description 1
- 208000032678 Fixed drug eruption Diseases 0.000 description 1
- 208000005232 Glossitis Diseases 0.000 description 1
- 206010019728 Hepatitis alcoholic Diseases 0.000 description 1
- 206010019799 Hepatitis viral Diseases 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 201000003838 Idiopathic interstitial pneumonia Diseases 0.000 description 1
- 208000004575 Infectious Arthritis Diseases 0.000 description 1
- 102000003810 Interleukin-18 Human genes 0.000 description 1
- 108090000171 Interleukin-18 Proteins 0.000 description 1
- 206010022941 Iridocyclitis Diseases 0.000 description 1
- 108010092694 L-Selectin Proteins 0.000 description 1
- 102000016551 L-selectin Human genes 0.000 description 1
- 206010024229 Leprosy Diseases 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- 239000012097 Lipofectamine 2000 Substances 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 208000008930 Low Back Pain Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 208000019022 Mood disease Diseases 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 208000009525 Myocarditis Diseases 0.000 description 1
- 208000000592 Nasal Polyps Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 208000027771 Obstructive airways disease Diseases 0.000 description 1
- 206010030216 Oesophagitis Diseases 0.000 description 1
- 206010031252 Osteomyelitis Diseases 0.000 description 1
- 206010034277 Pemphigoid Diseases 0.000 description 1
- 241000721454 Pemphigus Species 0.000 description 1
- 208000004362 Penile Induration Diseases 0.000 description 1
- 208000012896 Peritoneal disease Diseases 0.000 description 1
- 208000037581 Persistent Infection Diseases 0.000 description 1
- 208000020758 Peyronie disease Diseases 0.000 description 1
- 208000004983 Phantom Limb Diseases 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 206010036774 Proctitis Diseases 0.000 description 1
- 201000001263 Psoriatic Arthritis Diseases 0.000 description 1
- 208000036824 Psoriatic arthropathy Diseases 0.000 description 1
- 208000006311 Pyoderma Diseases 0.000 description 1
- 206010063837 Reperfusion injury Diseases 0.000 description 1
- 208000025747 Rheumatic disease Diseases 0.000 description 1
- 206010039094 Rhinitis perennial Diseases 0.000 description 1
- 208000036284 Rhinitis seasonal Diseases 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 206010039793 Seborrhoeic dermatitis Diseases 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- 208000009359 Sezary Syndrome Diseases 0.000 description 1
- 208000021388 Sezary disease Diseases 0.000 description 1
- 229910004298 SiO 2 Inorganic materials 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 208000010265 Sweet syndrome Diseases 0.000 description 1
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical group C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 1
- 206010057970 Toxic skin eruption Diseases 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 206010053613 Type IV hypersensitivity reaction Diseases 0.000 description 1
- 208000025851 Undifferentiated connective tissue disease Diseases 0.000 description 1
- 208000017379 Undifferentiated connective tissue syndrome Diseases 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- 206010047249 Venous thrombosis Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 208000035222 X-linked skeletal dysplasia-intellectual disability syndrome Diseases 0.000 description 1
- NQZLAWXEGDYJPY-UHFFFAOYSA-N [1-(6-chloropyridin-3-yl)-4,4-difluorocyclohexyl]methanamine Chemical compound C=1C=C(Cl)N=CC=1C1(CN)CCC(F)(F)CC1 NQZLAWXEGDYJPY-UHFFFAOYSA-N 0.000 description 1
- DKVYXQSQPDPUEW-UHFFFAOYSA-N [1-(6-chloropyridin-3-yl)cyclohexyl]methanamine Chemical compound C=1C=C(Cl)N=CC=1C1(CN)CCCCC1 DKVYXQSQPDPUEW-UHFFFAOYSA-N 0.000 description 1
- DTLFTPGATODELT-UHFFFAOYSA-N [2-tri(propan-2-yl)silyl-5,6-dihydrofuro[2,3-d][1,3]thiazol-6-yl]methanol Chemical compound O1CC(CO)C2=C1N=C([Si](C(C)C)(C(C)C)C(C)C)S2 DTLFTPGATODELT-UHFFFAOYSA-N 0.000 description 1
- 150000007960 acetonitrile Chemical class 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 206010000496 acne Diseases 0.000 description 1
- 238000004115 adherent culture Methods 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 208000002353 alcoholic hepatitis Diseases 0.000 description 1
- 201000009961 allergic asthma Diseases 0.000 description 1
- 208000002205 allergic conjunctivitis Diseases 0.000 description 1
- 201000010105 allergic rhinitis Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 208000004631 alopecia areata Diseases 0.000 description 1
- 150000001414 amino alcohols Chemical class 0.000 description 1
- 125000005219 aminonitrile group Chemical group 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 230000000954 anitussive effect Effects 0.000 description 1
- 201000004612 anterior uveitis Diseases 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 229940053202 antiepileptics carboxamide derivative Drugs 0.000 description 1
- 229940124584 antitussives Drugs 0.000 description 1
- 229910052586 apatite Inorganic materials 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 208000024998 atopic conjunctivitis Diseases 0.000 description 1
- 125000003725 azepanyl group Chemical group 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- KFFYBNSDGULKGB-UHFFFAOYSA-N bicyclo[2.2.1]hepta-2,5-diene 2-bromo-3-oxocyclopentane-1-carbonitrile Chemical compound C12C=CC(C=C1)C2.BrC2C(CCC2=O)C#N KFFYBNSDGULKGB-UHFFFAOYSA-N 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 208000010217 blepharitis Diseases 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- 201000009267 bronchiectasis Diseases 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 150000003857 carboxamides Chemical group 0.000 description 1
- 206010007604 cardiac sarcoidosis Diseases 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 208000010353 central nervous system vasculitis Diseases 0.000 description 1
- 208000036319 cervical spondylosis Diseases 0.000 description 1
- 238000004296 chiral HPLC Methods 0.000 description 1
- 208000002849 chondrocalcinosis Diseases 0.000 description 1
- 208000013116 chronic cough Diseases 0.000 description 1
- 208000017760 chronic graft versus host disease Diseases 0.000 description 1
- 201000009151 chronic rhinitis Diseases 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 208000018631 connective tissue disease Diseases 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- WZCRDVTWUYLPTR-UHFFFAOYSA-N cyclohept-2-en-1-one Chemical compound O=C1CCCCC=C1 WZCRDVTWUYLPTR-UHFFFAOYSA-N 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- DEZRYPDIMOWBDS-UHFFFAOYSA-N dcm dichloromethane Chemical compound ClCCl.ClCCl DEZRYPDIMOWBDS-UHFFFAOYSA-N 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 208000018180 degenerative disc disease Diseases 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 230000003210 demyelinating effect Effects 0.000 description 1
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 1
- 125000004431 deuterium atom Chemical group 0.000 description 1
- 208000014906 developmental dysplasia of the hip Diseases 0.000 description 1
- SZSMWWNXCCLLEK-UHFFFAOYSA-N dhp 3,4-dihydro-2h-pyran Chemical compound C1COC=CC1.C1COC=CC1 SZSMWWNXCCLLEK-UHFFFAOYSA-N 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- WMKGGPCROCCUDY-PHEQNACWSA-N dibenzylideneacetone Chemical compound C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 WMKGGPCROCCUDY-PHEQNACWSA-N 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- JMRYOSQOYJBDOI-UHFFFAOYSA-N dilithium;di(propan-2-yl)azanide Chemical compound [Li+].CC(C)[N-]C(C)C.CC(C)N([Li])C(C)C JMRYOSQOYJBDOI-UHFFFAOYSA-N 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- UXGNZZKBCMGWAZ-UHFFFAOYSA-N dimethylformamide dmf Chemical compound CN(C)C=O.CN(C)C=O UXGNZZKBCMGWAZ-UHFFFAOYSA-N 0.000 description 1
- PCHPORCSPXIHLZ-UHFFFAOYSA-N diphenhydramine hydrochloride Chemical compound [Cl-].C=1C=CC=CC=1C(OCC[NH+](C)C)C1=CC=CC=C1 PCHPORCSPXIHLZ-UHFFFAOYSA-N 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- CETRZFQIITUQQL-UHFFFAOYSA-N dmso dimethylsulfoxide Chemical compound CS(C)=O.CS(C)=O CETRZFQIITUQQL-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000007877 drug screening Methods 0.000 description 1
- 239000000428 dust Substances 0.000 description 1
- 206010014665 endocarditis Diseases 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 201000001564 eosinophilic gastroenteritis Diseases 0.000 description 1
- GKIPXFAANLTWBM-UHFFFAOYSA-N epibromohydrin Chemical compound BrCC1CO1 GKIPXFAANLTWBM-UHFFFAOYSA-N 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 208000006881 esophagitis Diseases 0.000 description 1
- 201000005884 exanthem Diseases 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 208000024711 extrinsic asthma Diseases 0.000 description 1
- RWTNPBWLLIMQHL-UHFFFAOYSA-N fexofenadine Chemical group C1=CC(C(C)(C(O)=O)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 RWTNPBWLLIMQHL-UHFFFAOYSA-N 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 208000012587 fixed pigmented erythema Diseases 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 208000021302 gastroesophageal reflux disease Diseases 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 208000007565 gingivitis Diseases 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 230000003676 hair loss Effects 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 201000002802 hemorrhagic cystitis Diseases 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- JAGYXYUAYDLKNO-UHFFFAOYSA-N hepta-2,5-diene Chemical compound CC=CCC=CC JAGYXYUAYDLKNO-UHFFFAOYSA-N 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 230000000642 iatrogenic effect Effects 0.000 description 1
- UTCSSFWDNNEEBH-UHFFFAOYSA-N imidazo[1,2-a]pyridine Chemical class C1=CC=CC2=NC=CN21 UTCSSFWDNNEEBH-UHFFFAOYSA-N 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 229940088592 immunologic factor Drugs 0.000 description 1
- 239000000367 immunologic factor Substances 0.000 description 1
- 201000001881 impotence Diseases 0.000 description 1
- 238000007901 in situ hybridization Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 201000009863 inflammatory diarrhea Diseases 0.000 description 1
- 208000030603 inherited susceptibility to asthma Diseases 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 208000021600 intervertebral disc degenerative disease Diseases 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 201000005851 intracranial arteriosclerosis Diseases 0.000 description 1
- 201000010659 intrinsic asthma Diseases 0.000 description 1
- CBEQRNSPHCCXSH-UHFFFAOYSA-N iodine monobromide Chemical compound IBr CBEQRNSPHCCXSH-UHFFFAOYSA-N 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 208000012947 ischemia reperfusion injury Diseases 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 201000002215 juvenile rheumatoid arthritis Diseases 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 239000011968 lewis acid catalyst Substances 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 230000001589 lymphoproliferative effect Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 208000008585 mastocytosis Diseases 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical class C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- ZDMFUKUPOLTVOE-UHFFFAOYSA-N methyl 4,5,6,7-tetrahydro-1,3-benzothiazole-7-carboxylate Chemical compound COC(=O)C1CCCC2=C1SC=N2 ZDMFUKUPOLTVOE-UHFFFAOYSA-N 0.000 description 1
- OBPVSHPLBWCGNB-UHFFFAOYSA-N methyl 5-(6-chloropyridin-3-yl)-5-cyano-2-hydroxycyclohexene-1-carboxylate Chemical compound C1C(C(=O)OC)=C(O)CCC1(C#N)C1=CC=C(Cl)N=C1 OBPVSHPLBWCGNB-UHFFFAOYSA-N 0.000 description 1
- ANGDWNBGPBMQHW-UHFFFAOYSA-N methyl cyanoacetate Chemical compound COC(=O)CC#N ANGDWNBGPBMQHW-UHFFFAOYSA-N 0.000 description 1
- 210000000274 microglia Anatomy 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- 208000025113 myeloid leukemia Diseases 0.000 description 1
- WOOWBQQQJXZGIE-UHFFFAOYSA-N n-ethyl-n-propan-2-ylpropan-2-amine Chemical compound CCN(C(C)C)C(C)C.CCN(C(C)C)C(C)C WOOWBQQQJXZGIE-UHFFFAOYSA-N 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 230000003959 neuroinflammation Effects 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 125000002560 nitrile group Chemical group 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- SJYNFBVQFBRSIB-UHFFFAOYSA-N norbornadiene Chemical compound C1=CC2C=CC1C2 SJYNFBVQFBRSIB-UHFFFAOYSA-N 0.000 description 1
- 230000001473 noxious effect Effects 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- 230000011164 ossification Effects 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- HOMBCMTVOCZMMX-UHFFFAOYSA-N panal Natural products CC1CC(=O)C(C2C=C(CC(O)C12)C(=O)O)C(=C)C=O HOMBCMTVOCZMMX-UHFFFAOYSA-N 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 206010033675 panniculitis Diseases 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 208000035824 paresthesia Diseases 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- VSIIXMUUUJUKCM-UHFFFAOYSA-D pentacalcium;fluoride;triphosphate Chemical compound [F-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O VSIIXMUUUJUKCM-UHFFFAOYSA-D 0.000 description 1
- 208000000689 peptic esophagitis Diseases 0.000 description 1
- 208000022719 perennial allergic rhinitis Diseases 0.000 description 1
- 208000008494 pericarditis Diseases 0.000 description 1
- 230000003836 peripheral circulation Effects 0.000 description 1
- 210000002856 peripheral neuron Anatomy 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 208000001297 phlebitis Diseases 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 208000017983 photosensitivity disease Diseases 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000000587 piperidin-1-yl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 230000001242 postsynaptic effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000003518 presynaptic effect Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 201000007094 prostatitis Diseases 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 208000002815 pulmonary hypertension Diseases 0.000 description 1
- DVUBDHRTVYLIPA-UHFFFAOYSA-N pyrazolo[1,5-a]pyridine Chemical class C1=CC=CN2N=CC=C21 DVUBDHRTVYLIPA-UHFFFAOYSA-N 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000004451 qualitative analysis Methods 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 206010037844 rash Diseases 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000000552 rheumatic effect Effects 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 208000017022 seasonal allergic rhinitis Diseases 0.000 description 1
- 208000008742 seborrheic dermatitis Diseases 0.000 description 1
- 201000001223 septic arthritis Diseases 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 208000025869 skeletal dysplasia-intellectual disability syndrome Diseases 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 230000037380 skin damage Effects 0.000 description 1
- 201000003646 skin sarcoidosis Diseases 0.000 description 1
- UKLNMMHNWFDKNT-UHFFFAOYSA-M sodium chlorite Chemical compound [Na+].[O-]Cl=O UKLNMMHNWFDKNT-UHFFFAOYSA-M 0.000 description 1
- 229960002218 sodium chlorite Drugs 0.000 description 1
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 1
- RNVYQYLELCKWAN-UHFFFAOYSA-N solketal Chemical compound CC1(C)OCC(CO)O1 RNVYQYLELCKWAN-UHFFFAOYSA-N 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 208000003001 spinal tuberculosis Diseases 0.000 description 1
- 208000005801 spondylosis Diseases 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 230000005062 synaptic transmission Effects 0.000 description 1
- 230000008409 synovial inflammation Effects 0.000 description 1
- 201000004595 synovitis Diseases 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
- YSHDPXQDVKNPKA-UHFFFAOYSA-N tert-butyl 2-(benzhydrylideneamino)acetate Chemical compound C=1C=CC=CC=1C(=NCC(=O)OC(C)(C)C)C1=CC=CC=C1 YSHDPXQDVKNPKA-UHFFFAOYSA-N 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 125000000025 triisopropylsilyl group Chemical group C(C)(C)[Si](C(C)C)(C(C)C)* 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 230000005951 type IV hypersensitivity Effects 0.000 description 1
- 208000027930 type IV hypersensitivity disease Diseases 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 208000000143 urethritis Diseases 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 230000003156 vasculitic effect Effects 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 201000001862 viral hepatitis Diseases 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 208000009935 visceral pain Diseases 0.000 description 1
- 208000010484 vulvovaginitis Diseases 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/06—Antigout agents, e.g. antihyperuricemic or uricosuric agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/64—Benzothiazoles with only hydrocarbon or substituted hydrocarbon radicals attached in position 2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/64—Benzothiazoles with only hydrocarbon or substituted hydrocarbon radicals attached in position 2
- C07D277/66—Benzothiazoles with only hydrocarbon or substituted hydrocarbon radicals attached in position 2 with aromatic rings or ring systems directly attached in position 2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/68—Benzothiazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/68—Benzothiazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D277/82—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Pulmonology (AREA)
- Pain & Pain Management (AREA)
- Dermatology (AREA)
- Rheumatology (AREA)
- Psychology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Urology & Nephrology (AREA)
- Psychiatry (AREA)
- Reproductive Health (AREA)
- Vascular Medicine (AREA)
- Transplantation (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Endocrinology (AREA)
- Ophthalmology & Optometry (AREA)
- Otolaryngology (AREA)
- Gastroenterology & Hepatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Epidemiology (AREA)
Description
性皮膚炎、喘息、慢性閉塞性肺疾患、気道過敏症、敗血症性ショック、気管支炎、糸球体腎炎、過敏性腸症候群、皮膚損傷、肺気腫、肢帯型筋ジストロフィー2B型、線維症、滑膜炎、座瘡、膿疱症の症候群、アテローム性動脈硬化、火傷、脊髄損傷、骨化症 骨炎、クローン病、潰瘍性大腸炎、悪性細胞の増殖と転移、骨髄性白血病、糖尿病、外傷、髄膜炎、骨粗鬆症、火傷、虚血性心疾患並びに静脈瘤及び外傷等の末梢炎症性疾患及び自己免疫疾患はすべてP2X7チャンネルの関与が示されている例であるが、これらに限定されるものではない。加えて、最近の報告は、P2RX7と慢性、炎症性及び神経因性疼痛の関係を示唆している(Chessell、I.P.、Hatcher、J.P.ら、Pain、2005、114(3)、386−96)。概して、これらの知見は、神経シナプス伝達過程におけるP2X7受容体の役割、従って神経因性疼痛の新規な治療用ツールとしてのP2X7アンタゴニストの潜在的役割を示している。
1) 本発明は、式(I)の複素環アミド誘導体及びそのような化合物の塩(特に、薬学的に許容される塩)に関する。
nは、1、2又は3を表し;
Xは、−O−又は−CH2−を表し;
R1は、水素、(C1−C2)アルキル又はヒドロキシ−(C1−C2)アルキルを表し;
R2は水素を表し、かつR3はヘテロシクリルを表すか;又はR2とR3は、それらが結合する炭素原子と一緒に、未置換であるか又は1若しくは2個のフルオロにより置換された5〜7員の飽和炭素環を形成し;
R4は、水素、又は、未置換であるか又は1若しくは2個の(C1−C4)アルキル、(C1−C3)フルオロアルキル若しくはハロゲンにより置換されたヘテロアリールを表す。
、Z−又はE−配置で存在してもよい。従って、式(I)の化合物は、立体異性体の混合物として、又は好ましくは純粋な立体異性体として存在してもよい。立体異性体の混合物は当業者に知られた方法で分離してもよい。
1−C3)フルオロアルキル基は、1〜3個の炭素原子を含み、1〜7個の水素原子がフルオロで置き換えられている。
ピリジル、ピリミジル、ピリダジニル及びピラジニルである。好ましい例は、ピリジル(特にピリジン−3−イル)及びピリミジル(特にピリミジン−5−イル)である。6員のヘテロアリール基は、未置換であるか、又は、明示的に定義されたように置換される。未置換であるか又は置換されたヘテロアリール基の好ましい例は、2−クロロ−ピリジン−5−イル、2−トリフルオロメチル−ピリジン−5−イル、2−メチル−ピリミジン−5−イル及び2−トリフルオロメチル−ピリミジン−5−イルである。最も好ましくは、2−クロロ−ピリジン−5−イルである。
nが、1、2又は3を表し;
Xが、−O−又は−CH2−を表し;
R1が、水素、(C1−C2)アルキル又はヒドロキシ−(C1−C2)アルキルを表し;
R2が水素を表し、かつR3が6員のヘテロシクリルを表すか;又はR2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は1若しくは2個のフルオロにより置換された6又は7員の飽和炭素環を形成し;
R4が、水素、又は、未置換であるか又は1若しくは2個の(C1−C4)アルキル、(C1−C3)フルオロアルキル若しくはハロゲンにより置換された6員のヘテロアリール基を表すが;
ただし、R1及びR4の1つは水素ではない;
態様1)に従う化合物及びそのような化合物の塩(特に、薬学的に許容される塩)に関する。
nが、1又は2を表し;
Xが、−O−又は−CH2−を表し;
R1が、水素、メチル又はヒドロキシ−メチルを表し;
R2が水素を表し、かつR3が6員のヘテロシクリルを表すか;又はR2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は1若しくは2個のフルオロにより置換された6又は7員の飽和炭素環を形成し;
R4が、水素、又は、1個のメチル、トリフルオロメチル又はクロロにより置換された6員のヘテロアリール基を表す;
態様1)又は2)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
nが、1又は2を表し;
Xが、−O−又は−CH2−を表し;
R1が、水素を表し;
R2が水素を表し、かつR3がヘテロシクリルを表すか;又は(好ましくは)R2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は1若しくは2個のフルオロにより置換された6又は7員の飽和炭素環を形成し;
R4が、未置換であるか又は1若しくは2個の(C1−C4)アルキル、(C1−C3)フルオロアルキル若しくはハロゲンにより置換されたヘテロアリールを表す;
態様1)に従う化合物及びそのような化合物の塩(特に、薬学的に許容される塩)に関する。
nが、1又は2を表し;
Xが、−O−又は−CH2−を表し;
R1が、水素を表し;
R2が水素を表し、かつR3が6員のヘテロシクリルを表すか;又はR2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は2個のフルオロにより置換された6員の飽和炭素環を形成し;
R4が、未置換であるか又は1個のメチル、トリフルオロメチル若しくはクロロにより置換された6員のヘテロアリール基を表す;
態様1)に従う化合物及びそのような化合物の塩(特に、薬学的に許容される塩)に関する。
nが、1又は2を表し;
Xが、−O−又は−CH2−を表し;
R1が、水素を表し;
R2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は2個のフルオロにより置換された6員の飽和炭素環を形成し;
R4が、1個のクロロにより置換された6員のヘテロアリール基を表す;
態様1)に従う化合物及びそのような化合物の塩(特に、薬学的に許容される塩)に関する。
nが、1、2又は3を表し;
Xが、−O−又は−CH2−を表し;
R1が、(C1−C2)アルキル又はヒドロキシ−(C1−C2)アルキルを表し;
R2とR3が、それらが結合する炭素原子と一緒に、未置換の6又は7員の飽和炭素環を形成し;
R4が、水素を表す;
態様1)に従う化合物及びそのような化合物の塩(特に、薬学的に許容される塩)に関する。
nが、1又は2を表し;
Xが、−O−又は−CH2−を表し;
R1が、メチル又はヒドロキシ−メチルを表し;
R2とR3が、それらが結合する炭素原子と一緒に、未置換の6員の飽和炭素環を形成し;
R4が、水素を表す;
態様1)に従う化合物及びそのような化合物の塩(特に、薬学的に許容される塩)に関する。
nが、1又は2を表す;
態様1)、2)又は7)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
nが、1を表す;
態様1)〜8)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
nが、2を表す;
態様1)〜8)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
Xが、−O−を表す;
態様1)〜11)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
Xが、−CH2−を表す;
態様1)〜11)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
R1が、ヒドロキシ−(C1−C2)アルキルを表す;
態様1)、2)、7)又は9)〜13)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
R2が水素を表し、かつR3がヘテロシクリルを表す;
態様1)、4)又は9)〜14)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
R2が水素を表し、かつR3が6員のヘテロシクリルを表す;
態様1)〜5)又は9)〜14)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
R2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は2個のフルオロにより置換された6員の飽和炭素環を形成する;
態様1)〜6)又は9)〜14)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
R4が、未置換であるか又は1個のメチル、トリフルオロメチル若しくはクロロにより置換された6員のヘテロアリール基を表す;
態様1)〜5)又は9)〜17)のいずれか1つに従う化合物及びそのような化合物の塩(特に薬学的に許容される塩)に関する。
N−(1−シクロヘプチル−2−ヒドロキシエチル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボキサミド;
N−((1−(6−クロロピリジン−3−イル)シクロヘキシル)メチル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボキサミド;
N−(2−(4,4−ジフルオロピペリジン−1−イル)−2−(2−メチルピリミジン−5−イル)エチル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボキサミド;
N−(2−モルフォリノ−2−(6−(トリフルオロメチル)ピリジン−3−イル)エチル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボキサミド;
N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−5,6−ジヒドロ−4H−シクロペンタ[d]チアゾール−6−カルボキサミド;
N−(2−(2−メチルピリミジン−5−イル)−2−モルフォリノエチル)−5,6−ジヒドロ−4H−シクロペンタ[d]チアゾール−6−カルボキサミド;
N−(2−(4,4−ジフルオロピペリジン−1−イル)−2−(2−メチルピリミジン−5−イル)エチル)−5,6−ジヒドロ−4H−シクロペンタ[d]チアゾール−6−カルボキサミド;
N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−6,7−ジヒドロ−5H−ピラノ[2,3−d]チアゾール−7−カルボキサミド;
N−(2−(2−メチルピリミジン−5−イル)−2−モルフォリノエチル)−6,7−ジヒドロ−5H−ピラノ[2,3−d]チアゾール−7−カルボキサミド;
N−(2−(6−クロロピリジン−3−イル)−2−(4,4−ジフルオロピペリジン−1−イル)エチル)−6,7−ジヒドロ−5H−ピラノ[2,3−d]チアゾール−7−カルボキサミド;
N−((R)−1−シクロヘキシルエチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;
N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;
N−((1−(6−クロロピリジン−3−イル)シクロヘキシル)メチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;
N−((1−(6−クロロピリジン−3−イル)−4,4−ジフルオロシクロヘキシル)メチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;
N−(2−モルフォリノ−2−(2−(トリフルオロメチル)ピリミジン−5−イル)エチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−(S)−5,6,7,8−テトラヒドロ−4H−シクロヘプタ[d]チアゾール−8−カルボキサミド;及び
N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−(R)−5,6,7,8−テトラヒドロ−4H−シクロヘプタ[d]チアゾール−8−カルボキサミド;
又はそのような化合物の塩(特に、薬学的に許容される塩)。
ミドであっても、N−((R)−2−モルフォリノ−2−(2−(トリフルオロメチル)ピリミジン−5−イル)エチル)−(R)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミドであっても、又はそれらのいかなる混合物であってもよい。
1、2+1、3+1、3+2+1、4+1、5+1、6+1、7+1、8+1、9+1、9+2+1、9+7+1、10+1、10+2+1、10+3+1、10+3+2+1、10+4+1、10+5+1、10+6+1、10+7+1、10+8+1、11+1、11+2+1、11+3+1、11+3+2+1、11+4+1、11+5+1、11+6+1、11+7+1、11+8+1、12+1、12+2+1、12+3+1、12+3+2+1、12+4+1、12+5+1、12+6+1、12+7+1、12+8+1、12+9+1、12+9+2+1、12+9+7+1、12+10+1、12+10+2+1、12+10+3+1、12+10+3+2+1、12+10+4+1、12+10+5+1、12+10+6+1、12+10+7+1、12+10+8+1、12+11+1、12+11+2+1、12+11+3+1、12+11+3+2+1、12+11+4+1、12+11+5+1、12+11+6+1、12+11+7+1、12+11+8+1、13+1、13+2+1、13+3+1、13+3+2+1、13+4+1、13+5+1、13+6+1、13+7+1、13+8+1、13+9+1、13+9+2+1、13+9+7+1、13+10+1、13+10+2+1、13+10+3+1、13+10+3+2+1、13+10+4+1、13+10+5+1、13+10+6+1、13+10+7+1、13+10+8+1、13+11+1、13+11+2+1、13+11+3+1、13+11+3+2+1、13+11+4+1、13+11+5+1、13+11+6+1、13+11+7+1、13+11+8+1、
14+1、14+2+1、14+7+1、14+9+1、14+9+2+1、14+9+7+1、14+11+1、14+11+2+1、14+11+3+1、14+11+3+2+1、14+11+4+1、14+11+5+1、14+11+6+1、14+11+7+1、14+11+8+1、14+12+1、14+12+2+1、14+12+3+1、14+12+3+2+1、14+12+4+1、14+12+5+1、14+12+6+1、14+12+7+1、14+12+8+1、14+12+9+1、14+12+9+2+1、14+12+9+7+1、14+12+10+1、14+12+10+2+1、14+12+10+3+1、14+12+10+3+2+1、14+12+10+4+1、14+12+10+5+1、14+12+10+6+1、14+12+10+7+1、14+12+10+8+1、14+12+11+1、14+12+11+2+1、14+12+11+3+1、14+12+11+3+2+1、14+12+11+4+1、14+12+11+5+1、14+12+11+6+1、14+12+11+7+1、14+12+11+8+1、14+13+1、14+13+2+1、14+13+3+1、14+13+3+2+1、14+13+4+1、14+13+5+1、14+13+6+1、14+13+7+1、14+13+8+1、14+13+9+1、14+13+9+
2+1、14+13+9+7+1、14+13+10+1、14+13+10+2+1、14+13+10+3+1、14+13+10+3+2+1、14+13+10+4+1、14+13+10+5+1、14+13+10+6+1、14+13+10+7+1、14+13+10+8+1、14+13+11+1、14+13+11+2+1、14+13+11+3+1、14+13+11+3+2+1、14+13+11+4+1、14+13+11+5+1、14+13+11+6+1、14+13+11+7+1、14+13+11+8+1、
15+1、15+4+1、15+9+1、15+9+2+1、15+9+7+1、15+13+1、15+13+2+1、15+13+3+1、15+13+3+2+1、15+13+4+1、15+13+5+1、15+13+6+1、15+13+7+1、15+13+8+1、15+13+9+1、15+13+9+2+1、15+13+9+7+1、15+13+10+1、15+13+10+2+1、15+13+10+3+1、15+13+10+3+2+1、15+13+10+4+1、15+13+10+5+1、15+13+10+6+1、15+13+10+7+1、15+13+10+8+1、15+13+11+1、15+13+11+2+1、15+13+11+3+1、15+13+11+3+2+1、15+13+11+4+1、15+13+11+5+1、15+13+11+6+1、15+13+11+7+1、15+13+11+8+1、
16+1、16+2+1、16+3+1、16+3+2+1、16+4+1、16+5+1、16+9+1、16+9+2+1、16+9+7+1、16+11+1、16+11+2+1、16+11+3+1、16+11+3+2+1、16+11+4+1、16+11+5+1、16+11+6+1、16+11+7+1、16+11+8+1、16+12+1、16+12+2+1、16+12+3+1、16+12+3+2+1、16+12+4+1、16+12+5+1、16+12+6+1、16+12+7+1、16+12+8+1、16+12+9+1、16+12+9+2+1、16+12+9+7+1、16+12+10+1、16+12+10+2+1、16+12+10+3+1、16+12+10+3+2+1、16+12+10+4+1、16+12+10+5+1、16+12+10+6+1、16+12+10+7+1、16+12+10+8+1、16+12+11+1、16+12+11+2+1、16+12+11+3+1、16+12+11+3+2+1、16+12+11+4+1、16+12+11+5+1、16+12+11+6+1、16+12+11+7+1、16+12+11+8+1、16+13+1、16+13+2+1、16+13+3+1、16+13+3+2+1、16+13+4+1、16+13+5+1、16+13+6+1、16+13+7+1、16+13+8+1、16+13+9+1、16+13+9+2+1、16+13+9+7+1、16+13+10+1、16+13+10+2+1、16+13+10+3+1、16+13+10+3+2+1、16+13+10+4+1、16+13+10+5+1、16+13+10+6+1、16+13+10+7+1、16+13+10+8+1、16+13+11+1、16+13+11+2+1、16+13+11+3+1、16+13+11+3+2+1、16+13+11+4+1、16+13+11+5+1、16+13+11+6+1、16+13+11+7+1、16+13+11+8+1、
17+1、17+2+1、17+3+1、17+3+2+1、17+4+1、17+5+1、17+6+1、17+9+1、17+9+2+1、17+9+7+1、17+10+1、17+10+2+1、17+10+3+1、17+10+3+2+1、17+10+4+1、17+10+5+1、17+10+6+1、17+10+7+1、17+10+8+1、17+11+1、17+11+2+1、17+11+3+1、17+11+3+2+1、17+11+4+1、17+11+5+1、17+11+6+1、17+11+7+1、17+11+8+1、17+12+1、17+12+2+1、17+12+3+1、17+12+3+2+1、17+12+4+1、17+12+5+1、17+12+6+1、17+12+7+1、17+12+8+1、17+12+9+1、17+12+9+2+1、17+12+9+7+1、17+12+10+1、17+12+10+2+1、17+12+10+3+1、17+12+10+3+2+1、17+12+10+4
+1、17+12+10+5+1、17+12+10+6+1、17+12+10+7+1、17+12+10+8+1、17+12+11+1、17+12+11+2+1、17+12+11+3+1、17+12+11+3+2+1、17+12+11+4+1、17+12+11+5+1、17+12+11+6+1、17+12+11+7+1、17+12+11+8+1、17+13+1、17+13+2+1、17+13+3+1、17+13+3+2+1、17+13+4+1、17+13+5+1、17+13+6+1、17+13+7+1、17+13+8+1、17+13+9+1、17+13+9+2+1、17+13+9+7+1、17+13+10+1、17+13+10+2+1、17+13+10+3+1、17+13+10+3+2+1、17+13+10+4+1、17+13+10+5+1、17+13+10+6+1、17+13+10+7+1、17+13+10+8+1、17+13+11+1、17+13+11+2+1、17+13+11+3+1、17+13+11+3+2+1、17+13+11+4+1、17+13+11+5+1、17+13+11+6+1、17+13+11+7+1、17+13+11+8+1、
18+1、18+4+1、18+9+1、18+9+2+1、18+9+7+1、18+10+1、18+10+2+1、18+10+3+1、18+10+3+2+1、18+10+4+1、18+10+5+1、18+10+6+1、18+10+7+1、18+10+8+1、18+11+1、18+11+2+1、18+11+3+1、18+11+3+2+1、18+11+4+1、18+11+5+1、18+11+6+1、18+11+7+1、18+11+8+1、18+12+1、18+12+2+1、18+12+3+1、18+12+3+2+1、18+12+4+1、18+12+5+1、18+12+6+1、18+12+7+1、18+12+8+1、18+12+9+1、18+12+9+2+1、18+12+9+7+1、18+12+10+1、18+12+10+2+1、18+12+10+3+1、18+12+10+3+2+1、18+12+10+4+1、18+12+10+5+1、18+12+10+6+1、18+12+10+7+1、18+12+10+8+1、18+12+11+1、18+12+11+2+1、18+12+11+3+1、18+12+11+3+2+1、18+12+11+4+1、18+12+11+5+1、18+12+11+6+1、18+12+11+7+1、18+12+11+8+1、18+13+1、18+13+2+1、18+13+3+1、18+13+3+2+1、18+13+4+1、18+13+5+1、18+13+6+1、18+13+7+1、18+13+8+1、18+13+9+1、18+13+9+2+1、18+13+9+7+1、18+13+10+1、18+13+10+2+1、18+13+10+3+1、18+13+10+3+2+1、18+13+10+4+1、18+13+10+5+1、18+13+10+6+1、18+13+10+7+1、18+13+10+8+1、18+13+11+1、18+13+11+2+1、18+13+11+3+1、18+13+11+3+2+1、18+13+11+4+1、18+13+11+5+1、18+13+11+6+1、18+13+11+7+1、18+13+11+8+1、
18+16+1、18+16+2+1、18+16+3+1、18+16+3+2+1、18+16+4+1、18+16+5+1、18+16+9+1、18+16+9+2+1、18+16+9+7+1、18+16+11+1、18+16+11+2+1、18+16+11+3+1、18+16+11+3+2+1、18+16+11+4+1、18+16+11+5+1、18+16+11+6+1、18+16+11+7+1、18+16+11+8+1、18+16+12+1、18+16+12+2+1、18+16+12+3+1、18+16+12+3+2+1、18+16+12+4+1、18+16+12+5+1、18+16+12+6+1、18+16+12+7+1、18+16+12+8+1、18+16+12+9+1、18+16+12+9+2+1、18+16+12+9+7+1、18+16+12+10+1、18+16+12+10+2+1、18+16+12+10+3+1、18+16+12+10+3+2+1、18+16+12+10+4+1、18+16+12+10+5+1、18+16+12+10+6
+1、18+16+12+10+7+1、18+16+12+10+8+1、18+16+12+11+1、18+16+12+11+2+1、18+16+12+11+3+1、18+16+12+11+3+2+1、18+16+12+11+4+1、18+16+12+11+5+1、18+16+12+11+6+1、18+16+12+11+7+1、18+16+12+11+8+1、18+16+13+1、18+16+13+2+1、18+16+13+3+1、18+16+13+3+2+1、18+16+13+4+1、18+16+13+5+1、18+16+13+6+1、18+16+13+7+1、18+16+13+8+1、18+16+13+9+1、18+16+13+9+2+1、18+16+13+9+7+1、18+16+13+10+1、18+16+13+10+2+1、18+16+13+10+3+1、18+16+13+10+3+2+1、18+16+13+10+4+1、18+16+13+10+5+1、18+16+13+10+6+1、18+16+13+10+7+1、18+16+13+10+8+1、18+16+13+11+1、18+16+13+11+2+1、18+16+13+11+3+1、18+16+13+11+3+2+1、18+16+13+11+4+1、18+16+13+11+5+1、18+16+13+11+6+1、18+16+13+11+7+1、18+16+13+11+8+1、
18+17+1、18+17+2+1、18+17+3+1、18+17+3+2+1、18+17+4+1、18+17+5+1、18+17+6+1、18+17+9+1、18+17+9+2+1、18+17+9+7+1、18+17+10+1、18+17+10+2+1、18+17+10+3+1、18+17+10+3+2+1、18+17+10+4+1、18+17+10+5+1、18+17+10+6+1、18+17+10+7+1、18+17+10+8+1、18+17+11+1、18+17+11+2+1、18+17+11+3+1、18+17+11+3+2+1、18+17+11+4+1、18+17+11+5+1、18+17+11+6+1、18+17+11+7+1、18+17+11+8+1、18+17+12+1、18+17+12+2+1、18+17+12+3+1、18+17+12+3+2+1、18+17+12+4+1、18+17+12+5+1、18+17+12+6+1、18+17+12+7+1、18+17+12+8+1、18+17+12+9+1、18+17+12+9+2+1、18+17+12+9+7+1、18+17+12+10+1、18+17+12+10+2+1、18+17+12+10+3+1、18+17+12+10+3+2+1、18+17+12+10+4+1、18+17+12+10+5+1、18+17+12+10+6+1、18+17+12+10+7+1、18+17+12+10+8+1、18+17+12+11+1、18+17+12+11+2+1、18+17+12+11+3+1、18+17+12+11+3+2+1、18+17+12+11+4+1、18+17+12+11+5+1、18+17+12+11+6+1、18+17+12+11+7+1、18+17+12+11+8+1、18+17+13+1、18+17+13+2+1、18+17+13+3+1、18+17+13+3+2+1、18+17+13+4+1、18+17+13+5+1、18+17+13+6+1、18+17+13+7+1、18+17+13+8+1、18+17+13+9+1、18+17+13+9+2+1、18+17+13+9+7+1、18+17+13+10+1、18+17+13+10+2+1、18+17+13+10+3+1、18+17+13+10+3+2+1、18+17+13+10+4+1、18+17+13+10+5+1、18+17+13+10+6+1、18+17+13+10+7+1、18+17+13+10+8+1、18+17+13+11+1、18+17+13+11+2+1、18+17+13+11+3+1、18+17+13+11+3+2+1、18+17+13+11+4+1、18+17+13+11+5+1、18+17+13+11+6+1、18+17+13+11+7+1、18+17+13+11+8+1、
19+1、19+2+1、19+3+1、19+3+2+1、19+4+1、19+5+1、19+6+1、19+7+1、19+8+1、19+9+1、19+9+2+1、19+9+7+1、19+12+1、19+12+2+1、19+12+3+1、19+1
2+3+2+1、19+12+4+1、19+12+5+1、19+12+6+1、19+12+7+1、19+12+8+1、19+12+9+1、19+12+9+2+1、19+12+9+7+1、19+12+10+1、19+12+10+2+1、19+12+10+3+1、19+12+10+3+2+1、19+12+10+4+1、19+12+10+5+1、19+12+10+6+1、19+12+10+7+1、19+12+10+8+1、19+12+11+1、19+12+11+2+1、19+12+11+3+1、19+12+11+3+2+1、19+12+11+4+1、19+12+11+5+1、19+12+11+6+1、19+12+11+7+1、19+12+11+8+1、19+13+1、19+13+2+1、19+13+3+1、19+13+3+2+1、19+13+4+1、19+13+5+1、19+13+6+1、19+13+7+1、19+13+8+1、19+13+9+1、19+13+9+2+1、19+13+9+7+1、19+13+10+1、19+13+10+2+1、19+13+10+3+1、19+13+10+3+2+1、19+13+10+4+1、19+13+10+5+1、19+13+10+6+1、19+13+10+7+1、19+13+10+8+1、19+13+11+1、19+13+11+2+1、19+13+11+3+1、19+13+11+3+2+1、19+13+11+4+1、19+13+11+5+1、19+13+11+6+1、19+13+11+7+1、19+13+11+8+1、
20+1、20+2+1、20+3+1、20+3+2+1、20+4+1、20+5+1、20+6+1、20+7+1、20+8+1、20+9+1、20+9+2+1、20+9+7+1、20+12+1、20+12+2+1、20+12+3+1、20+12+3+2+1、20+12+4+1、20+12+5+1、20+12+6+1、20+12+7+1、20+12+8+1、20+12+9+1、20+12+9+2+1、20+12+9+7+1、20+12+10+1、20+12+10+2+1、20+12+10+3+1、20+12+10+3+2+1、20+12+10+4+1、20+12+10+5+1、20+12+10+6+1、20+12+10+7+1、20+12+10+8+1、20+12+11+1、20+12+11+2+1、20+12+11+3+1、20+12+11+3+2+1、20+12+11+4+1、20+12+11+5+1、20+12+11+6+1、20+12+11+7+1、20+12+11+8+1、20+13+1、20+13+2+1、20+13+3+1、20+13+3+2+1、20+13+4+1、20+13+5+1、20+13+6+1、20+13+7+1、20+13+8+1、20+13+9+1、20+13+9+2+1、20+13+9+7+1、20+13+10+1、20+13+10+2+1、20+13+10+3+1、20+13+10+3+2+1、20+13+10+4+1、20+13+10+5+1、20+13+10+6+1、20+13+10+7+1、20+13+10+8+1、20+13+11+1、20+13+11+2+1、20+13+11+3+1、20+13+11+3+2+1、20+13+11+4+1、20+13+11+5+1、20+13+11+6+1、20+13+11+7+1、20+13+11+8+1、
21+1、21+7+1、21+19+1、21+19+2+1、21+19+3+1、21+19+3+2+1、21+19+4+1、21+19+5+1、21+19+6+1、21+19+7+1、21+19+8+1、21+19+9+1、21+19+9+2+1、21+19+9+7+1、21+19+12+1、21+19+12+2+1、21+19+12+3+1、21+19+12+3+2+1、21+19+12+4+1、21+19+12+5+1、21+19+12+6+1、21+19+12+7+1、21+19+12+8+1、21+19+12+9+1、21+19+12+9+2+1、21+19+12+9+7+1、21+19+12+10+1、21+19+12+10+2+1、21+19+12+10+3+1、21+19+12+10+3+2+1、21+19+12+10+4+1、21+19+12+10+5+1、21+19+12+10+6+1、21+19+12+10+7+1、21+19+12+10+8+1、
21+19+12+11+1、21+19+12+11+2+1、21+19+12+11+3+1、21+19+12+11+3+2+1、21+19+12+11+4+1、21+19+12+11+5+1、21+19+12+11+6+1、21+19+12+11+7+1、21+19+12+11+8+1、21+19+13+1、21+19+13+2+1、21+19+13+3+1、21+19+13+3+2+1、21+19+13+4+1、21+19+13+5+1、21+19+13+6+1、21+19+13+7+1、21+19+13+8+1、21+19+13+9+1、21+19+13+9+2+1、21+19+13+9+7+1、21+19+13+10+1、21+19+13+10+2+1、21+19+13+10+3+1、21+19+13+10+3+2+1、21+19+13+10+4+1、21+19+13+10+5+1、21+19+13+10+6+1、21+19+13+10+7+1、21+19+13+10+8+1、21+19+13+11+1、21+19+13+11+2+1、21+19+13+11+3+1、21+19+13+11+3+2+1、21+19+13+11+4+1、21+19+13+11+5+1、21+19+13+11+6+1、21+19+13+11+7+1、21+19+13+11+8+1、
21+20+1、21+20+2+1、21+20+3+1、21+20+3+2+1、21+20+4+1、21+20+5+1、21+20+6+1、21+20+7+1、21+20+8+1、21+20+9+1、21+20+9+2+1、21+20+9+7+1、21+20+12+1、21+20+12+2+1、21+20+12+3+1、21+20+12+3+2+1、21+20+12+4+1、21+20+12+5+1、21+20+12+6+1、21+20+12+7+1、21+20+12+8+1、21+20+12+9+1、21+20+12+9+2+1、21+20+12+9+7+1、21+20+12+10+1、21+20+12+10+2+1、21+20+12+10+3+1、21+20+12+10+3+2+1、21+20+12+10+4+1、21+20+12+10+5+1、21+20+12+10+6+1、21+20+12+10+7+1、21+20+12+10+8+1、21+20+12+11+1、21+20+12+11+2+1、21+20+12+11+3+1、21+20+12+11+3+2+1、21+20+12+11+4+1、21+20+12+11+5+1、21+20+12+11+6+1、21+20+12+11+7+1、21+20+12+11+8+1、21+20+13+1、21+20+13+2+1、21+20+13+3+1、21+20+13+3+2+1、21+20+13+4+1、21+20+13+5+1、21+20+13+6+1、21+20+13+7+1、21+20+13+8+1、21+20+13+9+1、21+20+13+9+2+1、21+20+13+9+7+1、21+20+13+10+1、21+20+13+10+2+1、21+20+13+10+3+1、21+20+13+10+3+2+1、21+20+13+10+4+1、21+20+13+10+5+1、21+20+13+10+6+1、21+20+13+10+7+1、21+20+13+10+8+1、21+20+13+11+1、21+20+13+11+2+1、21+20+13+11+3+1、21+20+13+11+3+2+1、21+20+13+11+4+1、21+20+13+11+5+1、21+20+13+11+6+1、21+20+13+11+7+1、21+20+13+11+8+1、及び22+1である;
ここで上記のリストは、以上に開示する態様1)から22)の従属関係に基づき可能とされ、また意図されているさらなる態様についての限定とは解釈されない。上記の表中、数字は上記の番号に応じた態様を意味し、「+」は他の態様への従属関係を表す。種々の態様は読点により個々に分けられている。換言すると、例えば「3+2+1」は、態様3)であって、態様2)に従属し、態様1)に従属することを意味し、すなわち、態様「3+2+1」は、態様2)及び3)の特徴によりさらに限定された態様1)の化合物に相当する。
化合物をも含み、当該同位体標識された化合物は、1又は2以上の原子が、同じ原子番号を有するが、自然において通常見出される原子量と異なる原子量を有する原子によってそれぞれ置き換えられていることを除いては、式(I)の化合物と同一である。同位体標識された、特に2H(デューテリウム)標識された式(I)の化合物、及びその塩は、本発明の範囲に含まれる。水素をより重い同位体2H(デューテリウム)に置換することにより代謝安定性が増大するため、例えば、in−vivoでの半減期が長くなり、あるいは、必要用量を減らすことができ、又は、チトクロームP450酵素の阻害が軽減され得るため、例えば、安全性プロファイルが改善される。本発明の1つの態様においては、式(I)の化合物は同位体標識されていないか、又は、それらは1若しくは2以上のデューテリウム原子によってのみ標識されている。副態様においては、式Iの化合物は全く同位体標識されていない。同位体標識された式Iの化合物は、適切な試薬又は出発物質の適宜な同位体種を用いることを除いては、下記の方法と同様に製造してもよい。
drugs」、Int.J.Pharm.(1986)、33、201−217。
1) 痛みであって、急性疼痛;慢性疼痛;捻挫及び筋挫傷に伴う痛み;慢性関節痛;リウマチ熱に伴う痛み;筋骨格痛;腰部頚部痛;炎症性疼痛;神経因性疼痛;内臓痛;インフルエンザ又は他のウイルス感染症に伴う痛み;癌及び腫瘍浸潤に伴う痛み;関節及び骨痛;非定型顔面痛;偏頭痛に伴う痛み、歯痛及び月経困難;緊張型頭痛及び群発頭痛を含む頭痛;心筋虚血に伴う痛み;機能性腸障害に伴う痛み;交感神経依存性疼痛;筋炎;癌化学療法に伴う痛み;並びに術後痛;を意味する上記痛み;
神経因性疼痛は特に、糖尿病性ニューロパシー、坐骨神経痛、非特異的腰痛、三叉神経痛、多発性硬化症痛、線維筋痛症、HIV関連ニューロパシー、ヘルペス後神経痛、三叉神経痛及び身体外傷、切断、幻肢症候群、脊髄手術、癌、毒素又は慢性炎症性状態により生じる痛みを含む。加えて、神経因性疼痛状態は、「ちくちくした感覚」のような通常は無痛の感覚に伴う痛み(知覚異常および異常感覚)、触れられた際の感受性の増大(知覚過敏)、無害な刺激後の痛みの感覚(動的、静的、熱的又は冷感異痛症)、侵害性刺激に対する感受性の増大(熱、冷、機械刺激に対する痛覚過敏症)、刺激の除去後の痛みの感覚の継続(痛覚過敏)又は選択的感覚経路の不在または欠損(痛覚鈍麻);を含む。
3) 関節リウマチ、骨関節炎、痛風若しくは結晶性関節症;椎間板変性等の関節炎;顎関節変性;骨粗鬆症、ページェット病又は骨壊死等の骨リモデリング疾患;多発性軟骨炎;強皮症;混合結合組織病;脊椎関節症;歯周炎等の歯周病;ベーチェット病;原発性及び続発性シェーグレン症候群;全身性硬化症及び限局性強皮症;全身性エリテマトーデス、混合性結合組織病及び未分化結合組織疾患;皮膚筋炎及び多発性筋炎を含む炎症性筋疾患;リウマチ性多発筋痛症;罹患関節を問わない特発性炎症性関節炎を含む若年性関節炎及び関連症候群並びにリウマチ熱およびその全身性合併症;巨細胞動脈炎、高安動脈炎、チャーグ・ストラウス症候群、結節性多発動脈炎、顕微鏡的多発血管炎並びにウイルス感染、過敏性反応、クリオグロブリン及び異常タンパクに関連する血管炎を含む血管炎;マックル−ウエルズ症候群及び家族性アイルランド熱、菊池病;並びに薬物誘発性関節痛、腱炎及び筋障害;等の骨関節疾患;
4) 慢性閉塞性肺疾患(COPD);嚢胞性線維症;肺気腫;サルコイドーシス;農夫肺及び関連疾患;結核の合併症としての線維症を含む肺線維症;及び気道の炎症及び分
泌症状を伴う慢性咳等の閉塞性気道疾患;
5) 炎症性及び自己免疫性心筋症等の心血管疾患;
6) 網膜に悪影響を与える変性又は炎症性の障害等の眼疾患;
7) 乾癬、火傷、アトピー性皮膚炎、接触性皮膚炎若しくは他の湿疹性皮膚疾患;及び円板状エリテマトーデス等の皮膚疾患;
8) 肝線維症及び肝硬変;胆嚢炎;急性及び慢性の両方の膵臓炎;クローン病;潰瘍性大腸炎を含む大腸炎;及び過敏性腸疾患/症候群等の腹腔及び消化管疾患;
9) 間質性及び糸球体腎炎を含む腎炎;ネフローゼ症候群;並びに急性及び慢性の(間質性)膀胱炎を含む膀胱炎等の泌尿生殖器疾患;並びに
10) 橋本甲状腺炎、グレーブス病、アジソン病、糖尿病、特発性血小板減少性紫斑病、好酸球性筋膜炎、高IgE症候群及び抗リン脂質症候群等のその他の自己免疫性及びアレルギー性障害。
1) 痛みであって、急性疼痛;慢性疼痛;捻挫および筋挫傷に伴う痛み;慢性関節痛;リウマチ熱に伴う痛み;筋骨格痛(好ましい);腰部頚部痛;炎症性疼痛;神経因性疼痛(好ましい);内臓痛;インフルエンザまたは他のウイルス感染症に伴う痛み;癌及び腫瘍浸潤に伴う痛み;関節及び骨痛;非定型顔面痛;偏頭痛に伴う痛み、歯痛及び月経困難;緊張型頭痛および群発頭痛を含む頭痛;心筋虚血に伴う痛み;機能性腸障害に伴う痛み;交感神経依存性疼痛;筋炎;癌化学療法に伴う痛み;及び術後痛を意味する上記痛み;
神経因性疼痛は、特に糖尿病性ニューロパシー、坐骨神経痛、非特異的腰痛、三叉神経痛、多発性硬化症痛、線維筋痛症、HIV関連ニューロパシー、ヘルペス後神経痛、三叉神経痛及び身体外傷、切断、幻肢症候群、脊髄手術、癌、毒素又は慢性炎症性状態により生じる痛みを含む。加えて、「ちくちくした感覚」のような通常は無痛の感覚に伴う痛み(知覚異常および異常感覚)、触れられた際の感受性の増大(知覚過敏)、無害な刺激後の痛みの感覚(動的、静的、熱的または冷感異痛症)、侵害性刺激に対する感受性の増大(熱、冷、機械刺激に対する痛覚過敏症)、刺激の除去後の痛みの感覚の継続(痛覚過敏)又は選択的感覚経路の不在または欠損(痛覚鈍麻)を含む神経因性疼痛状態;
特に関節リウマチ、骨関節炎、リウマチ性脊椎炎、痛風性関節炎及び若年性関節炎を含む慢性関節痛;
特に非潰瘍性胃腸障害、非心臓性胸痛及び過敏性腸症候群を含む機能性腸障害に伴う痛み;
2) 関節リウマチ及び骨関節炎;
3) 慢性閉塞性肺疾患(COPD);及び
4) クローン病。
れる塩は、医薬として、たとえば(特に経口等の)経腸又は(局所的適用又は吸入を含む)非経口投与用の医薬組成物の形態で使用することができる。
、そのような保護基が必要に応じて導入されているものと仮定する。
式(I)の化合物は、EDC.HCl/HOBt、SiliaBond(登録商標)、カルボジイミド/HOAt、HATU/HOAt又はPyBOP等の標準的なアミドカップリング試薬及びDIPEA等の塩基を用い、DCM、THF又はDMF等の溶媒中、好ましくはRTから45℃の間の温度にて、カルボン酸(II)をアミン(III)と反応させることにより製造することができる(スキーム1)。
温度にて、NBS等の求電子臭素源を用いた、得られるシリルエノールエーテルのブロモ化によって、対応するシクロアルカ−2−エノン(VIII)からα−ブロモケトン(IX)を生成させることにより、製造することができる(スキーム3)。アミノチアゾール(X)は、ジオキサン等の溶媒中、60℃から100℃の間の温度にて、対応するα−ブロモケトン(IX)のチオ尿素との縮合により製造される。式(X)のアミノチアゾールは、THF中、60℃から80℃の間の温度にて、tBu−亜硝酸を用いてジアゾ化することができ、対応するチアゾールを与える。濃HCl水溶液を用いて、60℃から100℃の間の温度にて、ニトリル基を加水分解することにより、カルボン酸(IIa)を生成する。
下、ジオキサン等の適宜な溶媒中、式Br−R4のブロモヘテロアレーンで処理することによるシアノ酢酸メチルのヘテロアリール化、及び(ii) 続けて、DMSO/水等の適宜な溶媒混合物中、140℃付近の温度にて、LiCl等の適宜な塩で処理することによる、単離したヘテロアリールシアノ酢酸メチル中間体の脱カルボキシル化。
びアンモニアメタノール等の適宜な溶媒の存在下、RT付近の温度にて、あるいは、THF等の適宜な溶媒中、70℃付近の温度にて、BH3THF錯体などの適宜な還元剤により、水素化条件下、式(XXV)のニトリルを還元することにより製造することができる。
適宜な溶媒中、0℃からRTの間の温度にて、R9がヒドロキシを表し、R10が水素を表す式(XXX)のアミンをBoc−無水物(又はZ−Cl、他の場合)で処理することにより製造することができる。得られる化合物は、DCM等の適宜な溶媒中、RT付近の温度にて、例えばDMPを用いて酸化することにより、R11がtBu又はMeを表し、R12がBoc又はZを表す式(XXXII)のケトンを与える。
(この項において、及び明細書の上記の部分において使用される)略語:
Ac アセチル
anh. 無水物
aq. 水溶液
Boc tert−ブトキシカルボニル
nBu n−ブチル
tBu tert−ブチル
CC カラムクロマトグラフィー
cod 1,5−シクロオクタジエン
conc. 濃縮した
comb. 合わせた
DAST ジエチルアミノ硫黄トリフルオリド
dba ジベンジリデンアセトン
DCM ジクロロメタン
DHP 3,4−ジヒドロ−2H−ピラン
DIPA ジイソプロピルアミン
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
DMP Dess−Martinペルヨージナン
DMSO ジメチルスルフォキシド
dppf 1,1’−ビス(ジフェニルホスフィノ)フェロセン
Et エチル
EDC.HCl N−(3−ジメチルアミノプロピル)−N’−
エチルカルボジイミド塩酸塩
h 時間
HATU O−(7−アザベンゾトリアゾール−1−イル)−
N,N,N’,N’−
テトラメチルウロニウムヘキサフルオロホスフェート
Hept ヘプタン
HOAT 1−ヒドロキシ−7−アザ−ベンゾトリアゾール
HOBT 1−ヒドロキシベンゾトリアゾール水和物
HV 高真空
LC−MS 液体クロマトグラフィー−質量分析
LDA リチウムジイソプロピルアミド
M モル濃度
Me メチル
MeCN アセトニトリル
min 分
NBS N−ブロモスクシンイミド
NMR 核磁気共鳴
org. 有機
PPTS ピリジニウム−p−トルエンスルフォネート
PTSA p−トルエンスルホン酸
PyBOP (ベンゾトリアゾール−1−イルオキシ)
トリピロリジノホスフォニウムヘキサフルオロ−
ホスフェート
RT 室温
sat. 飽和
soln. 溶液
TBAF テトラ−n−ブチルアンモニウムフルオリド
TBS tert−ブチルジメチルシリル
Tf トリフルオロメタンスルホニル
TFA トリフルオロ酢酸
THF テトラヒドロフラン
THP テトラヒドロピラン
TIPS トリイソプロピルシリル
TMS トリメチルシリル
tR 保持時間
UV 紫外線
Vis 可視
Z ベンジルオキシカルボニル
核磁気共鳴:
Brucker Avance 400、400MHz;化学シフトは、使用する溶媒に対するppmで示す;多重度:s=一重項、d=二重項、t=三重項、q=四重項、m=多重項、br=広域、結合定数はHzで示す。
HPLC−MS分析は、Dionex Ultimate HPG−3000ポンプ及びDionex Ultimate 3000光ダイオードアレイ検出器を備えたThermo MSQ質量分光計上で行った。
ラム:Ascentis Express C18、2.7um、2.1x50mm。
分取用LC−MS法:
分取用HPLC/MS精製は、binary gradient module(2545)、HPLCポンプ(515)、光ダイオードアレイ検出器(2998)及び質量検出器(3100)を備えたWatersシステム上で行った。
OBD(登録商標)、19x50mm。
333/334ポンプ、Dionex MSQ Plus検出器システム及びDionex UVD340U(又はDionex DAD−3000)UV検出器を備えたGilson HPLCシステム上で行った。
A.1 カルボン酸誘導体(II)の合成
A.1.1. 4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボン酸の合成
A.1.1.1. メチル 2−ブロモ−3−オキソシクロヘキサンカルボキシレートNBS(9.08g、51.0mmol)を、メチル シクロヘキサ−2−エンカルボキシレート(5.96g、42.5mmol)[Bioorg.Med.Chem.1999、7、1505−1511]をTHF/H2O(500mL、9:1)中に溶解したものに、0℃にて添加した。混合物をRTまで温まるようにし、そして2h撹拌した。次いで、飽和Na2S2O3水溶液及び飽和NaHCO3水溶液を添加し、そして混合物を真空濃縮した。残渣をEtOAcと飽和NaHCO3水溶液の間で分画した。有機層を飽和NaHCO3水溶液及び塩水(brine)で複数回洗浄し、MgSO4上で乾燥し、そして真空濃縮した。
0℃にて、細かく砕いたP4S10(9.35g、21.0mmol)を、ホルムアミド(4.73g、105.0mmol)のジオキサン(28.5mL)中の混合物に添加した。次いで、混合物を封止したバイアル内で100℃にて1.5h撹拌し、RTに冷却し、ろ過した。ろ液を、メチル 2−ブロモ−3−オキソシクロヘキサンカルボキシレート(2.06g、8.76mmol)のジオキサン(16.5mL)中の混合物に添加し、封止したバイアル内で80℃にて一晩攪拌した。混合物を、飽和NaHCO3水溶液の添加によりクェンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。CC(EtOAc/Hept 10〜40%)により精製して、黄色のオイルを得た。LC−MS(3):tR=0.47min;[M+H]+:198.16。
メチル 4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキシレート(1.22g、6.11mmol)及びLiOH.H2O(0.39g、9.17mmol)をTHF/MeOH/H2O(60mL、3:1:1)中に混合したものを、RTにて75min撹拌した。混合物をpH=3に酸性化し、DCMで抽出した。有機層を合わせたものをMgSO4上で乾燥し、そして真空濃縮して、黄色の固体を得た。LC−MS(3):tR=0.32min;[M+H]+:184.21。
A.1.2.1. 2−ブロモ−3−オキソシクロペンタンカルボニトリル
ビシクロ[2.2.1]ヘプタ−2,5−ジエン(0.84g、9.14mmol)、次いで、Gd(OTf)3(1.84g、3.05mmol)、2−シクロペンテン−1−オン(5.00g、60.9mmol)及びTMS−CN(9.25g、91.4mmol)を、Ni(cod)2(0.84g、3.04mmol)をTHF(160mL)中に溶解した脱気溶液に添加し、混合物をRTにて4h撹拌した。次いで、混合物を固体NaHCO3及び飽和NaHCO3水溶液でクエンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、そして真空濃縮した。残渣の黄色のオイルをTHF/H2O(450mL、9:1)中に溶解した。0℃にて、NBS(11.98g、67.3mmol)を添加し、そして混合物を0℃にて30min撹拌した。次いで、混合物を飽和Na2SO3水溶液でクエンチし、EtOAcで抽出した。有機層を合わせたものを5%NaHCO3水溶液及び塩水で洗浄し、Na2SO4上で乾燥し、真空濃縮した。残渣をEtOAc中に再溶解し、複数回5%NaHCO3水溶液及び塩水で洗浄し、有機層を合わせたものをNa2SO4上で乾燥し、真空濃縮して、茶色の液
体を得た。1H−NMR(CDCl3)δ:4.42(d、J=7.7Hz、0.5H)、4.34(d、J=5.8Hz、0.5H)、3.43−3.40(m、0.5H)、3.33−3.28(m、0.5H)、2.72−2.26(m、4H)。
2−ブロモ−3−オキソシクロペンタンカルボニトリル(A.1.2.1.からの粗製物;約13g)及びチオ尿素(13.77g、181mmol)をジオキサン(600mL)中に混合したものを、80℃にて1h撹拌した。混合物をRTに冷却し、飽和NaHCO3水溶液でクェンチし、そしてEtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、そして真空濃縮した。CC(MeOH(0.5% Et3N)/DCM 2〜20%)により精製して、茶色の固体を得た。LC−MS(3):tR=0.19min;[M+H]+:166.06。
2−アミノ−5,6−ジヒドロ−4H−シクロペンタ[d]チアゾール−6−カルボニトリル(1.00g、6.05mmol)をTHF(54mL)中に溶解したものに、亜硝酸tert−ブチル(1.04g、9.08mmol)を添加し、混合物を65℃にて3h撹拌した。次いで、混合物を、飽和NaHCO3水溶液でクエンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。CC(EtOAc/Hept 10〜80%)により精製して、黄色のオイルを得た。LC−MS(4):tR=0.52min;[M+H]+:151.13。
5,6−ジヒドロ−4H−シクロペンタ[d]チアゾール−6−カルボニトリル(265mg、1.59mmol)を濃HCl水溶液中に溶解したものを、90℃にて45min密封した管内で撹拌した。混合物をpH=3に調整し、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮して、黄色のオイルを得た。LC−MS(3):tR=0.33min;[M+H]+:170.03。
A.1.3.1. 2−アミノ−5,6,7,8−テトラヒドロ−4H−シクロヘプタ[d]チアゾール−8−カルボニトリル
ビシクロ[2.2.1]ヘプタ−2,5−ジエン(0.50g、5.45mmol)、次いで、Gd(OTf)3(1.10g、1.82mmol)、2−シクロヘプテン−1−オン(5.00g、36.3mmol)及びTMS−CN(5.51g、54.5mmol)を、Ni(cod)2(0.50g、1.82mmol)をTHF(100mL)中に溶解した脱気溶液に添加し、混合物をRTにて4h撹拌した。次いで、混合物を固体NaHCO3及び飽和NaHCO3水溶液でクエンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。
残渣をEtOAc/Hept(1:1)を溶出液として、SiO2プラグ上でろ過した。
2−アミノ−5,6,7,8−テトラヒドロ−4H−シクロヘプタ[d]チアゾール−8−カルボニトリル(1.00g、5.17mmol)をTHF(4mL)中に溶解したものに、亜硝酸tert−ブチル(0.65g、5.68mmol)を添加し、混合物を65℃にて2.5h撹拌した。次いで、混合物を、飽和NaHCO3水溶液でクエンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、そして真空濃縮した。CC(EtOAc/Hept 2〜40%)、CC(MeOH/DCM 0〜1.5%)及び分取用(prep.)HPLC(E)により精製して、黄色のオイルを得た。LC−MS(3):tR=0.51min;[M+H]+:179.23。
5,6,7,8−テトラヒドロ−4H−シクロヘプタ[d]チアゾール−8−カルボニトリル(151mg、0.84mmol)を濃HCl水溶液(2mL)中に溶解したものを、90℃にて1h密封した管内で撹拌した。混合物をpH=3に調整し、そしてEtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮して、ベージュ色の固体を得た。LC−MS(3):tR=0.36min;[M+H]+:198.20。
A.1.4.1. 3−((tert−ブチルジメチルシリル)オキシ)−1−(2,4−ジクロロチアゾール−5−イル)プロパン−1−オール
n−BuLiをヘキサン中に溶解したもの(2.3M、10.9mL、25.0mmol)を、−20℃にて、DIPA(3.5mL、25.0mmol)をTHF(102mL)中に溶解したものに添加した。溶液を−20℃にて30min撹拌し、次いで、それを−78℃に冷却し、2,4−ジクロロチアゾール(3.50g、22.7mmol)をTHF(16mL)中に溶解したものを添加した。混合物を−78℃にて30min撹拌し、次いで、3−[(tert−ブチルジメチルシリル)オキシ]−1−プロパナール(4.51g、22.7mmol)を添加し、混合物を−78℃にて1h撹拌した。次いで、混合物を飽和NH4Cl水溶液でクエンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。CC(EtOAc/Hept 2〜15%)により精製して、黄色のオイルを得た。LC−MS(3):tR=1.08min;[M+H]+:342.08。
3−((tert−ブチルジメチルシリル)オキシ)−1−(2,4−ジクロロチアゾー
ル−5−イル)プロパン−1−オール(6.62g、19.3mmol)、3,4−ジヒドロ−2H−ピラン(8.9mL、96.7mmol)及びPPTS(0.49g、1.93mmol)をDCM(75mL)中に溶解したものを、還流下、2h撹拌した。次いで、揮発物を真空除去し、残渣をCC(EtOAc/Hept 1〜10%)により精製して、生成物を異性体の混合物の無色のオイルとして得た。LC−MS(3):tR=1.27min;1.28min;[M+H]+:426.11;426.10。
n−BuLiをヘキサン中に溶解したもの(2.2M、9.6mL、21.0mmol)を、−78℃にて、5−(3−((tert−ブチルジメチルシリル)オキシ)−1−((テトラヒドロ−2H−ピラン−2−イル)オキシ)プロピル)−2,4−ジクロロチアゾール(6.89g、16.2mmol)をTHF(125mL)中に溶解したものに添加した。混合物を−78℃にて45min撹拌し、次いで、飽和NaHCO3水溶液の添加によりクェンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、そして真空濃縮した。CC(EtOAc/Hept 2〜20%)により精製して、生成物を異性体の混合物の黄色のオイルとして得た。LC−MS(3):tR=1.15min;1.16min;[M+H]+:392.17;392.17。
TBAFをTHF中に溶解したもの(1M、19.2mL、19.2mmol)を、0℃にて、5−(3−((tert−ブチルジメチルシリル)オキシ)−1−((テトラヒドロ−2H−ピラン−2−イル)オキシ)プロピル)−4−クロロチアゾール(6.27g、16.0mmol)をTHF(80mL)中に溶解したものに添加し、混合物をRTまで温まるようにし、そして一晩撹拌した。次いで、混合物を飽和NaHCO3水溶液の添加によりクェンチし、そしてEtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、そして真空濃縮した。CC(EtOAc/Hept 20〜85%)により精製して、生成物を異性体の混合物の黄色のオイルとして得た。LC−MS(3):tR=0.55min;0.57min;[M+H]+:278.11;278.10。
3−(4−クロロチアゾール−5−イル)−3−((テトラヒドロ−2H−ピラン−2−イル)オキシ)プロパン−1−オール(520mg、1.87mmol)をMePh(10mL)中に溶解したものを、Pd(OAc)2(63mg、0.28mmol)、2−(ジ−tert−ブチルホスフィノ)−1,1’−ビナフチル(140mg、0.35mmol)及びCs2CO3(915mg、2.81mmol)を仕込んだArで満たしたバイアルに添加した。バイアルを密封し、予熱したオイルバス(100℃)に一晩置いた。次いで、混合物をDCMで希釈し、セライト上でろ過し、真空濃縮した。CC(EtOAc/Hept 20〜80%)により精製して、生成物を異性体の混合物の黄色のオイルとして得た。LC−MS(3):tR=0.60min;0.64min;[M+H]+:241.94;241.94。
7−((テトラヒドロ−2H−ピラン−2−イル)オキシ)−6,7−ジヒドロ−5H−
ピラノ[2,3−d]チアゾール(895mg、3.71mmol)とPTSA(141mg、0.74mmol)をTHF/H2O(7.4mL、1:1)中に溶解したものを、RTにて一晩撹拌した。混合物をDCMで希釈し、Na2SO4上で乾燥し、真空濃縮した。CC(EtOAc/Hept 40〜100%)により精製して、黄色のオイルを得た。LC−MS(3):tR=0.23min;[M+H]+:158.15。
6,7−ジヒドロ−5H−ピラノ[2,3−d]チアゾール−7−オール(0.65g、4.14mmol)、アセトンシアノヒドリン(880mg、10.3mmol)及び(n−Bu)3P(1.67g、8.27mmol)をTHF(79mL)中に混合したものに、0℃にて1,1’−(アゾジカルボニル)ジピペリジン(2.09g、8.27mmol)を添加した。混合物を0℃にて30min撹拌し、次いで、それをRTまで温まるようにし、2h撹拌した。次いで、反応混合物をジイソプロピルエーテルで希釈し、ろ過し、ろ液を真空濃縮した。CC(EtOAc/Hept 5〜70%)により精製して、黄色の固体を得た。LC−MS(3):tR=0.36min;[M+H]+:167.13。
6,7−ジヒドロ−5H−ピラノ[2,3−d]チアゾール−7−カルボニトリル(462mg、2.78mmol)をHCl水溶液(32%、13.9mL)中に溶解したものを、60℃にて30min撹拌した。氷浴による冷却下、混合物のpHを約3に調整し、混合物をEtOAcで抽出した。有機層を合わせたものをMgSO4上で乾燥し、真空濃縮して、ベージュ色の固体を得た。LC−MS(3):tR=0.33min;[M+H]+:186.18.
A.1.5. 5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボン酸の合成
A.1.5.1. 4−((2,2−ジメチル−1,3−ジオキソラン−4−イル)メトキシ)チアゾール
NaH(鉱油中60%分散液、12.19g、305.3mmol)を、DL−1,2−イソプロピリデングリセロール(16.11g、1218mmol)に少しずつ添加し、そして混合物をガスの発生が止むまで撹拌した(RTにて約30min、次いで、60℃にて2h)。次いで、4−ブロモチアゾール(20.00g、121.9mmol)を添加し、混合物を140℃にて45min撹拌した。次いで、反応混合物を飽和NH4Cl水溶液でクエンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。残渣を蒸留に供して、揮発物を(HV、60℃)除去した。残渣をCC(EtOAc/Hept 5〜40%)により精製して、黄色のオイルを得た。LC−MS(3):tR=0.52min;[M+H]+:216.20。
NBS(11.94g、67.1mmol)を、4−((2,2−ジメチル−1,3−ジオキソラン−4−イル)メトキシ)チアゾール(13.75g、63.9mmol)をMeCN(320mL)中に溶解したものに、0℃にて、90minかけて加えた。混合物をさらに0℃にて30min撹拌し、次いで、それを5%NaHCO3水溶液の添加によりクェンチし、EtOAcで抽出した。有機層を合わせたものを5%NaHCO3水溶液及び塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。LC−MS(3):tR=0.74min;[M+H]+:294.13。
n−BuLiをヘキサン中に溶解したもの(2.18M、16.7mL、36.4mmol)を、−78℃にて、5−ブロモ−4−(オキシラン−2−イルメトキシ)チアゾール(7.17g、30.4mmol)をTHF(564mL)中に溶解したものに30minかけて加えた。混合物を−78℃にて2h撹拌し、次いで、TIPSCl(6.63mL、31.0mmol)を添加し、混合物をRTまで温まるようにし、RTにて30min撹拌した。次いで、混合物を、−78℃に冷却し、−BuLiをヘキサン中に溶解したもの(2.18M、13.9mL、30.4mmol)で処理した。混合物を0℃にて2h撹拌し、次いで、それを飽和NaHCO3水溶液でクエンチし、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、そして真空濃縮した。残渣をCC(EtOAc/Hept 5〜50%)により精製して、黄色のオイルを得た。LC−MS(3):tR=1.01min;[M+H]+:314.13。
(2−(トリイソプロピルシリル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−イル)メタノール(1.77g、5.64mmol))をDCM(56mL)中に溶解したものを、0℃にてDMP(2.87g、6.77mmol)で少しずつ1時間かけて処理した。混合物を0℃にて2h撹拌し、次いで、それをRTまで温まるようにし、そして2h撹拌した。次いで、混合物を、飽和Na2S2O3水溶液及び飽和NaHCO3水溶液でクエンチし、そしてDCMで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、そして真空濃縮した。残渣をtert−BuOH(16mL)及び2−メチル−2−ブテン(4mL)中に溶解し、0℃にて、NaH2PO4(2.64g、16.9mmol)とNaClO2(0.96g、8.46mmol)をH2O(5mL)中に溶解したものを30minかけて滴下して処理した。混合物をRTにて45min撹拌し、次いで、揮発物を真空除去し、残渣をH2Oで希釈し、EtOAcで抽出した。有機層を合わせたものをMgSO4上で乾燥し、真空濃縮した。LC−MS(3):tR=0.99min;[M+H]+:328.24。
TBAFをTHF中に溶解したもの(1M、4.9mL、4.90mmol)を、0℃にて、2−(トリイソプロピルシリル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボン酸(1.62mg、4.90mmol)をTHF(25mL)中に溶解したものに添加した。混合物を0℃にて30min撹拌し、AcOH(0.42mL、7.35mmol)を添加し、揮発物を真空除去した。残渣を分取用(prep.)HPLC(G)により精製して、無色の固体を得た。LC−MS(3):tR=0.30min;[M+H]+:172.05。
A.2.1. 2−アミノ−2−シクロヘプチルエタノールの合成
A.2.1.1. 2−アミノ−2−シクロヘプチル酢酸 tert−ブチルエステルの合成
N−(ジフェニルメチレン)グリセリン tert−ブチルエステル(6.83mmol)と(R)−4,4−ジブチル−2,6−ビス(3,4,5−トリフルオロフェニル)−4,5−ジヒドロ−3H−ジナフトール[7,6,1,2−cde]アゼピニウム ブロミド(6.84μmol)を、45mLのトルエン中に溶解したものに、シクロヘプチル
ブロミド(8.2mmol)とCsOH H2O(34.2mmol)を−10℃にて順番に添加した。反応混合物を、−10℃にて10min、次いでRTにて4日間撹拌した。さらなる(R)−4,4−ジブチル−2,6−ビス(3,4,5−トリフルオロフェニル)−4,5−ジヒドロ−3H−ジナフトール[7,6,1,2−cde]アゼピニウム ブロミド(6.84μmol)を添加し、撹拌をRTにてさらに24h続けた。反応を水でクェンチし、DCMで3回抽出した。有機層を合わせたものを濃縮し、残渣を100mLのTHF中に再溶解した。100mLの0.5Mクエン酸水溶液を添加し、混合物をRTにて4h撹拌した。混合物を体積が半量になるまで濃縮し、Et2Oで2回抽出した。水層を固体NaHCO3で塩基性化し、DCMで3回抽出した。有機層を合わせたものをMgSO4上で乾燥し、真空濃縮して、所望の生成物を黄色のオイルとして得た。LC−MS(3):tR=0.61min;[M+H]+:228.29。
3.43mLのLiAlH4(THF中1M)を8mLのTHF中に溶解したものに、2−アミノ−2−シクロヘプチル酢酸 tert−ブチルエステル(1.72mmol)を3mLのTHF中に溶解したものを、0℃にて添加した。氷浴を除き、撹拌をRTにて1h続けた。反応混合物を0℃に冷却し、水と1M NaOH溶液でクェンチし、セライトのパッド上でろ過し、EtOAcで洗浄した。ろ液を1M NaOH溶液でpH8−9に塩基性化し、次いで、EtOAcで3回抽出した。有機層を合わせたものをMgSO4上で乾燥し、真空濃縮して、粗製生成物を黄色のオイルとして得た。粗製物を3mLのEt2O中に溶解し、HClの4Mジオキサン溶液を0℃にて滴下した。得られた沈殿物をろ過により分離し、真空乾燥して、対応するHCl塩を黄色の固体として得た。LC−MS(3):tR=0.39min;[M+H]+:158.14。
A.2.2.1. 1−(6−クロロピリジン−3−イル)シクロヘキサンカルボニトリルの合成
2−(6−クロロピリジン−3−イル)アセトニトリル(26.2mmol)と1,5−ジブロモペンタン(26.2mmol)をTHF/DMSO(1:1、300mL)中に混合したものに、NaH(鉱物油中60%、55.1mmol)を、0℃にて45minに渡って少しずつ添加した。混合物をRTまで温まるようにし、1h45min撹拌した。反応混合物を水中に注ぎ、そしてDCMで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。残渣をCC(EtOAc/Hept 10
〜80%)により精製して、無色の固体を得た。LC−MS(3):tR=0.78min;[M+H]+:221.20。
1−(6−クロロピリジン−3−イル)シクロヘキサンカルボニトリル(20.1mmol)をTHF(88mL)中に溶解したものを、BH3をTHF中に溶解したもの(60.2mmol、1M)に滴下した。還流しながら1h加熱した後、反応混合物を氷浴中で冷却し、2M HCl(120mL)溶液をゆっくりと添加した。次いで、混合物をさらに20min加熱還流した。RTに冷却した後、混合物をDCMで洗浄し、次いで、それを1M NaOH水溶液で塩基性化し、DCMで抽出した。合わせた有機層をMgSO4上で乾燥し、そして真空濃縮した。LC−MS(3):tR=0.47min;[M+H]+:225.27。
A.2.3.1. メチル 5−(6−クロロピリジン−3−イル)−5−シアノ−2−ヒドロキシシクロヘキサ−1−エンカルボキシレートの合成
2−(6−クロロ−3−ピリジニル)アセトニトリル(13.1mmol)を35mLのTHF中に溶解したものに、アクリル酸メチル(26.2mmol)及びKOtBu(15.7mmol)を添加した。反応混合物をRTにて1h撹拌した。混合物を1M HCl水溶液で酸性化し、次いで、DCMで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。残渣をCC(EtOAc/Hept 10〜50%)で精製し、白色の固体を得た。LC−MS(3):tR=0.74min;[M+CH3CN+H]+:334.03。
メチル 5−(6−クロロピリジン−3−イル)−5−シアノ−2−ヒドロキシシクロヘキサ−1−エンカルボキシレート(10.6mmol)とLiCl(21.1mmol)を、15mLの含水DMSO中に混合したものを、マイクロ波条件下にて、120℃に2h加熱した。反応混合物を水で希釈し、EtOAcで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。残渣をCC(EtOAc/Hept 5〜20%)で精製し、黄色の固体を得た。LC−MS(3):tR=0.56min;[M+CH3CN+H]+:276.12。
1−(6−クロロピリジン−3−イル)−4−オキソシクロヘキサンカルボニトリル(3.89mmol)を4mLのDCM中に溶解したものを、−78℃に冷却し、(ジエチルアミノ)硫黄トリフルオリド(7.78mmol)を滴下し、混合物を24h撹拌して、ゆっくりとRTに達するようにした。反応混合物を氷冷下にて、飽和NaHCO3水溶液でクェンチし、DCMで希釈した。有機相を塩水で洗浄し、MgSO4上で乾燥し、真空濃縮した。残渣をCC(EtOAc/Hept 10〜50%)で精製し、ベージュ色の固体を得た。LC−MS(3):tR=0.74min;[M+CH3CN+H]+:298.00。
1−(6−クロロピリジン−3−イル)−4,4−ジフルオロシクロヘキサンカルボニト
リル(2.02mmol)を20mLのTHF中に溶解したものを、BH3をTHF中に溶解したもの(6.07mmol、1M)に添加した。還流しながら1h加熱した後、反応混合物を氷浴中で冷却し、2N HCl溶液をゆっくりと添加した。次いで、混合物をさらに20min加熱還流した。反応混合物をDCMで洗浄し、1M NaOH水溶液で塩基性化し、DCMで抽出した。有機層を合わせたものを塩水で洗浄し、MgSO4上で乾燥し、真空濃縮して、黄色のオイルを得た。LC−MS(3):tR=0.46min;[M+CH3CN+H]+:302.03。
A.2.4.1. Strecker反応(一般的手順I)
対応するアルデヒド(24.6mmol)を無水Et2O(8mL)中に懸濁したものに、TMSCN(27mmol)、次いで、ZnI2(1.23mmol)をRTにてゆっくりと添加した。混合物を0℃に冷却し、対応するアミン(24.6mmol)を無水MeOH(20mL)中に溶解したものを(アミンがHCl塩である場合には、24.6mmolのTEAをさらに添加した。)滴下した。混合物を70℃にて1〜6h加熱し、次いでRTに冷却した。それを10%Na2CO3水溶液でクエンチし、EtOAcで3回抽出した。有機相を合わせたものをMgSO4上で乾燥し、真空濃縮した。粗製物をCC(KP−NH(登録商標)製Biotage)で精製して、α−アミノ−ニトリル(下記の表を参照。)として単離した。
上記工程にて得たα−アミノ−ニトリル(4.38mmol)を7M NH3のMeOH溶液(32mL)中に溶解したものに、4%チオフェンのジイソプロピルエーテル溶液(0.16mL)とActimet M ラネーニッケルを0℃にて添加した。混合物をRTまで温まるようにし、そして水素雰囲気下にて、30h撹拌した。それをセライト上でろ過し、MeOHで洗浄し、真空濃縮した。任意で、Et2O(8.8mL)中に溶解し、0℃にて4M HClのジオキサン溶液(4.4mL)を添加し、形成された固体をろ過することにより、アミンをその塩酸塩に変換した。
B.1. 式(I)の化合物の合成(一般的方法)
それぞれのカルボン酸(II)(0.30mmol)、それぞれのアミン(III)(0.36mmol)、HOBt(0.45mmol)、EDC.HCl(0.45mmol)及びDIPEA(0.90mmol)をDMF(1.2mL)中に混合したものを、RTにて一晩撹拌した。混合物をろ過し、ろ液を前述の精製法で精製し、所望のアミド(I)を得た。
A. in vitro試験
式(I)の化合物のP2X7受容体アンタゴニスト活性を、以下の実験方法に従って測定する。
細胞株の樹立及びYO−PRO試験
概して細胞株の樹立は、確立された分子クローニングプロトコルに従って行った。具体的には、Qiagen RNeasy kit(Qiagen、CH)を製造業者の取り扱い説明書に従って用いて、RNAをヒト全血から抽出した。続いてcDNAを作成し(Superscript II、Invitrogen AG、CH)、ヒトP2X7遺伝子(genbank ref. BC011913)を下記のプライマーを用いて増幅した:
ATCGCGGCCGCTCAGTAAGGACTCTTGAAGCCACT及びCGCCGCTAGCACCACCATGCCGGCCTGCTGCAGCTGCA。次に、増幅したシークエンスをpcDNA3.1(+)NotI、NheI消化(digested)プラスミド内にライゲーションした。lipofectアミン2000(Invitrogen AG、CH)を製造業者の取り扱い説明書に従って用いて、ヒト胎児由来腎臓(HEK)細胞(ATCC CRL−1573、Manassas、VA、USA)にpcDNA3.1(+).hP2X7プラスミドを導入した。DNAに24h暴露した後、細胞をトリプシン処理し、250μgのジェネティシンの存在下で低密度で再播種した。段階的限界希釈(serial limiting dilution)による連続した2回のクローニングの間にジェネティシン耐性細胞を目視にて選択した。ATPを加え、結果として生じるYO−PRO1の取り込みを記録することにより、個々のクローンをP2X7の発現でスクリーニングした。RNAとタンパクの発現に基づいて細胞クローンを選択した。P2X7を安定に発現するHEK細胞を、YO−PRO1試験を用いた薬剤のスクリーニングに用いた。細胞を、加湿5%CO2インキュベーター内で37℃にて、コンフルエントになるまで接着培養で増殖させた(10%のFCS、1%のペニシリン/ストレプトマイシン、250μg/mlのジェネティシンを加えたDMEMで3〜4日毎に1/5の継代比率)。接着細胞をトリプシン(165cm2ディッシュ当たり1ml)で2分間インキュベートして剥がし、次いで10mlの(Mg2+及びCa2+を含まない)PBSで洗浄し、そして10%のFCS、1%のペニシリン/ストレプトマイシンを含み、ジェネティシンを含まないDMEMに再懸濁した。50μlの完全培地(full
medium)中、1ウェル当たり10’000細胞(試験前48時間)又は1ウェル当たり25’000細胞(Vi−cell XR(Beckman Coulter)(試験前24時間)を側面が黒く底面が透明の384ウェルプレートに藩種した。プレート
は、予め1ウェル当たり10μlのポリ−L−リジンでコートし、37℃にて30〜60分間インキュベートし、PBSで1回洗浄した。培地を細胞から除き、0.5μMのYO−PRO−1を含む試験バッファー50μlをウェルに添加した。アンタゴニスト化合物の溶液は、アンタゴニストの10mM DMSO溶液をBioMek(Beckman Coulter)を用いてPBSで段階希釈することにより調製した。各濃度について2度ずつ試験を行った。IC50の測定については、10種の濃度で試験を行った(10μMを最も高い濃度とし、それについて1/3の比率で9回の段階希釈を行う。)。細胞を本発明のアンタゴニスト及び最終濃度が250μMのATPと90分間インキュベートした。この時間内の4時点を選び、各時点において、数秒内に行う数回の測定を行いそれらを平均した。蛍光は、YO−PRO−1蛍光(励起485/20、発光530/25)に適切なフィルターを用いて、FLIPR tetra(Molecular Devices)で測定した。FLIPR tetraは、実験プロトコルを定義し作動させるためのMolecular Devices Screen Worksシステムコントロールソフトウェアを備えている。アンタゴニスト活性の測定について、最大強度は、アゴニストによる活性化に対するEC50値(ヒト組み換えP2X7受容体を発現するHEK−293細胞に対して0.25mMのATP)により誘導される最大強度の百分率として表した。IC50の測定については、最大強度を化合物の濃度に対してプロットしてIC50値を決定した。
Claims (13)
- nが、1又は2を表し;
Xが、−O−又は−CH2−を表し;
R1が、水素を表し;
R2が水素を表し、かつR3がヘテロシクリルを表すか;又はR2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は1若しくは2個のフルオロにより置換された6又は7員の飽和炭素環を形成し;
R4が、未置換であるか又は1若しくは2個の(C1−C4)アルキル、(C1−C3)フルオロアルキル若しくはハロゲンにより置換されたヘテロアリールを表す;
請求項1に記載の式(I)の化合物又はそのような化合物の塩。 - nが、1又は2を表し;
Xが、−O−又は−CH2−を表し;
R1が、水素を表し;
R2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は2個のフルオロにより置換された6員の飽和炭素環を形成し;
R4が、1個のクロロにより置換された6員のヘテロアリール基を表す;
請求項1に記載の式(I)の化合物又はそのような化合物の塩。 - Xが、−O−を表す;
請求項1〜3のいずれか1項に記載の式(I)の化合物又はそのような化合物の塩。 - Xが、−CH2−を表す;
請求項1〜3のいずれか1項に記載の式(I)の化合物又はそのような化合物の塩。 - R2が水素を表し、R3がヘテロシクリルを表す;
請求項1、2、4又は5のいずれか1項に記載の式(I)の化合物又はそのような化合物の塩。 - R2とR3が、それらが結合する炭素原子と一緒に、未置換であるか又は2個のフルオロにより置換された6員の飽和炭素環を形成する;
請求項1〜5のいずれか1項に記載の式(I)の化合物又はそのような化合物の塩。 - R4が、未置換であるか又は1個のメチル、トリフルオロメチル若しくはクロロにより置換された6員のヘテロアリール基を表す;
請求項1、2又は4〜7のいずれか1項に記載の式(I)の化合物又はそのような化合物の塩。 - 以下からなる群より選択される請求項1に記載の式(I)の化合物:
N−(1−シクロヘプチル−2−ヒドロキシエチル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボキサミド;
N−((1−(6−クロロピリジン−3−イル)シクロヘキシル)メチル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボキサミド;
N−(2−(4,4−ジフルオロピペリジン−1−イル)−2−(2−メチルピリミジン−5−イル)エチル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボキサミド;
N−(2−モルフォリノ−2−(6−(トリフルオロメチル)ピリジン−3−イル)エチル)−5,6−ジヒドロフロ[2,3−d]チアゾール−6−カルボキサミド;
N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−5,6−ジヒドロ−4H−シクロペンタ[d]チアゾール−6−カルボキサミド;
N−(2−(2−メチルピリミジン−5−イル)−2−モルフォリノエチル)−5,6−ジヒドロ−4H−シクロペンタ[d]チアゾール−6−カルボキサミド;
N−(2−(4,4−ジフルオロピペリジン−1−イル)−2−(2−メチルピリミジン−5−イル)エチル)−5,6−ジヒドロ−4H−シクロペンタ[d]チアゾール−6−カルボキサミド;
N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−6,7−ジヒドロ−5H−ピラノ[2,3−d]チアゾール−7−カルボキサミド;
N−(2−(2−メチルピリミジン−5−イル)−2−モルフォリノエチル)−6,7−ジヒドロ−5H−ピラノ[2,3−d]チアゾール−7−カルボキサミド;
N−(2−(6−クロロピリジン−3−イル)−2−(4,4−ジフルオロピペリジン−1−イル)エチル)−6,7−ジヒドロ−5H−ピラノ[2,3−d]チアゾール−7−カルボキサミド;
N−((R)−1−シクロヘキシルエチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;
N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;
N−((1−(6−クロロピリジン−3−イル)シクロヘキシル)メチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;
N−((1−(6−クロロピリジン−3−イル)−4,4−ジフルオロシクロヘキシル)メチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;
N−(2−モルフォリノ−2−(2−(トリフルオロメチル)ピリミジン−5−イル)エチル)−4,5,6,7−テトラヒドロベンゾ[d]チアゾール−7−カルボキサミド;N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−(S)−5,6,7,8−テトラヒドロ−4H−シクロヘプタ[d]チアゾール−8−カルボキサミド;及び
N−((S)−1−シクロヘキシル−2−ヒドロキシエチル)−(R)−5,6,7,8−テトラヒドロ−4H−シクロヘプタ[d]チアゾール−8−カルボキサミド;
又はそのような化合物の塩。 - 医薬として使用するための、請求項1〜9のいずれか1項に記載の式(I)の化合物又はその薬学的に許容される塩。
- 活性成分としての請求項1〜9のいずれか1項に記載の式(I)の化合物又はその薬学的に許容される塩と、少なくとも1種の治療上不活性な賦型剤とを含む医薬組成物。
- 痛み;神経変性及び神経炎症性疾患;骨関節疾患;閉塞性気道疾患;心血管疾患;眼疾患;皮膚疾患;腹腔及び消化管疾患;泌尿生殖器疾患;癌;他の自己免疫性及びアレルギー性障害;並びに炎症性又は免疫性要素を伴う他の障害から選択される疾患の予防又は治療のための医薬の製造のための、請求項1〜9のいずれか1項に記載の式(I)の化合物又はその薬学的に許容される塩の使用。
- 痛み;神経変性及び神経炎症性疾患;骨関節疾患;閉塞性気道疾患;心血管疾患;眼疾患;皮膚疾患;腹腔及び消化管疾患;泌尿生殖器疾患;癌;他の自己免疫性及びアレルギー性障害;並びに炎症性又は免疫性要素を伴う他の障害から選択される疾患の予防又は治療における使用のための、請求項1〜9のいずれか1項に記載の式(I)の化合物又はその薬学的に許容される塩。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP13152273 | 2013-01-22 | ||
| EP13152273.2 | 2013-01-22 | ||
| PCT/IB2014/058434 WO2014115078A1 (en) | 2013-01-22 | 2014-01-21 | Heterocyclic amide derivatives as p2x7 receptor antagonists |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016510325A JP2016510325A (ja) | 2016-04-07 |
| JP6282017B2 true JP6282017B2 (ja) | 2018-02-21 |
Family
ID=47559347
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015553217A Expired - Fee Related JP6282017B2 (ja) | 2013-01-22 | 2014-01-21 | P2x7受容体アンタゴニストとしての複素環アミド誘導体 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US9388198B2 (ja) |
| EP (1) | EP2956457B1 (ja) |
| JP (1) | JP6282017B2 (ja) |
| KR (1) | KR102220847B1 (ja) |
| CN (1) | CN104918946B (ja) |
| CA (1) | CA2897459C (ja) |
| ES (1) | ES2616883T3 (ja) |
| WO (1) | WO2014115078A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013014587A1 (en) | 2011-07-22 | 2013-01-31 | Actelion Pharmaceuticals Ltd | Heterocyclic amide derivatives as p2x7 receptor antagonists |
| TWI576347B (zh) | 2012-01-20 | 2017-04-01 | 艾克泰聯製藥有限公司 | 作為p2x受體拮抗劑之雜環醯胺衍生物 |
| PL2931717T3 (pl) | 2012-12-12 | 2017-05-31 | Actelion Pharmaceuticals Ltd. | Pochodne indolokarboksyamidu jako antagoniści receptora p2x7 |
| CN104854087B (zh) | 2012-12-18 | 2017-03-22 | 埃科特莱茵药品有限公司 | 作为p2x7受体拮抗剂的吲哚羧酰胺衍生物 |
| CN104918617B (zh) * | 2013-01-22 | 2017-05-10 | 埃科特莱茵药品有限公司 | 作为p2x7受体拮抗剂的杂环酰胺衍生物 |
| RU2724350C1 (ru) | 2017-03-13 | 2020-06-23 | Раквалиа Фарма Инк. | Производные тетрагидрохинолина в качестве антагонистов рецептора р2х7 |
Family Cites Families (65)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4033977A (en) | 1975-10-01 | 1977-07-05 | American Home Products Corporation | 4H-pyrano[4,3-d]thiazole derivatives and process therefor |
| FR2406635A1 (fr) * | 1977-10-24 | 1979-05-18 | Logeais Labor Jacques | Nouveaux derives du benzo(d)thiazole, leur procede de preparation et leurs applications en therapeutique |
| TR200102911T2 (tr) | 1999-04-09 | 2002-01-21 | Astrazeneca Ab | Adamantan türevleri. |
| SE9904505D0 (sv) | 1999-12-09 | 1999-12-09 | Astra Pharma Prod | Novel compounds |
| TWI258462B (en) | 1999-12-17 | 2006-07-21 | Astrazeneca Ab | Adamantane derivative compounds, process for preparing the same and pharmaceutical composition comprising the same |
| GB0013737D0 (en) | 2000-06-07 | 2000-07-26 | Astrazeneca Ab | Novel compounds |
| EP1216997B1 (de) * | 2000-12-20 | 2006-02-15 | Lanxess Deutschland GmbH | 2-Brom/Chlor-thiazoliumsalze und ihre Verwendung als Kondensationsreagenzien |
| WO2003042190A1 (en) | 2001-11-12 | 2003-05-22 | Pfizer Products Inc. | N-alkyl-adamantyl derivatives as p2x7-receptor antagonists |
| PA8557501A1 (es) | 2001-11-12 | 2003-06-30 | Pfizer Prod Inc | Benzamida, heteroarilamida y amidas inversas |
| SE0103836D0 (sv) | 2001-11-16 | 2001-11-16 | Astrazeneca Ab | Novel compounds |
| SE0200920D0 (sv) | 2002-03-25 | 2002-03-25 | Astrazeneca Ab | Novel compounds |
| PA8591801A1 (es) | 2002-12-31 | 2004-07-26 | Pfizer Prod Inc | Inhibidores benzamidicos del receptor p2x7. |
| BR0317844A (pt) | 2002-12-31 | 2005-12-06 | Pfizer Prod Inc | Inibidores de benzamida do receptor p2x7 |
| SE0300480D0 (sv) | 2003-02-21 | 2003-02-21 | Astrazeneca Ab | Novel compounds |
| ES2281801T3 (es) | 2003-05-12 | 2007-10-01 | Pfizer Products Inc. | Inhibidores benzamida del receptor p2x7. |
| GB0312609D0 (en) | 2003-06-02 | 2003-07-09 | Astrazeneca Ab | Novel compounds |
| SE0302139D0 (sv) | 2003-07-28 | 2003-07-28 | Astrazeneca Ab | Novel compounds |
| CA2565211A1 (en) | 2004-04-29 | 2005-11-24 | Abbott Laboratories | Amino-tetrazoles analogues and methods of use |
| SA05260265A (ar) | 2004-08-30 | 2005-12-03 | استرازينيكا ايه بي | مركبات جديدة |
| SE0402925D0 (sv) | 2004-11-30 | 2004-11-30 | Astrazeneca Ab | Novel Compounds |
| WO2006080884A1 (en) | 2005-01-27 | 2006-08-03 | Astrazeneca Ab | Novel biaromatic compounds, inhibitors of the p2x7-receptor |
| US7297700B2 (en) | 2005-03-24 | 2007-11-20 | Renovis, Inc. | Bicycloheteroaryl compounds as P2X7 modulators and uses thereof |
| WO2007055374A1 (ja) | 2005-11-14 | 2007-05-18 | Mitsubishi Tanabe Pharma Corporation | 骨粗鬆症治療剤 |
| WO2007109160A2 (en) | 2006-03-16 | 2007-09-27 | Renovis, Inc. | Bicycloheteroaryl compounds as p2x7 modulators and uses thereof |
| WO2007109182A2 (en) | 2006-03-16 | 2007-09-27 | Renovis, Inc. | Bicycloheteroaryl compounds as p2x7 modulators and uses thereof |
| WO2007109201A2 (en) | 2006-03-16 | 2007-09-27 | Renovis, Inc. | Bicycloheteroaryl compounds as p2x7 modulators and uses thereof |
| CA2645556C (en) | 2006-03-16 | 2016-05-24 | Renovis, Inc. | Bicycloheteroaryl compounds as p2x7 modulators and uses thereof |
| CA2645652A1 (en) | 2006-03-16 | 2007-09-27 | Renovis, Inc. | Bicycloheteroaryl compounds as p2x7 modulators and uses thereof |
| TWI464148B (zh) | 2006-03-16 | 2014-12-11 | Evotec Us Inc | 作為p2x7調節劑之雙環雜芳基化合物與其用途 |
| ATE489088T1 (de) | 2006-06-06 | 2010-12-15 | Glaxo Group Ltd | N- (phenylmethyl) -2- (1h-pyrazol-4-yl) acetamid- derivate als p2x7-antagonisten zur behandlung von schmerzen, entzündungen und neurodegeneration |
| GB0611154D0 (en) | 2006-06-06 | 2006-07-19 | Glaxo Group Ltd | Novel receptor antagonists and their methods of use |
| CA2655675A1 (en) | 2006-07-06 | 2008-01-10 | Glaxo Group Limited | Substituted n-phenylmethyl -5-oxo-proline-2-amides as p2x7-receptor antagonists and their methods of use |
| EA201300152A1 (ru) | 2006-11-27 | 2013-07-30 | Х. Лундбекк А/С | Гетероариламидные производные |
| TW200838516A (en) | 2007-01-31 | 2008-10-01 | Merck & Co Inc | Substituted pyrano[2,3-B]pyridine derivatives as cannabinoid-1 receptor modulators |
| ES2576643T3 (es) | 2007-03-09 | 2016-07-08 | Second Genome, Inc. | Compuestos de bicicloheteroarilo como moduladores de P2X7 y usos de los mismos |
| KR20090122396A (ko) | 2007-03-22 | 2009-11-27 | 아스트라제네카 아베 | 염증성 질환 치료용 퀴놀린 유도체 |
| GB0705882D0 (en) | 2007-03-27 | 2007-05-02 | Glaxo Group Ltd | Novel compounds |
| WO2008116845A1 (en) | 2007-03-28 | 2008-10-02 | Glaxo Group Limited | Piperidinone carboxamide derivatives as p2x7 modulators |
| JP2010522710A (ja) | 2007-03-29 | 2010-07-08 | グラクソ グループ リミテッド | P2x7調節因子としてのオキサゾリジンおよびモルホリンカルボキサミド誘導体 |
| JP2010523524A (ja) | 2007-04-03 | 2010-07-15 | グラクソ グループ リミテッド | P2x7調節因子としてのイミダゾリジンカルボキサミド誘導体 |
| EP2155744A1 (en) * | 2007-04-10 | 2010-02-24 | Lundbeck, H., A/S | Heteroaryl amide analogues as p2x7 antagonists |
| EP2150535A2 (en) | 2007-04-11 | 2010-02-10 | Glaxo Group Limited | Pyrazole derivatives as p2x7 modulators |
| DE602008005582D1 (de) | 2007-05-10 | 2011-04-28 | Glaxo Group Ltd | Pyrazolderivate als p2x7-modulatoren |
| ES2551095T3 (es) * | 2007-07-19 | 2015-11-16 | Lundbeck, H., A/S | Amidas heterocíclicas de 5 miembros y compuestos relacionados |
| WO2009023623A1 (en) * | 2007-08-10 | 2009-02-19 | H, Lundbeck A/S | Heteroaryl amide analogues |
| US8106073B2 (en) | 2007-11-30 | 2012-01-31 | Astrazeneca Ab | Quinoline derivatives 057 |
| GB0724258D0 (en) | 2007-12-12 | 2008-01-30 | Glaxo Group Ltd | Novel combinations |
| WO2009074518A1 (en) | 2007-12-12 | 2009-06-18 | Glaxo Group Limited | Combinations of prolinamide p2x7 modulators with further therapeutic agents |
| KR20100099178A (ko) | 2007-12-18 | 2010-09-10 | 글락소 그룹 리미티드 | P2x7 조절제로서의 5-옥소-3-피롤리딘카르복스아미드 유도체 |
| GB0724625D0 (en) | 2007-12-18 | 2008-01-30 | Glaxo Group Ltd | Novel compounds |
| WO2009108551A2 (en) | 2008-02-25 | 2009-09-03 | H. Lundbeck A/S | Heteroaryl amide analogues |
| ES2357682T3 (es) | 2008-03-25 | 2011-04-28 | Affectis Pharmaceuticals Ag | Antagonistas de p2x7r novedosos y su utilización. |
| ES2376092T3 (es) * | 2008-04-22 | 2012-03-08 | Janssen Pharmaceutica, N.V. | Antagonistas de p2x7 sustituidos con quinolina o isoquinolina. |
| CN102395562A (zh) | 2009-04-14 | 2012-03-28 | 阿费克蒂斯制药股份公司 | 新的p2x7r拮抗剂及其用途 |
| GB0919594D0 (en) | 2009-11-09 | 2009-12-23 | Glaxo Group Ltd | Compounds |
| US20120157494A1 (en) | 2010-12-16 | 2012-06-21 | Harris Iii Ralph New | Isoindolyl compounds |
| JP2014513671A (ja) * | 2011-02-22 | 2014-06-05 | アクテリオン ファーマシューティカルズ リミテッド | P2x7受容体アンタゴニストとしてのベンズアミド誘導体 |
| WO2012163792A1 (en) | 2011-05-27 | 2012-12-06 | Affectis Pharmaceuticals Ag | Novel p2x7r antagonists and their use |
| WO2013014587A1 (en) | 2011-07-22 | 2013-01-31 | Actelion Pharmaceuticals Ltd | Heterocyclic amide derivatives as p2x7 receptor antagonists |
| TWI576347B (zh) | 2012-01-20 | 2017-04-01 | 艾克泰聯製藥有限公司 | 作為p2x受體拮抗劑之雜環醯胺衍生物 |
| TWI598325B (zh) | 2012-10-12 | 2017-09-11 | H 朗德貝克公司 | 苯甲醯胺類 |
| TW201427947A (zh) | 2012-10-12 | 2014-07-16 | Lundbeck & Co As H | 環狀胺 |
| PL2931717T3 (pl) | 2012-12-12 | 2017-05-31 | Actelion Pharmaceuticals Ltd. | Pochodne indolokarboksyamidu jako antagoniści receptora p2x7 |
| CN104854087B (zh) | 2012-12-18 | 2017-03-22 | 埃科特莱茵药品有限公司 | 作为p2x7受体拮抗剂的吲哚羧酰胺衍生物 |
| CN104918617B (zh) | 2013-01-22 | 2017-05-10 | 埃科特莱茵药品有限公司 | 作为p2x7受体拮抗剂的杂环酰胺衍生物 |
-
2014
- 2014-01-21 WO PCT/IB2014/058434 patent/WO2014115078A1/en not_active Ceased
- 2014-01-21 JP JP2015553217A patent/JP6282017B2/ja not_active Expired - Fee Related
- 2014-01-21 CA CA2897459A patent/CA2897459C/en active Active
- 2014-01-21 ES ES14703442.5T patent/ES2616883T3/es active Active
- 2014-01-21 EP EP14703442.5A patent/EP2956457B1/en not_active Not-in-force
- 2014-01-21 KR KR1020157022715A patent/KR102220847B1/ko not_active Expired - Fee Related
- 2014-01-21 US US14/762,717 patent/US9388198B2/en not_active Expired - Fee Related
- 2014-01-21 CN CN201480005210.8A patent/CN104918946B/zh not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| CN104918946A (zh) | 2015-09-16 |
| ES2616883T3 (es) | 2017-06-14 |
| CA2897459A1 (en) | 2014-07-31 |
| CN104918946B (zh) | 2017-03-29 |
| US20150361097A1 (en) | 2015-12-17 |
| EP2956457B1 (en) | 2016-11-23 |
| KR20150107881A (ko) | 2015-09-23 |
| WO2014115078A1 (en) | 2014-07-31 |
| JP2016510325A (ja) | 2016-04-07 |
| CA2897459C (en) | 2021-03-02 |
| EP2956457A1 (en) | 2015-12-23 |
| KR102220847B1 (ko) | 2021-02-26 |
| US9388198B2 (en) | 2016-07-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6295269B2 (ja) | P2x7受容体アンタゴニストとしてのインドールカルボキサミド誘導体 | |
| JP6111268B2 (ja) | P2x7受容体アンタゴニストとしての複素環アミド誘導体 | |
| JP6282017B2 (ja) | P2x7受容体アンタゴニストとしての複素環アミド誘導体 | |
| JP6282016B2 (ja) | P2x7受容体アンタゴニストとしての複素環アミド誘導体 | |
| JP5955957B2 (ja) | P2x7受容体アンタゴニストとしての複素環アミド誘導体 | |
| KR102232744B1 (ko) | P2x7 수용체 길항제로서의 인돌 카르복사미드 유도체 | |
| CN105916859A (zh) | 杂环化合物 | |
| RS54311B1 (sr) | Kondezovani derivat aminodihidrotiazina |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170117 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20171214 |
|
| TRDD | Decision of grant or rejection written | ||
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20171228 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180110 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180122 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6282017 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |