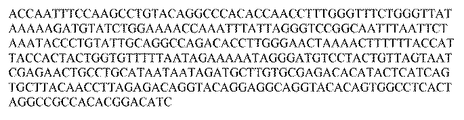JP6153866B2 - 迅速なハイブリッド捕捉アッセイ、及び関連する戦略的に切断されたプローブ - Google Patents
迅速なハイブリッド捕捉アッセイ、及び関連する戦略的に切断されたプローブ Download PDFInfo
- Publication number
- JP6153866B2 JP6153866B2 JP2013512140A JP2013512140A JP6153866B2 JP 6153866 B2 JP6153866 B2 JP 6153866B2 JP 2013512140 A JP2013512140 A JP 2013512140A JP 2013512140 A JP2013512140 A JP 2013512140A JP 6153866 B2 JP6153866 B2 JP 6153866B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- type
- nucleic acid
- sample
- probe
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000000523 sample Substances 0.000 title claims description 409
- 238000003556 assay Methods 0.000 title description 35
- 150000007523 nucleic acids Chemical class 0.000 claims description 253
- 102000039446 nucleic acids Human genes 0.000 claims description 243
- 108020004707 nucleic acids Proteins 0.000 claims description 243
- 238000000034 method Methods 0.000 claims description 87
- 108091033319 polynucleotide Proteins 0.000 claims description 64
- 102000040430 polynucleotide Human genes 0.000 claims description 64
- 239000002157 polynucleotide Substances 0.000 claims description 64
- 239000012472 biological sample Substances 0.000 claims description 20
- 230000000295 complement effect Effects 0.000 claims description 16
- 108020004711 Nucleic Acid Probes Proteins 0.000 claims description 9
- 239000002853 nucleic acid probe Substances 0.000 claims description 9
- 241000701806 Human papillomavirus Species 0.000 description 138
- 239000003599 detergent Substances 0.000 description 80
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 74
- 239000002609 medium Substances 0.000 description 71
- 238000012217 deletion Methods 0.000 description 54
- 230000037430 deletion Effects 0.000 description 54
- 239000013612 plasmid Substances 0.000 description 54
- 239000011324 bead Substances 0.000 description 46
- 238000001514 detection method Methods 0.000 description 44
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 42
- 239000002585 base Substances 0.000 description 40
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 38
- 230000009260 cross reactivity Effects 0.000 description 37
- 108020004414 DNA Proteins 0.000 description 36
- 239000003153 chemical reaction reagent Substances 0.000 description 30
- LBCZOTMMGHGTPH-UHFFFAOYSA-N 2-[2-[4-(2,4,4-trimethylpentan-2-yl)phenoxy]ethoxy]ethanol Chemical compound CC(C)(C)CC(C)(C)C1=CC=C(OCCOCCO)C=C1 LBCZOTMMGHGTPH-UHFFFAOYSA-N 0.000 description 29
- 210000004027 cell Anatomy 0.000 description 29
- 238000009396 hybridization Methods 0.000 description 29
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 27
- 239000011534 wash buffer Substances 0.000 description 26
- 239000007787 solid Substances 0.000 description 23
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 22
- 239000003085 diluting agent Substances 0.000 description 22
- 239000000203 mixture Substances 0.000 description 22
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 21
- 229960003964 deoxycholic acid Drugs 0.000 description 20
- 239000011780 sodium chloride Substances 0.000 description 19
- 238000012360 testing method Methods 0.000 description 19
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 18
- 239000012634 fragment Substances 0.000 description 18
- 208000022361 Human papillomavirus infectious disease Diseases 0.000 description 17
- 239000000872 buffer Substances 0.000 description 17
- 230000005291 magnetic effect Effects 0.000 description 17
- 238000011084 recovery Methods 0.000 description 17
- 108020004518 RNA Probes Proteins 0.000 description 14
- 239000003391 RNA probe Substances 0.000 description 14
- 108091008146 restriction endonucleases Proteins 0.000 description 14
- 230000003321 amplification Effects 0.000 description 13
- 238000003199 nucleic acid amplification method Methods 0.000 description 13
- 230000008569 process Effects 0.000 description 13
- AJTVSSFTXWNIRG-UHFFFAOYSA-N 2-[bis(2-hydroxyethyl)amino]ethanesulfonic acid Chemical compound OCC[NH+](CCO)CCS([O-])(=O)=O AJTVSSFTXWNIRG-UHFFFAOYSA-N 0.000 description 12
- 239000013598 vector Substances 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 10
- 108091028043 Nucleic acid sequence Proteins 0.000 description 9
- 229920002125 Sokalan® Polymers 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 238000005520 cutting process Methods 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 8
- 230000008901 benefit Effects 0.000 description 8
- 230000003196 chaotropic effect Effects 0.000 description 8
- 238000011534 incubation Methods 0.000 description 8
- 239000003550 marker Substances 0.000 description 8
- 230000005298 paramagnetic effect Effects 0.000 description 8
- 239000004584 polyacrylic acid Substances 0.000 description 8
- 238000012545 processing Methods 0.000 description 8
- 108090000623 proteins and genes Proteins 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 238000003860 storage Methods 0.000 description 8
- 241000341655 Human papillomavirus type 16 Species 0.000 description 7
- 206010028980 Neoplasm Diseases 0.000 description 7
- 239000007983 Tris buffer Substances 0.000 description 7
- 241000700605 Viruses Species 0.000 description 7
- 201000011510 cancer Diseases 0.000 description 7
- 230000021615 conjugation Effects 0.000 description 7
- 238000000605 extraction Methods 0.000 description 7
- 238000010438 heat treatment Methods 0.000 description 7
- 239000000758 substrate Substances 0.000 description 7
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 7
- 238000005406 washing Methods 0.000 description 7
- 108091093088 Amplicon Proteins 0.000 description 6
- 241000701022 Cytomegalovirus Species 0.000 description 6
- -1 cetrimonium compounds Chemical class 0.000 description 6
- 238000004925 denaturation Methods 0.000 description 6
- 230000036425 denaturation Effects 0.000 description 6
- 238000006386 neutralization reaction Methods 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000003755 preservative agent Substances 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 235000018102 proteins Nutrition 0.000 description 6
- 102000004169 proteins and genes Human genes 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 5
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 5
- 241000894006 Bacteria Species 0.000 description 5
- 102000004190 Enzymes Human genes 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 5
- 241000588724 Escherichia coli Species 0.000 description 5
- 239000003513 alkali Substances 0.000 description 5
- 238000002869 basic local alignment search tool Methods 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 230000001268 conjugating effect Effects 0.000 description 5
- 230000002068 genetic effect Effects 0.000 description 5
- 238000012203 high throughput assay Methods 0.000 description 5
- 210000004408 hybridoma Anatomy 0.000 description 5
- 238000002156 mixing Methods 0.000 description 5
- 238000002864 sequence alignment Methods 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 4
- 241000321096 Adenoides Species 0.000 description 4
- 241000283707 Capra Species 0.000 description 4
- 241000606153 Chlamydia trachomatis Species 0.000 description 4
- 108020004394 Complementary RNA Proteins 0.000 description 4
- 239000003298 DNA probe Substances 0.000 description 4
- 101710163270 Nuclease Proteins 0.000 description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 description 4
- 206010036790 Productive cough Diseases 0.000 description 4
- 210000002534 adenoid Anatomy 0.000 description 4
- 239000012491 analyte Substances 0.000 description 4
- 229940038705 chlamydia trachomatis Drugs 0.000 description 4
- 239000003184 complementary RNA Substances 0.000 description 4
- 235000013365 dairy product Nutrition 0.000 description 4
- 239000013024 dilution buffer Substances 0.000 description 4
- 230000007613 environmental effect Effects 0.000 description 4
- 210000002919 epithelial cell Anatomy 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 239000007791 liquid phase Substances 0.000 description 4
- 210000002751 lymph Anatomy 0.000 description 4
- 239000012139 lysis buffer Substances 0.000 description 4
- 235000013372 meat Nutrition 0.000 description 4
- 235000013336 milk Nutrition 0.000 description 4
- 239000008267 milk Substances 0.000 description 4
- 210000004080 milk Anatomy 0.000 description 4
- 201000000050 myeloid neoplasm Diseases 0.000 description 4
- 210000004910 pleural fluid Anatomy 0.000 description 4
- 230000002335 preservative effect Effects 0.000 description 4
- 210000003296 saliva Anatomy 0.000 description 4
- 210000000582 semen Anatomy 0.000 description 4
- 210000003802 sputum Anatomy 0.000 description 4
- 208000024794 sputum Diseases 0.000 description 4
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 108091023037 Aptamer Proteins 0.000 description 3
- 206010008342 Cervix carcinoma Diseases 0.000 description 3
- 241000606161 Chlamydia Species 0.000 description 3
- 229920004934 Dacron® Polymers 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 241000197306 H1N1 subtype Species 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 241000725303 Human immunodeficiency virus Species 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 3
- 241000588652 Neisseria gonorrhoeae Species 0.000 description 3
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 3
- 241000191967 Staphylococcus aureus Species 0.000 description 3
- 241000224527 Trichomonas vaginalis Species 0.000 description 3
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 3
- 201000010881 cervical cancer Diseases 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000011109 contamination Methods 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 230000005294 ferromagnetic effect Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 238000009595 pap smear Methods 0.000 description 3
- 239000005020 polyethylene terephthalate Substances 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 3
- 241001529453 unidentified herpesvirus Species 0.000 description 3
- 241000712461 unidentified influenza virus Species 0.000 description 3
- 210000002700 urine Anatomy 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- 206010003445 Ascites Diseases 0.000 description 2
- 206010008263 Cervical dysplasia Diseases 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 206010018612 Gonorrhoea Diseases 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 241000008910 Severe acute respiratory syndrome-related coronavirus Species 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- 108020000999 Viral RNA Proteins 0.000 description 2
- 239000012670 alkaline solution Substances 0.000 description 2
- 150000001540 azides Chemical class 0.000 description 2
- 244000052616 bacterial pathogen Species 0.000 description 2
- 239000003150 biochemical marker Substances 0.000 description 2
- 239000000337 buffer salt Substances 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- 208000007951 cervical intraepithelial neoplasia Diseases 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 230000005292 diamagnetic effect Effects 0.000 description 2
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 2
- 239000004205 dimethyl polysiloxane Substances 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 2
- 239000005447 environmental material Substances 0.000 description 2
- 210000003608 fece Anatomy 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 238000003205 genotyping method Methods 0.000 description 2
- 208000001786 gonorrhea Diseases 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 235000021056 liquid food Nutrition 0.000 description 2
- ADKOXSOCTOWDOP-UHFFFAOYSA-L magnesium;aluminum;dihydroxide;trihydrate Chemical compound O.O.O.[OH-].[OH-].[Mg+2].[Al] ADKOXSOCTOWDOP-UHFFFAOYSA-L 0.000 description 2
- 239000000696 magnetic material Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 238000009629 microbiological culture Methods 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 230000003472 neutralizing effect Effects 0.000 description 2
- 229920001778 nylon Polymers 0.000 description 2
- 229920002113 octoxynol Polymers 0.000 description 2
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 2
- 238000002203 pretreatment Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 229920002545 silicone oil Polymers 0.000 description 2
- 238000002741 site-directed mutagenesis Methods 0.000 description 2
- 239000002689 soil Substances 0.000 description 2
- 235000021055 solid food Nutrition 0.000 description 2
- 210000004989 spleen cell Anatomy 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 235000013311 vegetables Nutrition 0.000 description 2
- 239000002699 waste material Substances 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- QAQSNXHKHKONNS-UHFFFAOYSA-N 1-ethyl-2-hydroxy-4-methyl-6-oxopyridine-3-carboxamide Chemical compound CCN1C(O)=C(C(N)=O)C(C)=CC1=O QAQSNXHKHKONNS-UHFFFAOYSA-N 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- WCXBMXUFOCCQQM-PHDIDXHHSA-N C[C@H](C[IH]C1)[C@@]11[IH]C1 Chemical compound C[C@H](C[IH]C1)[C@@]11[IH]C1 WCXBMXUFOCCQQM-PHDIDXHHSA-N 0.000 description 1
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 241000711573 Coronaviridae Species 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- 108020003215 DNA Probes Proteins 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- BVTJGGGYKAMDBN-UHFFFAOYSA-N Dioxetane Chemical compound C1COO1 BVTJGGGYKAMDBN-UHFFFAOYSA-N 0.000 description 1
- 108010067770 Endopeptidase K Proteins 0.000 description 1
- 208000034826 Genetic Predisposition to Disease Diseases 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 101710203526 Integrase Proteins 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 108020003217 Nuclear RNA Proteins 0.000 description 1
- 102000043141 Nuclear RNA Human genes 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 108020002230 Pancreatic Ribonuclease Proteins 0.000 description 1
- 102000005891 Pancreatic ribonuclease Human genes 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- 241000124429 Phlox Species 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 108091034057 RNA (poly(A)) Proteins 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- BFDMCHRDSYTOLE-UHFFFAOYSA-N SC#N.NC(N)=N.ClC(Cl)Cl.OC1=CC=CC=C1 Chemical compound SC#N.NC(N)=N.ClC(Cl)Cl.OC1=CC=CC=C1 BFDMCHRDSYTOLE-UHFFFAOYSA-N 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 101710137500 T7 RNA polymerase Proteins 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 108020004566 Transfer RNA Proteins 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 108020005202 Viral DNA Proteins 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 229960001716 benzalkonium Drugs 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- 229960003431 cetrimonium Drugs 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 230000002380 cytological effect Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 238000010908 decantation Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 229940009976 deoxycholate Drugs 0.000 description 1
- 239000002889 diamagnetic material Substances 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- WQABCVAJNWAXTE-UHFFFAOYSA-N dimercaprol Chemical compound OCC(S)CS WQABCVAJNWAXTE-UHFFFAOYSA-N 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000003302 ferromagnetic material Substances 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 229960000789 guanidine hydrochloride Drugs 0.000 description 1
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000008696 hypoxemic pulmonary vasoconstriction Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 229940127121 immunoconjugate Drugs 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000013101 initial test Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 239000002923 metal particle Substances 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 210000000633 nuclear envelope Anatomy 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 239000002907 paramagnetic material Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- 238000002205 phenol-chloroform extraction Methods 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 239000000941 radioactive substance Substances 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 108020004418 ribosomal RNA Proteins 0.000 description 1
- 238000002133 sample digestion Methods 0.000 description 1
- 229940016590 sarkosyl Drugs 0.000 description 1
- 108700004121 sarkosyl Proteins 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- KSAVQLQVUXSOCR-UHFFFAOYSA-M sodium lauroyl sarcosinate Chemical compound [Na+].CCCCCCCCCCCC(=O)N(C)CC([O-])=O KSAVQLQVUXSOCR-UHFFFAOYSA-M 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000007723 transport mechanism Effects 0.000 description 1
- 239000006163 transport media Substances 0.000 description 1
- ODLHGICHYURWBS-LKONHMLTSA-N trappsol cyclo Chemical compound CC(O)COC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)COCC(O)C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1COCC(C)O ODLHGICHYURWBS-LKONHMLTSA-N 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/70—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving virus or bacteriophage
- C12Q1/701—Specific hybridization probes
- C12Q1/708—Specific hybridization probes for papilloma
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Virology (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Nuclear Medicine (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Description
本出願は2010年5月25日付けで出願された米国仮特許出願第61/347,941号(その内容全体が参照により本明細書に援用される)に対する優先権を主張する。
a)サンプルを回収媒体に懸濁することと、
b)標的核酸分子をサンプルから回収媒体に放出させることと、
c)二本鎖標的核酸分子を一本鎖標的核酸分子に変換することと、
d)1つ又は複数のポリヌクレオチドプローブを、ポリヌクレオチドプローブと標的一本鎖標的核酸分子とがハイブリダイズして二本鎖核酸ハイブリッドを形成することを可能にする条件下で、一本鎖標的核酸分子に接触させることと、
e)二本鎖核酸ハイブリッドを捕捉させることと、
f)二本鎖核酸ハイブリッドを、結合していない一本鎖標的核酸分子から分離することと、
g)二本鎖核酸ハイブリッドを検出し、それにより標的核酸の存在が示される、二本鎖核酸ハイブリッドを検出することと、
を含む、サンプル中の標的核酸分子の存在を決定する方法を提供する。
a)洗剤を含む回収媒体にサンプルを懸濁することと、
b)標的核酸分子を変性させることと、
c)1つ又は複数のポリヌクレオチドプローブを、プローブと標的核酸分子とがハイブリダイズすることにより二本鎖核酸ハイブリッドを形成することを可能にする条件下で、標的核酸分子に接触させることと、
d)二本鎖核酸ハイブリッドを、二本鎖ハイブリッド核酸ハイブリッドに特異的な第1の抗体をコーティングした固体支持体上に捕捉させ、それにより二本鎖核酸ハイブリッド/固体支持体複合体を形成する、二本鎖核酸ハイブリッドを捕捉させることと、
e)二本鎖核酸ハイブリッド/固体支持体複合体を、結合していない核酸から分離することと、
f)複合体に、二本鎖核酸ハイブリッドに特異的であるか、又は第1の抗体に特異的である、検出可能なマーカーで標識した第2の抗体をコンジュゲートし、二本鎖核酸ハイブリッド/固体支持体抗体複合体を形成する、第2の抗体をコンジュゲートすることと、
g)二本鎖核酸ハイブリッド/固体支持体抗体複合体を、洗剤を含む洗浄バッファで洗浄することと、
h)第2の抗体上の標識を検出することであって、検出が標的核酸分子の存在を示す、標識を検出すること、
とを含む。
a)洗剤を含む回収媒体にサンプルを懸濁することと、
b)サンプル中の標的核酸分子を変性させることと、
c)少なくとも1つのポリヌクレオチドプローブを標的核酸分子に接触させることによって、二本鎖核酸ハイブリッドを形成することと、
d)二本鎖核酸ハイブリッドを、第1の抗体を含む支持体上に捕捉させることによって、二本鎖核酸ハイブリッド−支持体複合体を形成することと、
e)二本鎖核酸ハイブリッド−支持体複合体に、検出可能なマーカーで標識した第2の抗体を接触させることによって、二本鎖核酸ハイブリッド−支持体−第2の抗体の複合体を形成することと、
f)二本鎖核酸ハイブリッド−支持体−第2の抗体の複合体を洗浄バッファで洗浄することと、
g)第2の抗体上のマーカーを検出することであって、検出が標的核酸分子の存在を示す、マーカーを検出することと、
を含む、サンプル中の標的核酸分子の存在を決定する方法を提供する。
(a)約0.5%〜約2.0%のNP−40、約0.10%〜約0.40%のデオキシコール酸ナトリウム、約25mM〜約75mMのTris−HCl、約10mM〜約50mMのEDTA、約50mM〜約200mMのNaCl及び約0.01%〜約0.10%のアジ化ナトリウムに懸濁した生物学的サンプルと、
(b)1つ又は複数のポリヌクレオチドプローブと、
を含む組成物を提供する。
(a)約0.5%〜約2.0%のNP−40、約0.10%〜約0.40%のデオキシコール酸ナトリウム、約25mM〜約75mMのTris−HCl、約10mM〜約50mMのEDTA、約50mM〜約200mMのNaCl及び約0.01%〜約0.10%のアジ化ナトリウムを含む回収媒体に懸濁した生物学的サンプルと、
(b)1つ又は複数のポリヌクレオチドプローブと、
(c)第1の抗体と、
を含む組成物を提供する。
(a)約0.5%〜約2.0%のNP−40、約0.10%〜約0.40%のデオキシコール酸ナトリウム、約25mM〜約75mMのTris−HCl、約10mM〜約50mMのEDTA、約50mM〜約200mMのNaCl及び約0.01%〜約0.10%のアジ化ナトリウムを含む回収媒体に懸濁した生物学的サンプルと、
(b)1つ又は複数のポリヌクレオチドプローブと、
(c)第1の抗体と、
(d)第2の抗体と、
を含む組成物を提供する。
(a)約0.5%〜約2.0%のNP−40、約0.10%〜約0.40%のデオキシコール酸ナトリウム、約25mM〜約75mMのTris−HCl、約10mM〜約50mMのEDTA、約50mM〜約200mMのNaCl及び約0.01%〜約0.10%のアジ化ナトリウムを含む回収媒体に懸濁した生物学的サンプルと、
(b)1つ又は複数のポリヌクレオチドプローブと、
(c)第1の抗体をコーティングした支持体と、
(d)第2の抗体と、
を含む組成物を提供する。
(a)少なくとも1つの洗剤を含む回収媒体に懸濁した生物学的サンプルと、
(b)変性試薬と、
(c)1つ又は複数のポリヌクレオチドプローブと、
(d)第1の抗体をコーティングした支持体と、
(e)検出可能なマーカーで標識した第2の抗体と、
を含む組成物を提供する。
本開示の方法を用いて、生物学的サンプル及び環境サンプルを含む、検体又は培養物(例えば細胞培養物、微生物培養物及びウイルス培養物)を含むが、これらに限定されないサンプルから標的核酸分子の存在を検出することができる。生物学的サンプルはヒトを含む動物由来のもの、流体、固体(例えば糞便)、又は組織、並びに乳製品、野菜、食肉及び食肉副産物等の液体又は固体の食品及び飼料の製品及び原料、並びに廃棄物であり得る。環境サンプルとしては、表層物質、土壌、水及び産業サンプル等の環境物質、並びに食品及び乳製品の加工用の機器、装置、設備、器具、使い捨て及び使い捨てではない(non-disposable)製品から得られるサンプルが挙げられる。
任意のタイプのサンプル管を使用することができる。汚染を最小限に抑えるためにサンプル管を閉鎖又は密封してもよい。クロージャーは永久的なものであっても、又は取り外し可能なものであってもよい。取り外し可能なクロージャーの例としては、スナップキャップ、スクリューキャップ、ゴム隔膜、ホイル及びフィルムが挙げられる。クロージャーは、穴を開けた場合に再封鎖可能な1つ又は複数の開口又は穿孔を含有し得る。かかる開口又は穿孔を含有するクロージャーの利点の一つは、例えばサンプル抽出デバイス又はサンプル検出デバイスによって穴を開けた場合に、クロージャーが無効にならないことである。サンプル抽出デバイス又はサンプル検出デバイスを取り外すと、クロージャーは再封鎖され、それにより汚染が最小限に抑えられる。
サンプルをサンプル管内に入れた後、基質とともに、若しくは保存媒体中で、又はその両方で乾燥させることによって、サンプルを貯蔵することができる。乾燥保存(Desiccation)は加圧乾燥又は化学物質を用いた乾燥によって達成される。これによって水分の大部分が除去され、長期安定性に好適となる。代替的に、サンプルの安定性を確保するために、サンプルをトレハロース等の基質とともに凍結乾燥(フリーズドライ)してもよい。
一態様では、サンプルを回収媒体に回収及び貯蔵することができる。回収媒体は、保存媒体と同様に核酸を保存すること、及び分析前の核酸の分解を防止するためにヌクレアーゼを阻害することを含む幾つかの機能を有する。一態様では、回収媒体は少なくとも1つの洗剤を含有する。別の態様では、回収媒体は少なくとも2つの洗剤、少なくとも3つの洗剤又は少なくとも4つの洗剤を含有する。一態様では、洗剤は各々異なる。別の態様では、洗剤ベースの回収媒体は、バックグラウンドシグナルを制御することが可能な或る洗剤と、磁性ビーズの挙動、例えば粘性サンプル中での移動、回収(すなわち磁性ビーズがサンプルウェルの底部にどの程度集合するか)、及び保持(すなわちサンプルを含有する容器から上清を除去する際に、磁性ビーズがどの程度適所に留まるか)を改善する別の洗剤の2つの異なる洗剤を含む。
一態様では、アッセイはサンプルの前処理調製工程を含まない。別の態様では、洗剤ベースの回収媒体を使用する場合、アッセイはサンプルの前処理調製を含まない。例えば、洗剤ベースの回収媒体が約0.5%〜約2.0%のNP−40、約0.10%〜約0.40%のデオキシコール酸ナトリウム、約25mM〜約75mMのTris−HCl、約10mM〜約50mMのEDTA、約50mM〜約200mMのNaCl、及び約0.01%〜約0.10%のアジ化ナトリウムを含むか、それらから本質的になるか、又はそれらからなる場合、サンプルの前処理調製は必要とされない。これらの成分の任意の組合せも企図される。
標的核酸分子としては、生物学的サンプル及び環境サンプルを含む検体又は培養物(例えば細胞培養物、微生物培養物及びウイルス培養物)中に見られる核酸分子が挙げられるが、これに限定されない。標的核酸分子は、ヒトを含む動物に由来する生物学的サンプル、流体、固体(例えば糞便)又は組織、並びに乳製品、野菜、食肉及び食肉副産物等の液体又は固体の食品及び飼料の製品及び原料、並びに廃棄物中に見られるものであり得る。標的核酸分子は環境サンプル中に見られるものであってもよく、環境サンプルには、表層物質、土壌、水及び産業サンプル等の環境物質、並びに食品及び乳製品の加工用の機器、装置、設備、器具、使い捨て及び使い捨てではない製品から得られるサンプルが挙げられる。
上記のようにサンプルを洗剤ベースの回収媒体に回収した後、サンプルを変性試薬で処理して、標的核酸分子をハイブリダイゼーションに利用しやすいものにしてもよい。一態様では、サンプルをアルカリ性溶液で変性させる。溶液のpHを約pH12、約pH13又は約pH14にすることができる任意のアルカリを使用することができる。さらに、溶液のpHを約pH12〜約pH13、約pH12〜約pH14、及び約pH13〜約pH14の範囲にすることができる任意のアルカリを使用することができる。アルカリの好適な濃度としては、約1.0N〜約2.0N、約1.25N〜約1.75N、及び約1.25N〜約1.5N、及び約1.5N、並びに列挙した範囲内の任意の濃度が挙げられる。限定されるわけではないが、好適なアルカリとしてはNaOH及びKOHが挙げられる。
核酸を含有するサンプルを変性させた後、1つ又は複数のポリヌクレオチドプローブと、1つ又は複数のポリヌクレオチドプローブがサンプル中の標的核酸とハイブリダイズして、二本鎖核酸ハイブリッドを形成するのに十分な条件下で接触させる。プローブは完全長DNA、切断DNA若しくは合成DNA、又は完全長RNA、切断RNA若しくは合成RNAであり得る。標的核酸がDNAであれば、プローブはRNAとすることができ、標的核酸がRNAであれば、プローブはDNAとすることができる。好ましくは、1つ又は複数のポリヌクレオチドプローブを、(塩基性変性試薬を中和する)中和ハイブリダイゼーションバッファとしても働くことができる(塩基性変性試薬を中和する)プローブ希釈剤で希釈する。
プローブを標的核酸分子とハイブリダイズさせ、二本鎖核酸ハイブリッドを形成した後、二本鎖核酸ハイブリッドに特異的な分子によってハイブリッドを捕捉させる。二本鎖核酸ハイブリッドに特異的な分子としては、モノクローナル抗体、ポリクローナル抗体、タンパク質(RNアーゼ(RNase)H等であるが、これに限定されない)、核酸(アプタマーを含むが、これに限定されない)、又は配列特異的な核酸が挙げられるが、これらに限定されない。アプタマーは、標的とハイブリダイズし、ハイブリダイズしたアプタマーを増幅して、この選抜プロセスを繰り返すことにより、配列のライブラリーから連続的に選択したランダム配列の短いストレッチである。一態様では、二本鎖核酸ハイブリッドに特異的な分子は、抗ハイブリッド抗体として知られる抗体により捕捉される。
方法の別の工程は、同様に二本鎖核酸ハイブリッドに特異的な、又は代替的には第1の抗体に特異的な第2の抗体を調製することを含み得る。第2の抗体は直接的又は関接的に検出可能に標識することができ、モノクローナル抗体であっても、又はポリクローナル抗体であってもよい。一態様では、第2の抗体はモノクローナル抗体である。別の態様では、第2の抗体は検出可能なマーカーで直接標識され、モノクローナル抗体である。第2の抗体は、二本鎖核酸ハイブリッドの存在を検出するために使用される。一態様では、第2の抗体は、基質と反応して、検出することのできるシグナルを生じる必要のある標識を有する。第2の抗体は好適なバッファに溶解することができる。一態様では、バッファは100mMのTris HCl(pH7.4)、0.5MのNaCl、0.1mMのZnCl2、1.0mMのMgCl2、0.25%のTween 20、0.2mg/mlのRNアーゼ A、4%のヒドロキシプロピル−β−シクロデキストリン(シクロデキストリン)、先に論考した30%のビーズ希釈バッファ、0.05%のヤギIgG、0.09%のアジ化ナトリウムを含む。一態様では、コンジュゲーション反応は室温で行われる。別の態様では、コンジュゲーション反応は約37℃、約45℃又は約50℃で行われる。一態様では、コンジュゲーション反応は約37℃、約45℃又は約50℃、35℃〜約40℃、40℃〜約50℃で約20分間〜40分間行われる。一態様では、コンジュゲーション反応は約37℃、約45℃又は約50℃で約20分間〜40分間行われる。別の態様では、コンジュゲーション反応は約45℃で約30分間行われる。
第2の抗体とのコンジュゲーション後、サンプルを塩基性の(based)洗浄バッファで洗浄する。洗浄バッファは1つ若しくは複数の洗剤を含有していても、又は洗剤を含まなくてもよい。洗浄バッファが洗剤を含有する場合、洗剤はイオン性洗剤であっても、又は非イオン性洗剤であってもよい。非イオン性洗剤の一例はTriton−Xである。洗剤は洗浄バッファ中に、約0.05%〜約1.5%、若しくは約0.075%〜約1.0%、若しくは約0.1%〜約0.75%、若しくは約0.5%、又は列挙した範囲内の任意の濃度で存在し得る。好適な洗浄バッファの一例は、40mMのTris(pH8.2)、100mMのNaCl、0.5%のTriton−X100及び0.05%のアジ化ナトリウムを含む。
第2若しくは第3、又はそれ以上の抗体に存在する標識が検出されることにより、標的核酸分子の存在が示される。様々な標識を検出する方法が当該技術分野で既知である。例えば、比色分析、放射能、表面プラズモン共鳴又は化学発光法が、例えばCoutlee et al., J. Clin. Microbiol. 27:1002-1007 (1989)(その内容全体が参照により本明細書中に援用される)によって記載されている。
本発明に従って形成した二本鎖核酸ハイブリッドを捕捉させ、二本鎖核酸ハイブリッドに特異的な抗体を用いて検出することができる。抗体は、RNA−DNA、DNA−DNA、RNA−RNA及びその模倣物等であるが、これらに限定されない二本鎖ハイブリッドに特異的であり、ここで模倣物とは、RNA−DNA、DNA−DNA又はRNA−RNAのハイブリッドと同様に振る舞う分子を指す。利用される抗二本鎖核酸ハイブリッド抗体、すなわち抗ハイブリッド抗体は、形成される二本鎖核酸ハイブリッドのタイプによって異なる。一態様では、抗ハイブリッド抗体はRNA−DNAハイブリッドに免疫特異的である。
ポリヌクレオチドプローブは、標的核酸分子とハイブリダイズ又は結合するように設計される。別の態様では、ポリヌクレオチドプローブは標的核酸分子に結合するように設計される。一態様では、プローブは、HPV及びHPV高リスク変異体とハイブリダイズ又は結合することが可能である。更なる態様では、ポリヌクレオチドプローブはHPV及びHPV高リスク変異体に特異的である。高リスク(HR)核酸プローブは、高リスクHPV16型、18型、26型、31型、33型、35型、39型、45型、51型、52型、56型、58型、59型、66型、68型、73型及び82型のプローブを含み得る。別の態様では、高リスク核酸プローブは、高リスクHPV16型、18型、31型、33型、35型、39型、45型、51型、52型、56型、58型、59型、66型、68型及び82型のプローブを含み得る。他の態様では、RNAプローブ又はDNAプローブは断片である。一態様では、プローブは長さ約6キロベース〜約8キロベース、約7.5キロベースであり、BLUESCRIPTベクターを用いたプラスミド鋳型を用いて作製することができる。しかしながら、他のプラスミド、ベクター及び方法が当該技術分野で既知であり、同様に本明細書中に記載のRNAプローブを作製するために使用することができる。
一態様では、戦略的に切断されたプローブは、高リスクHPV型とハイブリダイズする、結合することが可能であるか、又はそれに特異的である。別の態様では、戦略的に切断されたプローブは、高リスクHPV型とハイブリダイズする、結合することが可能であるか、又はそれに特異的であり、欠失部分は低リスクHPV型に対して高い配列同一性又は交差反応性を示す。別の態様では、戦略的に切断されたプローブは、LR型との同一性が最も高い傾向がある、HPV配列のE1位置及びE2位置の両方で切断されたものである(図1〜図9を参照されたい)。戦略的に切断されたプローブは、低リスク型と高い配列同一性を示すHPVゲノムの領域において、プラスミドのE1位置、E2位置及びL1位置で切断されていても(図1、図4、図7〜図8を参照されたい)、又はプラスミドのE1位置、E2位置及びL2位置で切断されていてもよい(図9を参照されたい)。
本発明は、HPV HRプローブセットと低リスクHPV型との間の交差反応性が、FDAに認可された標準的なHPVのアッセイ及びプローブセットと比較して劇的に低減したアッセイ組成物、プローブ及び条件も提供する。一態様では、HPV HRプローブセットは、高リスクHPV16型、18型、26型、31型、33型、35型、39型、45型、51型、52型、56型、58型、59型、66型、68型、73型及び82型、又は低リスクHPV1型、2型、3型、4型、5型、6型、8型、11型、13型、30型、34型、40型、42型、43型、44型、53型、61型、67型、69型、70型、71型、72型、74型、81型、83型、84型及び89型からなる群から選択される。本発明のアッセイをこれらのHR HPVプローブと用いると、低リスクHPV型と高リスクHPVプローブとの間の交差反応性が低減する。例えば、米国特許出願公開第12/426,076号を参照されたい。
一態様は、本明細書中に記載の方法又は組成物のいずれかを用いて実行することが可能なハイスループットアッセイ及び装置に関する。ハイスループットアッセイは、多数のサンプルを短期間で正確かつ迅速に処理することが可能である。
サンプル中の標的核酸分子の検出のためのキットであって、
a)回収媒体と、
b)変性試薬と、
c)ポリヌクレオチドプローブと、
d)第1の抗ハイブリッド抗体をコーティングしたビーズと、
e)検出可能に標識された第2の抗ポリハイブリッド抗体を含む検出試薬と、
f)洗浄バッファと、
g)第2の抗体上の標識の基質を含む第2の検出試薬と、
を含むか、それらからなるか、又はそれらから本質的になる、キットも提供する。
一態様は、本明細書中に記載の方法又は組成物のいずれかを用いて実行することが可能なハイスループット装置に関する。一態様では、本明細書中に記載の組成物、方法、アッセイ及びキットを、米国特許出願公開第12/508,304号、米国特許出願公開第12/508,306号、米国特許出願公開第12/622,131号、米国特許出願公開第12/605,540号及び同第12/605,605号(その各々の内容全体が参照により本明細書中に援用される)に記載の装置とともに使用する。米国特許出願公開第12/508,304号、米国特許出願公開第12/508,306号、米国特許出願公開第12/622,131号、米国特許出願公開第12/605,540号及び同第12/605,605号に記載の機器は広範にわたる用途を有し、多数のサンプルを短期間で正確かつ迅速に処理することが可能である。限定されるわけではないが、米国特許出願公開第12/508,304号、米国特許出願公開第12/508,306号、米国特許出願公開第12/622,131号、米国特許出願公開第12/605,540号及び同第12/605,605号に記載のシステム及び機器は、子宮頸部サンプル(例えば、子宮頸部スワブから得られるサンプル)又は子宮頸部細胞サンプル、アデノイド細胞、肛門上皮細胞、血液、唾液、脳脊髄液、胸膜液、乳汁、リンパ液、喀痰、尿及び精液、他のウイルス、細菌、抗酸菌又は変形体、例えばサイトメガロウイルス(CMV)、ヘルペスウイルス、HIVウイルス、H1N1ウイルス、クラミジア、淋菌、ナイセリア・ゴノレア(GC)、クラミジア・トラコマチス(CT)、トリコモナス・バギナリス、スタフィロコッカス・アウレウス、結核菌、SARS関連コロナウイルス又はインフルエンザウイルスのいずれか1つに関連する核酸分子を検出及び分析するために使用することができる。さらに、米国特許出願公開第12/508,304号、米国特許出願公開第12/508,306号、米国特許出願公開第12/622,131号、米国特許出願公開第12/605,540号及び同第12/605,605号に記載のシステム及び機器は、HPV、HPVの遺伝的変異体、高リスクHPV型のHPV DNA、高リスクHPV型のHPV RNA、又は高リスクHPV16型、18型、26型、31型、33型、35型、39型、45型、51型、52型、56型、58型、59型、66型、68型及び82型のいずれか1つ、又は低リスクHPV1型、2型、3型、4型、5型、6型、8型、11型、13型、30型、34型、40型、42型、43型、44型、53型、61型、67型、69型、70型、71型、72型、74型、81型、83型、84型及び89型のいずれか1つに関連する核酸分子を検出及び分析するために使用することができる。
LR−HPVと交差反応するリスクが最小のHR−HPVに特異的なプローブを生成するために、各々のHR−HPVゲノムの欠失プラスミドを生成した。これらの戦略的に切断されたプラスミドは、LR−HPV核酸と比較的高度の相同性を有する或る特定の領域を除いた各々のHR−HPVの完全長配列を含む。
15個のHR−HPV型(HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV58、HPV59、HPV66、HPV68及びHPV82)と、28個のLR−HPV型(HPV1、HPV2、HPV3、HPV4、HPV5、HPV6、HPV8、HPV11、HPV13、HPV30、HPV34、HPV40、HPV42、HPV43、HPV44、HPV53、HPV54、HPV61、HPV67、HPV69、HPV70、HPV71、HPV72、HPV74、HPV81、HPV83、HPV84及びHPV89)とを比較する配列アラインメントを行い、全体的な配列類似性を決定する。使用するHR−HPV配列及びLR−HPV配列を下記表1に記載する。
HR/LR配列アラインメントの結果に基づいて、各々のHR−HPVにおいて最も相同な領域を初めに欠失させる。関心の完全長HR−HPV配列を含むBluescriptプラスミドを、37℃で1時間メチル化する。次いで、重複増幅プライマーを用いてプラスミドを増幅する。増幅プライマーの一方は欠失に選択される標的の領域と重複するが、他方は重複しない。これにより得られる増幅産物は、欠失に選択される配列を除いた標的配列に対応する非メチル化線状アンプリコンである。次いで、標的配列及びアンプリコンを、メチル化された標的を消化し、非メチル化線状アンプリコンを環状化及び増幅する大腸菌株にトランスフェクトする。この方法の例示的なワークフローを図22〜図29に実証する。
切断プラスミドから生成したin vitro転写RNAプローブセットを、プローブセットに対する実施例1に記載の方法に従って試験し、LR−HPVとの交差反応性が低減又は排除されているか否かを決定した。第1の欠失後も顕著な交差反応性が依然として明らかな場合に第2の欠失を作り出した。欠失プライマー配列を以下の表に記載する。
二重の戦略的に切断されたHPV26プラスミドを生成するこのワークフローの一例を図19及び図20に示す。GenBankアクセッション番号X74472によるHPV26配列を保有するpBluescript II KS(+)プラスミドを、出発物質として使用した。メチル化の後、以下の欠失プライマー対を用いてプラスミドを増幅する:
フォワードプライマー(配列番号58):
5’ GTATTTCAATTGCCTGCCATGCCGTGTAACACTGTTTACATGTGTGTC 3’
リバースプライマー(配列番号118):
5’ ACGGCATGGCAGGCAATTGAAATACATATAGCATTGCAGTCG 3’
フォワードプライマー(配列番号60):
5’ GTTTCGGCCGTGTAACCAGTATGGCTTATTAAATAGTTGT 3’
リバースプライマー(配列番号119):
5’ ACTGGTTACACGGCCGAAACTAGGCACCAAACGTCCCTTA 3’
合計324個の医師によって採取された子宮頸部サンプルを、洗剤ベースの回収媒体に回収し、高リスクHPVの存在について試験した。
初期試験に続いて、サンプルを室温及び33℃で貯蔵し、サンプルの安定性を観察した。回収後21日目まで試験を行った。図3及び図4は、各々のサンプルのRLU/CO値が21日目まで経時的に変化しないことを実証する。ベースラインの結果と、21日間の貯蔵後の結果とを比較する2×2分析、及び散布図分析によって、RLU/CO値の経時的な直線性が実証された。これらのデータに基づいて、回収し、室温又は33℃で21日目まで貯蔵したサンプルが、ベースラインでの試験と同等のRLU/CO値をもたらすと結論付けることが可能である。貯蔵温度に対するRLU/CO値の線形混合モデル比較を用いると、P値は室温については0.8803、33℃で貯蔵したサンプルについては0.9517であり、これらの値が同等であることが示される。
本実施例では、検出限界(LOD)、C95濃度、並びに再設計したHYBRID CAPTURE化学、並びに高リスク(HR)及び低リスク(LR)のHPVプラスミドDNA構築物を用いた交差反応性実験について記載する。LODは、ウイルスが検出されるか否かを特定するのに必要とされるコピー数として定義される。C95濃度は、95%の時間で検体のシグナルが推定臨床カットオフを超えるか否かを特定するのに必要とされるコピー数として定義される。
本実施例は、8個の低リスクHPV型について、戦略的に切断されたプローブカクテル(B17XX)と比較した17完全長(B17FL)プローブカクテルの交差反応性の低下を実証する。低リスクHPVプラスミド30型、40型、53型、61型、67型、69型、71型及び81型を、試験される濃度:0.5ng/mL、1ng/mL及び2ng/mLで標的として使用した。結果を下記表9にまとめる。
Claims (8)
- 配列番号5、配列番号104及びそれらの相補体からなる群から選択される高リスクHPV核酸のL1、L2、E1、E2、E4、E6及びE7の各々の少なくとも100個の連続塩基に対して70%〜100%の相補性を有する少なくとも1つの配列を含み、
配列番号45、46、配列番号112及びそれらの相補体に対して70%〜100%の同一性を示す配列を含まず、低リスクHPV核酸と交差反応しない、配列番号97又はその相補体の配列から本質的になる、ポリヌクレオチドプローブ。 - 配列番号97又はその相補体の配列からなる、請求項1に記載のポリヌクレオチドプローブ。
- 請求項1又は2に記載のポリヌクレオチドプローブを断片化することによって生成される核酸プローブセット。
- 請求項1又は2に記載の少なくとも一つのポリヌクレオチドプローブを含む核酸プローブセット及び/又は請求項3に記載の核酸プローブセットを含むキット。
- サンプル中の標的核酸の存在を決定する方法であって、
a)請求項1又は2に記載の少なくとも1つのポリヌクレオチドプローブを標的核酸分子とハイブリダイズさせ、二本鎖核酸ハイブリッドを形成する、ポリヌクレオチドプローブをハイブリダイズさせることと、
b)該二本鎖核酸ハイブリッドを、二本鎖核酸ハイブリッドに特異的な第1の抗体を含む支持体上に捕捉させることと、
c)該標的核酸分子を検出することと、
を含む、サンプル中の標的核酸の存在を決定する方法。 - 二本鎖核酸ハイブリッドがDNA:RNAハイブリッドである、請求項5に記載の方法。
- 標的核酸が高リスクHPV核酸である、請求項5又は6に記載の方法。
- サンプルが生物学的サンプルである、請求項5〜7のいずれか一に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US34794110P | 2010-05-25 | 2010-05-25 | |
| US61/347,941 | 2010-05-25 | ||
| PCT/US2011/037684 WO2011149897A1 (en) | 2010-05-25 | 2011-05-24 | Fast results hybrid capture assay and associated strategically-truncated probes |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2013534810A JP2013534810A (ja) | 2013-09-09 |
| JP2013534810A5 JP2013534810A5 (ja) | 2014-05-29 |
| JP6153866B2 true JP6153866B2 (ja) | 2017-06-28 |
Family
ID=44275651
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013512140A Expired - Fee Related JP6153866B2 (ja) | 2010-05-25 | 2011-05-24 | 迅速なハイブリッド捕捉アッセイ、及び関連する戦略的に切断されたプローブ |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9376727B2 (ja) |
| EP (1) | EP2576840B1 (ja) |
| JP (1) | JP6153866B2 (ja) |
| AU (1) | AU2011258501B2 (ja) |
| CA (1) | CA2799205A1 (ja) |
| WO (1) | WO2011149897A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8877436B2 (en) | 2008-10-27 | 2014-11-04 | Qiagen Gaithersburg, Inc. | Fast results hybrid capture assay on an automated platform |
| EP2528932B1 (en) * | 2010-01-29 | 2016-11-30 | QIAGEN Gaithersburg, Inc. | Methods and compositions for sequence-specific purification and multiplex analysis of nucleic acids |
| CN105368982B (zh) | 2014-08-28 | 2019-01-29 | 杭州德同生物技术有限公司 | 一种高危型人乳头瘤病毒检测及分型方法 |
| AU2020205142A1 (en) * | 2019-01-03 | 2021-06-03 | Hangzhou New Horizon Health Technology Co. Ltd. | Compositions and methods for detecting human papillomavirus |
Family Cites Families (223)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4732847A (en) | 1981-06-09 | 1988-03-22 | University Of Hawaii | Monoclonal antibodies for DNA-RNA hybrid complexes and their uses |
| FI63596C (fi) | 1981-10-16 | 1983-07-11 | Orion Yhtymae Oy | Mikrobdiagnostiskt foerfarande som grundar sig pao skiktshybridisering av nukleinsyror och vid foerfarandet anvaenda kombinationer av reagenser |
| US4486536A (en) | 1982-05-28 | 1984-12-04 | Smithkline Diagnostics, Inc. | Specimen slide for occult blood testing |
| US4865980A (en) | 1982-12-29 | 1989-09-12 | University Of Hawaii | Monoclonal antibodies for DNA-RNA hybrid complexes and their uses |
| US5288611A (en) | 1983-01-10 | 1994-02-22 | Gen-Probe Incorporated | Method for detecting, identifying, and quantitating organisms and viruses |
| JPS60501339A (ja) | 1983-01-10 | 1985-08-22 | ジエン−プロ−ブ インコ−ポレィテッド | 生物を検出、同定又は定量する方法およびキット |
| US5200313A (en) | 1983-08-05 | 1993-04-06 | Miles Inc. | Nucleic acid hybridization assay employing detectable anti-hybrid antibodies |
| EP0144914A3 (en) | 1983-12-12 | 1986-08-13 | Miles Inc. | Hybridization assay employing labeled pairs of hybrid binding reagents |
| US4743535A (en) | 1984-11-07 | 1988-05-10 | Miles Inc. | Hybridization assay employing labeled probe and anti-hybrid |
| US7138505B1 (en) | 1984-01-12 | 2006-11-21 | Novartis Vaccines And Diagnostics, Inc. | Factor VIII:C nucleic acid molecules |
| FI71768C (fi) | 1984-02-17 | 1987-02-09 | Orion Yhtymae Oy | Foerbaettrade nykleinsyrareagenser och foerfarande foer deras framstaellning. |
| CA1260372A (en) | 1984-04-27 | 1989-09-26 | Elazar Rabbani | Hybridization method for the detection of genetic materials |
| CA1253777A (en) | 1984-06-01 | 1989-05-09 | Robert J. Carrico | Nucleic acid hybridization assay employing immobilized rna probes |
| US4563417A (en) | 1984-08-31 | 1986-01-07 | Miles Laboratories, Inc. | Nucleic acid hybridization assay employing antibodies to intercalation complexes |
| US4689294A (en) | 1984-11-19 | 1987-08-25 | Miles Laboratories, Inc. | Enhancement of hybridization of nucleic acids by anionic polymers |
| CA1276575C (fr) | 1984-11-30 | 1990-11-20 | Sylvie Beaudenon | Sondes a papillomavirus et procede de diagnostic in vitro d'infections a papillomavirus |
| US5876922A (en) | 1985-07-31 | 1999-03-02 | Institute Pasteur | Papillomavirus probe and a process for in vitro diagnosis of papillomavirus infections |
| US5411857A (en) | 1985-07-31 | 1995-05-02 | Institut Nationale De La Sante | Probes for papillomaviruses and an in vitro diagnostic procedure for papilloma infections |
| US4751177A (en) | 1985-06-13 | 1988-06-14 | Amgen | Methods and kits for performing nucleic acid hybridization assays |
| ES8707343A1 (es) | 1985-06-13 | 1987-07-16 | Amgen | Un metodo para aislar una secuencia de acido nucleico objetivo seleccionada |
| US4868105A (en) | 1985-12-11 | 1989-09-19 | Chiron Corporation | Solution phase nucleic acid sandwich assay |
| WO1987005630A1 (en) | 1986-03-21 | 1987-09-24 | Institut Pasteur | Determined dna sequences derived from a papillomavirus genome, their uses for in vitro diagnostic purposes and the production of antigenic compositions |
| US5750338A (en) | 1986-10-23 | 1998-05-12 | Amoco Corporation | Target and background capture methods with amplification for affinity assays |
| WO1988003957A1 (en) | 1986-11-24 | 1988-06-02 | Gen-Probe Incorporated | Nucleic acid probes for detection and/or quantitation of non-viral organisms |
| AU619170B2 (en) | 1987-01-09 | 1992-01-23 | Abbott Laboratories | Diagnostic assays using nucleic acid probes |
| DE3853678T2 (de) | 1987-02-26 | 1995-08-31 | Univ Sydney | Verfahren zum nachweis des karzinogenen menschlichen papillomavirus. |
| AU601021B2 (en) | 1987-03-11 | 1990-08-30 | Molecular Diagnostics, Inc. | Assay for necleic acid sequences in a sample |
| IL85551A0 (en) | 1987-04-01 | 1988-08-31 | Miles Inc | Rapid hybridization assay and reagent system used therein |
| DE3722968A1 (de) | 1987-07-11 | 1989-01-19 | Behringwerke Ag | Humaner papillomvirus typ 41, seine dna und die dafuer kodierenden proteine |
| US5656731A (en) | 1987-10-15 | 1997-08-12 | Chiron Corporation | Nucleic acid-amplified immunoassay probes |
| US5082830A (en) | 1988-02-26 | 1992-01-21 | Enzo Biochem, Inc. | End labeled nucleotide probe |
| DE68916671T2 (de) | 1988-03-18 | 1995-03-02 | Baylor College Medicine | Mutationsnachweis durch kompetitiven Oligonukleotid-Priming. |
| US5374524A (en) | 1988-05-10 | 1994-12-20 | E. I. Du Pont De Nemours And Company | Solution sandwich hybridization, capture and detection of amplified nucleic acids |
| FR2632956B2 (fr) | 1988-05-13 | 1991-07-12 | Pasteur Institut | Sondes a papillomavirus hpv49, hpv50, hpv54, hpv55; produits genetiquement et immunologiquement lies a ce papillomavirus hpv49, hpv50, hpv54, hpv55; procede de diagnostic in vitro d'infections a papillomavirus et d'immunisation in vivo contre ces papillomavirus |
| NO165894C (no) | 1988-05-24 | 1991-04-24 | Gunnar Paulsen | Analysemetode for gener. |
| DE3826793A1 (de) | 1988-08-06 | 1990-03-08 | Behringwerke Ag | Humaner papillomvirus typ 57, seine dna und die davon kodierten proteine |
| US5447839A (en) | 1988-09-09 | 1995-09-05 | Hoffmann-La Roche Inc. | Detection of human papillomavirus by the polymerase chain reaction |
| US5639871A (en) | 1988-09-09 | 1997-06-17 | Roche Molecular Systems, Inc. | Detection of human papillomavirus by the polymerase chain reaction |
| US5182377A (en) | 1988-09-09 | 1993-01-26 | Hoffmann-La Roche Inc. | Probes for detection of human papillomavirus |
| DE3856224T2 (de) | 1988-09-29 | 1998-12-03 | Chiron Corp., Emeryville, Calif. | Nachweis eines Polynukleotids durch Ersätzung einer Kette an einer Fangsonde |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5077192A (en) | 1988-10-25 | 1991-12-31 | The General Hospital Corporation | Method of detecting antigenic, nucleic acid-containing macromolecular entities |
| CA1339729C (en) | 1988-10-26 | 1998-03-17 | Wayne D. Lancaster | Human papillomavirus type 52 dna sequences and methods for employing thesame |
| DE3838269A1 (de) | 1988-11-11 | 1990-05-17 | Behringwerke Ag | Nachweis humaner papillomavirus dna und ihrer expression in zervix-abstrichen |
| AU5269590A (en) | 1989-03-10 | 1990-10-09 | Gene-Trak Systems | Immobilized oligonucleotide probes and uses therefor |
| US5106727A (en) | 1989-04-27 | 1992-04-21 | Life Technologies, Inc. | Amplification of nucleic acid sequences using oligonucleotides of random sequences as primers |
| US5863717A (en) | 1989-11-03 | 1999-01-26 | Abbott Laboratories | Use of conserved oligonucleotide primers to amplify human papillomavirus DNA sequences |
| EP0502994B1 (en) | 1989-12-01 | 1995-09-06 | Amoco Corporation | Detection of hpv transcripts |
| US5580970A (en) | 1989-12-01 | 1996-12-03 | Amoco Corporation | Detection of HPV transcripts |
| US6174870B1 (en) | 1989-12-04 | 2001-01-16 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide inhibition of papillomavirus |
| US5811232A (en) | 1989-12-04 | 1998-09-22 | Isis Pharmaceuticals, Inc. | Oligonucleotides for Papillomavirus |
| US5756282A (en) | 1989-12-04 | 1998-05-26 | Isis Pharmaceuticals, Inc. | Oligonucleotides for the diagnosis of papillomavirus |
| NL9000134A (nl) | 1990-01-19 | 1991-08-16 | Stichting Res Fonds Pathologie | Primers en werkwijze voor het detecteren van humaan papilloma virus genotypen m.b.v. pcr. |
| US5427930A (en) | 1990-01-26 | 1995-06-27 | Abbott Laboratories | Amplification of target nucleic acids using gap filling ligase chain reaction |
| CA2039517C (en) | 1990-04-03 | 2006-11-07 | David Segev | Dna probe signal amplification |
| US5695926A (en) | 1990-06-11 | 1997-12-09 | Bio Merieux | Sandwich hybridization assays using very short capture probes noncovalently bound to a hydrophobic support |
| GB9015845D0 (en) | 1990-07-19 | 1990-09-05 | Emery Vincent C | Diagnostic method |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5484699A (en) | 1990-09-28 | 1996-01-16 | Abbott Laboratories | Nucleotide sequences useful as type specific probes, PCR primers and LCR probes for the amplification and detection of human papilloma virus, and related kits and methods |
| WO1992008808A1 (en) | 1990-11-14 | 1992-05-29 | Siska Diagnostics, Inc. | Non-isotopic detection of nucleic acids using a polystyrene support-based sandwich hybridization assay and compositions useful therefor |
| US6582908B2 (en) * | 1990-12-06 | 2003-06-24 | Affymetrix, Inc. | Oligonucleotides |
| EP0566670A4 (en) | 1990-12-17 | 1993-12-08 | Idexx Laboratories, Inc. | Nucleic acid sequence detection by triple helix formation |
| FR2670797A1 (fr) * | 1990-12-20 | 1992-06-26 | Pasteur Institut | Sequences d'adn determinees derivees du genome du papillomavirus hpv39, application de ces sequences au diagnostic in vitro d'infection par ce papillomavirus, et a la production de composition immunogene. |
| US5219990A (en) | 1991-01-28 | 1993-06-15 | Biogen, Inc. | Papillomavirus e2 trans-activation repressors |
| GB9105383D0 (en) | 1991-03-14 | 1991-05-01 | Immunology Ltd | An immunotherapeutic for cervical cancer |
| FR2678284B1 (fr) | 1991-06-28 | 1993-10-08 | Pasteur Institut | Sequences d'adn derivees du genome du papillomavirus hpv42, application de ces sequences au diagnostic in vitro d'infection par ce papillomavirus et a la production de compositions immunogenes. |
| DE122007000017I1 (de) | 1991-07-19 | 2007-07-26 | Univ Queensland | Impfstoffe gegen Papillomavirus |
| US5543294A (en) | 1991-07-19 | 1996-08-06 | The Trustees Of Columbia University In The City Of New York | Polymerase chain reaction/restriction fragment length polymorphism method for the detection and typing of myobacteria |
| US5346811A (en) | 1991-07-22 | 1994-09-13 | Cerveceria Polar | Method and products for human papillomavirus detection |
| US5556748A (en) | 1991-07-30 | 1996-09-17 | Xenopore Corporation | Methods of sandwich hybridization for the quantitative analysis of oligonucleotides |
| US5981179A (en) | 1991-11-14 | 1999-11-09 | Digene Diagnostics, Inc. | Continuous amplification reaction |
| AU673813B2 (en) | 1991-11-14 | 1996-11-28 | Qiagen Gaithersburg, Inc. | Non-radioactive hybridization assay and kit |
| US5506105A (en) | 1991-12-10 | 1996-04-09 | Dade International Inc. | In situ assay of amplified intracellular mRNA targets |
| US5424413A (en) | 1992-01-22 | 1995-06-13 | Gen-Probe Incorporated | Branched nucleic acid probes |
| US5437951A (en) | 1992-09-03 | 1995-08-01 | The United States Of America As Represented By The Department Of Health And Human Services | Self-assembling recombinant papillomavirus capsid proteins |
| WO1994006859A1 (en) | 1992-09-15 | 1994-03-31 | The Dow Chemical Company | Impact modification of thermoplastics |
| JPH08503606A (ja) | 1992-10-09 | 1996-04-23 | アモコ・コーポレーション | 検定法 |
| AU6031094A (en) | 1993-01-15 | 1994-08-15 | Public Health Research Institute Of The City Of New York, Inc., The | Sensitive nucleic acid sandwich hybridization assays and kits |
| US6495676B1 (en) | 1993-04-13 | 2002-12-17 | Naxcor | Nucleic acid sequence detection employing probes comprising non-nucleosidic coumarin derivatives as polynucleotide-crosslinking agents |
| US6277570B1 (en) | 1993-04-13 | 2001-08-21 | Naxcor | Nucleic acid sequence detection employing probes comprising non-nucleosidic coumarin derivatives as polynucleotide-crosslinking agents |
| KR100189229B1 (ko) | 1993-07-23 | 1999-06-01 | 다니엘 엘. 캐시앙, 헨리 엘. 노르호프 | 핵산 증폭을 강화하는 방법 |
| DE4331012A1 (de) | 1993-09-13 | 1995-03-16 | Bayer Ag | Nukleinsäuren-bindende Oligomere mit N-Verzweigung für Therapie und Diagnostik |
| US5679509A (en) | 1993-09-28 | 1997-10-21 | University Of New Mexico | Methods and a diagnostic aid for distinguishing a subset of HPV that is associated with an increased risk of developing cervical dysplasia and cervical cancer |
| US5681697A (en) | 1993-12-08 | 1997-10-28 | Chiron Corporation | Solution phase nucleic acid sandwich assays having reduced background noise and kits therefor |
| DK145493D0 (da) | 1993-12-23 | 1993-12-23 | Dako As | Antistof |
| AUPM358894A0 (en) | 1994-01-31 | 1994-02-24 | Csl Limited | Modified papilloma virus l2 protein and vlps formed therefrom |
| CA2183154A1 (en) | 1994-02-14 | 1995-08-17 | Nicholas John Deacon | Non-pathogenic strains of hiv-1 |
| AU685233B2 (en) | 1994-02-21 | 1998-01-15 | Stichting Researchfonds Pathologie | Human papilloma virus detection in a nucleic acid amplification process using general primers |
| DE4415743C2 (de) | 1994-05-04 | 1996-10-10 | Deutsches Krebsforsch | Papillomviren, Mittel zu deren Nachweis sowie zur Therapie von durch sie verursachten Erkrankungen |
| AUPM566794A0 (en) | 1994-05-17 | 1994-06-09 | University Of Queensland, The | Process and product |
| US6045995A (en) | 1994-08-24 | 2000-04-04 | Isis Pharmaceuticals, Inc. | Capillary electrophoretic detection of nucleic acids |
| US5622822A (en) | 1994-09-13 | 1997-04-22 | Johnson & Johnson Clinical Diagnostics, Inc. | Methods for capture and selective release of nucleic acids using polyethyleneimine and an anionic phosphate ester surfactant and amplification of same |
| US5582988A (en) | 1994-09-15 | 1996-12-10 | Johnson & Johnson Clinical Diagnostics, Inc. | Methods for capture and selective release of nucleic acids using weakly basic polymer and amplification of same |
| EP0782615A4 (en) | 1994-09-22 | 2001-08-22 | Merck & Co Inc | DNA ENCODING FOR HUMAN PAPILLOMAVIRUS TYPE 6A |
| JP3093116B2 (ja) | 1994-09-30 | 2000-10-03 | 株式会社豊田中央研究所 | 核酸検出方法 |
| GB9420146D0 (en) | 1994-10-06 | 1994-11-23 | Cancer Res Campaign Tech | Papillomavirus vaccine |
| US6057099A (en) | 1994-12-02 | 2000-05-02 | Intelligene Ltd. | Detection of nucleic acid sequences |
| US20030104361A1 (en) | 1997-09-29 | 2003-06-05 | Susan Weininger | Method of detection of nucleic acids with a specific sequence composition |
| US5731153A (en) | 1996-08-26 | 1998-03-24 | The Regents Of The University Of California | Identification of random nucleic acid sequence aberrations using dual capture probes which hybridize to different chromosome regions |
| US5888724A (en) | 1995-02-17 | 1999-03-30 | The Trustees Of Columbia University In The City Of New York | Detection of high oncogenic-risk papilloma virus in high grade cervical lesions and cancers by a PCR/ELISA assay |
| DE19506561C1 (de) | 1995-02-24 | 1996-10-10 | Deutsches Krebsforsch | Verfahren zur Früherkennung von HPV-assoziierten Karzinomen bzw. von hochgradigen, durch HPV-verursachten Dysplasien |
| US5840306A (en) | 1995-03-22 | 1998-11-24 | Merck & Co., Inc. | DNA encoding human papillomavirus type 18 |
| US5820870A (en) | 1995-03-22 | 1998-10-13 | Merck & Co., Inc. | Recombinant human papillomavirus type 18 vaccine |
| IL117591A0 (en) | 1995-03-30 | 1996-07-23 | Merck & Co Inc | Synthetic DNA encoding human papillomavirus type 11 L1 protein |
| US6509149B2 (en) | 1995-06-06 | 2003-01-21 | Hybridon, Inc. | HPV-specific oligonucleotides |
| US6458940B2 (en) | 1995-06-06 | 2002-10-01 | Hybridon, Inc. | HPV-specific oligonucleotides |
| EP0832280A2 (en) | 1995-06-07 | 1998-04-01 | Abbott Laboratories | Probe masking method of reducing background in an amplification reaction |
| DE19526386C1 (de) | 1995-07-19 | 1997-01-02 | Deutsches Krebsforsch | Papillomviren, Mittel zu deren Nachweis sowie zur Therapie von durch sie verursachten Erkrankungen |
| FR2737502B1 (fr) | 1995-07-31 | 1997-10-24 | Genset Sa | Procede de detection d'acides nucleiques utilisant des sondes nucleotidiques permettant a la fois une capture specifique et une detection |
| WO1997018334A2 (en) | 1995-11-15 | 1997-05-22 | Gen-Probe Incorporated | Nucleic acid probes complementary to human papillomavirus nucleic acid and related methods and kits |
| US5888736A (en) | 1995-12-22 | 1999-03-30 | Visible Genetics, Inc. | Method, compositions and kit for detection and identification of microorganisms |
| EP1958955B1 (en) | 1996-02-09 | 2013-09-04 | Cornell Research Foundation, Inc. | Spatially addressable oligonucleotide arrays and method of making the same |
| US6852487B1 (en) | 1996-02-09 | 2005-02-08 | Cornell Research Foundation, Inc. | Detection of nucleic acid sequence differences using the ligase detection reaction with addressable arrays |
| US5981173A (en) | 1996-02-14 | 1999-11-09 | Institut Pasteur | Genital human papillomavirus type 68a (HPV-68a), related to the potentially oncogenic HPV-39 |
| US6511805B1 (en) | 1996-03-15 | 2003-01-28 | The Penn State Research Foundation | Methods for detecting papillomavirus DNA in blood plasma and serum |
| US6214555B1 (en) | 1996-05-01 | 2001-04-10 | Visible Genetics Inc. | Method compositions and kit for detection |
| WO1998001148A1 (en) | 1996-07-09 | 1998-01-15 | President And Fellows Of Harvard College | Use of papillomavirus e2 protein in treating papillomavirus-infected cells and compositions containing the protein |
| US6218105B1 (en) | 1996-07-19 | 2001-04-17 | Kathleen S. Hall | High throughput papilloma virus in vitro infectivity assay |
| US5853993A (en) | 1996-10-21 | 1998-12-29 | Hewlett-Packard Company | Signal enhancement method and kit |
| US6265154B1 (en) | 1996-10-25 | 2001-07-24 | Abbott Laboratories | Nucleic acid primers and probes for detecting oncogenic human papillomaviruses |
| US6117631A (en) | 1996-10-29 | 2000-09-12 | Polyprobe, Inc. | Detection of antigens via oligonucleotide antibody conjugates |
| GB9624165D0 (en) | 1996-11-19 | 1997-01-08 | Amdex A S | Use of nucleic acids bound to carrier macromolecules |
| DE19648962C1 (de) | 1996-11-26 | 1998-02-26 | Deutsches Krebsforsch | Papillomviren, Mittel zu deren Nachweis sowie zur Therapie von durch sie verursachten Erkrankungen |
| US6388065B1 (en) | 1996-11-27 | 2002-05-14 | Deutsches Krebsforschungszentrum Stiftung Des Offentlichen Rechts | DNA for evaluating the progression potential of cervical lesions |
| US6110676A (en) | 1996-12-04 | 2000-08-29 | Boston Probes, Inc. | Methods for suppressing the binding of detectable probes to non-target sequences in hybridization assays |
| US20020034737A1 (en) | 1997-03-04 | 2002-03-21 | Hyseq, Inc. | Methods and compositions for detection or quantification of nucleic acid species |
| DE19712541C1 (de) | 1997-03-25 | 1998-11-05 | Deutsches Krebsforsch | Papillomviren, Mittel zu deren Nachweis sowie zur Therapie von durch sie verursachten Erkrankungen |
| US5843995A (en) | 1997-07-07 | 1998-12-01 | University Of Medicine And Dentistry Of New Jersey | Inhibition of HIV-1 replication using oligocarbamate derivatives |
| DE19735118C1 (de) | 1997-08-13 | 1998-08-13 | Deutsches Krebsforsch | Papillomviren, Mittel zu deren Nachweis sowie zur Therapie von durch sie verursachten Erkrankungen |
| PT1012348E (pt) | 1997-09-16 | 2002-11-29 | Innogenetics Nv | Deteccao do virus do papiloma humano por pcr e hibridacao reversa tipo-especifica |
| US6013258A (en) | 1997-10-09 | 2000-01-11 | Zycos Inc. | Immunogenic peptides from the HPV E7 protein |
| CA2312779A1 (en) | 1997-11-04 | 1999-05-20 | Roche Diagnostics Gmbh | Specific and sensitive nucleic acid detection method |
| CA2313641A1 (en) | 1997-12-12 | 1999-06-24 | Digene Corporation | Universal collection medium |
| US20030096232A1 (en) | 1997-12-19 | 2003-05-22 | Kris Richard M. | High throughput assay system |
| WO1999032654A1 (en) | 1997-12-22 | 1999-07-01 | Hitachi Chemical Co., Ltd. | Direct rt-pcr on oligonucleotide-immobilized pcr microplates |
| WO1999036571A2 (en) | 1998-01-13 | 1999-07-22 | Biochip Technologies Gmbh | Method for the detection or nucleic acid of nucleic acid sequences |
| US5994079A (en) | 1998-02-06 | 1999-11-30 | Digene Corporation | Direct detection of RNA mediated by reverse transcriptase lacking RNAse H function |
| US7399589B2 (en) | 1998-02-06 | 2008-07-15 | Digene Corporation | Immunological detection of RNA:DNA hybrids on microarrays |
| US6686151B1 (en) | 1998-02-06 | 2004-02-03 | Digene Corporation | Immunological detection of RNA:DNA hybrids on microarrays |
| CA2229955C (en) | 1998-02-20 | 2003-12-09 | Medigene Gmbh | Papilloma virus capsomere vaccine formulations and methods of use |
| US20020039584A1 (en) | 1998-02-20 | 2002-04-04 | Medigene Ag | Papilloma virus capsomere vaccine formulations and methods of use |
| DE69820853T2 (de) | 1998-03-23 | 2004-11-18 | Spal S.R.L., Correggio | Axiallüfter |
| US6183956B1 (en) | 1998-03-31 | 2001-02-06 | Tularik, Incorporated | High throughput in vitro screening assays for transcription modulators |
| US6045993A (en) | 1998-05-30 | 2000-04-04 | Visible Genetics Inc. | Method, reagent and kit for genotyping of human papillomavirus |
| US6284532B1 (en) | 1998-08-17 | 2001-09-04 | Indiana University | Purified human papillomavirus |
| DE19840263C1 (de) | 1998-09-03 | 2000-05-25 | Deutsches Krebsforsch | Papillomviren, Mittel zu deren Nachweis sowie zur Therapie von durch sie verursachten Erkrankungen |
| EP1728865A1 (en) | 1998-09-04 | 2006-12-06 | Aventis Pasteur Limited | Treatment of cervical cancer |
| US7569344B2 (en) | 1998-10-26 | 2009-08-04 | Ventana Medical Systems, Inc. | Detection of human papilloma virus in papanicolaou (Pap) smears |
| US6951722B2 (en) | 1999-03-19 | 2005-10-04 | Takara Bio Inc. | Method for amplifying nucleic acid sequence |
| US20010055766A1 (en) | 1999-04-02 | 2001-12-27 | Alexander Aristarkhov | Immunosorbant assay using branched bis-biotin/avidin/multiple label complex as a detection reagent |
| WO2000060116A1 (en) | 1999-04-02 | 2000-10-12 | Tropix, Inc. | High throughput and high sensitivity detection assays |
| NZ514662A (en) | 1999-04-07 | 2004-01-30 | Sankyo Co | Amine derivatives |
| US6544732B1 (en) | 1999-05-20 | 2003-04-08 | Illumina, Inc. | Encoding and decoding of array sensors utilizing nanocrystals |
| US6420106B1 (en) | 1999-06-09 | 2002-07-16 | Quantovir Ab | Method and kit for early cancer prediction |
| US7001995B1 (en) | 1999-08-25 | 2006-02-21 | Merck & Co., Inc. | Synthetic human papillomavirus genes |
| US6200746B1 (en) | 1999-08-25 | 2001-03-13 | Pharmacia & Upjohn Company | Methods of identifying anti-viral agents |
| US20060275784A1 (en) * | 1999-10-26 | 2006-12-07 | Ventana Medical Systems, Inc. | Detection of Human Papilloma Virus in Papanicolaou (Pap) Smears |
| US6893819B1 (en) | 2000-11-21 | 2005-05-17 | Stratagene California | Methods for detection of a nucleic acid by sequential amplification |
| DE10009143B4 (de) | 2000-02-26 | 2012-04-26 | Eberhard-Karls-Universität Tübingen Universitätsklinikum | Nachweis von Humanen Papillomviren |
| KR100382703B1 (ko) | 2000-03-15 | 2003-05-09 | 주식회사 바이오메드랩 | 인유두종바이러스의 유전형 진단키트 및 상기 진단키트의제조방법 |
| US6936443B2 (en) | 2000-04-03 | 2005-08-30 | Cytyc Corporation | Detection and typing of human papillomavirus using PNA probes |
| US7510834B2 (en) | 2000-04-13 | 2009-03-31 | Hidetoshi Inoko | Gene mapping method using microsatellite genetic polymorphism markers |
| EP1290225A4 (en) | 2000-05-20 | 2004-09-15 | Univ Michigan | METHOD FOR PRODUCING A DNA BANK BY POSITIONAL REPRODUCTION |
| US6331423B1 (en) | 2000-06-01 | 2001-12-18 | Pe Corporation (Ny) | Isolated human kinase proteins, nucleic acid molecules encoding human kinase proteins, and uses thereof |
| EP1287165B1 (en) | 2000-06-02 | 2007-06-13 | Bayer Corporation | Method for detection and localization of genes in situ using branched-DNA hybridisation |
| US7439016B1 (en) | 2000-06-15 | 2008-10-21 | Digene Corporation | Detection of nucleic acids by type-specific hybrid capture method |
| US7601497B2 (en) | 2000-06-15 | 2009-10-13 | Qiagen Gaithersburg, Inc. | Detection of nucleic acids by target-specific hybrid capture method |
| EP1305450A2 (en) | 2000-07-28 | 2003-05-02 | Compugen Inc. | Oligonucleotide library for detecting rna transcripts and splice variants that populate a transcriptome |
| US6329152B1 (en) | 2000-11-30 | 2001-12-11 | Bruce K. Patterson | Process for detecting low abundance RNA in intact cells |
| US6803200B2 (en) | 2000-12-12 | 2004-10-12 | Invitrogen Corporation | Compositions and methods for the release of nucleic acid molecules from solid matrices |
| ES2322841T3 (es) | 2001-02-16 | 2009-06-30 | Promega Corporation | Aislamiento y purificacion magnetica de acidos nucleicos. |
| US6670150B1 (en) | 2001-05-10 | 2003-12-30 | Applera Corporation | Isolated human receptor proteins, nucleic acid molecules encoding human receptor proteins, and uses thereof |
| US6884605B2 (en) | 2001-08-09 | 2005-04-26 | Board Of Trustees Of The University Of Arkansas | Compositions, methods and products comprising human papillomavirus for detecting and treating a cancer |
| SI1421200T1 (sl) | 2001-08-23 | 2007-04-30 | Merck & Co Inc | Poskusi PCR fluorescentnih multipleks HPV-jev z uporabo vec fluoroforov |
| KR100452163B1 (ko) | 2001-09-14 | 2004-10-12 | 주식회사 바이오메드랩 | 인유두종 바이러스의 감염을 진단하기 위한 유전형 분석키트 |
| US20050032105A1 (en) | 2001-10-12 | 2005-02-10 | Bair Robert Jackson | Compositions and methods for using a solid support to purify DNA |
| US6977148B2 (en) | 2001-10-15 | 2005-12-20 | Qiagen Gmbh | Multiple displacement amplification |
| DE60311961T2 (de) | 2002-01-07 | 2007-10-18 | Norchip A/S | Detektionsverfahren für papillomavirus mrna |
| US20040121465A1 (en) | 2002-02-14 | 2004-06-24 | Novavax, Inc. | Optimization of gene sequences of virus-like particles for expression in insect cells |
| HUP0200981A3 (en) | 2002-03-14 | 2004-06-28 | Genoid Kft | Pcr reactions with hybridizing probes using primers with broad genotype-specificity for detection of human papilloma-viruses and typing amplificates by using specifically hybridizing oligonucleotides |
| DE60320244T2 (de) | 2002-04-16 | 2009-06-25 | Autogenomics, Inc., Carlsbad | Detektion von humanem papillomavirus mit hilfe eines dna-mikroarrays |
| AU2003232951B2 (en) | 2002-05-17 | 2009-07-23 | University Of Cape Town | Chimaeric human papillomavirus 16 L1 proteins comprising an L2 peptide, virus-like particles prepared therefrom and a method for preparing the particles. |
| JP2005537028A (ja) | 2002-06-26 | 2005-12-08 | ザ ペン ステート リサーチ ファウンデーション | ヒト乳頭腫ウイルス感染症を治療する方法及び材料 |
| SE0202896D0 (sv) | 2002-10-01 | 2002-10-01 | Quantovir Ab | Method for estimating the risk of carcinoma development |
| JP4755422B2 (ja) | 2002-10-03 | 2011-08-24 | ワイス・ホールディングズ・コーポレイション | ヒトパピローマウイルス・ポリペプチドおよび免疫原性組成物 |
| WO2004061125A2 (en) | 2002-12-31 | 2004-07-22 | Mmi Genomics, Inc. | Compositions, methods and systems for inferring bovine traits |
| ES2381964T3 (es) | 2003-03-24 | 2012-06-04 | Merck Sharp & Dohme Corp. | Expresión optimizada de L1 de VPH 31 en levadura |
| JP2006521092A (ja) | 2003-04-04 | 2006-09-21 | エフ.ホフマン−ラ ロシュ アーゲー | マルチカラーリアルタイムpcr用の改良されたシステム |
| US7129260B2 (en) | 2003-06-02 | 2006-10-31 | Abbott Laboratories | Isoindolinone kinase inhibitors |
| US20040248107A1 (en) | 2003-06-09 | 2004-12-09 | Sokolova Irina A. | Detection of high grade dysplasia in cervical cells |
| US8048627B2 (en) | 2003-07-05 | 2011-11-01 | The Johns Hopkins University | Method and compositions for detection and enumeration of genetic variations |
| DE60300339T2 (de) | 2003-08-25 | 2006-04-13 | Mtm Laboratories Ag | Verfahren zum Nachweis von Karzinomen in solubilisierten zervikalen Körperproben |
| CA2539703C (en) | 2003-09-25 | 2011-06-07 | Third Wave Technologies, Inc. | Detection of human papilloma virus (hpv) utilizing invasive cleavage structure assays |
| MY140664A (en) | 2003-09-29 | 2010-01-15 | Merck Sharp & Dohme | Optimized expression of hpv 45 l1 in yeast |
| WO2005033333A2 (en) * | 2003-10-07 | 2005-04-14 | Dako Denmark A/S | Methods and compositions for the diagnosis of cancer |
| US8012944B2 (en) | 2003-10-30 | 2011-09-06 | Pharmascience Inc. | Method for treating cancer using IAP antisense oligomer and chemotherapeutic agent |
| MY139500A (en) | 2003-11-12 | 2009-10-30 | Merck Sharp & Dohme | Optimized expression of hpv 58 l1 in yeast |
| JP2005243132A (ja) | 2004-02-26 | 2005-09-08 | Renesas Technology Corp | 半導体装置 |
| CA2560487C (en) | 2004-03-24 | 2013-01-29 | Merck & Co., Inc. | Optimized expression of hpv 52 l1 in yeast |
| CN1690223B (zh) | 2004-04-27 | 2010-05-05 | 亚能生物技术(深圳)有限公司 | 人乳头瘤病毒分型基因芯片检测系统 |
| US7482142B1 (en) | 2004-05-07 | 2009-01-27 | Roche Molecular Systems, Inc. | High-risk human papillomavirus detection |
| ES2787454T3 (es) | 2004-09-30 | 2020-10-16 | Epigenomics Ag | Método para proveer fragmentos de ADN derivados de una muestra archivada |
| US7670774B2 (en) | 2004-10-04 | 2010-03-02 | Goodgene Inc. | Probe of human papillomavirus and DNA chip comprising the same |
| JP5020825B2 (ja) | 2004-12-08 | 2012-09-05 | ジェン−プローブ・インコーポレーテッド | 複数型のヒトパピローマウイルスに由来する核酸の検出 |
| CN101151379A (zh) | 2005-01-14 | 2008-03-26 | 密执安州立大学董事会 | 检测生物样品中的人乳头瘤病毒的系统、方法和组合物 |
| US20060240449A1 (en) | 2005-01-19 | 2006-10-26 | Mcglennen Ronald C | Methods and compositions for preparation of biological samples |
| US7524631B2 (en) | 2005-02-02 | 2009-04-28 | Patterson Bruce K | HPV E6, E7 mRNA assay and methods of use thereof |
| EP1928560A2 (en) | 2005-04-06 | 2008-06-11 | Verenium Corporation | Enzymes and formulations for broad-specificity decontamination of chemical and biological warfare agents |
| US7803541B2 (en) | 2005-05-12 | 2010-09-28 | Panomics, Inc. | Multiplex branched-chain DNA assays |
| WO2007130519A2 (en) | 2006-05-02 | 2007-11-15 | Government Of The Usa, As Represented By The Secretary, Department Of Health And Human Services | Viral nucleic acid microarray and method of use |
| JP2009536958A (ja) | 2006-05-11 | 2009-10-22 | ベクトン・ディキンソン・アンド・カンパニー | 細胞からのタンパク質抽出方法 |
| JPWO2008139938A1 (ja) | 2007-05-02 | 2010-08-05 | 国立大学法人 東京医科歯科大学 | ヒトパピローマウイルス16型遺伝子を標的とする二本鎖核酸分子及びそれを含む医薬 |
| US8623599B2 (en) | 2007-06-08 | 2014-01-07 | Epigenomics Ag | Method for methylation analysis |
| CN101177701B (zh) | 2007-09-29 | 2010-08-18 | 潮州凯普生物化学有限公司 | 人乳头状瘤病毒基因分型检测试剂盒及其基因芯片制备方法 |
| JP2009106220A (ja) | 2007-10-31 | 2009-05-21 | Genodive Pharma Kk | 基板上での等温増幅反応による標的塩基配列の捕捉及び検出方法 |
| DK2209920T3 (en) | 2007-11-01 | 2016-08-15 | Self-Screen B V | NEW CERVIX-HPV DETECTION PROCEDURE |
| WO2009123996A2 (en) | 2008-03-31 | 2009-10-08 | The Ohio State University Research Foundation | Hybridization quantitation method for modified micro-rna and -dna based oligonucleotides |
| WO2010004251A1 (en) | 2008-06-16 | 2010-01-14 | Oncomethylome Sciences Sa | Dna methylomes |
| WO2010028382A2 (en) | 2008-09-05 | 2010-03-11 | Mayo Foundation For Medical Education And Research | Collecting and processing complex macromolecular mixtures |
| US9090948B2 (en) | 2008-09-30 | 2015-07-28 | Abbott Molecular Inc. | Primers and probes for detecting human papillomavirus and human beta globin sequences in test samples |
| US8877436B2 (en) * | 2008-10-27 | 2014-11-04 | Qiagen Gaithersburg, Inc. | Fast results hybrid capture assay on an automated platform |
| EP2184368A1 (en) | 2008-11-07 | 2010-05-12 | DKFZ Deutsches Krebsforschungszentrum | Diagnostic transcript and splice patterns of HPV16 in different cervical lesions |
| CA2760542A1 (en) | 2009-05-01 | 2010-11-04 | Qiagen Gaithersburg, Inc. | A non-target amplification method for detection of rna splice-forms in a sample |
-
2011
- 2011-05-24 US US13/114,344 patent/US9376727B2/en not_active Expired - Fee Related
- 2011-05-24 CA CA2799205A patent/CA2799205A1/en not_active Abandoned
- 2011-05-24 EP EP11726003.4A patent/EP2576840B1/en not_active Not-in-force
- 2011-05-24 WO PCT/US2011/037684 patent/WO2011149897A1/en active Application Filing
- 2011-05-24 AU AU2011258501A patent/AU2011258501B2/en not_active Ceased
- 2011-05-24 JP JP2013512140A patent/JP6153866B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| WO2011149897A1 (en) | 2011-12-01 |
| JP2013534810A (ja) | 2013-09-09 |
| US9376727B2 (en) | 2016-06-28 |
| EP2576840A1 (en) | 2013-04-10 |
| CA2799205A1 (en) | 2011-12-01 |
| EP2576840B1 (en) | 2018-10-17 |
| AU2011258501B2 (en) | 2016-07-07 |
| AU2011258501A1 (en) | 2013-01-10 |
| US20120004128A1 (en) | 2012-01-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI417389B (zh) | 於自動平台上之快速結果雜交捕捉法 | |
| JP6104296B2 (ja) | 標的核酸の存在を判別するための合成プローブを用いた組成物、方法、およびキット | |
| US9689047B2 (en) | Methods and compositions for sequence-specific purification and multiplex analysis of nucleic acids | |
| JP2012506705A5 (ja) | ||
| EP2529031B1 (en) | Method of determining and confirming the presence of hpv in a sample | |
| JP6153866B2 (ja) | 迅速なハイブリッド捕捉アッセイ、及び関連する戦略的に切断されたプローブ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140410 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140415 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150618 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150904 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20160128 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160512 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20160524 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20160729 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170531 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6153866 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |