JP5750433B2 - 診断および治療のための腫瘍関連抗原の同定 - Google Patents
診断および治療のための腫瘍関連抗原の同定 Download PDFInfo
- Publication number
- JP5750433B2 JP5750433B2 JP2012288124A JP2012288124A JP5750433B2 JP 5750433 B2 JP5750433 B2 JP 5750433B2 JP 2012288124 A JP2012288124 A JP 2012288124A JP 2012288124 A JP2012288124 A JP 2012288124A JP 5750433 B2 JP5750433 B2 JP 5750433B2
- Authority
- JP
- Japan
- Prior art keywords
- tumor
- nucleic acid
- associated antigen
- expression
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4748—Tumour specific antigens; Tumour rejection antigen precursors [TRAP], e.g. MAGE
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- G01N33/575—
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6854—Immunoglobulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5256—Virus expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/178—Oligonucleotides characterized by their use miRNA, siRNA or ncRNA
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Zoology (AREA)
- Microbiology (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Pathology (AREA)
- Analytical Chemistry (AREA)
- Oncology (AREA)
- Wood Science & Technology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Mycology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Hospice & Palliative Care (AREA)
- General Engineering & Computer Science (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- General Physics & Mathematics (AREA)
Description
本発明に従って、腫瘍細胞において選択的にまたは異常に発現する遺伝子を特定することで、腫瘍関連抗原を提供することができる。これらの遺伝子および/もしくは遺伝子産物ならびに/または誘導体および/もしくはそれらのフラグメントは、治療および診断アプローチのためのターゲット構造として有用である。
さらなる実施形態において、前記薬剤は、前記腫瘍関連抗原に選択的に結合する抗体、特に、前記腫瘍関連抗原に選択的に結合する補体活性化抗体または毒素結合抗体である。
一つの実施形態において、前記治療薬または診断薬は、毒素である。
本発明によると、用語「単離した核酸」は、(i)例えばポリメラーゼ連鎖反応(PCR)によって、インビトロで増幅されたこと、(ii)クローニングによって組換え生産されたこと、(iii)例えば切断およびゲル−電気泳動分画によって、精製されたこと、または(iv)例えば化学合成によって、合成された核酸を意味する。単離した核酸は、組換えDNA法による操作に利用可能な核酸である。
同様に、核酸の組み合わせにより、レポーター遺伝子または任意の「タグ」を表すことが可能である。
哺乳動物細胞、例えば、ヒト、マウス、ハムスター、ブタ、ヤギ、霊長類からの細胞が、特に好ましい。
MHC分子をコードする核酸配列を、腫瘍関連抗原またはその一部をコードする核酸として同じ発現ベクター上に提示させることができ、または両方の核酸を、異なる発現ベクター上に提示させることができる。後者の場合では、二つの発現ベクターを一つの細胞に共トランスフェクトすることができる。
siRNAは、二つの別個の相補的RNA分子として、または二つの相補的領域を有する単一のRNA分子として、合成することができる。
また、本発明の組換えプラスミドは、特定の組織または特定の細胞内環境でのsiRNAの発現を誘導しまたは調節するプロモーターを含むことができる。
1.小さな脂肪族の、非極性あるいはわずかに極性の残基:Ala、Ser、Thr(Pro、Gly)
2.負のチャージを帯びた残基およびそれらのアミド:Asn、Asp、Glu、Gln
3.正のチャージを帯びた残基:His、Arg、Lys
4.大きな脂肪族の、非極性残基:Met、Leu、Ile、Val(Cys)
5.大きな芳香族残基:Phe、Tyr、Trp
これらのCDR、特にCDR3領域、さらに特にH鎖のCDR3領域は、大いに、抗体特異性に関与する。
それらの例は、肺癌腫、乳癌腫、前立腺癌腫、結腸癌腫、腎細胞癌腫、子宮頸癌腫、または上に記載した癌タイプまたは腫瘍の転移である。本発明によると、癌という用語は、癌転移も含む。
腫瘍は、構造的機構および正常な組織との機能協調を部分的にまたは完全に欠如しており、通常、異質な組織塊を形成し、これは、良性である場合も、または悪性である場合もある。
腫瘍転移は、残存した腫瘍細胞または腫瘍成分が転移能力を維持および発達できるので、多くの場合、原発腫瘍の除去後でさえ発生する。一つの実施形態において、本発明の用語「転移」は、原発腫瘍および局所リンパ節系から遠く離れた転移を示す「遠隔転移」に関する。
これらの増殖した特定のTリンパ球の高親和性T細胞受容体をクローニングし、場合によっては、様々な程度にヒト化し、こうして得られたT細胞受容体を、その後、例えばレトロウイルスベクターを使用して、遺伝子導入により、患者のT細胞に形質導入することができる。
その結果、細胞は、対象の複合体を提示し、後に増殖する自己細胞傷害性Tリンパ球によって認識される。
本発明によると、核酸の医薬組成物への投与または導入に言及する場合、これは、その核酸がそうしたベクター内に存在する実施形態を含む。
相溶性担体および相溶性溶媒の例は、リンガー溶液および等張塩化ナトリウム溶液である。加えて、通常は滅菌固定油が溶解媒体または懸濁媒体として使用される。
以下、参考形態の例を付記する。
1. (I)腫瘍関連抗原の発現もしくは活性を阻害する、ならびに/または
(II)腫瘍阻害活性を有し、および腫瘍関連抗原を発現するもしくは異常発現する細胞に対して選択的である、ならびに/または
(III)投与されたとき、MHC分子と腫瘍関連抗原またはその一部との複合体の量を選択的に増加させる
薬剤を含む医薬組成物であって、
前記腫瘍関連抗原が、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされた配列を有する、医薬組成物。
2. (II)に属する前記薬剤が、細胞死を誘導し、細胞増殖を減少させ、細胞膜を損傷させまたはサイトカインを分泌させる、1.に記載の医薬組成物。
3. (I)または(II)に属する前記薬剤が、前記腫瘍関連抗原をコードする前記核酸と選択的にハイブリダイズするアンチセンス核酸である、1.に記載の医薬組成物。
4. (I)または(II)に属する前記薬剤が、前記腫瘍関連抗原に選択的に結合する抗体である、1.に記載の医薬組成物。
5. 前記薬剤が、
(i)前記腫瘍関連抗原またはその一部、
(ii)前記腫瘍関連抗原またはその一部をコードする核酸、
(iii)前記腫瘍関連抗原またはその一部に結合する抗体、
(iv)前記腫瘍関連抗原をコードする核酸と特異的にハイブリダイズするアンチセンス核酸、
(v)前記腫瘍関連抗原をコードする核酸に対するsiRNA、
(vi)前記腫瘍関連抗原またはその一部を発現する宿主細胞、および
(vii)前記腫瘍関連抗原またはその一部とMHC分子を単離した複合体
から成る群より選択される一つ以上の成分を含む、1.に記載の医薬組成物。
6. 前記薬剤が、各場合、異なる腫瘍関連抗原の発現もしくは活性のいずれも選択的に阻害する、異なる腫瘍関連抗原を発現するもしくは異常発現する細胞のいずれに対しても選択的である、またはMHC分子と異なる腫瘍関連抗原もしくはその一部との前記複合体の量を増加させる、二つ以上の前記薬剤を含み、
前記腫瘍関連抗原の少なくとも一つが、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされた配列を有する、1.に記載の医薬組成物。
7. (i)腫瘍関連抗原またはその一部、
(ii)腫瘍関連抗原またはその一部をコードする核酸、
(iii)腫瘍関連抗原またはその一部に結合する抗体、
(iv)腫瘍関連抗原をコードする核酸と特異的にハイブリダイズするアンチセンス核酸、
(v)腫瘍関連抗原をコードする核酸に対するsiRNA、
(vi)腫瘍関連抗原またはその一部を発現する宿主細胞、および
(vii)腫瘍関連抗原またはその一部とMHC分子を単離した複合体
から成る群より選択される一つ以上の成分を含み、
前記腫瘍関連抗原が、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされた配列を有する、医薬組成物。
8. (ii)の前記核酸が、発現ベクター内に存在する、5.または7.に記載の医薬組成物。
9. 前記宿主細胞が、前記腫瘍関連抗原またはその一部を分泌する、5.または7.に記載の医薬組成物。
10. 前記宿主細胞が、前記腫瘍関連抗原またはその一部に結合するMHC分子をさらに発現する、5.または7.に記載の医薬組成物。
11. 前記宿主細胞が、前記MHC分子および/また前記腫瘍関連抗原もしくは前記その一部を組換え様式で発現する、10.に記載の医薬組成物。
12. 前記宿主細胞が、前記MHC分子を内因的に発現する、10.に記載の医薬組成物。
13. 前記宿主細胞が、抗原提示細胞である、5.、7.、10.または12.に記載の医薬組成物。
14. 前記抗体が、モノクローナル抗体、キメラ抗体もしくはヒト化抗体である、または抗体のフラグメントである、4.、5.または7.に記載の医薬組成物。
15. 前記抗体が、治療薬または診断薬にカップリングする、4.、5.、7.または14.に記載の医薬組成物。
16. 前記癌の治療または予防に使用することができる、1.〜15.のいずれかに記載の医薬組成物。
17. 前記癌が、肺腫瘍、乳房腫瘍、前立腺腫瘍、黒色腫、結腸腫瘍、胃腫瘍、膵臓腫瘍、ENT腫瘍、腎細胞癌腫または子宮頸癌腫、結腸癌腫または乳房癌腫である、16.に記載の医薬組成物。
18. 前記腫瘍関連抗原が、配列番号:2、6、10、14、18、22、26、29、31、36、40、42、46、50〜60、63、68および69から成る群より選択されるアミノ酸配列、その一部または誘導体を含む、1.〜17.のいずれかに記載の医薬組成物。
19. ワクチンの形態である、1.、2.、5.〜13.および16.〜18.のいずれかに記載の医薬組成物。
20. 治療用途および/または予防用途のための、19.に記載の医薬組成物。
21. 腫瘍関連抗原の発現または異常発現を特徴とする疾病を診断またはモニタリングする方法であって、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされた配列を有する前記腫瘍関連抗原を用いて、;
(i)前記腫瘍関連抗原をコードする核酸のもしくはその一部の、および/または
(ii)前記腫瘍関連抗原もしくはその一部の、および/または
(iii)前記腫瘍関連抗原もしくはその一部に対する抗体の、および/または
(iv)患者から単離した生体サンプルにおける前記腫瘍関連抗原にもしくはその一部に特異的であるTリンパ球の、
量を検出または決定することを含む方法。
22. 前記量の検出または決定が、
(i)前記腫瘍関連抗原をコードする前記核酸にもしくは前記その一部に、前記腫瘍関連抗原もしくは前記その一部に、前記抗体に、または前記Tリンパ球に特異的に結合する薬剤と前記生体サンプルを接触させること、および
(ii)前記薬剤と、前記核酸もしくは前記その一部、前記腫瘍関連抗原もしくは前記その一部、前記抗体または前記Tリンパ球との複合体の形成を検出することまたは前記複合体の量を決定すること
を含む、21.に記載の方法。
23. 前記腫瘍関連抗原をコードする前記核酸にまたは前記その一部に特異的に結合する前記薬剤が、前記核酸にまたは前記その一部に特異的にハイブリダイズする、オリゴヌクレオチドまたはポリヌクレオチドである、22.に記載の方法。
24. 前記腫瘍関連抗原または前記その一部に特異的に結合する前記薬剤が、前記腫瘍関連抗原にまたは前記その一部に特異的に結合する抗体である、22.に記載の方法。
25. 前記抗体に特異的に結合する前記薬剤が、前記抗体に特異的に結合するタンパク質またはペプチドである、22.に記載の方法。
26. 前記Tリンパ球に特異的に結合する前記薬剤が、前記腫瘍関連抗原または前記その一部とMHC分子との前記複合体を提示する細胞である、22.に記載の方法。
27. 前記疾病の前記モニタリングが、前記疾病に罹患しているまたは前記疾病に罹患すると推測される患者からのサンプルにおいて前記疾病の退行、経過または発症を判定すること含む、21.から26.のいずれかに記載の方法。
28. 第一時間点での第一サンプルの量の検出または決定、第二時間点でのさらなるサンプルの量の検出または決定、ならびに前記二つのサンプルの比較を含む、27.に記載の方法。
29. 前記薬剤が、検出可能な様式で標識される、22.〜28.のいずれかに記載の方法。
30. 前記サンプルが、体液および/または体内組織を含む、21.〜29.のいずれかに記載の方法。
31. 腫瘍関連抗原の発現または異常発現を特徴とする疾病を治療または予防する方法であって、
前記腫瘍関連抗原が、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされた配列を有する;
1.〜20.のいずれかに記載の医薬組成物を投与することを含む方法。
32. 腫瘍関連抗原の発現または異常発現を特徴とする疾病を治療、予防、診断またはモニタリングする方法であって、
前記腫瘍関連抗原が、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされた配列を有する;
前記腫瘍関連抗原にまたはその一部に結合する、および治療薬または診断薬にカップリングする抗体を投与することを含む方法。
33. 前記抗体が、モノクローナル抗体、キメラ抗体もしくはヒト化抗体である、または抗体のフラグメントである、24.または32.に記載の方法。
34. 腫瘍関連抗原の発現または異常発現を特徴とする疾病に罹患している患者を治療する方法であって、
前記腫瘍関連抗原が、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされた配列を有する;
(i)免疫反応性細胞を含有するサンプルを提供すること、
(ii)細胞溶解性T細胞またはサイトカイン放出性T細胞の産生が前記腫瘍関連抗原または前記その一部に対して有利に働く条件下で、前記腫瘍関連抗原またはその一部を発現する宿主細胞と前記サンプルを接触させること、
(iii)細胞溶解性T細胞またはサイトカイン放出性T細胞を、前記患者に前記腫瘍関連抗原またはその一部を発現する細胞を溶解するのに適する量で導入すること
を含む方法。
35. 前記宿主細胞が、前記腫瘍関連抗原にまたはその一部に結合するMHC分子を組換え発現する、34.に記載の方法。
36. 前記宿主細胞が、前記腫瘍関連抗原にまたはその一部に結合するMHC分子を内因的に発現する、34.に記載の方法。
37. 1.〜20.のいずれかに記載の医薬組成物の有効量を投与することを含む、患者の癌の発生を抑制する方法。
38. 前記腫瘍関連抗原が、配列番号:2、6、10、14、18、22、26、29、31、36、40、42、46、50〜60、63、68および69から成る群より選択されるアミノ酸配列、その一部または誘導体を含む、21.〜37.のいずれかに記載の方法。
39. (a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされている前記タンパク質もしくはポリペプチドに、またはその一部に、特異的に結合する薬剤。
40. 前記タンパク質またはポリペプチドが、配列番号:2、6、10、14、18、22、26、29、31、36、40、42、46、50〜60、63、68および69から成る群より選択されるアミノ酸配列、その一部または誘導体を含む、39.に記載の薬剤。
41. 抗体である、39.または40.に記載の薬剤。
42. 前記抗体が、モノクローナル抗体、キメラ抗体もしくはヒト化抗体である、または抗体のフラグメントである、41.に記載の薬剤。
43. (i)タンパク質もしくはポリペプチドまたはその一部と、
(ii)前記タンパク質もしくはポリペプチドまたは前記その一部が結合するMHC分子と
の複合体に選択的に結合し、(i)または(ii)のみには結合しない前記抗体であって、
前記タンパク質またはポリペプチドが、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされている、抗体。
44. 前記タンパク質またはポリペプチドが、配列番号:2、6、10、14、18、22、26、29、31、36、40、42、46、50〜60、63、68および69から成る群より選択されるアミノ酸配列、その一部または誘導体を含む、43.に記載の抗体。
45. モノクローナル抗体、キメラ抗体もしくはヒト化抗体である、または抗体のフラグメントである、43.または44.に記載の抗体。
46. 39.〜42.のいずれかに記載の薬剤または43.〜45.のいずれかに記載の抗体と治療薬または診断薬とのコンジュゲート。
47. 前記治療薬または診断薬が、毒素である、46.に記載のコンジュゲート。
48. 腫瘍関連抗原の発現または異常発現を検出するためのキットであって、
前記腫瘍関連抗原が、
(a)配列番号:1、5、9、13、17、21、25、28、30、35、39、41、45、49、61、62および64〜67から成る群より選択される核酸配列、その一部または誘導体を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってコードされた配列を有する;
(i)前記腫瘍関連抗原をコードする核酸のもしくはその一部の、および/または
(ii)前記腫瘍関連抗原もしくはその一部の、および/または
(iii)前記腫瘍関連抗原もしくはその一部に結合する抗体の、および/または
(iv)前記腫瘍関連抗原またはその一部とMHC分子との複合体に対して特異的であるT細胞の、
量の検出または決定のための薬剤を含むキット。
実施例:
材料および方法
本明細書において述べる技術および方法は、それ自体が公知の様式で行い、例えば、Sambrookら,Molecular Cloning: A Laboratory
Manual,2nd Edition(1989)Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.に記載されている。キットおよび試薬の使用を含むすべての方法は、それらのメーカーの情報に従って行う。
完全長および遺伝子フラグメントのクローニングを従来の方法によって行った。配列を確認するために、校正ポリメラーゼpfu(Stratagene)を使用して、対応する逆遺伝子を増幅させた。
siRNA2本鎖をトランスフェクションして24時間後、濃度をふったFCSを添加した培地中で48時間、1×104個の細胞を培養した。
DELFIA細胞増殖キット(Perkin Elmer)をメーカーの取扱説明書に従って使用して新たに合成したDNA鎖へのBrdUの組み込みを、Wallac Victor2 マルチレベルカウンター(Perkin Elmer)で測定して、増殖を分析した。
濃度をふったFCSを添加した培地中で細胞を培養し、48時間後に集菌し、ヨウ化プロピジウムで染色し、その後、フローサイトメトリーDNA含量分析を行った。アポトーシス細胞、および細胞周期のS/G2/M期の細胞を、CellQuest−Software(Becton Dickinson)を使用して定量した。
実験開始12時間前に無血清培地中で培養した細胞を、8.0μm多孔質膜を有するトランスウエルチャンバー(BD Biosciences)を用いて、細胞移動アッセイした。siRNA実験のために、細胞を、上記で説明したようなsiRNA2本鎖でトランスフェクションした24時間後、無血清条件に移した。
実験開始12時間前に無血清培地中で培養した細胞を、8.0μm多孔質膜を有するトランスウエルチャンバー(BD Biosciences)を用いて、インビボ浸潤アッセイした。無血清培地中1mg/mLに希釈した100μLのMatrigel(BD Biosciences)で、チャンバーの上を作製した。
ゲル化のために5時間、37℃でチャンバーをインキュベートした。siRNA実験のために、細胞を、上記で説明したようなsiRNA2本鎖でトランスフェクションした24時間後、無血清条件に移した。
治療用および診断用癌ターゲットとしてのISC−468の同定
ISC−468(配列番号:1)は、212個のアミノ酸から成るタンパク質(配列番号:2)をエンコードし、23.6kDaの分子量を有する。
フェクションすることで可能となる。内因発現性乳癌腫細胞系統MCF−7およびBT−549をトランスフェクションした結果、ISC−468 mRNA発現が安定的で特異的に減少した(図23)。
治療用および診断用癌ターゲットとしてのISC−507の同定
ISC−507(配列番号:5)は、85.6kDaの分子量を有する754 aaのタンパク質(配列番号:6)をエンコードする。ISC−507は、付着タンパク質および/またはエンドペプチダーゼとして機能するディスインテグリンおよびメタロプロテアーゼ活性を有する亜鉛結合タンパク質ファミリーのメンバーである。
治療用および診断用癌ターゲットとしてのISC−466の同定
ISC−466(配列番号:9)は、48.2kDaの分子量を有する426 aaのタンパク質(配列番号:10)をエンコードする。これは、妊娠特異糖タンパクのファミリーに属する。
他のPSGと同様に、ISC−466も胎盤に限定されると報告されている。
RT−PCR分析の結果、正常胎盤においてISC−466トランスクリプトが発現し、ならびに胸腺および卵巣において弱い発現が示されている(表3、図5aA)。他のい
ずれの正常器官組織においても有意な発現は検出されなかった。
治療用および診断用癌ターゲットとしてのISC−518の同定
ISC−518(配列番号:13)は、237 aaの翻訳産物(配列番号:14)をエンコードする。しかし、これまでのところ、利用できる組織分布に関するデータおよび癌への関連付けはない。
治療用および診断用癌ターゲットとしてのISC−477の同定
ISC−477(配列番号:17)は、130 aaの翻訳産物(配列番号:18)をエンコードする。ISC−477は、仮説タンパク質である。公的に利用できる組織分布に関するデータおよび癌への関連付けはない。
治療用および診断用癌ターゲットとしてのISC−489の同定
ISC−489(配列番号:21)は、363 aaの翻訳産物(配列番号:22)をエンコードする。このタンパク質は、新たに記載されたGタンパク結合受容体のファミリーのメンバーである。しかし、公的に利用できる組織分布に関するデータおよび癌への関連付けはない。
治療用および診断用癌ターゲットとしてのISC−461の同定
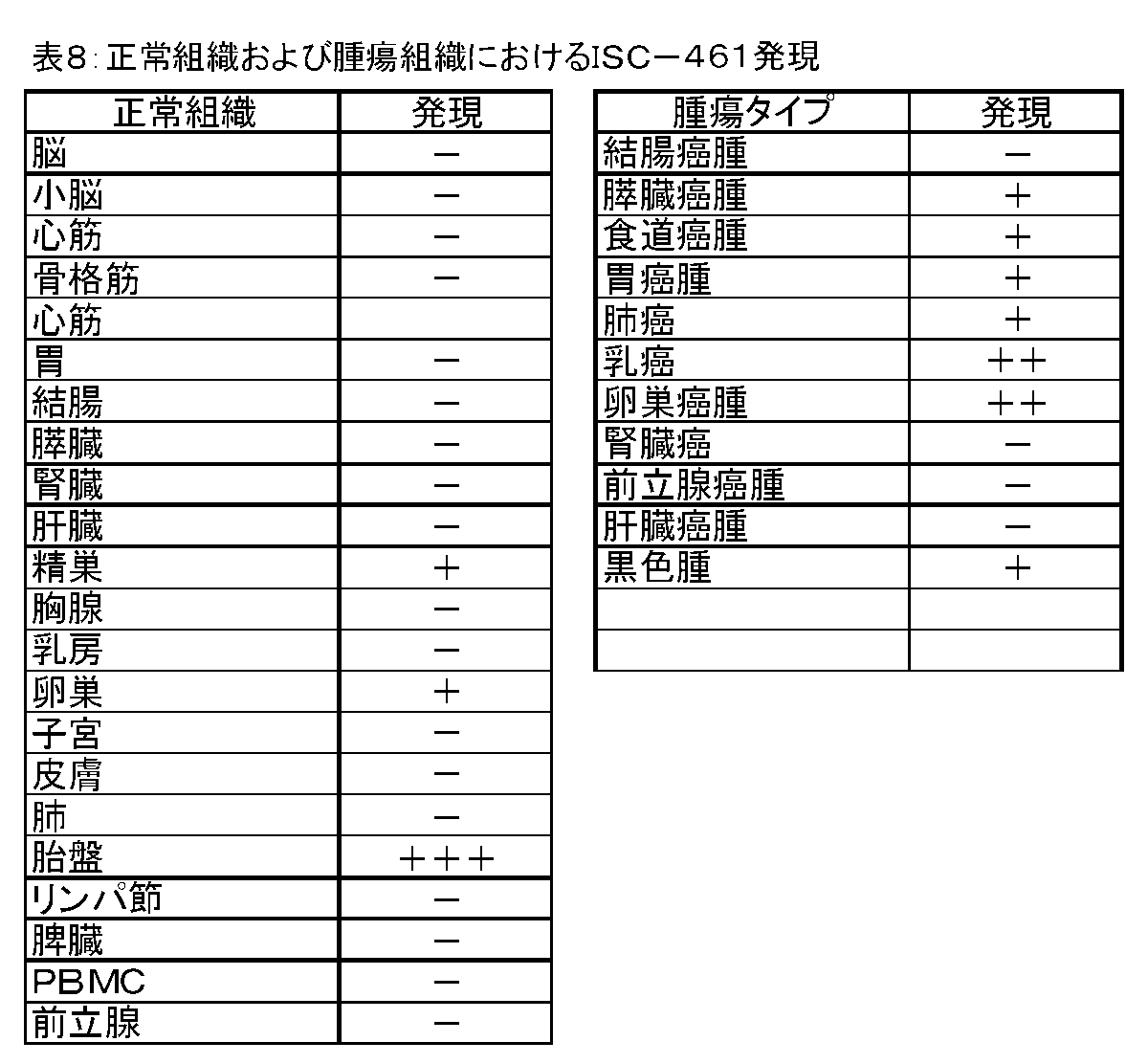
ISC−461(配列番号:25)は、47.1kDAの分子量を有する419 aaタンパク質(配列番号:26)をエンコードする。
C)、卵巣癌腫(図10bD)および黒色腫(図10aB、10bC)をはじめとする多数
の腫瘍タイプにおいて高く、有意なレベルの発現が発見された。
治療用および診断用癌ターゲットとしてのISC−465の同定
ISC−465(配列番号:30)は、47.0kDAの分子量を有する419 aaタンパク質(配列番号:31)をエンコードする。
ることが確認され、加えて、正常卵巣において弱い発現が確認された(図11A)。他のいずれの正常器官組織においても有意な発現はまったく検出されなかった。
治療用および診断用癌ターゲットとしてのMem−030の同定
Mem−030(配列番号:35)は、67.9kDAの分子量を有する592 aaタンパク質(配列番号:36)をエンコードする。
キタス発現パターンを示す(図12A、表9)。
治療用および診断用癌ターゲットとしてのMem−055の同定
Mem−055(配列番号:41)は、27.9kDAの分子量を有する250 aaタンパク質(配列番号:42)をエンコードする。この遺伝子がエンコードするタンパク質は、低pH下でタンパク質ジスルフィド結合を減少させることができる、リソソームチオールレダクターゼである。
キタス発現パターンを示す(図13A、表10)。
治療用および診断用癌ターゲットとしてのMem−062の同定
Mem−062(配列番号:45)は、30.7kDAの分子量を有する271 aaタンパク質(配列番号:46)をエンコードする。
治療用および診断用癌ターゲットとしてのMem−068の同定
Mem−068(配列番号:61)は、新たに同定されたcDNAクローンである。
治療用および診断用癌ターゲットとしてのMem−071の同定
Mem−071(配列番号:64)は、染色体1上の2つのエキソンにエンコードされる、新たなcDNAクローンである。
のcDNAを増幅した。この遺伝子を発現することが判明した唯一の正常組織が精巣であった(図16A)。コントロール的に、癌被検物を調査した結果、腎細胞癌腫および胃癌において高い、有意なレベルの発現が発見された(図16B)。
治療用および診断用癌ターゲットとしてのMem−072の同定
Mem−072(配列番号:65)は、染色体16上の3つのエキソンにエンコードされる、新たに同定された遺伝子である。
のcDNAを増幅した。試験したすべての正常組織におい発現は見られなかった(図17A、表14)。癌由来の組織および癌細胞系統を調査した結果、肺癌サンプルにおいて高い、有意なレベルの発現が発見された(図17B)。
治療用および診断用癌ターゲットとしてのMem−106の同定
Mem−106(配列番号:66)は、染色体2上にイントロンなしでエンコードされる、新たに同定された遺伝子である。
治療用および診断用癌ターゲットとしてのMem−131の同定
Mem−131(配列番号:67)は、新たに同定されたcDNAクローンである。Mem−131は、染色体15上の2エキソン遺伝子である。
のcDNAを増幅した。
意な発現は検出されなかった。
Claims (13)
- 腫瘍関連抗原の発現増加を特徴とする前立腺癌細胞を分析する方法であって、
(a)配列番号:5の核酸配列を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、
(c)(a)または(b)の前記核酸を基準にして縮重している核酸、および
(d)(a)、(b)または(c)の前記核酸に相補的である核酸
から成る群より選択される核酸によってエンコードされた配列を有する前記腫瘍関連抗原を用いて、;
(i)患者から単離した生体サンプルにおける前記腫瘍関連抗原をコードする核酸の、および/または
(ii)患者から単離した生体サンプルにおける前記腫瘍関連抗原の、および/または
(iii)患者から単離した生体サンプルにおける前記腫瘍関連抗原に対する抗体の、および/または
(iv)患者から単離した生体サンプルにおける前記腫瘍関連抗原に特異的であるTリンパ球の、
量を検出または決定することを含む方法。 - 前記量の検出または決定が、
(i)前記腫瘍関連抗原をコードする前記核酸に、前記腫瘍関連抗原に、前記抗体に、または前記Tリンパ球に特異的に結合する薬剤と前記生体サンプルを接触させること、および
(ii)前記薬剤と、前記核酸、前記腫瘍関連抗原、前記抗体または前記Tリンパ球との複合体の形成を検出することまたは前記複合体の量を決定すること
を含む、請求項1に記載の方法。 - 前記腫瘍関連抗原をコードする前記核酸に特異的に結合する前記薬剤が、前記核酸に特異的にハイブリダイズする、オリゴヌクレオチドまたはポリヌクレオチドである、請求項2に記載の方法。
- 前記腫瘍関連抗原に特異的に結合する前記薬剤が、前記腫瘍関連抗原に特異的に結合する抗体である、請求項2に記載の方法。
- 前記抗体に特異的に結合する前記薬剤が、前記抗体に特異的に結合するタンパク質またはペプチドである、請求項2に記載の方法。
- 前記Tリンパ球に特異的に結合する前記薬剤が、前記腫瘍関連抗原またはその一部とMHC分子との複合体を提示する細胞である、請求項2に記載の方法。
- 当該方法が、前立腺癌に罹患しているまたは前記前立腺癌に罹患すると推測される患者からのサンプルにおいて、前記前立腺癌の退行、経過または発症をモニタリングまたは判定すること含む、請求項1から6のいずれかに記載の方法。
- 第一時間点での第一サンプルの量の検出または決定、第二時間点でのさらなるサンプルの量の検出または決定、ならびに前記二つのサンプルの比較を含む、請求項7に記載の方法。
- 前記薬剤が、検出可能な様式で標識される、請求項2〜8のいずれかに記載の方法。
- 前記サンプルが、体液および/または体内組織を含む、請求項1〜9のいずれかに記載の方法。
- 前記抗体が、モノクローナル抗体、キメラ抗体もしくはヒト化抗体である、または抗体のフラグメントである、請求項4に記載の方法。
- 前記腫瘍関連抗原が、配列番号:6および51〜57から成る群より選択されるアミノ酸配列を含む、請求項1〜11のいずれかに記載の方法。
- 腫瘍関連抗原の発現増加を特徴とする前立腺癌細胞を検出するためのキットの使用であって、
前記腫瘍関連抗原が、
(a)配列番号:5の核酸配列を含む核酸、
(b)ストリンジェントな条件下で(a)の前記核酸とハイブリダイズする核酸、および
(c)(a)または(b)の前記核酸に相補的である核酸
から成る群より選択される核酸によってコードされた配列を有し;
前記キットが、
(i)患者から単離した生体サンプルにおける前記腫瘍関連抗原をコードする核酸の、および/または
(ii)患者から単離した生体サンプルにおける前記腫瘍関連抗原の、および/または
(iii)患者から単離した生体サンプルにおける前記腫瘍関連抗原に結合する抗体の、および/または
(iv)患者から単離した生体サンプルにおける前記腫瘍関連抗原またはその一部およびMHC分子に対して特異的であるT細胞の、
量の検出または決定のための薬剤を含む、キットの使用。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP05019786.2 | 2005-09-12 | ||
| EP20050019786 EP1762575A1 (en) | 2005-09-12 | 2005-09-12 | Identification of tumor-associated antigens for diagnosis and therapy |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008530387A Division JP6037593B2 (ja) | 2005-09-12 | 2006-09-06 | 診断および治療のための腫瘍関連抗原の同定 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014254806A Division JP5913547B2 (ja) | 2005-09-12 | 2014-12-17 | 診断および治療のための腫瘍関連抗原の同定 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2013136579A JP2013136579A (ja) | 2013-07-11 |
| JP5750433B2 true JP5750433B2 (ja) | 2015-07-22 |
Family
ID=35285406
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008530387A Expired - Fee Related JP6037593B2 (ja) | 2005-09-12 | 2006-09-06 | 診断および治療のための腫瘍関連抗原の同定 |
| JP2012288124A Active JP5750433B2 (ja) | 2005-09-12 | 2012-12-28 | 診断および治療のための腫瘍関連抗原の同定 |
| JP2014254806A Active JP5913547B2 (ja) | 2005-09-12 | 2014-12-17 | 診断および治療のための腫瘍関連抗原の同定 |
| JP2015228705A Pending JP2016102116A (ja) | 2005-09-12 | 2015-11-24 | 診断および治療のための腫瘍関連抗原の同定 |
| JP2016025541A Active JP6196338B2 (ja) | 2005-09-12 | 2016-02-15 | 診断および治療のための腫瘍関連抗原の同定 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008530387A Expired - Fee Related JP6037593B2 (ja) | 2005-09-12 | 2006-09-06 | 診断および治療のための腫瘍関連抗原の同定 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014254806A Active JP5913547B2 (ja) | 2005-09-12 | 2014-12-17 | 診断および治療のための腫瘍関連抗原の同定 |
| JP2015228705A Pending JP2016102116A (ja) | 2005-09-12 | 2015-11-24 | 診断および治療のための腫瘍関連抗原の同定 |
| JP2016025541A Active JP6196338B2 (ja) | 2005-09-12 | 2016-02-15 | 診断および治療のための腫瘍関連抗原の同定 |
Country Status (20)
| Country | Link |
|---|---|
| US (5) | US20090202530A1 (ja) |
| EP (14) | EP1762575A1 (ja) |
| JP (5) | JP6037593B2 (ja) |
| KR (2) | KR20130121198A (ja) |
| CN (1) | CN101305020B (ja) |
| AU (1) | AU2006291717B2 (ja) |
| BR (1) | BRPI0616827A2 (ja) |
| CA (2) | CA2820201C (ja) |
| CY (3) | CY1114661T1 (ja) |
| DK (3) | DK2433954T3 (ja) |
| ES (4) | ES2664386T3 (ja) |
| HR (3) | HRP20131047T1 (ja) |
| HU (1) | HUE037307T2 (ja) |
| LT (1) | LT2894162T (ja) |
| PL (3) | PL2433954T3 (ja) |
| PT (3) | PT2433954E (ja) |
| RS (3) | RS57080B1 (ja) |
| RU (2) | RU2485974C2 (ja) |
| SI (3) | SI1924600T1 (ja) |
| WO (1) | WO2007031222A2 (ja) |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10347710B4 (de) | 2003-10-14 | 2006-03-30 | Johannes-Gutenberg-Universität Mainz | Rekombinante Impfstoffe und deren Verwendung |
| EP1762575A1 (en) | 2005-09-12 | 2007-03-14 | Ganymed Pharmaceuticals AG | Identification of tumor-associated antigens for diagnosis and therapy |
| AU2013206613B2 (en) * | 2005-09-12 | 2017-03-02 | Biontech Ag | Identification of tumor-associated antigens for diagnosis and therapy |
| DE102005046490A1 (de) | 2005-09-28 | 2007-03-29 | Johannes-Gutenberg-Universität Mainz | Modifikationen von RNA, die zu einer erhöhten Transkriptstabilität und Translationseffizienz führen |
| EP1970384A1 (en) | 2007-03-14 | 2008-09-17 | Ganymed Pharmaceuticals AG | Monoclonal antibodies for treatment of cancer |
| AU2016201637B2 (en) * | 2007-10-23 | 2017-05-25 | Biontech Ag | Identification of tumor-associated markers for diagnosis and therapy |
| EP2060583A1 (en) | 2007-10-23 | 2009-05-20 | Ganymed Pharmaceuticals AG | Identification of tumor-associated markers for diagnosis and therapy |
| AU2015205868B2 (en) * | 2008-09-16 | 2017-04-27 | Ganymed Pharmaceuticals Ag | Monoclonal antibodies for treatment of cancer |
| EP2166021A1 (en) * | 2008-09-16 | 2010-03-24 | Ganymed Pharmaceuticals AG | Monoclonal antibodies for treatment of cancer |
| EP2371864A1 (en) | 2010-03-23 | 2011-10-05 | Ganymed Pharmaceuticals AG | Monoclonal antibodies for treatment of cancer |
| JP5860871B2 (ja) * | 2010-06-04 | 2016-02-16 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | 新規免疫アジュバント化合物およびその使用 |
| RU2670745C9 (ru) | 2011-05-24 | 2018-12-13 | Бионтех Рна Фармасьютикалс Гмбх | Индивидуализированные противоопухолевые вакцины |
| WO2013143555A1 (en) | 2012-03-26 | 2013-10-03 | Biontech Ag | Rna formulation for immunotherapy |
| EP2925348B1 (en) | 2012-11-28 | 2019-03-06 | BioNTech RNA Pharmaceuticals GmbH | Individualized vaccines for cancer |
| WO2014180490A1 (en) | 2013-05-10 | 2014-11-13 | Biontech Ag | Predicting immunogenicity of t cell epitopes |
| NZ723237A (en) | 2014-02-07 | 2018-02-23 | Dong Wha Pharm Co Ltd | Anticancer adjuvant composition containing rip3 expression promoter as active ingredient, method for screening for anticancer adjuvant enhancing sensitivity of anticancer drug by promoting rip3 expression, and method for monitoring sensitivity of anticancer drug |
| JP7044551B2 (ja) | 2014-09-10 | 2022-03-30 | ジェネンテック, インコーポレイテッド | 免疫原性変異体ペプチドスクリーニングプラットフォーム |
| WO2016045732A1 (en) | 2014-09-25 | 2016-03-31 | Biontech Rna Pharmaceuticals Gmbh | Stable formulations of lipids and liposomes |
| RU2620306C2 (ru) * | 2015-01-15 | 2017-05-24 | Олег Викторович Бухтояров | Способ прогнозирования рецидива злокачественного опухолевого заболевания |
| WO2016128060A1 (en) | 2015-02-12 | 2016-08-18 | Biontech Ag | Predicting t cell epitopes useful for vaccination |
| EP3271382B1 (en) * | 2015-03-16 | 2020-02-12 | Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft | Method of detecting new immunogenic t cell epitopes and isolating new antigen-specific t cell receptors by means of an mhc cell library |
| EP3310808A1 (en) * | 2015-06-16 | 2018-04-25 | Targovax Asa | Mutated fragments of the ras protein |
| GB201516047D0 (en) | 2015-09-10 | 2015-10-28 | Cancer Rec Tech Ltd | Method |
| WO2017059902A1 (en) | 2015-10-07 | 2017-04-13 | Biontech Rna Pharmaceuticals Gmbh | 3' utr sequences for stabilization of rna |
| BR112018012374A2 (pt) | 2015-12-16 | 2018-12-04 | Gritstone Oncology, Inc. | identificação, fabricação e uso de neoantígeno |
| JP2019505512A (ja) | 2016-01-08 | 2019-02-28 | バッシボディ アクスイェ セルスカプ | 治療用抗癌ネオエピトープワクチン |
| US10712310B2 (en) | 2016-01-22 | 2020-07-14 | Temple University—Of the Commonwealth System of Higher Education | Protein quantification by near infrared spectral imaging |
| CN107266552B (zh) * | 2016-03-30 | 2022-02-08 | 香雪生命科学技术(广东)有限公司 | 源自于prame的肿瘤抗原短肽 |
| CA3024655A1 (en) | 2016-05-20 | 2017-11-23 | Arlanxeo Netherlands B.V. | Rubber composition |
| DE102016115246C5 (de) * | 2016-08-17 | 2018-12-20 | Immatics Biotechnologies Gmbh | Neue t-zellrezeptoren und deren verwendung in immuntherapie |
| CN108250289B (zh) * | 2016-12-28 | 2021-10-08 | 香雪生命科学技术(广东)有限公司 | 源自于mage b6的肿瘤抗原短肽 |
| WO2018224166A1 (en) | 2017-06-09 | 2018-12-13 | Biontech Rna Pharmaceuticals Gmbh | Methods for predicting the usefulness of disease specific amino acid modifications for immunotherapy |
| TWI676483B (zh) * | 2017-08-06 | 2019-11-11 | 強普生技股份有限公司 | 醫藥套組及其用途 |
| JP7227237B2 (ja) | 2017-10-10 | 2023-02-21 | グリットストーン バイオ インコーポレイテッド | ホットスポットを利用した新生抗原の特定 |
| KR102905054B1 (ko) | 2017-11-22 | 2025-12-29 | 시애틀 프로젝트 코포레이션 | 신생항원에 대한 접합 에피토프 제시 감소 |
Family Cites Families (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4475196A (en) * | 1981-03-06 | 1984-10-02 | Zor Clair G | Instrument for locating faults in aircraft passenger reading light and attendant call control system |
| US4447233A (en) * | 1981-04-10 | 1984-05-08 | Parker-Hannifin Corporation | Medication infusion pump |
| US4474893A (en) * | 1981-07-01 | 1984-10-02 | The University of Texas System Cancer Center | Recombinant monoclonal antibodies |
| US4439196A (en) * | 1982-03-18 | 1984-03-27 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4522811A (en) * | 1982-07-08 | 1985-06-11 | Syntex (U.S.A.) Inc. | Serial injection of muramyldipeptides and liposomes enhances the anti-infective activity of muramyldipeptides |
| US4447224A (en) * | 1982-09-20 | 1984-05-08 | Infusaid Corporation | Variable flow implantable infusion apparatus |
| US4487603A (en) * | 1982-11-26 | 1984-12-11 | Cordis Corporation | Implantable microinfusion pump system |
| US4486194A (en) * | 1983-06-08 | 1984-12-04 | James Ferrara | Therapeutic device for administering medicaments through the skin |
| US4596556A (en) * | 1985-03-25 | 1986-06-24 | Bioject, Inc. | Hypodermic injection apparatus |
| US5374548A (en) * | 1986-05-02 | 1994-12-20 | Genentech, Inc. | Methods and compositions for the attachment of proteins to liposomes using a glycophospholipid anchor |
| MX9203291A (es) * | 1985-06-26 | 1992-08-01 | Liposome Co Inc | Metodo para acoplamiento de liposomas. |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| US4954617A (en) * | 1986-07-07 | 1990-09-04 | Trustees Of Dartmouth College | Monoclonal antibodies to FC receptors for immunoglobulin G on human mononuclear phagocytes |
| US4946778A (en) * | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US4881175A (en) * | 1986-09-02 | 1989-11-14 | Genex Corporation | Computer based system and method for determining and displaying possible chemical structures for converting double- or multiple-chain polypeptides to single-chain polypeptides |
| US5260203A (en) * | 1986-09-02 | 1993-11-09 | Enzon, Inc. | Single polypeptide chain binding molecules |
| WO1988007089A1 (en) * | 1987-03-18 | 1988-09-22 | Medical Research Council | Altered antibodies |
| US5013653A (en) * | 1987-03-20 | 1991-05-07 | Creative Biomolecules, Inc. | Product and process for introduction of a hinge region into a fusion protein to facilitate cleavage |
| DE3853515T3 (de) * | 1987-05-21 | 2005-08-25 | Micromet Ag | Multifunktionelle proteine mit vorbestimmter zielsetzung. |
| US5091513A (en) * | 1987-05-21 | 1992-02-25 | Creative Biomolecules, Inc. | Biosynthetic antibody binding sites |
| US5258498A (en) * | 1987-05-21 | 1993-11-02 | Creative Biomolecules, Inc. | Polypeptide linkers for production of biosynthetic proteins |
| US5132405A (en) * | 1987-05-21 | 1992-07-21 | Creative Biomolecules, Inc. | Biosynthetic antibody binding sites |
| US4941880A (en) * | 1987-06-19 | 1990-07-17 | Bioject, Inc. | Pre-filled ampule and non-invasive hypodermic injection device assembly |
| US4790824A (en) * | 1987-06-19 | 1988-12-13 | Bioject, Inc. | Non-invasive hypodermic injection device |
| GB8717430D0 (en) | 1987-07-23 | 1987-08-26 | Celltech Ltd | Recombinant dna product |
| GB8809129D0 (en) | 1988-04-18 | 1988-05-18 | Celltech Ltd | Recombinant dna methods vectors and host cells |
| US5108921A (en) * | 1989-04-03 | 1992-04-28 | Purdue Research Foundation | Method for enhanced transmembrane transport of exogenous molecules |
| US5312335A (en) * | 1989-11-09 | 1994-05-17 | Bioject Inc. | Needleless hypodermic injection device |
| US5064413A (en) * | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| US6255458B1 (en) | 1990-08-29 | 2001-07-03 | Genpharm International | High affinity human antibodies and human antibodies against digoxin |
| GB9019812D0 (en) | 1990-09-11 | 1990-10-24 | Scotgen Ltd | Novel antibodies for treatment and prevention of infection in animals and man |
| US5383851A (en) * | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| GB9223377D0 (en) | 1992-11-04 | 1992-12-23 | Medarex Inc | Humanized antibodies to fc receptors for immunoglobulin on human mononuclear phagocytes |
| ATE139900T1 (de) * | 1992-11-13 | 1996-07-15 | Idec Pharma Corp | Therapeutische verwendung von chimerischen und markierten antikörper gegen menschlichen b lymphozyt beschränkter differenzierung antigen für die behandlung von b-zell-lymphoma |
| US5744585A (en) * | 1995-03-16 | 1998-04-28 | Medenica; Rajko D. | Human monoclonal antibody against lung carcinoma |
| US6121022A (en) * | 1995-04-14 | 2000-09-19 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5677139A (en) | 1995-04-21 | 1997-10-14 | President And Fellows Of Harvard College | In vitro differentiation of CD34+ progenitor cells into T lymphocytes |
| UA56132C2 (uk) | 1995-04-25 | 2003-05-15 | Смітклайн Бічем Байолоджікалс С.А. | Композиція вакцини (варіанти), спосіб стабілізації qs21 відносно гідролізу (варіанти), спосіб приготування композиції вакцини |
| US6277375B1 (en) * | 1997-03-03 | 2001-08-21 | Board Of Regents, The University Of Texas System | Immunoglobulin-like domains with increased half-lives |
| US20020065394A1 (en) * | 1998-03-18 | 2002-05-30 | Kenneth Jacobs | Secreted proteins and polynucleotides encoding them |
| US6194551B1 (en) * | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| GB9826143D0 (en) | 1998-11-27 | 1999-01-20 | Ludwig Inst Cancer Res | Tumour rejection antigens |
| SI1230932T1 (en) * | 1999-01-13 | 2005-06-30 | Igeneon Krebs-Immuntherapie Forschungs- Und Entwicklungs-Ag | Use of antibodies for anticancer vaccination |
| US6943235B1 (en) * | 1999-04-12 | 2005-09-13 | Agensys, Inc. | Transmembrane protein expressed in prostate cancer |
| NZ522045A (en) | 2000-03-30 | 2007-05-31 | Whitehead Biomedical Inst | RNA sequence-specific mediators of RNA interference |
| US6974667B2 (en) * | 2000-06-14 | 2005-12-13 | Gene Logic, Inc. | Gene expression profiles in liver cancer |
| AU2001280608A1 (en) * | 2000-07-18 | 2002-01-30 | Curagen Corporation | Human polynucleotides and polypeptides encoded thereby |
| NZ524523A (en) * | 2000-08-03 | 2006-02-24 | Therapeutic Human Polyclonals | Production of humanized antibodies in transgenic animals |
| US6812339B1 (en) * | 2000-09-08 | 2004-11-02 | Applera Corporation | Polymorphisms in known genes associated with human disease, methods of detection and uses thereof |
| EP1916303B1 (en) | 2000-11-30 | 2013-02-27 | Medarex, Inc. | Nucleic acids encoding rearranged human immunoglobulin sequences from transgenic transchromosomal mice |
| US20020177547A1 (en) * | 2001-01-16 | 2002-11-28 | Karin Molling | Pharmaceutical compositions for treating or preventing cancer |
| US20030133939A1 (en) * | 2001-01-17 | 2003-07-17 | Genecraft, Inc. | Binding domain-immunoglobulin fusion proteins |
| US7754208B2 (en) * | 2001-01-17 | 2010-07-13 | Trubion Pharmaceuticals, Inc. | Binding domain-immunoglobulin fusion proteins |
| EP1578899A2 (en) * | 2001-05-25 | 2005-09-28 | Incyte Genomics, Inc. | Secreted proteins |
| WO2003016475A2 (en) * | 2001-08-14 | 2003-02-27 | The General Hospital Corporation | Nucleic acid and amino acid sequences involved in pain |
| WO2003075014A2 (en) * | 2002-03-06 | 2003-09-12 | Oxford Glycosciences (Uk) Ltd | Protein-protein interactions in human tumours involving bcmp-7 and bcmp-11 |
| WO2003102159A2 (en) * | 2002-06-04 | 2003-12-11 | Curagen Corporation | Novel proteins and nucleic acids encoding same |
| US7053201B2 (en) * | 2002-08-30 | 2006-05-30 | National Defense Medical Center | Nucleic acid molecules and polypeptides related to h-ADAM7 |
| TW200413539A (en) * | 2002-09-30 | 2004-08-01 | Oncotherapy Science Inc | Genes and polypeptides relating to prostate cancers |
| NZ568769A (en) | 2002-10-17 | 2010-04-30 | Genmab As | Human monoclonal antibodies against CD20 |
| WO2004043232A2 (en) * | 2002-11-06 | 2004-05-27 | Sequenom, Inc. | Methods for identifying risk of melanoma and treatments thereof |
| ATE533857T1 (de) * | 2003-01-17 | 2011-12-15 | Univ Hong Kong Chinese | Zirkulierende mrna als diagnostische marker für erkankungen die mit einer schwangerschaft zusammenhängen |
| CA2515677A1 (en) * | 2003-02-11 | 2004-08-26 | Wyeth | Methods for monitoring drug activities in vivo |
| WO2005049806A2 (en) * | 2003-03-14 | 2005-06-02 | Nuvelo, Inc. | Novel nucleic acids and polypeptides |
| US20050255114A1 (en) * | 2003-04-07 | 2005-11-17 | Nuvelo, Inc. | Methods and diagnosis for the treatment of preeclampsia |
| RU2256924C2 (ru) * | 2003-09-03 | 2005-07-20 | Торопова Надежда Ефимовна | Способ дифференциальной диагностики злокачественных опухолей простаты |
| WO2005079490A2 (en) * | 2004-02-13 | 2005-09-01 | Nuvelo, Inc. | Methods of therapy and diagnosis using targeting of cells that express steap2 polypeptides |
| CN1663603A (zh) * | 2004-03-02 | 2005-09-07 | 北京大学 | 一种肿瘤-胎盘抗原蛋白及其dna在肿瘤治疗中的应用 |
| EP1762575A1 (en) | 2005-09-12 | 2007-03-14 | Ganymed Pharmaceuticals AG | Identification of tumor-associated antigens for diagnosis and therapy |
| EP1970384A1 (en) | 2007-03-14 | 2008-09-17 | Ganymed Pharmaceuticals AG | Monoclonal antibodies for treatment of cancer |
| EP2166021A1 (en) | 2008-09-16 | 2010-03-24 | Ganymed Pharmaceuticals AG | Monoclonal antibodies for treatment of cancer |
| EP2398902B1 (en) * | 2009-02-20 | 2023-10-04 | Astellas Pharma Inc. | Methods and compositions for diagnosis and treatment of cancer |
| EP2221063A1 (en) * | 2009-02-20 | 2010-08-25 | Ganymed Pharmaceuticals AG | Methods and compositions for diagnosis and treatment of cancer |
| EP2371864A1 (en) | 2010-03-23 | 2011-10-05 | Ganymed Pharmaceuticals AG | Monoclonal antibodies for treatment of cancer |
-
2005
- 2005-09-12 EP EP20050019786 patent/EP1762575A1/en not_active Withdrawn
-
2006
- 2006-09-06 PL PL11003883T patent/PL2433954T3/pl unknown
- 2006-09-06 EP EP15156794.8A patent/EP2902412B1/en active Active
- 2006-09-06 PT PT110038833T patent/PT2433954E/pt unknown
- 2006-09-06 RS RS20180353A patent/RS57080B1/sr unknown
- 2006-09-06 KR KR1020137026645A patent/KR20130121198A/ko not_active Ceased
- 2006-09-06 EP EP06791878.9A patent/EP1924600B1/en active Active
- 2006-09-06 PL PL06791878T patent/PL1924600T3/pl unknown
- 2006-09-06 CA CA2820201A patent/CA2820201C/en active Active
- 2006-09-06 DK DK11003883T patent/DK2433954T3/en active
- 2006-09-06 EP EP20110003887 patent/EP2433958B1/en active Active
- 2006-09-06 ES ES15153951.7T patent/ES2664386T3/es active Active
- 2006-09-06 EP EP20110003883 patent/EP2433954B8/en active Active
- 2006-09-06 EP EP20110003884 patent/EP2433955A3/en not_active Withdrawn
- 2006-09-06 LT LTEP15153951.7T patent/LT2894162T/lt unknown
- 2006-09-06 SI SI200631679T patent/SI1924600T1/sl unknown
- 2006-09-06 CA CA002620712A patent/CA2620712A1/en not_active Abandoned
- 2006-09-06 SI SI200632252T patent/SI2894162T1/en unknown
- 2006-09-06 SI SI200631922T patent/SI2433954T1/sl unknown
- 2006-09-06 US US12/066,399 patent/US20090202530A1/en not_active Abandoned
- 2006-09-06 ES ES11003883.3T patent/ES2535500T3/es active Active
- 2006-09-06 JP JP2008530387A patent/JP6037593B2/ja not_active Expired - Fee Related
- 2006-09-06 EP EP20110003885 patent/EP2433956A3/en not_active Withdrawn
- 2006-09-06 CN CN200680041875.XA patent/CN101305020B/zh not_active Expired - Fee Related
- 2006-09-06 ES ES06791878T patent/ES2434945T3/es active Active
- 2006-09-06 RU RU2008114318/10A patent/RU2485974C2/ru not_active IP Right Cessation
- 2006-09-06 EP EP20110003891 patent/EP2433962B1/en active Active
- 2006-09-06 AU AU2006291717A patent/AU2006291717B2/en not_active Ceased
- 2006-09-06 HU HUE15153951A patent/HUE037307T2/hu unknown
- 2006-09-06 ES ES11003887.4T patent/ES2532410T3/es active Active
- 2006-09-06 BR BRPI0616827-2A patent/BRPI0616827A2/pt not_active Application Discontinuation
- 2006-09-06 EP EP20110003889 patent/EP2433960B1/en active Active
- 2006-09-06 RS RS20150290A patent/RS53988B1/sr unknown
- 2006-09-06 HR HRP20131047TT patent/HRP20131047T1/hr unknown
- 2006-09-06 PT PT151539517T patent/PT2894162T/pt unknown
- 2006-09-06 DK DK06791878.9T patent/DK1924600T3/da active
- 2006-09-06 PL PL15153951T patent/PL2894162T3/pl unknown
- 2006-09-06 KR KR1020087008926A patent/KR101359697B1/ko not_active Expired - Fee Related
- 2006-09-06 RS RS20130469A patent/RS53009B/sr unknown
- 2006-09-06 WO PCT/EP2006/008695 patent/WO2007031222A2/en not_active Ceased
- 2006-09-06 PT PT67918789T patent/PT1924600E/pt unknown
- 2006-09-06 EP EP15160484.0A patent/EP2966082B1/en active Active
- 2006-09-06 EP EP20110003890 patent/EP2433961A3/en not_active Withdrawn
- 2006-09-06 EP EP20110003886 patent/EP2433957A3/en not_active Withdrawn
- 2006-09-06 DK DK15153951.7T patent/DK2894162T3/en active
- 2006-09-06 EP EP15153951.7A patent/EP2894162B1/en active Active
- 2006-09-06 EP EP20110003888 patent/EP2433959A3/en not_active Withdrawn
-
2011
- 2011-04-13 US US13/086,176 patent/US8975375B2/en not_active Expired - Fee Related
-
2012
- 2012-12-28 JP JP2012288124A patent/JP5750433B2/ja active Active
-
2013
- 2013-03-26 RU RU2013113439A patent/RU2644686C2/ru not_active IP Right Cessation
- 2013-07-19 US US13/946,302 patent/US20140017254A1/en not_active Abandoned
- 2013-11-13 CY CY20131101005T patent/CY1114661T1/el unknown
-
2014
- 2014-12-17 JP JP2014254806A patent/JP5913547B2/ja active Active
-
2015
- 2015-01-27 US US14/606,729 patent/US9919036B2/en active Active
- 2015-04-21 HR HRP20150432TT patent/HRP20150432T1/hr unknown
- 2015-04-30 CY CY20151100395T patent/CY1116951T1/el unknown
- 2015-11-24 JP JP2015228705A patent/JP2016102116A/ja active Pending
-
2016
- 2016-02-15 JP JP2016025541A patent/JP6196338B2/ja active Active
- 2016-07-27 US US15/220,973 patent/US20170080068A1/en not_active Abandoned
-
2018
- 2018-03-27 CY CY20181100344T patent/CY1120096T1/el unknown
- 2018-03-27 HR HRP20180507TT patent/HRP20180507T1/hr unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6196338B2 (ja) | 診断および治療のための腫瘍関連抗原の同定 | |
| JP6285472B2 (ja) | 診断及び治療のための腫瘍関連マーカーの同定 | |
| AU2017203332B2 (en) | Identification of tumor-associated antigens for diagnosis and therapy | |
| MX2008003464A (en) | Identification of tumor-associated antigens for diagnosis and therapy | |
| HK1168609A (en) | Identification of tumor-associated antigens for diagnosis and therapy | |
| HK1168610A (en) | Identification of tumor-associated antigens for diagnosis and therapy | |
| HK1168611A (en) | Identification of tumor-associated antigens for diagnosis and therapy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20130808 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20130808 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140617 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140820 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140825 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141006 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141009 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141117 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141120 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20141217 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150428 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150518 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5750433 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |