JP5358564B2 - 環状ペプチドcxcr4アンタゴニスト - Google Patents
環状ペプチドcxcr4アンタゴニスト Download PDFInfo
- Publication number
- JP5358564B2 JP5358564B2 JP2010510418A JP2010510418A JP5358564B2 JP 5358564 B2 JP5358564 B2 JP 5358564B2 JP 2010510418 A JP2010510418 A JP 2010510418A JP 2010510418 A JP2010510418 A JP 2010510418A JP 5358564 B2 JP5358564 B2 JP 5358564B2
- Authority
- JP
- Japan
- Prior art keywords
- glu
- lys
- fmoc
- arg
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 229940121384 cxc chemokine receptor type 4 (cxcr4) antagonist Drugs 0.000 title abstract description 12
- 108010069514 Cyclic Peptides Proteins 0.000 title description 20
- 102000001189 Cyclic Peptides Human genes 0.000 title description 20
- 239000002576 chemokine receptor CXCR4 antagonist Substances 0.000 title description 6
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 120
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 claims description 83
- -1 n-hexanoyl Chemical group 0.000 claims description 78
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 claims description 76
- 150000003951 lactams Chemical class 0.000 claims description 63
- WHUUTDBJXJRKMK-GSVOUGTGSA-N D-glutamic acid Chemical compound OC(=O)[C@H](N)CCC(O)=O WHUUTDBJXJRKMK-GSVOUGTGSA-N 0.000 claims description 54
- 150000003839 salts Chemical class 0.000 claims description 37
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 claims description 36
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 34
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 34
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N D-alpha-Ala Natural products CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 claims description 31
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 claims description 31
- COLNVLDHVKWLRT-MRVPVSSYSA-N D-phenylalanine Chemical compound OC(=O)[C@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-MRVPVSSYSA-N 0.000 claims description 28
- 125000003277 amino group Chemical group 0.000 claims description 22
- 125000000899 L-alpha-glutamyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C([H])([H])C([H])([H])C(O[H])=O 0.000 claims description 20
- QNAYBMKLOCPYGJ-UWTATZPHSA-N D-alanine Chemical compound C[C@@H](N)C(O)=O QNAYBMKLOCPYGJ-UWTATZPHSA-N 0.000 claims description 15
- 244000137850 Marrubium vulgare Species 0.000 claims description 15
- QCXJEYYXVJIFCE-UHFFFAOYSA-N para-acetamidobenzoic acid Natural products CC(=O)NC1=CC=C(C(O)=O)C=C1 QCXJEYYXVJIFCE-UHFFFAOYSA-N 0.000 claims description 14
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 claims description 13
- 125000000570 L-alpha-aspartyl group Chemical group [H]OC(=O)C([H])([H])[C@]([H])(N([H])[H])C(*)=O 0.000 claims description 12
- DTERQYGMUDWYAZ-UHFFFAOYSA-N N-acetyl-N-thioacetyl-Lysine Natural products CC(=O)NCCCCC(N)C(O)=O DTERQYGMUDWYAZ-UHFFFAOYSA-N 0.000 claims description 12
- JPZXHKDZASGCLU-GFCCVEGCSA-N 3-(2-Naphthyl)-D-Alanine Chemical compound C1=CC=CC2=CC(C[C@@H](N)C(O)=O)=CC=C21 JPZXHKDZASGCLU-GFCCVEGCSA-N 0.000 claims description 11
- PECYZEOJVXMISF-UWTATZPHSA-N 3-amino-D-alanine Chemical compound NC[C@@H](N)C(O)=O PECYZEOJVXMISF-UWTATZPHSA-N 0.000 claims description 11
- 125000003412 L-alanyl group Chemical group [H]N([H])[C@@](C([H])([H])[H])(C(=O)[*])[H] 0.000 claims description 11
- ODKSFYDXXFIFQN-SCSAIBSYSA-N D-arginine Chemical compound OC(=O)[C@H](N)CCCNC(N)=N ODKSFYDXXFIFQN-SCSAIBSYSA-N 0.000 claims description 10
- 125000003798 L-tyrosyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C([H])([H])C1=C([H])C([H])=C(O[H])C([H])=C1[H] 0.000 claims description 9
- 125000003440 L-leucyl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])C(C([H])([H])[H])([H])C([H])([H])[H] 0.000 claims description 8
- 125000002435 L-phenylalanyl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 8
- 125000002730 succinyl group Chemical group C(CCC(=O)*)(=O)* 0.000 claims description 8
- 125000001176 L-lysyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C([H])([H])C([H])([H])C([H])([H])C(N([H])[H])([H])[H] 0.000 claims description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical group CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims description 3
- 125000001424 substituent group Chemical group 0.000 claims description 3
- 206010028980 Neoplasm Diseases 0.000 abstract description 12
- 208000031886 HIV Infections Diseases 0.000 abstract description 8
- 208000037357 HIV infectious disease Diseases 0.000 abstract description 8
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 abstract description 8
- 208000005069 pulmonary fibrosis Diseases 0.000 abstract description 6
- 206010039073 rheumatoid arthritis Diseases 0.000 abstract description 6
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 131
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 80
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 76
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 75
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 75
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 72
- 150000001875 compounds Chemical class 0.000 description 64
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 63
- PECYZEOJVXMISF-UHFFFAOYSA-N 3-aminoalanine Chemical compound [NH3+]CC(N)C([O-])=O PECYZEOJVXMISF-UHFFFAOYSA-N 0.000 description 61
- 229920005989 resin Polymers 0.000 description 59
- 239000011347 resin Substances 0.000 description 59
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 53
- RRBZUCWNYQUCTR-UHFFFAOYSA-N 2-(aminoazaniumyl)acetate Chemical compound NNCC(O)=O RRBZUCWNYQUCTR-UHFFFAOYSA-N 0.000 description 48
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 48
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 42
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 39
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 36
- 238000000034 method Methods 0.000 description 36
- HNICLNKVURBTKV-NDEPHWFRSA-N (2s)-5-[[amino-[(2,2,4,6,7-pentamethyl-3h-1-benzofuran-5-yl)sulfonylamino]methylidene]amino]-2-(9h-fluoren-9-ylmethoxycarbonylamino)pentanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)N[C@H](C(O)=O)CCCN=C(N)NS(=O)(=O)C1=C(C)C(C)=C2OC(C)(C)CC2=C1C HNICLNKVURBTKV-NDEPHWFRSA-N 0.000 description 35
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 33
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 31
- TUCNEACPLKLKNU-UHFFFAOYSA-N acetyl Chemical compound C[C]=O TUCNEACPLKLKNU-UHFFFAOYSA-N 0.000 description 30
- 125000004080 3-carboxypropanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C(O[H])=O 0.000 description 27
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 27
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 description 27
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 description 26
- 239000000243 solution Substances 0.000 description 25
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 24
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 24
- PNUFMLXHOLFRLD-KBPBESRZSA-N Gly-Tyr-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CC=C(O)C=C1 PNUFMLXHOLFRLD-KBPBESRZSA-N 0.000 description 23
- 108010059898 glycyl-tyrosyl-lysine Proteins 0.000 description 23
- WCYWZMWISLQXQU-UHFFFAOYSA-N methyl Chemical compound [CH3] WCYWZMWISLQXQU-UHFFFAOYSA-N 0.000 description 23
- 238000003556 assay Methods 0.000 description 22
- 238000006243 chemical reaction Methods 0.000 description 21
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 20
- 238000004364 calculation method Methods 0.000 description 20
- 239000002904 solvent Substances 0.000 description 20
- KSDTXRUIZMTBNV-INIZCTEOSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)butanedioic acid Chemical group C1=CC=C2C(COC(=O)N[C@@H](CC(=O)O)C(O)=O)C3=CC=CC=C3C2=C1 KSDTXRUIZMTBNV-INIZCTEOSA-N 0.000 description 17
- 102100021669 Stromal cell-derived factor 1 Human genes 0.000 description 17
- 238000012360 testing method Methods 0.000 description 17
- OGNSCSPNOLGXSM-UHFFFAOYSA-N 2,4-diaminobutyric acid Chemical compound NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 16
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 16
- DBNGDEAQXGFGRA-ACRUOGEOSA-N Phe-Tyr-Lys Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)N[C@@H](CCCCN)C(=O)O)N DBNGDEAQXGFGRA-ACRUOGEOSA-N 0.000 description 16
- 101710088580 Stromal cell-derived factor 1 Proteins 0.000 description 16
- 210000004027 cell Anatomy 0.000 description 15
- 238000010276 construction Methods 0.000 description 15
- 238000004128 high performance liquid chromatography Methods 0.000 description 15
- 239000002243 precursor Substances 0.000 description 15
- JMTMSDXUXJISAY-UHFFFAOYSA-N 2H-benzotriazol-4-ol Chemical compound OC1=CC=CC2=C1N=NN2 JMTMSDXUXJISAY-UHFFFAOYSA-N 0.000 description 14
- 230000008878 coupling Effects 0.000 description 14
- 238000010168 coupling process Methods 0.000 description 14
- 238000005859 coupling reaction Methods 0.000 description 14
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 14
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 14
- PKAUMAVONPSDRW-IBGZPJMESA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CNC(=O)OC(C)(C)C)C(O)=O)C3=CC=CC=C3C2=C1 PKAUMAVONPSDRW-IBGZPJMESA-N 0.000 description 13
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 13
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 13
- 235000001014 amino acid Nutrition 0.000 description 13
- 150000001413 amino acids Chemical class 0.000 description 13
- 125000000031 ethylamino group Chemical group [H]C([H])([H])C([H])([H])N([H])[*] 0.000 description 13
- 239000000047 product Substances 0.000 description 13
- ZGYICYBLPGRURT-UHFFFAOYSA-N tri(propan-2-yl)silicon Chemical compound CC(C)[Si](C(C)C)C(C)C ZGYICYBLPGRURT-UHFFFAOYSA-N 0.000 description 13
- FZTIWOBQQYPTCJ-UHFFFAOYSA-N 4-[4-(4-carboxyphenyl)phenyl]benzoic acid Chemical compound C1=CC(C(=O)O)=CC=C1C1=CC=C(C=2C=CC(=CC=2)C(O)=O)C=C1 FZTIWOBQQYPTCJ-UHFFFAOYSA-N 0.000 description 12
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 12
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 12
- 230000015572 biosynthetic process Effects 0.000 description 12
- 210000000440 neutrophil Anatomy 0.000 description 12
- 238000002360 preparation method Methods 0.000 description 12
- 238000007363 ring formation reaction Methods 0.000 description 12
- 238000003786 synthesis reaction Methods 0.000 description 12
- 102000004196 processed proteins & peptides Human genes 0.000 description 11
- 239000011541 reaction mixture Substances 0.000 description 11
- UMRUUWFGLGNQLI-QFIPXVFZSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-6-[(2-methylpropan-2-yl)oxycarbonylamino]hexanoic acid Chemical group C1=CC=C2C(COC(=O)N[C@@H](CCCCNC(=O)OC(C)(C)C)C(O)=O)C3=CC=CC=C3C2=C1 UMRUUWFGLGNQLI-QFIPXVFZSA-N 0.000 description 10
- NOGFHTGYPKWWRX-UHFFFAOYSA-N 2,2,6,6-tetramethyloxan-4-one Chemical group CC1(C)CC(=O)CC(C)(C)O1 NOGFHTGYPKWWRX-UHFFFAOYSA-N 0.000 description 10
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 10
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 10
- 150000001408 amides Chemical group 0.000 description 10
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 10
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 10
- 125000006239 protecting group Chemical group 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 9
- 239000012467 final product Substances 0.000 description 9
- 125000000593 indol-1-yl group Chemical group [H]C1=C([H])C([H])=C2N([*])C([H])=C([H])C2=C1[H] 0.000 description 9
- 210000000265 leukocyte Anatomy 0.000 description 9
- 239000002516 radical scavenger Substances 0.000 description 9
- 238000002390 rotary evaporation Methods 0.000 description 9
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 230000003993 interaction Effects 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 239000012071 phase Substances 0.000 description 8
- 239000007790 solid phase Substances 0.000 description 8
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 7
- 241000699670 Mus sp. Species 0.000 description 7
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 7
- 238000002953 preparative HPLC Methods 0.000 description 7
- 238000006268 reductive amination reaction Methods 0.000 description 7
- VYMPLPIFKRHAAC-UHFFFAOYSA-N 1,2-ethanedithiol Chemical compound SCCS VYMPLPIFKRHAAC-UHFFFAOYSA-N 0.000 description 6
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical group C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 6
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 6
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical class [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 6
- 159000000021 acetate salts Chemical class 0.000 description 6
- 125000004122 cyclic group Chemical group 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 238000001819 mass spectrum Methods 0.000 description 6
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 6
- 229910052763 palladium Inorganic materials 0.000 description 6
- 238000010647 peptide synthesis reaction Methods 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- DHHKPEUQJIEKOA-UHFFFAOYSA-N tert-butyl 2-[6-(nitromethyl)-6-bicyclo[3.2.0]hept-3-enyl]acetate Chemical compound C1C=CC2C(CC(=O)OC(C)(C)C)(C[N+]([O-])=O)CC21 DHHKPEUQJIEKOA-UHFFFAOYSA-N 0.000 description 6
- 108010008951 Chemokine CXCL12 Proteins 0.000 description 5
- 102000006573 Chemokine CXCL12 Human genes 0.000 description 5
- 102000009410 Chemokine receptor Human genes 0.000 description 5
- 108050000299 Chemokine receptor Proteins 0.000 description 5
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 5
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 description 5
- 208000034578 Multiple myelomas Diseases 0.000 description 5
- 206010035226 Plasma cell myeloma Diseases 0.000 description 5
- 238000005804 alkylation reaction Methods 0.000 description 5
- 210000001185 bone marrow Anatomy 0.000 description 5
- 210000004899 c-terminal region Anatomy 0.000 description 5
- 201000011510 cancer Diseases 0.000 description 5
- 230000035605 chemotaxis Effects 0.000 description 5
- 238000003776 cleavage reaction Methods 0.000 description 5
- 229910000040 hydrogen fluoride Inorganic materials 0.000 description 5
- 230000000144 pharmacologic effect Effects 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 230000002441 reversible effect Effects 0.000 description 5
- 230000007017 scission Effects 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 239000011877 solvent mixture Substances 0.000 description 5
- 238000010183 spectrum analysis Methods 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 230000004614 tumor growth Effects 0.000 description 5
- LIWKOFAHRLBNMG-FQEVSTJZSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-4-[(2-methylpropan-2-yl)oxycarbonylamino]butanoic acid Chemical group C1=CC=C2C(COC(=O)N[C@@H](CCNC(=O)OC(C)(C)C)C(O)=O)C3=CC=CC=C3C2=C1 LIWKOFAHRLBNMG-FQEVSTJZSA-N 0.000 description 4
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 4
- 206010006187 Breast cancer Diseases 0.000 description 4
- 208000026310 Breast neoplasm Diseases 0.000 description 4
- 108010061299 CXCR4 Receptors Proteins 0.000 description 4
- 102000012000 CXCR4 Receptors Human genes 0.000 description 4
- 206010009944 Colon cancer Diseases 0.000 description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 4
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 4
- 206010033128 Ovarian cancer Diseases 0.000 description 4
- 206010061535 Ovarian neoplasm Diseases 0.000 description 4
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 4
- 206010060862 Prostate cancer Diseases 0.000 description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 4
- 206010038389 Renal cancer Diseases 0.000 description 4
- 230000029936 alkylation Effects 0.000 description 4
- 239000012131 assay buffer Substances 0.000 description 4
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 4
- 239000003054 catalyst Substances 0.000 description 4
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 4
- 208000029742 colonic neoplasm Diseases 0.000 description 4
- 238000007796 conventional method Methods 0.000 description 4
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 4
- 238000010511 deprotection reaction Methods 0.000 description 4
- 201000010982 kidney cancer Diseases 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 201000005202 lung cancer Diseases 0.000 description 4
- 208000020816 lung neoplasm Diseases 0.000 description 4
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 4
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 4
- 201000001441 melanoma Diseases 0.000 description 4
- 238000012544 monitoring process Methods 0.000 description 4
- FEMOMIGRRWSMCU-UHFFFAOYSA-N ninhydrin Chemical compound C1=CC=C2C(=O)C(O)(O)C(=O)C2=C1 FEMOMIGRRWSMCU-UHFFFAOYSA-N 0.000 description 4
- IWDCLRJOBJJRNH-UHFFFAOYSA-N p-cresol Chemical compound CC1=CC=C(O)C=C1 IWDCLRJOBJJRNH-UHFFFAOYSA-N 0.000 description 4
- 201000002528 pancreatic cancer Diseases 0.000 description 4
- 208000008443 pancreatic carcinoma Diseases 0.000 description 4
- 210000005259 peripheral blood Anatomy 0.000 description 4
- 239000011886 peripheral blood Substances 0.000 description 4
- 238000000159 protein binding assay Methods 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 238000001665 trituration Methods 0.000 description 4
- 238000005406 washing Methods 0.000 description 4
- DFQSBSADGQZNFW-FVGYRXGTSA-N (2s)-2-(methylamino)-3-phenylpropanoic acid;hydrochloride Chemical compound Cl.CN[C@H](C(O)=O)CC1=CC=CC=C1 DFQSBSADGQZNFW-FVGYRXGTSA-N 0.000 description 3
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 3
- JVESLFWSVWNBQV-UHFFFAOYSA-N 1-ethylbenzimidazol-5-amine Chemical group NC1=CC=C2N(CC)C=NC2=C1 JVESLFWSVWNBQV-UHFFFAOYSA-N 0.000 description 3
- LINBWYYLPWJQHE-UHFFFAOYSA-N 3-(9h-fluoren-9-ylmethoxycarbonylamino)propanoic acid Chemical compound C1=CC=C2C(COC(=O)NCCC(=O)O)C3=CC=CC=C3C2=C1 LINBWYYLPWJQHE-UHFFFAOYSA-N 0.000 description 3
- 108010016626 Dipeptides Proteins 0.000 description 3
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 3
- 102000002791 Interleukin-8B Receptors Human genes 0.000 description 3
- 239000004472 Lysine Substances 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 206010029260 Neuroblastoma Diseases 0.000 description 3
- VJMAITQRABEEKP-UHFFFAOYSA-N [6-(phenylmethoxymethyl)-1,4-dioxan-2-yl]methyl acetate Chemical compound O1C(COC(=O)C)COCC1COCC1=CC=CC=C1 VJMAITQRABEEKP-UHFFFAOYSA-N 0.000 description 3
- 230000021736 acetylation Effects 0.000 description 3
- 238000006640 acetylation reaction Methods 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 229960003375 aminomethylbenzoic acid Drugs 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- BGRWYRAHAFMIBJ-UHFFFAOYSA-N diisopropylcarbodiimide Natural products CC(C)NC(=O)NC(C)C BGRWYRAHAFMIBJ-UHFFFAOYSA-N 0.000 description 3
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 208000005017 glioblastoma Diseases 0.000 description 3
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Chemical group CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 3
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Chemical group C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000002503 metabolic effect Effects 0.000 description 3
- 230000009401 metastasis Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- PARWUHTVGZSQPD-UHFFFAOYSA-N phenylsilane Chemical compound [SiH3]C1=CC=CC=C1 PARWUHTVGZSQPD-UHFFFAOYSA-N 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000011084 recovery Methods 0.000 description 3
- 238000004007 reversed phase HPLC Methods 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- ACTRVOBWPAIOHC-XIXRPRMCSA-N succimer Chemical compound OC(=O)[C@@H](S)[C@@H](S)C(O)=O ACTRVOBWPAIOHC-XIXRPRMCSA-N 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 231100000331 toxic Toxicity 0.000 description 3
- 230000002588 toxic effect Effects 0.000 description 3
- JOOIZTMAHNLNHE-NRFANRHFSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-5-[(2-methylpropan-2-yl)oxycarbonylamino]pentanoic acid Chemical group C1=CC=C2C(COC(=O)N[C@@H](CCCNC(=O)OC(C)(C)C)C(O)=O)C3=CC=CC=C3C2=C1 JOOIZTMAHNLNHE-NRFANRHFSA-N 0.000 description 2
- QWXZOFZKSQXPDC-NSHDSACASA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)propanoic acid Chemical group C1=CC=C2C(COC(=O)N[C@@H](C)C(O)=O)C3=CC=CC=C3C2=C1 QWXZOFZKSQXPDC-NSHDSACASA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- SLRMQYXOBQWXCR-UHFFFAOYSA-N 2154-56-5 Chemical compound [CH2]C1=CC=CC=C1 SLRMQYXOBQWXCR-UHFFFAOYSA-N 0.000 description 2
- LRCYAJZPDFSJPQ-UHFFFAOYSA-N 3-azaniumyl-2-phenylpropanoate Chemical compound NCC(C(O)=O)C1=CC=CC=C1 LRCYAJZPDFSJPQ-UHFFFAOYSA-N 0.000 description 2
- JLLYLQLDYORLBB-UHFFFAOYSA-N 5-bromo-n-methylthiophene-2-sulfonamide Chemical group CNS(=O)(=O)C1=CC=C(Br)S1 JLLYLQLDYORLBB-UHFFFAOYSA-N 0.000 description 2
- XAXMJQUMRJAFCH-CQDKDKBSSA-N Ala-Tyr-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=C(O)C=C1 XAXMJQUMRJAFCH-CQDKDKBSSA-N 0.000 description 2
- BJDHEININLSZOT-KKUMJFAQSA-N Asp-Tyr-Lys Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCCCN)C(O)=O BJDHEININLSZOT-KKUMJFAQSA-N 0.000 description 2
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 2
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 108010018951 Interleukin-8B Receptors Proteins 0.000 description 2
- BTEMNFBEAAOGBR-BZSNNMDCSA-N Leu-Tyr-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CCCCN)C(=O)O)N BTEMNFBEAAOGBR-BZSNNMDCSA-N 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- CSCPPACGZOOCGX-WFGJKAKNSA-N acetone d6 Chemical compound [2H]C([2H])([2H])C(=O)C([2H])([2H])[2H] CSCPPACGZOOCGX-WFGJKAKNSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- QCTBMLYLENLHLA-UHFFFAOYSA-N aminomethylbenzoic acid Chemical compound NCC1=CC=C(C(O)=O)C=C1 QCTBMLYLENLHLA-UHFFFAOYSA-N 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- UTZLYIFQYGQUPA-UHFFFAOYSA-N benzyl 2,5-dioxopyrrolidine-1-carboxylate Chemical compound O=C1CCC(=O)N1C(=O)OCC1=CC=CC=C1 UTZLYIFQYGQUPA-UHFFFAOYSA-N 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 201000000053 blastoma Diseases 0.000 description 2
- 210000000601 blood cell Anatomy 0.000 description 2
- 230000009400 cancer invasion Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 125000004431 deuterium atom Chemical group 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 201000008184 embryoma Diseases 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid group Chemical group C(CCCCC)(=O)O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 2
- 238000011065 in-situ storage Methods 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 229920001155 polypropylene Polymers 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 238000003908 quality control method Methods 0.000 description 2
- 230000007115 recruitment Effects 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 210000000130 stem cell Anatomy 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 230000005747 tumor angiogenesis Effects 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 230000005740 tumor formation Effects 0.000 description 2
- RWLSBXBFZHDHHX-VIFPVBQESA-N (2s)-2-(naphthalen-2-ylamino)propanoic acid Chemical compound C1=CC=CC2=CC(N[C@@H](C)C(O)=O)=CC=C21 RWLSBXBFZHDHHX-VIFPVBQESA-N 0.000 description 1
- VVQIIIAZJXTLRE-QMMMGPOBSA-N (2s)-2-amino-6-[(2-methylpropan-2-yl)oxycarbonylamino]hexanoic acid Chemical group CC(C)(C)OC(=O)NCCCC[C@H](N)C(O)=O VVQIIIAZJXTLRE-QMMMGPOBSA-N 0.000 description 1
- ZZDRDGKSMGGBDI-KRWDZBQOSA-N (2s)-4-azaniumyl-2-(9h-fluoren-9-ylmethoxycarbonylamino)butanoate Chemical group C1=CC=C2C(COC(=O)N[C@@H](CCN)C(O)=O)C3=CC=CC=C3C2=C1 ZZDRDGKSMGGBDI-KRWDZBQOSA-N 0.000 description 1
- ZODMYTRQCNEOFM-QMMMGPOBSA-N (2s)-6-amino-2-(propan-2-ylamino)hexanoic acid Chemical group CC(C)N[C@H](C(O)=O)CCCCN ZODMYTRQCNEOFM-QMMMGPOBSA-N 0.000 description 1
- UHPQFNXOFFPHJW-UHFFFAOYSA-N (4-methylphenyl)-phenylmethanamine Chemical compound C1=CC(C)=CC=C1C(N)C1=CC=CC=C1 UHPQFNXOFFPHJW-UHFFFAOYSA-N 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- UEUPDYPUTTUXLJ-UHFFFAOYSA-N 1-[[4-(1,4,8,11-tetrazacyclotetradec-1-ylmethyl)phenyl]methyl]-1,4,8,11-tetrazacyclotetradecane;octahydrochloride Chemical compound Cl.Cl.Cl.Cl.Cl.Cl.Cl.Cl.C=1C=C(CN2CCNCCCNCCNCCC2)C=CC=1CN1CCCNCCNCCCNCC1 UEUPDYPUTTUXLJ-UHFFFAOYSA-N 0.000 description 1
- JFLSOKIMYBSASW-UHFFFAOYSA-N 1-chloro-2-[chloro(diphenyl)methyl]benzene Chemical compound ClC1=CC=CC=C1C(Cl)(C=1C=CC=CC=1)C1=CC=CC=C1 JFLSOKIMYBSASW-UHFFFAOYSA-N 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-O 1h-benzotriazol-1-ium Chemical compound C1=CC=C2[NH2+]N=NC2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-O 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 102000040125 5-hydroxytryptamine receptor family Human genes 0.000 description 1
- 108091032151 5-hydroxytryptamine receptor family Proteins 0.000 description 1
- WVLHHLRVNDMIAR-IBGZPJMESA-N AMD 070 Chemical compound C1CCC2=CC=CN=C2[C@H]1N(CCCCN)CC1=NC2=CC=CC=C2N1 WVLHHLRVNDMIAR-IBGZPJMESA-N 0.000 description 1
- 206010003497 Asphyxia Diseases 0.000 description 1
- 101710149814 C-C chemokine receptor type 1 Proteins 0.000 description 1
- 102100031172 C-C chemokine receptor type 1 Human genes 0.000 description 1
- 101710149815 C-C chemokine receptor type 2 Proteins 0.000 description 1
- 102100031151 C-C chemokine receptor type 2 Human genes 0.000 description 1
- 102100028990 C-X-C chemokine receptor type 3 Human genes 0.000 description 1
- 108010053045 CTCE-9908 Proteins 0.000 description 1
- 108010061300 CXCR3 Receptors Proteins 0.000 description 1
- 102000011963 CXCR3 Receptors Human genes 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-N Caprylic acid Natural products CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 125000000030 D-alanine group Chemical group [H]N([H])[C@](C([H])([H])[H])(C(=O)[*])[H] 0.000 description 1
- WHUUTDBJXJRKMK-GSVOUGTGSA-L D-glutamate group Chemical group N[C@H](CCC(=O)[O-])C(=O)[O-] WHUUTDBJXJRKMK-GSVOUGTGSA-L 0.000 description 1
- 125000004077 D-glutamic acid group Chemical group [H]N([H])[C@@]([H])(C(=O)[*])C([H])([H])C([H])([H])C(N([H])[H])=O 0.000 description 1
- 125000001711 D-phenylalanine group Chemical group [H]N([H])[C@@]([H])(C(=O)[*])C([H])([H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 102000015554 Dopamine receptor Human genes 0.000 description 1
- 108050004812 Dopamine receptor Proteins 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical group CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 1
- XBGGUPMXALFZOT-VIFPVBQESA-N Gly-Tyr Chemical compound NCC(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 XBGGUPMXALFZOT-VIFPVBQESA-N 0.000 description 1
- 101000777564 Homo sapiens C-C chemokine receptor type 1 Proteins 0.000 description 1
- 101000777599 Homo sapiens C-C chemokine receptor type 2 Proteins 0.000 description 1
- 101000916059 Homo sapiens C-X-C chemokine receptor type 2 Proteins 0.000 description 1
- 101000916050 Homo sapiens C-X-C chemokine receptor type 3 Proteins 0.000 description 1
- 101000617130 Homo sapiens Stromal cell-derived factor 1 Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 1
- WINFHLHJTRGLCV-BZSNNMDCSA-N Lys-Tyr-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CCCCN)C(O)=O)CC1=CC=C(O)C=C1 WINFHLHJTRGLCV-BZSNNMDCSA-N 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 125000000729 N-terminal amino-acid group Chemical group 0.000 description 1
- 102000003840 Opioid Receptors Human genes 0.000 description 1
- 108090000137 Opioid Receptors Proteins 0.000 description 1
- FSXRLASFHBWESK-HOTGVXAUSA-N Phe-Tyr Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CC=CC=C1 FSXRLASFHBWESK-HOTGVXAUSA-N 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 238000011579 SCID mouse model Methods 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 241000209140 Triticum Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000004520 agglutination Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 150000001370 alpha-amino acid derivatives Chemical class 0.000 description 1
- 235000008206 alpha-amino acids Nutrition 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- MJSHDCCLFGOEIK-UHFFFAOYSA-N benzyl (2,5-dioxopyrrolidin-1-yl) carbonate Chemical compound O=C1CCC(=O)N1OC(=O)OCC1=CC=CC=C1 MJSHDCCLFGOEIK-UHFFFAOYSA-N 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 238000012754 cardiac puncture Methods 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000010924 continuous production Methods 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- VUYRSKROGTWHDC-HZGLMRDYSA-N ctce 9908 Chemical compound C([C@H](NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)CNC(=O)[C@@H](N)CCCCN)C(C)C)CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCCCC[C@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)CNC(=O)[C@@H](N)CCCCN)C(C)C)C(N)=O)C1=CC=C(O)C=C1 VUYRSKROGTWHDC-HZGLMRDYSA-N 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 125000001142 dicarboxylic acid group Chemical group 0.000 description 1
- 229960001760 dimethyl sulfoxide Drugs 0.000 description 1
- FSXRLASFHBWESK-UHFFFAOYSA-N dipeptide phenylalanyl-tyrosine Natural products C=1C=C(O)C=CC=1CC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FSXRLASFHBWESK-UHFFFAOYSA-N 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- QUPDWYMUPZLYJZ-UHFFFAOYSA-N ethyl Chemical compound C[CH2] QUPDWYMUPZLYJZ-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 230000002518 glial effect Effects 0.000 description 1
- XBGGUPMXALFZOT-UHFFFAOYSA-N glycyl-L-tyrosine hemihydrate Natural products NCC(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 XBGGUPMXALFZOT-UHFFFAOYSA-N 0.000 description 1
- 108010087823 glycyltyrosine Proteins 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 102000043450 human CCR1 Human genes 0.000 description 1
- 102000043994 human CCR2 Human genes 0.000 description 1
- 102000053523 human CXCR4 Human genes 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000005917 in vivo anti-tumor Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000031146 intracellular signal transduction Effects 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 238000003141 isotope labeling method Methods 0.000 description 1
- 238000001948 isotopic labelling Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 238000000670 ligand binding assay Methods 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 108010045397 lysyl-tyrosyl-lysine Proteins 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 239000008196 pharmacological composition Substances 0.000 description 1
- 238000009521 phase II clinical trial Methods 0.000 description 1
- 238000009522 phase III clinical trial Methods 0.000 description 1
- 239000013034 phenoxy resin Substances 0.000 description 1
- 229920006287 phenoxy resin Polymers 0.000 description 1
- YIQPUIGJQJDJOS-UHFFFAOYSA-N plerixafor Chemical compound C=1C=C(CN2CCNCCCNCCNCCC2)C=CC=1CN1CCCNCCNCCCNCC1 YIQPUIGJQJDJOS-UHFFFAOYSA-N 0.000 description 1
- 229960002169 plerixafor Drugs 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 201000006845 reticulosarcoma Diseases 0.000 description 1
- 208000029922 reticulum cell sarcoma Diseases 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 238000003375 selectivity assay Methods 0.000 description 1
- UQDJGEHQDNVPGU-UHFFFAOYSA-N serine phosphoethanolamine Chemical compound [NH3+]CCOP([O-])(=O)OCC([NH3+])C([O-])=O UQDJGEHQDNVPGU-UHFFFAOYSA-N 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 239000012265 solid product Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000011476 stem cell transplantation Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 238000013414 tumor xenograft model Methods 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 239000000273 veterinary drug Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/50—Cyclic peptides containing at least one abnormal peptide link
- C07K7/54—Cyclic peptides containing at least one abnormal peptide link with at least one abnormal peptide link in the ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/12—Cyclic peptides, e.g. bacitracins; Polymyxins; Gramicidins S, C; Tyrocidins A, B or C
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/50—Cyclic peptides containing at least one abnormal peptide link
- C07K7/54—Cyclic peptides containing at least one abnormal peptide link with at least one abnormal peptide link in the ring
- C07K7/56—Cyclic peptides containing at least one abnormal peptide link with at least one abnormal peptide link in the ring the cyclisation not occurring through 2,4-diamino-butanoic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Oncology (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Rheumatology (AREA)
- Immunology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Pulmonology (AREA)
- Pain & Pain Management (AREA)
- Hematology (AREA)
- AIDS & HIV (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Description
これらの重篤な疾患にCXCR4/SDF−1が関与しているという点において、CXCR4は、関心を引く治療標的である。
a)前記ラクタムは、X1の側鎖アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X1及びX7は、それぞれ(D/L)Agl/Glu、Dab/Glu、及びDap/Gluからなる群から選ばれる対であり、R1はAc又はn−ヘキサノイルであり;又は
b)前記ラクタムは、X1の側鎖カルボキシル基とX7の側鎖アミノ基との間のアミド結合により形成され、X1及びX7は、それぞれ、Asp/(D/L)Agl、Asp/Dab、Asp/Dap、Glu/(D/L)Agl、Glu/Dab、Glu/Dap、Glu/D−Dap、及びGlu/Lysからなる群から選ばれる対であり、R1はAc又はBzであるか、又はX1及びX7は、それぞれ、スクシニル/(D/L)Agl、スクシニル/Dab、スクシニル/Dap、スクシニル/Lys、及びスクシニル/Ornからなる群から選ばれる対であり、R1は存在せず;又は
c)前記ラクタムは、X1のα−アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X1及びX7は、それぞれ、Ala/Glu、Ala/D−Glu、D−Ala/Glu、D−Ala/D−Glu、Dap(Ac)/Glu、Gly/Asp、Gly/Glu、Gly/D−Glu、Leu/Glu、Leu/D−Glu、Lys/D−Glu、Lys(Ac)/Glu、2Nal/Glu、Phe/Glu、Phe/D−Glu、D−Phe/Glu、及びD−Phe/D−Gluからなる群から選ばれる対であり、R1は存在せず;又は
d)前記ラクタムは、X1の非α、非側鎖アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X1及びX7は、それぞれ、β−Ala/Asp、β−Ala/Glu、5−アミノ−バレリル/Asp、5−アミノバレリル/Glu、4−AMB/Glu、4−AMPA/Asp、及び4−AMPA/Gluからなる群から選ばれる対であり、R1は存在せず;又は
e)前記ラクタムは、X2のα−アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X2及びX7は、それぞれ、Tyr/Asp、Tyr/Glu、及びTyr/D−Gluからなる群から選ばれる対であり、R1及びX1はそれぞれ存在せず;
R1は、X1がα−アミノ基を含み、そのα−アミノ基が前記ラクタムのアミド結合を構成しないときにX1のα−アミノ基上の置換基であり、かつ、Ac、Bz、及びn−ヘキサノイルからなる群から選ばれるか、又は存在せず、X1は、(D/L)Agl、Asp、Dab、Dap、及びGluからなる群から選ばれ;
X1は、(D/L)Agl、Ala、β−Ala、D−Ala、5−アミノバレリル、4−AMB、4−AMPA、Asp、Dab、Dap、Dap(Ac)、Glu、Gly、Leu、Lys、Lys(Ac)、2Nal、Phe、D−Phe、及びスクシニルからなる群から選ばれるか、又は存在せず;
X3は、Arg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は、(D/L)Agl、Asp、Dab、Dap、D−Dap、Glu、D−Glu、Lys、及びOrnからなる群から選ばれ;
X8は、β−Ala、Arg、D−Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9は、Gly、2Nal、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は、2Nalであるか、又は存在せず;
X8が存在しないときに、X9及びX10はそれぞれ存在せず、X9が存在しないときに、X10は存在せず、R2は、NH2及びNHEtからなる群から選ばれる。
R1は、X1がα−アミノ基を含み、そのα−アミノ基が前記ラクタムのアミド結合を構成しないときにX1のα−アミノ基上の置換基であり、かつ、Ac、Bz、及びn−ヘキサノイルからなる群から選ばれるか、又は存在せず、X1は、(D/L)Agl、Asp、Dab、Dap、及びGluからなる群から選ばれ;
X1は、(D/L)Agl、Ala、β−Ala、D−Ala、5−アミノバレリル、4−AMB、4−AMPA、Asp、Dab、Dap、Dap(Ac)、Glu、Gly、Leu、Lys、Lys(Ac)、2Nal、Phe、D−Phe、及びスクシニルからなる群から選ばれるか、又は存在せず;
X3は、Arg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は、(D/L)Agl、Asp、Dab、Dap、D−Dap、Glu、D−Glu、Lys、及びOrnからなる群から選ばれ;
X8は、β−Ala、Arg、D−Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9は、Gly、2Nal、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は、2Nalであるか、又は存在せず;
X8が存在しないときに、X9及びX10はそれぞれ存在せず、X9が存在しないときに、X10は存在せず、R2は、NH2及びNHEtからなる群から選ばれ、
式中、
a)X1及びX7が、それぞれ、(D/L)Agl/Glu、Dab/Glu、及びDap/Gluからなる群から選ばれる対であり、R1がAc又はn−ヘキサノイルであるときに、前記ラクタムは、X1の側鎖アミノ基とX7の側鎖カルボキシル基との間のアミド結合によって形成され;
b)X1及びX7が、それぞれ、Asp/(D/L)Agl、Asp/Dab、Asp/Dap、Glu/(D/L)Agl、Glu/Dab、Glu/Dap、Glu/D−Dap、及びGlu/Lysからなる群から選ばれる対であり、R1がAc又はBzであるときに、又はX1及びX7が、それぞれ、スクシニル/(D/L)Agl、スクシニル/Dab、スクシニル/Dap、スクシニル/Lys、及びスクシニル/Ornからなる群から選ばれる対であり、R1が存在しないときに、前記ラクタムは、X1の側鎖カルボキシル基とX7の側鎖アミノ基との間のアミド結合によって形成され;
c)X1及びX7が、それぞれ、Ala/Glu、Ala/D−Glu、D−Ala/Glu、D−Ala/D−Glu、Dap(Ac)/Glu、Gly/Asp、Gly/Glu、Gly/D−Glu、Leu/Glu、Leu/D−Glu、Lys/D−Glu、Lys(Ac)/Glu、2Nal/Glu、Phe/Glu、Phe/D−Glu、D−Phe/Glu、及びD−Phe/D−Gluからなる群から選ばれる対であり、R1が存在しないときに、前記ラクタムは、X1の側鎖アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され;又は
d)X1及びX7が、それぞれ、β−Ala/Asp、β−Ala/Glu、5−アミノ−バレリル/Asp、5−アミノバレリル/Glu、4−AMB/Glu、4−AMPA/Asp、及び4−AMPA/Gluからなる群から選ばれる対であり、R1が存在しないときに、前記ラクタムは、X1の非α、非側鎖アミノ基と、X7の側鎖カルボキシル基との間のアミド結合により形成され;又は
e)X2及びX7が、それぞれ、Tyr/Asp、Tyr/Glu、及びTyr/D−Gluからなる群から選ばれる対であり、R1及びX1が存在しないときに、前記ラクタムは、X2のα−アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成される。
X1は、(D/L)Agl、Ala、β−Ala、D−Ala、5−アミノバレリル、4−AMB、4−AMPA、Asp、Dab、Dap、Dap(Ac)、Glu、Gly、Leu、Lys、Lys(Ac)、2Nal、Phe、D−Phe、及びスクシニルからなる群から選ばれるか、又は存在せず、X1が(D/L)Agl、Dab、又はDapであり、X1のα−アミノ基が前記ラクタムのアミド結合を構成しないときに、前記α−アミノ基はAc及びn−ヘキサノイルからなる群から選ばれるR1で置換され;
X1がAsp又はGluであり、X1のα−アミノ基が前記ラクタムのアミド結合を構成しないときに、前記α−アミノ基はAc及びBzからなる群から選ばれるR1で置換され;
及びX1がAla、β−Ala、DAla、5−アミノバレリル、4−AMB、4−AMPA、Dap(Ac)、Gly、Leu、Lys、Lys(Ac)、2Nal、Phe、DPhe又はスクシニルであるときに、R1は存在せず;
X3はArg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は(D/L)Agl、Asp、Dab、Dap、D−Dap、Glu、D−Glu、Lys、及びOrnからなる群から選ばれ;
X8はβ−Ala、Arg、D−Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9はGly、2Nal、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は2Nalであるか、又は存在せず、X8が存在しないときに、X9及びX10はそれぞれ存在せず、X9が存在しないときに、X10は存在せず;及び
R2はNH2及びNHEtからなる群から選ばれ、更に、式中、前記ラクタムは、X1の側鎖アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X1及びX7は、それぞれ、(D/L)Agl/Glu、Dab/Glu、及びDap/Gluからなる群から選ばれる対であり、R1はAc又はn−ヘキサノイルであり;又は
前記ラクタムは、X1の側鎖カルボキシル基とX7の側鎖アミノ基との間のアミド結合により形成され、X1及びX7は、それぞれ、Asp/(D/L)Agl、Asp/Dab、Asp/Dap、Glu/(D/L)Agl、Glu/Dab、Glu/Dap、Glu/D−Dap、及びGlu/Lysからなる群から選ばれる対であり、R1はAc又はBzであり、又はX1及びX7は、それぞれ、スクシニル/(D/L)Agl、スクシニル/Dab、スクシニル/Dap、スクシニル/Lys、及びスクシニル/Ornからなる群から選ばれる対であり、R1は存在せず;又は
前記ラクタムは、X1のα−アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X1及びX7は、それぞれ、Ala/Glu、Ala/D−Glu、D−Ala/Glu、D−Ala/D−Glu、Dap(Ac)/Glu、Gly/Asp、Gly/Glu、Gly/D−Glu、Leu/Glu、Leu/D−Glu、Lys/D−Glu、Lys(Ac)/Glu、2Nal/Glu、Phe/Glu、Phe/D−Glu、D−Phe/Glu、及びD−Phe/D−Gluからなる群から選ばれる対であり、R1は存在せず;又は
前記ラクタムは、X1の非α、非側鎖アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X1及びX7は、それぞれ、β−Ala/Asp、β−Ala/Glu、5−アミノ−バレリル/Asp、5−アミノバレリル/Glu、4−AMB/Glu、4−AMPA/Asp、及び4−AMPA/Gluからなる群から選ばれる対であり、R1は存在せず;又は
前記ラクタムは、X2のTyrのα−アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X7は、Asp、Glu、及びD−Gluからなる群から選ばれ、R1及びX1はそれぞれ存在しない。
X1は、β−Ala、4−AMB、4−AMPA、Asp、Dab、Dap、Dap(Ac)、Glu、2Nal、Phe、及びスクシニルからなる群から選ばれるか、又は存在せず;
X3は、Arg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は、Asp、Dab、Dap、Glu、D−Glu、Lys、及びOrnからなる群から選ばれ;
X8はArg及びLysからなる群から選ばれるか、又は存在せず;
X9は存在せず;
X10は存在せず;及び
R2は、NH2及びNHEtからなる群から選ばれる。
X1は、D−Ala、5−アミノバレリル、4−AMPA、Asp、Glu、Leu、Lys(Ac)、Phe、D−Phe、及びスクシニルからなる群から選ばれ;
X3は、Arg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は、(D/L)Agl、Asp、Dab、Dap、D−Dap、Glu、及びD−Gluからなる群から選ばれ;
X8は、Arg、D−Arg、及びLysからなる群から選ばれるか、又は存在せず;
X9は存在せず;
X10は存在せず;及び
R2は、NH2及びNHEtからなる群から選ばれる。
X1は、(D/L)Agl、Ala、β−Ala、Asp、Dap、Glu、Gly、Lys、及びPheからなる群から選ばれ;
X3は、Arg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は、(D/L)Agl、Asp、Dap、Glu、及びD−Gluからなる群から選ばれ;
X8は、β−Ala、Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9は、Gly、2Nal、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は2Nalであるか、又は存在せず;及び
R2は、NH2及びNHEtからなる群から選ばれる。
X1は、Ala、5−アミノバレリル、Asp、Glu、Gly、Phe、D−Phe、及びスクシニルからなる群から選ばれ;
X3は、Arg、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は、(D/L)Agl、Asp、Dap、Glu、及びD−Gluからなる群から選ばれ;
X8は、β−Ala、Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9は、Gly、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は2Nalであるか、又は存在せず;及び
R2は、NH2及びNHEtからなる群から選ばれる。
X1は、Gly及びPheからなる群から選ばれ;
X3はLys(iPr)であり;及び
X7はD−Gluである。
X1は、Gly及びPheからなる群から選ばれ;
X3はLys(iPr)であり;
X7はD−Gluであり;
X8は、Arg及びLys(iPr)からなる群から選ばれるか、又は存在せず;
X9は存在せず;
X10は存在せず;及び
R2は、NH2及びNHEtからなる群から選ばれる。
R1は、Ac及びn−ヘキサノイルからなる群から選ばれ;
X1は、(D/L)Agl、Dab、及びDapからなる群から選ばれ;
X3は、Arg及びLys(iPr)からなる群から選ばれ;
X7はGluであり;
X8はArgであり;
X9は存在せず;
X10は存在せず;及び
R2はNH2である。
R1は、Ac及びBzからなる群から選ばれ;
X1は、Asp及びGluからなる群から選ばれ;
X3は、Arg及びLys(Me2)からなる群から選ばれ;
X7は、(D/L)Agl、Dab、Dap、D−Dap、及びLysからなる群から選ばれ;
X8はArgであり;
X9は存在せず;
X10は存在せず;及び
R2はNH2である。
R1は存在せず;
X1はスクシニルであり;
X3はArgであり;
X7は、(D/L)Agl、Dab、Dap、Lys、及びOrnからなる群から選ばれ;
X8はArgであり;
X9は存在せず;
X10は存在せず;
及びR2はNH2である。
R1は存在せず;
X1は、Ala、D−Ala、Gly、Dap(Ac)、Leu、Lys、Lys(Ac)、2Nal、Phe、及びD−Pheからなる群から選ばれ;
X3は、Arg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は、Asp、Glu、及びD−Gluからなる群から選ばれ;
X8は、β−Ala、Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9は、Gly、2Nal、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は2Nalであるか、又は存在せず;
X8が存在しないときに、X9及びX10はそれぞれ存在せず;及び
R2は、NH2及びNHEtからなる群から選ばれる。
R1は存在せず;
X1は、β−Ala、4−AMB、5−アミノバレリル、及び4−AMPAからなる群から選ばれ;
X3はArgであり;
X7は、Asp及びGluからなる群から選ばれ;
X8は、Arg及びD−Argからなる群から選ばれ;
X9は存在せず;
X10は存在せず;及び
R2はNH2である。
R1は存在せず;
X1は存在せず;
X3はArgであり;
X7は、Asp、Glu、及びD−Gluからなる群から選ばれ;
X8はArgであり;
X9は存在せず;
X10は存在せず;及び
R2はNH2である。
Ac−シクロ[Dap−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:2)
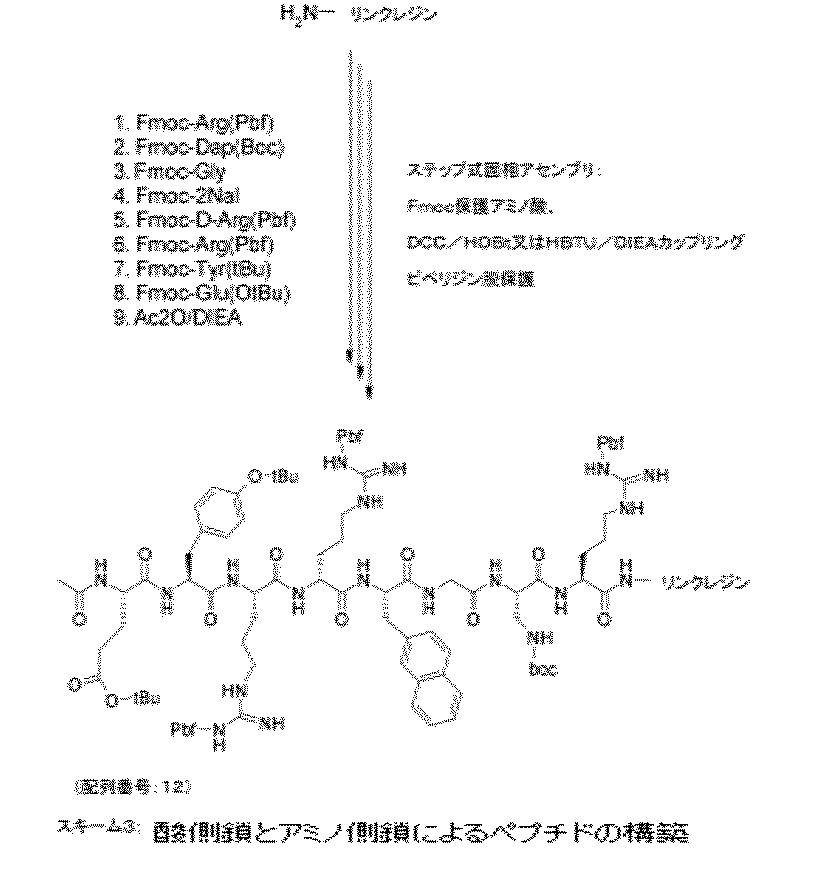
配列Ac−Dap(Alloc)−Tyr(tBu)−Arg(Pbf)−D−Arg(Pbf)−2Nal−Gly−Glu(O−アリル)−Arg(Pbf)(配列番号:3)は、スキーム1において後述するABI431型ペプチド合成器(アプライドバイオシステムズ社)を用い、標準Fmoc法により構築した。自動構築は、供給者の指示(ピー・イー・アプライドバイオシステムズ・インク社、米国カリフォルニア州フォスター市)にしたがい、標準のアプライドバイオシステムズ社DCC/HOBt法プロトコル、又は高速Moc法HBTU/DIEAプロトコルを用いて実施した。固相担体は、C末端アミド用のリンクアミドレジン(4−(2’,4’−ジメトキシフェニル−Fmoc−アミノメチル)−フェノキシレジン)、又はC末端エチルアミド用のインドールレジン[3−({エチル−Fmoc−アミノ}−メチル)−インドール−1−イル]−アセチル AMレジン(ノバ・バイオケム、EMDバイオサイエンス・インク社、米国カリフォルニア州サンディエゴ)である。ステップ式連鎖構築は、直鎖ペプチドのC末端から開始し、9つのメジャー・ステップで完了した。ステップ1において、保護アミノ酸であるFmoc−Arg(Pbf)の4つの等価物を、NMP中DCC/HOBt(又は、高速Moc法に対してはHBTU/DIEA)を用いて活性化し、20%ピペリジンを用いて脱保護されたリンクアミドレジンに結合した。ステップ2において、Fmoc−Glu(O−アリル)の4つの等価物を活性化し、ステップ1由来の脱保護されたペプチドレジンに結合した。Fmoc−Dap(Alloc)結合のステップ8まで、適切なステップを実施した。次いで、DMF中20%ピペリジンを用いてN末端のFmocを除去し、5当量の無水酢酸、乾燥DMF又はNMP中10当量のDIEAを用い、室温で1時間、α−アミノ基のアセチル化を実施した。
Ac−シクロ[Dab−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:6)
ステップ8におけるFmoc−Dap(Alloc)をFmoc−Dab(Alloc)に置き換えた以外は、実施例1と同様に調製した。計算MW:1156.33、観測MW:1156.10。
Ac−シクロ[Dap−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:7)
ステップ6におけるFmoc−Arg(Pbf)をFmoc−Lys(iPr)(Boc)に置き換えた以外は、実施例1と同様に調製した。計算MW:1156.37、観測MW:1156.78。
n−ヘキサノイル−シクロ[Dap−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:8)
ステップ6におけるFmoc−Arg(Pbf)をFmoc−Lys(iPr)(Boc)に置き換えた以外は、実施例1と同様に調製した。加えて、ステップ9における無水酢酸は、PyBOP/DIEAで活性化したヘキサン酸に置き換えた。計算MW:1212.47、観測MW:1212.92。
Ac−シクロ[(D/L)Agl−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:9)
ステップ2におけるFmoc−Glu(O−アリル)をFmoc−Glu(OtBu)に、ステップ8におけるFmoc−Dap(Alloc)をFmoc−(DL)Agl(Boc)に置き換えた以外は、実施例1と同様に調製した。アリル保護がないため、連鎖構築後には、Pd(Ph3P)4処理は行わなかった。代わりに、直鎖ペプチドを固体担体から切断して脱保護した後、溶液中で環化を実施した。切断物からの粗製直鎖ペプチド(0.25mmol)を真空乾燥し、10mL乾燥DMFに溶解した。このペプチド溶液(1.0mmol PyBOP及び4.0mmol DIEAを含む15mL乾燥ジクロロメタン及び15mL乾燥DMF)を、シリンジポンプを介し、2時間かけて後続の溶液に供給した。次いで、反応を室温で2時間進行させた。次いで、溶媒を真空下で蒸発させ、残渣を分取逆相HPLCに充填し、目標の環状ペプチドを単離し、実施例1に記載のように特性を分析した。計算MW:1128.27、観測MW:1128.26。
Ac−シクロ[Glu−Tyr−Arg−D−Arg−2Nal−Gly−Dap]−Arg−NH2(配列番号:10)
配列Glu(OtBu)−Tyr(tBu)−Arg(Pbf)−D−Arg(Pbf)−2Nal−Gly−Dap(Boc)−Arg(Pbf)(配列番号:11)は、下記のスキーム3に示すABI431装置を利用し、標準Fmoc法により構築した。自動構築は、供給者の指示(ピー・イー・アプライドバイオシステムズ・インク社、米国カリフォルニア州フォスター市)にしたがい、標準のアプライドバイオシステムズ社DCC/HOBt法プロトコル又は高速Moc法(HBTU/DIEA)プロトコルを用いて実施した。固相担体は、C末端アミド用のリンクアミドレジン、又はC末端エチルアミド用のインドールレジン[3−({エチル−Fmoc−アミノ}−メチル)−インドール−1−イル]−アセチルAMレジンである。ステップ式連鎖構築は、直鎖ペプチドのC末端から開始し、9つのメジャー・ステップで完了した。ステップ1において、保護アミノ酸であるFmoc−Arg(Pbf)の4つの等価物を、NMP中DCC/HOBt(又は、高速Moc法に対してはHBTU/DIEA)を用いて活性化し、脱保護されたリンクアミドレジンに結合した。ステップ2において、Fmoc−Dap(Boc)の2つの等価物を活性化し、ステップ1由来の脱保護されたレジンに結合した。Fmoc−Glu(OtBu)結合のステップ8まで、適切なステップを実施した。ステップ9では、N末端のFmocをDMF中20%ピペリジンで除去し、5当量の無水酢酸、乾燥DMF又はNMP中10当量のDIEAを用いて、室温で1時間、オフラインでα−アミノ基のアセチル化を実施した。完成したペプチドを同時に脱保護し、TFA/H2O/TIS/EDT(95/2/1/2、v/v/v/v)、又はTFA/H2O/TIS/アニソール(92/2/4/2、v/v/v/v)のスカベンジャ混合物を用いて、室温で2時間、レジンから切断した(スキーム4)。次いで、真空下で溶媒を蒸発させ、ペプチドを析出させ、冷ジエチルエーテルで3回洗浄してスカベンジャを除去した。粗生成物は、直接、環化反応に使用した。計算MW:1142.30、観測MW:1142.83。
Bz−シクロ[Glu−Tyr−Arg−D−Arg−2Nal−Gly−Dap]−Arg−NH2(配列番号:14)
ステップ9における無水酢酸を無水安息香酸に置き換えた以外は、実施例6と同様に調製した。計算MW:1204.37、観測MW:1204.87。
Ac−シクロ[Glu−Tyr−Arg−D−Arg−2Nal−Gly−D−Dap]−Arg−NH2(配列番号:15)
ステップ2におけるFmoc−Dap(Boc)をFmoc−D−Dap(Boc)に置き換えた以外は、実施例6と同様に調製した。計算MW:1142.30、観測MW:1142.73。
Ac−シクロ[Glu−Tyr−Arg−D−Arg−2Nal−Gly−Lys]−Arg−NH2(配列番号:16)
ステップ2におけるFmoc−Dap(Boc)をFmoc−Lys(Boc)に置き換えた以外は、実施例6と同様に調製した。計算MW:1184.38、観測MW:1184.23。
Ac−シクロ[Glu−Tyr−Arg−D−Arg−2Nal−Gly−Dab]−Arg−NH2(配列番号:17)
ステップ2におけるFmoc−Dap(Boc)をFmoc−Dab(Boc)に置き換えた以外は、実施例6と同様に調製した。計算MW:1156.33、観測MW:1156.07。
Ac−シクロ[Glu−Tyr−Arg−D−Arg−2Nal−Gly−(D/L)Agl]−Arg−NH2(配列番号:18)
ステップ2におけるFmoc−Dap(Boc)をFmoc−(DL)Agl(Boc)に置き換えた以外は、実施例6と同様に調製した。計算MW:1128.27、観測MW:1128.86。
Bz−シクロ[Glu−Tyr−Arg−D−Arg−2Nal−Gly−(D/L)Agl]−Arg−NH2(配列番号:19)
ステップ2におけるFmoc−Dap(Boc)をFmoc−(DL)Agl(Boc)に置き換えた以外は、実施例6と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1190.34、観測MW:1190.99。
Bz−シクロ[Asp−Tyr−Arg−D−Arg−2Nal−Gly−Dab]−Arg−NH2(配列番号:20)
ステップ2におけるFmoc−Dap(Boc)をFmoc−Dab(Boc)に、ステップ8におけるFmoc−Glu(OtBu)をFmoc−Asp(OtBu)に置き換えた以外は、実施例6と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1204.37、観測MW:1204.87。
Ac−シクロ[Asp−Tyr−Arg−D−Arg−2Nal−Gly−Dab]−Arg−NH2(配列番号:21)
ステップ2におけるFmoc−Dap(Boc)をFmoc−Dab(Boc)に、ステップ8におけるFmoc−Glu(OtBu)をFmoc−Asp(OtBu)に置き換えた以外は、実施例6と同様に調製した。計算MW:1142.30、観測MW:1142.81。
Ac−シクロ[Asp−Tyr−Arg−D−Arg−2Nal−Gly−Dap]−Arg−NH2(配列番号:22)
ステップ8におけるFmoc−Glu(OtBu)をFmoc−Asp(OtBu)に置き換えた以外は、実施例6と同様に調製した。計算MW:1128.27、観測MW:1128.78。
Bz−シクロ[Asp−Tyr−Arg−D−Arg−2Nal−Gly−Dap]−Arg−NH2(配列番号:23)
ステップ8におけるFmoc−Glu(OtBu)をFmoc−Asp(OtBu)に置き換えた以外は、実施例8と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1190.34、観測MW:1190.69。
Ac−シクロ[Asp−Tyr−Arg−D−Arg−2Nal−Gly−(D/L)Agl]−Arg−NH2(配列番号:24)
ステップ2におけるFmoc−Dap(Boc)をFmoc−(DL)Agl(Boc)に、ステップ8におけるFmoc−Glu(OtBu)をFmoc−Asp(OtBu)に置き換えた以外は、実施例6と同様に調製した。計算MW:1114.24、観測MW:1114.85。
Ac−シクロ[Asp−Tyr−Lys(Me2)−D−Arg−2Nal−Gly−Dap]−Arg−NH2(配列番号:25)
ステップ6におけるFmoc−Arg(Pbf)をFmoc−Lys(Me2)に、ステップ8におけるFmoc−Glu(OtBu)をFmoc−Asp(OtBu)に置き換えた以外は、実施例6と同様に調製した。計算MW:1128.31、観測MW:1128.92。
Bz−シクロ[Asp−Tyr−Lys(Me2)−D−Arg−2Nal−Gly−Dap]−Arg−NH2(配列番号:26)
ステップ6におけるFmoc−Arg(Pbf)をFmoc−Lys(Me2)に、ステップ8におけるFmoc−Glu(OtBu)をFmoc−Asp(OtBu)に置き換えた以外は、実施例6と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1190.38、観測MW:1191.14。
シクロ[スクシニル−Tyr−Arg−D−Arg−2Nal−Gly−(D/L)Agl]−Arg−NH2(配列番号:27)
ステップ2におけるFmoc−Dap(Boc)をFmoc−(DL)Agl(Boc)に置き換え、ステップ8におけるFmoc−Glu(OtBu)を使用せず当該ステップを省いた以外は、実施例6と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1057.19、観測MW:1057.87。
シクロ[スクシニル−Tyr−Arg−D−Arg−2Nal−Gly−Dap]−Arg−NH2(配列番号:28)
ステップ8におけるFmoc−Glu(OtBu)を使用せず当該ステップを省いた以外は、実施例6と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1071.22、観測MW:1071.85。
シクロ[スクシニル−Tyr−Arg−D−Arg−2Nal−Gly−Dab]−Arg−NH2(配列番号:29)
ステップ2におけるFmoc−Dap(Boc)をFmoc−Dab(Boc)に置き換え、ステップ8におけるFmoc−Glu(OtBu)を使用せず当該ステップを省いた以外は、実施例6と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1085.25、観測MW:1085.87。
シクロ[スクシニル−Tyr−Arg−D−Arg−2Nal−Gly−Orn]−Arg−NH2(配列番号:30)
ステップ2におけるFmoc−Dap(Boc)をFmoc−Orn(Boc)置き換え、ステップ8におけるFmoc−Glu(OtBu)を使用せず当該ステップを省いた以外は、実施例6と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1099.27、観測MW:1100.23。
シクロ[スクシニル−Tyr−Arg−D−Arg−2Nal−Gly−Lys]−Arg−NH2(配列番号:31)
ステップ2におけるFmoc−Dap(Boc)をFmoc−Lys(Boc)に置き換え、ステップ8におけるFmoc−Glu(OtBu)を使用せず当該ステップを省いた以外は、実施例6と同様に調製した。加えて、ステップ9における無水酢酸を無水安息香酸に置き換えた。計算MW:1113.30、観測MW:1114.25。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Arg−NH2(配列番号:32)
配列Gly−Tyr(tBu)−Lys(iPr)(Boc)−D−Arg(Pbf)−2Nal−Gly−D−Glu(O−アリル)−Arg(Pbf)(配列番号:33)は、スキーム5において後述するABI431を利用して構築した。自動構築は、供給者の指示(ピー・イー・アプライドバイオシステムズ・インク社、米国カリフォルニア州フォスター市)にしたがい、標準のアプライドバイオシステムズ社DCC/HOBt法プロトコルを用いて実施した。固相担体は、アミドに対してはリンクアミドレジン、C末端エチルアミドに対してはインドールレジン[3−({エチル−Fmoc−アミノ}−メチル)−インドール−1−イル]−アセチルAMレジンである。ステップ式連鎖構築は、直鎖ペプチドのC末端から開始し、8つのメジャー・ステップで完了した(スキーム5)。ステップ1において、保護アミノ酸であるFmoc−Arg(Pbf)の4つの等価物を、NMP中DCC/HOBt(又は、高速Moc法に対してはHBTU/DIEA)を用いて活性化し、リンクアミドレジンに結合した。ステップ2において、Fmoc−Glu(O−アリル)の2つの等価物を活性化し、ステップ1由来の脱保護されたペプチドレジンに結合した。Fmoc−Fmoc−Gly結合のステップ8まで、適切なステップを実施した。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Arg−NH2酢酸塩(配列番号:34)
実施例25のペプチドのTFA塩を、2%酢酸/H2O(v/v)で平衡化した適切なサイズの分取C18カラム上に吸着させ、酢酸塩に変換した。次いでカラムを3〜5のカラム容積の2%酢酸水(v/v)で洗浄した。2%酢酸を含有する水/アセトニトリルの1:1(v/v)混合溶媒を用いてペプチドを溶出し、凍結乾燥した。計算MW:1085.29、観測MW:1085.32。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−NH2(配列番号:37)
ステップ1を省いた以外は、実施例25と同様に調製した。計算MW:929.10、観測MW:929.39、
aシクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−NH2酢酸塩(配列番号:38)
実施例26のペプチドのTFA塩を、2%酢酸/H2O(v/v)で平衡化した適切なサイズの分取C18カラム上に吸着させ、酢酸塩に変換した。次いでカラムを3〜5のカラム容積の2%酢酸水(v/v)で洗浄した。2%酢酸を含有する水/アセトニトリルの1:1(v/v)混合溶媒を用いてペプチドを溶出し、凍結乾燥した。計算MW:929.10、観測MW:929.39。
シクロ[Gly−Tyr−Arg−D−Arg−2Nal−Gly−D−Glu]−Arg−NH2(配列番号:39)
ステップ6におけるFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換えた以外は、実施例25と同様に調製した。計算MW:1071.22、観測MW:1071.02。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2(配列番号:40)
ステップ1におけるFmoc−Arg(Pbf)をFmoc−Lys(iPr)(Boc)に置き換えた以外は、実施例25と同様に調製した。計算MW:1099.35、観測MW:1099.91。
シクロ[Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:41)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に、ステップ6におけるFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8を使用せずステップ8を省いた以外は、実施例25と同様に調製した。計算MW:1014.17、観測MW:1014.78。
シクロ[Tyr−Arg−D−Arg−2Nal−Gly−D−Glu]−Arg−NH2(配列番号:42)
ステップ6におけるFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8を使用せずステップ8を省いた以外は、実施例25と同様に調製した。計算MW:1014.17、観測MW:1014.65。
シクロ[Tyr−Arg−D−Arg−2Nal−Gly−Asp]−Arg−NH2(配列番号:43)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Asp(アリル)に、ステップ6におけるFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8を使用せずステップ8を省いた以外は、実施例25と同様に調製した。計算MW:1000.14、観測MW:1000.63。
シクロ[Gly−Tyr−Arg−D−Arg−2Nal−Gly−Asp]−Arg−NH2(配列番号:44)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Asp(アリル)に、ステップ6におけるFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換えた以外は、実施例25と同様に調製した。計算MW:1057.19、観測MW:1057.35。
シクロ[Gly−Tyr−Lys(Me2)−D−Arg−2Nal−Gly−Asp]−Arg−NH2(配列番号:45)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Asp(アリル)に、ステップ6におけるFmoc−Lys(iPr)(Boc)をFmoc−Lys(Me2)に置き換えた以外は、実施例25と同様に調製した。計算MW:1057.23、観測MW:1057.86。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Asp]−Arg−NH2(配列番号:46)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Asp(アリル)に置き換えた以外は、実施例25と同様に調製した。計算MW:1071.26、観測MW:1071.76。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Asp]−NH2(配列番号:47)
ステップ1を省き、ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Asp(アリル)に置き換えた以外は、実施例25と同様に調製した。計算MW:915.07、観測MW:915.38。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Asp]−Lys(iPr)−NH2(配列番号:48)
ステップ1におけるFmoc−Arg(Pbf)をFmoc−Lys(iPr)(Boc)に、ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Asp(アリル)に置き換えた以外は、実施例25と同様に調製した。計算MW:1085.33、観測MW:1085.78。
シクロ[Gly−Tyr−Lys(Me2)−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:49)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に、ステップ6におけるFmoc−Lys(iPr)(Boc)をFmoc−Lys(Me2)に置き換えた以外は、実施例25と同様に調製した。計算MW:1071.26、観測MW:1071.05.
シクロ[Gly−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:50)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に、ステップ6におけるFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換えた以外は、実施例25と同様に調製した。計算MW:1071.22、観測MW:1071.50。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:51)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換えた以外は、実施例25と同様に調製した。計算MW:1085.29、観測MW:1085.91。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NH2(配列番号:52)
ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換えた以外は、実施例25と同様に調製した。計算MW:929.10、観測MW:929.39。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Asp]−NHEt(配列番号:53)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)−インドール−1−イル]−アセチルAMレジンに置き換え、ステップ1を省き、ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Asp(アリル)に置き換えた以外は、実施例25と同様に調製した。計算MW:943.13、観測MW:943.36。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NHEt(配列番号:54)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)−インドール−1−イル]−アセチルAMレジンに置き換え、ステップ1を省き、ステップ2におけるFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換えた以外は、実施例25と同様に調製した。計算MW:957.15、観測MW:957.50。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−NHEt(配列番号:55)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)−インドール−1−イル]−アセチルAMレジンに置き換え、ステップ1を省いた以外は、実施例25と同様に調製した。計算MW:957.15、観測MW:957.46。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Arg−NHEt(配列番号:56)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)インドール−1−イル]−アセチル−AMレジンに置き換えた以外は、実施例25と同様に調製した。計算MW:1113.34、観測MW:1113.81。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Arg−NHEt酢酸塩(配列番号:57)
2%酢酸水溶液(v/v)で平衡化した好適なサイズのC18分取用カラムに物質を吸着させることによって実施例44のペプチドのTFA塩を酢酸塩に変換した。次いで、カラム容量の3〜5倍量の2%酢酸水溶液(v/v)でカラムを洗浄した。2%容量の酢酸を含有する水/アセトニトリルの1:1(v/v)混合溶媒を用いてペプチドを溶出し、凍結乾燥した。計算MW:1113.34、観測MW:1113.81。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NHEt(配列番号:58)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)インドール−1−イル]−アセチル−AMレジンに置き換え、ステップ1のFmoc−Arg(Pbf)をFmoc−Lys(iPr)(Boc)に置き換えた以外は、実施例25と同様に調製した。計算MW:1127.41、観測MW:1127.35。
シクロ[Lys(Ac)−Tyr−Lys(Me2)−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:59)
ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(OtBu)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Lys(Me2)に置き換え、ステップ8のFmoc−GlyをBoc−Lys(Fmoc)に置き換えた以外は、実施例25と同様に調製した。連鎖構築の後、DMF中20%ピペリジンでN末端Lysの側鎖上のFmocを除去し、10当量の無水酢酸/DIEAを用いて室温にて1時間Lys側鎖をアセチル化した。TFA/水/TIS/アニソール(90/5/2.5/2.5、v/v/v/v)の混合物を用いて室温にて2時間、全側鎖の保護基を外し、直鎖ペプチドを固相担体から切断した。溶液中で粗製の直鎖ペプチドの環化を行った。切断された粗製の直鎖ペプチド(約0.25mmol)を真空下で乾燥させ、無水DMF10mLに溶解した。このペプチド溶液(無水ジクロロメタン15mL及び1.0mmol PyBOPと4.0mmol DIEAを含有する無水DMF15mL)を、シリンジポンプを介して以下の反応混合物に2時間かけて供給した。次いで室温にて2時間、反応を進行させた。次いで真空下で溶媒を蒸発させ、逆相C18分取用HPLCカラムに残渣を充填し、目的の環状ペプチドを単離し、実施例1に記載されたように特性を分析した。計算MW:1184.42、観測MW:1184.06。
シクロ[Dap(Ac)−Tyr−Lys(Me2)−D−Arg−2Nal−Gly−Glu]−NH2(配列番号:60)
ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(OtBu)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Lys(Me2)に置き換え、ステップ8のFmoc−GlyをBoc−Dap(Fmoc)に置き換えた以外は、実施例25と同様に調製した。連鎖構築の後、DMF中20%ピペリジンでN末端Dapの側鎖上のFmocを除去し、10当量の無水酢酸/DIEAを用いて室温にて1時間Dap側鎖をアセチル化した。TFA/水/TIS/アニソール(90/5/2.5/2.5、v/v/v/v)の混合物を用いて室温にて2時間、全側鎖の保護基を外し、直鎖ペプチドを固相担体から切断した。溶液中で粗製の直鎖ペプチドの環化を行った。切断された粗製の直鎖ペプチド(約0.25mmol)を真空下で乾燥させ、無水DMF10mLに溶解した。このペプチド溶液(無水ジクロロメタン15mL及び1.0mmol PyBOPと4.0mmol DIEAを含有する無水DMF15mL)を、シリンジポンプを介して以下の反応混合物に2時間かけて供給した。次いで室温にて2時間、反応を進行させた。次いで真空下で溶媒を蒸発させ、分取用HPLCカラムに残渣を充填し、目的の環状ペプチドを単離し、実施例1に記載されたように特性を分析した。計算MW:986.15、観測MW:985.97。
シクロ[Ala−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NH2(配列番号:61)
ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−Alaに置き換えた以外は、実施例25と同様に調製した。計算MW:943.13、観測MW:942.92。
シクロ[D−Ala−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NH2(配列番号:62)
ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−D−Alaに置き換えた以外は、実施例25と同様に調製した。計算MW:943.13、観測MW:943.44
シクロ[D−Ala−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−NH2(配列番号:63)
ステップ1を省き、ステップ8のFmoc−GlyをFmoc−D−Alaに置き換えた以外は、実施例25と同様に調製した。計算MW:943.13、観測MW:943.42。
シクロ[Ala−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−NH2(配列番号:64)
ステップ1を省き、ステップ8のFmoc−GlyをFmoc−Alaに置き換えた以外は、実施例25と同様に調製した。計算MW:943.13、観測MW:943.48。
シクロ[Leu−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−NH2(配列番号:65)
ステップ1を省き、ステップ8のFmoc−GlyをFmoc−Leuに置き換えた以外は、実施例25と同様に調製した。計算MW:985.21、観測MW:985.56。
シクロ[Leu−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NH2(配列番号:66)
ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−Leuに置き換えた以外は、実施例25と同様に調製した。計算MW:985.21、観測MW:985.49。
シクロ[D−Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NH2(配列番号:67)
ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−D−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1019.22、観測MW:1019.52。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NH2(配列番号:68)
ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1019.22、観測MW:1019.53。
シクロ[D−Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−NH2(配列番号:69)
ステップ1を省き、ステップ8のFmoc−GlyをFmoc−D−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1019.22、観測MW:1019.50。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2(配列番号:70)
ステップ1のFmoc−Arg(Pbf)をLys(iPr)(Boc)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1189.48、観測MW:1189.92。
aシクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2酢酸塩(配列番号:71)
2%酢酸水溶液(v/v)で平衡化した好適なサイズのC18分取用カラムに物質を吸着させることによって実施例57のペプチドのTFA塩を酢酸塩に変換した。次いで、カラム容量の3〜5倍量の2%酢酸水溶液(v/v)でカラムを洗浄した。2%容量の酢酸を含有する水/アセトニトリルの1:1(v/v)混合溶媒を用いてペプチドを溶出し、凍結乾燥した。計算MW:1189.48、観測MW:1189.92。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Arg−NH2(配列番号:72)
ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1175.41、観測MW:1175.81。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−NH2(配列番号:73)
ステップ1を省き、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1019.22、観測MW:1019.56
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NHEt(配列番号:74)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)インドール−1−イル]−アセチル−AMレジンに置き換え、ステップ1のFmoc−Arg(Pbf)をLys(iPr)(Boc)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1217.53、観測MW:1217.97。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NHEt酢酸塩(配列番号:75)
2%酢酸水溶液(v/v)で平衡化した好適なサイズのC18分取用カラムに物質を吸着させることによって実施例60のペプチドのTFA塩を酢酸塩に変換した。次いで、カラム容量の3〜5倍量の2%酢酸水溶液(v/v)でカラムを洗浄した。2%容量の酢酸を含有する水/アセトニトリルの1:1(v/v)混合溶媒を用いてペプチドを溶出し、凍結乾燥した。計算MW:1217.53、観測MW:1217.97。
シクロ[D−Ala−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NHEt(配列番号:76)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)インドール−1−イル]−アセチル−AMレジンに置き換え、ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−D−Alaに置き換えた以外は、実施例25と同様に調製した。計算MW:971.18、観測MW:971.49。
シクロ[2Nal−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NHEt(配列番号:77)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)インドール−1−イル]−アセチル−AMレジンに置き換え、ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−2Nalに置き換えた以外は、実施例25と同様に調製した。計算MW:1097.34、観測MW:1097.53。
シクロ[D−Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NHEt(配列番号:78)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)インドール−1−イル]−アセチル−AMレジンに置き換え、ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−D−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1047.28、観測MW:1047.51。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−NHEt(配列番号:79)
リンクアミドレジンを[3−({エチル−Fmoc−アミノ}−メチル)インドール−1−イル]−アセチル−AMレジンと置き換え、ステップ1を省き、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1047.28、観測MW:1047.57。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Gly−2Nal−NH2(配列番号:80)
ステップ1のFmoc−Arg(Pbf)をFmoc−2Nalに置き換え、ステップ1と2との間にFmoc−Glyを用いてステップを1つ加えた。計算MW:1183.39、観測MW:1183.26。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−Glu]−β−Ala−D−2Nal−NH2(配列番号:81)
ステップ1のFmoc−Arg(Pbf)をFmoc−D−2Nalに置き換え、ステップ1と2の間にFmoc−β−Alaを用いてステップを1つ加え、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換えた以外は、実施例25と同様に調製した。計算MW:1197.40、観測MW:1196.70。
シクロ[β−Ala−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:82)
ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8のFmoc−GlyをFmoc−β−Alaに置き換えた以外は、実施例25と同様に調製した。計算MW:1085.25、観測MW:1085.05
シクロ[β−Ala−Tyr−Arg−D−Arg−2Nal−Gly−Asp]−Arg−NH2(配列番号:83)
ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Asp(O−アリル)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8のFmoc−GlyをFmoc−β−Alaに置き換えた以外は、実施例25と同様に調製した。計算MW:1071.22、観測MW:1071.15。
シクロ[5−アミノバレリル−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:84)
ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8のFmoc−GlyをFmoc−5アミノ吉草酸に置き換えた以外は、実施例25と同様に調製した。計算MW:1113.30、観測MW:1113.40。
シクロ[5−アミノバレリル−Tyr−Arg−D−Arg−2Nal−Gly−Asp]−Arg−NH2(配列番号:85)
ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Asp(O−アリル)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8のFmoc−GlyをFmoc−5アミノ吉草酸に置き換えた以外は、実施例25と同様に調製した。計算MW:1099.27、観測MW:1100.25。
シクロ[(4−AMPA)−Tyr−Arg−D−Arg−2Nal−Gly−Asp]−Arg−NH2(配列番号:86)
ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Asp(O−アリル)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8のFmoc−GlyをFmoc−4−アミノメチル−フェニル酢酸(4−AMPA)に置き換えた以外は、実施例25と同様に調製した。計算MW:1147.32、観測MW:1148.20。
シクロ[(4−AMPA)−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:87)
ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8のFmoc−GlyをFmoc−4−アミノメチル−フェニル酢酸(4−AMPA)に置き換えた以外は、実施例25と同様に調製した。計算MW:1161.34、観測MW:1161.99。
シクロ[(4−AMPA)−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−D−Arg−NH2(配列番号:88)
ステップ1のFmoc−Arg(Pbf)をFmoc−D−Arg(Pbf)と置き換え、ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8のFmoc−GlyをFmoc−4−アミノメチル−フェニル酢酸(4−AMPA)に置き換えた以外は、実施例25と同様に調製した。計算MW:1161.34、観測MW:1161.83。
シクロ[(4−AMB)−Tyr−Arg−D−Arg−2Nal−Gly−Glu]−Arg−NH2(配列番号:89)
ステップ2のFmoc−D−Glu(O−アリル)をFmoc−Glu(O−アリル)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Arg(Pbf)に置き換え、ステップ8のFmoc−GlyをFmoc−4−アミノメチル−安息香酸(4−AMB)に置き換えた以外は、実施例25と同様に調製した。計算MW:1147.32、観測MW:1147.66。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−Gly−2Nal−NH2(配列番号:90)
ステップ1を、3つの連続した残基のカップリング、すなわち先ず、Fmoc−2Nal、次いでFmoc−Gly、次いでFmoc−Lys(iPr)(Boc)に置き換えた以外は、実施例25と同様に調製した。計算MW:1353.69、観測MW:1354.03。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−Gly−2Nal−NH2(配列番号:91)
ステップ1を、3つの連続した残基のカップリング、すなわち先ず、Fmoc−2Nal、次いでFmoc−Gly、次いでFmoc−Lys(iPr)(Boc)に置き換えた以外は、実施例25と同様に調製した。更に、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた。計算MW:1443.82、観測MW:1444.13。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Gly−D−Phe−NH2(配列番号:92)
ステップ1を、2つの連続した残基のカップリング、すなわち先ずFmoc−D−Phe、次いでFmoc−Glyに置き換えた以外は、実施例25と同様に調製した。計算MW:1133.36、観測MW:1133.73。
シクロ[Gly−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−D−Phe−NH2(配列番号:93)
ステップ1を、2つの連続した残基のカップリング、すなわち先ずFmoc−D−Phe、次いでFmoc−Lys(iPr)(Boc)に置き換えた以外は、実施例25と同様に調製した。計算MW:1246.58、観測MW:1246.88。
シクロ[Lys−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2(配列番号:94)
ステップ1のFmoc−Arg(Pbf)をFmoc−Lys(iPr)(Boc)に置き換え、ステップ8のFmoc−GlyをFmoc−Lys(Boc)に置き換えた以外は、実施例25と同様に調製した。計算MW:1170.50、観測MW:1169.80
シクロ[Phe−Tyr−Lys−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2(配列番号:95)
ステップ1のFmoc−Arg(Pbf)をFmoc−Lys(iPr)(Boc)に置き換え、ステップ6のFmoc−Lys(iPr)(Boc)をFmoc−Lys(Boc)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1147.40、観測MW:1146.70。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys−NH2(配列番号:96)
ステップ1のFmoc−Arg(Pbf)をFmoc−Lys(Boc)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1147.40、観測MW:1146.70。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Orn−NH2(配列番号:97)
ステップ1のFmoc−Arg(Pbf)をFmoc−Orn(Boc)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1133.40、観測MW:1132.70。
シクロ[Phe−Tyr−Lys−D−Arg−2Nal−Gly−D−Glu]−Lys−NH2(配列番号:98)
ステップ1のFmoc−Arg(Pbf)及びステップ6のFmoc−Lys(iPr)(Boc)をそれぞれFmoc−Lys(Boc)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1105.37、観測MW:1105.40。
シクロ[Phe−Tyr−Lys−D−Arg−2Nal−Gly−D−Glu]−Lys−NHEt(配列番号:99)
リンクレジンを[3−({エチル−Fmoc−アミノ}−メチル)インドール−1−イル]−アセチル−AMレジンに置き換え、ステップ1のFmoc−Arg(Pbf)及びステップ6のFmoc−Lys(iPr)(Boc)をそれぞれFmoc−Lys(Boc)に置き換え、ステップ8のFmoc−GlyをFmoc−Pheに置き換えた以外は、実施例25と同様に調製した。計算MW:1133.36、観測MW:1133.82
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2(配列番号:70)の代替合成I
実施例57は、高価でかつ大量に入手するのが困難である市販のビルディングブロックFmoc−Lys(iPr)Bocを用いたFmoc固相ペプチド合成法による配列番号:70の合成を開示している。本実施例で記載される方法によって、高価ではないFmoc−Lys(Boc)、溶液環化、及び水素化シアノホウ素ナトリウムを用いた還元的アミノ化を介したリシンのアルキル化を用いて配列番号:70を合成することが可能になり、この最終生成物に更に経済的な経路を提供する。追加的な利点は、反応媒体(酢酸、アセトン及びメタノール)が相対的に安価であり、反応条件が制御しやすく、アルキル化反応に影響を及ぼすことなく溶媒の比率を十分に変えることができ、回収収率が90%以上であることである。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2(配列番号:70)の代替合成II
実施例85は、Fmoc固相ペプチド合成法による配列番号:70の費用効果のある合成を開示している。この方法は、相対的に安価なFmoc−Lys(Boc)と、相対的に安価な溶媒(酢酸、アセトン及びメタノール)中で水素化シアノホウ素ナトリウムを用いた還元的アミノ化によるリシンのアルキル化とを採用している。しかしながら、この方法には、アリルエステルの側鎖の保護基を除去するための重金属触媒パラジウムの使用が含まれる。パラジウムは毒性が高く、この元素の完全な除去を保証する品質管理は複雑でかつ困難である。本実施例で記載されるレジン上での環化を伴うBoc固相ペプチド合成法によって、毒性でかつ高価なパラジウム触媒を必要とすることなく、相対的に安価なBoc−Lys(2−Cl−Z)を用いて配列番号:70の製造が可能になり、更に一層経済的な、規模拡大しやすい、毒性の低い、簡単な品質管理で済む、最終生成物への経路が提供される。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2(配列番号:70)の代替合成III
溶液環化を介して、パラジウム触媒を使用せずに実施例57(配列番号:70)の化合物を以下のように調製し、規模拡大を促進できる。
シクロ[Phe−Tyr−Lys(iPr)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr)−NH2(配列番号:70)の代替合成IV
以下のスキーム13で要約される合成法によってパラジウム触媒を使用することなく、実施例57(配列番号:70)の化合物を調製することができる。
THF中のNMM及びIBCFとBoc−Lys(iPr,Z)−OHを反応させた。NH4OHを添加した後、回転蒸発によって溶媒を除き、生成物を酢酸エチルに溶解した。5%NaHCO3、次いで0.1NのHClで酢酸エチル層を徹底的に洗浄し、次いで無水硫酸ナトリウムで乾燥させた。ろ過によって硫酸ナトリウムを除去し、減圧下の蒸発によって酢酸エチルを除去した。得られたBoc−Lys(iPr,Z)−NH2をDCMに溶解し、TFAを加えた。いったん反応が進行して完了したら、回転蒸発によって溶媒を除去した。次いでH−Lys(iPr,Z)−NH2をDMFに溶解した。DIEAによってpHを8に調節した。別の容器で、Fmoc−DGlu(OtBu)−OH、HBTU及びHOBtをDMFに溶解し、DIEAを加えてpHを8に調節した。2つの溶液を混合し、C18逆相HPLCによって反応をモニタした。pHをモニタし、必要に応じてDIEAで調節した。回転蒸発によって溶媒を除去し、生成物を酢酸エチルに溶解した。5%NaHCO3、次いで0.1NのHClで酢酸エチル層を徹底的に洗浄し、次いで無水硫酸ナトリウムで乾燥させた。ろ過によって硫酸ナトリウムを除去し、減圧下の蒸発によって酢酸エチルを除去した。乾燥した残渣が形成されるまで回転蒸発を継続した。得られたFmoc−DGlu(OtBu)−Lys(iPr,Z)−NH2をDCMに溶解し、TFAを加えた。いったん反応が完了したら、回転蒸発によって溶媒を除去した。ジエチルエーテルによる粉砕によって固体の生成物が得られた。沈殿物をエーテルで洗浄した後、真空オーブンで生成物を乾燥させた。
同位体標識の取り込み
シクロ[Phe−Tyr−Lys(iPr−d6)−D−Arg−2Nal−Gly−D−Glu]−Lys(iPr−d6)−NH2の合成(配列番号:108)
以下に示すような同位体で標識されたアセトン、例えば、13C−、14C−又はトリチウムで標識されたアセトンで開始して、実施例85〜87の方法を用いることによって、種々の薬理試験及び画像試験のための環状ペプチドCXCR4アンタゴニストの部位特異的な同位体標識が可能になる。同位体標識されたアセトンは種々の関係筋から市販されている。アセトン−d6を用いて12の重水素原子を含有するペプチドを調製する例を以下に示す。非標識の対応物と比べて12の重水素原子のゆえに分子量が異なる得られた化合物は、質量スペクトルで容易に識別され、同一の標的受容体親和性を示す。
CXCR4の細胞内シグナル伝達経路の活性化の最初のステップは、CXCR4へのSDF−1の結合である。化合物がSDF−1とCXCR4との相互作用を阻止することができるかどうか決定するために、内因性のCXCR4を発現しているヒト白血病CCRF−CEM細胞(ATCCのCCL119)を125I標識のSDF−1α結合アッセイにおいて用いた。96穴U底の未処理のポリスチレンプレート(コースタNo.3632、コーニング社)にてアッセイを行った。10mMのHEPES、pH7.5と0.2%のBSAを含有するRPMI1640培地(ニューヨーク州グランドアイランドのギブコ社)によって結合アッセイの緩衝液を調製した。手短に述べると、300pMのSDFリガンド(60pMの125I−SDF−1α(パーキンエルマー社)と240pMの非標識SDF−1α(R&Dシステムズ社)を含有する200μLの反応混合物と、アッセイ緩衝液中の種々の濃度の試験化合物と100,000個のヒトCCRF−CEM細胞と0.5mgのSPAビーズ(コムギ胚芽凝集ビーズ、アマシャム社)とを室温にて2時間インキュベートした。次いで、SPAモードの1450マイクロベータ液体シンチレーション発光カウンタ(ワラック)にてプレートを計数した。CXCR4のアンタゴニストは、このアッセイでは、用量依存的に、結合された放射活性を低下させた。結合された放射活性の用量依存性の低下に基づいて、グラフパッドプリズム(商標)ソフトウェアを用いて試験化合物の阻害能(Ki又はIC50)を算出した。
CXCR4/SDF−1の相互作用は、細胞表面でCXCR4を担う細胞の移動(走化性)を調節する。試験化合物のアンタゴニスト活性と細胞活動とを測定するために、内因性CXCR4を発現しているヒト組織球性リンパ腫U937細胞(ATCCのCRL1593)を用いた走化性アッセイを採用した。手短に述べると、10%のFBSと、1%のMEMピルビン酸ナトリウム(ギブコ社)と、1%の非必須アミノ酸(ギブコ社)と1%GlutaMAX−1(ギブコ社)とを含有するDMEM培地(ニューヨーク州グランドアイランドのギブコ社)中で増殖したU937細胞を回収し、10mMのHEPES、pH7.5と0.3%のBSAを含有するRPM培地×1によって調製された走化性アッセイ緩衝液で1回洗浄した。洗浄後、5×106個/mLの濃度で細胞をアッセイ緩衝液に再浮遊させた。製造元の指示にしたがって、96穴のChemoTxプレート(ニューロプローブ社)にてアッセイを行った。一般に、試験化合物と共に、又はそれを含まない50μLの細胞混合物を上側のチャンバーに入れ、1×走化性緩衝液中で調製された30μLのSDF−1α(10ng/mL、R&Dシステムズ)を下側のチャンバーに入れた。構築後、5%CO2下で37℃にて2.5時間、プレートをインキュベートした。インキュベートに続いて、5μLのCellTiter 96AQ(ウィスコンシン州マジソンのプロメガ社)を下側のチャンバーに添加した。次いで37℃にてプレートを60分間インキュベートし、テキャン・スペクトラフロアプラス(商標)マイクロプレートリーダ(オーストリア、ザルツブルグ)によって492nmにて吸収を測定することによって移動した細胞を検出した。CXCR4のアンタゴニストは、細胞の移動を阻害し、吸収の読み取りを低下させた。492nmでの吸収の用量依存性の低下に基づいて、グラフパッドプリズムソフトウェアを用いてこのアッセイにおける試験化合物の阻害能(IC50)を算出した。
ヒトのCCR1、CCR2、CXCR2又はCXCR3のような他のケモカイン受容体及びGタンパク質結合受容体と比べたCXCR4受容体への本化合物の結合選択性を、そのような受容体をコードし、発現する核酸を形質移入された細胞又は内因的にそのような受容体を発現している細胞において評価することができる。CXCR4/125I−SDF−1α結合阻害アッセイについて上述されたものと同様の方法で、細胞全体又は膜断片を用いて、これらの受容体に対する各リガンドと試験化合物の競合を評価することができる。
骨髄内の幹細胞は、生涯にわたって成熟血液細胞のあらゆる系列の継続的な産生を積極的に持続する。骨髄は、白血球(WBC)/好中球の産生の主な部位であり、これらを循環系に放出する。CXCR4/SDF−1軸は、骨髄におけるWBC、好中球及び造血系前駆細胞の保持及び放出について重要であると思われ、骨髄におけるCXCR4/SDF−1相互作用の妨害は、末梢血におけるこれら細胞の増加をもたらす。短期間のマウスのWBC/好中球動員モデルを用いて、試験化合物の生体内での標的調節活性を測定することができる。手短に述べると、アッセイに先立って、無菌の5〜6週令のメスC57BL/6マウス(タコニック)を少なくとも1週間飼育した。動物は、滅菌したげっ歯類用の餌及び酸性水を自由に摂取できた。生理食塩水に溶解した試験化合物又は対照の生理食塩水を5匹のマウスの群に皮下注射し、化合物の投与後、種々の時点でCO2による窒息及び頚椎脱臼によってマウスを屠殺した。EDTAを被覆したシリンジ及びチューブを用いて心臓穿刺によって末梢血を回収した。ヘマベットマスコット(商標)ヘマトロジーアナライザ(米国テキサス州ダラスのドリュー・サイエンティフィック・グループ社)にて完全な血液細胞の分析を行った。末梢血中の全白血球、全好中球及び全リンパ球を記録した。マウスに皮下投与された有効なCXCR4アンタゴニストは、対照の生理食塩水に比べて、末梢血における好中球数及びWBC数を増やした。
SDF−1/CXCR4相互作用は、腫瘍増殖、侵入、血管新生、及び転移を始めとする腫瘍形成の複数の段階で重要な役割を担うと思われる。試験化合物の生体内での抗腫瘍活性を評価するために、NOD/SCIDマウス(ジャクソンラボラトリーズ)とヒト非ホジキンリンパ腫のNamaruwa細胞(ATCCのCRL1432)を用いた腫瘍異種移植モデルを採用した。手短に述べると、マトリゲルと混合したNamaruwa細胞(1:1)を動物の脇腹近くで皮下に移植した。移植した腫瘍細胞は固形腫瘍として増殖したが、その直径を連続的にモニタし、キャリパを用いて測定した。このモデルにおいて試験化合物の生体内有効性を測定するために、腫瘍細胞の移植後最初の48時間に、生理食塩水又はPBSに溶解した種々の用量の試験化合物で動物(10匹/群)を処理することができる。化合物を皮下に投与し、腫瘍体積及び体重を2、3日ごとに測定した。腫瘍の増殖次第で、試験は一般に3〜4週間続いた。ビヒクルのみで処理した対照群における腫瘍体積と比べた処理群の腫瘍体積のパーセント減少によって試験化合物の抗腫瘍活性を測定した。
Claims (6)
- 次式のラクタム環化ペプチド、
b)前記ラクタムは、X1の側鎖カルボキシル基とX7の側鎖アミノ基との間のアミド結合により形成され、X1及びX7は、それぞれ、Asp/(D/L)Agl、Asp/Dab、Asp/Dap、Glu/(D/L)Agl、Glu/Dab、Glu/Dap、Glu/D−Dap、及びGlu/Lysからなる群から選ばれる対であり、R1はAc又はBzであるか、又はX1及びX7は、それぞれ、スクシニル/(D/L)Agl、スクシニル/Dab、スクシニル/Dap、スクシニル/Lys、及びスクシニル/Ornからなる群から選ばれる対であり、R1は存在せず;
又は、c)前記ラクタムは、X1のα−アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X1及びX7は、それぞれ、Ala/Glu、Ala/D−Glu、D−Ala/Glu、D−Ala/D−Glu、Dap(Ac)/Glu、Gly/Asp、Gly/Glu、Gly/D−Glu、Leu/Glu、Leu/D−Glu、Lys/D−Glu、Lys(Ac)/Glu、2Nal/Glu、Phe/Glu、Phe/D−Glu、D−Phe/Glu、及びD−Phe/D−Gluからなる群から選ばれる対であり、R1は存在せず;
又は、d)前記ラクタムは、X1の非α、非側鎖アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X1及びX7は、それぞれ、β−Ala/Asp、β−Ala/Glu、5−アミノ−バレリル/Asp、5−アミノバレリル/Glu、4−AMB/Glu、4−AMPA/Asp、及び4−AMPA/Gluからなる群から選ばれる対であり、R1は存在せず;又は、
e)前記ラクタムは、X2のα−アミノ基とX7の側鎖カルボキシル基との間のアミド結合により形成され、X2及びX7は、それぞれ、Tyr/Asp、Tyr/Glu、及びTyr/D−Gluからなる群から選ばれる対であり、R1及びX1はそれぞれ存在せず;
R1は、X1がα−アミノ基を含み、そのα−アミノ基が前記ラクタムのアミド結合を構成しないときにX1のα−アミノ基上の置換基であり、かつ、Ac、Bz、及びn−ヘキサノイルからなる群から選ばれるか、又は存在せず、X1は、(D/L)Agl、Asp、Dab、Dap、及びGluからなる群から選ばれ;
X1は、(D/L)Agl、Ala、β−Ala、D−Ala、5−アミノバレリル、4−AMB、4−AMPA、Asp、Dab、Dap、Dap(Ac)、Glu、Gly、Leu、Lys、Lys(Ac)、2Nal、Phe、D−Phe、及びスクシニルからなる群から選ばれるか、又は存在せず;
X 2 は 、 Tyrであり;
X3は、Arg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は、(D/L)Agl、Asp、Dab、Dap、D−Dap、Glu、D−Glu、Lys、及びOrnからなる群から選ばれ;
X8は、β−Ala、Arg、D−Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9は、Gly、2Nal、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は、2Nal、又は存在せず;
X8が存在しないときに、X9及びX10はそれぞれ存在せず、X9が存在しないときに、X10は存在せず、R2は、NH2及びNHEtからなる群から選ばれる)又はその薬理学的に許容できる塩。 - R1はAc、Bz、及びn−ヘキサノイルからなる群から選ばれるか、又は存在せず;
X1は(D/L)Agl、Ala、β−Ala、Asp、Dap、Glu、Gly、Lys、及びPheからなる群から選ばれ;
X3はArg、Lys、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は(D/L)Agl、Asp、Dap、Glu、及びD−Gluからなる群から選ばれ;
X8はβ−Ala、Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9はGly、2Nal、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は2Nal又は存在せず;及び
R2はNH2及びNHEtからなる群から選ばれる、請求項1に記載のラクタム環化ペプチド又はその薬理学的に許容できる塩。 - R1は、Ac及びBzからなる群から選ばれるか、又は存在せず;
X1はAla、5−アミノバレリル、Asp、Glu、Gly、Phe、D−Phe、及びスクシニルからなる群から選ばれ;
X3はArg、Lys(iPr)、及びLys(Me2)からなる群から選ばれ;
X7は(D/L)Agl、Asp、Dap、Glu、及びD−Gluからなる群から選ばれ;
X8はβ−Ala、Arg、Gly、Lys、Lys(iPr)、及びOrnからなる群から選ばれるか、又は存在せず;
X9はGly、D−2Nal、及びD−Pheからなる群から選ばれるか、又は存在せず;
X10は2Nal又は存在せず;及び
R2はNH2及びNHEtからなる群から選ばれる、請求項1に記載のラクタム環化ペプチド又はその薬理学的に許容できる塩。 - 請求項1、2又は3に記載のラクタム環化ペプチド、(式中、X1はGly及びPheからなる群から選ばれ;
X3はLys(iPr)であり;及び
X7はD−Gluである)又はその薬理学的に許容できる塩。 - 前記薬理学的に許容できる塩は、酢酸塩である、請求項5に記載のラクタム環化ペプチド。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US94080207P | 2007-05-30 | 2007-05-30 | |
| US60/940,802 | 2007-05-30 | ||
| US94099607P | 2007-05-31 | 2007-05-31 | |
| US60/940,996 | 2007-05-31 | ||
| PCT/US2008/064177 WO2008150689A1 (en) | 2007-05-30 | 2008-05-20 | Cyclic peptide cxcr4 antagonists |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010529957A JP2010529957A (ja) | 2010-09-02 |
| JP2010529957A5 JP2010529957A5 (ja) | 2011-07-07 |
| JP5358564B2 true JP5358564B2 (ja) | 2013-12-04 |
Family
ID=39831600
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010510418A Expired - Fee Related JP5358564B2 (ja) | 2007-05-30 | 2008-05-20 | 環状ペプチドcxcr4アンタゴニスト |
Country Status (32)
| Country | Link |
|---|---|
| US (3) | US7691813B2 (ja) |
| EP (2) | EP2160221B1 (ja) |
| JP (1) | JP5358564B2 (ja) |
| KR (2) | KR101319740B1 (ja) |
| CN (1) | CN101678213B (ja) |
| AR (1) | AR066648A1 (ja) |
| AT (1) | ATE516853T1 (ja) |
| AU (1) | AU2008260326B2 (ja) |
| BR (1) | BRPI0812134A2 (ja) |
| CA (1) | CA2688574C (ja) |
| CL (1) | CL2008001467A1 (ja) |
| CO (1) | CO6241137A2 (ja) |
| CR (1) | CR11105A (ja) |
| CY (1) | CY1111815T1 (ja) |
| DK (1) | DK2160221T3 (ja) |
| DO (1) | DOP2009000270A (ja) |
| EA (1) | EA017716B1 (ja) |
| GT (1) | GT200900304A (ja) |
| HR (1) | HRP20110551T1 (ja) |
| IL (1) | IL201685A (ja) |
| JO (1) | JO2776B1 (ja) |
| MA (1) | MA31666B1 (ja) |
| MX (1) | MX2009012952A (ja) |
| MY (1) | MY149432A (ja) |
| NZ (1) | NZ580849A (ja) |
| PE (1) | PE20090299A1 (ja) |
| PL (1) | PL2160221T3 (ja) |
| PT (1) | PT2160221E (ja) |
| TN (1) | TN2009000496A1 (ja) |
| TW (1) | TWI423987B (ja) |
| WO (1) | WO2008150689A1 (ja) |
| ZA (1) | ZA200908345B (ja) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2942798B1 (fr) | 2009-03-05 | 2011-04-08 | Centre Nat Rech Scient | Peptides utilisables pour le traitement de la leucemie lymphoide chronique |
| IT1397901B1 (it) * | 2010-01-26 | 2013-02-04 | Consiglio Nazionale Ricerche | Peptidi ciclici che legano il recettore cxcr4 e relativi usi in campo medico e diagnostico. |
| WO2012118124A1 (ja) * | 2011-03-01 | 2012-09-07 | 国立大学法人京都大学 | 新規ケモカイン受容体拮抗剤 |
| KR102091456B1 (ko) * | 2011-06-07 | 2020-03-23 | 폴리포 리미티드 | CXC4 길항제로서의 β-헤어핀 펩타이드 모방체 |
| WO2013044500A1 (zh) * | 2011-09-30 | 2013-04-04 | Cheng Yun | 丙型肝炎病毒免疫原性肽或其衍生物在预防或治疗关节炎中的应用 |
| WO2013060865A1 (en) | 2011-10-28 | 2013-05-02 | Galderma Research & Development | New leukocyte infiltrate markers for rosacea and uses thereof |
| EP2979991A1 (en) | 2014-07-31 | 2016-02-03 | Greif International Holding BV. | Multilayer material, fire protection mat with said multilayer material and transport and storage container assembly comprising said fire protection mat. |
| ES2764840T3 (es) | 2015-01-28 | 2020-06-04 | Univ Bordeaux | Uso de plerixafor para tratar y/o prevenir exacerbaciones agudas de la enfermedad pulmonar obstructiva crónica |
| WO2017176565A1 (en) | 2016-04-07 | 2017-10-12 | Eli Lilly And Company | Combinations of an anti-b7-h1 antibody and a cxcr4 peptide antagonist for treating a solid tumor |
| CN109922818B (zh) * | 2016-09-06 | 2024-02-20 | 主线生物科学公司 | Cxcr4拮抗剂及使用方法 |
| CN106841624B (zh) * | 2017-01-26 | 2019-02-22 | 庄磊靓 | 抗人cd4和抗人cd184单克隆抗体作为标志物的应用 |
| US11123437B2 (en) * | 2017-09-05 | 2021-09-21 | Mainline Biosciences, Inc. | Selective CXCR4 binding peptide conjugate and methods for making and using the same |
| KR20230145543A (ko) * | 2017-09-05 | 2023-10-17 | 메인라인 바이오사이언스 | 고친화성 cxcr4 선택적 결합 콘쥬게이트 및 그 사용 방법 |
| WO2019126796A1 (en) * | 2017-12-21 | 2019-06-27 | Mainline Biosciences Llc | Composition comprising a therapeutic agent and a cxcr4 selective antagonist and methods for using the same |
| JP2021165234A (ja) * | 2018-07-03 | 2021-10-14 | 富士フイルム富山化学株式会社 | Cxcr4結合性化合物もしくはその塩またはそれらと金属との錯体 |
| EP3849997B1 (en) | 2018-09-12 | 2024-05-01 | Technische Universität München | Cxcr4-targeted diagnostic and therapeutic agents with reduced species selectivity |
| EA202190755A1 (ru) | 2018-09-12 | 2021-06-11 | Технише Универзитет Мюнхен | Агенты для терапии и диагностики рака |
| CN114364690A (zh) * | 2019-04-18 | 2022-04-15 | 省卫生服务机构 | 用于诊断和治疗的新型放射性标记的cxcr4靶向化合物 |
| CN115003684A (zh) * | 2020-01-26 | 2022-09-02 | 主线生物科学有限公司 | 同位素标记的选择性cxcr4结合肽偶联物及其制备和使用方法 |
| EP4232459A4 (en) * | 2020-10-21 | 2024-12-04 | Provincial Health Services Authority | NEW COMPOUNDS TARGETING CXCR4 |
| CN116615411A (zh) * | 2020-12-25 | 2023-08-18 | 中外制药株式会社 | 包含n-取代氨基酸残基的肽化合物的制造方法 |
| JPWO2022138891A1 (ja) * | 2020-12-25 | 2022-06-30 | ||
| EP4043041A1 (en) | 2021-02-15 | 2022-08-17 | Technische Universität München | Cxcr4-ligands for diagnostic and therapeutic use and precursors thereof |
| EP4511384A1 (en) * | 2022-04-20 | 2025-02-26 | Provincial Health Services Authority | Cxcr4-targeting compounds, and methods of making and using the same |
| CN115060901A (zh) * | 2022-06-21 | 2022-09-16 | 中国医学科学院基础医学研究所 | 苹果酸酶2在制备矽肺病或肺纤维化相关疾病诊断试剂或治疗药物中的应用 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4391123B2 (ja) * | 2002-10-24 | 2009-12-24 | 株式会社オーファンリンク | 新規cxcr4アンタゴニスト |
| JP5308829B2 (ja) * | 2006-02-27 | 2013-10-09 | テクニッシュ ユニべルシタット ミュンヘン | 癌の画像化および処置 |
-
2008
- 2008-05-20 JO JO2008229A patent/JO2776B1/en active
- 2008-05-20 TW TW097118554A patent/TWI423987B/zh not_active IP Right Cessation
- 2008-05-20 HR HR20110551T patent/HRP20110551T1/hr unknown
- 2008-05-20 US US12/123,574 patent/US7691813B2/en not_active Ceased
- 2008-05-20 PT PT08769524T patent/PT2160221E/pt unknown
- 2008-05-20 NZ NZ580849A patent/NZ580849A/en not_active IP Right Cessation
- 2008-05-20 BR BRPI0812134-6A2A patent/BRPI0812134A2/pt not_active IP Right Cessation
- 2008-05-20 CN CN2008800178577A patent/CN101678213B/zh not_active Expired - Fee Related
- 2008-05-20 KR KR1020117026680A patent/KR101319740B1/ko not_active Expired - Fee Related
- 2008-05-20 EP EP08769524A patent/EP2160221B1/en active Active
- 2008-05-20 AT AT08769524T patent/ATE516853T1/de active
- 2008-05-20 PE PE2008000868A patent/PE20090299A1/es not_active Application Discontinuation
- 2008-05-20 JP JP2010510418A patent/JP5358564B2/ja not_active Expired - Fee Related
- 2008-05-20 MX MX2009012952A patent/MX2009012952A/es active IP Right Grant
- 2008-05-20 CL CL2008001467A patent/CL2008001467A1/es unknown
- 2008-05-20 AR ARP080102137A patent/AR066648A1/es unknown
- 2008-05-20 EA EA200971129A patent/EA017716B1/ru not_active IP Right Cessation
- 2008-05-20 MY MYPI20095053A patent/MY149432A/en unknown
- 2008-05-20 KR KR1020097024829A patent/KR101169846B1/ko not_active Expired - Fee Related
- 2008-05-20 EP EP11172401A patent/EP2377579A1/en not_active Withdrawn
- 2008-05-20 AU AU2008260326A patent/AU2008260326B2/en not_active Ceased
- 2008-05-20 PL PL08769524T patent/PL2160221T3/pl unknown
- 2008-05-20 DK DK08769524.3T patent/DK2160221T3/da active
- 2008-05-20 CA CA2688574A patent/CA2688574C/en not_active Expired - Fee Related
- 2008-05-20 WO PCT/US2008/064177 patent/WO2008150689A1/en not_active Ceased
-
2009
- 2009-10-22 IL IL201685A patent/IL201685A/en not_active IP Right Cessation
- 2009-11-10 CR CR11105A patent/CR11105A/es not_active Application Discontinuation
- 2009-11-25 ZA ZA2009/08345A patent/ZA200908345B/en unknown
- 2009-11-26 TN TNP2009000496A patent/TN2009000496A1/fr unknown
- 2009-11-26 GT GT200900304A patent/GT200900304A/es unknown
- 2009-11-27 DO DO2009000270A patent/DOP2009000270A/es unknown
- 2009-11-27 CO CO09135750A patent/CO6241137A2/es active IP Right Grant
- 2009-12-21 MA MA32439A patent/MA31666B1/fr unknown
-
2010
- 2010-01-25 US US12/692,788 patent/US20100130409A1/en not_active Abandoned
- 2010-09-10 US US12/807,694 patent/USRE42274E1/en not_active Expired - Fee Related
-
2011
- 2011-09-07 CY CY20111100861T patent/CY1111815T1/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5358564B2 (ja) | 環状ペプチドcxcr4アンタゴニスト | |
| EP3452096B1 (en) | Bicyclic peptide-toxin conjugates specific for mt1-mmp | |
| Garanger et al. | Multivalent RGD synthetic peptides as potent α V β 3 integrin ligands | |
| JP5384342B2 (ja) | 癌のような変更された細胞遊走に関連する障害の治療のための薬理学的活性を有するペプチド | |
| JP2014111637A (ja) | メラノコルチン受容体特異的ペプチド | |
| KR20230145543A (ko) | 고친화성 cxcr4 선택적 결합 콘쥬게이트 및 그 사용 방법 | |
| CA2376506C (en) | Neuromedin b and somatostatin receptor agonists | |
| CA2405704C (en) | Bombesin analogs for treatment of cancer | |
| US10639379B2 (en) | High affinity CXCR4 selective binding conjugate and method for using the same | |
| CN108976287A (zh) | 一类阿片和神经肽ff受体多靶点分子bn-9的二硫键环化类似物及其制备方法与应用 | |
| CA2405724C (en) | Substance p analogs for the treatment of cancer | |
| ES2367941T3 (es) | Antagonistas cíclicos peptídicos de cxcr4. | |
| HK1141474B (en) | Cyclic peptide cxcr4 antagonists | |
| RS51950B (sr) | Ciklični peptidi antagonisti cxcr4 | |
| CN113024635B (zh) | 一类订书肽化合物及其药物组合物的用途 | |
| US20080213190A1 (en) | Selective Alfavbetas Receptor Peptide Antagonist for Therapeutic and Diagnostic Applications | |
| US6989371B1 (en) | Bombesin analogs for treatment of cancer | |
| KR20070119614A (ko) | 노시셉틴/오파닌 에프큐 수용체의 고강력 완전 및 부분작동물질 및 길항물질 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110520 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110520 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130507 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130717 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130813 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130902 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |