JP5350231B2 - 置換された1,3−ジフェニルプロパン誘導体、その製造および使用 - Google Patents
置換された1,3−ジフェニルプロパン誘導体、その製造および使用 Download PDFInfo
- Publication number
- JP5350231B2 JP5350231B2 JP2009515889A JP2009515889A JP5350231B2 JP 5350231 B2 JP5350231 B2 JP 5350231B2 JP 2009515889 A JP2009515889 A JP 2009515889A JP 2009515889 A JP2009515889 A JP 2009515889A JP 5350231 B2 JP5350231 B2 JP 5350231B2
- Authority
- JP
- Japan
- Prior art keywords
- propyl
- phenyl
- compound
- oxo
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 *c1ccc(*NNOc2cc(*)c(*)c(*)c2)c(*)c1 Chemical compound *c1ccc(*NNOc2cc(*)c(*)c(*)c2)c(*)c1 0.000 description 1
- IGCVCYKAJMHMHF-UHFFFAOYSA-N CC(C)(C(O)=O)Oc1c(C)cc(CCC(c(cc2)ccc2OC(F)(F)F)OC)cc1C Chemical compound CC(C)(C(O)=O)Oc1c(C)cc(CCC(c(cc2)ccc2OC(F)(F)F)OC)cc1C IGCVCYKAJMHMHF-UHFFFAOYSA-N 0.000 description 1
- WSQKEUFAAAVREJ-UHFFFAOYSA-N CC(C)(C(O)=O)Oc1c(C)cc(CCC(c(cc2)ccc2OCCC(F)(F)F)=O)cc1C Chemical compound CC(C)(C(O)=O)Oc1c(C)cc(CCC(c(cc2)ccc2OCCC(F)(F)F)=O)cc1C WSQKEUFAAAVREJ-UHFFFAOYSA-N 0.000 description 1
- DAMGPXQFKSIDDI-UHFFFAOYSA-N CC(C)OC(C(C)(C)Oc1c(C)cc(CCC(c(cc2)ccc2OC(F)(F)F)=O)cc1C)=O Chemical compound CC(C)OC(C(C)(C)Oc1c(C)cc(CCC(c(cc2)ccc2OC(F)(F)F)=O)cc1C)=O DAMGPXQFKSIDDI-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/51—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/52—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/76—Unsaturated compounds containing keto groups
- C07C59/84—Unsaturated compounds containing keto groups containing six membered aromatic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/06—Free radical scavengers or antioxidants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
- A61P5/50—Drugs for disorders of the endocrine system of the pancreatic hormones for increasing or potentiating the activity of insulin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C251/00—Compounds containing nitrogen atoms doubly-bound to a carbon skeleton
- C07C251/32—Oximes
- C07C251/34—Oximes with oxygen atoms of oxyimino groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals
- C07C251/48—Oximes with oxygen atoms of oxyimino groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals with the carbon atom of at least one of the oxyimino groups bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/10—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and singly-bound oxygen atoms bound to the same carbon skeleton
- C07C323/18—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and singly-bound oxygen atoms bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a six-membered aromatic ring of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/22—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and doubly-bound oxygen atoms bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/23—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton
- C07C323/45—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton having at least one of the nitrogen atoms doubly-bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/62—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a six-membered aromatic ring of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/58—Unsaturated compounds containing ether groups, groups, groups, or groups
- C07C59/64—Unsaturated compounds containing ether groups, groups, groups, or groups containing six-membered aromatic rings
- C07C59/66—Unsaturated compounds containing ether groups, groups, groups, or groups containing six-membered aromatic rings the non-carboxylic part of the ether containing six-membered aromatic rings
- C07C59/68—Unsaturated compounds containing ether groups, groups, groups, or groups containing six-membered aromatic rings the non-carboxylic part of the ether containing six-membered aromatic rings the oxygen atom of the ether group being bound to a non-condensed six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/76—Unsaturated compounds containing keto groups
- C07C59/86—Unsaturated compounds containing keto groups containing six-membered aromatic rings and other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/76—Unsaturated compounds containing keto groups
- C07C59/88—Unsaturated compounds containing keto groups containing halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/76—Unsaturated compounds containing keto groups
- C07C59/90—Unsaturated compounds containing keto groups containing singly bound oxygen-containing groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/66—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety
- C07C69/73—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety of unsaturated acids
- C07C69/734—Ethers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/66—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety
- C07C69/73—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety of unsaturated acids
- C07C69/734—Ethers
- C07C69/736—Ethers the hydroxy group of the ester being etherified with a hydroxy compound having the hydroxy group bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/28—Radicals substituted by singly-bound oxygen or sulphur atoms
- C07D213/30—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D335/00—Heterocyclic compounds containing six-membered rings having one sulfur atom as the only ring hetero atom
- C07D335/04—Heterocyclic compounds containing six-membered rings having one sulfur atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D335/06—Benzothiopyrans; Hydrogenated benzothiopyrans
Description
(式中、
X1は、ハロゲン原子、R1またはG1−R1基を表し;
X2は、ハロゲン原子、R2またはG2−R2基を表し;
X3は、R3またはG3−R3基を表し;
X4は、ハロゲン原子、R4またはG4−R4基を表し;
X5は、R5またはG5−R5基を表し;
R1は、ハロゲン化されたアルキル基を表し;
R2は、水素原子またはハロゲン化されていないアルキル基を表し;
R3、R4およびR5は、同一であるかまたは相異なり、水素原子を表すかまたは、1つまたは複数の基1または基2置換基により置換されているアルキル基または置換されていないアルキル基を表し;
G1、G2、G3、G4およびG5は、同一であるかまたは相異なり、酸素原子または硫黄原子を表し;
但し、X3、X4またはX5の中の少なくとも1つの基は、R3、G3R3、R4、G4R4、R5またはG5R5式
(式中、G3、G4およびG5は前記したとおりであり、そして
R3、R4およびR5は、同一であるかまたは相異なり、1つまたは複数の基1または基2置換基により置換されているアルキル基を表す)
に相当し;
Aは、
(i)−CR6R7基(式中、R6は水素原子、アルキル基または−OR8基を表し、そしてR7はアルキル基、ヒドロキシル基または−OR8基を表し、R8は下記するとおりである);
(ii)カルボニル基(CO)、
(iii)オキシム基(C=N−O−H)またはオキシムエーテル(C=N−O−R8)、
(R8は、同一であるかまたは相異なり、アリールまたはシクロアルキル基により置換されているアルキル基または置換されていないアルキル基を表す)
を表し;
Dは、
(i)2つの水素原子に連結された炭素原子(CH2)、
(ii)酸素化または硫黄化された複素環を形成するように、水素原子に連結されそしてG2に連結された炭素原子、
を表し;
基1の置換基は−COOR9および−CONR9R10の中から選ばれ;
基2の置換基は、−SO3Hおよび−SO2NR9R10の中から選ばれ;
R9およびR10は、同一であるかまたは相異なり、水素原子を表すかまたは、少なくとも1つの基1または基2置換基により置換されているアルキル基または置換されていないアルキル基を表す)
を有する1,3−ジフェニルプロパンに由来する化合物、それらの純粋なまたは混合した立体異性体(ジアステレオアイソマー、エナンチオマー)、ラセミ混合物(racemic mixtures)、幾何異性体、互変異性体、塩、水和物、溶媒和物、固体形態およびそれらの混合物を指向する。
(式中、G3、G4およびG5は前記したとおりであり、そして
R3、R4およびR5は、同一であるかまたは相異なり、1つまたは複数の基1または基2置換基により置換されているアルキル基を表す)
に相当する基X3、X4またはX5の少なくとも1つを与える一般式(I)の化合物は、それゆえ、それぞれ1つまたは複数の基1または基2置換基により置換されているアルキル基を表すX3、X4またはX5の基R3、R4およびR5の少なくとも1つを有する。
G3およびG5は前記したとおりであり、そして
R3およびR5は水素原子を表す、一般式(I)の化合物に関する。
G3およびG5が前記したとおりであり、そして
R3およびR5が、前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基または置換されていないアルキル基を表す、一般式(I)の化合物に関する。
G3およびG5が前記したとおりであり、そして
R3およびR5が、同一であるかまたは相異なり、前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基または置換されていないアルキル基を表す、一般式(I)の化合物に関する。
G4が前記したとうりであり、そして
R4が水素原子を表す、
一般式(I)の化合物に関する。
G4が前記したとおりであり、そして
R4が前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基または置換されていないアルキル基を表す、
一般式(I)の化合物に関する
X4がR4またはG4−R4基を表し、
G4が前記したとおりであり、そして
R4が1つまたは複数の基1または基2置換基により置換されているアルキル基を表す、一般式(I)の化合物に関する。好ましくは、G4は酸素原子を表しおよび/またはR4は基1置換基、特にCOOHにより置換されているアルキル基を表す。なお更に好ましくは、X4は−OC(CH3)2COOH、−OCH2COOHまたは−SC(CH3)2COOH基を表す。
G3、G4およびG5は前記したとおりであり、そして
R3、R4およびR5は、同一であるかまたは相異なり、前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基を表す、一般式(I)の化合物に関する。
G4は前記したとおりであり、そして
R4は、前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基を表す、一般式(I)の化合物に関する。
G3、G4およびG5は前記したとおりであり、そして
R3、R4およびR5は、同一であるかまたは相異なり、前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基を表す、一般式(I)の化合物に関する。
G3、G4およびG5は酸素原子を表し、そして
R3、R4またはR5は、同一であるかまたは相異なり、前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基を表す、一般式(I)の化合物に関する。
G4は水素原子を表し、そして
R4は、前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基を表す、一般式(I)の化合物に関する。
G3、G4およびG5が酸素原子を表し、そして
R3、R4およびR5が、前記したとおりの、1つまたは複数の基1または基2置換基により置換されているアルキル基を表す、一般式(I)の化合物に関する。
G1が前記したとおりであり、そして
R1がハロゲン化されたアルキル基を表す、一般式(I)の化合物に関する。
を有する化合物を形成する、一般式(I)の化合物に関する。好ましくは、G2は一般式(II)において硫黄原子を表す。
化合物1:2−[2,6−ジメチル−4−[3−[4−(トリフルオロメトキシ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸;
化合物2:2−[2,6−ジメチル−4−[3−[4−(トリフルオロメチルチオ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸;
化合物3:2−[2,6−ジメチル−4−[3−[4−ブロモフェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸;
化合物4:2−[2,6−ジメチル−4−[3−[4−(トリフルオロメチル)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸
化合物6:2−[2−メチル−4−[3−[4−(3,3,3−トリフルオロプロピルオキシ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸
化合物11:2−[2,6−ジメチル−4−[3−[4−(3,3,3−トリフルオロプロピルオキシ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸
化合物26:2−メチル−2−(2−メチル−4−(3−オキソ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)フェノキシ)プロパン酸
化合物36:2−(2,6−ジメチル−4−(3−オキソ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)フェノキシ)−2−メチルプロパン酸イソプロピルエステル
(i)式(A)の少なくとも1つの化合物を、式(B)
(式中、X1、X2、X3、X4およびX5は前記した定義を有する)
の少なくとも1つの化合物と塩基性または酸性媒体中で混合する工程、
(ii)得られる化合物を還元する工程、および最後に
(iii)官能基の連結を可能とする工程、
を含む。
−抗糖尿病薬:分泌促進薬(スルホニル尿素、(グリベンクラミド、グリメピリド、グリクラジド等)およびグリニド(glinides)(レパグリニド、ナテグリニド等))、α−グルコシダーゼ阻害剤、PPARγアゴニスト(チアゾリジンジオン、例えばロシグリタゾン、ピオグリタゾン)混合PPARα/γアゴニスト(テサグリタザール)、ムラグリタザール)、pan−PPARs(3つのPPARアイソフォームを同時に活性化する化合物)、ビグアニド(メトホルミン)、ジペプチジルペプチダーゼIV阻害剤(MK−431、ビルダグリプチン)、グルカゴン様ペプチド−1(GLP−1)アゴニスト(エキセナチド)等、
−インスリン、
−ipid低下分子および/またはコレステロール低下分子:フィブラート(フェノフィブラート、ゲムフィブロジル)、HMG CoAレダクターゼインヒビターもしくはヒドロキシイメチルグルタリル補酵素Aレダクターゼ(スタチン、例えばアトルバスタチン、シムバスタチン、フルバスタチン)、コレステロール吸収阻害剤(エゼチミブ、フィトステロール)、CETP阻害剤またはコレステロールエステル輸送タンパク質阻害剤(トルセトラピブ)、ACATもしくはアシルコエンザイムAコレステロールアシルトランスフェラーゼ(アバシミブ、エフルシミブ)、MTP(ミクロソームトリグリセリド輸送タンパク質)阻害剤、胆汁酸、金属イオン封鎖剤(コレスチラミン)、ビタミンE、ポリ不飽和脂肪酸、ω−3脂肪酸、ニコチン酸型誘導体(ナイアシン)等、
−抗高血圧剤および抗低血圧剤:ACE(アンギオテンシン転換酵素)阻害剤(カプトプリル、エナラプリル、ラミプリルまたはキナプリル)、アンギオテンシンIIレセプターアンタゴニスト(ロサルタン、バルサルタン、テルミサルタン、エポサルタン、イルベサルタン等)、βブロッカー(アテノロール、メトプロロール、ラベタロール、プロプラノロール)、チアジドおよび非チアジド利尿薬(フロセミド、インダパミド、ヒドロクロロチアジド、抗アルドステロン)、血管拡張剤、カルシウムチャンネルブロッカー(ニフェジピン、フェロジピンもしくはアムロジピン、ジルチアゼムまたはベラパミル)等、
−抗血小板剤:アスピリン、チクロピジン、ジピリダモール、クロピドグレル、フルルビプロフェン等、
−抗肥満剤:シブトラミン、リパーゼ阻害剤(オルリスタット)、PPARδ、カンナビノイドCB1レセプターアンタゴニスト(リモナバント)等、
−抗炎症剤:例えば、コルチコイド(プレドニゾン、βメタゾン、デキサメタゾン、プレドニゾロン、メチルプレドニゾロン、ヒドロコルチゾン等)、インドールに由来するNSAIDsまたは非ステロイド抗炎症薬(インドメタシン、スリンダック)、アリールカルボン酸基のNSAIDs(チアプロフェン酸、ジクロフェナック、エトドラック、フルルビプロフェン、イブプロフェン、ケトプロフェン、ナプロキセン、ナブメトン、アルミノプロフェン)、オキシカムに由来するNSAIDS(メロキシカム、ピロキシカム、テノキシカム)、フェナメート基に由来するNSAIDs、COX2選択性阻害剤(セレコキシブ、ロフェコキシブ)等、
−酸化防止剤:例えばプロブコ−ル等、
−心不全の処置に使用される作用物質:チアジドおよび非チアジド利尿薬(フロセミド、インダパミド、ヒドロクロルチアジド、抗アルドステロン)、ACE阻害剤(カプトプリル、エナラプリル、ラミプリルまたはキナプリル)、ジギタリス薬物(ジゴキシン、ジギトキシン)、βブロッカー(アテノロール、メトプロロール、ラベタロール、プロプラノロール)、ホスホジエステラーゼ阻害剤(エノキシモン、ミルリノン)等、
−冠不全の処置に使用される作用物質:βブロッカー(アテノロール、メトプロロール、ラベタロール、プロプラノロール)、カルシウムチャンネルブロッカー(ニフェジピン、フェロジピンもしくはアムロジピン、ベプリジル、ジルチアゼムまたはベラパミル)等、NO(酸化窒素)ドナー(トリニトリン、イソソルビドジナイトレート、モルシドミン)、アミオダロン等、
−抗癌薬:細胞毒性剤(DNA(デオキシリボ核酸)と相互作用する作用物質)、アルキル化剤、シスプラチンおよび誘導体)、細胞分裂抑制剤(GnRH(性腺刺激ホルモン放出ホルモン)アナログ、ソマトスタチンアナログ、プロゲスチン、抗エストロゲン薬物、アロマターゼ阻害剤等)、免疫応答モデュレーター(インターフェロン、IL2等)、
−抗喘息薬、例えば気管支拡張剤(β2レセプターアゴニスト)、コルチコイド、クロモグリケート、ロイコトリエンレセプターアンタゴニスト(モンテルカスト)等、
−乾癬および皮膚炎などの皮膚病理の処置に使用されるコルチコイド、
−血管拡張薬および/または抗虚血薬、(ブフロメディル、イチョウエキス、ナフチドロフリル、ペントキシフィリン、ピルベディル)等、
などの現在市販されているか開発中の他の治療剤および/または化粧品剤と組み合わせて有利に投与することができる。
Cpd=化合物
Ctrl=コントロール
mpk=mg/kg/日
LDLコレステロール=低密度リポタンパク質コレステロール
HDLコレステロール=高密度リポタンパク質コレステロール
VLDLコレステロール=超低密度リポタンパク質コレステロール
PPARsの活性化は、酵母のGal4転写因子のDNA結合ドメインおよび異なるPPARsのリガンドへの結合ドメインから構成されるキメラの転写活性を測定することにより、サル腎臓繊維芽細胞系(COS−7)を使用してin vitroで評価される。
本発明に従う化合物の効果を、E2アイソフォームアポリポタンパク質Eによりヒト化されたマウス(E2/E2)でin vivoで評価する。
異脂肪血症E2/E2マウスの体重、全コレステロールの比、トリグリセリドの比および血漿遊離脂肪酸の比を、本発明に従う化合物による経口処置の8日後に測定する。これらのパラメーターを、コントロール動物(本発明に従う化合物で処理されていない動物)から得られるパラメーターと比較する:測定された差は、本発明に従う化合物の体重に対する効果および低脂肪血症効果を示す。
本発明に従う化合物の効果を、本発明に従う化合物による経口処理の14日後の、体重進展、血漿HDLコレステロールおよびトリグリセリドレベルを測定することによりC57B16マウスでin vivoで評価する。これらのパラメーターをコントロール動物(本発明に従う化合物で処理されていない動物)で得られたパラメーターと比較する:測定された差は、本発明に従う化合物が体重に対して有する効果を示し、そしてそれらの低脂血症効果を示す。
本発明に従う化合物の効果を、本発明に従う化合物による経口処理の28日後の、体重進展、グルコースレベル、インスリンレベル、血漿全コレステロールおよびトリグリセリドレベルを測定することにより、および異なる血漿リポタンパク質画分におけるコレステロールの分布を解析することにより、db/dbマウスでin vivoで評価する。これらのパラメーターをコントロール動物(本発明に従う化合物で処理されていない動物)で得られたパラメーターと比較する:測定された差は、本発明に従う化合物が体重、インスリン抵抗性に対して有する効果を示しそしてそれらの低脂血症効果を示す。
統計的検定は、スチューデントのt検定(°/°°/°°°)および/または単変量ANOVA分散分析、続くテューキー検定(*/**/***)からなる。結果をパラメーターpの値:°/*:p<0.05;°°/**:p<0.01;°°°/***:p<0.001に従ってコントロールグループと比較する。
古典的試薬および触媒は市販されている(Aldrich, Alfa Aesar, Acros, FlukaまたはLancaster)。
本発明に従う化合物の大部分は、US2005176808特許に請求されおよび/または記載された化合物を使用して、下記する方法の1つに従って、特に還元により得られた。
他の化合物は、当業者が利用可能な類似した周知の製造方法に従って容易に得られた。
ジクロロメタン中のジフェニルプロパン−2−オンの溶液に、トリエチルシランを加え、次いでトリフルオロ酢酸を1滴ずつ(7.5当量)加えた。反応混合物を室温で攪拌しそして薄層クロマトグラフィーにより反応追跡を行った。反応混合物を水で洗浄した。水性層をジクロロメタンで抽出した。一緒にした有機相を硫酸マグネシウム上で乾燥しそして真空中で濃縮した。残留物をカラムクロマトグラフィーにかけた(分取HPLC、lichrospher(Merck) RP18 12μm100Å、カラム:25*250mm)。
アセトニトリル中のジフェニルプロパン−2−オンの溶液に、ヨウ化ナトリウムを加え、次いでテトラクロロシランを1滴ずつ加えた。反応混合物を室温で攪拌しそして薄層クロマトグラフィーにより反応追跡を行った。30分〜2時間後に、混合物をクロロホルムと水とに分配した。水性層クロロホルムで抽出した。一緒にした有機相を亜硫酸ナトリウム上で乾燥し、次いで硫酸マグネシウム上で乾燥しそして真空中で濃縮した。残留物をカラムクロマトグラフィーにかけた(分取HPLC、lichrospher(Merck) RP18 12μm100Å、カラム:25*250mm)。
エタノール中のジフェニルプロペン−2−オンの溶液に、触媒量の炭素上のパラジウム(10%)を加えた。反応混合物を常圧で水素下に室温で攪拌する。触媒をろ過し、ろ液を真空中で濃縮した。残留物をカラムクロマトグラフィーにかけた。
エタノール中のジフェニルプロパン−3−オンの溶液に、水素化ホウ素ナトリウムを加えた。反応混合物を50℃(122°F)で16時間攪拌した。冷却した後に、反応混合物を加水分解しそして真空中で濃縮した。残留物をジクロロメタンと希塩酸溶液とに分配した。有機相を水で洗浄し、硫酸マグネシウム上で乾燥しそして真空中で濃縮した。残留物をカラムクロマトグラフィーにかけた(分取HPLC、lichrospher(Merck) RP18 12μm100Å、カラム:25*250mm)。
触媒量のトリフルオロ酢酸の存在下に1/3:2/3水/アルコール混合物中のジフェニルプロパン−3−オールの溶液を60℃で16時間攪拌した。次いで反応混合物を真空中で濃縮した。残留物をカラムクロマトグラフィーにかけた(分取HPLC、lichrospher(Merck) RP18 12μm100Å、カラム:25*250mm)。
ピリジン中のジフェニルプロパン−3−オンの溶液に、O−アルキルヒドロキシルアミン塩酸塩を加えた。16時間の還流後に、反応混合物を真空中で濃縮した。残留物をカラムクロマトグラフィーにかけた。
化合物1:2−[2,6−ジメチル−4−[3−[4−(トリフルオロメトキシ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸
この化合物を、2−[2,6−ジメチル−4−[3−[4−(トリフルオロメトキシ)フェニル]−3−オキソ−プロプ−2−エニル]フェノキシ]−2−メチルプロパン酸、15当量のヨウ化ナトリウムおよび15当量のテトラクロロシランを使用して、一般的方法Bに従って製造した。
外観:白色固体;F=64〜66℃
この化合物を、2−[2,6−ジメチル−4−[3−[4−(トリフルオロメチルチオ)フェニル]−3−オキソ−プロプ−2−エニル]フェノキシ]−2−メチルプロパン酸および1当量のトリエチルシランを使用して一般的方法Aに従って製造した。
外観:白色固体;F=83〜85℃。
この化合物を、2−[2,6−ジメチル−4−[3−[4−ブロモフェニル]−3−オキソ−プロプ−2−エニル]フェノキシ]−2−メチルプロパン酸および1当量のトリエチルシランを使用して、一般的方法Aに従って製造した。
外観:白色粘性油
この化合物を、2−[2,6−ジメチル−4−[3−[4−(トリフルオロメチル)フェニル]−3−オキソ−プロプ−2−エニル]フェノキシ]−2−メチルプロパン酸および1当量のトリエチルシランを使用して一般的方法Aに従って製造した。
外観:黄色がかった粘性油。
この化合物を、2−[4−[3−[4−クロロ−2−ヒドロキシフェニル]−3−オキソ−プロプ−2−エニル]フェニルチオ]−2−メチルプロパン酸および5当量のヨウ化ナトリウムおよび5当量のテトラクロロシランを使用して一般的方法Bに従って製造した。
外観:白色固体;F=136〜137℃。
この化合物を、2−(4−(3−(4−ヒドロキシフェニル)−3−オキソ−プロプ−1−エニル)−2−メチルフェノキシ)−2−メチルプロパン酸テルチオブチルエステルを使用して一般的方法Cに従う還元、次いでUS2005/176808に記載の方法に従うこのフェノールのO−アルキル化およびテルチオブチルエステルの酸加水分解により製造した。
外観:無色の粘性油
この化合物を、水/メタノールの1/3:2/3混合物中の2−(4−(3−ヒドロキシ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)−2,6−ジメチルフェノキシ)−2−メチルプロパン酸の溶液を使用して一般的方法Eに従って製造した。
外観:無色粘性油
この化合物を、2−(4−(3−(4−ヒドロキシフェニル)−3−オキソ−プロプ−1−エニル)−2,6−ジメチルフェノキシ)−2−メチルプロパン酸テルチオブチルエステルを使用する一般的方法Cに従う還元、次いでUS2005176808に従うこのフェノールのO−アルキル化およびテルチオブチルエステルの酸加水分解により製造した。
外観:白色固体;F=98〜99℃。
この化合物を、2−(4−(3−(2−フルオロ−4−ヒドロキシフェニル)−3−オキソ−プロプ−1−エニル)−2,6−ジメチルフェノキシ)−2−メチルプロパン酸テルチオブチルエステルを使用する一般的方法Cに従う還元、次いで特許US2005176808に従うこのフェノールのO−アルキル化およびテルチオブチルエステルの酸加水分解により製造した。
外観:無色粘性油
この化合物を、2−[2,6−ジメチル−4−[3−[4−(トリフルオロメチルオキシ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸および4当量の水素化ホウ素ナトリウムを使用して一般的方法Dに従って製造した。
外観:無色粘性油
この化合物を、2−[2,6−ジメチル−4−[3−[4−(トリフルオロメトキシ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸を使用して一般的方法Fに従って製造した。
外観:黄色がかった粘性油
この化合物を、3−(4−ヒドロキシ−3,5−ジメチルフェニル)−1−(4−(トリフルオロメトキシ)フェニル)プロパン−1−オンを使用する一般的方法Cに従う還元、次いで特許US2005176808に従うこのフェノールのO−アルキル化およびテルチオブチルエステルの酸加水分解により製造した。
外観:無色粘性油
他の化合物は、方法A〜Fと同様なそして当業者が実施するのが容易な方法にしたがって得られた。
本発明に従う化合物のPPAR活性化性をin vitroで評価する。
原理
酵母のGal4転写因子のDNA結合ドメインおよび異なるPPARsのリガンドへの結合ドメインからなるキメラの転写活性を測定することにより、サル腎臓繊維芽細胞系(COS−7)を使用してPPARsの活性化をin vitroで評価する。化合物を、Gal4−PPARα、γおよびδキメラに対して10−7〜100μMの用量で試験する。
細胞の培養
COS−7細胞は、ATCC(American type culture collection)から得られそしてウシ胎仔血清10%(容積/容積)、ペニシリン100U/ml(Gibco, Paisley, UK)およびL−グルタミン2mM(Gibco, Paisley, UK)を補充されたDMEM(ダルベッコの改変イーグル培地)培地中で培養される。細胞を、5%CO2を含有する湿った雰囲気中で37℃にてインキュベーションする。
プラスミドGal4(RE)_TkpGL3、pGal4-hPPARα、pGal4-hPPARγ、pGal4-hPPARδおよびpGal4-φは、文献に記載されている(Raspe E et al., 1999)。構築物pGal4-hPPARα、pGal4-hPPARγ、pGal4-hPPARδは、PCRにより増幅されそしてヒトPPARα、PPARγおよびPPARδ核内レセプターのDEFドメインに相当するDNAフラグメントのpGal4-φベクターにおけるクローニングにより得られた。
懸濁液中のCOS−7細胞を、10%ウシ胎仔血清の存在下に1/10のpGal4-PPAR/Gal4(RE)_TkpGL3比で、ウエル当たりDNA150ngでトランスフェクションする。細胞を96ウエルプレート(4×104細胞/ウエル)においてプレートし、次いで37℃で24時間インキュベーションする。試験化合物による活性化を血清なしの培地中で37℃で24時間行う。実験の終りに、細胞を溶解させそしてルシフェラーゼ活性を、Steady-Lite(商標)HTS(Perkin Elmer)またはSteady Glow Luciferase(Promega)を使用して供給者の推奨に従って決定する。
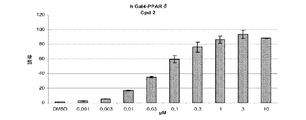
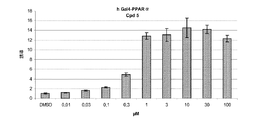
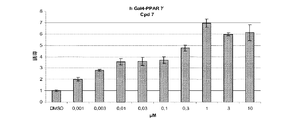
本発明に従う化合物を、3つのPPARアイソフォームに関して試験した。化合物1、2、3、4、5および7で得られる結果は、図(1−1)〜(1−8)に詳しく述べられている。
本発明者等は、プラスミドpGal4-hPPARでトランスフェクションされそして本発明に従う化合物で処理された細胞におけるルシフェラーゼ活性の有意なかつ用量依存性の増加を示した。
意外にも、提示された実験データは、in vitroで、本発明に従う化合物はin vitroでPPARsに結合しそして転写活性の活性化を誘導することを示す。
原理
本発明に従う化合物の、体重および低脂血症性をもたらす性質を、本発明に従う化合物による異脂肪血症E2/E2マウスの処理後に体重および血漿脂質を測定することにより、そしてPPARsの遺伝子ターゲットの遺伝子発現を解析することによりin vivoで評価する。
動物の処理
ApoE2/E2トランスジェニックマウスを20±3℃の定温で12時間/12時間明/暗サイクルに保った。1週間の順応期間後に、マウスを体重測定しそして、実験前に決定された体重および血漿脂質比の分布を均一にするように選ばれた6匹の動物のグループに分けた。試験された化合物をカルボキシメチルセルロース(Sigma C4888)中に懸濁させそして選ばれた投薬量で8日間1日1回、胃内管供給により投与する。動物は、食物および水(標準食餌)への自由な接近を有していた。食物の摂取および体重増加を実験全体にわたり記録する。実験の終りに、動物を4時間絶食後に麻酔し、(EDTA)抗凝固薬を使用して血液サンプルを採取した、次いでマウスを体重測定しそして安楽死させた。3000回転/分での20分間の遠心により血漿を調製した。サンプルを+4℃に保った。
肝臓サンプルを取り出し、液体窒素中で凍結させ、次いでその後の解析のために−80℃に保った。
血漿脂質濃度(全コレステロールおよびトリグリセリド)は、供給者の推奨に従って酵素投薬量(enzymatic dosages)(bioMerieux-Lyon-France)により測定する。
血漿コレステロールおよびトリグリセリトド比を、本発明に従う化合物による経口処理の8日後に測定する。これらの比を、コントロール動物(本発明に従う化合物で処理されていない)で得られる比と比較する。測定された差は、本発明に従う化合物の低脂血症効果を示す。
低密度リポタンパク質(VLDLおよびLDL)を、リンタングステン酸塩により沈澱させる。沈澱を、遠心により除去する。上清中に存在するHDLコレステロールは、供給者の推奨に従って酵素投薬量 (bioMerieux-Lyon-France)により測定する。
全RNAを、製造者の指示に従ってNucleoSpin(登録商標)96RNAキット(Macherey Nagel, Hoerdt, France)を使用することにより肝臓断片から抽出する。
次いで、関心のある遺伝子の発現レベルを参照遺伝子36B4(その特異的プライマーは、
である)
の1つに関して正規化する。
誘導係数:即ち、相対的シグナル(本発明に従う化合物により誘導された)とコントロールグループで得られた相対的値の平均との比を、次いで各サンプルについて計算する。誘導係数が高ければ高い程、化合物は遺伝子発現をより大きく促進する。最終結果は、各実験グルー得られた誘導値の平均として表わされる。
体重
図2〜1は、5、10および50mpkで投与された化合物1による処理の8日後に動物の重量増加をコントロール動物の体重の増加と比較する。意外にも、化合物1で処理された動物において重量損失が測定された。
血漿脂質の測定
図2−2および2−3は、5、10および50mpkで化合物1による処理の8日後に、血漿全コレステロールおよびHDLコレステロール比を、コントロール動物で得られた比と比較する。意外にも、循環している全コレステロール比は有意に減少しそしてHDLコレステロール比は処理により有意に増加した。
本発明者等は、本発明に従う化合物が、in vivoで、PPARsターゲット遺伝子発現のレギュレーターであることを示した。図2〜6および2〜7に提示された結果は、E2/E2マウスに8日間5、10および50mpkで投与された化合物1がPDK4をコードする遺伝子の肝臓での発現の有意な増加を誘導し(図2〜6)そしてApoCIIIをコードする遺伝子の肝臓での発現の減少を誘導する(図2〜7)ことを示す。脂質および糖質代謝に特異的に関与する酵素のためのすべてのコード遺伝子およびその発現が本発明に従う化合物によりモデュレーションされるという事実は、これらの化合物がメタボリック病理の処置のための大きな潜在力を与えるという考えを強化する。
意外にも、提示された実験データは、本発明に従う化合物が、in vivoで、体重損失を誘導しそしてHDLコレステロール合成および低脂血症効果(トリグリセリドおよび遊離脂肪酸の血漿レベルの減少)を刺激することを示す。更に、提示された実験データは、本発明に従う化合物が、脂質および糖質代謝に特異的に関与する酵素をコードするPPARsの活性化により調節される遺伝子の発現をモデュレーションすることを示す。
原理
本発明に従う化合物の体重に対する効果およびそれらの低脂血症性を、本発明に従う化合物で異脂肪血症C57B16マウス処理後に、体重および血漿脂質を測定することによりおよびPPARsターゲット遺伝子の遺伝子発現を解析することにより、in vivoで評価する。
動物の処理
雌C57B16マウスを20±3℃の定温で12時間/12時間明/暗サイクルに保った。1週間の順応期間の後に、マウスを、実験の前に決定された体重および血漿脂質の分布が均一であるように選ばれた6匹の動物のグループに分けた。試験される化合物をカルボキシメチルセルロース(Sigma C4888)中に懸濁させそして選ばれた用量で14日間1日1回、胃ガバージュにより動物に投与する。動物は、食物および水(標準食餌)への自由な接近を有していた。食物の摂取および体重増加を実験全体にわたり記録する。実験の終りに、4時間絶食後に動物を麻酔し、抗凝固薬(EDTA)に基づいて血液サンプルを採取した。次いでマウスを体重測定しそして安楽死させた。3000回転/分での20分間の遠心により血漿を分離した。サンプルを+4℃に保った。
肝臓組織サンプルを取り出し、液体窒素中に凍結し、次いで後の解析のために−80℃に保った。
低密度リポタンパク質(VLDLおよびLDL)を、リンタングステン酸塩により沈澱させる。沈澱を、遠心により除去する。上清中に存在するHDLコレステロールは、供給者の推奨に従って酵素アッセイ(bioMerieux-Lyon-France)により測定する。
供給者の推奨に従って酵素アッセイ(bioMerieux-Lyon-France)により、血漿トリグリセリド濃度を測定した。
全RNAを、製造者の指示に従ってNucleoSpin(登録商標)96RNAキット(Macherey Nagel, Hoerdt, France)を使用することにより肝臓断片から抽出する。
次いで、関心のある遺伝子の発現レベルを参照遺伝子36B4(その特異的プライマーは、
である)
の発現レベルに関して正規化した。
次いで各サンプルに対する誘導係数を計算した。誘導係数が高ければ高い程、化合物は遺伝子発現をより大きく促進する。最終結果は、各実験グループで得られた誘導値の平均として表わされる。
体重
図3〜1は、3、10および30mpkで投与された化合物1による処理の14日後に動物の重量増加をコントロール動物の体重の増加と比較する。意外にも、重量損失を化合物1で処理された動物において測定した。
図3−2は、3、10および30mpkで投与された化合物1による処理の14日後に、血漿HDLコレステロール比を、コントロール動物で得られた比と比較する。意外にも、循環しているHDLコレステロールの比は処理により極めて有意に増加した。
本発明者等は、本発明に従う化合物が、in vivoで、PPARsターゲット遺伝子発現のレギュレーターであることも示した。図3〜4および3〜5に提示された結果は、C57B16マウスに14日間3、10および30mpkで投与された化合物1がPDK4をコードする遺伝子の肝臓での発現の有意な増加を誘導し(図3〜4)そしてApoCIIIをコードする遺伝子の肝臓での発現の減少を誘導する(図3〜5)ことを示す。脂質および糖質代謝に特異的に関与する酵素をコードするすべての遺伝子およびそれらの発現が本発明に従う化合物によりモデュレーションされるという事実は、これらの化合物がメタボリック病理の処置のための大きな潜在力を有するという考えを強化する。
意外にも、提示された実験データは、本発明に従う化合物が、in vivoで、体重損失を誘導し、HDLコレステロール合成を刺激し、低脂血症効果(トリグリセリドの血漿レベルの減少)を有することを示す。更に、提示された実験データは、本発明に従う化合物が、脂質および炭水化物代謝に特異的に関与する酵素をコードするPPARsの活性化により調節される遺伝子の発現をモデュレーションすることを示す。
原理
本発明に従う化合物の体重、インスリン抵抗性に対する効果およびそれらの低脂血症性を、本発明に従う化合物によるdb/dbマウスの経口処理後に、体重および血漿グルコースおよびインスリンの比、血漿脂質の比を測定することにより、そして異なる血漿リポタンパク質画分におけるコレステロールの分布およびPPARsターゲット遺伝子の遺伝子発現の分布を解析することにより、in vivoで評価する。
動物の処理
雌db/dbマウスを20±3℃の定温で12時間/12時間明/暗サイクルに保った。1週間の順応期間の後に、マウスを、体重測定し、そして実験の前に決定されたマウスの体重および血漿脂質比の分布を均一にするように選ばれた8匹の動物のグループに分けた。試験される化合物をカルボキシメチルセルロース(Sigma C4888)中に懸濁させそして選ばれた用量で28間1日1回、胃内管供給により投与する。動物は、食物および水(標準食餌)に自由に接近できた。食物の摂取および体重増加を実験全体にわたり記録する。実験の終りに、4時間絶食後に動物を麻酔し、抗凝固薬(EDTA)を使用して血液サンプルを採取し、次いでマウスを体重測定しそして安楽死させた。3000回転/分での20分間の遠心により血漿を分離した。サンプルを+4℃に保った。
肝臓組織および骨格筋組織サンプルを採取し、液体窒素中に直ちに凍結し、次いで後の解析のために−80℃で保存した。
グルコースRTUキット(Biomerieux)を使用する酵素比色法に従ってマウス血漿グルコースを測定する。グルコースを、グルコースオキダーゼの作用下にグルコン酸に転換し;この反応は過酸化水素を放出する。ペルオキシダーゼの作用下に、かつフェノールとアミノ−4−アンチピリンの存在下に水と着色生成物、キノンイミンを生成するトリンダー反応に従って過酸化水素を測定する。キノンイミンによる色強度は、サンプル中に存在するグルコースの量に比例する。
供給者の推奨に従って酵素アッセイ(bioMerieux-Lyon-France)により、血漿脂質濃度(全コレステロールおよびトリグリセリド)を測定する。
血漿中の異なる脂質画分(VLDL、LDL、HDL)を、ゲルろ過クロマトグラフィーを使用して分離した。次いでコレステロール濃度を、供給者の推奨に従う酵素アッセイ(bioMerieux-Lyon-France)により各画分について測定した。
肝臓組織
全RNAを、製造者の指示に従ってNucleoSpin(登録商標)96RNAキット(Macherey Nagel, Hoerdt, France)を使用することにより肝臓断片から抽出する。
全RNAを、製造者の指示に従ってRNeasy(登録商標) Fibrous Tissue kit(Qiagen)を使用する腓腹筋骨格筋画分から抽出した。
である)の発現レベルに関して正規化し、そして骨格筋組織において、参照遺伝子36B4(その特異的プライマーは、
である)の発現レベルに関して正規化する。次いで各サンプルに対する誘導係数を計算した。誘導係数が高ければ高い程、化合物は遺伝子発現をより多く促進する。最終結果は、各実験グループ内の誘導値の平均として表わされる。
体重
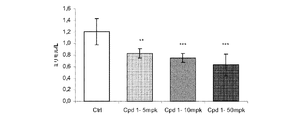
図4〜1は、50mpkで投与された化合物1による処理の28日後に動物の重量増加をコントロール動物の重量増加と比較する。意外にも、重量損失が化合物1で処理された動物において認められた。
図4−2および4−3は、50mpkで投与された化合物1による処理の28日後の血漿グルコースおよびインスリンレベルを比較する。意外にも、血糖症およびインスリン血症は、処理により有意に減少する。
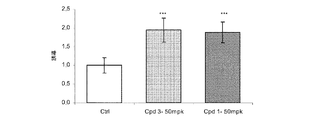
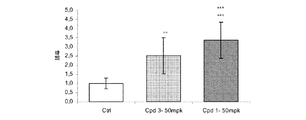
図4−4は、50mpkで投与された化合物1および3による処理の28日後に、全血漿コレステロール比を、コントロール動物で得られた比と比較する。意外にも、全コレステロール比は有意に増加した。
図4−5は、全血漿コレステロールのこの増加は、50mpkで投与された化合物1および3による動物の処理により誘導されたHDLコレステロール画分の有意な増加に相当することを示す。
図4−6および47は、50mpkで投与された化合物1および3による処理の28日後に血漿トリグリセリドおよび遊離脂肪酸比を、コントロール動物から得られた比と比較する。以外にも、循環しているトリグリセリドおよび遊離脂肪酸比は処理により極めて有意に減少した。
本発明者等は、本発明に従う化合物が、in vivoで、PPARsターゲット遺伝子発現のレギュレーターであることも示した。図4−8および4−9に提示された結果は、db/dbマウスに28日間50mpkで投与された化合物1および3がPDK4をコードする遺伝子の肝臓での発現の有意な増加を誘導し(図4−8)、そして骨格筋においてUCP2をコードする遺伝子の発現の減少を誘導する(図4−9)ことを示す。脂質および糖質代謝ならびにエネルギー消費に特異的に関与する酵素をコードするすべての遺伝子、およびそれらの発現が本発明に従う化合物によりモデュレーションされるという事実は、これらの化合物がメタボリック病理の処置のための大きな潜在力を有するという考えを強化する。
意外にも、提示された実験データは、本発明に従う化合物が、in vivoで、体重損失およびインスリン感受性の改善を誘導し、そしてHDLコレステロール合成を刺激しそして低脂血症効果を有する(血漿トリグリセリド比の減少をもたらす)ことを示す。更に、提示された実験データは、本発明に従う化合物が、PPARsの活性化により調節されそして脂質および糖質代謝ならびにエネルギー消費に特異的に関与する酵素をコードする遺伝子の発現をモデュレーションすることを示す。
原理
本発明に従う化合物の抗炎症性効果は、本発明従う化合物で24時間処理されそしてPMA(細胞における炎症性応答およびマクロファージへの細胞の分化を促進するホルボール12−ミリステート13−アセテート)により同時に刺激された単球によるMCP−1(単球化学走化性タンパク質1)の分泌を測定することにより評価された。MCP−1の分泌が少なければ少ない程、本発明に従う化合物による炎症性反応の阻害はより大きい。
THP−1細胞の培養および処理
THP−1ヒト単球系(ATCCソース)を、25mM Hepes(Gibco; 42401-018)、1%グルタミン(Gibco; 25030-24)、1%ペニシリン/ストレプトマイシン(Biochrom AG; A2213)および補充されていない(decomplemented)10%ウシ胎仔血清(SVF. Gibco; 26050-088)を有するRPMI1640培地中で培養する。
処理培地を回収しそしてMCP−1濃度を、製造者の推奨に従ってELISAキット≪Human MCP-1 ELISA Set≫(BD OptEIA; 555179)を使用して測定する。
本発明者等は、in vitro単球で、本発明に従う化合物が抗炎症性効果を有することを示した。図5に提示された結果は、本発明に従う化合物3が、1μMで、単球により分泌されるMCP1の有意な減少を誘導することを示す。
意外にも、開示された実験データは、本発明に従う化合物がPMAにより刺激された単球に対する抗炎症性効果を有することを示す。
本発明者等は、本発明に従う化合物が、体重損失をもたらし、低脂血症性を有し、コレステロールおよび血漿トリグリセリドのレベルを減少させ、HDLコレステロール合成を刺激し、そして抗糖尿病性を有することを示した。更に、本発明者等は、本発明に従う化合物が、脂質および糖質代謝並びにエネルギー消費に特異的に関与する酵素をコードする遺伝子の発現の調節を可能とすることを示した。
Claims (10)
- 一般式(I):
(式中、
X1は、ハロゲン原子、R1またはG1−R1基を表し;
X2は、ハロゲン原子または水素原子を表し;
X3は、R3基を表し;
X4は、G4−R4基を表し、ここで、R4は、1つ又は複数の下記に定義された基1により置換されている1〜10個の炭素原子を含むアルキル基を表し;
X5は、R5基を表し;
R1は、ハロゲン化された1〜10個の炭素原子を含むアルキル基を表し;
R3およびR5は、同一であるかまたは相異なり、置換されていない1〜4個の炭素原子を含むアルキル基を表し;
G1およびG4は、同一であるかまたは相異なり、酸素原子または硫黄原子を表し;
Aは、
(i)−CR6R7基(式中、R6は水素原子を表し、そしてR7はヒドロキシ基または−OR8基を表し、R8は下記するとおりである);
(ii)カルボニル基(CO)、
(iii)オキシム基(C=N−O−H)またはオキシムエーテル(C=N−O−R8)、
(R8は、アリールまたはシクロアルキル基により置換されているかまたは置換されていない1〜6個の炭素原子を含むアルキル基を表す)
を表し;
Dは、
(i)2つの水素原子に連結された炭素原子(CH2)を表し;
基1は−COOR9および−CONR9R10の中から選ばれ;
R9およびR10は、同一であるかまたは相異なり、水素原子を表すかまたは置換されていない1〜10個の炭素原子を含むアルキル基を表す)
を有する化合物、それらの純粋なもしくは混合した立体異性体(ジアステレオアイソマー、エナンチオマー)、ラセミ混合物、幾何異性体、互変異性体、塩、水和物、溶媒和物、または固体形態。 - Aがカルボニル基(CO)を表すことを特徴とする、請求項1に記載の化合物。
- G4が酸素原子を表すことを特徴とする、請求項1または2のいずれか1項に記載の化合物。
- X1がR1またはG1R1基を表し、G1が請求項1に定義されたとおりであり、そしてR1がハロゲン化されたアルキル基を表すことを特徴とする、請求項1〜3のいずれか1項に記載の化合物。
- X2が水素原子を表すことを特徴とする、請求項1〜4のいずれか1項に記載の化合物。
- 前記化合物が、
2−[2,6−ジメチル−4−[3−[4−(トリフルオロメトキシ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸、
2−[2,6−ジメチル−4−[3−[4−(トリフルオロメチルチオ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸、
2−[2,6−ジメチル−4−[3−[4−ブロモフェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸、
2−[2,6−ジメチル−4−[3−[4−(トリフルオロメチル)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸、
2−[2,6−ジメチル−4−[3−ヒドロキシ−3−[4−(トリフルオロメチルチオ)フェニル]プロピル]フェノキシ]−2−メチルプロパン酸、
2−[2,6−ジメチル−4−(3−(ピリジン−3−イルメトキシ)−3−[4−(トリフルオロメトキシ)フェニル]プロピル]フェノキシ]−2−メチルプロパン酸、
2−[4−(3−(4−ヨードベンジルオキシ)−3−(4−(トリフルオロメトキシ)フェニル)プロピル)−2,6−ジメチルフェノキシ]−2−メチルプロパン酸、
2−[4−(3−(4−メトキシ)−3−(4−(トリフルオロメトキシ)フェニル)プロピル)−2,6−ジメチルフェノキシ]−2−メチルプロパン酸、
2−[2,6−ジメチル−4−[3−[4−(3,3,3−トリフルオロプロピルオキシ)フェニル]−3−オキソ−プロピル]フェノキシ]−2−メチルプロパン酸、
2−(2,6−ジメチル−4−(3−オキソ−3−(4−(2,2,2−トリフルオロエトキシ)フェニル)プロピル)フェノキシ)−2−メチルプロパン酸、
2−(2,6−ジメチル−4−(3−オキソ−3−(4−(2,2,2−トリフルオロエチルチオ)フェニル)プロピル)フェノキシ)−2−メチルプロパン酸、
2−(4−(3−(2−フルオロ−4−(トリフルオロメチル)フェニル)−3−オキソ−プロピル)−2,6−ジメチルフェノキシ)−2−メチルプロパン酸、
2−(4−(3−(2−フルオロ−4−(2,2,2−トリフルオロエトキシ)フェニル)−3−オキソ−プロピル)−2,6−ジメチルフェノキシ)−2−メチルプロパン酸、
2−(2,6−ジメチル−4−(3−オキソ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)フェノキシ)プロパン酸、
2−[4−(3−ヒドロキシ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)−2,6−ジメチルフェノキシ]−2−メチルプロパン酸、
2−(2,6−ジメチル−4−(3−オキソ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)フェノキシ)−2−メチルプロパンアミド、
2−(4−(3−ヒドロキシイミノ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)−2,6−ジメチルフェノキシ)−2−メチルプロパン酸、
2−(4−(3−メトキシイミノ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)−2,6−ジメチルフェノキシ)−2−メチルプロパン酸、
4−(2,6−ジメチル−4−(3−オキソ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)フェノキシ)−2,2−ジメチル酪酸、
2−(2,6−ジメチル−4−(3−オキソ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)フェノキシ)−2−メチルプロパン酸テルチオブチルエステル、
2−(2,6−ジメチル−4−(3−オキソ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)フェノキシ)−2−メチルプロパン酸イソプロピルエステル、
2,2−ジフルオロ−2−(2,6−ジメチル−4−(3−オキソ−3−(4−(トリフルオロメトキシ)フェニル)プロピル)フェノキシ)酢酸
の中から選ばれることを特徴とする、請求項1〜5のいずれか1項に記載の化合物。 - 場合により1つまたは複数の他の治療的有効成分および/または化粧品有効成分とともに、請求項1〜6のいずれか1項に記載の化合物の少なくとも1つを、薬学的に許容されうる支持体中に含む医薬組成物。
- メタボリック症候群と関連した合併症、インスリン抵抗性、糖尿病、異脂肪血症、アテローム性動脈硬化症、心臓血管疾患、肥満、高血圧、炎症性疾患、神経変性病理または癌の処置のための、請求項7に記載の医薬組成物。
- 異脂肪血症の処置のための、請求項7に記載の医薬組成物。
- 脂質および/または糖質代謝の調節異常に関する心臓血管リスク因子を処置するための、請求項7に記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR0605540A FR2902789A1 (fr) | 2006-06-21 | 2006-06-21 | Derives de 1,3-diphenylpropane substitues, preparations et utilisations |
| FR06/05540 | 2006-06-21 | ||
| PCT/EP2007/056225 WO2007147880A1 (fr) | 2006-06-21 | 2007-06-21 | Derives de 1,3-diphenylpropane substitues, preparations et utilisations |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2009541270A JP2009541270A (ja) | 2009-11-26 |
| JP2009541270A5 JP2009541270A5 (ja) | 2010-07-15 |
| JP5350231B2 true JP5350231B2 (ja) | 2013-11-27 |
Family
ID=37845179
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009515889A Active JP5350231B2 (ja) | 2006-06-21 | 2007-06-21 | 置換された1,3−ジフェニルプロパン誘導体、その製造および使用 |
| JP2009515888A Active JP5350230B2 (ja) | 2006-06-21 | 2007-06-21 | 置換された1,3−ジフェニルプロパン誘導体、その製造および使用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009515888A Active JP5350230B2 (ja) | 2006-06-21 | 2007-06-21 | 置換された1,3−ジフェニルプロパン誘導体、その製造および使用 |
Country Status (22)
| Country | Link |
|---|---|
| US (2) | US8188148B2 (ja) |
| EP (2) | EP2046715B1 (ja) |
| JP (2) | JP5350231B2 (ja) |
| KR (2) | KR101416262B1 (ja) |
| CN (3) | CN101506138B (ja) |
| AU (2) | AU2007262938B2 (ja) |
| BR (1) | BRPI0713600B1 (ja) |
| CA (2) | CA2655744C (ja) |
| CY (2) | CY1115082T1 (ja) |
| DK (2) | DK2046715T5 (ja) |
| EA (1) | EA018437B1 (ja) |
| ES (2) | ES2466268T3 (ja) |
| FR (1) | FR2902789A1 (ja) |
| IL (2) | IL196071A0 (ja) |
| MX (1) | MX2008016239A (ja) |
| NO (1) | NO341866B1 (ja) |
| NZ (1) | NZ573674A (ja) |
| PL (2) | PL2046716T3 (ja) |
| PT (2) | PT2046716E (ja) |
| SI (2) | SI2046716T1 (ja) |
| WO (2) | WO2007147880A1 (ja) |
| ZA (1) | ZA200810709B (ja) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2902789A1 (fr) * | 2006-06-21 | 2007-12-28 | Genfit Sa | Derives de 1,3-diphenylpropane substitues, preparations et utilisations |
| FR2917084B1 (fr) * | 2007-06-05 | 2009-07-17 | Galderma Res & Dev | Nouveaux derives d'acide 3-phenyl propanoique activateurs des recpteurs de type ppar, leur methode de preparation et leur utilisation dans des compositions cosmetiques ou pharmaceutiques. |
| US10722575B2 (en) | 2009-11-26 | 2020-07-28 | Genfit | Use of 1,3-diphenylprop-2-en-1-one derivatives for treating liver disorders |
| NZ600439A (en) * | 2009-11-26 | 2014-06-27 | Genfit | Use of 1,3-diphenylprop-2-en-1-one derivatives for treating liver disorders |
| US9221751B2 (en) | 2009-11-26 | 2015-12-29 | Genfit | Use of 1,3-diphenylprop-2-en-1-one derivatives for treating liver disorders |
| WO2011080276A1 (en) | 2009-12-29 | 2011-07-07 | Genfit | Pharmaceutical combinations comprising a dpp-4 inhibitor and a 1,3-diphenylprop-2-en-1-one derivative |
| EP2571843B1 (en) | 2010-05-17 | 2017-12-27 | Genfit | Improved preparation of chalcone derivatives |
| MX2013000391A (es) * | 2010-07-12 | 2013-03-08 | Hoffmann La Roche | 1-hidroxiimino-3-fenil-propanos. |
| KR20140096369A (ko) * | 2011-11-14 | 2014-08-05 | 에프. 호프만-라 로슈 아게 | Gpbar1 작용제로서의 1-피리다지닐-하이드록시이미노-3-페닐-프로판 |
| US9115073B2 (en) * | 2011-12-28 | 2015-08-25 | Genfit | 1,3-diphenylpropane derivatives, preparations and uses thereof |
| WO2017143038A1 (en) * | 2016-02-16 | 2017-08-24 | Concert Pharmaceuticals, Inc. | Deuterated gft-505 |
| IT201600098338A1 (it) | 2016-09-30 | 2018-03-30 | Univ Degli Studi Padova | Composti 1-fenilpropanone e loro impiego |
| RU186145U1 (ru) * | 2018-08-08 | 2019-01-11 | Общество с ограниченной ответственностью "Научно-производственное объединение "Центротех" (ООО "НПО "Центротех") | Каркас виброрамы вибросита |
| US11634387B2 (en) | 2019-09-26 | 2023-04-25 | Abionyx Pharma Sa | Compounds useful for treating liver diseases |
| CA3163375A1 (en) | 2020-02-10 | 2021-08-19 | Genfit | Treatment of primary biliary cholangitis with elafibranor |
| CN114901641A (zh) * | 2020-02-28 | 2022-08-12 | 四川科伦博泰生物医药股份有限公司 | 芳香族化合物及其药物组合物和用途 |
| AU2021275381A1 (en) | 2020-05-18 | 2022-11-24 | Genfit | Elafibranor for the treatment of primary sclerosing cholangitis |
| US20230301951A1 (en) | 2020-08-26 | 2023-09-28 | Genfit | Compositions and methods for the treatment of primary biliary cholangitis |
| AU2022272414A1 (en) | 2021-05-11 | 2023-10-26 | Genfit | Elafibranor derivatives agonists of ppar for use in the treatment of sepsis |
| EP4337184A1 (en) | 2021-05-11 | 2024-03-20 | Genfit | Ppar-agonists for use in the treatment of liver failure |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2149070C3 (de) | 1971-10-01 | 1978-03-23 | Boehringer Mannheim Gmbh, 6800 Mannheim | Phenoxyalkylcarbonsäurederivate und deren Salze, Verfahren zu deren Herstellung und Arzneimittel |
| HU200591B (en) * | 1986-07-11 | 1990-07-28 | Chinoin Gyogyszer Es Vegyeszet | Process for producing new diphenyl propylamine derivatives and pharmaceutical compositions comprising such compounds |
| DE4121849A1 (de) * | 1991-07-02 | 1993-01-14 | Rhone Poulenc Rorer Gmbh | (4-((omega)-arylalkyl)-phenyl)alkansaeuren, ihre salze und/oder ihre derivate |
| DE4327365A1 (de) * | 1993-08-14 | 1995-02-16 | Boehringer Mannheim Gmbh | Verwendung von Phenolen und Phenolderivaten als Arzneimittel mit fibrinogensenkender Wirkung |
| DE60035682T2 (de) * | 1999-04-28 | 2008-04-30 | Sanofi-Aventis Deutschland Gmbh | Di-aryl-säurederivate als ppar rezeptor liganden |
| DE19933421A1 (de) * | 1999-07-16 | 2001-01-25 | Gruenenthal Gmbh | 2-Benzyl-3-dimethylamino-1-phenyl-propanderi- vate |
| FR2841900B1 (fr) | 2002-07-08 | 2007-03-02 | Genfit S A | Nouveaux derives de 1,3-diphenylprop-2-en-1-one substitues, preparation et utilisations |
| WO2005040104A1 (en) * | 2003-10-28 | 2005-05-06 | Dr. Reddy's Laboratories Ltd. | Novel compounds and their use in medicine: process for their preparation and pharmaceutical compositions containing them |
| MY147518A (en) * | 2004-09-15 | 2012-12-31 | Janssen Pharmaceutica Nv | 4-((phenoxyalkyl)thio)-phenoxyacetic acids and analogs |
| FR2902789A1 (fr) * | 2006-06-21 | 2007-12-28 | Genfit Sa | Derives de 1,3-diphenylpropane substitues, preparations et utilisations |
-
2006
- 2006-06-21 FR FR0605540A patent/FR2902789A1/fr not_active Withdrawn
-
2007
- 2007-06-21 KR KR1020097001319A patent/KR101416262B1/ko active IP Right Grant
- 2007-06-21 PL PL07786798T patent/PL2046716T3/pl unknown
- 2007-06-21 NZ NZ573674A patent/NZ573674A/en not_active IP Right Cessation
- 2007-06-21 AU AU2007262938A patent/AU2007262938B2/en active Active
- 2007-06-21 MX MX2008016239A patent/MX2008016239A/es active IP Right Grant
- 2007-06-21 PT PT77867984T patent/PT2046716E/pt unknown
- 2007-06-21 EP EP07730296.6A patent/EP2046715B1/fr active Active
- 2007-06-21 ES ES07730296.6T patent/ES2466268T3/es active Active
- 2007-06-21 PT PT77302966T patent/PT2046715E/pt unknown
- 2007-06-21 DK DK07730296.6T patent/DK2046715T5/da active
- 2007-06-21 BR BRPI0713600-5A patent/BRPI0713600B1/pt not_active IP Right Cessation
- 2007-06-21 PL PL07730296T patent/PL2046715T3/pl unknown
- 2007-06-21 CN CN200780030962.XA patent/CN101506138B/zh active Active
- 2007-06-21 EA EA200900044A patent/EA018437B1/ru not_active IP Right Cessation
- 2007-06-21 SI SI200731347T patent/SI2046716T1/sl unknown
- 2007-06-21 CA CA2655744A patent/CA2655744C/fr active Active
- 2007-06-21 JP JP2009515889A patent/JP5350231B2/ja active Active
- 2007-06-21 CA CA2655643A patent/CA2655643C/fr active Active
- 2007-06-21 AU AU2007262939A patent/AU2007262939B2/en not_active Ceased
- 2007-06-21 WO PCT/EP2007/056225 patent/WO2007147880A1/fr active Application Filing
- 2007-06-21 US US12/308,558 patent/US8188148B2/en active Active
- 2007-06-21 KR KR1020097001318A patent/KR101416257B1/ko active IP Right Grant
- 2007-06-21 ES ES07786798T patent/ES2434071T3/es active Active
- 2007-06-21 WO PCT/EP2007/056224 patent/WO2007147879A1/fr active Application Filing
- 2007-06-21 CN CN2007800310203A patent/CN101506139B/zh active Active
- 2007-06-21 DK DK07786798.4T patent/DK2046716T3/da active
- 2007-06-21 SI SI200731453T patent/SI2046715T1/sl unknown
- 2007-06-21 US US12/308,580 patent/US8258182B2/en active Active
- 2007-06-21 JP JP2009515888A patent/JP5350230B2/ja active Active
- 2007-06-21 CN CN201410016196.3A patent/CN104193660B/zh active Active
- 2007-06-21 EP EP07786798.4A patent/EP2046716B1/fr active Active
-
2008
- 2008-12-18 IL IL196071A patent/IL196071A0/en active IP Right Grant
- 2008-12-18 IL IL196057A patent/IL196057A/en active IP Right Grant
- 2008-12-19 ZA ZA200810709A patent/ZA200810709B/xx unknown
- 2008-12-19 NO NO20085338A patent/NO341866B1/no not_active IP Right Cessation
-
2013
- 2013-10-30 CY CY20131100955T patent/CY1115082T1/el unknown
-
2014
- 2014-05-27 CY CY20141100379T patent/CY1115414T1/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5350231B2 (ja) | 置換された1,3−ジフェニルプロパン誘導体、その製造および使用 | |
| CA2673761C (fr) | Derives de 3-phenyl-1-(phenylthienyl)propan-1-one et de 3-phenyl-1-(phenylfuranyl)propan-1-one substitues, preparation et utilisation | |
| WO2008087367A2 (fr) | Derives de (phenylthiazolyl)-phenyl-propan-1-one et de (phenyloxazodyl)-phenyl-propan-1-one substitues, preparations et utilisations | |
| WO2008087365A2 (fr) | Derives de 1,3-diphenylpropane substitues, preparations et utilisations |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100527 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100527 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120918 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20121217 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20121225 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130117 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130124 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130215 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130326 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130624 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130723 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130821 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5350231 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |