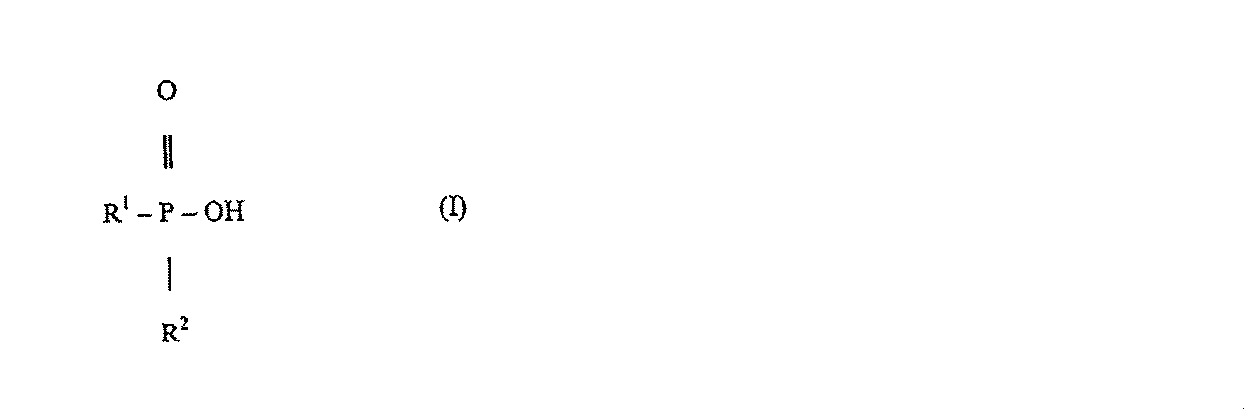JP5154940B2 - 高精製ジアルキルホスフィン酸の製造方法 - Google Patents
高精製ジアルキルホスフィン酸の製造方法 Download PDFInfo
- Publication number
- JP5154940B2 JP5154940B2 JP2007538176A JP2007538176A JP5154940B2 JP 5154940 B2 JP5154940 B2 JP 5154940B2 JP 2007538176 A JP2007538176 A JP 2007538176A JP 2007538176 A JP2007538176 A JP 2007538176A JP 5154940 B2 JP5154940 B2 JP 5154940B2
- Authority
- JP
- Japan
- Prior art keywords
- acid
- reaction
- dialkylphosphinic
- alkyl
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/30—Phosphinic acids [R2P(=O)(OH)]; Thiophosphinic acids ; [R2P(=X1)(X2H) (X1, X2 are each independently O, S or Se)]
- C07F9/301—Acyclic saturated acids which can have further substituents on alkyl
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
本発明は、一般に、ジアルキルホスフィン酸化合物好ましくは分枝状ジアルキルホスフィン酸化合物の経済的製造のための改良方法に関する。該方法は、高純度のジアルキルホスフィン酸生成物を実現する単一相分離を可能にする。
数多くの有機ホスフィン酸の誘導体が存在すること、並びにそれらはかなりの商業的価値及びまた非常に様々の有用な用途を有することが知られている。たとえば、有機ホスフィネート及びまたそれらの酸は、有効な湿潤剤及び洗剤;多くのプラスチック及び樹脂用の可塑剤;アスファルト及び同様な組成物用の結合剤;グリース及び潤滑剤用の色安定剤及び酸化防止剤(米国特許第3,001,938号明細書);腐食防止剤;防炎剤;浮選助剤;金属抽出剤;セッコウ用凝結遅緩剤;並びにフィラメント用安定剤のような繊維用助剤(米国特許第3,374,288号明細書)である。
の化合物から成る化合物のクラスとの間の反応を用いる方法を開示する。Stiles等が反応体として示唆するリンクラス及び化合物のなかに、次亜リン酸の塩、次亜リン酸のヒドロカルビルエステル、有機ホスフィン酸のヒドロカルビルエステル、並びに亜リン酸のモノ及びジヒドロカルビルエステルがある。特に好ましいサブクラスは、Stiles等が14個までの炭素原子を含有するオレフィンに直接的に付加されて「単一操作工程で水溶性洗剤を実質的に定量的収率にて製造する」ことができると見出した次亜リン酸ナトリウムのような次亜リン酸のアルカリ金属塩を含む。
本発明は、標準的な反応加工及び装置(すなわち、高い圧力及び温度の不存在下)、並びに追加的有機溶媒の添加工程並びにかかる必要な追加的溶媒の回収のための付随の回収手順及び装置の必要なしに単純な水性相抽出/分離加工を用いて、ジアルキルホスフィン酸特に分枝状ジアルキルホスフィン酸及びそれらのホスフィネートの単純な合成が高純度でもってもたらされ得る方法に関する。
本発明の主題は、精製ジアルキルホスフィン酸好ましくは式(I)
のジアルキルホスフィン酸の改良製造方法であって、次亜リン酸又はその塩と化学量論的過剰量のアルファオレフィンとのフリーラジカル促進反応並びに該反応によって形成されたモノアルキルホスフィン酸副生成物を優先的に中和することが分かっている塩基水溶液を添加することによってジアルキルホスフィン酸反応生成物を単離及び精製することによる方法である。ジアルキルホスフィン酸が優先的に可溶化されるところの有機相中よりも水性相中に一層可溶であるモノアルキルホスフィン酸は、ジアルキルホスフィン酸生成物から容易に分離される。随意に、ジアルキルホスフィン酸のより高度の精製のために、当業者によりよく知られた追加的精製工程(後続の酸性化及び蒸留のような)が用いられ得る。
本発明の方法において用いられるアルファオレフィンは、2から22個の炭素原子好ましくは2から12個の炭素原子そして最も好ましくは2から9個の炭素原子を含有する。本発明の方法において、直鎖アルファモノオレフィンが用いられ得るけれども、アルファモノオレフィンは好ましくは分枝状、最も好ましくは高分枝状である。かかるオレフィンの例は、エチレン、プロペン、ブテン−(1)、ヘキサン−(1)、オクタン−(1)、ドデセン−(1)、テトラデセン−(1)、ヘキサデセン−(1)、オクタデセン−(1)、ヘンエイコセン−(1)、ドコセン−(1)、2−メチルペンテン−(1)、2−エチルヘキセン−(1)及びジイソブチレン−(1)である。また、かかるオレフィンの混合物も用いられ得る。
合成
ビス(2,4,4−トリメチルペンチル)ホスフィン酸を合成するために、1.5リットルのオートクレーブに40g(0.377モル)の次亜リン酸ナトリウム、40gの酢酸、132.3g(0.943モル)のジイソブチレン(80%)及び2.8g(0.019モル)のtert−ブチルペルオキシド開始剤を装填した。次いで、この混合物を一日8時間の間約4日間すなわち合計30時間約135℃に加熱し、且つ1.4gの該開始剤を各日の始めに添加した。反応混合物は31P−NMRにより監視され、そして下記の表Iに同定された組成をもたらした。原混合物は、75.3%の所望ジアルキルホスフィン酸生成物及び12.1%の不所望モノアルキルホスフィン酸副生成物を含有していた。
完了反応混合物(220g)をエルレンマイヤーフラスコに移し、そして約70℃から約80℃の範囲にて加熱して粘度を低減した。2つの相が認められるまで、38gの水をゆっくり添加した。水性相を除去し、そしてそのpHは約5であると測定された。次いで、有機相を75gの4%苛性溶液で洗浄し、そして生じた水性層(89.2g)を除去した。有機層を50gの10%硫酸溶液で酸性にし且つ洗浄し、そして生じた水性相を除去した。
Claims (17)
- 次亜リン酸又は次亜リン酸塩を化学量論的過剰量のアルファオレフィンとフリーラジカル開始剤及び遷移金属触媒の存在下又は不存在下で反応させてモノアルキルホスフィン酸及びジアルキルホスフィン酸を含む反応生成物組成物を形成させることによる高い収率及び純度でのジアルキルホスフィン酸の改良製造方法において、
a)i)該ホスフィン酸類の塩を形成させる且つii)該モノアルキルホスフィン酸が水性相中に優先的に可溶化する水性相及び有機相を確立するのに十分な水性塩基を該反応生成物組成物に添加し、
b)該有機相を該水性相から分離し、
c)この有機相を酸性にし、そして
d)この有機相から該オレフィンを除去し、そして
e)精製されたジアルキルホスフィン酸生成物を単離する
ことを特徴とする方法。 - R1及びR2が、各々独立して、2から12個の炭素原子を有する置換アルキル基である、請求項2に記載の方法。
- R1及びR2が、各々独立して、2から9個の炭素原子を有する置換アルキル基である、請求項3に記載の方法。
- アルキル基が、各々独立して、クロロ、ブロモ、アルキル、アルコキシ基及びそれらの混合物から成る群から選択された2個又はそれ以上の基により置換されている、請求項2に記載の方法。
- アルキル基が、各々独立して、クロロ、ブロモ、アルキル、アルコキシ基及びそれらの混合物から成る群から選択された2個又はそれ以上の基により置換されている、請求項3に記載の方法。
- アルキル基が、各々独立して、クロロ、ブロモ、アルキル、アルコキシ基及びそれらの混合物から成る群から選択された2個又はそれ以上の基により置換されている、請求項4に記載の方法。
- 反応生成物組成物を形成させるべき反応を酸溶液の存在下で行う、請求項1に記載の方法。
- 酸溶液が、塩酸、硫酸、酢酸及びそれらの混合物から成る群から選択される、請求項8に記載の方法。
- 酸溶液が酢酸溶液である、請求項9に記載の方法。
- 次亜リン酸塩が次亜リン酸ナトリウム一水和物である、請求項1に記載の方法。
- アルファオレフィン対次亜リン酸又は次亜リン酸塩のモル比が、2:1より大である、請求項1に記載の方法。
- アルファオレフィン対次亜リン酸又は次亜リン酸塩のモル比が、2.5対1より大である、請求項12に記載の方法。
- 反応生成物組成物に添加される水性塩基が、水酸化ナトリウム水溶液又は炭酸ナトリウム水溶液である、請求項1に記載の方法。
- 酸性化工程における酸が、無機酸溶液を含む、請求項1に記載の方法。
- 無機酸溶液が硫酸溶液である、請求項15に記載の方法。
- 除去されたオレフィンを再循環させる、請求項1に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US62197204P | 2004-10-25 | 2004-10-25 | |
| US60/621,972 | 2004-10-25 | ||
| US11/256,704 | 2005-10-24 | ||
| US11/256,704 US7049463B2 (en) | 2004-10-25 | 2005-10-24 | Process for the preparation of highly purified, dialkyl phosphinic acids |
| PCT/US2005/038463 WO2006047545A2 (en) | 2004-10-25 | 2005-10-25 | Process for the preparation of highly purified, dialkyl phosphinic acids |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008517947A JP2008517947A (ja) | 2008-05-29 |
| JP5154940B2 true JP5154940B2 (ja) | 2013-02-27 |
Family
ID=36206994
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007538176A Expired - Lifetime JP5154940B2 (ja) | 2004-10-25 | 2005-10-25 | 高精製ジアルキルホスフィン酸の製造方法 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US7049463B2 (ja) |
| EP (1) | EP1805107B1 (ja) |
| JP (1) | JP5154940B2 (ja) |
| AT (1) | ATE445572T1 (ja) |
| AU (1) | AU2005299450B2 (ja) |
| CA (1) | CA2585291C (ja) |
| DE (1) | DE602005017173D1 (ja) |
| WO (1) | WO2006047545A2 (ja) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2084168B1 (en) * | 2006-10-25 | 2012-06-27 | Rhodia, Inc. | Process for the preparation of highly purified, dialkydithiophosphinic compounds |
| DE102008056341A1 (de) * | 2008-11-07 | 2010-05-12 | Clariant International Limited | Verfahren zur Herstellung von monoaminofunktionalisierten Dialkylphosphinsäuren, -estern und -salzen mittels Acrylnitrilen und ihre Verwendung |
| DE102008063640A1 (de) * | 2008-12-18 | 2010-06-24 | Clariant International Limited | Verfahren zur Herstellung von gemischtsubstituierten Dialkylphosphinsäuren, -estern und -salzen und ihre Verwendung |
| US8062555B2 (en) * | 2009-04-16 | 2011-11-22 | Rhodia Operations | Co-assembly method and co-assembled structures made thereby |
| DE102010018684A1 (de) | 2010-04-29 | 2011-11-03 | Clariant International Ltd. | Verfahren zur Herstellung von Mischungen aus Alkylphosphonigsäuresalzen und Dialkylphosphinsäuresalzen |
| DE102010018681A1 (de) | 2010-04-29 | 2011-11-03 | Clariant International Ltd. | Flammschutzmittel-Stabilisator-Kombination für thermoplastische und duroplastische Polymere |
| DE102010018680A1 (de) * | 2010-04-29 | 2011-11-03 | Clariant International Limited | Flammschutzmittel-Stabilisator-Kombination für thermoplastische und duroplastische Polymere |
| CN103694273B (zh) * | 2013-01-10 | 2017-04-12 | 中国科学院上海有机化学研究所 | 一种双烷基次膦酸类化合物或其盐的制备方法及用途 |
| CN104250440A (zh) | 2013-06-28 | 2014-12-31 | 杜邦公司 | 阻燃的聚合物组合物 |
| CN110746455A (zh) * | 2019-11-25 | 2020-02-04 | 岳阳富和科技有限公司 | 一种二(2,4,4-三甲基戊基)次膦酸铝的制备方法 |
| CN114478624B (zh) * | 2022-01-22 | 2024-07-02 | 兰州瑞朴科技有限公司 | 一种二乙基次膦酸铝的调聚物及其制备方法 |
| CN114685856B (zh) * | 2022-04-21 | 2024-02-20 | 兰州瑞朴科技有限公司 | 二乙基次膦酸铝的制备方法 |
| CN116925132B (zh) * | 2023-07-03 | 2024-06-14 | 太仓维龙化工有限公司 | 一种细粒径二烷基次膦酸盐的制备方法 |
| CN117510538A (zh) * | 2023-11-13 | 2024-02-06 | 福建瑞博奥科技有限公司 | 一种制备高纯度二烷基次膦酸或其盐的方法 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2957931A (en) * | 1949-07-28 | 1960-10-25 | Socony Mobil Oil Co Inc | Synthesis of compounds having a carbonphosphorus linkage |
| US4292284A (en) * | 1980-06-27 | 1981-09-29 | Toho Aen Kabushiki Kaisha | Solvent extraction recovery process for indium |
| US5085794A (en) * | 1990-04-25 | 1992-02-04 | Nalco Chemical Company | Oligomer containing phosphinate compositions and their method of manufacture |
| DE59807338D1 (de) * | 1997-11-28 | 2003-04-03 | Clariant Gmbh | Verfahren zur herstellung von dialkylphosphinsäuren |
| DE19927787C2 (de) * | 1999-06-18 | 2003-12-11 | Clariant Gmbh | Verfahren zur Herstellung von Alkylphosphonsäuren |
-
2005
- 2005-10-24 US US11/256,704 patent/US7049463B2/en not_active Expired - Lifetime
- 2005-10-25 JP JP2007538176A patent/JP5154940B2/ja not_active Expired - Lifetime
- 2005-10-25 EP EP05812709A patent/EP1805107B1/en not_active Expired - Lifetime
- 2005-10-25 AU AU2005299450A patent/AU2005299450B2/en not_active Expired
- 2005-10-25 CA CA2585291A patent/CA2585291C/en not_active Expired - Lifetime
- 2005-10-25 WO PCT/US2005/038463 patent/WO2006047545A2/en not_active Ceased
- 2005-10-25 DE DE602005017173T patent/DE602005017173D1/de not_active Expired - Lifetime
- 2005-10-25 AT AT05812709T patent/ATE445572T1/de not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| EP1805107B1 (en) | 2009-10-14 |
| JP2008517947A (ja) | 2008-05-29 |
| WO2006047545A2 (en) | 2006-05-04 |
| WO2006047545A3 (en) | 2007-02-01 |
| CA2585291A1 (en) | 2006-05-04 |
| EP1805107A4 (en) | 2008-02-13 |
| ATE445572T1 (de) | 2009-10-15 |
| EP1805107A2 (en) | 2007-07-11 |
| CA2585291C (en) | 2013-09-17 |
| AU2005299450B2 (en) | 2010-12-09 |
| US7049463B2 (en) | 2006-05-23 |
| DE602005017173D1 (de) | 2009-11-26 |
| US20060089508A1 (en) | 2006-04-27 |
| AU2005299450A1 (en) | 2006-05-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ZA200703149B (en) | Process for the preparation of highly purified, dialkyl phosphinic acids | |
| JP5154940B2 (ja) | 高精製ジアルキルホスフィン酸の製造方法 | |
| US6278012B1 (en) | Process for preparing phosphinate esters | |
| JP2001002686A (ja) | ジアルキルホスフィン酸及びそれの塩の製造方法 | |
| JP2001525328A (ja) | ジアルキルホスフィン酸の製造方法 | |
| JPH0631274B2 (ja) | リン含有シアンヒドリン誘導体の製造方法 | |
| US6600068B2 (en) | Process for preparing ethanebis(methylphosphinic) acid | |
| US8796487B2 (en) | Process for the preparation of highly purified, dialkydithiophosphinic compounds | |
| JP4224209B2 (ja) | 元素状燐のアルキル化法 | |
| US4122123A (en) | Production of quaternary phosphonium halides | |
| TW201726694A (zh) | 製造膦酸酯之方法 | |
| US9035083B2 (en) | Synthesis of H-phosphonate intermediates and their use in preparing the herbicide glyphosate | |
| WO2023054663A1 (ja) | ビニルホスホン酸モノエステルの製造方法 | |
| US3636144A (en) | Dithiophosphoric acid salts and process for making same | |
| US2848474A (en) | Method of producing and recovering trimethyl phosphite | |
| CN101044148B (zh) | 具有醇式羟基的膦酸酯的制备方法 | |
| JPH0751590B2 (ja) | 有機ホスフイニト類の製造 | |
| JPH0249317B2 (ja) | ||
| JPS6017800B2 (ja) | O,o−ジアルキル−ホスホロクロリドチオネ−トの製造方法 | |
| JPH0687874A (ja) | 高純度有機ホスフィン化合物の製造方法 | |
| JPH01268695A (ja) | 2−アルコキシカルボニルエチルホスフィン酸及びその製法 | |
| CN117700448A (zh) | 一种4-(羟基甲基膦酰基)-2-羰基丁酸的制备方法 | |
| CN112321638A (zh) | 单烷基亚膦酸二烷基酯、二烷基膦酸酯及其金属盐的制备方法 | |
| JPS6352039B2 (ja) | ||
| JP2001002688A (ja) | アルキル亜ホスホン酸の(金属)塩の製造方法i |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080925 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20111104 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111115 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120214 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120221 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20121106 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20121206 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20151214 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5154940 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| R371 | Transfer withdrawn |
Free format text: JAPANESE INTERMEDIATE CODE: R371 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |