JP5041663B2 - 拡散支配剤形および三次元印刷を含む作製方法 - Google Patents
拡散支配剤形および三次元印刷を含む作製方法 Download PDFInfo
- Publication number
- JP5041663B2 JP5041663B2 JP2004500818A JP2004500818A JP5041663B2 JP 5041663 B2 JP5041663 B2 JP 5041663B2 JP 2004500818 A JP2004500818 A JP 2004500818A JP 2004500818 A JP2004500818 A JP 2004500818A JP 5041663 B2 JP5041663 B2 JP 5041663B2
- Authority
- JP
- Japan
- Prior art keywords
- release
- shell
- polymer
- dosage form
- core
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2086—Layered tablets, e.g. bilayer tablets; Tablets of the type inert core-active coat
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2095—Tabletting processes; Dosage units made by direct compression of powders or specially processed granules, by eliminating solvents, by melt-extrusion, by injection molding, by 3D printing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/08—Bronchodilators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B29—WORKING OF PLASTICS; WORKING OF SUBSTANCES IN A PLASTIC STATE IN GENERAL
- B29C—SHAPING OR JOINING OF PLASTICS; SHAPING OF MATERIAL IN A PLASTIC STATE, NOT OTHERWISE PROVIDED FOR; AFTER-TREATMENT OF THE SHAPED PRODUCTS, e.g. REPAIRING
- B29C64/00—Additive manufacturing, i.e. manufacturing of three-dimensional [3D] objects by additive deposition, additive agglomeration or additive layering, e.g. by 3D printing, stereolithography or selective laser sintering
- B29C64/10—Processes of additive manufacturing
- B29C64/141—Processes of additive manufacturing using only solid materials
- B29C64/153—Processes of additive manufacturing using only solid materials using layers of powder being selectively joined, e.g. by selective laser sintering or melting
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B33—ADDITIVE MANUFACTURING TECHNOLOGY
- B33Y—ADDITIVE MANUFACTURING, i.e. MANUFACTURING OF THREE-DIMENSIONAL [3-D] OBJECTS BY ADDITIVE DEPOSITION, ADDITIVE AGGLOMERATION OR ADDITIVE LAYERING, e.g. BY 3-D PRINTING, STEREOLITHOGRAPHY OR SELECTIVE LASER SINTERING
- B33Y70/00—Materials specially adapted for additive manufacturing
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B33—ADDITIVE MANUFACTURING TECHNOLOGY
- B33Y—ADDITIVE MANUFACTURING, i.e. MANUFACTURING OF THREE-DIMENSIONAL [3-D] OBJECTS BY ADDITIVE DEPOSITION, ADDITIVE AGGLOMERATION OR ADDITIVE LAYERING, e.g. BY 3-D PRINTING, STEREOLITHOGRAPHY OR SELECTIVE LASER SINTERING
- B33Y80/00—Products made by additive manufacturing
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Materials Engineering (AREA)
- Manufacturing & Machinery (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Emergency Medicine (AREA)
- Mechanical Engineering (AREA)
- Pulmonology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
(発明の技術分野)
本発明は、全体として拡散支配剤形に関し、さらに詳しくは活性製薬成分の拡散支配放出を可能とするシェル剤形を含む三次元印刷ポリマーに関する。
徐放性製剤放出には少なくとも二つの重要な物理的機構、すなわち浸食および拡散がある。浸食では体液への溶解または体液による分解によるなど、活性製薬成分(Active Pharmaceutical Ingredient;API)および賦形剤の剤形からの物理的除去が関与する。浸食支配剤形では、放出終了時に剤形は無傷の固体単位として実質的にもはや存在しない。
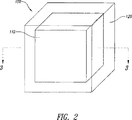
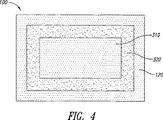
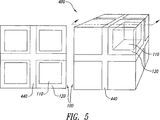
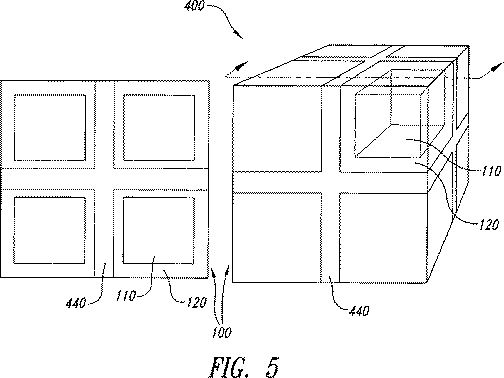
本発明は、コアがAPIを含み、たとえばシェル中のAPIの拡散制御によってシェルが実質的に放出を支配するコア−シェル単位または剤形を含む。シェルは放出抑制ポリマーおよび放出抑制ポリマー内に分散した放出調節ポリマーを含む。シェルはまた放出抑制ポリマーとともに混和された可塑剤を含むことがある。乾燥時にはシェルは実質的に連続的であり漏れ経路はないが、水性の液体で濡れると既知の拡散係数を有するようになる。コアは、シェルとAPI含有コア中心部との間にAPIが含まれない緩衝領域を備えることがある。望むなら、剤形は特定の条件下で互いに結合したり、互いに離れたりする複数の単位を含むことがある。本発明の剤形はほぼゼロ次の放出プロフィルを提供することができる。本発明は二種類のポリマーの比率の調整によって、放出プロフィルの時間的尺度の調整を可能にする。本発明は、たとえば一段法で剤形全体を作製することに適する三次元印刷によってそのような剤形を製造する方法をさらに含む。
本発明は、拡散支配経口剤形のコアおよびシェル構成を含む。コアは活性製薬成分(API)を含み、シェルは実質的にAPIの放出を支配する。シェルは、放出抑制ポリマーと放出調節ポリマーとの組み合わせを含む。シェルは、放出抑制ポリマーと混合された可塑剤をさらに含むことがある。コアは、シェルとAPI含有コアとの間に緩衝領域をさらに含むことがある。本発明の別の様相は一段法、たとえば三次元印刷(3DP)によって剤形を製造できることである。本発明の別の実施形態によると、剤形は特定の状況下で結合しあったり離れたりする複数の個別の単位を含む。本発明のまた別の実施形態はゼロ次放出プロフィルを有する剤形である。
放出調節粉体粒子はヒドロキシプロピルメチルセルロースのこともあり、またはヒドロキシプロピルメチルセルロースを含むこともある。ヒドロキシプロピルメチルセルロース(HPMC)は医薬用添加剤であり、水と接触するとジェルを形成するが非常に緩慢にしか分解しない。HPMCは親水性である。可能な放出調節ポリマーのその他の例はヒドロキシプロピルセルロース(HPC)や、メチルセルロースまたはカルボキシメチルセルロースや、キサンタムガム、ローカストビーンガム、アルギン酸誘導体、ゲランガム、グアーガム、トラガントなどの天然ヒドロゲルや、ビニルピロリドン/酢酸ビニル共重合体、およびポリビニルピロリドンである。
説明した剤形を製造する一つの方法は三次元印刷(3DP)である。3DPは、大部分のその他の製造方法では不可能なほど正確に製品の局所構造的な特徴および組成を確定する能力を提供する。
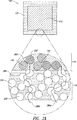
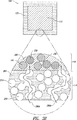
実質的に連続的シェルを実現するために有用なさらに別の方策は、全方向にシェルが少なくとも二ボクセル単位の厚さをもつ、すなわち、少なくとも二滴間距離または二線間距離または二粉体層厚さをもつようにパターン中にシェルバインダ液を堆積することである。一ボクセル厚さのシェルの場合に欠陥のないシェルを確実に製造しようとすれば、二ボクセル厚さのシェルの場合に必要な飽和度パラメータより大きな飽和度パラメータが必要になる。
剤形が互いに結合した複数の単位を含む場合、患者に投与されると、剤形は投与時または投与後に個別の単位に分かれる。たとえば、剤形は任意の液体、あるいは詳しくは胃液、または詳しくは腸液あるいはその他の種類の液に接触すると、液体のpHなどによって決定付けられるように分かれる。
(滴下試験)
候補材料の迅速スクリーニングのために、滴下試験を用いてバインダ液候補と粉体候補との間の相互作用を理解した。この試験は粉体候補物質層上にバインダ液候補物質の液滴を落下させ、視覚的に相互作用を観測することを含んだ。この試験では主な観察は浸入速度など粉体中へのバインダの浸入の定性的な観察であった。液滴の落下は手動で行ない、落下する液滴は三次元印刷中に実際にプリントヘッドから堆積される液滴よりかなり大きかったが、観察はそれでも定性的に有用であった。コア−シェル構造の構築については、次の粉体堆積工程前にコアバインダおよびシェルバインダをともに粉体に吸収する必要がある。浸入速度が遅いと相互作用が起こるには時間が不足する。浸入速度が極端に速いと、液を堆積することを意図していない局所的な領域に好ましくない流出を引き起こし、やはりいくらか不利である。
(線およびリボンなどの基本的形状の印刷)
滴下試験による若干の物質スクリーニング後に、さまざまな組合せの物質、流速ならびに滴間距離および線間距離を使用して、単純な線およびリボンなどの基本的な形状を粉体床に印刷することによって、物質および工程特性評価をさらに実施した。基本的な形状の印刷を行うこの試験によって、滴下試験で観察したものよりもさらに詳しく粉体と液体との間の相互作用を示すことに加えて、幾何学的な変形(膨潤または歪み)をもっとも引き起こしにくいバインダ溶液を見分け、特定の液体について適切な構造完成度を得るために最適な滴間距離および線間距離ならびに層の厚さを識別することができた。これらの線およびリボン試験を実施した粉体はユードラジットRSPOまたはコリドンSRのそれぞれであった。たとえ粉体が最終的に剤形を作製するために使用された粉体そのものではなかったとしても、最終的に剤形作製用に使用した粉体に得られた一般的な知見を適用できると考えられる。<0.0075インチ(190マイクロメートル)のオリフィスを有するノズルを使用した。三つの異なる液体を使用した。
(フィルム中の拡散または漏出試験)
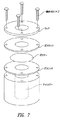
候補組成物のフィルムまたは膜の拡散挙動、とくに剤形からのAPIの拡散に影響を及ぼすピンホールおよび類似の欠陥の有無の特性を把握するためにこの実験を実施した。眼に見えるピンホールの有無は目視によっても若干は評価できるかもしれないが、より直接的で最終的な用途により密接に関係するピンホールの検査には、フィルムを液に暴露してフィルム中の物質移動を測定することを行った。したがってこの試験では、選んだ物質、シェルバインダ液の指定の流速および粉体の一層または二層のどちらかを使用して、3DPによって先に説明したリボンと同じように平面フィルムを印刷した。粉体として使用する物質は単一物質、すなわち放出抑制ポリマーだけであり、本明細書の他の部分で実際の剤形を作るために説明する二つの異なる種類のポリマーの組合せではなかった。印刷および回収の後、漏れがないようにフィルムの周辺部を固定して、フィルムの一方の面をAPI含有液に、反対側の面を胃液のシミュレーション液に接触させた。図7に装置を示す。被験物質を固定してAPI含有液に接触した装置を、フィルムが装置の底にあり、装置内に含まれる気泡がすべて確実にフィルムから浮かび去るような配置で溶解セル内の液体(溶出溶媒)中に沈めた。この実験配置では、装置から外側の液体(溶出溶媒)へのAPIの唯一の放出経路は、フィルムそのものを通る拡散または漏れであった。フィルムの供給側の液体は単純な溶液であり、液体の他にはどのような固体の溶質も含んでいなかったことが明らかである。すなわち、溶液は飽和していなかった。
(インビトロ溶解試験に関する試験手順)
剤形または単位を製造して液体溶解溶媒中に溶解することによって、インビボ条件にできるだけ近くシミュレーションしたインビトロ溶解データを得た。実際の患者の消化管中の正確な条件を予測することはできないので、溶出溶媒のpH、溶解セル中のパドル撹拌速度および(使用する場合には)溶解試験中に剤形を沈めておくために働くおもりの有無を変えることを含めて、さまざまな溶解条件下で製剤を試験した。任意の時点で試験される単位の数を溶解室の大きさによって変えた。
(剤形の製造)
実施例の剤形の製造は3DP機で実施される。使用した粉体は、コリドンSR(バスフ社、シュリーブポート、ルイジアナ)およびヒドロキシプロピルメチルセルロース、置換型2910(ファルマコート603(Pharmacoat 603)、信越化学工業)の指定した比率の混合物であった。コリドンSRは分子量450,000ダルトンのポリビニルアセテート(PVAc)80%、分子量30,000ダルトンのポリビニルピロリドン19%、および界面活性剤として少量のラウリル硫酸ナトリウムおよび安定剤として二酸化ケイ素の混合物である。コリドンが放出抑制ポリマーであり、ヒドロキシプロピルメチルセルロースが放出調節ポリマーであった。作製作業の前にツインシェルブレンダを使用してこれらの二つの物質を15分間混和した。三つの異なる比率(重量比)、すなわちコリドンSR−HPMC比80:20、70:30および60:40を使用した。最も遅い放出を生むように比80:20、最も速い放出を生むように比60:40を製剤した。比40:60を用いても若干のデータを採取した。
(剤形の物理安定性)
溶解特性に対する高温および湿気の影響を決定するために、12時間製剤に対して安定性試験を実施した。開放容器および閉鎖容器中で25℃、相対湿度60%、および40℃、相対湿度75%で剤型を保存した。1週間後、2週間後および4週間後に試料の溶出試験を実施した。4週間の貯蔵期間後に開放容器条件の試料のそれぞれについて、放出特性の有意な変化は観測されなかった。製剤の優れた物理安定性は、製造時に剤形がさらされた乾燥条件から生じる。製造方法の一部であるその死につつある工程は、50℃、12時間の暴露であり、コリドンSRのポリマー主成分、すなわち可塑剤を加えない状態でも低いガラス転移点(42から45℃)を有するポリビニルアセテートを効果的に硬化させた。ガスクロマトグラフ法を使用して12時間製剤(公称値)(乾燥工程後)中のエタノール残留量も評価し、1.2%未満であることを見いだした。
(二つのポリマーの比率の調整による放出プロフィルの全時間的尺度の調整を含むインビトロ溶解)
本明細書中の他の部分で説明するように単位を製造して、本明細書中の他の部分で説明するインビトロ溶出試験手順を使用して試験した。三つの異なる比の粉体成分を使用した。8時間(公称値)の期間にわたってほぼゼロ次で放出される放出プロフィルを提供することを目的として、コリドン:HPMC比60:40を考えた。12時間(公称値)放出プロフィルを提供するために比70:30を考えた。16時間(公称値)放出プロフィルを提供するために比80:20を考えた。コリドン:HPMC比40:60によって、さらに速い約4時間の放出プロフィルも実現した。図8はこれらの所望の時間範囲が実現されたことを示す。図には示していないが、異なる時間に製造された剤形の間の再現性は良好であった。
(緩衝領域が存在するときの放出開始の遅延を例示するインビトロ溶出)
本明細書中の他の部分で説明するように、緩衝領域を有する単位および緩衝領域のない単位の両方を製造した。剤形中に緩衝領域を含むとき、緩衝領域はシェル自体と同じくすべての方向に二ボクセル単位(二滴間距離、二線間距離、二粉体層厚さ)または約800マイクロメートルの厚さを有した。緩衝領域を有する単位および緩衝領域のない単位の両方の放出プロフィルを溶出装置中で測定して、図9に示す。緩衝領域のない単位からの放出と比較すると、厚さ800マイクロメートルの緩衝領域を使用することによって、放出開始に数時間の遅延が生じたことが分かる。緩衝領域が遅延の原因となる理由の一部は、緩衝領域が水和するために必要とする時間である。コリドンSR:HPMC比60:40を有する製剤でこのデータを採取した。この剤形からの薬物放出は少なくとも3時間の間完全に止められた。
(インビボ研究)
先に説明したように作製した塩酸プソイドエフェドリンを含む剤形を被験者に投与した。剤形の投与に続き、指定時間に被験者の血中API濃度を測定した。
三つの試験製剤および参照製剤の薬物動態学的パラメータの平均値(%RSD)
** 基準製剤のAUCに対する試験製剤のAUC(∞)の比から求められる相対的バイオアベイラビリティ
三つの試験製剤および参照製剤に対する血漿濃度−時間曲線を図10に示す。血漿プロフィルは、インビトロ溶出プロフィルに一致する製剤間の明らかな差異を示した。同じ製剤の血漿レベルデータの変動は小さく、剤形の再現性のよいインビボ性能を示唆した。血漿濃度−時間曲線から計算した薬物動態学的パラメータを表1に示した。薬物放出の持続時間が延びると試験製剤のCmax値は予想通り減少した。異なる製剤のCmax値はまた互いにかなり異なった。12時間および16時間製剤に対するTmax値には有意差がなかったが、それでも両方とも8時間製剤および直接放出参照製品より有意に長かった。放出持続時間が8時間(公称値)放出から12時間(公称値)放出、さらに16時間(公称値)放出に延びると、相対的バイオアベイラビリティはわずかに減少した。
上式中C(t)は時間tにおけるプソイドエフェドリンHClの血漿濃度、Keは半対数血漿薬物濃度−時間プロフィルの終了相の直線回帰による勾配の負の値として計算した除去速度定数である。試験製剤の相対的バイオアベイラビリティ(Frel)は、基準製剤のAUC(0−∞)に対する試験製剤のAUC(0−∞)値の比であった。各被検者に対してFrel値を計算し、10人の被検者の算術平均を使用して各試験製剤のFrelを表した。
三次元印刷によって作製することができるコア−シェル構造を使用して拡散支配剤形を開発することに成功した。剤形はほぼゼロ次放出プロフィルを有する。粉体全体の作製に使用する二種類のポリマー粉体の比率を調節することによって、放出プロフィルの時間的尺度を簡単に変えることができる。放出持続期間(公称値)8時間、12時間および16時間、および4時間、の製剤を実証した。ポリマー粉体ブレンド中のHPMCの割合とともに、薬物放出用の拡散経路の増大により、製剤の放出速度は増大した。剤形のシェル以外の部分が多孔性のときでも欠陥のないシェルを作製した。説明した製造方法は確実で再現性高く剤形を製造し、インビトロおよびインビボ試験において予測どおりの放出プロフィルを示した。説明した製造方法は、剤形の一部分を一段階操作で作製し、別の操作で別の部分を作るのではなく、一つの粉体原料だけを使用して実質的に一工程で剤形全体を製造した。
Claims (21)
- 活性製薬成分の拡散が制御された放出を提供する少なくとも一つの単位を有する拡散制御剤形であって、該単位が以下:
a)放出抑制ポリマーの粒子および放出調節ポリマーの粒子を含む粉体であって、該放出抑制ポリマーは、ポリビニルアセテート80%、ポリビニルピロリドン19%、ラウリル硫酸ナトリウムおよびシリカ1%未満の混合物からなる群より選択され;そして、該放出調節ポリマーは、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、メチルセルロース、カルボキシメチルセルロース、ポリビニルアルコール、ポリビニルピロリドン、アクリレート−メタクリレート共重合体、ポリエチレングリコール、キサンタンガム、ゲランガム、ローカストビーンガム、グアーガム、トラガントおよびアルギン酸ナトリウムからなる群より選択される、粉体;
b)該粉体と少なくとも一つの活性製薬成分とを含む印刷されたコアであって、該粉体の粒子は、活性製薬成分によって互いに結合している、コア、および
c)該コアを囲む印刷されたシェルであって、該シェルは該粉体を含み、該粉体の粒子は、互いに結合している、シェル
を含み、
該単位が、水または体液と接触すると、活性製薬成分の拡散制御放出を提供し;
該コアが、該コア中の放出調節ポリマーに対する放出抑制ポリマーのコア比を有し、該シェルが、該シェル中の放出調節ポリマーに対する放出抑制ポリマーのシェル比を有し、そして、該コア比は該シェル比と同じであり;
該コアが、該シェル中に含まれるのと同じ放出抑制ポリマーおよび放出調節ポリマーを含む、剤形。 - 前記シェルが少なくとも100ミクロンの厚さを有するか、または、
前記シェルが800ミクロンの厚さを有する、請求項1に記載の剤形。 - 前記剤形が三次元印刷された剤形であり、該三次元印刷された剤形が、滴間距離、線間距離および粉体層厚さの寸法増分を有し、前記シェルが少なくとも滴間距離一つ、線間距離一つまたは粉体層厚さ一つ分の厚さを有する、請求項1に記載の剤形。
- 前記活性製薬成分が、塩酸プソイドエフェドリン、メトプロロール、マレイン酸d−クロルフェニラミン、マレイン酸クロルフェニラミン、塩酸ジフェンヒドラミン、カフェイン、マレイン酸d−ブロムフェニラミン、マレイン酸ブロムフェニラミン、アミノフィリンおよびクエン酸オルフェナドリンからなる群からの少なくとも一つの物質を含む、請求項1に記載の剤形。
- 前記コアが活性製薬成分を含む中心領域、および該中心領域を囲む緩衝領域を含み、該緩衝領域が少なくとも部分的に多孔性を有し、薬剤成分を含まない、請求項1に記載の剤形。
- 請求項1〜5のいずれか1項に記載の剤形を作製する方法であって、
ポリビニルアセテート80%、ポリビニルピロリドン19%、ラウリル硫酸ナトリウムおよびシリカ1%未満の混合物からなる群より選択される放出抑制ポリマーの粒子と、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、メチルセルロース、カルボキシルメチルセルロース、ポリビニルアルコール、ポリビニルピロリドン、アクリレート−メタクリレート共重合体、ポリエチレングリコール、キサンタンガム、ゲランガム、ローカストビーンガム、グアーガム、トラガントおよびアルギン酸ナトリウムからなる群より選択される放出調節ポリマーの粒子とを含む粉体の層を堆積させる工程;
選ばれた場所の粉体上に該放出抑制ポリマー用の溶媒を含むシェルバインダ液のパターンを堆積させる工程;
選ばれた場所の粉体上に活性製薬成分含有液のパターンを堆積させる工程;
所望の形状を製造するのに上記の工程を十分な回数反復する工程であって、該シェルバインダ液および該活性製薬成分含有液が層によって異なる工程、
該剤形を乾燥させる工程、および
該剤形から非結合粉体を分離する工程
を包含し、
該単位が、水または体液と接触すると、活性製薬成分の拡散制御放出を提供し;
該コアが、該コア中の放出調節ポリマーに対する放出抑制ポリマーのコア比を有し、該シェルが、該シェル中の放出調節ポリマーに対する放出抑制ポリマーのシェル比を有し、そして、該コア比は該シェル比と同じであり;
該コアが、該シェル中に含まれるのと同じ放出抑制ポリマーおよび放出調節ポリマーを含む、方法。 - 前記活性製薬成分含有液が塩酸プソイドエフェドリンおよび水である、請求項6に記載の方法。
- 前記活性製薬成分含有液が塩酸プソイドエフェドリン50重量%、ポリビニルピロリドン5重量%、界面活性剤0.01重量%および水である、請求項6に記載の方法。
- 前記活性製薬成分含有液が塩酸プソイドエフェドリン、メトプロロール、マレイン酸d−クロルフェニラミン、マレイン酸クロルフェニラミン、塩酸ジフェンヒドラミン、カフェイン、マレイン酸d−ブロムフェニラミン、マレイン酸ブロムフェニラミン、アミノフィリンおよびクエン酸オルフェナドリンからなる群からの少なくとも一つの物質を含む、請求項6に記載の方法。
- 前記活性製薬成分含有液を少なくとも部分的に乾いた状態まで乾燥させ、別の粉体層の作製前に粉体上に活性製薬成分含有液を再び堆積させる工程をさらに含む、請求項6に記載の方法。
- 前記剤形を圧縮する工程をさらに包含する、請求項6に記載の方法。
- 一つ以上の単位をカプセル中に封じ込める工程をさらに包含する、請求項6に記載の方法。
- a)前記シェル中の放出調節ポリマーのうち少なくともいくつかは、別個の粒子の形態で存在し、該粒子は、他の粒子と接触しているか;
b)前記シェル中の放出調節ポリマーのうち少なくともいくつかは、蛇行する連続的な経路の形態で存在し、該経路がより広い部分およびより狭い部分を含むか;または
c)前記シェル中の放出調節ポリマーのうち少なくともいくつかは、三次元的に相互接続した網目状の形態で存在する、
請求項1に記載の剤形。 - a)前記シェルが均一なシェル壁厚さを有するか;
b)前記シェルが変化するシェル壁厚さを有するか;
c)前記シェルが非薬剤物質を含むか;または
d)前記シェルが可塑剤をさらに含む、
請求項1に記載の剤形。 - a)前記可塑剤および放出抑制ポリマーが同じ溶媒に可溶性であるか;
b)前記可塑剤がエタノールに可溶性であるか;
c)前記放出抑制ポリマー中に分散したミセルの形で前記可塑剤がシェル中に存在するか;または
d)前記可塑剤がクエン酸トリエチル、トリアセチン、フタル酸ジエチル、クエン酸アセチルトリエチル、クエン酸アセチルトリブチル、カルボン酸エステル類およびリン酸エステル類からなる群より選択される、
請求項14に記載の剤形。 - a)前記放出抑制ポリマーが体液によって影響を受けないか;
b)前記放出抑制ポリマーが水に対して不浸透性であるか;
c)前記放出抑制ポリマーが疎水性であるか;
d)前記放出抑制ポリマーが、少なくとも一つの非水溶媒に可溶性である少なくとも一つの成分を有するか;
e)前記放出抑制ポリマーがエタノールに可溶性である少なくとも一つの成分を有するか;
f)前記放出抑制ポリマーは、活性製薬成分が熱損傷を被る温度よりも低いガラス転移点を可塑剤無添加状態で有する少なくとも一つの成分を有するか;または
g)前記放出抑制ポリマーは、活性製薬成分が熱損傷を被る温度よりも低いガラス転移点を可塑剤添加状態で有する少なくとも一つの成分を有する、
請求項1に記載の剤形。 - a)水と接触すると前記放出調節ポリマー中の水溶液の拡散が可能になるか;
b)水と接触すると前記放出調節ポリマーがゲルを形成することができるか;
c)水のpHによってほとんど影響されずに前記放出調節ポリマーが水を吸収するか;
d)前記放出調節ポリマーが親水性であるか;または
e)体液と接触すると前記放出調節ポリマーが少なくともわずかに分解または溶解する、
請求項1に記載の剤形。 - a)前記コアが非結合粉体粒子を含むか;
b)少なくとも前記コアの一部がコアバインダ物質をさらに含むか;
c)前記コア中において、前記放出調節ポリマー粒子が粒子内に吸収された活性製薬成分を含むか;
d)前記コアが、該コア中のボイド体積に等しい水の体積中に、体温で溶液中に含まれ得るより多くの活性薬剤成分を含むか;
e)前記コアが、該コア中のボイド体積に等しい水の体積中に、体温で溶液中に含まれ得る量以下の活性製薬成分を含むか;または
f)前記コアが、コア領域の立方ミリメートルあたり0.34ミリグラム以下の活性製薬成分を含む、
請求項1に記載の剤形。 - a)前記シェル中の放出調節ポリマーの少なくともいくつかは、平均粒径寸法を有する別個の粒子の形態で存在し、該シェルが該平均粒径寸法の少なくとも3倍の厚さを有するか;
b)前記放出抑制ポリマーおよび放出調節ポリマーが、前記剤形からの活性製薬成分の放出プロフィルの所望の時間的尺度によって決定される比率で前記シェル中に存在するか;
c)前記シェル中の放出調節ポリマーが、該シェル中の放出調節ポリマーおよび放出抑制ポリマーを合わせた合計の20体積%から60体積%の範囲にあるか;または
d)前記剤形が三次元印刷された剤形であり、該三次元印刷された剤形が、滴間距離、線間距離および粉体層厚さの寸法増分を有し、前記シェルが少なくとも滴間距離二つ、線間距離二つまたは粉体層厚さ二つ分の厚さを有する、
請求項1に記載の剤形。 - a)前記剤形からの活性製薬成分の放出において所望の遅延時間を提供するために緩衝領域の大きさが設定されるか;
b)初期の爆発的な活性製薬成分放出を防ぐために緩衝領域の大きさが設定されるか;
c)前記緩衝領域が少なくとも200マイクロメートルの厚さを有するか;または、
d)前記緩衝領域が前記シェル中に含まれるのと同じ放出調節ポリマーおよび同じ放出抑制ポリマーを含み、前記緩衝領域が該緩衝領域中の放出調節ポリマーに対する放出抑制ポリマーの緩衝領域比を有し、該シェルが該シェル中の放出調節ポリマーに対する放出抑制ポリマーのシェル比を有し、該緩衝領域比が該シェル比と同じである、
請求項5に記載の剤形。 - 活性製薬成分の拡散が制御された放出を提供する少なくとも一つの単位を有する拡散制御剤形であって、該単位が以下:
a)放出抑制ポリマーの粒子および放出調節ポリマーの粒子を含む粉体であって、該放出抑制ポリマーは、ポリビニルアセテート80%、ポリビニルピロリドン19%、ラウリル硫酸ナトリウムおよびシリカ1%未満の混合物からなる群より選択され;そして、該放出調節ポリマーは、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、メチルセルロース、カルボキシメチルセルロース、ポリビニルアルコール、ポリビニルピロリドン、アクリレート−メタクリレート共重合体、ポリエチレングリコール、キサンタンガム、ゲランガム、ローカストビーンガム、グアーガム、トラガントおよびアルギン酸ナトリウムからなる群より選択される、粉体;
b)該粉体と少なくとも一つの活性製薬成分とを含む印刷されたコアであって、該粉体の粒子は、活性製薬成分によって互いに結合している、コア、および
c)該コアを囲む印刷されたシェルであって、該シェルは該粉体を含み、該粉体の粒子は、互いに結合している、シェル
を含み、
該単位が、水または体液と接触すると、活性製薬成分の拡散制御放出を提供し;
該コアが、該コア中の放出調節ポリマーに対する放出抑制ポリマーのコア比を有し、該シェルが、該シェル中の放出調節ポリマーに対する放出抑制ポリマーのシェル比を有し、そして、該コア比は該シェル比と同じであり;
該コアが、該シェル中に含まれるのと同じ放出抑制ポリマーおよび放出調節ポリマーを含む、剤形。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US37844902P | 2002-05-06 | 2002-05-06 | |
| US60/378,449 | 2002-05-06 | ||
| US42509402P | 2002-11-08 | 2002-11-08 | |
| US60/425,094 | 2002-11-08 | ||
| PCT/US2003/014376 WO2003092633A2 (en) | 2002-05-06 | 2003-05-06 | Diffusion-controlled dosage form and method of fabrication including three dimensional printing |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2005524702A JP2005524702A (ja) | 2005-08-18 |
| JP2005524702A5 JP2005524702A5 (ja) | 2006-06-08 |
| JP5041663B2 true JP5041663B2 (ja) | 2012-10-03 |
Family
ID=29406838
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004500818A Expired - Lifetime JP5041663B2 (ja) | 2002-05-06 | 2003-05-06 | 拡散支配剤形および三次元印刷を含む作製方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US8088415B2 (ja) |
| EP (1) | EP1503741B1 (ja) |
| JP (1) | JP5041663B2 (ja) |
| AT (1) | ATE407665T1 (ja) |
| AU (1) | AU2003232078A1 (ja) |
| CA (1) | CA2483028C (ja) |
| DE (1) | DE60323482D1 (ja) |
| ES (1) | ES2316791T3 (ja) |
| WO (1) | WO2003092633A2 (ja) |
Families Citing this family (70)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5041663B2 (ja) | 2002-05-06 | 2012-10-03 | マサチューセッツ インスティテュート オブ テクノロジー | 拡散支配剤形および三次元印刷を含む作製方法 |
| WO2005072079A2 (en) * | 2003-09-26 | 2005-08-11 | Alza Coporation | Drug coating providing high drug loading and methods for providing the same |
| US8101244B2 (en) * | 2004-06-09 | 2012-01-24 | Smithkline Beecham Corporation | Apparatus and method for producing or processing a product or sample |
| US20060002594A1 (en) * | 2004-06-09 | 2006-01-05 | Clarke Allan J | Method for producing a pharmaceutical product |
| TWI428271B (zh) * | 2004-06-09 | 2014-03-01 | Smithkline Beecham Corp | 生產藥物之裝置及方法 |
| JPWO2006004069A1 (ja) * | 2004-07-01 | 2008-04-24 | 日本碍子株式会社 | 微小カプセルおよびその製造方法 |
| WO2008110337A2 (en) * | 2007-03-09 | 2008-09-18 | Synthon B.V. | Pharmaceutical composition of quetiapine fumarate |
| US8357395B2 (en) * | 2007-12-21 | 2013-01-22 | Mcneil-Ppc, Inc. | Manufacture of tablet |
| CN101716162B (zh) * | 2009-11-26 | 2012-11-14 | 扬州中宝制药有限公司 | 一种氨茶碱缓释胶囊及其制备方法 |
| US8251837B2 (en) * | 2010-08-11 | 2012-08-28 | Nike, Inc. | Floating golf ball |
| WO2012080833A2 (en) | 2010-12-13 | 2012-06-21 | Purdue Pharma L.P. | Controlled release dosage forms |
| US9381154B2 (en) * | 2011-06-09 | 2016-07-05 | Xerox Corporation | Direct inkjet fabrication of drug delivery devices |
| JP5860570B2 (ja) | 2012-09-05 | 2016-02-16 | アプレシア・ファーマスーティカルズ・カンパニー | 3次元プリントシステムおよび装置アセンブリ |
| US8888480B2 (en) | 2012-09-05 | 2014-11-18 | Aprecia Pharmaceuticals Company | Three-dimensional printing system and equipment assembly |
| US20140099351A1 (en) * | 2012-10-04 | 2014-04-10 | Axxia Pharmaceuticals, Llc | Process for making controlled release medical implant products |
| ES2688880T3 (es) | 2013-03-15 | 2018-11-07 | Aprecia Pharmaceuticals LLC | Forma de dosificación de dispersión rápida que contiene levetiracetam |
| US9339489B2 (en) | 2013-03-15 | 2016-05-17 | Aprecia Pharmaceuticals Company | Rapid disperse dosage form containing levetiracetam |
| JP6233996B2 (ja) | 2013-08-16 | 2017-11-22 | ザ エクスワン カンパニー | 3次元印刷される金属鋳造用鋳型及び同鋳型の製造方法 |
| WO2015057761A1 (en) | 2013-10-17 | 2015-04-23 | The Exone Company | Three-dimensional printed hot isostatic pressing containers and processes for making same |
| EP2875933B1 (de) * | 2013-11-25 | 2019-04-03 | MTU Aero Engines GmbH | Dokumentation generativer Herstellungsverfahren |
| CA2933867A1 (en) | 2013-12-16 | 2015-06-25 | Massachusetts Institute Of Technology | Micromolded or 3-d printed pulsatile release vaccine formulations |
| SG10201808645TA (en) | 2013-12-16 | 2018-11-29 | Massachusetts Inst Technology | Fortified Micronutrient Salt Formulations |
| WO2015100086A1 (en) | 2013-12-23 | 2015-07-02 | The Exone Company | Methods and systems for three-dimensional printing utilizing multiple binder fluids |
| EP3086922B1 (en) | 2013-12-23 | 2022-03-09 | The Exone Company | Method of three-dimensional printing using a multi-component build powder |
| IL232696B (en) | 2014-05-19 | 2018-08-30 | Technion Res & Dev Foundation | Compound and method for detecting molecules of interest |
| WO2015183796A1 (en) | 2014-05-29 | 2015-12-03 | The Exone Company | Process for making nickel-based superalloy articles by three-dimensional printing |
| EP3169499A2 (en) | 2014-07-17 | 2017-05-24 | The Exone Company | Methods and apparatuses for curing three-dimensional printed articles |
| CN107107463B (zh) * | 2014-09-08 | 2019-10-25 | 中央兰开夏大学 | 固体剂型生产 |
| US9844930B2 (en) | 2014-11-05 | 2017-12-19 | Xerox Corporation | 3D printing of digestible shells for medicaments |
| ES2832588T3 (es) | 2014-12-03 | 2021-06-10 | The Exone Co | Proceso para fabricar artículos de carbono densificados mediante impresión tridimensional |
| CN206120771U (zh) * | 2015-06-03 | 2017-04-26 | 南京三迭纪医药科技有限公司 | 药品剂型 |
| WO2016192680A1 (en) | 2015-06-03 | 2016-12-08 | Triastek, Inc. | Dosage forms and use thereof |
| US20180214383A1 (en) * | 2015-07-16 | 2018-08-02 | National University Of Singapore | Printing drug tablets with fully customizable release profiles for personalized medicine |
| RU2018109736A (ru) | 2015-08-21 | 2019-09-23 | АПРЕЦИЯ ФАРМАСЬЮТИКАЛЗ ЭлЭлСи | Система и аппаратный агрегат трехмерной печати |
| GB201519128D0 (en) * | 2015-10-29 | 2015-12-16 | Univ Central Lancashire | Solid forms and methods of preparing the same |
| HK1249728B (zh) | 2016-05-05 | 2020-01-17 | 南京三迭纪医药科技有限公司 | 控制释放的药物剂型 |
| US12303603B2 (en) * | 2016-06-20 | 2025-05-20 | Sciperio, Inc | Real-time compounding 3D printer |
| US10765658B2 (en) | 2016-06-22 | 2020-09-08 | Mastix LLC | Oral compositions delivering therapeutically effective amounts of cannabinoids |
| GB201612853D0 (en) | 2016-07-25 | 2016-09-07 | Univ Central Lancashire | Solid dosage form production |
| EP3321002A1 (en) * | 2016-11-15 | 2018-05-16 | Höganäs AB | Feedstock for an additive manufacturing method, additive manufacturing method using the same, and article obtained therefrom |
| DE102017200773A1 (de) | 2017-01-18 | 2018-07-19 | Eos Gmbh Electro Optical Systems | Verfahren zum Nachbehandeln und Nachbehandlungssytem |
| AU2018212273B2 (en) | 2017-01-26 | 2023-12-21 | Triastek, Inc. | Dosage forms of controlled release at specific gastrointestinal sites |
| US10369557B2 (en) | 2017-04-12 | 2019-08-06 | International Business Machines Corporation | Three-dimensional printed objects for chemical reaction control |
| WO2018199998A1 (en) * | 2017-04-28 | 2018-11-01 | Hewlett-Packard Development Company, L.P. | Producing diffusion-controlled release devices |
| WO2019025869A1 (en) * | 2017-07-31 | 2019-02-07 | Teva Pharmaceutical Industries Limited | GALENIC FORMS WITH CONTROLLED RELEASE MANUFACTURED IN ADDITIVE MANNER |
| US11642841B2 (en) | 2017-10-13 | 2023-05-09 | Ut-Battelle, Llc | Indirect additive manufacturing process |
| US10350822B1 (en) * | 2018-01-09 | 2019-07-16 | Triastek Inc. | Dosage forms with desired release profiles and methods of designing and making thereof |
| CN116270513A (zh) | 2018-01-09 | 2023-06-23 | 南京三迭纪医药科技有限公司 | 一种包含固定剂量adhd非兴奋剂和adhd兴奋剂的复方口服药物剂型 |
| US10744087B2 (en) | 2018-03-22 | 2020-08-18 | Incarda Therapeutics, Inc. | Method to slow ventricular rate |
| DE102018107585B3 (de) * | 2018-03-29 | 2019-03-28 | Universität Rostock | Vorrichtung zur Herstellung von 3D-gedruckten Wirkstofffreisetzungssystemen mit Wirkstoffdepots, sowie Verfahren zur Herstellung von 3D-gedruckten Wirkstofffreisetzungssystemen |
| WO2019199328A1 (en) * | 2018-04-13 | 2019-10-17 | Hewlett-Packard Development Company, L.P. | Three-dimensional printing |
| CN108939162B (zh) * | 2018-07-10 | 2021-11-19 | 上海理工大学 | 一种介孔生物玻璃/海藻酸钠-海藻酸钠分层骨组织工程支架的制备方法 |
| GB201813186D0 (en) | 2018-08-13 | 2018-09-26 | Univ Central Lancashire | Solid dosage from production |
| US20220040917A1 (en) * | 2018-09-14 | 2022-02-10 | Merck Patent Gmbh | Process for the preparation of a coated solid pharmaceutical dosage form |
| EP3866757B1 (en) | 2018-10-15 | 2022-08-10 | Aprecia Pharmaceuticals LLC | Method and system for forming a dosage form within a packaging |
| US11254617B2 (en) | 2019-01-09 | 2022-02-22 | Ut-Battelle, Llc | Indirect additive manufacturing process using amine-containing adhesive polymers |
| US12103229B2 (en) * | 2019-03-15 | 2024-10-01 | Ricoh Company, Ltd. | Jettable temporary binders to create removable support materials |
| US11724486B2 (en) | 2019-07-09 | 2023-08-15 | Kyndryl, Inc. | Printing customized medication based on current user data and medical records of the user |
| CA3150809A1 (en) * | 2019-08-14 | 2021-02-18 | Merck Patent Gmbh | Method for additive manufacture of a product, manufacturing device and solid pharmaceutical dosage form |
| GB201913972D0 (en) | 2019-09-27 | 2019-11-13 | Univ Ulster | Pharmaceutical Delivery Device and method of manufacture |
| ES2828509B2 (es) | 2019-11-26 | 2022-03-09 | Fund Idonial | Composicion para la impresion 3d de farmacos semisolidos |
| EP3871859A1 (en) * | 2020-02-26 | 2021-09-01 | Hewlett-Packard Development Company, L.P. | Three-dimensional printing |
| US20230009115A1 (en) * | 2020-03-02 | 2023-01-12 | Craft Health Pte Ltd | Oral dosage forms for extended drug release |
| JP7776145B2 (ja) | 2020-05-13 | 2025-11-26 | マサチューセッツ インスティテュート オブ テクノロジー | ポリマーマイクロデバイスの組成物およびがん免疫療法におけるその使用 |
| AU2021296908A1 (en) | 2020-06-26 | 2023-02-16 | Aprecia Pharmaceuticals LLC | Rapidly-orodispersible tablets having an interior cavity |
| CN116507321A (zh) | 2020-10-30 | 2023-07-28 | 南京三迭纪医药科技有限公司 | 胃滞留药物剂型 |
| US12251208B2 (en) | 2020-11-30 | 2025-03-18 | International Business Machines Corporation | Time controlled medication |
| KR102723494B1 (ko) * | 2020-12-24 | 2024-10-31 | 동아제약 주식회사 | 적층 방식으로 제조된 방출 조절용 약제학적 조성물 |
| CN112940690B (zh) * | 2021-02-05 | 2021-11-02 | 中国科学院苏州纳米技术与纳米仿生研究所南昌研究院 | 一种具有豆荚结构的相变储能材料及其制备方法与应用 |
| EP4618958A1 (en) * | 2022-11-18 | 2025-09-24 | Aprecia Pharmaceuticals LLC | Functionally-dividable orodispersive dosage form |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US948297A (en) * | 1909-07-24 | 1910-02-01 | John A Stone | Corn-husker. |
| US986148A (en) * | 1910-05-09 | 1911-03-07 | Hoechst Ag | Derivative of oxyarylarsinic acids and process of making same. |
| ZA822995B (en) * | 1981-05-21 | 1983-12-28 | Wyeth John & Brother Ltd | Slow release pharmaceutical composition |
| WO1985003436A1 (en) * | 1984-02-10 | 1985-08-15 | A/S Alfred Benzon | Diffusion coated multiple-units dosage form |
| US4810502A (en) * | 1987-02-27 | 1989-03-07 | Alza Corporation | Pseudoephedrine brompheniramine therapy |
| US5133974A (en) * | 1989-05-05 | 1992-07-28 | Kv Pharmaceutical Company | Extended release pharmaceutical formulations |
| US5204055A (en) | 1989-12-08 | 1993-04-20 | Massachusetts Institute Of Technology | Three-dimensional printing techniques |
| NZ242065A (en) * | 1991-03-26 | 1996-06-25 | Csl Ltd | Delayed release implant having a degradable or rupturable polymeric coating |
| US5775402A (en) | 1995-10-31 | 1998-07-07 | Massachusetts Institute Of Technology | Enhancement of thermal properties of tooling made by solid free form fabrication techniques |
| US5490882A (en) | 1992-11-30 | 1996-02-13 | Massachusetts Institute Of Technology | Process for removing loose powder particles from interior passages of a body |
| US6280771B1 (en) | 1997-02-20 | 2001-08-28 | Therics, Inc. | Dosage forms exhibiting multi-phasic release kinetics and methods of manufacture thereof |
| US5490962A (en) | 1993-10-18 | 1996-02-13 | Massachusetts Institute Of Technology | Preparation of medical devices by solid free-form fabrication methods |
| AU4219497A (en) * | 1996-09-13 | 1998-04-02 | Shionogi & Co., Ltd. | Sustained-release preparation utilizing thermal change and process for the production thereof |
| AU736912B2 (en) | 1997-02-20 | 2001-08-02 | Therics, Inc. | Dosage form exhibiting rapid disperse properties, methods of use and process for the manufacture of same |
| WO1998043762A2 (en) | 1997-03-31 | 1998-10-08 | Therics, Inc. | Method for dispensing of powders |
| US6213168B1 (en) | 1997-03-31 | 2001-04-10 | Therics, Inc. | Apparatus and method for dispensing of powders |
| US6547994B1 (en) * | 1998-11-13 | 2003-04-15 | Therics, Inc. | Rapid prototyping and manufacturing process |
| US6485746B1 (en) * | 2000-08-25 | 2002-11-26 | Neurocrine Biosciences, Inc. | Controlled-release sedative-hypnotic compositions and methods related thereto |
| DE19961897A1 (de) * | 1999-12-20 | 2001-06-28 | Basf Ag | Verwendung eines Filmüberzuges als geschmacksmaskierendes Coating von pharmazeutischen Darreichungsformen |
| DE10015479A1 (de) * | 2000-03-29 | 2001-10-11 | Basf Ag | Feste orale Darreichungsformen mit retardierter Wirkstofffreisetzung und hoher mechanischer Stabilität |
| AU2001263506A1 (en) * | 2000-05-18 | 2001-11-26 | Massachusetts Institute Of Technology | Encapsulating a toxic core within a non-toxic region in an oral dosage form |
| US20020084290A1 (en) * | 2000-11-10 | 2002-07-04 | Therics, Inc. | Method and apparatus for dispensing small volume of liquid, such as with a weting-resistant nozzle |
| JP5041663B2 (ja) | 2002-05-06 | 2012-10-03 | マサチューセッツ インスティテュート オブ テクノロジー | 拡散支配剤形および三次元印刷を含む作製方法 |
| US20050015728A1 (en) * | 2003-07-17 | 2005-01-20 | International Business Machines Corporation | Method, system, and program product for customizing a user interface |
-
2003
- 2003-05-06 JP JP2004500818A patent/JP5041663B2/ja not_active Expired - Lifetime
- 2003-05-06 AT AT03747680T patent/ATE407665T1/de not_active IP Right Cessation
- 2003-05-06 AU AU2003232078A patent/AU2003232078A1/en not_active Abandoned
- 2003-05-06 WO PCT/US2003/014376 patent/WO2003092633A2/en not_active Ceased
- 2003-05-06 DE DE60323482T patent/DE60323482D1/de not_active Expired - Lifetime
- 2003-05-06 ES ES03747680T patent/ES2316791T3/es not_active Expired - Lifetime
- 2003-05-06 CA CA2483028A patent/CA2483028C/en not_active Expired - Lifetime
- 2003-05-06 US US10/431,353 patent/US8088415B2/en active Active
- 2003-05-06 EP EP03747680A patent/EP1503741B1/en not_active Expired - Lifetime
-
2011
- 2011-11-29 US US13/306,393 patent/US8465777B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| ATE407665T1 (de) | 2008-09-15 |
| CA2483028C (en) | 2011-04-05 |
| US20120177696A1 (en) | 2012-07-12 |
| WO2003092633A3 (en) | 2004-04-08 |
| ES2316791T3 (es) | 2009-04-16 |
| JP2005524702A (ja) | 2005-08-18 |
| US8088415B2 (en) | 2012-01-03 |
| US8465777B2 (en) | 2013-06-18 |
| EP1503741B1 (en) | 2008-09-10 |
| DE60323482D1 (de) | 2008-10-23 |
| CA2483028A1 (en) | 2003-11-13 |
| EP1503741A2 (en) | 2005-02-09 |
| AU2003232078A1 (en) | 2003-11-17 |
| US20040005360A1 (en) | 2004-01-08 |
| WO2003092633A2 (en) | 2003-11-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5041663B2 (ja) | 拡散支配剤形および三次元印刷を含む作製方法 | |
| JP4533531B2 (ja) | 制御放出組成物 | |
| AU2001297011B2 (en) | Methylphenidate modified release formulations | |
| JP6457458B2 (ja) | 時限パルス放出システム | |
| JP2637981B2 (ja) | 吸収制御薬剤組成物 | |
| AU2002320360B2 (en) | Drug delivery system for zero order, zero order-biphasic, ascending or descending drug delivery | |
| EP1267842B1 (en) | Method for producing a controlled-release tablet using a pore forming agent in the coating | |
| HRP960554A2 (en) | Pharmaceutical formulations | |
| JPH0269414A (ja) | 持続的制御放出パターンを有する生物活性物質コーティング剤 | |
| KR20040045034A (ko) | 변형된 방출형 제형 | |
| AU2001297011A1 (en) | Methylphenidate modified release formulations | |
| EP2910243A1 (en) | Pharmaceutic osmotic pump preparation | |
| CN1056057C (zh) | 口服延缓释放的曲美他嗪药物组合物 | |
| KR20110025654A (ko) | 제어 방출 골격근 이완제 투약 형태의 제조 | |
| US7858119B1 (en) | Extended release pharmaceuticals | |
| JPH01156929A (ja) | 腸溶製剤の安定化 | |
| EP0365947A1 (en) | Novel dosage form | |
| WO2007117110A2 (en) | Sustained-release pellets containing tamsulosin hydrochloride and processes for preparing the same | |
| JP2005533084A (ja) | 液体の有効成分の製剤を含んでなりかつ膨張可能な浸透圧組成物によりその放出を制御する経口の投薬形態 | |
| JPH06190267A (ja) | マイクロカプセル | |
| KR20060016382A (ko) | 록사티딘 아세테이트 다층 코팅과립을 이용한약물전달시스템 | |
| Ramadan | Using Ethylcellulose for the Development of 3D Printed Single Layer and Multilayer Controlled-Release Tablets | |
| JP2007500558A (ja) | 液状活性製剤の制御型放出のための透過抵抗性浸透エンジンおよび投薬剤形物 | |
| HK1078002A (en) | A controlled-release preparation having specific pore forming agents in the coating | |
| IE62640B1 (en) | Novel dosage form |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060417 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060417 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091112 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20091218 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20091228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100512 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110322 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110621 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110628 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110721 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110728 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110819 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110826 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110921 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120210 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120528 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20120618 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120705 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120710 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5041663 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150720 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |