JP4095685B2 - トルイレンジイソシアネートの製造方法、トルイレンジアミンと水の特定の混合物、及びトルイレンジイソシアネートを製造するための混合物の使用 - Google Patents
トルイレンジイソシアネートの製造方法、トルイレンジアミンと水の特定の混合物、及びトルイレンジイソシアネートを製造するための混合物の使用 Download PDFInfo
- Publication number
- JP4095685B2 JP4095685B2 JP21690096A JP21690096A JP4095685B2 JP 4095685 B2 JP4095685 B2 JP 4095685B2 JP 21690096 A JP21690096 A JP 21690096A JP 21690096 A JP21690096 A JP 21690096A JP 4095685 B2 JP4095685 B2 JP 4095685B2
- Authority
- JP
- Japan
- Prior art keywords
- water
- tda
- toluylenediamine
- mixture
- produce
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 0 CCC*1(C)C(C)(C2)C3*2C(C)C1C3 Chemical compound CCC*1(C)C(C)(C2)C3*2C(C)C1C3 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/43—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton
- C07C211/44—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to only one six-membered aromatic ring
- C07C211/49—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to only one six-membered aromatic ring having at least two amino groups bound to the carbon skeleton
- C07C211/50—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to only one six-membered aromatic ring having at least two amino groups bound to the carbon skeleton with at least two amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C209/00—Preparation of compounds containing amino groups bound to a carbon skeleton
- C07C209/30—Preparation of compounds containing amino groups bound to a carbon skeleton by reduction of nitrogen-to-oxygen or nitrogen-to-nitrogen bonds
- C07C209/32—Preparation of compounds containing amino groups bound to a carbon skeleton by reduction of nitrogen-to-oxygen or nitrogen-to-nitrogen bonds by reduction of nitro groups
- C07C209/36—Preparation of compounds containing amino groups bound to a carbon skeleton by reduction of nitrogen-to-oxygen or nitrogen-to-nitrogen bonds by reduction of nitro groups by reduction of nitro groups bound to carbon atoms of six-membered aromatic rings in presence of hydrogen-containing gases and a catalyst
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C209/00—Preparation of compounds containing amino groups bound to a carbon skeleton
- C07C209/82—Purification; Separation; Stabilisation; Use of additives
- C07C209/84—Purification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C263/00—Preparation of derivatives of isocyanic acid
- C07C263/10—Preparation of derivatives of isocyanic acid by reaction of amines with carbonyl halides, e.g. with phosgene
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
【発明の属する技術分野】
本発明は、トルイレンジイソシアネート(TDI)の製造方法に関する。この方法は、トルエンを硝酸と反応させてジニトロトルエン(DNT)を生成させること、生成したジニトロトルエン(DNT)を水素化させてトルイレンジアミン(TDA)と反応水を生成させること、そしてトルイレンジアミンとホスゲンとを反応させてTDIを生成させることから成る。しかしながら、トルイレンジアミン(TDA)を生成させるための方法ステップは、水素化ステップからのトルイレンジアミン(TDA)と水の粗製溶液を蒸留して、約1〜40重量%の水を含むトルイレンジアミンと水との中間混合物を生成させる第一製造プラントにおいて実施される。この中間混合物を、第一プラントからある程度の距離の位置にある第二製造プラントに輸送する。第二製造プラントにおいては、トルイレンジアミン(TDA)と水の中間混合物の蒸留を完了させて乾いたトルイレンジアミンを生成させ、次にこれをホスゲン化させてトルイレンジイソシアネート(TDI)を生成させる。
本発明はまた、トルイレンジアミンと水の特定の混合物に関し、そしてトルイレンジアミンと水の混合物が得られ又は製造された場所とは異なる場所においてトルイレンジイソシアネートを製造するためのこれらの混合物の使用に関する。
【0002】
【従来の技術】
通常は、TDIの大規模製造は、トルエンを硝酸と反応させてDNTと水を生成させ、このDNTを水素と反応させてTDAと水を生成させ、引き続いて処理され乾燥されたTDAをホスゲンと反応させてTDIと塩化水素を生成させる方法段階を使用して実施されるが、ここではこれらの方法の各々の段階のための製造装置は一つの製造プラント中でお互いに連結されている。
しかしながら、これらの方法ステップをお互いからある程度の距離の位置にある二つの製造プラントにおいて実施し、そこではTDAの製造までの方法段階を一つの製造プラントで実施しそしてTDAとホスゲンとの反応及び市販可能なTDI最終生成物を与えるための処理を第二製造プラント中で実施することが有利である可能性がある。このタイプの手順は、例えば適切な原材料及びインフラストラクチャーが一つの地域において容易に利用可能であるが、最終生成物の地方での製造のための必要性を有する大きな購入マーケットがかなり距離が離れた位置にあるもう一つの地域において与えられる場合には、経済的に魅力的である可能性がある。更にまた、一つの中央の統合されたアミンプラントからある程度距離が離れた位置にある種々の場所に、種々の小さなホスゲン装置を備えるえることもまた、経済的に有利である可能性がある。
【0003】
しかしながら、この製造及び/又は操作の態様は、中間生成物即ちTDAが高い融点を有するという事実によってかなり一層困難になる。これは、TDAを固体の形でか又は100℃より高い温度での熱い溶融液としてかのどちらかでしか輸送することができないことを意味する。固体の形でTDAを輸送する時には、その最後のホスゲン化反応における使用のための輸送の後で製品(生成物)を再び溶融させることができるために、TDAをまず高価な処理段階にかけなければならない、例えばフレークを製造しなければならない。他方、熱い溶融液としての海外輸送は、加熱可能なタンク容器の使用及び船上での適切な加熱設備例えば加熱スチームのための若しくは電力のための接続、又は、ばら積み商品としての輸送の場合には、それらの船倉を105〜110℃の温度に加熱することができるタンカー船の使用を必要とする。加熱可能なタンク容器の使用を必要とする第一の場合は、大量のTDAの輸送のためには非常に高価かつ不経済である。第二の場合には、加熱可能な船倉を有する船の中のばら積み商品としての輸送もまた、非常に高価でありそしてそれ故不経済であろう。何故ならば、通常のタンカー船及びドックにおける積み換え装置は、高温での使用を意図していないからである。仮にこの方法をとるとすれば、まず、タンカー船及び積み換え装置(設備)をこの目的のために適応させるようにするが必要であり、そしてこれは大きな出費である。最後に、必要に応じて地上での高価で特別な廃物焼却手順によって、船の船倉からの残り物を処分する問題を克服しなければならない。
【0004】
米国特許第5,449,832号は、トルエンジアミン(TDA)を貯蔵しそして輸送するための一つの方法を述べている。この方法は、トルエンをジニトロ化させてジニトロトルエンの2,4−及び2,6−異性体を生成させること、ジニトロトルエンを水素化させてトルエンジアミンの2,4−及び2,6−異性体を生成させること、並びにトルエンジアミンを蒸留して本質的に無水の2,4−及び2,6−トルエンジアミンの生成物を生成させること、次にこれを冷却しそして貯蔵及び/又は出荷のために移送することから成る。トルエンジアミン(TDA)を貯蔵び/又は出荷するのに先立って、約5〜15%、好ましくは7〜10重量%(無水TDAの重量を基にして)の量で水を添加することによって、TDAの融点を低下させ、そして生成するTDA−水混合物の温度を、TDA−水混合物の最後の温度が沸点にある又はそれ未満であるように制御する。長期間の貯蔵及び/又は輸送のために適切であるのはこの混合物である。無水TDAに添加される水は、熱い脱ミネラル水、脱イオン水、又は減圧下での蒸留水である。無水TDAへの水の添加からの最後の温度レベルは、TDA−水混合物を長い時間の期間の間液体状態に維持し、そしてかくして、混合物の貯蔵及び/又は輸送を可能にするのに十分な内部熱を供給する。
【0005】
【発明が解決しようとする課題】
本発明は、固体の析出無しで95℃未満の温度で液体の形で貯蔵又は輸送することができるTDA調合物を提供する。
別の目的は、トルエンをニトロ化させてDNTを生成させ、DNTを水素化させてTDA及び水を生成させ、そしてタンカー容器中の又はばら積み商品としてのTDAを第一製造プラントから、ある程度離れた距離の位置にある第二製造プラントへ、上で述べた欠点無しで、輸送することが可能であるようなやり方で、乾燥されたTDAをホスゲンと反応させてTDIを生成させることによって、TDIの製造方法を改善(改質)することである。
【0006】
【課題を解決するための手段】
この目的は本発明の混合物及び方法によって達成される。
1〜40%、好ましくは2〜10%の水含量を有するTDAと水の特定の混合物は、明確に融点を押下げ、そしてそれ故純粋なTDAよりも取り扱うのがかなり容易でありそしてタンカー船中のばら積み商品として長い距離にわたって輸送するのが一層コスト効果的であることが、ここに驚くべきことに示された。化学品を輸送するために設計されたタンカー船は、一般に、輸送の間に約65〜70℃の範囲の温度に輸送されている商品を維持し、そしてまた類似の温度範囲にわたって化学品を荷下ろしすることができる。かくして、本発明による方法の一つの目的は、それらの溶融特徴が通常のタンカー船中のばら積み商品としてのそれらの輸送を可能にするTDA/水混合物を得ることである。
本発明による混合物は、原理的には、純粋なTDA、即ち約80重量%の2,4−TDA及び約20重量%の2,6−TDAを含む一般的な工業的異性体混合物を水と混合させることによって製造することができる。しかしながら、これらの混合物は、TDA及び水を含む水素化生成物の蒸留ステップの間に、工業的方法を、一般的方法におけるような無水TDAの代わりに、約1〜40重量%の水含量を有するTDAと水の中間混合物が得られるような適切な点で中断するならば一層容易に入手できる。
【0007】
かくして、本発明は、トルエンを硝酸と反応させてジニトロトルエンを生成させること、前記ジニトロトルエンを水素化させてトルイレンジアミンと反応水の粗製溶液を生成させること、並びにトルイレンジアミンと反応水の前記粗製溶液を蒸留して、約1〜40%、好ましくは約2〜10重量%の水を含むトルイレンジアミンと水の中間混合物を生成させること、次にトルイレンジアミンと水のこの中間混合物を第一製造プラントから第二製造プラントに輸送すること、引き続いて、トルイレンジアミンと水の前記中間混合物を第二製造プラントにおいて完全に蒸留して乾いたトルイレンジアミンを生成させること、並びに前記の乾いたトルイレンジアミンをホスゲン化させてトルイレンジイソシアネートを生成させることから成るトルイレンジイソシアネートの製造方法を提供する。
もう一つの実施態様においては、ジニトロトルエンを溶媒又は希釈剤の存在下水素化させる。この溶媒又は希釈剤は、トルイレンジアミンと反応水の粗製溶液を蒸留して、貯蔵及び/又は輸送のために適切であるトルイレンジアミンと水の中間混合物を生成させるのに先立って、付加的なステップにおいてトルイレンジアミンと反応水の粗製溶液から、部分的に又は完全に、除去又は分離することができる。
もう一つの実施態様においては、乾燥されたジアミンを、第二製造プラントにおいて完全に蒸留した後で、それ自体は既知のやり方でトルイレンジイソシアネートを生成させるためのホスゲン化に先立って更なる処理段階にかけることができる。
【0008】
本発明によれば、
- トルイレンジアミンが、2,4−トルイレンジアミン、2,6−トルイレンジアミン又はこれらの異性体の任意の混合物を、そして、必要に応じて任意の量の2,3−トルイレンジアミン、3,4−トルイレンジアミン又はこれらの混合物と共に含むこと、
並びに
- ジニトロトルエンの水素化の間には溶媒又は希釈剤が存在しないこと
が好ましい。
本発明はまた、トルイレンジアミンと水の混合物であって、これらの混合物の凝固点が高々95℃である混合物に関する。
本発明によれば、
- 2,4−及び/又は2,6−トルイレンジアミン並びに水から成り、
そして
- 100重量部のトルイレンジアミンに対して1〜40重量部の水、更に好ましくは2〜10重量部の水を含み、
約60〜95℃、更に好ましくは65〜70℃の範囲の凝固点を有する混合物が好ましい。
【0009】
上で与えられた水含量に加えて、本発明による混合物は、必要に応じて、約10重量%の最大濃度の有機の均一に溶かされた溶媒又は希釈剤を含むことができる。この場合の適切な溶媒又は希釈剤は、特に、低級アルコール、好ましくはメタノール、エタノール、n−プロパノール及びイソプロパノール、低級ケトン、詳細にはアセトン、並びにジオール、詳細にはエチレングリコール、又はまたトルエンである。
本発明はまた、水を先行して除去して、ホスゲン化によってトルイレンジイソシアネートを製造するためのTDAと水の中間混合物の使用を提供する。
トルイレンジイソシアネートを製造するための意図の中間混合物を、混合物の製造の場所から空間的に離れている(displaced)製造プラントに輸送することが好ましい。
【0010】
ジニトロトルエンからのTDAの工業的製造は、一般には、懸濁され粉末化された触媒例えば活性炭上のパラジウム又はラネーニッケル上で、そして必要に応じて希釈剤又は溶媒の存在下で、高圧下で水素によってDNT中の窒素基を還元させることによる連続的方法を使用して達成される。本発明における対応するニトロ化合物、DNTの接触水素化によって芳香族アミン例えばTDAを製造するための多数の方法が既に開示されている。これらの方法は、例えば、ドイツ特許出願公開明細書第1,542,544号、第1,947,851号、第2,016,644号、第2,135,154号、第2,214,056号、第2,456,308号、ベルギー特許発明明細書第631,964号、第661,047号、第661,946号、フランス特許発明明細書第1,359,438号、英国特許発明明細書第768,111号、欧州特許出願公開明細書第0,124,010号中に述べられている。
【0011】
適切な溶媒又は希釈剤は、メタノール、エタノール又はプロパノールのような化合物を含む(ウルマン、第4版、1977、13巻、14頁)。これらの溶媒又は希釈剤の存在は、(1モルのニトロ基あたり約418kJの)高い反応熱を大量の反応物質中に分配し、そしてその除去を容易にし、並びに溶解度を改善することによって懸濁液中のジニトロトルエンの利用性を増加させるのを助ける。これらの望ましい特性とは逆に、溶媒の存在には、それらの分離のための付加的な蒸留コストが伴う。それ故、この段階の安全及び反応要件を同時に観察しながら、溶媒の使用を最小にすることは、最適化目標に相当する。従って、溶媒の使用無しのTDAの連続的製造は、その開示が引用によって本明細書中に組み込まれる米国特許第5,3,87,396号(ドイツ特許出願公開明細書第3,635,217号に対応すると信じられる)に従った反応器を使用することが可能であるので、本発明による方法のために好ましい。これらの反応器は、それらが蒸発冷却による、即ち例えば冷却剤側での水蒸気の生成による、熱の特に効果的な除去を可能にするようなやり方で作られる。かくしてジニトロトルエンの場合には、これらの反応器は、さもなければ通常であるよりも高い温度で、即ち100〜150℃の代わりに180〜200℃で、そして溶媒の使用無しでこの反応を実施することを可能にする。
【0012】
ジニトロトルエンと水素との間の反応の間に得られる粗製溶液は、約60重量%のTDAと約40重量%の反応水及び、随時、使用された希釈剤又は溶媒から成る。この粗製溶液はまた、例えば濾過又は沈降による固体触媒の単離の後で、この方法の副生成物を含む。これらの副生成物は主に2,3−TDA及び3,4−TDAであり、そして粗製溶液の約3〜5重量%を占めるであろう。高分子量を有するものを含むその他の副生成物もまた存在する可能性がある。ホスゲン化のために使用することができる適切な出発生成物を製造するために、水及び、必要に応じて、存在し得る希釈剤又は溶媒を、それ自体は既知のやり方で例えば蒸留によって完全に除去しなければならない。加えて、TDIの可能な最高収率を得るためには、蒸留によって副生成物を除去することもまた好都合であり、そうすると、一般的な純度の商業的に入手できるTDAが得られる。一般的な純粋なTDAは、約80重量%の2,4−トルイレンジアミン及び約20重量%の2,6−トルイレンジアミンから成る。
【0013】
ジニトロトルエンの水素化の間に製造される反応水を除去する前に、存在し得る溶媒を、トルイレンジアミン(TDA)及び反応水の、粗製の触媒を含まない溶液からまず除去しなければならない。溶媒の除去は、一般に、連続的に運転される蒸留塔中での蒸留によって既知のやり方で行い、その際には、溶媒を追加の精製無しで本発明の方法中に直接再使用することができるような純度の状態で、プロセス管理によって、回収する。TDAと反応水の粗製溶液から、蒸留によって生成水の幾らか(又はすべて)と一緒に溶媒を分離し、そして次に後のプロセス段階において溶媒と水の混合物から必要な程度の純度を有する溶媒を回収することもまた可能である。溶媒を添加すること無く反応を実施する時には、溶媒単離は明らかに必要ではない。
【0014】
トルイレンジイソシアネート(TDI)の製造のための慣用的な工業的方法においては、TDAと水の粗製溶液の乾燥手順が次に続く。この手順は、TDAと反応水の粗製溶液中に存在するすべての反応水を完全に除去する。水は、一般に、粗製溶液の約40重量%を占める。原理的には、これは、真空下で粗製溶液を加熱しそして生成される蒸気を取り出すことによって、水を単に蒸発させることによって達成することができる。しかしながら、この簡単な手順によって得られる単離水は、そのままの廃物処理のために必要とされる純度では製造されず、多かれ少なかれ常にTDAによって汚染される。従って、適切な蒸留装置中での蒸留によって反応水を除去することがより良い。この場合には、例えば、TDAと反応水の粗製溶液を塔底で200℃よりも高い温度に加熱し、かくして塔頂で純粋な形の水を製造する。慣用的な方法において使用されるこれらの蒸留塔は、大気圧で又は少し過剰の圧力で運転され、約20〜30段の泡鐘(bubble)棚板(即ち実際の棚板)を有し、そしてTDAが塔底から取り出され、そして最後の微量の水が30〜50ミリバールへ減圧することにより除去される。
【0015】
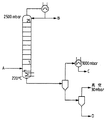
図1は、TDAからの水の除去のための伝統的な方法(即ち、先行技術の方法)の略図である。図1において:
Aは、約60重量%のTDAを含む、TDAと水の粗製溶液を表し、
Bは、水取り出しを表し、
Cは、Aに返されるTDA/水混合物を表し、
Dは、TDA(乾いた)取り出しを表し、
そして
25は、蒸留塔中の泡鐘棚板の数を表す。
【0016】
しかしながら、本発明は、上で述べたTDAを製造するための従来の過程とは異なる。更に詳細には、本発明は、TDAと反応水の粗製溶液から水を分離するステップを二つのステップで実施するということで従来の方法とは異なる。事実、約40重量%の水を含む、TDAと反応水の粗製溶液は、約45℃の非常に低下した凝固点を有する。それ故、TDAと反応水のこの粗製溶液は、タンカー船中のばら積み輸送のために適切であろう。本発明において使用する時には、凝固点は、液体状態から固体状態への転移が起こる温度であると理解される。しかしながら、TDAと反応水の粗製溶液を輸送することは、高価な積み荷スペースが水の輸送のために大幅に浪費されるであろうことを意味するであろう。
それ故、本発明による方法においては、TDAと反応水の粗製溶液からの反応水の部分的除去を実施して、TDAと水の中間混合物を生成させるが、ここにおいては、中間混合物中の水の残留濃度を、生成する中間混合物の凝固点がタンカー船中で通常利用される制御温度範囲のものよりも高くないように調節する。
図3中に示すようなTDAと水の混合物の凝固点の変化を、混合物を貯蔵及び/又は輸送のために適切にせしめるために、これらの中間混合物中の水の適切な濃度を決定するための基準として使用する。図3は、TDAと水の混合物の凝固点を図示する。更に詳細には、このTDAは80重量%の2,4−TDA及び20重量%の2,6−TDAから成る。x軸は重量%での水含量を表し、そしてy軸は℃での凝固点を表す。この図(グラフ)によれば、例えば、65℃の凝固点は7重量%の水含量に対応する。
【0017】
TDAと反応水の粗製溶液からの水の部分的な除去のために使用される方法は、上で述べたような従来の方法においてTDAを乾燥させるための装置よりもずっと簡単である。水の部分的な除去は簡単な大気圧蒸留による。本発明による方法においては、わずかに5段の泡鐘棚板(即ち実際の棚板)しか持たない蒸留塔が、TDAを含まない塔頂生成物を製造するために適切である以上である。主要な割合の水をこのやり方で既に除去してしまうので、乾いたTDAを生成させるための最後の目的地において必要とされる真空蒸留装置、即ち第二製造プラントは、わずかに約10段の棚板(即ち実際の棚板)を有することが必要とされるに過ぎない。かくして、本発明によって必要とされる真空蒸留装置は、TDAを製造するための従来の工業的方法において必要とされる従来の真空蒸留装置よりも小さい。従って、本発明の蒸留装置もまた一層経済的に効率的である。
乾いたTDAを生成させるための、本発明のために適切な蒸留塔は、TDA/水の系に関する相平衡図を考慮に入れることによって、それ自体は既知のやり方で設計される(図4を参照せよ、太線:1013ミリバール、細線:100ミリバール)。図4においては、x軸は液相中の水のモル濃度を表し、そしてy軸は蒸気相中の水のモル濃度を表す。
【0018】
本発明による方法の別の利点は、船のタンクからの残渣の問題の無い廃物処分である。船を水によってすすぎ出すことができそしてTDAと水の中間混合物の蒸留を各々の最終目的地で完了させるので、TDA含有のすすぎ水の処理もまた最後の目的地において可能である。従って、高価な特別な廃物焼却手順は必要ではない。
最終的な(又は最後の)目的地におけるTDIを与える乾燥TDAの更なる処理はまた、当業者には既知の従来の方法を使用して実施する。TDAの2,3−及び3,4−異性体並びにその他の副生成物は、必要に応じて、まずTDAの異性体混合物から除去することができる。これらの異性体及びその他の副生成物の除去のための適切な方法は、例えば、それらの開示が引用によって本明細書中に組み込まれる米国特許第3,420,752号及び第3,414,619号中に述べられている。TDAのホスゲン化によってTDIを製造する全体の方法の最後のステップは既知のやり方で進行する。例えば、ベッカー/ヴラウン、プラスチックハンドブック、第2版、1983、7巻、63頁以降、カール−ハンザー出版社 ミュンヘン、及びそこで引用された文献を参照せよ。
【0019】
従って、本発明は、トルエンをニトロ化させてジニトロトルエン(DNT)を生成させること、必要に応じて溶媒又は希釈剤の存在下で、しかしながら好ましくはこれらの使用無しでDNTを水素化させてトルイレンジアミン(TDA)と反応水の粗製溶液を生成させること、必要に応じて、完全に又は部分的に溶媒を除去すること、並びにTDAと反応水の粗製溶液を蒸留してTDAと水の中間混合物を生成させるが、この際TDAと水の中間混合物が約1〜40重量%の水を含むような点で蒸留を停止させることによってTDIを製造するための方法を提供する。次に、この中間混合物を第一製造設備から第二製造設備に輸送する。第二製造設備においては、TDAと水の中間混合物を更に蒸留して乾いたTDAを生成させる。あり得る副生成物例えば2,3−TDA及び/又は3,4−TDAもまた、この第二蒸留ステップ又はもう一つの処理ステップのどちらかによって除去して、商業的品質の乾いたTDAを生成させることができる。次に、乾いたTDAをホスゲン化させてTDIを生成させる。
【0020】
本発明による方法のための適切な化合物は、2,4−トルイレンジアミン及びトルイレンジアミンの種々の異性体混合物である。商業的品質のTDAは、典型的には、2,4−TDA対2,6−TDAの異性体比が約65:35又は80:20である2,4−異性体及び2,6−異性体の混合物である。一つの製造プラントから第二製造プラントに輸送することができるTDAと水の適切な中間混合物は、2,4−TDA及び/又は2,6−TDAと種々の濃度のTDAの2,3−及び3,4−異性体との異性体混合物を含む。これらの中間混合物もまた反応の副生成物を含む。典型的には、2,3−及び/又は3,4−異性体は、約0.05〜5.0重量%の量でこれらの中間混合物中に存在する。TDAと水のこれらの中間混合物はまた、種々の割合の高分子量を有する副生成物を含む。これらの比較的高分子量の副生成物は、典型的には、約0.01〜2.5重量%、通常は0.2〜1.8重量%の量で存在する。
【0021】
以下の実施例は本発明の方法のための詳細を更に説明する。上述の開示中に述べられている本発明は、これらの実施例によって精神又は範囲のどちらにおいても限定されるべきではない。当業者は、以下の手順の条件の既知の変更を使用することができることを容易に理解するであろう。特記しない限り、すべての温度は摂氏度であり、そしてすべてのパーセントは重量%である。
【0022】
【発明の実施の形態】
実施例1
本発明によるTDA/水混合物の製造
a)ジニトロトルエンの製造
ジニトロトルエン(DNT)を、水によって冷却された2つの撹拌タンク反応器中で製造した。各々の反応器は500リットルの稼働容積を有しそして分離フラスコ中への横のオーバーフローを備えていて、そして各々のフラスコは100リットルの容積を有していた。脱ガス側において、装置を、大気圧で運転されたベントガス収集ラインに接続した。反応を開始させる前に、両方の容器を92%濃度の硫酸でオーバーフローまで満たして、撹拌機のスイッチを入れた。
第一タンク中に、93kg/hのトルエン及び100kg/hの65%濃度の硝酸並びに、665kg/hで92%濃度として第二タンク中に導入されそして下流沈降フラスコ中にオーバーフローしていた硫酸を供給した。
第一タンクからのオーバーフローは、関連の沈降フラスコ中で、処理のために除去される硫酸相と、モノニトロトルエン(MNT)から主に成る有機相とに分離した。有機相を連続的に第二タンク中にポンプ輸送し、そこで、上で述べた92%硫酸に加えて、別の105kg/hの65%濃度の硝酸を添加した。第二タンク中の温度は70℃であった。
第二タンクからのオーバーフローは、関連の沈降フラスコ中で、後で第一タンク中にポンプ輸送される上述のような硫酸相と、そして粗製DNTを含みそして微量の酸を同伴する有機相とに分離した。
生成物を精製するために、組成DNTを70℃で維持された3段階のミキサー/セトラーの組を通して連続的に流し、そこでは粗製DNTを、順番に、50リットル/hの温水(70℃)、50リットル/hの2%濃度の苛性ソーダ溶液(70℃)、及び50リットル/hの脱イオン水(70℃)で洗浄した。生成したDNTの水性抽出物は、7.6のpHを有していた。水性相を流出物として排除した。
【0023】
b)TDAを生成させるDNTの水素化
冷却及び加熱設備、ガス分散撹拌機、温度計及びレベル指示計を備えた500リットルのオートクレーブを使用してDNTを水素化させてトルイレンジアミン(TDA)を生成させた。
70kgの水及び150kgのトルイレンジアミンの混合物を、80℃で最初にオートクレーブ中に導入し、そして次に約30リットルの水の中に懸濁させた約7kgのラネーニッケルをこの混合物に添加した。このオートクレーブを10回、10バールの圧力で水素で満たし、そして次に各々の回毎に大気圧まで減圧した。次に、水素を22バールの圧力で導入し、撹拌機のスイッチを入れ、そして182kg/hの流量で、沈めたチューブを経由して、反応混合物中へのDNTの添加を開始した。
約2分後に、オートクレーブ内側の温度の急速な上昇によって、反応の開始を検出した。加熱手順を冷却手順に変えた後で、温度を190℃で制御した。オートクレーブ内側の圧力が22バールで一定に維持されるように新しい水素を添加することによって、水素消費を補った。25Nm3 /hのガス流れをオートクレーブ中のガス空間から取り出した。
液体がオートクレーブの75%を満たした時に、浸漬チューブを経由しての生成物の取り出しを開始した。生成物は、その中に3つの焼結金属フィルターカートリッジが事前に挿入されている約20リットルの容積を有する濾過容器中に流れ込んだ。
【0024】
触媒が濃縮された反応混合物の約50リットル/hを、ポンプを使用して濾過容器から反応器に返し、一方フィルターカートリッジを通って流れる反応混合物の圧力を、反応器中のレベルによって制御される制御弁を経由して、還流コンデンサーを有する減圧容器中で3バールに減圧した。減圧されたガスをベントガスとして排出した。
反応混合物は減圧容器から、5段の泡鐘棚板を有する第一蒸留塔中に連続的に流れたが、ここでこの蒸留塔は長さが約2.5mそして径が約200mmであった。塔を周囲圧力で運転し、そして塔底を差し込み式(plug−in)蒸発器及び6バールのスチームを使用して135℃に加熱した。塔頂においては、約25ppmのTDAを含む水を還流比(還流/取り出し)=3で取り出した。塔底からの生成物は、約7重量%の水を含み、そして約65℃の凝固点を有する、TDAと水の中間混合物であった。それは、TDAの異なる異性体、即ち2,3−、2,4−、3,4−及び2,6−異性体、並びにもっと高分子量を有する副生成物を含んでいた。4週間の間約70℃で貯蔵した後で、TDAと水のこの中間混合物からは固体が沈殿しなかった。かくして、TDAと水のこの中間混合物は、船の中での70℃でばら積み輸送のために適切であった。
【0025】
実施例2
本発明によるTDAと水の中間混合物からのトルイレンジイソシアネートの製造TDAと水の中間混合物(即ち上の実施例1b中で述べられた第一蒸留塔からの生成物)から、トップでの100ミリバールでの真空下でそして10段の泡鐘棚板を有する第二蒸留塔中の液溜め中の205℃で、残留水を除去した。この第二蒸留塔は、長さが約4.5mそして径が約300mmであった。塔底を30バールのスチームを使用して加熱した。この蒸留は、(還流/取り出し)=4である時に、塔底において本質的に乾いたTDA(これは約400ppmの水を含んでいた)を生成させ、そして塔頂では水(これは約10ppmのTDAを含んでいた)が製造された。
【0026】
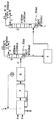
第二蒸留ステップを通る、本発明による方法の略図を図2中に示す。図2においては:
AはDNT供給を表し、
Bは水素供給を表し、
Cはベントガスを表し、
Dは熱除去を表し、
EはDNTからTDAへの接触転換(185℃、25〜30バール、2〜3重量%の触媒)を表し、
Fは触媒分離を表し、
Gは130℃、3バールへの減圧を表し、
Hは塔1への供給を表し、
Iは水取り出し(TDA含量:25ppm)を表し、
JはTDAと水の中間混合物の取り出し(本発明による)を表し、
Kは80℃での、TDAと水の中間混合物の一時的な貯蔵及び/又は輸送(本発明による)を表し、
Lは塔2からのTDA(水含量:400ppm)の取り出しを表し、
Mは塔2からの水取り出し(TDA含量:10ppm)を表し、
1)は第一蒸留塔を表し[ここで、5は塔1中の泡鐘棚板の数を表し]
そして
2)は第二蒸留塔を表し[ここで、10は塔2中の泡鐘棚板の数を表す]。
【0027】
次に、乾いたTDAをホスゲンと反応させてTDIを生成させた。この段階は、30バールのスチームによって加熱された二つの撹拌タンクから本質的に成る連続的に運転される装置中で実施された。ここで、これらの二つのタンクの各々は、2m3 の容積及び二本の蒸留塔を有していた。
オルトジクロロベンゼン(ODB)中の50%濃度溶液の形の800kg/hのホスゲンを二つの撹拌タンクの第一のものの中に供給し、そして1.9バールの圧力で90℃に加熱した。オーバーフローは、脱ガス側で第一タンクに接続された第二撹拌タンク中に流れ込み、そして約135℃の温度で維持された。
ポンプを経由してODB中の5%濃度の溶液の形で45℃で120kg/hでTDA溶液タンクから取り出されたTDAを、第一撹拌タンク中に導入されたホスゲン溶液と混合させた。開いたインペラーを有する遠心分離ポンプを、これらの二つの溶液を良く混合させるために使用した。
第二撹拌タンクを去った後で、反応混合物を、30バールのスチームによって運転された熱交換器中で190℃に加熱した。
撹拌タンクからそして熱交換器から排出された蒸気を、約500mmの径、約4mの長さを有しそして10段の泡鐘棚板を含む洗浄塔を通して流した。塔頂で60℃でODBによって冷却されたコンデンサーは、還流媒体として塔に添加された幾らかの反応混合物を凝縮させた。塔からの排出を、第一撹拌タンクの液体レベルよりも下に返した。塔から出る蒸気は、製造された塩化水素から使用される過剰のホスゲンを、分離するための回収装置中に流した。
【0028】
熱交換器(上で述べた)から出る190℃の反応混合物を、約450mmの径、約6mの長さを有しそして約4mの高さまで充填物を含む溶媒塔の塔底中に導入した。溶媒塔の塔底を差し込み式蒸発器を使用して30バールのスチームによって約185℃に加熱したが、塔頂での圧力は330ミリバールであった。冷水によって運転されているコンデンサーを使用して、還流比R:E=2を確立した。取り出されたODBはTDIを含まず、そしてTDA溶液及びホスゲン溶液(上で述べたように、これは第一タンクに入る)を製造するために再び使用した。
溶媒塔の塔底から取り出されたTDIを、30バールのスチームによって加熱されそして100ミリバールの圧力で維持された、下流の薄層蒸発器(TLE)中で約10%のODBと共に加熱し、そしてODBを完全に除去した。TLE留出物を、冷水を使用するコンデンサー中で凝縮させそして溶媒塔に返した。
TLEの底からの排出物を、これもまた30バールのスチームによって加熱されそして10ミリバールの圧力で維持された第二薄層蒸発器中で、約90%の塔頂生成物と約10%の塔底生成物とに分離した。塔底生成物を2m3 の容量を有する蒸留ボイラー中で収集し、そして粘着性溶融液が生成されるまで220℃/5ミリバールで30バールのスチームを使用して回分式に蒸発させた。この粘着性溶融液を、熱い間に流し去り、板紙のタブ中で固化させ、そして廃物焼却手順によって処分した。それは、ホスゲン化の間に生成される高沸副生成物に加えて、またTDA供給物からの高分子量の副生成物も含んでいた。
【0029】
ボイラー蒸留からの留分を、第二TLEからの留分と一緒にTDI塔に供給した。
TDI塔は、約5mの全高さ、250mmの径を有し、そして約3.5mの高さまで充填物を含んでいた。塔頂には、全部の還流をもたらすコンデンサーがあった。TDI塔からの生成物取り出しは、取り出し棚板によって内部充填物のトップから約400mm下で行った。還流比R:Eは15であった。塔頂では15ミリバールの圧力が存在した。
TDI塔の底は、約100リットルの容量を有していたが、温度が163℃であるように差し込み蒸発器によって30バールのスチームで加熱した。底部分の内容物を、6時間の規則的な間隔で約30リットルだけ減少させ、そして取り出した生成物を上で述べた第二TLEに原料として添加した。
TDI塔から取り出したTDI生成物は、以下の分析的特徴を有していた:
79.4% 2,4−異性体
20.6% 2,6−異性体
0.005% 加水分解可能な塩素
及び
0.005%未満 ODB。
それ故、この実施例のTDI生成物は、市販のTDIの品質に相当した。
トルエンからトルイレンジイソシアネートまでのすべての製造段階にわたる収率は約85%であった。
【0030】
例証の目的のためにこれまで本発明を詳細に説明してきたけれども、このような詳細は単にその目的のためだけであること、並びに本発明を特許請求の範囲によって限定して良い以外は本発明の精神及び範囲から逸脱することなく当業者はその中で変更を加えることができることが理解されるべきである。
【0031】
本発明の主なる特徴及び態様は以下の通りである。
1. 1)トルエンを硝酸と反応させてジニトロトルエンを生成させるステップ、
2)前記ジニトロトルエンを水素化してトルイレンジアミンと反応水の粗製溶液を生成させるステップ、
3)トルイレンジアミンと反応水の前記粗製溶液を蒸留してトルイレンジアミンと水の中間混合物を生成させるステップ[ここで、前記蒸留は前記中間混合物の水含量が約1〜40重量%である点で中断される]、
4)トルイレンジアミンと水の前記中間混合物を第一製造プラントから第二製造プラントに輸送するステップ、
引き続いて、
5)トルイレンジアミンと水の前記中間混合物を第二製造プラントにおいて完全に蒸留して乾いたトルイレンジアミンを生成させるステップ
並びに
6)前記の乾いたトルイレンジアミンをホスゲン化してトルイレンジイソシアネートを生成させるステップ
から成るトルイレンジイソシアネートの製造方法。
【0032】
2. 前記ジニトロトルエンの水素化を溶媒又は希釈剤の存在下にて行い、そして引き続いて、前記のトルイレンジアミンと反応水の粗製溶液を蒸留してトルイレンジアミンと水の前記中間混合物を生成させるのに先立って、トルイレンジアミンの前記粗製溶液から、部分的に又は完全に、前記溶媒又は希釈剤を除去する、上記1記載の方法。
3. トルイレンジアミンと反応水の前記の粗製溶液を蒸留してトルイレンジアミンと水の前記中間混合物を生成させるステップを、前記中間混合物の水含量が約2〜10重量%である点で中断する、上記1記載の方法。
4. 前記トルイレンジアミンが2,4−異性体、2,6−異性体又はそれらの混合物を含む、上記1記載の方法。
5. 前記トルイレンジアミンが2,4−異性体、2,6−異性体又はそれらの混合物を2,3−異性体、3,4−異性体又はそれらの混合物と組み合わせて含む、上記4記載の方法。
【0033】
6. トルイレンジアミンと水の混合物であって、高くとも95℃の凝固点を有する前記混合物。
7. 凝固点が60〜95℃の範囲にある、上記6記載の混合物。
8. 凝固点が65〜70℃の範囲にある、上記6記載の混合物。
9. 前記トルイレンジアミンが2,4−異性体及び2,6−異性体から成る、上記6記載の混合物。
10. 前記トルイレンジアミンが2,3−異性体、3,4−異性体又はそれらの混合物と組み合わせられた2,4−異性体、2,6−異性体又はそれらの混合物、並びにもっと高分子量の副生成物から成る、上記6記載の混合物。
11. 前記混合物が約100重量部のトルイレンジアミンに対して約1〜40重量部の水を含む、上記6記載の混合物。
12. 前記混合物が約100重量部のトルイレンジアミンに対して約2〜10重量部の水を含む、上記6記載の混合物。
13. トルイレンジアミンをホスゲン化してトルイレンジイソシアネートを生成させることから成るトルイレンジイソシアネートの製造方法において、前記トルイレンジアミンが、ホスゲン化を施されるのに先立って水含量を除去するために蒸留された上記6記載の混合物から成るという改善を含む前記方法。
14. 上記6記載の前記混合物が、前記混合物の製造の場所から空間的に離れている製造プラントに輸送された、上記13記載の方法。
【図面の簡単な説明】
【図1】先行技術中で述べられたような伝統的な方法において、乾いたTDAを生成させるためのTDAと水の粗製溶液からの水の除去を図示する略図である。
【図2】第二蒸留ステップを通る、本発明による方法を図示する略図である。
【図3】TDAと水の粗製溶液の凝固点の変化を示すグラフである。
【図4】TDAと水の粗製溶液の相平衡図である。
【符号の説明】
1) 第一蒸留塔
2) 第二蒸留塔
Claims (2)
- 1)トルエンを硝酸と反応させてジニトロトルエンを生成させるステップ、
2)前記ジニトロトルエンを水素化してトルイレンジアミンと反応水の粗製溶液を生成させるステップ、
3)トルイレンジアミンと反応水の前記粗製溶液を蒸留してトルイレンジアミンと水の中間混合物を生成させるステップ[ここで、前記蒸留は前記中間混合物の水含量が約1〜40重量%である点で中断される]、
4)トルイレンジアミンと水の前記中間混合物を第一製造プラントから第二製造プラントに輸送するステップ、
引き続いて、
5)トルイレンジアミンと水の前記中間混合物を第二製造プラントにおいて完全に蒸留して乾いたトルイレンジアミンを生成させるステップ
並びに
6)前記の乾いたトルイレンジアミンをホスゲン化してトルイレンジイソシアネートを生成させるステップ
から成るトルイレンジイソシアネートの製造方法。 - トルイレンジアミンをホスゲン化してトルイレンジイソシアネートを生成させることから成るトルイレンジイソシアネートの製造方法において、前記トルイレンジアミンが、ホスゲン化を施されるのに先立って水含量を除去するために蒸留された、
1)トルエンを硝酸と反応させてジニトロトルエンを生成させるステップ、
2)前記ジニトロトルエンを水素化してトルイレンジアミンと反応水の粗製溶液を生成させるステップ、
3)トルイレンジアミンと反応水の前記粗製溶液を蒸留してトルイレンジアミンと水の中間混合物を生成させるステップ[ここで、前記蒸留は前記中間混合物の水含量が約1〜40重量%である点で中断される]、
4)トルイレンジアミンと水の前記中間混合物を第一製造プラントから第二製造プラントに輸送するステップ、
引き続いて、
5)トルイレンジアミンと水の前記中間混合物を第二製造プラントにおいて完全に蒸留して乾いたトルイレンジアミンを生成させるステップ
によって得られたトルイレンジアミンと水の混合物から成るという改善を含むトルイレンジイソシアネートの製造方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19528781A DE19528781A1 (de) | 1995-08-04 | 1995-08-04 | Verfahren zur Herstellung von Toluylendiisocyanat, spezielle Gemische aus Toluylendiamin und Wasser und deren Verwendung zur Herstellung von Toluylendiisocyanat |
| DE19528781.9 | 1995-08-04 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH0952873A JPH0952873A (ja) | 1997-02-25 |
| JP4095685B2 true JP4095685B2 (ja) | 2008-06-04 |
Family
ID=7768754
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP21690096A Expired - Lifetime JP4095685B2 (ja) | 1995-08-04 | 1996-07-31 | トルイレンジイソシアネートの製造方法、トルイレンジアミンと水の特定の混合物、及びトルイレンジイソシアネートを製造するための混合物の使用 |
Country Status (15)
| Country | Link |
|---|---|
| US (2) | US5849947A (ja) |
| EP (2) | EP0757034B1 (ja) |
| JP (1) | JP4095685B2 (ja) |
| KR (1) | KR100453862B1 (ja) |
| CN (2) | CN1070474C (ja) |
| BR (1) | BR9603278A (ja) |
| CA (1) | CA2182654A1 (ja) |
| CZ (1) | CZ292604B6 (ja) |
| DE (2) | DE19528781A1 (ja) |
| ES (1) | ES2176380T3 (ja) |
| PL (1) | PL184186B1 (ja) |
| PT (1) | PT757034E (ja) |
| RU (1) | RU2202537C2 (ja) |
| TW (1) | TW374080B (ja) |
| UA (1) | UA47399C2 (ja) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR100311692B1 (ko) * | 1997-12-23 | 2001-11-15 | 신현준 | 활성탄소 섬유의 제조방법 |
| EP1371633A1 (en) * | 2002-06-14 | 2003-12-17 | Bayer Ag | Process for the purification of mixtures of toluenediisocyanate incorporating a dividing-wall distillation column |
| ATE337297T1 (de) * | 2002-10-22 | 2006-09-15 | Bayer Materialscience Ag | Verfahren zur reinigung von diisocyanatotoluol unter verwendung einer destillationskolonne mit trennwand in der endreinigung |
| DE10260093A1 (de) * | 2002-12-19 | 2004-07-01 | Basf Ag | Verfahren zur Abtrennung von Isocyanaten aus einem Reaktionsgemisch |
| KR101338571B1 (ko) * | 2005-03-10 | 2013-12-06 | 미쓰이 가가쿠 가부시키가이샤 | 폴리이소시아네이트의 제조 방법 및 폴리이소시아네이트의제조 장치 |
| JP5175033B2 (ja) * | 2005-03-10 | 2013-04-03 | 三井化学株式会社 | ポリイソシアネートの製造方法およびポリイソシアネートの製造装置 |
| DE102005032430A1 (de) * | 2005-07-12 | 2007-01-25 | Bayer Materialscience Ag | Verfahren zur Herstellung von Toluylendiamin |
| HUE033435T2 (en) * | 2005-07-12 | 2017-11-28 | Covestro Deutschland Ag | Process for preparing toluenediamine |
| JP4791783B2 (ja) * | 2005-08-31 | 2011-10-12 | 三井化学株式会社 | ポリイソシアネートの製造方法 |
| DE102006022447A1 (de) * | 2006-05-13 | 2007-11-15 | Bayer Materialscience Ag | Verfahren zur gekoppelten Herstellung von Chlor und Isocyanaten |
| US8030522B2 (en) * | 2006-06-07 | 2011-10-04 | Bayer Materialscience Llc | Process for the production of toluene diisocyanate |
| CN100455559C (zh) * | 2006-11-08 | 2009-01-28 | 大连理工大学 | 芳香族硝基化合物还原制备芳胺的方法 |
| DE102006059678A1 (de) * | 2006-12-18 | 2008-06-19 | Bayer Materialscience Ag | Verfahren zur Herstellung von aromatischen Aminen |
| DE102006060572A1 (de) † | 2006-12-19 | 2008-06-26 | Bayer Materialscience Ag | Verfahren zur Herstellung von Toluylendiaminen durch katalytische Hydrierung von Dinitrotoluolen |
| WO2009069584A1 (ja) * | 2007-11-27 | 2009-06-04 | Mitsui Chemicals Polyurethanes, Inc. | トリレンジアミンの脱水方法および脱水装置 |
| DK2367783T3 (da) | 2008-11-19 | 2013-04-08 | Basf Se | Fremgangsmåde til fremstilling af et isocyanat |
| CN101712621B (zh) * | 2009-09-02 | 2012-10-31 | 甘肃银达化工有限公司 | 连续制备甲苯二胺的方法 |
| CN101671277B (zh) * | 2009-09-18 | 2011-12-28 | 天津大学 | 一种甲苯二异氰酸酯连续生产中热集成的溶剂回收方法 |
| BR112012021120A2 (pt) * | 2010-03-18 | 2016-05-17 | Huntsman Int Llc | processo para a conversão do composto nitro aromático em aminas |
| JP5883661B2 (ja) * | 2012-01-25 | 2016-03-15 | 旭化成ケミカルズ株式会社 | N−置換カルバミン酸エステルの製造方法 |
| WO2018140461A1 (en) * | 2017-01-27 | 2018-08-02 | Covestro Llc | Process for the preparation of stable toluene diamine residue/water blends, related compositions, and methods of using such blends as a fuel |
| CN110105248B (zh) * | 2019-05-31 | 2021-07-20 | 上海应用技术大学 | 一种甲苯二异氰酸酯的制备方法 |
| EP4151619A1 (en) | 2021-09-20 | 2023-03-22 | Covestro Deutschland AG | Method for the removal of water from and transport of aliphatic diamines |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2976320A (en) * | 1957-07-30 | 1961-03-21 | Allied Chem | Catalytic hydrogenation of the dinitro derivatives of toluene |
| GB895197A (en) * | 1960-11-25 | 1962-05-02 | Gen Aniline & Film Corp | Catalytic reduction of aromatic dinitro compounds |
| GB1164519A (en) * | 1966-07-19 | 1969-09-17 | Inst Chemii Ogolnej | Method for preparing Toluylenediisocyanates from Dinitrotoluenes |
| US4224249A (en) * | 1979-05-14 | 1980-09-23 | Air Products And Chemicals, Inc. | Toluene diamine from non-washed dinitrotoluene |
| US4717774A (en) * | 1985-12-20 | 1988-01-05 | Basf Corporation | Process for the preparation of toluene diamines |
| DE4230098C1 (ja) * | 1992-09-09 | 1993-06-03 | Bayer Ag, 5090 Leverkusen, De | |
| US5449832A (en) * | 1994-10-05 | 1995-09-12 | Air Products And Chemicals, Inc. | Process for storage and transport of toluenediamine |
| US5714634A (en) * | 1996-06-25 | 1998-02-03 | Air Products And Chemicals, Inc. | Process for storage and transport of toluenediamine |
| US5693862A (en) * | 1996-12-18 | 1997-12-02 | Arco Chemical Technology, L.P. | Process for transport of toluenediamine |
-
1995
- 1995-08-04 DE DE19528781A patent/DE19528781A1/de not_active Withdrawn
-
1996
- 1996-07-23 ES ES96111809T patent/ES2176380T3/es not_active Expired - Lifetime
- 1996-07-23 DE DE59609285T patent/DE59609285D1/de not_active Expired - Lifetime
- 1996-07-23 PT PT96111809T patent/PT757034E/pt unknown
- 1996-07-23 EP EP96111809A patent/EP0757034B1/de not_active Expired - Lifetime
- 1996-07-23 EP EP01100055A patent/EP1090906A1/de not_active Ceased
- 1996-07-31 JP JP21690096A patent/JP4095685B2/ja not_active Expired - Lifetime
- 1996-08-01 US US08/691,222 patent/US5849947A/en not_active Expired - Lifetime
- 1996-08-02 CZ CZ19962299A patent/CZ292604B6/cs not_active IP Right Cessation
- 1996-08-02 TW TW85109303A patent/TW374080B/zh not_active IP Right Cessation
- 1996-08-02 CN CN96111631A patent/CN1070474C/zh not_active Expired - Lifetime
- 1996-08-02 CN CNB001317962A patent/CN1163470C/zh not_active Expired - Lifetime
- 1996-08-02 RU RU96115368/04A patent/RU2202537C2/ru active
- 1996-08-02 UA UA96083118A patent/UA47399C2/uk unknown
- 1996-08-02 PL PL96315490A patent/PL184186B1/pl not_active IP Right Cessation
- 1996-08-02 CA CA002182654A patent/CA2182654A1/en not_active Abandoned
- 1996-08-03 KR KR1019960032490A patent/KR100453862B1/ko not_active IP Right Cessation
- 1996-08-05 BR BR9603278A patent/BR9603278A/pt not_active Application Discontinuation
-
1998
- 1998-09-08 US US09/149,379 patent/US6472564B1/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| TW374080B (ja) | 1999-11-11 |
| CZ229996A3 (en) | 1997-02-12 |
| KR100453862B1 (ko) | 2005-04-08 |
| KR970010735A (ko) | 1997-03-27 |
| MX9603167A (es) | 1997-07-31 |
| EP1090906A1 (de) | 2001-04-11 |
| CN1149579A (zh) | 1997-05-14 |
| EP0757034A1 (de) | 1997-02-05 |
| CN1332149A (zh) | 2002-01-23 |
| DE59609285D1 (de) | 2002-07-11 |
| BR9603278A (pt) | 1998-05-12 |
| RU2202537C2 (ru) | 2003-04-20 |
| CA2182654A1 (en) | 1997-02-05 |
| DE19528781A1 (de) | 1997-02-06 |
| ES2176380T3 (es) | 2002-12-01 |
| JPH0952873A (ja) | 1997-02-25 |
| UA47399C2 (uk) | 2002-07-15 |
| PL184186B1 (pl) | 2002-09-30 |
| EP0757034B1 (de) | 2002-06-05 |
| CN1070474C (zh) | 2001-09-05 |
| US5849947A (en) | 1998-12-15 |
| US6472564B1 (en) | 2002-10-29 |
| PT757034E (pt) | 2002-09-30 |
| CN1163470C (zh) | 2004-08-25 |
| CZ292604B6 (cs) | 2003-11-12 |
| MX195147B (ja) | 2000-01-31 |
| PL315490A1 (en) | 1997-02-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4095685B2 (ja) | トルイレンジイソシアネートの製造方法、トルイレンジアミンと水の特定の混合物、及びトルイレンジイソシアネートを製造するための混合物の使用 | |
| JP5449082B2 (ja) | メチレンジアニリンおよびメチレンビス(フェニルイソシアナート)の製造方法 | |
| KR101032936B1 (ko) | 이소시아네이트의 연속 제조 방법 | |
| US8026387B2 (en) | Method for producing isocyanates | |
| EP1864969B1 (en) | Process for the production of the toluene diisocyanate | |
| EP1734035B1 (en) | Process for the preparation of 4,4'-diphenylmethane diisocyanate | |
| KR101685699B1 (ko) | 이소시아네이트의 기상 제조 방법 | |
| US4014914A (en) | Manufacture of 4,4'-diphenylmethane diisocyanate and a mixture of diisocyanates and polyisocyanates | |
| JP2008150379A (ja) | ジニトロトルエンの接触水素化によるトルエンジアミンの製造方法 | |
| JP5116954B2 (ja) | ポリイソシアネート残渣の濃縮方法、処理方法、濃縮装置および処理装置 | |
| KR101829481B1 (ko) | 기체 상에서의 이소시아네이트의 제조 방법 | |
| JP4307588B2 (ja) | 脂肪族イソシアネート化合物の製造法 | |
| MXPA96003167A (en) | A process to prepare toluylendiisocyanate, toluylendiamines and water specific mixtures, and mixtures use to prepare toluylendiisocyanate | |
| JP4241968B2 (ja) | ジニトロトルエンの断熱製造法 | |
| WO2023041768A1 (en) | Method for the processing and transport of hexane-1,6-diamine or pentane-1,5-diamine | |
| HU202834B (en) | Process and apparatus for producing aromathic isocyanates |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20061109 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20061124 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070219 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20070412 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070705 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20070820 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080208 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080310 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110314 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110314 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120314 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130314 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130314 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140314 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |