JP2018525005A - 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 - Google Patents
抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 Download PDFInfo
- Publication number
- JP2018525005A JP2018525005A JP2018508695A JP2018508695A JP2018525005A JP 2018525005 A JP2018525005 A JP 2018525005A JP 2018508695 A JP2018508695 A JP 2018508695A JP 2018508695 A JP2018508695 A JP 2018508695A JP 2018525005 A JP2018525005 A JP 2018525005A
- Authority
- JP
- Japan
- Prior art keywords
- bcma
- antibody
- binding fragment
- seq
- antigen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 C*CN1C(CNC)C1 Chemical compound C*CN1C(CNC)C1 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3061—Blood cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/515—Complete light chain, i.e. VL + CL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Abstract
Description
本出願は、ASCIIフォーマットで電子的に提出済みの配列表を含み、当該配列表の全体を参照により本明細書に援用するものである。当該ASCIIのコピーは、2016年8月15日に作成され、ファイル名はPRD3383USNP_SL.txtであり、そのサイズは87,341バイトである。
本明細書で提供される開示は、B細胞成熟抗原(BCMA)に免疫特異的に結合するモノクローナル抗体、BCMA及びクラスター決定因子3(CD3)に免疫特異的に結合する多重特異性抗体、並びに当該抗体の産生及び使用方法に関する。
本明細書において、BCMAに特異的な組換え抗体及び抗原結合フラグメントが記載されている。一部の実施形態では、BCMA特異性抗体及び抗原結合フラグメントは、ヒトBCMAに結合する。一部の実施形態では、BCMA特異性抗体及び抗原結合フラグメントは、ヒトBCMA及びカニクイザルBCMAに結合する。一部の実施形態では、BCMA特異性抗体及び抗原結合フラグメントは、BCMA細胞外ドメイン(ECD)からの1つ又は2つ以上の残基を含むエピトープに結合する。このBCMA特異性抗体又は抗原結合フラグメントは、ELISAにより測定するとき、少なくとも5.9nMのIC50でAPRIL結合を阻害し得る。
記載されたBCMA特異性抗体又は抗原結合フラグメントを使用する方法もまた開示されている。本項に記載の方法に使用するための特定の抗体としては、表1の抗体に関して記載されたCDR一式を有するものが挙げられる。例えば、これらの抗体又は抗原結合フラグメントは、BCMA受容体の相互作用を使用して阻害することにより、がんを処置するのに有用であり得る。すなわち、抗体が毒物に結合され、この毒物をBCMA発現がんに標的化する。更に、これらの抗体又は抗原結合フラグメントは、生体サンプル、例えば、血液又は血清中におけるBCMAの存在を検出するのに、生体サンプル、例えば、血液又は血清中におけるBCMAの量を定量するのに、BCMA発現がんを診断するのに、がんで苦しむ対象を処置する方法を決定するのに、又は対象におけるBCMA発現がんの進行をモニタするのに、有用であり得る。一部の実施形態では、BCMA発現がんは、多発性骨髄腫(MM)などのリンパ腫であり得る。記載された方法は、対象がBCMA発現がんの処置、例えば、BCMA及びCD3に対する多重特異性抗体による処置を受ける前に行われてもよい。更に、記載された方法は、対象がBCMA発現がんの処置、例えば、本明細書に記載されたBCMA及びCD3に対する多重特異性抗体による処置を受けた後に行われてもよい。
開示されたBCMA特異性抗体又はその抗原結合フラグメントを含むキットが本明細書において記載されている。記載されたキットを使用して、本明細書で提供されたBCMA特異性抗体又は抗原結合フラグメントを使用する方法、又は当業者に既知の他の方法を行うことができる。一部の実施形態では、記載されたキットは、本明細書に記載された抗体又は抗原結合フラグメントと、生体サンプル中のBCMAの存在を検出する際の使用のための試薬と、を含んでもよい。したがって、記載されたキットは、本明細書に記載された抗体又はその抗原結合フラグメントのうち1つ又は2つ以上と、使用していないときに抗体又はフラグメントを収容するための容器と、抗体又はフラグメントの使用のための取扱説明書と、本明細書に記載されたとおり、固体支持体に固定された抗体若しくはフラグメント及び/又は検出可能に標識された形態の抗体若しくはフラグメントを含んでもよい。
TCR/CD3複合体を介したBCMAを発現しているMM細胞へのTリンパ球のリダイレクトは、魅力的な別の方法を提示する。Tリンパ球のTCR/CD3複合体は、CD3標識化ガンマ(γ)、デルタ(δ)、イプシロン(ε)、ゼータ(ζ)、及びイータ(η)の不変サブユニットを有する細胞表面で共発現されたTCRアルファ(α)/ベータ(β)又はTCRガンマ(γ)/デルタ(δ)ヘテロ二量体のいずれかで構成される。ヒトCD3εは、UniProt P07766(CD3E_HUMAN)に記載されている。現況技術に記載されている抗CD3ε抗体は、SP34である(Yang SJ,The Journal of Immunology(1986)137;1097〜1100)。SP34は、霊長類及びヒトCD3の両方に反応する。SP34は、Pharmingenから入手可能である。現況技術に記載されている更なる抗CD3抗体は、UCHT−1である(国際公開第2000041474号参照)。現況技術に記載されている更なる抗CD3抗体は、BC−3である(Fred Hutchinson Cancer Research Institute;used in Phase I/II trials of GvHD,Anasetti et al.,Transplantation 54:844(1992))。SP34はCD3のε鎖だけに存在するエピトープを認識するが(Salmeron et al.,(1991)J.Immunol.147:3047参照)、UCHT−1及びBC−3はε及びγ鎖の両方によって与えられるエピトープを認識しており、この点でSP34はUCHT−1及びBC−3とは異なる。抗体SP34と同じ配列を有する抗体の配列は、国際公開第2008119565号、同第2008119566号、同第2008119567号、同第2010037836号、同第2010037837号、及び同第2010037838号で言及されている。抗体SP34の重鎖可変ドメイン(VH)と96%同じ配列は、米国特許第8236308号(国際公開第2007042261号)で言及されている。
記載されたBCMA×CD3多重特異性抗体及びその多重特異性抗原結合フラグメントを使用する方法もまた開示される。例えば、BCMA×CD3多重特異性抗体及びその多重特異性抗原結合フラグメントは、それを必要とする対象における、BCMA発現がんの処置に有用であり得る。一部の実施形態では、BCMA発現がんは、多発性骨髄腫などのリンパ腫である。
本明細書において、開示されたBCMA×CD3多重特異性抗体を含むキットが記載されている。記載されたキットを使用して、本明細書で提供されたBCMA×CD3多重特異性抗体を使用する方法又は当業者に既知の他の方法を行うことができる。一部の実施形態では、記載されたキットは、本明細書に記載された抗体と、BCMA発現がんを処置する際の使用のための試薬と、を含んでもよい。したがって、記載されたキットは、本明細書に記載された多重特異性抗体又はその多重特異性抗原結合フラグメントのうち1つ若しくは2つ以上、使用していないときに抗体又はフラグメントを収容するための容器、並びに/又は抗体若しくはフラグメントの使用のための取扱説明書、本明細書に記載されたとおりの、固体支持体に固定された抗体若しくはフラグメント及び/若しくは検出可能に標識された形態の抗体若しくはフラグメントを含んでもよい。
本明細書及び特許請求の範囲を通して本明細書の諸態様に関する様々な用語が使用される。別途記載のない限り、そのような用語には、当該技術分野におけるそれらの通常の意味が与えられるものとする。その他の具体的に定義される用語は、本明細書に提供される定義と一致する様式で解釈されるものとする。
本明細書において、BCMAに特異的に結合する、組換えモノクローナル抗体又は抗原結合フラグメントが記載されている。抗体分子の全体的な構造は、抗原結合ドメインを含む。同ドメインは、重鎖及び軽鎖並びにFcドメインを含み、補体固定及び結合抗体受容体を含む各種の機能を果たす。
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK
本明細書において、治療に使用するための、BCMA特異性抗体又はその抗原結合フラグメントが提供される。特に、これらの抗体又は抗原結合フラグメントは、がん、例えば、BCMA発現がんを治療するのに有用であり得る。したがって、本発明は、本明細書に記載されたとおりの抗体、例えば、BCMA特異性抗体又は抗原結合フラグメントを投与することを含むがんを治療する方法を提供する。例えば、この使用は、BCMA受容体の相互作用を使用した阻害によるものであってよく、すなわち、抗体が毒物に結合され、この毒物をBCMA発現がんに標的化する。一部の実施形態では、BCMA発現がんは、多発性骨髄腫(MM)などのリンパ腫を含む。これらの方法に使用するための抗体としては、本明細書で上述されたもの、例えば、表1に列記された特徴(例えば、CDR又は可変ドメイン配列)及びこれらの抗体の更なる検討において列記された特徴を有する、BCMA特異性抗体又は抗原結合フラグメントが挙げられる。
本明細書において、サンプルを、本明細書に記載された抗体又はその抗原結合フラグメントと接触させることにより、生体サンプル中のBCMAを検出するための方法が提供される。本明細書に記載されたように、サンプルは、尿、血液、血清、血漿、唾液、腹水、循環細胞、循環腫瘍細胞、組織会合していない細胞(すなわち、遊離細胞)、組織(例えば、外科手術的に切除された腫瘍組織、微小針吸引を含む生検)、組織学的調製物等から得ることができる。一部の実施形態では、記載された方法は、サンプルを、本明細書に記載されたBCMA特異性抗体又はその抗原結合フラグメントのいずれかと接触させることにより、生体サンプル中のBCMAを検出することを含む。
本明細書において、対象におけるBCMA発現がんを診断するための方法が提供される。一部の実施形態では、BCMA発現がんは、多発性骨髄腫(MM)などのリンパ腫を含む。一部の実施形態では、上記されたように、生体サンプル、例えば、血液サンプル又は血清サンプル中のBCMAを検出することは、サンプルが得られた対象中のがんを診断する能力を提供する。あるいは、一部の実施形態では、他のサンプル、例えば、組織学的サンプル、微小針吸引サンプル、切除された腫瘍組織、循環細胞、循環腫瘍細胞等もまた、サンプルが得られた対象ががんを有するかどうかを評価するのに使用されてもよい。一部の実施形態では、サンプルが得られた対象ががんを有することが既に分かっていてもよいが、対象を苦しめているがんの種類は、未だに診断されていなくてもよく、又は予備的診断では未知であるため、対象から得られた生体サンプル中のBCMAを検出することにより、がんの診断を可能にし、又は明確にすることができる。例えば、対象ががんを有することが分かっていてもよいが、分かっていなくてもよく、又は、対象のがんがBCMAを発現しているかどうかが、不明であってもよい。
本明細書において、対象におけるBCMA発現がんをモニタするための方法が提供される。一部の実施形態では、BCMA発現がんは、多発性骨髄腫(MM)などのリンパ腫を含む。一部の実施形態では、記載された方法は、対象から得られた試験サンプル中に存在するBCMAの量を決定することと、観察されたBCMAの量をより早い時点で対象から同様にして得られた生体サンプル中のBCMAの量と比較することと、により、BCMA発現がんが進行性、退行性、又は不変なままであるかどうかを評価することを含む。この場合、試験サンプル中のBCMAの量とより早期のサンプル中のBCMAの量との間の差は、がんが、進行性、退行性、又は不変なままであるかどうかの指標を提供する。これに関して、より早期のサンプルについて観察された量に対して増大した量のBCMAを含む試験サンプルは、BCMA発現がんの進行を示すことができる。逆に、より早期のサンプルについて観察された量に対して減少した量のBCMAを含む試験サンプルは、BCMA発現がんの退行を示すことができる。
本明細書において、生体サンプル中のBCMAを検出するためのキットが提供される。これらのキットは、本明細書に記載されたBCMA特異性抗体又はその抗原結合フラグメントのうち1つ又は2つ以上と、このキットを使用するための取扱説明書とを含む。
本明細書に記載された抗BCMA抗体の結合ドメインは、その表面上にBCMAを発現している細胞を認識する。上記されたように、BCMAの発現は、がん細胞を示し得る。特定の部分集合の細胞に対するより特異的な標的化は、二重特異性分子、例えば、BCMA及び別の標的(CD3など)に結合する抗体又は抗体フラグメントを作製することにより達成され得る。これは、BCMAに結合する第1の領域及び他の標的抗原に結合する第2の結合領域を含む分子を作製することにより達成される。抗原結合領域は、標的の特異的認識を可能にするいずれの形態もとることができ、例えば、結合領域は、重鎖可変ドメイン、Fv(重鎖可変ドメイン及び軽鎖可変ドメインの組み合わせ)、フィブロネクチンIII型ドメインに基づく結合ドメイン(例えば、フィブロネクチン由来、若しくはフィブロネクチン由来のIII型ドメインのコンセンサスに基づく、又はテネイシン由来、若しくはテネイシン由来のIII型ドメインのコンセンサスに基づく、例えば、Janssen Biotech,Inc.から得られるCentyrin分子、例えば、国際公開第2010/051274号及び同第2010/093627号を参照のこと)であってよく、又はこれらを含んでよい。したがって、BCMA及び別の抗原にそれぞれに結合する2種類の異なる抗原結合領域を含む二重特異性分子が提供される。
上記で検討されたBCMA二重特異性抗体、例えば、上記で検討されたBCMA×CD3二重特異性抗体は、治療に有用である。特に、BCMA二重特異性抗体は、がんを処置するのに有用である。また、本明細書において、治療的に有効な量の、本明細書に記載された多重特異性抗体又は多重特異性抗原結合フラグメントと、医薬的に許容され得る担体とを含む、哺乳類における過剰増殖性障害を処置するための治療組成物が提供される。好ましい実施形態では、多重特異性抗体は、本明細書に記載されたようなBCMA×CD3多重特異性抗体又はその多重特異性抗原結合フラグメントであり、より好ましくは、本明細書に記載されたようなBCMA×CD3二重特異性抗体又はそのBCMA×CD3二重特異性抗原結合フラグメントである。一実施形態では、当該医薬組成物は、BCMA発現がんの治療用であり、BCMA発現がんとしては、多発性骨髄腫(MM)などのBCMA発現B細胞がん、及びBCMAが発現していると今のところ判定される他のがんが挙げられる(ただし、これらに限定されない)。がん、例えば、上記で検討された特定のがんを含む血液がんを処置するのに使用されてもよい特定の二重特異性抗体には、抗体BCMB69、BCMB117、BCMB123、BCMB128、BCMB129、BCMB176、若しくはBCMB177、又はCD3B219が挙げられる。がん、例えば、これらの特定のがんを含む血液がんを処置するのに有用な二重特異性抗体の一例は、BCMB72である。
また、本明細書において、例えば、記載された多重特異性抗体又はその抗原結合フラグメントと、特定の細胞種を殺傷するための抗体又はフラグメントを使用するための取扱説明書と、を含むキットも提供される。好ましい実施形態では、多重特異性抗体は、本明細書に記載されたようなBCMA×CD3多重特異性抗体又はその多重特異性抗原結合フラグメントであり、より好ましくは、本明細書に記載されたようなBCMA×CD3二重特異性抗体又はそのBCMA×CD3二重特異性抗原結合フラグメントである。取扱説明書は、多重特異性抗体又はその抗原結合フラグメントを、インビトロ、インビボ、又はエクスビボにおいて使用するための指示を含んでもよい。
本明細書に記載された多重特異性抗体及びフラグメントはまた、診断目的に使用されてもよい。このため、本明細書で定義されたような多重特異性抗体又はフラグメントを含む診断組成物及びその使用もまた提供される。好ましい実施形態では、多重特異性抗体は、本明細書に記載されたようなBCMA×CD3多重特異性抗体又はその多重特異性抗原結合フラグメントであり、より好ましくは、本明細書に記載されたようなBCMA×CD3二重特異性抗体又はそのBCMA×CD3二重特異性抗原結合フラグメントである。一実施形態において、本発明は、二重特異性BCMA×CD3抗体と、BCMAに対する抗体の結合を検出するための1種又は2種以上の試薬と、を含む容器を含む、がんを診断するためのキットを提供する。試薬には、例えば、蛍光タグ、酵素タグ、又は他の検出可能なタグを挙げることができる。試薬はまた、酵素反応のための二次若しくは三次抗体又は試薬を含んでもよい。この場合、酵素反応は、可視化することができる生成物を生じる。例えば、本明細書に記載された多重特異性抗体又はその抗原結合フラグメントは、放射線標識、蛍光標識、エピトープタグ、ビオチン、発色団標識、ECL標識、酵素、ルテニウム、111In−DOTA、111In−ジエチレントリアミンペンタ酢酸(DTPA)、西洋わさびペルオキシダーゼ、アルカリホスファターゼ、及びベータガラクトシダーゼ、若しくはポリヒスチジン、又は、当技術分野において公知の類似するこのような標識で標識されてもよい。
本明細書における主題をより良くより完全に説明するために、本項は提示された主題の例示的な実施形態の列挙を提供する。
1.BCMAに免疫特異的に結合する組換え抗体、又はその抗原結合フラグメントであって、抗体は重鎖及び軽鎖を有し、当該重鎖は、
a.配列番号4のアミノ酸配列を有する重鎖相補性決定領域1(CDR1)、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号6のアミノ酸配列を有する重鎖CDR3、
b.配列番号4のアミノ酸配列を有する重鎖CDR1、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号6のアミノ酸配列を有する重鎖CDR3、
c.配列番号7のアミノ酸配列を有する重鎖CDR1、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号6のアミノ酸配列を有する重鎖CDR3、
d.配列番号4のアミノ酸配列を有する重鎖CDR1、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号19のアミノ酸配列を有する重鎖CDR3、
e.配列番号4のアミノ酸配列を有する重鎖CDR1、配列番号8のアミノ酸配列を有する重鎖CDR2、及び配列番号6のアミノ酸配列を有する重鎖CDR3、
f.配列番号13のアミノ酸配列を有する重鎖CDR1、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号19のアミノ酸配列を有する重鎖CDR3、
g.配列番号13のアミノ酸配列を有する重鎖CDR1、配列番号8のアミノ酸配列を有する重鎖CDR2、及び配列番号19のアミノ酸配列を有する重鎖CDR3、を含む、組換え抗体、又はその抗原結合フラグメント。
2.当該抗体は、配列番号24のアミノ酸配列を有する軽鎖CDR1、配列番号25のアミノ酸配列を有する軽鎖CDR2、及び配列番号26のアミノ酸配列を有する軽鎖CDR3、を更に含む、実施形態1に記載の抗体、又はその抗原結合フラグメント。
3.(a)の抗体の重鎖は、配列番号27のアミノ酸配列を含み、(b)の抗体の重鎖は、配列番号57のアミノ酸配列を含み、(f)の抗体の重鎖は、配列番号34のアミノ酸配列を含み、(k)の抗体の重鎖は、配列番号39のアミノ酸配列を含み、(l)の抗体の重鎖は、配列番号40のアミノ酸配列を含み、(m)の抗体の重鎖は、配列番号58のアミノ酸配列を含み、又は(n)の抗体の重鎖は、配列番号43のアミノ酸配列を含む、実施形態1に記載の抗体又は抗原結合フラグメント。
4.抗体の軽鎖は、配列番号28のアミノ酸配列を含む、実施形態2又は3に記載の抗体又は抗原結合フラグメント。
5.抗体又はその抗原結合フラグメントは、ヒトBCMAの細胞外ドメインに結合する、実施形態1〜4のいずれか一項に記載の抗体又は抗原結合フラグメント。
6.抗体又は抗原結合フラグメントは、ヒトの抗体又は抗原結合フラグメントである、実施形態1〜5のいずれか一項に記載の抗体又は抗原結合フラグメント。
7.抗原結合フラグメントは、Fabフラグメント、Fab2フラグメント、又は一本鎖抗体である、実施形態1〜6のいずれか一項に記載の抗原結合フラグメント。
8.抗体又はその抗原結合フラグメントは、BCMA及びAPRILの相互作用を阻害する、実施形態1〜7のいずれか一項に記載の抗体又は抗原結合フラグメント。
9.抗体又は抗原結合フラグメントは、ELISAにより測定するとき、BCMA及びAPRILの相互作用について約5.9nMのIC50を示す、実施形態8に記載の抗体又は抗原結合フラグメント。
10.抗体又はその抗原結合フラグメントはIgGである、実施形態1〜9のいずれか一項に記載の抗体又は抗原結合フラグメント。
11.IgG4アイソタイプである、実施形態1〜10のいずれか一項に記載の抗体又は抗原結合フラグメント。
12.IgG4は、そのFc領域中に、S228P置換、L234A置換、及びL235A置換を有する、実施形態11に記載の抗体。
13.抗体又はその抗原結合フラグメントは、ヒトBCMAに免疫特異的に結合し、カニクイザルBCMAに交差反応する、実施形態1〜12のいずれか一項に記載の抗体又は抗原結合フラグメント。
14.抗体又はその抗原結合フラグメントは、ヒト骨髄腫細胞の表面上のBCMAに結合する、実施形態1〜13のいずれか一項に記載の抗体又は抗原結合フラグメント。
15.抗体又はその抗原結合フラグメントは、ヒト多発性骨髄腫細胞の表面上のBCMAに結合する、実施形態1〜14のいずれか一項に記載の抗体又は抗原結合フラグメント。
16.実施形態1〜15のいずれか一項に記載の抗体又は抗原結合フラグメントを発現している、組換え細胞。
17.細胞はハイブリドーマである、実施形態16に記載の細胞。
18.抗体は組換え的に生成される、実施形態16に記載の細胞。
19.組換えBCMA×CD3二重特異性抗体又はそのBCMA×CD3二重特異性結合フラグメントであって、
a)第1の重鎖(HC1)、
b)第2の重鎖(HC2)、
c)第1の軽鎖(LC1)、と、
d)第2の軽鎖(LC2)を含み、
HC1はLC1と結合され、HC2はLC2と結合され、CD3に免疫特異的に結合する第1の抗原結合部位を形成するために、HC1は配列番号59、配列番号60、及び配列番号61を含み、LC1は配列番号62、配列番号63、及び配列番号64を含み、またBCMAに免疫特異的に結合する第2の抗原結合部位を形成するために、HC2は配列番号4、配列番号5、及び配列番号6を含み、LC2は配列番号24、配列番号25、及び配列番号26を含む、組換えBCMA×CD3二重特異性抗体又はそのBCMA×CD3二重特異性結合フラグメント。
20.配列番号55を含むHC1と、配列番号56を含むLC1と、配列番号65を含むHC2と、a)配列番号66又はb)配列番号76を含むLC2と、を含む、実施形態19に記載の組換えBCMA×CD3二重特異性抗体又はそのフラグメント。
21.抗体又は二重特異性結合フラグメントはIgGである、実施形態20に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
22.抗体又は二重特異性結合フラグメントはIgG4アイソタイプである、実施形態19、20、又は21のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
23.抗体又は二重特異性結合フラグメントは、表面プラズモン共鳴により測定するとき、少なくとも0.22nMの親和性でヒトBCMAに免疫特異的に結合する、実施形態19〜22に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
24.抗体又はその二重特異性結合フラグメントは、ヒト骨髄腫細胞の表面上のBCMAに結合する、実施形態19〜23に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
25.抗体又はその二重特異性結合フラグメントは、ヒト多発性骨髄腫細胞の表面上のBCMAに結合する、実施形態19〜24に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
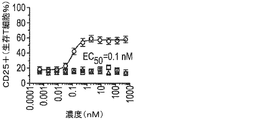
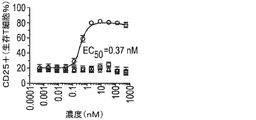
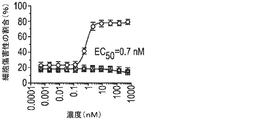
26.抗体又は二重特異性結合フラグメントは、約0.37nM未満のEC50でインビトロでヒトT細胞活性化を誘発する、実施形態19〜25に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
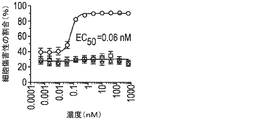
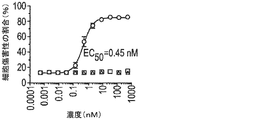
27.抗体又は二重特異性結合フラグメントは、約0.45nM未満のEC50でインビトロでBCMA発現細胞のT細胞依存性細胞傷害を誘発する、実施形態19〜26に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
28.抗体又は二重特異性結合フラグメントは、BCMAアゴニストではない、実施形態19〜27に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
29.抗体又は二重特異性結合フラグメントは、10nM未満の濃度でNF−κB活性化を変化させない、実施形態19〜28に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
30.実施形態19〜29のいずれか一項に記載の抗体又は二重特異性結合フラグメントを発現している、組換え細胞。
31.細胞はハイブリドーマである、実施形態30に記載の細胞。
32.がんを有する対象を処置するための方法であって、実施形態19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントの治療的に有効な量を、それを必要とする対象に、がんを処置するのに十分な時間投与することを含む、方法。
33.がん細胞の成長又は増殖を阻害するための方法であって、実施形態19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントの治療的に有効な量を投与し、がん細胞の成長又は増殖を阻害することを含む、方法。
34.T細胞をBCMA発現がん細胞にリダイレクトする方法であって、実施形態19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントの治療的に有効な量を投与し、T細胞をがんにリダイレクトすることを含む、方法。
35.がんは血液がんである、実施形態32、33、又は34に記載の方法。
36.血液がんはBCMA発現B細胞がんである、実施形態35に記載の方法。
37.BCMA発現B細胞がんは多発性骨髄腫である、実施形態36に記載の方法。
38.第2の治療剤を投与することを更に含む、実施形態32に記載の方法。
39.第2の治療剤は、化学療法剤又は標的化抗がん治療剤である、実施形態38に記載の方法。
40.化学療法剤は、シタラビン、アントラサイクリン、ヒスタミン二塩酸塩、又はインターロイキン2である、実施形態39に記載の方法。
41.実施形態19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントと、医薬的に許容され得る担体と、を含む、医薬組成物。
42.実施形態30〜31のいずれか一項に記載の細胞を培養することにより、実施形態19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントを生成するための方法。
43.実施形態19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントのHC1、HC2、LC1、又はLC2をコードする、単離された合成ポリヌクレオチド。
44.実施形態19〜29のいずれか一項に定義されるようなBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント、及び/又は請求項44に定義されるようなポリヌクレオチド、及びこれらのための包装、を含む、キット。
BCMA ECD分子
組換えヒト(h)BCMA−Fc融合タンパク質(カタログ#193−BC−050、hBCMA(配列番号1)のアミノ酸1〜54に相当する)及び組換えマウス(m)BCMA−Fc融合タンパク質(カタログ#593−BC−050、mBCMA(配列番号2)のアミノ酸1〜49に相当する)をR&D Systemsから入手した。組換えカニクイザルBCMAタンパク質は、遺伝子合成技術(米国特許第6,670,127号、同第6,521,427号)から得たcDNAから調製した。全てのタンパク質を、使用前にエンドトキシンについて検査し、ファージパニング試験のためにビオチン化した。これらの材料を結合性及び親和性の測定にも使用した。
可溶性hAPRIL(カタログ#DY884)、hBAFF(カタログ#2149−BF)、hBAFF−R(カタログ#1162−BR、hBAFF−Rのアミノ酸7〜71に相当する)、及びhTAC1(TACIのアミノ酸2〜166に相当する)をR&D Systemsから入手した。BAFF−R及びTAC1をSPR試験のためにビオチン化した。
ヒトBCMA(図1A)及びカニクイザルBCMA(図1B)を提供するベクターを、標準的な方法を使用してHEK293 expi細胞に一次的にトランスフェクションした。トランスフェクションされた293F付着細胞を、安定したプラスミド組込み用に選択した。ついで、単一細胞を選別し、BCMA表面受容体発現を、抗ヒトBCMA−PE標識抗体(R&D Systems FAB193P)を使用するFACSにより定量した。
ヒト免疫グロブリントランスジェニックラット株(OmniRat(登録商標)、OMT,Inc.)を使用して、ヒトBCMAモノクローナル抗体発現ハイブリドーマ細胞を発生させた。OmniRat(登録商標)は、完全なヒトIgL座(Jκ−Cκに結合した12のVκ及びJλ−Cλに結合した16のVλ)と共に、キメラヒト/ラットIgH座(ラットCH座に結合した自然構成での22のヒトVHセグメント、全てのヒトD及びJHセグメントからなる)を含む。(例えば、Osborn,et al.(2013)J Immunol 190(4):1481〜1490を参照のこと)。したがって、ラットは、ラットIgM又はκの発現の減少を示し、免疫付与に応じて、導入されたヒト重鎖及び軽鎖導入遺伝子がクラススイッチ及び体細胞突然変異を受け、高親和性ヒトIgGモノクローナル抗体を生成する。OmniRat(登録商標)の調製及び使用、並びにこのようなラットにより生じるゲノム修飾は、国際公開第14/093908号(Bruggemannら)に記載されている。
清澄化した培養上清中のBCMA抗体を、MabSelect SuRe Protein A樹脂により捕捉し、100mM酢酸ナトリウム(pH3.5)で溶出した。抗体を含む画分をプールし、2.5M Tris HCl(pH 7.2)で直ちに中和し、ついで1×D−PBS又は指定がある場合は他の所望のバッファにバッファ交換した。タンパク質濃度を、NanoDrop分光光度計でOD280を測定して決定し、その吸光係数を用いて計算した。抗体の純度及び均質性をSDS−PAGE及びSE−HPLCにより評価した。単量体がSE−HPLCにより95%未満であった場合、Superdex 200を用いたSECポリッシュ工程を行った。
操作されたBCMA発現細胞並びにがん細胞株U2392、EJM、MMIR、U266、OPM2、及びRPMI−18226に対するBCMA抗体の結合性を、MSD(Mesoscale)細胞結合アッセイ及びフローサイトメトリーを使用して評価した。スクリーニングアッセイの目的は、BCMAを発現している細胞に結合した抗体を特定すること、並びにカニクイザルBCMAを発現している細胞との交差反応性を特定することであった。
BCMA抗体パネルを、APRIL結合競合ELISAにおいてスクリーニングした。可溶性ヒトAprilをR&D systemsから購入し(カタログ#DY884)、固定されたBCMAへのAPRILの結合を阻害する抗BCMA抗体の能力を評価した。
特性試験の完了後、以下の特徴を有するように、M2ハイブリドーマから得られた抗体(BCMB69と命名)を決定した。
・組換えヒトBCMAに結合する
・組換えカニクイザルBCMAに結合する
・マウスBCMAへの弱い結合性を示す
・フローサイトメトリーにより測定するとき、HEK発現ヒトBCMA及びHEK発現カニクイザルBCMAの両方に結合する
・BCMA(U2392、EJM、MMIR、U266、OPM2、及びRPMI−18226)を発現するヒトがん株に結合する
・IC50=5.9nMでAPRIL結合を阻害する
結果として、BCMA×CD3二重特異性抗体を作製するために、BCMB69(表4及び表5)を発現させ、精製した。
抗体/抗原相互作用を原子的詳細において特徴付け、抗体の作用機序の理解を深め、いずれか必要な抗体操作の試行を支持するために、1つの抗BCMA抗体(BCMB69)の結晶構造を遊離Fab形態並びにヒトBCMAに結合した場合において決定した。
Hisタグを付けたBCMA Fab(配列番号75及び76、以降は単にBCMB69 Fabとする)をHEK293細胞で発現させ、親和性及びサイズ排除クロマトグラフィーを使用して精製した。Fabを130mM NaCl、20mM MES(pH7.4)中に得た。
BCMA/BCMB69 Fab複合体
BCMAとBCMB69 Fabとを3.8:1のモル比(BCMA過剰)で4℃で約16時間混合し、一方で20mM Hepes(pH7.5)にバッファ交換することにより、Fab/抗原複合体を調製した。°その後、20mM Hepes(pH7.5)中で51〜63mM NaClのグラジエントを用いて複合体をモノS 5/50カラムから溶出させ、17mg/mLに濃縮した。X線回折に適した結晶を、マイクロ播種を用いたシッティングドロップ蒸気拡散法を20℃で使用して、25%PEG 3kDa、0.2M MgCl2、0.1M Mes(pH6.5)から得られた。
BCMB69 Fabを更に精製することなく9mg/mLに濃縮した。X線回折に適した結晶を、シッティングドロップ蒸気拡散法を20℃で用いて、2M(NH4)2SO4、5%MPD、0.1M Mes(pH6.5)から得た。
X線データ収集のため、結晶を、20%グリセロールを添加した対応する母液を含むクライオプロテクタント溶液中に数秒間浸漬した後、液体窒素中で瞬間凍結した。BCMA/BCMB69複合体のX線回析データは、Canadian Light Source(CLS)のビームラインCMCF−08IDでRayonix 300HS CCD検出器を使用して収集したが、遊離BCMB69 FabのX線データは、Argonne National LaboratoryのAdvanced Photon Source(APS)のビームライン17−IDでDectris Pilatus 6M Pixel Array検出器を使用して収集した。回折データをプログラムHKLで処理した(Otwinowski,Z.& Minor,W.(1997).Processing of X−ray diffraction data collected in oscillation mode.Methods in Enzymology 276:307〜326.)。
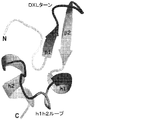
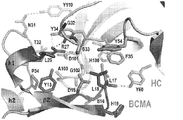
BCMB69は、BCMAのβ−ヘアピン領域内の残基(残基Y13−H19)及びヘリックス−ループ−ヘリックス領域内の残基(残基L26、R27、及びN31−L35)から構成される立体構造エピトープを認識する(図3及び4)。BCMB69エピトープは、BCMA上の約830Å2の面積からなり、リガンド結合DXLモチーフ(β−ヘアピンのI型ターン内の残基D15−L18)を含み、これは抗体の相補性決定領域(CDR)に覆われた浅い空洞内に突き出している。DXLターンの先端にあるロイシン17は、抗体の空洞内に完全に埋没し、BCMB69との広範な相互作用を有する。別の主要なエピトープ残基はArg27であり、これは310−ヘリックスh1上にあり、重鎖CDRといくつかの水素結合接触を形成する。
BCMB69は、MMがん細胞に対するT細胞のリダイレクトに関する候補である。BCMB69×抗CD3二重特異性抗体により媒介されるがん細胞の殺傷は、BCMB69エピトープの構造及び位置により弱められるとは推測されない。エピトープの接触可能位置は、BCMB69 Fabアームを膜結合型BCMAに結合させるが、他方のFabアームは、依然としてT細胞膜内のCD3に結合している。
非結合BCMB69可変ドメインの翻訳後修飾モチーフ及び凝集リスクの計算評価は、D101−G102残基(CDR−H3)の異性化の媒体リスクと、凝集リスクを有し得るCDR領域内の486Å2の疎水性パッチとを示す。パッチ内で最も露出した疎水性残基は、I58(CDR−H2)、F35(CDR−H1)、及びV104(CDR−H3)である(V104は、Fv相同性モデルには関連したが、Fab結晶構造には関連しなかった)。BCMB69可変ドメインにおける異性化及び凝集リスクを排除するために、様々な突然変異を合理的に設計した(表7)。
BCMA抗体は、Fc置換S228P、L234A、及びL235A(EUインデックスによる番号付け)を有するIgG4として発現された。配列番号55及び配列番号56の配列をそれぞれ有する重鎖及び軽鎖を含む、単特異性抗CD3抗体のCD3B19も生成した。
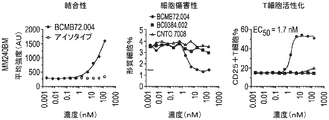
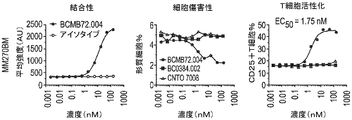
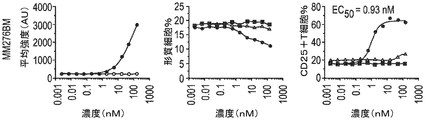
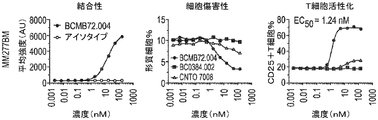
表面プラズモン共鳴(SPR)を使用して、CD3二重特異性抗体の生成に使用されるBCMA抗体のヒトBCMA親和性の値を測定した。SPRのために従ったプロトコルは、実施例4に記載したプロトコルと同様であった。表11に示した結果は、全てのサンプルが様々な親和性で単量体BCMA抗原に結合したことを示す。親mAb(BCMB69)は、〜1.4nMの結合親和性を有した。BCMB117及びBCMB128は、BCMB69の範囲内の親和性を有したが、BCMB123、BCMB129、BCMB176、及びBCMB177は、オフ速度が速いために比較的弱い親和性を有した(3〜15倍)。データの再現性を評価するために、全てのサンプルを少なくとも3回実施し、標準偏差を記録した。
BCMA×CD3抗体により媒介されるT細胞の活性化を評価した。簡潔に言えば、BCMB72(BCMA×CD3)及びコントロール抗体(BCMA×無及び無×CD3)をPBSで800μg/mLに希釈した。96ウェルU底プレートにおいてPBSで4倍系列希釈して用量設定を調製した。最後のカラムをPBSのみとして残した(溶媒コントロール)。
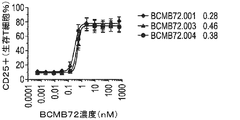
悪性バックグラウンドの種々のBCMA+細胞株に結合するBCMB72のEC50値を評価した。簡潔に言えば、二重特異性抗体BCMB72(BCMA×CD3)をPBSで750μg/mLに希釈した。96ウェルU底プレートにおいてPBSで3倍系列希釈して用量設定を調製した。最後のカラムをPBSのみとして残した(溶媒コントロール)。
白血球でのBCMAの発現及びBCMB72の結合性を、エクスビボで3人の正常ヒトドナー由来の全血において評価した。簡潔に言えば、正常ヒトドナー由来の新鮮末梢血を試験前にヘパリン被覆管に保存した。血液を100μLの一定分量で96ウェルU底プレートにピペットで移した。染色抗体を、試験の集計表に示したように、マスターミックスで調製した。マスターミックスを、BCMAに対する抗体(すなわち、BCMB72)と共に血液に直接添加した。室温で30分間のインキュベーション後、血液を有するプレートを4℃において1350rpmで3分間遠心分離した。上清血漿を捨て、ペレットを4回連続繰り返して赤血球溶解に供し、各洗浄の間に5分間インキュベートした。溶解の完了後、ペレットをPBSで1回洗浄し、ついで1:200のLive/Dead近赤外染料及び1:50の抗IgG4 PE(BCMB72を有するウェルについてのみ)を有するPBSで染色した。プレートを更に室温で15分間インキュベートした。その後、サンプルを200μLのFACSバッファで洗浄し、最後にLSRFortessaでの分析用に150μLのFACSバッファで再構成した。各ウェルから約100,000のイベントを収集した。分析をFlowJo 7.6で行った。
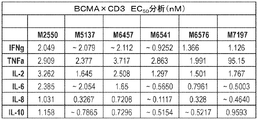
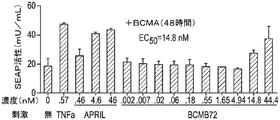
T細胞媒介性殺傷アッセイから得られた上清におけるサイトカインプロファイルを、BCMB72及びコントロール抗体を使用して評価した。T細胞及び抗体を、T細胞媒介性細胞傷害アッセイで行ったように播種した(実施例10参照)。48時間のインキュベーション後、細胞上清を採取し、MSDに基づくELISAを使用して異なる(10/30Plex)サイトカインを測定した。サイトカイン濃度をpg/mLとして表し、データのグラフ化及びフィッティングは、可変勾配(4パラメータ)関数を有する非線形回帰を使用してGraphPad Prism 6で行った。6人のT細胞ドナーを用いたRPMI8226細胞株から得た6種類のサイトカインのEC50値を図13に示す。データは、T細胞の活性化から得られた有意なサイトカイン放出を示す。コントロール抗体では、サイトカイン放出が少ない/ないことが観察された(データは示していない)。
異なる細胞において及び異なる発現方式の下で産生された二重特異性抗体は、活性が異なり得る。したがって、HEK細胞(一過性発現)又はCHO細胞(一過性若しくは安定発現)で産生されたBCMB72のインビトロでの有効性を評価した。
BAFF及びAPRILは共に、2つの受容体BCMA(B細胞成熟抗原、TNFRSF 17)及びTACI(膜貫通活性化因子及びCAML相互作用体、TNFRSF 13b)に結合する。BCMAの結合は、JNK及びP38 MAPKシグナル伝達経路を活性化する。BCMA×CD3二重特異性抗体のBCMB72は、BCMAに向けてアゴニスト作用を及ぼし得る可能性がある。この試験は2つの部分を含んだ。1.APRIL又はBAFF処理後のH929又はMM1.R細胞におけるP38a MAPKの変化をモニタするために、簡単なウエスタン分析アッセイを開発すること。2.新たに開発されたアッセイを使用して、BCMB72がBCMAに向けていずれかのアゴニスト作用を有するかどうかを調べること。
H929又はMM1.R細胞を、処理前に37℃において5%CO2の存在下で24時間、血清を含まないRPMI培地に1.5e6/mLで播種した。処理日に、細胞を遠沈させ、血清を含まないRPMI中に1.5e6/mLで再懸濁した。経時変化アッセイでは、細胞を10本の管に管あたり5mLを分取した。各管の細胞を、1000ng/mLのAPRIL(R&D Systems、カタログ#5860−AP−010)又は1000ng/mLのBAFF(R&D Systems、カタログ#2149−BF−010)を用いてそれぞれ0、5、15、30、及び60分間、37℃において5%CO2の存在下で処理した。インキュベーション後、細胞を直ちにペレット状にし、細胞溶解物を形成するために−80℃で凍結した。BCMB72のアゴニスト作用アッセイについて、H929細胞処理群を表13に列記した。BCMB72のアゴニスト作用アッセイは2回行った。
ホスファターゼ及びプロテアーゼ阻害剤を含むRIPAバッファで細胞を溶解した。タンパク質濃度を、BioRad DC Protein Assay(BioRad #500−0112)及びウシ血清アルブミン標準を用いてSpectraMax Plus 384マイクロプレートリーダー(Molecular Devices,Sunnyvale,CA,USA)で測定した。
Simple Western分析を、ProteinSimpleユーザーマニュアルに従ってWes−Rabbit(12−230KDa)Master kit(ProteinSimple #PS−MK01)を用いて行った。簡潔に言うと、細胞溶解物サンプルをマスターミックスと混合して、1×サンプルバッファ、1×蛍光分子量マーク、及び40mMジチオスレイトール(DTT)の最終濃度にし、ついで95℃で5分間加熱した。サンプル、阻害試薬、一次抗体蛍光体−p38 MAPK(ThermoFisher:VWR# MA5−15182)又はActin−beta(Cell Signaling,#8457S)、HRP結合二次抗体、化学発光基質、並びに分離及び積層マトリックスを、Simple Wesマイクロプレート内の指定のウェルに分配し、プレートの読み込み後、分離電気泳動及び免疫検出工程をキャピラリーシステムで実施したが、これらは完全自動化であった。電気泳動中、タンパク質は、積層及び分離マトリックスにより分子量に基づいて分離され、独自の光活性化捕獲化学を用いてキャピラリー壁に固定された。一次抗体を抗体希釈剤II(ProteinSimple #042−203)で1:50に希釈した。標的タンパク質を、一次抗体で60分間、ついでHRP結合二次抗体を用いて免疫学的検出を行った。Simon−simple Western分析を室温で行い、機器のデフォルト設定を使用した。デジタル画像をCompassソフトウェア(ProteinSimple)を用いて分析し、検出タンパク質の定量データを分子量、シグナル/ピーク強度、及びピーク面積として記録した。
経時変化試験から得られた情報に基づいて、15分間のインキュベーション終点を使用してH929細胞でBCMB72アゴニストアッセイを行った。p38 MAPKシグナルをヒトベータアクチンシグナルにより正規化した。2つのアッセイから得られた正規化p38 MAPKシグナルの平均を図15に示す。BCMB72アゴニストアッセイは、BCMB72がH929細胞においてBCMAに向けたアゴニスト作用を有していないことを実証した。
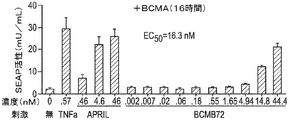
BCMAは、内因性リガンドに応答してNF−κBシグナル伝達を生じさせ得る表面受容体である。NF−κB経路活性化におけるBCMAに結合したBCMB72の影響を、NFκBプロモータの下でアルカリホスファターゼ(SEAP)を発現するBCMA発現レポーター細胞株を使用して評価した。
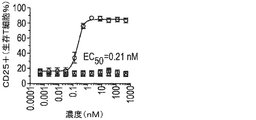
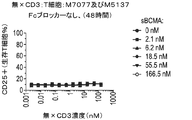
BCMAの細胞外ドメイン(ECD)は、溶液中で三量体を形成し得る。したがって、多数の二重特異性抗体が、標的細胞の不在下でBCMA ECD三量体及び架橋TCR複合体に結合できる可能性がある。これは同様にして、標的非依存性でT細胞を活性化し得る。この試験は、外部添加したBCMAのECDが、標的細胞との相互作用なしにCD25発現濃度でT細胞活性化を誘発し得るかどうかを調べた。
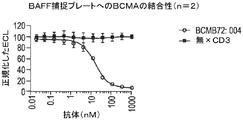
可溶性BCMA ECDは、BCMA×CD3抗体のシンクとして働き得るが、APRIL及びBAFFは、表面受容体とBCMA×CD3抗体との相互作用の競合的阻害剤であり得る。BCMB72依存性細胞殺傷のインビトロでの細胞傷害能における可溶性BCMA ECD並びに内因性リガンドAPRIL及びBAFFの影響を、固定細胞株H929及び正常ドナーM7077由来の汎T細胞を用いたT細胞リダイレクトアッセイで評価した。
2つのTNFリガンド、APRIL及びBAFFは、BCMAに結合し、シグナル伝達カスケードを誘発し、細胞の生存及び増殖をもたらし得る。BCMAの細胞外ドメインは、これら2つのリガンド、並びにこのモチーフに対して挙げられた抗体に結合する、短い54個のアミノ酸フラグメントである。ここでは、これらのリガンドのBCMB72に対する競合性を評価した。
多発性骨髄腫患者由来の一次サンプルにおけるBCMB72の能力を評価するために、5人の患者由来の凍結骨髄の多発性骨髄腫サンプル及び健康ドナー由来のT細胞を使用した細胞傷害性殺傷アッセイでこの抗体を試験した。抗体結合性及びT細胞活性化能も測定した。
96ウェルU底プレートにおいてウェルあたり100μLの細胞懸濁液を分取し、ついで95μLの培地を分取した。次に、5μLのBCMB72の系列希釈又はコントロールをウェルに添加し、プレートを4℃で1時間インキュベートした。染色後、細胞を1,200rpmで3分間遠心分離し、200μLのPBSで1回洗浄した。細胞を再度遠心分離し、上清を捨てた後、ペレットを50μLの近赤外Live/Dead染料(1:200希釈物)、抗ヒトIgG4 Fc PE抗体(1:50希釈物)、抗CD138(MI15 1:50希釈物及びDL−101 1:50希釈物)で再構成し、暗所において室温で20分間インキュベートした。その後、細胞を遠心分離し、200μLのFACSバッファで洗浄し、最後に150μLのFACSバッファで再構成した。CD138+ MNCでのBCMB72の結合強度について、FACSCanto II及びFlowJo 7.6を使用してサンプルを分析した。データのフィッティングは、最小2乗法を用いた可変勾配(4パラメータ)関数を有する非線形回帰を使用してGraphPad Prism 6で行った。
1×10^5個の標的細胞を96ウェルU底プレートのウェルに添加し、ついで1×10^5個のT細胞を添加した(5:1のおよそのエフェクター:標的比、ただし、骨髄由来の肥満細胞中の形質細胞計数を平均20%とする)。標的及びT細胞を混合した後、5μLのBCMB72希釈物を各ウェルに添加した。プレートを37℃において5%CO2で48時間インキュベートした。
図20は、CD138+形質細胞の喪失により立証されるように、BCMB72が48時間後に用量依存的に全ての患者サンプルに結合し、その殺傷を誘発したことを示す。T細胞活性化データは、予想どおり殺傷データとよく相関している。T細胞活性化の平均EC50は、1nMの範囲内であった。これらのデータは、BCMB72がインビトロで原発性多発性骨髄腫の骨髄細胞を殺傷できることを立証している。
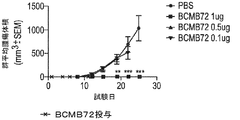
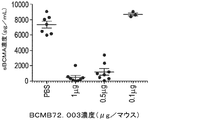
この試験は、PBMC(末梢血単核球)ヒト化NSG(NOD SCID Gamma)マウスでのH929ヒト多発性骨髄腫(MM)異種移植片の腫瘍形成予防におけるBCMB72の効果を評価した。NSGマウスは、成熟機能性T細胞、B細胞、及びナチュラルキラー(NK)細胞を欠失する免疫不全状態株である。試験7日前に、同齢雌NSGマウスに1×107個のヒトPBMCを静脈内注射した。PBMC接種後1日目に、各マウスにH929ヒトMM細胞(200μLのPBS中に5×106個の細胞)を右後背面脇腹に皮下移植し、ついでPBS並びにBCMB72 0.1μg(0.005mg/kg)、0.5μg(0.025mg/kg)、及び1μg(0.05mg/kg)/動物を静脈内(IV)投与した。合計5つの治療について、PBSコントロール及びBCMB72を1日おき又は2日おきに投与した。H929 sc腫瘍は、腫瘍細胞移植後、早ければ8日目にPBS及び0.1μg BCMB72治療群で検出可能であった。これら2つの群の腫瘍は、22日目に平均腫瘍体積が>500mm3になるまで成長し続けた。24日目までに、PBSコントロール群の平均腫瘍体積は1000mm3を超えていた。興味深いことに、sc H929腫瘍は、0.5μg及び1μgのBCMB72で治療したマウスでは成長しなかった(図21)。したがって、BCMB72は、0.5及び1μg/動物で治療した全ての動物でH929ヒトMM異種移植片の腫瘍形成を阻害した。
この試験は、H929異種移植片マウス由来の血清中の可溶性BCMA濃度を定量するために、及び可溶性BCMA濃度をこれらの動物における腫瘍の負担に相関させるために設計された。
Claims (44)
- BCMAに免疫特異的に結合する組換え抗体、又はその抗原結合フラグメントであって、前記抗体は重鎖及び軽鎖を有し、前記重鎖は、
a.配列番号4のアミノ酸配列を有する重鎖相補性決定領域1(CDR1)、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号6のアミノ酸配列を有する重鎖CDR3、
b.配列番号4のアミノ酸配列を有する重鎖CDR1、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号6のアミノ酸配列を有する重鎖CDR3、
c.配列番号7のアミノ酸配列を有する重鎖CDR1、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号6のアミノ酸配列を有する重鎖CDR3、
d.配列番号4のアミノ酸配列を有する重鎖CDR1、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号19のアミノ酸配列を有する重鎖CDR3、
e.配列番号4のアミノ酸配列を有する重鎖CDR1、配列番号8のアミノ酸配列を有する重鎖CDR2、及び配列番号6のアミノ酸配列を有する重鎖CDR3、
f.配列番号13のアミノ酸配列を有する重鎖CDR1、配列番号5のアミノ酸配列を有する重鎖CDR2、及び配列番号19のアミノ酸配列を有する重鎖CDR3、
g.配列番号13のアミノ酸配列を有する重鎖CDR1、配列番号8のアミノ酸配列を有する重鎖CDR2、及び配列番号19のアミノ酸配列を有する重鎖CDR3、を含む、組換え抗体、又はその抗原結合フラグメント。 - 前記抗体は、配列番号24のアミノ酸配列を有する軽鎖CDR1、配列番号25のアミノ酸配列を有する軽鎖CDR2、及び配列番号26のアミノ酸配列を有する軽鎖CDR3、を更に含む、請求項1に記載の抗体、又はその抗原結合フラグメント。
- (a)の抗体の重鎖は、配列番号27のアミノ酸配列を含み、(b)の抗体の重鎖は、配列番号57のアミノ酸配列を含み、(f)の抗体の重鎖は、配列番号34のアミノ酸配列を含み、(k)の抗体の重鎖は、配列番号39のアミノ酸配列を含み、(l)の抗体の重鎖は、配列番号40のアミノ酸配列を含み、(m)の抗体の重鎖は、配列番号58のアミノ酸配列を含み、又は(n)の抗体の重鎖は、配列番号43のアミノ酸配列を含む、請求項1に記載の抗体又は抗原結合フラグメント。
- 前記抗体の軽鎖は、配列番号28のアミノ酸配列を含む、請求項2又は3に記載の抗体又は抗原結合フラグメント。
- 前記抗体又はその抗原結合フラグメントは、ヒトBCMAの細胞外ドメインに結合する、請求項1〜4のいずれか一項に記載の抗体又は抗原結合フラグメント。
- 前記抗体又は抗原結合フラグメントは、ヒトの抗体又は抗原結合フラグメントである、請求項1〜5のいずれか一項に記載の抗体又は抗原結合フラグメント。
- 前記抗原結合フラグメントは、Fabフラグメント、Fab2フラグメント、又は一本鎖抗体である、請求項1〜6のいずれか一項に記載の抗原結合フラグメント。
- 前記抗体又はその抗原結合フラグメントは、BCMA及びAPRILの相互作用を阻害する、請求項1〜7のいずれか一項に記載の抗体又は抗原結合フラグメント。
- 前記抗体又は抗原結合フラグメントは、ELISAにより測定するとき、BCMA及びAPRILの相互作用について約5.9nMのIC50を示す、請求項8に記載の抗体又は抗原結合フラグメント。
- 前記抗体又はその抗原結合フラグメントはIgGである、請求項1〜9のいずれか一項に記載の抗体又は抗原結合フラグメント。
- IgG4アイソタイプである、請求項1〜10のいずれか一項に記載の抗体又は抗原結合フラグメント。
- 前記IgG4は、そのFc領域中にS228P置換、L234A置換、及びL235A置換を有する、請求項11に記載の抗体。
- 前記抗体又はその抗原結合フラグメントは、ヒトBCMAに免疫特異的に結合し、カニクイザルBCMAに交差反応する、請求項1〜12のいずれか一項に記載の抗体又は抗原結合フラグメント。
- 前記抗体又はその抗原結合フラグメントは、ヒト骨髄腫細胞の表面上のBCMAに結合する、請求項1〜13のいずれか一項に記載の抗体又は抗原結合フラグメント。
- 前記抗体又はその抗原結合フラグメントは、ヒト多発性骨髄腫細胞の表面上のBCMAに結合する、請求項1〜14のいずれか一項に記載の抗体又は抗原結合フラグメント。
- 請求項1〜15のいずれか一項に記載の抗体又は抗原結合フラグメントを発現している、組換え細胞。
- 前記細胞はハイブリドーマである、請求項16に記載の細胞。
- 前記抗体は組換え的に生成される、請求項16に記載の細胞。
- 組換えBCMA×CD3二重特異性抗体又はそのBCMA×CD3二重特異性結合フラグメントであって、
a)第1の重鎖(HC1)と、
b)第2の重鎖(HC2)と、
c)第1の軽鎖(LC1)と、
d)第2の軽鎖(LC2)と、を含み、
HC1はLC1と結合され、HC2はLC2と結合され、CD3に免疫特異的に結合する第1の抗原結合部位を形成するために、HC1は配列番号59、配列番号60、及び配列番号61を含み、LC1は配列番号62、配列番号63、及び配列番号64を含み、またBCMAに免疫特異的に結合する第2の抗原結合部位を形成するために、HC2は配列番号4、配列番号5、及び配列番号6を含み、LC2は配列番号24、配列番号25、及び配列番号26を含む、組換えBCMA×CD3二重特異性抗体又はそのBCMA×CD3二重特異性結合フラグメント。 - 配列番号55を含むHC1と、配列番号56を含むLC1と、配列番号65を含むHC2と、配列番号76を含むLC2と、を含む、請求項19に記載の組換えBCMA×CD3二重特異性抗体又はそのフラグメント。
- 前記抗体又は二重特異性結合フラグメントはIgGである、請求項20に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 前記抗体又は二重特異性結合フラグメントはIgG4アイソタイプである、請求項19、20、又は21のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 前記抗体又は二重特異性結合フラグメントは、表面プラズモン共鳴により測定するとき、少なくとも0.22nMの親和性でヒトBCMAに免疫特異的に結合する、請求項19〜22に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 前記抗体又はその二重特異性結合フラグメントは、ヒト骨髄腫細胞の表面上のBCMAに結合する、請求項19〜23に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 前記抗体又はその二重特異性結合フラグメントは、ヒト多発性骨髄腫細胞の表面上のBCMAに結合する、請求項19〜24に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 前記抗体又は二重特異性結合フラグメントは、約0.37nM未満のEC50でインビトロでヒトT細胞活性化を誘発する、請求項19〜25に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 前記抗体又は二重特異性結合フラグメントは、約0.45nM未満のEC50でインビトロでBCMA発現細胞のT細胞依存性細胞傷害を誘発する、請求項19〜26に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 前記抗体又は二重特異性結合フラグメントは、BCMAアゴニストではない、請求項19〜27に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 前記抗体又は二重特異性結合フラグメントは、10nM未満の濃度でNF−κB活性化を変化させない、請求項19〜28に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント。
- 請求項19〜29のいずれか一項に記載の抗体又は二重特異性結合フラグメントを発現している、組換え細胞。
- 前記細胞はハイブリドーマである、請求項30に記載の細胞。
- がんを有する対象を処置するための方法であって、請求項19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントの治療的に有効な量を、それを必要とする対象に、がんを処置するのに十分な時間投与することを含む、方法。
- がん細胞の成長又は増殖を阻害するための方法であって、請求項19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントの治療的に有効な量を投与し、がん細胞の成長又は増殖を阻害することを含む、方法。
- T細胞をBCMA発現がん細胞にリダイレクトする方法であって、請求項19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントの治療的に有効な量を投与し、T細胞をがんにリダイレクトすることを含む、方法。
- 前記がんは血液がんである、請求項32、33、又は34に記載の方法。
- 前記血液がんはBCMA発現B細胞がんである、請求項35に記載の方法。
- 前記BCMA発現B細胞がんは多発性骨髄腫である、請求項36に記載の方法。
- 第2の治療剤を投与することを更に含む、請求項32に記載の方法。
- 前記第2の治療剤は、化学療法剤又は標的化抗がん治療剤である、請求項38に記載の方法。
- 前記化学療法剤は、シタラビン、アントラサイクリン、ヒスタミン二塩酸塩、又はインターロイキン2である、請求項39に記載の方法。
- 請求項19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントと、医薬的に許容され得る担体と、を含む、医薬組成物。
- 請求項30〜31のいずれか一項に記載の細胞を培養することにより、請求項19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントを生成するための方法。
- 請求項19〜29のいずれか一項に記載のBCMA×CD3二重特異性抗体又は二重特異性結合フラグメントのHC1、HC2、LC1、又はLC2をコードする、単離された合成ポリヌクレオチド。
- 請求項19〜29のいずれか一項に定義されるようなBCMA×CD3二重特異性抗体又は二重特異性結合フラグメント、及び/又は請求項44に定義されるようなポリヌクレオチド、及びこれらのための包装、を含む、キット。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021126285A JP7194240B2 (ja) | 2015-08-17 | 2021-07-30 | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 |
| JP2022196582A JP2023027228A (ja) | 2015-08-17 | 2022-12-08 | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562206246P | 2015-08-17 | 2015-08-17 | |
| US62/206,246 | 2015-08-17 | ||
| PCT/US2016/047146 WO2017031104A1 (en) | 2015-08-17 | 2016-08-16 | Anti-bcma antibodies, bispecific antigen binding molecules that bind bcma and cd3, and uses thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021126285A Division JP7194240B2 (ja) | 2015-08-17 | 2021-07-30 | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2018525005A true JP2018525005A (ja) | 2018-09-06 |
Family
ID=56740579
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018508695A Pending JP2018525005A (ja) | 2015-08-17 | 2016-08-16 | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 |
| JP2021126285A Active JP7194240B2 (ja) | 2015-08-17 | 2021-07-30 | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 |
| JP2022196582A Pending JP2023027228A (ja) | 2015-08-17 | 2022-12-08 | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021126285A Active JP7194240B2 (ja) | 2015-08-17 | 2021-07-30 | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 |
| JP2022196582A Pending JP2023027228A (ja) | 2015-08-17 | 2022-12-08 | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 |
Country Status (40)
| Country | Link |
|---|---|
| US (1) | US10072088B2 (ja) |
| EP (2) | EP3337824B1 (ja) |
| JP (3) | JP2018525005A (ja) |
| KR (1) | KR20180040671A (ja) |
| CN (1) | CN108350076B (ja) |
| AR (1) | AR105724A1 (ja) |
| AU (1) | AU2016308567B2 (ja) |
| BR (1) | BR112018003017A2 (ja) |
| CA (1) | CA2995754A1 (ja) |
| CL (1) | CL2018000431A1 (ja) |
| CO (1) | CO2018001524A2 (ja) |
| CY (1) | CY1123297T1 (ja) |
| DK (1) | DK3337824T3 (ja) |
| EA (1) | EA201890513A1 (ja) |
| EC (1) | ECSP18019568A (ja) |
| ES (1) | ES2814550T3 (ja) |
| FI (1) | FIC20230012I1 (ja) |
| FR (2) | FR23C1012I1 (ja) |
| HR (1) | HRP20201375T1 (ja) |
| HU (2) | HUE050556T2 (ja) |
| IL (2) | IL298041A (ja) |
| JO (1) | JO3799B1 (ja) |
| LT (2) | LT3337824T (ja) |
| MA (1) | MA53750A (ja) |
| MX (2) | MX2018002043A (ja) |
| MY (1) | MY191325A (ja) |
| NI (1) | NI201800027A (ja) |
| NL (1) | NL301219I2 (ja) |
| PE (1) | PE20180795A1 (ja) |
| PH (1) | PH12018500361A1 (ja) |
| PL (1) | PL3337824T3 (ja) |
| PT (1) | PT3337824T (ja) |
| RS (1) | RS60755B1 (ja) |
| SI (1) | SI3337824T1 (ja) |
| SV (1) | SV2018005634A (ja) |
| TW (2) | TWI777924B (ja) |
| UA (1) | UA127515C2 (ja) |
| UY (1) | UY36859A (ja) |
| WO (1) | WO2017031104A1 (ja) |
| ZA (1) | ZA201801789B (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020537644A (ja) * | 2017-10-13 | 2020-12-24 | ハープーン セラピューティクス,インク. | 三重特異性タンパク質と使用方法 |
Families Citing this family (100)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB201317928D0 (en) * | 2013-10-10 | 2013-11-27 | Ucl Business Plc | Molecule |
| TWI796283B (zh) | 2015-07-31 | 2023-03-21 | 德商安美基研究(慕尼黑)公司 | Msln及cd3抗體構築體 |
| TWI829617B (zh) | 2015-07-31 | 2024-01-21 | 德商安美基研究(慕尼黑)公司 | Flt3及cd3抗體構築體 |
| US11698369B2 (en) | 2016-01-12 | 2023-07-11 | Oncotracker, Inc. | Methods for monitoring immune status of a subject |
| EA039859B1 (ru) | 2016-02-03 | 2022-03-21 | Эмджен Рисерч (Мюник) Гмбх | Биспецифические конструкты антител, связывающие egfrviii и cd3 |
| SG10202007836WA (en) | 2016-02-17 | 2020-09-29 | Seattle Genetics Inc | Bcma antibodies and use of same to treat cancer and immunological disorders |
| CN109476742B (zh) * | 2016-05-09 | 2023-04-14 | 百时美施贵宝公司 | Tl1a抗体及其用途 |
| US11623958B2 (en) | 2016-05-20 | 2023-04-11 | Harpoon Therapeutics, Inc. | Single chain variable fragment CD3 binding proteins |
| BR112018073739A2 (pt) | 2016-05-20 | 2019-02-26 | Harpoon Therapeutics, Inc. | proteína de ligação de albumina sérica de domínio único |
| TWI781108B (zh) | 2016-07-20 | 2022-10-21 | 比利時商健生藥品公司 | 抗gprc5d抗體、結合gprc5d與cd3之雙特異性抗原結合分子及其用途 |
| BR112019004873A2 (pt) | 2016-09-14 | 2019-06-11 | Teneobio Inc | anticorpos de ligação a cd3 |
| AU2017382251A1 (en) | 2016-12-21 | 2019-07-11 | Teneobio, Inc. | Anti-BCMA heavy chain-only antibodies |
| US20190375815A1 (en) | 2017-01-31 | 2019-12-12 | Novartis Ag | Treatment of cancer using chimeric t cell receptor proteins having multiple specificities |
| EP3589662A4 (en) | 2017-02-28 | 2020-12-30 | Harpoon Therapeutics, Inc. | INDUCTIBLE MONOVALENT ANTIGBINDING PROTEIN |
| US20200179511A1 (en) | 2017-04-28 | 2020-06-11 | Novartis Ag | Bcma-targeting agent, and combination therapy with a gamma secretase inhibitor |
| US20200055948A1 (en) | 2017-04-28 | 2020-02-20 | Novartis Ag | Cells expressing a bcma-targeting chimeric antigen receptor, and combination therapy with a gamma secretase inhibitor |
| US10543271B2 (en) | 2017-05-12 | 2020-01-28 | Harpoon Therapeutics, Inc. | Mesothelin binding proteins |
| US11635435B2 (en) | 2017-06-13 | 2023-04-25 | Oncotracker, Inc. | Diagnostic, prognostic, and monitoring methods for solid tumor cancers |
| KR20200018498A (ko) * | 2017-06-20 | 2020-02-19 | 테네오바이오, 인코포레이티드 | 항-bcma 중쇄-단독 항체 |
| CN117567624A (zh) * | 2017-06-20 | 2024-02-20 | 特纳奥尼股份有限公司 | 仅有重链的抗bcma抗体 |
| WO2019000223A1 (en) * | 2017-06-27 | 2019-01-03 | Nanjing Legend Biotech Co., Ltd. | ENABLERS OF IMMUNE EFFECTOR CELLS OF CHIMERIC ANTIBODIES AND METHODS OF USE THEREOF |
| US10988546B2 (en) | 2017-08-01 | 2021-04-27 | Medimmune, Llc | BCMA monoclonal antibody-drug conjugate |
| WO2019035938A1 (en) | 2017-08-16 | 2019-02-21 | Elstar Therapeutics, Inc. | MULTISPECIFIC MOLECULES BINDING TO BCMA AND USES THEREOF |
| KR20200047660A (ko) * | 2017-09-01 | 2020-05-07 | 다나-파버 캔서 인스티튜트 인크. | 암의 치료를 위한 bcma 및 taci 항원에 특이적인 면역원성 펩타이드 |
| CN111629749A (zh) | 2017-10-18 | 2020-09-04 | 诺华股份有限公司 | 用于选择性蛋白质降解的组合物和方法 |
| EP3703688A2 (en) * | 2017-11-01 | 2020-09-09 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for b-cell maturation antigen |
| JP2021502979A (ja) | 2017-11-15 | 2021-02-04 | ノバルティス アーゲー | Bcmaターゲティングキメラ抗原受容体、cd19ターゲティングキメラ抗原受容体及び併用療法 |
| US20200371091A1 (en) | 2017-11-30 | 2020-11-26 | Novartis Ag | Bcma-targeting chimeric antigen receptor, and uses thereof |
| WO2019136432A1 (en) | 2018-01-08 | 2019-07-11 | Novartis Ag | Immune-enhancing rnas for combination with chimeric antigen receptor therapy |
| AU2019215031A1 (en) | 2018-01-31 | 2020-08-20 | Novartis Ag | Combination therapy using a chimeric antigen receptor |
| EP3752203A1 (en) | 2018-02-13 | 2020-12-23 | Novartis AG | Chimeric antigen receptor therapy in combination with il-15r and il15 |
| EP3774901A1 (en) * | 2018-03-26 | 2021-02-17 | Sutro Biopharma, Inc. | Anti-bcma receptor antibodies, compositions comprising anti bcma receptor antibodies and methods of making and using anti-bcma antibodies |
| SG11202010064QA (en) * | 2018-04-13 | 2020-11-27 | Affimed Gmbh | Nk cell engaging antibody fusion constructs |
| CN112368019A (zh) | 2018-05-16 | 2021-02-12 | 詹森生物科技公司 | 治疗癌症并增强t细胞重定向治疗剂的功效的方法 |
| PE20210320A1 (es) * | 2018-06-01 | 2021-02-16 | Novartis Ag | Moleculas de union contra bcma y usos de las mismas |
| CA3100724A1 (en) | 2018-06-13 | 2019-12-19 | Novartis Ag | B-cell maturation antigen protein (bcma) chimeric antigen receptors and uses thereof |
| CN112243381A (zh) * | 2018-06-14 | 2021-01-19 | 蓝鸟生物公司 | 抗bcma car抗体、缀合物和使用方法 |
| CA3100187A1 (en) * | 2018-06-26 | 2020-01-02 | Abl Bio, Inc. | Anti-bcma antibody and use thereof |
| DE202019005887U1 (de) | 2018-07-03 | 2023-06-14 | Marengo Therapeutics, Inc. | Anti-TCR-Antikörpermoleküle und Verwendungen davon |
| AU2019307928A1 (en) * | 2018-07-19 | 2021-02-11 | Regeneron Pharmaceuticals, Inc. | Bispecific anti-BCMA x anti-CD3 antibodies and uses thereof |
| JP2021532073A (ja) * | 2018-07-31 | 2021-11-25 | アムジェン リサーチ (ミュニック) ゲゼルシャフト ミット ベシュレンクテル ハフツング | Bcma−cd3二重特異性抗体のための投与レジメン |
| BR112021003305A2 (pt) | 2018-08-31 | 2021-05-25 | Novartis Ag | métodos para produzir células que expressam receptor de antígeno quimérico |
| US20210171909A1 (en) | 2018-08-31 | 2021-06-10 | Novartis Ag | Methods of making chimeric antigen receptor?expressing cells |
| JP7425049B2 (ja) | 2018-09-25 | 2024-01-30 | ハープーン セラピューティクス,インク. | Dll3結合タンパク質および使用方法 |
| US20230416385A1 (en) * | 2018-11-01 | 2023-12-28 | Shandong New Time Pharmaceutical Co., Ltd. | Bispecific antibody and use thereof |
| EP3897720A4 (en) * | 2018-12-19 | 2022-12-07 | City of Hope | BAFF-R BISPECIFIC T-CELL ENGAGER ANTIBODY |
| US20220098303A1 (en) * | 2019-02-01 | 2022-03-31 | Glaxosmithkline Intellectual Property Development Limited | Combination treatments for cancer comprising belantamab mafodotin and an anti ox40 antibody and uses and methods thereof |
| EP3930763A1 (en) | 2019-02-25 | 2022-01-05 | Novartis AG | Mesoporous silica particles compositions for viral delivery |
| MX2021010281A (es) * | 2019-02-26 | 2021-09-23 | Sorrento Therapeutics Inc | Proteinas de enlace a antigenos que se enlazan al bcma. |
| CN113597328A (zh) | 2019-03-21 | 2021-11-02 | 瑞泽恩制药公司 | 用于治疗过敏症的il-4/il-13途径抑制剂和浆细胞消融的组合 |
| US20230074800A1 (en) | 2019-03-21 | 2023-03-09 | Novartis Ag | Car-t cell therapies with enhanced efficacy |
| WO2020210678A1 (en) | 2019-04-12 | 2020-10-15 | Novartis Ag | Methods of making chimeric antigen receptor-expressing cells |
| EP3959320A1 (en) | 2019-04-24 | 2022-03-02 | Novartis AG | Compositions and methods for selective protein degradation |
| EP3733707A1 (en) | 2019-04-30 | 2020-11-04 | Celyad S.A. | Car t-cells targeting bcma and uses thereof |
| JP2022531001A (ja) * | 2019-05-03 | 2022-07-05 | セルジーン コーポレーション | 抗bcma抗体コンジュゲート、そのコンジュゲートを含む組成物ならびにそのコンジュゲートの製造および使用方法 |
| CN114206927A (zh) | 2019-06-14 | 2022-03-18 | 特尼奥生物股份有限公司 | 与cd22和cd3结合的多特异性重链抗体 |
| CN110229232B (zh) * | 2019-06-19 | 2020-05-19 | 北京智仁美博生物科技有限公司 | 双特异性抗体及其用途 |
| WO2021018168A1 (zh) * | 2019-07-30 | 2021-02-04 | 上海翰森生物医药科技有限公司 | 抗bcma抗体、其抗原结合片段及其医药用途 |
| WO2021092060A1 (en) * | 2019-11-05 | 2021-05-14 | Engmab Sarl | Methods of treatment |
| AU2020393912A1 (en) | 2019-11-26 | 2022-06-09 | Novartis Ag | Chimeric antigen receptors binding BCMA and CD19 and uses thereof |
| EP4069373A1 (en) * | 2019-12-06 | 2022-10-12 | Regeneron Pharmaceuticals, Inc. | Methods of treating multiple myeloma with bispecific anti-bcma x anti-cd3 antibodies |
| US20230051266A1 (en) * | 2019-12-10 | 2023-02-16 | Abl Bio Inc. | Anti-bcma/anti-4-1bb bispecific antibodies and uses thereof |
| WO2021132746A1 (en) * | 2019-12-24 | 2021-07-01 | Abl Bio, Inc. | Anti-bcma/anti-4-1bb bispecific antibodies and uses thereof |
| US20230030085A1 (en) * | 2019-12-16 | 2023-02-02 | 2Seventy Bio, Inc. | Anti-bcma car antibodies, conjugates, and methods of use |
| MX2022010604A (es) | 2020-02-27 | 2022-09-09 | Novartis Ag | Metodos de produccion de celulas que expresan receptores antigenicos quimericos. |
| JP2023515211A (ja) | 2020-02-27 | 2023-04-12 | ノバルティス アーゲー | キメラ抗原受容体発現細胞を作製する方法 |
| JP2023518189A (ja) * | 2020-03-13 | 2023-04-28 | ヤンセン バイオテツク,インコーポレーテツド | デルタ鎖媒介性免疫を調節するための材料及び方法 |
| TW202144425A (zh) * | 2020-04-17 | 2021-12-01 | 大陸商上海翰森生物醫藥科技有限公司 | 特異性抗原結合分子,其製備方法及醫藥用途 |
| JP2023526774A (ja) | 2020-04-29 | 2023-06-23 | テネオバイオ, インコーポレイテッド | 重鎖定常領域が修飾された多重特異性重鎖抗体 |
| WO2021222578A1 (en) * | 2020-04-29 | 2021-11-04 | Teneobio, Inc. | Multispecific heavy chain antibodies with modified heavy chain constant regions |
| AU2021272291A1 (en) | 2020-05-11 | 2023-02-02 | Janssen Biotech, Inc. | Methods for treating multiple myeloma |
| CN113637073B (zh) * | 2020-05-11 | 2024-04-12 | 上海赛比曼生物科技有限公司 | Bcma抗体及其制备和应用 |
| BR112022023392A2 (pt) | 2020-05-19 | 2022-12-20 | Janssen Biotech Inc | Composições que compreendem um agente terapêutico de redirecionamento de células t e um inibidor da via de adesão de vla-4 |
| IL298473A (en) | 2020-06-11 | 2023-01-01 | Novartis Ag | zbtb32 inhibitors and uses thereof |
| AU2021300179A1 (en) | 2020-06-30 | 2023-02-02 | Teneobio, Inc. | Multi-specific antibodies binding to BCMA |
| CN114075287B (zh) * | 2020-08-18 | 2023-07-21 | 湖南远泰生物技术有限公司 | 人源化bcma抗体和bcma-car-t细胞 |
| EP4199960A2 (en) | 2020-08-21 | 2023-06-28 | Novartis AG | Compositions and methods for in vivo generation of car expressing cells |
| AU2021345124A1 (en) | 2020-09-16 | 2023-03-30 | Amgen Inc. | Methods for administering therapeutic doses of bispecific T-cell engaging molecules for the treatment of cancer |
| US20240002539A1 (en) * | 2020-11-03 | 2024-01-04 | Ab Studio Inc. | Multispecific antibodies and uses thereof |
| CN116802203A (zh) | 2020-11-04 | 2023-09-22 | 朱诺治疗学股份有限公司 | 从经修饰的恒定cd3免疫球蛋白超家族链基因座表达嵌合受体的细胞、相关多核苷酸和方法 |
| WO2022135468A1 (zh) * | 2020-12-23 | 2022-06-30 | 信达生物制药(苏州)有限公司 | 抗bcma×cd3双特异性抗体及其用途 |
| JP2024506831A (ja) | 2021-01-28 | 2024-02-15 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | サイトカイン放出症候群を治療するための組成物及び方法 |
| JP2024507180A (ja) | 2021-02-16 | 2024-02-16 | ヤンセン ファーマシューティカ エヌ.ベー. | Bcma、gprc5d、及びcd3を標的とする三重特異的抗体 |
| WO2022187710A1 (en) * | 2021-03-05 | 2022-09-09 | Atreca, Inc. | Epha2 antibodies |
| BR112023019484A2 (pt) | 2021-03-24 | 2023-12-05 | Janssen Biotech Inc | Anticorpo triespecífico que tem como alvo cd79b, cd20 e cd3 |
| WO2022216993A2 (en) | 2021-04-08 | 2022-10-13 | Marengo Therapeutics, Inc. | Multifuntional molecules binding to tcr and uses thereof |
| WO2022229853A1 (en) | 2021-04-27 | 2022-11-03 | Novartis Ag | Viral vector production system |
| WO2022232488A1 (en) | 2021-04-30 | 2022-11-03 | Celgene Corporation | Combination therapies using an anti-bcma antibody drug conjugate (adc) in combination with a gamma secretase inhibitor (gsi) |
| TW202309522A (zh) | 2021-05-11 | 2023-03-01 | 美商健生生物科技公司 | 用於監測復發性及/或難治性多發性骨髓瘤之治療的方法及組成物 |
| CA3221399A1 (en) | 2021-05-28 | 2022-12-01 | Janssen Biotech, Inc. | Bcma as a target for t cell redirecting antibodies in b cell lymphomas |
| CN115521381A (zh) * | 2021-06-24 | 2022-12-27 | 益科思特(北京)医药科技发展有限公司 | 结合bcma和cd3的双特异性抗体及其制备方法与应用 |
| CN115569191A (zh) * | 2021-07-05 | 2023-01-06 | 山东新时代药业有限公司 | 一种重组人源化抗bcma/cd3双特异性抗体冻干制剂 |
| WO2023021477A1 (en) | 2021-08-20 | 2023-02-23 | Novartis Ag | Methods of making chimeric antigen receptor–expressing cells |
| WO2023076921A1 (en) * | 2021-10-27 | 2023-05-04 | Janssen Biotech, Inc. | Methods for enhanced bcma immunohistochemistry detection in human and monkey tissue |
| US20230134748A1 (en) | 2021-11-03 | 2023-05-04 | Janssen Biotech, Inc. | Corticosteriod Reduction in Treatment with Anti-CD38 Antibody |
| WO2023086817A1 (en) * | 2021-11-10 | 2023-05-19 | Janssen Biotech, Inc. | Stable formulations comprising a bispecific bcma/cd3 antibody |
| WO2023098846A1 (zh) * | 2021-12-03 | 2023-06-08 | 江苏先声药业有限公司 | 抗bcma纳米抗体及其应用 |
| US20230357446A1 (en) | 2022-04-11 | 2023-11-09 | Regeneron Pharmaceuticals, Inc. | Compositions and methods for universal tumor cell killing |
| CN117003871A (zh) * | 2022-04-28 | 2023-11-07 | 北京天广实生物技术股份有限公司 | 结合bcma和cd3的抗体及其用途 |
| CN117186229B (zh) * | 2022-12-06 | 2024-03-29 | 成都赛恩吉诺生物科技有限公司 | 具有长cdr3序列的抗人bcma纳米抗体及car-t和应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014519322A (ja) * | 2011-05-16 | 2014-08-14 | フェイビオン ファーマシューティカルズ, インコーポレイテッド | 多重特異性Fab融合タンパク質および使用法 |
| JP2014534242A (ja) * | 2011-11-15 | 2014-12-18 | アムゲン リサーチ (ミュンヘン) ゲーエムベーハーAMGEN Research(Munich)GmbH | Bcmaおよびcd3に対する結合分子 |
Family Cites Families (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6670127B2 (en) | 1997-09-16 | 2003-12-30 | Egea Biosciences, Inc. | Method for assembly of a polynucleotide encoding a target polypeptide |
| EP1015576B1 (en) | 1997-09-16 | 2005-05-04 | Egea Biosciences, LLC | Method for the complete chemical synthesis and assembly of genes and genomes |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US20020142000A1 (en) | 1999-01-15 | 2002-10-03 | Digan Mary Ellen | Anti-CD3 immunotoxins and therapeutic uses therefor |
| UA74798C2 (uk) | 1999-10-06 | 2006-02-15 | Байоджен Айдек Ма Інк. | Спосіб лікування раку у ссавця за допомогою поліпептиду, що протидіє взаємодії april з його рецепторами |
| WO2001024812A1 (en) | 1999-10-06 | 2001-04-12 | N.V. Nutricia | USE OF TRANSFORMING GROWTH FACTOR β AND GROWTH FACTORS IN THE TREATMENT AND PREVENTION OF DISEASES OF THE INTESTINAL MUCOSA |
| CA2438682A1 (en) | 2001-02-20 | 2002-08-29 | Zymogenetics, Inc. | Antibodies that bind both bcma and taci |
| AU2005282700A1 (en) | 2004-09-02 | 2006-03-16 | Genentech, Inc. | Heteromultimeric molecules |
| AU2006232287B2 (en) | 2005-03-31 | 2011-10-06 | Chugai Seiyaku Kabushiki Kaisha | Methods for producing polypeptides by regulating polypeptide association |
| DE102005028778A1 (de) | 2005-06-22 | 2006-12-28 | SUNJÜT Deutschland GmbH | Mehrlagige Folie mit einer Barriere- und einer antistatischen Lage |
| ES2856451T3 (es) | 2005-10-11 | 2021-09-27 | Amgen Res Munich Gmbh | Composiciones que comprenden anticuerpos específicos para diferentes especies, y usos de las mismas |
| US10155816B2 (en) | 2005-11-28 | 2018-12-18 | Genmab A/S | Recombinant monovalent antibodies and methods for production thereof |
| WO2007117600A2 (en) | 2006-04-07 | 2007-10-18 | Macrogenics, Inc. | Combination therapy for treating autoimmune diseases |
| JP2009541275A (ja) | 2006-06-22 | 2009-11-26 | ノボ・ノルデイスク・エー/エス | 二重特異性抗体の生産 |
| EP4059964A1 (en) | 2007-04-03 | 2022-09-21 | Amgen Research (Munich) GmbH | Cross-species-specific binding domain |
| JP2010524851A (ja) | 2007-04-03 | 2010-07-22 | マイクロメット アーゲー | 種間特異的結合ドメイン |
| US20100183615A1 (en) | 2007-04-03 | 2010-07-22 | Micromet Ag | Cross-species-specific bispecific binders |
| CA2720682A1 (en) | 2008-04-25 | 2009-10-29 | Zymogenetics, Inc. | Levels of bcma protein expression on b cells and use in diagnostic methods |
| PL2352763T5 (pl) | 2008-10-01 | 2023-01-30 | Amgen Research (Munich) Gmbh | Bispecyficzne przeciwciała jednołańcuchowe o specyficzności wobec antygenów docelowych o dużej masie cząsteczkowej |
| US10981998B2 (en) | 2008-10-01 | 2021-04-20 | Amgen Research (Munich) Gmbh | Cross-species-specific single domain bispecific single chain antibody |
| CA2738565C (en) | 2008-10-01 | 2023-10-10 | Micromet Ag | Cross-species-specific psmaxcd3 bispecific single chain antibody |
| AU2009308935B2 (en) | 2008-10-31 | 2015-02-26 | Janssen Biotech, Inc. | Fibronectin type III domain based scaffold compositions, methods and uses |
| EP2396011B1 (en) | 2009-02-12 | 2016-04-13 | Janssen Biotech, Inc. | Fibronectin type iii domain based scaffold compositions, methods and uses |
| NZ612647A (en) | 2009-03-10 | 2015-03-27 | Biogen Idec Inc | Anti-bcma antibodies |
| CN102459346B (zh) | 2009-04-27 | 2016-10-26 | 昂考梅德药品有限公司 | 制造异源多聚体分子的方法 |
| EA201201435A1 (ru) | 2010-04-20 | 2013-04-30 | Генмаб А/С | ГЕТЕРОДИМЕРНЫЕ АНТИТЕЛО-Fc-СОДЕРЖАЩИЕ БЕЛКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ |
| MX352929B (es) | 2010-11-05 | 2017-12-13 | Zymeworks Inc | DISEÑO DE ANTICUERPOS HETERODIMÉRICOS ESTABLES CON MUTACIONES EN EL DOMINIO Fc. |
| EP2640750A1 (en) | 2010-11-16 | 2013-09-25 | Boehringer Ingelheim International GmbH | Agents and methods for treating diseases that correlate with bcma expression |
| US20130101599A1 (en) | 2011-04-21 | 2013-04-25 | Boehringer Ingelheim International Gmbh | Bcma-based stratification and therapy for multiple myeloma patients |
| AU2012289926A1 (en) * | 2011-08-03 | 2014-03-13 | Children's Medical Center Corporation | A broadly neutralizing human antibody that recognizes the receptor-binding pocket of influenza hemagglutinin |
| DK2773671T3 (da) | 2011-11-04 | 2021-11-15 | Zymeworks Inc | Udformning af stabilt heterodimert antistof med mutationer i fc-domænet |
| SG11201504676VA (en) | 2012-12-14 | 2015-07-30 | Omt Inc | Polynucleotides encoding rodent antibodies with human idiotypes and animals comprising same |
| ES2829499T3 (es) | 2013-02-05 | 2021-06-01 | Engmab Sarl | Método para la selección de anticuerpos contra BCMA |
| EP2762497A1 (en) * | 2013-02-05 | 2014-08-06 | EngMab AG | Bispecific antibodies against CD3epsilon and BCMA |
-
2016
- 2016-08-16 DK DK16754148.1T patent/DK3337824T3/da active
- 2016-08-16 JP JP2018508695A patent/JP2018525005A/ja active Pending
- 2016-08-16 UA UAA201802674A patent/UA127515C2/uk unknown
- 2016-08-16 SI SI201630895T patent/SI3337824T1/sl unknown
- 2016-08-16 PL PL16754148T patent/PL3337824T3/pl unknown
- 2016-08-16 ES ES16754148T patent/ES2814550T3/es active Active
- 2016-08-16 EP EP16754148.1A patent/EP3337824B1/en active Active
- 2016-08-16 EA EA201890513A patent/EA201890513A1/ru unknown
- 2016-08-16 US US15/237,889 patent/US10072088B2/en active Active
- 2016-08-16 PE PE2018000262A patent/PE20180795A1/es unknown
- 2016-08-16 CA CA2995754A patent/CA2995754A1/en active Pending
- 2016-08-16 MY MYPI2018700579A patent/MY191325A/en unknown
- 2016-08-16 TW TW105126031A patent/TWI777924B/zh active
- 2016-08-16 PT PT167541481T patent/PT3337824T/pt unknown
- 2016-08-16 CN CN201680060812.2A patent/CN108350076B/zh active Active
- 2016-08-16 MX MX2018002043A patent/MX2018002043A/es unknown
- 2016-08-16 JO JOP/2016/0184A patent/JO3799B1/ar active
- 2016-08-16 WO PCT/US2016/047146 patent/WO2017031104A1/en active Application Filing
- 2016-08-16 BR BR112018003017-1A patent/BR112018003017A2/pt active Search and Examination
- 2016-08-16 KR KR1020187007297A patent/KR20180040671A/ko not_active Application Discontinuation
- 2016-08-16 EP EP20177664.8A patent/EP3757131A1/en active Pending
- 2016-08-16 TW TW111126438A patent/TWI811023B/zh active
- 2016-08-16 IL IL298041A patent/IL298041A/en unknown
- 2016-08-16 HU HUE16754148A patent/HUE050556T2/hu unknown
- 2016-08-16 RS RS20201050A patent/RS60755B1/sr unknown
- 2016-08-16 MA MA053750A patent/MA53750A/fr unknown
- 2016-08-16 LT LTEP16754148.1T patent/LT3337824T/lt unknown
- 2016-08-16 AU AU2016308567A patent/AU2016308567B2/en active Active
- 2016-08-17 AR ARP160102519A patent/AR105724A1/es unknown
- 2016-08-17 UY UY0001036859A patent/UY36859A/es active IP Right Grant
-
2018
- 2018-02-11 IL IL257468A patent/IL257468B2/en unknown
- 2018-02-15 PH PH12018500361A patent/PH12018500361A1/en unknown
- 2018-02-16 CO CONC2018/0001524A patent/CO2018001524A2/es unknown
- 2018-02-16 CL CL2018000431A patent/CL2018000431A1/es unknown
- 2018-02-16 MX MX2022006650A patent/MX2022006650A/es unknown
- 2018-02-16 NI NI201800027A patent/NI201800027A/es unknown
- 2018-02-16 SV SV2018005634A patent/SV2018005634A/es unknown
- 2018-03-14 EC ECIEPI201819568A patent/ECSP18019568A/es unknown
- 2018-03-16 ZA ZA201801789A patent/ZA201801789B/en unknown
-
2020
- 2020-08-28 CY CY20201100810T patent/CY1123297T1/el unknown
- 2020-08-28 HR HRP20201375TT patent/HRP20201375T1/hr unknown
-
2021
- 2021-07-30 JP JP2021126285A patent/JP7194240B2/ja active Active
-
2022
- 2022-12-08 JP JP2022196582A patent/JP2023027228A/ja active Pending
-
2023
- 2023-02-22 FR FR23C1012C patent/FR23C1012I1/fr active Active
- 2023-02-22 FR FR23C1011C patent/FR23C1011I1/fr active Active
- 2023-02-22 NL NL301219C patent/NL301219I2/nl unknown
- 2023-02-22 HU HUS2300011C patent/HUS2300011I1/hu unknown
- 2023-02-22 FI FIC20230012C patent/FIC20230012I1/fi unknown
- 2023-02-23 LT LTPA2023509C patent/LTPA2023509I1/lt unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014519322A (ja) * | 2011-05-16 | 2014-08-14 | フェイビオン ファーマシューティカルズ, インコーポレイテッド | 多重特異性Fab融合タンパク質および使用法 |
| JP2014534242A (ja) * | 2011-11-15 | 2014-12-18 | アムゲン リサーチ (ミュンヘン) ゲーエムベーハーAMGEN Research(Munich)GmbH | Bcmaおよびcd3に対する結合分子 |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020537644A (ja) * | 2017-10-13 | 2020-12-24 | ハープーン セラピューティクス,インク. | 三重特異性タンパク質と使用方法 |
| JP7084990B2 (ja) | 2017-10-13 | 2022-06-15 | ハープーン セラピューティクス,インク. | 三重特異性タンパク質と使用方法 |
| JP2022116283A (ja) * | 2017-10-13 | 2022-08-09 | ハープーン セラピューティクス,インク. | 三重特異性タンパク質と使用方法 |
| JP7385707B2 (ja) | 2017-10-13 | 2023-11-22 | ハープーン セラピューティクス,インク. | 三重特異性タンパク質と使用方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7194240B2 (ja) | 抗bcma抗体、bcma及びcd3に結合する二重特異性抗原結合分子、並びにそれらの使用 | |
| JP7469432B2 (ja) | 抗gprc5d抗体、gprc5dとcd3を結合する二重特異性抗原結合分子、及びその使用 | |
| AU2015311931B2 (en) | CD123 binding agents and uses thereof | |
| JP2018534933A (ja) | 抗il1rap抗体、il1rapとcd3を結合する二重特異性抗原結合分子、及びその使用 | |
| JP2024507180A (ja) | Bcma、gprc5d、及びcd3を標的とする三重特異的抗体 | |
| TW202304988A (zh) | 靶向CD79b、CD20、及CD3之三特異性抗體 | |
| TW202406935A (zh) | 抗bcma抗體,結合bcma及cd3之雙特異性抗原結合分子及其用途 | |
| EA046105B1 (ru) | Антитела к bcma, биспецифические антигенсвязывающие молекулы, которые связываются с bcma и cd3, и их применение | |
| EA044685B1 (ru) | Антитела к gprc5d, биспецифические антигенсвязывающие молекулы, которые связывают gprc5d и cd3, и их применение |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190815 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20200727 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200804 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201104 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201228 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210330 |