JP2016502996A - ナイーブな対象のためのワクチン組成物 - Google Patents
ナイーブな対象のためのワクチン組成物 Download PDFInfo
- Publication number
- JP2016502996A JP2016502996A JP2015547077A JP2015547077A JP2016502996A JP 2016502996 A JP2016502996 A JP 2016502996A JP 2015547077 A JP2015547077 A JP 2015547077A JP 2015547077 A JP2015547077 A JP 2015547077A JP 2016502996 A JP2016502996 A JP 2016502996A
- Authority
- JP
- Japan
- Prior art keywords
- acid
- composition
- vaccine
- influenza
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 229
- 229960005486 vaccine Drugs 0.000 title claims abstract description 222
- 241000712461 unidentified influenza virus Species 0.000 claims abstract description 63
- 108091007433 antigens Proteins 0.000 claims description 164
- 102000036639 antigens Human genes 0.000 claims description 164
- 239000000427 antigen Substances 0.000 claims description 163
- 241000700605 Viruses Species 0.000 claims description 102
- 206010022000 influenza Diseases 0.000 claims description 78
- 230000003053 immunization Effects 0.000 claims description 64
- 239000002671 adjuvant Substances 0.000 claims description 56
- 230000036039 immunity Effects 0.000 claims description 45
- 206010061598 Immunodeficiency Diseases 0.000 claims description 39
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 claims description 37
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 claims description 37
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 claims description 37
- 239000005642 Oleic acid Substances 0.000 claims description 37
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 claims description 37
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 claims description 37
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 claims description 37
- 150000001735 carboxylic acids Chemical class 0.000 claims description 33
- OGBUMNBNEWYMNJ-UHFFFAOYSA-N batilol Chemical class CCCCCCCCCCCCCCCCCCOCC(O)CO OGBUMNBNEWYMNJ-UHFFFAOYSA-N 0.000 claims description 32
- 208000015181 infectious disease Diseases 0.000 claims description 29
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 claims description 28
- 239000012736 aqueous medium Substances 0.000 claims description 23
- 238000000034 method Methods 0.000 claims description 23
- 229960003971 influenza vaccine Drugs 0.000 claims description 21
- RZRNAYUHWVFMIP-KTKRTIGZSA-N 1-oleoylglycerol Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(O)CO RZRNAYUHWVFMIP-KTKRTIGZSA-N 0.000 claims description 18
- WWZKQHOCKIZLMA-UHFFFAOYSA-N Caprylic acid Natural products CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 claims description 18
- 241000193998 Streptococcus pneumoniae Species 0.000 claims description 17
- 229940031000 streptococcus pneumoniae Drugs 0.000 claims description 17
- 244000052769 pathogen Species 0.000 claims description 15
- 239000005639 Lauric acid Substances 0.000 claims description 14
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 claims description 13
- 239000002253 acid Substances 0.000 claims description 12
- MBMBGCFOFBJSGT-KUBAVDMBSA-N all-cis-docosa-4,7,10,13,16,19-hexaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCC(O)=O MBMBGCFOFBJSGT-KUBAVDMBSA-N 0.000 claims description 12
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 claims description 12
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 claims description 12
- VKOBVWXKNCXXDE-UHFFFAOYSA-N icosanoic acid Chemical compound CCCCCCCCCCCCCCCCCCCC(O)=O VKOBVWXKNCXXDE-UHFFFAOYSA-N 0.000 claims description 12
- 125000005456 glyceride group Chemical group 0.000 claims description 9
- UKMSUNONTOPOIO-UHFFFAOYSA-N docosanoic acid Chemical compound CCCCCCCCCCCCCCCCCCCCCC(O)=O UKMSUNONTOPOIO-UHFFFAOYSA-N 0.000 claims description 8
- VZCCETWTMQHEPK-UHFFFAOYSA-N gamma-Linolensaeure Natural products CCCCCC=CCC=CCC=CCCCCC(O)=O VZCCETWTMQHEPK-UHFFFAOYSA-N 0.000 claims description 8
- VZCCETWTMQHEPK-QNEBEIHSSA-N gamma-linolenic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/CCCCC(O)=O VZCCETWTMQHEPK-QNEBEIHSSA-N 0.000 claims description 8
- 235000020664 gamma-linolenic acid Nutrition 0.000 claims description 8
- 229960002733 gamolenic acid Drugs 0.000 claims description 8
- 229960003444 immunosuppressant agent Drugs 0.000 claims description 8
- 239000003018 immunosuppressive agent Substances 0.000 claims description 8
- 210000000056 organ Anatomy 0.000 claims description 8
- 230000002980 postoperative effect Effects 0.000 claims description 8
- 230000002829 reductive effect Effects 0.000 claims description 8
- 208000024891 symptom Diseases 0.000 claims description 8
- 230000007485 viral shedding Effects 0.000 claims description 8
- 235000020661 alpha-linolenic acid Nutrition 0.000 claims description 7
- 229960004488 linolenic acid Drugs 0.000 claims description 7
- 230000002028 premature Effects 0.000 claims description 7
- GWHCXVQVJPWHRF-KTKRTIGZSA-N (15Z)-tetracosenoic acid Chemical compound CCCCCCCC\C=C/CCCCCCCCCCCCCC(O)=O GWHCXVQVJPWHRF-KTKRTIGZSA-N 0.000 claims description 6
- DPUOLQHDNGRHBS-UHFFFAOYSA-N Brassidinsaeure Natural products CCCCCCCCC=CCCCCCCCCCCCC(O)=O DPUOLQHDNGRHBS-UHFFFAOYSA-N 0.000 claims description 6
- 239000005635 Caprylic acid (CAS 124-07-2) Substances 0.000 claims description 6
- URXZXNYJPAJJOQ-UHFFFAOYSA-N Erucic acid Natural products CCCCCCC=CCCCCCCCCCCCC(O)=O URXZXNYJPAJJOQ-UHFFFAOYSA-N 0.000 claims description 6
- OPGOLNDOMSBSCW-CLNHMMGSSA-N Fursultiamine hydrochloride Chemical compound Cl.C1CCOC1CSSC(\CCO)=C(/C)N(C=O)CC1=CN=C(C)N=C1N OPGOLNDOMSBSCW-CLNHMMGSSA-N 0.000 claims description 6
- 235000021353 Lignoceric acid Nutrition 0.000 claims description 6
- CQXMAMUUWHYSIY-UHFFFAOYSA-N Lignoceric acid Natural products CCCCCCCCCCCCCCCCCCCCCCCC(=O)OCCC1=CC=C(O)C=C1 CQXMAMUUWHYSIY-UHFFFAOYSA-N 0.000 claims description 6
- OYHQOLUKZRVURQ-HZJYTTRNSA-N Linoleic acid Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(O)=O OYHQOLUKZRVURQ-HZJYTTRNSA-N 0.000 claims description 6
- XJXROGWVRIJYMO-SJDLZYGOSA-N Nervonic acid Natural products O=C(O)[C@@H](/C=C/CCCCCCCC)CCCCCCCCCCCC XJXROGWVRIJYMO-SJDLZYGOSA-N 0.000 claims description 6
- 235000021314 Palmitic acid Nutrition 0.000 claims description 6
- 235000021355 Stearic acid Nutrition 0.000 claims description 6
- PHYFQTYBJUILEZ-UHFFFAOYSA-N Trioleoylglycerol Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC(OC(=O)CCCCCCCC=CCCCCCCCC)COC(=O)CCCCCCCC=CCCCCCCCC PHYFQTYBJUILEZ-UHFFFAOYSA-N 0.000 claims description 6
- JAZBEHYOTPTENJ-JLNKQSITSA-N all-cis-5,8,11,14,17-icosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O JAZBEHYOTPTENJ-JLNKQSITSA-N 0.000 claims description 6
- 235000021342 arachidonic acid Nutrition 0.000 claims description 6
- 229940114079 arachidonic acid Drugs 0.000 claims description 6
- GONOPSZTUGRENK-UHFFFAOYSA-N benzyl(trichloro)silane Chemical compound Cl[Si](Cl)(Cl)CC1=CC=CC=C1 GONOPSZTUGRENK-UHFFFAOYSA-N 0.000 claims description 6
- GWHCXVQVJPWHRF-UHFFFAOYSA-N cis-tetracosenoic acid Natural products CCCCCCCCC=CCCCCCCCCCCCCCC(O)=O GWHCXVQVJPWHRF-UHFFFAOYSA-N 0.000 claims description 6
- HABLENUWIZGESP-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O.CCCCCCCCCC(O)=O HABLENUWIZGESP-UHFFFAOYSA-N 0.000 claims description 6
- 235000020669 docosahexaenoic acid Nutrition 0.000 claims description 6
- 229940090949 docosahexaenoic acid Drugs 0.000 claims description 6
- 235000020673 eicosapentaenoic acid Nutrition 0.000 claims description 6
- 229960005135 eicosapentaenoic acid Drugs 0.000 claims description 6
- JAZBEHYOTPTENJ-UHFFFAOYSA-N eicosapentaenoic acid Natural products CCC=CCC=CCC=CCC=CCC=CCCCC(O)=O JAZBEHYOTPTENJ-UHFFFAOYSA-N 0.000 claims description 6
- DPUOLQHDNGRHBS-KTKRTIGZSA-N erucic acid Chemical compound CCCCCCCC\C=C/CCCCCCCCCCCC(O)=O DPUOLQHDNGRHBS-KTKRTIGZSA-N 0.000 claims description 6
- FARYTWBWLZAXNK-WAYWQWQTSA-N ethyl (z)-3-(methylamino)but-2-enoate Chemical compound CCOC(=O)\C=C(\C)NC FARYTWBWLZAXNK-WAYWQWQTSA-N 0.000 claims description 6
- 239000012678 infectious agent Substances 0.000 claims description 6
- 230000002458 infectious effect Effects 0.000 claims description 6
- 235000020778 linoleic acid Nutrition 0.000 claims description 6
- OYHQOLUKZRVURQ-IXWMQOLASA-N linoleic acid Natural products CCCCC\C=C/C\C=C\CCCCCCCC(O)=O OYHQOLUKZRVURQ-IXWMQOLASA-N 0.000 claims description 6
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 claims description 6
- FUZZWVXGSFPDMH-UHFFFAOYSA-N n-hexanoic acid Natural products CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 claims description 6
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 claims description 6
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 claims description 6
- 229960002446 octanoic acid Drugs 0.000 claims description 6
- 239000008117 stearic acid Substances 0.000 claims description 6
- JIWBIWFOSCKQMA-UHFFFAOYSA-N stearidonic acid Natural products CCC=CCC=CCC=CCC=CCCCCC(O)=O JIWBIWFOSCKQMA-UHFFFAOYSA-N 0.000 claims description 6
- 235000021357 Behenic acid Nutrition 0.000 claims description 4
- 229940116226 behenic acid Drugs 0.000 claims description 4
- 230000002265 prevention Effects 0.000 claims description 4
- HOBAELRKJCKHQD-UHFFFAOYSA-N (8Z,11Z,14Z)-8,11,14-eicosatrienoic acid Natural products CCCCCC=CCC=CCC=CCCCCCCC(O)=O HOBAELRKJCKHQD-UHFFFAOYSA-N 0.000 claims description 3
- OYHQOLUKZRVURQ-NTGFUMLPSA-N (9Z,12Z)-9,10,12,13-tetratritiooctadeca-9,12-dienoic acid Chemical compound C(CCCCCCC\C(=C(/C\C(=C(/CCCCC)\[3H])\[3H])\[3H])\[3H])(=O)O OYHQOLUKZRVURQ-NTGFUMLPSA-N 0.000 claims description 3
- TWJNQYPJQDRXPH-UHFFFAOYSA-N 2-cyanobenzohydrazide Chemical compound NNC(=O)C1=CC=CC=C1C#N TWJNQYPJQDRXPH-UHFFFAOYSA-N 0.000 claims description 3
- 235000021298 Dihomo-γ-linolenic acid Nutrition 0.000 claims description 3
- 235000021360 Myristic acid Nutrition 0.000 claims description 3
- TUNFSRHWOTWDNC-UHFFFAOYSA-N Myristic acid Natural products CCCCCCCCCCCCCC(O)=O TUNFSRHWOTWDNC-UHFFFAOYSA-N 0.000 claims description 3
- HOBAELRKJCKHQD-QNEBEIHSSA-N dihomo-γ-linolenic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/CCCCCCC(O)=O HOBAELRKJCKHQD-QNEBEIHSSA-N 0.000 claims description 3
- 235000021313 oleic acid Nutrition 0.000 claims description 3
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 claims description 3
- 150000007513 acids Chemical class 0.000 claims description 2
- 230000001932 seasonal effect Effects 0.000 abstract description 10
- 101710154606 Hemagglutinin Proteins 0.000 description 85
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 85
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 85
- 101710176177 Protein A56 Proteins 0.000 description 85
- 239000000185 hemagglutinin Substances 0.000 description 83
- 241001465754 Metazoa Species 0.000 description 56
- 238000002649 immunization Methods 0.000 description 54
- 210000004072 lung Anatomy 0.000 description 42
- 241000282898 Sus scrofa Species 0.000 description 29
- 238000002255 vaccination Methods 0.000 description 27
- 241000282339 Mustela Species 0.000 description 23
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 20
- 230000028993 immune response Effects 0.000 description 20
- 230000003612 virological effect Effects 0.000 description 20
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 19
- 102000005348 Neuraminidase Human genes 0.000 description 17
- 108010006232 Neuraminidase Proteins 0.000 description 17
- 239000011780 sodium chloride Substances 0.000 description 17
- 210000004027 cell Anatomy 0.000 description 16
- 239000007983 Tris buffer Substances 0.000 description 14
- 210000000987 immune system Anatomy 0.000 description 14
- 210000002966 serum Anatomy 0.000 description 14
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 14
- 229960000172 trivalent influenza vaccine Drugs 0.000 description 14
- 210000001519 tissue Anatomy 0.000 description 13
- 239000003814 drug Substances 0.000 description 12
- RZRNAYUHWVFMIP-HXUWFJFHSA-N glycerol monolinoleate Natural products CCCCCCCCC=CCCCCCCCC(=O)OC[C@H](O)CO RZRNAYUHWVFMIP-HXUWFJFHSA-N 0.000 description 12
- 108090000623 proteins and genes Proteins 0.000 description 12
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 11
- 230000000890 antigenic effect Effects 0.000 description 11
- 230000001965 increasing effect Effects 0.000 description 11
- 230000003902 lesion Effects 0.000 description 11
- 210000001944 turbinate Anatomy 0.000 description 11
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 10
- 210000002741 palatine tonsil Anatomy 0.000 description 10
- 230000001717 pathogenic effect Effects 0.000 description 10
- 230000001681 protective effect Effects 0.000 description 10
- 102000004169 proteins and genes Human genes 0.000 description 10
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 10
- 229960004279 formaldehyde Drugs 0.000 description 9
- 235000018102 proteins Nutrition 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 7
- 229940124896 Fluarix Drugs 0.000 description 7
- 241000282412 Homo Species 0.000 description 7
- 210000002534 adenoid Anatomy 0.000 description 7
- 238000003556 assay Methods 0.000 description 7
- 210000003743 erythrocyte Anatomy 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 150000002632 lipids Chemical class 0.000 description 7
- 229940074096 monoolein Drugs 0.000 description 7
- 210000002345 respiratory system Anatomy 0.000 description 7
- 239000004094 surface-active agent Substances 0.000 description 7
- 238000011282 treatment Methods 0.000 description 7
- LDVVTQMJQSCDMK-UHFFFAOYSA-N 1,3-dihydroxypropan-2-yl formate Chemical compound OCC(CO)OC=O LDVVTQMJQSCDMK-UHFFFAOYSA-N 0.000 description 6
- 108090000288 Glycoproteins Proteins 0.000 description 6
- 102000003886 Glycoproteins Human genes 0.000 description 6
- 241000725303 Human immunodeficiency virus Species 0.000 description 6
- 241000712431 Influenza A virus Species 0.000 description 6
- -1 alkynyl carboxylic acid Chemical class 0.000 description 6
- 230000002238 attenuated effect Effects 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 238000010211 hemagglutination inhibition (HI) assay Methods 0.000 description 6
- 230000002779 inactivation Effects 0.000 description 6
- 208000037797 influenza A Diseases 0.000 description 6
- 239000002245 particle Substances 0.000 description 6
- 239000002953 phosphate buffered saline Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 241000894006 Bacteria Species 0.000 description 5
- 229940124895 FluMist Drugs 0.000 description 5
- 241000282341 Mustela putorius furo Species 0.000 description 5
- 201000005702 Pertussis Diseases 0.000 description 5
- 239000003963 antioxidant agent Substances 0.000 description 5
- 235000006708 antioxidants Nutrition 0.000 description 5
- 235000014113 dietary fatty acids Nutrition 0.000 description 5
- 238000010790 dilution Methods 0.000 description 5
- 239000012895 dilution Substances 0.000 description 5
- 229930195729 fatty acid Natural products 0.000 description 5
- 239000000194 fatty acid Substances 0.000 description 5
- 150000004665 fatty acids Chemical class 0.000 description 5
- 210000004969 inflammatory cell Anatomy 0.000 description 5
- 210000003563 lymphoid tissue Anatomy 0.000 description 5
- 229920001983 poloxamer Polymers 0.000 description 5
- 108090000765 processed proteins & peptides Proteins 0.000 description 5
- 208000023504 respiratory system disease Diseases 0.000 description 5
- 229960005322 streptomycin Drugs 0.000 description 5
- CGMWMYHEKGCISN-UHFFFAOYSA-N (2-chloro-6-fluorophenyl)hydrazine Chemical compound NNC1=C(F)C=CC=C1Cl CGMWMYHEKGCISN-UHFFFAOYSA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 4
- 229930182566 Gentamicin Natural products 0.000 description 4
- 208000007514 Herpes zoster Diseases 0.000 description 4
- 241000701806 Human papillomavirus Species 0.000 description 4
- 108010093965 Polymyxin B Proteins 0.000 description 4
- 241000725643 Respiratory syncytial virus Species 0.000 description 4
- 230000003078 antioxidant effect Effects 0.000 description 4
- 206010013023 diphtheria Diseases 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 229960002518 gentamicin Drugs 0.000 description 4
- 235000011187 glycerol Nutrition 0.000 description 4
- 230000000415 inactivating effect Effects 0.000 description 4
- 208000037798 influenza B Diseases 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 210000001331 nose Anatomy 0.000 description 4
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 238000012545 processing Methods 0.000 description 4
- 235000012424 soybean oil Nutrition 0.000 description 4
- 239000003549 soybean oil Substances 0.000 description 4
- 230000029812 viral genome replication Effects 0.000 description 4
- 206010002091 Anaesthesia Diseases 0.000 description 3
- 241000701022 Cytomegalovirus Species 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 241000709661 Enterovirus Species 0.000 description 3
- 206010015719 Exsanguination Diseases 0.000 description 3
- 208000032843 Hemorrhage Diseases 0.000 description 3
- 241001500351 Influenzavirus A Species 0.000 description 3
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 3
- 101710199667 Nuclear export protein Proteins 0.000 description 3
- 208000002606 Paramyxoviridae Infections Diseases 0.000 description 3
- 229930182555 Penicillin Natural products 0.000 description 3
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 3
- 206010035664 Pneumonia Diseases 0.000 description 3
- 206010037660 Pyrexia Diseases 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 3
- 230000037005 anaesthesia Effects 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 3
- VEZXCJBBBCKRPI-UHFFFAOYSA-N beta-propiolactone Chemical compound O=C1CCO1 VEZXCJBBBCKRPI-UHFFFAOYSA-N 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 230000000875 corresponding effect Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 239000000975 dye Substances 0.000 description 3
- HQPMKSGTIOYHJT-UHFFFAOYSA-N ethane-1,2-diol;propane-1,2-diol Chemical compound OCCO.CC(O)CO HQPMKSGTIOYHJT-UHFFFAOYSA-N 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 230000035931 haemagglutination Effects 0.000 description 3
- 208000005252 hepatitis A Diseases 0.000 description 3
- 230000002163 immunogen Effects 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 229960003299 ketamine Drugs 0.000 description 3
- 239000010410 layer Substances 0.000 description 3
- 210000003928 nasal cavity Anatomy 0.000 description 3
- 230000003472 neutralizing effect Effects 0.000 description 3
- 239000008188 pellet Substances 0.000 description 3
- 229940049954 penicillin Drugs 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 210000003800 pharynx Anatomy 0.000 description 3
- 229920001993 poloxamer 188 Polymers 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 102000004196 processed proteins & peptides Human genes 0.000 description 3
- 229960000380 propiolactone Drugs 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 238000013207 serial dilution Methods 0.000 description 3
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 206010001889 Alveolitis Diseases 0.000 description 2
- 229930183010 Amphotericin Natural products 0.000 description 2
- QGGFZZLFKABGNL-UHFFFAOYSA-N Amphotericin A Natural products OC1C(N)C(O)C(C)OC1OC1C=CC=CC=CC=CCCC=CC=CC(C)C(O)C(C)C(C)OC(=O)CC(O)CC(O)CCC(O)C(O)CC(O)CC(O)(CC(O)C2C(O)=O)OC2C1 QGGFZZLFKABGNL-UHFFFAOYSA-N 0.000 description 2
- 241000271566 Aves Species 0.000 description 2
- 241000304886 Bacilli Species 0.000 description 2
- 241000588832 Bordetella pertussis Species 0.000 description 2
- 241000282465 Canis Species 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- 241000606161 Chlamydia Species 0.000 description 2
- 206010008631 Cholera Diseases 0.000 description 2
- 206010011224 Cough Diseases 0.000 description 2
- 206010015548 Euthanasia Diseases 0.000 description 2
- 206010069767 H1N1 influenza Diseases 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 241000606768 Haemophilus influenzae Species 0.000 description 2
- 239000012981 Hank's balanced salt solution Substances 0.000 description 2
- 241000590002 Helicobacter pylori Species 0.000 description 2
- 241000711549 Hepacivirus C Species 0.000 description 2
- 241000700721 Hepatitis B virus Species 0.000 description 2
- 241000724675 Hepatitis E virus Species 0.000 description 2
- 241000701085 Human alphaherpesvirus 3 Species 0.000 description 2
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 2
- 241000342334 Human metapneumovirus Species 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 241000713174 Influenza B virus (B/Ann Arbor/1/1966 [wild- type]) Species 0.000 description 2
- 102000004407 Lactalbumin Human genes 0.000 description 2
- 108090000942 Lactalbumin Proteins 0.000 description 2
- 206010024229 Leprosy Diseases 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 241000712079 Measles morbillivirus Species 0.000 description 2
- 241000711386 Mumps virus Species 0.000 description 2
- 241000204031 Mycoplasma Species 0.000 description 2
- SBKRTALNRRAOJP-BWSIXKJUSA-N N-[(2S)-4-amino-1-[[(2S,3R)-1-[[(2S)-4-amino-1-oxo-1-[[(3S,6S,9S,12S,15R,18R,21S)-6,9,18-tris(2-aminoethyl)-15-benzyl-3-[(1R)-1-hydroxyethyl]-12-(2-methylpropyl)-2,5,8,11,14,17,20-heptaoxo-1,4,7,10,13,16,19-heptazacyclotricos-21-yl]amino]butan-2-yl]amino]-3-hydroxy-1-oxobutan-2-yl]amino]-1-oxobutan-2-yl]-6-methylheptanamide (6S)-N-[(2S)-4-amino-1-[[(2S,3R)-1-[[(2S)-4-amino-1-oxo-1-[[(3S,6S,9S,12S,15R,18R,21S)-6,9,18-tris(2-aminoethyl)-15-benzyl-3-[(1R)-1-hydroxyethyl]-12-(2-methylpropyl)-2,5,8,11,14,17,20-heptaoxo-1,4,7,10,13,16,19-heptazacyclotricos-21-yl]amino]butan-2-yl]amino]-3-hydroxy-1-oxobutan-2-yl]amino]-1-oxobutan-2-yl]-6-methyloctanamide sulfuric acid Polymers OS(O)(=O)=O.CC(C)CCCCC(=O)N[C@@H](CCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCN)C(=O)N[C@H]1CCNC(=O)[C@@H](NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](Cc2ccccc2)NC(=O)[C@@H](CCN)NC1=O)[C@@H](C)O.CC[C@H](C)CCCCC(=O)N[C@@H](CCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCN)C(=O)N[C@H]1CCNC(=O)[C@@H](NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](Cc2ccccc2)NC(=O)[C@@H](CCN)NC1=O)[C@@H](C)O SBKRTALNRRAOJP-BWSIXKJUSA-N 0.000 description 2
- 229930193140 Neomycin Natural products 0.000 description 2
- 101710144128 Non-structural protein 2 Proteins 0.000 description 2
- 102000011931 Nucleoproteins Human genes 0.000 description 2
- 108010061100 Nucleoproteins Proteins 0.000 description 2
- 208000002193 Pain Diseases 0.000 description 2
- 241000845082 Panama Species 0.000 description 2
- 208000035109 Pneumococcal Infections Diseases 0.000 description 2
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- 235000001630 Pyrus pyrifolia var culta Nutrition 0.000 description 2
- 240000002609 Pyrus pyrifolia var. culta Species 0.000 description 2
- 241000702670 Rotavirus Species 0.000 description 2
- 241000607142 Salmonella Species 0.000 description 2
- 208000034189 Sclerosis Diseases 0.000 description 2
- 201000003176 Severe Acute Respiratory Syndrome Diseases 0.000 description 2
- 206010061372 Streptococcal infection Diseases 0.000 description 2
- 241000282887 Suidae Species 0.000 description 2
- 206010043376 Tetanus Diseases 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 230000010530 Virus Neutralization Effects 0.000 description 2
- 241000710772 Yellow fever virus Species 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 229940009444 amphotericin Drugs 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 125000000129 anionic group Chemical group 0.000 description 2
- 239000003146 anticoagulant agent Substances 0.000 description 2
- 229940127219 anticoagulant drug Drugs 0.000 description 2
- 239000002518 antifoaming agent Substances 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 206010064097 avian influenza Diseases 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000005540 biological transmission Effects 0.000 description 2
- 229960000074 biopharmaceutical Drugs 0.000 description 2
- 230000036760 body temperature Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- CYDMQBQPVICBEU-UHFFFAOYSA-N chlorotetracycline Natural products C1=CC(Cl)=C2C(O)(C)C3CC4C(N(C)C)C(O)=C(C(N)=O)C(=O)C4(O)C(O)=C3C(=O)C2=C1O CYDMQBQPVICBEU-UHFFFAOYSA-N 0.000 description 2
- CYDMQBQPVICBEU-XRNKAMNCSA-N chlortetracycline Chemical compound C1=CC(Cl)=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O CYDMQBQPVICBEU-XRNKAMNCSA-N 0.000 description 2
- 238000002591 computed tomography Methods 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- 230000029142 excretion Effects 0.000 description 2
- 201000001155 extrinsic allergic alveolitis Diseases 0.000 description 2
- 206010016256 fatigue Diseases 0.000 description 2
- 238000011832 ferret model Methods 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 229940047650 haemophilus influenzae Drugs 0.000 description 2
- 229940037467 helicobacter pylori Drugs 0.000 description 2
- 206010020718 hyperplasia Diseases 0.000 description 2
- 208000022098 hypersensitivity pneumonitis Diseases 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 229940031551 inactivated vaccine Drugs 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 208000037799 influenza C Diseases 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 210000005265 lung cell Anatomy 0.000 description 2
- 238000000386 microscopy Methods 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 210000002850 nasal mucosa Anatomy 0.000 description 2
- 229960004927 neomycin Drugs 0.000 description 2
- 229940031462 non-live vaccine Drugs 0.000 description 2
- 229960000988 nystatin Drugs 0.000 description 2
- VQOXZBDYSJBXMA-NQTDYLQESA-N nystatin A1 Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/CC/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 VQOXZBDYSJBXMA-NQTDYLQESA-N 0.000 description 2
- 230000036407 pain Effects 0.000 description 2
- 244000045947 parasite Species 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 229940124531 pharmaceutical excipient Drugs 0.000 description 2
- 229940031960 pneumococcal polysaccharide vaccine Drugs 0.000 description 2
- 229960001973 pneumococcal vaccines Drugs 0.000 description 2
- 229960000502 poloxamer Drugs 0.000 description 2
- 229920000024 polymyxin B Polymers 0.000 description 2
- 229960005266 polymyxin b Drugs 0.000 description 2
- 229960003548 polymyxin b sulfate Drugs 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 201000010740 swine influenza Diseases 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 235000010384 tocopherol Nutrition 0.000 description 2
- 229960001295 tocopherol Drugs 0.000 description 2
- 229930003799 tocopherol Natural products 0.000 description 2
- 239000011732 tocopherol Substances 0.000 description 2
- 210000003437 trachea Anatomy 0.000 description 2
- 201000008827 tuberculosis Diseases 0.000 description 2
- 241001529453 unidentified herpesvirus Species 0.000 description 2
- 239000011534 wash buffer Substances 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 229940051021 yellow-fever virus Drugs 0.000 description 2
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- QCDWFXQBSFUVSP-UHFFFAOYSA-N 2-phenoxyethanol Chemical compound OCCOC1=CC=CC=C1 QCDWFXQBSFUVSP-UHFFFAOYSA-N 0.000 description 1
- 108010068327 4-hydroxyphenylpyruvate dioxygenase Proteins 0.000 description 1
- 241000238876 Acari Species 0.000 description 1
- 101710186708 Agglutinin Proteins 0.000 description 1
- APKFDSVGJQXUKY-KKGHZKTASA-N Amphotericin-B Natural products O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1C=CC=CC=CC=CC=CC=CC=C[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-KKGHZKTASA-N 0.000 description 1
- 101100272788 Arabidopsis thaliana BSL3 gene Proteins 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 241000193738 Bacillus anthracis Species 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- 241000606153 Chlamydia trachomatis Species 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 241000711573 Coronaviridae Species 0.000 description 1
- 241000709687 Coxsackievirus Species 0.000 description 1
- 101710118188 DNA-binding protein HU-alpha Proteins 0.000 description 1
- 229940032046 DTaP vaccine Drugs 0.000 description 1
- 241000725619 Dengue virus Species 0.000 description 1
- 239000006145 Eagle's minimal essential medium Substances 0.000 description 1
- 241000991587 Enterovirus C Species 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical group CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 1
- 201000006353 Filariasis Diseases 0.000 description 1
- 241000710831 Flavivirus Species 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108091006027 G proteins Proteins 0.000 description 1
- 102000030782 GTP binding Human genes 0.000 description 1
- 108091000058 GTP-Binding Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 208000037262 Hepatitis delta Diseases 0.000 description 1
- 241000724709 Hepatitis delta virus Species 0.000 description 1
- 241000709721 Hepatovirus A Species 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- 101710146024 Horcolin Proteins 0.000 description 1
- 241000700588 Human alphaherpesvirus 1 Species 0.000 description 1
- 241000701074 Human alphaherpesvirus 2 Species 0.000 description 1
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 101150027427 ICP4 gene Proteins 0.000 description 1
- 101100028758 Influenza A virus (strain A/Swine/Wisconsin/1/1967 H1N1) PB1-F2 gene Proteins 0.000 description 1
- 241000713196 Influenza B virus Species 0.000 description 1
- 102100034353 Integrase Human genes 0.000 description 1
- 208000029523 Interstitial Lung disease Diseases 0.000 description 1
- 108090000862 Ion Channels Proteins 0.000 description 1
- 102000004310 Ion Channels Human genes 0.000 description 1
- 241000710842 Japanese encephalitis virus Species 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- 206010023825 Laryngeal cancer Diseases 0.000 description 1
- 101710189395 Lectin Proteins 0.000 description 1
- 208000004554 Leishmaniasis Diseases 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 101710179758 Mannose-specific lectin Proteins 0.000 description 1
- 101710150763 Mannose-specific lectin 1 Proteins 0.000 description 1
- 101710150745 Mannose-specific lectin 2 Proteins 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 1
- 241000588652 Neisseria gonorrhoeae Species 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 241000724832 Non-A, non-B hepatitis virus Species 0.000 description 1
- 101710144111 Non-structural protein 3 Proteins 0.000 description 1
- 241001263478 Norovirus Species 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 206010068319 Oropharyngeal pain Diseases 0.000 description 1
- 241000150452 Orthohantavirus Species 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 101150103639 PB1 gene Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 201000007100 Pharyngitis Diseases 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- BELBBZDIHDAJOR-UHFFFAOYSA-N Phenolsulfonephthalein Chemical compound C1=CC(O)=CC=C1C1(C=2C=CC(O)=CC=2)C2=CC=CC=C2S(=O)(=O)O1 BELBBZDIHDAJOR-UHFFFAOYSA-N 0.000 description 1
- 241000283216 Phocidae Species 0.000 description 1
- 235000014676 Phragmites communis Nutrition 0.000 description 1
- 241000709664 Picornaviridae Species 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 206010036590 Premature baby Diseases 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 1
- 206010037423 Pulmonary oedema Diseases 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 241000710799 Rubella virus Species 0.000 description 1
- 241000315672 SARS coronavirus Species 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- 206010041925 Staphylococcal infections Diseases 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 241000193985 Streptococcus agalactiae Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 241000710771 Tick-borne encephalitis virus Species 0.000 description 1
- 201000005485 Toxoplasmosis Diseases 0.000 description 1
- 101710134694 Transcriptional regulator ICP22 homolog Proteins 0.000 description 1
- 101800000385 Transmembrane protein Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 241000700647 Variola virus Species 0.000 description 1
- 241000607626 Vibrio cholerae Species 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000000910 agglutinin Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 239000013566 allergen Substances 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- 230000008382 alveolar damage Effects 0.000 description 1
- 229960003942 amphotericin b Drugs 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 230000002421 anti-septic effect Effects 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 229940065181 bacillus anthracis Drugs 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 229960001212 bacterial vaccine Drugs 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- 229960001506 brilliant green Drugs 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 229940038705 chlamydia trachomatis Drugs 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000013170 computed tomography imaging Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229960005097 diphtheria vaccines Drugs 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- CETRZFQIITUQQL-UHFFFAOYSA-N dmso dimethylsulfoxide Chemical compound CS(C)=O.CS(C)=O CETRZFQIITUQQL-UHFFFAOYSA-N 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 239000000428 dust Substances 0.000 description 1
- 108010078428 env Gene Products Proteins 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 239000012595 freezing medium Substances 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 239000003163 gonadal steroid hormone Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000001861 immunosuppressant effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- KQQKGWQCNNTQJW-UHFFFAOYSA-N linolenic acid Natural products CC=CCCC=CCC=CCCCCCCCC(O)=O KQQKGWQCNNTQJW-UHFFFAOYSA-N 0.000 description 1
- 229940124590 live attenuated vaccine Drugs 0.000 description 1
- 229940023012 live-attenuated vaccine Drugs 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 101710130522 mRNA export factor Proteins 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 230000007257 malfunction Effects 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- VPNGEIHDPSLNMU-UHFFFAOYSA-N medetomidine hydrochloride Chemical compound Cl.C=1C=CC(C)=C(C)C=1C(C)C1=CNC=N1 VPNGEIHDPSLNMU-UHFFFAOYSA-N 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- 229960005037 meningococcal vaccines Drugs 0.000 description 1
- RUAIJHHRCIHFEV-UHFFFAOYSA-N methyl 4-amino-5-chlorothiophene-2-carboxylate Chemical compound COC(=O)C1=CC(N)=C(Cl)S1 RUAIJHHRCIHFEV-UHFFFAOYSA-N 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 1
- 235000019796 monopotassium phosphate Nutrition 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 244000039328 opportunistic pathogen Species 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 206010034674 peritonitis Diseases 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 229960003531 phenolsulfonphthalein Drugs 0.000 description 1
- 229960005323 phenoxyethanol Drugs 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 1
- 210000003281 pleural cavity Anatomy 0.000 description 1
- 229940124733 pneumococcal vaccine Drugs 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 239000012898 sample dilution Substances 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 201000004409 schistosomiasis Diseases 0.000 description 1
- 238000004062 sedimentation Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000000405 serological effect Effects 0.000 description 1
- 208000026425 severe pneumonia Diseases 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 206010041232 sneezing Diseases 0.000 description 1
- YEENEYXBHNNNGV-XEHWZWQGSA-M sodium;3-acetamido-5-[acetyl(methyl)amino]-2,4,6-triiodobenzoate;(2r,3r,4s,5s,6r)-2-[(2r,3s,4s,5r)-3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound [Na+].CC(=O)N(C)C1=C(I)C(NC(C)=O)=C(I)C(C([O-])=O)=C1I.O[C@H]1[C@H](O)[C@@H](CO)O[C@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 YEENEYXBHNNNGV-XEHWZWQGSA-M 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000012289 standard assay Methods 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 229910021653 sulphate ion Inorganic materials 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 238000012549 training Methods 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 201000002311 trypanosomiasis Diseases 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 229940118696 vibrio cholerae Drugs 0.000 description 1
- 244000052613 viral pathogen Species 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 239000002888 zwitterionic surfactant Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/145—Orthomyxoviridae, e.g. influenza virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5252—Virus inactivated (killed)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
- A61K2039/543—Mucosal route intranasal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55588—Adjuvants of undefined constitution
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/58—Medicinal preparations containing antigens or antibodies raising an immune response against a target which is not the antigen used for immunisation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
Description
本発明は、小児などのナイーブな対象において有効な経鼻投与ワクチン組成物に関する。さらに、このワクチン組成物は、パンデミック期間中に一般集団にワクチン接種するのに適している。
現在、一般に用いられているインフルエンザワクチンは生ウイルスまたは不活化ウイルスをベースとしており、不活化ウイルスワクチンは、全ウイルス、「スプリット」ウイルス、サブユニットタンパク質、または精製された表面抗原(赤血球凝集素およびノイラミニダーゼを含む)をベースとしうる。
i)1種または複数種の非生抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、ナイーブな対象において使用する鼻腔内投与ワクチンとして使用するための組成物に関する。
1種または複数種の非生インフルエンザウイルス抗原、および
1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、免疫無防備状態の小児科対象への鼻腔内投与ワクチンとして使用するための組成物に関する。
i)1種または複数種の非生抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、免疫無防備状態のナイーブな患者において使用する鼻腔内投与ワクチンとして使用するための組成物に関する。
i)1種または複数種の肺炎連鎖球菌(Streptococcus pneumoniae)抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、肺炎連鎖球菌感染の予防または肺炎連鎖球菌感染に関連した症状の重篤度の低下のために、ナイーブな対象および/または免疫無防備状態の患者において使用する鼻腔内投与ワクチンとして使用するための組成物に関する。
本発明の態様の説明では、理解しやすくするために特定の用語が用いられる。しかしながら、本発明は、そのように選択された特定の用語に限定されることは意図されず、それぞれの特定の用語は、同様の目的を達成するために同様に働く全ての技術的同等物を含むことが理解される。
i)1種または複数種の非生抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、ナイーブな対象において使用する鼻腔内投与ワクチンとして使用するための組成物に関する。
i)1種または複数種の非生ウイルス抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、ナイーブな対象において使用する鼻腔内投与ワクチンとして使用するための組成物に関する。
1.ワクチンの張性/容量オスモル濃度を制御するための物質。このような物質は、例えば、塩化ナトリウムのような生理学的な塩である。他の生理学的な塩は、塩化カリウム、リン酸二水素カリウム、リン酸水素二ナトリウム、塩化マグネシウムなどである。このような薬剤は、イオン強度および安定性に影響を及ぼす他のイオン性物質でもよい。ワクチンの浸透圧モル濃度は、約200〜約400mOsm/kgの範囲、好ましくは、約240〜約360mOsm/kgの範囲の値に調節されてもよく、または浸透圧モル濃度は生理学的レベルに近くなければならない、例えば、約290〜約310mOsm/kgの生理学的範囲になければならない。
2.ワクチン組成物のpHを調節するための、またはワクチン組成物を緩衝するための物質。通常、ワクチン組成物のpHは約5〜約8.5の範囲にある。適切なpH調節剤または緩衝物質には、塩酸、水酸化ナトリウム(pHを調節する)、ならびにリン酸緩衝液、Tris緩衝液、クエン酸緩衝液、酢酸緩衝液、ヒスチジン緩衝液など(ワクチンを緩衝する)が含まれる。
3.例えば、界面活性剤、酸化防止剤、キレート剤、抗菌剤、ウイルス失活因子、防腐剤、色素、消泡剤、安定剤もしくは界面活性剤、またはその組み合わせのような他の添加物。
i)1種または複数種の非生抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、免疫無防備状態の小児科患者において鼻腔内投与ワクチンとして使用するための組成物に関する。
i)1種または複数種の非生インフルエンザウイルス抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、免疫無防備状態の小児科患者において鼻腔内投与ワクチンとして使用するための組成物でもよい。
i)1種または複数種の非生抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、ナイーブな対象および免疫無防備状態の小児科患者において使用する鼻腔内投与ワクチンとして使用するための組成物に関する。
i)1種または複数種の肺炎連鎖球菌抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、肺炎連鎖球菌感染の予防または肺炎連鎖球菌感染に関連した症状の重篤度の低下のための、ナイーブな対象および免疫無防備状態の小児科患者において使用する非生鼻腔内投与ワクチンとして使用するための組成物に関する。
目的
本研究の目的は、本発明に従って、鼻腔内投与された、アジュバントを用いて製剤化されたインフルエンザスプリット抗原およびアジュバントを用いて製剤化された不活化全インフルエンザウイルス抗原の、フェレットモデルにおける免疫原性および防御効力を調べることであった。
食塩水:0.9%食塩水pH5〜5.5。
Fluarix(登録商標):非経口ワクチン(A/California/7/2009(H1N1)様、A/Perth/16/2009(H3N2)様、およびB/Brisbane/60/2008様ワクチン株から構成される。0.5ml中に各ワクチン株HAを15μg含む)。21日目および42日目に、群2の動物に0.5ml Fluarix(GlaxoSmithKline Biologicals)を皮下ワクチン接種した。
ワクチンA:インフルエンザワクチン点鼻、5μg、15μg、および30μg HA/0.2ml、ワクチン組成物中に等モル量のモノオレイン酸グリセロールおよびオレイン酸(pH8、Tris 0.1Mに溶解した)を最終濃度20mg/mlで含むEndocine製剤を含むアジュバント製剤。H1N1 /California/2009スプリット抗原。
ワクチンB:インフルエンザワクチン点鼻、15μg HA/0.2ml、ワクチン組成物中に等モル量のモノオレイン酸グリセロールおよびオレイン酸(pH8、Tris 0.1Mに溶解した)を最終濃度20mg/mlで含むEndocine製剤を含むアジュバント製剤。H1N1/California/2009不活化全ウイルス抗原。
約12ヶ月齢、体重760〜1210g、かつ赤血球凝集抑制(HI)アッセイによる実証において循環インフルエンザウイルスB、A/H1N1、A/H3N2、およびA/pH1N1に対する抗体について血清陰性であった健常雌フェレット(Mustela putorius furo: 非近交系)を使用した。動物を、免疫化前段階には最大8匹の群で、免疫化段階には6匹の試験群で標準的なケージに入れた。抗原投与日に、陰圧がかかったグローブボックス隔離飼育ケージに試験群を移した。試験全体を通して、動物に市販のフードペレットおよび水を自由に与えた。
0日目、21日目、および42日目に、6匹のフェレットの5つの群に、ケタミンおよびドミトール(domitor)による麻酔下で、3回の鼻腔内免疫化を(液滴: フィルターチップ付きピペットを用いて各外鼻孔に100μlずつ)行った。群1の動物には滅菌生理食塩水(0,9%食塩水pH5〜5,5)200μlを与えた。群3、群4、および群5をそれぞれ、5μg、15μg、および30μg HAを含有する、Endocine(商標)を用いて製剤化されたH1N1/California/2009スプリット抗原200μlで鼻腔内免疫化した。群6を、15μg HAを含有する、Endocine(商標)を用いて製剤化されたH1N1/California/2009全ウイルス抗原200μlで鼻腔内免疫化した。対照群1には鼻腔内に食塩水200μlを与えた。21日目および42日目に、6匹のフェレットの1つの群(群2)の皮下に、0.5mlのFluarix(登録商標)(GlaxoSmithKline Biologicals)(2010/2011シーズン、各ワクチン株HA 15μgを含有するアジュバント無添加三価インフルエンザワクチン(TIV))をワクチン接種した。
試験70日目に、全動物を、気管内経路によってインフルエンザウイルス(H1N1株A/The Netherlands/602/2009)野生分離株で抗原投与した。攻撃ウイルスを調製するために、H1N1 A/The Netherlands/602/2009攻撃ウイルスストック(7.8 log10 TCID50/ml)を3.3x105 TCID50/mlの濃度まで氷冷PBSで希釈した。全動物を、106 TCID50を含有する攻撃ウイルス調製物3mlで気管内に抗原投与した。攻撃ウイルス調製物を気管鏡を用いて小さなカテーテルで気管に投与し、分岐部のすぐ上で放出した。攻撃ウイルスの調製および投与はBSL3条件下で行った。抗原投与の1日後に、ウイルスの感染性を確かめるために、残っている攻撃ウイルス希釈液の試料をメディン・ダービー(Madin Darby)イヌ腎(MDCK)細胞において滴定した。接種して1日後の攻撃ウイルス希釈液の逆滴定から、この物質は依然として4.8 log10 TCID50を含んでいることが分かった。
実験中に、フェレットに対していくつかの処置を行った。温度センサー埋め込み、免疫化、ウイルス抗原投与、およびコンピュータ断層撮影(CT)イメージングのために、動物をケタミン(4〜8mg/kg: i.m.; Alfasan, Woerden, The Netherlands)およびドミトール(0.1mg/kg: i.m.; Orion Pharma, Espoo, Finland)のカクテルで麻酔した。サンプリング(血液、スワブ、および鼻洗浄液)ならびに放血による安楽死のために、動物をケタミンで麻酔した。実験開始の2週間前に、温度ロガー(DSTマイクロ-T超小型温度ロガー; Star-Oddi, Reykjavik, Iceland)をフェレット腹腔内に入れた。この装置は10分ごとに動物の体温を記録した。各免疫化の前に(0日目、21日目、および42日目)、ならびに抗原投与および安楽死の日(70日目および74日目)にフェレットを秤量した。64日目、71日目、72日目、73日目、および74日目に、群1、群2、および群4の動物をCTイメージングによってモニタリングした。0日目、21日目、および42日目、64日目の免疫化前に、ならびに70日目の抗原投与前に、血液試料を収集した。70日目の抗原投与前、および抗原投与後の毎日、鼻スワブおよび咽頭スワブを収集した。
血液試料を収集し、2つの等しい体積に分けた。一方の体積をPBMC分離に使用し、すぐに、EDTA抗凝血剤含有チューブに移した。他方の体積を血清収集に使用し、凝血活性化剤含有セラムチューブに移した。セラムチューブを全て約2000xgで室温で10分間、遠心分離した。血清を0.1ml試料に分注し、約-80℃で保管した。
PBMCを分離するのに使用した血液試料を、すぐに、EDTA抗凝血剤含有チューブに移し、880xGで5分間、遠心分離し、血漿を約-80℃で保管した。細胞ペレットを3.5ml洗浄用緩衝液(D-PBS: lot#: RNBB7791, V-CMS: 10700395およびEDTA:lot#: 079K8712, V-CMS: 10700037)で再懸濁し、3mlリンホプレップ(lymphoprep)上に層状に積み重ね、800xGで30分間、遠心分離した。遠心分離後、細胞を含有する境界面を収集し、新たなチューブに移し、洗浄用緩衝液で4回洗浄した。後の洗浄工程には、600xg、465xg、および350xgで10分間、ならびに250xgで15分間の遠心分離が含まれた。最後の洗浄工程後に、細胞ペレットを再懸濁し、少なくとも10分間、氷上に置き、1ml氷冷凍結培地(RPMI lot#1MB078、20%FCS VC#201110194、10%DMSO VC#10700203)に再懸濁し、アンプルに移し、-80℃で保管した。
H1N1 A/The Netherlands/602/2009ならびに2種類の遠縁ウイルスH1N1 A/Swine/Ned/25/80およびH1N1 A/Swine/Italy/14432/76に対する抗体価を赤血球凝集抑制アッセイ(HI)およびウイルス中和アッセイ(VN)によって求めた。遠縁ウイルスH1N1 A/New Jersey/08/76に対する抗体価を赤血球凝集抑制アッセイによって求めた。
HIアッセイは、インフルエンザウイルス赤血球凝集素特異的抗体が赤血球のインフルエンザ誘導凝集をブロックする能力に基づく標準的な結合アッセイである。非特異的な抗赤血球凝集素活性を除去するために、試料をコレラ濾液(コレラ菌(Vibrio cholerae)培養物から入手した)で前処理した。37℃で16時間インキュベートした後に、試料を56℃で1時間インキュベートすることによってコレラ濾液を不活化した。試料の2倍段階希釈液を、(1:20の希釈度から開始して96ウェルプレート中で2回繰り返して)リン酸緩衝硫酸(phosphate buffered sulphate)(PBS)で作製し、試料が特異的赤血球凝集を示したときにシチメンチョウ赤血球で前処理した。これらの赤血球を除去した後に、試料を4赤血球凝集単位(hemagglutination unit)(HAU)の一定濃度の関係するインフルエンザウイルスと4℃で1時間インキュベートした。最後に、複数のプレートを独立に、赤血球沈降によって示される赤血球凝集の抑制についてスコア付けした。対応するフェレット対照血清を全測定に含めた。
VNアッセイは、インフルエンザウイルス特異的抗体のサブセットが、細胞培養物中のウイルス複製がなくなるようにウイルスを中和する能力に基づく、標準的なアッセイである。試料を56℃で30分間、熱失活させ、その後に、96ウェルプレート中で3回繰り返して、1:8の希釈度から開始して試料の2倍段階希釈液を感染培地(20mM Hepes、0.075%重炭酸ナトリウム、2mM L-グルタミン、100IU/mlのペニシリンおよびストレプトマイシン、17.5μg/mlトリプシン、ならびに2.3ng/mlアンホテリシンBを添加したイーグル最小必須培地)で作製した。次いで、試料希釈液を、25〜400 TCID50の関係するウイルスと5%CO2、37℃で1時間インキュベートした。1時間のインキュベーション期間が終了した後に、ウイルス-抗体混合物を、95〜100%コンフルエントなメディン・ダービーイヌ腎(MDCK)細胞培養単層を有するプレートに移した。次いで、これらのプレートを5%CO2、37℃で1時間インキュベートし、その後に、ウイルス-抗体混合物を除去し、感染培地と交換した。5%CO2、37℃で6日間のインキュベーション期間後に、インフルエンザウイルス赤血球凝集素の存在を検出するためにシチメンチョウ赤血球を用いてプレートを読み取った。VN力価は、Reed and Muench(Reed, L.J.; Muench, H. (1938). 「A simple method of estimating fifty percent endpoints」. The American Journal of Hygiene 27: 493-497)に記載の方法に従って計算した。
抗原投与後、0日目、1日目、2日目、3日目、および4日目に、麻酔下の動物から鼻スワブおよび咽頭スワブを採取した。抗原投与して4日後に、フェレットを麻酔下で放血によって安楽死させ、この後に全身肉眼所見を行い、組織を収集した。右鼻甲介ならびに右肺全葉および副葉の試料を収集し、さらに処理するまで-80℃で保管した。鼻甲介および肺試料を秤量し、その後に、0.5%ラクトアルブミン、10%グリセロール、200U/mlペニシリン、200μg/mlストレプトマイシン、100U/mlポリミキシンB硫酸塩、250μg/mlゲンタマイシン、および50U/mlナイスタチン(ICN Pharmaceuticals, Zoetermeer, The Netherlands)を含有するハンクス液に溶解したFastPrep-24(MP Biomedicals, Eindhoven, The Netherlands)と一緒にホモジナイズし、短時間、遠心分離した後に、希釈した。
0日目、21日目、42日目、64日目、および70日目に、抗体の血清中濃度を各免疫化前に求めた。H1N1 A/The Netherlands/602/2009ならびに2種類の遠縁ウイルス(H1N1 A/Swine/Ned/25/80およびH1N1 A/Swine/Italy/14432/76)に対する力価を赤血球凝集抑制アッセイ(HI)およびウイルス中和アッセイ(VNT)によって求めた。遠縁ウイルス(H1N1 A/New Jersey/08/76)に対する抗体価を赤血球凝集抑制アッセイ(HI)によって求めた。
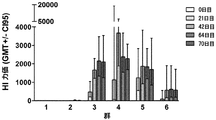
幾何平均HI力価を図1に示した。幾何平均を計算するために、≦5の値を、対応する絶対値5で置き替えた。全ての前血清(0日目)がHI抗体陰性(力価:≦5)であった。
全血清試料がHI抗体陰性であった。
1回目の免疫化後(42日目)に収集した1個の血清試料が、低いHI抗体陽性であった(力価: 13)。2回目の免疫化後に、6匹の動物のうち5匹の血清中に低いHI力価(範囲13〜70)が検出された。
1回目の免疫化後に収集した全試料がHI抗体陽性であった(21日目; GMT: 477、範囲160〜1120)。HI抗体価は、2回目の免疫化後(42日目; GMT: 1669、範囲1120〜2560)、および3回目の免疫化後にも6匹の動物のうち4匹(64日目; GMT: 2158、範囲1280〜3840)において大幅に増加した。70日目(抗原投与日)に収集した試料は、64日目に測定した試料に匹敵するHI力価を示した(70日目; GMT: 2103、範囲1120〜3840)。
1回目の免疫化後に収集した6個の試料のうち5個がHI抗体陽性であった(21日目; GMT: 1130範囲、5〜5760)。2回目の免疫化後に収集した全試料がHI抗体陽性であった。HI抗体価は5匹の動物において大幅に増加した(42日目; GMT: 3673、範囲、1120〜5760)。3回目の免疫化によってHI抗体価は増加しなかった(64日目; GMT: 2386、範囲1920〜4480)。70日目(抗原投与日)に収集した試料は、64日目に測定した試料に匹敵するHI力価を示した(70日目; GMT: 2281、範囲1280〜2560)。
1回目の免疫化後に収集した全試料がHI抗体陽性であった(21日目; GMT: 1249、範囲400〜3200)。HI抗体価は、2回目の免疫化後に6匹の動物のうち5匹(42日目; GMT: 1874、範囲640〜3840)、および3回目の免疫化後にも2匹の動物(64日目; GMT: 1837 範囲1280〜3200)において増加した。70日目(抗原投与日)に収集した試料は、64日目に測定した試料に匹敵するHI力価を示した(70日目; GMT: 1699、範囲640〜3200)。
1回目の免疫化後に収集した6個の試料のうち5個がHI抗体陽性であった(21日目; GMT: 87、範囲5〜1280)。HI抗体価は、2回目の免疫化後に全動物(42日目;GMT: 577、範囲100〜2880)、および3回目の免疫化後にも2匹の動物(64日目; GMT: 626、範囲160〜2560)において大幅に増加した。70日目(抗原投与日)に収集した試料は、64日目に測定した試料に匹敵するHI力価を示した(70日目; GMT: 583、範囲160〜2240)。
遠縁ウイルスH1N1 A/Swine/Ned/25/80、H1N1 A/Swine/Italy/14432/76、およびH1N1 A/New Jersey/08/76に対するHI抗体価を検出した。遠縁ウイルスに対する幾何平均HI力価を図2に示した。幾何平均を計算するために、≦5の値を、対応する絶対値5で置き替えた。全ての前血清(0日目)がHI抗体陰性(力価:≦5)であった。交差反応性HI抗体価は、同種H1N1 A/The Netherlands/602/2009 HI抗体価よりかなり低かった。
1個を除く全血清試料がHI抗体陰性であった。64日目に収集した1個の試料は、H1N1 A/Swine/Italy/14432/76に対して7.5という非常に低いHI抗体価を示した。
全試料がH1N1 A/Swine/Ned/25/80およびH1N1 A/Swine/Italy/14432/76 HI抗体陰性であった。1回目の免疫化後、42日目に収集した血清中に、6匹の動物のうち3匹においてH1N1 A/New Jersey/08/76に対する低いHI力価が検出された。
全動物が3種類の遠縁ウイルスに対する交差反応性HI抗体を生じた。2回目および/または3回目の免疫化後に最も高い力価が測定された。21日目、42日目、64日目、および70日目のH1N1 A/Swine/Ned/25/80 HI抗体価(GMT)はそれぞれ、6(範囲5〜7.5)、24(範囲5〜60)、32(範囲20〜80)、および19(範囲5〜70)であった。21日目、42日目、64日目、および70日目のH1N1 A/Swine/Italy/14432/76 HI抗体価(GMT)はそれぞれ、16(範囲5〜50)、38(範囲10〜80)、63(範囲40〜160)、および42(範囲20〜120)であった。21日目、42日目、64日目、および70日目のH1N1 A/New Jersey/08/76 HI抗体価(GMT)はそれぞれ、5、26(範囲7.5〜70)、39(範囲5〜80)、および29(範囲20〜50)であった。
全動物が2回目の免疫化後に3種類の遠縁ウイルスに対する交差反応性HI抗体を生じた。3回目の免疫化によってHI力価は増加しなかった。21日目、42日目、64日目、および70日目のH1N1 A/Swine/Ned/25/80 HI抗体価(GMT)はそれぞれ、42(範囲5〜90)、239(範囲20〜1120)、88(範囲50〜160)、および75(範囲40〜160)であった。21日目、42日目、64日目、および70日目のH1N1 A/Swine/Italy/14432/76 HI抗体価(GMT)はそれぞれ、78(範囲5〜280)、327(範囲35〜1280)、153(範囲80〜320)、および105(範囲70〜160)であった。21日目、42日目、64日目、および70日目のH1N1 A/New Jersey/08/76 HI抗体価(GMT)はそれぞれ、25(範囲5〜80)、176(範囲60〜400)、64(範囲40〜140)、および63(範囲40〜160)であった。
1匹を除く全動物がH1N1 A/Swine/Ned/25/80に対する交差反応性HI抗体を生じた。全動物がH1N1 A/Swine/Italy/14432/76およびH1N1 A/New Jersey/08/76に対する交差反応性HI抗体を生じた。2回目および/または3回目の免疫化後に最も高い力価が測定された。21日目、42日目、64日目、および70日目のH1N1 A/Swine/Ned/25/80 HI抗体価(GMT)はそれぞれ、23(範囲5〜80)、41(範囲5〜320)、42(範囲5〜320)、および34(範囲5〜320)であった。21日目、42日目、64日目、および70日目のH1N1 A/Swine/Italy/14432/76 HI抗体価(GMT)はそれぞれ、39(範囲5〜160)、54(範囲5〜640)、78(範囲20〜720)、50(範囲5〜480)であった。21日目、42日目、64日目、および70日目のH1N1 A/New Jersey/08/76 HI抗体価(GMT)はそれぞれ、9(範囲5〜30)、40(範囲5〜400)、35(範囲5〜160)、および27(範囲5〜160)であった。
全動物がH1N1 A/Swine/Italy/14432/76に対する交差反応性HI抗体を生じた。1匹を除く全動物がH1N1 A/Swine/Ned/25/80に対する交差反応性HI抗体を生じ、1匹を除く全動物がH1N1 A/New Jersey/08/76に対する交差反応性HI抗体を生じた。2回目および/または3回目の免疫化後に最も高い力価が測定された。21日目、42日目、64日目、および70日目のH1N1 A/Swine/Ned/25/80 HI抗体価(GMT)はそれぞれ、7(範囲5〜40)、19(範囲5〜80)、15(範囲5〜80)、および9(範囲5〜40)であった。21日目、42日目、64日目、および70日目のH1N1 A/Swine/Italy/14432/76 HI抗体価(GMT)はそれぞれ、9(範囲5〜160)、32(範囲5〜160)、27(範囲5〜160)、15(範囲5〜80)であった。21日目、42日目、64日目、および70日目のH1N1 A/New Jersey/08/76 HI抗体価(GMT)はそれぞれ、8(範囲5〜80)、47(範囲10〜240)、19(範囲5〜140)、および13(範囲5〜80)であった。
同種: H1N1 A/The Netherlands/602/2009
全実験動物からの血清試料中のVN抗体価を測定した。幾何平均VN力価を図3に示した。全ての前血清(0日目)がVN抗体陰性であった(力価:≦8)。
≦64と測定された42日目に収集した1個を除いて、全血清試料がVN抗体陰性であった。
全血清試料がVN抗体陰性であった。
1回目の免疫化後に収集した6個の試料のうち4個が低いVN抗体陽性であった(21日目 ; GMT: 19 範囲、8〜64)。2回目の免疫化後に収集した全試料がVN抗体陽性であった。VN抗体価は、5匹の動物において2回目の免疫化後(42日目; GMT: 242、範囲、64〜859)および3回目の免疫化後(64日目; GMT: 995、範囲362〜2436)に大幅に増加した。70日目(抗原投与日)に収集した試料は、64日目に測定した試料と同等の、または64日目に測定した試料より低いVN力価を示した(70日目; GMT: 535、範囲304〜859)。
1回目の免疫化後に収集した6個の試料のうち5個がVN抗体陽性であった(21日目; GMT: 147範囲、8〜724)。2回目の免疫化後に収集した全試料がVN抗体陽性であった。VN抗体価は、2回目の免疫化後に5匹の動物(42日目; GMT: 2376、範囲、64〜8192)および3回目の免疫化後に2匹の動物(64日目; GMT: 1688、範囲662〜4871)において大幅に増加した。70日目(抗原投与日)に収集した試料は、64日目に測定した試料に匹敵するVN力価を示した(70日目; GMT: 1581、範囲351〜3444)。
1回目の免疫化後に収集した全試料がVN抗体陽性であった(21日目; GMT: 74、範囲11〜627)。VN抗体価は、2回目の免疫化後に6匹の動物のうち5匹(42日目; GMT: 504、範囲41〜3435)、3回目の免疫化後に6匹の動物のうち3匹(64日目; GMT: 1673 範囲724〜4884)において大幅に増加した。70日目(抗原投与日)に収集した試料は、64日目に測定した試料に匹敵するVN力価を示した(70日目; GMT: 1699、範囲304〜5793)。
1回目の免疫化後に収集した6個の試料のうち2個が低いVN抗体陽性であった(21日目; GMT: 12、範囲8〜64)。2回目の免疫化後に収集した全試料がVN抗体陽性であった(42日目;GMT: 78、範囲32〜304)。VN抗体価は3回目の免疫化後に増加した(64日目; GMT: 242、範囲113〜747)。70日目(抗原投与日)に収集した試料は、64日目に測定した試料と同等の、または64日目に測定した試料より低いVN力価を示した(70日目; GMT: 177、範囲91〜362)。
遠縁ウイルスH1N1 A/Swine/Ned/25/80およびH1N1 A/Swine/Italy/14432/76に対するVN抗体価を試験した(データ示さず)。42日目、64日目、および70日目に、群3、群4、群5、および群6の全てが群1および群2より優れていた。
全ての実験動物について、特定の臨床パラメータおよび病理学的パラメータ、すなわち、死亡率、体温、体重、含気肺容量(aerated lung volume)、鼻甲介および肺におけるウイルス量、上気道におけるウイルス排出、肺重量の肉眼による死後病理検査、肺組織病変部の平均パーセント、鼻甲介および肺の炎症パラメータの顕微鏡検査を測定した。動物群3、動物群4、および動物群5は、試験した全ての肉眼パラメータおよびほとんどの顕微鏡パラメータの点で群1および群2より優れていた(データ示さず)。
抗原投与後、0日目、1日目、2日目、3日目、および4日目に、麻酔下の動物から鼻スワブおよび咽頭スワブを採取した。抗原投与して4日後に、フェレットを麻酔下で放血によって安楽死させ、この後に全身肉眼所見を行い、組織を収集した。右鼻甲介ならびに右肺全葉および副葉の試料を収集し、さらに処理するまで-80℃で保管した。鼻甲介および肺試料を秤量し、その後に、0.5%ラクトアルブミン、10%グリセロール、200U/mlペニシリン、200μg/mlストレプトマイシン、100U/mlポリミキシンB硫酸塩、250μg/mlゲンタマイシン、および50U/mlナイスタチン(ICN Pharmaceuticals, Zoetermeer, The Netherlands)を含有するハンクス液に溶解したFastPrep-24(MP Biomedicals, Eindhoven, The Netherlands)と一緒にホモジナイズし、短時間、遠心分離した後に、希釈した。
以前に述べられたように(van den Brand JM et al., PLoS One 2012;7(8)e42343)、標準的なプロトコールに従って動物を屍検した。手短に言うと、胸膜腔を開き、罹患した肺実質の面積を目視により正確に定量するときに肺が収縮しないように、気管をクランプで締めた。左肺の組織学的検査のために試料を採取し、10%中性緩衝ホルマリン(ホルマリンをゆっくりと注入した後)に入れて保管し、パラフィン包埋し、4μm切片を作製し、光学顕微鏡による検査のためにヘマトキシリンおよびエオシン(HE)で染色した。試料は標準的なやり方で採取され、肉眼所見で観察された変化に左右されなかった。以前に述べられたように(表4)(Munster VJ et al., Science 2009 Jul 24;325(5939):481-3)、肺におけるインフルエンザウイルス関連炎症の半定量評価を行った。動物がどのようなものかも動物の処置も知らされることなく全スライドを検査した。
対照群1(i.n. 食塩水)および対照群2(非経口TIV)の全フェレットが、高力価の複製能力のあるウイルスを肺(平均力価;それぞれ、5.7および5.5 log10 TCID50/グラム組織)ならびに鼻甲介(平均力価:それぞれ、7.2および6.9 log10 TCID50/グラム組織)において示した(表3)。群3、群4、および群5(i.n. Endocine(商標)アジュバント添加スプリット抗原pH1N1/09ワクチン)のフェレットの肺および鼻甲介には、検出可能な感染性ウイルスがなかった。群6(15μg HA のi.n. Endocine(商標)アジュバント添加全ウイルス)のフェレットの肺には、検出可能な感染性ウイルスがなく、鼻甲介のウイルス力価は、対照群1と比較して平均力価4.1 log10 TCID50/グラム組織と有意に少なかった(p=0.02)。
Endocine(商標)アジュバント添加pH1N1/09ワクチンを用いて鼻腔内免疫化した群におけるウイルス複製の低下は肺の肉眼所見変化の低下と一致した(表3)。
以下の表2および図4は、ナイーブなフェレットにおいて本発明のワクチンと他の製品FluMistおよび注射用ワクチンとを比較している。
HA インフルエンザウイルス赤血球凝集素タンパク質
TCID50 50%組織培養感染量
PBMC 末梢血単核球
HI インフルエンザ赤血球凝集抑制アッセイ
SOP 標準操作手順
PBS リン酸緩衝食塩水
EDTA エチレンジアミン四酢酸
GMT 幾何平均力価(血清学的データを表すために使用した)
FCS ウシ胎仔血清(培養培地添加物)
VN ウイルス中和アッセイ
DMSO ジメチルスルホキシド
i)1種または複数種の肺炎連鎖球菌(Streptococcus pneumoniae)抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、肺炎連鎖球菌感染の予防または肺炎連鎖球菌感染に関連した症状の重篤度の低下のために、ナイーブな対象および/または免疫無防備状態の患者において使用する鼻腔内投与ワクチンとして使用するための組成物に関する。
[本発明1001]
1種または複数種の非生抗原、および
1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、ナイーブな対象において使用する鼻腔内投与ワクチンとして使用するための組成物。
[本発明1002]
ワクチンが小児科的使用のためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1003]
ワクチンが、インフルエンザに対してナイーブな対象において使用するためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1004]
ウイルス排出を低減するためにナイーブな対象において使用するためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1005]
ワクチンが、小児において使用するためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1006]
小児が8歳未満、例えば、6歳以下である、前記本発明のいずれかの使用のための組成物。
[本発明1007]
小児が2ヶ月〜9歳未満、例えば、6ヶ月〜8歳未満、好ましくは、6ヶ月〜7歳未満の小児である、前記本発明のいずれかの使用のための組成物。
[本発明1008]
インフルエンザワクチンとして使用するためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1009]
ワクチンが、インフルエンザに対してナイーブな対象においてインフルエンザに対する免疫性を与えるためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1010]
ナイーブな対象が、12歳未満の小児およびパンデミック地域にいるあらゆる年齢の人からなる群より選択される、前記本発明のいずれかの使用のための組成物。
[本発明1011]
ワクチンが、ペリパンデミック(peri-pandemic)感染性病原体またはパンデミック感染性病原体に対する免疫性を与えるためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1012]
ワクチンが、乳幼児、小児、および成人においてパンデミック感染性病原体に対する免疫性を与えるためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1013]
ワクチンが、乳幼児、小児、および成人において感染性病原体に対する免疫性を与えるためのものである、前記本発明のいずれかの使用のための組成物。
[本発明1014]
非生インフルエンザウイルス抗原が、不活化全ウイルス、スプリットウイルス、およびサブユニットインフルエンザ抗原からなる群より選択される、前記本発明のいずれかの使用のための組成物。
[本発明1015]
非生インフルエンザウイルス抗原がスプリット抗原である、前記本発明のいずれかの使用のための組成物。
[本発明1016]
1種または複数種のモノグリセリドが、ラウリン酸(C12)、ミリスチン酸(C14)、パルミチン酸(C16)、パルミトオレイン酸(C16:1)、オレイン酸(C18:1)、リノール酸(C18:2)、ステアリン酸、ヘキサン酸、カプリル酸、デカン酸(カプリン酸)、アラキジン酸、ベヘン酸、リグノセリン酸、α-リノレン酸、ステアリドン酸、エイコサペンタエン酸、ドコサヘキサエン酸、γ-リノレン酸、ジホモ-γ-リノレン酸、アラキドン酸、エルカ酸、ネルボン酸からなる群より選択されるカルボン酸でモノエステル化されたグリセリドである、前記本発明のいずれかの使用のための組成物。
[本発明1017]
1種または複数種のモノグリセリドが、パルミトオレイン酸(C16:1)、オレイン酸(C18:1)、およびリノール酸(C18:2)からなる群より選択されるカルボン酸でモノエステル化されたグリセリドである、前記本発明のいずれかの使用のための組成物。
[本発明1018]
1種または複数種のモノグリセリドが、オレイン酸でモノエステル化されたグリセリド(オレイン酸グリセリル)である、前記本発明のいずれかの使用のための組成物。
[本発明1019]
1種または複数種のカルボン酸が、ラウリン酸、ミリスチン酸、パルミチン酸、パルミトオレイン酸、オレイン酸、リノール酸、ステアリン酸、ヘキサン酸、カプリル酸、デカン酸(カプリン酸)、アラキジン酸、ベヘン酸、リグノセリン酸、α-リノレン酸、ステアリドン酸、エイコサペンタエン酸、ドコサヘキサエン酸、γ-リノレン酸、ジホモ-γ-リノレン酸、アラキドン酸、エルカ酸、およびネルボン酸からなる群より選択される、前記本発明のいずれかの使用のための組成物。
[本発明1020]
1種または複数種のカルボン酸が、オレイン酸およびラウリン酸からなる群より選択される、前記本発明のいずれかの使用のための組成物。
[本発明1021]
カルボン酸がオレイン酸である、前記本発明のいずれかの使用のための組成物。
[本発明1022]
アジュバントがオレイン酸グリセリル、オレイン酸、および水性媒体を含む、前記本発明のいずれかの組成物。
[本発明1023]
ワクチン組成物が、ワクチン組成物100mLあたり約0.1g〜約5.0gの範囲、またはワクチン組成物100mLあたり約0.1g〜約2.0g、またはワクチン組成物100mLあたり約0.5g〜約2.0g、例えば、0.5g〜約1.5gの範囲の量のモノグリセリドを含む、前記本発明のいずれかの使用のための組成物。
[本発明1024]
ワクチン組成物が、ワクチン組成物100mLあたり約0.1g〜約5.0gの範囲、またはワクチン組成物100mLあたり約0.1g〜約2.0gの範囲、またはワクチン組成物100mLあたり約0.5g〜約2.0g、例えば、0.5g〜約1.5gの範囲の量のカルボン酸を含む、前記本発明のいずれかの使用のための組成物。
[本発明1025]
アジュバントミックス中の1種または複数種のモノグリセリドおよび1種または複数種のカルボン酸が、ワクチンの多くても10%w/v、または多くても5%w/v、または多くても4%w/v、または多くても3%w/v、または多くても2%w/v、または多くても1%w/vである、前記本発明のいずれかの使用のための組成物。
[本発明1026]
本発明1001〜1025のいずれかの組成物を含む治療的有効量のワクチン組成物を鼻腔内投与する工程を含む、ペリパンデミック期またはパンデミック期の期間中に免疫性を与える方法。
[本発明1027]
本発明1001〜1025のいずれかの組成物を含む治療的有効量のワクチン組成物を鼻腔内投与する工程を含む、小児科対象に免疫性を与える方法。
[本発明1028]
本発明1001〜1025のいずれかの組成物を含む治療的有効量のワクチン組成物を鼻腔内投与する工程を含む、ナイーブな対象に免疫性を与える方法。
[本発明1029]
1種または複数種の非生インフルエンザウイルス抗原、および
1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、免疫無防備状態の小児科対象への鼻腔内投与ワクチンとして使用するための組成物。
[本発明1030]
免疫無防備状態の小児科対象への鼻腔内投与インフルエンザワクチンとして使用するための、本発明1029の組成物。
[本発明1031]
免疫無防備状態の小児科対象が、HIVに感染した対象である人; 免疫抑制剤を服用している対象、最近臓器移植を受けた人; 未熟児、および術後患者からなる群より選択される、本発明1029または1030の組成物。
[本発明1032]
i)1種または複数種の非生抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、免疫無防備状態のナイーブな患者において使用する鼻腔内投与ワクチンとして使用するための組成物。
[本発明1033]
免疫無防備状態のナイーブな対象への鼻腔内投与インフルエンザワクチンとして使用するための、本発明1032の使用のための組成物。
[本発明1034]
免疫無防備状態の小児科対象が、HIVに感染した対象である人; 免疫抑制剤を服用している対象、最近臓器移植を受けた人; 未熟児、および術後患者からなる群より選択される、本発明1032または1033の使用のための組成物。
[本発明1035]
i)1種または複数種の肺炎連鎖球菌(Streptococcus pneumoniae)抗原、および
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、肺炎連鎖球菌感染の予防または肺炎連鎖球菌感染に関連した症状の重篤度の低下のために、ナイーブな対象および/または免疫無防備状態の患者において使用する鼻腔内投与ワクチンとして使用するための組成物。
Claims (35)
1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、ナイーブな対象において使用する鼻腔内投与ワクチンとして使用するための組成物。
1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、免疫無防備状態の小児科対象への鼻腔内投与ワクチンとして使用するための組成物。
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、免疫無防備状態のナイーブな患者において使用する鼻腔内投与ワクチンとして使用するための組成物。
ii)1種または複数種のカルボン酸と、水性媒体と、任意で1種または複数種のモノグリセリドとを含む、アジュバント
を含む、肺炎連鎖球菌感染の予防または肺炎連鎖球菌感染に関連した症状の重篤度の低下のために、ナイーブな対象および/または免疫無防備状態の患者において使用する鼻腔内投与ワクチンとして使用するための組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12197522.1A EP2742952A1 (en) | 2012-12-17 | 2012-12-17 | Influenza vaccine composition |
| EP12197522.1 | 2012-12-17 | ||
| PCT/EP2013/077006 WO2014095943A1 (en) | 2012-12-17 | 2013-12-17 | Vaccine composition for naive subjects |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019049330A Division JP2019112448A (ja) | 2012-12-17 | 2019-03-18 | ナイーブな対象のためのワクチン組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016502996A true JP2016502996A (ja) | 2016-02-01 |
| JP2016502996A5 JP2016502996A5 (ja) | 2016-12-01 |
Family
ID=47358019
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015547077A Pending JP2016502996A (ja) | 2012-12-17 | 2013-12-17 | ナイーブな対象のためのワクチン組成物 |
| JP2015547078A Pending JP2016502997A (ja) | 2012-12-17 | 2013-12-17 | 免疫無防備状態の集団において使用するためのワクチン組成物 |
| JP2019049330A Pending JP2019112448A (ja) | 2012-12-17 | 2019-03-18 | ナイーブな対象のためのワクチン組成物 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015547078A Pending JP2016502997A (ja) | 2012-12-17 | 2013-12-17 | 免疫無防備状態の集団において使用するためのワクチン組成物 |
| JP2019049330A Pending JP2019112448A (ja) | 2012-12-17 | 2019-03-18 | ナイーブな対象のためのワクチン組成物 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US11065325B2 (ja) |
| EP (4) | EP2742952A1 (ja) |
| JP (3) | JP2016502996A (ja) |
| KR (3) | KR20210007042A (ja) |
| CN (3) | CN104884085A (ja) |
| AU (2) | AU2013360890B2 (ja) |
| BR (2) | BR112015014243A8 (ja) |
| CA (2) | CA2895028A1 (ja) |
| HK (2) | HK1212611A1 (ja) |
| MX (2) | MX2015007753A (ja) |
| RU (2) | RU2661407C2 (ja) |
| WO (2) | WO2014095944A1 (ja) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2592210C2 (ru) * | 2010-09-30 | 2016-07-20 | Юросайн Вэксинз Аб | Усовершенствованные композиции вакцин |
| CA2962214A1 (en) | 2014-09-26 | 2016-03-31 | Seqirus UK Limited | Vaccination of immunocompromised subjects |
| DK3197487T3 (da) * | 2014-09-26 | 2022-09-05 | Seqirus Uk Ltd | Vaccination af immunsvækkede individer |
| RU2634247C2 (ru) * | 2015-09-28 | 2017-10-24 | Федеральное государственное бюджетное научное учреждение "СЕВЕРО-КАВКАЗСКИЙ ЗОНАЛЬНЫЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ВЕТЕРИНАРНЫЙ ИНСТИТУТ" (ФГБНУ СКЗНИВИ) | Способ стимуляции иммунного ответа и препарат для его осуществления |
| US20200306364A1 (en) * | 2017-11-30 | 2020-10-01 | Ohio State Innovation Foundation | Mucoadhesive nanoparticle entrapped influenza virus vaccine delivery system |
| AR121829A1 (es) * | 2020-04-16 | 2022-07-13 | Bayer Ag | Combinaciones de compuestos activos y composiciones fungicidas que los comprenden |
| US20230133087A1 (en) * | 2020-04-16 | 2023-05-04 | Bayer Aktiengesellschaft | Active compound combinations and fungicide compositions comprising those |
| WO2021209368A1 (en) * | 2020-04-16 | 2021-10-21 | Bayer Aktiengesellschaft | Active compound combinations and fungicide compositions comprising those |
| CN112063699B (zh) * | 2020-09-16 | 2021-06-18 | 成都市疾病预防控制中心 | 一种用于研究hiv感染者免疫衰老机制的系统 |
| WO2023133342A2 (en) * | 2022-01-10 | 2023-07-13 | The Children's Medical Center Corporation | Methods and compositions relating to immunization of immune distinct patients |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012042003A1 (en) * | 2010-09-30 | 2012-04-05 | Eurocine Vaccines Ab | Improved vaccine compositions |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE9602280D0 (sv) | 1996-06-10 | 1996-06-10 | Pharmatrix Ab | Immunstimulerande lipidformulering |
| SE9900496D0 (sv) | 1999-02-12 | 1999-02-12 | Pharmatrix Ab | Vaccine formulation |
| US8410248B2 (en) | 1999-03-12 | 2013-04-02 | Human Genome Sciences Inc. | HWBAO62 polypeptides |
| WO2002080648A2 (en) | 2001-04-05 | 2002-10-17 | Chiron Corporation | Mucosal boosting following parenteral priming |
| US20050208602A1 (en) | 2001-08-10 | 2005-09-22 | Rosen Craig A | 89 human secreted proteins |
| AU2003301843A1 (en) | 2002-05-17 | 2004-06-07 | Human Genome Sciences, Inc. | 157 human secreted proteins |
| SI1567191T1 (sl) | 2002-11-26 | 2011-01-31 | Eurocine Vaccines Ab | Novi adjuvans na aminski osnovi |
| CN1867355A (zh) | 2003-08-11 | 2006-11-22 | 财团法人阪大微生物病研究会 | 包含诱导粘膜免疫的佐剂的新型疫苗 |
| EP1885393A4 (en) | 2005-05-18 | 2011-03-02 | Childrens Hosp & Res Ct Oak | METHODS AND COMPOSITIONS FOR IMMUNIZATION AGAINST CHLAMYDIA INFECTIONS |
| EP1910387B1 (en) | 2005-06-30 | 2016-11-16 | Eisai R&D Management Co., Ltd. | Compounds for preparing immunological adjuvant |
| WO2007018152A1 (ja) | 2005-08-05 | 2007-02-15 | The University Of Tokushima | IgA抗体の選択的産生からIgA及びIgG両抗体産生への切換えを可能にする抗原薬物ビークルとこれを用いる経鼻・粘膜ワクチン |
| RU2323742C1 (ru) * | 2007-02-15 | 2008-05-10 | Государственное учреждение Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова (ГУ НИИВС им. И.И. Мечникова) | Способ повышения иммуногенности инактивированной гриппозной вакцины |
| EP2227251A1 (en) | 2007-12-06 | 2010-09-15 | GlaxoSmithKline Biologicals SA | Influenza composition |
| AU2009293595A1 (en) | 2008-05-23 | 2010-03-25 | The Regents Of The University Of Michigan | Nanoemulsion adjuvants |
| CA2725329C (en) | 2008-05-23 | 2013-10-01 | The Regents Of The University Of Michigan | Nanoemulsion vaccines |
| US20130178383A1 (en) | 2008-11-12 | 2013-07-11 | David Spetzler | Vesicle isolation methods |
| CN103221541B (zh) | 2009-05-28 | 2017-03-01 | 库尔纳公司 | 通过抑制抗病毒基因的天然反义转录物来治疗抗病毒基因相关疾病 |
-
2012
- 2012-12-17 EP EP12197522.1A patent/EP2742952A1/en not_active Withdrawn
-
2013
- 2013-12-17 KR KR1020217000812A patent/KR20210007042A/ko not_active Application Discontinuation
- 2013-12-17 JP JP2015547077A patent/JP2016502996A/ja active Pending
- 2013-12-17 EP EP13805935.7A patent/EP2931307B1/en not_active Not-in-force
- 2013-12-17 EP EP18193418.3A patent/EP3431101A1/en not_active Withdrawn
- 2013-12-17 CA CA2895028A patent/CA2895028A1/en not_active Abandoned
- 2013-12-17 BR BR112015014243A patent/BR112015014243A8/pt not_active Application Discontinuation
- 2013-12-17 US US14/650,809 patent/US11065325B2/en active Active
- 2013-12-17 KR KR1020157019562A patent/KR20150132093A/ko not_active Application Discontinuation
- 2013-12-17 BR BR112015014174A patent/BR112015014174A2/pt not_active Application Discontinuation
- 2013-12-17 WO PCT/EP2013/077007 patent/WO2014095944A1/en active Application Filing
- 2013-12-17 AU AU2013360890A patent/AU2013360890B2/en not_active Ceased
- 2013-12-17 CA CA2895023A patent/CA2895023A1/en not_active Abandoned
- 2013-12-17 CN CN201380065856.0A patent/CN104884085A/zh active Pending
- 2013-12-17 MX MX2015007753A patent/MX2015007753A/es unknown
- 2013-12-17 CN CN202110039199.9A patent/CN112826929A/zh active Pending
- 2013-12-17 EP EP13811462.4A patent/EP2931308B1/en not_active Not-in-force
- 2013-12-17 WO PCT/EP2013/077006 patent/WO2014095943A1/en active Application Filing
- 2013-12-17 AU AU2013360889A patent/AU2013360889C1/en not_active Ceased
- 2013-12-17 RU RU2015129028A patent/RU2661407C2/ru not_active IP Right Cessation
- 2013-12-17 JP JP2015547078A patent/JP2016502997A/ja active Pending
- 2013-12-17 RU RU2015129077A patent/RU2661408C2/ru not_active IP Right Cessation
- 2013-12-17 US US14/650,807 patent/US20150306204A1/en not_active Abandoned
- 2013-12-17 MX MX2015007688A patent/MX2015007688A/es unknown
- 2013-12-17 CN CN201380065877.2A patent/CN104870010A/zh active Pending
- 2013-12-17 KR KR1020157019558A patent/KR20150132092A/ko active Application Filing
-
2016
- 2016-01-20 HK HK16100580.8A patent/HK1212611A1/zh unknown
- 2016-02-14 HK HK16101591.3A patent/HK1213492A1/zh unknown
-
2019
- 2019-03-18 JP JP2019049330A patent/JP2019112448A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012042003A1 (en) * | 2010-09-30 | 2012-04-05 | Eurocine Vaccines Ab | Improved vaccine compositions |
Non-Patent Citations (9)
| Title |
|---|
| BARAS B, ET AL.: "Longevity of the protective immune response induced after vaccination with one or two doses of AS03A", VACCINE, vol. 29, no. 11, JPN6018013957, 13 January 2011 (2011-01-13), pages 2092 - 2099, XP028152755, ISSN: 0003921334, DOI: 10.1016/j.vaccine.2010.12.128 * |
| BARAS B, ET AL.: "Pandemic H1N1 vaccine requires the use of an adjuvant to protect against challenge in naive ferrets", VACCINE, vol. 29, no. 11, JPN6018013954, 14 January 2011 (2011-01-14), pages 2120 - 2126, XP028152758, ISSN: 0003921335, DOI: 10.1016/j.vaccine.2010.12.125 * |
| LAMBKIN R, ET AL.: "Strong local and systemic protective immunity induced in the ferret model by an intranasal virosome-", VACCINE, vol. Vol.22, No.31-32, JPN6018013952, 2004, pages 4390 - 4396, ISSN: 0003921333 * |
| PETERSSON P, ET AL.: "The Eurocine L3 adjuvants with subunit influenza antigens induce protective immunity in mice after i", VACCINE, vol. 28, no. 39, JPN6017028568, 2010, pages 6491 - 6497, XP027267112, ISSN: 0003921329 * |
| 出口 安裕: "インフルエンザワクチン 高齢者・ハイリスク者・医療介護従事者への接種", 臨牀と研究, vol. 第81巻,12号, JPN6017022992, December 2004 (2004-12-01), pages 1938 - 1942, ISSN: 0003921331 * |
| 大藤 さとこ ほか: "インフルエンザワクチンの接種対象", 日本公衆衛生雑誌, vol. 第54巻,第6号, JPN6017022995, 15 June 2007 (2007-06-15), pages 361 - 367, ISSN: 0003921330 * |
| 相内 章 ほか: "経鼻投与型インフルエンザワクチンの実用化に向けて", インフルエンザ, vol. 第13巻,第3号, JPN6017028570, October 2012 (2012-10-01), pages 199 - 204, ISSN: 0003780568 * |
| 菅谷 憲夫: "インフルエンザワクチン", 小児科診療, vol. 第67巻,第11号, JPN6017022998, 2004, pages 1913 - 1918, ISSN: 0003921332 * |
| 長谷川 秀樹: "経鼻粘膜投与型インフルエンザワクチンの開発", THE LUNG-PERSPECTIVES, vol. 第20巻,第4号, JPN6017028572, November 2012 (2012-11-01), pages 418 - 422, ISSN: 0003780569 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2019112448A (ja) | ナイーブな対象のためのワクチン組成物 | |
| TWI737584B (zh) | 手、足及口疫苗及其製備及使用方法 | |
| KR20140033171A (ko) | 비활성화된 뎅기 바이러스 백신 | |
| JP2016516755A (ja) | ワクチン組成物及びその使用方法 | |
| BE1022008B1 (fr) | Compositions immunogenes combinees | |
| JP2011525902A (ja) | 遅延型追加刺激免疫処置に対する迅速な応答 | |
| Nitika et al. | The development of mRNA vaccines for infectious diseases: recent updates | |
| JP2011057605A (ja) | 粘膜投与型ワクチン | |
| JP2018172434A (ja) | 鼻腔内予防接種投薬レジメン | |
| JP2019520090A (ja) | 弱毒変異型ジカウイルスを含むワクチン組成物 | |
| JP2009209086A (ja) | 粘膜投与型ワクチン | |
| JP2023091085A (ja) | 粘膜アジュバント | |
| Morelli et al. | ISCOMATRIX adjuvant in the development of prophylactic and therapeutic vaccines | |
| Willis | The Effect of Maternal Antibodies on Anti-viral Immunity in Infant Mice | |
| US20080038294A1 (en) | Intranasal or inhalational administration of virosomes | |
| Yoshita Bhide et al. | pter 2 | |
| Herzog | Epaxal®: clinical experience with the only aluminium-free hepatitis A vaccine | |
| Huckriede et al. | IntrAnASAL deLIVery oF InFLuenzA SuBunIt VAccIne ForMuLAted WItH GeM PArtIcLeS AS An AdJuVAnt |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161012 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20161012 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170802 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171102 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180419 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180704 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20180705 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20181119 |