KR20140033171A - 비활성화된 뎅기 바이러스 백신 - Google Patents
비활성화된 뎅기 바이러스 백신 Download PDFInfo
- Publication number
- KR20140033171A KR20140033171A KR1020137034545A KR20137034545A KR20140033171A KR 20140033171 A KR20140033171 A KR 20140033171A KR 1020137034545 A KR1020137034545 A KR 1020137034545A KR 20137034545 A KR20137034545 A KR 20137034545A KR 20140033171 A KR20140033171 A KR 20140033171A
- Authority
- KR
- South Korea
- Prior art keywords
- dengue virus
- immunogenic composition
- inactivated dengue
- virus
- preparation
- Prior art date
Links
- 229940023605 dengue virus vaccine Drugs 0.000 title description 3
- 239000000203 mixture Substances 0.000 claims abstract description 283
- 241000725619 Dengue virus Species 0.000 claims abstract description 178
- 230000002163 immunogen Effects 0.000 claims abstract description 147
- 238000000034 method Methods 0.000 claims abstract description 103
- 238000002360 preparation method Methods 0.000 claims description 118
- 239000004094 surface-active agent Substances 0.000 claims description 100
- 241000700605 Viruses Species 0.000 claims description 79
- 229920001983 poloxamer Polymers 0.000 claims description 77
- 239000000872 buffer Substances 0.000 claims description 66
- 239000002671 adjuvant Substances 0.000 claims description 59
- 239000000243 solution Substances 0.000 claims description 51
- 241000710829 Dengue virus group Species 0.000 claims description 35
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 claims description 32
- 229960000502 poloxamer Drugs 0.000 claims description 32
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 claims description 31
- 230000003308 immunostimulating effect Effects 0.000 claims description 28
- 206010012310 Dengue fever Diseases 0.000 claims description 26
- 208000025729 dengue disease Diseases 0.000 claims description 25
- 235000000346 sugar Nutrition 0.000 claims description 25
- 208000001490 Dengue Diseases 0.000 claims description 24
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 23
- 229920005862 polyol Polymers 0.000 claims description 22
- 150000003077 polyols Chemical class 0.000 claims description 21
- 150000003839 salts Chemical class 0.000 claims description 21
- 150000007949 saponins Chemical class 0.000 claims description 21
- 239000002158 endotoxin Substances 0.000 claims description 20
- 229920006008 lipopolysaccharide Polymers 0.000 claims description 20
- 229930182490 saponin Natural products 0.000 claims description 20
- 235000017709 saponins Nutrition 0.000 claims description 20
- 230000028993 immune response Effects 0.000 claims description 19
- 108091034117 Oligonucleotide Proteins 0.000 claims description 18
- 229930006000 Sucrose Natural products 0.000 claims description 17
- 239000007788 liquid Substances 0.000 claims description 17
- 239000005720 sucrose Substances 0.000 claims description 17
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 16
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 16
- 150000007523 nucleic acids Chemical class 0.000 claims description 16
- 239000000839 emulsion Substances 0.000 claims description 15
- 108020004707 nucleic acids Proteins 0.000 claims description 15
- 102000039446 nucleic acids Human genes 0.000 claims description 15
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 claims description 14
- 150000008163 sugars Chemical class 0.000 claims description 14
- 239000003795 chemical substances by application Substances 0.000 claims description 13
- 239000003921 oil Substances 0.000 claims description 12
- 239000000126 substance Substances 0.000 claims description 12
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 11
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 claims description 11
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 claims description 11
- 238000007496 glass forming Methods 0.000 claims description 11
- 239000008103 glucose Substances 0.000 claims description 11
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 claims description 10
- 229920002675 Polyoxyl Polymers 0.000 claims description 10
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 claims description 10
- VEZXCJBBBCKRPI-UHFFFAOYSA-N beta-propiolactone Chemical compound O=C1CCO1 VEZXCJBBBCKRPI-UHFFFAOYSA-N 0.000 claims description 10
- 230000002779 inactivation Effects 0.000 claims description 10
- 239000002502 liposome Substances 0.000 claims description 10
- 229960000380 propiolactone Drugs 0.000 claims description 10
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 claims description 10
- 238000011084 recovery Methods 0.000 claims description 9
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 claims description 8
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 claims description 8
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 claims description 8
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 claims description 8
- NBGXQZRRLOGAJF-UHFFFAOYSA-N Maltulose Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)(CO)OCC1O NBGXQZRRLOGAJF-UHFFFAOYSA-N 0.000 claims description 8
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 claims description 8
- 239000008101 lactose Substances 0.000 claims description 8
- JCQLYHFGKNRPGE-FCVZTGTOSA-N lactulose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 JCQLYHFGKNRPGE-FCVZTGTOSA-N 0.000 claims description 8
- 229960000511 lactulose Drugs 0.000 claims description 8
- PFCRQPBOOFTZGQ-UHFFFAOYSA-N lactulose keto form Natural products OCC(=O)C(O)C(C(O)CO)OC1OC(CO)C(O)C(O)C1O PFCRQPBOOFTZGQ-UHFFFAOYSA-N 0.000 claims description 8
- JCQLYHFGKNRPGE-HFZVAGMNSA-N maltulose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 JCQLYHFGKNRPGE-HFZVAGMNSA-N 0.000 claims description 8
- 239000011780 sodium chloride Substances 0.000 claims description 8
- 238000001179 sorption measurement Methods 0.000 claims description 8
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 claims description 8
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 claims description 7
- QWIZNVHXZXRPDR-UHFFFAOYSA-N D-melezitose Natural products O1C(CO)C(O)C(O)C(O)C1OC1C(O)C(CO)OC1(CO)OC1OC(CO)C(O)C(O)C1O QWIZNVHXZXRPDR-UHFFFAOYSA-N 0.000 claims description 7
- 229920002307 Dextran Polymers 0.000 claims description 7
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 claims description 7
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 claims description 7
- 230000002776 aggregation Effects 0.000 claims description 7
- 238000004220 aggregation Methods 0.000 claims description 7
- 230000002238 attenuated effect Effects 0.000 claims description 7
- QWIZNVHXZXRPDR-WSCXOGSTSA-N melezitose Chemical compound O([C@@]1(O[C@@H]([C@H]([C@@H]1O[C@@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O)CO)CO)[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O QWIZNVHXZXRPDR-WSCXOGSTSA-N 0.000 claims description 7
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 claims description 7
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 claims description 6
- UOQHWNPVNXSDDO-UHFFFAOYSA-N 3-bromoimidazo[1,2-a]pyridine-6-carbonitrile Chemical compound C1=CC(C#N)=CN2C(Br)=CN=C21 UOQHWNPVNXSDDO-UHFFFAOYSA-N 0.000 claims description 6
- PVXPPJIGRGXGCY-TZLCEDOOSA-N 6-O-alpha-D-glucopyranosyl-D-fructofuranose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)C(O)(CO)O1 PVXPPJIGRGXGCY-TZLCEDOOSA-N 0.000 claims description 6
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 claims description 6
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 6
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 claims description 6
- 241000710831 Flavivirus Species 0.000 claims description 6
- AYRXSINWFIIFAE-SCLMCMATSA-N Isomaltose Natural products OC[C@H]1O[C@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)[C@@H](O)[C@@H](O)[C@@H]1O AYRXSINWFIIFAE-SCLMCMATSA-N 0.000 claims description 6
- 229930195725 Mannitol Natural products 0.000 claims description 6
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 claims description 6
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 claims description 6
- 230000005847 immunogenicity Effects 0.000 claims description 6
- 238000007918 intramuscular administration Methods 0.000 claims description 6
- DLRVVLDZNNYCBX-RTPHMHGBSA-N isomaltose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)C(O)O1 DLRVVLDZNNYCBX-RTPHMHGBSA-N 0.000 claims description 6
- 239000000832 lactitol Substances 0.000 claims description 6
- VQHSOMBJVWLPSR-JVCRWLNRSA-N lactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-JVCRWLNRSA-N 0.000 claims description 6
- 235000010448 lactitol Nutrition 0.000 claims description 6
- 229960003451 lactitol Drugs 0.000 claims description 6
- 229940099563 lactobionic acid Drugs 0.000 claims description 6
- VQHSOMBJVWLPSR-WUJBLJFYSA-N maltitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-WUJBLJFYSA-N 0.000 claims description 6
- 239000000845 maltitol Substances 0.000 claims description 6
- 235000010449 maltitol Nutrition 0.000 claims description 6
- 229940035436 maltitol Drugs 0.000 claims description 6
- 239000000594 mannitol Substances 0.000 claims description 6
- 235000010355 mannitol Nutrition 0.000 claims description 6
- 229960001855 mannitol Drugs 0.000 claims description 6
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 claims description 6
- 238000002156 mixing Methods 0.000 claims description 6
- 239000000600 sorbitol Substances 0.000 claims description 6
- 229960002920 sorbitol Drugs 0.000 claims description 6
- 235000010356 sorbitol Nutrition 0.000 claims description 6
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 claims description 5
- SHBUUTHKGIVMJT-UHFFFAOYSA-N Hydroxystearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OO SHBUUTHKGIVMJT-UHFFFAOYSA-N 0.000 claims description 5
- 239000004359 castor oil Substances 0.000 claims description 5
- 235000019438 castor oil Nutrition 0.000 claims description 5
- 229960001031 glucose Drugs 0.000 claims description 5
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 claims description 5
- 229940072106 hydroxystearate Drugs 0.000 claims description 5
- 230000000415 inactivating effect Effects 0.000 claims description 5
- 229960003511 macrogol Drugs 0.000 claims description 5
- 229940035032 monophosphoryl lipid a Drugs 0.000 claims description 5
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 claims description 5
- 229920002113 octoxynol Polymers 0.000 claims description 5
- 229940066429 octoxynol Drugs 0.000 claims description 5
- HEGSGKPQLMEBJL-RKQHYHRCSA-N octyl beta-D-glucopyranoside Chemical compound CCCCCCCCO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HEGSGKPQLMEBJL-RKQHYHRCSA-N 0.000 claims description 5
- 229920000136 polysorbate Polymers 0.000 claims description 5
- 229950008882 polysorbate Drugs 0.000 claims description 5
- 229910000160 potassium phosphate Inorganic materials 0.000 claims description 5
- 235000011009 potassium phosphates Nutrition 0.000 claims description 5
- 239000001488 sodium phosphate Substances 0.000 claims description 5
- 229910000162 sodium phosphate Inorganic materials 0.000 claims description 5
- 239000007787 solid Substances 0.000 claims description 5
- 238000007920 subcutaneous administration Methods 0.000 claims description 5
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 claims description 5
- 239000008215 water for injection Substances 0.000 claims description 5
- 241000710842 Japanese encephalitis virus Species 0.000 claims description 4
- 241000710772 Yellow fever virus Species 0.000 claims description 4
- 229910017053 inorganic salt Inorganic materials 0.000 claims description 4
- 238000007911 parenteral administration Methods 0.000 claims description 4
- 229940051021 yellow-fever virus Drugs 0.000 claims description 4
- 101710204837 Envelope small membrane protein Proteins 0.000 claims description 3
- 101710145006 Lysis protein Proteins 0.000 claims description 3
- 239000006172 buffering agent Substances 0.000 claims description 3
- 239000001397 quillaja saponaria molina bark Substances 0.000 claims description 3
- 239000000644 isotonic solution Substances 0.000 claims description 2
- 230000005855 radiation Effects 0.000 claims 3
- 238000009472 formulation Methods 0.000 abstract description 59
- 210000004027 cell Anatomy 0.000 description 39
- 239000000556 agonist Substances 0.000 description 33
- 108091007433 antigens Proteins 0.000 description 29
- 102000036639 antigens Human genes 0.000 description 29
- 230000004044 response Effects 0.000 description 29
- 239000000427 antigen Substances 0.000 description 28
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 25
- 102000002689 Toll-like receptor Human genes 0.000 description 25
- 108020000411 Toll-like receptor Proteins 0.000 description 25
- -1 poly (oxypropylene) Polymers 0.000 description 25
- 229960005486 vaccine Drugs 0.000 description 24
- 238000004108 freeze drying Methods 0.000 description 21
- 230000011664 signaling Effects 0.000 description 19
- 235000014633 carbohydrates Nutrition 0.000 description 14
- 244000052769 pathogen Species 0.000 description 14
- 108090000623 proteins and genes Proteins 0.000 description 14
- 238000000746 purification Methods 0.000 description 14
- 150000001720 carbohydrates Chemical class 0.000 description 13
- 230000001717 pathogenic effect Effects 0.000 description 13
- 239000000546 pharmaceutical excipient Substances 0.000 description 13
- 235000018102 proteins Nutrition 0.000 description 13
- 102000004169 proteins and genes Human genes 0.000 description 13
- 150000001875 compounds Chemical class 0.000 description 12
- 238000004519 manufacturing process Methods 0.000 description 12
- 230000003612 virological effect Effects 0.000 description 12
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 10
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 10
- CTMZLDSMFCVUNX-VMIOUTBZSA-N cytidylyl-(3'->5')-guanosine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@H](OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=C(C(N=C(N)N3)=O)N=C2)O)[C@@H](CO)O1 CTMZLDSMFCVUNX-VMIOUTBZSA-N 0.000 description 10
- 201000010099 disease Diseases 0.000 description 10
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 10
- 208000015181 infectious disease Diseases 0.000 description 10
- 229920001451 polypropylene glycol Polymers 0.000 description 10
- 238000001914 filtration Methods 0.000 description 9
- 239000004615 ingredient Substances 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- 239000000725 suspension Substances 0.000 description 9
- 229910052782 aluminium Inorganic materials 0.000 description 8
- 235000001014 amino acid Nutrition 0.000 description 8
- 150000001413 amino acids Chemical class 0.000 description 8
- 239000002245 particle Substances 0.000 description 8
- 230000002829 reductive effect Effects 0.000 description 8
- 230000001900 immune effect Effects 0.000 description 7
- 239000007764 o/w emulsion Substances 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 238000001542 size-exclusion chromatography Methods 0.000 description 7
- 238000003860 storage Methods 0.000 description 7
- 241000894006 Bacteria Species 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 6
- 108010028921 Lipopeptides Proteins 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 239000007983 Tris buffer Substances 0.000 description 6
- 229940037003 alum Drugs 0.000 description 6
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 6
- 230000001580 bacterial effect Effects 0.000 description 6
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 6
- 239000013020 final formulation Substances 0.000 description 6
- 230000002209 hydrophobic effect Effects 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 230000007935 neutral effect Effects 0.000 description 6
- 108090000765 processed proteins & peptides Proteins 0.000 description 6
- 102000004196 processed proteins & peptides Human genes 0.000 description 6
- 230000004224 protection Effects 0.000 description 6
- 230000001681 protective effect Effects 0.000 description 6
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 5
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 5
- 230000000890 antigenic effect Effects 0.000 description 5
- 230000009849 deactivation Effects 0.000 description 5
- 238000001035 drying Methods 0.000 description 5
- 231100000252 nontoxic Toxicity 0.000 description 5
- 230000003000 nontoxic effect Effects 0.000 description 5
- 238000012545 processing Methods 0.000 description 5
- 210000002966 serum Anatomy 0.000 description 5
- 150000005846 sugar alcohols Chemical class 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- 108091035707 Consensus sequence Proteins 0.000 description 4
- CTKXFMQHOOWWEB-UHFFFAOYSA-N Ethylene oxide/propylene oxide copolymer Chemical compound CCCOC(C)COCCO CTKXFMQHOOWWEB-UHFFFAOYSA-N 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 208000009714 Severe Dengue Diseases 0.000 description 4
- 230000002378 acidificating effect Effects 0.000 description 4
- 229940047712 aluminum hydroxyphosphate Drugs 0.000 description 4
- 238000011026 diafiltration Methods 0.000 description 4
- 238000003306 harvesting Methods 0.000 description 4
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 239000012669 liquid formulation Substances 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 230000003472 neutralizing effect Effects 0.000 description 4
- 229920001542 oligosaccharide Polymers 0.000 description 4
- 229920001993 poloxamer 188 Polymers 0.000 description 4
- 229940044519 poloxamer 188 Drugs 0.000 description 4
- 229920001184 polypeptide Polymers 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 238000000859 sublimation Methods 0.000 description 4
- 230000008022 sublimation Effects 0.000 description 4
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 3
- 241000255925 Diptera Species 0.000 description 3
- 241000196324 Embryophyta Species 0.000 description 3
- 101100481584 Mus musculus Tlr1 gene Proteins 0.000 description 3
- 241000588653 Neisseria Species 0.000 description 3
- 101710116435 Outer membrane protein Proteins 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 108010013381 Porins Proteins 0.000 description 3
- 102000017033 Porins Human genes 0.000 description 3
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 3
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 3
- UZQJVUCHXGYFLQ-AYDHOLPZSA-N [(2s,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-4-[(2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-6-(hydroxymethyl)-4-[(2s,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-6-(hy Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1CC[C@]2(C)[C@H]3CC=C4[C@@]([C@@]3(CC[C@H]2[C@@]1(C=O)C)C)(C)CC(O)[C@]1(CCC(CC14)(C)C)C(=O)O[C@H]1[C@@H]([C@@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O[C@H]4[C@@H]([C@@H](O[C@H]5[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O5)O)[C@H](O)[C@@H](CO)O4)O)[C@H](O)[C@@H](CO)O3)O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O UZQJVUCHXGYFLQ-AYDHOLPZSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 235000012000 cholesterol Nutrition 0.000 description 3
- 239000003599 detergent Substances 0.000 description 3
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 3
- 150000002016 disaccharides Chemical class 0.000 description 3
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 229930182470 glycoside Natural products 0.000 description 3
- 230000002949 hemolytic effect Effects 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 230000003053 immunization Effects 0.000 description 3
- 238000002649 immunization Methods 0.000 description 3
- 239000003022 immunostimulating agent Substances 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- GZQKNULLWNGMCW-PWQABINMSA-N lipid A (E. coli) Chemical class O1[C@H](CO)[C@@H](OP(O)(O)=O)[C@H](OC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCCCC)[C@@H](NC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCC)[C@@H]1OC[C@@H]1[C@@H](O)[C@H](OC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](NC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](OP(O)(O)=O)O1 GZQKNULLWNGMCW-PWQABINMSA-N 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 238000011140 membrane chromatography Methods 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 235000021317 phosphate Nutrition 0.000 description 3
- 239000008363 phosphate buffer Substances 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 3
- 229940031439 squalene Drugs 0.000 description 3
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 3
- 231100000331 toxic Toxicity 0.000 description 3
- 230000002588 toxic effect Effects 0.000 description 3
- DFUSDJMZWQVQSF-XLGIIRLISA-N (2r)-2-methyl-2-[(4r,8r)-4,8,12-trimethyltridecyl]-3,4-dihydrochromen-6-ol Chemical compound OC1=CC=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1 DFUSDJMZWQVQSF-XLGIIRLISA-N 0.000 description 2
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 2
- 108010042708 Acetylmuramyl-Alanyl-Isoglutamine Proteins 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 2
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 2
- 101000831567 Homo sapiens Toll-like receptor 2 Proteins 0.000 description 2
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- 108090001030 Lipoproteins Proteins 0.000 description 2
- 102000004895 Lipoproteins Human genes 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 239000012519 Q-Sepharose 4FF resin Substances 0.000 description 2
- 241000219287 Saponaria Species 0.000 description 2
- 239000012506 Sephacryl® Substances 0.000 description 2
- PRXRUNOAOLTIEF-ADSICKODSA-N Sorbitan trioleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC PRXRUNOAOLTIEF-ADSICKODSA-N 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 229940124614 TLR 8 agonist Drugs 0.000 description 2
- 102100024333 Toll-like receptor 2 Human genes 0.000 description 2
- 102100039390 Toll-like receptor 7 Human genes 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 229940087168 alpha tocopherol Drugs 0.000 description 2
- 239000008365 aqueous carrier Substances 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 150000001719 carbohydrate derivatives Chemical class 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 201000002950 dengue hemorrhagic fever Diseases 0.000 description 2
- 201000009892 dengue shock syndrome Diseases 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 238000005187 foaming Methods 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 229940124669 imidazoquinoline Drugs 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 229960001438 immunostimulant agent Drugs 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 230000003204 osmotic effect Effects 0.000 description 2
- 230000010412 perfusion Effects 0.000 description 2
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- GRLPQNLYRHEGIJ-UHFFFAOYSA-J potassium aluminium sulfate Chemical compound [Al+3].[K+].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O GRLPQNLYRHEGIJ-UHFFFAOYSA-J 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 2
- 229960000984 tocofersolan Drugs 0.000 description 2
- 229930003799 tocopherol Natural products 0.000 description 2
- 235000010384 tocopherol Nutrition 0.000 description 2
- 239000011732 tocopherol Substances 0.000 description 2
- 229960001295 tocopherol Drugs 0.000 description 2
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 description 2
- 229940044655 toll-like receptor 9 agonist Drugs 0.000 description 2
- 229920000428 triblock copolymer Polymers 0.000 description 2
- 238000013060 ultrafiltration and diafiltration Methods 0.000 description 2
- 238000009281 ultraviolet germicidal irradiation Methods 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- 210000003501 vero cell Anatomy 0.000 description 2
- 210000000605 viral structure Anatomy 0.000 description 2
- 239000002076 α-tocopherol Substances 0.000 description 2
- 235000004835 α-tocopherol Nutrition 0.000 description 2
- QPGLTHGSKVUPIB-DHIUTWEWSA-N (3R)-N-[(1R)-1,10-dihydroxydecyl]-3-hydroxytetradecanamide Chemical compound O[C@@H](CC(=O)N[C@@H](CCCCCCCCCO)O)CCCCCCCCCCC QPGLTHGSKVUPIB-DHIUTWEWSA-N 0.000 description 1
- SERLAGPUMNYUCK-DCUALPFSSA-N 1-O-alpha-D-glucopyranosyl-D-mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O SERLAGPUMNYUCK-DCUALPFSSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- VDCRFBBZFHHYGT-IOSLPCCCSA-N 2-amino-9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-enyl-3h-purine-6,8-dione Chemical group O=C1N(CC=C)C=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VDCRFBBZFHHYGT-IOSLPCCCSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PZPXDAEZSA-N 4β-mannobiose Chemical compound O[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-PZPXDAEZSA-N 0.000 description 1
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- 101150116940 AGPS gene Proteins 0.000 description 1
- 241000256118 Aedes aegypti Species 0.000 description 1
- 241000256173 Aedes albopictus Species 0.000 description 1
- 108020000946 Bacterial DNA Proteins 0.000 description 1
- 241000589969 Borreliella burgdorferi Species 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical class [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 241000282552 Chlorocebus aethiops Species 0.000 description 1
- OCUCCJIRFHNWBP-IYEMJOQQSA-L Copper gluconate Chemical class [Cu+2].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O OCUCCJIRFHNWBP-IYEMJOQQSA-L 0.000 description 1
- AEMOLEFTQBMNLQ-VANFPWTGSA-N D-mannopyranuronic acid Chemical compound OC1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@@H]1O AEMOLEFTQBMNLQ-VANFPWTGSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 101000738180 Euglena gracilis Chaperonin CPN60, mitochondrial Proteins 0.000 description 1
- 102000008946 Fibrinogen Human genes 0.000 description 1
- 108010049003 Fibrinogen Proteins 0.000 description 1
- 108010040721 Flagellin Proteins 0.000 description 1
- 241000710781 Flaviviridae Species 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 1
- 229930186217 Glycolipid Natural products 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical group C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 1
- 241001316290 Gypsophila Species 0.000 description 1
- 206010018910 Haemolysis Diseases 0.000 description 1
- 101710113864 Heat shock protein 90 Proteins 0.000 description 1
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- 229920002971 Heparan sulfate Polymers 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000831496 Homo sapiens Toll-like receptor 3 Proteins 0.000 description 1
- 101000669406 Homo sapiens Toll-like receptor 6 Proteins 0.000 description 1
- 101000800483 Homo sapiens Toll-like receptor 8 Proteins 0.000 description 1
- 229920001612 Hydroxyethyl starch Chemical class 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical class [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 201000005505 Measles Diseases 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241001092142 Molina Species 0.000 description 1
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 1
- VCUFZILGIRCDQQ-KRWDZBQOSA-N N-[[(5S)-2-oxo-3-(2-oxo-3H-1,3-benzoxazol-6-yl)-1,3-oxazolidin-5-yl]methyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C1O[C@H](CN1C1=CC2=C(NC(O2)=O)C=C1)CNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F VCUFZILGIRCDQQ-KRWDZBQOSA-N 0.000 description 1
- 108010084333 N-palmitoyl-S-(2,3-bis(palmitoyloxy)propyl)cysteinyl-seryl-lysyl-lysyl-lysyl-lysine Proteins 0.000 description 1
- 241000588650 Neisseria meningitidis Species 0.000 description 1
- 108700018753 Neisseria porin Proteins 0.000 description 1
- DKXNBNKWCZZMJT-UHFFFAOYSA-N O4-alpha-D-Mannopyranosyl-D-mannose Natural products O=CC(O)C(O)C(C(O)CO)OC1OC(CO)C(O)C(O)C1O DKXNBNKWCZZMJT-UHFFFAOYSA-N 0.000 description 1
- 235000010676 Ocimum basilicum Nutrition 0.000 description 1
- 240000007926 Ocimum gratissimum Species 0.000 description 1
- 108700006640 OspA Proteins 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical class [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- 108010075142 Protollin Proteins 0.000 description 1
- 102000007615 Pulmonary Surfactant-Associated Protein A Human genes 0.000 description 1
- 108010007100 Pulmonary Surfactant-Associated Protein A Proteins 0.000 description 1
- 241001454523 Quillaja saponaria Species 0.000 description 1
- 235000009001 Quillaja saponaria Nutrition 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 241000144290 Sigmodon hispidus Species 0.000 description 1
- 239000004147 Sorbitan trioleate Substances 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- 230000029662 T-helper 1 type immune response Effects 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 102000008235 Toll-Like Receptor 9 Human genes 0.000 description 1
- 108010060818 Toll-Like Receptor 9 Proteins 0.000 description 1
- 102100024324 Toll-like receptor 3 Human genes 0.000 description 1
- 102100039387 Toll-like receptor 6 Human genes 0.000 description 1
- 102100033110 Toll-like receptor 8 Human genes 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 108020005202 Viral DNA Proteins 0.000 description 1
- 108010003533 Viral Envelope Proteins Proteins 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 229920000392 Zymosan Polymers 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 238000000787 affinity precipitation Methods 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 230000001668 ameliorated effect Effects 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 210000001224 bacterial fimbriae Anatomy 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- 239000011575 calcium Chemical class 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 229940077731 carbohydrate nutrients Drugs 0.000 description 1
- 229910052799 carbon Chemical group 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 108091092356 cellular DNA Proteins 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- SQQXRXKYTKFFSM-UHFFFAOYSA-N chembl1992147 Chemical compound OC1=C(OC)C(OC)=CC=C1C1=C(C)C(C(O)=O)=NC(C=2N=C3C4=NC(C)(C)N=C4C(OC)=C(O)C3=CC=2)=C1N SQQXRXKYTKFFSM-UHFFFAOYSA-N 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000012297 crystallization seed Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 150000001924 cycloalkanes Chemical class 0.000 description 1
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical class NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 1
- FOTKYAAJKYLFFN-UHFFFAOYSA-N decane-1,10-diol Chemical compound OCCCCCCCCCCO FOTKYAAJKYLFFN-UHFFFAOYSA-N 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-N dithiophosphoric acid Chemical class OP(O)(S)=S NAGJZTKCGNOGPW-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000002296 dynamic light scattering Methods 0.000 description 1
- 239000006274 endogenous ligand Substances 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- NLFBCYMMUAKCPC-KQQUZDAGSA-N ethyl (e)-3-[3-amino-2-cyano-1-[(e)-3-ethoxy-3-oxoprop-1-enyl]sulfanyl-3-oxoprop-1-enyl]sulfanylprop-2-enoate Chemical compound CCOC(=O)\C=C\SC(=C(C#N)C(N)=O)S\C=C\C(=O)OCC NLFBCYMMUAKCPC-KQQUZDAGSA-N 0.000 description 1
- 239000006277 exogenous ligand Substances 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 229940012952 fibrinogen Drugs 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000004088 foaming agent Substances 0.000 description 1
- 239000013022 formulation composition Substances 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 150000002338 glycosides Chemical class 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical class O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 230000008588 hemolysis Effects 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229940099552 hyaluronan Drugs 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 229940050526 hydroxyethylstarch Drugs 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical group C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 230000000951 immunodiffusion Effects 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 230000002480 immunoprotective effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 239000002563 ionic surfactant Substances 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 229920005684 linear copolymer Polymers 0.000 description 1
- AGBQKNBQESQNJD-UHFFFAOYSA-M lipoate Chemical compound [O-]C(=O)CCCCC1CCSS1 AGBQKNBQESQNJD-UHFFFAOYSA-M 0.000 description 1
- 235000019136 lipoic acid Nutrition 0.000 description 1
- 229950005634 loxoribine Drugs 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000011777 magnesium Chemical class 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical class [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 238000004848 nephelometry Methods 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000006353 oxyethylene group Chemical group 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000004713 phosphodiesters Chemical class 0.000 description 1
- 230000007505 plaque formation Effects 0.000 description 1
- 238000002962 plaque-reduction assay Methods 0.000 description 1
- 229940115272 polyinosinic:polycytidylic acid Drugs 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 238000011027 product recovery Methods 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 235000019337 sorbitan trioleate Nutrition 0.000 description 1
- 229960000391 sorbitan trioleate Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 125000000185 sucrose group Chemical group 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L sulfate group Chemical group S(=O)(=O)([O-])[O-] QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229960002663 thioctic acid Drugs 0.000 description 1
- 150000003573 thiols Chemical group 0.000 description 1
- 239000003970 toll like receptor agonist Substances 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 150000004043 trisaccharides Chemical class 0.000 description 1
- 201000008827 tuberculosis Diseases 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 239000012646 vaccine adjuvant Substances 0.000 description 1
- 229940124931 vaccine adjuvant Drugs 0.000 description 1
- 230000029812 viral genome replication Effects 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 229960004854 viral vaccine Drugs 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- 230000007923 virulence factor Effects 0.000 description 1
- 239000000304 virulence factor Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000002888 zwitterionic surfactant Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5252—Virus inactivated (killed)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55505—Inorganic adjuvants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/24011—Flaviviridae
- C12N2770/24111—Flavivirus, e.g. yellow fever virus, dengue, JEV
- C12N2770/24134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본 발명은 정제된 비활성화된 뎅기 바이러스를 함유하는 면역원성 조성물의 제형, 및 이를 생성하는 방법을 제공한다.
Description
관련 출원의 전후-참조
본 출원은 2011년 5월 26일에 출원된 미국 가출원 번호 61/490,205호 및 2011년 12월 15일에 출원된 61/570,966호의 더 이른 출원일의 이익을 주장하며, 상기 출원들의 개시내용은 본원에 포함된다.
37 C.F.R. § 1.71(E)에 준한 저작권 고시
본 특허 문헌의 개시내용의 일부는 저작권 보호에 적용되는 요소를 함유한다. 저작권 소유자는 특허청 파일 또는 기록에서 명시되어 있는 바와 같이 누군가에 의한 특허 문헌 또는 특허 명세의 팩시밀리 복제에 대해 이의가 없으나, 어떤 경우에든 모든 저작권 권리가 보존된다.
배경
뎅기(Dengue)는 모기에 의해 전염되는 인간의 급성 바이러스 질병이다. 이는 열대 및 아열대에서의 풍토병이며, 전세계적으로 매년 100,000,000의 병증이 발생하는 것으로 추정된다. 비교적 희귀하지만, 뎅기출혈열(Dengue hemorrhagic fever, DHF) 및 뎅기 쇼크 증후군(Dengue shock syndrome, DSS)은 아동에서의 유의한 사망 원인이다. 현재, 뎅기에 대해 보호하는 백신은 존재하지 않으며, 모기 매개 동물을 조절함으로써 질병을 예방하려는 시도는 대부분 효과가 없는 것으로 입증되었다. 따라서, 뎅기 바이러스에 의해 야기되는 질병에 대해 보호하기 위한 안전하고 효과적인 백신이 필요하다.
개요
본 발명의 개시는 뎅기 바이러스에 대해 면역 반응을 유도하는 조성물의 제형화에 관한 것이다.
도면의 간단한 설명
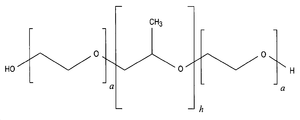
도 1은 폴록사머(poloxamer) 계면활성제: α-하이드로-ω-하이드록시폴리(옥시에틸렌) 폴리(옥시프로필렌) 폴리(옥시에틸렌) 트리블록 공중합체의 일반식의 개략적 예시이다.
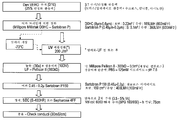
도 2A 및 B는 정제된 비활성화된 뎅기 바이러스를 포함하는 면역원성 조성물의 정제 및 비활성화를 위한 예시적 방법을 예시하는 순서도이다. 도 2C 및 D는 정제 및 비활성화를 위한 대안적 방법을 예시하는 순서도이다.
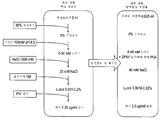
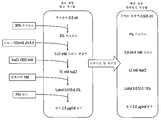
도 3A 및 B는 정제된 비활성화된 뎅기 바이러스를 포함하는 면역원성 조성물의 제형화를 위한 예시적 방법을 예시하는 순서도이다.
도 4A-B는 정제된 비활성화된 뎅기 바이러스를 포함하는 면역원성 조성물의 제형화 후의 생성물 특성규명의 대표적 결과를 예시하는 표이다.
도 5A-C는 동결건조 및 재구성 후의 생성물 특성규명의 대표적 결과를 예시하는 표이다.
도 6A 및 B는 안정성 특징의 도표적 표현이다(A: 고유 형광 280/320; B: ELISA).
상세한 설명
서문
본 발명의 개시는 면역원성 조성물의 제형화에 관한 것이다. 특히, 본 발명의 개시는 정제된 비활성화된 뎅기 바이러스의 하나 이상의 균주를 함유하는 조성물, 예를 들어, 벌크 백신 제조물 및 면역원성 조성물의 제형화에 관한 것이다. 본원에 개시된 제형화는 정제된 비활성화된 뎅기 바이러스를 함유하는 면역원성 조성물의 회수 및 안정성을 증가시켜, 이들의 생성, 저장 및 유통을 촉진시킨다.
본 발명의 개시의 첫번째 양태는 완충제 및 계면활성제와 조합된 하나 이상의 정제된 비활성화 뎅기 바이러스를 포함하는 조성물에 관한 것이다. 유리하게는, 상기 조성물은 면역원성 조성물(예를 들어, 뎅기 바이러스에 의한 감염 및/또는 이로 인한 질병을 예방하기 위한 백신)로의 제형화에 적합한 비활성화된 뎅기 바이러스의 벌크 제조물이다. 선택된 계면활성제의 첨가는, 예를 들어, 계면활성제를 포함하지 않는 제형에 비해 항원적으로 보존된 비활성화된 뎅기 바이러스의 회수를 향상시킨다. 계면활성제를 함유하는 정제된 비활성화된 뎅기 바이러스의 제형은, 예를 들어, 동결건조, 저장 및 재구성 동안 비활성화된 바이러스의 비특이적 흡착 및/또는 응집을 감소시키는 유리한 특징을 갖는다.
본원에 개시된 조성물은 뎅기 바이러스의 하나 이상의 혈청형을 포함할 수 있다. 일반적으로, 조성물은 뎅기 혈청형 1, 뎅기 혈청형 2, 뎅기 혈청형 3 및/또는 뎅기 혈청형 4(각각, DEN-1, DEN-2, DEN-3, 및/또는 DEN-4)인 하나 이상의 혈청형으로부터의 복수의 뎅기 바이러스를 포함한다. 예를 들어, 조성물은 뎅기 바이러스의 다양한 혈청으로부터의 2, 3 또는 4개의 상이한 바이러스를 포함할 수 있다. 한 특정 예에서, 조성물은 4개의 상이한 정제된 비활성화된 뎅기 바이러스를 포함하며, 상기 각각의 상이한 혈청형은 뎅기 바이러스의 상이한 혈청형 각각에 특이적인 면역 반응을 유도한다(또는 유도할 수 있다). 따라서, 조성물은 유리하게는 DEN-1, DEN-2, DEN-3 및 DEN-4 모두에 대한 면역 반응을 유도하는 4개의 상이한 정제된 비활성화된 뎅기 바이러스를 포함한다. 바이러스(들)은 야생형 바이러스(즉, 자연 발생 분리물로부터의 독성 바이러스로부터 증식되거나 이에 상응하는 바이러스)로부터 선택될 수 있거나, 바이러스(들)은 약독화된 바이러스로부터 선택될 수 있다. 선택된 바이러스는 재조합 바이러스일 수 있다. 예를 들어, 재조합 바이러스는 키메라 바이러스, 예를 들어, 뎅기 바이러스로부터의 핵산 및 또 다른 플라비바이러스로부터의 핵산을 갖는 바이러스, 예를 들어, 상이한 뎅기 바이러스, 황열 바이러스, 또는 일본 뇌염 바이러스일 수 있다. 통상적으로, 키메라 바이러스는 뎅기 M 및 뎅기 E 단백질 중 하나 또는 둘 모두를 포함한다. 단일 조성물은 임의의 조합의 하나 이상의 야생형 바이러스, 하나 이상의 약독화된 바이러스, 하나 이상의 재조합 바이러스, 및/또는 하나 이상의 키메라 바이러스를 포함할 수 있다.
정제된 비활성화된 뎅기 바이러스는 화학적, 물리적 및/또는 방사선조사 비활성화 작용제를 단독으로 또는 임의의 조합으로 이용하여 비활성화될 수 있다. 정제된 비활성화된 뎅기 바이러스는 포름알데하이드, 베타프로피오락톤 (BPL), 과산화수소, 자외선 방사선조사 및 감마 방사선조사, 또는 이들 기술 중 임의의 기술의 조합에 대한 노출에 의해 비활성화될 수 있다.
통상적으로, 면역원성 조성물의 단일 인간 용량은 적어도 0.1 ㎍, 0.2 ㎍, 적어도 0.25 ㎍, 적어도 0.3 ㎍, 적어도 0.33 ㎍, 적어도 0.4 ㎍, 적어도 0.5 ㎍, 적어도 1.0 ㎍, 또는 적어도 2.0 ㎍, 또는 적어도 3.0 ㎍, 또는 적어도 5.0 ㎍, 또는 적어도 10.0 ㎍(또는 0.1과 10.0 ㎍ 사이의 임의의 양)의 각각의 바이러스 혈청형을 함유한다. 통상적으로, 면역원성 조성물의 단일 인간 용량은 100 ㎍ 이하의 각각의 바이러스 혈청형, 예를 들어, 90 ㎍ 이하, 또는 80 ㎍ 이하, 또는 75 ㎍ 이하, 또는 70 ㎍ 이하, 또는 60 ㎍ 이하, 또는 50 ㎍ 이하, 또는 40 ㎍ 이하, 또는 30㎍ 이하, 또는 20㎍ 이하, 또는 10㎍ 이하(또는 10과 100 ㎍ 사이의 임의의 양)의 각각의 바이러스 혈청형을 함유한다. 예를 들어, 면역원성 조성물의 단일 인간 용량은, 예를 들어, 0.05 내지 2 ㎖의 부피, 예를 들어 부피 0.5 및 1.5 ㎖로 투여되는 0.1 내지 10 ㎍, 또는 0.25 내지 5 ㎍을 포함할 수 있다.
특정 구체예에서, 정제된 비활성화된 뎅기 바이러스(들)은 알루미늄 염("명반"), 예를 들어, 알루미늄 하이드록시드, 알루미늄 포스페이트 또는 알루미늄 하이드록시포스페이트에 흡착된다. 복수의 뎅기 바이러스가 포함되는 경우, 각각은 동일 알루미늄 염에 흡착될 수 있거나, 다양한 바이러스가 다양한 알루미늄 염에 흡착될 수 있다. 따라서, 한 양태에서, 본 발명의 개시는 완충제 및 계면활성제와 조합된, 알루미늄 염에 흡착(예를 들어, 예비흡착)된 적어도 하나의 정제된 비활성화된 뎅기 바이러스를 함유하는 면역원성 조성물에 관한 것이다.
본원에 개시된 면역원성 조성물(및 완성된 면역원성 조성물로부터 제형화된 벌크 제조물)의 상황에서, 계면활성제는 피검체, 특히, 인간 피검체로의 투여에 적합한 것으로 선택된다. 특정 구체예에서, 계면활성제는 비경구 투여, 예를 들어, 근내, 피하, 경피 또는 피내 투여에 적합한 것으로 선택된다.
본원에 개시된 뎅기 조성물에 적합한 예시적 계면활성제는 폴록사머 계면활성제, 뿐만 아니라 인간 피검체로의 투여에 적합한 다른 계면활성제를 포함한다. 따라서, 적합한 계면활성제(폴록사머 계면활성제에 더함)는 폴리소르베이트 계면활성제, 옥톡시놀 계면활성제, 폴리도카놀 계면활성제, 폴리옥실 스테아레이트 계면활성제, 폴리옥실 피마자유 계면활성제, N-옥틸-글루코시드 계면활성제, 마크로골(macrogol) 15 하이드록시 스테아레이트, 및 이들의 조합물로 구성되는 군으로부터 선택될 수 있다. 특정 구체예에서, 폴록사머 계면활성제는 정제된 비활성화된 뎅기 바이러스(들)이 알루미늄 염에 흡착되지 않는 제형에 특히 적합하다.
폴록사머 계면활성제는 폴리에틸렌-폴리프로필렌 글리콜 선형 공중합체이다. 상업적으로, 이들은 종종 플루로닉(Pluronic) 계면활성제로 언급된다. 특정 구체예에서, 폴록사머 계면활성제는 적어도 약 1000 kD의 평균 분자량, 및 약 15,000 kD 이하의 평균 분자량을 갖는 폴리에틸렌-폴리프로필렌 글리콜 공중합체로부터 선택된다. 한 특정 구체예에서, 면역원성 조성물은 1800 g/mole의 폴리옥시프로필렌 분자량 및 80% 폴리옥시에틸렌 함량과 함께 8600 kD의 평균 분자량을 갖는, 상표명 Pluronic™ F 68, Lutrol™ F 68, 및 Kolliphor™ P188로 시판되는, 폴리에틸렌-폴리프로필렌 글리콜 공중합체, 폴록사머 188과 함께 제형화된다.
조성물(벌크 제조물 및 면역원성 조성물)은 또한 하나 이상의 완충제를 포함한다. 뎅기 바이러스는 산 조건하에서 면역원성을 상실하며, 따라서 완충제는 중성 근처 또는 중성 위의 pH를 유지하도록 선택된다. 완충제 또는 완충제들은 통상적으로 pH 6.4 이상, 바람직하게는 pH 6.8 초과, 및 가장 바람직하게는 pH 7.0 초과, 예를 들어, pH 7.4 또는 약 pH 7.4로 조성물의 pH를 유지시키도록 선택된다. 완충제는 특정 추가 성분(예를 들어, 특정 애쥬번트)이 완충제의 양 또는 선택을 조절하는 것을 필요로 할 수 있음을 고려하여, 제형화된 면역원성 조성물의 다른 성분의 상황에서 요망되는 pH를 유지하도록 선택된다. 한 구체예에서, 완충제는 소듐 포스페이트 및 포타슘 포스페이트 중 하나 또는 둘 모두를 포함한다. 또 다른 구체예에서, 완충제는 트리스(하이드록시메틸)아미노메탄("트리스(Tris)")을 포함한다.
벌크 제조물 및 면역원성 조성물은 또한, 예를 들어, 요망되는 범위 내로 긴장성을 변형시키거나 유지시키기 위해 추가 성분, 예를 들어, 하나 이상의 무기염을 포함할 수 있다. 가장 일반적으로, 염은 무기염, 예를 들어, 소듐 클로라이드이다. 이러한 염은 유리하게는 등장성 또는 등장성 근처로 제형화된 조성물을 유지시키는데 필요한 양으로 첨가된다. 정확한 양은 제형 내의 다른 성분, 가장 특히 완충제(들)의 선택에 따라 상이하며, 이는 당업자에 의해 과도한 실험 없이 결정될 수 있다.
본원에 개시된 벌크 제조물 및 면역원성 조성물은 또한 용해 상태 및/또는 가공, 예를 들어, 동결건조 동안 정제된 비활성화된 뎅기 바이러스의 구조적 및/또는 면역학적 안정성을 향상(또는 제형의 다른 특성, 예를 들어, 긴장성을 변형)시키는 하나 이상의 부형제를 포함할 수 있다. 일부 구체예에서, 부형제는 유리 형성 당 또는 폴리올을 포함한다. 특정 구체예에서, 유리 형성 당 또는 폴리올은 수크로스, 트레할로스, 만노스, 만니톨, 라피노스, 락티톨, 소르비톨 및 락토비온산, 글루코스, 말툴로스, 이소-말툴로스, 락툴로스, 말토스, 락토스, 이소-말토스, 말티톨, 팔라티니트, 스타키오스, 멜레지토스, 덱스트란 또는 이들의 조합물로 구성되는 군으로부터 선택된다. 한 특정 구체예에서, 부형제는 수크로스를 포함한다. 임의로, 당 또는 폴리올은 아미노산, 예를 들어, 글리신, 알라닌, 아르기닌, 리신 및/또는 글루타민과 조합하여 사용될 수 있다.
특정 구체예에서, 조성물은 액체 제형, 예를 들어, 용액 또는 현탁액이다. 다른 구체예에서, 조성물은 제조되고, 동결건조되고, 투여 전에 재현탁된다. 예를 들어, 면역원성 조성물은 주사에 의한 투여를 위한 등장성 액체 제형 내에서 제형화될 수 있다.
특정 구체예에서, 면역원성 조성물은 인간 피검체로의 투여를 위해 제형화된다. 인간 피검체로의 투여를 위해, 면역원성 조성물은 적어도 0.05 ㎖ 및 2 ㎖ 이하의 단일 용량의 양, 예를 들어, 0.5 내지 1.5 ㎖의 단일 용량의 양으로 제형화될 수 있다.
임의로, 본원에 개시된 면역원성 조성물은 애쥬번트를 포함할 수 있다. 일부 구체예, 예를 들어, 정제된 비활성화된 뎅기 바이러스가 명반에 흡착되는 구체예에서, 알루미늄 염은 애쥬번트로 작용한다. 다른 구체예에서, 애쥬번트는 알루미늄-비함유 애쥬번트이다. 예를 들어, 명반과 조합, 예를 들어, 명반에 흡착되거나 그렇지 않은 간에, 애쥬번트는 하나 이상의 면역자극성 성분을 포함할 수 있다. 면역자극성 성분은 하기에 보다 상세히 기재되는 바와 같이 오일 및 물 에멀젼, 리포솜, 지질다당류, 사포닌, 및 올리고누클레오티드 중 하나 이상을 포함할 수 있다.
본 발명의 개시의 또 다른 양태는 하나 이상의 정제된 비활성화 뎅기 바이러스를 포함하는 벌크 항원 제조물 및 면역원성 조성물을 제형화시키는 방법에 관한 것이다. 이러한 방법은 완충제 및 계면활성제를 포함하는 용액을 제공하고, 상기 용액과 하나 이상의 정제된 비활성화된 뎅기 바이러스를 혼합하는 것을 포함한다. 일부 구체예에서, 하나 이상의 정제된 비활성화된 뎅기 바이러스는 용액과 혼합하기 전에 알루미늄 염에 흡착(예를 들어, 비활성화된 뎅기 바이러스의 예비-흡착된 벌크 제조물을 생성시키기 위한 것임)된다. 통상적으로, 정제된 비활성화된 뎅기 바이러스의 단일 균주는 예비-흡착된 모노벌크(monobulk)를 생성시키기 위해 알루미늄 염(예를 들어, 알루미늄 하이드록시드, 알루미늄 포스페이트 또는 알루미늄 하이드록시포스페이트)에 흡착된다. 다가 면역원성 조성물을 생성시키기 위해, 개별적 모노벌크는 이후 완충제 및 계면활성제를 함유하는 용액과 요망되는 비(예를 들어, 중량을 기초로 하여 1:1:1:1, 또는 상대 면역원성을 기초로 하여 조정됨)로 조합된다.
통상적으로, 정제된 비활성화된 뎅기 바이러스(들)이 비경구 투여에 적합한 용액(최종 제형)에 첨가된다. 일부 구체예에서, 용액은 등장액이다. 일부 구체예에서, 용액은 또한 하나 이상의 부형제, 예를 들어, 염 및/또는 유리 형성 당 또는 폴리올을 포함한다.
한 구체예에서, 주사용수(예를 들어, 멸균, 내독소-비함유 물)에 유리 형성 당 또는 폴리올, 완충제, 염 및 계면활성제(상기 논의된 바와 같음)가, 예를 들어, 연속적인 순서로 첨가된다. 상기 논의된 바와 같은 정제된 비활성화된 뎅기 바이러스(들)이 제조된 용액에 첨가된다.
일부 구체예에서, 상기 방법은 이후 동결건조된 조성물을 생성시키기 위해 정제된 비활성화된 뎅기 바이러스(들)을 함유하는 용액(예를 들어, 벌크 제조물)을 동결건조시키는 것을 포함한다. 예를 들어, 저장 및/또는 유통을 위한 면역원성 조성물의 동결건조를 포함하는 구체예에서, 동결건조된 조성물은 통상적으로 투여 전에 적합한 양, 예를 들어, 0.05-2 ㎖, 통상적으로 0.5 내지 1.5 ㎖, 예를 들어, 0.5 또는 1.0 또는 1.5 ㎖의 약학적으로 허용되는 용액, 예를 들어, 주사용수에 재현탁된다. 임의로, 약학적으로 허용되는 용액은 상기 논의된 바와 같이 적어도 하나의 면역자극성 성분을 포함한다.
또 다른 양태에서, 상기 개시는 상기 논의된 바와 같은 비활성화된 뎅기 바이러스(들)을 제형화시킴으로써 정제된 비활성화된 뎅기 바이러스(또는 복수의 정제된 비활성화된 뎅기 바이러스), 또는 정제된 비활성화된 뎅기 바이러스(또는 복수의 정제된 비활성화된 뎅기 바이러스)를 함유하는 조성물의 비특이적 흡착 및/또는 응집을 감소시키기는 방법에 관한 것이다.
또 다른 양태에서, 본 발명의 개시는 상기 기재된 바와 같은 비활성화된 뎅기 바이러스(들)을 제형화시킴으로써 항원적으로 보존된 비활성화된 뎅기 바이러스(또는 복수의 항원적으로 보존된 비활성화된 뎅기 바이러스), 또는 항원적으로 보존된 비활성화된 뎅기 바이러스(또는 복수의 항원적으로 보존된 비활성화된 뎅기 바이러스)를 함유하는 조성물의 회수를 향상시키는 방법에 관한 것이다.
용어
달리 설명하지 않는 한, 본원에서 사용되는 모든 기술 및 과학 용어는 본 발명의 개시가 속하는 분야의 당업자에 의해 일반적으로 이해되는 것과 동일한 의미를 갖는다. 분자생물학에서의 일반적인 용어의 정의는 문헌[Benjamin Lewin, Genes V, published by Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al . (eds.), The Encyclopedia of Molecular Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Robert A. Meyers (ed.), Molecular Biology and Biotechnology : a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8)]에서 발견될 수 있다.
단수 용어는 문맥이 명백히 다른 방식으로 지정하지 않는 한 복수의 지시대상물을 포함한다. 유사하게, 용어 "또는"은 문맥이 명백히 다른 방식으로 지정하지 않는 한 "및"을 포함하는 것으로 의도된다. 용어 "복수"는 2개 이상을 나타낸다. 핵산 또는 폴리펩티드에 대해 제공된 모든 염기 크기 또는 아미노산 크기, 및 모든 분자량 또는 분자 질량 값은 근사값이고, 설명을 위해 제공된 것이 추가로 이해되어야 한다. 또한, 물질, 예를 들어, 항원의 농도 또는 수준과 관련하여 제공된 숫자상의 제한은 근사값인 것으로 의도된다. 따라서, 농도가 적어도(예를 들어) 20 ㎍인 것으로 지정되는 경우, 농도는 적어도 대략(또는 "약" 또는 "~") 20 ㎍인 것으로 이해되는 것으로 의도된다.
본원에 기재된 방법 및 물질과 유사하거나 동등한 방법 및 물질이 본 발명의 개시의 실시 또는 시험에서 사용될 수 있으나, 적합한 방법 및 물질은 하기에 기재된다. 용어 "포함하다(comprise)"는 "포함하다(include)"를 의미한다. 따라서, 문맥이 다른 방식을 필요로 하지 않는 한, 용어 "~을 포함하다" 및 변화, 예를 들어, "~들을 포함하다" 및 "포함하는"은 언급된 화합물 또는 조성물(예를 들어, 핵산, 폴리펩티드, 항원) 또는 단계, 또는 화합물들 또는 단계들의 그룹의 포함을 의미하는 것이 이해될 것이나, 임의의 다른 화합물, 조성물, 단계, 또는 이들의 그룹의 배제를 의미하지는 않는 것이 이해될 것이다. 약어 "e.g."는 라틴어 예컨대(exempli gratia)으로부터 유래되며, 이는 비제한적 예를 나타내기 위해 본원에서 사용된다. 예를 들어, 약어 "e.g."는 "예를 들어(for example)"와 동의어이다.
본 발명의 개시의 다양한 구체예의 개관을 촉진시키기 위해, 하기 용어의 설명이 제공된다. 추가 용어 및 설명이 본 발명이 개시의 상황에서 제공될 수 있다.
비활성화된 뎅기 바이러스의 "벌크 제조물"은 피검체로의 투여를 위해 의도된, 정제 및 비활성화와 관련하여 최종 항원성 형태의 뎅기 바이러스를 나타내기 위해 본원에서 사용된다. 벌크 제조물 또는 벌크 제형은, 예를 들어, 희석, 농축, 예를 들어, 동결건조 및 재현탁에 의해 추가로 가공될 수 있고/있거나, 예를 들어, 면역원성 조성물 또는 백신으로서의 투여를 위해 다중용량 또는 단일 용량 바이얼 또는 주사기로 패키징될 수 있다.
용어 "정제"(예를 들어, 병원체, 또는 병원체, 예를 들어, 뎅기 바이러스를 함유하는 조성물 관련)는 조성물로부터 존재가 요망되지 않는 성분을 제거하는 공정을 나타낸다. 정제는 상대적 용어이며, 요망되지 않는 성분의 모든 흔적이 조성물로부터 제거되는 것을 필요로 하지는 않는다. 백신 생성의 상황에서, 정제는 원심분리, 디얼라이제이션(dialization), 이온-교환 크로마토그래피, 및 크기-배제 크로마토그래피, 친화성-정제 또는 침전과 같은 공정을 포함한다. 따라서, 용어 "정제된"은 절대 순도를 필요로 하지 않으며; 오히려, 이는 상대적 용어로 의도된다. 따라서, 예를 들어, 정제된 바이러스 제조물은 바이러스가 이의 발생 환경, 예를 들어, 바이러스가 자연적으로 복제되는 세포 또는 세포의 집단 내 또는 인공 환경 내에서보다 더욱 농축된 것이다. 실질적으로 순수한 바이러스의 제조물은, 요망되는 바이러스 또는 바이러스 성분이 제조물의 전체 단백질 함량의 적어도 50%가 되도록 정제될 수 있다. 특정 구체예에서, 실질적으로 순수한 바이러스는 제조물의 전체 단백질 함량의 적어도 60% 또는 적어도 70%, 예를 들어, 적어도 80%, 적어도 85%, 적어도 90%, 또는 적어도 95% 또는 그 초과에 상당할 것이다. 대안적으로, 바이러스 제조물의 정제는 제조물 내의 오염물질, 예를 들어, 숙주 세포 단백질에서의 감소로 평가될 수 있다. 따라서, 실질적으로 순수한 바이러스(예를 들어, 정제된 비활성화된 뎅기 바이러스)의 제조물은 통상적으로 30% 미만 또는 25% 미만의 잔여 숙주 세포 단백질을 포함한다. 예를 들어, 정제된 비활성화된 뎅기 바이러스를 포함하는 벌크 제조물 또는 면역원성 조성물은 20% 미만의 잔여 숙주 세포 단백질 또는 심지어 15% 미만 또는 10% 이하의 잔여 숙주 세포 단백질을 포함할 수 있다(예를 들어, wt/wt를 기초로 하여 측정됨).
뎅기 바이러스 백신의 상황에서의 용어 "비활성화된"은 항원성 성분(예를 들어, 바이러스)이 생체내 또는 시험관내에서 복제할 수 없는 것을 의미한다. 예를 들어, 용어 "비활성화된"은, 예를 들어, 시험관내에서 복제된 후, 화학적 또는 물리적 수단을 이용하여 사멸되어, 더 이상 복제할 수 없는 바이러스를 포함한다. 상기 용어는 또한 추가 가공(예를 들어, 분할, 분획화 등)에 의해 생성된 항원, 및, 예를 들어, 세포 배양물에서의 재조합 수단에 의해 생성된 성분을 포함할 수 있다.
"애쥬번트"는 작용제의 부재하에서의 항원의 투여에 비해 항원-특이적 면역 반응의 생성을 향상시키는 작용제이다. 통상적인 애쥬번트는 항원이 흡착되는 무기질(또는 무기염, 예를 들어, 알루미늄 하이드록시드, 알루미늄 포스페이트, 알루미늄 하이드록시포스페이트)의 현탁액을 포함하는 알루미늄 함유 애쥬번트를 포함한다. 다른 애쥬번트는 향상된 항원-특이적 면역 반응의 생성에 기여하는 하나 이상의 면역자극성 성분을 포함한다. 면역자극성 성분은 오일 및 물 에멀젼, 예를 들어, 유중수, 및 수중유(및 이중 에멀젼 및 가역 에멀젼(reversible emulsion)을 포함하는 이들의 변형), 지질당류, 지질다당류, 면역자극성 핵산(예를 들어, CpG 올리고누클레오티드), 리포솜, Toll-유사 수용체 효능제(특히, TLR2, TLR4, TLR7/8 및 TLR9 효능제), 및 상기 성분의 다양한 조합물을 포함한다. 애쥬번트는 면역자극성 성분의 조합물을 포함할 수 있다.
"면역원성 조성물"은, 예를 들어, 병원체, 예를 들어, 뎅기 바이러스에 대한 특정 면역 반응을 유도할 수 있는, 인간 또는 동물 피검체(예를 들어, 실험 환경 내)로의 투여에 적합한 물질의 조성물이다. 이와 같이, 면역원성 조성물은 하나 이상의 항원(예를 들어, 전체 정제된 바이러스 또는 항원성 서브유닛, 예를 들어, 이들의 폴리펩티드) 또는 항원성 에피토프를 포함한다. 면역원성 조성물은 또한 면역 반응을 유도하거나 향상시킬 수 있는 하나 이상의 추가 성분, 예를 들어, 부형제, 담체, 및/또는 애쥬번트를 포함할 수 있다. 특정 예에서, 면역원성 조성물은 병원체에 의해 유도되는 증상 또는 질환에 대해 피검체를 보호하는 면역 반응을 유도하기 위해 투여된다. 일부 경우에, 병원체에 의해 야기되는 증상 또는 질병은 병원체에 대한 피검체의 노출 후에 병원체(예를 들어, 뎅기 바이러스)의 복제를 억제함으로써 예방(또는 치료되고, 예를 들어, 감소되거나 개선됨)된다. 본 발명의 개시의 상황에서, 용어 면역원성 조성물은 뎅기에 대한 보호 또는 완화 면역 반응을 유도하는 목적을 위해 피검체 또는 피검체의 집단으로의 투여가 의도되는 조성물(즉, 백신 조성물 또는 백신)을 포함하는 것이 이해될 것이다.
"면역 반응"은 자극에 대한 면역계 세포, 예를 들어, B 세포, T 세포, 또는 단핵구의 반응이다. 면역 반응은 특정 항체, 예를 들어, 항원 특이적 중화 항체를 생성시키는 B 세포 반응일 수 있다. 면역 반응은 또한 T 세포 반응, 예를 들어, CD4+ 반응 또는 CD8+ 반응일 수 있다. 일부 경우에, 반응은 특정 항원에 특이적(즉, "항원-특이적 반응")이다. 항원이 병원체로부터 유래되는 경우, 항원-특이적 반응은 "병원체-특이적 반응"이다. "보호 면역 반응"은 병원체의 유해한 기능 또는 활성을 억제하거나, 병원체에 의한 감염을 감소시키거나, 병원체에 의한 감염으로부터 발생하는 증상(사망을 포함함)을 감소시키는 면역 반응이다. 보호 면역 반응은, 예를 들어, 플라크 감소 검정 또는 ELISA-중화 검정에서 바이러스 복제 또는 플라크 형성의 억제에 의하거나, 생체내에서 병원체 공격에 대한 내성을 측정함으로써 측정될 수 있다.
"피검체"는 살아있는 다세포 척추동물 유기체이다. 본 발명의 개시의 상황에서, 피검체는 실험 피검체, 예를 들어, 비-인간 동물, 예를 들어, 마우스, 코튼랫(cotton rat), 또는 비-인간 영장류일 수 있다. 대안적으로, 피검체는 인간 피검체일 수 있다.
"완충제"는 산 또는 알칼리가 첨가되는 경우 pH를 유지시키거나 pH에서의 변동에 저항하는 용액의 능력을 단독으로 또는 조합하여 증가시키는 화합물 또는 조성물이다. 용어 완충제는 각각의 컨쥬게이트 염기 또는 산과 함께 용액 중에 존재하는 경우 요망되는 값 또는 요망되는 범위 내의 pH를 유지시키기 위해 사용될 수 있는, 통상적으로 약한 산 또는 약한 염기인 매우 다양한 화합물 및 조성물을 포함한다.
"계면활성제" 또는 표면 활성 작용제는 친수성 머리 및 소수성 꼬리를 특징으로 하는 양친매성 분자이다. 액체의 표면에 흡착되는 경우, 계면활성제는 액체의 표면 장력, 2개의 액체 사이의 계면 장력, 또는 액체와 고체 사이의 장력을 낮추는 작용을 한다. 계면활성제는 세제, 습윤제, 유화제, 기포제, 및/또는 분산제로 작용할 수 있다.
본원에 개시된 조성물은 하나 이상의 정제된 비활성화된 뎅기 바이러스 항원을 포함한다. 다양한 양태에서, 조성물은 선택된 규모의, 예를 들어, 액체 제형, 고체(예를 들어, 동결건조된) 제조물 내의 비활성화된 뎅기 바이러스의 제조된 벌크 제조물, 또는 피검체(통상적으로, 인간 피검체)로의 투여를 위해 제형화된 면역원성 조성물이다. 예를 들어, 벌크 제조물(액체이거나 고체이건 간에) 및/또는 면역원성 조성물은 뎅기 바이러스의 단일 균주를 포함(즉, 1가 조성물, 예를 들어, 1가 벌크 제조물 또는 1가 면역원성 조성물)할 수 있거나, 이들은 뎅기 바이러스의 하나 이상의 균주를 함유(즉, 다가 조성물, 예를 들어, 다가 벌크 제조물 또는 다가 면역원성 조성물)할 수 있다. 통상적으로, 다가 조성물은 다양한 혈청형으로부터 선택된 균주를 함유한다. 질병을 야기시킬 수 있는 뎅기 바이러스의 4개의 혈청형, 즉, 뎅기 타입 1(DEN-1), 뎅기 타입 2(DEN-2), 뎅기 타입 3(DEN-3) 및 뎅기 타입 4(DEN-4)이 존재하고, 교차-반응성 비-중화 항체가 더욱 중증 형태의 뎅기 질병에 걸리기 쉽게 하므로, 4개의 혈청형 중 임의의 혈청형으로부터의 질병에 대한 보호를 보장하기 위해 벌크 제조물 및 최종 백신으로의 포함을 위해 각각의 혈청형의 하나의 대표자가 선택될 수 있다. 따라서, 한 구체예에서, 면역원성 조성물은 뎅기 바이러스의 4개의 혈청형 각각으로부터 선택된 균주를 포함하는 4가 조성물이다.
항원으로 사용되는 바이러스는 본질적으로 뎅기 바이러스의 임의의 균주(또는 균주들)로부터 선택될 수 있다. 예를 들어, 바이러스 균주는 각각의 혈청형에 대해 선택될 수 있으며, 이는 혈청형에 대해 규정된(예를 들어, 컨센서스(consensus)) 서열, 예를 들어, DEN-1 컨센서스 서열, DEN-2 컨센서스 서열, DEN-3 컨센서스 서열, 또는 DEN-4 컨센서스 서열에 대한 일치를 기초로 하여 선택된다. 이러한 바이러스는 자연 발생 또는 합성 바이러스일 수 있다. 예를 들어, 바이러스 균주는 백신이 투여되는 것이 의도되는 영역 또는 집단에서 유행하는 균주(예를 들어, 자연 발생 또는 "야생형" 균주)와 관련되도록 선택될 수 있다. 또 다른 선택은 가용성 또는 이전의 경험을 기초로 하여 편리한 물질로서 각각의 혈청형에 대한 균주를 선택하는 것이다. 예를 들어, 예시적 균주는 본원에 참조로서 포함되는 미국 특허 번호 6,254,873호에 기재되어 있다. 추가의 적합한 균주는, 예를 들어, 참조로서 또한 본원에 포함되는 미국 특허 번호 7,226,602호에 개시되어 있다. 추가 균주는, 예를 들어, VBRC 바이러스 유전체 데이터베이스(http://athena.bioc.uvic.ca/organisms/Flaviviridae/Dengue/Curated_genes), 및 뎅기 바이러스 데이터베이스(http://www.broad.mit.edu/annotation/viral/Dengue/Projectlnfo.html)에서 발견될 수 있다.
정제된 비활성화된 뎅기 바이러스 백신의 상황에서, 독성 또는 약독화된 균주가 사용될 수 있다. 통상적으로, 독성 균주는 숙주 세포에서 더 높은 역가로 증식하여, 상업적 규모의 생산을 촉진시킨다. 그러나, 독성 균주는 제조와 관련된 직원의 감염을 예방하기 위해 취급에서 특별한 주의를 필요로 한다. 예를 들어, 배양된 세포에서의 생산에 대한 적합 및 뎅기의 모기 매개 동물에서의 감소된 독성 및/또는 감소된 복제에 대한 선택에 의해 개발된 약독화된 균주는 더 적은 취급 지침을 필요로 하나, 생산하기에 어려울 수 있다. 비활성화된 뎅기 바이러스를 함유하는 면역원성 조성물의 상황에서 사용하기에 적합한 예시적인 약독화된 균주는 WO 2000/057907호 및 미국 특허 번호 6,638,514호, 및 WO 2000/058444호 및 US 6,613,556호, WO 2002/066621호(미국 공개 번호 2004052818호), WO 2000/057904호(미국 특허 번호 6,528,065호, WO 2000/057908호, WO 2000/057909호(미국 특허 번호 6,511,667호); WO 2000/057910호(미국 특허 번호 6,537,557호), WO 2002/095075호(예를 들어, 미국 특허 번호 7,226,602호) 및 WO 2002/102828호(미국 특허 번호 7,569,383호)에 기재되어 있으며, 이들은 참조로서 본원에 포함된다.
키메라 "뎅기" 바이러스가 또한 본원에 개시된 제형의 상황에서 적합하다. 이러한 키메라 바이러스는 통상적으로, 예를 들어, 다양한 뎅기 바이러스 또는 다양한 플라비바이러스, 예를 들어, 황열 바이러스 또는 일본 뇌염 바이러스의 핵산 백본을 이용하여 뎅기 바이러스 외피 단백질을 발현한다. 키메라 뎅기 바이러스의 예는, 예를 들어, WO 98/37911호(미국 특허 번호 6,696,281호; 6,962,708호), WO 96/40933호 및 WO 2001060847호(미국 특허 번호 7,094,411호; 7,641,909호; 8,025,887호) 및 EP1159968호에서 발견될 수 있다. 상기 키메라 뎅기 바이러스를 생성하는 방법은 또한 WO 03/101397호에서 발견될 수 있다. 상기 공개된 출원 및 특허의 개시내용은 본원에 개시된 제형화 및 방법의 상황에서 사용하기에 적합한 예시적 키메라 뎅기 바이러스를 제공하기 위한 목적상 참조로서 본원에 포함된다.
따라서, 선택된 균주(들)은 통상적으로 인간 사용에 대해 의도된 물질의 생성에 적합한 세포(예를 들어, 병원체를 함유하지 않는 것으로 증명된 세포)에서 복제시키는데 이용가능한 다수의 균주로부터 선택된다. 예를 들어, 균주는 선택 세포주(들)에서 가장 높은 역가, 예를 들어, 적어도 약 5x106 pfu/㎖, 바람직하게는 적어도 1x107 pfu/㎖ 또는 그 초과의 역가로 성장하는 바이러스를 확인하고; (ii) 선택 세포주(들)에서 가장 높은 역가로 성장하는 뎅기 바이러스의 균주를 선택하고; (iii) 선택 세포주(들)에서 1회 내지 수회의 추가 계대배양에 의해 향상된 성장에 대해 상기 선택된 균주를 추가로 적합시킴으로써 스크리닝될 수 있다. 선택된 바이러스(예를 들어, 뎅기 바이러스의 4개의 혈청형으로부터 선택됨)는 추가 세포 계대 배양 또는 높은 역가의 마스터(master) 및 생성 시드 로트(seed lot)를 제조하기 위한 유전학적 조작에 의해 높은 역가로 성장하도록 추가로 적합될 수 있다.
뎅기 바이러스(들)을 생성하기 위한 방법은 당 분야에 공지되어 있고, 예를 들어, 공개된 PCT 출원 번호 WO 2010/094663호, 미국 공개 번호 2011318407호에 당업자에게 안내하기에 충분히 상세히 기재되어 있다. 혈청 비함유 조건에서 바이러스를 생성시키기 위한 방법은 또한, 예를 들어, 미국 공개 번호 20060183224호에서 발견될 수 있다. 상기 공개된 특허 출원의 개시내용은 본원에 개시된 벌크 제조물 및 면역원성 조성물 내의 포함을 위한 뎅기 바이러스의 증식 및 정제에 관한 추가의 세부사항을 제공하기 위해 참조로서 본원에 포함된다. 정제된 비활성화된 뎅기 바이러스를 생성시키기 위해 뎅기 바이러스를 비활성화시키기 위한 유사한 방법이 당 분야에 잘 확립되어 있고, 이는 화학적, 물리적 및/또는 방사선조사 작용제에 대한 노출을 포함한다. 적합한 방법은, 예를 들어, 포름알데하이드, 베타프로피오락톤(BPL), 과산화수소, 자외선 방사선조사 및 감마 방사선조사, 또는 이들의 조합물에 대한 노출을 포함한다. 상기 방법의 세부사항은, 예를 들어, 공개된 PCT 출원 번호 WO 2010/094663호(미국 공개 번호 2011318407호), 및 미국 공개 번호 20070031451호에서 발견될 수 있고, 이들은 뎅기 바이러스를 비활성화시키는 예시적 방법을 예시하기 위한 목적을 위해 참조로서 본원에 포함된다.
뎅기 바이러스의 정제를 위한 예시적 절차는 도 2A-D의 순서도에 도시되어 있다. 상업적 용도에 적합한 뎅기 바이러스의 양을 생성시키기 위해, 민감한 세포주가 적합한 배지 중에서 시험관 내에서 배양액 중에서 성장된다. 통상적으로, 세포는 포유동물 세포, 예를 들어, 신장 또는 폐 상피 세포이다. 여러 적합한 세포주, 예를 들어, 아프리카 녹색 원숭이 신장 세포(African Green Monkey Kidney cell), 예를 들어, 베로 세포(Vero cell), MRC-5 세포, MDCK 세포, 및 FRhL-2 세포가 존재한다. 대안적으로, 곤충 세포, 특히 모기 세포, 예를 들어, 흰줄숲모기(Aedes albopictus) 세포주 C6/36이 사용될 수 있다. 세포는 혈청 함유 또는 동물 비함유(AF 배지)로 배양될 수 있다. 임의로, 배지는 처음에 또는 주기적으로 첨가물, 예를 들어, 글루코스, 아미노산, 합성 성장인자 또는 다른 단백질로 보충된다. 세포는 통상적으로 일련의 증가하는 용기 크기(예를 들어, 175 ㎠ 플라스크; CF2(1200 ㎠); CF10(6000 ㎠); CF40(50L 생물반응기); 200L 생물반응기)를 통해 확장된다. 더 큰 용기 크기에서, 세포 부착을 위해 현탁액 중에서 미세담체를 이용하는 것이 일반적이다. 임의로, 배지는 관류에 의해 공급되거나, 배양액이 주기적으로 공급될 수 있다. 특정 구체예에서, 세포는 상업적 규모의 생물반응기에서 배양될 수 있는 베로 세포이다.
세포는 규모에 있어서 요망되는 밀도로 성장되고, 바이러스(예를 들어, DEN-1, DEN-2, DEN-3 및/또는 DEN-4의 항원성 결정인자를 제공하기 위해 선택된 균주)로 감염된다. 세포는 적합한 MOI(예를 들어, 0.01-0.1 MOI, 예를 들어, 0.05 MOI)로 감염되고, 선택된다. 예비배양 및/또는 감염을 위해 혈청-함유 배지를 이용하는 경우, 배지는 수거 및 정제 단계 동안 외부 단백질 함량을 감소시키기 위해 AF 배지로 교환될 수 있다. 예를 들어, 1 내지 4일, 예를 들어, 약 2일의 최초 감염 단계 후, 배지는 AF 배지로 교환될 수 있다. 임의로, AF 배지는 처음에 또는 주기적으로 글루코스, 아미노산 등으로 보충된다. 바이러스 성장을 위해 적합한 기간, 예를 들어, 최소 6 내지 8일의 기간 후, 바이러스가 세포로부터 수거된다. 임의로, 바이러스는 감염 후 약 6일에서 시작하여 간격(예를 들어, 2일의 간격)을 두어 증진적으로 수거될 수 있다. 수거는 유리하게는 수일의 기간, 예를 들어, 10일 이하, 예를 들어, 12일, 또는 14일 또는 그 이상까지 지속될 수 있다.
통상적으로 일련의 감소하는 포어(pore) 크기(예를 들어, 8μ, 0.6μ, 0.45μ, 0.2μ)를 통해 바이러스를 함유하는 배지가 정화된다. 적합한 시판되는 필터 및 여과 장치는 당 분야에 널리 공지되어 있고, 당업자에 의해 선택될 수 있다. 예시적 여과 장치는, 예를 들어, Millipore™ Millistak™ DOHC 및 Sartobran™ P 여과 장치를 포함한다. 임의로, 정화된 바이러스 수거물은 요망시 -70℃에서 동결 저장될 수 있다.
이후, 바이러스 현탁액은 농축(예를 들어, 20-50x 또는 그 초과, 예를 들어, 30x 또는 40x)되고, 배지는, 예를 들어, 초여과 및 정용여과(diafiltration)에 의해 적합한 완충액(예를 들어, 인산염 완충 염수(PBS), 125 mM 시트레이트, pH 7.6)으로 교환된다. 상기 단계 및 정제 전체에 걸쳐 선택된 완충액은 pH를 유지시키고, 응집을 감소시키고, 가공 동안 바이러스의 항원성을 보존하도록 선택된다. 본원에 지정된 완충액은 단지 예시이며, 지정된 목적을 위한 대안적 완충액이 당업자에 의해 선택될 수 있다. 최초 농축 및 완충액 교환에 이어, 예를 들어, Sephacryl S-400HR 또는 Sepharose 4 FF 수지를 이용하여 추가 여과 및 크기 배제 크로마토그래피(SEC)가 후속된다. 임의로, 추가 가공 전, 정화된 바이러스 현탁액이 농축 단계 전 또는 후에 UV 방사선조사(100 내지 500, 예를 들어, 200 J/m2)에 대한 노출에 의해 비활성화된다.
임의로, 크기 배제 크로마토그래피 단계에 이어 잔여 핵산, 예를 들어, 세포 DNA를 제거하기 위해 하나 이상의 단계가 후속될 수 있다. 상기 목적을 위해, 하나의 적합한 방법은 막 크로마토그래피, 예를 들어, Sartobind-Q 막 크로마토그래피(음성 모드) 및 여과이다. 잔여 DNA가 단백질 ㎍ 당 100 pg 이하의 DNA(또는 100 pg/용량 미만)로 감소되는 것이 일반적으로 바람직하다.
유리하게는, 상기 단계에서, 비활성화 전, 계면활성제, 예를 들어, 본원에 개시되고, 벌크 제조물 및/또는 면역원성 조성물 내의 포함을 위해 선택된 바와 같은 폴록사머 계면활성제가 완충액에 첨가될 수 있다. 대안적으로, 계면활성제가 비활성화 후에 완충액에 첨가될 수 있다. 이후, 바이러스는 화학적 비활성화 및/또는 방사선조사에 의한 것을 포함하는 당 분야에 공지된 하나 이상의 방법 중 임의의 방법에 의해 비활성화된다. 예를 들어, 포름알데하이드, 베타프로피오락톤(BPL) 또는 과산화수소에 의한 화학적 비활성화가 뎅기 바이러스의 비활성화에 대해 당 분야에 기재되었으며, 이는 본원에 개시된 제형의 상황에서 정제된 비활성화된 뎅기 바이러스를 제공하기 위해 이용될 수 있다. 예를 들어, 바이러스는 실온에서 통상적으로 7 내지 10일의 기간 동안 포름알데하이드(약 100 ㎍/㎖)에 대한 노출에 의해 비활성화될 수 있다. 임의로, 현탁액은 응집물을 제거하고 포름알데하이드 노출을 개선시키기 위해 비활성화 과정 동안 중간 시점, 예를 들어, 2일, 3일, 4일, 또는 5일에서 여과(예를 들어, 0.22μ)된다. 비활성화의 화학적 수단은 단독으로 또는 조합하여 이용될 수 있다. 대안적으로, 또는 하나 이상의 화학적 수단과 조합하여, 바이러스는 방사선조사(예를 들어, UV 또는 감마 방사선조사)에 의해 비활성화될 수 있다. 포름알데하이드 또는 다른 화학적 비활성화 화합물은 이후 제거되거나 중화(예를 들어, 포름알데하이드의 경우에서, 소듐 바이설파이트를 이용함)된다. 화학적 비활성화 작용제를 제거하고, 이후의 제형화 동안 적합한 완충액에 정제된 바이러스를 배치하기 위해 초여과/정용여과가 이용될 수 있다. 정제된 비활성화 뎅기 바이러스는 이후 최종적으로 멸균 여과되어, 비활성화된 뎅기 바이러스의 벌크 제조물이 생성된다. 임의로, 수크로스는 벌크 제조물의 최종 제형에 첨가된다. 요망시, 최종 벌크 제조물은, 예를 들어, -70℃에서 동결 저장될 수 있다.
선택된 정제된 비활성화된 바이러스는 안정적이고 면역원성이며, 이전에 이용가능한 방법 및 제형화에서 관찰된 동결건조 및 재구성 동안의 많은 손실 없이 상업적 규모로 생성될 수 있는 벌크 제조물 및 면역원성 조성물을 생성시키기 위해 본원에 기재된 바와 같이 제형화된다. 상기 기재된 방법은 적어도 70% 및, 통상적으로 적어도 80%의 뎅기 바이러스 물질인 정제된 비활성화된 뎅기 바이러스 제조물을 발생시킬 수 있다. 제조물은 25% 미만, 및 통상적으로 20% 미만의 숙주 세포 단백질을 함유한다. 또한, 상기 기재된 방법에 따르면, 정제된 비활성화된 뎅기 바이러스의 회수는 실질적으로 향상되어, 90% 초과(또는 95% 초과)의 바이러스 물질이 최종 제조물에서 회수된다. 즉, 비활성화된 정제된 벌크의 최종 0.2μ 여과 후에 10% 미만, 또는 심지어 5% 미만의 바이러스 물질의 손실이 관찰된다. 따라서, 본 발명의 개시는 특히 정제된 비활성화된 뎅기 바이러스의 비특이적 흡착 및/또는 응집 중 적어도 하나를 감소시키는 방법 및 개시된 방법에 따라 비활성화된 뎅기 바이러스를 제형화시킴으로써 항원적으로 보존된 비활성화된 뎅기 바이러스의 회수를 향상시키는 방법을 제공한다.
특정 구체예에서, 하나 이상의 정제된 비활성화 뎅기 바이러스가 용액과 혼합되기 전에 알루미늄 염에 흡착되어 비활성화된 뎅기 바이러스의 예비-흡착된 벌크 제조물이 생성된다. 뎅기 바이러스가 알루미늄 염과 용액 중에서 조합되고, 알루미늄 입자에 대한 비활성화된 바이러스의 흡착을 가능케 하는 시간 동안 알루미늄 입자와 접촉된다. 적합한 알루미늄 염은 알루미늄 하이드록시드, 알루미늄 포스페이트, 알루미늄 하이드록시포스페이트, 및 포타슘 알루미늄 설페이트를 포함한다. 통상적으로, 각각의 선택된 바이러스가 바이러스:알루미늄 비의 경험적 최적화를 가능케 하도록 알루미늄에 독립적으로 흡착된다. 한 유리한 예에서, 각각의 선택된 뎅기 바이러스는 알루미늄 하이드록시드 상에 단독으로 흡착되어 면역원성 조성물의 다른 성분과의 이후의 제형화 전에 명반 흡착된 모노벌크가 생성된다. 대안적으로, 선택된 뎅기 바이러스 각각은 알루미늄 포스페이트 또는 또 다른 약학적으로 허용되는 알루미늄 염에 흡착될 수 있다. 요망되는 경우, 정제된 비활성화된 뎅기 바이러스가 요망되는 비로 조합될 수 있고, 이후 선택된 알루미늄 염 상에 혼합물로서 흡착될 수 있다. 대안적으로, 알루미늄 염 상의 예비-흡착 대신, 정제된 비활성화된 뎅기 바이러스가 선택된 알루미늄 염을 함유하는 용액 중에 하기 기재되는 바와 같이 재현탁될 수 있다.
본원에 개시된 제형의 상황에서, 정제된 비활성화된 뎅기 바이러스(임의로, 알루미늄 염에 예비-흡착됨)가 혼합되는 용액은 완충제를 함유한다. 즉, 용액은 하기에 논의되는 바와 같이 투여를 위한 제형, 또는 면역원성 조성물의 최종 제조물로의 다른 성분의 첨가에 의해 다른 방식으로 야기될 수 있는 pH 변화에 저항할 수 있는 완충된 용액이다.
뎅기 바이러스는 산성 pH에 민감하며, 산성 pH에서, 중요한 면역학적 에피토프가 상실되어 면역 반응을 유도하는 정제된 비활성화된 바이러스 항원의 능력이 감소될 수 있다. 따라서, 완충제는 중성 또는 중성 근처, 또는 약간의 염기성 pH로 pH를 유지하도록 선택된다. 일부 제형에서 최종 pH를 개선시키기 위해, 완충제는 피검체에 투여되는 최종 조성물에서 요망되는 것보다 높은 최초 제형(예를 들어, 산성 pH를 가질 수 있는 특정 성분, 예를 들어, 애쥬번트의 첨가 전) 내의 pH를 촉진시키도록 선택된다. 따라서, 완충제(또는 작용제의 조합물)는 pH 6.4 또는 pH 6.4 초과의 pH를 유지하도록 선택된다. 더욱 바람직하게는, 완충제는 pH 6.8 또는 pH 6.8 초과로 pH를 유지시키도록 선택되고, 가장 바람직하게는, 완충제는 중성 또는 중성 초과의 pH, 예를 들어, 7.4의 생리학적 pH 또는 7.4의 생리학적 pH 근처, 및 일부 경우에, pH 7.5 또는 pH 7.5 초과, 예를 들어, pH 8.0 또는 pH 8.0 초과, 또는 심지어 pH 8.5를 유지하도록 선택된다.
적합한 완충제는 카르보네이트, 포스페이트, 시트레이트, 락테이트, 글루코네이트 및 타르트레이트 완충제, 뿐만 아니라 더욱 복잡한 유기 완충제를 포함한다. 특정 예에서, 완충제는 소듐 포스페이트 및/또는 포타슘 포스페이트를 함유하는 포스페이트 완충제를 포함한다. 통상적으로, 상기 완충제, 또는 시스템은 요망되는 pH를 달성하도록 선택된 비로 소듐 포스페이트 및 포타슘 포스페이트 둘 모두를 포함한다. 또 다른 예에서, 완충제는 요망되는 pH를 달성하도록 제형화된 트리스(하이드록시메틸)아미노메탄, 또는 "트리스"를 함유한다. 요망되는 pH로 완충액을 제형화시키는 방법은 당업자에게 널리 공지되어 있고, 요망되는 pH를 기초로 하여 과도한 실험 없이 적합한 조성이 결정될 수 있다.
본원에 개시된 벌크 제조물 및 면역원성 조성물의 제형화에서, 정제된 비활성화된 뎅기 바이러스(들)를 함유하는 용액이 또한 계면활성제를 포함한다. 다수의 계면활성제가 당 분야에 공지되어 있으며, 이는 약학적 제형에서 사용될 수 있다. 본원에 개시된 제형의 상황에서의 계면활성제는, 예를 들어, 바이러스의 비특이적 흡착 및/또는 응집을 감소시킴으로써 제형의 안정성을 증가시키고 회수를 향상시키면서, 정제된 비활성화된 뎅기 바이러스의 면역학적 특성(예를 들어, 입체형태 및 면역학적 에피토프)을 보유하도록 선택된다.
계면활성제는 주로 친수성 "머리" 및 소수성 "꼬리"를 갖는 양친매성 분자이다. 계면활성제는 이들의 머리 및 꼬리 부분의 조성에 따라 분류될 수 있다. 이들의 머리 부분의 특징을 기초로 하여, 계면활성제는 비이온성(전하 없음) 또는 이온성(하전됨)으로 분류될 수 있다. 이온성 계면활성제는 음이온성(음성으로 하전됨), 양이온성(양성으로 하전됨), 및 양쪽성, 예를 들어, 쯔비터이온성(zwitterionic)(2개의 반대로 하전된 기)로 나누어질 수 있다. 계면활성제는 또한 이들의 꼬리 부분의 조성에 의해 분류될 수 있다. 적합한 계면활성제는 탄화수소(예를 들어, 아렌, 알칸, 알켄, 사이클로알칸 및 알킨) 꼬리; 알킬 에테르 꼬리, 에톡실화된(폴리에틸렌 옥시드) 꼬리; 프로폭실화된 (폴리프로필렌 옥시드) 꼬리를 갖는 것을 포함한다.
특정 구체예에서, 선택된 계면활성제는 쯔비터이온성 계면활성제이다. 한 구체예에서, 계면활성제는 주사가능한 계면활성제이다. 본 발명의 제형의 상황에서, 계면활성제의 하나의 적합한 부류는 폴록사머 계면활성제를 포함한다. 폴록사머는 도 1에 개략적으로 예시된 바와 같이 폴리옥시에틸렌 (폴리에틸렌 옥시드)의 2개의 친수성 사슬에 의해 플랭킹(flaking)된 폴리옥시프로필렌 (폴리프로필렌 옥시드)의 중심 소수성 사슬로 구성된 비이온성 트리블록(triblock) 공중합체이다. 폴록사머는 또한 상표명 Pluronics™로 공지되어 있으며, 이들 중 특정 폴록사머는 상표명 Lutrol™ 또는 Kolliphor™으로 시판된다. 정제된 비활성화된 뎅기 바이러스(들)이 알루미늄 염에 흡착되지 않은 제형에 폴록사머 계면활성제가 특히 적합하다.
특정 구체예에서, 폴록사머 계면활성제는, 예를 들어, 적어도 약 4500 kD의 평균 분자량, 및 약 15,000 kD 이하의 평균 분자량을 갖는, 실온에서 고체 형태로 존재하는 폴리에틸렌-폴리프로필렌 글리콜 공중합체로부터 선택된다. 예를 들어, 폴록사머 계면활성제는 Pluronic™ F108, Pluronic™ F127, Pluronic™ F188, Pluronic™ F38, Pluronic™ F68, Pluronic™ F77, Pluronic™ F87, Pluronic™ F88, 및 Pluronic™ F98의 군으로부터 선택될 수 있다. 다양한 Pluronic™ 계면활성제가 또한 상표명 Lutrol™(현재, Kolliphor™)으로 시판된다. 한 특정 구체예에서, 면역원성 조성물은 1800 g/mole의 폴리옥시프로필렌 분자량 및 80% 폴리옥시에틸렌 함량과 함께 8600 kD의 평균 분자량을 갖는, Pluronic™ F68 또는 Lutrol™ F68(Kolliphor™ P188)로 명명된 폴리에틸렌-폴리프로필렌 글리콜 공중합체와 함께 제형화된다. 대안적으로, 예를 들어, 적어도 약 1000 kD의 분자량을 갖는 실온에서 페이스트 또는 액체 형태로 존재하는 폴록사머 계면활성제, 예를 들어, Pluronic™ L10, Pluronic™ L101, Pluronic™ L121, Pluronic™ L31, Pluronic™ L35, Pluronic™ L43, Pluronic™ L44, Pluronic™ L61, Pluronic™ L62, Pluronic™ L64, Pluronic™ L81, Pluronic™ L92, Pluronic™ P103, Pluronic™ P104, Pluronic™ P105, Pluronic™ P123, Pluronic™ P65, Pluronic™ P84 또는 Pluronic™ P 85가 사용될 수 있다.
본원에 개시된 제형의 상황에서 상기 기재된 바와 같은 폴록사머 계면활성제에 더하여 적합한 계면활성제의 다른 예는 폴록사머, 마크로골 15 하이드록시 스테아레이트, 폴리소르베이트, 옥톡시놀, 폴리도카놀, 폴리옥실 스테아레이트, 폴리옥실 피마자유, N-옥틸-글루코시드, 및 이들의 조합물로 구성되는 군으로부터 선택된 계면활성제를 포함한다.
계면활성제는 적어도 0.0001% 및 1.0% 이하의 양으로 제형에 첨가될 수 있다. 예를 들어, 계면활성제는 적어도 0.0005% 및 0.5% 이하, 예를 들어, 0.001 내지 0.2%의 양, 예를 들어, 0.0005%, 또는 0.001%, 또는 0.005%, 또는 0.01%, 또는 0.025%, 또는 0.05%, 또는 0.1%, 또는 0.2%, 또는 0.3%, 또는 0.4%, 또는 0.5%, 또는 1.0% 이하(또는 임의의 사이에 존재하는 양)의 농도로 첨가될 수 있다. 이들 농도는 최초 제형에서 중량/부피로 제공된다. 조성물이 동결건조되고/되거나, 동결건조되고 재현탁되는 하기 논의되는 구체예에서, 정확한 양이 중량/중량 기준(고체 조성물에 대함)으로 다시 계산될 수 있고/있거나, 피검체에 투여되는 최종 제형의 농도 또는 희석 인자에 따라 조정될 수 있음이 이해될 것이다.
통상적으로, 최종 양은 일일 노출 허용량(permissible daily exposure, PDE) 범위 내로 계산된다. 예를 들어, Pluronic™ F68에 대해, 허용되는 PDE는 주사되는 용량 당 150 ㎍이다. 따라서, 최종 제형 중 농도는 허용가능한 PDE를 달성하기 위해 투여되는 부피에 따라 다양할 수 있다.
일부 구체예에서, 본원에 개시된 제형은 용액의 긴장성, 점도, 안정성, 균질성 등을 변형시키기 위해 추가의 약학적으로 허용되는 성분을 포함한다.
예를 들어, 용액(및, 이에 따라, 제형)은 하나 이상의 염을 포함할 수 있다. 가장 일반적으로, 염은 소듐 클로라이드이다. 그러나, 다른 약학적으로 허용되는 염 및 이온과 같이, 다른 무기염 및 이온, 예를 들어, 포타슘, 칼슘, 마그네슘, 망간, 아연의 염이 또한 사용될 수 있다. 약학적으로 허용되는 염 및 이들의 선택은, 예를 들어, 문헌[Pharmaceutical Salts: Properties, Selection, and Use, 2nd Revised Edition, P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), Wiley, 2011]에 충분히 논의되어 있다.
일부 구체예에서, 용액은 적어도 하나의 추가 부형제 또는 담체를 함유한다. 예를 들어, 용액(및, 이에 따라, 제형)은 탄수화물 및 비-탄수화물 폴리올, 예를 들어, 유리 형성 당 및 폴리올을 포함하는 적어도 하나의 당 또는 폴리올(또는 이들의 조합물)을 포함할 수 있다. 부형제는 통상적으로 면역학적으로 중요한 에피토프의 실질적 손실 없이 비활성화된 뎅기 바이러스가 저장되는 것을 가능케 하도록 선택된다. 적합한 부형제의 예는 당, 당 알코올 및 탄수화물 유도체를 포함한다.
탄수화물은 단당류, 이당류, 삼당류, 올리고당류 및 이들의 상응하는 당 알코올, 폴리하이드록실 화합물, 예를 들어, 탄수화물 유도체 및 화학적으로 변형된 탄수화물, 하이드록시에틸 전분 및 당 공중합체를 포함하나, 이에 제한되지는 않는다. 자연 및 합성 탄수화물 둘 모두가 사용에 적합하다. 합성 탄수화물은 티올 또는 탄소 결합에 의해 대체되는 글리코시드 결합을 갖는 것을 포함하나, 이에 제한되지는 않는다. 탄수화물의 D 및 L 형태 둘 모두가 사용될 수 있다. 탄수화물은 비-환원 또는 환원 탄수화물일 수 있다. 환원 탄수화물이 사용되는 경우, 메일라드 반응(Maillard reaction)의 억제제의 첨가가 바람직하다.
본 발명에서 사용하기에 적합한 환원 탄수화물은 당 분야에 공지된 것이며, 이는 글루코스, 말토스, 락토스, 프룩토스, 갈락토아스(galactoase), 만노스, 말툴로스(maltulose) 및 락툴로스(lactulose)를 포함하나, 이에 제한되지는 않는다. 비-환원 탄수화물은 당 알코올 및 다른 직쇄 다가알코올로부터 선택된 폴리하이드록실 화합물의 비-환원 글리코시드를 포함하나, 이에 제한되지는 않는다. 다른 유용한 탄수화물은 라피노스, 스타키오스, 멜레지토스, 덱스트란, 수크로스, 셀리비오스(cellibiose), 만노비오스(mannobiose) 및 당 알코올을 포함한다. 당 알코올 글리코시드는 바람직하게는 모노글리코시드, 특히 락토스, 말토스, 락툴로스 및 말툴로스와 같은 이당류의 환원에 의해 수득되는 화합물이다.
통상적으로, 부형제는 글루코스, 말툴로스, 이소-말툴로스, 락툴로스, 락토비온산(lactobionic acid), 수크로스, 말토스, 락토스, 글루코스, 이소-말토스, 만니톨, 말티톨, 락티톨, 소르비톨, 팔라티니트, 트레할로스, 라피노스, 스타키오스, 멜레지토스 만노스 또는 덱스트란, 또는 이들의 조합물을 포함하는 탄수화물(또는 이들의 유도체)의 군으로부터 선택된다. 특정 예에서, 유리 형성 당 또는 폴리올은 수크로스, 트레할로스, 만노스, 만니톨, 라피노스, 락티톨, 소르비톨 및 락토비온산, 글루코스, 말툴로스, 이소-말툴로스, 락툴로스, 말토스, 락토스, 이소-말토스, 말티톨, 팔라티니트, 스타키오스, 멜레지토스, 덱스트란 또는 이들의 조합물로 구성되는 군으로부터 선택된다. 한 특정 구체예에서, 부형제는 수크로스이다.
용액에 포함된 당 또는 폴리올의 농도는 1% 내지 50% 중량/부피, 예를 들어, 1-10%(예를 들어, 1-5%, 3-7%, 5-10%, 또는 임의의 사이에 존재하는 간격), 또는 10-15%, 15-20%, 20-25% 또는 25-50%, 가장 바람직하게는 5% 이하 또는 10% 이하(w/v)일 수 있다.
대안적으로, 또는 추가로, 부형제는 아미노산, 예를 들어, 글리신, 알라닌, 아르기닌, 리신 및 글루타민을 포함할 수 있으나, 임의의 아미노산, 또는 아미노산의 조합물, 펩티드, 가수분해된 단백질 또는 혈청 알부민과 같은 단백질이 포함될 수 있다.
예시적 제형 조성이 하기 표 1에 제공된다.
한 바람직한 구체예에서, 완충액은 임의로 계면활성제, 예를 들어, 폴록사머 188 및 당, 예를 들어, 수크로스를 갖는 5mM 트리스, 50 mM NaCl을 포함한다. 그럼에도 불구하고, 본원에 제공된 완충액의 예는 특정 성분 또는 예로서 제공되는 특정 조합에 의해 제한되는 것이 의도되지 않는 것이 인지될 것이다.
통상적으로, 정제된 비활성화된 뎅기 바이러스(들)이 제형화되는 용액은 내독소-비함유 물(예를 들어, 멸균수)에 다양한 성분을 첨가함으로써 제조된다. 예를 들어, 정제된 비활성화된 뎅기 바이러스(들)이 첨가되는 용액은 내독소-비함유 물에 유리 형성 당 또는 폴리올; 완충제; 염; 및 계면활성제를 첨가함으로써 제조될 수 있다. 한 구체예에서, 성분은 다음과 같은 순서로 연속적으로 첨가된다: 유리 형성 당 또는 폴리올; 완충제; 염; 및 계면활성제. 예를 들어, 여과 또는 다른 편리한 방법에 의해 성분이 멸균될 수 있고/있거나, 용액이 멸균될 수 있다. 정제된 비활성화된 바이러스(들)이 최종 제형에 포함되는 성분 중 하나 이상을 함유하는 용액에 존재하는 경우, 최종 벌크 제조물 또는 면역원성 조성물의 선택된 농도로 양이 조절될 수 있다.
추가의 약학적으로 허용되는 담체 및 부형제가 또한 제형에 포함될 수 있고, 상기 담체 및 부형제는 당 분야에 널리 공지되어 있으며, 이들은, 예를 들어, 문헌[Remington's Pharmaceutical Sciences, by E.W. Martin, Mack Publishing Co., Easton PA, 5th Ed]에 기재되어 있다.
특정 구체예에서, 상기 기재된 바와 같은 완충액 및 계면활성제(및 임의로, 추가 성분)를 함유하는 용액으로의 정제된 비활성화된 뎅기 바이러스의 첨가 후, 제형화된 면역원성 조성물은, 예를 들어, 실온, 0-4℃, 또는 0℃ 미만, 예를 들어, -20℃ 또는 약 -20℃, 또는 -70 내지 -80℃ 또는 약 -70 내지 약 -80℃에서 액체로 저장된다.
대안적으로, 제형화된 조성물은, 예를 들어, 건조되거나 동결건조된 조성물을 생성시키기 위한 동결건조에 의해 건조된다. 건조(제형으로부터 용매의 증발에 의함)는 동결건조에 의해 달성될 수 있다. 동결건조는 진공하에서 용매/용질 혼합물 상에서 수행되어, 용매의 승화를 발생시키고, 정제된 비활성화된 뎅기 바이러스(들) 및 제형의 다른 성분을 포함하는 건조된 용질(들)을 남긴다. 100 μbar 미만의 임의의 압력이 적합할 수 있다. 통상적으로, 적어도 약 500 mBar의 진공이 용매의 효과적인 증발을 촉진하기에 충분하고, 적어도 약 6 mBar의 진공이 용매의 효과적인 승화를 촉진시키기에 충분하다. 압력은 추가로 감소될 수 있으나, 그렇게 하는 것은 건조 속도에 거의 영향을 미치지 않고, 매우 낮은 압력 조건하에서, 승화의 효율은 감소된다. 용매 제거는 단순히 액체 샘플을 진공 챔버에 배치함으로써 수행될 수 있으나, 거품형성(foaming) 또는 프로딩(frothing)은 생성물 손실을 발생시킬 수 있고, 생성물 균질성 또는 면역원성에서 감소를 발생시킬 수 있다. 거품형성 또는 프로딩을 방지하기 위해, 제형화된 면역원성 조성물이 먼저 동결될 수 있고, 다음으로 용매가 진공하에서의 승화, 즉, 동결건조 또는 동결 건조에 의해 제거될 수 있다. 예시적 절차가 실시예 3에 개설되어 있다.
따라서, 특정 구체예에서, 본 발명의 개시는 적어도 하나의 정제된 비활성화된 뎅기 바이러스 및 계면활성제, 예를 들어, 상기 개시된 계면활성제, 예를 들어, 폴록사머 계면활성제 등을 함유하는 비활성화된 뎅기 바이러스의 동결건조된 제조물을 제공한다. 일부 경우에, 동결건조된 제조물은 알루미늄 염, 예를 들어, 알루미늄 하이드록시드 또는 알루미늄 포스페이트를 함유한다. 예를 들어, 하나 이상의 정제된 비활성화된 뎅기 바이러스는 알루미늄 염에 흡착될 수 있다. 동결건조된 제조물은 또한 완충제 및/또는 유리 형성 당 및 유리 형성 폴리올 중 적어도 하나로 작용하는 적어도 하나의 성분을 포함할 수 있다. 당업자는 상기 개시를 기초로 하여 추가 구체예 및 대안을 인지할 것이다.
제형화된 조성물이 건조되는 구체예에서, 건조된 조성물은 통상적으로, 예를 들어, 주사가능한 액체로서 투여 전에 약학적으로 허용되는 용매에 재현탁된다. 정제된 비활성화된 뎅기 바이러스가 혼합되는 용액은 인간 피검체로의 약학적 투여에 적합하도록 선택된다. 통상적으로, 용액은, 예를 들어, 근내, 피하, 경피 또는 피내 투여에 의한 비경구 투여에 허용될 수 있도록 선택된다. 예를 들어, 건조된 조성물은 주사용수, 예를 들어, 멸균, 내독소-비함유 물에 재현탁될 수 있다. 대안적으로, 용매는 수성 및 유기 용매의 혼합물일 수 있다. 일부 구체예에서, 재현탁된 면역원성 조성물은 등장성이다. 대안적으로, 재현탁된 면역원성 조성물이 등장성이 아닌 경우, 긴장성은, 예를 들어, 투여 전에 등장성 또는 거의 등장성에 염 또는 다른 부형제의 첨가에 의해 조정될 수 있다. 동결건조 전, 임의로 동결건조 후에 적절한 경우 부피는 편의를 기초로 하여 선택되고 조정될 수 있음이 당업자에 의해 인지될 것이다. 예를 들어, 동결건조 전 및 재현탁 후 면역원성 조성물을 제형화시키는 것의 상대 부피에 따라, 투여를 위해 제조된 최종 조성물은 보다 적거나 많은 부피로 존재할 수 있고, 이에 따라 본원에 예시된 제형보다 더 또는 덜 농축될 수 있다. 농도에서의 상기 조정은 선호사항을 적합화시키기 위해 과도한 실험 없이 용이하게 계산될 수 있다.
통상적으로, 면역원성 조성물의 각각의 용량에서의 바이러스의 양은 통상적인 피검체에서 유의한 해로운 부작용 없이 면역보호 반응(하나 이상의 용량 후)을 유도하는 양으로 선택된다. 이러한 상황에서의 면역보호는 감염에 대한 완전한 보호를 반드시 의미하지는 않으며; 이는 증상 또는 질병, 특히 바이러스와 관련된 중증 질병에 대한 보호를 의미한다. 항원의 양은 사용되는 특정 면역원에 따라 다양할 수 있다. 항원 함량은 정제되거나 부분적으로 정제된 바이러스 항원의 전체 단백질 함량 ㎍에 의해 측정될 수 있거나, 면역학적 방법, 예를 들어, ELISA, 또는 정량적 면역침전 방법, 예를 들어, 방사상면역확산(radial immunodiffusion)에 의해 측정될 수 있다. 일반적으로, 각각의 인간 용량은 0.01-100㎍의 비활성화된 바이러스, 예를 들어, 적어도 약 0.1㎍(예를 들어, 0.1, 0.2, 0.25, 0.3, 0.33, 0.4, 또는 0.5 ㎍) 내지 약 50 ㎍ 이하, 예를 들어, 약 0.25 ㎍ 내지 약 30 ㎍, 예를 들어, 약 0.25 ㎍, 0.33 ㎍, 0.5 ㎍, 1 ㎍, 약 2 ㎍, 약 2.5 ㎍, 약 3 ㎍, 약 4 ㎍, 약 5 ㎍, 또는 약 10 ㎍(또는 0.1 내지 10.0 ㎍의 임의의 양)의 각각의 바이러스 혈청형을 포함할 것이다. 통상적으로, 면역원성 조성물의 단일 인간 용량은 약 100 ㎍ 이하, 예를 들어, 약 90 ㎍ 이하, 또는 약 80 ㎍ 이하, 또는 약 75 ㎍ 이하, 또는 약 70 ㎍ 이하, 또는 약 60 ㎍ 이하, 또는 약 50 ㎍ 이하, 또는 40 ㎍ 이하, 또는 30 ㎍ 이하, 또는 20 ㎍ 이하, 또는 10 ㎍ 이하(또는 10 내지 100 ㎍의 임의의 양)의 각각의 바이러스 혈청형을 함유한다. 예를 들어, 면역원성 조성물의 단일 인간 용량은 인간 용량 당 0.10 내지 10 ㎍, 또는 0.25 내지 5 ㎍, 또는 상기 언급된 개별적 파라미터에 의해 정의된 임의의 다른 범위를 포함할 수 있다.
면역원성 조성물에서 사용되는 양은 피검체 집단(예를 들어, 유아)을 기초로 하여 선택된다. 특정 조성물에 대한 최적량은 피검체에서의 항체 역가 및 다른 반응의 관찰을 포함하는 표준 연구에 의해 확인될 수 있다. 최초 예방접종 후, 피검체는 적합한 간격(예를 들어, 약 4주 내) 후에 하나 이상의 추가 용량을 수용할 수 있다. 면역보호는 통상적으로 적합한 간격 후에 전달되는, 본원에 기재된 바와 같은 면역원성 조성물의 적어도 2개 용량 후에 발생할 수 있고, 일부 경우에, 2 또는 3개 이상의 용량 후에 발생할 수 있다.
일부 구체예에서, 면역원성 조성물은 적어도 하나의 면역자극성 성분 또는 애쥬번트를 포함한다. 일부 구체예에서, 애쥬번트는 무기염, 예를 들어, 알루미늄(명반) 염, 예를 들어, 포타슘 알루미늄 설페이트, 알루미늄 포스페이트 또는 알루미늄 하이드록시드를 포함한다. 명반이 존재하는 경우, 상기 양은 통상적으로 용량 당 약 100㎍ 내지 1㎎, 예를 들어, 약 100㎍, 또는 약 200㎍ 내지 약 750㎍, 예를 들어, 약 500㎍이다. 상기 논의된 바와 같이, 알루미늄 염이 사용되는 제형에서, 정제된 비활성화된 뎅기 바이러스(들)은 본원에 개시된 조성물에서의 제형화 전에 알루미늄 염에 예비-흡착될 수 있다. 대안적으로, 알루미늄 염은 동결건조된 면역원성 조성물이 재현탁되는 액체에 포함될 수 있거나, 액체 조성물에 첨가될 수 있다. 알루미늄 염에 더하여, 칼슘 염이 또한, 예를 들어, 미립자 애쥬번트로서 사용될 수 있다.
대안적으로 또는 추가로(예를 들어, 알루미늄 염에 추가로), 건조된 제형이 재현탁되는 액체는 면역자극성 성분을 포함할 수 있다. 면역자극성 성분은 또한 투여 전에 액체 제형에 첨가(예를 들어, 2개의 바이얼 및/또는 주사기 또는 다른 용기에서 제조되고, 투여 전에 혼합됨)될 수 있다. 예를 들어, 면역원성 조성물이 근내 투여를 위해 제형화되는 경우, 3D-MPL, 스쿠알렌(예를 들어, QS21), 리포솜, 및/또는 오일 및 물 에멀젼 중 하나 이상을 포함하는 애쥬번트가 유리하게 선택된다.
정제된 비활성화된 뎅기 바이러스 항원과 조합하여 사용하기 위한 하나의 적합한 애쥬번트는 비-독성 박테리아 지질다당류 유도체이다. 지질 A의 적합한 비-독성 유도체의 한 예는 모노포스포릴 지질 A 또는 더욱 특히 3-데아실화된 모노포스포릴 지질 A(3D-MPL)이다. 3D-MPL은 Glaxo SmithKline Biologicals N.A.에 의해 명칭 MPL로 시판되고, 이는 MPL 또는 3D-MPL로 본 문헌 전체에 걸쳐 언급된다. 예를 들어, 미국 특허 번호 4,436,727호; 4,877,611호; 4,866,034호 및 4,912,094호를 참조하라. 3D-MPL은 주로 IFN-γ(Th1) 표현형을 갖는 CD4+ T 세포 반응을 촉진한다. 3D-MPL은 GB2220211 A호에 개시된 방법에 따라 생성될 수 있다. 화학적으로, 이는 3-데아실화된 모노포스포릴 지질 A와 3, 4, 5 또는 6 아실화된 사슬의 혼합물이다. 본 발명의 조성물에서, 소립자 3D-MPL이 사용될 수 있다. 소립자 3D-MPL은, 0.22㎛ 필터를 통해 멸균-여과될 수 있도록 하는 입자 크기를 갖는다. 이러한 제조물은 W094/21292호에 기재되어 있다.
지질다당류, 예를 들어, 3D-MPL은 면역원성 조성물의 인간 용량 당 1 내지 50㎍의 양으로 사용될 수 있다. 이러한 3D-MPL은 약 25㎍, 예를 들어, 20 내지 30㎍, 적합하게는 21 내지 29㎍ 또는 22 내지 28㎍ 또는 23 내지 27㎍ 또는 24 내지 26㎍, 또는 25㎍의 수준으로 사용될 수 있다. 또 다른 구체예에서, 면역원성 조성물의 인간 용량은 약 10㎍, 예를 들어, 5 내지 15㎍, 적합하게는 6 내지 14㎍, 예를 들어, 7 내지 13㎍ 또는 8 내지 12㎍ 또는 9 내지 11㎍, 또는 10㎍의 수준의 3D-MPL을 포함한다. 한 추가 구체예에서, 면역원성 조성물의 인간 용량은 약 5㎍, 예를 들어, 1 내지 9㎍, 또는 2 내지 8㎍ 또는 적합하게는 3 내지 7㎍ 또는 4 및 6 ㎍, 또는 5㎍의 수준의 3D-MPL을 포함한다.
다른 구체예에서, 지질다당류는 미국 특허 번호 6,005,099호 및 유럽 특허 번호 0 729 473 B1호에 기재된 바와 같은 β(1-6) 글루코사민 이당류일 수 있다. 당업자는 상기 참고문헌의 교시내용을 기초로 하여 다양한 지질다당류, 예를 들어, 3D-MPL을 용이하게 생성시킬 수 있을 것이다. 그럼에도 불구하고, 상기 참고문헌 각각은 참조로서 본원에 포함된다. 상기 언급된 면역자극제(LPS 또는 MPL 또는 3D-MPL의 구조와 구조에 있어서 유사함)에 더하여, MPL의 상기 구조에 대한 하위-부분인 아실화된 단당류 및 이당류 유도체가 또한 적합한 애쥬번트이다. 다른 구체예에서, 애쥬번트는 지질 A의 합성 유도체이며, 이중 일부는 TLR-4 효능제로 기재되며, 이는 OM174 (2-데옥시-6-o-[2-데옥시-2-[(R)-3-도데카노일옥시테트라-데카노일아미노]-4-o-포스포노-β-D-글루코피라노실]-2-[(R)-3-하이드록시테트라데카노일아미노]-α-D-글루코피라노실디하이드로겐포스페이트), (WO 95/14026호); OM 294 DP (3S, 9R)-3--[(R)-도데카노일옥시테트라데카노일아미노]-4-옥소-5-아자-9(R)-[(R)-3-하이드록시테트라데카노일아미노]데칸-1,10-디올, 1,10-비스(디하이드로게노포스페이트) (WO 99/64301호 및 WO 00/0462호); 및 OM 197 MP-Ac DP (3S-, 9R)-3-[(R)-도데카노일옥시테트라데카노일아미노]-4-옥소-5-아자-9-[(R)-3-하이드록시테트라데카노일아미노]데칸-1,10-디올, 1-디하이드로게노포스페이트 10-(6-아미노헥사노에이트) (WO 01/46127호)를 포함하나, 이에 제한되지는 않는다.
예를 들어, 단독으로 또는 3D-MPL, 또는 본원에 기재된 또 다른 애쥬번트와 조합된, 정제된 비활성화된 뎅기 바이러스(들)과 함께 면역원성 조성물에서 사용될 수 있는 다른 면역자극성 성분은 사포닌, 예를 들어, QS21이다.
사포닌은 문헌[Lacaille-Dubois, M and Wagner H. (1996. A review of the biological and pharmacological activities of saponins. Phytomedicine vol 2 pp 363-386)]에 교시되어 있다. 사포닌은 식물 및 해양 동물계에 광범위하게 분포된 스테로이드 또는 트리터르펜 글리코시드이다. 사포닌은 진탕시 거품을 형성하는 물에서 콜로이드 용액을 형성시키고, 콜레스테롤을 침전시키는 것으로 기재되어 있다. 사포닌이 세포막에 근접하는 경우, 이들은 막에서 포어-유사 구조를 발생시켜, 막을 파열시킨다. 적혈구의 용혈은 상기 현상의 예이고, 이는 특정하지만 전부는 아닌 사포닌의 특성이다.
사포닌은 전신 투여를 위한 백신에서 애쥬번트로 공지되어 있다. 개별적 사포닌의 애쥬번트 및 용혈 활성은 당 분야에서 광범위하게 연구되어 있다(Lacaille-Dubois and Wagner, 상기). 예를 들어, Quil A(남아메리카 나무 퀼라자 사포나리아 몰리나(Quillaja Saponaria Molina)의 나무껍질로부터 유래됨), 및 이의 분획은 미국 특허 5,057,540호 및 문헌["Saponins as vaccine adjuvants", Kensil, C. R., Crit Rev Ther Drug Carrier Syst, 1996, 12 (1-2): 1-55]; 및 유럽 특허 EP 0 362 279 B1호에 기재되어 있다. Quil A의 분획을 포함하는 면역 자극 복합체(Immune Stimulating Complexes, ISCOMS)로 언급되는 미립자 구조는 용혈성이며, 백신의 제조에서 사용되어 왔다(Morein, B., 유럽 특허 0 109 942 B1호; WO 96/11711호; WO 96/33739호). 용혈 사포닌 QS21 및 QS17(Quil A의 HPLC 정제된 분획)은 효능있는 전신 애쥬번트로 기재되었으며, 이들의 생성 방법은 참조로서 본원에 포함되는 미국 특허 번호 5,057,540호 및 유럽 특허 0 362 279 B1호에 개시되어 있다. 전신 예방접종 연구에 사용된 다른 사포닌은 집소필라(Gypsophila) 및 사포나리아(Saponaria)와 같은 다른 식물 종으로부터 유래된 것을 포함한다(Bomford et al., Vaccine, 10(9):572-577, 1992).
QS21은 퀼라자 사포나리아 몰리나의 나무껍질로부터 유래된 Hplc 정제된 비-독성 분획이다. QS21을 생성시키기 위한 방법은 미국 특허 번호 5,057,540호에 개시되어 있다. QS21을 함유하는 비-반응원성 애쥬번트 제형은 WO 96/33739호에 기재되어 있다. 상기 언급된 참고문헌은 본원에 참조로서 포함된다. 상기 면역학적으로 활성인 사포닌, 예를 들어, QS21은 면역원성 조성물의 인간 용량 당 1 내지 50㎍의 양으로 사용될 수 있다. 유리하게는, QS21은 약 25㎍, 예를 들어, 20 내지 30㎍, 적합하게는 21 내지 29㎍ 또는 22 내지 28㎍ 또는 23 내지 27㎍ 또는 24 내지 26㎍, 또는 25㎍의 수준으로 사용된다. 또 다른 구체예에서, 면역원성 조성물의 인간 용량은 약 10㎍, 예를 들어, 5 내지 15㎍, 적합하게는 6 내지 14㎍, 예를 들어, 7 내지 13㎍ 또는 8 내지 12㎍ 또는 9 내지 11㎍, 또는 10㎍의 수준의 QS21을 포함한다. 한 추가 구체예에서, 면역원성 조성물의 인간 용량은 약 5㎍, 예를 들어, 1 내지 9㎍, 또는 2 내지 8㎍ 또는 적합하게는 3 내지 7㎍ 또는 4 내지 6㎍, 또는 5㎍의 수준의 QS21을 포함한다. QS21 및 콜레스테롤을 포함하는 상기 제형은 항원과 함께 제형화되는 경우 성공적인 Th1 자극 애쥬번트인 것으로 밝혀졌다. 따라서, 예를 들어, 정제된 비활성화된 뎅기 바이러스(들)은 유리하게는 QS21 및 콜레스테롤의 조합물을 포함하는 애쥬번트와 함께 면역원성 조성물에서 사용될 수 있다.
사용될 수 있는 다른 TLR4 리간드는 WO 98/50399호 또는 미국 특허 번호 6,303,347호(AGP의 제조를 위한 방법이 또한 개시됨)에 개시된 것과 같은 알킬 글루코사미니드 포스페이트(AGP), 적합하게는 RC527 또는 RC529 또는 미국 특허 번호 6,764,840호에 개시된 바와 같은 AGP의 약학적으로 허용되는 염이다. 일부 AGP는 TLR4 효능제이고, 일부는 TLR4 길항제이다. 둘 모두는 애쥬번트로서 유용한 것으로 생각된다.
TLR-4를 통한 신호전달 반응을 야기시킬 수 있는 다른 적합한 TLR-4 리간드(Sabroe et al, JI 2003 pi 630-5)는, 예를 들어, 그람-음성 박테리아로부터의 지질다당류 및 이의 유도체, 또는 이들의 단편, 특히, LPS의 비-독성 유도체(예를 들어, 3D-MPL)이다. 다른 적합한 TLR 효능제는 열 충격 단백질(HSP) 10, 60, 65, 70, 75 또는 90; 계면활성제 단백질 A, 히알루로난 올리고당류, 헤파란 설페이트 단편, 섬유결합소 단편, 섬유소원 펩티드 및 b-디펜신-2, 및 무라밀 디펩티드(MDP)이다. 한 구체예에서, TLR 효능제는 HSP 60, 70 또는 90이다. 다른 적합한 TLR-4 리간드는 WO 2003/011223호 및 WO 2003/099195호에 기재되어 있고, 예를 들어, WO2003/011223호의 4-5페이지 또는 WO2003/099195호의 3-4페이지에 개시된 화합물 I, 화합물 II 및 화합물 III, 특히 ER803022, ER803058, ER803732, ER804053, ER804057, ER804058, ER804059, ER804442, ER804680, 및 ER804764로서 WO2003/011223호에 개시된 화합물이 있다. 예를 들어, 한 적합한 TLR-4 리간드는 ER804057이다.
추가 TLR 효능제가 또한 애쥬번트로서 유용하다. 용어 "TLR 효능제"는 직접적인 리간드로서 또는 간접적으로 내인성 또는 외인성 리간드의 생성을 통해, TLR 신호전달 경로를 통한 신호전달 반응을 야기시킬 수 있는 작용제를 나타낸다. 이러한 자연 또는 합성 TLR 효능제는 대안적 또는 추가 애쥬번트로서 사용될 수 있다. 애쥬번트 수용체로서의 TLR의 역할의 간단한 개관이 문헌[Kaisho & Akira, Biochimica et Biophysica Acta 1589: 1-13, 2002]에 제공된다. 이들 잠재적 애쥬번트는 TLR2, TLR3, TLR7, TLR8 및 TLR9에 대한 효능제를 포함하나, 이에 제한되지는 않는다. 따라서, 한 구체예에서, 애쥬번트 및 면역원성 조성물은 TLR-1 효능제, TLR-2 효능제, TLR-3 효능제, TLR-4 효능제, TLR-5 효능제, TLR-6 효능제, TLR-7 효능제, TLR-8 효능제, TLR-9 효능제, 또는 이들의 조합물로 구성되는 군으로부터 선택되는 애쥬번트를 추가로 포함한다.
본 발명의 한 구체예에서, TLR-1을 통한 신호전달 반응을 야기시킬 수 있는 TLR 효능제가 사용된다. 적합하게는, TLR-1을 통한 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 트리-아실화된 지질펩티드(LP); 페놀-가용성 모듈린; 결핵균(Mycobacterium tuberculosis) LP; S-(2,3-비스(팔미토일옥시)-(2-RS)-프로필)-N-팔미토일-(R)-Cys-(S)-Ser-(S)-Lys(4)-OH, 박테리아 지질단백질의 아세틸화된 아미노 말단을 모방하는 트리하이드로클로라이드(Pam3Cys) LP 및 보렐리아 부르그도르페리(Borrelia burgdorferi)로부터의 OspA LP로부터 선택된다.
한 대안적 구체예에서, TLR-2를 통한 신호전달 반응을 야기시킬 수 있는 TLR 효능제가 사용된다. 적합하게는, TLR-2를 통한 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 M 튜베르쿨로시스(M tuberculosis), B 부르그도르페리(B burgdorferi) 또는 T 팔리둠(T pallidum)으로부터의 지질단백질, 펩티도글리칸, 박테리아 지질펩티드; 스태필로코쿠스 아우레우스(Staphylococcus aureus)를 포함하는 종으로부터의 펩티도글리칸; 지질타이코산, 만누론산, 나이세리아 포린(Neisseria porin), 박테리아 핌브리애(fimbriae), 예르시나(Yersina) 독성 인자, CMV 비리온, 홍역 헤마글루티닌, 및 효소로부터의 지모산 중 하나 이상이다.
한 대안적 구체예에서, TLR-3를 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제가 사용된다. 적합하게는, TLR-3를 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 이중 가닥 RNA(dsRNA), 또는 폴리이노신산-폴리시티딜산(Poly IC), 바이러스 감염과 관련된 분자 핵산 패턴이다.
한 대안적 구체예에서, TLR-5을 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제가 사용된다. 적합하게는, TLR-5를 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 박테리아 플라젤린(flagellin)이다.
한 대안적 구체예에서, TLR-6을 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제가 사용된다. 적합하게는, TLR-6을 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 미코박테리아 지질단백질, 디-아실화된 LP, 및 페놀-가용성 모듈린이다. 추가 TLR6 효능제는 WO 2003/043572호에 기재되어 있다.
한 대안적 구체예에서, TLR-7를 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제가 사용된다. 적합하게는, TLR-7을 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 단일 가닥 RNA(ssRNA), 록소리빈(loxoribine), 위치 N7 및 C8에서의 구아노신 유사체, 또는 이미다조퀴놀린 화합물, 또는 이들의 유도체이다. 한 구체예에서, TLR 효능제는 이미퀴모드(imiquimod)이다. 추가의 TLR7 효능제가 WO 2002/085905호에 기재되어 있다.
한 대안적 구체예에서, TLR-8을 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제가 사용된다. 적합하게는, TLR-8을 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 단일 가닥 RNA (ssRNA), 항-바이러스 활성을 갖는 이미다조퀴놀린 분자, 예를 들어, 레시퀴모드(resiquimod)(R848)이며; 레시퀴모드는 또한 TLR-7에 의해 인지될 수 있다. 사용될 수 있는 다른 TLR-8 효능제는 WO 2004/071459호에 기재된 것을 포함한다.
한 대안적 구체예에서, TLR-9를 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제가 사용된다. 한 구체예에서, TLR-9를 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 HSP90이다. 대안적으로, TLR-9을 통해 신호전달 반응을 야기시킬 수 있는 TLR 효능제는 박테리아 또는 바이러스 DNA, 메틸화되지 않은 CpG 누클레오티드, 특히 CpG 모티프로 공지된 서열 환경을 함유하는 DNA이다. CpG-함유 올리고누클레오티드는 주로 Th1 반응을 유도한다. 이러한 올리고누클레오티드는 널리 공지되어 있고, 예를 들어, WO 96/02555호, WO 99/33488호 및 미국 특허 번호 6,008,200호 및 5,856,462호에 기재되어 있다. 적합하게는, CpG 누클레오티드는 CpG 올리고누클레오티드이다. 본 발명의 면역원성 조성물에서 사용하기에 적합한 올리고누클레오티드는 임의로 적어도 3개, 적합하게는 적어도 6개 이상의 누클레오티드에 의해 분리된 2개 이상의 디누클레오티드 CpG 모티프를 함유하는 CpG 함유 올리고누클레오티드이다. CpG 모티프는 시토신 누클레오티드 뒤에 구아닌 누클레오티드가 존재한다. 본 발명의 CpG 올리고누클레오티드는 통상적으로 데옥시누클레오티드이다. 한 특정 구체예에서, 올리고누클레오티드 내의 누클레오티드간은 포스포로디티오에이트, 또는 적합하게는 포스포로티오에이트 결합이 존재하지만, 포스포디에스테르 및 다른 누클레오티드간 결합이 본 발명의 범위 내이다. 또한, 혼합된 누클레오티드간 결합을 갖는 올리고누클레오티드가 본 발명의 범위 내에 포함된다. 포스포로티오에이트 올리고누클레오티드 또는 포스포로디티오에이트를 생성시키는 방법은 미국 특허 번호 5,666,153호, 5,278,302호 및 WO 95/26204호에 기재되어 있다.
정제된 비활성화된 뎅기 바이러스(들)과의 제형화에 사용하기 위한 또 다른 부류의 애쥬번트는 OMP-기반 면역자극성 조성물을 포함한다. OMP-기반 면역자극성 조성물은, 예를 들어, 비내 투여를 위한 점막 애쥬번트로서 특히 적합하다. OMP-기반 면역자극성 조성물은 그람-음성 박테리아, 비제한적인 예로, 나이세리아 종으로부터의 외막 단백질(OMP, 일부 포린을 포함함)의 제조물의 부류이며(예를 들어, Lowell et al., J. Exp. Med. 167:658, 1988; Lowell et al., Science 240:800, 1988; Lynch et al., Biophys. J. 45:104, 1984; Lowell, in "New Generation Vaccines" 2nd ed., Marcel Dekker, Inc., New York, Basil, Hong Kong, page 193, 1997; 미국 특허 번호 5,726,292호; 미국 특허 번호 4,707,543호 참조), 이는 담체로서 또는 박테리아 또는 바이러스 항원과 같은 면역원을 위한 조성물 내에서 유용하다. 일부 OMP-기반 면역자극성 조성물은 "프로테오솜"으로 언급될 수 있고, 이는 소수성이고, 인간 사용을 위해 안전하다. 프로테오솜은 약 20 ㎚ 내지 약 800 ㎚의 소포 또는 소포-유사 OMP 클러스터로 자가-어셈블리되고, 단백질 항원(Ag), 특히 소수성 모이어티를 갖는 항원과 비공유적으로 통합되거나, 배위결합되거나, 회합되거나(예를 들어, 정전기적으로 또는 소수성으로 회합), 다른 방식으로 협동하는 능력을 갖는다. 다중-분자 막 구조 또는 하나 이상의 OMP의 용해된 구상-유사 OMP 조성물을 포함하는, 소포 또는 소포-유사 형태의 외막 단백질 성분을 발생시키는 임의의 제조 방법이 프로테오솜의 정의 내에 포함된다. 프로테오솜은, 예를 들어, 당 분야에 기재된 바와 같이 제조될 수 있다(예를 들어, 미국 특허 번호 5,726,292호 또는 미국 특허 번호 5,985,284호 참조). 프로테오솜은 또한 일반적으로 전체 OMP 제조물의 2% 미만이 되는 OMP 포린을 생성시키는 사용되는 박테리아(예를 들어, 나이세리아 종)로부터 유래되는 내인성 지질다당류 또는 지질올리고당류(각각, LPS 또는 LOS)를 함유할 수 있다.
프로테오솜은 주로 세제에 의해 용해 상태로 유지되는, 나이세리아 메닌기티디스(Neisseria menigitidis)로부터의 화학적으로 추출된 외막 단백질(OMP)(대부분, 포린 A 및 B 뿐만 아니라 클래스 4 OMP)로 구성된다(Lowell GH. Proteosomes for Improved Nasal, Oral, or Injectable Vaccines. In: Levine MM, Woodrow GC, Kaper JB, Cobon GS, eds, New Generation Vaccines. New York: Marcel Dekker, Inc. 1997; 193-206). 프로테오솜은, 예를 들어, 정용여과 또는 전통적인 투석 방법에 의해 본원에 개시된 PreF 폴리펩티드를 포함하는 바이러스 공급원으로부터 유래된 정제된 단백질 또는 재조합 단백질과 같은 다양한 항원과 함께 제형화될 수 있다. 세제의 점진적 제거는 약 100-200㎚의 직경의 미립자 소수성 복합체의 형성을 가능케 한다(Lowell GH. Proteosomes for Improved Nasal, Oral, or Injectable Vaccines. In: Levine MM, Woodrow GC, Kaper JB, Cobon GS, eds, New Generation Vaccines. New York: Marcel Dekker, Inc. 1997; 193-206).
본원에서 사용되는 "프로테오솜: LPS 또는 프로톨린(Protollin)"은 OMP-LPS 조성물(면역자극성 조성물로 작용할 수 있음)을 제공하기 위해, 예를 들어, 외인성 첨가에 의해 적어도 하나의 종류의 지질다당류와 함께 혼합된 프로테오솜의 제조물을 나타낸다. 따라서, OMP-LPS 조성물은 (1) 그람-음성 박테리아, 예를 들어, 나이세리아 메닌기티디스로부터 제조된 프로테오솜의 외막 단백질 제조물(예를 들어, 프로쥬번트(Projuvant)), 및 (2) 하나 이상의 지질당류의 제조물을 포함하는, 프로톨린의 기본 성분 중 2개로 구성될 수 있다. 지질올리고당류는 내인성(예를 들어, OMP 프로테오솜 제조물을 자연적으로 함유함)일수 있거나, 외인적으로 제조된 지질올리고당류로부터의 OMP 제조물과 혼합되거나 조합될 수 있거나(예를 들어, OMP 제조물과 상이한 배양물 또는 미생물로부터 제조됨), 이들의 조합일 수 있다. 이러한 외인적으로 첨가된 LPS는 OMP 제조물이 제조되는 것과 동일한 그람-음성 박테리아 또는 상이한 그람-음성 박테리아로부터의 것일 수 있다. 프로톨린은 또한 지질, 당지질, 당단백질, 소분자 등, 및 이들의 조합물을 임의로 포함하는 것이 이해되어야 한다. 프로톨린은, 예를 들어, 미국 특허 출원 공개 번호 2003/0044425호에 기재된 바와 같이 제조될 수 있다.
다양한 애쥬번트, 예를 들어, 상기 본원에 언급된 애쥬번트의 조합물이 또한 정제된 비활성화된 뎅기 바이러스(들)을 갖는 조성물에서 사용될 수 있다. 예를 들어, 이미 기재된 바와 같이, QS21은 3D-MPL과 함께 제형화될 수 있다. QS21:3D-MPL의 비는 통상적으로 약 1:10 내지 10:1; 예를 들어, 1:5 내지 5:1, 및 종종 실질적으로 1:1일 것이다. 통상적으로, 상기 비는 2.5:1 내지 1:1의 3D-MPL 대 QS21의 범위 내이다. 임의로, 상기 조합물은 리포솜의 형태일 수 있다.
또 다른 조합의 애쥬번트 제형은 3D-MPL 및 알루미늄 염, 예를 들어, 알루미늄 하이드록시드를 포함한다. 조합하여 제형화되는 경우, 이러한 조합물은 항원-특이적 Th1 면역 반응을 향상시킬 수 있다.
일부 구체예에서, 애쥬번트는 오일 및 물 에멀젼, 예를 들어, 수중유 에멀젼을 포함한다. 수중유 에멀젼의 한 예는 수성 담체 중 대사가능한 오일, 예를 들어, 스쿠알렌, 및 계면활성제, 예를 들어, 소르비탄 트리올레에이트(Span 85™) 또는 폴리옥시에틸렌 소르비탄 모노올리에이트(Tween 80™), 또는 이들의 조합물을 포함한다. 수성 담체는, 예를 들어, 인산염 완충 염수일 수 있다. 특정 구체예에서, 수중유 에멀젼은 임의의 추가 면역자극제(들)을 함유하지 않는다(특히, 이는 비-독성 지질 A 유도체, 예를 들어, 3D-MPL, 또는 사포닌, 예를 들어, QS21을 함유하지 않는다). 특정 구체예에서, 수중유 에멀젼은 토콜, 예를 들어, 토코페롤, 예를 들어, 알파-토코페롤을 포함한다. 추가로, 수중유 에멀젼은 레시틴 및/또는 트리카프릴린을 함유할 수 있다.
본 발명의 또 다른 구체예에서, 항원 또는 항원 조성물 및 수중유 에멀젼 및 임의로 하나 이상의 추가 면역자극제를 포함하는 애쥬번트 조성물을 포함하는 백신 조성물이 제공되며, 상기 수중유 에멀젼은 0.5-10 ㎎의 대사가능한 오일(적합하게는, 스쿠알렌), 0.4-4 ㎎의 유화제, 및 임의로 0.5-11 ㎎의 토콜(적합하게는, 토코페롤, 예를 들어, 알파-토코페롤)을 포함한다.
한 특정 구체예에서, 애쥬번트 제형은 에멀젼, 예를 들어, 수중유 에멀젼의 형태로 제조된 3D-MPL을 포함한다. 일부 경우에, 에멀젼은 WO 94/21292호에 개시된 바와 같이 0.2㎛ 직경 미만의 소립자 크기를 갖는다. 예를 들어, 3D-MPL의 입자는 0.22 마이크론 막을 통해 멸균 여과되기에 충분히 작을 수 있다(유럽 특허 번호 0 689 454호에 기재된 바와 같음). 대안적으로, 3D-MPL은 리포솜 제형 내에서 제조될 수 있다. 임의로, 3D-MPL(또는 이의 유도체)를 함유하는 애쥬번트는 또한 추가 면역자극성 성분을 포함한다.
애쥬번트는 면역원성 조성물이 투여되는 집단에서 안전하고 효과적인 것으로 선택된다. 성인 및 노인 집단에 대해, 제형은 통상적으로 유아 제형에서 통상적으로 발견되는 것보다 많은 애쥬번트 성분을 포함한다. 정제된 비활성화된 뎅기 바이러스를 갖는 면역원성 조성물이 유아 투여를 위해 제형화되는 경우, 애쥬번트의 투여량은 유아 피검체에서 효과적이고 비교적 비-반응원인 것으로 결정된다. 일반적으로, 유아 제형에서의 애쥬번트의 투여량은 성인(예를 들어, 65세 이상의 연령의 성인)으로의 투여를 위해 설계된 제형에서 사용되는 것보다 적다(예를 들어, 용량은 성인에게 투여되는 제형에 제공되는 용량의 분획일 수 있다). 예를 들어, 3D-MPL의 양은 통상적으로 용량 당 1㎍-200㎍, 예를 들어, 10-100㎍, 또는 10㎍-50㎍의 범위 내이다. 유아 용량은 통상적으로 상기 범위의 하한이며, 예를 들어, 이는 약 1㎍ 내지 약 50㎍, 예를 들어, 약 2㎍ 또는 약 5㎍ 또는 약 10㎍ 내지 약 25㎍ 또는 약 50㎍이다. 통상적으로, QS21이 제형에서 사용되는 경우, 상기 범위는 동등하다(또한 상기 기재된 비를 따른다). 오일 및 물 에멀젼(예를 들어, 수중유 에멀젼)의 경우, 아동 또는 유아에게 제공되는 애쥬번트의 용량은 성인 피검체에게 투여되는 용량의 분획일 수 있다.
따라서, 제형화된 면역원성 조성물(임의의 애쥬번트를 포함함)은 인간 피검체로의 투여에 적합하며, 이는 허용가능한 안전성 및 반응원성과 조합된 요망되는 면역원성 특성을 가질 것이다. 통상적으로, 제형화된 면역원성 조성물은 적어도 0.05 ㎖ 및 2 ㎖ 이하, 예를 들어, 0.5 내지 1.5 ㎖의 단일 용량의 양으로 제형화된다. 예를 들어, 단일 용량은 0.5 내지 0.5 ㎖, 또는 0.1 내지 2 ㎖, 또는 0.5 내지 1.5 ㎖의 양, 예를 들어, 0.05 ㎖, 0.06 ㎖, 0.07 ㎖, 0.075 ㎖, 0.08 ㎖, 0.09 ㎖, 0.1 ㎖, 0.2 ㎖, 0.25 ㎖, 0.3 ㎖, 0.33 ㎖, 0.4 ㎖, 0.5 ㎖, 0.6 ㎖, 0.66 ㎖, 0.7 ㎖, 0.75 ㎖, 0.8 ㎖, 0.9 ㎖, 1.0 ㎖, 1.25 ㎖, 1.33 ㎖, 1.5 ㎖ 또는 2 ㎖의 양, 또는 임의의 사이에 존재하는 부피로 존재할 수 있다.
조성물은 다양한 상이한 경로에 의해 투여될 수 있으나, 가장 일반적으로는 면역원성 조성물은 근내, 피하 또는 피내 투여 경로에 의해 전달된다. 일반적으로, 백신은 중화 항체 및 보호의 생성에 효과적인 용량으로 피하, 피내, 또는 근내 투여될 수 있다. 백신은 투여량 제형과 양립되는 방식, 및 예방적 및/또는 치료적으로 효과적일 양으로 투여된다. 일반적으로 용량 당 0.05-100 ㎍의 각각의 균주의 비활성화된 바이러스의 범위 내인 투여되는 양은 치료되는 피검체, 항체를 합성하는 피검체의 면역계의 능력, 및 요망되는 보호의 정도에 좌우된다. 투여되는 백신의 정확한 양은 숙련자의 판단에 좌우될 수 있고, 각각의 피검체에 고유할 수 있다.
백신은 단일 용량 스케줄로 제공될 수 있거나, 바람직하게는 예방접종의 일차 과정이 1-10개의 별개의 용량으로 이루어진 후, 면역 반응을 유지하고/하거나 강화시키는데 필요한 이후의 시간 간격, 예를 들어, 두번째 용량에 대해 1-4개월에 제공되는 다른 용량, 및 필요시, 수개월 또는 수년 후에 이후의 용량(들)이 제공될 수 있는 다수 용량 스케줄로 제공될 수 있다. 투여 요법은 또한 적어도 부분적으로는 개체의 필요에 의해 결정될 것이며, 이는 진료의의 판단에 좌우될 것이다. 적합한 면역화 스케줄의 예는 첫번째 용량 후, 7일 내지 6개월 사이의 두번째 용량, 및 최초 면역화 후 1개월 내지 2년 사이의 임의의 세번째 용량, 또는, 예를 들어, 확립된 소아 백신 스케줄에 상응하도록 선택된 보호 면역을 부여하는 것으로 예상되는 바이러스-중화 항체의 역가를 유도하기에 충분한 다른 스케줄을 포함한다. 비활성화된 바이러스 백신을 이용한 뎅기에 대한 보호 면역의 발생이 1 내지 3회의 접종으로 구성되는 면역화의 일차 과정 후에 합리적으로 예상될 수 있다. 이들은 만족스러운 수준의 보호 면역을 유지하도록 설계된 간격(예를 들어, 2년 마다)의 부스터에 의해 보충될 수 있다.
하기 실시예는 어떤 특정한 특징 및/또는 구체예를 예시하기 위해 제공된다. 이들 실시예는 기재된 특정 특징 또는 구체예로 본 발명을 제한하는 것으로 해석되어선 안된다. 양, 예를 들어, 부피는 단지 예로서 제공되고, 진료의의 선택으로 규모가 변형(증가 또는 감소)될 수 있음이 당업자에 의해 인지될 것이다. 유사하게, 정제에 사용되는 구성요소, 예를 들어, 필터, 컬럼은 어떠한 방식으로든 제한하거나 배타적인 것으로 의도되지 않으며, 이는 진료의의 판단으로 동일 목적을 달성하기 위해 다른 구성요소를 대체될 수 있다.
실시예
실시예 1: 정제된 비활성화된 뎅기 바이러스를 생성시키기 위한 정제 방법
뎅기 바이러스는 Vera 세포에서 성장되고, 본질적으로 WO 2010/094663호에 기재된 바와 같이 정제된다. 예를 들어, 뎅기 바이러스는, 예를 들어, 동물 비함유 배지 중에서 Vera 세포에서 성장된다. 통상적으로, 세포는 동물 비함유(AF) 배지, 예를 들어, Invitrogen으로부터 시판되는 VPSFM 배지에서 정지 예비배양 상태(예를 들어, T 플라스크 또는 세포 공장 내)로 유지된다. 세포는 이후 통상적으로 미세담체(예를 들어, Cytodex 1)에 부착되고, 관류 또는 배치 방식으로 공급되는 생물반응기에서 확장된다. 세포가 적합한 밀도에 도달한 후, 세포는 혈청-함유(예를 들어, 1.5%) 또는 AF 배지에서 바이러스로 적합한 MOI(예를 들어, 0.01-0.1, 예를 들어, 0.05)로 감염된다. 혈청-함유 배지를 이용하는 경우, 최초 감염 단계 후(통상적으로, 약 2일), 배지는 통상적으로 AF 배지로 교환된다. 임의로, AF 배지는 처음에 또는 주기적으로 글루코스, 아미노산 등으로 보충된다.
바이러스 성장을 위한 적합한 기간, 예를 들어, 최소 6 내지 8일 후, 바이러스가 세포로부터 수거된다. 임의로, 바이러스는 감염 후 약 6일에서 시작하여 간격(예를 들어, 2일의 간격)을 두어 증진적으로 수거될 수 있다.
예시적 정제 방법이 도 2A에 개략적으로 예시되어 있다. 변형된 정제 방법이 도 2B에 개략적으로 예시되어 있다. 도 2A의 방법과 본질적으로 유사하나, 상기 방법은 하기 변형을 포함한다. 포름알데하이드를 이용한 비활성화 후, 소듐 바이설파이트의 첨가에 의한 벌크 내의 유리 포르말린을 중화시키는 단계가 배제된다. 소듐 바이설파이트 중화의 배제는 이후의 여과 단계에서 수율을 유의하게 증가시킨다. 유리 포르말린은 정용여과 단계에 의해 제거된다.
대안적 정제 방법이 도 2C 및 D에 예시되어 있다. 수거 후, 바이러스를 함유하는 배지가 통상적으로 일련의 감소하는 포어 크기(예를 들어, 8μ, 0.6μ, 0.45μ, 0.2μ)를 통해 정화된다. 바이러스 현탁액은 이후 농축되고, 예를 들어, 초여과 및 정용여과에 의해 배지가 완충액으로 교환된 후, 추가로 여과되고, 예를 들어, Sephacryl s-400HR 또는 Sepharose 4 FF 수지를 이용하여 크기 배제 크로마토그래피(SEC)가 수행된다. 임의로, 추가 공정 전, 정화된 바이러스 현탁액은 농축 단계 전 또는 후에 UV 방사선조사(100 내지 500, 예를 들어, 200 J/m2)에 대한 노출에 의해 비활성화된다. 임의로, 잔여 DNA를 제거하기 위해 크기 배제 크로마토그래피 단계에 이어 하나 이상의 단계, 예를 들어, Sartobind-Q 막 크로마토그래피(음성 방식) 및 여과가 후속될 수 있다. 일반적으로, 잔여 DNA가 단백질 ㎍ 당 100 pg DNA 이하(또는 100 pg/용량 미만)로 감소되는 것이 바람직하다.
바이러스는 이후 실온에서 통상적으로 7 내지 10일의 기간 동안 포름알데하이드(약 100 ㎍/㎖)에 대한 노출에 의해 비활성화된다. 임의로, 현탁액은 응집물을 제거하고 포름알데하이드 노출을 개선시키기 위해 중간 시점, 예를 들어, 2, 3, 4, 또는 5일에서 여과(예를 들어, 0.22μ)된다. 비활성화 후, 폴록사머 계면활성제가 초여과/정용여과 전에 완충액에 첨가되어 포름알데하이드가 제거될 수 있고, 저장에 적합한 완충액에 정제된 비활성화된 뎅기 바이러스가 배치될 수 있다. 정제된 비활성화된 뎅기 바이러스는 이후 비활성화된 뎅기 바이러스의 벌크 제조물로서 저장 전에 최종적으로 멸균 여과된다. 임의로, 수크로스가 벌크 제조물의 최종 제형에 첨가된다.
실시예 2: 예시적 면역원성 조성물의 제형화
저장, 동결건조 및 이후의 취급 동안 생성물을 손실 문제를 해결하기 위해 다양한 조건하에서 정제된 비활성화된 뎅기 바이러스의 제형을 평가하였다. 하기 변수를 비활성화된 뎅기 바이러스(균주 당 3.3 ㎍/㎖)의 벌크 제조물의 제형에서 평가하였다: 주사용수 중 5% 수크로스, 25 mM NaCl의 존재하에서, 포스페이트 완충액(pH 8.5) 농도(5, 15, 30mM), 폴록사머 계면활성제 농도(0, 0.001%, 0.2%). 벌크를 동결건조시켰고, 0.625 ㎖의 재현탁 용액 중에서 재구성시켰다. 제형화 방법은 도 3A에 개략적으로 예시되어 있다. 포스페이트 완충액을 트리스 완충액으로 대체하고, 동결건조 전에 1.0으로부터 0.5 ㎖로 단일 용량을 발생시키기 위해 단위 부피를 감소시키는 대안적 제형화가 도 3B에 예시되어 있다. 부피 조정 및 완충액 변형은 독립적 변수이며, 어느 하나 또는 둘 모두의 변형이 별개로 또는 일렬로(in tandem) 이루어질 수 있음이 인지될 것이다.
건조된 케이크의 안정성을 4℃ 및 37℃에서 7일 동안 인큐베이션 후에 평가하였다. 건조된 생성물의 케이크 양상 및 잔여 습도를 평가하였다. 동결건조된 케이크를 이후 NaCl 또는 다양한 완충액에 재구성시켜 pH 안정성을 평가하였다. 1.5 ㎖의 예비-동결건조 부피를 사용하여 0.625㎖의 재현탁 용액을 이용한 재구성 후에 2.4배 농축 계수를 발생시켰다. 생성된 재현탁된 면역원성 조성물을 고유 형광 280/320㎚, 질소 함량, Elisa, 동적광산란, 비탁법(Nephelometry), pH, 및 삼투압에 의해 케이크 품질에 대해 분석하였다.
예시적 결과가 도 4A-B에 제시되어 있다.
이들 결과는 0.001% 내지 0.2% 계면활성제(Lutrol™)의 농도에서 모든 시험된 재현탁 용액에서 단백질의 완전한 회수를 발생시킨 것을 나타내었다. 이는 계면활성제의 부재하에서의 단백질 함량의 손실과 대조되었다. 이론으로 제한하고자 하는 것은 아니지만, 계면활성제의 부재하에서의 단백질의 손실은 적합한 계면활성제의 첨가에 의해 예방되는 바이얼 상의 비특이적 흡착으로 인한 것으로 생각된다. 0.2%의 농도에서, 계면활성제는 또한 바이러스 입자의 응집을 방지하였다.
재현탁 용액의 완충액 농도 및 조성은 최초 생성물 회수에 영향을 미치지 않았다.
ELISA에 의한 면역학적 평가는 비활성화된 뎅기 바이러스의 면역학적 에피토프가 동결건조 및 재구성 후에 보존된 것을 나타내었다. 동결건조 및 재구성과 관련된 추가 세부사항이 실시예 3에 제공된다.
실시예 3: 동결건조 벌크 제조물 및 면역원성 조성물로의 재구성
정제된 비활성화된 뎅기 바이러스를 다음과 같은 명세에 따라 상기 기재되고 도 3B에 제시된 바와 같이 벌크 제조물로 제형화시켰다: 4개의 균주 각각에 대해 1.25 ㎍/균주의 정제된 비활성화된 뎅기 바이러스와 함께 5% 수크로스, 1-31 mM 트리스 완충액, 15 mM NaCl, 0.015-0.2% 폴록사머 188. 동결건조를 위해, 벌크 제조물을 0.5 ㎖ 분취량으로 분배하였다. 이후, 벌크 제조물을 다음과 같은 74시간의 동결 건조 주기로 동결건조시켰다: 1 기압(Atm.)에서 1시간에 걸쳐 ≤ -52℃로 동결; 45 μbar에서 일차 건조를 다음과 같이 수행: 1) 3시간에 걸쳐 -52℃로부터 -32℃로 냉각; 2) 32시간 동안 32℃; 3) 10분 감소와 함께 1℃ 증분의 온도에서의 연속적 감소 후, 2시간 25분의 유지 기간(전체 7시간 55분); 4) 9시간 동안 -28℃; 이차 건조를 다음과 같이 수행: 45 μbar에서 9시간에 걸쳐 -28℃로부터 37℃로 온도 증가 후, 27 μbar에서 12시간 동안 37℃. 동결건조된 샘플을 이후 2 내지 8℃로 평형화시켜 주기를 완료시켰다. 생성된 동결건조된 생성물("케이크")을 재수화 후 또는 동결건조된 형태로 37℃에서의 1개월 또는 -20℃에서의 3개월, 또는 4℃에서의 5개월 후에 실온에서 24시간 동안 인큐베이션하여 안정성을 평가하였다.
선택된 완충액 중에서 0.625 ㎖로 재구성 후, 면역원성 조성물 내에서 생성된 농도는 다음과 같았다: 4% 수크로스, 0.8-24.8 mM 포스페이트, 12 mM NaCl, 0.012-0.16% 폴록사머 188, 2.0 ㎍의 정제된 비활성화된 뎅기 바이러스. 생성된 면역원성 조성물을 다음 평가에 의해 품질, 안정성 및 면역원성에 대해 분석하였다: 고유 형광, DLS, 비탁법, pH, 삼투압 및 ELISA. 대표적 결과가 도 5A-C에 제시되어 있다. 도 6A 및 6B는 계면활성제의 존재 및 부재하에서 동결건조된 제조물의 완충액 중의 재구성 후의 안정성 특징(각각, 고유 형광 및 ELISA)을 도표로 예시한다. 모든 데이터는 예상된 값이었고, 계면활성제-비함유 제형에 비해 계면활성제-함유 제형에 대해 회수에서의 명백한 증가가 있었다. 시험된 범위에 걸쳐 완충액(트리스) 농도의 영향이 관찰되지 않았다. 다양한 재구성 완충액(예를 들어, 다양한 애쥬번트와의 투여에 적합한 액체 면역원성 조성물을 수득하기 위함)에서 유사한 결과가 수득되었다. 이들 결과는 중성 또는 그 초과로 pH를 유지시키기 위한 완충액 및 폴록사머 계면활성제의 존재하에서의 동결건조 및 재구성이 다양한 완충액 조성물에서 유리한 안정성 및 면역원성을 발생시킨 것을 나타내었다.
Claims (119)
- 하나 이상의 정제된 비활성화된 뎅기 바이러스;
완충제; 및
폴록사머 계면활성제를 포함하는, 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물. - 제 1항에 있어서, 애쥬번트를 추가로 포함하는 면역원성 조성물.
- 제 2항에 있어서, 애쥬번트가 알루미늄 염을 포함하는 면역원성 조성물.
- 제 3항에 있어서, 애쥬번트가 알루미늄 하이드록시드 및 알루미늄 포스페이트 중 적어도 하나를 포함하는 면역원성 조성물.
- 제 3항 또는 제 4항에 있어서, 적어도 하나의 추가 면역자극성 성분을 추가로 포함하는 면역원성 조성물.
- 제 5항에 있어서, 적어도 하나의 추가 면역자극성 성분이 오일 및 물 에멀젼, 리포솜, 지질다당류, 사포닌, 및 올리고누클레오티드 중 하나 이상을 포함하는 면역원성 조성물.
- 제 2항에 있어서, 애쥬번트가 알루미늄-비함유 애쥬번트인 면역원성 조성물.
- 제 7항에 있어서, 알루미늄-비함유 애쥬번트가 오일 및 물 에멀젼, 리포솜, 지질다당류, 사포닌 및 올리고누클레오티드로 구성되는 군으로부터 선택된 하나 이상의 면역자극성 성분을 포함하는 면역원성 조성물.
- 알루미늄 염에 흡착된 적어도 하나의 정제된 비활성화된 뎅기 바이러스;
완충제; 및
계면활성제를 포함하는, 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물. - 제 9항에 있어서, 적어도 하나의 추가 면역자극성 성분을 추가로 포함하는 면역원성 조성물.
- 제 10항에 있어서, 면역자극성 성분이 오일 및 물 에멀젼, 리포솜, 지질다당류, 사포닌, 및 올리고누클레오티드 중 하나 이상을 포함하는 면역원성 조성물.
- 제 6항, 제 8항, 및 제 11항에 있어서, 하나 이상의 면역자극성 성분이 3-데아실화된 모노포스포릴 지질 A(3D-MPL)를 포함하는 면역원성 조성물.
- 제 5항, 제 6항, 제 7항, 제 8항, 제 10항, 제 11항, 및 제 12항 중 어느 한 항에 있어서, 하나 이상의 면역자극성 성분이 QS21을 포함하는 면역원성 조성물.
- 제 6항, 제 8항, 제 10항, 제 11항, 제 12항 및 제 13항 중 어느 한 항에 있어서, 면역자극성 성분이 적어도 하나의 메틸화되지 않은 CpG를 포함하는 DNA 올리고누클레오티드를 포함하는 면역원성 조성물.
- 제 6항, 제 8항, 제 10항, 제 11항, 제 12항, 제 13항 및 제 14항 중 어느 한 항에 있어서, 면역자극성 성분이 리포솜을 포함하는 면역원성 조성물.
- 제 1항 내지 제 15항 중 어느 한 항에 있어서, 계면활성제가 근내, 피하, 경피 또는 피내 투여에 적합한 것인 비활성화 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 16항 중 어느 한 항에 있어서, 계면활성제가 폴록사머(poloxamer), 마크로골(macrogol) 15 하이드록시 스테아레이트, 폴리소르베이트, 옥톡시놀, 폴리도카놀, 폴리옥실 스테아레이트, 폴리옥실 피마자유, N-옥틸-글루코시드, 및 이들의 조합물로 구성되는 군으로부터 선택되는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 17항 중 어느 한 항에 있어서, 계면활성제가 폴록사머인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 18항 중 어느 한 항에 있어서, 폴록사머 계면활성제가 적어도 4500kD의 분자량을 갖는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 19항 중 어느 한 항에 있어서, 폴록사머 계면활성제가 15,000 kD 이하의 분자량을 갖는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 20항 중 어느 한 항에 있어서, 계면활성제가 적어도 0.001%(w/v)의 양으로 존재하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 21항 중 어느 한 항에 있어서, 계면활성제가 1.0%(wt/v) 이하의 양으로 존재하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 22항 중 어느 한 항에 있어서, 면역원성 조성물이 복수의 정제된 비활성화 뎅기 바이러스를 포함하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 23항 중 어느 한 항에 있어서, 복수의 정제된 비활성화 뎅기 바이러스가 다양한 혈청형의 것인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 24항 중 어느 한 항에 있어서, 복수의 정제된 비활성화 뎅기 바이러스가 각각의 DEN-1, DEN-2, DEN-3 및 DEN-4에 대한 면역 반응을 유도하는 복수의 바이러스를 포함하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 25항 중 어느 한 항에 있어서, 정제된 비활성화 뎅기 바이러스 중 적어도 하나가 약독화된 뎅기 바이러스인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 26항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스 중 적어도 하나가 재조합 뎅기 바이러스인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 27항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스 중 적어도 하나가 제 1의 뎅기 바이러스 핵산 및 제 2의 플라비바이러스 핵산을 포함하는 키메라 바이러스인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 28항에 있어서, 제 2의 플라비바이러스가 제 2의 뎅기 핵산, 황열 바이러스, 및 일본 뇌염 바이러스로부터 선택되는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 28항 또는 제 29항에 있어서, 키메라의 정제된 비활성화된 뎅기 바이러스가 뎅기 M 및 뎅기 E 단백질 중 하나 또는 둘 모두를 엔코딩하는 핵산을 포함하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 25항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스 중 적어도 하나가 야생형 뎅기 바이러스인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 31항 중 어느 한 항에 있어서, 하나 이상의 정제된 비활성화 뎅기 바이러스가 각각 단일 인간 용량 당 적어도 0.1 μ 및 100 ㎍ 이하의 양으로 존재하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 32항 중 어느 한 항에 있어서, 하나 이상의 정제된 비활성화 뎅기 바이러스가 각각 인간 용량 당 적어도 0.25 ㎍ 및 10 ㎍ 이하의 양으로 존재하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 33항 중 어느 한 항에 있어서, 완충제가 소듐 포스페이트 및 포타슘 포스페이트 중 하나 또는 둘 모두를 포함하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 34항 중 어느 한 항에 있어서, 완충제가 트리스(하이드록시메틸)아미노메탄을 포함하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 35항 중 어느 한 항에 있어서, 완충제가 액체 조성물 내의 pH를 pH 6.4 또는 그 초과로 유지시키는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 36항 중 어느 한 항에 있어서, 완충제가 액체 조성물 내의 pH를 pH 6.8 또는 그 초과로 유지시키는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 37항 중 어느 한 항에 있어서, 완충제가 액체 조성물을 pH 7.0 또는 그 초과로 유지시키는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 38항 중 어느 한 항에 있어서, 유리 형성 당 및 유리 형성 폴리올 중 적어도 하나를 추가로 포함하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 39항 중 어느 한 항에 있어서, 유리 형성 당 또는 폴리올이 수크로스, 트레할로스, 만노스, 만니톨, 라피노스, 락티톨, 소르비톨 및 락토비온산, 글루코스, 말툴로스, 이소-말툴로스, 락툴로스, 말토스, 락토스, 이소-말토스, 말티톨, 팔라티니트, 스타키오스, 멜레지토스, 덱스트란 또는 이들의 조합물로 구성되는 군으로부터 선택되는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 40항 중 어느 한 항에 있어서, 유리 형성 당 또는 폴리올이 수크로스를 포함하는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 41항 중 어느 한 항에 있어서, 조성물이 동결건조된 고체인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 42항 중 어느 한 항에 있어서, 조성물이 액체인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 43항 중 어느 한 항에 있어서, 조성물이 등장액인 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 44항 중 어느 한 항에 있어서, 면역원성 조성물이 인간 피검체로의 투여용으로 제형화되는 면역원성 조성물.
- 제 1항 내지 제 45항 중 어느 한 항에 있어서, 면역원성 조성물이 적어도 0.05 ㎖ 및 2 ㎖ 이하의 단일 인간 용량의 양으로 제형화되는 면역원성 조성물.
- 제 1항 내지 제 46항 중 어느 한 항에 있어서, 면역원성 조성물이 0.5 내지 1.5 ㎖의 단일 인간 용량의 양으로 제형화되는 면역원성 조성물.
- 제 1항 내지 제 47항 중 어느 한 항에 있어서, 하나 이상의 정제된 비활성화된 뎅기 바이러스가 화학적 비활성화 작용제, 물리적 비활성화 작용제 및 방사선조사 비활성화 작용제 중 적어도 하나에 의해 비활성화되는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 제 1항 내지 제 48항 중 어느 한 항에 있어서, 하나 이상의 정제된 비활성화된 뎅기 바이러스가 포름알데하이드, 베타프로피오락톤(BPL), 과산화수소, 자외선 방사선조사 및 감마 방사선조사 중 적어도 하나에 대한 노출에 의해 비활성화되는 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물.
- 적어도 하나의 정제된 비활성화된 뎅기 바이러스; 및 폴록사머 계면활성제를 포함하는, 비활성화된 뎅기 바이러스의 동결건조된 제조물.
- 제 50항에 있어서, 알루미늄 염을 추가로 포함하는 동결건조된 제조물.
- 제 51항에 있어서, 제조물이 알루미늄 하이드록시드 및 알루미늄 포스페이트 중 적어도 하나를 포함하는 동결건조된 제조물.
- 제 51항 또는 제 52항에 있어서, 적어도 하나의 정제된 비활성화된 뎅기 바이러스가 알루미늄 염에 흡착되는 동결건조된 제조물.
- 제 50항 내지 제 53항 중 어느 한 항에 있어서, 계면활성제가 폴록사머, 마크로골 15 하이드록시 스테아레이트, 폴리소르베이트, 옥톡시놀, 폴리도카놀, 폴리옥실 스테아레이트, 폴리옥실 피마자유, N-옥틸-글루코시드, 및 이들의 조합물로 구성되는 군으로부터 선택되는 동결건조된 제조물.
- 제 50항 내지 제 54항 중 어느 한 항에 있어서, 계면활성제가 폴록사머인 동결건조된 제조물.
- 제 55항에 있어서, 폴록사머 계면활성제가 적어도 4500kD의 분자량을 갖는 동결건조된 제조물.
- 제 55항에 있어서, 폴록사머 계면활성제가 15,000 kD 이하의 분자량을 갖는 동결건조된 제조물.
- 제 50항 내지 제 57항 중 어느 한 항에 있어서, 계면활성제가 적어도 0.001% (w/v)의 양으로 존재하는 동결건조된 제조물.
- 제 50항 내지 제 58항 중 어느 한 항에 있어서, 계면활성제가 1.0%(wt/v) 이하의 양으로 존재하는 동결건조된 제조물.
- 제 50항 내지 제 59항 중 어느 한 항에 있어서, 면역원성 조성물이 복수의 정제된 비활성화된 뎅기 바이러스를 포함하는 동결건조된 제조물.
- 제 60항에 있어서, 복수의 정제된 비활성화된 뎅기 바이러스가 다양한 혈청형의 것인 동결건조된 제조물.
- 제 60항 또는 제 61항에 있어서, 복수의 정제된 비활성화된 뎅기 바이러스가 각각의 DEN-1, DEN-2, DEN-3 및 DEN-4에 대한 면역 반응을 유도하는 복수의 바이러스를 포함하는 동결건조된 제조물.
- 제 50항 내지 제 62항 중 어느 한 항에 있어서, 적어도 하나의 정제된 비활성화된 뎅기 바이러스가 단일 인간 용량 당 적어도 0.1 μ 및 100 ㎍ 이하의 양으로 존재하는 동결건조된 제조물.
- 제 50항 내지 제 63항 중 어느 한 항에 있어서, 적어도 하나의 정제된 비활성화된 뎅기 바이러스가 인간 용량 당 적어도 0.25 ㎍ 및 10 ㎍ 이하의 양으로 존재하는 동결건조된 제조물.
- 제 50항 내지 제 64항 중 어느 한 항에 있어서, 완충제로 작용하는 적어도 하나의 성분을 추가로 포함하는 동결건조된 제조물.
- 제 50항 내지 제 65항 중 어느 한 항에 있어서, 유리 형성 당 및 유리 형성 폴리올 중 적어도 하나를 추가로 포함하는 동결건조된 제조물.
- 제 66항에 있어서, 유리 형성 당 또는 폴리올이 수크로스, 트레할로스, 만노스, 만니톨, 라피노스, 락티톨, 소르비톨 및 락토비온산, 글루코스, 말툴로스, 이소-말툴로스, 락툴로스, 말토스, 락토스, 이소-말토스, 말티톨, 팔라티니트, 스타키오스, 멜레지토스, 덱스트란 또는 이들의 조합물로 구성되는 군으로부터 선택되는 동결건조된 제조물.
- 완충제 및 계면활성제를 포함하는 용액을 제공하는 단계; 및 상기 용액과 하나 이상의 정제된 비활성화된 뎅기 바이러스를 혼합하는 단계를 포함하는, 비활성화된 뎅기 바이러스의 벌크 제조물 또는 면역원성 조성물을 제형화시키는 방법.
- 제 68항에 있어서, 용액과 혼합시키기 전에 하나 이상의 정제된 비활성화 뎅기 바이러스를 알루미늄 염에 흡착시키는 것을 포함하는 방법.
- 제 69항에 있어서, 알루미늄 염이 알루미늄 하이드록시드 및 알루미늄 포스페이트 중 적어도 하나를 포함하는 방법.
- 제 68항 내지 제 70항 중 어느 한 항에 있어서, 복수의 정제된 비활성화된 뎅기 바이러스 각각을 알루미늄 염에 흡착시켜 예비-흡착된 모노벌크(monobulk)를 생성시키고, 복수의 예비-흡착된 모노벌크와 용액을 혼합하는 것을 포함하는 방법.
- 제 68항 내지 제 71항 중 어느 한 항에 있어서, 상기 용액이 비경구 투여에 적합한 것인 방법.
- 제 68항 내지 제 72항 중 어느 한 항에 있어서, 상기 용액이 등장성인 방법.
- 제 68항 내지 제 73항 중 어느 한 항에 있어서, 상기 용액이 유리 형성 당; 유리 형성 폴리올; 및 염 중 하나 이상을 추가로 포함하는 방법.
- 제 68항 내지 제 74항 중 어느 한 항에 있어서, 용액을 제공하는 것이 내독소-비함유 물에 유리 형성 당 또는 폴리올; 완충제; 염; 및 계면활성제를 첨가하는 것을 포함하는 방법.
- 제 75항에 있어서, 각각의 성분이 연속적으로 첨가되는 방법.
- 제 68항 내지 제 76항 중 어느 한 항에 있어서, 완충제가 소듐 포스페이트, 포타슘 포스페이트 및 트리스(하이드록시메틸)아미노메탄으로부터 선택된 적어도 하나의 성분을 포함하는 방법.
- 제 68항 내지 제 77항 중 어느 한 항에 있어서, 완충제가 표 1로부터 선택되는 방법.
- 제 68항 내지 제 78항 중 어느 한 항에 있어서, 완충제가 pH 6.4 또는 pH 6.4 초과로 벌크 제조물 또는 면역원성 조성물의 pH를 유지시키는 방법.
- 제 68항 내지 제 79항 중 어느 한 항에 있어서, 완충제가 pH 6.8 또는 pH 6.8 초과로 벌크 제조물 또는 면역원성 조성물의 pH를 유지시키는 방법.
- 제 68항 내지 제 80항 중 어느 한 항에 있어서, 완충제가 pH 7.0 또는 pH 7.0 초과로 벌크 제조물 또는 면역원성 조성물의 pH를 유지시키는 방법.
- 제 68항 내지 제 81항 중 어느 한 항에 있어서, 계면활성제가 근내, 피하, 경피 또는 피내 투여에 적합한 방법.
- 제 68항 내지 제 82항 중 어느 한 항에 있어서, 계면활성제가 폴록사머, 마크로골 15 하이드록시 스테아레이트, 폴리소르베이트, 옥톡시놀, 폴리도카놀, 폴리옥실 스테아레이트, 폴리옥실 피마자유, N-옥틸-글루코시드, 및 이들의 조합물로 구성되는 군으로부터 선택되는 방법.
- 제 68항 내지 제 83항 중 어느 한 항에 있어서, 계면활성제가 폴록사머인 방법.
- 제 68항 내지 제 84항 중 어느 한 항에 있어서, 폴록사머 계면활성제가 적어도 4500 kD의 분자량을 갖는 방법.
- 제 50항 내지 제 85항 중 어느 한 항에 있어서, 폴록사머 계면활성제가 15,000 kD 이하의 분자량을 갖는 방법.
- 제 68항 내지 제 86항 중 어느 한 항에 있어서, 계면활성제가 적어도 0.001%(w/v)의 양으로 벌크 제조물 또는 면역원성 조성물에 존재하는 방법.
- 제 68항 내지 제 87항 중 어느 한 항에 있어서, 계면활성제가 1.0%(w/v) 이하의 양으로 벌크 제조물 또는 면역원성 조성물에 존재하는 방법.
- 제 74항 내지 제 86항 중 어느 한 항에 있어서, 유리 형성 당 또는 폴리올이 수크로스, 트레할로스, 만노스, 만니톨, 라피노스, 락티톨, 소르비톨 및 락토비온산, 글루코스, 말툴로스, 이소-말툴로스, 락툴로스, 말토스, 락토스, 이소-말토스, 말티톨, 팔라티니트, 스타키오스, 멜레지토스, 덱스트란 또는 이들의 조합물로 구성되는 군으로부터 선택되는 방법.
- 제 74항 내지 제 89항 중 어느 한 항에 있어서, 유리 형성 당 또는 폴리올이 수크로스를 포함하는 방법.
- 제 74항 내지 제 90항 중 어느 한 항에 있어서, 염이 무기염을 포함하는 방법.
- 제 74항 내지 제 91항 중 어느 한 항에 있어서, 무기염이 소듐 클로라이드를 포함하는 방법.
- 제 68항 내지 제 92항 중 어느 한 항에 있어서, 벌크 제조물 또는 면역원성 조성물이 복수의 정제된 비활성화된 뎅기 바이러스를 포함하는 방법.
- 제 68항 내지 제 93항 중 어느 한 항에 있어서, 복수의 정제된 비활성화된 뎅기 바이러스가 다양한 혈청형의 정제된 비활성화된 뎅기 바이러스인 방법.
- 제 68항 내지 제 94항 중 어느 한 항에 있어서, 복수의 정제된 비활성화된 뎅기 바이러스가 각각의 DEN-1, DEN-2, DEN-3 및 DEN-4에 대한 면역 반응을 유도하는 복수의 바이러스를 포함하는 방법.
- 제 68항 내지 제 95항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스 중 적어도 하나가 약독화된 뎅기 바이러스인 방법.
- 제 68항 내지 제 96항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스 중 적어도 하나가 재조합 뎅기 바이러스인 방법.
- 제 68항 내지 제 97항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스 중 적어도 하나가 제 1 뎅기 바이러스 핵산 및 제 2 플라비바이러스 핵산을 포함하는 키메라 바이러스인 방법.
- 제 98항에 있어서, 제 2 플라비바이러스가 제 2 뎅기 핵산, 황열 바이러스, 및 일본 뇌염 바이러스로부터 선택되는 방법.
- 제 98항 또는 제 99항에 있어서, 키메라 정제된 비활성화된 뎅기 바이러스가 뎅기 M 및 뎅기 E 단백질 중 하나 또는 둘 모두를 엔코딩하는 핵산을 포함하는 방법.
- 제 68항 내지 제 95항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스 중 적어도 하나가 야생형 뎅기 바이러스인 방법.
- 제 68항 내지 제 96항 중 어느 한 항에 있어서, 하나 이상의 정제된 비활성화 뎅기 바이러스가 적어도 0.1 μ 및 100 ㎍ 이하의 양으로 각각 존재하는 방법.
- 제 68항 내지 제 102항 중 어느 한 항에 있어서, 하나 이상의 정제된 비활성화 뎅기 바이러스가 적어도 0.25 ㎍ 및 10 ㎍ 이하의 양으로 각각 존재하는 방법.
- 제 68항 내지 제 103항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스가 화학적 비활성화 작용제, 물리적 비활성화 작용제 및 방사선조사 비활성화 작용제 중 적어도 하나에 의해 비활성화되는 방법.
- 제 68항 내지 제 104항 중 어느 한 항에 있어서, 정제된 비활성화된 뎅기 바이러스가 포름알데하이드, 베타프로피오락톤(BPL), 과산화수소, 자외선 방사선조사 및 감마 방사선조사 중 적어도 하나에 대한 노출에 의해 비활성화되는 방법.
- 제 68항 내지 제 105항 중 어느 한 항에 있어서, 동결건조된 조성물을 생성시키기 위해 적어도 하나의 정제된 비활성화된 뎅기 바이러스를 포함하는 용액을 동결건조시키는 것을 추가로 포함하는 방법.
- 제 106항에 있어서, 약학적으로 허용되는 용액 중에 동결건조된 조성물을 재현탁시키는 것을 추가로 포함하는 방법.
- 제 107항에 있어서, 약학적으로 허용되는 용액이 주사용수인 방법.
- 제 107항에 있어서, 약학적으로 허용되는 용액이 적어도 하나의 애쥬번트를 포함하는 방법.
- 제 109항에 있어서, 애쥬번트가 알루미늄 염, 오일 및 물 에멀젼, 지질다당류, 사포닌, 및 올리고누클레오티드 중 하나 이상을 포함하는 방법.
- 제 110항에 있어서, 지질다당류가 3-데아실화된 모노포스포릴 지질 A(3D-MPL)를 포함하는 방법.
- 제 110항 또는 제 111항에 있어서, 사포닌이 QS21을 포함하는 방법.
- 제 110항 내지 제 112항 중 어느 한 항에 있어서, 올리고누클레오티드가 적어도 하나의 메틸화되지 않은 CpG를 포함하는 DNA 올리고누클레오티드인 방법.
- 제 110항 내지 제 113항 중 어느 한 항에 있어서, 애쥬번트가 리포솜을 포함하는 방법.
- 제 68항 내지 제 113항 중 어느 한 항에 있어서, 면역원성 조성물이 인간 피검체로의 투여에 적합한 방법.
- 제 68항 내지 제 115항 중 어느 한 항에 있어서, 면역원성 조성물이 적어도 0.05 ㎖ 및 2 ㎖ 이하의 단일 용량의 양으로 제형화되는 방법.
- 제 68항 내지 제 116항 중 어느 한 항에 있어서, 면역원성 조성물이 0.5 내지 1.5 ㎖의 단일 용량의 양으로 제형화되는 방법.
- 제 68항 내지 제 117항 중 어느 한 항의 방법에 따라 비활성화된 뎅기 바이러스를 제형화시키는 것을 포함하는, 정제된 비활성화된 뎅기 바이러스의 비특이적 흡착 및/또는 응집 중 적어도 하나를 감소시키는 방법.
- 제 68항 내지 제 118항 중 어느 한 항의 방법에 따라 비활성화된 뎅기 바이러스를 제형화시키는 것을 포함하는, 항원적으로 보존된 비활성화된 뎅기 바이러스의 회수를 향상시키는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161490205P | 2011-05-26 | 2011-05-26 | |
| US61/490,205 | 2011-05-26 | ||
| US201161570966P | 2011-12-15 | 2011-12-15 | |
| US61/570,966 | 2011-12-15 | ||
| PCT/EP2012/059879 WO2012160199A1 (en) | 2011-05-26 | 2012-05-25 | Inactivated dengue virus vaccine |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140033171A true KR20140033171A (ko) | 2014-03-17 |
Family
ID=46148894
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137034545A KR20140033171A (ko) | 2011-05-26 | 2012-05-25 | 비활성화된 뎅기 바이러스 백신 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US20140112953A1 (ko) |
| EP (1) | EP2714076A1 (ko) |
| JP (1) | JP2014515367A (ko) |
| KR (1) | KR20140033171A (ko) |
| CN (2) | CN107050445A (ko) |
| AU (2) | AU2012260807B2 (ko) |
| BR (1) | BR112013030236A2 (ko) |
| CA (1) | CA2837145A1 (ko) |
| CO (1) | CO6811814A2 (ko) |
| EA (1) | EA201391515A1 (ko) |
| IL (1) | IL229307A0 (ko) |
| MX (1) | MX349119B (ko) |
| PE (1) | PE20140646A1 (ko) |
| SG (1) | SG194950A1 (ko) |
| WO (1) | WO2012160199A1 (ko) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10086061B2 (en) * | 2015-03-11 | 2018-10-02 | The United States Of America, As Represented By The Secretary Of The Army, On Behalf Of The Walter Reed Army Institute Of Research | Combination purified inactivated vaccine for flaviviruses |
| DE202016008300U1 (de) | 2015-07-02 | 2017-07-14 | PrimeVax Immuno-Oncology, Inc. | Zusammensetzungen zur Kombinationstherapie mit Denguevirus und dendritischen Zellen |
| CN108291205A (zh) | 2015-09-26 | 2018-07-17 | 普莱瓦克斯免疫肿瘤学公司 | 用于产生树突细胞的组合物和方法 |
| GB201522068D0 (en) * | 2015-12-15 | 2016-01-27 | Glaxosmithkline Biolog Sa | Dried composition |
| WO2017109698A1 (en) | 2015-12-22 | 2017-06-29 | Glaxosmithkline Biologicals Sa | Immunogenic formulation |
| WO2017210215A1 (en) * | 2016-05-31 | 2017-12-07 | The Government Of The United States Of America As Represented By The Secretary Of The Army | Zika virus vaccine and methods of production |
| WO2018093907A1 (en) | 2016-11-16 | 2018-05-24 | PrimeVax Immuno-Oncology, Inc. | Combination immunotherapies for treatment of cancer |
| CA3049225A1 (en) * | 2017-01-04 | 2018-07-12 | PrimeVax Immuno-Oncology, Inc. | Compositions and methods for therapy with dengue virus |
| CN107140625A (zh) * | 2017-06-14 | 2017-09-08 | 中国海洋大学 | 一种利用植物油制备石墨烯薄膜的方法 |
| EP3703739A2 (en) | 2017-11-03 | 2020-09-09 | Takeda Vaccines, Inc. | Zika vaccines and immunogenic compositions, and methods of using the same |
| GEP20237539B (en) | 2017-12-07 | 2023-09-11 | Merck Sharp & Dohme Llc | Formulations of dengue virus vaccine compositions |
| BR112022015710A2 (pt) * | 2020-02-27 | 2022-09-27 | Takeda Vaccines Inc | Método para remover dna de célula hospedeira a partir da preparação de vírus |
| CN112546213A (zh) * | 2020-12-31 | 2021-03-26 | 中国医学科学院医学生物学研究所 | 一种制备新型冠状病毒疫苗的方法及针对其有效性的评价方法 |
| CN113750228B (zh) * | 2021-09-25 | 2024-02-20 | 大连理工大学 | 一种冷冻保护剂在铝佐剂中的应用 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6254873B1 (en) * | 1995-04-17 | 2001-07-03 | The United States Of America As Represented By The Secretary Of The Army | Inactivated dengue virus vaccine |
| HUP0302636A3 (en) * | 2000-10-02 | 2008-03-28 | Glaxosmithkline Biolog Sa | Split enveloped virus preparation |
| EP3417875B1 (en) * | 2003-02-10 | 2020-06-17 | Biogen MA Inc. | Immunoglobulin formulation and method of preparation thereof |
| EP1766034B1 (en) * | 2004-05-21 | 2014-03-19 | Novartis Vaccines and Diagnostics, Inc. | Alphavirus vectors for influenza virus vaccines |
| CN104984352A (zh) * | 2005-11-21 | 2015-10-21 | 圣诺菲·帕斯图尔有限公司 | 重组病毒的稳定制剂 |
| ES2621511T3 (es) * | 2007-04-06 | 2017-07-04 | Takeda Vaccines, Inc. | Métodos y composiciones para virus vivos atenuados |
| WO2010035119A2 (en) * | 2008-09-29 | 2010-04-01 | Cadila Pharmaceuticals Ltd. | Vaccine adjuvants |
| PE20110992A1 (es) * | 2009-02-17 | 2012-02-12 | Glaxosmithkline Biolog Sa | Composicion inmunogenica que comprende un antigeno del virus del dengue |
| US9005633B2 (en) * | 2009-07-17 | 2015-04-14 | The United States Of America As Represented By The Secretary Of The Navy. | Psoralen-inactivated viral vaccine and method of preparation |
| US8557253B2 (en) * | 2009-10-07 | 2013-10-15 | Sanofi Pasteur Sa | Stabilizing excipient for inactivated whole virus vaccine |
-
2012
- 2012-05-25 BR BR112013030236A patent/BR112013030236A2/pt not_active Application Discontinuation
- 2012-05-25 JP JP2014511908A patent/JP2014515367A/ja active Pending
- 2012-05-25 CN CN201710173241.XA patent/CN107050445A/zh active Pending
- 2012-05-25 EA EA201391515A patent/EA201391515A1/ru unknown
- 2012-05-25 WO PCT/EP2012/059879 patent/WO2012160199A1/en active Application Filing
- 2012-05-25 CA CA2837145A patent/CA2837145A1/en not_active Abandoned
- 2012-05-25 US US14/119,902 patent/US20140112953A1/en not_active Abandoned
- 2012-05-25 KR KR1020137034545A patent/KR20140033171A/ko not_active Application Discontinuation
- 2012-05-25 MX MX2013013862A patent/MX349119B/es active IP Right Grant
- 2012-05-25 CN CN201280031821.0A patent/CN103619349A/zh active Pending
- 2012-05-25 AU AU2012260807A patent/AU2012260807B2/en not_active Ceased
- 2012-05-25 PE PE2013002709A patent/PE20140646A1/es not_active Application Discontinuation
- 2012-05-25 SG SG2013084298A patent/SG194950A1/en unknown
- 2012-05-25 EP EP12723216.3A patent/EP2714076A1/en not_active Withdrawn
-
2013
- 2013-11-07 IL IL229307A patent/IL229307A0/en unknown
- 2013-11-26 CO CO13277999A patent/CO6811814A2/es unknown
-
2016
- 2016-08-05 AU AU2016210743A patent/AU2016210743A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| MX2013013862A (es) | 2014-01-23 |
| AU2016210743A1 (en) | 2016-08-25 |
| US20140112953A1 (en) | 2014-04-24 |
| EP2714076A1 (en) | 2014-04-09 |
| IL229307A0 (en) | 2014-01-30 |
| WO2012160199A1 (en) | 2012-11-29 |
| BR112013030236A2 (pt) | 2016-12-06 |
| CA2837145A1 (en) | 2012-11-29 |
| CN107050445A (zh) | 2017-08-18 |
| CN103619349A (zh) | 2014-03-05 |
| CO6811814A2 (es) | 2013-12-16 |
| EA201391515A1 (ru) | 2014-05-30 |
| PE20140646A1 (es) | 2014-05-29 |
| SG194950A1 (en) | 2013-12-30 |
| MX349119B (es) | 2017-07-12 |
| AU2012260807B2 (en) | 2016-05-12 |
| JP2014515367A (ja) | 2014-06-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2012260807B2 (en) | Inactivated Dengue virus vaccine | |
| Cimica et al. | Adjuvant formulations for virus-like particle (VLP) based vaccines | |
| AU2012260807A1 (en) | Inactivated Dengue virus vaccine | |
| JP2021138745A (ja) | ワクチン組成物 | |
| JP6104988B2 (ja) | アルミニウム不含アジュバントを添加した不活化デング熱ウイルスワクチン | |
| EP3888676A1 (en) | Immunogenic combinations | |
| BE1022008B1 (fr) | Compositions immunogenes combinees | |
| US20150202283A1 (en) | Method for eliciting in infants an immune response against rsv and b. pertussis | |
| JP6985384B2 (ja) | 弱毒変異型ジカウイルスを含むワクチン組成物 | |
| WO2014024026A1 (en) | Method for eliciting in infants an immune response against rsv and b. pertussis | |
| AU2016222377B2 (en) | Inactivated dengue virus vaccine with aluminium-free adjuvant | |
| AU2014200047B2 (en) | Inactivated dengue virus vaccine with aluminium-free adjuvant |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |