KR20150132092A - 나이브한 대상들을 위한 백신 조성물 - Google Patents
나이브한 대상들을 위한 백신 조성물 Download PDFInfo
- Publication number
- KR20150132092A KR20150132092A KR1020157019558A KR20157019558A KR20150132092A KR 20150132092 A KR20150132092 A KR 20150132092A KR 1020157019558 A KR1020157019558 A KR 1020157019558A KR 20157019558 A KR20157019558 A KR 20157019558A KR 20150132092 A KR20150132092 A KR 20150132092A
- Authority
- KR
- South Korea
- Prior art keywords
- acid
- vaccine
- composition
- influenza
- virus
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/145—Orthomyxoviridae, e.g. influenza virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5252—Virus inactivated (killed)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
- A61K2039/543—Mucosal route intranasal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55588—Adjuvants of undefined constitution
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/58—Medicinal preparations containing antigens or antibodies raising an immune response against a target which is not the antigen used for immunisation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Pulmonology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Otolaryngology (AREA)
Abstract
본 발명은 어린이들과 같이 나이브한 대상들에 효과적인 코로 투여되는 백신 조성물들에 대한 것이다. 나아가, 상기 백신 조성물은 전세계적 유행(pandemic) 동안 일반 대중을 백신접종시키기에 적합하다. 본 발명의 한 측면은 계절성 인플루엔자 바이러스 균주들에 대한 어린이들에서 효과적인 백신을 포함하는 본 발명의 백신의 소아과적(paediatric) 이용에 대한 것이다. 본 발명의 나아간 측면은 본 조성물이 전세계적 유행병(pandemic)에 사용될 때, 모든 연령 군들의 대상들에 대한 것이다.
Description
본 발명은 어린이들과 같은 나이브한 대상들에서 효과적인 비강-투여되는 백신 조성물들에 대한 것이다. 나아가 상기 백신 조성물은 범유행(pandemic) 동안 일반대중에게 적합하다.
현재 널리 사용되는 인플루엔자 백신은 살아있는(live) 바이러스 또는 불활성화된 바이러스에 기초하며, 불활성화된 바이러스 백신들은 전체(whole) 바이러스, "분할(split)" 바이러스, 소단위체 단백질들 또는 정제된 표면 항원들(해마글루티닌(haemagglutinin) 및 뉴라미니다제(neuraminidase)를 포함함)에 기초할 수 있다.
인플루엔자의 사회경제적 영향 및 건강한 어린 아이들에게서 그것의 의학적 부담이 점점 더 인식되어 왔다. 게다가 어린이들은 유행성 주기들 동안 가장 높은 인플루엔자의 공격 비율들을 갖고, 지역사회의 인플루엔자 바이러스들을 다른 위험 집단들에게 전염시킨다.
건강한 어린 아이들은 인플루엔자 감염 위험이 높은데, 이는 그들이 완전히 발달한 면역 시스템을 갖고 있지 않기 때문이다. 유아들은 더 나이가 많은 개인들에게서는 흔하지 않은(스트렙토코커스(Streptococcus) 아갈락티애(agalactiae)와 같은) 감염들에 민감한 생애 첫 3달들이며, 유아들은 생애 첫 몇 달 동안 모계 항체에 의존한다. 유아들은 성인들과 같은 방식으로 특정 백신들에 대응하지 않으며, 약 5 살이 될 때까지 다당류에 효과적인 항체들을 생산할 수 없다. 면역 시스템은 어린이와 함께 자라고 발전하며, 어린이의 면역 시스템의 완전한 성숙에 성호르몬들이 원인이 될 수 있는 것을 생각하면, 사춘기까지는 성인의 그것과 완전히 닮지 않는다.
미국 예방접종 자문 위원회(American Advisory Committee on Immunization Practices)(ACIP)는 6-59 개월의 연령의 모든 어린이들에게 매년 인플루엔자 백신 접종을 권고하는데, 이는 6-23 개월의 연령의 어린이들이 인플루엔자-관련 입원을 할 위험이 상당히 높고, 24-59 개월의 연령의 어린이들이 인플루엔자 관련 병원 및 응급실 방문을 할 위험이 높기 때문이다. 상기 권고는 사용금지사유가 없는 ≥ 6 개월의 연령의 모든 사람에게의 계절별 인플루엔자 백신 접종으로 확장되어 왔다. 미국 식품의약국은 하기 연령 범위들에 따라 소아과(pediatric) 소집단(subpopulation)을 분류한다. 출생부터 1 개월의 연령까지의 신생(newborn) 인구 범위. 1 개월부터 2 살(years)의 연령까지의 유아 인구 범위. 2 살부터 12살까지의 연령까지의 어린이 인구 범위. 12 살부터 21 살의 연령까지의 청소년 소집단 범위. 어린 어린이들의 보편적인 면역 조치에 관하여 더 제한된 입장을 갖기는 하지만, 유럽에서, 몇몇 국가들은 ACIP와 유사한 권고들을 발행한다. 유럽 의약청(European Medicines Agency)은 하기 집단들에 따라 소아과 의약들을 분류한다. 신생 집단은 조산(pre-term) 내지 정상적으로 달이 차서 태어난 아기(term)를 포함하며, 28일까지를 포함한다. 유아 인구들은 1 달부터 23 달까지이다. 어린이 인구는 2살부터 11살까지이다. 청소년들은 12 살부터 18 살까지이다.
연구들은 종래의 비경구(parenteral) 백신들이 준비가 되어 있지 않은(unprimed)((나이브(naive)) 어린이들, 특히 매우 어린 아이들에게 만족할만한 방어면역(protective immunity)을 유도하기에는 능력이 제한된다는 것을 보여왔다. ACIP는 면역적으로 나이브한(naive) 매우 어린 어린이들에게 2회-투여(two-dose) 백신 투약방식(regimen)을 권고하는데, 그러나 더욱 최근에는 이러한 권고는 8 살까지의 연령의 어린이들에게로 확대되어 왔고, 이는 이 집단에서 2회(doses)가 방어에 요구되는 것을 가리키는 증거들이 축적되었기 때문이다.
대유행(inter-pandemic) 기간 동안, 돌아다니는 인플루엔자 바이러스들은 그 전의 전염병으로부터 그것들과 관련된다. 바이러스들은 젊은 시절에 감염들에 대한 면역이 서로 다른 레벨인 사람들 사이로 퍼진다. 보통 2-3 년의 기간 동안 항원소변이(antigenic drift)로 알려진 현상에서, 이렇게 퍼지는 것은 일반 대중들 사이에 다시 유행을 일으키기에 충분히 변화한 새로운 균주들의 선택을 촉진한다. 이동(drift) 변종들은, 몇 년 동안 그것들의 전반적인 영향이 자주 유사함에도 불구하고, 일 년 이내에 다른 커뮤니티들, 지역들, 국가들 및 대륙들에 다른 영향들을 가질 수 있다. 보통 인플루엔자 전염병은 입원 및 사망의 증가한 비율에 의하여 관찰되는 대로 폐렴 및 하기도 호흡기 질환(lower respiratory disease)의 발생 정도의 증가를 야기한다.
예상할 수 없는 간격으로, 신규 인플루엔자 바이러스들은 "항원소변이(antigenic drift)"로 알려진 과정을 통하여 드러나며, 전세계적인 유행병(pandemics)을 일으킬 수 있다. 항원소변이는 이것에 의하여 바이러스의 둘 또는 그 이상의 다른 균주들이 결합하여 둘 또는 그 이상의 원래 균주들의 표면 항원들의 혼합물을 갖는 새로운 아류형(subtype)을 형성하는 과정이다. 항원소변이는 표현형 변화를 주는 재편성(reassortment) 또는 바이러스성 변화(viral shift)의 특정 케이스이다. 이와 같이, 인플루엔자 전세계적 유행병은 인간 개체군이 기존의(pre-existing) 면역력을 갖지 않는 것에 대하여 새로운 인플루엔자 바이러스가 나타날 때 발생한다. 일반 대중은 항원(antigenic) 변이(shift)가 발생할 때, 새로운 바이러스 균주에 대하여 나이브(naive)할 것이다.
항원 변이(antigenic shift)는 항원소변이(antigenic drift)와 대비되는데, 이는 면역력의 상실을 이끌 수 있거나 또는 백신 불일치(백신 mismatch)인 인플루엔자의 공지의 균주들의 시간에 따른 자연적 돌연변이이다. 항원소변이(antigenic drift)는 인플루엔자 바이러스 A, 인플루엔자 B 및 인플루엔자 C를 포함하는 모든 타입의 인플루엔자에서 발생한다. 그러나 항원 변이(antigenic shift)는 인플루엔자 바이러스 A에서만 발생하는데, 이는 그것이 인간들 이상을 감염시키기 때문이다.
전세계적 유행(pandemic) 동안, 항바이러스제는 잠재적으로 생명을 위협하는 인플루엔자 질병의 위험이 있는 개인들의 수 및 수요를 커버하기에 충분히 효과적이거나 충분하지 않을 것이다. 적절한 백신들의 개발은 면역적으로 나이브(naive)한 대상들의 방어 항체 레벨들을 달성하기 위하여 필수적이다.
이러한 문제들은 그것의 목표가 항원 함량을 감소시킬 수 있어 따라서 이용가능한 백신 투여량들(doses)의 수를 증가시킬 수 있게 하기 위하여 백신의 면역원성을 증가시키는 것을 목적으로 하는 최적의 백신 전달 및/또는 아쥬반트하는 것(adjuvantation)에 의하여 대응될 수 있다. 아쥬반트(adjuvant)의 사용은 또한 특정 인플루엔자 균주에 기존의 면역력을 갖지 않는 인구의 항원에 대하여 면역 시스템을 준비시키는 것을 도울 수 있다. 아쥬반트는 또한 백신 전달을 증강시켜 면역 반응을 유도하는데 필요한 항원의 양을 감소시킬 수 있다. 백신 전달 및/또는 백신 접종(vaccination)의 경로(route)는 매우 중요할 수 있다. 대부분의 인플루엔자 백신들은 비경구적으로 전달되며, 그러므로 주로 혈중 인플루엔자에 대한 면역력을 유도한다. 그러나 인플루엔자 바이러스들은 우리의 코 또는 입을 통하여, 즉, 점막(mucosal) 막(membranes)들을 통하여 우리 몸들로 들어온다. 인플루엔자 백신을 코로 전달함으로써, 점막 및 혈액 모두에서 인플루엔자-특이적 면역을 유도할 수 있다. 이는 특히, 임의의 인플루엔자 또는 인플루엔자 백신 균주에 대하여 전에 면역이 없는 개인에게서, 인플루엔자에 대한 방어 면역을 유도하는 것을 목적으로 할 때 도움이 될 수 있다.
전체 불활성화된 바이러스 또는 불활성화된 바이러스로부터의 부분에 기초한 백신과 같이, 백신에 대한 기존의 면역력이 없는 개인들에게서 인플루엔자에 대한 방어 면역을 유도할 수 있는 신규의 살아있지 않은(non-live) 백신들이 필요하다. 인플루엔자에 대한 충분한 기존의 면역력이 없고/없거나 약해진 면역 상태인 개인들은 면역손상된(immuno-compromised) 개인들, 어린아이들, 전 세계적인 전염병의 경우 세계적 인구의 대부분(large parts) (또는 모두) 및 노인을 포함한다. 본 발명은 특히 바이러스성 항원들에 대한 기존의 면역력이 없거나 또는 제한된 어린이들을 향한 것이다. 이 그룹은 특히 예컨대 인플루엔자에 대한 면역 반응을 준비시킬 수 있는 안전하고, 살아 있지 않은(non-live) 백신을 필요로 한다. 전세계적 전염병의 공표 이전 또는 즉시 전세계적 균주에 대하여 면역적으로 나이브한 인구를 대비시키기 위한 페리판데믹(peri-pandemic) 백신들로서 사용될 수 있는 새 백신들 또한 필요하다. 본 발명은 특히 나이브한 사람들(populations)을 향하는 것이며, 비강 투여를 위해 만들어지고 바이러스들의 일부분들 또는 불활성화된 바이러스만을 포함하여, 의학적으로 훈련된 직원들을 요구하지 않기 때문에 분명히 쉽게 투여될 수 있다. 강한(potent) 아쥬반트들을 갖는 백신 항원들의 제형(formulations)은 면역 반응들을 증강시키기 위하여 허용된다.
전체 불활성화된 바이러스 또는 불활성화된 바이러스로부터의 부분에 기초한 백신과 같이, 백신에 대한 기존의 면역력이 없는 개인들에게서 인플루엔자에 대한 방어 면역을 유도할 수 있는 신규의 살아있지 않은(non-live) 백신들이 필요하다.
본 발명은 어린이들과 같은 나이브한 대상들에서 효과적인 비강-투여되는 백신 조성물들에 대한 것이다. 나아가 상기 백신 조성물은 범유행(pandemic) 동안 일반대중에게 적합하다.
본 발명은 어린이들과 같은 나이브한 대상들에서 효과적인 비강-투여되는 백신 조성물들에 대한 것이다. 나아가 상기 백신 조성물은 범유행(pandemic) 동안 일반대중에게 적합하다.
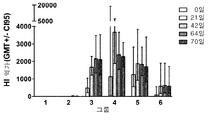
도 1: H1N1 A/Ned/602/09 (A)에 대한 HI 항체 역가들의 발달. 그룹 1, 3-6의 페럿들은 0, 21 및 42일에 점비액(nasal drops)에 의하여 비강내로 접종되었고, 그룹 2의 페럿들은 21 및 42 일에 피하로 주입되었다. HI 항체 역가들은 0, 21 및 42 일에 면역조치들 전 및 64 및 70 일에 마지막 면역조치 후 수집된 혈청들에서 결정되었다. 그룹 1 (대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 불활성화된 전체 바이러스 항원). 막대들은 95% CI로 그룹 당 6 마리 동물들의 기하 평균을 나타낸다(GMT +/- CI95).
도 2: 먼(distant) 바이러스들에 대한 HI 역가들.
그룹 1, 3-6의 페럿들은 0, 21 및 42 일에 점비액(nasal drops)에 의하여 접종되었고, 그룹 2의 페럿들은 21 및 42 일에 피하로 주입되었다. HI 항체 역가들은 0, 21 및 42 일에 면역조치들 전 및 64 및 70 일에 마지막 면역조치 후 수집된 혈청들에서 결정되었다. 그룹 1(대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 불활성화된 전체 바이러스 항원). 막대들은 95% CI로 그룹 당 6 마리 동물들의 기하 평균을 나타낸다(GMT +/- CI95). GMT 계산을 위하여, ≤5 값은 절대값 5로 대체되었다. A: H1N1 A/Swine/Ned/25/80에 대한 항체 역가들. B: H1N1 A/Swine/Italy/14432/76에 대한 항체 역가들. C: H1N1 A/New Jersey/08/76에 대한 항체 역가들.
도 3: H1N1 A/Ned/602/09에 대한 VN 항체 역가들의 발달.
그룹 1, 3-6의 페럿들은 0, 21 및 42 일에 점비액에 의하여 접종되었고, 그룹 2의 페럿들은 21 및 42 일에 피하로 주입되었다. VN 항체 역가들은 0, 21 및 42 일에 면역조치들 전 및 64 및 70 일에 마지막 면역조치 후 수집된 혈청들에서 결정되었다. 그룹 1 (대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 불활성화된 전체 바이러스 항원). 막대들은 95% CI로 그룹 당 6 마리 동물들의 기하 평균을 나타낸다 (GMT +/- CI95).
도 4: 인플루엔자 나이브한 페럿들에서, 본 발명의 20 mg/ml (2 %) 엔도신(Endocine)TM과 15 ug HA 분할(split) 인플루엔자 항원을 포함하는 여기 백신 이뮤노스(Immunose)TM FLU와 다른 아쥬반트된 백산 제품들, 플루미스트(FluMist) 살아있는 약독화된 백신) 및 주입가능한 백신들과의 비교.
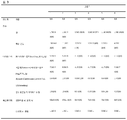
표 3: 페럿들에서 엔도신(Endocine)™ 제형화된(formulated) 2009 H1N1 백신들의 효험은 임상적, 바이러스학적 및 육안병리학적 파라미터들에 의하여 입증되었다.
:그룹 1 (대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 불활성화된 전체 바이러스 항원).
임상 점수들. 생존(survival), 4 dpi까지 생존한 동물들의 수; 열(fever) (0C), 최대 온도 증가는 표준편차와 평균으로 보여주었다, 괄호에 열이 관찰된 동물의 수, (*), 그룹 4의 1 마리 동물의 체온은 기록계(recorder)의 기능 불량으로 이용할 수 없었다; 0 및 4 dpi 사이의 % 체중 손실은 표준편차와 평균으로 보여주었다, 괄호 내에 체중 손실이 있는 동물들의 수.
바이러스학. 코 및 인후 표본 샘플들에서 바이러스 쉐딩(shedding), 적정을 위한 곡선 하 영역(AUC)는 1-4 dpi가 발생했다, 괄호 안에 1 또는 그 이상의 바이러스 양성 표본을 보인 동물들의 수; 4 dpi 상 폐 및 비갑개(turbinates)의 바이러스 로드(load)(log10TCID50 /g)는 표준편차 및 평균으로 나타내었고, 또는 그룹 내 모든 동물들의 경우 더 낮은 감지 한계는 바이러스 음성, 괄호 안에 폐 / 비갑개(turbinate) 바이러스를 갖는 동물들의 수.
육안병리학(Gross pathology). 4 dpi 상 부검 동안 외관시험에 의하여 추정된 영향받은 폐 실질(parenchyma)의 %, 괄호 안에 영향받은 폐를 갖는 동물들의 수; 4 dpi 상 폐/신체 중량 비율 (×102) 은 표준편차 및 평균으로 나타내었다.
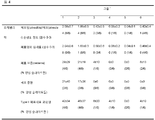
표 4: 4 dpi 상 조직병리학적 파라미터들을 위한 반정량적 점수 기록.
a: 그룹 1 (대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된 불활성화된 전체 바이러스 항원).
조직병리학. 4 dpi 상 조직병리학적 파라미터들을 위한 반정량적 점수기록. 폐포염(alveolitis)/폐포(alveolar) 손상의 정도, 점수: 0, 0%; 1, 25%; 2, 25-50%; 3, > 50 %; 폐포염(alveolitis)의 심각성, 점수: 염증성 세포들 없음 (0); 염증성 세포들 적음 (1); 염증성 세포들 적당한 수임 (2); 많은 염증성 세포들 (3); 폐포(alveolar) 부종(oedema), 폐포(alveolar) 출혈(haemorrhage) 및 타입 Ⅱ 폐포세포(pneumocyte) 과다형성(hyperplasia)이 양성(positive) 활주들(slides)로서 점수화되었다(no=0, yes=1); 모든 조직병리학적 결과들은 표준편차 및 평균으로 나타내어졌다.
도 2: 먼(distant) 바이러스들에 대한 HI 역가들.
그룹 1, 3-6의 페럿들은 0, 21 및 42 일에 점비액(nasal drops)에 의하여 접종되었고, 그룹 2의 페럿들은 21 및 42 일에 피하로 주입되었다. HI 항체 역가들은 0, 21 및 42 일에 면역조치들 전 및 64 및 70 일에 마지막 면역조치 후 수집된 혈청들에서 결정되었다. 그룹 1(대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 불활성화된 전체 바이러스 항원). 막대들은 95% CI로 그룹 당 6 마리 동물들의 기하 평균을 나타낸다(GMT +/- CI95). GMT 계산을 위하여, ≤5 값은 절대값 5로 대체되었다. A: H1N1 A/Swine/Ned/25/80에 대한 항체 역가들. B: H1N1 A/Swine/Italy/14432/76에 대한 항체 역가들. C: H1N1 A/New Jersey/08/76에 대한 항체 역가들.
도 3: H1N1 A/Ned/602/09에 대한 VN 항체 역가들의 발달.
그룹 1, 3-6의 페럿들은 0, 21 및 42 일에 점비액에 의하여 접종되었고, 그룹 2의 페럿들은 21 및 42 일에 피하로 주입되었다. VN 항체 역가들은 0, 21 및 42 일에 면역조치들 전 및 64 및 70 일에 마지막 면역조치 후 수집된 혈청들에서 결정되었다. 그룹 1 (대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 불활성화된 전체 바이러스 항원). 막대들은 95% CI로 그룹 당 6 마리 동물들의 기하 평균을 나타낸다 (GMT +/- CI95).
도 4: 인플루엔자 나이브한 페럿들에서, 본 발명의 20 mg/ml (2 %) 엔도신(Endocine)TM과 15 ug HA 분할(split) 인플루엔자 항원을 포함하는 여기 백신 이뮤노스(Immunose)TM FLU와 다른 아쥬반트된 백산 제품들, 플루미스트(FluMist) 살아있는 약독화된 백신) 및 주입가능한 백신들과의 비교.
표 3: 페럿들에서 엔도신(Endocine)™ 제형화된(formulated) 2009 H1N1 백신들의 효험은 임상적, 바이러스학적 및 육안병리학적 파라미터들에 의하여 입증되었다.
:그룹 1 (대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 불활성화된 전체 바이러스 항원).
임상 점수들. 생존(survival), 4 dpi까지 생존한 동물들의 수; 열(fever) (0C), 최대 온도 증가는 표준편차와 평균으로 보여주었다, 괄호에 열이 관찰된 동물의 수, (*), 그룹 4의 1 마리 동물의 체온은 기록계(recorder)의 기능 불량으로 이용할 수 없었다; 0 및 4 dpi 사이의 % 체중 손실은 표준편차와 평균으로 보여주었다, 괄호 내에 체중 손실이 있는 동물들의 수.
바이러스학. 코 및 인후 표본 샘플들에서 바이러스 쉐딩(shedding), 적정을 위한 곡선 하 영역(AUC)는 1-4 dpi가 발생했다, 괄호 안에 1 또는 그 이상의 바이러스 양성 표본을 보인 동물들의 수; 4 dpi 상 폐 및 비갑개(turbinates)의 바이러스 로드(load)(log10TCID50 /g)는 표준편차 및 평균으로 나타내었고, 또는 그룹 내 모든 동물들의 경우 더 낮은 감지 한계는 바이러스 음성, 괄호 안에 폐 / 비갑개(turbinate) 바이러스를 갖는 동물들의 수.
육안병리학(Gross pathology). 4 dpi 상 부검 동안 외관시험에 의하여 추정된 영향받은 폐 실질(parenchyma)의 %, 괄호 안에 영향받은 폐를 갖는 동물들의 수; 4 dpi 상 폐/신체 중량 비율 (×102) 은 표준편차 및 평균으로 나타내었다.
표 4: 4 dpi 상 조직병리학적 파라미터들을 위한 반정량적 점수 기록.
a: 그룹 1 (대조군, 비강내(i.n.) 식염수), 그룹 2 (피하(s.c.) TIV), 그룹 3 (5 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된 분할(split) 항원), 그룹 4 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된 분할(split) 항원), 그룹 5 (30 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 및 그룹 6 (15 μg HA에서 비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된 불활성화된 전체 바이러스 항원).
조직병리학. 4 dpi 상 조직병리학적 파라미터들을 위한 반정량적 점수기록. 폐포염(alveolitis)/폐포(alveolar) 손상의 정도, 점수: 0, 0%; 1, 25%; 2, 25-50%; 3, > 50 %; 폐포염(alveolitis)의 심각성, 점수: 염증성 세포들 없음 (0); 염증성 세포들 적음 (1); 염증성 세포들 적당한 수임 (2); 많은 염증성 세포들 (3); 폐포(alveolar) 부종(oedema), 폐포(alveolar) 출혈(haemorrhage) 및 타입 Ⅱ 폐포세포(pneumocyte) 과다형성(hyperplasia)이 양성(positive) 활주들(slides)로서 점수화되었다(no=0, yes=1); 모든 조직병리학적 결과들은 표준편차 및 평균으로 나타내어졌다.
발명의 개요
본 발명의 목적은 백신 균주에 대한 기존의 면역력이 없는 대상들에서 계절적 및 전세계적인 유행병 바이러스 균주들 및 다른 전세계적인 유행병 생물들 모두에 대하여 방어 면역을 제공하고 면역 반응을 준비시킬 수 있는 백신들을 제공하는 것이다. 본 발명의 하나의 측면은 계절성 인플루엔자 바이러스 균주들에 대하여 어린이들에게서 효과적인 백신을 포함하는 본 발명의 백신의 소아과적인 용도에 대한 것이다. 본 발명의 더 나아간 측면은 조성물이 전세계적인 유행병 용도에 사용될 때 모든 연령 그룹의 대상들에 대한 것이다.
본 발명의 첫 번째 측면은, 나이브한 대상들에게서 사용하기 위하여 비강 투여된 백신으로서의 이용을 위한, 하기를 포함하는 조성물에 대한 것이다:
i) 하나 또는 그 이상의 살아있지 않은 항원들, 및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질(medium), 및
선택적으로(ptionally) 하나 또는 그 이상의 모노글리세라이드들.
상기 조성물은 모든 적절한 병원체(pathogens)에 대한 백신으로서의 사용을 위하여 만들어질 수 있다. 이런 식으로 상기 조성물은 임의의 적절한 바이러스 균주 또는 박테리아의 백신으로서 만들어질 수 있다. 상기 조성물은 비강내 투여를 위한 인플루엔자 백신으로서 사용을 위하여 만들어질 수 있다. 본 발명은 백신 균주(strain)에 대한 기존의 면역력이 없거나 제한된 대상에서 병원성 감염, 예컨대 인플루엔자에 대한 비강내 면역 조치(immunization)를 위한 백신으로서의 사용을 위하여 개발되었다.
본 발명의 두 번째 측면은 소아과의 면역손상된(immuno-compromised) 대상들에 비강내 투여된 백신으로서 이용을 위한 조성물에 대한 것으로, 상기 조성물은 하기를 포함한다:
하나 또는 그 이상의 살아있지 않은 인플루엔자 바이러스 항원들, 및
하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질, 및
선택적으로 하나 또는 그 이상의 모노글리세라이드들.
본 발명의 세 번째 측면은 나이브한 면역손상된 환자들에서의 사용을 위한 비강내 투여된 백신으로서 사용을 위한, 하기를 포함하는 조성물에 대한 것이다:
i) 하나 또는 그 이상의 살아있지 않은 항원들, 및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질, 및
선택적으로 하나 또는 그 이상이 모노글리세라이드들.
본 발명의 더 나아간 측면은 스트렙토코쿠스 뉴모니애로 된 감염과 관련된 증상의 심각성을 감소시키거나 또는 스트렙토코쿠스 뉴모니애로 된 감염의 예방을 위하여 면역손상된 환자들 및/또는 나이브한 대상들에서의 이용을 위한 비강내 투여된 백신으로서 이용되기 위한 조성물에 대한 것으로, 상기 조성물은 하기를 포함한다:
i) 하나 또는 그 이상의 스트렙토코쿠스(Streptococcus) 뉴모니애(pneumoniae) 항원들, 및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질, 및
선택적으로 하나 또는 그 이상의 모노글리세라이드들.
발명의 상세한 설명
본 발명의 예들을 설명하는데 있어, 명확성을 위하여 특정 전문 용어에 의존할 것이다. 그러나 본 발명은 특정 용어들에 제한되는 것으로 의도되는 것은 아니며, 각각의 특정 용어는 유사한 목적을 달성하기 위하여 유사한 방식으로 작동하는 기술적으로 등가인 모든 것을 포함하는 것으로 이해되어야 한다.
용어 "나이브한(naive) 대상들(subjects)"는 병원체(pathogen)에 면역적으로 나이브한 대상들, 즉 특정 병원체에 노출되거나 백신접종되지 않아, 그러므로 그 병원체에 기존에 면역력이 없는 대상들을 의미한다.
용어 "인플루엔자 나이브한 대상들"은 특정 인플루엔자 바이러스에 면역적으로 나이브한 대상들, 즉, 특정 인플루엔자에 노출되거나 백신접종되지 않아, 그러므로 그 인플루엔자 균주에 기존에 면역력이 없는 대상들을 의미한다. 인플루엔자에 대하여, 그것은 계절성 인플루엔자에 대하여 백신접종될 때 유아들 및 어린이들을 의미하며, 페리판데믹(peri-pandemic) 및 전세계적 유행(pandemic) 기간에는, 유아들, 어린이들, 성인들 및 노인들을 포함하는 모든 인구들을 의미한다.
용어 "소아과적(pediatric) 대상들"은 21세 미만(under)의 어린이들을 가리키며, 하기 소집단들을 포함하는데, 출생일로부터 1달 연령(age)까지의 신생 인구, 1 달부터 2 살까지의 유아들, 2 살부터 12살까지의 어린이 및 12살부터 21살까지의 청소년이다.
용어 "페리판데믹(peri-pandemic) 기간"은 전세계적 유행(pandemic) 주위의 시간 기간을 가리킨다. 특정 전세계적 유행(pandemics)은 WHO에 의하여 공식적으로 확인된 시간 기간들(time period)로, 상기 용어는 전세계적 유행병의 공식적인 인식 전 즉시의 기간 및, 백신접종이 권장되는, 바로 그 다음의 전세계적 유행을 가리킨다.
용어 "살아있지 않은(non-live) 항원들"은 바이러스들, 예컨대 전체(whole) 불활성화된 바이러스들, "분할(split)" 항원들, 소단위체(subunit) 항원들, 재조합 항원들 또는 펩타이드들 또는 박테리아 떠는 기생충들(parasites)을 포함하는 불활성화된, 살아있지 않은 병원체들로부터 유래한 항원들을 가리킨다.
용어 "이뮤노즈(Immunose)™ FLU"는 살아있지 않은 인플루엔자 항원 및 엔도신(Endocine)™을 포함하는 조성물을 가리킨다.
용어 "엔도신(Endocine)™"은 등몰(equimolar) 량의 글리세롤(glycerol) 모노올리에이트(monooleate) 및 올레산(oleic acid)을 포함하는 아쥬반트(adjuvant)를 가리킨다.
본 발명의 조성물 내 하나 또는 그 이상의 살아있지 않은 인플루엔자 바이러스 항원들은 하나 또는 그 이상의 인플루엔자 균주(strain), A, B 및/또는 C 균주로부터 될 수 있다. 세계적 유행병인 인플루엔자 균주들에 대한 방어 면역력(immunity)을 제공하고 면역 반응을 준비시킬 수 있는 백신 조성물은 보통 하나의 인플루엔자 A 균주(strain) (1가(monovalent))로부터의 항원만을 포함하는 반면, 계절성 인플루엔자 균주들에 대한 방어 면역력을 제공하고 면역 반응을 준비시킬 수 있는 백신 조성물은 보통 셋 또는 그 이상의 다른 균주들(3가(trivalent) 또는 4가(quadrivalent))로부터의 항원들을 포함한다. 가장 흔하게 2개의 다른 인플루엔자 A 균주들(strains) 및 하나 또는 그 이상의 인플루엔자 B 균주들.
본 발명은 페리-판데믹(peri-pandemic) 또는 전세계적 유행병 기간 동안 사람들 및 (8세보다 어린) 어린이들과 같은, 인플루엔자 바이러스 균주들에 나이브한 대상들에 대하여 놀랍게도 매우 효과적인 것으로 밝혀진 백신 조성물에 대한 것이다. 어린이들은 계절병으로 도는 인플루엔자 균주들에 자주 나이브하며, 반면 모든 사람들은 전세계적 유행병 기간 동안 나이브한 것으로 생각된다.
본 발명은 나아가 유행병(epidemic) 또는 전세계적 유행병(pandemic) 기간 동안 또는 그 전에 본 발명의 조성물을 포함하는 백신 조성물을 비강 내 투여하는 것을 포함하는 면역 조치(immunization)하는 방법 뿐 아니라, 본 발명의 조성물을 포함하는 백신 조성물을 비강내 투여하는 것을 포함하는 소아과적(paediatric) 환자(subjection)의 면역 조치하는 방법, 및 더 나아가 본 발명의 조성물을 포함하는 백신 조성물을 비강내 투여하는 것을 포함하는 나이브한 대상들의 면역 조치하는 방법에 대한 것이다.
본 발명은 유아들, 어린이들 및 청소년 인구들에 대한 것인데, 이는 이들 인구들이 나이브할 때, 보통의 백신 전략들에 관한 한 덜 반응적(responsive)이기 때문이다. 유아들 및 어린이들의 면역 시스템은 완전히 발달하지 않았으며, 그러므로 그들은 종래 비경구적(parenteral) 백신 전략들(strategies)에 덜 효과적인 면역 반응이 만들어진다(mount). 그러나 본 발명은 유아들 및 어린이들에게 특별한 기회를 제공하는데, 이는 상기도(upper respiratory tract)에서 특별한 림프양(lymphoid) 조직(tissue)이 출생시 존재하고 어린 시절에 일찍 잘 발달하기 때문이다. 아데노이드(adenoid) (또는 비인두(nasopharyngeal) 편도선(tonsil))으로 알려진 인두의(pharyngeal) 림프양(lymphoid) 조직은 어린이들의 인두(pharynx)에 위치하며, 비인두 편도선(아데노이드(들)), 한 쌍의(the pair of) 구개(palatine) 편도들(tonsils), 한 쌍의 이관(tubal) 편도(tonsils) 및 설(lingual) 편도들(tonsils)을 포함하는 발다이어 고리(Waldeyer's ring)의 부분이다. 아데노이드는 면역 시스템을 크게 하는데 적극적이며(active), 청소년기 동안 사라지기 시작한다. 비강(Nasal) 백신 전달은 그러므로 유아들 및 어린이들에게 특히 유리할 수 있다. 소아과적 소집단들은 미국 식품의약국에 의하여 정의된 대로 또는 유럽 의약청에 의하여 정의된 대로 또는 이 둘의 조합에 의하여 정의된 대로 정의될 수 있다.
한 예에서 조성물은 소아과적 사용을 위하여 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다. 한 예에서, 조성물은 신생아(28일까지의 연령의 (정상적으로 태어난 아이 및 조산으로 태어난 아이))에 있어, 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다. 한 예에서, 조성물은 (1 개월 내지 23 개월의 연령의) 유아들에 있어, 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다. 한 예에서, 조성물은 (2 살 내지 11 살의 연령의) 어린이들에 있어, 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다. 한 예에서, 조성물은 (12 살 내지 18 살의 연령의) 청소년에 있어, 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다.
예컨대 인플루엔자에 대한 기존의 면역력이 없거나 제한된 작은 어린이들 및 예컨대 인플루엔자 질병에 대한 방어 면역력(immunity)을 유도하는 일반적인 나이브한 환자들에게 적합한 안전한 백신에 대한 수요가 있다.
살아있는 약독화된(attenuated) 바이러스 백신들은 안전성 우려와 관련된다. 플루미스트(Flumist)®는, 그것들의 안전성 이슈들 때문에, 2 살 미만(under)의 작은 어린이들에게의 사용에 대하여 승인되지 않았다. 역설적으로, 이들은 인플루엔자에 특히 취약한 가장 자주 나이브한 대상들이며, 인플루엔자의 높은 위험 집단에 속한다. 플루미스트(Flumist)®는 더 나이 많은 어린이들에 대하여는 승인되었으나, 이것은 살아있는(live) 약독화된 바이러스 백신이다.
아쥬반트된(adjuvanted) 살아있지 않은 인플루엔자 백신들의 비강내 투여가 매운 높은 면역 반응들 및 뒤이어 백신 항원에 대한 기존의 면역력이 없는 페럿들(ferrets)에게서 인플루엔자 질병에 대한 완전한 보호를 유도한 것이 놀랍게도 발견되었다. 전체(whole) 및 분할(split)의 살아있지 않은 항원 백신들 모두는, 주사된 상업적으로 이용가능한 인플루엔자 백신인 플루아릭스(Fluarix)®보다 우수한 결과들을 주었다.
본 발명의 조성물은 살아있는 약독화된 바이러스이 아니라, 살아있지 않은 인플루엔자 바이러스 항원들을 이용한다. 게다가, 그것은 비강내로 투여될 수 있다. 비강내 투여는 특히 유아들 및 어린이들의 소아과적 투여에 적합한데, 이는 아데노이드로 알려진 인두(pharyngeal) 림프성(lymphoid) 조직의 존재 때문이다. 본 발명의 조성물의 비강내 투여는 자가 투여에 의하여 페리-판데믹 및 세계적 유행병 기간들 동안 전 인구들에게와 같이, 특정화된 훈련 없이 투여 및 일반적인 사용을 허용한다. 살아있지 않은 인플루엔자 바이러스 항원들의 이용은 살아있는 약독화된 바이러스 백신들과 관련된 안전성 우려 없이 작은 어린이들에게서 그것의 이용을 허용한다. 본 발명자들은 비강내 투여될 수 있는 나이브한 대상들에게서 효과적인 백신을 개발하였고, 이로써 상기 언급한 이점들을 갖고, 환자들의 종류들(classes) 및 취약한 인구들의 중요한 수요를 충족시킨다.
첫 번째 측면에서, 본 발명은 나이브한 대상들에의 사용을 위한 비강내 투여되는 백신으로서의 사용을 위한 조성물에 대한 것으로, 상기 조성물은 하기를 포함한다:
i) 하나 또는 그 이상의 살아있지 않은 항원들, 및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질(medium), 및
선택적으로 하나 또는 그 이상의 모노글리세라이드들.
또다른 측면에서 본 발명은 나이브한 대상들에의 사용을 위한 비강내 투여되는 백신으로서의 사용을 위한 조성물에 대한 것으로, 상기 조성물은 하기를 포함한다:
i) 하나 또는 그 이상의 살아있지 않은 바이러스 항원들, 및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질, 및
선택적으로 하나 또는 그 이상의 모노글리세라이드들(mono-glycerides).
본 발명의 조성물은 전염성 병원체(pathogens)들, 예컨대 바이러스 및 박테리아에 대한 백신으로서의 용도에 적합하다. 본 발명의 조성물은 비강내 투여를 위한 인플루엔자 백신에 적합하다. 본 발명의 조성물은 나이브한 대상들에서 인플루엔자에 대한 비강내 면역 조치(immunization)를 위한 백신으로서의 용도에 대한 것이다.
인플루엔자 바이러스들 3개 타입들 A, B, 및 C로 구성된다. 인플루엔자 A 바이러스들은 인간들, 말들, 돼지들, 페럿들 및 닭들을 포함하는 매우 다양한 포유동물들 및 조류들을 감염시킨다. 인플루엔자 B는 인간들, 페럿들 및 바다표범들(seal)에 존재하며, 인플루엔자 C는 인간들 개들 및 돼지들에 존재한다. 인플루엔자 A에 감염된 동물들은, 인간 인구들에게 전염되는 유전적으로 그리고 항원과 관련하여 다양한 바이러스들의 풀(pools)을 형성함으로써, 자주 인플루엔자 바이러스에 대한 병원소(reservoir)로서 작용한다. 전염은 예컨대 가축을 다루는 것에 의하여 감염된 동물들 및 인간들 사이의 밀접한 접촉을 통하여 발생할 수 있다. 인간으로부터 인간으로의 전염은 밀접한 접촉을 통하여, 또는 기침 또는 재채기에 의하여 생기는 비말(droplet)의 흡입을 통하여, 발생할 수 있다.
인플루엔자 A 바이러스 입자의 외부 표면은 당단백질(glycoproteins)들 헤마글루티닌(hemagglutinn)(HA) 및 뉴라미니다제(neuraminidase)(NA)를 포함하는 지질 외피(envelope)로 이루어진다. HA 당단백질은 HA1 및 HA2로 불리는 2 개의 소단위체들을 포함한다. HA는 시알산(sialic acid) 결합 부위(site)를 포함하는데, 이는 상기도 및 하기도의 상피 세포들의 외막(outer membrane) 상에서 발견되는 시알산에 결합하고, 수용체 매개 세포내섭취(endocytosis)를 통하여 세포 내로 흡수된다. 세포 내로 들어가면, 인플루엔자 바이러스 입자는 그것의 게놈을 방출하는데, 이는 핵으로 들어가, 새로운 인플루엔자 바이러스 입자들의 생산을 시작한다. NA 또한 생산되는데, 이는 방출된 인플루엔자 바이러스 입자들을 다시 붙잡는 것을 방지하기 위하여 세포 표면으로부터 시알산을 자른다. 잠복기 기간이 상당히 다를 수 있긴 하지만, 바이러스는 짧은 기간, 보통의 경우 대략 5일, 동안 잠복기가 된다. 바이러스들은 질환의 시작 거의 하루 전 분비되고, 보통 3일 내지 5일까지 지속된다. 보통 증상들은 열, 피로, 불안, 두통, 아픔 및 고통, 기침 및 인후염을 포함한다. 일부 증상들은 감염 후 몇 주 동안 지속될 수 있다.
인플루엔자 바이러스의 다른 균주들은 HA 및 NA 당단백질들의 돌연변이에 의하여 주로 특징되고, 그러므로 HA 및 NA는 바이러스 서브타입(subtype)들을 확인하는데 이용된다(즉, H5N1는 HA 서브타입 5 및 NA 서브타입 1을 가리킨다). 보통 말하는, 인플루엔자 백신들은 자주 HA 및 NA 분자들을 타겟으로 한다. 종래 인플루엔자 바이러스 백신들은 적절한 HA 및/또는 NA 분자들을 보유한, 전체 불활성화된 바이러스들을 이용한다. 대체하여, HA 및 NA 단백질들 또는 그것들의 소단위체들(subunits)의 재조합 형태들은 백신들로서 이용될 수 있다. 백신 조성물 내 항원은 예컨대 전체 불활성화된 바이러스들, 분할 항원들, 소단위체 항원들, 재조합 항원들 또는 펩타이드들과 같은 불활성화된 항원들일 수 있다. 용어 "항원" 또는 "면역원(immunogen)"은 면역 반응을 위한 타겟으로 작용할 수 있는 임의의 것으로 정의된다. 상기 용어는 또한 단백질 항원들, 재조합 단백질 성분들(components), 바이러스 같은 입자들(virus like particles)(VLPs)과 더불어 유전적으로 조작된 RNA 또는 DNA를 포함하는데, 이것은-체내 세포 내로 주입될 때- 숙주 세포의 "내부(inner) 기구들(machinery)"이 DNA를 "읽고(read)" 그리고 그것을 이용하여 병원체의 단백질들을 합성한다. 이들 단백질들이 이물질(foreign)로서 인식되기 때문에, 그것들이 숙주 세포들에 의하여 공정이 이루어지고, 그것들의 표면에 개시(display)될 때, 면역 시스템이 위험을 알리고, 그 다음 다양한 면역 반응들을 촉발시킨다. 이 용어는 또한, 불활성화된 박테리아 또는 바이러스들 또는 그것들의 부분들을 모방하는(mimic) 물질들을 포함한다. 면역 반응은 세포 및/또는 체액의 것일 수 있으며, 전신성(systemic) 및/또는 점막의(mucosal) 격실들(compartment)에서 감지될 수 있다.
그러나, 인플루엔자는 RNA 바이러스이고, 그러므로 빈번한 돌연변이를 겪게 될 수 있어, 바이러스의 항원성(antigenic) 조성물에 변함없고 영구적인 변화들을 야기할 수 있다. 상기 항원성(antigenic) 조성물은 항체 결합 에피토프들(epitopes)과 같이, 면역 시스템에 의하여 인식되는 폴리펩타이드의 부분들을 가리킨다. 상기 항원성 조성물에 대한 작고 가벼운(minor) 변화들은 자주 항원소변이(antigenic drift)로 지시된다. 인플루엔자 A 바이러스들 또한 재배열(reassortment)이라고 불리는 과정에서 다른 서브타입들로부터 유전적 물질들을 "교체(swapping)"할 수 있는데, 이는 항원 변이(antigenic shift)로 불리는 항원성 조성물에 큰(major) 변화를 야기한다. 바이러스 입자들에 대한 면역 반응이 HA 및 NA 당단백질들에 대한 항체들의 결합에 의존하기 때문에, 당단백질들의 빈번한 변화들은 시간이 흐르면서 인플루엔자 바이러스들에 대항하여 요구되는 면역 반응의 유효성을 감소시키고, 결국 면역력의 부족에 이르게 된다. 빠른 항원 소변이(antigenic drift) 및 변이(shift)를 겪는 인플루엔자 A의 능력은 새로운 균주에 대한 기존의 면역력의 결핍 때문에 인플루엔자 전염병(epidemics)을 촉발시킬 수 있다.
미국 예방접종 자문 위원회(American Advisory Committee on Immunization Practices)(ACIP)는 6 - 59 개월들의 모든 어린이들에 대하여 매년 인플루엔자 백신접종을 권고해 왔는데, 6 - 23 개월들의 어린이들이 인플루엔자 관련 입원들에 상당히 증가된 위험이 있고, 24 - 59 개월들의 어린이들이 인플루엔자 관련 병원 및 응급실 방문들에 증가된 위험이 있기 때문이다. 상기 권고는 ≥ 6 개월들인 모든 사람들에게 계절성 인플루엔자 백신접종으로 확대되어 왔다. 따라서, 본 발명의 조성물은 18 살 및 그 미만(under), 특히 12 살 및 그 미만(under)의 어린이들에게 비강내 투여를 위한 백신으로서의 용도를 위한 것이다. 보통 그 어린이들은, 6살 또는 그 미만(less)인 것과 같은, 8살 미만(less)이다. 본 발명의 백신의 환자들의 중요한 의도된 종류는 어린이들, 특히 2 개월 내지 9 살 미만(less)의 어린이들, 6 개월 내지 8 살 미만(less)과 같은 보통 3 개월 내지 9 살 미만(less)의 어린이들, 6 개월 내지 72 개월 미만(less)과 같은 가장 보통으로는 6 개월 내지 7살 미만(less), 또는 6 개월 내지 60 개월의, 또는 6 개월 내지 24 개월의 어린이들이다. 본 발명의 조성물은 적어도 부분적으로는 소아과적 용도를 위한 백신으로서 의도된다.
전세계적 유행병 발생을 야기할 잠재성을 주는 인플루엔자 바이러스 균주의 특징들은 하기이다:그것은 최근에 돌아다닌 균주들의 해마글루티닌에 비하여 새로운 해마글루티닌을 포함하는데, 이는 뉴라미니다제 서브타입의 변화를 수반하거나 수반하지 않을 수 있다; 그것은 인간 인구들에게서 수평으로 전염될 수 있다; 그리고 그것은 인간들에게 병원성일 수 있다. 새로운 해마글루티닌은 H2와 같이, 아마 수 십년인, 확장된 시간 기간 동안 인간 인구들에서 눈에 띄지 않아온 것일 수 있다. 또는 그것은 예컨대 조류에서는 발견되지 않은 H5, H9, H7 또는 H6인, 전에인간 인구들에서는 돌아다니지 않아왔던 해마글루티닌일 수 있다. 어떠한 경우든, 대다수 또는 적어도 큰 비율이, 또는 심지어 전체 인구가 이전에 그 항원을 접해보지 않았고, 그것에 대하여 면역적으로 나이브하다.
본 발명은 유아들, 어린이들 및 청소년 인구들에 대한 것인데, 이는 이들 인구들이 나이브할 때, 보통의 백신 전략들에 관한 한 덜 반응적(responsive)이기 때문이다. 유아들 및 어린이들의 면역 시스템은 완전히 발달하지 않았으며, 그러므로 그들은 종래 비경구적(parenteral) 백신 전략들(strategies)에 덜 효과적인 면역 반응이 만들어진다(mount). 그러나 본 발명은 유아들 및 어린이들에게 특별한 기회를 제공하는데, 이는 상기도(upper respiratory tract)에서 특별한 림프양(lymphoid) 조직(tissue)이 출생시 존재하고 어린 시절에 일찍 잘 발달하기 때문이다. 아데노이드(adenoid) (또는 비인두(nasopharyngeal) 편도선(tonsil))으로 알려진 인두의(pharyngeal) 림프양(lymphoid) 조직은 어린이들의 인두(pharynx)에 위치하며, 비인두 편도선(아데노이드(들)), 한 쌍의(the pair of) 구개(palatine) 편도들(tonsils), 한 쌍의 이관(tubal) 편도(tonsils) 및 설(lingual) 편도들(tonsils)을 포함하는 발다이어 고리(Waldeyer's ring)의 부분이다. 아데노이드는 면역 시스템을 크게 하는데 적극적이며(active), 청소년기 동안 사라지기 시작한다. 비강(Nasal) 백신 전달은 그러므로 유아들 및 어린이들에게 특히 유리할 수 있다. 소아과적 소집단들은 미국 식품의약국에 의하여 정의된 대로 또는 유럽 의약청에 의하여 정의된 대로 또는 이 둘의 조합에 의하여 정의된 대로 정의될 수 있다.
미국 식품의약국은 하기 연령 범위들에 따라 소아과적 소집단(subpopulation)을 분류한다. 출생부터 1 개월의 연령까지의 신생(newborn) 인구 범위. 1 개월부터 2 살(years)의 연령까지의 유아 인구 범위. 2 살부터 12살까지의 연령까지의 어린이 인구 범위. 12 살부터 21 살의 연령까지의 청소년 인구 범위. 유럽 의약청(European Medicines Agency)은 하기 인구들에 따라 소아과 의약들을 분류한다. 신생 인구는 조산(pre-term) 내지 정상적으로 달이 차서 태어난 아기(term)를 포함하며, 28일까지를 포함한다. 유아 인구는 1 개월부터 23 개월까지이다. 어린이 인구는 2살부터 11살까지이다. 청소년들은 12 살부터 18 살까지이다.
한 예에서, 조성물은 소아과적 이용을 위한 비강내 투여되는 백신으로서의 용도를 위한 것이다. 한 예에서, 조성물은 신생아(28일까지의 연령의 (정상적으로 태어난 아이 및 조산으로 태어난 아이) 또는 출생일부터 1 달의 나이까지 신생아에서 사용하기 위한, 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다. 한 예에서, 조성물은 1 개월 내지 23 개월의 연령의 또는 대체하여 1 개월 내지 2 살의 연령의 유아들에 있어, 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다. 한 예에서, 조성물은 2 살 내지 11 살의 연령의 또는 대체하여 2살 내지 12살의 연령의 어린이들에 있어, 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다. 한 예에서, 조성물은 12 살 내지 18 살의 연령의 대체하여 12살 내지 21살의 연령의 청소년에 있어, 비강내(intranasal) 투여되는 백신으로서의 용도를 위한 것이다.
본 발명의 백신은 나이브한 대상들, 예컨대 계절성 인플루엔자 유행병(epidemics) 동안 8살 미만(below)의 어린이들에 대한 것이다. 본 발명의 조성물은 또한 전세계적인 유행병 또는 페리판데믹(peri-pandemic) 기간 동안 모든 연령 군들에서의 이용을 위한 백신으로서 의도된다.
본 조성물은 그러므로 특히 나이브한 대상들에 대한 것이다. 상기 나이브한 대상들은 0 내지 18 살들의 어린이들과 같은, 특히 12 살 및 그 미만(under)의 어린이들인, 18살 미만(under)의 어린이들일 수 있다. 보통, 상기 어린이들은 6 살 또는 그 미만(less)과 같은 8살 미만(less)이다. 본 발명의 백신에 대한 환자들의 중요한 의도된 종류는 특히 2 개월 내지 9 살 미만(less)의 어린이들, 보통 6 개월 내지 8 살 미만(less)과 같은 3 개월 내지 9 살 미만(less)의 어린이들, 가장 일반적으로는 6 개월 내지 72 개월 미만(less)의 연령과 같은 6 개월 내지 7 살 미만(less)의 연령의, 또는 6 개월 내지 60 개월의 연령의 또는 6 개월 내지 24 개월의 연령의 어린이들이다. 본 발명의 조성물은 소아과적 사용을 위한 백신으로서, 적어도 어느 정도 의도된다.
나이브한 대상들은, 조성물이 특히 전세계적 전염병 또는 페리판데믹(peri-pandemic) 기간들 동안의 사용을 위한 백신에 대한 것일 때, 모든 연령 군들일 수 있다.
비강내 투여는 백신을 비강 내로 분무하거나 또는 백신을 피펫 또는 유사항 장치를 통하여 비강 내로 또는 코의 점막(mucosal) 벽(wall) 상으로 백신을 흘려넣음으로써 투여하는 것과 같이 임의의 투여 방식(mode)에 의하여 코에 투여되는 것을 의미하는 것으로 의도된다.
조성물은 유리하게는 살아있는 약독화된 바이러스보다는 하나 또는 그 이상의 살아있지 않은 인플루엔자 바이러스 항원들을 포함한다. 기재한 바와 같이, 이것은 환자 종류의 선택 뿐 아니라 생산, 분포( distribution), 코의 투여, 다루기 및 처분(disposal)의 면 보두에서 안전성 우려를 피한다. 살아있지 않은 인플루엔자 바이러스 항원은 전체 불활성화된 바이러스, 분할(split) 바이러스, 소단위체 인플루엔자 항원 및 재조합 항원들로 구성된 군으로부터 선택될 수 있다. 재조합 단백질들의 이용은 바이러스로 하는 도전에 대하여 생산되는 항체들 상쇄시키는 역가(titer)를 증가시키는데 이용된다. HA의 글리코실화(glycosylation)는 면역 시스템을 피하는(evade) 바이러스 능력 및 항체 반응을 끌어내는(elict) 면역 반응의 능력에서 중요한 역할을 한다. 이런 이유로 재조합 HA 단백질들은 여러 다른 종류로 이루어진(heterogeneous) 복합체-타입 글리칸드(glycans)과 더불어 증가된 면역원성으로 비-글리코실화되거나(non-glycosylated) 또는 모노글리코실화된(monoglycosylated) 재조합 단백질들을 포함하는 것으로 만들어질 수 있다.
바람직하게는, 살아있지 않은 인플루엔자 바이러스 항원은 분할(split) 항원 또는 소단위체 인플루엔자 항원, 더욱 바람직하게는 분할(split) 항원이다.
인플루엔자 A 게놈(genome)은 11 개 단백질들을 코드하는 RNA의 8개 조각들 상에 11 개 유전자들을 포함한다: 혈구응집소(hemagglutinin) (HA), 뉴라미니다제 (NA), 핵단백질(nucleoprotein) (NP), M1, M2, NS1, NS2(NEP: 핵(nuclear) 수출(export) 단백질(protein), PA, PB1 (폴리머라제(polymerase) 베이직(basic) 1), PB1-F2 및 PB. 살아있지 않은 인플루엔자 바이러스 항원들은 바이러스로부터의 단백질들의 조합 또는 임의의 하나의 단백질로부터 선택될 수 있다.
본 발명의 조성물은 임의의 불활성화된 인플루엔자 바이러스를 포함할 수 있다. 당업자에 의하여 이해된 바와 같이, 인플루엔자 바이러스는 계절별로 또한 지리적 지역에 따라서 그리고 그것들이 감염되는 인구들에 따라서 다양하다. 본 발명은 본 발명의 아쥬반트 및 하나 또는 그 이상의 인플루엔자 바이러스로부터의 살아있지 않은 인플루엔자 바이러스 항원들을 포함하는 백신들에 대한 것이다. 본 발명의 백신 조성물에서 사용되는 살아있지 않은 인플루엔자 항원은 불활성화된 인플루엔자 바이러스로부터 유래되는 임의의 항원성 물질일 것이다. 예를 들어, 불활성화된 전체(whole) 바이러스 입자들을 포함할 수 있다. 대체하여, 그것은 방해된(disrupted) 바이러스 (분할 바이러스)를 포함할 수 있는데, 이때 예를 들어 면역성(immunogenic) 단백질, 예를 들어 M2 이온 채널 단백질, 또는 당단백질들이 계속 함유된다. 인플루엔자 막 당단백질들, 해마글루티닌 (HA) 및/또는 뉴라미니다제 (NA)의 정제된 조제용 물질(preparations)들은 백신 조성물에서 항원성(antigenic) 물질로서 사용될 수 있다. 본 발명에 따른 백신 조성물은 하나 또는 그 이상의 타입들의 항원성(antigenic) 물질들을 포함할 수 있다. 백신 조성물을 제조하는데 사용되는 인플루엔자 타입 바이러스는 물론, 백신의 맞는 사람(recipient)이 보호되려는 인플루엔자에 의존한다.
예를 들어, 살아있지 않은 인플루엔자 바이러스 항원은 예를 들어, 하나 또는 그 이상의 하기 인플루엔자 바이러스들의 유전적 백본(backbone)의 하나 또는 그 이상의 항원들을 포함한다:A/Ann Arbor/6/60 (A/AA/6/60), B/Ann Arbor/1/66 바이러스, FluMist MDV-A (ca A/Ann Arbor/6/60), FluMist MDV-B (ca B/Ann Arbor/1/66), A/Leningrad/17 도너(donor) 균주 백본(backbone), 및 PR8.
또다른 특정 예에서, 본 발명의 백신 조성물들은 예를 들어 하기의 하나 또는 그 이상으로부터의 HA 또는 an NA 폴리펩타이드 서열 (또는 상기 서열들의 적어도 90% 동일한(identical) 또는 적어도 95% 동일한 것)의 살아있지 않은 인플루엔자 바이러스 항원을 포함한다: B/Yamanashi; A/New Caledonia; A/Sydney; A/Panama; B/Johannesburg; B/Victoria; B/Hong Kong; A/Shandong/9/93; A/Johannesburg/33/94; A/Wuhan/395/95; A/Sydney/05/97; A/Panama/2007/99; A/Wyoming/03/2003; A/Texas/36/91; A/Shenzhen/227/95; A/Beijing/262/95; A/New Caledonia/20/99; B/Ann Arbor/1/94; B/Yamanashi/166/98; B_Johannesburg.sub.--5.sub.--99; BVictoria/504/2000; B/Hong Kong/330/01; B_Brisbane.sub.--32.sub.--2002; B/Jilin/20/03; H1N1 인플루엔자 A 바이러스, H3N2 인플루엔자 A 바이러스, H9N2 인플루엔자 A 바이러스, H5N1 인플루엔자 A 바이러스, H7N9 인플루엔자 A 바이러스 ; 인플루엔자 B 바이러스; 및 세계적 유행병인 인플루엔자 균주 (WHO에 의하여 지정되거나 도는 인간 인구에서 돌지 않은 것).
또다른 예에서, 인플루엔자 바이러스 균주는 2013/2014 백신에 포함된 하나 또는 그 이상의 균주들일 수 있다: A/California/7/2009 (H1N1)-유사 바이러스, 세포-증식된 프로토타입(prototype) 바이러스 A/Victoria/361/2011 또는 A/Texas/50/2012와 항원과 관련하여 유사한 (H3N2) 바이러스 및B/Massachusetts/2/2012-유사 (Yamagata lineage) 바이러스.
한 예에서, 인플루엔자 바이러스 균주는 인플루엔자 백신에 사용되기 위하여 WHO에 의하여 이전에 권고되었던 하나 또는 그 이상의 균주들일 수 있다.
한 예에서, 인플루엔자 바이러스 균주 또는 균주들은 4가의(Quadrivalent) 인플루엔자 백신으로부터의 균주일 수 있고, 하기 5개 인플루엔자 바이러스 균주들 중 임의의 4 개로부터의 항원들을 포함할 수 있다; A/California/7/2009 (H1N1)-유사 바이러스, 세포-증식 프로토타입 바이러스 A/Victoria/361/2011 또는 A/Texas/50/2012와 항원과 관련하여 유사한 (H3N2) 바이러스 및 B/Massachusetts/2/2012-유사 (Yamagata 계통) 바이러스, B/Brisbane/60/2008-유사 (Victoria 계통) 바이러스.
본 발명의 조성물의 아쥬반트(adjuvant)는 비강내 투여 및 그것의 약효를 위한 그것의 적합함에 매우 중요하다. 비강내 투여에 적합한 아쥬반트는 지방산과 조합하여(combination) 글리세롤의 모노에스테르(monoester)를 선택적으로 포함하는 아쥬반트일 수 있고, 지방산들의 조합일 수 있다. 이러한 아쥬반트들에 사용되는 카르복실산들은 긴 사슬(C4-C30) 알킬, 알케닐(alkenyl) 또는 알키닐(alkynyl) 카르복실산들을 포함하는데, 이는 선택적으로 다른 종류일 수 있는 단일, 이중 또는 다중 불포화(이중 또는 삼중 결합)을 갖는, 선택적으로 가지달리거나 또는 가지없거나, 고리형(cyclic) 또는 비고리형(acyclic)일 수 있다.
이러한 아쥬반트들에 이용되는 모노글리세라이드들(monoglycerides)은 글리세린의 카르복실산 에스테르(ester)들일 수 있고, 이때 상기 카르복실산들은 긴 사슬 (C4-C30) 알킬, 알케닐(alkenyl) 또는 알키닐(alkynyl) 카르복실산들일 수 있는데, 이는 나아가 선택적으로 다른 종류일 수 있는, 단일, 이중 또는 다중 불포화(이중 또는 삼중 결합)을 선택적으로 갖는, 가지달린 또는 가지달리지 않은 것일 수 있다.
백신 조성물의 모노글리세라이드의 농도는 예컨대 약 1 내지 약 50 mg/ml, 예컨대 약 1 부터 약 25 mg/ml 까지와 같은, 약 5 부터 약 15 mg/ml 까지 또는 약 10 mg/ml의 범위에 있을 수 있다.
백신 조성물의 지방산의 농도는 예컨대 약 0.5 내지 약 50 mg/ml, 예컨대 약 1 부터 약 25 mg/ml 까지와 같은, 약 1 부터 약 15 mg/ml까지, 약 1 부터 약 10 mg/ml 까지, 약 2 부터 약 8 mg/ml 까지 또는 약 6-7 mg/ml의 범위 내에 있을 수 있다. 한 예에서, 백신 조성물 내 지방산의 농도의 몰(molar) 단위(basis)는 모노글리세라이드의 (몰 단위 상) 농도에 일치한다(correspond).
모노글리세라이드 및 지방산에 대한 상기 언급한 농도 범위들의 임의의 조합은 본 출원의 맥락 내에 있다. 게다가, 언급한 가장 넓은 범위는 바람직한 범위를 주며, 그러고는 그 범위는 가장 바람직한 범위로 좁혀진다.
본 발명의 발명자들은 전술한 바와 같이 그리고 (참조로서 그 전체가 여기에 포함되는) WO 2012/042003에 공개된 바와 같이 아쥬반트들이 백신접종이, 예컨대 비강의 점막에의 투여인, 코를 통한 루트를 거쳐 수행될 때 특히 유용하다는 것을 발견하였다. 본 발명자들은 코를 통한 루트를 거친 백신접종에서 이러한 아쥬반트들의 사용이 백신접종에 대한 면역 반응을 개선시킨다는 것을 발견했다. 본 발명자들은 인간들을 포함하는 몇몇 종들에서, 이러한 아쥬반트들의 사용이 안전하며 웬만큼 괜찮다는 것을 발견했다.
그래서, 조성물은 라우르산(lauric acid) (C12), 미리스트산(myristic acid) (C14), 팔미트산(palmitic acid) (C16), 팔미톨레산(palmitoleic acid) (C16:1), 올레산(oleic acid) (C18:1), 리놀레산(linoleic acid) (C18:2), 스테아르산(stearic acid), 헥사노익산(hexanoic acid), 카프릴산(caprylic acid), 데칸산(decanoic acid) (카프르산(capric acid)), 아라키드산(arachidic acid), 베헨산(behenic acid), 리그노세르산(lignoceric acid), 알파-리놀렌산(linolenic acid), 스테아리돈산(stearidonic acid), 에이코사펜타에노익산(eicosapentaenoic acid), 도코사헥사에노익산(docosahexaenoic acid), 감마-리놀렌산(linolenic acid), 다이호모(dihomo)- 감마-리놀렌산(linolenic acid), 아라키돈산(arachidonic acid), 에루크산(erucic acid), 네르본산(nervonic acid)로 구성되는 군으로부터 선택되는 카르복실산들로 모노-에스테르화된 글리세라이드들인 모노-글리세라이드들을 포함할 수 있다.
더 나아간 예에서, 모노-글리세라이드들은 팔미톨레산(palmitoleic acid) (C16:1), 올레산(oleic acid) (C18:1) 및 리놀레산(linoleic acid) (C18:2)로 구성되는 군으로부터 선택되는 카르복실산들로 모노-에스테르화된 글리세라이드들이다.
바람직하게는, 모노-글리세라이드는 올레산(oleic acid) (glyceryl oleate)으로 모노-에스테르화된 글리세라이드이다.
아쥬반트는 바람직하게는 라우르산(lauric acid), 미리스트산(myristic acid), 팔미트산(palmitic acid), 팔미톨레산(palmitoleic acid), 올레산, 리놀레산(linoleic acid) 스테아르산(stearic acid), 헥사노익산(hexanoic acid), 카프릴산(caprylic acid), 데칸산(decanoic acid) (카프르산(capric acid)), 아라키드산(arachidic acid), 베헨산(behenic acid), 리그노세르산(lignoceric acid), 알파-리놀렌산(linolenic acid), 스테아리돈산(stearidonic acid), 에이코사펜타에노익산(eicosapentaenoic acid), 도코사헥사에노익산(docosahexaenoic acid), 감마-리놀렌산(linolenic acid), 다이호모(dihomo)-감마- linolenic acid, 아라키돈산(arachidonic acid), 에루크산(erucic acid) 및 네르본산(nervonic acid)으로 구성되는 군으로부터 선택된 하나 또는 그 이상의 카르복실산들을 포함한다. 바람직하게는, 하나 또는 그 이상의 카르복실산들은 올레산(oleic acid) 및 라우르산(lauric acid)으로 구성되는 군으로부터 선택된다.
적절한 예들의 조합에서, 아쥬반트는 글리세릴(glyceryl) 올레이트(oleate), 올레산(oleic acid) 및 수성 매질을 포함한다. 본 발명의 백신 조성물은 또한 추가적인 약학적 첨가제들을 포함할 수 있다.이러한 약학적 첨가제들은 하기가 될 수 있다:
1. 백신의 긴장성(tonicity)/삼투성(osmolarity)을 통제하기 위한 제제(agent)들. 이러한 제제(agent)들은 예컨대 염화나트륨과 같은 생리학적 염들이다. 다른 생리학적 염들은 염화칼륨, 인산이수소칼륨(potassium dihydrogen phosphate), 인산이나트륨(disodium phosphat), 염화마그네슘(magnesium chloride) 등이다. 이러한 제제는 또한 이온 강도 및 안정성에 영향을 미치는 다른 이온성 성분들(substance)일 수 있다. 백신의 삼투성은 약 200 부터 약 400 mOsm/kg 까지의 범위, 바람직하게는 약 240 부터 약 360 mOsm/kg까지의 범위 내 값으로 조정될 수 있고, 또는 삼투성은 예컨대 약 290 부터 약 310 mOsm/kg 까지의 생리학적 범위 내 생리학적 레벨에 근접해야 한다.
2. 백신 조성물의 pH를 조정하거나 완충시키기 위한 제제들. 일반적으로 백신 조성물의 pH는 약 5 부터 약 8.5 까지의 범위이다. 적절한 pH 조정 제제들 또는 버퍼 성분들은 (pH를 조정하기 위한) 수산화나트륨, 염산과 더불어 (백신의 완충제 역할을 하기 위한) 인산 버퍼(buffer), 트리스(Tris) 버퍼, 시트레이트(citrate) 버퍼, 아세테이트 버퍼, 히스티딘(histidine) 버퍼 등이다.
3. 예컨대 계면활성제들, 항산화제들, 킬레이트화제들, 항세균제들, 바이러스 불활성화물질들, 방부제들, 염료들, 소포제들, 안정제들 또는 계면활성제들, 또는 이들의 조합과 같은 다른 첨가제들.
계면활성제는 예컨대 플루로닉(Pluronic) F68 또는 플루로닉(Pluronic) 127과 같은 예컨대, 폴록사머들(poloxamers)과 같은, 친수성, 비활성(inert)이고 생체에 적합한(biocompatible) 것일 수 있다.
항세균제들은 예컨대 암포테리신(amphotericin) 또는 그것의 임의의 유도체, 클로로테트라사이클린(chlorotetracyclin), 포름알데히드(formaldehyde) 또는 포르말린(formalin), 젠타마이신(gentamicin), 네오마이신(neomycin), 폴리믹신(polymyxin) B 또는 그것의 임의의 유도체, 스트렙토마이신(streptomycin) 또는 그것의 임의의 조합일 수 있다.
항산화제들은 예컨대 아스코르브산 또는 토코레롤 또는 그것의 임의의 조합일 수 있다.
바이러스 불활성화물질들은 예컨대 포르말린, 베타-프로피오락톤(propiolactone), UV-방사선(irradiation), 가열 또는 그것의 임의의 조합일 수 있다.
방부제들은 예컨대 염화벤제토늄(benzethonium chloride), EDTA, 페놀, 2-페녹시에탄올(phenoxyethanol) 또는 티메로살(thimerosal) 또는 그것의 임의의 조합일 수 있다. EDTA는 킬레이트화제, 항산화제 및 안정제로 보여져 왔다.
염료들은 (예컨대 페놀 레드(red)와 같은) 임의의 지시약(indicators)들, 또는 브릴리언트 그린(brilliant green)) 또는 그것의 임의의 조합일 수 있다.
소포제들은 예컨대 폴리디메틸실로존(polydimethylsilozone)일 수 있다.
계면활성제들은 예컨대 폴리옥시에틸렌(polyoxyethylene) 및 그것의 유도체들과 같은 음이온성, 양이온성, 비이온성 또는 쌍성이온성(zwitterionic), (예컨대 폴리소르베이트(polysorbate) 20 또는 폴리소르베이트(polysorbate) 80와 같은) 폴리소르베이트들(polysorbates), 트윈(Tween) 80, (예컨대 플루로닉(Pluronic) F68과 같은) 폴록사머들(poloxamers) 또는 그것의 임의의 조합일 수 있다.
보통, 백신 조성물 내 모노글리세라이드의 농도는 백신 조성물의 100 mL 당 약 0.1 g 내지 약 5.0 g의 범위 내, 또는 100 mL 당 약 0.1 g 내지 약 2.0 g의 범위 내, 또는 100 mL 당 0.5 g 내지 약 1.5 g와 같은 약 0.5 g 내지 약 2.0 g의 양이다.
게다가, 하나 또는 그 이상의 카르복실산들의 농도는 백신 조성물의 100 mL 당 약 0.1 g 부터 약 5.0 g 까지 또는 100 mL 당 약 0.1 g 내지 약 2.0 g의 범위 내, 100 mL 당 0.5 g 내지 약 1.5 g 과 같은, 약 0.5 g 내지 약 2.0 g의 양이다.
백신 조성물에서 하나 또는 그 이상의 카르복실산들과 함께 하나 또는 그 이상의 모노글리세라이드들은 많아봤자 10% w/v, 또는 많아봤자 5% w/v, 또는 많아봤자 4% w/v, 또는 많아봤자 3% w/v, 또는 많아봤자 2% w/v 또는 많아봤자 1 % w/v 또는 많아봤자 0.5 % w/v 또는 많아봤자 0.1 % w/v 또는 많아봤자 0.05 % w/v의 양일 수 있다.
아쥬반트는 모노-올레인(olein), 올레산(oleic acid), 라우르산(lauric acid), 및 대두유(soybean oil)로 구성되는 군으로부터 선택되는 지질의 조합을 포함할 수 있다. 하나의 적합한 예에서, 아쥬반트는 Tris 버퍼 내에 올레산, 라우르산(lauric acid)을 포함한다. 적합하게, 이 예는 7 - 15 mL의 Tris 버퍼 (pH 7-9) 내에 0.25 g 내지 0.75 g의 올레산, 0.25 g 내지 0.75 g의 라우르산(lauric acid)을 포함한다. 특정 실시예는 8 - 10 mL 의 0.1 M Tris 버퍼 (pH 7-9) 내에 0.4 g 내지 0.5 g 의 올레산, 0.3 g 내지 0.4 g 의 라우르산(lauric acid)을 포함한다. 더 나아간 적합한 예에서, 아쥬반트는 Tris 버퍼 내에 올레산(oleic acid) 및 모노-올레인을 포함한다. 적합하게, 이 예는 7 - 15 mL 의 Tris 버퍼 내에 0.25 g 내지 0.75 g 의 올레산, 0.25 g 내지 0.75 g 의 모노-올레인을 포함한다. 특정 실시예는 8 - 10 mL 의 0.1 M Tris 버퍼 (pH 7-9) 내에 0.3 g 내지 0.4 g 의 올레산, 0.4 g 내지 0.5 g 의 모노-올레인을 포함한다. 더 나아간 예는 7 - 15 mL 의 Tris 버퍼 내에 0.5 g 내지 0.25 g 의 모노-올레인, 0.5 g 내지 0.25 g 의 올레산, 및 0.25 g 내지 0.75 g 의 대두유를 포함한다. 이 예의 특정 실시예는 8-12 mL of Tris 버퍼 (pH 7-9) 내에 0.1 g 내지 0.2 g 의 모노-올레인, 0.8 g 내지 1.5 g 의 올레산, 및 0.5 g 내지 0.6 g 의 대두유를 포함한다.
3 가지 타입들의 아쥬반트들이 하기 실시예들에서 성공적으로 사용되었다: 8-10 mL 의 0.1 M Tris 버퍼 (pH 7-9) 내 0.4 g 내지 0.5 g 의 올레산, 0.3 g 내지 0.4 g 의 라우르산(lauric acid)을 포함하는 실시예 아쥬반트 A; 8-10 mL 의 0.1 M Tris 버퍼 (pH 7-9) 내 0.3 g 내지 0.4 g 의 올레산, 0.4 g 내지 0.5 g 의 모노-올레인을 포함하는 실시예 아쥬반트 B; 및 8-12 mL 의 Tris 버퍼 (pH 7-9) 내 0.1 g 내지 0.2 g 의 모노-올레인, 0.8 g 내지 1.5 g 의 올레산, 및 0.5 g 내지 0.6 g 의 대두유를 포함하는 실시예 아쥬반트 C. 이들 아쥬반트들은 2-12% 지질 함량 (100 mL 당 6 g - 12 g)의, 4%, 5%, 6%, 7, 8%, 또는 9%와 같은 가장 보통은 3-10%로부터의, w/v 농도로 조제된다. 이들 농도들은 아쥬반트 믹스(mix) 그 자체의 것들이다. 이 아쥬반트는 그 다음에 8% 지질 농도로 아쥬반트로부터 시작할 때, 4% 지질 함량 백신 조성물을 제공하기 위하여, 예를 들어 1:1 비율과 같은 2:1 내지 1:8 비율들로 조성물을 포함하는 항원과 혼합된다. 보통 본 발명의 백신 조성물의 지질 함량은 0.5% 내지 6% w/v이고, 보통 1% 내지 6% w/v, 더욱 보통 1% 내지 4%이다.
실시예 B 조성물은 글리세롤 모노올리에이트(monooleate) 및 올레산(oleic acid)을 등몰(equimolar)량으로 포함하는 엔도신(Endocine)™ 제제(formulation) 이다. 상당히 바람직한 예에서, 8% 지질 제제(formulation)는 지질 농도가 1-4% w/v인 백신 조성물을 제공하기 위하여 조성물들을 포함하는 항원으로 희석된다.
기재한 바와 같이, 본 조성물은 본 발명의 백신 조성물을 비강내로 투여하는 것을 포함하는, 페리판데믹(peri-pandemic) 또는 전세계적 전염병 기간 동안의 면역조치(immunization) 방법에 사용하기에 적합하다. 페리판데믹(peri-pandemic) 또는 전세계적 전염병 기간 동안의 면역조치 방법은 모든 연령의 대상들에게 사용될 수 있다. 본 발명은 나아가 전술한 바와 같은 백신 조성물을 비강내로 투여하는 것을 포함하는 소아과적 대상들의 계절성 전염병들(epidemics) 기간 동안의 면역조치(immunization) 방법과 관련된다.
기재한 바와 같이, 본 발명은 백신 조성물을 비강내로 투여하는 것을 포함하는 나이브한 대상들의 면역조치(immunization) 방법에 대한 것이다.
하기 실시예들은 나이브한 대상들에서 이 백신 조성물의 약효를 보여준다.
나이브한 개인들에게서 면역 반응을 끌어내는 놀랄 만한 약효는 이미 그들이 기존의 강한 면역력을 갖고 있지 않을 때, 바이러스(vira)와 같은 침습성(invasive) 병원체들에 반응할 수 있는 면에서 본 발명의 백신이 약한 면역 시스템을 갖는 개인들의 면역 반응을 끌어낼 수 있다는 것을 시사한다. 그러므로 본 발명의 조성물은 면역손상된 개인들에 적합하다. 따라서, 본 발명의 나아간 측면은 HIV를 갖는 그들, 면역억제제를 투여하는 대상들, 최근 장기 이식받은 사람들; 조산아들, 및 수술 후 환자들을 포함하는 소아과의 면역손상된 환자들에게 비강내 투여되는 아쥬반트된(adjuvanted) 살아있지 않은 인플루엔자 항원들을 포함하는 백신 조성물에 대한 것이다.
이 측면은 소아과의(pediatric) 면역손상된 환자들에 비강내로 투여되는 백신으로서의 사용을 위한 조성물에 대한 것으로, 상기 조성물은 하기를 포함한다:
i) 하나 또는 그 이상의 살아있지 않은 항원들, 및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질, 및
선택적으로 하나 또는 그 이상의 모노-글리세라이드들.
면역손상된 개인들은 예컨대 인플루엔자 바이러스인 기회감염성 병원체들에 대한 증가된 민감성을 갖고, 인플루엔자로 인한 사망 및 위험의 위험이 높다. 면역손상된 개인들 및 특히 소아과의 면역손상된 개인들은 본 발명의 조성물로 면역조치하는 것에 적합한 환자 종류일 수 있다. 그러므로 본 발명의 예는 소아과의(pediatric) 면역손상된 환자들에게서 비강내로 투여되는 백신으로서 사용을 위한 하기를 포함하는 조성물일 수 있다:
i) 하나 또는 그 이상의 살아있지 않은 인플루엔자 바이러스 항원들,및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질,및
선택적으로 하나 또는 그 이상의 모노-글리세라이드들.
실시예 2에서 나타낸 바와 같이 본 발명의 놀랄만한 효과는 본 발명의 조성물이 바이러스 쉐딩(shedding)을 감소시킬 수 있다는 것이다. 어린이들은 면역적격인(immune-competent) 성인보다, 더 많은 바이러스를 쉐드하는데, 이는 근접한 다른 사람들에게 증가된 바이러스를 퍼지는 것을 이끈다. 본 발명은 그러므로 유아들, 어린이들 및 청소년들과 같은 소아과적 인구들을 치료하는데 적합할 수 있다. 본 발명은 소아과적 인구에 의하여 바이러스가 퍼지는 것을 예방하는데 적합할 수 있다. 한 예에서 본 발명의 조성물은 유아들, 어린이들 및 청소년들과 같은 소아과의 대상들에서의 사용을 위한 것이다. 한 예에서 본 발명의 조성물은 바이러스 쉐딩(shedding)을 감소시키기 위하여 나이브한 대상들에서의 사용을 위한 것이다. 한 예에서 본 발명의 조성물은 바이러스 쉐딩(shedding)을 감소시키기 위하여 인플루엔자 나이브한 대상들에서의 사용을 위한 것이다. 나아가, 본 발명의 조성물은 특히 바이러스 쉐딩(shedding)의 감소에 의하여 전세계적인 전염병을 방지하는데 적합할 수 있다. 한 예에서 본 발명의 조성물은 전세계적 영역에서 바이러스 쉐딩(shedding)을 감소시키기 위하여 나이브한 대상들에서의 사용을 위한 것이다. 한 예에서 본 발명의 조성물은 페리판데믹(peri-pandemic) 기간 동안 바이러스 쉐딩(shedding)을 감소시키기 위하여 나이브한 대상들에서의 사용을 위한 것이다. 한 예에서 본 발명의 조성물은 페리판데믹(peri-pandemic) 기간 동안 바이러스 쉐딩(shedding)을 감소시키기 위하여 소아과적 대상들에서의 사용을 위한 것이다.
앞서 기재된 조성물의 비강내 투여에 의한 소아과의 면역손상된 환자들에서 인플루엔자에 대한 면역조치 방법은 놀라운 결과의 흥미로운 면이다.
조성물은 보통 인플루엔자에 대하여 소아과의 면역손상된 대상들에게 비강내로 투여되는 백신으로서의 용도를 위한 것이다. 소아과의 면역손상된 대상들은 HIV에 감염된 사람들; 최근 장기 이식받은 사람들과 같은 면역억제제들을 투여하는 대상들, 조산된 아기들, 및 수술 후 환자들로 구성된 군으로부터 적합하게 선택된다.
본 발명의 나아간 측면은 나이브한 대상들 및 소아과의 면역손상된 환자들에서의 사용을 위한 백신에 대한 것이다. 본 발명의 아쥬반트는 인플루엔자 나이브한 대상들에서 그것의 약효가 입증되어 왔다. 이는 그것을 나이브한 환자 종류들 및 소아과의 면역손상된 환자들 모두에 적합하게 한다.
따라서, 본 발명의 나아간 면은 나이브한 대상들 및 소아과의(pediatric) 면역손상된 환자들에서의 사용을 위한 비강내로 투여되는 백신으로서의 용도를 위한 조성물에 대한 것으로, 상기 조성물은 하기를 포함한다:
i) 하나 또는 그 이상의 살아있지 않은 항원들,및
ii)
하기를 포함하는 아쥬반트 comprising:
하나 또는 그 이상의 카르복실산들,
수성 매질, 및
선택적으로 하나 또는 그 이상의 모노-글리세라이드들.
나이브한 대상들 및 소아과의(pediatric) 면역손상된 환자들의 면역조치를 위한 백신들의 적합한 타입들은, 본 발명에 따라 백신으로 처리되거나 또는 면역화되도록 의도된 각각 관련된 병원체의 항원을 포함한다. 이것은 B형 간염(hepatitis B), A형 간염(hepatitis A), C형 간염(hepatitis C), D & E 간염(hepatitis) 바이러스, Non-A/Non-B 간염(Hepatitis) 바이러스, 수두(pox) 및 천연두(smallpox) 바이러스들, 소아마비(polio) 바이러스, 홍역(measles) 바이러스, 인간(human) 면역결핍(immunodeficiency) 바이러스 (HIV), 엔테로바이러스들(enteroviruses), 레트로바이러스들(retroviruses), 호흡기(respiratory) 합포체(syncytial) 바이러스, 로타바이러스(rotavirus), 인유두종(human papilloma) 바이러스, 수두대상포진(varicella-zoster) 바이러스, 황열병(yellow fever) 바이러스, SARS 바이러스, 동물(animal) 바이러스들, 헤르페스(herpes) 바이러스들, 시트메갈로바이러스(cytomegalovirus), 수두대상포진(varicella zoster), 엡스타인 바(Epstein Barr) 바이러스, 파라-인플루엔자(para-influenza) 바이러스들, 아데노바이러스들(adenoviruses), 콕사키(coxsakie) 바이러스들, 피코르나(picorna) 바이러스들, 리노바이러스들(rhinoviruses), 루벨라(rubella) 바이러스, 파보바이러스(papovirus), 및 볼거리(mumps) 바이러스로 구성되는 군으로부터 선태고디는 바이러스들로부터 유래되는 면역원들을 포함하나, 이에 제한되는 것은 아니다. 상기 언급한 인플루엔자 바이러스 항원들 외 제한되지 않는 몇몇 알려진 바이러스 항원들의 예들은 하기를 포함할 수 있다: tat, nef, gpl20 또는 gpl[베타]O, gp40, p24, gag, env, vif, vpr, vpu, rev 또는 part 및/또는 그것들의 조합과 같은 HIV-I 유래의 항원들; gH, gL gM gB gC gK gE 또는 gD 또는 부분 및/또는 그것의 조합들과 같은 인간 헤르페스 바이러스들로부터 유래된 항원들 또는 ICP27, ICP47, ICP4, ICP36 from HSVI 또는 HSV2과 같은 전초기(Immediate Early) 단백질들; 시토메갈로바이러스(cytomegalovirus), 특히 gB 또는 그것의 유도체들과 같은 인간 시토메갈로바이러스(cytomegalovirus)로부터 유래된 항원들; gp350 또는 그것의 유도체들과 같은 엡스타인 바(Epstein Barr) 바이러스로부터 유래된 항원들; 항원들 gp I, 11, 111 및 IE63과 같은 수두대상포진(Varicella Zoster) 바이러스로부터 유래된 항원들; B형 간염(hepatitis B), 간염(hepatitis) C 또는 간염(hepatitis) E 바이러스 항원 (예컨대 외피(env) 단백질 EI 또는 E2, 코어(core) 단백질, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7, 또는 HCV의 그것의 조합들 및/또는 부분)과 같은 간염(hepatitis) 바이러스로부터 유래한 항원들; (예를 들어 HPV6, 11, 16, 18, 예컨대 LI, L2, EI, E2, E3, E4, E5, E6, E7, 또는 그것의 조합들 및/또는 부분인) 인유두종(human papilloma) 바이러스들로부터 유래한 항원들; 호흡기(Respiratory) 합포체(Syncytial) 바이러스 (예를 들어 F 및 G 단백질들 또는 그것의 유도체들), 파라인플루엔자(parainfluenza) 바이러스, 홍역(measles) 바이러스, 볼거리(mumps) 바이러스, 플라비바이러스들(flaviviruses) (예를 들어 황열병(Yellow Fever) 바이러스, 뎅기(Dengue) 바이러스, 진드기 매개 뇌염(Tick-borne encephalitis) 바이러스, 일본뇌염(Japanese Encephalitis) 바이러스) 또는 그것의 조합들 및/또는 부분과 같은 다른 바이러스 병원체들로부터 유래한 항원들.
본 발명의 조성물은 하기 바이러스들의 살아있지 않은 항원들을 포함할 수 있지만 이에 제한되는 것은 아니다: 대상포진(Herpes zoster), HIB, 백일해(Pertussis), 소아마비(Polio), 파상풍(Tetanus), 디프테리아(Diphteria), A 형 간염(Hepatitis), 계절성 인플루엔자(Seasonal Influenza), 인플루엔자(Influenza) A, 인플루엔자(Influenza) B, 호흡기(Respiratory) 합포체(syncytial) 바이러스 (RSV), 인간(Human) 메타뉴모바이러스(metapneumovirus) (hMPV), 인유두종바이러스(Human papillomavirus) (HPV), 로타바이러스(Rotavirus), 노로바이러스(Norovirus), 인간(Human) 면역결핍(immunodeficiency) 바이러스 (HIV), 단순포진(Herpes simplex), 및/또는 파라인플루엔자(Parainfluenza) 바이러스 (OIV), 리노(Rhino) 바이러스, 중증(Severe) 급성(acute) 호흡기(respiratory) 증후군(syndrome) (SARS), 코로나바이러스들(Coronaviruses), 대상포진(Herpes zoster)/수두(varicella), 간염(Hepatitis) A-E, 한타바이러스(Hantavirus), 및/도는 시토메가바이러스(Cytomegalovirus), 또는 이것의 혼합물들로부터의 살아있지 않은 항원들.
본 발명의 조성물은 하기 박테리아의 살아있지 않은 항원들을 포함할 수 있지만 이에 제한되는 것은 아니다: 폐렴구균(Pneumococci), 뇌척수막염균(Meningococci), 헤모필루스(Haemophilus) 인플루엔자(influenzae) b,(Hib) 바실러스(Bacillus) 안트라시스(anthracis), 클라미디아(Chlamydia) 트라코마티스(trachomatis), 슈도모나스(Pseudomonas) 애루지노사(aeruginosa), 마이코박테리움(Mycobacterium) 튜버쿨로시스(tuberculosis), 디프테리아(Diphtheria), 대장균(Escherichia coli)의 살아있지 않은 항원들. 스트렙토코커스 군(Group Streptococcus), 나이세리아(Neisseria) 고놀호애(gonorrhoeae), 보르데텔라(Bordetella) 페르투시스(pertussis) 또는 그것의 혼합물들,
상기 항원들은 예컨대 전체 불활성화된 바이러스들과 같은 예컨대 전체 살아있지 않은 항원들일 수 있다. 상기 항원은 또한 예컨대 불활성화된 바이러스의 부분과 같은 병원체의 부분일 수 있다. 사용될 수 있는 항원 성분들은 예를 들어 바이러스, 빅테리아, 마이코박테리아(mycobaterial) 또는 기생충의(parasitic) 항원들일 수 있으나 이에 제한되는 것은 아니다. 박테리아 병원체들은 예컨대 폐결핵(tuberculosis) 및 한센병(leprosy)을 유발하는 마이코박테리아(Mycobacteria), 뉴모사이(pneumocci), 호기성 그람(gram) 음성 또는 그람 양성 바실러스들(bacilli), 마이코플라즈마(mycoplasma), 스타필로코커스(staphylococcal) 감염들, 스트렙토코커스(streptococcal) 감염들, 헬리코박터(Helicobacter) 파일로리(pylori), 살모넬라(salmonellae), 보르데텔라(Bordetella) 페르투시스(pertussis) 및 클라미디아(chlamydiae)일 수 있다. 질병들은 또한 폐결핵(tuberculosis) 및 한센병(leprosy)을 유발하는 마이코박테리아(Mycobacteria), 뉴모사이(pneumocci), 호기성 그람(gram) 음성 바실러스들(bacilli), 마이코플라즈마(mycoplasma), 스타필로코커스(staphylococcal) 감염들, 스트렙토코커스(streptococcal) 감염들, 헬리코박터(Helicobacter) 파일로리(pylori), 살모넬라(salmonellae), 디프테리아(diphtheria), 백일해(whooping cough)를 야기하는 보르데텔라(Bordetella) 페르투시스(pertussis) 및 클라미디아(chlamydiae)에 의하여 야기되는 박테리아 감염들일 수 있다.
나이브한 대상들 및 면역손상된 환자들의 면역조치를 위한 백신들의 바람직한 타입들은 폐렴구균(pneumococcal) 백신, 간염(Hepatitis) A-E 백신, 뇌척수막염(Meningococci) 백신, 해모필루스(Haemophilus) 인플루엔자(influenzae) b (Hib) 백신, 디프테리아(Diphtheria) 백신 및 DTaP 백신 (디프테리아(diphtheria), 파상풍(tetanus), 및 백일해(pertussis) (백일해(whooping cough))로부터 보호한다)로 구성되는 군으로부터 선택될 수 있다.
질병들은 예컨대 말라리아(malaria), 레슈마니어증(leishmaniasis), 트리파노소마증(trypanosomiasis), 톡소플라즈마증(toxoplasmosis), 주혈흡충병(schistosomiasis), 필라리아병(filariasis) 또는 예컨대 유방암, 위암, 대장암, 직장암, 머리 및 목의 암, 신장(renal) 암, 악성 흑색종, 후두암, 난소암, 자궁경부암, 전립선암과 같은 다른 타입들의 암들과 같이 기생충에 의한(parasitic) 것일 수 있다.
질병들은 또한 예컨대 전신성 홍반성 낭창(systemic lupus erythematosis)과 같은 자가면역 질환들 및 집먼지진드기(house dust mite), 꽃가루(pollen) 및 다른 환경적 알러겐들(allergens) 때문인 알레르기들일 수 있다.
백신 조성물 내 항원은 예컨대 소단위체 살아있지 않은 항원들, 분할(split) 살아있지 않은 항원들 또는 전체 불활성화된 바이러스들과 같은 전체 살아있지 않은 항원들일 수 있다. 불활성화 과정들은 열 불활성화, UV-빛에 의한 조사(irradiation) 불활성화 또는 포르말린 불활성화 또는 베타-프로피오락톤에 의한 처리에 의한 불활성화와 같이 당업계에 잘 알려져 있다.
본 발명의 조성물은 나이브한 대상들 및 소아과의(pediatric) 면역손상된 환자들의 면역조치(immunization)를 위한 백신들로서의 용도를 위한 것이다. 소아과의(pediatric) 면역손상된 환자들은 HIV 감염된 대상들; 최근 장기 이식받은 사람들과 같이 면역억제제를 투여하는 대상들; 조산된 아기들, 및 수술 후 환자들인 사람들로 구성된 군으로부터 적절하게 선택된다. 나이브한 대상들은 0 내지 18 살의 어린이들과 같은 18세 미만(under)의 어린이들, 특히 12 세 및 그 그 미만(under)의 어린이들일 수 있다. 보통, 어린이들은 6살 또는 그 미만(less)과 같은, 8살 미만(less)이다. 본 발명의 백신의 환자들의 중요한 의도된 종류는 특히, 2 개월 내지 9 살 미만(less)의 어린이들, 6개월 내지 8살 미만(less)의 나이와 같은, 보통 3 개월 내지 9 살 미만(less)의 나이의, 가장 보통으로는 6 개월 내지 72 개월 미만(less)의 나이와 같은 6개월 내지 7살 미만(less), 또는 6 개월 내지 60 개월의 나이 또는 6 개월 내지 24 개월의 나이의 어린이들이다. 본 발명의 조성물은 적어도 부분적으로는 소아과적 사용을 위한 백신으로서 의도된다.
나이브한 대상들은 상기 조성물이 특히 세계전 전염병 또는 페리판데믹(peri-pandemic) 기간 동안 사용을 위한 백신에 관한 것일 때 모든 연령 군들일 수 있다.
스트렙토코커스(Streptococcus) 뉴모니아(pneumoniae)는 매년 침습성(invasive) 폐렴구균(pneumococcal) 질병(disease)(IPD)으로 사망하는 1백 6십만명으로 추산되는 사람들의 전세계적 사망율(mortality) 및 유병율(morbidity)의 주된 원인이다(WHO, 2002). IPD는 가장 어린 사람들과(< 24개월) 노인들(> 65 세) 중에 가장 흔하게 발생하며; 노인은 가장 높은 IPD 사망율을 갖는다. 현재, 스트렙토코커스 뉴모니아의 감염을 예방하기 위하여 4 가지 백신들이 이용가능하다. 비강내-아닌 백신들이 스트렙토코커스 뉴모니아에 이용가능하다.
본 발명의 하나의 흥미로운 예는 특히 유아들, 어린이들, 청소년들 및 다른 스트렙토코쿠스(Streptococcus) 뉴모니아(pneumoniae) 나이브한 대상들에 대한, 스트렙토코쿠스(Streptococcus) 뉴모니아(pneumoniae)로의 감염의 예방을 위한 비강내 대체제(alternative)에 대한 것이다. 본 발명의 조성물은 살아있는 약독화된 박테리아를 이용하지 않고 살아있지 않은 스트렙토코쿠스(streptococcus) 뉴모니아(pneumonia) 항원들을 이용한다. 본 발명의 백신의 놀라운 약효는 사용된 아쥬반트의 결과이며, 놀라운 결과는 나이브한 대상들에 특이적이었다. 유사한 결과들이 면역손상된 대상들에서 또한 예상되었다.
따라서, 본 발명의 나아간 측면은 스트렙토코쿠스(Streptococcus) 뉴모니아(pneumonia) 감염과 관련된 증상들의 심각도(severity)를 감소시키기 위하거나 또는 스트렙토코쿠스(Streptococcus) 뉴모니아(pneumoniae)로의 감염의 예방을 위하여 나이브한 대상들 및 소아과의(pediatric) 면역손상된 환자들에서의 이용을 위한 살아있지 않은 비강내 투여 백신으로서의 이용을 위한 조성물에 대한 것으로, 상기 조성물은 하기를 포함한다:
i) 하나 또는 그 이상의 스트렙토코쿠스(Streptococcus) 뉴모니아(pneumoniae) 항원들, 및
ii)
하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질, 및
선택적으로 하나 또는 그 이상의 모노-글리세라이드들.
면역손상된 환자들은 HIV 감염된 대상들; 최근 장기 이식 받은 사람들과 같은 면역억제제를 투여하는 대상들; 조산된 아기들, 및 수술 후 환자들인 청소년, 어린이들 및 유아들로 구성되는 군으로부터 적절하게 선택된다.
본 발명의 중요한 예는 기관지염(bronchitis), 폐렴(pneumonia), 패혈증(septicemia), 심막염(pericarditis), 수막염(meningitis) 및 복막염(peritonitis)으로 구성되는 군으로부터 선택되는 질병 상태들의 증상을 감소시키고/감소시키거나 예방을 위한 폐렴구균(pneumococcal) 감염에 대한 백신에 대한 것이다.
한 예는 소아과의(pediatric) 대상들에서의 폐렴구균의(pneumococcal) polysaccharide 백신 (PPV)과 같은 폐렴구균(pneumococcal) 백신의 용도, 특히 예컨대 완전히 발달하지 않은 면역 시스템 및 폐렴구균의(pneumococcal) 항원들에 면역적으로 나이브한 대상들에 대한, 4 주 부터 6 살 까지의 나이의 대상들에서의 용도에 대한 것이다.
본 발명에 따른 백신 조성물은 예컨대 플루로닉(Pluronic) F68 또는 플루로닉(Pluronic) 127와 같은, 예컨대, 폴록사머들(poloxamers)과 같은, 친수성이고 비활성(inert)이며 생체에 적합할(biocompatible) 수 있는 계면활성제를 더 포함하는, 예컨대 수성 매질(mudium)일 수 있는 매질과 같은, 약학저긍로 허용가능한 첨가제들을 더 포함할 수 있다.
본 발명에 따른 폐렴구균의(pneumococcal) 백신은 여기에 기재한 바와 같이, 항세균제들, 항산화제들, 바이러스 불활성화물질들, 방부제들, 염료들, 안정제들, 소포제들, 계면활성제들 (비이온성, 음이온성 또는 양이온성) 또는 그것의 임의의 조합을 더 포함할 수 있다. 상기 항세균제들은 예컨대 암포테리신 또는 그것의 임의의 유도체, 클로로테트라사이클린(chlorotetracyclin), 포름알데히드 또는 포르말린, 젠타마이신, 네오마이신(neomycin), 폴리믹신(polymyxin) B 또는 그것의 임의의 유도체, 스트렙토마이신(streptomycin) 또는 그것의 임의의 조합일 수 있다. 상기 항산화제들은 예컨대 아스코르브산 또는 토코레롤 또는 그것의 임의의 조합일 수 있다. 상기 병원성 예컨대 바이러스 및/또는 박테리아 불활성물질들(inactivators)은 예컨대 포르말린, 베타-프로피오락톤(propiolactone), UV-조사(radiation), 가열 또는 그것의 임의의 조합일 수 있다.
본 발명의 예들을 설명할 때, 모든 가능한 예들의 조합들 및 치환들(permutation)은 구체적으로 기재되지 않는다. 그럼에도 불구하고 특정 수치들(measures)이 상호간에 다른 종속항들에서 나열되거나 또는 다른 예들에서 기재되었다는 단순한 사실이, 이들 수치들의 조합이 유리하게 사용될 수 없다는 것을 가리키는 것이 아니다. 본 발명은 기재된 예들의 모든 가능한 조합들 및 치환들을 예상한다.
실시예들
실시예
1
목적
본 연구의 목적은 본 발명에 따라, 페럿(ferret) 모델에서, 비강내로 투여되는 아쥬반트-제형화된(formulated) 죽은(killed) 전체(whole) 인플루엔자 바이러스 항원 및 아쥬반트-제형화된 인플루엔자 분할(split) 항원의 면역원성 및 방어적(protective) 약효를 조사하는 것이다.
H1N1/California/2009 분할(split) 항원 (백신 A)에 기초한 백신이 5, 15, 또는 30 μg HA의 항원 투여량(doses)과 연구되었고, H1N1/California/2009 죽은(killed) 전체(whole) 바이러스 항원 (백신 B)에 기초한 백신은 15 μg HA의 항원 투여량과 연구되었다. 백신 약효는 시험감염(challenge)으로서 야생형 H1N1 A/The Netherlands/602/2009 바이러스를 이용하여 연구되었다.
엔도신(Endocine)™ 아쥬반트는 등몰(equimolar) 량의 글리세롤 모노올리에이트(monooleate) 및 올레산(oleic acid)을 백신 조성물 내 20 mg/ml (2 %)의 최종 농도로 포함하였다. 이 예에서, 이뮤노스™FLU는 엔도신(Endocine)™과 혼합된 살아있지 않은 인플루엔자 항원들을 의미한다.
실험 그룹들 면역조치 단계
백신 조제용 물질(
preparation
) 및 투여
식염수(saline): 0.9% 식염수(saline) pH 5-5.5.
플루아릭스(Fluarix)® : 0.5ml의 각각의 백신 균주의 15 μg HA 에서 A/California/7/2009(H1N1)-유사, A/Perth/16/2009(H3N2)-유사 및 B/Brisbane/60/2008-유사 백신 균주들를 포함하는) 비경구(parenteral) 백신. 그룹 2의 동물들은 0.5ml 플루아릭스(Fluarix) (GlaxoSmithKline Biologicals)로 21일 및 42일에 피하로 백신접종되었다.
백신 A: 5, 15 및 30 μg HA / 0.2 ml의 인플루엔자 백신 점비액들(nasal drops), 백신 조성물 내 최종 농도 20mg/ml의, 등몰(equimolar)량의 글리세롤 모노올리에이트(monooleate) 및 올레산(oleic acid)의 엔도신(Endocine) 제제(formulation)(pH 8, in Tris 0.1M)를 포함하는 아쥬반트 제제(formulation); H1N1/California/2009 분할(split) 항원.
백신 B: 15 μg HA / 0.2 ml의 인플루엔자 점비액들(nasal drops), 백신 조성물 내 20mg/ml의 최종 농도를 갖는 (pH 8, in Tris 0.1M), 등몰(equimolar)량의 글리세롤 모노올리에이트(monooleate) 및 올레산(oleic acid)의 엔도신(Endocine) 제제를 포함하는 아쥬반트 제제(formulation), H1N1/California/2009 죽은 전체 바이러스 항원.
페럿들
대략 12 개월 나이, 760-1210 g 의 체중 및 혈구응집(hemagglutination) 억제(inhibition) (HI) 시험에 의하여 입증된 대로, 돌고 있는(circulating) 인플루엔자 바이러스들 B, A/H1N1, A/H3N2 및 A/pH1N1에 대한 항체들에 혈청반응 음성인(seronegative) 건강한 암컷 페럿들(ferrets)(무스텔라(Mustela) 푸토리우스(putorius) 푸로(furo), 이계교배됨)이 사용되었다. 면역조치-전(pre-immunization) 단계 동안 최대 8 마리의 그룹으로, 그리고 면역조치 단계 동안 6 마리의 연구 그룹으로, 동물들은 정상 우리들에서 사육되었다. 연구 그룹들은 시험감염(challenge)하는 날에 음압(negatively pressurized) 글로브박스(glovebox) 분리기(isolator) 우리들로 옮겨졌다. 모든 연구 동안 동물들에는 상업 식품 펠렛들 및 물이 자유식(ad libitum)으로 공급되었다.
면역조치(
Immunization
)
6마리 페럿들의 5개 그룹들이 0, 21 및 42 일에 도미터(domitor) 및 케타민(ketamine)으로 마취 하 3개의 비강내(intranasal) 면역조치를 받았다(작은 액체 방울들(droplets): 각각의 콧구멍에 100 μl, 필터팁(filtertip)이 있는 피펫을 이용함). 그룹 1의 동물들은 200 μl의 멸균된 생리식염수(saline) (0,9% 식염수 pH 5-5,5). 그룹 3, 4 및 5는 각각 5, 15 및 30 μg HA를 포함하는 200 μl의 엔도신(Endocine)™ 제형화된 H1N1/California/2009 분할(split) 항원으로 비강내로 면역화되었다. 그룹 6은 15 μg HA를 포함하는 200 μl의 엔도신(Endocine)™ 제형화된 H1N1/California/2009 전체 바이러스 항원으로 비강내로 면역화되었다. 대조군 1은 비강내로 200 μl의 식염수(saline)을 받았다. 6 마리 페럿들의 한 그룹(그룹 2)은 21 및 42 일에, 각각 백신 균주에 15 μg HA를 포함하는 비-아쥬반트된 3가(trivalent) 인플루엔자 백신 (TIV)인 시즌 2010/2011, 0.5 ml 플루아릭스(Fluarix)® (GlaxoSmithKline Biologicals)로 피하로 백신접종되었다. 혈청 조제용 물질(preparation)을 위한 혈액 샘플들이 연구일 64 및 70 연구일에 시험감염(challenge) 전 및 0, 21 및 42 일에 면역조치(immunization) 전에 수집되었다.
바이러스 조제용 물질의 시험감염(
challenge
) 및 투여
70일에, 모든 동물들이 기관내(intratracheal) 루트에 의하여 인플루엔자 바이러스 (H1N1 균주 A/The Netherlands/602/2009)의 필드(field) 분리주(isolate)로 시험감염되었다. 시험감염(challenge) 바이러스를 준비하기 위하여, H1N1 A/The Netherlands/602/2009 시험감염(challenge) 스톡(stock) (7.8 log10 TCID50/ml)이 아주 찬(ice-cold) PBS에서 3.3 X 105 TCID50/ml의 농도로 희석되었다. 모든 동물들은 106 TCID50을 포함하는 3 ml 의 시험감염(challenge) 바이러스 조제용 물질(preparation)로, 기관 내로 시험감염되었고, 기관경을 이용하여 기관 안으로 작은 카테터로 투여되었고, 분기(bifurcation) 바로 위에서 방출되었다. 시험감염(challenge) 바이러스의 준비 및 투여는 BSL3 조건 하 수행되었다. 시험감염 1일 후, 남아 있는 시험감염 바이러스 희석액 샘플이 마딘-다비(Madin-Darby) 개(canine) 신장(kidney) 세포들 상에 적정되어(titrated) 바이러스의 감염성을 확정하였다. 접종 하루 후 시험감염 희석액의 역적정(Back titration)은 여전히 4.8 log10 TCID50으로 물질이 포함되어 있다는 것을 보여주었다.
절차들 및 샘플 수집
실험의 코스들로 상기 페럿들 상에서 몇몇 절차들이 수행되었다. 온도 센서들의 이식, 면역조치들, 바이러스 시험감염(challenge) 및 컴퓨터(computed) 단층촬영(tomography) (CT) 이미징(imaging)를 위하여 동물들이 케타민(4-8 mg/kg: i.m.; Alfasan, Woerden, The Netherlands) 및 도미터(domitor) (0.1 mg/kg: i.m.; Orion Pharma, Espoo, Finland) 칵테일로 마비되었다. (혈액, 표본들(swabs) 및 세비액들(nasal washes)의 샘플링 및 방혈(exsanguination)에 의한 안락사를 위하여, 동물들이 케타민으로 마비되었다. 실험 시작 2주 전, 온도 로거(logger) (DST micro-T ultrasmall 온도 logger; Star-Oddi, Reykjavik, Iceland)를 페럿들의 복강에 위치시켰다. 이 장치는 매 10분 마다 동물들의 체온을 기록하였다. 페럿들은 각 면역조치 전 (0, 21 및 42 일) 및 시험감염 및 안락사의 날 (70 및 74 일)에 체중을 측정하였다. 그룹들 1, 2 및 4의 동물들은 64, 71, 72, 73 및 74 일에 CT 이미징에 의하여 모니터링하였다. 혈액 샘플들은 0, 21 및 42 일 면역조치 전, 64 일에, 그리고 70일 시험감염 전에 수집되었다. 코 및 인후(throat) 표본(swabs)은 70 일 시험감염 전 및 시험감염 후 매일 수집되었다.
혈액 샘플들 및 혈청의 수집
혈액 샘플들이 수집되고 2 개의 동일한 용량(volume)들로 나뉘어졌다. PBMC를 분리하는데 사용된 한 용량(volume)은 EDTA 혈액응고방지제(anti-coagulant)를 포함하는 튜브로 즉시 이동되었다. 혈청을 수집하는데 사용된 또다른 용량은 혈전(clot) 활성제(activator)를 포함하는 혈청 튜브로 이동되었다. 모든 혈청 튜브들은 실온에서 10 분 동안 약 2000 xg로 원심분리되었다. 혈청은 0.1ml 샘플들에서 부분표본화(aliquote)되었고, 약 -80 ℃에서 보관되었다.
PBMC
및 혈장(
plasma
)의 분리
PBMC를 분리하는데 사용된 혈액 샘플들은 EDTA 혈액응고방지제(anti-coagulant)를 포함하는 튜브로 즉시 이동되었고, 5 분 동안 880x G에서 원심분리되었고, 혈장은 약 -80 ℃에서 보관되었다. 세포 펠렛(pellet)은 3.5 ml 세척 버퍼 (D-PBS: lot#: RNBB7791, V-CMS: 10700395 및 EDTA:lot#: 079K8712, V-CMS: 10700037)에서 재현탁되었고(resuspended), 3ml 림포프렙(lymphoprep) 상에 층으로 놓고(layer), 그리고 30분 간 800x G에서 원심분리하였다. 원심분리 후 세포 포함 인터페이스(interface)가 수집되고, 새로운 튜브로 이동되고 4 회 세척 버퍼에서 세척되었다. 10 분 간 600 xg, 465 xg 및 350 xg 에서의, 그리고 15분 간 250 xg 에서의 원심분리는 다음의 세척 단계들에 수반되었다. 마지막 세척 단계 후, 세포 펠렛들이 재현탁되었고, 적어도 10 분 간 얼음 상에 놓이고, 아주 찬 동결(freeze) 매질(medium) (RPMI lot# 1MB078, 20 % FCS VC# 201110194, 10% DMSO VC # 10700203) 1 ml 에서 재현탁시켰고, 앰플(ampoule)로 이동시키고, -80 ℃에서 저장하였다.
혈청반응 테스트(
Serology
)
H1N1 A/The Netherlands/602/2009 에 대한 항체 역가들(titers) 및 2 먼(distant) 바이러스들 H1N1 A/Swine/Ned/25/80 및 H1N1 A/Swine/Italy/14432/76이 혈구응집(hemagglutination) 억제(inhibition) 분석 (HI) 및 바이러스 중화(neutralization) 분석 (VN)에 의하여 결정되었다. 먼(distant) 바이러스 H1N1 A/New Jersey/08/76에 대한 항체 역가들(titers)은 혈구응집 억제 분석에 의하여 결정되었다.
HI
분석
HI 분석은 적혈구들의 인플루엔자 유도된 응집을 막기 위하여 인플루엔자 바이러스 혈구응집소(hemagglutinin) 특이적 항체들의 능력에 기초한 표준 결합 분석이다. 샘플들은 비특이적 항-혈구응집소(hemagglutinin) 활성ㅇ르 제거하기 위하여 (비브리오(Vibrio) 콜레라(cholerae) 배양물들로부터 수득되는) 콜레라 여과물로 전처리되었다. 그 다음의 37 ℃에서의 16시간의 배양(incubation)에서 콜레라 여과물은 56 ℃에서 1 시간 동안 샘플들을 배양함으로써 불활성화되었다. 샘플들의 순차적인 2배(two-fold) 희석액들은 포스페이트(phosphate) 버퍼드(buffered) 설페이트(sulphate) (PBS) (1:20의 희석으로 시작하여 2 개의 96-웰 플레이트들로) 만들어졌고, 샘플들이 특이적인 혈구응집을 보일 때, 그것들을 칠면조 적혈구들(erythrocytes)로 전처리하였다. 이들 적혈구들의 제거 후 샘플들이 4 ℃에서 1 시간 동안 관련된 인플루엔자 바이러스의, 고정된 농도의 4 혈구응집(hemagglutination) 단위들(units) (HAU)로 배양되었다. 마지막으로 상기 플레이트들이 적혈구들의 퇴적에 의하여 나타난 바와 같이, 혈구응집의 억제를 위해 독립적으로 점수화(score)되었다. 페럿 대조군 혈청들로 기우는 것(Trending)은 모든 득점들(runs)에 포함되었다.
VN
분석
VN 분석은 바이러스를 중화시켜(neutralize) 세포 배양액 내 바이러스 복제물(replication)이 없도록 하는 인플루엔자 바이러스-특이적 항체들의 부분집합(subset)의 능력에 기초한다. 샘플들은 56 ℃에서 30 분 동안 열-불활성화되었고, 그 후 샘플들의 순차적 2 배(two-fold) 희석들이 1:8의 희석으로 시작하는 96 웰 플레이트들에서 3회 감염 배지(mediium)(Eagles minimal essential medium supplemented with 20 mM Hepes, 0.075% 중탄산나트륨(sodium bicarbonate), 2 mM L-글루타민(Glutamine), 100 IU/ml 의 페니실린(penicillin) 및 스트렙토마이신, 17.5 μg/ml 트립신(trypsin) 및 2.3 ng/ml 암포테리신 B으로 보충된 이글스(Eagles) 최소(minimal) 필수(essential) 배지(medium))에서 이루어졌다. 샘플 희석물은 그 다음 37 ℃, 5% CO2에서 1 시간 동안 관련 바이러스의 25-400 TCID50로 배양되었다. 1 시간 배양 기간의 완료 후 바이러스-항체 혼합물들은 95-100% 융합성(confluent)인 마딘-다비(Madin-Darby) 개(canine) 신장(kidney) (MDCK) 세포 배양 단층들(monolayers)으로 플레이트들에 옮겨졌다. 이들 플레이트들은 그 다음 37 ℃, 5% CO2에서 1 시간 동안 배양되었고, 그 바이러스-항체 혼합물들은 그 다음에 제거되고 감염 배지(medium)에 의하여 대체되었다. 37 ℃, 5% CO2에서 6일의 배양 기간 후, 플레이트들은 칠면조 적혈구들을 이용하여 읽혀져(read) 인플루엔자 바이러스 혈구응집소(hemagglutinin)의 존재를 감지했다. VN 역가들(titers)은 Reed and Muench (Reed, L.J.; Muench, H. (1938). "A simple method of estimating fifty percent endpoints". The American Journal of Hygiene 27: 493-497)에 기재된 방법에 따라 계산되었다.
상기도 및
하기도에서
바이러스 복제
시험감염 후 0, 1, 2, 3 및 4 일에, 코 및 인후 표본들(swabs)이 마취 하 동물들로부터 채취되었다. 시험감염 4일 후, 상기 페럿들은 마취 하 방혈(exsanguination)에 의하여 안락사되었고, 그 후 전신 육안병리학(gross-pathology)이 수행되고, 조직들이 수집되었다. 오른쪽 비갑개(nose turbinate) 및 오른쪽 폐의 모든 엽들(lobes) 및 부엽(accessory lobe)의 샘플들이 수집되었고, 추가의 공정들까지 -80 ℃에서 저장되었다. 비갑개(turbinate) 및 폐 샘플들이 무게가 측정되었고, 그 다음에 0.5% 락트알부민(lactalbumin), 10% 글리세롤, 200 U/ml 페니실린(penicillin), 200 μg/ml 스트렙토마이신, 100 U/ml 폴리믹신(polymyxin) B 설페이트, 250 μg/ml 젠타마이신(gentamycin), 및 50 U/ml 니스타틴(nystatin) (ICN Pharmaceuticals, Zoetermeer, The Netherlands)를 포함하는 Hank's 평형(balanced) 염 용액 내 FastPrep-24 (MP Biomedicals, Eindhoven, The Netherlands)으로 균질화하였다.
수집 후, 코 및 인후 표본들(swabs)이 조직 샘플들의 공정들에 사용된 동일한 매질(medium)에서 -80 ℃에서 저장되었다. 폐의 4회(quadruplicate) 10 배 순차적 희석액들 및 표본(swab) 상청액들이 전에 (Rimmelzwaan GF et al.,J Virol Methods 1998 Sep;74(1)57-66) 기재된 바와 같이 MDCK 세포들의 융합성(confluent) 층들에서 바이러스 역가들(titers)을 결정하는데 이용되었다.
항체
역가
(
titer
) 결과들
항체들의 혈청 레벨들이 각각의 면역조치 전 0, 21, 42, 64, 및 70 일에 결정되었다. H1N1 A/The Netherlands/602/2009 및 2 먼(distant) 바이러스들 (H1N1 A/Swine/Ned/25/80 및 H1N1 A/Swine/Italy/14432/76에 대한 역가들은 혈구응집 억제 분석 (HI) 및 바이러스 중화(neutralization) 분석 (VNT)에 의하여 결정되었다. 먼(distant) 바이러스 H1N1 A/New Jersey/08/76)에 대한 항체 역가들(titers)이 혈구응집 억제 분석 (HI)에 의하여 결정되었다.
HI 항체 역가들(titers) - 동종(homologous): H1N1 A/The Netherlands/602/2009
HI 역가들(titers)의 기하(geometric) 평균은 도 1에 그려져 있다. ≤ 5의 값은 기하 평균의 계산을 위하여 대응하는 절대 값 5로 대체되었다. 모든 전(pre)-혈청들(sera)(0일)은 HI 항체 음성 (역가: ≤5)이었다.
그룹에 의한 HI 역가들(titers)의 분석은 하기 결과들을 보였다:
그룹 1 (식염수(Saline); 감염 대조군)
모든 혈청 샘플들이 HI 항체 음성이었다.
그룹 2 (플루아릭스(Fluarix)®; 비경구(parenteral) 대조군)
첫 번째 면역조치 후 수집된 하나의 혈청 샘플(42 일)이 낮은 HI 항체 양성이었다(역사: 13). 낮은 HI 역가들(titers) (범위 13-70)은 6 마리 중 5 마리 동물들의 혈청들에서 두 번째 면역조치 후 감지되었다.
그룹 3 (백신 A, 5 μg HA; 비강내)
첫 번째 면역조치 후 수집된 모든 샘플들은 HI 항체 양성이었다(21 일; GMT: 477, 범위 160-1120). HI 항체 역가들은 두 번째 면역조치 후(42 일; GMT: 1669, 범위 1120-2560), 및 세 번째 면역조치 후 또한 6 중 4의 동물들에서(64 일; GMT: 2158, 범위 1280-3840) 상당히 증가되었다. (시험감염일) 70 일에 수집된 샘플들은 64일에 측정된 그것들에 필적하는 HI 역가들을 보였다(70 일; GMT: 2103, 범위 1120-3840).
그룹 4 (백신 A, 15 μg HA; 비강내)
첫 번째 면역조치 후 수집된 6 중 5 개 샘플들이 HI 항체 양성 (21일; GMT: 1130 범위, 5-5760)이었다. 두 번째 면역조치 후 수집된 모든 샘플들이 HI 항체 양성이었고; HI 항체 역가들은 5 개 동물들에서 상당히 증가하였다(42 일; GMT: 3673, 범위, 1120-5760). 세 번째 면역조치는 증가된 HI 항체 역가들을 야기하지 않았다(64 일; GMT: 2386, 범위 1920-4480). (면역조치일) 70일에 수집된 샘플들은 64일에 측정된 그것들에 필적하는 HI 역가들을 보여주었다(70 일; GMT: 2281, 범위 1280-2560).
그룹 5 (백신 A, 30 μg HA; 비강내)
첫 번째 면역조치 후 수집된 모든 샘플들은 HI 항체 양성 (21일; GMT: 1249, 범위 400-3200)이었다. 두 번째 면역조치 후 6 중 5 개 동물들 (42 일; GMT: 1874, 범위 640-3840) 및 또한 세 번째 면역조치 후 2개 동물들에서 (64 일; GMT: 1837 범위 1280-3200) HI 항체 역가들이 증가하였다. (시험감염일) 70일에 수집된 샘플들은 64일에 측정된 그것들에 필적하는 HI 역가들을 보여주었다(70 일; GMT: 1699, 범위 640-3200).
그룹 6 (백신 B, 15 μg HA; 비강내)
첫 번째 면역조치 후 수집된 6 중 5 개 샘플들은 HI 항체 양성이었다 ( 21일; GMT: 87, 범위 5-1280). HI 항체 역가들은 두 번째 면역조치 후 모든 동물들에서 (42 일;GMT: 577, 범위 100-2880) 및 세 번째 면역조치 후에 또한 2 개 동물들에서 (64일; GMT: 626, 범위 160-2560) 상당히 증가하였다. (시험감염일) 70일에 수집된 샘플들은 64일에 측정된 그것들에 필적하는 HI 역가들을 보여주었다(70일; GMT: 583, 범위 160-2240).
이종기원(heterologous): H1N1 A/Swine/Ned/25/80, H1N1 A/Swine/Italy/14432/76 및 H1N1 A/New Jersey/08/76
먼(distant) 바이러스들 H1N1 A/Swine/Ned/25/80, H1N1 A/Swine/Italy/14432/76 및 H1N1 A/New Jersey/08/76 에 대한 HI 항체 역가들이 검출되었다. 상기 먼(distant) 바이러스들에 대한 기하 평균 HI 역가들으 도 2에 도시되어 있다. ≤ 5 값은 기하 평균의 계산을 위하여 대응하는 절대값 5로 대체되었다. 모든 전-혈청(0 일)은 HI 항체 음성이었다 (역가: ≤5). 교차반응을 일으킬 수 있는 HI 항체 역가들은 동종(homologous) H1N1 A/The Netherlands/602/2009 HI 항체 역가들보다 상당히 더 낮았다.
그룹에 의한 HI 역가들의 분석은 하기 결과들을 보였다:
그룹 1 (식염수(saline); 감염 대조군)
1개를 제외하고 모든 혈청 샘플들은 HI 항체 음성이었다. 64 일에 수집된 하나의 샘플은 H1N1 A/Swine/Italy/14432/76에 대하여 7.5의 매우 낮은 HI 항체 역가를 보였다.
그룹 2 (플루아릭스(Fluarix)®; 비경구(parenteral) 대조군)
모든 샘플들은 H1N1 A/Swine/Ned/25/80 및 H1N1 A/Swine/Italy/14432/76 HI 항체 음성이었다. H1N1 A/New Jersey/08/76에 대한 낮은 HI 역가들은 42일에 수집된 혈청들에서 첫 번째 면역조치 후 6 중 3 개 동물들에서 감지되었다.
그룹 3 (백신 A, 5 μg HA; 비강내)
모든 동물들은 3 개의 먼(distant) 바이러스들에 대하여 교차반응을 일으킬 수 있는 HI 항체들을 발달시켰다. 가장 높은 역가들은 두 번째 및/또는 세 번째 면역조치 후 측정되었다. 21, 42, 64 및 70 일에서 H1N1 A/Swine/Ned/25/80 HI 항체 역가들(GMT)은 각각 6 (범위 5-7.5), 24 (범위 5-60), 32 (범위 20-80) 및 19 (범위 5-70)이었다. 21, 42, 64 및 70 일에 H1N1 A/Swine/Italy/14432/76 HI 항체 역가들은 각각 16 (범위 5-50), 38 (범위 10-80), 63 (범위 40-160) 및 42 (범위 20-120)이었다. 21, 42, 64 및 70 일에 H1N1 A/New Jersey/08/76 HI 항체 역가들은 각각 5, 26 (범위 7.5-70), 39 (범위 5-80) 및 29 (범위 20-50)이었다.
그룹 4 (백신 A, 15 μg HA; 비강내)
모든 동물들이 두 번째 면역조치 후 3 개의 먼(distant) 바이러스들에 대하여 교차반응을 일으킬 수 있는 HI 항체들을 발달시켰다. 세 번째 면역조치는 증가된 HI 역가들을 야기하지 않았다. 21, 42, 64 및 70 일에 H1N1 A/Swine/Ned/25/80 HI 항체 역가들(GMT)은 각각 42 (범위 5-90), 239 (범위 20-1120), 88 (범위 50-160) 및 75 (범위 40-160)이었다. 21, 42, 64 및 70 일에 H1N1 A/Swine/Italy/14432/76 HI 항체 역가들 (GMT)은 각각 78 (범위 5-280), 327 (범위 35-1280), 153 (범위 80-320) 및 105 (범위 70-160)이었다. 21, 42, 64 및 70 일에 H1N1 A/New Jersey/08/76 HI 항체 역가들 (GMT)은 각각 25 (범위 5-80), 176 (범위 60-400), 64 (범위 40-140) 및 63 (범위 40-160)였다.
그룹 5 (백신 A, 30 μg HA; 비강내)
1 개를 제외한 모든 동물들은 H1N1 A/Swine/Ned/25/80에 대하여 교차반응을 일으킬 수 있는 HI 항체들을 발달시켰다. 모든 동물들은 H1N1 A/Swine/Italy/14432/76 및 H1N1 A/New Jersey/08/76에 대하여 교차반응을 일으킬 수 있는 HI 항체들을 발달시켰다. 가장 높은 역가들은 두 번째 및/또는 세 번째 면역조치 후 측정되었다. 21, 42, 64 및 70 일에 H1N1 A/Swine/Ned/25/80 HI 항체 역가들(GMT)은 각각 23 (범위 5-80), 41 (범위 5-320), 42 (범위 5-320) 및 34 (범위 5-320)이었다. 21, 42, 64 및 70 일에 H1N1 A/Swine/Italy/14432/76 HI 항체 역가들(GMT)은 각각 39 (범위 5-160), 54 (범위 5-640), 78 (범위 20-720) 50 (범위 5-480)이었다. 21, 42, 64 및 70 일에 H1N1 A/New Jersey/08/76 HI 항체 역가들(GMT)은 각각 9 (범위 5-30), 40 (범위 5-400), 35 (범위 5-160) 및 27 (범위 5-160)이었다.
그룹 6 (백신 B, 15 μg HA; 비강내)
모든 동물들은 H1N1 A/Swine/Italy/14432/76에 대하여 교차반응을 일으킬 수 있는 HI 항체들을 발달시켰다. 1 개를 제외한 모든 동물들은 H1N1 A/Swine/Ned/25/80에 대하여 교차반응을 일으킬 수 있는 HI 항체들을 발달시켰고, 1 개를 제외한 모든 동물들은 H1N1 A/New Jersey/08/76에 대하여 교차반응을 일으킬 수 있는 HI 항체들을 발달시켰다. 가장 높은 역가들은 두 번째 및/또는 세 번째 면역조치 후 측정되었다. 21, 42, 64 및 70 일에 H1N1 A/Swine/Ned/25/80 HI 항체 역가들(titers) (GMT)은 각각 7 (범위 5-40), 19 (범위 5-80), 15 (범위 5-80) 및 9 (범위 5-40)이었다. 21, 42, 64 및 70 일에 H1N1 A/Swine/Italy/14432/76 HI 항체 역가들(titers) (GMT)은 각각 9 (범위 5-160), 32 (범위 5-160), 27 (범위 5-160), 15 (범위 5-80)였다. 21, 42, 64 및 70 일에 H1N1 A/New Jersey/08/76 HI 항체 역가들(GMT)는 각각 8 (범위 5-80), 47 (범위 10-240), 19 (범위 5-140) 및 13 (범위 5-80)였다.
VN
항체
역가들
:
동종(homologous): H1N1 A/The Netherlands/602/2009
VN 항체 역가들이 모든 실험 동물들로부터의 혈청 샘플들로부터 측정되었다. 기하 평균 VN 역가들은 도 3에 도시되어 있다. 모든 전-혈청들(0 일)은 VN 항체 음성이었다 (역가: ≤ 8).
그룹에 의한 VN 역가들의 분석은 하기 결과들을 보였다:
그룹 1 (식염수(saline); 감염 대조군)
≤ 64로 측정된 42 일에 수집된 모든 혈청 샘플들은 하나만 빼고 VN 항체 음성이었다.
그룹 2 (플루아릭스(Fluarix)®; 비경구(parenteral) 대조군)
모든 혈청 샘플들은 VN 항체 음성이었다.
그룹 3 (백신 A, 5 μg HA; 비강내)
첫 번째 면역조치 후 수집된 6 개 중 4 개 샘플들이 낮은 VN 항체 양성이었다 (21 일; GMT: 19 범위, 8-64). 두 번째 면역조치 후 수집된 모든 샘플들은 VN 항체 양성이었다. 두 번째 면역조치 후 (42 일; GMT: 242, 범위, 64-859) 및 세 번째 면역조치 후 (64 일; GMT: 995, 범위 362-2436) 5 마리 동물들에서 VN 항체 역가들이 상당히 증가했다. 70 일(시험감염일)에 수집된 샘플들은 64 일에 측정된 그것들보다 비슷하거나(comparable) 또는 더 낮은 VN 역가들을 보였다(70 일; GMT: 535, 범위 304-859).
그룹 4 (백신 A, 15 μg HA; 비강내)
첫 번째 면역조치 후 수집된 6 개 중 5 개 샘플들이 VN 항체 양성이었다 (21 일; GMT: 147 범위, 8-724). 두 번째 면역조치 후 수집된 모든 샘플들이 VN 항체 양성이었다. 두 번째 면역조치 후 5 마리 동물들에서 (42 일; GMT: 2376, 범위, 64-8192) 그리고 세 번째 면역조치 후 2 마리 동물들에서 (64 일; GMT: 1688, 범위 662-4871) VN 항체 역가들이 상당히 증가하였다. 70 일(시험감염일)에 수집된 샘플들은 64 일에 측정된 그것들과 비슷한(comparable) VN 역가들을 보였다(70 일; GMT: 1581, 범위 351-3444).
그룹 5 (백신 A, 30 μg HA; 비강내)
첫 번째 면역조치 후 수집된 모든 샘플들이 VN 항체 양성이었다 (21 일; GMT: 74, 범위 11-627). 두 번째 면역조치 후 6 마리 중 5마리 동물들에서 (42 일; GMT: 504, 범위 41-3435) 그리고 세 번째 면역조치 후 6 마리 중 3 마리 동물들에서 (64 일; GMT: 1673 범위 724-4884) VN 항체 역가들이 상당히 증가했다. 70 일(시험감염일)에 수집된 샘플들은 64 일에 측정된 그것들과 비슷한 VN 역가들을 보였다(70 일; GMT: 1699, 범위 304-5793).
그룹 6 (백신 B, 15 μg HA; 비강내)
첫 번째 면역조치 후 수집된 6 개 중 2개 샘플들이 낮은 VN 항체 양성이었다 (21 일; GMT: 12, 범위 8-64). 두 번째 면역조치 후 수집된 모든 샘플들이 VN 항체 양성이었다 (42 일;GMT: 78, 범위 32-304). 세 번째 면역조치 후 VN 항체 역가들이 증가하였다 (64 일; GMT: 242, 범위 113-747). 70 일(시험감염일)에 수집된 샘플들은 64일에 측정된 그것들과 비슷하거나, 또는 더 낮은 VN 역가들을 보였다(70 일; GMT: 177, 범위 91-362).
이종기원(heterologous): H1N1 A/Swine/Ned/25/80, H1N1 A/Swine/Italy/14432/76. 먼(distant) 바이러스들 H1N1 A/Swine/Ned/25/80 및 H1N1 A/Swine/Italy/14432/76에 대한 VN 항체 역가들이 시험되었다(데이터는 기재하지 않음). 모든 그룹들 3, 4, 5, 및 6은 그룹들 1 및 2를 42, 64 및 70 일에 능가하였다(outperform).
실시예
2
모든 실험 동물들에 대하여, 특정 임상적 및 병리학적 파라미터들, 즉, 사망(mortality), 체온, 체중, 공기가 통하는(aerated) 폐 용량(volumes), 폐들 및 비갑개들(turbinates)에서 바이러스 로드(load), 상기도에서 바이러스 쉐딩(shedding), 폐 무게의 사후 육안으로 보이는(macroscopic) 병리학적 조사, 병변이 발생한(lesion affected) 폐 조직의 평균 퍼센트가 결정되었다. 폐들 및 비갑개들(nasal turbinates)의 염증 파라미터들의 현미경을 이용한 조사. 동물 그룹들 3, 4 및 5 는 그룹들 1 및 2를 시험된 모든 육안으로 보이는(macroscopic) 그리고 대부분의 현미경을 이용한 파라미터들에서 능가하였다(데이터는 기재하지 않음).
상기도 및
하기도에서
바이러스 복제
시험감염 후 0, 1, 2, 3 및 4 일에 코 및 인후 표본들(swabs)이 마취 하 동물들로부터 채취되었다. 시험감염 4일 후에 페럿들이 마취 하 방혈(exsanguination)에 의하여 안락사되고, 그 후 전신 육안병리학(gross-pathology)이 수행되고, 조직들이 수집되었다. 오른쪽 비갑개(nose turbinate) 및 오른쪽 폐의 모든 엽들(lobes) 및 부엽(accessory lobe)의 샘플들이 수집되었고, 추가의 공정들까지 -80 ℃에서 저장되었다. 비갑개(turbinate) 및 폐 샘플들이 무게가 측정되었고, 그 다음에 0.5% 락트알부민(lactalbumin), 10% 글리세롤, 200 U/ml 페니실린(penicillin), 200 μg/ml 스트렙토마이신, 100 U/ml 폴리믹신(polymyxin) B 설페이트, 250 μg/ml 젠타마이신(gentamycin), 및 50 U/ml 니스타틴(nystatin) (ICN Pharmaceuticals, Zoetermeer, The Netherlands)을 포함하는 Hank's 평형 염 용액에서 FastPrep-24 (MP Biomedicals, Eindhoven, The Netherlands)로 균질화되고, 희석 전 가볍게 원심분리되었다.
수집 후, 코 및 인후 표본들(swabs)이 조직 샘플들의 공정에 사용된 동일한 매질(medium)에서 -80 ℃에서 저장되었다. 폐의 4 회 10-배 순차적 희석액들 및 표본 상청액들은 전에 기재한 바와 같이(Rimmelzwaan GF et al.,J Virol Methods 1998 Sep;74(1)57-66) MDCK 세포들의 융합성(confluent) 층들에서 바이러스 역가들을 결정하는데 이용되었다.
육안병리학
(
gross
-
pathology
) 및 조직병리학(
histopathology
)
동물들은 전술한 바와 같이(van den Brand JM et al.,PLoS One 2012;7(8)e42343), 표준 프로토콜에 따라 검시되었다(necropsied). 요약하자면, 기도(trachea)가 죄여져서(clamped off), 영향을 받은 폐 실질(parenchyma)의 영역을 정확하게 시각적으로 정량화할 수 있도록 흉강(pleural cavity)을 열자마자 폐가 공기를 빼지 않았다. 왼쪽 폐의 조직학적 조사를 위한 샘플들이 채취되었고, (포르말린이 천천히 투입된 후) 10 % 중성(neutral)- 완충된(buffered) 포르말린에서 저장되었고, 파라핀에 끼워넣고(embed), 4 μm로 절단되고, 그리고 광학현미경으로 조사하기 위하여 헤마톡실린(haematoxylin) 및 에오신(eosin) (HE)으로 염색되었다. 샘플들은 표준화된 방법들로 채취되었고, 육안병리학(gross pathology)에서 관찰된 변화로 가이드되지 않았다. 폐에서 인플루엔자 바이러스-관련된 염증의 반정량적(Semi-quantitative) 평가(assessment)는 전술한 바와 같이 수행되었다(표 4)(Munster VJ et al.,Science 2009 Jul 24;325(5939):481-3). 모든 슬라이드들이 동물들의 처리 또는 정체의 지식 없이 시험되었다.
하부도 및 폐에서 바이러스 로드(
load
) 결과들
대조군 그룹들 1 (비강내(i.n.) 식염수) 및 2 (비경구 TIV)의 모든 페럿들은 폐(평균 역가들; 각각 5.7 및 5.5 log10TCID50/그램(gram) 조직) 및 비갑개(nasal turbinates) (평균 역가들: 각각 7.2 및 6.9 log10TCID50/그램 조직)에서 높은 역가들의 복제 괜찮은(competent) 바이러스를 보였다(표 3). 그룹들 3, 4 및 5 (비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원 pH1N1/09 백신들)의 페럿들은 그것들의 폐들 및 비갑개에 감지될만한 감염성 바이러스를 갖지 않았다. 그룹 6 (비강내(i.n.) 15 μg HA에서 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 전체 바이러스)의 페럿들은 대조군 그룹 1에 비교할 때 4.1 log10TCID50/그램 조직의 평균 역가로 비갑개(nasal turbinates)에서 상당히 더 낮은 바이러스 역가 및 그것들의 폐들에서 감지될만한 감염성 바이러스를 갖지 않았다(p=0.02).
엔도신(Endocine)™ 아쥬반트된(adjuvanted) pH1N1/09 백신들로 비강내 면역조치는 식염수 또는 TIV 투여에 비교할 때 코 및 인후로부터 취해진 표본들(swabs)에서 바이러스 역가들을 감소시켰다. 코 및 인후 표본들(swabs)에서 1-4 dpi의 시간 간격으로 곡선 하 영역(area under the curve) (AUC)으로서 표현되는 바이러스 로드(loads)들은 표 3에 나타나 있다. (비강내(i.n.) 각각 5, 15 및 30 μg HA에서 엔도신(Endocine)™ 아쥬반트된(adjuvanted) 분할(split) 항원) 그룹들 3, 4 및 5의 코(nasal) 표본들(swabs)의 바이러스 로드들(loads)은, 그러나 그룹들 2 및 6에서는 아니고, 그룹 1보다 상당히 더 낮았다(그룹 1 대(versus) 그룹들 3-5; p≤0.03). 그룹 1 및 2의 인후 표본들(swabs)에서의 바이러스 로드들(loads)은 비슷했고, 그리고 그룹들 3, 4, 5 및 6에서보다 상당히 더 높았다(p≤0.03)..
육안병리학
및 조직병리학 결과들
엔도신(Endocine)™ 아쥬반트된(adjuvanted) pH1N1/09 백신들로 비강내 면역화된 그룹들에서 감소한 바이러스 복제는 폐들의 육안병리학적인 변화들의 감소와 부합하였다(표 3).
육안으로 보이는(macroscopic) 사후분석(post-mortem) 폐 병변들은 초점의(focal) 또는 다초점의(multifocal) 폐(pulmonary) 경화(consolidation)를 포함하는데(sconsisted of), 이는 실질(parenchyma)의 잘 묘사된(delineated) 적색화(reddening)로 특징된다. 대조군 그룹 1 (비강내(i.n.) 식염수) 및 그룹 2 (비경구 TIV)의 모든 페럿들은 각각 50% 및 37%의 평균 퍼센트로 영향받은 폐 조직을 보였고, 각각 1.5 및 1.3의 상대적(relative) 폐(lung) 중량(weight)(RLW)으로 해당하였다(표 3). 반면, (비강내(i.n.) 엔도신(Endocine)™ 아쥬반트된(adjuvanted) pH1N1/09 백신들) 그룹들 3, 4, 5 및 6의 폐들은 7-8%의 영향받은 폐 조직의 평균 퍼센트로, 훨씬 덜 영향받았다. 이들 4 개 엔도신(Endocine)™ 백신접종된 그룹들의 RLW들은 (0.8 내지 0.9의 밀접한 범위에서) 이들 관찰들과 일치했다.
상기 폐 경화(consolidation)는 현미경 조사에서 급성 기관지(broncho)-사이(interstitial) 폐렴(pneumonia)에 부합하였다. 그것은 폐포(alveoli)의 내강(lumina) 및 벽들 내 염증성 세포들 (주로 호중구(neutrophils)) 및 대식세포들)의 존재 또는 막을 형성한(lining) 폐포세포들(pneumocytes)의 상실에 의하여 특징된다. 게다가 단백질이 풍부한 부종(oedema) 체액(fluid), 피브린(fibrin) 가닥들(strands) 및 폐포 공간들로부터 관외로 흘러나온 적혈구들 및 타입 Ⅱ 폐포세포(pneumocyte) 과형성(hyperplasia)은 보통 폐포염(alveolitis)의 더 심각한 케이스들에서 관찰되었다. 점수화된 조직학적 파라미터들은 표 4에 정리되어 있다. 가장 심각한 폐포(alveolar) 병변들은 대조군 그룹들 1 (비강내(i.n.) 식염수) 및 2 (비경구 TIV)에서 발견되었다. 폐포(alveolar) 병변들의 모든 파라미터들은 그룹 5에서 가장 낮게 점수화되었으나, 사실 그룹들 3, 4, 5 및 6 사이의 차이들은 크지 않았다.
결론적으로, 폐들에서 - 이 페럿 모델에서 H1N1 인플루엔자 A/Netherlands/602/2009 바이러스로 기관내로(intratracheal) 시험감염하는 것은 심각한 폐렴(pneumonia)에 무시(slight)를 야기하였다. 그러나, 모든 백신접종된 그룹들로부터, 몇몇 동물들은 육안으로 보이게 인식 가능한 폐 병변들에 의하여 전혀 영향받지 않았다. 폐 병변들의 육안으로 보이는 사후분석 평가(영향받은 폐의 추정된 %)에 기초하여, 백신접종된(백신-A 15 μg HA) 그룹 4 및 백신접종된 (백신-A 30 μg HA) 그룹 5 는 둘 다 7%의 매우 낮은 점수로 동일하게 가장 적은 폐 병변들 로 고통받았고, 바로 뒤이어, 둘 다 8 %로 백신접종된 (백신-A 5 μg HA) 그룹 3 및 백신접종된 (백신-B 15 μg HA) 그룹 6 이었다. 플라시보-PBS-처리된 그룹 1 동물들은 50%의 뚜렷한 평균 점수로 가장 큰 폐 병변들로 고통받았다. 비경구적으로 백신접종된 대조군 그룹 2는 약간 덜하지만 평균 37%의 여전히 현저한 폐 병변들으로 고통받았다. 평균 상대적 폐 중량(RLW)는 영향받은 폐 조직의 이들 추정된 퍼센트들과 명백히 일치하여 영향받은 폐 조직의 이들 추정된 퍼센트들의 유효함을 입증하였다.
폐 병변들의 평가된 파라미터들의 대다수를 위한, 폐들의 현미경을 이용한(microscopic) 조사의 결과들은, 가장 높이 투여되어 백신접종된(백신-A 30 μg HA) 그룹 5에 대한 가장 높은 점수들, 및 백신-A (각각 그룹들 3 및 2)의 HA 투여량의 감소와 연관있는 호흡기 병변들에서의 점진적 진행을 확인해 주었다. 백신-B 15 μg HA로의 백신접종은 가장 낮은 투여량 백신-A 5 μg HA (그룹 3)의 결과와 거의 동일했다. 플라시보-PBS-처리(그룹 1)은 모든 평가된 병리학적 파라미터들 중 훨씬 더 가장 나쁜 점수를 얻었고, 바싹 뒤이어 비경구적으로 백신접종된 대조군 그룹 2였다. 현저하게, 모든 비강내로 백신접종된 동물들 (그룹들 3, 4, 5, 및 6) 은 폐포(alveolar) 출혈(haemorrhage)로부터 보호되었다.
종합적인 결과- 그러므로, 결론적으로 이 페럿 바이러스 시험감염 모델에서 평균된 병리학적 점수들에 기초하여, 백신-A 30 μg HA (그룹 5)로 한 백신접종이 가장 우수하게 수행되었으며, 가장 적은 호흡기 병변들을 야기한 반면, 플라시보-PBS-처리는 가장 나쁘게 수행되었고, 제일 호흡기 병변들을 야기했다. 백신-A 15 μg HA (그룹 4)로 한 백신접종은 그룹 5에 비하면 약간 덜하게 수행되었으며, 뒤이어 백신-B 15 μg HA (그룹 6)로 한 백신접종과 비교하여 거의 비슷하게 수행된 백신-A 5 μg HA (그룹 3)으로 한 백신접종이었다. 백신의 타입 및 투여량에 관계없이 모든 비강내로 백신접종된 동물들은 폐포 출혈로부터 보호되었다. 비경구 대조군 백신접종 (그룹 2)는 뚜렷한 호흡기 병변들로 저조하게 수행되었고, 플라시보-PBS-처리 (그룹 1)에 비하여 단지 아주 조금 나았다.
실시예
3
하기 표 2 및 도 4는 나이브한 페럿들에서 본 발명의 백신을 다른 제품들, 플루미스트(FluMist) 및 주사 가능한 백신들과 비교한다.
* Baras et al. Vaccine 29 (2011) 2120-2126
# Chen et al. JID 2011:203
¤ 유로시네(Eurocine) 백신들(Vaccines): 본 연구
GSK 1가(monovalent) 전세계적 유행병(pandemic) 백신 (GSK H1N1), Novartis 3가(trivalent) 불활성화된 백신 (Novartis TIV), GSK 3가(trivalent) 불활성화된 백신 (GSK TIV) 그룹들은 15 미만(below)의 중화(neutralization) 역가(titer) (NT)의 역가를 가졌다.
결과들은 20 mg/ml (2 %) 엔도신(Endocine)TM과 15 μg HA 분할(split) 인플루엔자 항원을 여기에 포함하는 본 발명의 백신 조성물, 이뮤노스(Immunose)TM FLU이 메딤뮨(Medimmune)의 전세계적 유행병(pandemic) LAIV 백신 FluMist와 유사한 중화 역가들을 보였고(도 5 참조), 그리고 주입된 백신들보다 우수한 역가들을 보인 반면, 비-아쥬반트된 TIV는 좋지 못한 반응을 주는 것을 보였다.
실시예들에서 사용된 약어들:
HA 인플루엔자 바이러스 혈구응집소(hemagglutinin) 단백질
TCID50 조직(Tissue) 배양(culture) 감염성(infectious) 투여량(dose) 50 %
PBMC 말초(Peripheral) 혈액(blood) 단핵(mononuclear) 세포들
HI 인플루엔자(Influenza) 혈구응집 억제 분석
SOP 표준(Standard) 수술(Operation) 공정(Procedure)
PBS 인산(Phosphate) 완충(buffered) 식염수(saline)
EDTA 에틸렌(Ethylene) 디아민(diamine) 테트라아세트산(tetraacetic acid)
GMT 기하(Geometric) 평균(mean) 역가들(titers) (혈청학적 데이터를 표현하는데 사용됨)
FCS 태아(Fetal) 송아지(Calf) 혈청(Serum) (배양 배지 보충물)
VN 바이러스 중화(neutralization) 분석
DMSO 디메틸(Dimethyl) 설폭사이드(Sulfoxide)
Claims (35)
- 나이브한 대상들에서 사용을 위한, 비강내로 투여되는 백신으로서 사용을 위한, 하기를 포함하는 조성물:
하나 또는 그 이상의 살아있지 않은(non-live) 항원들, 및
하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질(mediium), 및
선택적으로 하나 또는 그 이상의 모노-글리세라이드들.
- 제 1항에 있어서,
상기 백신은 소아과적(pediatric) 사용을 위한 것인 조성물.
- 제 1항 또는 제 2항에 있어서,
상기 백신은 인플루엔자 나이브한 대상들을 위한 것인 조성물.
- 제 1항 내지 제 3항 중 어느 한 항에 있어서,
상기 조성물은 바이러스 쉐딩(shedding)을 감소시키기 위하여 나이브한 대상들에서 사용되기 위한 것인 조성물.
- 제 1항 내지 제 4항 중 어느 한 항에 있어서,
상기 백신은 어린이들에게 사용하기 위한 것인 조성물.
- 제 1항 내지 제 5항 중 어느 한 항에 있어서,
상기 어린이들은 6살 또는 그 미만과 같은, 8살 미만인 조성물.
- 제 1항 내지 제 6항 중 어느 한 항에 있어서,
상기 어린이들은 6 개월 내지 8살 미만의 나이와 같은, 바람직하게는 6 개월 내지 7살 미만의 나이인, 2 개월 내지 9살 미만의 나이의 어린이들인 조성물.
- 제 1항 내지 제 7항 중 어느 한 항에 있어서,
인플루엔자 백신으로서 사용을 위한 조성물.
- 제 1항 내지 제 8항 중 어느 한 항에 있어서,
상기 백신은 인플루엔자 나이브한 대상들에서 인플루엔자에 대한 면역조치를 위한 것인 조성물.
- 제 1항 내지 제 9항 중 어느 한 항에 있어서,
상기 나이브한 대상들은 전세계적으로 유행병인(pandemic) 지역(zone)의 임의의 나이의 사람들 및 12 살 미만의 어린이들로 구성된 군으로부터 선택되는 것인 조성물.
- 제 1항 내지 제 10항 중 어느 한 항에 있어서,
상기 백신은 페리-판데믹(peri-pandemic) 또는 전세계적 유행인(pandemic) 감염성 병원체에 대한 면역조치를 위한 것인 조성물.
- 제 1항 내지 제 11항 중 어느 한 항에 있어서,
상기 백신은 유아들, 어린이들 및 성인들에서 전세계적 유행인 전염성 병원체에 대한 면역조치를 위한 것인 조성물.
- 제 1항 내지 제 12항 중 어느 한 항에 있어서,
상기 백신은 유아, 어린이들 및 성인들에서 감염성 병원체에 대한 면역조치를 위한 것인 조성물.
- 제 1항 내지 제 13항 중 어느 한 항에 있어서,
상기 살아있지 않은 인플루엔자 바이러스 항원은 전체 불활성화된 바이러스, 분할 바이러스 및 인플루엔자 항원의 서브유닛으로 구성된 군으로부터 선택되는 조성물.
- 제 1항 내지 제 14항에 있어서,
상기 살아있지 않은 인플루엔자 바이러스 항원은 분할 항원인 조성물.
- 제 1항 내지 제 15ㅎ아 중 어느 한 항에 있어서,
상기 하나 또는 그 이상의 모노-글리세라이드들은 라우르산(lauric acid) (C12), 미리스트산(myristic acid) (C14), 팔미트산(palmitic acid) (C16), 팔미톨레산(palmitoleic acid) (C16: 1), 올레산(oleic acid) (C18: 1), 리놀레산(linoleic acid) (C18:2), 스테아르산(stearic acid), 헥사노익산(hexanoic acid), 카프릴산(caprylic acid), 데칸산(decanoic acid) (카프르산(capric acid)), 아라키드산(arachidic acid), 베헨산(behenic acid), 리그노세르산(lignoceric acid), 알파-리놀렌산(linolenic acid), 스테아리돈산(stearidonic acid), 에이코사펜타에노익산(eicosapentaenoic acid), 도코사헥사에노익산(docosahexaenoic acid), 감마-리놀렌산(linolenic acid), 다이호모(dihomo)-감마-리놀렌산(linolenic acid), 아라키돈산(arachidonic acid), 에루크산(erucic acid), 네르본산(nervonic acid)으로 구성되는 군으로부터 선택되는 카르복실산들로 모노-에스테르화된 글리세라이드들인 조성물.
- 제 1항 내지 제 16항에 있어서,
상기 하나 또는 그 이상의 모노-글리세라이드들은 팔미톨레산(palmitoleic acid) (C16: 1), 올레산(oleic acid) (C18: 1) 및 리놀레산(linoleic acid) (C18:2)로 구성되는 군으로부터 선택되는 카르복실산들로 모노에스테르화된 글리세라이드들인 조성물.
- 제 1항 내지 제 17항 중 어느 한 항에 있어서,
상기 하나 또는 그 이상의 모노-글리세라이드들은 올레산(글리세릴(glyceryl) 올리에이트(oleate))으로 모노에스테르화된 글리세라이드인 조성물.
- 제 1항 내지 제 18항 중 어느 한 항에 있어서,
상기 하나 또는 그 이상의 카르복실산들은 라우르산(lauric acid), 미리스트산(myristic acid), 팔미트산(palmitic acid), 팔미톨레산(palmitoleic acid), 올레산(oleic acid), 리놀레산(linoleic acid) 스테아르산(stearic acid), 헥사노익산(hexanoic acid), 카프리산(caprylic acid), 데칸산(decanoic acid) (카프르산(capric acid)), 아라키드산(arachidic acid), 베헨산(behenic acid), 리그노세르산(lignoceric acid), 알파-리놀렌산(linolenic acid), 스테아리돈산(stearidonic acid), 에이코사펜타에노익산(eicosapentaenoic acid), 도코사펙사에노익산(docosahexaenoic acid), 감마-리놀렌산(linolenic acid), 다이호모(dihomo)-감마-리놀렌산(linolenic acid), 아라키돈산(arachidonic acid), 에루크산(erucic acid) 및 네르본산(nervonic acid)으로 구성된 군으로부터 선택되는 것인 조성물.
- 제 1항 내지 제 19항 중 어느 한 항에 있어서,
하나 또는 그 이상의 카르복실산들은 올레산 및 라우르산으로 구성된 군으로부터 선택되는 것인 조성물.
- 제 1항 내지 제 20항 중 어느 한 항에 있어서,
상기 카르복실산은 올레산인 조성물.
- 제 1항 내지 제 21항에 있어서,
상기 아쥬반트는 글리세릴(glyceryl) 올리에이트(oleate), 올레산(oleic acid) 및 수성 매질(medium)을 포함하는 것인 조성물.
- 제 1항 내지 제 22항에 있어서,
상기 백신 조성물은 백신 조성물 100 ml 당 약 0.1 g 내지 약 5.0 g 의 범위의, 또는 100 ml 당 약 0.1 g 약 2.0 g의 범위의, 또는 0.5 g 내지 약 1.5 g 과 같은, 약 0.5 g 내지 약 2.0 g의 양의 모노글리세라이드들을 포함하는 것인 조성물.
- 제 1항 내지 제 23항 중 어느 한 항에 있어서,
상기 백신 조성물은 백신조성물의 100 mL 당 약 0.1 g 부터 약 5.0 g 까지의 범위의, 또는 100 mL 당 약 0.1 g 내지 약 2.0 g 의 범위의, 또는 100 mL 당 0.5 g 내지 약 1.5 g와 같은, 약 0.5 g 내지 약 2.0 g의 양의 카르복실산들을 포함하는 조성물.
- 제 1항 내지 제 24항 중 어느 한 항에 있어서,
아쥬반트 혼합(mix)에 하나 또는 그 이상의 카르복실산들을 갖는 하나 또는 그 이상의 모노글리세라이드들은 백신의 기껏해야 10% w/v, 또는 기껏해야 5% w/v, 또는 기껏해야 4% w/v, 또는 기껏해야 3% w/v, 또는 기껏해야 2% w/v 또는 기껏해야 1 % w/v인 조성물.
- 제 1항 내지 제 25항 중 어느 한 항의 조성물을 포함하는 백신 조성물의 약학적으로 효과적인 양을 비강내로 투여하는 단계를 포함하는, 페리-판데믹(peri-pandemic) 또는 전세계적 유행(pandemic) 기간 동안의 면역조치 방법.
- 제 1항 내지 제 25항 중 어느 한 항의 조성물을 포함하는 백신 조성물의 약학적으로 효과적인 양을 비강내로 투여하는 단계를 포함하는 소아과적 대상들의 면역조치 방법.
- 제 1항 내지 제 25항 중 어느 한 항의 조성물을 포함하는 백신 조성물의 약학적으로 효과적인 양을 비강내로 투여하는 단계를 포함하는 나이브한 대상들에서의 면역조치 방법.
- 소아과의 면역손상된 대상들에 비강내로 투여되는 백신으로서의 사용을 위한, 하기를 포함하는 조성물:
하나 또는 그 이상의 살아있지 않은 인플루엔자 바이러스 항원들, 및
하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실 산들,
수성 매질(medium), 및
선택적으로 하나 또는 그 이상의 모노-글리세라이드들.
- 제 29항에 있어서,
인플루엔자에 대한 소아과적 면역손상된 대상들에 비강내로 투여되는 백신으로서 사용을 위한 조성물.
- 제 29항 또는 제 30항에 있어서,
상기 소아과적 면역손상된 대상들은 HIV 감염된 대상들; 면역억제제를 투여하는 대상들, 최근에 장기 이식받은 사람; 조산된 아기들, 및 수술후 환자들인 사람들로 구성되는 군으로부터 선택되는 조성물.
- 나이브한 면역손상된 환자들에서의 사용을 위한 비강내로 투여되는 백신으로서의 사용을 위한, 하기를 포함하는 조성물:
i) 하나 또는 그 이상의 살아있지 않은 항원들, 및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질(medium),및
선택적으로 하나 또는 그 이상의 모노-글리세라이드들.
- 제 32항에 있어서,
인플루엔자에 대하여 나이브한 면역손상된 대상들에 비강내로 투여되는 백신으로서 사용을 위한 것인 조성물.
- 제 32항 또는 33항에 있어서,
상기 소아과의(pediatic) 면역손상된 대상들은 HIV 손상된 대상들;면역억제제들 투여하는 대상들, 최근 장기 이식받은 사람들; 조산된 아기들, 및 수술 후 환자들인 사람들로 구성되는 군으로부터 선택되는 것인 조성물.
- 스트렙토코커스(Streptococcus) 뉴모니애(pneumoniae)의 감염과 관련된 증상들의 심각도를 감소시키기 위하여 또는 스트렙토코커스(Streptococcus) 뉴모니애(pneumoniae)의 감염의 예방을 위한 면역손상된 및/또는 나이브한 대상들에서의 사용을 위한 비강내로 투여되는 백신으로서의 사용을 위한, 하기를 포함하는 조성물:
i) 하나 또는 그 이상의 스트렙토코커스 뉴모니애 항원들, 및
ii) 하기를 포함하는 아쥬반트:
하나 또는 그 이상의 카르복실산들,
수성 매질, 및
선택적으로 하나 또는 그 이상의 모노-글리세라이드들.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12197522.1A EP2742952A1 (en) | 2012-12-17 | 2012-12-17 | Influenza vaccine composition |
| EP12197522.1 | 2012-12-17 | ||
| PCT/EP2013/077006 WO2014095943A1 (en) | 2012-12-17 | 2013-12-17 | Vaccine composition for naive subjects |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020217000812A Division KR20210007042A (ko) | 2012-12-17 | 2013-12-17 | 나이브한 대상들을 위한 백신 조성물 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150132092A true KR20150132092A (ko) | 2015-11-25 |
Family
ID=47358019
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020217000812A KR20210007042A (ko) | 2012-12-17 | 2013-12-17 | 나이브한 대상들을 위한 백신 조성물 |
| KR1020157019562A KR20150132093A (ko) | 2012-12-17 | 2013-12-17 | 면역손상된 인구들에서의 사용을 위한 백신 조성물 |
| KR1020157019558A KR20150132092A (ko) | 2012-12-17 | 2013-12-17 | 나이브한 대상들을 위한 백신 조성물 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020217000812A KR20210007042A (ko) | 2012-12-17 | 2013-12-17 | 나이브한 대상들을 위한 백신 조성물 |
| KR1020157019562A KR20150132093A (ko) | 2012-12-17 | 2013-12-17 | 면역손상된 인구들에서의 사용을 위한 백신 조성물 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US11065325B2 (ko) |
| EP (4) | EP2742952A1 (ko) |
| JP (3) | JP2016502996A (ko) |
| KR (3) | KR20210007042A (ko) |
| CN (3) | CN104884085A (ko) |
| AU (2) | AU2013360890B2 (ko) |
| BR (2) | BR112015014243A8 (ko) |
| CA (2) | CA2895028A1 (ko) |
| HK (2) | HK1212611A1 (ko) |
| MX (2) | MX2015007753A (ko) |
| RU (2) | RU2661407C2 (ko) |
| WO (2) | WO2014095944A1 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2592210C2 (ru) * | 2010-09-30 | 2016-07-20 | Юросайн Вэксинз Аб | Усовершенствованные композиции вакцин |
| CA2962214A1 (en) | 2014-09-26 | 2016-03-31 | Seqirus UK Limited | Vaccination of immunocompromised subjects |
| DK3197487T3 (da) * | 2014-09-26 | 2022-09-05 | Seqirus Uk Ltd | Vaccination af immunsvækkede individer |
| RU2634247C2 (ru) * | 2015-09-28 | 2017-10-24 | Федеральное государственное бюджетное научное учреждение "СЕВЕРО-КАВКАЗСКИЙ ЗОНАЛЬНЫЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ВЕТЕРИНАРНЫЙ ИНСТИТУТ" (ФГБНУ СКЗНИВИ) | Способ стимуляции иммунного ответа и препарат для его осуществления |
| US20200306364A1 (en) * | 2017-11-30 | 2020-10-01 | Ohio State Innovation Foundation | Mucoadhesive nanoparticle entrapped influenza virus vaccine delivery system |
| AR121829A1 (es) * | 2020-04-16 | 2022-07-13 | Bayer Ag | Combinaciones de compuestos activos y composiciones fungicidas que los comprenden |
| US20230133087A1 (en) * | 2020-04-16 | 2023-05-04 | Bayer Aktiengesellschaft | Active compound combinations and fungicide compositions comprising those |
| WO2021209368A1 (en) * | 2020-04-16 | 2021-10-21 | Bayer Aktiengesellschaft | Active compound combinations and fungicide compositions comprising those |
| CN112063699B (zh) * | 2020-09-16 | 2021-06-18 | 成都市疾病预防控制中心 | 一种用于研究hiv感染者免疫衰老机制的系统 |
| WO2023133342A2 (en) * | 2022-01-10 | 2023-07-13 | The Children's Medical Center Corporation | Methods and compositions relating to immunization of immune distinct patients |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE9602280D0 (sv) | 1996-06-10 | 1996-06-10 | Pharmatrix Ab | Immunstimulerande lipidformulering |
| SE9900496D0 (sv) | 1999-02-12 | 1999-02-12 | Pharmatrix Ab | Vaccine formulation |
| US8410248B2 (en) | 1999-03-12 | 2013-04-02 | Human Genome Sciences Inc. | HWBAO62 polypeptides |
| WO2002080648A2 (en) | 2001-04-05 | 2002-10-17 | Chiron Corporation | Mucosal boosting following parenteral priming |
| US20050208602A1 (en) | 2001-08-10 | 2005-09-22 | Rosen Craig A | 89 human secreted proteins |
| AU2003301843A1 (en) | 2002-05-17 | 2004-06-07 | Human Genome Sciences, Inc. | 157 human secreted proteins |
| SI1567191T1 (sl) | 2002-11-26 | 2011-01-31 | Eurocine Vaccines Ab | Novi adjuvans na aminski osnovi |
| CN1867355A (zh) | 2003-08-11 | 2006-11-22 | 财团法人阪大微生物病研究会 | 包含诱导粘膜免疫的佐剂的新型疫苗 |
| EP1885393A4 (en) | 2005-05-18 | 2011-03-02 | Childrens Hosp & Res Ct Oak | METHODS AND COMPOSITIONS FOR IMMUNIZATION AGAINST CHLAMYDIA INFECTIONS |
| EP1910387B1 (en) | 2005-06-30 | 2016-11-16 | Eisai R&D Management Co., Ltd. | Compounds for preparing immunological adjuvant |
| WO2007018152A1 (ja) | 2005-08-05 | 2007-02-15 | The University Of Tokushima | IgA抗体の選択的産生からIgA及びIgG両抗体産生への切換えを可能にする抗原薬物ビークルとこれを用いる経鼻・粘膜ワクチン |
| RU2323742C1 (ru) * | 2007-02-15 | 2008-05-10 | Государственное учреждение Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова (ГУ НИИВС им. И.И. Мечникова) | Способ повышения иммуногенности инактивированной гриппозной вакцины |
| EP2227251A1 (en) | 2007-12-06 | 2010-09-15 | GlaxoSmithKline Biologicals SA | Influenza composition |
| AU2009293595A1 (en) | 2008-05-23 | 2010-03-25 | The Regents Of The University Of Michigan | Nanoemulsion adjuvants |
| CA2725329C (en) | 2008-05-23 | 2013-10-01 | The Regents Of The University Of Michigan | Nanoemulsion vaccines |
| US20130178383A1 (en) | 2008-11-12 | 2013-07-11 | David Spetzler | Vesicle isolation methods |
| CN103221541B (zh) | 2009-05-28 | 2017-03-01 | 库尔纳公司 | 通过抑制抗病毒基因的天然反义转录物来治疗抗病毒基因相关疾病 |
| RU2592210C2 (ru) | 2010-09-30 | 2016-07-20 | Юросайн Вэксинз Аб | Усовершенствованные композиции вакцин |
-
2012
- 2012-12-17 EP EP12197522.1A patent/EP2742952A1/en not_active Withdrawn
-
2013
- 2013-12-17 KR KR1020217000812A patent/KR20210007042A/ko not_active Application Discontinuation
- 2013-12-17 JP JP2015547077A patent/JP2016502996A/ja active Pending
- 2013-12-17 EP EP13805935.7A patent/EP2931307B1/en not_active Not-in-force
- 2013-12-17 EP EP18193418.3A patent/EP3431101A1/en not_active Withdrawn
- 2013-12-17 CA CA2895028A patent/CA2895028A1/en not_active Abandoned
- 2013-12-17 BR BR112015014243A patent/BR112015014243A8/pt not_active Application Discontinuation
- 2013-12-17 US US14/650,809 patent/US11065325B2/en active Active
- 2013-12-17 KR KR1020157019562A patent/KR20150132093A/ko not_active Application Discontinuation
- 2013-12-17 BR BR112015014174A patent/BR112015014174A2/pt not_active Application Discontinuation
- 2013-12-17 WO PCT/EP2013/077007 patent/WO2014095944A1/en active Application Filing
- 2013-12-17 AU AU2013360890A patent/AU2013360890B2/en not_active Ceased
- 2013-12-17 CA CA2895023A patent/CA2895023A1/en not_active Abandoned
- 2013-12-17 CN CN201380065856.0A patent/CN104884085A/zh active Pending
- 2013-12-17 MX MX2015007753A patent/MX2015007753A/es unknown
- 2013-12-17 CN CN202110039199.9A patent/CN112826929A/zh active Pending
- 2013-12-17 EP EP13811462.4A patent/EP2931308B1/en not_active Not-in-force
- 2013-12-17 WO PCT/EP2013/077006 patent/WO2014095943A1/en active Application Filing
- 2013-12-17 AU AU2013360889A patent/AU2013360889C1/en not_active Ceased
- 2013-12-17 RU RU2015129028A patent/RU2661407C2/ru not_active IP Right Cessation
- 2013-12-17 JP JP2015547078A patent/JP2016502997A/ja active Pending
- 2013-12-17 RU RU2015129077A patent/RU2661408C2/ru not_active IP Right Cessation
- 2013-12-17 US US14/650,807 patent/US20150306204A1/en not_active Abandoned
- 2013-12-17 MX MX2015007688A patent/MX2015007688A/es unknown
- 2013-12-17 CN CN201380065877.2A patent/CN104870010A/zh active Pending
- 2013-12-17 KR KR1020157019558A patent/KR20150132092A/ko active Application Filing
-
2016
- 2016-01-20 HK HK16100580.8A patent/HK1212611A1/zh unknown
- 2016-02-14 HK HK16101591.3A patent/HK1213492A1/zh unknown
-
2019
- 2019-03-18 JP JP2019049330A patent/JP2019112448A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2013360889B2 (en) | Vaccine composition for naive subjects | |
| KR101696727B1 (ko) | 인플루엔자 백신 | |
| KR20140069379A (ko) | 인플루엔자 백신 | |
| JP2011057605A (ja) | 粘膜投与型ワクチン | |
| JP5918870B2 (ja) | インフルエンザに対する改善されたワクチン接種 | |
| Maltais et al. | Intranasally administered Endocine™ formulated 2009 pandemic influenza H1N1 vaccine induces broad specific antibody responses and confers protection in ferrets | |
| WO2016109656A1 (en) | Recombinant influenza virus vaccines for influenza and respiratory syncytial virus | |
| JP2009209086A (ja) | 粘膜投与型ワクチン | |
| US8535683B2 (en) | Intranasal or inhalational administration of virosomes | |
| Lee et al. | Protection against respiratory syncytial virus by inactivated influenza virus carrying a fusion protein neutralizing epitope in a chimeric hemagglutinin | |
| Fonseca et al. | Immunological profile of mice immunized with a polyvalent virosome-based influenza vaccine | |
| KR20090016659A (ko) | 비로좀을 기제로 한 비강내 인플루엔자 백신 | |
| US20080038294A1 (en) | Intranasal or inhalational administration of virosomes | |
| WO2023047419A1 (en) | A vaccine for coronavirus and influenza virus, and method for preparation thereof | |
| Willis | The Effect of Maternal Antibodies on Anti-viral Immunity in Infant Mice | |
| CN111148532A (zh) | 疫苗组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application | ||
| A107 | Divisional application of patent |