JP2010209259A - 光活性化合物及び化学増幅型フォトレジスト組成物 - Google Patents
光活性化合物及び化学増幅型フォトレジスト組成物 Download PDFInfo
- Publication number
- JP2010209259A JP2010209259A JP2009058584A JP2009058584A JP2010209259A JP 2010209259 A JP2010209259 A JP 2010209259A JP 2009058584 A JP2009058584 A JP 2009058584A JP 2009058584 A JP2009058584 A JP 2009058584A JP 2010209259 A JP2010209259 A JP 2010209259A
- Authority
- JP
- Japan
- Prior art keywords
- group
- photoactive
- compound
- hydrocarbon group
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Landscapes
- Materials For Photolithography (AREA)
- Silicon Polymers (AREA)
Abstract
【解決手段】環状ポリシロキサンと、該環状ポリシロキサンを構成する珪素原子に結合した1又は2以上の側鎖と、を備え、前記側鎖のうち少なくとも一部が、光の作用により酸を発生する光活性基を含み、該光活性基が同一分子中に複数存在するときそれらは同一でも異なっていてもよい、光活性化合物。
【選択図】なし
Description
モノマー(b1):酸の作用により分解してカルボキシル基を生成する、炭素数6〜20の脂環式炭化水素基を有するアクリル系モノマー
モノマー(b2):水酸基(ただし、カルボキシル基中の−OH基は除く)で置換されたアダマンチル基を有するアクリル系モノマー
モノマー(b3):ラクトン環を有するアクリル系モノマー
で表される基を示し、R32及びR33はそれぞれ独立に、カルボキシル基、シアノ基又は炭素数1〜4の炭化水素基を示す。tは0〜5の整数を示し、t’及びt’’はそれぞれ独立に0〜3の整数を示す。同一分子中の複数のR32及びR33は、互いに同一でも異なってもよい。
(1)溶剤を含有する化学増幅型フォトレジスト組成物を基板上に塗布する工程、
(2)塗布された化学増幅型フォトレジスト組成物から溶剤を除去してフォトレジスト層を形成する工程、
(3)フォトレジスト層上に水を含む浸漬流体の層を直接形成する工程、
(3)浸漬流体を解してフォトレジスト層に露光する工程、
(4)露光されたフォトレジスト層を加熱する工程、及び
(5)加熱されたフォトレジスト層をアルカリ現像する工程、
をこの順に備える。
Applied Organometallic Chemistry 2003 (17) 287−290頁に従って、下記の手順で化合物(α)を合成した。
1H−NMR(270MHz、CDCl3)δ=0.2ppm(48H)、4.7pp(8H)
上記で得た合成中間体としての化合物(α)と、下記各化学式で示される化合物とを以下の手順で反応させて、光活性基が導入された光活性化合物を合成した。
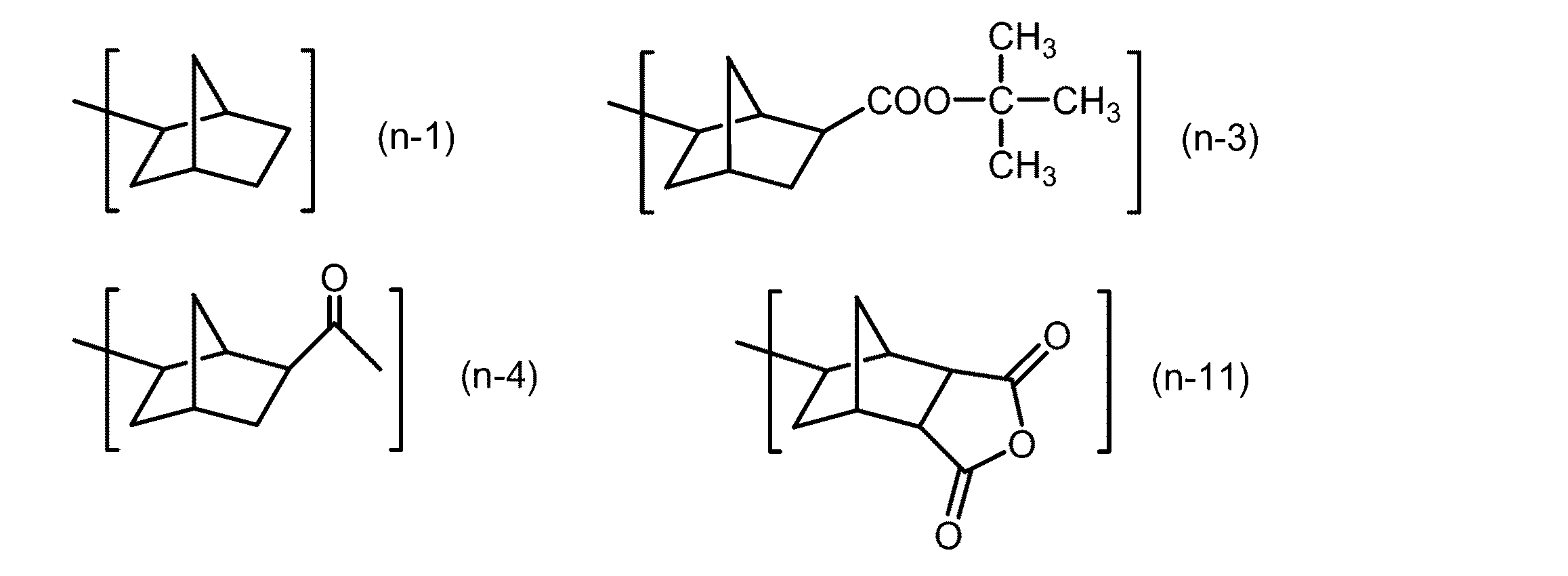
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)2.4g、化合物(N−1)1.0g、化合物(N−2)4.9g及びトルエン23.8gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.05mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.6gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−1)を得た。GPC測定による光活性化合物(XX−1)の重量平均分子量は2870であり、その分散度は1.18であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)1.9g、(N−1)0.6g、(N−2)2.0g、(N−3)1.3g及びトルエン19.3gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.04mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.5gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−2)を得た。GPC測定による光活性化合物(XX−2)の重量平均分子量は2560であり、その分散度は1.18であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換とした。そこに化合物(α)2.0g、化合物(N−1)0.6g、化合物(N−2)2.1g、化合物(N−4)0.9g及びトルエン20.4gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.05mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.5gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−3)を得た。GPC測定による光活性化合物(XX−3)の重量平均分子量は2070であり、その分散度は1.15であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)2.0g、化合物(N−1)0.6g、化合物(N−5)0.7g、化合物(N−4)1.2g及びトルエン20.4gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.05mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.5gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−4)を得た。GPC測定による光活性化合物(XX−4)の重量平均分子量は1790であり、その分散度は1.07であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)2.0g、化合物(N−1)0.6g、化合物(N−5)1.4g、化合物(N−4)0.9g及びトルエン20.4gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.05mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.5gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−5)を得た。GPC測定による光活性化合物(XX−5)の重量平均分子量は2020であり、その分散度は1.10であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)2.0g、化合物(N−1)0.6g、化合物(N−6)0.7g、化合物(N−4)1.2g及びトルエン20.4gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.05mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.5gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、そこにプロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−6)を得た。GPC測定による光活性化合物(XX−6)の重量平均分子量は1700であり、その分散度は1.05であった。
冷却管、温度計および攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)2.0g、化合物(N−1)0.6g、化合物(N−6)1.4g、化合物(N−4)0.9g及びトルエン40.7gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.09mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.5gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−7)を得た。GPC測定による光活性化合物(XX−7)の重量平均分子量は1740であり、その分散度は1.09であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)2.0g、化合物(N−1)0.6g、化合物(N−7)1.4g、化合物(N−4)0.9g及びトルエン20.4gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.05mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.5gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−8)を得た。GPC測定による光活性化合物(XX−8)の重量平均分子量は1800であり、その分散度は1.07であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)1.0g、化合物(N−1)0.3g、化合物(N−8)0.6g、化合物(N−4)0.6g及びトルエン10.2gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.02mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.3gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−9)を得た。GPC測定による光活性化合物(XX−9)の重量平均分子量は1920であり、その分散度は1.11であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)1.5g、化合物(N−1)0.5g、化合物(N−9)0.9g、化合物(N−4)0.7g及びトルエン15.3gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.03mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.4gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−10)を得た。GPC測定による光活性化合物(XX−10)の重量平均分子量は1740であり、その分散度は1.09であった。
冷却管、温度計および攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)1.5g、化合物(N−1)0.5g、化合物(N−10)1.0g、化合物(N−4)0.7g及びトルエン15.3gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.03mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.4gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、光活性化合物(XX−11)を得た。GPC測定による光活性化合物(XX−11)の重量平均分子量は1960であり、その分散度1.08であった。
化合物(Y1)の合成
冷却管、温度計および攪拌装置を備えた四つ口フラスコ内を窒素置換した。そこに化合物(α)4.0g、化合物(N−1)3.7g及びトルエン15.3gを仕込み、これを撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.09mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.4gを加えて、1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、化合物(Y1)を得た。GPC測定による光活性化合物(Y1)の重量平均分子量は1450であり、その分散度1.01であった。
冷却管、温度計及び攪拌装置を備えた四つ口フラスコ内を窒素雰囲気とした。そこに化合物(α)4.0g、化合物(N−11)6.5g及びトルエン25.0gを仕込み撹拌した。そこへPt(0)−1,3−ジビニル−1,1,3,3−テトラメチルジシロキサン錯体キシレン溶液(Pt含有量2%)0.09mLを仕込み、12時間撹拌を行った。得られた反応液に活性炭0.7gを加えて1時間撹拌した。その後、濾過により濾液を回収した。回収された濾液を濃縮し、プロピレングリコールメチルエーテルアセテートを加えて、更に濃縮を行い、化合物(Y2)を得た。化合物(Y2)のGPC測定による重量平均分子量は3650であり、その分散度は1.46であった。
酸の作用によりアルカリ現像液に可溶となる樹脂として、下記各化学式で表されるモノマーA、B、C、D及びEから構成される共重合体(樹脂(A1))を合成した。
以下に示す各成分を、表1に記載された比率で混合して溶解し、さらに孔径0.2μmのフッ素樹脂製フィルターで濾過して、化学増幅型フォトレジスト組成物を調製した。
酸発生剤C1:下記化学式で表される化合物
クエンチャーQ1:2,6−ジイソプロピルアニリン
下記組成を有する混合溶剤D1:
プロピレングリコールモノメチルエーテルアセテート 270部
プロピレングリコールモノメチルエーテル 20部
2−ヘプタノン 35部
γ−ブチロラクトン 3部
(1)ラインエッジラフネス(LWR)
シリコンウェハーに、有機反射防止膜用組成物[ARC−29A−8;日産化学工業(株)製]を塗布し、205℃、60秒の条件でベークすることによって厚さ780Åの有機反射防止膜を形成させた。次いでこの上に、上記の各化学増幅型フォトレジスト組成物を乾燥後の膜厚が0.08μmとなるようにスピンコートした。スピンコートされた化学増幅型フォトレジスト組成物を、プロキシミティホットプレート上にて85℃で60秒間の加熱によりプリベークして、有機反射防止膜上にレジスト膜を形成させた。形成されたレジスト膜に対して、ArFエキシマスキャナー[FPA−5000AS3;キヤノン(株)製;NA=0.75、3/4Annular]を用い、露光量を段階的に変化させながらラインアンドスペースパターンを露光した。
シリコンウェハー上に、上記の各化学増幅型フォトレジスト組成物を、その乾燥後の膜厚が0.08μmとなるようにスピンコートした。スピンコートされた化学増幅型フォトレジスト組成物を、プロキシミティホットプレート上にて85℃で60秒間の加熱によりプリベークして、ウェハー上にレジスト膜を形成させた。形成された未露光のレジスト膜の水に対する後退角及び接触角を、接触角測定装置(Drop Master−700;協和界面科学製)を用いて測定した。接触角は、液滴法により1μLの水をレジスト膜上に滴下し、0.1秒後に測定した。後退角は、傾斜法により、50μLの水を用いて、段階傾斜モードで測定した。
Claims (8)
- 環状ポリシロキサンと、該環状ポリシロキサンを構成する珪素原子に結合した1又は2以上の側鎖と、を備え、前記側鎖のうち少なくとも一部が、光の作用により酸を発生する光活性基を含み、該光活性基が同一分子中に複数存在するときそれらは同一でも異なっていてもよい、光活性化合物。
- 下記一般式(I)で表される、請求項1に記載の光活性化合物。
[式(I)中、R1、R2、R3、R4、R5、R6、R7及びR8はそれぞれ独立に、下記一般式(a1)又は(a2):
で表される基を示し、式(a1)及び式(a2)中、
Qa、Qb及びQcはそれぞれ独立に、置換基を有していてもよい脂肪族炭化水素基を示し、同一分子中に含まれる複数のQa、Qb及びQcは同一でも異なっていてもよく、
mは1〜10の整数を示し、nは0〜10の整数を示し、
R1、R2、R3、R4、R5、R6、R7及びR8から選ばれる少なくとも1つにおいて、Qa、Qb及びQcから選ばれる少なくとも1つが、前記光活性基を置換基として有する脂肪族炭化水素基である。] - 前記光活性基を置換基として有する脂肪族炭化水素基がQbである、請求項2に記載の光活性化合物。
- 前記光活性基を置換基として有する前記脂肪族炭化水素基が、前記光活性基を置換基として有する脂環式炭化水素基であり、該脂環式炭化水素基の環状構造を構成する炭素原子の一部が酸素原子及び/又はカルボニル基で置換されていてもよい、請求項2又は3に記載の光活性化合物。
- 請求項1〜7のいずれか一項に記載の光活性化合物と、酸の作用によりアルカリ現像液に可溶となる樹脂と、を含有する、化学増幅型フォトレジスト組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009058584A JP5702525B2 (ja) | 2009-03-11 | 2009-03-11 | 光活性化合物及び化学増幅型フォトレジスト組成物 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009058584A JP5702525B2 (ja) | 2009-03-11 | 2009-03-11 | 光活性化合物及び化学増幅型フォトレジスト組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010209259A true JP2010209259A (ja) | 2010-09-24 |
| JP5702525B2 JP5702525B2 (ja) | 2015-04-15 |
Family
ID=42969767
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009058584A Active JP5702525B2 (ja) | 2009-03-11 | 2009-03-11 | 光活性化合物及び化学増幅型フォトレジスト組成物 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5702525B2 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012050065A1 (ja) * | 2010-10-14 | 2012-04-19 | 日産化学工業株式会社 | 単分子層又は多分子層形成用組成物 |
| JP2013129649A (ja) * | 2011-11-22 | 2013-07-04 | Central Glass Co Ltd | 珪素化合物、縮合物およびそれを用いたレジスト組成物、ならびにそれを用いるパターン形成方法 |
| JP2013167706A (ja) * | 2012-02-14 | 2013-08-29 | Jsr Corp | 液浸露光用レジスト組成物 |
| JP2015056312A (ja) * | 2013-09-12 | 2015-03-23 | 三菱化学株式会社 | 非水系電解液及びそれを用いた非水系電解液二次電池 |
| WO2018047759A1 (ja) * | 2016-09-07 | 2018-03-15 | 住友化学株式会社 | 硬化物、波長変換シート、発光装置、封止用部材および半導体発光装置 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004012012A1 (ja) * | 2002-07-30 | 2004-02-05 | Hitachi, Ltd. | 電子装置の製造方法 |
| JP2004189602A (ja) * | 2002-12-06 | 2004-07-08 | Kri Inc | 光活性化合物及び感光性樹脂組成物並びにパターン形成方法 |
| JP2004530921A (ja) * | 2001-03-12 | 2004-10-07 | ユニバーシティ オブ ノース カロライナ アット シャルロット | 次世代リソグラフィー用の高分解能レジスト |
| US20060063103A1 (en) * | 2004-09-23 | 2006-03-23 | International Business Machines Corporation | Radiation-sensitive composition and method of fabricating a device using the radiation-sensitive composition |
| JP2007137800A (ja) * | 2005-11-16 | 2007-06-07 | Chisso Corp | 感光性化合物、添加用化合物、これらを含有するポジ型感光性組成物、及びこのポジ型感光性組成物の膜を有する表示素子 |
| US20070254235A1 (en) * | 2006-04-28 | 2007-11-01 | International Business Machines Corporation | Self-topcoating resist for photolithography |
| JP2007293160A (ja) * | 2006-04-27 | 2007-11-08 | Asahi Kasei Corp | 感光性かご状シルセスキオキサン化合物 |
| JP2008083384A (ja) * | 2006-09-27 | 2008-04-10 | Fujifilm Corp | ポジ型レジスト組成物及びそれを用いたパターン形成方法 |
-
2009
- 2009-03-11 JP JP2009058584A patent/JP5702525B2/ja active Active
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004530921A (ja) * | 2001-03-12 | 2004-10-07 | ユニバーシティ オブ ノース カロライナ アット シャルロット | 次世代リソグラフィー用の高分解能レジスト |
| WO2004012012A1 (ja) * | 2002-07-30 | 2004-02-05 | Hitachi, Ltd. | 電子装置の製造方法 |
| JP2004189602A (ja) * | 2002-12-06 | 2004-07-08 | Kri Inc | 光活性化合物及び感光性樹脂組成物並びにパターン形成方法 |
| US20060063103A1 (en) * | 2004-09-23 | 2006-03-23 | International Business Machines Corporation | Radiation-sensitive composition and method of fabricating a device using the radiation-sensitive composition |
| JP2007137800A (ja) * | 2005-11-16 | 2007-06-07 | Chisso Corp | 感光性化合物、添加用化合物、これらを含有するポジ型感光性組成物、及びこのポジ型感光性組成物の膜を有する表示素子 |
| JP2007293160A (ja) * | 2006-04-27 | 2007-11-08 | Asahi Kasei Corp | 感光性かご状シルセスキオキサン化合物 |
| US20070254235A1 (en) * | 2006-04-28 | 2007-11-01 | International Business Machines Corporation | Self-topcoating resist for photolithography |
| JP2008083384A (ja) * | 2006-09-27 | 2008-04-10 | Fujifilm Corp | ポジ型レジスト組成物及びそれを用いたパターン形成方法 |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012050065A1 (ja) * | 2010-10-14 | 2012-04-19 | 日産化学工業株式会社 | 単分子層又は多分子層形成用組成物 |
| US9023583B2 (en) | 2010-10-14 | 2015-05-05 | Nissan Chemical Industries, Ltd. | Monolayer or multilayer forming composition |
| JP2013129649A (ja) * | 2011-11-22 | 2013-07-04 | Central Glass Co Ltd | 珪素化合物、縮合物およびそれを用いたレジスト組成物、ならびにそれを用いるパターン形成方法 |
| JP2013167706A (ja) * | 2012-02-14 | 2013-08-29 | Jsr Corp | 液浸露光用レジスト組成物 |
| JP2015056312A (ja) * | 2013-09-12 | 2015-03-23 | 三菱化学株式会社 | 非水系電解液及びそれを用いた非水系電解液二次電池 |
| WO2018047759A1 (ja) * | 2016-09-07 | 2018-03-15 | 住友化学株式会社 | 硬化物、波長変換シート、発光装置、封止用部材および半導体発光装置 |
| CN109661418A (zh) * | 2016-09-07 | 2019-04-19 | 住友化学株式会社 | 固化物、波长转换片材、发光装置、密封用构件及半导体发光装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP5702525B2 (ja) | 2015-04-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5125832B2 (ja) | 感放射線性樹脂組成物 | |
| JP5516195B2 (ja) | パターン形成方法及びレジスト材料 | |
| TWI465848B (zh) | 正型光阻組成物,光阻圖型之形成方法,高分子化合物 | |
| JP4361527B2 (ja) | 化学増幅型シリコーン系ポジ型ホトレジスト組成物、それを用いた二層レジスト材料及びそれらに用いられるラダー型シリコーン共重合体 | |
| US8663904B2 (en) | Norbornene-type polymers, compositions thereof and lithographic process using such compositions | |
| KR20120052884A (ko) | 염기 반응성 포토애시드 발생제 및 이를 포함하는 포토레지스트 | |
| JP5702525B2 (ja) | 光活性化合物及び化学増幅型フォトレジスト組成物 | |
| JP2001051422A (ja) | 感放射線レジスト組成物 | |
| JP2009120612A (ja) | 感光性化合物及びそれを含むフォトレジスト組成物 | |
| TWI596121B (zh) | 高分子化合物之製造方法,光阻組成物及光阻圖型之形成方法 | |
| KR101324202B1 (ko) | 술포닐기를 포함하는 포토레지스트 모노머, 폴리머 및 이를포함하는 포토레지스트 조성물 | |
| JP3427133B2 (ja) | レジスト材料 | |
| US7592122B2 (en) | Photoresist composition, and low-molecular compound and high-molecular compound for the photoresist composition | |
| TWI471700B (zh) | A positive resist composition, a photoresist pattern formation method, and a polymer compound | |
| WO2008007578A1 (fr) | Composé, générateur d'acide, composition de résist et procédé de formation d'un motif de résist | |
| TW200804261A (en) | Compound, positive resist composition and formation method of resist pattern | |
| TWI498369B (zh) | 抗蝕劑用酸擴散抑制劑及包含它的抗蝕劑組合物 | |
| TW201235349A (en) | Resist composition, method of forming resist pattern, polymer compound, compound | |
| KR20080023657A (ko) | 포토레지스트 모노머, 폴리머 및 이를 포함하는포토레지스트 조성물 | |
| JP2008203612A (ja) | ネガ型レジスト組成物およびレジストパターン形成方法 | |
| US8124311B2 (en) | Photosensitive molecular compound and photoresist composition including the same | |
| KR101253292B1 (ko) | 감광성 고분자 및 이를 포함하는 포토레지스트 조성물 | |
| KR100787853B1 (ko) | 아크릴계 포토레지스트 모노머, 폴리머 및 이를 포함하는포토레지스트 조성물 | |
| JP2009067795A (ja) | 感光性化合物及びこれを含むフォトレジスト組成物 | |
| KR20070019450A (ko) | 감광성 고분자 및 이를 포함하는 포토레지스트 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111118 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20130321 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130423 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130530 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140304 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140421 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141125 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150107 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150217 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150220 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5702525 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |