JP2005298870A - 電解採取による金属インジウムの回収方法 - Google Patents
電解採取による金属インジウムの回収方法 Download PDFInfo
- Publication number
- JP2005298870A JP2005298870A JP2004114180A JP2004114180A JP2005298870A JP 2005298870 A JP2005298870 A JP 2005298870A JP 2004114180 A JP2004114180 A JP 2004114180A JP 2004114180 A JP2004114180 A JP 2004114180A JP 2005298870 A JP2005298870 A JP 2005298870A
- Authority
- JP
- Japan
- Prior art keywords
- indium
- aqueous solution
- acid
- acidic
- cathode
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 229910052738 indium Inorganic materials 0.000 title claims abstract description 108
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 title claims abstract description 101
- 229910052751 metal Inorganic materials 0.000 title claims abstract description 83
- 239000002184 metal Substances 0.000 title claims abstract description 83
- 238000000034 method Methods 0.000 title claims abstract description 83
- 238000005363 electrowinning Methods 0.000 title claims abstract description 47
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 claims abstract description 84
- 239000007864 aqueous solution Substances 0.000 claims abstract description 79
- ROOXNKNUYICQNP-UHFFFAOYSA-N ammonium persulfate Chemical class [NH4+].[NH4+].[O-]S(=O)(=O)OOS([O-])(=O)=O ROOXNKNUYICQNP-UHFFFAOYSA-N 0.000 claims abstract description 76
- 230000002378 acidificating effect Effects 0.000 claims abstract description 45
- 238000005868 electrolysis reaction Methods 0.000 claims abstract description 43
- 239000003792 electrolyte Substances 0.000 claims abstract description 33
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 claims abstract description 32
- 229910001449 indium ion Inorganic materials 0.000 claims abstract description 30
- 239000012528 membrane Substances 0.000 claims abstract description 26
- 238000005341 cation exchange Methods 0.000 claims abstract description 25
- 238000011084 recovery Methods 0.000 claims abstract description 10
- 150000003839 salts Chemical class 0.000 claims abstract description 6
- 229910001870 ammonium persulfate Inorganic materials 0.000 claims description 37
- 239000008151 electrolyte solution Substances 0.000 claims description 36
- -1 alkali metal salt Chemical class 0.000 claims description 34
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 claims description 18
- 229910052921 ammonium sulfate Inorganic materials 0.000 claims description 18
- 235000011130 ammonium sulphate Nutrition 0.000 claims description 18
- AJAXZLXLXZWIIE-UHFFFAOYSA-N indium;hydrochloride Chemical compound Cl.[In] AJAXZLXLXZWIIE-UHFFFAOYSA-N 0.000 claims description 18
- 150000003863 ammonium salts Chemical class 0.000 claims description 17
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 claims description 17
- 229910052783 alkali metal Inorganic materials 0.000 claims description 15
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 claims description 13
- 229910052938 sodium sulfate Inorganic materials 0.000 claims description 10
- 235000011152 sodium sulphate Nutrition 0.000 claims description 10
- 235000019395 ammonium persulphate Nutrition 0.000 claims description 9
- JRKICGRDRMAZLK-UHFFFAOYSA-N peroxydisulfuric acid Chemical compound OS(=O)(=O)OOS(O)(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-N 0.000 claims description 9
- 235000010265 sodium sulphite Nutrition 0.000 claims description 8
- PQUCIEFHOVEZAU-UHFFFAOYSA-N Diammonium sulfite Chemical compound [NH4+].[NH4+].[O-]S([O-])=O PQUCIEFHOVEZAU-UHFFFAOYSA-N 0.000 claims description 5
- 238000005070 sampling Methods 0.000 claims description 5
- 229910000337 indium(III) sulfate Inorganic materials 0.000 claims description 3
- RODAKIFYLYKDTD-UHFFFAOYSA-N indium;sulfuric acid Chemical compound [In].OS(O)(=O)=O RODAKIFYLYKDTD-UHFFFAOYSA-N 0.000 claims description 2
- XGCKLPDYTQRDTR-UHFFFAOYSA-H indium(iii) sulfate Chemical compound [In+3].[In+3].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O XGCKLPDYTQRDTR-UHFFFAOYSA-H 0.000 claims 1
- 239000000243 solution Substances 0.000 abstract description 51
- 238000004519 manufacturing process Methods 0.000 abstract description 14
- 238000005260 corrosion Methods 0.000 abstract description 6
- 230000007797 corrosion Effects 0.000 abstract description 6
- 239000000126 substance Substances 0.000 abstract description 6
- 239000000460 chlorine Substances 0.000 abstract description 4
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 abstract description 3
- 229910052801 chlorine Inorganic materials 0.000 abstract description 3
- 239000002253 acid Substances 0.000 abstract 1
- 125000005385 peroxodisulfate group Chemical group 0.000 abstract 1
- 230000008719 thickening Effects 0.000 abstract 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 20
- 229910021645 metal ion Inorganic materials 0.000 description 16
- 238000003860 storage Methods 0.000 description 16
- 238000006243 chemical reaction Methods 0.000 description 13
- 229910000510 noble metal Inorganic materials 0.000 description 11
- 238000002425 crystallisation Methods 0.000 description 10
- 230000008025 crystallization Effects 0.000 description 10
- 150000002500 ions Chemical class 0.000 description 10
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 9
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 239000011701 zinc Substances 0.000 description 8
- 239000007788 liquid Substances 0.000 description 7
- 239000012452 mother liquor Substances 0.000 description 7
- 239000002994 raw material Substances 0.000 description 7
- CHQMHPLRPQMAMX-UHFFFAOYSA-L sodium persulfate Chemical compound [Na+].[Na+].[O-]S(=O)(=O)OOS([O-])(=O)=O CHQMHPLRPQMAMX-UHFFFAOYSA-L 0.000 description 7
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 6
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 6
- 229910001882 dioxygen Inorganic materials 0.000 description 6
- 239000001301 oxygen Substances 0.000 description 6
- 229910052760 oxygen Inorganic materials 0.000 description 6
- 229940001482 sodium sulfite Drugs 0.000 description 6
- 229920003934 Aciplex® Polymers 0.000 description 5
- 229910052782 aluminium Inorganic materials 0.000 description 5
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 5
- 150000001768 cations Chemical class 0.000 description 5
- 238000004090 dissolution Methods 0.000 description 5
- 239000007789 gas Substances 0.000 description 5
- 239000012535 impurity Substances 0.000 description 5
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 4
- 238000004070 electrodeposition Methods 0.000 description 4
- 238000000605 extraction Methods 0.000 description 4
- 238000005342 ion exchange Methods 0.000 description 4
- 238000007254 oxidation reaction Methods 0.000 description 4
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 4
- 229910052697 platinum Inorganic materials 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 229910052725 zinc Inorganic materials 0.000 description 4
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 3
- QCWXUUIWCKQGHC-UHFFFAOYSA-N Zirconium Chemical compound [Zr] QCWXUUIWCKQGHC-UHFFFAOYSA-N 0.000 description 3
- 239000004063 acid-resistant material Substances 0.000 description 3
- 239000003513 alkali Substances 0.000 description 3
- SOIFLUNRINLCBN-UHFFFAOYSA-N ammonium thiocyanate Chemical compound [NH4+].[S-]C#N SOIFLUNRINLCBN-UHFFFAOYSA-N 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 150000002739 metals Chemical class 0.000 description 3
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 229910052726 zirconium Inorganic materials 0.000 description 3
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 239000010953 base metal Substances 0.000 description 2
- 238000005266 casting Methods 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 238000002848 electrochemical method Methods 0.000 description 2
- 239000007772 electrode material Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 239000003595 mist Substances 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 150000002978 peroxides Chemical class 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- OTYBMLCTZGSZBG-UHFFFAOYSA-L potassium sulfate Chemical compound [K+].[K+].[O-]S([O-])(=O)=O OTYBMLCTZGSZBG-UHFFFAOYSA-L 0.000 description 2
- 229910052939 potassium sulfate Inorganic materials 0.000 description 2
- BHZRJJOHZFYXTO-UHFFFAOYSA-L potassium sulfite Chemical compound [K+].[K+].[O-]S([O-])=O BHZRJJOHZFYXTO-UHFFFAOYSA-L 0.000 description 2
- 235000011151 potassium sulphates Nutrition 0.000 description 2
- 235000019252 potassium sulphite Nutrition 0.000 description 2
- 239000010970 precious metal Substances 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 229910001220 stainless steel Inorganic materials 0.000 description 2
- 239000010935 stainless steel Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- LCPVQAHEFVXVKT-UHFFFAOYSA-N 2-(2,4-difluorophenoxy)pyridin-3-amine Chemical compound NC1=CC=CN=C1OC1=CC=C(F)C=C1F LCPVQAHEFVXVKT-UHFFFAOYSA-N 0.000 description 1
- WWILHZQYNPQALT-UHFFFAOYSA-N 2-methyl-2-morpholin-4-ylpropanal Chemical compound O=CC(C)(C)N1CCOCC1 WWILHZQYNPQALT-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M Thiocyanate anion Chemical compound [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical compound ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 1
- 229910001361 White metal Inorganic materials 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 229910001413 alkali metal ion Inorganic materials 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 229940101006 anhydrous sodium sulfite Drugs 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 238000007743 anodising Methods 0.000 description 1
- 239000003518 caustics Substances 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000005352 clarification Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000000498 cooling water Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 238000000151 deposition Methods 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- RJMMFJHMVBOLGY-UHFFFAOYSA-N indium(3+) Chemical compound [In+3] RJMMFJHMVBOLGY-UHFFFAOYSA-N 0.000 description 1
- 238000009776 industrial production Methods 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- IQPQWNKOIGAROB-UHFFFAOYSA-N isocyanate Chemical compound [N-]=C=O IQPQWNKOIGAROB-UHFFFAOYSA-N 0.000 description 1
- QTWZICCBKBYHDM-UHFFFAOYSA-N leucomethylene blue Chemical compound C1=C(N(C)C)C=C2SC3=CC(N(C)C)=CC=C3NC2=C1 QTWZICCBKBYHDM-UHFFFAOYSA-N 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 238000007670 refining Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 238000007790 scraping Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 239000004590 silicone sealant Substances 0.000 description 1
- 229910001415 sodium ion Inorganic materials 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 238000005987 sulfurization reaction Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000010969 white metal Substances 0.000 description 1
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P10/00—Technologies related to metal processing
- Y02P10/20—Recycling
Landscapes
- Electrolytic Production Of Non-Metals, Compounds, Apparatuses Therefor (AREA)
- Electrolytic Production Of Metals (AREA)
Abstract
【解決手段】不溶性電極を配置した陽極室の電解液を硫酸、酸性硫酸、亜硫酸若しくは酸性亜硫酸のアルカリ金属塩の水溶液とし、陰極室の電解液をインジウムイオンを含有する水溶液とし、前記陰極室と前記陽極室との間に陽イオン交換膜を存在させて電解を行い、陰極に金属インジウムを得るとともに陽極液中にペルオキシ二硫酸のアルカリ金属塩を生成させ、該陽極液の濃縮によってこれを得る電解採取による金属インジウムの回収方法。
【選択図】なし
Description
2Cl- = Cl2 + 2e-
2.陰極電解液としてインジウム塩酸塩水溶液を陰極室に満たし、陽極電解液として硫酸を陽極に満たす。
3.陰極室の塩素イオン及び陽極室の硫酸イオンは、いずれも、陽イオン交換膜に遮られるため、他方の電解室に移動することができない。
4.陽イオン交換膜は、1価の陽イオンを透過させるが、多価の陽イオンを透過させないので、3価のインジウムカチオンは、陽極室に移動することができない。
5.その結果、電解反応は、次のように進行する(例えば、非特許文献1参照)。
(カソード反応) In3+ + 3e - = In
(全反応) In3+ + 3/2H2O = In + 3/4O2 ↑+ 3H +
2HSO4 - −2e- → S2O8 2-+2H+ E0 =2.057V
2SO4 2- −2e- → S2O8 2- E0 =1.939V
(アノード反応) 6HSO4 - +6NH4 + − 6e - = 3(NH4)2S2O8+6H+
(カソード反応) 2In3+ +6e- = 2In
(全体の反応) 2In3+ +6NH4 + + 6HSO4 - = 2In +3(NH4)2S2O8 +6H+
6(NH4)2SO4 → 12NH4 2 -+6SO4 2-
(アノード反応) 6SO4 2-+ 12NH4 + −6e- = 3(NH4)2S2O8+6NH4 +
(カソード反応) 2In3+ +6e- = 2In
(全体の反応) 2In3+ +6NH4 + + 6SO4 2- = 2In + 3(NH4)2S2O8
塩酸溶解、硫化物処理及びイオン交換処理など公知の方法により不純物を除去したインジウム塩酸溶液は、表1に示す組成であった。
塩酸溶解、硫化物処理及びイオン交換処理など公知の方法により不純物を除去したインジウム塩酸溶液は、表2に示す組成であった。
塩酸溶解、硫化物処理及びイオン交換処理などの公知の方法により、不純物を除去したインジウム塩酸溶液は、表3に示す組成を有していた。
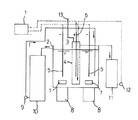
図2に示す装置を用いた。電解採取槽102 は、塩化ビニル樹脂製の深さ100mm 、幅100mm 、長さ200mm で長手方向の中央にシリコーンシーラントで固定した陽イオン交換膜104 〔旭化成(株)製、商品名:ACIPLEX K-501 〕で陰極室と陽極室に区切った。
2 電解採取槽
3 陰極室
4 陽イオン交換膜
5 陰極
6 陽極(不溶性電極)
7 攪拌回転子
8 マグネットスターラー
9 循環ポンプ
10 高濃度インジウム塩酸溶液循環貯槽
11 電解液貯蔵槽
12 循環ポンプ
13 排気管(陽極発生ガス出口)
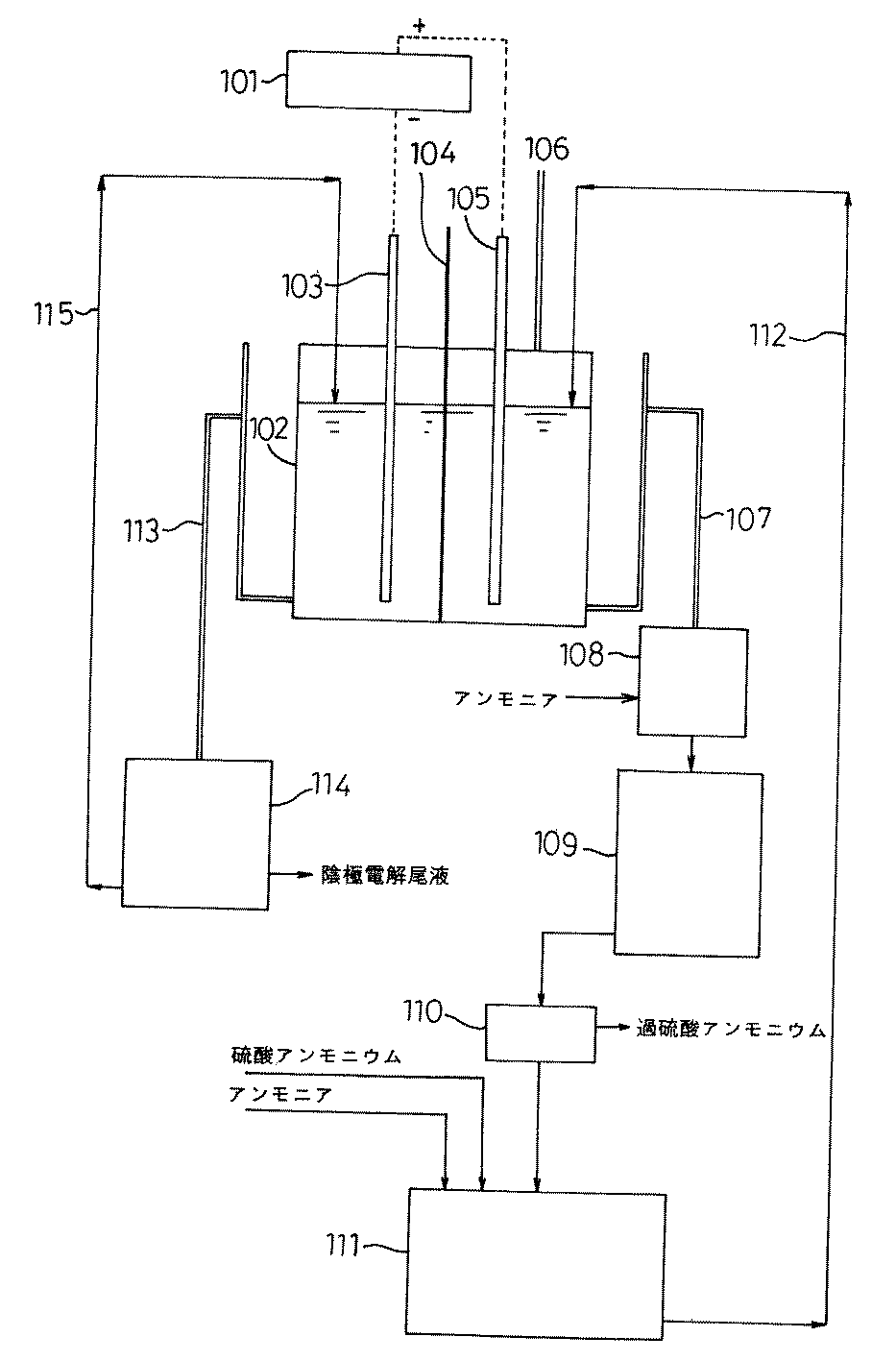
101 定電流装置
102 電解採取槽
103 陰極
104 陽イオン交換膜
105 陽極
106 陽極発生ガス出口
107 陽極電解液溢流管
108 陽極電解液貯槽
109 陽極電解液減圧濃縮装置
110 過硫酸アンモニウム取得用遠心分離器
111 過硫酸アンモニウム母液調整槽
112 陽極電解液補充仕込み管
113 陰極電解液液面調整・循環ライン
114 陰極電解液貯槽
115 陰極電解液戻りライン
Claims (11)
- インジウムイオンを含有する水溶液から金属インジウムを電解採取により回収する方法であって、不溶性電極を配置した陽極室の電解液を硫酸、酸性硫酸、亜硫酸若しくは酸性亜硫酸のアルカリ金属塩又はアンモニウム塩の水溶液とし、陰極室の電解液をインジウムイオンを含有する水溶液とし、前記陰極室と前記陽極室との間に陽イオン交換膜を存在させて電解を行い、陰極に金属インジウムを得ることを特徴とする電解採取による金属インジウムの回収方法。
- インジウムイオンを含有する水溶液が、インジウム硫酸水溶液又はインジウム塩酸水溶液である請求項1記載の回収方法。
- インジウムイオンを含有する水溶液から金属インジウムを電解採取により回収する方法であって、不溶性電極を配置した陽極室の電解液を硫酸、酸性硫酸、亜硫酸若しくは酸性亜硫酸のアンモニウム塩の水溶液とし、陰極室の電解液をインジウムイオンを含有する水溶液とし、前記陰極室と前記陽極室との間に陽イオン交換膜を存在させて電解を行い、陰極に金属インジウムを得ると共に陽極液中にペルオキシ二硫酸のアンモニウム塩を生成させ、該陽極液の濃縮によってこれを得ることを特徴とする電解採取による金属インジウムの回収方法。
- 陽極液を陽極室から外部に取り出し、減圧下で濃縮してペルオキシ二硫酸のアンモニウム塩を析出させて濾過・取得すると共に、そのペルオキシ二硫酸のアンモニウム塩に対応する量の硫酸、酸性硫酸、亜硫酸若しくは酸性亜硫酸のアンモニウム塩の水溶液を追加し、陽極室に循環させる請求項3記載の回収方法。
- 不溶性電極を配置した陽極室の電解液を、硫酸アンモニウムの水溶液及び/又は酸性硫酸アンモニウムの水溶液とする請求項3又は4記載の回収方法。
- 不溶性電極を配置した陽極室の電解液を、亜硫酸アンモニウムの水溶液及び/又は酸性亜硫酸アンモニウムの水溶液とする請求項3又は4記載の回収方法。
- インジウムイオンを含有する水溶液が、インジウム硫酸水溶液又はインジウム塩酸水溶液である請求項3〜6いずれか記載の回収方法。
- インジウムイオンを含有する水溶液から金属インジウムを電解採取により回収する方法であって、不溶性電極を配置した陽極室の電解液を硫酸、酸性硫酸、亜硫酸若しくは酸性亜硫酸のアルカリ金属塩の水溶液とし、陰極室の電解液をインジウムイオンを含有する水溶液とし、前記陰極室と前記陽極室との間に陽イオン交換膜を存在させて電解を行い、陰極に金属インジウムを得ると共に陽極液中にペルオキシ二硫酸のアルカリ金属塩を生成させ、該陽極液の濃縮によってこれを得ることを特徴とする電解採取による金属インジウムの回収方法。
- 陽極液を陽極室から外部に取り出し、減圧下で濃縮してペルオキシ二硫酸のアルカリ金属塩を析出させて濾過・取得すると共に、そのペルオキシ二硫酸のアルカリ金属塩に対応する量の硫酸、酸性硫酸、亜硫酸若しくは酸性亜硫酸のアルカリ金属塩の水溶液を追加し、陽極室に循環させる請求項8記載の回収方法。
- 不溶性電極を配置した陽極室の電解液を、硫酸ナトリウムの水溶液及び/又は酸性硫酸ナトリウムの水溶液とする請求項8又は9記載の回収方法。
- 不溶性電極を配置した陽極室の電解液を、亜硫酸ナトリウムの水溶液及び/又は酸性亜硫酸ナトリウムの水溶液とする請求項8又は9記載の回収方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004114180A JP4515804B2 (ja) | 2004-04-08 | 2004-04-08 | 電解採取による金属インジウムの回収方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004114180A JP4515804B2 (ja) | 2004-04-08 | 2004-04-08 | 電解採取による金属インジウムの回収方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005298870A true JP2005298870A (ja) | 2005-10-27 |
| JP4515804B2 JP4515804B2 (ja) | 2010-08-04 |
Family
ID=35330783
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004114180A Expired - Fee Related JP4515804B2 (ja) | 2004-04-08 | 2004-04-08 | 電解採取による金属インジウムの回収方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4515804B2 (ja) |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010007133A (ja) * | 2008-06-27 | 2010-01-14 | Daiso Co Ltd | 金属インジウム製造方法及び装置 |
| RU2490375C2 (ru) * | 2012-07-09 | 2013-08-20 | Борис Николаевич Дьяков | Электролизер для извлечения индия из индийсодержащего расплава в виде конденсата из вакуумной печи |
| JP2014040639A (ja) * | 2012-08-23 | 2014-03-06 | Sumitomo Electric Ind Ltd | 金属の製造方法 |
| KR20160027085A (ko) * | 2013-09-27 | 2016-03-09 | 제이엑스 킨조쿠 가부시키가이샤 | 고순도 In 및 그 제조 방법 |
| JP2018016834A (ja) * | 2016-07-26 | 2018-02-01 | 住友電気工業株式会社 | 電解液、電解槽用電解液、及び電解槽システム |
| US10358698B2 (en) | 2009-12-28 | 2019-07-23 | Nippon Steel Corporation | Heat resistant titanium alloy material for exhaust system part use excellent in oxidation resistance, method of production of heat resistant titanium alloy material for exhaust system part use excellent in oxidation resistance, and exhaust system |
| JP2020158862A (ja) * | 2019-03-28 | 2020-10-01 | 東レ株式会社 | 過硫酸アンモニウムの製造方法 |
| CN113789522A (zh) * | 2021-10-27 | 2021-12-14 | 湖北理工学院 | 一种电解置换结合的高纯硫酸铟制备方法 |
| CN114808042A (zh) * | 2022-06-07 | 2022-07-29 | 赵坤 | 一种阳离子膜连续电解装置及其使用方法 |
| CN119221042A (zh) * | 2024-11-29 | 2024-12-31 | 扬州新达再生资源科技有限公司 | 一种从含锌浮渣中提纯锌粉的装置及其方法 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5534700A (en) * | 1978-08-30 | 1980-03-11 | Air Liquide | Production of peroxy bisulphte alkali metal or ammonium salt |
| JPH0860264A (ja) * | 1994-08-19 | 1996-03-05 | Nikko Kinzoku Kk | 電解採取によるインジウムの回収方法 |
| WO2002088429A1 (de) * | 1999-11-11 | 2002-11-07 | Eilenburger Elektrolyse- Und Umwelttechnik Gmbh | Verfahren zur gleichzeitigen elektrochemischen herstellung von natriumdithionit und natriumperoxodisulfat |
| JP2003247090A (ja) * | 2002-02-25 | 2003-09-05 | Asahi Denka Kogyo Kk | ペルオキシ二硫酸塩の製造方法 |
-
2004
- 2004-04-08 JP JP2004114180A patent/JP4515804B2/ja not_active Expired - Fee Related
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5534700A (en) * | 1978-08-30 | 1980-03-11 | Air Liquide | Production of peroxy bisulphte alkali metal or ammonium salt |
| JPH0860264A (ja) * | 1994-08-19 | 1996-03-05 | Nikko Kinzoku Kk | 電解採取によるインジウムの回収方法 |
| WO2002088429A1 (de) * | 1999-11-11 | 2002-11-07 | Eilenburger Elektrolyse- Und Umwelttechnik Gmbh | Verfahren zur gleichzeitigen elektrochemischen herstellung von natriumdithionit und natriumperoxodisulfat |
| JP2003247090A (ja) * | 2002-02-25 | 2003-09-05 | Asahi Denka Kogyo Kk | ペルオキシ二硫酸塩の製造方法 |
Cited By (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010007133A (ja) * | 2008-06-27 | 2010-01-14 | Daiso Co Ltd | 金属インジウム製造方法及び装置 |
| US10358698B2 (en) | 2009-12-28 | 2019-07-23 | Nippon Steel Corporation | Heat resistant titanium alloy material for exhaust system part use excellent in oxidation resistance, method of production of heat resistant titanium alloy material for exhaust system part use excellent in oxidation resistance, and exhaust system |
| RU2490375C2 (ru) * | 2012-07-09 | 2013-08-20 | Борис Николаевич Дьяков | Электролизер для извлечения индия из индийсодержащего расплава в виде конденсата из вакуумной печи |
| JP2014040639A (ja) * | 2012-08-23 | 2014-03-06 | Sumitomo Electric Ind Ltd | 金属の製造方法 |
| KR20160027085A (ko) * | 2013-09-27 | 2016-03-09 | 제이엑스 킨조쿠 가부시키가이샤 | 고순도 In 및 그 제조 방법 |
| KR101696161B1 (ko) | 2013-09-27 | 2017-01-13 | 제이엑스금속주식회사 | 고순도 In 및 그 제조 방법 |
| WO2018020788A1 (ja) * | 2016-07-26 | 2018-02-01 | 住友電気工業株式会社 | 電解液、電解槽用電解液、及び電解槽システム |
| CN109477230A (zh) * | 2016-07-26 | 2019-03-15 | 住友电气工业株式会社 | 电解液、电解槽用电解液和电解槽系统 |
| JP2018016834A (ja) * | 2016-07-26 | 2018-02-01 | 住友電気工業株式会社 | 電解液、電解槽用電解液、及び電解槽システム |
| CN109477230B (zh) * | 2016-07-26 | 2021-03-30 | 住友电气工业株式会社 | 电解液、电解槽用电解液和电解槽系统 |
| JP2020158862A (ja) * | 2019-03-28 | 2020-10-01 | 東レ株式会社 | 過硫酸アンモニウムの製造方法 |
| JP7163841B2 (ja) | 2019-03-28 | 2022-11-01 | 東レ株式会社 | 過硫酸アンモニウムの製造方法 |
| CN113789522A (zh) * | 2021-10-27 | 2021-12-14 | 湖北理工学院 | 一种电解置换结合的高纯硫酸铟制备方法 |
| CN114808042A (zh) * | 2022-06-07 | 2022-07-29 | 赵坤 | 一种阳离子膜连续电解装置及其使用方法 |
| CN119221042A (zh) * | 2024-11-29 | 2024-12-31 | 扬州新达再生资源科技有限公司 | 一种从含锌浮渣中提纯锌粉的装置及其方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP4515804B2 (ja) | 2010-08-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3089595B2 (ja) | 電解採取によるインジウムの回収方法 | |
| JP2014501850A (ja) | チオ硫酸塩溶液からの金および銀の電気的回収 | |
| JPH0382720A (ja) | インジウムを回収する方法 | |
| JP5250683B2 (ja) | Pb−free廃はんだからの有価金属の回収方法 | |
| JP4515804B2 (ja) | 電解採取による金属インジウムの回収方法 | |
| CN102677062B (zh) | 一种电解再生碱性蚀刻液的方法 | |
| CN110857470B (zh) | 一种三氯化铁蚀刻液的再生与循环方法 | |
| JP7122315B2 (ja) | 電極及びその製造方法並びに再生電極の製造方法 | |
| CN104531991B (zh) | 一种低品位铜矿生物浸出液处理方法 | |
| KR100425662B1 (ko) | 염기성 탄산코발트(ii), 그의 제조방법 및 그의 용도 | |
| CA1064856A (en) | Purification of nickel electrolyte by electrolytic oxidation | |
| US4073705A (en) | Method for treating used or exhausted photographic fixing solution | |
| JP5344278B2 (ja) | 金属インジウム製造方法及び装置 | |
| CN104451688B (zh) | 一种电解再生含镍三氯化铁蚀刻废液并联产铁黄的方法 | |
| CN102534659A (zh) | 提高氯化锌电解获得高纯锌电流效率的方法 | |
| JP4501726B2 (ja) | 酸性塩化物水溶液からの鉄の電解採取方法 | |
| JP4787951B2 (ja) | 銀の電解精製方法 | |
| JP6543516B2 (ja) | 鉛電解液のリサイクル方法 | |
| RU2361967C1 (ru) | Способ электроизвлечения компактного никеля | |
| JP3805411B2 (ja) | 亜鉛の改良電解採取法 | |
| JP4182302B2 (ja) | 過硫酸カリウムの製造方法 | |
| TW201527599A (zh) | 高純度氯化鈷及其製造方法 | |
| RU2830268C1 (ru) | Способ извлечения металлического цинка из твердых металлургических отходов | |
| JP3651872B2 (ja) | 塩水中の硫酸根と塩素酸根の除去方法 | |
| CN119040910A (zh) | 从低纯度氯化锂制备高纯度氢氧化锂的方法及装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070118 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20090924 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100128 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100219 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100506 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100513 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4515804 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130521 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140521 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |