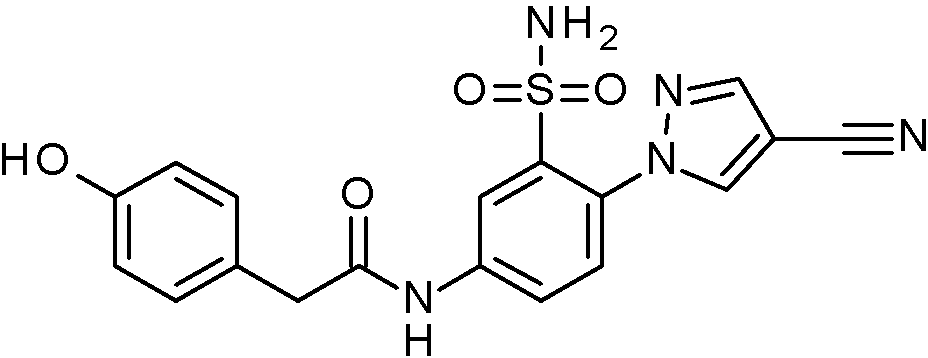
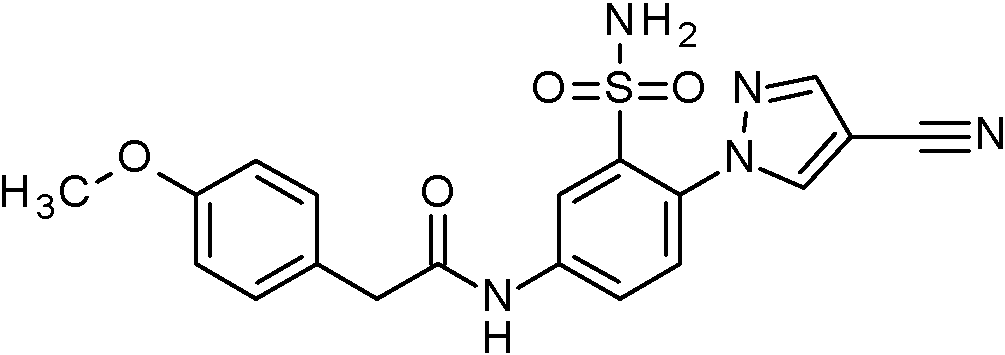
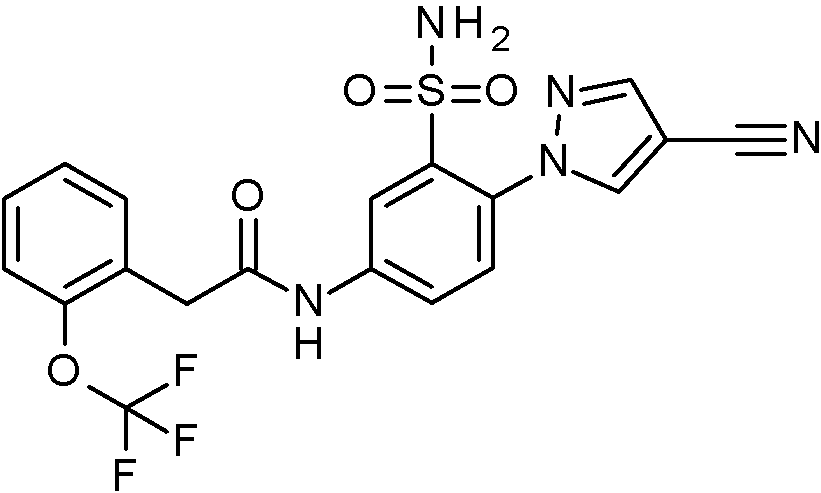
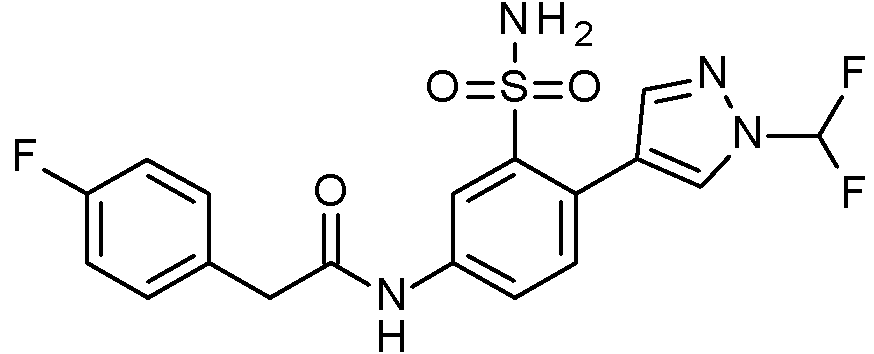
ES2829270T3 - Derivados de sulfonamida aromáticos - Google Patents
Derivados de sulfonamida aromáticos Download PDFInfo
- Publication number
- ES2829270T3 ES2829270T3 ES17724498T ES17724498T ES2829270T3 ES 2829270 T3 ES2829270 T3 ES 2829270T3 ES 17724498 T ES17724498 T ES 17724498T ES 17724498 T ES17724498 T ES 17724498T ES 2829270 T3 ES2829270 T3 ES 2829270T3
- Authority
- ES
- Spain
- Prior art keywords
- acetamide
- pyrazol
- sulfamoylphenyl
- chlorophenyl
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- -1 Aromatic sulfonamide Chemical class 0.000 title claims abstract description 390
- 229940124530 sulfonamide Drugs 0.000 title claims description 15
- 150000001875 compounds Chemical class 0.000 claims abstract description 261
- 239000001257 hydrogen Substances 0.000 claims abstract description 168
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 168
- 150000003839 salts Chemical class 0.000 claims abstract description 122
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 110
- 150000002367 halogens Chemical group 0.000 claims abstract description 110
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 80
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 73
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims abstract description 69
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 66
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 62
- 125000004767 (C1-C4) haloalkoxy group Chemical group 0.000 claims abstract description 56
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 55
- 150000001204 N-oxides Chemical class 0.000 claims abstract description 50
- 125000004765 (C1-C4) haloalkyl group Chemical group 0.000 claims abstract description 48
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 44
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 40
- 239000011737 fluorine Chemical group 0.000 claims abstract description 31
- 229910052731 fluorine Chemical group 0.000 claims abstract description 31
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims abstract description 29
- 239000012453 solvate Substances 0.000 claims abstract description 29
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 28
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 27
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims abstract description 26
- 125000001188 haloalkyl group Chemical group 0.000 claims abstract description 22
- 125000001153 fluoro group Chemical group F* 0.000 claims abstract description 20
- 125000004433 nitrogen atom Chemical group N* 0.000 claims abstract description 15
- 125000001424 substituent group Chemical group 0.000 claims abstract description 14
- 125000005842 heteroatom Chemical group 0.000 claims abstract description 12
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 12
- 229910052717 sulfur Inorganic materials 0.000 claims abstract description 12
- 125000000623 heterocyclic group Chemical group 0.000 claims abstract description 11
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims abstract description 10
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 claims abstract description 9
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical group FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims abstract description 7
- 150000002431 hydrogen Chemical group 0.000 claims abstract 40
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims abstract 17
- 125000004438 haloalkoxy group Chemical group 0.000 claims abstract 2
- 125000004182 2-chlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(*)C([H])=C1[H] 0.000 claims description 179
- 208000002193 Pain Diseases 0.000 claims description 109
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 108
- 230000036407 pain Effects 0.000 claims description 98
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 95
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 87
- 239000000203 mixture Substances 0.000 claims description 69
- 201000010099 disease Diseases 0.000 claims description 54
- 238000011282 treatment Methods 0.000 claims description 52
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 claims description 37
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 claims description 37
- 201000009273 Endometriosis Diseases 0.000 claims description 34
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 claims description 31
- 208000035475 disorder Diseases 0.000 claims description 31
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 claims description 28
- 239000003814 drug Substances 0.000 claims description 27
- 206010028980 Neoplasm Diseases 0.000 claims description 26
- METKIMKYRPQLGS-UHFFFAOYSA-N atenolol Chemical compound CC(C)NCC(O)COC1=CC=C(CC(N)=O)C=C1 METKIMKYRPQLGS-UHFFFAOYSA-N 0.000 claims description 26
- 238000002360 preparation method Methods 0.000 claims description 24
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 22
- 239000000460 chlorine Substances 0.000 claims description 22
- 229910052801 chlorine Inorganic materials 0.000 claims description 22
- 125000006239 protecting group Chemical group 0.000 claims description 22
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 20
- 208000024891 symptom Diseases 0.000 claims description 20
- 125000004198 2-fluorophenyl group Chemical group [H]C1=C([H])C(F)=C(*)C([H])=C1[H] 0.000 claims description 19
- 238000011321 prophylaxis Methods 0.000 claims description 19
- 239000008194 pharmaceutical composition Substances 0.000 claims description 18
- 206010013935 Dysmenorrhoea Diseases 0.000 claims description 16
- 208000004296 neuralgia Diseases 0.000 claims description 16
- 230000001684 chronic effect Effects 0.000 claims description 15
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 15
- 125000004399 C1-C4 alkenyl group Chemical group 0.000 claims description 14
- 208000005171 Dysmenorrhea Diseases 0.000 claims description 14
- 208000004483 Dyspareunia Diseases 0.000 claims description 13
- 230000001154 acute effect Effects 0.000 claims description 13
- 201000011510 cancer Diseases 0.000 claims description 13
- 208000002551 irritable bowel syndrome Diseases 0.000 claims description 13
- 206010020751 Hypersensitivity Diseases 0.000 claims description 10
- 206010065390 Inflammatory pain Diseases 0.000 claims description 10
- 208000026935 allergic disease Diseases 0.000 claims description 10
- 206010003246 arthritis Diseases 0.000 claims description 10
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 10
- 230000009610 hypersensitivity Effects 0.000 claims description 10
- 201000008482 osteoarthritis Diseases 0.000 claims description 10
- NKFLEFWUYAUDJV-UHFFFAOYSA-N pyridine-3-sulfonamide Chemical compound NS(=O)(=O)C1=CC=CN=C1 NKFLEFWUYAUDJV-UHFFFAOYSA-N 0.000 claims description 10
- 208000011580 syndromic disease Diseases 0.000 claims description 10
- 208000004454 Hyperalgesia Diseases 0.000 claims description 9
- 208000028389 Nerve injury Diseases 0.000 claims description 9
- 229910052794 bromium Inorganic materials 0.000 claims description 9
- 230000008764 nerve damage Effects 0.000 claims description 9
- 201000001119 neuropathy Diseases 0.000 claims description 9
- 230000007823 neuropathy Effects 0.000 claims description 9
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 9
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 8
- 230000002496 gastric effect Effects 0.000 claims description 8
- 208000014674 injury Diseases 0.000 claims description 8
- 208000021722 neuropathic pain Diseases 0.000 claims description 8
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 8
- 206010002556 Ankylosing Spondylitis Diseases 0.000 claims description 7
- 208000008035 Back Pain Diseases 0.000 claims description 6
- 208000008930 Low Back Pain Diseases 0.000 claims description 6
- 208000019695 Migraine disease Diseases 0.000 claims description 6
- 208000000450 Pelvic Pain Diseases 0.000 claims description 6
- 208000005298 acute pain Diseases 0.000 claims description 6
- 206010013990 dysuria Diseases 0.000 claims description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 6
- 230000002757 inflammatory effect Effects 0.000 claims description 6
- KHBQMWCZKVMBLN-UHFFFAOYSA-N Benzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CC=C1 KHBQMWCZKVMBLN-UHFFFAOYSA-N 0.000 claims description 5
- 206010068065 Burning mouth syndrome Diseases 0.000 claims description 5
- 208000000094 Chronic Pain Diseases 0.000 claims description 5
- 208000032131 Diabetic Neuropathies Diseases 0.000 claims description 5
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 5
- 201000003146 cystitis Diseases 0.000 claims description 5
- 230000003176 fibrotic effect Effects 0.000 claims description 5
- 208000021302 gastroesophageal reflux disease Diseases 0.000 claims description 5
- 210000000056 organ Anatomy 0.000 claims description 5
- 201000007094 prostatitis Diseases 0.000 claims description 5
- 208000005641 Adenomyosis Diseases 0.000 claims description 4
- 208000025978 Athletic injury Diseases 0.000 claims description 4
- 208000035154 Hyperesthesia Diseases 0.000 claims description 4
- 208000003251 Pruritus Diseases 0.000 claims description 4
- 208000010261 Small Fiber Neuropathy Diseases 0.000 claims description 4
- 206010053552 allodynia Diseases 0.000 claims description 4
- 125000003277 amino group Chemical group 0.000 claims description 4
- 238000002512 chemotherapy Methods 0.000 claims description 4
- 201000009274 endometriosis of uterus Diseases 0.000 claims description 4
- 206010027599 migraine Diseases 0.000 claims description 4
- 208000005069 pulmonary fibrosis Diseases 0.000 claims description 4
- 230000000472 traumatic effect Effects 0.000 claims description 4
- 206010044652 trigeminal neuralgia Diseases 0.000 claims description 4
- 125000004200 2-methoxyethyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])* 0.000 claims description 3
- 206010000060 Abdominal distension Diseases 0.000 claims description 3
- 201000001320 Atherosclerosis Diseases 0.000 claims description 3
- 208000006561 Cluster Headache Diseases 0.000 claims description 3
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 claims description 3
- 206010016654 Fibrosis Diseases 0.000 claims description 3
- 208000018737 Parkinson disease Diseases 0.000 claims description 3
- 206010036968 Prostatic pain Diseases 0.000 claims description 3
- 206010073928 Small fibre neuropathy Diseases 0.000 claims description 3
- 230000004761 fibrosis Effects 0.000 claims description 3
- 208000017692 primary erythermalgia Diseases 0.000 claims description 3
- 230000002062 proliferating effect Effects 0.000 claims description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 3
- 208000000143 urethritis Diseases 0.000 claims description 3
- 208000009935 visceral pain Diseases 0.000 claims description 3
- 230000029663 wound healing Effects 0.000 claims description 3
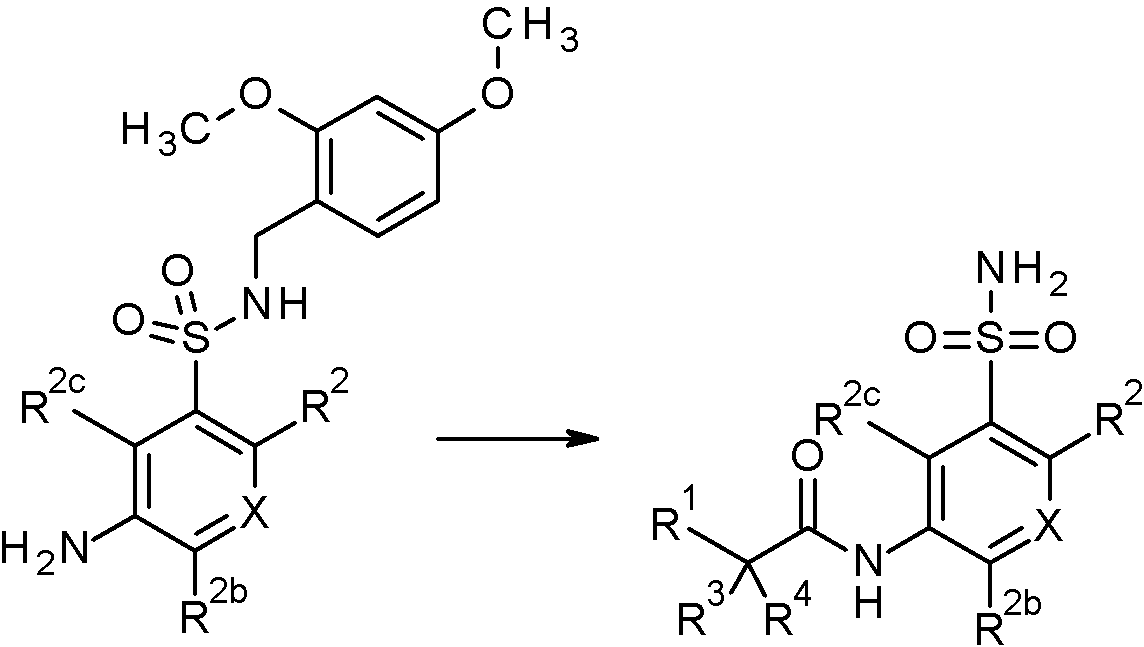
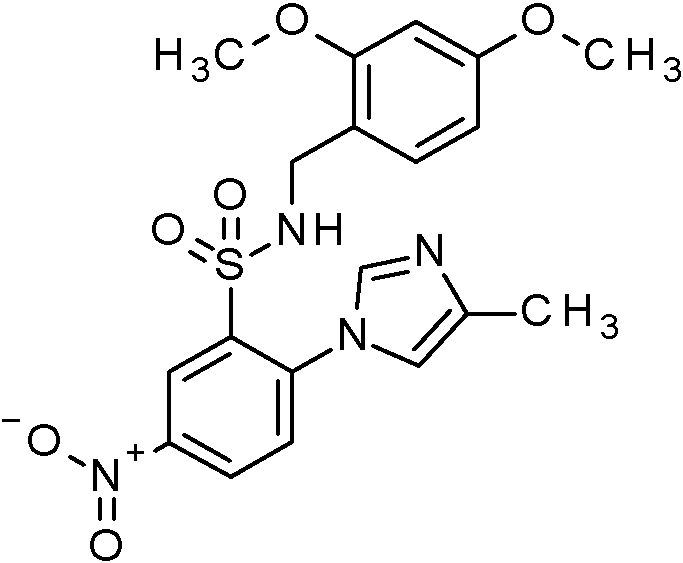
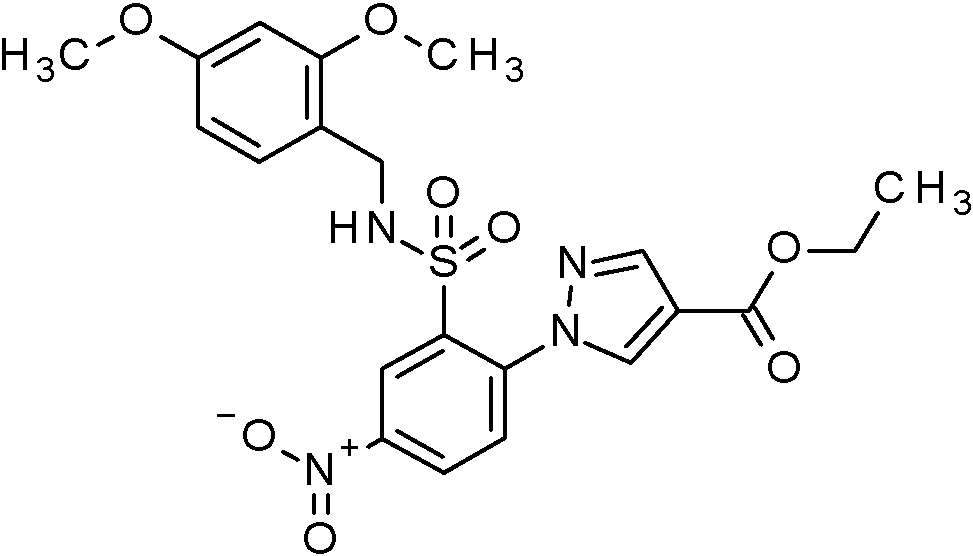
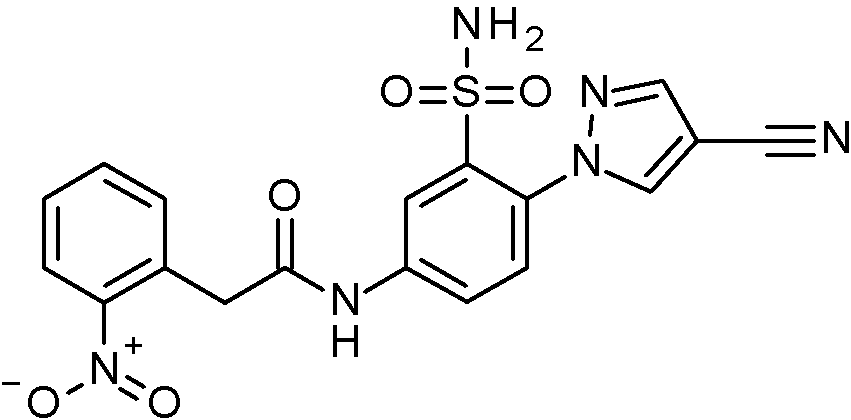
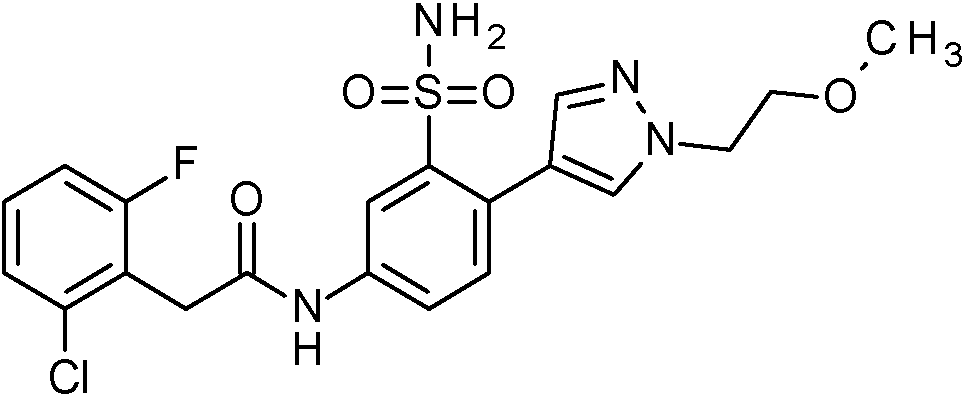
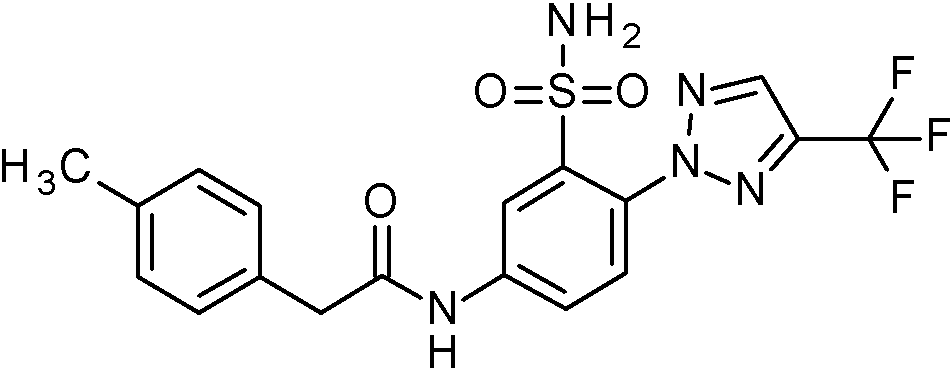
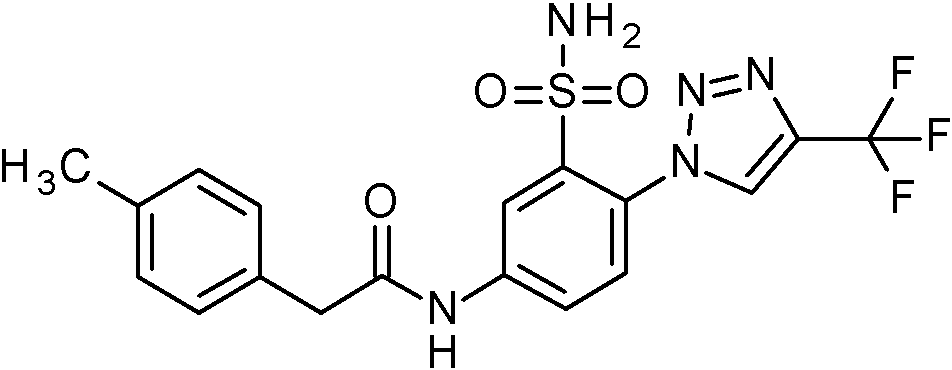
- WRFOJGXVZQHQRF-UHFFFAOYSA-N 1-[2-[(2,4-dimethoxyphenyl)methylsulfamoyl]-4-nitrophenyl]pyrazole-4-carboxylic acid Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])N2N=CC(=C2)C(=O)O)C=CC(=C1)OC WRFOJGXVZQHQRF-UHFFFAOYSA-N 0.000 claims description 2
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 claims description 2
- VWIYHUUJLYDCMT-UHFFFAOYSA-N 2-(2-benzylsulfanyl-4-nitrophenyl)-5-(trifluoromethyl)-1,3,4-oxadiazole Chemical compound C(C1=CC=CC=C1)SC1=C(C=CC(=C1)[N+](=O)[O-])C=1OC(=NN=1)C(F)(F)F VWIYHUUJLYDCMT-UHFFFAOYSA-N 0.000 claims description 2
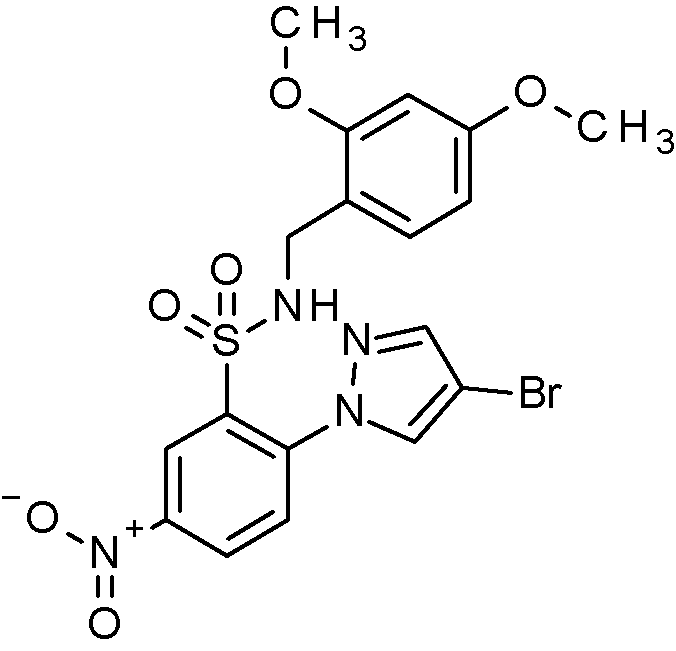
- IAGDUBGJJVAEGH-UHFFFAOYSA-N 2-(4-bromopyrazol-1-yl)-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound BrC=1C=NN(C=1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC IAGDUBGJJVAEGH-UHFFFAOYSA-N 0.000 claims description 2
- WJPIIJHLNLPVBF-UHFFFAOYSA-N 2-(4-chloropyrazol-1-yl)-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound ClC=1C=NN(C=1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC WJPIIJHLNLPVBF-UHFFFAOYSA-N 0.000 claims description 2
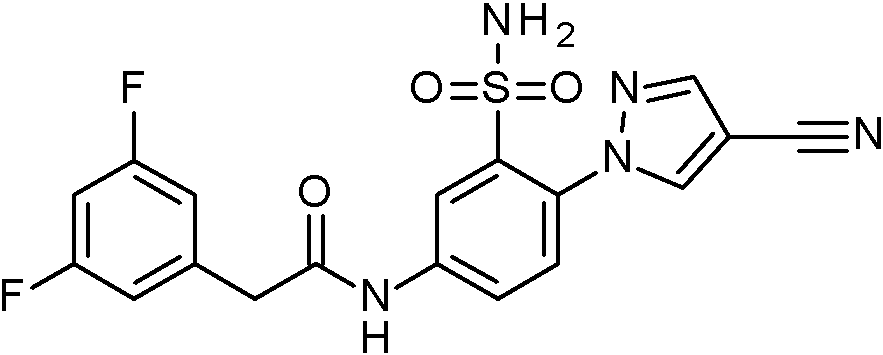
- SRVNIWZFNZSVBC-UHFFFAOYSA-N 2-(4-cyanopyrazol-1-yl)-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound C(#N)C=1C=NN(C=1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC SRVNIWZFNZSVBC-UHFFFAOYSA-N 0.000 claims description 2
- LHCKXYXQCWEGEK-UHFFFAOYSA-N 2-[(2,4-dimethoxyphenyl)methylsulfamoyl]-N'-hydroxy-4-nitrobenzenecarboximidamide Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])C(N)=NO)C=CC(=C1)OC LHCKXYXQCWEGEK-UHFFFAOYSA-N 0.000 claims description 2
- NCGGFAGHZCUWIL-UHFFFAOYSA-N 2-[3-(difluoromethyl)-1,2,4-triazol-1-yl]-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound FC(C1=NN(C=N1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC)F NCGGFAGHZCUWIL-UHFFFAOYSA-N 0.000 claims description 2
- MVLVKWDXIOOWMI-UHFFFAOYSA-N 2-benzylsulfanyl-4-nitro-N'-(2,2,2-trifluoroacetyl)benzohydrazide Chemical compound C(C1=CC=CC=C1)SC1=C(C(=O)NNC(C(F)(F)F)=O)C=CC(=C1)[N+](=O)[O-] MVLVKWDXIOOWMI-UHFFFAOYSA-N 0.000 claims description 2
- OVPUDFJIOVFGQL-UHFFFAOYSA-N 2-benzylsulfanyl-4-nitrobenzohydrazide Chemical compound C(C1=CC=CC=C1)SC1=C(C(=O)NN)C=CC(=C1)[N+](=O)[O-] OVPUDFJIOVFGQL-UHFFFAOYSA-N 0.000 claims description 2
- UOGBLHSENOPHFV-UHFFFAOYSA-N 2-benzylsulfanyl-4-nitrobenzonitrile Chemical compound [O-][N+](=O)C1=CC=C(C#N)C(SCC=2C=CC=CC=2)=C1 UOGBLHSENOPHFV-UHFFFAOYSA-N 0.000 claims description 2
- IWJCPJRZFKZSLW-UHFFFAOYSA-N 2-bromo-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound BrC1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC IWJCPJRZFKZSLW-UHFFFAOYSA-N 0.000 claims description 2
- LAKKISPSJNIBMM-UHFFFAOYSA-N 2-chloro-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound ClC1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC LAKKISPSJNIBMM-UHFFFAOYSA-N 0.000 claims description 2
- BCFYCEGMRYFNFZ-UHFFFAOYSA-N 2-cyano-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound C(#N)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC BCFYCEGMRYFNFZ-UHFFFAOYSA-N 0.000 claims description 2
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 claims description 2
- PZLHTPJIAILLFD-UHFFFAOYSA-N 5-(2-benzylsulfanyl-4-nitrophenyl)-3-(trifluoromethyl)-1,2,4-oxadiazole Chemical compound C(C1=CC=CC=C1)SC1=C(C=CC(=C1)[N+](=O)[O-])C1=NC(=NO1)C(F)(F)F PZLHTPJIAILLFD-UHFFFAOYSA-N 0.000 claims description 2
- SSCMWENZKSGWBV-UHFFFAOYSA-N 5-(2-benzylsulfanyl-4-nitrophenyl)-3-methyl-1,2,4-oxadiazole Chemical compound C(C1=CC=CC=C1)SC1=C(C=CC(=C1)[N+](=O)[O-])C1=NC(=NO1)C SSCMWENZKSGWBV-UHFFFAOYSA-N 0.000 claims description 2
- NCAGCDHIUXXOPI-UHFFFAOYSA-N 5-amino-N-[(2,4-dimethoxyphenyl)methyl]-2-[3-(trifluoromethyl)-1,2,4-triazol-1-yl]benzenesulfonamide Chemical compound NC=1C=CC(=C(C=1)S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC)N1N=C(N=C1)C(F)(F)F NCAGCDHIUXXOPI-UHFFFAOYSA-N 0.000 claims description 2
- 208000024827 Alzheimer disease Diseases 0.000 claims description 2
- 206010004663 Biliary colic Diseases 0.000 claims description 2
- 208000011231 Crohn disease Diseases 0.000 claims description 2
- 206010012735 Diarrhoea Diseases 0.000 claims description 2
- 208000018522 Gastrointestinal disease Diseases 0.000 claims description 2
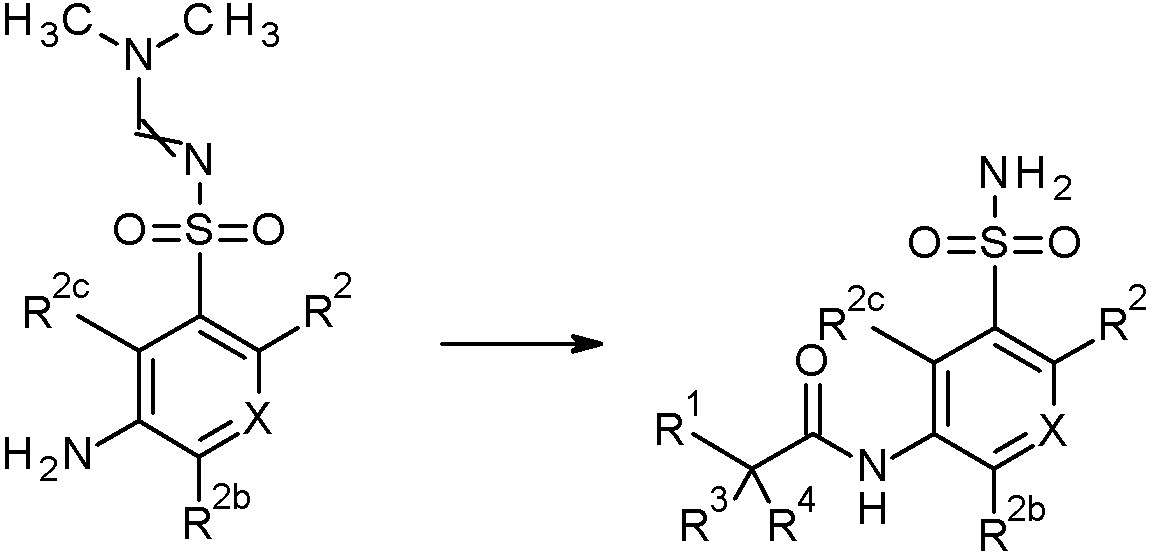
- CKVXGMJOUWQLJU-UHFFFAOYSA-N N'-(2-bromo-5-nitrophenyl)sulfonyl-N,N-dimethylmethanimidamide Chemical compound BrC1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)N=CN(C)C CKVXGMJOUWQLJU-UHFFFAOYSA-N 0.000 claims description 2
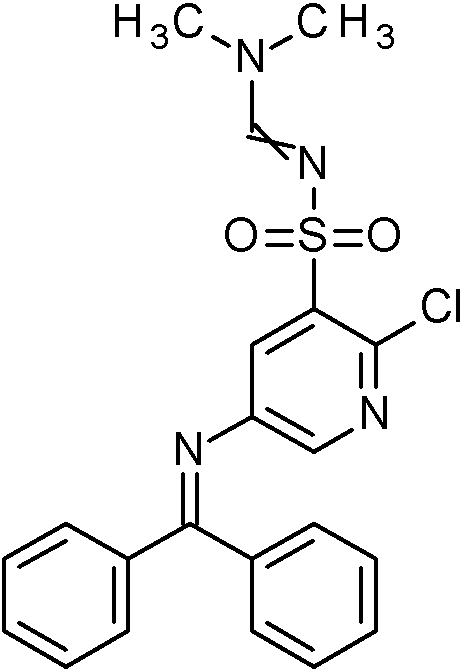
- ZMPYUEWRNCTEER-UHFFFAOYSA-N N'-[5-(benzhydrylideneamino)-2-[5-(trifluoromethyl)pyridin-3-yl]pyridin-3-yl]sulfonyl-N,N-dimethylmethanimidamide Chemical compound CN(C)C=NS(=O)(=O)C=1C(=NC=C(C=1)N=C(C1=CC=CC=C1)C1=CC=CC=C1)C=1C=NC=C(C=1)C(F)(F)F ZMPYUEWRNCTEER-UHFFFAOYSA-N 0.000 claims description 2
- COLNGYFINSWYAN-UHFFFAOYSA-N N'-[5-amino-2-[1-(difluoromethyl)pyrazol-4-yl]phenyl]sulfonyl-N,N-dimethylmethanimidamide Chemical compound CN(C)C=NS(=O)(=O)C1=C(C=CC(N)=C1)C1=CN(N=C1)C(F)F COLNGYFINSWYAN-UHFFFAOYSA-N 0.000 claims description 2
- YHJFAYUVRXLGEX-UHFFFAOYSA-N N'-[5-amino-2-[4-(trifluoromethyl)pyrazol-1-yl]pyridin-3-yl]sulfonyl-N,N-dimethylmethanimidamide Chemical compound NC=1C=C(C(=NC=1)N1N=CC(=C1)C(F)(F)F)S(=O)(=O)N=CN(C)C YHJFAYUVRXLGEX-UHFFFAOYSA-N 0.000 claims description 2
- QZOKKTLPXFUNSR-UHFFFAOYSA-N N'-[5-amino-2-[5-(trifluoromethyl)pyridin-3-yl]phenyl]sulfonyl-N,N-dimethylmethanimidamide Chemical compound NC=1C=CC(=C(C=1)S(=O)(=O)N=CN(C)C)C=1C=NC=C(C=1)C(F)(F)F QZOKKTLPXFUNSR-UHFFFAOYSA-N 0.000 claims description 2
- IYFWCKAZYZOGJN-UHFFFAOYSA-N N-(2,2,2-trifluoroethyl)-1H-pyrazol-4-amine Chemical compound FC(CNC=1C=NNC=1)(F)F IYFWCKAZYZOGJN-UHFFFAOYSA-N 0.000 claims description 2
- NHHHGJAEANIKDH-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-2-(3-fluoropyrazol-1-yl)-5-nitrobenzenesulfonamide Chemical compound COc1ccc(CNS(=O)(=O)c2cc(ccc2-n2ccc(F)n2)[N+]([O-])=O)c(OC)c1 NHHHGJAEANIKDH-UHFFFAOYSA-N 0.000 claims description 2
- QMEHZGCDFQCIMC-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-2-(3-methoxy-1,2,4-triazol-1-yl)-5-nitrobenzenesulfonamide Chemical compound COc1ncn(n1)-c1ccc(cc1S(=O)(=O)NCc1ccc(OC)cc1OC)[N+]([O-])=O QMEHZGCDFQCIMC-UHFFFAOYSA-N 0.000 claims description 2
- JUYSSCPRPIERFL-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-2-(4-fluoropyrazol-1-yl)-5-nitrobenzenesulfonamide Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])N2N=CC(=C2)F)C=CC(=C1)OC JUYSSCPRPIERFL-UHFFFAOYSA-N 0.000 claims description 2
- PKCHYFWKPIEVHP-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-2-(4-methylimidazol-1-yl)-5-nitrobenzenesulfonamide Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])N2C=NC(=C2)C)C=CC(=C1)OC PKCHYFWKPIEVHP-UHFFFAOYSA-N 0.000 claims description 2
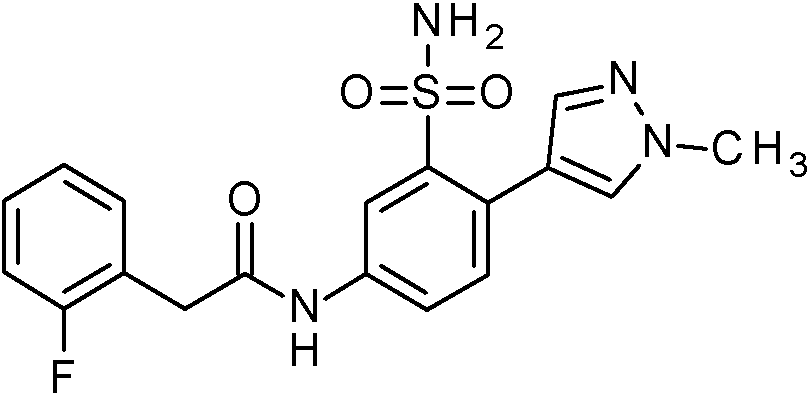
- KKPJNQJIHIOJGD-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-2-(4-methylpyrazol-1-yl)-5-nitrobenzenesulfonamide Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])N2N=CC(=C2)C)C=CC(=C1)OC KKPJNQJIHIOJGD-UHFFFAOYSA-N 0.000 claims description 2
- QMBXXPVJJILNEO-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-2-(5-methyl-1,3,4-oxadiazol-2-yl)-5-nitrobenzenesulfonamide Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])C=2OC(=NN=2)C)C=CC(=C1)OC QMBXXPVJJILNEO-UHFFFAOYSA-N 0.000 claims description 2
- QJMGHOONDLZSCM-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-2-[4-(2-hydroxyethyl)pyrazol-1-yl]-5-nitrobenzenesulfonamide Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])N2N=CC(=C2)CCO)C=CC(=C1)OC QJMGHOONDLZSCM-UHFFFAOYSA-N 0.000 claims description 2
- LSJJJNMIUQAIMS-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-5-nitro-2-(4-propan-2-ylpyrazol-1-yl)benzenesulfonamide Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])N2N=CC(=C2)C(C)C)C=CC(=C1)OC LSJJJNMIUQAIMS-UHFFFAOYSA-N 0.000 claims description 2
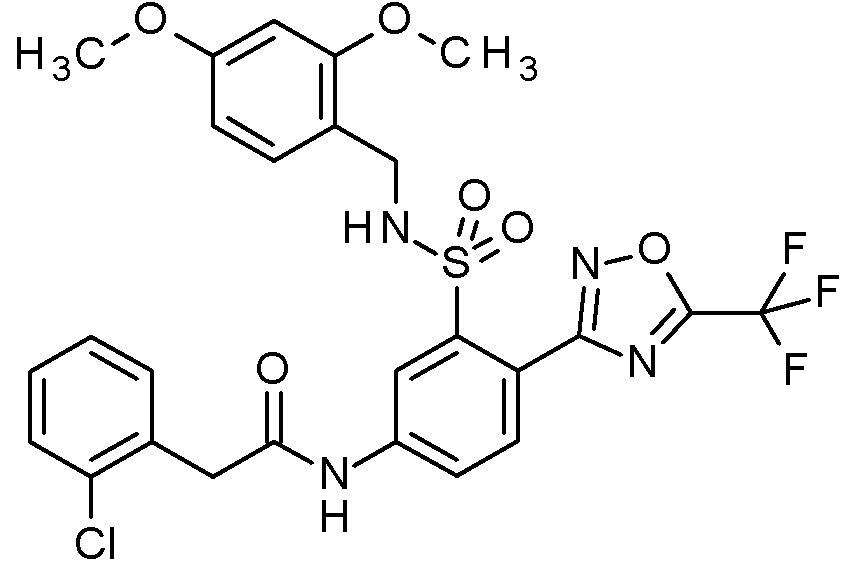
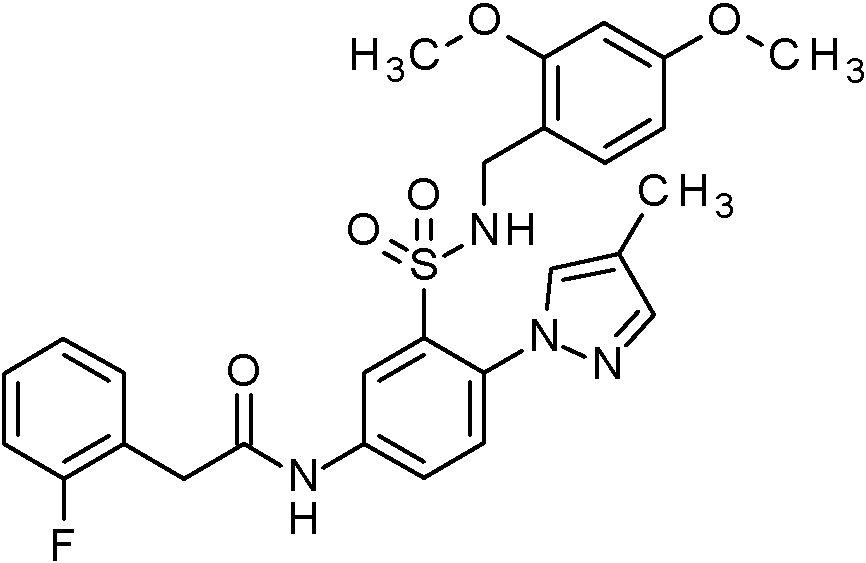
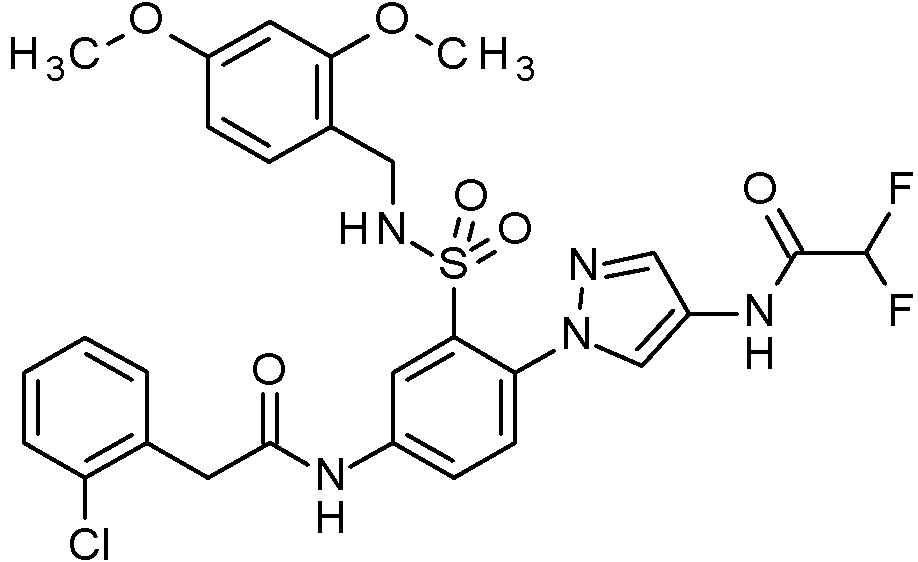
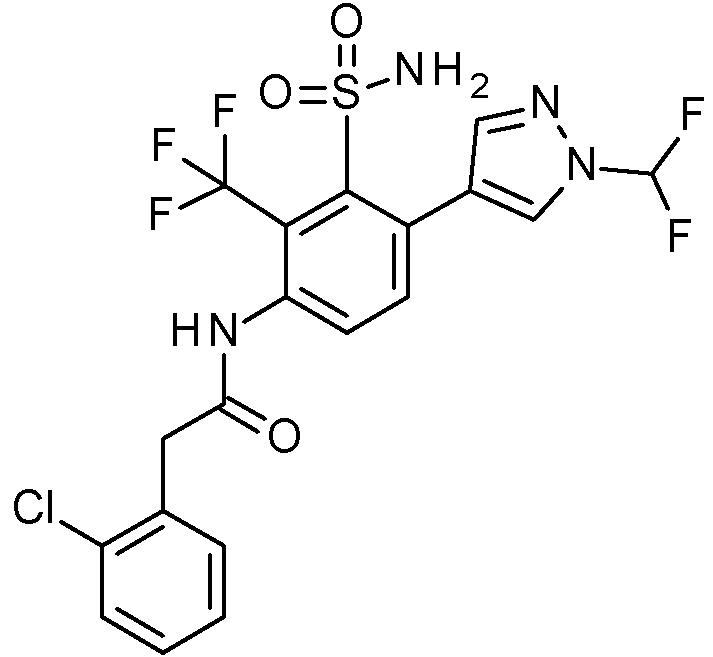
- PNASJKHRHZXHMA-UHFFFAOYSA-N N-[1-[4-[[2-(2-chlorophenyl)acetyl]amino]-2-[(2,4-dimethoxyphenyl)methylsulfamoyl]phenyl]pyrazol-4-yl]-2,2-difluoroacetamide Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)N1N=CC(=C1)NC(C(F)F)=O)S(NCC1=C(C=C(C=C1)OC)OC)(=O)=O PNASJKHRHZXHMA-UHFFFAOYSA-N 0.000 claims description 2
- WOLMYVDNYORCDL-UHFFFAOYSA-N N-[1-[4-[[2-(2-chlorophenyl)acetyl]amino]-2-[(2,4-dimethoxyphenyl)methylsulfamoyl]phenyl]pyrazol-4-yl]-3,3,3-trifluoro-2-methylpropanamide Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)N1N=CC(=C1)NC(C(C(F)(F)F)C)=O)S(NCC1=C(C=C(C=C1)OC)OC)(=O)=O WOLMYVDNYORCDL-UHFFFAOYSA-N 0.000 claims description 2
- ADYYDQABIFSIHW-UHFFFAOYSA-N N-[1-[4-[[2-(2-chlorophenyl)acetyl]amino]-2-[(2,4-dimethoxyphenyl)methylsulfamoyl]phenyl]pyrazol-4-yl]-3,3,3-trifluoropropanamide Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)N1N=CC(=C1)NC(CC(F)(F)F)=O)S(NCC1=C(C=C(C=C1)OC)OC)(=O)=O ADYYDQABIFSIHW-UHFFFAOYSA-N 0.000 claims description 2
- 208000005890 Neuroma Diseases 0.000 claims description 2
- 208000004983 Phantom Limb Diseases 0.000 claims description 2
- 206010056238 Phantom pain Diseases 0.000 claims description 2
- 206010065347 Premenstrual pain Diseases 0.000 claims description 2
- 206010038419 Renal colic Diseases 0.000 claims description 2
- 230000002917 arthritic effect Effects 0.000 claims description 2
- 230000009787 cardiac fibrosis Effects 0.000 claims description 2
- 230000007850 degeneration Effects 0.000 claims description 2
- VRGIWLCGOHWGOG-UHFFFAOYSA-N ethyl 1-[2-[(2,4-dimethoxyphenyl)methylsulfamoyl]-4-nitrophenyl]pyrazole-4-carboxylate Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])N2N=CC(=C2)C(=O)OCC)C=CC(=C1)OC VRGIWLCGOHWGOG-UHFFFAOYSA-N 0.000 claims description 2
- AQYSYJUIMQTRMV-UHFFFAOYSA-N hypofluorous acid Chemical compound FO AQYSYJUIMQTRMV-UHFFFAOYSA-N 0.000 claims description 2
- 230000001771 impaired effect Effects 0.000 claims description 2
- 150000002632 lipids Chemical class 0.000 claims description 2
- 208000010125 myocardial infarction Diseases 0.000 claims description 2
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 claims 341
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 claims 14
- YNPNZTXNASCQKK-UHFFFAOYSA-N Phenanthrene Natural products C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 claims 11
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 claims 11
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 claims 11
- 239000005631 2,4-Dichlorophenoxyacetic acid Substances 0.000 claims 5
- 125000004179 3-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(Cl)=C1[H] 0.000 claims 5
- 125000006276 2-bromophenyl group Chemical group [H]C1=C([H])C(Br)=C(*)C([H])=C1[H] 0.000 claims 4
- 125000004180 3-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(F)=C1[H] 0.000 claims 3
- 125000004786 difluoromethoxy group Chemical group [H]C(F)(F)O* 0.000 claims 3
- 125000003784 fluoroethyl group Chemical group [H]C([H])(F)C([H])([H])* 0.000 claims 3
- PUPFATUGTIQBQA-UZQPLGKSSA-N fluorophen Chemical compound C([C@@]1(C)C2=CC(O)=CC=C2C[C@H]2[C@@H]1C)CN2CCC1=CC=C(F)C=C1 PUPFATUGTIQBQA-UZQPLGKSSA-N 0.000 claims 3
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 claims 3
- 125000004204 2-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C(OC([H])([H])[H])C([H])=C1[H] 0.000 claims 2
- 125000004211 3,5-difluorophenyl group Chemical group [H]C1=C(F)C([H])=C(*)C([H])=C1F 0.000 claims 2
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 claims 2
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 claims 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 claims 2
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 claims 2
- GYUFLTOWUVCCNO-UHFFFAOYSA-N 1-(difluoromethyl)pyrazole Chemical compound FC(F)N1C=CC=N1 GYUFLTOWUVCCNO-UHFFFAOYSA-N 0.000 claims 1
- KIPSRYDSZQRPEA-UHFFFAOYSA-N 2,2,2-trifluoroethanamine Chemical compound NCC(F)(F)F KIPSRYDSZQRPEA-UHFFFAOYSA-N 0.000 claims 1
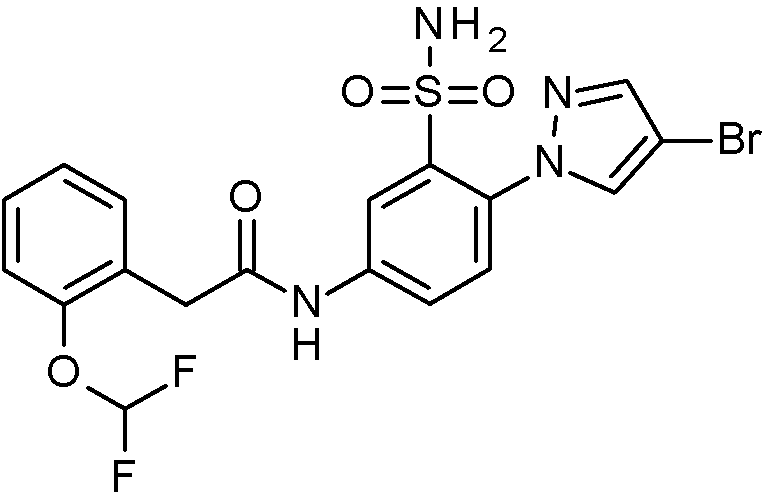
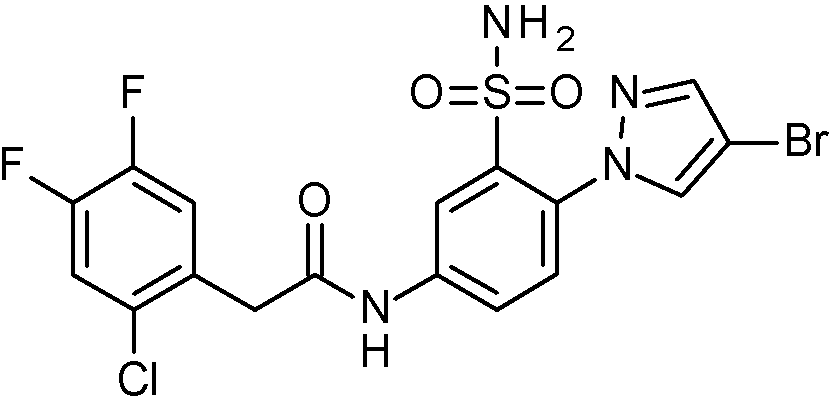
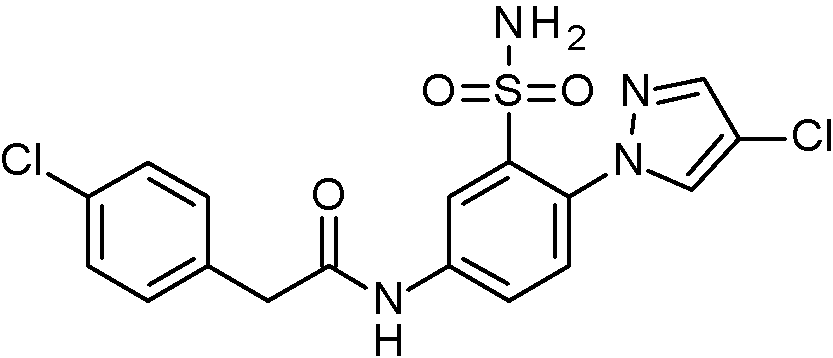
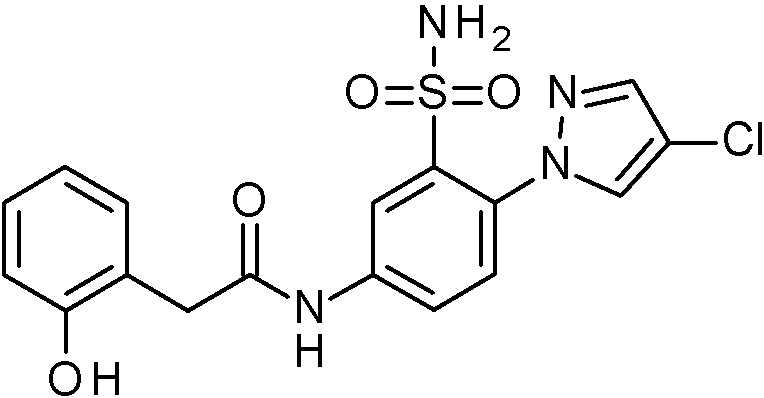
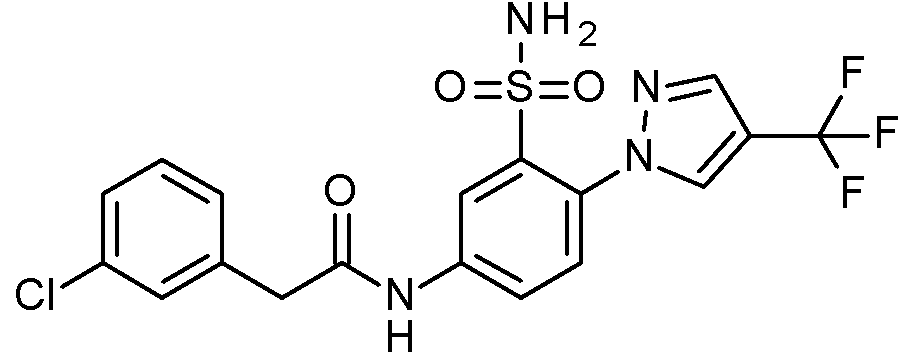
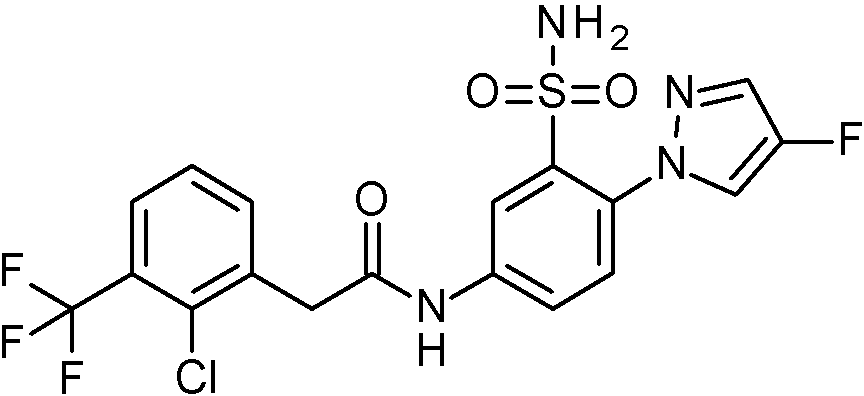
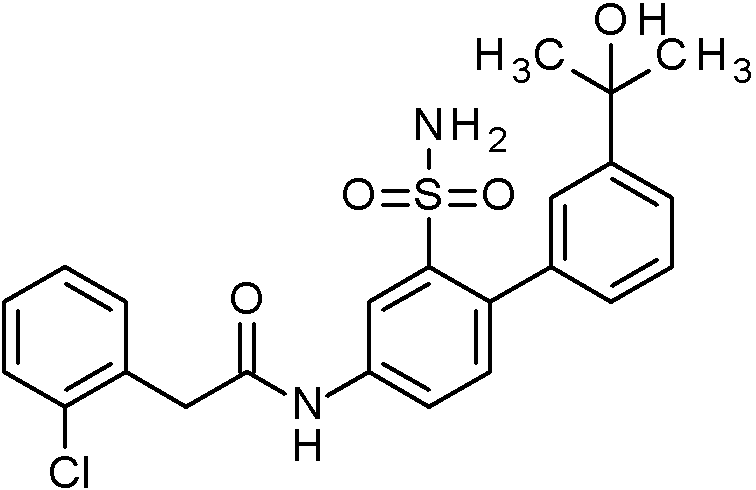
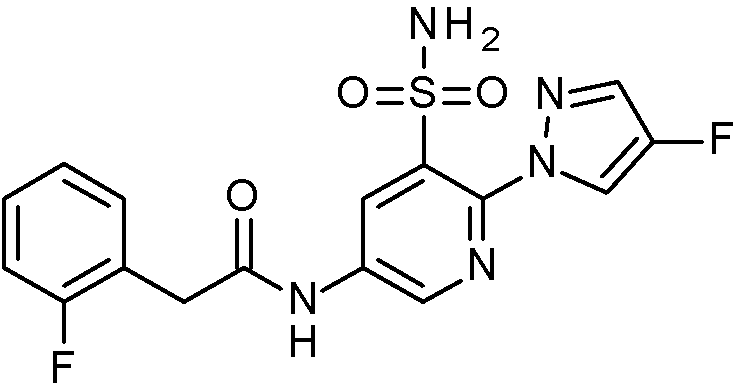
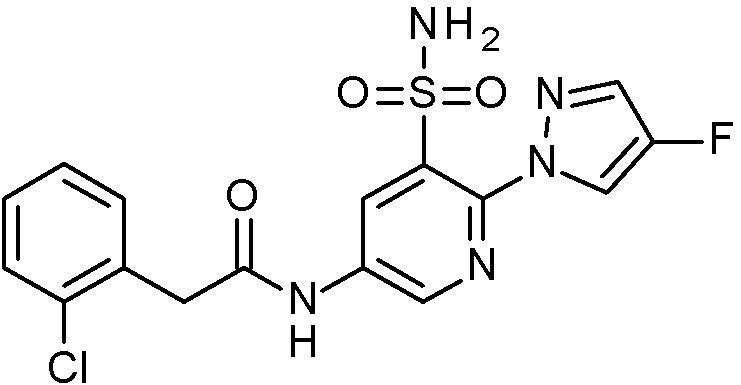
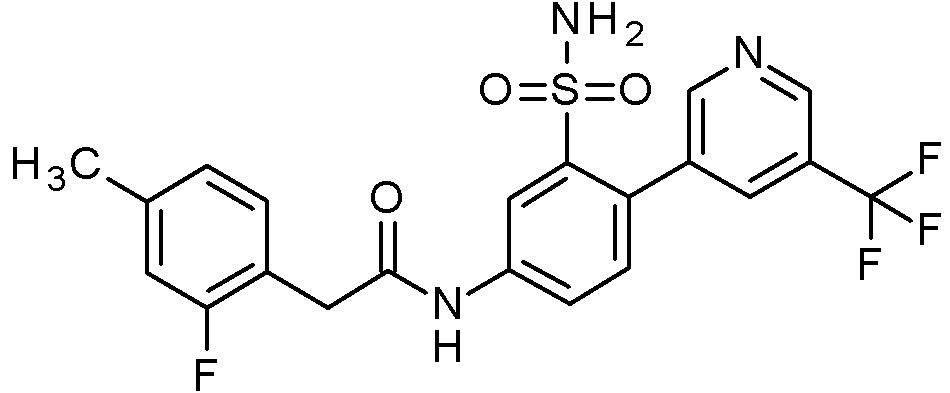
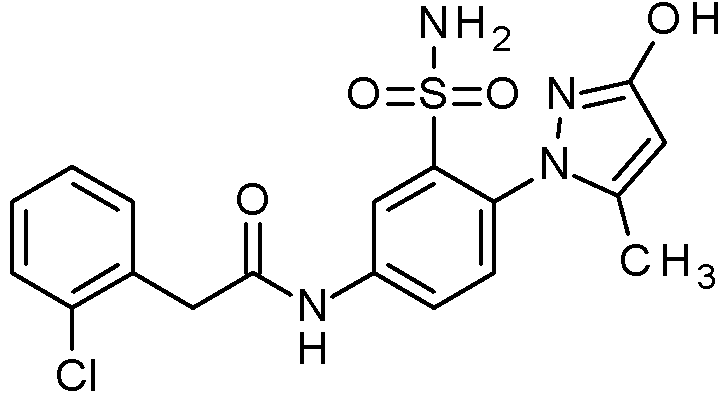
- IASYZBIWQFQHHX-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[3-sulfamoyl-4-[2-(2,2,2-trifluoroethoxy)pyrimidin-5-yl]phenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1cnc(OCC(F)(F)F)nc1 IASYZBIWQFQHHX-UHFFFAOYSA-N 0.000 claims 1
- BJPMQVDZQIRVAL-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[3-sulfamoyl-4-[2-(trifluoromethyl)pyrimidin-5-yl]phenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1cnc(nc1)C(F)(F)F BJPMQVDZQIRVAL-UHFFFAOYSA-N 0.000 claims 1
- FJNNNZGGZNHDLB-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[3-sulfamoyl-4-[4-(trifluoromethyl)pyridin-2-yl]phenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1cc(ccn1)C(F)(F)F FJNNNZGGZNHDLB-UHFFFAOYSA-N 0.000 claims 1
- GGCNZTJDNPEKPD-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[3-sulfamoyl-4-[5-(trifluoromethoxy)pyridin-3-yl]phenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1cncc(OC(F)(F)F)c1 GGCNZTJDNPEKPD-UHFFFAOYSA-N 0.000 claims 1
- HJWMWYQPCPJFNC-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[3-sulfamoyl-4-[5-(trifluoromethyl)-1,3,4-oxadiazol-2-yl]phenyl]acetamide Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)C=1OC(=NN=1)C(F)(F)F)S(N)(=O)=O HJWMWYQPCPJFNC-UHFFFAOYSA-N 0.000 claims 1
- OASVTWXVRPKTRA-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[3-sulfamoyl-4-[5-(trifluoromethyl)pyridin-3-yl]phenyl]acetamide Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)C=1C=NC=C(C=1)C(F)(F)F)S(N)(=O)=O OASVTWXVRPKTRA-UHFFFAOYSA-N 0.000 claims 1
- UPUJSAIZLBWQPW-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[3-sulfamoyl-4-[6-(trifluoromethyl)pyridin-2-yl]phenyl]acetamide Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)C1=NC(=CC=C1)C(F)(F)F)S(N)(=O)=O UPUJSAIZLBWQPW-UHFFFAOYSA-N 0.000 claims 1
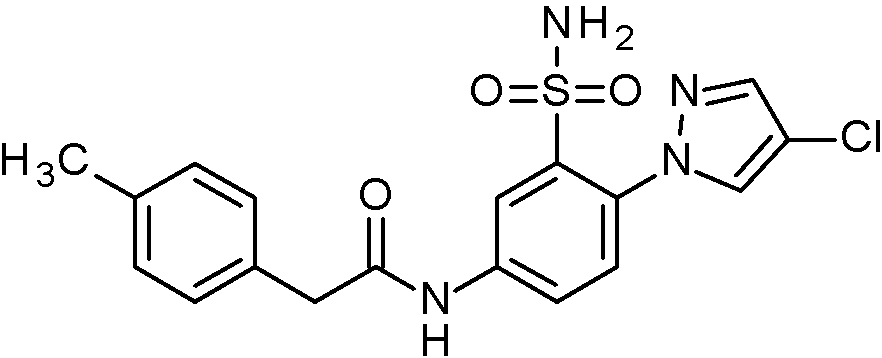
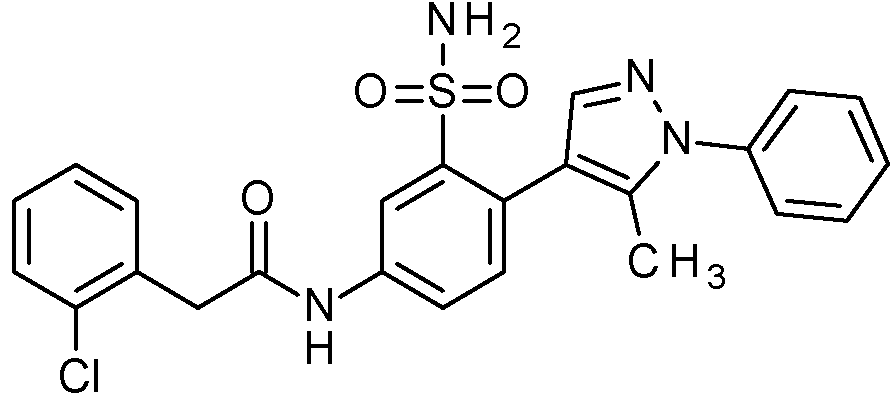
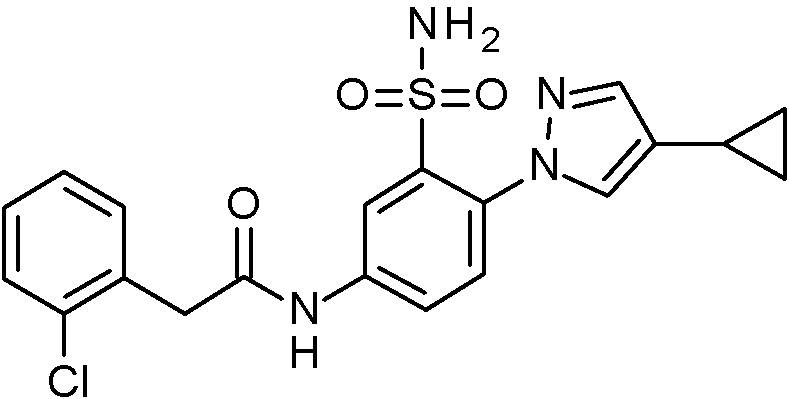
- JNUMULMSRNBCBC-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(1H-pyrazol-4-yl)-3-sulfamoylphenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1cn[nH]c1 JNUMULMSRNBCBC-UHFFFAOYSA-N 0.000 claims 1
- SUCISZOMZFSFCC-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(2-ethoxypyrimidin-5-yl)-3-sulfamoylphenyl]acetamide Chemical compound CCOc1ncc(cn1)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O SUCISZOMZFSFCC-UHFFFAOYSA-N 0.000 claims 1
- HSIZGLOELJUFDM-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(2-methoxypyrimidin-5-yl)-3-sulfamoylphenyl]acetamide Chemical compound COc1ncc(cn1)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O HSIZGLOELJUFDM-UHFFFAOYSA-N 0.000 claims 1
- WDUNIIUHLNTGQS-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(2-methylpyrimidin-5-yl)-3-sulfamoylphenyl]acetamide Chemical compound Cc1ncc(cn1)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O WDUNIIUHLNTGQS-UHFFFAOYSA-N 0.000 claims 1
- UZXNEHBQWQISFW-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(3,5-dimethyl-1,2-oxazol-4-yl)-3-sulfamoylphenyl]acetamide Chemical compound Cc1noc(C)c1-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O UZXNEHBQWQISFW-UHFFFAOYSA-N 0.000 claims 1
- ADZHRDRROWRATL-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(5-cyanopyridin-3-yl)-3-sulfamoylphenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1cncc(c1)C#N ADZHRDRROWRATL-UHFFFAOYSA-N 0.000 claims 1
- PHXSJHXVBNMKCT-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(5-methoxypyridin-3-yl)-3-sulfamoylphenyl]acetamide Chemical compound COc1cncc(c1)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O PHXSJHXVBNMKCT-UHFFFAOYSA-N 0.000 claims 1
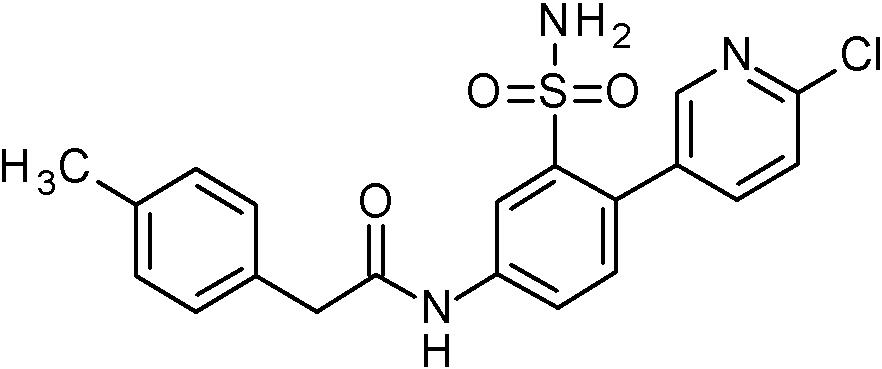
- YYRJDELBTXHAOG-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(6-chloropyridin-3-yl)-3-sulfamoylphenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1ccc(Cl)nc1 YYRJDELBTXHAOG-UHFFFAOYSA-N 0.000 claims 1
- QSFHZIGTIPGWES-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-(6-methylpyridin-3-yl)-3-sulfamoylphenyl]acetamide Chemical compound Cc1ccc(cn1)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O QSFHZIGTIPGWES-UHFFFAOYSA-N 0.000 claims 1
- POKIPPYKLYGEBY-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-[1-(difluoromethyl)pyrazol-4-yl]-3-sulfamoylphenyl]-2-hydroxyacetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)C(O)c2ccccc2Cl)ccc1-c1cnn(c1)C(F)F POKIPPYKLYGEBY-UHFFFAOYSA-N 0.000 claims 1
- GJZUYYOWCUTXNV-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-[2-(cyclopropylamino)pyrimidin-5-yl]-3-sulfamoylphenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1cnc(NC2CC2)nc1 GJZUYYOWCUTXNV-UHFFFAOYSA-N 0.000 claims 1
- RIMHTVIYENGENA-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-[2-(ethylamino)pyrimidin-5-yl]-3-sulfamoylphenyl]acetamide Chemical compound CCNc1ncc(cn1)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O RIMHTVIYENGENA-UHFFFAOYSA-N 0.000 claims 1
- WEKBTRJPYLZYFA-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-[2-(methylamino)pyrimidin-5-yl]-3-sulfamoylphenyl]acetamide Chemical compound CNc1ncc(cn1)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O WEKBTRJPYLZYFA-UHFFFAOYSA-N 0.000 claims 1
- UYIASKNVHUNHPL-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-[2-(propan-2-ylamino)pyrimidin-5-yl]-3-sulfamoylphenyl]acetamide Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)C=1C=NC(=NC=1)NC(C)C)S(N)(=O)=O UYIASKNVHUNHPL-UHFFFAOYSA-N 0.000 claims 1
- NKMBJYKJNXPBHH-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-[2-(propylamino)pyrimidin-5-yl]-3-sulfamoylphenyl]acetamide Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)C=1C=NC(=NC=1)NCCC)S(N)(=O)=O NKMBJYKJNXPBHH-UHFFFAOYSA-N 0.000 claims 1
- HBKCRSCIOAGBGB-UHFFFAOYSA-N 2-(2-chlorophenyl)-N-[4-[5-(difluoromethoxy)pyridin-3-yl]-3-sulfamoylphenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2Cl)ccc1-c1cncc(OC(F)F)c1 HBKCRSCIOAGBGB-UHFFFAOYSA-N 0.000 claims 1
- NOTDRJRDJVASCW-UHFFFAOYSA-N 2-(2-fluorophenyl)-N-[3-sulfamoyl-4-[5-(trifluoromethyl)-1,3,4-oxadiazol-2-yl]phenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2F)ccc1-c1nnc(o1)C(F)(F)F NOTDRJRDJVASCW-UHFFFAOYSA-N 0.000 claims 1
- FZBWJLYIKNGVCE-UHFFFAOYSA-N 2-(2-fluorophenyl)-N-[3-sulfamoyl-4-[5-(trifluoromethyl)pyridin-3-yl]phenyl]acetamide Chemical compound FC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)C=1C=NC=C(C=1)C(F)(F)F)S(N)(=O)=O FZBWJLYIKNGVCE-UHFFFAOYSA-N 0.000 claims 1
- IMIXQJGMRWDFDJ-UHFFFAOYSA-N 2-(2-fluorophenyl)-N-[4-(5-fluoropyridin-3-yl)-3-sulfamoylphenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2F)ccc1-c1cncc(F)c1 IMIXQJGMRWDFDJ-UHFFFAOYSA-N 0.000 claims 1
- AYNQNASJBDNENF-UHFFFAOYSA-N 2-(3-cyclopropylpyrazol-1-yl)-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound C1(CC1)C1=NN(C=C1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC AYNQNASJBDNENF-UHFFFAOYSA-N 0.000 claims 1
- BROGVWCNKQVSPW-UHFFFAOYSA-N 2-[4-(2,2-difluoroethyl)pyrazol-1-yl]-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound FC(CC=1C=NN(C=1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC)F BROGVWCNKQVSPW-UHFFFAOYSA-N 0.000 claims 1
- JBHSUNYTQWPKQF-UHFFFAOYSA-N 2-[4-(2,2-difluoroethylamino)pyrazol-1-yl]-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound COc1ccc(CNS(=O)(=O)c2cc(ccc2-n2cc(NCC(F)F)cn2)[N+]([O-])=O)c(OC)c1 JBHSUNYTQWPKQF-UHFFFAOYSA-N 0.000 claims 1
- UVQLOPYPYIJHDQ-UHFFFAOYSA-N 2-[4-[(2,2-difluoroethylamino)methyl]pyrazol-1-yl]-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound FC(CNCC=1C=NN(C=1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC)F UVQLOPYPYIJHDQ-UHFFFAOYSA-N 0.000 claims 1
- NEURYOYRKPFLKH-UHFFFAOYSA-N 2-chloro-1-isocyanato-4-(trifluoromethyl)benzene Chemical group FC(F)(F)C1=CC=C(N=C=O)C(Cl)=C1 NEURYOYRKPFLKH-UHFFFAOYSA-N 0.000 claims 1
- UDHXJZHVNHGCEC-UHFFFAOYSA-N Chlorophacinone Chemical compound C1=CC(Cl)=CC=C1C(C=1C=CC=CC=1)C(=O)C1C(=O)C2=CC=CC=C2C1=O UDHXJZHVNHGCEC-UHFFFAOYSA-N 0.000 claims 1
- 206010017076 Fracture Diseases 0.000 claims 1
- 206010023421 Kidney fibrosis Diseases 0.000 claims 1
- VQWLDQLWLKIWCP-UHFFFAOYSA-N N'-(2-chloro-5-nitrophenyl)sulfonyl-N,N-dimethylmethanimidamide Chemical compound CN(C)C=NS(=O)(=O)c1cc(ccc1Cl)[N+]([O-])=O VQWLDQLWLKIWCP-UHFFFAOYSA-N 0.000 claims 1
- GQIJNEFFTPHMSR-UHFFFAOYSA-N N'-[2-[1-(difluoromethyl)pyrazol-4-yl]-5-nitrophenyl]sulfonyl-N,N-dimethylmethanimidamide Chemical compound FC(N1N=CC(=C1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)N=CN(C)C)F GQIJNEFFTPHMSR-UHFFFAOYSA-N 0.000 claims 1
- XFRARZZBLDZLJR-UHFFFAOYSA-N N'-[5-amino-2-[5-(trifluoromethyl)pyridin-3-yl]pyridin-3-yl]sulfonyl-N,N-dimethylmethanimidamide Chemical compound NC=1C=C(C(=NC=1)C=1C=NC=C(C=1)C(F)(F)F)S(=O)(=O)N=CN(C)C XFRARZZBLDZLJR-UHFFFAOYSA-N 0.000 claims 1
- APHDIKDFNFAPTQ-UHFFFAOYSA-N N-[3-sulfamoyl-4-[5-(trifluoromethyl)pyridin-3-yl]phenyl]-2-[2-(trifluoromethoxy)phenyl]acetamide Chemical compound S(N)(=O)(=O)C=1C=C(C=CC=1C=1C=NC=C(C=1)C(F)(F)F)NC(CC1=C(C=CC=C1)OC(F)(F)F)=O APHDIKDFNFAPTQ-UHFFFAOYSA-N 0.000 claims 1
- KPMIIVCYNIHLND-UHFFFAOYSA-N N-[3-sulfamoyl-4-[5-(trifluoromethyl)pyridin-3-yl]phenyl]-2-[2-(trifluoromethyl)phenyl]acetamide Chemical compound NS(=O)(=O)c1cc(NC(=O)Cc2ccccc2C(F)(F)F)ccc1-c1cncc(c1)C(F)(F)F KPMIIVCYNIHLND-UHFFFAOYSA-N 0.000 claims 1
- MOLKNYMGWNMWEG-UHFFFAOYSA-N N-[4-(2-chloro-5-methoxypyridin-3-yl)-3-sulfamoylphenyl]-2-(2-chlorophenyl)acetamide Chemical compound COc1cnc(Cl)c(c1)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O MOLKNYMGWNMWEG-UHFFFAOYSA-N 0.000 claims 1
- OOSSKECULYNOGQ-UHFFFAOYSA-N N-[4-(5-fluoropyridin-3-yl)-3-sulfamoylphenyl]acetamide Chemical compound C(C)(=O)NC1=CC(=C(C=C1)C=1C=NC=C(C=1)F)S(N)(=O)=O OOSSKECULYNOGQ-UHFFFAOYSA-N 0.000 claims 1
- MOQCSSQAAOCJAA-UHFFFAOYSA-N N-[4-(6-chloro-5-methylpyridin-3-yl)-3-sulfamoylphenyl]-2-(2-chlorophenyl)acetamide Chemical compound Cc1cc(cnc1Cl)-c1ccc(NC(=O)Cc2ccccc2Cl)cc1S(N)(=O)=O MOQCSSQAAOCJAA-UHFFFAOYSA-N 0.000 claims 1
- 125000004567 azetidin-3-yl group Chemical group N1CC(C1)* 0.000 claims 1
- NOMRGTQAOQNKQV-UHFFFAOYSA-N ethyl 1-[4-[[2-(2-fluorophenyl)acetyl]amino]-2-sulfamoylphenyl]pyrazole-4-carboxylate Chemical compound FC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)N1N=CC(=C1)C(=O)OCC)S(N)(=O)=O NOMRGTQAOQNKQV-UHFFFAOYSA-N 0.000 claims 1
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 claims 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 claims 1
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 claims 1
- QLNJFJADRCOGBJ-UHFFFAOYSA-N propionamide Chemical compound CCC(N)=O QLNJFJADRCOGBJ-UHFFFAOYSA-N 0.000 claims 1
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 claims 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 abstract description 3
- 125000002853 C1-C4 hydroxyalkyl group Chemical group 0.000 abstract description 2
- 125000006577 C1-C6 hydroxyalkyl group Chemical group 0.000 abstract description 2
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 abstract 6
- 125000006656 (C2-C4) alkenyl group Chemical group 0.000 abstract 2
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 abstract 1
- 238000000034 method Methods 0.000 description 79
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 32
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 27
- 239000004480 active ingredient Substances 0.000 description 27
- 238000006243 chemical reaction Methods 0.000 description 25
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 25
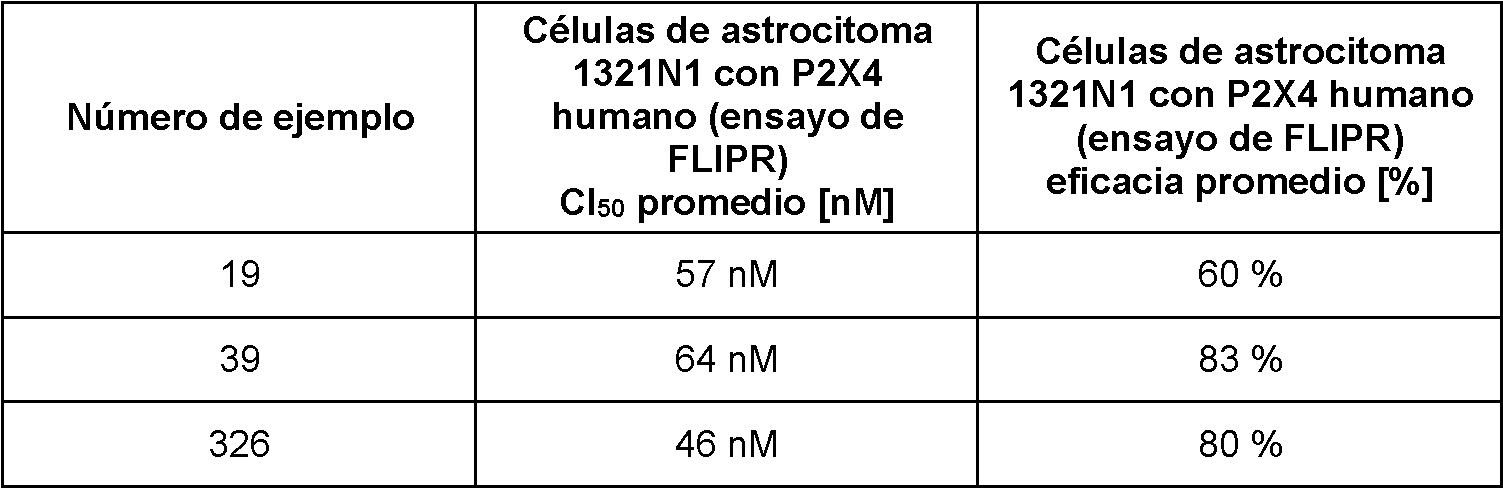
- 101710189967 P2X purinoceptor 4 Proteins 0.000 description 24
- 102100037601 P2X purinoceptor 4 Human genes 0.000 description 24
- 239000002253 acid Substances 0.000 description 23
- 239000003795 chemical substances by application Substances 0.000 description 23
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 22
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 22
- 239000000543 intermediate Substances 0.000 description 22
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 21
- 230000015572 biosynthetic process Effects 0.000 description 20
- 239000003826 tablet Substances 0.000 description 20
- 235000019441 ethanol Nutrition 0.000 description 16
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 15
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 15
- 125000003118 aryl group Chemical group 0.000 description 15
- 239000002585 base Substances 0.000 description 15
- 229940079593 drug Drugs 0.000 description 15
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 14
- 235000014113 dietary fatty acids Nutrition 0.000 description 14
- 239000000194 fatty acid Substances 0.000 description 14
- 229930195729 fatty acid Natural products 0.000 description 14
- 210000003932 urinary bladder Anatomy 0.000 description 14
- 150000001412 amines Chemical class 0.000 description 13
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 13
- 230000000694 effects Effects 0.000 description 13
- 239000002904 solvent Substances 0.000 description 13
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 12
- 150000001408 amides Chemical class 0.000 description 12
- 238000010511 deprotection reaction Methods 0.000 description 12
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 12
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 11
- 125000004432 carbon atom Chemical group C* 0.000 description 11
- 239000003480 eluent Substances 0.000 description 11
- 238000009472 formulation Methods 0.000 description 11
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 11
- 229920006395 saturated elastomer Polymers 0.000 description 11
- 239000000243 solution Substances 0.000 description 11
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 10
- 238000003786 synthesis reaction Methods 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 9
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 9
- 206010061218 Inflammation Diseases 0.000 description 9
- 239000003153 chemical reaction reagent Substances 0.000 description 9
- 239000003433 contraceptive agent Substances 0.000 description 9
- 238000005859 coupling reaction Methods 0.000 description 9
- 230000006378 damage Effects 0.000 description 9
- 150000002148 esters Chemical class 0.000 description 9
- 208000027866 inflammatory disease Diseases 0.000 description 9
- 230000004054 inflammatory process Effects 0.000 description 9
- 239000003921 oil Substances 0.000 description 9
- 235000019198 oils Nutrition 0.000 description 9
- 230000008569 process Effects 0.000 description 9
- 239000000583 progesterone congener Substances 0.000 description 9
- 238000000746 purification Methods 0.000 description 9
- WWYNJERNGUHSAO-XUDSTZEESA-N (+)-Norgestrel Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 WWYNJERNGUHSAO-XUDSTZEESA-N 0.000 description 8
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 8
- 208000005615 Interstitial Cystitis Diseases 0.000 description 8
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 8
- 235000011114 ammonium hydroxide Nutrition 0.000 description 8
- 229910052796 boron Inorganic materials 0.000 description 8
- 239000002775 capsule Substances 0.000 description 8
- 150000004665 fatty acids Chemical class 0.000 description 8
- 235000011187 glycerol Nutrition 0.000 description 8
- 150000002430 hydrocarbons Chemical group 0.000 description 8
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 8
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 150000003456 sulfonamides Chemical class 0.000 description 8
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 7
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 7
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 7
- 241000124008 Mammalia Species 0.000 description 7
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 7
- 230000002378 acidificating effect Effects 0.000 description 7
- 150000007513 acids Chemical class 0.000 description 7
- 150000001263 acyl chlorides Chemical class 0.000 description 7
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 7
- 239000001768 carboxy methyl cellulose Substances 0.000 description 7
- 239000003054 catalyst Substances 0.000 description 7
- 230000008878 coupling Effects 0.000 description 7
- 238000010168 coupling process Methods 0.000 description 7
- 229960001031 glucose Drugs 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 239000002480 mineral oil Substances 0.000 description 7
- 235000010446 mineral oil Nutrition 0.000 description 7
- 229910052763 palladium Inorganic materials 0.000 description 7
- 239000000546 pharmaceutical excipient Substances 0.000 description 7
- 229940044551 receptor antagonist Drugs 0.000 description 7
- 239000002464 receptor antagonist Substances 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 239000000725 suspension Substances 0.000 description 7
- 229940124597 therapeutic agent Drugs 0.000 description 7
- BFPYWIDHMRZLRN-UHFFFAOYSA-N 17alpha-ethynyl estradiol Natural products OC1=CC=C2C3CCC(C)(C(CC4)(O)C#C)C4C3CCC2=C1 BFPYWIDHMRZLRN-UHFFFAOYSA-N 0.000 description 6
- 208000004998 Abdominal Pain Diseases 0.000 description 6
- 206010011224 Cough Diseases 0.000 description 6
- BFPYWIDHMRZLRN-SLHNCBLASA-N Ethinyl estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 BFPYWIDHMRZLRN-SLHNCBLASA-N 0.000 description 6
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 6
- 108010010803 Gelatin Proteins 0.000 description 6
- 239000007821 HATU Substances 0.000 description 6
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 6
- 239000005557 antagonist Substances 0.000 description 6
- 230000037396 body weight Effects 0.000 description 6
- 238000004587 chromatography analysis Methods 0.000 description 6
- 229940124301 concurrent medication Drugs 0.000 description 6
- 239000003599 detergent Substances 0.000 description 6
- 239000008121 dextrose Substances 0.000 description 6
- 239000003085 diluting agent Substances 0.000 description 6
- 229960002568 ethinylestradiol Drugs 0.000 description 6
- 239000008273 gelatin Substances 0.000 description 6
- 229920000159 gelatin Polymers 0.000 description 6
- 235000019322 gelatine Nutrition 0.000 description 6
- 235000011852 gelatine desserts Nutrition 0.000 description 6
- 125000005843 halogen group Chemical group 0.000 description 6
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 229920000609 methyl cellulose Polymers 0.000 description 6
- 235000010981 methylcellulose Nutrition 0.000 description 6
- 239000001923 methylcellulose Substances 0.000 description 6
- 229960002900 methylcellulose Drugs 0.000 description 6
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 6
- 230000000144 pharmacologic effect Effects 0.000 description 6
- 239000006187 pill Substances 0.000 description 6
- 239000002798 polar solvent Substances 0.000 description 6
- 239000003755 preservative agent Substances 0.000 description 6
- 238000000926 separation method Methods 0.000 description 6
- 239000004094 surface-active agent Substances 0.000 description 6
- 239000000375 suspending agent Substances 0.000 description 6
- 239000003765 sweetening agent Substances 0.000 description 6
- 239000006188 syrup Substances 0.000 description 6
- 235000020357 syrup Nutrition 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 239000003643 water by type Substances 0.000 description 6
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 5
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 5
- 206010058019 Cancer Pain Diseases 0.000 description 5
- 229920002261 Corn starch Polymers 0.000 description 5
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 5
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 5
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 5
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 5
- 240000007472 Leucaena leucocephala Species 0.000 description 5
- 206010029240 Neuritis Diseases 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 229930006000 Sucrose Natural products 0.000 description 5
- 229920001615 Tragacanth Polymers 0.000 description 5
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 5
- 230000010933 acylation Effects 0.000 description 5
- 238000005917 acylation reaction Methods 0.000 description 5
- 125000004429 atom Chemical group 0.000 description 5
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 5
- 210000004027 cell Anatomy 0.000 description 5
- 239000003086 colorant Substances 0.000 description 5
- 239000007859 condensation product Substances 0.000 description 5
- 239000000470 constituent Substances 0.000 description 5
- 229940124558 contraceptive agent Drugs 0.000 description 5
- 239000008120 corn starch Substances 0.000 description 5
- 229940099112 cornstarch Drugs 0.000 description 5
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 5
- AZFLJNIPTRTECV-FUMNGEBKSA-N dienogest Chemical compound C1CC(=O)C=C2CC[C@@H]([C@H]3[C@@](C)([C@](CC3)(O)CC#N)CC3)C3=C21 AZFLJNIPTRTECV-FUMNGEBKSA-N 0.000 description 5
- 239000000796 flavoring agent Substances 0.000 description 5
- 235000003599 food sweetener Nutrition 0.000 description 5
- 150000004677 hydrates Chemical class 0.000 description 5
- 239000003112 inhibitor Substances 0.000 description 5
- 230000000155 isotopic effect Effects 0.000 description 5
- 239000008101 lactose Substances 0.000 description 5
- 229960004400 levonorgestrel Drugs 0.000 description 5
- 230000003647 oxidation Effects 0.000 description 5
- 238000007254 oxidation reaction Methods 0.000 description 5
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 5
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 5
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 5
- 230000002265 prevention Effects 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 5
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000000600 sorbitol Substances 0.000 description 5
- 239000005720 sucrose Substances 0.000 description 5
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 5
- 230000009466 transformation Effects 0.000 description 5
- 150000003852 triazoles Chemical class 0.000 description 5
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 5
- 239000000080 wetting agent Substances 0.000 description 5
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 description 4
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 4
- 241000416162 Astragalus gummifer Species 0.000 description 4
- 229920000089 Cyclic olefin copolymer Polymers 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 241000282414 Homo sapiens Species 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- 206010020853 Hypertonic bladder Diseases 0.000 description 4
- 235000019483 Peanut oil Nutrition 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical class C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 4
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 4
- 206010039491 Sarcoma Diseases 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- 208000000921 Urge Urinary Incontinence Diseases 0.000 description 4
- 208000027418 Wounds and injury Diseases 0.000 description 4
- 239000000556 agonist Substances 0.000 description 4
- 150000001298 alcohols Chemical class 0.000 description 4
- 235000010443 alginic acid Nutrition 0.000 description 4
- 229920000615 alginic acid Polymers 0.000 description 4
- 239000000783 alginic acid Substances 0.000 description 4
- 229960001126 alginic acid Drugs 0.000 description 4
- 150000004781 alginic acids Chemical class 0.000 description 4
- 150000001448 anilines Chemical class 0.000 description 4
- 208000006673 asthma Diseases 0.000 description 4
- 239000012752 auxiliary agent Substances 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 150000001649 bromium compounds Chemical class 0.000 description 4
- 210000003169 central nervous system Anatomy 0.000 description 4
- 229960000541 cetyl alcohol Drugs 0.000 description 4
- 230000002254 contraceptive effect Effects 0.000 description 4
- 206010012601 diabetes mellitus Diseases 0.000 description 4
- 229960003309 dienogest Drugs 0.000 description 4
- 239000002270 dispersing agent Substances 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 239000003995 emulsifying agent Substances 0.000 description 4
- 235000019253 formic acid Nutrition 0.000 description 4
- 239000012458 free base Substances 0.000 description 4
- 238000005984 hydrogenation reaction Methods 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 229910052742 iron Inorganic materials 0.000 description 4
- 238000002955 isolation Methods 0.000 description 4
- 235000010445 lecithin Nutrition 0.000 description 4
- 239000000787 lecithin Substances 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 125000002950 monocyclic group Chemical group 0.000 description 4
- 201000006417 multiple sclerosis Diseases 0.000 description 4
- 230000000269 nucleophilic effect Effects 0.000 description 4
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 4
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 4
- 239000002674 ointment Substances 0.000 description 4
- 239000004006 olive oil Substances 0.000 description 4
- 235000008390 olive oil Nutrition 0.000 description 4
- 230000036961 partial effect Effects 0.000 description 4
- 239000000312 peanut oil Substances 0.000 description 4
- 239000002957 persistent organic pollutant Substances 0.000 description 4
- 239000008177 pharmaceutical agent Substances 0.000 description 4
- 229910052697 platinum Inorganic materials 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 4
- 229920000053 polysorbate 80 Polymers 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 4
- 125000004076 pyridyl group Chemical group 0.000 description 4
- 239000008159 sesame oil Substances 0.000 description 4
- 235000011803 sesame oil Nutrition 0.000 description 4
- 210000000278 spinal cord Anatomy 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- 235000000346 sugar Nutrition 0.000 description 4
- 229910052718 tin Inorganic materials 0.000 description 4
- 239000011135 tin Substances 0.000 description 4
- 238000000844 transformation Methods 0.000 description 4
- 235000015112 vegetable and seed oil Nutrition 0.000 description 4
- 239000008158 vegetable oil Substances 0.000 description 4
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 3
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 3
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 3
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 3
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 3
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 3
- 208000023275 Autoimmune disease Diseases 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 208000017604 Hodgkin disease Diseases 0.000 description 3
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 3
- 239000004264 Petrolatum Substances 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 208000000453 Skin Neoplasms Diseases 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 229920002125 Sokalan® Polymers 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 235000021355 Stearic acid Nutrition 0.000 description 3
- 208000006011 Stroke Diseases 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 3
- 206010046543 Urinary incontinence Diseases 0.000 description 3
- 208000012931 Urologic disease Diseases 0.000 description 3
- 208000036142 Viral infection Diseases 0.000 description 3
- WERKSKAQRVDLDW-ANOHMWSOSA-N [(2s,3r,4r,5r)-2,3,4,5,6-pentahydroxyhexyl] (z)-octadec-9-enoate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO WERKSKAQRVDLDW-ANOHMWSOSA-N 0.000 description 3
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 3
- 229910021529 ammonia Inorganic materials 0.000 description 3
- 150000003863 ammonium salts Chemical class 0.000 description 3
- 239000000440 bentonite Substances 0.000 description 3
- 229910000278 bentonite Inorganic materials 0.000 description 3
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 3
- 125000005605 benzo group Chemical group 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 238000004166 bioassay Methods 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 208000013116 chronic cough Diseases 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- RPLCPCMSCLEKRS-BPIQYHPVSA-N desogestrel Chemical compound C1CC[C@@H]2[C@H]3C(=C)C[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 RPLCPCMSCLEKRS-BPIQYHPVSA-N 0.000 description 3
- 229960004976 desogestrel Drugs 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 229930182833 estradiol Natural products 0.000 description 3
- 229960005309 estradiol Drugs 0.000 description 3
- 229960002428 fentanyl Drugs 0.000 description 3
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 3
- 235000013355 food flavoring agent Nutrition 0.000 description 3
- 239000007903 gelatin capsule Substances 0.000 description 3
- 230000003054 hormonal effect Effects 0.000 description 3
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 3
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 3
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 3
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 3
- 230000003463 hyperproliferative effect Effects 0.000 description 3
- 229960004801 imipramine Drugs 0.000 description 3
- BCGWQEUPMDMJNV-UHFFFAOYSA-N imipramine Chemical compound C1CC2=CC=CC=C2N(CCCN(C)C)C2=CC=CC=C21 BCGWQEUPMDMJNV-UHFFFAOYSA-N 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 230000000302 ischemic effect Effects 0.000 description 3
- 229940067606 lecithin Drugs 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 238000007726 management method Methods 0.000 description 3
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 3
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 3
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 3
- 229940016286 microcrystalline cellulose Drugs 0.000 description 3
- 239000008108 microcrystalline cellulose Substances 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 229960005181 morphine Drugs 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- VIKNJXKGJWUCNN-XGXHKTLJSA-N norethisterone Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 VIKNJXKGJWUCNN-XGXHKTLJSA-N 0.000 description 3
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 3
- 235000021313 oleic acid Nutrition 0.000 description 3
- 229940005483 opioid analgesics Drugs 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- 239000012188 paraffin wax Substances 0.000 description 3
- 229940066842 petrolatum Drugs 0.000 description 3
- 235000019271 petrolatum Nutrition 0.000 description 3
- 231100000572 poisoning Toxicity 0.000 description 3
- 230000000607 poisoning effect Effects 0.000 description 3
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 3
- LWIHDJKSTIGBAC-UHFFFAOYSA-K potassium phosphate Substances [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 230000003449 preventive effect Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 239000003586 protic polar solvent Substances 0.000 description 3
- 230000001850 reproductive effect Effects 0.000 description 3
- 208000023504 respiratory system disease Diseases 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 235000010413 sodium alginate Nutrition 0.000 description 3
- 239000000661 sodium alginate Substances 0.000 description 3
- 229940005550 sodium alginate Drugs 0.000 description 3
- 235000011069 sorbitan monooleate Nutrition 0.000 description 3
- 239000001593 sorbitan monooleate Substances 0.000 description 3
- 229940035049 sorbitan monooleate Drugs 0.000 description 3
- 239000003549 soybean oil Substances 0.000 description 3
- 235000012424 soybean oil Nutrition 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 229940032147 starch Drugs 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000008117 stearic acid Substances 0.000 description 3
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical class ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 3
- 239000000454 talc Substances 0.000 description 3
- 229910052623 talc Inorganic materials 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 229960004418 trolamine Drugs 0.000 description 3
- 208000014001 urinary system disease Diseases 0.000 description 3
- 210000001635 urinary tract Anatomy 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- KBFRRZPPJPKFHQ-WOMZHKBXSA-N (8R,9S,10R,13S,14S,17R)-13-ethyl-17-ethynyl-3-hydroxyimino-1,2,6,7,8,9,10,11,12,14,15,16-dodecahydrocyclopenta[a]phenanthren-17-ol (8R,9S,13S,14S,17R)-17-ethynyl-13-methyl-7,8,9,11,12,14,15,16-octahydro-6H-cyclopenta[a]phenanthrene-3,17-diol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1.ON=C1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 KBFRRZPPJPKFHQ-WOMZHKBXSA-N 0.000 description 2
- MXBCYQUALCBQIJ-RYVPXURESA-N (8s,9s,10r,13s,14s,17r)-13-ethyl-17-ethynyl-11-methylidene-1,2,3,6,7,8,9,10,12,14,15,16-dodecahydrocyclopenta[a]phenanthren-17-ol;(8r,9s,13s,14s,17r)-17-ethynyl-13-methyl-7,8,9,11,12,14,15,16-octahydro-6h-cyclopenta[a]phenanthrene-3,17-diol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1.C1CC[C@@H]2[C@H]3C(=C)C[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 MXBCYQUALCBQIJ-RYVPXURESA-N 0.000 description 2
- MXDOOIVQXATHKU-RYVPXURESA-N (8s,9s,10r,13s,14s,17r)-13-ethyl-17-ethynyl-17-hydroxy-11-methylidene-2,6,7,8,9,10,12,14,15,16-decahydro-1h-cyclopenta[a]phenanthren-3-one;(8r,9s,13s,14s,17r)-17-ethynyl-13-methyl-7,8,9,11,12,14,15,16-octahydro-6h-cyclopenta[a]phenanthrene-3,17-diol Chemical group OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1.O=C1CC[C@@H]2[C@H]3C(=C)C[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 MXDOOIVQXATHKU-RYVPXURESA-N 0.000 description 2
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 2
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 2
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- XDOFQFKRPWOURC-UHFFFAOYSA-N 16-methylheptadecanoic acid Chemical compound CC(C)CCCCCCCCCCCCCCC(O)=O XDOFQFKRPWOURC-UHFFFAOYSA-N 0.000 description 2
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 2
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 2
- OGSPWJRAVKPPFI-UHFFFAOYSA-N Alendronic Acid Chemical compound NCCCC(O)(P(O)(O)=O)P(O)(O)=O OGSPWJRAVKPPFI-UHFFFAOYSA-N 0.000 description 2
- 239000005995 Aluminium silicate Substances 0.000 description 2
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 2
- 235000003911 Arachis Nutrition 0.000 description 2
- 244000105624 Arachis hypogaea Species 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 208000035143 Bacterial infection Diseases 0.000 description 2
- 201000009144 Bartter disease type 3 Diseases 0.000 description 2
- 206010071445 Bladder outlet obstruction Diseases 0.000 description 2
- 201000006474 Brain Ischemia Diseases 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- 206010006811 Bursitis Diseases 0.000 description 2
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 2
- QFOHBWFCKVYLES-UHFFFAOYSA-N Butylparaben Chemical compound CCCCOC(=O)C1=CC=C(O)C=C1 QFOHBWFCKVYLES-UHFFFAOYSA-N 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 2
- XUEGVRUGKRHCCX-UHFFFAOYSA-N Cl.S(=O)(=O)=C1CC=CC=C1 Chemical class Cl.S(=O)(=O)=C1CC=CC=C1 XUEGVRUGKRHCCX-UHFFFAOYSA-N 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- RSEPBGGWRJCQGY-RBRWEJTLSA-N Estradiol valerate Chemical compound C1CC2=CC(O)=CC=C2[C@@H]2[C@@H]1[C@@H]1CC[C@H](OC(=O)CCCC)[C@@]1(C)CC2 RSEPBGGWRJCQGY-RBRWEJTLSA-N 0.000 description 2
- 239000001856 Ethyl cellulose Substances 0.000 description 2
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 2
- DBVJJBKOTRCVKF-UHFFFAOYSA-N Etidronic acid Chemical compound OP(=O)(O)C(O)(C)P(O)(O)=O DBVJJBKOTRCVKF-UHFFFAOYSA-N 0.000 description 2
- 208000001640 Fibromyalgia Diseases 0.000 description 2
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- UGJMXCAKCUNAIE-UHFFFAOYSA-N Gabapentin Chemical compound OC(=O)CC1(CN)CCCCC1 UGJMXCAKCUNAIE-UHFFFAOYSA-N 0.000 description 2
- NMJREATYWWNIKX-UHFFFAOYSA-N GnRH Chemical class C1CCC(C(=O)NCC(N)=O)N1C(=O)C(CC(C)C)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 NMJREATYWWNIKX-UHFFFAOYSA-N 0.000 description 2
- 108010069236 Goserelin Proteins 0.000 description 2
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 2
- 201000005569 Gout Diseases 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- 206010019233 Headaches Diseases 0.000 description 2
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 2
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- 208000003456 Juvenile Arthritis Diseases 0.000 description 2
- 206010059176 Juvenile idiopathic arthritis Diseases 0.000 description 2
- 108010000817 Leuprolide Proteins 0.000 description 2
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 206010027566 Micturition urgency Diseases 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 206010028391 Musculoskeletal Pain Diseases 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- QECVIPBZOPUTRD-UHFFFAOYSA-N N=S(=O)=O Chemical class N=S(=O)=O QECVIPBZOPUTRD-UHFFFAOYSA-N 0.000 description 2
- 108010021717 Nafarelin Proteins 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 2
- 239000005642 Oleic acid Substances 0.000 description 2
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 2
- 208000009722 Overactive Urinary Bladder Diseases 0.000 description 2
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 208000005374 Poisoning Diseases 0.000 description 2
- 206010036018 Pollakiuria Diseases 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- GOOHAUXETOMSMM-UHFFFAOYSA-N Propylene oxide Chemical compound CC1CO1 GOOHAUXETOMSMM-UHFFFAOYSA-N 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 102000000033 Purinergic Receptors Human genes 0.000 description 2
- 108010080192 Purinergic Receptors Proteins 0.000 description 2
- 206010037660 Pyrexia Diseases 0.000 description 2
- 206010069645 Reduced bladder capacity Diseases 0.000 description 2
- IIDJRNMFWXDHID-UHFFFAOYSA-N Risedronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CC1=CC=CN=C1 IIDJRNMFWXDHID-UHFFFAOYSA-N 0.000 description 2
- 229920001800 Shellac Polymers 0.000 description 2
- 206010066218 Stress Urinary Incontinence Diseases 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- 238000006069 Suzuki reaction reaction Methods 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- 235000009470 Theobroma cacao Nutrition 0.000 description 2
- 244000299461 Theobroma cacao Species 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 208000025865 Ulcer Diseases 0.000 description 2
- 208000003800 Urinary Bladder Neck Obstruction Diseases 0.000 description 2
- 208000026723 Urinary tract disease Diseases 0.000 description 2
- 208000003728 Vulvodynia Diseases 0.000 description 2
- 206010069055 Vulvovaginal pain Diseases 0.000 description 2
- 229960002184 abarelix Drugs 0.000 description 2
- AIWRTTMUVOZGPW-HSPKUQOVSA-N abarelix Chemical compound C([C@@H](C(=O)N[C@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)N(C)C(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 AIWRTTMUVOZGPW-HSPKUQOVSA-N 0.000 description 2
- 108010023617 abarelix Proteins 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 125000000218 acetic acid group Chemical group C(C)(=O)* 0.000 description 2
- 108010052004 acetyl-2-naphthylalanyl-3-chlorophenylalanyl-1-oxohexadecyl-seryl-4-aminophenylalanyl(hydroorotyl)-4-aminophenylalanyl(carbamoyl)-leucyl-ILys-prolyl-alaninamide Proteins 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 229910052783 alkali metal Inorganic materials 0.000 description 2
- 230000003281 allosteric effect Effects 0.000 description 2
- 235000012211 aluminium silicate Nutrition 0.000 description 2
- 229960000836 amitriptyline Drugs 0.000 description 2
- KRMDCWKBEZIMAB-UHFFFAOYSA-N amitriptyline Chemical compound C1CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 KRMDCWKBEZIMAB-UHFFFAOYSA-N 0.000 description 2
- 208000037769 antenatal Bartter syndrome Diseases 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- 239000000935 antidepressant agent Substances 0.000 description 2
- 229940005513 antidepressants Drugs 0.000 description 2
- 239000000010 aprotic solvent Substances 0.000 description 2
- 239000007900 aqueous suspension Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 208000010668 atopic eczema Diseases 0.000 description 2
- 208000022362 bacterial infectious disease Diseases 0.000 description 2
- 235000013871 bee wax Nutrition 0.000 description 2
- 239000012166 beeswax Substances 0.000 description 2
- 238000013542 behavioral therapy Methods 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 229960000686 benzalkonium chloride Drugs 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 2
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 2
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229950005499 carbon tetrachloride Drugs 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 2
- 230000000973 chemotherapeutic effect Effects 0.000 description 2
- 238000004296 chiral HPLC Methods 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 208000006990 cholangiocarcinoma Diseases 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229940110456 cocoa butter Drugs 0.000 description 2
- 235000019868 cocoa butter Nutrition 0.000 description 2
- 235000005687 corn oil Nutrition 0.000 description 2
- 239000002285 corn oil Substances 0.000 description 2
- 235000012343 cottonseed oil Nutrition 0.000 description 2
- 239000002385 cottonseed oil Substances 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 229960002272 degarelix Drugs 0.000 description 2
- MEUCPCLKGZSHTA-XYAYPHGZSA-N degarelix Chemical compound C([C@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CC=1C=CC(NC(=O)[C@H]2NC(=O)NC(=O)C2)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(NC(N)=O)C=C1 MEUCPCLKGZSHTA-XYAYPHGZSA-N 0.000 description 2
- 229960001251 denosumab Drugs 0.000 description 2
- 238000001212 derivatisation Methods 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- 125000002576 diazepinyl group Chemical class N1N=C(C=CC=C1)* 0.000 description 2
- 235000019700 dicalcium phosphate Nutrition 0.000 description 2
- 229940095079 dicalcium phosphate anhydrous Drugs 0.000 description 2
- 235000005911 diet Nutrition 0.000 description 2
- 230000037213 diet Effects 0.000 description 2
- FLKPEMZONWLCSK-UHFFFAOYSA-N diethyl phthalate Chemical compound CCOC(=O)C1=CC=CC=C1C(=O)OCC FLKPEMZONWLCSK-UHFFFAOYSA-N 0.000 description 2
- 125000006001 difluoroethyl group Chemical group 0.000 description 2
- METQSPRSQINEEU-UHFFFAOYSA-N dihydrospirorenone Natural products CC12CCC(C3(CCC(=O)C=C3C3CC33)C)C3C1C1CC1C21CCC(=O)O1 METQSPRSQINEEU-UHFFFAOYSA-N 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 229960004845 drospirenone Drugs 0.000 description 2
- METQSPRSQINEEU-HXCATZOESA-N drospirenone Chemical compound C([C@]12[C@H]3C[C@H]3[C@H]3[C@H]4[C@@H]([C@]5(CCC(=O)C=C5[C@@H]5C[C@@H]54)C)CC[C@@]31C)CC(=O)O2 METQSPRSQINEEU-HXCATZOESA-N 0.000 description 2
- 238000003821 enantio-separation Methods 0.000 description 2
- 229960004579 epoetin beta Drugs 0.000 description 2
- 229960004766 estradiol valerate Drugs 0.000 description 2
- 229940011871 estrogen Drugs 0.000 description 2
- 239000000262 estrogen Substances 0.000 description 2
- 150000002170 ethers Chemical class 0.000 description 2
- 235000019325 ethyl cellulose Nutrition 0.000 description 2
- 229920001249 ethyl cellulose Polymers 0.000 description 2
- 229940009626 etidronate Drugs 0.000 description 2
- GCKFUYQCUCGESZ-BPIQYHPVSA-N etonogestrel Chemical compound O=C1CC[C@@H]2[C@H]3C(=C)C[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 GCKFUYQCUCGESZ-BPIQYHPVSA-N 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 150000004675 formic acid derivatives Chemical class 0.000 description 2
- 238000001640 fractional crystallisation Methods 0.000 description 2
- 229960003794 ganirelix Drugs 0.000 description 2
- GJNXBNATEDXMAK-PFLSVRRQSA-N ganirelix Chemical compound C([C@@H](C(=O)N[C@H](CCCCN=C(NCC)NCC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN=C(NCC)NCC)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 GJNXBNATEDXMAK-PFLSVRRQSA-N 0.000 description 2
- 108700032141 ganirelix Proteins 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 229960002913 goserelin Drugs 0.000 description 2
- 231100000869 headache Toxicity 0.000 description 2
- 201000005787 hematologic cancer Diseases 0.000 description 2
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- FBPFZTCFMRRESA-UHFFFAOYSA-N hexane-1,2,3,4,5,6-hexol Chemical compound OCC(O)C(O)C(O)C(O)CO FBPFZTCFMRRESA-UHFFFAOYSA-N 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 230000004047 hyperresponsiveness Effects 0.000 description 2
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 2
- 239000007943 implant Substances 0.000 description 2
- 230000004968 inflammatory condition Effects 0.000 description 2
- 206010022000 influenza Diseases 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 150000004694 iodide salts Chemical class 0.000 description 2
- 208000037906 ischaemic injury Diseases 0.000 description 2
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 2
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- 208000017169 kidney disease Diseases 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 2
- 229960004338 leuprorelin Drugs 0.000 description 2
- 229960004194 lidocaine Drugs 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- 229940057995 liquid paraffin Drugs 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- 239000008176 lyophilized powder Substances 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 230000027939 micturition Effects 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 125000000896 monocarboxylic acid group Chemical group 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 2
- RWHUEXWOYVBUCI-ITQXDASVSA-N nafarelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 RWHUEXWOYVBUCI-ITQXDASVSA-N 0.000 description 2
- 229960002333 nafarelin Drugs 0.000 description 2
- 210000003739 neck Anatomy 0.000 description 2
- 229940126662 negative allosteric modulator Drugs 0.000 description 2
- 208000015122 neurodegenerative disease Diseases 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 150000002829 nitrogen Chemical class 0.000 description 2
- 206010029446 nocturia Diseases 0.000 description 2
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 description 2
- 239000000346 nonvolatile oil Substances 0.000 description 2
- 229940053934 norethindrone Drugs 0.000 description 2
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 2
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 2
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 229940071844 ortho evra Drugs 0.000 description 2
- 208000020629 overactive bladder Diseases 0.000 description 2
- 125000001715 oxadiazolyl group Chemical group 0.000 description 2
- 229960002085 oxycodone Drugs 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 235000010987 pectin Nutrition 0.000 description 2
- 239000001814 pectin Substances 0.000 description 2
- 229920001277 pectin Polymers 0.000 description 2
- VOKSWYLNZZRQPF-GDIGMMSISA-N pentazocine Chemical compound C1C2=CC=C(O)C=C2[C@@]2(C)[C@@H](C)[C@@H]1N(CC=C(C)C)CC2 VOKSWYLNZZRQPF-GDIGMMSISA-N 0.000 description 2
- 229960005301 pentazocine Drugs 0.000 description 2
- WEXRUCMBJFQVBZ-UHFFFAOYSA-N pentobarbital Chemical compound CCCC(C)C1(CC)C(=O)NC(=O)NC1=O WEXRUCMBJFQVBZ-UHFFFAOYSA-N 0.000 description 2
- 210000001428 peripheral nervous system Anatomy 0.000 description 2
- 239000002831 pharmacologic agent Substances 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 2
- 229920000728 polyester Polymers 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 229920001296 polysiloxane Polymers 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 229920003124 powdered cellulose Polymers 0.000 description 2
- 235000019814 powdered cellulose Nutrition 0.000 description 2
- 238000002953 preparative HPLC Methods 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 2
- 229940127293 prostanoid Drugs 0.000 description 2
- 150000003814 prostanoids Chemical class 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- 229940075993 receptor modulator Drugs 0.000 description 2
- 230000000241 respiratory effect Effects 0.000 description 2
- 210000002345 respiratory system Anatomy 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 201000003068 rheumatic fever Diseases 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 2
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical compound C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 2
- 239000004208 shellac Substances 0.000 description 2
- 229940113147 shellac Drugs 0.000 description 2
- 235000013874 shellac Nutrition 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 239000000344 soap Substances 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 239000008227 sterile water for injection Substances 0.000 description 2
- 208000022170 stress incontinence Diseases 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 150000005846 sugar alcohols Polymers 0.000 description 2
- 239000011593 sulfur Substances 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 239000002562 thickening agent Substances 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- RMVRSNDYEFQCLF-UHFFFAOYSA-N thiophenol Chemical class SC1=CC=CC=C1 RMVRSNDYEFQCLF-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 2
- 235000010487 tragacanth Nutrition 0.000 description 2
- 239000000196 tragacanth Substances 0.000 description 2
- 229940116362 tragacanth Drugs 0.000 description 2
- 238000012549 training Methods 0.000 description 2
- 229960004380 tramadol Drugs 0.000 description 2
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 2
- RUVINXPYWBROJD-ONEGZZNKSA-N trans-anethole Chemical compound COC1=CC=C(\C=C\C)C=C1 RUVINXPYWBROJD-ONEGZZNKSA-N 0.000 description 2
- 229960001612 trastuzumab emtansine Drugs 0.000 description 2
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 206010046494 urge incontinence Diseases 0.000 description 2
- 239000006213 vaginal ring Substances 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- 229940045860 white wax Drugs 0.000 description 2
- XOOUIPVCVHRTMJ-UHFFFAOYSA-L zinc stearate Chemical compound [Zn+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O XOOUIPVCVHRTMJ-UHFFFAOYSA-L 0.000 description 2
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 2
- 229960004276 zoledronic acid Drugs 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- QCHFTSOMWOSFHM-WPRPVWTQSA-N (+)-Pilocarpine Chemical compound C1OC(=O)[C@@H](CC)[C@H]1CC1=CN=CN1C QCHFTSOMWOSFHM-WPRPVWTQSA-N 0.000 description 1
- DNXHEGUUPJUMQT-UHFFFAOYSA-N (+)-estrone Natural products OC1=CC=C2C3CCC(C)(C(CC4)=O)C4C3CCC2=C1 DNXHEGUUPJUMQT-UHFFFAOYSA-N 0.000 description 1
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- VLPIATFUUWWMKC-SNVBAGLBSA-N (2r)-1-(2,6-dimethylphenoxy)propan-2-amine Chemical compound C[C@@H](N)COC1=C(C)C=CC=C1C VLPIATFUUWWMKC-SNVBAGLBSA-N 0.000 description 1
- FKHUGQZRBPETJR-RXSRXONKSA-N (2r)-2-[[(4r)-4-[[(2s)-2-[[(2r)-2-[(3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxypropanoyl]amino]propanoyl]amino]-5-amino-5-oxopentanoyl]amino]-6-(octadecanoylamino)hexanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(=O)NCCCC[C@H](C(O)=O)NC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)OC(O)[C@@H]1NC(C)=O FKHUGQZRBPETJR-RXSRXONKSA-N 0.000 description 1
- CATMPQFFVNKDEY-DGCLKSJQSA-N (2r)-2-amino-5-[[(1r)-1-carboxy-2-(1h-indol-3-yl)ethyl]amino]-5-oxopentanoic acid Chemical compound C1=CC=C2C(C[C@@H](NC(=O)CC[C@@H](N)C(O)=O)C(O)=O)=CNC2=C1 CATMPQFFVNKDEY-DGCLKSJQSA-N 0.000 description 1
- UELYDGOOJPRWGF-SRQXXRKNSA-N (2r,3r)-3-[2-[4-(cyclopropylsulfonimidoyl)anilino]-5-(trifluoromethyl)pyrimidin-4-yl]oxybutan-2-ol Chemical compound C1=C(C(F)(F)F)C(O[C@H](C)[C@H](O)C)=NC(NC=2C=CC(=CC=2)[S@](=N)(=O)C2CC2)=N1 UELYDGOOJPRWGF-SRQXXRKNSA-N 0.000 description 1
- CUGDYSSBTWBKII-LXGUWJNJSA-N (2r,3r,4r,5s)-6-(dimethylamino)hexane-1,2,3,4,5-pentol Chemical compound CN(C)C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO CUGDYSSBTWBKII-LXGUWJNJSA-N 0.000 description 1
- IKXCHOUDIPZROZ-LXGUWJNJSA-N (2r,3r,4r,5s)-6-(ethylamino)hexane-1,2,3,4,5-pentol Chemical compound CCNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO IKXCHOUDIPZROZ-LXGUWJNJSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- ISHXLNHNDMZNMC-VTKCIJPMSA-N (3e,8r,9s,10r,13s,14s,17r)-13-ethyl-17-ethynyl-3-hydroxyimino-1,2,6,7,8,9,10,11,12,14,15,16-dodecahydrocyclopenta[a]phenanthren-17-ol Chemical compound O/N=C/1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C\1 ISHXLNHNDMZNMC-VTKCIJPMSA-N 0.000 description 1
- FELGMEQIXOGIFQ-CYBMUJFWSA-N (3r)-9-methyl-3-[(2-methylimidazol-1-yl)methyl]-2,3-dihydro-1h-carbazol-4-one Chemical compound CC1=NC=CN1C[C@@H]1C(=O)C(C=2C(=CC=CC=2)N2C)=C2CC1 FELGMEQIXOGIFQ-CYBMUJFWSA-N 0.000 description 1
- GDFGTRDCCWFXTG-SCTDSRPQSA-N (3r,4ar,10as)-3-(diethylsulfamoylamino)-6-hydroxy-1-propyl-3,4,4a,5,10,10a-hexahydro-2h-benzo[g]quinoline Chemical compound C1=CC=C2C[C@@H]3N(CCC)C[C@H](NS(=O)(=O)N(CC)CC)C[C@H]3CC2=C1O GDFGTRDCCWFXTG-SCTDSRPQSA-N 0.000 description 1
- CUKWUWBLQQDQAC-VEQWQPCFSA-N (3s)-3-amino-4-[[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2s,3s)-1-[[(2s)-1-[(2s)-2-[[(1s)-1-carboxyethyl]carbamoyl]pyrrolidin-1-yl]-3-(1h-imidazol-5-yl)-1-oxopropan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amino]-3-methyl-1-ox Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C1=CC=C(O)C=C1 CUKWUWBLQQDQAC-VEQWQPCFSA-N 0.000 description 1
- DKSZLDSPXIWGFO-BLOJGBSASA-N (4r,4ar,7s,7ar,12bs)-9-methoxy-3-methyl-2,4,4a,7,7a,13-hexahydro-1h-4,12-methanobenzofuro[3,2-e]isoquinoline-7-ol;phosphoric acid;hydrate Chemical compound O.OP(O)(O)=O.OP(O)(O)=O.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC DKSZLDSPXIWGFO-BLOJGBSASA-N 0.000 description 1
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 1
- PUDHBTGHUJUUFI-SCTWWAJVSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5,8,11,14,17-p Chemical compound C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 PUDHBTGHUJUUFI-SCTWWAJVSA-N 0.000 description 1
- CNVRALIOWLIHEP-UHFFFAOYSA-N (5,5-dimethyloxolan-3-yl)methanol Chemical compound CC1(C)CC(CO)CO1 CNVRALIOWLIHEP-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-STQMWFEESA-N (6S)-5-formyltetrahydrofolic acid Chemical compound C([C@H]1CNC=2N=C(NC(=O)C=2N1C=O)N)NC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-STQMWFEESA-N 0.000 description 1
- SSNHGLKFJISNTR-DYSNNVSPSA-N (6ar,10ar)-6,6,9-trimethyl-3-pentyl-6a,7,8,10a-tetrahydrobenzo[c]chromen-1-ol;2-[(1r,6r)-3-methyl-6-prop-1-en-2-ylcyclohex-2-en-1-yl]-5-pentylbenzene-1,3-diol Chemical class OC1=CC(CCCCC)=CC(O)=C1[C@H]1[C@H](C(C)=C)CCC(C)=C1.C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 SSNHGLKFJISNTR-DYSNNVSPSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- ORKBYCQJWQBPFG-WOMZHKBXSA-N (8r,9s,10r,13s,14s,17r)-13-ethyl-17-ethynyl-17-hydroxy-1,2,6,7,8,9,10,11,12,14,15,16-dodecahydrocyclopenta[a]phenanthren-3-one;(8r,9s,13s,14s,17r)-17-ethynyl-13-methyl-7,8,9,11,12,14,15,16-octahydro-6h-cyclopenta[a]phenanthrene-3,17-diol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1.O=C1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 ORKBYCQJWQBPFG-WOMZHKBXSA-N 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- ZEUITGRIYCTCEM-KRWDZBQOSA-N (S)-duloxetine Chemical compound C1([C@@H](OC=2C3=CC=CC=C3C=CC=2)CCNC)=CC=CS1 ZEUITGRIYCTCEM-KRWDZBQOSA-N 0.000 description 1
- 150000000177 1,2,3-triazoles Chemical class 0.000 description 1
- 125000004505 1,2,4-oxadiazol-5-yl group Chemical group O1N=CN=C1* 0.000 description 1
- 125000004509 1,3,4-oxadiazol-2-yl group Chemical group O1C(=NN=C1)* 0.000 description 1
- WSTAITCRSVOCTK-UHFFFAOYSA-N 1,4-diazabicyclo[2.2.2]octane;trimethylalumane Chemical compound C[Al](C)C.C[Al](C)C.C1CN2CCN1CC2 WSTAITCRSVOCTK-UHFFFAOYSA-N 0.000 description 1
- HJTAZXHBEBIQQX-UHFFFAOYSA-N 1,5-bis(chloromethyl)naphthalene Chemical compound C1=CC=C2C(CCl)=CC=CC2=C1CCl HJTAZXHBEBIQQX-UHFFFAOYSA-N 0.000 description 1
- ZGCHLAJIRWDGFE-UHFFFAOYSA-N 1-aminopropane-1,1-diol Chemical compound CCC(N)(O)O ZGCHLAJIRWDGFE-UHFFFAOYSA-N 0.000 description 1
- VFWCMGCRMGJXDK-UHFFFAOYSA-N 1-chlorobutane Chemical class CCCCCl VFWCMGCRMGJXDK-UHFFFAOYSA-N 0.000 description 1
- VUQPJRPDRDVQMN-UHFFFAOYSA-N 1-chlorooctadecane Chemical class CCCCCCCCCCCCCCCCCCCl VUQPJRPDRDVQMN-UHFFFAOYSA-N 0.000 description 1
- 125000004066 1-hydroxyethyl group Chemical group [H]OC([H])([*])C([H])([H])[H] 0.000 description 1
- DGHHQBMTXTWTJV-BQAIUKQQSA-N 119413-54-6 Chemical compound Cl.C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 DGHHQBMTXTWTJV-BQAIUKQQSA-N 0.000 description 1
- BOMZMNZEXMAQQW-UHFFFAOYSA-N 2,5,11-trimethyl-6h-pyrido[4,3-b]carbazol-2-ium-9-ol;acetate Chemical compound CC([O-])=O.C[N+]1=CC=C2C(C)=C(NC=3C4=CC(O)=CC=3)C4=C(C)C2=C1 BOMZMNZEXMAQQW-UHFFFAOYSA-N 0.000 description 1
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 1
- CLJJCXCOVSQUAA-UHFFFAOYSA-N 2-(2-benzylsulfanyl-4-nitrophenyl)-5-(difluoromethyl)-1,3,4-oxadiazole Chemical compound C(C1=CC=CC=C1)SC1=C(C=CC(=C1)[N+](=O)[O-])C=1OC(=NN=1)C(F)F CLJJCXCOVSQUAA-UHFFFAOYSA-N 0.000 description 1
- YAFALPCGBLOTTA-UHFFFAOYSA-N 2-(4-cyanopyrazol-1-yl)-5-nitrobenzenesulfonamide Chemical compound C(#N)C=1C=NN(C=1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)N YAFALPCGBLOTTA-UHFFFAOYSA-N 0.000 description 1
- KUXGUCNZFCVULO-UHFFFAOYSA-N 2-(4-nonylphenoxy)ethanol Chemical compound CCCCCCCCCC1=CC=C(OCCO)C=C1 KUXGUCNZFCVULO-UHFFFAOYSA-N 0.000 description 1
- QMFDJNHWUUDLNN-UHFFFAOYSA-N 2-(5-cyclopropyl-1,2,4-oxadiazol-3-yl)-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound C1(CC1)C1=NC(=NO1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC QMFDJNHWUUDLNN-UHFFFAOYSA-N 0.000 description 1
- ASMUOTPBGOIPMM-UHFFFAOYSA-N 2-[5-(difluoromethyl)-1,3,4-oxadiazol-2-yl]-N-[(2,4-dimethoxyphenyl)methyl]-5-nitrobenzenesulfonamide Chemical compound FC(C1=NN=C(O1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NCC1=C(C=C(C=C1)OC)OC)F ASMUOTPBGOIPMM-UHFFFAOYSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- MWYDSXOGIBMAET-UHFFFAOYSA-N 2-amino-N-[7-methoxy-8-(3-morpholin-4-ylpropoxy)-2,3-dihydro-1H-imidazo[1,2-c]quinazolin-5-ylidene]pyrimidine-5-carboxamide Chemical compound NC1=NC=C(C=N1)C(=O)N=C1N=C2C(=C(C=CC2=C2N1CCN2)OCCCN1CCOCC1)OC MWYDSXOGIBMAET-UHFFFAOYSA-N 0.000 description 1
- KJJPLEZQSCZCKE-UHFFFAOYSA-N 2-aminopropane-1,3-diol Chemical compound OCC(N)CO KJJPLEZQSCZCKE-UHFFFAOYSA-N 0.000 description 1
- CFWRDBDJAOHXSH-SECBINFHSA-N 2-azaniumylethyl [(2r)-2,3-diacetyloxypropyl] phosphate Chemical compound CC(=O)OC[C@@H](OC(C)=O)COP(O)(=O)OCCN CFWRDBDJAOHXSH-SECBINFHSA-N 0.000 description 1
- FHFGMSZCWRYPHZ-UHFFFAOYSA-N 2-benzylsulfanyl-N'-(2,2-difluoroacetyl)-4-nitrobenzohydrazide Chemical compound C(C1=CC=CC=C1)SC1=C(C(=O)NNC(C(F)F)=O)C=CC(=C1)[N+](=O)[O-] FHFGMSZCWRYPHZ-UHFFFAOYSA-N 0.000 description 1
- TWJNQYPJQDRXPH-UHFFFAOYSA-N 2-cyanobenzohydrazide Chemical compound NNC(=O)C1=CC=CC=C1C#N TWJNQYPJQDRXPH-UHFFFAOYSA-N 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- WMPPDTMATNBGJN-UHFFFAOYSA-N 2-phenylethylbromide Chemical class BrCCC1=CC=CC=C1 WMPPDTMATNBGJN-UHFFFAOYSA-N 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- MIDXCONKKJTLDX-UHFFFAOYSA-N 3,5-dimethylcyclopentane-1,2-dione Chemical compound CC1CC(C)C(=O)C1=O MIDXCONKKJTLDX-UHFFFAOYSA-N 0.000 description 1
- UZFPOOOQHWICKY-UHFFFAOYSA-N 3-[13-[1-[1-[8,12-bis(2-carboxyethyl)-17-(1-hydroxyethyl)-3,7,13,18-tetramethyl-21,24-dihydroporphyrin-2-yl]ethoxy]ethyl]-18-(2-carboxyethyl)-8-(1-hydroxyethyl)-3,7,12,17-tetramethyl-22,23-dihydroporphyrin-2-yl]propanoic acid Chemical compound N1C(C=C2C(=C(CCC(O)=O)C(C=C3C(=C(C)C(C=C4N5)=N3)CCC(O)=O)=N2)C)=C(C)C(C(C)O)=C1C=C5C(C)=C4C(C)OC(C)C1=C(N2)C=C(N3)C(C)=C(C(O)C)C3=CC(C(C)=C3CCC(O)=O)=NC3=CC(C(CCC(O)=O)=C3C)=NC3=CC2=C1C UZFPOOOQHWICKY-UHFFFAOYSA-N 0.000 description 1
- QOXOZONBQWIKDA-UHFFFAOYSA-N 3-hydroxypropyl Chemical group [CH2]CCO QOXOZONBQWIKDA-UHFFFAOYSA-N 0.000 description 1
- 125000001541 3-thienyl group Chemical group S1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 1
- WIFPJDJJFUSIFP-UHFFFAOYSA-N 4-aminobutane-1,2,3-triol Chemical compound NCC(O)C(O)CO WIFPJDJJFUSIFP-UHFFFAOYSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- XHZWFUVEKDDQPF-UHFFFAOYSA-N 5-bromo-1h-pyrazole Chemical class BrC1=CC=NN1 XHZWFUVEKDDQPF-UHFFFAOYSA-N 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- SHGAZHPCJJPHSC-ZVCIMWCZSA-N 9-cis-retinoic acid Chemical compound OC(=O)/C=C(\C)/C=C/C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-ZVCIMWCZSA-N 0.000 description 1
- 208000002008 AIDS-Related Lymphoma Diseases 0.000 description 1
- ZKHQWZAMYRWXGA-KQYNXXCUSA-J ATP(4-) Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-J 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 235000006491 Acacia senegal Nutrition 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- WDJHALXBUFZDSR-UHFFFAOYSA-N Acetoacetic acid Natural products CC(=O)CC(O)=O WDJHALXBUFZDSR-UHFFFAOYSA-N 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 1
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 1
- 102000005862 Angiotensin II Human genes 0.000 description 1
- 101800000733 Angiotensin-2 Proteins 0.000 description 1
- 102000004411 Antithrombin III Human genes 0.000 description 1
- 108090000935 Antithrombin III Proteins 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 206010060971 Astrocytoma malignant Diseases 0.000 description 1
- 206010061666 Autonomic neuropathy Diseases 0.000 description 1
- 208000000412 Avitaminosis Diseases 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 206010065687 Bone loss Diseases 0.000 description 1
- 241000167854 Bourreria succulenta Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 208000009079 Bronchial Spasm Diseases 0.000 description 1
- 208000014181 Bronchial disease Diseases 0.000 description 1
- 206010006482 Bronchospasm Diseases 0.000 description 1
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 1
- 208000011691 Burkitt lymphomas Diseases 0.000 description 1
- 108010037003 Buserelin Proteins 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- VSEIDZLLWQQJGK-CHOZPQDDSA-N CCC1=C(C)C2=N\C\1=C/C1=C(C)C(C(O)=O)=C(N1)\C(CC(=O)N[C@@H](CC(O)=O)C(O)=O)=C1/N=C(/C=C3\N/C(=C\2)C(C=C)=C3C)[C@@H](C)[C@@H]1CCC(O)=O Chemical compound CCC1=C(C)C2=N\C\1=C/C1=C(C)C(C(O)=O)=C(N1)\C(CC(=O)N[C@@H](CC(O)=O)C(O)=O)=C1/N=C(/C=C3\N/C(=C\2)C(C=C)=C3C)[C@@H](C)[C@@H]1CCC(O)=O VSEIDZLLWQQJGK-CHOZPQDDSA-N 0.000 description 1
- DPSWQKRAGYYQPC-UHFFFAOYSA-N COC1=CC(OC)=C(CNS(C(C=C(C=C2)NC(CC(C=CC=C3)=C3Cl)=O)=C2N2N=CC(OC(N)=O)=C2)(=O)=O)C=C1 Chemical compound COC1=CC(OC)=C(CNS(C(C=C(C=C2)NC(CC(C=CC=C3)=C3Cl)=O)=C2N2N=CC(OC(N)=O)=C2)(=O)=O)C=C1 DPSWQKRAGYYQPC-UHFFFAOYSA-N 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- 208000020446 Cardiac disease Diseases 0.000 description 1
- AOCCBINRVIKJHY-UHFFFAOYSA-N Carmofur Chemical compound CCCCCCNC(=O)N1C=C(F)C(=O)NC1=O AOCCBINRVIKJHY-UHFFFAOYSA-N 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- PTHCMJGKKRQCBF-UHFFFAOYSA-N Cellulose, microcrystalline Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC)C(CO)O1 PTHCMJGKKRQCBF-UHFFFAOYSA-N 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 208000018380 Chemical injury Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- QMBJSIBWORFWQT-DFXBJWIESA-N Chlormadinone acetate Chemical compound C1=C(Cl)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 QMBJSIBWORFWQT-DFXBJWIESA-N 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- VWFCHDSQECPREK-LURJTMIESA-N Cidofovir Chemical compound NC=1C=CN(C[C@@H](CO)OCP(O)(O)=O)C(=O)N=1 VWFCHDSQECPREK-LURJTMIESA-N 0.000 description 1
- 241000744472 Cinna Species 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- GDLIGKIOYRNHDA-UHFFFAOYSA-N Clomipramine Chemical compound C1CC2=CC=C(Cl)C=C2N(CCCN(C)C)C2=CC=CC=C21 GDLIGKIOYRNHDA-UHFFFAOYSA-N 0.000 description 1
- 208000002881 Colic Diseases 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 102100031162 Collagen alpha-1(XVIII) chain Human genes 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 206010010741 Conjunctivitis Diseases 0.000 description 1
- 206010010904 Convulsion Diseases 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 108010019673 Darbepoetin alfa Proteins 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- HCYAFALTSJYZDH-UHFFFAOYSA-N Desimpramine Chemical compound C1CC2=CC=CC=C2N(CCCNC)C2=CC=CC=C21 HCYAFALTSJYZDH-UHFFFAOYSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- XIQVNETUBQGFHX-UHFFFAOYSA-N Ditropan Chemical compound C=1C=CC=CC=1C(O)(C(=O)OCC#CCN(CC)CC)C1CCCCC1 XIQVNETUBQGFHX-UHFFFAOYSA-N 0.000 description 1
- CYQFCXCEBYINGO-DLBZAZTESA-N Dronabinol Natural products C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@H]21 CYQFCXCEBYINGO-DLBZAZTESA-N 0.000 description 1
- 208000032928 Dyslipidaemia Diseases 0.000 description 1
- XXPXYPLPSDPERN-UHFFFAOYSA-N Ecteinascidin 743 Natural products COc1cc2C(NCCc2cc1O)C(=O)OCC3N4C(O)C5Cc6cc(C)c(OC)c(O)c6C(C4C(S)c7c(OC(=O)C)c(C)c8OCOc8c37)N5C XXPXYPLPSDPERN-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 108010079505 Endostatins Proteins 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- OBMLHUPNRURLOK-XGRAFVIBSA-N Epitiostanol Chemical compound C1[C@@H]2S[C@@H]2C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 OBMLHUPNRURLOK-XGRAFVIBSA-N 0.000 description 1
- DNXHEGUUPJUMQT-CBZIJGRNSA-N Estrone Chemical compound OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1 DNXHEGUUPJUMQT-CBZIJGRNSA-N 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 206010073306 Exposure to radiation Diseases 0.000 description 1
- 201000006107 Familial adenomatous polyposis Diseases 0.000 description 1
- 208000004930 Fatty Liver Diseases 0.000 description 1
- 108010029961 Filgrastim Proteins 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- MPJKWIXIYCLVCU-UHFFFAOYSA-N Folinic acid Natural products NC1=NC2=C(N(C=O)C(CNc3ccc(cc3)C(=O)NC(CCC(=O)O)CC(=O)O)CN2)C(=O)N1 MPJKWIXIYCLVCU-UHFFFAOYSA-N 0.000 description 1
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 1
- 206010017533 Fungal infection Diseases 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 229920002907 Guar gum Polymers 0.000 description 1
- 206010019708 Hepatic steatosis Diseases 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 208000007514 Herpes zoster Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 101000620451 Homo sapiens Leucine-rich glioma-inactivated protein 1 Proteins 0.000 description 1
- 101001098179 Homo sapiens P2X purinoceptor 4 Proteins 0.000 description 1
- 101001135391 Homo sapiens Prostaglandin E synthase Proteins 0.000 description 1
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 1
- 206010056305 Hypopharyngeal neoplasm Diseases 0.000 description 1
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 1
- 229940127590 IRAK4 inhibitor Drugs 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- VDJHFHXMUKFKET-UHFFFAOYSA-N Ingenol mebutate Natural products CC1CC2C(C)(C)C2C2C=C(CO)C(O)C3(O)C(OC(=O)C(C)=CC)C(C)=CC31C2=O VDJHFHXMUKFKET-UHFFFAOYSA-N 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- 108010078049 Interferon alpha-2 Proteins 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 208000037396 Intraductal Noninfiltrating Carcinoma Diseases 0.000 description 1
- 206010073094 Intraductal proliferative breast lesion Diseases 0.000 description 1
- 206010061252 Intraocular melanoma Diseases 0.000 description 1
- 102000004310 Ion Channels Human genes 0.000 description 1
- 108090000862 Ion Channels Proteins 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 208000002260 Keloid Diseases 0.000 description 1
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 1
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- XUIIKFGFIJCVMT-LBPRGKRZSA-N L-thyroxine Chemical compound IC1=CC(C[C@H]([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-LBPRGKRZSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 239000003798 L01XE11 - Pazopanib Substances 0.000 description 1
- 239000002145 L01XE14 - Bosutinib Substances 0.000 description 1
- 239000002138 L01XE21 - Regorafenib Substances 0.000 description 1
- 239000002137 L01XE24 - Ponatinib Substances 0.000 description 1
- 239000002176 L01XE26 - Cabozantinib Substances 0.000 description 1
- 239000004166 Lanolin Substances 0.000 description 1
- 229920001491 Lentinan Polymers 0.000 description 1
- 102100022275 Leucine-rich glioma-inactivated protein 1 Human genes 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 206010073099 Lobular breast carcinoma in situ Diseases 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 206010025312 Lymphoma AIDS related Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 208000006644 Malignant Fibrous Histiocytoma Diseases 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- JCYZMTMYPZHVBF-UHFFFAOYSA-N Melarsoprol Chemical compound NC1=NC(N)=NC(NC=2C=CC(=CC=2)[As]2SC(CO)CS2)=N1 JCYZMTMYPZHVBF-UHFFFAOYSA-N 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- IVDYZAAPOLNZKG-KWHRADDSSA-N Mepitiostane Chemical compound O([C@@H]1[C@]2(CC[C@@H]3[C@@]4(C)C[C@H]5S[C@H]5C[C@@H]4CC[C@H]3[C@@H]2CC1)C)C1(OC)CCCC1 IVDYZAAPOLNZKG-KWHRADDSSA-N 0.000 description 1
- 208000001145 Metabolic Syndrome Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- FQISKWAFAHGMGT-SGJOWKDISA-M Methylprednisolone sodium succinate Chemical compound [Na+].C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)COC(=O)CCC([O-])=O)CC[C@H]21 FQISKWAFAHGMGT-SGJOWKDISA-M 0.000 description 1
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 1
- 206010027761 Mixed hepatocellular cholangiocarcinoma Diseases 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 208000000112 Myalgia Diseases 0.000 description 1
- 208000031888 Mycoses Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 201000002481 Myositis Diseases 0.000 description 1
- 235000021360 Myristic acid Nutrition 0.000 description 1
- TUNFSRHWOTWDNC-UHFFFAOYSA-N Myristic acid Natural products CCCCCCCCCCCCCC(O)=O TUNFSRHWOTWDNC-UHFFFAOYSA-N 0.000 description 1
- ZSXGLVDWWRXATF-UHFFFAOYSA-N N,N-dimethylformamide dimethyl acetal Chemical compound COC(OC)N(C)C ZSXGLVDWWRXATF-UHFFFAOYSA-N 0.000 description 1
- GHMAZEAGIMNETL-UHFFFAOYSA-N N-(4-bromo-3-sulfamoylphenyl)-2-(2-chlorophenyl)acetamide Chemical compound BrC1=C(C=C(C=C1)NC(CC1=C(C=CC=C1)Cl)=O)S(N)(=O)=O GHMAZEAGIMNETL-UHFFFAOYSA-N 0.000 description 1
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-Chlorosuccinimide Substances ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 1
- WVSATIGXTGFJJD-UHFFFAOYSA-N N-[(2,4-dimethoxyphenyl)methyl]-2-[4-(2-methoxyethyl)pyrazol-1-yl]-5-nitrobenzenesulfonamide Chemical compound COC1=C(CNS(=O)(=O)C2=C(C=CC(=C2)[N+](=O)[O-])N2N=CC(=C2)CCOC)C=CC(=C1)OC WVSATIGXTGFJJD-UHFFFAOYSA-N 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 208000001894 Nasopharyngeal Neoplasms Diseases 0.000 description 1
- 206010028836 Neck pain Diseases 0.000 description 1
- 206010028851 Necrosis Diseases 0.000 description 1
- 208000009277 Neuroectodermal Tumors Diseases 0.000 description 1
- 208000001294 Nociceptive Pain Diseases 0.000 description 1
- IMONTRJLAWHYGT-ZCPXKWAGSA-N Norethindrone Acetate Chemical compound C1CC2=CC(=O)CC[C@@H]2[C@@H]2[C@@H]1[C@@H]1CC[C@](C#C)(OC(=O)C)[C@@]1(C)CC2 IMONTRJLAWHYGT-ZCPXKWAGSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 108010016076 Octreotide Proteins 0.000 description 1
- 206010030216 Oesophagitis Diseases 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- 206010057444 Oropharyngeal neoplasm Diseases 0.000 description 1
- 208000010191 Osteitis Deformans Diseases 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- UQCNKQCJZOAFTQ-ISWURRPUSA-N Oxymorphone Chemical compound O([C@H]1C(CC[C@]23O)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O UQCNKQCJZOAFTQ-ISWURRPUSA-N 0.000 description 1
- 102100040460 P2X purinoceptor 3 Human genes 0.000 description 1
- 101710189970 P2X purinoceptor 3 Proteins 0.000 description 1
- 102100037602 P2X purinoceptor 7 Human genes 0.000 description 1
- 101710189965 P2X purinoceptor 7 Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000027868 Paget disease Diseases 0.000 description 1
- 206010033645 Pancreatitis Diseases 0.000 description 1
- IQPSEEYGBUAQFF-UHFFFAOYSA-N Pantoprazole Chemical compound COC1=CC=NC(CS(=O)C=2NC3=CC=C(OC(F)F)C=C3N=2)=C1OC IQPSEEYGBUAQFF-UHFFFAOYSA-N 0.000 description 1
- 206010033892 Paraplegia Diseases 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- CXOFVDLJLONNDW-UHFFFAOYSA-N Phenytoin Chemical compound N1C(=O)NC(=O)C1(C=1C=CC=CC=1)C1=CC=CC=C1 CXOFVDLJLONNDW-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 208000007641 Pinealoma Diseases 0.000 description 1
- KMSKQZKKOZQFFG-HSUXVGOQSA-N Pirarubicin Chemical compound O([C@H]1[C@@H](N)C[C@@H](O[C@H]1C)O[C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1CCCCO1 KMSKQZKKOZQFFG-HSUXVGOQSA-N 0.000 description 1
- 208000008713 Piriformis Muscle Syndrome Diseases 0.000 description 1
- 201000008199 Pleuropulmonary blastoma Diseases 0.000 description 1
- 206010036105 Polyneuropathy Diseases 0.000 description 1
- 241000097929 Porphyria Species 0.000 description 1
- 208000010642 Porphyrias Diseases 0.000 description 1
- 206010036376 Postherpetic Neuralgia Diseases 0.000 description 1
- 208000004550 Postoperative Pain Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- HFVNWDWLWUCIHC-GUPDPFMOSA-N Prednimustine Chemical compound O=C([C@@]1(O)CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)[C@@H](O)C[C@@]21C)COC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 HFVNWDWLWUCIHC-GUPDPFMOSA-N 0.000 description 1
- 108010002519 Prolactin Receptors Proteins 0.000 description 1
- 102100029000 Prolactin receptor Human genes 0.000 description 1
- QPCVHQBVMYCJOM-UHFFFAOYSA-N Propiverine Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(OCCC)C(=O)OC1CCN(C)CC1 QPCVHQBVMYCJOM-UHFFFAOYSA-N 0.000 description 1
- 102100033076 Prostaglandin E synthase Human genes 0.000 description 1
- 101710195838 Prostaglandin E2 receptor EP4 subtype Proteins 0.000 description 1
- 102100024450 Prostaglandin E2 receptor EP4 subtype Human genes 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 241000736246 Pyrola Species 0.000 description 1
- 206010037714 Quadriplegia Diseases 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- AHHFEZNOXOZZQA-ZEBDFXRSSA-N Ranimustine Chemical compound CO[C@H]1O[C@H](CNC(=O)N(CCCl)N=O)[C@@H](O)[C@H](O)[C@H]1O AHHFEZNOXOZZQA-ZEBDFXRSSA-N 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 206010063837 Reperfusion injury Diseases 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- BKRGVLQUQGGVSM-KBXCAEBGSA-N Revanil Chemical compound C1=CC(C=2[C@H](N(C)C[C@H](C=2)NC(=O)N(CC)CC)C2)=C3C2=CNC3=C1 BKRGVLQUQGGVSM-KBXCAEBGSA-N 0.000 description 1
- QCHFTSOMWOSFHM-UHFFFAOYSA-N SJ000285536 Natural products C1OC(=O)C(CC)C1CC1=CN=CN1C QCHFTSOMWOSFHM-UHFFFAOYSA-N 0.000 description 1
- 208000004337 Salivary Gland Neoplasms Diseases 0.000 description 1
- 241000277284 Salvelinus fontinalis Species 0.000 description 1
- 108010077895 Sarcosine Proteins 0.000 description 1
- 206010039705 Scleritis Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- OCOKWVBYZHBHLU-UHFFFAOYSA-N Sobuzoxane Chemical compound C1C(=O)N(COC(=O)OCC(C)C)C(=O)CN1CCN1CC(=O)N(COC(=O)OCC(C)C)C(=O)C1 OCOKWVBYZHBHLU-UHFFFAOYSA-N 0.000 description 1
- 108010052164 Sodium Channels Proteins 0.000 description 1
- 102000018674 Sodium Channels Human genes 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 229920002385 Sodium hyaluronate Polymers 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- IYFATESGLOUGBX-YVNJGZBMSA-N Sorbitan monopalmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O IYFATESGLOUGBX-YVNJGZBMSA-N 0.000 description 1
- 208000036982 Spinal cord ischaemia Diseases 0.000 description 1
- 201000002661 Spondylitis Diseases 0.000 description 1
- 208000010040 Sprains and Strains Diseases 0.000 description 1
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 description 1
- LKAJKIOFIWVMDJ-IYRCEVNGSA-N Stanazolol Chemical compound C([C@@H]1CC[C@H]2[C@@H]3CC[C@@]([C@]3(CC[C@@H]2[C@@]1(C)C1)C)(O)C)C2=C1C=NN2 LKAJKIOFIWVMDJ-IYRCEVNGSA-N 0.000 description 1
- ULUAUXLGCMPNKK-UHFFFAOYSA-N Sulfobutanedioic acid Chemical class OC(=O)CC(C(O)=O)S(O)(=O)=O ULUAUXLGCMPNKK-UHFFFAOYSA-N 0.000 description 1
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 1
- CYQFCXCEBYINGO-UHFFFAOYSA-N THC Natural products C1=C(C)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 CYQFCXCEBYINGO-UHFFFAOYSA-N 0.000 description 1
- GKLVYJBZJHMRIY-OUBTZVSYSA-N Technetium-99 Chemical compound [99Tc] GKLVYJBZJHMRIY-OUBTZVSYSA-N 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- 102000036693 Thrombopoietin Human genes 0.000 description 1
- 108010041111 Thrombopoietin Proteins 0.000 description 1
- 108010066702 Thyrotropin Alfa Proteins 0.000 description 1
- KJADKKWYZYXHBB-XBWDGYHZSA-N Topiramic acid Chemical compound C1O[C@@]2(COS(N)(=O)=O)OC(C)(C)O[C@H]2[C@@H]2OC(C)(C)O[C@@H]21 KJADKKWYZYXHBB-XBWDGYHZSA-N 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- YCPOZVAOBBQLRI-WDSKDSINSA-N Treosulfan Chemical compound CS(=O)(=O)OC[C@H](O)[C@@H](O)COS(C)(=O)=O YCPOZVAOBBQLRI-WDSKDSINSA-N 0.000 description 1
- 229940123445 Tricyclic antidepressant Drugs 0.000 description 1
- 108010050144 Triptorelin Pamoate Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 208000015778 Undifferentiated pleomorphic sarcoma Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 201000005969 Uveal melanoma Diseases 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- 235000009499 Vanilla fragrans Nutrition 0.000 description 1
- 244000263375 Vanilla tahitensis Species 0.000 description 1
- 235000012036 Vanilla tahitensis Nutrition 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 206010047601 Vitamin B1 deficiency Diseases 0.000 description 1
- 206010047627 Vitamin deficiencies Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- VWQVUPCCIRVNHF-OUBTZVSYSA-N Yttrium-90 Chemical compound [90Y] VWQVUPCCIRVNHF-OUBTZVSYSA-N 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- LRHSUZNWLAJWRT-GAJBHWORSA-N [(8r,9s,13s,14s,17s)-3-hydroxy-13-methyl-6,7,8,9,11,12,14,15,16,17-decahydrocyclopenta[a]phenanthren-17-yl] pentanoate;2-[(8s,13s,14s,17r)-17-hydroxy-13-methyl-3-oxo-1,2,6,7,8,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-17-yl]acetonitrile Chemical compound C1CC(=O)C=C2CC[C@@H]([C@H]3[C@@](C)([C@](CC3)(O)CC#N)CC3)C3=C21.C1CC2=CC(O)=CC=C2[C@@H]2[C@@H]1[C@@H]1CC[C@H](OC(=O)CCCC)[C@@]1(C)CC2 LRHSUZNWLAJWRT-GAJBHWORSA-N 0.000 description 1
- RUJWZZRJSQGFCW-OGPYDZPMSA-N [(8s,9s,10r,13s,14s,17r)-17-acetyl-6,13-dimethyl-3-oxo-1,2,8,9,10,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-17-yl] acetate;(8r,9s,13s,14s,17s)-13-methyl-6,7,8,9,11,12,14,15,16,17-decahydrocyclopenta[a]phenanthrene-3,17-diol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1.C1=C(C)C2=CC(=O)CC[C@@H]2[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RUJWZZRJSQGFCW-OGPYDZPMSA-N 0.000 description 1
- PNDPGZBMCMUPRI-XXSWNUTMSA-N [125I][125I] Chemical compound [125I][125I] PNDPGZBMCMUPRI-XXSWNUTMSA-N 0.000 description 1
- XSMVECZRZBFTIZ-UHFFFAOYSA-M [2-(aminomethyl)cyclobutyl]methanamine;2-oxidopropanoate;platinum(4+) Chemical compound [Pt+4].CC([O-])C([O-])=O.NCC1CCC1CN XSMVECZRZBFTIZ-UHFFFAOYSA-M 0.000 description 1
- ZVQOOHYFBIDMTQ-UHFFFAOYSA-N [methyl(oxido){1-[6-(trifluoromethyl)pyridin-3-yl]ethyl}-lambda(6)-sulfanylidene]cyanamide Chemical compound N#CN=S(C)(=O)C(C)C1=CC=C(C(F)(F)F)N=C1 ZVQOOHYFBIDMTQ-UHFFFAOYSA-N 0.000 description 1
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 description 1
- GZOSMCIZMLWJML-VJLLXTKPSA-N abiraterone Chemical compound C([C@H]1[C@H]2[C@@H]([C@]3(CC[C@H](O)CC3=CC2)C)CC[C@@]11C)C=C1C1=CC=CN=C1 GZOSMCIZMLWJML-VJLLXTKPSA-N 0.000 description 1
- 229960000853 abiraterone Drugs 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 229940022663 acetate Drugs 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 239000002535 acidifier Substances 0.000 description 1
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 1
- 229960004176 aclarubicin Drugs 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- ULXXDDBFHOBEHA-CWDCEQMOSA-N afatinib Chemical compound N1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-CWDCEQMOSA-N 0.000 description 1
- 229960001686 afatinib Drugs 0.000 description 1
- 229960002833 aflibercept Drugs 0.000 description 1
- 108010081667 aflibercept Proteins 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 229940062527 alendronate Drugs 0.000 description 1
- 229960004343 alendronic acid Drugs 0.000 description 1
- 229960001445 alitretinoin Drugs 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 230000003113 alkalizing effect Effects 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 230000009285 allergic inflammation Effects 0.000 description 1
- 229940125516 allosteric modulator Drugs 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 229960004538 alprazolam Drugs 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 238000005576 amination reaction Methods 0.000 description 1
- 239000001099 ammonium carbonate Substances 0.000 description 1
- 235000012501 ammonium carbonate Nutrition 0.000 description 1
- 229960002550 amrubicin Drugs 0.000 description 1
- VJZITPJGSQKZMX-XDPRQOKASA-N amrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC=C4C(=O)C=3C(O)=C21)(N)C(=O)C)[C@H]1C[C@H](O)[C@H](O)CO1 VJZITPJGSQKZMX-XDPRQOKASA-N 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- 210000003484 anatomy Anatomy 0.000 description 1
- 229960002616 ancestim Drugs 0.000 description 1
- 108700024685 ancestim Proteins 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 229940011037 anethole Drugs 0.000 description 1
- 229950006323 angiotensin ii Drugs 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 229940040526 anhydrous sodium acetate Drugs 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000010617 anise oil Substances 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 230000003288 anthiarrhythmic effect Effects 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000000843 anti-fungal effect Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000003502 anti-nociceptive effect Effects 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 229940065524 anticholinergics inhalants for obstructive airway diseases Drugs 0.000 description 1
- 229940125681 anticonvulsant agent Drugs 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 229940125715 antihistaminic agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 229960005348 antithrombin iii Drugs 0.000 description 1
- 229960001372 aprepitant Drugs 0.000 description 1
- ATALOFNDEOCMKK-OITMNORJSA-N aprepitant Chemical compound O([C@@H]([C@@H]1C=2C=CC(F)=CC=2)O[C@H](C)C=2C=C(C=C(C=2)C(F)(F)F)C(F)(F)F)CCN1CC1=NNC(=O)N1 ATALOFNDEOCMKK-OITMNORJSA-N 0.000 description 1
- 229950005725 arcitumomab Drugs 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- GOLCXWYRSKYTSP-UHFFFAOYSA-N arsenic trioxide Inorganic materials O1[As]2O[As]1O2 GOLCXWYRSKYTSP-UHFFFAOYSA-N 0.000 description 1
- 229960002594 arsenic trioxide Drugs 0.000 description 1
- 238000006254 arylation reaction Methods 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000010385 ascorbyl palmitate Nutrition 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 238000011914 asymmetric synthesis Methods 0.000 description 1
- 229960003005 axitinib Drugs 0.000 description 1
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical compound CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000004931 azocinyl group Chemical group N1=C(C=CC=CC=C1)* 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 239000008228 bacteriostatic water for injection Substances 0.000 description 1
- 229960004669 basiliximab Drugs 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 229960004217 benzyl alcohol Drugs 0.000 description 1
- 208000002894 beriberi Diseases 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000008499 blood brain barrier function Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- 229910021538 borax Inorganic materials 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- UBPYILGKFZZVDX-UHFFFAOYSA-N bosutinib Chemical compound C1=C(Cl)C(OC)=CC(NC=2C3=CC(OC)=C(OCCCN4CCN(C)CC4)C=C3N=CC=2C#N)=C1Cl UBPYILGKFZZVDX-UHFFFAOYSA-N 0.000 description 1
- 229960003736 bosutinib Drugs 0.000 description 1
- 230000006931 brain damage Effects 0.000 description 1
- 231100000874 brain damage Toxicity 0.000 description 1
- 208000029028 brain injury Diseases 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 201000005389 breast carcinoma in situ Diseases 0.000 description 1
- 229960000455 brentuximab vedotin Drugs 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- 201000002143 bronchus adenoma Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 1
- 229960001736 buprenorphine Drugs 0.000 description 1
- CUWODFFVMXJOKD-UVLQAERKSA-N buserelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](COC(C)(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 CUWODFFVMXJOKD-UVLQAERKSA-N 0.000 description 1
- 229960002719 buserelin Drugs 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- 229940043253 butylated hydroxyanisole Drugs 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 1
- 229940067596 butylparaben Drugs 0.000 description 1
- BMQGVNUXMIRLCK-OAGWZNDDSA-N cabazitaxel Chemical compound O([C@H]1[C@@H]2[C@]3(OC(C)=O)CO[C@@H]3C[C@@H]([C@]2(C(=O)[C@H](OC)C2=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=3C=CC=CC=3)C[C@]1(O)C2(C)C)C)OC)C(=O)C1=CC=CC=C1 BMQGVNUXMIRLCK-OAGWZNDDSA-N 0.000 description 1
- 229960001573 cabazitaxel Drugs 0.000 description 1
- 229960001292 cabozantinib Drugs 0.000 description 1
- ONIQOQHATWINJY-UHFFFAOYSA-N cabozantinib Chemical compound C=12C=C(OC)C(OC)=CC2=NC=CC=1OC(C=C1)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 ONIQOQHATWINJY-UHFFFAOYSA-N 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 235000008207 calcium folinate Nutrition 0.000 description 1
- 239000011687 calcium folinate Substances 0.000 description 1
- 229960001921 calcium levofolinate Drugs 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 229950001178 capromab Drugs 0.000 description 1
- 235000013736 caramel Nutrition 0.000 description 1
- FFGPTBGBLSHEPO-UHFFFAOYSA-N carbamazepine Chemical compound C1=CC2=CC=CC=C2N(C(=O)N)C2=CC=CC=C21 FFGPTBGBLSHEPO-UHFFFAOYSA-N 0.000 description 1
- 229960000623 carbamazepine Drugs 0.000 description 1
- 235000013877 carbamide Nutrition 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 206010007604 cardiac sarcoidosis Diseases 0.000 description 1
- BLMPQMFVWMYDKT-NZTKNTHTSA-N carfilzomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)[C@]1(C)OC1)NC(=O)CN1CCOCC1)CC1=CC=CC=C1 BLMPQMFVWMYDKT-NZTKNTHTSA-N 0.000 description 1
- 108010021331 carfilzomib Proteins 0.000 description 1
- 229960002438 carfilzomib Drugs 0.000 description 1
- 229960003261 carmofur Drugs 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 239000004203 carnauba wax Substances 0.000 description 1
- 235000013869 carnauba wax Nutrition 0.000 description 1
- 235000010418 carrageenan Nutrition 0.000 description 1
- 239000000679 carrageenan Substances 0.000 description 1
- 229920001525 carrageenan Polymers 0.000 description 1
- 229940113118 carrageenan Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 206010007821 cauda equina syndrome Diseases 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 201000007335 cerebellar astrocytoma Diseases 0.000 description 1
- 208000030239 cerebral astrocytoma Diseases 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 210000004289 cerebral ventricle Anatomy 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 229960003230 cetrorelix Drugs 0.000 description 1
- SBNPWPIBESPSIF-MHWMIDJBSA-N cetrorelix Chemical compound C([C@@H](C(=O)N[C@H](CCCNC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 SBNPWPIBESPSIF-MHWMIDJBSA-N 0.000 description 1
- 108700008462 cetrorelix Proteins 0.000 description 1
- 229960001927 cetylpyridinium chloride Drugs 0.000 description 1
- NFCRBQADEGXVDL-UHFFFAOYSA-M cetylpyridinium chloride monohydrate Chemical compound O.[Cl-].CCCCCCCCCCCCCCCC[N+]1=CC=CC=C1 NFCRBQADEGXVDL-UHFFFAOYSA-M 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- UKTAZPQNNNJVKR-KJGYPYNMSA-N chembl2368925 Chemical compound C1=CC=C2C(C(O[C@@H]3C[C@@H]4C[C@H]5C[C@@H](N4CC5=O)C3)=O)=CNC2=C1 UKTAZPQNNNJVKR-KJGYPYNMSA-N 0.000 description 1
- 235000019693 cherries Nutrition 0.000 description 1
- 235000020426 cherry syrup Nutrition 0.000 description 1
- 150000008280 chlorinated hydrocarbons Chemical class 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 229960001616 chlormadinone acetate Drugs 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- KYKAJFCTULSVSH-UHFFFAOYSA-N chloro(fluoro)methane Chemical compound F[C]Cl KYKAJFCTULSVSH-UHFFFAOYSA-N 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- WHTVZRBIWZFKQO-UHFFFAOYSA-N chloroquine Chemical compound ClC1=CC=C2C(NC(C)CCCN(CC)CC)=CC=NC2=C1 WHTVZRBIWZFKQO-UHFFFAOYSA-N 0.000 description 1
- 239000000812 cholinergic antagonist Substances 0.000 description 1
- 208000019069 chronic childhood arthritis Diseases 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 229960000724 cidofovir Drugs 0.000 description 1
- 229960003315 cinacalcet Drugs 0.000 description 1
- VDHAWDNDOKGFTD-MRXNPFEDSA-N cinacalcet Chemical compound N([C@H](C)C=1C2=CC=CC=C2C=CC=1)CCCC1=CC=CC(C(F)(F)F)=C1 VDHAWDNDOKGFTD-MRXNPFEDSA-N 0.000 description 1
- 239000010630 cinnamon oil Substances 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 239000008395 clarifying agent Substances 0.000 description 1
- 208000029664 classic familial adenomatous polyposis Diseases 0.000 description 1
- 229960002286 clodronic acid Drugs 0.000 description 1
- ACSIXWWBWUQEHA-UHFFFAOYSA-N clodronic acid Chemical compound OP(O)(=O)C(Cl)(Cl)P(O)(O)=O ACSIXWWBWUQEHA-UHFFFAOYSA-N 0.000 description 1
- 229960000928 clofarabine Drugs 0.000 description 1
- WDDPHFBMKLOVOX-AYQXTPAHSA-N clofarabine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1F WDDPHFBMKLOVOX-AYQXTPAHSA-N 0.000 description 1
- 229960004606 clomipramine Drugs 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 229960004415 codeine phosphate Drugs 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 208000011588 combined hepatocellular carcinoma and cholangiocarcinoma Diseases 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 235000008504 concentrate Nutrition 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 229950002550 copanlisib Drugs 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 238000006880 cross-coupling reaction Methods 0.000 description 1
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 238000007333 cyanation reaction Methods 0.000 description 1
- WZHCOOQXZCIUNC-UHFFFAOYSA-N cyclandelate Chemical compound C1C(C)(C)CC(C)CC1OC(=O)C(O)C1=CC=CC=C1 WZHCOOQXZCIUNC-UHFFFAOYSA-N 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 229960003843 cyproterone Drugs 0.000 description 1
- DUSHUSLJJMDGTE-ZJPMUUANSA-N cyproterone Chemical compound C1=C(Cl)C2=CC(=O)[C@@H]3C[C@@H]3[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 DUSHUSLJJMDGTE-ZJPMUUANSA-N 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 229960002465 dabrafenib Drugs 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- POZRVZJJTULAOH-LHZXLZLDSA-N danazol Chemical compound C1[C@]2(C)[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=CC2=C1C=NO2 POZRVZJJTULAOH-LHZXLZLDSA-N 0.000 description 1
- 229960000766 danazol Drugs 0.000 description 1
- 229960002677 darifenacin Drugs 0.000 description 1
- HXGBXQDTNZMWGS-RUZDIDTESA-N darifenacin Chemical compound C=1C=CC=CC=1C([C@H]1CN(CCC=2C=C3CCOC3=CC=2)CC1)(C(=O)N)C1=CC=CC=C1 HXGBXQDTNZMWGS-RUZDIDTESA-N 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- MSJQCBORNZDNDU-UHFFFAOYSA-D decasodium 3-methoxy-6-[2-(6-methoxy-4,5-disulfonatooxyoxan-3-yl)oxy-5-[5-(5-methoxy-3,4-disulfonatooxyoxan-2-yl)oxy-3,4-disulfonatooxyoxan-2-yl]oxy-4-sulfonatooxyoxan-3-yl]oxy-4,5-disulfonatooxyoxane-2-carboxylate Chemical compound [Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].COC1COC(OC2COC(OC3COC(OC4COC(OC)C(OS([O-])(=O)=O)C4OS([O-])(=O)=O)C(OC4OC(C(OC)C(OS([O-])(=O)=O)C4OS([O-])(=O)=O)C([O-])=O)C3OS([O-])(=O)=O)C(OS([O-])(=O)=O)C2OS([O-])(=O)=O)C(OS([O-])(=O)=O)C1OS([O-])(=O)=O MSJQCBORNZDNDU-UHFFFAOYSA-D 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 description 1
- 229940063223 depo-provera Drugs 0.000 description 1
- 229960003914 desipramine Drugs 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229940119744 dextran 40 Drugs 0.000 description 1
- 229960004193 dextropropoxyphene Drugs 0.000 description 1
- QMQBBUPJKANITL-MYXGOWFTSA-N dextropropoxyphene hydrochloride Chemical compound [H+].[Cl-].C([C@](OC(=O)CC)([C@H](C)CN(C)C)C=1C=CC=CC=1)C1=CC=CC=C1 QMQBBUPJKANITL-MYXGOWFTSA-N 0.000 description 1
- WOWBFOBYOAGEEA-UHFFFAOYSA-N diafenthiuron Chemical compound CC(C)C1=C(NC(=S)NC(C)(C)C)C(C(C)C)=CC(OC=2C=CC=CC=2)=C1 WOWBFOBYOAGEEA-UHFFFAOYSA-N 0.000 description 1
- 150000008050 dialkyl sulfates Chemical class 0.000 description 1
- AAOVKJBEBIDNHE-UHFFFAOYSA-N diazepam Chemical compound N=1CC(=O)N(C)C2=CC=C(Cl)C=C2C=1C1=CC=CC=C1 AAOVKJBEBIDNHE-UHFFFAOYSA-N 0.000 description 1
- 229960003529 diazepam Drugs 0.000 description 1
- LMEDOLJKVASKTP-UHFFFAOYSA-N dibutyl sulfate Chemical compound CCCCOS(=O)(=O)OCCCC LMEDOLJKVASKTP-UHFFFAOYSA-N 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 229960000920 dihydrocodeine Drugs 0.000 description 1
- RBOXVHNMENFORY-DNJOTXNNSA-N dihydrocodeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC RBOXVHNMENFORY-DNJOTXNNSA-N 0.000 description 1
- XYYVYLMBEZUESM-UHFFFAOYSA-N dihydrocodeine Natural products C1C(N(CCC234)C)C2C=CC(=O)C3OC2=C4C1=CC=C2OC XYYVYLMBEZUESM-UHFFFAOYSA-N 0.000 description 1
- 125000005045 dihydroisoquinolinyl group Chemical group C1(NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- GAFRWLVTHPVQGK-UHFFFAOYSA-N dipentyl sulfate Chemical class CCCCCOS(=O)(=O)OCCCCC GAFRWLVTHPVQGK-UHFFFAOYSA-N 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 1
- 235000019797 dipotassium phosphate Nutrition 0.000 description 1
- 238000007907 direct compression Methods 0.000 description 1
- DRFILBXQKYDTFW-JIWRMXRASA-L disodium;2-[[(2r)-2-[[(4s)-4-amino-4-carboxybutanoyl]amino]-3-[[(2r)-2-[[(4s)-4-amino-4-carboxybutanoyl]amino]-3-(carboxylatomethylamino)-3-oxopropyl]disulfanyl]propanoyl]amino]acetate Chemical compound [Na+].[Na+].OC(=O)[C@@H](N)CCC(=O)N[C@H](C(=O)NCC([O-])=O)CSSC[C@@H](C(=O)NCC([O-])=O)NC(=O)CC[C@H](N)C(O)=O DRFILBXQKYDTFW-JIWRMXRASA-L 0.000 description 1
- FPAYXBWMYIMERV-UHFFFAOYSA-L disodium;5-methyl-2-[[4-(4-methyl-2-sulfonatoanilino)-9,10-dioxoanthracen-1-yl]amino]benzenesulfonate Chemical compound [Na+].[Na+].[O-]S(=O)(=O)C1=CC(C)=CC=C1NC(C=1C(=O)C2=CC=CC=C2C(=O)C=11)=CC=C1NC1=CC=C(C)C=C1S([O-])(=O)=O FPAYXBWMYIMERV-UHFFFAOYSA-L 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- RCRYEYMHBHPZQD-UHFFFAOYSA-N ditert-butyl-[2,3,4,5-tetramethyl-6-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=C(C)C(C)=C(C)C(C)=C1P(C(C)(C)C)C(C)(C)C RCRYEYMHBHPZQD-UHFFFAOYSA-N 0.000 description 1
- 125000005883 dithianyl group Chemical group 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229960003413 dolasetron Drugs 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229960005426 doxepin Drugs 0.000 description 1
- ODQWQRRAPPTVAG-GZTJUZNOSA-N doxepin Chemical compound C1OC2=CC=CC=C2C(=C/CCN(C)C)/C2=CC=CC=C21 ODQWQRRAPPTVAG-GZTJUZNOSA-N 0.000 description 1
- ZWAOHEXOSAUJHY-ZIYNGMLESA-N doxifluridine Chemical compound O[C@@H]1[C@H](O)[C@@H](C)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ZWAOHEXOSAUJHY-ZIYNGMLESA-N 0.000 description 1
- 229950005454 doxifluridine Drugs 0.000 description 1
- 229960004242 dronabinol Drugs 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 208000028715 ductal breast carcinoma in situ Diseases 0.000 description 1
- 201000007273 ductal carcinoma in situ Diseases 0.000 description 1
- 229960002866 duloxetine Drugs 0.000 description 1
- 208000000718 duodenal ulcer Diseases 0.000 description 1
- 229960002224 eculizumab Drugs 0.000 description 1
- 229940124274 edetate disodium Drugs 0.000 description 1
- 229960001484 edetic acid Drugs 0.000 description 1
- 229960001776 edrecolomab Drugs 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 229950000549 elliptinium acetate Drugs 0.000 description 1
- 229940043249 elmiron Drugs 0.000 description 1
- XDXWLKQMMKQXPV-QYQHSDTDSA-N eltrombopag Chemical compound CC1=NN(C=2C=C(C)C(C)=CC=2)C(=O)\C1=N/NC(C=1O)=CC=CC=1C1=CC=CC(C(O)=O)=C1 XDXWLKQMMKQXPV-QYQHSDTDSA-N 0.000 description 1
- 229960001069 eltrombopag Drugs 0.000 description 1
- 239000003974 emollient agent Substances 0.000 description 1
- 239000008393 encapsulating agent Substances 0.000 description 1
- 230000002357 endometrial effect Effects 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 229960004671 enzalutamide Drugs 0.000 description 1
- WXCXUHSOUPDCQV-UHFFFAOYSA-N enzalutamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1N1C(C)(C)C(=O)N(C=2C=C(C(C#N)=CC=2)C(F)(F)F)C1=S WXCXUHSOUPDCQV-UHFFFAOYSA-N 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 229950002973 epitiostanol Drugs 0.000 description 1
- 108010002601 epoetin beta Proteins 0.000 description 1
- HCZKYJDFEPMADG-UHFFFAOYSA-N erythro-nordihydroguaiaretic acid Natural products C=1C=C(O)C(O)=CC=1CC(C)C(C)CC1=CC=C(O)C(O)=C1 HCZKYJDFEPMADG-UHFFFAOYSA-N 0.000 description 1
- 208000006881 esophagitis Diseases 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 230000001076 estrogenic effect Effects 0.000 description 1
- 229960003399 estrone Drugs 0.000 description 1
- 229940031098 ethanolamine Drugs 0.000 description 1
- 229960004667 ethyl cellulose Drugs 0.000 description 1
- 229960001617 ethyl hydroxybenzoate Drugs 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 235000010228 ethyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004403 ethyl p-hydroxybenzoate Substances 0.000 description 1
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 1
- JYILPERKVHXLNF-QMNUTNMBSA-N ethynodiol Chemical compound O[C@H]1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 JYILPERKVHXLNF-QMNUTNMBSA-N 0.000 description 1
- 229960002941 etonogestrel Drugs 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960000218 etynodiol Drugs 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 210000001508 eye Anatomy 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 150000002194 fatty esters Chemical class 0.000 description 1
- 208000010706 fatty liver disease Diseases 0.000 description 1
- JEIPFZHSYJVQDO-UHFFFAOYSA-N ferric oxide Chemical compound O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 1
- 229960005191 ferric oxide Drugs 0.000 description 1
- 229960004177 filgrastim Drugs 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 1
- 229960000961 floxuridine Drugs 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 238000003682 fluorination reaction Methods 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- YLRFCQOZQXIBAB-RBZZARIASA-N fluoxymesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)C[C@@H]2O YLRFCQOZQXIBAB-RBZZARIASA-N 0.000 description 1
- 229960001751 fluoxymesterone Drugs 0.000 description 1
- 229960003528 flurazepam Drugs 0.000 description 1
- SAADBVWGJQAEFS-UHFFFAOYSA-N flurazepam Chemical compound N=1CC(=O)N(CCN(CC)CC)C2=CC=C(Cl)C=C2C=1C1=CC=CC=C1F SAADBVWGJQAEFS-UHFFFAOYSA-N 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 229960004421 formestane Drugs 0.000 description 1
- OSVMTWJCGUFAOD-KZQROQTASA-N formestane Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1O OSVMTWJCGUFAOD-KZQROQTASA-N 0.000 description 1
- 229960004783 fotemustine Drugs 0.000 description 1
- YAKWPXVTIGTRJH-UHFFFAOYSA-N fotemustine Chemical compound CCOP(=O)(OCC)C(C)NC(=O)N(CCCl)N=O YAKWPXVTIGTRJH-UHFFFAOYSA-N 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 229960002258 fulvestrant Drugs 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 238000007306 functionalization reaction Methods 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 229960002870 gabapentin Drugs 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960000578 gemtuzumab Drugs 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229960004859 glucarpidase Drugs 0.000 description 1
- 108010049491 glucarpidase Proteins 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 108010068227 glutoxim Proteins 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 229960003727 granisetron Drugs 0.000 description 1
- MFWNKCLOYSRHCJ-BTTYYORXSA-N granisetron Chemical compound C1=CC=C2C(C(=O)N[C@H]3C[C@H]4CCC[C@@H](C3)N4C)=NN(C)C2=C1 MFWNKCLOYSRHCJ-BTTYYORXSA-N 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 235000010417 guar gum Nutrition 0.000 description 1
- 239000000665 guar gum Substances 0.000 description 1
- 229960002154 guar gum Drugs 0.000 description 1
- 201000009277 hairy cell leukemia Diseases 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 230000026030 halogenation Effects 0.000 description 1
- 238000005658 halogenation reaction Methods 0.000 description 1
- 239000007887 hard shell capsule Substances 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 208000031209 hemophilic arthropathy Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid group Chemical group C(CCCCCC)(=O)O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid group Chemical group C(CCCCC)(=O)O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 229960004931 histamine dihydrochloride Drugs 0.000 description 1
- PPZMYIBUHIPZOS-UHFFFAOYSA-N histamine dihydrochloride Chemical compound Cl.Cl.NCCC1=CN=CN1 PPZMYIBUHIPZOS-UHFFFAOYSA-N 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 108700020746 histrelin Proteins 0.000 description 1
- HHXHVIJIIXKSOE-QILQGKCVSA-N histrelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC(N=C1)=CN1CC1=CC=CC=C1 HHXHVIJIIXKSOE-QILQGKCVSA-N 0.000 description 1
- 229960002193 histrelin Drugs 0.000 description 1
- HYFHYPWGAURHIV-UHFFFAOYSA-N homoharringtonine Natural products C1=C2CCN3CCCC43C=C(OC)C(OC(=O)C(O)(CCCC(C)(C)O)CC(=O)OC)C4C2=CC2=C1OCO2 HYFHYPWGAURHIV-UHFFFAOYSA-N 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 102000045277 human P2RX4 Human genes 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- WVLOADHCBXTIJK-YNHQPCIGSA-N hydromorphone Chemical compound O([C@H]1C(CC[C@H]23)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O WVLOADHCBXTIJK-YNHQPCIGSA-N 0.000 description 1
- 229960001410 hydromorphone Drugs 0.000 description 1
- 239000008311 hydrophilic ointment Substances 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000002267 hypothalamic effect Effects 0.000 description 1
- 208000003532 hypothyroidism Diseases 0.000 description 1
- 230000002989 hypothyroidism Effects 0.000 description 1
- 229960005236 ibandronic acid Drugs 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000008105 immune reaction Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 229940044513 implanon Drugs 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 229950008097 improsulfan Drugs 0.000 description 1
- DBIGHPPNXATHOF-UHFFFAOYSA-N improsulfan Chemical compound CS(=O)(=O)OCCCNCCCOS(C)(=O)=O DBIGHPPNXATHOF-UHFFFAOYSA-N 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 229950006971 incadronic acid Drugs 0.000 description 1
- LWRDQHOZTAOILO-UHFFFAOYSA-N incadronic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)NC1CCCCCC1 LWRDQHOZTAOILO-UHFFFAOYSA-N 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- MHNNVDILNTUWNS-XYYAHUGASA-N indisetron Chemical compound C1=CC=C2C(C(=O)N[C@H]3C[C@H]4CN(C[C@@H](C3)N4C)C)=NNC2=C1 MHNNVDILNTUWNS-XYYAHUGASA-N 0.000 description 1
- 229950007467 indisetron Drugs 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- VDJHFHXMUKFKET-WDUFCVPESA-N ingenol mebutate Chemical compound C[C@@H]1C[C@H]2C(C)(C)[C@H]2[C@@H]2C=C(CO)[C@@H](O)[C@]3(O)[C@@H](OC(=O)C(\C)=C/C)C(C)=C[C@]31C2=O VDJHFHXMUKFKET-WDUFCVPESA-N 0.000 description 1
- 229960002993 ingenol mebutate Drugs 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 229960003507 interferon alfa-2b Drugs 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 229960001388 interferon-beta Drugs 0.000 description 1
- 201000007450 intrahepatic cholangiocarcinoma Diseases 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 201000008893 intraocular retinoblastoma Diseases 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 206010073095 invasive ductal breast carcinoma Diseases 0.000 description 1
- 201000010985 invasive ductal carcinoma Diseases 0.000 description 1
- 206010073096 invasive lobular breast carcinoma Diseases 0.000 description 1
- 229940125425 inverse agonist Drugs 0.000 description 1
- YLPBXIKWXNRACS-UHFFFAOYSA-N iobitridol Chemical compound OCC(O)CN(C)C(=O)C1=C(I)C(NC(=O)C(CO)CO)=C(I)C(C(=O)N(C)CC(O)CO)=C1I YLPBXIKWXNRACS-UHFFFAOYSA-N 0.000 description 1
- 229960004108 iobitridol Drugs 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 229960000780 iomeprol Drugs 0.000 description 1
- NJKDOADNQSYQEV-UHFFFAOYSA-N iomeprol Chemical compound OCC(=O)N(C)C1=C(I)C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C1I NJKDOADNQSYQEV-UHFFFAOYSA-N 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229960005386 ipilimumab Drugs 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- GURKHSYORGJETM-WAQYZQTGSA-N irinotecan hydrochloride (anhydrous) Chemical compound Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 GURKHSYORGJETM-WAQYZQTGSA-N 0.000 description 1
- 201000004614 iritis Diseases 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 230000007803 itching Effects 0.000 description 1
- FABUFPQFXZVHFB-CFWQTKTJSA-N ixabepilone Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@H](C)C(=O)C(C)(C)[C@H](O)CC(=O)N1)O)C)=C\C1=CSC(C)=N1 FABUFPQFXZVHFB-CFWQTKTJSA-N 0.000 description 1
- 229960002014 ixabepilone Drugs 0.000 description 1
- 201000002215 juvenile rheumatoid arthritis Diseases 0.000 description 1
- 229960000829 kaolin Drugs 0.000 description 1
- 210000001117 keloid Anatomy 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 210000000244 kidney pelvis Anatomy 0.000 description 1
- 238000011005 laboratory method Methods 0.000 description 1
- 229960001375 lactose Drugs 0.000 description 1
- 235000019388 lanolin Nutrition 0.000 description 1
- 229940039717 lanolin Drugs 0.000 description 1
- 108010021336 lanreotide Proteins 0.000 description 1
- 229960002437 lanreotide Drugs 0.000 description 1
- SIXIIKVOZAGHPV-UHFFFAOYSA-N lansoprazole Chemical compound CC1=C(OCC(F)(F)F)C=CN=C1CS(=O)C1=NC2=CC=C[CH]C2=N1 SIXIIKVOZAGHPV-UHFFFAOYSA-N 0.000 description 1
- 229960003174 lansoprazole Drugs 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 229940115286 lentinan Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- 229960002826 levonorgestrel and ethinylestradiol Drugs 0.000 description 1
- 229960003918 levothyroxine sodium Drugs 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 229960003587 lisuride Drugs 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 229950008991 lobaplatin Drugs 0.000 description 1
- 201000011059 lobular neoplasia Diseases 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- WDRYRZXSPDWGEB-UHFFFAOYSA-N lonidamine Chemical compound C12=CC=CC=C2C(C(=O)O)=NN1CC1=CC=C(Cl)C=C1Cl WDRYRZXSPDWGEB-UHFFFAOYSA-N 0.000 description 1
- 229960003538 lonidamine Drugs 0.000 description 1
- 229960003088 loratadine Drugs 0.000 description 1
- JCCNYMKQOSZNPW-UHFFFAOYSA-N loratadine Chemical compound C1CN(C(=O)OCC)CCC1=C1C2=NC=CC=C2CCC2=CC(Cl)=CC=C21 JCCNYMKQOSZNPW-UHFFFAOYSA-N 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 208000025036 lymphosarcoma Diseases 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 208000030883 malignant astrocytoma Diseases 0.000 description 1
- 208000027202 mammary Paget disease Diseases 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 229960001855 mannitol Drugs 0.000 description 1
- 229960003951 masoprocol Drugs 0.000 description 1
- HCZKYJDFEPMADG-TXEJJXNPSA-N masoprocol Chemical compound C([C@H](C)[C@H](C)CC=1C=C(O)C(O)=CC=1)C1=CC=C(O)C(O)=C1 HCZKYJDFEPMADG-TXEJJXNPSA-N 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 229960004616 medroxyprogesterone Drugs 0.000 description 1
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 1
- 229960001786 megestrol Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960001728 melarsoprol Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 239000001525 mentha piperita l. herb oil Substances 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 229950009246 mepitiostane Drugs 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 210000000716 merkel cell Anatomy 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 238000006263 metalation reaction Methods 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 238000006198 methoxylation reaction Methods 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 229960004584 methylprednisolone Drugs 0.000 description 1
- 229960003404 mexiletine Drugs 0.000 description 1
- 239000004200 microcrystalline wax Substances 0.000 description 1
- 235000019808 microcrystalline wax Nutrition 0.000 description 1
- 230000002025 microglial effect Effects 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 229960005225 mifamurtide Drugs 0.000 description 1
- 108700007621 mifamurtide Proteins 0.000 description 1
- 229960003775 miltefosine Drugs 0.000 description 1
- PQLXHQMOHUQAKB-UHFFFAOYSA-N miltefosine Chemical compound CCCCCCCCCCCCCCCCOP([O-])(=O)OCC[N+](C)(C)C PQLXHQMOHUQAKB-UHFFFAOYSA-N 0.000 description 1
- 229960001551 mirabegron Drugs 0.000 description 1
- PBAPPPCECJKMCM-IBGZPJMESA-N mirabegron Chemical compound S1C(N)=NC(CC(=O)NC=2C=CC(CCNC[C@H](O)C=3C=CC=CC=3)=CC=2)=C1 PBAPPPCECJKMCM-IBGZPJMESA-N 0.000 description 1
- 229940110234 mirena Drugs 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960005485 mitobronitol Drugs 0.000 description 1
- 229960003539 mitoguazone Drugs 0.000 description 1
- MXWHMTNPTTVWDM-NXOFHUPFSA-N mitoguazone Chemical compound NC(N)=N\N=C(/C)\C=N\N=C(N)N MXWHMTNPTTVWDM-NXOFHUPFSA-N 0.000 description 1
- VFKZTMPDYBFSTM-GUCUJZIJSA-N mitolactol Chemical compound BrC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-GUCUJZIJSA-N 0.000 description 1
- 229950010913 mitolactol Drugs 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 229950007699 mogamulizumab Drugs 0.000 description 1
- 108010032806 molgramostim Proteins 0.000 description 1
- 229960003063 molgramostim Drugs 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- PJUIMOJAAPLTRJ-UHFFFAOYSA-N monothioglycerol Chemical compound OCC(O)CS PJUIMOJAAPLTRJ-UHFFFAOYSA-N 0.000 description 1
- 229960005195 morphine hydrochloride Drugs 0.000 description 1
- XELXKCKNPPSFNN-BJWPBXOKSA-N morphine hydrochloride trihydrate Chemical compound O.O.O.Cl.O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O XELXKCKNPPSFNN-BJWPBXOKSA-N 0.000 description 1
- 229960004715 morphine sulfate Drugs 0.000 description 1
- GRVOTVYEFDAHCL-RTSZDRIGSA-N morphine sulfate pentahydrate Chemical compound O.O.O.O.O.OS(O)(=O)=O.O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O.O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O GRVOTVYEFDAHCL-RTSZDRIGSA-N 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 208000013465 muscle pain Diseases 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- 208000031225 myocardial ischemia Diseases 0.000 description 1
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- XNSAINXGIQZQOO-UHFFFAOYSA-N n-[1-(2-carbamoylpyrrolidin-1-yl)-3-(1h-imidazol-5-yl)-1-oxopropan-2-yl]-5-oxopyrrolidine-2-carboxamide Chemical compound NC(=O)C1CCCN1C(=O)C(NC(=O)C1NC(=O)CC1)CC1=CN=CN1 XNSAINXGIQZQOO-UHFFFAOYSA-N 0.000 description 1
- RDSACQWTXKSHJT-NSHDSACASA-N n-[3,4-difluoro-2-(2-fluoro-4-iodoanilino)-6-methoxyphenyl]-1-[(2s)-2,3-dihydroxypropyl]cyclopropane-1-sulfonamide Chemical compound C1CC1(C[C@H](O)CO)S(=O)(=O)NC=1C(OC)=CC(F)=C(F)C=1NC1=CC=C(I)C=C1F RDSACQWTXKSHJT-NSHDSACASA-N 0.000 description 1
- ILCQYORZHHFLNL-UHFFFAOYSA-N n-bromoaniline Chemical compound BrNC1=CC=CC=C1 ILCQYORZHHFLNL-UHFFFAOYSA-N 0.000 description 1
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- GECBBEABIDMGGL-RTBURBONSA-N nabilone Chemical compound C1C(=O)CC[C@H]2C(C)(C)OC3=CC(C(C)(C)CCCCCC)=CC(O)=C3[C@@H]21 GECBBEABIDMGGL-RTBURBONSA-N 0.000 description 1
- 229960002967 nabilone Drugs 0.000 description 1
- 229960004127 naloxone Drugs 0.000 description 1
- RGPDIGOSVORSAK-STHHAXOLSA-N naloxone hydrochloride Chemical compound Cl.O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C RGPDIGOSVORSAK-STHHAXOLSA-N 0.000 description 1
- DQCKKXVULJGBQN-XFWGSAIBSA-N naltrexone Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=O)O)CC1)O)CC1CC1 DQCKKXVULJGBQN-XFWGSAIBSA-N 0.000 description 1
- 229960003086 naltrexone Drugs 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 108010032539 nartograstim Proteins 0.000 description 1
- 229950010676 nartograstim Drugs 0.000 description 1
- 229920003052 natural elastomer Polymers 0.000 description 1
- 229920001194 natural rubber Polymers 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 229950007221 nedaplatin Drugs 0.000 description 1
- QZGIWPZCWHMVQL-UIYAJPBUSA-N neocarzinostatin chromophore Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1O[C@@H]1C/2=C/C#C[C@H]3O[C@@]3([C@@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(O)C=CC2=C(C)C=C(OC)C=C12 QZGIWPZCWHMVQL-UIYAJPBUSA-N 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 201000008383 nephritis Diseases 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 239000002581 neurotoxin Substances 0.000 description 1
- 231100000618 neurotoxin Toxicity 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 229960001420 nimustine Drugs 0.000 description 1
- VFEDRRNHLBGPNN-UHFFFAOYSA-N nimustine Chemical compound CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 VFEDRRNHLBGPNN-UHFFFAOYSA-N 0.000 description 1
- 229950008607 nitracrine Drugs 0.000 description 1
- YMVWGSQGCWCDGW-UHFFFAOYSA-N nitracrine Chemical compound C1=CC([N+]([O-])=O)=C2C(NCCCN(C)C)=C(C=CC=C3)C3=NC2=C1 YMVWGSQGCWCDGW-UHFFFAOYSA-N 0.000 description 1
- 125000002560 nitrile group Chemical group 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 150000002828 nitro derivatives Chemical class 0.000 description 1
- 229960003301 nivolumab Drugs 0.000 description 1
- 230000003040 nociceptive effect Effects 0.000 description 1
- IIVBFTNIGYRNQY-YQLZSBIMSA-N nomegestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@@H]2[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 IIVBFTNIGYRNQY-YQLZSBIMSA-N 0.000 description 1
- 229960004190 nomegestrol acetate Drugs 0.000 description 1
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 229940073555 nonoxynol-10 Drugs 0.000 description 1
- 229960002667 norelgestromin Drugs 0.000 description 1
- 229960001652 norethindrone acetate Drugs 0.000 description 1
- 229960000417 norgestimate Drugs 0.000 description 1
- KIQQMECNKUGGKA-NMYWJIRASA-N norgestimate Chemical compound O/N=C/1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(OC(C)=O)C#C)[C@@H]4[C@@H]3CCC2=C\1 KIQQMECNKUGGKA-NMYWJIRASA-N 0.000 description 1
- 229940053973 novocaine Drugs 0.000 description 1
- 229940115044 nuvaring Drugs 0.000 description 1
- GYCKQBWUSACYIF-UHFFFAOYSA-N o-hydroxybenzoic acid ethyl ester Natural products CCOC(=O)C1=CC=CC=C1O GYCKQBWUSACYIF-UHFFFAOYSA-N 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 229960003347 obinutuzumab Drugs 0.000 description 1
- 229960002700 octreotide Drugs 0.000 description 1
- 201000002575 ocular melanoma Diseases 0.000 description 1
- 229960002450 ofatumumab Drugs 0.000 description 1
- 239000012053 oil suspension Substances 0.000 description 1
- 239000003883 ointment base Substances 0.000 description 1
- 150000002889 oleic acids Chemical class 0.000 description 1
- 229960002230 omacetaxine mepesuccinate Drugs 0.000 description 1
- HYFHYPWGAURHIV-JFIAXGOJSA-N omacetaxine mepesuccinate Chemical compound C1=C2CCN3CCC[C@]43C=C(OC)[C@@H](OC(=O)[C@@](O)(CCCC(C)(C)O)CC(=O)OC)[C@H]4C2=CC2=C1OCO2 HYFHYPWGAURHIV-JFIAXGOJSA-N 0.000 description 1
- SBQLYHNEIUGQKH-UHFFFAOYSA-N omeprazole Chemical compound N1=C2[CH]C(OC)=CC=C2N=C1S(=O)CC1=NC=C(C)C(OC)=C1C SBQLYHNEIUGQKH-UHFFFAOYSA-N 0.000 description 1
- 229960000381 omeprazole Drugs 0.000 description 1
- 229960005343 ondansetron Drugs 0.000 description 1
- 239000000014 opioid analgesic Substances 0.000 description 1
- 239000003217 oral combined contraceptive Substances 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 239000010502 orange oil Substances 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 229960004534 orgotein Drugs 0.000 description 1
- 108010070915 orgotein Proteins 0.000 description 1
- 229950001550 orilotimod Drugs 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 230000016087 ovulation Effects 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- CTRLABGOLIVAIY-UHFFFAOYSA-N oxcarbazepine Chemical compound C1C(=O)C2=CC=CC=C2N(C(=O)N)C2=CC=CC=C21 CTRLABGOLIVAIY-UHFFFAOYSA-N 0.000 description 1
- 229960001816 oxcarbazepine Drugs 0.000 description 1
- 125000003585 oxepinyl group Chemical group 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 229960005434 oxybutynin Drugs 0.000 description 1
- ICMWWNHDUZJFDW-DHODBPELSA-N oxymetholone Chemical compound C([C@@H]1CC2)C(=O)\C(=C/O)C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@](C)(O)[C@@]2(C)CC1 ICMWWNHDUZJFDW-DHODBPELSA-N 0.000 description 1
- 229960005244 oxymetholone Drugs 0.000 description 1
- ICMWWNHDUZJFDW-UHFFFAOYSA-N oxymetholone Natural products C1CC2CC(=O)C(=CO)CC2(C)C2C1C1CCC(C)(O)C1(C)CC2 ICMWWNHDUZJFDW-UHFFFAOYSA-N 0.000 description 1
- 229960005118 oxymorphone Drugs 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- 229950007318 ozogamicin Drugs 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 235000019629 palatability Nutrition 0.000 description 1
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 1
- 229960003978 pamidronic acid Drugs 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 229960005019 pantoprazole Drugs 0.000 description 1
- RUVINXPYWBROJD-UHFFFAOYSA-N para-methoxyphenyl Natural products COC1=CC=C(C=CC)C=C1 RUVINXPYWBROJD-UHFFFAOYSA-N 0.000 description 1
- 230000003071 parasitic effect Effects 0.000 description 1
- 230000000849 parathyroid Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000001991 pathophysiological effect Effects 0.000 description 1
- 229960000639 pazopanib Drugs 0.000 description 1
- CUIHSIWYWATEQL-UHFFFAOYSA-N pazopanib Chemical compound C1=CC2=C(C)N(C)N=C2C=C1N(C)C(N=1)=CC=NC=1NC1=CC=C(C)C(S(N)(=O)=O)=C1 CUIHSIWYWATEQL-UHFFFAOYSA-N 0.000 description 1
- HQQSBEDKMRHYME-UHFFFAOYSA-N pefloxacin mesylate Chemical compound [H+].CS([O-])(=O)=O.C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCN(C)CC1 HQQSBEDKMRHYME-UHFFFAOYSA-N 0.000 description 1
- 229960001373 pegfilgrastim Drugs 0.000 description 1
- 108010044644 pegfilgrastim Proteins 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 229960002621 pembrolizumab Drugs 0.000 description 1
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 210000003899 penis Anatomy 0.000 description 1
- 229960001412 pentobarbital Drugs 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 235000019477 peppermint oil Nutrition 0.000 description 1
- 201000001245 periodontitis Diseases 0.000 description 1
- 210000000578 peripheral nerve Anatomy 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000008180 pharmaceutical surfactant Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 229960002695 phenobarbital Drugs 0.000 description 1
- DDBREPKUVSBGFI-UHFFFAOYSA-N phenobarbital Chemical compound C=1C=CC=CC=1C1(CC)C(=O)NC(=O)NC1=O DDBREPKUVSBGFI-UHFFFAOYSA-N 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- 229940067107 phenylethyl alcohol Drugs 0.000 description 1
- PDTFCHSETJBPTR-UHFFFAOYSA-N phenylmercuric nitrate Chemical compound [O-][N+](=O)O[Hg]C1=CC=CC=C1 PDTFCHSETJBPTR-UHFFFAOYSA-N 0.000 description 1
- 229960002036 phenytoin Drugs 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 125000001095 phosphatidyl group Chemical group 0.000 description 1
- ACVYVLVWPXVTIT-UHFFFAOYSA-N phosphinic acid Chemical compound O[PH2]=O ACVYVLVWPXVTIT-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 229960001416 pilocarpine Drugs 0.000 description 1
- 208000024724 pineal body neoplasm Diseases 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 229960001221 pirarubicin Drugs 0.000 description 1
- 206010049433 piriformis syndrome Diseases 0.000 description 1
- 229960004403 pixantrone Drugs 0.000 description 1
- PEZPMAYDXJQYRV-UHFFFAOYSA-N pixantrone Chemical compound O=C1C2=CN=CC=C2C(=O)C2=C1C(NCCN)=CC=C2NCCN PEZPMAYDXJQYRV-UHFFFAOYSA-N 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229960002169 plerixafor Drugs 0.000 description 1
- YIQPUIGJQJDJOS-UHFFFAOYSA-N plerixafor Chemical compound C=1C=C(CN2CCNCCCNCCNCCC2)C=CC=1CN1CCCNCCNCCCNCC1 YIQPUIGJQJDJOS-UHFFFAOYSA-N 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 238000005498 polishing Methods 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 208000019629 polyneuritis Diseases 0.000 description 1
- 150000007519 polyprotic acids Polymers 0.000 description 1
- 208000006473 polyradiculopathy Diseases 0.000 description 1
- 108010001062 polysaccharide-K Proteins 0.000 description 1
- 229940034049 polysaccharide-k Drugs 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- UVSMNLNDYGZFPF-UHFFFAOYSA-N pomalidomide Chemical compound O=C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O UVSMNLNDYGZFPF-UHFFFAOYSA-N 0.000 description 1
- 229960000688 pomalidomide Drugs 0.000 description 1
- PHXJVRSECIGDHY-UHFFFAOYSA-N ponatinib Chemical compound C1CN(C)CCN1CC(C(=C1)C(F)(F)F)=CC=C1NC(=O)C1=CC=C(C)C(C#CC=2N3N=CC=CC3=NC=2)=C1 PHXJVRSECIGDHY-UHFFFAOYSA-N 0.000 description 1
- 229960001131 ponatinib Drugs 0.000 description 1
- 229960004293 porfimer sodium Drugs 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 235000007686 potassium Nutrition 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- OQZCJRJRGMMSGK-UHFFFAOYSA-M potassium metaphosphate Chemical compound [K+].[O-]P(=O)=O OQZCJRJRGMMSGK-UHFFFAOYSA-M 0.000 description 1
- 229940099402 potassium metaphosphate Drugs 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 229940116317 potato starch Drugs 0.000 description 1
- OGSBUKJUDHAQEA-WMCAAGNKSA-N pralatrexate Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CC(CC#C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OGSBUKJUDHAQEA-WMCAAGNKSA-N 0.000 description 1
- 229960000214 pralatrexate Drugs 0.000 description 1
- 229940088417 precipitated calcium carbonate Drugs 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 229960004694 prednimustine Drugs 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- AYXYPKUFHZROOJ-ZETCQYMHSA-N pregabalin Chemical compound CC(C)C[C@H](CN)CC(O)=O AYXYPKUFHZROOJ-ZETCQYMHSA-N 0.000 description 1
- 229960001233 pregabalin Drugs 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 208000029340 primitive neuroectodermal tumor Diseases 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- XYWJNTOURDMTPI-UHFFFAOYSA-N procodazole Chemical compound C1=CC=C2NC(CCC(=O)O)=NC2=C1 XYWJNTOURDMTPI-UHFFFAOYSA-N 0.000 description 1
- 229950000989 procodazole Drugs 0.000 description 1
- 229940095055 progestogen systemic hormonal contraceptives Drugs 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 229960003510 propiverine Drugs 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 230000001696 purinergic effect Effects 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 229960000924 quinagolide Drugs 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 229960004157 rabeprazole Drugs 0.000 description 1
- YREYEVIYCVEVJK-UHFFFAOYSA-N rabeprazole Chemical compound COCCCOC1=CC=NC(CS(=O)C=2NC3=CC=CC=C3N=2)=C1C YREYEVIYCVEVJK-UHFFFAOYSA-N 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 229960002633 ramucirumab Drugs 0.000 description 1
- 229960002185 ranimustine Drugs 0.000 description 1
- 229960000424 rasburicase Drugs 0.000 description 1
- 108010084837 rasburicase Proteins 0.000 description 1
- BMKDZUISNHGIBY-UHFFFAOYSA-N razoxane Chemical compound C1C(=O)NC(=O)CN1C(C)CN1CC(=O)NC(=O)C1 BMKDZUISNHGIBY-UHFFFAOYSA-N 0.000 description 1
- 229960000460 razoxane Drugs 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 229950008933 refametinib Drugs 0.000 description 1
- 208000000029 referred pain Diseases 0.000 description 1
- 229960004836 regorafenib Drugs 0.000 description 1
- FNHKPVJBJVTLMP-UHFFFAOYSA-N regorafenib Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=C(F)C(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 FNHKPVJBJVTLMP-UHFFFAOYSA-N 0.000 description 1
- 201000002793 renal fibrosis Diseases 0.000 description 1
- 238000001226 reprecipitation Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- WUAPFZMCVAUBPE-IGMARMGPSA-N rhenium-186 Chemical compound [186Re] WUAPFZMCVAUBPE-IGMARMGPSA-N 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- 229940089617 risedronate Drugs 0.000 description 1
- 229960000759 risedronic acid Drugs 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 1
- 229960003452 romidepsin Drugs 0.000 description 1
- 108010091666 romidepsin Proteins 0.000 description 1
- OHRURASPPZQGQM-UHFFFAOYSA-N romidepsin Natural products O1C(=O)C(C(C)C)NC(=O)C(=CC)NC(=O)C2CSSCCC=CC1CC(=O)NC(C(C)C)C(=O)N2 OHRURASPPZQGQM-UHFFFAOYSA-N 0.000 description 1
- 229960004262 romiplostim Drugs 0.000 description 1
- 108010017584 romiplostim Proteins 0.000 description 1
- 229950003733 romurtide Drugs 0.000 description 1
- 108700033545 romurtide Proteins 0.000 description 1
- XWGJFPHUCFXLBL-UHFFFAOYSA-M rongalite Chemical compound [Na+].OCS([O-])=O XWGJFPHUCFXLBL-UHFFFAOYSA-M 0.000 description 1
- 229950002433 roniciclib Drugs 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- HNMATTJJEPZZMM-BPKVFSPJSA-N s-[(2r,3s,4s,6s)-6-[[(2r,3s,4s,5r,6r)-5-[(2s,4s,5s)-5-[acetyl(ethyl)amino]-4-methoxyoxan-2-yl]oxy-6-[[(2s,5z,9r,13e)-13-[2-[[4-[(2e)-2-[1-[4-(4-amino-4-oxobutoxy)phenyl]ethylidene]hydrazinyl]-2-methyl-4-oxobutan-2-yl]disulfanyl]ethylidene]-9-hydroxy-12-(m Chemical compound C1[C@H](OC)[C@@H](N(CC)C(C)=O)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@@](C/3=C/CSSC(C)(C)CC(=O)N\N=C(/C)C=3C=CC(OCCCC(N)=O)=CC=3)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HNMATTJJEPZZMM-BPKVFSPJSA-N 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 229960003021 samarium (153sm) lexidronam Drugs 0.000 description 1
- JSTADIGKFYFAIY-GJNDDOAHSA-F samarium-153(3+);n,n,n',n'-tetrakis(phosphonatomethyl)ethane-1,2-diamine Chemical compound [153Sm+3].[O-]P([O-])(=O)CN(CP([O-])([O-])=O)CCN(CP([O-])([O-])=O)CP([O-])([O-])=O JSTADIGKFYFAIY-GJNDDOAHSA-F 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 125000005920 sec-butoxy group Chemical group 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- WUWDLXZGHZSWQZ-WQLSENKSSA-N semaxanib Chemical compound N1C(C)=CC(C)=C1\C=C/1C2=CC=CC=C2NC\1=O WUWDLXZGHZSWQZ-WQLSENKSSA-N 0.000 description 1
- 230000020341 sensory perception of pain Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 230000016160 smooth muscle contraction Effects 0.000 description 1
- 229950010372 sobuzoxane Drugs 0.000 description 1
- 235000015424 sodium Nutrition 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010378 sodium ascorbate Nutrition 0.000 description 1
- PPASLZSBLFJQEF-RKJRWTFHSA-M sodium ascorbate Substances [Na+].OC[C@@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RKJRWTFHSA-M 0.000 description 1
- 229960005055 sodium ascorbate Drugs 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 229960003885 sodium benzoate Drugs 0.000 description 1
- 229940001607 sodium bisulfite Drugs 0.000 description 1
- 229940001593 sodium carbonate Drugs 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 229960000999 sodium citrate dihydrate Drugs 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 229940010747 sodium hyaluronate Drugs 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 229960003339 sodium phosphate Drugs 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 235000010339 sodium tetraborate Nutrition 0.000 description 1
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 1
- YWIVKILSMZOHHF-QJZPQSOGSA-N sodium;(2s,3s,4s,5r,6r)-6-[(2s,3r,4r,5s,6r)-3-acetamido-2-[(2s,3s,4r,5r,6r)-6-[(2r,3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2- Chemical compound [Na+].CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 YWIVKILSMZOHHF-QJZPQSOGSA-N 0.000 description 1
- SARBMGXGWXCXFW-GJHVZSAVSA-M sodium;2-[[(2s)-2-[[(4r)-4-[[(2s)-2-[[(2r)-2-[(3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxypropanoyl]amino]propanoyl]amino]-5-amino-5-oxopentanoyl]amino]propanoyl]amino]ethyl [(2r)-2,3-di(hexadecanoyloxy)propyl] phosphate;hydrate Chemical compound O.[Na+].CCCCCCCCCCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCCCCCCCCCC)COP([O-])(=O)OCCNC(=O)[C@H](C)NC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)OC(O)[C@@H]1NC(C)=O SARBMGXGWXCXFW-GJHVZSAVSA-M 0.000 description 1
- FWYUJENICVGSJH-UHFFFAOYSA-M sodium;2-[bis[2-[2-(2-methyl-5-nitroimidazol-1-yl)ethoxy]-2-oxoethyl]amino]acetate Chemical compound [Na+].CC1=NC=C([N+]([O-])=O)N1CCOC(=O)CN(CC([O-])=O)CC(=O)OCCN1C([N+]([O-])=O)=CN=C1C FWYUJENICVGSJH-UHFFFAOYSA-M 0.000 description 1
- MIXCUJKCXRNYFM-UHFFFAOYSA-M sodium;diiodomethanesulfonate;n-propyl-n-[2-(2,4,6-trichlorophenoxy)ethyl]imidazole-1-carboxamide Chemical compound [Na+].[O-]S(=O)(=O)C(I)I.C1=CN=CN1C(=O)N(CCC)CCOC1=C(Cl)C=C(Cl)C=C1Cl MIXCUJKCXRNYFM-UHFFFAOYSA-M 0.000 description 1
- 239000007892 solid unit dosage form Substances 0.000 description 1
- 229960003855 solifenacin Drugs 0.000 description 1
- FBOUYBDGKBSUES-VXKWHMMOSA-N solifenacin Chemical compound C1([C@H]2C3=CC=CC=C3CCN2C(O[C@@H]2C3CCN(CC3)C2)=O)=CC=CC=C1 FBOUYBDGKBSUES-VXKWHMMOSA-N 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 235000011071 sorbitan monopalmitate Nutrition 0.000 description 1
- 239000001570 sorbitan monopalmitate Substances 0.000 description 1
- 229940031953 sorbitan monopalmitate Drugs 0.000 description 1
- 229960002920 sorbitol Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 229960000912 stanozolol Drugs 0.000 description 1
- 231100000240 steatosis hepatitis Toxicity 0.000 description 1
- 239000008229 sterile water for irrigation Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229920003048 styrene butadiene rubber Polymers 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 235000020238 sunflower seed Nutrition 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000002511 suppository base Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 201000004595 synovitis Diseases 0.000 description 1
- 229920003051 synthetic elastomer Polymers 0.000 description 1
- 239000005061 synthetic rubber Substances 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 238000009492 tablet coating Methods 0.000 description 1
- 239000002700 tablet coating Substances 0.000 description 1
- 239000007885 tablet disintegrant Substances 0.000 description 1
- 229950010924 talaporfin Drugs 0.000 description 1
- MUTNCGKQJGXKEM-UHFFFAOYSA-N tamibarotene Chemical compound C=1C=C2C(C)(C)CCC(C)(C)C2=CC=1NC(=O)C1=CC=C(C(O)=O)C=C1 MUTNCGKQJGXKEM-UHFFFAOYSA-N 0.000 description 1
- 229950010130 tamibarotene Drugs 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 229960005126 tapentadol Drugs 0.000 description 1
- KWTWDQCKEHXFFR-SMDDNHRTSA-N tapentadol Chemical compound CN(C)C[C@H](C)[C@@H](CC)C1=CC=CC(O)=C1 KWTWDQCKEHXFFR-SMDDNHRTSA-N 0.000 description 1
- 229960003102 tasonermin Drugs 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- 229960000235 temsirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-UHFFFAOYSA-N temsirolimus Natural products C1CC(O)C(OC)CC1CC(C)C1OC(=O)C2CCCCN2C(=O)C(=O)C(O)(O2)C(C)CCC2CC(OC)C(C)=CC=CC=CC(C)CC(C)C(=O)C(OC)C(O)C(C)=CC(C)C(=O)C1 QFJCIRLUMZQUOT-UHFFFAOYSA-N 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 150000003505 terpenes Chemical class 0.000 description 1
- 235000007586 terpenes Nutrition 0.000 description 1
- MZOOWDNOTXAKNO-UHFFFAOYSA-N tert-butyl 3-[4-[[2-(2-chlorophenyl)acetyl]amino]-2-(dimethylaminomethylideneamino)sulfonylphenyl]pyrrole-1-carboxylate Chemical compound ClC1=C(C=CC=C1)CC(=O)NC1=CC(=C(C=C1)C1=CN(C=C1)C(=O)OC(C)(C)C)S(N=CN(C)C)(=O)=O MZOOWDNOTXAKNO-UHFFFAOYSA-N 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- TUGDLVFMIQZYPA-UHFFFAOYSA-N tetracopper;tetrazinc Chemical compound [Cu+2].[Cu+2].[Cu+2].[Cu+2].[Zn+2].[Zn+2].[Zn+2].[Zn+2] TUGDLVFMIQZYPA-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 229960003433 thalidomide Drugs 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 229960000902 thyrotropin alfa Drugs 0.000 description 1
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- QQHMKNYGKVVGCZ-UHFFFAOYSA-N tipiracil Chemical compound N1C(=O)NC(=O)C(Cl)=C1CN1C(=N)CCC1 QQHMKNYGKVVGCZ-UHFFFAOYSA-N 0.000 description 1
- 229960002952 tipiracil Drugs 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 229960003989 tocilizumab Drugs 0.000 description 1
- 229960004045 tolterodine Drugs 0.000 description 1
- OOGJQPCLVADCPB-HXUWFJFHSA-N tolterodine Chemical compound C1([C@@H](CCN(C(C)C)C(C)C)C=2C(=CC=C(C)C=2)O)=CC=CC=C1 OOGJQPCLVADCPB-HXUWFJFHSA-N 0.000 description 1
- 208000004371 toothache Diseases 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229960004394 topiramate Drugs 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- PKVRCIRHQMSYJX-AIFWHQITSA-N trabectedin Chemical compound C([C@@]1(C(OC2)=O)NCCC3=C1C=C(C(=C3)O)OC)S[C@@H]1C3=C(OC(C)=O)C(C)=C4OCOC4=C3[C@H]2N2[C@@H](O)[C@H](CC=3C4=C(O)C(OC)=C(C)C=3)N(C)[C@H]4[C@@H]21 PKVRCIRHQMSYJX-AIFWHQITSA-N 0.000 description 1
- 229960000977 trabectedin Drugs 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 238000007056 transamidation reaction Methods 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 230000009529 traumatic brain injury Effects 0.000 description 1
- 229960003181 treosulfan Drugs 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 239000003029 tricyclic antidepressant agent Substances 0.000 description 1
- 238000006692 trifluoromethylation reaction Methods 0.000 description 1
- 229960003962 trifluridine Drugs 0.000 description 1
- VSQQQLOSPVPRAZ-RRKCRQDMSA-N trifluridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(C(F)(F)F)=C1 VSQQQLOSPVPRAZ-RRKCRQDMSA-N 0.000 description 1
- KVJXBPDAXMEYOA-CXANFOAXSA-N trilostane Chemical compound OC1=C(C#N)C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@@]32O[C@@H]31 KVJXBPDAXMEYOA-CXANFOAXSA-N 0.000 description 1
- 229960001670 trilostane Drugs 0.000 description 1
- VXKHXGOKWPXYNA-PGBVPBMZSA-N triptorelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 VXKHXGOKWPXYNA-PGBVPBMZSA-N 0.000 description 1
- 229960004824 triptorelin Drugs 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- BSVBQGMMJUBVOD-UHFFFAOYSA-N trisodium borate Chemical compound [Na+].[Na+].[Na+].[O-]B([O-])[O-] BSVBQGMMJUBVOD-UHFFFAOYSA-N 0.000 description 1
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 125000005455 trithianyl group Chemical group 0.000 description 1
- 229960000875 trofosfamide Drugs 0.000 description 1
- UMKFEPPTGMDVMI-UHFFFAOYSA-N trofosfamide Chemical compound ClCCN(CCCl)P1(=O)OCCCN1CCCl UMKFEPPTGMDVMI-UHFFFAOYSA-N 0.000 description 1
- 229960001491 trospium Drugs 0.000 description 1
- OYYDSUSKLWTMMQ-JKHIJQBDSA-N trospium Chemical compound [N+]12([C@@H]3CC[C@H]2C[C@H](C3)OC(=O)C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CCCC1 OYYDSUSKLWTMMQ-JKHIJQBDSA-N 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- BDIAUFOIMFAIPU-UHFFFAOYSA-N valepotriate Natural products CC(C)CC(=O)OC1C=C(C(=COC2OC(=O)CC(C)C)COC(C)=O)C2C11CO1 BDIAUFOIMFAIPU-UHFFFAOYSA-N 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- NMDYYWFGPIMTKO-HBVLKOHWSA-N vinflunine Chemical compound C([C@@](C1=C(C2=CC=CC=C2N1)C1)(C2=C(OC)C=C3N(C)[C@@H]4[C@@]5(C3=C2)CCN2CC=C[C@]([C@@H]52)([C@H]([C@]4(O)C(=O)OC)OC(C)=O)CC)C(=O)OC)[C@H]2C[C@@H](C(C)(F)F)CN1C2 NMDYYWFGPIMTKO-HBVLKOHWSA-N 0.000 description 1
- 229960000922 vinflunine Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- BPQMGSKTAYIVFO-UHFFFAOYSA-N vismodegib Chemical compound ClC1=CC(S(=O)(=O)C)=CC=C1C(=O)NC1=CC=C(Cl)C(C=2N=CC=CC=2)=C1 BPQMGSKTAYIVFO-UHFFFAOYSA-N 0.000 description 1
- 229960004449 vismodegib Drugs 0.000 description 1
- 239000000341 volatile oil Substances 0.000 description 1
- 229960000237 vorinostat Drugs 0.000 description 1
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 1
- 229960001771 vorozole Drugs 0.000 description 1
- XLMPPFTZALNBFS-INIZCTEOSA-N vorozole Chemical compound C1([C@@H](C2=CC=C3N=NN(C3=C2)C)N2N=CN=C2)=CC=C(Cl)C=C1 XLMPPFTZALNBFS-INIZCTEOSA-N 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- UHVMMEOXYDMDKI-JKYCWFKZSA-L zinc;1-(5-cyanopyridin-2-yl)-3-[(1s,2s)-2-(6-fluoro-2-hydroxy-3-propanoylphenyl)cyclopropyl]urea;diacetate Chemical compound [Zn+2].CC([O-])=O.CC([O-])=O.CCC(=O)C1=CC=C(F)C([C@H]2[C@H](C2)NC(=O)NC=2N=CC(=CC=2)C#N)=C1O UHVMMEOXYDMDKI-JKYCWFKZSA-L 0.000 description 1
- 229950009268 zinostatin Drugs 0.000 description 1
- FYQZGCBXYVWXSP-STTFAQHVSA-N zinostatin stimalamer Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1OC1C/2=C/C#C[C@H]3O[C@@]3([C@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(C)C=CC2=C(C)C=C(OC)C=C12 FYQZGCBXYVWXSP-STTFAQHVSA-N 0.000 description 1
- 229950009233 zinostatin stimalamer Drugs 0.000 description 1
- FBTUMDXHSRTGRV-ALTNURHMSA-N zorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 FBTUMDXHSRTGRV-ALTNURHMSA-N 0.000 description 1
- 229960000641 zorubicin Drugs 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4418—Non condensed pyridines; Hydrogenated derivatives thereof having a carbocyclic group directly attached to the heterocyclic ring, e.g. cyproheptadine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/32—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/33—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms with substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/333—Radicals substituted by oxygen or sulfur atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/4155—1,2-Diazoles non condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4184—1,3-Diazoles condensed with carbocyclic rings, e.g. benzimidazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4192—1,2,3-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4196—1,2,4-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4245—Oxadiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/15—Sulfonamides having sulfur atoms of sulfonamide groups bound to carbon atoms of six-membered aromatic rings
- C07C311/16—Sulfonamides having sulfur atoms of sulfonamide groups bound to carbon atoms of six-membered aromatic rings having the nitrogen atom of at least one of the sulfonamide groups bound to hydrogen atoms or to an acyclic carbon atom
- C07C311/17—Sulfonamides having sulfur atoms of sulfonamide groups bound to carbon atoms of six-membered aromatic rings having the nitrogen atom of at least one of the sulfonamide groups bound to hydrogen atoms or to an acyclic carbon atom to an acyclic carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/30—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/37—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring
- C07C311/38—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring having sulfur atoms of sulfonamide groups and amino groups bound to carbon atoms of six-membered rings of the same carbon skeleton
- C07C311/39—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring having sulfur atoms of sulfonamide groups and amino groups bound to carbon atoms of six-membered rings of the same carbon skeleton having the nitrogen atom of at least one of the sulfonamide groups bound to hydrogen atoms or to an acyclic carbon atom
- C07C311/40—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring having sulfur atoms of sulfonamide groups and amino groups bound to carbon atoms of six-membered rings of the same carbon skeleton having the nitrogen atom of at least one of the sulfonamide groups bound to hydrogen atoms or to an acyclic carbon atom to an acyclic carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/30—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/45—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups at least one of the singly-bound nitrogen atoms being part of any of the groups, X being a hetero atom, Y being any atom, e.g. N-acylaminosulfonamides
- C07C311/46—Y being a hydrogen or a carbon atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/62—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a six-membered aromatic ring of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/34—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/36—Oxygen or sulfur atoms
- C07D207/40—2,5-Pyrrolidine-diones
- C07D207/416—2,5-Pyrrolidine-diones with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to other ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/36—Radicals substituted by singly-bound nitrogen atoms
- C07D213/40—Acylated substituent nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/61—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
- C07D213/64—One oxygen atom attached in position 2 or 6
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
- C07D213/65—One oxygen atom attached in position 3 or 5
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/74—Amino or imino radicals substituted by hydrocarbon or substituted hydrocarbon radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/84—Nitriles
- C07D213/85—Nitriles in position 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/16—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/18—One oxygen or sulfur atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/38—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/54—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings condensed with carbocyclic rings or ring systems
- C07D231/56—Benzopyrazoles; Hydrogenated benzopyrazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/04—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D233/06—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms
- C07D233/08—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms with alkyl radicals, containing more than four carbon atoms, directly attached to ring carbon atoms
- C07D233/12—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms with alkyl radicals, containing more than four carbon atoms, directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D233/16—Radicals substituted by nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
- C07D233/61—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms with hydrocarbon radicals, substituted by nitrogen atoms not forming part of a nitro radical, attached to ring nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/64—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms, e.g. histidine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/68—Halogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/06—Benzimidazoles; Hydrogenated benzimidazoles with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached in position 2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/06—Benzimidazoles; Hydrogenated benzimidazoles with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached in position 2
- C07D235/08—Radicals containing only hydrogen and carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D237/00—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings
- C07D237/02—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings
- C07D237/06—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D237/08—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/26—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/30—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/34—One oxygen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/42—One nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/04—1,2,3-Triazoles; Hydrogenated 1,2,3-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/04—1,2,3-Triazoles; Hydrogenated 1,2,3-triazoles
- C07D249/06—1,2,3-Triazoles; Hydrogenated 1,2,3-triazoles with aryl radicals directly attached to ring atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
- C07D249/10—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
- C07D249/10—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D249/12—Oxygen or sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
- C07D249/10—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D249/14—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/16—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms condensed with carbocyclic rings or ring systems
- C07D249/18—Benzotriazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/16—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms condensed with carbocyclic rings or ring systems
- C07D249/18—Benzotriazoles
- C07D249/20—Benzotriazoles with aryl radicals directly attached in position 2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D261/00—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings
- C07D261/02—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings
- C07D261/06—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members
- C07D261/08—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D263/00—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings
- C07D263/02—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings
- C07D263/30—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D263/32—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D271/00—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms
- C07D271/02—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms not condensed with other rings
- C07D271/04—1,2,3-Oxadiazoles; Hydrogenated 1,2,3-oxadiazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D271/00—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms
- C07D271/02—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms not condensed with other rings
- C07D271/06—1,2,4-Oxadiazoles; Hydrogenated 1,2,4-oxadiazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D275/00—Heterocyclic compounds containing 1,2-thiazole or hydrogenated 1,2-thiazole rings
- C07D275/02—Heterocyclic compounds containing 1,2-thiazole or hydrogenated 1,2-thiazole rings not condensed with other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/22—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D277/26—Radicals substituted by sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D277/34—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D277/56—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/04—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/06—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic Table
- C07F5/02—Boron compounds
- C07F5/025—Boronic and borinic acid compounds
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Urology & Nephrology (AREA)
- Reproductive Health (AREA)
- Physical Education & Sports Medicine (AREA)
- Endocrinology (AREA)
- Pulmonology (AREA)
- Immunology (AREA)
- Heart & Thoracic Surgery (AREA)
- Gynecology & Obstetrics (AREA)
- Pregnancy & Childbirth (AREA)
- Biomedical Technology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Cardiology (AREA)
- Neurosurgery (AREA)
- Gastroenterology & Hepatology (AREA)
- Neurology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pyridine Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pyrrole Compounds (AREA)
Abstract
Un compuesto de fórmula (I) **(Ver fórmula)** caracterizado porque: X representa C-R2a o N; R1 representa un grupo seleccionado entre: **(Ver fórmula)** en las que * indica el punto de unión de dicho grupo con el resto de la molécula; R2 representa fenilo o heteroarilo, en las que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros; R2a representa hidrógeno, ciano, nitro, halógeno, alquilo C1-C2 o haloalquilo C1-C2; R2b representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2; R2c representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2, en las que no menos que uno de R2a, R2b y R2c representa hidrógeno; 20 R3 representa hidrógeno o flúor; R4 representa hidrógeno, flúor, metilo o OH; R5 representa hidrógeno o alquilo C1-C3; R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-; R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; o R6a y R6b adyacentes entre sí representan juntos un grupo seleccionado entre -O-CH2-CH2-, -O-CH2-O- u -O-CH2- CH2-O-; R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, halógeno, alquilo C1-C4 o haloalquilo C1-C4; R8 representa, en forma independiente en cada instancia, alquilo C1-C6, alcoxi C1-C4-alquilo C1-C4, cicloalquilo C3- C6 o haloalquilo C1-C4; R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4 o (CH3)2N-alquilo C1-C4 o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros, en el cual dicho anillo contiene opcionalmente un heteroátomo adicional seleccionado entre O, S, NH, NRa en el cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6 y está opcionalmente sustituido, entre una y tres veces, en forma independiente en cada caso, con halógeno o alquilo C1-C4; R11 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2- C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi C1-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil C1-C4)-S- o (alquil C1-C4)-SO2-; R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino, **(Ver fórmula)** en las que * indica el punto de unión de dicho grupo con el resto de la molécula; R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2- C4, haloalquilo C1-C4, hidroxialquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C2-C4)-, (haloalcoxi C1-C4)-(alquil C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; n representa 0, 1, 2 o 3; o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
Description
DESCRIPCIÓN
Derivados de sulfonamida aromáticos
Campo de aplicación de la invención
La invención se relaciona con sulfonamidas aromáticas sustituidas de fórmula (I) como se describe y se define en el presente documento, con composiciones farmacéuticas y combinaciones que comprenden dichos compuestos y con el uso de dichos compuestos para fabricar una composición farmacéutica para el tratamiento o profilaxis de una enfermedad. La presente invención, como se describe y se define en el presente documento, se relaciona con composiciones farmacéuticas y combinaciones que comprenden un principio activo que es un antagonista o un modulador alostérico negativo de P2X4. También, con el uso de dichos compuestos para fabricar una composición farmacéutica para el tratamiento o profilaxis de una enfermedad, en particular en mamíferos, tales como a título enunciativo no taxativo, enfermedades asociadas con dolor, o para el tratamiento o profilaxis de dolor o daño neuronal e inflamación en el cerebro o cordón espinal o síndromes de artritis o espondilitis (agudos o crónicos), dolor inducido por inflamación, dolor neuropático, dolor pélvico, dolor asociado con cáncer, dolor asociado con endometriosis así como también endometriosis como tal, cáncer como tal, esclerosis múltiple como tal, daño al cordón espinal o por isquemia de cerebro como tal, como único agente o en combinación con otros principios activos.
Antecedentes de la invención
El dolor inflamatorio crónico tal como en, a título enunciativo no taxativo, las condiciones de endometriosis y adenomiosis, surge como una consecuencia de las respuestas inflamatorias llevadas a cabo por el sistema inmunológico después de un daño tisular o muerte celular local, y en general persiste mucho tiempo después de que el daño inicial se ha curado. Debido al gran porcentaje de pacientes con enfermedades inflamatorias que no responden en forma adecuada a los tratamientos o fármacos analgésicos antiinflamatorios disponibles en la actualidad, o que sufren de efectos secundarios intolerables, es necesaria la investigación de tratamientos alternativos para las afecciones / trastornos inflamatorios.
La adenosina trifosfato o ATP es ampliamente reconocido como un importante neurotransmisor que posee varios roles fisiológicos y patofisiológicos actuando a través de diferentes subtipos de receptores purinérgicos (Burntock 1993, Drug Dev Res 28:196-206; Burntock 2011, Prog Neurobiol 95:229-274). Hasta la fecha, se han clonado siete miembros de la familia P2X, que comprenden P2X1-7 (Burntock 2013, Front Cell Neurosci 7:227). El receptor P2X4 es un canal iónico activado por ligando que se expresa en una variedad de tipos celulares ampliamente conocidos por estar implicados en procedimientos inflamatorios/inmunológicos que incluyen específicamente monocitos, macrófagos, mastocitos y células de la microglia (Wang y col., 2004, BMC Immunol 5:16; Brone y col., 2007 Immunol Lett 113:83-89). Se sabe que la activación de P2X4 por el ATP extracelular, entre otras cosas, conduce a la liberación de citoquinas y prostaglandinas proinflamatorias (Pg E2) (Bo y col., 2003 Cell Tissue Res 313:159-165; Ulmann y col., 2010, EMBO Journal 29:2290-2300; de Ribero Vaccari y col., 2012, J Neurosci 32:3058-3066). Numerosas líneas de evidencia de la literatura usando modelos animales han asociado al receptor P2X4 con la nocicepción y el dolor. Los ratones que carecen del receptor P2X4 no desarrollan hipersensibilidad al dolor en respuesta a numerosas situaciones inflamatorias tales como adyuvante completo de Freund, carragenano o formalina (Ulmann y col., 2010, EMBO Journal 29:2290-2300). Además, los ratones que carecen de P2X4R no desarrollan alodinia mecánica después de un daño de los nervios periféricos, lo que indica un importante rol para el P2X4 también en afecciones de dolor neuropático (Tsuda y col., 2009, Mol Pain 5:28; Ulmann y col., 2008, J Neurocsci 28:11263-11268). Además del rol prominente de P2X4 en las enfermedades agudas o crónicas relacionadas con el dolor (Trang and Salter, 2012, Purinergic Signalling 8:621-628; Burnstock, 2013 Eur J Pharmacol 716:24-40), el P2X4 se considera como un mediator críticamente importante de las enfermedades inflamatorias tales como, enfermedades respiratorias (por ejemplo asma, EPOC), enfermedades pulmonares incluyendo fibrosis, cáncer y aterosclerosis (Burnstock y col., 2012 Pharmacol Rev. 64:834-868).
EP 2597088 A1 describe antagonistas del receptor P2X4 y en particular a un derivado de diazepina de fórmula (III) o una sal farmacéuticamente aceptable del mismo. Dicho documento además desveló el uso de los derivados de diazepina antagonistas del receptor P2X4 representados por la fórmula (I), (II), (III), o sus sales farmacológicamente aceptables, los cuales muestran antagonismo para el receptor P2X4, siendo eficaces como agentes para la prevención o tratamiento de dolor nociceptivo, inflamatorio y neuropático. Con mayor detalle, EP 2 597 088 A1 describe a antagonistas del receptor P2X4 que son eficaces como agentes preventivos o terapéuticos para el dolor causado por diversos cánceres, neuritis diabética, enfermedades virales tales como herpes, y osteoartritis. El agente preventivo o terapéutico de acuerdo a EP 2 597 088 A1 también se puede usar en combinación con otros agentes tales como analgésicos opioides (por ejemplo, morfina, fentanilo), inhibidores de canal de sodio (por ejemplo, novocaína, lidocaína), o NSAID (por ejemplo, aspirina, ibuprofeno). El antagonista del receptor P2X4 usado contra el dolor causado por cánceres también se puede usar en combinación con un carcinostático tal como un quimioterapéutico. Además, los antagonistas del receptor P2X4 y su uso se desvelan en WO2013105608, WO2015005467 y WO2015005468.
"Discovery and characterization of novel, potent and selective P2X4 receptor antagonists for the treatment of pain" se presentó en el Society for Neuroscience Annual Meeting 2014 (Carrie A Bowen y col.; póster N. 241.1). Dicho póster describe los procedimientos para identificar antagonistas de molécula pequeña nuevos, potentes y selectivos que inhiben a P2X4 a través de distintas especies, y para evaluar los compuestos seleccionados en modelos
experimentales de dolor neuropático e inflamatorio. En particular se describieron un procedimiento de cribado basado en Flipr para P2X4R de humano, rata, y ratón, un ensayo electrofisiólogico para P2X4R humano, un modelo adecuado de neuropatía en ratón y un modelo de inflamación en ratón.
WO2015/088564 y WO2015/088565 proveen compuestos moduladores del receptor P2X4, procedimientos para su síntesis, composiciones farmacéuticas que comprenden los compuestos, y procedimientos para su uso. Dichos compuestos moduladores del receptor P2X4 son útiles para el tratamiento, prevención, y/o manejo de diversos trastornos, incluyendo, a título enunciativo no taxativo, dolor crónico, neuropatía, enfermedades inflamatorias y trastornos del sistema nervioso central.
No existe una referencia en el estado de la técnica acerca de sulfonamidas aromáticas sustituidas de fórmula general (I) como se describe y se define en el presente documento, ni acerca del uso de dichos compuestos para fabricar una composición farmacéutica para el tratamiento o profilaxis de una enfermedad, particularmente acerca del uso de las sulfonamidas aromáticas sustituidas de fórmula general (I) para el tratamiento o profilaxis de enfermedades asociadas con dolor, o para el tratamiento o profilaxis de síndromes de dolor (agudos y crónicos), dolor inducido por inflamación, dolor neuropático, dolor pélvico, dolor asociado con cáncer, dolor asociado con endometriosis así como también endometriosis como tal, cáncer como tal, y enfermedades proliferativas como tal, como endometriosis, como agente único o en combinación con otros principios activos.
Por lo tanto, los inhibidores de P2X4 de la presente invención representan compuestos valiosos que podrían complementar opciones terapéuticas ya sea como agentes individuales o bien en combinación con otros fármacos.
Descripción de la invención
La presente invención se refiere a un compuesto de fórmula (I)
en la que:
X representa C-R2a o N;
R1 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R 2 representa fenilo o heteroarilo,
en las que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o
están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en
cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros;
R2a representa hidrógeno, ciano, nitro, halógeno, alquilo C1-C2 o haloalquilo C1-C2;
R2b representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2;
R2c representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2, en la que no menos que uno de R2a, R2b y R2c representa hidrógeno;
R3 representa hidrógeno o flúor;
R4 representa hidrógeno, flúor, metilo o OH;
R5 representa hidrógeno o alquilo C1-C3;
R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-;
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;
R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; o
R6a y R6b adyacentes entre sí representan juntos un grupo seleccionado entre -O-CH2-CH2-, -O-CH2-O- u -O-CH2-CH2-O-;
R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, halógeno, alquilo C1-C4 o haloalquilo C1-C4;
R8 representa, en forma independiente en cada instancia, alquilo C1-C6, C1-C4-alcoxi-alquilo C1-C4, cicloalquilo C3-C6 o haloalquilo C1-C4;
R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4 o (CH3)2N-alquilo C1-C4 o
junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros, en el cual dicho anillo contiene opcionalmente un heteroátomo adicional seleccionado entre O, S, NH, NRa en el que Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6 y está opcionalmente sustituido, entre una y tres veces, en forma independiente en cada caso, con halógeno o alquilo C1-C4;
R11 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi C1-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil Cr C4)-S- o (alquil C1-C4)-SO2-;
R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino,
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C2-C4)-, (haloalcoxi C1-C4)-(alquil C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;
n representa 0, 1,2 o 3;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En otra forma de realización la invención se relaciona con un compuesto de fórmula (I), en la cual:
X representa C-R2a o N;
R1 representa un grupo seleccionado entre:
R2 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula y dichos grupos están opcionalmente sustituidos una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí;
R2a representa hidrógeno, ciano, nitro, halógeno, alquilo C1-C2 o haloalquilo C1-C2;
R2b representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2;
R2c representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2, en la que no menos que uno de R2a, R2b y
R2c representa hidrógeno;
R3 representa hidrógeno o flúor;
R4 representa hidrógeno, flúor, metilo o OH;
R5 representa hidrógeno o alquilo C1-C3;
R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil Cr C4)-SO2-;
R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; o
R6a y R6b adyacentes entre sí representan juntos un grupo seleccionado entre -O-CH2-CH2-, -O-CH2-O- u -O-CH2-CH2-O-;
R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, halógeno, alquilo C1-C4 o haloalquilo C1-C4;
R8 representa, en forma independiente en cada instancia, alquilo C1-C6, alcoxi C1-C4-alquilo C1-C4, cicloalquilo C3-C6 o haloalquilo C1-C4;
R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4 o (CH3)2N-alquilo C1-C4 o
junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros, en el cual dicho anillo contiene opcionalmente un heteroátomo adicional seleccionado entre O, S, NH, NRa en la cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6 y está opcionalmente sustituido, entre una y tres veces, en forma independiente en cada caso, con halógeno o alquilo C1-C4; R11 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi C1-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil C1-C4)-S- o (alquil C1-C4)-SO2-;
R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino,
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C2-C4)-, (haloalcoxi C1-C4)-(alquil C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;
n representa 0, 1,2 o 3;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En una forma de realización preferida la invención se relaciona con un compuesto de fórmula (I), en la cual:
X representa C-R2a o N;
R1 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R2 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula y dicho grupo está opcionalmente sustituido una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí;
R2a representa hidrógeno, flúor, cloro o ciano;
R2b representa hidrógeno, flúor o cloro;
R2c representa hidrógeno, flúor o cloro; en el que no menos que uno de R2a, R2b y R2c representa hidrógeno;
R3 representa hidrógeno o flúor;
R4 representa hidrógeno, flúor o OH;
R5 representa hidrógeno o metilo;
R6 representa flúor, cloro, bromo, ciano, nitro, OH, alquilo C1-C3, difluorometilo, trifluorometilo, metoxi, etoxi, difluorometoxi o trifluorometoxi;
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, flúor, cloro, bromo, ciano, metilo, trifluorometilo o metoxi;
R6b hidrógeno o flúor;
R7a y R7b representan hidrógeno;
R11 representa, en forma independiente en cada caso, ciano, alquilo C1-C4, difluorometilo, trifluorometilo, difluoroetilo, hidroxialquilo C1-C6, (alcoxi C-i-C3)-etilo-, trifluorometoxi-etilo-, F2CH-CH2-NH-CH2-, H3C-C(O)-, H3C-CH2-O-C(O)-;
R11a representa un grupo seleccionado entre ciclopropilo,
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En una forma de realización preferida la invención se relaciona con un compuesto de fórmula (I), en la cual:
X representa C-R2a o N;
R1 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R2 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula y dichos grupos están opcionalmente sustituidos una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí;
R2a representa hidrógeno, flúor, cloro o ciano;
R2b representa hidrógeno, flúor o cloro;
R2c representa hidrógeno, flúor o cloro; en el que no menos que uno de R2a, R2b y R2c representa hidrógeno; R3 representa hidrógeno o flúor;
R4 representa hidrógeno, flúor o metilo;
R5 representa hidrógeno o metilo;
R6 representa flúor, cloro, bromo, ciano, nitro, OH, alquilo C1-C3, difluorometilo, trifluorometilo, metoxi, etoxi, difluorometoxi o trifluorometoxi;
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, flúor, cloro, bromo, ciano, metilo, trifluorometilo o metoxi;
R6b hidrógeno o flúor;
R7a y R7b representan hidrógeno;
R11 representa, en forma independiente en cada caso, flúor, cloro, bromo, ciano, metilo, difluorometilo, trifluorometilo, difluoroetilo, hidroxipropilo, alcoxi C1-C3, metoxi-etilo-, F2CH-CH2-NH-CH2-, F2CH-CH2-NH-, H3C-C(O)-, H3C-CH2-O-C(O)- o H3C-S-;
R11a representa ciclopropilo; piridilo o pirazinilo,
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En un segundo aspecto, la invención se refiere en particular a compuestos de fórmula (Ia),
en la cual:
R1 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R2 representa fenilo o heteroarilo,
en el que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o
están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, ^es tán sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros;
R2a representa hidrógeno, ciano, nitro, halógeno, alquilo C1-C2 o haloalquilo C1-C2;
R2b representa hidrógeno o halógeno;
R2c representa hidrógeno o halógeno; en el que no menos que uno de R2a, R2b y R2c representa hidrógeno;
R3 representa hidrógeno o flúor;
R4 representa hidrógeno, flúor, metilo o OH;
R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-;
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C ^ M a lc o x i C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil Cr C4)-SO2-;
R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; o
R6a y R6b adyacentes entre sí representan juntos un grupo seleccionado entre -O-CH2-CH2-, -O-CH2-O- u -O-CH2-CH2-O-;
R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, halógeno, alquilo C1-C4 o haloalquilo C1-C4;
R8 representa, en forma independiente en cada instancia, alquilo C1-C6, alcoxi C1-C4-alquilo C1-C4, cicloalquilo C3-C6 o haloalquilo C1-C4;
R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4 o (CH3)2N-alquilo C1-C4 o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros, en el cual dicho anillo contiene opcionalmente un heteroátomo adicional seleccionado entre O, S, NH, NRa en la cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6 y está opcionalmente sustituido, entre una y tres veces, en forma independiente en cada caso, con halógeno o alquilo C1-C4;
R11 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi C1-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil C1-C4)-S- o (alquil C1-C4)-SO2-;
R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino,
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C2-C4)-, (haloalcoxi C1-C4)-(alquil C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;
n representa 0, 1,2 o 3;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En un tercer aspecto, la invención se refiere en particular a compuestos de fórmula (Ia), anteriormente,
en la cual:
R1 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R2 representa fenilo o heteroarilo,
en el que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o
están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí;
R2a representa hidrógeno, cloro o ciano;
R2b representa hidrógeno o flúor;
R2c representa hidrógeno o flúor; en el que no menos que uno de R2a, R2b y R2c representa hidrógeno;
R3 representa hidrógeno o flúor;
R4 representa hidrógeno, flúor, metilo o OH;
R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, C(O)-, R9R10N-C(O)- o (alquil Cr C4)-SO2-;
R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;
R8 representa, en forma independiente en cada instancia, alquilo C1-C6;
R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4 o (CH3)2N-alquilo C1-C4 o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros;
R11 representa, en forma independiente en cada caso, halógeno, hidroxi, ciano, alquilo C1-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi C1-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil Cr C4)-S- o (alquil C1-C4)-SO2-;
R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino,
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4;
n representa 0 o 1;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En un cuarto aspecto, la invención se refiere en particular a compuestos de fórmula (Ia) anteriormente, en la cual:
R1 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula;
R2 representa fenilo o heteroarilo,
en el que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o
están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí;
R2a representa hidrógeno, cloro o ciano;
R2b representa hidrógeno o flúor;
R2c representa hidrógeno o flúor; en el que no menos que uno de R2a, R2b y R2c representa hidrógeno;
R3 representa hidrógeno;
R4 representa hidrógeno;
R6 representa halógeno, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4 o haloalcoxi C1-C4;
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, halógeno, alquilo C1-C4, haloalquilo C1-C4 o alcoxi C1-C4;
R6b hidrógeno o flúor;
R8 representa, en forma independiente en cada instancia, metilo o etilo;
R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, haloalquilo C1-C2 o ciclopropilo o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de 5 miembros;
R11 representa, en forma independiente en cada caso, halógeno, ciano, alquilo C1-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C3)-etilo-, metoxi-etilo-, R9R10N-, R8-C(O)-, R8-O-C(O)- o R9R10N-C(O)-;
R11a representa un grupo seleccionado entre cicloalquilo C3-C5,
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En un quinto aspecto, la invención se refiere en particular a compuestos de fórmula (Ib)
en la cual:
R1 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R2 representa fenilo o heteroarilo,
en el que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o
están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros;
R3 representa hidrógeno o flúor;
R4 representa hidrógeno, flúor, metilo o OH;
R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquMo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil Cr C4)-SO2-;
R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; o
R6a y R6b adyacentes entre sí representan juntos un grupo seleccionado entre -O-CH2-CH2-, -O-CH2-O- u -O-CH2-CH2-O-;
R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, halógeno, alquilo C1-C4 o haloalquilo C1-C4;
R8 representa, en forma independiente en cada instancia, alquilo C1-C6, alcoxi C1-C4-alquilo C1-C4, cicloalquilo C3-C6 o haloalquilo C1-C4;
R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4 o (CH3)2N-alquilo C1-C4 o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros, en el cual dicho anillo contiene opcionalmente un heteroátomo adicional seleccionado entre O, S, NH, NRa en la cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6 y está opcionalmente sustituido, entre una y tres veces, en forma independiente en cada caso, con halógeno o alquilo C1-C4;
R11 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi C1-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil Cr C4)-S- o (alquil C1-C4)-SO2-;
R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino,
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C2-C4)-, (haloalcoxi C1-C4)-(alquil C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;
n representa 0, 1,2 o 3;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En un sexto aspecto, la invención se refiere en particular a compuestos de fórmula (Ib), anteriormente,
en la cual:
R1 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula;
R2 representa heteroarilo,
en el que dicho grupo heteroarilo está opcionalmente sustituido una vez con R11;
R3 representa hidrógeno;
R4 representa hidrógeno;
R6 representa halógeno;
R6a y R6b representan hidrógeno;
R11 representa, en forma independiente en cada caso, halógeno, ciano, alquilo C1-C4 o haloalquilo C1-C4;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las cuales:
R1 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula;
R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, C1-C4-alcoxi o haloalcoxi C1-C4; R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil Cr C4)-SO2-;
R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-.
De acuerdo con una alternativa adicional la invención se refiere a compuestos de fórmulas (I), (la) y (Ib) como se describe anteriormente, en las cuales:
R1 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula;
R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4 o haloalcoxi C1-C4; R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente
R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil Cr C4)-SO2-;
R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, e las que:
R1 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, flúor, cloro, alquilo C1-C4, difluorometilo o trifluorometilo.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa fenilo,
en el que dicho grupo fenilo está opcionalmente sustituido entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa heteroarilo monocíclico de 5 miembros,
en el que dicho grupo heteroarilo está opcionalmente sustituido entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula y dichos grupos están opcionalmente sustituidos una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula y dichos grupos están opcionalmente sustituidos una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula y dicho grupo está opcionalmente sustituido una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula y dicho grupo está opcionalmente sustituido una o dos veces con R11, en forma independiente en cada caso iguales o diferentes
entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí.
En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa heteroarilo monocíclico de 6 miembros,
en el que dicho grupo heteroarilo está opcionalmente sustituido entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí. En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa un grupo seleccionado entre:
en las que dichos grupos están opcionalmente sustituidos entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí. En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa heteroarilo bicíclico condensado en [5.6],
en el que dicho grupo heteroarilo está opcionalmente sustituido entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí. En particular la invención se refiere además a compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente, en las que:
R2 representa un grupo seleccionado entre:
en las que * indica el punto de unión de dicho grupo con el resto de la molécula.
De acuerdo con un aspecto adicional de la presente invención, los compuestos de fórmulas (I), (Ia) y (Ib) como se
describe anteriormente son aquellos en la cual:
R3 representa hidrógeno; y
R4 representa hidrógeno, metilo o OH.
De acuerdo con un aspecto adicional de la presente invención, los compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente son aquellos en la cual:
R3 representa hidrógeno; y
R4 representa hidrógeno.
De acuerdo con un aspecto adicional de la presente invención, los compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente son aquellos en la cual:
R3 representa flúor; y
R4 representa flúor.
De acuerdo con un aspecto más particular de la presente invención, los compuestos de fórmulas (I), (Ia) y (Ib) como se describe anteriormente son aquellos en la cual:
R5 representa hidrógeno.
De acuerdo con una forma particular adicional de la invención, los compuestos de fórmulas (Ia) y (Ib ) son aquellos en las cuales:
R1 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula y R6, R6a representan en forma independiente entre sí flúor, cloro o hidrógeno;
R2 representa
en las que * indica el punto de unión de dicho grupo con el resto de la molécula y dicho grupo está opcionalmente sustituido una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí;
R2a, R2b, y R2c representan hidrógeno;
R3, R4 y R5 representan hidrógeno;
R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, haloalquilo C1-C2 o ciclopropilo o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de 5 miembros;
R11 representa, en forma independiente en cada caso, halógeno, ciano, alquilo C1-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C3)-etilo-, metoxi-etilo-, R9R10N-, R8-C(O)-, R8-O-C(O)- o R9R10N-C(O)-;
R11a representa un grupo seleccionado entre cicloalquilo C3-C5,
en las que * indica el punto de unión de dicho grupo con el resto de la molécula;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dichos compuestos, o una sal de dicho N-óxido, tautómero o estereoisómero.
De acuerdo con una forma particular adicional de la invención, los compuestos de fórmulas (Ia) y (Ib ) son aquellos en las cuales:
R1 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula y R6, R6a representan en forma independiente entre sí flúor, cloro o hidrógeno;
R2 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula y dicho grupo está opcionalmente sustituido una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, halógeno, ciano, alquilo C1-C4 o haloalquilo C1-C4;
R2a, R2b, y R2c representan hidrógeno;
R3 , R4 y R5 representan hidrógeno;
R6a y R6b representan hidrógeno;
R11 representa, en forma independiente en cada caso, halógeno, ciano, alquilo C1-C4 o haloalquilo C1-C4;
o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dichos compuestos, o una sal de dicho N-óxido, tautómero o estereoisómero.
Un aspecto de la invención está constituido por compuestos de fórmula (I), (Ia), (Ib) como se describe en los ejemplos, caracterizados por sus nombres en los títulos y sus estructuras así como también las subcombinaciones de todos los residuos desvelados específicamente en los compuestos de los ejemplos.
Otro aspecto de la presente invención está constituido por intermedios de acuerdo con las fórmulas 3a, 3b, 4a y 4b
3a 3b 4a 4b en las que R2, R2a, R2b y R2c son como se definen en la descripción y las reivindicaciones de esta invención.
En una forma de realización particular de la presente invención, en las fórmulas 3a, 3b, 4a y 4b los grupos R2, R2a, R2b y R2c se definen de la siguiente manera:
R2 representa
en las que * indica el punto de unión de dicho grupo con el resto de la molécula y dicho grupo está opcionalmente sustituido una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí;
R2a, R2b, y R2c representan hidrógeno.
Además la presente invención se refiere a intermedios de acuerdo con la fórmula 30
en la que R1, R2a, R2b, R2c, R3 y R4 son como se definen en la descripción y las reivindicaciones de esta invención, W representa un grupo amino que está opcionalmente sustituido con un grupo protector (por ejemplo, (dimetilamino)metileno o 2,4-dimetoxibencilo) y V representa cloro o bromo.
En una forma de realización particular de la presente invención, los grupos de la fórmula 30 se definen de la siguiente manera:
R1 representa
en la que * indica el punto de unión de dicho grupo con el resto de la molécula;
R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4 o haloalcoxi C1-C4;
R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamente R6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil Cr C4)-SO2-;
R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C-,-C4)-SO2-.
R2a, R2b, y R2c representan hidrógeno;
R3, R4 y R5 representan hidrógeno.
Los intermedios específicos para la síntesis de compuestos de fórmulas (I), (Ia) y (Ib) de acuerdo con la presente invención son:
1 2-Cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
2 N-(2,4-Dimetoxibencil)-2-flúor-5-nitrobencensulfonamida
3 N-(2,4-Dimetoxibencil)-5-nitro-2-[4-(trifluorometil)-1H-pirazol-1-il]bencensulfonamida
4 2-(4-Cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
5 N-(2,4-Dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)-5-nitrobencensulfonamida
6 2-(4-Bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
7 N-(2,4-Dimetoxibencil)-5-nitro-2-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]bencensulfonamida
8 2-[3-(Difluorometil)-1H-1,2,4-triazol-1-il]-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
9 2-(4-Ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
10 5-Amino-N-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1H-pirazol-1-il]bencensulfonamida
11 5-Amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida
12 5-Amino-N-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida
13 5-Amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida
14 5-Amino-N-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]-bencensulfonamida
152-(2-Clorofenil)-N-{4-[3-(difluorometil)-1H-1,2,4-triazol-1-il]-3-[(2,4-dimetoxi-bencil)sulfamoil]fenil}acetamida 16 N-{4-[3-(Difluorometil)-1H-1,2,4-triazol-1-il]-3-[(2,4-dimetoxibencil)sulfamoil]-fenil}-2-(2-fluorofenil)acetamida 172-Cloro-N-[(dimetilamino)metilen]-5-nitrobencensulfonamida
18 N-[(Dimetilamino)metilen]-5-nitro-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida
19 5-Amino-N-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida
202-[1-(Difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metilen]-5-nitrobencensulfonamida
21 5-Amino-2-[1-(difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metilen]-bencensulfonamida
222-(2-Clorofenil)-N-(3-{[(dimetilamino)metilen]sulfamoil}-4-[4-(trifluoro-metil)-1H-pirazol-1-il]fenil)acetamida 232-(2-Clorofenil)-N-[3-{[(dimetilamino)metilen]sulfamoil}-4-(4-flúor-1H-pirazol-1-il)fenil]acetamida
24 N-(2,4-Dimetoxibencil)-2-(4-metil-1H-pirazol-1-il)-5-nitrobencensulfonamida
25 N-(2,4-Dimetoxibencil)-2-(3-metoxi-1H-1,2,4-triazol-1-il)-5-nitrobencensulfonamida
262-(4-Ciclopropil-1H-imidazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
27 N-(2,4-Dimetoxibencil)-2-(4-metil-1H-imidazol-1-il)-5-nitrobencensulfonamida
282-(3-Ciclopropil-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
29 N-(2,4-Dimetoxibencil)-5-nitro-2-(2H-pirazolo[3,4-b]piridin-2-il)bencensulfonamida
30 N-(2,4-Dimetoxibencil)-5-nitro-2-(2H-pirazolo[3,4-c]piridin-2-il)bencensulfonamida
31 N-(2,4-Dimetoxibencil)-5-nitro-2-(2H-pirazolo[4,3-b]piridin-2-il)bencensulfonamida
32 N-(2,4-Dimetoxibencil)-2-[4-(2-metoxietil)-1H-pirazol-1-il]-5-nitrobencensulfonamida
33 N-(2,4-Dimetoxibencil)-2-(3-flúor-1H-pirazol-1-il)-5-nitrobencensulfonamida
352-{4-[(2,2-Difluoroetil)amino]-1H-pirazol-1-il}-N-(2,4-dimetoxibencil)-5-nitro-bencensulfonamida
36 N-(2,4-Dimetoxibencil)-2-[4-(2-hidroxietil)-1H-pirazol-1-il]-5-nitrobencensulfonamida
37 N-(2,4-Dimetoxibencil)-5-nitro-2-[4-(2-oxoetil)-1H-pirazol-1-il]bencensulfonamida
382-[4-(2,2-Difluoroetil)-1H-pirazol-1-il]-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
392-(2-Clorofenil)-N-{4-[4-(2,2-difluoroetil)-1H-pirazol-1-il]-3-[(2,4-dimetoxi-bencil)sulfamoil]fenil}acetamida 422-(4-{[(2,2-Difluoroetil)amino]metil}-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
43 (2,2-difluoroetil)[(1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-il)metil]carbamato de ferc-butilo 44 {[1-(4-{[(2-dorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]metil}(2,2-difluoroetil)carbamato de ferc-butilo
45 2-(Bencilsulfanil)-4-nitrobenzonitrilo
46 2-Ciano-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
47 2-[(2,4-Dimetoxibencil)sulfamoil]-N'-hidroxi-4-nitrobencencarboximidamida
48 N-(2,4-Dimetoxibencil)-5-nitro-2-[5-(trifluorometil)-1,2,4-oxadiazol-3-il]bencensulfonamida
49 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[5-(trifluorometil)-1,2,4-oxadiazol-3-il]fenil}acetamida 50 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-metil-1H-pirazol-1-il)fenil}acetamida
51 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(3-metoxi-1H-1,2,4-triazol-1-il)fenil}acetamida
52 2-(2-Clorofenil)-N-{4-(4-ciclopropil-1H-imidazol-1-il)-3-[(2,4-dimetoxi-bencil)sulfamoil]fenil}acetamida
53 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-metil-1H-imidazol-1-il)fenil}acetamida
54 2-(2-Clorofenil)-N-{4-(3-ciclopropil-1H-pirazol-1-il)-3-[(2,4-dimetoxi-bencil)sulfamoil]fenil}acetamida
55 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(2H-pirazolo[3,4-b]piridin-2-il)fenil}acetamida
56 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(2H-pirazolo[3,4-c]piridin-2-il)fenil}acetamida
57 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(2H-pirazolo[4,3-b]piridin-2-il)fenil}acetamida
58 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[4-(2-metoxietil)-1H-pirazol-1-il]fenil}acetamida
59 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(3-flúor-1H-pirazol-1-il)fenil}acetamida
60 2-(2-Clorofenil)-N-(4-{4-[(2,2-difluoroetil)amino]-1H-pirazol-1-il}-3-[(2,4-dimetoxibencil)sulfamoil]fenil)acetamida 61 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(4-metil-1H-pirazol-1-il)fenil}-2-(2-fluorofenil)acetamida
62 2-(2-Fluorofenil)-N-{4-(4-cidopropil-1H-imidazol-1-il)-3-[(2,4-dimetoxibencil)-sulfamoil]fenil}acetamida 63 N-{4-(3-Ciclopropil-1H-pirazol-1-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-fluorofenil)acetamida
64 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-[4-(2-metoxietil)-1H-pirazol-1-il]-fenil}-2-(2-fluorofenil)acetamida 66 2-(Bencilsulfanil)-4-nitrobenzohidrazida
67 2-(Bencilsulfanil)-4-nitro-N'-(trifluoroacetil)benzohidrazida
68 2-[2-(Bencilsulfanil)-4-nitrofenil]-5-(trifluorometil)-1,3,4-oxadiazol
69 N-(2,4-Dimetoxibencil)-5-nitro-2-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]bencensulfonamida
70 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]fenil}acetamida 71 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]fenil}-2-(2-fluorofenil)acetamida 72 2-Bromo-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
73 5-Amino-2-bromo-N-(2,4-dimetoxibencil)bencensulfonamida
74 N-{4-Bromo-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-clorofenil)acetamida
76 2-Bromo-N-[(dimetilamino)metiliden]-5-nitrobencensulfonamida
77 5-Amino-2-bromo-N-[(dimetilamino)metiliden]bencensulfonamida
78 N-(4-Bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida
79 N-(4-Bromo-3-{(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-fluorofenil)acetamida
80 N-(4-Bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-cloro-4-fluorofenil)acetamida
81 2-(2-Clorofenil)-N-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(1H-pirazol-4-il)fenil]acetamida
82 4-Amino-N-(2,4-dimetoxibencil)bifenil-2-sulfonamida
83 5-Amino-2-(1-metil-1H-pirazol-4-il)bencensulfonamida
84 5-Amino-2-(1-ciclopropil-1H-pirazol-4-il)-N-[(dimetilamino)metiliden]bencensulfonamida
85 5-Amino-2-(1-ferc-butil-1H-pirazol-4-il)bencensulfonamida
86 5-Amino-2-(1-metil-1H-pirazol-4-il)bencensulfonamida
87 5-Amino-N-[(dimetilamino)metiliden]-2-[1-(tetrahidro-2H-piran-2-il)-1H-pirazol-4-il]bencensulfonamida 88 5-Amino-2-(1-ciclopentil-1H-pirazol-4-il)bencensulfonamida
89 5-Amino-2-[1-(2-metoxietil)-1H-pirazol-4-il]bencensulfonamida
90 5-Amino-2-(1,3-dimetil-1H-pirazol-5-il)bencensulfonamida
91 5-Amino-2-[1-metil-3-(trifluorometil)-1H-pirazol-5-il]bencensulfonamida
92 5-Amino-N-[(dimetilamino)metiliden]-2-[5-(trifluorometil)piridin-3-il]-bencensulfonamida
93 5-Amino-2-(1,3-dimetil-1H-pirazol-4-il)bencensulfonamida
94 5-Amino-2-[1-(difluorometil)-1H-pirazol-4-il]bencensulfonamida
95 4-[4-(4-amino-2-sulfairioilfeml)-1H-pirazoM-il]pipendin-1-carboxilato de ferc-butilo
97 5-Bromo-2-cloro-N-[(dimetilamino)metiliden]piridin-3-sulfonamida
98 2-Cloro-N-[(dimetilamino)metiliden]-5-[(difenilmetiliden)amino]piridin-3-sulfonamida
99 2-[1-(Difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metiliden]-5-[(difenil-metiliden)amino]piridin-3-sulfonamida 1005-Amino-2-[1-(difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metiliden]piridin-3-sulfonamida
101 N-[(Dimetilamino)metiliden]-5-[(difenilmetiliden)amino]-2-(1-metil-1H-pirazol-4-il)piridin-3-sulfonamida 1025-Amino-N-[(dimetilamino)metiliden]-2-(1-metil-1H-pirazol-4-il)piridin-3-sulfonamida
103 N-[(Dimetilamino)metiliden]-5-[(difenilmetiliden)amino]-5'-(trifluorometil)-2,3'-bipiridin-3-sulfonamida
1045-Amino-N-[(dimetilamino)metiliden]-5'-(trifluorometil)-2,3'-bipiridin-3-sulfonamida
105 2-(2-Clorofenil)-N-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida
1065-Amino-2-(5-ciclopropil-1,3,4-oxadiazol-2-il)-N-[(dimetilamino)metiliden]-bencensulfonamida
1072-[4-(Difluorometil)-1H-pirazol-1-il]-N-[(dimetilamino)metilen]-5-nitro-bencensulfonamida
1085-Amino-2-(4-ciano-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida
1095-Amino-2-(4-cloro-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida
110 5-Amino-2-(4-bromo-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida
111 5-Amino-N-[(dimetilamino)metilen]-2-(4-flúor-1H-pirazol-1-il)piridin-3-sulfonamida
112 5-Amino-N-[(dimetilamino)metiliden]-2-[4-(trifluorometil)-1H-pirazol-1-il]-piridin-3-sulfonamida
113 1-(4-{[(2-dorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-carboxilato de metilo
114 N-(4-Bromo-3-sulfamoilfenil)-2-(2-clorofenil)acetamida
115 N-(4-Bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida
116 N-[(Dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]bencensulfonamida
117 N-[(Dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]bencensulfonamida
118 2-(4-Ciano-1H-pirazol-1-il)-5-nitrobencensulfonamida
119 5-Amino-2-(4-ciano-1H-pirazol-1-il)bencensulfonamida
120 1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-carboxilato de etilo
121 ácido 1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-carboxílico
122 (1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-il)carbamato de 2-(trimetilsilil)etilo
123 [1-(4-{[(2-clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]carbamato de 2-(trimetilsilil)etilo
124 N-{4-(4-Amino-1H-pirazol-1-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-clorofenil)acetamida
125 N-[1-(4-{[(2-Clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]-2,2-difluoroacetamida
126 N-[1-(4-{[(2-Clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]-3,3,3-trifluoropropanamida
127 (±)-N-[1-(4-{[(2-Clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]-3,3,3-trifluoro-2-metilpropanamida
128 2-(2-Clorofenil)-N-(3-[(2,4-dimetoxibencil)sulfamoil]-4-{4-(2,5-dimetil-pirrolidin-1-il)-1H-pirazol-1-il}fenil)acetamida (Mezcla de estereoisómeros)
129 N-(4-{4-[(2,2-Difluoroetil)amino]-1H-pirazoM-il}-3-[(2,4-dimetoxibencil)sulfamoil]fenil)-2-(2-fluorofenil)acetamida
130 N-(2,2,2-Trifluoroetil)-1H-pirazol-4-amina
131 N-(2,4-Dimetoxibencil)-5-nitro-2-{4-[(2,2,2-trifluoroetil)amino]-1H-pirazol-1-il}bencensulfonamida
132 2-(2-Clorofenil)-N-(3-[(2,4-dimetoxibencil)sulfamoil]-4-{4-[(2,2,2-trifluoroetil)amino]-1H-pirazoM-il}fenil)acetamida
133 N-(2,4-Dimetoxibencil)-2-(4-isopropil-1H-pirazol-1-il)-5-nitrobencensulfonamida
134 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-isopropil-1H-pirazol-1-il)fenil}acetamida
135 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(4-isopropil-1H-pirazol-1-il)fenil}-2-(2-fluorofenil)acetamida
138 N-(2,4-Dimetoxibencil)-5-nitro-2-[4-(2,2,2-trifluoroetil)-1H-pirazol-1-il]bencensulfonamida
139 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[4-(2,2,2-trifluoroetil)-1H-pirazol-1-il]fenil}acetamida 140 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-[4-(2,2,2-trifluoroetil)-1H-pirazoM-ilífenil}-2-(2-fluorofenil)acetamida 141 2-(5-Ciclopropil-1,2,4-oxadiazol-3-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
142 2-(2-Clorofenil)-N-{4-(5-ciclopropil-1,2,4-oxadiazol-3-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida 143 5-[2-(Bencilsulfanil)-4-nitrofenil]-3-(trifluorometil)-1,2,4-oxadiazol
144 N-(2,4-Dimetoxibencil)-5-nitro-2-[3-(trifluorometil)-1,2,4-oxadiazol-5-il]bencensulfonamida
145 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[3-(trifluorometil)-1,2,4-oxadiazol-5-il]fenil}acetamida 146 2-(Bencilsulfanil)-N'-(difluoroacetil)-4-nitrobenzohidrazida
147 2-[2-(Bencilsulfanil)-4-nitrofenil]-5-(difluorometil)-1,3,4-oxadiazol
148 2-[5-(Difluorometil)-1,3,4-oxadiazol-2-il]-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida
149 2-(2-Clorofenil)-N-{4-[5-(difluorometil)-1,3,4-oxadiazol-2-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida 150 N-{4-[5-(Difluorometil)-1,3,4-oxadiazol-2-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-fluorofenil)acetamida 151 5-[2-(Bencilsulfanil)-4-nitrofenil]-3-metil-1,2,4-oxadiazol
152 N-(2,4-Dimetoxibencil)-2-(5-metil-1,3,4-oxadiazol-2-il)-5-nitrobencensulfonamida
153 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}acetamida
154 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}-2-(2-fluorofenil)acetamida
155 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}-2-(4-metilfenil)acetamida
156 3-(4-{[(2-clorofenil)acetil]amino}-2-{[(dimetilamino)metilen]sulfamoil}fenil)-1H-pirrol-1-carboxilato de ferc-butilo 157 2-(2-Clorofenil)-N-[3-{[(dimetilamino)metilen]sulfamoil}-4-(1H-pirrol-3-il)fenil]acetamida
158 2-(2-Clorofenil)-N-[3-{[(dimetilamino)metilen]sulfamoil}-4-(1-metiMH-pirrol-3-il)fenil]acetamida
159 2-(2-Clorofenil)-N-[4-(5-ciano-1-metil-1H-pirrol-2-il)-3-{[(dimetilamino)metilen]sulfamoil}fenil]acetamida
Otro aspecto de la invención se relaciona con el uso de cualquiera de los intermedios que se describen en el presente documento para preparar un compuesto de fórmula (I) como se define en el presente documento o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.
Los intermedios preferidos son los Ejemplos de Intermedios que se desvelan más adelante.
Un aspecto adicional de la invención son los compuestos de fórmula (I), (Ia) y (Ib) que están presentes como sus sales.
Ha de comprenderse que la presente invención se relaciona con cualquier subcombinación, dentro de cualquier forma
de realización o aspecto de la presente invención, de compuestos de fórmula general (I), (la) y (Ib) anteriormente.
Más en particular, la presente invención abarca a compuestos de fórmula general (I), (Ia) y (Ib) los cuales se desvelan en la Sección de Ejemplos de este documento, infra.
De acuerdo con otro aspecto, la presente invención abarca procedimientos para preparar compuestos de la presente invención, dichos procedimientos comprenden los pasos como se describen en la Sección Experimental de la presente documentación.
Otra forma de realización de la invención son compuestos de acuerdo a las reivindicaciones tal como se desvelan en la Sección de Reivindicaciones en la que las definiciones están limitadas de acuerdo a las definiciones preferidas o más preferidas, como se desvelan más adelante, o los residuos específicamente desvelados de los compuestos ejemplificativos y las subcombinaciones de los mismos.
Definiciones
Los constituyentes que están sustituidos de manera opcional como se indica en el presente documento, se pueden sustituir, a menos que se indique de una manera diferente, una o más veces, en forma independiente entre sí en cualquier posición posible. Cuando alguna variable está presente más de una vez en cualquier constituyente, cada definición es independiente. Por ejemplo, cuando R1, R2 , R3 , R4 , R5 , R6, R7, R8 , R9 , R10, R11, R12, X y/o Yestán presentes más de una vez en cualquier compuesto de fórmula (I), cada definición de R1, R2, R3 , R4, R5 , R6, R7 , R8, R9 , R10, R11, R12, X e Y es independiente.
Si un constituyente está compuesto por más de una parte, por ejemplo alcoxi C1-C4-alquilo C1-C4, la posición de un posible sustituyente puede ser en cualquiera de estas partes en cualquier posición adecuada. Un guión al comienzo del constituyente marca el punto de unión con el resto de la molécula. Si se sustituye un anillo, el sustituyente puede estar en cualquier posición adecuada del anillo, también sobre un átomo anular de nitrógeno, si fuese adecuado.
Más aún, un constituyente compuesto por más de una parte y que comprende varios residuos químicos, por ejemplo alcoxi C1-C4-alquilo C1-C4 o fenil-alquilo C1-C4. debe leerse de izquierda a derecha con el punto de unión al resto de la molécula en la última parte (en el ejemplo que se menciona precedentemente, en el residuo de alquilo C1-C4)
La expresión "que comprende" cuando se usa en la memoria descriptiva incluye a "que consiste en".
En la descripción se usa la frase "como se mencionó precedentemente" o "mencionado precedentemente" para hacer referencia a cualquiera de las divulgaciones hechas dentro de la memoria descriptiva en cualquiera de las páginas precedentes.
El término "adecuado" en el sentido de la invención significa químicamente posible de hacer mediante los procedimientos que están dentro del conocimiento de una persona con experiencia en la materia.
Los términos tal como se mencionan en el presente texto preferentemente tienen los siguientes significados:
El término "halógeno", "átomo de halógeno", "halo-" o "Hal-" designa a un átomo de flúor, cloro, bromo o yodo, preferentemente un átomo de flúor o cloro.
La expresión "alquilo C1-C4" preferentemente designa a un grupo hidrocarbonado lineal o ramificado, saturado, monovalente que tiene 1, 2, 3 o 4 átomos de carbono, por ejemplo un grupo metilo, etilo, propilo, butilo, iso-propilo, iso-butilo, sec-butilo, tere-butilo, en particular de 1, 2 o 3 átomos de carbono ("alquilo C1-C3"), por ejemplo un grupo metilo, etilo, n-propilo o iso-propilo.
La expresión "haloalquilo C1-C4" preferentemente designa a un grupo hidrocarbonado lineal o ramificado, saturado, monovalente en la cual el término "alquilo C1-C4" está definido anteriormente, y en el cual uno o más átomos de hidrógeno se reemplazan por un átomo de halógeno, en forma idéntica o bien en forma diferente, es decirun átomo de halógeno que es independiente del otro. Particularmente, dicho átomo de halógeno es F. Dicho grupo haloalquilo C1-C4 es, por ejemplo, -CF3, -CHF2, -CH2F, -CF2CF3, o -CH2CF3.
La expresión "alcoxi C1-C4" preferentemente designa a un grupo hidrocarbonado lineal o ramificado, saturado, monovalente de fórmula -O-alquilo, en la cual el término "alquilo" está definido anteriormente, por ejemplo un grupo metoxilo, etoxilo, n-propoxilo, iso-propoxilo, n-butoxilo, iso-butoxilo, tere-butoxilo o sec-butoxilo, o un isómero de los mismos.
La expresión "haloalcoxi C1-C4" preferentemente designa a un grupo alcoxi C1-C4 lineal o ramificado, saturado, monovalente, como se define anteriormente, en la cual uno o más de los átomos de hidrógeno se reemplazan, en forma idéntica o bien en forma diferente, por un átomo de halógeno. Particularmente, dicho átomo de halógeno es F. Dicho grupo haloalcoxi C1-C4 es, por ejemplo, -OCF3, -OCHF2, -OCH2F, -OCF2CF3, u -OCH2CF3.
La expresión "hidroxialquilo C1-C4" designa a un grupo hidrocarbonado lineal o ramificado, saturado, monovalente en la cual el término "alquilo C1-C4" está definido anteriormente, y en la cual uno o más átomos de hidrógeno se reemplaza por un grupo hidroxilo, por ejemplo un grupo hidroximetilo, 1-hidroxietilo, 2-hidroxietilo, 1,2-dihidroxietilo, 3hidroxipropilo, 2-hidroxipropilo, 2,3-dihidroxipropilo, 1,3-dihidroxipropan-2-ilo, 3-hidroxi-2-metil-propilo, 2-hidroxi-2-metil-propilo, 1 -hidroxi-2-metil-propilo.
La expresión "alcoxi Ci -C4-alquilo C1-C4" preferentemente designa a un grupo alquilo lineal o ramificado, saturado, monovalente, como se define anteriormente, en la cual uno o más de los átomos de hidrógeno se reemplaza, en forma idéntica o bien en forma diferente, por un grupo alcoxi C1-C4, como se define anteriormente, por ejemplo un grupo metoxialquilo, etoxialquilo, propiloxialquilo, iso-propoxialquilo, butoxialquilo, iso-butoxialquilo, ferc-butoxialquilo o secbutoxialquilo, en la cual la expresión "alquilo C1-C4" está definido anteriormente, o un isómero de los mismos.
La expresión "cicloalquilo C3-C6" designa a un anillo hidrocarbonado saturado, monovalente, mono o bicíclico que contiene 3, 4, 5 o 6 átomos de carbono ("cicloalquilo C3-C6"). Dicho grupo cicloalquilo C3-C6 es, por ejemplo, un anillo hidrocarbonado monocíclico, por ejemplo un ciclopropilo, ciclobutilo, ciclopentilo o ciclohexilo, o un anillo hidrocarbonado bicíclico.
La expresión "heterocicloalquilo de entre 4 y 6 miembros" o "anillo heterocíclico de entre 4 y 6 miembros", designa a un anillo hidrocarbonado saturado, monovalente, mono o bicíclico que contiene 3, 4 o 5 átomos de carbono, y uno o más grupos que contienen heteroátomos que se seleccionan de C(=O), O, S, S(=O), S(=O)2, NH, NRa , en la cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6; en la cual es posible para dicho grupo heterocicloalquilo estar unido al resto de la molécula a través de cualquiera de los átomos de carbono o, si está presente, el átomo de nitrógeno.
Particularmente, dicho heterocicloalquilo puede contener 4 o 5 átomos de carbono, y uno o más de los grupos que se mencionaron precedentemente que contienen heteroátomos (un "heterocicloalquilo de entre 5 y 6 miembros").
Particularmente, sin estar limitados a ello, dicho heterocicloalquilo puede ser un anillo de 4 miembros, tal como azetidinilo, oxetanilo, o un anillo de 5 miembros, tal como tetrahidrofuranilo, dioxolinilo, pirrolidinilo, imidazolidinilo, pirazolidinilo, pirrolinilo, o un anillo de 6 miembros, tal como tetrahidropiranilo, piperidinilo, morfolinilo, ditianilo, tiomorfolinilo, piperazinilo, o tritianilo, por ejemplo. Opcionalmente, dicho heterocicloalquilo puede estar benzo fusionado.
El término "heteroarilo" se interpreta como preferentemente designando a un sistema de anillo aromático monovalente, monocíclico, bicíclico o tricíclico que tiene 5, 6, 7, 8, 9, 10, 11, 12, 13 o 14 átomos anulares (un grupo "heteroarilo" de entre 5 y 14 miembros), en particular 5, 6, 9 o 10 átomos anulares, y el cual contiene por lo menos un heteroátomo que puede ser idéntico o diferente, en la cual dicho átomo es uno tal como oxígeno, nitrógeno o azufre. Además dicho sistema anular puede estar benzocondensado. Particularmente, el heteroarilo se selecciona de tienilo, furanilo, pirrolilo, oxazolilo, tiazolilo, imidazolilo, pirazolilo, isoxazolilo, isotiazolilo, oxadiazolilo, triazolilo, tiadiazolilo, tia-4H-pirazolilo, y venzo derivados de los mismos, tales como, por ejemplo, benzofuranilo, benzotienilo, benzoxazolilo, bencisoxazolilo, bencimidazolilo, benzotriazolilo, indazolilo, indolilo, isoindolilo; o piridinilo, piridazinilo, pirimidinilo, pirazinilo, triazinilo, y benzo derivados de los mismos, tales como, por ejemplo, quinolinilo, quinazolinilo, isoquinolinilo; o azocinilo, indolizinilo, purinilo, y benzo derivados de los mismos; o cinolinilo, ftalazinilo, quinazolinilo, quinoxalinilo, naftpiridinilo, pteridinilo, carbazolilo, acridinilo, fenazinilo, fenotiazinilo, fenoxazinilo, xantenilo o oxepinilo.
En general, y a menos que se indique otra cosa diferente, los radicales heteroarílicos incluyen a todas las formas isoméricas posibles de los mismos, por ejemplo los isómeros posicionales de los mismos. Por lo tanto, para algunos ejemplos ilustrativos no restrictivos, el término piridilo incluye a piridin-2-ilo, piridin-3-ilo y piridin-4-ilo; o el término tienilo incluye a tien-2-ilo y tien-3-ilo. Preferentemente, el grupo heteroarilo es un grupo piridilo.
Como se mencionó precedentemente, dicho anillo que contiene átomos de nitrógeno puede estar parcialmente insaturado, es decir el mismo puede contener uno o más dobles enlaces, tales como, sin estar limitados a ello, un anillo 2,5-dihidro-1H-pirrolilo, 4H-[1,3,4]tiadiazinilo, 4,5-dihidrooxazolilo, o 4H-[1,4]tiazinilo, por ejemplo, o el mismo puede estar venzo fusionado, tal como, sin estar limitados a ello, un anillo dihidroisoquinolinilo, por ejemplo.
El término "C1-C4", tal como se usa a lo largo de este documento, por ejemplo en el contexto de la definición de "alquilo C1-C4", "haloalquilo C1-C4", "alcoxi C1-C4", o "haloalcoxi C1-C4" designa a un grupo alquilo que tiene un número finito de átomos de carbono entre 1 y 4, es decir 1, 2, 3 o 4 átomos de carbono. Además, ha de comprenderse que dicho término "C1-C4" debe interpretarse que incluye a cualquier subrango comprendido dentro del mismo, por ejemplo C1-C4 , C2-C4 , C3-C4 , C1-C2 , C1-C3 , en particular C1-C2 , C1-C3 , C1-C4, en el caso de "haloalquilo C1-C6" o "haloalcoxi C1-C4" aún más en particular C1-C2.
Además, tal como se usa en el presente documento, el término "C3-C6", tal como se usa a lo largo de este documento, por ejemplo en el contexto de la definición de "cicloalquilo C3-C6", designa a un grupo cicloalquilo que tiene un número finito de átomos de carbono entre 3 y 6, es decir 3, 4, 5 o 6 átomos de carbono. Además, ha de comprenderse que dicho término "C3-C6" debe interpretarse que incluye a cualquier subrango comprendido dentro del mismo, por ejemplo C3-C6 , C4-C5 , C3-C5 , C3-C4 , C4-C6, C5-C6 ; en particular C3-C6.
El grupo R9R10N-C(O)- incluye, por ejemplo, a -C(O)NH2, -C(O)N(H)CH3, -C(O)N(CH3)2, -C(O)N(H)CH2CHa, -C(O)N(CH3)CH2CH3 o -C(O)N(CH2CH3)2.
El grupo R9R10N- incluye, por ejemplo, a -NH2, -N(H)CH3, -N(CH3)2, -N(H)CH2CH3, y -N(CH3)CH2CH3. En el caso de R9R10N-, cuando R9 y R10 junto con el átomo de nitrógeno al que los mismos están unidos forman un anillo heterocíclico de entre 4 y 6 miembros que contiene nitrógeno, en en el cual dicho anillo de manera opcional contiene un heteroátomo adicional seleccionado de O, NH, NRa en la cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6, en particular un CH3, o S y estando sustituido de manera opcional, entre una y tres veces, en forma independiente entre sí, con halógeno o alquilo C1-C4, en particular un CH3.
El término "sustituido" significa que uno o más hidrógenos sobre el átomo designado se reemplaza por una selección dentro del grupo indicado, con la condición de que la valencia normal del átomo designado bajo las circunstancias del caso, no se vea excedida, y que la sustitución resulte en un compuesto estable. Las combinaciones de sustituyentes y/o variables solo están permitidas si dichas combinaciones resultan en compuestos estables.
La expresión "sustituido de manera opcional " significa una sustitución opcional con los grupos, radicales o porciones especificadas.
Un sustituyente de sistema anular designa a un sustituyente unido a un sistema anular aromático o no aromático que, por ejemplo, reemplaza a un hidrógeno disponible del sistema anular.
Tal como se usa en el presente documento, la expresión "uno o más", por ejemplo en la definición de los sustituyentes de los compuestos de fórmulas generales de la presente invención, designa a "uno, dos, tres, cuatro o cinco, en particular uno, dos, tres o cuatro, más en particular uno, dos o tres, incluso más en particular uno o dos".
La invención también incluye a todas las variantes isotópicas adecuadas de un compuesto de la invención. Una variante isotópica de un compuesto de la invención está definida como una en la cual por lo menos un átomo se reemplaza por un átomo que tiene el mismo número atómico pero una masa atómica diferente de la masa atómica que usualmente o predominantemente se halla en la naturaleza. Los ejemplos de isótopos que se pueden incorporar en un compuesto de la invención incluyen a los isótopos de hidrógeno, carbono, nitrógeno, oxígeno, fósforo, azufre, flúor, cloro, bromo y yodo, tales como 2H (deuterio), 3H (tritio), 11C, 13C, 14C, 15N, 17O, 18O, 32P, 33P, 18F, 36Cl, 82Br, 123I, 124I, 125I, 129I e 131I, respectivamente. Ciertas variantes isotópicas de un compuesto de la invención, por ejemplo, aquellas en las cuales se incorporan uno o más isótopos radiactivos tales como 3H 14C, son útiles en estudios de distribución tisular de fármacos y/o sustratos. El tritio y el carbono-14, es decir, 14C, son isótopos que en particular se prefieren por su facilidad de preparación y capacidad de detección. Además, la sustitución con isótopos tales como deuterio puede dar ciertas ventajas terapéuticas que son el resultado de una mayor estabilidad metabólica, por ejemplo, mayor vida media in vivo o menores requerimientos de dosificación, y por lo tanto se puede preferir en algunas circunstancias. Las variantes isotópicas de un compuesto de la invención en general se pueden preparar mediante procedimientos convencionales conocidos para las personas con experiencia en la materia, tales como mediante los procedimientos ilustrativos o mediante las preparaciones que se describen en los ejemplos más adelante, usando las variantes isotópicas apropiadas de los reactivos adecuados.
Cuando en el presente documento se usa la forma en plural de las palabras compuestos, sales, polimorfos, hidratos, solvatos y similares, esto también incluye a cualquier compuesto, sal, polimorfo, isómero, hidrato o solvato individual, o similares.
Como "compuesto estable" o "estructura estable" se designa a un compuesto que es lo suficientemente robusto para sobrevivir durante el aislamiento hasta un grado útil de pureza en una mezcla de reacción, y a la formulación en un agente terapéutico eficaz.
Los compuestos de esta invención pueden contener uno o más centros asimétricos, dependiendo de la localización y la naturaleza de los diversos sustituyentes deseados. Los átomos de carbono asimétricos pueden estar presentes en la configuración (R) o (S), resultando en mezclas racémicas en el caso de un único centro asimétrico, en el mezclas diasteroisoméricas en el caso de múltiples centros asimétricos. En ciertos casos, también puede haber asimetría debido a una rotación restringida alrededor de un enlace dado, por ejemplo, el enlace central que une dos anillos aromáticos sustituidos de los compuestos especificados.
Los sustituyentes de un anillo también pueden estar presentes en forma cis o trans. Se pretende que todas dichas configuraciones (incluyendo a los enantiómeros y diasteroisómeros), estén incluidas dentro del alcance de la presente invención.
Los compuestos preferidos son aquellos que producen la actividad biológica más deseable. También se incluyen dentro del alcance de la presente invención las formas separadas, puras o parcialmente purificadas de isómeros y estereoisómeros o mezclas racémicas o diasteroisoméricas de los compuestos de esta invención. La purificación y separación de dichos materiales se puede llevar a cabo mediante técnicas estándares conocidas en la materia.
Los isómeros ópticos pueden obtenerse por resolución de las mezclas racémicas de acuerdo a procedimientos convencionales, por ejemplo, mediante la formación de sales diasteroisoméricas usando un ácido o base ópticamente activa o la formación de diasteroisómeros covalentes. Los ejemplos de ácidos apropiados son el ácido tartárico, diacetiltartárico, ditoluoiltartárico y camforsulfónico. Las mezclas de diasteroisómeros se pueden separar en sus diasteroisómeros individuales en base a sus diferencias físicas y/o químicas por procedimientos conocidos en la
materia, por ejemplo, por cromatografía o por cristalización fraccional. Las bases o ácidos ópticamente activos se liberan después de las sales diasteroisoméricas separadas. Un procedimiento diferente para la separación de isómeros ópticos implica el uso de cromatografía quiral (por ejemplo, columnas de HPLC quiral), con o sin derivatización convencional, óptimamente elegida para maximizar la separación de los enantiómeros. Las columnas de HPLC quiral adecuadas son fabricadas por Daicel, por ejemplo, Chiracel OD y Chiracel OJ entre muchas otras, todas las cuales se pueden seleccionar de forma rutinaria. También son útiles las separaciones enzimáticas, con o sin derivatización. Los compuestos ópticamente activos de esta invención se pueden obtener de forma similar por síntesis quirales usando materiales de partida ópticamente activos.
Con el objetivo de limitar los diferentes tipos de isómeros entre sí, se hace referencia a las Reglas de la IUPAC Sección E (Pure Appl Chem 45, 11-30, 1976).
La presente invención incluye todos los posibles estereoisómeros de los compuestos de la presente invención como estereoisómeros individuales, o como cualquier mezcla de dichos estereoisómeros, por ejemplo isómeros R o S, o isómeros E o Z, en cualquier proporción. El aislamiento de un estereoisómero individual, por ejemplo un enantiómero individual o un diasteroisómero individual, de un compuesto de la presente invención se puede conseguir mediante cualquier procedimiento adecuado del estado de la técnica, tal como cromatografía, especialmente cromatografía quiral, por ejemplo.
Además, los compuestos de la presente invención pueden existir como tautómeros. Por ejemplo, cualquier compuesto de la presente invención que contenga una porción de pirazol como grupo heteroarilo, por ejemplo, puede existir como un tautómero 1H, o un tautómero 2H, o incluso como una mezcla de cualquier cantidad de dos tautómeros, o una porción de triazol por ejemplo puede existir como un tautómero 1H, un tautómero 2H, o un tautómero 4H, o incluso como una mezcla de cualquier cantidad de dichos tautómeros 1H, 2H y 4H, a saber:
La presente invención incluye todos los posibles tautómeros de los compuestos de la presente invención como tautómeros individuales, o como cualquier mezcla de dichos tautómeros, en cualquier proporción.
Además, los compuestos de la presente invención pueden existir como N-óxidos, que se definen como aquellos en los cuales por lo menos un nitrógeno de los compuestos de la presente invención está oxidado. La presente invención incluye todos los posibles N-óxidos.
La presente invención también se relaciona con formas útiles de los compuestos desvelados en el presente documento, tales como metabolitos, hidratos, solvatos, profármacos, sales, en particular sales farmacéuticamente aceptables, y coprecipitados.
Los compuestos de la presente invención pueden existir como un hidrato, o como un solvato, en los que los compuestos de la presente invención contienen disolventes polares, en particular agua, metanol o etanol por ejemplo, como elemento estructural del entramado cristalino de los compuestos. La cantidad de disolventes polares, en particular agua, puede estar en una proporción estequiométrica o no estequiométrica. En el caso de los solvatos estequiométricos, por ejemplo un hidrato, son posibles hemi, (semi), mono, sesqui, di, tri, tetra, penta, etc. solvatos o hidratos, respectivamente. La presente invención incluye a todos dichos hidratos o solvatos.
Además, los compuestos de la presente invención pueden existir en forma libre, por ejemplo como base libre, o como ácido libre, o como un zwitterión, o pueden existir en la forma de sal. Dicha sal puede ser cualquier sal, ya sea una sal de adición orgánica o bien inorgánica, en particular cualquier sal de adición orgánica o inorgánica farmacéuticamente aceptable usada convencionalmente en la farmacia.
La expresión "sal farmacéuticamente aceptable " se refiere a una sal de adición ácida inorgánica u orgánica relativamente no tóxica de un compuesto de la presente invención. Por ejemplo, véase S. M. Berge, y col. "Pharmaceutical Salts," J. Pharm. Sci. 1977, 6 6 , 1-19.
Una sal farmacéuticamente aceptable adecuada de los compuestos de la presente invención puede ser, por ejemplo, una sal de adición ácida de un compuesto de la presente invención que porta un átomo de nitrógeno, en una cadena o en un anillo, por ejemplo, que es suficientemente básico, tal como una sal de adición ácida con un ácido inorgánico, tal como ácido clorhídrico, bromhídrico, yodhídrico, sulfúrico, bisúlfurico, fosfórico, o nítrico, por ejemplo, o con un ácido orgánico, tal como ácido fórmico, acético, acetoacético, pirúvico, trifluoroacético, propiónico, butítico, hexanoico, heptanoico, undecanoico, láurico, benzoico, salicílico, 2-(4-hidroxibenzoil)-benzoico, camfórico, cinámico,
ciclopentanopropiónico, diglucónico, 3-hidroxi-2-naftoico, nicotínico, pamoico, pectínico, persulfúrico, 3-fenilpropiónico, pícrico, piválico, 2-hidroxietanesulfonato, itacónico, sulfámico, trifluorometanesulfónico, dodecilsulfúrico, etanosulfónico, bencenosulfónico, para-toluenosulfónico, metanosulfónico, 2-naftalenosulfónico, naftalinodisulfónico, camforsulfónico, cítrico, tartárico, esteárico, láctico, oxálico, malónico, succínico, málico, adípico, algínico, maleico, fumárico, D-glucónico, mandélico, ascórbico, glucoheptanoico, glicerofosfórico, aspártico, sulfosalicílico, hemisulfúrico, o tiocciánico, por ejemplo.
Además, otra sal farmacéuticamente aceptable adecuada de un compuesto de la presente invención que es suficientemente ácida, es una sal de metal alcalino, por ejemplo una sal de sodio o potasio, una sal de metal alcalino térreo, por ejemplo una sal de calcio o magnesio, una sal de amonio o una sal con una base orgánica que da un catión fisiológicamente aceptable, por ejemplo una sal con N-metil-glucamina, dimetil-glucamina, etil-glucamina, lisina, diciclohexilamina, 1,6-hexadiamina, etanolamina, glucosamina, sarcosina, serinol, tris-hidroxi-metil-aminometano, aminopropandiol, base de sovak, 1-amino-2,3,4-butantriol. Además, los grupos que contienen nitrógeno básico se pueden hacer cuaternarios con dichos agentes como haluros de alquilo menores tales como cloruros, bromuros o yoduros de metilo, etilo, propilo, y butilo; sulfatos de dialquilo como sulfato de dimetilo, dietilo, y dibutilo; y sulfatos de diamilo, haluros de cadena larga tales como cloruros, bromuros y yoduros de decilo, laurilo, miristilo y estrearilo, haluros de aralquilo como bromuros de bencilo y fenetilo y otros.
Las personas con experiencia en la materia reconocerán además que las sales de adición ácida de los compuestos reivindicados se pueden preparar por reacción de los compuestos con el ácido inorgánico u orgánico apropiado a través de cualquiera de varios procedimientos conocidos. Como alternativa, las sales de metales alcalinos y alcalinotérreos de los compuestos ácidos de la invención se preparan por reacción de los compuestos de la invención con la base apropiada mediante una variedad de procedimientos conocidos.
La presente invención incluye todas las posibles sales de los compuestos de la presente invención como sales individuales, o como cualquier mezcla de dichas sales, en cualquier proporción.
En el presente documento, en particular en la Sección Experimental, para la síntesis de los intermedios y los ejemplos de la presente invención, cuando se menciona un compuesto como una forma de sal con la correspondiente base o ácido, la composición estequiométrica exacta de dicha forma de sal, tal como se obtiene por el procedimiento respectivo de preparación y/o purificación, es, en la mayoría de los casos, desconocida.
A menos que se especifique otra cosa, los sufijos de los nombre químicos o las fórmulas estructurales tales como "clorhidrato", "trifluoroacetato", "sal de sodio ", o "x HCl", "x CF3COOH", "x Na+", por ejemplo, no han de interpretarse como una especificación estequiométrica, sino solamente como una forma de sal.
Esto se aplica en forma análoga a los casos en los cuales los intermedios de síntesis o los compuestos ejemplificativos o las sales de los mismos se han obtenido, mediante los procedimientos de preparación y/o purificación descritos, como solvatos, tales como hidratos con (si está definido) una composición estequiométrica desconocida.
Las sales incluyen a las sales insolubles en agua, en particular, a las sales solubles en agua.
Más aún, la invención abarca a los derivados de los compuestos de fórmula (I) y las sales de los mismos que se convierten a un compuesto de fórmula (I) o una sal del mismo en un sistema biológico (bioprecursores o profármacos). Dicho sistema biológico es por ejemplo un organismo mamífero, en particular un sujeto humano. El bioprecursor, por ejemplo, se convierte al compuesto de fórmula (I) o una sal del mismo mediante procedimientos metabólicos.
Más aún, la presente invención incluye a todas las formas cristalinas, o polimorfos, de los compuestos de la presente invención, ya sea como polimorfos individuales, o como una mezcla de más de un polimorfo, en cualquier proporción.
En el contexto de las propiedades de los compuestos de la presente invención el término "perfil farmacocinético" designa a un parámetro individual o a una combinación de los mismos incluyendo a la permeabilidad, biodisponibilidad, exposición, y parámetros farmacodinámicos tales como duración, o magnitud de efecto farmacológico, medido en un experimento adecuado. Los compuestos con mejores perfiles farmacocinéticos pueden, por ejemplo, usarse en menor dosis para conseguir el mismo efecto, pueden conseguir una duración mayor de su acción, o pueden conseguir una combinación de ambos efectos.
Ahora se ha hallado, y esto constituye la base de la presente invención, que dichos compuestos de la presente invención tienen propiedades sorprendentes y ventajosas.
En particular, se ha hallado sorprendentemente que los compuestos de acuerdo a la presente invención son activos en forma eficaz como antagonista o modulador alostérico negativo de P2X4.
Un modulador alostérico es una sustancia que influencia directamente (modula) los efectos de un agonista o agonista inverso sobre una proteína blanco, por ejemplo un receptor. Los moduladores alostéricos se unen a un sitio diferente que el sitio de unión de un agonista ortostérico. Usualmente los mismos inducen un cambio conformacional dentro de la estructura de la proteína. Un modulador negativo (NAM) reduce los efectos del ligando ortostérico, pero es inactivo en ausencia del ligando ortostérico.
Utilidad comercial e indicaciones médicas
Como se mencionó precedentemente, sorprendentemente se ha hallado que los compuestos de la presente invención son activos en forma eficaz como antagonista o como modulador alostérico negativo de P2X4.
Un compuesto de acuerdo a la invención se usa para la fabricación de un medicamento.
Un aspecto adicional de la invención es el uso de los compuestos de acuerdo a la fórmula (I), (Ia) o (Ib) para el tratamiento o profilaxis de una enfermedad
Más aún, la invención se relaciona con un compuesto de fórmula general (I) (Ia) o (Ib), o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, como se describe y se define en el presente documento, para usar en el tratamiento o profilaxis de una enfermedad.
La invención además se relaciona con un procedimiento para usar los compuestos de fórmula general (I) (Ia) o (Ib) o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero para tratar trastornos y enfermedades en mamíferos y en humanos, la cual incluye pero no se limita a:
• enfermedades, afecciones y trastornos genitourinarias, gastrointestinales, respiratorias, proliferativas y relacionadas con el dolor;
• enfermedades ginecológicas incluyendo a dismenorrea primaria y secundaria, dispareunia, vulvodinia, endometriosis y adenomiosis; dolor asociado con endometriosis; síntomas asociados con endometriosis, en las que dichos síntomas son en particular dolor abdominal, dismenorrea, dispareunia, disuria, disquecia o hipersensibilidad pélvica;
• estados patológicos del tracto urinario incluyendo a aquellos asociados con obstrucción de salida de vejiga;
afecciones de incontinencia urinaria tales como capacidad de vejiga reducida, frecuencia incrementada de micción, incontinencia urgente, incontinencia por estrés, o hiperreactividad de vejiga; hipertrofia prostática benigna; hiperplasia prostática; prostatitis; hiperreflexia de detrusor; vejiga urinaria sobrerreactiva y síntomas relacionados con vejiga urinaria sobrerreactiva en las que dichos síntomas son en particular frecuencia urinaria incrementada, nocturia, urgencia urinaria o incontinencia urgente; hipersensibilidad pélvica; uretritis; prostatitis; prostatodinia; cistitis, en particular cistitis intersticial; hipersensibilidad de vejiga idiopática; enfermedad renal como síndrome de hiperprostaglandina E, síndrome clásico de Bartter;
• cáncer, dolor relacionado con cáncer y caquexia por cáncer;
• epilepsia, ataques parciales y generalizados;
• trastornos respiratorios incluyendo asma, enfermedad pulmonar obstructiva crónica, fibrosis pulmonar, fibrosis intersticial pulmonar, broncoespasmo, tos crónica, tos crónica refractaria, tos crónica idiopática;
• trastornos gastrointestinales incluyendo síndrome de intestino irritable (IBS), enfermedad de intestino inflamatoria (IBD), cólico biliar y otros trastornos biliares, cólico renal, IBS con diarrea predominante, reflujo gastroesofágico, distensión gastrointestinal, enfermedad de Crohn y semejantes;
• trastornos de hígado graso, en particular NASH (esteatohepatitis no alcohólica); enfermedades fibróticas incluyendo fibrosis pulmonar, fibrosis cardiaca, fibrosis renal y fibrosis de otros órganos; síndrome metabólico incluyendo, por ejemplo, resistencia a la insulina, hipertensión, hipertensión refractaria, dislipoproteinemia y obesidad, diabetes mellitus, en particular diabetes de tipo II, infarto de miocardio; aterosclerosis; trastornos lipídicos;
• trastornos neurodegenerativos tales como mal de Alzheimer, esclerosis múltiple, mal de Parkinson, isquemia de cerebro, lesión de cerebro traumático; daño al cordón espinal;
• prurito.
• trastornos cardiacos incluyendo daño por isquemia reperfusión, isquemia cardiaca,
La presente invención además se relaciona con un procedimiento para usar los compuestos de fórmula general (I) (Ia) o (Ib) o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, para tratar trastornos y enfermedades asociadas con el dolor en mamíferos, la cual incluye pero no se limita a
• enfermedades o trastornos asociados al dolor seleccionados del grupo que consiste en hiperalgesia, alodinia, trastornos funcionales del intestino (tal como el síndrome de intestino irritable), gota, artritis (tal como osteoartritis, artritis reumatoide y espondilitis anquilosante), síndrome de boca ardiente, quemaduras, migraña o dolores de cabeza, lesión nerviosa, lesión traumática de los nervios, lesiones postraumáticas (incluyendo fracturas y lesiones deportivas), neuritis, neuralgias, intoxicaciones, lesión isquémica, cistitis intersticial, cáncer, neuralgia del trigémino, neuropatía de fibras pequeñas, neuropatía diabética, artritis crónica y neuralgias relacionadas, neuropatía inducida por el tratamiento del VIH y por el VIH, prurito; alteración de la cicatrización de heridas y enfermedades del esqueleto como la degeneración de las articulaciones;.
Más aún, la presente invención se relaciona con un procedimiento para usar los compuestos de fórmula general (I) (Ia) o (Ib) o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido,
tautómero o estereoisómero en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, para tratar trastornos y enfermedades en mamíferos y en humanos, que están asociadas con dolor o síndromes de dolor que son en particular:
• síndromes de dolor (incluyendo hiperalgesia, alodinia, dolor agudo, crónico, inflamatorio y neuropático), preferentemente dolor inflamatorio, dolor lumbar, dolor quirúrgico, dolor visceral, dolor dental, periodontitis, dolor premenstrual, dolor asociado con endometriosis, dolor asociado con enfermedades fibróticas, dolor central, dolor debido al síndrome de boca ardiente, dolor debido a quemaduras, dolor debido a migraña, cefaleas en racimo, dolor debido a lesiones de nervios, dolor debido a neuritis, neuralgias, dolor debido a envenenamiento, dolor debido a una lesión isquémica, dolor debido a cistitis intersticial, dolor por cáncer, dolor debido infecciones virales, parasitarias o bacterianas, dolor debido a lesiones de nervios traumáticas, dolor debido a lesiones postraumáticas (incluyendo fracturas y lesiones deportivas), dolor debido a neuralgia del trigémino, dolor asociado con neuropatías de fibras pequeñas, dolor asociado con una neuropatía diabética, neuralgia postherpética, dolor lumbar crónico, dolor de cuello, dolor de miembro fantasma, síndrome de dolor pélvico, dolor pélvico crónico, dolor de neuroma, síndrome de dolor regional complejo, fibromialgia, trastornos miofasciales, dolor asociado con una distensión gastrointestinal, dolor artrítico crónico y neuralgias relacionadas, y dolor asociado con cáncer, dolor resistente a morfina, dolor asociado con una quimioterapia, Neuropatía por VIH y neuropatía inducida por el tratamiento del VIH; y dolor asociado con enfermedades o trastornos seleccionados del grupo que consiste en dolor abdominal tales como trastornos funcionales del intestino, síndrome de intestino irritable, enfermedad de intestino irritable, seleccionados del grupo de artritis (tales como osteoartritis, artritis reumatoide y espondilitis anquilosante).
Por lo tanto se espera que los compuestos de la invención sean útiles en el tratamiento de inflamación. Se considera entonces que el término "inflamación" también incluirá a cualquier enfermedad, trastorno o afección inflamatoria per se, cualquier afección a la cual está asociado un componente inflamatorio y/o cualquier afección caracterizada por una inflamación como síntoma, incluyendo, entre otros, una inflamación aguda, crónica, ulcerosa, fibrótica, alérgica y enfermedades autoinmunes; reacciones inmunes debido a hipersensibilidad, ingreso de cuerpos extraños, lesiones físicas, necrosis, endometriosis, y otras formas de inflamación conocidas por los especialistas en la materia. El término incluye también, a los efectos de esta invención, el dolor inflamatorio, el dolor en general y/o fiebre. Los compuestos de la presente invención también pueden ser útiles en el tratamiento de infecciones virales (por ejemplo, gripe, resfriado, Herpes zoster, hepatitis C común y VIH), infecciones bacterianas, infecciones fúngicas, procedimientos quirúrgicos o dentales, malignidades (por ejemplo melanoma, cáncer de mama, cáncer de colon, cáncer de pulmón y cáncer de próstata), artritis, osteoartritis, artritis juvenil, artritis reumatoide, artritis reumatoide de inicio juvenil, fiebre reumática, espondilitis anquilosante, enfermedad de Hodgkin, lupus eritematoso sistémico, vasculitis, pancreatitis, nefritis, bursitis, conjuntivitis, iritis, escleritis, uveítis, cicatrización de heridas, dermatitis, eczema, accidente cerebrovascular, diabetes mellitas, enfermedades autoinmunes, trastornos alérgicos, rinitis, úlceras, colitis ulcerosa leve a moderadamente activa, poliposis adenomatosa familiar, enfermedad cardíaca coronaria, sarcoidosis y cualquier otra enfermedad con un componente inflamatorio.
Los compuestos de la invención también se espera que sean útiles en el tratamiento de afecciones asociadas o que causan pérdida ósea en un sujeto. Las afecciones que se pueden mencionar en este sentido incluyen a osteoporosis, osteoartritis, enfermedad de Paget y/o enfermedades periodontológicas.
Sobre la base de la actividad antagonista contra P2X4 los compuestos de acuerdo a la invención son útiles para el alivio del dolor, fiebre e inflamación de una variedad de afecciones incluyendo fiebre reumática, síntomas asociados con la gripe u otras infecciones virales, resfriado, dolor lumbar y de cuello, dismenorrea, cefalea, migraña (tratamiento agudo y profiláctico), dolor de muelas, esguinces y distensiones, miositis, neuralgia, sinovitis, artritis, incluyendo artritis reumatoide, artritis reumatoide juvenil, enfermedades degenerativas de las articulaciones (osteoartritis), gota aguda y espondilitis anquilosante, síndromes de dolor musculoesquelético agudo, subagudo y crónico, tales como bursitis, quemaduras, heridas y dolor tras cirugía (dolor postoperatorio) y procedimientos dentales, así como el tratamiento preventivo del dolor quirúrgico. El dolor puede ser dolor leve, dolor moderado, dolor intenso, dolor musculoesquelético, síndrome de dolor regional complejo, dolor neuropático, dolor lumbar tal como dolor visceral agudo, neuropatías, traumatismo agudo, estados de dolor de mononeuropatía inducidos por una quimioterapia, estados de dolor por polineuropatía (como neuropatía periférica por diabetes y/o neuropatía inducida por una quimioterapia), estados de dolor de neuropatía autónomos, lesión del sistema nervioso periférico (PNS) o lesión del sistema nervioso central (SNC) o enfermedad relacionada con los estados de dolor, poliradiculopatías de tipo cervical, lumbar o ciático, síndrome de cauda equina, síndrome piriforme, paraplejia, tetraplejia, estados de dolor relacionados con varias afecciones de polineuritis subyacentes de diversas infecciones, lesiones químicas, exposición a radiación, enfermedad o deficiencia de afecciones subyacentes (tales como beriberi, deficiencias vitamínicas, hipotiroidismo, porfiria, cáncer, VIH, enfermedades autoinmunes como esclerosis múltiple y lesión de la médula espinal, fibromialgia, lesión de los nervios, isquemia, neurodegeneración, apoplejía, dolor post ictus, trastornos inflamatorios, esofagitis, trastorno de reflujo gastroeosofágico (ERGE), síndrome de intestino irritable, enfermedad inflamatoria intestinal, vejiga hiperactiva, hipersensibilidad pélvica, incontinencia urinaria, cistitis, estómago, úlcera duodenal, dolor muscular, dolor debido a cólicos y dolor referido. Los compuestos de la presente invención también pueden ser útiles para el tratamiento o la prevención de artropatía hemofílica y mal de Parkinson.
La invención de relaciona también se relaciona con un procedimiento para usar los compuestos de fórmula general (I) (Ia) o (Ib) o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido,
tautómero o estereoisómero en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, para tratar afecciones que se pueden tratar mediante la inhibición de la contracción de músculo liso inducida por prostanoide a través de la prevención de la síntesis de los prostanoides contráctiles y por lo tanto puede ser de relevancia para usar en el tratamiento de dismenorrea, trabajo de parte prematuro y asma.
La presente invención se relaciona con un procedimiento para usar los compuestos de fórmula general (I) (Ia) o (Ib) o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, para tratar cáncer y trastornos hiperproliferativos. Los trastornos hiperproliferativos incluyen, a título enunciativo no taxativo, por ejemplo: psoriasis, queloides, y otras hiperplasias que afectan a la piel, hiperplasia prostática benigna (BPH), tumores sólidos, tales como cánceres de mama, tracto respiratorio, cerebro, órganos reproductivos, tracto digestivo, tracto urinario, ojo, hígado, piel, cabeza y cuello, tiroides, paratiroides y sus metástasis distantes. Aquellos trastornos también incluyen a linfomas, sarcomas, y leucemias.
Los ejemplos de cánceres de mama incluyen, a título enunciativo no taxativo, carcinoma ductal invasivo, carcinoma lobular invasivo, y carcinoma ductal in situ, y carcinoma lobular in situ.
Los ejemplos de cánceres del tracto respiratorio incluyen, a título enunciativo no taxativo, carcinoma de pulmón a células pequeñas y a células no pequeñas, así como también adenoma bronquial y blastoma pleuropulmonar.
Los ejemplos de cánceres de cerebro incluyen, a título enunciativo no taxativo, glioma de tallo cerebral e hipotalámico, astrocitoma cerebelar y cerebral, meduloblastoma, ependinoma, así como también tumor neuroectodérmico y pineal.
Los tumores de los órganos reproductivos masculinos incluyen, a título enunciativo no taxativo, cáncer de próstata y testicular.
Los tumores de los órganos reproductivos femeninos incluyen, a título enunciativo no taxativo, cáncer endometrial, cervical, ovárico, vaginal, y vulvar, así como también sarcoma del útero.
Los tumores del tracto digestivo incluyen, a título enunciativo no taxativo, canceres anal, de colon, colorrectal, esofágico, de vesícula biliar, gástrico, pancreático, rectal, de intestino delgado, y cánceres de glándulas salivales.
Los tumores del tracto urinario incluyen, a título enunciativo no taxativo, canceres de vejiga, de pene, de riñón, y de pelvis renal, de uréter, uretral y renal papilar humano.
Los cánceres de ojo incluyen, a título enunciativo no taxativo, a melanoma intraocular y retinoblastoma.
Los ejemplos de cánceres de hígado incluyen, a título enunciativo no taxativo, carcinoma hepatocelular (carcinomas de células hepáticas con o sin variante fibrolamelar), colangiocarcinoma (carcinoma de ducto biliar intrahepatico), y colangiocarcinoma hepatocelular mixto.
Los cánceres de piel incluyen, a título enunciativo no taxativo, carcinoma de células escamosas, sarcoma de Kaposi, melanoma maligno, cáncer de piel de células de Merkel, y cáncer de piel no melanómico.
Los cánceres cabeza y cuello incluyen, a título enunciativo no taxativo, cáncer laríngeo, hipofaríngeo, nasofaríngeo, orofaríngeo, cáncer de labios y de cavidad oral y células escamosas.
Los linfomas incluyen, a título enunciativo no taxativo, linfoma relacionado con SIDA, linfoma de no Hodgkin, linfoma cutáneo de células T, linfoma de Burkitt, enfermedad de Hodgkin, y linfoma del sistema nervioso central.
Los sarcomas incluyen, a título enunciativo no taxativo, sarcoma de tejido blando, osteosarcoma, histiocitoma fibroso maligno, linfosarcoma, y rabdomiosarcoma.
Las leucemias incluyen, a título enunciativo no taxativo, leucemia mieloide aguda, leucemia linfoblástica aguda, leucemia linfocítica crónica, leucemia mielogenosa crónica, y tricoleucemia.
Una forma de realización preferida de la presente invención se relaciona con un procedimiento para usar los compuestos de fórmula general (I) (Ia) o (Ib) o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, para tratar una enfermedad ginecológica, preferentemente dismenorrea, dispareunia, vulvodinia o endometriosis, dolor asociado con endometriosis, u otros síntomas asociados con endometriosis, en la que dichos síntomas son en particular dolor abdominal agudo y crónico, dismenorrea, dispareunia, disuria, o disquecia.
Otra forma de realización preferida de la presente invención se relaciona con un procedimiento para usar los compuestos de la presente invención, y con composiciones con los mismos, en el tratamiento de una enfermedad del tracto urinario, en particular vejiga hiperactiva o cistitis, preferentemente cistitis intersticial.
Otra forma de realización preferida de la presente invención se relaciona con un procedimiento para usar los
compuestos de la presente invención, y con composiciones con los mismos, en el tratamiento de un trastorno respiratorio, preferentemente tos, en particular una tos crónica.
Otra forma de realización preferida de la presente invención se relaciona con un procedimiento para usar los compuestos de la presente invención, y con composiciones con los mismos, en el tratamiento de trastornos neurodegenerativos, preferentemente daño isquémico de cerebro, daño al cordón espinal y esclerosis múltiple.
Otra forma de realización preferida de la presente invención se relaciona con un procedimiento para usar de fórmula general (I) (Ia) o (Ib) o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, para tratar artritis, en particular artritis reumatoide y espondilitis anquilosante (Burnstock y col., 2012 Pharmacol Rev. 64:834-868).
Todos estos trastornos han sido bien caracterizados en humanos, pero también existen con una etiología similar en otros mamíferos, y pueden tratarse administrando las composiciones farmacéuticas de la presente invención.
El término "tratar" o "tratamiento", según se estableció en todo este documento se usa de la manera convencional, por ejemplo, el manejo o cuidado de un sujeto con el propósito de combatir, aminorar, reducir, aliviar, mejorar la condición de, etc., de una enfermedad o trastorno, tal como una enfermedad ginecológica o una enfermedad asociada con proliferación indeseada como endometriosis o cáncer.
Preferentemente, las enfermedades tratadas con dicho procedimiento son trastornos ginecológicos, más preferentemente dismenorrea, dispareunia o endometriosis, dolor asociado con endometriosis, u otros síntomas asociados con endometriosis, en los que dichos síntomas son en particular dolor abdominal agudo o crónico, dismenorrea, dispareunia, disuria, o disquecia.
Otras enfermedades, que se pueden tratar con dicho procedimiento, son osteoartritis, neuropatía diabética, síndrome de boca ardiente, reflujo gastroesofágico, trastornos de migrañas, tos crónica, asma, prurito, enfermedad de intestino irritable, vejiga urinaria sobrerreactiva, hiperplasia prostática, cistitis intersticial.
Preferentemente, el procedimiento para tratar las enfermedades que se mencionaron previamente no se limita al tratamiento de dicha enfermedad sino que también incluye el tratamiento del dolor relacionado o asociado con dichas enfermedades.
Los compuestos de la presente invención se pueden usar en particular en terapia y prevención, es decir profilaxis, de una enfermedad, condición o trastorno genitourinario, gastrointestinal, respiratorio o relacionado con el dolor.
Composiciones farmacéuticas de los compuestos de la invención
Esta invención también se relaciona con composiciones farmacéuticas que contienen uno o más compuestos de la presente invención. Estas composiciones se pueden usar para conseguir el efecto farmacológico deseado mediante la administración a un paciente que lo necesite. Un paciente, para los propósitos de esta invención, es un mamífero, incluyendo a un humano, en necesidad de tratamiento para la condición o enfermedad particular.
Por lo tanto, la presente invención incluye composiciones farmacéuticas que comprenden un vehículo o auxiliar farmacéuticamente aceptable y una cantidad farmacéuticamente eficaz de un compuesto, o una sal del mismo, de la presente invención.
Otro aspecto de la invención es una composición farmacéutica que comprende una cantidad farmacéuticamente eficaz de un compuesto de fórmula (I) y un auxiliar farmacéuticamente aceptable para el tratamiento de una enfermedad mencionada previamente, especialmente para el tratamiento de tumores hematológicos, tumores sólidos y/o metástasis de los mismos.
Un vehículo o auxiliar farmacéuticamente aceptable es preferentemente un vehículo que es no tóxico e inocuo para un paciente a las concentraciones consistentes con la actividad eficaz del principio activo, de forma que cualquier efecto secundario asociado con el vehículo no vicia los efectos beneficiosos del principio activo. Los vehículos y auxiliares son todos los tipos de aditivos que ayudan a la composición para que sea adecuada para su administración.
Una cantidad farmacéuticamente eficaz de compuesto preferentemente es la cantidad que produce un resultado o que ejerce la influencia pretendida sobre la condición particular que se está tratando.
Los compuestos de la presente invención pueden administrarse con vehículos o auxiliares farmacéuticamente aceptables bien conocidos en la materia usando cualquier forma unitaria de dosificación eficaz convencional, incluyendo a preparaciones de liberación inmediata, lenta y a tiempo definido, por vía oral, parenteral, tópica, nasal, oftálmica, óptica, sublingual, rectal, vaginal, subcutánea, intrauterina y similares.
Para la administración oral, los compuestos se pueden formular en preparaciones sólidas o líquidas tales como cápsulas, píldoras, comprimidos, pastillas, grageas, mezclas fundidas, polvos, soluciones, suspensiones, o emulsiones, y se pueden preparar de acuerdo a procedimientos conocidos en la técnica de la fabricación de
composiciones farmacéuticas. Las formas de dosificación unitarias sólidas pueden ser una cápsula que puede ser del tipo ordinario recubierta con gelatina dura o blanda que contiene auxiliares, por ejemplo, tensioactivos, lubricantes, y rellenos inertes tales como lactosa, sacarosa, fosfato de calcio, y almidón de maíz.
En otra forma de realización, los compuestos de esta invención se pueden comprimir con bases convencionales para comprimidos tales como lactosa, sacarosa y almidón de maíz en combinación con aglutinantes tales como acacia, almidón de maíz o gelatina, agentes desintegrantes que tienen el objetivo de ayudar a la fragmentación y disolución del comprimido después de su administración, tal como almidón de papa, ácido algínico, almidón de maíz, y goma guar, goma tragacanto, acacia, lubricantes que mejoran la fluidez de la granulación del comprimido y que evitan la adhesión del material del comprimido a las superficies de las matrices y perforadores de comprimidos, por ejemplo talco, ácido esteárico, o estearato de magnesio, calcio o zinc, tinturas, agentes colorantes, y agentes saborizantes tales como menta, aceite de pirola, o saborizante de cereza, que tienen el objetivo de mejorar la calidad estética de los comprimidos y hacerlos más aceptables para los pacientes. Los excipientes adecuados para usar en las formas de dosificación líquidas orales incluyen a fosfato de dicalcio y diluyentes tales como agua y alcoholes, por ejemplo, etanol, alcohol bencílico, y polietilen alcoholes, ya sea con o bien sin el agregado de un agente tensioactivo, agente de suspensión o agente emulsionante farmacéuticamente aceptable. Pueden estar presentes varios otros materiales como recubrimientos o que modifican de alguna otra forma la forma física de la unidad de dosificación. Por ejemplo los comprimidos, píldoras o cápsulas se pueden recubrir con shellac, azúcar o ambos.
Los polvos y gránulos dispersables son adecuados para la preparación de una suspensión acuosa. Los mismos proveen el principio activo mezclado con un agente de dispersión o humectante, un agente de suspensión y uno o más conservantes. Los agentes de dispersión o humectantes y agentes de suspensión adecuados están ejemplificados por aquellos que se mencionaron anteriormente. También puede haber presentes otros excipientes, por ejemplo los agentes edulcorantes, saborizantes y colorantes descritos previamente.
Las composiciones farmacéuticas de esta invención también pueden estar en la forma de emulsiones de aceite en agua. La fase oleosa puede ser un aceite vegetal tal como parafina líquida o una mezcla de aceites vegetales. Los agentes emulsionantes adecuados pueden ser (1) gomas de origen natural tales como goma acacia y goma tragacanto, (2) fosfátidos de origen natural tales como poroto de soja y lecitina, (3) ésteres o ésteres parciales derivados de ácidos grasos y anhídridos de hexitol, por ejemplo, sorbitano monooleato, (4) productos de condensación de dichos ésteres parciales con óxido de etileno, por ejemplo, polioxietileno sorbitano monooleato. Las emulsiones también pueden contener agentes edulcorantes y saborizantes.
Las suspensiones oleosas se pueden formular por suspensión del principio activo en un aceite vegetal tal como, por ejemplo, aceite de Arachis, aceite de oliva, aceite de sésamo o aceite de coco, o en un aceite mineral tal como parafina líquida. Las suspensiones oleosas pueden contener un agente espesante tal como, por ejemplo, cera de abejas, parafina dura, o alcohol cetílico. Las suspensiones también pueden contener uno o más conservantes, por ejemplo, etil o n-propil p-hidroxibenzoato; uno o más agentes colorantes; uno o más agentes saborizantes; y uno o más agentes edulcorantes tales como sacarosa o sacarina.
Los jarabes o elixires se pueden formular con agentes edulcorantes tales como, por ejemplo, glicerol, propilenglicol, sorbitol o sacarosa. Dichas formulaciones también pueden contener un emoliente, y un conservante, tal como metil y propil parabenos y agentes saborizantes y colorantes.
Los compuestos de esta invención también se pueden administrar por vía parenteral, o sea, por vía subcutánea, intravenosa, intraocular, intrasinovial, intramuscular, o intraperitoneal, como dosificaciones inyectables del compuesto preferentemente en un diluyente fisiológicamente aceptable con un vehículo farmacéutico que puede ser un líquido o mezcla de líquidos estériles tales como agua, solución salina, dextrosa acuosa y soluciones de azucares relacionados, un alcohol tal como etanol, isopropanol, o alcohol hexadecílico, glicoles tales como propilenglicol o polietilenglicol, cetales de glicerol tales como 2,2-dimetil-1,1-dioxolano-4-metanol, éteres tales como poli(etileneglicol) 400, un aceite, un ácido graso, un éster de ácido graso o, un glicérido de ácido graso, o un glicérido de ácido graso acetilado, con o sin el agregado de un tensioactivo farmacéuticamente aceptable tal como un jabón o un detergente, agente de suspensión tal como pectina, carbómeros, metilcelulosa, hidroxipropilmetilcelulosa, o carboximetilcelulosa, un agente emulsionantes y otros adyuvantes farmacéuticos.
Los ejemplos de aceites que se pueden usar en las formulaciones parenterales de esta invención son los de petróleo, de origen animal, vegetal, o sintético, por ejemplo, aceite de maní, aceite de soja, aceite de sésamo, aceite de algodón, aceite de maíz, aceite de oliva, petrolato y aceite mineral. Los ácidos grasos adecuados incluyen a ácido oleico, ácido esteárico, ácido isoesteárico y ácido mirístico. Los ésteres de ácido graso adecuados son, por ejemplo, oleato de etilo y miristato de isopropilo. Los jabones adecuados incluyen a sales de ácidos grasos con metales alcalinos, amonio, y trietanolamina y los detergentes apropiados incluyen detergentes catiónicos, por ejemplo haluros de dimetil dialquil amonio, haluros de alquil piridinio, y acetatos de alquilamina; detergentes aniónicos, por ejemplo, sulfonatos de alquilo, arilo, y olefina, sulfatos de alquilo, olefina, éter, y monoglicéridos, y sulfosuccinatos; detergentes no iónicos, por ejemplo, óxidos de amina grasa, alcanolamidas de ácido graso, y copolímeros de poli(oxietilen-oxipropileno) u óxido de etileno u óxido de propileno; y detergentes anfotéricos, por ejemplo, alquil-beta-aminopropionatos, y sales de amonio cuaternario de 2-alquilimidazolina, así como también sus mezclas.
Las composiciones parenterales de esta invención típicamente contendrán entre aproximadamente 0,5 % y aproximadamente 25 % en peso del principio activo en solución. En forma ventajosa, también se pueden usar conservantes y soluciones amortiguadoras. Con el objetivo de minimizar o eliminar la irritación en el sitio de la inyección, dichas composiciones pueden contener un tensioactivo no iónico que tiene un equilibrio hidrófilo-lipófilo (HLB) preferentemente de entre aproximadamente 12 y aproximadamente 17. La cantidad de tensioactivo en dicha formulación preferentemente está en el rango entre aproximadamente 5% y aproximadamente 15% en peso. El tensioactivo puede ser un componente individual que tiene el HLB anterior, o puede ser una mezcla de dos o más componentes que tienen el HLB deseado.
Los ejemplos ilustrativos de tensioactivos usados en las formulaciones parenterales son de la clase de los ésteres de ácido graso de polietilen sorbitano, por ejemplo, sorbitano monooleato y los aductos de alto peso molecular de óxido de etileno con una base hidrofóbica, formados por la condensación de óxido de propileno con propilenglicol.
Las composiciones farmacéuticas pueden estar en la forma de suspensiones acuosas inyectables estériles. Dichas suspensiones se pueden formular de acuerdo a procedimientos conocidos usando agentes de dispersión o humectantes y agentes de suspensión adecuados tales como, por ejemplo, carboximetilcelulosa de sodio, metilcelulosa, hidroxipropilmetilcelulosa, alginato de sodio, polivinilpirrolidona, goma tragacanto y goma acacia; agentes de dispersión o humectantes que puede ser un fosfátido de origen natural tal como lecitina, un producto de condensación de un óxido de alquileno con un ácido graso, por ejemplo, polioxietilen estearato, un producto de condensación de óxido de etileno con un alcohol alifático de cadena larga, por ejemplo, heptadeca-etileneoxicetanol, un producto de condensación de óxido de etileno con un éster parcial derivado de un ácido graso y un hexitol tal como polioxietilen sorbitol monooleato, o un producto de condensación de un óxido de etileno con un éster parcial derivado de un ácido graso y un anhídrido de hexitol, por ejemplo polioxietilen sorbitano monooleato.
La preparación inyectable estéril también puede ser una solución o suspensión inyectable estéril en un diluyente o disolvente no tóxico parenteralmente aceptable. Los diluyentes y disolventes que se pueden emplear son, por ejemplo, agua, solución de Ringer, soluciones isotónicas de cloruro de sodio y soluciones isotónicas de glucosa. Además, convencionalmente se emplean aceites fijos estériles como disolventes o medios de suspensión. Para este propósito, se puede emplear cualquier aceite fijo blando incluyendo a mono o diglicéridos sintéticos. Además, en la preparación de inyectables se pueden usar ácidos grasos tales como ácidos oleico.
Una composición de la invención también se puede administrar en la forma de supositorios para administración rectal del fármaco. Estas composiciones se pueden preparar por mezclado del fármaco con un excipiente no irritante adecuado que es sólido a temperatura ordinaria, pero líquido a la temperatura rectal, y que por lo tanto de fundirá en el recto para liberar el fármaco. Dichos materiales son, por ejemplo, manteca de cacao y polietilenglicol.
Las formulaciones de liberación controlada para administración parenteral incluyen a formulaciones liposomales, poliméricas en microesferas y poliméricas en gel, que son conocidas en la técnica.
Puede ser deseable o necesario introducir la composición farmacéutica al paciente a través de un dispositivo de administración mecánica. La construcción y uso de dispositivos de administración mecánica para la administración de agentes farmacéuticos es bien conocida en la materia. Las técnicas directas de administración, por ejemplo, administrar un fármaco directamente al cerebro usualmente implica colocar un catéter de administración de fármaco en el sistema ventricular del paciente para evitar la barrera hematoencefálica. Uno de dichos sistemas de administración por implantación, que se usa para el transporte de agentes a regiones anatómicas específicas del cuerpo, se describe en la Patente de los EE. UU. n.° 5.011.472, presentada el 30 de abril de 1991.
Las composiciones de la invención también pueden contener otros ingredientes de composición convencionales farmacéuticamente aceptables, en general denominados como vehículos o diluyentes, según sea necesario o deseable. Se pueden utilizar procedimientos convencionales para preparar dichas composiciones en formas de dosificación apropiadas.
Dichos ingredientes y procedimientos incluyen a los que se describen en las siguientes referencias, cada una de las cuales se incorpora a la presente documentación a modo de referencia: Powell, M.F. y col., "Compendium of Excipients for Parenteral Formulations" PDA Journal of Pharmaceutical Science & Technology 1998, 52(5), 238-311; Strickley, R.G "Parenteral Formulations of Small Molecule Therapeutics Marketed in the United States (1999)-Parte-1" PDA Journal of Pharmaceutical Science & Technology 1999, 53(6), 324-349; y Nema, S. y col., "Excipients and Their Use in Injectable Products" PDA Journal of Pharmaceutical Science & Technology 1997, 51(4), 166-171.
Los ingredientes farmacéuticos comúnmente usados que se pueden utilizar como apropiados para formular la composición mediante su ruta de administración pretendida incluyen a:
agentes acidificantes (los ejemplos incluyen a título enunciativo no taxativo ácido acético, ácido cítrico, ácido fumárico, ácido clorhídrico, ácido nítrico);
agentes alcalinizantes (los ejemplos incluyen a título enunciativo no taxativo solución de amoniaco, carbonato de amonio, dietanolamina, monoetanolamina, hidróxido de potasio, borato de sodio, carbonato de sodio, hidróxido de sodio, trietanolamina, trolamina);
adsorbentes (los ejemplos incluyen a título enunciativo no taxativo celulosa en polvo y carbón activado); propelentes para aerosol (los ejemplos incluyen a título enunciativo no taxativo dióxido de carbono, CChF2, F2C C CClF2 y CCF3)
agentes de desplazamiento de aire (los ejemplos incluyen a título enunciativo no taxativo nitrógeno y argón ; conservantes antifúnaicos (los ejemplos incluyen a título enunciativo no taxativo ácido benzoico, butilparabeno, etilparabeno, metilparabeno, propilparabeno, benzoato de sodio);
conservantes antimicrobianos (los ejemplos incluyen a título enunciativo no taxativo cloruro de benzalconio, cloruro de bencetonio, alcohol bencílico, cloruro de cetilpiridinio, clorobutanol, fenol, feniletil alcohol, nitrato fenilmercúrico y timerosal);
antioxidantes (los ejemplos incluyen a título enunciativo no taxativo ácido ascórbico, palmitato de ascorbilo, hidroxianisol butilado, hidroxitolueno butilado, ácido hipofosforoso, monotioglicerol, propil galato, ascorbato de sodio, bisulfito de sodio, formaldehído sulfoxilato de sodio, metabisulfito de sodio);
materiales de unión (los ejemplos incluyen a título enunciativo no taxativo polímeros en bloque, goma natural y sintética, poliacrilatos, poliuretanos, siliconas, polisiloxanos y copolímeros de estireno-butadieno);
agentes amortiguadores del pH (los ejemplos incluyen a título enunciativo no taxativo metafosfato de potasio, fosfato de dipotasio, acetato de sodio, citrato de sodio anhidro y citrato de sodio dihidratado);
agentes vehiculizantes (los ejemplos incluyen a título enunciativo no taxativo jarabe de acacia, jarabe aromático, elixir aromático, jarabe de cereza, jarabe de cacao, jarabe de naranja, jarabe, aceite de maíz, aceite mineral, aceite de maní, aceite de sésamo, cloruro de sodio bacteriostático para inyección y agua bacteriostática para inyección); agentes quelantes (los ejemplos incluyen a título enunciativo no taxativo edetato de disodio y ácido edético); colorantes (los ejemplos incluyen a título enunciativo no taxativo FD&C Rojo n.° 3, FD&C Rojo n.° 20, FD&C Amarillo n.° 6 , f D&C Azul n.° 2, D&C Verde n.° 5, D&C Naranja n.° 5, D&C Red n.° 8 , caramelo y rojo de óxido férrico);
agentes clarificantes (los ejemplos incluyen a título enunciativo no taxativo bentonita);
agentes emulsionantes (los ejemplos incluyen a título enunciativo no taxativo acacia, cetomacrogol, alcohol cetílico, monoestearato de glicerilo, lecitina, sorbitano monooleato, monoestearato de polioxietileno 50);
agentes encapsulantes (los ejemplos incluyen a título enunciativo no taxativo gelatina y celulosa acetato ftalato), saborizantes (los ejemplos incluyen a título enunciativo no taxativo aceite de anís, aceite de canela, cacao, mentol, aceite de naranja, aceite de menta y vainilla);
humectantes (los ejemplos incluyen a título enunciativo no taxativo glicerol, propilenglicol y sorbitol); agentes de levigación (los ejemplos incluyen a título enunciativo no taxativo aceite mineral y glicerina); aceites (los ejemplos incluyen a título enunciativo no taxativo aceite de Arachis, aceite mineral, aceite de oliva, aceite de maní, aceite de sésamo y aceite vegetal);
bases para ungüentos (los ejemplos incluyen a título enunciativo no taxativo lanolina, ungüento hidrofílico, ungüento de polietilenglicol, petrolato, petrolato hidrofílico, ungüento blanco, ungüento amarillo, y ungüento agua rosa);
mejoradores de la penetración (administración transdérmica) (los ejemplos incluyen a título enunciativo no taxativo alcoholes monohidroxílicos o polihidroxílicos, alcoholes mono o polivalentes, alcoholes grasos saturados o insaturados, ésteres grasos saturados o insaturados, ácidos dicarboxílicos saturados o insaturados, aceites esenciales, derivados de fosfatidilo, cefalina, terpenos, amidas, éteres, cetonas y ureas),
plastificantes (los ejemplos incluyen a título enunciativo no taxativo ftalato de dietilo y glicerol);
solventes (los ejemplos incluyen a título enunciativo no taxativo etanol, aceite de maíz, aceite de algodón, glicerol, isopropanol, aceite mineral, ácido oleico, aceite de maní, agua purificada, agua para inyección, agua estéril para inyección y agua estéril para irrigación);
agentes endurecedores (los ejemplos incluyen a título enunciativo no taxativo alcohol cetílico, cera de ésteres de cetilo, cera microcristalina, parafina, alcohol estearílico, cera blanca y cera amarilla);
bases para supositorios (los ejemplos incluyen a título enunciativo no taxativo manteca de cacao y polietilenglicoles
(mezclas));
tensioactivos (los ejemplos incluyen a título enunciativo no taxativo cloruro de benzalconio, nonoxinol 10, oxtoxinol 9, polisorbato 80, lauril sulfato de sodio y sorbitano monopalmitato);
agentes de suspensión (los ejemplos incluyen a título enunciativo no taxativo agar, bentonita, carbómeros, carboximetilcelulosa de sodio, hidroxietilcelulosa, hidroxipropilcelulosa, hidroxipropilmetilcelulosa, caolina, metilcelulosa, tragacanto y veegum);
agentes edulcorantes (los ejemplos incluyen a título enunciativo no taxativo aspartame, dextrosa, glicerol, manitol, propilenglicol, sacarina de sodio, sorbitol y sacarosa);
antiadherentes para comprimidos (los ejemplos incluyen a título enunciativo no taxativo estearato de magnesio y talco);
aglutinantes para comprimidos (los ejemplos incluyen a título enunciativo no taxativo acacia, ácido algínico, carboximetilcelulosa de sodio, azúcar comprimible, etilcelulosa, gelatina, glucosa líquida, metilcelulosa, polivinilpirrolidona no entrecruzada, y almidón pregelatinizado);
diluyentes para comprimidos y cápsulas (los ejemplos incluyen a título enunciativo no taxativo fosfato dibásico de calcio, caolina, lactosa, manitol, celulosa microcristalina, celulosa en polvo, carbonato de calcio precipitado, carbonato de sodio, fosfato de sodio, sorbitol y almidón);
agentes de recubrimiento para comprimidos (los ejemplos incluyen a título enunciativo no taxativo glucosa líquida, hidroxietilcelulosa, hidroxipropilcelulosa, hidroxipropilmetilcelulosa, metilcelulosa, etilcelulosa, celulosa acetato ftalato y shellac);
excipientes para compresión directa de comprimidos (los ejemplos incluyen a título enunciativo no taxativo fosfato dibásico de calcio);
desintegrantes de comprimidos (los ejemplos incluyen a título enunciativo no taxativo ácido algínico, carboximetilcelulosa de calcio, celulosa microcristalina, polacrilina de potasio, polivinilpirrolidona entrecruzada, alginato de sodio, glicolato almidón de sodio y almidón);
deslizantes para comprimidos (los ejemplos incluyen a título enunciativo no taxativo sílice coloidal, almidón de maíz y talco);
lubricantes para comprimidos (los ejemplos incluyen a título enunciativo no taxativo estearato de calcio, estearato de magnesio, aceite mineral, ácido esteárico y estearato de zinc);
opacantes para comprimidos/cápsulas (los ejemplos incluyen a título enunciativo no taxativo dióxido de titanio);
agentes de pulido para comprimidos (los ejemplos incluyen a título enunciativo no taxativo cera carnauba y cera blanca);
agentes espesantes (los ejemplos incluyen a título enunciativo no taxativo cera de abejas, alcohol cetílico y parafina);
agentes tonificantes (los ejemplos incluyen a título enunciativo no taxativo dextrosa y cloruro de sodio);
agentes de incremento de la viscosidad (los ejemplos incluyen a título enunciativo no taxativo ácido algínico, bentonita, carbómeros, carboximetilcelulosa de sodio, metilcelulosa, polivinilpirrolidona, alginato de sodio y tragacanto); y
agentes humectantes (los ejemplos incluyen a título enunciativo no taxativo heptadecaetilen oxicetanol, lecitinas, sorbitol monooleato, polioxietilen sorbitol monooleato, y polioxietilen estearato).
Las composiciones farmacéuticas de acuerdo a la presente invención pueden ilustrarse como sigue:
Solución i.v. estéril: Se puede elaborar una solución de 5 mg/ml del compuesto deseado de esta invención usando agua estéril para inyección, y se ajusta el pH si es necesario. La solución se diluye para su administración a entre 1 y 2 mg/ml con dextrosa estéril al 5 % y se administra como una infusión i.v. a lo largo de 60 minutos.
Polvo liofilizado para administración i.v.: Se puede elaborar una preparación estéril con (i) entre 100 y 1000 mg del compuesto deseado de esta invención como polvo liofilizado, (ii) entre 32 y 327 mg/ml de citrato de sodio, y (iii) entre 300 y 3000 mg de Dextrano 40. La formulación se reconstituye con solución salina o dextrosa al 5 % inyectable estéril a una concentración de entre 10 y 20 mg/ml, que se diluye adicionalmente con solución salina o dextrosa al 5 % a entre 0,2 y 0,4 mg/ml, y se administra como bolo IV o por infusión IV a lo largo de entre 15 y 60 minutos.
Suspensión intramuscular: Se puede preparar la siguiente solución o suspensión, para inyección intramuscular:
50 mg/ml del compuesto deseado de esta invención insoluble en agua
5 mg/ml de carboximetilcelulosa de sodio
4 mg/ml de TWEEN 80
9 mg/ml de cloruro de sodio
9 mg/ml de alcohol bencílico
Cápsulas de cubierta dura: Se prepara un gran número de cápsulas unitarias por rellenado de cápsulas de gelatina dura estándares de dos partes, cada una con 100 mg de principio activo en polvo, 150 mg de lactosa, 50 mg de celulosa y 6 mg de estearato de magnesio.
Cápsulas de gelatina blanda: Se prepara una mezcla de principio activo en un aceite digerible tal como aceite de soja, aceite de semilla de girasol o aceite de oliva y se inyecta en gelatina fundida mediante una bomba de desplazamiento positivo para formar cápsulas de gelatina blandas que incluyen 100 mg del principio activo. Las cápsulas se lavan y se secan. El principio activo puede disolverse en una mezcla de polietilenglicol, glicerina y sorbitol para preparar una mezcla medicinal miscible en agua.
Comprimidos: se preparan un gran número de comprimidos mediante procedimientos convencionales de manera que la unidad de dosificación es 100 mg de principio activo, 0,2 mg de dióxido de silicio coloidal, 5 mg de estearato de magnesio, 275 mg de celulosa microcristalina, 11 mg de almidón, y 98,8 mg de lactosa. Pueden aplicarse recubrimientos acuosos y no acuosos apropiados para aumentar la palatibilidad, mejorar la elegancia y estabilidad o retrasar la absorción.
Comprimidos/Cápsulas de liberación inmediata: Estas son formas orales sólidas de dosificación elaboradas por procedimientos convencionales y novedosos. Estas unidades se toman oralmente sin agua para la disolución inmediata y la provisión de la medicación. El principio activo se mezcla en un líquido que contiene un ingrediente tal como azúcar, gelatina, pectina y endulzantes. Estos líquidos se solidifican a comprimidos o pastillas sólidos mediante técnicas de secado por congelamiento y extracción en estado sólido. Los compuestos farmacológicos pueden comprimirse con azúcares viscoelásticos y termoelásticos y componentes polímeros o efervescentes para producir matrices porosas para una liberación inmediata, sin requerir agua.
Dosis y administración
La dosificación eficaz de los compuestos de esta invención para el tratamiento de trastornos y/o enfermedades influidas por P2X4, se puede determinar fácilmente en base a las técnicas de laboratorio estándar conocidas para evaluar los compuestos de utilidad en el tratamiento de trastornos hiperproliferativos, mediante pruebas de toxicidad estándar y mediante ensayos farmacológicos estándar para determinar el tratamiento de las afecciones identificadas precedentemente en mamíferos, y por comparación de estos resultados con los resultados de los medicamentos conocidos que se usan para tratar estas afecciones. La cantidad de principio activo a administrar en el tratamiento de una de estas afecciones puede variar ampliamente de acuerdo con dichas consideraciones, tales como el compuesto particular y la unidad de dosificación empleada, el modo de administración, el período de tratamiento, la edad y el sexo del paciente tratado, y la naturaleza y la extensión de la afección a tratar.
La cantidad total de principio activo que será administrada varía en general en el rango de entre aproximadamente 0,001 mg/kg y aproximadamente 200 mg/kg de peso corporal por. Los programas de dosificación clínicamente útiles varían en un rango de entre una dosificación de una a tres veces por día y una dosificación de una vez cada cuatro semanas. Además, el "descanso del fármaco" durante el cual un paciente no recibe ninguna dosis del fármaco por un período de tiempo determinado, puede ser beneficioso para el balance global entre el efecto farmacológico y la capacidad de tolerancia. Una dosificación unitaria puede contener entre aproximadamente 0,5 mg y aproximadamente 1500 mg de principio activo, y puede ser administrada una o más veces por día o menos de una vez por día. Una dosificación unitaria oral preferida para la administración de los compuestos de la presente invención incluye, pero en un sentido no taxativo, entre 0,1 mg/kg y aproximadamente 10 mg/kg de peso corporal, una a tres veces por día hasta una vez por semana. La dosificación diaria promedio para una administración por inyección, incluyendo inyecciones intravenosas, intramusculares, subcutáneas y parenterales, y el uso de técnicas de infusión, será preferentemente de entre 0,01 y 200 mg/kg de peso corporal total. El régimen de dosificación rectal diaria promedio será preferentemente de entre 0,01 y 200 mg/kg de peso corporal total. El régimen de dosificación vaginal diaria promedio será preferentemente de entre 0,01 y 200 mg/kg de peso corporal total. El régimen de dosificación diaria tópica promedio será preferentemente de entre 0,1 y 200 mg, donde las dosis se administran entre una y cuatro veces por día. La concentración transdérmica será preferentemente la que se requiere para mantener una dosis diaria entre 0,01 y 200 mg/kg. El régimen de dosificación diaria promedio por inhalación comprenderá preferentemente entre 0,01 y 100 mg/kg de peso corporal total.
Por supuesto, el régimen de dosificación inicial y continuo específico para cada paciente varía de acuerdo con la naturaleza y la severidad de la afección como lo podrá determinar el médico a cargo del paciente, con la actividad del compuesto específico empleado, la edad y la condición general del paciente, el tiempo de administración, la ruta de administración, la velocidad de excreción del fármaco, las combinaciones de fármacos y semejantes. El modo de
tratamiento deseado y la cantidad de dosis de un compuesto de la presente invención, o una sal, un éster o una composición del mismo farmacéuticamente aceptable, pueden ser evaluados por los especialistas en la materia, usando pruebas de tratamiento convencionales.
Terapias combinadas
El término "combinación" en la presente invención se usa tal como es conocido para las personas con experiencia en la materia y puede estar presente como una combinación fija, una combinación no fija o un kit (conjunto de componentes) de partes.
Una "combinación fija" en la presente invención se usa tal como es conocido para las personas con experiencia en la materia y se define como una combinación en la que el dicho primer principio activo y el dicho segundo principio activo están presentes juntos en una dosificación unitaria o en una entidad única. Un ejemplo de una "combinación fija" es una composición farmacéutica en la que el dicho primer principio activo y el dicho segundo principio activo están presentes en una mezcla para la administración simultánea, tal como en una formulación. Otro ejemplo de una "combinación fija" es una combinación farmacéutica en la que el dicho primer principio activo y el dicho segundo principio activo están presentes en una unidad sin estar mezclados.
Una combinación no fija o "kit de partes" en la presente invención se usa tal como es conocido para las personas con experiencia en la materia y se define como una combinación en la que el dicho primer principio activo y el dicho segundo principio activo están presentes en más de una unidad. Un ejemplo de una combinación no fija o kit de partes es una combinación en la que el dicho primer principio activo y el dicho segundo principio activo están presentes por separado. Los componentes de la combinación no fija o kit de partes pueden administrarse por separado, secuencialmente, simultáneamente, concurrentemente o en etapas cronológicamente.
Los compuestos de la presente invención pueden administrarse como un agente farmacéutico solo o en combinación con uno o más agentes farmacéuticos adicionales en la que la combinación no produce efectos adversos inaceptables. La presente invención se relaciona también con dichas combinaciones.
Aquellos agentes farmacéuticos pueden ser otros agentes que tienen efectos antiproliferativos, antinociceptivos y/o antiinflamatorios tales como por ejemplo para el tratamiento de tumores hematológicos, tumores sólidos y/o metástasis de los mismos y/o agentes para el tratamiento de diferentes síndromes de dolor y/o efectos secundarios no deseados. La presente invención se relaciona con dichas combinaciones.
Otros agentes antihiperproliferativos adecuados para usar con la composición de la invención incluyen a título enunciativo no taxativo aquellos compuestos que se sabe que se usan en el tratamiento de enfermedades neoplásicas en Goodman and Gilman's The Pharmacological Basis of Therapeutics (novena edición), editor Molinoff y col., publ. Por McGraw-Hill, páginas 1225-1287, (1996), que se incorpora a la presente a modo de referencia, especialmente agentes anticancerígenos (quimioterapéuticos) como se define precedentemente.
Por ejemplo, los compuestos de la presente invención pueden combinarse con agentes terapéuticos hormonales conocidos.
En particular, los compuestos de la presente invención pueden administrarse en combinación o como una comedicación con anticonceptivos hormonales. Los anticonceptivos hormonales pueden administrase por ruta oral, subcutánea, transdérmica, intrauterina o intravaginal, por ejemplo como anticonceptivos orales combinados (COC, del inglés) o píldoras solamente de progestina (POP, del inglés) o dispositivos que contienen hormonlas como implantes, parches o anillos intravaginales.
Los COC incluyen a título enunciativo no taxativo píldoras para el control natal o procedimiento de control de natalidad que incluyen una combinación de un estrógeno (estradiol) y un progestágeno (progestina). La parte estrogénica está principalmente en los COC etinilestradiol. Algunos COC contienen estradiol o estradiol valerato.
Dichos COC contienen las progestinas noretinodrel, noretindrona, noretindrona acetato, etinodiol acetato, norgestrel, levonorgestrel, norgestimato, desogestrel, gestodeno, drospirenona, dienogest, o nomegestrol acetato.
Las píldoras para el control natal incluyen por ejemplo a título enunciativo no taxativo Yasmin, Yaz, ambas contienen etinil estradiol y drospirenona; Microgynon o Miranova que contienen levonorgestrel y etinil estradiol; Marvelon que contiene etinil estradiol y desogestrel; Valette que contiene etinil estradiol y dienogest; Belara y Enriqa que contienen etinil estradiol y clormadinonacetato; Qlaira que contiene estradiol valerato y dienogest como principios activos; y Zoely que contiene estradiol y normegestrol.
Las POP son píldoras anticonceptivas que contiene solo progestágenos sintéticos (progestinas) y no contienen estrógeno. Coloquialmente son conocidas como minipíldoras.
Las POP incluyen a título enunciativo no taxativo Cerazette que contiene desogestrel; Microlut que contiene levonorgestrel y Micronor que contiene noretindrona.
Otras formas de solo progestágeno son los dispositivos intrauterinos (DIU), por ejemplo Mirena que contiene
levonorgestrel, o inyectables, por ejemplo Depo-Provera que contiene medroxiprogesterona acetato, o implantes, por ejemplo Implanon que contiene etonogestrel.
Otros dispositivos que contienen hormonas con efecto anticonceptivo que son adecuados para una combinación con los compuestos de la presente invención son los anillos vaginales como Nuvaring que contienen etinil estradiol y etonogestrel, o sistemas transdérmicos como parches anticonceptivos, por ejemplo Ortho-Evra que contiene etinil estradiol y norelgestromina o Apleek (Lisvy) que contiene etinil estradiol y gestodeno.
Una forma de realización preferida de la presente invención es la administración de un compuesto de fórmula general (I) en combinación con un COC o una POP u otras formas de solo progestina así como también anillos vaginales o parches anticonceptivos como se mencionó precedentemente.
Además, los compuestos de la presente invención pueden combinarse con agentes terapéuticos o principios activos, que ya están aprobados o que están aún en desarrollo para el tratamiento y/o profilaxis de enfermedades que se relacionan con o están mediadas por P2X4.
Para el tratamiento y/o profilaxis de enfermedades del tracto urinario, los compuestos de la presente invención pueden administrarse en combinación o como comedicación con cualquier sustancia que puede aplicarse como agente terapéutico en las siguientes indicaciones:
estados de enfermedad del tracto urinario que incluyen aquellos asociados con obstrucción de la salida de la vejiga; afecciones de incontinencia urinaria tales como capacidad de vejiga reducida, frecuencia aumentada de micción, incontinencia imperiosa, incontinencia por estrés, o hiperreactividad de vejiga; hipertrofia prostática benigna; hiperplasia prostática; prostatitis; hiperreflexia del detrusor; vejiga sobrerreactiva y síntomas relacionados con la vejiga sobrerreactiva en la que dichos síntomas en particular son frecuencia urinaria aumentada, nocturia, urgencia urinaria o incontinencia imperiosa; hipersensibilidad pélvica; uretritis; prostatitis; prostatodinia; cistitis, en particular cistitis intersticial; hipersensibilidad de vejiga idiopática; enfermedad renal como síndrome de hiperprostaglandina E, síndrome de Bartter clásico.
Para el tratamiento y/o profilaxis de vejiga sobrerreactiva y síntomas relacionados con la vejiga sobrerreactiva, los compuestos de la presente invención pueden administrarse en combinación o como comedicación adicionalmente a terapia conductual como dieta, estilo de vida o entrenamiento de la vejiga con anticolinérgicos como oxibutinina, tolterodina, propiverina, solifenacina, darifenacina, trospio, fesoterdina; agonistas p3 como mirabegron; neurotoxinas como onabutolinumtoxina A; o antidepresivos como imipramina, duloxetina.
Para el tratamiento y/o profilaxis de cistitis intersticial, los compuestos de la presente invención pueden administrarse en combinación o como comedicación adicionalmente a terapia de conducta como dieta, estilo de vida o entrenamiento de vejiga con pentosanos como elmiron; antidepresivos como amitriptilina, imipramina; o antihistamínicos como loratadina.
Para el tratamiento y/o profilaxis de enfermedades ginecológicas, los compuestos de la presente invención pueden administrarse en combinación o como comedicación con cualquier sustancia que puede aplicarse como agente terapéutico en las siguientes indicaciones:
dismenorrea, que incluye primaria y secundaria; dispareunia; endometriosis; dolor asociado con endometriosis; síntomas asociados con endometriosis, en el que dichos síntomas son en particular dolor abdominal agudo y crónico, dismenorrea, dispareunia, disuria, o disquecia.
Para el tratamiento y/o profilaxis de dismenorrea, que incluye primaria y secundaria; dispareunia; endometriosis y dolor asociado con endometriosis, los compuestos de la presente invención pueden administrarse en combinación con tratamiento inhibitorio de la ovulación, en particular COC como se mencionó precedentemente o parches anticonceptivos como Ortho-Evra o Apleek (Lisvy); o con progestágenos como dienogest (Visanne); o con análogos de GnRH, en particular agonistas y antagonistas de GnRH, por ejemplo leuprorelina, nafarelina, goserelina, cetrorelix, abarelix, ganirelix, degarelix; o con andrógenos: danazol.
Para el tratamiento y/o profilaxis de enfermedades, las cuales están asociadas con dolor, o síndromes de dolor, los compuestos de la presente invención pueden administrarse en combinación o como comedicación con cualquier sustancia que puede aplicarse como agente terapéutico en las siguientes indicaciones:
enfermedades o trastornos asociados con dolor como hiperalgesia, alodinia, trastornos funcionales del intestino (tales como síndrome de intestino irritable) y artritis (tal como osteoartritis, artritis reumatoide y espondilitis anquilosante), síndrome de boca ardiente, quemaduras, migrañas o cefalea en racimos, lesión nerviosa, lesión nerviosa traumática, lesiones postraumáticas (que incluyen fracturas y lesiones deportivas), neuritis, neuralgia, envenenamiento, daño isquémico, cistitis intersticial, viral, neuralgia del trigémino, neuropatía de fibras pequeñas, neuropatía diabética, artritis crónica y neuralgias relacionadas, neuropatía inducida por VIH y tratamiento de v Ih .
Los compuestos de la presente invención pueden combinarse con otros agentes farmacológicos y compuestos que son para tratar enfermedades inflamatorias, dolor inflamatorio o afecciones de dolor general.
Además de los medicamentos bien conocidos que ya están aprobados y en el mercado, los compuestos de la presente invención pueden administrarse en combinación con inhibidores de la familia P2X de purinoceptores (por ejemplo
P2X3 y P2X7), con inhibidores de IRAK4, con inhibidores de PTGES y con antagonistas del receptor de prostaglandinas EP4.
En particular, los compuestos de la presente invención pueden administrarse en combinación con agentes de endometriosis farmacológica, pretendidos para tratar enfermedades inflamatorias, dolor inflamatorio o afecciones de dolor general y/o para interferir con la proliferación endometriótica y síntomas asociados con la endometriosis, es decir con inhibidores de Aldo-ceto-reductasa1C3 (AKR1C3) y con anticuerpos bloqueantes funcionales del receptor de prolactina.
Los compuestos de la presente invención pueden combinarse con otros agentes farmacológicos y compuestos que se pretenden para el tratamiento, prevención o manejo de cáncer.
En particular, los compuestos de la presente invención pueden administrarse en combinación con 131I-chTNT, abarelix, abiraterona, aclarubicina, ado-trastuzumab emtansina, afatinib, aflibercept, aldesleuquina, alemtuzumab, ácido alendrónico, alitretinoina, altretamina, amifostina, aminoglutetimida, Hexil aminolevulinato, amrubicina, amsacrina, anastrozol, ancestim, anetol ditioletiona, angiotensina II, antitrombina III, aprepitant, arcitumomab, arglabina, trióxido de arsénico, asparaginasa, axitinib, azacitidina, basiliximab, belotecan, bendamustina, belinostat, bevacizumab, bexaroteno, bicalutamida, bisantreno, bleomicina, bortezomib, buserelina, bosutinib, brentuximab vedotina, busulfan, cabazitaxel, cabozantinib, folinato de calcio, levofolinato de calcio, capecitabina, capromab, carboplatino, carfilzomib, carmofur, carmustina, catumaxomab, celecoxib, celmoleuquina, ceritinib, cetuximab, clorambucilo, clormadinona, clormetina, cidofovir, cinacalcet, cisplatino, cladribina, ácido clodrónico, clofarabina, copanlisib, crisantaspasa, ciclofosfamida, ciproterona, citarabina, dacarbazina, dactinomicina, darbepoyetina alfa, dabrafenib, dasatinib, daunorubicina, decitabina, degarelix, denileuquina diftitox, denosumab, depreotido, deslorelina, dexrazoxano, cloruro de dibrospidio, dianhidrogalactitol, diclofenac, docetaxel, dolasetron, doxifluridina, doxorubicina, doxorubicina estrona, dronabinol, eculizumab, edrecolomab, eliptinio acetato, eltrombopag, endostatina, enocitabina, enzalutamida, epirubicina, epitiostanol, epoyetina alfa, epoyetina beta, epoyetina zeta, eptaplatino, eribulina, erlotinib, esomeprazol, estradiol, estramustina, etopósido, everolimus, exemestano, fadrozol, fentanilo, filgrastim, fluoximesterona, floxuridina, fludarabina, fluorouracilo, flutamida, ácido folínico, formestano, fosaprepitant, fotemustina, fulvestrant, gadobutrol, gadoteridol, ácido gadotérico meglumina, gadoversetamida, ácido gadoxético, nitrato de galio, ganirelix, gefitinib, gemcitabina, gemtuzumab, Glucarpidasa, glutoxim, GM-CSF, goserelina, granisetron, factor estimulante de colonia de granulocitos, diclorhidrato de histamina, histrelina, hidroxicarbamida, semillas de I-125, lansoprazol, ácido ibandrónico, ibritumomab tiuxetan, ibrutinib, idarubicina, ifosfamida, imatinib, imiquimod, improsulfan, indisetron, ácido incadrónico, ingenol mebutato, interferón alfa, interferón beta, interferón gamma, iobitridol, iobenguano (123I), iomeprol, ipilimumab, irinotecan, Itraconazol, ixabepilona, lanreotido, lapatinib, Iasocolina, lenalidomide, lenograstim, lentinan, letrozol, leuprorelina, levamisol, levonorgestrel, levotiroxina sódica, lisuride, lobaplatino, lomustina, lonidamina, masoprocol, medroxiprogesterona, megestrol, melarsoprol, melfalan, mepitiostano, mercaptopurina, mesna, metadona, metotrexato, metoxsalen, metilaminolevulinato, metilprednisolona, metiltestosterona, metirosina, mifamurtide, miltefosina, miriplatino, mitobronitol, mitoguazona, mitolactol, mitomicina, mitotano, mitoxantrona, mogamulizumab, molgramostim, mopidamol, clorhidrato de morfina, sulfato de morfina, nabilona, nabiximoles, nafarelina, naloxona pentazocina, naltrexona, nartograstim, nedaplatino, nelarabina, ácido neridrónico, nivolumabpentetreótido, nilotinib, nilutamida, nimorazol, nimotuzumab, nimustina, nitracrina, nivolumab, obinutuzumab, octreótido, ofatumumab, omacetaxina mepesuccinato, omeprazol, ondansetron, oprelvequina, orgoteína, orilotimod, oxaliplatino, oxicodona, oximetolona, ozogamicina, terapia génica con p53, paclitaxel, palifermina, semillas de paladio-103, palonosetron, ácido pamidrónico, panitumumab, pantoprazol, pazopanib, pegaspargasa, epoyetina beta tratada con PEG (metoxi PEG-epoyetina beta), pembrolizumab, pegfilgrastim, interferón alfa-2b tratado con PEG, pemetrexed, pentazocina, pentostatina, peplomicina, Perflubutano, perfosfamida, Pertuzumab, picibanilo, pilocarpina, pirarubicina, pixantrona, plerixafor, plicamicina, poliglusam, poliestradiol fosfato, polivinilpirrolidona hialuronato de sodio, polisacárido-K, pomalidomide, ponatinib, porfimer sódico, pralatrexato, prednimustina, prednisona, procarbazina, procodazol, propranolol, quinagolide, rabeprazol, racotumomab, cloruro de radio-223, radotinib, raloxifeno, raltitrexed, ramosetron, ramucirumab, ranimustina, rasburicasa, razoxano, refametinib, regorafenib, ácido risedrónico, etidronato de renio-186, rituximab, romidepsina, romiplostim, romurtide, roniciclib, samario (153Sm) lexidronam, sargramostim, satumomab, secretina, sipuleucel-T, sizofiran, sobuzoxano, glicididazol sódico, sorafenib, stanozolol, estreptozocina, sunitinib, talaporfina, tamibaroteno, tamoxifeno, tapentadol, tasonermina, teceleuquina, tecnecio (99mTc) nofetumomab merpentano, 99mTc-HYNIC-[Tyr3]-octreótido, tegafur, tegafur gimeracilo oteracilo, temoporfina, temozolomide, temsirolimus, tenipósido, testosterona, tetrofosmina, talidomida, tiotepa, timalfasina, tirotrofina alfa, tioguanina, tocilizumab, topotecan, toremifeno, tositumomab, trabectedina, tramadol, trastuzumab, trastuzumab emtansina, treosulfano, tretinoina, trifluridina tipiracilo, trilostano, triptorelina, trametinib, trofosfamida, trombopoyetina, triptofano, ubenimex, valatinib, valrubicina, vandetanib, vapreótido, vemurafenib, vinblastina, vincristina, vindesina, vinflunina, vinorelbina, vismodegib, vorinostat, vorozol, microesferas de vidrio de itrio-90, zinostatina, zinostatina stimalamer, ácido zoledrónico, zorubicina.
Más aún, los compuestos de la presente invención pueden combinarse con principios activos, los cuales son bien conocidos para el tratamiento de dolor relacionado con cáncer y dolor crónico. Dichas combinaciones incluyen, a título enunciativo no taxativo opioides de paso II como fosfato de codeína, dextropropoxifeno, dihidro-codeína,Tramadol), opioides de paso III como morfina, fentanilo, buprenorfina, oximorfona, oxicodona y hidromorfona; y otras medicaciones usadas para el tratamiento del dolor por cáncer como esteroides como Dexametasona y metilprednisolona; bisfosfonatos como Etidronato, Clodronato, Alendronato, Risedronato, y Zoledronato;
antidepresivos tricíclicos como Amitriptilina, Clomipramina, Desipramina, Imipramina y Doxepina; antiarrítmicos clase I como mexiletina y lidocaína; anticonvulsivantes como carbamazepina, Gabapentina, oxcarbazepina, fenitoína, pregabalina, topiramato, alprazolam, diazepam, flurazepam, pentobarbital y fenobarbital.
Los procedimientos para evaluar una propiedad farmacológica o farmacéutica particular son bien conocidos por los especialistas en la materia.
Los experimentos de ensayo de ejemplo descritos en el presente documento sirven para ilustrar la presente invención y la invención no está limitada a los ejemplos dados.
Tal como lo apreciarán las personas con experiencia en la materia, la invención no se limita a las formas de realización particulares descritas en el presente documento, pero abarca todas las modificaciones de dichas formas de realización que se encuentran dentro del espíritu y alcance de la invención como se define en las reivindicaciones anexas.
Los siguientes ejemplos ilustran la invención con mayor detalle, sin restringirla. Otros compuestos de acuerdo con la invención, cuya preparación no se describe explícitamente, pueden prepararse de una manera análoga.
Los compuestos, los cuales se mencionan en los ejemplos y las sales de los mismos representan formas de realización preferidas de la invención así como también una reivindicación que abarca todas las subcombinaciones de los residuos del compuesto de fórmula (I) como se desvela en los ejemplos específicos.
La expresión "de acuerdo con" en la sección experimental se usa en el sentido que el procedimiento referido es para usar "de manera análoga a".
SÍNTESIS DE LOS COMPUESTOS
Los siguientes esquemas y procedimientos generales ilustran rutas de síntesis generales de los compuestos de fórmula general (I), (Ia) y (Ib) de la invención y no tienen como intención ser limitantes. Resulta obvio para la persona con experiencia en la materia que el orden de las transformaciones como se ejemplifica en los esquemas 1 a 5 puede modificarse de diversas maneras. El orden de las transformaciones ejemplificado en los esquemas 1 a 5 por lo tanto no tiene como intención ser limitante. Además, la interconversión de sustituyentes, por ejemplo de los residuos R1, R2, R2a, R2b, R2c, R3, R4, R5, R6, R6a, R6b, R7a, R7b, R8, R9, R10, R11, R11a, o R12 puede realizarse antes y/o después de las transformaciones ejemplificadas. Estas modificaciones pueden ser tales como la introducción de grupos protectores, escisión de grupos protectores, reducción u oxidación de grupos funcionales, halogenación, metalación, sustitución u otras reacciones conocidas para las personas con experiencia en la materia. Estas transformaciones incluyen aquellas que introducen una funcionalidad que permite otra interconversión de sustituyentes. Los grupos protectores apropiados y su introducción y escisión son bien conocidos para la persona con experiencia en la materia (véase por ejemplo T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3ra edición, Wiley 1999).
Todos los reactivos usados para la preparación de los compuestos de la invención se encuentran disponibles comercialmente, son conocidos en la literatura o pueden prepararse como se describe.
Esquema 1: Procedimientos generales para la preparación de los compuestos de fórmula general (I) y (la) correspondientes a la fórmula 6; R1, R2a, R2b- R2c, R3, y R4 son como se define en la descripción y en las reivindicaciones de esta invención; Wcorresponde a una amina con hidrógeno y/o bien a un grupo protector PG (por ejemplo, (dimetilamino)metileno, 2,4-dimetoxibencilo); V corresponde a LG, cloruro o bromuro; LG corresponde a un grupo saliente (por ejemplo cloruro, fluoruro, tosilo); R2 es un sistema heteroaromático con un nitrógeno nucleofílico (por ejemplo pirazol, imidazol, triazol) y recibe una sustitución nucleofílica aromática en este átomo de nitrógeno.
Los compuestos de fórmula general 6 se pueden sintetizar como se describe en el Esquema 1. Las personas con experiencia en la materia serán capaces de convertir los cloruros de sulfonilo 1 a las sulfonil amidas desprotegidas 2 y serán capaces de seleccionar un grupo protector PG que es adecuado para los pasos siguientes. Los ejemplos de grupos protectores adecuados PG son 2,4-dimetoxibencilo o (dimetilamino)metileno. En el caso que V corresponda a un grupo saliente LG (por ejemplo fluoruro, cloruro, tosilo) los compuestos 2 se pueden convertir en una reacción de sustitución nucleofílica aromática en un disolvente adecuado (por ejemplo acetonitrilo) y en presencia de una base adecuada (por ejemplo carbonato de potasio, carbonato de cesio, ...) con un sistema heteroaromático R2H que contiene un nitrógeno nucleofílico (por ejemplo pirazol, imidazol, triazol, . ) a los compuestos 3 a la vez que se forma un nuevo enlace C-N. En el caso de que V corresponda a cloruro o bromuro, los compuestos 3 se pueden formar en una reacción de acoplamiento C-N catalizada por metal con un sistema heteroaromático que contiene nitrógeno (por ejemplo 1,2,3-triazoles) y en presencia de un sistema catalítico adecuado (por ejemplo tris(dibencilideneacetona)dipaladio / di-terc-butil(2',4',6’-triisopropil-3,4,5,6-tetrametil-[1,1'-bifenil]-2-il)fosfina / fosfato de potasio / tolueno). En el siguiente paso, los compuestos nitro 3 se pueden convertir a las correspondientes anilinas 4 por reducción bajo condiciones de hidrogenación, en disolventes polares tales como etanol, metanol, dioxano o tetrahidrofurano en presencia de por ejemplo catalizadores basados en Pd, Pt, Fe o Sn. Las anilinas 4 se pueden convertir a las correspondientes amidas 5 por ejemplo por reacción con cloruros de acilo o por formación de un enlace peptídico estándar usando procedimientos que son todos conocidos, tales como la reacción del correspondiente ácido carboxílico en presencia de un reactivo de acoplamiento por ejemplo HATU. En el último paso, las amidas 5 se desprotegen a las sulfonamidas deseadas 6. Las condiciones de desprotección dependen del grupo protector que se use (por ejemplo TFA/diclorometano en el caso de 2,4-dimetoxibencilo o amoniaco acuoso/metanol en el caso de (dimetilamino)metileno).
Esquema 2: Procedimiento general para la preparación de los compuestos de fórmula general (I) y (Ib) correspondientes a la fórmula 13; R1, R2b- R2c, R3, y R4 son como se define en la descripción y en las reivindicaciones de esta invención; W corresponde a una amina con hidrógeno y/o bien a un grupo protector PG (por ejemplo (dimetilamino)metileno); Ar es arilo; R2 es un sistema heteroaromático con un nitrógeno nucleofílico (por ejemplo pirazol, imidazol, triazol) y recibe una sustitución nucleofílica aromática en este átomo de nitrógeno.
Los compuestos de fórmula general 13 se pueden sintetizar como se describe en el Esquema 2. Las personas con experiencia en la materia serán capaces de convertir los cloruros de sulfonilo 7 a las sulfonilamidas desprotegidas 8 y serán capaces de seleccionar un grupo protector PG que es adecuado para los pasos siguientes. Un ejemplo de un grupo protector adecuado PG es (dimetilamino)metileno (reacción de cloruros de sulfoniilo 7 con amoniaco, después reacción con 1,1-dimetoxi-W,A/-dimetilmetanamina en DMF). Usando estrategias de protección y desprotección, la aminación de Buchwald de 8 en presencia de catalizadores adecuados (véase por ejemplo WO2011120026A1) conduce a los intermedios 9. La reacción de sustitución nucleofílica aromática en un disolvente adecuado (por ejemplo acetonitrilo) y en presencia de una base adecuada (por ejemplo carbonato de potasio, ...) con un sistema heteroaromático R2H que contiene un nitrógeno nucleofílico (por ejemplo pirazol, imidazol, triazol, ...) conduce a las piridinas 10. La desprotección de 10 (bajo condiciones ácidas en el caso Y = -N=CAr2) es seguida por la conversión de las anilinas resultantes 11 a las amidas 12 por ejemplo por reacción con cloruros de acilo o por formación de un enlace peptídico estándar usando procedimientos que son todos conocidos, tales como la reacción de los ácidos carboxílicos correspondientes en presencia de un reactivo de acoplamiento por ejemplo HATU. En el último paso, amida 12 se desprotege a las sulfonamidas deseadas 13. Las condiciones de desprotección dependen del grupo protector que se use (por ejemplo amoniaco acuoso/metanol en el caso de (dimetilamino)metileno).
(U = PG; V = COOH o CN)
aminación y protección
acilacion/acoplamiento
19 (W = NPG o NHPG)
desproteccionCT 20 (W= NHP)
Esquema 3: Procedimientos generales para la preparación de los compuestos de fórmula general (I) y (la) correspondientes a la fórmula 20; R1, R2a, R2b- R2c, R3 and R4 son como se define en la descripción y en las reivindicaciones de esta invención, Wcorresponde a una amina con hidrógeno y/o bien a un grupo protector PG (por ejemplo, (dimetilamino)metileno, 2,4-dimetoxibencil), R2 corresponde a oxadiazolilo sustituido de manera opcional.
Los compuestos de fórmula general 20 se pueden sintetizar como se describe en el Esquema 3. Partiendo a partir de los bencenotioles protegidos 14 (PG: por ejemplo, bencilo, benzoilo) con V = COOh , se pueden preparar los sustituyentes de 1,3,4-oxadiazol-2-ilo y 1,2,4-oxadiazol-5-ilo a partir del grupo carboxilo mediante procedimientos conocidos para las personas con experiencia en la materia (véase por ejemplo WO 2011/028741). La conversión de
los bencenotioles protegidos 15 a los bencenocloruros de sulfonilo 16 se puede conseguir mediante oxidación en un disolvente prótico, por ejemplo con A/-dorosucdnim¡da en ácido acético o con cloro gaseoso en tetraclorometano/agua. Las correspondientes sulfonamidas 17 se pueden obtener a partir de los intermedios 16 por reacción de amoniaco o cualquier amina en disolventes apróticos tales como diclorometano y acetonitrilo. La reducción subsiguiente bajo condiciones de hidrogenación, en disolventes polares tales como etanol o tetrahidrofurano en presencia de por ejemplo catalizadores basados en Pd, Pt, Fe o Sn da los derivados de anilina con fórmula general 18. La acilación subsiguiente a las correspondientes amidas se puede llevar a cabo por ejemplo por reacción con cloruros de acilo o por formación de un enlace peptídico estándar usando procedimientos que son todos conocidos, tales como la reacción del correspondiente ácido carboxílico en presencia de un reactivo de acoplamiento por ejemplo HATU. Cuando W es una función amina protegida, la desprotección subsiguiente con por ejemplo ácido trifluoroacético (TFA), resulta en los compuestos de fórmula general 20.
Como alternativa, comenzando con los intermedios 14 con V = CN, la oxidación a bencenocloruros de sulfonilo 21 se puede llevar a cabo en presencia del nitrilo en un disolvente prótico, por ejemplo con W-clorosuccinimida en ácido acético o con cloro gaseoso en tetraclorometano/agua. Las correspondientes sulfonamidas 22 se pueden obtener a partir de los intermedios 21 por reacción de amoniaco o cualquier amina en disolventes apróticos tales como diclorometano y acetonitrilo. En un paso subsiguiente, el grupo nitrilo de los intermedios 22 se puede transformar a las sulfonamidas con sustituyentes de 1,2,4-oxadiazol-2-ilo 17 mediante procedimientos conocidos para las personas con experiencia en la materia (véase por ejemplo WO 2011/028741).
Esquema 4: Procedimientos generales para la preparación de los compuestos de fórmula general (I) y (la) correspondientes a la fórmula 28; R1, R2, R2a, R2b- R2c, R3 y R4 son como se define en la descripción y en las reivindicaciones de esta invención, B(OZ) 2 corresponde a B(OH) 2 o B O 2C6H12) o una mezcla de ambos, y W corresponde a una amina con hidrógeno y/o un grupo protector PG (por ejemplo, (dimetilamino)metileno, 2,4-dimetoxibencilo).
Los compuestos de fórmula general 28 se pueden sintetizar como se describe en el Esquema 4. Comenzando desde
los correspondientes cloruros de sulfonilo 23 (donde V es bromuro o cloruro) los derivados de arilo y heteroarilo conectados por C se pueden preparar a través de, por ejemplo, reacciones de acoplamiento cruzado de Suzuki conocidas para las personas con experiencia en la materia. La transformación de las sulfonamidas protegidas 24 a compuestos de arilo/heteroarilo con fórmula general 25 se puede llevar a cabo por reacción con el correspondiente ácido borónico (o un éster o una mezcla de ambos) bajo catálisis con paladio en disolventes próticos (por ejemplo isopropanol) o apróticos. Las correspondientes aminas 26 se pueden obtener a partir de los intermedios 25 por reducción bajo condiciones de hidrogenación, en disolventes polares tales como etanol o tetrahidrofurano en presencia de por ejemplo catalizadores basados en Pd, Pt, Fe o Sn. La acilación subsiguiente a las correspondientes amidas 27 se puede llevar a cabo por ejemplo por reacción con cloruros de acilo o por formación de un enlace peptídico estándar usando procedimientos que son todos conocidos, tales como la reacción del correspondiente ácido carboxílico en presencia de un reactivo de acoplamiento por ejemplo HATU. Cuando W es un grupo protector, la desprotección subsiguiente con por ejemplo ácido trifluoroacético (TFA), resulta en los compuestos de fórmula general 28.
Como alternativa, comenzando con los intermedios 24 con V = Br, la reducción bajo condiciones de hidrogenación, en disolventes polares tales como etanol o tetrahidrofurano en presencia de por ejemplo catalizadores basados en Pt, Fe o Sn rinde las aminas 29. Las correspondientes amidas 30a se pueden obtener por reacción con cloruros de acilo o por formación de un enlace peptídico estándar usando procedimientos que son todos conocidos. La subsiguiente arilación/heteroarilación usando por ejemplo reacciones de acoplamiento catalizadas con paladio, da acceso a los intermedios 27. Como alternativa los bromuros 30a se pueden convertir a los correspondientes intermedios de ácido/ éster borónico 31 (B(OZ)2 = B(OH)2 o B(O2C6Hi2)) y además hacerse reaccionar con por ejemplo catalizadores de paladio conocidos para las personas con experiencia en la materia para obtener los intermedios 27, que después de su desprotección dan los productos finales con fórmula general 28.
Esquema 5: Procedimiento general para la preparación de los compuestos de fórmula general (I) y (Ib) correspondientes a la fórmula 35; R1, R2, R2b- R2c, R3, R4 son como se define en la descripción y en las reivindicaciones de esta invención, W corresponde a amina con hidrógeno y/o un grupo protector PG (por ejemplo, (dimetilamino)metileno, 2,4-dimetoxibencilo); Ar es arilo.
Los compuestos de fórmula general 35 se pueden sintetizar como se describe en el Esquema 5. Comenzando a partir del intermedio 9 se pueden preparar los derivados de arilo y heteroarilo C acoplados 32 a través de por ejemplo acoplamientos cruzados con paladio, por ejemplo las reacciones de Suzuki, conocidas para las personas con experiencia en la materia (véase por ejemplo US 20110281865). La desprotección bajo por ejemplo una condición ácida, rinde las aminas 33. La acilación subsiguiente a las correspondientes amidas se puede llevar a cabo por ejemplo por reacción con cloruros de acilo o por formación de un enlace peptídico estándar usando procedimientos que son todos conocidos, tales como la reacción del correspondiente ácido carboxílico en presencia de un reactivo de acoplamiento por ejemplo HATU. Cuando W es una función amina protegida, la desprotección subsiguiente (con por ejemplo amoniaco acuoso en el caso de (dimetilamino)metileno como grupo protector), resulta en los compuestos de fórmula general 35.
Esquema 6: Procedimiento general para la preparación de los compuestos de fórmula 30a; R1, R3 y R4 son como se define en la descripción y en las reivindicaciones de esta invención, R2a, R2b y R2c son hidrógeno, W corresponde a una amina con hidrógeno y/o un grupo protector PG (por ejemplo, (dimetilamino)metileno, 2,4 dimetoxibencilo).
Los compuestos de fórmula general 30a se pueden sintetizar como se describe en el Esquema 6. Partiendo a partir de la correspondiente anilina 36, la bromación (por ejemplo con NBS en DMF) conduce a la bromoanilina 37. La acilación subsiguiente a las correspondientes amidas 38 se puede llevar a cabo por ejemplo por reacción con cloruros de acilo o por formación de un enlace peptídico estándar usando procedimientos que son todos conocidos, tales como la reacción del correspondiente ácido carboxílico en presencia de un reactivo de acoplamiento por ejemplo HATU. La protección subsiguiente de la porción de sulfonamida (por ejemplo con 1,1-dimetoxi-N,N-dimetilmetanamina en DMF) conduce a las amidas protegidas 30a que después se pueden transformar adicionalmente por ejemplo usando la química de Suzuki como se describe en el Esquema 4.
39: W = NH2 41: W = NHPG NPGprotecció *n C desproteccion
40: W = N H P G /N P G
c
42: W = NH
Esquema 7: Procedimiento general para la preparación de los compuestos de fórmula general (I) y (Ia) correspondientes a la fórmula 42; R1, R2a, R2b, R2c, R3 y R4 son como se define en la descripción y en las reivindicaciones de esta invención, W corresponde a una amina con hidrógeno and /or un grupo protector PG (por ejemplo, (dimetilamino)metileno, 2,4-dimetoxibencilo).
Los compuestos de fórmula general 42 se pueden sintetizar como se describe en el Esquema 7. Después de la protección de la porción de sulfonamida de los bromopirazoles 39 (por ejemplo con un grupo (dimetilamino)metileno), estos se pueden transformar por ejemplo mediante reacciones de acoplamiento cruzado de Suzuki conocidas para las personas con experiencia en la materia, para dar los compuestos 41. Cuando W es un grupo protector, la desprotección subsiguiente con, por ejemplo, amoniaco acuoso en un alcohol (por ejemplo metanol, etanol, propanol) resulta en los compuestos de fórmula general 42.
Esquema 8: Procedimientos generales para la preparación de los compuestos de fórmula general (I) y (Ia) correspondientes a la fórmula 44; R1, R2a, R2b, R2c, R3, R4, R9 y R10 son como se define en la descripción y en las reivindicaciones de esta invención.
Los compuestos de fórmula general 44 se pueden sintetizar como se describe en el Esquema 8. Los ésteres carboxílicos 43 se pueden transformar a las correspondientes amidas 44 por transamidación directa (por ejemplo con un ácido de Lewis como el bis(trimetilaluminio)-1,4-diazabiciclo[2.2.2]-octano (DABAL-Me3) en THF) o por procedimientos subsiguientes de hidrólisis y amidación, conocidos para las personas con experiencia en la materia.
Además, los compuestos de los ejemplos se pueden derivatizar adicionalmente mediante química de funcionalización de etapa tardía (por ejemplo Bioorg. Med. Chem. Lett. 2012, 22, 1255-1262, Chem. Soc. Rev. 2016, 45(3), 546-476, Chem. Rev. 20l6, 116(2), 422-518; Chem Rev. 2014, 114(4), 2432-2506), como es conocido para las personas con experiencia en la materia. Estas pueden ser, por ejemplo, reacciones de fluoración, difluorometilación, trifluorometilación, cianación, metoxilación, oxidación o alquilación (para los ejemplos de oxidación, véase Org. Lett.
2015, 17, 6066-6069, Adv. Synth. Catal. 2004, 346, 171-184, Science 2007, 318(5851), 783-7, Org. Lett., 2005, 7(1), 79-82, J. Organomet. Chem., 2015, 793, 217-231).
Los compuestos de acuerdo con la invención se aíslan y se purifican de una manera conocida per se, por ejemplo por eliminación por destilación del disolvente al vacío y recristalización del residuo obtenido a partir de un disolvente adecuado o sometiéndolos a uno de los procedimientos de purificación comunes, tales como cromatografía en un material soporte adecuado. Más aún, la HPLC preparativa en fase reversa de compuestos de la presente invención que poseen una funcionalidad suficientemente básica o ácida, pueden dar como resultado la formación de una sal, tal como, en el caso de un compuesto de la presente invención el cual es suficientemente básico, una sal trifluoroacetato o formiato por ejemplo, o, en el caso de un compuesto de la presente invención el cual es suficientemente ácido, una sal de amonio por ejemplo. Las sales de este tipo pueden transformarse en su forma de base libre o ácido libre, respectivamente, por diferentes procedimientos conocidos para la persona con experiencia en la materia, o ser usadas como sales en ensayos biológicos posteriores. Además, el procedimiento de secado durante el aislamiento de compuestos de la presente invención puede no remover completamente las trazas de cosolventes, especialmente tal como ácido fórmico o ácido trifluoroacético, para dar solvatos o complejos de inclusión. Las personas con experiencia en la materia reconocerán cuales solvatos o complejos de inclusión son aceptables para usar en ensayos biológicos posteriores. Ha de comprenderse que la forma específica (por ejemplo sal, base libre, solvato, complejo de inclusión) de un compuesto de la presente invención aislado como se describe en el presente documento no necesariamente es la única forma en la cual dicho compuesto puede aplicarse a un ensayo biológico con el objetivo de cuantificar la actividad biológica específica.
Las sales de los compuestos de fórmula (I), (la) y (Ib) de acuerdo con la invención pueden obtenerse por disolución del compuesto libre en un disolvente adecuado (por ejemplo una cetona tal como acetona, metiletilcetona o metilisobutilcetona, un éter tal como éter dietílico, tetrahidrofurano o dioxano, un hidrocarburo clorado tal como cloruro de metileno o cloroformo, o un alcohol alifático de bajo peso molecular tal como metanol, etanol o isopropanol) el cual contiene el ácido o base deseado, o al cual se le agrega después el ácido o base deseado. El ácido o base puede emplearse en la preparación de la sal, dependiendo de si se refiere a un ácido o base mono o polibásico y dependiendo de cuál sal se desea, en una relación cuantitativa equimolar o uno difiriendo del otro. Las sales se obtienen por filtración, reprecipitación, precipitación con un no disolvente para la sal o por evaporación del disolvente. Las sales obtenidas pueden convertirse en los compuestos libres los cuales, a su vez, pueden convertirse en sales. De esta manera, las sales farmacéuticamente no aceptable, que pueden obtenerse, por ejemplo, como productos de procedimientos en la elaboración en una escala industrial, pueden convertirse a sales farmacéuticamente aceptables por procedimientos conocidos para la persona con experiencia en la materia. Se prefieren especialmente los clorhidratos y el procedimiento usado en la sección de ejemplos.
Los diasteroisómeros puros y los enantiómeros puros de los compuestos y sales de acuerdo con la invención pueden obtenerse por ejemplo por síntesis asimétrica, mediante el uso de compuestos de partida quirales en síntesis y por separación de las mezclas enantioméricas y diastereoisoméricas obtenidas durante la síntesis.
Las mezclas enantioméricas y diastereoisoméricas pueden separarse a los enantiómeros puros y diasteroisómeros puros por procedimientos conocidos para las personas con experiencia en la materia. Preferentemente, se separan las mezclas diasteroisoméricas por cristalización, en particular cristalización fraccional, o cromatografía. Las mezclas enantioméricas pueden separarse por ejemplo por formación de diasteroisómeros con un agente auxiliar quiral, resolviendo los diasteroisómeros obtenidos y eliminando el agente auxiliar quiral. Como agentes auxiliares quirales, por ejemplo, pueden usarse ácidos quirales para separar bases enantioméricas tales como por ejemplo ácido mandélico y pueden usarse bases quirales para separar ácidos enantioméricas por formación de sales diasteroisoméricas. Más aún, los derivados diasteroisoméricos tales como ésteres diasteroisoméricos pueden formarse a partir de mezclas enantioméricas de alcoholes o mezclas enantioméricas de ácidos, respectivamente, usando ácidos quirales o alcoholes quirales, respectivamente, como agentes auxiliares quirales. Además, pueden usarse complejos diasteroisoméricos o clatratos diasteroisoméricos para separar mezclas enantioméricas. Como alternativa, las mezclas enantioméricas pueden separarse usando columnas de separación quiral en cromatografía. Otro procedimiento adecuado para el aislamiento de enantiómeros es la separación enzimática.
Un aspecto preferido de la invención es el procedimiento para la preparación de los compuestos de fórmula general (I), (la) o (Ib) o un N-óxido, una sal, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero de acuerdo con los ejemplos, así como también los intermedios usados para su preparación.
Opcionalmente, los compuestos de la fórmula (I), (Ia) y (Ib) pueden convertirse a sus sales, o, de manera opcional, sales de los compuestos de la fórmula (I), (Ia) y (Ib) pueden convertirse a los compuestos libres. Los procedimientos
correspondientes son comunes para la persona con experiencia.
PARTE EXPERIMENTAL
Abreviaturas
La siguiente tabla enumera las abreviaturas usadas en este párrafo y en los Ejemplos intermedios y sección de Ejemplos que no se explican en el cuerpo del texto.
Otras abreviaturas tienen sus significados comunes per se para la persona con experiencia.
Los diferentes aspectos de la invención descritos en esta solicitud se ilustran mediante los siguientes ejemplos que no tienen como intención limitar la invención en ningún sentido.
Descripciones experimentales específicas
Las formas de pico de RMN en las siguientes descripciones experimentales específicas se describen tal como aparecen en los espectros, no se han considerado posibles efectos de orden mayor. Las reacciones que emplean irradiación con microondas pueden llevarse a cabo en un horno microondas Biotage Initator® de manera opcional equipado con una unidad robótica. Los tiempos de reacción reportados empleando calentamiento con microondas tienen como intención que se comprendan como tiempos de reacción fijos después de alcanzar la temperatura de reacción indicada. Los compuestos e intermedios producidos de acuerdo con los procedimientos de la invención pueden requerir purificación. La purificación de compuestos orgánicos es bien conocida para la persona con experiencia en la materia y existen varias maneras de purificar el mismo compuesto. En algunos casos, puede no ser necesario ninguna purificación. En algunos casos, los compuestos pueden purificarse por cristalización. En algunos casos, las impurezas pueden ser agitadas usando un disolvente adecuado. En algunos casos, los compuestos pueden purificarse por cromatografía, en particular cromatografía rápida en columna, usando por ejemplo cartuchos de gel de sílice preempaquetado, por ejemplo de Separtis tal como gel de sílice rápido Isolute® o gel de sílice rápido NH2 Isolute® en combinación con un autopurificador Isolera® (Biotage) y eluyentes tales como gradientes de por ejemplo hexano/acetato de etilo o DCM/metanol. En algunos casos, los compuestos pueden purificarse por HPLC preparativa usando por ejemplo un autopurificador Waters equipado con un detector de arreglo de diodos y/u un espectrómetro de masas por electroaspersión en línea en combinación con una columna en ase reversa preempaquetada adecuada y eluyentes tales como gradientes de agua y acetonitrilo el cual puede contener aditivos tales como ácido trifluoroacético, ácido fórmico o amoniaco acuoso. En algunos casos, los procedimientos de purificación como se describen en la presente pueden proveer aquellos compuestos de la presente invención que poseen una funcionalidad suficientemente básica o ácida en la forma de una sal, tal como, en el caso de un compuesto de la presente invención el cual es básico suficientemente, una sal trifluoroacetato o formiato por ejemplo, o, en el caso de un compuesto de la presente invención el cual es suficientemente ácido, una sal de amonio por ejemplo. Una sal de este tipo puede transformarse en su forma libre o ácido libre, respectivamente, por diferentes procedimientos conocidos para la persona con experiencia en la materia, o usarse como sales en ensayos biológicos posteriores. Ha de comprenderse que la forma específica (por ejemplo sal, base libre, etc.) de un compuesto de la presente invención aislado como se describe en el presente documento no es necesariamente la única forma en la cual dicho compuesto puede aplicarse a un ensayo biológico con el objetivo de cuantificar la actividad biológica específica.
Los rendimientos porcentuales informados en los siguientes ejemplos se basan en el componente de partida que se usó en la cantidad molar más bajas. Las principales condiciones de reacción no se optimizaron para el rendimiento. Se transfirieron líquidos y soluciones sensibles al aire y humedad mediante una jeringa o cánula, y se introdujo en el los recipientes de reacción mediante tabiques de goma. Los reactivos de grado comercial y los disolventes se usaron sin purificación adicional. La expresión "concentrado al vacío" se refiere al uso de un evaporador rotatorio Buchi a una mínima presión de aproximadamente 15 mm de Hg. Todas las temperaturas se informan sin corregir en grados Celsius (°C).
Con el objetivo que esta invención pueda comprenderse mejor, se describen los siguientes ejemplos. Estos ejemplos tienen el solo propósito de ilustración, y no deben ser interpretados como limitantes del alcance de la invención en ningún sentido. Todas las publicaciones mencionadas en el presente documento se incorporan en su totalidad a modo de referencia.
Condiciones de CL-EM y UPCL-EM analíticos
Los datos de CL-EM y UPCL-EM que se brindan en las siguientes descripciones experimentales específicas se refieren (a menos que se indique de una manera diferente) a las siguientes condiciones:
Procedimiento A
Instrumento: Waters Acquity UPCL-EM SingleQuad; Columna: Acquity UPLC BEH C18 1,7 pm, 50 x 2,1 mm; eluyente A: agua 0,1 vol % ácido fórmico (99 %), eluyente B: acetonitrilo; gradiente: 0-1,6 min 1-99 % B, 1,6 2,0 min 99 % B; flujo 0,8 ml/min; temperatura: 60 °C; barrido DAD: 210-400 nm.
Procedimiento B
Instrumento: Waters Acquity UPCL-EM SingleQuad; Columna: Acquity UPLC BEH C18 1,7 pm, 50 x 2,1 mm; eluyente A: agua 0,2 vol % amoniaco acuoso (32 %), eluyente B: acetonitrilo; gradiente: 0-1,6 min 1-99 % B, 1,6 2,0 min 99 % B; flujo 0,8 ml/min; temperatura: 60 °C; barrido DAD: 210-400 nm.
Procedimiento C
Instrumento: Waters Acquity UPCL-EM SingleQuad; Columna: Acquity UPLC BEH C18 1,7 pm 50 x 2,1 mm; eluyente A: agua 0,1 vol % ácido fórmico (99 %), eluyente B: acetonitrilo; gradiente: 0-4,5 min 1-99 % B, 4,5 5,0 min 99 % B; flujo 0,8 ml/min; temperatura: 60 °C; barrido DAD: 210-400 nm.
Procedimiento D
Instrumento: Waters Acquity UPCL-EM SingleQuad; Columna: Acquity UPLC BEH C18 1,7 pm, 50 x 2,1 mm; eluyente A: agua 0,2 vol % amoniaco acuoso (32 %), eluyente B: acetonitrilo; gradiente: 0-4,5 min 5-95 % B, 4,5 5,0 min 95 % B; flujo 0,8 ml/min; temperatura: 50 °C; barrido DAD: 210-400 nm.
Procedimiento E
Instrumento: Waters Acquity UPLCMS SingleQuad; Columna: Acquity UPLC BEH C18 1,7 |jm, 50 x 2,1 mm; eluyente A: agua 0,1 vol % ácido trifluoroacético, eluyente B: acetonitrilo; gradiente: 0-4,5 min 5-95% B, 4,5 5,0 min 95 % B; flujo 0,8 ml/min; temperatura: 50 °C; barrido DAD: 210-400 nm.
Procedimiento F (HPLC quiral)
Instrumento: Agilent HPLC 1260; Columna: Chiralpak IB 3 jm 100 x 4,6 mm; eluyente A: hexano 0,1 % vol. dietilamina (99 %), eluyente B: etanol; isocrático: 70 %A 30 %B; flujo 1,0 ml/min; temperatura: 25 °C; inyección: 5 jl; DAD @ 254 nm.
Procedimiento G
Instrumento: Agilent UHPLC 1290 SingleQuad; Columna: Phenomenex Kinetex C181,7 jm 50 x 2,1 mm; Eluyente A: Agua 0,1 vol % ácido trifluoroacético (99 %), Eluyente B: acetonitrilo; gradiente: 0-4,5 min 5-95 % B, 4,5 5,0 min 95 % B; flujo 0,8 ml/min; temperatura: 50 °C; dAd @ 254 nm.
Procedimiento H
Instrumento: Agilent: 1260, Aurora SFC-Modul; Columna: Luna Hilic 5 jm 100 x 4,6 mm; Eluyente A: CO2, Eluyente B: metanol 0,5 vol % amoniaco (32 %); isocrático: 20 %B; flujo 4,0 ml/min; temperatura: 37,5 °C; BPR: 10 MPa; MWD @ 254nm .
Procedimiento I
Instrumento: Waters Acquity UPCL-EM SingleQuad; Columna: Acquity UPLC BEH C18 1,7 jm , 50 x 2,1 mm; eluyente A: agua 0,1 vol % ácido fórmico (99 %), eluyente B: metanol; gradiente: 0-1,6 min 1-99 % B, 1,6-2,0 min 99 % B; flujo 0,8 ml/min; temperatura: 60 °C; barrido Da D: 210-400 nm.
Procedimiento J
Instrumento: Waters Acquity UPCL-EM SingleQuad; Columna: Acquity UPLC BEH C18 1,7 jm , 50 x 2,1 mm; eluyente A: agua 0,2 vol % amoniaco acuoso (32 %), eluyente B: metanol; gradiente: 0-1,6 min 1-99 % B, 1,6 2,0 min 99 % B; flujo 0,8 ml/min; temperatura: 60 °C; barrido DAD: 210-400 nm.
Procedimiento K
Instrumento: Agilent: 1260, Aurora SFC-Modul; Columna: Chiralpak IA 5 jm 100 x 4,6 mm; Eluyente A: CO2, Eluyente B: metanol+ 0,2 Vol-% dietilamina (99 %); isocrático: 28 %B; flujo 4,0 ml/min; temperatura: 37,5 °C; BPR: 10 MPa; MWD @ 254nm
Procedimiento L
Instrumento: Agilent: 1260, Aurora SFC-Modul; Columna: Chiralpak IA 5 jm 100 x 4,6 mm; Eluyente A: CO2, Eluyente B: etanol+ 0,2 Vol-% amoniaco acuoso (32 %); isocrático: 29 %B; flujo 4,0 ml/min; temperatura: 37,5 °C; BPR: 10 MPa; MWD @ 220nm
Procedimiento M
Instrumento: Agilent: 1260, Aurora SFC-Modul; Columna: Chiralpak IA 5 jm 100 x 4,6 mm; Eluyente A: CO2, Eluyente B: metanol+ 0,2 Vol-% dietilamina (99 %); isocrático: 28 %B; flujo 4,0 ml/min; temperatura: 37,5 °C; BPR: 10 MPa; MWD @ 254nm
Procedimiento N
Instrumento: Agilent: 1260, Aurora SFC-Modul; Columna: Chiralpak IA 5 jm 100 x 4,6 mm; Eluyente A: CO2, Eluyente B: metanol; isocrático: 21 %B; flujo 4,0 ml/min; temperatura: 37,5 °C; BPR: 10 MPa; MWD @ 254nm
Procedimiento O
Instrumento: Agilent: 1260, Aurora SFC-Modul; Columna: YMC Celulosa SC 3 j 100 x 4,6 mm; Eluyente A: hexano 0,1 Vol-% dietilamina (99 %), Eluyente B: etanol; isocrático: 10 % B; flujo 1,0 ml/min; temperatura: 25 °C; DAD @ 254 nm
Condiciones de cromatografía rápida en columna
La "purificación por cromatografía (rápida) en columna" como se describe en las siguientes descripciones experimentales específicas se refiere al uso de un sistema de purificación Biotage Isolera. Para las especificaciones técnicas véase "Biotage product catalogue" en www.biotage.com.
Procedimientos experimentales generales
Procedimiento general GP1.1
Se disolvió sulfonamida A (por ejemplo escala 1,29 mmol) en acetonitrilo (10 ml en el caso de la escala 1,29 mmol) y se añadió carbonato de cesio (1,0 eq) y el correspondiente nucleófilo (1,0 eq). Se continuó la agitación a 110 °C hasta que la TLC mostró el consumo del material de partida. Se retiró el disolvente a presión reducida, seguido por agregado de agua y diclorometano. Después, se separaron las fases, se secó la fase orgánica y se concentró al vacío. El en bruto se usó sin purificación adicional o se purificó como se indica en los ejemplos.
Procedimiento general GP1.2
Se disolvió sulfonamida A (por ejemplo 1,29 mmol) en acetonitrilo (15 ml en el caso de la escala 1,29 mmol) y se añadió carbonato de potasio (3,0 eq) finamente molido y el correspondiente azol (1,5 eq). Se continuó la agitación a entre 100 y 110 °C hasta que la t Lc mostró el consumo del material de partida. Se retiró el disolvente a presión reducida, seguido por agregado de agua y diclorometano. Después, se separaron las fases, se secó la fase orgánica y se concentró al vacío. El en bruto se usó sin purificación adicional o se purificó como se indica en los ejemplos.
B C
Procedimiento general GP2.1
Se disolvió el compuesto nitro B en bruto (por ejemplo 1,29 mmol) en dioxano (15 ml en el caso de la escala 1,29 mmol) y se añadió dihidrato de cloruro de estaño (II) (3,0 eq) y la mezcla de reacción se agitó durante 2 h a 70 °C. Después de enfriar a temperatura ambiente la mezcla de reacción se filtró y se concentró al vacío. El filtrado se usó sin purificación adicional o se purificó como se indicó en los ejemplos.
Procedimiento general GP2.2
Se disolvió el compuesto nitro B en bruto (por ejemplo 1,29 mmol) en dioxano (15 ml en el caso de la escala 1,29 mmol) y se añadió dihidrato de cloruro de estaño (II) (5,0 eq) y la mezcla de reacción se agitó durante 2 h a 70 °C. Después de enfriar a temperatura ambiente la mezcla de reacción se filtró y se concentró al vacío. El filtrado se usó sin purificación adicional o se purificó como se indicó en los ejemplos.
Procedimiento general GP2.3
Se disolvió el compuesto nitro B en bruto (por ejemplo 1,29 mmol) en metanol (15 ml en el caso de la escala 1,29 mmol) y se añadió Pd/C (10 % de carga, 50 mg). El frasco se evacuó tres veces y se purgó con hidrógeno (0,1 MPa) y se continuó la agitación a temperatura ambiente. Después de completarse la reacción, la mezcla se filtró y se concentró al vacío. El en bruto se utilizó sin purificación adicional.
Procedimiento general GP2.4
Se disolvió el compuesto nitro B en bruto (por ejemplo 1,29 mmol) en metanol/dioxano (15 ml en el caso de la escala 1.29 mmol) y se añadió Pd/C (10 % de carga, 50 mg). El frasco se evacuó tres veces y se purgó con hidrógeno (0,1 MPa) y se continuó la agitación a temperatura ambiente. Después de completarse la reacción, la mezcla se filtró y se concentró al vacío. El en bruto se utilizó sin purificación adicional.
Procedimiento general GP2.5
Se disolvió compuesto nitro B en bruto (por ejemplo 1,29 mmol) en metanol/dioxano (15 ml en el caso de la escala 1.29 mmol) y se cargó Pt/C (10 % de carga, 50 mg). El frasco se evacuó tres veces y se purgó con hidrógeno (0,1 MPa) y se continuó la agitación a temperatura ambiente. Después de completarse la reacción, la mezcla se filtró y se concentró al vacío. El en bruto se utilizó sin purificación adicional.
C D
Procedimiento general GP3.1
Se disolvió anilina sustituida en bruto C (por ejemplo 1,29 mmol) en dimetilformamida (6 ml en el caso de la escala 1,29 mmol) seguido por el agregado del correspondiente ácido (cantidad tal como se indica en los ejemplos), N,N-diisopropiletilamina (4,5 eq a base de ácido) y HATU (1,5 eq a base de ácido). La mezcla de reacción se agitó durante la noche a temperatura ambiente o se calentó a 50 °C hasta que la TLC mostró el consumo del material de partida. Después de enfriar a temperatura ambiente la mezcla de reacción se concentró al vacío. Se añadió acetato de etilo y agua, se secó la fase orgánica y se concentró al vacío. El en bruto se utilizó sin purificación adicional.
Procedimiento general GP3.2
Se disolvió anilina sustituida en bruto C (1,29 mmol) en dimetilformamida (10 ml en el caso de la escala 1,29 mmol) seguido por el agregado del correspondiente ácido (cantidad tal como se indica en los ejemplos), N,N-diisopropiletilamina (2,7 eq a base de ácido) y HATU (1,0 eq a base de ácido). La mezcla de reacción se agitó durante la noche a temperatura ambiente o se calentó a 50 °C hasta que la TLC mostró el consumo del material de partida. Después de enfriar a temperatura ambiente la mezcla de reacción se concentró al vacío. Se añadió acetato de etilo y agua, se secó la fase orgánica y se concentró al vacío. El en bruto se utilizó sin purificación adicional.
Procedimiento general GP3.3
Se disolvió anilina sustituida en bruto C (1,29 mmol) en dimetilformamida (10 ml en el caso de la escala 1,29 mmol) seguido por el agregado del correspondiente ácido (cantidad tal como se indica en los ejemplos), N,N-diisopropiletilamina (2,7 eq a base de ácido) y HATU (1,0 eq a base de ácido). La mezcla de reacción se agitó durante la noche a temperatura ambiente o se calentó a 50 °C hasta que la TLC mostró el consumo del material de partida. Después de enfriar a temperatura ambiente la mezcla de reacción se concentró al vacío. Se añadió acetato de etilo y agua, se secó la fase orgánica y se concentró al vacío. El en bruto se utilizó sin purificación adicional.
Procedimiento general GP3.4
Se disolvió anilina sustituida en bruto C (1,29 mmol) en dimetilformamida (10 ml en el caso de la escala 1,29 mmol) seguido por el agregado del correspondiente ácido (cantidad tal como se indica en los ejemplos), N,N-diisopropiletilamina (2,0 eq a base de ácido) y HATU (1,0 eq a base de ácido). La mezcla de reacción se agitó durante la noche a temperatura ambiente o se calentó a 50 °C hasta que la TLC mostró el consumo del material de partida. Después de enfriar a temperatura ambiente la mezcla de reacción se concentró al vacío. Se añadió acetato de etilo y agua, se secó la fase orgánica y se concentró al vacío. El en bruto se utilizó sin purificación adicional.
Procedimiento general GP3.5
Se disolvió anilina sustituida en bruto C (1,29 mmol) en dimetilformamida (10 ml en el caso de la escala 1,29 mmol) seguido por el agregado del correspondiente ácido (cantidad tal como se indica en los ejemplos), N,N-diisopropiletilamina (4,0 eq a base de ácido) y HATU (1,3 eq a base de ácido). La mezcla de reacción se agitó durante la noche a temperatura ambiente o se calentó a 50 °C hasta que la TLC mostró el consumo del material de partida. Después de enfriar a temperatura ambiente la mezcla de reacción se concentró al vacío. Se añadió acetato de etilo y agua, se secó la fase orgánica y se concentró al vacío. El en bruto se utilizó sin purificación adicional.
Procedimiento general GP4.1
Se disolvió amida en bruto D (por ejemplo 1,29 mmol) en diclorometano (5-10 ml en el caso de la escala 1,29 mmol), se añadió ácido trifluoroacético (50 eq) y la mezcla de reacción se agitó a temperatura ambiente hasta que la TLC mostró el consumo del material de partida. La mezcla de reacción se concentró al vacío, se añadió acetato de etilo y agua al en bruto y la fase orgánica se secó y se retiró el disolvente a presión reducida. El residuo resultante se purificó como se indica en los ejemplos. La purificación sin extracción acuosa fue posible pero hizo más difícil la purificación por HPLC.
Procedimiento general GP4.2
Se disolvió amida en bruto D (por ejemplo 1,29 mmol) en diclorometano/ácido trifluoroacético 2/1 (6 ml en el caso de la escala 1,29 mmol) y la mezcla de reacción se agitó a temperatura ambiente hasta que la TLC mostró el consumo del material de partida. La mezcla de reacción se concentró al vacío, se añadió acetato de etilo y agua al en bruto y la fase orgánica se secó y se retiró el disolvente a presión reducida. El residuo resultante se purificó como se indica en los ejemplos. La purificación sin extracción acuosa fue posible pero hizo más difícil la purificación por HPLC.
Procedimiento general GP4.3
Se disolvió amida en bruto D (por ejemplo 1,29 mmol) en diclorometano/ácido trifluoroacético 1/1 (6 ml en el caso de escala 1,29 mmol) y la mezcla de reacción se agitó a temperatura ambiente hasta que la TLC mostró el consumo del material de partida. La mezcla de reacción se concentró al vacío, se añadió acetato de etilo y agua al en bruto y la fase orgánica se secó y se retiró el disolvente a presión reducida. El residuo resultante se purificó como se indica en los ejemplos. La purificación sin extracción acuosa fue posible pero hizo más difícil la purificación por HPLC.
C E
Procedimiento general GP5.1
Se añadieron soluciones de anilina sustituida C (0,20 mmol en 0,4 ml de 1 -metil-2-pirrolidon), el correspondiente ácido (0,40 mmol en 0,8 ml de 1 -metil-2-pirrolidon), HATU (0,40 mmol en 0,8 ml de 1 -metil-2-pirrolidon), N-metilmorfolina (0,80 mmol en 0,267 ml de 1 -metil-2-pirrolidon, que contenía 2,5 % de 4-dimetilaminopiridina) y se agitaron durante la noche. Después, se concentró al vacío y se redisolvió el residuo en ácido trifluoroacético/diclorometano 3/1 (2 ml, que contenían agua 5 %). La mezcla de reacción se agitó nuevamente durante la noche, seguido por concentración al vacío y purificación por HPLC.
Procedimiento general GP5.2
Se combinaron soluciones de anilina sustituida C (0,20 mmol en 0,8 ml de 1,2-dicloroetano) y HATU (0,40 mmol en 0,8 ml de 1,2-dicloroetano) y se añadió el correspondiente ácido (0,40 mmol) y N,N-diisopropiletilamina (103 mg, 0,80 mmol), seguido por agitación durante la noche. Después, se concentró al vacío y se redisolvió el residuo en ácido trifluoroacético (1 ml, que contenía agua 5 %). La mezcla de reacción se agitó nuevamente durante la noche, seguido por concentración al vacío y purificación por HPLC.
F E
Procedimiento general GP6.1
Se disolvió anilina sustituida en bruto F (0,137 mmol) en dimetilformamida (2 ml en el caso de escala de 0,137 mmol) seguido por el agregado del correspondiente ácido (cantidad tal como se indica en los ejemplos), N,N-diisopropiletilamina (2,7 eq a base de ácido) y HATU (1,0 eq a base de ácido). La mezcla de reacción se agitó durante la noche a temperatura ambiente seguido por concentración al vacío. Se añadió acetato de etilo y agua, se secó la fase orgánica y se concentró al vacío.
El en bruto se redisolvió en metanol (1 ml), se trató con amoniaco acuoso concentrado (70 j l ) y se agitó durante la noche. La mezcla de reacción se concentró al vacío y se purificó como se indica en los ejemplos.
Procedimiento general GP6.2
Se añadió anilina sustituida en bruto F (cantidad tal como se indica en los ejemplos) en NMP (0,4 ml) al correspondiente ácido (2 eq), seguido por HATU (2 eq) en NMP (0,8 ml) y N-metilmorfolina (4 eq) en NMP (0,27 ml, que contenía 2,5 % de 4-dimetilaminopiridina). La mezcla de reacción se agitó durante la noche. Después, se añadió
metanol (1 ml) y amoniaco concentrado acuoso (2 ml), seguido por agitación a temperatura ambiente durante 4 días. La purificación por HPLC proveyó el compuesto E deseado.
Procedimiento general GP6.3
Se disolvió anilina sustituida en bruto F (0,137 mmol) en dimetilformamida (2 ml en el caso de escala de 0,137 mmol) seguido por el agregado del correspondiente ácido (cantidad tal como se indica en los ejemplos), N,N-diisopropiletilamina (2,0 eq a base de ácido) y HATU (1,0 eq a base de ácido). La mezcla de reacción se agitó durante la noche a temperatura ambiente seguido por concentración al vacío. Se añadió acetato de etilo y agua, se secó la fase orgánica y se concentró al vacío.
El en bruto se redisolvió en metanol (2 ml), se trató con amoniaco acuoso concentrado (1 ml) y se agitó durante la noche. La mezcla de reacción se concentró al vacío y se purificó como se indica en los ejemplos.
Procedimiento general GP6.4
Se disolvió anilina sustituida en bruto F (0,137 mmol) en dimetilformamida (2 ml en el caso de escala de 0,137 mmol) seguido por el agregado del correspondiente ácido (cantidad tal como se indica en los ejemplos), N,N-diisopropiletilamina (1,5 eq a base de ácido) y HATU (1,0 eq a base de ácido). La mezcla de reacción se agitó durante la noche a temperatura ambiente seguido por concentración al vacío. Se añadió diclorometano y agua, se secó la fase orgánica y se concentró al vacío.
El en bruto se redisolvió en metanol (2 ml), se trató con amoniaco acuoso concentrado (1 ml) y se agitó durante la noche. La mezcla de reacción se concentró al vacío y se purificó como se indica en los ejemplos.
F G
Procedimiento general GP7.1
Se disolvió 1-(4-{[(2-clorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-carboxilato de metilo (cantidad tal como se indica en los ejemplos) en THF (2 ml en el caso de escala de 0,22 mmol) y el vial se purgó con argón. Se añadió la correspondiente amina (2,5 eq), seguido por agregado de bis(trimetilaluminio)-1,4-diazabiciclo[2.2.2]-octano (DABAL-Me3, 3 eq). La mezcla de reacción se agitó durante la noche a temperatura ambiente, detenido con HCl 1 M y se extrajo con etilacetato. Las fases orgánicas se lavaron con solución salina, se secaron sobre sulfato de sodio, se concentraron al vacío y se purificaron como se indica en los ejemplos.
Procedimiento general GP8.1
Se disolvió N-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (cantidad tal como se indica en los ejemplos) en metanol (1,5 ml en el caso de escala de 0,33 mmol) y se desgaseó con nitrógeno. Se añadió Bis(pinacolato)diboro (2,5 eq), mesilato[(di(1-adamantil)-n-butilfosfina)-2-(2‘-amino-1,1‘-bifenil)]paladio(N) (cataCXium® A Pd G3, 0,05 eq) y N,N-diisopropiletilamina (2,5 eq) y se agitó durante 1 hora a 50 °C. Se retiró el catalizador por filtración y el filtrado se redujo al vacío.
El en bruto se redisolvió en n-propanol (1,5 ml en el caso de escala de 0,33 mmol), seguido por desgaseado con nitrógeno. Se añadió el correspondiente bromuro de hetarilo (2 eq), fluoruro de potasio (0,23 eq), bis(tri-fercbutilfosfina)paladio(O) (0,05 eq) y trifenilfosfina (0,05 eq). Nuevamente se desgaseó con nitrógeno y se añadió fosfato de potasio (2,5 eq), seguido por irradiación durante 1 hora a 100 °C en el microondas. La mezcla de reacción se concentró al vacío y se extrajo con agua/diclorometano. Las fases orgánicas se lavaron con solución salina, se secaron sobre sulfato de sodio, se concentraron al vacío y se purificó como se indica en los ejemplos.
Procedimiento general GP8.2
Se disolvieron W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (cantidad tal como se indica en los ejemplos) en metanol (3 ml en el caso de escala 0,59 mmol) y se desgaseó con nitrógeno. Se añadió Bis(pinacolato)diboro (2,5 eq), mesilato[(di(1-adamantil)-n-butilfosfina)-2-(2‘-amino-1,1‘-bifenil)]paladio(N) (cataCXium® A Pd G3, 0,05 eq) y W,A/-diisopropiletilamina (2,5 eq) y se agitó durante 1 hora a 50 °C. Se retiró el catalizador por filtración y el filtrado se redujo al vacío.
El en bruto se redisolvió en n-propanol (3 ml en el caso de escala de 0,59 mmol), seguido por desgaseado con nitrógeno. Se añadió el correspondiente bromuro de hetarilo (2 eq), fluoruro de potasio (0,23 eq), bis(tri-tercbutilfosfina)paladio(0) (0,05 eq) y trifenilfosfina (0,05 eq). Nuevamente se desgaseó con nitrógeno y se añadió fosfato de potasio (2,5 eq), seguido por irradiación durante 1 hora a 100 °C en el microondas.
Cualquier precipitado se retiró por filtración y el filtrado se concentró al vacío y se redisolvió en metanol (2 ml en el caso de escala 0,59 mmol). Se añadió solución acuosa de hidróxido de amonio (33 %, 2 ml). Se agitó hasta que la UPCL-EM mostró que se completó la desprotección. En la mayoría de los casos la agitación durante la noche fue suficiente, en determinados casos fue necesaria una agitación más prolongada y el agregado de solución acuosa de hidróxido de amonio adicional. La mezcla de reacción después se concentró al vacío y se purificó como se indica en los ejemplos.
Síntesis de intermedios
Intermedio 1
2-Cloro-W-(2,4-dimetoxibencil)-5-mtrobencensulfonamida
A una solución de cloruro de 2-cloro-5-nitrobencensulfonilo (10,8 g, 42,2 mmol) en diclorometano (108 ml) se le añadieron bicarbonato de sodio (7,09 g, 84,4 mmol) y 1-(2,4-dimetoxifenil)metanamina (7,05 g, 42,2 mmol). La mezcla se agitó durante la noche. La mezcla de reacción se concentró al vacío, seguido de la adición de agua (75 ml) y acetato de etilo (75 ml). Después de agitar durante 10 min el precipitado resultante se separó mediante filtración y se secó a 40 °C durante la noche al vacío para dar el compuesto del título (14,1 g, 36,5 mmol, 86 % de rendimiento).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (lENneg): m/z = 385 [M-H]-RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,56 (s, 3H), 3,61 (s, 3H), 4,08 (s, 2H), 6,10 (d, 1H), 6,26 (dd, 1H), 7,04 (d, 1H), 7,79 (d, 1H), 8,19 (d, 1H), 8,28 (dd, 1H), 8,45 (s, 1H).
Intermedio 2
W-(2,4-Dimetoxibencil)-2-flúor-5-nitrobencensulfonamida
A una solución de 1-(2,4-dimetoxifenil)metanamina (0,669 g, 4,00 mmol) en diclorometano (40 ml) se le añadió en
enfriamiento con hielo, A/-etil-W-isopropilpropan-2-amina (1,29 g, 10,0 mmol). Durante 25 min se añadió una solución de cloruro de 2-flúor-5-nitrobencensulfonilo (0,958 g, 4,00 mmol) en diclorometano (10 ml) lentamente. Se continuó la agitación en enfriamiento con hielo durante 2 h, después se agitó a temperatura ambiente durante la noche. Se lavó con agua, se secó sobre sulfato de sodio y se concentró al vacío. La cromatografía en columna en un sistema Biotage Isolera (gel de sílice, gradiente n-hexano/acetato de etilo) dio el compuesto del título (400 mg, 1,08 mmol, 27 % de rendimiento, pureza 70 %).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENneg): m/z = 369 [M-H]-
Intermedio 3
W-(2,4-DimetoxibencN)-5-mtro-2-[4-(trifluorometM)-1H-pirazoM -il]bencensulfonamida
A una solución de 2-cloro-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (5,69 g, 14,7 mmol) en acetonitrilo (170 ml) se le añadieron 4-(trifluorometil)-1H-pirazol (3,00 g, 22,1 mmol) y carbonato de potasio en polvo (6,09 g, 44,1 mmol) y se agitó durante la noche a 100 °C. La mezcla de reacción se concentró al vacío y el residuo se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera y se secó sobre sulfato de sodio. La concentración a presión reducida dio el compuesto del título en bruto (7,50 g, cuant., aprox. 95% de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento B): Tr = 1,31 min; EM (lENpos): m/z = 487 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,52 (s, 3H), 3,64 (s, 3H), 4,15 (d, 2H), 6,18 (d, 1H), 6,29 (dd, 1H), 7,08 (d, 1H), 7,93 (d, 1H), 8,03 - 8,09 (m, 1H), 8,25 (d, 1H), 8,39 (s, 1H), 8,49 (dd, 1H), 8,94 (s, 1H).
Intermedio 4
2-(4-Cloro-1H-pirazoM-M)-W-(2,4-dimetoxibencM)-5-mtrobencensulfonamida
A una solución de 2-cloro-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (5,03 g, 13,0 mmol) en acetonitrilo (150 ml) se le añadieron 4-cloro-1H-pirazol (2,00 g, 19,5 mmol) y carbonato de potasio en polvo (5,39 g, 39,0 mmol) y se agitó durante la noche a 100 °C. La mezcla de reacción se concentró al vacío y el residuo se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera y se secó. La concentración al vacío dio el compuesto del título en bruto (6,27 g, cuant., aprox. 95 % de pureza) que se usó sin purificación adicional en el paso siguiente. CL-EM (Procedimiento A): Tr = 1,26 min; EM (lENpos): m/z = 453 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,48 (s, 3H), 3,62 (s, 3H), 4,15 (s, 2H), 6,14 (d, 1H), 6,27 (dd, 1H), 7,08 (d, 1H), 7,84 (d, 1H), 8,05 (s, 1H), 8,09 (d, 1H), 8,21 (d, 1H), 8,45 (dd, 1H), 8,57 (s, 1H).
Intermedio 5
W-(2,4-DimetoxibencN)-2-(4-flúor-1H-pirazoM-M)-5-mtrobencensulfonamida
A una solución de 2-doro-W-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (5,00 g, 11,6 mmol) en acetonitrilo (135 ml) se le añadieron 4-flúor-1H-pirazol (1,50 g, 17,4 mmol) y carbonato de potasio en polvo (4,82 g, 34,9 mmol) y se agitó durante la noche a 100 °C. La mezcla de reacción se concentró al vacío y el residuo se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera y se secó sobre sulfato de sodio. La concentración al vacío dio el compuesto del título en bruto (5,54 g, cuant., aprox. 85 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 1,23 min; EM (lENpos): m/z = 437 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,48 (s, 3H), 3,62 (s, 3H), 4,13 (s, 2H), 6,15 (d, 1H), 6,28 (dd, 1H), 7,09 (d, 1H), 7,81 (d, 1H), 8,00 - 8,10 (m, 2H), 8,23 (d, 1H), 8,43 (dd, 1H), 8,59 (s, 1H).
Intermedio 6
2-(4-Bromo-1H-pirazoM-M)-W-(2,4-dimetoxibencM)-5-mtrobencensulfonamida
A una solución de 2-cloro-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (1,75 g, 4,54 mmol) en acetonitrilo (53 ml) se le añadieron 4-bromo-1H-pirazol (1,00 g, 6,80 mmol) y carbonato de potasio en polvo (1,88 g, 13,6 mmol) y se agitó durante la noche a 100 °C. La mezcla de reacción se concentró al vacío y el residuo se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera y se secó sobre sulfato de sodio. La concentración al vacío dio el compuesto del título en bruto (2,38 g, cuant., aprox. 95 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 1,29 min; EM (lENpos): m/z = 497 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,48 (s, 3H), 3,62 (s, 3H), 4,13 (s, 2H), 6,15 (d, 1H), 6,28 (dd, 1H), 7,09 (d, 1H), 7,84 (d, 1H), 8,00 - 8,10 (m, 2H), 8,23 (s, 1H), 8,43 (dd, 1H), 8,65 (s, 1H).
Intermedio 7
W-(2,4-DimetoxibencN)-5-mtro-2-[3-(tN fluorometM)-1H-1,2,4-tnazoM-N]bencensulfonamida
A una solución de 2-doro-A/-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (2,00 g, 5,17 mmol) en acetonitrilo (60 ml) se le añadieron 3-(trifluorometil)-1H-1,2,4-triazol (1,06 g, 7,76 mmol) y carbonato de potasio en polvo (2,14 g, 15,5 mmol) y se agitó durante la noche a 100 °C. La mezcla de reacción se concentró al vacío y el residuo se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera y se secó sobre sulfato de sodio. La concentración al vacío dio el compuesto del título en bruto (2,33 g, 79 % de rendimiento., aprox. 85 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 1,26 min; EM (lENpos): m/z = 488 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,59 (s, 3H), 3,66 (s, 3H), 4,06 (s, 2H), 6,26 (d, 1H), 6,31 (dd, 1H), 7,02 (d, 1H), 8,02 (d, 1H), 8,36 (s, 1H), 8,40 (d, 1H), 8,55 (dd, 1H), 9,21 (s, 1H).
Intermedio 8
2-[3-(DifluorometM)-1H-1,2,4-tnazoM-M]-W-(2,4-dimetoxibencM)-5-mtrobencensulfonamida
A una solución de 2-cloro-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (550 mg, 1,42 mmol) en acetonitrilo (15 ml) se le añadieron 3-(difluorometil)-1H-1,2,4-triazol (254 mg, 2,13 mmol) y carbonato de potasio en polvo (589 mg, 4,27 mmol) y se irradió durante una hora a 120 °C en el microondas. La mezcla de reacción se concentró al vacío y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (504 mg, 1,07 mmol, 76 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (lENpos): m/z = 470 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,56 (s, 3H), 3,65 (s, 3H), 4,11 (s, 2H), 6,22 (d, 1H), 6,30 (dd, 1H), 7,05 (d, 1H), 7,31 (t, 1H), 7,98 (d, 1H), 8,17 -8,25 (m, 1H), 8,32 (d, 1H), 8,52 (dd, 1H), 9,12 (s, 1H).
Intermedio 9
-(4-Ciano-1H-pirazoM-M)-N-(2,4-dimetoxibenril)-5-mtrobencensulfonamida
A una solución de 2-doro-W-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (15,0 g, 38,8 mmol) en acetonitrilo (450 ml) se le añadieron 1H-pirazol-4-carbonitnlo (5,41 g, 93,1 mmol) y carbonato de potasio en polvo (16,1 g, 116 mmol) y se agitó durante la noche a 100 °C. La mezcla de reacción se concentró al vacío y el residuo se extrajo con acetato de etilo y agua. El compuesto del título puro precipitó y se retiró por filtración (9,09 g 20,5 mmol, 53 % de rendimiento, 97 % de pureza). La fase orgánica se lavó con salmuera y se secó sobre sulfato de sodio. La concentración al vacío dio más compuesto del título en bruto (9,11 g., aprox. 60 % de pureza).
CL-EM (Procedimiento B): Tr = 1,17 min; EM (lENneg): m/z = 442 [M-H]-RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,53 (s, 3H), 3,64 (s, 3H), 4,08 (s, 2H), 6,20 (d, 1H), 6,29 (dd, 1H), 7,07 (d, 1H), 7,89 (d, 1H), 8,12 (s a, 1H), 8,30 (s a, 1H), 8,41 - 8,54 (m, 2H), 9,17 (s a, 1H).
Intermedio 10
5-Ammo-W-(2,4-dimetoxibencM)-2-[4-(tnfluorometM)-1H-pirazol-1-N]bencensulfonamida
Se añadió Pd/C (10% de carga, 750 mg) a una solución de W-(2,4-d¡metox¡benc¡l)-5-n¡tro-2-[4-(tr¡fluoromet¡l)-1H-pirazol-1-il]bencensulfonamida (7,50 g, 14,7 mmol) en metanol (120 ml) y se agitó en una atmósfera de hidrógeno durante 4 h a temperatura ambiente. Se añadió acetato de etilo para disolver el producto precipitado, después se filtró, se lavó y se concentró al vacío para dar el compuesto del título en bruto (6,50 g, cuant., aprox. 95 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 1,20 min; EM (lENpos): m/z = 457 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,70 (s, 3H), 3,73 (s, 3H), 3,94 (d, 2H), 6,01 (s, 2H), 6,41 - 6,48 (m, 2H), 6,78 (dd, 1H), 7,09 - 7,14 (m, 2H), 7,18 - 7,27 (m, 2H), 8,12 (s, 1H), 8,56 (s, 1H).
Intermedio 11
5-Ammo-2-(4-cloro-1H-pirazol-1 -M)-W-(2,4-dimetox¡benc¡l)bencensulfonam¡da
Se añadió Pt/C (10% de carga, 600 mg) a una solución de 2-(4-doro-1H-p¡razoM-¡l)-A/-(2,4-dimetox¡benc¡l)-5-nitrobencensulfonamida en bruto (6,27 g, 13,9 mmol) en etanol (100 ml) y se agitó en una atmósfera de hidrógeno durante 24 h a temperatura ambiente. El catalizador se retiró por filtración, se lavó con acetato de etilo y el material filtrado se concentró al vacío para dar el compuesto del título en bruto (5,99 g, cuant., aprox. 90 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 1,23 min; EM (lENpos): m/z = 423 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,69 (s, 3H), 3,72 (s, 3H), 3,92 (d, 2H), 5,95 (s, 2H), 6,41 - 6,47 (m, 2H), 6,76 (dd, 1H), 7,08 -7,12 (m, 2H), 7,15 (d, 1H), 7,19 (t, 1H), 7,78 (d, 1H), 8,15 (d, 1H).
Intermedio 12
5-Ammo-W-(2,4-dimetoxibencM)-2-(4-flúoMH-pirazoM-N)bencensulfonamida
Se añadió Pt/C (10% de carga, 1,76 g) a una solución de A/-(2,4-d¡metox¡benc¡l)-2-(4-flúor-1H-p¡razol-1-¡l)-5-nitrobencensulfonamida en bruto (5,50 g, 12,6 mmol) en una mezcla de etanol (125 ml) y dioxano (200 ml) y se agitó en una atmósfera de hidrógeno durante 8 h a temperatura ambiente. El catalizador se retiró por filtración, se lavó con acetato de etilo y el material filtrado se concentró al vacío para dar el compuesto del título en bruto (5,07 g, cuant., aprox. 90 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 1,10 min
EM (lENpos): m/z = 407 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,69 (s, 3H), 3,72 (s, 3H), 3,92 (d, 2H), 5,93 (s, 2H), 6,42 - 6,47 (m, 2H), 6,78 (dd, 1H), 7,08 - 7,19 (m, 4H), 7,74 (dd, 1H), 8,07 (dd, 1H).
Intermedio 13
5-Ammo-2-(4-bromo-1H-pirazoM-M)-W-(2,4-dimetoxibencN)bencensulfonamida
Se añadió Pt/C (10% de carga, 1,76 g) a una solución de 2-(4-bromo-1H-p¡razol-1-¡l)-W-(2,4-dimetox¡benc¡l)-5-nitrobencensulfonamida en bruto (5,60 g, 12,8 mmol) en etanol (140 ml) y se agitó en una atmósfera de hidrógeno durante 14 h a temperatura ambiente. El catalizador se retiró por filtración, se lavó con acetato de etilo y el material filtrado se concentró al vacío para dar el compuesto del título en bruto (1,87 g, cuant., aprox. 90 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 1,18 min; EM (lENpos): m/z = 467 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,69 (s, 3H), 3,72 (s, 3H), 3,92 (d, 2H), 5,95 (s, 2H), 6,39 - 6,48 (m, 2H), 6,77 (dd, 1H), 7,08 - 7,23 (m, 4H), 7,79 (d, 1H), 8,15 (d, 1H).
Intermedio 14
5-Ammo-W-(2,4-dimetoxibencM)-2-[3-(tN fluorometM)-1H-1,2,4-tnazoM -il]bencensulfonamida
Se añadió Pd/C (10 % de carga, 170 mg) a una solución de A/-(2,4-d¡metox¡benc¡l)-5-n¡tro-2-[3-(tr¡fluoromet¡l)-1H-1,2,4-triazol-1-il]bencensulfonamida en bruto (2,33 g, 4,78 mmol) en metanol (45 ml) y se agitó en una atmósfera de hidrógeno durante la noche a temperatura ambiente. El catalizador se retiró por filtración, se lavó con acetato de etilo y el material filtrado se concentró al vacío para dar el compuesto del título en bruto (2,04 g, cuant., aprox. 95 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 458 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,69 (s, 3H), 3,73 (s, 3H), 3,91 (s, 2H), 6,15 (s, 2H), 6,40 - 6,49 (m, 2H), 6,80 (dd, 1H), 7,09 (d, 1H), 7,14 (d, 1H), 7,28 (d, 1H), 7,56 (s, 1H), 8,91 (d, 1H).
Intermedio 15
2-(2-Clorofeml)-W-{4-[3-(difluorometM)-1H-1,2,4-tnazoM-M]-3-[(2,4-dimetoxibencN)sulfamoM]feml}acetamida
Se añadió Pd/C (10% de carga, 22 mg) a una solución de 2-[3-(d¡fluorometil)-1H-1,2,4-tnazol-1-¡l]-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (252 mg, 0,53 mmol) en metanol (3,5 ml) y tetrahidrofurano (1,5 ml) y se agitó en una atmósfera de hidrógeno durante 6 h a temperatura ambiente. La mezcla de reacción se filtró sobre Celite y se concentró al vacío. El residuo se disolvió nuevamente en etanol (5 ml), se añadió platino/vanadio (55 mg, 1/2 % sobre carbón) y se agitó durante 3 h en una atmósfera de hidrógeno. La mezcla de reacción se filtró sobre Celite y se concentró al vacío para dar 213 mg de 5-am¡no-2-[3-(d¡fluoromet¡l)-1H-1,2,4-tr¡azol-1-¡l]-W-(2,4-d¡metox¡-bencil)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente. El material en bruto del paso previo (213 mg) se disolvió en dimetilformamida (5 ml), después se añadieron ácido (2-clorofenil)acético (124 mg, 0,727 mmol), AA-diisopropiletilamina (196 mg, 1,94 mmol) y HATU (276 mg, 0,727 mmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Después se concentró al vacío y se extrajo con acetato de etilo y agua. La fase acuosa se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se purificó mediante HPLC preparativa (112 mg, 0,189 mmol, 36 % de rendimiento al cabo de 2 pasos, 90 % de pureza). CL-EM (Procedimiento B): Tr = 1,26 min; EM (lENpos): m/z = 592 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,63 (s, 3H), 3,68 (s, 3H), 3,92 (s, 2H), 3,99 (d, 2H), 6,33 - 6,39 (m, 2H), 7,06 (d, 1H), 7,21 (t, 1H), 7,30 -7,38 (m, 2H), 7,44 -7,51 (m, 2H), 7,60 (d, 1H), 7,68 (t, 1H), 7,95 (dd, 1H), 8,20 (d, 1H), 8,92 (s, 1H), 10,79 (s, 1H).
Intermedio 16
W-{4-[3-(DifluorometM)-1H-1,2,4-tNazoM-M]-3-[(2,4-dimetoxibencil)sulfamoil]feml}-2-(2-fluorofeml)acetamida
Se añadió Pd/C (10% de carga, 22 mg) a una solución de 2-[3-(d¡fluoromet¡l)-1H-1,2,4-t^azol-1-¡l]-W-(2,4-dimetoxibencil^-nitrobencensulfonamida (252 mg, 0,53 mmol) en metanol (3,5 ml) y tetrahidrofurano (1,5 ml) y se agitó en una atmósfera de hidrógeno durante 6 h a temperatura ambiente. La mezcla de reacción se filtró sobre Celite y se concentró al vacío. El residuo se disolvió nuevamente en etanol (5 ml), se añadió platino/vanadio (55 mg, 1/2 % sobre carbón) y se agitó durante 3 h en una atmósfera de hidrógeno. La mezcla de reacción se filtró sobre Celite y se concentró al vacío para dar 213 mg de 5-am¡no-2-[3-(d¡fluoromet¡l)-1H-1,2,4-tr¡azol-1-¡l]-W-(2,4-d¡metox¡-bencil)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente. El material en bruto del paso previo (213 mg) se disolvió en dimetilformamida (5 ml), después se añadieron ácido (2-fluorofenil)acético (112 mg, 0,727 mmol), A/A-diisopropiletilamina (196 mg, 1,94 mmol) y HATU (276 mg, 0,727 mmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Después se concentró al vacío y se extrajo con acetato de etilo y agua. La fase acuosa se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron,
se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se purificó mediante HPLC preparativa (94 mg, 0,163 mmol, 31 % de rendimiento al cabo de 2 pasos, 90 % de pureza).
CL-EM (Procedimiento B): Tr = 1,21 min, EM (IENpos): m/z = 576 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,62 (s, 3H), 3,67 (s, 3H), 3,82 (s, 2H), 3,99 (d, 2H), 6,33 - 6,37 (m, 2H), 7,07 (d, 1H), 7,17 - 7,24 (m, 2H), 7,21 (t, 1H), 7,31 - 7,38 (m, 1H), 7,40 - 7,46 (m, 1H), 7,60 (d, 1H), 7,67 (t, 1H), 7,94 (dd, 1H), 8,18 (d, 1H), 8,92 (s, 1H), 10,76 (s, 1H).
Intermedio 17
2-Cloro-W-[(d¡met¡lammo)met¡len]-5-mtrobencensulfonam¡da
Se añadió 1,1-dimetoxi-N,N-dimetilmetanamina (3,02 g, 25,4 mmol) a una solución de 2-cloro-5-nitrobencensulfonamida (3,00 g, 12,7 mmol) en N,N-dimetilformamida (43 ml) y se agitó a temperatura ambiente durante 2 días. La mezcla de reacción se concentró al vacío y el residuo se extrajo con diclorometano/agua. La fase orgánica se lavó con salmuera y se secó. La concentración al vacío dio el compuesto del título en bruto (4,18 g, cuant., aprox. 90 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 0,86 min; EM (IENpos): m/z = 292 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,94 -2,96 (m, 3H), 3,20 (s, 3H), 7,91 (d, 1H), 8,31 -8,33 (m, 1H), 8,39 (dd, 1H), 8,69 (d, 1H).
Intermedio 18
W-[(D¡met¡lammo)met¡len]-5-mtro-2-[5-(tnfluorometM)pmdm-3-¡l]bencensulfonam¡da
Se disolvió 2-cloro-N-[(dimetilamino)metilen]-5-nitrobencensulfonamida (1,10 g, 3,77 mmol) en n-propanol desgasificado (33 ml) y se trató con ácido [5-(trifluorometil)piridin-3-il]borónico (1,08 g, 5,68 mmol), dicloruro de bis(trifenilfosfin)paladio(N) (132 mg, 0,189 mmol) y trifenilfosfina (49,5 mg, 0,189 mmol). Se añadió solución acuosa desgasificada de carbonato de potasio 2 M (5,65 ml), el vial se selló y se agitó durante 16 horas a 100 °C. Después de enfriar a temperatura ambiente se añadió agua, se extrajo tres veces con acetato de etilo y después se concentró al vacío.
La molécula deseada parcialmente desprotegida se protegió nuevamente como se describió previamente agitando a temperatura ambiente con 1,1-dimetoxi-N,N-dimetilmetanamina en NDMF. La mezcla de reacción se concentró al vacío y el residuo se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) para dar el compuesto del título (174 mg, 0,432 mmol, 11 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 1,08 min; EM (IENpos): m/z = 403 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,76 (s, 3H), 2,99 (s, 3H), 7,76 (s, 1H), 7,81 (d, 1H), 8,33 - 8,36 (m, 1H), 8,52 (dd, 1H), 8,76 (d, 1H), 8,88 (d, 1H), 9,09 (dd, 1H).
Intermedio 19
5-Ammo-W-[(d¡met¡lammo)met¡len]-2-[5-(tnfluoromet¡l)pmdm-3-¡l]bencensulfonam¡da
Se añadió Pd/C (10 % de carga, 21 mg) a una solución de A/-[(d¡met¡lam¡no)met¡len]-5-n¡tro-2-[5-(tr¡fluoromet¡l)p¡r¡d¡n-3-il]bencensulfonamida (174 mg, 0,39 mmol) en una mezcla de metanol (10 ml) y d¡oxano ( l0 ml) y se ag¡tó en una atmósfera de h¡drógeno durante la noche a temperatura amb¡ente. El catal¡zador se ret¡ró por f¡ltrac¡ón, se lavó con acetato de et¡lo y el mater¡al f¡ltrado se concentró al vacío para dar el compuesto del título (140 mg, cuant., 95 % de pureza) que se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
CL-EM (Proced¡m¡ento A): Tr = 0,90 m¡n; EM (lENpos): m/z = 373 [M+H]+
Intermed¡o 20
2-[1-(D¡fluoromet¡l)-1H-p¡razol-4-¡l]-W-[(d¡met¡lammo)met¡len]-5-mtrobencensulfonam¡da
Se d¡solv¡ó 2-cloro-A/-[(d¡met¡lam¡no)met¡len]-5-n¡trobencensulfonam¡da (1,00 g, 3,43 mmol) en n-propanol desgas¡f¡cado (30 ml) y se trató con 1-(d¡fluoromet¡l)-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (1,25 g, 5,14 mmol), d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (121 mg, 0,171 mmol) y tr¡fen¡lfosf¡na (45,0 mg, 0,171 mmol). Se añad¡ó soluc¡ón acuosa desgas¡f¡cada de carbonato de potas¡o 2 M (5,14 ml), el v¡al se selló y se ag¡tó durante 16 horas a 100 °C. Después de enfr¡ar a temperatura amb¡ente se añad¡ó agua, se extrajo tres veces con acetato de et¡lo y después se concentró al vacío.
El res¡duo se d¡solv¡ó nuevamente en una mezcla de metanol (25 ml) y n-propanol (25 ml) y se añad¡ó amoníaco acuoso concentrado (50 ml) para desproteger completamente la molécula deseada para fac¡l¡tar la pur¡f¡cac¡ón. La mezcla de reacc¡ón se extrajo con d¡clorometano y acetato de et¡lo. Las fases orgán¡cas se secaron, y después se concentraron al vacío y se pur¡f¡caron med¡ante HPLC preparat¡va (Chromatorex C-18 10 pm, 125x30 mm, aceton¡tr¡lo/agua 0,1% de amoníaco acuoso (32%)) para dar 2-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-5-n¡trobencensulfonam¡da (383 mg).
Después, la molécula deseada desproteg¡da se proteg¡ó nuevamente como se descr¡be precedentemente ag¡tando a temperatura amb¡ente con 1,1-d¡metox¡-A/,W-d¡met¡lmetanam¡na en DMF. La concentrac¡ón al vacío d¡o el compuesto del título (418 mg) que se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
CL-EM (Proced¡m¡ento B): Tr = 0,98 m¡n; EM (lENpos): m/z = 374 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,76 (d, 3H), 3,02 (s, 3H), 7,85 (d, 1H), 7,91 - 7,93 (m, 2H), 7,95 (t, 1H), 8,19 -8,21 (m, 1H), 8,43 (dd, 1H), 8,72 (d, 1H), 8,77 (d, 1H).
Intermed¡o 21
5-Ammo-2-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-W-[(d¡met¡lammo)met¡len]bencensulfonam¡da
Se añadió Pd/C (10% de carga, 54 mg) a una solución de 2-[1-(d¡fluorometil)-1H-p¡razol-4-¡l]-A/-[(dimetilamino)metilen]-5-nitrobencensulfonamida (418 mg, 1,01 mmol) en una mezcla de metanol (10 ml) y dioxano (10 ml) y se agitó en una atmósfera de hidrógeno durante la noche a temperatura ambiente. El catalizador se retiró por filtración, se lavó con acetato de etilo y el material filtrado se concentró al vacío para dar el compuesto del título en bruto (370 mg, cuant., 90 % de pureza) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento A): Tr = 0,74 min; EM (lENpos): m/z = 344 [M+H]+
Intermedio 22
2-(2-Clorofeml)-W-(3-{[(d¡met¡lammo)metMen]sulfamoM}-4-[4-(tr¡fluorometM)-1H-p¡razol-1-¡l]feml)acetam¡da
Se disolvió 2-(2-clorofen¡l)-A/-{3-sulfamo¡l-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l}acetam¡da (2,00 g, 3,92 mmol) en dimetilformamida (13,3 ml) y se trató con dimetilacetato de dimetilformamida (935 mg, 7,85 mmol), después se agitó a temperatura ambiente durante el fin de semana. La mezcla de reacción se redujo al vacío y se extrajo con diclorometano y agua. El compuesto deseado había precipitado parcialmente. La fase orgánica se secó, se concentró al vacío y se purificó adicionalmente agitando como suspensión en n-propanol, después se filtró. Las fracciones precipitadas se combinaron para dar el compuesto del título con pureza suficiente para los pasos siguientes (1,33 g, 2,59 mmol, 66 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 1,19 min; EM (lENpos): m/z = 514 [M+H]+
Isómero E/Z mayoritario RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,77 (s, 3H), 3,01 (s, 3H), 3,91 (s, 2H), 7,30 - 7,36 (m, 2H), 7,43 - 7,52 (m, 3H), 7,58 (s, 1H), 7,97 (dd, 1H), 8,14 (s, 1H), 8,38 (d, 1H), 8,62 - 8,64 (m, 1H), 10,80 (s, 1H).
Intermed¡o 23
2-(2-Clorofeml)-W-[3-{[(d¡met¡lammo)met¡len]sulfamoM}-4-(4-flúor-1H-p¡razol-1-¡l)feml]acetam¡da
Se disolvió 2-(2-dorofeml)-W-[4-(4-flúor-1H-p¡razol-1-¡l)-3-sulfamoilfeml]acetam¡da (125 mg, 0,31 mmol) en dimetilformamida (1 ml) y se trató con dimetilacetato de dimetilformamida (72,9 mg, 0,61 mmol), después se agitó a temperatura ambiente durante el fin de semana. La mezcla de reacción se redujo al vacío y se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró al vacío para dar el compuesto del título con pureza suficiente para los pasos siguientes (167 mg, quant).
CL-EM (Procedimiento A): Tr = 1,06 min; EM (IENpos): m/z = 464 [M+H]+
Intermedio 24
W-(2,4-DimetoxibencN)-2-(4-metiMH-pirazoM-M)-5-mtrobencensulfonamida
A una solución de 2-cloro-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (800 mg, 2,07 mmol) en acetonitrilo (16 ml) se le añadieron 4-metil-1H-pirazol (260 pl, 3,1 mmol, CAS-RN 7554-65-5) y carbonato de potasio en polvo (857 mg, 6,20 mmol) y se irradió durante 2 h a 140 °C en el microondas. Después de la adición de más 4-metil-1 H-pirazol (347 pl, 4,1 mmol) la mezcla nuevamente se irradió durante 2h a 140 °C en el microondas. La mezcla de reacción se concentró al vacío y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (718 mg, 64 % de rendimiento, 80 % de pureza).
CL-EM (Procedimiento B): Tr = 1,30 min; EM (IENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,13 (s, 3H), 3,41 (s, 3H), 3,60 (s, 3H), 4,17 (d, 2H), 6,09 (d, 1H), 6,26 (dd, 1H), 7,09 (d, 1H), 7,77 (d, 1H), 7,81 (s, 1H), 8,11 (s, 1H), 8,17 (d, 1H), 8,28 (t, 1H), 8,40 (dd, 1H).
Intermedio 25
W-(2,4-DimetoxibencN)-2-(3-metoxMH-1,2,4-tnazoM-M)-5-mtrobencensulfonamida
A una solución de 2-cloro-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (700 mg, 1,81 mmol) en acetonitrilo (19 ml) se le añadieron 3-metoxi-4H-1,2,4-triazol (269 mg, 2,71 mmol) y carbonato de potasio en polvo (750 mg, 5,43 mmol) y la mezcla se irradió durante 1 ha 120 °C en el microondas. La mezcla de reacción se filtró y se concentró al vacío, y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (293 mg, 31 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 450 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,30 (s, 3H), 3,51 (s, 3H), 3,62 (s, 3H), 4,12 (d, 2H), 6,16 (d, 1H), 6,27 (dd, 1H), 7,09 (d, 1H), 7,83 (t, 1H), 7,85 (d, 1H), 8,18 (d, 1H), 8,35 (s, 1H), 8,43 (dd, 1H).
Intermedio 26
2-(4-C¡cloprop¡l-1H-¡m¡dazol-1-¡l)-W-(2,4-d¡metox¡benc¡l)-5-mtrobencensulfonam¡da
A una solución de 2-cloro-A/-(2,4-d¡metox¡bendl)-5-n¡trobencensulfonam¡da (700 mg, 1,81 mmol) en acetonitrilo (14 ml) se le añadieron 5-dcloprop¡l-1H-im¡dazol (294 mg, 2,71 mmol, CAS-RN 89830-98-8) y carbonato de potasio en polvo (750 mg, 5,43 mmol) y la mezcla se irradió durante 1 h a 120 °C en el microondas. Se añadió 4-ciclopropil-1H-imidazol (196 mg, 1,81 mmol), y la irradiación de microondas se continuó durante 2h a 140 °C. La mezcla de reacción se filtró y se concentró al vacío, y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (309 mg, 22 % de rendimiento, 60 % de pureza).
CL-EM (Procedimiento A): Tr = 1,06 min; EM (lENpos): m/z = 459 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 0,71 (m, 2H), 0,82 (m, 2H), 1,87 (m, 1H), 3,61 (s, 3H), 3,68 (s, 3H), 4,01 (d, 2H), 6,33 (d, 1H), 6,36 (dd, 1H), 7,02 (d, 1H), 7,17 (s, 1H), 7,67 (d, 1H), 7,74 (s, 1H), 8,41 (dd, 1H), 8,43 (d, 1H), 8,49 (t, 1H).
Intermed¡o 27
W-(2,4-D¡metox¡benc¡l)-2-(4-met¡l-1H-¡m¡dazol-1-¡l)-5-mtrobencensulfonam¡da
A una solución de 2-cloro-A/-(2,4-d¡metox¡bendl)-5-n¡trobencensulfonam¡da (700 mg, 1,81 mmol) en acetonitrilo (14 ml) se le añadieron 5-metil-1H-im¡dazol (223 mg, 2,71 mmol, CAS-RN 822-36-6) y carbonato de potasio en polvo (750 mg, 5,43 mmol) y la mezcla se irradió durante 2 h a 110 °C en el microondas. Se añadió 4-metil-1H-im¡dazol (223 mg, 2,71 mmol), y la irradiación de microondas se continuó durante 2 h a 110 °C. La mezcla de reacción se filtró y se concentró al vacío, y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (252 mg, 29 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento B): Tr = 1,03 min; EM (lENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,18 (s, 3H), 3,60 (s, 3H), 3,68 (s, 3H), 4,01 (d, 2H), 6,33 (d, 1H), 6,34 (dd, 1H), 7,00 (d, 1H), 7,12 (s, 1H), 7,66 (d, 1H), 7,75 (s, 1H), 8,41 (dd, 1H), 8,43 (d, 1H), 8,46 (t, 1H).
Intermed¡o 28
2-(3-C¡cloprop¡l-1H-p¡razol-1-¡l)-W-(2,4-d¡metox¡benc¡l)-5-mtrobencensulfonam¡da
A una solución de 2-doro-A/-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (700 mg, 1,81 mmol) en acetonitrilo (14 ml) se le añadieron 3-dclopropiMH-pirazol (240 pl, 2,71 mmol, CAS-RN 100114-57-6) y carbonato de potasio en polvo (750 mg, 5,43 mmol) y la mezcla se irradió durante 1 h a 120 °C en el microondas. Se añadió 5-dclopropil-1H-pirazol (240 pl, 2,71 mmol), y la irradiación de microondas se continuó durante 2 h a 140 °C. La mezcla de reacción se filtró y se concentró al vacío, y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (187 mg, 21 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 1,34 min, EM (lENpos): m/z = 459 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 0,76 (m, 2H), 1,00 (m, 2H), 2,03 (m, 1H), 3,40 (s, 3H), 3,60 (s, 3H), 4,17 (s, 2H), 6,11 (d, 1H), 6,28 (dd, 1H), 6,42 (d, 1H), 7,09 (d, 1H), 7,78 (d, 1H), 8,18 (d, 1H), 8,21 (d, 1H), 8,37 (t, 1H), 8,39 (dd, 1H).
Intermedio 29
N-(2,4-Dimetoxibencil)-5-mtro-2-(2H-pirazolo[3,4-b]pmdm-2-N)bencensulfonamida
A una solución de 2-doro-A/-(2,4-d¡metox¡bendl)-5-n¡trobencensulfonam¡da (700 mg, 1,81 mmol) en acetonitrilo (18 ml) se le añadieron 1H-p¡razolo[3,4-6]p¡^d¡na (307 mg, 2,58 mmol, CAS-RN 271-73-8) y carbonato de potasio en polvo (750 mg, 5,43 mmol) y la mezcla se irradió durante 2 h a 120 °C en el microondas. La mezcla de reacción se filtró y se concentró al vacío, y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (428 mg, 37 % de rendimiento, 70 % de pureza).
CL-EM (Procedimiento B): Tr = 1,24 min; EM (lENpos): m/z = 470 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,51 (s, 3H), 3,62 (s, 3H), 4,20 (d, 2H), 6,15 (d, 1H), 6,29 (dd, 1H), 7,13 (d, 1H), 7,45 (dd, 1H), 7,98 (t, 1H), 8,14 (d, 1H), 8,24 (dd, 1H), 8,46 (dd, 1H), 8,52 (d, 1H), 8,63 (dd, 1H), 8,65 (s, 1H).
Intermedio 30
W-(2,4-D¡metox¡benc¡l)-5-mtro-2-(2H-p¡razolo[3,4-c]pmdm-2-¡l)bencensulfonam¡da
A una solución de 2-doro-A/-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (700 mg, 1,81 mmol) en acetonitrilo (18 ml) se le añadieron 1H-pirazolo[3,4-c]pindina (307 mg, 2,58 mmol, CAS-RN 271-47-6) y carbonato de potasio en polvo (750 mg, 5,43 mmol) y la mezcla se irradió durante 2 h a 120 °C en el microondas. La mezcla de reacción se filtró y se concentró al vacío, y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (610 mg, 72 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 1,15 min, EM (lENpos): m/z = 470 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,55 (s, 3H), 3,64 (s, 3H), 4,15 (d, 2H), 6,19 (d, 1H), 6,29 (dd, 1H), 7,07 (d, 1H), 7,96 (dd, 1H), 7,99 (t, 1H), 8,10 (d, 1H), 8,33 (d, 1H), 8,45 (d, 1H), 8,50 (dd, 1H), 8,71 (d, 1H), 9,00 (s, 1H).
Intermedio 31
W-(2,4-D¡metox¡benc¡l)-5-mtro-2-(2H-p¡razolo[4,3-6]pmdm-2-¡l)bencensulfonam¡da
A una solución de 2-cloro-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (700 mg, 1,81 mmol) en acetonitrilo (18 ml) se le añadieron 1H-pirazolo[4,3-6]pmdina (307 mg, 2,58 mmol, CAS-RN 272-52-6) y carbonato de potasio en polvo (750 mg, 5,43 mmol) y la mezcla se irradió durante 2 h a 120 °C en el microondas. La mezcla de reacción se filtró y se concentró al vacío, y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (270 mg, 20 % de rendimiento, 60 % de pureza).
CL-EM (Procedimiento B): Tr = 1,16 min; EM (lENpos): m/z = 470 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,55 (s, 3H), 3,63 (s, 3H), 4,16 (d, 2H), 6,18 (d, 1H), 6,29 (dd, 1H), 7,08 (d, 1H), 7,54 (dd, 1H), 7,99 (d, 1H), 8,00 (t, 1H), 8,01 (dd, 1H), 8,32 (d, 1H), 8,49 (dd, 1H), 8,71 (dd, 1H), 8,80 (s, 1H).
Intermed¡o32
W-(2,4-D¡metox¡benc¡l)-2-[4-(2-metox¡et¡l)-1H-p¡razol-1-M]-5-mtrobencensulfonam¡da
A una solución de 2-doro-A/-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (1,41 g, 3,65 mmol) en acetonitrilo (16 ml) se le añadieron 4-(2-metoxietil)-1H-pirazol (260 pl, 3,1 mmol, CAS-RN 1696383-18-12) y carbonato de potasio en polvo (1,51 g, 10,9 mmol) y se irradió durante 2h a 140 °C en el microondas. La mezcla de reacción se filtró, se concentró al vacío, y el residuo se purificó mediante HPLC (300 mg, 15 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento B): Tr = 1,26 min; EM (lENpos): m/z = 477 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,75 (t, 2H), 3,29 (s, 3H), 3,43 (s, 3H), 3,55 (t, 2H), 3,60 (s, 3H), 4,16 (d, 2H), 6,11 (d, 1H), 6,26 (dd, 1H), 7,09 (d, 1H), 7,78 (d, 1H), 7,85 (s, 1H), 8,17 (s, 1H), 8,19 (d, 1H), 8,26 (t, 1H), 8,40 (dd, 1H).
Intermedio 33
W-(2,4-DimetoxibencN)-2-(3-flúor-1H-pirazoM-M)-5-mtrobencensulfonamida
A una solución de 2-cloro-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (700 mg, 1,81 mmol) en acetonitrilo (19 ml) se le añadieron 3-flúor-1H-pirazol (234 mg, 2,71 mmol, CAS-RN 14521-81-4) y carbonato de potasio en polvo (750 mg, 5,43 mmol) y la mezcla se irradió durante 2h a 120 °C en el microondas. Se añadió 3-flúor-1H-pirazol (234 mg, 2,71 mmol), y la irradiación de microondas se continuó durante 2 h a 120 °C. La mezcla de reacción se filtró y se concentró al vacío, y el residuo se extrajo con diclorometano y agua. La fase acuosa se lavó tres veces con diclorometano. Después las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (567 mg, 61 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento B): Tr = 1,25 min; EM (lENpos): m/z = 437 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,52 (s, 3H), 3,63 (s, 3H), 4,14 (s, 2H), 6,19 (d, 1H), 6,28 (dd, 1H), 6,46 (dd, 1H), 7,06 (d, 1H), 7,82 (d, 1H), 8,04 (s, 1H), 8,23 (dd, 1H), 8,26 (d, 1H), 8,44 (dd, 1H).
Intermedio 34
W-(2,2-Difluoroetil)-1H-pirazol-4-amma
A una solución de 1H-pirazol-4-amina (300 mg, 95 % de pureza, 3,43 mmol) en acetonitrilo (17 ml) se le añadieron
trifluorometansulfonato de 2,2-difluoroetilo (690 pl, 5,1 mmol, CAS-RN 74427-22-8), carbonato de potasio en polvo (1,06 g, 7,65 mmol), y trietilamina (720 pl, 5,1 mmol). La mezcla se calentó a 120 °C durante la noche. Para el tratamiento posterior, se filtró, y el sólido se enjuagó con acetato de etilo. La concentración del material filtrado al vacío seguida por cromatografía ultrarrápida dio el compuesto del título (505 mg, 90 % de rendimiento, 90 % de pureza). CL-EM (Procedimiento B): Tr = 0,43 min
EM (lENpos): m/z = 148 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,23 (tdd, 2H), 4,72 (t, 1H), 6,05 (tt, 1H), 7,12 (s, 2H), 12,10 (s, 1H).
Intermedio 35
2-{4-[(2,2-Difluoroetil)ammo]-1H-pirazoM-M}-N-(2,4-dimetoxibencil)-5-mtrobencensulfonamida
A una solución de 2-cloro-A/-(2,4-dimetox¡benc¡l)-5-n¡trobencensulfonam¡da (623 mg, 1,53 mmol) en acetonitrilo (16 ml) se le añadieron W-(2,2-difluoroetil)-1H-pirazol-4-amina (500 mg, 3,06 mmol) y carbonato de potasio en polvo (634 mg, 4,59 mmol) y se irradió durante 12 h a 120 °C en el microondas. La mezcla de reacción se filtró, se concentró al vacío, y el residuo se purificó mediante cromatografía ultrarrápida (280 mg, 31 % de rendimiento, 85 % de pureza). CL-EM (Procedimiento A): Tr = 1,23 min; EM (lENpos): m/z = 498 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,38 (m, 2H), 3,38 (s, 3H), 3,59 (s, 3H), 4,16 (d, 2H), 5,49 (t, 1H), 6,08 (d, 1H), 6,15 (tt, 1H), 6,25 (dd, 1H), 7,08 (d, 1H), 7,65 (s, 1H), 7,73 (d, 1H), 7,80 (s, 1H), 8,17 (d, 1H), 8,24 (t, 1H), 8,38 (dd, 1H).
Intermedio 36
N-(2,4-DimetoxibencN)-2-[4-(2-hidroxietM)-1H-pirazoM-M]-5-mtrobencensulfonamida
A una solución de 2-cloro-A/-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (661 mg, 1,71 mmol) en acetonitrilo (13 ml) se le añadieron 2-(1H-pirazol-4-il)etanol (383 mg, 3,42 mmol, CAS-RN 180207-57-2) y carbonato de potasio en polvo (944 mg, 6,83 mmol), y la mezcla se irradió durante 2 h a 140 °C en el microondas. La mezcla de reacción se diluyó con agua y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (285 mg, 34 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 1,08 min; EM (lENpos): m/z = 463 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,66 (t, 2H), 3,42 (s, 3H), 3,60 (s, 3H), 3,62 (td, 2H), 4,17 (d, 2H), 4,75 (t, 1H), 6,11 (d, 1H), 6,26 (dd, 1H), 7,09 (d, 1H), 7,78 (d, 1H), 7,85 (s, 1H), 8,15 (s, 1H), 8,19 (d, 1H), 8,28 (t, 1H), 8,40 (dd, 1H).
Intermedio 37
W-(2,4-D¡metox¡benc¡l)-5-mtro-2-[4-(2-oxoetM)-1H-p¡razoM-¡l]bencensulfonam¡da
A una solución de W-(2,4-d¡metox¡benc¡l)-2-[4-(2-h¡drox¡et¡l)-1H-p¡razol-1-¡l]-5-n¡trobencensulfonam¡da (279 mg, 573 |jmol, 95% de pureza) en d¡clorometano (19 ml) se le añad¡ó 1,1,1-tr¡s(acet¡lox¡)-1A5,2-benc¡odoxol-3(1H)-ona (486 mg, 1,15 mmol), y la mezcla se ag¡tó durante 2 h a temperatura amb¡ente. La mezcla de reacc¡ón se d¡luyó con soluc¡ón acuosa de t¡osulfato de sod¡o (10 %) y soluc¡ón acuosa saturada de carbonato ác¡do de sod¡o (1:1), y se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se lavaron con salmuera y se secaron usando un f¡ltro Whatman. La concentrac¡ón a pres¡ón reduc¡da d¡o el compuesto del título en bruto que se usó s¡n pur¡f¡cac¡ón ad¡c¡onal (440 mg, 33 % de rend¡m¡ento, 20 % de pureza).
CL-EM (Proced¡m¡ento B): Tr = 1,11 m¡n; EM (lENpos): m/z = 461 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,44 (s, 3H), 3,61 (s, 3H), 3,77 (t, 2H), 4,17 (d, 2H), 6,12 (d, 1H), 6,27 (dd, 1H), 7,09 (d, 1H), 7,80 (d, 1H), 7,90 (s, 1H), 8,20 (d, 1H), 8,23 (t, 1H), 8,26 (s, 1H), 8,42 (dd, 1H), 9,71 (t, 1H).
Intermedio 38
2-[4-(2,2-D¡fluoroetM)-1H-p¡razoM-il]-W-(2,4-d¡metox¡bencM)-5-mtrobencensulfonam¡da
A una soluc¡ón de A/-(2,4-d¡metox¡benc¡l)-5-n¡tro-2-[4-(2-oxoet¡l)-1H-p¡razol-1-¡l]bencensulfonam¡da en bruto (440 mg, 191 jmol, 20% de pureza) en tetrah¡drofurano (500 j l) se le añad¡ó 2-metox¡-W-(2-metox¡et¡l)-A/-(tr¡fluoro-A4-sulfan¡l)etanam¡na (210 ml, 2,7 M en tolueno, 570 jmol), y la mezcla se ag¡tó a temperatura amb¡ente durante la noche. La mezcla de reacc¡ón se d¡luyó con acetato de et¡lo, y se lavó con soluc¡ón acuosa saturada de carbonato ác¡do de sod¡o y con salmuera. La fase orgán¡ca se secó usando un f¡ltro Whatman y se evaporó al vacío. La pur¡f¡cac¡ón med¡ante cromatografía ultrarráp¡da d¡o el compuesto del título (56 mg, 43 % de rend¡m¡ento, 70 % de pureza). CL-EM (Proced¡m¡ento B): Tr = 1,26 m¡n; EM (lENpos): m/z = 483 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,16 (td, 2H), 3,44 (s, 3H), 3,61 (s, 3H), 4,16 (d, 2H), 6,12 (d, 1H), 6,26 (tt, 1H), 6,26 (dd, 1H), 7,09 (d, 1H), 7,79 (d, 1H), 7,89 (s, 1H), 8,20 (d, 1H), 8,20 (t, 1H), 8,26 (s, 1H), 8,42 (dd, 1H).
Intermed¡o 39
2-(2-Clorofeml)-W-{4-[4-(2,2-d¡fluoroetM)-1H-p¡razoM-M]-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (530 mg, 2,35 mmol) a una solución de 2-[4-(2,2-difluoroetil)-1H-pirazol-1-il]-A/-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (227 mg, 469 pmol) en dioxano (6 ml), después se agitó durante 6 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. La fase orgánica combinada se filtró sobre Celite, se lavó con salmuera, se secó usando sulfato de sodio, y se concentró al vacío para dar 245 mg de 5-amino-2-[4-(2,2-difluoroetil)-1H-pirazol-1-il]-W-(2,4-dimetoxibencil)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (217 mg) se disolvió en DMF (6 ml), después se añadieron ácido (2-clorofenil)acético (84 mg, 492 pmol), A/,W-diisopropiletilamina (230 pl, 1,3 mmol) y HATU (187 mg, 492 pmol). La mezcla de reacción se agitó durante 3,5 h a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (336 mg, 40 % de pureza, 47 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,34 min; EM (lENpos): m/z = 605 (M+H)+
Intermedio 40
2,2-D¡fluoro-W-(1H-p¡razol-4-ilmet¡l)etanamma
A una solución de diclorhidrato de 1-(1H-pirazol-4-il)metanamina (500 mg, 2,94 mmol) en acetonitrilo (30 ml) se le añadieron trifluorometansulfonato de 2,2-difluoroetilo (590 pl, 4,4 mmol, CAS-RN 74427-22-8), carbonato de potasio en polvo (1,02 g, 7,35 mmol), y trietilamina (1,2 ml, 8,8 mmol). La mezcla se calentó a 100 °C durante 4 h y a 70 °C durante la noche. Para el tratamiento posterior, se filtró, y el sólido se enjuagó con diclorometano. La concentración del material filtrado al vacío seguida por extracción del residuo con diclorometano y evaporación de la fase orgánica dio el compuesto del título (482 mg, 86 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento B): Tr = 0,49 min; EM (lENpos): m/z = 162 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,82 (td, 2H), 3,61 (s, 2H), 5,98 (tt, 1H), 7,50 (s, 2H).
Intermedio 41
(2,2-difluoroetil)(1H-p¡razol-4-¡lmet¡l)carbamato de tere-butilo
A una solución de 2,2-difluoro-A/-(1H-pirazol-4-ilmetil)etanamina (370 mg, 2,30 mmol) en diclorometano (23 ml) se le añadió dicarbonato de di-ferc-butilo (551 mg, 2,53 mmol), y la mezcla se agitó durante 90 min a temperatura ambiente. La mezcla de reacción se diluyó con solución acuosa saturada de carbonato ácido de sodio, y se extrajo con diclorometano. Las fases orgánicas combinadas se concentraron a presión reducida dando el compuesto del título en bruto que se usó sin purificación adicional (302 mg, 45 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (lENpos): m/z = 262 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,82 (td, 2H), 3,62 (s, 2H), 5,99 (tt, 1H), 7,74 (s, 2H), 8,12 (s, 2H).
Intermedio 42
2-(4-{[(2,2-D¡fluoroet¡l)ammo]met¡l}-1H-p¡razoM-¡l)-W-(2,4-d¡metox¡benc¡l)-5-mtrobencensulfonam¡da
A una solución de 2-cloro-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (200 mg, 517 |jmol) en acetonitrilo (10 ml) se le añadieron (2,2-difluoroetil)(1H-pirazol-4-ilmetil)carbamato de ferc-butilo (300 mg, 90 % de pureza, 1,03 mmol) y carbonato de potasio en polvo (286 mg, 2,07 mmol), y la mezcla se irradió durante 4 h a 120 °C en el microondas. La mezcla de reacción se diluyó con agua y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (84 mg, 22 % de rendimiento, 70 % de pureza).
CL-EM (Procedimiento B): Tr = 1,21 min: EM (lENpos): m/z = 512 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,89 (td, 2H), 3,44 (s, 3H), 3,61 (s, 3H), 3,71 (s, 2H), 4,16 (d, 2H), 6,02 (tt, 1H), 6,12 (d, 1H), 6,27 (dd, 1H), 7,09 (d, 1H), 7,80 (d, 1H), 7,90 (s, 1H), 8,19 (d, 1H), 8,21 (s, 1H), 8,26 (t, 1H), 8,41 (dd, 1H).
Intermedio 43
(2,2-d¡fluoroet¡l)[(1-{2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-mtrofeml}-1H-p¡razol-4-¡l)met¡l]carbamato de terc-but¡lo
A una solución de 2-(4-{[(2,2-difluoroetil)amino]metil}-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (370 mg, 723 jm ol) en diclorometano (7 ml) se le añadieron dicarbonato de di-ferc-butilo (174 mg, 796 jm ol) y 4-(dimetilamino)piridina (4,4 mg, 36 jmol), y la mezcla se agitó durante la noche a temperatura ambiente. Se añadió otra porción de dicarbonato de di-ferc-butil(174 mg, 796 jm ol) y 4-(dimetilamino)piridina (4,4 mg, 36 jmol), y la agitación se continuó durante 3 h. La mezcla de reacción se diluyó con solución acuosa saturada de carbonato ácido de sodio, y se extrajo con diclorometano. Las fases orgánicas combinadas se concentraron a presión reducida dando el compuesto del título en bruto que se usó sin purificación adicional (150 mg, 17 % de rendimiento, 50 % de pureza). CL-Em (Procedimiento B): Tr = 1,42 min
EM (lENpos): m/z = 612 (M+H)+
Intermed¡o 44
{[1-(4-{[(2-clorofeml)acet¡l]ammo}-2-[(2,4-d¡metox¡bendl)sulfamo¡l]feml)-1H-p¡razol-4-¡l]met¡l}(2,2-d¡fluoroet¡l)carbamato de terc-but¡lo
Se añadió dihidrato de cloruro de estaño (II) (277 mg, 1,23 mmol) a una solución de (2,2-difluoroetil)[(1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-il)metil]carbamato de ferc-butilo (150 mg, 123 |jmol, 50% de pureza) en dioxano (3 ml), después se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. La fase orgánica combinada se filtró sobre Celite, se lavó con salmuera, se secó usando sulfato de sodio, y se concentró al vacío para dar 74 mg de [(1-{4-amino-2-[(2,4-dimetoxibencil)sulfamoil]fenil}-1H-pirazol-4-il)metil](2,2-difluoroetil)carbamato de ferc-butilo en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (74 mg) se disolvió en DMF (2,5 ml), después se añadió ácido (2-clorofenil)acético (33 mg, 191 jmol), A/,W-diisopropiletilamina (89 jl, 510 jm ol) y HATU (72,6 mg, 191 jmol). La mezcla de reacción se agitó durante 3 h a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (76 mg, 50 % de pureza, 42 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,36 min; EM (lENpos): m/z = 734 (M+H)+
Intermedio 45
2-(Bencilsulfanil)-4-nitrobenzonitrilo
A una solución de 2-bromo-4-nitrobenzonitrilo (400 mg, 1,76 mmol) en dioxano (34 ml) se le añadieron fenilmetanotiol (197 jl, 1,67 mmol), (9,9-dimetil-9H-xanten-4,5-diil)bis(difenilfosfano) (51 mg, 88 jmol), aducto tr¡s(dibencilidenacetona)dipaladio(0) cloroformo (91 mg, 88 jmol), y A/,W-diisopropiletilamina (614 jl, 3,5 mmol), y la mezcla se agitó durante 3 h a 100 °C. La mezcla de reacción se concentró al vacío, y se recogió en agua y acetato de etilo. La fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (457 mg, 91 % de rendimiento, 95 % de pureza).
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 4,58 (s, 2H), 7,28 (dd, 1H), 7,35 (dd, 2H), 7,44 (d, 2H), 8,10 (dd, 1H), 8,12 (d, 1H), 8,30 (d, 1H).
Intermedio 46
2-Ciano-W-(2,4-d¡metox¡bencM)-5-mtrobencensulfonam¡da
Se agitó 2-(bencilsulfanil)-4-nitrobenzonitrilo (450 mg, 1,55 mmol, 95% de pureza) con W-clorosuccimida (634 mg, 4,75 mmol) en ácido acético (15 ml) a temperatura ambiente durante 3 h. La mezcla de reacción se concentró al vacío para dar 390 mg de cloruro de 2-ciano-5-nitrobencensulfonilo en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (390 mg) se disolvió en diclorometano (7,7 ml), después se añadieron 1-(2,4-dimetoxifenil)metanamina (291 mg, 1,74 mmol), y carbonato ácido de sodio (531 mg, 6,33 mmol) a 0 °C. La mezcla de reacción se agitó durante 1 h a 0 °C y durante 1 h a temperatura ambiente. La mezcla de reacción se concentró al vacío, y se recogió en agua y acetato de etilo. La fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (118 mg, 12 % de rendimiento, 60 % de pureza).
CL-EM (Procedimiento B): Tr = 1,05 min; EM (lENpos): m/z = 378 (M+H)+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 3,56 (s, 3H), 3,62 (s, 3H), 4,11 (d, 2H), 6,11 (d, 1H), 6,26 (dd, 1H), 7,02 (d, 1H), 8,20 (d, 1H), 8,26 (d, 1H), 8,43 (dd, 1H), 8,76 (t, 1H).
Intermedio 47
2-[(2,4-D¡metox¡benc¡l)sulfamo¡l]-W-h¡drox¡-4-mtrobencencarbox¡m¡dam¡da
Se disolvió cloruro de hidroxiamonio (258 mg, 3,71 mmol) en DMSO (5 ml). Se añadió ferc-butilato de potasio (416 mg, 3,71 mmol) en pequeñas porciones a 10 °C, después se agitó durante 1 h. Después se añadió una solución de 2-ciano-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (140 mg, 371 pmol) en DMSO (3 ml), y la mezcla se agitó durante la noche a temperatura ambiente. La mezcla de reacción se vertió sobre agua helada. El precipitado se filtró y se secó al vacío para dar el compuesto del título (126 mg, 74 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento B): Tr = 0,99 min; EM (lENneg): m/z = 409 (M-H)-RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,47 (s, 3H), 3,60 (s, 3H), 4,07 (d, 2H), 6,08 (d, 1H), 6,23 (s, 2H), 6,25 (dd, 1H), 7,06 (d, 1H), 7,79 (d, 1H), 7,89 (t, 1H), 8,03 (d, 1H), 8,33 (dd, 1H), 10,02 (s, 1H).
Intermed¡o 48
W-(2,4-D¡metox¡benc¡l)-5-mtro-2-[5-(tr¡fluoromet¡l)-1,2,4-oxad¡azol-3-¡l]bencensulfonam¡da
Se agitó 2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-W-h¡droxi-4-n¡trobencencarbox¡m¡dam¡da (125 mg, 305 |jmol) con anhídrido trifluoroacético (47 jl, 340 jm ol) en tetrah¡drofurano (2,5 ml) a reflujo durante 2 h y a temperatura amb¡ente durante la noche. Se añadió más anhídrido trifluoroacético (43 jl, 300 jm ol) y la reacción se calentó a reflujo durante 90 min. La mezcla de reacción se colocó en agua y se extrajo con acetato de etilo. La fase orgánica se lavó con salmuera, se secó sobre un filtro Whatman, y se concentró a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (87 mg, 56 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,36 min; EM (lENneg): m/z = 487 (M-H)-RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,54 (s, 3H), 3,64 (s, 3H), 4,07 (d, 2H), 6,22 (d, 1H), 6,27 (dd, 1H), 7,01 (d, 1H), 7,99 (d, 1H), 8,13 (t, 1H), 8,41 (d, 1H), 8,52 (dd, 1H).
Intermedio 49
2-(2-Clorofen¡l)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamoM]-4-[5-(tr¡fluorometM)-1,2,4-oxad¡azol-3-¡l]feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (196 mg, 870 jm ol) a una solución de W-(2,4-dimetox¡benc¡l)-5-nitro-2-[5-(trifluorometil)-1,2,4-oxad¡azol-3-¡l]bencensulfonam¡da (85,0 mg, 174 jmol) en dioxano (2,2 ml), después se agitó durante 4 h a 70 °C y durante la noche a temperatura ambiente. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. La fase orgánica combinada se filtró sobre Celite, se secó sobre un filtro Whatman, y se concentró al vacío para dar 74 mg de 5-amino-A/-(2,4-dimetox¡benc¡l)-2-[5-(tr¡fluoromet¡l)-1,2,4-oxad¡azol-3-¡l]bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (70 mg) se disolvió en DMF (3 ml), después se añadieron ácido (2-clorofenil)acético (31,3 mg, 183 jmol), N,N-di¡soprop¡let¡lam¡na (110 jl, 610 jm ol) y HATU (69,7 mg, 183 jmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (112 mg, 40 % de pureza, 8 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,36 min; EM (lENneg): m/z = 609 (M-H)-
Intermed¡o 50
2-(2-Clorofeml)-N-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(4-met¡l-1H-p¡razoM-¡l)feml}acetam¡da
Se añadió platino/vanadio (130 mg, 1/2% sobre carbón) a una solución de W-(2,4-dimetoxibencil)-2-(4-metil-1H-pirazol-1-il)-5-nitrobencensulfonamida (540 mg, 80% de pureza, 1,00 mmol) en etanol (12 ml) y se agitó en una atmósfera de hidrógeno durante tres días a temperatura ambiente. La mezcla de reacción se filtró sobre Celite y se concentró al vacío para dar 520 mg de 5-amino-A/-(2,4-dimetoxibencil)-2-(4-metil-1H-pirazol-1-il)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (520 mg) se disolvió en DMF (13 ml), después se añadieron ácido (2-clorofenil)acético (331 mg, 1,94 mmol), DMF (900 pl, 5,2 mmol) y HATU (737 mg, 1,94 mmol). La mezcla de reacción se agitó durante 72 h a temperatura ambiente. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se purificó mediante HPLC preparativa (176 mg, 60 % de pureza, 19 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,34 min; EM (lENpos): m/z = 555 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,09 (s, 3H), 3,59 (s, 3H), 3,66 (s, 3H), 3,79 (s, 2H), 4,01 (d, 2H), 6,33 (d, 1H), 6,34 (dd, 1H), 7,07 (d, 1H), 7,15 (m, 2H), 7,33 (m, 2H), 7,44 (d, 1H), 7,60 (s, 1H), 7,77 (t, 1H), 7,83 (s, 1H), 7,93 (dd, 1H), 8,06 (d, 1H), 10,63 (s, 1H).
Intermedio 51
2-(2-Clorofeml)-W-{3-[(2,4-dimetoxibencil)sulfamoM]-4-(3-metoxi-1H-1,2,4-tNazoM -il)fenil}acetamida
Se añadió platino/vanadio (71 mg, 1/2 % sobre carbón) a una solución de W-(2,4-dimetoxibencil)-2-(3-metoxi-1H-1,2,4-triazol-1-il)-5-nitrobencensulfonamida (290 mg, 85% de pureza, 0,55 mmol) en etanol (6 ml) y se agitó en una atmósfera de hidrógeno durante dos días a temperatura ambiente. La mezcla de reacción se filtró sobre Celite y se concentró al vacío para dar 520 mg de 5-amino-W-(2,4-dimetoxibencil)-2-(3-metoxi-1H-1,2,4-triazol-1-il)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (200 mg) se disolvió en DMF (5 ml), después se añadieron ácido (2-clorofenil)acético (331 mg, 1,94 mmol), A/,W-diisopropiletilamina (332 pl, 1,9 mmol) y Ha TU (272 mg, 0,72 mmol). La mezcla de reacción se agitó durante 24 h a temperatura ambiente. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se purificó mediante HPLC preparativa (17 mg, 60 % de pureza, 3 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,16 min; EM (lENpos): m/z = 572 [M+H]+
Intermedio 52
2-(2-Clorofenil)-N-{4-(4-ciclopropN-1H-imidazoM-M)-3-[(2,4-dimetoxibencN)sulfamoN]feml}acetamida
Se añadió dihidrato de cloruro de estaño (II) (244 mg, 1,08 mmol) a una solución de 2-(4-ciclopropil-1H-imidazol-1-il)-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (99,0 mg, 216 pmol) en dioxano (5 ml) y se agitó durante 2 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. La fase orgánica combinada se filtró sobre Celite, se lavó con salmuera, se secó usando un filtro Whatman, y se concentró al vacío para dar 140 mg de 5-amino-2-(4-ciclopropil-1H-imidazol-1-il)-A/-(2,4-dimetoxibencil)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (140 mg) se disolvió en DMF (3,4 ml), después se añadieron ácido (2-clorofenil)acético (83,6 mg, 490 pmol), A/,W-diisopropiletilamina (230 pl, 1,3 mmol) y HATU (186 mg, 490 pmol). La mezcla de reacción se agitó durante la noche a 60 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (35 mg, 52 % de pureza, 15 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,25 min; EM (lENpos): m/z = 581 [M+H]+
Intermedio 53
2-(2-Clorofeml)-N-{3-[(2,4-dimetoxibencN)sulfamoM]-4-(4-metiMH-imidazoM-N)feml}acetamida
Se añadió dihidrato de cloruro de estaño (II) (784 mg, 1,08 mmol) a una solución de W-(2,4-dimetoxibencil)-2-(4-metil-1H-imidazol-1-il)-5-nitrobencensulfonamida (300 mg, 695 pmol) en dioxano (16 ml) y se agitó durante 2,5 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman, y se concentraron al vacío para dar 243 mg de 5-amino-W-(2,4-dimetoxibencil)-2-(4-metil-1H-imidazol-1-il)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (243 mg) se disolvió en DMF (6,2 ml), después se añadieron ácido (2-clorofenil)acético (154 mg, 904 pmol), A/,W-diisopropiletilamina (420 pl, 2,4 mmol) y Ha TU (344 mg, 904 pmol). La mezcla de reacción se agitó durante la noche a 60 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se purificó mediante HPLC (69 mg, 85 % de pureza, 15 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,19 min, EM (IENpos): m/z = 555 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,13 (s, 3H), 3,64 (s, 3H), 3,71 (s, 3H), 3,89 (d, 2H), 3,90 (s, 2H), 6,42 (dd, 1H), 6,44 (d, 1H), 6,88 (d, 1H), 7,04 (d, 1H), 7,32 (m, 2H), 7,33 (d, 1H), 7,45 (m, 2H), 7,51 (d, 1H), 7,71 (t, 1H), 7,88 (dd, 1H), 8,26 (d, 1H), 10,73 (s, 1H).
Intermedio 54
2-(2-Clorofeml)-W-{4-(3-c¡cloprop¡l-1H-p¡razol-1-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (437 mg, 1,94 mmol) a una solución de 2-(3-ciclopropil-1H-pirazol-1-il)-A/-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (187 mg, 387 pmol) en dioxano (9 ml) y se agitó durante 4,5 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 170 mg de 5-amino-2-(3-ciclopropil-1H-pirazol-1-il)-W-(2,4-dimetoxibencil)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (170 mg) se disolvió en DMF (3,3 ml), después se añadieron ácido (2-clorofenil)acético (81 mg, 475 pmol), A/,W-diisopropiletilamina (220 pl, 1,3 mmol) y HATU (180 mg, 475 pmol). La mezcla de reacción se agitó durante la noche a 60 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (306 mg, 60 % de pureza, 82 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,39 min; EM (lENpos): m/z = 581 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 0,61 (m, 2H), 0,87 (m, 2H), 1,89 (m, 1H), 3,57 (s, 3H), 3,68 (s, 3H), 3,90 (s, 2H), 4,00 (d, 2H), 6,24 (d, 1H), 6,36 (d, 1H), 6,37 (dd, 1H), 7,08 (d, 1H), 7,33 (m, 2H), 7,45 (d, 1H), 7,46 (m, 2H), 7,83 (t, 1H), 7,91 (d, 1H), 7,94 (dd, 1H), 8,10 (d, 1H), 10,66 (s, 1H).
Intermed¡o 55
2-(2-Clorofeml)-N-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(2H-p¡razolo[3,4-b]pmdm-2-¡l)feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (721 mg, 3,19 mmol) a una solución de W-(2,4-dimetoxibencil)-5-nitro-2-(2H-pirazolo[3,4-8]piridin-2-il)bencensulfonamida (428 mg, 70 % de pureza, 639 pmol) en dioxano (15 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 339 mg de 5-amino-W-(2,4-dimetoxibencil)-2-(2H-pirazolo[3,4-8]piridin-2-il)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente. El material en bruto del paso previo (339 mg) se disolvió en DMF (6,4 ml), después se añadieron ácido (2-clorofenil)acético (158 mg, 925 pmol), A/,W-diisopropiletilamina (430 pl, 2,5 mmol) y Ha TU (352 mg, 925 pmol). La mezcla de reacción se agitó durante 5 h a 100 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (751 mg, 45 % de pureza, 89 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,30 min; EM (IENpos): m/z = 592 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,68 (s, 3H), 3,69 (s, 3H), 3,93 (s, 2H), 4,03 (d, 2H), 6,37 (dd, 1H), 6,40 (d, 1H),
7,10 (d, 1H), 7,34 (m, 3H), 7,38 (t, 1H), 7,48 (m, 2H), 7,63 (d, 1H), 7,99 (dd, 1H), 8,22 (d, 1H), 8,37 (dd, 1H), 8,47 (s, 1H), 8,52 (dd, 1H), 10,74 (s, 1H).
Intermedio 56
2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencN)sulfamoM]-4-(2H-pirazolo[3,4-c]pmdm-2-N)feml}acetamida
Se añadió dihidrato de cloruro de estaño (II) (1,39 g, 6,17 mmol) a una solución de W-(2,4-dimetoxibencil)-5-nitro-2-(2H-pirazolo[3,4-c]piridin-2-il)bencensulfonamida (610 mg, 1,23 mmol) en dioxano (28 ml) y se agitó durante 4h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 498 mg de 5-amino-W-(2,4-dimetoxibencil)-2-(2H-pirazolo[3,4-c]piridin-2-il)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (498 mg) se disolvió en DMF (9,9 ml), después se añadieron ácido (2-clorofenil)acético (246 mg, 1,44 mmol), A/,W-diisopropiletilamina (670 pl, 3,8 mmol) y HATU (549 mg, 1,44 mmol). La mezcla de reacción se agitó durante la noche a 60 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (1,09 g, 50 % de pureza, 75 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,26 min; EM (lENpos): m/z = 592 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,67 (s, 3H), 3,69 (s, 3H), 3,94 (s, 2H), 4,00 (d, 2H), 6,36 (dd, 1H), 6,38 (d, 1H), 7,08 (d, 1H), 7,35 (m, 2H), 7,40 (t, 1H), 7,48 (m, 2H), 7,68 (d, 1H), 7,87 (dd, 1H), 8,01 (dd, 1H), 8,25 (d, 1H), 8,35 (d, 1H), 8,53 (s, 1H), 8,80 (s, 1H), 10,79 (s, 1H).
Intermedio 57
2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencN)sulfamoM]-4-(2H-pirazolo[4,3-b]pmdm-2-N)feml}acetamida
Se añadió dihidrato de cloruro de estaño (II) (389 mg, 1,72 mmol) a una solución de W-(2,4-dimetoxibencil)-5-nitro-2-(2H-pirazolo[4,3-8]piridin-2-il)bencensulfonamida (270 mg, 60 % de pureza, 345 pmol) en dioxano (8 ml) y se agitó durante 195 min a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 214 mg de 5-amino-W-(2,4-dimetoxibencil)-2-(2H-pirazolo[4,3-8]piridin-2-il)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (214 mg) se disolvió en DMF (3 ml), después se añadieron ácido (2-clorofenil)acético (75 mg, 437 pmol), W,A/-diisopropiletilamina (25 pl, 150 pmol) y HATU (166 mg, 437 pmol). La mezcla
de reacción se agitó durante la noche a 80 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (405 mg, 25 % de pureza, 50 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,25 min; EM (IENneg): m/z = 590 [M-H]-
Intermedio 58
2-(2-ClorofenM)-W-{3-[(2,4-dimetoxibencN)sulfamoM]-4-[4-(2-metoxietM)-1H-pirazoM-N]feml}acetamida
Se añadió dihidrato de cloruro de estaño (II) (389 mg, 1,72 mmol) a una solución de A/-(2,4-dimetoxibencil)-2-[4-(2-metoxietil)-1H-pirazol-1-il]-5-nitrobencensulfonamida (928 mg, 80 % de pureza, 1,56 mmol) en dioxano (20 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando sulfato de sodio, y se concentraron al vacío para dar 578 mg de 5-amino-A/-(2,4-dimetoxibencil)-2-[4-(2-metoxietil)-1H-pirazol-1-il]bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (255 mg) se disolvió en DMF (6 ml), después se añadieron ácido (2-clorofenil)acético (195 mg, 1,14 mmol), A/,W-diisopropiletilamina (400 pl, 2,3 mmol) y Ha TU (434 mg, 1,14 mmol). La mezcla de reacción se agitó durante 2 días a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (556 mg, 50 % de pureza, 30 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,32 min; EM (lENpos): m/z = 599 [M+H]+
Intermedio 59
2-(2-Clorofenil)-W-{3-[(2,4-dimetoxibencN)sulfamoM]-4-(3-flúoMH-pirazoM -il)fenil}acetamida
Se añadió dihidrato de cloruro de estaño (II) (1,21 g, 5,36 mmol) a una solución de A/-(2,4-dimetoxibencil)-2-(3-flúor-1H-pirazol-1-il)-5-nitrobencensulfonamida (550 mg, 85 % de pureza, 1,07 mmol) en dioxano (25 ml) y se agitó durante 3 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 1,0 g de 5-amino-W-(2,4-dimetoxibencil)-2-(3-flúor-1H-pirazol-1-il)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (1,0 g) se disolvió en DMF (7,6 ml), después se añadieron ácido (2-clorofenil)acético (189 mg, 1,11 mmol), A/,W-diisopropiletilamina (64 pl, 370 pmol) y Ha TU (421 mg, 1,11 mmol). La
mezcla de reacción se agitó durante la noche a 60 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (847 mg, 40 % de pureza, 57 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,34 min; EM (lENpos): m/z = 559 [M+H]+
Intermedio 60
2-(2-Clorofeml)-W-(4-{4-[(2,2-difluoroetil)ammo]-1H-pirazoM-il}-3-[(2,4-dimetoxibencil)sulfamoil]feml)acetamida
Se añadió dihidrato de cloruro de estaño (II) (318 mg, 1,41 mmol) a una solución de 2-{4-[(2,2-difluoroetil)amino]-1H-pirazol-1-il}-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (140 mg, 281 pmol) en dioxano (3,6 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 114 mg de 5-amino-2-{4-[(2,2-difluoroetil)amino]-1H-pirazol-1-il}-A/-(2,4-dimetoxibencil)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (107 mg) se disolvió en DMF (4,5 ml), después se añadieron ácido (2-clorofenil)acético (48 mg, 282 pmol), A/,W-diisopropiletilamina (160 pl, 940 pmol) y HATU (107 mg, 282 pmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (196 mg, 30 % de pureza, 34 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,27 min; EM (lENpos): m/z = 620 [M+H]+
Intermedio 61
N-{3-[(2,4-DimetoxibencN)sulfamoN]-4-(4-metiMH-pirazoM-N)feml}-2-(2-fluorofeml)acetamida
Se añadió dihidrato de cloruro de estaño (II) (1,49 g, 6,61 mmol) a una solución de A/-(2,4-dimetoxibencil)-2-(4-metil-1H-pirazol-1-il)-5-nitrobencensulfonamida (715 mg, 80 % de pureza, 1,32 mmol) en dioxano (17 ml) y se agitó durante 4,5 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 440 mg de 5-amino-W-(2,4-dimetoxibencil)-2-(4-metil-1H-pirazol-1-il)bencenosulfonamida en bruto que se usó sin purificación adicional en el paso siguiente. El material en bruto del paso previo (435 mg) se disolvió en DMF (8 ml), después se añadieron ácido (2fluorofenil)acético (187 mg, 1,22 mmol), WW-diisopropiletilamina (565 pl, 3,2 mmol) y HATU (462 mg, 1,22 mmol). La mezcla de reacción se agitó durante la noche a 60 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (634 mg, 65 % de pureza, 58 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,31 min; EM (lENpos): m/z = 539 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,09 (s, 3H), 3,60 (s, 3H), 3,67 (s, 3H), 3,90 (s, 2H), 4,00 (d, 2H), 6,34 (dd, 1H), 6,35 (d, 1H), 7,06 (d, 1H), 7,33 (m, 2H), 7,44 (d, 1H), 7,46 (m, 2H), 7,60 (s, 1H), 7,76 (t, 1H), 7,83 (s, 1H), 7,93 (dd, 1H), 8,08 (d, 1H), 10,65 (s, 1H).
Intermedio 62
2-(2-Fluorofeml)-W-{4-(4-c¡cloprop¡l-1H-¡m¡dazol-1-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (650 mg, 2,88 mmol) a una solución de 2-(4-ciclopropil-1 W-imidazol-1 -il)-W-^^-dimetoxibencil^-nitrobencensulfonamida (440,0 mg, 60 % de pureza, 576 pmol) en dioxano (13 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 252 mg de 5-am¡no-2-(4-c¡cloprop¡l-1H-¡m¡dazol-1-¡l)-W-(2,4-d¡metox¡benc¡l)bencensulfonam¡da en bruto que se usó sin purificación adicional en el paso siguiente. El material en bruto del paso previo (250 mg) se disolvió en DMF (1,2 ml), después se añadieron ácido (2-fluorofenil)acético (27,0 mg, 175 pmol), W,W-diisopropiletilamina (81 pl, 470 pmol) y HATU (67 mg, 175 pmol). La mezcla de reacción se agitó durante la noche a 60 °C y durante otras 2,5 ha 100 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (50 mg, 50 % de pureza, 8 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,21 min; EM (lENpos): m/z = 565 [M+H]+
Intermed¡o 63
W-{4-(3-C¡cloprop¡l-1H-p¡razol-1-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]feml}-2-(2-fluorofeml)acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (783 mg, 3,47 mmol) a una solución de 2-(3-ciclopropil-1 W-pirazol-1-il)-W-^^-dimetoxibencil^-nitrobencensulfonamida (530 mg, 60% de pureza, 694 pmol) en dioxano (16 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 315 mg de 5-amino-2-(3-ciclopropil-1 H-pirazol1-¡l)-W-(2,4-d¡metoxibenc¡l)bencensulfonam¡da en bruto que se usó sin purificación adicional en el paso siguiente. El material en bruto del paso previo (315 mg) se disolvió en DMF (5,7 ml), después se añadieron ácido (2-fluorofenil)acético (127 mg, 827 pmol), AZA-diisopropiletilamina (380 pl, 2,2 mmol) y Ha TU (314 mg, 827 pmol). La mezcla de reacción se agitó durante la noche a 60 °C. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (507 mg, 50 % de pureza, 65 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,36 min; EM (lENpos): m/z = 565 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 0,61 (m, 2H), 0,87 (m, 2H), 1,89 (m, 1H), 3,56 (s, 3H), 3,67 (s, 3H), 3,79 (s, 2H), 4,00 (d, 2H), 6,24 (d, 1H), 6,35 (d, 1H), 6,36 (dd, 1H), 7,07 (d, 1H), 7,33 (m, 2H), 7,42 (m, 2H), 7,44 (d, 1H), 7,84 (t, 1H), 7,91 (d, 1H), 7,95 (dd, 1H), 8,07 (d, 1H), 10,64 (s, 1H).
Intermedio 64
W-{3-[(2,4-DimetoxibencN)sulfamoN]-4-[4-(2-metoxietM)-1H-pirazoM-N]feml}-2-(2-fluorofeml)acetamida
Se añadió dihidrato de cloruro de estaño (II) (389 mg, 1,72 mmol) a una solución de W-(2,4-dimetoxibencil)-2-[4-(2-metox¡et¡l)-1H-p¡razol-1-¡l]-5-n¡trobencensulfonam¡da (928 mg, 80 % de pureza, 1,56 mmol) en dioxano (20 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando sulfato de sodio, y se concentraron al vacío para dar 578 mg de 5-amino-A/-(2,4-d¡metox¡benc¡l)-2-[4-(2-metox¡et¡l)-1H-p¡razol-1-¡l]bencensulfonam¡da en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (255 mg) se disolvió en DMF (6 ml), después se añadieron ácido (2-fluorofenil)acético (176 mg, 1,14 mmol), A, A-diisopropiletilamina (400 pl, 2,3 mmol) y Ha TU (434 mg, 1,14 mmol). La mezcla de reacción se agitó durante 2 días a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (503 mg, 50 % de pureza, 28 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,29 min; EM (lENpos): m/z = 583 [M+H]+
Intermedio 65
ácido 2-(bencilsulfanil)-4-nitrobenzoico
A una solución de ácido 2-bromo-4-nitrobenzoico (5,00 g, 20,3 mmol) en dioxano (500 ml) se le añadieron fenilmetanotiol (2,4 ml, 20,3 mmol), ^^-dim etil^H-xanten^^-dN^bis^ifenilfosfano) (588 mg, 1,02 mmol), aducto
tris(dibencilidenacetona)dipaladio(0) cloroformo (1,05 g, 1,02 |jmol), y NN-diisopropiletNamina (7,1 ml, 41 mmol), y la mezcla se agitó durante 2h a 100 °C. La mezcla de reacción se concentró al vacío, y se purificó mediante cromatografía ultrarrápida para dar el compuesto del título (6,2 g, 96 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (IENneg): m/z = 288 (M-H)-RMN 1H (400MHz, DMSO-da) 8 [ppm]: 4,37 (s, 2H), 7,28 (dd, 1H), 7,36 (dd, 2H), 7,47 (d, 2H), 7,99 (dd, 1H), 8,08 (d, 1H), 8,20 (d, 1H).
Intermedio 66
2-(Bencilsulfanil)-4-nitrobenzohidrazida
A una suspensión de ácido 2-(benc¡lsulfan¡l)-4-n¡trobenzo¡co (8,41 g, 29,1 mmol) en tetrahidrofurano (220 ml) se le añadieron NN-diciclohexilcarbodiimida (6,6 g, 32 mmol), 1-h¡drox¡p¡rrol¡d¡n-2,5-d¡ona (3,68 g, 32 mmol), y N,N-diisopropiletilamina (5,6 ml, 32 mmol), y la mezcla se agitó durante 1 h a temperatura ambiente. Después se añadió hidrato de hidrazina (1:1) (1,6 ml, 32 mmol), y se continuó la agitación a temperatura ambiente durante 21 h. Se añadió agua a la mezcla de reacción, y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (3,71 g, 36 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (lENpos): m/z = 304 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 4,36 (s, 2H), 4,56 (s, 2H), 7,26 (dd, 1H), 7,33 (dd, 2H), 7,41 (d, 2H), 7,56 (d, 1H), 8,01 (dd, 1H), 8,14 (d, 1H), 9,78 (s, 1H).
Intermedio 67
2-(BencMsulfaml)-4-mtro-W-(trifluoroacetil)benzohidrazida
A una suspensión de 2-(benc¡lsulfan¡l)-4-n¡trobenzoh¡draz¡da (3,70 g, 85% de pureza, 10,4 mmol) en acetonitrilo (86 ml) se le añadieron NN-diisopropiletNamina (2,2 ml, 12 mmol), y anhídrido trifluoroacético (1,6 ml, 11 mmol) a -50 °C. La mezcla se dejó calentar a temperatura ambiente y se agitó durante 17 h. La reacción se vertió sobre solución acuosa de hidróxido de sodio (5 %). La mezcla se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (4,35 g, 84 % de rendimiento, 80 % de pureza). CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENneg): m/z = 398 (M-H)-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 4,38 (s, 2H), 7,25 (dd, 1H), 7,33 (dd, 2H), 7,42 (d, 2H), 7,66 (d, 1H), 8,03 (dd, 1H), 8,16 (d, 1H).
Intermedio 68
2-[2-(Bencilsulfanil)-4-nitrofenil]-5-(trifluorometil)-1,3,4-oxadiazol
Una solución de 2-(bencilsulfaml)-4-mtro-W-(trifluoroacet¡l)benzohidraz¡da (4,34 g, 80 % de pureza, 8,69 mmol) y 2,2-dióxido de 3,3,3-tr¡et¡l-1-(metox¡carbon¡l)d¡azat¡an-3-¡o-1-¡da (8,29 g, 34,8 mmol) en tetrahidrofurano (150 ml) se irradió durante 30 min a 150 °C en el microondas. Se añadió agua a la mezcla de reacción, y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (3,28 g, 94 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,43 min; EM (lENpos): m/z = 382 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 4,55 (s, 2H), 7,29 (dd, 1H), 7,35 (dd, 2H), 7,47 (d, 2H), 8,16 (dd, 1H), 8,22 (d, 1H), 8,38 (d, 1H).
Intermedio 69
W-(2,4-D¡metox¡benc¡l)-5-mtro-2-[5-(tr¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]bencensulfonam¡da
Se agitó 2-[2-(benc¡lsulfan¡l)-4-n¡trofen¡l]-5-(tr¡fluoromet¡l)-1,3,4-oxad¡azol (3,60 g, 95 % de pureza, 8,97 mmol) con N-clorosuccimida (3,59 g, 26,9 mmol) en ácido acético (80 ml) a temperatura ambiente durante 6 h. La mezcla de reacción se concentró al vacío para dar 9,14 g de cloruro de 5-n¡tro-2-[5-(tr¡fluoromet¡l)-1,3,4-oxad¡azol-2-il]bencensulfonilo en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (3,21 g) se disolvió en diclorometano (42 ml), después se añadió carbonato ácido de sodio (1,51 g, 17,9 mmol), y después se añadió lentamente 1-(2,4-d¡metox¡fen¡l)metanam¡na (1,31 ml, 9 mmol) a temperatura ambiente. La mezcla de reacción se agitó durante 17 h a temperatura ambiente. Se añadió agua a la mezcla de reacción, y se extrajo con diclorometano. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (582 mg, 13 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,31 min; EM (lENneg): m/z = 487 (M-H)-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,56 (s, 3H), 3,65 (s, 3H), 4,06 (d, 2H), 6,22 (d, 1H), 6,26 (dd, 1H), 6,97 (d, 1H), 8,14 (d, 1H), 8,43 (d, 1H), 8,51 (t, 1H), 8,55 (dd, 1H).
Intermed¡o 70
2-(2-Clorofeml)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-[5-(tr¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (1,02 g, 4,51 mmol) a una solución de W-(2,4-dimetoxibencil)-5-nitro-2-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]bencensulfonamida (464 mg, 95% de pureza, 903 pmol) en dioxano (12 ml), después se agitó durante 7 h a 70 °C y durante la noche a temperatura ambiente. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se secaron sobre un filtro Whatman, y se concentraron al vacío para dar 485 mg de 5-amino-A/-(2,4-dimetoxibencil)-2-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (207 mg) se disolvió en DMF (9 ml), después se añadieron ácido (2-clorofenil)acético (154 mg, 902 pmol), A/,W-diisopropiletilamina (310 pl, 1,8 mmol) y HATU (343 mg, 902 pmol). La mezcla de reacción se agitó durante 5 h a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (369 mg, 40 % de pureza, 10 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 0,81 min; EM (lENneg): m/z = 609 (M-H)-
Intermedio 71
W-{3-[(2,4-D¡metox¡benc¡l)sulfamo¡l]-4-[5-(tr¡fluorometM)-1,3,4-oxad¡azol-2-¡l]feml}-2-(2-fluorofeml)acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (1,02 g, 4,51 mmol) a una solución de W-(2,4-dimetoxibencil)-5-nitro-2-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]bencensulfonamida (464 mg, 95% de pureza, 903 pmol) en dioxano (12 ml), después se agitó durante 7 h a 70 °C y durante la noche a temperatura ambiente. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se secaron sobre un filtro Whatman, y se concentraron al vacío para dar 485 mg de 5-amino-A/-(2,4-dimetoxibencil)-2-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (207 mg) se disolvió en DMF (9 ml), después se añadieron ácido (2-fluorofenil)acético (139 mg, 902 pmol), W,A/-diisopropiletilamina (310 pl, 1,8 mmol) y HATU (343 mg, 902 pmol). La mezcla de reacción se agitó durante 5 h a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (403 mg, 40 % de pureza, 16 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 0,77 min; EM (IENneg): m/z = 593 (M-H)-
Intermed¡o 72
2-Bromo-W-(2,4-d¡metox¡bencM)-5-mtrobencensulfonam¡da
Se disolvió cloruro de 2-bromo-5-nitrobencensulfonilo (5,00 g, 16,6 mmol) en diclorometano (48 ml) y se añadió bicarbonato de sodio (2,80 g, 33,3 mmol), y después se añadió lentamente 1-(2,4-dimetoxifenil)metanamina (2,7 ml, 18 mmol). La reacción se agitó durante 30 minutos a temperatura ambiente. Se añadió diclorometano y agua. Las fases se separaron y la fase orgánica se lavó con salmuera. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se cristalizó a partir de éter dietílico (5,57 g, 78 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,16 min; EM (IENneg): m/z = 429 [M-H]-
Intermedio 73
-Ammo-2-bromo-N-(2,4-dimetoxibencil)bencensulfonamida
Se suspendió cloruro de amonio (3,52 g, 65,7 mmol) y polvo de hierro (3,67 g, 65,7 mmol) en agua (150 ml). Después se añadió una solución de 2-bromo-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (5,67 g, 13,1 mmol) en THF/metanol (1/1; 150 ml) y la reacción se calentó a 80 °C durante 2 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida. El material en bruto se repartió en acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (5,10 g, 96 % de pureza, 97 % de rendimiento)
CL-EM (Procedimiento A): Tr = 1,05 min; EM (IENneg): m/z = 399 [M-H]-
Intermedio 74
N-{4-Bromo-3-[(2,4-dimetoxibencil)sulfamoM]feml}-2-(2-clorofeml)acetamida
Se disolvió 5-amino-2-bromo-A/-(2,4-d¡metox¡benc¡l)bencensulfonam¡da (5,00 g, 12,5 mmol) en DMF (100 ml) y se añadió ácido (2-clorofenil)acético (2,55 g, 15,0 mmol), después se añadieron N,N-diisopropiletilamina (11 ml, 62 mmol)
y HATU (6,16 g, 16,2 mmol). La reacción se agitó a 50 °C durante 16 h. El disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, acetato de etilo/ hexano) para dar el compuesto del título (5,70 g, 94 % de pureza, 83 % de rendimiento)
CL-EM (Procedimiento A): Tr = 1,29 min; EM (IENneg): m/z = 551 [M-H]-
Intermedio 75
2-Bromo-5-nitrobencensulfonamida
Se disolvió cloruro de 2-bromo-5-nitrobencensulfonilo (20,0 g, 66,6 mmol) en 1,4-dioxano (100 ml) y se enfrió a 0 °C. Se añadió amoníaco acuoso (400 ml, 0,50 M, 200 mmol) lentamente y se continuó la agitación a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y se añadió diclorometano. La fase orgánica se lavó con agua tres veces. La suspensión se filtró (el sólido es el producto), y la fase orgánica se lavó con salmuera. Las fases orgánicas combinadas se secaron sobre sulfato de sodio y el disolvente se retiró a presión reducida. El material en bruto se recristalizó a partir de éter dietílico para dar 16,4 g (93 % de pureza, 88 % de rendimiento). CL-EM (Procedimiento B): Tr = 0,45 min; EM (lENpos): m/z = 281 [M+H]+
Intermedio 76
2-Bromo-W-[(dimetilammo)metMiden]-5-mtrobencensulfonamida
Se disolvió 2-bromo-5-nitrobencensulfonamida (16,4 g, 58,3 mmol) en DMF (200 ml) a temperatura ambiente y se añadió 1,1-dimetoxi-W,W-dimetilmetanamina (15 ml, 120 mmol). Se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se repartió entre diclorometano y salmuera. La fase orgánica se secó sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (19,2 g, 78 % de pureza, 98 % de rendimiento).
CL-EM (Procedimiento A): Tr = 0,92 min; EM (lENpos): m/z = 336 [M+H]+
Intermedio 77
5-Ammo-2-bromo-W-[(dimetilammo)metMiden]bencensulfonamida
Se disolvió 2-bromo-W-[(d¡met¡lammo)met¡liden]-5-mtrobencensulfonam¡da (12,7 g, 37,8 mmol) en metanol (170 ml) y el recipiente se purgó con nitrógeno. Se añadió platino sobre carbón (5 % de carga, 1,61 g, 8,26 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (5,5 g, 76 % de pureza, 59 % de rendimiento). CL-EM (Procedimiento A): Tr = 0,75 min; EM (IENpos): m/z = 306 [M+H]+
Intermedio 78
W-(4-Bromo-3-{[(d¡metMammo)met¡Mden]sulfamoil}feml)-2-(2-clorofeml)acetam¡da
Se disolvió 5-am¡no-2-bromo-W-[(d¡met¡lam¡no)met¡l¡den]bencensulfonam¡da (4,85 g, 15,8 mmol) en DMF (100 ml) y se añadió ácido (2-clorofenil)acético (3,24 g, 19,0 mmol), después se añadieron N^-diisopropiletilamina (13 ml, 79 mmol) y HATU (9,64 g, 25,3 mmol). La mezcla de reacción se agitó durante 3 h a 50 °C. El disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se suspendió en diclorometano y se filtró, el disolvente se retiró y el material en bruto se usó sin purificación adicional en el paso siguiente (15,7 g).
CL-EM (Procedimiento B): Tr = 1,08 min; EM (IENpos): m/z = 458 [M+H]+
Este intermedio también puede usarse como la sal HCl.
Intermedio 79
N-(4-Bromo-3-{(dimetNammo)metiliden]sulfamoN}feml)-2-(2-fluorofeml)acetamida
Se disolvió 5-am¡no-2-bromo-A/-[(d¡met¡lamino)met¡l¡den]bencensulfonam¡da (1,00 g, 3,27 mmol) en DMF (21 ml) y se añadió ácido (2-fluorofenil)acético (604 mg, 3,92 mmol), después se añadieron W,A/-di¡soprop¡let¡lam¡na (2,7 ml, 16 mmol) y HATU (1,99 g, 5,23 mmol). La reacción se agitó a 50 °C durante 16 h. El disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se suspendió en ferc-butilmetiléter/hexano (1/1), se filtró y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (1,17 g, 85% de pureza, 81% de rendimiento).
CL-EM (Procedimiento B): Tr = 1,05 min; EM (lENpos): m/z = 442 [M+H]+
Intermedio 80
N-(4-Bromo-3-{[(dimetilammo)metiliden]sulfamoil}feml)-2-(2-cloro-4-fluorofeml)acetamida
Se disolvió 5-am¡no-2-bromo-A/-[(d¡met¡lam¡no)met¡l¡den]bencensulfonam¡da (1,00 g, 3,27 mmol) en DMF (21 ml) y se añadió ácido (2-cloro-4-fluorofenil)acético (739 mg, 3,92 mmol), después se añadieron N,N-diisopropiletilamina (2,7 ml, 16 mmol) y HATU (1,99 g, 5,23 mmol). La reacción se agitó a 50 °C durante 16 h. El disolvente se retiró a presión reducida y se añadieron agua y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se trituró en diclorometano y éter dietílico y se filtró. El sólido se usó en el paso siguiente sin purificación adicional (1,10 g, 82 % de pureza, 71 % de rendimiento).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (lENneg): m/z = 474 [M-H]-
Intermedio 81
2-(2-Clorofeml)-W-[3-{[(dimetilammo)metiliden]sulfamoil}-4-(1H-pirazol-4-il)feml]acetamida
Se disolvió 2-(2-clorofen¡l)-W-(3-{[(d¡met¡lam¡no)metil¡den]sulfamo¡l}-4-[1-(tetrah¡dro-2H-p¡ran-2-¡l)-1H-p¡razol-4-il]fenil)acetamida (1,30 g, 2,45 mmol) en diclorometano (20 ml), se añadió ácido trifluoroacético (4,7 ml, 61 mmol) y se continuó la agitación a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se destiló conjuntamente con tolueno y se usó sin purificación adicional en el paso siguiente. CL-EM (Procedimiento A): Tr = 0,93 min; EM (lENpos): m/z = 446 [M+H]+
Intermedio 82
-Ammo-N-(2,4-dimetoxibencil)bifeml-2-sulfonamida
Se disolvieron 2-doro-W-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (300 mg, 776 |jmol) y ácido fenilborónico (113 mg, 931 jmol) en DMF (10 ml) y se añadieron [IJ'-bis^ifem lfosfinoferroce^dicloropaladio^I) (1:1) (CAS 95464 05-4) (127 mg, 155 jm o l) y carbonato de potasio acuoso (1,2 ml, 1,0 M, 1,2 mmol). La reacción se calentó a 120 °C durante 1 h en el microondas. Después se añadieron agua y acetato de etilo y las fases se separaron. La fase acuosa se extrajo con acetato de etilo tres veces. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 260 mg (99 % de pureza, 78 % de rendimiento).
CL-EM (Procedimiento A): Tr = 1,33 min; EM (lENpos): m/z = 429 [M+H]+
Se disolvió W-^^-dimetoxibencil^-nitrobifenil^-sulfonamida (260 mg, 607 jm ol) en THF (15 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 6,46 mg, 60,7 jm ol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (270 mg).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (lENpos): m/z = 399 [M+H]+
Intermedio 83
5-Ammo-2-(1-metiMH-pirazol-4-il)bencensulfonamida
Se disolvieron 2-bromo-5-nitrobencensulfonamida (800 mg, 2,85 mmol) y 1-metil-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (1,18 g, 5,69 mmol) en n-propanol (38 ml) y se añadieron dicloruro de bis^rifenilfosfin^aladio^l) (CAS 13965-03-2) (100 mg, 142 jmol), trifenilfosfina (37,3 mg, 142 jm ol) y carbonato de potasio acuoso (4,3 ml, 2,0 M, 8,5 mmol). La reacción se purgó con argón durante 5 minutos y después se calentó a 120 °C durante 1 h en el microondas (0,4 MPa/40W). Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con metanol y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(1-met¡l-1H-p¡razol-4-¡l)-5-n¡trobencensulfonam¡da (800 mg, 2,83 mmol) en THF (78 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 308 mg, 2,89 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente (1,6 g).
CL-EM (Procedimiento B): Tr = 0,50 min; EM (lENpos): m/z = 253 [M+H]+
Intermedio 84
5-Ammo-2-(1-c¡cloprop¡MH-p¡razol-4-M)-W-[(d¡metilammo)metM¡den]bencensulfonam¡da
Se disolvieron 2-cloro-5-nitrobencensulfonamida (674 mg, 2,85 mmol) y 1-cidopropil-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-p¡razol (1,00 g, 4,27 mmol) en n-propanol (34 ml) y se añadieron dicloruro de bis(tnfemlfosfm)paladio(N) (CAS 13965-03-2) (100 mg, 142 jm ol) y trifenilfosfina (37,3 mg, 142 jmol). La reacción se purgó con argón durante 5 minutos y se añadió carbonato de potasio acuoso (5,7 ml, 1,0 M, 5,7 mmol). La reacción se calentó a 100 °C durante 3 h. Después la mezcla se filtró sobre Celite y el disolvente se retiró a presión reducida. Se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvieron 2-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-5-n¡trobencensulfonam¡da (1,17 g, 3,79 mmol) y 1,1-dimetoxi-N,N-dimetilmetanamina (1,0 ml, 7,6 mmol) en DMF (25 ml) y la reacción se agitó a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-N-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (1,84 g, 5,06 mmol) en THF (30 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 53,9 g, 506 |jmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (1,3 g, 53 % de pureza, 75 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento A): Tr = 0,70 min; EM (lENpos): m/z = 334 [M+H]+
Intermedio 85
5-Ammo-2-(1-íerc-butiMH-pirazol-4-N)bencensulfonamida
Se disolvieron 2-cloro-N-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (200 mg, 686 jm ol) y 1-ferc-butil-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (206 mg, 823 jm ol) en n-propanol (9,2 ml) y se añadieron dicloruro de bis^rifenilfosfin^aladioOl) (CAS 13965-03-2) (24,1 mg, 34,3 jmol), trifenilfosfina (8,99 mg, 34,3 jm ol) y carbonato de potasio acuoso (860 jl, 2,0 M, 1,7 mmol). La reacción se purgó con argón durante 5 minutos y se calentó a 80 °C durante 16 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(1-ferc-but¡l-1H-p¡razol-4-¡l)-5-n¡trobencensulfonam¡da (250 mg, 771 jm ol) en metanol (50 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 83,6 mg, 786 jm ol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (230 mg).
CL-EM (Procedimiento A): Tr = 0,80 min; EM (lENpos): m/z = 295 [M+H]+
Intermedio 86
5-Ammo-2-(1-metiMH-pirazol-4-il)bencensulfonamida
Se disolvió 2-(1-met¡l-1H-p¡razol-4-il)-5-mtrobencensulfonam¡da (800 mg, 2,83 mmol) en metanol (100 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 308 mg, 2,89 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente (1,59 g).
CL-EM (Procedimiento B): Tr = 0,50 min; EM (IENpos): m/z = 253 [M+H]+
Intermedio 87
5-Ammo-W-[(d¡met¡lammo)metM¡den]-2-[1-(tetrah¡dro-2H-p¡ran-2-M)-1H-p¡razol-4-¡l]bencensulfonam¡da
Se disolvieron 2-bromo-A/-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (2,0 g, 6,86 mmol) y 1-(tetrahidro-2H-p¡ran-2-¡l)-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (3,81 g mg, 13,7 mmol) en n-propanol (92 ml) y se añadieron dicloruro de bis^rifenilfosfin^aladio^I) (CAS 13965-03-2) (241 mg, 342 jmol), trifenilfosfina (90 mg, 340 |jmol) y carbonato de potasio acuoso (8,6 ml, 2,0 M, 17 mmol). La solución se purgó con argón durante 5 minutos y la reacción se calentó a 80 °C durante 16 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente.
Se disolvieron 5-n¡tro-2-[1-(tetrah¡dro-2H-p¡ran-2-¡l)-1H-p¡razol-4-¡l]bencensulfonam¡da (3,00 g, 8,51 mmol) y 1,1-dimetoxi-AA-dimetilmetanamina (2,3 ml, 17 mmol) en DMF (29 ml) y se agitó durante 24 h a temperatura ambiente. El disolvente se retiró a presión reducida y se añadió diclorometano y salmuera. Las fases se separaron y la fase orgánica se lavó con agua. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvió A/-[(d¡met¡lam¡no)met¡l¡den]-5-n¡tro-2-[1-(tetrah¡dro-2H-p¡ran-2-¡l)-1H-p¡razol-4-¡l]bencensulfonam¡da (3,50 g, 8,59 mmol) en metanol (860 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 932 mg, 8,76 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente. Después de 1 h el recipiente se evacuó tres veces y se purgó con hidrógeno. La agitación se continuó durante 3 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (3,4 g).
CL-EM (Procedimiento A): Tr = 0,88 min; EM (IENpos): m/z = 378 [M+H]+
Intermed¡o 88
5-Ammo-2-(1-c¡clopent¡l-1H-p¡razol-4-¡l)bencensulfonam¡da
Se disolvieron 2-cloro-W-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (550 mg, 1,89 mmol) y 1 -ciclopentil-4
(4,4,5,5-tetrametil-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (989 mg, 3,77 mmol) en n-propanol (25 ml) y se añadieron dicloruro de bis(tnfemlfosfm)paladio(N) (CAS 13965-03-2) (66,4 mg, 94,3 |jmol), trifenilfosfina (24,7 mg, 94,3 pmol) y carbonato de potasio acuoso (2,4 ml, 2,0 M, 4,7 mmol). La solución se purgó con argón durante 5 minutos y la reacción se calentó a 8o °C durante 16 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(1-c¡clopent¡l-1H-p¡razol-4-¡l)-5-n¡trobencensulfonam¡da (640 mg, 1,90 mmol) en metanol (50 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 206 mg, 1,94 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 4 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (590 mg).
CL-EM (Procedimiento A): Tr = 0,87 min; EM (lENpos): m/z = 307 [M+H]+
Intermedio 89
5-Ammo-2-[1-(2-metoxietM)-1H-pirazol-4-N]bencensulfonamida
Se disolvieron 2-cloro-W-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (550 mg, 1,89 mmol) y 1-(2-metoxietil)-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (951 mg, 3,77 mmol) en n-propanol (25 ml) y se añadieron dicloruro de bis^rifenilfosfin^aladioOl) (CAS 13965-03-2) (66,4 mg, 94,3 pmol), trifenilfosfina (24,7 mg, 94,3 pmol) y carbonato de potasio acuoso (2,4 ml, 2,0 M, 4,7 mmol). La reacción se calentó a 80 °C durante 16 h. La reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-[1-(2-metox¡et¡l)-1H-p¡razol-4-¡l]-5-n¡trobencensulfonam¡da (620 mg, 1,90 mmol) en metanol (50 ml) y el recipiente se purgó con nitrógeno. Después se añadió paladio sobre carbón (10 % de carga, 206 mg, 1,94 mmol) y el recipiente se evacuó y se llenó nuevamente con hidrógeno (0,1 MPa). La reacción se agitó a temperatura ambiente hasta completarse la reacción. La mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente (580 mg).
CL-EM (Procedimiento A): Tr = 0,59 min; EM (lENpos): m/z = 297 [M+H]+
Intermedio 90
5-Ammo-2-(1,3-d¡met¡l-1H-p¡razol-5-¡l)bencensulfonam¡da
Se disolvieron 2-bromo-W-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (400 mg, 1,19 mmol) y ácido (1,3-d¡met¡l-1H-p¡razol-5-¡l)borón¡co (333 mg, 2,38 mmol) en n-propanol (110 ml) y se añadieron dicloruro de bis^rifenilfosfin^aladioOl) (CAS 13965-03-2) (41,9 mg, 59,5 pmol), trifenilfosfina (21,6 mg, 59,5 pmol) y carbonato de potasio acuoso (1,8 ml, 2,0 M, 3,6 mmol). La solución se purgó con argón durante 5 minutos y la reacción se calentó a 120 °C durante 1 h en el microondas (0,4 MPa/40 W). Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con metanol y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(1,3-d¡met¡l-1H-p¡razol-5-¡l)-5-n¡trobencensulfonam¡da (450 mg, 1,52 mmol) en metanol (33 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 165 mg, 1,55 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 4 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente (435 mg).
CL-EM (Procedimiento B): Tr = 0,56 min; EM (lENpos): m/z = 267 [M+H]+
Intermed¡o 91
5-Ammo-2-[1-metN-3-(tr¡fluorometM)-1H-p¡razol-5-N]bencensulfonam¡da
Se disolvieron 2-cloro-W-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (550 mg, 1,89 mmol) y 1-met¡l-5-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-3-(tr¡fluoromet¡l)-1H-p¡razol (1,04 g, 3,77 mmol) en n-propanol (25 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (66,4 mg, 94,3 jmol), tr¡fen¡lfosf¡na (24,7 mg, 94,3 |jmol) y carbonato de potas¡o acuoso (2,4 ml, 2,0 M, 4,7 mmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y la reacc¡ón se calentó a 80 °C durante 16 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se dest¡ló conjuntamente con THF y se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-[1-met¡l-3-(tr¡fluoromet¡l)-1H-p¡razol-5-¡l]-5-n¡trobencensulfonam¡da (660 mg, 1,88 mmol) en metanol (190 ml) y el rec¡p¡ente se purgó con n¡trógeno. Se añad¡ó plat¡no sobre carbón (5 % de carga, 375 mg, 1,92 mmol) y el rec¡p¡ente se evacuó y después se purgó con h¡drógeno (0,1 MPa). Se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente durante 18 h. La mezcla de reacc¡ón se f¡ltró sobre Cel¡te y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (600 mg).
CL-EM (Proced¡m¡ento A): Tr = 0,86 m¡n; EM (lENpos): m/z = 321 [M+H]+
Intermedio 92
5-Ammo-W-[(d¡met¡lammo)metM¡den]-2-[5-(tr¡fluoromet¡l)pmdm-3-M]bencensulfonam¡da
Se d¡solv¡eron 5-am¡no-2-bromo-W-[(d¡met¡lam¡no)met¡l¡den]bencensulfonam¡da (300 mg, 980 jm ol) y ác¡do [5 (tr¡fluoromet¡l)p¡r¡d¡n-3-¡l]borón¡co (374 mg, 1,96 mmol) en DMF (27 ml) y se añad¡eron tr¡fen¡lfosf¡na (12,8 mg, 49,0 jm ol) y fluoruro de potas¡o (14,2 mg, 245 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (34,5 mg, 49,0 jmol) segu¡do por soluc¡ón acuosa de fosfato de potas¡o (730 jl, 2,0 M, 1,5 mmol). La reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (365 mg).
CL-EM (Proced¡m¡ento B): Tr = 0,91 m¡n; EM (lENpos): m/z = 373 [M+H]+
Intermed¡o 93
5-Ammo-2-(1,3-d¡met¡l-1H-p¡razol-4-¡l)bencensulfonam¡da
Se disolvieron 2-cloro-A/-[(d¡met¡lamino)met¡l¡den]-5-n¡trobencensulfonam¡da (550 mg, 1,89 mmol) y 1,3-dimetil-4-(4,4,5,5-tetrametil-1,3,2-d¡oxaborolan-2-il)-1H-p¡razol (837 mg, 3,77 mmol) en n-propanol (25 ml) y se añadieron dicloruro de b¡s(trifen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (66,4 mg, 94,3 pmol), tr¡fen¡lfosf¡na (24,7 mg, 94,3 pmol) y carbonato de potasio acuoso (2,4 ml, 2,0 M, 4,7 mmol). La reacción se calentó a 80 °C durante 16 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida. El material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(1,3-dimet¡l-1H-p¡razol-4-¡l)-5-n¡trobencensulfonam¡da (560 mg, 1,89 mmol) en metanol (50 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 205 mg, 1,93 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 16 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (500 mg).
CL-EM (Procedimiento A): Tr = 0,63 min; EM (lENpos): m/z = 267 [M+H]+
Intermedio 94
5-Ammo-2-[1-(d¡fluorometM)-1H-pirazol-4-¡l]bencensulfonam¡da
Se disolvieron 2-bromo-W-[(d¡met¡lamino)met¡l¡den]-5-n¡trobencensulfonam¡da (800 mg, 2,3 mmol) y 1 -(difluorometil)-4-(4,4,5,5-tetrametil-1,3,2-d¡oxaborolan-2-il)-1H-p¡razol (700 mg, 2,87 mmol) en n-propanol (15 ml) y se añadieron dicloruro de bis(trifen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (84 mg, 119 pmol) y trifenilfosfina (31 mg, 119 pmol). La solución se purgó con argón durante 5 minutos y se añadió carbonato de potasio acuoso (3,6 ml, 2,0 M, 7,2 mmol). La reacción se calentó a 100 °C durante 16 h. Se añadió agua y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvió 2-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-W-[(d¡met¡lamino)met¡l¡den]-5-n¡trobencensulfonam¡da (2,16 g, 5,79 mmol) en tetrahidrofurano (50 ml) y se añadió platino sobre carbón (5% de carga, 307 mg, 1,57 mmol). El recipiente se evacuó tres veces y se purgó con hidrógeno (0,1 MPa). La reacción se agitó durante 4 h a temperatura ambiente. De acuerdo con UPCL-EM la reacción no se había completado y se añadió la misma cantidad de platino sobre carbón y la reacción se agitó en atmósfera de hidrógeno durante otras 16 h. Después, la mezcla se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se utilizó en el paso siguiente sin purificación adicional.
Se disolvió 5-am¡no-2-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-A/-[(d¡met¡lamino)met¡l¡den]bencensulfonam¡da (670 mg, 1,95 mmol) en metanol (25 ml) y se trató con solución acuosa de amoníaco al 25 % (25 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, gradiente diclorometano / acetato de etilo) y después se purificó por HPLC ((Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar 53 mg (99 % de pureza, 9 % de rendimiento al cabo de 3 pasos). Las reacciones se repitieron y el material en bruto se usó en los pasos siguientes usando este intermedio.
CL-EM (Procedimiento B): Tr = 0,58 min; EM (lENpos): m/z = 289 [M+H]+
Intermedio 95
4-[4-(4-ammo-2-sulfamoilfeml)-1H-pirazoM-N]piperídm-1-carboxMato de tere-butilo
Se disolvieron 2-cloro-A/-[(d¡met¡lamino)met¡l¡den]-5-n¡trobencensulfonam¡da (250 mg; 857 pmol) y 4-[4-(4,4,5,5
tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol-1-¡l]p¡per¡d¡n-1-carbox¡lato de ferc-but¡lo (485 mg, 1,29 mmol) en npropanol (12 ml) y se añadieron dicloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (30,2 mg, 42,9 |jmol), tr¡fen¡lfosf¡na (11,2 mg, 42,9 pmol) y carbonato de potas¡o acuoso (1,1 ml, 2,0 M, 2,1 mmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y la reacc¡ón se calentó a 80 °C durante 16 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se dest¡ló conjuntamente con THF y se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 4-[4-(4-n¡tro-2-sulfamo¡lfen¡l)-1H-p¡razol-1-¡l]p¡per¡d¡n-1-carbox¡lato de ferc-but¡lo (400 mg, 886 pmol) en tetrah¡drofurano (89 ml) y el rec¡p¡ente se purgó con n¡trógeno. Se añad¡ó palad¡o sobre carbón (10% de carga, 96,1 mg, 904 pmol) y el rec¡p¡ente se evacuó y después se purgó con h¡drógeno (0,1 MPa). Se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente durante 4 h. La mezcla de reacc¡ón se f¡ltró sobre Cel¡te y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (380 mg).
CL-EM (Proced¡m¡ento A): Tr = 0,98 m¡n; EM (lENpos): m/z = 422 [M+H]+
Intermedio 96
1-(Oxetan-2-NmetM)-4-(4,4,5,5-tetrametiM,3,2-dioxaborolan-2-M)-1H-pirazol
Se d¡solv¡ó 4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (500 mg, 2,58 mmol) en DMF (20,0 ml) y se añad¡ó 2-(bromomet¡l)oxetano (778 mg, 5,15 mmol) y carbonato de ces¡o (1,68 g, 5,15 mmol). La reacc¡ón se calentó durante 1 h a 100 °C en el m¡croondas (0 MPa/18W). La suspens¡ón se f¡ltró y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El react¡vo se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (770 mg).
CL-EM (Proced¡m¡ento B): Tr = 0,83 m¡n; EM (lENpos): m/z = 266 [M+H]+
Intermedio 97
5-Bromo-2-cloro-W-[(d¡metMammo)met¡Mden]p¡r¡dm-3-sulfonam¡da
Se d¡solv¡eron 5-bromo-2-clorop¡r¡d¡n-3-sulfonam¡da (3,86 g, 14,2 mmol) y 1,1-d¡metox¡-W,W-d¡met¡lmetanam¡na (3,8 ml, 28 mmol) en DMF (40 ml) y se ag¡tó durante 2 h a temperatura amb¡ente. El d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡ó d¡clorometano y salmuera. Las fases se separaron y la fase orgán¡ca se lavó con agua. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal (5,12 g).
CL-EM (Proced¡m¡ento B): Tr = 0,89 m¡n; EM (lENpos): m/z = 326 [M+H]+
Intermed¡o98
2-Cloro-W-[(dimetilamino)metiliden]-5-[(difenilmetiliden)amino]piridin-3-sulfonamida
Se disolvieron 5-bromo-2-cloro-A/-[(dimetilamino)metiliden]piridin-3-sulfonamida (5,00 g, 15,3 mmol), 1,1-difenilmetanimina (3,9 ml, 23 mmol), XantPhos (886 mg, 1,53 mmol) y acetato de paladio(II) (172 mg, 765 |jmol) en dioxano (150 ml). La solución se purgó con argón durante 5 minutos y se añadió carbonato de cesio (15,0 g, 45,9 mmol). La reacción se calentó a 100 °C durante 1 h, Después, el disolvente se retiró a presión reducida y se añadieron agua y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. La mitad del material en bruto se usó sin purificación adicional y 3 g se purificaron mediante cromatografía sobre gel de sílice recubierto de amoníaco (Biotage, hexano/ acetato de etilo) para dar 1,00 g (78 % de pureza, 15 % de rendimiento basado en la cantidad total de material de partida)
CL-EM (Procedimiento B): Tr = 1,26 min; EM (lENpos): m/z = 427 [M+H]+
Intermedio 99
2-[1-(D¡fluorometM)-1H-p¡razol-4-M]-W-[(d¡met¡lammo)metM¡den]-5-[(d¡femlmet¡Mden)ammo]p¡r¡dm-3-sulfonamida
Se disolvieron 2-cloro-W-[(dimetilamino)metiliden]-5-[(difenilmetiliden)amino]piridin-3-sulfonamida (1,50 g, 3,51 mmol, en bruto) y 1-(difluorometil)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (1,71 g, 7,03 mmol) en n-propanol (30 ml)/ DMF (15 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (371 mg, 527 jmol), trifenilfosfina (225 mg, 0,85 mmol), fluoruro de potasio (408 mg, 7,03 mmol) y solución acuosa de fosfato de potasio (1,8 ml, 2,0 M, 3,5 mmol). La solución se purgó con argón durante 5 minutos y la reacción se calentó a 100 °C durante 1 h en el microondas (0,1 MPa/30W). El disolvente se retiró a presión reducida y se añadieron agua y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice recubierto de amoníaco (Biotage, hexano/ acetato de etilo) (1,54 g, 65 % de pureza, 86 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,26 min; EM (lENpos): m/z = 509 [M+H]+
Intermed¡o 100
5-Ammo-2-[1-(d¡fluorometM)-1H-p¡razol-4-M]-W-[(d¡met¡lammo)met¡Mden]p¡r¡dm-3-sulfonam¡da
Se disolvió 2-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-N-[(d¡met¡lam¡no)met¡l¡den]-5-[(d¡fen¡lmet¡l¡den)am¡no]p¡r¡d¡n-3-sulfonamida (1,54 g, 3,03 mmol) en d¡oxano (15 ml) y se añad¡ó HCl acuoso (2,0 ml, 3,0 M, 6,1 mmol). La reacdón se ag¡tó durante 1 h a temperatura amb¡ente. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (2,45 g).
CL-EM (Proced¡m¡ento B): Tr = 0,66 m¡n; EM (lENpos): m/z = 345 [M+H]+
Intermedio 101
W-[(D¡metMammo)met¡Mden]-5-[(d¡femlmet¡Mden)ammo]-2-(1-met¡MH-p¡razol-4-¡l)p¡r¡dm-3-sulfonam¡da
Se secó DMF sobre f¡ltros moleculares y se purgó con argón. Después se d¡solv¡eron 2-cloro-N-[(d¡met¡lam¡no)met¡l¡den]-5-[(d¡fen¡lmet¡l¡den)am¡no]p¡r¡d¡n-3-sulfonam¡da (350 mg, 820 pmol), 1-met¡l-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (341 mg, 1,64 mmol) y fluoruro de potas¡o (143 mg, 2,46 mmol) en DMF seca y desgas¡f¡cada (15 ml) y la soluc¡ón se purgó nuevamente con argón durante 5 m¡nutos, después se añad¡ó b¡s(tr¡-terc-but¡lfosf¡n)palad¡o(0) (CAS 53199-31-8) (251 mg, 492 pmol). La reacc¡ón se calentó durante 18 h a 100 °C. El d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡ó acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal (450 mg).
CL-EM (Proced¡m¡ento A): Tr = 1,16 m¡n; EM (lENpos): m/z = 473 [M+H]+
Intermed¡o 102
-Ammo-N-[(d¡met¡lammo)metM¡den]-2-(1-met¡l-1H-p¡razol-4-¡l)p¡r¡dm-3-sulfonam¡da
Se disolvió A/-[(d¡met¡lam¡no)met¡l¡den]-5-[(d¡fen¡lmet¡l¡den)am¡no]-2-(1-met¡l-1H-p¡razol-4-¡l)p¡r¡d¡n-3-sulfonam¡da (430 mg, 910 pmol) en d¡oxano (16,0 ml), se añad¡ó HCl acuoso (610 pl, 3,0 M, 1,8 mmol) y la reacdón se ag¡tó durante 1 h a temperatura amb¡ente. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (500 mg).
CL-EM (Proced¡m¡ento B): Tr = 0,52 m¡n; EM (lENpos): m/z = 309 [M+H]+
Intermedio 103
W-[(D¡met¡lammo)met¡l¡den]-5-[(d¡femlmet¡l¡den)ammo]-5'-(tr¡fluoromet¡l)-2,3'-b¡p¡r¡dm-3-sulfonam¡da
Se d¡solv¡eron 2-cloro-W-[(d¡met¡lam¡no)met¡l¡den]-5-[(d¡fen¡lmet¡l¡den)am¡no]p¡r¡d¡n-3-sulfonam¡da (150 mg, 351 pmol) y ác¡do [5-(tr¡fluoromet¡l)p¡r¡d¡n-3-¡l]borón¡co (80,5 mg, 422 pmol) en n-propanol (10 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (12,4 mg, 17,6 pmol), tr¡fen¡lfosf¡na (4,61 mg, 17,6 pmol) y carbonato de potas¡o acuoso (1,1 ml, 1,0 M, 1,1 mmol). La reacc¡ón se calentó a 100 °C durante 1 h. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se repart¡ó entre acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se d¡solv¡ó en DMF (10 ml) y se añad¡ó 1,1-d¡metox¡-Ñ,W-d¡met¡lmetanam¡na (140 pl, 1,1 mmol). La reacc¡ón se ag¡tó a temperatura amb¡ente durante 2 h. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (260 mg).
CL-EM (Proced¡m¡ento B): Tr = 1,33 m¡n; EM (lENpos): m/z = 538 [M+H]+
Intermed¡o 104
-Ammo-N-[(d¡met¡lammo)met¡l¡den]-5'-(tr¡fluoromet¡l)-2,3'-b¡p¡r¡dm-3-sulfonam¡da
Se d¡solv¡ó W-[(d¡met¡lam¡no)met¡l¡den]-5-[(d¡fen¡lmet¡l¡den)am¡no]-5'-(tr¡fluoromet¡l)-2,3'-b¡p¡r¡d¡n-3-sulfonam¡da (230 mg, 428 pmol) en d¡oxano (20 ml), se añad¡ó HCl acuoso (290 pl, 3,0 M, 860 pmol) y se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente durante 2 h. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (250 mg).
CL-EM (Proced¡m¡ento B): Tr = 0,81 m¡n; EM (lENpos): m/z = 374 [M+H]+
Intermed¡o 105
2-(2-Clorofeml)-N-[3-{[(d¡met¡lammo)met¡l¡den]sulfamo¡l}-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)fen¡l]acetam¡da
Se disolvió A/-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (250 mg, 545 |jmol), 4,4,4',4',5,5,5',5'-octamet¡l-2,2'-b¡-1,3,2-d¡oxaborolano (346 mg, 1,4 mmol) y precatal¡zador CataCX¡um A (20,0 mg, 27,2 jm ol) en metanol (10 ml) y se añad¡ó W,A/-d¡¡soprop¡let¡lam¡na (237 jl, 1,4 mmol) en atmósfera de argón. La reacc¡ón se ag¡tó durante 2 h a 50 °C. La soluc¡ón se usó s¡n mod¡f¡cac¡ones en el paso s¡gu¡ente.
La reacc¡ón se llevó a cabo múlt¡ples veces sólo a esa escala.
CL-EM (Proced¡m¡ento B): Tr = 1,23 m¡n; EM (lENpos): m/z = 506 [M+H]+
Intermedio 106
5-Ammo-2-(5-ciclopropiM,3,4-oxadiazol-2-M)-W-[(dimetMammo)metMiden]bencensulfonamida
Se d¡solv¡ó ác¡do 2-bromo-4-n¡trobenzo¡co (1,50 g, 6,10 mmol) en DMF (50 ml) y se añad¡eron c¡clopropancarboh¡draz¡da (671 mg, 6,71 mmol), HATU (2,78 g, 7,32 mmol) y W,A/-d¡¡soprop¡let¡lam¡na (5,3 ml, 30 mmol). La reacc¡ón se ag¡tó a temperatura amb¡ente durante 2 h. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se repart¡ó entre acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se extrajo tres veces con agua. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal (7,9 g).
Se d¡solv¡ó 2-bromo-W’-(c¡cloprop¡lcarbon¡l)-4-n¡trobenzoh¡draz¡da (7,87 g, 24,0 mmol) en DMF (100 ml) y se añad¡eron W,W-d¡¡soprop¡let¡lam¡na (8,4 ml, 48 mmol) y cloruro de 4-met¡lbencensulfon¡lo (4,57 g, 24,0 mmol) en forma suces¡va. La reacc¡ón se ag¡tó a temperatura amb¡ente durante 2 h. Se añad¡ó la m¡sma cant¡dad de react¡vo y la ag¡tac¡ón se cont¡nuó durante 2 h. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se d¡solv¡ó en acetato de et¡lo. Después de lavar con agua, la fase acuosa se extrajo tres veces con acetato de et¡lo y las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman. El mater¡al en bruto se pur¡f¡có sobre gel de síl¡ce (B¡otage, hexano / acetato de et¡lo) para dar 1,35 g (85 % de pureza, 18 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 1,16 m¡n; EM (lENpos): m/z = 310 [M+H]+
Se d¡solv¡ó 2-(2-bromo-4-n¡trofen¡l)-5-c¡cloprop¡l-1,3,4-oxad¡azol (1,00 g, 3,22 mmol) en 1,4-d¡oxano (75 ml) y se añad¡eron XantPhos (93,3 mg, 161 jmol), complejo tr¡s(d¡benc¡l¡denacetona)d¡palad¡o cloroformo (CAS 52522-40-4) (167 mg, 161 jm ol) y W,W-d¡¡soprop¡let¡lam¡na (1,1 ml, 6,4 mmol). La reacc¡ón se calentó a 100 °C y se añad¡ó una soluc¡ón de fen¡lmetanot¡ol (360 jl, 3,1 mmol) en 1,4-d¡oxano (1 ml). La ag¡tac¡ón se cont¡nuó durante 1 h a 100 °C. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se repart¡ó entre acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se extrajo tres veces con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un filtro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal (1,42 g).
Se d¡solv¡ó 2-[2-(benc¡lsulfan¡l)-4-n¡trofen¡l]-5-c¡cloprop¡l-1,3,4-oxad¡azol (1,42 g, 4,02 mmol) en ác¡do acét¡co (40 ml), se añad¡ó W-clorosucc¡n¡m¡da (1,61 g, 12,1 mmol) y la reacc¡ón se ag¡tó durante 3h a temperatura amb¡ente. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (1,96 g).
Se añad¡ó cloruro de 2-(5-c¡cloprop¡l-1,3,4-oxad¡azol-2-¡l)-5-n¡trobencensulfon¡lo (1,96 g, 5,94 mmol) a una soluc¡ón de amoníaco en 1,4-d¡oxano (0,5 M, 300 ml) y la ag¡tac¡ón se cont¡nuó durante 16 h a temperatura amb¡ente. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó nuevamente en 1,4-d¡oxano (100 ml) y se trató con soluc¡ón concentrada de amoníaco hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se suspend¡ó en 1,4-d¡oxano y la suspens¡ón se f¡ltró. El mater¡al f¡ltrado se concentró y se obtuvo el producto
puro después de la purificación por HPLC (tres veces, Chromatorex C-1810 |jm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar 3,6 g (194 %, 43 % de pureza).
CL-EM (Procedimiento A): Tr = 0,88 min; EM (lENpos): m/z = 311 [M+H]+
Se disolvió 2-(5-ciclopropil-1,3,4-oxadiazol-2-il)-5-nitrobencensulfonamida (3,60 g, 11,6 mmol) en DMF (40 ml) y se añadió 1,1-dimetoxi-W,A/-dimetilmetanamina (3,1 ml, 23 mmol). La reacción se agitó a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. Se obtuvo el compuesto puro después de la cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) (0,4 g, 99 % de pureza, 9 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,91 min; EM (lENpos): m/z = 366 [M+H]+
Se disolvió 2-(5-ciclopropil-1,3,4-oxadiazol-2-il)-W-[(dimetilamino)metiliden]-5-nitrobencensulfonamida (400 mg, 1,09 mmol) en THF (200 ml) y se añadió platino sobre carbón (5 % de carga, 214 mg, 109 jmol). El recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). La agitación se continuó durante 4 h a temperatura ambiente. El análisis CL-EM indicó que no se había completado la reacción. La mezcla se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se disolvió en etanol (200 ml) y se añadió paladio sobre carbón (10 % de carga, 214 mg, 109 jmol). El recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa) y la reacción se agitó durante 3 h. Después se añadió más catalizador (214 mg, 109 jmol) y la agitación se continuó durante otras 3 h. La mezcla se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (260 mg, 85 % de pureza, 70 % de rendimiento).
CL-EM (Procedimiento A): Tr = 0,71 min; EM (lENpos): m/z = 336 [M+H]+
Intermedio 107
2-[4-(D¡fluorometM)-1H-p¡razol-1 -M]-W-[(d¡metilammo)met¡len]-5-mtrobencensulfonam¡da
Se disolvieron 2-cloro-A/-[(dimetilamino)metilen]-5-nitrobencensulfonamida (2,02 g, 6,94 mmol) y 1-(1H-pirazol-4-il)etanona (1,00 g, 10,4 mmol) en acetonitrilo, se añadió carbonato de potasio en polvo (2,88 g, 20,8 mmol) y la mezcla de reacción se agitó a 100 °C durante la noche. Después, se concentró al vacío y se extrajo con diclorometano/agua. La fase orgánica se lavó nuevamente con salmuera, después se secó sobre sulfato de sodio y se concentró al vacío. Como se había perdido parcialmente el grupo protector, se disolvió nuevamente en DMF (6,6 ml) y se añadió 1,1-dimetoxi-W,A/-dimetilmetanamina (0,882 g, 7,4 mmol). Se agitó durante la noche, se concentró al vacío y se extrajo con diclorometano/agua. La fase orgánica se lavó nuevamente con salmuera, después se secó sobre sulfato de sodio y se concentró al vacío para dar 1,3 g de W-[(dimetilamino)metilen]-2-(3-formil-1H-pirazol-1-il)-5-nitrobencensulfonamida en bruto.
Se añadió trifluoruro de bis(2-metoxietil)aminoazufre (Deoxo-Fluor®; 3,09 ml de solución en tolueno 2,7 M, 8,34 mmol) al material en bruto del paso previo (1,03 g, 2,94 mmol) y la mezcla de reacción se agitó durante 5 horas a 80 °C. Se añadió acetato de etilo y solución acuosa de carbonato de potasio 2 M para la extracción. La fase orgánica se secó sobre sulfato de sodio y se concentró al vacío. La purificación mediante cromatografía (ultrarrápida) en columna en un sistema Biotage dio el compuesto del título (600 mg, 1,61 mmol, 24 % de rendimiento al cabo de 3 pasos, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 0,96 min; EM (lENpos): m/z = 374 [M+H]+
Intermed¡o 108
5-Ammo-2-(4-c¡ano-1H-p¡razoM-¡l)-W-[(d¡metMammo)metMen]pmdm-3-sulfonam¡da
Se disolvió 2-cloro-N-[(d¡met¡lam¡no)met¡len]-5-[(d¡fen¡lmet¡len)am¡no]p¡rid¡n-3-sulfonam¡da (480 mg, 1,12 mmol) en DMSO (14 ml). Se añadió 1H-pirazol-4-carbon¡trilo (209 mg, 2,25 mmol), yoduro de potasio (187 mg, 1,12 mmol) y fosfato de potasio (358 mg, 1,69 mmol) y la mezcla de reacción se agitó durante la noche a 100 °C. Después se concentró al vacío, se extrajo con diclorometano/agua, la fase orgánica se lavó con salmuera, se secó sobre sulfato de sod¡o y después se concentró al vacío.
Debido a una desprotección parcial, el material se disolvió nuevamente en DMF (2 ml) y se agitó durante la noche con 1,1-d¡metoxi-N,N-d¡met¡lmetanam¡na (0,4 ml). Después se concentró al vacío, se extrajo con diclorometano/agua y la fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y después se concentró al vacío.
CL-EM (Procedimiento A): Tr = 1,22 min, EM (lENpos): m/z = 484 [M+H]+
El compuesto del paso previo se disolvió en dioxano (2,5 ml) y se añadió HCl en dioxano 2 M (1,18 ml, 2,36 mmol), después se agitó durante la noche. Se concentró al vacío y se extrajo con acetato de etilo/agua. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró al vacío para dar el compuesto del título en bruto (110 mg) que se usó sin purificación adicional en los pasos siguientes.
CL-EM (Procedimiento A): Tr = 0,58 min, EM (lENpos): m/z = 320 [M+H]+
Intermedio 109
5-Ammo-2-(4-cloro-1H-pirazol-1 -M)-W-[(d¡met¡lammo)met¡len]p¡r¡dm-3-sulfonam¡da
Se disolvió 2-cloro-A/-[(d¡met¡lam¡no)met¡len]-5-[(d¡fen¡lmet¡len)am¡no]p¡rid¡n-3-sulfonam¡da (1,00 g, 2,34 mmol) en DMSO (18 ml). Se añadió 4-cloro-1H-pirazol (480 mg, 4,69 mmol), yoduro de potasio (389 mg, 2,34 mmol) y fosfato de potasio (746 mg, 3,51 mmol) y la mezcla de reacción se agitó durante la noche a 100 °C. Después se concentró al vacío, se extrajo con diclorometano/agua y la fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y después se concentró al vacío.
Debido a una desprotección parcial, el material se disolvió nuevamente en DMF (2 ml) y se agitó durante la noche con 1,1-d¡metoxi-N,N-d¡met¡lmetanam¡na (0,5 ml). La agitación durante la noche resultó en un precipitado que se retiró mediante filtración (229 mg de 2-(4-cloro-1H-p¡razol-1-¡l)-A/-[(d¡met¡lam¡no)met¡len]-5-[(d¡fen¡lmet¡len)amino]p¡r¡d¡n-3-sulfonamida pura). El material filtrado se concentró al vacío, se extrajo con diclorometano/agua, la fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y después se concentró al vacío para dar 2-(4-cloro-1H-pirazol-1-¡l)-N-[(d¡met¡lam¡no)metilen]-5-[(d¡fen¡lmet¡len)am¡no]p¡r¡d¡n-3-sulfonam¡da en bruto (549 mg).
CL-EM (Procedimiento A): Tr = 1,31 min, EM (lENpos): m/z = 493 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,80 (s, 3H), 3,09 (s, 3H), 7,27 - 7,33 (m, 2H), 7,38 - 7,44 (m, 3H), 7,49 - 7,56 (m, 2H), 7,58 - 7,64 (m, 1H), 7,67 (s, 1H), 7,69 - 7,76 (m, 2H), 7,79 - 7,83 (m, 2H), 8,17 (d, 1H), 8,32 (d, 1H).
El material puro (229 mg) del paso previo se disolvió en dioxano (2,0 ml) y se añadió HCl en dioxano 2 M (1,00 ml, 2,00 mmol), después se agitó durante la noche. Se concentró al vacío y se extrajo con acetato de etilo/agua. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró al vacío para dar el compuesto del título en bruto (200 mg) que se usó sin purificación adicional en los pasos siguientes.
CL-EM (Procedimiento A): Tr = 0,71 min, EM (lENpos): m/z = 329 [M+H]+
Intermed¡o 110
5-Ammo-2-(4-bromo-1H-p¡razol-1-M)-W-[(d¡metMammo)metMen]p¡r¡dm-3-sulfonam¡da
Se disolvió 2-cloro-N-[(d¡met¡lam¡no)met¡len]-5-[(d¡fen¡lmet¡len)am¡no]p¡rid¡n-3-sulfonam¡da (1,00 g, 2,34 mmol) en DMSO (18 ml). Se añadieron 4-bromo-1H-pirazol (689 mg, 4,69 mmol), yoduro de potasio (389 mg, 2,34 mmol) y fosfato de potasio (746 mg, 3,51 mmol) y la mezcla de reacción se agitó durante la noche a 100 °C. Después se concentró al vacío, se extrajo con diclorometano/agua, la fase orgánica se lavó con salmuera, se secó sobre sulfato de sod¡o y después se concentró al vacío.
Debido a una desprotección parcial, el material se disolvió nuevamente en DMF (2 ml) y se agitó durante la noche con 1,1-d¡metoxi-N,N-d¡met¡lmetanam¡na (0,5 ml). La agitación durante la noche resultó en un precipitado que se retiró mediante filtración (213 mg de 2-(4-bromo-1H-p¡razol-1-¡l)-A/-[(d¡met¡lam¡no)met¡len]-5-[(d¡fen¡lmet¡len)amino]p¡r¡d¡n-3-sulfonamida pura). El material filtrado se concentró al vacío, se extrajo con diclorometano/ agua, la fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y después se concentró al vacío para dar 2-(4-bromo-1H-pirazol-1-¡l)-N-[(d¡met¡lam¡no)metilen]-5-[(d¡fen¡lmet¡len)am¡no]p¡r¡d¡n-3-sulfonam¡da en bruto (758 mg).
CL-EM (Procedimiento A): Tr = 1,32 min, EM (lENpos): m/z = 537/539 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,79 (s, 3H), 3,09 (s, 3H), 7,27 - 7,33 (m, 2H), 7,38 - 7,45 (m, 3H), 7,49 - 7,56 (m, 2H), 7,58 - 7,67 (m, 2H), 7,73 (d, 2H), 7,79 - 7,83 (m, 2H), 8,16 (d, 1H), 8,31 (d, 1H).
El material puro (213 mg) del paso previo se disolvió en dioxano (2,0 ml) y se añadió HCl en dioxano 2 M (1,00 ml, 2,00 mmol), después se ag¡tó durante la noche. Se concentró al vacío y se extrajo con acetato de et¡lo/agua. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró al vacío para dar el compuesto del título en bruto (168 mg) que se usó sin purificación adicional en los pasos siguientes.
CL-EM (Procedimiento A): Tr = 0,73 min, EM (lENpos): m/z = 373/375 [M+H]+
Intermed¡o 111
5-Ammo-W-[(d¡met¡lammo)met¡len]-2-(4-flúor-1H-p¡razoM-¡l)pmdm-3-sulfonam¡da
Se disolvió 2-cloro-N-[(d¡met¡lam¡no)metilen]-5-[(d¡fen¡lmet¡len)am¡no]p¡r¡d¡n-3-sulfonam¡da (1,00 g, 2,34 mmol) en DMSO (18 ml). Se añadieron 4-flúor-1H-pirazol (403 mg, 4,69 mmol), yoduro de potasio (389 mg, 2,34 mmol) y fosfato de potasio (746 mg, 3,51 mmol) y la mezcla de reacción se agitó durante la noche a 100 °C. Después se concentró al vacío, se extrajo con diclorometano/agua, la fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y después se concentró al vacío.
Debido a una desprotección parcial, el material se disolvió nuevamente en dimetilformamida (2 ml) y se agitó durante la noche con 1,1-dimetoxi-N,N-d¡met¡lmetanam¡na (0,5 ml). La mezcla de reacción se concentró al vacío, se extrajo con diclorometano/agua, la fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y después se concentró al vacío para dar N-[(d¡met¡lam¡no)met¡len]-5-[(d¡fen¡lmetilen)am¡no]-2-(4-flúor-1H-p¡razol-1-¡l)p¡r¡d¡n-3-sulfonam¡da en bruto (723 mg).
CL-EM (Procedimiento A): Tr = 1,25 min, EM (lENpos): m/z = 477 [M+H]+
El material en bruto (723 mg) del paso previo se disolvió en dioxano (4,0 ml) y se añadió HCl en dioxano 2 M (3,00 ml, 6,00 mmol), después se agitó durante la noche. Se concentró al vacío y se extrajo con acetato de etilo/agua. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró al vacío para dar compuesto del título
en bruto (455 mg) que se usó sin purificación adicional en los pasos siguientes.
CL-EM (Procedimiento A): Tr = 0,62 min, EM (IENpos): m/z = 313 [M+H]+
Intermedio 112
5-Ammo-W-[(d¡met¡lammo)met¡l¡den]-2-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]p¡r¡dm-3-sulfonam¡da
La reacción se llevó a cabo tres veces a una escala de 1 g. Se disolvió 2-cloro-N-[(dimetilamino)metiliden]-5-[(difenilmetiliden)amino]piridin-3-sulfonamida (3,00 g, 7,03 mmol) y 4-(trifluorometil)-1H-pirazol (1,43 g, 10,5 mmol) en DMSO (110 ml, 1,6 mol) y se añadieron yoduro de potasio (583 mg, 3,51 mmol) y fosfato de potasio (2,24 g, 10,5 mmol). La reacción se calentó durante 5 h en el microondas a 100 °C. Después, el sólido se retiró por filtración y al material filtrado se añadió acetato de etilo y agua. La fase orgánica se lavó con salmuera y se secó sobre sulfato de sodio. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, acetato de etilo/hexano) para dar 15,7 g (424 % de rendimiento).
CL-EM (Procedimiento A): Tr = 1,40 min; EM (IENpos): m/z = 472 [M+H]+
Se disolvió 5-[(difenilmetiliden)amino]-2-[4-(trifluorometil)-1H-pirazol-1-il]piridin-3-sulfonamida (3,50 g, 7,42 mmol) en 1,4-dioxano (100 ml) y se añadió HCl (4,9 ml, 3,0 M, 15 mmol). La reacción se agitó a temperatura ambiente durante 2 h. El disolvente se retiró a presión reducida y el material en bruto se repartió entre acetato de etilo y agua. Después, la fase orgánica se secó sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se disolvió en acetonitrilo y agua y se liofilizó durante la noche.
CL-EM (Procedimiento B): Tr = 0,56 min; EM (IENpos): m/z = 307 [M+H]+
Intermed¡o 113
1-(4-{[(2-clorofeml)acetM]ammo}-2-sulfamoMfeml)-1H-p¡razol-4-carbox¡lato de met¡lo
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.3 y GP4.1, se convirtieron 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (2,04 g, 5,29 mmol), 1H-pirazol-4-carboxilato de metilo (1,00 g, 7,93 mmol) y ácido (2-clorofenil)acético (10,5 g, 6,16 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante cristalización a partir de hexano/acetato de etilo (2/1) (1,10 g, 2,45 mmol, 46 % de rendimiento al cabo de 4 pasos, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,01 min; EM (IENpos): m/z = 449 [M+H]+
Intermed¡o 114
N-(4-Bromo-3-sulfamo¡lfeml)-2-(2-clorofeml)acetam¡da
Se disolvió 3-aminobencensulfonamida (70,0 g, 406 mmol) en dimetilformamida (540 ml) y se enfrió a 0 °C. Se añadió una solución de W-bromosuccinimida (76,0 g, 427 mmol) en dimetilformamida (300 ml) durante 1,5 horas. Se dejó calentar hasta temperatura ambiente a lo largo de 1 hora y se continuó la agitación a temperatura ambiente durante 2 horas. La mezcla de reacción se concentró al vacío, se extrajo con acetato de etilo (500 ml) y se lavó varias veces con agua (250 ml) y solución de salmuera (300 ml). Las fases acuosas se extrajeron nuevamente dos veces con acetato de etilo y las fases orgánicas se combinaron, se secó sobre sulfato de sodio y se concentró al vacío para dar 141 g de 5-amino-2-bromobencensulfonamida en bruto.
CL-EM (Procedimiento A): Tr = 0,56 min; EM (IENpos): m/z = 251/253 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 5,71 (s, 2H), 6,60 (dd, 1H), 7,25 - 7,24 (s a, 2H), 7,27 (d, 1H), 7,34 (d, 1H). Parte de la 5-amino-2-bromobencensulfonamida en bruto del paso previo (54,3 g) y ácido (2-clorofenil)acético (38,8 g, 0,23 mmol) se suspendieron en dimetilformamida (1000 ml) y se enfrió a 0 °C. Se añadieron W,A/-diisopropiletilamina (83,9 g, 0,65 mmol) y hexafluorofosfato de 3-óxido de 1-[bis(dimetilamino)metilen]-1H-1,2,3-triazolo[4,5-b]piridinio (HATU, 90,5 g, 0,24 mmol) lentamente manteniendo la temperatura por debajo de 10 °C. Se dejó calentar hasta temperatura ambiente durante la noche. La mezcla de reacción se concentró al vacío, se extrajo con acetato de etilo (1250 ml), se lavó con solución de hidróxido de sodio 1 M (500 ml) y dos veces con agua (500 ml). La fase orgánica se secó sobre sulfato de sodio y se concentró al vacío. Este producto en bruto (66 g) se suspendió en diclorometano (350 ml) y se agitó en un baño ultrasónico, para dar un precipitado blanco del compuesto del título que se retiró por filtración y se secó en un horno de secado (25,0 g, 61,9 mmol, 40 % al cabo de 2 pasos, 96 % de pureza).
CL-EM (Procedimiento A): Tr = 1,00 min; EM (IENpos): m/z = 403/405 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,86 (s, 2H), 7,28 - 7,35 (m, 2H), 7,40 - 7,48 (m, 2H), 7,57 (s, 2H), 7,70 - 7,78 (m, 2H), 8,34 - 8,38 (m, 1H), 10,65 (s, 1H).
Intermedio 115
W-(4-Bromo-3-{[(d¡met¡lammo)met¡len]sulfamo¡l}feml)-2-(2-clorofeml)acetam¡da
Se disolvió W-(4-bromo-3-sulfamoilfenil)-2-(2-clorofenil)acetamida (25,0 g, 61,9 mmol) en dimetilformamida (320 ml) y se añadió 1,1-dimetoxi-W,A/-dimetilmetanamina (14,6 g, 119 mmol). Se agitó a temperatura ambiente durante 3 horas, después se concentró al vacío y se extrajo con acetato de etilo (80 ml). Bajo estas condiciones el compuesto del título se disolvió y recristalizó al enfriarse con hielo. Este precipitado se retiró por filtración y se lavó con una pequeña cantidad de acetato de etilo para dar el compuesto del título puro (25,8 g, 56,2 mmol, 97 % de pureza, 91 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,09 min; EM (IENpos): m/z = 458/460 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,93 (s, 3H), 3,19 (s, 3H), 3,86 (s, 2H), 7,28 - 7,35 (m, 2H), 7,40 - 7,48 (m, 2H), 7,68 (d, 1H), 7,74 (dd, 1H), 8,27 (s, 1H), 8,37 (d, 1H), 10,63 (s, 1H).
Intermed¡o 116 y Intermed¡o 117
Se disolvieron tris(dibencilidenacetona)dipaladio(0) (409 mg, 0,45 mmol) y 2-di-terc-butilfosfino-3,4,5,6-tetrametil-2',4',6'-triisopropil-1,1'-bifenilo (Tetrametil-di-tBuXPhos, 215 mg, 0,45 mmol) en tolueno (12 ml) y se evacuaron y se purgaron con argón tres veces. La mezcla se calentó a 120 °C (para dar un color parduzco) y se añadieron 2-bromo-W-[(dimetilamino)metilen]-5-nitrobencensulfonamida (3,00 g, 8,92 mmol) y 4-(trifluorometil)-1H-1,2,3-triazol (2,08 g,
15,2 mmol), después se añadió fosfato de potasio (3,79 g, 17,9 mmol) y se agitó a 20 °C durante la noche. Después de enfriar a temperatura ambiente, la mezcla de reacción se extrajo con acetato de etilo y se lavó con solución de salmuera. La fase orgánica se secó sobre sulfato de sodio y se concentró al vacío. Para volver a proteger el compuesto deseado, el material en bruto se disolvió nuevamente en dimetilformamida (9 ml) y se añadió 1,1-dimetoxi-N,N-dimetilmetanamina (1,5 ml). Se agitó a temperatura ambiente durante la noche y se extrajo con diclorometano/agua. La fase orgánica se lavó con solución de salmuera, se secó sobre sulfato de sodio y se concentró al vacío. La cromatografía en un sistema Biotage Isolera permitió la purificación y separación los dos compuestos del título.
Intermedio 116
W-[(D¡met¡lammo)met¡len]-5-mtro-2-[4-(tr¡fluoromet¡l)-2H-1,2,3-tr¡azol-2-¡l]bencensulfonam¡da
193 mg, 0,492 mmol, 6 % de rendimiento, 90 % de pureza
CL-EM (Procedimiento A): Tr = 1,06 min; EM (lENpos): m/z = 393 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,87 (s, 3H), 3,14 (s, 3H), 7,92 (s, 1H), 8,07 (d, 1H), 8,62 (dd, 1H), 8,79 (d, 1H), 8,87 (s, 1H).
Intermed¡o 117
W-[(D¡met¡lammo)met¡len]-5-mtro-2-[4-(tr¡fluoromet¡l)-1H-1,2,3-tr¡azol-1-¡l]bencensulfonam¡da
180 mg, 0,459 mmol, 5 % de rendimiento, 90 % de pureza
CL-EM (Procedimiento A): Tr = 1,04 min; EM (lENpos): m/z = 393 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,80 (d, 3H), 3,08 (s, 3H), 7,88 (s, 1H), 8,11 (d, 1H), 8,65 (dd, 1H), 8,77 (d, 1H), 9,35 (d, 1H).
Intermed¡o 118
2-(4-C¡ano-1H-p¡razol-1 -¡l)-5-n¡trobencensulfonam¡da
Se disolvió 2-cloro-5-nitrobencensulfonamida (250 mg, 1,06 mmol) en acetonitrilo (10 ml), después se añadieron 1H-pirazol-4-carbonitrilo (148 mg, 1,59 mmol) y polvo fino de carbonato de potasio (438 mg, 3,17 mmol). La mezcla de reacción se agitó durante la noche a 100 °C. Después de enfriar a temperatura ambiente, se añadieron diclorometano y agua y la fase orgánica se lavó con solución de salmuera, se secó sobre sulfato de sodio y se concentró al vacío. La purificación mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) dio el compuesto del título (128 mg, 0,436 mmol, 41 % de rendimiento, 70 % de pureza).
CL-EM (Procedimiento A): Tr = 0,78 min; EM (lENpos): m/z = 294 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 7,94 (d a, 2H), 7,98 (d, 1H), 8,42 (d, 1H), 8,61 (dd, 1H), 8,83 (d, 1H), 9,04 (d, 1H).
Intermedio 119
5-Ammo-2-(4-c¡ano-1H-p¡razol-1-¡l)bencensulfonam¡da
Se disolvieron 2-(4-ciano-1H-pirazol-1-il)-5-nitrobencensulfonamida (128 mg, 0,44 mmol) en metanol (17 ml) y dioxano (3 ml). El recipiente se evacuó y se purgó con nitrógeno, después se añadió paladio sobre carbono (13 mg, 10 % de carga). Se evacuó nuevamente y se purgó con hidrógeno, después se agitó en una atmósfera de hidrógeno durante 5 h a temperatura ambiente. El hidrógeno se retiró, el catalizador se separó por filtración y el material filtrado se concentró al vacío. Se disolvió nuevamente en diclorometano y se concentró nuevamente al vacío para dar el compuesto del título (81 mg, 0,308 mmol, 70 % de rendimiento, 79 % de pureza).
CL-EM (Procedimiento B): Tr = 0,46 min; EM (lENpos): m/z = 264 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 6,06 (s, 2H), 6,77 (dd, 1H), 7,17 - 7,23 (m, 4H), 8,23 (d, 1H), 8,71 (d, 1H).
Intermedio 120
1-{2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-mtrofeml}-1H-p¡razol-4-carbox¡lato de etilo
A una solución de 2-cloro-A/-(2,4-dimetox¡benc¡l)-5-n¡trobencensulfonam¡da (5 g, 12,9 mmol) en acetonitrilo (250 ml) se le añadieron 1H-pirazol-4-carboxilato de etilo (2,72 g, 19,4 mmol, CAS-r N 37622-90-5) y carbonato de potasio en polvo (5,36 g, 38,8 mmol) y se calentó durante 19 h a 90 °C. La mezcla de reacción se diluyó con agua y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se usó sin purificación adicional (7,8 g, 98 % de rendimiento, 80 % de pureza).
CL-EM (Procedimiento A): Tr = 1,27 min; EM (lENpos): m/z = 491 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,30 (t, 3H), 3,51 (s, 3H), 3,63 (s, 3H), 4,14 (s, 2H), 4,29 (q, 2H), 6,17 (d, 1H), 6,28 (dd, 1H), 7,07 (d, 1H), 7,91 (d, 1H), 8,05 (s a, 1H), 8,24 (d, 1H), 8,29 (s, 1H), 8,46 (dd, 1H), 8,84 (s, 1H).
Intermed¡o 121
ác¡do 1-{2-[(2,4-D¡metox¡benc¡l)sulfamo¡l]-4-mtrofeml}-1H-p¡razol-4-carboxíl¡co
A una solución de 1-{2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-n¡trofen¡l}-1H-p¡razol-4-carbox¡lato de etilo (7,8 g, 12,9 mmol, 80 % de pureza) en tetrahidrofurano (129 ml) se le añadió una solución de hidróxido de litio (1,55 g, 64,6 mmol) en agua (11,6 ml) y se agitó durante 18 h a temperatura ambiente. El disolvente se evaporó y el material en bruto se suspendió en agua (15 ml), y se acidificó hasta un pH de 5 usando HCl acuoso (55 ml, 1,0 M). La suspensión se agitó durante 30 min y se filtró. El precipitado se secó a 50 °C al vacío (5,7 g, 91 % de rendimiento, 95 % de pureza). CL-EM (Procedimiento A): Tr = 1,08 min; EM (lENpos): m/z = 463 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,50 (s, 3H), 3,62 (s, 3H), 4,14 (d, 2H), 6,16 (d, 1H), 6,28 (dd, 1H), 7,07 (d, 1H), 7,90 (d, 1H), 8,12 (t, 1H), 8,22 (d, 1H), 8,24 (s, 1H), 8,45 (dd, 1H), 8,76 (s, 1H), 12,82 (s a, 1H).
Intermedio 122
(1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-mtrofeml}-1H-pirazol-4-il)carbamato de 2-(trim etilsilil)etilo
A una solución de ácido 1-{2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-n¡trofen¡l}-1H-p¡razol-4-carboxílico (5,7 g, 11,7 mmol, 95 % de pureza) y trietilamina (2,45 ml, 17,6 mmol) en dioxano (59 ml) se le añadió fosforazidato de difenilo (6,45 g, 23,4 mmol), y la solución se calentó a 50 °C durante 75 min. Después, se añadió 2-(trimetils¡l¡l)etanol (8,39 ml, 58,5 mmol), y la mezcla se agitó a 100 °C durante 3 h. La mezcla de reacción se diluyó con acetato de etilo y se lavó con solución acuosa saturada de carbonato ácido de sodio y con salmuera. La fase orgánica se secó usando un filtro Whatman y se evaporó al vacío. La purificación mediante cromatografía ultrarrápida dio el compuesto del título (6,5 g, 86 % de rendimiento, 89 % de pureza).
CL-EM (Procedimiento A): Tr = 1,46 min; EM (lENpos): m/z = 578 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 0,07 (s, 9H), 1,03 (m, 2H), 3,46 (s, 3H), 3,63 (s, 3H), 4,18 (d, 2H), 4,21 (m, 2H), 6,14 (d, 1H), 6,29 (dd, 1H), 7,10 (d, 1H), 7,81 (d, 1H), 7,88 (s, 1H), 8,17 (t, 1H), 8,20 (d, 1H), 8,21 (s, 1H), 8,40 (dd, 1H), 9,74 (s, 1H).
Intermedio 123
[1-(4-{[(2-clorofeml)acetil]ammo}-2-[(2,4-dimetoxibencil)sulfamoil]feml)-1H-pirazol-4-il]carbamato de 2-(trim etils ilil)etilo
Se añadió dihidrato de cloruro de estaño (II) (11,1 g, 50,3 mmol) a una solución de (1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-il)carbamato de 2-(trimetilsilil)etilo (6,5 g, 89 % de pureza, 10,1 mmol) en dioxano (129 ml), después se agitó durante 4 h a 70 °C y durante la noche a temperatura ambiente. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se neutralizó con solución acuosa al 5 % de hidróxido de sodio, después se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se secaron sobre un filtro Whatman, y se concentraron al vacío para dar 5,5 g de (1-{4-amino-2-[(2,4-dimetoxibencil)sulfamoil]fenil}-1H-pirazol-4-il)carbamato de 2-(trimetilsilil)etilo en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (5,5 g) se disolvió en DMF (154 ml), después se añadieron ácido (2-clorofenil)acético (2,74 g, 16,1 mmol), W,A/-diisopropiletilamina (5,6 ml, 32,1 mmol) y HATU (6,11 g, 16,1 mmol). La mezcla de reacción se agitó durante 17 h a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (10,55 g, 50 % de pureza, 75 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,49 min; EM (lENpos): m/z = 700 [M+H]+
Intermedio 124
W-{4-(4-Ammo-1H-pirazoM-M)-3-[(2,4-dimetoxibencN)sulfamoN]fenM}-2-(2-dorofeml)acetamida
A una solución de [1-(4-{[(2-clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]carbamato de 2-(trimetilsilil)etilo (10,55 g, 7,53 mmol) en tetrahidrofurano (4 ml), se le añadió una solución de fluoruro de tetrabutilamonio en tetrahidrofurano 1 M (15,1 ml, 15,1 mmol), y la mezcla se calentó durante 2,5 ha 50 °C. Se añadió más solución de fluoruro de tetrabutilamonio en tetrahidrofurano 1 M (3,77 ml, 3,77 mmol), y se continuó el calentamiento a 50 °C durante 3 h. La mezcla de reacción se diluyó con agua y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (2,9 g, 55 % de rendimiento, 80 % de pureza).
CL-EM (Procedimiento B): Tr = 1,18 min; EM (lENpos): m/z = 556 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,56 (s, 3H), 3,63 (s, 3H), 3,84 (s, 2H), 3,95 (d, 2H), 4,13 (s, 2H), 6,30 (dd, 1H), 6,31 (d, 1H), 7,02 (d, 1H), 7,24 (s, 1H), 7,28 (s, 1H), 7,30 (m, 2H), 7,36 (d, 1H), 7,42 (m, 2H), 7,77 (t, 1H), 7,87 (dd, 1H), 8,02 (d, 1H), 10,57 (s, 1H).
Intermedio 125
W-[1-(4-{[(2-Clorofeml)acetM]ammo}-2-[(2,4-dimetoxibencN)sulfamoN]feml)-1H-pirazol-4-M]-2,2-difluoroacetamida
Se disolvió W-{4-(4-am¡no-1H-p¡razol-1-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l}-2-(2-clorofen¡l)acetam¡da (200 mg, 360 |jmol) en DMF (6,9 ml), y se añad¡eron ác¡do d¡fluoroacét¡co (45,4 jl, 719 jmol), W,A/-d¡¡soprop¡let¡lam¡na (251 jl, 1,44 mmol) y HATU (274 mg, 719 jmol). La mezcla de reacc¡ón se ag¡tó durante la noche a temperatura amb¡ente. Se añad¡ó soluc¡ón acuosa saturada de carbonato ác¡do de sod¡o y la mezcla se extrajo tres veces con acetato de et¡lo. Después las fases orgán¡cas se comb¡naron, se lavaron con salmuera, se secaron sobre un f¡ltro Whatman y se concentraron al vacío para dar el compuesto del título en bruto (251 mg) que se usó s¡n pur¡f¡cac¡ón ad¡c¡onal.
CL-EM (Proced¡m¡ento B): Tr = 1,24 m¡n; EM (lENpos): m/z = 634 [M+H]+
Intermedio 126
W-[1-(4-{[(2-Clorofeml)acetM]ammo}-2-[(2,4-dimetoxibencN)sulfamoN]feml)-1H-pirazol-4-M]-3,3,3-trifluoropropanamida
Una mezcla de A/-{4-(4-am¡no-1H-p¡razol-1-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l}-2-(2-clorofen¡l)acetam¡da (200 mg, 288 jmol, 80 % de pureza), W,W-d¡¡soprop¡let¡lam¡na (150 jl, 863 jmol), y cloruro de 3,3,3-tr¡fluoropropano¡lo (35,6 jl, 345 jmol) en THF (400 j l) se ag¡tó enérg¡camente a temperatura amb¡ente durante 7 días. Se añad¡ó soluc¡ón acuosa saturada de carbonato ác¡do de sod¡o y la mezcla se extrajo tres veces con d¡clorometano. Después las fases orgán¡cas se comb¡naron, se lavaron con salmuera, se secaron sobre un f¡ltro Whatman y se concentraron al vacío para dar el compuesto del título en bruto (285 mg) que se usó s¡n pur¡f¡cac¡ón ad¡c¡onal.
CL-EM (Proced¡m¡ento B): Tr = 1,27 m¡n; EM (lENpos): m/z = 666 [M+H]+
Intermedio 127
(±)-W-[1-(4-{[(2-Clorofeml)acetM]ammo}-2-[(2,4-dimetoxibencN)sulfamoN]feml)-1H-pirazol-4-M]-3,3,3-trifluoro-2-metilpropanamida
Se preparó una mezcla de W-{4-(4-am¡no-1H-p¡razol-1-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l}-2-(2-clorofenil)acetamida (216 mg, 350 pmol, 90 % de pureza), A/,W-d¡¡soprop¡let¡lam¡na (305 pl, 1,75 mmol), y cloruro de (±)-3,3,3-tr¡fluoro-2-met¡lpropano¡lo (112 mg, 700 pmol) a 0 °C y se ag¡tó a temperatura amb¡ente durante la noche. Se añad¡ó soluc¡ón acuosa saturada de carbonato ác¡do de sod¡o y la mezcla se extrajo tres veces con d¡clorometano. Después las fases orgán¡cas se comb¡naron, se lavaron con salmuera, se secaron sobre un f¡ltro Whatman y se concentraron al vacío para dar el compuesto del título en bruto (327 mg) que se usó s¡n pur¡f¡cac¡ón ad¡c¡onal.
CL-EM (Proced¡m¡ento A): Tr = 1,31 m¡n; EM (lENpos): m/z = 680 [M+H]+
Intermedio 128
-(2-ClorofenM)-W-(3-[(2,4-dimetoxibencN)sulfamoM]-4-{4-(2,5-dimetNpirroNdm-1-M)-1H-pirazoM-il}fenil)acetamida (Mezcla de estereoisómeros)
A una soluc¡ón de A/-{4-(4-am¡no-1H-p¡razol-1-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l}-2-(2-clorofen¡l)acetam¡da (400 mg, 575 pmol, 80% de pureza) en aceton¡tr¡lo (10 ml) se le añad¡eron 2,5-d¡bromohexano (107 pl, 691 pmol, CAS-RN 24774-58-1) y carbonato de potas¡o en polvo (191 mg, 1,38 mmol), y la mezcla se ag¡tó durante 6 días a 90 °C. La mezcla de reacc¡ón se d¡luyó con agua y se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se lavaron con salmuera y se secaron usando un f¡ltro Whatman. La concentrac¡ón a pres¡ón reduc¡da d¡o el compuesto del título en bruto (531 mg) como una mezcla de estereo¡sómeros que se usó s¡n pur¡f¡cac¡ón ad¡c¡onal.
CL-EM (Proced¡m¡ento A): Tr = 1,29 m¡n y 1,36 m¡n; EM (lENpos): m/z = 638 [M+H]+ each.
Intermedio 129
W-(4-{4-[(2,2-DifluoroetN)ammo]-1H-pirazoM-M}-3-[(2,4-dimetoxibencN)sulfamoN]fenM)-2-(2-fluorofenil)acetamida
Se añadió dihidrato de cloruro de estaño (II) (621 mg, 2,75 mmol) a una solución de 2-{4-[(2,2-difluoroetil)amino]-1H-pirazol-1-il}-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (274 mg, 551 pmol) en dioxano (7,1 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 114 mg de 5-amino-2-{4-[(2,2-difluoroetil)amino]-1H-pirazol-1-il}-A/-(2,4-dimetoxibencil)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (230 mg) se disolvió en DMF (10 ml), después se añadieron ácido (2 fluorofenil)acético (114 mg, 738 pmol), W,A/-diisopropiletilamina (343 pl, 1,97 mmol) y HATU (281 mg, 738 pmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (426 mg, 60 % de pureza, 77 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,25 min; EM (lENpos): m/z = 604 [M+H]+
Intermedio 130
W-(2,2,2-TrifluoroetM)-1H-pirazol-4-amma
A una solución de 1H-pirazol-4-amina (300 mg, 95 % de pureza, 3,43 mmol) en acetonitrilo (17 ml) se le añadieron trifluorometansulfonato de 2,2,2-trifluoroetilo (741 pl, 5,1 mmol, CAS-RN 6226-25-1), carbonato de potasio en polvo (1,06 g, 7,65 mmol) y trietilamina (720 pl, 5,1 mmol). La mezcla se calentó a 90 °C durante 4 h y se agitó a temperatura ambiente durante la noche. Para el tratamiento posterior, se filtró, y el sólido se enjuagó con acetato de etilo. La concentración del material filtrado al vacío seguida por cromatografía ultrarrápida dio el compuesto del título (435 mg, 73 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 0,61 min; EM (lENpos): m/z = 166 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,62 (qd, 2H), 5,06 (t, 1H), 7,13 (s, 2H), 12,12 (s, 1H).
Intermedio 131
W-(2,4-DimetoxibencN)-5-mtro-2-{4-[(2,2,2-trifluoroetN)ammo]-1H-pirazoM -il}bencensulfonamida
A una solución de 2-doro-A/-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (371 mg, 911 |jmol) en acetonitrilo (9,6 ml) se le añadieron W-(2,2,2-tnfluoroetil)-1H-p¡razol-4-amina (430 mg, 1,82 mmol) y carbonato de potasio en polvo (377 mg, 2,73 mmol) y se irradió durante 12 h a 120 °C en el microondas. La mezcla de reacción se filtró, se concentró al vacío, y el residuo se purificó mediante cromatografía ultrarrápida (345 mg, 55 % de rendimiento, 75 % de pureza). CL-EM (Procedimiento B): Tr = 1,28 min; EM (lENpos): m/z = 516 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,38 (s, 3H), 3,59 (s, 3H), 3,81 (qd, 2H), 4,16 (d, 2H), 5,80 (t, 1H), 6,08 (d, 1H), 6,25 (dd, 1H), 7,08 (d, 1H), 7,67 (s, 1H), 7,70 (d, 1H), 7,83 (s, 1H), 8,16 (d, 1H), 8,22 (t, 1H), 8,38 (dd, 1H).
Intermedio 132
-(2-Clorofeml)-W-(3-[(2,4-dimetoxibencN)sulfamoM]-4-{4-[(2,2,2-trifluoroetN)ammo]-1H-pirazoM-il}fenil)acetamida
Se añadió dihidrato de cloruro de estaño (II) (558 mg, 2,47 mmol) a una solución de W -^^-d im etoxibencil^-n itro^-{4-[(2,2,2-t^fluoroet¡l)am¡no]-1H-p¡razol-1-¡l}bencensulfonam¡da (340 mg, 495 jmol, 75% de pureza) en dioxano (6,3 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 320 mg de 5-amino-W-(2,4-d¡metox¡benc¡l)-2-{4-[(2,2,2-t^fluoroet¡l)am¡no]-1H-p¡razol-1-¡l}bencensulfonam¡da en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (315 mg) se disolvió en DMF (8,2 ml), después se añadieron ácido (2-clorofenil)acético (116 mg, 681 jmol), W,W-diisopropiletilamina (316 jl, 1,82 mmol) y HATU (259 mg, 681 jmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió agua y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (528 mg, 55 % de pureza, 92 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,33 min; EM (lENpos): m/z = 638 [M+H]+
Intermedio 133
W-(2,4-Dimetoxibencil)-2-(4-isopropil-1H-pirazol-1-M)-5-mtrobencensulfonamida
A una solución de 2-doro-W-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (1,0 g, 2,59 mmol) en acetonitrilo (13 ml) se le añadieron clorhidrato de 4-isopropiMH-pirazol (568 mg, 3,88 mmol, CAS-RN 1390654-61-1) y carbonato de potasio en polvo (1,43 g, 10,3 mmol). La mezcla se irradió durante la noche a 120 °C y durante otra noche a 130 °C en el microondas. La mezcla de reacción se filtró, se concentró al vacío, y el residuo se purificó mediante cromatografía ultrarrápida (646 mg, 49 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento B): Tr = 1,37 min; EM (lENpos): m/z = 461 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,24 (d, 6H), 2,89 (sept, 1H), 3,42 (s, 3H), 3,60 (s, 3H), 4,16 (d, 2H), 6,11 (d, 1H), 6,26 (dd, 1H), 7,09 (d, 1H), 7,81 (d, 1H), 7,89 (s, 1H), 8,16 (s, 1H), 8,20 (d, 1H), 8,28 (t, 1H), 8,40 (dd, 1H).
Intermedio 134
2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencM)sulfamoM]-4-(4-isopropil-1H-pirazol-1-N)feml}acetamida
Se añadió dihidrato de cloruro de estaño (II) (1,42 g, 6,29 mmol) a una solución de W-(2,4-dimetoxibencil)-2-(4-¡soprop¡l-1H-p¡razol-1-¡l)-5-n¡trobencensulfonam¡da (644 mg, 1,26 mmol, 90 % de pureza) en dioxano (16 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 443 mg de 5-am¡no-W-(2,4-d¡metox¡benc¡l)-2-(4-¡soprop¡l-1H-p¡razol-1-¡l)bencensulfonam¡da en bruto que se usó sin purificación adicional en el paso siguiente. El material en bruto del paso previo (220 mg) se disolvió en d Mf (5 ml), después se añadieron ácido (2 clorofenil)acético (124 mg, 728 pmol), AA-diisopropiletilamina (338 pl, 1,94 mmol) y HATU (277 mg, 728 pmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (410 mg, 65 % de pureza, 73 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,43 min; EM (lENpos): m/z = 583 [M+H]+
Intermedio 135
A-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(4-isopropiMH-pirazol-1-il)feml}-2-(2-fluorofeml)acetamida
Se disolvió 5-am¡no-W-(2,4-d¡metox¡benc¡l)-2-(4-¡soprop¡l-1H-pirazol-1-¡l)bencensulfonam¡da en bruto (220 mg) en DMF (5 ml), después se añadieron ácido (2-fluorofenil)acético (112 mg, 728 pmol), W,A/-di¡soprop¡let¡lam¡na (338 pl, 1,94 mmol) y HATU (277 mg, 728 pmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (407 mg, 65 % de pureza, 74 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,40 min; EM (lENpos): m/z = 567 [M+H]+
Intermedio 136
hexafluorofosfato de 2-[(d¡met¡lammo)met¡len]-4,4,4-tr¡fluoro-W,W-d¡met¡lbutan-1-¡m¡mo
A una solución de ácido 4,4,4-trifluorobutanoico (5,0 g, 35,2 mmol, CAS-RN 406-93-9) en DMF (17,5 ml), a 50 °C se le añadió tricloruro fosfórico (3,28 ml, 35,2 mmol) por goteo. Después de agitar durante 2 h a 70 °C, la solución se enfrió a temperatura ambiente. Se añadió esta mezcla de reacción y NaOH 5 N (12,7 ml, 63,3 mmol) conjuntamente a lo largo de 30 min a una mezcla de ácido hexafluorofosfórico al 55 % (6,1 ml, 38,0 mol) y NaOH 5 N (14,1 ml) en agua (46 ml) manteniendo la temperatura a <10 °C. La mezcla se agitó durante 1 ha 0 °C y se retiró por filtración. El sólido amarillo se lavó con agua, después se secó al vacío a <40 °C para dar el compuesto del título (545 mg, 4 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 0,56 min; EM (lENpos): m/z = 209 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,30 (s, 12H), 3,62 (q, 2H), 7,72 (s, 2H).
Intermed¡o 137
4-(2,2,2-Tr¡fluoroet¡l)-1H-p¡razol
Se añadió monohidrato de hidrazina (82 mg, 1,69 mmol) por goteo a una solución agitada de hexafluorofosfato de 2-[(d¡met¡lam¡no)met¡len]-4,4,4-tr¡fluoro-W,A/-d¡met¡lbutan-1-¡m¡n¡o (543 mg, 1,53 mmol) en metanol (7,5 ml). La solución resultante se sometió a reflujo durante 90 min, y se enfrió a temperatura ambiente. Se añadió ácido clorhídrico concentrado (378 pl) y se continuó el calentamiento a reflujo durante 2 h. El disolvente se evaporó al vacío y el residuo se colocó en agua y se ajustó a pH 10 con NaOH 2 M (3 ml]. El producto se extrajo con diclorometano. Los extractos combinados se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título (226 mg, 88 % de rendimiento, 90 % de pureza) que se usó sin purificación adicional.
CL-EM (Procedimiento B): Tr = 0,71 min; EM (lENpos): m/z = 151 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,48 (q, 2H), 7,44 (s, 1H), 7,72 (s, 1H), 12,85 (s, 1H).
Intermedio 138
W-(2,4-D¡metox¡benc¡l)-5-mtro-2-[4-(2,2,2-tr¡fluoroet¡l)-1H-p¡razol-1-¡l]bencensulfonam¡da
A una solución de 2-cloro-A/-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (417 mg, 1,08 mmol) en acetonitrilo (17 ml) se le añadieron 4-(2,2,2-trifluoroetil)-1H-pirazol (270 mg, 1,62 mmol, 90 % de pureza) y carbonato de potasio en polvo (447 mg, 3,24 mmol). La mezcla se irradió durante 195 min a 120 °C en el microondas. La mezcla de reacción se diluyó con agua y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera y se secaron usando un filtro Whatman. La concentración a presión reducida dio el compuesto del título que se purificó mediante cromatografía ultrarrápida (185 mg, 29 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento B): Tr = 1,33 min; EM (lENpos): m/z = 501 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,46 (s, 3H), 3,61 (s, 3H), 3,65 (q, 1H), 4,16 (d, 2H), 6,14 (d, 1H), 6,27 (dd, 1H), 7,09 (d, 1H), 7,81 (d, 1H), 7,94 (s, 1H), 8,16 (t, 1H), 8,21 (d, 1H), 8,34 (s, 1H), 8,42 (dd, 1H).
Intermed¡o 139
2-(2-Clorofeml)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-[4-(2,2,2-tr¡fluoroet¡l)-1H-p¡razol-1-¡l]feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (344 mg, 1,53 mmol) a una solución de W-(2,4-dimetoxibencil)-5-nitro-2-[4-(2,2,2-trifluoroetil)-1H-pirazol-1-il]bencensulfonamida (180 mg, 306 pmol, 85 % de pureza) en dioxano (3,9 ml) y se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se lavaron con salmuera, se secaron usando un filtro Whatman y se concentraron al vacío para dar 196 mg de 5-amino-W-(2,4-dimetoxibencil)-2-[4-(2,2,2-trifluoroetil)-1H-pirazol-1-il]bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (145 mg) se disolvió en DMF (6 ml), después se añadieron ácido (2-clorofenil)acético (63 mg, 371 pmol), A/,W-diisopropiletilamina (215 pl, 1,24 mmol) y HATU (141 mg, 371 pmol). La mezcla de reacción se agitó a temperatura ambiente durante 2 días. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (220 mg, 85 % de pureza, 98 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,37 min; EM (lENpos): m/z = 623 [M+H]+
Intermed¡o 140
W-{3-[(2,4-D¡metox¡benc¡l)sulfamo¡l]-4-[4-(2,2,2-tr¡fluoroet¡l)-1H-p¡razol-1-¡l]feml}-2-(2-fluorofeml)acetam¡da
Se disolvió 5-am¡no-A/-(2,4-d¡metox¡benc¡l)-2-[4-(2,2,2-tr¡fluoroet¡l)-1H-p¡razol-1-¡l]bencensulfonam¡da en bruto (89 mg) en DMF (4 ml), después se añadieron ácido (2-fluorofenil)acético (117 mg, 760 pmol), A/,W-di¡soprop¡let¡lam¡na (165 pl, 950 pmol) y HATU (217 mg, 570 pmol). La mezcla de reacción se agitó durante 3 días a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (136 mg, 85 % de pureza, 98 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,36 min; EM (lENpos): m/z = 607 [M+H]+
Intermed¡o 141
2-(5-C¡cloprop¡l-1,2,4-oxad¡azol-3-¡l)-W-(2,4-d¡metox¡benc¡l)-5-mtrobencensulfonam¡da
Se agitó 2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-W-h¡drox¡-4-n¡trobencencarbox¡m¡dam¡da (84 mg, 205 pmol) con anhídrido ciclopropancarboxílico (51 pl, 450 pmol) en tolueno (4,2 ml) a reflujo durante la noche. Se añadió más anhídrido ciclopropancarboxílico (27 pl, 225 pmol) y la reacción se calentó a reflujo durante 3 h. La mezcla de reacción se colocó en agua y se extrajo con acetato de etilo. La fase orgánica se lavó con salmuera, se secó sobre un filtro Whatman, y se concentró a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (60 mg, 48 % de rendimiento, 75 % de pureza).
CL-EM (Procedimiento B): Tr = 1,32 min; EM (lENneg): m/z = 459 (M-H)-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,19 (m, 2H), 1,38 (m, 2H), 2,53 (m, 1H), 3,42 (s, 3H), 3,60 (s, 3H), 4,16 (d, 2H), 6,07 (d, 1H), 6,25 (dd, 1H), 7,06 (d, 1H), 7,75 (t, 1H), 7,98 (d, 1H), 8,18 (d, 1H), 8,43 (dd, 1H).
Intermed¡o 142
2-(2-Clorofen¡l)-W-{4-(5-c¡cloprop¡l-1,2,4-oxad¡azol-3-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (252 mg, 1,12 mmol) a una solución de 2-(5-ciclopropil-1,2,4-oxadiazol-3-il)-W-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (103 mg, 224 |jmol) en dioxano (2,9 ml), después se agitó durante 4 h a 70 °C y durante la noche a temperatura ambiente. La mezcla de reacción se concentró al vacío. Se añadió acetato de etilo al residuo y la mezcla se extrajo con salmuera. La fase orgánica se filtró sobre Celite, se secó sobre un filtro Whatman, y se concentró al vacío para dar 118 mg de 5-amino-2-(5-ciclopropil-1,2,4-oxadiazol-3-il)-A/-(2,4-dimetoxibencil)bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (118 mg) se disolvió en DMF (4,4 ml), después se añadieron ácido (2-clorofenil)acético (76,4 mg, 448 jmol), A/,W-diisopropiletilamina (156 jl, 896 jm ol) y HATU (170 mg, 448 jmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo con acetato de etilo. Después la fase orgánica se lavó con salmuera, se secó sobre un filtro Whatman y se concentró al vacío para dar el compuesto del título que se usó sin purificación adicional (135 mg, 95 % de pureza, 98 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,35 min; EM (lENpos): m/z = 583 [M+H]+
Intermedio 143
5-[2-(Bencilsulfanil)-4-nitrofenil]-3-(trifluorometil)-1,2,4-oxadiazol
A una suspensión de ácido 2-(bencilsulfanil)-4-nitrobenzoico (715 mg, 2,35 mmol, 95 % de pureza) en tolueno (7,4 ml) se le añadió cloruro de tionilo (343 jl, 4,70 mmol). La mezcla se calentó a 70 °C durante 210 min. El disolvente se retiró a presión reducida, el residuo se destiló conjuntamente con tolueno y después se disolvió en THF (10 ml). Se añadieron 2,2,2-trifluoro-A/-hidroxietanimidamida (341 mg, 2,53 mmol, CAS-RN 4314-35-6) y W,W-diisopropiletilamina (1,20 ml, 6,90 mmol), y la mezcla se agitó a temperatura ambiente durante la noche y a reflujo durante 2 h. Se añadió agua a la mezcla de reacción, y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (640 mg, 69 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 1,51 min; EM (lENpos): m/z = 382 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 4,57 (s, 2H), 7,29 (dd, 1H), 7,35 (dd, 2H), 7,47 (d, 2H), 8,16 (dd, 1H), 8,38 (d, 1H), 8,38 (d, 1H).
Intermedio 144
N-(2,4-DimetoxibencN)-5-mtro-2-[3-(trífluorometM)-1,2,4-oxadiazol-5-N]bencensulfonamida
Se agitó 5-[2-(bencilsulfanil)-4-nitrofenil]-3-(trifluorometil)-1,2,4-oxadiazol (636 mg, 1,58 mmol, 95 % de pureza) con N-clorosuccimida (952 mg, 7,13 mmol) en ácido acético (15 ml) a temperatura ambiente durante 5 h. La mezcla de reacción se concentró al vacío para dar 565 mg de cloruro de 5-nitro-2-[3-(trifluorometil)-1,2,4-oxadiazol-3-il]bencensulfonilo en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (565 mg) se disolvió en diclorometano (8 ml), después se añadió carbonato ácido de sodio (531 mg, 6,32 mmol), y después se añadió lentamente 1-(2,4-dimetoxifenil)metanamina (291 pl, 1,74 mmol) a temperatura ambiente. La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió agua a la mezcla de reacción, y se extrajo con diclorometano. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (153 mg, 16 % de rendimiento, 80 % de pureza).
CL-EM (Procedimiento A): Tr = 1,36 min; EM (lENneg): m/z = 487 (M-H)-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,57 (s, 3H), 3,65 (s, 3H), 4,06 (d, 2H), 6,24 (d, 1H), 6,26 (dd, 1H), 6,97 (d, 1H), 8,18 (d, 1H), 8,44 (d, 1H), 8,55 (dd, 1H), 8,56 (t, 1H).
Intermedio 145
2-(2-Clorofeml)-N-{3-[(2,4-dimetoxibencil)sulfamoM]-4-[3-(trífluorometM)-1,2,4-oxadiazol-5-il]feml}acetamida
Se añadió dihidrato de cloruro de estaño (II) (425 mg, 1,88 mmol) a una solución de N-(2,4-dimetoxibencil)-5-nitro-2-[3-(trifluorometil)-1,2,4-oxadiazol-5-il]bencensulfonamida (230 mg, 80% de pureza, 377 pmol) en dioxano (4,8 ml), después se agitó durante 5 h a 70 °C y durante la noche a temperatura ambiente. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se secaron sobre un filtro Whatman, y se concentraron al vacío para dar 217 mg de 5-amino-N-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1,2,4-oxadiazol-5-il]bencensulfonamida en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (216 mg) se disolvió en DMF (8 ml), después se añadieron ácido (2-clorofenil)acético (129 mg, 754 pmol), N,N-diisopropiletilamina (263 pl, 1,51 mmol) y HATU (287 mg, 754 pmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (355 mg, 65 % de pureza, 98 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,43 min; EM (lENneg): m/z = 609 (M-H)-
Intermedio 146
2-(Bencilsulfaml)-W-(difluoroacetil)-4-mtrobenzohidrazida
A una suspensión de 2-(bencilsulfanil)-4-nitrobenzohidrazida (2,64 g, 95 % de pureza, 8,27 mmol) en acetonitrilo (100 ml), se le añadieron A/,W-diisopropiletilamina (1,73 ml, 9,92 mmol) y difluoroanhídrido acético (1,13 ml, 9,10 mmol) a -50 °C. La mezcla se dejó calentar a temperatura ambiente y se agitó durante 5 h. La reacción se vertió sobre solución acuosa de hidróxido de sodio (5 %). La mezcla se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se usó sin purificación (3,57 g, 91 % de rendimiento, 80 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (lENneg): m/z = 380 (M-H)-RMN 1H (400MHz, DMSO-da) 8 [ppm]: 4,32 (s, 2H), 5,97 (t, 1H), 7,25 (dd, 1H), 7,32 (dd, 2H), 7,43 (d, 2H), 7,69 (d, 1H), 7,96 (dd, 1H), 8,11 (d, 1H).
Intermedio 147
2-[2-(Bencilsulfanil)-4-nitrofenil]-5-(difluorometil)-1,3,4-oxadiazol
Una solución de 2-(bencilsulfanil)-W-(difluoroacetil)-4-nitrobenzohidrazida (3,57 g, 80 % de pureza, 7,49 mmol) y 2,2 dióxido de 3,3,3-trietil-1-(metoxicarbonil)diazatian-3-io-1-ida (7,38 g, 31,0 mmol) en tetrahidrofurano (90 ml) se irradió durante 30 min a 150 °C en el microondas. Se añadió agua a la mezcla de reacción y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (2,18 g, 76 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,33 min; EM (lENpos): m/z = 364 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 4,54 (s, 2H), 7,29 (dd, 1H), 7,35 (dd, 2H), 7,47 (d, 2H), 7,59 (t, 1H), 8,15 (dd, 1H), 8,20 (d, 1H), 8,36 (d, 1H).
Intermedio 148
2-[5-(DifluorometM)-1,3,4-oxadiazol-2-M]-W-(2,4-dimetoxibencM)-5-mtrobencensulfonamida
Se agitó 2-[2-(bencilsulfanil)-4-nitrofenil]-5-(difluorometil)-1,3,4-oxadiazol (1,23 g, 95 % de pureza, 2,93 mmol) con N-clorosuccimida (1,76 g, 13,2 mmol) en ácido acético (29 ml) a temperatura ambiente durante 16 h. La mezcla de reacción se concentró al vacío para dar 3g de cloruro de 2-[5-(difluorometil)-1,3,4-oxadiazol-2-il]-5-nitrobencensulfonilo en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (3 g) se disolvió en diclorometano (13,5 ml), después se añadió carbonato ácido de sodio (983 mg, 17,7 mmol), y después se añadió lentamente 1-(2,4-dimetoxifenil)metanamina (484 pl, 3,22 mmol) a 0 °C. La mezcla de reacción se agitó durante 3 h a 0 °C y durante 22 h a temperatura ambiente. Se añadió agua a la mezcla de reacción, y se extrajo con diclorometano. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (242 mg, 16 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento B): Tr = 1,21 min; EM (lENpos): m/z = 488 (M+H+NHa)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,53 (s, 3H), 3,64 (s, 3H), 4,09 (d, 2H), 6,19 (d, 1H), 6,26 (dd, 1H), 6,99 (d, 1H), 7,64 (t, 1H), 8,14 (d, 1H), 8,33 (t, 1H), 8,39 (d, 1H), 8,52 (dd, 1H).
Intermedio 149
2-(2-Clorofen¡l)-W-{4-[5-(d¡fluorometM)-1,3,4-oxad¡azol-2-M]-3-[(2,4-d¡metox¡bencM)sulfamo¡l]feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (1,12 g, 4,95 mmol) a una solución de 2-[5-(difluorometil)-1,3,4-oxadiazol-2-il]-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (466 mg, 990 pmol) en dioxano (12,7 ml), después se agitó durante 4,5 ha 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se secaron sobre un filtro Whatman, y se concentraron al vacío para dar 489 mg de 5-amino-2-[5-(difluorometil)-1,3,4-oxadiazol-2-il]-N-(2,4-dimetoxibencil)bencensulfonamida en bruto que se usó sin purificación adicional.
El material en bruto del paso previo (218 mg) se disolvió en DMF (5,1 ml), después se añadieron ácido (2-clorofenil)acético (127 mg, 742 pmol), N,N-diisopropiletilamina (345 pl, 1,98 mmol) y HATU (282 mg, 742 pmol). La mezcla de reacción se agitó durante 23 h a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (499 mg, 60 % de pureza, 23 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,83 min; EM (lENpos): m/z = 593 (M+H)+
Intermed¡o 150
W-{4-[5-(D¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]feml}-2-(2-fluorofeml)acetam¡da
Se disolvió 5-am¡no-2-[5-(d¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]-W-(2,4-d¡metox¡benc¡l)bencensulfonam¡da en bruto (218 mg) en DMF (5 ml), después se añad¡eron ác¡do (2-fluorofen¡l)acét¡co (92 mg, 594 jmol), A/,W-d¡¡soprop¡let¡lam¡na (207 |jl, 1,19 mmol) y HATU (226 mg, 594 jmol). La mezcla de reacc¡ón se ag¡tó durante la noche a temperatura amb¡ente. Se añad¡ó soluc¡ón acuosa saturada de carbonato ác¡do de sod¡o y la mezcla se extrajo tres veces con acetato de et¡lo. Después las fases orgán¡cas se comb¡naron, se lavaron con salmuera, se secaron sobre un f¡ltro Whatman y se concentraron al vacío para dar el compuesto del título que se usó s¡n pur¡f¡cac¡ón ad¡c¡onal (466 mg, 37 % de pureza, 60 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,80 m¡n; EM (lENpos): m/z = 577 [M+H]+
Intermedio 151
5-[2-(Bencilsulfanil)-4-nitrofenil]-3-metil-1,2,4-oxadiazol
A una suspens¡ón de ác¡do 2-(benc¡lsulfan¡l)-4-n¡trobenzo¡co (1,94 g, 6,69 mmol) en tolueno (20 ml) se le añad¡ó cloruro de t¡on¡lo (3,42 ml, 46,8 mmol). La mezcla se calentó a 70 °C durante 150 m¡n. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el res¡duo se dest¡ló conjuntamente con tolueno y después se d¡solv¡ó en THF (77 ml). Esta soluc¡ón se añad¡ó por goteo a lo largo de 30 m¡n a una soluc¡ón de acetoh¡draz¡da (991 mg, 13,4 mmol) y W,A/-d¡¡soprop¡let¡lam¡na (1,28 ml, 7,36 mmol) en THF (11 ml), y la mezcla se ag¡tó de temperatura amb¡ente a reflujo durante 75 m¡n. Se añad¡ó agua a la mezcla de reacc¡ón y se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se lavaron con salmuera, se secaron sobre un f¡ltro Whatman, y se concentraron a pres¡ón reduc¡da para dar 2,44 g de W-acet¡l-2-(benc¡lsulfan¡l)-4-n¡trobenzoh¡draz¡da en bruto.
Una soluc¡ón de la h¡draz¡da en bruto (2,43 g) y 2,2-d¡óx¡do de 3,3,3-tr¡et¡l-1-(metox¡carbon¡l)d¡azat¡an-3-¡o-1-¡da (7,55 g, 31,7 mmol) en tetrah¡drofurano (75 ml) se ¡rrad¡ó durante 30 m¡n a 150 °C en el m¡croondas. Se añad¡ó agua a la mezcla de reacc¡ón y se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se lavaron con salmuera, se secaron sobre un f¡ltro Whatman, y se concentraron a pres¡ón reduc¡da dando el compuesto del título en bruto que se pur¡f¡có med¡ante cromatografía ultrarráp¡da (2,08 g, 86 % de rend¡m¡ento, 90 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 1,25 m¡n; EM (lENpos): m/z = 328 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,61 (s, 3H), 4,50 (s, 2H), 7,28 (dd, 1H), 7,35 (dd, 2H), 7,47 (d, 2H), 8,11 (d, 1H), 8,13 (dd, 1H), 8,32 (d, 1H).
Intermedio 152
N-(2,4-Dimetoxibencil)-2-(5-metiM,3,4-oxadiazol-2-M)-5-mtrobencensulfonamida
Se agitó 2-[2-(bencilsulfanil)-4-nitrofenil]-5-metil-1,3,4-oxadiazol (1,81 g, 5,51 mmol) con A/-clorosucdmida (3,32 g, 24,8 mmol) en ácido acético (55 ml) a temperatura ambiente durante 210 min. La mezcla de reacción se concentró al vacío para dar 7,34 g de cloruro de 2-(5-metil-1,3,4-oxadiazol-2-il)-5-nitrobencensulfonilo en bruto que se usó sin purificación adicional en el paso siguiente.
El material en bruto del paso previo (7,34 g) se disolvió en diclorometano (61 ml), después se añadió carbonato ácido de sodio (1,85 g, 22,1 mmol), y después se añadió lentamente 1-(2,4-dimetoxifenil)metanamina (911 pl, 6,07 mmol) a 0 °C. La mezcla de reacción se agitó durante 18 h a temperatura ambiente. Se añadió agua a la mezcla de reacción, y se extrajo con diclorometano. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (462 mg, 17 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 435 (M+H)+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 2,65 (s, 3H), 3,44 (s, 3H), 3,61 (s, 3H), 4,14 (d, 2H), 6,11 (d, 1H), 6,24 (dd, 1H), 7,01 (d, 1H), 8,08 (d, 1H), 8,16 (t, 1H), 8,28 (d, 1H), 8,48 (dd, 1H).
Intermedio 153
2-(2-Clorofeml)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(5-met¡l-1,3,4-oxad¡azol-2-¡l)feml}acetam¡da
Se añadió dihidrato de cloruro de estaño (II) (1,07 g, 4,75 mmol) a una solución de A/-(2,4-dimetoxibencil)-2-(5-metil-1,3,4-oxadiazol-2-il)-5-nitrobencensulfonamida (459 mg, 951 pmol, 90 % de pureza) en dioxano (12,1 ml), después se agitó durante 4 h a 70 °C. La mezcla de reacción se concentró al vacío. Se añadió agua al residuo y la mezcla se extrajo tres veces con acetato de etilo. Las fases orgánicas combinadas se filtraron sobre Celite, se secaron sobre un filtro Whatman, y se concentraron al vacío para dar 459 mg de 5-amino-2-(5-metil-1,3,4-oxadiazol-2-il)-A/-(2,4-dimetoxibencil)bencensulfonamida en bruto que se usó sin purificación adicional.
El material en bruto del paso previo (127 mg) se disolvió en DMF (3,2 ml), después se añadieron ácido (2-clorofenil)acético (80,1 mg, 470 pmol), A/,W-diisopropiletilamina (218 pl, 1,25 mmol) y HATU (179 mg, 470 pmol). La mezcla de reacción se agitó durante 17 h a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (260 mg, 60 % de pureza, 88 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,23 min; EM (lENpos): m/z = 557 (M+H)+
Intermed¡o 154
W-{3-[(2,4-D¡metox¡benc¡l)sulfamo¡l]-4-(5-met¡l-1,3,4-oxad¡azol-2-¡l)feml}-2-(2-fluorofeml)acetam¡da
Se disolvió 5-am¡no-2-(5-metil-1,3,4-oxad¡azol-2-¡l)-A/-(2,4-d¡metox¡benc¡l)bencensulfonam¡da en bruto (229 mg) en DMF (5 ml), después se añadieron ácido (2-fluorofenil)acético (147 mg, 951 pmol), W,A/-di¡soprop¡let¡lam¡na (331 pl, 1,90 mmol) y HATU (362 mg, 951 pmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (427 mg, 60 % de pureza, 88 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (lENpos): m/z = 541 [M+H]+
Intermedio 155
N-{3-[(2,4-DimetoxibencN)sulfamoN]-4-(5-metiM,3,4-oxadiazol-2-N)feml}-2-(4-metilfeml)acetamida
Se disolvió 5-am¡no-2-(5-met¡l-1,3,4-oxad¡azol-2-il)-A/-(2,4-d¡metox¡benc¡l)bencensulfonam¡da en bruto (229 mg) en DMF (5 ml), después se añadieron ácido (4-metilfenil)acét¡co (143 mg, 952 pmol), A/,W-di¡soprop¡let¡lam¡na (332 pl, 1,90 mmol) y HATU (362 mg, 952 pmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Se añadió solución acuosa saturada de carbonato ácido de sodio y la mezcla se extrajo tres veces con acetato de etilo. Después las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío para dar el compuesto del título que se usó sin purificación adicional (351 mg, 72 % de pureza, 88 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,25 min; EM (lENpos): m/z = 537 [M+H]+
Intermedio 156
3-(4-{[(2-clorofeml)acetM]ammo}-2-{[(dimetilammo)metNen]sulfamoN}feml)-1H-pirroM-carboxNato de terc-butilo
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamoil}fen¡l)-2-(2-clorofen¡l)acetam¡da (500 mg, 1,09 mmol), 3-(4,4,5,5-tetrametil-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡rrol-1-carboxilato de ferc-butilo (479 mg, 1,64 mmol) y fluoruro de potasio (139 mg, 2,4 mmol) en DMF seca y desgas¡f¡cada (11 ml) y la soluc¡ón se purgó nuevamente con argón durante 5 minutos, después se añadió b¡s(tr¡-ferc-but¡lfosfin)palad¡o(0) (CAS 53199-31-8) (28 mg, 54 pmol). La reacción se calentó durante 3 h a 100 °C. Se añadió solución acuosa saturada de carbonato ácido de sodio a la mezcla de reacción, y se extrajo con acetato de etilo. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando el compuesto del título en bruto que se purificó mediante cromatografía ultrarrápida (470 mg, 75 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,30 min; EM (lENpos): m/z = 545 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 1,57 (s, 9H), 2,74 (s, 3H), 2,92 (s, 3H), 3,87 (s, 2H), 6,41 (dd, 1H), 7,26 (dd, 1H), 7,31 (d, 1H), 7,32 (m, 2H), 7,37 (dd, 1H), 7,45 (m, 2H), 7,58 (s, 1H), 7,84 (dd, 1H), 8,29 (d, 1H), 10,57 (s, 1H).
Intermedio 157
2-(2-Clorofeml)-W-[3-{[(d¡met¡lammo)met¡len]sulfamo¡l}-4-(1H-p¡rrol-3-¡l)feml]acetam¡da
Se disolvió 3-(4-{[(2-clorofen¡l)acet¡l]am¡no}-2-{[(d¡met¡lam¡no)metilen]sulfamo¡l}fen¡l)-1H-p¡rrol-1-carbox¡lato de fercbutilo (350 mg, 610 pmol, 95 % de pureza) en diclorometano (6 ml) y se trató con ácido trifluoroacético (1,18 ml, 15,3 mmol), después se agitó a temperatura ambiente durante 5 h. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (60 mg, 18 % de rendimiento, 80 % de pureza).
CL-EM (Procedimiento A): Tr = 1,01 min; EM (lENpos): m/z = 445 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,66 (s, 3H), 2,84 (s, 3H), 3,86 (s, 2H), 6,16 (dd, 1H), 6,76 (dd, 1H), 6,88 (dd, 1H), 7,22 (d, 1H), 7,25 (s, 1H), 7,32 (m, 2H), 7,44 (m, 2H), 7,79 (dd, 1H), 8,25 (d, 1H), 10,49 (s, 1H), 10,91 (s, 1H).
Intermed¡o 158
2-(2-Clorofeml)-W-[3-{[(d¡met¡lammo)met¡len]sulfamo¡l}-4-(1-met¡MH-p¡rrol-3-¡l)feml]acetam¡da
Se disolvieron A/-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (200 mg, 436 |jmol), 1-met¡l-3-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡rrol (181 mg, 872 jmol, CAS-RN 953040-54-5) y fluoruro de potas¡o (76 mg, 1,3 mmol) en DMF seca y desgas¡f¡cada (4,4 ml) y la soluc¡ón se purgó nuevamente con argón durante 5 m¡nutos, después se añad¡ó b¡s(tr¡-terc-but¡lfosf¡n)palad¡o(0) (11 mg, 22 jmol, CAS-RN 53199-31-8). La reacc¡ón se calentó durante 4 h a 100 °C. Se añad¡ó soluc¡ón acuosa saturada de carbonato ác¡do de sod¡o a la mezcla de reacc¡ón, y se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se lavaron con salmuera, se secaron sobre un f¡ltro Whatman, y se concentraron a pres¡ón reduc¡da dando el compuesto del título en bruto que se pur¡f¡có med¡ante cromatografía ultrarráp¡da (107 mg, 51 % de rend¡m¡ento, 95 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 1,07 m¡n; EM (lENpos): m/z = 459 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,67 (s, 3H), 2,89 (s, 3H), 3,67 (s, 3H), 3,86 (s, 2H), 6,09 (dd, 1H), 6,70 (dd, 1H), 6,84 (dd, 1H), 7,20 (d, 1H), 7,32 (m, 2H), 7,40 (s, 1H), 7,44 (m, 2H), 7,79 (dd, 1H), 8,25 (d, 1H), 10,49 (s, 1H).
Intermedio 159
2-(2-Clorofeml)-W-[4-(5-ciano-1-metM-1H-pirrol-2-N)-3-{[(dimetMammo)metilen]sulfamoN}feml]acetamida
Se d¡solv¡eron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (250 mg, 545 jmol), ác¡do (5-c¡ano-1-met¡l-1H-p¡rrol-2-¡l)borón¡co (163 mg, 1,09 mmol, Ca S-RN 860617-71-6) y fluoruro de potas¡o (95 mg, 1,64 mmol) en DMF seca y desgas¡f¡cada (5,5 ml) y la soluc¡ón se purgó nuevamente con argón durante 5 m¡nutos, después se añad¡ó b¡s(tr¡-terc-but¡lfosf¡n)palad¡o(0) (14 mg, 27 jmol, CAS-RN 53199-31-8). La reacc¡ón se calentó durante 3 h a 100 °C. Se añad¡ó soluc¡ón acuosa saturada de carbonato ác¡do de sod¡o a la mezcla de reacc¡ón y se extrajo con acetato de et¡lo. El producto prec¡p¡tó de ambas fases, se ret¡ró por f¡ltrac¡ón y se secó a pres¡ón reduc¡da dando el compuesto del título con pureza suf¡c¡ente (100 mg, 35 % de rend¡m¡ento, 94 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 1,13 m¡n; EM (lENpos): m/z = 484 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,82 (s, 3H), 2,98 (s, 3H), 3,35 (s, 3H), 3,90 (s, 2H), 6,12 (d, 1H), 7,01 (d, 1H), 7,24 (s, 1H), 7,33 (m, 2H), 7,34 (d, 1H), 7,45 (m, 2H), 7,93 (dd, 1H), 8,37 (d, 1H), 10,73 (s, 1H).
Síntesis de Ejemplos
Ejemplo 1
2-(2-Clorofeml)-W-[4-(2-oxop¡r¡dm-1(2H)-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con los procedimientos generales GP1.1, GP2.2, GP3.1 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), piridin-2-ol (123 mg, 1,29 mmol) y ácido (2-clorofenil)acético (240 mg, 1,41 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 |j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (9,3 mg, 0,0222 mmol, 1 % de rendimiento al cabo de 4 pasos, 98 % de pureza). El regioisómero conectado por O también se aisló.
CL-EM (Procedimiento B): Tr = 0,74 min; EM (lENpos): m/z = 418 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,89 (s, 2H), 6,32 (td, 1H), 6,47 (d, 1H), 7,18 (s, 2H), 7,28 - 7,34 (m, 2H), 7,37 (d, 1H), 7,42 - 7,47 (m, 2H), 7,48 - 7,56 (m, 2H), 7,92 (dd, 1H), 8,34 (d, 1H), 10,74 (s, 1H).
Ejemplo 2
W-[4-(4-Cloro-2-oxopindm-1(2W)-M)-3-sulfamoNfeml]-2-(2-clorofeml)-acetamida
De acuerdo con los procedimientos generales GP1.1, GP2.1, GP3.1 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (1,50 g, 3,88 mmol), 4-cloropiridin-2-ol (502 mg, 3,88 mmol) y ácido (2-clorofenil)acético (634 mg, 3,72 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %))) y después otra vez mediante HPLC preparativa (Fenomenex Kinetex C185 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido trifluoroacético) (7,3 mg, 0,0161 mmol, 1 % de rendimiento al cabo de 4 pasos, 97 % de pureza). El regioisómero conectado por O también se aisló.
CL-EM (Procedimiento C): Tr = 1,91 min; EM (lENpos): m/z = 452 [M+H]+
RMN 1H (500MHz, DMSO-d6) 8 [ppm]: 3,90 (s, 2H), 6,43 (dd, 1H), 6,63 (d, 1H), 7,26 - 7,36 (m, 4H), 7,40 (d, 1H), 7,43 - 7,48 (m, 2H), 7,58 (d, 1H), 7,91 (dd, 1H), 8,36 (d, 1H), 10,76 (s, 1H).
Ejemplo 3
2-(2-ClorofenM)-W-[4-(3,5-didoro-2-oxopmdm-1(2H)-M)-3-sulfamoNfenM]-acetamida
De acuerdo con los procedimientos generales GP1.1, GP2.1, GP3.1 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (3,00 g, 7,76 mmol), 3,5-dicloropiridin-2-ol (1,27 g, 7,76 mmol) y ácido (2 clorofenil)acético (879 mg, 5,16 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final
mediante HPLC preparativa (Fenomenex Kinetex C18 5 |j 100x30 mm, acetonitrilo/agua 0,1% de ácido trifluoroacético) seguida por cristalización desde metanol (13 mg, 0,0267 mmol, 1 % de rendimiento al cabo de 4 pasos, 99 % de pureza).
CL-EM (Procedimiento C): Tr = 2,14 min; EM (IENpos): m/z = 486 [M+H]+
RMN 1H (500MHz, DMSO-da) 8 [ppm]: 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,38 (s, 2H), 7,43 - 7,49 (m, 3H), 7,83 (d, 1H), 7,90 (dd, 1H), 8,04 (d, 1H), 8,36 (d, 1H), 10,77 (s, 1H).
Ejemplo 4
W-[4-(3-Cloro-2-oxopindm-1(2W)-M)-3-sulfamoNfeml]-2-(2-clorofeml)-acetamida
De acuerdo con los procedimientos generales GP1.1, GP2.1, GP3.1 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (1,50 g, 3,88 mmol), 3-cloropiridin-2-ol (502 mg, 3,88 mmol) y ácido (2-clorofenil)acético (646 mg, 3,78 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (YMC Triart C185 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) seguida por cristalización desde metanol (21,8 mg, 0,0482 mmol, 1 % de rendimiento al cabo de 4 pasos, 98 % de pureza). El regioisómero conectado por O también se aisló.
CL-EM (Procedimiento C): Tr = 1,83 min; EM (IENpos): m/z = 452 [M+H]+
RMN 1H (500MHz, DMSO-d6) 8 [ppm]: 3,91 (s, 2H), 6,33 (t, 1H), 7,25 -7,36 (m, 4H), 7,41 -7,47 (m, 3H), 7,53 (dd, 1H), 7,83 (dd, 1H), 7,92 (dd, 1H), 8,37 (d, 1H), 10,77 (s, 1H).
Ejemplos 5 y 6
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 5-metil-1H-1,2,4-triazol (161 mg, 1,94 mmol) y ácido (2-clorofenil)acético (202 mg, 1,18 mmol) sin purificación de intermedios en 2-(2-clorofenil)-N-[4-(3-metil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida y 2-(2-clorofenil)-N-[4-(5-metil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida. Los dos regioisómeros se purificaron y se separaron al final mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (Waters XBridge C185 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico).
Ejemplo 5
2-(2-Clorofeml)-W-[4-(3-metiMH-1,2,4-tnazoM -il)-3-sulfamoilfenil]-acetamida
37 mg, 0,0912 mmol, 7 % de rendimiento al cabo de 4 pasos, 98 % de pureza
CL-EM (Procedimiento A): Tr = 0,89 min; CL-EM (Procedimiento F): Tr = 3,37 min; EM (IENpos): m/z = 406 [M+H]+ RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,36 (s, 3H), 3,92 (s, 2H), 7,30 - 7,37 (m, 2H), 7,42 - 7,52 (m, 4H), 7,56 (d, 1H), 7,96 (dd, 1H), 8,39 (d, 1H), 8,66 (s, 1H), 10,83 (s, 1H).
Ejemplo 6
2-(2-Clorofeml)-W-[4-(5-metiMH-1,2,4-tnazoM -il)-3-sulfamoilfenil]-acetamida
8 mg, 0,0197 mmol, 2 % de rendimiento al cabo de 4 pasos, 97 % de pureza
CL-EM (Procedimiento A): Tr = 0,89 min; CL-EM (Procedimiento F): Tr = 1,68 min; EM (IENpos): m/z = 452 [M+H]+ RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,22 (s, 3H), 3,93 (s, 2H), 7,25 (s, 2H), 7,31 - 7,38 (m, 2H), 7,43 - 7,50 (m, 2H), 7,57 (d, 1H), 7,98 (dd, 1H), 8,03 (s, 1H), 8,41 (d, 1H), 10,87 (s, 1H).
Ejemplo 7
2-(2-Clorofeml)-W-{3-sulfamoM-4-[3-(tN fluorometM)-1H-1,2,4-tnazoM-M]feml}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 5-(trifluorometil)-1H-1,2,4-triazol (266 mg, 1,94 mmol) y ácido (2-clorofenil)acético (175 mg, 1,02 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) (35 mg, 0,0761 mmol, 6 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,79 min; EM (IENpos): m/z = 460 [M+H]+
RMN 1H (600MHz, DMSO-d6) 8 [ppm]: 3,93 (s, 2H), 7,30 - 7,36 (m, 2H), 7,43 - 7,46 (m, 2H), 7,54 (s, 2H), 7,66 (d, 1H), 7,96 (dd, 1H), 8,45 (d, 1H), 9,03 (s, 1H), 10,87 (s, 1H).
Ejemplo 8
2-(2-Clorofeml)-W-{4-[5-metM-3-(tN fluorometM)-1H-1,2,4-tnazoM-M]-3-sulfamoNfeml}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-metil-5-(trifluorometil)-1H-1,2,4-triazol (293 mg, 1,94 mmol) y ácido (2-clorofenil)acético (203 mg, 1,19 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (YMC Triart C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (49,4 mg, 0,104 mmol, 8 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 474 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,29 (s, 3H), 3,93 (s, 2H), 7,30 - 7,37 (m, 2H), 7,44 - 7,50 (m, 2H), 7,61 (s, 2H), 7,65 (d, 1H), 7,95 (dd, 1H), 8,46 (d, 1H), 10,91 (s, 1H).
Ejemplo 9
2-(2-Clorofeml)-W-[4-(1H-¡midazoM-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 1H-imidazol (132 mg, 1,94 mmol) y ácido (2 clorofenil)acético (203 mg, 1,19 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (6 mg, 0,0154 mmol, 1 % de rendimiento al cabo de 4 pasos, 99 % de pureza).
CL-EM (Procedimiento B): Tr = 0,68 min; EM (lENpos): m/z = 391 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,91 (s, 2H), 7,02 (t, 1H), 7,30 - 7,37 (m, 3H), 7,40 (d, 1H), 7,43 - 7,49 (m, 2H), 7,52 (s, 2H), 7,75 (t, 1H), 7,89 (dd, 1H), 8,40 (d, 1H), 10,78 (s, 1H).
Ejemplo 10
2-(2-Clorofeml)-W-{3-sulfamoN-4-[4-(trifluorometM)-1H-imidazol-1-N]feml}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-(trifluorometil)-1H-imidazol (264 mg, 1,94 mmol) y ácido (2-clorofenil)acético (199 mg, 1,17 mmol) sin purificación de intermedios el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (11 mg, 0,0240 mmol, 2 % de rendimiento al cabo de 4 pasos, 99 % de pureza).
CL-EM (Procedimiento A): Tr = 1,05 min; EM (lENpos): m/z = 459 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,92 (s, 2H), 7,30 - 7,37 (m, 2H), 7,43 - 7,49 (m, 2H), 7,51 (d, 1H), 7,72 (s, 2H), 7,90 (dd, 1H), 7,95 (s, 1H), 7,97 - 7,99 (m, 1H), 8,42 (d, 1H), 10,83 (s, 1H).
Ejemplo 11
2-(2-Clorofem l)-W-{3-sulfamoil-4-[3-(tNfluorometM)-1H-pirazol-1 -il]fenil}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-(trifluorometil)-1H-pirazol (264 mg, 1,94 mmol) y ácido (2-clorofenil)acético (243 mg, 1,42 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico)
y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (6,7 mg, 0,0146 mmol, 1 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 1,05 min; EM (IENpos): m/z = 459 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,92 (s, 2H), 6,98 (d, 1H), 7,29 - 7,36 (m, 2H), 7,40 - 7,52 (m, 4H), 7,61 (d, 1H), 7,98 (dd, 1H), 8,26 - 8,30 (m, 1H), 8,42 (d, 1H), 10,85 (s, 1H).
Ejemplo 12
2-(2-Clorofeml)-W-{4-[3-(difluorometM)-1H-pirazoM -il]-3-sulfamoilfenil}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.3 y GP4.1, se convirtió W-(2,4-dimetoxibencil)-2-flúor-5-nitrobencensulfonamida (250 mg, 0,68 mmol), 3-(difluorometil)-1H-pirazol (120 mg, 1,01 mmol) y ácido (2-clorofenil)acético (102 mg, 0,60 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Chromatorex C-1810 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) (4 mg, 0,00907 mmol, 1 % de rendimiento al cabo de 4 pasos, 80 % de pureza).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (IENpos): m/z = 441 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,92 (s, 2H), 6,75 -6,78 (m, 1H), 7,18 (t, 1H), 7,31 -7,36 (m, 2H), 7,38 (m, 2H), 7,43 - 7,49 (m, 2H), 7,58 (d, 1H), 7,98 (dd, 1H), 8,20 (d, 1H), 8,40 (d, 1H), 10,82 (s, 1H).
Ejemplo 13
2-(2-Clorofeml)-W-{4-[5-ciclopropN-3-(difluorometM)-1H-pirazoM-M]-3-sulfamoNfeml}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.3 y GP4.2, se convirtió W-(2,4-dimetoxibencil)-2-flúor-5-nitrobencensulfonamida (350 mg, 0,95 mmol), 5-ciclopropil-3-(difluorometil)-1H-pirazol (224 mg, 1,42 mmol) y ácido (2-clorofenil)acético (202 mg, 1,18 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (12,7 mg, 0,0264 mmol, 3 % de rendimiento al cabo de 4 pasos, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENpos): m/z = 481 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 0,70 - 0,75 (m, 2H), 0,76 - 0,84 (m, 2H), 1,52 - 1,60 (m, 1H), 3,92 (s, 2H), 6,37 (s, 1H), 7,06 (t, 1H), 7,12 (s, 2H), 7,31 - 7,37 (m, 2H), 7,43 - 7,50 (m, 2H), 7,63 (d, 1H), 8,00 (dd, 1H), 8,41 (d, 1H), 10,84 (s, 1H).
Ejemplo 14
2-(2-Clorofeml)-W-{4-[4-metN-3-(tnfluorometM)-1H-pirazoM-M]-3-sulfamoNfeml}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-metil-3-(trifluorometil)-1H-pirazol (291 mg, 1,94 mmol) y ácido (2-clorofenil)acético (255 mg, 1,50 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%)) y después otra vez mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (43 mg, 0,0909 mmol, 7 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 1,18 min; EM (lENpos): m/z = 473 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,19 (s, 3H), 3,92 (s, 2H), 7,30 - 7,37 (m, 2H), 7,41 (s, 2H), 7,43 - 7,49 (m, 2H), 7,58 (d, 1H), 7,98 (dd, 1H), 8,10 (s, 1H), 8,40 (d, 1H), 10,83 (s, 1H).
Ejemplo 15
2-(2-ClorofenM)-W-{4-[5-metN-3-(tN fluorometM)-1H-pirazoM-M]-3-sulfamoNfeml}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 5-metil-3-(trifluorometil)-1H-pirazol (291 mg, 1,94 mmol) y ácido (2-clorofenil)acético (268 mg, 1,57 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (36,5 mg, 0,0772 mmol, 6 % de rendimiento al cabo de 4 pasos, 98 % de pureza). CL-EM (Procedimiento B): Tr = 1,13 min; EM (lENpos): m/z = 473 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,12 (s, 3H), 3,92 (s, 2H), 6,73 (s, 1H), 7,24 (s, 2H), 7,31 - 7,36 (m, 2H), 7,44 -7,49 (m, 2H), 7,57 (d, 1H), 7,97 (dd, 1H), 8,42 (d, 1H), 10,88 (s, 1H).
Ejemplo 16
2-(2-Clorofeml)-W-[3-sulfamoN-4-(1H-1,2,4-tnazoM -il)fenil]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.3, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 1H-1,2,4-triazol (134 mg, 1,94 mmol) y ácido (2-clorofenil)acético (303 mg, 1,77 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final
mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (27 mg, 0,0689 mmol, 5 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,68 min; EM (IENpos): m/z = 392 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,92 (s, 2H), 7,30 -7,37 (m, 2H), 7,43 -7,50 (m, 4H), 7,59 (d, 1H), 7,98 (dd, 1H), 8,23 (s, 1H), 8,42 (d, 1H), 8,82 (s, 1H), 10,85 (s, 1H).
Ejemplo 17
2-(2-Clorofeml)-W-{4-[3-(difluorometM)-1H-1,2,4-tnazoM-M]-3-sulfamoNfeml}acetamida
Se disolvió 2-(2-clorofenil)-A/-{4-[3-(difluorometil)-1H-1,2,4-triazol-1-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida (112 mg, 0,189 mmol) en diclorometano (5 ml) y se trató con ácido trifluoroacético (129 mg, 1,14 mmol), después se agitó a temperatura ambiente durante la noche y durante una hora a 55 °C. Se concentró al vacío y se extrajo con diclorometano y solución de bicarbonato de sodio. La fase acuosa se extrajo nuevamente dos veces con diclorometano y dos veces con 1-butanol. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío. La purificación mediante HPLC dio el compuesto del título (5 mg, 0,0113 mmol, 6 %, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 0,79 min; EM (IENpos): m/z = 442 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,93 (s, 2H), 7,21 (t, 1H), 7,30 - 7,37 (m, 2H), 7,43 - 7,49 (m, 2H), 7,55 (s, 2H), 7,64 (d, 1H), 7,97 (dd, 1H), 8,44 (d, 1H), 8,95 (s, 1H), 10,90 (s, 1H).
Ejemplo 18
W-{4-[3-(DifluorometM)-1H-1,2,4-tnazoM-M]-3-sulfamoNfeml}-2-(2-fluorofeml)acetamida
Se disolvió A/-{4-[3-(difluorometil)-1H-1,2,4-triazol-1-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-fluorofenil)acetamida (94 mg, 0,163 mmol) en diclorometano (5 ml) y se trató con ácido trifluoroacético (112 mg, 0,979 mmol), después se agitó a temperatura ambiente durante la noche y durante una hora a 55 °C. Se concentró al vacío y se extrajo con diclorometano y solución de bicarbonato de sodio. La fase acuosa se extrajo nuevamente dos veces con diclorometano y dos veces con 1-butanol. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman y se concentraron al vacío. La purificación mediante HPLC dio el compuesto del título (2 mg, 0,00470 mmol, 3 %, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,70 min; EM (IENpos): m/z = 426 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,82 (s, 2H), 7,07 - 7,37 (m, 4H), 7,39 - 7,44 (m, 1H), 7,55 (s, 2H), 7,64 (d, 1H), 7,96 (dd, 1H), 8,43 (d, 1H), 8,95 (s, 1H), 10,86 (s, 1H).
Ejemplo 19
2-(2-Clorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM -il]fenil}acetamida
Se disolvió 5-am¡no-N-(2,4-d¡metox¡benc¡l)-2-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]bencensulfonam¡da (22,3 g, 48,9 mmol) en DMF (460 ml), después se añadieron ácido (2-clorofen¡l)acético (12,5 g, 73,3 mmol), N,N-di¡soprop¡let¡lam¡na (25,3 g, 195 mmol) y HATU (27,9 g, 73,3 mmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Después se concentró al vacío y se extrajo con diclorometano y agua. La fase orgánica se lavó con solución de b¡carbonato de sod¡o, salmuera y soluc¡ón de cloruro de amon¡o, se secó sobre sulfato de sod¡o y se concentró nuevamente al vacío. El producto protegido precipitó parcialmente durante el lavado con cloruro de amonio y se retiró antes de secar con sulfato de sodio.
El residuo y el precipitado se disolvieron en diclorometano (150 ml) y se trató con ácido trifluoroacético (75 ml), después se agitó durante la noche a temperatura ambiente.
Nuevamente, el producto precipitó parcialmente y se retiró. La solución restante se concentró al vacío y se extrajo con diclorometano y agua. La fase orgánica se lavó con solución de bicarbonato y salmuera, se secó sobre sulfato de sodio y finalmente se concentró al vacío. Durante el tratamiento posterior acuoso, el producto precipitó parcialmente nuevamente. Las fracciones con precipitado combinadas más la fracción concentrada de la fase orgánica se combinaron y se purificaron mediante cristalización desde acetato de etilo en reflujo para dar el compuesto del título (12,3 g, 26,8 mmol, 55 % de rendimiento al cabo de 2 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 1,06 min; EM (lENpos): m/z = 459 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,92 (s, 2H), 7,30 -7,37 (m, 2H), 7,42 -7,48 (m, 4H), 7,60 (d, 1H), 7,98 (dd, 1H), 8,18 (s, 1H), 8,39 (d, 1H), 8,74 (s, 1H), 10,83 (s, 1H).
Ejemplo 20
2-(2-Fluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
Se disolvió 5-am¡no-N-(2,4-d¡metox¡benc¡l)-2-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]bencensulfonam¡da (350 mg, 0,767 mmol) en DMF (15 ml), después se añadieron ácido (2-fluorofenil)acético (130 mg, 0,843 mmol), N,N-diisopropiletilamina (496 mg, 3,83 mmol) y HATU (466 mg, 1,23 mmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Después se concentró al vacío y se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró nuevamente al vacío.
El residuo se disolvió en diclorometano (10 ml) y se trató con ácido trifluoroacético (4,37 g, 38,3 mmol), después se agitó durante la noche a temperatura ambiente. Se concentró al vacío y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (60,5 mg, 0,137 mmol, 18 % de rendimiento al cabo de 2 pasos, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (lENpos): m/z = 443 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,82 (s, 2H), 7,17 -7,23 (m, 2H), 7,31 -7,49 (m, 4H), 7,60 (d, 1H), 7,98 (dd, 1H), 8,18 (s, 1H), 8,39 (d, 1H), 8,74 (s, 1H), 10,82 (s, 1H).
Ejemplo 21
2-[2-(DifluorometN)feml]-W-{3-sulfamoN-4-[4-(trifluorometM)-1H-pirazoM-N]feml}acetamida
Se disolvió 5-am¡no-N-(2,4-d¡metox¡benc¡l)-2-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]bencensulfonam¡da (350 mg, 0,767 mmol) en DMF (15 ml), después se añadieron ácido [2-(difluorometil)fen¡l]acét¡co (157 mg, 0,843 mmol), N,N-diisopropiletilamina (496 mg, 3,83 mmol) y HATU (466 mg, 1,23 mmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Después se concentró al vacío y se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró nuevamente al vacío.
El residuo se disolvió en diclorometano (10 ml) y se trató con ácido trifluoroacético (4,37 g, 38,3 mmol), después se agitó durante la noche a temperatura ambiente. Se concentró al vacío y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (65 mg, 0,137 mmol, 18 % de rendimiento al cabo de 2 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (lENpos): m/z = 475 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,95 (s, 2H), 7,24 (t, 1H), 7,41 - 7,48 (m, 4H), 7,51 - 7,56 (m, 1H), 7,58 - 7,63 (m, 2H), 7,97 (dd, 1H), 8,18 (s, 1H), 8,38 (d, 1H), 8,74 (s, 1H), 10,81 (s, 1H).
Ejemplo 22
W-{3-SulfamoM-4-[4-(tN fluorometM)-1H-pirazoM-N]feml}-2-[2-(tnfluorometM)feml]acetamida
Se disolvió 5-am¡no-N-(2,4-d¡metox¡benc¡l)-2-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]bencensulfonam¡da (350 mg, 0,767 mmol) en DMF (15 ml), después se añadieron ácido [2-(trifluoromet¡l)fen¡l]acét¡co (172 mg, 0,843 mmol), N,N-diisopropiletilamina (496 mg, 3,83 mmol) y HATU (466 mg, 1,23 mmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Después se concentró al vacío y se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró nuevamente al vacío.
El residuo se disolvió en diclorometano (10 ml) y se trató con ácido trifluoroacético (4,37 g, 38,3 mmol), después se agitó durante la noche a temperatura ambiente. Se concentró al vacío y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (48 mg, 0,0975 mmol, 13 % de rendimiento al cabo de 2 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,18 min; EM (lENpos): m/z = 493 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 4,01 (s, 2H), 7,43 (s, 2H), 7,49 -7,63 (m, 3H), 7,65 -7,76 (m, 2H), 7,96 (dd, 1H), 8,18 (s, 1H), 8,38 (d, 1H), 8,74 (s, 1H), 10,82 (s, 1H).
Ejemplo 23
W-[4-(3-ferc-ButiMH-1,2,4-tnazoM-M)-3-sulfamoNfeml]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-ferc-butil-1H-1,2,4-triazol (242 mg, 1,94 mmol) y ácido (2-clorofenil)acético (296 mg, 1,74 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 |j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) (96 mg, 0,214 mmol, 17 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,92 min; EM (lENpos): m/z = 448 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 1,34 (s, 9H), 3,92 (s, 2H), 7,30 -7,37 (m, 2H), 7,43 -7,50 (m, 4H), 7,63 (d, 1H), 7,99 (dd, 1H), 8,40 (d, 1H), 8,71 (s, 1H), 10,83 (s, 1H).
Ejemplo 24
2-(2-Clorofeml)-W-[4-(3-cloro-1H-1,2,4-tnazoM-M)-3-sulfamoMfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-cloro-1H-1,2,4-triazol (201 mg, 1,94 mmol) y ácido (2-clorofenil)acético (203 mg, 1,19 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (9 mg, 0,0211 mmol, 2 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,70 min; EM (lENpos): m/z = 426 [M+H]+
RMN 1H (600MHz, DMSO-d6) 5 [ppm]: 3,92 (s, 2H), 7,31 - 7,35 (m, 2H), 7,43 - 7,49 (m, 2H), 7,60 (s, 2H), 7,62 (d, 1H), 7,95 (dd, 1H), 8,42 (d, 1H), 8,81 (s, 1H), 10,87 (s, 1H).
Ejemplo 25
2-(2-Clorofeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-cloro-1H-pirazol (199 mg, 1,94 mmol) y ácido (2-clorofenil)acético (313 mg, 1,83 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (55 mg, 0,129 mmol, 10 % de rendimiento al cabo de 4 pasos, 99 % de pureza).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (lENpos): m/z = 425 [M+H]+
RMN 1H (500MHz, DMSO-d6) 5 [ppm]: 3,91 (s, 2H), 7,31 - 7,37 (m, 2H), 7,41 (s, 2H), 7,44 - 7,49 (m, 2H), 7,55 (d, 1H), 7,87 (s, 1H), 7,97 (dd, 1H), 8,35 (d, 1H), 8,38 (d, 1H), 10,81 (s, 1H).
Ejemplo 26
2-(2-ClorofenM)-W-[4-(4-flúor-1H-pirazoM-N)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-flúor-1H-pirazol (167 mg, 1,94 mmol) y ácido (2-clorofenil)acético (151 mg, 1,89 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (43 mg, 0,105 mmol, 8 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,88 min; EM (lENpos): m/z = 409 [M+H]+
RMN 1H (500MHz, DMSO-da) 8 [ppm]: 3,91 (s, 2H), 7,30 - 7,37 (m, 2H), 7,39 (s, 2H), 7,43 - 7,50 (m, 2H), 7,53 (d, 1H), 7,84 (d, 1H), 7,97 (dd, 1H), 8,26 (d, 1H), 8,37 (d, 1H), 10,79 (s, 1H).
Ejemplo 27
2-(2-ClorofenM)-W-[4-(4-isopropoxi-1H-pirazoM-M)-3-sulfamoNfenM]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.5 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (400 mg, 1,03 mmol), 4-isopropoxi-1H-pirazol (196 mg, 1,55 mmol) y ácido (2-clorofenil)acético (264 mg, 1,55 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (16 mg, 0,0356 mmol, 3 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 449 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,27 (d, 6H), 3,89 (s, 2H), 4,25 - 4,32 (m, 1H), 7,29 - 7,36 (m, 2H), 7,38 - 7,48 (m, 4H), 7,52 (d, 1H), 7,56 (d, 1H), 7,86 (d, 1H), 7,96 (dd, 1H), 8,33 (d, 1H), 10,74 (s, 1H).
Ejemplo 28
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.5 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (400 mg, 1,03 mmol), 4-bromo-1H-pirazol (228 mg, 1,55 mmol) y ácido (2-clorofenil)acético (264 mg, 1,55 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (27 mg,
0,0575 mmol, 6 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (IENpos): m/z = 469/471 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,41 (s, 2H), 7,42 - 7,48 (m, 2H), 7,54 (d, 1H), 7,87 (d, 1H), 7,96 (dd, 1H), 8,34 (d, 1H), 8,37 (d, 1H), 10,80 (s, 1H).
Ejemplo 29
2-(2-Clorofeml)-W-[4-(3-isobutiMH-1,2,4-tnazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-isobutil-1H-pirazol (243 mg, 1,94 mmol) y ácido (2 clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) (27 mg, 0,0603 mmol, 5 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,93 min; EM (IENpos): m/z = 448 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 0,93 (d, 6H), 1,99 -2,11 (m, 1H), 2,57 (d, 2H), 3,91 (s, 2H), 7,27 -7,37 (m, 2H), 7,37 - 7,49 (m, 4H), 7,58 (d, 1H), 7,97 (dd, 1H), 8,39 (d, 1H), 8,68 (s, 1H), 10,82 (s, 1H).
Ejemplo 30
2-(2-Clorofeml)-W-{4-[4-(metMsulfaml)-1H-p¡razol-1-M]-3-sulfamoilfeml}acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.5 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (400 mg, 1,03 mmol), 4-(metilsulfanil)-1H-pirazol (177 mg, 1,55 mmol) y ácido (2-clorofenil)acético (264 mg, 1,55 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (31 mg, 0,0709 mmol, 7 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 437 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,40 (s, 3H), 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,39 - 7,49 (m, 4H), 7,54 (d, 1H), 7,81 (d, 1H), 7,97 (dd, 1H), 8,17 (d, 1H), 8,36 (d, 1H), 10,78 (s, 1H).
Ejemplo 31
2-(2-Clorofeml)-W-[4-(4-metoxi-1H-pirazol-1-M)-3-sulfamoilfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-metoxi-1H-pirazol (190 mg, 1,94 mmol) y ácido (2-clorofenil)acético (304 mg, 1,78 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (83 mg, 0,0197 mmol, 15 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,90 min; EM (lENpos): m/z = 421 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,75 (s, 3H), 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,40 - 7,48 (m, 4H), 7,51 (d, 1H), 7,59 (d, 1H), 7,89 (d, 1H), 7,97 (dd, 1H), 8,34 (d, 1H), 10,74 (s, 1H).
Ejemplo 32
N-[4-(1H-Bencimidazol-1-il)-3-sulfamoilfeml]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 1H-bencimidazol (229 mg, 1,94 mmol) y ácido (2-clorofenil)acético (322 mg, 1,89 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (83 mg, 0,0197 mmol, 15 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,83 min; EM (lENpos): m/z = 441 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,07 - 7,12 (m, 1H), 7,20 - 7,28 (m, 2H), 7,30 - 7,37 (m, 2H), 7,44 - 7,52 (m, 3H), 7,58 (s, 2H), 7,69 - 7,74 (m, 1H), 7,95 (dd, 1H), 8,22 (s, 1H), 8,50 (d, 1H), 10,85 (s, 1H).
Ejemplo 33
W-[4-(4-Cloro-1H-imidazoM-M)-3-sulfamoilfeml]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-cloro-1H-imidazol (199 mg, 1,94 mmol) y ácido (2 clorofenil)acético (255 mg, 1,50 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) (23 mg, 0,0541 mmol, 4 % de rendimiento al cabo de 4 pasos, 96 % de pureza).
CL-EM (Procedimiento B): Tr = 0,75 min, EM (lENpos): m/z = 425 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,40 - 7,48 (m, 4H), 7,65 (s, 2H), 7,72 (d, 1H), 7,87 (dd, 1H), 8,39 (d, 1H), 10,80 (s, 1H).
Ejemplo 34
2-(2-Clorofenil)-W-{4-[3-(dimetilamino)-1H-1,2,4-triazol-1-il]-3-sulfamoilfenil}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), N,N-dimetil-1H-1,2,4-triazol-3-amina (217 mg, 1,94 mmol) y ácido (2-clorofenil)acético (310 mg, 1,82 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32%)) y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) (45 mg, 0,103 mmol, 8 % de rendimiento al cabo de 4 pasos, 99 % de pureza). CL-EM (Procedimiento B): Tr = 0,80 min; EM (lENpos): m/z = 435 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,93 (s, 6H), 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,49 (m, 2H), 7,56 (d, 1H), 7,59 (s, 2H), 7,96 (dd, 1H), 8,37 (d, 1H), 8,45 (s, 1H), 10,79 (s, 1H).
Ejemplo 35
2-(2-Clorofeml)-W-[4-(3-etiMH-1,2,4-tnazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-etil-1H-1,2,4-triazol (188 mg, 1,94 mmol) y ácido (2-clorofenil)acético (286 mg, 1,67 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) (20 mg, 0,0476 mmol, 4 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,75 min; EM (lENpos): m/z = 420 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,25 (t, 3H), 2,73 (q, 2H), 3,91 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,50 (m, 4H), 7,58 (d, 1H), 7,97 (dd, 1H), 8,39 (d, 1H), 8,68 (s, 1H), 10,82 (s, 1H).
Ejemplo 36 y Ejemplo 37
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-ciclopropil-1H-1,2,4-triazol (212 mg, 1,94 mmol) y ácido (2-clorofenil)acético (310 mg, 1,82 mmol) sin purificación de intermedios en (2-clorofenil)-N-[4-(3-ciclopropil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida y 2-(2-clorofenil)-N-[4-(5-ciclopropil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida. Los dos regioisómeros se purificaron y se separaron al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (YMC Triart C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico).
Ejemplo 36
(2-Clorofeml)-W-[4-(3-ciclopropiMH-1,2,4-tnazoM-M)-3-sulfamoNfeml]acetamida
83,4 mg, 0,124 mmol, 10 % de rendimiento al cabo de 4 pasos, 98 % de pureza
CL-EM (Procedimiento E): Tr = 1,86 min; EM (IENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 0,83 -0,88 (m, 2H), 0,94 -1,01 (m, 2H), 2,06 -2,13 (m, 1H), 3,91 (s, 2H), 7,29 - 7,36 (m, 2H), 7,41 - 7,53 (m, 4H), 7,57 (d, 1H), 7,95 (dd, 1H), 8,39 (d, 1H), 8,61 (s, 1H), 10,82 (s, 1H).
Ejemplo 37
2-(2-ClorofenM)-W-[4-(5-cidopropiMH-1,2,4-tnazoM -il)-3-sulfamoilfenil]acetamida
12,6 mg, 0,0292 mmol, 2 % de rendimiento al cabo de 4 pasos, 98 % de pureza
CL-EM (Procedimiento E): Tr = 1,82 min; EM (IENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 0,92 (s, 4H), 1,63 -1,71 (m, 1H), 3,92 (s, 2H), 7,22 (s, 2H), 7,30 - 7,37 (m, 2H), 7,43 - 7,49 (m, 2H), 7,61 (d, 1H), 7,98 (s, 1H), 8,00 (dd, 1H), 8,42 (d, 1H), 10,86 (s, 1H).
Ejemplo 38
2-(2-Clorofeml)-W-{4-[3-(metoximetM)-1H-1,2,4-tnazoM-M]-3-sulfamoNfeml}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-(metoximetil)-1H-1,2,4-triazol (219 mg, 1,94 mmol) y ácido (2-clorofenil)acético (306 mg, 1,80 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 |j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) (14,5 mg, 0,0333 mmol, 3 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,67 min; EM (IENpos): m/z = 436 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,31 (s, 3H), 3,92 (s, 2H), 4,50 (s, 2H), 7,29 - 7,37 (m, 2H), 7,43 - 7,49 (m, 4H), 7,60 (d, 1H), 7,97 (dd, 1H), 8,41 (d, 1H), 8,78 (s, 1H), 10,84 (s, 1H).
Ejemplo 39
-(2-Clorofeml)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
Procedimiento 1: Se añadió Pd/C (10 % de carga, 350 mg) a una solución de 2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (9,09 g, 20,5 mmol) en una mezcla de metanol (120 ml) y tetrahidrofurano (250 ml) y se agitó a temperatura ambiente durante 3 h bajo un flujo de hidrógeno. El catalizador se retiró mediante filtración, seguido por lavado con tetrahidrofurano y concentración del material filtrado al vacío. Se extrajo con acetato de etilo/agua. Se añadió solución de carbonato de sodio y se agitó durante la noche. El precipitado resultante se retiró mediante filtración y se descartó. La fase orgánica se separó, se secó sobre sulfato de sodio y se concentró al vacío para dar 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida en bruto (6,37 g) que se usó sin purificación adicional en el paso siguiente. CL-EM (Procedimiento B): Tr = 1,06 min; EM (lENpos): m/z = 414 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,69 (s, 3H), 3,72 (s, 3H), 3,92 (d a, 2H), 6,04 (s, 2H), 6,40 - 6,48 (m, 2H), 6,78 (dd, 1H), 7,08 - 7,14 (m, 2H), 7,19 (d, 1H), 7,27 (t a, 1H), 8,25 (s, 1H), 8,70 (s, 1H).
El material en bruto del paso previo (6,37 g) se disolvió en DMF (87 ml), después se añadieron ácido (2-clorofenil)acético (3,94 g, 23,1 mmol), N,N-diisopropiletilamina (5,97 g, 46,2 mmol) y HATU (8,78 g, 23,1 mmol). La mezcla de reacción se agitó durante el fin de semana a temperatura ambiente. Después se concentró al vacío y se extrajo con acetato de etilo y agua. La fase orgánica se lavó con cloruro de amonio, solución de bicarbonato de sodio y salmuera, se secó sobre sulfato de sodio y se concentró nuevamente al vacío para dar 2-(2-clorofenil)-N-{4-(4-ciano-1H-pirazol-1-il)-3-[(2,4-dimetoxibencil)-sulfamoil]fenil}acetamida en bruto (9,77 g) que se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento B): Tr = 1,27 min; EM (lENpos): m/z = 566 [M+H]+
El material en bruto del paso previo (9,77 g) se disolvió en una mezcla de diclorometano (30 ml) y ácido trifluoroacético (15 ml) y se agitó a temperatura ambiente durante la noche. Se concentró al vacío, se disolvió en diclorometano y se concentró al vacío nuevamente para retirar el ácido trifluoroacético restante. Después se agitó en una mezcla de diclorometano/agua durante el fin de semana. El precipitado resultante se retiró mediante filtración y se obtuvo compuesto del título puro (5,40 g, 13,0 mmol, 63 % de rendimiento al cabo de 3 pasos, 97 % de pureza). La pureza pudo haberse mejorado por recristalización desde acetato de etilo/hexanos.
CL-EM (Procedimiento B): Tr = 0,84 min, EM (lENpos): m/z = 416 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,91 (s, 2H), 7,29 -7,36 (m, 2H), 7,42 -7,49 (m, 4H), 7,58 (d, 1H), 7,97 (dd, 1H), 8,31 (d, 1H), 8,39 (d, 1H), 8,86 (d, 1H), 10,84 (s a, 1H).
Procedimiento 2: Se disolvió 5-amino-2-(4-ciano-1H-pirazol-1-il)bencensulfonamida (81 mg, 0,31 mmol) en dimetilformamida (1 ml), después se añadieron N,N-diisopropiletilamina (119 mg, 0,92 mmol), ácido (2-clorofenil)acético (63 mg, 0,37 mmol) y HATU (hexafluorofosfato de 3-óxido de 1-[bis(dimetilamino)metilen]-1H-1,2,3-triazolo[4,5-b]piridinio, 140 mg, 0,37 mmol). La mezcla de reacción se agitó durante la noche a temperatura ambiente. Después se concentró al vacío, se añadió acetato de etilo y agua y la fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio y se concentró al vacío. La purificación mediante HPLC preparativa (Chromatorex C-1810 |jm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) dio el compuesto del título (33 mg, 0,0794 mmol, 26 % de rendimiento, 50 % de pureza).
Ejemplo 40
W-[4-(4-íerc-ButiMH-imidazoM-M)-3-sulfamoMfeml]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2 (pero con 4,5 eq de 4-terc-butil-1H-imidazol y 9 eq de base,
durante 2d a 100 °C), GP2.4, GP3.4 y GP4.2, se convirtió 2-doro-W-(2,4-d¡metoxibenc¡l)-5-mtrobencensulfonam¡da (500 mg, 1,29 mmol), 4-terc-butiMH-imidazol (723 mg, 5,82 mmol) y ácido (2-clorofen¡l)acético (333 mg, 1,95 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (YMC Trairt C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (25 mg, 0,0559 mmol, 4 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,91 min; EM (lENpos): m/z = 447 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 1,24 (s, 9H), 3,90 (s, 2H), 6,99 (d, 1H), 7,28 -7,36 (m, 2H), 7,36 -7,49 (m, 5H), 7,63 (d, 1H), 7,87 (dd, 1H), 8,38 (d, 1H), 10,75 (s, 1H).
Ejemplo 41
2-(2-Clorofeml)-W-[4-(3-ciano-1H-1,2,4-tnazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.5 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil^-nitrobencensulfonamida (400 mg, 1,03 mmol), 1H-1,2,4-triazol-3-carbonitrilo (145 mg, 1,55 mmol) y ácido (2-clorofenil)acético (264 mg, 1,55 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) y después otra vez mediante HPLC preparativa (YMC Trairt C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (3,8 mg, 0,00912 mmol, 1 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 0,98 min; EM (lENpos): m/z = 417 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,93 (s, 2H), 7,28 - 7,38 (m, 2H), 7,41 - 7,51 (m, 2H), 7,60 - 7,69 (m, 3H), 7,92 - 8,02 (m, 1H), 8,43 (s, 1H), 9,12 (s, 1H), 10,90 (s, 1H).
Ejemplo 42
W-[4-(4-Bromo-1H-imidazoM-M)-3-sulfamoNfeml]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil^-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-bromo-1H-imidazol (285 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) (20 mg, 0,0426 mmol, 3 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 0,97 min; EM (lENpos): m/z = 469/471 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,91 (s, 2H), 7,29 -7,35 (m, 2H), 7,41 -7,48 (m, 4H), 7,65 (s, 2H), 7,73 (d, 1H), 7,89 (dd, 1H), 8,40 (d, 1H), 10,80 (s, 1H).
Ejemplo 43 y Ejemplo 44
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil^-nitrobencensulfonamida (500 mg, 1,29 mmol), 3H-¡m¡dazo[4,5-b]p¡r¡d¡na (231 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en 2-(2-clorofenil)-N-[4-(3H-imidazo[4,5-b]piridin-3-il)-3-sulfamoilfenil]acetamida y 2-(2-clorofenil)-N-[4-(1H-imidazo[4,5-b]piridin-1-il)-3-sulfamoilfenil]acetamida. Los dos regioisómeros se purificaron y se separaron al final mediante HPLC preparativa
(YMC Triart C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico).
Ejemplo 43
2-(2-Clorofeml)-W-[4-(3H-¡m¡dazo[4,5-b]p¡r¡dm-3-¡l)-3-sulfamo¡lfeml]acetam¡da
1 mg, 0,00226 mmol, 1 % de rendimiento al cabo de 4 pasos, 98 % de pureza
CL-EM (Procedimiento G): Tr = 1,52 min; EM (IENpos): m/z = 442 [M+H]+
RMN 1H (600MHz, DMSO-d6) 8 [ppm]: 3,93 (s, 2H), 7,26 (dd, 1H), 7,31 - 7,37 (m, 2H), 7,44 - 7,49 (m, 2H), 7,53 - 7,56 (m, 2H), 7,61 (s, 2H), 7,96 (dd, 1H), 8,46 (dd, 1H), 8,47 (d, 1H), 8,49 (d, 1H), 10,87 (s, 1H).
Ejemplo 44
-(2-Clorofeml)-N-[4-(1H-¡m¡dazo[4,5-b]p¡r¡dm-1-¡l)-3-sulfamo¡lfeml]acetam¡da
5 mg, 0,0113 mmol, 1 % de rendimiento al cabo de 4 pasos, 95 % de pureza
CL-EM (Procedimiento G): T r= 1,61 min; EM (IENpos): m/z = 442 (M+H)+
RMN 1H (600MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,31 - 7,37 (m, 3H), 7,45 - 7,49 (m, 2H), 7,52 - 7,57 (m, 3H), 7,95 (dd, 1H), 8,16 (dd, 1H), 8,29 (dd, 1H), 8,46 (s, 1H), 8,48 (d, 1H), 10,84 (s, 1H).
Ejemplo 45 y Ejemplo 46
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.5 y GP4.1, se convirtió 2-cloro-A/-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3H-imidazo[4,5-c]piridina (231 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en 2-(2-clorofenil)-N-[4-(1H-imidazo[4,5-c]piridin-1-il)-3-sulfamoilfenil]acetamida y 2-(2-clorofenil)-N-[4-(3H-imidazo[4,5-c]piridin-3-il)-3-sulfamoilfenil]acetamida. Los dos regioisómeros se purificaron y se separaron al final mediante HPLC preparativa (Fenomenex Kinetex C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) y después otra vez mediante HPLC preparativa (Luna Hilic 5 p 250x30 mm, CO2/metanol 0,5 % de amoníaco (32 %)).
Ejemplo 45
-(2-Clorofeml)-N-[4-(1H-¡m¡dazo[4,5-c]p¡r¡dm-1-¡l)-3-sulfamo¡lfeml]acetam¡da
5 mg, 0,0113 mmol, 1 % de rendimiento al cabo de 4 pasos, 95 % de pureza
CL-EM (Procedimiento H): Tr = 2,75 min, EM (lENpos): m/z = 442 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,28 (d, 1H), 7,31 -7,38 (m, 2H), 7,43 -7,50 (m, 2H), 7,58 (d, 1H), 7,61 -7,68 (m, 2H), 7,97 (dd, 1H), 8,37 -8,43 (m, 1H), 8,47 -8,54 (m, 2H), 9,15 (s, 1H), 10,90 (s, 1H).
Ejemplo 46
-(2-Clorofeml)-N-[4-(3H-¡m¡dazo[4,5-c]p¡r¡dm-3-¡l)-3-sulfamo¡lfeml]acetam¡da
5 mg, 0,0113 mmol, 1 % de rendimiento al cabo de 4 pasos, 85 % de pureza
CL-EM (Procedimiento H): Tr = 3,34 min; EM (lENpos): m/z = 442 [M+H]+
RMN 1H (600MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,27 - 7,39 (m, 2H), 7,42 - 7,50 (m, 2H), 7,67 (d, 1H), 7,73 - 7,82 (m, 3H), 7,94 (dd, 1H), 7,98 - 8,03 (m, 1H), 8,42 - 8,48 (m, 2H), 8,95 (s, 1H), 10,91 (s, 1H).
Ejemplo 47
2-(2-Clorofeml)-N-[4-(2,4-d¡met¡MH-¡m¡dazol-1-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 2,4-dimetil-1H-imidazol (207 mg, 1,94 mmol) y ácido (2-clorofenil)acético (262 mg, 1,53 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (Waters YMC Triart C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (1 mg, 0,00239 mmol, 1 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 0,76 min; EM (lENpos): m/z = 419 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,97 (s, 3H), 2,07 (s, 3H), 3,90 (s, 2H), 6,74 (s, 1H), 7,26 - 7,38 (m, 5H), 7,41 -7,49 (m, 2H), 7,87 (dd, 1H), 8,37 (d, 1H), 10,77 (s, 1H).
Ejemplo 48
2-(2-Fluorofeml)-N-[4-(4-flúor-1H-p¡razol-1 -¡l)-3-sulfamo¡lfen¡l]acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (450 mg, 1,17 mmol), 4-flúor-1H-pirazol (150 mg, 1,75 mmol) y ácido (2-fluorofenil)acético (284 mg, 1,85 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final
mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (38 mg, 0,0969 mmol, 8 % de rendimiento al cabo de 4 pasos, 93 % de pureza).
CL-EM (Procedimiento A): Tr = 0,97 min; EM (IENpos): m/z = 393 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,80 (s, 2H), 7,15 - 7,22 (m, 2H), 7,29 - 7,44 (m, 4H), 7,52 (d, 1H), 7,83 (dd, 1H), 7,96 (dd, 1H), 8,26 (dd, 1H), 8,36 (d, 1H), 10,76 (s, 1H).
Ejemplo 49
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-[2-(difluorometM)feml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-cloro-1H-pirazol (199 mg, 1,94 mmol) y ácido [2-(difluorometil)fenil]acético (330 mg, 1,77 mmol) sin purificación de intermedios el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (29 mg, 0,0659 mmol, 5 % de rendimiento al cabo de 4 pasos, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 441 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,23 (t, 1H), 7,38 - 7,46 (m, 4H), 7,49 - 7,62 (m, 3H), 7,86 (d, 1H), 7,95 (dd, 1H), 8,34 (d, 1H), 8,35 (d, 1H), 10,77 (s, 1H).
Ejemplo 50
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2-fluorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-cloro-1H-pirazol (199 mg, 1,94 mmol) y ácido (2-fluorofenil)acético (273 mg, 1,77 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (25 mg, 0,0659 mmol, 5 % de rendimiento al cabo de 4 pasos, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (IENpos): m/z = 409 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,80 (s, 2H), 7,16 -7,23 (m, 2H), 7,30 -7,44 (m, 4H), 7,54 (d, 1H), 7,86 (d, 1H), 7,96 (dd, 1H), 8,34 (d, 1H), 8,36 (d, 1H), 10,78 (s, 1H).
Ejemplo 51
2-[2-(DifluorometN)feml]-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (450 mg, 1,17 mmol), 4-flúor-1H-pirazol (150 mg, 1,75 mmol) y ácido [2-(difluorometil)fenil]acético (343 mg, 1,85 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (24 mg, 0,566 mmol, 5 % de rendimiento al cabo de 4 pasos, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,02 min; EM (lENpos): m/z = 425 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,94 (s, 2H), 7,23 (t, 1H), 7,38 (s, 2H), 7,42 - 7,46 (m, 2H), 7,50 - 7,55 (m, 2H), 7,58 - 7,63 (m, 1H), 7,83 (dd, 1H), 7,95 (dd, 1H), 8,26 (dd, 1H), 8,35 (d, 1H), 10,76 (s, 1H).
Ejemplo 52
W-[4-(4-Ciano-1H-pirazoM -il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.4 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (1,00 g, 2,59 mmol), 1H-pirazol-4-carbonitrilo (361 mg, 3,88 mmol) y ácido (2-fluorofenil)acético (226 mg, 1,47 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (YMC Triart C-185 pm, 100x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) (44 mg, 0,110 mmol, 4 % de rendimiento al cabo de 4 pasos, 98 % de pureza). CL-EM (Procedimiento B): Tr = 0,73 min; EM (lENpos): m/z = 400 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,81 (s, 2H), 7,16 - 7,23 (m, 2H), 7,30 - 7,50 (m, 4H), 7,58 (d, 1H), 7,96 (dd, 1H), 8,31 (d, 1H), 8,39 (d, 1H), 8,86 (d, 1H), 10,82 (s, 1H).
Ejemplo 53
2-(2-Metoxifenil)-W-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1 -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-metoxifenil)acético (0,40 mmol) en el compuesto del título (3,4 mg, 0,00747 mmol, 4 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (lENpos): m/z = 456 [M+H]+
Ejemplo 54
2-(2-Fluorofeml)-W-{3-sulfamoN-4-[3-(tN fluorometM)-1H-1,2,4-tnazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1 H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-fluorofenil)acético (0,40 mmol) en el compuesto del título (12,7 mg, 0,0286 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (IENpos): m/z = 444 [M+H]+
Ejemplo 55
2-(3-Fluorofeml)-W-{3-sulfamoN-4-[3-(tN fluorometM)-1H-1,2,4-tnazoM-M]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1 H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido (3-fluorofenil)acético (0,40 mmol) en el compuesto del título (11,6 mg, 0,0262 mmol, 13% de rendimiento, 100% de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 444 [M+H]+
Ejemplo 56
-(2-Cloro-4-fluorofeml)-W-{3-sulfamoN-4-[3-(tN fluorometM)-1H-1,2,4-tn azoM-M]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-4-fluorofenil)acético (0,40 mmol) en el compuesto del título (13,8 mg, 0,0289 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 478 [M+H]+
Ejemplo 57
2-[2-(Difluorometoxi)feml]-W-{3-sulfamoN-4-[3-(tN fluorometM)-1H-1,2,4-tnazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1 H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido [2-(difluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (3,4 mg, 0,00692 mmol, 3 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENpos): m/z = 492 [M+H]+
Ejemplo 58
2-(2-Cloro-5-fluorofeml)-W-{3-sulfamoN-4-[3-(tN fluorometM)-1H-1,2,4-tn azoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1 H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-fluorofenil)acético (0,40 mmol) en el compuesto del título (5,2 mg, 0,0109 mmol, 5 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 478 [M+H]+
Ejemplo 59
2-(3-Cloropmdm-4-M)-W-{3-sulfamoN-4-[3-(tN fluorometM)-1H-1,2,4-tn azoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido (3-cloropiridin-4-il)acético (0,40 mmol) en el compuesto del título (8,0 mg, 0,0174 mmol, 9 % de rendimiento, 82 % de pureza).
CL-EM (Procedimiento A): Tr = 0,92 min; EM (IENpos): m/z = 461 [M+H]+
Ejemplo 60
2-[4-(DifluorometN)feml]-W-{3-sulfamoN-4-[3-(trifluorometM)-1H-1,2,4-tnazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1 H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido [4-(difluorometil)fenil]acético (0,40 mmol) en el compuesto del título (11,4 mg, 0,0240 mmol, 12 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (IENpos): m/z = 476 [M+H]+
Ejemplo 61
2-(2-ClorofenM)-2,2-difluoro-W-{3-sulfamoN-4-[3-(tN fluorometM)-1H-1,2,4-tn azoM-N]fem l}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1 H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-clorofenil)(difluoro)acético (0,40 mmol) en el compuesto del título (16,2 mg, 0,0327 mmol, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (IENpos): m/z = 496 (M+H)+
Ejemplo 62
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfenM]-2-(2-clorofenM)-2,2-difluoroacetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-clorofenil)(difluoro)acético (0,40 mmol) en el compuesto del título (5,8 mg, 0,0115 mmol, 6 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 505 [M+H]+
Ejemplo 63
W-[4-(4-Bromo-1H-pirazol-1-M)-3-sulfamoNfeml]-2-(2-fluorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-fluorofenil)acético (0,40 mmol) en el compuesto del título (9,6 mg, 0,0212 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (IENpos): m/z = 453 [M+H]+
Ejemplo 64
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfeml]-2-[2-(trifluorometM)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (23,4 mg, 0,0465 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENpos): m/z = 503 [M+H]+
Ejemplo 65
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfeml]-2-(3-fluorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3-fluorofenil)acético (0,40 mmol) en el compuesto del título (12,3 mg, 0,0271 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENpos): m/z = 453 [M+H]+
Ejemplo 66
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2-metNfeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-metilfenil)acético (0,40 mmol) en el compuesto del título (25,9 mg, 0,0576 mmol, 29 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 449 [M+H]+
Ejemplo 67
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfenM]-2-(2-cloropmdm-3-M)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloropiridin-3-il)acético (0,40 mmol) en el compuesto del título (13,4 mg, 0,0285 mmol, 14 % de rendimiento, 79 % de pureza).
CL-EM (Procedimiento A): Tr = 0,98 min; EM (IENpos): m/z = 470 [M+H]+
Ejemplo 68
W-[4-(4-Bromo-1H-pirazol-1-M)-3-sulfamoNfeml]-2-(2-cloro-4-fluorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4-fluorofenil)acético (0,40 mmol) en el compuesto del título (3,0 mg, 0,00615 mmol, 3 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (IENpos): m/z = 487 [M+H]+
Ejemplo 69
W-[4-(4-Bromo-1H-pirazol-1-M)-3-sulfamoNfeml]-2-[2-(difluorometoxi)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-(difluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (21,5 mg, 0,0429 mmol, 21 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 501 [M+H]+
Ejemplo 70
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfenM]-2-[2-(trifluorometoxi)fenM]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-(trifluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (16,8 mg, 0,0324 mmol, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,22 min; EM (IENpos): m/z = 519 [M+H]+
Ejemplo 71
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfenM]-2-(2-cloro-4,5-difluorofenM)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (4,6 mg, 0,00910 mmol, 5 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (IENpos): m/z = 505 [M+H]+
Ejemplo 72
W-[4-(4-Bromo-1H-pirazol-1-M)-3-sulfamoNfeml]-2-(3-cloropmdm-4-N)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3-cloropiridin-4-il)acético (0,40 mmol) en el compuesto del título (5,9 mg, 0,0125 mmol, 6 % de rendimiento, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 0,96 min; EM (IENpos): m/z = 470 [M+H]+
Ejemplo 73
W-[4-(4-Bromo-1H-pirazoM-M)-3-sulfamoNfeml]-2-[4-(difluorometM)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [4-(difluorometil)fenil]acético (0,40 mmol) en el compuesto del título (15,7 mg, 0,0323 mmol, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (IENpos): m/z = 485 [M+H]+
Ejemplo 74
2-(2-Bromofeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-bromofenil)acético (0,40 mmol) en el compuesto del título (28,8 mg, 0,0613 mmol, 31 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (IENpos): m/z = 469 [M+H]+
Ejemplo 75
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2-metoxifeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-metoxifenil)acético (0,40 mmol) en el compuesto del título (2,7 mg, 0,0642 mmol, 3 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 421 [M+H]+
Ejemplo 76
2-(4-Clorofeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-clorofenil)acético (0,40 mmol) en el compuesto del título (5,8 mg, 0,0136 mmol, 7 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (IENpos): m/z = 425 [M+H]+
Ejemplo 77
2-(2-Cloro-6-fluorofeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-fluorofenil)acético (0,40 mmol) en el compuesto del título (33,9 mg, 0,0765 mmol, 38 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (IENpos): m/z = 443 [M+H]+
Ejemplo 78
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2-mtrofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-nitrofenil)acético (0,40 mmol) en el compuesto del título (8,3 mg, 0,0190 mmol, 10 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (IENpos): m/z = 436 [M+H]+
Ejemplo 79
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2,4-diclorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2,4-diclorofenil)acético (0,40 mmol) en el compuesto del título (4,2 mg, 0,00914 mmol, 5 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,23 min; EM (IENpos): m/z = 459 [M+H]+
Ejemplo 80
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2,6-diclorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2,6-diclorofenil)acético (0,40 mmol) en el compuesto del título (43,4 mg, 0,0944 mmol, 47 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,18 min; EM (IENpos): m/z = 459 [M+H]+
Ejemplo 81
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(3,4-difluorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3,4-difluorofenil)acético (0,40 mmol) en el compuesto del título (7,1 mg, 0,0166 mmol, 8 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 427 [M+H]+
Ejemplo 82
2-(3-Clorofeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3-clorofenil)acético (0,40 mmol) en el compuesto del título (11,4 mg, 0,0268 mmol, 13% de rendimiento, 100% de pureza).
CL-EM (Procedimiento A): Tr = 1,17 min, EM (lENpos): m/z = 425 [M+H]+
Ejemplo 83
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(3,5-difluorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (6,3 mg, 0,0148 mmol, 7 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (lENpos): m/z = 427 [M+H]+
Ejemplo 84
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(4-fluorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-fluorofenil)acético (0,40 mmol) en el compuesto del título (8,2 mg, 0,0201 mmol, 10 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (IENpos): m/z = 409 [M+H]+
Ejemplo 85
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2-hidroxifeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-hidroxifenil)acético (0,40 mmol) en el compuesto del título (12,5 mg, 0,0307 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,00 min; EM (IENpos): m/z = 407 [M+H]+
Ejemplo 86
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(4-hidroxifeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-hidroxifenil)acético (0,40 mmol) en el compuesto del título (5,5 mg, 0,0135 mmol, 7 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,93 min; EM (IENpos): m/z = 407 [M+H]+
Ejemplo 87
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2,3-difluorofeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2,3-difluorofenil)acético (0,40 mmol) en el compuesto del título (18,4 mg, 0,0431 mmol, 22 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENpos): m/z = 427 [M+H]+
Ejemplo 88
2-(2-Cloro-4-fluorofeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4-fluorofenil)acético (0,40 mmol) en el compuesto del título (14,5 mg, 0,0327 mmol, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (IENpos): m/z = 443 [M+H]+
Ejemplo 89
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfenM]-2-(2-cloropmdm-3-M)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloropiridin-3-il)acético (0,40 mmol) en el compuesto del título (21,3 mg, 0,0500 mmol, 25 % de rendimiento, 81 % de pureza).
CL-EM (Procedimiento A): Tr = 0,96 min, EM (IENpos): m/z = 426 [M+H]+
Ejemplo 90
W-[4-(4-Cloro-1H-pirazol-1-M)-3-sulfamoNfeml]-2-[2-cloro-3-(tnfluorometM)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-cloro-3-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (30,4 mg, 0,0616 mmol, 31 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,24 min; EM (IENpos): m/z = 493 [M+H]+
Ejemplo 91
W-[4-(4-Cloro-1H-pirazol-1-M)-3-sulfamoNfeml]-2-[2-(difluorometoxi)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-(difluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (20,7 mg, 0,0453 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (IENpos): m/z = 457 [M+H]+
Ejemplo 92
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-[2-(trifluorometoxi)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-(trifluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (14,1 mg, 0,0297 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 475 [M+H]+
Ejemplo 93
2-(2-Cloro-4,5-difluorofeml)-W-[4-(4-cloro-1H-pirazoM-N)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (9,8 mg, 0,0212 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENpos): m/z = 461 [M+H]+
Ejemplo 94
2-(2-Cloro-4-metoxifeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4-metoxifenil)acético (0,40 mmol) en el compuesto del título (16,4 mg, 0,0360 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (IENpos): m/z = 455 [M+H]+
Ejemplo 95
2-(2-Cloro-6-flúor-3-metNfenM)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-flúor-3-metilfenil)acético (0,40 mmol) en el compuesto del título (18,3 mg, 0,0400 mmol, 20 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 457 [M+H]+
Ejemplo 96
2-(2-Cloro-3,6-difluorofenM)-W-[4-(4-cloro-1H-pirazoM-N)-3-sulfamoNfenM]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-3,6-difluorofenil)acético (0,40 mmol) en el compuesto del título (20,1 mg, 0,0436 mmol, 22 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (IENpos): m/z = 461 [M+H]+
Ejemplo 97
2-(2-Cloro-5-metNfenM)-W-[4-(4-cloro-1H-pirazoM -il)-3-sulfamoilfenil]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-metilfenil)acético (0,40 mmol) en el compuesto del título (29,6 mg, 0,0674 mmol, 34 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (IENpos): m/z = 439 [M+H]+
Ejemplo 98
2-(2-Cloro-5-fluorofeml)-W-[4-(4-cloro-1H-p¡razol-1-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-fluorofenil)acético (0,40 mmol) en el compuesto del título (17,2 mg, 0,0388 mmol, 19 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 443 [M+H]+
Ejemplo 99
W-[4-(4-Cloro-1H-p¡razol-1-M)-3-sulfamo¡lfeml]-2-(2,5-d¡clorofeml)acetam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2,5-diclorofenil)acético (0,40 mmol) en el compuesto del título (26,1 mg, 0,0568 mmol, 28 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,22 min; EM (IENpos): m/z = 459 [M+H]+
Ejemplo 100
W-[4-(4-Cloro-1H-p¡razol-1-M)-3-sulfamo¡lfeml]-2-(2-¡soprop¡lfeml)acetam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-isopropilfenil)acético (0,40 mmol) en el compuesto del título (24,2 mg, 0,0559 mmol, 28 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,25 min; EM (IENpos): m/z = 433 [M+H]+
Ejemplo 101
2-(2-Cloro-5-metoxifenM)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfenM]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-metoxifenil)acético (0,40 mmol) en el compuesto del título (8,0 mg, 0,0176 mmol, 9 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 455 [M+H]+
Ejemplo 102
2-(2-Cloro-4,6-difluorofenM)-W-[4-(4-cloro-1H-pirazoM-N)-3-sulfamoNfenM]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4,6-difluorofenil)acético (0,40 mmol) en el compuesto del título (25,8 mg, 0,0559 mmol, 28 % de rendimiento, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 1,18 min; EM (IENpos): m/z = 461 [M+H]+
Ejemplo 103
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfenM]-2-[2-cloro-6-(tnfluorometM)fenM]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-cloro-6-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (26,7 mg, 0,0541 mmol, 27 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,22 min; EM (IENpos): m/z = 493 [M+H]+
Ejemplo 104
2-(5-Bromo-4-flúor-2-metNfeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (5-bromo-4-flúor-2-metilfenil)acético (0,40 mmol) en el compuesto del título (11,2 mg, 0,0223 mmol, 11 % de rendimiento, 83 % de pureza).
CL-EM (Procedimiento A): Tr = 1,24 min; EM (IENpos): m/z = 501 [M+H]+
Ejemplo 105
2-(2-Cloro-6-metoxifeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-metoxifenil)acético (0,40 mmol) en el compuesto del título (23,6 mg, 0,0518 mmol, 26 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (IENpos): m/z = 455 [M+H]+
Ejemplo 106
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(2,6-difluorofeml)propanamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido 2-(2,6-difluorofenil)propanoico (0,40 mmol) en el compuesto del título (21,1 mg, 0,0479 mmol, 24 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (IENpos): m/z = 441 [M+H]+
Ejemplo 107
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-[4-(difluorometM)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [4-(difluorometil)fenil]acético (0,40 mmol) en el compuesto del título (20,0 mg, 0,0454 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 441 [M+H]+
Ejemplo 108
2-(4-Clorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (4-clorofenil)acético (0,40 mmol) en el compuesto del título (18,5 mg, 0,0403 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,22 min; EM (IENpos): m/z = 459 [M+H]+
Ejemplo 109
2-(2-Clorofeml)-W-[4-(4-cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2,2-difluoroacetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-W-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-clorofenil)(difluoro)acético (0,40 mmol) en el compuesto del título (3,4 mg, 0,00737 mmol, 4 % de rendimiento, 81 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (IENpos): m/z = 461 [M+H]+
Ejemplo 110
2-(2-NitrofenM)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-nitrofenil)acético (0,40 mmol) en el compuesto del título (14,0 mg, 0,0298 mmol, 15 % de rendimiento, 91 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 470 [M+H]+
Ejemplo 111
2-(2,4-Didorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2,4-diclorofenil)acético (0,40 mmol) en el compuesto del título (16,4 mg, 0,0332 mmol, 17 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,28 min; EM (IENpos): m/z = 493 [M+H]+
Ejemplo 112
2-(2-Metoxifeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-metoxifenil)acético (0,40 mmol) en el compuesto del título (13,8 mg, 0,0304 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 455 [M+H]+
Ejemplo 113
2-(2-Cloro-6-fluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-fluorofenil)acético (0,40 mmol) en el compuesto del título (10,0 mg, 0,0210 mmol, 10 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (IENpos): m/z = 477 [M+H]+
Ejemplo 114
2-(3-Fluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (3-fluorofenil)acético (0,40 mmol) en el compuesto del título (13,5 mg, 0,0305 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (IENpos): m/z = 443 [M+H]+
Ejemplo 115
2-(3,5-Difluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (3,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (16,4 mg, 0,0356 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENpos): m/z = 461 [M+H]+
Ejemplo 116
2-(2,6-Didorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2,6-diclorofenil)acético (0,40 mmol) en el compuesto del título (15,8 mg, 0,0320 mmol, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,23 min; EM (IENpos): m/z = 493 [M+H]+
Ejemplo 117
2-(2-Bromofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-bromofenil)acético (0,40 mmol) en el compuesto del título (7,4 mg, 0,0147 mmol, 7 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (IENpos): m/z = 503 [M+H]+
Ejemplo 118
2-(3,4-Difluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (3,4-difluorofenil)acético (0,40 mmol) en el compuesto del título (13,3 mg, 0,0289 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,18 min; EM (IENpos): m/z = 461 [M+H]+
Ejemplo 119
2-(4-Fluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (4-fluorofenil)acético (0,40 mmol) en el compuesto del título (20,9 mg, 0,0472 mmol, 24 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (IENpos): m/z = 443 [M+H]+
Ejemplo 120
2-(3-Clorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (3-clorofenil)acético (0,40 mmol) en el compuesto del título (12,6 mg, 0,0275 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,22 min; EM (IENpos): m/z = 459 [M+H]+
Ejemplo 121
2-(4-Metoxifeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (4-metoxifenil)acético (0,40 mmol) en el compuesto del título (14,3 mg, 0,0315 mmol, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 455 [M+H]+
Ejemplo 122
2-(2,3-Difluorofeml)-W-{3-sulfamoN-4-[4-(tN fluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2,3-difluorofenil)acético (0,40 mmol) en el compuesto del título (8,0 mg, 0,0174 mmol, 92 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (IENpos): m/z = 461 [M+H]+
Ejemplo 123
2-(2-MetNfeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-metilfenil)acético (0,40 mmol) en el compuesto del título (21,4 mg, 0,0488 mmol, 24 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENpos): m/z = 439 [M+H]+
Ejemplo 124
-(3-MetNfeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (3-metilfenil)acético (0,40 mmol) en el compuesto del título (15,8 mg, 0,0360 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (IENpos): m/z = 439 [M+H]+
Ejemplo 125
2-[2-(Difluorometoxi)feml]-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido [2-(difluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (5,3 mg, 0,0108 mmol, 5 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENpos): m/z = 491 [M+H]+
Ejemplo 126
2-(2-Cloropmdm-3-M)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloropiridin-3-il)acético (0,40 mmol) en el compuesto del título (12,7 mg, 0,0276 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min; EM (IENpos): m/z = 460 [M+H]+
Ejemplo 127
2-(2-Cloro-4-fluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-4-fluorofenil)acético (0,40 mmol) en el compuesto del título (9,1 mg, 0,0191 mmol, 10 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 477 [M+H]+
Ejemplo 128
2-(2-Cloro-5-metNfeml)-W-{3-sulfamoN-4-[4-(trifluorometM)-1H-pirazoM-M]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-metilfenil)acético (0,40 mmol) en el compuesto del título (13,7 mg, 0,0290 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,25 min; EM (IENpos): m/z = 473 [M+H]+
Ejemplo 129
W-{3-SulfamoN-4-[4-(tN fluorometM)-1H-pirazoM-N]feml}-2-[2-(tnfluorometoxi)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido [2-(trifluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (9,5 mg, 0,0189 mmol, 9 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,25 min; EM (IENpos): m/z = 509 [M+H]+
Ejemplo 130
2-(2-Cloro-4,5-difluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-4,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (17,1 mg, 0,0346 mmol, 17 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,24 min; EM (IENpos): m/z = 495 [M+H]+
Ejemplo 131
2-[2-Cloro-3-(tN fluorometN)feml]-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido [2-cloro-3-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (15,3 mg, 0,0290 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,28 min; EM (IENpos): m/z = 527 [M+H]+
Ejemplo 132
2-(2-Cloro-6-flúor-3-metNfenM)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-flúor-3-metilfenil)acético (0,40 mmol) en el compuesto del título (10,9 mg, 0,0222 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,25 min; EM (IENpos): m/z = 491 [M+H]+
Ejemplo 133
2-(2-Cloro-3,6-difluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-3,6-difluorofenil)acético (0,40 mmol) en el compuesto del título (16,4 mg, 0,0331 mmol, 17 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 495 [M+H]+
Ejemplo 134
2-[2-Cloro-6-(tN fluorometN)feml]-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido [2-cloro-6-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (11,2 mg, 0,0213 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,26 min; EM (IENpos): m/z = 527 [M+H]+
Ejemplo 135
2-(2-Cloro-4-metox¡fem l)-W-{3-sulfamoN-4-[4-(tN fluorometM)-1H-p¡razol-1-¡l]fem l}acetam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-4-metoxifenil)acético (0,40 mmol) en el compuesto del título (17,9 mg, 0,0366 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENpos): m/z = 489 [M+H]+
Ejemplo 136
2-(2,5-D¡dorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-p¡razol-1-N]feml}acetam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2,5-diclorofenil)acético (0,40 mmol) en el compuesto del título (10,3 mg, 0,0209 mmol, 10 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,26 min; EM (IENpos): m/z = 493 [M+H]+
Ejemplo 137
2-(2-Isoprop¡lfeml)-W-{3-sulfamo¡l-4-[4-(tr¡fluorometM)-1H-p¡razol-1-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-isopropilfenil)acético (0,40 mmol) en el compuesto del título (19,8 mg, 0,0424 mmol, 21 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,30 min; EM (IENpos): m/z = 467 [M+H]+
Ejemplo 138
2-(2-Cloro-5-metoxifeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-metoxifenil)acético (0,40 mmol) en el compuesto del título (6,7 mg, 0,0137 mmol, 7 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (IENpos): m/z = 489 [M+H]+
Ejemplo 139
2-(2-Cloro-5-fluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-fluorofenil)acético (0,40 mmol) en el compuesto del título (12,6 mg, 0,0264 mmol, 13 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 477 [M+H]+
Ejemplo 140
W-[4-(4-Fluoro-1H-pirazoM-M)-3-sulfamoMfeml]-2-[2-(trifluorometN)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido [2-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (1 l,8 mg, 0,0267 mmol, 13 % de rendimiento, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (lENpos): m/z = 443 [M+H]+
Ejemplo 141
2-(5-Bromo-4-flúor-2-metNfeml)-W-{3-sulfamoN-4-[4-(trifluorometM)-1H-pirazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (5-bromo-4-flúor-2-metilfenil)acético (0,40 mmol) en el compuesto del título (19,5 mg, 0,0364 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,29 min; EM (lENpos): m/z = 535 [M+H]+
Ejemplo 142
2-(2-Cloro-6-metoxifeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-metoxifenil)acético (0,40 mmol) en el compuesto del título (23,8 mg, 0,0487 mmol, 24 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (lENpos): m/z = 489 [M+H]+
Ejemplo 143
2-(2-Cloro-4,6-difluorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-4,6-difluorofenil)acético (0,40 mmol) en el compuesto del título (7,7 mg, 0,0156 mmol, 8 % de rendimiento, 91 % de pureza).
CL-EM (Procedimiento A): Tr = 1,23 min; EM (IENpos): m/z = 495 [M+H]+
Ejemplo 144
2-(3-Fluorofeml)-W-[4-(4-flúoMH-pirazoM -il)-3-sulfamoilfenil]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (3-fluorofenil)acético (0,40 mmol) en el compuesto del título (12,9 mg, 0,0328 mmol, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (IENpos): m/z = 393 [M+H]+
Ejemplo 145
2-(3,4-Difluorofeml)-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (3,4-difluorofenil)acético (0,40 mmol) en el compuesto del título (16,0 mg, 0,0390 mmol, 19 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (IENpos): m/z = 411 [M+H]+
Ejemplo 146
2-(3,5-Difluorofeml)-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (3,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (11,4 mg, 0,0278 mmol, 14 % de rendimiento, 81 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (lENpos): m/z = 411 [M+H]+
Ejemplo 147
W-[4-(4-Fluoro-1H-pirazoM-M)-3-sulfamoMfeml]-2-(2-hidroxifeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-hidroxifenil)acético (0,40 mmol) en el compuesto del título (8,8 mg, 0,0225 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,93 min; EM (lENpos): m/z = 391 [M+H]+
Ejemplo 148
2-(3-Clorofeml)-W-[4-(4-flúor-1H-pirazoM-N)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (3-clorofenil)acético (0,40 mmol) en el compuesto del título (15,2 mg, 0,0372 mmol, 19 % de rendimiento, 86 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (lENpos): m/z = 409 [M+H]+
Ejemplo 149
-(4-Fluorofeml)-W-[4-(4-flúoMH-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (4-fluorofenil)acético (0,40 mmol) en el compuesto del título (20,3 mg, 0,0517 mmol, 26 % de rendimiento, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (lENpos): m/z = 393 [M+H]+
Ejemplo 150
W-[4-(4-Fluoro-1H-pirazoM-M)-3-sulfamoMfeml]-2-(4-hidroxifeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (4-hidroxifenil)acético (0,40 mmol) en el compuesto del título (l3 ,9m g, 0,0356 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,85 min; EM (lENpos): m/z = 391 [M+H]+
Ejemplo 151
W-[4-(4-Fluoro-1H-pirazoM-M)-3-sulfamoMfeml]-2-(3-metNfeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (3-metilfenil)acético (0,40 mmol) en el compuesto del título (6,1 mg, 0,0157 mmol, 8 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min, EM (lENpos): m/z = 389 [M+H]+
Ejemplo 152
W-[4-(4-Fluoro-1H-pirazoM-M)-3-sulfamoMfeml]-2-(4-metNfeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (4-metilfenil)acético (0,40 mmol) en el compuesto del título (11,4 mg, 0,0293 mmol, 15 % de rendimiento, 91 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (lENpos): m/z = 389 [M+H]+
Ejemplo 153
W-[4-(4-Fluoro-1H-pirazoM-M)-3-sulfamoMfeml]-2-(4-metoxifeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (4-metoxifenil)acético (0,40 mmol) en el compuesto del título (21,8 mg, 0,0539 mmol, 27 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,01 min, EM (lENpos): m/z = 405 [M+H]+
Ejemplo 154
W-[4-(4-Fluoro-1H-pirazoM-M)-3-sulfamoMfeml]-2-(2-metNfeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-metilfenil)acético (0,40 mmol) en el compuesto del título (18,9 mg, 0,0487 mmol, 24 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min, EM (lENpos): m/z = 389 [M+H]+
Ejemplo 155
2-(2,3-Difluorofeml)-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2,3-difluorofenil)acético (0,40 mmol) en el compuesto del título (10,4 mg, 0,0253 mmol, 13 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,05 min; EM (lENpos): m/z = 411 [M+H]+
Ejemplo 156
-(2-Etoxifeml)-W-[4-(4-flúoMH-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-etoxifenil)acético (0,40 mmol) en el compuesto del título (20,2 mg, 0,0483 mmol, 24 % de rendimiento, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (lENpos): m/z = 419 [M+H]+
Ejemplo 157
2-[2-(Difluorometoxi)feml]-W-[4-(4-flúoMH-pirazoM-M)-3-sulfamoMfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido [2-(difluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (14,9 mg, 0,0338 mmol, 17 % de rendimiento, 88 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (lENpos): m/z = 441 [M+H]+
Ejemplo 158
2-(2-Cloropmdm-3-M)-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-cloropiridin-3-il)acético (0,40 mmol) en el compuesto del título (7,1 mg, 0,0173 mmol, 9 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,88 min; EM (lENpos): m/z = 410 [M+H]+
Ejemplo 159
2-(2-Cloro-6-flúor-3-metNfeml)-W-[4-(4-flúoMH-pirazoM-N)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-flúor-3-metilfenil)acético (0,40 mmol) en el compuesto del título (17,7 mg, 0,0401 mmol, 20 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (lENpos): m/z = 441 [M+H]+
Ejemplo 160
W-[4-(4-Fluoro-1H-pirazoM-M)-3-sulfamoMfeml]-2-[2-(trifluorometoxi)feml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido [2-(trifluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (16,4 mg, 0,0358 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (lENpos): m/z = 459 [M+H]+
Ejemplo 161
2-(2-Cloro-4,5-difluorofeml)-W-[4-(4-flúoMH-pirazoM-M)-3-sulfamoNfemlo]
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (6,4 mg, 0,0144 mmol, 7 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 445 [M+H]+
Ejemplo 162
2-[2-Cloro-3-(tnfluorometN)feml]-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido [2-cloro-3-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (13,6 mg, 0,0285 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (lENpos): m/z = 477 [M+H]+
Ejemplo 163
2-(2,5-Didorofeml)-W-[4-(4-flúoMH-pirazol-1-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2,5-diclorofenil)acético (0,40 mmol) en el compuesto del título (13,8 mg, 0,0311 mmol, 16 % de rendimiento, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (lENpos): m/z = 443 [M+H]+
Ejemplo 164
2-(2-Cloro-3,6-difluorofeml)-W-[4-(4-flúoMH-pirazoM-M)-3-sulfamoMfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-cloro-3,6-difluorofenil)acético (0,40 mmol) en el compuesto del título (19,1 mg, 0,0429 mmol, 22 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (lENpos): m/z = 445 [M+H]+
Ejemplo 165
2-(2-Cloro-5-metNfeml)-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-metilfenil)acético (0,40 mmol) en el compuesto del título (20,6 mg, 0,0487 mmol, 24 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (lENpos): m/z = 423 [M+H]+
Ejemplo 166
2-(5-Bromo-4-flúor-2-metNfeml)-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (5-bromo-4-flúor-2-metilfenil)acético (0,40 mmol) en el compuesto del título (13,7 mg, 0,0282 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (lENpos): m/z = 485 [M+H]+
Ejemplo 167
W-[4-(4-Fluoro-1H-p¡razol-1-M)-3-sulfamoMfeml]-2-(2-isoprop¡lfeml)acetam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-isopropilfenil)acético (0,40 mmol) en el compuesto del título (21,3 mg, 0,0511 mmol, 26 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (lENpos): m/z = 417 [M+H]+
Ejemplo 168
2-(2-Cloro-5-fluorofeml)-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamoMfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-fluorofenil)acético (0,40 mmol) en el compuesto del título (16,7 mg, 0,0391 mmol, 20 % de rendimiento, 84 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (lENpos): m/z = 427 [M+H]+
Ejemplo 169
2-[2-Cloro-6-(trifluoromet¡l)fen¡l]-W-[4-(4-flúor-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido [2-cloro-6-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (1o,8 mg, 0,0226 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min, EM (lENpos): m/z = 477 [M+H]+
Ejemplo 170
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-(4-metoxifeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-metoxifenil)acético (0,40 mmol) en el compuesto del título (12,2 mg, 0,0290 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (lENpos): m/z = 421 [M+H]+
Ejemplo 171
2-(2,6-D¡fluorofeml)-W-[4-(4-flúor-1H-pirazoM-M)-3-sulfamo¡lfeml]propanam¡da
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2,6-difluorofenil)acético (0,40 mmol) en el compuesto del título (12,2 mg, 0,0287 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (lENpos): m/z = 425 [M+H]+
Ejemplo 172
W-[4-(4-Cloro-1H-pirazol-1-M)-3-sulfamoilfeml]-2-(4-metNfeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-metilfenil)acético (0,40 mmol) en el compuesto del título (8,8 mg, 0,0217 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min, EM (IENpos): m/z = 405 [M+H]+
Ejemplo 173
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfenM]-2-(2-metNfeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-metilfenil)acético (0,40 mmol) en el compuesto del título (13,7 mg, 0,0338 mmol, 17 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 405 [M+H]+
Ejemplo 174
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfenM]-2-(3-metNfeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3-metilfenil)acético (0,40 mmol) en el compuesto del título (27,3 mg, 0,0674 mmol, 34 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 405 [M+H]+
Ejemplo 175
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfenM]-2-(2-etoxifeml)acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-W-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-etoxifenil)acético (0,40 mmol) en el compuesto del título (28,3 mg, 0,0651 mmol, 33 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 435 [M+H]+
Ejemplo 176
2-(2-Etoxifeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM -il]fenil}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1 H-pirazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-etoxifenil)acético (0,40 mmol) en el compuesto del título (4,9 mg, 0,0105 mmol, 5 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 469 [M+H]+
Ejemplo 177
2-(2-Bromofeml)-W-[4-(4-flúor-1H-pirazoM-N)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2-bromofenil)acético (0,40 mmol) en el compuesto del título (17,9 mg, 0,0395 mmol, 20 % de rendimiento, 91 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 453 [M+H]+
Ejemplo 178
2-(2,4-Didorofeml)-W-[4-(4-flúoMH-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2,4-diclorofenil)acético (0,40 mmol) en el compuesto del título (8,3 mg, 0,0187 mmol, 9 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,18 min; EM (lENpos): m/z = 443 [M+H]+
Ejemplo 179
2-(2,6-DidorofenM)-W-[4-(4-flúoMH-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-N-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida (0,20 mmol) y ácido (2,6-diclorofenil)acético (0,40 mmol) en el compuesto del título (20,0 mg, 0,0451 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 443 [M+H]+
Ejemplo 180
W-[4-(4-Ciano-1H-pirazoM -il)-3-sulfamoilfenil]-2-(2-nitrofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-nitrofenil)acético (0,40 mmol) en el compuesto del título (19,0 mg, 0,0446 mmol, 22 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,95 min; EM (lENpos): m/z = 427 [M+H]+
Ejemplo 181
2-(4-ClorofenM)-N-[4-(4-dano-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-clorofenil)acético (0,40 mmol) en el compuesto del título (17,8 mg, 0,0428 mmol, 21 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (lENpos): m/z = 416 [M+H]+
Ejemplo 182
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(2-metoxifenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-metoxifenil)acético (0,40 mmol) en el compuesto del título (24,1 mg, 0,0586 mmol, 29 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,99 min; EM (lENpos): m/z = 412 [M+H]+
Ejemplo 183
2-(2-Cloro-6-fluorofeml)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-fluorofenil)acético (0,40 mmol) en el compuesto del título (37,3 mg, 0,0860 mmol, 43 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (lENpos): m/z = 434 [M+H]+
Ejemplo 184
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-[2-(trifluorometil)fenil]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (28,1 mg, 0,0625 mmol, 31 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 450 [M+H]+
Ejemplo 185
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(3-fluorofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3-fluorofenil)acético (0,40 mmol) en el compuesto del título (24,7 mg, 0,0618 mmol, 31 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,99 min; EM (IENpos): m/z = 400 [M+H]+
Ejemplo 186
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(2,4-diclorofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2,4-diclorofenil)acético (0,40 mmol) en el compuesto del título (25,9 mg, 0,0575 mmol, 29 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 450 [M+H]+
Ejemplo 187
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(2,6-diclorofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2,6-diclorofenil)acético (0,40 mmol) en el compuesto del título (27,8 mg, 0,0617 mmol, 31 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 450 [M+H]+
Ejemplo 188
2-(2-Bromofeml)-N-[4-(4-ciano-1H-pirazol-1-M)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-bromofenil)acético (0,40 mmol) en el compuesto del título (32,0 mg, 0,0695 mmol, 35 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (IENpos): m/z = 460 [M+H]+
Ejemplo 189
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(3,4-difluorofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3,4-difluorofenil)acético (0,40 mmol) en el compuesto del título (4,0 mg, 0,00958 mmol, 5 % de rendimiento, 86 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min; EM (IENpos): m/z = 418 [M+H]+
Ejemplo 190
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(3,5-difluorofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (6,2 mg, 0,0149 mmol, 7 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min; EM (IENpos): m/z = 418 [M+H]+
Ejemplo 191
2-(3-ClorofenM)-N-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3-clorofenil)acético (0,40 mmol) en el compuesto del título (28,6 mg, 0,0688 mmol, 34 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (IENpos): m/z = 416 [M+H]+
Ejemplo 192
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(4-fluorofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-fluorofenil)acético (0,40 mmol) en el compuesto del título (8:7 mg, 0,0218 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0:99 min; EM (IENpos): m/z = 400 [M+H]+
Ejemplo 193
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(2-hidroxifenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-hidroxifenil)acético (0,40 mmol) en el compuesto del título (18:5 mg, 0,0466 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0:88 min; EM (IENpos): m/z = 398 [M+H]+
Ejemplo 194
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(4-hidroxifenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-hidroxifenil)acético (0,40 mmol) en el compuesto del título (14,4 mg, 0,0362 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0:79 min; EM (IENpos): m/z = 398 [M+H]+
Ejemplo 195
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(4-metilfenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-metilfenil)acético (0,40 mmol) en el compuesto del título (27,2 mg, 0,0688 mmol, 34 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (IENpos): m/z = 396 [M+H]+
Ejemplo 196
N-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-metoxifenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (4-metoxifenil)acético (0,40 mmol) en el compuesto del título (25,9 mg, 0,0629 mmol, 31 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,96 min; EM (IENpos): m/z = 412 [M+H]+
Ejemplo 197
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(2-metilfenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-metilfenil)acético (0,40 mmol) en el compuesto del título (14,9 mg, 0,0377 mmol, 19 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min; EM (IENpos): m/z = 396 [M+H]+
Ejemplo 198
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(3-metilfenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3-metilfenil)acético (0,40 mmol) en el compuesto del título (22,0 mg, 0,0556 mmol, 28 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (IENpos): m/z = 396 [M+H]+
Ejemplo 199
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(2-etoxifenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-etoxifenil)acético (0,40 mmol) en el compuesto del título (27,6 mg, 0,0649 mmol, 32 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,05 min; EM (IENpos): m/z = 426 [M+H]+
Ejemplo 200
N-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(2,3-difluorofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2,3-difluorofenil)acético (0,40 mmol) en el compuesto del título (28,0 mg, 0,0671 mmol, 34 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,01 min; EM (IENpos): m/z = 418 [M+H]+
Ejemplo 201
2-(2-Cloropir¡dm-3-M)-W-[4-(4-c¡ano-1H-p¡razoM -il)-3-sulfamoilfenil]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloropiridin-3-il)acético (0,40 mmol) en el compuesto del título (20,7 mg, 0,0497 mmol, 25 % de rendimiento, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 0,83 min; EM (IENpos): m/z = 417 [M+H]+
Ejemplo 202
2-(2-Cloro-4-fluorofeml)-W-[4-(4-ciano-1H-pirazol-1-M)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4-fluorofenil)acético (0,40 mmol) en el compuesto del título (23,4 mg, 0,0539 mmol, 27 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,06 min; EM (IENpos): m/z = 434 [M+H]+
Ejemplo 203
N-[4-(4-Ciano-1H-pirazol-1 -il^-sulfamoilfeml^-p-jdifluorometoxifem^acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-(difluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (28,4 mg, 0,0635 mmol, 32 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min; EM (IENpos): m/z = 448 [M+H]+
Ejemplo 204
W-[4-(4-Ciano-1H-pirazoM -il)-3-sulfamoilfenil]-2-[2-(trifluorometoxi)fenil]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-(trifluorometoxi)fenil]acético (0,40 mmol) en el compuesto del título (25,1 mg, 0,0539 mmol, 27 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (IENpos): m/z = 466 [M+H]+
Ejemplo 205
2-(2-Cloro-4,5-difluorofeml)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4,5-difluorofenil)acético (0,40 mmol) en el compuesto del título (16,5 mg, 0,0365 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 452 [M+H]+
Ejemplo 206
2-[2-Cloro-3-(tnfluorometN)feml]-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoMfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-cloro-3-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (14,4 mg, 0,0298 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 484 [M+H]+
Ejemplo 207
2-(2-Cloro-6-flúor-3-metNfenM)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfenM]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-flúor-3-metilfenil)acético (0,40 mmol) en el compuesto del título (28,1 mg, 0,0627 mmol, 31 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (IENpos): m/z = 448 [M+H]+
Ejemplo 208
2-(2-Cloro-3,6-difluorofenM)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfenM]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-3,6-difluorofenil)acético (0,40 mmol) en el compuesto del título (6,5 mg, 0,0144 mmol, 7 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,05 min; EM (IENpos): m/z = 452 [M+H]+
Ejemplo 209
2-(2-Cloro-5-metNfenM)-W-[4-(4-ciano-1H-pirazoM-N)-3-sulfamoNfenM]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-metilfenil)acético (0,40 mmol) en el compuesto del título (19,4 mg, 0,0451 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (IENpos): m/z = 430 [M+H]+
Ejemplo 210
2-(2-Cloro-4-metoxifeml)-W-[4-(4-ciano-1H-pirazol-1-M)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4-metoxifenil)acético (0,40 mmol) en el compuesto del título (14,9 mg, 0,0334 mmol, 17 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (IENpos): m/z = 446 [M+H]+
Ejemplo 211
W-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-(2,5-diclorofenil)acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2,5-diclorofenil)acético (0,40 mmol) en el compuesto del título (17,1 mg, 0,0380 mmol, 19 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENpos): m/z = 450 [M+H]+
Ejemplo 212
2-(5-Cloro-2-metoxifeml)-N-[4-(4-ciano-1H-pirazol-1-M)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (5-cloro-2-metoxifenil)acético (0,40 mmol) en el compuesto del título (26,8 mg, 0,0601 mmol, 30 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 446 [M+H]+
Ejemplo 213
W-[4-(4-Ciano-1H-pirazol-1 -il)-3-sulfamoilfenil]-2-[2-(propan-2-il)fenil]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-isopropilfenil)acético (0,40 mmol) en el compuesto del título (33,3 mg, 0,0786 mmol, 39 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 424 [M+H]+
Ejemplo 214
2-(2-Cloro-5-fluorofeml)-N-[4-(4-ciano-1H-pirazol-1-M)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-5-fluorofenil)acético (0,40 mmol) en el compuesto del título (23,0 mg, 0,0530 mmol, 27 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min, EM (IENpos): m/z = 434 [M+H]+
Ejemplo 215
2-[2-Cloro-6-(tnfluorometN)feml]-N-[4-(4-ciano-1H-pirazol-1-M)-3-sulfamoMfeml]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [2-cloro-6-(trifluorometil)fenil]acético (0,40 mmol) en el compuesto del título (25,0 mg, 0,0517 mmol, 26 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENpos): m/z = 484 [M+H]+
Ejemplo 216
2-(2-Cloro-6-metox¡feml)-W-[4-(4-c¡ano-1H-p¡razol-1-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-metoxifenil)acético (0,40 mmol) en el compuesto del título (7,8 mg, 0,0175 mmol, 9 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,06 min; EM (IENpos): m/z = 446 [M+H]+
Ejemplo 217
2-(2-Cloro-4,6-d¡fluorofeml)-W-[4-(4-c¡ano-1H-p¡razol-1-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-cloro-4,6-difluorofenil)acético (0,40 mmol) en el compuesto del título (18,0 mg, 0,0398 mmol, 20 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (IENpos): m/z = 452 [M+H]+
Ejemplo 218
2-(3-Cloropir¡dm-4-M)-W-[4-(4-c¡ano-1H-p¡razoM -il)-3-sulfamoilfenil]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (3-cloropiridin-4-il)acético (0,40 mmol) en el compuesto del título (31,2 mg, 0,0748 mmol, 37 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,81 min; EM (IENpos): m/z = 417 [M+H]+
Ejemplo 219
W-[4-(4-C¡ano-1H-p¡razol-1 -il)-3-sulfamoilfenil]-2-[4-(difluorometil)fenil]acetamida
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido [4-(difluorometil)fenil]acético (0,40 mmol) en el compuesto del título (21,8 mg, 0,0505 mmol, 25 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,02 min; EM (IENpos): m/z = 432 [M+H]+
Ejemplo 220
2-(2-Clorofeml)-N-[4-(4-c¡ano-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]-2,2-d¡fluoroacetam¡da
De acuerdo con el procedimiento general GP5.2, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (0,20 mmol) y ácido (2-clorofenil)(difluoro)acético (0,40 mmol) en el compuesto del título (10,9 mg, 0,0241 mmol, 12 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 452 [M+H]+
Ejemplo 221
2-(2-Fluorofeml)-N-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)pmdm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6, se convirtió 5-amino-W-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (47,0 mg, 0,126 mmol) y ácido (2-fluorofenil)acético (29,2 mg, 0,189 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (14 mg, 0,0309 mmol, 25 % de rendimiento al cabo de 2 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,97 min; EM (lENpos): m/z = 454 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,80 (s, 2H), 7,15 - 7,23 (m, 2H), 7,30 - 7,52 (m, 5H), 7,87 (dd, 1H), 8,12 - 8,15 (m, 1H), 8,40 (d, 1H), 8,81 (d, 1H), 8,96 (d, 1H), 10,71 (s, 1H).
Ejemplo 222
W-{3-Sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}-2-[2-(tr¡fluorometox¡)feml]acetam¡da
De acuerdo con el procedimiento general GP6, se convirtió 5-amino-W-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (47,0 mg, 0,126 mmol) y ácido [2-(trifluorometoxi)fenil]acético (41,7 mg, 0,189 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (14 mg, 0,0270 mmol, 21 % de rendimiento al cabo de 2 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 1,11 min; EM (lENpos): m/z = 520 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,85 (s, 2H), 7,34 - 7,49 (m, 6H), 7,51 (dd, 1H), 7,88 (dd, 1H), 8,12 - 8,15 (m, 1H), 8,37 (d, 1H), 8,82 (d, 1H), 8,96 (d, 1H), 10,72 (s, 1H).
Ejemplo 223
W-{4-[1-(D¡fluoromet¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡lfen¡l}-2-(2-met¡lfen¡l)acetam¡da
De acuerdo con el procedimiento general GP6, se convirtió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-A/-[(dimetilamino)metilen]bencensulfonamida (47,0 mg, 0,137 mmol) y ácido (2-metilfenil)acético (30,8 mg, 0,205 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (13 mg, 0,0309 mmol, 23 % de rendimiento al cabo de 2 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,93 min; EM (lENpos): m/z = 421 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 3,72 (s, 2H), 7,12 - 7,20 (m, 3H), 7,22 - 7,28 (m, 1H), 7,39 (s, 2H), 7,47 (d, 1H), 7,84 (t, 1H), 7,86 (dd, 1H), 8,01 (s, 1H), 8,34 (d, 1H), 8,42 (s, 1H), 10,57 (s, 1H).
Ejemplo 224
W-{4-[1-(Difluorometil)-1H-pirazol-4-il]-3-sulfamoilfeml}-2-[2-(trifluorometil)feml]acetamida
De acuerdo con el procedimiento general GP6, se convirtió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-A/-[(dimetilamino)metilen]bencensulfonamida (47,0 mg, 0,137 mmol) y ácido [2-(trifluorometil)fenil]acético (42,0 mg, 0,205 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (14 mg, 0,0295 mmol, 22 % de rendimiento al cabo de 2 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 1,00 min; EM (lENpos): m/z = 475 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,97 (s, 2H), 7,40 (s, 2H), 7,45 - 7,57 (m, 3H), 7,63 - 7,74 (m, 2H), 7,83 (dd, 1H), 7,84 (t, 1H), 8,01 (s, 1H), 8,34 (d, 1H), 8,42 (s, 1H), 10,62 (s, 1H).
Ejemplo 225
-[2-(Difluorometil)feml]-N-{4-[1-(difluorometil)-1H-pirazol-4-il]-3-sulfamoilfeml}acetamida
De acuerdo con el procedimiento general GP6, se convirtió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-A/-[(dimetilamino)metilen]bencensulfonamida (47,0 mg, 0,137 mmol) y ácido [2-(difluorometil)fenil]acético (38,2 mg, 0,205 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (14 mg, 0,0307 mmol, 22 % de rendimiento al cabo de 2 pasos, 99 % de pureza).
CL-EM (Procedimiento B): Tr = 0,94 min; EM (lENpos): m/z = 457 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,92 (s, 2H), 7,24 (t, 1H), 7,30 - 7,56 (m, 6H), 7,60 (d, 1H), 7,84 (dd, 1H), 7,84 (t, 1H), 8,01 (s, 1H), 8,34 (d, 1H), 8,42 (s, 1H), 10,62 (s, 1H).
Ejemplo 226
W-{4-[1-(Difluorometil)-1H-pirazol-4-il]-3-sulfamoilfeml}-2-(2-metoxifeml)acetamida
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-W-[(dimetilamino)metilen]bencensulfonamida (47,0 mg, 0,137 mmol) y ácido (2-metoxifenil)acético (34,1 mg, 0,205 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (15 mg, 0,0344 mmol, 25 % de rendimiento al cabo de 2 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,89 min; EM (lENpos): m/z = 437 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,67 (s, 2H), 3,77 (s, 3H), 6,91 (td, 1H), 6,98 (dd, 1H), 7,20 - 7,29 (m, 2H), 7,39 (s, 2H), 7,46 (d, 1H), 7,84 (t, 1H), 7,84 (dd, 1H), 8,01 (s, 1H), 8,36 (d, 1H), 8,42 (s, 1H), 10,47 (s, 1H).
Ejemplo 227
W'{4-[1-(DifluorometM)-1H-pirazol-4-M]-3-sulfamoNfeml}-2-(4-fluorofeml)acetamida
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-W-[(dimetilamino)metilen]bencensulfonamida (47,0 mg, 0,137 mmol) y ácido (4-fluorofenil)acético (31,6 mg, 0,205 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (14 mg, 0,0330 mmol, 24 % de rendimiento al cabo de 2 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,89 min; EM (lENpos): m/z = 425 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,68 (s, 2H), 7,12 - 7,20 (m, 2H), 7,32 - 7,44 (m, 4H), 7,46 (d, 1H), 7,83 (t, 1H), 7,84 (dd, 1H), 8,00 (s, 1H), 8,33 (d, 1H), 8,42 (s, 1H), 10,57 (s, 1H).
Ejemplo 228
2-(2-Cloro-5-fluorofeml)-W-{4-[1-(difluorometM)-1H-pirazol-4-M]-3-sulfamoMfeml}acetamida
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-W-[(dimetilamino)metilen]bencensulfonamida (47,0 mg, 0,137 mmol) y ácido (2-cloro-5-fluorofenil)acético (38,7 mg, 0,205 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (13 mg, 0,0283 mmol, 21 % de rendimiento al cabo de 2 pasos, 99 % de pureza).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (lENpos): m/z = 459 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,90 (s, 2H), 7,20 (td, 1H), 7,37 (dd, 1H), 7,41 (s, 2H), 7,46 - 7,53 (m, 2H), 7,83 (dd, 1H), 7,84 (t, 1H), 8,01 (s, 1H), 8,35 (d, 1H), 8,42 (d, 1H), 10,66 (s, 1H).
Ejemplo 229
2-(2,3-Didorofeml)-W-{4-[1-(difluorometM)-1H-pirazol-4-M]-3-sulfamoNfeml}acetamida
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metilen]bencensulfonamida (47,0 mg, 0,137 mmol) y ácido (2,3-diclorofenil)acético (42,1 mg, 0,205 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (14 mg, 0,0295 mmol, 22 % de rendimiento al cabo de 2 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 1,02 min; EM (lENpos): m/z = 475 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 3,97 (s, 2H), 7,33 -7,45 (m, 4H), 7,48 (d, 1H), 7,58 (dd, 1H), 7,83 (dd, 1H), 7,84 (t, 1H), 8,01 (s, 1H), 8,35 (d, 1H), 8,42 (d, 1H), 10,67 (s, 1H).
Ejemplo 230
2-(3-Cloropmdm-4-M)-W-{4-[1-(difluorometM)-1H-pirazol-4-M]-3-sulfamoNfeml}acetamida
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metilen]bencensulfonamida (47,0 mg, 0,137 mmol) y ácido (3-cloropiridin-4-il)acético (35,2 mg, 0,205 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (11 mg, 0,0249 mmol, 18 % de rendimiento al cabo de 2 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,72 min; EM (lENpos): m/z = 442 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 3,96 (s, 2H), 7,42 (s, 2H), 7,47 - 7,53 (m, 2H), 7,83 (dd, 1H), 7,84 (t, 1H), 8,01 (s, 1H), 8,34 (d, 1H), 8,43 (d, 1H), 8,50 (d, 1H), 8,62 (s, 1H), 10,73 (s, 1H).
Ejemplo 231
2-(2-ClorofenM)-W-[4-(3-cidobutiMH-1,2,4-tnazoM -il)-3-sulfamoilfenil]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (350 mg, 0,904 mmol), 3-ciclobutil-1H-1,2,4-triazol (167 mg, 1,36 mmol) y ácido (2-clorofenil)acético (231 mg, 1,36 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) y después otra vez mediante HPLC preparativa (YMC Triart 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (8,8 mg, 0,0197 mmol, 2 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min; EM (lENpos): m/z = 446 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 1,85 - 1,97 (m, 1H), 1,98 - 2,08 (m, 1H), 2,22 - 2,32 (m, 4H), 3,63 (quin, 1H),
3,91 (s, 2H), 7,29 - 7,36 (m, 2H), 7,38 - 7,50 (m, 4H), 7,59 (d, 1H), 7,96 (dd, 1H), 8,39 (d, 1H), 8,70 (s, 1H), 10,82 (s, 1H).
Ejemplo 232
W-[4-(4-AcetiMH-pirazoM -il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (350 mg, 0,904 mmol), 1-(1H-pirazol-4-il)etanona (149 mg, 1,36 mmol) y ácido (2-clorofenil)acético (231 mg, 1,36 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) y después otra vez mediante HPLC preparativa (YMC Triart 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (5,4 mg, 0,0125 mmol, 1 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,94 min; EM (lENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,44 (s, 3H), 3,91 (s, 2H), 7,29 - 7,37 (m, 2H), 7,38 - 7,49 (m, 4H), 7,60 (d, 1H), 7,99 (dd, 1H), 8,17 (d, 1H), 8,39 (d, 1H), 8,75 (d, 1H), 10,82 (s, 1H).
Ejemplo 233
2-(2-Clorofeml)-W-[4-(3-isopropiMH-1,2,4-tnazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (350 mg, 0,904 mmol), 3-isopropil-1H-1,2,4-triazol (51 mg, 1,36 mmol) y ácido (2-clorofenil)acético (231 mg, 1,36 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) y después otra vez mediante HPLC preparativa (YMC Triart 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (16 mg, 0,0369 mmol, 4 % de rendimiento al cabo de 4 pasos, 96 % de pureza).
CL-EM (Procedimiento A): Tr = 1,00 min, EM (lENpos): m/z = 434 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,28 (d, 6H), 3,05 (sept., 1H), 3,91 (s, 2H), 7,29 - 7,37 (m, 2H), 7,40 - 7,52 (m, 4H), 7,60 (d, 1H), 7,97 (dd, 1H), 8,39 (d, 1H), 8,69 (s, 1H), 10,82 (s, 1H).
Ejemplo 234
W-[4-(4-Cloro-1H-pirazoM-M)-3-sulfamoNfeml]-2-[2-(trifluorometM)feml]acetamida
De acuerdo con los procedimientos generales GP3.3 y GP4.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida (500 mg, 1,18 mmol) y ácido [2-(trifluorometil)fenil]acético (362 mg, 1,77 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HpLC preparativa (Waters XBridge C185 |j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (70 mg, 0,153 mmol, 13 % de rendimiento al cabo de 2 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 459 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,99 (s, 2H), 7,40 (s, 2H), 7,48 - 7,58 (m, 3H), 7,67 (t, 1H), 7,73 (d, 1H), 7,86 (s, 1H), 7,94 (dd, 1H), 8,32 - 8,38 (m, 2H), 10,78 (s, 1H).
Ejemplo 235
1-(4-{[(2-clorofeml)acetM]ammo}-2-sulfamoMfeml)-1H-pirazol-4-carboxMato de etilo
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (1,00 g, 0,645 mmol), 1H-pirazol-4-carboxilato de etilo (544 mg, 3,88 mmol) y ácido (2-clorofenil)acético (661 mg, 3,88 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (YMC Triart 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (22 mg, 0,0475 mmol, 7 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (lENpos): m/z = 463 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,29 (t, 3H), 3,91 (s, 2H), 4,26 (q, 2H), 7,30 - 7,36 (m, 2H), 7,40 - 7,49 (m, 4H), 7,59 (d, 1H), 7,96 (dd, 1H), 8,12 (d, 1H), 8,38 (d, 1H), 8,62 (d, 1H), 10,82 (s, 1H).
Ejemplo 236
1-(4-{[(2-fluorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-carboxilato de etilo
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (1,00 g, 0,645 mmol), 1H-pirazol-4-carboxilato de etilo (544 mg, 3,88 mmol) y ácido (2-fluorofenil)acético (596 mg, 3,88 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (YMC Triart 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (28 mg, 0,0627 mmol, 10 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 0,92 min; EM (lENpos): m/z = 447 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 1,29 (t, 3H), 3,81 (s, 2H), 4,26 (q, 2H), 7,16 - 7,22 (m, 2H), 7,30 - 7,37 (m, 1H), 7,41 (m, 3H), 7,58 (d, 1H), 7,96 (dd, 1H), 8,12 (d, 1H), 8,37 (d, 1H), 8,62 (d, 1H), 10,79 (s, 1H).
Ejemplo 237
2-(2-Fluorofeml)-W-{4-[4-(2-hidroxipropan-2-M)-1H-pirazoM-M]-3-sulfamoMfeml}acetamida
Una solución de bromuro de metilmagnesio en tolueno/tetrahidrofurano 1,4 M (4,8 ml, 6,72 mmol) se añadió lentamente en una atmósfera de nitrógeno a 0 °C a una solución de 1-(4-{[(2-fluorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-carboxilato de etilo (250mg, 0,600 mmol) en tetrahidrofurano (10 ml). La agitación a 0°C se continuó durante 2 horas, después se agitó a temperatura ambiente durante la noche. Se detuvo con solución acuosa saturada de cloruro de amonio y se extrajo dos veces con acetato de etilo. Las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre sulfato de sodio y se concentró al vacío.
La purificación mediante HPLC preparativa (Waters XBridge C18 5 |j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) dio el compuesto del título (25 mg, 0,0578 mmol, 10 %, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 0,79 min; EM (lENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,45 (s, 6H), 3,79 (s, 2H), 4,98 (s, 1H), 7,15 - 7,23 (m, 2H), 7,30 - 7,37 (m, 1H), 7,41 (td, 1H), 7,50 (d, 1H), 7,48 (s, 2H), 7,71 (d, 1H), 7,94 (d, 1H), 7,97 (dd, 1H), 8,33 (d, 1H), 10,73 (s, 1H).
Ejemplo 238
2-(2-Clorofeml)-W-{4-[4-(2-hidroxipropan-2-N)-1H-pirazoM-M]-3-sulfamoNfeml}acetamida
Una solución de bromuro de metilmagnesio en tolueno/tetrahidrofurano 1,4 M (2,8 ml, 3,89 mmol) se añadió lentamente en una atmósfera de nitrógeno a 0 °C a una solución de 1-(4-{[(2-clorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-carboxilato de etilo (150 mg, 0,324 mmol) en tetrahidrofurano (10 ml). La agitación a 0 °C se continuó durante 2 horas, después se agitó a temperatura ambiente durante la noche. Se detuvo con solución acuosa saturada de cloruro de amonio y se extrajo dos veces con acetato de etilo. Las fases orgánicas se combinaron, se lavaron con salmuera, se secaron sobre sulfato de sodio y se concentró al vacío.
La purificación mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) dio el compuesto del título (30 mg, 0,0668 mmol, 21 %, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,85 min; EM (lENpos): m/z = 449 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,45 (s, 6H), 3,89 (s, 2H), 4,98 (s, 1H), 7,29 - 7,36 (m, 2H), 7,41 - 7,54 (m, 5H), 7,72 (d, 1H), 7,94 (d, 1H), 7,98 (dd, 1H), 8,34 (d, 1H), 10,75 (s, 1H).
Ejemplo 239
2-(2-Cloropmdm-3-M)-W-{3-sulfamoN-4-[3-(tN fluorometM)-1H-1,2,4-tn azoM-N]feml}acetamida
De acuerdo con el procedimiento general GP5.1, se convirtió 5-amino-W-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1 H-1,2,4-triazol-1-il]bencensulfonamida (0,20 mmol) y ácido (2-cloropiridin-3-il)acético (0,40 mmol) en el compuesto del título (4,0 mg, 0,00868 mmol, 4 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,63 min; EM (lENpos): m/z = 461 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,97 (s, 2H), 7,45 (dd, 1H), 7,63 - 7,70 (m, 3H), 7,91 (dd, 1H), 7,95 (dd, 1H), 8,35 (dd, 1H), 8,44 (d, 1H), 9,04 - 9,06 (m, 1H), 10,95 (s, 1H).
Ejemplo 240
2-(2-Clorofeml)-W-metN-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-N]feml}acetamida
Se disolvió 2-(2-clorofenil)-A/-(3-{[(dimetilamino)metilen]sulfamoil}-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil)acetamida (200 mg, 0,39 mmol) en tetrahidrofurano (5 ml) y se trató en porciones con hidruro de sodio (14,4 mg, 0,39 mmol, 65 % de pureza). Después de agitar a temperatura ambiente durante 10 min, se añadió solución de yodometano en metilferc-butiléter 2 M y se continuó la agitación durante la noche. La mezcla de reacción se extrajo con agua y acetato de etilo y la fase orgánica se lavó con solución de cloruro de amonio y salmuera, después se secó sobre sulfato de sodio. La concentración al vacío dio 2-(2-clorofenil)-W-(3-{[(dimetilamino)metilen]sulfamoil}-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil)-A/-metilacetamida que se disolvió nuevamente en metanol (1 ml). Se añadió amoníaco acuoso (1 ml, 33 %) y se continuó la agitación durante la noche. Se añadió un segundo lote de amoníaco acuoso (1 ml, 33 %) y se continuó la agitación durante el fin de semana. La mezcla de reacción se concentró al vacío y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) para dar el compuesto del título (28 mg, 0,0592 mmol, 15 % de rendimiento, 99 % de pureza).
CL-EM (Procedimiento B): Tr = 1,00 min; EM (lENpos): m/z = 473 [M+H]+
RMN 1H (400MHz, DMsO-d6) 8 [ppm]: NMe superpuesto con señal de agua, 3,55 - 3,90 (m, 2H), 7,25 - 7,31 (m, 2H), 7,31 -7,36 (m, 1H), 7,39 -7,44 (m, 1H), 7,55 -7,64 (m, 2H), 7,71 -7,78 (m, 1H), 7,80 -7,84 (m, 1H), 8,06 (d, 1H), 8,21 (s, 1H), 8,77 (s, 1H).
Ejemplo 241 y Ejemplo 242
Se disolvieron tris(dibencilidenacetona)dipaladio(0) (81,7 mg, 0,079 mmol) y di-ferc-butil(2',4',6'-triisopropil-3,4,5,6-tetrametil-[1,1'-bifenil]-2-il)fosfina (42,9 mg, 0,089 mmol) en tolueno (1,2 ml), se evacuó y se llenó nuevamente tres veces con argón y después se calentó a reflujo (dando un color marrón). En un recipiente separado se disolvieron 2-bromo-A/-[(dimetilamino)metilen]-5-nitrobencensulfonamida (600 mg, 1,79 mmol) y 4-(trifluorometil)-2H-1,2,3-triazol (294 mg, 2,15 mmol) en tolueno (1,2 ml), se evacuó y se llenó nuevamente tres veces con argón y se añadió después a la solución caliente de catalizador. Se añadió fosfato de potasio (758 mg, 3,58 mmol) y se agitó durante la noche a reflujo. La mezcla de reacción se diluyó con acetato de etilo y se lavó dos veces con solución de salmuera, después se secó sobre sulfato de sodio. La concentración al vacío dio una mezcla en bruto de dos regioisómeros que se usó en el paso siguiente sin purificación adicional.
El intermedio del paso previo se disolvió nuevamente en metanol (9 ml), se añadió paladio sobre carbón (90 mg, 10 % de carga) y se agitó durante 5 h en una atmósfera de hidrógeno. El catalizador se retiró mediante filtración y después se concentró al vacío. El intermedio en bruto se disolvió nuevamente en DMF (10 ml). Se añadieron ácido (2-clorofenil)acético (383 mg, 2,25 mmol), HATU (855 mg, 2,25 mmol) y A/,W-diisopropiletilamina (775 mg, 5,99 mmol) y se agitó durante la noche. La mezcla de reacción se concentró al vacío, y se extrajo con diclorometano y agua. La fase orgánica se lavó con salmuera y se secó sobre sulfato de sodio, después se filtró y se concentró al vacío. El intermedio del paso previo se disolvió nuevamente en metanol (5 ml) y se añadió amoníaco acuoso (2,5 ml, 33 %),
después se agitó durante la noche. Se añadió un segundo lote de amoníaco acuoso (2 ml, 33 %) y se agitó nuevamente durante la noche. Se concentró al vacío y se purificó mediante HPLC preparativa (Chromatorex C-18 10 |jm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar los dos regioisómeros 2-(2-clorofenil)-A/-{3-sulfamoil-4-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]fenil}acetamida ( l7 mg, 0,0370 mmol, 2% de rendimiento, 85% de pureza) y 2-(2-clorofenil)-W-{3-sulfamoil-4-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]fenil}acetamida (11 mg, 0,0239 mmol, 1 % de rendimiento, 90 % de pureza), que se separaron bajo esas condiciones de HPLC.
Ejemplo 241
2-(2-Clorofeml)-W-{3-sulfamoM-4-[4-(tN fluorometM)-2H-1,2,3-tnazol-2-M]feml}acetamida
CL-EM (Procedimiento A): Tr = 1,18 min; EM (lENpos): m/z = 460 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,93 (s, 2H), 7,30 - 7,48 (m, 6H), 7,75 (d, 1H), 8,00 (dd, 1H), 8,46 (d, 1H), 8,69 (s, 1H), 10,91 (s, 1H).
Ejemplo 242
2-(2-Clorofeml)-W-{3-sulfamoM-4-[4-(tN fluorometM)-1H-1,2,3-tnazoM-M]feml}acetamida
CL-EM (Procedimiento A): Tr = 1,12 min; EM (lENpos): m/z = 460 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,30 - 7,36 (m, 2H), 7,43 - 7,48 (m, 2H), 7,65 (s, 2H), 7,67 (d, 1H), 7,98 (dd, 1H), 8,46 (d, 1H), 9,16 (d, 1H), 10,92 (s, 1H).
Ejemplo 243
-(2-Cloro-5-cianofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-M]feml}acetamida
Se disolvió 2-(2-clorofenil)-A/-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida (50 mg, 0,11 mmol) en ácido trifluoroacético (0,25 ml) y se trató en porciones con W-yodosuccinimida (111 mg, 0,28 mmol). La mezcla de reacción se agitó a temperatura ambiente durante 5 min, después a 65 °C durante 3,5 horas. Se añadió acetato de etilo (100 ml) y se lavó con solución acuosa de tiosulfato de sodio 10 %, después se neutralizó (hasta pH8) con solución acuosa de bicarbonato de sodio y se realizó otro paso de lavado con agua. Después la fase orgánica se secó sobre sulfato de sodio y se concentró al vacío.
Se disolvió nuevamente en DMSO (0,5 ml) en un tubo para presión, se añadieron cianuro de cobre(l) (14,6 mg,
0,16 mmol) y WW-dimetiletilenediamina (14,4 mg, 0,16 mmol) y el tubo para presión sellado se calentó a 140 °C durante dos horas. La mezcla de reacción se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)), y después otra vez mediante HPLC preparativa (Chiralpak IA 5 p 250x30 mm, etanol/hexano 0,1 Vol-% de dietilamina) y una tercera vez mediante HPLC preparativa (Chiralpak IE 5 p 250x30 mm, etanol/hexano 0,1 Vol-% de dietilamina) para dar el compuesto del título (5 mg, 0,0103 mmol, 9 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (lENpos): m/z = 484 [M+H]+
RMN 1H (400MHz, cloroformo-d) 8 [ppm]: 3,84 (s, 2H), 7,31 (d, 1H), 7,46 - 7,49 (m, 2H), 7,61 - 7,64 (m, 1H), 7,85 (s, 1H), 7,96 - 7,98 (m, 1H), 8,01 (d, 1H), 8,14 (dd, 1H).
Ejemplo 244
2-(2-ClorofenM)-W-{3-ciano-5-sulfamoN-4-[4-(tnfluorometM)-1H-pirazoM-M]fenM}acetamida
Se añadieron 2-(2-clorofen¡l)-A/-(3-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l)acetam¡da (51,4 mg, 0,10 mmol), W-ciano-4-metil-W-fenilbencensulfonamida, (54,5 mg, 0,20 mmol), hexafluoroantimoniato de tns^cetonitri^pentametilciclopentadienilrodioON) (8,3 mg, 0,01 mmol) y carbonato de plata (11,0 mg, 0,04 mmol) en un tubo para presión, se purgó con argón, después se añadió dioxano (0,5 ml). El tubo se selló y la mezcla de reacción se agitó a 130 °C durante la noche. Se añadió agua y se extrajo dos veces con diclorometano. Las fases orgánicas se combinaron, se concentró al vacío y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1% de amoníaco acuoso (32%) para dar 2-(2-clorofeml)-W-(3-ciano-5-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l)acetam¡da.
Este intermedio se redisolvió en metanol (2 ml) y se añadió amoníaco acuoso (1 ml, 25 %), después se agitó a 50 °C durante la noche, se concentró al vacío y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (6,3 mg, 0,0130 mmol, 13 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 0,81 min; EM (lENpos): m/z = 484 [M+H]+
RMN 1H (400MHz, cloroformo-d) 8 [ppm]: 3,92 (s, 2H), 5,81 (s, 2H), 7,31 - 7,36 (m, 2H), 7,38 - 7,42 (m, 1H), 7,45 -7,50 (m, 1H), 8,00 (s, 1H), 8,02 (s, 1H), 8,09 (s, 1H), 8,12 (d, 1H), 8,66 (d, 1H).
Ejemplo 245
2-(5-Bromo-2-clorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-pirazol-1-N]feml}acetamida
Se disolvió 2-(2-clorofen¡l)-A/-{3-sulfamo¡l-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l}acetam¡da (100 mg, 0,22 mmol) en ácido trifluoroacético, se añadió W-bromosuccinimida (48,4 mg, 0,27 mmol) y se agitó a 60 °C durante la noche. Se añadió otra porción de W-bromosuccinimida (19,4 mg, 0,11 mmol) y se agitó nuevamente a 60 °C durante la noche. Se añadió agua (1 ml) y solución saturada de bicarbonato de sodio (1 ml) y se extrajo con acetato de etilo tres veces. Las fases orgánicas combinadas se lavaron con salmuera, se secaron y se concentró al vacío. La purificación mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) y después otra vez mediante HPLC preparativa (Chiralpak ID 5p 250x30 mm, etanol/hexano 0,1 % de ácido trifluoroacético) y otro paso de lavado con HCl 1 M dio 2-(5-bromo-2-clorofen¡l)-W-{3-sulfamo¡l-4-[4-(tr¡fluoromet¡l)-1H-pirazol-1-ilfeni^acetamida (8,3 mg, 0,0154 mmol, 7 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 1,19 min; EM (lENpos): m/z = 537/539 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,93 (s, 2H), 7,35 - 7,47 (m, 3H), 7,53 (dd, 1H), 7,60 (d, 1H), 7,71 (d, 1H), 7,95
(dd, 1H), 8,17 (s, 1H), 8,38 (d, 1H), 8,74 (s, 1H), 10,86 (s, 1H).
Ejemplo 246
W-[4-(3-Cloro-1H-1,2,4-tnazoM-N)-3-sulfamoNfeml]-2-(2-fluorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.5, GP3.3 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (161 mg, 1,03 mmol), 3-cloro-1H-1,2,4-triazol (201 mg, 1,56 mmol) y ácido (2-fluorofenil)acético (273 mg, 1,77 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32%)) y una tercera vez mediante HPLC preparativa (YMC Triart C18 5p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (13 mg, 0,0317 mmol, 3 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,66 min; EM (lENpos): m/z = 410 [M+H]+
RMN 1H (600MHz, DMSO-d6) 8 [ppm]: 3,82 (s, 2H), 7,15 - 7,23 (m, 2H), 7,30 - 7,44 (m, 2H), 7,54 - 7,66 (m, 3H), 7,94 (dd, 1H), 8,41 (d, 1H), 8,81 (s, 1H), 10,85 (s, 1H).
Ejemplo 247
2-(2-ClorofenM)-W-[3-ciano-4-(4-flúoMH-pirazoM -il)-5-sulfamoilfenil]acetamida
Se añadieron 2-(2-clorofenil)-N-[3-{[(dimetilamino)metilen]sulfamoil}-4-(4-flúor-1H-pirazol-1-il)fenil]acetamida (51,4 mg, 0,11 mmol), N-ciano-4-metil-N-fenilbencensulfonamida, (58,7 mg, 0,22 mmol), hexafluoroantimoniato de tris(acetonitril)pentametilciclopentadienilrodio(NI) (8,3 mg, 0,01 mmol) y carbonato de plata (11,9 mg, 0,04 mmol) en un tubo para presión, se purgó con argón, después se añadió dioxano (0,5 ml). El tubo se selló y la mezcla de reacción se agitó a 130 °C durante la noche. Se añadió agua y se extrajo dos veces con diclorometano. Las fases orgánicas se combinaron, se concentró al vacío y se purificó mediante HPLC preparativa para dar 2-(2-clorofenil)-N-[3-ciano-5-{[(dimetilamino)metilen]sulfamoil}-4-(4-flúor-1H-pirazol-1-il)fenil]acetamida.
Este intermedio se redisolvió en metanol (2 ml) y se añadió amoníaco acuoso (2 ml), después se agitó a 50 °C durante la noche. Se añadió agua y se extrajo tres veces con diclorometano. Las fases orgánicas combinadas se lavaron con salmuera, se secaron y se concentró al vacío. La purificación mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) dio el compuesto del título (4,9 mg, 0,0113 mmol, 10 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (lENpos): m/z = 434 [M+H]+
RMN 1H (400MHz, metanol-d4) 8 [ppm]: 3,94 (s, 2H), 7,27 - 7,33 (m, 2H), 7,38 - 7,44 (m, 2H), 7,78 (dd, 1H), 8,05 (dd, 1H), 8,41 (d, 1H), 8,56 (d, 1H).
Ejemplo 248
2-(2-Clorofeml)-W-[4-(4-metiMH-pirazoM-M)-3-sulfamoNfeml]acetamida
Se disolvió 2-(2-clorofen¡l)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamoil]-4-(4-met¡l-1H-p¡razol-1-¡l)fen¡l}acetam¡da (170 mg, 306 |jmol) en diclorometano (8 ml) y se trató con ácido trifluoroacético (142 jl, 1,84 mmol), después se ag¡tó a temperatura ambiente durante tres horas. Se añadió más ácido trifluoroacético (71 jl, 0,92 mmol) y se continuó la agitación durante la noche a temperatura ambiente. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (26 mg, 21 % de rendimiento, 99 % de pureza).
CL-EM (Procedimiento B): Tr = 1,02 min; EM (lENpos): m/z = 405 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,10 (s, 3H), 3,90 (s, 2H), 7,33 (m, 2H), 7,45 (m, 2H), 7,48 (s, 2H), 7,49 (d, 1H), 7,60 (s, 1H), 7,87 (s, 1H), 7,96 (dd, 1H), 8,34 (d, 1H), 10,75 (s, 1H).
Ejemplo 249
2-(2-Clorofeml)-W-[4-(3-metoxMH-1,2,4-tnazoM-il)-3-sulfamoMfeml]acetamida
Se disolvió 2-(2-clorofen¡l)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(3-metox¡-1H-1,2,4-triazol-1-¡l)fen¡l}acetam¡da (17 mg, 18 jmol, 60 % de pureza) en diclorometano (0,8 ml) y se trató con ácido trifluoroacético (13,7 jl, 178 jmol), después se agitó a temperatura ambiente durante seis horas. Se añadió más ácido trifluoroacético (13,7 jl, 178 jmol) y se continuó la agitación durante la noche a temperatura ambiente. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (4,3 mg, 47 % de rendimiento, 82 % de pureza).
CL-EM (Procedimiento B): Tr = 0,73 min; EM (lENpos): m/z = 422 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,26 (s, 3H), 3,90 (s, 2H), 7,25 (s, 2H), 7,32 (m, 2H), 7,45 (m, 2H), 7,49 (d, 1H), 7,95 (dd, 1H), 8,19 (s, 1H), 8,34 (d, 1H), 10,77 (s, 1H).
Ejemplo 250
2-(2-Clorofeml)-N-[4-(4-ciclopropiMH-imidazoM-M)-3-sulfamoilfeml]acetamida
Se disolvió 2-(2-clorofen¡l)-W-{4-(4-c¡cloprop¡l-1H-¡m¡dazol-1-¡l)-3-[(2,4-d¡metoxibenc¡l)sulfamo¡l]fen¡l}acetam¡da (35,0 mg, 60,2 jm ol) en diclorometano (1,6 ml) y se trató con ácido trifluoroacético (231 jl, 3,0 mmol), después se agitó a temperatura ambiente durante 48 horas. Se añadió más ácido trifluoroacético (13,7 jl, 178 jm ol) y se continuó la agitación durante la noche a temperatura ambiente. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (13,4 mg, 51 % de rendimiento, 99 % de pureza).
CL-EM (Procedimiento D): Tr = 0,84 min; EM (lENpos): m/z = 431 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 0,68 (m, 2H), 0,78 (m, 2H), 1,82 (m, 1H), 3,90 (s, 2H), 7,06 (d, 1H), 7,32 (m, 2H), 7,37 (d, 1H), 7,45 (m, 2H), 7,47 (d, 1H), 7,50 (s, 2H), 7,86 (dd, 1H), 8,38 (d, 1H), 10,75 (s, 1H).
Ejemplo 251
2-(2-Clorofeml)-W-[4-(4-met¡l-1H-¡m¡dazol-1-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvió 2-(2-clorofen¡l)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(4-met¡l-1H-¡m¡dazol-1-¡l)fen¡l}acetam¡da (69,5 mg, 125 |jmol) en d¡clorometano (4,0 ml) y se trató con ác¡do tr¡fluoroacét¡co (480 jl, 6,3 mmol), después se ag¡tó a temperatura amb¡ente durante la noche. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (12 mg, 22 % de rend¡m¡ento, 95 % de pureza).
CL-EM (Proced¡m¡ento B): Tr = 0,74 m¡n; EM (lENpos): m/z = 405 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,14 (s, 3H), 3,90 (s, 2H), 7,01 (d, 1H), 7,32 (m, 2H), 7,36 (d, 1H), 7,45 (m, 2H), 7,47 (s, 2H), 7,60 (d, 1H), 7,86 (dd, 1H), 8,37 (d, 1H), 10,76 (s, 1H).
Ejemplo 252
2-(2-Clorofeml)-W-[4-(3-c¡clopropil-1H-p¡razol-1-M)-3-sulfamoMfeml]acetam¡da
Se d¡solv¡ó 2-(2-clorofen¡l)-W-{4-(3-c¡cloprop¡l-1H-p¡razol-1-¡l)-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l}acetam¡da (306 mg, 527 jm ol) en d¡clorometano (6,8 ml) y se trató con ác¡do tr¡fluoroacét¡co (410 jl, 5,3 mmol), después se ag¡tó a temperatura amb¡ente durante la noche. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (12 mg, 5 % de rend¡m¡ento, 90 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 1,13 m¡n; EM (lENpos): m/z = 431 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 0,69 (m, 2H), 0,93 (m, 2H), 1,98 (m, 1H), 3,89 (s, 2H), 6,23 (d, 1H), 7,32 (m, 2H), 7,45 (m, 2H), 7,49 (d, 1H), 7,54 (s, 2H), 7,96 (dd, 1H), 7,94 (d, 1H), 8,33 (d, 1H), 10,74 (s, 1H).
Ejemplo 253
2-(2-Clorofeml)-W-[4-(2H-pirazolo[3,4-6]pmdm-2-M)-3-sulfamoMfeml]acetamida
Se d¡solv¡ó 2-(2-clorofen¡l)-A/-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(2H-p¡razolo[3,4-£)]p¡r¡d¡n-2-¡l)fen¡l}acetam¡da (751 mg, 863 jmol, 68 % de pureza) en d¡clorometano (11 ml) y se trató con ác¡do tr¡fluoroacét¡co (2,0 ml, 26 mmol), después se ag¡tó a temperatura amb¡ente durante 48 horas. Se añad¡ó más ác¡do tr¡fluoroacét¡co (2,66 ml, 34,5 mmol) y la ag¡tac¡ón se cont¡nuó durante 1 hora a temperatura amb¡ente. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (41 mg, 11 % de rend¡m¡ento, 98 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 0,99 m¡n; EM (lENpos): m/z = 442 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm] 3,93 (s, 2H), 7,31 (s, 2H), 7,34 (m, 1H), 7,35 (m, 2H), 7,47 (m, 2H), 7,67 (d, 1H), 8,02 (dd, 1H), 8,38 (dd, 1H), 8,45 (s, 1H), 8,45 (d, 1H), 8,56 (dd, 1H), 10,83 (s, 1H).
Ejemplo 254
2-(2-Clorofeml)-N-[4-(2H-pirazolo[3,4-c]pmdm-2-il)-3-sulfamoilfeml]acetamida
Se disolvió 2-(2-clorofen¡l)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(2H-p¡razolo[3,4-c]p¡r¡d¡n-2-¡l)fen¡l}acetam¡da (1,09 g, 1,84 mmol) en d¡clorometano (24 ml) y se trató con ác¡do tr¡fluoroacét¡co (1,4 ml, 18 mmol), después se ag¡tó a temperatura amb¡ente durante la noche. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (210 mg, 26 % de rend¡m¡ento, 99 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 0,78 m¡n; EM (lENpos): m/z = 442 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm] 3,94 (s, 2H), 7,33 (s, 2H), 7,34 (m, 2H), 7,47 (m, 2H), 7,71 (d, 1H), 7,87 (d, 1H), 8,04 (dd, 1H), 8,34 (d, 1H), 8,49 (d, 1H), 8,50 (s, 1H), 8,80 (s, 1H), 10,88 (s, 1H).
Ejemplo 255
2-(2-Clorofeml)-W-[4-(2H-pirazolo[4,3-6]piridm-2-M)-3-sulfamoilfeml]acetamida
Se d¡solv¡ó 2-(2-clorofen¡l)-A/-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(2H-p¡razolo[4,3-£)]p¡r¡d¡n-2-¡l)fen¡l}acetam¡da (405 mg, 171 pmol, 25 % de pureza) en d¡clorometano (2,2 ml) y se trató con ác¡do tr¡fluoroacét¡co (790 pl, 10 mmol), después se ag¡tó a temperatura amb¡ente durante la noche. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (20 mg, 25 % de rend¡m¡ento, 95 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 0,97 m¡n; EM (lENpos): m/z = 442 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm] 3,93 (s, 2H), 7,32 (s, 2H), 7,34 (m, 2H), 7,44 (dd, 1H), 7,46 (m, 2H), 7,63 (d, 1H), 7,82 (ddd, 1H), 8,03 (dd, 1H), 8,46 (d, 1H), 8,58 (d, 1H), 8,63 (dd, 1H), 10,86 (s, 1H).
Ejemplo 256
2-(2-Clorofenil)-W-{4-[4-(2-metoxietil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida
Se d¡solv¡ó 2-(2-clorofen¡l)-W-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-[4-(2-metox¡et¡l)-1H-p¡razol-1-¡l]fen¡l}acetam¡da (551 mg, 570 pmol, 62 % de pureza) en d¡clorometano (7,3 ml) y se trató con ác¡do tr¡fluoroacét¡co (2,2 ml, 28 mmol), después se ag¡tó a temperatura amb¡ente durante la noche. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (203 mg, 74 % de rend¡m¡ento, 94 % de pureza).
CL-EM (Procedimiento A): Tr = 1,02 min; EM (lENpos): m/z = 449 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,72 (t, 2H), 3,28 (s, 3H), 3,52 (t, 2H), 3,89 (s, 2H), 7,33 (m, 2H), 7,45 (m, 2H), 7,47 (s, 2H), 7,50 (d, 1H), 7,65 (s, 1H), 7,92 (s, 1H), 7,97 (dd, 1H), 8,34 (d, 1H), 10,75 (s, 1H).
Ejemplo 257
-(2-Clorofeml)-W-[4-(3-flúor-1H-pirazoM-il)-3-sulfamoilfeml]acetamida
Se disolvió 2-(2-clorofenil)-W-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(3-flúor-1H-pirazol-1-il)fenil}acetamida (840 mg, 601 |jmol, 40 % de pureza) en diclorometano (7,7 ml) y se trató con ácido trifluoroacético (2,3 ml, 30 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (36 mg, 14 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 0,93 min; EM (lENpos): m/z = 409 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,90 (s, 2H), 6,26 (dd, 1H), 7,33 (m, 2H), 7,39 (s, 2H), 7,45 (m, 2H), 7,53 (d, 1H), 7,95 (dd, 1H), 7,98 (dd, 1H), 8,36 (d, 1H), 10,79 (s, 1H).
Ejemplo 258
-(2-Clorofeml)-N-(4-{4-[(2,2-difluoroetil)ammo]-1H-pirazoM-il}-3-sulfamoilfeml)acetamida
Se disolvió 2-(2-clorofenil)-W-(4-{4-[(2,2-difluoroetil)amino]-1H-pirazol-1-il}-3-[(2,4-dimetoxibencil)sulfamoil]fenil)acetamida (190 mg, 184 jmol, 60 % de pureza) en diclorometano (2,4 ml) y se trató con ácido trifluoroacético (710 jl, 9,2 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (13 mg, 14 % de rendimiento, 90 % de pureza). CL-EM (Procedimiento A): Tr = 0,97 min; EM (lENpos): m/z = 470 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,34 (m, 2H), 3,89 (s, 2H), 5,18 (t, 1H), 6,12 (tt, 1H), 7,32 (m, 2H), 7,41 (d, 1H), 7,45 (m, 2H), 7,48 (s, 2H), 7,49 (d, 1H), 7,56 (d, 1H), 7,95 (dd, 1H), 8,32 (d, 1H), 10,71 (s, 1H).
Ejemplo 259
-(2-Clorofeml)-W-{4-[4-(2,2-difluoroetil)-1H-pirazoM-il]-3-sulfamoilfeml}acetamida
Se disolvió 2-(2-clorofenil)-A/-{4-[4-(2,2-difluoroetil)-1H-pirazol-1-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida (336 mg, 222 jmol, 40 % de pureza) en diclorometano (4,3 ml) y se trató con ácido trifluoroacético ( 860 jl, 11 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante
HPLC para dar el compuesto del título (66 mg, 62 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 455 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,12 (td, 2H), 6,22 (tt, 1H), 7,33 (m, 2H), 7,45 (m, 2H), 7,45 (s, 2H), 7,50 (d, 1H), 7,70 (s, 1H), 7,97 (dd, 1H), 8,02 (s, 1H), 8,35 (d, 1H), 10,77 (s, 1H).
Ejemplo 260
2-(2-Clorofeml)-W-[4-(4-{[(2,2-d¡fluoroetil)ammo]metM}-1H-p¡razol-1-M)-3-sulfamoMfeml]acetam¡da
Se disolvió {[1-(4-{[(2-clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]metil}(2,2-difluoroetil)carbamato de ferc-butilo (75,0 mg, 102 pmol) en diclorometano (3,0 pl) y se trató con ácido trifluoroacético (390 pl, 5,1 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (9 mg, 16 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 0,79 min; EM (IENpos): m/z = 484 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,87 (td, 2H), 3,68 (s, 2H), 3,90 (s, 2H), 6,01 (tt, 1H), 7,33 (m, 2H), 7,45 (m, 2H), 7,46 (s, 2H), 7,51 (d, 1H), 7,71 (s, 1H), 7,97 (s, 1H), 7,97 (dd, 1H), 8,34 (d, 1H), 10,76 (s, 1H).
Ejemplo 261
2-(2-Clorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)-1,2,4-oxad¡azol-3-¡l]feml}acetam¡da
Se disolvió 2-(2-clorofenil)-A/-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[5-(trifluorometil)-1,2,4-oxadiazol-3-il]fenil}acetamida (112 mg, 156 pmol, 85 % de pureza) en diclorometano (3,0 ml) y se trató con ácido trifluoroacético (600 pl, 7,8 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (8 mg, 10 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENpos): m/z = 461 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,93 (s, 2H), 7,33 (m, 2H), 7,44 (m, 2H), 7,46 (m, 2H), 7,75 (d, 1H), 8,00 (dd, 1H), 8,45 (d, 1H), 10,90 (s, 1H).
Ejemplo 262
2-(2-Fluorofeml)-W-[4-(4-met¡l-1H-p¡razoM-¡l)-3-sulfamo¡lfeml]acetam¡da
Se disolvió W-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-metil-1H-pirazol-1-il)fenil}-2-(2-fluorofenil)acetamida (599 mg, 65% de pureza, 1,003 mmol) en diclorometano (29 ml) y se trató con ácido trifluoroacético (514 pl, 6,67 mmol),
después se agitó a temperatura ambiente durante la noche. Se añadió más ácido trifluoroacético (257 jl, 334 |jmol) y la agitación se continuó durante 2 horas a temperatura ambiente. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (85 mg, 96 % de pureza).
CL-EM (Procedimiento D): Tr = 1,02 min; EM (lENpos): m/z = 389 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,09 (s, 3H), 3,79 (s, 2H), 7,18 (m, 1H), 7,19 (m, 1H), 7,33 (m, 1H), 7,41 (ddd, 1H), 7,48 (s, 2H), 7,49 (d, 1H), 7,60 (s, 1H), 7,87 (s, 1H), 7,96 (dd, 1H), 8,33 (d, 1H), 10,73 (s, 1H).
Ejemplo 263
W-[4-(4-C¡cloprop¡l-1H-¡m¡dazol-1-M)-3-sulfamo¡lfeml]-2-(2-fluorofeml)acetam¡da
Se disolvió W-{4-(4-ciclopropil-1H-imidazol-1-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-fluorofenil)acetamida (50,0 mg, 44,3 jmol, 50 % de pureza) en diclorometano (280 j l) y se trató con ácido trifluoroacético (170 jl, 2,2 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (2,3 mg, 11 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento B): Tr = 0,74 min; EM (lENpos): m/z = 415 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 0,68 (m, 2H), 0,78 (m, 2H), 1,82 (m, 1H), 3,79 (s, 2H), 7,06 (d, 1H), 7,18 (m, 1H), 7,19 (m, 1H), 7,33 (m, 1H), 7,39 (m, 1H), 7,37 (d, 1H), 7,50 (s, 2H), 7,57 (d, 1H), 7,85 (dd, 1H), 8,37 (d, 1H), 10,73 (s, 1H).
Ejemplo 264
W-[4-(3-C¡cloprop¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]-2-(2-fluorofeml)acetam¡da
Se disolvió A/-{4-(3-ciclopropil-1H-pirazol-1-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-fluorofenil)acetamida (507 mg, 494 jmol, 55 % de pureza) en diclorometano (3,2 ml) y se trató con ácido trifluoroacético (230 jl, 3,0 mmol), después se agitó a temperatura ambiente durante la noche. Se añadió más ácido trifluoroacético (799 jl, 10,4 mmol) y la agitación se continuó durante 4 horas a temperatura ambiente. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (115 mg, 53 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (lENpos): m/z = 415 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 0,69 (m, 2H), 0,93 (m, 2H), 1,98 (m, 1H), 3,79 (s, 2H), 6,24 (d, 1H), 7,18 (m, 1H), 7,19 (m, 1H), 7,33 (m, 1H), 7,40 (m, 1H), 7,49 (d, 1H), 7,53 (s, 2H), 7,95 (dd, 1H), 7,94 (d, 1H), 8,23 (d, 1H), 10,72 (s, 1H).
Ejemplo 265
2-(2-Fluorofen¡l)-W-{4-[4-(2-metox¡et¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfen¡l}acetam¡da
Se disolvió A/-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-[4-(2-metox¡et¡l)-1H-p¡razol-1-¡l]fen¡l}-2-(2-fluorofen¡l)acetam¡da (500 mg, 566 pmol, 66 % de pureza) en d¡clorometano (7,3 ml) y se trató con ác¡do tr¡fluoroacét¡co (2,2 ml, 28 mmol), después se ag¡tó a temperatura amb¡ente durante la noche. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (197 mg, 72 % de rend¡m¡ento, 90 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 1,06 m¡n; EM (lENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,72 (t, 2H), 3,28 (s, 3H), 3,52 (t, 2H), 3,79 (s, 2H), 7,18 (m, 1H), 7,19 (m, 1H), 7,33 (m, 1H), 7,40 (ddd, 1H), 7,47 (s, 2H), 7,50 (d, 1H), 7,65 (s, 1H), 7,92 (s, 1H), 7,96 (dd, 1H), 8,34 (d, 1H), 10,73 (s, 1H).
Ejemplo 266
2-(2-Clorofeml)-W-(2-sulfamo¡lb¡feml-4-¡l)acetam¡da
Se d¡solv¡eron 2-cloro-W-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (300 mg, 776 pmol) y ác¡do fen¡lborón¡co (113 mg, 931 pmol) en DMF (10 ml), después se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (127 mg, 155 pmol) y carbonato de potas¡o acuoso (1,2 ml, 1,0 M, 1,2 mmol). La reacc¡ón se calentó durante 1 h a 120 °C en el m¡croondas. Después, se añad¡ó acetato de et¡lo y se lavó con agua. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage, hexano/ acetato de et¡lo 1/1) para dar W-(2,4-d¡metox¡benc¡l)-4-n¡trob¡fen¡l-2-sulfonam¡da 260 mg (99 % de pureza, 78 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento A): Tr = 1,33 m¡n; EM (lENneg): m/z = 427 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,62 (s, 3H), 3,68 (s, 3H), 3,91 (s, 2H), 6,28 -6,37 (m, 2H), 6,96 (d, 1H), 7,33 - 7,41 (m, 2H), 7,41 - 7,47 (m, 3H), 7,54 (d, 1H), 7,96 (s, 1H), 8,33 (dd, 1H), 8,50 (d, 1H).
Se d¡solv¡ó W-(2,4-d¡metox¡benc¡l)-4-n¡trob¡fen¡l-2-sulfonam¡da (260 mg, 607 pmol) en THF (15 ml) y se añad¡ó palad¡o sobre carbón (10 % de carga, 6,46 mg, 60,7 pmol). El rec¡p¡ente se evacuó y se purgó con h¡drógeno (0,1 MPa) y se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente hasta completarse la reacc¡ón. La mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente. Se d¡solv¡ó 4-am¡no-A/-(2,4-d¡metox¡benc¡l)b¡fen¡l-2-sulfonam¡da (90,0 mg, 226 pmol) en DMF (4,0 ml) y se añad¡ó ác¡do (2-clorofen¡l)acét¡co (46,2 mg, 271 pmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (190 pl, 1,1 mmol) y HATU (129 mg, 339 pmol). La mezcla de reacc¡ón se calentó a 50 °C durante 16 h. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-(2-clorofen¡l)-W-(2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]b¡fen¡l-4-¡l}acetam¡da (490 mg, 889 pmol) en d¡clorometano (2 ml) y se trató con ác¡do trífl¡co (2,0 ml, 26 mmol). La reacc¡ón se ag¡tó a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se evaporó y el mater¡al en bruto se d¡solv¡ó en acetato de et¡lo y se añad¡ó una soluc¡ón acuosa de NaOH/NaCl (30 g / 5 g en 90 g agua). Las fases se separaron y la fase acuosa se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante cromatografía HPLC (Waters XBr¡gde C18 5p 100x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (43 mg, 97% de pureza, 12% de rend¡m¡ento al cabo de 3 pasos).
CL-EM (Proced¡m¡ento A): Tr = 1,13 m¡n; EM (lENpos): m/z = 401 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,89 (s, 2H), 7,04 (s, 2H), 7,24 (d, 1H), 7,30 - 7,35 (m, 2H), 7,35 - 7,40 (m, 5H), 7,42 - 7,48 (m, 2H), 7,82 (dd, 1H), 8,34 (d, 1H), 10,60 (s, 1H).
Ejemplo 267
2-(2-Clorofeml)-W-{4-[1-(c¡cloprop¡lmetM)-1H-p¡razol-4-¡l]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron A/-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (200 mg, 436 jmol), 1-(cidopropilmetil)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (216 mg, 872 jmol), d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (15,3 mg, 21,8 jmol), fluoruro de potas¡o (50,7 mg, 872 jm ol) y tr¡fen¡lfosf¡na (5,72 mg, 21,8 jm ol) en n-propanol (3,6 ml). Después se añad¡eron fluoruro de potas¡o (50,7 mg, 872 |jmol) y carbonato de potas¡o acuoso (540 jl, 2,0 M, 1,1 mmol) y la soluc¡ón se purgó con argón durante 5 m¡nutos. La mezcla de reacc¡ón se calentó durante 3 ha 80 °C. El mater¡al en bruto se f¡ltró sobre cel¡te y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-(2-clorofen¡l)-W-(4-[1-(c¡cloprop¡lmet¡l)-1H-p¡razol-4-¡l]-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)acetam¡da (240 mg, 480 jm ol) en metanol (4,9 ml) y se añad¡ó soluc¡ón acuosa de h¡dróx¡do de sod¡o al 32 % (210 jl, 7,2 mmol). La reacc¡ón se calentó a 80 °C hasta completarse la reacc¡ón y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se repart¡ó entre d¡clorometano y agua, las fases orgán¡cas se comb¡naron y se secó sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C185 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto f¡nal (9,20 mg, 95 % de pureza, 4 % de rend¡m¡ento al cabo de 2 pasos)
CL-EM (Proced¡m¡ento B): Tr = 1,00 m¡n; EM (lENpos): m/z = 445 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,30 -0,43 (m, 2H), 0,50 -0,59 (m, 2H), 1,21 -1,34 (m, 1H), 3,88 (s, 2H), 3,99 (d, 2H), 7,16 (s, 2H), 7,29 - 7,39 (m, 2H), 7,41 - 7,50 (m, 3H), 7,70 (d, 1H), 7,78 - 7,86 (m, 1H), 8,01 - 8,09 (m, 1H), 8,28 -8,35 (m, 1H), 10,57 (s, 1H).
Ejemplo 268
2-(2-Clorofeml)-W-{4-[1-(2-metox¡et¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡lfeml}acetam¡da
Se d¡solv¡ó 5-am¡no-2-[1-(2-metox¡et¡l)-1H-p¡razol-4-¡l]bencensulfonam¡da (190 mg, 641 jm ol) en DMF (4,5 ml) y se añad¡ó HATU (390 mg, 1,03 mmol), W,W-d¡¡soprop¡let¡lam¡na (560 j l , 3,2 mmol) y ác¡do (2-clorofen¡l)acét¡co (131 mg, 769 jmol). La mezcla de reacc¡ón se ag¡tó durante 18 h a 50 °C. Después se añad¡eron agua y d¡clorometano, las fases se separaron y las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman. Los d¡solventes se ret¡raron a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C18 5 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) (70,0 mg, 95 % de pureza, 23 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 0,92 m¡n; EM (lENpos): m/z = 449 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,24 (s, 3H), 3,70 (t, 2H), 3,87 (s, 2H), 4,28 (t, 2H), 7,08 (s, 2H), 7,27 - 7,37 (m, 2H), 7,40 - 7,50 (m, 3H), 7,70 (m, 1H), 7,81 (dd, 1H), 8,00 (m, 1H), 8,32 (d, 1H), 10,56 (s, 1H).
Ejemplo 269
2-(2-Clorofeml)-W-{4-[1-(p¡per¡dm-4-¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡lfeml}acetam¡da
Se disolvió 4-[4-(4-am¡no-2-sulfamo¡lfen¡l)-1H-p¡razol-1-¡l]p¡per¡d¡n-1-carbox¡lato de ferc-but¡lo (190 mg, 451 |jmol) en DMF (3,2 ml) y se añad¡ó ác¡do (2-clorofen¡l)acét¡co (92,3 mg, 541 jmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (390 jl, 2,3 mmol) y HATU (274 mg, 721 jmol). La reacdón se ag¡tó a 50 °C durante 18 h. Se añad¡eron agua y d¡clorometano. Las fases se separaron y la fase acuosa se lavó con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal.
Se d¡solv¡ó 4-[4-(4-{[(2-clorofen¡l)acet¡l]am¡no}-2-sulfamo¡lfen¡l)-1H-p¡razol-1-¡l]p¡per¡d¡n-1-carbox¡lato de ferc-but¡lo (260 mg, 453 jm ol) en d¡clorometano (2,7 ml), se añad¡ó ác¡do tr¡fluoroacét¡co (1,7 ml, 23 mmol) y se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se dest¡ló conjuntamente dos veces con tolueno. El compuesto del título puro se obtuvo después de la pur¡f¡cac¡ón por HPLC (pr¡mero: Waters XBr¡gde C18 5 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %); después Waters XBr¡gde C18 5 j 100x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) (2,6 mg, 96 % de pureza, 2 % de rend¡m¡ento al cabo de 3 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,87 m¡n; EM (lENneg): m/z = 472 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,87 - 2,03 (m, 2H), 2,04 - 2,13 (m, 2H), 2,73 - 2,86 (m, 2H), 3,15 - 3,23 (m, 2H), 3,88 (s, 2H), 4,25 -4,38 (m, 1H), 7,21 (s, 2H), 7,25 -7,38 (m, 2H), 7,41 -7,50 (m, 3H), 7,74 (s, 1H), 7,82 (dd, 1H), 8,07 (s, 1H), 8,29 - 8,36 (m, 2H), 10,61 (s, 1H).
Ejemplo 270
2-(2-Fluorofeml)-W-{4-[1-(piperidm-4-M)-1H-pirazol-4-M]-3-sulfamoNfeml} acetamida
Se d¡solv¡ó 4-[4-(4-am¡no-2-sulfamo¡lfen¡l)-1H-p¡razol-1-¡l]p¡per¡d¡n-1-carbox¡lato de ferc-but¡lo (190 mg, 451 jm ol) en DMF (3,7 ml) y se añad¡ó ác¡do (2-fluorofen¡l)acét¡co (83,4 mg, 541 jmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (390 jl, 2,3 mmol) y HATU (274 mg, 721 jmol). La reacc¡ón se ag¡tó a 50 °C durante 18 h. Después se añad¡eron agua y d¡clorometano. Las fases se separaron y la fase acuosa se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal.
Se d¡solv¡ó 4-[4-(4-{[(2-fluorofen¡l)acet¡l]am¡no}-2-sulfamo¡lfen¡l)-1H-p¡razol-1-¡l]p¡per¡d¡n-1-carbox¡lato de ferc-but¡lo (250 mg, 448 jm ol) en d¡clorometano (2,6 ml), se añad¡ó ác¡do tr¡fluoroacét¡co (1,7 ml, 22 mmol) y se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se dest¡ló conjuntamente con tolueno dos veces. El compuesto del título puro se obtuvo después de someterse a HPLC (Waters XBr¡gde C185 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) (13,6 mg, 90 % de pureza, 12 % de rend¡m¡ento al cabo de 3 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,81 m¡n; EM (lENneg): m/z = 456 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,74 - 1,96 (m, 2H), 1,96 - 2,09 (m, 2H), 2,63 - 2,75 (m, 2H), 3,06 - 3,17 (m, 2H), 3,77 (s, 2H), 4,17 -4,32 (m, 1H), 7,13 -7,23 (m, 4H), 7,26 -7,48 (m, 3H), 7,72 (s, 1H), 7,81 (dd, 1H), 8,05 (s, 1H), 8,31 (d, 1H), 10,55 (s, 1H), 10,51 -10,61 (m, 1H).
Ejemplo 271
W-{4-[1-(Azetidm-3-M)-1H-pirazol-4-M]-3-sulfamoMfeml}-2-(2-clorofeml)acetamida
Se disolvieron 2-cloro-N-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (170 mg, 583 |jmol) y 3-[4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol-1-¡l]azet¡d¡n-1-carbox¡lato de ferc-but¡lo (305 mg, 874 jm ol) en npropanol (7,8 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (20,5 mg, 29,1 jmol), tr¡fen¡lfosf¡na (7,64 mg, 29,1 jm ol) y carbonato de potas¡o acuoso (730 jl, 2,0 M, 1,5 mmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y la reacc¡ón se calentó a 80 °C durante 16 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se dest¡ló conjuntamente con THF y se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 3-[4-(4-n¡tro-2-sulfamo¡lfen¡l)-1H-p¡razol-1-¡l]azet¡d¡n-1-carbox¡lato de ferc-but¡lo (250 mg, 590 jm ol) en THF (59 ml)/metanol (50 ml) y el rec¡p¡ente se purgó con n¡trógeno. Se añad¡ó palad¡o sobre carbón (10 % de carga, 64,1 mg, 602 jm ol) y el rec¡p¡ente se evacuó y después se purgó con h¡drógeno (0,1 MPa). Se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente durante 4 h. La mezcla de reacc¡ón se f¡ltró sobre Cel¡te y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 3-[4-(4-am¡no-2-sulfamo¡lfen¡l)-1H-p¡razol-1-¡l]azet¡d¡n-1-carbox¡lato de ferc-but¡lo (230 mg, 585 jm ol) en DMF (4,1 ml) y se añad¡ó ác¡do (2-clorofen¡l)acét¡co (120 mg, 701 jmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (510 jl, 2,9 mmol) y HATU (356 mg, 935 jmol). La reacc¡ón se ag¡tó a 50 °C durante 18 h. Después se añad¡eron agua y d¡clorometano. Las fases se separaron y la fase acuosa se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal.
Se d¡solv¡ó 3-[4-(4-{[(2-clorofen¡l)acet¡l]am¡no}-2-sulfamo¡lfen¡l)-1H-p¡razol-1-¡l]azet¡d¡n-1-carbox¡lato de ferc-but¡lo (150 mg, 275 jm ol) en d¡clorometano (1,6 ml), se añad¡ó ác¡do tr¡fluoroacét¡co (1,1 ml, 14 mmol) y se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente hasta completarse la reacc¡ón. Se añad¡ó d¡clorometano y agua. Las fases se separaron y la fase acuosa se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se dest¡ló conjuntamente con tolueno y el producto puro se obtuvo después de la pur¡f¡cac¡ón med¡ante HPLC (Waters XBr¡gde C18 5 j 100x30 mm, metanol/agua 0,2 % de amoníaco acuoso (32 %), después Waters XBr¡gde C185 j 100x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) (4,90 mg, 90 % de pureza, 4 % de rend¡m¡ento al cabo de 3 pasos).
CL-EM (Proced¡m¡ento I): T r= 1,05 m¡n; EM (lENneg): m/z = 444 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,87 (s, 2H), 3,94 -4,04 (m, 2H), 4,07 -4,18 (m, 2H), 5,23 -5,35 (m, 1H), 7,09 - 7,28 (m, 2H), 7,29 - 7,35 (m, 2H), 7,41 - 7,48 (m, 3H), 7,76 - 7,88 (m, 2H), 8,12 (s, 1H), 8,28 - 8,38 (m, 2H), 10,61 (s, 1H).
Ejemplo 272
2-(3-Clorofeml)-W-(2-sulfamo¡lb¡feml-4-¡l)acetam¡da
Se d¡solv¡ó 4-am¡no-N-(2,4-d¡metox¡benc¡l)b¡fen¡l-2-sulfonam¡da (75,0 mg, 188 jm ol) en DMF (1,5 ml) y se añad¡ó ác¡do (3-clorofen¡l)acét¡co (38,5 mg, 226 jmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (160 jl, 940 jm ol) y HATU (107 mg, 282 jmol). La reacc¡ón se ag¡tó a 60 °C durante 2 h. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal.
Se d¡solv¡ó 2-(3-clorofen¡l)-N-{2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]b¡fen¡l-4-¡l}acetam¡da (340 mg, 617 jm ol) en d¡clorometano (1,9 ml),y se añad¡ó ác¡do tr¡fluoroacét¡co (1,9 ml, 24 mmol) y se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se d¡solv¡ó en acetato de et¡lo y se lavó con una soluc¡ón acuosa de h¡dróx¡do de sod¡o/ cloruro de sod¡o (30 g / 5 g en 90 g agua). Las fases se separaron y la fase acuosa se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC
(Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (41,7 mg, 98 % de pureza, 17 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (IENneg): m/z = 399 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,73 (s, 2H), 7,07 (s, 2H), 7,24 (d, 1H), 7,29 - 7,40 (m, 8H), 7,43 (s, 1H), 7,80 - 7,86 (m, 1H), 8,31 (d, 1H), 10,57 (s, 1H).
Ejemplo 273
2-(2-Clorofeml)-W-[4-(3-met¡l-1H-p¡razol-1-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron 2-cloro-A/-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-metil-1H-pirazol (159 mg, 1,94 mmol) y carbonato de potasio (536 mg, 3,88 mmol) en acetonitrilo (15 ml) y la reacción se agitó a 100 °C durante la noche. El disolvente se retiró a presión reducida y se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvió W-(2,4-dimetoxibencil)-2-(3-metil-1H-pirazol-1-il)-5-nitrobencensulfonamida (500 mg, 1,16 mmol) en acetato de etilo/etanol (1/1, 40 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 123 mg, 116 pmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 18 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió 5-amino-A/-(2,4-dimetoxibencil)-2-(3-metil-1H-pirazol-1-il)bencensulfonamida (410 mg, 1,02 mmol) en DMF (30 ml) y se añadió ácido (2-clorofenil)acético (209 mg, 1,22 mmol), después se añadieron W,A/-diisopropiletilamina (890 pl, 5,1 mmol) y HATU (799 mg, 2,04 mmol). La reacción se agitó a 50 °C durante 3 h. El disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano/ acetato de etilo) para dar 80 mg (14 % de rendimiento al cabo de 3 pasos).
Se disolvió 2-(2-clorofenil)-W-(3-[(2,4-dimetoxibencil)sulfamoil]-4-(3-metil-1H-pirazol-1-il)fenil}acetamida (80,0 mg, 144 pmol) en diclorometano (2,0 ml), se añadió ácido trifluoroacético (1,5 ml, 19 mmol) y se continuó la agitación a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el compuesto del título puro se obtuvo después de la purificación mediante HPLC (Waters XBrigde C18 5p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (9,00 mg, 95 % de pureza, 15 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,98 min; EM (IENneg): m/z = 403 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,27 (s, 3H), 3,90 (s, 2H), 6,31 (d, 1H), 7,27 - 7,37 (m, 2H), 7,43 - 7,50 (m, 2H), 7,52 (s, 2H), 7,86 - 8,08 (m, 2H), 8,35 (d, 1H), 10,75 (s, 1H).
Ejemplo 274
2-(2-Clorofeml)-W-[4-(6-clorop¡r¡dm-3-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron 2-bromo-A/-[(dimetilamino)metiliden]-5-nitrobencensulfonamida (632 mg, 1,88 mmol) y 2-cloro-5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)piridina (450 mg, 1,88 mmol) en n-propanol (35 ml) y se añadió dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (66,1 mg, 93,9 pmol) y trifenilfosfina (24,6 mg, 93,9 pmol). La solución se purgó con argón durante 5 minutos y se añadió carbonato de potasio acuoso (5,6 ml, 1,0 M, 5,6 mmol). La reacción
se calentó a 100 °C durante 3 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvió 2-(6-clorop¡r¡d¡n-3-¡l)-A/-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (660 mg, 1,79 mmol) en THF (50 ml) y el recipiente se purgó con nitrógeno. Se añadió platino sobre carbón (5 % de carga, 698 mg, 179 jm ol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 2 h. Se añadió platino sobre carbón (698 mg, 179 jm ol) nuevamente y la agitación se continuó durante 2 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió 5-amino-2-(6-cloropiridin-3-il)-W-[(dimetilamino)metiliden]bencensulfonamida (630 mg, 1,86 mmol) en DMF (25 ml) y se añadió ácido (2-clorofenil)acético (381 mg, 2,23 mmol), después se añadieron W,A/-diisopropiletilamina (1,6 ml, 9,3 mmol) y HATU (1,41 g, 3,72 mmol). La reacción se agitó a 50 °C durante 16 h. Se añadió agua y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, gradiente de etanol en diclorometano 2 %) para dar 100 mg (11 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 1,15 min; EM (lENneg): m/z = 489 [M-H]-Se disolvió 2-(2-clorofenil)-W-[4-(6-cloropiridin-3-il)-3-{[(dimetilamino)metiliden]-sulfamoil}fenil]acetamida (100 mg, 204 |jmol) en metanol (30 ml) y se trató con solución acuosa de amoníaco al 25 % (30 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-1810 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (4,90 mg, 95 % de pureza, 5 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,01 min; EM (lENneg): m/z = 434 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,90 (s, 2H), 7,26 - 7,36 (m, 3H), 7,39 (s, 2H), 7,43 - 7,50 (m, 2H), 7,53 (d, 1H), 7,84 (ddd, 2H), 8,36 (dd, 2H), 10,70 (s, 1H).
Ejemplo 275
2-(2-Clorofeml)-W-[4-(3,5-d¡met¡M,2-oxazol-4-¡l)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron 2-bromo-W-[(dimetilamino)metiliden]-5-nitrobencensulfonamida (400 mg, 1,19 mmol) y ácido (3,5-dimetil-1,2-oxazol-4-il)borónico (335 mg, 2,38 mmol) en n-propanol (110 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (41,9 mg, 59,5 jmol), trifenilfosfina (21,6 mg, 59,5 jm ol) y carbonato de potasio acuoso (1,8 ml, 2,0 M, 3,6 mmol). La reacción se agitó a 120 °C durante 1 h en el microondas. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con metanol y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(3,5-dimetil-1,2-oxazol-4-il)-5-nitrobencensulfonamida (450 mg, 1,51 mmol) en metanol (69 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 164 mg, 1,54 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 4 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente.
Se disolvió 5-amino-2-(3,5-dimetil-1,2-oxazol-4-il)bencensulfonamida (200 mg, 748 jmol) en DMF (5,3 ml) y se añadió ácido (2-clorofenil)acético (153 mg, 898 jmol), después se añadieron W,A/-diisopropiletilamina (620 jl, 3,7 mmol) y HATU (455 mg, 1,20 mmol). La reacción se agitó a 50 °C durante 4 h, después se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El producto puro se obtuvo después de la purificación por HPLC (Waters XBrigde C18 5 j 100x30 mm, metanol/agua 0,2% de amoníaco acuoso (32%)) (28,4 mg, 95 % de pureza, 9 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento J): Tr = 0,99 min; EM (lENneg): m/z = 418 [M-H]-RMN 1H (500MHz, DMSO-d6): 8 [ppm]= 1,94 (s, 3H), 2,12 (s, 3H), 3,89 (s, 2H), 7,22 (d, 1H), 7,29 - 7,38 (m, 4H), 7,42 - 7,48 (m, 2H), 7,85 (dd, 1H), 8,34 (d, 1H), 10,67 (s, 1H).
Ejemplo 276
2-(2-Clorofeml)-W-(4-{1-[(3-met¡loxetan-3-¡l)metM]-1H-p¡razol-4-M}-3-sulfamo¡lfeml)acetam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (225 mg, 490 |jmol) y 1-[(3-met¡loxetan-3-¡l)met¡l]-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (273 mg, 981 jm ol) en n-propanol (9,0 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (17,3 mg, 24,5 jmol), tr¡fen¡lfosf¡na (6,43 mg, 24,5 jm ol) y fluoruro de potas¡o (6,55 mg, 113 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (610 jl, 2,0 M, 1,2 mmol). La reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-(2-clorofen¡l)-A/-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-{1-[(3-met¡loxetan-3-¡l)met¡l]-1H-p¡razol-4-¡l}fen¡l)acetam¡da (270 mg, 509 jm ol) en metanol (5,2 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (300 j l ) a 50 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (20,8 mg, 95 % de pureza, 8 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento A): Tr = 0,99 m¡n; EM (lENneg): m/z = 473 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,17 (s, 3H), 3,88 (s, 2H), 4,25 (d, 2H), 4,36 (s, 2H), 4,61 (d, 2H), 7,13 (s, 2H), 7,26 - 7,39 (m, 2H), 7,39 - 7,50 (m, 3H), 7,69 - 7,71 (m, 1H), 7,82 (dd, 1H), 8,03 (s, 1H), 8,33 (d, 1H), 10,58 (s, 1H).
Ejemplo 277
-(2-Cloro-4-fluorofeml)-W-{4-[1-(2-metoxietM)-1H-pirazol-4-M]-3-sulfamoNfeml}acetamida
Se d¡solv¡eron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-cloro-4-fluorofen¡l)acetam¡da (250 mg, 524 jm ol) y 1-(2-metox¡et¡l)-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (264 mg, 1,05 mmol) en n-propanol (9,6 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (18,5 mg, 26,2 jm ol) y tr¡fen¡lfosf¡na (6,88 mg, 26,2 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (660 jl, 2,0 M, 1,3 mmol). La reacc¡ón se calentó a 120 °C durante 1 h (0,5 MPa/25 W). Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C185 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (37,8 mg, 95 % de pureza, 15 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 0,93 m¡n; EM (lENneg): m/z = 465 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,25 (s, 3H), 3,71 (t, 2H), 3,87 (s, 2H), 4,28 (t, 2H), 7,09 (s, 2H), 7,23 (td, 1H), 7,43 - 7,52 (m, 3H), 7,71 (s, 1H), 7,81 (dd, 1H), 8,01 (s, 1H), 8,32 (d, 1H), 10,57 (s, 1H).
Ejemplo 278
2-(2-Cloro-4-fluorofeml)-W-[4-(1-ciclopropN-1H-pirazol-4-N)-3-sulfamoNfeml]acetamida
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-cloro-4-fluorofen¡l)acetam¡da (250 mg, 524 |jmol) y 1-c¡cloprop¡l-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (246 mg, 1,05 mmol) en n-propanol (9,6 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (18,5 mg, 26,2 jm ol) y tr¡fen¡lfosf¡na (6,88 mg, 26,2 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (660 jl, 2,0 M, 1,3 mmol). La reacc¡ón se calentó a 120 °C durante 1 h en el m¡croondas (0,2 MPa / 25W). Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se d¡solv¡ó en metanol (5 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (0,2 ml) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C18 5 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (38,2 mg, 95 % de pureza, 15 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,98 m¡n; EM (lENneg): m/z = 447 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,94 -1,01 (m, 2H), 1,05 -1,11 (m, 2H), 3,74 (tt, 1H), 3,87 (s, 2H), 7,17 -7,25 (m, 3H), 7,41 - 7,52 (m, 3H), 7,67 (s, 1H), 7,80 (dd, 1H), 8,04 (s, 1H), 8,31 (d, 1H), 10,57 (s, 1H).
Ejemplo 279
2-(2-Clorofeml)-W-(3-sulfamo¡l-4-{1-[2-(trifluorometox¡)etN]-1H-p¡razol-4-N}feml)acetam¡da
Se d¡solv¡eron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (250 mg, 545 jm ol) y 4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1-[2-(tr¡fluorometox¡)et¡l]-1H-p¡razol (334 mg, 1,09 mmol) en n-propanol (10 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (19,2 mg, 27,2 jm ol) y tr¡fen¡lfosf¡na (7,15 mg, 27,2 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (680 jl, 2,0 M, 1,4 mmol). La reacc¡ón se calentó a 80 °C durante 18 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente. Se d¡solv¡ó 2-(2-clorofen¡l)-A/-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-{1-[2-(tr¡fluorometox¡)et¡l]-1H-p¡razol-4-¡l}fen¡l)acetam¡da (250 mg, 448 jm ol) en metanol (4,6 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (0,2 ml) a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C185 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (1,60 mg, 95 % de pureza, 1 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 1,06 m¡n; EM (lENneg): m/z = 501 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,88 (s, 2H), 4,48 (s, 4H), 7,14 (s, 2H), 7,28 - 7,37 (m, 2H), 7,41 - 7,49 (m, 3H), 7,76 (s, 1H), 7,82 (dd, 1H), 8,07 (s, 1H), 8,33 (d, 1H), 10,59 (s, 1H).
Ejemplo 280
2-(2-Clorofeml)-W-[4-(1-c¡clobut¡l-1H-p¡razol-4-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (225 mg, 490 |jmol) y ácido (1-c¡clobut¡l-1H-p¡razol-4-¡l)borón¡co (163 mg, 981 jm ol) en n-propanol (9,0 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (17,3 mg, 24,5 jmol), tr¡fen¡lfosf¡na (6,43 mg, 24,5 jm ol) y fluoruro de potas¡o (6,55 mg, 113 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (610 jl, 2,0 M, 1,2 mmol). La reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-(2-clorofen¡l)-W-[4-(1-c¡clobut¡l-1H-p¡razol-4-¡l)-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l]acetam¡da (250 mg, 500 jm ol) en metanol (5,1 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (0,2 ml) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (71,8 mg, 95 % de pureza, 31 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento A): Tr = 1,10 m¡n; EM (lENneg): m/z = 443 [M-H]-.
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,74 - 1,84 (m, 2H), 2,35 -2,44 (m, 2H), 3,88 (s, 2H), 4,85 (qu¡n, 1H), 7,22 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,48 (m, 3H), 7,74 (s, 1H), 7,81 (dd, 1H), 8,05 (s, 1H), 8,32 (d, 1H), 10,58 (s, 1H).
Ejemplo 281
2-(2-Clorofeml)-W-(4-{1-[2-(p¡rrol¡dm-1-N)etM]-1H-p¡razol-4-M}-3-sulfamoNfeml)acetam¡da
Se d¡solv¡eron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (90,0 mg, 196 jm ol) y 1- [2-(p¡rrol¡d¡n-1-¡l)et¡l]-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (114 mg, 392 jm ol) en n-propanol (3,6 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(M) (CAS 13965-03-2) (6,90 mg, 9,81 jmol), tr¡fen¡lfosf¡na (2,57 mg, 9,81 jm ol) y fluoruro de potas¡o (2,62 mg, 45,1 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (250 jl, 2,0 M, 490 jmol). La reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-(2-clorofen¡l)-A/-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-{1-[2-(p¡rrol¡d¡n-1-¡l)et¡l]-1H-p¡razol-4-¡l}fen¡l)acetam¡da (110 mg, 203 jmol) en metanol (2,1 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (80 j l ) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (4,00 mg, 95 % de pureza, 4 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento A): Tr = 0,81 m¡n; EM (lENneg): m/z = 486 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,69 (s, 4H), 2,79 (t, 2H), 3,88 (s, 2H), 4,25 (t, 2H), 6,94 (s, 2H), 7,28 - 7,37 (m, 2H), 7,41 - 7,50 (m, 3H), 7,66 (s, 1H), 7,84 (dd, 1H), 8,05 (s, 1H), 8,32 (d, 1H), 10,58 (s, 1H).
Ejemplo 282
2- (2-Clorofeml)-W-[4-(5-c¡anop¡r¡dm-3-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (250 mg, 545 |jmol) y 5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)piridin-3-carbonitrilo (125 mg, 545 jm ol) en n-propanol (10 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (19,2 mg, 27,2 jm ol) y tr¡fen¡lfosf¡na (7,15 mg, 27,2 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (1,6 ml, 1,0 M, 1,6 mmol). La reacc¡ón se calentó a 100 °C durante 1 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡ó acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal.
Se d¡solv¡ó 2-(2-clorofen¡l)-W-[4-(5-c¡anop¡r¡d¡n-3-¡l)-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l]acetam¡da (270 mg, 560 jm ol) en metanol (25 ml) y se trató con soluc¡ón acuosa de amoníaco al 25 % (25 ml) a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante dos corr¡das de HPLC (pr¡mero Waters XBr¡gde C18 5 j 100x30 mm, aceton¡tr¡lo/agua 0,2% de amoníaco acuoso (32%), después Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el producto f¡nal (10,4 mg, 98 % de pureza, 4 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,90 m¡n; EM (lENneg): m/z = 425 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,91 (s, 2H), 7,30 - 7,39 (m, 3H), 7,41 - 7,53 (m, 4H), 7,89 (dd, 1H), 8,27 (t, 1H), 8,39 (d, 1H), 8,79 (d, 1H), 9,02 (d, 1H), 10,74 (s, 1H).
Ejemplo 283
2-(2-Clorofeml)-W-(4-{1-[oxetan-2-NmetM]-1H-pirazol-4-M}-3-sulfamoMfeml)acetamida
Se d¡solv¡eron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (250 mg, 545 jm ol) y 1-[oxetan-2-¡lmet¡l]-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (288 mg, 1,09 mmol) en n-propanol (10 ml) y se añad¡ó d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (19,2 mg, 27,2 jmol), tr¡fen¡lfosf¡na (7,15 mg, 27,2 jm ol) y fluoruro de potas¡o (7,28 mg, 125 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (680 jl, 2,0 M, 1,4 mmol). La reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C18 5 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el producto f¡nal (16,7 mg, 95 % de pureza, 6 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,88 m¡n; EM (lENneg): m/z = 459 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,34 - 2,46 (m, 1H), 2,60 - 2,70 (m, 1H), 3,88 (s, 2H), 4,29 - 4,51 (m, 4H), 4,98 - 5,05 (m, 1H), 7,14 (s, 2H), 7,28 - 7,38 (m, 2H), 7,41 - 7,50 (m, 3H), 7,73 (d, 1H), 7,82 (dd, 1H), 8,05 (s, 1H), 8,33 (d, 1H), 10,58 (s, 1H).
Ejemplo 284
2-(2-Clorofeml)-N-{3-sulfamoil-4-[2-(2,2,2-trífluoroetoxi)pirímidm-5-il]feml}acetamida
Se disolvieron N-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (210 mg, 458 |jmol) y 5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-2-(2,2,2-trifluoroetoxi)pirimidina (251 mg, 824 jm ol) en n-propanol (6,2 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (16,1 mg, 22,9 jmol), tr¡fen¡lfosf¡na (6,00 mg, 22,9 jmol), fluoruro de potas¡o (53,2 mg, 915 jmol) y carbonato de potas¡o acuoso (690 jl, 2,0 M, 1,4 mmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y la reacc¡ón se calentó a 80 °C durante 1 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡eron 2-(2-clorofen¡l)-N-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[2-(2,2,2-tr¡fluoroetox¡)p¡r¡m¡d¡n-5-¡l]fen¡l)acetam¡da (250 mg, 450 jmol) en metanol (4,6 ml) y se trató con soluc¡ón acuosa de amoníaco al 25 % (4,6 ml) a temperatura amb¡ente durante 18 h. Después se añad¡ó h¡dróx¡do de sod¡o acuoso al 32 % (50 j l ) y se cont¡nuó la ag¡tac¡ón hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (dos veces, Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (2,50 mg, 95 % de pureza, 1 % de rend¡m¡ento al cabo de 2 pasos).
CL-e M (Proced¡m¡ento B): Tr = 1,05 m¡n; EM (lENneg): m/z = 499 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,91 (s, 2H), 5,09 (q, 2H), 7,30 - 7,48 (m, 7H), 7,89 (dd, 1H), 8,39 (d, 1H), 8,61 (s, 2H), 10,71 (s, 1H).
Ejemplo 285
2-(2-Clorofeml)-N-[4-(2-metoxipirímidm-5-M)-3-sulfamoilfeml]acetamida
El compuesto del título se a¡sló como subproducto en la desprotecc¡ón de 2-(2-clorofen¡l)-N-{3-sulfamo¡l-4-[2-(2,2,2-tr¡fluoroetox¡)p¡r¡m¡d¡n-5-¡l]fen¡l}acetam¡da (56,8 mg, 95 % de pureza, 28 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 0,85 m¡n; EM (lENneg): m/z = 431 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,90 (s, 2H), 3,97 (s, 3H), 7,28 - 7,41 (m, 5H), 7,41 - 7,51 (m, 2H), 7,87 (dd, 1H), 8,38 (d, 1H), 8,53 (s, 2H), 10,70 (s, 1H).
Ejemplo 286
2-(2-Clorofeml)-W-(4-{1-[2-(propan-2-Noxi)etM]-1H-pirazol-4-M}-3-sulfamoilfeml)acetamida
Se disolvieron clorhidrato de W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (1:1) (200 mg, 404 jmol), 1-[2-(propan-2-iloxi)etil]-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (226 mg, 808 |jmol) y fluoruro de potasio (51,6 mg, 888 jm ol) en DMF seca y desgasificada (8,0 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (10,3 mg, 20,2 jmol). La reacción se calentó durante 18 h a 100 °C. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente. Se disolvió 2-(2-clorofenil)-A/-(3-{[(dimetilamino)metiliden]sulfamoil}-4-{1-[2-(propan-2-iloxi)etil]-1H-pirazol-4-il}fenil)acetamida (230 mg, 432 jm ol) en metanol (4,4 ml) y se trató con hidróxido de sodio acuoso al 32 % (170 j l ) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %), después acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (11,8 mg, 95 % de pureza, 5 % de rendimiento al cabo de 2 pasos). CL-EM (Procedimiento A): Tr = 1,11 min; EM (lENneg): m/z = 475 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,05 (d, 6H), 3,54 (spt, 1H), 3,73 (t, 2H), 3,88 (s, 2H), 4,24 (t, 2H), 7,07 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,48 (m, 3H), 7,70 (d, 1H), 7,82 (dd, 1H), 8,03 (s, 1H), 8,33 (d, 1H), 10,57 (s, 1H).
Ejemplo 287
2-(2-Clorofeml)-W-{4-[1-(3-hidroxi-3-metNbutM)-1H-pirazol-4-M]-3-sulfamoNfeml}acetamida
Se disolvieron clorhidrato de W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (1:1) (250 mg, 505 jmol), 2-metil-4-[4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol-1-il]butan-2-ol (283 mg, 1,01 mmol) y fluoruro de potasio (64,5 mg, 1,11 mmol) en DMF seca y desgasificada (14 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (12,9 mg, 25,2 jmol). La reacción se calentó durante 18 h a 100 °C. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente. Se disolvió 2-(2-clorofenil)-A/-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[1-(3-hidroxi-3-metilbutil)-1H-pirazol-4-il]fenil)acetamida (250 mg, 470 jm ol) en metanol (4,8 ml) y se trató con hidróxido de sodio acuoso al 32 % (180 j l ) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%)) para dar el compuesto del título (31,3 mg, 95 % de pureza, 14 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,92 min; EM (lENneg): m/z = 475 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,15 (s, 6H), 1,88 - 1,99 (m, 2H), 3,88 (s, 2H), 4,16 - 4,23 (m, 2H), 4,48 (s, 1H), 7,15 (s, 2H), 7,29 -7,37 (m, 2H), 7,41 -7,49 (m, 3H), 7,66 -7,70 (m, 1H), 7,81 (dd, 1H), 8,01 (s, 1H), 8,31 (d, 1H), 10,57 (s, 1H).
Ejemplo 288
2-(2-Clorofeml)-W-{4-[5-(2-h¡drox¡propan-2-N)-1-metN-1H-p¡razol-3-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron clorhidrato de W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (1:1) (500 mg, 1,01 mmol) y 1-metil-3-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol-5-carboxilato de metilo (537 mg, 2,02 mmol) en n-propanol (19 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (35,5 mg, 50,5 jmol), trifenilfosfina (13,2 mg, 50,5 jm ol) y fluoruro de potasio (13,5 mg, 232 jmol). La solución se purgó con argón durante 5 minutos y se añadió carbonato de potasio acuoso (1,3 ml, 2,0 M, 2,5 mmol). La reacción se calentó a 100 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) (260 mg, 47 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,10 min; EM (lENneg): m/z = 516 [M-H]-Se disolvió 3-(4-{[(2-clorofenil)acetil]amino}-2-{[(dimetilamino)metiliden]sulfamoil}fenil)-1-metil-1H-pirazol-5-carboxilato de propilo (250 mg, 458 jmol) en THF seco (8,3 ml) y se añadió bromuro de metilmagnesio en THF (14 ml, 1,0 M, 14 mmol). La reacción se agitó durante 18 h a 22 °C, después se añadió solución acuosa saturada de cloruro de amonio y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvió 2-(2-clorofenil)-W-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[5-(2-hidroxipropan-2-il)-1-metil-1H-pirazol-3-il]fenil)acetamida (250 mg, 483 jm ol) en metanol (5,0 ml) y se trató con hidróxido de sodio acuoso al 32 % (0,6 ml) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 |jm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el producto final (10,1 mg, 95 % de pureza, 4 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,02 min; EM (lENneg): m/z = 461 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,55 (s, 6H), 3,88 (s, 2H), 4,02 (s, 3H), 5,45 (s, 1H), 6,45 (s, 1H), 7,28 - 7,38 (m, 2H), 7,41 - 7,49 (m, 2H), 7,49 - 7,78 (m, 3H), 7,93 (dd, 1H), 8,28 (d, 1H), 10,64 (s, 1H).
Ejemplo 289
2-(2-Clorofeml)-W-{4-[5-(d¡fluorometox¡)p¡r¡dm-3-il]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron clorhidrato de W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (1:1) (250 mg, 505 jm ol) y [5-(difluorometoxi)piridin-3-il](trifluoro)borato de potasio (380 mg, 1,51 mmol) en n-propanol (9,3 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (17,8 mg, 25,2 jmol), trifenilfosfina (6,62 mg, 25,2 jm ol) y fluoruro de potasio (7,33 mg, 126 jmol). La solución se purgó con argón durante 5 minutos y se añadió carbonato de potasio acuoso (760 jl, 2,0 M, 1,5 mmol). La reacción se calentó a 100 °C durante 2 h en el microondas. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto
se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(2-clorofenil)-A/-(4-[5-(difluorometoxi)piridin-3-il]-3-{[(dimetilamino)metiliden]sulfamoil}fenil)acetamida (250 mg, 478 pmol) en metanol (4,9 ml) y se trató con hidróxido de sodio acuoso al 32 % (0,6 ml) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (39,1 mg, 95 % de pureza, 17 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (lENneg): m/z = 466 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,91 (s, 2H), 7,15 - 7,54 (m, 8H), 7,65 (t, 1H), 7,88 (dd, 1H), 8,39 - 8,49 (m, 3H), 10,71 (s, 1H).
Ejemplo 290
W-[4-(2-Cloro-5-metox¡pmdm-3-¡l)-3-sulfamo¡lfeml]-2-(2-clorofeml)acetam¡da
Se secó DMF sobre filtros moleculares y se purgó con argón. Después se disolvieron clorhidrato de W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (1:1) (250 mg, 505 pmol), ácido (2-cloro-5-metoxipiridin-3-il)borónico (189 mg, 1,01 mmol) y fluoruro de potasio (64,5 mg, 1,11 mmol) en DMF seca y desgasificada (14 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió precatalizador CataCXium A (18,4 mg, 25,2 pmol). La reacción se calentó durante 18 h a 100 °C. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió W-[4-(2-cloro-5-metoxipiridin-3-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]-2-(2-clorofenil)acetamida (350 mg, 25 % de pureza, 168 pmol) en metanol (1,7 ml) y se trató con hidróxido de sodio acuoso al 32 % (0,2 ml) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (25,5 mg, 90 % de pureza, 29 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (lENneg): m/z = 464 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,84 (s, 3H), 3,90 (s, 2H), 7,27 (d, 1H), 7,31 - 7,38 (m, 5H), 7,43 - 7,50 (m, 2H), 7,85 (dd, 1H), 8,12 (d, 1H), 8,35 (d, 1H), 10,70 (s, 1H).
Ejemplo 291
2-(2-Clorofeml)-W-{4-[1-(2-hidroxietM)-1H-pirazol-4-M]-3-sulfamoilfeml}acetamida
Se secó DMF sobre filtros moleculares y se purgó con argón. Después se disolvieron clorhidrato de W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (1:1) (250 mg, 505 pmol), 2-[4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol-1-il]etanol (240 mg, 1,01 mmol) y fluoruro de potasio (65,0 mg, 1,1 mmol) en DMF seca y desgasificada (6,6 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (12,9 mg, 25,2 pmol). La reacción se calentó durante 4 h a 100 °C.
Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(2-clorofenil)-W-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[1-(2-hidroxietil)-1H-pirazol-4-il]fenil)acetamida (250 mg, 510 pmol) en metanol (5,2 ml) y se trató con hidróxido de sodio acuoso al 32 % (0,2 ml) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (28,1 mg, 90 % de pureza, 11 % de rendimiento al cabo de 2 pasos). La segunda fracción se cristalizó adicionalmente desde éter dietílico (47,1 mg, 95 % de pureza, 20 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 0,89 min; EM (lENneg): m/z = 433 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,75 (q, 2H), 3,88 (s, 2H), 4,16 (t, 2H), 4,94 (t, 1H), 7,04 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,48 (m, 3H), 7,71 (s, 1H), 7,83 (dd, 1H), 8,01 (s, 1H), 8,32 (d, 1H), 10,57 (s, 1H).
Ejemplo 292
W-[4-(5-íerc-ButiMH-pirazol-3-M)-3-sulfamoMfeml]-2-(2-clorofeml)acetamida
Se secó DMF sobre filtros moleculares y se purgó con argón. Después se disolvieron clorhidrato de W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (1:1) (250 mg, 505 pmol), (3-(terc-butil)-1H-pirazol-5-il)trifluoroborato de potasio (232 mg, 1,01 mmol) y fluoruro de potasio (65,0 mg, 1,1 mmol) en DMF seca y desgasificada (14 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tri-tercbutilfosfin)paladio(0) (Ca s 53199-31-8) (12,9 mg, 25,2 pmol). La reacción se calentó durante 18 h a 100 °C. Después la mezcla se filtró sobre gel de sílice y se lavó con acetato de etilo. Después de retirar el disolvente la reacción se repitió. Después de la filtración sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió A/-[4-(5-terc-butil-1 H-pirazol-3-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]-2-(2-clorofenil)acetamida (270 mg, 30 % de pureza, 161 pmol) en metanol (1,7 ml) y se trató con hidróxido de sodio acuoso al 32 % (63 pl) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%)) para dar el compuesto del título (10,1 mg, 90 % de pureza, 12 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,15 min; EM (lENneg): m/z = 445 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,33 (s, 9H), 3,88 (s, 2H), 6,38 (s, 1H), 7,30 - 7,36 (m, 2H), 7,42 - 7,49 (m, 2H), 7,64 (d, 1H), 7,86 - 7,97 (m, 3H), 8,30 (d, 1H), 10,64 (s, 1H), 12,89 (s, 1H).
Ejemplo 293
W-[4-(1-BenciMH-pirazol-4-M)-3-sulfamoMfeml]-2-(2-clorofeml)acetamida
Se disolvieron W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (200 mg, 436 pmol) y 1-bencil-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (248 mg, 872 pmol) en n-propanol (8,0 ml) y se
añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (15,3 mg, 21,8 |jmol) y trifenilfosfina (5,72 mg, 21,8 jmol). La solución se purgó con argón durante 5 minutos y se añadió carbonato de potasio acuoso (540 j l , 2,0 M, 1,1 mmol). La reacción se calentó a 80 °C durante 2 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió A/-[4-(1-bencil-1H-pirazol-4-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]-2-(2-clorofenil)acetamida (250 mg, 466 jm ol) en metanol (4,8 ml) y se trató con hidróxido de sodio acuoso al 32 % (0,6 ml) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, metanol/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (5,50 mg, 80 % de pureza, 2 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento J): Tr = 1,29 min; EM (lENneg): m/z = 479 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,88 (s, 2H), 5,36 (s, 2H), 7,22 - 7,37 (m, 8H), 7,42 - 7,46 (m, 3H), 7,73 (s, 1H), 7,81 (dd, 1H), 8,12 (s, 1H), 8,33 (d, 1H), 8,45 (s, 1H), 10,60 (s, 1H).
Ejemplo 294
2-(2-Clorofeml)-W-[4-(6-met¡lp¡r¡dazm-4-¡l)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron 2-bromo-A/-[(dimetilamino)metiliden]-5-nitrobencensulfonamida (400 mg, 1,19 mmol) y 3-metil-5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)piridazina (524 mg, 2,38 mmol) en n-propanol (110 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (41,9 mg, 59,5 jmol), trifenilfosfina (21,6 mg, 59,5 jm ol) y carbonato de potasio acuoso (1,8 ml, 2,0 M, 3,6 mmol). La reacción se calentó a 120 °C durante 1 h en el microondas (0,4 MPa/40 W). Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(6-metilpiridazin-4-il)-5-nitrobencensulfonamida (400 mg, 1,36 mmol) en THF (140 ml)/metanol (50 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (148 mg, 1,39 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 4 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió 5-amino-2-(6-metilpiridazin-4-il)bencensulfonamida (200 mg, 757 jmol) en DMF (5,3 ml) y se añadió ácido (2-clorofenil)acético (155 mg, 908 jmol), después se añadieron W,W-diisopropiletilamina (630 jl, 3,8 mmol) y HATU (460 mg, 1,21 mmol). La reacción se agitó a 50 °C durante 18 h. Después se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó dos veces mediante HPLC (primero Waters XBrigde C185 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico, después Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (2,20 mg, 95 % de pureza, 1 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 0,78 min; EM (lENneg): m/z = 415 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,66 (s, 3H), 3,91 (s, 2H), 7,30 - 7,37 (m, 3H), 7,43 - 7,55 (m, 5H), 7,89 (dd, 1H), 8,40 (d, 1H), 9,05 (d, 1H), 10,75 (s, 1H).
Ejemplo 295
2-(2-Clorofeml)-N-{3-sulfamo¡l-4-[6-(trífluoromet¡l)p¡r¡dm-2-¡l]feml}acetam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (150 mg, 327 |jmol), 4,4,4',4',5,5,5',5'-octametil-2,2'-bi-1,3,2-dioxaborolano (208 mg, 817 jm ol) y precatal¡zador CataCX¡um A (11,9 mg, 16,3 jm ol) en metanol seco (20,0 ml) en atmósfera de argón, después se añad¡ó W,W-d¡¡soprop¡let¡lam¡na (140 jl, 820 jmol). La reacc¡ón se calentó durante 2 h a 50 °C. Después de enfr¡ar a temperatura amb¡ente, se añad¡eron fluoruro de potas¡o (38,0 mg, 654 jmol) y 2-bromo-6-(tr¡fluoromet¡l)p¡r¡d¡na (148 mg, 654 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó b¡s(tr¡-terc-but¡lfosf¡n)palad¡o(0) (CAS 53199-31-8) (8,35 mg, 16,3 jmol). La reacc¡ón se calentó a 80 °C durante 2 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-(2-clorofen¡l)-W-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[6-(tr¡fluoromet¡l)p¡r¡d¡n-2-¡l]fen¡l)acetam¡da (56,0 mg, 107 jm ol) en metanol (25 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (1,6 ml) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (5,50 mg, 95 % de pureza, 10 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 1,16 m¡n; EM (lENneg): m/z = 468 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,92 (s, 2H), 7,07 (s a, 2H), 7,30 - 7,37 (m, 2H), 7,43 - 7,50 (m, 2H), 7,57 (d, 1H), 7,92 - 8,04 (m, 3H), 8,18 - 8,24 (m, 1H), 8,37 (d, 1H), 10,76 (s, 1H).
Ejemplo 296
W-{4-[1-(D¡fluorometM)-1H-p¡razol-4-M]-3-sulfamo¡lfeml}-2-(2-fluorofeml)acetam¡da
Se d¡solv¡eron A/-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-fluorofen¡l)acetam¡da (250 mg, 565 jm ol) y 1- (d¡fluoromet¡l)-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (276 mg, 1,13 mmol) en n-propanol (10 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (19,9 mg, 28,3 jmol), tr¡fen¡lfosf¡na (7,41 mg, 28,3 jm ol) y fluoruro de potas¡o (7,55 mg, 130 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó carbonato de potas¡o acuoso (710 jl, 2,0 M, 1,4 mmol). La reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó W-(4-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-fluorofen¡l)acetam¡da (280 mg, 584 jm ol) en metanol (2,4 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (0,2 ml) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (21,8 mg, 96 % de pureza, 8 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento A): Tr = 1,00 m¡n; EM (lENpos): m/z = 425 [M+H]+
RMN 1H (500MHz, DMSO-d6): 8 [ppm]= 3,77 (s, 2H), 7,14 -7,20 (m, 2H), 7,30 -7,34 (m, 1H), 7,37 -7,42 (m, 3H), 7,46 (d, 1H), 7,66 - 7,96 (m, 2H), 8,00 (s, 1H), 8,34 (d, 1H), 8,41 (s, 1H), 10,61 (s, 1H).
Ejemplo 297
2- (2-Clorofeml)-W-{6-[1-(d¡fluorometM)-1H-p¡razol-4-M]-5-sulfamo¡lp¡r¡dm-3-¡l}acetam¡da
Se disolvió 5-am¡no-2-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-N-[(d¡met¡lam¡no)met¡l¡den]p¡rid¡n-3-sulfonam¡da (750 mg, 2,18 mmol) en DMF (43 ml) y se añadió ácido (2-clorofenil)acét¡co (372 mg, 2,18 mmol), después se añadieron N,N-d¡¡soprop¡let¡lam¡na (1,9 ml, 11 mmol) y HATU (994 mg, 2,61 mmol). La reacción se agitó a 50 °C durante 1 h. El disolvente se retiró a presión reducida y se añadieron agua y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar 160 mg (15 % de rendimiento al cabo de 4 pasos). CL-EM (Procedimiento B): Tr = 1,00 min; EM (lENneg): m/z = 495 [M-H]-Se disolvió 2-(2-clorofen¡l)-N-(6-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-5-{[(d¡met¡lam¡no)met¡l¡den]sulfamoil}p¡r¡d¡n-3-¡l)acetamida (160 mg, 322 pmol) en metanol (10 ml) y se trató con solución acuosa de amoníaco al 25 % (10 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (dos veces, Chromatorex C-1810 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (18,9 mg, 92 % de pureza, 13 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,71 min; EM (lENneg): m/z = 440 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,94 (s, 2H), 7,30 - 7,38 (m, 2H), 7,43 - 7,52 (m, 2H), 7,71 - 8,08 (m, 3H), 8,29 (s, 1H), 8,70 (s, 1H), 8,78 (d, 1H), 8,93 (d, 1H), 10,88 (s, 1H).
Ejemplo 298
W-[4-(6-Cloro-5-metMp¡r¡dm-3-M)-3-sulfamoilfeml]-2-(2-clorofeml)acetam¡da
Se secó DMF sobre filtros moleculares y se purgó con argón. Después se disolvieron clorhidrato de N-(4-bromo-3-{[(dimet¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (1:1) (300 mg, 606 pmol), ácido (6-cloro-5-metilp¡r¡d¡n-3-¡l)borónico (208 mg, 1,21 mmol) y fluoruro de potasio (77,4 mg, 1,33 mmol) en DMF seca y desgasificada (9,3 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tri-tercbutilfosfin)paladio(0) (CAS 53199-31-8) (15,5 mg, 30,3 pmol). La reacción se calentó durante 1 h a 100 °C. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se sometió nuevamente a las condiciones de reacción. Después, la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y se usó sin purificación adicional en el paso siguiente.
Se disolvió N-[4-(6-cloro-5-met¡lp¡r¡d¡n-3-¡l)-3-{[(dimet¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l]-2-(2-clorofen¡l)acetam¡da (250 mg, 495 pmol) en metanol (2,0 ml) y se trató con solución acuosa de amoníaco al 25 % (10 ml) a temperatura ambiente durante 18 h. Después se añadió hidróxido de sodio acuoso al 32 % (0,2 ml) y la reacción se calentó a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) y mediante cromatografía sobre gel de sílice (Biotage, acetato de etilo en hexano 35 %) y el compuesto del título puro se obtuvo después de la recristalización desde diclorometano/ éter dietílico (6,30 mg, 90 % de pureza, 3 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,05 min; EM (lENneg): m/z = 448 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,36 (s, 3H), 3,90 (s, 2H), 7,29 - 7,39 (m, 5H), 7,42 - 7,50 (m, 2H), 7,76 (d, 1H), 7,86 (dd, 1H), 8,19 (d, 1H), 8,38 (d, 1H), 10,70 (s, 1H).
Ejemplo 299
2-(2-Clorofeml)-W-{4-[2-(c¡cloprop¡lammo)p¡r¡m¡dm-5-M]-3-sulfamo¡lfeml}acetam¡da
Se secó DMF sobre filtros moleculares y se purgó con argón. Después se disolvieron o clorhidrato de A/-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-dorofenil)acetamida (1:1) (250 mg, 505 |jmol), W-ciclopropil-5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)pirimidin-2-amina (264 mg, 1,01 mmol) y fluoruro de potasio (64,5 mg, 1,11 mmol) en DMF seca y desgasificada (7,7 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tri-ferc-butilfosfin)paladio(0) (CAS 53199-31-8) (12,9 mg, 25,2 jm ol) y la solución se purgó nuevamente con argón. La reacción se calentó durante 2 h a 100 °C. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(2-clorofenil)-W-(4-[2-(ciclopropilamino)pirimidin-5-il]-3-{[(dimetilamino)-metiliden]sulfamoil}fenil)acetamida (250 mg, 487 jm ol) en metanol (2,0 ml) y se trató con solución acuosa de amoníaco al 25 % (10 ml) a temperatura ambiente durante 4 h. Después se añadió hidróxido de sodio acuoso al 32 % (0,2 ml) y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (34,0 mg, 95 % de pureza, 14 % de rendimiento al cabo de 2 pasos)
CL-EM (Procedimiento B): Tr = 0,91 min; EM (lENneg): m/z = 456 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 0,48 - 0,53 (m, 2H), 0,65 - 0,71 (m, 2H), 2,73 (tq, 1H), 3,89 (s, 2H), 7,28 - 7,39 (m, 5H), 7,43 - 7,49 (m, 3H), 7,84 (dd, 1H), 8,26 (s, 2H), 8,36 (d, 1H), 10,65 (s, 1H).
Ejemplo 300
2-(2-Clorofeml)-W-{3-sulfamoN-4-[1-(tetrahidrofurano-3-M)-1H-pirazol-4-N]feml}acetamida
Se secó DMF sobre filtros moleculares y se purgó con argón. Después se disolvieron A/-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (250 mg, 545 jmol), 1-(tetrahidrofurano-3-il)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (288 mg, 1,09 mmol) y fluoruro de potasio (69,6 mg, 1,20 mmol) en DMF seca y desgasificada (7,7 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tri-ferc-butilfosfin)paladio(0) (CAS 53199-31-8) (13,9 mg, 27,2 jmol). La reacción se purgó nuevamente durante 1 minuto con argón y se calentó durante 18 h a 100 °C. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se sometió nuevamente a las condiciones de reacción. Después de la filtración y eliminación del disolvente, el material en bruto se usó sin purificación adicional en el paso siguiente. Se disolvió 2-(2-clorofenil)-W-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[1-(tetrahidrofurano-3-il)-1H-pirazol-4-il]fenil)acetamida (300 mg, 20 % de pureza, 116 jm ol) en metanol (0,5 ml) y se trató con hidróxido de sodio acuoso al 32 % (45 j l ) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) y el compuesto del título puro se obtuvo después de la cristalización desde diclorometano / éter dietílico (4,70 mg, 95 % de pureza, 8 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 0,98 min; EM (lENneg): m/z = 459 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,36 -2,42 (m, 1H), 3,76 - 3,91 (m, 4H), 3,92 - 4,04 (m, 3H), 4,99 - 5,11 (m, 1H), 7,18 (s, 2H), 7,30 - 7,34 (m, 2H), 7,43 - 7,48 (m, 3H), 7,74 (s, 1H), 7,82 (dd, 1H), 8,06 (d, 1H), 8,32 (d, 1H), 10,58 (s, 1H).
Ejemplo 301
2-(2-Clorofeml)-W-{4-[2-(metMammo)pmmidm-5-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron N-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (250 mg, 545 jm ol) y N-met¡l-5-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)p¡r¡m¡d¡n-2-am¡na (256 mg, 1,1 mmol) en n-propanol (8,1 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (19,2 mg, 27,2 jmol), tr¡fen¡lfosf¡na (5,4 jl, 27 |jmol), fluoruro de potas¡o (7,91 mg, 136 jm ol) y fosfato de potas¡o acuoso (540 j l , 2,0 M, 1,1 mmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y la reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-(2-clorofen¡l)-N-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[2-(met¡lam¡no)p¡r¡m¡d¡n-5-¡l]fen¡l)acetam¡da (300 mg, 616 jm ol) en metanol (2,5 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (240 j l ) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage, acetato de et¡lo), el sól¡do se tr¡turó en éter d¡etíl¡co / acetato de et¡lo y el mater¡al f¡ltrado después se somet¡ó a pur¡f¡cac¡ón HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (36,0 mg, 95 % de pureza, 13 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,84 m¡n; EM (lENneg): m/z = 430 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,84 (d, 3H), 3,89 (s, 2H), 7,18 (q, 1H), 7,26 - 7,38 (m, 5H), 7,43 - 7,49 (m, 2H), 7,83 (dd, 1H), 8,24 (s, 2H), 8,35 (d, 1H), 10,64 (s, 1H).
Ejemplo 302
2-(2-Clorofeml)-W-[6-(1-metN-1H-pirazol-4-M)-5-sulfamoilpiridm-3-N]acetamida
Se d¡solv¡ó 5-am¡no-N-[(d¡met¡lam¡no)met¡l¡den]-2-(1-met¡l-1H-p¡razol-4-¡l)p¡r¡d¡n-3-sulfonam¡da (500 mg, 1,62 mmol) en DMF (15 ml) y se añad¡ó ác¡do (2-clorofen¡l)acét¡co (277 mg, 1,62 mmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (1,4 ml, 8,1 mmol) y HATU (925 mg, 2,43 mmol). La reacc¡ón se ag¡tó a temperatura amb¡ente durante 3 h. El d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡eron agua y acetato de et¡lo. Las fases se separaron y la fase acuosa se lavó con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage, grad¡ente de etanol en d¡clorometano 2 %) para dar 120,0 mg (16 % de rend¡m¡ento al cabo de 3 pasos). CL-EM (Proced¡m¡ento B): Tr = 0,93 m¡n; EM (lENneg): m/z = 459 [M-H]-Se d¡solv¡ó 2-(2-clorofen¡l)-N-[5-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-6-(1-met¡l-1H-p¡razol-4-¡l)p¡r¡d¡n-3-¡l]acetam¡da (120 mg, 260 jm ol) en metanol (20 ml) y se trató con soluc¡ón acuosa de amoníaco al 25 % (20 ml) a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (2,60 mg, 97 % de pureza, 2 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 0,65 m¡n; EM (lENneg): m/z = 404 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,81 - 3,98 (m, 5H), 7,26 - 7,37 (m, 2H), 7,42 - 7,51 (m, 2H), 7,65 (s, 2H), 7,99 (d, 1H), 8,26 (s, 1H), 8,71 (d, 1H), 8,88 (d, 1H), 10,77 (s, 1H).
Ejemplo 303
2-(2-Clorofeml)-W-{4-[1-(2,2-d¡fluoroetM)-1H-p¡razol-4-M]-3-sulfamoMfeml}acetam¡da
Se secó DMF sobre filtros moleculares y se purgó con argón. Después se disolvieron N-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-dorofenil)acetamida (250 mg, 545 |jmol), 1-(2,2-difluoroetil)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1 H-pirazol (281 mg, 1,09 mmol) y fluoruro de potasio (69,6 mg, 1,20 mmol) en DMF seca y desgasificada (8,3 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (13,9 mg, 27,2 jmol). La reacción se calentó durante 1 ha 100 °C. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se disolvió en DMF seco (8,0 ml). Se añadieron 1-(2,2-difluoroetil)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (281 mg, 1,09 mmol), dicloruro de bis(trifenilfosfin)paladio(II) (CAS 13965-03-2) (19,2 mg, 27,2 jm ol) y solución acuosa de fosfato de potasio (540 jl, 2,0 M, 1,1 mmol). La reacción se calentó a 100 °C durante 1 h en el microondas. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 100 mg (36 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,07 min; EM (lENneg): m/z = 508 [M-H]-Se disolvió 2-(2-clorofenil)-N-(4-[1-(2,2-difluoroetil)-1H-pirazol-4-il]-3-{[(dimetilamino)-metiliden]sulfamoil}fenil)acetamida (100 mg, 196 jm ol) en metanol (0,8 ml) y se trató con hidróxido de sodio acuoso al 32 % (280 j l) a temperatura ambiente durante la noche. Se añadió hidróxido de sodio acuoso al 32 % (280 j l) y la reacción se calentó a 50 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (9,20 mg, 95 % de pureza, 10 % de rendimiento).
CL-EM (Procedimiento A): Tr = 1,02 min; EM (lENneg): m/z = 453 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,88 (s, 2H), 4,65 (td, 2H), 6,19 - 6,59 (m, 1H), 7,19 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,48 (m, 3H), 7,78 (s, 1H), 7,83 (dd, 1H), 8,08 (s, 1H), 8,33 (d, 1H), 10,59 (s, 1H).
Ejemplo 304
W-{3-Sulfamo¡l-4-[5-(tr¡fluoromet¡l)pmdm-3-¡l]feml}-2-[2-(tr¡fluorometM)feml]acetam¡da
Se disolvió 5-amino-N-[(dimetilamino)metiliden]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (185 mg, 497 jm ol) en DMF (3,5 ml) y se añadió ácido [2-(trifluorometil)fenil]acético (122 mg, 596 jmol), después se añadieron N,N-diisopropiletilamina (410 jl, 2,5 mmol) y HATU (302 mg, 795 jmol). La reacción se agitó a 50 °C durante 2 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se lavó con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano/ acetato de etilo) para dar 200 mg (41 % de pureza, 72 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,21 min; EM (lENneg): m/z = 557 [M-H]-Se disolvió N-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[5-(trifluorometil)piridin-3-il]fenil)-2-[2
(trifluorometil)fenil]acetamida (200 mg, 358 |jmol) en metanol (1,5 ml) y se trató con solución acuosa de amoníaco al 25 % (0,5 ml) a temperatura ambiente durante la noche. Después se añadió hidróxido de sodio acuoso al 32 % (0,2 ml) y se continuó la agitación a 50 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, acetato de etilo en hexano 40 %) y después mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (10,0 mg, 95 % de pureza, 5 % de rendimiento).
CL-EM (Procedimiento A): Tr = 1,18 min; EM (lENneg): m/z = 502 [M-H]-RMN 1H (500MHz, DMSO-d6): Shift [ppm]= 4,00 (s, 2H), 7,28 - 7,45 (m, 2H), 7,48 - 7,59 (m, 2H), 7,65 -7,70 (m, 1H), 7,73 (d, 1H), 7,87 (dd, 1H), 8,08 - 8,23 (m, 1H), 8,31 (s, 1H), 8,38 (d, 1H), 8,82 (d, 1H), 8,95 (d, 1H), 10,70 (s, 1H).
Ejemplo 305
2-(2-Clorofeml)-N-[3-sulfamoil-5'-(trífluorometM)-2,3'-bipmdm-5-il]acetamida
Se disolvió 5-amino-W-[(dimetilamino)metiliden]-5'-(trifluorometil)-2,3'-bipiridin-3-sulfonamida (250 mg, 670 jm ol) en DMF (10 ml) y se añadió ácido (2-clorofenil)acético (126 mg, 737 jmol), después se añadieron W,W-diisopropiletilamina (580 jl, 3,3 mmol) y HATU (306 mg, 804 jmol). La reacción se agitó a 50 °C durante 3 h. Después se añadió la misma cantidad de ácido y la agitación se continuó durante 2 h. El disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-1810 jm , 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) para dar 160 mg (45 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 1,13 min; EM (lENneg): m/z = 524 [M-H]-Se disolvió 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-5'-(trifluorometil)-2,3'-bipiridin-5-il]acetamida (160 mg, 304 jm ol) en metanol (20 ml) y se trató con solución acuosa de amoníaco al 25 % (20 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (11,6 mg, 99 % de pureza, 8 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,81 min; EM (lENneg): m/z = 469 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,96 (s, 2H), 7,29 - 7,40 (m, 2H), 7,43 - 7,52 (m, 2H), 7,77 (s, 2H), 8,28 - 8,35 (m, 1H), 8,86 (d, 1H), 8,99 (d, 1H), 9,02 (dd, 2H), 10,99 (s, 1H).
Ejemplo 306
2-(2-Clorofeml)-W-{3-sulfamoil-4-[2-(trifluorometil)pirimidm-5-il]feml}acetamida
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (250 mg, 494 jm ol) se le añadieron 5-bromo-2-(trifluorometil)pirimidina (224 mg, 988 jm ol) y fluoruro de potasio (57,4 mg, 988 jm ol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (12,6 mg, 24,7 jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin
purificación adicional en el paso siguiente.
Se disolvió 2-(2-clorofenil)-W-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[2-(trifluorometil)pirimidin-5-il]fenil)acetamida (300 mg, 570 pmol) en metanol (2,3 ml) y se trató con solución acuosa de amoníaco (810 pl, 7,0 M, 5,7 mmol) a temperatura ambiente. Después se añadió solución acuosa de hidróxido de sodio al 32 % (200 pl) y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (19,1 mg, 95 % de pureza, 7 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 0,98 min; EM (lENneg): m/z = 469 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,92 (s, 2H), 7,24 - 7,40 (m, 3H), 7,41 - 7,55 (m, 4H), 7,93 (dd, 1H), 8,42 (d, 1H), 9,03 (s, 2H), 10,77 (s, 1H).
Ejemplo 307
2-(2-Clorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluorometox¡)p¡r¡dm-3-¡l]feml}acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (100 mg, 197 pmol) se le añadieron 3-bromo-5-(trifluorometoxi)piridina (95,7 mg, 395 pmol) y fluoruro de potasio (23,0 mg, 395 pmol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (5,05 mg, 9,88 pmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 81,3 mg (76 % de rendimiento). CL-EM (Procedimiento B): Tr = 1,21 min; EM (lENneg): m/z = 539 [M-H]-Se disolvió 2-(2-clorofenil)-A/-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[5-(trifluorometoxi)piridin-3-il]fenil)acetamida (190 mg, 351 pmol) en metanol (1,4 ml) y se trató con solución acuosa de amoníaco (500 pl, 7,0 M, 3,5 mmol) a temperatura ambiente. Después de 18 h, se añadió solución acuosa de hidróxido de sodio al 32% (200 pl) y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) para dar el compuesto del título (27,3 mg, 95 % de pureza, 15 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 1,11 min; EM (lENneg): m/z = 484 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,91 (s, 2H), 7,29 - 7,41 (m, 3H), 7,43 - 7,53 (m, 4H), 7,80 - 7,97 (m, 2H), 8,40 (d, 1H), 8,58 (d, 1H), 8,67 (d, 1H), 10,73 (s, 1H).
Ejemplo 308
2-(2-Clorofeml)-W-[4-(2-c¡cloprop¡lp¡r¡m¡dm-5-¡l)-3-sulfamo¡lfeml]acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (100 mg, 198 pmol) se le añadieron 5-bromo-2-ciclopropilpirimidina (78,7 mg, 395 pmol) y fluoruro de potasio (23,0 mg, 395 pmol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (5,05 mg,
9,88 |jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 50,0 mg (51 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,15 min; EM (IENneg): m/z = 496 [M-H]-Se disolvió 2-(2-clorofenil)-A/-[4-(2-ciclopropilpirimidin-5-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]acetamida (50,0 mg, 100 jm ol) en metanol (0,4 ml) y se trató con solución acuosa de amoníaco (140 jl, 7,0 M, 3,5 mmol) a temperatura ambiente. Después de 18 h, se añadió solución acuosa de hidróxido de sodio al 32% (200 j l) y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) para dar el compuesto del título (6,30 mg, 95 % de pureza, 13 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (IENneg): m/z = 441 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 0,93 -1,17 (m, 4H), 2,11 -2,28 (m, 1H), 3,90 (s, 2H), 7,19 -7,40 (m, 3H), 7,42 - 7,59 (m, 4H), 7,87 (dd, 1H), 8,39 (d, 1H), 8,57 (s, 2H), 10,70 (s, 1H).
Ejemplo 309
-(2-Clorofeml)-N-[4-(2-etoxipirímidm-5-M)-3-sulfamoilfeml]acetamida
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (100 mg, 198 jm ol) se le añadieron 5-bromo-2-etoxipirimidina (80,3 mg, 395 jm ol) y fluoruro de potasio (23,0 mg, 395 jm ol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (5,05 mg, 9,88 jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 50,0 mg (50 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,15 min; EM (IENneg): m/z = 500 [M-H]-Se disolvió 2-(2-clorofenil)-W-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(2-etoxipirimidin-5-il)fenil]acetamida (50,0 mg, 99,6 jm o l) en metanol (0,4 ml) y se trató con solución acuosa de amoníaco (140 jl, 7,0 M, 3,5 mmol) a temperatura ambiente. Después de 18 h, se añadió solución acuosa de hidróxido de sodio al 32 % (200 j l) y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (1,00 mg, 95 % de pureza, 2 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,96 min; EM (IENneg): m/z = 445 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,37 (t, 3H), 3,90 (s, 2H), 4,40 (q, 2H), 7,09 - 7,63 (m, 7H), 7,87 (dd, 1H), 8,36 (s, 1H), 8,53 (s, 2H), 10,68 (s, 1H).
Ejemplo 310
-(2-Clorofeml)-N-{4-[2-(propan-2-ilammo)pmmidm-5-M]-3-sulfamoilfeml}acetamida
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (100 mg, 198 jm ol) se le añadieron 5-bromo-A/-(propan-2il)pirimidin-2-amina (85,4 mg, 395 |jmol) y fluoruro de potasio (23,0 mg, 395 |jmol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (5,05 mg, 9,88 jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 50,0 mg (49 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,17 min; EM (lENneg): m/z = 513 [M-H]-Se disolvió 2-(2-clorofen¡l)-A/-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[2-(propan-2-ilam¡no)p¡r¡m¡d¡n-5-il]fenil)acetamida (50,0 mg, 97,1 jmol) en metanol (0,4 ml) y se trató con solución acuosa de amoníaco (140 jl, 7,0 M, 3,5 mmol) a temperatura ambiente. Después de 18 h, se añadió solución acuosa de hidróxido de sodio al 32 % (200 j l) y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) para dar el compuesto del título (2,70 mg, 95 % de pureza, 6 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,03 min; EM (lENneg): m/z = 458 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,18 (d, 6H), 3,89 (s, 2H), 4,07 (spt, 1H), 7,10 (d, 1H), 7,29 (d, 1H), 7,31 -7,39 (m, 4H), 7,42 - 7,50 (m, 2H), 7,83 (dd, 1H), 8,23 (s, 2H), 8,35 (d, 1H), 10,63 (s, 1H).
Ejemplo 311
2-(2-Clorofeml)-W-{4-[2-(propan-2-¡lox¡)p¡r¡m¡dm-5-¡l]-3-sulfamo¡lfeml}acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (100 mg, 198 jm ol) se le añadieron 5-bromo-2-(propan-2-iloxi)pirimidina (94,6 mg, 436 jm ol) y fluoruro de potasio (25,3 mg, 436 jm ol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió paladio-tri-ferc-butilfosfano (1:2) (5,57 mg, 10,9 jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente. CL-EM (Procedimiento B): Tr = 1,16 min; EM (lENpos): m/z = 516 [M+H]+
Se disolvió 2-(2-clorofenil)-W-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[2-(propan-2-iloxi)pirimidin-5-il]fenil)acetamida (150 mg, 291 jm ol) en metanol (1,1 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (140 j l) a 50 °C durante 4 h. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (23,7 mg, 95 % de pureza, 17 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,02 min; EM (lENneg): m/z = 459 [M-H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,35 (d, 6H), 3,89 (s, 2H), 5,24 (quin, 1H), 6,99 - 7,67 (m, 7H), 7,85 - 8,04 (m, 1H), 8,36 (d, 1H), 8,51 (s, 2H), 10,68 (s, 1H).
Ejemplo 312
2-(2-Clorofeml)-W-{4-[2-(et¡lammo)p¡r¡m¡dm-5-¡l]-3-sulfamo¡lfeml}acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (100 mg, 198 jm ol) se le añadieron 5-bromo-W-etilpirimidin-2-amina (88,1 mg, 436 jm ol) y fluoruro de potasio (25,3 mg, 436 jm ol) en atmósfera de argón. La solución se purgó
con argón durante 5 minutos y se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (5,57 mg, 10,9 |jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento B): Tr = 1,05 min; EM (lENpos): m/z = 501 [M+H]+
Se disolvió 2-(2-clorofen¡l)-A/-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[2-(et¡lam¡no)p¡r¡m¡d¡n-5-¡l]fen¡l)acetam¡da (150 mg, 299 jm ol) en metanol (1,2 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (140 j l) a 50 °C hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el producto final 25,1 mg (95 % de pureza, 18 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (lENpos): m/z = 446 [M+H]+
RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,15 (t, 3H), 3,89 (s, 2H), 7,14 - 7,41 (m, 6H), 7,42 - 7,56 (m, 2H), 7,83 (dd, 1H), 8,23 (s, 2H), 8,35 (d, 1H), 10,64 (s, 1H).
Ejemplo 313
-(2-Clorofeml)-N-[4-(2-metilpirímidm-5-M)-3-sulfamoilfeml]acetamida
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (100 mg, 198 jm ol) se le añadieron 5-bromo-2-metilpirimidina (75,4 mg, 436 jm ol) y fluoruro de potasio (25,3 mg, 436 jm ol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (5,57 mg, 10,9 jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
CL-EM (Procedimiento B): Tr = 0,98 min; EM (lENpos): m/z = 472 [M+H]+
Se disolvió 2-(2-clorofenil)-W-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(2-metilpirimidin-5-il)fenil]acetamida (150 mg, 318 jm ol) en metanol (1,3 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (200 j l) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%), después Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (10,0 mg, 93 % de pureza, 7 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (lENpos): m/z = 417 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,67 (s, 3H), 3,91 (s, 2H), 7,28 - 7,38 (m, 3H), 7,41 - 7,58 (m, 4H), 7,88 (dd, 1H), 8,40 (d, 1H), 8,63 (s, 2H), 10,71 (s, 1H).
Ejemplo 314
-(2-Clorofeml)-N-{4-[2-(propilammo)pirímidm-5-M]-3-sulfamoMfeml}acetamida
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (150 mg, 297 jm ol) se le añadieron 5-bromo-A/propilpirimidin-2-amina (141 mg, 654 |jmol) y fluoruro de potasio (38,0 mg, 654 |jmol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (8,35 mg, 16,3 jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 2 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 90,0 mg (53 % de rendimiento). CL-EM (Procedimiento B): Tr = 1,12 min; EM (lENpos): m/z = 515 [M+H+]
Se disolvió 2-(2-clorofen¡l)-A/-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[2-(prop¡lam¡no)p¡rim¡d¡n-5-¡l]fen¡l)acetam¡da (90,0 mg, 175 jm ol) en metanol (1,8 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (200 j l) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (30,3 mg, 95 % de pureza, 36 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,01 min; EM (lENpos): m/z = 460 [M+H+]
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,91 (t, 3H), 1,56 (sxt, 2H), 3,23 - 3,29 (m, 2H), 3,89 (s, 2H), 7,21 - 7,37 (m, 6H), 7,42 - 7,52 (m, 2H), 7,83 (dd, 1H), 8,23 (s, 2H), 8,35 (d, 1H), 10,64 (s, 1H).
Ejemplo 315
2-(2-Clorofeml)-W-(3-sulfamoil-4-{2-[(2,2,2-tr¡fluoroet¡l)ammo]pmm¡dm-5-¡l}feml)acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-N-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (150 mg, 297 jm ol) se le añadieron 5-bromo-N-(2,2,2-trifluoroetil)pirimidin-2-amina (167 mg, 654 jm ol) y fluoruro de potasio (38,0 mg, 654 jm ol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió bis(tri-terc-butilfosfin)pa!adio(0) (CAS 53199-31-8) (8,35 mg, 16,3 jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 2 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 150 mg (80 % de pureza, 66 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,14 min; EM (lENpos): m/z = 555 [M+H+]
Se disolvió 2-(2-clorofenil)-N-(3-{[(dimetilamino)metiliden]sulfamoil}-4-{2-[(2,2,2-trifluoroetil)amino]pirimidin-5-il}fenil)acetamida (150 mg, 80 % de pureza, 216 jmol) en metanol (2,2 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (200 j l) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (41,3 mg, 95 % de pureza, 36 % de rendimiento). CL-EM (Procedimiento B): Tr = 0,99 min; EM (lENpos): m/z = 500 [M+H+]
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,90 (s, 2H), 4,12 - 4,25 (m, 2H), 7,29 - 7,35 (m, 3H), 7,39 (s, 2H), 7,43 - 7,49 (m, 2H), 7,81 - 7,92 (m, 2H), 8,32 (s, 2H), 8,36 (d, 1H), 10,66 (s, 1H).
Ejemplo 316
2-(2-Clorofeml)-W-{4-[2-(c¡clobutMox¡)p¡r¡m¡dm-5-M]-3-sulfamo¡lfeml}acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (150 mg, 297 pmol) se le añadieron 5-bromo-2-(ciclobutiloxi)pirimidina (150 mg, 654 pmol) y fluoruro de potasio (38,0 mg, 654 pmol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (8,35 mg, 16,3 pmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 2 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 110 mg (64 % de rendimiento). CL-EM (Procedimiento B): Tr = 1,20 min; EM (lENpos): m/z = 528 [M+H+]
Se disolvió 2-(2-clorofenil)-A/-(4-[2-(ciclobutiloxi)pirimidin-5-il]-3-{[(dimetilamino)metiliden]sulfamoil}fenil)acetamida (110 mg, 208 pmol) en metanol (2,3 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (200 pl) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (10,6 mg, 95 % de pureza, 10 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,07 min; EM (lENpos): m/z = 473 [M+H+]
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,59 -1,71 (m, 1H), 1,81 (q, 1H), 2,06 -2,24 (m, 2H), 2,39 -2,47 (m, 2H), 3,89 (s, 2H), 5,08 - 5,26 (m, 1H), 7,26 - 7,40 (m, 5H), 7,42 - 7,52 (m, 2H), 7,86 (dd, 1H), 8,37 (d, 1H), 8,50 (s, 2H), 10,69 (s, 1H).
Ejemplo 317
W-[4-(2-Cloro-4-metMp¡r¡m¡dm-5-M)-3-sulfamoilfeml]-2-(2-clorofeml)acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (400 mg, 792 pmol) se le añadieron 5-bromo-2-cloro-4-metilpirimidina (362 mg, 1,74 mmol) y fluoruro de potasio (101 mg, 1,74 mmol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (22,3 mg, 43,6 pmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 2 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 124 mg (28 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,12 min; EM (lENneg): m/z = 504 [M-H+]
Se disolvió W-[4-(2-cloro-4-metilpirimidin-5-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]-2-(2-clorofenil)acetamida (124 mg, 245 pmol) en metanol (2,5 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (200 pl) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32%), después Waters XBrigde C18 5p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (2,60 mg, 95 % de pureza, 2 % de rendimiento).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (lENpos): m/z = 451 [M+H+]
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,20 (s, 3H), 3,91 (s, 2H), 7,27 - 7,39 (m, 3H), 7,41 - 7,56 (m, 4H), 7,89 (dd, 1H), 8,31 - 8,45 (m, 2H), 10,73 (s, 1H).
Ejemplo 318
2-(2-Clorofeml)-W-{3-sulfamo¡l-4-[4-(tr¡fluoromet¡l)pmdm-2-¡l]feml}acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (300 mg, 594 pmol) se le añadieron 2-bromo-4-(trifluorometil)piridina (296 mg, 1,31 mmol) y fluoruro de potasio (76,0 mg, 1,31 mmol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (16,7 mg, 32,7 pmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 3 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 150 mg (44 % de rendimiento). CL-EM (Procedimiento B): Tr = 1,17 min; EM (lENpos): m/z = 525 [M+H]+
Se disolvió 2-(2-clorofenil)-W-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[4-(trifluorometil)piridin-2-il]fenil)acetamida (50,0 mg, 95,2 pmol) en metanol (1,2 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (200 pl) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (9,90 mg, 95 % de pureza, 21 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,17 min; EM (lENpos): m/z = 470 [M+H]+
RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,91 (s, 2H), 6,90 - 7,22 (s, 1H), 7,25 - 7,42 (m, 3H), 7,44 - 7,53 (m, 2H), 7,61 (d, 1H), 7,78 (d, 1H), 7,97 (dd, 1H), 8,10 (s, 1H), 8,35 (s, 1H), 8,93 (d, 1H), 10,73 (s, 1H).
Ejemplo 319
2-(2-Clorofeml)-W-[4-(5-cloropmdm-2-¡l)-3-sulfamo¡lfeml]acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-A/-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (300 mg, 594 pmol) se le añadieron 2-bromo-5-cloropiridina (252 mg, 1,31 mmol) y fluoruro de potasio (76,0 mg, 1,31 mmol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (16,7 mg, 32,7 pmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 3 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 100 mg (31 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,11 min; EM (lENneg): m/z = 489 [M-H]+
Se disolvió 2-(2-clorofenil)-W-[4-(5-cloropiridin-2-il)-3-{[(dimetilamino)metiliden]sulfamoil}-fenil]acetamida (68,8 mg, 140 pmol) en metanol (0,6 ml) y se trató con solución acuosa de hidróxido de sodio al 32 % (200 pl) a temperatura ambiente durante 1 h, después se agitó a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%), después Waters XBrigde C18 5p 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) para dar el compuesto del título (7,20 mg, 93 % de pureza, 11 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,13 min; EM (lENneg): m/z = 434 [M-H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,91 (s, 2H), 7,26 - 7,38 (m, 2H), 7,39 - 7,51 (m, 4H), 7,56 (d, 1H), 7,65 (d, 1H), 7,98 (dd, 1H), 8,03 -8,15 (m, 1H), 8,36 (d, 1H), 8,73 (d, 1H), 10,74 (s, 1H).
Ejemplo 320
2-(2-Clorofeml)-W-[4-(1,2-d¡met¡MH-¡m¡dazol-4-¡l)-3-sulfamoilfeml]acetam¡da
A una solución que contenía el intermedio éster borónico 2-(2-clorofenil)-N-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida (100 mg, 198 jm ol) se le añadieron 4-bromo-1,2-dimetil-1 H-imidazol (76,3 mg, 436 jm ol) y fluoruro de potasio (25,3 mg, 436 jm ol) en atmósfera de argón. La solución se purgó con argón durante 5 minutos y se añadió dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (7,67 mg, 10,9 |jmol). La solución se purgó nuevamente con argón y la reacción se calentó a 80 °C durante 2 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, hexano / acetato de etilo) para dar 11,6 mg (11 % de rendimiento).
CL-EM (Procedimiento A): Tr = 0,8 min; EM (ESlnes): m/z = 472 [M-H]+
Se disolvió 2-(2-clorofenil)-N-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(1,2-dimetil-1H-imidazol-4-il)fenil]acetamida (11,6 mg, 24,5 jmol) en amoníaco en metanol (1,2 ml, 7 M, 10 eq) y se agitó a temperatura ambiente durante la noche. Después el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía HPLC (Chromatorex C-1810 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (1,80 mg, 95 % de pureza, 17 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,99 min; EM (lENpos): m/z = 419 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,34 (s, 3H), 3,61 (s, 3H), 3,87 (s, 2H), 7,27 - 7,36 (m, 2H), 7,38 (s, 1H), 7,40 - 7,55 (m, 3H), 7,87 (dd, 1H), 8,23 (d, 1H), 8,31 (s, 2H), 10,57 (s, 1H).
Ejemplo 321
W-{6-[1-(D¡fluorometM)-1H-p¡razol-4-M]-5-sulfamo¡lp¡ridm-3-M}-2-(2-fluorofeml)acetam¡da
Se disolvió 5-amino-2-[1-(difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metiliden]piridin-3-sulfonamida (400 mg, 1,16 mmol) en DMF (10 ml) y se añadió ácido (2-fluorofenil)acético (179 mg, 1,16 mmol), después se añadieron N,N-diisopropiletilamina (1,0 ml, 5,8 mmol) y HATU (530 mg, 1,39 mmol). La reacción se agitó a temperatura ambiente durante 2 h. El disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar 30,0 mg (5 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,99 min; EM (lENpos): m/z = 481 [M+H]+
Se disolvió N-(6-[1-(difluorometil)-1H-pirazol-4-il]-5-{[(dimetilamino)metiliden]sulfamoil}piridin-3-il)-2-(2-fluorofenil)acetamida (30,0 mg, 62,4 jm ol) en amoníaco en metanol (10 ml, 7 M) y se agitó a temperatura ambiente. Después el disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%)) para dar el compuesto del título (10,1 mg, 99 % de pureza, 38 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,66 min; EM (lENpos): m/z = 426 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,83 (s, 2H), 7,15 -7,24 (m, 2H), 7,31 -7,38 (m, 1H), 7,42 (td, 1H), 7,71 -8,07 (m, 3H), 8,29 (s, 1H), 8,70 (s, 1H), 8,78 (d, 1H), 8,93 (d, 1H), 10,86 (s, 1H).
Ejemplo 322
2-(2-Clorofeml)-W-{4-[5-(p¡rrol¡dm-1-¡l)pmdm-3-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (250 mg, 545 |jmol) y ácido [5-(p¡rrol¡d¡n-1-¡l)p¡r¡d¡n-3-¡l]borón¡co (209 mg, 1,09 mmol) en n-propanol (8,1 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (19,2 mg, 27,2 jmol), tr¡fen¡lfosf¡na (7,16 mg, 27 jm ol) y fluoruro de potas¡o (7,91 mg, 136 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó fosfato de potas¡o acuoso (540 j l , 2,0 M, 1,1 mmol). La reacc¡ón se calentó a 100 °C durante 3 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
CL-EM (Proced¡m¡ento B): Tr = 1,16 m¡n; EM (lENpos): m/z = 526 [M+H]+
Se d¡solv¡ó 2-(2-clorofen¡l)-W-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[5-(p¡rrol¡d¡n-1-¡l)p¡r¡d¡n-3-¡l]fen¡l)acetam¡da (190 mg, 361 jmol) en metanol (1,5 ml) y se trató con soluc¡ón acuosa de h¡dróx¡do de sod¡o al 32 % (200 jl, 3,6 mmol) durante 1 h a temperatura amb¡ente, después se ag¡tó a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (79,1 mg, 95 % de pureza, 44 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 1,08 m¡n; EM (lENpos): m/z = 417 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,87 -2,06 (m, 4H), 3,22 -3,30 (m, 4H), 3,90 (s, 2H), 6,86 -6,97 (m, 1H), 7,20 (s, 2H), 7,27 - 7,40 (m, 3H), 7,43 - 7,52 (m, 2H), 7,80 (d, 1H), 7,83 (dd, 1H), 7,90 (d, 1H), 8,37 (d, 1H), 10,65 (s, 1H).
Ejemplo 323
2-(2-Clorofeml)-W-[4-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-3-sulfamo¡lfeml]-2-h¡drox¡etanam¡da
Se d¡solv¡eron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (1,45 g, 3,16 mmol), 1-c¡cloprop¡l-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (740 mg, 3,16 mmol), d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (111 mg, 158 jm ol) y tr¡fen¡lfosf¡na (41,5 mg, 158 jm o l) en n-propanol (40 ml) y la soluc¡ón se purgó con argón durante 5 m¡nutos. Después se añad¡ó soluc¡ón acuosa de carbonato de potas¡o (9,5 ml, 1,0 M, 9,5 mmol) y la mezcla de reacc¡ón se ag¡tó durante 1 ha 80 °C. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡ó acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de et¡lo tres veces. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage Isolera, grad¡ente hexano / acetato de et¡lo) para dar 310 mg (20 % de rend¡m¡ento).
Este ¡ntermed¡o am¡da (310 mg, 638 jm ol) se d¡solv¡ó en metanol (30 ml) y se trató con soluc¡ón acuosa de amoníaco al 25 % (30 ml). La reacc¡ón se ag¡tó a temperatura amb¡ente durante 16 h. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (43,3 mg, 99 % de pureza, 15 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 0,88 m¡n; EM (lENpos): m/z = 447 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,98 (dd, 2H), 1,04 - 1,14 (m, 2H), 3,67 - 3,80 (m, 1H), 5,51 (d, 1H), 6,69 (d, 1H), 7,18 (s, 2H), 7,30 - 7,49 (m, 4H), 7,58 (s, 1H), 7,68 (d, 1H), 7,87 (d, 1H), 8,05 (s, 1H), 8,51 (d, 1H), 10,42 (s, 1H).
Ejemplo 324
2-(2-Clorofeml)-W-{4-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡lfeml}-2-h¡drox¡etanam¡da
Este compuesto se aisló como un subproducto formado durante la reacción de Suzuki (observado cuando se usó carbonato de potasio como base):
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (1,10 g, 2,40 mmol), 1-(difluorometil)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (585 mg, 2,40 mmol), dicloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (84,4 mg, 12o pmol) y tr¡fen¡lfosf¡na (31,4 mg, 120 pmol) en n-propanol (40 ml) y la soluc¡ón se purgó con argón durante 5 m¡nutos. Después, se añad¡ó carbonato de potas¡o acuoso (7,2 ml, 1,0 M, 7,2 mmol) y la mezcla de reacc¡ón se ag¡tó durante 1 h a 100 °C. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡ó acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de et¡lo tres veces. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage Isolera, grad¡ente hexano / acetato de et¡lo) para dar 460 mg (39 % de rend¡m¡ento).
Este ¡ntermed¡o am¡da (460 mg, 928 pmol) se d¡solv¡ó en metanol (40 ml) y se trató con soluc¡ón acuosa de amoníaco al 25 % (40 ml). La reacc¡ón se ag¡tó a temperatura amb¡ente durante 16 h. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 pm, 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (4,7 mg, 95 % de pureza, 1 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 0,86 m¡n; EM (lENpos): m/z = 457 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 5,52 (d, 1H), 6,72 (d, 1H), 7,30 - 7,44 (m, 4H), 7,44 - 7,53 (m, 2H), 7,60 (dd, 1H), 7,67 - 8,06 (m, 3H), 8,44 (s, 1H), 8,56 (d, 1H), 10,50 (s, 1H).
Ejemplo 325
2-(2-Clorofeml)-N-[4-(5-cloropmdm-3-M)-3-sulfamoilfeml]acetamida
Se d¡solv¡eron 2-cloro-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (1,00 g, 2,59 mmol) y ác¡do (5-clorop¡r¡d¡n-3-¡l)borón¡co (814 mg, 5,17 mmol) en DMF (10 ml), después se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(M) (CAS 13965-03-2) (273 mg, 388 pmol) y carbonato de potas¡o acuoso (6,2 ml, 1,0 M, 6,2 mmol). La reacc¡ón se calentó durante 1 h a 120 °C en el m¡croondas. La mezcla de reacc¡ón se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage, hexano/ acetato de et¡lo 1/1) para dar 700 mg (58 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento A): Tr = 1,20 m¡n; EM (lENpos): m/z = 396 [M+H]+
Se suspend¡ó h¡erro (421 mg, 7,54 mmol) y acetato de amon¡o (404 mg, 7,54 mmol) en agua (20 ml). Se d¡solv¡ó 2-(5-clorop¡r¡d¡n-3-¡l)-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (700 mg, 1,51 mmol) en THF/metanol (10 ml/10 ml) y se añad¡ó a la suspens¡ón acuosa. La mezcla de reacc¡ón se calentó durante 2 h a 80 °C y una vez completa la reacc¡ón se f¡ltró sobre Cel¡te. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se d¡solv¡ó en acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal.
Se d¡solv¡ó 5-am¡no-2-(5-clorop¡r¡d¡n-3-¡l)-A/-(2,4-d¡metox¡benc¡l)bencensulfonam¡da (690 mg, 1,59 mmol) en d¡clorometano (9,4 ml) y la soluc¡ón se enfr¡ó a 0 °C. Se añad¡ó cloruro de (2-clorofen¡l)acet¡lo (110 pl, 800 pmol) y tr¡et¡lam¡na (1,3 ml, 9,5 mmol) y la ag¡tac¡ón se cont¡nuó durante 4 h a 0 °C. Se añad¡ó cloruro de (2-clorofen¡l)acet¡lo (110 pl, 800 pmol) y se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente durante 18 h. Después, se añad¡ó agua y las fases se separaron. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante cromatografía en columna sobre gel de síl¡ce (B¡otage,
gradiente de acetato de etilo en hexano 10 %) para dar 179 mg (19 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,32 min; EM (lENpos): m/z = 586 [M+H]+
Se disolvió 2-(2-clorofenil)-A/-{4-(5-cloropiridin-3-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida (179 mg, 305 |jmol) en diclorometano (3,9 ml), se añadió ácido trifluoroacético (3,9 ml, 50 mmol) y se continuó la agitación a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se disolvió en acetato de etilo y se lavó con agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (12,0 mg, 95 % de pureza, 9 % de rendimiento).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (IENpos): m/z = 436 [M+H]+
RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,90 (s, 2H), 7,27 - 7,38 (m, 3H), 7,41 (s, 2H), 7,43 - 7,48 (m, 2H), 7,82 - 7,94 (m, 2H), 8,38 (d, 1H), 8,48 (d, 1H), 8,61 (d, 1H), 10,70 (s, 1H).
Ejemplo 326
2-(2-Clorofeml)-W-{4-[1-(d¡fluorometM)-1H-p¡razol-4-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (1,50 g, 3,27 mmol), 1-(difluorometil)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (958 mg, 3,92 mmol) y fluoruro de potasio (418 mg, 7,19 mmol) en DMF (36 ml). La mezcla se purgó con argón durante 5 minutos, después se añadió bis(triferc-but¡lfosfin)paladio(0) (CAS 53199-31-8) (83,5 mg, 163 jmol). La reacción se calentó durante 1 ha 100 °C, se filtró sobre un filtro de fibra de vidrio y el procedimiento se repitió. Después, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (2,78 g).
Se disolvió 2-(2-clorofenil)-A/-(4-[1-(difluorometil)-1H-pirazol-4-il]-3-{[(dimetilamino)metiliden]sulfamoil}fenil)acetamida (2,78 g, 5,61 mmol) en metanol (90 ml) y se trató con solución acuosa de amoníaco al 25 % (90 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, etanol en diclorometano 8 %) y después mediante HPLC (Chromatorex C-1810 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (1,09 g, 99 % de pureza, 34 % al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,94 min; EM (IENpos): m/z = 441 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,89 (s, 2H), 7,31 - 7,35 (m, 2H), 7,41 (s, 2H), 7,43 - 7,50 (m, 3H), 7,69 - 8,00 (m, 2H), 8,02 (m, 1H), 8,36 (d, 1H), 8,43 (m, 1H), 10,65 (s, 1H).
Ejemplo 327
2-(2-Clorofeml)-W-[4-(5-fluorop¡r¡dm-3-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron 2-bromo-W-[(dimetilamino)metiliden]-5-nitrobencensulfonamida (400 mg, 1,19 mmol) y ácido (5-fluoropiridin-3-il)borónico (335 mg, 2,38 mmol) en n-propanol (110 ml, 1,5 mol) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (41,9 mg, 59,5 jmol), trifenilfosfina (21,6 mg, 59,5 jm ol) y solución
acuosa de carbonato de potasio (1,8 ml, 2,0 M, 3,6 mmol). La reacción se calentó a 120 °C durante 1 h (0,4 MPa/40 W). La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(5-fluoropiridin-3-il)-5-nitrobencensulfonamida (400 mg, 1,35 mmol) en metanol (37 ml) y el recipiente se purgó con nitrógeno. Se añadió platino sobre carbón (5 % de carga, 71,4 mg, 366 pmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (400 mg).
Se disolvió 5-amino-2-(5-fluoropiridin-3-il)bencensulfonamida (200 mg, 748 pmol) en DMF (5,3 ml) y se añadió ácido (2-clorofenil)acético (153 mg, 898 pmol), después se añadieron N,N-diisopropiletilamina (620 pl, 3,7 mmol) y HATU (455 mg, 1,20 mmol). La reacción se agitó durante 18 h a 50 °C. Después, se añadió diclorometano y agua y se separaron las fases. La fase acuosa se lavó con diclorometano, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %), después Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (4,70 mg, 95 % de pureza, 1 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 0,93 min; EM (lENpos): m/z = 420 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,90 (s, 2H), 7,31 - 7,37 (m, 3H), 7,40 (s, 2H), 7,42 - 7,48 (m, 2H), 7,68 - 7,75 (m, 1H), 7,87 (dd, 1H), 8,34 - 8,44 (m, 2H), 8,57 (d, 1H), 10,71 (s, 1H).
Ejemplo 328
2-(2-Clorofeml)-W-{4-[1-(2-metNpropN)-1H-p¡razol-4-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (200 mg, 436 pmol) y 1- (2-metilpropil)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (220 pl, 870 pmol) en n-propanol (5,9 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (15,3 mg, 21,8 pmol), trifenilfosfina (5,72 mg, 21,8 pmol) y solución acuosa de carbonato de potasio (540 pl, 2,0 M, 1,1 mmol). La reacción se purgó con argón durante 5 minutos y después se calentó a 80 °C durante 3 h. Después, la mezcla se filtró sobre Celite y el disolvente se retiró a presión reducida.
El material en bruto se disolvió en metanol (51 ml) y se trató con hidróxido de sodio acuoso al 32 % (100 ml) a 40 °C hasta completarse la reacción. La mezcla de reacción se neutralizó mediante la adición de HCl 2 N. El disolvente se retiró a presión reducida y se añadió diclorometano y agua. Las fases se separaron y la fase acuosa se lavó con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (10,9 mg, 98 % de pureza, 5 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 1,09 min; EM (lENneg): m/z = 445 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,86 (d, 6 H), 2,01 -2,22 (m, 1H), 3,87 (s, 2H), 3,92 (d, 2H), 7,16 (s, 2H), 7,27 - 7,38 (m, 2H), 7,38 - 7,51 (m, 3H), 7,64 - 7,73 (m, 1H), 7,78 - 7,83 (m, 1H), 7,95 - 8,00 (m, 1H), 8,31 (d, 1H), 10,57 (s, 1H).
Ejemplo 329
2- (2-Clorofeml)-W-[4-(1-c¡clopent¡l-1H-p¡razol-4-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (200 mg, 436 |jmol) y 1- c¡clopent¡l-4-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (229 mg, 872 jm ol) en n-propanol (5,9 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (15,3 mg, 21,8 jmol), tr¡fen¡lfosf¡na (5,72 mg, 2 l,8 jm ol) y soluc¡ón acuosa de carbonato de potas¡o (540 jl, 2 M, 1,1 mmol). La mezcla de reacc¡ón se purgó con argón durante 5 m¡nutos y después se ag¡tó durante 2 h a 80 °C. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (250 mg).
Se d¡solv¡ó 2-(2-clorofen¡l)-W-[4-(1-c¡clopent¡l-1H-p¡razol-4-¡l)-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l]acetam¡da (250 mg, 486 jm ol) en metanol (5,0 ml) y se trató con soluc¡ón acuosa de h¡dróx¡do de sod¡o al 32 % (300 j l) a 65 °C hasta completarse la reacc¡ón. Se añad¡ó d¡clorometano y agua y las fases se separaron. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C185 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %), después Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (7,80 mg, 98 % de pureza, 3 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 1,12 m¡n; EM (lENpos): m/z = 459 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,56 - 1,71 (m, 2H), 1,74 - 1,89 (m, 2H), 1,90 - 2,03 (m, 2H), 2,03 - 2,17 (m, 2H), 3,87 (s, 2H), 4,63 - 4,77 (m, 1H), 7,17 (s, 2H), 7,27 - 7,36 (m, 2H), 7,39 - 7,50 (m, 3H), 7,70 (s, 1H), 7,77 - 7,85 (m, 1H), 8,03 (s, 1H), 8,31 (d, 1H), 10,56 (s, 1H).
Ejemplo 330
2- (2-Clorofeml)-W-[2'-flúor-3'-(propan-2-¡lox¡)-2-sulfamo¡lb¡feml-4-¡l]acetam¡da
Se d¡solv¡eron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (250 mg, 545 jm ol) y ác¡do [2-flúor-3-(propan-2-¡lox¡)fen¡l]borón¡co (108 mg, 545 jm ol) en n-propanol (10 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (19,2 mg, 27,2 jm ol) y tr¡fen¡lfosf¡na (7,15 mg, 27,2 jmol). La mezcla de reacc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó soluc¡ón acuosa de carbonato de potas¡o (1,6 ml, 1,0 M, 1,6 mmol). La reacc¡ón se calentó a 100 °C durante 2 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (630 mg).
Se d¡solv¡ó 2-(2-clorofen¡l)-W-[2-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-2'-flúor-3'-(propan-2-¡lox¡)b¡fen¡l-4-¡l]acetam¡da (630 mg, 1,18 mmol) en metanol (25 ml) y se trató con soluc¡ón acuosa de amoníaco 33 % (25 ml) a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el producto f¡nal (37,6 mg, 95 % de pureza, 6 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 1,24 m¡n; EM (lENpos): m/z = 477 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,24 - 1,34 (m, 6 H), 3,89 (s, 2H), 4,54 -4,66 (m, 1H), 6,77 -6,90 (m, 1H), 7,00 - 7,11 (m, 1H), 7,17 (m, 3H), 7,22 -7,39 (m, 3H), 7,43 -7,52 (m, 2H), 7,81 (dd, 1H), 8,34 (d, 1H), 10,65 (s, 1H).
Ejemplo 331
2-(2-Clorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)pmdm-3-¡l]feml}acetam¡da
Se disolvieron A/-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (500 mg, 1,09 mmol) y ácido [5-(tr¡fluoromet¡l)p¡r¡d¡n-3-¡l]borón¡co (520 mg, 2,72 mmol) en n-propanol (15 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (38,4 mg, 54,5 pmol), tr¡fen¡lfosf¡na (14,3 mg, 54,5 pmol), fluoruro de potas¡o (23,1 mg, 270 pmol) y soluc¡ón acuosa de carbonato de potas¡o (1,4 ml, 2,0 M, 2,7 mmol). La reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas (0,1 MPa/ 15W). Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se dest¡ló conjuntamente con THF y se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 2-(2-clorofen¡l)-W-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[5-(tr¡fluoromet¡l)p¡r¡d¡n-3-¡l]fen¡l)acetam¡da (1,50 g, 2,86 mmol) en metanol (29 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (1,6 ml) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage, acetato de et¡lo en hexano 40% ) y después med¡ante HPLC (Chromatorex C-18 10 pm, 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (562 mg, 95% de pureza, 40% de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento A): Tr = 1,13 m¡n; EM (lENneg): m/z = 468 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,91 (s, 2H), 7,28 - 7,37 (m, 2H), 7,39 (d, 1H), 7,42 - 7,51 (m, 4H), 7,88 (dd, 1H), 8,10 - 8,16 (m, 1H), 8,40 (d, 1H), 8,81 (d, 1H), 8,96 (d, 1H), 10,73 (s, 1H).
Ejemplo 332
W-[4-(6-Cloro-5-metoxipmdm-3-N)-3-sulfamoNfeml]-2-(2-clorofeml)acetamida
Se d¡solv¡eron clorh¡drato de W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (1:1) (250 mg, 50 % de pureza, 252 pmol) y 2-cloro-3-metox¡-5-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)p¡r¡d¡na (81,6 mg, 303 pmol) en DMF (7 ml) y se añad¡ó fluoruro de potas¡o (32,3 mg, 555 pmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó b¡s(tr¡-terc-but¡lfosf¡n)palad¡o(0) (CAS 53199-31-8) (6,45 mg, 12,6 pmol). La soluc¡ón se purgó nuevamente con argón durante 1 m¡nuto y después se calentó a 100 °C durante 18 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se dest¡ló conjuntamente con THF y se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (270 mg).
CL-EM (Proced¡m¡ento B): Tr = 1,12 m¡n; EM (lENpos): m/z = 521 [M+H]+
Se d¡solv¡ó W-[4-(6-cloro-5-metox¡p¡r¡d¡n-3-¡l)-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l]-2-(2-clorofen¡l)acetam¡da (270 mg, 259 pmol) en metanol (2,7 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (100 pl, 850 pmol) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 pm, 125x30 mm, aceton¡tr¡lo/agua 0 ,2 % de amoníaco acuoso (32%)) para dar el compuesto del título (24,2 mg, 95 % de pureza, 19 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 1,02 m¡n; EM (lENpos): m/z = 466 [M+H]+
RMN 1H (400MHz, DMSO-d6 ): Sh¡ft [ppm]= 3,86 -3,91 (m, 5H), 7,28 - 7,39 (m, 5H), 7,41 - 7,47 (m, 2H), 7,54 (d, 1H), 7,86 (dd, 1H), 7,91 (d, 1H), 8,37 (d, 1H), 10,68 (s, 1H).
Ejemplo 333
2-(2-Cloro-6-fluorofeml)-W-[4-(1-ciclopropiMH-pirazol-4-N)-3-sulfamoNfeml]acetamida
Se disolvió 5-am¡no-2-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-N-[(d¡met¡lam¡no)met¡l¡den]bencensulfonam¡da (200 mg, 600 |jmol) en DMF (10 ml) y se añadió ácido (2-cloro-6-fluorofen¡l)acét¡co (136 mg, 720 jmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (520 jl, 3,0 mmol) y HATU (456 mg, 1,20 mmol). La reacción se calentó a 50 °C durante 16 h. Después, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (750 mg).
Se disolvió 2-(2-cloro-6-fluorofen¡l)-N-[4-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-3-{[(d¡met¡lam¡no)met¡l¡den]-sulfamoil}fenil]acetamida (302 mg, 600 jm ol) en metanol (5,0 ml) y se trató con solución acuosa de amoníaco al 25 % (10 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) para dar el compuesto del título (21,5 mg, 94 % de pureza, 8 % de rendimiento al cabo de 5 pasos). CL-EM (Procedimiento A): Tr = 1,03 min; EM (lENneg): m/z = 447 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,91 -1,00 (m, 2H), 1,04 -1,12 (m, 2H), 3,66 -3,79 (m, 1H), 3,92 (d, 2H), 7,13 - 7,33 (m, 3H), 7,33 - 7,46 (m, 3H), 7,63 - 7,71 (m, 1H), 7,74 - 7,81 (m, 1H), 8,00 - 8,08 (m, 1H), 8,31 (d, 1H), 10,66 (s, 1H).
Ejemplo 334
2-(2-Cloro-3-fluorofeml)-W-[4-(1-metiMH-pirazol-4-M)-3-sulfamoMfeml]acetamida
Se disolvió 5-am¡no-2-(1-metil-1H-p¡razol-4-¡l)bencensulfonam¡da (200 mg, 793 jm ol) en DMF (6 , 6 ml) y se añadió ácido (2-cloro-3-fluorofenil)acét¡co (179 mg, 951 jmol), después se añadieron N,N-di¡sopropilet¡lam¡na (690 jl, 4,0 mmol) y HATU (482 mg, 1,27 mmol). La reacción se agitó a 50 °C durante 18 h. Después, se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se lavó con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%)) para dar el compuesto del título (111 mg, 95 % de pureza, 32 % de rendimiento al cabo de 4 pasos).
CL-EM (Procedimiento B): Tr = 0,90 min; EM (lENneg): m/z = 421 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,86 (s, 3H), 3,93 (s, 2H), 7,17 (s, 2H), 7,27 - 7,45 (m, 4H), 7,64 - 7,68 (m, 1H), 7,77 - 7,83 (m, 1H), 7,94 - 7,98 (m, 1H), 8,31 (d, 1H), 10,60 (s, 1H).
Ejemplo 335
W-[4-(1-íerc-ButiMH-pirazol-4-M)-3-sulfamoMfeml]-2-(2-clorofeml)acetamida
Se disolvió 5-am¡no-2-(1-ferc-but¡l-1H-pirazol-4-¡l)bencensulfonam¡da (125 mg, 425 |jmol) en DMF (3,0 ml) y se añadió ácido (2-clorofeml)acético (86,9 mg, 510 jmol), después se añadieron WW-diisopropiletilamina (370 jl, 2,1 mmol) y HATU (258 mg, 679 jmol). La reacción se agitó durante 18 h a 50 °C. Se añadieron agua y diclorometano y las fases se separaron. La fase acuosa se lavó con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%), después Waters XBrigde C18 5 j 100x30 mm, metanol/agua 0,1 % de ácido fórmico) para dar el compuesto del título (5,60 mg, 80 % de pureza, 2 % de rendimiento al cabo de 4 pasos).
CL-EM (Procedimiento B): Tr = 1,07 min; EM (lENneg): m/z = 445 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,54 (s, 9H), 3,87 (s, 2H), 7,15 (s, 2H), 7,30 - 7,39 (m, 2H), 7,39 - 7,52 (m, 3H), 7,74 (d, 1H), 7,78 - 7,86 (m, 1H), 8,10 (d, 1H), 8,31 (d, 1H), 10,56 (s, 1H).
Ejemplo 336
2-(2-Clorofeml)-W-{4-[2-(propan-2-¡lox¡)p¡r¡dm-3-¡l]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron W -^-bromo^-^dimetilam ino^etiNden^ulfamoNfeml^-p-clorofem^acetamida (200 mg, 436 jm ol) y ácido ^-(propan-^-ilox^piridin^-i^borónico (78,9 mg, 436 jm ol) en n-propanol (10 ml) y se añadieron dicloruro de bis^rifenilfosfin^aladioOl) (CAS 13965-03-2) (15,3 mg, 21,8 jmol), trifenilfosfina (5,72 mg, 21,8 jmol). La mezcla se purgó con nitrógeno durante 5 minutos y se añadió solución acuosa de carbonato de potasio (1,3 ml, 1,0 M, 1,3 mmol). La reacción se calentó a 100 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente (590 mg).
Se disolvió 2-(2-clorofen¡l)-W-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[2-(propan-2-¡lox¡)p¡r¡d¡n-3-¡l]fen¡l)acetam¡da (590 mg, 1,15 mmol) en metanol (51 ml) y se trató con solución acuosa de amoníaco al 25 % (51 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (19,5 mg, 96 % de pureza, 4 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,15 min; EM (lENneg): m/z = 458 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,15 (d, 6 H), 3,89 (s, 2H), 5,15 - 5,28 (m, 1H), 6 , 86 - 6,99 (m, 1H), 7,12 (s, 2H), 7,19 (d, 1H), 7,29 - 7,38 (m, 2H), 7,45 - 7,57 (m, 3H), 7,75 - 7,85 (m, 1H), 8,07 - 8,14 (m, 1H), 8,30 (d, 1H), 10,61 (s, 1H).
Ejemplo 337
2-(2-Cloro-3-fluorofeml)-W-[4-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-3-sulfamo¡lfeml]acetam¡da
Se disolvió 5-am¡no-2-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-N-[(d¡met¡lam¡no)met¡l¡den]bencensulfonam¡da (200 mg, 600 |jmol) en DMF (10 ml) y se añadió ácido (2-cloro-3-fluorofenil)acét¡co (136 mg, 720 jmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (520 jl, 3,0 mmol) y HATU (456 mg, 1,20 mmol). La reacción se agitó a 50 °C durante 16 h. Después, se añad¡ó acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de et¡lo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional ( 810 mg).
Se disolvió 2-(2-cloro-3-fluorofen¡l)-N-[4-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-3-{[(d¡met¡lam¡no)-metiliden]sulfamo¡l}fen¡l]acetam¡da (302 mg, 600 jm ol) en metanol (5 ml) y se trató con solución acuosa de amoníaco al 25 % (5 ml) a temperatura ambiente durante 16 h, después se añadió la misma cantidad de solución de amoníaco y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %), después Waters XBrigde C185 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (19,7 mg, 98 % de pureza, 7 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,06 min; EM (lENneg): m/z = 502 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,90 - 1,00 (m, 2H), 1,03 -1,14 (m, 2H), 3,68 -3,81 (m, 1H), 3,93 (s, 2H), 7,20 (s, 2H), 7,28 - 7,49 (m, 4H), 7,67 (s, 1H), 7,74 - 7,83 (m, 1H), 8,03 (s, 1H), 8,30 (d, 1H), 10,61 (s, 1H).
Ejemplo 338
2-(2-Fluorofeml)-W-[4-(p¡r¡dm-3-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron 2-cloro-N-(2,4-d¡metox¡bencil)-5-n¡trobencensulfonam¡da (1,00 g, 2,59 mmol) y ácido piridin-3-ilborónico (477 mg, 3,88 mmol) en DMF (8,0 ml), después se añadió solución acuosa de carbonato de potasio (4,1 ml, 1,0 M, 4.1 mmol). La reacción se purgó con argón durante 5 minutos y después se añadió dicloruro de bis(trifen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (273 mg, 388 jmol). La reacción se calentó durante 1 h a 120 °C en el microondas. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, acetato de etilo / hexano) para dar 390 mg (35 % de rendimiento).
Se disolvió N-(2,4-dimetox¡benc¡l)-5-n¡tro-2-(p¡r¡d¡n-3-¡l)bencensulfonam¡da (390 mg, 908 jm ol) en THF (20 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 966 mg, 908 jm ol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 2 h. Después se añadió la misma cantidad de paladio sobre carbón y se continuó la agitación hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (490 mg).
Se disolvió 5-amino-N-(2,4-d¡metox¡benc¡l)-2-(p¡r¡d¡n-3-¡l)bencensulfonam¡da (245 mg, 613 jmol) en DMF (5,0 ml) y se añadió ácido (2-fluorofenil)acético (113 mg, 736 jmol), después se añadieron N,N-diisoprop¡let¡lam¡na (530 jl, 3.1 mmol) y HATU (303 mg, 797 jmol). La reacción se agitó a 50 °C durante 16 h. Se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (490 mg).
Se disolvió N-{3-[(2,4-d¡metox¡bencil)sulfamo¡l]-4-(p¡r¡d¡n-3-¡l)fen¡l}-2-(2-fluorofen¡l)acetam¡da (328 mg, 613 jm ol) en diclorometano (2 , 0 ml), se añadió ácido trifluoroacético (2 , 0 ml, 26 mmol) y se continuó la agitación a temperatura
ambiente hasta completarse la reacción. La mezcla de reacción se añadió a una solución acuosa saturada de bicarbonato de sodio. Se añadió diclorometano y las fases se separaron. La fase acuosa se lavó con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 |jm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (49,2 mg, 97 % de pureza, 21 % de rendimiento al cabo de 4 pasos). CL-EM (Procedimiento A): Tr = 0,75 min; EM (lENneg): m/z = 384 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,79 (s, 2H), 7,15 - 7,22 (m, 2H), 7,28 - 7,37 (m, 4H), 7,38 - 7,44 (m, 2H), 7,73 - 7,80 (m, 1H), 7,82 - 7,87 (m, 1H), 8,37 (d, 1H), 8,49 - 8,58 (m, 2H), 10,65 (s, 1H).
Ejemplo 339
2-(2-Cloro-6-fluorofeml)-W-[4-(1-metN-1H-p¡razol-4-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvió 5-amino-2-(1-metil-1H-pirazol-4-il)bencensulfonamida (200 mg, 793 jm ol) en DMF (6 , 6 ml) y se añadió ácido (2-cloro-6-fluorofenil)acético (179 mg, 951 jmol), después se añadieron W,W-diisopropiletilamina (690 jl, 4,0 mmol) y HATU (482 mg, 1,27 mmol). La reacción se agitó a 50 °C durante 18 h. Se añadieron agua y diclorometano y las fases se separaron. La fase acuosa se lavó con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C185 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (67,6 mg, 95 % de pureza, 19 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,89 min; EM (lENneg): m/z = 421 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,86 (s, 3H), 3,92 (d, 2H), 7,18 (s, 2H), 7,22 - 7,29 (m, 1H), 7,33 - 7,45 (m, 3H), 7,62 - 7,69 (m, 1H), 7,75 - 7,79 (m, 1H), 7,94 - 7,98 (m, 1H), 8,31 (d, 1H), 10,65 (s, 1H).
Ejemplo 340
2-(2-Clorofeml)-W-[3'-flúor-5'-(2-h¡drox¡propan-2-¡l)-2-sulfamo¡lb¡feml-4-¡l]acetam¡da
Se disolvieron 2-cloro-5-nitrobencensulfonamida (330 mg, 1,39 mmol) y ácido [3-flúor-5-(2-hidroxipropan-2-il)fenil]borónico (552 mg, 2,79 mmol) en n-propanol (130 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(ll) (CAS 13965-03-2) (49,1 mg, 69,7 jmol), trifenilfosfina (18,3 mg, 69,7 jm ol) y solución acuosa de carbonato de potasio (2,1 ml, 2,0 M, 4,2 mmol). La reacción se purgó con argón durante 5 minutos y después se calentó a 120 °C durante 2 h en el microondas (0,4 MPa/40W). Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente (550 mg).
Se disolvió 3'-flúor-5'-(2-hidroxipropan-2-il)-4-nitrobifenil-2-sulfonamida (330 mg, 931 jm ol) en THF (93 ml) y el recipiente se purgó con nitrógeno. Se añadió platino sobre carbón (5 % de carga, 185 mg, 950 jm ol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 1 h. Después, el recipiente se evacuó y se purgó con hidrógeno tres veces y se continuó la agitación hasta completarse la reacción. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (350 mg).
Se disolvió 4-amino-3'-flúor-5'-(2-hidroxipropan-2-il)bifenil-2-sulfonamida (175 mg, 539 jm ol) en DMF (3,8 ml) y se añadió ácido (2-clorofenil)acético (110 mg, 647 jmol), después se añadieron W,A/-diisopropiletilamina (470 jl,
2,7 mmol) y HATU (328 mg, 863 |jmol). La reacción se agitó a 50 °C durante 18 h. Después se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se lavó con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (dos veces Waters XBrigde C l8 5 j 100x30 mm, metanol/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (10,0 mg, 98 % de pureza, 4 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento J): Tr = 1,28 min; EM (lENneg): m/z = 475 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,43 (s, 6 H), 3,89 (s, 2H), 5,15 (s, 1H), 6,99 -7,08 (m, 1H), 7,12 -7,22 (s, 2H), 7,22 - 7,40 (m, 5H), 7,42 - 7,50 (m, 2H), 7,76 - 7,90 (m, 1H), 8,35 (d, 1H), 10,65 (s, 1H).
Ejemplo 341
2-(2-Clorofeml)-W-[4-(5-metox¡p¡r¡dm-3-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (250 mg, 545 jm ol) y 3-metoxi-5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)piridina (192 mg, 817 jm ol) en n-propanol (10 ml), se añadieron dicloruro de bis(trifenilfosfin)paladio(II) (CAS 13965-03-2) (19,2 mg, 27,2 jm ol) y trifenilfosfina (7,15 mg, 27,2 jm ol) y la solución se purgó con argón durante 5 minutos. Después se añadió solución acuosa de carbonato de potasio (1,6 ml, 1,0 M, 1,6 mmol) y la reacción se agitó durante 2 h a 100 °C. La mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, etanol en diclorometano 5 %) para dar 60 mg (23 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,05 min; EM (lENneg): m/z = 485 [M-H]-Se disolvió 2-(2-clorofenil)-W-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(5-metoxipiridin-3-il)fenil]acetamida (60,0 mg, 123 jm ol) en metanol (10 ml) y se trató con solución acuosa de amoníaco al 25 % (10 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%)) para dar el compuesto del título (4,2 mg, 90 % de pureza, 8 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,92 min; EM (lENneg): m/z = 430 [M-H]-RMN 1 H (400MHz, CD3OD): 8 [ppm]= 3,91 (s, 3H), 3,94 (s, 2H), 7,31 (d, 3H), 7,38 - 7,49 (m, 2H), 7,52 - 7,60 (m, 1H), 7,82 - 7,92 (m, 1H), 8,12 - 8,35 (m, 2H), 8,41 - 8,53 (m, 1H).
Ejemplo 342
2-(2-Clorofeml)-W-[3'-(2-h¡drox¡propan-2-¡l)-2-sulfamo¡lb¡feml-4-¡l]acetam¡da
Se disolvieron W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (200 mg, 436 jm ol) y ácido [3-(2-hidroxipropan-2-il)fenil]borónico (157 mg, 872 jm ol) en n-propanol (12 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(ll) (c As 13965-03-2) (15,3 mg, 21,8 jmol), trifenilfosfina (7,90 mg, 21,8 jm ol) y fluoruro de potasio (50,7 mg, 872 jmol). La solución se purgó durante 5 minutos con argón y se añadió solución acuosa de carbonato de potasio (650 jl, 2,0 M, 1,3 mmol). La reacción se calentó a 80 °C durante 2 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente (250 mg).
Se disolvió 2-(2-clorofenil)-W-[2-{[(dimetilamino)metiliden]sulfamoil}-3'-(2-hidroxipropan-2-il)bifenil-4-il]acetamida (250 mg, 486 jm ol) en metanol (1,8 ml) y se trató con hidróxido de sodio acuoso al 32 % (140 j l ) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el
disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC ((Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %), después Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (7,70 mg, 95 % de pureza, 3 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,02 min; EM (lENneg): m/z = 457 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,43 (s, 6 H), 3,89 (s, 2H), 5,01 (s, 1H), 6,94 (s, 2H), 7,18 - 7,40 (m, 5H), 7,42 - 7,52 (m, 4H), 7,82 (dd, 1H), 8,34 (d, 1H), 10,62 (s, 1H).
Ejemplo 343
2-(2-Fluorofeml)-W-{4-[1-(propan-2-M)-1H-p¡razol-4-M]-3-sulfamoMfeml}acetam¡da
Se disolvieron A/-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fenil)-2-(2-fluorofen¡l)acetam¡da (250 mg, 565 pmol) y 1-(propan-2-il)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (267 mg, 1,13 mmol) en n-propanol (10 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (19,9 mg, 28,3 pmol), trifenilfosfina (7,41 mg, 28,3 pmol) y fluoruro de potasio (7,55 mg, 130 pmol). La solución se purgó con argón durante 5 minutos y se añadió solución acuosa de carbonato de potasio (710 pl, 2,0 M, 1,4 mmol). La reacción se calentó a 120 °C durante 1 h en el microondas (0,4 MPa / 25W). Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente (270 mg).
Se disolvió N-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[1-(propan-2-il)-1H-pirazol-4-il]fenil)-2-(2-fluorofenil)acetamida (250 mg, 530 pmol) en metanol (15 ml) y se trató con hidróxido de sodio acuoso al 32 % (470 pl) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (47,5 mg, 95 % de pureza, 20 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,00 min; EM (lENneg): m/z = 415 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,44 (d, 6 H), 3,76 (s, 2H), 4,43 -4,56 (m, 1H), 7,09 -7,24 (m, 4H), 7,27 -7,51 (m, 3H), 7,67 - 7,74 (m, 1H), 7,77 - 7,85 (m, 1H), 8,02 - 8,05 (m, 1H), 8,30 (d, 1H), 10,55 (s, 1H).
Ejemplo 344
W-[4-(1-C¡clopropil-1H-p¡razol-4-M)-3-sulfamoMfeml]-2-(2-fluorofeml)acetam¡da
Se disolvió 5-amino-2-(1-ciclopropil-1H-pirazol-4-il)-N-[(dimetilamino)metiliden]bencensulfonamida (200 mg, 600 pmol) en DMF (10 ml) y se añadió ácido (2-fluorofenil)acético (111 mg, 720 pmol), después se añadieron N,N-diisopropiletilamina (520 pl, 3,0 mmol) y HATU (456 mg, 1,20 mmol). La reacción se agitó a 50 °C durante 16 h, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvió N-[4-(1-ciclopropil-1H-pirazol-4-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]-2-(2-fluorofenil)acetamida (282 mg, 600 pmol) en metanol (5 ml) y se trató con solución acuosa de amoníaco al 25 % (5 5 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para
dar el compuesto del título (27,2 mg, 98 % de pureza, 11 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,91 min; EM (IENneg): m/z = 413 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 0,91 - 1,01 (m, 2H), 1,04 - 1,13 (m, 2H), 3,67 - 3,82 (m, 3H), 7,13 - 7,26 (m, 4H), 7,28 - 7,37 (m, 1H), 7,37 - 7,47 (m, 2H), 7,67 (d, 1H), 7,80 (dd, 1H), 7,98 - 8,07 (m, 1H), 8,30 (d, 1H), 10,55 (s, 1H).
Ejemplo 345
2-(2-Clorofeml)-W-{3-sulfamoN-4-[1-(tetrahidro-2H-piran-2-M)-1H-pirazol-4-N]feml}acetamida
Se disolvió 5-amino-A/-[(dimetilamino)metiliden]-2-[1-(tetrahidro-2H-piran-2-il)-1H-pirazol-4-il]bencensulfonamida (3,40 g, 9,01 mmol) en DMF (63 ml) y se añadió ácido (2-clorofenil)acético (1,84 g, 10,8 mmol), después se añadieron W,W-diisopropiletilamina (7,8 ml, 45 mmol) y HATU (5,48 g, 14,4 mmol). La reacción se agitó a 50 °C durante 18 h. El disolvente se retiró a presión reducida y se añadió diclorometano y agua. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice recubierto de amoníaco (gradiente de acetato de etilo en hexano 10 %) para dar 2,1 g (50 % de pureza, 43 % de rendimiento). CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENneg): m/z = 528 [M-H]-Se disolvió 2-(2-clorofenil)-W-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[1-(tetrahidro-2H-piran-2-il)-1H-pirazol-4-il]fenil)acetamida (350 mg, 660 pmol) en metanol (15 ml) y se trató con hidróxido de sodio acuoso al 32 % (190 pl) a 80 °C hasta completarse la reacción. Se añadió HCl acuoso (100 pl, 6,0 M) para ajustar el pH a 7. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5p 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) para dar el compuesto del título (31 mg, 80 % de pureza, 8 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 1,02 min; EM (IENneg): m/z = 473 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,45 - 1,61 (m, 2H), 1,61 - 1,74 (m, 1H), 1,88 - 2,01 (m, 2H), 2,02 - 2,17 (m, 1H), 3,60 - 3,71 (m, 1H), 3,81 - 3,98 (m, 3H), 5,42 (dd, 1H), 7,24 (s, 2H), 7,30 - 7,36 (m, 2H), 7,42 - 7,48 (m, 3H), 7,77 (s, 1H), 7,81 (dd, 1H), 8,14 (s, 1H), 8,32 (d, 1H), 10,59 (s, 1H).
Ejemplo 346
W-[4-(1-íerc-ButiMH-pirazol-4-M)-3-sulfamoMfeml]-2-(2-fluorofeml)acetamida
Se disolvió 5-amino-2-(1-terc-butil-1H-pirazol-4-il)bencensulfonamida (125 mg, 425 pmol) en DMF (3,5 ml) y se añadió ácido (2-fluorofenil)acético (78,5 mg, 510 pmol), después se añadieron W,A/-diisopropiletilamina (370 pl, 2,1 mmol) y HATU (258 mg, 679 pmol). La reacción se agitó a 50 °C durante 18 h y se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %), después Waters XBrigde C18 5 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) para dar el compuesto del título (12,8 mg, 96 % de pureza, 7 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,03 min; EM (IENneg): m/z = 429 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,54 (s, 9H), 3,77 (s, 2H), 7,11 -7,22 (m, 4H), 7,29 -7,37 (m, 1H), 7,37 -7,43
(m, 1H), 7,46 (d, 1H), 7,74 (s, 1H), 7,78 - 7,85 (m, 1H), 8,10 (s, 1H), 8,31 (d, 1H), 10,55 (s, 1H).
Ejemplo 347
W-[3'-Fluoro-5'-(2-h¡drox¡propan-2-M)-2-sulfamoilb¡feml-4-M]-2-(2-fluorofeml)acetam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-fluorofen¡l)acetam¡da (500 mg, 1,13 mmol) y ác¡do [3-(etox¡carbon¡l)-5-fluorofen¡l]borón¡co (479 mg, 2,26 mmol) en n-propanol (21 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (39,8 mg, 56,5 jmol), tr¡fen¡lfosf¡na (14,8 mg, 56,5 jm ol) y fluoruro de potas¡o (15,1 mg, 260 jmol). La soluc¡ón se purgó con argón y se añad¡ó soluc¡ón acuosa de carbonato de potas¡o (1,4 ml, 2,0 M, 2,8 mmol). La reacc¡ón se calentó a 100 °C durante 1 h en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage, acetato de et¡lo / hexano) para dar 220 mg (37 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 1,28 m¡n; EM (lENneg): m/z = 528 [M-H]-Se d¡solv¡ó 2'-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-5-flúor-4'-{[(2-fluorofen¡l)acet¡l]am¡no}b¡fen¡l-3-carbox¡lato de et¡lo (220 mg, 415 jm ol) en THF seco (7,6 ml), se añad¡ó soluc¡ón de bromuro de met¡lmagnes¡o en THF (12 ml, 1,0 M, 12 mmol) y la ag¡tac¡ón se cont¡nuó durante 18 h a temperatura amb¡ente. Después se añad¡ó acetato de et¡lo segu¡do por soluc¡ón acuosa saturada de cloruro de amonio. El prec¡p¡tado se ret¡ró por f¡ltrac¡ón, las fases se separaron y la fase orgán¡ca se concentró a pres¡ón reduc¡da. El mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (430 mg).
Se d¡solv¡ó W-[2-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-3’-flúor-5’-(2-h¡drox¡propan-2-¡l)b¡fen¡l-4-¡l]-2-(2-fluorofen¡l)acetam¡da (250 mg, 485 jm ol) en metanol (1,8 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (430 |jl) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2% de amoníaco acuoso (32%)) para dar el compuesto del título (50,2 mg, 95 % de pureza, 21 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 1,01 m¡n; EM (lENneg): m/z = 459 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,43 (s, 6 H), 3,79 (s, 2H), 5,15 (s, 1H), 6,98 - 7,10 (m, 1H), 7,15 - 7,37 (m, 8 H), 7,38 - 7,45 (m, 1H), 7,76 - 7,86 (m, 1H), 8,35 (d, 1H), 10,63 (s, 1H).
Ejemplo 348
W-[4-(1-C¡clopentil-1H-p¡razol-4-M)-3-sulfamoMfeml]-2-(2-fluorofeml)acetam¡da
Se d¡solv¡eron 5-am¡no-2-(1-c¡clopent¡l-1H-p¡razol-4-¡l)bencensulfonam¡da (290 mg, 947 jm ol) en DMF (7,8 ml) y se añad¡ó ác¡do (2-fluorofen¡l)acét¡co (175 mg, 1,14 mmol), después se añad¡eron W,W-d¡¡soprop¡let¡lam¡na (820 jl, 4,7 mmol) y HATU (576 mg, 1,51 mmol). La reacc¡ón se ag¡tó a 50 °C durante 16 h. Se añad¡eron agua y d¡clorometano. Las fases se separaron y la fase acuosa se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se d¡solv¡ó en metanol (2 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (210 j l ) a 80 °C durante 2 h. El pH se ajustó a 7 med¡ante la ad¡c¡ón de HCl acuoso 6 N. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC
(Waters XBrigde C185 p 100x30 mm, metanol/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (37,1 mg, 95 % de pureza, 8 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento J): Tr = 1,26 min; EM (IENneg): m/z = 441 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,57 - 1,73 (m, 2H), 1,73 - 1,89 (m, 2H), 1,89 - 2,03 (m, 2H), 2,03 - 2,15 (m, 2H), 3,76 (s, 2H), 4,63 - 4,79 (m, 1H), 7,13 - 7,25 (m, 4H), 7,28 - 7,49 (m, 3H), 7,71 (d, 1H), 7,76 - 7,85 (m, 1H), 8,03 (d, 1H), 8,30 (d, 1H), 10,55 (s, 1H).
Ejemplo 349
2-(2-Clorofeml)-W-[4-(1-c¡cloprop¡l-1H-p¡razol-4-¡l)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron W-(4-Bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (500 mg, 1,09 mmol), 1- ciclopropil-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (510 mg, 2,18 mmol) y fluoruro de potasio (139 mg, 2,4 mmol) en DMF seca y desgasificada (30 ml) y la solución se purgó nuevamente con argón durante 5 minutos, después se añadió bis(tr¡-terc-butilfosfin)paladio(0) (CAS 53199-31-8) (28 mg, 54 pmol). La reacción se calentó durante 2 h a 100 °C. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(2-clorofenil)-W-[4-(1-ciclopropil-1H-pirazol-4-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]acetamida (560 mg, 1,15 mmol) en metanol (54 ml) y se trató con hidróxido de sodio acuoso al 32 % (560 pl) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida y se purificó mediante cromatografía sobre gel de sílice (Biotage, acetato de etilo / hexano) y después mediante HPLC (Waters XBrigde C18 5p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (192 mg, 95 % de pureza, 37 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,96 min; EM (IENneg): m/z = 429 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,94 -1,01 (m, 2H), 1,05 -1,10 (m, 2H), 3,67 -3,80 (m, 1H), 3,88 (s, 2H), 7,19 (s, 2H), 7,30 - 7,35 (m, 2H), 7,40 - 7,48 (m, 3H), 7,67 (d, 1H), 7,81 (dd, 1H), 8,04 (s, 1H), 8,31 (d, 1H), 10,57 (s, 1H).
Ejemplo 350
2- (2-Cloro-6-fluorofeml)-W-{4-[1-(2-metox¡et¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡lfeml}acetam¡da
Se disolvió 5-amino-2-[1-(2-metoxietil)-1H-pirazol-4-il]bencensulfonamida (190 mg, 641 pmol) en DMF (5,3 ml) y se añadió ácido (2-cloro-6-fluorofenil)acético (145 mg, 769 pmol), después se añadiweon W,A/-diisopropiletilamina (560 pl, 3,2 mmol) y HATU (390 mg, 1,03 mmol). La reacción se agitó a 50 °C durante 16 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %), después Waters XBrigde C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) para dar el compuesto del título (53,8 mg, 99 % de pureza, 18 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento I): T r= 1,17 min; EM (IENneg): m/z = 465 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,24 (s, 3H), 3,70 (t, 2H), 3,92 (d, 2H), 4,28 (t, 2H), 7,10 (s, 2H), 7,22 - 7,32 (m, 1H), 7,32 - 7,50 (m, 3H), 7,69 - 7,72 (m, 1H), 7,78 (dd, 1H), 8,00 - 8,02 (m, 1H), 8,32 (d, 1H), 10,66 (s, 1H).
Ejemplo 351
2-(2-Clorofeml)-W-[4-(1,3-d¡met¡MH-p¡razol-5-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvió 5-amino-2-(1,3-d¡met¡l-1H-p¡razol-5-¡l)bencensulfonam¡da (200 mg, 751 |jmol) en DMF (5,3 ml) y se añadió ácido (2-clorofen¡l)acét¡co (154 mg, 901 jmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (620 jl, 3,8 mmol) y HATU (457 mg, 1,20 mmol). La reacción se agitó a 50 °C durante 5 h. Se añadieron agua y diclorometano y las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante cromatografía sobre gel de sílice recubierto de amoníaco (Biotage, hexano / acetato de etilo) y después se sometió a purificación HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%)) para dar el compuesto del título (12,6 mg, 95 % de pureza, 4 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 0,87 min; EM (lENneg): m/z = 417 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 2,16 (s, 3H), 3,41 (s, 3H), 3,89 (s, 2H), 6,07 (s, 1H), 7,08 (s, 2H), 7,26 - 7,39 (m, 3H), 7,41 - 7,51 (m, 2H), 7,86 (dd, 1H), 8,36 (d, 1H), 10,72 (s, 1H).
Ejemplo 352
2-(2-Clorofeml)-W-(4'-cloro-2-sulfamo¡lb¡feml-4-¡l)acetam¡da
Se disolvieron 2-cloro-A/-(2,4-dimetox¡benc¡l)-5-n¡trobencensulfonam¡da (400 mg, 1,03 mmol) y ácido (4-clorofenil)borónico (243 mg, 1,55 mmol) en DMF (50 ml), después se añadieron dicloruro de bis(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (109 mg, 155 jm ol) y solución acuosa de carbonato de potasio (2,5 ml, 1,0 M, 2,5 mmol). La reacción se calentó durante 1 h a 120 °C en el microondas (0,2 MPa, 50W). Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, acetato de etilo / hexano) para dar 467 mg (82 % de pureza, 97 % de rendimiento).
CL-EM (Procedimiento B): Tr = 1,39 min; EM (lENneg): m/z = 461 [M-H]-Se disolvió 4'-cloro-W-(2,4-d¡metoxibenc¡l)-4-n¡trob¡fen¡l-2-sulfonam¡da (467 mg, 1,01 mmol) en dioxano (4,8 ml) y se añadió dihidrato de cloruro de estaño (II) (1,14 g, 5,04 mmol). La reacción se agitó durante 2 h a 70 °C. Después la mezcla se filtró sobre gel de sílice, el disolvente se retiró a presión reducida y el material en bruto se suspendió en diclorometano y se filtró nuevamente. El disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente (230 mg).
Se disolvió 4-am¡no-4'-cloro-W-(2,4-dimetox¡benc¡l)b¡fen¡l-2-sulfonam¡da (110 mg, 254 jm ol) en DMF (1,8 ml) y se añadió ácido (2-clorofenil)acético (52,0 mg, 305 jmol), después se añadieron N,N-diisoprop¡let¡lam¡na (210 jl, 1,3 mmol) y HATU (155 mg, 407 jmol). La reacción se agitó a 50 °C durante 4 h y se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (150 mg).
Se disolvió W-(4'-cloro-2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]b¡fen¡l-4-¡l}-2-(2-clorofen¡l)acetam¡da (150 mg, 256 jm ol) en diclorometano (1,5 ml), se añadió ácido trifluoroacético (990 jl, 13 mmol) y se continuó la agitación a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con tolueno. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (29,8 mg, 95 % de pureza, 25 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 1,20 min; EM (lENneg): m/z = 432 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,89 (s, 2H), 7,17 - 7,27 (m, 3H), 7,30 - 7,39 (m, 4H), 7,40 - 7,48 (m, 4H), 7,82 (dd, 1H), 8,35 (d, 1H), 10,63 (s, 1H).
Ejemplo 353
2-(2-Clorofeml)-W-{4-[1-metN-3-(tnfluorometM)-1H-p¡razol-5-M]-3-sulfamoNfeml}acetam¡da
Se disolvió 5-am¡no-2-[1-met¡l-3-(tr¡fluoromet¡l)-1H-p¡razol-5-¡l]bencensulfonam¡da (300 mg, 937 |jmol) en DMF (6 , 6 ml) y se añad¡ó ác¡do (2-clorofen¡l)acét¡co (192 mg, 1,12 mmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (820 jl, 4,7 mmol) y HATU (570 mg, 1,50 mmol). La reacdón se ag¡tó a 50 °C durante 18 h. Se añad¡eron agua y d¡clorometano. Las fases se separaron y la fase acuosa se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C18 5 j 100x30 mm, metanol/agua 0,2% de amoníaco acuoso (32%), después aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) para dar el compuesto del título (28,2 mg, 99% de pureza, 6 % de rend¡m¡ento al cabo de 3 pasos).
CL-EM (Proced¡m¡ento A): Tr = 1,14 m¡n; EM (lENneg): m/z = 471 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,59 (s, 3H), 3,91 (s, 2H), 6,72 (s, 1H), 7,31 - 7,35 (m, 2H), 7,38 - 7,48 (m, 5H), 7,85 - 7,93 (m, 1H), 8,40 (d, 1H), 10,79 (s, 1H).
Ejemplo 354
2-(2-Clorofeml)-W-[4-(p¡r¡dm-3-M)-3-sulfamo¡lfeml]acetam¡da
Se d¡solv¡eron A/-{4-bromo-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l}-2-(2-clorofen¡l)acetam¡da (250 mg, 451 jm ol) y ác¡do p¡r¡d¡n-3-¡lborón¡co (83,2 mg, 677 jm ol) en DMF (10 ml), después se añad¡ó soluc¡ón acuosa de carbonato de potas¡o (1,1 ml, 1,0 M, 1,1 mmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (Ca s 13965-03-2) (47,7 mg, 67,7 jmol). La reacc¡ón se calentó durante 30 m¡nutos a 120 °C en el m¡croondas. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡ó acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal (740 mg).
Se d¡solv¡ó 2-(2-clorofen¡l)-W-(3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-(p¡r¡d¡n-3-¡l)fen¡l}acetam¡da (347 mg, 628 jm ol) en d¡clorometano (5,0 ml) y se añad¡ó ác¡do tr¡fluoroacét¡co (5,0 ml, 65 mmol). Se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡ó acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-1810 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (49,6 mg, 95 % de pureza, 19 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,85 m¡n; EM (lENneg): m/z = 400 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,90 (s, 2H), 7,27 -7,36 (m, 5H), 7,38 -7,42 (m, 1H), 7,44 -7,46 (m, 2H), 7,73 - 7,81 (m, 1H), 7,81 - 7,89 (m, 1H), 8,38 (d, 1H), 8,49 - 8,59 (m, 2H), 10,66 (s, 1H).
Ejemplo 355
2-(2-Clorofeml)-W-{4-[1-metN-3-(tnfluorometM)-1H-pirazol-4-M]-3-sulfamoNfeml}acetamida
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (200 mg, 436 |jmol) y ácido [1-met¡l-3-(tr¡fluoromet¡l)-1H-p¡razol-4-¡l]borón¡co (169 mg, 872 jm ol) en n-propanol (8,0 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (15,3 mg, 21,8 jm ol) y tr¡fen¡lfosf¡na (5,72 mg, 21,8 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó soluc¡ón acuosa de carbonato de potas¡o (540 jl, 2,0 M, 1,1 mmol). La reacc¡ón se calentó a 80 °C durante 2 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (250 mg).
Se d¡solv¡ó 2-(2-clorofen¡l)-W-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-[1-met¡l-3-(tr¡fluoromet¡l)-1H-p¡razol-4-¡l]fen¡l)acetam¡da (250 mg, 474 jm ol) en metanol (4,9 ml) y se trató con h¡dróx¡do de sod¡o acuoso al 32 % (130 j l ) a 80 °C hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da, el mater¡al en bruto se d¡solv¡ó en d¡clorometano y se lavó con agua. Las fases se separaron, las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C185 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (3,60 mg, 98 % de pureza, 2 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 1,20 m¡n; EM (lENneg): m/z = 471 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,88 (s, 2H), 3,93 (s, 3H), 7,14 - 7,29 (m, 3H), 7,29 - 7,39 (m, 2H), 7,41 - 7,53 (m, 2H), 7,80 (dd, 1H), 7,84 - 7,89 (m, 1H), 8,32 (d, 1H), 10,65 (s, 1H).
Ejemplo 356
2-(2-Clorofeml)-N-(3'-cloro-2-sulfamoilbifeml-4-il)acetamida
Se d¡solv¡eron 2-cloro-A/-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (400 mg, 1,03 mmol) y ác¡do (3-clorofen¡l)borón¡co (243 mg, 1,55 mmol) en DMF (20 ml), después se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (109 mg, 155 jm ol) y soluc¡ón acuosa de carbonato de potas¡o (2,5 ml, 1,0 M, 2,5 mmol). La reacc¡ón se calentó durante 1 h a 120 °C en el m¡croondas (0,2 MPa, 50W). Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante cromatografía sobre gel de síl¡ce (B¡otage, acetato de et¡lo/ hexano) para dar 702 mg.
CL-EM (Proced¡m¡ento A): Tr = 1,39 m¡n; EM (lENneg): m/z = 461 [M-H]-Se d¡solv¡ó 3’-cloro-W-(2,4-d¡metox¡benc¡l)-4-n¡trob¡fen¡l-2-sulfonam¡da (470 mg, 1,02 mmol) en d¡oxano (4,9 ml) y se añad¡ó d¡h¡drato de cloruro de estaño (II) (1,15 g, 5,08 mmol). La reacc¡ón se ag¡tó durante 2 h a 70 °C. Después la mezcla se f¡ltró sobre gel de síl¡ce, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se suspend¡ó en d¡clorometano y se f¡ltró nuevamente. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (652 mg).
Se d¡solv¡ó 4-am¡no-3’-cloro-A/-(2,4-d¡metox¡benc¡l)b¡fen¡l-2-sulfonam¡da (200 mg, 60 % de pureza, 277 jm ol) en DMF (2,0 ml) y se añad¡ó ác¡do (2-clorofen¡l)acét¡co (56,7 mg, 333 jmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (230 jl, 1,4 mmol) y HATU (169 mg, 443 jmol). La reacc¡ón se ag¡tó a 50 °C durante 4 h. Se añad¡eron agua y d¡clorometano. Las fases se separaron y la fase acuosa se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal (170 mg).
Se d¡solv¡ó A/-{3’-cloro-2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]b¡fen¡l-4-¡l}-2-(2-clorofen¡l)acetam¡da (170 mg, 290 jm ol) en d¡clorometano (1,5 ml), se añad¡ó ác¡do tr¡fluoroacét¡co (1,1 ml) y se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se dest¡ló conjuntamente con tolueno. El mater¡al en bruto se pur¡f¡có med¡ante HPLC (Waters XBr¡gde C185 j 100x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (22,6 mg, 95 % de pureza, 17 % de rend¡m¡ento
al cabo de 4 pasos).
CL-EM (Procedimiento B): Tr = 1,15 min; EM (lENneg): m/z = 433 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,90 (s, 2H), 7,22 - 7,29 (m, 3H), 7,31 - 7,35 (m, 3H), 7,38 - 7,42 (m, 3H), 7,43 - 7,48 (m, 2H), 7,82 (dd, 1H), 8,35 (d, 1H), 10,65 (s, 1H).
Ejemplo 357
2-(2-Clorofeml)-W-(4-{1-[(2,2-d¡cloroc¡cloprop¡l)met¡l]-1H-p¡razol-4-¡l}-3-sulfamo¡lfeml)acetam¡da
Se disolvió 2-(2-clorofenil)-W-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(1H-pirazol-4-il)fenil]acetamida (200 mg, 448 jm ol) en DMF (3 ml) y se añadieron carbonato de cesio (292 mg, 897 |jmol), yoduro de potasio (74,5 mg, 448 |jmol) y 2-(bromometil)-1,1-diclorociclopropano (101 mg, 493 jmol). La reacción se agitó durante 18 h a 100 °C. Se añadió la misma cantidad de reactivos y la agitación se continuó durante 24 h a 100 °C. Después se añadieron agua y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvió 2-(2-clorofenil)-W-(4-{1-[(2,2-diclorociclopropil)metil]-1H-pirazol-4-il}-3-{[(dimetilamino)metiliden]sulfamoil}fenil)acetamida (302 mg, 531 jm ol) en metanol (4,4 ml) y se trató con solución acuosa de amoníaco al 25% (4,4 ml) a temperatura ambiente. Después de 16 h, se añadió solución acuosa de hidróxido de sodio al 32 % (200 j l ) y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) para dar el compuesto del título (6,80 mg, 95 % de pureza, 2 % de rendimiento al cabo de 3 pasos). CL-EM (Procedimiento B): Tr = 1,11 min; EM (lENneg): m/z = 511 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,57 -1,71 (m, 1H), 1,81 -1,90 (m, 1H), 2,26 -2,35 (m, 1H), 3,87 (s, 2H), 4,33 (m, 2H), 7,14 (s, 2H), 7,27 - 7,40 (m, 2H), 7,40 - 7,53 (m, 3H), 7,76 (s, 1H), 7,80 - 7,86 (m, 1H), 8,11 (s, 1H), 8,30 -8,39 (m, 1H), 10,59 (s, 1H).
Ejemplo 358
2-(2-Clorofeml)-W-[4-(1,3-d¡met¡MH-p¡razol-4-¡l)-3-sulfamo¡lfeml]acetam¡da
Se disolvió 5-amino-2-(1,3-dimetil-1H-pirazol-4-il)bencensulfonamida (250 mg, 939 jmol) en DMF (6 , 6 ml) y se añadió ácido (2-clorofenil)acético (192 mg, 1,13 mmol), después se añadieron N,N-diisopropiletilamina (820 jl, 4,7 mmol) y HATU (571 mg, 1,50 mmol). La reacción se agitó a 50 °C durante 18 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se disolvió en metanol (4 ml) y se añadió solución acuosa de hidróxido de sodio al 32 % (210 jl). La reacción se agitó a 80 °C durante 2 h. Después, la reacción se neutralizó con HCl 6 N y se añadieron agua y diclorometano. Las fases se separaron, la fase orgánica se secó sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%), después Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto final (19,6 mg, 90 %
de pureza, 4 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 0,94 min; EM (IENneg): m/z = 417 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,99 (s, 3H), 3,77 (s, 3H), 3,87 (s, 2H), 6,91 (s, 2H), 7,23 (d, 1H), 7,27 - 7,38 (m, 2H), 7,38 - 7,52 (m, 2H), 7,59 (s, 1H), 7,77 - 7,88 (m, 1H), 8,30 (d, 1H), 10,58 (s, 1H).
Ejemplo 359
2-(2-Clorofeml)-W-{4-[1-(propan-2-M)-1H-pirazol-4-M]-3-sulfamoMfeml}acetamida
Se disolvieron 2-cloro-5-nitrobencensulfonamida (500 mg, 2,11 mmol) y 1-(propan-2-il)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (998 mg, 4,23 mmol) en n-propanol (28 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(II) (CAS 13965-03-2) (74,4 mg, 106 pmol), trifenilfosfina (27,7 mg, 106 pmol) y solución acuosa de carbonato de potasio (3,2 ml, 2,0 M, 6,3 mmol). La solución se purgó con argón durante 5 minutos y la reacción se calentó durante 1 ha 120 °C en el microondas (0,4 MPa/40 W). Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con metanol y se usó sin purificación adicional en el paso siguiente (700 mg).
Se disolvió 5-nitro-2-[1-(propan-2-il)-1H-pirazol-4-il]bencensulfonamida (700 mg, 2,26 mmol) en THF (230 ml) y metanol (50 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10% de carga, 245 mg, 2,30 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 16 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (600 mg).
Se disolvió 5-amino-2-[1-(propan-2-il)-1H-pirazol-4-il]bencensulfonamida (300 mg, 1,07 mmol) en DMF (7,5 ml) y se añadió ácido (2-clorofenil)acético (219 mg, 1,28 mmol), después se añadieron N,N-diisopropiletilamina (880 pl, 5,4 mmol) y HATU (651 mg, 1,71 mmol). La reacción se agitó a 50 °C durante 18 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) para dar el compuesto del título (66 , 6 mg, 95 % de pureza, 14 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento I): T r= 1,27 min; EM (IENneg): m/z = 431 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,45 (d, 6 H), 3,88 (s, 2H), 4,45 - 4,58 (m, 1H), 7,16 (s, 2H), 7,27 - 7,40 (m, 2H), 7,41 - 7,49 (m, 3H), 7,72 (s, 1H), 7,78 - 7,89 (m, 1H), 8,04 (s, 1H), 8,32 (d, 1H), 10,57 (s, 1H).
Ejemplo 360
2-(2-Clorofeml)-W-[4-(1-metiMH-pirazol-4-M)-3-sulfamoNfeml]acetamida
Se disolvieron A/-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (900 mg, 1,96 mmol) y 1-metil-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (490 mg, 2,35 mmol) en DMF (25 ml), después se añadió fluoruro de potasio (251 mg, 4,32 mmol). La solución se purgó con argón durante 5 minutos y se añadió bis(triferc-butilfosfin)paladio(0 ) (Ca s 53199-31-8) (50,1 mg, 98,1 pmol). La reacción se calentó durante 1 h a 100 °C. La mezcla se filtró a través de un filtro de fibra de vidrio y el disolvente se retiró a presión reducida. El en bruto se sometió otra vez al procedimiento de reacción descrito precedentemente. Después, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (2,39 g).
Se disolvió 2-(2-clorofen¡l)-W-[3-{[(d¡met¡lam¡no)met¡l¡den]sulfamoil}-4-(1-met¡l-1H-p¡razol-4-¡l)fen¡l]acetam¡da (2,39 g, 5,20 mmol) en metanol (80 ml) y se trató con solución acuosa de amoníaco al 25 % (80 ml) a temperatura ambiente. El análisis por UPLC indicó una reacción incompleta, se añadió solución acuosa de amoníaco al 25 % (80 ml) y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante cromatografía sobre gel de sílice (Biotage, etanol en diclorometano 10 %) seguida por HPLC (Waters XBrigde C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (327 mg, 98 % de pureza, 15 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,86 min; EM (lENneg): m/z = 403 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,78 - 3,96 (m, 5H), 7,17 (s, 2H), 7,28 - 7,37 (m, 2H), 7,38 - 7,52 (m, 3H), 7,66 (d, 1H), 7,82 (dd, 1H), 7,96 (s, 1H), 8,32 (d, 1H), 10,57 (s, 1H).
Ejemplo 361
2-(2-Clorofeml)-W-{4-[1-(2-h¡drox¡-3,3-d¡metMbutM)-1H-pirazol-4-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvió 2-(2-clorofen¡l)-W-[3-{[(d¡met¡lam¡no)met¡liden]sulfamo¡l}-4-(1H-p¡razol-4-¡l)fen¡l]acetam¡da (250 mg, 561 pmol) en DMF (10 ml) y se añadieron 2-ferc-butiloxirano (1,68 g, 16,8 mmol) y carbonato de cesio (365 mg, 1,12 mmol). La reacción se calentó a 130 °C durante 30 minutos en el microondas. El disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente (306 mg).
Se disolvió 2-(2-clorofen¡l)-W-(3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-{1-[2-hidrox¡-3,3-d¡met¡lbut¡l]-1H-p¡razol-4-¡l}fenil)acetamida (306 mg, 560 pmol) en metanol (5,8 ml) y se trató con hidróxido de sodio acuoso al 32 % (480 pl) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (8,80 mg, 95 % de pureza, 3 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 1,28 min; EM (lENneg): m/z = 489 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 0,93 (s, 9H), 3,37 - 3,51 (m, 1H), 3,85 - 3,93 (m, 3H), 4,26 (dd, 1H), 4,91 (d, 1H), 6,99 (s, 2H), 7,29 - 7,36 (m, 2H), 7,41 - 7,49 (m, 3H), 7,70 (s, 1H), 7,84 (dd, 1H), 8,02 (s, 1H), 8,31 (d, 1H), 10,58 (s, 1H).
Ejemplo 362
2-(2-Fluorofeml)-W-[4-(5-fluoropmdm-3-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fenil)-2-(2-fluorofen¡l)acetam¡da (750 mg, 1,70 mmol) y ácido (5-fluoropir¡d¡n-3-il)borón¡co (478 mg, 3,39 mmol) en n-propanol (15 ml) y se añadieron dicloruro de bis(tr¡fen¡lfosfin)paladio(N) (Ca s 13965-03-2) (59,7 mg, 84,8 pmol) y trifenilfosfina (22,2 mg, 84,8 pmol). La solución se purgó con argón durante 5 minutos y se añadió solución acuosa de carbonato de potasio (2,1 ml, 2,0 M, 4,2 mmol). La reacción se calentó a 100 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (970 mg).
Se disolvió W-[3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-4-(5-fluorop¡r¡d¡n-3-¡l)fen¡l]-2-(2-fluorofen¡l)acetam¡da (970 mg, 2,12 mmol) en metanol (50 ml) y se trató con solución acuosa de amoníaco al 25 % (50 ml) a temperatura ambiente durante 4 h. El análisis por UPLC indicó una reacción incompleta, y se añadió solución acuosa de amoníaco al 25 % (50 ml) nuevamente. Se continuó la agitación a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (126 mg, 99 % de pureza, 15 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,83 min; EM (lENneg): m/z = 402 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,80 (s, 2H), 7,14 -7,24 (m, 2H), 7,30 -7,47 (m, 5H), 7,68 -7,75 (m, 1H), 7,87 (dd, 1H), 8,33 - 8,44 (m, 2H), 8,57 (d, 1H), 10,69 (s, 1H).
Ejemplo 363
2-(2-Clorofeml)-W-[4-(5-met¡l-1-feml-1H-p¡razol-4-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron 2-cloro-A/-[(d¡met¡lam¡no)met¡l¡den]-5-nitrobencensulfonam¡da (170 mg, 583 pmol) y 5-metil-1 -fenil-4-(4,4,5,5-tetrametil-1,3,2-d¡oxaborolan-2-¡l)-1H-p¡razol (248 mg, 874 pmol) en n-propanol (7,8 ml) y se añadieron dicloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (20,5 mg, 29,1 pmol), trifenilfosfina (7,64 mg, 29,1 pmol) y solución acuosa de carbonato de potasio (730 pl, 2,0 M, 1,5 mmol). La reacción se calentó a 80 °C durante 16 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente (210 mg). El grupo protector se retiró parcialmente bajo las condiciones de reacción. La mezcla se sometió a los pasos siguientes.
Se disolvió 2-(5-metil-1-fen¡l-1H-p¡razol-4-il)-5-n¡trobencensulfonam¡da (210 mg, 586 pmol) en metanol (30 ml) y THF (59 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 63,6 mg, 598 pmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 16 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (190 mg).
Se disolvió 5-amino-2-(5-met¡l-1-fen¡l-1H-pirazol-4-¡l)bencensulfonam¡da (190 mg, 579 pmol) en DMF (4,1 ml) y se añadió ácido (2-clorofenil)acético (118 mg, 694 pmol), después se añadieron N,N-di¡sopropilet¡lam¡na (500 pl, 2,9 mmol) y HATU (352 mg, 926 pmol). La reacción se agitó a 50 °C durante 16 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se disolvió en metanol (5 ml) y se trató con hidróxido de sodio acuoso al 32 % (130 pl) a 45 °C hasta haberse completado la desprotección. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %), después Waters XBrigde C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (10,0 mg, 95 % de pureza, 3 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento A): Tr = 1,35 min; EM (lENneg): m/z = 479 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 2,16 (s, 3H), 3,89 (s, 2H), 7,05 (s, 2H), 7,27 - 7,37 (m, 3H), 7,40 - 7,49 (m, 3H), 7,51 - 7,62 (m, 4H), 7,65 (s, 1H), 7,84 - 7,93 (m, 1H), 8,35 (d, 1H), 10,63 (s, 1H).
Ejemplo 364
4'-{[(2-Clorofeml)acetM]ammo}-W-[2-(d¡met¡lammo)etM]-2'-sulfamo¡lb¡feml-3-carboxam¡da
Se disolvieron W-(4-bromo-3-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}fen¡l)-2-(2-clorofen¡l)acetam¡da (300 mg, 654 |jmol) y W-[2-(d¡met¡lam¡no)et¡l]-3-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)benzam¡da (229 mg, 719 jm ol) en n-propanol ( l3 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (23,0 mg, 32,7 jm ol) y tr¡fen¡lfosf¡na (8,58 mg, 32,7 jmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y se añad¡ó soluc¡ón acuosa de carbonato de potas¡o (2,0 ml, 1,0 M, 2,0 mmol). La reacc¡ón se calentó a 100 °C durante 2 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se repart¡ó entre acetato de et¡lo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de et¡lo. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal (350 mg).
Se d¡solv¡ó 4'-{[(2-clorofen¡l)acet¡l]am¡no}-W-[2-(d¡met¡lam¡no)et¡l]-2'-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}b¡fen¡l-3-carboxam¡da (350 mg, 614 jm ol) en metanol (40 ml) y se trató con soluc¡ón acuosa de amoníaco al 25 % (40 ml) a temperatura amb¡ente hasta completarse la reacc¡ón. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (19,5 mg, 96 % de pureza, 6 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,95 m¡n; EM (lENneg): m/z = 513 [M-H]-RMN 1H (600MHz, DMSO-d6): 8 [ppm]= 2,20 (s, 6 H), 2,44 (t, 2H), 3,34 - 3,40 (m, 2H), 3,90 (s, 2H), 7,17 (s, 2H), 7,28 (d, 1H), 7,30 - 7,36 (m, 2H), 7,42 - 7,49 (m, 3H), 7,51 - 7,58 (m, 1H), 7,76 - 7,86 (m, 3H), 8,16 (s, 1H), 8,31 - 8,44 (m, 2H), 10,63 (s, 1H).
Ejemplo 365
2-(2-Clorofeml)-N-[4-(pirazolo[1,5-a]pirímidm-3-M)-3-sulfamoilfeml]acetamida
Se d¡solv¡eron 2-bromo-W-[(d¡met¡lam¡no)met¡l¡den]-5-n¡trobencensulfonam¡da (229 mg, 680 jm ol) y 3-(4,4,5,5-tetramet¡l-1,3,2-d¡oxaborolan-2-¡l)p¡razolo[1,5-a]p¡r¡m¡d¡na (250 mg, 1,02 mmol) en n-propanol (9,1 ml) y se añad¡eron d¡cloruro de b¡s(tr¡fen¡lfosf¡n)palad¡o(N) (CAS 13965-03-2) (23,9 mg, 34,0 jmol), tr¡fen¡lfosf¡na (8,92 mg, 34,0 jm ol) y soluc¡ón acuosa de carbonato de potas¡o (850 jl, 2,0 M, 1,7 mmol). La soluc¡ón se purgó con argón durante 5 m¡nutos y la reacc¡ón se calentó a 80 °C durante 4 h. Después la mezcla se f¡ltró sobre Cel¡te, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se repart¡ó entre d¡clorometano y agua. Las fases se separaron y la fase acuosa se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se dest¡ló conjuntamente con THF y se usó en el paso s¡gu¡ente s¡n pur¡f¡cac¡ón ad¡c¡onal (260 mg).
Se d¡solv¡ó A/-[(d¡met¡lam¡no)met¡l¡den]-5-n¡tro-2-(p¡razolo[1,5-a]p¡r¡m¡d¡n-3-¡l)bencensulfonam¡da (260 mg, 694 jmol) en metanol (30 ml) y THF (70 ml) y el rec¡p¡ente se purgó con n¡trógeno. Se añad¡ó palad¡o sobre carbón (10 % de carga, 75,4 mg, 708 jm ol) y el rec¡p¡ente se evacuó y después se purgó con h¡drógeno (0,1 MPa). Se cont¡nuó la ag¡tac¡ón a temperatura amb¡ente durante 16 h. La mezcla de reacc¡ón se f¡ltró sobre Cel¡te y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente.
Se d¡solv¡ó 5-am¡no-W-[(d¡met¡lam¡no)met¡l¡den]-2-(p¡razolo[1,5-a]p¡r¡m¡d¡n-3-¡l)bencensulfonam¡da (330 mg, 958 jmol) en DMF (6,7 ml) y se añad¡ó ác¡do (2-clorofen¡l)acét¡co (196 mg, 1,15 mmol), después se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (830 jl, 4,8 mmol) y HATU (583 mg, 1,53 mmol). La reacc¡ón se ag¡tó a 50 °C durante 16 h. Se añad¡eron agua y d¡clorometano. Las fases se separaron y la fase acuosa se extrajo con d¡clorometano. Las fases orgán¡cas comb¡nadas se secaron sobre un f¡ltro Whatman y el d¡solvente se ret¡ró a pres¡ón reduc¡da. El mater¡al en
bruto se usó en el paso siguiente sin purificación adicional (480 mg).
Se disolvió 2-(2-clorofenil)-W-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(pirazolo[1,5-a]pirimidin-3-il)fenil]acetamida (450 mg, 905 pmol) en metanol (10 ml) y se trató con hidróxido de sodio acuoso al 32 % (100 pl) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (9,60 mg, 95 % de pureza, 2 % de rendimiento al cabo de 4 pasos).
CL-EM (Procedimiento B): Tr = 0,90 min; EM (lENneg): m/z = 440 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,90 (s, 2H), 7,05 - 7,13 (m, 1H), 7,23 (s, 2H), 7,29 - 7,38 (m, 2H), 7,43 - 7,50 (m, 2H), 7,57 (d, 1H), 7,83 -7,91 (m, 1H), 8,40 (d, 1H), 8,44 (s, 1H), 8,51 -8,61 (m, 1H), 9,11 -9,21 (m, 1H), 10,64 (s, 1H).
Ejemplo 366
2-(2-Clorofeml)-W-{4-[5-(p¡rrol¡dm-1-¡lcarboml)pmdm-3-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvieron W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (250 mg, 545 pmol) y pirrolidin-1 -il[5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)piridin-3-il]metanona (165 mg, 545 pmol) en DMF (10 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (19,2 mg, 27,2 pmol), trifenilfosfina (7,15 mg, 27,2 pmol). La solución se purgó con argón durante 5 minutos y se añadió solución acuosa de carbonato de potasio (1,6 ml, 1,0 M, 1,6 mmol). La reacción se calentó a 100 °C durante 1 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se lavó con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional (280 mg).
Se disolvió 2-(2-clorofenil)-W-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[5-(pirrolidin-1-ilcarbonil)piridin-3-il]fenil)acetamida (280 mg, 505 pmol) en metanol (25 ml) y se trató con solución acuosa de amoníaco al 25 % (25 ml) a temperatura ambiente hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (67,3 mg, 97 % de pureza, 26 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,89 min; EM (lENneg): m/z = 497 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,73 - 1,99 (m, 4H), 3,43 -3,52 (m, 4H), 3,91 (s, 2H), 7,29 -7,37 (m, 3H), 7,38 - 7,43 (m, 2H), 7,43 - 7,49 (m, 2H), 7,82 - 7,89 (m, 2H), 8,40 (d, 1H), 8,58 (d, 1H), 8 , 68 (d, 1H), 10,71 (s, 1H).
Ejemplo 367
2-(2-Clorofeml)-W-[4-(1H-p¡razol-4-¡l)-3-sulfamo¡lfeml]acetam¡da
Se disolvió 2-(2-clorofenil)-A/-{3-sulfamoil-4-[1-(tetrahidro-2H-piran-2-il)-1H-pirazol-4-il]fenil}acetamida (197 mg, 414 pmol) en diclorometano (5 ml), se añadió ácido trifluoroacético (950 pl, 12 mmol) y se continuó la agitación a temperatura ambiente hasta completarse la reacción. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (30,9 mg, 95 % de pureza, 18 % de rendimiento).
CL-EM (Procedimiento A): Tr = 0,89 min; EM (lENneg): m/z = 389 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,88 (s, 2H), 7,15 (s, 2H), 7,29 - 7,37 (m, 2H), 7,42 - 7,48 (m, 3H), 7,70 - 7,91 (m, 2H), 7,91 -8,11 (m, 1H), 8,33 (d, 1H), 10,57 (s, 1H), 12,92 (s, 1H).
Ejemplo 368
2-(2-Fluorofeml)-W-{4-[1-metM-3-(tnfluorometM)-1H-pirazol-5-M]-3-sulfamoNfeml}acetamida
Se disolvieron 2-cloro-W-[(dimetilamino)metiliden]-5-nitrobencensulfonamida (550 mg, 1,89 mmol) y 1-metil-5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-3-(trifluorometN)-1H-pirazol (1,04 g, 3,77 mmol) en n-propanol (25 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(N) (CAS 13965-03-2) (66,4 mg, 94,3 jmol), trifenilfosfina (24,7 mg, 94,3 |jmol) y solución acuosa de carbonato de potasio (2,4 ml, 2,0 M, 4,7 mmol). La solución se purgó con argón durante 5 minutos y la reacción se calentó a 80 °C durante 16 h. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente (660 mg).
Se disolvió 2-[1-metil-3-(trifluorometil)-1H-pirazol-5-il]-5-nitrobencensulfonamida (660 mg, 1,88 mmol) en metanol (30 ml) y THF (30 ml) y el recipiente se purgó con nitrógeno. Se añadió platino sobre carbón (5 % de carga, 375 mg, 1,92 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 4 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (600 mg). Se observó una desprotección parcial bajo las condiciones de reacción; la mezcla se utilizó en los pasos siguientes.
Se disolvió 5-amino-2-[1-metil-3-(trifluorometil)-1H-pirazol-5-il]bencensulfonamida (300 mg, 937 jm ol) en DMF (7,8 ml) y se añadió ácido (2-fluorofenil)acético (173 mg, 1,12 mmol), después se añadieron N,N-diisopropiletilamina (820 jl, 4,7 mmol) y HATU (570 mg, 1,50 mmol). La reacción se agitó a 50 °C durante 18 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida.
El material en bruto se disolvió en metanol (20 ml) y se trató con hidróxido de sodio acuoso al 32 % (1,6 ml) a 80 °C durante 2 h. La reacción se neutralizó y el disolvente se retiró a presión reducida. El residuo se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%), después Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (10,2 mg, 95 % de pureza, 2 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (lENneg): m/z = 455 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,58 (s, 3H), 3,80 (s, 2H), 6,72 (s, 1H), 7,14 - 7,25 (m, 2H), 7,29 - 7,48 (m, 5H), 7,84 - 7,93 (m, 1H), 8,40 (d, 1H), 10,77 (s, 1H).
Ejemplo 369
2-(2-Fluorofeml)-W-{4-[1-(2-metoxietM)-1H-pirazol-4-M]-3-sulfamoNfeml}acetamida
Se disolvió 5-amino-2-[1-(2-metoxietil)-1H-pirazol-4-il]bencensulfonamida (190 mg, 641 jm ol) en DMF (5,3 ml) y se añadió ácido (2-fluorofenil)acético (119 mg, 769 jmol), después se añadieron N,N-diisopropiletilamina (560 jl,
3,2 mmol) y HATU (390 mg, 1,03 mmol). La reacción se agitó a 50 °C durante 16 h, después se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 |j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%)) para dar el compuesto del título (66,4 mg, 95 % de pureza, 23 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,96 min; EM (lENneg): m/z = 529 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,24 (s, 3H), 3,70 (t, 2H), 3,77 (s, 2H), 4,28 (t, 2H), 7,09 (s, 2H), 7,14 - 7,25 (m, 2H), 7,29 - 7,48 (m, 3H), 7,70 (s, 1H), 7,81 (dd, 1H), 8,01 (s, 1H), 8,31 (d, 1H), 10,55 (s, 1H).
Ejemplo 370
2-(2-Clorofeml)-W-{4-[1-(2-hidroxi-2-metNpropM)-1H-pirazol-4-M]-3-sulfamoNfeml}acetamida
Se disolvió 2-(2-clorofenil)-W-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(1H-pirazol-4-il)fenil]acetamida (180 mg, 404 jm ol) en DMF (4 ml), se añadieron 2,2-dimetiloxirano (1,3 ml, 14 mmol) y carbonato de cesio (263 mg, 807 jm ol) y la reacción se calentó durante 30 minutos a 130 °C en el microondas (0,2 MPa / 35W). Después la mezcla se filtró, el disolvente se retiró a presión reducida y el material en bruto se usó sin purificación adicional en el paso siguiente (250 mg).
Se disolvió 2-(2-clorofenil)-A/-(3-{[(dimetilamino)metiliden]sulfamoil}-4-[1-(2-hidroxi-2-metilpropil)-1H-pirazol-4-il]fenil)acetamida (250 mg, 483 jm ol) en metanol (5,0 ml) y se trató con hidróxido de sodio acuoso al 32 % (270 j l ) a 80 °C hasta completarse la reacción. El disolvente se retiró a presión reducida, el material en bruto se disolvió en diclorometano y se lavó con agua. Las fases se separaron, las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32%), después Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (2,60 mg, 95 % de pureza, 1 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento B): Tr = 0,88 min; EM (lENneg): m/z = 461 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,09 (s, 6 H), 3,88 (s, 2H), 4,04 (s, 2H), 4,77 (s, 1H), 7,04 (s, 2H), 7,29 - 7,37 (m, 2H), 7,41 - 7,50 (m, 3H), 7,67 (s, 1H), 7,83 (dd, 1H), 8,02 (s, 1H), 8,32 (d, 1H), 10,57 (s, 1H).
Ejemplo 371
2-(5-Cloro-2-fluorofeml)-W-[4-(1-ciclopropiMH-pirazol-4-N)-3-sulfamoNfeml]acetamida
Se disolvió 5-amino-2-(1-ciclopropil-1H-pirazol-4-il)-W-[(dimetilamino)metiliden]bencensulfonamida (200 mg, 600 jm ol) en DMF (10 ml) y se añadió ácido (5-cloro-2-fluorofenil)acético (136 mg, 720 jmol), después se añadieron N,N-diisopropiletilamina (520 jl, 3,0 mmol) y HATU (456 mg, 1,20 mmol). La reacción se agitó a 50 °C durante 16 h. Se añadió agua y acetato de etilo. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó en el paso siguiente sin purificación adicional.
Se disolvió 2-(5-cloro-2-fluorofenil)-W-[4-(1-ciclopropil-1H-pirazol-4-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]acetamida (302 mg, 600 jm ol) en metanol (5,0 ml) y se trató con solución acuosa de amoníaco al 25 % (5,0 ml) a temperatura ambiente. Después de 16 h, se añadió la misma cantidad de
amoníaco y se continuó la agitación hasta completarse la reacción. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 |j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) para dar el compuesto del título (27,6 mg, 96 % de pureza, 10 % de rendimiento al cabo de pasos).
CL-EM (Procedimiento B): Tr = 0,99 min; EM (lENneg): m/z = 447 [M-H]-RMN 1 H (600MHz, CD3OD): 8 [ppm]= 1,03 - 1,08 (m, 2H), 1,13 -1,19 (m, 2H), 3,66 -3,73 (m, 1H), 7,12 (t, 1H), 7,29 -7,36 (m, 1H), 7,37 - 7,45 (m, 2H), 7,69 (s, 1H), 7,80 (dd, 1H), 7,97 (s, 1H), 8,37 (d, 1H).
Ejemplo 372
2-(2-Clorofeml)-W-[4-(6-met¡lp¡r¡dm-3-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron 2-bromo-W-[(dimetilamino)metiliden]-5-nitrobencensulfonamida (200 mg, 595 jmol) y 2-metil-5-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)piridina (261 mg, 1,19 mmol) en n-propanol (55 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(II) (CAS 13965-03-2) (20,9 mg, 29,7 jmol), trifenilfosfina (10,8 mg, 29,7 jm ol) y solución acuosa de carbonato de potasio (890 jl, 2,0 M, 1,8 mmol). La solución se purgó con argón durante 5 minutos y se calentó a 120 °C durante 1 h en el microondas. Después la mezcla se filtró sobre Celite, el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente. Se observó desprotección bajo las condiciones de reacción y se utilizó la sulfonamida libre en los pasos siguientes.
Se disolvió 2-(6-metilpiridin-3-il)-5-nitrobencensulfonamida (450 mg, 1,53 mmol) en metanol (70 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 167 mg, 1,56 mmol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 4 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se destiló conjuntamente con THF y se usó sin purificación adicional en el paso siguiente (400 mg).
Se disolvió 5-amino-2-(6-metilpiridin-3-il)bencensulfonamida (200 mg, 760 jm ol) en DMF (5,3 ml) y se añadió ácido (2-clorofenil)acético (155 mg, 911 jmol), después se añadieron N,N-diisopropiletilamina (630 jl, 3,8 mmol) y HATU (462 mg, 1,22 mmol). La reacción se agitó a 50 °C durante 16 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C185 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (33,3 mg, 95 % de pureza, 10 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento B): Tr = 0,94 min; EM (lENneg): m/z = 414 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,11 (s, 3H), 3,89 (s, 2H), 7,20 -7,39 (m, 6 H), 7,42 -7,52 (m, 2H), 7,62 -7,70 (m, 1H), 7,78 - 7,89 (m, 1H), 8,31 - 8,44 (m, 2H), 10,66 (s, 1H).
Ejemplo 373
2-(2-Clorofeml)-W-{4-[1-(oxetan-3-M)-1H-p¡razol-4-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvió 2-bromo-5-nitrobencensulfonamida (100 mg, 356 jm ol) y 1-(oxetan-3-il)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-1H-pirazol (107 mg, 427 jm ol) en n-propanol (4,8 ml) y se añadieron dicloruro de bis(trifenilfosfin)paladio(ll) (CAS 13965-03-2) (12,5 mg, 17,8 jmol), trifenilfosfina (4,67 mg, 17,8 jm ol) y solución acuosa de carbonato de potasio (530 jl, 2,0 M, 1,1 mmol). La solución se purgó con argón durante 5 minutos y la reacción se calentó a 120 °C durante 1 h en el microondas (0,4 MPa/40 W). Después la mezcla se filtró sobre Celite,
el disolvente se retiró a presión reducida y el material en bruto se destiló conjuntamente con metanol y se usó sin purificación adicional en el paso siguiente ( 120 mg).
Se disolvió 5-nitro-2-[1-(oxetan-3-il)-1H-pirazol-4-il]bencensulfonamida (120 mg, 370 |jmol) en THF (37 ml) y el recipiente se purgó con nitrógeno. Se añadió paladio sobre carbón (10 % de carga, 40,2 mg, 377 jm ol) y el recipiente se evacuó y después se purgó con hidrógeno (0,1 MPa). Se continuó la agitación a temperatura ambiente durante 4 h. La mezcla de reacción se filtró sobre Celite y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente ( 110 mg).
Se disolvió 5-amino-2-[1-(oxetan-3-il)-1H-pirazol-4-il]bencensulfonamida (110 mg, 374 jm ol) en DMF (2,6 ml) y se añadió ácido (2-clorofenil)acético (76,5 mg, 448 jmol), después se añadieron N,N-diisopropiletilamina (330 jl, 1,9 mmol) y HATU (227 mg, 598 jmol). La reacción se agitó a 50 °C durante 18 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C185 j 100x30 mm, metanol/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (38,6 mg, 95 % de pureza, 22 % de rendimiento al cabo de 3 pasos).
CL-EM (Procedimiento J): Tr = 1,09 min; EM (lENneg): m/z = 445 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,88 (s, 2H), 4,86 - 5,00 (m, 4H), 5,54 - 5,68 (m, 1H), 7,19 (s, 2H), 7,29 - 7,37 (m, 2H), 7,40 -7,51 (m, 3H), 7,78 -7,86 (m, 2H), 8,11 (s, 1H), 8,27 - 8,35 (m, 1H), 10,58 (s, 1H).
Ejemplo 374
2-(2-Fluorofeml)-W-[4-(1-metiMH-pirazol-4-N)-3-sulfamoMfeml]acetamida
Se disolvió 5-amino-2-(1-metil-1H-pirazol-4-il)bencensulfonamida (200 mg, 793 jm ol) en DMF (6 , 6 ml) y se añadió ácido (2-fluorofenil)acético (147 mg, 951 jmol), después se añadieron N,N-diisopropiletilamina (350 jl, 4,0 mmol) y HATU (482 mg, 1,27 mmol). La reacción se agitó a 50 °C durante 18 h. Se añadieron agua y diclorometano. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Waters XBrigde C18 5 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) para dar el compuesto del título (75,6 mg, 95 % de pureza, 23 % de rendimiento).
CL-EM (Procedimiento A): Tr = 0,90 min; EM (lENneg): m/z = 387 [M-H]-RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 3,76 (s, 2H), 3,86 (s, 3H), 7,12 - 7,27 (m, 4H), 7,30 - 7,44 (m, 3H), 7,66 (d, 1H), 7,77 - 7,86 (m, 1H), 7,95 (s, 1H), 8,30 (d, 1H), 10,55 (s, 1H).
Ejemplo 375
W-[4-(1,3-DimetiMH-pirazol-4-M)-3-sulfamoNfeml]-2-(2-fluorofeml)acetamida
Se usó una mezcla de material de partida (dimetilamino)metileno protegido / desprotegido:
Se disolvió 5-amino-2-(1,3-dimetil-1H-pirazol-4-il)bencensulfonamida (250 mg, 939 jm ol) en DMF (7,8 ml) y se añadió ácido (2-fluorofenil)acético (174 mg, 1,13 mmol), después se añadieron N,N-diisopropiletilamina (820 jl, 4,7 mmol) y HATU (571 mg, 1,50 mmol). La reacción se agitó a 50 °C durante 18 h. Se añadió diclorometano y agua. Las fases se separaron y la fase acuosa se extrajo con diclorometano. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El residuo se disolvió nuevamente en metanol (10 ml) y se trató con hidróxido de sodio acuoso al 32 % (0,2 ml) a 80 °C durante 2 h. La mezcla de
reacción se neutralizó y se añadieron agua y diclorometano. Las fases se separaron y las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante (Waters XBrigde C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) para dar el compuesto del título (28,0 mg, 90 % de pureza, 7 % de rendimiento).
CL-EM (Procedimiento B): Tr = 0,94 min; EM (lENneg): m/z = 456 [M-H]-RMN 1H (400MHz, DMSO-da): 8 [ppm]= 1,99 (s, 3H), 3,77 (s, 5H), 6,91 (s, 2H), 7,14 - 7,25 (m, 3H), 7,29 - 7,46 (m, 2H), 7,59 (s, 1H), 7,77 - 7,85 (m, 1H), 8,29 (d, 1H), 10,56 (s, 1H).
Ejemplo 376
W-[4-(5-C¡cloprop¡l-1,3,4-oxad¡azol-2-M)-3-sulfamo¡lfeml]-2-(2-fluorofeml)acetam¡da
Se disolvió 5-amino-2-(5-ciclopropil-1,3,4-oxadiazol-2-il)-W-[(dimetilamino)metiliden]bencensulfonamida (100 mg, 298 pmol) en DMF (5,0 ml) y se añadió ácido (2-fluorofenil)acético (55,2 mg, 358 pmol), después se añadieron N,N-diisopropiletilamina (260 pl, 1,5 mmol) y HATU (227 mg, 596 pmol). La reacción se agitó a temperatura ambiente durante 2 h. Después, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (290 mg).
CL-EM (Procedimiento A): Tr = 1,00 min; EM (lENpos): m/z = 472 [M+H]+
Se disolvió W-[4-(5-ciclopropil-1,3,4-oxadiazol-2-il)-3-{[(dimetilamino)metiliden]sulfamoil}fenil]-2-(2-fluorofenil)acetamida (290 mg, 615 pmol) en metanol (50 ml) y se trató con solución concentrada de amoníaco (10 ml) a temperatura ambiente durante 2 h. El disolvente se retiró a presión reducida y el compuesto del título puro se obtuvo después de la purificación por HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (56,8 mg, 98 % de pureza, 22 % de rendimiento al cabo de 2 pasos).
CL-EM (Procedimiento A): Tr = 1,02 min; EM (lENpos): m/z = 417 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,07 - 1,22 (m, 4H), 2,34 (tt, 1H), 3,82 (s, 2H), 7,15 - 7,24 (m, 2H), 7,30 - 7,38 (m, 1H), 7,41 (td, 1H), 7,62 (s, 2H), 7,88 (d, 1H), 7,99 (dd, 1H), 8,43 (d, 1H), 10,88 (s, 1H).
Ejemplo 377
2-(2-Clorofeml)-W-[4-(5-c¡cloprop¡l-1,3,4-oxad¡azol-2-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvió 5-amino-2-(5-ciclopropil-1,3,4-oxadiazol-2-il)-W-[(dimetilamino)metiliden]bencensulfonamida (100 mg, 298 pmol) en DMF (5,0 ml) y se añadió ácido (2-clorofenil)acético (61,0 mg, 358 pmol), después se añadieron N,N-diisopropiletilamina (260 pl, 1,5 mmol) y HATU (227 mg, 596 pmol). La reacción se agitó a temperatura ambiente durante 2 h. Después, se añadió 0,5 eq de todos los reactivos y la agitación se continuó durante 16 h a temperatura ambiente. Después, el disolvente se retiró a presión reducida y se añadió acetato de etilo y agua. Las fases se separaron y la fase acuosa se extrajo con acetato de etilo. Las fases orgánicas combinadas se secaron sobre un filtro Whatman y el disolvente se retiró a presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente (340 mg).
CL-EM (Procedimiento A): Tr = 1,05 min; EM (lENpos): m/z = 488 [M+H]+
Se disolvió 2-(2-clorofen¡l)-A/-[4-(5-c¡cloprop¡l-1,3,4-oxad¡azol-2-¡l)-3-{[(d¡met¡lam¡no)met¡l¡den]-sulfamoil}fenil]acetamida (340 mg, 697 pmol) en metanol (10 ml) y se trató con soluc¡ón concentrada de amoníaco (10 ml) a temperatura amb¡ente durante 2 h. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el producto puro se obtuvo después de la pur¡f¡cac¡ón por HPLC (Chromatorex C-18 10 pm, 125x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) (56,6 mg, 93 % de pureza, 17 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento A): Tr = 1,06 m¡n; EM (lENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-d6): 8 [ppm]= 1,06 - 1,22 (m, 4H), 2,28 -2,39 (m, 1H), 3,93 (s, 2H), 7,29 -7,38 (m, 2H), 7,42 - 7,50 (m, 2H), 7,62 (s, 2H), 7,88 (d, 1H), 7,99 (dd, 1H), 8,44 (d, 1H), 10,90 (s, 1H).
Ejemplo 378
W-{4-[4-(DifluorometM)-1H-pirazoM-M]-3-sulfamoNfeml}-2-(2-fluorofeml)acetamida
De acuerdo con los proced¡m¡entos generales GP2.3 y GP6.1, se conv¡rt¡ó 2-[4-(d¡fluoromet¡l)-1H-p¡razol-1-¡l]-W-[(d¡met¡lam¡no)met¡len]-5-n¡trobencensulfonam¡da (250 mg, 0,670 mmol) y ác¡do (2-fluorofen¡l)acét¡co (154 mg, 1,00 mmol) s¡n pur¡f¡cac¡ón de ¡ntermed¡os en el compuesto del título y se pur¡f¡có al f¡nal med¡ante HPLC preparat¡va (Waters xBr¡dge C185 p 100x30 mm, aceton¡tr¡lo/agua 0 , 1 % de ác¡do fórm¡co).
CL-EM (Proced¡m¡ento A): Tr = 1,02 m¡n, EM (lENpos): m/z = 425 [M+H]+
RMN 1H (400 MHz, DMSO-d6) 8 [ppm]: 3,80 (s, 2H), 7,11 (t, 1H), 7,15 -7,23 (m, 2H), 7,30 -7,47 (m, 4H), 7,56 (d, 1H), 7,97 (dd, 1H), 7,99 (d, 1H), 8,37 (d, 1H), 8,41 - 8,44 (m, 1H), 10,79 (s, 1H).
Ejemplo 379
2-(2-Clorofeml)-W-{4-[4-(difluorometM)-1H-pirazoM-M]-3-sulfamoNfeml}acetamida
De acuerdo con los proced¡m¡entos generales GP2.3 y GP6.1, se conv¡rt¡ó 2-[4-(d¡fluoromet¡l)-1H-p¡razol-1-¡l]-W-[(d¡met¡lam¡no)met¡len]-5-n¡trobencensulfonam¡da (250 mg, 0,670 mmol) y ác¡do (2-clorofen¡l)acét¡co (154 mg, 1,00 mmol) s¡n pur¡f¡cac¡ón de ¡ntermed¡os en el compuesto del título y se pur¡f¡có al f¡nal med¡ante HPLC preparativa (Waters xBr¡dge C185 p 100x30 mm, aceton¡tr¡lo/agua 0 , 1 % de ác¡do fórm¡co).
CL-EM (Proced¡m¡ento A): Tr = 1,05 m¡n, EM (lENpos): m/z = 441 [M+H]+
RMN 1H (400 MHz, DMSO-d6) 8 [ppm]: 3,91 (s, 2H), 7,12 (t, 1H), 7,29 -7,37 (m, 2H), 7,39 -7,49 (m, 4H), 7,56 (d, 1H), 7,97 (dd, 1H), 7,99 (s, 1H), 8,38 (d, 1H), 8,41 - 8,44 (m, 1H), 10,81 (s, 1H).
Ejemplo 380
2-(2-Clorofeml)-W-{5-sulfamoM-6-[4-(t
N fl
uorometM)-1H-pirazoM-N]pindm-3-N}acetamida
Se disolvieron 5-am¡no-N-[(d¡met¡lam¡no)met¡l¡den]-2-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]p¡r¡d¡n-3-sulfonam¡da (250 mg, 690 |jmol) y ác¡do (2-clorofen¡l)acét¡co (177 mg, 1,03 mmol) en DMF (10 ml) y se añad¡eron N,N-d¡¡soprop¡let¡lam¡na (600 jl, 3,4 mmol) y 2,4,6-tr¡óx¡do de 2,4,6-tr¡prop¡l-1,3,5,2,4,6-tr¡oxatr¡fosf¡nano (310 jl, 1,0 mmol) en forma suces¡va. La reacc¡ón se ag¡tó a temperatura amb¡ente durante la noche. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y se añad¡ó acetato de et¡lo y agua. Las fases se separaron y la fase orgán¡ca se secó sobre un f¡ltro Whatman. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se usó s¡n pur¡f¡cac¡ón ad¡c¡onal en el paso s¡gu¡ente (400 mg).
Se d¡solv¡ó 2-(2-clorofen¡l)-N-(5-{[(d¡met¡lam¡no)met¡l¡den]sulfamo¡l}-6-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]p¡r¡d¡n-3-¡l)acetam¡da (400 mg, 777 jm ol) en metanol (37 ml) y se trató con soluc¡ón acuosa de h¡dróx¡do de sod¡o al 40 % (24 jl, 1,9 mmol) durante 1 ha 50 °C. Después, el d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante cromatografía HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) para dar 3,8 mg del compuesto del título (95 % de pureza, 1 % de rend¡m¡ento al cabo de 2 pasos).
CL-EM (Proced¡m¡ento B): Tr = 0,93 m¡n; EM (lENpos): m/z = 460 [M+H]+
RMN 1H (400MHz, DMSO-da): 8 [ppm]= 3,95 (s, 2H), 7,29 - 7,39 (m, 2H), 7,43 - 7,52 (m, 2H), 7,61 (s, 2H), 8,24 (s, 1H), 8 , 86 (d, 1H), 8,91 (d, 1H), 8,97 (d, 1H), 11,06 (s, 1H).
Ejemplo 381
2-(2-Fluorofeml)-W-{5-sulfamoN-6-[4-(tN fluorometM)-1H-pirazol-1-N]pindm-3-N}acetamida
El compuesto del título se obtuvo de manera análoga al Ejemplo 380 comenzando a part¡r de 5-am¡no-N-[(d¡met¡lam¡no)met¡l¡den]-2-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]p¡r¡d¡n-3-sulfonam¡da (250 mg, 690 jm ol) en 2 pasos después de la pur¡f¡cac¡ón por HPLC (Chromatorex C-18 10 jm , 125x30 mm, aceton¡tr¡lo/agua 0,2 % de amoníaco acuoso (32 %)) (12,8 mg, 90 % de pureza, 4 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento B): Tr = 0,90 m¡n; EM (IENpos): m/z = 444 [M+H]+
RMN 1H (400MHz, DMSO-d6 ): 8 [ppm]= 3,85 (s, 2H), 7,13 - 7,26 (m, 2H), 7,29 - 7,47 (m, 2H), 7,61 (s, 2H), 8,23 (s, 1H), 8 , 86 (d, 1H), 8,91 (d, 1H), 8,97 (s, 1H), 11,04 (s, 1H).
Ejemplo 382
W-[6-(4-Ciano-1H-pirazol-1 -il)-5-sulfamoilpiridin-3-il]-2-(2-fluorofenil)acetamida
De acuerdo con el proced¡m¡ento general GP6.1, se conv¡rt¡ó 5-am¡no-2-(4-c¡ano-1H-p¡razol-1-¡l)-N-[(d¡met¡lam¡no)met¡len]p¡r¡d¡n-3-sulfonam¡da en bruto (200 mg) y ác¡do (2-fluorofen¡l)acét¡co (145 mg, 0,94 mmol) s¡n pur¡f¡cac¡ón de ¡ntermed¡os en el compuesto del título y se pur¡f¡có al f¡nal med¡ante HPLC preparat¡va (Chromatorex
C-18 10 |jm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (13 mg, 0,0325 mmol, 2% de rendimiento al cabo de 5 pasos, 99 % de pureza).
CL-EM (Procedimiento A): Tr = 0,96 min, EM (IENpos): m/z = 401 [M+H]+
RMN 1H (400 MHz, DMSO-da) 8 [ppm]: 3,85 (s, 2H), 7,16 - 7,23 (m, 2H), 7,30 - 7,38 (m, 1H), 7,42 (td, 1H), 7,63 (s, 2H), 8,35 (d, 1H), 8,87 (d, 1H), 8,89 (d, 1H), 9,10 (d, 1H), 11,06 (s, 1H).
Ejemplo 383
2-(2-Clorofeml)-W-[6-(4-c¡ano-1H-p¡razol-1-¡l)-5-sulfamo¡lp¡r¡dm-3-¡l]acetam¡da
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-(4-ciano-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida en bruto (55 mg) y ácido (2-clorofenil)acético (41 mg, 0,26 mmol) sin purificación de intermedios en el compuesto del título. El compuesto del título precipitó durante la reacción y se obtuvo mediante filtración, no siendo necesario purificarse adicionalmente (20,5 mg, 0,0492 mmol, 9 % de rendimiento al cabo de 5 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,01 min, EM (IENpos): m/z = 417 [M+H]+
RMN 1H (400 MHz, DMSO-d6) 8 [ppm]: 3,95 (s, 2H), 7,30 -7,37 (m, 2H), 7,43 -7,50 (m, 2H), 7,63 (s, 2H), 8,36 (d, 1H), 8,87 (d, 1H), 8,90 (d, 1H), 9,10 (d, 1H), 11,08 (s, 1H).
Ejemplo 384
2-(2-Fluorofeml)-W-[6-(4-flúor-1H-p¡razol-1 -¡l)-5-sulfamo¡lp¡r¡d¡n-3-¡l]acetam¡da
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-N-[(dimetilamino)metilen]-2-(4-flúor-1H-pirazol-1- il)piridin-3-sulfonamida en bruto (150 mg) y ácido (2-fluorofenil)acético (111 mg, 0,72 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters xBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (24 mg, 0,061 mmol, 8 % de rendimiento al cabo de 5 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,98 min, EM (IENpos): m/z = 394 [M+H]+
RMN 1H (400 MHz, DMSO-d6 ) 8 [ppm]: 3,94 (s, 2H), 7,30 - 7,37 (m, 2H), 7,44 - 7,49 (m, 2H), 7,60 (s, 2H), 7,93 (dd, 1H), 8,50 (dd, 1H), 8,83 (d, 1H), 8 , 88 (d, 1H), 10,99 (s, 1H).
Ejemplo 385
4-flúor-1H-p¡razol-1-¡l)-5-sulfamo¡lp¡r¡d¡n-3-¡l]acetam¡da
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-N-[(dimetilamino)metilen]-2-(4-flúor-1H-pirazol-1-il)piridin-3-sulfonamida en bruto (150 mg) y ácido (2-clorofenil)acético (123 mg, 0,72 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters xBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (25 mg, 0,061 mmol, 8 % de rendimiento al cabo de 5 pasos, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min, EM (lENpos): m/z = 410 [M+H]+
RMN 1H (400 MHz, DMSO-da) 8 [ppm]: 3,84 (s, 2H), 7,16 - 7,23 (m, 2H), 7,31 - 7,38 (m, 1H), 7,42 (td, 1H), 7,60 (s, 2H), 7,93 (dd, 1H), 8,50 (dd, 1H), 8,83 (d, 1H), 8 , 88 (d, 1H), 10,97 (s, 1H).
Ejemplo 386
W-[6-(4-Bromo-1H-pirazoM-M)-5-sulfamoNpiridm-3-M]-2-(2-fluorofeml)acetamida
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida en bruto (84 mg) y ácido (2-fluorofenil)acético (50,5 mg, 0,33 mmol) sin purificación de intermedios en el compuesto del título. El producto deseado precipitó durante la reacción y se obtuvo mediante filtración, no siendo necesario purificarse adicionalmente (14 mg, 0,0308 mmol, 12 % de rendimiento al cabo de 5 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min, EM (lENpos): m/z = 454/456 [M+H]+
RMN 1H (400 MHz, DMSO-d6) 8 [ppm]: 3,84 (s, 2H), 7,16 - 7,23 (m, 2H), 7,31 - 7,38 (m, 1H), 7,42 (td, 1H), 7,59 - 7,65 (m, 2H), 7,94 (d, 1H), 8,58 (d, 1H), 8,83 (d, 1H), 8 , 88 (d, 1H), 10,99 (s, 1H).
Ejemplo 387
2-(2-Clorofeml)-W-[6-(4-cloro-1H-pirazoM-M)-5-sulfamoNpiridm-3-N]acetamida
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida en bruto (100 mg) y ácido (2-clorofenil)acético (77,8 mg, 0,46 mmol) sin purificación de intermedios en el compuesto del título. El compuesto del título precipitó durante la reacción y se obtuvo mediante filtración, no siendo necesario purificarse adicionalmente (38 mg, 0,0891 mmol, 27 % de rendimiento al cabo de 5 pasos, 99 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min, EM (lENpos): m/z = 426 [M+H]+
RMN 1H (400 MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,30 -7,37 (m, 2H), 7,43 -7,49 (m, 2H), 7,60 (s, 2H), 7,94 (d, 1H), 8,58 (d, 1H), 8,84 (d, 1H), 8,89 (d, 1H), 11,01 (s, 1H).
Ejemplo 388
W-[6-(4-Cloro-1H-pirazoM-M)-5-sulfamoNpiridm-3-M]-2-(2-fluorofeml)acetamida
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-(4-cloro-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida en bruto (100 mg) y ácido (2-fluorofenil)acético (70 mg, 0,46 mmol) sin purificación de intermedios en el compuesto del título. El compuesto del título precipitó durante la reacción y se obtuvo mediante filtración, no siendo necesario purificarse adicionalmente (8 mg, 0,0195 mmol, 6 % de rendimiento al cabo de 5 pasos, 99 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min, EM (lENpos): m/z = 410 [M+H]+
RMN 1H (400 MHz, DMSO-da) 8 [ppm]: 3,84 (s, 2H), 7,16 - 7,24 (m, 2H), 7,31 - 7,38 (m, 1H), 7,42 (td, 1H), 7,60 (s, 2H), 7,94 (d, 1H), 8,58 (d, 1H), 8,83 (d, 1H), 8 , 88 (d, 1H), 10,99 (s, 1H).
Ejemplo 389
W-[6-(4-Bromo-1H-p¡razol-1-M)-5-sulfamo¡lp¡ridm-3-M]-2-(2-clorofeml)acetam¡da
De acuerdo con el procedimiento general GP6.1, se convirtió 5-amino-2-(4-bromo-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida en bruto (84 mg) y ácido (2-clorofenil)acético (55,9 mg, 0,33 mmol) sin purificación de intermedios en el compuesto del título. El compuesto del título precipitó durante la reacción y se obtuvo mediante filtración, no siendo necesario purificarse adicionalmente (20 mg, 0,0425 mmol, 17 % de rendimiento al cabo de 5 pasos, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min, EM (lENpos): m/z = 470/472 [M+H]+
RMN 1H (400 MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,31 -7,36 (m, 2H), 7,43 -7,49 (m, 2H), 7,60 (s, 2H), 7,94 (d, 1H), 8,57 (d, 1H), 8,83 (d, 1H), 8,87 (d, 1H), 11,02 (s, 1H).
Ejemplo 390
2-(2-Fluorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluorometM)-1,3,4-oxad¡azol-2-¡l]feml}acetam¡da
Se disolvió 2-(2-fluorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]fenil}acetamida (268 mg, 451 pmol) en diclorometano (7,3 ml) y se trató con ácido trifluoroacético (1,7 ml, 23 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (25 mg, 12 % de rendimiento, 99 % de pureza).
CL-Em (Procedimiento A): Tr = 0,93 min
EM (lENpos): m/z = 445 (M+H)+
RMN 1H (600MHz, DMSO-d6) 8 [ppm] 3,85 (s, 2H), 7,19 (m, 2H), 7,34 (m, 1H), 7,41 (m, 1H), 7,91 (dd, 1H), 8,06 (d, 1H), 8,29 (d, 1H), 11,00 (s, 1H).
Ejemplo 391
2-(2-Clorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]feml}acetam¡da
Se disolvió 2-(2-clorofen¡l)-N-{3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-[5-(tr¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]fen¡l}acetam¡da (276 mg, 451 pmol) en d¡clorometano (7,3 ml) y se trató con ác¡do tr¡fluoroacét¡co (1,7 ml, 23 mmol), después se ag¡tó a temperatura amb¡ente durante la noche. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (23 mg, 11 % de rend¡m¡ento, 95 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 0,97 m¡n
EM (lENpos): m/z = 461 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,95 (s, 2H), 7,33 (m, 2H), 7,46 (m, 2H), 7,90 (dd, 1H), 8,06 (d, 1H), 8,28 (d, 1H), 11,01 (s, 1H).
Ejemplo 392
2-(2-Clorofen¡l)-W-{4-[3-(p¡r¡d¡n-3-¡l)-1H-1,2,4-tr¡azol-1-¡l]-3-sulfamo¡lfen¡l}acetam¡da
De acuerdo con los proced¡m¡entos generales GP1.2, GP2.4, GP3.2 y GP4.2, se conv¡rt¡ó 2-cloro-N-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (500 mg, 1,29 mmol), 3-(1H-1,2,4-tr¡azol-3-¡l)p¡r¡d¡na (283 mg, 1,94 mmol) y ác¡do (2-clorofen¡l)acét¡co (197 mg, 1,15 mmol) s¡n pur¡f¡cac¡ón de ¡ntermed¡os en el compuesto del título y se pur¡f¡có al f¡nal med¡ante HPLC preparat¡va (Waters XBr¡dge C185 p 100x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) y después otra vez med¡ante HPLC preparativa (Waters XBr¡dge C185 p 100x30 mm, metanol/agua 0,1 % de ác¡do tr¡fluoroacét¡co) (10 mg, 0,0213 mmol, 2 % de rend¡m¡ento al cabo de 4 pasos, 96 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 0,90 m¡n; EM (lENpos): m/z = 469 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,31 - 7,39 (m, 2H), 7,44 - 7,50 (m, 2H), 7,55 (s, 2H), 7,61 (dd, 1H), 7,69 (d, 1H), 8,00 (dd, 1H), 8,46 (d, 1H), 8,48 (dt, 1H), 8,71 (dd, 1H), 8,93 (s, 1H), 9,28 (d, 1H), 10,88 (s, 1H).
Ejemplo 393
-(2-Fluorofeml)-W-[4-(1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con los proced¡m¡entos generales GP1.2, GP2.4, GP3.2 y GP4.3, se conv¡rt¡ó 2-cloro-N-(2,4-d¡metox¡benc¡l)-5-n¡trobencensulfonam¡da (250 mg, 0,65 mmol), 1H-p¡razol (66 mg, 0,97 mmol) y ác¡do (2-fluorofen¡l)acét¡co (120 mg, 0,78 mmol) s¡n pur¡f¡cac¡ón de ¡ntermed¡os en el compuesto del título y se pur¡f¡có al f¡nal med¡ante HPLC preparativa (Waters XBr¡dge C185 p 100x30 mm, aceton¡tr¡lo/agua 0,1 % de ác¡do fórm¡co) (11 mg,
0. 294 mmol, 5 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 0,91 min; EM (IENpos): m/z = 375 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,80 (s, 2H), 6,51 (t, 1H), 7,15 -7,23 (m, 2H), 7,30 -7,37 (m, 1H), 7,41 (td, 1H), 7,46 (s, 2H), 7,53 (d, 1H), 7,78 (dd, 1H), 7,97 (dd, 1H), 8,10 (dd, 1H), 8,36 (d, 1H), 10,75 (s, 1H).
Ejemplo 394
W-[4-(4-ferc-Butil-1H-pirazol-1-M)-3-sulfamoilfeml]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-ferc-butil-1H-pirazol (241 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Waters XBridge C18 5 |j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (28 mg, 0,0626 mmol, 3 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,26 min; EM (IENpos): m/z = 447 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,27 (s, 9H), 3,89 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,48 (m, 2H), 7,50 (s, 2H), 5,52 (d, 1H), 7,72 (d, 1H), 7,94 (d, 1H), 7,97 (dd, 1H), 8,33 (d, 1H), 10,74 (s, 1H).
Ejemplo 395 y Ejemplo 396
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 2H-indazol (229 mg, 1,94 mmol) y ácido (2-clorofenil)acético (321 mg, 1,88 mmol) sin purificación de intermedios en los dos compuestos del título y se purificaron y se separaron al final mediante HPLC preparativa (Waters XBridge C185 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), seguida por HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)).
Ejemplo 395
2-(2-Clorofeml)-N-[4-(1H-mdazol-1-il)-3-sulfamoilfeml]acetamida
58 mg, 0,132 mmol, 10 % de rendimiento al cabo de 4 pasos, 99 % de pureza
CL-EM (Procedimiento B): Tr = 1,33 min; EM (IENpos): m/z = 441 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,93 (s, 2H), 7,26 (ddd, 1H), 7,29 - 7,40 (m, 5H), 7,41 - 7,49 (m, 3H), 7,64 (d, 1H), 7,89 (dt, 1H), 8,05 (dd, 1H), 8,40 (d, 1H), 8,46 (d, 1H), 10,84 (s, 1H).
Ejemplo 396
2-(2-Clorofeml)-W-[4-(2H-mdazol-2-M)-3-sulfamoilfeml]acetam¡da
14 mg, 0,0318 mmol, 2 % de rendimiento al cabo de 4 pasos, 99 % de pureza
CL-EM (Procedimiento B): Tr = 1,27 min; EM (IENpos): m/z = 441 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,93 (s, 2H), 7,14 (ddd, 1H), 7,30 - 7,39 (m, 3H), 7,44 - 7,50 (m, 2H), 7,64 (s a, 2H), 7,70 (d, 1H), 7,74 (dd, 1H), 7,78 - 7,82 (m, 1H), 8,04 (dd, 1H), 8,44 (d, 1H), 8,71 (d, 1H), 10,86 (s, 1H).
Ejemplo 397 y Ejemplo 398
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 2H-indazol (229 mg, 1,94 mmol) y ácido (2-fluorofenil)acético (290 mg, 1,88 mmol) sin purificación de intermedios en los dos compuestos del título y se purificaron y se separaron al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), seguida por HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)).
Ejemplo 397
2-(2-Fluorofeml)-N-[4-(2H-mdazol-2-il)-3-sulfamoilfeml]acetamida
15 mg, 0,0353 mmol, 3 % de rendimiento al cabo de 4 pasos, 99 % de pureza
CL-EM (Procedimiento B): Tr = 1,21 min; EM (IENpos): m/z = 425 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,83 (s, 2H), 7,11 - 7,24 (m, 3H), 7,31 - 7,38 (m, 2H), 7,43 (td, 1H), 7,63 (s a, 2H), 7,70 (d, 1H), 7,74 (dd, 1H), 7,78 - 7,82 (m, 1H), 8,03 (dd, 1H), 8,43 (d, 1H), 8,72 (d, 1H), 10,85 (s, 1H).
Ejemplo 398
2-(2-Fluorofeml)-W-[4-(1H-mdazoM-il)-3-sulfamoilfeml]acetamida
70 mg, 0,0165 mmol, 13 % de rendimiento al cabo de 4 pasos, 99 % de pureza
CL-EM (Procedimiento B): Tr = 1,27 min; EM (IENpos): m/z = 425 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,83 (s, 2H), 7,17 - 7,23 (m, 2H), 7,26 (t, 1H), 7,29 - 7,39 (m, 4H), 7,41 - 7,47 (m, 2H), 7,64 (d, 1H), 7,89 (d, 1H), 8,05 (dd, 1H), 8,40 (s, 1H), 8,46 (d, 1H), 10,84 (s, 1H).
Ejemplo 399
1-(4-{[(2-Clorofeml)acet¡l]ammo}-2-sulfamo¡lfeml)-W,W-d¡metM-1H-p¡razol-4-carboxam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), N,N-dimetil-1H-pirazol-4-carboxamida (270 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (35 mg, 0,0758 mmol, 6 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,91 min; EM (lENpos): m/z = 462 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,97 (s a, 3H), 3,18 (s a, 3H), 3,91 (s, 2H), 7,30 - 7,37 (m, 2H), 7,38 - 7,48 (m, 4H), 7,60 (d, 1H), 7,97 (dd, 1H), 8,00 (d, 1H), 8,38 (d, 1H), 8,42 (d, 1H), 10,80 (s, 1H).
Ejemplo 400
W-[1-(4-{[(2-Clorofeml)acetM]ammo}-2-sulfamo¡lfeml)-1H-p¡razol-4-¡l]c¡clopropancarboxam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), N-(1H-pirazol-4-il)ciclopropancarboxamida (293 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (44 mg, 0,0928 mmol, 7 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,98 min; EM (lENpos): m/z = 474 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 0,76 - 0,82 (m, 4H), 1,72 (quin, 1H), 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,39 -7,48 (m, 4H), 7,52 (d, 1H), 7,77 (d, 1H), 7,95 (dd, 1H), 8,14 (s, 1H), 8,35 (d, 1H), 10,40 (s, 1H), 10,75 (s, 1H).
Ejemplo 401
2-(2-Clorofeml)-W-{4-[4-(p¡razm-2-¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 2-(1H-pirazol-4-il)pirazina (283 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (41 mg, 0,0874 mmol, 7 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,98 min; EM (lENpos): m/z = 469 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,92 (s, 2H), 7,30 - 7,37 (m, 2H), 7,43 - 7,50 (m, 4H), 7,65 (d, 1H), 8,01 (dd, 1H), 8,40 (d, 1H), 8,43 (d, 1H), 8,49 (d, 1H), 8,62 (dd, 1H), 8,81 (d, 1H), 9,11 (d, 1H), 10,82 (s, 1H).
Ejemplo 402
2-(2-Clorofeml)-W-{4-[4-(pmdm-2-M)-1H-p¡razoM-il]-3-sulfamo¡lfeml}acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 2-(1H-pirazol-4-il)piridina (281 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (54 mg, 0,115 mmol, 9 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,91 min; EM (lENpos): m/z = 468 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,91 (s, 2H), 7,24 (ddd, 1H), 7,30 - 7,37 (m, 2H), 7,42 - 7,51 (m, 4H), 7,64 (d, 1H), 7,76 - 7,85 (m, 2H), 8,00 (dd, 1H), 8,34 (d, 1H), 8,39 (d, 1H), 8,57 (ddd, 1H), 8,67 (d, 1H), 10,80 (s, 1H).
Ejemplo 403
2-(2-Clorofeml)-W-{4-[4-(pmdm-3-M)-1H-p¡razoM-¡l]-3-sulfamo¡lfeml}acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3-(1H-pirazol-4-il)piridina (281 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (20 mg, 0,0427 mmol, 3 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,92 min; EM (lENpos): m/z = 468 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,92 (s, 2H), 7,30 - 7,37 (m, 2H), 7,40 - 7,52 (m, 5H), 7,63 (d, 1H), 8,01 (dd, 1H), 8,09 (dt, 1H), 8,35 (s, 1H), 8,39 (d, 1H), 8,45 (dd, 1H), 8,70 (s, 1H), 8,97 (d, 1H), 10,81 (s, 1H).
Ejemplo 404
2-(2-Clorofeml)-W-{4-[4-(pmmidm-4-M)-1H-p¡razol-1 -il]-3-sulfamoilfen¡l}acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (250 mg, 0,65 mmol), 4-(1H-pirazol-4-il)pirimidina (142 mg, 0,97 mmol) y ácido (2-clorofenil)acético (162 mg, 0,95 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico)
seguida por HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) (6,1 mg, 0,0130 mmol, 2 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento I): Tr = 1,21 min; EM (IENpos): m/z = 469 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,92 (s, 2H), 7,28 - 7,39 (m, 2H), 7,43 - 7,52 (m, 4H), 7,64 (d, 1H), 7,87 (dd, 1H), 8,00 (dd, 1H), 8,40 (d, 1H), 8,46 (s, 1H), 8,77 (d, 1H), 8,87 (s, 1H), 9,12 (d, 1H), 10,83 (s, 1H).
Ejemplo 405
2-(2-Fluorofeml)-W-{4-[4-(pmmidm-4-M)-1H-pirazoM-M]-3-sulfamoNfeml}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (250 mg, 0,65 mmol), 4-(1H-pirazol-4-il)pirimidina (142 mg, 0,97 mmol) y ácido (2-fluorofenil)acético (146 mg, 0,95 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) seguida por HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) (7,3 mg, 0,0161 mmol, 2 % de rendimiento al cabo de 4 pasos, 95 % de pureza).
CL-EM (Procedimiento I): T r= 1,16 min; EM (IENpos): m/z = 453 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,81 (s, 2H), 6,50 - 8,00 (very ancho peak en the baseline, 2H), 7,15 - 7,24 (m, 2H), 7,29 - 7,37 (m, 1H), 7,42 (td, 1H), 7,64 (d, 1H), 7,87 (dd, 1H), 8,00 (dd, 1H), 8,40 (d, 1H), 8,46 (s, 1H), 8,77 (d, 1H), 8,87 (s, 1H), 9,12 (d, 1H), 10,85 (s, 1H).
Ejemplos 406 y 407
De acuerdo con los procedimientos generales GP2.4 y GP6.3, se convirtió una mezcla regioisomérica de N-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]bencensulfonamida, N-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]bencensulfonamida (159 mg, 0,404 mmol) y ácido (4-metoxifenil)acético (99,8 mg, 0,60 mmol) sin purificación de intermedios en los compuestos del título que se purificaron y se separaron mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)).
Ejemplo 406
2-(4-Metoxifeml)-W-{3-sulfamoM-4-[4-(tN fluorometM)-2H-1,2,3-tnazol-2-N]feml}acetamida
17 mg, 0,0373 mmol, 9 % de rendimiento al cabo de 3 pasos, 97 % de pureza
CL-EM (Procedimiento B): Tr = 0,99 min; EM (lENneg): m/z = 454 [M-H]-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,64 (s, 2H), 3,73 (s, 3H), 6,90 (d, 2H), 7,27 (d, 2H), 7,39 (s a, 2H), 7,73 (d, 1H), 8,01 (dd, 1H), 8,42 (d, 1H), 8,69 (s, 1H), 10,78 (s, 1H).
Ejemplo 407
2-(4-Metoxifeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1H-1,2,3-tnazoM -il]fenil}acetamida
48 mg, 0,105 mmol, 26 % de rendimiento al cabo de 3 pasos, 97 % de pureza
CL-EM (Procedimiento B): Tr = 0,81 min; EM (IENneg): m/z = 454 [M-H]-RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,65 (s, 2H), 3,73 (s, 3H), 6,91 (d, 2H), 7,27 (d, 2H), 7,33 (s a, 2H), 7,65 (d, 1H), 7,99 (dd, 1H), 8,43 (d, 1H), 9,16 (d, 1H), 10,79 (s, 1H).
Ejemplos 408 y 409
De acuerdo con los procedimientos generales GP2.4 y GP6.3, se convirtió una mezcla regioisomérica de N-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]bencensulfonamida, N-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]bencensulfonamida (159 mg, 0,404 mmol) y ácido (4-metilfenil)acético (90,1 mg, 0,60 mmol) sin purificación de intermedios en los compuestos del título que se purificaron y se separaron mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)).
Ejemplo 408
2-(4-MetNfeml)-W-{3-sulfamoN-4-[4-(tN fluorometM)-2H-1,2,3-tnazol-2-N]feml}acetamida
12,4 mg, 0,0282 mmol, 7 % de rendimiento al cabo de 3 pasos, 98 % de pureza, después de la purificación adicional mediante otra corrida de HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico)
CL-EM (Procedimiento A): Tr = 1,19 min; EM (IENneg): m/z = 438 [M-H]-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,28 (s, 3H), 3,67 (s, 2H), 7,15 (d, 2H), 7,24 (d, 2H), 7,44 (s, 2H), 7,73 (d, 1H), 8,01 (dd 1H), 8,42 (d, 1H), 8,69 (s, 1H), 10,80 (s, 1H).
Ejemplo 409
2-(4-MetNfeml)-W-{3-sulfamoN-4-[4-(tN fluorometM)-1H-1,2,3-tnazoM-N]feml}acetamida
22,3 mg, 0,0507 mmol, 13 % de rendimiento al cabo de 3 pasos, 98 % de pureza
CL-EM (Procedimiento B): Tr = 0,98 min; EM (IENneg): m/z = 438 [M-H]-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,28 (s, 3H), 3,67 (s, 2H), 7,15 (d, 2H), 7,24 (d, 2H), 7,62 (s a, 2H), 7,65 (d, 1H), 7,99 (dd, 1H), 8,43 (d, 1H), 9,16 (d, 1H), 10,80 (s, 1H).
Ejemplo 410
2-[4-(DifluorometN)feml]-W-{3-sulfamoN-4-[4-(trifluorometM)-2H-1,2,3-tnazol-2-N]feml}acetamida
De acuerdo con los procedimientos generales GP2.4 y GP6.4, se convirtió W-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]bencensulfonamida (48 mg, 0,123 mmol), y ácido [4-(difluorometil)fenil]acético (36,5 mg, 0,20 mmol) sin purificación de intermedios en el compuesto del título el cual precipitó de la mezcla de reacción después del último paso (15 mg, 0,0316 mmol, 26 % de rendimiento al cabo de 3 pasos, 95 % de pureza). CL-EM (Procedimiento A): Tr = 1,16 min; EM (lENneg): m/z = 474 [M-H]-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,81 (s, 2H), 7,02 (t, 1H), 7,45 (s, 2H), 7,49 (d, 2H), 7,55 (d, 2H), 7,74 (d, 1H), 8,01 (dd, 1H), 8,43 (d, 1H), 8,69 (d, 1H), 10,88 (s, 1H).
Ejemplo 411
2-[4-(DifluorometN)feml]-W-{3-sulfamoN-4-[4-(trifluorometM)-1H-1,2,3-tnazoM -il]fenil}acetamida
De acuerdo con los procedimientos generales GP2.4 y GP6.4, se convirtió W-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]bencensulfonamida (45 mg, 0,115 mmol), y ácido [4-(difluorometil)fenil]acético (40 mg, 0,22 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) (16 mg, 0,0337 mmol, 29 % de rendimiento al cabo de 3 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,88 min; EM (lENpos): m/z = 476 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,82 (s, 2H), 7,03 (t, 1H), 7,37 - 7,60 (m, 6H), 7,67 (d, 1H), 7,99 (dd, 1H), 8,43 (d, 1H), 9,16 (d, 1H), 10,89 (s, 1H).
Ejemplo 412
2-(2-Fluorofeml)-W-{3-sulfamoN-4-[4-(tN fluorometM)-2H-1,2,3-tnazol-2-N]feml}acetamida
De acuerdo con los procedimientos generales GP2.4 y GP6.4, se convirtió W-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]bencensulfonamida (48 mg, 0,123 mmol), y ácido (2-fluorofenil)acético (30,2 mg, 0,20 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (3 mg, 0,00677 mmol, 6 % de rendimiento al cabo de 3 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENneg): m/z = 442 [M-H]-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,83 (s, 2H), 7,15 - 7,23 (m, 2H), 7,30 - 7,51 (m, 4H), 7,75 (d, 1H), 8,00 (dd, 1H), 8,45 (d, 1H), 8,70 (d, 1H), 10,90 (s, 1H).
Ejemplo 413
2-(2-Fluorofeml)-W-{3-sulfamoN-4-[4-(tN fluorometM)-1H-1,2,3-tnazoM-N]feml}acetamida
De acuerdo con los procedimientos generales GP2.4 y GP6.4, se convirtió W-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]bencensulfonamida (45 mg, 0,115 mmol), y ácido (2-fluorofenil)acético (33,2 mg, 0,22 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-1810 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) (21 mg, 0,0474 mmol, 41 % de rendimiento al cabo de 3 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,82 min; EM (lENpos): m/z = 444 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,83 (s, 2H), 7,15 - 7,23 (m, 2H), 7,31 - 7,38 (m, 1H), 7,42 (td, 1H), 7,57 (s a, 2H), 7,67 (d, 1H), 7,97 (dd, 1H), 8,46 (d, 1H), 9,17 (d, 1H), 10,90 (s, 1H).
Ejemplo 414
2-[2-Cloro-4-(tN fluorometN)feml]-W-{3-sulfamoN-4-[4-(tN fluorometM)-2H-1,2,3-tnazol-2-N]feml}acetamida
De acuerdo con los procedimientos generales GP2.4 y GP6.4, se convirtió W-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]bencensulfonamida (48 mg, 0,123 mmol), y ácido [2-cloro-4-(trifluorometil)fenil]acético (46,7 mg, 0,20 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-1810 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (5 mg, 0,00947 mmol, 5 % de rendimiento al cabo de 3 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,29 min; EM (lENneg): m/z = 526 [M-H]-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 4,06 (s, 2H), 7,46 (s a, 2H), 7,68 - 7,78 (m, 3H), 7,89 (s, 1H), 7,99 (dd, 1H), 8,44 (d, 1H), 8,70 (s, 1H), 10,99 (s, 1H).
Ejemplo 415
2-[2-Cloro-4-(tN fluorometN)feml]-W-{3-sulfamoN-4-[4-(tN fluorometM)-1H-1,2,3-tnazoM-N]feml}acetamida
De acuerdo con los procedimientos generales GP2.4 y GP6.4, se convirtió W-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]bencensulfonamida (45 mg, 0,115 mmol), y ácido [2-cloro-4-(trifluorometil)fenil]acético (51,4 mg, 0,22 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco
acuoso (32 %)) (17 mg, 0,0322 mmol, 28 % de rendimiento al cabo de 3 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 1,04 min; EM (IENpos): m/z = 528 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 4,06 (s, 2H), 7,57 (s a, 2H), 7,65 - 7,77 (m, 3H), 7,90 (s, 1H), 7,97 (dd, 1H), 8,45 (d, 1H), 9,17 (s, 1H), 10,99 (s, 1H).
Ejemplo 416
2-(2,4-D¡d orofem l)-W-{3-sulfamoN-4-[4-(tN fluorometM)-2H-1,2,3-tn azol-2-N]fem l}acetam¡da
De acuerdo con los procedimientos generales GP2.4 y GP6.4, se convirtió W-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]bencensulfonamida (48 mg, 0,123 mmol), y ácido (2,4-diclorofenil)acético (40,2 mg, 0,20 mmol) sin purificación de intermedios en el compuesto del título el cual precipitó de la mezcla de reacción después del último paso (26 mg, 0,0526 mmol, 43 % de rendimiento al cabo de 3 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,26 min; EM (lENneg): m/z = 492 [M-H]-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,41 - 7,52 (m, 4H), 7,64 (d, 1H), 7,75 (d, 1H), 7,99 (dd, 1H), 8,44 (d, 1H), 8,70 (s, 1H), 10,92 (s, 1H).
Ejemplo 417
2-(2,4-D¡dorofeml)-W-{3-sulfamoN-4-[4-(tN fluorometM)-1H-1,2,3-tnazoM-N]feml}acetam¡da
De acuerdo con los procedimientos generales GP2.4 y GP6.4, se convirtió W-[(dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]bencensulfonamida (45 mg, 0,115 mmol), y ácido (2,4-diclorofenil)acético (44,1 mg, 0,22 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-1810 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)) (17 mg, 0,0344 mmol, 30 % de rendimiento al cabo de 3 pasos, 97 % de pureza).
CL-EM (Procedimiento B): Tr = 0,98 min; EM (IENpos): m/z = 494 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,94 (s, 2H), 7,44 (dd, 1H), 7,50 (dd, 1H), 7,53 - 7,71 (m, 4H), 7,97 (dd, 1H), 8,45 (d, 1H), 9,17 (d, 1H), 10,93 (s, 1H).
Ejemplo 418
2-(2-Clorofeml)-W-[3-sulfamo¡l-4-(1,3-t¡azol-5-¡l)feml]acetam¡da
De acuerdo con el procedimiento general GP8.1, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (150 mg, 0,33 mmol) y 5-bromo-1,3-tiazol (97,3 mg, 0,59 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1% de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) (5,9 mg, 0,0145 mmol, 4 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento I): Tr = 1,22 min; EM (lENpos): m/z = 408 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,38 (s, 2H), 7,42 - 7,49 (m, 3H), 7,85 (dd, 1H), 7,94 (s, 1H), 8,40 (d, 1H), 9,13 (s, 1H), 10,72 (s, 1H).
Ejemplo 419
2-(2-Clorofeml)-N-[3-sulfamoil-4-(1,2-tiazol-3-il)feml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 3-bromo-1,2-tiazol (195 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)), y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,2 % de amoníaco acuoso (32 %)) (2,9 mg, 0,00711 mmol, 1 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento J): T r= 1,19 min; EM (lENpos): m/z = 408 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,40 - 7,50 (m, 4H), 7,60 - 7,67 (m, 2H), 7,96 (dd, 1H), 8,36 (d, 1H), 9,15 (d, 1H), 10,74 (s, 1H).
Ejemplo 420
2-(2-Clorofeml)-W-[4-(2-metil-1,3-tiazol-4-il)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 4-bromo-2-metil-1,3-tiazol (211 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (19 mg, 0,0450 mmol, 7 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,06 min; EM (lENpos): m/z = 422 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,73 (s, 3H), 3,89 (s, 2H), 7,30 - 7,35 (m, 2H), 7,42 - 7,48 (m, 2H), 7,59 - 7,63 (m, 3H), 7,71 (s, 1H), 7,93 (dd, 1H), 8,32 (d, 1H), 10,69 (s, 1H).
Ejemplo 421
2-(2-Clorofenil)-W-[4-(2-metoxi-1,3-tiazol-4-il)-3-sulfamoilfenil]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 4-bromo-2-metoxi-1,3-tiazol (230 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (25 mg, 0,057 mmol, 9 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (lENpos): m/z = 438 [M+H]+
RMN 1H (500MHz, DMSO-da) 8 [ppm]: 3,89 (s, 2H), 4,05 (s, 3H), 7,25 (s, 1H), 7,30 - 7,35 (m, 2H), 7,42 - 7,47 (m, 2H), 7,49 (s, 2H), 7,61 (d, 1H), 7,92 (dd, 1H), 8,31 (d, 1H), 10,69 (s, 1H).
Ejemplo 422
2-(2-Clorofeml)-W-[4-(2-metox¡-1,3-t¡azol-5-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-2-metoxi-1,3-tiazol (230 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (23 mg, 0,0525 mmol, 8 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,97 min; EM (lENpos): m/z = 438 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,89 (s, 2H), 4,04 (s, 3H), 7,22 (s, 1H), 7,29 - 7,35 (m, 2H), 7,37 (s, 2H), 7,41 -7,47 (m, 3H), 7,83 (dd, 1H), 8,36 (d, 1H), 10,69 (s, 1H).
Ejemplo 423
2-(2-Clorofeml)-W-[4-(2-met¡l-1,3-t¡azol-5-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-2-metil-1,3-tiazol (211 mg, 1,19 mmol) en el compuesto del título y se purificó dos veces mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (20 mg, 0,0474 mmol, 7 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,99 min; EM (lENpos): m/z = 422 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,67 (s, 3H), 3,89 (s, 2H), 7,28 - 7,38 (m, 4H), 7,39 - 7,48 (m, 3H), 7,65 (s, 1H), 7,83 (dd, 1H), 8,37 (d, 1H), 10,70 (s, 1H).
Ejemplo 424
2-(2-Clorofeml)-W-[4-(3-met¡l-1,2-t¡azol-5-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-3-metil-1,2-tiazol (211 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,2 % de amoníaco acuoso (32 %)) (32 mg, 0,0758 mmol, 12 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento J): Tr = 1,22 min; EM (lENpos): m/z = 422 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,45 (s, 3H), 3,90 (s, 2H), 7,28 - 7,36 (m, 3H), 7,39 - 7,50 (m, 5H), 7,87 (dd, 1H), 8,40 (d, 1H), 10,75 (s, 1H).
Ejemplo 425
2-(2-Clorofeml)-N-[4-(4-metil-1,3-tiazol-2-M)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 2-bromo-4-metil-1,3-tiazol (211 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (35 mg, 0,0830 mmol, 13 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (lENpos): m/z = 422 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,43 (d, 3H), 3,90 (s, 2H), 7,28 - 7,37 (m, 2H), 7,41 - 7,49 (m, 3H), 7,72 - 7,78 (m, 3H), 7,99 (dd, 1H), 8,38 (d, 1H), 10,81 (s, 1H).
Ejemplo 426
2-(2-Clorofeml)-W-[3-sulfamo¡l-4-(1,2-t¡azol-4-¡l)feml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 4-bromo-1,2-tiazol (195 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (9 mg, 0,0221 mmol, 3 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 0,86 min; EM (lENpos): m/z = 408 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,90 (s, 2H), 7,30 - 7,35 (m, 2H), 7,37 (s, 2H), 7,40 (d, 1H), 7,42 - 7,48 (m, 2H),
7,85 (dd, 1H), 8,38 (d, 1H), 8,63 (s, 1H), 9,04 (s, 1H), 10,68 (s, 1H).
Ejemplo 427
2-(2-Clorofen¡l)-W-[3-sulfamo¡l-4-(1,3-t¡azol-2-¡l)feml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 2-bromo-1,3-tiazol (195 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (6 mg, 0,0147 mmol, 2 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento b ): Tr = 1,01 min; EM (lENpos): m/z = 408 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,91 (s, 2H), 7,29 - 7,37 (m, 2H), 7,42 - 7,49 (m, 2H), 7,73 (s, 2H), 7,77 (d, 1H), 7,91 (d, 1H), 7,98 - 8,03 (m, 2H), 8,40 (d, 1H), 10,82 (s, 1H).
Ejemplo 428
2-(2-Clorofeml)-W-[4-(4-c¡ano-1,3-t¡azol-2-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 2-bromo-1,3-tiazol-4-carbonitrilo (224 mg, 1,19 mmol) en el compuesto del título y se purificó dos veces mediante HpLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (5 mg, 0,0116 mmol, 2 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 0,95 min; EM (lENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,92 (s, 2H), 7,30 - 7,36 (m, 2H), 7,43 - 7,53 (m, 4H), 7,75 (d, 1H), 7,98 (dd, 1H), 8,42 (d, 1H), 9,01 (s, 1H), 10,87 (s, 1H).
Ejemplo 429
2-(2-Clorofeml)-W-{4-[2-(d¡fluoromet¡l)-1,3-t¡azol-5-¡l]-3-sulfamo¡lfeml}acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-2-(difluorometil)-1,3-tiazol (254 mg, 1,19 mmol) en el compuesto del título y se purificó dos veces mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm,
acetonitrilo/agua 0,1 % de ácido fórmico) (11 mg, 0,0240 mmol, 4 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (IENpos): m/z = 458 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,90 (s, 2H), 7,30 - 7,35 (m, 2H), 7,38 (tr, 1H), 7,42 - 7,48 (m, 2H), 7,49 - 7,55 (m, 3H), 7,88 (dd, 1H), 8,00 (s, 1H), 8,42 (d, 1H), 10,77 (s, 1H).
Ejemplo 430
2-(2-Clorofeml)-W-[4-(2-c¡cloprop¡l-1,3-t¡azol-5-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-2-ciclopropil-1,3-tiazol (242 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (26 mg, 0,0580 mmol, 9 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,06 min; EM (IENpos): m/z = 448 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 0,97 - 1,02 (m, 2H), 1,09 - 1,15 (m, 2H), 2,39 (tt, 1H), 3,89 (s, 2H), 7,30 - 7,34 (m, 2H), 7,37 (s, 2H), 7,40 - 7,47 (m, 3H), 7,60 (s, 1H), 7,82 (dd, 1H), 8,37 (d, 1H), 10,69 (s, 1H).
Ejemplo 431
2-(2-Clorofeml)-W-[4-(2-c¡cloprop¡l-1,3-t¡azol-4-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 4-bromo-2-ciclopropil-1,3-tiazol (242 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (12 mg, 0,0268 mmol, 4 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (IENpos): m/z = 448 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 0,95 -0,99 (m, 2H), 1,16 -1,21 (m, 2H), 1H superpuesto con señal de disolvente, 3,89 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,49 (m, 2H), 7,54 - 7,64 (m, 4H), 7,93 (dd, 1H), 8,30 (d, 1H), 10,69 (s, 1H).
Ejemplo 432
2-(2-Clorofeml)-W-[4-(4-met¡l-1,3-oxazol-2-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2(2-clorofenil)acetamida (300 mg, 0,65 mmol) y clorhidrato de 4-bromo-2-metil-1,3-oxazol (235 mg, 1,19 mmol) en el compuesto del título y se purificó dos veces mediante HPLC preparativa (Chromatorex C-18 10 |jm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (1 mg, 0,00246 mmol, 1 % de rendimiento, 80 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (lENpos): m/z = 406 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,18 (d, 3H), 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,41 - 7,49 (m, 2H), 7,87 (s, 2H), 7,91 (d, 1H), 7,96 - 8,03 (m, 2H), 8,39 (d, 1H), 10,83 (s, 1H).
Ejemplo 433
2-(2-Clorofeml)-W-{3-sulfamoN-4-[2-(tnfluorometM)-1,3-tiazol-4-N]feml}acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 4-bromo-2-(trifluorometil)-1,3-tiazol (275 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Chromatorex C-1810 jm , 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (9 mg, 0,0189 mmol, 3 % de rendimiento, 85 % de pureza). CL-EM (Procedimiento B): Tr = 1,14 min; EM (ESlpneg): m/z = 474 [M-H]-RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,91 (s, 2H), 7,28 - 7,38 (m, 4H), 7,42 - 7,49 (m, 2H), 7,67 (d, 1H), 7,95 (dd, 1H), 8,35 (s, 1H), 8,39 (d, 1H), 10,76 (s, 1H).
Ejemplo 434
2-(2-Clorofeml)-W-{3-sulfamoN-4-[4-(tnfluorometM)-1,3-tiazol-2-N]feml}acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 2-bromo-4-(trifluorometil)-1,3-tiazol (275 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Chromatorex C-1810 jm , 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (5 mg, 0,0105 mmol, 2 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,18 min; EM (lENpos): m/z = 476 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,92 (s, 2H), 7,28 - 7,37 (m, 2H), 7,41 - 7,51 (m, 4H), 7,80 (d, 1H), 8,00 (dd, 1H), 8,43 (d, 1H), 8,69 (d, 1H), 10,87 (s, 1H).
Ejemplo 435
-(2-Clorofeml)-N-{4-[2-(2-hidroxipropan-2-il)-1,3-tiazol-5-M]-3-sulfamoilfeml}acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 2-(5-bromo-1,3-tiazol-2-il)propan-2-ol (263 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (25 mg, 0,0537 mmol, 8 % de rendimiento, 99 % de pureza).
CL-EM (Procedimiento A): Tr = 0,95 min; EM (lENpos): m/z = 466 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,54 (s, 6H), 3,89 (s, 2H), 5,99 (s, 1H), 7,28 - 7,40 (m, 4H), 7,41 - 7,48 (m, 3H), 7,70 (s, 1H), 7,83 (dd, 1H), 8,38 (d, 1H), 10,70 (s, 1H).
Ejemplo 436
-(2-Clorofeml)-N-{4-[2-(2-hidroxipropan-2-il)-1,3-tiazol-4-il]-3-sulfamoilfeml}acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 2-(4-bromo-1,3-tiazol-2-il)propan-2-ol (263 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (42 mg, 0,0901 mmol, 14 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,01 min; EM (lENpos): m/z = 466 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,53 (s, 6H), 3,89 (s, 2H), 6,15 (s, 1H), 7,29 - 7,36 (m, 2H), 7,41 - 7,48 (m, 2H), 7,59 - 7,66 (m, 3H), 7,74 (s, 1H), 7,95 (dd, 1H), 8,31 (d, 1H), 10,69 (s, 1H).
Ejemplo 437
-(2-Clorofeml)-N-[3-sulfamoil-4-(1,3-tiazol-4-il)feml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (600 mg, 1,31 mmol) y 4-bromo-1,3-tiazol (389 mg, 2,37 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1% de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (3 mg, 0,00735 mmol, 1 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,02 min; EM (lENpos): m/z = 408 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,89 (s, 2H), 7,29 - 7,36 (m, 2H), 7,41 - 7,49 (m, 2H), 7,54 - 7,65 (m, 3H), 7,92 - 7,97 (m, 2H), 8,34 (d, 1H), 9,25 (d, 1H), 10,70 (s, 1H).
Ejemplo 438
2-(2-Clorofeml)-W-[4-(5-c¡cloprop¡l-1,2-oxazol-3-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 3-bromo-5-ciclopropil-1,2-oxazol (223 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (12 mg, 0,0427 mmol, 7 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (lENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 0,79 -0,85 (m, 2H), 1,00 - 1,07 (m, 2H), 2,00 -2,07 (m, 1H), 3,90 (s, 2H), 6,60 (s, 1H), 7,28 - 7,36 (m, 2H), 7,40 - 7,50 (m, 4H), 7,67 (d, 1H), 7,92 (dd, 1H), 8,40 (d, 1H), 10,80 (s, 1H).
Ejemplo 439
2-(2-Clorofeml)-W-[4-(2-c¡cloprop¡l-1,3-oxazol-5-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-2-ciclopropil-1,3-oxazol (223 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, metanol/agua 0,1 % de ácido fórmico) (12 mg, 0,0427 mmol, 7 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento I): T r= 1,31 min; EM (lENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 0,98 -1,10 (m, 4H), 2,13 -2,21 (m, 1H), 3,89 (s, 2H), 7,28 - 7,36 (m, 2H), 7,39 - 7,48 (m, 5H), 7,68 (d, 1H), 7,89 (dd, 1H), 8,37 (d, 1H), 10,71 (s, 1H).
Ejemplo 440
2-(2-Clorofeml)-W-(4-{4-[(3,3-d¡fluoroazet¡dm-1 -¡l)carboml]-1H-p¡razol-1-¡l}-3-sulfamo¡lfeml)acetam¡da
De acuerdo con el procedimiento general GP7.1, se convirtió 1-(4-{[(2-clorofenil)acetil]amino}-2-sulfamoilfenil)-1 H-pirazol-4-carboxilato de metilo (100 mg, 0,22 mmol) y 3,3-difluoroazetidina (51,8 mg, 0,56 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (31 mg, 0,0608 mmol, 28 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,97 min; EM (lENpos): m/z = 510 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,91 (s, 2H), 4,35 - 4,56 (m, 2H), 4,74 - 5,00 (m, 2H), 7,30 - 7,37 (m, 2H), 7,38 - 7,49 (m, 4H), 7,59 (d, 1H), 7,98 (dd, 1H), 8,07 (s, 1H), 8,39 (d, 1H), 8,50 (s, 1H), 10,82 (s, 1H).
Ejemplo 441
W-{4-[4-(Azet¡dm-1-¡lcarboml)-1H-p¡razoM-¡l]-3-sulfamo¡lfeml}-2-(2-clorofeml)acetam¡da
De acuerdo con el procedimiento general GP7.1, se convirtió 1-(4-{[(2-clorofenil)acetil]amino}-2-sulfamoilfenil)-1 H-pirazol-4-carboxilato de metilo (100 mg, 0,22 mmol) y azetidina (31,8 mg, 0,56 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (17 mg, 0,0359 mmol, 16 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 0,90 min; EM (lENpos): m/z = 474 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,24 - 2,32 (m, 2H), 3,91 (s, 2H), 4,00 (t a, 2H), 4,39 (t a, 2H), 7,30 - 7,36 (m, 2H), 7,40 - 7,48 (m, 4H), 7,58 (d, 1H), 7,97 (dd, 1H), 8,01 (d, 1H), 8,38 (d, 1H), 8,41 (d, 1H), 10,80 (s, 1H).
Ejemplo 442
2-(2-Clorofeml)-W-{4-[4-(p¡rrol¡dm-1-¡lcarboml)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da
De acuerdo con el procedimiento general GP7.1, se convirtió 1-(4-{[(2-clorofenil)acetil]amino}-2-sulfamoilfenil)-1 H-pirazol-4-carboxilato de metilo (100 mg, 0,22 mmol) y pirrolidina (39,6 mg, 0,56 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (21 mg, 0,0430 mmol, 20 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 0,95 min; EM (lENpos): m/z = 488 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 1,79 - 1,88 (m, 2H), 1,89 - 1,97 (m, 2H), 3,46 (t, 2H), 3,68 (t, 2H), 3,91 (s, 2H), 7,29 - 7,37 (m, 2H), 7,40 - 7,49 (m, 4H), 7,60 (d, 1H), 7,97 (dd, 1H), 8,06 (d, 1H), 8,38 (d, 1H), 8,46 (d, 1H), 10,80 (s, 1H).
Ejemplo 443
2-(2-Clorofeml)-W-(4-{4-[(3,3-d¡fluorop¡rrol¡dm-1-¡l)carboml]-1H-p¡razol-1-¡l}-3-sulfamo¡lfeml)acetam¡da
De acuerdo con el procedimiento general GP7.1, se convirtió 1-(4-{[(2-clorofenil)acetil]amino}-2-sulfamoilfenil)-1 H-pirazol-4-carboxilato de metilo (100 mg, 0,22 mmol) y 3,3-difluoropirrolidina (59,7 mg, 0,56 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (31 mg, 0,0592 mmol, 27 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 0,99 min; EM (lENpos): m/z = 524 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 3,70 (t a, 1H), 3,88 (t a, 1H), 3,91 (s, 2H), 3,97 (t a, 1H), 4,19 (t a, 1H), 7,29 -7,36 (m, 2H), 7,40 - 7,49 (m, 4H), 7,62 (t a, 1H), 7,98 (dd, 1H), 8,10 (s, 1H), 8,38 (d, 1H), 8,53 (d a, 1H), 10,81 (s, 1H), 2H probablemente superpuesto con señal de agua
Ejemplo 444
-(4-Clorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (4-clorofenil)acético en el compuesto del título (12,9 mg, 0,0275 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (lENpos): m/z = 470 [M+H]+
Ejemplo 445
2-(2-Cloro-6-fluorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (2-cloro-6-fluorofenil)acético en el compuesto del título (18,0 mg, 0,0369 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 488 [M+H]+
Ejemplo 446
W-{3-Sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}-2-[4-(tr¡fluoromet¡l)feml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido [4-(trifluorometil)fenil]acético en el compuesto del título (10,6 mg, 0,0211 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (lENpos): m/z = 504 [M+H]+
Ejemplo 447
2-(3-Fluorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (3-fluorofenil)acético en el compuesto del título (20,7 mg, 0,0457 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 454 [M+H]+
Ejemplo 448
2-(2,4-D¡clorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (2,4-diclorofenil)acético en el compuesto del título (15,0 mg, 0,0297 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,22 min; EM (IENpos): m/z = 504 [M+H]+
Ejemplo 449
2-(2-Bromofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (2-bromofenil)acético en el compuesto del título (12,9 mg, 0,0251 mmol, 13 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 514 [M+H]+
Ejemplo 450
2-(2,4-D¡fluorofeml)-N-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (2,4-difluorofenil)acético en el compuesto del título (13,9 mg, 0,0295 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,10 min; EM (IENpos): m/z = 472 [M+H]+
Ejemplo 451
2-(3,4-Difluorofeml)-N-{3-sulfamoil-4-[5-(trífluorometM)pmdm-3-N]feml}acetamida
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (3,4-difluorofenil)acético en el compuesto del título (20,3 mg, 0,0431 mmol, 22 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENpos): m/z = 472 [M+H]+
Ejemplo 452
2-(3,5-D¡fluorofeml)-W-{3-sulfamo¡l-4-[5-(tr¡fluorometM)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (3,4-difluorofenil)acético en el compuesto del título (20,3 mg, 0,0431 mmol, 22 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENpos): m/z = 472 [M+H]+
Ejemplo 453
2-(3-Clorofeml)-N-{3-sulfamoil-4-[5-(trífluorometil)pmdm-3-il]feml}acetamida
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (3-clorofenil)acético en el compuesto del título (7,0 mg, 0,0149 mmol, 7 % de rendimiento, 78 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 470 [M+H]+
Ejemplo 454
2-(4-MetNfeml)-N-{3-sulfamoil-4-[5-(trífluorometM)pmdm-3-N]feml}acetamida
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (4-metilfenil)acético en el compuesto del título (13,2 mg, 0,0294 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 450 [M+H]+
Ejemplo 455
2-(4-Metox¡feml)-W-{3-sulfamo¡l-4-[5-(tr¡fluorometM)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (4-metoxifenil)acético en el compuesto del título (17,9 mg, 0,0385 mmol, 19 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,06 min; EM (IENpos): m/z = 466 [M+H]+
Ejemplo 456
2-(2-Fluoro-4-metilfeml)-N-{3-sulfamoil-4-[5-(trífluorometil)pmdm-3-il]feml}acetamida
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (2-flúor-4-metilfenil)acético en el compuesto del título (21,6 mg, 0,0462 mmol, 23 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (IENpos): m/z = 468 [M+H]+
Ejemplo 457
2-(2-Fluoro-4-metox¡feml)-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)pmdm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido (2-flúor-4-metoxifenil)acético en el compuesto del título (23,5 mg, 0,0486 mmol, 24 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 484 [M+H]+
Ejemplo 458
2-[4-(D¡fluoromet¡l)feml]-W-{3-sulfamo¡l-4-[5-(tr¡fluoromet¡l)p¡r¡dm-3-¡l]feml}acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-A/-[(dimetilamino)metilen]-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida (0,20 mmol) y ácido [4-(difluorometil)fenil]acético en el compuesto del título (17,1 mg, 0,0352 mmol, 18 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (IENpos): m/z = 486 [M+H]+
Ejemplo 459
2-(4-Clorofeml)-W-[4-(6-cloropmdm-3-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (4-clorofenil)acético en el compuesto del título (14,0 mg, 0,0321 mmol, 15 % de rendimiento, 81 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (IENpos): m/z = 436 [M+H]+
Ejemplo 460
W-[4-(6-Cloropmdm-3-M)-3-sulfamoMfeml]-2-(2-fluorofeml)acetamida
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (2-fluorofenil)acético en el compuesto del título (15,0 mg, 0,0357 mmol, 17 % de rendimiento, 91 % de pureza).
CL-EM (Procedimiento A): Tr = 1,02 min; EM (IENpos): m/z = 420 [M+H]+
Ejemplo 461
2-(2-Cloro-6-fluorofeml)-W-[4-(6-cloropmdm-3-M)-3-sulfamoilfeml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (2-cloro-6-fluorofenil)acético en el compuesto del título (10,3 mg, 0,0223 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 454 [M+H]+
Ejemplo 462
N-[4-(6-Cloropiridm-3-M)-3-sulfamoMfeml]-2-[4-(trifluorometil)feml]acetamida
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido [4-(trifluorometil)fenil]acético en el compuesto del título (12,6 mg, 0,0268 mmol, 13 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (IENpos): m/z = 470 [M+H]+
Ejemplo 463
W-[4-(6-Clorop¡r¡dm-3-M)-3-sulfamoMfeml]-2-[2-(tr¡fluoromet¡l)feml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido [2-(trifluorometil)fenil]acético en el compuesto del título (20,0 mg, 0,0426 mmol, 20 % de rendimiento, 76 % de pureza).
CL-EM (Procedimiento A): Tr = 1,12 min; EM (IENpos): m/z = 470 [M+H]+
Ejemplo 464
W-[4-(6-Clorop¡r¡dm-3-M)-3-sulfamo¡lfeml]-2-(3-fluorofeml)acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (3-fluorofenil)acético en el compuesto del título (13,1 mg, 0,0312 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (IENpos): m/z = 420 [M+H]+
Ejemplo 465
W-[4-(6-Cloropmdm-3-M)-3-sulfamo¡lfeml]-2-(2,4-d¡clorofeml)acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (2,4-diclorofenil)acético en el compuesto del título (13,0 mg, 0,0276 mmol, 13 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (IENpos): m/z = 470 [M+H]+
Ejemplo 466
W-[4-(6-Clorop¡r¡dm-3-M)-3-sulfamo¡lfeml]-2-(2,4-d¡fluorofeml)acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (2,4-difluorofenil)acético en el compuesto del título (13,0 mg, 0,0297 mmol, 14 % de rendimiento, 82 % de pureza).
CL-EM (Procedimiento A): Tr = 1,05 min; EM (IENpos): m/z = 438 [M+H]+
Ejemplo 467
2-(2-Bromofeml)-W-[4-(6-clorop¡r¡dm-3-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (2-bromofenil)acético en el compuesto del título (18 , 8 mg, 0,0391 mmol, 19 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 480 [M+H]+
Ejemplo 468
W-[4-(6-Cloropmdm-3-M)-3-sulfamo¡lfeml]-2-(3,4-d¡fluorofeml)acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (3,4-difluorofenil)acético en el compuesto del título (13,9 mg, 0,0317 mmol, 15 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,07 min; EM (IENpos): m/z = 438 [M+H]+
Ejemplo 469
W-[4-(6-Cloropmdm-3-M)-3-sulfamoMfeml]-2-(4-metilfeml)acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (4-metilfenil)acético en el compuesto del título (9,4 mg, 0,0226 mmol, 11 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 416 [M+H]+
Ejemplo 470
W -^-^ -C lo rop iridm ^-il^ -su lfam o ilfe m l^ -^-m e to x ifem ^ace ta m id a
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (4-metoxifenil)acético en el compuesto del título (18,8 mg, 0,0435 mmol, 21 % de rendimiento, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 1,01 min; EM (IENpos): m/z = 432 [M+H]+
Ejemplo 471
W-[4-(6-Cloropmdm-3-M)-3-sulfamoMfeml]-2-(2-flúor-4-metMfeml)acetamida
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (2-flúor-4-metilfenil)acético en el compuesto del título (21,2 mg, 0,0489 mmol, 23 % de rendimiento, 85 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 434 [M+H]+
Ejemplo 472
W-[4-(6-Clorop¡r¡dm-3-M)-3-sulfamo¡lfeml]-2-(2-flúor-4-metox¡feml)acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido (2-flúor-4-metoxifenil)acético en el compuesto del título (15,3 mg, 0,0340 mmol, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,04 min; EM (IENpos): m/z = 450 [M+H]+
Ejemplo 473
W-[4-(6-Cloropmdm-3-M)-3-sulfamoMfeml]-2-[4-(difluorometM)feml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido [4-(difluorometil)fenil]acético en el compuesto del título (12 , 6 mg, 0,0279 mmol, 13 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,06 min; EM (IENpos): m/z = 452 [M+H]+
Ejemplo 474
W-[4-(6-Clorop¡r¡dm-3-M)-3-sulfamoMfeml]-2-[2-cloro-4-(tr¡fluoromet¡l)feml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-2-(6-cloropiridin-3-il)-A/-[(dimetilamino)metilen]bencensulfonamida (0,21 mmol) y ácido [2-cloro-4-(trifluorometil)fenil]acético en el compuesto del título (13,7 mg, 0,0272 mmol, 13 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 504 [M+H]+
Ejemplo 475
2-(2,4-D¡dorofeml)-W-[4-(5-fluorop¡r¡dm-3-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-W-[(dimetilamino)metilen]-2-(5-fluoropiridin-3-il)bencensulfonamida (0,25 mmol) y ácido (2,4-diclorofenil)acético en el compuesto del título (16,0 mg, 0,0352 mmol, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (IENpos): m/z = 454 [M+H]+
Ejemplo 476
2-(2-Fluoro-4-met¡lfeml)-W-[4-(5-fluoropmdm-3-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-W-[(dimetilamino)metilen]-2-(5-fluoropiridin-3-il)bencensulfonamida (0,25 mmol) y ácido (2-flúor-4-metilfenil)acético en el compuesto del título (42,2 mg, 0,101 mmol, 40 % de rendimiento, 73 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min; EM (IENpos): m/z = 418 [M+H]+
Ejemplo 477
2-[4-(D¡fluoromet¡l)feml]-W-[4-(5-fluoropmdm-3-¡l)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con el procedimiento general GP6.2, se convirtió 5-amino-N-[(dimetilamino)metilen]-2-(5-fluoropiridin-3-il)bencensulfonamida (0,25 mmol) y ácido [4-(difluorometil)fenil]acético en el compuesto del título (27,5 mg, 0,0632 mmol, 25 % de rendimiento, 78 % de pureza).
CL-EM (Procedimiento A): Tr = 1,00 min; EM (lENpos): m/z = 436 [M+H]+
Ejemplo 478
2-(2-Clorofeml)-W-[4-(4-c¡cloprop¡l-1H-p¡razol-1-M)-3-sulfamo¡lfeml]acetam¡da
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-ciclopropil-1H-pirazol (210 mg, 1,94 mmol) y ácido (2-clorofenil)acético (330 mg, 1,94 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final dos veces mediante HPLC preparativa (Waters XBridge C18 5 |j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (1 mg, 0,00232 mmol, 2 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,27 min; EM (lENpos): m/z = 431 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 0,55 - 0,61 (m, 2H), 0,84 - 0,90 (m, 2H), 1,73 -1,81 (m, 1H), 3,89 (s, 2H), 7,29 - 7,37 (m, 2H), 7,42 - 7,51 (m, 5H), 7,58 (s, 1H), 7,88 (s, 1H), 7,96 (dd, 1H), 8,33 (d, 1H), 10,74 (s, 1H).
Ejemplo 479 y Ejemplo 480
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4,6-difluoro-2H-benzotriazol (300 mg, 1,94 mmol) y ácido (2-fluorofenil)acético (267 mg, 1,74 mmol) sin purificación de intermedios en los compuestos del título que se purificaron y se separaron al final mediante HPLC preparativa (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Fenomenex Kinetex C18 EVO 5 j 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)).
Ejemplo 479
M-[4-(4,6-D¡fluoro-2H-benzotríazol-2-¡l)-3-sulfamo¡lfeml]-2-(2-fluorofeml)acetam¡da
11 mg, 0,0238 mmol, 2 % de rendimiento al cabo de 4 pasos, 95 % de pureza
CL-EM (Procedimiento J): Tr = 1,32 min; EM (lENpos): m/z = 460 [M-H]
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 3,84 (s, 2H), 7,16 - 7,24 (m, 2H), 7,31 - 7,38 (m, 1H), 7,43 (td, 1H), 7,52 - 7,61 (m, 3H), 7,81 (dd, 1H), 7,87 (d, 1H), 8,05 (dd, 1H), 8,50 (d, 1H), 10,93 (s, 1H).
Ejemplo 480
W-[4-(4,6-Difluoro-1H-benzotriazol-1-M)-3-sulfamoilfeml]-2-(2-fluorofeml)acetamida
6,1 mg, 0,0132 mmol, 1 % de rendimiento al cabo de 4 pasos, 95 % de pureza
CL-EM (Procedimiento J): Tr = 1,22 min; EM (IENpos): m/z = 460 [M-H]-RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,85 (s, 2H), 7,15 - 7,24 (m, 3H), 7,31 - 7,39 (m, 1H), 7,40 - 7,48 (m, 2H), 7,50 (s, 2H), 7,66 (d, 1H), 8,02 (dd, 1H), 8,52 (d, 1H), 10,93 (s, 1H).
Ejemplo 481 y Ejemplo 482
De acuerdo con los procedimientos generales GP1.2, GP2.1, GP3.3 y GP4.1, se convirtió 2-cloro-A/-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4,6-difluoro-2H-benzotriazol (300 mg, 1,94 mmol) y ácido (2-clorofenil)acético (296 mg, 1,74 mmol) sin purificación de intermedios en los compuestos del título que se purificaron y se separaron al final mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Fenomenex Kinetex C18 EVO 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)).
Ejemplo 481
2-(2-Clorofeml)-W-[4-(4,6-difluoro-1H-benzotriazol-1-M)-3-sulfamoilfeml]acetamida
10,6 mg, 0,0222 mmol, 2 % de rendimiento al cabo de 4 pasos, 95 % de pureza
CL-EM (Procedimiento J): Tr = 1,28 min; EM (IENpos): m/z = 476 [M-H]-RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,95 (s, 2H), 7,19 (dd, 1H), 7,30 - 7,38 (m, 2H), 7,41 - 7,54 (m, 5H), 7,66 (d, 1H), 8,02 (dd, 1H), 8,53 (d, 1H), 10,95 (s, 1H).
Ejemplo 482
-(2-Clorofeml)-N-[4-(4,6-difluoro-2H-benzotríazol-2-M)-3-sulfamoilfeml]acetamida
13,1 mg, 0,0274 mmol, 2 % de rendimiento al cabo de 4 pasos, 95 % de pureza
CL-EM (Procedimiento J): Tr = 1,36 min; EM (IENpos): m/z = 476 [M-H]-RMN 1H (600MHz, DMSO-da) 8 [ppm]: 3,95 (s, 2H), 7,31 - 7,37 (m, 2H), 7,45 - 7,49 (m, 2H), 7,52 - 7,60 (m, 3H), 7,82 (dd, 1H), 7,88 (d, 1H), 8,06 (dd, 1H), 8,51 (d, 1H), 10,97 (s, 1H).
Ejemplo 483
2-(2-Clorofeml)-W-{3-sulfamoN-4-[2-(tnfluorometM)-1,3-tiazol-5-N]feml}acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-2-(trifluorometil)-1,3-tiazol (275 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (11 mg, 0,0462 mmol, 7 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,16 min; EM (IENpos): m/z = 476 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,91 (s, 2H), 7,29 - 7,36 (m, 2H), 7,41 - 7,48 (m, 2H), 7,53 - 7,58 (m, 3H), 7,90 (dd, 1H), 8,13 (d, 1H), 8,42 (d, 1H), 10,80 (s, 1H).
Ejemplo 484, Ejemplo 485, Ejemplo 486, Ejemplo 487 y Ejemplo 488
A una mezcla de 2-(2-clorofenil)-A/-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida (200 mg, 0,48 mmol), trifluorometansulfinato de sodio (600 mg, 3,85 mmol) y triflato de cobre (II) (35 mg; 0,10 mmol), en argón, se le añadió acetonitrilo (2 ml). A la mezcla resultante, en agitación vigorosa, se le añadió por goteo hidroperóxido de tere-butilo (70 % en peso en agua, 0,53 ml, 3,85 mmol) a lo largo de 30 min por medio de una bomba de jeringa. Después de agitar durante otras 15 h la mezcla de reacción se filtró. El filtrado resultante se concentró al vacío hasta aproximadamente 1 ml y se purificó mediante HPLC para dar los compuestos del título separados.
Ejemplo 484
2-(2-Clorofeml)-W-[4-(4-ciano-1H-pirazoM-M)-5-sulfamoN-2-(tnfluorometN)feml]acetamida
0,9 mg, 1 % de rendimiento, 85 % de pureza
CL-EM (Procedimiento M): Tr = 2,63 min; EM (IENpos): m/z = 484 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,99 (s, 2H), 6,33 (s, 2H), 7,35 (m, 2H), 7,45 (m, 1H), 7,48 (m, 1H), 7,87 (s, 1H), 8,14 (d, 1H), 8,22 (bs, 1H), 8,45 (d, 1H), 8,76 (s, 1H).
Ejemplo 485
2-[2-Cloro-5-(tnfluorometN)feml]-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
6,5 mg, 2 % de rendimiento, 85 % de pureza
CL-EM (Procedimiento M): Tr = 2,64 min; EM (lENpos): m/z = 484 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,99 (s, 2H), 6,33 (s, 2H), 7,35 (m, 2H), 7,45 (m, 1H), 7,48 (m, 1H), 7,87 (s, 1H), 8,14 (d, 1H), 8,22 (s, 1H), 8,45 (d, 1H), 8,76 (s, 1H).
Ejemplo 486
2-[2-Cloro-5-(tnfluorometN)feml]-W-[4-(4-ciano-1H-pirazoM-M)-5-sulfamoN-2-(trifluorometM)feml]acetamida
5,0 mg, 2 % de rendimiento, 90 % de pureza
CL-EM (Procedimiento M): Tr = 2,93 min; EM (lENpos): m/z = 552 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 4,07 (s, 2H), 6,34 (s, 2H), 7,66 (m, 2H), 7,78 (m, 1H), 7,89 (s, 1H), 8,15 (d, 1H), 8,39 (s, 1H), 8,46 (d, 1H), 8,67 (s, 1H).
Ejemplo 487
2-(2-Clorofeml)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoN-2-(trifluorometN)feml]acetamida
0,7 mg, 1 % de rendimiento, 90 % de pureza
CL-EM (Procedimiento M): Tr = 2,33 min; EM (lENpos): m/z = 484 [M+H]+
RMN 1 H (600MHz, CD3CN) 5 [ppm] 3,94 (s, 2H), 6,08 (s, 2H), 7,34 (m, 2H), 7,43 (m, 1H), 7,47 (m, 1H), 7,73 (d, 1H), 8,02 (d, 1H), 8,13 (d, 1H), 8,37 (s, 1H), 8,47 (d, 1H).
Ejemplo 488
2-[2-Cloro-3-(trifluorometil)fenil]-N-[4-(4-ciano-1H-pirazol-1-il)-5-sulfamoil-2-(trifluorometil)fenil]acetamida
5,3 mg, 2 % de rendimiento, 90 % de pureza
CL-EM (Procedimiento M): Tr = 2,89 min; EM (IENpos): m/z = 552 [M+H]+
RMN 1 H (600MHz, CD3CN) 5 [ppm] 4,13 (s, 2H), 6,37 (s, 2H), 7,54 (t, 1H), 7,74 (d, 1H), 7,81 (d, 1H), 7,92 (s, 1H), 8,18 (s, 1H), 8,40 (s, 1H), 8,49 (s, 1H), 8,71(s, 1H).
Ejemplo 489, Ejemplo 490 y Ejemplo 491
A una mezcla de 2-(2-clorofenil)-W-(4-[1-(difluorometil)-1H-pirazol-4-il]-3-{[(dimetilamino)metilen]sulfamoil}fenil)acetamida (150 mg, 0,30 mmol), trifluorometansulfinato de sodio (378 mg, 2,42 mmol) y triflato de cobre (ll) (22 mg; 0,06 mmol), en argón, se le añadió acetonitrilo (1,5 ml). A la mezcla resultante, en agitación vigorosa, se le añadió por goteo hidroperóxido de ferc-butilo (70 % en peso en H2O, 0,33 ml, 2,42 mmol) a lo largo de 30 min por medio de una bomba de jeringa. Después de agitar durante otras 15 h la mezcla de reacción se filtró. El filtrado resultante se concentró al vacío hasta aproximadamente 1 ml y se purificó mediante HPLC para dar los siguientes intermedios: 2-(2-clorofenil)-W-{4-[1-(difluorometil)-1H-pirazol-4-il]-3-{[(dimetilamino)metilen]sulfamoil}-2-(trifluorometil)fenil}acetamida (5,4 mg, 3,0 % de rendimiento, 95 % de pureza), 2-[2-cloro-3-(trifluorometil)fenil]-A/-(4-[1-(difluorometil)-1H-pirazol-4-il]-3-{[(dimetilamino)metilen]sulfamoil}fenil)acetamida (6,1 mg, 3,2% de rendimiento, 90% de pureza), 2-(2-clorofenil)-W-{4-[1-(difluorometil)-1H-pirazol-4-il]-5-{[(dimetilamino)metilen]sulfamoil}-2-(trifluorometil)fenil}acetamida (5,0 mg, 2,8 % de rendimiento, 95% de pureza) y 2-(2-clorofenil)-W-(4-[1-(difluorometil)-5-(trifluorometil)-1H-pirazol-4-il]-3-{[(dimetilamino)metilen]sulfamoil}fenil)acetamida (2,3 mg, 1,2 % de rendimiento, 90 % de pureza).
Estos intermedios se volvieron a disolver separadamente en metanol (0,5 ml) y se añadió amoníaco acuoso (0,5 ml), después se agitó a temperatura ambiente durante 2 días. Se añadió agua y la mezcla resultante se extrajo tres veces con diclorometano. Las fases orgánicas combinadas se lavaron con salmuera, se secaron y se concentró al vacío para dar los compuestos del título.
Ejemplo 489
2-(2-Clorofeml)-W-{4-[1-(difluorometM)-1H-pirazol-4-M]-3-sulfamoN-2-(trifluorometM)feml}acetamida
4,3 mg, 3 % de rendimiento, 95 % de pureza
CL-EM (Procedimiento M): Tr = 2,64 min; EM (lENpos): m/z = 509 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,92 (s, 2H), 5,57 (s, 2H), 7,33 (m, 2H), 7,42 (t, 1H), 7,43 (m, 1H), 7,46 (m, 1H), 7,60 (d, 1H), 7,82 (d, 1H), 7,92 (s, 1H), 8,20 (s, 1H), 8,25 (s, 1H).
Ejemplo 490
2-[2-Cloro-3-(tnfluorometN)feml]-W-{4-[1-(difluorometM)-1H-pirazol-4-M]-3-sulfamoNfeml}acetamida
5,0 mg, 3 % de rendimiento, 90 % de pureza
CL-EM (Procedimiento M): Tr = 2,82 min; EM (lENpos): m/z = 509 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,99 (s, 2H), 5,50 (bs, 2H), 7,40 (t, 1H), 7,42 (d, 1H), 7,49 (dd, 1H), 7,68 (dd, 1H), 7,75 (dd, 1H), 7,79 (dd, 1H), 7,89 (s, 1H), 8,22 (d, 1H), 8,38 (d, 1H), 8 , 88 (s, 1H).
Ejemplo 491
2-(2-Clorofeml)-W-{4-[1-(difluorometM)-1H-pirazol-4-M]-5-sulfamoN-2-(trifluorometM)feml}acetamida
4,6 mg, 3 % de rendimiento, 90 % de pureza
CL-EM (Procedimiento M): Tr = 2,92 min; EM (lENpos): m/z = 509 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,95 (s, 2H), 5,65 (s, 2H), 7,35 (m, 2H), 7,41 (t, 1H), 7,45 (m, 1H), 7,48 (m, 1H), 7,76 (s, 1H), 7,94 (s, 1H), 8,12 (s, 1H), 8,28 (s, 1H), 8,62 (s, 1H).
Ejemplo 492
2-(2-ClorofenM)-W-{4-[1-(difluorometM)-5-(trifluorometM)-1H-pirazol-4-M]-3-sulfamoMfenM}acetamida
2,4 mg, 1 % de rendimiento, 80 % de pureza
CL-EM (Procedimiento M): Tr = 2,87 min; EM (lENpos): m/z = 509 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,92 (s, 2H), 5,50 (bs, 2H), 7,35 (m, 3H), 7,45 (m, 1H), 7,47 (m, 1H), 7,59 (t, 1H), 7,81 (dd, 1H), 7,82 (s, 1H), 8,43 (d, 1H), 8,90 (s, 1H).
Ejemplo 493 y Ejemplo 494
En un tubo para presión, a una mezcla de 2-(2-clorofenil)-W-(4-[1-(difluorometil)-1H-pirazol-4-il]-3-{[(dimetilamino)metilen]sulfamoil}fenil)acetamida (200 mg, 0,40 mmol) y bis(tetrafluoroborato) de 1-clorometil-4-flúor-1,4-diazoniabicido[2.2.2]octano (286 mg, 0,81 mmol) se le añadió, en argón, acetonitrilo (2 ml). La mezcla resultante se agitó enérgicamente a 80 °C durante 15 h, después se concentró al vacío y se purificó mediante HPLC para dar los siguientes intermedios: 2-(2-clorofenil)-W-(4-[1-(difluorometil)-1H-pirazol-4-il]-3-{[(dimetilamino)metilen]sulfamoil}-2-fluorofenil)acetamida (18,5 mg, 8,5% de rendimiento, 95% de pureza) y 2-(2-clorofenil)-A/-(4-[1-(difluorometil)-1H-pirazol-4-il]-5-{[(dimetilamino)metilen]sulfamoil}-2-fluorofenil)acetamida (4,9 mg, 2,0 % de rendimiento, 85 % de pureza).
Estos intermedios se volvieron a disolver separadamente en metanol (0,5 ml) y se añadió amoníaco acuoso (0,5 ml), después se agitó a temperatura ambiente durante 2 días. Se añadió agua y la mezcla resultante se extrajo tres veces con diclorometano. Las fases orgánicas combinadas se lavaron con salmuera, se secaron y se concentró al vacío para dar los compuestos del título.
Ejemplo 493
2-(2-Clorofeml)-W-{4-[1-(difluorometM)-1H-pirazol-4-M]-2-flúor-3-sulfamoNfeml}acetamida
16,1 mg, 8 % de rendimiento, 95 % de pureza
CL-EM (Procedimiento M): Tr = 2,41 min; EM (lENpos): m/z = 459 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,95 (s, 2H), 5,95 (bs, 2H), 7,16 (dd, 1H), 7,33 (m, 2H), 7,38 (t, 1H), 7,42 (m, 1H), 7,46 (m, 1H), 7,76 (s, 1H), 8,04 (s, 1H), 8,25 (t, 1H), 8,47 (s, 1H).
Ejemplo 494
2-(2-ClorofenM)-W-{4-[1-(difluorometM)-1H-pirazol-4-M]-2-flúor-5-sulfamoNfeml}acetamida
4,1 mg, 2 % de rendimiento, 85 % de pureza
CL-EM (Procedimiento M): Tr = 2,56 min; EM (lENpos): m/z = 459 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,95 (s, 2H), 5,62 (bs, 2H), 7,32 (m, 3H), 7,41 (t, 1H), 7,42 (m, 1H), 7,46 (m, 1H), 7,91 (s, 1H), 8,26 (s, 1H), 8,53 (s, 1H), 8,90 (d, 1H).
Ejemplo 495
2-(2-Clorofeml)-N-{4-[2-(dimetilammo)-1,3-tiazol-4-il]-3-sulfamoilfeml}acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 4-bromo-A/,W-dimetil-1,3-tiazol-2-amina (123 mg, 0,59 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Chromatorex C-1810 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (30 mg, 0,0665 mmol, 10 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 452 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,06 (s, 6 H), 3,88 (s, 2H), 6,91 (s, 1H), 7,29 - 7,35 (m, 2H), 7,42 - 7,48 (m, 2H), 7,56 (d, 1H), 7,83 (s, 2H), 7,90 (dd, 1H), 8,27 (d, 1H), 10,65 (s, 1H).
Ejemplo 496
2-(2-Clorofeml)-W-[3-sulfamoil-4-(1,2-tiazol-5-il)feml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-1,2-tiazol (195 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters Fenomenex Kinetex EVO C18 5p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (6,5 mg, 0,0159 mmol, 2 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento I): T r= 1,25 min; EM (lENpos): m/z = 408 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,90 (s, 2H), 7,29 - 7,35 (m, 2H), 7,41 - 7,52 (m, 5H), 7,56 (d, 1H), 7,88 (dd, 1H), 8,42 (d, 1H), 8,54 (d, 1H), 10,76 (s, 1H).
Ejemplo 497
1-(4-{[(2-Clorofenil)acetil]amino}-2-sulfamoilfenil)-W-ciclopropil-W-metil-1H-pirazol-4-carboxamida
De acuerdo con el procedimiento general GP7.1, se convirtió 1-(4-{[(2-clorofenil)acetil]amino}-2-sulfamoilfenil)-1 H-pirazol-4-carboxilato de metilo (100 mg, 0,22 mmol) y A/-metilciclopropanamina (39,6 mg, 0,56 mmol) en THF (solamente 0,25 ml) en el compuesto del título y se purificó mediante HPLC preparativa (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (2,4 mg, 0,00492 mmol, 2 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,99 min; EM (lENpos): m/z = 488 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 0,58 -0,64 (m, 2H), 0,80 -0,87 (m, 2H), 2,97 (s, 3H), 3,03 -3,11 (m, 1H), 3,91 (s, 2H), 7,29 - 7,37 (m, 2H), 7,37 - 7,49 (m, 4H), 7,58 (d, 1H), 7,98 (dd, 1H), 8,07 (s, 1H), 8,38 (d, 1H), 8,50 (s, 1H), 10,81 (s, 1H).
Ejemplo 498
2-(2-ClorofenM)-2-hidroxi-W-{3-sulfamoN-4-[4-(trifluorometM)-1H-pirazoM -il]fenil}etanamida
Se disolvió 2-(2-clorofenil)-A/-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida (160 mg, 0,35 mmol) en etilenglicol (1,2 ml) en un recipiente para microondas sellable y compresible (5 ml) y se añadió hidrato de trifluoroacetato de cobre (II) (151 mg, 0,52 mmol), el recipiente se selló con un septum y el recipiente se calentó a 150 °C durante 12 horas. Se añadió diclorometano (30 ml) y agua (20 ml), las fases se separaron, la fase acuosa se extrajo con diclorometano (2 x 30 ml), las fases orgánicas se combinaron, se secó sobre sulfato de sodio y el disolvente se retiró a presión reducida. La mezcla de reacción en bruto se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) y después otra vez mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0 , 2 % de solución de amoníaco (32 %)) dando el compuesto del título (1,5 mg, 0,003 mmol, 1 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,98 min; EM (lENpos): m/z = 474 [M+H]+
RMN 1H (400 MHz, DMSO-d6 ) 8 ppm 5,53 (d, 1 H) 6,77 (s a, 1 H) 7,29 - 7,49 (m, 5 H) 7,55 - 7,66 (m, 2 H) 8,07 (dd, 1 H) 8,18 (s, 1 H) 8,61 (d, 1 H) 8,73 (s, 1 H) 10,72 (s, 1 H)
Ejemplo 499
2-(2-ClorofenM)-W-{3-cloro-5-sulfamoN-4-[4-(trifluorometM)-1H-pirazoM-N]feml}acetamida
Se disolvió 2-(2-clorofenil)-A/-(3-{[(dimetilamino)metilen]sulfamoil}-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil)acetamida
(135 mg, 0,26 mmol) en dicloroetano (1 ml) en un recipiente para microondas sellable y compresible (5 ml) y se añadió hidrato de trifluoroacetato de cobre (II) (91 mg, 0,32 mmol), el recipiente se selló con un septum y el recipiente se calentó a 130 °C durante 24 horas. Se añadió metanol (3 ml) y amoníaco acuoso (25 %, 1 ml) y el recipiente se calentó a 50 °C durante 36 horas. Se añadió diclorometano (30 ml) y agua (20 ml), las fases se separaron, y la fase acuosa se extrajo con diclorometano (2 x 30 ml), las fases orgánicas se combinaron, se secó sobre sulfato de sodio y el disolvente se retiró a presión reducida. La mezcla resultante se purificó mediante HPLC preparativa (Waters XBridge C185 |j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) dando el compuesto del título (5 mg, 0,01 mmol, 4 % de rendimiento al cabo de 2 pasos, 81 % de pureza).
CL-EM (Procedimiento A): Tr = 1,26 min; EM (lENpos): m/z = 493 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 3,94 (s, 2H), 7,26 -7,33 (m, 2H), 7,37 -7,45 (m, 2H), 8,06 (d, 1H), 8,25 (d, 1H), 8,29 (d, 1H), 8,35 (s, 1H).
Ejemplo 500
2-(2-Clorofeml)-W-[4-(4-c¡ano-3-h¡drox¡-1H-p¡razol-1-M)-3-sulfamo¡lfeml]acetam¡da
Se colocó 2-(2-clorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3{[(dimetilamino)metilen]sulfamoil}fenil]acetamida (200 mg, 0,425 mmol) en un recipiente para microondas sellable y compresible (5 ml) y, el recipiente se cerró por compresión y se purgó con argón durante 5 minutos. Una solución de dímero (1,5-ciclooctadien)(metoxi)iridio(I) (14 mg, 0,021 mmol), 4,4'-di-terc-butil-2,2'-dipiridilo (11,4 mg, 0,042 mmol) y bis(pinacolato)diboro (129,4 mg, 0,51 mmol) en THF (0,42 ml) que se había agitado en argón durante 1 hora a 80 °C se añadió en una atmósfera de argón. El recipiente después se calentó a 80 °C durante 24 horas, después de lo cual el disolvente se retiró a presión reducida. Se añadió hidróxido de potasio (72 mg, 1,27 mmol), agua (2 ml) y dimetilformamida (2 ml) y se añadió peróxido de hidrógeno (solución en agua 30 %, 0,13 ml, 1,27 mmol) por goteo. La mezcla se agitó durante 1 hora a temperatura ambiente, después de lo cual se añadió amoníaco acuoso (4 ml) y la mezcla se agitó a temperatura ambiente durante la noche. Se añadió un volumen adicional de amoníaco acuoso ( 6 ml) y la mezcla se agitó durante otras 48 horas a temperatura ambiente. Se añadió diclorometano (30 ml) y agua (20 ml), las fases se separaron, y la fase acuosa se extrajo con diclorometano (2 x 30 ml) y acetato de etilo (30 ml), las fases orgánicas se combinaron, se secó sobre sulfato de sodio y el disolvente se retiró a presión reducida. El sólido se purificó primero mediante cromatografía ultrarrápida (MeOH:DCM 2:98 hasta 20:80) y después por HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) dando el compuesto del título (5,5 mg, 0,01 mmol, 3 % de rendimiento al cabo de 3 pasos, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,84 min; EM (lENpos): m/z = 431 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,90 (s, 2 H) 7,28 - 7,36 (m, 2 H) 7,41 - 7,48 (m, 2 H) 7,50 (s a, 2 H) 7,55 (d, 1 H) 7,95 (dd, 1 H) 8,34 (d, 1 H) 8,54 (s, 1 H) 10,79 (s, 1 H) 11,35 - 12,45 (s a, 1 H)
Ejemplo 501
2-(2-Clorofeml)-W-[4-(1H-p¡razolo[4,3-c]piridm-1 -il)-3-sulfamoilfenil]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.2 y GP4.3, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 1H-pirazolo[4,3-c]piridina (231 mg, 1,94 mmol) y ácido (2-clorofenil)acético (352 mg, 2,07 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 jm , 125x30 mm, acetonitrilo/agua 0,1% de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua
0,1 % de ácido fórmico) (4,4 mg, 0,0100 mmol, 1 % de rendimiento al cabo de 4 pasos, 99 % de pureza).
CL-EM (Procedimiento A): Tr = 0,72 min; EM (IENpos): m/z = 442 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,93 (s, 2H), 7,26 - 7,38 (m, 5H), 7,44 - 7,49 (m, 2H), 7,63 (d, 1H), 8,03 (dd, 1H), 8,40 (d, 1H), 8,47 (d, 1H), 8,58 (d, 1H), 9,21 (d, 1H), 10,87 (s, 1H).
Ejemplo 502
2-(2-Clorofeml)-N-[4-(4,5-dimetiM,3-tiazol-2-il)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 2-bromo-4,5-dimetil-1,3-tiazol (114 mg, 0,59 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (2,5 mg, 0,00573 mmol, 1 % de rendimiento, 99 % de pureza).
CL-EM (Procedimiento B): Tr = 1,19 min; EM (IENpos): m/z = 436 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,32 (s, 3H), 2,41 (s, 3H), 3,90 (s, 2H), 7,28 - 7,36 (m, 2H), 7,41 - 7,49 (m, 2H), 7,68 (d, 1H), 7,75 (s, 2H), 7,97 (dd, 1H), 8,36 (d, 1H), 10,79 (s, 1H).
Ejemplo 503
2-(2-Clorofeml)-W-[4-(2,4-dimetil-1,3-tiazol-5-il)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-2,4-dimetil-1,3-tiazol (114 mg, 0,59 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Labomatic XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (2,4 mg, 0,00551 mmol, 1 % de rendimiento, 99 % de pureza). CL-EM (Procedimiento B): Tr = 0,94 min; EM (IENpos): m/z = 436 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,03 (s, 3H), 2,60 (s, 3H), 3,89 (s, 2H), 7,25 (s, 2H), 7,28 - 7,37 (m, 3H), 7,41 -7,48 (m, 2H), 7,83 (dd, 1H), 8,35 (d, 1H), 10,69 (s, 1H).
Ejemplo 504
2-(2-Clorofeml)-W-[4-(4-metil-1,3-tiazol-5-il)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]-sulfamoil}fenil)-2(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 5-bromo-4-metil-1,3-tiazol (106 mg, 0,59 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Labomatic XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (3,7 mg, 0,00877 mmol, 1 % de rendimiento, 97 % de pureza). CL-EM (Procedimiento B): Tr = 0,90 min; EM (lENpos): m/z = 422 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,13 (s, 3H), 3,90 (s, 2H), 7,25 - 7,37 (m, 5H), 7,42 - 7,48 (m, 2H), 7,84 (dd, 1H), 8,37 (d, 1H), 9,01 (s, 1H), 10,71 (s, 1H).
Ejemplo 505
W-{4-(4-Ammo-1H-pirazoM-il)-3-[(2,4-dimetoxibencil)sulfamoil]feml}-2-(2-clorofeml)acetamida
Se disolvió W-{4-(4-amino-1H-pirazol-1-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-clorofenil)acetamida (403 mg, 435 pmol, 60 % de pureza) en diclorometano (5,6 ml) y se trató con ácido trifluoroacético (1,7 ml, 22 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (28 mg, 16 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 0,74 min; EM (lENpos): m/z = 406 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,88 (s, 2H), 4,14 (s, 2H), 7,30 (d, 1H), 7,32 (m, 2H), 7,35 (d, 1H), 7,44 (m, 2H), 7,45 (d, 1H), 7,48 (s, 2H), 7,94 (dd, 1H), 8,32 (d, 1H), 10,70 (s, 1H).
Ejemplo 506
W-[1-(4-{[(2-Clorofeml)acetil]ammo}-2-sulfamoilfeml)-1H-pirazol-4-il]-2,2-difluoroacetamida
Se disolvió W-[1-(4-{[(2-clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]-2,2-difluoroacetamida (231 mg, 182 pmol, 50 % de pureza) en diclorometano (3,6 ml) y se trató con ácido trifluoroacético (0,7 ml, 9,1 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (8 , 6 mg, 10 % de rendimiento, 99 % de pureza).
CL-EM (Procedimiento A): Tr = 0,98 min; EM (lENpos): m/z = 484 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,90 (s, 2H), 6,44 (t, 1H), 7,33 (m, 2H), 7,41 (s, 2H), 7,45 (m, 2H), 7,55 (d, 1H), 7,91 (s, 1H), 7,96 (dd, 1H), 8,27 (s, 1H), 8,37 (d, 1H), 10,79 (s, 1H), 11,13 (s, 1H).
Ejemplo 507
W-[1-(4-{[(2-Clorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-il]-3,3,3-trifluoropropanamida
Se disolvió W-[1-(4-{[(2-clorofen¡l)acet¡l]am¡no}-2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l)-1H-p¡razol-4-¡l]-3,3,3-trifluoropropanamida (285 mg, 214 |jmol, 50% de pureza) en d¡clorometano (2,8 ml) y se trató con ác¡do tr¡fluoroacét¡co (0,8 ml, 10,7 mmol), después se agitó a temperatura ambiente durante 195 min. La mezcla se concentró al vacío y se purificó mediante cromatografía ultrarrápida para dar el compuesto del título (14,9 mg, 13 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,03 min; EM (lENpos): m/z = 516 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,44 (q, 2H), 3,90 (s, 2H), 7,33 (m, 2H), 7,42 (s, 2H), 7,45 (m, 2H), 7,55 (d, 1H), 7,83 (d, 1H), 7,96 (dd, 1H), 8,21 (d, 1H), 8,36 (d, 1H), 10,59 (s, 1H), 10,77 (s, 1H).
Ejemplo 508 (racémico), Ejemplo 509 (Enantiómero A) y Ejemplo 510 (Enantiómero B)
Ejemplo 508
W-[1-(4-{[(2-ClorofenM)acetM]amino}-2-sulfamoNfenM)-1H-pirazol-4-M]-3,3,3-trifluoro-2-metilpropanamida
Se disolvió (±)-W-[1-(4-{[(2-clorofen¡l)acet¡l]am¡no}-2-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l)-1H-p¡razol-4-¡l]-3,3,3-tr¡fluoro-2-metilpropanamida (298 mg, 350 pmol, 80 % de pureza) en diclorometano (7 ml) y se trató con ácido trifluoroacético (1,3 ml, 17,5 mmol), después se agitó a temperatura ambiente durante 4 h. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (55 mg, 30 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,08 min; EM (lENpos): m/z = 530 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 1,35 (d, 3H), 3,47 (m, 1H), 3,90 (s, 2H), 7,33 (m, 2H), 7,42 (s, 2H), 7,45 (m, 2H), 7,55 (d, 1H), 7,84 (d, 1H), 7,95 (dd, 1H), 8,22 (d, 1H), 8,36 (d, 1H), 10,63 (s, 1H), 10,77 (s, 1H).
Se separaron 51 mg del compuesto racémico en los enantiómeros por HPLC en fase quiral (Instrumento: Sepiatec: Prep SFC100; Columna: Chiralpak IA 5 pm 250x30 mm; Eluyente A: CO2, Eluyente B: metanol; ¡socrático: B 21 %; flujo 100,0 ml/min; temperatura: 40 °C; BPR: 15 Mpa; MWD @ 254nm) dando los dos siguientes isómeros:
Ejemplo 509
W-[1-(4-{[(2-ClorofenM)acetM]amino}-2-sulfamoNfenM)-1H-pirazol-4-M]-3,3,3-trifluoro-2-metilpropanamida (Enantiómero A)
20 mg, 96 % de pureza
CL (Procedimiento N): Tr = 2,56 min
Ejemplo 510
W-[1-(4-{[(2-ClorofenM)acetM]amino}-2-sulfamoNfenM)-1H-pirazol-4-M]-3,3,3-trifluoro-2-metilpropanamida (Enantiómero B)
20 mg, 99 % de pureza
CL (Procedimiento N): Tr = 3,62 min
Ejemplo 511 (racémico cis), Ejemplo 512 (Enantiómero A trans) y Ejemplo 513 (Enantiómero B trans)
Ejemplo 511
2-(2-Clorofeml)-W-(4-{4-[(c/s)-2,5-dimetilpirrolidm-1-M]-1H-pirazol-1-M}-3-sulfamoilfeml)acetamida
Se disolvió 2-(2-clorofen¡l)-A/-(3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]-4-{4-(2,5-d¡met¡l-p¡rrol¡d¡n-1-¡l)-1H-p¡razol-1-il}fenil)acetamida (mezcla de estereo¡sómeros) (531 mg, 575 |jmol, 80 % de pureza) en d¡clorometano (7,4 ml) y se trató con ác¡do tr¡fluoroacét¡co (2,2 ml, 28,8 mmol), después se ag¡tó a temperatura amb¡ente durante 5 h. La mezcla se concentró al vacío y se pur¡f¡có med¡ante HPLC para dar el compuesto del título (23,5 mg, 8 % de rend¡m¡ento, 97 % de pureza) como el ¡sómero meso.
CL-EM (Proced¡m¡ento A): Tr = 0,93 m¡n; EM (lENpos): m/z = 488 (M+H)+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 1,57 (m, 2H), 1,98 (m, 2H), 1,19 (d, 6 H), 3,30 (m, 2H), 3,89 (s, 2H), 7,33 (m, 2H), 7,45 (m, 2H), 7,46 (d, 1H), 7,52 (m, 2H), 7,54 (d, 1H), 7,54 (d, 1H), 7,95 (dd, 1H), 8,33 (d, 1H), 10,72 (s, 1H).
En otra fracc¡ón, se a¡sló el ¡sómero trans racém¡co 2-(2-clorofen¡l)-W-(4-{4-[(trans)-2,5-d¡met¡lp¡rrol¡d¡n-1-¡l]-1H-p¡razol-1- ¡l}-3-sulfamo¡lfen¡l)acetam¡da (85,6 mg, 21 %, 70 % de pureza).
CL-EM (Proced¡m¡ento A): Tr = 1,02 m¡n; EM (lENpos): m/z = 488 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 1,52 (m, 2H), 2,15 (m, 2H), 1,01 (d, 6 H), 3,64 (m, 2H), 3,89 (s, 2H), 7,33 (m, 2H), 7,40 (d, 1H), 7,44 (d, 1H), 7,45 (m, 2H), 7,49 (m, 2H), 7,53 (d, 1H), 7,95 (dd, 1H), 8,33 (d, 1H), 10,72 (s, 1H).
Se separaron 80 mg del compuesto racém¡co en los enant¡ómeros por HPLC en fase qu¡ral (Instrumento: Labomat¡c HD5000, Labocord-5000; G¡lson GX-241, Labcol Var¡o 4000; Columna: YMC Cellulose SC 5 p 250x30 mm; Eluyente A: hexano 0,1 Vol-% de d¡et¡lam¡na (99 %), Eluyente B: etanol; grad¡ente: B 20-50 % en 20 m¡n; flujo 40,0 ml/m¡n; UV @ 254 nm) dando los dos s¡gu¡entes ¡sómeros:
Ejemplo 512
2- (2-Clorofeml)-W-(4-{4-[(frans)-2,5-dimetilpirrolidm-1-M]-1H-pirazoM-M}-3-sulfamoilfeml)acetamida (Enantiómero A)
22,3 mg, 100 % de pureza
CL (Proced¡m¡ento O): Tr = 4,35 m¡n
Ejemplo 513
2-(2-Clorofeml)-W-(4-{4-[(frans)-2,5-dimetilpirrolidm-1-M]-1H-pirazoM-M}-3-sulfamoilfeml)acetamida (Enantiómero B)
21 mg, 99 % de pureza
CL (Proced¡m¡ento O): Tr = 5,32 m¡n
Ejemplo 514
W-(4-{4-[(2,2-Difluoroetil)ammo]-1H-pirazol-1-M}-3-sulfamoilfeml)-2-(2-fluorofeml)acetamida
Se d¡solv¡ó A/-(4-{4-[(2,2-d¡fluoroet¡l)am¡no]-1H-p¡razol-1-¡l}-3-[(2,4-d¡metox¡benc¡l)sulfamo¡l]fen¡l)-2-(2-fluorofen¡l)acetam¡da (420 mg, 417 pmol, 60% de pureza) en d¡clorometano (5,4 ml) y se trató con ác¡do
trifluoroacético 1,6 ml, 20,9 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (13,8 mg, 7 % de rendimiento, 95 % de pureza). CL-EM (Procedimiento A): Tr = 0,99 min; EM (IENpos): m/z = 454 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,33 (m, 2H), 3,78 (s, 2H), 5,18 (t, 1H), 6,12 (tt, 1H), 7,19 (m, 2H), 7,33 (m, 1H), 7,40 (m, 1H), 7,41 (d, 1H), 7,47 (s, 2H), 7,49 (d, 1H), 7,56 (d, 1H), 7,95 (dd, 1H), 8,32 (d, 1H), 10,74 (s, 1H).
Ejemplo 515
2-(2-Clorofeml)-W-(3-sulfamo¡l-4-{4-[(2,2,2-tr¡fluoroet¡l)ammo]-1H-p¡razol-1 -il}fenil)acetamida
Se disolvió 2-(2-clorofenil)-A/-(3-[(2,4-dimetoxibencil)sulfamoil]-4-{4-[(2,2,2-trifluoroetil)amino]-1H-pirazol-1-il}fenil)acetamida (528 mg, 455 jmol, 55 % de pureza) en diclorometano (5,9 ml) y se trató con ácido trifluoroacético 1,8 ml, 22,8 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (30 mg, 13 % de rendimiento, 99 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 488 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,74 (dq, 2H), 3,89 (s, 2H), 5,51 (t, 1H), 7,32 (m, 2H), 7,43 (d, 1H), 7,46 (s, 2H), 7,46 (d, 1H), 7,46 (m, 2H), 7,58 (d, 1H), 7,95 (dd, 1H), 8,32 (d, 1H), 10,72 (s, 1H).
Ejemplo 516
2-(2-Clorofeml)-W-[4-(4-¡soprop¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]acetam¡da
Se disolvió 2-(2-clorofenil)-A/-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-isopropil-1H-pirazol-1-il)fenil}acetamida (410 mg, 457 |jmol, 65 % de pureza) en diclorometano (5,9 ml) y se trató con ácido trifluoroacético 1,8 ml, 22,9 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (44 mg, 22 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (IENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 1,22 (d, 6 H), 2,86 (sept, 1H), 3,89 (s, 2H), 7,33 (m, 2H), 7,45 (m, 2H), 7,50 (s, 2H), 7,51 (d, 1H), 7,68 (s, 1H), 7,91 (s, 1H), 7,97 (dd, 1H), 8,33 (d, 1H), 10,74 (s, 1H).
Ejemplo 517
2-(2-Fluorofeml)-W-[4-(4-¡soprop¡l-1H-p¡razol-1 -¡l)-3-sulfamo¡lfen¡l]acetam¡da
Se disolvió W-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-isopropil-1H-pirazol-1-il)fenil}-2-(2-fluorofenil)acetamida (407 mg, 467 jmol, 65 % de pureza) en diclorometano (6,0 ml) y se trató con ácido trifluoroacético 1,8 ml, 23,3 mmol), después
se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (70 mg, 34 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,17 min; EM (IENpos): m/z = 417 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 1,22 (d, 6 H), 2,86 (sept, 1H), 3,79 (s, 2H), 7,18 (m, 1H), 7,20 (m, 1H), 7,38 (m, 1H), 7,41 (m, 1H), 7,50 (s, 2H), 7,51 (d, 1H), 7,68 (s, 1H), 7,91 (s, 1H), 7,97 (dd, 1H), 8,33 (d, 1H), 10,72 (s, 1H).
Ejemplo 518
2-(2-Clorofenil)-W-{3-sulfamoN-4-[4-(2,2,2-tNfluoroetM)-1H-pirazoM-N]feml}acetamida
Se disolvió 2-(2-clorofenil)-W-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[4-(2,2,2-trifluoroetil)-1H-pirazol-1-il]fenil}acetamida (219 mg, 300 pmol, 85 % de pureza) en diclorometano (6,0 ml) y se trató con ácido trifluoroacético (1,2 ml, 15,0 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (56 mg, 39 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (IENpos): m/z = 473 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,60 (q, 2H), 3,90 (s, 2H), 7,33 (m, 2H), 7,43 (s, 2H), 7,45 (m, 2H), 7,52 (d, 1H), 7,75 (s, 1H), 7,97 (dd, 1H), 8,10 (s, 1H), 8,36 (d, 1H), 10,78 (s, 1H).
Ejemplo 519
2-(2-Fluorofeml)-W-{3-sulfamoN-4-[4-(2,2,2-tnfluoroetM)-1H-pirazoM-N]feml}acetamida
Se disolvió W-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[4-(2,2,2-trifluoroetil)-1H-pirazol-1-il]fenil}-2-(2-fluorofenil)acetamida (136 mg, 190 pmol, 85 % de pureza) en diclorometano (3,8 ml) y se trató con ácido trifluoroacético (0,7 ml, 9,50 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (22 mg, 24 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 457 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,60 (q, 2H), 3,80 (s, 2H), 7,19 (m, 2H), 7,33 (m, 1H), 7,41 (m, 1H), 7,43 (s, 2H), 7,52 (d, 1H), 7,75 (s, 1H), 7,97 (dd, 1H), 8,10 (s, 1H), 8,36 (d, 1H), 10,76 (s, 1H).
Ejemplo 520
2-(2-Clorofeml)-N-[4-(5-ciclopropil-1,2,4-oxadiazol-3-M)-3-sulfamoMfeml]acetamida
Se disolvió 2-(2-clorofenil)-A/-{4-(5-ciclopropil-1,2,4-oxadiazol-3-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida (135 mg, 220 pmol, 95 % de pureza) en diclorometano (4,4 ml) y se trató con ácido trifluoroacético (847 pl, 11,0 mmol),
después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (13 mg, 14 % de rendimiento, 100 % de pureza).
CL-EM (Procedimiento A): Tr = 1,11 min; EM (IENpos): m/z = 433 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 1,18 (m, 2H), 1,32 (m, 2H), 2,46 (m, 1H), 3,91 (s, 2H), 7,33 (m, 2H), 7,35 (s, 2H), 7,46 (m, 2H), 7,75 (d, 1H), 7,98 (dd, 1H), 8,40 (d, 1H), 10,85 (s, 1H).
Ejemplo 521
2-(2-Clorofenil)-N-{3-sulfamoN-4-[3-(trífluorometM)-1,2,4-oxadiazol-5-N]feml}acetamida
Se disolvió 2-(2-clorofenil)-A/-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[3-(trifluorometil)-1,2,4-oxadiazol-5-il]fenil}acetamida (355 mg, 380 pmol, 65% de pureza) en diclorometano (4,9 ml) y se trató con ácido trifluoroacético (1,46 ml, 19,0 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (13 mg, 7 % de rendimiento, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,20 min; EM (IENpos): m/z = 461 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,94 (s, 2H), 7,33 (m, 2H), 7,46 (m, 2H), 7,72 (s, 2H), 7,95 (d, 1H), 8,00 (dd, 1H), 8,50 (d, 1H), 11,01 (s, 1H).
Ejemplo 522
2-(2-Clorofeml)-W-{4-[5-(d¡fluorometM)-1,3,4-oxad¡azol-2-M]-3-sulfamo¡lfeml}acetam¡da
Se disolvió 2-(2-clorofenil)-A/-{4-[5-(difluorometil)-1,3,4-oxadiazol-2-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida (498 mg, 495 pmol, 60% de pureza) en diclorometano (6,4 ml) y se trató con ácido trifluoroacético (1,91 ml, 24,8 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante cromatografía ultrarrápida para dar el compuesto del título (15 mg, 6 % de rendimiento, 90 % de pureza). CL-EM (Procedimiento A): Tr = 1,08 min; EM (IENpos): m/z = 443 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 3,93 (s, 2H), 7,33 (m, 2H), 7,46 (m, 2H), 7,55 (t, 1H), 7,64 (s, 2H), 7,89 (d, 1H), 8,00 (dd, 1H), 8,47 (d, 1H), 10,95 (s, 1H).
Ejemplo 523
W-{4-[5-(D¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]-3-sulfamo¡lfeml}-2-(2-fluorofeml)acetam¡da
Se disolvió A/-{4-[5-(difluorometil)-1,3,4-oxadiazol-2-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-fluorofenil)acetamida (466 mg, 297 pmol, 37% de pureza) en diclorometano (3,8 ml) y se trató con ácido trifluoroacético (1,14 ml,
14,9 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante cromatografía ultrarrápida para dar el compuesto del título (30 mg, 21 % de rendimiento, 90 % de pureza). CL-EM (Procedimiento A): Tr = 1,01 min; EM (IENpos): m/z = 427 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 3,83 (s, 2H), 7,19 (m, 1H), 7,20 (m, 1H), 7,34 (m, 1H), 7,41 (m, 1H), 7,55 (t, 1H), 7,64 (s, 2H), 7,88 (d, 1H), 8,00 (dd, 1H), 8,46 (d, 1H), 10,93 (s, 1H).
Ejemplo 524
2-(2-Clorofeml)-N-[4-(5-metil-1,3,4-oxadiazol-2-il)-3-sulfamoilfeml]acetamida
Se disolvió 2-(2-clorofenil)-W-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}acetamida (260 mg, 313 |jmol, 60% de pureza) en diclorometano (6,4 ml) y se trató con ácido trifluoroacético (1,21 ml, 15,7 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante cromatografía ultrarrápida para dar el compuesto del título (51 mg, 39 % de rendimiento, 96 % de pureza).
CL-EM (Procedimiento A): Tr = 0,96 min; EM (IENpos): m/z = 407 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,59 (s, 3H), 3,92 (s, 2H), 7,33 (m, 2H), 7,45 (m, 2H), 7,62 (s, 2H), 7,85 (d, 1H), 8,01 (dd, 1H), 8,43 (d, 1H), 10,91 (s, 1H).
Ejemplo 525
2-(2-Fluorofeml)-W-[4-(5-metil-1,3,4-oxadiazol-2-M)-3-sulfamoilfeml]acetamida
Se disolvió A/-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}-2-(2-fluorofenil)acetamida (427 mg, 476 jmol, 60% de pureza) en diclorometano (6,1 ml) y se trató con ácido trifluoroacético (1,83 ml, 23,8 mmol), después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante cromatografía ultrarrápida para dar el compuesto del título (105 mg, 51 % de rendimiento, 95 % de pureza). CL-EM (Procedimiento A): Tr = 0,93 min; EM (IENpos): m/z = 391 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm] 2,59 (s, 3H), 3,82 (s, 2H), 7,18 (m, 1H), 7,19 (m, 1H), 7,34 (m, 1H), 7,41 (m, 1H), 7,61 (s, 2H), 7,85 (d, 1H), 8,01 (dd, 1H), 8,43 (d, 1H), 10,89 (s, 1H).
Ejemplo 526
W-[4-(5-MetM-1,3,4-oxadiazol-2-M)-3-sulfamoilfeml]-2-(4-metilfeml)acetamida
Se disolvió W-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}-2-(4-metilfenil)acetamida (351 mg, 476 jmol, 72% de pureza) en diclorometano (6,1 ml) y se trató con ácido trifluoroacético (1,83 ml, 23,8 mmol),
después se agitó a temperatura ambiente durante la noche. La mezcla se concentró al vacío y se purificó mediante HPLC para dar el compuesto del título (21 mg, 11 % de rendimiento, 95 % de pureza).
CL-EM (Procedimiento B): Tr = 0,85 min; EM (IENpos): m/z = 387 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm] 2,28 (s, 3H), 2,58 (s, 3H), 3,65 (s, 2H), 7,14 (d, 2H), 7,23 (d, 2H), 7,60 (s, 2H), 7,84 (d, 1H), 8,02 (dd, 1H), 8,40 (d, 1H), 10,78 (s, 1H).
Ejemplo 527
2-(2-ClorofenM)-W-[4-(1H-pirrol-3-M)-3-sulfamoNfeml]acetamida
Se disolvió 3-(4-{[(2-clorofenil)acetil]amino}-2-{[(dimetilamino)metilen]sulfamoil}fenil)-1H-pirrol-1-carboxilato de terc-butilo (50 mg, 92 pmol) en metanol (2 ml) y se trató con solución acuosa de amoníaco 30 % (2 ml) a temperatura ambiente durante 3 días. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC para dar 22 mg (94 % de pureza, 58 % de rendimiento).
CL-EM (Procedimiento A): Tr = 0,97 min; EM (IENpos): m/z = 390 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,86 (s, 2H), 6,36 (ddd, 1H), 6,56 (s, 2H), 6,83 (ddd, 1H), 7,13 (ddd, 1H), 7,32 (m, 2H), 7,40 (d, 1H), 7,44 (m, 2H), 7,79 (dd, 1H), 8,27 (d, 1H), 10,50 (s, 1H), 11,04 (s, 1H).
Ejemplo 528
2-(2-ClorofenM)-W-{4-[5-(difluoroacetM)-1H-pirrol-3-M]-3-sulfamoNfeml}acetamida
Se disolvió 2-(2-clorofenil)-N-[3-{[(dimetilamino)metilen]sulfamoil}-4-(1H-pirrol-3-il)fenil]acetamida (67 mg, 136 pmol, 90% de pureza) en diclorometano ( 6 ml) y se trató con difluorocloruro de acetilo (93 mg, 813mmol) y N,N-diisopropiletilamina (242 pl, 1,35 mmol), después se agitó a temperatura ambiente durante la noche. Se añadió solución acuosa saturada de carbonato ácido de sodio a la mezcla de reacción, y se extrajo con diclorometano. Las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre un filtro Whatman, y se concentraron a presión reducida dando 2-(2-clorofenil)-N-(4-[1-(difluoroacetil)-1H-pirrol-3-il]-3-{[(dimetilamino)metilen]sulfamoil}fenil)acetamida en bruto (57 mg) que se usó sin purificación adicional.
El producto de acilación en bruto (57 mg) se disolvió en metanol (1 ml) y THF (1 ml) y se trató con solución acuosa de amoníaco al 25 % (2 ml) a 50 °C durante 3 h. El disolvente se retiró a presión reducida y el material en bruto se purificó mediante HPLC para dar 7 mg (95 % de pureza, 13 % de rendimiento) del compuesto del título.
CL-EM (Procedimiento B): Tr = 0,95 min; EM (IENpos): m/z = 468 (M+H)+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,88 (s, 2H), 6,85 (t, 1H), 7,22 (s, 2H), 7,32 (m, 2H), 7,43 (d, 1H), 7,43 (s, 1H), 7,45 (m, 2H), 7,64 (s, 1H), 7,83 (dd, 1H), 8,32 (d, 1H), 10,60 (s, 1H), 12,53 (s, 1H).
Ejemplo 529
2-(2-Clorofeml)-W-[4-(1-metN-1H-pirrol-3-M)-3-sulfamoNfeml]acetamida
Se disolvió 2-(2-clorofen¡l)-A/-[3-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}-4-(1-met¡l-1H-p¡rrol-3-¡l)fen¡l]acetam¡da (105 mg, 229 |jmol) en metanol (0,8 ml) y se trató con soluc¡ón acuosa de amoníaco 30 % (4,5 ml) a temperatura amb¡ente durante 2 días. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC para dar 30 mg (95 % de pureza, 31 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento A): Tr = 1,07 m¡n; EM (lENpos): m/z = 404 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,65 (s, 3H), 3,86 (s, 2H), 6,31 (dd, 1H), 6,70 (s, 2H), 6,76 (dd, 1H), 7,08 (dd, 1H), 7,32 (m, 2H), 7,38 (d, 1H), 7,44 (m, 2H), 7,78 (dd, 1H), 8,26 (d, 1H), 10,50 (s, 1H).
Ejemplo 530
2-(2-Clorofeml)-W-[4-(5-ciano-1-metM-1H-pirrol-2-N)-3-sulfamoNfeml]acetamida
Se d¡solv¡ó 2-(2-clorofen¡l)-A/-[4-(5-c¡ano-1-met¡l-1H-p¡rrol-2-¡l)-3-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}fen¡l]acetam¡da (93 mg, 192 jm ol) en metanol (0,8 ml) y THF (0,9 ml) y se trató con soluc¡ón acuosa de amoníaco 30 % (2 ml) a 50 °C durante la noche. El d¡solvente se ret¡ró a pres¡ón reduc¡da y el mater¡al en bruto se pur¡f¡có med¡ante HPLC para dar 43 mg (99 % de pureza, 51 % de rend¡m¡ento).
CL-EM (Proced¡m¡ento A): Tr = 1,07 m¡n; EM (lENpos): m/z = 429 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,37 (s, 3H), 3,90 (s, 2H), 6,21 (d, 1H), 7,16 (s, 2H), 6,97 (d, 1H), 7,33 (m, 2H), 7,35 (d, 1H), 7,45 (m, 2H), 7,87 (dd, 1H), 8,37 (d, 1H), 10,74 (s, 1H).
Ejemplo 531, Ejemplo 532, Ejemplo 533 y Ejemplo 534
A una mezcla de 2-(2-clorofen¡l)-W-(3-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l)acetam¡da (200 mg, 0,39 mmol), tr¡fluorometansulf¡nato de sod¡o (486 mg, 3,11 mmol) y tr¡flato de cobre (II) (28 mg; 0,08 mmol), en argón, se le añad¡ó aceton¡tr¡lo (4 ml). A la mezcla resultante, en ag¡tac¡ón v¡gorosa, se le añad¡ó por goteo h¡droperóx¡do de terc-but¡lo (70 % en peso en H2O, 0,42 ml, 3,11 mmol) a lo largo de 30 m¡n por med¡o de una bomba de jer¡nga. Después de ag¡tar durante otras 15 h se añad¡eron más tr¡fluorometansulf¡nato de sod¡o (486 mg, 3,11 mmol) y h¡droperóx¡do de terc-but¡lo (70 % en peso en H2O, 0,42 ml, 3,11 mmol). La mezcla de reacc¡ón se ag¡tó durante 12 h y después se f¡ltró. El f¡ltrado resultante se concentró al vacío hasta aprox¡madamente 1 ml y se pur¡f¡có med¡ante HPLC para dar los s¡gu¡entes ¡ntermed¡os: 2-(2-clorofen¡l)-A/-(3-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}-2-(tr¡fluoromet¡l)-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l)acetam¡da (3,1 mg, 1,1 % de rend¡m¡ento, 80 % de pureza), 2-(2-clorofen¡l)-A/-(5-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}-2-(tr¡fluoromet¡l)-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l)acetam¡da (5,5 mg, 1,8% de rend¡m¡ento, 75% de pureza), 2-[2-cloro-3-(tr¡fluoromet¡l)fen¡l]-A/-(5-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}-2-(tr¡fluoromet¡l)-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l)acetam¡da (5,0 mg, 1,5% de rend¡m¡ento, 75% de pureza), 2-[2-cloro-5-(tr¡fluoromet¡l)fen¡l]-W-(5-{[(d¡met¡lam¡no)met¡len]sulfamo¡l}-2-(tr¡fluoromet¡l)-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]fen¡l)acetam¡da (3,9 mg, 1,3 % de rend¡m¡ento, 85 % de pureza).
Los ¡ntermed¡os correspondentes se volv¡eron a d¡solver en metanol (0,5 ml) y se añad¡ó amoníaco acuoso (0,5 ml), después se ag¡tó a temperatura amb¡ente durante 2 días. Se añad¡ó agua y la mezcla resultante se extrajo tres veces con d¡clorometano. Las fases orgán¡cas comb¡nadas se lavaron con salmuera, se secaron, se concentró al vacío, y el res¡duo selecc¡onado se pur¡f¡có ad¡c¡onalmente med¡ante HPLC para dar los compuestos del título.
Ejemplo 531
2-(2-Clorofem l)-W-{3-sulfamoN-2-(tN fluorometM)-4-[4-(tN fluorometM)-1H-pirazoM-N]fem l}acetamida
2 , 8 mg, 1 , 1 % de rendimiento, 80 % de pureza
CL-EM (Procedimiento K): Tr = 2,93 min; EM (lENpos): m/z = 527 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,94 (s, 2H), 6,10 (s, 2H), 7,34 (m, 2H), 7,43 (m, 1H), 7,47 (m, 1H), 7,75 (d, 1H), 8,01 (d, 1H), 8,06 (s, 1H), 8,35 (s, 1H), 8,38 (s, 1H).
Ejemplo 532
2-(2-ClorofenM)-W-{5-sulfamoN-2-(tN fluorometM)-4-[4-(tN fluorometM)-1H-pirazoM -il]fenil}acetamida
0,6 mg, 0,2 % de rendimiento, 75 % de pureza
CL-EM (Procedimiento K): Tr = 3,22 min; EM (lENpos): m/z = 527 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 3,99 (s, 2H), 6,39 (s, 2H), 7,36 (m, 2H), 7,46 (m, 1H), 7,48 (m, 1H), 7,90 (s, 1H), 8,07 (s, 1H), 8,20 (s, 1H), 8,35 (s, 1H), 8,78 (s, 1H).
Ejemplo 533
2-[2-Cloro-3-(tnfluorometN)feml]-W-{5-sulfamoN-2-(tN fluorometM)-4-[4-(tN fluorometM)-1H-pirazoM-il]fenil}acetamida
1,5 mg, 0,6 % de rendimiento, 95 % de pureza
CL-EM (Procedimiento K): Tr = 3,42 min; EM (lENpos): m/z = 595 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 4,10 (s, 2H), 6,40 (s, 2H), 7,52 (t, 1H), 7,71 (d, 1H), 7,78 (d, 1H), 7,92 (s, 1H), 8,08 (s, 1H), 8,34 (s, 1H), 8,36 (s, 1H), 8 , 68 (s, 1H).
Ejemplo 534
2-[2-Cloro-5-(tnfluorometN)feml]-W-{5-sulfamoN-2-(tN fluorometM)-4-[4-(tN fluorometM)-1H-pirazoM
il]fenil}acetamida
1,4 mg, 0,6 % de rendimiento, 99 % de pureza
CL-EM (Procedimiento K): Tr = 3,45 min; EM (lENpos): m/z = 595 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 4,07 (s, 2H), 6,41 (s, 2H), 7,65 (m, 2H), 7,78 (d, 1H), 7,92 (s, 1H), 8,08 (s, 1H), 8,37 (s, 1H), 8,38 (s, 1H), 8 , 66 (s, 1H).
Ejemplo 535, Ejemplo 536, Ejemplo 537 y Ejemplo 538
A una mezcla de 2-(2-clorofenil)-A/-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida (200 mg, 0,49 mmol), trifluorometansulfinato de sodio (611 mg, 3,91 mmol) y triflato de cobre (II) (35 mg; 0,10 mmol), en argón, se le añadió acetonitrilo ( 6 ml). A la mezcla resultante, en agitación vigorosa, se le añadió por goteo hidroperóxido de ferc-butilo (70 % en peso en H2O, 0,54 ml, 3,91 mmol) a lo largo de 30 min por medio de una bomba de jeringa. Después de agitar durante otras 15 h se añadieron más trifluorometansulfinato de sodio (611 mg, 3,91 mmol) y hidroperóxido de ferc-butilo (70 % en peso en H2O, 0,54 ml, 3,91 mmol). La mezcla de reacción se agitó durante 12 h, y después se filtró. El filtrado resultante se concentró al vacío hasta aproximadamente 1 ml y se purificó mediante HPLC para dar los compuestos del título separados.
Ejemplo 535
2-[2-Cloro-6-(tNfluorometN)feml]-W-[4-(4-flúor-1H-pirazoM-M)-5-sulfamoN-2-(trifluorometM)feml]acetamida
3,0 mg, 0,8 % de rendimiento, 70 % de pureza
CL-EM (Procedimiento K): Tr = 3,10 min; EM (lENpos): m/z = 545 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 4,22 (s, 2H), 6,45 (s, 2H), 7,51 (t, 1H), 7,75 (m, 3H), 7,83 (s, 1H), 7,94 (d, 1H), 8,35 (s, 1H), 8,55 (s, 1H).
Ejemplo 536
2-[2-Cloro-3-(tNfluorometN)feml]-W-[4-(4-flúor-1H-pirazoM-M)-5-sulfamoN-2-(trifluorometM)feml]acetamida
5,4 mg, 1,8 % de rendimiento, 90 % de pureza
CL-EM (Procedimiento K): Tr = 3,14 min; EM (IENpos): m/z = 545 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 4,08 (s, 2H), 6,46 (s, 2H), 7,51 (t, 1H), 7,71 (d, 1H), 7,74 (d, 1H), 7,78 (d, 1H), 7,82 (s, 1H), 7,94 (d, 1H), 8,31 (s, 1H), 8,63 (s, 1H).
Ejemplo 537
2-[2-Cloro-5-(tN fluorometN)fenM]-W-[4-(4-flúor-1H-pirazoM-M)-5-sulfamoN-2-(trifluorometN)feml]acetamida
6,5 mg, 1,7 % de rendimiento, 70 % de pureza
CL-EM (Procedimiento K): Tr = 3,19 min; EM (IENpos): m/z = 545 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 4,06 (s, 2H), 6,46 (s, 2H), 7,65 (m, 2H), 7,74 (d, 1H), 7,78 (d, 1H), 7,82 (s, 1H), 7,95 (d, 1H), 8,33 (s, 1H), 8,61 (s, 1H).
Ejemplo 538
2-[2-Cloro-4-(tN fluorometN)fenM]-W-[4-(4-flúor-1H-pirazoM-M)-5-sulfamoN-2-(trifluorometN)feml]acetamida
3,2 mg, 0,9 % de rendimiento, 75 % de pureza
CL-EM (Procedimiento K): Tr = 3,23 min; EM (IENpos): m/z = 545 [M+H]+
RMN 1 H (600MHz, CD3CN) 8 [ppm] 4,06 (s, 2H), 6,46 (s, 2H), 7,64 (m, 2H), 7,74 (d, 1H), 7,81 (s, 1H), 7,83 (s, 1H), 7,95 (d, 1H), 8,33 (s, 1H), 8,61 (s, 1H).
Ejemplo 539
W-[4-(3-ferc-ButN-4-ciano-1H-pirazoM-N)-3-sulfamoNfenM]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (1,00 g, 2,59 mmol), 3-ferc-butil-1H-pirazol-4-carbonitrilo (579 mg, 3,88 mmol) y ácido (2-clorofenil)acético (661 mg, 3,88 mmol) sin purificación de intermedios en el compuesto del título
y se purificó al final mediante HPLC preparativa (Chromatorex C-18 10 |jm, 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (303 mg, 0,642 mmol, 25 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,23 min; EM (IENpos): m/z = 472 [M+H]+
RMN 1H (400MHz, DMSO-da) 5 [ppm]: 1,39 (s, 9H), 3,91 (s, 2H), 7,30 -7,36 (m, 2H), 7,39 -7,48 (m, 4H), 7,61 (d, 1H), 7,98 (dd, 1H), 8,38 (d, 1H), 8,84 (s, 1H), 10,84 (s, 1H).
Ejemplo 540
W-[4-(3-Bromo-4-ciano-1H-pirazoM-M)-3-sulfamoMfenM]-2-(2-dorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (1,00 g, 2,59 mmol), 3-bromo-1H-pirazol-4-carbonitrilo (667 mg, 3,88 mmol) y ácido (2-clorofenil)acético (480 mg, 2,81 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Chromatorex C-1810 jm , 125x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (92 mg, 0,186 mmol, 7 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,15 min; EM (IENpos): m/z = 494/496 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,92 (s, 2H), 7,30 - 7,36 (m, 2H), 7,42 - 7,48 (m, 2H), 7,55 (s, 2H), 7,60 (d, 1H), 7,94 (dd, 1H), 8,40 (d, 1H), 8,56 (s, 1H), 10,87 (s, 1H).
Ejemplo 541
2-(2-ClorofenM)-W-{4-[4-doro-3-(tnfluorometM)-1H-pirazoM-M]-3-sulfamoNfenN}acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-cloro-3-(trifluorometil)-1H-pirazol (331 mg, 1.94 mmol) y ácido (2-clorofenil)acético (293 mg, 1,72 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (90 mg, 0,182 mmol, 14 % de rendimiento al cabo de 4 pasos, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,26 min; EM (IENpos): m/z = 493 [M+H]+
RMN 1H (400MHz, DMSO-d6) 5 [ppm]: 3,92 (s, 2H), 7,30 - 7,37 (m, 2H), 7,42 - 7,49 (m, 2H), 7,53 (s, 2H), 7,62 (d, 1H), 7.95 (dd, 1H), 8,41 (d, 1H), 8,55 (d, 1H), 10,86 (s, 1H).
Ejemplo 542
2-(2-ClorofenM)-W-[4-(3,4-dimetiMH-pirazoM -il)-3-sulfamoilfenil]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 3,4-dimetil-1H-pirazol (186 mg, 1,94 mmol) y ácido (2-clorofenil)acético (216 mg, 1,27 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (27 mg, 0,0645 mmol, 5 % de rendimiento al cabo de 4 pasos, 90 % de pureza).
CL-EM (Procedimiento A): Tr = 1,13 min; EM (lENpos): m/z = 419 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,01 (d, 3H), 2,17 (s, 3H), 3,89 (s, 2H), 7,29 - 7,36 (m, 2H), 7,41 - 7,49 (m, 3H), 7,56 (s, 2H), 7,78 (s, 1H), 7,94 (dd, 1H), 8,32 (d, 1H), 10,72 (s, 1H).
Ejemplo 543
W-[4-(4-Cloro-3,5-dimetiMH-pirazoM-M)-3-sulfamoNfeml]-2-(2-clorofeml)acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 4-cloro-3,5-dimetil-1H-pirazol (253 mg, 1,94 mmol) y ácido (2-clorofenil)acético (291 mg, 1,71 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (52 mg, 0,115 mmol, 9 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,21 min; EM (lENpos): m/z = 453 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,02 (s, 3H), 2,19 (s, 3H), 3,91 (s, 2H), 7,15 (s, 2H), 7,30 - 7,37 (m, 2H), 7,42 -7,52 (m, 3H), 7,96 (dd, 1H), 8,37 (d, 1H), 10,82 (s, 1H).
Ejemplo 544
2-(2-Clorofeml)-W-[4-(1H-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.4, GP3.2 y GP4.3, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 1H-pirazol (132 mg, 1,94 mmol) y ácido (2-clorofenil)acético (339 mg, 1,99 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después dos veces por HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) (25 mg, 0,640 mmol, 5 % de rendimiento al cabo de 4 pasos, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,01 min; EM (lENpos): m/z = 391 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,90 (s, 2H), 6,51 (dd, 1H), 7,29 - 7,36 (m, 2H), 7,40 - 7,50 (m, 4H), 7,53 (d,
1H), 7,78 (d, 1H), 7,98 (dd, 1H), 8,09 (dd, 1H), 8,36 (d, 1H), 10,77 (s, 1H).
Ejemplo 545
2-(2-Clorofeml)-W-[4-(3-ciano-5-metiMH-pirazoM-N)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 5-metil-1H-pirazol-3-carbonitrilo (208 mg, 1,94 mmol) y ácido (2-clorofenil)acético (292 mg, 1,71 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters YMC C18 5p 100x50 mm, acetonitrilo/agua 0,2% de amoníaco acuoso (32 %)) (110 mg, 0,256 mmol, 20 % de rendimiento al cabo de 4 pasos, 90 % de pureza).
CL-EM (Procedimiento B): Tr = 0,94 min; EM (lENneg): m/z = 428 [M-H]-RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,09 (s, 3H), 3,93 (s, 2H), 6,92 (s, 1H), 7,31 - 7,36 (m, 2H), 7,39 (s a, 2H), 7,44 - 7,49 (m, 2H), 7,52 (d, 1H), 7,96 (dd, 1H), 8,42 (d, 1H), 10,89 (s, 1H).
Ejemplo 546
-(2-Clorofeml)-W-[4-(3-hidroxi-5-metiMH-pirazoM-M)-3-sulfamoNfeml]acetamida
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 5-metil-1H-pirazol-3-ol (190 mg, 1,94 mmol) y ácido (2-clorofenil)acético (229 mg, 1,34 mmol) sin purificación de intermedios en el compuesto del título y se purificó al final mediante HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,2 % de amoníaco acuoso (32 %)) (16,1 mg, 0,0383 mmol, 3 % de rendimiento al cabo de 4 pasos, 98 % de pureza).
CL-EM (Procedimiento B): Tr = 0,61 min; EM (lENpos): m/z = 421 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 2,01 (s, 3H), 3,89 (s, 2H), 5,55 (s, 1H), 7,30 - 7,36 (m, 4H), 7,43 - 7,48 (m, 3H), 7,95 (dd, 1H), 8,32 (d, 1H), 10,00 (s, 1H), 10,76 (s, 1H).
Ejemplos 547 y Ejemplo 548
De acuerdo con los procedimientos generales GP1.2, GP2.2, GP3.2 y GP4.2, se convirtió 2-cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida (500 mg, 1,29 mmol), 5-metil-1H-pirazol-4-carbonitrilo (208 mg, 1,94 mmol) y ácido (2-clorofenil)acético (291 mg, 1,71 mmol) sin purificación de intermedios en los compuestos del título y se purificaron y se separaron al final mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Sepiatec Prep SFC100; Chiralpak IA 5 pm 250x30 mm; Eluyente A: CO2, Eluyente B: Etanol 0,2 Vol-% de amoníaco acuoso (32 %)).
Ejemplo 547
2-(2-Clorofeml)-W-[4-(4-ciano-5-metiMH-pirazoM-N)-3-sulfamoNfeml]acetamida
45 mg, 0,105 mmol, 8 % de rendimiento al cabo de 4 pasos, 98 % de pureza
CL-EM (Procedimiento A): Tr = 1,05 min; EM (IENpos): m/z = 430 [M+H]+
CL-EM (Procedimiento L): Tr = 1,69 min
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,20 (s, 3H), 3,91 (s, 2H), 7,21 - 7,37 (m, 4H), 7,41 - 7,49 (m, 2H), 7,54 (d, 1H), 7,94 (dd, 1H), 8,15 (s, 1H), 8,41 (d, 1H), 10,88 (s, 1H).
Ejemplo 548
2-(2-Clorofeml)-W-[4-(4-ciano-3-metiMH-pirazoM-N)-3-sulfamoNfeml]acetamida
95 mg, 0,221 mmol, 16 % de rendimiento al cabo de 4 pasos, 98 % de pureza
CL-EM (Procedimiento A): Tr = 1,05 min; EM (IENpos): m/z = 430 [M+H]+
CL-EM (Procedimiento L): Tr = 2,81 min
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 2,37 (s, 3H), 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,37 - 7,50 (m, 4H), 7,55 (d, 1H), 7,93 (dd, 1H), 8,38 (d, 1H), 8,72 (s, 1H), 10,83 (s, 1H).
Ejemplo 549
2-(2-Clorofeml)-W-{4-[4-(morfolm-4-M)-1,3-tiazol-2-M]-3-sulfamoNfeml}acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 4-(2-bromo-1,3-tiazol-4-il)morfolina (148 mg, 0,59 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C185 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (16 mg, 0,0325 mmol, 5 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 1,09 min; EM (IENpos): m/z = 493 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,34 - 3,40 (m, 4H), 3,71 - 3,77 (m, 4H), 3,88 (s, 2H), 7,05 (s, 1H), 7,29 - 7,36 (m, 2H), 7,41 - 7,48 (m, 2H), 7,57 (d, 1H), 7,62 (s, 2H), 7,90 (dd, 1H), 8,28 (d, 1H), 10,66 (s, 1H).
Ejemplo 550
2-(2-Clorofeml)-W-{4-[5-(morfolm-4-M)-1,3-tiazol-2-M]-3-sulfamoNfeml}acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 4-(2-bromo-1,3-tiazol-5-il)morfolina (148 mg, 0,59 mmol) en el compuesto del título y se purificó dos veces mediante HPLC preparativa (Waters XBridge C18 5 |j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (23 mg, 0,0467 mmol, 8 % de rendimiento, 97 % de pureza).
CL-EM (Procedimiento A): Tr = 0,99 min; EM (lENpos): m/z = 493 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,37 - 3,42 (m, 4H), 3,69 - 3,76 (m, 4H), 3,88 (s, 2H), 7,27 - 7,35 (m, 5H), 7,38 - 7,47 (m, 3H), 7,81 (dd, 1H), 8,34 (d, 1H), 10,65 (s, 1H).
Ejemplo 551
2-(2-Clorofeml)-N-[4-(5-metil-1,3-tiazol-2-il)-3-sulfamoilfeml]acetamida
De acuerdo con el procedimiento general GP8.2, se convirtió W-(4-bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-clorofenil)acetamida (300 mg, 0,65 mmol) y 2-bromo-5-metil-1,3-tiazol (211 mg, 1,19 mmol) en el compuesto del título y se purificó mediante HPLC preparativa (Waters XBridge C18 5 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico), y después otra vez mediante HPLC preparativa (Waters Fenomenex Kinetex EVO C185 j 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) (2,1 mg, 0,00498 mmol, 1 % de rendimiento, 98 % de pureza).
CL-EM (Procedimiento A): Tr = 1,14 min; EM (lENpos): m/z = 422 [M+H]+
RMN 1H (400MHz, DMsO-d6) 8 [ppm]: señal de metilo superpuesta con señal de disolvente, 3,90 (s, 2H), 7,29 - 7,36 (m, 2H), 7,42 - 7,48 (m, 2H), 7,65 - 7,74 (m, 4H), 7,98 (dd, 1H), 8,38 (d, 1H), 10,80 (s, 1H).
Ejemplo 552
2-(2-Clorofeml)-W-[4-(p¡ndm-4-M)-3-sulfamo¡lfeml]acetam¡da
Se disolvieron W-(4-bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida (500 mg, 1,09 mmol), ácido piridin-4-ilborónico (268 mg, 2,18 mmol), dicloruro de bis(trifenilfosfin)-paladio(N) (CAS 13965-03-2) (38,4 mg, 54,5 jm ol) y trifenilfosfina (14,3 mg, 54,5 jmol) en n-propanol (10 ml). Después de purgar con argón durante 5 minutos, se añadió carbonato de potasio acuoso (2,7 ml, 1,0 M, 2,7 mmol) y la solución se purgó nuevamente con argón durante 5 minutos. La mezcla de reacción se calentó durante 1 h a 100 °C. Se añadió la misma cantidad de reactivos y la reacción se calentó durante 1 ha 100 °C. Después, el material en bruto se filtró sobre celite y el disolvente se retiró a
presión reducida. El material en bruto se usó sin purificación adicional en el paso siguiente.
Se disolvió 2-(2-clorofenil)-W-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(piridin-4-il)fenil]acetamida en bruto del paso previo (530 mg, 1,16 mmol) en metanol (50 ml) y se añadió amoníaco acuoso (50 ml). La reacción se agitó a temperatura ambiente hasta completarse la reacción y el disolvente se retiró a presión reducida. El material en bruto se purificó mediante HPLC (Chromatorex C-18 10 pm, 125x30 mm, acetonitrilo/agua 0,1 % de amoníaco acuoso (32 %)). Las trazas de óxido de trifenilfosfina se retiraron después de una segunda corrida de HPLC para dar el compuesto del título (79,3 mg, 90 % de pureza, 15 % de rendimiento al cabo de 2 pasos)
CL-EM (Procedimiento A): Tr = 0,80 min; EM (lENpos): m/z = 402 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,91 (s, 2H), 7,26 - 7,37 (m, 4H), 7,37 - 7,41 (m, 3H), 7,44 - 7,49 (m, 2H), 7,86 (dd, 1H), 8,38 (d, 1H), 8,55 - 8,61 (m, 2H), 10,70 (s, 1H).
Ejemplo 553
1-(4-{[(2-Clorofeml)acetN]ammo}-2-sulfamoilfeml)-1H-pirazol-4-carboxamida
Se colocó 2-(2-clorofenil)-W-[4-(4-ciano-1H-pirazol-1-il)-3{[(dimetilamino)metilen]sulfamoil}fenil]acetamida (200 mg, 0,425 mmol) en un recipiente para microondas sellable y compresible (5 ml), el recipiente se cerró por compresión y se purgó con argón durante 5 minutos. Una solución de dímero (1,5-ciclooctadien)(metoxi)iridio(I) (14 mg, 0,021 mmol), 4,4'-di-terc-butil-2,2'-dipiridilo (11,4 mg, 0,042 mmol) y bis(pinacolato)diboro (129,4 mg, 0,51 mmol) en THF (0,42 ml) que se había agitado en argón durante 1 hora a 80 °C se añadió en una atmósfera de argón. El recipiente después se calentó a 80 °C durante 24 horas, después de lo cual el disolvente se retiró a presión reducida. Se añadió hidróxido de potasio (72 mg, 1,27 mmol), agua (2 ml) y dimetilformamida (2 ml) y se añadió peróxido de hidrógeno (solución en agua 30 %, 0,13 ml, 1,27 mmol) por goteo. La mezcla se agitó durante 1 hora a temperatura ambiente, después de lo cual se añadió amoníaco acuoso (4 ml) y la mezcla se agitó a temperatura ambiente durante la noche. Se añadió un volumen adicional de amoníaco acuoso ( 6 ml) y la mezcla se agitó durante otras 48 horas a temperatura ambiente. Se añadió diclorometano (30 ml) y agua (20 ml), las fases se separaron, y la fase acuosa se extrajo con diclorometano ( 2 x 30 ml) y acetato de etilo (30 ml), las fases orgánicas se combinaron, se secó sobre sulfato de sodio y el disolvente se retiró a presión reducida. El sólido se purificó primero mediante cromatografía ultrarrápida (MeOH:DCM 2/98 hasta 20/80) y después por HPLC preparativa (Waters XBridge C18 5p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) dando un sólido blanco (9,7 mg, 0,01 mmol, 5 % de rendimiento al cabo de 3 pasos, 92 % de pureza).
CL-EM (Procedimiento A): Tr = 0,84 min; EM (lENpos): m/z = 434 [M+H]+
RMN 1H (400 MHz, DMSO-d6 ) 8 ppm 3,91 (s, 2 H) 7,19 (s a, 1 H) 7,27 - 7,37 (m, 2 H) 7,38 - 7,51 (m, 4 H) 7,57 (d, 1 H) 7,70 (s a, 1 H) 7,97 (dd, 1 H) 8,10 (s, 1 H) 8,37 (d, 1 H) 8,44 (s, 1 H) 10,81 (s, 1 H).
Ejemplo 554, Ejemplo 555, Ejemplo 556 y Ejemplo 557
Se disolvió 2-(2-clorofenil)-W-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida (500 mg, 1,2 mmol) en acetonitrilo (4 ml) y se añadió ferroceno (224 mg, 1,2 mmol) junto con ácido trifluoroacético (308 pl, 2,4 mmol). La mezcla se agitó a temperatura ambiente y se añadió peróxido de hidrógeno (acuoso 30 %, 491 pl, 4,81 mmol) a lo largo de 15 minutos usando una bomba de jeringa. La mezcla se agitó durante 1 hora a temperatura ambiente después de lo cual se añadió tiosulfato de sodio acuoso (solución saturada, 2 ml) y la mezcla se agitó durante otros 5 minutos. Después se añadió salmuera (50 ml) y la fase acuosa se extrajo con diclorometano (3 x 70 ml), las fases orgánicas se combinaron, se realizó una prueba de peróxido en la fase orgánica (resultado negativo), la fase orgánica se pasó a través de un filtro repelente de agua y el disolvente se retiró a presión reducida. El sólido resultante se purificó mediante cromatografía ultrarrápida (MeOH/DCM 2/98 hasta 20/80 hasta 100/0), seguida por HPLC preparativa (Waters XBridge C18 5 p 100x30 mm, acetonitrilo/agua 0,1 % de ácido fórmico) dando los cuatro compuestos del título separados como sólidos blancos.
Ejemplo 554
2-(2-Cloro-3-hidroxifeml)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoilfeml]acetamida
19,2 mg, 0,04 mmol, 4 % de rendimiento, 95 % de pureza.
CL-EM (Procedimiento A): Tr = 0,82 min; EM (IENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,85 (s, 2 H) 6,85 (dd, 1 H) 6,90 (dd, 1 H) 7,05 - 7,14 (m, 1 H) 7,44 (s a, 2 H) 7,58 (d, 1 H) 7,97 (dd, 1 H) 8,31 (s, 1 H) 8,39 (d, 1 H) 8 , 86 (s, 1 H) 10,13 (s a, 1 H) 10,80 (s, 1 H).
Ejemplo 555
2-(2-Cloro-4-hidroxifeml)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
20 mg, 0,04 mmol, 4 % de rendimiento, 95 % de pureza.
CL-EM (Procedimiento A): Tr = 0,84 min; EM (IENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,76 (s, 2 H) 6,72 (dd, 1 H) 6,83 (d, 1 H) 7,22 (d, 1 H) 7,44 (s a, 2 H) 7,57 (d, 1 H) 7,96 (dd, 1 H) 8,31 (s, 1 H) 8,39 (d, 1 H) 8 , 86 (s, 1 H) 9,84 (s a, 1 H) 10,75 (s, 1 H).
Ejemplo 556
2-(2-Cloro-5-hidroxifeml)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfeml]acetamida
17,4 mg, 0,04 mmol, 4 % de rendimiento, 95 % de pureza.
CL-EM (Procedimiento A): Tr = 0,87 min; EM (IENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 3,79 (s, 2 H) 6,70 (dd, 1 H) 6,84 (d, 1H) 7,21 (d, 1 H) 7,45 (s a, 2 H) 7,58 (d, 1 H) 7,98 (dd, 1 H) 8,29 - 8,32 (m, 1 H) 8,40 (d, 1 H) 8 , 86 (s, 1 H) 9,67 (s, 1 H) 10,81 (s, 1 H).
Ejemplo 557
2-(2-Cloro-6-hidroxifeml)-W-[4-(4-ciano-1H-pirazoM-N)-3-sulfamoNfeml]acetamida
19,4 mg, 0,04 mmol, 4 % de rendimiento, 95 % de pureza.
CL-EM (Procedimiento A): Tr = 0,93 min; EM (IENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-da) 8 [ppm]: 3,86 (s, 2 H) 6,81 (d, 1 H) 6,90 (dd, 1 H) 7,07 - 7,14 (m, 1 H) 7,44 (s, 2 H) 7,56 (d, 1 H) 7,94 (dd, 1 H) 8,30 (s, 1 H) 8,41 (d, 1 H) 8,85 (s, 1 H) 10,02 (s, 1 H) 10,74 (s, 1 H).
Ejemplo 558
2-(2-Clorofeml)-W-[4-(4-ciano-1H-pirazoM-M)-3-sulfamoNfeml]-2-hidroxiacetamida
Un recipiente Erlenmeyer de 100 ml que contenía medio de crecimiento estéril (20 ml) se inoculó con un criocultivo en DMSO (0,2 ml) de Streptomyces antibioticus (NRRL 3238). Un medio de cultivo que consistía en D-(+)-glucosa monohidrato (10 g/l), extracto de levaduras (1 g/l), extracto de carne (1 g/l), triptosa (2 g/l), se ajustó a pH 7,2 con solución de hidróxido de sodio (16 % en agua) y se esterilizó a 121 °C durante 20 minutos. Después de la inoculación, el recipiente de crecimiento se agitó en un agitador por rotación (165 rpm) a 27 °C durante 72 horas. Un recipiente Erlenmeyer de 2 l que contenía el mismo medio de cultivo estéril (1000 ml, preparado bajo las mismas condiciones) se inoculó con el precultivo (5 ml). Después, el recipiente se agitó en un agitador por rotación (165 rpm) a 27 °C durante 72 horas.
Un fermentador de 10 l se llenó con el mismo medio de cultivo (8,3 l) y se ajustó a pH 7,2. Se añadió aceite de silicio (0,5 ml) y Synperonic (0,5 ml), y se esterilizó a 121 °C durante 40 minutos. El cultivo del recipiente Erlenmeyer de 2 l se añadió al fermentador bajo condiciones estériles. El fermentador se operó a presión manométrica (0,07 MPa), se aireó (3 l min-1) y se agitó (300 rpm) a 27 °C. Después de 8 horas, se añadió el Ejemplo 39 (250 mg, 0,601 mmol), disuelto en DMF (20 ml), y se continuó la fermentación durante 123,5 horas.
El caldo de cultivo se extrajo con metilisobutilcetona (20 l) durante 19,5 horas y nuevamente con metilisobutilcetona (10 l) durante 14,3 horas. Las dos fases orgánicas se combinaron y se concentró hasta secar a presión reducida. El residuo se trató con una mezcla de metanol/agua. Esta solución se extrajo tres veces con n-hexano (50 ml). La fase en metanol/agua se concentró hasta secar. El producto en bruto se absorbió sobre Isolute y se sometió a cromatografía primero por Biotage Isolera, después mediante HPLC preparativa (Waters XBridge C18 5 p, 100x30 mm; eluyente A: agua 0,1 %vol. de ácido fórmico (99 %), eluyente B: acetonitrilo; gradiente: 0,00-0,50 min B 10 % (40 >70 ml/min), 0,51-5,50 min B 21-41 % (70 ml/min), temperatura ambiente) dando el compuesto del título.
25,3 mg, 0,0586 mmol, 10 % de rendimiento, 99 % de pureza.
Rotación óptica: [a]o20 = -15° /-0,2° (c=1, DMSO)
EM (IENpos): m/z = 432 [M+H]+
RMN 1H (400MHz, DMSO-d6) 8 [ppm]: 5,53 (d, 1H), 6,79 (d, 1H), 7,34 - 7,40 (m, 2H), 7,43 (s a, 2H), 7,47 (dd, 1H), 7,57 - 7,62 (m, 2H), 8,08 (dd, 1H), 8,31 (s, 1H), 8,62 (d, 1H), 8,87 (s, 1H), 10,74 (s, 1H).
ENSAYOS BIOLÓGICOS
Los siguientes ensayos se pueden usar para ilustrar la utilidad comercial de los compuestos según la presente invención.
Los ejemplos fueron evaluados una o más veces en ensayos biológicos seleccionados. Cuando se evaluaban más de una vez, los datos se informan ya sea como valores promedio o como valores de la mediana, en los que
- al valor promedio, también conocido como el valor de la media aritmética, representa la suma de los valores obtenidos dividida por la cantidad de valores obtenidos, y
- el valor de la mediana representa el número del medio del grupo de valores obtenidos cuando se clasifican en
orden ascendente o descendente. Si el número de valores del conjunto de datos es impar, la mediana es el valor del medio. Si el número de valores del conjunto de datos es par, la mediana es la media aritmética de los dos valores del medio.
Cuando no es posible el cálculo significativo de valores promedio o valores de la mediana debido a la existencia de valores de mediadas que caen fuera del rango de detección del ensayo (indicado por < o > en las tablas más adelante) todos los valores de medida individuales están indicados. Los ejemplos se sintetizaron una o más veces. Cuando se sintetizaban más de una vez, los datos de los ensayos biológicos representan los valores promedio o los valores de la mediana calculados utilizando conjuntos de datos obtenidos de la evaluación de uno o más lotes de síntesis.
ESTUDIOS IN VITRO
Ensayo de FLIPR en células HEK con P2X4 humano
Se plaquearon células HEK293 que expresaban establemente el P2X4 humano en placas de 384 pocillos recubiertos con poli-D-lisina con una densidad de siembre de 30000 células/pocillo y se incubaron durante la noche. La función de P2X4 se evaluó por medida de los cambios de calcio intracelular usando el indicador quelante de calcio Fluo-8 -AM (Molecular Devices) en un lector de placas para obtención de imágenes fluorescentes (estación de FLEX/FLIPR; Molecular Devices). En el día del ensayo, se retiró el medio y las células se incubaron durante 30 min a 37 °C y con 5 % de CO2 en 30 pl de solución amortiguadora de indicador (solución salina balanceada de Hank, HEPES 10 mM, CaCl2 1,8 mM, MgCh 1 mM, probenecid 2 mM, D-glucosa monohidrato 5 mM, Fluo-8 -AM 5 jM , pH=7,4). Los compuestos diluidos en solución amortiguadora de probenecid (solución salina balanceada de Hank, HEPES 10 mM, CaCl21,8 mM, MgCh 1 mM, probenecid 2 mM, D-glucosa monohidrato 5 mM, pH=7,4) se añadieron en un volumen de 10 pl y se dejaron incubar durante 30 min a temperatura ambiente. La concentración final de DMSO en el ensayo fue 0,5 %. Se añadió el agonista, Bz-ATP (Tocris), en un volumen de 10 j l a una concentración que representa el valor de ECs0. El valor de ECs0 de Bz-ATP se determinó cada día de ensayo antes de obtener el perfil del compuesto. La fluorescencia se midió durante un intervalo de 120 segundos cada un intervalo de 2 segundos. Las longitudes de onda de excitación y de emisión usadas para monitorear la fluorescencia fueron 470-495 nm y 515-575 nm, respectivamente. Los datos se analizaron en base al aumento en las unidades de fluorescencia relativas pico (RFU) comparado con la fluorescencia basal y los datos se normalizaron al control agonista. Los compuestos fueron evaluados por triplicado por placa y los valores promedio se graficaron con Excel XLFit para determinar los valores de CI 50, el porcentaje de inhibición máxima y los coeficientes de Hill.
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
Procedimientos de FLIPR para células de astrocitoma h/m/rP2X41321N1
Se plaquearon células de astrocitoma 1321N1 que expresaban establemente el P2X4 humano o el P2X4 de rata o el P2X4 de ratón en microplacas tratadas con Colágeno I TC con una densidad de siembra de 10000 células/pocillo y se incubaron durante la noche. La función de P2X4 se evaluó por medida de los cambios en el calcio intracelular usando un indicador quelante de calcio Fluo-8 -AM (Molecular Devices) en un lector de placas para obtención de imágenes fluorescentes (estación FLEX/FLIPR; Molecular Devices). En el día del ensayo, se retiró el medio y las células se incubaron durante 30 min a 37 °C y con 5 % de CO2 en 30 pl de solución amortiguadora de indicador (solución salina balanceada de Hank, HEPES 10 mM, CaCh 1,8 mM, MgCh 1 mM, probenecid 2 mM, D-glucosa monohidrato 5 mM, Fluo-8 -AM 5 |jM, pH=7,4). Los compuestos diluidos en solución amortiguadora de probenecid (solución salina balanceada de Hank, HEpES 10 mM, CaCh 1,8 mM, MgCh 1 mM, probenecid 2 mM, D-glucosa monohidrato 5 mM, pH=7,4) se añadieron en un volumen de 10 pl y se dejaron incubar durante 30 min a temperatura ambiente. La concentración final de DMSO en el ensayo fue 0,25 %. Se añadió el agonista, Mg-ATP (Sigma), en un volumen de 10 j l a una concentración que representa el valor de ECs0. Se determinó que el valor de ECs0 era 0,5 j M para P2X4 de humano y de ratón y 5 jM para el P2X4 de rata. La fluorescencia se midió durante un intervalo de 120 segundos cada un intervalo de 2 segundos. Las longitudes de onda de excitación y de emisión usadas para monitorear la fluorescencia fueron 470-495 nm y 515-575 nm, respectivamente. Los datos se analizaron en base al aumento en las unidades de fluorescencia relativas pico (RFU) comparado con la fluorescencia basal y los datos se normalizaron al control agonista. Los compuestos fueron evaluados por triplicado por placa y los valores promedio se graficaron con Excel XLFit para determinar los valores de CI50, el porcentaje de inhibición máxima y los coeficientes de Hill.
Ensayo de electrofisiología de células HEK con P2X4 Humano
Ensayo de electrofisiología A
Se sembraron células HEK293 que expresaban establemente P2X4 humano en frascos de cultivo celular T75 con una densidad de 7*106 células y se incubaron durante la noche. Se evaluó la función de P2X4 usando la plataforma para patch clamp automatizada PatchLiner (Nanion) en modo de perforación simple. La composición de la solución amortiguadora extracelular fue (en mM) NaCl 145, KCl 4, HEPES 10, CaCh 1, MgCh 0,5, D-glucosa monohidrato 10, pH=7,4. La solución amortiguadora intracelular contenía (en mM): CsF 135, EGTA 1, HEPES 10, NaCl 10, pH 7,2. En el día del ensayo, las células se recolectaron usando Accumax (Sigma) y se resuspendieron en solución amortiguadora extracelular. Se añadió el agonista ligando, adenosina 5'-trisfosfato (ATP, 5 pM), en un volumen de 5 pl, se lavó directamente con solución amortiguadora extracelular (40 pl). Las células se ajustaron a un voltaje de -80 mV y se aplicó el ligando cada 5 min durante 20 min. Durante este periodo la respuesta al agonista fue estable y se midieron los compuestos en concentración simple por modo de pocillo. Se añadieron los compuestos diluidos en solución amortiguadora extracelular (concentración final de DMSO en el ensayo de 0,3 %) en un volumen de 40 pl y se dejaron incubar durante 8 min a temperatura ambiente. Los datos se analizaron en base a la disminución en la amplitud de la corriente pico y se normalizaron al control agonista. Los valores de la media se graficaron en Excel XLFit para determinar los valores de CI50, porcentaje de inhibición máxima y los coeficientes de Hill.
Ensayo de electrofisiología B
Condiciones de cultivo celular: Se cultivaron células HEK-293 mito-Photina pcDNA3(neo-)/pPURO N/pcDNA3_P2RX4, clon 2a/4 (HEK-293 mito-Photina/hP2RX4) en medio Eagle esencial mínimo EMe M con solución salina balanceada de Earl (BioWhittaker cat. BE12-125F) suplementado con 5 ml de Ultraglutamina 1 200 mM (BioWhittaker cat. BE17-605E/U1), 5 ml de 100X Penicilina/estreptomicina (BioWhittaker cat. DE17-602E; concentración final 1 %), 4 ml de G41850 mg/ml (Sigma cat. G8168-100 ml; concentración final 400 pg/ml), 10 pl de Puromicina 10 mg/ml (InvivoGen cat. ant-pr-1; concentración final 0,2 pg/ml) y 50 ml de suero fetal bovino (Sigma cat. F7524; concentración final 10 %).
Protocolo experimental: se sembraron las líneas celulares HEK-293 72 o 96 horas antes del experimento, a una concentración de 5 o 2,5 millones de células, respectivamente en un frasco T225. Justo antes del experimento las células se lavaron dos veces con D-PBS sin Ca2+/Mg2+ (Euroclone cat. ECB4004L) y se despegaron del frasco con tripsina-EDTA (Sigma, cat. T4174 diluido 1/10). Las células después se resuspendieron en la solución de suspensión: 25 ml de medio EX-CELL ACF CHO (Sigma, cat. C5467); 0,625 ml de HEPES (BioWhittaker, cat. BE17-737E); 0,25 ml de 100x Penicilina/estreptomicina (BioWhittaker, cat. DE17-602E), 0,1 ml de inhibidor de tripsina de soja 10 mg/ml (Sigma, cat. T6522) y se colocaron en el QPatch 16X.
Preparación y almacenamiento del compuesto: Se usaron soluciones madre del compuesto (10 mM; 100 % DMSO; almacenadas a -20 °C). Se prepararon soluciones frescas a partir de las soluciones madre (1 o 3 mM, 100 % DMSO) justo antes de los experimentos (0,1 % de concentración final de DMSO).
La solución de DMSO se obtuvo de SIGMA (cat.# D-5879) y se almacenó a temperatura ambiente.
Análisis de Patch Clamp con QPatch16X (Figura 1): Se realizaron experimentos estándares de fijación de voltaje en célula entera a temperatura ambiente usando la tecnología multiperforación.
Para los experimentos de fijación de voltaje de hP2X4, los datos se muestrearon a 2 KHz. Después del establecimiento del sello y el pasaje a la configuración de célula entera, las células se mantuvieron a -90 mV y se evocó la corriente de hP2X4 mediante el agonista en ausencia (periodo de vehículo, es decir DMSO 0,1 %) o en presencia del compuesto en investigación a concentraciones en aumento; véase el protocolo de aplicación en la Figura 1.
Salida: la corriente hacia adentro máxima inducida por el agonista (ATP 5 microM).
La solución intracelular contenía (mM) CsF 135, NaCl 10, EGTA 1, HEPES 10 (pH 7,2 con CsOH) mientras que la solución extracelular (mM) NaCl 145, KCl 4, MgCh 0,5, CaCh 1, HEPES 10, Glucosa 10 (pH 7,4 con NaOH).
Para la recolección de los datos, se usó el programa de computación y el análisis se realizó fuera de línea usando Excel y GraphPad Prism.
Cuando fue posible, es decir cuando el % de inhibición con la mayor concentración ensayada fue mayor que el 50 %, las curvas de respuesta a dosis se ajustaron con la siguiente ecuación:
Y=100/(1 10 A((LogCl50-X)*HillSlope))
[X es el log de la concentración; Y es la response normalizada (100 % hasta 0 %, disminuyendo cuando X aumenta); LogCl50 misma unidades de log que X; HillSlope es el factor de pendiente sin unidades o pendiente de Hill]
ESTUDIOS EX VIVO
Ensayo de P2X4 en monocitos humanos
El principio del ensayo es medir el influjo de calcio a través de los canales P2X4 endógenos en monocitos humanos primarios, seguido por activación con 2',3'-O-(4-benzoil-benzoil)-ATP (Bz-ATP). Se midieron los cambios en la concentración de calcio intracelular con un dispositivo FliprTM (Molecular Devices) usando un indicador sensible a calcio (Fluo-8 ). En los monocitos primarios el P2X4 se localiza en la membrana de lisosomas, por lo tanto se tiene que generar la exocitosis para exponer a P2X4 a la membrana celular.
Se aislaron células mononucleares de sangre periférica humana (PBMC) de sangre anticoagulada (células sanguíneas, BC) mediante centrifugación en gradiente de densidad. Se diluyó sangre entera 1:3 con PBS. Las muestras de 30 ml se colocaron en capa cuidadosamente por encima de 15 ml de Biocoll (BIOCHROM) en tubos de centrifuga de 50 ml (Falcon). Los tubos se centrifugaron a 914 xg durante 25 min a TA sin freno. Se retiró la capa de PBMC con una pipeta de 10 ml y se transfirió a tubos con PBS helado en un volumen total de 50 ml. Las células se lavaron dos veces por decantación a 300 xg a 4 °C, durante 10 min y durante 5 min respectivamente. Se resuspendieron los PBMC en 10 ml de medio (X-vivo, Biozym Scientific) y se contaron en una cámara de Neubauer. Los monocitos se aislaron por selección negativa usando el kit de asilamiento de monocitos II de Miltenyi (#130-091-153) de acuerdo con las instrucciones. El aislamiento debe hacerse rápido y las células y soluciones deben mantenerse sobre hielo en todo momento. Se precipitaron por centrifugación los PBMC en lotes de 10exp8 (300 xg, 10 min) y se resuspendieron con 300 pl de solución amortiguadora MACS en un tubo Falcon de 50 ml. Se añadió el reactivo de bloqueo FcR (100 pl) y Biotina-Ab (100 pl), se mezclaron y se incubaron sobre hielo durante 10 min. Se añadió solución amortiguadora MACS (300 pl) y microesferas anti-Biotina (100 pl), se mezclaron y se incubaron sobre hielo durante 15 min. Se lavaron las células por precipitación (300 xg durante 10 min) y se resuspendieron en 500 pl de solución amortiguadora MACS. Para cada lote se colocó una Columna de separación en el separador MACS y se lavó con 3 ml de solución amortiguadora MACS. La suspensión celular se añadió a la columna, seguido por 3 x 3 ml de solución amortiguadora MACS para el lavado, y se recolectó el eluyente que contenía los monocitos. Las células se precipitaron (300 xg durante 10 min), se resuspendieron en medio X-vivo y se contaron. Los monocitos se sembraron en microplacas recubiertas con fibronectina (384 pocillos, negras, de fondo transparente plano; Corning #3848) con una densidad de 30.000 células/pocillo en 50 pl, y se cultivaron durante la noche (37 °C, 5 % CO2).
Se disolvieron las sustancias de ensayo en DMSO 100 % a una concentración madre de 10 mM y se almacenaron a -20 °C en alícuotas. Se prepararon diluciones seriales (2x) en DMSO y se diluyeron 500x con solución amortiguadora de ensayo para generar la placa de antagonista. En la medida de FLlPR, se transfirieron 10 pl por pocillo (dilución 4x) y se obtuvieron unas concentraciones máximas finales de 5 pM y 0,05 % de DMSO en el ensayo. Se almacenó el agonista BzATP a 10 mM en alícuotas y se diluyó a una concentración intermedia de 15 pM para generar la placa de agonista. En la medida de FLIPR, se transfirieron 10 pl por pocillo (dilución 5x) de manera que se obtuvo una concentración final en el ensayo de 3 pM.
Para el experimento, se descartó manualmente el medio de la placa de las células y se cargaron 70 pl/pocillo de solución amortiguadora de carga y se incubó durante 1 h (37 °C, 5 % CO2). La solución amortiguadora de carga contenía HBSS (sin calcio/magnesio), HEPES 10 mM pH 7,4, Fluo- 8 (AM) 5 pM (Tebu-bio) y metilamina 50 mM (Sigma) para generar la exocitosis. La solución amortiguadora de carga se descartó manualmente y se añadieron 30 pl/pocillo de solución amortiguadora de ensayo con bajo calcio (KCl 5 mM, NaCl 145 mM, CaCh 0,5 mM, glucosa 13 mM, HEPES 10 mM pH 7,4). La placa de antagonista se transfirió (10 pl/pocillo) y después de 15 min a TA se transfirió la placa de agonista ( 10 pl/pocillo).
El agregado de agonista se registró durante 240 después de un basal de 10 segundos. Para el análisis, se aplicó una corrección del basal, y se extrajo el máximo de la curva. Los datos se normalizaron al 0 % de inhibición (señal a BzATP 3 pM) y 100 % de inhibición (ausencia de estimulación con BzATP) y se ajustó con una curva de inhibición sigmoidea de cuatro parámetros usando Prism GraphPad para obtener los valores de CI50.
Ensayo de P2X4 en sangre entera de humano
En este ensayo, ex vivo, primero se sensibiliza la sangre de voluntarios femeninos sanos con lipopolisacárido (LPS) y después se estimula con ATP para iniciar la liberación de Interleuquina 1beta (IL-1p). En este sistema, se evaluó la eficacia de los antagonistas de P2X4 en la producción de IL-1p en sangre entera. Las células primero se trataron con 100 ng/ml de LPS durante 2 h y después se estimularon con ATP 3 mM y se trataron por triplicado con los ejemplos 19, 28, 39, 321, 326 y 380 a diferentes concentraciones. Después de 1 h de incubación, se tomó el sobrenadante y después de la centrifugación se estudió la IL-1p en el sobrenadante usando los kits de ELISA estándar. El ensayo se realizó con sangre de tres donantes diferentes (véanse las Figuras 2a y 2b).
Las Figuras 2a y 2b como ejemplo explicativo no vinculante de los compuestos de acuerdo con la invención representa el efecto de los compuestos de acuerdo con los ejemplos 19, 28, 39, 321, 326 y 380 en la generación de IL-1p en sangre entera humana después de la estimulación con ATP seguido por la sensibilización de las células con lipopolisacárido durante dos horas y tratamiento indicado. Los datos muestran la cantidad absoluta de IL-1p en pg/ml en el sobrenadante de sangre de tres donantes en el eje y los tratamientos con control y tratamientos con diferentes concentraciones de los ejemplos están indicados en el eje x. Para cada barra se muestra el promedio de tres réplicas técnicas y la SD. Los datos muestran la inhibición de la liberación de IL-1p para varios pero no todos los ejemplos ensayados.
ESTUDIOS IN VIVO
Modelo de inflamación por CFA en ratones con observación de comportamiento de dolor
Los ratones C57BL/6 hembra de tipo salvaje (Taconic) recibieron una inyección intraplantar de adyuvante completo de Freund (CFA) (30 pl, 1 mg/ml, Sigma) en la pata trasera izquierda bajo anestesia con isoflurano. Se les administró oralmente a los animales el ejemplo 326 (0,3, 1, y 3 mg/kg, n=10/grupo) en el día 2 posterior a la inyección con CFA. Se evaluó el comportamiento espontáneo relacionado con el dolor en animales con movimiento libre usando el dispositivo de soporte de peso dinámico automatizado (DWB, Bioseb, France) una hora después del tratamiento con compuesto de acuerdo con protocolos publicados y validados (Robinson y col., 2012; Tetreault y col., 2011; Gruen y col. 2014). Para la evaluación del comportamiento, el animal se colocó dentro de una cámara de Plexiglas en la cual se midió la presión ejercida en el piso. Los animales se dejaron mover libremente sin el aparato durante 5 min y posteriormente se registró el comportamiento de dolor durante un periodo de otros 5 min. La distribución relativa del peso se calcula determinando la relación del peso puesto en naíve (contralateral) respecto a al puesto en las patas tratadas con CFA intraplantar (ipsilateral).
En la Figura 3 como ejemplo explicativo no vinculante de los compuestos de acuerdo con la invención se representa la relación de la distribución de peso en porcentaje (eje y) de ratones tratados oralmente con el ejemplo 326 o vehículo 1 hora antes de la medida de distribución de peso. Cada símbolo representa la distribución de peso relativo para un ratón. El análisis estadístico se realizó con un análisis de varianza de una vía, seguido por la prueba de comparación múltiple de Dunnet contra el grupo control vehículo usando el programa de computación GraphPad PRISM, *p<0,05, **p<0,01. El ejemplo 326 redujo significativamente el comportamiento de dolor.
Modelo de hiperalgesia mecánica inducida por CFA en ratas
Se usaron ratas Sprague Dawley macho. Se indujo hiperalgesia mecánica por inyección de 25 pl de adyuvante completo de Freund (CFA) en la superficie plantar de la pata trasera izquierda. Se midió la hiperalgesia mecánica usando el aparato de medida de aplicación de presión (Ugo Basile, Gemonio, Italia). Brevemente, se aplicó una presión creciente linealmente a un área de aproximadamente 50 mm2 del lado plantar de la pata trasera, hasta que se observó un comportamiento (retirada de la pata) o hasta que la presión alcanzó 1000 gf. La presión en la cual se produce la respuesta conductual se registró como el umbral de retirada de la pata (PWT, del inglés Paw Withdrawal Threshold). Se determinaron los PWT correspondiente a la inyectada con CFA y a la contralateral para cada rata, en cada grupo de tratamiento y en cada punto de tiempo de los estudios. Las ratas recibieron 3 dosis orales del compuesto de ensayo a aproximadamente 12 horas de intervalo comenzando 1 hora antes de la inyección con CFA. Se realizó la prueba de hiperalgesia mecánica 2 horas antes de la inyección con CFA y 2 horas después de la última dosis (Figuras 4a y 4b).
Las Figuras 4a y 4b como ejemplo explicativo no vinculante de los compuestos de acuerdo con la invención representan el umbral de retirada de la pata en gramos (eje y) de la pata ipsilateral de todos los animales estudiados antes del tratamiento con CFA y 26 h después del tratamiento con CFA y tratamiento con vehículo o Ejemplo 39 (Fig.4a) o 326 (Fig.4b). Se realizó el análisis estadístico con análisis de varianza de una vía, seguido por la prueba de comparación múltiple de Dunnett contra los grupos control con vehículo usando el programa de computación GraphPad PRISM, *p<0,05, **p<0,01 ***p<0,001. Los ejemplos 39 y 326 aumentaron significativamente el PWT en comparación con los animales tratados con vehículo.
Claims (1)
- REIVINDICACIONES1. Un compuesto de fórmula (I)caracterizado porque:X representa C-R2a o N;R1 representa un grupo seleccionado entre:en las que * indica el punto de unión de dicho grupo con el resto de la molécula;R2 representa fenilo o heteroarilo,en las que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, oestán sustituidos una vez con R11a y opcionalmente una o dos veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros;R2a representa hidrógeno, ciano, nitro, halógeno, alquilo C1-C2 o haloalquilo C1-C2;R2b representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2;R2c representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2, en las que no menos que uno de R2a, R2b y R2c representa hidrógeno;R3 representa hidrógeno o flúor;R4 representa hidrógeno, flúor, metilo o OH;R5 representa hidrógeno o alquilo C1-C3;R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-; R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamenteR6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C ^ M a lc o x i C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; oR6a y R6b adyacentes entre sí representan juntos un grupo seleccionado entre -O-CH2-CH2-, -O-CH2-O- u -O-CH2-CH2-O-;R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, halógeno, alquilo C1-C4 o haloalquilo C1-C4;R8 representa, en forma independiente en cada instancia, alquilo C1-C6, alcoxi C1-C4-alquilo C1-C4, cicloalquilo C3-C6 o haloalquilo C1-C4;R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquMo C1-C4 o (CH3)2N-alquilo C1-C4 o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros, en el cual dicho anillo contiene opcionalmente un heteroátomo adicional seleccionado entre O, S, NH, NRa en el cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6 y está opcionalmente sustituido, entre una y tres veces, en forma independiente en cada caso, con halógeno o alquilo C1-C4;R11 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi C1-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil C1-C4)-S- o (alquil C1-C4)-SO2-;R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino,en las que * indica el punto de unión de dicho grupo con el resto de la molécula;R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C2-C4)-, (haloalcoxi C1-C4)-(alquil C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;n representa 0, 1, 2 o 3;o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.22. Un compuesto de acuerdo con la reivindicación 1 de fórmula (Ia),caracterizado porque:R1 representa un grupo seleccionado entre:en las que * indica el punto de unión de dicho grupo con el resto de la molécula;R2 representa fenilo o heteroarilo,en el que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros;R2a representa hidrógeno, ciano, nitro, halógeno, alquilo C1-C2 o haloalquilo C1-C2;R2b representa hidrógeno o halógeno;R2c representa hidrógeno o halógeno; en el que no menos que uno de R2a, R2b y R2c representa hidrógeno;R3 representa hidrógeno o flúor;R4 representa hidrógeno, flúor, metilo o OH;R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-; R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamenteR6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C ^ M a lc o x i C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C^C 4)-SO2-;R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; oR6a y R6b adyacentes entre sí representan juntos un grupo seleccionado entre -O-CH2-CH2-, -O-CH2-O- u -O-CH2-CH2-O-;R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, halógeno, alquilo C1-C4 o haloalquilo C1-C4;R8 representa, en forma independiente en cada instancia, alquilo C1-C6, alcoxi C1-C4-alquilo C1-C4, cicloalquilo C3-C6 o haloalquilo C1-C4;R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4 o (CH3)2N-alquilo C1-C4 o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros, en el cual dicho anillo contiene opcionalmente un heteroátomo adicional seleccionado entre O, S, NH, NRa en el cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6 y está opcionalmente sustituido, entre una y tres veces, en forma independiente en cada caso, con halógeno o alquilo C1-C4;R11 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi Ci-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil Ci-C4)-S- o (alquil C-i-C4)-SO2-;R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino,en las que * indica el punto de unión de dicho grupo con el resto de la molécula;R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C2-C4)-, (haloalcoxi C1-C4)-(alquil C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;n representa 0, 1, 2 o 3;o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.3. Un compuesto de acuerdo con la reivindicación 1 de fórmula (Ib)aracterizado porque:R1 representa un grupo seleccionado entre:en las que * indica el punto de unión de dicho grupo con el resto de la molécula;R2 representa fenilo o heteroarilo,en el que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, oestán sustituidos una vez con R11a y opcionalmente una o dos veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros;R3 representa hidrógeno o flúor;R4 representa hidrógeno, flúor, metilo o OH;R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4 o F3CS-; R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamenteR6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C ^ M a lc o x i C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-; oR6a y R6b adyacentes entre sí representan juntos un grupo seleccionado entre -O-CH2-CH2-, -O-CH2-O- u -O-CH2-CH2-O-;R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, halógeno, alquilo C1-C4 o haloalquilo C1-C4;R8 representa, en forma independiente en cada instancia, alquilo C1-C6, alcoxi C1-C4-alquilo C1-C4, cicloalquilo C3-C6 o haloalquilo C1-C4;R9 y R10 son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4 o (CH3)2N-alquilo C1-C4 o junto con el átomo de nitrógeno al cual están unidos forman un anillo heterocíclico que contiene nitrógeno de entre 4 y 6 miembros, en el cual dicho anillo contiene opcionalmente un heteroátomo adicional seleccionado entre O, S, NH, NRa en la cual Ra representa un grupo alquilo C1-C6 o haloalquilo C1-C6 y está opcionalmente sustituido, entre una y tres veces, en forma independiente en cada caso, con halógeno o alquilo C1-C4;R11 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C6, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C1-C4)-, (haloalcoxi C1-C4)-(alquil C1-C4)-, R9R10N-(alquil C1-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)-, (alquil C1-C4)-S- o (alquil C1-C4)-SO2-;R11a representa un grupo seleccionado entre cicloalquilo C3-C6, morfolino,en las que * indica el punto de unión de dicho grupo con el resto de la molécula;R12 representa, en forma independiente en cada caso, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, alquenilo C2-C4, haloalquilo C1-C4, hidroxialquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, (alcoxi C1-C4)-(alquil C2-C4)-, (haloalcoxi C1-C4)-(alquil C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;n representa 0, 1, 2 o 3;o un N-óxido, una sal, un hidrato, un solvato, un tautómero o un estereoisómero de dicho compuesto, o una sal de dicho N-óxido, tautómero o estereoisómero.4. Un compuesto de acuerdo con cualquiera de las reivindicaciones precedentes caracterizado porque:R1 representaen la que * indica el punto de unión de dicho grupo con el resto de la molécula;R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4 o haloalcoxi C1-C4;R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamenteR6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-.5. Un compuesto de acuerdo con cualquiera de las reivindicaciones precedentes caracterizado porque:R1 representaen la que * indica el punto de unión de dicho grupo con el resto de la molécula;R6 representa halógeno, ciano, nitro, OH, alquilo C1-C4, haloalquilo C1-C4, alcoxi C1-C4 o haloalcoxi C1-C4;R6a y R6b son iguales o diferentes y representan, en forma independiente entre sí, respectivamenteR6a hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, alcoxi C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil C1-C4)-SO2-;R6b hidrógeno, halógeno, hidroxi, nitro, ciano, alquilo C1-C4, cicloalquilo C3-C6, haloalquilo C1-C4, haloalcoxi C1-C4, HO-(alcoxi C2-C4)-, (alcoxi C1-C4)-(alcoxi C2-C4)-, R9R10N-, R8-C(O)-NH-, R8-C(O)-, R8-O-C(O)-, R9R10N-C(O)- o (alquil Ci-C4)-SO2-.6. Un compuesto de acuerdo con cualquiera de las reivindicaciones precedentes caracterizado porque:en las que * indica el punto de unión de dicho grupo con el resto de la molécula;R7a y R7b son iguales o diferentes y representan, en forma independiente entre sí, hidrógeno, hidroxi, flúor, cloro, alquilo C1-C4, difluorometilo o trifluorometilo.7. Un compuesto de acuerdo con cualquiera de las reivindicaciones precedentes, caracterizado porque:R2 representa fenilo,en el que dicho grupo fenilo está opcionalmente sustituido entre una y tres veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros.8. Un compuesto de acuerdo con cualquiera de las reivindicaciones 1-6 caracterizado porque:R2 representa heteroarilo monocíclico de 5 miembros,en el que dicho grupo heteroarilo está opcionalmente sustituido entre una y tres veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí.9. Un compuesto de acuerdo con la reivindicación 8 , caracterizado porque:R2 representa un grupo seleccionado entre:en las que * indica el punto de unión de dicho grupo con el resto de la molécula y dichos grupos están opcionalmente sustituidos una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí.10. Un compuesto de acuerdo con la reivindicación 8 o 9, caracterizado porque:R2 representa un grupo seleccionado entre:en las que * indica el punto de unión de dicho grupo con el resto de la molécula y dichos grupos están opcionalmente sustituidos una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una vez con R11, en forma independiente en cada caso iguales o diferentes entre sí.11. Un compuesto de acuerdo con cualquiera de las reivindicaciones 1-6, caracterizado porque:R2 representa heteroarilo monocíclico de 6 miembros,en el que dicho grupo heteroarilo está opcionalmente sustituido entre una y tres veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí.12. Un compuesto de acuerdo con cualquiera de las reivindicaciones 1-6, caracterizado porque:R2 representa heteroarilo bicíclico condensado en [5.6],en el que dicho grupo heteroarilo está opcionalmente sustituido entre una y tres veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos una vez con R11a y opcionalmente una o dos veces con R11 , en forma independiente en cada caso iguales o diferentes entre sí.13. Un compuesto de acuerdo con cualquiera de las reivindicaciones 1-12, caracterizado porque:R3 representa hidrógeno; yR4 representa hidrógeno, metilo o OH.14. Un compuesto de acuerdo con las reivindicaciones 1 a 13 caracterizado porque:R8 representa alquilo C1-C4, cicloalquilo C3-C6 o haloalquilo C1-C4.15. Un compuesto de acuerdo con las reivindicaciones 1 a 14, caracterizado porque:R9 representa, en forma independiente en cada caso, alquilo C1-C4 o cicloalquilo C3-C6;R10 representa, en forma independiente en cada caso, hidrógeno o alquilo C1-C4.16. Un compuesto de acuerdo con las reivindicaciones 1 a 15, seleccionado de la siguiente lista:2-(2-Clorofenil)-N-[4-(2-oxopiridin-1(2H)-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Cloro-2-oxopiridin-1(2H)-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida2-(2-Clorofenil)-N-[4-(3,5-dicloro-2-oxopiridin-1(2H)-il)-3-sulfamoilfenil]acetamidaN-[4-(3-Cloro-2-oxopiridin-1(2H)-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida2-(2-Clorofenil)-N-[4-(3-metil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(5-metil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida2-(2-Clorofenil)-N-{4-[5-metil-3-(trifluorometil)-1H-1,2,4-triazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(1H-imidazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-imidazol-1-il]fenil}acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Clorofenil)-N-{4-[3-(difluorometil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{4-[5-ciclopropil-3-(difluorometil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{4-[4-metil-3-(trifluorometil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{4-[5-metil-3-(trifluorometil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[3-sulfamoil-4-(1H-1,2,4-triazol-1-il)fenil]acetamida2-(2-Clorofenil)-N-{4-[3-(difluorometil)-1H-1,2,4-triazol-1-il]-3-sulfamoilfenil}acetamidaN-{4-[3-(Difluorometil)-1H-1,2,4-triazol-1-il]-3-sulfamoilfenil}-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Fluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-[2-(Difluorometil)fenil]-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamidaN-{3-Sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}-2-[2-(trifluorometil)fenil]acetamidaN-[4-(3-ferc-Butil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida2-(2-Clorofenil)-N-[4-(3-cloro-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(4-cloro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(4-isopropoxi-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida2-(2-Clorofenil)-N-[4-(3-isobutil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[4-(metilsulfanil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(4-metoxi-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(1H-Bencimidazol-1-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamidaN-[4-(4-Cloro-1H-imidazol-1-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida2-(2-Clorofenil)-N-{4-[3-(dimetilamino)-1H-1,2,4-triazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(3-etil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida(2-Clorofenil)-N-[4-(3-ciclopropil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(5-cidopropil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofeml)-N-{4-[3-(iT ietoxiiT ietil)-1H-1,2,4-triazol-1-il]-3-sulfaiT ioNfeml}acetaiT iida2-(2-Clorofeml)-N-[4-(4-dano-1H-pirazoM-il)-3-sulfaiT ioilfenN]acetaiT iidaN-[4-(4-ferc-Butil-1H-imidazol-1-il)-3-sulfamoilfeml]-2-(2-dorofeml)acetamida2-(2-Clorofeml)-N-[4-(3-dano-1H-1,2,4-triazol-1-il)-3-sulfai r ioNfemi]acetaiT iidaN-[4-(4-Bromo-1H-imidazol-1-il)-3-sulfamoilfenil]-2-(2-dorofenil)acetamida2-(2-Clorofenil)-N-[4-(3H-imidazo[4,5-b]piridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(1H-imidazo[4,5-b]piridin-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(1H-imidazo[4,5-c]piridin-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(3H-imidazo[4,5-c]piridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(2,4-dimetil-1H-imidazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Fluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(difluorometil)fenil]acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamida2-[2-(Difluorometil)fenil]-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamida2-(2-Metoxifenil)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida 2-(2-Fluorofenil)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida2-(3-Fluorofenil)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida2-(2-Cloro-4-fluorofenil)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida 2-[2-(Difluorometoxi)fenil]-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida 2-(2-Cloro-5-fluorofenil)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida 2-(3-Cloropiridin-4-il)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida 2-[4-(Difluorometil)fenil]-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida 2-(2-Clorofenil)-2,2-difluoro-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida N-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-dorofenil)-2,2-difluoroacetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(trifluorometil)fenil]acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3-fluorofenil)acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-metilfenil)acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-cloropiridin-3-il)acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-doro-4-fluorofenil)acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(difluorometoxi)fenil]acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(trifluorometoxi)fenil]acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-cloro-4,5-difluorofenil)acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3-cloropiridin-4-il)acetamidaN-[4-(4-Bromo-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[4-(difluorometil)fenil]acetamida2-(2-Bromofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-metoxifenil)acetamida2-(4-Clorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-6-fluorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-nitrofenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2,4-diclorofenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2,6-diclorofenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3,4-difluorofenil)acetamida2-(3-Clorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3,5-difluorofenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-fluorofenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-hidroxifenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-hidroxifenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2,3-difluorofenil)acetamida2-(2-Cloro-4-fluorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-doropiridin-3-il)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-doro-3-(trifluorometil)fenil]acetamida N-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(difluorometoxi)fenil]acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(trifluorometoxi)fenil]acetamida2-(2-Cloro-4,5-difluorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-4-metoxifenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-6-flúor-3-metilfenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-3,6-difluorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-5-metilfenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-5-fluorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2,5-didorofenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-isopropilfenil)acetamida2-(2-Cloro-5-metoxifenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-4,6-difluorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-doro-6-(trifluorometil)fenil]acetamida 2-(5-Bromo-4-flúor-2-metilfenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2-Cloro-6-metoxifeml)-N-[4-(4-doro-1H-pirazoM-il)-3-sulfair ioNfeml]acetaiT iidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfeml]-2-(2,6-difluorofeml)propanamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[4-(difluorometil)fenil]acetamida2-(4-Clorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Clorofenil)-N-[4-(4-doro-1H-pirazol-1-il)-3-sulfamoilfenil]-2,2-difluoroacetamida2-(2-Nitrofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2,4-Didorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Metoxifenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Cloro-6-fluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(3-Fluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(3,5-Difluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2,6-Didorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Bromofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(3,4-Difluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(4-Fluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(3-Clorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(4-Metoxifenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2,3-Difluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Metilfenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(3-Metilfenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-[2-(Difluorometoxi)fenil]-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloropiridin-3-il)-N-[3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloro-4-fluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloro-5-metilfenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida N-{3-Sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}-2-[2-(trifluorometoxi)fenil]acetamida 2-(2-Cloro-4,5-difluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-[2-Cloro-3-(trifluorometil)fenil]-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloro-6-flúor-3-metilfenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloro-3,6-difluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-[2-Cloro-6-(trifluorometil)fenil]-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloro-4-metoxifenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2,5-Didorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Isopropilfenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida2-(2-Cloro-5-metoxifenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloro-5-fluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida N-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(trifluorometil)fenil]acetamida2-(5-Bromo-4-flúor-2-metilfenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloro-6-metoxifenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Cloro-4,6-difluorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(3-Fluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(3,4-Difluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(3,5-Difluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-hidroxifenil)acetamida2-(3-Clorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(4-Fluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-hidroxifenil)acetamidaN-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3-metilfenil)acetamidaN-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-metilfenil)acetamidaN-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-metoxifenil)acetamidaN-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-metilfenil)acetamida2-(2,3-Difluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Etoxifenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-[2-(Difluorometoxi)fenil]-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloropiridin-3-il)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-6-flúor-3-metilfenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(trifluorometoxi)fenil]acetamida2-(2-Cloro-4,5-difluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-[2-Cloro-3-(trifluorometil)fenil]-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2,5-didorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-3,6-difluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-5-metilfenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(5-Bromo-4-flúor-2-metilfenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-Fluoro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-isopropilfenil)acetamida2-(2-Cloro-5-fluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-[2-Cloro-6-(trifluorometil)fenil]-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-metoxifenil)acetamida2-(2,6-Difluorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]propanamida N-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfeml]-2-(4-metilfenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfeml]-2-(2-metilfenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3-metilfenil)acetamidaN-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-etoxifenil)acetamida2-(2-Etoxifenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Bromofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2,4-Didorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2,6-Didorofenil)-N-[4-(4-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-nitrofenil)acetamida2-(4-Clorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-metoxifenil)acetamida2-(2-Cloro-6-fluorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(trifluorometil)fenil]acetamida N-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3-fluorofenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2,4-didorofenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfeml]-2-(2,6-didorofeml)acetamida2-(2-Bromofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3,4-difluorofenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3,5-difluorofenil)acetamida2-(3-Clorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-fluorofenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-hidroxifenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-hidroxifenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-metilfenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(4-metoxifenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-metilfenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(3-metilfenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-etoxifenil)acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2,3-difluorofenil)acetamida2-(2-Cloropiridin-3-il)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-4-fluorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(difluorometoxi)fenil]acetamida N-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(trifluorometoxi)fenil]acetamida 2-(2-Cloro-4,5-difluorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-[2-Cloro-3-(trifluorometil)fenil]-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2-doro-6-flúor-3-metilfenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2-Cloro-3,6-difluorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2-Cloro-5-metilfenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2-Cloro-4-metoxifenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfeml]-2-(2,5-didorofeml)acetamida2-(5-Cloro-2-metoxifenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(propan-2-il)fenil]acetamida 2-(2-Cloro-5-fluorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-[2-Cloro-6-(trifluorometil)fenil]-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2-Cloro-6-metoxifenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2-Cloro-4,6-difluorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(3-Cloropiridin-4-il)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[4-(difluorometil)fenil]acetamida 2-(2-Clorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]-2,2-difluoroacetamida 2-(2-Fluorofenil)-N-{3-sulfamoil-4-[5-(trifluorometil)piridin-3-il]fenil}acetamidaN-{3-Sulfamoil-4-[5-(trifluorometil)piridin-3-il]fenil}-2-[2-(trifluorometoxi)fenil]acetamida N-{4-[1-(Difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}-2-(2-metilfenil)acetamida N-{4-[1-(Difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}-2-[2-(trifluorometil)fenil]acetamida 2-[2-(Difluorometil)fenil]-N-{4-[1-(difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida N-{4-[1-(Difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}-2-(2-metoxifenil)acetamida N-{4-[1-(Difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}-2-(4-fluorofenil)acetamida 2-(2-Cloro-5-fluorofenil)-N-{4-[1-(difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida 2-(2,3-Didorofenil)-N-{4-[1-(difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida 2-(3-Cloropiridin-4-il)-N-[4-[1-(difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-[4-(3-cidobutil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-AcetiMH-pirazol-1-il)-3-sulfamoilfeml]-2-(2-dorofeml)acetamida2-(2-Clorofenil)-N-[4-(3-isopropil-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida N-[4-(4-Cloro-1H-pirazol-1-il)-3-sulfamoilfenil]-2-[2-(trifluorometil)fenil]acetamida 1-(4-{[(2-dorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-carboxilato de etilo1- (4-{[(2-fluorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-carboxilato de etilo2- (2-Fluorofenil)-N-{4-[4-(2-hidroxipropan-2-il)-lH-pirazol-1-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-{4-[4-(2-hidroxipropan-2-il)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida 2-(2-Cloropiridin-3-il)-N-{3-sulfamoil-4-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]fenil}acetamida 2-(2-Clorofenil)-N-metil-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Clorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]fenil}acetamida 2-(2-Clorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]fenil}acetamida 2-(2-Cloro-5-cianofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(2-Clorofenil)-N-{3-ciano-5-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida 2-(5-Bromo-2-clorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)-1H-pirazol-1-il]fenil}acetamida N-[4-(3-Cloro-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-[3-ciano-4-(4-flúor-1H-pirazol-1-il)-5-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(4-metil-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(3-metoxi-1H-1,2,4-triazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(4-ciclopropil-1H-imidazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(4-metil-1H-imidazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(3-ciclopropil-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(2H-pirazolo[3,4-b]piridin-2-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(2H-pirazolo[3,4-c]piridin-2-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(2H-pirazolo[4,3-b]piridin-2-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[4-(2-metoxietil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(3-flúor-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-(4-{4-[(2,2-difluoroetil)amino]-1H-pirazol-1-il}-3-sulfamoilfenil)acetamida 2-(2-Clorofenil)-N-{4-[4-(2,2-difluoroetil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(4-{[(2,2-difluoroetil)amino]metil}-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida 2-(2-Clorofenil)-N-{3-sulfamoil-4-[5-(trifluorometil)-1,2,4-oxadiazol-3-il]fenil}acetamida 2-(2-Fluorofenil)-N-[4-(4-metil-1H-pirazol-1-il)-3-sulfamoilfenil]acetamidaN-[4-(4-Ciclopropil-1H-imidazol-1-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamidaN-[4-(3-Ciclopropil-1H-pirazol-1-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamida2-(2-Fluorofenil)-N-{4-[4-(2-metoxietil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-(2-sulfamoilbifenil-4-il)acetamida2-(2-Clorofenil)-N-{4-[1-(ciclopropilmetil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{4-[1-(2-metoxietil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{4-[1-(piperidin-4-il)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida2-(2-Fluorofenil)-N-{4-[1-(piperidin-4-il)-1H-pirazol-4-il]-3-sulfamoilfenil} acetamidaN-{4-[1-(Azetidin-3-il)-1H-pirazol-4-il]-3-sulfamoilfenil}-2-(2-clorofenil)acetamida2-(3-Clorofenil)-N-(2-sulfamoilbifenil-4-il)acetamida2-(2-Clorofenil)-N-[4-(3-metil-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(6-cloropiridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(3,5-dimetil-1,2-oxazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-(4-{1-[(3-metiloxetan-3-il)metil]-1H-pirazol-4-il}-3-sulfamoilfenil)acetamida 2-(2-Cloro-4-fluorofenil)-N-{4-[1-(2-metoxietil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida 2-(2-Cloro-4-fluorofenil)-N-[4-(1-ciclopropil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-(3-sulfamoil-4-{1-[2-(trifluorometoxi)etil]-1H-pirazol-4-il}fenil)acetamida 2-(2-Clorofenil)-N-[4-(1-ciclobutil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-(4-{1-[2-(pirrolidin-1-il)etil]-1H-pirazol-4-il}-3-sulfamoilfenil)acetamida 2-(2-Clorofenil)-N-[4-(5-cianopiridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-(4-{1-[oxetan-2-ilmetil]-1H-pirazol-4-il}-3-sulfamoilfenil)acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[2-(2,2,2-trifluoroetoxi)pirimidin-5-il]fenil}acetamida2-(2-Clorofenil)-N-[4-(2-metoxipirimidin-5-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-(4-{1-[2-(propan-2-iloxi)etil]-1H-pirazol-4-il}-3-sulfamoilfenil)acetamida 2-(2-Clorofenil)-N-{4-[1-(3-hidroxi-3-metilbutil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-{4-[5-(2-hidroxipropan-2-il)-1-metil-1H-pirazol-3-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-{4-[5-(difluorometoxi)piridin-3-il]-3-sulfamoilfenil}acetamidaN-[4-(2-Cloro-5-metoxipiridin-3-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida2-(2-Clorofenil)-N-{4-[1-(2-hidroxietil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamidaN-[4-(5-ferc-Butil-1H-pirazol-3-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamidaN-[4-(1-Bencil-1H-pirazol-4-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida2-(2-Clorofenil)-N-[4-(6-metilpiridazin-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[6-(trifluorometil)piridin-2-il]fenil}acetamidaN-{4-[1-(Difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-{6-[1-(difluorometil)-1H-pirazol-4-il]-5-sulfamoilpiridin-3-il}acetamida N-[4-(6-Cloro-5-metilpiridin-3-il)-3-sulfamoilfenil]-2-(2-clorofenil)acetamida2-(2-Clorofenil)-N-{4-[2-(ciclopropilamino)pirimidin-5-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[1-(tetrahidrofurano-3-il)-1H-pirazol-4-il]fenil}acetamida 2-(2-Clorofenil)-N-{4-[2-(metilamino)pirimidin-5-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-[6-(1-metil-1H-pirazol-4-il)-5-sulfamoilpiridin-3-il]acetamida2-(2-Clorofenil)-N-{4-[l-(2,2-difluoroetil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamidaN-{3-Sulfamoil-4-[5-(trifluorometil)piridin-3-il]fenil}-2-[2-(trifluorometil)fenil]acetamida2-(2-Clorofenil)-N-[3-sulfamoil-5'-(trifluorometil)-2,3'-bipiridin-5-il]acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[2-(trifluorometil)pirimidin-5-il]fenil}acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[5-(trifluorometoxi)piridin-3-il]fenil}acetamida2-(2-Clorofenil)-N-[4-(2-cidopropilpirimidin-5-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(2-etoxipirimidin-5-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[2-(propan-2-ilamino)pirimidin-5-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{4-[2-(propan-2-iloxi)pirimidin-5-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{4-[2-(etilamino)pirimidin-5-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(2-metilpirimidin-5-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[2-(propilamino)pirimidin-5-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-(3-sulfamoil-4-{2-[(2,2,2-trifluoroetil)amino]pirimidin-5-il}fenil)acetamida 2-(2-Clorofenil)-N-{4-[2-(cidobutiloxi)pirimidin-5-il]-3-sulfamoilfenil}acetamidaN-[4-(2-Cloro-4-metilpirimidin-5-il)-3-sulfamoilfenil]-2-(2-dorofenil)acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[4-(trifluorometil)piridin-2-il]fenil}acetamida2-(2-Clorofenil)-N-[4-(5-doropiridin-2-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(l,2-dimetil-1H-imidazol-4-il)-3-sulfamoilfenil]acetamidaN-{6-[1-(Difluorometil)-1H-pirazol-4-il]-5-sulfamoilpiridin-3-il}-2-(2-fluorofenil)acetamida 2-(2-Clorofenil)-N-{4-[5-(pirrolidin-1-il)piridin-3-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(1-cidopropil-1H-pirazol-4-il)-3-sulfamoilfenil]-2-hidroxietanamida 2-(2-Clorofenil)-N-{4-[1-(difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}-2-hidroxietanamida 2-(2-Clorofenil)-N-[4-(5-doropiridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[1-(difluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(5-fluoropiridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[1-(2-metilpropil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(1-cidopentil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[2'-flúor-3'-(propan-2-iloxi)-2-sulfamoilbifenil-4-il]acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[5-(trifluorometil)piridin-3-il]fenil}acetamidaN-[4-(6-doro-5-metoxipiridin-3-il)-3-sulfamoilfenil]-2-(2-dorofenil)acetamida2-(2-Cloro-6-fluorofenil)-N-[4-(1-cidopropil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida 2-(2-Cloro-3-fluorofenil)-N-[4-(1-metil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamidaN-[4-(1-ferc-butN-1H-pirazol-4-N)-3-sulfair ioNfenN]-2-(2-dorofeml)acetaiT iida2-(2-Clorofenil)-N-{4-[2-(propan-2-iloxi)piridin-3-il]-3-sulfamoilfenil}acetamida2-(2-Cloro-3-fluorofenil)-N-[4-(1-cidopropil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida 2-(2-Fluorofenil)-N-[4-(piridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-6-fluorofenil)-N-[4-(1-metil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[3'-flúor-5'-(2-hidroxipropan-2-il)-2-sulfamoilbifenil-4-il]acetamida2-(2-Clorofenil)-N-[4-(5-metoxipiridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[3'-(2-hidroxipropan-2-il)-2-sulfamoilbifenil-4-il]acetamida2-(2-Fluorofenil)-N-{4-[1-(propan-2-il)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamidaN-[4-(1-Cidopropil-1H-pirazol-4-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[1-(tetrahidro-2H-piran-2-il)-1H-pirazol-4-il]fenil}acetamida N-[4-(1-ferc-Butil-1H-pirazol-4-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamidaN-[3'-Fluoro-5'-(2-hidroxipropan-2-il)-2-sulfamoilbifenil-4-il]-2-(2-fluorofenil)acetamida N-[4-(1-Cidopentil-1H-pirazol-4-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-[4-(1-cidopropil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Cloro-6-fluorofenil)-N-{4-[1-(2-metoxietil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-[4-(1,3-dimetil-1H-pirazol-5-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-(4'-doro-2-sulfamoilbifenil-4-il)acetamida2-(2-Clorofenil)-N-{4-[1-metil-3-(trifluorometil)-1H-pirazol-5-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-[4-(piridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[1-metil-3-(trifluorometil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-(3'-doro-2-sulfamoilbifenil-4-il)acetamida2-(2-Clorofenil)-N-(4-{1-[(2,2-didorocidopropil)metil]-1H-pirazol-4-il}-3-sulfamoilfenil)acetamida 2-(2-Clorofenil)-N-[4-(1,3-dimetil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[1-(propan-2-il)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-[4-(1-metil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[1-(2-hidroxi-3,3-dimetilbutil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida 2-(2-Fluorofenil)-N-[4-(5-fluoropiridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(5-metil-1-fenil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida4'-{[(2-Clorofenil)acetil]amino}-N-[2-(dimetilamino)etil]-2'-sulfamoilbifenil-3-carboxamida 2-(2-Clorofenil)-N-[4-(pirazolo[1,5-a]pirimidin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[5-(pirrolidin-1-ilcarbonil)piridin-3-il]-3-sulfamoilfenil}acetamida 2-(2-Clorofenil)-N-[4-(1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Fluorofenil)-N-{4-[1-metil-3-(trifluorometil)-1H-pirazol-5-il]-3-sulfamoilfenil}acetamida2-(2-Fluorofenil)-N-{4-[l-(2-metoxietil)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida2-(2-Clorofeml)-N-{4-[1-(2-h¡drox¡-2-met¡lprop¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡lfeml}acetam¡da2-(5-Cloro-2-fluorofenil)-N-[4-(1-cidopropil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-[4-(6-metilpiridin-3-il)-3-sulfamoilfenil]acetamida2-(2-Clorofenil)-N-{4-[1-(oxetan-3-il)-1H-pirazol-4-il]-3-sulfamoilfenil}acetamida2-(2-Fluorofenil)-N-[4-(1-metil-1H-pirazol-4-il)-3-sulfamoilfenil]acetamidaN-[4-(1,3-dimetil-1H-pirazol-4-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamidaN-[4-(5-cidopropil-1,3,4-oxadiazol-2-il)-3-sulfamoilfenil]-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-[4-(5-cidopropil-1,3,4-oxadiazol-2-il)-3-sulfamoilfenil]acetamidaN-{4-[4-(Difluorometil)-1H-pirazol-1-il]-3-sulfamoilfenil}-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-{4-[4-(difluorometil)-1H-pirazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Clorofenil)-N-{5-sulfamoil-6-[4-(trifluorometil)-1H-pirazol-1-il]piridin-3-il}acetamida2-(2-Fluorofenil)-N-{5-sulfamoil-6-[4-(trifluorometil)-1H-pirazol-1-il]piridin-3-il}acetamidaN-[6-(4-Ciano-1H-pirazol-1-il)-5-sulfamoilpiridin-3-il]-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-[6-(4-ciano-1H-pirazol-1-il)-5-sulfamoilpiridin-3-il]acetamida2-(2-Fluorofenil)-N-[6-(4-flúor-1H-pirazol-1-il)-5-sulfamoilpiridin-3-il]acetamida2-(2-dorofenil)-N-[6-(4-flúor-1H-pirazol-1-il)-5-sulfamoilpiridin-3-il]acetamidaN-[6-(4-Bromo-1H-pirazol-1-il)-5-sulfamoilpiridin-3-il]-2-(2-fluorofenil)acetamida2-(2-Clorofenil)-N-[6-(4-doro-1H-pirazol-1-il)-5-sulfamoilpiridin-3-il]acetamidaN-[6-(4-Cloro-1H-pirazol-1-il)-5-sulfamoilpiridin-3-il]-2-(2-fluorofenil)acetamidaN-[6-(4-Bromo-1H-p¡razol-1-¡l)-5-sulfamo¡lp¡nd¡n-3-¡l]-2-(2-dorofeml)acetam¡da2-(2-Fluorofenil)-N-{3-sulfamoil-4-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]fenil}acetamida2-(2-Clorofenil)-N-{3-sulfamoil-4-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]fenil}acetamida2-(2-Clorofenil)-N-{4-[3-(piridin-3-il)-1H-1,2,4-triazol-1-il]-3-sulfamoilfenil}acetamida2-(2-Fluorofeml)-W-[4-(1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]acetam¡daW-[4-(4-terc-But¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]-2-(2-dorofeml)acetam¡da2-(2-Clorofeml)-A/-[4-(1H-¡ndazol-1-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(2H-¡ndazol-2-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Fluorofeml)-W-[4-(2H-¡ndazol-2-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Fluorofeml)-W-[4-(1H-¡ndazol-1-¡l)-3-sulfamo¡lfeml]acetam¡da1- (4-{[(2-Clorofeml)acet¡l]am¡no}-2-sulfamo¡lfeml)-N,W-d¡met¡l-1H-p¡razol-4-carboxam¡daW-[1-(4-{[(2-Clorofen¡l)acet¡l]am¡no}-2-sulfamo¡lfeml)-1H-p¡razol-4-¡l]ddopropancarboxam¡da 2- (2-Clorofeml)-A/-{4-[4-(p¡raz¡n-2-¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-{4-[4-(p¡rid¡n-2-¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-{4-[4-(p¡rid¡n-3-¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-{4-[4-(pmm¡d¡n-4-¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Fluorofen¡l)-W-{4-[4-(pmm¡d¡n-4-¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da2-(4-Metox¡fen¡l)-W-{3-sulfamo¡l-4-[4-(tr¡fluoromet¡l)-2H-1,2,3-tr¡azol-2-¡l]fen¡l}acetam¡da2-(4-Metox¡feml)-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-1H-1,2,3-tnazol-1-¡l]feml}acetam¡da2-(4-Met¡lfen¡l)-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-2H-1,2,3-tnazol-2-¡l]feml}acetam¡da2-(4-Met¡lfen¡l)-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-1H-1,2,3-tnazol-1-¡l]feml}acetam¡da2-[4-(D¡fluoromet¡l)feml]-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-2H-1,2,3-tnazol-2-¡l]feml}acetam¡da 2-[4-(D¡fluoromet¡l)feml]-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-1H-1,2,3-tnazol-1-¡l]feml}acetam¡da 2-(2-Fluorofen¡l)-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-2H-1,2,3-tnazol-2-¡l]feml}acetam¡da2-(2-Fluorofen¡l)-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-1H-1,2,3-tnazol-1-¡l]feml}acetam¡da2-[2-Cloro-4-(trifluoromet¡l)fen¡l]-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-2H-1,2,3-tnazol-2-¡l]feml}acetam¡da 2-[2-Cloro-4-(trifluoromet¡l)fen¡l]-W-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-1H-1,2,3-tnazol-1-¡l]feml}acetam¡da 2-(2,4-D¡dorofeml)-A/-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-2H-1,2,3-tnazol-2-¡l]feml}acetam¡da2-(2,4-D¡dorofeml)-A/-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-1H-1,2,3-tnazol-1-¡l]feml}acetam¡da2-(2-Clorofeml)-A/-[3-sulfamo¡l-4-(1,3-t¡azol-5-¡l)feml]acetam¡da2-(2-Clorofeml)-A/-[3-sulfamo¡l-4-(1,2-t¡azol-3-¡l)feml]acetam¡da2-(2-Clorofeml)-A/-[4-(2-met¡l-1,3-t¡azol-4-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(2-metox¡-1,3-t¡azol-4-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(2-metox¡-1,3-t¡azol-5-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(2-met¡l-1,3-t¡azol-5-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(3-met¡l-1,2-t¡azol-5-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(4-met¡l-1,3-t¡azol-2-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[3-sulfamo¡l-4-(1,2-t¡azol-4-¡l)feml]acetam¡da2-(2-Clorofeml)-A/-[3-sulfamo¡l-4-(1,3-t¡azol-2-¡l)feml]acetam¡da2-(2-Clorofeml)-A/-[4-(4-dano-1,3-t¡azol-2-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-{4-[2-(d¡fluoromet¡l)-1,3-t¡azol-5-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-[4-(2-ddoprop¡l-1,3-t¡azol-5-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(2-ddoprop¡l-1,3-t¡azol-4-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(4-met¡l-1,3-oxazol-2-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-{3-sulfamo¡l-4-[2-(trifluoromet¡l)-1,3-t¡azol-4-¡l]feml}acetam¡da2-(2-Clorofeml)-A/-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-1,3-t¡azol-2-¡l]feml}acetam¡da2-(2-Clorofeml)-A/-{4-[2-(2-h¡drox¡propan-2-¡l)-1,3-t¡azol-5-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-{4-[2-(2-h¡drox¡propan-2-¡l)-1,3-t¡azol-4-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-[3-sulfamo¡l-4-(1,3-t¡azol-4-¡l)feml]acetam¡da2-(2-Clorofeml)-A/-[4-(5-ddoprop¡l-1,2-oxazol-3-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(2-ddoprop¡l-1,3-oxazol-5-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-(4-{4-[(3,3-d¡fluoroazet¡d¡n-1-¡l)carboml]-1H-p¡razol-1-¡l}-3-sulfamo¡lfeml)acetam¡da W-{4-[4-(Azet¡d¡n-1-¡lcarbon¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfen¡l}-2-(2-clorofen¡l)acetam¡da2-(2-Clorofeml)-A/-{4-[4-(p¡rrol¡d¡n-1-¡lcarboml)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-(4-{4-[(3,3-d¡fluorop¡rrol¡d¡n-1-¡l)carboml]-1H-p¡razol-1-¡l}-3-sulfamo¡lfeml)acetam¡da 2-(4-Clorofeml)-A/-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(2-Cloro-6-fluorofernl)-W-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡daW-{3-Sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}-2-[4-(trifluoromet¡l)fen¡l]acetam¡da2-(3-Fluorofen¡l)-Ñ-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(2,4-D¡dorofeml)-A/-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡rid¡n-3-¡l]feml}acetam¡da2-(2-Bromofen¡l)-W-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(2,4-D¡fluorofen¡l)-W-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(3,4-D¡fluorofen¡l)-W-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(3,5-D¡fluorofen¡l)-W-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(3-Clorofeml)-A/-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(4-Met¡lfen¡l)-W-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(4-Metox¡fernl)-Ñ-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(2-Fluoro-4-met¡lfen¡l)-W-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(2-Fluoro-4-metox¡feml)-Ñ-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-[4-(D¡fluoromet¡l)feml]-W-{3-sulfamo¡l-4-[5-(trifluoromet¡l)p¡nd¡n-3-¡l]feml}acetam¡da2-(4-Clorofeml)-A/-[4-(6-dorop¡rid¡n-3-¡l)-3-sulfamo¡lfen¡l]acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-(2-fluorofeml)acetam¡da2-(2-Cloro-6-fluorofeml)-W-[4-(6-dorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-[4-(trifluoromet¡l)fen¡l]acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-[2-(trifluoromet¡l)fen¡l]acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-(3-fluorofeml)acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-(2,4-d¡dorofeml)acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-(2,4-d¡fluorofeml)acetam¡da2-(2-Bromofeml)-W-[4-(6-dorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-(3,4-d¡fluorofeml)acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-(4-met¡lfen¡l)acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-(4-metox¡feml)acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-(2-flúor-4-met¡lfeml)acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfeml]-2-(2-flúor-4-metox¡feml)acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-[4-(d¡fluoromet¡l)fen¡l]acetam¡daW-[4-(6-Clorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]-2-[2-doro-4-(trifluoromet¡l)fen¡l]acetam¡da2-(2,4-D¡dorofeml)-A/-[4-(5-fluorop¡nd¡n-3-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Fluoro-4-met¡lfeml)-W-[4-(5-fluorop¡nd¡n-3-¡l)-3-sulfamo¡lfeml]acetam¡da2-[4-(D¡fluoromet¡l)feml]-W-[4-(5-fluorop¡nd¡n-3-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(4-ddoprop¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡daW-[4-(4,6-D¡fluoro-2H-benzotriazol-2-¡l)-3-sulfamo¡lfen¡l]-2-(2-fluorofeml)acetam¡daW-[4-(4,6-D¡fluoro-1H-benzotriazol-1-¡l)-3-sulfamo¡lfen¡l]-2-(2-fluorofeml)acetam¡da2-(2-Clorofeml)-A/-[4-(4,6-d¡fluoro-1H-benzotnazol-1-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(4,6-d¡fluoro-2H-benzotriazol-2-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-{3-sulfamo¡l-4-[2-(trifluoromet¡l)-1,3-t¡azol-5-¡l]feml}acetam¡da2-(2-Clorofeml)-A/-[4-(4-dano-1H-p¡razol-1-¡l)-5-sulfamo¡l-2-(trifluoromet¡l)fen¡l]acetam¡da2-[2-Cloro-5-(trifluoromet¡l)fen¡l]-W-[4-(4-dano-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]acetam¡da2-[2-Cloro-5-(trifluoromet¡l)fen¡l]-W-[4-(4-dano-1H-p¡razol-1-¡l)-5-sulfamo¡l-2-(trifluoromet¡l)feml]acetam¡da 2-(2-Clorofeml)-A/-[4-(4-dano-1H-p¡razol-1-¡l)-3-sulfamo¡l-2-(trifluoromet¡l)fen¡l]acetam¡da2-[2-Cloro-3-(trifluoromet¡l)fen¡l]-W-[4-(4-dano-1H-p¡razol-1-¡l)-5-sulfamo¡l-2-(trifluoromet¡l)feml]acetam¡da 2-(2-Clorofeml)-A/-{4-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡l-2-(trifluoromet¡l)feml}acetam¡da 2-[2-Cloro-3-(trifluoromet¡l)fen¡l]-W-{4-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡lfeml}acetam¡da 2-(2-Clorofeml)-A/-{4-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-5-sulfamo¡l-2-(trifluoromet¡l)feml}acetam¡da 2-(2-Clorofeml)-A/-{4-[1-(d¡fluoromet¡l)-5-(trifluoromet¡l)-1H-p¡razol-4-¡l]-3-sulfamo¡lfeml}acetam¡da 2-(2-Clorofeml)-A/-{4-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-2-flúor-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-{4-[1-(d¡fluoromet¡l)-1H-p¡razol-4-¡l]-2-flúor-5-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-{4-[2-(d¡met¡lam¡no)-1,3-t¡azol-4-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-[3-sulfamo¡l-4-(1,2-t¡azol-5-¡l)feml]acetam¡da1- (4-{[(2-Clorofeml)acet¡l]am¡no}-2-sulfamo¡lfeml)-A/-ddoprop¡l-W-met¡l-1H-p¡razol-4-carboxam¡da 2- (2-Clorofeml)-2-h¡drox¡-A/-{3-sulfamo¡l-4-[4-(trifluoromet¡l)-1H-p¡razol-1-¡l]íeml}etanam¡da2-(2-Clorofeml)-A/-{3-doro-5-sulfamo¡l-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]feml}acetam¡da2-(2-Clorofeml)-A/-[4-(4-dano-3-h¡drox¡-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(1H-p¡razolo[4,3-c]p¡r¡d¡n-1-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(4,5-d¡met¡l-1,3-t¡azol-2-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(2,4-d¡met¡l-1,3-t¡azol-5-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(4-met¡l-1,3-t¡azol-5-¡l)-3-sulfamo¡lfeml]acetam¡daW-{4-(4-Am¡no-1H-p¡razol-1-¡l)-3-[(2,4-d¡metox¡bendl)sulfamo¡l]fen¡l}-2-(2-dorofeml)acetam¡daW-[1-(4-{[(2-Clorofeml)acet¡l]am¡no}-2-sulfamo¡lfeml)-1H-p¡razol-4-¡l]-2,2-d¡fluoroacetam¡daW-[1-(4-{[(2-Clorofeml)acet¡l]am¡no}-2-sulfamo¡lfeml)-1H-p¡razol-4-¡l]-3,3,3-tr¡fluoropropanam¡daW-[1-(4-{[(2-Clorofeml)acet¡l]am¡no}-2-sulfamo¡lfeml)-1H-p¡razol-4-¡l]-3,3,3-tr¡fluoro-2-met¡lpropanam¡da (racém¡ca) W-[1-(4-{[(2-Clorofeml)acet¡l]am¡no}-2-sulfamo¡lfeml)-1H-p¡razol-4-¡l]-3,3,3-tr¡fluoro-2-met¡lpropanam¡da (Enant¡ómero A)W-[1-(4-{[(2-Clorofeml)acet¡l]am¡no}-2-sulfamo¡lfeml)-1H-p¡razol-4-¡l]-3,3,3-tr¡fluoro-2-met¡lpropanam¡da (Enant¡ómero B)2-(2-Clorofeml)-A/-(4-{4-[(ds)-2,5-d¡met¡lp¡rrol¡d¡n-1-¡l]-1H-p¡razol-1-¡l}-3-sulfamo¡lfeml)acetam¡da2-(2-Clorofeml)-A/-(4-{4-[(trans)-2,5-d¡met¡lp¡rrol¡d¡n-1-¡l]-1H-p¡razol-1-¡l}-3-sulfamo¡lfeml)acetam¡da (Enant¡ómero A)2-(2-Clorofeml)-A/-(4-{4-[(trans)-2,5-d¡met¡lp¡rrol¡d¡n-1-¡l]-1H-p¡razol-1-¡l}-3-sulfamo¡lfeml)acetam¡da (Enant¡ómero B)W-(4-{4-[(2,2-D¡fluoroet¡l)am¡no]-1H-p¡razol-1-¡l}-3-sulfamo¡lfeml)-2-(2-fluorofeml)acetam¡da2-(2-Clorofeml)-A/-(3-sulfamo¡l-4-{4-[(2,2,2-tr¡fluoroet¡l)am¡no]-1H-p¡razol-1-¡l}feml)acetam¡da2-(2-Clorofeml)-A/-[4-(4-¡soprop¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Fluorofeml)-W-[4-(4-¡soprop¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-{3-sulfamo¡l-4-[4-(2,2,2-tr¡fluoroet¡l)-1H-p¡razol-1-¡l]feml}acetam¡da2-(2-Fluorofeml)-W-{3-sulfamo¡l-4-[4-(2,2,2-tr¡fluoroet¡l)-1H-p¡razol-1-¡l]feml}acetam¡da2-(2-Clorofeml)-A/-[4-(5-ddoprop¡l-1,2,4-oxad¡azol-3-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-{3-sulfamo¡l-4-[3-(tr¡fluoromet¡l)-1,2,4-oxad¡azol-5-¡l]feml}acetam¡da2-(2-Clorofeml)-A/-{4-[5-(d¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]-3-sulfamo¡lfeml}acetam¡daW-{4-[5-(D¡fluoromet¡l)-1,3,4-oxad¡azol-2-¡l]-3-sulfamo¡lfeml}-2-(2-fluorofeml)acetam¡da2-(2-Clorofeml)-A/-[4-(5-met¡l-1,3,4-oxad¡azol-2-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Fluorofeml)-W-[4-(5-met¡l-1,3,4-oxad¡azol-2-¡l)-3-sulfamo¡lfeml]acetam¡daW-[4-(5-Met¡l-1,3,4-oxad¡azol-2-¡l)-3-sulfamo¡lfeml]-2-(4-met¡lfen¡l)acetam¡da2-(2-Clorofeml)-A/-[4-(1H-p¡rrol-3-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-{4-[5-(d¡fluoroacet¡l)-1H-p¡rrol-3-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-[4-(1-met¡l-1H-p¡rrol-3-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(5-dano-1-met¡l-1H-p¡rrol-2-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-{3-sulfamo¡l-2-(tr¡fluoromet¡l)-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]feml}acetam¡da2-(2-Clorofeml)-A/-{5-sulfamo¡l-2-(tr¡fluoromet¡l)-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]feml}acetam¡da2-[2-Cloro-3-(tr¡fluoromet¡l)fen¡l]-W-{5-sulfamo¡l-2-(tr¡fluoromet¡l)-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]feml}acetam¡da 2-[2-Cloro-5-(tr¡fluoromet¡l)fen¡l]-W-{5-sulfamo¡l-2-(tr¡fluoromet¡l)-4-[4-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]feml}acetam¡da 2-[2-Cloro-6-(tr¡fluoromet¡l)fen¡l]-W-[4-(4-flúor-1H-p¡razol-1-¡l)-5-sulfamo¡l-2-(tr¡fluoromet¡l)feml]acetam¡da 2-[2-Cloro-3-(tr¡fluoromet¡l)fen¡l]-W-[4-(4-flúor-1H-p¡razol-1-¡l)-5-sulfamo¡l-2-(tr¡fluoromet¡l)feml]acetam¡da 2-[2-Cloro-5-(tr¡fluoromet¡l)fen¡l]-W-[4-(4-flúor-1H-p¡razol-1-¡l)-5-sulfamo¡l-2-(tr¡fluoromet¡l)feml]acetam¡da 2-[2-Cloro-4-(tr¡fluoromet¡l)fen¡l]-W-[4-(4-flúor-1H-p¡razol-1-¡l)-5-sulfamo¡l-2-(tr¡fluoromet¡l)feml]acetam¡da W-[4-(3-terc-But¡l-4-dano-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]-2-(2-dorofeml)acetam¡daW-[4-(3-Bromo-4-dano-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]-2-(2-dorofeml)acetam¡da2-(2-Clorofeml)-A/-{4-[4-doro-3-(tr¡fluoromet¡l)-1H-p¡razol-1-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-[4-(3,4-d¡met¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡daW-[4-(4-Cloro-3,5-d¡met¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]-2-(2-clorofen¡l)acetam¡da2-(2-Clorofeml)-A/-[4-(1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(3-dano-5-met¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(3-h¡drox¡-5-met¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(4-dano-5-met¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofeml)-A/-[4-(4-dano-3-met¡l-1H-p¡razol-1-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-{4-[4-(morfol¡n-4-¡l)-1,3-t¡azol-2-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-{4-[5-(morfol¡n-4-¡l)-1,3-t¡azol-2-¡l]-3-sulfamo¡lfeml}acetam¡da2-(2-Clorofeml)-A/-[4-(5-met¡l-1,3-t¡azol-2-¡l)-3-sulfamo¡lfeml]acetam¡da2-(2-Clorofeml)-A/-[4-(p¡r¡d¡n-4-¡l)-3-sulfamo¡lfeml]acetam¡da1- (4-{[(2-Clorofeml)acet¡l]am¡no}-2-sulfamo¡lfeml)-1H-p¡razol-4-carboxam¡da2- (2-Cloro-3-h¡drox¡feml)-A/-[4-(4-dano-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Cloro-4-h¡drox¡feml)-A/-[4-(4-dano-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Cloro-5-h¡drox¡feml)-A/-[4-(4-dano-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Cloro-6-h¡drox¡feml)-A/-[4-(4-dano-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]acetam¡da2-(2-Clorofen¡l)-N-[4-(4-c¡ano-1H-p¡razol-1-¡l)-3-sulfamo¡lfen¡l]-2-h¡drox¡acetam¡da.17. Un compuesto de acuerdo con la re¡v¡nd¡cac¡ón 1 de fórmula:2-(2-Clorofenil)-N-[4-(4-ciano-1H-pirazol-1-il)-3-sulfamoilfenil]acetamida.18. Un compuesto de fórmula general I, o un estereoisómero, un tautómero, un óxido de N, un hidrato, un solvato o una sal del mismo, en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, de acuerdo con una cualquiera de las reivindicaciones 1 a 17, para su uso en el tratamiento o profilaxis de una enfermedad.19. Un compuesto de fórmula general I, o un estereoisómero, un tautómero, un N óxido, un hidrato, un solvato o una sal del mismo, en particular una sal farmacéuticamente aceptable del mismo, o una mezcla de los mismos, de acuerdo con una cualquiera de las reivindicaciones 1 a 17 para la preparación de un medicamento para su uso en la profilaxis o el tratamiento de una enfermedad.20. Un compuesto para su uso de acuerdo con las reivindicaciones 18 o 19, en el que dicha enfermedad es una enfermedad, afección o trastorno genitourinario, gastrointestinal, proliferativo o relacionado con el dolor; cáncer; enfermedades fibróticas que incluyen fibrosis pulmonar, fibrosis cardíaca, fibrosis renal y fibrosis de otros órganos; enfermedades ginecológicas, dismenorrea, dispareunia, endometriosis y adenomiosis; dolor asociado a la endometriosis; síntomas asociados a endometriosis, en los que dichos síntomas son en particular asociados a endometriosis, dismenorrea, dispareunia, disuria o disquecia; hipersensibilidad pélvica; uretritis; prostatitis; prostatodinia; cistitis; hipersensibilidad idiopática de la vejiga; trastornos gastrointestinales que incluyen síndrome del intestino irritable (SII), enfermedad inflamatoria intestinal (EII), cólico biliar y otros trastornos biliares, cólico renal, SII con diarrea dominante, reflujo gastroesofágico, distensión gastrointestinal, enfermedad de Crohn y similar; enfermedad de Parkinson; enfermedad de Alzheimer; infarto de miocardio; aterosclerosis; trastornos de lípidos; trastornos funcionales del intestino, síndrome del intestino irritable, artritis, osteoartritis y artritis reumatoide, y enfermedades o síndromes asociados al dolor (incluyendo dolor agudo, crónico, inflamatorio y neuropático), dolor inflamatorio, dolor lumbar, dolor quirúrgico, dolor visceral, dolor dental, dolor premenstrual, dolor asociado con endometriosis, dolor asociado con enfermedades fibróticas, dolor central, dolor debido al síndrome de boca ardiente, dolor debido a quemaduras, dolor debido a migraña, dolores de cabeza en racimo, hiperalgesia, alodinia, dolor debido a una lesión nerviosa traumática, dolor debido a lesiones postraumáticas, dolor debido a fracturas y lesiones deportivas, dolor debido a la neuralgia del trigémino, dolor asociado con la neuropatía de fibras pequeñas, dolor asociado con la neuropatía diabética, dolor lumbar crónico, dolor del miembro fantasma, síndrome de dolor pélvico, dolor pélvico crónico, dolor neuroma, síndrome de dolor regional complejo, dolor asociado con distensión gastrointestinal, dolor artrítico crónico y neuralgias relacionadas, y dolor asociado con cáncer, dolor asociado con quimioterapia, VIH y neuropatía inducida por tratamiento del VIH, prurito; alteración de la cicatrización de heridas y enfermedades del esqueleto como degeneración de las articulaciones, espondilitis anquilosante.21. Un compuesto para su uso de acuerdo con una cualquiera de las reivindicaciones 18 o 19, en el que dicha enfermedad es una enfermedad ginecológica, dismenorrea, dispareunia o endometriosis, adenomiosis, dolor asociado con endometriosis u otros síntomas asociados con endometriosis, en el que dichos síntomas son dismenorrea asociada con endometriosis, dispareunia, disuria o disquecia.22. Una composición farmacéutica que comprende al menos un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 17, junto con al menos un auxiliar farmacéuticamente aceptable.23. Un intermedio de fórmula 3a, 3b, 4a o 4b3a 3b 4a 4ben las queR2 representa fenilo o heteroarilo,en el que dichos grupos fenilo o heteroarilo están opcionalmente sustituidos entre una y tres veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, oestán sustituidos una vez con R11a y opcionalmente una o dos veces con R11, en forma independiente en cada caso iguales o diferentes entre sí, o están sustituidos con dos sustituyentes R11 adyacentes que representan juntos un grupo metilendioxi para formar un anillo de 5 miembros;R2a representa hidrógeno, ciano, nitro, halógeno, alquilo C1-C2 o haloalquilo C1-C2;R2b representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2;R2c representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2, en el que no menos que uno de R2a, R2b y R2c representa hidrógeno.24. Un intermedio de la siguiente fórmula:en la queR1 representa un grupo seleccionado entre:en las que * indica el punto de unión de dicho grupo con el resto de la molécula en la cual R6, R6a, R6b, R7 y R7b tienen los significados definidos en la reivindicación 1 ;R2a representa hidrógeno, ciano, nitro, halógeno, alquilo C1-C2 o haloalquilo C1-C2;R2b representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2;R2c representa hidrógeno, halógeno, alquilo C1-C2 o haloalquilo C1-C2, en el que no menos que uno de R2a, R2b y R2c representa hidrógeno;R3 representa hidrógeno o flúor;R4 representa hidrógeno, flúor, metilo o OH;W representa un grupo amino que está opcionalmente sustituido con un grupo protector (por ejemplo, (dimetilamino)metileno o 2,4-dimetoxibencilo);V representa cloro o bromo.25. Un compuesto con la siguiente fórmula:1 2-Cloro-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida2 N-(2,4-Dimetoxibencil)-2-flúor-5-nitrobencensulfonamida3 N-(2,4-Dimetoxibencil)-5-nitro-2-[4-(trifluorometil)-1H-pirazol-1-il]bencensulfonamida4 2-(4-Cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida5 N-(2,4-Dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)-5-nitrobencensulfonamida6 2-(4-Bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida7 N-(2,4-Dimetoxibencil)-5-nitro-2-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]bencensulfonamida8 2-[3-(Difluorometil)-1H-1,2,4-triazol-1-il]-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida9 2-(4-Ciano-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida10 5-Amino-N-(2,4-dimetoxibencil)-2-[4-(trifluorometil)-1H-pirazol-1-il]bencensulfonamida11 5-Amino-2-(4-cloro-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida12 5-Amino-N-(2,4-dimetoxibencil)-2-(4-flúor-1H-pirazol-1-il)bencensulfonamida13 5-Amino-2-(4-bromo-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)bencensulfonamida14 5-Amino-N-(2,4-dimetoxibencil)-2-[3-(trifluorometil)-1H-1,2,4-triazol-1-il]-bencensulfonamida15 2-(2-Clorofenil)-N-{4-[3-(difluorometil)-1H-1,2,4-triazol-1-il]-3-[(2,4-dimetoxi-bencil)sulfamoil]fenil}acetamida 16 N-{4-[3-(Difluorometil)-1H-1,2,4-triazol-1-il]-3-[(2,4-dimetoxibencil)sulfamoil]-fenil}-2-(2-fluorofenil)acetamida 17 2-Cloro-N-[(dimetilamino)metilen]-5-nitrobencensulfonamida18 N-[(Dimetilamino)metilen]-5-nitro-2-[5-(trifluorometil)piridin-3-il]bencensulfonamida19 5-Amino-N-[(diirietilaiTimo)iTietilen]-2-[5-(trifluoroiTietil)pindin-3-il]bencensulfonaiTiida20 2-[1-(Difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metilen]-5-nitrobencensulfonamida21 5-Amino-2-[1-(difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metilen]-bencensulfonamida22 2-(2-Clorofenil)-N-(3-{[(dimetilamino)metilen]sulfamoil}-4-[4-(trifluoro-metil)-1H-pirazol-1-il]fenil)acetamida 23 2-(2-Clorofenil)-N-[3-{[(dimetilamino)metilen]sulfamoil}-4-(4-flúor-1H-pirazol-1-il)fenil]acetamida24 N-(2,4-Dimetoxibencil)-2-(4-metil-1H-pirazol-1-il)-5-nitrobencensulfonamida25 N-(2,4-Dimetoxibencil)-2-(3-metoxi-1H-1,2,4-triazol-1-il)-5-nitrobencensulfonamida26 2-(4-Cidopropil-1H-imidazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida27 N-(2,4-Dimetoxibencil)-2-(4-metil-1H-imidazol-1-il)-5-nitrobencensulfonamida28 2-(3-Ciclopropil-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida29 N-(2,4-Dimetoxibencil)-5-nitro-2-(2H-pirazolo[3,4-b]piridin-2-il)bencensulfonamida30 N-(2,4-Dimetoxibencil)-5-nitro-2-(2H-pirazolo[3,4-c]piridin-2-il)bencensulfonamida31 N-(2,4-Dimetoxibencil)-5-nitro-2-(2H-pirazolo[4,3-b]piridin-2-il)bencensulfonamida32 N-(2,4-Dimetoxibencil)-2-[4-(2-metoxietil)-1H-pirazol-1-il]-5-nitrobencensulfonamida33 N-(2,4-Dimetoxibencil)-2-(3-flúor-1H-pirazol-1-il)-5-nitrobencensulfonamida35 2-{4-[(2,2-Difluoroetil)amino]-1H-pirazol-1-il}-N-(2,4-dimetoxibencil)-5-nitro-bencensulfonamida36 N-(2,4-Dimetoxibencil)-2-[4-(2-hidroxietil)-1H-pirazol-1-il]-5-nitrobencensulfonamida37 N-(2,4-Dimetoxibencil)-5-nitro-2-[4-(2-oxoetil)-1H-pirazol-1-il]bencensulfonamida38 2-[4-(2,2-Difluoroetil)-1H-pirazol-1-il]-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida39 2-(2-Clorofenil)-N-{4-[4-(2,2-difluoroetil)-1H-pirazol-1-il]-3-[(2,4-dimetoxi-bencil)sulfamoil]fenil}acetamida 42 2-(4-{[(2,2-Difluoroetil)amino]metil}-1H-pirazol-1-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida43 (2,2-difluoroetil)[(1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-il)metil]carbamato de ferc-butilo 44 {[1-(4-{[(2-dorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]metil}(2,2-difluoroetil)carbamato de ferc-butilo45 2-(Bencilsulfanil)-4-nitrobenzonitrilo46 2-Ciano-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida47 2-[(2,4-Dimetoxibencil)sulfamoil]-N'-hidroxi-4-nitrobencencarboximidamida48 N-(2,4-Dimetoxibencil)-5-nitro-2-[5-(trifluorometil)-1,2,4-oxadiazol-3-il]bencensulfonamida49 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[5-(trifluorometil)-1,2,4-oxadiazol-3-il]fenil}acetamida 50 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-metil-1H-pirazol-1-il)fenil}acetamida51 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(3-metoxi-1H-1,2,4-triazol-1-il)fenil}acetamida52 2-(2-Clorofenil)-N-{4-(4-ciclopropil-1H-imidazol-1-il)-3-[(2,4-dimetoxi-bencil)sulfamoil]fenil}acetamida53 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-metil-1H-imidazol-1-il)fenil}acetamida54 2-(2-Clorofenil)-N-{4-(3-ciclopropil-1H-pirazol-1-il)-3-[(2,4-dimetoxi-bencil)sulfamoil]fenil}acetamida55 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(2H-pirazolo[3,4-b]piridin-2-il)fenil}acetamida56 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(2H-pirazolo[3,4-c]piridin-2-il)fenil}acetamida57 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(2H-pirazolo[4,3-b]piridin-2-il)fenil}acetamida58 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[4-(2-metoxietil)-1H-pirazol-1-il]fenil}acetamida59 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(3-flúor-1H-pirazol-1-il)fenil}acetamida60 2-(2-Clorofenil)-N-(4-{4-[(2,2-difluoroetil)amino]-1H-pirazol-1-il}-3-[(2,4-dimetoxibencil)sulfamoil]fenil)acetamida 61 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(4-metil-1H-pirazol-1-il)fenil}-2-(2-fluorofenil)acetamida62 2-(2-Fluorofenil)-N-{4-(4-cidopropil-1H-imidazol-1-il)-3-[(2,4-dimetoxibencil)-sulfamoil]fenil}acetamida 63 N-{4-(3-Ciclopropil-1H-pirazol-1-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-fluorofenil)acetamida64 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-[4-(2-metoxietil)-1H-pirazol-1-il]-fenil}-2-(2-fluorofenil)acetamida 66 2-(Bencilsulfanil)-4-nitrobenzohidrazida67 2-(Bencilsulfanil)-4-nitro-N'-(trifluoroacetil)benzohidrazida68 2-[2-(Bencilsulfanil)-4-nitrofenil]-5-(trifluorometil)-1,3,4-oxadiazol69 N-(2,4-Dimetoxibencil)-5-nitro-2-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]bencensulfonamida70 2-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]fenil}acetamida 71 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-[5-(trifluorometil)-1,3,4-oxadiazol-2-il]fenil}-2-(2-fluorofenil)acetamida 72 2-Bromo-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida73 5-Amino-2-bromo-N-(2,4-dimetoxibencil)bencensulfonamida74 N-{4-Bromo-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-clorofenil)acetamida76 2-Bromo-N-[(dimetilamino)metiliden]-5-nitrobencensulfonamida77 5-Amino-2-bromo-N-[(dimetilamino)metiliden]bencensulfonamida78 N-(4-Bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-clorofenil)acetamida79 N-(4-Bromo-3-{(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-fluorofenil)acetamida80 N-(4-Bromo-3-{[(dimetilamino)metiliden]sulfamoil}fenil)-2-(2-cloro-4-fluorofenil)acetamida81 2-(2-Clorofenil)-N-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(1H-pirazol-4-il)fenil]acetamida82 4-Amino-N-(2,4-dimetoxibencil)bifenil-2-sulfonamida83 5-Amino-2-(1-metil-1H-pirazol-4-il)bencensulfonamida84 5-Amino-2-(1-ciclopropil-1H-pirazol-4-il)-N-[(dimetilamino)metiliden]bencensulfonamida85 5-Amino-2-(1-ferc-butil-1H-pirazol-4-il)bencensulfonamida86 5-Amino-2-(1-metil-1H-pirazol-4-il)bencensulfonamida87 5-Amino-N-[(dimetilamino)metiliden]-2-[1-(tetrahidro-2H-piran-2-il)-1H-pirazol-4-il]bencensulfonamida 88 5-Amino-2-(1-cidopentil-1H-pirazol-4-il)bencensulfonamida89 5-Amino-2-[1-(2-metoxietil)-1H-pirazol-4-il]bencensulfonamida90 5-Amino-2-(1,3-dimetil-1H-pirazol-5-il)bencensulfonamida91 5-Amino-2-[1-metil-3-(trifluorometil)-1H-pirazol-5-il]bencensulfonamida92 5-Amino-N-[(dimetilamino)metiliden]-2-[5-(trifluorometil)piridin-3-il]-bencensulfonamida93 5-Amino-2-(1,3-dimetil-1H-pirazol-4-il)bencensulfonamida94 5-Amino-2-[1-(difluorometil)-1H-pirazol-4-il]bencensulfonamida95 4-[4-(4-amino-2-sulfamoilfenil)-1H-pirazol-1-il]pipendin-1-carboxilato de ferc-butilo97 5-Bromo-2-doro-N-[(dimetilamino)metiliden]piridin-3-sulfonamida98 2-Cloro-N-[(dimetilamino)metiliden]-5-[(difenilmetiliden)amino]piridin-3-sulfonamida99 2-[1-(Difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metiliden]-5-[(difenil-metiliden)amino]pindin-3-sulfonamida 100 5-Amino-2-[1-(difluorometil)-1H-pirazol-4-il]-N-[(dimetilamino)metiliden]piridin-3-sulfonamida101 N-[(Dimetilamino)metiliden]-5-[(difenilmetiliden)amino]-2-(1-metil-1H-pirazol-4-il)piridin-3-sulfonamida 10 2 5-Amino-N-[(dimetilamino)metiliden]-2-(1-metil-1H-pirazol-4-il)pindin-3-sulfonamida103 N-[(Dimetilamino)metiliden]-5-[(difenilmetiliden)amino]-5'-(trifluorometil)-2,3'-bipiridin-3-sulfonamida104 5-Amino-N-[(dimetilamino)metiliden]-5'-(trifluorometil)-2,3'-bipiridin-3-sulfonamida105 2-(2-Clorofenil)-N-[3-{[(dimetilamino)metiliden]sulfamoil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)fenil]acetamida106 5-Amino-2-(5-cidopropil-1,3,4-oxadiazol-2-il)-N-[(dimetilamino)metiliden]-bencensulfonamida1072-[4-(Difluorometil)-1H-pirazol-1-il]-N-[(dimetilamino)metilen]-5-nitro-bencensulfonamida108 5-Amino-2-(4-ciano-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida109 5-Amino-2-(4-doro-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida11 0 5-Amino-2-(4-bromo-1H-pirazol-1-il)-N-[(dimetilamino)metilen]piridin-3-sulfonamida111 5-Amino-N-[(dimetilamino)metilen]-2-(4-flúor-1H-pirazol-1-il)piridin-3-sulfonamida112 5-Amino-N-[(dimetilamino)metiliden]-2-[4-(trifluorometil)-1H-pirazol-1-il]-piridin-3-sulfonamida113 1-(4-{[(2-dorofenil)acetil]amino}-2-sulfamoilfenil)-1H-pirazol-4-carboxilato de metilo114 N-(4-Bromo-3-sulfamoilfenil)-2-(2-dorofenil)acetamida115 N-(4-Bromo-3-{[(dimetilamino)metilen]sulfamoil}fenil)-2-(2-dorofenil)acetamida116 N-[(Dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-2H-1,2,3-triazol-2-il]bencensulfonamida117 N-[(Dimetilamino)metilen]-5-nitro-2-[4-(trifluorometil)-1H-1,2,3-triazol-1-il]bencensulfonamida1182-(4-Ciano-1H-pirazol-1-il)-5-nitrobencensulfonamida119 5-Amino-2-(4-ciano-1H-pirazol-1-il)bencensulfonamida120 1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-carboxilato de etilo121 ácido 1-{2-[(2,4-dimetoxibencil)sulfamoil]-4-nitrofenil}-1H-pirazol-4-carboxílico122 (1-{2-[(2,4-dimetoxibendl)sulfamoil]-4-nitrofenil}-1H-pirazol-4-il)carbamato de 2-(trimetilsilil)etilo123 [1-(4-{[(2-dorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]carbamato de 2-(trimetilsilil)etilo124 N-{4-(4-Amino-1H-pirazol-1-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-dorofenil)acetamida125 N-[1-(4-{[(2-Clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]-2,2-difluoroacetamida126 N-[1-(4-{[(2-Clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]-3,3,3-trifluoropropanamida127 (±)-N-[1-(4-{[(2-Clorofenil)acetil]amino}-2-[(2,4-dimetoxibencil)sulfamoil]fenil)-1H-pirazol-4-il]-3,3,3-trifluoro-2-metilpropanamida128 2-(2-Clorofenil)-N-(3-[(2,4-dimetoxibencil)sulfamoil]-4-{4-(2,5-dimetil-pirrolidin-1-il)-1H-pirazol-1-il}fenil)acetamida (Mezcla de estereoisómeros)129 N-(4-{4-[(2,2-Difluoroetil)amino]-1H-pirazol-1-il}-3-[(2,4-dimetoxibencil)sulfamoil]fenil)-2-(2-fluorofenil)acetamida130 N-(2,2,2-Trifluoroetil)-1H-pirazol-4-amina131 N-(2,4-Dimetoxibencil)-5-nitro-2-{4-[(2,2,2-trifluoroetil)amino]-1H-pirazol-1-il}bencensulfonamida132 2-(2-Clorofenil)-N-(3-[(2,4-dimetoxibencil)sulfamoil]-4-{4-[(2,2,2-trifluoroetil)amino]-1H-pirazol-1-il}fenil)acetamida133 N-(2,4-Dimetoxibencil)-2-(4-isopropil-1H-pirazol-1-il)-5-nitrobencensulfonamida1342-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(4-isopropil-1H-pirazol-1-il)fenil}acetamida135 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(4-isopropil-1H-pirazol-1-il)fenil}-2-(2-fluorofenil)acetamida138 N-(2,4-Dimetoxibencil)-5-nitro-2-[4-(2,2,2-trifluoroetil)-1H-pirazol-1-il]bencensulfonamida1392-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[4-(2,2,2-trifluoroetil)-1H-pirazol-1-il]fenil}acetamida 140 N-{3-[(2,4-Dimetoxibendl)sulfamoil]-4-[4-(2,2,2-tnfluoroetil)-1H-pirazol-1-il]fenil}-2-(2-fluorofenil)acetamida 141 2-(5-Cidopropil-1,2,4-oxadiazol-3-il)-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida1422-(2-Clorofenil)-N-{4-(5-cidopropil-1,2,4-oxadiazol-3-il)-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida 143 5-[2-(Bencilsulfanil)-4-nitrofenil]-3-(trifluorometil)-1,2,4-oxadiazol144 N-(2,4-Dimetoxibencil)-5-nitro-2-[3-(trifluorometil)-1,2,4-oxadiazol-5-il]bencensulfonamida1452-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-[3-(trifluorometil)-1,2,4-oxadiazol-5-il]fenil}acetamida 1462-(Bencilsulfanil)-N'-(difluoroacetil)-4-nitrobenzohidrazida1472-[2-(Bencilsulfanil)-4-nitrofenil]-5-(difluorometil)-1,3,4-oxadiazol1482-[5-(Difluorometil)-1,3,4-oxadiazol-2-il]-N-(2,4-dimetoxibencil)-5-nitrobencensulfonamida 1492-(2-Clorofenil)-N-{4-[5-(difluorometil)-1,3,4-oxadiazol-2-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}acetamida 150 N-{4-[5-(Difluorometil)-1,3,4-oxadiazol-2-il]-3-[(2,4-dimetoxibencil)sulfamoil]fenil}-2-(2-fluorofenil)acetamida 151 5-[2-(Bencilsulfanil)-4-nitrofenil]-3-metil-1,2,4-oxadiazol152 N-(2,4-Dimetoxibencil)-2-(5-metil-1,3,4-oxadiazol-2-il)-5-nitrobencensulfonamida1532-(2-Clorofenil)-N-{3-[(2,4-dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}acetamida154 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}-2-(2-fluorofenil)acetamida155 N-{3-[(2,4-Dimetoxibencil)sulfamoil]-4-(5-metil-1,3,4-oxadiazol-2-il)fenil}-2-(4-metilfenil)acetamida1563-(4-{[(2-dorofenil)acetil]amino}-2-{[(dimetilamino)metilen]sulfamoil}fenil)-1H-pirrol-1-carboxilato de ferc-butilo 1572-(2-Clorofenil)-N-[3-{[(dimetilamino)metilen]sulfamoil}-4-(1H-pirrol-3-il)fenil]acetamida1582-(2-Clorofenil)-N-[3-{[(dimetilamino)metilen]sulfamoil}-4-(1-metil-1H-pirrol-3-il)fenil]acetamida1592-(2-Clorofenil)-N-[4-(5-ciano-1-metil-1H-pirrol-2-il)-3-{[(dimetilamino)metilen]sulfamoil}fenil]acetamida.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16167996 | 2016-05-03 | ||
| PCT/EP2017/059882 WO2017191000A1 (en) | 2016-05-03 | 2017-04-26 | Aromatic sulfonamide derivatives |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2829270T3 true ES2829270T3 (es) | 2021-05-31 |
Family
ID=55910814
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES17724498T Active ES2829270T3 (es) | 2016-05-03 | 2017-04-26 | Derivados de sulfonamida aromáticos |
Country Status (42)
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SI3458443T1 (sl) * | 2016-05-03 | 2020-11-30 | Bayer Pharma Aktiengesellschaft | Aromatski derivati sulfonamida |
| BR112019006490B1 (pt) * | 2016-10-24 | 2023-11-28 | Fmc Corporation | Composto, composições fungicidas e métodos para o controle das doenças dos vegetais |
| WO2018104307A1 (en) * | 2016-12-09 | 2018-06-14 | Bayer Pharma Aktiengesellschaft | Aromatic sulfonamide derivatives and their use as anatagon i sts or negative allosteric modulators of p2x4 |
| WO2018210729A1 (en) * | 2017-05-18 | 2018-11-22 | Bayer Pharma Aktiengesellschaft | Aromatic sulfonamide derivatives as antagonists or negative allosteric modulators of p2x4 receptor |
| JOP20190278A1 (ar) * | 2017-05-31 | 2019-11-28 | Novartis Ag | مركبات 5، 6-ثنائية الحلقة مندمجة وتركيبات لعلاج الأمراض الطفيلية |
| KR20200081445A (ko) * | 2017-10-29 | 2020-07-07 | 바이엘 악티엔게젤샤프트 | 허혈성 졸중의 치료를 위한 방향족 술폰아미드 유도체 |
| PE20211066A1 (es) | 2018-08-31 | 2021-06-09 | Xenon Pharmaceuticals Inc | Compuestos de sulfonamida sustituidos con heteroarilo y su uso como agentes terapeuticos |
| CA3159689C (en) * | 2019-11-29 | 2025-05-27 | Wuhan Ll Science And Technology Development Co., Ltd. | COMPOUND CONTAINING AN ORTHOCODENSE HETEROCYCLE AND USE AS A P2X4 ANTAGONIST |
| CN113082023B (zh) * | 2019-12-23 | 2024-03-01 | 武汉朗来科技发展有限公司 | P2x3抑制剂和p2x4抑制剂的药物组合及其应用 |
| CN114901642B (zh) * | 2019-12-30 | 2024-02-23 | 武汉朗来科技发展有限公司 | 一种稠环化合物及其应用 |
| CN115989218A (zh) | 2020-06-30 | 2023-04-18 | 拜耳公司 | 具有p2x4受体拮抗活性的n-苯乙酰胺用于治疗某些眼部疾病的用途 |
| BR112022021391A2 (pt) | 2020-06-30 | 2023-01-10 | Bayer Ag | N-fenilacetamidas substituídas que possuem atividade antagonista a receptor de p2x4 |
| CN111743864B (zh) * | 2020-08-05 | 2022-04-01 | 牡丹江医学院 | 一种体育外伤喷雾剂及其制备方法 |
| WO2022049253A1 (en) | 2020-09-07 | 2022-03-10 | Bayer Aktiengesellschaft | Substituted n-heteroaryl-n-pyridinylacetamides as p2x4 modulators |
| TW202239748A (zh) * | 2021-01-27 | 2022-10-16 | 大陸商武漢朗來科技發展有限公司 | 芳香化合物、其製備方法及應用 |
| WO2022186133A1 (ja) | 2021-03-01 | 2022-09-09 | 日本農薬株式会社 | スルホンアミド基を有する縮合複素環化合物又はその塩類及び該化合物若しくはその塩類を含有する農園芸用殺虫剤又は動物用の外部若しくは内部寄生虫防除剤並びにそれらの使用方法 |
| US11975290B2 (en) | 2022-03-17 | 2024-05-07 | International Business Machines Corporation | Cyclopropeneimines for capture and transfer of carbon dioxide |
| US11878269B2 (en) | 2022-03-17 | 2024-01-23 | International Business Machines Corporation | Cyclopropeneimines for capture and transfer of carbon dioxide |
| AU2023244778A1 (en) * | 2022-03-31 | 2024-10-17 | Nippon Chemiphar Co., Ltd. | Pharmaceutical composition for preventing or suppressing or treating symptoms accompanying pseudo-allergic reactions |
| US12478951B2 (en) | 2022-08-19 | 2025-11-25 | International Business Machines Corporation | Cyclopropenimines for activation of carbon dioxide |
| US12479793B2 (en) | 2022-08-19 | 2025-11-25 | International Business Machines Corporation | Cyclopropenimines for mineralization of carbon dioxide |
| US12415889B2 (en) | 2022-08-19 | 2025-09-16 | International Business Machines Corporation | Cyclopropenimines for activation of carbon dioxide |
| WO2025051851A1 (en) | 2023-09-05 | 2025-03-13 | Bayer Aktiengesellschaft | Pharmaceutical dosage forms comprising 2-(2-chlorophenyl)-n-[4-(4-cyano-1h-pyrazol-1-yl)-3-sulfamoylphenyl]acetamide |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5011472A (en) | 1988-09-06 | 1991-04-30 | Brown University Research Foundation | Implantable delivery system for biological factors |
| US5770615A (en) * | 1996-04-04 | 1998-06-23 | Bristol-Myers Squibb Company | Catecholamine surrogates useful as β3 agonists |
| US5994398A (en) * | 1996-12-11 | 1999-11-30 | Elan Pharmaceuticals, Inc. | Arylsulfonamides as phospholipase A2 inhibitors |
| EP3124475B1 (en) * | 2009-09-03 | 2019-08-07 | Bristol-Myers Squibb Company | Quinazolines as potassium ion channel inhibitors |
| JP2013523658A (ja) | 2010-03-26 | 2013-06-17 | グラクソ グループ リミテッド | キナーゼ阻害剤としてのピラゾリル‐ピリミジン |
| EP2571878B1 (en) | 2010-05-17 | 2018-10-17 | Incozen Therapeutics Pvt. Ltd. | Novel 3,5-disubstitued-3h-imidazo[4,5-b]pyridine and 3,5- disubstitued -3h-[1,2,3]triazolo[4,5-b]pyridine compounds as modulators of protein kinases |
| WO2012008478A1 (ja) | 2010-07-13 | 2012-01-19 | 日本ケミファ株式会社 | P2x4受容体拮抗剤 |
| NZ627878A (en) | 2012-01-13 | 2016-03-31 | Nippon Chemiphar Co | P2x4 receptor antagonist |
| US9872822B2 (en) * | 2013-06-21 | 2018-01-23 | L'oreal | Process for dyeing in the presence of oxidation bases comprising at least one sulfonic, sulfonamide, sulfone, amid or acid group and a metal catalyst, device and ready-to-use composition |
| EP3020717B1 (en) | 2013-07-12 | 2021-12-15 | Nippon Chemiphar Co., Ltd. | P2x4 receptor antagonist |
| EP3020707B1 (en) * | 2013-07-12 | 2019-08-21 | Nippon Chemiphar Co., Ltd. | P2x4 receptor antagonist |
| WO2015088564A1 (en) | 2013-12-13 | 2015-06-18 | Sunovion Pharmaceuticals Inc. | P2x4 receptor modulating compounds |
| WO2015088565A1 (en) | 2013-12-13 | 2015-06-18 | Sunovion Pharmaceuticals Inc. | P2x4 receptor modulating compounds and methods of use thereof |
| EP3307715A1 (en) * | 2015-06-10 | 2018-04-18 | Bayer Pharma Aktiengesellschaft | Aromatic sulfonamide derivatives |
| US9988367B2 (en) | 2016-05-03 | 2018-06-05 | Bayer Pharma Aktiengesellschaft | Amide-substituted pyridinyltriazole derivatives and uses thereof |
| SI3458443T1 (sl) * | 2016-05-03 | 2020-11-30 | Bayer Pharma Aktiengesellschaft | Aromatski derivati sulfonamida |
| KR20180132939A (ko) | 2016-05-03 | 2018-12-12 | 갈레라 랩스, 엘엘씨 | 암 치료를 위한 조합 요법 |
| WO2018104305A1 (en) * | 2016-12-09 | 2018-06-14 | Bayer Pharma Aktiengesellschaft | Field of application of the invention |
| WO2018104307A1 (en) * | 2016-12-09 | 2018-06-14 | Bayer Pharma Aktiengesellschaft | Aromatic sulfonamide derivatives and their use as anatagon i sts or negative allosteric modulators of p2x4 |
| WO2018210729A1 (en) * | 2017-05-18 | 2018-11-22 | Bayer Pharma Aktiengesellschaft | Aromatic sulfonamide derivatives as antagonists or negative allosteric modulators of p2x4 receptor |
| KR20200081445A (ko) * | 2017-10-29 | 2020-07-07 | 바이엘 악티엔게젤샤프트 | 허혈성 졸중의 치료를 위한 방향족 술폰아미드 유도체 |
-
2017
- 2017-04-26 SI SI201730430T patent/SI3458443T1/sl unknown
- 2017-04-26 EA EA201892450A patent/EA201892450A1/ru unknown
- 2017-04-26 CN CN202210645365.4A patent/CN114984003B/zh active Active
- 2017-04-26 DK DK17724498.5T patent/DK3458443T3/da active
- 2017-04-26 RS RS20201318A patent/RS61012B1/sr unknown
- 2017-04-26 HU HUE17724498A patent/HUE051348T2/hu unknown
- 2017-04-26 GE GEAP201714943A patent/GEP20217316B/en unknown
- 2017-04-26 US US16/098,767 patent/US10844016B2/en active Active
- 2017-04-26 ES ES17724498T patent/ES2829270T3/es active Active
- 2017-04-26 MX MX2018013490A patent/MX382068B/es unknown
- 2017-04-26 MY MYPI2018704032A patent/MY187845A/en unknown
- 2017-04-26 LT LTEP17724498.5T patent/LT3458443T/lt unknown
- 2017-04-26 CR CR20180528A patent/CR20180528A/es unknown
- 2017-04-26 JP JP2018557818A patent/JP7033079B2/ja active Active
- 2017-04-26 PL PL17724498T patent/PL3458443T3/pl unknown
- 2017-04-26 HR HRP20201746TT patent/HRP20201746T1/hr unknown
- 2017-04-26 CN CN201780041379.2A patent/CN109415321B/zh active Active
- 2017-04-26 TN TNP/2018/000369A patent/TN2018000369A1/fr unknown
- 2017-04-26 PE PE2018002313A patent/PE20190913A1/es unknown
- 2017-04-26 AU AU2017260125A patent/AU2017260125B2/en active Active
- 2017-04-26 KR KR1020187034452A patent/KR102388962B1/ko active Active
- 2017-04-26 SG SG11201809126RA patent/SG11201809126RA/en unknown
- 2017-04-26 EP EP20191219.3A patent/EP3763704A1/en active Pending
- 2017-04-26 EP EP17724498.5A patent/EP3458443B1/en active Active
- 2017-04-26 CU CU2018000137A patent/CU24516B1/es unknown
- 2017-04-26 PT PT177244985T patent/PT3458443T/pt unknown
- 2017-04-26 MA MA45020A patent/MA45020B1/fr unknown
- 2017-04-26 WO PCT/EP2017/059882 patent/WO2017191000A1/en not_active Ceased
- 2017-04-26 UA UAA201811683A patent/UA122819C2/uk unknown
- 2017-04-26 CN CN202210644997.9A patent/CN115054600B/zh active Active
- 2017-05-02 TW TW106114429A patent/TWI723158B/zh active
- 2017-05-03 UY UY0001037224A patent/UY37224A/es active IP Right Grant
- 2017-05-03 AR ARP170101138A patent/AR108356A1/es not_active Application Discontinuation
- 2017-05-03 JO JOP/2017/0107A patent/JOP20170107B1/ar active
-
2018
- 2018-10-24 IL IL262580A patent/IL262580B/en unknown
- 2018-10-30 PH PH12018502307A patent/PH12018502307A1/en unknown
- 2018-11-01 NI NI201800116A patent/NI201800116A/es unknown
- 2018-11-02 DO DO2018000241A patent/DOP2018000241A/es unknown
- 2018-11-02 CO CONC2018/0011935A patent/CO2018011935A2/es unknown
- 2018-11-04 SA SA518400371A patent/SA518400371B1/ar unknown
- 2018-11-05 CL CL2018003135A patent/CL2018003135A1/es unknown
- 2018-11-05 SV SV2018005778A patent/SV2018005778A/es unknown
- 2018-11-06 EC ECSENADI201882774A patent/ECSP18082774A/es unknown
- 2018-11-30 ZA ZA2018/08130A patent/ZA201808130B/en unknown
-
2020
- 2020-10-09 US US17/067,434 patent/US11524938B2/en active Active
- 2020-11-16 CY CY20201101080T patent/CY1123801T1/el unknown
-
2021
- 2021-12-07 JP JP2021198484A patent/JP7104232B2/ja active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2829270T3 (es) | Derivados de sulfonamida aromáticos | |
| JP6704398B2 (ja) | 4H−ピロロ[3,2−c]ピリジン−4−オン誘導体 | |
| AU2018309356A1 (en) | Dihydrooxadiazinones | |
| WO2018104307A1 (en) | Aromatic sulfonamide derivatives and their use as anatagon i sts or negative allosteric modulators of p2x4 | |
| WO2019096914A1 (en) | Macrocyclic chlorine substituted indole derivatives | |
| WO2019096911A1 (en) | Macrocyclic indole derivatives | |
| WO2018210729A1 (en) | Aromatic sulfonamide derivatives as antagonists or negative allosteric modulators of p2x4 receptor | |
| AU2023207765A1 (en) | Bicyclic triazine derivatives for the treatment of cancer | |
| CA3022793C (en) | Aromatic sulfonamide derivatives | |
| HK40079881A (en) | Aromatic sulfonamide derivatives | |
| BR112018072549B1 (pt) | Derivados de sulfonamida aromática, seus intermediários, seus usos, e composição farmacêutica | |
| HK40079811A (en) | Aromatic sulfonamide derivatives | |
| HK1262908A1 (en) | Aromatic sulfonamide derivatives | |
| HK1262908B (en) | Aromatic sulfonamide derivatives | |
| EA040608B1 (ru) | Ароматические сульфонамидные производные |